Композиція, що містить сполуки хіноліну
Номер патенту: 90463
Опубліковано: 11.05.2010
Автори: Веннман Ханс, Янссон Карл, Фрістедт Томас, Бьйорк Андерс
Формула / Реферат
1. Стабільна тверда фармацевтична композиція, яка відрізняється тим, що містить ефективну кількість солі формули (II)
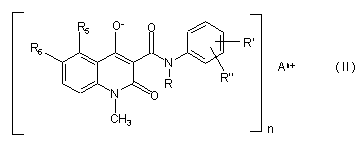 ,
,
де n являє собою ціле число 1, 2 або 3;
Аn+ являє собою одно- або полівалентний катіон металу, вибраний з Lі+, Na+, K+, Mg2+, Ca2+, Mn2+, Cu2+, Zn2+, Al3+ і Fe3+;
R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл;
R5 являє собою насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4-алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і
R6 являє собою водень; або
R5 та R6 разом являють собою метилендіокси;
R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і
R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор;
компонент з лужною реакцією, який підтримує рН переважно вище 8, або солі з двовалентним катіоном металу;
і щонайменше однієї фармацевтичної допоміжної речовини.
2. Тверда фармацевтична композиція за п. 1, яка відрізняється тим, що сіль формули (II) являє собою літієву або кальцієву сіль N-етил-N-феніл-5-хлор-1,2-дигідро-4-гідрокси-1-метил-2-оксо-3-хінолінкарбоксаміду або літієву, кальцієву або цинкову сіль N-етил-N-феніл-5-етил-1,2-дигідро-4-гідрокси-1-метил-2-оксо-3-хінолінкарбоксаміду.
3. Тверда фармацевтична композиція за пп. 1 або 2, яка відрізняється тим, що містить сіль формули (II) в кількості від 0,01 до 10 % композиції по масі, переважно від 0,1 до 2 % композиції по масі.
4. Тверда фармацевтична композиція за будь-яким з пп. 1-3, яка відрізняється тим, що компонент з лужною реакцією вибраний з натрієвої, калієвої, кальцієвої та алюмінієвої солей оцтової кислоти, вугільної кислоти, лимонної кислоти і фосфорної кислоти.
5. Тверда фармацевтична композиція за будь-яким з пп. 1-4, яка відрізняється тим, що містить компонент з лужною реакцією в кількості від 0,1 до 99 % композиції по масі, переважно від 1 до 20 % композиції по масі.
6. Тверда фармацевтична композиція за будь-яким з пп. 1-3, яка відрізняється тим, що сіль з двовалентним катіоном металу являє собою кальцію ацетат.
7. Тверда фармацевтична композиція за п. 6, яка відрізняється тим, що містить кальцію ацетат в кількості від 1 до 10 % композиції по масі.
8. Тверда фармацевтична композиція за будь-яким з пп. 1-7, яка відрізняється тим, що містить фармацевтичну допоміжну речовину, вибрану з твердих носіїв, зв'язуючих агентів, дезінтегрантів та змащуючих агентів у формі порошку.
9. Тверда фармацевтична композиція за п. 8, яка відрізняється тим, що тверді порошкоподібні носії вибрані з маніту, мікрокристалічної целюлози, кальцію гідрофосфату, кальцію сульфату і крохмалю.
10. Тверда фармацевтична композиція за пп. 8 або 9, яка відрізняється тим, що містить зв'язуючі агенти, вибрані з полівінілпіролідону, крохмалю і гідроксипропілметилцелюлози.
11. Тверда фармацевтична композиція за будь-яким з пп. 8-10, яка відрізняється тим, що дезінтегранти вибрані з натрію кроскармелози, натрію крохмальгліколяту і полівінілпіролідону.
12. Тверда фармацевтична композиція за будь-яким з пп. 8-10, яка відрізняється тим, що змащуючі агенти вибрані з магнію стеарату, натрію стеарилфумарату, тальку та гідрогенізованої рослинної олії.
13. Спосіб стабілізації солі формули (II)
 ,
,
де
n дорівнює 2;
Аn+ являє собою Са2+;
R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл;
R5 являє собою насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4-алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і
R6 являє собою водень; або
R5 та R6 разом являють собою метилендіокси;
R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і
R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор;
шляхом розпилення розчину кальцію ацетату на суміш кальцієвої солі формули (II) і щонайменше одну фармацевтичну допоміжну речовину.
14. Спосіб стабілізації солі формули (II)
 ,
,
де
n являє собою ціле число 2 або 3;
Аn+ являє собою полівалентний катіон металу, вибраний з Са2+, Zn2+ і Fe3+;
R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл;
R5 являє собою насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4-алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і
R6 являє собою водень; або
R5 та R6 разом являють собою метилендіокси;
R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і
R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор;
шляхом розпилення розчину компонента з лужною реакцією на фармацевтичну допоміжну речовину або суміш допоміжних речовини, грануляції до належної консистенції, висушування одержаного таким чином гранулята та змішування висушеного гранулята з сіллю формули (II).
15. Спосіб стабілізації солі формули (II)
 ,
,
де
n являє собою 1;
Аn+ являє собою одновалентний катіон металу, вибраний з Lі+, Na+ або К+;
R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл;
R5 являє собою насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4-алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і
R6 являє собою водень; або
R5 та R6 разом являють собою метилендіокси;
R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і
R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор;
шляхом розпилення розчину солі формули (II) і компонента з лужною реакцією на фармацевтичну допоміжну речовину або суміш допоміжних речовин.
16. Спосіб виготовлення кристалічної солі формули (II)
 ,
,
де
n являє собою ціле число 2 або 3;
Аn+ являє собою полівалентний катіон металу, вибраний з Мg2+, Са2+, Мn2+, Cu2+, Zn2+, Al3+ і Fe3+;
R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл;
R5 являє собою насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4-алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і
R6 являє собою водень; або
R5 та R6 разом являють собою метилендіокси;
R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і
R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор;
шляхом здійснення реакції нейтральної форми натрієвої солі похідного 3-хінолінкарбоксаміду з сіллю, яка містить полівалентний катіон металу в рідкій фазі, яка складається з води і щонайменше одного органічного розчинника, який змішується з водою, причому сіль формули (II) є слабкорозчинною в зазначеній рідкій фазі.
17. Спосіб за п. 16, який відрізняється тим, що рідка фаза являє собою суміш води та етанолу, яка містить 10-95 % етанолу.
18. Кристалічна сіль формули (II)
 ,
,
де
n являє собою ціле число 2 або 3;
Аn+ являє собою полівалентний катіон металу, вибраний з Mg2+, Ca2+, Mn2+, Cu2+, Zn2+, Al3+ і Fe3+;
R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл;
R5 являє собою насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4-алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і
R6 являє собою водень; або
R5 та R6 разом являють собою метилендіокси;
R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і
R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор.
Текст
1. Стабільна тверда фармацевтична композиція, яка відрізняється тим, що містить ефективну кількість солі формули (II) (21) a200608964 (22) 04.02.2005 (24) 11.05.2010 (86) PCT/EP2005/050485, 04.02.2005 (31) 0400235-8 (32) 06.02.2004 (33) SE (46) 11.05.2010, Бюл.№ 9, 2010 р. O O R' R6 N R ( II ) (13) , R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор; компонент з лужною реакцією, який підтримує рН переважно вище 8, або солі з двовалентним катіоном металу; і щонайменше однієї фармацевтичної допоміжної речовини. 2. Тверда фармацевтична композиція за п. 1, яка відрізняється тим, що сіль формули (II) являє собою літієву або кальцієву сіль N-етил-N-феніл-5хлор-1,2-дигідро-4-гідрокси-1-метил-2-оксо-3хінолінкарбоксаміду або літієву, кальцієву або цинкову сіль N-етил-N-феніл-5-етил-1,2-дигідро-4гідрокси-1-метил-2-оксо-3-хінолінкарбоксаміду. 3. Тверда фармацевтична композиція за пп. 1 або 2, яка відрізняється тим, що містить сіль формули (II) в кількості від 0,01 до 10 % композиції по масі, переважно від 0,1 до 2 % композиції по масі. 4. Тверда фармацевтична композиція за будьяким з пп. 1-3, яка відрізняється тим, що компонент з лужною реакцією вибраний з натрієвої, калієвої, кальцієвої та алюмінієвої солей оцтової кислоти, вугільної кислоти, лимонної кислоти і фосфорної кислоти. 90463 де n являє собою ціле число 1, 2 або 3; Аn+ являє собою одно- або полівалентний катіон металу, вибраний з Lі+, Na+, K+, Mg2+, Ca2+, Mn2+, Cu2+, Zn2+, Al3+ і Fe3+; R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл; R5 являє собою насичений або ненасичений С1-С4алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і R6 являє собою водень; або R5 та R6 разом являють собою метилендіокси; R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і n (11) CH3 C2 O UA N An+ R'' (19) R5 3 90463 5. Тверда фармацевтична композиція за будьяким з пп. 1-4, яка відрізняється тим, що містить компонент з лужною реакцією в кількості від 0,1 до 99 % композиції по масі, переважно від 1 до 20 % композиції по масі. 6. Тверда фармацевтична композиція за будьяким з пп. 1-3, яка відрізняється тим, що сіль з двовалентним катіоном металу являє собою кальцію ацетат. 7. Тверда фармацевтична композиція за п. 6, яка відрізняється тим, що містить кальцію ацетат в кількості від 1 до 10 % композиції по масі. 8. Тверда фармацевтична композиція за будьяким з пп. 1-7, яка відрізняється тим, що містить фармацевтичну допоміжну речовину, вибрану з твердих носіїв, зв'язуючих агентів, дезінтегрантів та змащуючих агентів у формі порошку. 9. Тверда фармацевтична композиція за п. 8, яка відрізняється тим, що тверді порошкоподібні носії R5 O 4 вибрані з маніту, мікрокристалічної целюлози, кальцію гідрофосфату, кальцію сульфату і крохмалю. 10. Тверда фармацевтична композиція за пп. 8 або 9, яка відрізняється тим, що містить зв'язуючі агенти, вибрані з полівінілпіролідону, крохмалю і гідроксипропілметилцелюлози. 11. Тверда фармацевтична композиція за будьяким з пп. 8-10, яка відрізняється тим, що дезінтегранти вибрані з натрію кроскармелози, натрію крохмальгліколяту і полівінілпіролідону. 12. Тверда фармацевтична композиція за будьяким з пп. 8-10, яка відрізняється тим, що змащуючі агенти вибрані з магнію стеарату, натрію стеарилфумарату, тальку та гідрогенізованої рослинної олії. 13. Спосіб стабілізації солі формули (II) O R' R6 N N R An+ R'' ( II ) O CH3 n , де n дорівнює 2; Аn+ являє собою Са2+; R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл; R5 являє собою насичений або ненасичений С1-С4алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і R5 O R6 являє собою водень; або R5 та R6 разом являють собою метилендіокси; R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор; шляхом розпилення розчину кальцію ацетату на суміш кальцієвої солі формули (II) і щонайменше одну фармацевтичну допоміжну речовину. 14. Спосіб стабілізації солі формули (II) O R' R6 N N R An+ R'' ( II ) O CH3 n , де n являє собою ціле число 2 або 3; Аn+ являє собою полівалентний катіон металу, вибраний з Са2+, Zn2+ і Fe3+; R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл; 5 90463 R5 являє собою насичений або ненасичений С1-С4алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і R6 являє собою водень; або R5 та R6 разом являють собою метилендіокси; R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, R5 O 6 С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор; шляхом розпилення розчину компонента з лужною реакцією на фармацевтичну допоміжну речовину або суміш допоміжних речовини, грануляції до належної консистенції, висушування одержаного таким чином гранулята та змішування висушеного гранулята з сіллю формули (II). 15. Спосіб стабілізації солі формули (II) O R' R6 N N R An+ R'' ( II ) O CH3 n , де n являє собою 1; Аn+ являє собою одновалентний катіон металу, вибраний з Lі+, Na+ або К+; R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл; R5 являє собою насичений або ненасичений С1-С4алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і R6 являє собою водень; або R5 O R5 та R6 разом являють собою метилендіокси; R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор; шляхом розпилення розчину солі формули (II) і компонента з лужною реакцією на фармацевтичну допоміжну речовину або суміш допоміжних речовин. 16. Спосіб виготовлення кристалічної солі формули (II) O R' R6 N N R An+ R'' ( II ) O CH3 n , де n являє собою ціле число 2 або 3; Аn+ являє собою полівалентний катіон металу, вибраний з Мg2+, Са2+, Мn2+, Cu2+, Zn2+, Al3+ і Fe3+; R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл; R5 являє собою насичений або ненасичений С1-С4алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4 7 90463 алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і R6 являє собою водень; або R5 та R6 разом являють собою метилендіокси; R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і R5 O 8 R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор; шляхом здійснення реакції нейтральної форми натрієвої солі похідного 3-хінолінкарбоксаміду з сіллю, яка містить полівалентний катіон металу в рідкій фазі, яка складається з води і щонайменше одного органічного розчинника, який змішується з водою, причому сіль формули (II) є слабкорозчинною в зазначеній рідкій фазі. 17. Спосіб за п. 16, який відрізняється тим, що рідка фаза являє собою суміш води та етанолу, яка містить 10-95 % етанолу. 18. Кристалічна сіль формули (II) O R' R6 N N R An+ R'' ( II ) O CH3 n , де n являє собою ціле число 2 або 3; Аn+ являє собою полівалентний катіон металу, вибраний з Mg2+, Ca2+, Mn2+, Cu2+, Zn2+, Al3+ і Fe3+; R являє собою С1-С4-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом або циклічний С3-С4-алкіл; R5 являє собою насичений або ненасичений С1-С4алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і R6 являє собою водень; або R5 та R6 разом являють собою метилендіокси; R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор. Галузь винаходу Даний винахід стосується стабільних композицій, які містять сіль похідного 3-хінолінкарбоксаміду, способів виробництва такої солі і способів виробництва твердої лікарської форми з підвищеною стабільністю при довгостроковому зберіганні при кімнатній температурі. Рівень техніки Похідні 3-хінолінкарбоксаміду описані в Патентах США 4,547,511, 6,077,851, 6,133,285 і 6,121,287. Термін "похідні 3-хінолінкарбоксаміду" в даному описі означає недисоційовану кислу форму сполуки формули (І), яка має назву нейтральної форми, тобто форму, наведену як формула (І). 9 90463 10 Несподівано було виявлено, що деякі похідні 3-хінолінкарбоксаміду в нейтральній формі, розкриті у наведених вище Патентах США, в твердому стані вразливі до хімічного розкладання, і особливо в складі фармацевтичних рецептур. Деякі солі похідних 3-хінолінкарбоксаміду формули (І) відомі з вказаних Патентів США. Однак, ні одна з наведених вище патентних специфікацій не розкриває придатного способу забезпечення вразливих до розкладання похідних 3-хінолінкарбоксаміду формули (І) у достатньо стабільній лікарській формі, і навіть не вказує на будь-які переваги використання солі похідного 3-хінолінкарбоксаміду у фармацевтичних рецептурах. Короткий опис винаходу Згідно даного винаходу забезпечено стабільну тверду фармацевтичну рецептуру, яка містить сіль похідного 3-хінолінкарбоксаміду формули (І) з одновалентним або полівалентним катіоном, і спосіб виготовлення вказаної рецептури. Спосіб включає утворення капсули або таблетки, яка містить сіль похідного 3-хінолінкарбоксаміду та рівномірно розподілений компонент з лужною реакцією, здатний нейтралізувати будь-які протони, що дисоціюють від допоміжних речовин, таким чином зберігаючи 3-хінолінкарбоксамід у формі солі формули (II). Альтернативно, спосіб включає утворення капсули або таблетки, яка містить слабко розчинну у воді сіль похідного 3-хінолінкарбоксаміду, і сіль двовалентного катіону металу, здатну зменшувати дисоціацію солі формули (II) на іони. Компонент з лужною реакцією за даним винаходом типово являє собою натрію карбонат, а сіль з двовалентним катіоном металу типово являє собою кальцію ацетат. Тверда рецептура за винаходом включає фармацевтичні допоміжні речовини, такі як носії у вигляді твердого порошку, зв'язуючі речовини, дезінтегранти та змащуючі агенти. Винахід додатково забезпечує спосіб виробництва кристалічної солі похідного 3хінолінкарбоксаміду формули (І) з протиіоном, що являє собою полівалентний катіон металу. Даний винахід вирішує проблему вразливості до розкладання похідних 3-хінолінкарбоксаміду в складі твердих фармацевтичних рецептур. Опис винаходу Деякі похідні 3-хінолінкарбоксаміду в нейтральній формі розкриті у наведених вище патентах США, є вразливими до хімічного розкладання в твердому стані і, особливо, в складі лікарських форм. Головним об'єктом даного винаходу є подолання зазначеної проблеми із стабільністю. Рішення, яке пропонує даний винахід для зазначеної проблеми із стабільністю, базується на несподіваному відкритті того, що сіль сполуки формули (І) виявляє підвищену хімічну стабільність в порівнянні з нейтральною формою зазначеної сполуки. Ретельно досліджено розкладання сполук формули (І). Винахідники продемонстрували, що аніліновий фрагмент сполуки формули (І) несподівано відщеплюється з утворенням кетену з високою реакційною здатністю. Даний кетен швидко реагує, наприклад, з сполуками формули ROH. При зберіганні без дотримання спеціальних заходів деякі похідні 3-хінолінкарбоксаміду формули (І) розкладаються з неприпустимою швидкістю. При зберіганні в умовах прискореного старін ня, а саме при температурі 40 °С і відносній вологості 75 %, розкладання деяких похідних 3хінолінкарбоксаміду за період 6 місяців може перевищувати 2 % (табл. 1). Хоча швидкість розкладання похідних 3-хінолінкарбоксаміду формули (І) за нормальних умов зберігання є меншою, в будьякому випадку бажаним є одержати фізичну форму похідного 3-хінолінкарбоксаміду з покращеною стабільністю. 11 90463 12 Несподівано було виявлено, що похідні 3хінолінкарбоксаміду формули (І) при перетворенні на сіль з одно- або полівалентним катіоном металу структурної формули (II) де n являє собою ціле число 1, 2 або 3; Аn+ являє собою одно- або полівалентний катіон металу, вибраний з LI+, Na+, К+, Mg2+, Ca2+, Mn2+, Cu2+, Zn2+, Al3+ і Fe3+; R являє собою С1-С3-алкіл або -алкеніл з розгалуженим або нерозгалуженим ланцюгом, або циклічний С3-С4-алкіл; R5 являє собою насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-аклкіл, С1-С4-алкілтіо з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілтіо, С1-С4алкілсульфініл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкілсульфініл, фтор, хлор, бром, трифторметил або трифторметокси; і R6 являє собою водень; або R5 та R6 разом являють собою метилендіокси; R' являє собою водень, насичений або ненасичений С1-С4-алкіл або -алкеніл з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4алкіл, С1-С4-алкокси з нерозгалуженим або розгалуженим ланцюгом, циклічний С3-С4-алкокси, фтор, хлор, бром або трифторметил; і R'' являє собою водень, фтор або хлор, за умови, що R'' являє собою фтор або хлор тільки тоді, коли R' являє собою фтор або хлор; мають підвищену стабільність в порівнянні з відповідною нейтральною формою 3хінолінкарбоксамідів формули (І). Переважну групу солей 3-хінолінкарбоксаміду формули (II) складають ті, в яких Аn+ являє собою Li+, Na+ та Са2+. Іншу переважну групу солей 3хінолінкарбоксаміду формули (II) складають солі, слабко розчинні у воді, в тому числі солі Са2+, Zn2+ і Fe3+. Сіль 3-хінолінкарбоксаміду формули (II) виготовляють шляхом реакції 3-хінолінкарбоксаміду формули (І) з сіллю одно- або полівалентного металу. Приклади таких солей та умов реакції наведені нижче. Загалом, розчинність солей формули (II) у воді вища за розчинність солей з одновалентними катіонами, наприклад, сіль натрію або ка лію, в порівнянні з солями полівалентних катіонів, наприклад, сіль кальцію, цинку, міді (II) або заліза (III). Як приклад, натрієві солі легко розчиняються у воді, але мають обмежену розчинність в менш полярних розчинниках, наприклад, у хлороформ. І навпаки, сіль заліза (III) є майже нерозчинною у воді, але має високу розчинність у хлороформі та низьку розчинність в метанолі. При використанні виключно водного розчинника для осадження солі полівалентного металу, наприклад, кальцієвої солі формули (II), внаслідок дуже низької розчинності у воді може утворюватися аморфний осад. Однак при підвищенні температури і додаванні органічного розчинника, який змішується з водою, наприклад, етанолу, в якому сіль має дещо вищу, але все ще обмежену розчинність, може осаджуватися кристалічна сполука. Переважно для забезпечення кристалічних сполук використовують суміші води та етанолу, які містять 10-95 % етанолу. В таких сумішах розмір частки осаду залежить від температури реакції, причому більш висока температура реакції приводить до утворення кристалів більшого розміру. Температура реакції може варіювати від 0 °С до температури кипіння із зворотним холодильником. Альтернативно, кристалічна сіль може бути виготовлена з аморфної солі шляхом змішування з розчинником, в якому кристалічна сполука має обмежену розчинність, як показано в Прикладах 4 і 7. Стабільність сполук формули (II) при зберіганні істотним чином покращується. Це очевидно з порівняння N-етил-N-феніл-5-хлор-1,2-дигідро-4гідрокси-1-метил-2-оксо-3-хінолінкарбоксаміду (в даному описі має назву сполуки А) з натрієвою сіллю N-етил-N-феніл-5-хлор-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксаміду (в даному описі має назву сполука А натрій). Хоча при температурі 40 °С та відносній вологості 75 % менше 0,01 % сполуки А натрій в твердому стані перетворюється на продукти розкладання протягом періоду 24 місяці, 0,31 % сполуки А розкладається протягом періоду 6 місяців. Іншим прикладом похідного 3-хінолінкарбоксаміду, вразливого до 13 розкладання, є N-етил-N-феніл-5-етил-1,2-дигідро4 90463 14 15 90463 16 гідрокси-1-метил-2-оксо-3-хінолінкарбоксамід (в даному описі має назву сполуки В), див. табл. 1. Таблиця 1 Стабільність похідних 3-хінолінкарбоксаміду Умови зберігання: +40 °С / відносна вологість 75 % Сполука А А натрій В Розкладання1 0,31 % 6 місяців > 6 місяців < 1 місяця 1 Розкладання наведено як відсоток підвищення вмісту споріднених сполук після 6 місяців зберігання. "Термін придатності" показує, як довго сполука може зберігатися при вказаних умовах з розкладанням не більше 0,5 %. 3 Такі ж результати отримані після 24 місяців зберігання. 2 Загалом, будь-яка тенденція до нестабільності підсилюється, якщо сполуку формули (II) змішують з різними допоміжними речовинами. Це підтверджено результатами з порівняльного дослідження, в якому сполуку А порівнювали з сполукою А на трій, які наведені в табл. 2. Очевидно, що форма солі, як субстанція лікарського засобу, є переважною в будь-яких двокомпонентних сумішах вказаної сполуки. Таблиця 2 Порівняльні дослідження стабільності сполуки А та сполуки А натрій Зразки являють собою двокомпонентні суміші (1:1) допоміжної речовини і досліджуваної субстанції. Умови зберігання: + 40 °С / відносна вологість 75 % Допоміжна речовина Мікрокристалічна целюлоза (Avicel PH-101) Крохмаль кукурудзяний Маніт (Pearlitol 200SD) Кремній колоїдний (Aerosil 200) 1 Розкладання1 (Сполука А) 1,1% 0,41 % 0,45 % 20 % Розкладання1 (Сполука А натрій) 0,31 % 0,05 % 0,05 % 1,5 % Розкладання наведено як відсоток підвищення вмісту споріднених речовин після 6 місяців зберігання. Однак при введенні в традиційні тверді фармацевтичні рецептури вказана натрієва сіль все ще розкладається з неприпустимою швидкістю з утворенням продуктів деградації в кількості більше 5 % за 6 місяців при зберіганні при температурі +40 °С та відносній вологості 75 % (табл. 3). Такий рівень вважається проблематичним. За цих умов прийнятна межа розкладання вважається менш ніж 0,5 % розкладання після 6 місяців зберігання. Ця межа вважається показовою для строку зберігання 3 роки при кімнатній температурі. З іншого боку, традиційні тверді фармацевтичні рецептури з компонентом, який має лужну реакцію, також демонструють неприпустиму швидкість розкладання. Критичним кроком є одержання однорідного розподілу на молекулярному рівні солі формули (II), компонента з лужною реакцією і всіх фармацевтичних допоміжних речовин. 17 90463 18 Таблиця 3 Дані стабільності для різних рецептур сполуки А натрій Рецептура Умови зберігання Розкладання1 3 Водний розчин від + 2 °С до + 8 °С 6 місяців 6 місяців 1 Деградація виражається як відсоток підвищення вмісту споріднених сполук після 6 місяців зберігання. "Строк зберігання" показує, як довго може зберігатися рецептура за даних умов з розкладанням вище 0,5 %. 3 Склад: сполука А натрій 1 мг, натрію гідроксид 0,112 мг, вода для ін'єкцій до 1 мл, з корекцією pH до 7,5. 4 Склад: сполука А натрій 0,3 мг (0,19 %), мікрокристалічна целюлоза 49,8 %, лактози моногідрат 48,5%, натрій кроскармеллоза 0,5 %, натрію стеарилфумарат 1 %. 5 Склад: сполука А натрій 0,3 мг (0,19 %), крохмаль прежелатинізований 66 %, маніт 29,8 %, натрію карбонат 3,0 %, натрію стеарилфумарат 1,0 %. 6 Склад: згідно Прикладу 10. 7 Утворення споріднених сполук після 2 місяців зберігання. 2 Даний винахід забезпечує композиції солі похідного 3-хінолінкарбоксаміду, причому такі композиції демонструють покращену стабільність при зберіганні, що дозволяє створення нових фармацевтичних рецептур 3-хінолінкарбоксаміду з підвищеною стабільністю при довгостроковому, щонайменше 3 роки, зберіганні при кімнатній температурі. Таким чином, вираз "похідне 3хінолінкарбоксаміду, вразливе до деградації" слід вживати для позначення субстанції з індексом реакційної здатності > 1,0 (див. Приклади, Дослідження швидкості деградації нижче). Механістичні дослідження розкладання кетену продемонстрували, що розкладання залучає внутрішньомолекулярний переніс єнольного протону в положенні 4 хінолінового кільця на атом азоту 3карбоксамідного фрагменту (Схема 1). Рекомендується одержувати стабільну дозовану форму сполуки формули (І), якщо зазначена сполука перетворюється на сіль формули (II). Однак, незважаючи на підвищену хімічну стабільність вказаної солі в твердому стані, міра нестабільності традиційних твердих дозованих форм солей формули (II) все ще лишається неприпустимою. Вважається, що причина нестабільності солей формули (II) в традиційних твердих дозованих формах пов'язана з обміном протиіону на протон в комбінації з конформацією солі в твердому стані. Рентгенівські дослідження натрієвої солі сполуки А продемонстрували, що конформація твердої солі є такою, що екзоциклічна карбонільна група відхилена в напрямку від єнольного атому кисню в положенні 4. Це приводить до відкритого шляху між атомом азоту 3-карбоксамідного фрагмента і єнольного атому натрію в положенні 4. Не прив'язуючись до будь-якої гіпотези, вважаємо, що така конформаційна властивість солей формули (II) приводить до неприпустимої швидкості розкладання в традиційних твердих дозованих формах, як тільки протиіон солі замінюється на протон, що може походити з допоміжних речовин. З викладеного вище щодо властивостей стабільності похідних 3-хінолінкарбоксаміду, очевидно, що стабільна дозована форма сполуки формули (І) утворюється, коли вказана сполука присутня і залишається у формі солі формули (II). Для клінічного застосування сіль формули (II) за даним винаходом, тобто активний інгредієнт, вводять придатним чином до твердих фармацевтичних рецептур для перорального способу введення. Ретельне запобігання будь-якого перетворення вказаної солі на нейтральну форму буде приводити до покращеної стабільності вказаних солей в процесі виробництва і під час зберігання фармацевтичної рецептури. Прикладами таких рецептур є таблетки і капсули. Звичайно кількість активного інгредієнта становить від близько 0,01 до 10 % рецептури по масі, переважно від близько 0,1 до 2 % рецептури по масі. Фармацевтичні композиції за даним винаходом містять солі формули (II) в комбінації з щонайменше одним компонентом, який інгібує розкладання активного інгредієнта, та фармацевтичних допоміжних речовин. Ці сполуки являють собою один об'єкт даного винаходу. В одному втіленні даного винаходу композиція включає компонент з лужною реакцією, який нейтралізує протони. Кількість компонента з лужною реакцією залежить від властивостей зазначеного компонента з лужною реакцією і становить від близько 0,1 до 99 % по масі рецептури, переважно від близько 1 до 20 %. pH конкретної композиції визначають додаванням 2 г композиції до 4 г води деіонізованої і далі вимірюванням pH одержаної суспензії. Переважно pH має бути близько 8. При 19 датні компоненти з лужною реакцією вибирають з натрієвих, калієвих, кальцієвих та алюмінієвих солей оцтової кислоти, вугільної кислоти, лимонної кислоти, фосфорної кислоти, сірчаної кислоти, або інших придатних слабких неорганічних або органічних кислот. В іншому втіленні композиція включає сіль з двовалентним катіоном металу, переважно кальцію ацетат, і кальцієву сіль формули (II). Будь-яка інша сіль з двовалентним катіоном металу є придатною з точки зору цільового застосування композиції, наприклад, солі цинку і марганцю. Кількість вказаної солі становить від близько 1 до 99 % по масі рецептури, в залежності від вибраної солі. Вважається, що додавання солі, яка містить двовалентний катіон металу до фармацевтичної композиції буде зменшувати дисоціацію солі формули (II) на іони. Сіль формули (II) з двовалентним протиіоном металу має обмежену розчинність. Таким чином, протонування аніону солі формули (II) пригнічується, що приводить до підвищення стабільності. Сполуки і фармацевтичні рецептури, які містять сполуки формули (II), описані вище, виробляють, як описано нижче. Для виготовлення фармацевтичних рецептур у формі дозованих одиниць для перорального введення сполуку (II) змішують з сіллю з двовалентним катіоном металу або компонентом з лужною реакцією і традиційними фармацевтичними допоміжними речовинами. Придатні допоміжні речовини можуть бути вибрані з числа твердих допоміжних речовин у вигляді порошків, наприклад, не обмежуючись ними, маніт, мікрокристалічна целюлоза, кальцію гідрофосфат, кальцію сульфат і крохмаль; зв'язуючих речовин, наприклад, полівінілпіролідон, крохмаль і гідроксипропілметилцелюлозу; дезінтегрантів, наприклад, натрій кроскармеллоза, натрій крохмаль гліколят і полівінілпіролідон, а також змащуючих агентів, наприклад, магнію стеарат, натрій стеарилфумарат, тальк і гідрогенізована рослинна олія, така як Sterotex NF. Далі суміш формують у вигляді таблеток або гранул для наповнення капсул. Згідно одного аспекту, даний винахід забезпечує спосіб виготовлення таблетки, що містить як активний інгредієнт похідне 3-хінолінкарбоксаміду з підвищеною хімічною стабільністю, за яким виробляють ядро таблетки, що містить сіль формули (II) та компонент з лужною реакцією, або сіль з двовалентним катіоном металу, а також придатні фармацевтичні допоміжні речовини. Критичною стадією є одержання ядра таблетки з рівномірним розподілом, на молекулярному рівні, компонента з лужною реакцією з метою нейтралізації всіх протонів, які дифундують з фармацевтичних допоміжних речовин, або солі з двовалентним катіоном металу з метою пригнічення дисоціації солі формули (II) на іони. Способи виробництва таблетки за винаходом є наступними: a) ядро таблетки, яке містить кальцієву сіль формули (II), виробляють шляхом розпилення розчину кальцію ацетату на суміш кальцієвої солі формули (II) і фармацевтичних допоміжних речо 90463 20 вин, грануляції суміші до належної консистенції, висушування і подальшого пресування гранулята; або b) ядро таблетки, яке містить слабко розчинну у воді сіль формули (II), виробляють шляхом розпилення розчину компонента з лужною реакцією на суміш фармацевтичних допоміжних речовин, грануляції суміші до належної консистенції, висушування, змішування з кристалічною сіллю формули (II), слабко розчинною у воді, і подальшого пресування кінцевої суміші; або c) ядро таблетки, яке містить літієву, натрієву або калієву сіль формули (II), виробляють шляхом розпилення розчину солі формули (II) і компонента з лужною реакцією на суміш фармацевтичних допоміжних речовин, грануляції суміші до належної консистенції, висушування і подальшого пресування гранулята; і d) до гранулята перед пресуванням необов'язково може бути доданий змащуючий агент; і e) до вказаного ядра необов'язково додають шар покриття з використанням традиційних фармацевтичних допоміжних речовин для покриття. Переважний спосіб виробництва таблетки за винаходом являє собою: f) ядро таблетки, яке містить натрієву сіль формули (II), виробляють шляхом розпилення розчину натрієвої солі формули (II) і компонента з лужною реакцією на суміш фармацевтичних допоміжних речовин, грануляції суміші до належної консистенції, висушування і подальшого пресування гранулята. До гранулята перед пресуванням необов'язково може бути доданий змащуючий агент, і до вказаного ядра необов'язково додають шар покриття з використанням традиційних фармацевтичних речовин для утворення покриття. Згідно іншого аспекту даний винахід забезпечує спосіб виготовлення капсули, яка містить як активний інгредієнт похідне 3-хінолінкарбоксаміду з підвищеною хімічною стабільністю. Способи виробництва капсули за винаходом є наступними: g) суміш, яка містить кальцієву сіль формули (II) виробляють шляхом розпилення розчину кальцію ацетату на суміш кальцієвої солі формули (II) і фармацевтичних допоміжних речовин, з грануляцією суміші до належної консистенції і наступним висушуванням гранулята; або h) суміш, яка містить слабко розчинну у воді сіль формули (II), виробляють шляхом розпилення розчину компонента з лужною реакцією на суміш фармацевтичних допоміжних речовин, грануляції суміші до належної консистенції, висушування гранулята і змішування з кристалічною сіллю формули (II), слабко розчинною у воді; або і) суміш, яка містить літієву, натрієву або калієву сіль формули (II), більш переважно натрієву сіль, виробляють шляхом розпилення розчину солі формули (II) та компонента з лужною реакцією на суміш фармацевтичних допоміжних речовин, грануляції суміші до належної консистенції з наступним висушуванням гранулята; j) до суміші необов'язково додають змащуючий агент; і 21 90463 k) кінцевою сумішшю наповнюють тверді желатинові капсули. Альтернативний спосіб виготовлення солі формули (II), яка далі має бути легко розчинною у воді, полягає в розчиненні відповідної сполуки формули (І) в нейтральній формі в розчині компонента з лужною реакцією, такому як натрію карбонат, з одержанням солі формули (II) на місці, та наступною обробкою за способами, описаними нижче. Приклади Наведені нижче приклади мають на меті ілюстрацію винаходу без обмеження його меж. Приклад 1 Дослідження швидкості розкладання Міру розкладання, яка в даному описі має назву індексу реакційної здатності, сполуки формули (І), визначають у розчині. Roquinimex (Merck Index 12th Ed., No. 8418; Linomide®, LS2616, N-метил-Nфеніл-1,2-дигідро-4-гідрокси-1-метил-2-оксо-3 22 хінолінкарбоксамід) вибраний як сполука порівняння, для якої визначений індекс реакційної здатності 1,0. Вибране середовище являє собою 1 % 0,01 Μ кислоту хлористоводневу в н-пропанолі. Температура реакції знаходиться в інтервалі від 45 °С до 60 °С. Похідне 3-хінолінкарбоксаміду формули (І) додають до розчину н-пропанолу. Реакція переводить сполуку в н-пропіловий ефір. Реакцію зупиняють через 0,2 і 4 год. та здійснюють аналіз за допомогою ВЕРХ з УФ-детектуванням. Для оцінки індексу реакційної здатності використовують зникнення похідного 3-хінолінкарбоксаміду, але як альтернатива також може бути використане утворення н-пропілового ефіру. Індекс реакційної здатності 1,0 відповідає швидкості розкладання 13% на годину при температурі 60 °С. Індекс реакційної здатності 2,0 відповідає швидкості розкладання 2 6% на годину і т. д. Показники реакційної здатності деяких сполук формули (І) наведені в табл. 1. Таблиця 4 Індекс реакційної здатності сполук формули (І) Сполука Roquinimex А В С D Ε F Структура по відношенню до сполуки (І) R5, R6 R', R' ' R Η Η метил 5-хлор Η етил 5-етил Η етил 5-хлор 2,4-F2 метил 5-метил 4-CF3 метил 5,6-метилендіокси Η етил 5-метилтіо Η етил Сполука А являє собою N-етил-N-феніл-5хлор-1,2-дигідро-4-гідрокси-1-метил-2-оксо-3хінолінкарбоксамід; Сполука В являє собою N-метил-N-феніл-5етил-1,2-дигідро-4-гідрокси-1-метил-2-оксо-3хінолінкарбоксамід; Сполука С являє собою N-метил-N-(2,4дифторфеніл)-5-хлор-1,2-дигідро-4-гідрокси-1метил-2-оксо-3-хінолінкарбоксамід; Сполука D являє собою N-метил-N-(4трифторфеніл)-1,2-дигідро-1,5-диметил-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксамід; Сполука Ε являє собою N-етил-N-феніл-5,6метилендіокси-1,2-дигідро-4-гідрокси-1-метил-2оксо-3-хінолінкарбоксамід; і Сполука F являє собою N-етил-N-феніл-5метилтіо-1,2-дигідро-4-гідрокси-1-метил-2-оксо-3хінолінкарбоксамід. Наступні деталізовані Приклади 2-7 служать для ілюстрації способу виробництва сполук формули (II), які використовують у фармацевтичних рецептурах за даним винаходом. Приклад 2 N-етил-N-феніл-5-хлор-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксаміду натрієва сіль; N-етил-N-феніл-5-хлор-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксамід (28 ммоль, 10,0 г) суспендують в 99,5 % етанолі (150 мл) і Індекс реакційної здатності 1,0 (визначений) 3,1 4,6 2,6 > 10 2,9 > 10 додають 5 Μ водний розчин натрію гідроксиду (28,4 ммоль, 5,68 мл). Реакційну суміш перемішують протягом 30 хвилин при кімнатній температурі. Одержаний кристалічний осад відокремлюють фільтрацією, двічі швидко промивають холодним етанолом (2 150 мл) і висушують під вакуумом над Р2О5 з одержанням названої в заголовку сполуки (9,5 г, вихід 90 %). Теоретично обчислено для C19H16ClN2O3Na : С, 60,2 ; Η, 4,26 ; Ν, 7,40. Знайдено: С, 60,4; Η, 4,20 ; Ν, 7,32. Розчинність у воді при кімнатній температурі становить 138 мг/мл. Приклад 3 N-етил-N-феніл-5-хлор-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксаміду кальцієва сіль N-етил-N-феніл-5-хлор-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксаміду натрієву сіль (2,63 ммоль, 1,0 г) розчиняють в суміші етанолу (10,5 мл) і води (5,3 мл). Розчин нагрівають до 70°С і додають розчин кальцію ацетату гідрату у воді (1 Μ розчин, 1,05 екв., 1,38 ммоль, 1,38 мл). Одержану суспензію перемішують протягом 30 хвилин, потім охолоджують і кристали відокремлюють фільтрацією, промивають водою та висушують під вакуумом (966 мг, вихід 98 %). Теоретично обчислено для С38Н32Сl2N4O6Са: С, 60,7; Н, 4,29; Ν, 7,45. Знайдено: С, 60,5; Η, 4,34; Ν, 7,41. Розчинність у воді при кімнатній температурі ста 23 90463 новить близько 1,0 мг/мл. Сіль вважається слабко розчиною у воді. Приклад 4 N-етил-N-феніл-5-хлор-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксаміду заліза (III) сіль N-етил-N-феніл-5-хлор-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксамід у натрієву сіль (5,0 г, 13,2 ммоль) розчиняють у воді (80 мл) при 40 °С і додають хлороформ (100 мл). Додають розчин заліза (III) сульфату пентагідрату (0,95 екв., 2,09 ммоль, 1,023 г) у воді (30 мл). Двохфазну систему енергійно перемішують і доводять pH водної фази до 8 за допомогою 1 Μ NaOH. Органічну фазу насиченого червоного кольору відокремлюють, висушують з натрію сульфатом і розчинники видаляють з одержанням названої в заголовку сполуки у вигляді червоної аморфної склоподібної маси (4,22 г, вихід 85 %). MS-ESI: m/z 1122 [МН] +. Склоподібну масу розчиняють в метанолі з утворенням червоних кристалів названої в заголовку сполуки. Кристали відфільтровують, промивають метанолом і висушують під вакуумом з одержанням названої в заголовку сполуки (3,96 г, вихід 80 %). Теоретично обчислено для C57H48N6O9Cl3Fe: С, 61,0; Η, 4,31; Ν, 7,48. Знайдено: С, 62,7; Η, 4,37; Ν, 7,27. Титрометричне визначення заліза (III) за допомогою ЕДТА дає вміст 4,90 % (теоретичний вміст 4,97 %). Приклад 5 N-етил-N-феніл-5-етил-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксаміду літієва сіль N-етил-N-феніл-5-етил-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксамід (4,39 ммоль, 1,539 г) суспендують в етанолі (7,5 мл) та додають розчин літію гідроксиду гідрату (1,05 екв., 4,61 ммоль, 195 г) у воді (1,5 мл). Суміш перемішують протягом 4 год. і додають етилацетат (30 мл). Після перемішування протягом 1 год. кристали відфільтровують, промивають етилацетатом і висушують під вакуумом з одержанням названого в заголовку продукту (1,31 г, вихід 84 %). Теоретично обчислено для C21H21N2O3Li: С, 70,8; Η, 5,94; Ν, 7,86. Знайдено: С, 70,5; Η, 5,22; Ν, 8,01. Розчинність у воді при кімнатній температурі становить 18 мг/мл. Приклад 6 Тверді допоміжні речовини Рідина для грануляції Кінцева суміш 1 2 24 N-етил-N-феніл 5-етил-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксаміду кальцієва сіль N-Етил-N-феніл-5-етил-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксамід (95,0 г, 14,2 ммоль) розчиняють в суміші 1 Μ NaOH (14,26 ммоль, 14,26 мл) та етанолу (30 мл), та доводять pH до 7,5. Розчин нагрівають до 70 °С і по краплях протягом 5 хв. додають кальцію ацетат гідрат (1,05 екв., 7,5 ммоль, 1,335 г) у воді (7 мл). Нагрівання припиняють і суміш перемішують при кімнатній температурі протягом 1 год., кристали відфільтровують, промивають сумішшю етанол/вода 1:1 і висушують під вакуумом з утворенням названої в заголовку сполуки (5,16 г, вихід 98 %). Теоретично обчислено для C42H42N4O6Ca: С, 68,3; Η, 5,73; Ν, 7,58. Знайдено: С, 68,4; Η, 5,72; Ν, 7,63. Титрометричне визначення кальцію за допомогою ЕДТА дає вміст 5,42 % (теоретичний вміст 5,42 %). Розчинність у воді при кімнатній температурі становить 0,3 мг/мл. Приклад 7 N-етил-N-феніл-5-етил-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксаміду цинкова сіль N-етил-N-феніл-5-етил-1,2-дигідро-4-гідрокси1-метил-2-оксо-3-хінолінкарбоксамід (1,0 г, 2,85 ммоль) розчиняють у суміші 1 М NaOH (2,95ммоль, 2,95мл) і етанолу (6,0мл). Додають хлороформ (20 мл) і воду (40 мл) з наступним додаванням цинку ацетату дигідрату (3,0ммоль, 660 мг). Двохфазну суміш енергійно перемішують протягом 10 хв., органічну фазу відокремлюють і висушують з натрію сульфатом, розчинники видаляють. Залишок перекристалізують з метанолу з одержанням названої в заголовку сполуки (823 мг, вихід 76 %). Теоретично обчислено для C42H42N4O6Zn: С, 66,01; Η, 5,54; Ν, 7,33. Знайдено: С, 65,4; Η, 5,68; Ν, 7,29. Титрометричне визначення цинку за допомогою ЕДТА дає вміст 8,45 % (теоретичний вміст 8,56 %). Розчинність у воді при кімнатній температурі становить 0,3 мг/мл. Приклад 8 Опис виробництва Виготовляють фармацевтичну рецептуру за даним винаходом в формі капсул наступного складу: Гранулят 0,17 % Маніт Натрію карбонат Сполука А натрій1 Натрію карбонат Вода (13,3 % від кількості твердих допоміжних речовин) Капсули Гранулят сполуки А натрій 0,17 % Натрію стеарилфумарат Вказана вище сполука може бути замінена на іншу сполуку за даним винаходом. Воду видаляють в ході висушування. 96,8 % 3,00 % 0,18 % 0,03 % немає2 99,0 % 1,00 % 25 90463 Сполуку А натрій розчиняють у водному розчині натрію карбонату і гранулюють шляхом вологої грануляції разом з манітом та додатковою кількістю натрію карбонату. На стадії грануляції присутні всі необхідні для заповнення капсули допоміжні речовини, за винятком змащувача. Одержаний гранулят висушують традиційним способом і пропускають крізь сито придатного розміру. Сухі гранули ретельно перемішують з натрію стеарил Тверді допоміжні речовини Рідина для грануляції 1 2 26 фумаратом та одержаною сумішшю заповнюють капсули. Капсули містять придатні кількості активного інгредієнта. Приклад 9 Опис виробництва Виготовляють фармацевтичну рецептуру за даним винаходом в формі капсул наступного складу: Гранулят 0,18 % Сполука В кальцій1 Маніт Мікрокристалічна целюлоза Кальцію ацетат Вода (50,0 % від кількості твердих допоміжних речовин) 0,19 % 65,0 % 32,0 % 3,00 % немає2 Вказана вище сполука може бути замінена на іншу сполуку за даним винаходом. Воду видаляють в ході висушування. Виготовляють премікс сполуки В кальцій, маніту і мікрокристалічної целюлози. Здійснюють вологу грануляцію преміксу з водним розчином кальцію ацетату. На стадії грануляції присутні всі допоміжні речовини, необхідні для заповнення капсул. Одержаний гранулят висушують традиційним способом і пропускають крізь сито придатного розміру. Сухими гранулами заповнюють капсули. КапТверді допоміжні речовини Рідина для грануляції сули містять придатні кількості активного інгредієнта. Приклад 10 Опис виробництва Виготовляють фармацевтичну рецептуру за даним винаходом в формі таблеток наступного складу: Гранулят 0,19 % Маніт Крохмаль прежелатинізований Натрію карбонат Сполука А натрій1 Натрію карбонат Вода (35,8 % від кількості твердих допоміжних речовин) Таблетки Гранулят сполуки А натрій0,19 % Натрію стеарилфумарат Суспензія для покриття Опадри 03В28796 білий 30,0 % 66,8 % 2,84 % 0,20 % 0,20 % немає2 93,1 % 0,94 % 6,00 % 1 Вказана вище сполука може бути замінена на іншу сполуку за даним винаходом. 2 Воду видаляють в ході висушування. Сполуку А натрій розчиняють у водному розчині натрію карбонату і здійснюють вологу грануляцію разом з манітом, крохмалем прежелатинізованим та додатковою кількістю натрію карбонату. На стадії грануляції присутні всі необхідні для таблетування допоміжні речовини, за винятком змащувача. Одержаний гранулят висушують традиційним способом і пропускають крізь сито придатного розміру. Сухі гранули ретельно пере мішують з натрію стеарилфумаратом та одержану суміш пресують у таблетки. Таблетки покривають плівкою Опадри 03В28796 білого. Таблетки містять придатні кількості активного інгредієнта. Приклад 11 Опис виробництва Виготовляють фармацевтичну рецептуру за даним винаходом в формі таблеток наступного складу: 27 Тверді допоміжні речовини Рідина для грануляції 1 2 90463 28 Гранулят 0,18 % Маніт Мікрокристалічна целюлоза Сполука А натрій1 Натрію карбонат Натрію гідрокарбонат Вода (50,0 % від кількості твердих допоміжних речовин) Таблетки Гранулят сполуки А натрій 0,18 % Натрію стеарилфумарат 32,0 % 65,8 % 0,20 % 0,20 % 1,80 % немає2 99,0 % 1,00 % Вказана вище сполука може бути замінена на іншу сполуку за даним винаходом. Воду видаляють в ході висушування. Сполуку А натрій розчиняють у водному розчині суміші натрію карбонату/натрію гідрокарбонату і здійснюють вологу грануляцію разом з манітом та мікрокристалічною целюлозою. На стадії грануляції присутні всі необхідні для таблетування допоміжні речовини, за винятком змащувача. Одержаний гранулят висушують традиційним способом і пропускають крізь сито придатного розміру. Сухі гранули ретельно перемішують з натрію стеарилТверді допоміжні речовини Рідина для грануляції фумаратом та одержану суміш пресують у таблетки. Таблетки покривають плівкою Опадри 03В28796 білого. Таблетки містять придатні кількості активного інгредієнта. Приклад 12 Опис виробництва Виготовляють фармацевтичну рецептуру за даним винаходом в формі таблеток наступного складу: Гранулят 0,18 % Маніт Кальцію сульфат дигідрат Натрію карбонат 1 Сполука А натрій Натрію карбонат Вода (6,7 % від кількості твердих допоміжних речовин) Таблетки Гранулят сполуки А натрій 0,18 % Натрію стеарилфумарат 48,5 % 48,3 % 3,02 % 0,19 % 0,01 % немає2 99,0 % 1,00 % 1 Вказана вище сполука може бути замінена на іншу сполуку за даним винаходом. 2 Воду видаляють в ході висушування. Сполуку А натрій розчиняють у водному розчині натрію карбонату і здійснюють вологу грануляцію разом з манітом, кальцію сульфату дигідрату і додатковою кількістю натрію карбонату. На стадії грануляції присутні всі необхідні для таблетування допоміжні речовини, за винятком змащу Комп’ютерна верстка Л.Литвиненко вача. Одержаний гранулят висушують традиційним способом. Сухі гранули ретельно ють з натрію стеарилфумаратом та одержану міш пресують у таблетки. Таблетки містять придатні кількості активного інгредієнта. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition containing quinoline compounds
Автори англійськоюJansson Karl, Fristedt Tomas, Waennman Hans, Bjoerk Anders
Назва патенту російськоюКомпозиция, содержащая соединения хинолина
Автори російськоюЯнссон Карл, Фристедт Томас, Веннман Ханс, Бйорк Андерс
МПК / Мітки
МПК: A61K 31/00
Мітки: композиція, хіноліну, сполуки, містить
Код посилання
<a href="https://ua.patents.su/14-90463-kompoziciya-shho-mistit-spoluki-khinolinu.html" target="_blank" rel="follow" title="База патентів України">Композиція, що містить сполуки хіноліну</a>
Попередній патент: Вуглецевий матеріал, спосіб його одержання, застосування, дисперсія вуглецевого матеріалу, спосіб її одержання та застосування
Наступний патент: Підошва для взуття та взуття з такою підошвою
Випадковий патент: Джерело вторинного електроживлення з імпульсним регулюванням












