Похідні мигдалевої кислоти та їх використання як інгібіторів тромбіну
Формула / Реферат
1. Сполука формули І:
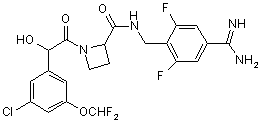 (I)
(I)
або її фармацевтично прийнятна похідна.
2. Фармацевтично прийнятна похідна сполуки формули І за п. 1, яка має формулу Iа:
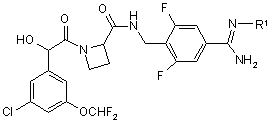 , Ia
, Ia
де R1 - OR2 або C(O)OR3; a
R2 - Н, С1-10алкіл, С1-3алкіларил або С1-3алкілоксіарил (алкільні частини останніх двох груп, як варіант, перервані одним або більше атомами оксигену, а арильні частини цих груп, як варіант, заміщені одним або більше замісниками, вибраними з галогену, фенілу, метилу або метоксилу, причому три останні групи також, як варіант, заміщені одним або більше галогеновими замісниками); і
R3 – С1-10алкіл (ця група, як варіант, перервана одним або більше атомами оксигену) або С1-3алкіларил або С1-3алкілоксіарил (алкільні частини цих двох груп, як варіант, перервані одним або більше атомами оксигену, арильні частини цих груп, як варіант, заміщені одним або більше замісниками, вибраними з галогену, фенілу, метилу або метоксилу, причому три останні групи також, як варіант, заміщені одним або більше галогеновими замісниками);
і її фармацевтично прийнятна похідна.
3. Сполука за п. 2, яка відрізняється тим, що R1 - OR2.
4. Сполука за п. 3, яка відрізняється тим, що R2 - Н або незаміщений лінійний, розгалужений або циклічний С1-8алкіл.
5. Сполука за п. 4, яка відрізняється тим, що R2 - Н або С1-6алкіл.
6. Сполука за п. 4, яка відрізняється тим, що R2 - лінійний С1-3алкіл, розгалужений С3-8алкіл або циклічний С4-7алкіл.
7. Сполука за п. 5 або п. 6, яка відрізняєтьсятим, що R2 - метил, етил, n-пропіл, i-пропіл або циклобутил.
8. Сполука за п. 7, яка відрізняється тим, що R2 - метил.
9. Сполука за будь-яким з пп. 1 - 8, яка відрізняється тим, що фрагмент
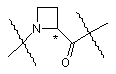
має S-конфігурацію.
10. Сполука за будь-яким з пп. 1 - 9, яка відрізняється тим, що фрагмент
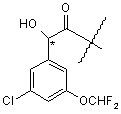
має R-конфігурацію.
11. Сполука за п. 1, яка відрізняється тим, що нею є Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6-diF).
12. Сполука за п. 2, яка відрізняється тим, що нею є
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6-diF)(OMe) aбo
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6-diF)(OH).
13. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1 - 12 або її фармацевтично прийнятну похідну, у суміші з фармацевтично прийнятним наповнювачем, розріджувачем або носієм.
14. Сполука за будь-яким з пп. 1-12 або її фармацевтично прийнятна похідна, призначена для використання у фармацевтиці.
15. Сполука за будь-яким з пп. 1-12 або її фармацевтично прийнятна похідна, призначена для використання при лікуванні стану, що потребує інгібування тромбіну.
16. Сполука за будь-яким з пп. 1-12 або її фармацевтично прийнятна похідна, призначена для використання при лікуванні стану, що потребує антикоагуляційної терапії.
17. Сполука за будь-яким з пп. 1 - 12 або її фармацевтично прийнятна похідна, призначена для використання при лікуванні тромбозу.
18. Сполука за будь-яким з пп. 1 - 12 або її фармацевтично прийнятна похідна, призначена для використання як антикоагулянту.
19. Використання сполуки за будь-яким з пп. 1-12 або її фармацевтично прийнятної похідної як активного інгредієнта для виготовлення медикаменту для лікування стану, що потребує інгібування тромбіну.
20. Використання сполуки за будь-яким з пп. 1-12 або її фармацевтично прийнятної похідної як активного інгредієнта для виготовлення медикаменту для лікування стану, що потребує антикоагуляційної терапії.
21. Використання за п. 19 або п. 20, яке відрізняється тим, що станом є тромбоз.
22. Використання за п. 19 або п. 20, яке відрізняється тим, що станом є гіперкоагуляція у крові і/або тканинах.
23. Використання сполуки за будь-яким з пп. 1-12 або її фармацевтично прийнятної похідної як активного інгредієнта для виготовлення антикоагулянту.
Текст
УКРАЇНА UA (19) (11) 75937 (13) C2 (51) МПК (2006) C07D 205/00 A61K 31/397 A61P 7/02 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) ПОХІДНІ МИГДАЛЕВОЇ КИСЛОТИ ТА ЇХ ВИКОРИСТАННЯ ЯК ІНГІБІТОРІВ ТРОМБІНУ NH2 F Cl OCHF (I) або її фармацевтично прийнятна похідна. 2. Фармацевтично прийнятна похідна сполуки формули І за п.1, яка має формулу Iа: 2 O HO H N F R1 NH2 має S-конфігурацію. 10. Сполука за будь-яким з пп.1-9, яка відрізняється тим, що фрагмент O OCHF2 , Ia де R - OR або C(O)OR ; a R2 - Н, С1-10алкіл, С1-3алкіларил або С13алкілоксіарил (алкільні частини останніх двох груп, як варіант, перервані одним або більше атомами оксигену, а арильні частини цих груп, як варіант, заміщені одним або більше замісниками, вибраними з галогену, фенілу, метилу або метоксилу, причому три останні групи також, як варіант, заміщені одним або більше галогеновими замісниками); і R3 – С1-10алкіл (ця група, як варіант, перервана одним або більше атомами оксигену) або С13алкіларил або С1-3алкілоксіарил (алкільні частини цих двох груп, як варіант, перервані одним або більше атомами оксигену, арильні частини цих 1 2 * O N N Cl N F (11) O HO 3 * Cl C2 NH N (13) F H N OCHF2 має R-конфігурацію. 11. Сполука за п.1, яка відрізняється тим, що нею є Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)AzePab(2,6-diF). 12. Сполука за п.2, яка відрізняється тим, що нею є Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6diF)(OMe) aбo Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6diF)(OH). 13. Фармацевтична композиція, що містить сполуку за будь-яким з пп.1-12 або її фармацевтично UA O O HO груп, як варіант, заміщені одним або більше замісниками, вибраними з галогену, фенілу, метилу або метоксилу, причому три останні групи також, як варіант, заміщені одним або більше галогеновими замісниками); і її фармацевтично прийнятна похідна. 3. Сполука за п.2, яка відрізняється тим, що R1OR2. 4. Сполука за п.3, яка відрізняється тим, що R2-Н або незаміщений лінійний, розгалужений або циклічний С1-8алкіл. 5. Сполука за п.4, яка відрізняється тим, що R2-Н або С1-6алкіл. 6. Сполука за п.4, яка відрізняється тим, що R2лінійний С1-3алкіл, розгалужений С3-8алкіл або циклічний С4-7алкіл. 7. Сполука за п.5 або п.6, яка відрізняється тим, що R2 - метил, етил, n-пропіл, i-пропіл або циклобутил. 8. Сполука за п.7, яка відрізняється тим, що R2метил. 9. Сполука за будь-яким з пп.1-8, яка відрізняється тим, що фрагмент (19) (21) 2004020839 (22) 30.08.2002 (24) 15.06.2006 (86) PCT/SE02/01557, 30.08.2002 (31) 0102921-4 (32) 30.08.2001 (33) SE (31) PCT/SE01/02657 (32) 30.11.2001 (33) SE (46) 15.06.2006, Бюл. № 6, 2006 р. (72) Інґгардт Тод, SE, Йоханссон Андерс, SE, Свенссон Арне, SE (73) АСТРАЗЕНЕКА АБ, SE (56) WO 0042059 A1, 20.07.2000 WO 9702284 A1, 23.01.1997 (57) 1. Сполука формули І: 2 75937 1 3 75937 4 прийнятну похідну, у суміші з фармацевтично при19. Використання сполуки за будь-яким з пп.1-12 йнятним наповнювачем, розріджувачем або носіабо її фармацевтично прийнятної похідної як актиєм. вного інгредієнта для виготовлення медикаменту 14. Сполука за будь-яким з пп.1-12 або її фармадля лікування стану, що потребує інгібування троцевтично прийнятна похідна, призначена для вимбіну. користання у фармацевтиці. 20. Використання сполуки за будь-яким з пп.1-12 15. Сполука за будь-яким з пп.1-12 або її фармаабо її фармацевтично прийнятної похідної як актицевтично прийнятна похідна, призначена для вивного інгредієнта для виготовлення медикаменту користання при лікуванні стану, що потребує інгідля лікування стану, що потребує антикоагуляційбування тромбіну. ної терапії. 21. Використання за п.19 або п.20, яке відрізня16. Сполука за будь-яким з пп.1-12 або її фармається тим, що станом є тромбоз. цевтично прийнятна похідна, призначена для ви22. Використання за п.19 або п.20, яке відрізнякористання при лікуванні стану, що потребує антиється тим, що станом є гіперкоагуляція у крові коагуляційної терапії. 17. Сполука за будь-яким з пп.1-12 або її фармаі/або тканинах. цевтично прийнятна похідна, призначена для ви23. Використання сполуки за будь-яким з пп.1-12 користання при лікуванні тромбозу. або її фармацевтично прийнятної похідної як акти18. Сполука за будь-яким з пп.1-12 або її фармавного інгредієнта для виготовлення антикоацевтично прийнятна похідна, призначена для вигулянту. користання як антикоагулянту. Винахід стосується нових фармацевтично цінних сполук, зокрема, сполук, які є і/або метаболізуються у сполуки, що є конкурентними інгібіторами трипсиноподібних протеаз серину, зокрема, тромбіну, їх використання як медикаментів, фармацевтичних композицій, що містять їх, і їх синтезу. Коагуляція крові є ключовим процесом, що проходить як при гемостазі (тобто запобіганню втрати крові з пошкодженої судини), так і при тромбозі (тобто утворенні кров'яних згустків у кров'яній судині, що іноді призводить до її закупорки). Коагуляція є результатом складної послідовності ензимних реакцій. Однією з вирішальних стадій цієї послідовності є перетворення проензимного протромбіну у активний ензимний тромбін. Відомо, що тромбін грає центральну роль у коагуляції. Він активує бляшки, що призводить до їх агрегування, перетворює фібриноген у фібринові мономери, які спонтанно полімеризуються у фібринові полімери, і активує фактор XIII, який викликає формування у цих полімерах поперечних зв'язків з утворенням нерозчинного фібрину. Крім того, тромбін активує фактор V і фактор VIII, створюючи "позитивний зворотний зв'язок" при утворенні тромбіну з протромбіну. Можна сподіватись, що результатом інгібування агрегування бляшок і формування поперечних зв'язків у фібрині ефективним інгібітором тромбіну буде виникнення антитромботичної дії. Крім того, можна сподіватись, що антитромботична активність буде підсилена ефективним інгібуванням механізму позитивного зворотного зв'язку. Ранні дослідження низькомолекулярних інгібіторів були [описані у Claesson, Blood Coagul. Fibrinol. (1994) 5, 411. Blomback et al., J. Clin. Lab. Invest. 24, suppl. 107, 59, (1969)] описали інгібітори тромбіну, базовані на амінокислотній послідовності, розташованій навколо кливажного сайту для фібриногенового ланцюга Аа. Ці автори вважають, що серед згаданих амінокислотних послідовностей найбільш ефективним інгібітором є трипептидна послідовність Phe-Val-Arg (P9-P2-P1, яку далі позначено як послідовність РЗ-Р2-Р1). Інгібітори тромбіну, базовані на похідних дипептидилу з α,ω-аміноалкілкуанідином у Р1-позиції, відомі [з патенту США 4 346 078 і міжнародної заявки WO 93/11152]. Були також описані схожі, структурно близькі похідні дипептидилу. Наприклад, [у міжнародній заявці WO 94/29336] описано сполуки з, наприклад, амінометилбензамідинами, циклічними аміноалкіламідинами і циклічними аміноалкілгуанідинами у Р1-прозиції [у заявці WO 97/23499], описано проліки деяких з цих сполук; [у європейській заявці 0 648 780], описано сполуки з, наприклад, циклічними аміноалкілгуанідинами у Р1-позиції. Інгібітори тромбіну, базовані на похідних пептидилу, також мають циклічні аміноалкілгу-анідини (наприклад, 3або 4-амінометил-1амідинопіперидин) у Р1-позиції, описано [у європейських заявках 0 468 231, 0 559 046 і 0 641 779]. Інгібітори тромбіну, базовані на похідних трипептидилу з аргінінальдегідом у Р1-позиції були вперше [описані європейській заявці 0 185 390]. Пізніше були описані базовані на аргінінальдегіді похідні пептидилу, модифіковані у Р3-позиції. Наприклад, [у міжнародній заявці WO 93/18060] описано гідроксикислоти, [у європейській заявці 0 526 877] - дезамінокислоти, і [у європейській заявці 0 542 525 0] - метилмигдалевої кислоти у Р3позиції. Відомі також інгібітори протеаз серину (наприклад, тромбіну), базовані на електрофільних кетонах у Р1-позиції. Наприклад, [у європейській заявці 0 195 212] описано пептидил-α-кетонові естери і аміди, [у європейській заявці 0 362 002] - флуоралкіламідкетони, [у європейській заявці 0 364 344] α,β,δ-трикетосполуки і [у європейській заявці 0 530 167] - α-алкоксикетонові похідні аргініну у Р1позиції. 5 75937 6 [У європейській заявці 0 293 881] описано інші, відмінні за структурою, інгібітори трипсиноподібних протеаз серину, базовані на С-термінальних борIV нокислотних похідних аргініну і ізотіоуронію і їх аналогах. Пізніше [у європейській заявці 0 669 317 і міжнародних заявках WO 95/35309, WO 95/23609, WO з сполукою формули V: 96/25426, WO 97/02284, WO 97/46577, WO 96/32110, WO 96/31504, WO 96/03374, WO V 98/06740, WO 97/49404, WO 98/57932, WO 99/29664, WO 00/35869 і WO 00/42059] були описані інгібітори тромбіну, базовані на похідних пепнаприклад, в умовах, описаних для операції тидилу. (і); або Зокрема, [у WO 97/02284 і WO 00/42059] опи(ііі) реакція відповідної сполуки формули XVI з сано інгібітори тромбіну з заміщеними мигдалевипридатним джерелом амонію (наприклад, ацетами кислотами у Р3-позиції. том амонію або газоподібним амонієм) в умовах, Однак, існує потреба у ефективних інгібіторах відомих фахівцям, наприклад, реакцією етилімідотрипсиноподібних протеаз серину, наприклад, атного інтермедіату (утвореного реакцією сполуки тромбіну. Існує також потреба у сполуках з сприяформули XVI з газом НСІ в етанолі) з газоподібним тливим фармакокінетичним профілем, які є селекамонієм в етанолі або в умовах, описаних [у Теmтивними інгібіторами тромбіну і інших протеаз сеpahedron Lett. 40, 7067 (1999)] (цей документ рину, зокрема таких, що беруть участь у гемостазі. включено в опис посиланням). Сполуки, що проявляють конкурентну інгібіторну Сполуки формули II можна одержати, викориактивність до тромбіну, можуть виявитись особлистовуючи відомі і/або стандартні способи. во корисними як антикоагулянти і, отже, при тераНаприклад, сполуки формули II можна одерпевтичному лікуванні тромбозу і споріднених зажати через реакцію альдегіду формули VI, хворювань. Винахід стосується сполуки формули І: VI I III з: (a) сполукою формули VII: R"CN VII де R" - Η або (CH3)3Si, наприклад, при кімнатній або підвищеній температурі (наприклад, до 100°С) у присутності придатного органічного розчинника (наприклад, хлороформу або метиленхлориду) і, якщо необхідно, у присутності належної основи (наприклад, TEA) і/або придатної каталітичної системи (наприклад, бензиламоній-хлориду або іодиду цинку або з використанням хірального каталізатора, наприклад, [описаного у Chem. Rev., (1999) 99, 3649]), з подальшим гідролізом в умовах, відомих фахівцям (наприклад, як описано нижче); (b) NaCN або KCN, наприклад, у присутності NaHSO3 і води, з подальшим гідролізом; (c) хлороформом, наприклад, при підвищеній температурі (наприклад, вище кімнатної і нижче 100°С) у присутності придатного органічного розчинника (наприклад, хлороформу) і, якщо необхідно, у присутності придатної каталітичної системи (наприклад, бензиламонійхлориду), з подальшим гідролізом; (d) сполукою формули VIII, наприклад, у присутності сполучаючого агента (наприклад, оксалілхлориду у ДМФ, ЕДК, ДЦК, ГФБУ, ГФТУ, ГФБТФ або ТФТУ), належної основи (наприклад, піридину, ДМАП, TEA, 2,4,6-колідину або ДІПЕА) і придатного органічного розчинника (наприклад, ДХМ, ацетонітрилу, ЕtOАс або ДМФ); (іі) з'єднання сполуки формули IV, де Μ - Mg або Li, з подальшим окиснювальним розщепленням (наприклад, озонолізом або з каталізом осмієм або рутенієм) в умовах, добре відомих фахівцям; або (e) трис(метилтіо)метаном в умовах, добре відомих фахівцям, з подальшим гідролізом у присутності наприклад, НgО і HBF4. (тобто Ph(3-CI)(5-OCHF2)-CH(OH)C(O)-AzePab(2,6-diF)) або її фармацевтично прийнятної похідної. Термін "фармацевтично прийнятна похідна" включає фармацевтично прийнятні солі (наприклад, кислотно-адитивні солі) Список абревіатур наведено після опису. Сполуки формули І можна приготувати згідно с методами, добре відомими фахівцям, наприклад, як це описано нижче. Ще одним об'єктом винаходу є спосіб приготування сполуки формули І, який включає операції: (і) з'єднання сполуки формули II, II з сполукою формули III, VIII 7 75937 У іншому варіанті сполуки формули II можна одержати окисненням сполуки формули IX, IX або її похідної, як варіант, захищеної у вторинній гідроксильній групі у присутності придатного окиснювача (наприклад, комбінації придатної окиснювальної вільної основи (наприклад, ТМПО) і належної гіпохлоритної солі (наприклад, гіпохлориту натрію), в умовах, відомих фахівцям, наприклад, між -10°С і кімнатною температурою, у присутності, належного розчинника (наприклад, води, ацетону або їх суміші), належної солі (наприклад, галогеніду лужного металу, наприклад, броміду калію) і придатної основи (наприклад, карбонату або гідрокарбонату лужного металу, наприклад, гідрокарбонату натрію). Енантіомерично чисті форми сполук формули II (тобто сполуки з різними конфігураціями замісників при С-атомі α- у групі СО2Н) можуть бути розділені операцією енантіоселективної деривації. Це можна здійснити за допомогою ензимного процесу. Такі процеси включають, наприклад, трансестерифікацію групи α-ОН при температурі між кімнатною і температурою флегми (наприклад, 4565°С) у присутності належного ензиму (наприклад, Lipase PS Amano), належного естеру (наприклад, вінілацетату) і придатного розчинника (наприклад, метил-трет-бутилового етеру). Далі дериватизований ізомер може бути ізольований від ізомеру, що не реагував, звичайними методами розділення (наприклад, хроматографією). Групи, додані до сполук формули II такою дериватизацією, можуть бути видалені або перед подальшими реакціями, або на будь-якій подальшій стадії синтезу сполук формули І. Ці додаткові групи можна видалити, використовуючи відомі способи (наприклад, для естерів групи α-ОН - гідролізом в умовах, відомих фахівцям (наприклад, при температурах між кімнатною і температурою флегми у присутності належної основи (наприклад, NaOH) і відповідного розчинника (наприклад, МеОН, води або їх суміші). Сполуки формули III можна приготувати, з'єднуючи ацетидин-2-карбонову кислоту з сполукою формули V, як це було описано вище, наприклад, в умовах, подібним визначеним для приготування сполук формули І. Сполуки формули IV можна приготувати, з'єднуючи сполуку формули II, як це було визначено вище, з ацетидин-2-карбоновою кислотою, наприклад, в умовах, подібним визначеним для приготування сполук формули І. Сполуку формули VI можна одержати, використовуючи відомі і/або стандартні методи, наприклад: (і) металізацією (металом може бути, наприклад, лужний метал, наприклад, Li або, бажано, двовалентний метал, наприклад, Мg) сполуки формули X: 8 X де Hal - атом галогену (СІ, Вr або І), з подальшою реакцією з придатним джерелом формільної групи (наприклад, Ν,Ν-ДМФ), наприклад, в умовах, описаних нижче; (іі) відновленням сполуки формули XI: XI у присутності належного відновлювача (наприклад, ГДБА); або (ііі) окисненням сполуки формули XII, XII у присутності належного окиснювача (наприклад, МnО2, піридинхлорхромату, суміші ДМСО і оксалілхлориду або SО3-піридинового комплексу у ДМСО). Сполуки формули IX можна приготувати дигідроксилюванням відповідної сполуки формули XIII XIII у присутності належного дигідроксилювального агента (наприклад, реагента або суміші реагентів, які є джерелом OsO4, наприклад, AD-mix-α або, зокрема, AD-mix-β), наприклад, в умовах, відомих фахівцям, наприклад, між -10°С і кімнатною температурою у присутності відповідного розчинника (наприклад, води, трет-бутанолу або їх суміші). Якщо використовувати асиметричні окиснювачі, наприклад, AD-mix-α або AD-mix-β, цей спосіб можна використати для приготування сполук формули IX з специфічною конфігурацією груп (тобто R або S) при атомах С, до яких приєднані первинні і вторинні гідроксильні групи. Сполуку формули XIII можна приготувати реакцією відповідної сполуки формули X (див. вище) з придатним джерелом вінілового аніону (наприклад, трибутил(вініл)олова) в умовах, відомих фахівцям, наприклад при температурах від кімнатної до температури флегми (наприклад, 50°С) у присутності належного розчинника (наприклад, толуолу), придатного сполучаючого агента (наприклад, координатного комплексу паладію(0), наприклад, тетракіс(трифенілфосфін)паладію(0)), як варіант, у присутності належного каталізатора (наприклад, 2,6-ди-трет-бутил-4-метилфенолу). Сполуки формул V, VII, VIII, X, XI, XII і ацетидин-2-карбонову кислоту або можна придбати, або вони відомі з літератури, або можуть бути отримані методами, схожими на описані тут, або звичайними стандартними процедурами синтезу з доступних вихідних матеріалів з використанням належних реагентів і у належних реакційних умо 9 75937 10 вах. Одержання сполук формули XVI розглядаєтьцих двох груп, як варіант, перервані одним або ся нижче. більше атомами оксигену, арильні частини цих Замісники на фенільному кільці у сполуках груп, як варіант, заміщені одним або більше замісформул І, II, III, IV, V, VI, IX, X, XI, XII і XIII можуть никами, вибраними серед галогену, фенілу, метибути введені з використанням способів, відомих лу або метоксилу, причому три останні групи тафахівцям, через стандартне взаємне перетворенкож, як варіант, заміщені одним або більше ня функціональних груп, з доступних вихідних магалогеновими замісниками); теріалів з використанням належних реагентів і у і їх фармацевтично прийнятні похідні. належних реакційних умовах. Термін "фармацевтично прийнятні похідні" Наприклад, сполуки формул І, II, IV, VI, X, XI і сполуки формули Іа включає фармацевтично приXII можна приготувати з сполук, відповідних сполуйнятні солі (наприклад, кислотно-адитивні солі). кам, у яких замість групи -OCHF2 знаходиться груАлкілоксиарильні групи, що можуть бути репа -ОН (вони називаються далі "відповідними фепрезентовані R2 і R3, включають алкільні і арильні нольними препаративними сполуками"), групи, зв'язані через атом атом оксигену. Алкіланаприклад реакцією такої відповідної фенольної рильна і алкілоксиарильна групи мають зв'язок з препаративної сполуки з відповідним флуоринорештою молекули через алкільні частини цих груп, ваним галогеноалканом (наприклад, CICHF2), наякі можуть бути (якщо є достатня кількість (тобто приклад, при кімнатній температур або вище (на3) атомів карбону) розгалуженими ланцюгами. приклад, при температурі флегми) у присутності Арильні частини алкіларилу і алкілоксиарильні належної основи (наприклад, трет-бутоксиду кагрупи, що можуть бути репрезентовані R2 і R3, або лію, КОН або NaOH, наприклад, у водному розчибути заміщені, включають карбоциклічні і гетероні) і придатному органічному розчиннику (наприциклічні ароматичні групи, наприклад, фенільну, клад, ТГФ, хлороформі або і-пропанолі), нафтильну, піридинільну, оксазолільну, ізоксазолінаприклад, як це описано нижче. льну, тіадіазолільну, ін-долільну, бензофуранільну Фахівцю зрозуміло, що такі перетворення фунтощо. кціональних груп можна також проводити на ранАлкільні групи, що можуть бути репрезентованій стадії синтезу сполук формул II, IV, VI, X, XI і ні R2 і R3, можуть бути лінійними ланцюгами або, XII (тобто на відповідних проліках відповідних фепри достатній кількості (мінімум 3) атомів карбону, нольних сполук проліків). Відповідні фенольні спобути розгалуженими і/або циклічними ланцюгами. луки проліків можна придбати, або вони відомі з Якщо є достатня кількість (мінімум 4) атомів карлітератури, або можуть бути отримані методами, бону, такі алкільні групи можуть також бути частсхожими на описані тут, або звичайними стандарково циклічними/ациклічними. Такі алкільні групи тними процедурами синтезу з доступних вихідних можуть також бути насиченими або, якщо є достаматеріалів з використанням належних реагентів і у тня кількість (мінімум 2) атомів карбону, бути неналежних реакційних умовах. Наприклад, ці сполунасиченими. ки можна приготувати видаленням захисту з відГалогенові групи, якими можуть бути заміщені повідних захищених фенолів (захисною групою R2 і R3, включають флуор, хлор, бром і іод. може бути, наприклад, метил, аліл, бензил або Коли R1 є C(O)OR3, бажані групи R3 можуть трет-бутил) в стандартних умовах. бути: Сполуки формули І можуть бути ізольовані з їх (a) лінійним, розгалуженим або циклічним С3реакційних сумішей звичайними способами. 6алкілом, наприклад, С4-6цикло-алкілом; Згідно з винаходом, фармацевтично прийнятні С1-2алкіларильними групами, наприклад, бенпохідні сполук формули І також включають "захизилом, як варіант, заміщеним, як було зазначено щені" похідні і/або сполуки, що діють як проліки вище. сполук формули І. Бажаними є сполуки формули Іа, у яких R12 Сполуки, що можуть діяти як проліки сполук OR . формули І, включають сполуки формули Іа: Коли R1-OR2, бажаними групами R2 можуть бути: (а)Н; (b) незаміщений, лінійний, розгалужений або Ia циклічний С1-8(наприклад, С1-6)алкіл, наприклад, лінійний С1-3алкіл (наприклад, етил або метил), розгалужений С3-8алкіл (наприклад, і-пропіл, ібутил або 4-гептил) або циклічний С4-7алкіл (тобто де R1 - OR2 або C(O)OR3; a С1-7циклоалкіл, наприклад, циклобутил або циклоR2 - Н, С1-10алкіл, С1-3алкіларил або С1гексил); 3алкілоксиарил (алкільні частини останніх двох (c) С1-2алкілоксифеніл (наприклад, груп, як варіант, перервані одним або більше атоС2алкілоксифеніл), у якому фенільна група, як вамами оксигену, арильні частини цих груп, як варіріант, заміщена одним або більше замісниками, як ант, заміщені одним або більше замісниками, виббуло зазначено вище, (наприклад, трифлуорраними серед галогену, фенілу, метилу або метил); метоксилу, причому три останні групи також, як (d) С1-2алкіларил (наприклад, метиларил), у варіант, заміщені одним або більше галогеновими якому арильна група є фенілом, піридинілом, окзамісниками); і сазолілом або ізоксазолілом, причому останні три R3 - С1-10алкіл (ця група, як варіант, перервана групи, як варіант, заміщені одним або більше заміодним або більше атомами оксигену) або С13алкіларил або С1-3алкілоксиарил (алкільні частини 11 75937 12 сниками, вказаними вище (наприклад, метокси(f) для сполук формули Іа, у яких R1 - COOR3, лом, метилом, бромом і/або хлором). реакція відповідної сполуки формули І, визначеної Бажані сполуки формули Іа включають ті, у вище, з сполукою формули XIX: яких R1 - OR2, a R2 - лінійний, розгалужений або L1COOR3 XIX циклічний, С1-6(наприклад, С1-4)алкіл, наприклад, де L1 - належна відщеплювальна група, наприметил, етил, n-пропіл, і-пропіл або циклобутил. клад, галогенова або нітрофенільна (наприклад, 4Сполуки формули Іа можна приготувати, занітрофеніл), a R3 є подібною визначеній вище, стосовуючи один або більше наведених далі спонаприклад, при кімнатній температурі, у присутнособів: сті придатної основи (наприклад, NaOH, напри(а) реакція відповідної сполуки формули II, виклад, у водному розчині) і у належному органічнозначеної вище, з сполукою формули XIV: му розчиннику (наприклад, метиленхлориді); або (g) для сполук формули Іа, у яких R1 - ОСН3 або ОСН2СН3, - реакція відповідної сполуки форXIV мули Іа, у якій R1- ОН, з диметилсульфатом або діетилсульфатом, відповідно, наприклад у присутності належної основи (наприклад, гідроксиду лу1 де R є подібною визначеній вище, наприклад, жного металу, наприклад, КОН (наприклад, у водв умовах, подібних описаним вище для синтезу ному розчині при, наприклад, 50%-му (за масою)) з сполук формули І; належним каталізатором (наприклад, четвертич(b) реакція відповідної сполуки формули IV, ному амонійгалогеніді, наприклад, хлориді бензилвизначеної вище, з сполукою формули XV: триметиламонію (наприклад, у розчині СН2Сl2 або ТГФ, наприклад, 10%-му (мас)). Сполуки формули XVI можна приготувати реаXV кцією відповідної сполуки формули II, визначеної вище, з сполукою формули XX: де R1 є подібною визначеній вище, наприклад, в умовах, подібних описаним вище для синтезу XX сполук формули І; (с) для сполук формули Іа, у яких R1 - ОН, реакція відповідної сполуки формули XVI: наприклад, в умовах, подібних описаним вище для синтезу сполуки формули І. У іншому варіанті сполуки формули XVI можна приготувати реакцією XVI відповідної сполуки формули IV, визначеної вище, з сполукою формули XXI: з гідроксиламіном, наприклад, в умовах, відомих фахівцям; (d) для сполук формули Іа у яких R1 - OR2, реакція захищеної похідної відповідної сполуки формули І, яка є, наприклад, сполукою формули XVII: XXI наприклад в умовах, подібних описаним вище для синтезу сполуки формули І. Сполуки формули XVII можна приготувати реакцією відповідної сполуки формули II, визначеної вище, з сполукою формули XXII: XVII XXII де Ra є, наприклад, -CH2CH2-Si(CH3)3 або бензилом, або їх таутомером, з сполукою формули XVIII: R2ONH2 XVIII де R2 є подібною визначеній вище, або з її кислотоадитивною сіллю, наприклад, при температурі між кімнатною і температурою флегми у присутності відповідного органічного розчинника (наприклад, ТГФ, CH3CN, ДМФ або ДМСО), з подальшим видаленням групи -C(O)ORa, в умовах, відомих фахівцям (наприклад, реакцією з ФТБА або ТФК (наприклад, як описано нижче)); (e) для сполук формули Іа, у яких R1 - ОН, реакція сполуки формули XVII, визначеної вище, у якій R1 - бензил, з гідроксиламіном або його кислотоадитивною сіллю, наприклад, в умовах, відомих фахівцям; де Ra є подібною визначеній вище, наприклад, в умовах, подібних описаним вище для синтезу сполук формули І. У іншому варіанті сполуки формули XVII можна приготувати реакцією відповідної сполуки формули І з сполукою, що відповідає сполуці формули XIX, у якій група R3 заміщена групою Ra, подібною визначеній вище, наприклад, в умовах, описаних вище при приготування сполуки формули Іа. Сполуки формул XIV і XXII можна приготувати реакцією ацетидин-2-карбонової кислоти з відповідною сполукою формули XV, визначеною вище, або з сполукою формули XXIII: XXIII 13 75937 14 де Ra є подібною визначеній вище, наприклад, Функціональні групи, які бажано захищати, в умовах, подібних описаних вище для синтезу включають гідрокси- і аміногрупи і карбонову киссполук формули І. лоту. Придатними захисними групами гідроксигруп Сполуки формул XV, XVIII, XIX, XX, XXI і XXIII можуть бути, як варіант, заміщені і/або ненасичені або можна придбати, або вони відомі з літератури, алкільні групи (наприклад, метил, аліл, бензил або або можуть бути отримані методами, схожими на трет-бутил), триалкілсилільні або діарилалкілсиліописані тут, або звичайними стандартними процельні групи (наприклад, t-бутилдиметилсиліл, tдурами синтезу з доступних вихідних матеріалів з бутилдифенілсиліл або триметилсиліл) і тетрагідвикористанням належних реагентів і у належних ропіраніл. Придатними захисними групами карбореакційних умовах. Наприклад, сполуки формули нової кислоти можуть бути, наприклад, С1-6алкілові XX можна приготувати реакцією відповідної сполуабо бензилові естери. ки формули XXI з ацетидин-2-карбоновою кислоПридатними захисними групами для аміну і тою, наприклад, в умовах, подібних описаним виамідину можуть бути t-бутилоксикарбоніл, бензище. локсикарбоніл або 2-триметилсилілетоксикарбоніл Сполуки формул І і Іа, визначені вище, і їх по(Теос). Нітрогени амідину можуть бути також західні далі називаються "сполуками винаходу". хищені гідрокси- або алкоксигрупами можуть бути Сполуки винаходу можуть проявляти таутомемоно-або дизахищеними. рність. Винахід включає всі таутомерні форми і Захист і зняття захисту для функціональних суміші. Слід відзначити таутомерні форми, з'єднані груп можна проводити до або після сполучення, з позицією подвійного зв'язку амідинової функціоабо до або після будь-якої реакції у описаних вище нальності у сполуці формули Іа і з позицією заміссхемах. ників R1. Захисні групи можуть бути зняті згідно з відоСполуки винаходу також містять два або більмими або описаними нижче способами. ше асиметричних атомів карбону і тому можуть Фахівцю зрозуміло, що для одержання сполук проявляти оптичну і/або діастереомерність. Діасвинаходу у інший, а у деяких випадках, зручніший тереомери можна розділити звичайними методаспосіб окремі операції описаного вище процесу ми, наприклад, хроматографією. Різні стереоізоможна виконувати у іншому порядку і/або окремі мери можна ізолювати сепарацією рацемічної або реакції можна проводити на інших стадіях процесу іншої суміші сполуки за допомогою відомих спосо(тобто вводити замісники і/або проводити хімічні бів, наприклад, використовуючи РХВР. Бажані опперетворення і використовувати інтермедіати, тичні ізомери можна також приготувати реакцією відмінні від зазначених вище для конкретних реакналежних оптично активних вихідних матеріалів в цій). У таких випадках може не бути необхідності умовах, що не призводять до рацемізації або епівикористовувати захисні групи. меризації, або дериватизацією, наприклад, гомохіХімічні особливості визначають необхідність і ральною кислотою, з подальшою сепарацією діастип захисних груп, а також послідовність операцій тереомерних похідні звичайними методами синтезу. (наприклад, РХВР, хроматографією на кремнезеВикористання захисних груп описано [у мі). Всі стереоізомери включено в об'єм винаходу. "Protective Groups у Organic Chemistry", edited by J Бажаними є сполуки винаходу, у яких фрагW F McOmie, Plenum Press (1973), і "Protective мент: Groups у Organic Synthesis", 3rd edition, T.W. Greene & P.G.M. Wutz, Wiley-lnterscience (1999)]. Захищені похідні сполук винаходу можуть бути хімічно перетворені у сполуки винаходу з використанням стандартних методів зняття захисту (намає S-конфігурацію. приклад, гідрогенуванням). Фахівцю зрозуміло, що Бажаними сполуками винаходу є також ті, що певні сполуки формули Іа також можна вважати включають структурний фрагмент: "захищеними похідними" сполук формули І. Медичне і фармацевтичне застосування Сполуки винаходу як такі можуть володіти фармакологічною активністю. Сполуки винаходу з такою властивістю включають (але не лише) сполуки формули І. Однак, інші сполуки винаходу (включаючи сполуки формули Іа) можуть не проявляти такої який має R-конфігурацію. активності, але, будучи введені парентерально Хвилясті лінії на зв'язках у цих двох фрагменабо орально, можуть метаболізуватись у тілі з тах позначають положення зв'язків фрагментів. утворенням фармакологічно активних сполук Отже, бажані сполуки винаходу включають: (включаючи (але не лише) сполуки формули І). Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6Такі сполуки (а також сполуки з деякою фармакоdiF); логічною активністю, але суттєво нижчою за актиPh(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)Azeвність "активних сполук", у які вони метаболізуPab(2,6-diF)(OMe);i ються), можуть розглядатись як "проліки" активних Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)Azeсполук. Pab(2,6-diF)(OH). Отже, сполуки винаходу, що володіють фарФахівцю зрозуміло, що у процесах, описаних макологічною активністю і/або метаболізуються у вище і далі, функціональні групи інтермедіатів мотілі після перорального або парентерального ввежуть потребувати захисту захисними групами. 15 75937 16 дення з утворенням сполук, що володіють фармаяким іншим механізмом; антикоагуляційне лікукологічною активністю, можна розглядати як фарвання, коли кров контактує з сторонніми поверхмацевтичні препарати. нями у тілі, наприклад, судинним трансплантатом, Одним з аспектів винаходу є фармацевтичне судинними стентами і катетерами, механічними і використання сполук винаходу. біологічними протезами клапанів або іншими меЗокрема, сполуки винаходу є потужними інгібідичними пристроями; і антикоагуляційне лікуванторами тромбіну як такі і/або (наприклад, у випадня, коли кров контактує з медичними пристроями ку проліків) метаболізуються після перорального назовні тіла, наприклад, при кардіоваскулярній або парентерального введення з утворенням похірургії з використанням штучних легенів і серця тужних інгібіторів тромбіну, як це, наприклад, може або при гемодіалізі; терапевтичне і/або профілакбути продемонстровано описаними нижче тестичне лікування ідіопатичного синдрому порушентами. ня дихання у дорослих, легеневого фіброзу після "Проліки інгібітора тромбіну" включають сполікування радіоопромінюванням або хіміотерапії, луки, що утворюють інгібітор тромбіну у кількості, септичного шоку, септицемії, запальних реакцій, що може бути експериментально виявлена через включаючи (але не лише) набряк, гострий або заздалегідь визначений час (наприклад, приблизхронічний атеросклероз, наприклад, коронарну но 1год.) після перорального або парентерального артеріальну хворобу і формування атеросклерозвведення (див., наприклад, Test Ε) або, у іншому них бляшок, мозкову артеріальну хворобу, церебваріанті, після інкубування у присутності мікросом ральний інфаркт, церебральний тромбоз, церебпечінки (див., наприклад, Test G). ральний емболізм, периферійну артеріальну Отже, можна сподіватись, що сполуки винахохворобу, ішемію, стенокардію (включаючи нестійду можуть бути використані при станах, коли потку), реперрузійну травму, рестеноз після перкутанрібно інгібувати тромбін, і/або коли показано антиної транслюмінальної ангіопластії (РТА) і операції когуляційну терапію, включаючи такі випадки: шунтування коронарної артерії. Лікування і/або профілактика тромбозу і гіперСполуки винаходу, що інгібують трипсин і/або коагуляції у крові і/або тканинах тварин, включаютромбін, можуть бути використані при лікування чи людину. Відомо, що гіперкоагуляційність може панкреатиту. призвести до тромбо-емболічних захворювань. Отже, сполуки винаходу показані у терапевтиСеред станів, пов'язаних з гіперкоагуляцією і трочному і/або профілактичному лікування таких стамбо-емболічними захворюваннями, можна відзнанів. чити наслідувану або набуту резистивність до акЗгідно з іншим аспектом, винахід включає спотивованого протеїну С, наприклад, мутацію сіб лікування стану, який вимагає інгібування трофактора V (фактора V Leiden), і наслідуваний або мбіну, і який включає введення терапевтично ефенабутий дефіцит антитромбіну III, протеїну С, проктивної кількості сполуки винаходу пацієнту, що теїну S, кофактора гепарину II. Інші стани, пов'язастраждає від такого стану або є сприйнятливим до ні, як відомо, з гіперкоагуляцією і тромбонього. емболічноою хворобою, включають циркуляційні Сполуки винаходу в нормальних умовах можантифосфоліпідні антитіла (Lupus anticoagulant), на вводити орально, внутрішньовенно, підшкірно, гомоцистеїнемію, індуковану гепарином тромбоцибукально, ректально, дермально, назально, тратопенію, і дефекти у фібринолізі, а також коагуляхеально, бронхіально, будь-яким парентеральним ційні синдроми (наприклад, розсіяну внутрішньошляхом або інгаляцією, у формі фармацевтичних судинну коагуляцію (DIG)) і травми судин взагалі композицій, що містять сполуку винаходу у фар(наприклад, при хірургічному втручанні). мацевтично прийнятній дозованій формі. Лікування станів, пов'язаних з небажаним надЗалежно від розладу і пацієнта, що отримує лишком тромбіну, але без ознак гіперкоагуляції, які лікування, і способу введення, композиції вводять виникають при таких нейродегенеративних хвороу різних дозах. бах, як хвороба Альцгеймера. Сполуки винаходу можна також комбінувати Слід відзначити терапію і/або профілактику таі/або вводити разом будь-яким антитромботичниких станів, як тромбоз вени (наприклад, ГТБ) і леми агентами різних механізмів дії, наприклад, з геневий емболізм, артеріальний тромбоз (наприантитромботичними ацетилсаліциловою кислотою, клад, при інфоркті міокарду, нестійкій стенокардії, тиклопідином і клопідогрелем; рецептором тромвикликаному тромбозом інсульті і периферійному боксану і/або інгібіторами синтетази; антагоністаартеріальному тромбозі), і системний емболізм ми рецептора фібриногену; міметиками простаципередсердя при атриальній фібриляції (наприклад, кліну; інгібіторами фосфодіестерази; невальвулярній атриальній фібриляції) або від антагоністами ADP-рецептора (Р2Т); і інгібіторами лівого шлуночка після трансмулярного інфаркту карбоксипептидази U (CPU). міокарда, або спричинений конгестивним серцеСполуки винаходу можна комбінувати і/або вим нападом; профілактику реоклюзії (тобто тромвводити разом з тромболітиками, наприклад, з бозу) після тромболізу, перкутальної транслюміодним або більше активаторами тканевого плазмінальної ангіопластики (РТА) і операції коронарного ногену (природними, рекомбінантними або модишунтування; відвертання ретромбозу після мікрофікованими), стрептокіназою, урокіназою, проурохірургії і судинної хірургії взагалі. кіназою, комплексом активатора анісолілової Подальші показання включають терапевтичне плазміноген-стрептокінази (APSAC), активаторів і/або профілактичне лікування розсіяної внутріштваринного плазміногену слинної залози, тощо, ньосудинної коагуляції, спричиненої бактеріями, при лікування тромботичних захворювань, зокремножинними травмами, інтоксикацією або будьма, інфаркту міокарду. 17 75937 18 Згідно з ще одним аспектом, винахід включає тромбін, Sigma Chemical Co. або Hematologic фармацевтичну композицію, що містить сполуку Technologies), і зразки перемішують. Кінцеві конвинаходу у суміші з фармацевтично прийнятним центрації аналізу: наповнювачем, розріджувачем або носієм. - тестована речовина - 0,00068 - 13,3мкмоль/л, Придатні денні дози сполук винаходу при те- S-2366 - 0,30ммоль/л, рапевтичному лікуванні людини становлять приб- α-тромбін - 0,020один. NIH/мл. лизно 0,001-100мг на кг маси тіла при пероральЛінійний інкремент абсорбції протягом 40хвил. ному введенні і 0,001-50мг на кг маси тіла при інкубації при 37°С використовується для обчиспарентеральному введенні, виключаючи масу лення %% інгібування для тестованих зразків побудь-якого кислотного проти-іону. рівняно з чистими зразками без інгібітора. ЗначенДалі термін "лікування" включає терапевтичне ня ІС50, визначене роботом, яке відповідає і/або профілактичне лікування. концентрації інгібітора, що викликає 50%-не інгібуПеревагами сполук винаходу є те, що вони є вання активності тромбіну, обчислюється через більш ефективними, менш токсичними, більш довкриву залежності log активності тромбіну і % інгігодіючими, мають ширший діапазон дії, є більш бування. потужними, створюють менше побічних явищ, леТест С гше поглинаються, мають кращий фармакокінетиВизначення константи K інгібування для людчний профіль (наприклад, вищу пероральну біозаського тромбіну своюваність і/або менший кліренс, ніж відомі Визначення K, виконують методом хромогенсполуки і/або мають інші корисні фармакологічні, ного субстрату, при 37°С на центрифуговому анафізичні або хімічні властивості. лізаторі Cobas Bio (Roche, Basel, Switzerland). ЗаПеревагою сполук винаходу є також те, що їх лишкову активність ензима після інкубації можна вводити менш часто, ніж відомі сполуки. людського α-тромбіну з різними концентраціями Біологічні тести тестованої сполуки визначають при трьох різних Можуть бути застосовані такі процедури. концентраціях субстрату і виміряють як зміну у Test A оптичній поглинальності на 405нм. Визначення часу коагуляції тромбіну (ТТ) Розчини тестованої сполуки (100мкл; у буфері Розчин інгібітора (25мкл) інкубують з плазмою або розсолі з 10г/л АБС) змішують з 200мкл люд(25мкл) три хвил. Додають людський тромбін (Т ського α-тромбіну (Sigma Chemical Co) у аналітич6769; Sigma Chem. Co або Hematologic ному буфері (0,05моль/л Трис-НСІ, рН7,4, іонна Technologies) у буферному розчині, рН7,4 (25мкл, сила 0,15, коригована NaCI), що містить АБС 4,0 одиниць NIH/мл), і виміряють час коагуляції у (10г/л), і аналізують як зразки у Cobas Bio. Додаавтоматичному пристрої (KС 10; Amelung). ють 60мкл зразка, разом з 20мкл води, до 320мкл Час коагуляції тромбіну (ТТ) репрезентується субстрату S-2238 (Chromogenix AB, Molndal, як абсолютні значення (сек.), а також як відношенSweden) у аналітичному буфері, ведуть моніторинг ня ТТ без інгібітора (ТТ0) до ТТ з інгібітором (ТТi). зміни поглинальності (АА/хвил.). Кінцеві концентЦе відношення (в межах 1-0) наносять на графік рації S-2238 - 16, 24 і 50мкл/л і тромбіну залежності від логарифма концентрації інгібітора і 0,125один. NIH/мл. суміщають з сигмовидними кривими реакції на Стала швидкість реакції використовується для дозу згідно з рівнянням побудови графіків Диксона (Dixon), тобто діаграм y=a/[l+(x/IC50)s] концентрації інгібітора у залежності від де а=1 (максимальне значення), s= крутість І/(АА/хвил.). Для реверсивних конкурентних інгібікривої залежності від дози; і ІС50 - концентрація торів точки даних для різних концентрацій субінгібітора, яка подвоює час коагуляції. Обчислення страту звичайно лежать на прямій, яка перетинає виконують на ПК, використовуючи програмний x у точці Ki. пакет GraFit, Version 3, з початковими значеннями Тест D для рівняння: початок - 0, визначення кінця - 1 Визначення часу часткового активування тро(Erithacus Software, Robin Leatherbarrow, Imperial мбопластину College of Science, London, UK). АРТТ визначають у об'єднаній нормальній циТест В трованій плазмі людини з реагентом РТТ Визначення інгібування тромбіну у хромогенAutomated 5 (від Stago). інгібітори додають до планому робототехнічному аналізі зми (10мкл розчину інгібітора до 90мкл плазми і Потужність інгібітора тромбіну виміряють з виінкубують з реагентом АРТТ протягом 3хвил., далі користанням хромогенного субстрату роботом з додають 100мкл розчину хлориду кальцію процесором Plato 3300 мікроплат (Rosys AG, СН(0,025М) і АРТТ визначають, використовуючи ана8634 Hombrechtikon, Switzerland), з використанням лізатор КС10 (Аmе-lung) коагуляції згідно з інстру96-гніздових півоб'ємних мікролітрових плат ецією виробника реагента. (Costar, Cambridge, MA, USA; Cat No 3690). МаточЧас коагуляції репрезентують в абсолютних ні розчини тестованої речовини у ДМСО (72мкл), значеннях (сек.), а також як відношення АРТТ без 0,1-1ммоль/л, послідовно розбавляють до 1:3 інгібітора (АРТТ0) до АРТТ з інгібітором (АРТТi). Це (24+48мкл) ДМСО з одержанням 10 різних конценвідношення (в межах 1-0) наносять на графік затрацій, які аналізують як зразки. 2мкл тестового лежності від логарифма концентрації інгібітора і зразка розбавляють 124мкл аналітичного буфера, суміщають з сигмовидними кривими реакції на до буфера додають 12мкл розчину хромогенного дозу згідно з рівнянням субстрату (S-2366, Chromogenix, Molndal, Sweden) y=a/[l+(x/IC50)s] і потім 12мкл розчину α-тромбіну (Human α 19 75937 20 де а=1 (максимальне значення), s= крутість зка. Кінцеву концентрацію сполуки (FINAL CONC) у кривої залежності від дози; і ІС50= концентрація 60 хвилинному зразку визначають через PXMS, інгібітора, яка подвоює час коагуляції. Обчислення використовуючи як еталон зразок, відібраний у виконують на ПК, використовуючи програмний нульовий момент часу (START CONC). % деграпакет GraFit, Version 3, з початковими значеннями дації інгібітора тромбіну обчислюють як: для рівняння: початок - 0, визначення кінця - 1 100% (START CONC - FINAL CONC)/START (Erithacus Software, Robin Leatherbarrow, Imperial CONC College of Science, London, UK). ІС50АРТТ є концеТест Н нтрацією інгібітора, яка подвоює АРТТ. Модель артеріального тромбозу Тест Ε Пошкодження судини викликали локальним Визначення часу тромбіну ex vivo нанесенням FeCI3 на каротидну артерію. Щурів Інгібування тромбіну після орального або паанастезували внутрішньочеревним введенням рентерального введення сполук винаходу, розчипентобарбіталу натрію (80мг/кг, Apoteksbolaget; нених у суміші етанолі: SolutolK: вода (5:5:90), виUmea, Sweden), з подальшою безперервною інфузначають у щурів у стані пильнування, яким за зією (12г/кг/год.) протягом експерименту. Темпераодин-два дні перед експериментом був введений туру тіла щура протягом експерименту підтримукатетер для відбору зразків крові з каротидної арвали на рівні 38°С зовнішнім підігріванням. терії. Під час експерименту у пластмасові трубки у Експеримент починається 5 хвилинним контрольфіксовані моменти після введення сполуки відбиним періодом. Через 5хвил. внутрішньовенно вворають зразки крові у пластмасові трубки, що місдять людський 125І-фібріноген (80kBq; ІМ53; тять 1 частину розчину цитрату натрію Amersham International, Buckinghamshire, UK), який (0,13моль/л) і 9 частин крові. Трубки центрифугувикористовують як маркер при подальшому ввеють для одержання збідненої на бляшки плазми. денню фібріногену у тромб. Ближчий кінець сегме50мкл зразків плазми осаджують з 100мкл хонта каротидної артерії вводять у відкриту по довлодного асетонітрилу. Зразки центрифугують жині пластмасову трубку (6мм; Silastic®; Dow 10хвил. при 4000об./хвил. 75мкл надосадової ріCorning, Ml, USA), яка містить просочений FeCI3 дини розбавляють 75мкл 0,2%-ї мурашиної кисло(2мкл; 55% (за масою); Merck, Darmstadt, Germany) ти, 10мкл одержаного розчину аналізують PXфільтрувальний папір (діаметр 3мм; IF; Munktell, MS/MS і концентрації інгібітора тромбіну визначаGrycksbo, Sweden). Ліву каротидну артерію піддають, використовуючи стандартні криві. ють дії FeCI3 протягом 10хвил., потім виймають з Тест F пластмасової трубки і просочують у сольовому Визначення кліренса плазми у щура розчині. Через 50хвил. каротидну артерію видаКліренс плазми оцінюють у самців щурів ляють і промивають сольовим розчином. ВідбираSprague Dawley. Сполуку розчиняють у воді і ввоються також еталонні зразки крові для визначення дять підшкірною болюсною ін'єкцією дозою кров'яної активності 125І через 10хвил. після ін'єкції 125 4мкмоль/кг. Зразки крові відбирають з частим інтеІ-фібриногену і наприкінці експерименту. 125Ірвалом протягом до 5год. після введення. Зразки активність у еталонних зразках крові і сегменті крові центрифугують, плазму відокремлюють від судини виміряють гамма-лічильнтком (1282 клітин крові і вносять у колби з цитратом (кінцева Cotnpugamma; LKB Wailac Oy, Turku, Finland), і концентрація 10%). 50мкл зразків плазми осаджуудень експерименту виміряють розмір тромбу чеють з 100мкл холодного асетонітрилу. Зразки рез кількісний показник активності 125І, введеного у центрифугують 10хвил. при 4000об./хвил. 75мкл сегмент судини, відносно 125І-активності у крові надосадової рідини розбавляють 75мкл 0,2%-ї (срm/мг). мурашиної кислоти, 10мкл одержаного розчину ТРХ виконують на силікагелі. Хіральний анааналізують PX-MS/MS і концентрації інгібітора лиз РХВР виконують, використовуючи колонку тромбіну визначають, використовуючи стандартні 46мм 250мм ChiraPXel OD з 5-сантиметровою криві. Площу під профілем "концентрація плазми захисною колонкою. час" оцінюють, використовуючи трапецеїдальне Температуру колонки підтримують на рівні правило логарифм/лінійність і екстраполюють у 35°С, витрата потоку - 1,0мл/хвил. Використовучасі до нескінченності. Кліренс плазми (CL) визнається детектор УФ Gilson 115 на 228нм. Мобільна чають як фаза складається з гексанів, етанолу і трифлуоCL= Доза/Значення ППК умл/хвил./кг. роцтової кислоти з належними відношенням для Тест G кожної сполуки. Звичайно продукт розчиняють у Визначення стабільності in vitro мінімальній кількості етанолу і розбавляють мобіГотують мікросоми печінки щурів Spragueльною фазою. Dawley і зразки людської печінки згідно з внутрішPX-MS/MS проводять, використовуючи інструніми СРПи. Сполуки інкубують при 37°С при повній мент НР-1100, обладнаний інжектором CTC-PAL і концентрації протеїну мікросомів 3мг/мл у колонкою 5мкм, 4 100мм ThermoQuest, Hypersil 0,05моль/л Tris-буфері при рН7,4, у присутності EDS-CIS з використанням детектора MS API-3000 кофакторів НААД (2,5ммоль/л) і НААДФ (Sciex). Витрата потоку - 1,2мл/хвил., мобільна (0,8ммоль/л). Початкові концентрації сполуки - 5 фаза (градієнт) складається з 10-90% ацетонітриабо 10мкмоль/л. Зразки для аналізу відбираються лу з 90-10% 4мМ водного ацетату амонію і з 0,2% протягом не менше 60хвил. після початку інкубації. мурашиної кислоти. Ензимну активність у відібраному зразку негайно Спектр 1Н ЯМР реєструють, використовуючи припиняють доданням 20%-ї муристонової кислоти тетраметилсилан як внутрішній стандарт. Спектр у кількості, що відповідає 3,3% повного об'єму зра 21 75937 22 С ЯМР реєструють, використовуючи як внутріш15год., суміш частково концентрують у вакуумі і ній стандарт наведені дейтеровані розчинники . одержують бажану сполуку у вигляді рідини, яку Приклад 1 Ph(3-CI)(5-OCHF2)-(R)CH(QH)C(O)безпосередньо використовують у операції (ν) без (S)Aze-Pab(2,6-diF) очищення і характеризації. (v) Ph(3-CI)(5-OCHF2)-(R,S)CH(OH)C(NH)OEt Ph(3-CI)(5-OCHF2)-(R,S)CH(OTMS)CN (6,82г, приблизно 22,3ммоль; опер, (iv)) додають краплями до HCI/EtOH (500мл). Реакційну суміш перемішують 15год., потім частково концентрують у вакуумі і одержують бажану сполуку у вигляді рідини, яку безпосередньо використовують у операції' (vi) (і) 3-хлор-5-метоксибензальдегід без очищення і характеризації. 3,5-дихлоранізол (74,0г, 419ммоль) у ТГФ (vi) Ph(3-CI)(5-OCHF2)-(R,S)CH(OH)C(O)OEt (200мл) додають краплями до металевого магнію Ph(3-CI)(5-OCHF2)-(R,S)CH(OH)C(NH)OEt (14,2 г, 585ммоль, промитого 0,5N НСІ) у ТГФ (6,24г, приблизно 22,3ммоль; опер, (ν)) розчиня(100мл) при 25°С. Після додання, додають крапють у ТГФ (250мл), додають 0,5М H2SO4 (400мл) і лями 1,2-диброметан (3,9г, 20,8ммоль). Одержану реакцію перемішують при 40°С 65год., охолоджутемнокоричневу суміш гріють під зворотним холоють і потім частково концентрують у вакуумі для дильником протягом 3год. Суміш охолоджують до видалення більшої частини ТГФ. Реакційну суміш 0°С і однією порцією додають Ν,Ν-ДМФ (60мл). екстрагують Et2O (3 100мл), сушать (Na2SO4), фіСуміш розділяють діетилетером (3 400мл) і 6N льтрують і концентрують у вакуумі, одержуючи НСІ (500мл). Об'єднані органічні екстракти промибажану сполуку як тверду речовину, яку безпосевають 400мл) і 6N НСІ (500мл). Об'єднані органічні редньо використовують у операції (vii) без очиекстракти промивають розсолом (300мл), сушать щення і характеризації. (Na2SO4). фільтрують і концентрують у вакуумі, (vii) Ph(3-CI)(5-OCHF2)-(R,S)CH(OH)C(O)OH одержуючи масло. Флеш-хроматографія (2х) на Розчин Ph(3-CI)(5-OCHF2)силікагелі з елюентом Нех:ЕtOАс (4:1) дає бажану (R,S)CH(OH)C(O)OEt (6,25г, приблизно 22,3ммоль; сполуку (38,9г, 54%) у вигляді жовтого масла. опер, (vi)) у 2-пропанолі (175мл) і 20% КОН 1 Н ЯМР (300МГц, CDCI3) δ 9,90 (s, 1H), 7,53 (s, (350мл) перемішують при кімнатній температур 1H), 7,38 (s, 1H), 7,15 (s, 1H), 3,87 (s,3H). 15год., реакцію потім частково концентрують у (ii) 3-хлор-5-гідроксибензальдегід вакуумі для видалення більшої частини 2Розчин 3-хлор-5-метоксибензальдегіду (22,8г, пропанолу. Залишок підкислюють 1М H2SO4, екст134ммоль; див. опер, (і)) у СН2СІ2 (250мл) охолорагують Et2O (3 100мл), сушать (Na2SO4), конценджують до 0°С. Протягом 15хвил. додають краптрують у вакуумі і одержують тверду речовину. лями трибромід бору (15,8мл, 167ммоль). Після Флеш-хроматографія на силікагелі з елюентом перемішування реакційної суміші протягом 2год. СНСІ3:МеОН:конц. NH4OH (6:3:1) дає амонієву сіль повільно додають Н2О (50мл). Розчин потім екстбажаної сполуки, яку потім розчиняють у суміші рагують Et2O (2 100мл), органічні шари об'єднуEtOAc (75мл) і Н2О (75мл) і підкислюють 2N НСІ. ють, сушать (Na2SO4), фільтрують і концентрують Органічний шар відділяють і промивають розсолом у вакуумі. Флеш-хроматографія на силікагелі з (50мл), сушать (Na2SO4), концентрують у вакуумі і елюентом Нех:EtOAc (4:1) дає бажану сполуку одержують бажану сполуку (3,2г, 57% від опер, (5,2г, 25%). (iv)-(vii)). 1 1 Н ЯМР (300МГц, CDCI3) δ 9,85 (s, 1H), 7,35 Н ЯМР (300МГц, CD3OD) δ 7,38 (s, 1H), 7,22 (s,1H), 7,20 (s,1H), 7,10 (s,1H), 3,68(s,1H). (s, 1H), 7,15 (s, 1H), 6,89 (t, JH-F=71,1Гц, 1H), 5,16 (ііі) 3-хлор-5-дифлуорметоксибензальдегід (s.1H). Розчин 3-хлор-5-гідроксибензальдегіду (7,5г, (viii) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)OH (а) і 48ммоль; опер, (іі)) у 2-пропанолі (250мл) і 30% Ph(3-CI)(5-OCHF2)-(S)CH(OAc)C(O)OH (b) КОН (100мл) гріють під зворотним холодильником. Суміш Ph(3-CI)(5-OCHF2)-(R,S)CH(OH)C(O)OH З перемішуванням протягом 2год. у реакційну су(3,2г, 12,7ммоль; опер, (vii)) і Lipase PS "Amano" міш бульбашками додають CHCIF2, охолоджують, (прибл. 2,0г) у вінілацетаті (125мл) і МТБЕ (125мл) підкислюють НСІ і екстрагують ЕtOАс (2 100мл). гріють під зворотним холодильником 48год. РеакОрганічні компоненти промивають розсолом ційну суміш охолоджують, фільтрують через (100мл), сушать (Na2SO4), фільтрують і концентCelite® і фільтрувальний брикет промивають рують у вакуумі. Флеш-хроматографія на силікагеEtOAc. Фільтрат концентрують у вакуумі, піддають лі з елюентом Нех:EtOAc (4:1) дає бажану сполуку флеш-хроматографії на силікагелі з елюентом з (4,6г, 46%). СНСІ3:МеОН:конц. NH4OH (6:3:1) і одержують 1 Н ЯМР (300МГц, CDCI,) δ 9,95 (s, 1H), 7,72 (s, амонієву сіль бажаних сполук (а) і (b). Сполуку (а) 1H), 7,52 (s, 1H), 7,40 (s, 1H), 6,60 (t, JH-F=71,1Гц, у вигляді солі розчиняють у Н2О, підкислюють 2N 1Н) НСІ і екстрагують EtOAc. Органічний шар проми(iv) Ph(3-CI)(5-OCHF2)-(R,S)CH(OTMS)CN вають розсолом, сушать (Na2SO4), фільтрують, Розчин 3-хлор-5концентрують у вакуумі і одержують бажану сподифлуорметоксибензальдегіду (4,6г, 22,3ммоль; луку (а) (1,2г, 37%). опер, (ііі)) у СН2СІ2 (200мл) охолоджують до 0°С. Для сполуки (а) 1 Додають Znl2 (1,8г, 5,6ммоль) і триметилсилілціаН ЯМР (300МГц, CD3OD) δ 7,38 (s, 1H), 7,22 нід (2,8г, 27,9ммоль) і реакційну суміш залишають (s, 1H), 7,15 (s, 1H), 6,89 (t, JH-F=71,1Гц, 1H), 5,17 досягти кімнатної температури, перемішують (s,1H). 13 23 75937 24 1 (ix) 2,6-дифлуорΗ ЯМР (300МГц, CDCI3) δ 7,29 (m, 2H), 5,33 4[(метилсульфініл)(метилтіо)метил]бензонітрил (s, 2H), 3,07 (s, 3Н) (Метилсульфініл)(метилтіо)метан (7,26г, (хііі) 4-азидометил-2,6-дифлуорбензонітрил 0,0584моль) розчиняють у 100мл сухого ТГФ під Суміш 4-ціано-2,6аргоном і охолоджують до -78°С. Краплями додадифлуорбензилметансульфонату (1,61г, ють бутиллітій у гексані (16мл 1,6М, 0,0256моль) з 6,51ммоль; опер, (хіі)) і азиду натрію (0,72г, перемішуванням. Суміш перемішують 15хвил. Тим 0,0111моль) у 10мл води і 20мл ДМФ перемішують часом розчин 3,4,5-трифлуорбензонітрилу (4,0г, при кімнатній температурі протягом ночі і потім 0,025ммоль) у 100мл сухого ТГФ охолоджують до вливають у 200мл вод і екстрагують тричі діетиле78°С під аргоном і через канюлю до цього розчину тером. Об'єднану етерну фазу промивають п'ять протягом 35хвил. додають попередній розчин. Черазів водою, сушать (Na2SO4) і випарюють. Неверез 30хвил. охолоджуючу ванну видаляють і після ликий зразок випарюють для ЯМР-аналізу і продосягнення реакцією кімнатної температури її влидукт кристалізують. Залишок випарюють, але не вають у 400мл води. ТГФ випарюють і залишковий до повної сухості. Вихід (теоретично 1,26 г) визнаводний шар екстрагують тричі діетилетером. Об'єчається, базуючись на ЯМР і аналітичній РХВР. 1 днану етерну фазу промивають водою, сушать Н ЯМР (400МГц, CDCI3) δ 7,29 (m, 2H), 4,46 (Na2SO4) і випарюють. Вихід 2,0г (30%). (s, 2H). 1 Н ЯМР (500МГц, CDCI3) δ 7,4-7,25 (m, 2H), (xiv) 4-амінометил-2,6-дифлуорбензонітрил 5,01 (s, 1H, діастереомер), 4,91 (s, 1H, діастереоЦю реакцію проводять за процедурою, описамер), 2,88 (s, 3Н, діастереомер), 2,52 (s, 3H, діасною [у J. Chem. Res. (M) (1992) 3128]. До суспензії тереомер), 2,49 (s, 3H, діастереомер), 2,34 (s, 3Н, 520мг 10% Pd/C (вологість 50%) у 20мл води додіастереомер), 1,72 (broad, 1H) дають розчин боргідриду натрію (0,834г, (х) 2,6-дифлуор-4-формілбензонітрил 0,0221моль) у 20мл вод. Відбувається деяке від2,6-дифлуорходження газу. 4-азидометил-2,64[(метилсульфініл)(метилтіо)метил]бензонітрил дифлуорбензонітрил (1,26г, 6,49ммоль; опер, (хііі)) (2,17г, 8,32ммоль; опер, (іх)) розчиняють у 90мл розчиняють у 50мл ТГФ і додають до водної суміші ТГФ і додають 3,5мл концентрованої сульфурової на льодяній ванні протягом 15хвил. і перемішують кислоти. Суміш залишають при кімнатній темпера4год., після чого додають 20мл 2М НСІ і суміш турі на 3 дні і потім вливають у 450мл води. Екстфільтрують через Celite. Celite промивають водою рагують тричі EtOAc і об'єднану етерну фазу проі об'єднану водну фазу промивають EtOAc і підлумивають двічі водним бікарбонатом натрію і жують 2М NaOH. Далі екстрагують тричі метиленрозсолом, сушать (Na2SO4) і випарюють. Вихід хлоридом і об'єднану органічну фазу промивають 1,36г (98%). Положення фо-рмільної групи встановодою, сушать (Na2SO4) і випарюють. Вихід 0,87г влюється 13С ЯМР. Сигнал від флуоринованих (80%). 1 карбонів при 162,71/млн дає очікувану картину Н ЯМР (400МГц, CDCI3) δ 7,20 (m, 2H), 3,96 сполучення з двома константами сполучення у (s, 2H), 1,51 (broad, 2H) порядку 260Гц і 6,3Гц, відповідно, що відповідає (xv) 2,6-дифлуор-4-третipso і meta сполучення від атомів флуору. бутоксикарбоніламінометилбензонітрил 1 Н ЯМР (400МГц, CDCI3) δ 10,35 (s, 1H), 7,33 Розчин 4-амінометил-2,6(m, 2H) дифлуорбензонітрилу (0,876г, 5,21ммоль; опер, (xi) 2,6-дифлуор-4-гідроксиметилбензонітрил (xiv)) розчиняють у 50мл ТГФ і додають трет2,6-дифлуор-4-формілбензонітрил (1,36г, бутилдикарбонат (1,14г, 5,22ммоль) у 10мл ТГФ. 8,13ммоль; опер, (x)) розчиняють у 25мл метанолу Суміш перемішують 3,5год., ТГФ випарюють і заі охолоджують на льодяній ванні. Порціями з пелишок розділяють між водою і EtOAc. Органічний ремішуванням додають боргідрид натрію (0,307г, шар промивають тричі 0,5М НСІ і водою, сушать 8,12ммоль) і реакцію залишають на 65хвил. Роз(Na2SO4) і випарюють. Продукт використовують чинник випарюють і залишок розділяють між діебез подальшого очищення. Вихід: 1,38г (99%). 1 тилетером і водним бікарбонатом натрію. Етерний H ЯМР (300МГц, CDCI3) δ 7,21 (m,2H), 4,95 шар промивають водним бікарбонатом натрію і (broad, 1H), 4,43 (broad, 2H), 1,52(s,9H) розсолом, сушать (Na2SO4) і випарюють. Сирий (xvi) Boc-Pab(2,6-diF)(OH) продукт кристалізують і використовують без подаСуміш 2,6-дифлуор-4-трктльшого очищення. Вихід 1,24г (90%). бутоксикарбоніламінометилбензонітрилу (1,38г, 1 Н ЯМР (400МГц, CDCI3) δ 7,24 (m, 2H), 4,81 5,16ммоль; опер. (xv)). гідроксиламінгідрохлориду (s, 2H), 2,10 (broad, 1H) (1,08г, 0,0155моль) і триетиламіну (1,57г, (xii) 4-ціано-2,60,0155моль) у 20мл етанолу перемішують при кімдифлуорбензилметансульфонат натній температур 36год. Розчинник випарюють і До охолодженого на льоду розчину 2,6залишок розділяють між водою і метиленхлоридифлуор-4-гідроксиметилбензонітрилу (1,24г, дом. Органічний шар промивають водою, сушать 7,32ммоль; опер, (хі) і метансульфонілхлориду (Na2SO4) і випарюють. Продукт використовують (0,93г, 8,1ммоль) у 60мл метиленхлориду з перебез подальшого очищення. Вихід: 1,43д(92%). 1 мішуванням додають триетиламін (0,81г, H ЯМР (500МГц, CD3OD) δ 7,14 (m, 2H), 4,97 8,1ммоль). Через 3год. при 0°С суміш промивають (broad, 1H), 4,84 (broad, 2H), 4,40 (broad, 2H), 1,43 двічі 1М НСІ і один раз водою, сушать (Na2SO4) і (s, 9H) випарюють. Продукт використовують без подаль(xvii) Boc-Pab(2,6-diF) HOAc шого очищення. Вихід: 1,61г (89%). Цю реакцію проводять за процедурою, [описано Judkins et al., Synth. Comm. (1998) 4351]. Boc 25 75937 26 Pab(2,6-diF)(OH) (1-32г, 4,37ммоль; опер, (xvi)), ший ротамер), 5,15 (s, 1H, старший ротамер), 5,12 оцтовий ангідрид (0,477г, 4,68ммоль) і 442мг 10% (m, 1H, молодший ротамер), 5,06 (s, 1Н, молодший Pd/C (вологість 50%) у 100мл оцтової кислоти гідротамер), 4,72 (m, 1Н, старший ротамер), 4,6-4,45 рогенують під тиском 5ат протягом 3,5год. Суміш (m, 2Н), 4,30 (m, 1Н, старший ротамер), 4,24 (m, фільтрують через Celite, промивають етанолом і 2Н), 4,13 (m, 1Н, старший ротамер), 4,04 (m, 1Н, випарюють. Залишок сушать виморожуванням з молодший ротамер), 3,95 (m, 1H, молодший ротаацетонітрилу і води і кількох крапель етанолу. мер), 2,62 (m, 1H, молодший ротамер), 2,48 (m, Продукт використовують без подальшого очищен1Η,старший ротамер), 2,22 (m, 1H, старший ротаня. Вихід 0,1,49г (99%). мер), 2,10 (m, 1H, молодший ротамер), 1,07(m, 1 Н ЯМР (400МГц, CD3OD) δ 7,45 (m, 2Н), 4,34 2H),0,07(m, 9H) (s, 2H), 1,90 (s, 3Н), 1,40 (s,9H) (xxi) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze(xviii) Boc-Pab(2,6-diF)(Teoc) Pab(2,6-diF) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)AzeДо розчину Boc-Pab(2,6-diF) HOAc (1,56г, Pab(2,6-diF)(Teoc) (81мг, 0,127ммоль; опер, (хх)) 5,49ммоль; опер, (xvii)) у 100мл ТГФ і 1мл води розчиняють у 0 5мл метиленхлориду і охолоджудодають 2-(триметилсиліл)етил рють на льоду. Додають ТФК (3мл) і реакцію залинітрофенілкалбонат (1,67г, 5,89ммоль). Додають шають на 75хвил. ТФК випарюють і залишок сукраплями розчин карбонату калію (1,57г, шать виморожуванням з води і ацетонітрилу. 0,0114моль) у 20мл води протягом 5хвил. Суміш Сирий продукт очищують препаративною рідинперемішують протягом ночі, ТГФ випарюють і заною хроматографією з елюентом CH3CN:0,1M лишок розділяють між водою і метиленхлоридом. NH4OAc (35:65) і одержують 39мг (55%) бажаної Водний шар екстрагують метиленхлоридом і об'єсполуки у вигляді її солі НОАс, чистота - 99%. днану органічну фазу промивають двічі водним 1 Н ЯМР (400МГц, CD3OD суміш ротамерів) δ бікарбонатом натрію, сушать (Na2SO4) і випарю7,5-7,4 (m, 2H), 7,32 (m, 1H, старший ротамер), ють. Флеш-хроматографія на силікагелі з елюен7,28 (m, 1H, молодший ротамер), 7,2-7,1 (m, 3H) том гептан/EtOAc=2/1 дає 1,71г (73%) чистої спо6,90 (t, 1H, старший ротамер), 6,86 (t, молодший луки. 1 ротамер), 5,15 (s, 1H, старший ротамер), 5,14 (m, Н ЯМР (400МГц, CDCI3) δ 7,43 (m, 2H), 4,97 1H, молодший ротамер), 5,07 (s, 1H, молодший (broad, 1H), 4,41 (broad, 2H), 4,24 (m, 2H), 1,41 (s, ротамер), 4,72 (m, 1H, старший ротамер), 4,65-4,45 9H), 1,11 (m, 2H), 0,06 (s, 9H) (m, 2H), 4,30 (m, 1Н, старший ротамер), 4,16 (m, (хіх) Boc-(S)Aze-Pab(2,6-diF)(Teoc) 1H, старший ротамер), 4,03 (m, 1H, молодший роBoc-Pab(2,6-diF)(Teoc) (1,009г, 2,35ммоль; тамер), 3,95 (m, 1H молодший ротамер), 2,63 (m, опер, (xviii) розчиняють у 50мл EtOAc насиченого 1H, молодший ротамер), 2,48 (m, 1H, старший рогазом НСІ. Суміш залишають на 10хвил., випарютамер), 2,21 (m, 1Н, старший ротамер), 2,07 (m, ють і розчиняють у 18мл ДМФ, і потім охолоджу1Н, молодший ротамер), 1,89 (s, 3Н). 13С ЯМР ють на льоду. Додають Boc-(5)Aze-OH (0,450г, (75МГц,.СО3OD): (карбоніл і/або амідинкарбони, 2,24ммоль), ГФБТФ (1,24г, 2,35ммоль) і потім діісуміш ротамерів) δ 171,9, 171,2, 165,0, 162,8, 160,4 зопропілетиламін (1,158г, 8,96ммоль). Реакційну APCI-MS: (Μ+1)=503/505 m/z. суміш перемішують 2год. і потім вливають у 350мл Приклад 2 Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)води і екстрагують тричі EtOAc. Об'єднані органічні (S)Aze-Pab(2,6-diF)(OMe) фази промивають розсолом, сушать (Na2SO4) і випарюють. Флеш-хроматографія на силікагелі з елюентом гептан:EtOAc (1:3) дає 1,097г (96%) бажаної сполуки. 1 Н ЯМР (500МГц. CDCI3) δ 7,46 (m, 2H), 4,654,5 (m, 3Н), 4,23 (m, 2H), 3,87 (m, 1H), 3,74 (m, 1H), 2,45-2,3 (m, 2H), 1,40 (s, 9H), 1,10 (m, 2H),0,05(s,9H) (і) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze(xx) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)AzePab(2,6-diF)(OMe,Teoc) Pab(2,6-diF)(Teoc) Суміш Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)Boc-(S)Aze-Pab(2,6-diF)(Teoc) (0,256r, (S)Aze-Pab(2,6-diF) (64мг, 0,099ммоль; див. Прик0,500ммоль; опер, (хіх)) розчиняють у 20мл EtOAc, лад 1 (хх)) i О-метилгідроксиламінгідрохлорид насиченого газом НСІ. Суміш залишають на (50мг, 0,60ммоль) у 4мл ацетонітрилу гріють при 10хвил., випарюють і розчиняють у 5мл ДМФ. До70°С 3год. Розчинник випарюють і залишок роздідають Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)OH ляють між водою і EtOAc. водний шар was екстра(0,120г, 0,475ммоль; опер, (viii)), ГФБТФ (0,263г, гують двічі EtOAc і об'єднану органічну фазу про0,498ммоль) і потім діізопропілетиламін (0,245г, мивають водою, сушать (Na2SO4) і випарюють. 1,89ммоль). Реакційну суміш перемішують 2год. і Одержаний продукт використовують без подальпотім вливають у 350мл води і екстрагують тричі шого очищення. Вихід 58мг (87%). 1 EtOAc. Об'єднану органічну фазу промивають розH ЯМР (400МГц. CDCI3) δ 7,90 (bt, 1H), 7,46 солом, сушать (Na2SO4) і випарюють. Флеш(m, 1H), 7,25-6,95 (m, 5H), 6,51, t, 1H), 4,88 (s, 1H), хроматографія на силікагелі з EtOAc дає 0,184г 4,83 (m, 1H), 4,6-4,5 (m, 2H), 4,4-3,9 (m, 4H), 3,95 (60%) бажаної сполуки. (s, ЗН), 3,63 (m, 1H), 2,67 (m, 1H), 2,38 (m, 1H), 1,87 1 Н ЯМР (400МГц, CD3OD, суміш ротамерів) δ (broad, 1H), 0,98 (m,2H), 0,01 (s, 9H). 7,55-7,45 (m, 2H), 7,32 (m, 1H, старший ротамер), (ii) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(OHS)Aze7,27 (m, 1Н, молодший ротамер), 7,2-7,1 (m, 2Н), Pab(2,6-diF)(OMe) 6,90 (t, 1Н, старший рота-мер), 6,86 (t, 1H, молод 27 75937 28 Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)AzeEtOAc і об'єднану органічну фазу промивають розPab(2,6-diF)(OMe) (58мг, 0,086ммоль; опер, (і)) солом і сушать over Na2SO4. Флеш-хроматографія розчиняють у 3мл ТФК, охолоджують на льоду і (SiO2, EtOAc/гептан (4/1)) дає бажану сполуку залишають реагувати на 2год. ТФК випарюють і (0,56г, 81%) у вигляді масла. 1 залишок розчиняють у EtOAc. Органічний шар Н ЯМР (400МГц; CD3OD) ротамери: δ 7,43 (m, промивають двічі водним карбонатом натрію і во2Н), 7,31 (m, 1Н, старший ротамер), 7,26 (m, 1H, дою, сушать (Na2SO4) і випарюють. Залишок сумолодший ротамер), 7,2-7,1 (m, 2H), 6,90 (t, 1H, шать виморожуванням з води і ацетонітрилу і одестарший ротамер), 6,86 (t, 1H, молодший ротаржують 42мг (92%) бажаної сполуки. Чистота мер). 5,14 (s, 1H, старший ротамер), 5,11 (m, 1H, 94%. молодший ротамер), 5,04 (s, 1Н, молодший рота1 H ЯМР (300МГц, CDCI3) δ 7,95 (bt, 1Н), 7,2-7,1 мер), 4,71 (m, 1Н, старший ротамер), 4,6-4,45 (m, (m, 4Н), 6,99 (m, 1Н), 6,52 (t, 1Н), 4,88 (s, 1Н), 4,852H), 4,30 (m, 1Н, старший ротамер), 4,2-3,9 (m, 1Н; 4,75 (m, 3Н), 4.6-4,45 (m, 2Н), 4,29 (broad, 1Н), 4,09 і 1Н, молодший ротамер), 2,62 (m, 1H, молодший (m, 1Н), 3,89 (s, 3Н), 3,69 (m, 1Н), 2,64 (m, 1Н), 2,38 ротамер), 2,48 (m, 1H, старший ротамер), 2,21 (m, (m, 1Н),1,85 (broad, 1Н). 13С ЯМР (100МГц; CDCI3): 1H, старший ротамер), 2,09 (m, 1H, молодший ро(карбоніл і/або амідинокарбони) δ 172,1, 169,8, тамер) 13С ЯМР (100МГц; CD3OD): (карбонілкар151,9 бони) δ 171,9, 171,8 MS (m/z) 484,0, 485,9 (Μ-1)+, APCI-MS: (М+1)=533/535 m/z 486,0, 487,9 (Μ+1)+ Приклад 3 Ph(3-CI)(5-OCHF2)(iv) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(OHS)Aze(R)CH(OH)C(OHS)Aze-Pab(2,6-diF)(OH) Pab(2,6-diF)(OH) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)AzeNHCH2-Ph(2,6-diF, 4-CN) (0,555г, 1,14ммоль, опер, (ііі)) розчиняють у 10мл EtOH (95%). До цього розчину додають гідроксиламінгідрохлорид (0,238г, 3.42ммоль) і Et3N (0,48мл, 3,44ммоль). Після перемішування при кімнатній температурі протягом 14год. розчинник видаляють і залишок розчиняють (ι) Boc-(S)Aze-NHCHvPh(2,6-diF, 4-CN) у EtOAc. Органічну фазу промивають розсолом і Boc-(S)Aze-OH (1,14г, 5,6ммоль) розчиняють у Н2О і сушать над Na2SO4. Сирий продукт очищу45мл ДМФ. Додають 4-амінометил-2,6ють препаративною рідинною хроматографією з дифлуорбензонітрил (1,00г, 5,9моль, див. Приклад елюентоим CH3CN:0,1M NH4OAc і одержують ба1 (xiv)), ГФБТФ (3,10г, 5,95ммоль) і ДІПЕА (3,95мл, жану сполуку у вигляді аморфного порошку 22,7ммоль) і розчин перемішують при кімнатній (0,429г, 72%) після сушіння виморожуванням. температурі 2год. Розчинник випарюють і залишок 1 Н ЯМР (400МГц; CD3OD) ротамери: δ 7,35-7,1 розділяють між Н2О і EtOAc (75мл кожного). Водну (m, 5H), 6,90 (t, 1H, старший ротамер), 6,85 (t, 1H, фазу екстрагують 2 50мл EtOAc і об'єднану оргамолодший ротамер), 5,15 (s, 1H, старший ротанічну фазу промивають розсолом ι сушать над мер), 5,12 (m, 1H, молодший ротамер), 5,08 (s, 1H, Na2SO4. Флеш-хроматографія (SiO2, EtOAc/гептан молодший ротамер), 4,72 (m, 1H, старший рота(3/1)) дає бажану сполуку (1,52г, 77%) у вигляді мер), 4,6-4,4 (m, 2H), 4,30 (m, 1Н, старший ротамасла, яке кристалізують у холодильнику. 1 мер), 4,12 (m, 1H, старший ротамер), 4,04 (m, 1H, Н ЯМР (400МГц; CD3OD): δ 7,19 (m, 2H), 4,65молодший ротамер), 3,94 (m, 1H, молодший рота4,5 (m, 3Н), 3,86 (m, 1H), 3,73 (m, 1H), 2,45-2,3 мер), 2,62 (m, 1H, молодший ротамер), 2,48 (m, (m,2H), 1,39 (s, 9H) 1H, старший ротамер), 2,22 (m, 1H, старший рота(ii) H-(S)Aze-NHCH2-Ph(2,6-diF, 4-CN) HCl мер), 2.10 (m. 1H, молодший ротамер) Boc-(S)Aze-NHCH2-Ph(2,6-diF, 4-CN) (0,707г, 13 С ЯМР (100МГц: CD,OD): (карбоніл і аміди2,01ммоль, опер, (і)) розчиняють у 60мл EtOAc, нокарбони, ротамери) δ 172,4, 171,9, 171,0, 152,3, насиченого газом НСІ. Після перемішування при 151,5 кімнатній температурі протягом 15хвил. розчинник MS (m/z) 517,1, 519,0 (Μ-1)+, 519,1, 521,0 випарюють, залишок розчиняють у CH3CN/H2O (Μ+1)+ (1/1) і сушать виморожуванням, одержуючи бажаПриклад 4 ну сполук (0,567г, 98%) у вигляді білуватого аморСполуку Прикладу 1 випробують згідно з Тесфного порошку. 1 том А, описаним вище. Одержують ІС50ТТ менше Н ЯМР (400МГц, CD3OD): δ 7,49 (m, 2H), 4,99 0,02мкМ. (m, 1H), 4,58 (m, 2H), 4,12 (m, 1H), 3,94 (m, 1H), Приклад 5 2,80 (m, 1H), 2,47 (m, 1H) MS(m/z) 252,0 (M+1)+ Сполуку Прикладу 1 випробують згідно з Тес(iii) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(OHS)Azeтом D, описаним вище. Одержують IC50TT менше NHCH2-Ph(2,6-diF, 4-CN) 1мкМ. Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)OH (0,40г, Приклад 6 1,42ммоль, Приклад 1 (viii)) розчиняють у 10мл Сполуку Прикладу 1 випробують згідно з ТесДМФ і додають H-(S)Aze-NHCH2-Ph(2,6-diF, 4том Е, описаним вище. Ця сполука показує оральCN) HCI (0,43г, 1,50ммоль, опер.(іі)) і ГФБТФ ну і/або парентеральну біозасвоюваність у щурів, (0,779г, 1,50ммоль) з подальшим доданням ДІПЕА що відповідає активному інгібітору (вільний амі(1,0мл, 5,7ммоль). Після перемішування при кімдин). натній температурі протягом 2год. розчинник виПриклад 7 парюють, залишок розділяють між Н2О (200мл) і Сполуку Прикладу 1 випробують згідно з ТесEtOAc (75мл), водну фазу екстрагують 2 75мл том G, описаним вище. Виявлено, що вона перет 29 75937 30 ворюється у відповідний активний інгібітор (вільPX рідинна хроматографія ний амідин) у мікросомах печінки людини і щура. Me метил Абревіатури MeOH метанол Ас ацетил хвил. хвилин хімічна іонізація при атмосферному тиску MS мас-спектрографія АРСІ (при мас-спектрографії) МТБЕ метил-трет-бутиловий етер іонізація при атмосферному тиску (при нікотинамідадениндинуклеотид, редукоАРІ НААД мас-спектрографії) вана форма aq. водн. нікотинамідадениндинуклеотидфосфат, НААДФ ППК площа під кривою редукована форма Aze ацетидин-2-карбоксилат National Institute of Health (US) (НаціонаN1H AzeOH ацетидин-2-карбонова кислота льний Інститут Здоров'я - США) Воc трет-бутоксикарбоніл одиниці Національного Інституту ЗдороN1HU АБС альбумін бичої сироватки в'я СІ хімічна іонізація (при мас-спектрографії) ЯМР ядерно-магнітний резонанс ДН днів OAc ацетат ДЦК дициклогексилкарбодіімід Паб пара-амідинобензиламін ГДБА гідрид діізобутилалюмінію H-Pab пара-амідинобензиламін ДІПЕА діізопропілетиламін Ph феніл ДМАП 4-(N,N-диметиламіно)піридин гексафлуорфосфат (бензотриазол-1ГФБТФ ДМФ диметилформамід ілокси)трипіролідинфосфонію ДМСО диметилсульфоксид ФТБА флуорид тетрабутиламонію ГТВ глибокий тромбоз вени зворотно-фазова рідинна хроматографія RPPX високого розрізнення 1-(3-диметиламінопропіл)-3ЕДХ етилкарбодіімідгідрохлорид к.т. кімнатна температура Et етил СРПи стандартні робочі процедури етер діетилетер [тетрафлуорборат Ν,Ν,Ν',Ν'-тетраметилТФТУ О-(бензотриазол-1-іл)уронію] EtOAc етилацетат TEA триетиламін EtOH етанол Teoc 2-(триметилсиліл)етоксикарбоніл Et2O діетилетер 2,2,6,6-тетраметил-1-піперидинілоксил, год. годин ТМПО= вільний радикал гексафлуорфосфат О-азабензотриазолГФТУ ΤΦΚ трифлуороцтова кислота 1-Ν,Ν,Ν',Ν'-тетраметилуронію ΤΓΦ тетрагідрофуран [гексафлуорфосфат Ν,Ν,Ν',Ν'ГФБУ тетраметил-O-(бензотриазол-1-іл)уронію] тшх тонкошарова хроматографія гідрохлоридна кислота, хлорний газ або УФ ультрафіолет HCl гідрохлоридна сіль Hex гексани Префікси n, s, i t мають звичайні значення: нормальний, вторинний, ізо- і тетичний. Префікс с HOAc оцтова кислота або її сіль означає цикло. рідинна хроматографія високого розрізPXBP нення Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAmygdalic acid derivatives and use thereof as a thrombin inhibitors
Автори англійськоюINGHARD TORD, Johansson Anders, SVENSSON ARNE
Назва патенту російськоюПроизводные миндальной кислоты и их применение в качестве ингибиторов тромбина
Автори російськоюЙоханссон Андерс
МПК / Мітки
МПК: C07D 205/00, A61K 31/397, A61P 7/02
Мітки: похідні, використання, мигдалевої, інгібіторів, тромбіну, кислоти
Код посилання
<a href="https://ua.patents.su/15-75937-pokhidni-migdalevo-kisloti-ta-kh-vikoristannya-yak-ingibitoriv-trombinu.html" target="_blank" rel="follow" title="База патентів України">Похідні мигдалевої кислоти та їх використання як інгібіторів тромбіну</a>
Попередній патент: Спосіб (варіанти) передачі інформації для контролю потужності для швидкісного загального каналу зв’язку “по лінії вниз” (hs-scch) у мобільній комунікаційній системі
Наступний патент: Трикоординатний лазерний сканер для діагностики порушень постави
Випадковий патент: Адгезиметр адгм 20-"техно-ресурс"



















