Інгібітори 5-ліпоксигенази, фармацевтична композиція та спосіб лікування
Номер патенту: 45312
Опубліковано: 15.04.2002
Автори: Стівенс Родні В., Окумура Йосіюкі, Накао Казунарі, МАНО Такасі
Формула / Реферат
1. Соединение, имеющее следующую химическую формулу:
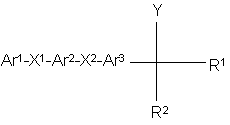
и его фармацевтически приемлемые соли, где
Аr1 представляет гетероциклический радикал, выбранным из группы, включающей: имидазолил, пирролил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, индолил, индазолил, бензимидазолил, который присоединен к Х1 по атому азота цикла и который необязательно замещен одним или двумя заместителями, выбранными из галогена, гидроксигруппы, цианогруппы, аминогруппы, С1—С4-алкила, С1—С4-алкокси, С1—С4-алкилтиогруппы, галогензамещенного С1—С4-алкила, галогензамещенной С1—С4-алкпксигруппы, С1—С4-алкиламиногруппы и ди (С1—С4)алкиламиногруппы,
Х1 представляет простую связь или С1—С4-алкилен,
Аr2 представляет фенилен, необязательно замещенный одним или двумя заместителями, выбранными из галогена, гидроксигруппы, цианогруппы, аминогруппы, С1—С4-алкила, С1—С4-алкоксигруппы, С1—С4-алкилтиогруппы, галогензамещенного С1—С4-алкила и галогензамещенной С1—С4-алкоксигруппы,
Х2 представляет -А-Х- или -Х-А-, где А - простая связь или С1—С4-алкилен и Х представляет оксигруппу, тиогруппу, сульфинил или сульфонил,
Ar3 представляет фенилен, пиридилен, тиенилен, фурилен, оксазолилен или тиазолилен, необязательно замещенный одним или двумя заместителями, выбранными из галогена, гидроксигруппы, цианогруппы, аминогруппы, С1—С4-алкила, С1—С4-алкоксигруппы, С1—С4-алкилтиогруппы, галогензамещенного С1—С4-алкила, галогензамещенной С1—С4-алкоксигруппы, С1—С4-алкиламиногруппы й ди(С1—С4)алкиламиногруппы,
R1 и R2 каждый представляет С1—С4-алкил или совместно они образуют группу –D1-z-D2-, которая вместе с атомом углерода, к которому она присоединена, составляет цикл из 3-8 атомов, где D1 и D2 - С1—С4-алкилен и Z представляет простую связь, оксигруппу, тиогруппу, сульфинил, сульфонил или винилен и D1 и D2 могут быть замещены С1—С3-алкилом и
У представляет СОNR3R4, СN, СООR3 или СSNR3R4, COR3, где R3 и R4 каждый представляет Н или С1—С4-алкил.
2. Соединение по п. 1, отличающееся тем, что Аr3 представляет необязательно замещенные фенилен.
3. Соединение по п. 2, отличающееся тем, что Аr2 представляет 1,4-фенилен и Аr3 представляет 1,3-Фенилен или 5-фтор-1,3-фенилен.
4. Соединение по п. 3, отличающееся тем, что Аr1 - 2-алкилимидазолил и Х1 - простая связь.
5. Соединение по п. 4, отличающееся тем, что У - группа CONН2.
6. Соединение по п. 5, отличающееся тем, что R1 и R2 - группа D1-Z-D2, где D1 и D2 каждый представляет этилен и Z представляет 0.
7. Соединение по п. 6, отличающееся тем, что Аr1 - 2-метилимидазолил и Х2 - группа СН2О.
8. Соединение по п. 6, отличающееся тем, что Аr1 - 2-метилимидазолил и Х2 – S.
9. Соединение по п. 3, отличающееся тем, что Аr1 - пирролил, Х1 - группа СН2, Х2 - S и У - группа CONH2.
10. Соединение по п. 1, отличающееся тем, что выбрано из:
4-/5-фтор-3-/4-(2-метилимидазол-1-ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамида,
4-/3-/4-(2-метилимидазол-1-ил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамида и
4-/3-/4-(пиррол-1-илметил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамида.
11. Фармацевтическая композиция для лечения аллергического или воспалительного состояния у млекопитающего, содержащая эффективное количество соединения по п. 1 и фармацевтически приемлемый носитель.
12. Способ лечения медицинского состояния, для которого необходим ингибитор 5-липоксигеназы, у млекопитающего, который представляет собой введение млекопитающему терапевтически эффективного количества соединения по п. I.
13. Способ по п. 12, отличающееся тем, что медицинское состояние является аллергическим или воспалительным состоянием.
Текст
1 Соединение, имеющее следующую химическую формулу Y Ar1-X1-Ar2-X2-Ar3 1 R 2 R и его фармацевтически приемлемые соли, где Аг1 представляет гетероциклический радикал, выбранным из группы, включающей имидазолил, пирролил, пиразолил, 1,2,3-триазолил, 1,2,4триазолил, индолил, индазолил, бензимидазолил, который присоединен к X1 по атому азота цикла и который необязательно замещен одним или двумя заместителями, выбранными из галогена, гидроксигруппы, цианогруппы, аминогруппы, Сі—С4алкила, Сі—С4-алкокси, Сі—С4-алкилтиогруппы, галогензамещенного Сі—С4-алкила, галогензамещенной Сі—С4-алкпксигруппы, Сі—С4алкиламиногруппы и ди (Сі— Сралкиламиногруппы, " представляет простую связь или Сі—СлX алкилен, Аг2 представляет фенилен, необязательно замещенный одним или двумя заместителями, выбранными из галогена, гидроксигруппы, цианогруппы, аминогруппы, Сі—С4-алкила, Сі—С4алкоксигруппы, Сі—С4-алкилтиогруппы, галогензамещенного Сі—С4-алкила и галогензамещенной С і —С4-ал ко кс и гру п п ы, X2 представляет -А-Х- или -Х-А-, где А - простая связь или Сі—С4-алкилен и X представляет оксигруппу, тиогруппу, сульфинил или сульфонил, Аг представляет фенилен, пиридилен, тиенилен, фурилен, оксазолилен или тиазолилен, необязательно замещенный одним или двумя заместителями, выбранными из галогена, гидроксигруппы, цианогруппы, аминогруппы, Сі—С4-алкила, Сі— С4-алкоксигруппы, Сі—С4-алкилтиогруппы, галогензамещенного Сі—С4-алкила, галогензамещенной Сі—С4-алкоксигруппы, Сі—С4алкиламиногруппы й ди(Сі— С4)алкиламиногруппы, R1 и R2 каждый представляет Сі—С4-алкил или совместно они образуют группу -D1-z-D2-, которая вместе с атомом углерода, к которому она присоединена, составляет цикл из 3-8 атомов, где D1 и D2 - Сі—С4-алкилен и Z представляет простую связь, оксигруппу, тиогруппу, сульфинил, сульфонил или винилен и D1 и D2 могут быть замещены Сі—Сз-алкилом и У представляет CONR3R4, CN, COOR3 или CSNR3R4, COR3, где R3 и R4 каждый представляет Н или Сі—С4-алкил 2 Соединение по п 1, отличающееся тем, что Аг3 представляет необязательно замещенные фенилен 3 Соединение по п 2, отличающееся тем, что Аг2 представляет 1,4-фенилен и Аг3 представляет 1,3Фенилен или 5-фтор-1,3-фенилен 4 Соединение по п 3, отличающееся тем, что Аг1 - 2-ал кил имидазолил и X1 - простая связь 5 Соединение по п 4, отличающееся тем, что У группа CONH2 6 Соединение по п 5, отличающееся тем, что R1 и R2 - группа D1-Z-D2, где D1 и D2 каждый представляет этилен и Z представляет 0 7 Соединение по п 6, отличающееся тем, что Аг1 - 2-метилимидазолил и X2 - группа СНгО 8 Соединение по п 6, отличающееся тем, что Аг1 - 2-метилимидазолил и X2 - S 9 Соединение по п 3, отличающееся тем, что Аг1 д , 1 , X2 - S и У - группа - пирролил, X1 - группа CONH2 10 Соединение по п 1, отличающееся тем, что выбрано из 4-/5-фтор-3-/4-(2-метилимидазол-1ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Нпиран-4-карбоксамида, 4-/3-/4-(2-метилимидазол-1-ил)фенилтио/фенил/3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамида и О ГО Ю 45312 4-/3-/4-(пиррол-1-илметил)фенилтио/фенил/3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамида 11 Фармацевтическая композиция для лечения аллергического или воспалительного состояния у млекопитающего, содержащая эффективное количество соединения по п 1 и фармацевтически приемлемый носитель Изобретение относится к новым соединениям Соединения настоящего изобретения подавляют действие фермента липоксигеназы, и применимы для лечения или облегчения симптомов воспалительных заболеваний, аллергии и сердечнососудистых заболеваний млекопитающих Кроме того, изобретение относится к содержащим такие соединения фармацевтическим композициям Арахидоновая кислота, как известно, является биологическим предшественником нескольких групп биологически активных эндогенных метаболитов Первым этапом в метаболизме арахидоновой кислоты является ее выделение из мембранных фосфолипидов под действием фосфолипазы А2 Затем арахидоновая кислота подвергается метаболизму либо под действием циклоксигеназы с образованием простагландинов, в том числе и простациклина и тромбоксанов, либо под действием липоксигеназы с образованием жирных гидроксипероксикислот, которые далее могут быть превращены влейкотриены Лейкотриены являются чрезвычайно активными веществами, проявляющими биологическую активность в широком диапазоне, часто в от наномолярного до пикомолярного интервала концентраций Пептидолейкотриены (ЛТС4, ЛТД4, ЛТЕ4) являются важными суживающими бронхи и сосуды веществами, и кроме того вызывают транссудацию плазмы за счет повышения проницаемости капилляров ЛТВ4 является эффективным хемотактическим агентом, усиливающим приток лейкоцитов и индуцирующим их последующее дегранулирование в месте воспаления Патофизиологическая роль лейкотриенов выявлена в целом ряду болезненных состояний человека, в том числе астмы и родственных заболеваний с абструкцией дыхательных путей, аллергического ринита, ревматоидного артрита а подагры, псориаза и атопического дерматита, респираторного дистресс-синдрома взрослых (РДСВ), воспалительных заболеваний кишечника (напр , болезни Крона), эндотоксинового шока, атеросклероза и сердечнососудистых нарушений (напр, индуцируемого ишемией повреждения миокарда) и гломерулярного нефрита Ожидается, что любое средство, подавляющее действие липоксигеназы, будет иметь значительную терапевтическую ценность для лечения острых и хронических воспалительных состояний Обзорную статью по ингибиторам липоксигеназы см Н Masamune и LS Melvm, Sr Annual Reports in Medical 1989, 24 cnh 71-80 (Академик) 4 12 Способ лечения медицинского состояния, для которого необходим ингибитор 5-липоксигеназы, у млекопитающего, который представляет собой введение млекопитающему терапевтически эффективного количества соединения по п I 13 Способ по п 12, отличающееся тем, что медицинское состояние является аллергическим или воспалительным состоянием Несколько позднее в патентах ЕР 0 462 830, А2, ЕР 0 505 122 А1 и ЕР 0 540 165 А1 раскрыты дополнительные примеры ингибиторов липоксигеназы Краткое описание изобретения Настоящее изобретение относится к новым химическим соединениям следующей формулы I Y Аг1-Х1-Аг2-Х2-Аг3 1 R 2 R и их фармацевтически приемлемые соли, где Аг1 представляет гетероциклический радикал, выбранный из группы, включающей имидазолил, пирролил, пиразолил, 1,2,3-триазолил, 1,2,4триазолил, индолил, индазолил, бензимидазолил, который присоединен к х1 через атом азота цикла у который возможно замещен одним или двумя заместителями, выбранными из галогена, гидроксигруппы, цианогруппы, аминогруппы, С1-С4алкила, Сі-С4-алкоксигруппьі, С1-С4алкилтиогруппы, галогензамещенного С1-С4алкила, галогензамещенной Сі-С4~алкоксигруппа, Сі-С4-алкиламиногруппьі и ди-(Сі-С4)злкиламиногруппы, Xі представляет простую связь или С1-С4алкилен, Аг2 представляет фенилен, возможно замещенный одним или двумя заместителями, выбранными из галогена, гидрокеигруппы, цианогруппы, аминогруппы, Сі-С4-алкила, С1-С4алкокойгрувпы, С-|-С4-алкилтиогруппы, галогензамещенного Сі-С4-алкила Сі-С4-алкокси группы, замещенной галогеном, X2 представляет группу -А-Х или -Х-А, где А простая связь или Сі-С4-алкилен и X представляет окоигрунду, тиогруппу, сульфинил или сульфонил, Аг3 представляет феиилен, пиридилен, тиенилен, фуриден, оксазолилен или тиазолилен, возможно замещенный одним или двумя заместителями, выбранными из галогена, гидрокеигруппы, цианогруппы, аминогруппы, Сі-С4-алкила, С1-С4алкоксигруппы, С-|-С4-алкилтиогрунпы, галогензамещенного Сі-С4-алкила, галогензамещенной С-іС4-алкоксйгруппы, Сі-С4-алкиламиногруппьі и ди (С-|-С4)алкиламиногруппы, R1 и R2 каждый представляет Сі-С4-алкил или вместе они образуют группу - D1-z-D2-, которая 45312 вместе с углеродом, к которому она присоединена 1 определяет цикл с 3-8 атомами, где D и D - C-iС4-алкилен и z представляет простую связь, оксигруппу, тиогруппу, сульфинил, сульфонил или ви2 нилен и D и D могут быть замещены С-і-Сзалкилом и У представляет CONR3R4, CN, COOR3, COR3 или CSNR3R4, где R3 и R4 каждый представляет Н или СгС4-алкил Предпочтительное значение для галогензамещенного Сі-С4-алкила - трифторметил и предпочтительное значение для СгС4-алкоксигруппы трифторметокситруппа Предпочтительная группа соединений настоящего изобретения включает соединения фор3 мулы I, где Аг - 1,4-фенилен и Аг -1,3-фенилен или 5-фтор-1,3-фенилен В рамках предпочтительное группы особенно предпочтительны соединения, в которых (1) Аг1 - 2-алкилимидазолил, X1 - простая связь и У -группа CONH2 и (2) Аг1 - пирролил, X1 - группа СЬЬ и У - группа CONH2 Указанные соединения применимы для лечения или облегчения симптомов воспалительных заболевание, аллергии или сердечнососудистых заболевание млекопитающих и в качестве активных компонентов применимы в фармацевтических препаратах для лечения таких состояние Подробное описание изобретения Соединения формулы I или их фармацевтически приемлемые соли могут быть получены разнообразными методами К примеру, соединения формулы I получают реакциями, иллюстрируемыми схемой I 1 ~ A ^ ^ — A — Q + 1І — X — Аґ В + — q Схеиа І В одном из вариантов соединение формулы II, где Q - замещаемая группа, вступает в реакцию сочетания с соединением формулы III в присутствии приемлемого основания Во втором варианте соединение формулы У, где Q - замещаемая группа, вступает в реакцию сочетания с соединением формулы IV в присутствии основания Приемлемая замещаемая группа Q представлена галогеном или сульфонилоксигруппой, например фтором, хлором, бромом, йодом, трифторметансульфонилоксигруппой, метансульфонилоксигруппой или птолуолсульфонилоксигруппой, каждая из которых легко доступна обычными методами Рекомендуемые для реакции сочетания основания включают, например гидроксиды, алкоксиды, карбонаты или гидриды щелочных или щелочноземельных металлов, например гидроксид натрия, гадроксид калия, метоксид натрия, этоксид натрия, трет-бутоксид натрия, карбонат натрия, карбонат калия, гидрид натрия или гидро ксид калия, или амин, например триэтиламин, диизопропилэтиламин или диметиламинопиридин Рекомендуемые, инертные в условиях реакции растворители включают, например ацетон, ацетонитрил, дихлорметан, N.N-диметилформамид, д и метил сульфоксид, диоксан и тетрагидрофуран Температура реакции предпочтительно находится в интервале от комнатное температуры до температуры кипения растворителя, но могут быть использованы и более низкие или более высокие температуры Реакцию удобно проводить в присутствии соответствующего катализатора, например тетракис-(трифенилфосфин)палладия, хлорида бис (трифенилфосфин) палладия (II), оксида меди (I), йодида меди (I), бромида меди (I) или хлорида меди (I) Продолжительность реакции, как правило, от нескольких часов до нескольких дней Кроме того, соединение формулы II (или формулы V), где Q -гидроксил, А - СгС4-алкилен, например, метилен, вступает в реакнйю сочетания с соединением формулы III (или формулы IV) в условиях реакции типа реакыии Митцунобу (Mitsunobu) К приемлемым конденсирующим агентам относятся, например диэтилазодикарбоксилат и трифенилфосфин, и приемлемые, инертные в условиях реакции растворители включают дихлорметан, тетрагидрофуран и толуол Температура реакции предпочтительно находится в интервале от 0°С до комнатной температуры, но при необходимости могут быть использованы более низкие или более высокие температуры Продолжительность реакции, как правило, от нескольких минут до нескольких часов Для получения тех соединение формулы I, в которых X -сульфинил или сульфонил, соединение формулы I, где X - тиогруппа, может быть окислено обычными методами Приемлемые окислители включают перекись водорода, надкислоты, например м-хлорнадбензойную или надуксусную кислоты, перйодат натрия или пероксисульфаты щелочных металлов, например, пероксимоносульфат натрия Рекомендуемые, инертные в условиях реакции растворители включают ацетон, дихлорметан, хлороформ, тетрагидрофуран или воду Температура реакции предпочтительно находится в интервале от 0°С до комнатной температуры, но при необходимости могут быть использованы более низкие или более высокие температуры, продолжительность реакции, как правило, от нескольких минут до нескольких часов Исходные соединения формул II, III, IV и V могут быть синтезированы обычными, известными специалистам методами, известные соединения могут быть получены по опубликованным методикам, а аналоги известных соединение могут быть получены по аналогичным методикам Соединения формул I, II, III, IV и V могут быть выделены стандартными методами и их очистка может быть осуществлена обычными, известными специалистам средствами, например перегонкой, кристаллизацией и хроматографическими методами Соединения настоящего изобретения, содержащие один или несколько асимметрических цен 8 Соединения настоящего изобретения подавляют активность фермента 5-липоксигеназы Такое подавление может быть показано in vitro, в анализах с применением находящихся в брюшной полости крысы (ВПК) клеток (Japanese Journal of Inflammation, 1987, 7, 145-150) и гепаринизированной полной крови человека (ПКЧ) (Вг J of Pharmacol , 1990, 99, 113-118) В обоих анализах определяют влияние указанных соединение на метаболизм арахидоновои кислоты Показано, что все соединения нижеследующих примеров, испытанные в вышеупомянутых анализах, обладают эффективностью в подавлении активности липоксигеназы Отдельные рекомендуемые соединения доказали низкие величины ИК50 в интервале 0,011мкМ относительно активности липоксигеназы 45312 тров, могут существовать в различных стереоизомерных формах Все такие индивидуальные формы и их смеси включены в объем изобретения Разнообразные изомеры могут быть получены стандартными методами К примеру, рацемические смеси могут быть разделены на индивидуальные энантиомеры стандартными методами разделения Индивидуальные диастереомеры могут быть получены стереоселективным синтезом или разделением смесей фракционной кристаллизацией или хроматографическими методами Поскольку соединения настоящего изобретения являются соединениями основного характера, все они способны образовывать при добавлении кислот самые разнообразные кислотноаддитивные соли с неорганическими и органическими кислотами Кислотно-аддитивные соли новых соединение данного изобретения легко образуются при контактировании соединения с выбранное минеральное или органической кислотой в водной растворяющей среде или в приемлемом органическом растворителе, например метаноле или этаноле Целевая твердая соль может быть затем получена осаждением или осторожным испарением растворителя Кислоты, применяемые для получения фармацевтически приемлемых кислотноаддитивных солей вышеупомянутых соединений данного изобретения, являются кислотами, образующими нетоксичные соли, например гидрохлорид, гидробромид, гидрододид, нитрат, сульфат, ацетат, фумарат, тартрат, сукцинат, малеат, глюконат, сахарат, бензоат, метансулъфонат, бензолсульфонат, п-толуолсульфонал и паноат (те І,Гметиленбис (2-гидрокси-З-нафтоат)) Соединения изобретения, имеющие также кислотные группы, способны образовывать соли с основаниями при добавлении разнообразных фармацевтически приемлемых катионов Примеры подобных солей включают соли с щелочными металлами или щелочноземельными металлами, в частности, соли натрия и калия Такие соли получают обычными методами К химическим основаниям, применяемым в качестве реагентов при получении фармацевтически приемлемых солей с основаниями данного изобретения, относятся основания, образующие нетоксичные соли Такие конкретные нетоксичные соли с основаниями включают соли, образованные с такими фармацевтически приемлемыми катионами, как катионы натрия, калия, кальция, магния и т д Такие соли могут быть легко получены обработкою вышеупомянутых соединении водным раствором, содержащим целевой фармацевтически приемлемый катион с последующим испарением полученного раствора досуха, предпочтительно при пониженном давлении Или же такие соли могут быть также получены смешиванием раствора кислотного соединения в низшем спирте с полевым алкоксидом щелочного металла с последующим испарением полученного раствора досуха в вышеуказанных условиях В обоих случаях рекомендуют применять стехиометрические количества реагентов с целью обеспечения полноты реакции и максимального выхода целевого продукта Способность соединении настоящего изобретения подавлять фермент липоксигеназу делает их полезными в регулировании симптомов, индуцируемых эндогенными метаболитами, возникающими при метаболизме арахидоновои кислоты у млекопитающих, особенно у человека Вследствие этого соединения представляют ценность для профилактики и лечения тех болезненных состояний, побудительным фактором которых является накопление метаболитов арахидоновои кислоты, напр аллергическое бронхиальное астмы, кожных нарушений, ревматоидного артрита и остеоартрита Соединения настоящего изобретения и их фармацевтически приемлемые соли полезны, в частности, для лечения или облегчения симптомов воспалительных заболевание человека Для лечения различных вышеуказанных состояний соединения и их фармацевтически приемлемые соли могут быть введены человеку в чистом виде или, что предпочтительнее, в сочетании с фармацевтически приемлемым носителем или разбавителем в виде фармацевтической композиции, приготовленное согласно стандартное фармацевтической практике Соединения могут быть введены перорально или парентерально обычным образом При введений соединений человеку с целью профилактики или лечения воспалительного заболевания пероральная доза будет в интервале 0,1-Юмг на кг веса тела подлежащего лечению субъекта в день, предпочтительно 0,1-4мг/кг в день единственной или раздельными дозами Если желательно парентеральное введение, в этом случае эффективная доза будет в интервале 0,055мг на кг веса тела подлежащего лечению субъекта в день В отдельных случаях может оказаться необходимым применение дозировок вне указанных пределов, поскольку дозировки обязательно меняются в зависимости от возраста, веса и реакции отдельного больного, а также тяжести симптомов у больного и эффективности конкретного вводимого соединения При пероральном введении соединения изобретения и их фармацевтически приемлемые соли могут быть введены в виде, например таблеток, порошков, лепешек, сиропов или капсул или в виде водного раствора или суспензии В случае таблеток для приема перорально носители, обычно применяемые для приготовления таблеток, 45312 10 включают лактозу и кукурузный крахмал Кроме Заглавное соединение получено из этилового того, обычно добавляют смазывающие агенты, эфира 1-(5-фтор-3-гидроксафенил)циклопентан-1такие как стеарат магния В случае капсул к прикарбоновой кислоты по методике получения этиемлемым разбавителям относятся лактоза и вылового эфира 4-/5-фтор-3-/4-(2-метилимидазол-1сушенный кукурузный крахмал Если для пероил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Нрального введения требуется водная суспензия, пиран-4-карбоновой кислоты (Пример 2) активный компонент смешивают с эмульгаторами 1Н ЯМР (CDCI3)5 7,55 (2Н, д, J = 8,4Гц), 7,33 и суспендирующими средствами При желании (2Н, д, J = 8,4Гц), 7,04 (1Н, д, J =1,5Гц), 7,01 (1Н, д, могут быть добавлены определенные подслащиJ = 1,5Гц), 6,8-6,78 (1Н, м), 6,73 (1Н, ддд, J = 9,5, вающие и/или ароматизирующие средства Для 2,2 и 2,2Гц), 6,58 (1Н, ддд, J = 10, 2,2 и 2,2Гц), 5,08 внутримышечного, внутрибрюшинного, подкожного (2Н, с), 4,09 (2Н, к, J = 7Гц), 2,64-2,55 (2Н, м), 2,38 и внутривенного введения обычно получают сте(ЗН, с), 1,93-1,68 (6Н, м), 1,17 (ЗН,т, J =7Гц) рильные растворы активного компонента, устаD 1-/5-Фтор-3-/4-(2-метилимидазол-1навливают в растворе требуемое значение рН и ил)бензилокси/фенил/-циклопентан-1-карбоксамид добавляют буфер Для внутривенного введения Целевое соединение получено из этилового полная концентрация растворенных веществ доэфира 1-/3-фтор-5-/4-(2-метилимидазол-1лина, регулироваться с приданием препарату изоил)бензилокси/фенил/цикловентан-1-карбоиовой тоничности кислоты по методике получения 4-/5-фтор-3-/4-(2метилимидазол-1-ил)беизилоксй/фенил/-3,4,5,6Кроме того, в частности, для лечения астмы тетрагидро-2Н-пиран-4-карбоксамида (Пример 5) соединения формулы I данного изобретения могут быть введены человеку ингаляцией Для этой це1Н ЯМР (С DCI3) 5 7,56 (2Н, д, J = 8,1 Гц), 7,34 ли соединения вводятся в виде капелек или тума(2Н, д, J = 8,1 Гц), 7,04 (1Н, с), 7,02 (1Н, с), 6,93 на, в соответствий со стандартной практикой (1Н, дд, J = 2,2 и 2,2 Гц), 6,78 (1Н, ддд, J = 2,2, 2,2 и 9,5Гц), 6,65 (1Н, ддд, J = 2,2, 2,2 и 9,5 Гц), 6,11 Примеры (2Н, ш с), 5,12 (2Н, с), 2,52-2,4 (2Н, м), 2,38 (ЗН, с), Настоящее изобретение иллюстрируется сле2,13-1,82 (6Н, м) дующими примерами Однако, необходимо подчеркнуть, что изобретение не может быть ограниПример 2 чено характерными деталями этих примеров Этиловый эфир 4-/5-фтор-3~/4-(2Спектры протонного ядерного магнитного резометилимидазол-1 ~ил)бенэил-окси/фенил/-3 4,5,6нанса (ЯМР) нолучены при 270МГц, если нет осотетрагидро-2Н-пиран-4-карбоновой кислоты бых указаний, й положение пиков выражают в часА Этиловый эфир 4-(2-метилимидазол-1тях на миллион (ч/млн) в нисходящем ил)бензойной кислоты направлении от тетраметисилана Форма пика Смесь 2-метилимидазола (50г, О.бмоля), этиопределяется следующим образом с -синглет, д лового эфира 4-фторбензойной кислоты (ЮОг, дублет, т - триплет, м - мультиплет и ш - широкий О.бмоля) и карбоната калия (415г, Змоля) в сухом ДМСО (1,5л) нагревают 66 часов при 120°С в атПример 1 мосфере азота После охлаждения до комнатной 1-/3-фтор-5-/4-(2-метилимидазол-1 температуры реакционную смесь переносят в леил)фенил/циклопентан-1-карбоксамид дяную воду (1л) и экстрагируют ЕЬО (750мл х 2) А Этиловый эфир 1 -(З-бензилокси-5Органическую фазу промывают водой 500мл) и фторфенил)циклопентан-1-карбоновой кислоты рассолом (500мл), сушат над MgSO4 и испаряют Названное соединение получено из этилового Перекристаллизацией твердого остатка из смеси эфира З-бензилокси-5-фторфенилуксусной кислоэтил ацетат-гексан получают заглавное соединеты по методике получения этилового эфира 4-(3ние (47г, 33%) в виде желтых игл бензилокси-5-фторфенил-3,4,5,6-тетрагидро-2Нпиран-4-карбоновои кислоты, но с заменой 1,41Н ЯМР (С DCI3) 5 8,22-8,12 (м, 2Н), 7,43-7,33 дибромбутаном бис(2-хлорэтилового) эфира (м, 2Н), 7,1-6,99 (м, 2Н), 4,42 (к, J = 7 Гц, 2Н), 1,43 1Н ЯМР (CDCI3) 5 7,49-7,28 (5Н,м), 6,81-6,75 (т, J = 7 Гц, ЗН) (1Н,м), 6,69 (1Н, ддд, J = 9,8, 2,2 и 2,2Гц), 6,56 (1Н, В 4-(2-Метилимидазол-1-ил)бензиловый ддд, J =10,2, 2 и 2,2Гц), 5,02 (2Н, с), 4,07 (2Н, к, J = спирт 7Гц), 2,67-2,52 (2Н, м), 1,93-1,6 (6Н, м), 1,16 (ЗН, т, К раствору этилового эфира 4-(2J = 7Гц) метилимидазол-1-ил)бензойной кислоты (46г, В Этиловый, эфир 1-(5-фтор-30,2моля) в сухом CH2CI2 (1л), охлажденному до гидроксифенил)диклопентан-1-карбоновой кисло75°С, в атмосфере азота осторожно в течение 30 ты минут прибавляют диизобутилалюминий гидрид (540мл, 0.93М раствор в гексане), после чего Заглавное соединение получено из этилового смесь оставляют медленно нагреваться до комэфира 1 -(З-бензилокои-5натной температуры После перемешивания 5 фторфенил)циклопентан-1-карбоновой кислоты по часов реакционную смесь охлаждают в бане со методике получения этилового эфира 4-(5-фтор-3льдом и осторожно прибавляют метанол (30мл) гидроксифенил)-3,4,5,6-тетрагйдро-2Н-пиран-4Затем добавляют 30%-ый водным раствор соли карбоновой кислоты Рошелля (500мл) и смесь перемешивают 16 часов 1Н ЯМР (CDCI3)5 6,68-6,58 (2Н,м), 6,48 (1Н, при комнатной температуре Нерастворимые веддд, J = 10, 2,2 и 2,2Гц), 4,12 (2Н, к, J = 7Гц), 2,47щества (по существу продукт) отфильтровывают, 2,31 (2Н, м), 1,73-1,33 (6Н, м), 1,19 (ЗН, т, J = 7Гц) органическую фазу отделяют, промывают водої* С Этиловый эфир 1-/5-фтор-3-/4-(2(500мл), сушат (MgSO4) и испаряют Полученный метиимидазол-1-)бензилокси/фенил/циклопентанобъединенный твердый продукт перекристаллизо1-карбоновой кислоты 11 45312 12 вывают из этанола (прим 300мл) с получением 1Н ЯМР (CDCI3) 5 7,5-7,3 (5Н, м), 6,77-6,5 заглавного соединения (35,6г, 95%) в виде белых (ЗН, м), 5,02 (2Н, с), 4,16 (2Н, к, J = 7,3Гц), 3,56 игл (2Н, с), 1,26 (ЗН,т, и = 7,ЗГц) 1Н ЯМР (ДМСО-de) 5 7,5-7,33 (4Н, м), 7,25 F Этиловый эфир 4-/3-(бензилокси)-5(1Н, д, J = 1,1Гц), 6,9 (1Н, д, J = 1,1 Гц), 5,33 (1Н, т, фторфенил/-3,4,5,6-тетрагидро-2Н-пиран-4J = 6Гц), 4,56 (2Н, д, J = 6Гц), 2,27 (ЗН, с) карбоновой кислоты С Гидоохлорид 4-(2-метилимидазол-1 К перемешиваемому раствору этилового эфиил)бензилхлорида ра 3-(бензилокси)-5-фторфенилуксусной кислоты (17,5г, 61ммоль) и 15-краун-5 (1,32г, бммоль) в 4-(2-метилимидозол-1-ил)бензиловый спирт ДМФА (300мл) добавляют при комнатной темпе(1,28г, 6,8ммоля) в SOCb (5мл) перемешивают 30 ратуре гидрид натрия порциями (5,37г, 134ммоль, минут при комнатной температуре, после чего 60%-ая дисперсия в минеральном масле) После летучие вещества удаляют при пониженном давперемешивания 25мин при комнатной температулении Полученный сырой продукт промывают ре добавляют йодид натрия (1,32г, бммоль) и минимальным количеством ЕЬО и после сушки в бис(2-хлорэтиловый) эфир (9,14г, 61ммоль) Спусвакууме получают заглавное соединение (1,65г, тя 1 день смесь разбавляют 0,5н соляной кислоколич ) в виде белого твердого вещества той (500мл) и экстрагируют эфиром (3 х 500мл) 1Н ЯМР (ДМСО-de) 5 7,91 (1Н, д, J = 1,84Гц), Объединенные экстракты промывают водой 7,79 (1Н, д, J = 1,84Гц), 7,72 (2Н, д, J = 8,8Гц), 7,66 (500мл), насыщенным раствором бикарбоната (2Н, д, J = 8,8Гц), 4,89 (2Н, с), 2,56 (ЗН, с) натрия (500мл), водой (500мл) и рассолом D Диэтиловый эфир З-бензилокси-5(500мл), сушат (сульфат магния) и концентрирофторфенилмалоновой кислоты ванней при пониженном давлении получают 26,15 К перемешиваемому раствору дизтилмалонаг сырого продукта в виде желтой жидкости Колота (110,2г, 688ммоль) в диоксане (1л) при 0°С в ночной хроматографией (силикагель, 1кг, 20% атмосфере азота порциями прибавляют гидрид этилацетата в гексане) получают заглавное сонатрия (27,5г, 688ммоль, 60%-ал дисперсия в миединение в виде бесцветной жидкости (12,7г, неральном масле) После перемешивания 20мин 58%) при 0°С и 80мин при комнатной температуре добавляют бромид меди (I) (98,7г, 688ммолей) и 1Н ЯМР (CDCI3) 5 7,45-7,31 (5Н, м), 6,81-6,78 раствор З-бензилокси-5-фторфенилбромида (1Н, м), 6,7 (1Н, ддд, I = 1,83, 2,2 и 10,25 Гц), 6,59 (1Н, ддд, J = 2,2, 2,2 и 10,25 Гц), 5,03 (2Н, с), 4,14 J Med Chem , 1992, 35, 2600) (96,7г, 344ммоль) в (2Н, к, J = 6,96 Гц), 3,92 (2Н, ддд, J = 3,29, 4,03 и диоксане (100мл) и полученную суспензию кипятят 11,72 Гц), 3,54 (2Н, ддд, J = 2,2, 11,35 и 11,72 Гц), с перемешиванием 4,5 часа Реакционную смесь 2,5-2,4 (2Н, м), 1,92 (2Н, ддд, J = 4,03, 11,35 и нейтрализуют добавлением при 0°С 6н соляной 13,55 Гц), 1,19 (ЗН,т, J = 6,96 Гц) кислоты (120мл), разбавляют водой (1л) и экстрагируют н-гексаном (3 х 700мл) Объединенные G Этиловый эфир 4-(5-фтор-3экстракты промывают водой (2 х 500мл), насыгидроксифенил)-3 4,5 6-тетра-гидро-2Н-диран-4щенным раствором бикарбоната натрия (500мл), карбоновой кислоты водой (500мл) и рассолом (500мл), сушат (сульСмесь этилового эфира 4-/3-(бензилокси)-5фат магния) и концентрированней! при пониженфторфенид/-3,4,5,6-тетрагидро-2Н-пиран-4ном давлении получают 147,5г сырого продукта в карбоновой кислоты (2,7г, 7,5ммоля) и 10% палвиде янтарной жидкости Очистку проводят кололадия на активированном угле (0,27г) в этаноле ночной хроматографией (силикагель, 1,7кг, этил(100мл) перемешивают 3,5ч в атмосфере водороацетат в гексане, повышение концентрации этилда Катализатор отфильтровывают и испарением ацетата с 5% до 20%) с получением 60,8г смеси фильтрата получают заглавное соединение в виде заглавного соединения с диэтилмалонатом в отбесцветно, жидкости (2,01 г, выход количественношении 1 1 в виде бесцветной жидкости Выход ный) заглавного соединения 34% 1Н ЯМР (CD СІз) 5 6,72-6,62 (2Н, м), 6,47 (1Н, 1Н ЯМР (CDCI3) 5 7,46-7,31 (5Н, м), 6,85-6,81 ддд, J = 2,2, 2,2 и 10,36 Гц), 5,4 (1Н, ш с), 4,17 (2Н, (1Н, м), 6,76 (1Н, ддд, J = 1,82, 2,2 и 9,16Гц), 6,66 к, J = 6,96 Гц), 3,98-3,89 (2Н, м), 3,61-3,49 (2Н, м), (1Н, ддд, J = 2,2, 2,56 и 10,62Гц), 5,04 (2Н, с), 4,54 2,5-2,41 (2Н, м), 2-1,86 (2Н, м), 1,24 (ЗН, т, J = (1Н, с), 4,3-4,16 (4Н, м), 1,32-1,22 (6Н, м) 6,96 Гц) Е Этиловый эфир З-бензилокси-5Н Этиловый эфир 4-/5-фтор-3-/4-(2фторфенилуксусной кислоты метилимидазол-1-ил)бензилокси/фенил/-3,4,5,6тетрагидро-2Н-пиран-4-карбоновой кислоты Полученную смесь диэтиловоро эфира 3бензилокси-5-фторфенил малоновой кислоты и Перемешиваемую смесь этилового эфира 4диэтилмалоната (прим 1 1,2, 1г), ДМСО (10мл), (5-фтор-3-гидроксифенил)-3,4,5,6-тетрагидро-2Нводы (0,1мл) и LiCI (346мг) помещают в круглопиран-4-карбоновой кислоты (2,01 г, 7,5ммолей, 4донную колбу на 50мл, снабженную магнитной (2-метилимидазол-1-ил)бензилхлорида гидрохломешалкой и холодильником Смесь кипятят 5ч, рида (1,82г, 7,5ммоля) и карбоната калия (5,18г, затем переносят в воду (50мл) и все экстрагируют 37,5ммоля) в ДМФА (30мл) нагревают при 100°С н-гексаном (2 х 50мл) Объединенные органиче1,33ч После охлаждения до комнатнор темпераские экстракты промывают водой (50мл), рассотуры смесь разбавляют смесью этилацетата с лом (50мл) и сушат над Na2SO4 Удалением растолуолом (2 1, 200мл) и промывают водой (4 х творителя получают 283мг (57%) этилового эфира 100мл) и рассолом (100мл), сушат (сульфат магЗ-бензилокси-5-фторфенилуксусной кислоты в ния) и коннентрированием получают 3,38г сырого виде желтого масла продукта в виде янтарного твердого вещества 45312 14 13 Перекристаллизацией из смеси изопропилового щенным водным раствором хлорида аммония эфира (25мл) с етилацетатом (2мл) получают за(40мл) и экстрагируют дихлорметаном (2х40мл) главное соединение (2,22г, 68%) Объединенные органические слои промывают водой (40мл) й рассолом (40мл), сушат (сульфат 1Н ЯМР (CDCI3) 5 7,55 (2Н, д, J = 8,43 Гц), магния) и концентрируют досуха Очисткой коло7,34 (2Н, д, J= 8,43 Гц), 7,04 (1Н, д, J= 1,5 Гц), 7,01 ночной хроматографией (силикагель, 160г, в каче(1Н, д, J = 1 Гц), 6,82 (1Н, дд, J = 2,2 и 2,2 Гц), 6,75 стве элюента этилацетат в н-гексане с повышени(1Н, ддд, J =2,2, 2,2 и 10,26 Гц), 6,62 (1Н, ддд, J ем концентрации этилацетата от 40% до 60%) =2, 2, 2,2 и 10,26 Гц), 5,09 (2Н, с), 4,16 (2Н, к, J = получают заглавное соединение в виде бесцвет7,33 Гц), 3,98-3,88 (2Н, м), 3,6-3,5 (2Н, м), 2,51-2,42 ной жидкости (0,71г, 63%) (2Н, м), 2,38 (ЗН, с), 2,01-1,86 (2Н, м), 1,21 (ЗН, т, J = 7,33 Гц) ІН ЯМР (CDCI3) 5 7,47-7,32 (5Н, м), 6,75-6,7 Пример 3 (1Н, м), 5,05 (2Н, с), 3,85-3,75 (2Н, м), 3,64 (1Н, дт, J = 6,96 и 6,96 Гц), 3,47-3,27 (2Н, м), 2,28-2,2 (1Н, 4-Ацетил-4-/5-фтор-3-/4-(2-метилимидазол-1м), 2,06-2 (1Н, м), 1,93-1,78 (2Н, м), 1,11 (1Н, д, J = ил)6ензилокси/-фенил/-3,4,5,6-тетрагидро-2Ндиран 6.96 Гц), 0,9 (ЗН, д, J = 6,96 Гц) А 4-/3-(Бензилокси)-5-фторфенил/-4D 4-(5-Фтор-3-гидроксиаенил)-4-Нгидроксметил-3,4 5,6-тетрагидро-2Н-пиран гЬдроксиэтил)-3 4,5 6-тетрагидро-2Н-пиран К перемешиваемому раствору этилового эфиЗаглавное соединение получено по методике, ра 4-/3-(бензилокси)-5-(фторфенил/-3,4,5,6приведенной в Примере 2G для получения этилотетрагидро-2Н-пиран-4-карбоновой кислоты (1,54г, вого эфира 4-/5-фтор-3-гидроксифенид/-3,4,5,64,3ммоля) в эфире (150мл) тремя порциями притетрагидро-2Н-пиран-4-карбоновой кислоты, прибавляют литийалюминий гидрид (0,16г, 4,3ммоля) менением 4-(1-гидроксиэтил)-4-/3-(бензилокси)-5Полученную суспензию перемешивают 20 мин при фторфенил/-3,4,5,6-тетрагидро-2Н-пирана комнатной температуре в атмосфере азота ИзбыIH ЯМР (ДМСО-de ) 5 9,7 (1Н, ш с), 6,6-6,52 ток гидрида разрушают добавлением насыщенно(2Н, м), 6,4 (1Н, ддд, J = 2,2, 2,2 и 10,63 Гц), 4,62 го водного раствора сульфата натрия Смесь раз(1Н, ш д, J = 4,76 Гц), 3,77-3,61 (2Н, м), 3,54-3,41 бавляют 10%-ной водной серной кислотой (100мл) (1Н, м), 3,3-3,12 (2Н, м), 2,11-2 (1Н, м), 1,95-1,72 и органический слой отделяют Эфирный слой (ЗН, м), 0,7 (ЗН, д, J = 6,23 Гц) промывают водой (100мл), насыщенным водным Е 4-Ацетил-4-(3-фтор-5-Гидроксифенинил)раствором бикарбоната натрия (100мл) и рассо3,4,5,6-тетрагидролом (100мл), сушат (сульфат магния) а концетри2Н-пиран рованием досуха получают заглавное соединение Заглавное соединение получено по методике, в виде белого твердого вещества (1,28г, 94%) приведенной в Примере ЗВ дли получения 4-/3(бензилокси)-5-фторфенил/-4-формил-3,4,5,61Н ЯМР (CDCI3) 5 7,44-7,33 (5Н, м), 6,78-6,58 тетрагидро-2Н-пирана, применением 4-(5-фтор -3(ЗН, м), 5,05 (2Н, с), 3,84-3,73 (2Н, м), 3,62-3,48 гидроксифенил) -4- (1-гидроксиэтил) -3,4,5,6(4Н, м), 2,13-2 (2Н, м), 1,95-1,82 (2Н, м), 1,09 (1Н, тетрагидро-2Н-пирана т, J = 6,96 Гц) В 4-/3-(Бензилокси)-5-фторфенил/-4-формил-1Н-ЯМР (CDCI3) 5 6,61 (1Н, д, J = 1,84, 2,2 и 3 4 5 6-тетрагидро-2Н-пиран 9,9 Гц), 6,55-6,47 (2Н, м), 5,9 (1Н ш с), 3,85 (2Н, ддд, J = 4,4, 4,4 и 12,09 Гц), 3,59 (2Н, ддд, J = 2,2, К перемешиваемой при комнатной температу9,42 и 12,09 Гц), 2,4-2,29 (2Н, м), 2,19-2,18 (2Н, м), ре в атмосфере азота смеси 4-/3-(бензилокси)-5фторфенил/-4-гидроксиметил-3,4,5,6-тетрагидро1.97 (ЗН, с) 2Н-пирана (1,28г, 4ммоля), г\І-метилморфолин-І\ІF 4-Ацетил-4-/5-фтор-3-/4-(2-метилимидазолоксида (0,7г, 6 ммолей) и порошка 3 А молекулярІ-ил) бензилокси/ ных сит (2г) одной порцией прибавляют перрутефенил/-3,4,5,6-тетрагидро-2Н-пиран нат тетра-н-пропиламмонйя (70мг, 0,2ммоля) ЧеЗаглавное соединение получено по методике, рез 20 мин добавляют перрутенат тетра-нприведенной в Примере 2Н для получения этилопропиламмоний (30мг, 0,085ммоля) и Nвого эфира 4-/5-фтор-3-/4-(2-метилимидазол-1метилморфолин-Ы-оксид (0,Зг, 2,6ммоля) и переил)бензилоксй/фенил/-3,4,5,6-тетрагидро-2Нмешивание продолжают 30 мин Хроматографией пиран-4-карбоновойі кислоты, применением 4-(5смеси (силикагель, 110г, 25% этилацетата в гекфтор-3-гидроксифенил)-4-(1-гид роксиэтил)-3,4,5,6сане) получают заглавное соединение в виде бестетрагидро-2Н-пирана вместо этилового эфира 4цветной жидкости (1,08г, 86%) (5-фтор-3-гцдроксифенил)-3,4,5,6—тетрагидро-2Нпиран-4-карбоиовой кислоты 1Н ЯМР (CDCI3) 5 9,38 (1Н, с), 7,44-7,32 (5Н, м), 6,7-6,58 (ЗН, м), 5,03 (2Н, с), 3,89 (2Н, ддд, J = 1Н ЯМР (CDCI3) 5 7,54 (2Н, д, J = 8,43 Гц), 4,03, 4,03 и 12,09 Гц), 3,62-3,51 (2Н, м), 2,38-2,28 7,34 (2Н,д, J = 8,43 Гц), 7,05 (1Н, д, J = 1,47 Гц), (2Н, м), 2,09-1,97 (2Н, м) 7,02 (1Н, д, J = 1,47 Гц), 6,73-6,61 (ЗН, м), 5,08 (2Н, с), 3,84 (2Н, ддд, J = 4,4, 4,4 и 12,09 Гц), 3,58 (2Н, С 4-/3-(Бензилокси)-5-фторфенил/-4-Иддд, J = 2,57, 9,52 и 12,09 Гц), 2,38 (ЗН, с), 2,41гидроксиэтил)-3 4 5 6-тетрагидро-2Н-диран 2,31 (2Н, м), 2,2 (2Н, ддд, J = 4,4, 9,52 и 14,29 Гц), К перемешиваемому раствору 4-/31,95 (ЗН, с) (бензилокси)-5-фторфенил/-4-формил-3,4,5,6тетранидно-2Н-пирана (1,08г, 3,4ммоля) в ТГФ Пример 4 (16мл) при комнатной температуре в атмосфере 4-/5-Фтор-3-/4-(2-метилимидазол-І-ил) беизиазота по каплям прибавляют 0,96 М раствор мелокси/фенил/-3,4,5,6-тетрагидро-2Н-пиран-4тилмагнийбромида (5,3мл, 5,1ммоля) Смесь пекарбоновая кислота ремешивают примерно сутки, разбавляют насыПеремешиваемую смесь этилового эфира 4 15 45312 16 /5-фтор-3-/4-(2-метилимидазол-1смеси изопропиловый- эфир-этилацетат (1 1) поил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Нлучают заглавное соединение (51 мг, 50%) пиран--4-карбоновой кислоты (Пример 2) (1,1 г, 1Н ЯМР (CDCI3) 5 7,54 (2Н, д, J = 8,43 Гц), 25ммоля) в водном растворе гидроксида лития 7,33 (2Н, д, J = 8,43 Гц), 7,04 (1Н, д, J = 1,1 Гц), (0,13г, ЗОммолкй, 5мл), метаноле (15мл) й ТТФ 7,01 (1Н, д, J = 1,1 Гц), 6,69-6,58 (ЗН, м), 5,08 (2Н, (15мл) кипятят 24ч Реакционную смесь нейтралис), 3,93-3,85 (2Н, м), 3,83-3,72 (2Н, м), 2,67 (6Н, ш зуют I н соляной кислотой Летучие компоненты с), 2,38 (ЗН, с), 2,28-2,19 (2Н, м), 2,05-1,92 (2Н, м) удаляют испарением при пониженном давлении Пример 7 Остаток суспендируют в смеси воды (20мл) и 4-ІДиано-4-/3-/4- (2-меилимидазол-1-ил) бенфосфатного буфера (рН 7,5мл) и кипятят ЗОмин зилокси/фенил/-3,4,5,6-тетрагидро-2Н-пиран После охлаждения до 0°С осадок отфильтровыА 4-ІДиано-4-(3--метоксифенил)-3,4,5,6вают, промывают водой, и затем эфиром и сушат тетрагидро-2Н-пиран 14ч под вакуумом при 80°С до постоянной массы с Заглавное соединение долучено по методике, получением заглавного соединения в виде белого приведенной в Примере 2F, за исключением, что твердого вещества (0,98г, 96%) вместо этилового эфира 4-/31Н ЯМР (ДМСО- de) 5 7,62 (2Н, д, J = 8,43 (бензилокси)-5-фторфенил/-3,4,5,6Гц), 7,48 (2Н, д, J = 8,43 Гц), 7,3 (1Н, д, J = 1,1 Гц), тетрагидро-2Н-пиран-4-кар-боновой кислоты ис6,92 (1Н, д, J = 1,1 Гц), 6,9-6,76 (ЗН, м), 5,19 (2Н, пользован (З-метоксифенил)ацетонитрил с), 3,84-3,85 (2Н, м), 3,5-3,4 (2Н, м), 2,36-2,27 (2Н, 1Н ЯМР (CDCI3) 5 7,34 (1Н, дд, J = 8,1 и м), 2,29 (ЗН, с), 1,88-1,75 (2Н, м) 8,1Гц), 7,02-6,98 (2Н, м), 6,93-6,84 (1Н, м), 4,193,75 (4Н, м), 3,84 (ЗН, с), 2,22-1,98 (4Н, м) Пример 5 4-/5-Фтор-3-/4-( 2-метилимидазол-1-ил) бензиВ 4-ІДиано-4-(3-гидроксифенил)-3,4,5,6локси/фенил/-3,4,5,6-тетрагидро-2Н-пиран-4тетрагидро-2Н-пиран карбоксамид Заглавное соединение получено по методике, приведенной в Примере 20В, за тем исключением, К перемешиваемой суспензии 4-/5-фтор-3-/4что вместо метилового эфира 1 -(З-фтор-5(2-метилимидазол-1-ил)бензилокси/фенил/метоксифенил)циклопент-3-ен-1-карбоновой ки3,4,5,6-тетрагидро-2Н-пиран-4-карбсновой кислослоты использован 4-циано-4-(3-метоксифенил)ты (616мг, 1,5ммоля) в дихлорметане (20мл) при 3,4,5,6-тетрагидро-2Н-пиран 0°С в атмосфере азота добавляют оксалилхлорид (419мг, З.Зммоля) Полученную суспензию пере1Н ЯМР (CDCI3) 5 7,36-7,21 (1Н, м), 7,1-6,95 мешивают ЗОмин при 0°С и Іч при комнатной тем(2Н, м), 6,89-6,77 (1Н, м), 5,79 (1Н, с), 4,21-4,03 пературе Образовавшуюся белую суспензию кон(2Н, м), 4-3,8 (2Н, м), 2,25-1,95 (4Н, м) центрируют досуха и остаток добавляют к С 4-1Диано-4-/3-/4-(2-метилмидазол-1перемешиваемому водному раствору аммиака ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Н26%, 20мл), после перемешивания 70мин при пиран комнатное температуре осадок отфильтровывают, Заглавное соединение с выходом 38% полупромывают водой и после сушки в вакууме при чено по методике, приведенной в Примере 2Н, 80°С в течение примерно суток до постоянной реакцией 4-циано-4-(3-гидроксифенил)-3,4,5,6массы получают заглавное соединение (337мг, тетрагидро-2Н-пирана с 4-(2-метилимидазол-154%) ил)бензилхлоридом 1Н ЯМР (ДМСО- d6) 5 7,61 (2Н, д, J = 8,43 1Н ЯМР (CDCI3) 5 7,57 (2Н, д, J = 8,4 Гц), Гц), 7,48 (2Н, д, J = 8,43 Гц), 7,3 (1Н, д, J = 1,08 7,42-7,29 (ЗН, м), 7,19-6,93 (5Н, м), 5,15 (2Н, с), Гц), 7,24 (1Н, ш с), 7,08 (1Н, ш с), 6,92 (1Н, д, J = 4,16-3,81 (4Н, м), 2,38 (ЗН, с), 2,22-2 (4Н, м) 1,08 Гц), 6,89-6,82 (2Н, м), 6,8-6,75 (1Н, м), 5,18 ИК (КВг) v 1610, 1585, 1519, 1489, 1416, 1391 (2Н, с), 3,66-3,57 (2Н, м), 3,51-3,4 (2Н, м), 2,44-2,35 см-1, Тпл 153-154°С (2Н, м), 2,,29 (ЗН, с), 1,84-1,72 (2Н, м) Пример 8 Пример 6 4-/3-/4-(2-МетилимидазолМ,ІЧ-Диметил-4-/5-фтор-3-/4-(21ил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Нметилимидазол-1-ил)бензилокси/фенил/-3,4,5,6пиран-4-карбоксамид тетрагидро-2Н-пиран-4-карбоксамид А 4-(2-Метилимидазол-1-ил)фенилйодидО К перемешиваемой суспензии 4-/5-фтор-3-/4К перемешиваемому раствору 2(2-метилимидазол-1-ил)бензилскси/фенил/метилимидазола (13,6г, 165ммолей) в ДМФА 3,4,5,6-тетрагидро-2Н-пиран-4-карбоновой кисло(500мл) добавляют порциями гидрид натрия (6,6г, ты (100мг, и,24ммоля), гидрохлорида диметила165ммолей, 60%-ая дисперсия в минеральном мина (98мг, 1,2ммоля) и триэтиламина (253мг, масле) 2,5ммоля) в ТГФ (50мл) добавляют при 0°С диОбразовавшуюся белую суспензию перемеэтилцианофосфонат (44мг, 0,27ммоля) Спустя шивают ЗОмин при комнатной температуре, доЮмин реакционную смесь разбавляют водой бавляют 4-фторйодбензол (33,3г, 150ммолей) и (50мл) и экстрагируют этилацетатом (50мл) Экссмесь нагревают до 100°С Через 16ч основную тракт промывают водой (50мл) и рассолом (50мл), массу ДМФА удаляют испарением Остаток затем сушат над сульфатом магния и концентрируют распределяют между смесью этил ацетат-толуол Очисткой остатка колоночной хроматографией (2 1, 500мл) и водой (250мл) Органический слой (силикагель, 50г, в качестве элюента полярный отдаляют и промывают водой (250мл) Продукт градиент от дихлорметана до 5% метанола в диэкстрагируют 10%-ой соляной кислотой (2х200мл) хлорметане) получают 117мг сырого продукта в и объединенные водные экстракты нейтрализуют виде бесцветной пены Перекристаллизацией из 30%-ым водным раствором гидроксида калия Об 45312 18 17 разовавшуюся суспензию экстрагируют смесью (1Н, ддц, J = 1,46, 1,83 и 8,06Гц), 7,24 (1Н, дд, J = этил ацетат-толуол (2 1, Зх250мл) и объединен8,06 и 8,06Гц), 3,94 (2Н, ддд, J = 3,67, 4,03 и ные органические экстракты промывают водой 12,09Гц), 3,62 (2Н, ддд, J = 1,83, 11,72 и 12,09Гц), (2х250мл), рассолом (250мл), сушат (сульфат 2,5 (2Н, м), 1,97 (2Н, ддд, J = 4,03, магния) и концентрируют досуха Перекристалли11,72 и 13,92Гц) зацией остатка из толуола получают заглавное D Метиловый эфир 4-(3соединение в виде снежно-белого вещества метилсульфинилфенил)-3,4,5,6-тетрагидро-2Н(21,9г. 51%) пиран-4-карбоновой кислоты 1Н ЯМР (CDCI3) 5 7,65-7,61 (2Н, м), 7,32-7,26 К перемешиваемому раствору 4-(3(2Н, м), 7,33 (1Н, д, J = 1,47Гц), 6,98 (1Н, д, J = бромфенил)-3,4,5,6-тет-рагидро-2Н-пиран-41,47 Гц), 2,83 (ЗН, с) карбоновой кислоты (19,1г, 67ммолей) в ТГФ при 78°С в атмосфере азота прибавляют раствор нВ Этиловый эфир 4-(3-бромфенил)-3,4,5,6бутиллития (1,6 М раствор в н-гексане, 100мл) тетрагидро-2Н-пиран-2-4карбоновой кислоты Спустя 45мин медленно в течение ЗОмин прибавК перемешиваемому раствору этилового эфиляют раствор диметиддисульфида (8,84г, ра 3-бромфенил-уксусной кислоты (Guenthes О и 94ммоля) в ТГФ (50мл) и смесь перемешивают др , Сет Вег 1967, 100, 425) (41,Зг, 170ммолей) и при -78°С еще 70мин и затем Зч при комнатной 15-краун-5 (3,74г, 17ммолей) в ДМФА (1л) при температуре К образовавшейся суспензии добавкомнатной температуре порциями прибавляют ляют 2 н соляную кислоту (500мл) и слои раздегидрид натрия (14,8г 370ммолей, 60%-ая дисперляют Водный слой экстрагируют этилацетатом сия в минеральном масле) После перемешивания (2х250мл), объединенные органические слои про40мин при комнатной температуре добавляют мывают водой (4x100мл) и рассолом (100мл), суйодид натрия (25,5г, 170ммолей) и бис(2шат (сульфат магния) и концентрируют досуха хлорэтиловый) эфир (30,4г, 210ммолей) Спустя 10,5ч основную массу ДМФА удаляют при пониОстаток (21,5г) растворяют в метаноле женном давлении Остаток покрывают смесью (100мл), добавляют 10%-ый метанольный раствор этил ацетат-толуол (1 1, 500мл) и промывают 0,5г хлористого водорода (100мл) и смесь кипятят с соляной кислотой (500мл) Водный слой экстрагиперемешиванием 13ч Еще одну порцию 10%-го руют смесью этил ацетат-толуол (1 1, 1х500мл) и метанольного раствора хлористого водорода объединенные экстракты промывают водой (100мл) добавляют и нагревание продолжают еще (250мл), насыщенным раствором бикарбоната 7ч Летучие компоненты испаряют, остаток раснатрия (250мл), водой (2х250мл) и рассолом творяют в этилацетате (500мл), промывают водой (250мл), сушат (сульфат магния) и концентриро(2х250мл), насыщенным водным раствором биванием при пониженном давлении получают 56,8г карбоната натрия (250мл), водой (250мл) и рассосырого продукта в виде оранжевой жидкости Очилом (250мл) Водные слои объединяют и экстрасткой колоночной хроматографией (силикагель, гируют этилацетатом (2х250мл) Объединенные 700г, 15% и затем 20% этилацетата в н-гексане) органические слои сушат (сульфат магния) и конполучают заглавное соединение в виде желтой центрируют досуха жидкости (36,5г, 69%) Полученный продукт (17,9г) растворяют в метаноле (200мл) и охлаждают до 0°С Добавляют 1Н ЯМР (CDCI3) 5 7,52 (1Н, дд, J = 1,83 и раствор перйодата натрия (16г, 75ммолей) в воде 1,83Гц), 7,4 (1Н, ддд, J = 1,83, 1,83 и 7,7Гц), 7,31 (200мл) и образовавшуюся суспензию перемеши(1Н, ддд, J = 1,83, 1,83 и 8,06 Гц), 7,22 (1Н, дд, J = вают Іч при О°С Реакционную смесь разбавляют 7,7 и 8,06Гц), 4,16 (2Н, к, J = 7,33Гц), 3,94 (2Н, ддд, водой (500 мл) и экстрагируют дихлорметаном J = 3,29, 4,03 и 11,73Гц), 3,56 (2Н, ддд, J = 2,2, (200мл) и 10%-ым метанолом в дихлорметане 11,73 и 13,56Гц), 2,5 (2Н, ддд, J = 2,2, 3,29 и (Зх200мл) Объединенные экстракты промывают 11,36Гц), 1,94 (2Н, ддд, J = 4,03, 11,36 й 13,56Гц), рассолом (200мл), сушат (сульфат магния) и кон1,2(ЗН,т, и = 7,ЗЗГц) центрируют досуха Очисткой колоночной хромаС 4-(3-Бромфенил)-3,4,5,6-тетрагидро-2Нтографией (силикагель, 700г, етилацетат) получапиран-4-карбоновая-кислота ют заглавное соединение в виде бесцветной Перемешиваемую смесь этилового эфира 4жидкости (12,2г, 64%), затвердевающей при стоя(3-бромфенил)-3,4,5,6-тетрагидро-2Н-пиран-4нии карбоновой кислоты (36,5г, 117ммолей) , водного раствора гидроксида лития (6,14г, 146ммолей, 1Н ЯМР (CDCI3) 5 7,71-7,68 (1Н, м), 7,55-7,5 50мл), метанола (150мл) и ТГФ (150мл) кипятят 1 (ЗН, м), 4,02-3,92 (2Н, м), 3,69 (ЗН, с), 3,62-3,5 (2Н, день Реакционную смесь распределяют мевду м), 2,73 (ЗН, с), 2,62-2,52 (2Н, м), 2,06-1,59 (2Н, м) эфиром (100мл) и 10%-ым водным раствором гидЕ Метиловый эфир 4-(3-меркалтофенил)роксида калия (300мл) Эфирный слой отделяют, 3,4,5,6-трагидро-2Н-пиран-4-карбоновой кислоты экстрагируют 10%-нм водным раствором гидроВ трифторуксусном ангидриде (50мл) раствоксида калия (2x100мл) и отбрасывают Объедиряют метиловый эфир 4-(3ненные водные экстракты подкисляют концентриметилсульфинилфенил)-3,4,5,6-тетрагидро-2Нрованной соляной кислотой, образовавшийся пиран-4-карбоновой кислоты (12,2г, 43ммоля) и белый осадок отфильтровывают, промывают вораствор кипятят ЗОмин Летучие компоненты исдой и после сушки в вакууме при 80°С до постоянпаряют и остаток растворяют в метиловом спирте ной массы получают заглавное соединение в виде (100мл) Вточение5мин прибавляюттриэтиламин белого твердого вещества (26,4г, 79%) (100мл) и смесь концентрируют досуха Остаток растворяют в этилацетате (500мл), промывают 1Н ЯМР (CDCI3) 5 7,55 (1Н, дд, J = 1,83 и насыщенным водным раствором хлорида аммо1,83Гц), 7,43 (1Н, ддд, J = 1,46, 1,83 и 8,06Гц), 7,35 20 19 45312 ния (200мл) и рассолом (200 мл), сушат (сульфат (217мг, 0,55ммоля) добавляют при 0°С оксалилмагния) и концентрированием досуха получают хлорид (254мг, 2 ммоля) Полученный раствор песырое заглавное соединение в виде блндноремешивают ЗОмин при 0°С и затем 20мин при черной жидкости, которую используют как таковую комнатной температуре Летучие компоненты удабез дополнительной очичтки ляют испарением Остаток добавляют к перемешиваемому водному раствору аммиака (30мл) и 1Н ЯМР (CDCI3) 5 7,5-7,13 (ЗН, м), 4-3,9 (2Н, перемешивают 1ч После охлаждения до 0°С осам), 3,68 (ЗН, с), 3,64-3,48 (2Н, м), 2,58-2,48 (2Н, док отфильтровывают, промывают водой и сушкой м)2,04-1,93(2н,м) в вакууме при 80°С до постоянной массы получаF Этиловый эфир 4-/3-/4-(2-метилимидазол-1ют заглавное соединение (207мг, 96%) ил)фенилтио/-фенил/-3,4,5,6-тетрагидро-2Нпиран-4-карбоновой кислоты 1Н ЯМР (ДМСО- de) 5 7,49-7,26 (ЮН, м), 7,1 Раствор метилового эфира 4-(3(1Н, ш с), 6,9 (1Н, д, J = 1,1 Гц), 3,78-3,68 (2Н, м), меркаптофенил)-3,4,5,6-тетрагидро-2Н-пиран-43,52-3,4 (2Н, м), 2,46-2,36 (2Н, м), 2,28 (ЗН, с), карбоновой кислоты (1,04г, 3,5ммоля), 4-(21,06-1,64 (2Н, м) метилимидазол-1-ил)фенилйодида (0,89г, Пример 9 3,5ммоля), третбутокосида натрия (673мг, 4-/3-/4-(Пиррол-1-илметил)фенлтио/фенил/7ммолей) и тетракис-(трифенилфосфин)палладия 3,4,5,6-тетрагидро-2Н- пиран-4-карбоксамид (162мг, 0,14ммоля) в сухом этаноле (20мл) кипяЗаглавное соединение получено по методике, тят с перемешиванием примерно сутки Летучие приведенной в Примере 8F для получения этилокомпоненты удаляют испарением и остаток расвого эфира 4-/3-/4-(2-метилимидазол-1пределяют между етилацетатом (100мл) и водой ил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н-пиран(100мл) Водный слой экстрагируют этилацетатом 4-карбоновой кислоты, применением 4-(пиррол-1(100мл) Объединенные органические слон проилметил)фенилйодида (ЕР 488 602 А1) вместо 4мывают рассолом (100мл), сушат (сульфат маг(2-метилимидазол-1-ил)фенилйодида ния) и концентрированием досуха получают 1,09г 1Н ЯПР (CDCI) 5 7,38-7,34 (1Н, м), 7,28-7,18 сырого продукта в виде коричневой жидкости (5Н, м), 7,04 (2Н, д, J= 8,43Гц), 6,68 (2Н, т, J = Очисткой колоночной хроматографией (силика2,2Гц), 6,19 (2Н, т, J = 2,2Гц), 5,05 (2Н, с), 4,12 (2Н, гель, 50г, метанол и дихлорметане, повышение к, J = 7,33Гц), 3,96-3,86 (2Н, м), 3,49 (2Н, м), 2,5концентрации метанола с 0% до 4%) получают 2,42 (2Н, м),1,99-1,85 (2Н, м), 1,16 (ЗН, т, J = 7,33 заглавное соединение (0,9г) ГЦ) 1Н ЯМР (CDCI3) 5 7,51-6,98 (ЮН, м), 4,15 В 4-/3-/4-(Пиррол-1-метил)фенлтио/фенил/(2Н, д, J = 6,96 Гц), 3,98-3,88 (2Н, м), 3,61-3,5 (ЗН, 3,4,5,6-тетрагидро-2Н- пиран-4-карбоновой кислом), 2,55-2,45 (2Н, м), 2,37 (ЗН, с), 2,01-1,9 (2Н, м), ты 1,18 (ЗН, т, J = 6,96 Гц) Заглавное соединение получено во методике, приведенной в Примере 8G для получения 4-/3-/4G 4-/3-/4-(2-Метилимидазол-1(2-метилимидазол-1-ил)фенилтио/ фенил/-3,4,5,6ил)фенилтио/фенил-3,4,5,6-тетрагидро-2Н-пирантетрагидро-2Н-пиран-4-карбоновой кислоты, при4-карбоновая кислота менением этилового эфира 4-/3-/4-(пиррол-1К раствору этилового эфира 4-/3-/4-(2йлметил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Нметилимидазол-1 -ил)фенилтио/фенил/-3,4,5,6пиран-4-карбоновой кислоти вместо этилового тетрагидро-2Н-пиран-4-карбоновой кислоты, полуэфира 4-/3-/4-(2-метилимидазол-1ченного вышеприведенным способом, в смеси тетрагидрофурана (20мл) с метанолом (20мл) доил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н-пиранбавляют водный раствор гидроксида лития (0,42г, 4-карбоновой кислоты Юммолей) и смесь кипятят 11ч Летучие компо1Н ЯМР (CDCI3) 5 7,4-7,37 (1Н, м), 7,32-7,25 ненты удаляют при пониженном давлении Оста(4Н, м), 7,23-7,16 (1Н, м), 7,04 (2Н, д, J = 8,43Гц), ток распределяют между эфиром (100мл) и водой 6,68 (2Н, т, J = 2,2Гц), 6,19 (2Н, т, J = 2,2Гц), 5,05 (100мл) и эфирный слой экстрагируют 1 н водным (2Н, с), 3,96-3,87 (2Н, м), 3,66-3,55 (2Н, м), 2,51раствором гидроксида калия (2х50мл) Объеди2,41 (2Н, м), 2-1,88 (2Н, м) ненные водные слои нейтрализуют 1 н соляной G 4-/3-/4-(Пиррол-1-илметил)фенлтио/фенил/кислотой и насыщенным водным раствором би3,4,5,6-тетрагидро-2Н- пиран-4-карбоксамид карбоната натрия Осадок отфильтровывают, Суспензию 4-/3-/4-(пиррол-1промывают водой и сушкой в вакууме при 80°С метил)фенилтио/фенил/-3,4,-5,6-тетрагидро-2Нполучают заглавное соединение (488мг, 35% на пиран-4-карбоновой кислоты (0,36г, 0,93ммоля), метиловый эфир 4-(3-метилсульфинилфенил)бикарбоната аммония (0,44г, 5,58ммоля) и 23,4,5,6-тетрагидро-2Н-пиран-4-карбоновой кислоэтокси-1-этоксикарбонил-1,2-дигидрохинолина ты) (0,28г, 1,12ммоля) в дихлорметане (20мл) перемешивают при комнатной температуре примерно 1Н ЯМР (CDCI3) 5 7,49-7,37 (7Н, м), 7,34-7,29 сутки Бикарбонат аммония и 2-этокси-1(1Н, м), 7,3 (1Н, д, J = 1,1 Гц), 6,91 (1Н, д, J = этоксикарбонил-1,2-дигидрохинолин до полного 1,1 Гц), 3,9-3,78 (2Н, м), 3,49-3,36 (2Н, м), 2,38-2,28 исчезновения кислоты Реакционную смесь раз(2Н, м), 2,28 (ЗН, с), 1,88-1,76 (2Н, м) бавляют дихлорметаном (50мл) к промывают воН 4-/3-/4-(2-Метилимидазол-1дой (50мл) Органический экстракт промывают ил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н-пиранхолодной 1 н соляной кислотой (50мл), водой 4-карбоксамид (50мл), насыщенным водным раствором бикарбоК перемешиваемой суспензии 4-/3-/4-(2ната натрия (5мл), водой (50мл) а рассолом метилимидазол-1-ил) фенилтио/фенил/-3,4,5,6(50мл), сушат (сульфат магния) н концентрируют тетрагидро-2Н-пиран-4-карбоновой кислоты 22 21 45312 досуха Перекристаллизацией остатка из этилаце(100мл) и водой (100мл) Эфирный слой отделятата получают заглавное соединение (198 мг, ют, промывают рассолом (100мл), сушат (сульфат 54%) магния) и концентрируют Очисткой колоночной хроматографией (силикагель, 50г, метанол в ди1Н ЯМР (ДМСО- de) 5 7,38-7,25 (6Н, м), 7,18хлорметане, повышение концентрации с 0% до 7,03 (4Н, м), 7,8 (2Н, т, J = 2.2ГЦ), 6,02 (2Н, т, J = 5%) получают заглавное соединение (1,05г, 44%) 2,2Гц), 5,09 (2Н, с), 3,77-3,66 (2Н, м), 3,5-3,38 (2Н, м), 2,42-2,32 (2Н, м), 1,82-1,68 (2Н, м) 1Н ЯМР (CDCI3) 5 7,67 (2Н, д, J = 8,42Гц), Пример10 6,96 (1Н, д, J = 1,1 Гц), 6,82 (1Н, д, J = 1,1 Гц), 6,79 (2Н, д, 7 = 8,42Гц), 4,99 (2Н, с), 2,32 (ЗН, с) В_ 1Ч-Метил-4-/5-фтор-3-/4-(2-метилимидазол-1ил)6ензилокси/фенил/-3,4,5,6-тетрагидро-2НВ Этиловый эфир 4-/3-/4-(2-метилимидазол-1пиран-4-карбоксамид илметил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Нпиран-4-карбоновой кислоты Заглавное соединение получено по методике, приведенной в Примере 5, за тем исключением, Заглавное соединение получено во методике, что вместо водного аммиака применяют водный приведенной в Примере 8F для получения этилометиламин (40%) Избыток метиламина удаляют вого эфира 4-/3-/4-(2-метилимидаазол-1при пониженном давлении, остаток разбавляют ил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н-пиранводой (100мл) и экстрагируют дихлометаном -4-карбоновой кислоты, применением 4-/(2(2x100мл) Объединенные экстракты сушат (сульметилимидазол-1-ил) метил/фенилйодида вместо фат магния) и концентрируют Перекристаллиза4-(2-метилимидазол-1-ил)фенилйодида цией остатка из этилацетата получают заглавное 1Н ЯМР CDCI3) 5 7,4-6,82 (ЮН, м), 5,27 (2Н, соединение в виде мелкого белого порошка с), 4,13 (2Н, к, J = 6,96Гц), 3,96-3,66 (2Н, м), 3,613,47 (2Н, м), 2,52-2,42 (2Н, м), 2,33 (ЗН, м), 1,991Н ЯМР (ДМСО- d6) 5 7,69 (1Н, ш с), 7,61 1,87 (2Н, м), 1,25 (ЗН, т, J = 6,96Гц) (2Н, д, J = 8,43Гц), 7,47 (2Н, д, J = 8,43Гц), 7,29 (1Н, д, J = 1,1 Гц), 6,91 (1Н, д, J = 1,1 Гц), 6,9-6,8 С 4-/3-/4-(2-Метилимидазол-1(2Н, м), 6,79-6,7 (1Н, м), 5,17 (2Н, с), 3,75-3,65 (2Н, илметил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Нм), 3,48-3,36 (2Н, м), 2,55 (ЗН, с), 2,41-2,31 (2Н, м), пиран-4-карбоновая кислота 2,29 (ЗН, с), 1,9-1,77 (2Н, м) Заглавное соединение синтезировано по меПримерИ тодике, приведенной в Примере 8G для получения 4-/3-/4-(2-метилимидазол-1-ил)фенилтио/фенил/4-/5-Фтор-3-/4-(2-метилимидазол-13,4,5,6-тетрагидро-2Н-пиран-4-карбоновой кислоил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Нты, применением этилового эфира4-/3-/4-(2пиран-4-тиокарбоксамид метилимидазол-1-илметил)фенилтио/фенил/К перемешиваемому раствору 4-/5-фтор-3-/43,4,5,6-тетрагидро-2Н-пиран-4-карбоновой кисло(2-метилимидазол-1-ил)бензилокси/фенил/ты вместо этилового эфира 4-/3-/4-(23,4,5,6-тетрагидро-2Н-пиран-4-карбоксамиду метилимидазол-1-ил) фенилтио/фенил/-3,4,5,6(Пример 5) в ТГФ (10мл) добавляют пентасульфид тетрагидро-2Н-пиран-4-карбоновой кислоты фосфора (236мг, 0,53ммоля) и бикарбонат натрия (176мг, 2,1ммоля) Полученную смесь нагревают 1Н ЯМР (CDCI3) 5 7,56-7,52 (1Н, м), 7,45-7,4 4ч при 40°С Смесь концентрируют в вакууме К (1Н, м), 7,36-7,23 (2Н, м), 7,19 (2Н, д, J = 8,42 Гц), остатку добавляют воду (100мл) и смесь экстраги6,95 (1Н, д, J = 1,46Гц), 6,91 (2Н, д, J = 8,42Гц), руют дихлорметаном (2x100мл) Объединенные 6,79 (1Н, д, J = 1,46Гц), 4,98 (2Н, с), 3,96-3,86 (2Н, органические экстракты сушат над сульфатом м), 3,74-3,62 (2Н, м), 2,57-2,47 (2Н, м), 2,31 (ЗН, с), натрия и концентрируют в вакууме Очисткой ос1,97-1,83 (2Н, м) татка колоночной хроматографией ( Li ХропрепD 4-/3-/4-(2-Метилимидазол-1NH2 и затем п-ТСХ с элюированием смесью диилметил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Нхлорметан-метаиол (10 1)) получают 38мг заглавпиран-4-карбоксамид ного соединения в виде белого твердого вещестЗаглавное соединение синтезировано во мева тодике, приведенной в Примере 9С для получения 4-/3-/4-(пиррол-1-ил)метил/ фенилтио/фенил//1Н-ЯМР (CDCI3) 5 7,67-7,49 (ЗН, м), 7,39-7,29 3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамида, (2Н, м), 7,03 (1Н, д, J = 1,47Гц), 7,01 (1Н, д, J = применением 4-/3-/4-(2-метилимидазол-11,46Гц), 6,98-6,62 (4Н, м), 5,09 (2Н, с), 3,95-3,8 (2Н, м), 3,7-3,54 (2Н, м), 2,7-2,55 (2Н, м), 2,37 (ЗН, с), илметил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н2,3-2,14 (2Н, м) ИК (КВг) v 1620, 1590, 1520, пиран-4-карбоновой кислоты вместо 4-/3-/41420, 1140 см-1 Тпл 167-170°С (пиррол-1-ил метил)фенилтио/фенил/-3,4,5,6тетрагидро~2Н-пиран-4-карбоновой кислоты Пример 12 1Н ЯМР (CDCI3) 5 7,39-7,36 (1Н, м), 7,37-7,19 4-/3-/4-(2-Метилимидазол-1(5Н, м), 6,99 (2Н, д, J = 8,79Гц), 6,96 (1Н, д, J = илметил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н1,47Гц), 6,85 (1Н, д, J = 1,47Гц), 5,2 (2Н, ш с), 5,04 пиран-4-карбоксамид (2Н, с), 3,82-3,72 (4Н, м), 2,34 (ЗН, с), 2,35-2,29 А 4-(2-Метилимидазол-1(2Н, м), 2,09-1,97 (2Н, м) ил)метил/фенилйодид Пример 13 Смесь 2-метилимидазола (0,66г, 8ммолей), 41-5-фтор-3-/4-(2-метилимидазол-1йодбензилбромида (I Am Chem Soc 1949, 71, ил)бензилокси/фенил/циклогексан-1-карбоксамид 3360) (2,38г, 8ммолей) и карбоната калия (2,21г, Ібммолей) в ацетонитриле (100мл) кипятят с пеА Этиловый эфир 1 -/З-бензилокси-5ремешиванием 15ч После охлаждения осадок фторфенил)циклогексан-1-карбоновой кислоты отфильтровывают и фильтрат концентрируют доЗаглавное соединение получено из этилового суха Остаток распределяют между эфиром эфира З-бен-зилокси-5-фторфенилуксусной ки 23 45312 24 слоты по методике, приведенной в Примере 2F, за ддд, J = 2,2, 2,2 и 11 Гц) 3,79 (ЗН, с), 3,71 (ЗН, с), тем исключением, что вместо бис(23,57 (2Н, с) хлорэтилового) эфира применяют 1,5В Метиловый эфир 1-(3-фтор-3дибромпентан метоксифенил)циклопент-3-ен-1-карбоновой кислоты 1Н ЯМР (CDCI3) 5 7,48-7,27 (5Н, м), 6,84-6,8 (1Н, м), 6,73 (1Н, дцд, J = 10, 2,2 и 2,2Гц), 6,56 (1Н, К перемешиваемому раствору метилового дцд, J = 10, 2,2 и 2,2Гц), 5,02 (2Н, с), 4,11 (2Н, к, J эфира 5-фтор-З-метоксфенилуксусиой кислоты = 7Гц), 2,49-2,32 (2Н, м), 1,77-1,35 (8Н, м), 1,18 (708мг, З.бммоля) в ТГФ (10мл) прибавляют при (ЗН, т, J = 7Гц) 30°С в течение 0,25ч 1 М раствор третбутоксида калия в ТГФ (4мл, 4ммоля) После перемешивания В Этиловый эфир 1-(5-фтор-3Іч при той же температуре по каплям прибавляют гидроксифенил)циклогексан-1-карбоновой кислораствор цис-1,4-дихлорбут-2-ена (526мг, 4ммоля) ты в ТГФ (2мл) и реакционную смесь в течение 2ч Заглавное соединение получено из этилового нагревают до комнатной температуры Реакционэфира 1 -(3-бензилокси-5-фторфенил)циклогексанную смесь охлаждают до -30°С, добавляют 1 М 1-карбоновой кислоты по методике, приведенной в раствор третбутоксида калия в ТГФ (4мл, 4ммоля) Примере 2G и смесь перемешивают примерно сутки при ком1Н ЯМР (CDCI3) 5 6,72-6,63 (2Н, м), 6,47 (1Н, натной температуре Реакционную смесь нейтраддд, J = 2,2, 2,2 и 10Гц), 4,13 (2Н, к, J = 7Гц), 2,48лизуют добавлением насыщенного водного рас2,33 (2Н, м), 1,75-1,35 (8Н, м), 1,2 (ЗН, т, J = 7Гц) твора хлорида аммония и экстрагируют С Этиловый эфир 1-/5-фтор-3-/4-(2етилацетатом Объединенные экстракты промыметилимидазол-1вают рассолом, сушат над MgSO4 и концентрируил)бензилокси/фенил/циклогексан-1-карбоновой ют в вакууме Очисткой колоночной хроматогракислоты фией (S1O2, 150г, гексан этила цетат (201)) Заглавное соединение получено из этилового получают 495мг (55%) метилового эфира 1-(5эфира 1 -(5-фтор-3-гидроксифенил)циклогексан-1 фтор-3-метоксифенил)циклопент-3-ен-1карбоновой кислоты по методике, приведенной в карбоновой кислоты в виде бесцветного масла Примере 2Н 1Н ЯМР (CDCI3) 5 7,55 (2Н, д, J = 8,4Гц), 7,33 1Н ЯМР (CDCI3) 5 6,67-6,6 (2Н, м), 6,49 (1Н, (2Н, д, J = 8,4Гц), 7,04 (1Н, д, J = 1,5Гц), 7,01 (1Н, ддд, J = 11, 2,2 и 2,2Гц), 5,75 (2Н, с), 3,78 (ЗН, с), д, J = 1,5Гц), 6,86-6,83 (1Н, м), 6,76 (1Н, ддд, J = 3,66 (ЗН, с), 3,36 (2Н, д, J= 15Гц), 2,72 (2Н, д, J = 2,2, 2,2 и 9,7Гц), 6,58 (1Н, ддд, J = 2,2, 2,2 и 10Гц), 15Гц) 5,08 (2Н, с), 4,12 (2Н, к, J= 7Гц), 2,49-2,38 (2Н, м), С Метиловый эфир 1-(5-фтор-32,38 (ЗН, с), 1,79-1,58 (6Н, м), 1,53-1,32 (2Н, м), гидроксифенил)циклопент-3-ен-1-карбоновой ки1,19 (ЗН,т, и = 7Гц) слоты D 1-/5-Фтор-3-/4-(2-метилимидазол-1К перемешиваемому раствору метилового ил)6ензилокси/фенил/циклогексан-4-карбоксамид эфира 1-(5-фтор-3-метоксифенил)циклопент-3-ен1 -карбоновой кислоты (495мг, 2ммоля) в сухом Целевое соединение получено из этилового дихлорметане (10мл) при -78°С прибавляют 1 М эфира 1-/3-фтор-5-/4-(2-метилимидазол-1раствор трехбромистого бора в дихлорметане ил)бензилокси/фенил/циклогексан-1-карбоновой (10мл, Юммолей) и смесь перемешивают Іч при кислоты по методике, приведенной в Примере 5 той же температуре Реакционную смесь нейтра1Н ЯМР (CDCI3) 5 7,53 (2Н, д, J = 8,1 Гц), 7,22 лизуют добавлением воды (20мл) и образовав(2Н, д, J = 8,1 Гц), 7,08 (1Н, с), 6,96 (1Н, с), 6,95 шуюся смесь подкисляют I н соляной кислотой, (1Н, м), 6,83 (1Н, ддд, J = 2,2, 2,2 и 9,5Гц), 6,56 после чего экстрагируют этилацетатом Органиче(1Н, ддд, J = 2,2 2,2 и 9,5Гц), 6,1 (2Н, ш с), 5,11 скую фазу промывают рассолом, сушат и концен(2Н, с), 2,6-2,35 (2Н, м), 2,33 (ЗН, с), 1,79-1,5 (8Н, трируют при пониженном давлении Остаток расм) творяют в смеси метанола (5мл) с толуолом Пример 14 (15мл) и при комнатной температуре и перемеши1-/5-Фтор-3-/4-(2-метилимидазол-1вании добавляют 2 М раствор триметилсилилдиаил)бензилокси/фенил/циклопент-4-карбоксамид зометана в гексане (2мл, 4ммоля) Спустя 0,5ч А Метиловый эфир 5-фтор-Зреакнионную смесь распределяют между этилметоксифенилуксусной кислоты ацетатом и водой, органическую фазу отделяют, а К перемешиваемой смеси метилового эфира водную фазу экстрагируют этилацетатом Объе5-фтор-З-гидрок-сифенилуксусной кислоты (3,3г, диненную органическую фазу промывают рассо15,7ммоля) карбоната калия (1,82г, 50ммолей) в лом, сушат над MgSO4 и концентрируют в вакууДМФА (30мл) добавляют при комнатной темпераме Очисткойл полученного масла колоночной туре метилйодид (1,82г, 50ммолей) и реакционную хроматографией (S1O2, 150 г, гексан-этил а цетат смесь перемешивают примерно сутки Затем (4 1)) получают 407мг (87%) метилового эфира 1смесь разбавляют водой (50мл) и экстрагируют (5-фтор-3-гидроксифенил)циклолент-3-ен-1эфиром Объединенные экстракты промывают карбоиовой кислоты в виде белых кристаллов водой и рассолом, сушат (MgSO4) и концентрируют ввакууме Очисткой остатка колоночной хроматографией (S1O2, 150г, гексан-этил ацетат (10 1)) получают метиловый эфир 5-фтор-Зметоксифенилуксусной кислоты в виде бесцветного масла (495мг, 55%) 1Н ЯМР (CDCI3) 5 6,64-6,57 (2Н, м), 6,53 (1Н, ІН ЯМР (CDCI3) 5 6,64-6,57 (2Н, м), 6,46 (1Н, ддд, J = 9,9, 2,2 и 2,2Гц), 5,75 (2Н, с), 5,68 (1Н, ш с), 3,67 (ЗН, с), 3,35 (2Н, д, J = 15Гц), 2,71 (2Н, д, J = 15Гц) 1-/5-Фтор-3-/4-(2-метилимидазол-1ил)бензилокси/фенил/циклопент-3-ен-1 25 45312 26 карбоксамид (2Н, ш с), 5,13 (2Н, с), 3,89-3,76 (4Н, м), 2,44-2,33 (5Н, м), 2,19-2,02 (2Н, м) Метиловый эфир 1-(5-фтор-3-гидроксифенил) циклопент-З-ен-1-карбоновой кислоты превращаИК (КВг) v 3430, 3200, 2900 1680, 1520, 1420, 1 ют в заглавное соединение по методике получе1380, 1310, 1250, 1170, 1100см ния 4-/5-фтор-3-/4-(2-метилимидазол-1-ил)Пример 16 бензилокси/фенил/-6,4,5,6-тетрагидро-2Н-пиран-41 -3-/4-(2-Метилимидазол-1 карбоксамида (Пример 5) ил)бензилокси/фенил/циклопентан-1-карбоксамид 1Н ЯМР (ДМСО- de) 5 7,62 (2Н, д, J = 8,4Гц), А Этиловый эфир I; 7,48 (2Н, д, J = 8,4Гц), 7,3 (1Н, д, J = 2,2Гц), 6,92 (бензилоксифенил)циклопентан-1-карбоновой ки(1Н, д, J = 2,2Гц), 6,92-6,83 (1Н, м), 6,79-6,75 (1Н, слоты м), 6,74-6,67 (1Н, м), 5,76 (2Н, с), 5,18 (2Н, с), 3,27 Заглавное соединение синтезировано по ме(2Н, д, J = 15Гц), 2,62 (2Н, д, J = 15Гц), 2,3 (ЗН, с) тодике, приведенной в Примере 2F, за тем исклюПример 15 чением, что вместо бис(2-хлорэтилового) эфира 4-3-/4-(2-Метилимидазол-1применяют 1,4-дибромбутан, а вместо этилового ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Нэфира 3-(бензилокси)-5-фторфенилуксусной кипиран-4-карбоксамид слоты применяют этиловый эфир 3бензилоксифенилуксусной кислоты А 4-(3-Бензилоксифенил)-3,4,5,6-тетрагидро2Н-пиран-4-карбоновая кислота 1Н-ЯМР (CDCI3) 5 7,52-7,3 (5Н, м), 7,3-7,2 Заглавное соединение получено по методике, (1Н, м), 7,09-6,94 (2Н, м), 6,91-6,82 (1Н, м), 5,05 приведенной в Примере 4, за тем исключением, (2Н, с), 4,06 (2Н, к, J = 7ГЦ), 3,72-2,56 (2Н, м), 1,99что использован этиловый эфир 4-(31,83 (2Н, м), 1,82-1,64 (4Н, м), 1,15 (ЗН, т, J = 7Гц) бензилоксифенил)-3,4,5,6-тетрагидро-2Н-пиран-4В 1 -(3-Бензилоксифенил)циклопентан-1 карбоновой кислоты (ЕР 462830 А2) вместо этикарбоновая кислота лового эфира 4-/5-фтор-3-/4-(2-метилимидазол-1Заглавное соединение синтезировано по меил)бензилокси/фенил-3,4,5,6-2Н-пиран-4тодике, приведенной в Примере 4, применением карбоновой кислоты этилового эфира 1 -(3-бензил1Н-ЯМР (CDCI3) 5 7,68-7,22 (6Н, м), 7,22-7,01 оксифенил)циклопентан-1-карбоновой кислоты (2Н, м), 6,95-6,82 (1Н, м), 5,09 (2Н, с), 4,1-3,8 (2Н, вместо этилового эфира 4-/5-фтор-3-/4-(2м), 3,8-3,41 (2Н, м), 2,8-2,25 (2Н, м), 2,19-1,75 (2Н, метилимадазол-1-ил)бензилокси/фенил/-3,4,5,6м) тетрагидро-2Н-пиран-4-карбоновой кислоты В 4-(3-Бензилоксифенил)-3,4,5,6-тетрагидро1Н-ЯМР (CDCI3) 5 7,56-7,21 (6Н, м), 7,09-7 2Н-пиран-4-карбоксамид (2Н, м), 6,88 (1Н, м), 5,03 (2Н, с), 2,71-2,53 (2Н, м), Заглавное соединение получено по методике, 2-1,88 (2Н, м), 1,87-1,66 (4Н, м) приведенной в Примере 5, за тем исключением, С 1 -(3-Бензилоксифенил)циклопентан-1 что применяют 4-(3-бензилокси)-3,4,5,6карбоксимид тетрагидро-2Н-пиран-4-карбоновой кислоты вмеЗаглавное соединение синтезировано по место 4-/5-фтор-3-/4-(2-метилимидазол-1тодике, приведенной в Примере 4, за тем исклюил)бензилокси/фенил/-3,4,5,-6,-тетрагидро-2Нчением, что вместо 4-/5-фтор-3-/4-(2пиран-4-карбоновой кислоты метилимидазол-1-ил)бензилокси/фенил/-3,4,5,6тетрагидро-2Н-пиран-4-карбоновой кислоты при1Н-ЯМР (CDCI3) 5 7,52-7,3 (6Н, м), 7,04-6,99 меняют 1 -(3-бензилокси-фенил)циклопентан-1 (2Н, м),6,98-6,88 (1Н, м), 5,19 (2Н, ш с), 5,07 (2Н, карбоновую кислоту с), 3,91-3,74 (4Н, м), 2,43-2,31 (2Н, м), 2,19-2,02 (2Н, м) 1Н-ЯМР (CDCI3) 5 7,5-7,22 (6Н, м), 6,92 (2Н, С 4-(3-Гидроксифенил)-3,4,5,6-тетрагидро-2Нс), 6,88 (1Н, м), 5,48-5,1 (2Н, ш с), 5,04 (2Н, с), пиран-4-карбоксамид 2,52-2,36 (2Н, м), 2,12-1,95 (2Н, м), 1,92-1,55 (4Н, Заглавное соединение получено по методике, м) приведенной в Примере 2G, за тем исключением, D 1 -(3-Гидроксифенил)циклопентан-1 что вместо этилового эфира 4-(3-бензилокси-5карбоксимид фторфенил)-3,4,5,6-тетрагидро-2Н-пиран-4Заглавием соединение синтезировано по мекарбоновой кислоты применяют 4-(3тодике, приведенной в Примере 2G, затем исклюбензилоксифенил)-3,4,5,6-тетрагидро-2Н-пиран-4чением, что вместо этилового эфира 4-(3карбоксамид бензилокси-5-фторфенил)-3,4,5,6-тетрагидро-2Н~ пиран-4-карбоновой кислоты применяют 1-(31Н-ЯМР (CDCI3) 5 9,4 (1Н, ш с), 7,11 (1Н, т, J бензилоксифенил) циклопентан-1 -карбоксамид = 8,1 Гц), 6,97 (1Н, с), 6,78 (1Н, д, J = 7,7Гц), 6,62 (Ш, д, J= 8,4Гц), 3,68-3,82 (2Н, м), 3,58-3,4 (2Н, м), 1Н-ЯМР (CDCI3) 5 9,84 (1Н, ш с), 7,59 (1Н, т, 2,44-2,27 (2Н, м), 0,82-0,68 (2Н, м) J = 7,7Гц), 7,45 (1Н, с), 7,3 (1Н, с), 7,1 (1Н, д, J = D 4-/3-/4-(2-Метилимидазол-18,4Гц), 3,06-2,88 (4Н, м), 2,3-1 (4Н, м) ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2НЕ 1 -/3-/4-(2-Метилимидазол-1 пиран-4-карбоксамид ил)бензилокси/фенил/циклопентан-1-карбоксамид Заглавное соединение получено реакцией 4По методике, приведенной в Примере 2Н, ре(3-гидрокси-фенил)-3,4,5,6-тетрагидро-2Н-пиранакцией 1 -(3-гидроксифенил)циклонентан-1 карбоксамида с гидрохлоридом 4-(2карбоксамида с гидрохлоридом 4-(2метилимидазол-1-ил)бензилхлорида по методике, метилимидазол-1-ил)бензилхлорида получают приведенной в Примере 2Н Т пл 183-186°С заглавное соединение Т пл 163-164°С 1Н-ЯМР (CDCI3) 5 7,6-7,57 (2Н, м), 7,41-7,32 1Н-ЯМР (CDCI3) 5 7,56 (2Н, д, J = 8Гц), 7,5(ЗН, м), 7,09-7 (4Н, м), 6,98-6,91 (1Н, м), 5,36-5,22 7,31 (ЗН, м), 7,18-6,99 (4Н, м), 6,97-6,88 (1Н, м), 28 27 45312 5,45-5,2 (ш с), 5,11 (2Н, с), 2,6-2,3 (2Н, м), 2,38 ральном масле, 1,6г) и реакционную смесь пере(ЗН, с), 2,19-1,6 (6Н, м) мешивают 30 мин Затем добавляют йодид натрия (3,6г, 24ммоля) и 1,3-дибромпропан (8г, ИК (KBr) v 3400, 3200, 2950, 1670, 1610 1580, i 40ммолей) и смесь перемешивают примерно су1520, 1420, 1370, 1310,1290, 1260, 1060 см тки После добавления 2 н НС1 (50мл) смесь эксПример 17 трагируют эфиром (100мл х 2) Объединенные 4-/5-Фтор-3-/4-(2-метилимидазол-1экстракты промывают водой (100 мл х 2) и рассоил)6ензилокси/фенил/-3,4,5,6-тетрагидро-2Нлом (100мл), сушат (MgSO4) и концентрируют в пиран-4-карбоксамида гидрохлорид вакууме Очисткой остатка колоночной хроматоВ 10%-ом метанольном растворе хлористого графией (S1O2, 300 г, гексан-этил ацетат (20 1)) водорода (2мл) растворяют 4-/5-фтор-3-/4-(2получают заглавное соединение (2,1 г, 56%) в виде метилимидазол-1-ил)бензилокси/ фенил/-3,4,5,6бесцветного масла тетрагидро-2Н-пиран-4-карбоксамид (39мг, 1Н ЯМР (CDCI3) 5 7,32 (1Н, дд, J = 13,9 и 0,1ммоля) После перемешивания Юмин летучие 5,9Гц), 7 (1Н, м), 6,93 (1Н, J = 2,2 и 2,2Гц), 6,85 компоненты удаляют испарением и перекристал(1Н, дд, J = 8,1 и 2,6Гц), 3,85 (ЗН, с), 2,9-2,77 (2Н, лизацией полученного остатка из этанола полум), 2,71-2,58 (2Н, м), 2,54-2,31 (1Н, м), 2,18-2 (1Н, чают заглавное соединение (24мг, 57%) в виде м) белого твердого вещества В 1 -ІДиано-1 -(З-гидроксифенил)циклобутан ІН-ЯМР (ДМСО- de) 5 7,87 (1Н, с), 7,78-7,63 К перемешиваемому раствору 1 -циано-1 -(3(5Н, м), 7,25 (1Н, с), 7,08 (1Н, с), 6,88-6,74 (ЗН, м), метоксифенил)-циклобутана (1,93г, 10ммолей) в 5,23 (2Н, с), 3,8-3,66 (2Н, м), 3,6-3,42 (2Н, м), 2,54 сухом дихлорметане (50мл) добавляют при 0°С 1 (ЗН, с), 2,5-2,33 (2Н, м), 1,88-1,69 (2Н, м) М раствор трехбромистого бора в дихлорметане Пример 18 (22мл, 22ммоля), смесь перемешивают ЗОмин ври 4-3-/4-(2-Метилимидазол-1той же температуре и затем примерно сутки при ил)фенилл~иофенил/-3,4,5,6-тетрагидро-2Н-пиранкомнатной температуре Реакционную смесь ней4-карбоксамида гидрохлорид трализуют добавлением воды (100мл) и экстрагиВоспроизведена методика, приведенная в руют дихлорметаиом (50мл х 2) Органическую Примере 17, затем исключением, что вместо 4-/5фазу промывают рассолом (50мл), сушат (MgSO4) фтор-3/4-(2-метилимидазол-1и концентрированием в вакууме получают 1,7г йл)бензилокси/фенил/-3,4,5,6-тетрагидро-2Н(100%) заглавного соединения в виде прозрачного пиран-4-карбоксамида применяют 4-/3-/4-(2коричневого масла метилимидазол-1 -ил)фенил/-тиофенил/-3,4,5,6тетрагидро-2Н-пиран-4-карбоксамид Т пл 2161Н ЯМР (CDCI3) 5 7,29 (1Н, д, J = 1,8 Гц), 6,98 222°С (разложение) (1Н, м), 6,83 (1Н, м), 6,78 (1Н, ш с), 2,91-2,78 (2Н, м), 2,78-2,53 (2Н, м), 2,52-2,33 (1Н, м), 2,2-1,99 (1Н, 1Н-ЯМР (ДМСО- d6) 5 7,86 (1Н, д, J = 2,2Гц), м) 7,75 (1Н, д, J= 2,2Гц), 7,59 (1Н, д, J = 8,79Гц), 7,53С 1 -ІДиано-1 -(З-метилимидазол-1 7,5 (1Н, м), 7,49-7,33 (ЗН, м), 7,41 (1Н, д, J = 8,79 ил)бензилокси/фенил/циклобутан Гц), 7,32 (1Н, ш с), 7,1 (1Н, ш с), 3,78-3,69 (2Н, м), 3,51-3,43 (2Н, м), 2,51 (ЗН, с), 2,48-2,37 (2Н, м), Смесь 1 -циано-1 -(31,88-1,74 (2Н, м) гидроксифенил)цйклобутана (1,76г, 10ммолей), гидрохлорида 4-(2-метилимидазол-1 Пример 19 ил)бензилхлорида (2,1 г, Юммолей) и карбоната 4-3-/4-(2-Метилимидазол-1калия (6,9г, 50ммоля) в ДМФА (80мл) перемешиил)фенилтио/фенил/-3,4,5,6-тетрагидро-2Н-пиранвают Зч при 80°С После добавления воды 4-карбоксамида полуфумарат (200мл) смесь экстрагируют смесью этилацетатВ метаноле (Змл) растворяют 4-/3-/4-(2бензол (2 1, 100 мл х 2), промывают водой (100 мл метилимидазол-1 -ил)фенилтио/фенил/-3,4,5,6х 2), рассолом (100мл), сушат (MgSO4) и концентетрагидро-2Н-пиран-4г-карбоксамид (39мг, трируют в вакууме Очисткой остатка колоночной 0,1ммоля) и фумаровую кислоту (12мг, 0,1ммоля) хроматографией ((S1O2, 150г, дихлорметанПосле перемешивания Юмин летучие компоненты метанол (20 1)) получают 2,9г (84%) заглавного удаляют испарением и перекристаллизацией посоединения в виде прозрачного желтого масла лученного остатка из 2-пропанола получают заглавное соединение (40мг, 78%) в виде белого 1Н ЯМР (CDCI3) 5 7,6 (2Н, д, J = 8,2Гц), 7,44твердого вещества Т пл 183,5-184,5°С 7,3 (ЗН, м), 7,13-6,88 (5Н, м), 5,18 (2Н, с), 2,93-2,78 (2Н, м), 2,73-2,58 (2Н, м), 2,52-2,58 (2Н, м), 2,52-2,3 1Н-ЯМР (ДМСО- d6) 5 7,43-7,34 (7Н, м), 7,32(4Н, м), 2,2-2 (1Н, м) 7,25 (ЗН, м), 7,08 (1Н, с), 6,93 (1Н, с), 6,63-6,61 (1Н, м), 3,79-3,64 (2Н, м), 3,55-3,37 (2Н, м), 2,45D 1 -/3-/4-(2-Метилимидазол-1 2,36 (2Н, м), 2,28 (ЗН, с), 1,84-1,72 (2Н, м) ил)бензилокси/фенил/циклобутан-1-карбоксамид К охлажденному до 0°С раствору 1 -циано-1 ИК (KBr) v 3400, 3200, 2950, 1670, 1610, 1580, /3-/4-(2-метилимидазол-11520, 1420, 1370, 1310,1290, 1260, 1060 см 1 ил)бензилокси/фенил/циклобутана (2,9г, Пример 20 8,4ммоля) в ДМСО (5мл) добавляют 30%-ую Н2О2 1-/3-/4-(2-метилимидазол-1(2мл) и карбонат калия (0,4г) Смесь оставляют ил)6ензилокси/фенил/цикло6утан-1-карбоксамид нагреваться до комнатной температуры, перемеА 1 -ІДиано-1 -(З-метоксифенил)циклобутан шивают при этой температуре примерно сутки и К раствору (З-метоксйфенил)ацетонитрила 6ч при 60°С После добавления воды (100мл) (Зг, 20ммолей) в ДМСО (120мл) при комнатной смесь экстрагируют этилацетатом (100мл х 3) температуре добавляют 3 капли 15-краун-5 и гидОбъединенные органические слои экстрагируют 2 рид натрия (60%-ая (мае/мае) дисперсия в мине 30 29 45312 н НС1 (100мл х 2) и водный слой промывают приведенной в Примере 26, за тем исключением, етилацетатом (100мл х 3) Водный кислый слой что применяют 4-/3-(бензилокси)-5-фторфенил/подщелачивают до рН 9 добавление 5 н NaOH 3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамид вме(150мл) и экстрагируют етилацетатом (100 мл х 3) сто этилового эфира 4-(5-фтор-3Объединенные органические экстракты промывабензилоксифенил)-3,4,5,6-тетрагидро-2Н-пиранют водой (100мл), рассолом (100мл), сушат 4г-карбоновой кислоты (MgSO4) и концентрированном в вакууме получают 1Н ЯМР (CDCI3) 5 9,32 (1Н, ш с), 6,75-6,45 сырой продукт в виде белого твердого вещества (ЗН, с), 6,13 (1Н, ш с), 5,83 (1Н, ш с), 3,9-3,58 (4Н, Перекристаллизацией из этилацетата получают м), 2,47-2,3 (2Н, м), 2,1-1,9 (2Н, м) 2,13г (70%) заглавного соединения в виде белого D 4-/5-фтор-3-//2-фтор-4-(2-метилимидазол-1твердого вещества ил)6ензилокси/фенил/-3,4,5,6-тетрагидро-2Нпиран-4-карбоксамид 1Н ЯМР (CDCI3) 5 7,56 (2Н, д, J = 8,4Гц), 7,36-7,29 (ЗН, м), 7,08-6,87 (5Н, м), 5,2 (2Н, ш с), По методике, приведенной в Примере 2Н, ре5,12 (2Н, с), 2,91-2,78 (2Н, м), 2,56-2,42 (2Н, м), акцией 4-(5-фтор-3-гщроксифенил)-3,4,5,62,38 (ЗН, с), 2,28-2,1 (1Н, м), 1,98-1,82 (1Н, м) тетрагидро-2Н-пиранкарбоксаммда с гидрохлоридом 2-фтор-4-(2-метилимидазол-1Пример 21 ил)бензилхлорида с выходом 4 1 % получают за1 -/3-/4-(2-Метилимидазол-1 главное соединение в виде белого порошка ил)бензилокси/фен ил/циклоп ропан-1-карбоксамид Заглавное соединение получено по методике, 1Н ЯМР (CDCI3) 5 7,63 (1Н, дд, J = 7,7 и приведенной для получения 1-/3-/4-(28,1 Гц), 7,2-6,98 (4Н, м), 6,89-6,6 (ЗН, м), 5,41 (2Н, метилимидазол-1ш с), 5,14 (2Н, с), 3,93-3,7 (4Н, м), 2,46-2,28 (5Н, м), 2,14-1,96 (2Н, м) ИК (КВг) v 3310, 3165, 1687, ил)бензилокси/фенил/циклобутан-1-карбоксамида, 1619, 1590, 1519, 1456, 1415 за тем исключением, что применяют 1,2дибромэтан вместо 1,3-дибромпропана (Пример Пример 23 20) 4-//2,5-Дифтор-3-/4-(2-метилимидазол-11Н ЯМР (CDCI3) 5 7,56 (2Н, д, J = 8,4Гц), ил)6ензилокси/фенил/-3,4,5,6-тетрагидро-2Н7,37-7,28 (2Н, м), 7,12-7,07 (2Н, м), 7,04 (1Н, д, J = пиран-4-карбоксамид 1,5Гц), 7,01 (1Н, д, J = 1,5Гц), 6,95 (1Н, ддд, J = А О-трет-Бутилдиметилисилил-2,58,1, 1,8 и 0,7Гц), 5,8 (HI, ш с),5,42 (1Н, ш с), 2,38 дифтофренол (ЗН, с), 1,68-1,56 (2Н, м), 1,17-1,06 (2Н, м) К перемешиваемому раствору 2,5Пример 22 дифторфенола (15,1г, 116ммолей) в ДМФА 4-/5-фтор-3-/2-фтор-4-(2-метилимидазол-1(100мл) при охлаждении льдом добавляют гидрид ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Ннатрия (60%-ая (мас/мас ) дисперсия в минеральпиран-4-карбоксамид ном масле, 5,13г, 139ммолей) После перемешивания ЗОмин добавляют третА 4-/3-(Бензилокси)-5-фторфенил/-3,4,5,6бутилдиметилсилилхлорид (17,5г, 0,116ммоля) и тетрагидро-2Н-пиран-4-карбоновая кислота перемешивание продолжают еще 1ч Смесь переЗаглавное соединение синтезировано по меносят в воду (200мл) и экстрагируют эфиром тодике, приведенной в Примере 4, за тем исклю(300мл) Экстракт промывают рассолом (200мл), чением, что вместо этилового эфира 4-/5-фтор-3сушат (сульфат натрия) и удалением растворите/4-(2-метилимидазол-1-ил)бензилокси/-фенил/ля испарением получают 26,65г (94%) заглавного 3,4,5,6-тетрагидро-2Н-пиран-4-карбоновой кислосоединения в виде бесцветного масла ты применяют этиловый эфьр 4-/3-(бензилокси)-5фторфенил/-3,4,5,6-тетрагидро-2Н-пиран-41Н ЯМР CDCI3) 5 7,05-6,91 (1Н, м), 6,7-6,52 карбоновой кислоты (2Н, м), 1 (9Н, с), 0,201 (ЗН, с), 0,197 (ЗН, с) 1Н ЯМР (CDCI3) 5 7,49-7,29 (5Н, м), 6,87-6,8 В З-трет-Бутилдиметилисилилокси-2,5(1Н, м), 6,74 (1Н, ддд, J = 1,8, 2,2 и 9,9Гц), 6,62 дифторбензальдегид (1Н, д, J = 2,2, 2,2 и 10,3Гц), 5,02 (2Н, с), 4-3,85 К перемешиваемому раствору 0-трет(2Н, м), 3,7-3,5 (2Н, м), 2,52-2,38 (2Н, м), 2,04-1,85 бутилдиметилсилил-2,5-днфторфенола (5г, (2Н, м) 20ммолей) в ТГФ (20мл) при -78°С прибавляют по В 4-/3-(Бензилокси)-5-фторфенил/-3,4,5,6каплям 1 М раствор втор-Buh (21,5мл, 21,5ммоля) тетрагидро-2Н-пиран-4-карбоксамид Через 0,5ч по каплям прибавляют ДМФА (1,9мл, Заглавное соединение синтезировано по ме24,6ммоля), поддерживая температуру ниже тодике, приведенной в Примере 5, за тем исклю70°С Спустя ЗОмин смесь оставляют нагреваться чением, что вместо 4-/5-фтор-3-/4-(2в течение ЗОмин до комнатной температуры К метилимидазол-1-ил)бензилокси/фенил/-3,4,5,6смеси добавляют 3 н HCL (30 мл) и перемешиватетрагидро-2Н-пиран-4-карбоновой кислоты приние продолжают ЗОмин Смесь экстрагируют эфименяют 4-/3-(бензилокси)-5-фторфенил/-3,4,5,6ром (100мл) и экстракт промывают водой (100мл), тетрагидро-2Н-пиран-4-карбоновую кислоту рассолом (100мл), сушат (сульфат натрия) и испаряют Колоночной хроматографией (силикагель) 1Н ЯМР (CDCI3) 5 7,48-7,31 (5Н, м), 6,82-6,76 остатка с элюированием н-гексаном получают (1Н, м), 6,71 (1Н, ддд, J = 1,8, 1,8 и 9,9Гц), 6,65 3,56г (64%) заглавного соединения в виде бес(1Н, ддд, J = 2,2, 2,2 и 10,3Гц), 5,23 (2Н, ш с), 5,04 цветного масла (2Н, с), 3,85-3,7 (4Н, м), 2,4-2,26 (2Н, м), 2,1-1,95 (2Н, м) 1Н ЯМР CDCI3) 5 10,31 (Ш, д, J = 2,93Гц), С 4-(5-фтор-3-гидроксифенил)-3,4,5,67,12 (1Н, ддд, J = 3,3, 4,4 й 7,7Гц), 6,89 (1Н, ддд J тетрагидро-2Н-пиран-4-карбоксамид = 3,3, 7 и 9,2Гц), 1,02 (9Н, с), 0,245 (ЗН, с), 0,24 (ЗН, с) Заглавное соединение получено по методике, 31 32 концентрируют в вакууме Остаток растворяют в эфире (100мл), промывают водой (100мл), насыщенным водным раствором гидрокарбоната натрия (100мл), рассолом (100мл) и сушат над сульфатом магния Удаляя растворитель получают 3,8г (59%) заглавного соединения в виде желтого масла 1Н ЯМР (CDCI3) 5 6,7-6,5 (2Н, м), 3,87 (ЗН, с), 3,72 (ЗН, с), 3,65 (2Н, д, J = 1,84Гц) G Метиловый эфир 4-(2,5-дифтор-3метоксифенил)-3,4,5,6-тетрагидропиран-4карбоновой кислоты Заглавное соединение синтезировано по методике, приведенной в Примере 2F, за тем исключением, что вместо этилового эфира 3бензилокси-5-фторфенилуксусной кислоты применяют метиловый эфир 2,5-дифтор-Зметоксифенилуксусной кислоты 1Н ЯМР (CDCI3) 5 6,71-6,59 (2Н, м), 3,93-3,73 (4Н, м), 3,86 (ЗН, с), 3,75 (ЗН, с), 2,45-2,32 (2Н, м), 2,14-1,96 (2Н, м) Н Метиловый эфир 4-(2,5-дифтор-3гидроксифенил)-3,4,5,6-тетрагидропиран-4карбоновой кислоты Заглавное соединение синтезировано по методике, приведенной в Примере 14С, за тем исключением, что применяют метиловый эфир 4(2,5-дифтор-3-метоксифекил)-3,4,5,6-тетрагидро2Н-пиран-4-карбоновой кислоты вместо метилового эфира 1 -(3-фтор-5-гидрокси)циклопент-3-ен-1 карбоновой кислоты 1Н ЯМР (CDCI3) 5 6,8-6,5 (2Н, м), 3,96-3,68 (7Н, м), 2,49-2,32 (2Н, м), 2,16-1,95 (2Н, м) I Метиловый эфир 4-/2,5-дифтор-3-/4-(2метилимидазол-1-ил)-бензилокси/фенил)-3,4,5,6тетрагидро-2Н-пиран-4-карбоновой кислоты По методике, приведенной в Примере 2Н, реакцией метилового эфира 4-(2,5-дифтор-3гидроксифенил)-3,4,5,6-тетрагидропиран-4карбоновой кислоты с гидрохлоридом 4-(2метилимидазол-1-ил)бензилхлорида, с выходом 49% получают заглавное соединение в виде желтого масла 1И ЯМР (CDCI3) 5 7,57 (2Н, д, J = 8,4Гц), 7,34 (2Н, д, J = 8,4Гц), 7,05 (1Н, д, J = 1,5 Гц), 7,01 (1Н, д, J = 1,5Гц), 6,9-6,45 (2Н, м), 5,13 (2Н, с), 3,95-3,62 (7Н, м), 2,5-2,3 (5Н, м), 2,16-1,94 (2Н, м) J 4-/2,5-Дифтор-3-/4-(2-метилимидазол-1-ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Н-пиран-4карбоксамид Заглавное соединение получено по методикам, приведенным в Примере 4 и Примере 5, за тем исключением, что вместо этилового эфира 4/5-фтор-3-/4-(2-метилимидазол-1ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Нпиран-4-карбоновой кислоты применяют метиловый эфир 4-/2,5-дифтор-3-//4-(2-метилимидазол-1ил)бензилокси/фенил/-3,4,5,6-тетрагидро-2Нпиран-4-карбоновой кислоты 1Н ЯМР (CDCI3) 5 7,56 (2Н, д, J = 8,43Гц), 7,34 (2Н, д, J = 8,4Гц), 7,04 (1Н, д, J = 1,1 Гц), 7,01 (1Н, д, J = 1,5Гц), 6,82-6,69 (2Н, м), 5,4 (2Н, ш с), 5,15 (2Н, с), 4-3,7 (4Н, м), 2,5-2,3 (5Н, м), 2,22-2,02 (2Н, м) 45312 С 2,5-Дифтор-З-иетоксибензальдегид К перемешиваемому раствору 3-третбутилдиметилсилилокси-2,5дифторбензальдегида (19,45г, 67ммоля в ДМФА (100мл) при комнатной температуре добавляют фторид калия (7,79г, 134ммоля) и йодметан (4,98мл, 80ммолей) Через 5ч смесь переносят в воду (100мл) и экстрагируют етилацетатом (200мл) Экстракт промывают водой (100мл), рассолом (100мл), сушат (сульфат магния) и испаряют Очисткой остатка колоночной хроматографией (силикагель) с элюированием смесью этилацетатн-гексан (1 10) получают 8,58г (74%) заглавного соединения в виде белого твердого вещества 1Н ЯМР (CDCI3) 5 10,35 (1Н, д, J= 2,93Гц), 7,08 (1Н, ддд, J = 2,9, 4 и 7,3Гц), 6,94 (1Н, ддд, J = 2,9, 6,6 й 9,5Гц), 3,94 (ЗН, с) D 2,5-Дифтор-З-метоксибензиловый спирт К перемешиваемому раствору 2,5-дифтор-Зметоксибензальдегида (8,57г, 49,8ммоля) в этаноле (100мл) добавляют при комнатной температуре боргидрид натрия (2,83г, 74,7ммоля) Спустя ЗОмин смесь концентрируют, остаток разбавляют эфиром (300мл) и последовательно промывают водой (200мл), 10%-ой лимонной кислотой (200мл), водой (200мл), рассолом (200мл) и сушат над сульфатом магния Удалением растворителя получают 8,26г (95%) заглавного соединения в виде белого твердого вещества 1Н ЯМР (CDCI3) 5 6,8-6,69 (2Н, м), 4,74 (2Н, с), 3,86 (ЗН, с), 2,14 (1Н, ш с) Е 2,5-Дифтор-З-метоксифенилацетонитрил К перемешиваемому раствору 2,5-дифтор-Зметоксвбензилового спирта (8,26г, 47,4ммоля) в дихлорметане (100мл) добавляют при комнатной температуре п-толуолсульфонилхлорид (9,95г, 52,2ммоля) и триэтиламин (7,3мл, 52,2ммоля) Через 3,5ч смесь переносят в воду (200мл) м экстрагируют эфиром (200мл) Экстракт промывают рассолом (200мл), сушат (сульфат магния) и испаряют К остатку добавляют ДМСО (200мл) и цианид натрия (3,48г, 71ммоль) Полученную смесь перемешивают 2ч и затем переносят в воду (200мл), и экстрагируют эфиром (300мл) Экстракт промывают водой (100мл), рассолом (100мл) и сушат над сульфатом магния Удалением растворителя получают 5,91г (63%) заглавного соединения в виде красного масла 1Н ЯМР (CDCI3) 5 6,8-6,65 (2Н, м), 3,89 (ЗН, с), 3,76 (2Н, д, J = 0,74Гц) Г Метиловый эфир 2-дифтор-Зметилксифенилуксусной кислоты К перемешиваемому раствору 2,5-дифтор-Зметоксифенил-ацетонитрила (5,92г, ЗОммолей) в этиленгликоле (150мл) добавляют гидроксид калия (85%, Зг, 45ммолей) Смесь нагревают 1ч при 120°С, затем смесь переносят в воду (100мл) й промывают эфиром (100мл) Водный слой подкисляют 6 н HCL (10мл) й экстрагируют эфиром (200мл) Экстракт промывают водой (50мл), рассолом (50мл), сушат (сульфат магния) и испаряют Твердый остаток растворяют в метаноле (200мл) и к раствору добавляют конц серную кислоту (2мл) Полученную смесь Кипятят 1ч, охлаждают и 33 45312 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044)456-20- 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 34
ДивитисяДодаткова інформація
Автори англійськоюMANO Takashi, NAKAO, Kazunari
Автори російськоюМАНО Такаси
МПК / Мітки
МПК: A61P 43/00, C07D 309/08, A61P 37/08, C07D 233/60, A61K 31/4164, C07D 405/12, C07D 521/00, A61K 31/415
Мітки: композиція, інгібітори, спосіб, фармацевтична, 5-ліпоксигенази, лікування
Код посилання
<a href="https://ua.patents.su/17-45312-ingibitori-5-lipoksigenazi-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Інгібітори 5-ліпоксигенази, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Фізична форма (r)-7-ацетил-5-(4-амінофеніл)-8, 9-дигідро-8-метил-7н-1, 3-діоксоло[4, 5-h]-[2, 3]-бензодіазепіну, спосіб її отримання та фармацевтична композиція
Наступний патент: Розпушувач
Випадковий патент: Кріпильний пристрій












