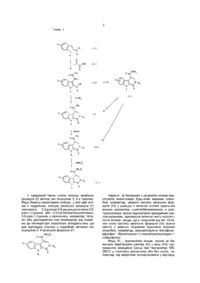
Похідні 1н-піридо[3,4-b]індол-4-карбоксаміду та фармацевтична композиція
Номер патенту: 57037
Опубліковано: 16.06.2003
Автори: Жорж Паскаль, Легаллудек Одетт, Севрен Мірей, Еванно Яннік, Малуазель Крістіан
Формула / Реферат
1. Похідні 1Н-піридо[3,4-b]індол-4-карбоксаміду, як варіант, у формі чистого оптичного ізомеру або суміші таких ізомерів, загальної формули (I)
, (I)
де
X - атом гідрогену або галогену або (С1-С3)алкіл, (С1-С3)алкоксил, трифлуорметил або фенілметоксил,
R1 - атом гідрогену або (С1-С3)алкіл, циклопропіл або фенілметил,
R2 - (С1-С3)алкільна група, як варіант, заміщена метоксильною групою, або феніл(С1-С3)алкільна група, як варіант, заміщена у фенільному кільці атомом галогену, або метильною або метоксильною групою, або циклогексилметильною групою, або тієнілметильна група, або піридинілметильна група, або фенільна група, як варіант, заміщена одним або більше атомами галогену, або (С1-С3)алкільною або (С1-С3)алкоксильною групою, або піридинільна група, або 5-метил-1,2-оксазолільна група, або 5-метил-1,3,4-тіадіазолільна група, або нафтильна група,
R3, R4 - незалежно один від одного атом гідрогену, (С1-С3)алкільна група, 2-метоксіетильна група, гідроксі(С2-С4)алкільна група, карбоксі(С1-С3)алкільна група, (С1-С3)алкоксикарбоніл(С1-С3)алкільна група, або феніл(С1-С3)алкільна група, або разом з атомом азоту, з яким вони з'єднані, утворюють піролідинільну групу, як варіант, заміщену гідроксильною, етоксильною, метоксикарбонільною або метоксиметильною групою, або піперидинільну групу, або морфолінільну групу, або 4-метилпіперазинільну групу, або азетидинільну групу, або тіазолідинільну групу, причому зв'язок між атомами карбону у 3-й та 4-й позиціях простий або подвійний.
2. Сполука за п. 1, яка відрізняється тим, що у загальній формулі (I) X знаходиться у 6-й позиції i є атомом фтору.
3. Сполука за п. 1, яка відрізняеться тим, що R1 - метильна група.
4. Сполука за п. 1, яка відрізняеться тим, що R2 - фенільна група.
5. Сполука за п. 1, яка відрізняеться тим, що R3 - метильна група, a R4 - етильна група.
6. Сполука за п. 1, яка відрізняеться тим, що R3 та R4 разом з атомом азоту, з яким вони з'єднані, утворюють піролідинільне кільце.
7. Фармацевтична композиція, що містить активний компонент та наповнювач, яка відрізняеться тим, що як активний компонент вона містить сполуку за одним з пп. 1-6.
Текст
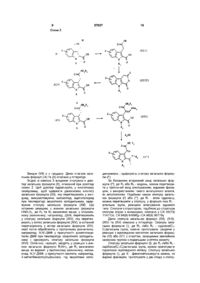
1 ПОХІДНІ 1Н-піридо[3,4-Ь]індол-4 карбоксаміду, як варіант, у формі чистого оптичного ізомеру або суміші таких ізомерів, загальної формули (І) група, як варіант, заміщена у фенільному КІЛЬЦІ атомом галогену, або метильною або метоксильною групою, або циклогексилметильною групою, або тієнілметильна група, або піридинілметильна група, або фенільна група, як варіант, заміщена одним або більше атомами галогену, або ( d Сз)алкільною або (Сі-Сз)алкоксильною групою, або піридинільна група, або 5-метил-1,2оксазолільна група, або 5-метил-1,3,4тіадіазолільна група, або нафтильна група, R3, R4 - незалежно один від одного атом гідрогену, (Сі-Сз)алкільна група, 2-метоксіетильна група, пдроксі(С2-С4)алкільна група, карбоксі(Сг Сз)алкільна група, (Сі-Сз)алкокси карбон іл(Сг Сз)алкільна група, або феніл(Сі-Сз)алкільна група, або разом з атомом азоту, з яким вони з'єднані, утворюють піролідинільну групу, як варіант, заміщену гідроксильною, етоксильною, метоксикарбонільною або метоксиметильною групою, або піперидинільну групу, або морфолінільну групу, або 4метилпіперазинільну групу, або азетидинільну групу, або тіазолідинільну групу, причому зв'язок між атомами карбону у 3-й та 4-й позиціях простий або подвійний 2 Сполука за п гальній формулі атомом фтору 3 Сполука за п метильна група 4 Сполука за п фенільна група 5 Сполука за п N-R, ,() Де X - атом гідрогену або галогену або (С-і-Сз)алкіл, (Сі-Сз)алкоксил, трифлуорметил або фенілметоксил, Ri - атом гідрогену або (С-і-Сз)алкіл, циклопропіл або фенілметил, R2 - (Сі-Сз)алкільна група, як варіант, заміщена метоксильною групою, або феніл(Сі-Сз)алкільна Винахід стосується похідних 1Н-піридо[3,4Ь]шдол-4-карбоксаміду, їх виготовлення та засто О 1, яка відрізняється тим, що у за(І) X знаходиться у 6-й позиції і є 1, яка відрізняється тим що R! 1, яка відрізняється тим, що R 2 1. яка відрізняється тим що R 3 метильна група, a R4 - етильна група 6 Сполука за п 1, яка відрізняється тим, що R3 та R4 разом з атомом азоту, з яким вони з'єднані, утворюють піролідинільне кільце 7 Фармацевтична композиція, що містить активний компонент та наповнювач, яка відрізняється тим, що як активний компонент вона містить сполуку за одним з пп 1-6 сування у терапії Сполука згідно з винаходом має загальну формулу (І) го о ю 57037 О Ы-R, у якій X - атом гідрогену або галогену, або ( d Сз)алкіл, (Сі-Сз)алкоксил, трифлуорметил або фенілметоксил, Ri - атом гідрогену або (С-і-Сз)алкіл, циклопропіл або фенілметил, R2 - (Сі-Сз)алкільна група, як варіант, заміщена метоксильною групою, або феніл ( d Сз)алкільна група, як варіант, заміщена у фенольному КІЛЬЦІ атомом галогену, або метильною або метоксильною групою, або циклогексилметильною група, або тієнілметильна група, або піридинілметильна група, або фенільна група, як варіант, заміщена одним або більше атомами галогену, або (Сі-Сз)алкільною або (Сі-Сз)алкоксильною групою, або піридинільна група, або 5-метил-1,2оксазолільна група, або 5-метил-1,3,4тіадіазолільна група, або нафтильна група, R3, R4 - незалежно один від одного атом гідрогену, (Сі-Сз)алкільна група, 2-метоксіетильна група, пдрокси(С2-С4)алкільна група, карбокси(Сг Сз)алкільна група, (Сі-Сз)алкокси карбон іл(Сг Сз)алкільна група, або феніл(Сі-Сз)алкільна група, або разом з атомом азоту, з яким вони з'єднані, утворюють піролідинільну групу, як варіант, заміщену гідроксильною, етоксильною, метоксикарбонільною або метоксиметильною групою, або піперидинільну групу, або морфолінильну групу, або 4метилпіперазинільну групу, або азетидинільну групу, або тіазолідинільну групу, причому зв'язок між атомами карбону у 3-й та 4-й позиціях простий або подвійний Залежно від виду цього зв'язку сполука згідно з винаходом може існувати у формі оптично чистого ізомеру або у формі суміші таких ізомерів Бажаними сполуками загальної формули (І) є такі, у яких X знаходиться у 6-й позиції і є атомом флуору, Ri - метильна група, R2 - фенільна група, R3 - метильна група, a R4 - етильна група, або R3 та R4 разом з атомом азоту, з яким вони з'єднані, утворюють піролідинільне кільце Сполуки загальної формули (І) можна приготувати способами, ілюстрованими подальшими схемами Згідно З схемою 1 вихідна сполука має формулу (II), у якій X та R, визначено вище, якщо R, водень, то за бажанням можна алкілуванням одержати сполуку загальної формули (II), у якій Ri (Сі-Сз)алкільна група Сполуку загальної формули (II) уводять у реакцію з етилпіруватом формули (III) у кислотному середовищі, наприклад, у присутності газоподібного пдрогенхлориду у етанолі або у присутності сірчаної кислоти або етерату трифлуориду бору в оцтовій кислоті при температурі від кімнатної до температури зворотного холодильника, що дає діестер загальної формули (IV) Останній при температурі зворотного холодильника обробляють у етанолі аміном загальної формули R2NH2, де R2 визначено вище Одержаний естер загальної формули (V) перетворюють у відповідну кислоту загальної формули (IV) гідролізом у лужному середовищі Після ЦЬОГО кислоту перетворюють у первинний, вторинний або третинний амід загальної формули (Г) реакцією з аміном загальної формули HNR3R4, де R3 та R4 визначено вище, через імідазолід, одержаний реакцією з N,N'карбонілдммідазолом або через хлорангідрид n: II. NKR, . P N>i, . m DC E і VI M RH H. . '! • I У одержаній таким чином сполуці загальної формули (Г) зв'язок між позиціями 3, 4 є простим Якщо бажано приготувати сполуку, у якій цей зв'язок є подвійним, сполуку загальної формули (Г) окиснюють 2,3-дихлор-5,6-диціанциклогекса-3,5дієн-1,2-дюном або 3,4,5,6-тетрахлорциклогекса3,5-дієн-1,2-дюном у розчиннику, наприклад, толуолі або дихлорметані при температурі від кімнатної до температури зворотного холодильника, що дає відповідну сполуку з подвійним зв'язком між позиціями 3, 4 загальної формули (І") Нарешті, за бажанням з рацематів можна приготувати енантюмери будь-яким відомим способом, наприклад, уводячи кислоту загальної формули (VI) у реакцію з оптично чистим хіральним аміном, наприклад, а-метилбензиламіном, а діастереоізомери можна відокремити фракційним кристалізуванням, одержуючи оптично чисту кислоту і потім естери і аміди, що є похідними від неї Оптично чисту кислоту загальної формули (VI) можна увести у реакцію з'єднання будь-яким відомим способом, наприклад, використовуючи гексафлуорфосфат (бензотріазол-1 -ілокси)трис(піролідин-1 іл)фосфонію Якщо F 2 - ароматичне кільце, можна за ба? жанням перетворити діестер (IV) у амід (VII) підігріванням реакційної суміші при температурі 100200°С у інертному розчиннику або без нього, наприклад, під зворотним холодильником у ВІДПОВІД 8 57037 ному аміні загальної формули R2NH2 Після цього можна перетворити сполуку загальної формули (VII) у естер загальної формули (V) під зворотним холодильником у етанолі, у кислотному середовищі, наприклад, у присутності концентрованої соляної кислоти, або у кислоту загальної формули (VI) гідролізом у лужному середовищі ВИХІДНІ сполуки загальної формули (II), головним чином, з Ri = Н описано у літературі, а пірувати формули (III) є у продажу Згідно З схемою 2 вихідна сполука має загальну формулу (VIII), де X визначено вище Цю сполуку уводять у реакцію з 2-кетоглютаровою кислотою і потім обробляють у кислотно-спиртовому середовищі, наприклад, у етанолі насиченому газоподібним пдрогенхлоридом під зворотним холодильником, що дає діестер загальної формули (IX), де R - (Сі-Сз)алкіл За бажанням цю сполуку можна алкілувати і одержати сполуку загальної формули (X), де Ri - (С-і-Сз)алкіл, яку потім у протонному розчиннику, наприклад, N.N'-ДМФ у присутності диметилацеталю ДМФ під зворотним холодильником перетворюють у сполуку загальної формули (XI) За бажанням сполука загальної формули (IX) може бути безпосередньо перетворена у сполуку загальної формули (XI), де Ri - метильна група, за умов, описаних вище Сполуку загальної формули (XI) потім обробляють аміном загальної формули R2NH2, де R2 визначено вище, у протонному розчиннику, наприклад, N N'-ДМФ, у присутності кислоти, наприклад, 4-метилбензолсульфоновоі, під зворотним холодильником, і одержують естер загальної формули і (V ), ЯКИЙ ПОТІМ перетворюють у відповідну кислоту і загальної формули (VI ) гідролізом у лужному середовищі Нарешті, цю кислоту перетворюють у первинний, вторинний або третинний амід загальної формули (І") через імідазолід, отриманий реакцією з ІЧ.М'-карбонілдіїмідазолом або через хлорангідрид Схема 2 СІХ) «vim (XI (VI') (Vі ш =. (І") 57037 9 10 Схема 3 ІХШ // OR N (XIII) ,x:v» NTKe, IX > V R,NH M 4, R ВИХІДНІ (VII) є у продажу Деякі сполуки загальних формул (IX) та (X) описано у літературі Згідно ЗІ схемою 3 вихідною сполукою є діестер загальної формули (X), описаний при розгляді схеми 2 Цей діестер пдролізують у кислотному середовищі, щоб одержати двоосновну кислоту загальної формули (XII), яку перетворюють у ангідрид, використовуючи, наприклад, ацетилхлорид при температурі зворотного холодильника, одержуючи сполуку загальної формули (XIII) Цю останню реакцією з аміном загальної формули HNR3R4, де R3 та R4 визначено вище, у хлорованому розчиннику, наприклад, ДХМ, перетворюють у сполуку загальної формули (XIV), яку перетворюють у естер загальної формули (XIV), а останній перетворюють у естер загальної формули (XV), який потім обробляють у протонному розчиннику, наприклад, N.N'-ДМФ у присутності диметилацеталю ДМФ при температурі зворотного холодильника і одержують сполуку загальної формули (XVI) Останню, нарешті, уводять у реакцію з аміном загальної формули R2NH2, де R2 визначено вище, як варіант, у протонному розчиннику, наприклад, N.N'-ДМФ, у присутності кислоти, наприклад, 4-метилбензолсульфоновоі, під зворотним холо дильником, і одержують сполуку загальної формули (І") За бажанням вторинний амід загальної формули (І"), де R3 або R4 - водень, можна перетворити у третинний амід алкілуванням, відомим фахівцям, з використанням такого алкілуючого агента, як алкілгалоген Подібним чином сполуку загальної формули (Г) або (І"), де Ri - атом гідрогену, можна перетворити у сполуку, у формулі якої Ri алкільна група, реакцією алкілування відомого типу Сполуки з структурою, подібною до структури сполуки згідно з винаходом, описано у СА 83(13) 114712с, СА 94(9) 64698д і СА 96(9) 68779у Деякі сполуки загальних формул (XII), (XIII), (XIV) та (XV) описано у літературі Сполуку загальної формули (І), де R3 і/або R4 - пдрокси(С2С4)алкільна група, можна приготувати, уводячи у реакцію з ВІДПОВІДНОЮ кислотою загальної формули (VI) або (VIі) З спиртом, захищеним звичайною захисною групою з подальшим зняттям захисту Сполуку загальної формули (І), де R3 і/або R4 карбокси(С2-С4)алкільна група, можна приготувати гідролізом ВІДПОВІДНОГО естеру Сполуку загальної формули (і), де X - фенілметоксигрупа можна, як відомо фахівцям, приготувати у дві стадії з сполу 12 11 57037 ки загальної формули (І), де X - метоксигрупа льодяною водою, водним аміаком довели рН до лужного і екстрагували дихлорметаном Органічну Далі наведено приклади, що детально ілюстфазу промивали та сушили сульфатом натрію і рують приготування деяких сполук згідно з винавипарювали розчинник під зниженим тиском, заходом Мікроаналізи на елементи, ІЧ та ЯМР спеклишок перекристалізовували з суміші пентану та три підтверджують структуру одержаних сполук діетилового етеру, отримавши 13г (42ммоль) Номери у лапках після назв сполук відповідатвердого продукту з т пл 86-88°С ють номерам у таблиці, наведеній нижче Приклад 1 (Сполука №20) 13 Етил[(±)-6-флуор-9-метил-1 -оксо-2(±)-6-флуор-г\І,І\І,9-триметил-1-оксо-2(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4Ь]шдол-4-карбоксилат] Ь]шдол-4-карбоксамід Розчин 7г (23ммоль) етил[2-(етоксикарбоніл)1 1 Етил[5-флуор-1 -метил-1 Н-шдол-25-флуор-1-метил-а-метилен-1Н-шдол-3-ацетату] карбоксилат] та 15мл (140ммоль) бензиламшу в 200мл етанолу гріли під зворотним холодильником протягом 8 1 1 1 Етил [5-флуор-1 Н-шдол-2-карбоксилат] годин, випарювали розчинник під зниженим тиском 150г (0,92 моль) пдрохлориду 4і до залишку додавали дихлорметан та 1Н пдрофлуорфенілпдразину при охолодженні додали до хлоридну кислоту Органічну фазу промивали вовиготовленого розчину 23г (1моль) натрію в 1,5л дою та сушили сульфатом натрію і випарювали метанолу і суміш при кімнатній температурі перерозчинник під зниженим тиском, а залишок очимішували протягом ЗО хвилин Розчин концентрущали хроматографією на колонці з силікагелем, вали під зниженим тиском, залишок переносили в елююючи сумішшю дихлорметану та етилацетату дихлорметан (ДХМ) і відфільтровували хлорид Отримали 7г (18ммоль) твердого продукту, який натрію Розчинник випарювали під зниженим тисвикористали в наступній стадії ком, залишок розчиняли в 830мл етанолу з вмістом 4,4мл оцтової кислоти та 102мл (0,91 моль) 14 (±)-6-флуор-9-метил-1-оксо-2етилпірувату і суміш гріли під зворотним холоди(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4льником протягом 2 годин, концентрували під зниЬ]шдол-4-карбонова кислота женим тиском, до залишку додавали етилацетат, 6г (Ібммоль) етил[(±)-6-флуор-9-метил-1-оксопромивали розчин водою, та випарювали розчин2-(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4ник під зниженим тиском Отримали 181,6г пдраЬ]шдол-4-карбоксилату] пдролізували 2,5 г гідрозону 214г (1,12моль) моногідрату 4-метил бензоксиду натрію в суміші води та етанолу, суміш конлсульфонової кислоти у 2,5л толуолу депдрували центрували під зниженим тиском, додавали воду нагріванням суміші протягом 2 годин під зворотта оцтову кислоту, екстрагували етилацетатом, ним холодильником в апараті Дина-Старка 181,6г органічну фазу промивали водою та сушили су(0,83моль) отриманого пдразону додали при охольфатом натрію і випарювали розчинник під знилодженні і суміш гріли під зворотним холодильниженим тиском Отримали 7г (18ммоль) твердого ком протягом 3 годин, охолоджували, додавали продукту з т пл 264-265°С, який використали в етилацетат та воду, ВІДДІЛЯЛИ та сушили органічну наступній стадії фазу та випарювали розчинник під зниженим тис15 (±)-6-флуор-г\І,г\І,9-триметил-1-оксо-2ком Залишок перекристалізовували з пропан-2(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4олу і маточник очищали хроматографією на колоЬ]шдол-4-карбоксамід нці з силікагелем, елююючи дихлорметаном Розчин 4г (11ммоль) (±)-6-флуор-г\І,г\І,9Отримали 144г (0,7моль) продукту, який використриметил-1-оксо-2-(фенілметил)-2,3,4,9тали в наступній стадії тетрапдро-1 Н-піридо[3,4-Ь]шдол-4-карбоновоі кислоти та 2,2г (ЗОммоль) 1,1'-карбонілдммідазолу в 1 1 2 Етил [5-флуор-1 -метил-1 Н-шдол-2200мл тетрапдрофурану гріли протягом 2 годин карбоксилат] при 40°С, потім охолоджували, додавали великий 11,7г (0,39моль) гідриду натрію як 80% суспеннадлишок зрідженого диметиламіну і перемішувазію в маслі промили петролейним етером і додали ли протягом кількох годин 62,1г (О.Змоль) етил [5-флуор-1Н-шдол-2карбоксилату] у 600мл диметилформаміду, переВипарювали розчинник під зниженим тиском, мішували при кімнатній температурі протягом 2 до залишку додавали дихлорметан та воду, оргагодин і додавали 24,3мл (0,39моль) метилюдиду у нічну фазу ВІДДІЛЯЛИ, промивали водою та сушили 50мл диметилформаміду, перемішували при кімсульфатом натрію, випарювали розчинник під натній температурі протягом 2 годин і виливали в зниженим тиском і залишок очищали хроматогральодяну воду, потім екстрагували етилацетатом, фією на колонці з силікагелем, елююючи сумішшю органічну фазу промивали та сушили сульфатом дихлорметану та метанолу Продукт перекристалінатрію і випарювали розчинник під зниженим тисзовували з етилацетату, отримавши 1,2г (Зммоль) ком, отримавши 62,5г (0,28моль) твердого продукпродукту з т пл 185-186°С ту, який використали в наступній стадії Приклад 2 (Сполука №59) 1 2 Етил[2-(етоксикарбоніл)-5-флуор-1-метил(±)-6-флуор-г\І,І\І,9-триметил-1-оксо-2а-метилен-1 Н-індол-3-ацетат] (фенілметил)-2,9-дипдро-1Н-піридо[3,4-Ь]індол-4карбоксамід Розчин 10,5г (48ммоль) етил[5-флуор-1-метилРозчин 2г (5ммоль) (±)-6-флуор-9-метил-11Н-шдол-2-карбоксилату], 18г (155ммоль) етилпіоксо-2-(фенілметил)-2,3,4,9-тетрапдро-1Нрувату та 7,8мл концентрованої сульфатної кислопіридо[3,4-Ь]шдол-4-карбоксаміду та 1,6г (7ммоль) ти в ЮОмл оцтової кислоти перемішували при кім2,3-дихлор-5,6-диціано-1,4-бензохшону в 250мл натній температурі протягом 1,5 годин Суміш дихлорметану перемішували протягом 1 години концентрували під зниженим тиском, пдролізували 14 13 57037 Органічну фазу промивали та сушили сульфатом 8,6г продукту, який перекристалізовували з пронатрію, а залишок очищали хроматографією на пан-2-олу, отримавши 6,9г (19ммоль) продукту з колонці з силікагелем, елююючи сумішшю дихлот п л 217-218°С рметану та етилацетату Продукт перекристалізоПриклад 4 (Сполука №77) вували з діетилового етеру, отримавши 1 г (+)-6-флуор-г\І,І\І,9-триметил-1-оксо-2(2,бммоль) продукту з т пл 192-193°С (фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4Ь]шдол-4-карбоксамід Приклад 3 (Сполука №36) 6-хлор-2-(2-метоксіетил)-І\І,г\І,9-триметил-141 (+)-6-флуор-9-метил-1-оксо-2оксо-2,3,4,9-тетрапдро-1Н-піридо[3,4-Ь]шдол-4(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4карбоксамід Ь]шдол-4-карбонова кислота 31 Етил[5-хлор-1-метил1Н-шдол-2Розчин 20,5 г (58 ммоль) (±)-6-флуор-9-метилкарбоксилат] 1-оксо-2-(фенілметил)-2,3,4,9-тетрапдро-Шпіридо[3,4-Ь]шдол-4-карбоновоі кислоти та 7,5мл Виготовили способом з прикладу 1 1 2 з 8,95г (58ммоль) (Р)-(+)-а-метилбензиламшу в ЮООмл (40ммоль) етил[5-хлор-1Н-шдол-2-карбоксилату], метанолу перемішували, потім концентрували під 1,6г (52ммоль) гідриду натрію як 80% суспензії в зниженим тиском, додавали 50мл етилацетату та маслі та 11,35г (80ммоль) метилюдиду, отримав400мл діетилового етер, ВІДДІЛЯЛИ осад фільтруши 9,5г (40ммоль) твердого продукту, який ванням і тричі перекристалізовували з пропан-2З 2 Етил[5-хлор-2-(етоксикарбоніл)-1-метил-аолу 7,3г (15ммоль) діастереоізомерної солі видіметилен-1 Н-індол-3-ацетат] ляли і розчиняли в ЮОмл метанолу, додавали Насичений пдрохлоридом розчин 9,5г 16мл 1Н пдрохлоридної кислоти та 200мл води, (40ммоль) етил[5-хлор-1 -метил- 1Н-шдол-2ВІДДІЛЯЛИ осад фільтруванням і сушили при кімнакарбоксилату] та 8,8мл (80ммоль) етилпірувату тній температурі під зниженим тиском Отримали гріли під зворотним холодильником протягом 4 5,1г (15ммоль) правообертаючої кислоти з т пл годин, випарювали розчинник під зниженим тис264-265°С ком, до залишку додавали етилацетат, промивали до нейтральної реакції, органічну фазу сушили [a] D 2 0 = 41,6 (с - 0,5, СНзОН) еч >99% (ВЕРХ) сульфатом натрію і випарювали розчинник під 42 (+)-6-флуор-г\І,г\І,9-триметил-1-оксо-2зниженим тиском Залишок очищали хроматогра(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4фією на колонці з силікагелем, елююючи дихлорЬ]шдол-4-карбоксамід метаном і отримавши 9,6г (32ммоль) твердого Розчин 0,5г (1,3ммоль) (+)-6-флуор-г\І,г\І,9продукту, який використали в наступній стадії триметил-1-оксо-2-(фенілметил)-2,3,4,9тетрапдро-1 Н-піридо[3,4-Ь]шдол-4-карбоновоі кисЗ 3 Етил[(±)-6-хлор-2-(2-метоксіетил)-9-метиллоти, 0,11г (1,3ммоль) пдрохлориду диметиламіну 1-оксо-2,3,4,9-тетрапдро-1Н-піридо[3,4-Ь]індол-4попередньо сушили під зниженим тиском, а 0,68г карбоксилат] (ІЗммоль) гексафлуорфосфату (бензотріазол-1Розчин 9,5г (31 ммоль) етил[5-хлор-2ілокси)трис(піролідино)фосфонію в Юмл дихлор(етоксикарбоніл)-1-метил-а-метилен-1Н-шдол-3метану, пропущеного попередньо через колонку з ацетату] та 8,1г (ЭЗммоль) 2-метоксиетиламшу в оксидом алюмінію, охолоджували до -30°С, і крап20мл етанолу гріли під зворотним холодильником лями додавали розчин 0,68мл (3,9ммоль) N,Nпротягом 3 годин, випарювали розчинник під зниди(1-метилетил)етиламшу в 5мл дихлорметану женим тиском і до залишку додавали етилацетат, Суміш перемішували протягом 6 годин при темпеякий промивали водою та сушили сульфатом наратурі -ЗО - -20°С і пдролізували Юмл 5% розчину трію Отримали 9,7г (27ммоль) твердого продукту, гідросульфату калію, екстрагували дихлорметаякий використали в наступній стадії ном, органічну фазу промивали та сушили і випаЗ4 (±)-6-хлор-2-(2-метоксіетил)-9-метил-1 рювали розчинник під зниженим тиском, а залишок оксо-2,3,4,9-тетрапдро-1Н-піридо[3,4-Ь]шдол-4очищали хроматографією на колонці з силікагекарбонова кислота лем, елююючи сумішшю дихлорметану та етила9,6г (26ммоль) етил[(±)-6-хлор-2-(2цетату Отриманий продукт метоксіетил)-9-метил-1-оксо-2,3,4,9-тетрапдро-1Нпіридо[3,4-Ь]шдол-4-карбоксилату] пдролізували перекристалізовували з пропанолу-2, отрима3,1г (80ммоль) гідроксиду натрію в суміші 50мл вши 0,37г (1 ммоль) правообертаючого аміду з води та 260мл етанолу, суміш концентрували під т п л 199-202°С зниженим тиском, до залишку додавали воду та [a] D 2 0 = +6,3 (с = 1, СНСІз) еч >94% (ВЕРХ) водну фазу промивали підкислювали до рН=1 Приклад 5 (Сполука №76) концентрованою пдрохлоридною кислотою і екст(-)-6-флуор-г\І,І\І,9-триметил-1-оксо-2рагували етилацетатом, органічну фазу промива(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4ли водою та сушили сульфатом натрію і випарюЬ]шдол-4-карбоксамід вали розчинник під зниженим тиском Отримали 51 (-)-6-флуор-9-метил-1-оксо-28,3г (26ммоль) твердого продукту, який використа(фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,4ли в наступній стадії Ь]шдол-4-карбонова кислота З5 (±)-6-хлор-2-(2-метошетил)-М,М,9Маточник від отримання діастереоізомерної триметил-1-оксо-2,3,4,9-тетрапдро-1Н-піридо[3,4солі з прикладу 4 1 випарювали під зниженим тисЬ]шдол-4-карбоксамід ком, додавали воду та концентровану пдрохлориВиготовили способом з прикладу 1 5 з 8,3г дну кислоту і осад відфільтровували та сушили під (26ммоль) (±)-6-хлор-2-(2-метоксіетил)-9-метил-1зниженим тиском при кімнатній температурі, отриоксо-2,3,4,9-тетрапдро-1Н-піридо[3,4-Ь]шдол-4мавши 13,6г (38ммоль) забрудненої лівообертаюкарбонової кислоти та диметиламіну, виділивши чоі кислоти, до якої додавали 250мл метанолу та 16 15 57037 шок зрідженого диметиламіну і перемішували про4,97мл (38ммоль) (3)-(-)-а-метилбензиламшу, петягом кількох годин, додавали воду і осад ремішували, потім концентрували під зниженим відфільтровували та сушили під зниженим тиском тиском, ВІДДІЛЯЛИ осад фільтруванням і тричі пеОтримали 3,4г (9ммоль) сполуки, 2,5г якої розчирекристалізовували з пропан-2-олу Отримали 7г нили в 50мл диметилсульфоксиду і додали 0,6г (15ммоль) діастереоізомерної солі, яку розчиняли порошку гідроксиду калію та 1,2мл юдметану, сув мінімальній КІЛЬКОСТІ метанолу, додавали 15мл міш перемішували при 50°С протягом 5 годин і 1Н пдрохлоридної кислоти та подвоїли об'єм розпротягом 20 годин при кімнатній температурі чину водою, ВІДДІЛИЛИ осад фільтруванням, промили водою і сушили при кімнатній температурі під Додавали розбавлену пдрохлоридну кислоту зниженим тиском Отримали 5г (14ммоль) лівота екстрагували етилацетатом, органічну фазу обертаючої кислоти з т пл 264-269°С сушили сульфатом натрію, випарювали розчинник 20 під зниженим тиском і залишок очищали хроматог[a]D =-42,2 (с - 0,5, СН3ОН) еч >99% (ВЕРХ) рафією на колонці з силікагелем, елююючи сумі52 (-)-6-флуор-г\І,І\І,9-триметил-1-оксо-2шшю етилацетату та циклогексану, отримавши (фенілметил)-2,3,4,9-тетрапдро-1Н-піридо[3,42,2г суміші з вмістом 6-флуор-г\І,І\І,9-триметил-1Ь]шдол-4-карбоксамід оксо-2-феніл-2,9-дипдро-1Н-піридо[3,4-Ь]індол-4Виготовили способом з прикладу 4,2 з (-)-бкарбоксаміду та 6-флуор-г\І,І\І,9-триметил-1-оксо-2флуор-г\І,І\І,9-триметил-1-оксо-2-(фенілметил)феніл-2,3,4,9-тетрапдро-1Н-піридо[3,4-Ь]індол-42,3,4,9-тетрапдро-1Н-піридо[3,4-Ь]шдол-4карбоксаміду карбонової кислоти та диметиламіну, отримавши Цю суміш перемішували з 1г 2,3-дихлор-5,6після фінальної перекристалізації 0,3г (0,8ммоль) диціано-1,4-бензохшону протягом 20 годин і пролівообертаючого аміду з т пл 204-205°С мивали насиченим водним розчином гідрокарбо[a] D = -7,5 (с = 1, СНСІз) еч >98% (ВЕРХ) нату натрію, органічну фазу ВІДДІЛЯЛИ І сушили Приклад 6 (Сполука №101) сульфатом натрію, випарювали розчинник під 6-флуор-г\І,І\І,9-триметил-1-оксо-2-феніл-2,9зниженим тиском і залишок очищали хроматоградипдро-1Н-піридо[3,4-Ь]шдол-4-карбоксамід фією на колонці з силікагелем, елююючи сумішшю 61 Етил[2-(етоксикарбоніл)-5-флуор-аетилацетату та циклогексану, і продукт перекрисметилен-1 Н-індол-3-ацетат] талізовували з етилацетату, отримавши 0,5г Розчин 37,2г (180ммоль) етил[5-флуор-1Н(1,5ммоль) сполуки з т пл 195-197°С шдол-2-карбоксилату], 25,8г (222ммоль) етилпіруПриклад 7 (Сполука №97) ватута 31 мл концентрованої сульфатної кислоти в г\І,г\І,9-триметил-1-оксо'2-феніл-2,3,4,9400мл оцтової кислоти перемішували 20 годин тетрапдро-1Н-піридо[3,4-Ь]шдол-4-карбоксамід Розчинник випарювали під зниженим тиском, до 7 1 Етил[2-(етоксикарбоніл)- а-метилен-1 Нзалишку додали воду та етилацетат, органічну шдол-3-ацетат] фазу ВІДДІЛЯЛИ, промивали розбавленим розчином аміаку, а далі насиченим водним розчином хлориНасичений пдрохлоридом розчин 39,1 г ду натрію та сушили сульфатом натрію і випарю(207ммоль) етил[1Н-шдол-2-карбоксилату] та вали розчинник під зниженим тиском, отримавши 45,3мл (410ммоль) етилпірувату витримували при 37,1г (122ммоль) твердого продукту, який викорисприблизно 60°С протягом 3 годин, концентрували товували а наступній стадії під зниженим тиском, до залишку додавали діетиловий етер, промивали органічну фазу водою, 6 2 6-флуор-1-оксо-2-феніл-2,3,4,9-тетрапдросушили сульфатом натрію і випарювали розчинник 1 Н-піридо[3,4-Ь]шдол-4-карбонова кислота під зниженим тиском Залишок перекристалізовуСуміш 25г (82ммоль) етил[2-(етоксикарбоніл)вали з циклогексану, отримавши 45,4г (158ммоль) 5-флуор-а-метилен-1 Н-індол-3-ацетату] та 31,8г твердого продукту, який використали в наступній (342ммоль) аніліну гріли під зворотним холодильстадії ником протягом 17 годин, додавали розбавлену 7 2 1-оксо-г\І,2-дифеніл-2,3,4,9-тетрапдро-1Нпдрохлоридну кислоту та етилацетат Органічну піридо[3,4-Ь]шдол-4-карбоксамід фазу промивали водою та сушили сульфатом натрію і випарювали розчинник під зниженим тиском, Суміш 32г (111 ммоль) етил[2-(етоксикарбоніл)отримавши 30г залишку, який пдролізували розчиметилен-1Н-шдол-3-ацетату] та 47,5г (511 ммоль) ном 43мл 30% гідроксиду натрію в 400мл етанолу аніліну гріли під зворотним холодильником протяпід зворотним холодильником протягом 1 години, гом 13 годин, і додавали дихлорметан Органічну суміш концентрували під зниженим тиском, додафазу промивали 1Н пдрохлоридною кислотою та вали воду, промивали етилацетатом та дихлормесушили сульфатом натрію і випарювали розчинник таном, водну фазу підкислювали концентрованою під зниженим тиском, отримавши 38,8г брудного пдрохлоридною кислотою, осад відфільтровували продукту, який використали в наступній стадії та сушили під зниженим тиском Отримали 18,5 г 7 3 Етил[1-оксо-2-феніл-2,3,4,9-тетрапдро-1Н(57 ммоль) твердого продукту, який використали в піридо[3,4-Ь]шдол-4-карбоксилат] наступній стадії 38,8г брудного 1 -оксо-г\І,2-дифеніл-2,3,4,9тетрапдро-1Н-піридо[3,4-Ь]шдол-4-карбоксилату в 63 6-флуор-г\І,І\І,9-триметил-1-оксо-2-фенілсуміші етанолу, води та 37% пдрохлоридної кис2,9-дипдро-1Н-піридо[3,4-Ь]шдол-4-карбоксамід лоти гріли під зворотним холодильником протягом 5г (15ммоль) 6-флуор-1-оксо-2-феніл-І\І,г\І,98 годин, нейтралізували концентрованим гідрокситриметил-2,3,4,9-тетрапдро-1Н-піридо[3,4-Ь]індолдом натрію та екстрагували етилацетатом, випа4-карбоновоі кислоти в 40мл тюнілхлориду гріли рювали розчинник під зниженим тиском, залишок під зворотним холодильником протягом 1 години, очищали хроматографією на колонці з силікагевипарювали розчинник під зниженим тиском, долем, елююючи сумішшю етилацетату та дихлордавали до залишку дихлорметан і великий надли 18 17 57037 метану, отримавши 22,6г (68ммоль) продуїсгу, який ром, органічну фазу промивали водою та сушили використали в наступній стадії сульфатом магнію і випарювали розчинник під зниженим тиском, отримавши 44,3г 144ммоль) 74 1 -оксо-2-феніл-2,3,4,9-тетрапдро-1Нтвердого продукту, який використали в наступній піридо[3,4-Ь]шдол-4-карбоксамід стадії 22,6г (68ммоль) етил[1-оксо-2-феніл-2,3,4,9тетрапдро-1 Н-піридо[3,4-Ь]шдол-4-карбоксилату] в 83 Етил [а-диметиламшометиліден-2ЗОмл тюнілхлориду гріли під зворотним холодиль(етоксикарбоніл)-5-флуор-1-метил-1 Н-шдол-3ником протягом 4 годин, випарювали розчинник ацетат] під зниженим тиском, додавали до залишку дих44,3г (144ммоль) етил[2-(етоксикарбоніл)-5лорметан і великий надлишок зрідженого диметифлуор-1 -метил- 1Н-шдол-3-ацетату] та 57,4мл ламіну і перемішували протягом кількох годин, диметилацеталю диметилформаміду в 450мл N,Nвипарювали розчинник під зниженим тиском, додиметилформаміду гріли під зворотним холодильдавали воду та етилацетат і осад відфільтровуваником протягом 50 годин, випарювали розчинник ли та сушили під зниженим тиском Отримали 8,2г під зниженим тиском та додавали діетиловий етер, брудного продукту, який використали в наступній нерозчинний матеріал відфільтровували і випарюстадії вали розчинник під зниженим тиском, отримавши 49,3г ІЗбммоль) твердого продукту, який викорис75 г\І,г\І,9-триметил-1-оксо-2-феніл-2,3,4,9тали в наступній стадії тетрапдро-1Н-піридо[3,4-Ь]шдол-4-карбоксамід Суміш 1,3г (23ммоль) порошку гідроксиду ка8 4 Етил[6-флуор-9-метил-1 -оксо-2-феніл-2,9лію та 6г брудного 1-оксо-2-феніл-2,3,4,9дипдро-1Н-піридо[3,4-Ь]шдол-4-карбоксилат тетрапдро-1Н-піридо[3,4-Ь]шдол-4-карбоксаміду в Розчин 16,3мл (45ммоль) етил[а60мл диметилсульфоксиду гріли при 40°С протядиметиламшометиліден-2-(етоксикарбоніл)-5гом ЗО хвилин і додали 2,5мл (40ммоль) юдметафлуор-1 -метил-1 Н-індол-3-ацетату], 4,64г ну, суміш перемішували протягом 5 годин при кім(50ммоль) аніліну та 1,6г (8ммоль) моногідрату 4натній температурі метилбензолсульфонової кислоти в 160мл N,NДодавали до залишку дихлорметан, органічну диметилформаміду гріли під зворотним холодильфазу сушили сульфатом натрію, випарювали розником протягом 24 годин, і малими порціями додачинник під зниженим тиском і залишок очищали вали 3 3г (Зіммоль) карбонату натрію і гріли під хроматографією на колонці з силікагелем, елюююзворотним холодильником ще протягом 2 годин чи сумішшю етилацетату та дихлорметану ПроРозчин виливали у льодяну воду, екстрагували дукт перекристалізовували з етилацетату, отримаетилацетатом, органічну фазу промивали водою вши 0,5г (1,5ммоль) сполуки з т пл 196-197°С та сушили сульфатом магнію і випарювали розчинник під зниженим тиском, і залишок очищали Приклад 8 (Сполука №123) хроматографією на колонці з силікагелем, елюююІ\І-етил-6-флуор-г\І,9-диметил-1-оксо-2-фенілчи сумішшю етилацетату та дихлорметану, отри2,9-дипдро-1Н-піридо[3,4-Ь]шдол-4-карбоксамід мавши 10,9г (ЗОммоль) продукту, який використа81 Етил[2-(етоксикарбоніл)-5-флуор-1 Нли в наступній стадії шдол-3-ацетат] Розчин 7,4г (185ммоль) гідроксиду натрію в 85 6-флуор-9-метил-1 -оксо-2-феніл-2,975мл води додали до розчину 30г (185ммоль) пддипдро-1 Н-піридо[3,4-Ь]шдол-4-карбонова кислота рохлориду 4-флуорфенілпдразину в ЗООмл води, Розчин 22,8г (65ммоль) етил[6-флуор-9-метилсуміш перемішували 15 хвилин і додали розчин 1 -оксо-2-феніл-2,9-дипдро-1 Н-піридо[3,4-Ь]шдол-429г (198ммоль) кетоглутарової кислоти в 60мл карбоксилату та 7,46г (186ммоль) гідроксиду наводи, перемішували протягом 3 годин при кімнаттрію в суміші 100мл води та 1000мл етанолу гріли ній температурі і екстрагували етилацетатом, орпід зворотним холодильником протягом 3 годин, ганічну фазу промивали водою, сушили сульфасуміш концентрували під зниженим тиском, до затом натрію, випарювали розчинник під зниженим лишку додавали воду та водну фазу промивали тиском і 42г (144ммоль) отриманого продукту розетилацетатом, підкислювали до рН-1 концентрочиняли в 420мл насиченого газуватим хлороводваною пдрохлоридною кислотою і відфільтровуванем етанолу і гріли під зворотним холодильником ли продукт, який кілька разів промивали водою та протягом 4 годин Суміш концентрували під знисушили під зниженим тиском Отримали 20,4г женим тиском і додавали до залишку етилацетат, (64ммоль) твердої сполуки, яку використали в наорганічну фазу промивали нормальним гідроксиступній стадії дом натрію, водою, сушили сульфатом натрію і 86 6-флуор-9-метил-1 -оксо-2-феніл-2,9випарювали розчинник під зниженим тиском, дипдро-1-піридо[3,4-Ь]шдол-4-карбоксамід отримавши 42г (143ммоль) твердого продукту Розчин 5г (15,6ммоль) етил[6-флуор-9-метил82 Етил[2-(етоксикарбоніл)-5-флуор-1 1 -оксо-2-феніл-2,9-дипдро-1 Н-піридо[3,4-Ь]шдол-4метил-1 Н-індол-3-ацетат] карбонової кислоти та 4,8г (ЗОммоль) N',Nкарбонілдммідазолу в 200мл N',N7,36г (184ммоль) 60% гідриду натрію, промидиметилформаміду перемішували протягом 4 готого петролейним етером, та 45г (153ммоль) дин при 60°С, потім при кімнатній температурі доетил[2-(етоксикарбоніл)-5-флуор-1Н-шдол-2давали великий надлишок зрідженого диметилакарбоксилату] у 450мл диметилформаміду, переміну і перемішували протягом 20 годин Розчин мішували при кімнатній температурі протягом 2 виливали у льодяну воду, осад відфільтровували, годин і додавали 19мл (ЗОбммоль) метилюдиду у промивали насиченим розчином гідрокарбонату 50мл диметилформаміду, перемішували при кімнатрію, водою та сушили під зниженим тиском, натній температурі протягом 20 годин і виливали в отримавши 3,5г сирого продукту Фільтрати поєдльодяну воду, потім екстрагували діетиловим ете 19 57037 нували та екстрагували дихлорметаном, органічну фазу ВІДДІЛЯЛИ, промивали насиченим розчином гідрокарбонату натрію, водою та сушили сульфатом магнію, отримавши ще 1,5г сирого продукту Дві партії поєднували і очищали хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану та етилацетату, отримавши 4,7г (13,5ммоль) продукту 87 ІЧ-етил-6-флуор-9-метил-1 -оксо-2-феніл2,9-дипдро-1Н-піридо[3,4-Ь]шдол-4-карбоксамід Розчин 2,5г (7,1ммоль) 6-флуор-9-метил-1оксо-2-феніл-2,9-дипдро-1Н-піридо[3,4-Ь]індол-4карбоксаміду та 0,36г (9ммоль) 60% гідриду натрію, промитого петролейним етером, перемішували при 50°С протягом 3 годин, додавали 1,67мл (21ммоль) юдетану і перемішували ще протягом 20 годин, розчин виливали в льодяну воду, потім екстрагували етилацетатом, органічну фазу промивали водою та сушили сульфатом магнію і випарювали розчинник під зниженим тиском, очищали залишок хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану та етилацетату Продукт перекристалізовували з пропан-2-олу, отримавши 2,3г твердого продукту з т п л 181-182°С Приклад 9 (сполука 98) 6-флуор-9-метил-1-оксо-2-феніл-4-(піролідин1 ілкарбоніл)-2,9-дипдро-1 Н-піридо[3,4-Ь]шдол-1 -он Розчин 3,2г (Юммоль) 6-флуор-9-метил-1оксо-2-феніл-2,9-дипдро-1Н-піридо[3,4-Ь]індол-4карбонової кислоти та 3,2г (20ммоль) N',Nкарбонілдммідазолу в 65мл N',Nдиметилформаміду перемішували протягом 4 годин при 60°С, потім при кімнатній температурі додавали 2,5г (ЗОммоль) піролідину і перемішували протягом ще 20 годин Розчин виливали у льодяну воду і екстрагували етилацетатом, органічну фазу промивали водою, сушили сульфатом магнію і випарювали розчинник під зниженим тиском Залишок очищали хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану та етилацетату Продукт перекристалізовували з пропан-2-олу, отримавши Зг (7,7ммоль) твердої сполуки з т пл 203205°С Приклад 10 (Сполука №122) 6-флуор-г\І,г\І,9-триметил-1-оксо-2-(піридин-2іл)-2,9-дипдро-1Н-піридо[3,4-Ь]шдол-4-карбоксамід 10 1 Метил[6-флуор-9-метил-1 -оксо-2(піридин-2-іл)-2,9-дипдро-1Н-піридо[3,4-Ь]шдол-4карбоксилат Суміш 4,1г (12,2ммоль) метил [2(етоксикарбоніл)-5-флуор-а(диметиламінометиліден)-ІН-шдол-З-ацетату] та 1,73г (18,4ммоль) 2-амшопіридину гріли при 180°С протягом ЗО хвилин, додавали 7мл N',Nдиметилформаміду і гріли ще протягом 4 годин Суміш охолоджували та виливали у воду та етилацетат Нерозчинний матеріал відфільтровували та сушили під зниженим тиском, отримавши 1,8г (5,1ммоль) твердого продукту, який використали в наступній стадії 10 2 6-флуор-9-метил-1 -оксо-2-(піридин-2-іл)2,9-дипдро-1 Н-піридо[3,4-Ь]шдол-4-карбонова кислота Розчин 3,3г (9,4ммоль) метил [6-флуор-9 20 метил-1 -оксо-2-(піридин-2-іл)-2,9-дипдро-1 Нпіридо[3,4-Ь]шдол-4-карбоксилату в суміші ЮОмл води та 28 мл 1Н гідроксиду натрію гріли під зворотним холодильником протягом 4 годин, випарювали розчинник під зниженим тиском, додавали воду, підкислювали концентрованою пдрохлоридною кислотою, осад відфільтровували, промивали водою та сушили під зниженим тиском, отримавши 2,8г (8,3ммоль) твердого продукту, який використали в наступній стадії 10 3 6-флуор-г\І,г\І,9-триметил-1-оксо-2(піридин-2-іл)-2,9-дипдро-1Н-піридо[3,4-Ь]шдол-4карбоксамід Розчин 2,5г (7,4ммоль) 6-флуор-9-метил-1оксо-2-(піридин-2-іл)-2,9-дипдро-1Н-піридо[3,4Ь]шдол-4-карбоновоі кислоти та 2,4г (14,8ммоль) г\Г,г\І-карбонілдіімідазолу в 65мл N',Nдиметилформаміду перемішували протягом 4 годин, охолоджували суміш і додавали великий надлишок зрідженого диметиламіну, потім при кімнатній температурі перемішували протягом 48 годин і виливали у воду та екстрагували етилацетатом, органічну фазу ВІДДІЛЯЛИ, промивали водою та сушили сульфатом магнію, випарювали розчинник під зниженим тиском і залишок очищали етилацетату і перекристалізовували з етилацетату отримавши 1,6г (4,4ммоль) твердого продукту з т пл 220-221 °С Приклад 11 (Сполука №125) 6-флуор-9-метил-2-(5-метил-1,3,4-тіадіазол-2іл)-4-(піролідин-1 -ілкарбоніл)-2,9-дипдро-1 Нпіридо[3,4-Ь]шдол-1-он 111 2-карбокси-5-флуор-1 Н-шдол-3-оцтова кислота Розчин 26,5г (ЮЗммоль) етил[2(етоксикарбоніл)-5-флуор-1Н-шдол-3-ацетату] та 24г гідроксиду натрію в 530мл етанолу та ЮОмл води гріли під зворотним холодильником, суміш концентрували під зниженим тиском, додавали воду, промивали етилацетатом, водну фазу підкислювали концентрованою пдрохлоридною кислотою, осад відфільтровували, промивали водою та сушили під зниженим тиском Отримали 23,4г (98,7ммоль) твердого продукту, який використали в наступній стадії 11 2 6-флуор-1,3,4,9-тетрапдропірано[3,4Ь]індол-1,3-дюн Розчин 4,7г (19,8ммоль) 2-(етоксикарбоніл)-5флуор-1Н-шдол-3-оцтовоі кислоти в 94мл ацетилхлориду гріли під зворотним холодильником протягом 5 годин, концентрували під зниженим тиском, додавали толуол і випарювали розчинник під зниженим тиском, отримавши 4,5г твердого продукту, який використали в наступній стадії 113 5-флуор-3-(2-оксо-2-(піролідин-1-іл)етил)1Н-шдол-2-карбонова кислота Розчин 4,4г (20ммоль) 6-флуор-1,3,4,9тетрапдропірано[3,4-Ь]індол-1,3-дюн та, 8,3мл (ЮОммоль) піролідину в ЮОмл дихлорметану перемішували при кімнатній температурі протягом 24 годин, суміш концентрували під зниженим тиском, додавали воду, водну фазу промивали етилацетатом, підкислювали концентрованою пдрохлоридною кислотою і додавали етилацетат, осад відфільтровували, промивали водою та сушили під зниженим тиском Отримали 23,4г (98,7ммоль) 21 57037 22 твердого продукту, який використали в наступній лол і випарювали розчинник під зниженим тиском, стадії отримавши 4г залишку, що містив приблизно 50% 114 Метил[5-флуор-3-(2-оксо-2-(піролідин-1 бажаного продукту (за даними ПМР), який викориіл)етил)-1Н-шдол-2-карбоксилат] 3,8мл (51ммоль) стали в наступній стадії тюнілхлориду краплями додали до розчину 5г 11 6 6-флуор-9-метил-2-(5-метил-1,3,4(17,2ммоль) 5-флуор-3-(2-оксо-2-(піролідин-1тіадіазол-2-іл)-4-(піролідин-1 -ілкарбоніл)-2,9іл)етил)-1Н-шдол-2-карбоновоі кислоти в 50мл дипдро-1Н-піридо[3,4-Ь]шдол-1-он охолодженого на льодяній бані метанолу і гріли Розчин 4г отриманого на попередній стадії запід зворотним холодильником протягом 3, суміш лишку та метил [3-(1-диметиламшометиліден-2концентрували під зниженим тиском, додавали оксо-2-(піролідин-1 -іл)етил)-5-флуор-1 -метил-1 Нводу та дихлорметан, органічну фазу промивали шдол-2-карбоксилату] та 1,04г (5,5ммоль) моногідводою та сушили сульфатом магнію, випарювали рату 4-метилбензолсульфоновоі кислоти в 40мл розчинник під зниженим тиском і отримали 4,5г N.N-диметилформаміду перемішували 15 хвилин і (14ммоль) продукту, який використали в наступній додавали 0,65г (6,4ммоль) 2-амшо-5-метил-1,3,4стадії тіадіазолу, гріли під зворотним холодильником протягом 24 годин, виливали у воду та етилаце115 Метил[3-(1-диметиламшометиліден-2тат, осад відфільтровували, промивали водою, оксо-2-(піролідин-1-іл)етил)-5-флуор-1 -метил- 1Нсушили під зниженим тиском та перекристалізовушдол-2-карбоксилат] вали з N.N-диметилформаміду, отримавши 1г Розчин 3,4г метил [5-флуор-3-(2-оксо-2(2,4ммоль) продукту з т пл 299-301 °С (піролідин-1-іл)етил)-1Н-шдол-2-карбоксилату] та 4,66мл (35ммоль) диметилацеталю диметилфорХімічну структуру та фізичні властивості кільмаміду в 34мл N.N-диметилформаміду гріли під кох сполук згідно з винаходом наведено в наступзворотним холодильником протягом ЗО годин, конній таблиці центрували під зниженим тиском та додавали ксиТаблиця Но X R, 1 н M e 2 н 3 HR3R4 3-4 Pr NHHe / 150-1S2 Не Pr NHe 2 / 342-144 н Рг Pr NMe2 / 125-126 4 н Me PhCHj SEE 2 / 10-7-109 5 н Не PhCH2 NMe2 / 162-163 6 н РГ PtiCH2 / 17В-ІН0 ? н Me 4-MeO-PhCH2 / 149-150 В к Не 4-F-PhCH 2 ! 172- і 74 9 н Me PhCKjCH2 HWe2 I 138-139 10 н Me 4-Cl-PhCH 3 ЫМе2 I 16S-U0 11 н Et E>hCH2 HMe2 / 172-174 NHe2 23 24 57037 So. X 1 H Me 2~MeO-PhCH2 NMe 2 1 H Me 3-MeO-PhCHj NMe, 14 H He 2~МЄ-РЬСНг 15 H Me 16 H 17 ; 3-4 a*. / 162-163, / 3^9-140 НМЄ; / 154 3-Me-PhCHj NM« 2 / 137-13Э Et 1-MeO-PhCH 3 NM 6 , / 149 H Me 4-Me~PSiOI 2 NMe, / isa-jtss 1Є H He PMCH^ NMe 3 / 1 1 8 - 120 19 5-F Me PhCH, MMe2 / 195,-196 20 6-F Me PhCH a NMe 2 / І9S 21 7-F Me PhCH 2 NMe, / 195-196 22 B-P Me PhCH, NMe 3 / 188-190 23 6-MeO Me PhCH3 NMe 2 / 161-182 24 •j-MeO Me PhCH 3 NMe 3 / 208-210 25 6 СІ Me PhCH, ЫИе 2 / 200-210 26 7-Cl Me PhCH* me3 / 209-210 27 a-ci Me PhCH 3 / 218-219 28 6-Me Me PhCHj / 209-210 т.пя.(-с) Ко NHez . 156 1^0 186 X Hi a* 3-4 2 7-Me Me PhCHj / 1 8-Me Me Риси, ымег J 6-F Me PiiCHj NBt2 / 120-121 3 Ь-F Me PhCHг ЫРг2 / 156-157 n 6-F Et 2-M«O-PhCHa NMe 2 / 136-137 203-205 204-205 34 6-F Me PhCH, NHMe / 205-20Й 35 6-F Et PhCH, «M«a / 206-207 36 6-СЇ Me МеО(СИ2)2 NMe 2 217-219 37 6-F Me PhCH 2 NH-, 259-260 3B 6-F Me 2-Pyridyi-CHj HMe a / 1В6-1Є9 33 S-F Me 2-Thienyl-CH, НМе г / 191-1ЭЗ 40 fi-F Me 3-Pyridyl-CHj ММ Є ї 41 6-F Me / 209-211 42 6-F Me PhCH, Piperi^ / -205-2O6 43 6-p Me PhCH 2 Pyrrolid / 228-229 44 H Pr Pr // 107-108 45 H Me PhCHj // 130-131 ЫМеэ m S 2 HMe 2 200-2O2 25 57037 26 He. X 41 H Pc PhCHj. ым е , 4' H Me 4-MeO-PhCHj Шег 46 Я Me 4 - F - PhCH j 49 H Me 5 H a 5 H 5 3- т.пл. (>c) // 160-162 // 98-100 NMe5 // 1(35-106 4-Cl-PhCH3 нме2 // І 03-1,04 PhCH, NMes // І6Є Me 2-MeO-PhCHj NM6, // 17 1-173 H Me 3-MeO-phCH 3 NMe, // 166-170 5 к Me 3-Me,-PhCH, NMe2 // 1П-ЦВ 54 H Et 4-MeO-PhCHj NMe3 55 H Me 2-Me-PhCHj и 11 I57-JS6 56 H Me fl Me PhCH2 ЫМег // W-W 8-Me Me PhCH, NMe 2 // 168-169 69 6-F Et РИСИ; // 216-21? 70 6-СЇ Me MeO- (CH 2 3i // 179-ЇЄ0 71 6-F Me 2-Pyridyl-CHa // 221-223 72 6-F Me 2-Thieriyl-CH2 // 164-165 73 6-F Me с й н п сн 3 ние 2 // 170-172 74 6-F Bt 2-MeO-PhCH2 ше, // 199-200 75 6-F Me 3-Pyridyl-CH2 // 172~' 175 6-P Me PhCH, 204-205 6-V Me И H PhCH, Pc NHMe H H Pr NMfi, / / / I 76 77 78 79 NHGT NMe i «Ме г . 199-202 2Ї5-217 202-204 27 57037 Ко X в, Є0 Н Н РГ в1 Н и PC а2 Н н 8з": н 28 3220-222 NHCHjPh / 226-230 РГ NMe2 1! 244-2-47 н Ph Шег It 292-294 н PhCH t NMe^ it 29b-3O4 и а4 1 / РЬСЯ г NMet I 320-32Z (,-? е 8> H>0 es И н PhCH 2 NMe, // 268-269 е 6-F » Me ыИеа 11 >зо6 90 6-F и IP* ымег N 264-265 91 6-С1 н PhCH 2 нме 2 11 >30O 92 6-МеО я PhCH, NMe2 II >30O 93 6-М* н PhCH, «м Є 4 if 267-268 94 6-F н Ph ММе э II 295-297 d 95 6-F U Ph НИЄ, I 300 d 96 6-Р Z Thienyl-CHj, ЫМе г II 318-Э20 KRjR, 3-4 • Но д ™»-M 97 Н в» M e 98 6-F M e Ph I'y t r o 1 і d II 203 20S 99 6-F M e 3 rhienyl-CH 3 NMe, 1 196-19? 100 6-F M e J-Th.wyi-CH, HMe 2 II 172-174 101 '6-F He Ph ЫМе 2 П 19S-137 102 ее M e Ph Ше 2 1 213-215 103 6-F Et Ph НМе : II 210-212 104 6-F Ми 2-F-Ph ым ез II 235-237 105 6-Г Me 4-F-Ph NMea II 214-215 106 6-СІ Me Ph ЫКе г II 195-196 107 &-? Me 4-Me-Pll Меэ II 252-254 10Й 6-Me Me Ph II І92-193 109 Н Me Ph ММИ] II 205-207 ПО 6-F Me E'h NHCH.Ph II 243-244 1І1 6-F Me Ph NHMe 11 294-296 112 6-F Me 3-F-Ph кме2 II 199-202 113 6F Me 3-Cl-Ph НМе, II iefi-ue Ph ЫМе2 I М 196-197 1 29 57037 ЗО IIS 254-255 17Ц Nft, 180 і 6-1 !«S 172 174 Э02 6 Г Э-НО p y r r o l i d 201 ft F 3 EtO p y r r o l i t 109 140 6 F 220 221 Є F 2 PyrtdyJ 18І Me t h l a d l a z Ph Ph Й Cl (> P tyir , 20S slid 299 301 Pyjrrr i b d 172 174 Pyrr ] К 104 210 Pyrr< lid 24fl 2Ы) 230 He ox a z o l 2Ї1 6 Г ПО] 103 203 6 F Іі j 172 Д73 , — No X "i Яг !%*« 3-4 TIM. (°С) 13 6-F PhCH 2 Ph Ыме2 It 201 203 132 6-F Me Ph N(Me)CH2Ph 11 i$A b-F Me 3,-Napht 135 6-F Me 2-Napfrfc 136 6 - F Me Ph 137 6-F Me Ph, N
ДивитисяДодаткова інформація
Назва патенту англійською1h-pyrido[3,4-b]indol-4-carboxamide derivatives, their application and use in therapy
Автори англійськоюEvanno Yannick, Maloizel Christian
Назва патенту російськоюПроизводные 1н-пиридо[3,4-b]индол-4-карбоксамида, их изготовление и применение в терапии
Автори російськоюЭванно Янник, Малуазель Кристиан
МПК / Мітки
МПК: C07D 471/04, A61P 25/00, A61P 25/20, A61K 31/437, A61P 25/08, A61P 25/22
Мітки: 1н-піридо[3,4-b]індол-4-карбоксаміду, фармацевтична, композиція, похідні
Код посилання
<a href="https://ua.patents.su/17-57037-pokhidni-1n-pirido34-bindol-4-karboksamidu-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні 1н-піридо[3,4-b]індол-4-карбоксаміду та фармацевтична композиція</a>
Попередній патент: Чіп-модуль, зокрема для монтажу у корпусі чіп-картки
Наступний патент: Пристрій для дозованої подачі дрібнозернистого матеріалу в реакційну ємність і спосіб експлуатації цього пристрою та пристрій для отримання розплаву металу
Випадковий патент: Спосіб контролю розповсюдження побутових лускокрилих комах