Похідні індолу або бензимідазолу для модуляції ikb-кінази
Формула / Реферат
1. Сполука формули І
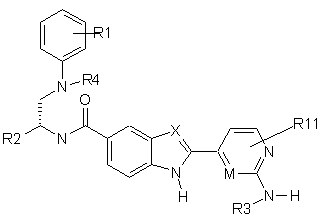 , (І)
, (І)
і/або стереоізомерна форма сполуки формули І, і/або фізіологічно сумісна сіль сполуки формули І, причому
Х і М є однаковими або різними і, незалежно один від одного, означають атом N або СН,
R1 і R11 є однаковими або різними і, незалежно один від одного, означають
1. атом водню,
2. F, Сl, J або Вr,
3. -(С1-С4)-алкіл,
4. -CN,
5. -СF3,
6. -OR5, де R5 означає атом водню або -(С1-С4)-алкіл,
7. -N(R5)-R6, де R5 і R6, незалежно один від одного, означають атом водню або -(С1-С4)-алкіл,
8. -C(О)-R5, де R5 означає атом водню або -(С1-С4)-алкіл, або
9. -S(О)x-R5, де х означає ціле число нуль, 1 або 2, і R5 означає атом водню або -(С1-С4)-алкіл,
R2 означає
1. гетероарильний залишок з групи, що включає 3-гідроксипіро-2,4-діон, імідазол, імідазолідин, імідазолін, індазол, ізотіазол, ізотіазолідин, ізоксазол, 2-ізоксазолідин, ізоксазолідин, ізоксазолон, морфолін, оксазол, 1,3,4-оксадіазол, оксадіазолідиндіон, оксадіазолон, 1,2,3,5-оксатіадіазол-2-оксид, 5-оксо-4,5-дигідро-[1,3,4]оксадіазол, 5-оксо-1,2,4-тіадіазол, піперазин, піразин, піразол, піразолін, піразолідин, піридазин, піримідин, тетразол, тіадіазол, тіазол, тіоморфолін, триазол або триазолон, і гетероарильний залишок є незаміщеним або, незалежно один від одного, одно-, дво- або трикратно заміщеним
1.1. -C(О)-R5, де R5 означає атом водню або -(С1-С4)-алкіл,
1.2. -(С1-С4)-алкілом,
1.3. -О-R5, де R5 означає атом водню або -(С1-С4)-алкіл,
1.4. -N(R5)-R6, де R5 і R6, незалежно один від одного, означають атом водню або -(С1-С4)-алкіл,
1.5. галогеном,
1.6. кето-залишком,
2. -C(О)-R5, де R5 означає атом водню або -(С1-С4)-алкіл,
3. -C(О)-OR5, де R5 означає атом водню або -(С1-С4)-алкіл, або
4. -C(O)-N(R7)-R8, де R7 і R8, незалежно один від одного, означають атом водню, -(С1-С4)-алкіл-ОН, -O-(С1-С4)-алкіл або -(С1-С4)-алкіл,
R3 означає атом водню або -(С1-С4)-алкіл, R4 означає
1. гетероарильний залишок з групи, що включає пірол, фуран, тіофен, імідазол, піразол, оксазол, ізоксазол, тіазол, ізотіазол, тетразол, 1,2,3,5-оксатіадіазол-2-оксиди, триазолони, оксадіазолон, ізоксазолон, оксадіазолідиндіон, триазол, 3-гідроксипіро-2,4-діони, 5-оксо-1,2,4-тіадіазоли, піридин, піразин, піримідин, індол, ізоіндол, індазол, фталазин, хінолін, ізохінолін, хіноксалін, хіназолін, цинолін, ![]() -карболін і бензанельовані циклопента- або циклогексапохідні цих гетероарильних залишків, причому гетероарильний залишок незаміщений або одно-, дво- або трикратно заміщений, незалежно один від одного, -(С1-С5)-алкілом, -(С1-С5)-алкокси, галогеном, нітро, аміно, трифторметилом, гідроксилом, гідроксі-(С1-С4)-алкілом, метилендіокси, етилендіокси, формілом, ацетилом, ціано, гідроксикарбонілом, амінокарбонілом або -(С1-С4)-алкоксикарбонілом, або
-карболін і бензанельовані циклопента- або циклогексапохідні цих гетероарильних залишків, причому гетероарильний залишок незаміщений або одно-, дво- або трикратно заміщений, незалежно один від одного, -(С1-С5)-алкілом, -(С1-С5)-алкокси, галогеном, нітро, аміно, трифторметилом, гідроксилом, гідроксі-(С1-С4)-алкілом, метилендіокси, етилендіокси, формілом, ацетилом, ціано, гідроксикарбонілом, амінокарбонілом або -(С1-С4)-алкоксикарбонілом, або
2. арильний залишок з групи, що включає феніл, нафтил, 1-нафтил, 2-нафтил, біфеніліл, 2-біфеніліл, 3-біфеніліл і 4-біфеніліл, антрил або флуореніл, і арильний залишок незаміщений або одно-, дво- або трикратно заміщений, незалежно один від одного, -(С1-С5)-алкілом, -(С1-С5)-алкокси, галогеном, нітро, аміно, трифторметилом, гідроксилом, гідроксі-(С1-С4)-алкілом, метилендіокси, етилендіокси, формілом, ацетилом, ціано, гідроксикарбонілом, амінокарбонілом або -(С1-С4)-алкоксикарбонілом.
2. Сполука формули І за п. 1, де
X і М є однаковими або різними, і, незалежно один від одного, означають атом N або СН,
R1 і R11 є однаковими або різними, і, незалежно один від одного, означають
1. атом водню,
2. F, Сl, J або Вr,
3. -(С1-С4)-алкіл,
4. -CN,
5. -СF3,
6. -OR5, де R5 означає атом водню або -(С1-С4)-алкіл,
7. -N(R5)-R6, де R5 і R6, незалежно один від одного, означають атом водню або -(С1-С4)-алкіл,
8. -C(О)-R5, де R5 означає атом водню або -(С1-С4)-алкіл, або
9. -S(О)x-R5, де х означає ціле число нуль, 1 або 2, і R5 означає атом водню або -(С1-С4)-алкіл,
R2 означає
1. гетероарильний залишок з групи, що включає імідазол, ізотіазол, ізоксазол, 2-ізоксазолідин, ізоксазолідин, ізоксазолон, 1,3,4-оксадіазол, оксадіазолідиндіон, 1,2,3,5-оксадіазолон, оксазол, 5-оксо-4,5-дигідро-[1,3,4]оксадіазол, тетразол, тіадіазол, тіазол, триазол або триазолон, і гетероарильний залишок є незаміщеним або, незалежно один від одного, одно-, дво- або трикратно заміщеним
1.1. кето-залишком,
1.2. F, Cl, J aбo Br, aбo
1.3. -(С1-С2)-алкілом, або
2. -C(O)-N(R7)-R8, де R7 і R8, незалежно один від одного, означають атом водню, -(С1-С4)-алкіл-ОН, -O-(С1-С4)-алкіл або -(С1-С4)-алкіл,
R3 означає атом водню, метил або етил,
R4 означає
1. гетероарильний залишок з групи ненасичених, частково насичених або повністю насичених циклів, утворених з піридину, піразину, піримідину, піридазину, піролу, фурану, тіофену, імідазолу, піразолу, оксазолу, ізоксазолу, тіазолу, триазолу або ізотіазолу, причому гетероарильний залишок незаміщений або одно-, дво- або трикратно заміщений, незалежно один від одного, -(С1-С4)-алкілом, -(С1-С4)-алкокси, F, Сl, J, Вr, нітро, аміно, трифторметилом, гідроксилом, гідроксі-(С1-С4)-алкілом, метилендіокси, етилендіокси, формілом, ацетилом, ціано, гідроксикарбонілом, амінокарбонілом або -(С1-С4)-алкоксикарбонілом, або
2. феніл, і феніл незаміщений або одно-, дво- або трикратно заміщений, незалежно один від одного, F, Сl, J, Вr, СF3, -ОН, (С1-С4)-алкілом або -(С1-С4)-алкокси.
3. Сполука формули І за пп. 1 або 2, що являє собою:
[(S)-2-дифеніламіно-1-(5-оксо-4,5-дигідро-[1,3,4]оксадіазол-2-іл)-етил]-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
{1-карбамоїл-2-[(4-фторфеніл)-піридин-2-іламіно]-етил}-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
[(S)-1-(5-оксо-4,5-дигідро-1,3,4-оксадіазол-2-іл)-2-(фенілпіридин-2-іламіно)-етил]-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
{1-карбамоїл-2-[(4-фторфеніл)-піридин-2-іламіно]-етил}-амід 2-(2-амінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
[2-[(4-фторфеніл)-піридин-2-іламіно]-1-(4Н-[1,2,4]триазол-3-іл)-етил]-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
[1-карбамоїл-2-(фенілтіазол-2-іламіно)-етил]-амід (S)-2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
[1-метоксикарбамоїл-2-(фенілпіридин-2-іламіно)-етил]-амід (S)-2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
{1-карбамоїл-2-[(феніл)-піридин-2-іламіно]-етил}-амід 2-(2-амінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
{1-карбамоїл-2-[(феніл)-піримідил-2-іламіно]-етил}-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
[1-(2-гідроксіетилкарбамоїл)-2-(фенілпіримідин-2-іламіно)-етил]-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
(S)-2-{[2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбоніл]-аміно}-3-[феніл-(4-трифторметилпіримідин-2-іл)-аміно]пропіонову кислоту,
{1-карбамоїл-2-[(4-фторфеніл)-(5-метилпіримідин-2-іл)-аміно]-етил}-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти,
((S)-1-карбамоїл-2-дифеніламіноетил)-амід 2-(2-метиламінопіримідин-4-іл)-1Н-бензоімідазол-5-карбонової кислоти,
{1-карбамоїл-2-[(феніл)-піримідил-2-іламіно]-етил}-амід 2-(2-метиламінопіримідин-4-іл)-1Н-бензимідазол-5-карбонової кислоти або
{1-карбамоїл-2-[(феніл)-піридил-2-іламіно]-етил}-амід 2-(2-метиламінопіримідин-4-іл)-1Н-бензимідазол-5-карбонової кислоти.
4. Спосіб отримання сполуки формули І за будь-яким з пп. 1-3, який відрізняється тим, що
а) сполуку формули IV
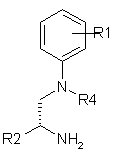 , (IV)
, (IV)
де R1, R2 і R4 визначені як в формулі І, піддають взаємодії з хлорангідридом або активованим складним ефіром сполуки формули III
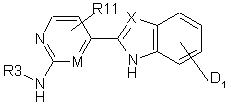 , (III)
, (III)
причому D1 означає -СООН, і R11, X, М і R3 визначені як в формулі І, в присутності основи або, у разі необхідності, зневоднювального засобу в розчині, і переводять в сполуку формули І,
b) сполуку формули І, отриману за способом а), внаслідок своєї хімічної структури існуючу в енантіомерних формах, розділяють шляхом солеутворення з енантіомерно чистими кислотами або основами, хроматографією на хіральних стаціонарних фазах або перетворенням за допомогою хіральних енантіомерно чистих сполук як амінокислоти, відділенням отриманих таким чином діастереомерів, і відщепленням хіральних допоміжних груп в чисті енантіомери, або
c) сполуку формули І, отриману за способом а) або b), виділяють або у вільній формі, або, у разі наявності кислотних або основних груп, переводять в фізіологічно сумісні солі.
5. Лікарський засіб, який відрізняється тим, що містить ефективну кількість щонайменше однієї сполуки формули І і/або однієї фізіологічно сумісної солі сполуки формули І, і/або, у разі необхідності, однієї стереоізомерної форми сполуки формули І разом з фармацевтично придатним і фізіологічно сумісним носієм, домішкою і/або іншими біологічно активними і допоміжними речовинами.
6. Застосування сполуки формули І за будь-яким з пп. 1-3 для отримання лікарського засобу для профілактики і лікування всіх захворювань, перебіг яких пов'язаний з підвищеною активністю ІкВ-кінази.
7. Застосування за п. 6, яке відрізняється тим, що захворювання являють собою хронічні захворювання рухового апарату такі, як запальні, зумовлені обміном речовин або імунологічні гострі і хронічні артрити, артропатії, ревматоїдний артрит, або дегенеративні захворювання суглобів такі, як остеоартрози, спондильози, діабет типу II, захворювання запаленого кишечнику, атрофія хряща після травми суглоба або тривалого положення спокою суглоба після ушкодження меніска або колінної чашечки, або розривів зв'язок, або захворювання з'єднувальної тканини такі, як колагенози і періодонтальні захворювання, міалгії і порушення обміну речовин кістки, або захворювання, зумовлені надекспресією фактора некрозу пухлини альфа ![]() або підвищеною концентрацією
або підвищеною концентрацією ![]() , такі, як виснаження, розсіяний склероз, черепно-мозкова травма, хвороба Крона і виразки кишечнику, або захворювання такі, як атеросклероз, стенози, ульцерація, хвороба Альцгеймера, дисиміляція м'язів, ракові захворювання, інфаркт міокарда, подагра, сепсис, септичний шок, ендотоксичний шок, вірусні інфекції такі, як грип, гепатит, тяжкі вірусні інфекції (HIV-інфекції), СНІД, або захворювання, викликані аденовірусами або герпесвірусами, паразитарні інфекції такі, як малярія або лепра, грибкові або дріжджові інфекції, запалення мозкових оболонок, хронічні запальні легеневі захворювання такі, як хронічний бронхіт або астма, гострі респіраторні дистресові синдроми, гострий синовіт, туберкульоз, псоріаз, діабет, гострі або хронічні реакції відторгнення органом реципієнта трансплантованого органа, хронічні захворювання "трансплантат проти хазяїна" і запальні захворювання судин.
, такі, як виснаження, розсіяний склероз, черепно-мозкова травма, хвороба Крона і виразки кишечнику, або захворювання такі, як атеросклероз, стенози, ульцерація, хвороба Альцгеймера, дисиміляція м'язів, ракові захворювання, інфаркт міокарда, подагра, сепсис, септичний шок, ендотоксичний шок, вірусні інфекції такі, як грип, гепатит, тяжкі вірусні інфекції (HIV-інфекції), СНІД, або захворювання, викликані аденовірусами або герпесвірусами, паразитарні інфекції такі, як малярія або лепра, грибкові або дріжджові інфекції, запалення мозкових оболонок, хронічні запальні легеневі захворювання такі, як хронічний бронхіт або астма, гострі респіраторні дистресові синдроми, гострий синовіт, туберкульоз, псоріаз, діабет, гострі або хронічні реакції відторгнення органом реципієнта трансплантованого органа, хронічні захворювання "трансплантат проти хазяїна" і запальні захворювання судин.
Текст
Винахід стосується похідних індолу або бензімідазолу, які інгібують ІкВ-кіназу, способу їх о тримання і їх застосування як лікарських засобів. У [заявці WO 94/12478] серед інших описуються похідні індолу, які інгібують агрегацію тромбоцитів. У [заявках WO 01/00610 і WO 01/30774] описуються похідні індолу і бензімідазолу, які можуть модулювати NFkB. NFkB є гетеродимерним фактором транскрипції, який може активувати велике число генів, що кодують, серед інших, передзапальні цитокіни, такі як IL-1, IL-2, TNFa або IL-6. NFkB знаходиться в цитозолі клітин, утворюючи комплекс з його інгібітором ІкВ, що зустрічається в природі. Стимуляція клітин, наприклад, за допомогою цитокінів, призводить до фосфорилювання і подальшого протеолітичного розщеплення ІкВ. Це протеолітичне розщеплення веде до активації NFkB, який потім переходить в ядро клітини і там активує множину передзапальних генів. При захворюваннях таких, як ревматичний артрит (при запаленні), остеоартрит, астма, інфаркт міокарда, хвороби Альцгеймера, діабету типу II, запальні захворювання кишечнику "inflammatory bowel disease" або артеріосклероз, NFkB є активізованим понад нормальної міри. Гальмування NFkB застосовується також при лікуванні раку, оскільки воно використовується в цьому випадку саме по собі або для посилення цитостатичного лікування. Було показано, що лікарські засоби, такі як глкжокортикоїди, саліцилати або солі золота, які використовуються при лікуванні ревматизму, інгібуюче вбудовуються в різні сайти сигнального ланцюга, що активує NFkB, або безпосередньо інтерферують з транскрипцією генів. Першим етапом в названих сигнальних каскадах є розщеплення ІкВ. Це фосфорилювання регулюється специфічною ІкВ-кіназою. Досі не відомі інгібітори, які інгібують специфічну ІкВ-кіназу. Недоліком відомих інгібіторів ІкВ-кінази часто є недостатня специфічність інгібування тільки одного класу кіназ. Наприклад, більшість інгібіторів ІкВ-кінази гальмують одночасно декілька різних кіназ, оскільки каталітичні домени цих кіназ мають схожу стр уктур у. Внаслідок цього інгібітори небажаним чином впливають на багато які ферменти, також на ферменти з життєвою функцією. У [заявці WO 01/30774] вже були описані похідні індолу, які можуть модулювати NFkB і надають сильної інгібуючої дії на ІкВ-кіназу. Сполуки, описані в [заявці WO 01/30774], які приведені в прикладах, однак надають сильної гальмуючої дії також на інші кінази такі, як сАМР-залежну протеїнкіназу, протеїнкіназу С або казеїнкіназу II. Однак деякі ці похідні індолу при поліпшенні специфічності виявляють знижене інгібування ІкВкінази. Далі, рівень плазми крові, що досягається за допомогою сполук, описаних в [заявці WO 01/30774], не достатній для орального введення цих похідних. При пошуку ефективних сполук для лікування ревматичного артриту (при запаленні), остеоартриту, астми, інфаркту міокарда, хвороб Альцгеймера, ракових захворювань (потенціювання цитотоксичної терапії) або артеріосклерозу, було виявлено, що похідні індолу і бензімідазолу згідно з винаходом не мають вищеназваних недоліків. Похідні індолу і бензімідазолу згідно з винаходом є сильними інгібіторами ІкВ-кінази, при цьому дуже селективно інгібують кінази і характеризуються високим рівнем плазми крові після орального введення. Таким чином, винахід стосується сполуки формули І і/або стереоізомерної форми сполуки формули І, і/або фізіологічно сумісної солі сполуки формули І, причому X і М є однаковими або різними і незалежно один від одного означають атом N або СН, R1 і R11 є однаковими або різними і незалежно один від одного означають 1. атом водню, 2. F, СІ, J або Вг, 3. -(С1-С4)-алкіл, 4. -CN, 5. -CF3, 6. -OR 5, де R 5 означає атом водню або -(С1-С4)-алкіл, 7. -N(R5)-R6, де R5 і R 6 незалежно один від одного означають атом водню або -(С1-С4)-алкіл, 8. -C(O)-R5, де R5 означає атом водню або -(С1-С4)-алкіл, або 9. -S(O)X-R5, де х означає ціле число нуль, 1 або 2, і R5 означає атом водню або -(С1-С4)-алкіл, R2 означає 1. гетероарильний залишок з групи, що включає 3-гідроксипіро-2,4-діон, імідазол, імідазолідин, імідазолін, індазол, ізотіазол, ізотіазолідин, ізоксазол, 2-ізоксазолідин, ізоксазолідин, ізоксазолон, морфолін, оксазол, 1,3,4-оксадіазол, оксадіазолідиндіон, оксадіазолон, 1,2,3,5-оксатіадіазол~2-оксид, 5-оксо-4,5-дигідро-[ 1,3,4]оксадіазол, 5-оксо-1,2,4-тіадіазол, піперазин, піразин, піразол, піразолін, піразолідин, піридазин, піримідин, тетразол, тіадіазол, тіазол, тіоморфолін, триазол або триазолон, і гетероарильний залишок є незаміщеним або, незалежно один від одного, одно-, дво- або трикратно заміщеним 1.1. -C(O)-R5, де R5 означає атом водню або -(С1-С4)-алкіл, 1.2. -(С1-С4)-алкілом, 1.3. -O-R 5, де R5 означає атом водню або -(С1-С4)-алкіл, 1.4. -N(R 5)-R6, де R5 і R 6 незалежно один від одного означають атом водню або -(С1-С4)-алкіл, 1.5. галогеном, 1.6. кето-залишком, 2. -C(O)-R5, де R5 означає атом водню або -(С1-С4)-алкіл, 3. -C(O)-OR 5, де R 5 означає атом водню або -(С1-С4)-алкіл, або 4. -C(O)-N(R )-R , де R і R незалежно один від одного означають атом водню, -(С1-С4)-алкіл-ОН, -О-(С1-С4)алкіл або -(С1-С4)-алкіл, R3 означає атом водню або -(С1-С4)-алкіл, R4 означає 1. Гетероарильний залишок з групи, що включає пірол, фуран, тіофен, імідазол, піразол, оксазол, ізоксазол, тіазол, ізотіазол, тетразол, 1,2,3,5-оксатіадіазол-2-оксиди, триазолони, оксадіазолон, ізоксазолон, оксадіазолідиндіон, триазол, 3-гідроксипіро-2,4-діони, 5-оксо-1,2,4-тіадіазоли, піридин, піразин, піримідин, індол, ізоіндол, індазол, фталазин, хінолін, ізохінолін, хіноксалін, хіназолін, цинолін, р-карболін і бензанельовані, циклопента- або циклогекса-похідні цих гетероарильних залишків, причому гетероарильний залишок незаміщений або одно-, дво- або трикратно заміщений, незалежно один від одного, -(С1-С5)-алкілом, (С1-С4)-алкокси, галогеном, нітро, аміно, трифторметилом, гідроксилом, гідроксі-(С1-С4)-алкілом, метилендіокси, етилендіокси, формілом, ацетилом, ціано, гідроксикарбонілом, амінокарбонілом або -(С1-С4)алкоксикарбонілом, або 2. Арильний залишок з групи, що включає феніл, нафтил, 1-нафтил, 2-нафтил, біфеніліл, 2-біфеніліл, 3біфеніліл і 4-біфеніліл, антрил або флуореніл, і арильний залишок незаміщений або одно-, дво- або трикратно заміщений, незалежно один від одного, -(С1-С4)-алкілом> -(С1-С5)-алкокси, галогеном, нітро, аміно, трифторметилом, гідроксилом, гідроксі-(С1-С4)-алкілом, метилендіокси, етилендіокси, формілом, ацетилом, ціано, гідроксикарбонілом, амінокарбонілом або -(С1-С4)-алкоксикарбонілом. Винахід стосується далі сполук формули І, причому X і М є однаковими або різними і незалежно один від одного означають атом N або СН, R1 і R11 визначені, як вказано вище в пунктах 1-9, R2 означає 1. Гетероарильний залишок з групи, що включає імідазол, ізотіазол, ізоксазол, 2-ізоксазолідин, ізоксазолідин, ізоксазолон, 1,3,4-оксадіазол, оксадіазолідиндіон, 1,2,3,5-оксадіазолон, оксазол, 5-оксо-4,5дигідро-[1,3,4]оксадіазол, тетразол, тіадіазол, тіазол, триазол або триазолон, і гетероарильний залишок є незаміщеним або, незалежно один від одного, одно-, дво- або трикратно заміщеним 1.1. кето-залишком, 1.2. галогеном або 1.3. -(С1С2)-алкілом, або 2. -C(O)-N(R )-R , де R і R, незалежно один від одного, означають атом водню, -(С1-С4)-алкіл-ОН, -О-(С1С4)-алкіл або -(С1-С4)-алкіл, R3 означає атом водню, метил або етил, R4 означає 1. Гетероарильний залишок з групи ненасичених, частково насичених або повністю насичених циклів, утворених з піридину, піразину, піримідину, піридазину, піролу, фурану, тіофену, імідазолу, піразолу, оксазолу, ізоксазолу, тіазолу, триазолу або ізотіазолу, причому гетероарильний залишок незаміщений або одно-, двоабо трикратно заміщений, незалежно один від одного, -(С1-С4)-алкілом, -(С1-С4)-алкокси, F, СІ, J, Вг, нітро, аміно, трифторметилом, гідроксилом, гідроксі-(С1-С4)-алкілом, метилендіокси, етилендіокси, формілом, ацетилом, ціано, гідроксикарбонілом, амінокарбонілом або -(С1-С4)-алкоксикарбонілом, або 2. Феніл, і феніл незаміщений або одно-, дво- або трикратно заміщений, незалежно один від одного, F, СІ, J, Br, CF 3, -OH, (С1-С4)-алкілом або -(С1-С4)-алкокси. Далі винахід стосується сполук: [(S)-2-дифеніламіно-1-(5-оксо-4,5-дигідро-[1,3,4]оксадіазол-2-іл)-етил]-амід 2-(2-метиламіно-піримідин-4іл)-1Н-індол-5-карбонової кислоти, {1-карбамоїл-2-[(4-фтор-феніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-метиламіно-тримідин-4-іл)-1Н-індол-5карбонової кислоти, [(S)-1-(5-оксо-4,5-дигідро-1,3,4-оксадіазол-2-іл)-2-(феніл-тридин-2-іл-аміно)-етил]-амід 2-(2-метиламінопіримідин-4-іл)- 1Н-індол-5-карбонової кислоти, {1-карбамоїл-2-[(4-фтор-феніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-аміно-піримідин-4~іл)-1Н-індол-5карбонової кислоти, [2-[(4-фтор-феніл)-піридин-2-іл-аміно]-1-(4Н-[1,2,4]триазол-3-іл)-етил]-амід 2-(2-метиламіно-піримідин-4-іл)1Н-індол-5-карбонової кислоти, [1-карбамоїл-2-(феніл-тіазол-2-іл-аміно)-етил]-амід (S)-2-(2-метиламіно-піримідин-4-іл)1H-індол-5карбонової кислоти, [1-метоксикарбамоїл-2-(феніл-піридин-2-іл-аміно)-етил]-амід (S)-2-(2-метиламіно-піримідин-4-іл)- 1Н-індол5-карбонової кислоти, {1-карбамоїл-2-[(феніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-аміно-піримідин-4-іл)-1Н-індол-5-карбонової кислоти, {1-карбамоїл-2-[(феніл)-піримідил-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)1Н-індол-5карбонової кислоти, [1-(2-гідроксі-етилкарбамоїл)-2-(феніл-піримідин-2-іл-аміно)-етил]-амід 2-(2-метиламіно-піримідин-4-іл)-1Ніндол-5-карбонової кислоти, (S)-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбоніл]-аміно}-3-[феніл-(4-трифторметил-пІримідин-2іл)-аміно]-пропіонова кислота, {1-карбамоїл-2-[(4-фтор-феніл)-(5-метил-піримідин-2-іл)-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл) 1Н-індол-5-карбонової кислоти, ((S)-1-карбамоїл-2-дифеніламіно-етил)-амід2-(2-метиламіно-шримідин-4-іл)-1H-бензоімідазол-5карбонової кислоти, {1-карбамоїл-2-[(феніл)-піримідин-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)-1H-бензімідазол5-карбонової кислоти або {1-карбамоїл-2-[(феніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-метиламіно- піримідин-4-іл)-1Н-бензоімідазол5-карбонової кислоти. Під поняттям «галоген» мають на увазі фтор, хлор, бром або йод. Під поняттями «-(С1-С5)-алкіл» або «(С1-С5)-алкокси» мають на увазі вуглеводневі залишки, вуглецеві ланцюги яких є нерозгалуженими або розгалуженими і містять від 1 до 5 атомів вуглецю, такі, як метил, етил, пропіл, н-бутил, пентил або трет.бутил. Під поняттям «гетероарильний залишок з групи ненасичених, частково насичених або повністю насичених циклів, утворених з піридину, піразину, піримідину, піридазину, піролу, фурану, тіофен у, імідазолу, піразолу, оксазолу, ізоксазолу, тіазолу, ізотіазолу» мають на увазі, наприклад, сполуки такі, як піперазин, піразолін, імідазолін, піразолідин, імідазолідин, тетрагідропіридин, ізоксазолін, ізоксазолідин, морфолін, ізотіазолін, ізотіазолідин, тетрагідро-1,4-тіазин або піперидин. Отримання сполук формули І здійснюють, наприклад, як описано в [заявках WO 01/00610 і WO 01/30774]. Вихідними речовини для хімічних перетворень є відомими або можуть бути легко отримані описаними в літературі способами. Далі винахід стосується способу отримання сполуки формули І і/або стереоізомерної форми сполуки формули ї, і/або фізіологічно сумісної солі сполуки формули І, яка відрізняється тим, що а) сполука формули IV, де R1, R2 і R4 визначені як в формулі І, піддають взаємодії з хлорангідридом або активованим складним ефіром сполуки формули III, причому D1 означає -СООН, і R11, X, М і R3 визначені як в формулі І, в присутності основи або, у разі необхідності, зневоднювального засобу в розчині, і переводять в сполуку формули І, b) сполука формули І, отримана за способом а), внаслідок своєї хімічної структури існуюче в енантіомерних формах, розділяють шляхом солеутворення з енантіомерно чистими кислотами або основами, хроматографією на хіральних стаціонарних фазах або перетворенням за допомогою хіральних енантіомерно чистих сполук таких, як амінокислоти, відділенням таким чином отриманих діастереомерів, і відщепленням хіральних допоміжних гр уп в чистих енантіомерах, або c) сполука формули І, отримана за способом а) або Ь), виділяють або у вільній формі, або, у випадку наявності кислотних або основних груп, переводять в фізіологічно сумісні солі. Отримання похідних індол- або бензімідазолкарбонових кислот здійснюється за методикою, описаною в ["Houben-Weyl Methoden der Org. Chemie", Band E6-2A або Е6-2В]. Так, для отримання похідних індол- або бензімідазолкарбонових кислот формули III переважно можуть зазнавати взаємодії гідразинобензойні кислоти і арил- або гетероарилкетони, в присутності поліфосфорної кислоти як розчинника при 145°С. Отримання необхідних гідразинобензойних кислот здійснюють відомими фахівцям способами, наприклад, з відповідних анілінів бензойної кислоти, арил- або гетероарилкетони також отримують загальноприйнятими серед фахівців способами, наприклад, з відповідних хлорангідридів кислот або нітрилів за допомогою взаємодії наприклад, з металоорганічними сполуками. Для конденсації сполук формули IV із сполуками формули III переважно використовують самі по собі добре відомі фахівцям з хімії пептидів способи приєднання [див., наприклад, Houben-Weyl, Methoden der Organischen Chemie, Band 15/1 і 15/2, Georg Thieme Verlag, Stuttgart, 1974]. Як засоби для конденсації або реагенти приєднання мають на увазі такі сполуки, як карбонілдіімідазол, карбодіімід, як дициклогексилкарбодіімід або діізопропілкарбодіімід (DIC), О-((ціано(етокси-карбоніл)-(метилен)аміно)-N,N,N', N'-тетраметилуроніум-тетрафторборат (TOTU) або ангідрид пропілфосфонової кислоти (РРА). Конденсація може проводитися в стандартних умовах. При конденсації, як правило, необхідно, щоб наявні нереагуючі аміногрупи були захищені оборотними захисними групами. Це відноситься рівним чином до карбоксильних груп, що не беруть участі в реакції, які під час конденсації переважно знаходяться у ви гляді (С1-С5)-алкілових складних ефірів, бензилових складних ефірів або трет.-бутилови х складних ефірів. Захист аміногруп є зайвим, якщо аміногрупи ще знаходяться в формі стадії попередника, як нітрогрупи або ціаногрупи, і утворюються тількипісля конденсації за допомогою гідрування. Після конденсації наявні захисні групи відщеплюють придатним чином. Наприклад, NO2-групи (гуанідиновий захист в амінокислотах), бензилоксикарбонільні групи і бензильні групи в бензиловому складному ефірі можуть бути видалені гідруванням. Захисні групи трет.-бутильного типу відщеплюються в кислих умовах, в той час як залишок 9 флуоренілметилоксикарбонільного залишку видаляють за допомогою вторинних амінів. Винахід стосується також лікарських засобів, які відрізняються ефективним вмістом, щонайменше, однієї сполуки формули І і/або однієї фізіологічно сумісної солі сполуки формули І, і/або, у разі необхідності, однієї стереоізомерної форми сполуки формули І, разом з фармацевтично придатними і фізіологічно сумісними носієм, добавкою і/або іншими біологічно активними і допоміжними речовинами. Завдяки фармакологічним властивостям сполуки згідно з винаходом придатні для профілактики і лікування всіх захворювань, протікання яких зумовлене підвищеною активністю ІкВ-кінази. До них відносяться, наприклад, хронічні захворювання рухо вого апарату, такі, як запальні, імунологічно або обміном речовин зумовлені гострі і хронічні артрити, артропатії, ревматоїдний артрит, або дегенеративні захворювання суглобів, такі як остеоартрози, спондильози, діабет типу II, запальні захворювання кишечнику, атрофія хряща після травми суглоба або тривалого положення спокою суглоба після ушкодження меніска або колінної чашечки, або розривів зв'язок, або захворювання з'єднувальної тканини такі, як колагенози і періодонтальні захворювання, міалгії і порушення обміну речовин кістки, або захворювання, зумовлені понадекспресією фактора некрозу пухлини альфа (TNFa) або підвищеною концентрацією TNFa такі, як виснаження, розсіяний склероз, черепно-мозкова травма, хвороба Крона і виразки кишечнику, або захворювання такі, як артеріосклероз, стенози, ульцерація, хвороба Альцгеймера, дисиміляція м'язів, ракові захворювання (потенціювання цитотоксичної терапії), інфаркт міокарда, подагра, сепсис, септичний шок, ендотоксичний шок, вірусні інфекції такі, як грип, гепатит, тяжкі вірусні інфекції (HIV-інфекції), СНІД, або захворювання, викликані аденовірусами або герпесвірусами, паразитарні інфекції такі, як малярія або лепра, грибкові або дріжджові інфекції, запалення мозкових оболонок, хронічні запальні легеневі захворювання такі, як хронічний бронхіт або астма, гострі респіраторні дистресові синдроми, гострий синовіт, туберкульоз, псоріаз, діабет, лікування гострих або хронічних реакцій відторгнення органу реципієнта проти трансплантованого органу, хронічні захворювання «трансплантат проти хазяїна» і запальні захворювання судин. Названі захворювання можна лікувати сполуками згідно з винаходом в основному специфічно і з мінімальним спектром побічної дії, оскільки в основному інгібується тільки ІкВ-кіназа. Лікарські засоби згідно з винаходом можна вводити орально, шляхом інгаляції, ректально або черезшкірно, або шляхом підшкірних, вн утрішньосуглобних, вн утрішньочеревинних або внутрішньовенних ін'єкцій. Переважне оральне введення. Винахід стосується також способу отримання лікарського засобу, який відрізняється тим, що, щонайменше, одна сполуку формули І з фармацевтично придатним і фізіологічно сумісним носієм і, у разі необхідності, іншими придатними біологічно активними речовинами, добавками або допоміжними речовинами доводять до придатної форми введення. Придатними твердими або галеновими препаративними готовими формами є, наприклад, грануляти, порошки, драже, таблетки, (мікро)капсули, супозиторії, сиропи, соки, суспензії, емульсії, краплі або розчини для ін'єкцій, а також препарати з пролонгованим вивільненням біологічно активної речовини, для отримання яких використовуються звичайні допоміжні речовини, як носії, розпилювачі, зв'язуючі, речовини для покриттів, агенти набухання, речовини, що додають ковзкості або змащування, смакові добавки, підсолоджувачі і агенти розчинення. Як часто використовувані допоміжні речовини називаються карбонат магнію, діоксид титану, лактозу, маніт і інші цукри, тальк, молочний білок, желатин, крохмаль, целюлозу і її похідні, тваринні жири і рослинні олії, такі як риб'ячий жир, соняшникова, арахісова або кунжутна олії, поліетиленгліколь і розчинник, такий як, наприклад, стерильна вода, і одно- або багатоатомні спирти, такі як гліцерин. Переважно фармацевтичні препарати виготовляють і вводять в разових дозах, причому кожна разова доза містить як активний компонент одну певну дозу сполуки формули І згідно з винаходом. Для твердих разових доз у вигляді таблеток, капсул, драже або супозиторіїв, ця доза може складати аж до близько 1000 мг, переважно від приблизно 50 мг до 300 мг, і для ін'єкційних розчинів в формі ампул аж до близько 300 мг, переважно від приблизно 10 мг до 100 мг. Для лікування дорослих пацієнтів вагою близько 70 кг, в залежності від ефективності сполуки згідно з формулою І, показана добова доза від приблизно 20 мг до 1000 мг біологічно активної речовини, переважно від приблизно 100 мг до 500 мг. При відомих умовах, однак, також можуть бути використані більші або менші добові дози. Введення добової дози може здійснюватися як за допомогою одноразового введення в формі окремої разової дози, або ж декількох менших разових доз, так і за допомогою багаторазового прийому розділених доз в певні інтервали. Цільові продукти, як правило, визначаються за допомогою мас-спектрометричних методів (FAB-, ESI-MC). Температуру позначають в градусах Цельсія, КТ (RT) означає кімнатну температуру (22°С до 26°С). Використовувані скорочення або пояснені, або відповідають загальноприйнятим угодам. Далі винахід ілюструється наступними прикладами. Приклади отримання А) Отримання аніліну. A.1.) 2-(п-фтораніліно)-піридин (3) Суміш з 29,34г (0,264моль) 4-фтораніліну (1) і 29,98г (0,264моль) 2-хлорпіридину (2) нагрівали 2 години при 150°С. Після охолоджування до кімнатної температури (КТ) розподіляли між 500мл 1н NaOH і 500мл етилового ефіру оцтової кислоти. Водну фазу 2 рази екстрагували етилацетатом (по 300мл) і об'єднані органічні фази сушили сульфатом магнію. Після випарювання розчинника осад поглинали 500мл етилацетату і додавали близько 40г активованого вугілля. 10 хвилин перемішували при КТ і потім відфільтровувати через кізельгур. Активоване вугілля 4 разу промивали етилацетатом (по 1л). Розчинник відганяли під вакуумом, і осад вимішували з 120мл етилацетату. Тверду речовину відсмоктували і при 50°С сушили під вакуумом. Отримали 41г 2-(п-фтораніліно)-піридину (3); ви хід 83%. Сумарна формула C11H9N2 ;M.B. = 188,21; МС(М+Н) 189,1. 1 Н ЯМР (CDCl3) 6,68-6,75 (м, 2Н), 6,88 (с, 1Н), 7,05 (т, 2Н), 7,24-7,32 (м, 2Н), 7,43-7,49 (м, 1Н), 8,18 (д, 1Н). А.2.) 2-(аніліно)-піримідин (6). З 16,2г аніліну (4) за допомогою аналогічних перетворень, вище описаних в п. А.1.), за допомогою 2хлорпіримідину (5) отримали 9,15г (31%) анілінопіримідину 6. Сумарна формула C10H9N3 ; М.В. = 171,08; МС (М+Н) 172,2. В.) Синтез амінокислоти через Z-серин-лактон 8 В.1) Ме тиловий ефір (S)-2-аміно-3-дифеніламшо-пропіонової кислоти (11) В. 1.1.) N-бензилокси-карбоніл-L-серин-b-лактон (8) 54,8г (0,209моль) трифенілфосфіну суспендували в 600мл ацетонітрилу і охолоджували до температури від -35°С до -45°С при виключенні вогкості. При цій температурі протягом 50 хвилин по краплях додавали 36,4г (0,209 моль) діетилового ефіру азодикарбонової кислоти. Потім перемішували 15 хвилин при -35°С. До цієї суміші потім повільно прикапували розчин з 50г (0,209моль) N-бензилоксикарбоніл-L-серину (7) в 500 мл ацетонітрилу, так що температура не підіймалася вище за -35°С. Потім 12 годин перемішували при 5°С. Через припинення реакції реакційний розчин при зниженому тиску звільняли від розчинника, і сирий продукт очищали за допомогою хроматографії середнього тиску на кізельгелі (DCM/ацетонітрил (AcCN):25/1). Після видалення розчинника отримали 20,8г N-бензилокси-карбоніл-L-серин-b-лактону (8) у вигляді тонких голок; вихід 45 %; [ди в. також Org. Synth. 1991 (70) Iff.]. Сумарна формула С11Н11NO4 М.В. = 221,2; МС (М+Н) 222,1. 1 Н ЯМР (ДМСО-d6) 4,30 (м, 1H), 4,45 (м, 1H) 5,10 (с, 2Н), 5,22 (м, 2Н), 7,45 (м, 5Н), 8,20 (д,J = 9,8 Гц, 1H). В. 1.2.) (8)-2-бензилоксикарбоніламіно-3-дифеніламінопропіонова кислота (9) 5,0г (22,6ммоль) серинлактону (5) домішували до 20г (118,2ммоль) дифеніламіну і 2 години нагрівали при 100°С. Сирий продукт очищали за допомогою хроматографії середнього тиску на кізельгелі (БСМ/метанол:9/1, потім ЕА(етилацетат)/н-гептан:4/1). Після видалення розчинника отримали 3,65 г (вихід 42%) чистої 2бензилоксикарбоніламіно-3-дифеніламінопропіонової кислоти (9). Сумарна формула C23H22N2O4 ; M.B. = 390,44; МС (М+Н) 391,2. 1 Н ЯМР (ДМСО-d6) 3,85 (м, 1Н), 4,18 (м, 1Н), 4,3 (м, 1Н), 4,9 (м, 2Н), 6,9 (м, 5Н),7,25(м, 10Н). В. 1.3.) метиловий ефір (8)-2-бензилоксикарбоніламіно-3-дифеніламіно-пропіонової кислоти (10) До 75мл метанолу прикапували при -5°С 6,5мл (89,1ммоль) тіонілхлориду і 15 хв. перемішували. Потім додавали 3,6г (9,22ммоль) розчиненої в 75мл метанолу 2-бензилоксикарбоніламіно-3-дифеніламінопропіонової кислоти (9) і далі перемішували 3 години при кімнатній температурі. Після випарювання розчинника осад поглинали етилацетатом і екстрагували розчином карбонату натрію. Після очищення за допомогою флеш-хроматографії (н-гептан/етилацетат 7:3) отримали 2,76г (50% вихід) метилового ефіру 2бензилоксикарбоніламіно-3-дифеніламіно-пропіонової кислоти (10). Сумарна формула C24H24N2O4 ; М.В. - 404,47; МС (М+Н) 405,2. 1 Н ЯМР (ДМСО-d6) 3,58 (с, 3H)3,95 (м, 1Н), 4,18 (м, 1H) 4,4 (м, 1H), 4,95 (м, 2Н), 6,9 (м, 6Н), 7,3 (м, 9Н), 7,85 (д, J = 9,8Гц, 1H). В. 1.4.) метиловий ефір (8)-2-аміно-3-дифеніламіно-пропіонової кислоти (11) Для відщеплення захисної Z-групи 2,7г (6,68ммоль) похідного (10), захищеного Z-групою, розчиняли в 500мл метанолу і додавали в захисній атмосфері азоту 100мг каталізатора (10% Pd(OH)2-C). Потім заміняли інертний газ великим надлишком водню і 2 години струшували в атмосфері водню. Після завершення реакції відфільтровували каталізатор і концентрували фільтрат. Отримали 1,65г (вихід 91%) метилового ефіру 2аміно-3-дифеніламіно-пропіонової кислоти (11). Сумарна формула C16H18N2O2 ; М.В. = 270,32; МС (М+Н) 271,2. 1 Н ЯМР (ДМСО-с16) 3,45 (с, 3Н), 3,58 (м, 1Н), 3,8 (м, 1Н), 3,95 (м, 1Н), 6,9 (м, 6Н), 7,3 (м, 4Н). В.2.) Синтез амінокислот через акрилову кислоту 13 В.2.1.) Розділення енантіомерів Рацемічні амінокислоти, отримані через акрилову кислоту, могли бути розділені на енантіомери за допомогою препаративної ВЕРХ (HPLC) з хіральними фазами, як, наприклад, Chiralpak AD (Daicel) 100x380, КТ, потік 300 мл/хв. Чистота енантіомерів могла бути визначена за допомогою аналітичної ВЕРХ як Chiralpak AD-H (Daicel) 4;6х250, 30°С, потік 1 мл/хв, кімнатна температура). В.2.2.) метиловий ефір (3-(N-4-фторфеніл-Н-2-піридил)-аміно)-2-(ди-трет.-бутилоксикарбоніл)-амінопропіонової кислоти (14) В.2.2.1.) метиловий ефір 2-(ди-трет.-бутилоксикарбоніл)-аміно-акрилової кислоти (13) 50г (0,228моль) Воссерину (12) розчиняли в 300мл ацетонітрилу. Додавали 107г (0,493моль) Вос-ангідриду і 2,64г (22ммоль) DMAP. Залишали на ніч перемішува тися при КТ, відганяли розчинник під вакуумом, і осад поглинали 500мл етилацетату. Органічну фазу промивали 500мл 1н НСl і сушили сульфатом магнію. За допомогою кристалізації з 200мл гептану при -30°С після відсмоктування отримали 23г акрилової кислоти 13. Маточний розчин концентрували, і осад розчиняли в 140мл ацетонітрилу. Додавали 31г (0,142моль) Вос-ангідриду і 1,26г (10ммоль) DMAP. Після нагрівання до 50°С протягом 8 годин відганяли розчинник під вакуумом, і осад поглинали 500мл етилацетату. Органічну фаз у промивали 400мл 1 н НС1 і сушили над сульфатом магнію. Після видалення розчинника під вакуумом за допомогою кристалізації з гептану далі отримали 31,5г акрилату 13. Вихід 54,5г (0,181моль), 79%. Сумарна формула C14H23NO6; М.В. - 301,34; МС (M*2)(+Na+) 625,7. 1 НЯМР (ДМСО-d6) 1,40 (с, 18Н), 3,74 (с, 3Н), 5,85 (с, 1Н), 6,28 (с, 1Н). В.2.2.2.) метиловий ефір (3-N-4-фторфеніл-N-2-піридил)-аміно)-2-(ди-трет.-бутилоксикарбоніл)-амінопропіонової кислоти (14) 11,5г (38,2ммоль) акрилату 13 змішували з 7,2г (38,2ммоль) аніліну 3 і 37,3г (114 ммоль) карбонату цезію. Додавали 100 мл ацетонітрилу і залишали 2 дні перемішуватися при 55°С. Після цього залишали далі на 2 дні перемішува тися при кімнатній температурі. Тверду речовину відсмоктували через кізельгур і 3 рази промивали ацетонітрилом (по 100 мл). З об'єднаних органічних фаз під вакуумом відганяли розчинник, і осад хроматографували на кізельгелі з елюентом гептан/етилацетат 4:1. Вихід: 14 г (75%) 14. Сумарна формула C25H32FN3 O6; MB. = 489,55; МС (М+Н) 490,6. 1 HЯМP (CDC13) 1,28 (с, 18Н), 3,72 (с, 3Н), 4,25 (дд, 1Н), 4,75 (дд, 1Н), 5,83 (дд, 1Н), 6,22 (д, 1Н), 6.56-6,61 (м, 1H), 7,05-7,12 (м, 2Н), 7,19-7,26 (м, 3Н), 8,18 (д, 1Н). В.2.3.) метиловий ефір (3-(N-феніл-N-2-пиримідил)-аміно)--2-(ди-трет.-бутилоксикарбоніл)-амінопропіонової кислоти (15) З 35г 6, при аналогічному перетворенні, описаному в п. В.2.2.2.), отримали 3г (7%) амінокислоти 15. Сумарна формула C24H32N4O6 ; MB. = 472,23; МС (М+Н) 473,1. С.) Синтез гетероциклічних основних фрагментів С1.) Синтез індольного основного фрагмента: 2-(2-метиламіно-піримідин-4-іл)- 1Н-індол-5-карбонова кислота (20) С1.1.) 1-диметиламіно-4,4-диметокси-пент-1-ен-3-он (18) 100г (0,76моль) 3,3-диметокси-2-бутанону (16) при 120°С перемішували протягом 48 години з 90,2г N,Nдиметилформамід-диметилацеталю (17) (0,76моль). Метанол, що утворюється в результаті реакції, безперервно видаляли з реакційного розчину за допомогою дистиляції. При охолоджуванні розчину починалася спонтанна кристалізація, яка за допомогою невеликої добавки гептану доходила до повного завершення. Таким чином отримали 128,24г сирого продукту 18 (ви хід 90%), які піддавали перетворенню без подальшого очищення. Сумарна формула C9H17NO 3; М. В. = 187,24; МС (М+Н) 188,2. 1 Н ЯМР (ДМСО-d6) 1,22 (с, 3Н), 2, 80 (с, 3Н), 3,10 (с, 9Н), 5,39 (д, J = 15Гц, 1Н),7,59(д,J=15Гц, 1Н). С1.2.) [4-(1,1-диметоксі-етил)-піримідин-2-іл]-метил-амін (19) 1,22г (53ммоль) натрію розчиняли в 100мл абсолютного етанолу. До цього при перемішуванні додавали 5,8г (53ммоль) метилгуанідингідрохлориду і 10г (53ммоль) 1-диметиламіно-4,4-диметокси-пент-1-ен-3-он (18) і 4 години нагрівали до кипіння. По завершенні реакції випаровували етанол. Отриманим таким чином продукт 19 без подальшого очищення використовували в подальшій реакції. Вихід 11,5г (58ммоль, кількісно). Сумарна формула C9H15N3 O2; М.В. = 197,24; МС (М+Н) 198,2. 1 Н ЯМР (ДМСО-d6) 1,45 (с, 3Н), 2,78 (с, 3Н), 3,10 (с, 6Н), 6,75 (д, J=3Гц, 1Н), 7,0-7,1 (с(уш.), 1H), 8,30 (д, J=3Гц, 1Н). С.1.3.) 2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбонова кислота (20) До 150мл 50%-ної сірчаної кислоти при кімнатній температурі при перемішуванні додавали 5г (25ммоль) [4-(1,1-диметоксі-етил)-піримідин-2-іл]-метиламіну (19) і 3,85г 4-гідразинбензойної кислоти і 4 години нагрівали при 130°С. Метанол, що утворюється в результаті реакції, безперервно видаляли з реакційного розчину за допомогою дистиляції. Після охолоджування до 10°С реакційну суміш виливали на 200мл льоду і за допомогою концентрованого розчину гідроксиду натрію встановлювали значення рН близько 5,5. Осад сульфату натрію, що утворюється при цьому, і суміші продукту відфільтровувати, і осад з фільтра багато разів екстрагували метанолом. Об'єднаний метанольний екстракт концентрували, і продукт 20 очищали за допомогою флеш-хроматографії (DCM/метанол 9:1). Вихід 0,76г (11%). Сумарна формула C14H13N4O2 ; MC (М+Н) 269,1. 1 Н ЯМР (ДМСО-d6) 2,95 (с, 3Н), 6,90-7,10 (с(уш.), 1H), 7,18 (д, J=3Гц, 1H), 7,4 (с, 1H), 7,58 (д, J=4,5Гц, 1Н), 7,80 (д, J=4,5Гц, 1H), 8,30 (с, 1Н), 7,80 (д, J=4,5Гц, 1H), 8,38 (д, J=3Гц; 1H), 11,85 (с, 1Н), 12,40-12,60 (с(уш.), 1Н). С.2.) Синтез бензімідазольного основного фрагмента: 2-(2-метиламіно-піримідин-4-іл)-1Н-бензімідазол-5 карбонова кислота (25) С.2.1) 4-диметиламін- 1,1-диметокси-бут-3-ен-2-он (22) 300г (307мл, 2,54моль) метилгліоксальдиметилацеталю (21) при 110°С перемішували протягом 4 годину, з 300г (337мл, 2,54моль) N,N-диметилформамід-диметилацеталю (17). Метанол, що утворюється в результаті реакції, безперервно видаляли з реакційного розчину за допомогою дистиляції. Після охолоджування розчин екстрагували гептаном і випаровували розчинник. Отримали 303г сирого продукту 22 (ви хід 70%), який піддавали перетворенню без подальшого очищення. Сумарна формула C8H15NO 3; M.B. = 173,21; МС (М+Н) 174,1. 1 Н ЯМР (ДМСО-d6) 2, 10 (с, 1H), 2, 80 (с, 3Н), 3,10 (с, 3Н), 3,25 (с, 3Н), 3,3 (с, 3Н), 4,42 (с, 1Н), 5,19 (д(уш.), J=12,8Гц, 1H), 7,60 (д, J=15Гц, 1Н). С.2.2.) (4-диметоксиметил-піримідин-2-іл)-метил-амін (23) 0,33г (14,4ммоль) натрію розчиняли в 50мл абсолютного етанолу. До цього при перемішуванні додавали 1,57г (14,4ммоль) метилгуанідингідрохлориду і 2,48г (14,4ммоль) 4-диметиламін-1,1-диметокси-бут-3-ен-2-ону (22) і 3 години нагрівали до кипіння. По завершенні реакції випарювали етанол. Отриманий таким чином продукт 23 використовували без подальшого очищення. Вихід 2,6 г (кількісно). Сумарна формула C8H13N3 O2; М.В. = 183,21; МС (М+Н) 184,1. 1 Н ЯМР (ДМСО-d6) 2,78 (с, 6Н), 3,10 (с, 3Н), 5,02 (с, 1Н), 6,62 (д, J=3Гц, 1Н), 8,30(д, J=3Гц,1Н). С.2.3.) 2-метиламіно-піримідин-4-карбальдегід (24) 10г (54ммоль) (4-диметоксиметил-піримідин-2-іл)-метиламіну (23) розчиняли в 54мл 2н сірчаної кислоти і при перемішуванні нагрівали 3 години до 80°С. Після охолодження реакції реакційний розчин обережно доводили до рН близько 9 твердим Na2CO3 і 3 рази екстрагували етанолом. Об'єднаний висушений екстракт після випарювання розчинника містив титульний альдегід 24 з 60%-ним виходом (4,47г). Сумарна формула C6H7N3O; М.В. - 137,12; МС (М+Н) 138,2. 1 H ЯМР (ДМСО-d6) 2,60-2,80 (с(уш.), 3Н), 6,95 (д, J=3Гц, 1H), 7,40-7,60 (с(уш.), 1Н), 8,55 (д, J=3Гц, 1Н). С.2.4.) 2-(2-метиламін-шримідин-4-іл)-1Н-бензоімідазол-5-карбонова кислота (25) 4,3г (31,3ммоль) метиламін-піримідин-4-карбальдегіду (24) і 4,8г (31,1ммоль) 3,4-діаміно-бензойної кислоти 2 години нагрівали в 300мл нітробензолу до 150°С. Після охолоджування до 0°С осад бензімідазолу відділяли від нітробензолу шляхом фільтрації, і продукт 25 очищали за допомогою флеш-хроматографії (DCM/метанол 4:1). Вихід 2,66г (32%). Сумарна формула C13H11N5O2 ; М.В. = 269,28; МС (М+Н) 270,2. 1Н ЯМР (ДМСО-d6) 2,95 (с, 3Н), 7,50 (д, J=3Гц, 1Н), 7,75 (д, J=4,5Гц, 1Н), 7,90 (д, J=4,5Гц, 1H), 8,35(с, 1Н), 8,55 (д, J=3Гц, 1Н), 8,70-9,05 (с(уш.), 1Н). D.) Цільовий продукт індол D.1.) [(S)-2-дифеніламіно-1-(5-оксо-4,5-дигідро-[1,3,4]оксадіазол-2-іл)-етил]-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти (28) D.1.1.) метиловий ефір 3-дифеніламіно-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбоніл]-(8)амино}-пропіонової кислоти (26) 5,0г (18,64ммоль) 2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбонової кислоти (20) розчиняли в 1,2л диметилформаміду (ДМФА) і один за одним додавали 7,9г (24,08ммоль) TOTU (О-[(ціано(етоксикарбоніл)метиліден)аміно)-1,1,3,3-тетраметил]уроніум-тетрафторборат) і 7,9мл (46,45ммоль) етилдіізопропіламіну. Перемішували 20хв. при 5°С і додавали до розчину 0,73г (3,28ммоль) метилового ефіру (S)-2-аміно-3-дифеніламінопропіонової кислоти (11). Після 15 годин перемішування реакційну суміш концентрували при зниженому тиску, осад поглинали н-бутанолом, і органічну фазу для відділення побічних продуктів екстрагували насиченим розчином гідрокарбонату натрію. Після сушіння над MgSO4 і концентрування органічної фази виділяли метиловий ефір титульної сполуки 26 за допомогою флешхроматографії на кізельгелі (ОСМ:метанол=19:1). Вихід 4,3г (98%). Сумарна формула C30H28N6O3 ; М.В. = 520,22; МС (М+Н) 521,3. 1 Н ЯМР (ДМСО-d6) 2,95 (с(уш.), 3Н), 3 ,60 (с, 3Н), 4,19-4,58 (м, 2Н), 4,85 (кв, 1H 6,90-7,10 (м, 7Н), 7,18 (д, J = 3 Гц, 1Н), 7,25-7,40 (м, 5Н), 7,50 (д, J = 4,5 Гц, 1H), 7,65 (д, J = 4,5 Гц, 1H), 8,05 (с, 1Н), 8,35 (д, J = 3 Гц, 1H), 8,70 (д, J = 3,75 Гц, 1H), 11,85 (с, 1Н). D.1.2.) ((S)-2-дифеніламіно-1-гідразин-карбоніл-етил)-амід2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5карбонової кислоти (27) 1,0 г (1,92 ммоль) метилового ефіру 3-дифеніламіно-2-{[2-(2-метиламіно-піримідин-4іл)-1Н-індол-5-карбоніл]-(8)-аміно}-пропіонової кислоти (26) розчиняли в 10мл метанолу, додавали 0,48г (9,95ммоль) гідразингідрату і 15 годин перемішували при кімнатній температурі. Осад продукту (0,3г) відділяли від маточного розчину фільтрацією. З концентрованого маточного розчину далі виділяли гідразид 27 (0,1г) за допомогою флеш-хроматографії на кізельгелі (DСМ:метанол=19:1). Вихід 0,4г (40%). Сумарна формула C29H28N8O2 ; М.В. = 520,6; МС (М+Н) 521,4. 1 Н ЯМР (ДМСО-d6) 2,95 (с(уш.), 3Н), 4,02-4,58 (м, 2Н), 4,4 (с, 2Н), 4,85 (кв, 1H), 6,90-7,10 (м, 7Н), 7,18 (д, J = 3 Гц, 1Н), 7,20-7,45 (м, 5Н), 7,50 (д, J = 4,5 Гц, 1Н), 7,62 (д, J = 4,5 Гц, 1Н), 7,99 (с, 1Н), 8,25 (д, J = 3 Гц, 1Н), 8,35 (с(уш.), 1Н), 9,30 (с, 1Н), 11,70 (с,1Н). D. 1.3.) [(S)-2-дифеніламіно-1 -(5-оксо-4,5-дигідро-[1,3,4]оксадіазол-2-іл)-етил]-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти (28) 200мг (0,384ммоль) (8)(-2-дифеніламіно-1-гідразин-карбоніл-етил)-аміду 2-(2-метиламіно-піримідин-4-іл)1Н-індол-5-карбонової кислоти (27) суспендували в 20мл метиленхлориду і при 0°С прикапували при перемішуванні 20%-ний розчин фосгену в толуолі (0,398ммоль). Далі перемішували 15 годину при кімнатній температурі і концентрували розчинник. Потім оксадіазолон 28 виділяли за допомогою флеш-хроматографії на кізельгелі (DСМ:метанол = 9:1). Вихід 160мг (76%). Сумарна формула С30H26N8O3 ; М.В. = 546,6; МС (м+Н) 547,3. 1 Н ЯМР (ДМСО-d6) 2,95 (с(уш.), 3Н), 4,02-4,58 (м, 2Н), 4,85 (кв, 1Н), 6,90-7,10 (м, 7Н), 7,15 (д, J = 3 Гц, 1Н), 7,20-7,40 (м, 6Н), 7,52 (д, J = 4,5 Гц, 1Н), 7,68 (д, J = 4,5 Гц, 1Н), 8,10 (с, 1Н). 8 ,92 (д, J = 3 Гц, 1Н), 11,78 (с, 1Н), 12,15-12,40 (с(уш.), 1Н). D.2.) {1-карбамоїл-2-[(4-фторфеніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)-1Ніндол-5-карбонової кислоти (30) D.2.1.) метиловий ефір 3-[(4-фторфеніл)-піридин-2-іл-аміно]-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-індол5-карбоніл]-аміно}-пропіонової кислоти (29) 0,75г (1,53ммоль) 14 розчиняли в 10мл діоксану і охолоджували до 0°С. Додавали 10мл 4н НСl в діоксані, витримували протягом 2 години при кімнатній температурі і 12 годин після перемішували. Розчинник відганяли під вакуумом. Осад поглинали 10мл ДМФА (розчин А). 617мг кислоти 20 розчиняли в 20мл ДМФА і охолоджували до 0°С. Додавали 1,05 г H ATU і 1,6 мл DIEA. Після перемішування протягом 40хв. при 0°С додавали розчин А. Витримували при кімнатній температурі і після перемішували протягом 4 години. Розчинник відганяли під вакуумом, і осад розподіляли між 100 мл насиченого розчину NaHCO3 і 100мл етилацетату. Водну фазу 3 разу екстрагували етилацетатом (по 50мл), і об'єднані органічні фази промивали 100мл насиченого розчину NaCl. Органічну фазу сушили сульфа том магнію. Розчинник відганяли під вакуумом, і осад хроматографували на кізельгелі з елюентом гептан/етилацетат 1:3. Отримали 560мг (68%) складного ефіру 29. Сумарна формула C29H26FN7O 3; М.В. - 539,57; МС (М+Н) 540,2. D.2.2.) {1-карбамоїл-2-[(4-фторфеніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)-1Hіндол-5-карбонової кислоти (30) 320мг (0,593ммоль) складного ефіру 29 розчиняли при 0°С в 50мл метанолу, насиченого аміаком. Перемішували протягом 24 годин при кімнатній температурі. Розчинник відганяли під вакуумом, і осад вимішували з 5 мл етилацетату. Тверду речовину відсмоктували і при 50°С сушили під вакуумом. Отримали 270мг (87%) аміду 30. Сумарна формула C28H25FN8O 2; М.В. - 524,56; МС (М+Н) 525,2. 1 Н ЯМР (ДМСО-с16) 2,45 (с, ЗН), 4,10 (д, 1Н), 4,52-4,66 (м, 2Н), 6,26 (д, 1Н), 6,77 (т, 1Н), 7,02 (уш.с, 1Н), 7,09-7,17 (м, 2Н), 7,22-7,32 (м, 5Н), 7,38-7,46 (м, 1Н), 7,47-7,58 (м, ЗН), 7,92 (с, 1Н), 8,27-8,36 (м, 2Н), 8,59 (д, 1Н), 11,70 (с, 1Н). D.3.) [(8)-1-(5-оксо-4,5-дигідро-1,3,4-оксадіазол-2-іл)-2-(феніл-піридин-2-іл-аміно)-етил]-амід 2-(2метиламіно-піримідин-4-іл)-1Н-індол-5-карбонової кислоти (33) D.3.1.) метиловий ефір (3-N-феніл-N-2-піридил)-аміно)-2-(ди-трет.-бутилоксикарбоніл)-аміно-пропіонової кислоти (31) 4,96г (16,5ммоль) акрилату 13 змішували з 5,6г (32,9ммоль) 2-анілінопіридину і 32,16г (98,7ммоль) карбонату цезію. Додавали 50мл ацетонітрилу і протягом 2 днів перемішували при 45°С. Тверду речовину відсмоктували через кізельгур і 3 рази промивали ацетонітрилом (по 100мл). Об'єднані органічні фази концентрували, і осад хроматографували на кізельгелі з елюентом гептан/діетиловий ефір 1:1. Отримали 5,66г (73%) складного ефіру 31. Сумарна формула С25Н33К306; М.В. = 471,56; МС (М+Н) 472,2. D.3.2.) Розділення енантіомерів здійснювали, як описано в п. В.2.1.). D.3.3.) метиловий ефір 2- {[2-(2-метиламіно-піримідин-4-іл)- 1H-індол-5-карбоніл]-аміно}-3-(феніл-піридин2-іл-аміно)-пропіонової кислоти (32) 2,9г S-енантіомеру 31 розчиняли в 30 мл діоксану і охолоджували до 0°С. Додавали 30 мл 4н НСl в діоксані, залишали при кімнатній температурі і потім 12 годин перемішували. Розчинник відганяли під вакуумом. Осад поглинали 30 мл ДМФА (розчин А). 2,47г (9,2ммоль) кислоти 20 розчиняли в 50мл ДМФА і охолоджували до 0°С. Додавали 4,21г HATU і 6,4мл DIEA. Після перемішування протягом 45хв. при 0°С залишали при кімнатній температурі і додавали розчин А. Витримували при кімнатній температурі протягом 12 годин. Розчинник відганяли під вакуумом, і осад розподіляли між 300мл насиченого розчину NaHCO3 і 300мл етилацетату. Водну фазу 3 разу екстрагували етилацетатом (по 100мл), і об'єднані органічні фази промивали 400мл насиченого розчину NaCl. Органічну фазу сушили сульфа том магнію. Розчинник відганяли під вакуумом, і осад хроматографували на кізельгелі з елюентом гептан/етилацетат 1:3. Отримали 1,78г (55%) складного ефіру 32. Сумарна формула С29H27N7О3 ; М.В. = 521,58; МС (М+Н) 522,2. D.3.4.) [(S)-1-(5-оксо-4,5-дигідро-1,3,4-оксадіазол-2-іл)-2-(феніл-піридин-2-іл-аміно)-етил]-амід 2-(2метиламіно-піримідин-4-іл)-1Н-індол-5-карбонової кислоти (33) 1,78г (3,4ммоль) складного ефіру 32 розчиняли в 30мл метанолу. Додавали 0,83мл гідразингідрату і перемішували 5 годин при 40°С. Після цього додавали 1,6мл гідразингідрату і перемішували 15 годин при кімнатній температурі. Розчинник відганяли під вакуумом, і осад поглинали 80мл дихлорметану. Додавали 3,2мл 20%-ного розчини фосгену в толуолі і витримували при перемішуванні 3 дні. Потім розчинник видаляли під вакуумом, і осад розподіляли між 80мл води і 80 мл етилацетату. При цьому тверду речовину, яка випала в осад, відсмоктували. Органічну фазу концентрували, і осад об'єднували з твердою речовиною і хроматографували на кізельгелі з елюентом гептан/етилацетат 1:5. Отримали 390мг (21%) оксадіазолону 33. Сумарна формула C29H25N9O3 ; М.В. - 547,58; МС (М+Н) 548,2. 1 Н ЯМР (ДМСО-dб ) 2,96 (с, 3Н), 4,30 (дд, 1Н), 4,67 (дд, 1Н), 5,40 (дд, 1H), 6,32 (д, 1H), 6,70-6,75 (м, 1H), 6,98 (уш. с, 1Н), 7,16 (д, 1H), 7,22-7,33 (м, 4Н), 7,38-7,46 (м, 3Н), 7,52 (д, 1H), 7,63 (д, 1H), 8,08 (с, 1H), 8,21 (д, 1Н), 8,31-8,35 (м, 1Н), 9,00 (д, 1Н), 11,72 (с, 1H), 12,15 (с, 1Н). D.4.) {1-карбамоїл-2-[(4-фтор-феніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-аміно-піримідин-4-іл)-1Н-шдол-5карбонової кислоти (35) D.4.1.) метиловий ефір 3-[(4-фтор-феніл)-піридин-2-іл-аміно]-2-{[2-(2-аміно-піримідин-4-іл)-1Н-індол-5карбоніл]-аміно}-пропіонової кислоти (34) З 750мг 14, при перетворенні, аналогічному до описаного в п. D.2.I.); отримали 370 мг (46%) складного метилового ефіру 34. Сумарна формула C28H24FN7O 3; М.В. = 525,55; МС (м+Н) 526,2. D.4.2.) {1-карбамоїл-2-[(4-фтор-феніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-аміно-тримідин-4-іл)-1Н-індол-5карбонової кислоти (35) З 150мг 34, при перетворенні, аналогічному до описаного в п. D.2.2.), отримали 95 мг (65%) аміду 35. Сумарна формула C27H23FN8O2 ; М.В. = 510,54; МС (М+Н) 511,2. 1 Н ЯМP (ДМСО-d6) 4,08-4,17 (м, 1H), 4,54-4,65 (м, 2Н), 6,29 (д, 1Н), 6,54 (с, 2Н), 6,74-6,80 (м, 1Н), 7,10 (с, 1H), 7,18(д, 1Н), 7,22-7,31 (м, 4Н), 7,38-7,56 (м, 6Н), 7,92 (с, 1Н), 8,29-8,35 (м, 2Н), 8,74 (д, 1Н), 11,80 (с, 1Н). D.5.) [2-[(4-фтор-феніл)-піридин-2-іл-аміно]-1-(4Н-[1,2,4]-триазол-3-іл)-етил]-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти (36) 30мг (0,25ммоль) аміду 35 розчиняли в 10 мл ДМФА. Додавали 40 мкл ДМФА-диметилацеталю і нагрівали 4 години до 90°С. Розчинник відганяли під вакуумом, і осад поглинали 3,5 мл оцтової кислоти. Після додання 27 мкл гідразингідрату залишали перемішуватися протягом 18 годин. Розчинник відганяли під вакуумом, і осад очищали за допомогою препаративної ВЕРХ. Отримали 84 мг (50%) триазолу 36. Сумарна формула C29H25FN10 O; М.В. = 548, 59; МС (М+Н) 549,2. 1 НЯМР (ДМСО-d6) 3.04 (с, 3Н), 4,36-4,43 (м, 1Н), 4,49-4,59(м, 1Н), 5,60-5,67 (м, 1Н), 6,50 (д, 1H), 6,78 (т, 1H), 7,17-7,37 (м, 7Н), 7,45-7,65 (м, 4Н), 8,02 (с, 1Н), 8,19 (д, 1Н), 8,35 (д. 1Н), 8,39 (д, 1Н), 11,85 (с, 1Н). D.6.) [1 -карбамоїл-2-(феніл-тіазол-2-іл-аміно)-етил]-амід 8-2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5карбонової кислоти (42) D.6.1.) феніл-тіазол-2-іл-амін (39) 10г (65,7 ммоль) фенілтіосечовини 37 розчиняли в 100 мл оцтової кислоти. Додавали 9,9мл ацеталю 38 і нагрівали 2 години до 100°С. Розчинник відганяли під вакуумом, і осад розподіляли між 300мл 1н NaOH і 300 мл етилацетату. Водн у фазу двічі екстрагували етилацетатом (по 100мл), і об'єднані органічні фази сушили сульфатом магнію. Розчинник відганяли, і осад вимішували з 50мл діізопропілового ефіру. Тверду речовину відсмоктували і сушили при 50°С під вакуумом. Отримали 2,5 г аніліну 39. Маточний розчин діізопропілового ефіру концентрували і осад хроматографували на кізельгелі з елюентом гептан/етилацетат 2:1. Таким чином отримали 3,5г 39. Вихід 6,0г (52%). Сумарна формула C9H8N2S; М.В. - 176,24; МС (М+Н) 177,1. D.6.2.) метиловий ефір (3-(]М-фенщ-]Ч-2-тіазоліл)-аміно)-2-(ди-трет.-бутилоксикарбоніл)-аміно-пропіонової кислоти (40) З 3,8г (12,5ммоль) акрилату 13, 2,2г (12,5ммоль) аніліну 39 і 20г карбонату цезію аналогічно перетворенню, описаному в п. D.3.1.), о тримали 4,5г (75 %) складного ефіру 40. Сумарна формула C23H31N3O6S; М.В. = 477, 58; МС (М+Н) 478,2. D.6.3.) Розділення енантіомерів здійснювали, як описано в п. В.2.1.) D.6.4.) метиловий ефір 8-2-{[2-(2-метиламіно-піримідин-4-іл)-Щ-індол-5-карбоніл]-аміно} -3 -(феніл-тіазол2-іл-аміно)-пропіонової кислоти (41) З 1,07г (2,2ммоль) складного ефіру 40 і 901мг (3,3ммоль) кислоти 20, аналогічно описаному в D.3.3.) перетворенню, отримали 640мг (55%) 41. Сумарна формула C27H25N7O3S; М.В. - 527,61; МС (М+Н) 528,1. D.6.4.) [1-карбамоїл-2-(феніл-тіазол-2-іл-аміно)-етил]-амід 8-2-(2-метиламіно-шримідин-4-іл)-1Н-індол-5карбонової кислоти (42) З 500мг (0,95ммоль) 41, аналогічно описаному в D.2.2.) перетворенню, отримали 340мг (70%) аміду 42. Сумарна формула C26H24N8O2S; М.В. = 512,60; МС (М+Н) 513,3. 'Н ЯМР (ДМСО-сі6) 2,97 (с, 3Н), 4,23-4,30 (м, 1H), 4,39-4,48 (м, 1H), 4,71-4,78 (м, 1Н), 6,78 (д, 1H), 7,16 (д, 1Н), 7,28-7,35 (м, 3Н), 7,37-7,60 (м, 7Н), 7,98 (с, 1Н), 8,33 (д, 1H), 8,62 (д, 1H), 11,70 (с, 1Н), D.7.) [1-метоксикарбамоїл-2-(феніл-піридин-2-іл-аміно)-етил]-амід S-2-(2-метиламіно-піримідин-4-іл)-1Ніндол-5-карбонової кислоти (43) 80мг (0,95ммоль) гідрохлориду О-метилгідроксиламіну розчиняли в 10мл ТГФ і охолоджували до -40°С. Прикапували 0,95мл (1,9ммоль) 2М розчину ізопропілмагній-хлориду в ТГФ. Протягом 1 години витримували при -20°С. Потім прикапували розчин 100мг (0,19ммоль) складного ефіру 32 в 3мл ТГФ. Протягом 4 години витримували при кімнатній температурі і закінчували реакцію доданням 5мл води. ТГФ відганяли під вакуумом, і осад розподіляли між 20мл насиченого розчину хлориду амонію і 20мл етилацетату. Водну фазу 3 разу екстрагували етилацетатом (по 20мл), і об'єднані органічні фази сушили сульфатом магнію. Розчинник відганяли під вакуумом, і осад очищали за допомогою препаративної ВЕРХ. Отримали 60мг (61%) метилгідроксамату 43. Сумарна формула C29H28N8O3 ; М.В. - 536, 60; МС (М+Н) 537,2. 1 Н ЯМР (ДМСО-d6) 2,95 (с, 1H), 3,52 (с, 3Н), 4,09-4,18 (м, 1H), 5,51-4,62 (м, 2Н), 6,33 (д, 1Н), 6,78 (т, 1Н), 7,00 (уш.с, 1Н), 7,18 (д, 1Н), 7,25-7,33 (м, 4Н), 7,49-7,61 (м, 5Н), 7,98 (с, 1Н), 8,29-8,36 (м,2Н), 8,79 (д, 1H), 11,31 (с, 1Н), 11,75 (с, 1Н). D.8.) {1-карбамоїл-2-[(феніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-аміно-піримідин-4-іл)-1H-індол-5карбонової кислоти (45) D.8.1.) метиловий ефір 3-[(феніл)-піридин-2-іл-аміно]-2-{[2-(2-аміно-шримідин-4-іл)-1Н-індол-5-карбоніл]аміно}-пропіонової кислоти (44) З 540мг rас.-10 (рац.-10), аналогічно описаному в В. 1.4.) і D.1.1.) перетворенню, отримали 816мг (80%) складного метилового ефіру 44. Сумарна формула C29H28N6O3 ; MB. = 506,56; МС (М+Н) 507,37. D.8.2.) {1-карбамоїл-2-[(феніл)-піридин-2-іл-аміно]-етил}-амід 2-(2-аміно-піримідин-4-іл)-1H-індол-5карбонової кислоти (45) З 150мг 44 аналогічно описаному в D.2.2.) перетворенню, отримали 162мг (67%) аміду 45. Сумарна формула C28H25N7O2 ; М.В. = 491,56; МС (М+Н) 492,32. 1 Н ЯМР (ДМСО-d6) 3,18 (с(уш.), 3Н), 4,05-4,13 (м, 2Н), 4,85 (кв, 1Н), 6,58 (с(уш.), 2Н), 6,88-7,59 (м, 19Н), 7,98 (с, 1Н), 8,25 (д, J = 3 Гц, 1Н), 8,35 (д, J = 2 Гц, 1Н), 11,78 (с, 1H). D.9.) {1-карбамоїл-2-[(феніл)-піримідил-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5карбонової кислоти (47) D.9.1.) метиловий ефір 3-[(феніл)-піримідил-2-іл-аміно]-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5карбоніл]-аміно}-пропіонової кислоти (46) З 2,36г 15 аналогічно описаному в п. D.2.1.) перетворенню, отримали 1,75мг (67%) складного метилового ефіру 46. Сумарна формула C28H26N8O3 ; М. В. = 522,57; МС (М+Н) 523,3. D.9.2.) {1-карбамоїл-2-[(феніл)-піримідил-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)-1Н-індол5-карбонової кислоти (47) З 700 мг 46 аналогічно описаному в п. D.2.2.) перетворенню, отримали 440мг (65%) аміду 47. Сумарна формула C27H25N9O2 ; MB. - 507,21; МС (М+Н) 508,4. 1 Н ЯМP (ДМСО-d6) 3,0 (с(уш.), 3Н), 4,20-4,32 (м, 1H), 4,45-4,59 (м, 2Н), 4,75-4,90 (м, 1Н), 6,75 (м, 1Н), 7,107,60 (м, 12Н), 7,95 (с, 1Н), 8,35-8,45 (м, 4Н), 11,85 (с(уш.), 1Н). D.10.) [1-(2-гідроксіетилкарбамоїл)-2-(феніл-піримідин-2-іл-аміно)-етил]-амід 2-(2-метиламіно-піримідин-4іл)-1Н-індол-5-карбонової кислоти (49) D.10.1) 2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбоніл]-аміно}-3-(феніл-піримідин-2-іл-аміно)пропіонова кислота (48) 4,0г складного метилового ефіру 46 розчиняли в 400 мл метанолу. До цього додавали 40мл 2н водного розчину NaOH і 12 годин перемішували при кімнатній температурі. Після випарювання розчинника осад розчиняли у воді і насиченим розчином NaH2PO4 доводили рН~5. Осад, що утворився, відфільтровувати і промивали водою. Отримали 1,3г (вихід 93 %) кислоти 48. Сумарна формула C29H26N6O3 ; М.В. - 506,21; МС (М+Н) 507,3. D.10.2) [1-(2-гідроксі-етилкарбамоїл)-2-(феніл-піримідин-2-іл-аміно)-етил]-амід 2-(2-метиламшо-піримідин4-іл)-1Н-індол-5-карбонової кислоти (49) 200мг кислоти 48 розчиняли в 2 мл абсолютного ДМФА. До цього додавали 94мг HOAt і 158 мкл DIEA. Потім прикапували 56мкл етаноламіну, о холоджували до 0°С і додавали 195мг EDC. Після 2 днів перемішування при кімнатній температурі випарювали розчинник, і очищали сирий продукт за допомогою хроматографії середнього тиску (MPLC) (елюент: ОС Мгметанол = 9:1). Ви хід 108мг (50%) цільового аміду 49. Сумарна формула C3IH31N8 O2 ; Ms В, = 549,64; МС (М+Н) 550,4. 1 Н ЯМР (ДМСО-с1б ) 1,2 (т, 2Н), 3,0 (с(уш.), 3Н), 3,35 (т, 1Н), 4,00-4,32 (м, 2Н), 4,80-4,99 (м, 1Н), 6,95 (м, 1H), 7,00-7,65 (м, 7Н), 7,90 (м, 1H), 8,35-8,40 (м, 1Н), 11,90(с(уш.), 1Н). D.11.) (8)-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбоніл]-аміно}-3-[феніл-(4-трифторметилпіримідин-2-іл) аміно]-пропіонова кислота (54) D.11.1.) феніл-(4-трифторметил-піримідин-2-іл)-амін (51) З 5,1г аніліну (4) і 5г хлорпіримідину 50 аналогічно описаному в п.А.1.) перетворенню, отримали 5,1г (78%) аніліну 51. Сумарна формула C11H8F 3N3; М.В. = 239,20; МС (М+Н) 240,1. D.11.2.) метиловий ефір (3-(К-феніл-М-4-трифторметилпіримідин-2-іл)-(аміно)-2-ди-трет.бутилоксикарбоніл)-аміно-пропіонової кислоти (52) З 2,5г (8,4ммоль) акрилату 13, 3г (12,5ммоль) аніліну 51 і 16г (50ммоль) карбонату цезію аналогічно описаному в п. D.3.1.) перетворенню, отримали 3,9г (86%) складного ефіру 52. Сумарна формула C25H31F3N4 O6 М.В. - 540, 54; МС (М+Н) 541,2. D.11.3.) Розділення енантіомерів здійснювали, як описано в п. В.2.1.) D.11.4.) метиловий ефір 8-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбоніл]-аміно}-3-[феніл-(4трифторметил-піримідин-2-іл)-аміно]-пропіонової кислоти (53) З 743мг (1,375ммоль) S-енантіомеру складного ефіру 52 і 550мг (1,436ммоль) кислоти 20 аналогічно описаному в п. D.3.3.) перетворенню, отримали 467мг (58%)53. Сумарна формула C29H25F3N8 O3 ; М.В. - 590,57; МС (М+Н) 591,7. D.11.5.) (8)-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбоніл]-аміно}-3-[феніл-(4-трифторметилпіримідин-2-іл)-аміно]-пропіонова кислота (54) З 97мг (0,164ммоль) складного ефіру 53 аналогічно описаному в п. D.10.1.) перетворенню, отримали 38мг (40%) кислоти 54. Сумарна формула C28H23F3N8 O3 ; М.В. = 576,54; МС (М+Н) 577,7. 1 H ЯМР (ДМСО-d6) 2,95 (с, 3Н), 4,27-4,34 (м, 1Н), 4,54-4,63 (м, 1H), 4,83-4,92 (м, 1H), 6,90 (уш.с, 1Н), 7,15 (д, 2Н), 7,19-7,23 (м, 1Н), 7,27-7,36 (м, 5Н), 7,45-7,55 (м, 2Н), 7,96 (с, 1Н), 8,32 (с, 1H), 8,41 (уш.с, 1Н), 8,66 (д, 1Н), 11,70 (с, 1Н). D.12.) {1-карбамоїл-2-[(4-фторфеніл)-(5-метил-піримідин-2-іл)-аміно]-етил}-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти (61) D.12.1.) пентафторфеніловий ефір 2-(2-метиламіно-піримідин-4-іл)-1Н-індол-5-карбонової кислоти (55) 6,38г (23,78ммоль) кислоти 20 суспендували в 100мл ТГФ. До цього додавали 5.25т (28,54ммоль) пентафторфенолу і 5,47г (28,54ммоль) гідрохлориду 1-етил-3-(3-диметиламінопропш)-карбодііміду (EDC*HCl). Витримували 15 годин при перемішуванні при кімнатній температурі, видалялирозчинник під вакуумом, і осад розподіляли між 300 мл насиченого розчину NaHCO3 і 300мл етилацетату. Тверду речовину відфільтровувати через кізельгур, і осад 2 рази промивали етилацетатом (по 100 мл). Фази розділяли, і водну фазу 2 рази екстрагували етилацетатом (по 100мл). Об'єднані органічні фази промивали 200мл насиченого розчину NaCl і потім сушили MgSO4 . Після видалення розчинника під вакуумом осад хроматографували на кізельгелі з елюентом гептан/етилацетат 1:1. Отримали 4,7г (46%) пентафторфенілового складного ефіру 55. Сумарна формула C20H11F5N4 O2 ; М. В. - 434,33; МС (М+Н) 435,4. D.12.2.) 2-хлор-5-метил-піримідин (57) 10,0г (61,35 ммоль) 2,4-дихлор-5-метилпіримідину (56) розчиняли в 50мл ТГФ. Додавали 12,93г (184ммоль) цинку і нагрівали із зворотним холодильником. Потім повільно прикапували розчин з 3,51мл (61,35ммоль) оцтової кислоти в 10мл ТГФ. Після закінчення додання ще 1 годину нагрівали із зворотним холодильником. Далі прикапували 1,5мл оцтової кислоти в 5мл ТГФ і 1 годину нагрівали із зворотним холодильником. Потім залишали охолоджуватися до кімнатної температури, фільтрували через кізельгур і промивали 2 рази, кожний раз по 20мл ТГФ. Розчинник відганяли під вакуумом, і осад хроматографували на кізельгелі. Отримали 4,7г (60%) хлорпіримідину 57. Сумарна формула C5H5ClN2; М.В. = 128,56; МС (М+Н) 129,2. D.12.3.) (4-фтор-феніл)-(5-метил-піримідин-2-іл)-амін (58) З 2,5г (19,45ммоль) 2-хлор-5-метилпіримідину (57) і 2,7г (24,31ммоль) 4-фтораніліну (1) аналогічно описаному в п. А.1.) перетворенню, отримали 1,8г (45%) аніліну 58. Сумарна формула C11H10FN3; M. В. = 203,22; МС (М+Н) 204,2. D.12.4.) метиловий ефір (3-(М-4-фтор-феніл-N-5-метил~піримідин-2-іл)-аміно)-2-ди-трет.бутилоксикарбоніл)-аміно-пропіонової кислоти (59) З 2,67г (8,86ммоль) акрилату 10, 1,8г (8,86ммоль) аніліну 58 і 8,66г (26,58ммоль) карбонату цезію аналогічно описаному в п. D.3.1.) перетворенню, отримали 2,88г (64%) складного ефіру 59. Сумарна формула C25H33FN4O 6; М.В. - 504,56; МС (М+Н) 505,6. D.12.5.) метиловий ефір 3-[(4-фтор-феніл)-(5-метил-піримідин-2-іл)-аміно]-2-{[2-(2-метиламіно-піримідин-4іл)-1Н-індол-5-карбоніл]-аміно}-пропіонової кислоти (60) 500мг (0,991ммоль) складного ефіру 59 розчиняли в 10мл дихлорметану і охолоджували до 0°С. До цього додавали 5 мл ТФА, витримували 1 годину при кімнатній температурі і перемішували. Видаляли розчинник під вакуумом. Осад поглинали 10 мл ДМФА і додавали 430мг (0,991ммоль) 55 і 1,38мл (7,93ммоль) DIEA. Перемішували протягом 15 години при кімнатній температурі, видаляли розчинник під вакуумом і осад хроматографували на кізельгелі з елюентом гептан/етилацетат 1:3. Отримали 423мг (77%) 60. Сумарна формула C29H27FN8O 3; М.В. = 554,59; МС (М+Н) 555,2. D.12.6.) {1-карбамоїл-2-[(4-фторфеніл)-(5-метил-піримідин-2-іл)-аміно]-етил}-амід 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти (61) З 260мг (0,469ммоль) складного ефіру 60 аналогічно описаному в п. D.2.2.) перетворенню, отримали 250 мг (99%) аміду 61. Сумарна формула C28H26FN9O 2; MB. = 539, 58; МС (М+Н) 540,2. 1 НЯМР (ДМСО-d6) 2,11 (с, 3Н), 2, 95 (с, 3Н), 4,21 (дд, 1Н), 4,48 (дд, 1H), 4,75-4,80 (м, 1Н), 7,01 (уш.с, 1H), 7,10-7,16 (м, 4H), 7,22-7,30 (м, 3Н), 7,43 (с, 1Н), 7,47-7,53 (м, 2H 7,91 (с, 1H), 8,26 (с, 2Н), 8,29-8,34 (м, 2Н), 11,70 (с, 1Н). F.) Цільовий продукт бензімідазол F.1.) ((8)1-карбамоїл-2-дифеніламіно-етил)амід 2-(2-метиламіно-піримідин-4-іл)-1Н-бензімідазол-5карбонової кислоти (63) F.1.1.) метиловий ефір 3-дифеніламіно-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-бензімідазол-5-карбоніл](8)-аміно}-пропіонової кислоти (62) 2,6г (9,6ммоль) 2-(2-метиламін-піримідин-4-іл)-1Н-бензімідазол-5-карбонової кислоти (25) розчиняли в 300мл ДМФА і послідовно додавали 3,17г (9,6ммоль) TOTU і 1,6мл (11,6ммоль) етилдіізопропіламіну. Перемішували 20хв. при 5°С і додавали до розчину 2,6г (9,6ммоль) метилового ефіру (S)-2-aMmo-3дифеніламіно-пропіонової кислоти (11). Після перемішування протягом 16 години концентрували при зниженому тиску, потім виділяли складний метиловий ефір 62 за допомогою флеш-хроматографії на кізельгелі фС М:метанол = 9:1). Вихід 1,61г (32%). Сумарна формула С29Н27К7О 3; М.В. = 521,58; МС (М+Н) 522,3. 1 H ЯМР (ДМСО-d6) 2,95 (с(уш.), 3Н), 3, 60 (с, 3Н), 4,19-4,40 (м, 2Н), 4,90 (кв, 1Н), 6,90-7,10 (м, 6Н), 7,257,35 (м, 6Н), 7,40 (д, J = 4,5 Гц, 1H), 7,60-7,80 (д(уш.), 1Н), 8,05-8,25 (д(уш.), 1Н), 8,45 (д, J = 3 Гц, 1Н), 8,90 (с(уш.), 1Н), 11,85 (с(уш.), 1Н). F.1.2.) ((8)1-карбамоїл-2-дифеніламіно-етил)амід 2-(2-метиламіно-піримідин-4-іл)-1Н-бензімідазол-5карбонової кислоти (63) 50мл метанолу (абсолют.) при 0°С насичували аміаком. До цього додавали 0,5г (0,959 ммоль) метилового ефіру 3-дифеніламіно-2-{[2-(2-метиламін-піримідин-4-іл)-1Н-бензімідазол-5-карбоніл]-(8)-аміно}-пропіонової кислоти (62) і 24 години перемішували при кімнатній температурі. Після випарювання розчинника і надлишкового аміаку виділяли амід 63 за допомогою флеш-хроматографії на кізельгелі (DСМ:метанол = 19:1). Вихід 0,43г (89%). Сумарна формула С29Н28N8О2 ; МС (М+Н) 507,2. 1 Н ЯМР (ДМСО-d6) 2,95 (с(уш.), 1Н), 4,02-4,35 (м, 2Н), 4,85 (кв, 1Н), 6,80-7,10 (м, 6Н), 7,15-7,25 (м, 5Н), 7,40 (д, J = 4,5 Гц, 1H), 7,58 (с(уш.), 1H), 7,68 (с(уш.), 1H), 8,06-8,19 (д(уш.), 1Н), 8,40-8,58 (м, 2Н), 13,10 (с, 1Н). F.2.) {1-карбамоїл-2-[(феніл)-піримідин-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)-1Нбензоімідазол-5-карбонової кислоти (65) F .2.1.) метиловий ефір 3 - [(феніл)-піридімідин-2-іл-аміно]-2- {[2-(2-метиламіно-піримідин-4-іл)-1Нбензімідазол-5-карбоніл]-аміно}-пропіонової кислоти (64) З 657мг 15 аналогічно описаному в п. D.2.1.) перетворенню, отримали 210мг (29%) складного метилового ефіру 64. Сумарна формула C27H25N9O3 ; М.В. = 523,56; МС (М+Н) 524,2. F.2.2.) {1-карбамоїл-2-[(феніл)-піримідин-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)-1Нбензімідазол-5-карбонової кислоти (65) З 200мг 64 аналогічно описаному в п. D.2.2.) перетворенню, отримали 110мг (65%) аміду 65. Сумарна формула C26H24FN10 O2 ; М.В. - 508, 55; МС (М+Н) 509,3. 1Н ЯМР (ДМСО-d6) 3 ,00 (с(уш.), 3Н), 4,20-4,32 (м, 1Н), 4,41-4,55(м, 2Н), 4,80-4,90 (м, 1H), 6,75 (м, 1H), 7,107,50 (м, 10Н), 7,65 (кв, 2Н), 8,10 (с, 1Н), -8,45 (д, 2Н), 8,50 (д, 1Н), 8,58 (д, 1Н), 12,95 (с(уш.), 1Н). F.3.) {1-карбамоїл-2-[(феніл)-піридил-2-іл-аміно]-етил}-амід 2-(2-метиламіно-піримідин-4-іл)-1Нбєнзімідазол-5-карбонової кислоти (67) F.3.1.) метиловий ефір 3-[(феніл)-піридил-2-іл-аміно]-2-{[2-(2-метиламіно-піримідин-4-іл)-1Н-бензімідазол5-карбоніл]-аміно}-пропіонової кислоти (66) З 3,44г 31 аналогічно описаному в п. D.2.1.) перетворенню, отримали 0,85г (22%) складного метилового ефіру 66. Сумарна формула C28H26N8O3 ; М.В. - 522,57; МС (М+Н) 523,3. F.3.2.) {1-карбамоїл-2-[(феніл)-піридил-2-іл-аміно]-етил}-амід 2-(2-метиламіно-тримідин-4-іл)-1Hбензімідазол-5-карбонової кислоти (67) З 200мг 66 аналогічно описаному в п. D.2.2.) перетворенню, отримали 160мг (98%) аміду 67. Сумарна формула C27H25N9O2 ; М.В. - 507,56; МС (М+НСОO-) 552,3. 1 H ЯМР (ДМСО-d6) 3,0 (с(уш.), 3Н), 4,20-4,32 (м, 1Н), 4,41-4,55 (м, 2Н), 4,70-4,80 (м, 1Н), 6,63 (м, 1Н), 6,85 (м, 1Н), 7,20-7,75 (м, 14Н), 8,10 (с, 1H), 8,20 (д, 2Н), 8,50 (д, 1H), 8,88 (д, 1H). Фармакологічні приклади Твердофазний імуноферментний аналіз (ELISA) ІкВ-кінази: Активність ІкВ-кінази визначали з допомогою ELISA, що складається з біотинільованого субстратного пептиду, який містить амінокислотну послідовність в протеїні ІкВ з серину 32 до 36, і специфічного полі- або моноклонального антитіла (наприклад, від New England Biolabs, Beverly, MA, USA, Kat: 9240), яке пов'язане тільки з фосфорильованою формою пептиду ІкВ. Цей комплекс імобілізовували на зв'язуючий антитіла планшет (з нашарованим протеїном А) і визначали з допомогою кон'югата з біотинзв'язуючого протеїну і пероксидази хріну (HRP) (наприклад, стрептавідин-HRP). Активність можна кількісно визначити відповідно до стандартнїю кривої з субстратним фосфопептидом. Проведення аналізу: Для отримання комплексу кінази 10мл HeLa S3-екстракту клітин S 100 розбавляли 40мл 50мМ HEPES, рН 7,5, вміщували в 40% сульфат амонію і інкубували на льоду протягом 30 хвилин. Осаджений гранулят розчиняли в 5мл SEC- буфера (50мМ HEPES, рН 7,5, 1мМ дитіотреітолу ДТТ (DTT), 0,5мМ етилендіамінтетраацетату ЕДТА (EDTA), 10мМ 2-гліцерофосфату), центрифугували при 20000 х g 15 хвилин і фільтрували через фільтр з порами 0,22мкм. Пробу подавали в 320мл Superose-б колонку ВЕРХ (FPLC) (Amersham Pharmacia Biotech AB, Uppsala, Schweden), яка була врівноважена SEC- буфером і діяла при 4°С з швидкістю потоку 2мл/хв. Фракції, час пробігу яких співпадав з часом пробігу стандартної молекулярної ваги 670кДа, з'єднували для активації. Активацію забезпечували за допомогою 45-хвилинної інкубації з 100нМ МЕКК1Д, 250мкМ Mg ATO, 10мМ MgCl2, 5мМ дитіотреітолу (ДТТ), 10мМ 2-гліцерофосфату, 2,5мкМ мікроцистину-LR при 37°С. Активований фермент зберігали при -80°С. Речовини (2мкл), що тестуються, розчинені в ДМСО, заздалегідь інкубували 30 хвилин при 25°С з 43мкл активованого ферменту (розбавлений 1:25 в реакційному буфері: 50мМ HEPES, рН 7,5, 10мМ MgCl2, 5мМ ДТТ, 10мМ b-гліцерофосфату, 2,5мкМ мікроцистину-LR). Потім додавали 5 мкл субстратного пептиду (6ioTHH(CH2)6-DRHDSGLDSMKD-CONH2) (200 мкМ), інкубували одну годину і припиняли процес за допомогою 150мкл 50мМ HEPES, рН 7,5, 0,1% бичачого сироваткового альбуміну БСА (BSA), 50мМ ЕДТА, антитіла [1:200]. 100мкл інгібованої реакційної суміші або розбавлений ряд стандартного фосфопептиду, (біотин-(CH2)6-DRHDS [PO3] GLDSMKD-CONH2) переносили потім на планшет з протеїном-А (Pierce Chemical Co., Rockford, IL, USA) і 2 години інкубували при струшуванні. Після 3-стадійного промивання субстратом, який зв'язує білок (PBS), додавали 100мкл 0,5мкг/мл стрептавідин- HRP (пероксидази хріну) (розбавленої в 50мМ HEPES/ 0,1% БСА) протягом 30 хвилин. Після 5-стадійного промивання PBS додавали 100мкл субстрату ТМВ (Kirkegaard & Perry Laboratories, Gaithersburg, MD, USA) і припиняли розвиток кольору доданням 100мкл 0,18 М сірчаної кислоти. Абсорбцію вимірювали при 450 нм. Стандартну криву отримували за допомогою лінійної регресії, відповідної 4-параметровому відношенню доза-результат. На основі цієї стандартної кривої кількісно визначали активність ферменту або його інгібування за допомогою речовин, що тестуються. Значення ІС50 [(S)-2-ди феніламін-1-(5-оксо-4,5-дигідро-[1,3,4]оксадіазол-2-іл)-етил]-аміду 2-(2-метиламінпіримідин-4-іл)-1Н-індол-5-карбонової кислоти становило 0,050 мкМ. Вміст в плазмі крові [(8)-2-дифеніламін-1-(5-оксо-4,5-дигідро-[1,3,4]оксадіазол-2-іл)-етил]-аміду 2-(2метиламш-піримідин-4-іл)-1Н-індол-5-карбонової кислоти. Сполука [(S)-2-дифеніламін-1-(5-оксо-4,5-дигідро-[1,3,4]оксадіазол-2-іл)-етил]-амід 2-(2-метиламінпіримідин-4-іл)-1H-індол-5-карбонової кислоти, яка надалі називається сполука 28, вводили чоловічим особням мишей C57/BL6. Для цього в кожному випадку вводили орально (через шлунковий зонд) близько 25 мг сполуки 28 на кг ваги тіла миші, розмолотого в 0,5% гідроксіетилцелюлози (НЕС) у вигляді суспензії. Витяг проб крові відбувався через 0,25; 0,5; 1; 2; 4; 6 і 8 годин (в кожний названий момент часу відбирали кров від 2 умертвлених тварин в кожному випадку). Проби крові перетворювали в гепарин-плазму. Проби плазми до аналізу зберігали при -20°С. Аналіз. Проби плазми відтавали. Потім протеши плазми, що заважають аналізу, осаджували ацетонітрилом. Обробка: 50мкл плазми+20мкл внутрішнього стандарту (5мкг/мл)+50мкл буфера (2мМоль розчину форміату амонію, рН 2,6/ацетонітрил, 40:60, об./об.) змішували близько 10 сек. на вихровому змішувачі. Потім додавали 150мкл ацетонітрилу і знову змішували близько 10сек. Потім проби центрифугували (Hettlich, EBA 12, близько 12000 обертів за хвилину). Надосадову рідину (близько 200мкл) переносили в скляну посудину. 70мкл надосадової рідини ін'єктували. З відповідної надосадової рідини визначали вміст сполуки 13 в плазмі за допомогою LC-MS/MS (рідинна хроматографія з мас-спектрометрією) за наступною методикою: Система ВЕРХ: Agilent 1100 Програмне забезпечення: Analyst Колонка: 125х4ммНуклеосил 120 5 С18 (Machery&Nagel) Довжина колонки: 125 мм Детектування: LC-MS/MS MS-прилад: PE-Sciex API 365 (триплет-квадрополярний мас-спектрометр) Програмне забезпечення: MasQuan Software (PE-Sciex) Рід детектування: MS/MS (MRM) Швидкість потоку: 0,5 мл/хв Об'єм ін'єкції: 70 мкл Внутрішній стандарт: SK-7 в ацетонітрилі Рухома фаза: ацетонітрил/2 мМоль розчину форміату амонію, рН 2,6 (70:30, об./об.) Час утримання (Rt): Внутрішній стандарт: 4,4хв. Сполука 28: 3,9хв. Межа достовірності методу становить 0,01мкг/мл. Результати: Вміст сполуки 28 в плазмі становив максимально 4,3мкг/мл. Експозиція, виміряна у вигляді площі (AUC) під кривою, становила 5,4мкг/мл х годину. Протеїнтирозинкіназа. Як приклад специфічності виявленого інгібування ІкВ-кінази визначали значення ІС 50 для ферменту протеїнтирозинкінази. Активність протеїнтирозинкінази визначали відповідним набором тестів від Upstate Biotechnologie згідно з розпорядженням виробника при концентрації АТФ (АТР) 50мкМ. Замість фосфоцелюлозного фільтра використали багатошарові планшети (Multi-Screen-Platten) (Millipore; фосфоцелюлоза МС-РН, Kat. MAPHNOB 10, або Durapore PVDF, Kat. MAD VNOB 50) з відповідною системою відсмоктування. Як субстратний набір тестів використали Poly (Glu, Tyr 4:1) (Sigma Kat. P0275), концентрація тестів 1мг/мл. Потім планшети вимірювали в Wallac MicroBeta сцинциляційному лічильнику. По мірі потреби використали 100мкМ речовини, що тестується. Кожну речовину, що тестується, тестували двічі. Визначення ІС50 проводили з програмним забезпеченням GraFit 3.0. ІС50 для [(8)-2-дифеніламін-1 -(5-оксо-4,5-дигідро-[ 1,3,4]оксадіазол-2-іл)-етил]-аміду 2-(2-метиламінопіримідин-4-іл)-1Н-індол-5-карбонової кислоти (сполука 28) складає в аналізі протеїнтирозинкінази 82,5мкМ. Порівняльний досвід: Сполуку отримували, як описано в [WO 01/30774] і надалі позначали як порівняльну сполуку. Порівняльну сполуку вводили чоловічим особням мишей NMRI. Для цього в кожному випадку вводили орально (через шлунковий зонд) близько 50мг порівняльної сполуки в 0,5% НЕС у вигляді суспензії (на кг ваги тіла миші). Відбір проб крові проводили через 0,25; 0,5; 1; 2; 4; 6 і 8 годин (в кожний названий момент часу відбирали кров від 2 умертвлених тварин в кожному випадку). Проби крові перетворювали в гепарин-плазму. Проби плазми до аналізу зберігали при -20°С. Аналіз. Аналіз проводили за допомогою ВЕРХ/УФ (HPLC/UV). Обробка: 50мкл плазми+20мкл внутрішнього стандарту (5мкг/мл)+50мкл буфера (1% мурашиної кислоти/ацетонітрил, 40:60, об./об.) змішували близько 10сек. на вихровому змішувачі. Потім додавали 150мкл ацетонітрилу і знову змішували близько 10сек. Потім проби центрифугували (Hettich, ЄВА 12, близько 12000 обертів за хвилину). Надосадову рідину (близько 200мкл) переносили в скляну посудину. 100мкл надосадової рідини вводили у вигляді ін'єкцій. Для відповідної надосадової рідини визначали вміст порівняльної сполуки в плазмі за допомогою ВЕРХ/УФ за наступною методикою: Система ВЕРХ: Gynkoteck P580 HPG-Pumpe+Gilson Abimed XL-231 Autosampler Програмне забезпечення: Mass-chrom Колонка: 125х4мм протосил 120 3 ODS AQ 3 (фірма Bischoff) Довжина колонки: 125мм Детектування: LC-MS/MS МС-прилад: PE-Sciex API 365 (триплет-квадрополярний мас-спектрометр) Програмне забезпечення: MasQuan Software (PE-Sciex) Рід детектування: MS/MS (MRM) Швидкість потоку: 0,5мл/хв Об'єм ін'єкції: 100мкл Внутрішній стандарт; SK-7 (фірма Aventis) в ацетонітрилі Рухома фаза: ацетонітрил/2 мМоль розчину форміату амонію, рН 2,6 (70:30, об ./об.) Час утримання (Rt): Внутрішній стандарт: 4хв. Порівняльна сполука: 1,5хв. Межа достовірності методу 0,01мкг/мл була ідентична такій же, визначеній за допомогою LC-MS/MS в прикладі зі сполукою 28. Результати: Вміст порівняльної сполуки в плазмі становив максимально 1,5мкг/мл. Експозиція, виміряна у вигляді площі (AUC) під кривою, становила 1,7мкг/мл х годину. У порівнянні з прикладом сполуки 28 максимальний вміст в плазмі крові був приблизно на 60% нижчий в порівняльному досвіді, хоча порівняльної сполуки було взято 50мг/кг в два рази більше, ніж сполуки 28. Аналогічний результат показала також усереднена величина AUC для порівняльної сполуки. Величина ІС50 для порівняльної сполуки складала у вищеописаному аналізі з протеїнтирозинкіназою 46,35 мкМ. Таким чином, ІС50 виразно краще, ніж для сполуки 28. Ще виразніше поліпшення специфічності по відношенню до ІкВ-кінази, якщо зіставляються співвідношення значення ІС50 протеїнтирозинкінази до ІкВ-кінази. Цей показник складає для сполуки 28 1650 (82,5/0,05) і для порівняльної сполуки 46,35 (46,35/1,0; згідно з [даними WO 01/30774]). Аналогічно було визначене співвідношення специфічності або рівень в плазмі і експозиція наступних прикладів: Приклад 28 30 33 35 36 42 43 45 47 49 54 61 63 65 67 Молекулярна формула нейтральної сполуки G30 Н26 N8 03 C28H25FN8O2 C29H25N9O3 C27H23FN8O2 C29H25FN10O C26H24N8O2S C29H28N8O3 С28 Н25 N7 02 C27H25N9O2 C31H31N7O3 C28H23F3N8O3 C28H26FN9O2 С28 Н26 N8 02 C26H24N10O2 C27H25N9O2 > означає краще, ніж... Молекулярна вага ІККІС5050 мкМ 546,59 524,56 547,58 510,54 548,59 512,60 536,60 491,55 507,56 549,63 576,54 539,58 506,57 508,55 507,56 0305 0,05 0,012 0,01 0,005 0,009 0,0008 0,015 0,006 0,035 0,003 0,006 0,003 0,004 0,002 Співвідношення специфічності 1650 >200 >833 >1000 >2000 >1110 >12500 >665 >1665 >285 >3330 >1650 >1000 >2500 >5000
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole or benzimidazole derivative as substances modulating ікв kinase
Автори англійськоюRitzeler Olaf, Jaehne Gerhard
Назва патенту російськоюПроизводные индола или бензимидазола для модуляции ікв -киназы
Автори російськоюРитцелер Олаф, Йэне Герхард
МПК / Мітки
МПК: A61P 19/02, A61P 33/00, A61P 19/06, C07D 417/04, A61P 19/08, A61P 29/00, A61P 35/00, A61P 1/02, A61P 37/06, A61P 31/18, A61P 1/04, A61P 37/00, C07D 403/04, A61P 3/10, A61P 31/12, A61P 21/00, A61P 31/00, C07D 401/14, A61P 19/04, A61P 25/28, A61K 31/506, A61P 43/00, C07D 417/14, A61P 11/00, C07D 403/14, C07D 413/14, A61P 17/06, C07D 403/12, A61P 9/10, A61P 9/02
Мітки: бензимідазолу, модуляції, похідні, індолу, ikb-кінази
Код посилання
<a href="https://ua.patents.su/17-78591-pokhidni-indolu-abo-benzimidazolu-dlya-modulyaci-ikb-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні індолу або бензимідазолу для модуляції ikb-кінази</a>
Попередній патент: Спосіб безперервної сортової прокатки
Наступний патент: Спосіб інактивації насіння бобових культур та пристрій для його здійснення
Випадковий патент: Живильник для сипучих матеріалів












