Синтез попередника інгібітора протеази
Формула / Реферат
1. Сполука формули (І) або її стереоізомер
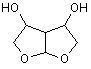 , (І)
, (І)
або її сольова форма.
2. Сполука за п. 1, яка відрізняється тим, що сполука являє собою один із наступних стереоізомерів
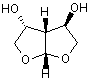 , (Іа)
, (Іа) 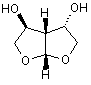 (Ib).
(Ib).
3. Спосіб одержання сполуки за п. 1 або 2, в якому піддають сполуку формули (II)
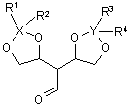 , (II)
, (II)
в якій
X і Y незалежно вибирають з Si і С; та
R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів;
R1 і R2 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R1-R2-;
R3 і R4 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R3-R4-;
умовам зняття захисту зі спирту та піддають одержану таким чином проміжну сполуку зі знятими захисними групами внутрішньомолекулярній циклізації із одержанням сполуки формули (І).
4. Спосіб за п. 3, який відрізняється тим, що агент, за допомогою якого знімають захист, вибирають із групи, що складається з реагентів гідрогенолізу, фторидвмісних реагентів, кислот та основ, переважно неорганічних та органічних кислот, найбільш переважно сульфокислот або карбонових кислот.
5. Спосіб за п. 3, який відрізняється тим, що зняття захисних груп здійснюють у водному розчині, що необов'язково містить один або більше органічних розчинників.
6. Спосіб за п. 3, який відрізняється тим, що додатково окиснюють сполуку формули (III)
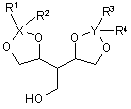 , (III)
, (III)
в якій
X і Y незалежно вибирають з Si і С; та
R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів;
R1 і R2 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R1-R2-;
R3 і R4 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R3-R4-;
із одержанням сполуки формули (II).
7. Спосіб за п. 6, який відрізняється тим, що окиснення здійснюють в умовах Сверна (Swern), Пфіцнера-Мофата (Pfitzner-Moffatt) або Паріха-Дерінга (Parikh-Doering).
8. Спосіб за п. 6, який відрізняється тим, що додатково гідроборують сполуку формули (IV)
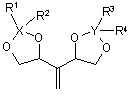 , (IV)
, (IV)
в якій
X і Y незалежно вибирають з Si і С; та
R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів;
R1 і R2 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R1-R2-;
R3 і R4 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R3-R4-;
та потім окиснюють одержану таким чином гідроборовану проміжну сполуку із одержанням сполуки формули (III).
9. Спосіб за будь-яким з пп. 3-8, який відрізняється тим, що X і Y є однаковими.
10. Спосіб за п. 9, який відрізняється тим, що X і Y являють собою С.
11. Спосіб за будь-яким з пп. 3-8, який відрізняється тим, що R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н, С1-20алкілу, С2-20алкенілу, С2-20алкоксіалкілу, С7-20алкоксіарилу, С2-20алкінілу, С3-30циклоалкілу, С4-30(циклоалкіл)алкілу, С4-30(циклоалкеніл)алкілу, С9-30(циклоалкініл)алкілу, С3-30циклоалкенілу, С4-30циклоалкінілу, С7-30арилалкілу, С7-30алкіларилу, С6-30арилу, С6-30гетероциклілалкілу, С6-30алкілгетероциклілу та С5-30гетероциклілу.
12. Спосіб за будь-яким з пп. 3-8, який відрізняється тим, що R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н, первинного або вторинного С1-6алкілу, С2-6алкенілу, С1-6алкоксіС1-6алкілу, С1-6алкоксіС5-10арилу, С5-7циклоалкілу, С5-11циклоалкілС1-6алкілу, С4-11циклоалкенілС1-6алкілу, С8-12циклоалкінілС1-6алкілу, С5-7циклоалкенілу, С5-7циклоалкінілу, С6-11арилС1-6алкілу, С1-6алкілС6-11арилу, С6-11арилу, С5-12гетероциклілС1-6алкілу, С1-6алкілС5-12гетероциклілу та С5-12гетероциклілу.
13. Спосіб за будь-яким з пп. 3-8, який відрізняється тим, що R1, R2, R3 і R4 є однаковими.
14. Спосіб за будь-яким з пп. 3-8, який відрізняється тим, що X і Y являють собою С та R1, R2, R3 і R4 є однаковими та їх вибирають з групи, що складається з метилу, етилу, н-пропілу, втор-пропілу, н-бутилу, втор-бутилу, трет-бутилу, бензилу, фенілу та метоксифенілу.
15. Проміжна сполука формули (II) або її стереоізомер
 , (II)
, (II)
в якій
X і Y незалежно вибирають з Si і С; та
R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів;
R1 і R2 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R1-R2-;
R3 і R4 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R3-R4-;
або її сольова форма.
16. Сполука за п. 15, яка відрізняється тим, що являє собою один з наступних стереоізомерів
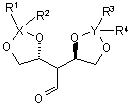 , (IIa)
, (IIa) 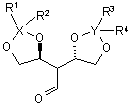 (IIb).
(IIb).
17. Сполука за п. 15 або 16, яка відрізняється тим, що X і Y є однаковими.
18. Сполука за п. 17, яка відрізняється тим, що X і Y являють собою С.
19. Сполука за п. 15 або 16, яка відрізняється тим, що R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н, С1-20алкілу, С2-20алкенілу, С2-20алкоксіалкілу, С7-20алкоксіарилу, С2-20алкінілу, С3-30циклоалкілу, С4-30(циклоалкіл)алкілу, С4-30(циклоалкеніл)алкілу, С9-30(циклоалкініл)алкілу, С3-30циклоалкенілу, С4-30циклоалкінілу, С7-30арилалкілу, С7-30алкіларилу, С6-30арилу, С6-30гетероциклілалкілу, С6-30алкілгетероциклілу та С6-30гетероциклілу.
20. Сполука за п. 15 або 16, яка відрізняється тим, що R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н, первинного або вторинного С1-6алкілу, С2-6алкенілу, С1-6алкоксіС1-6алкілу, С1-6алкоксіС5-10арилу, С5-7циклоалкілу, С5-11циклоалкілС1-6алкілу, С4-11циклоалкенілС1-6алкілу, С8-12циклоалкінілС1-6алкілу, С5-7циклоалкенілу, С5-7диклоалкінілу, С6-11арилС1-6алкілу, С1-6алкілС6-11арилу, С6-11арилу, С5-12гетероциклілС1-6алкілу, С1-6алкілС5-12гетероциклілу та С5-12гетероциклілу.
21. Сполука за п. 15 або 16, яка відрізняється тим, що R1, R2, R3 і R4 є однаковими.
22. Сполука за п. 15 або 16, яка відрізняється тим, що X і Y являють собою С та R1, R2, R3 і R4 є однаковими та їх вибирають з групи, що складається з метилу, етилу, н-пропілу, втор-пропілу, н-бутилу, втор-бутилу, трет-бутилу, бензилу, фенілу та метоксифенілу.
23. Проміжна сполука формули (III) або її стереоізомер
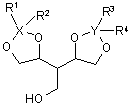 , (III)
, (III)
в якій
X і Y незалежно вибирають з Si і С; та
R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів;
R1 і R2 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R1-R2-;
R3 і R4 можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позначається -R3-R4-;
або її сольова форма.
24. Сполука за п. 23, яка відрізняється тим, що являє собою один із наступних стереоізомерів
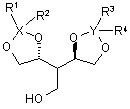 , (IIIa)
, (IIIa) 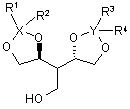 (IIIb).
(IIIb).
25. Сполука за п. 23 або 24, яка відрізняється тим, що X і Y є однаковими.
26. Сполука за п. 25, яка відрізняється тим, що X і Y являють собою С.
27. Сполука за п. 23 або 24, яка відрізняється тим, що R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н, С1-20алкілу, С2-20алкенілу, С2-20алкоксіалкілу, C7-20алкоксіарилу, С2-20алкінілу, С3-30циклоалкілу, С4-30(циклоалкіл)алкілу, С4-30(циклоалкеніл)алкілу, С9-30(циклоалкініл)алкілу, С3-30циклоалкенілу, С4-30циклоалкінілу, С7-30арилалкілу, С7-30алкіларилу, С6-30арилу, С6-30гетероциклілалкілу, С6-30алкілгетероциклілу та С5-30гетероциклілу.
28. Сполука за п. 23 або 24, яка відрізняється тим, що R1, R2, R3 і R4 незалежно вибирають із групи, що складається з -Н, первинного або вторинного С1-6алкілу, С2-6алкенілу, С1-6алкоксіС1-6алкілу, С1-6алкоксіС5-10арилу, С5-7циклоалкілу, С5-11циклоалкілС1-6алкілу, С4-11циклоалкенілС1-6алкілу, С8-12циклоалкінілС1-6алкілу, С5-7циклоалкенілу, C5-7циклоалкінілу, С6-11арилС1-6алкілу, C1-6алкілС6-11арилу, С6-11арилу, С5-12гетероциклілС1-6алкілу, С1-6алкілС5-12гетероциклілу та С5-12гетероциклілу.
29. Сполука за п. 23 або 24, яка відрізняється тим, що R1, R2, R3 і R4 є однаковими.
30. Сполука за п. 23 або 24, яка відрізняється тим, що X і Y являють собою С та R1, R2, R3 і R4 є однаковими та їх вибирають з групи, що складається з метилу, етилу, н-пропілу, втор-пропілу, н-бутилу, втор-бутилу, трет-бутилу, бензилу, фенілу та метоксифенілу.
Текст
1. Сполука формули (І) або її стереоізомер HO OH 2 3 R1 X O R3 R2 O O Y R4 O HO , (III) в якій X і Y незалежно вибирають з Si і С; та 1 2 3 4 R , R , R і R незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів; 1 2 R і R можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що познача1 2 ється -R -R -; 3 4 R і R можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що познача3 4 ється -R -R -; із одержанням сполуки формули (II). 7. Спосіб за п. 6, який відрізняється тим, що окиснення здійснюють в умовах Сверна (Swern), Пфіцнера-Мофата (Pfitzner-Moffatt) або Паріха-Дерінга (Parikh-Doering). 8. Спосіб за п. 6, який відрізняється тим, що додатково гідроборують сполуку формули (IV) R1 R3 R2 X Y R4 O O O O , (IV) в якій X і Y незалежно вибирають з Si і С; та 1 2 3 4 R , R , R і R незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів; 1 2 R і R можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що познача1 2 ється -R -R -; 3 4 R і R можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що познача3 4 ється -R -R -; та потім окиснюють одержану таким чином гідроборовану проміжну сполуку із одержанням сполуки формули (III). 9. Спосіб за будь-яким з пп. 3-8, який відрізняється тим, що X і Y є однаковими. 10. Спосіб за п. 9, який відрізняється тим, що X і Y являють собою С. 11. Спосіб за будь-яким з пп. 3-8, який відрізня1 2 3 4 ється тим, що R , R , R і R незалежно вибирають із групи, що складається з -Н, С1-20алкілу, С2С2-20алкоксіалкілу, С7-20алкоксіарилу, 20алкенілу, С2-20алкінілу, С3-30циклоалкілу, С430(циклоалкіл)алкілу, С4-30(циклоалкеніл)алкілу, С9С3-30циклоалкенілу, С430(циклоалкініл)алкілу, 30циклоалкінілу, С7-30арилалкілу, С7-30алкіларилу, С6-30арилу, С6-30гетероциклілалкілу, С630алкілгетероциклілу та С5-30гетероциклілу. 12. Спосіб за будь-яким з пп. 3-8, який відрізня1 2 3 4 ється тим, що R , R , R і R незалежно вибирають із групи, що складається з -Н, первинного або вторинного С1-6алкілу, С2-6алкенілу, С1-6алкоксіС1 94391 4 6алкілу, С1-6алкоксіС5-10арилу, С5-7циклоалкілу, С5С4-11циклоалкенілС1С8-12циклоалкінілС1-6алкілу, С56алкілу, С5-7циклоалкінілу, С6-11арилС17циклоалкенілу, С1-6алкілС6-11арилу, С6-11арилу, С56алкілу, С1-6алкілС512гетероциклілС1-6алкілу, 12гетероциклілу та С5-12гетероциклілу. 13. Спосіб за будь-яким з пп. 3-8, який відрізня1 2 3 4 ється тим, що R , R , R і R є однаковими. 14. Спосіб за будь-яким з пп. 3-8, який відрізня1 2 3 ється тим, що X і Y являють собою С та R , R , R 4 і R є однаковими та їх вибирають з групи, що складається з метилу, етилу, н-пропілу, вторпропілу, н-бутилу, втор-бутилу, трет-бутилу, бензилу, фенілу та метоксифенілу. 15. Проміжна сполука формули (II) або її стереоізомер R1 R3 R2 X Y R4 O O O O 11циклоалкілС1-6алкілу, O , (II) в якій X і Y незалежно вибирають з Si і С; та 1 2 3 4 R , R , R і R незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів; 1 2 R і R можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що познача1 2 ється -R -R -; 3 4 R і R можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що познача3 4 ється -R -R -; або її сольова форма. 16. Сполука за п. 15, яка відрізняється тим, що являє собою один з наступних стереоізомерів R1 R3 R2 X O O O Y R4 O O R1 X O , (IIa) R3 R2 O O O Y R4 O (IIb). 17. Сполука за п. 15 або 16, яка відрізняється тим, що X і Y є однаковими. 18. Сполука за п. 17, яка відрізняється тим, що X і Y являють собою С. 19. Сполука за п. 15 або 16, яка відрізняється 1 2 3 4 тим, що R , R , R і R незалежно вибирають із групи, що складається з -Н, С1-20алкілу, С2С2-20алкоксіалкілу, С7-20алкоксіарилу, 20алкенілу, С2-20алкінілу, С3-30циклоалкілу, С430(циклоалкіл)алкілу, С4-30(циклоалкеніл)алкілу, С9 5 30(циклоалкініл)алкілу, С3-30циклоалкенілу, С430циклоалкінілу, С7-30арилалкілу, С7-30алкіларилу, С6-30арилу, С6-30гетероциклілалкілу, С630алкілгетероциклілу та С6-30гетероциклілу. 20. Сполука за п. 15 або 16, яка відрізняється 1 2 3 4 тим, що R , R , R і R незалежно вибирають із групи, що складається з -Н, первинного або вторинного С1-6алкілу, С2-6алкенілу, С1-6алкоксіС16алкілу, С1-6алкоксіС5-10арилу, С5-7циклоалкілу, С5С4-11циклоалкенілС111циклоалкілС1-6алкілу, С8-12циклоалкінілС1-6алкілу, С56алкілу, С5-7диклоалкінілу, С6-11арилС17циклоалкенілу, С1-6алкілС6-11арилу, С6-11арилу, С56алкілу, С1-6алкілС512гетероциклілС1-6алкілу, 12гетероциклілу та С5-12гетероциклілу. 21. Сполука за п. 15 або 16, яка відрізняється 1 2 3 4 тим, що R , R , R і R є однаковими. 22. Сполука за п. 15 або 16, яка відрізняється 1 2 3 4 тим, що X і Y являють собою С та R , R , R і R є однаковими та їх вибирають з групи, що складається з метилу, етилу, н-пропілу, втор-пропілу, нбутилу, втор-бутилу, трет-бутилу, бензилу, фенілу та метоксифенілу. 23. Проміжна сполука формули (III) або її стереоізомер R1 R3 R2 X O O O Y R4 O HO , (III) в якій X і Y незалежно вибирають з Si і С; та 1 2 3 4 R , R , R і R незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів; 1 2 R і R можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що познача1 2 ється -R -R -; 3 4 R і R можуть бути взяті разом і утворювати двовалентний вуглеводневий радикал, що познача3 4 ється -R -R -; або її сольова форма. 24. Сполука за п. 23, яка відрізняється тим, що являє собою один із наступних стереоізомерів Даний винахід відноситься до сполук і способів їх одержання, які застосовуються для одержання інгібіторів протеази, зокрема, інгібіторів протеази ВІЛ широкого спектра. ВІЛ-інфекція залишається важливою медичною проблемою. Доступні в даний час лікарські засоби для лікування ВІЛ включають нуклеозидні інгібітори зворотної транскриптази (ЗТ), ненуклеозидні інгібітори зворотної транскриптази, а також пептидоміметики - інгібітори протеази. Кожний із зазначених лікарських засобів може тільки тимча 94391 6 R1 X O R3 R2 O O Y R4 O HO R1 X O , (IIIa) R3 R2 O O Y R4 O HO (IIIb). 25. Сполука за п. 23 або 24, яка відрізняється тим, що X і Y є однаковими. 26. Сполука за п. 25, яка відрізняється тим, що X і Y являють собою С. 27. Сполука за п. 23 або 24, яка відрізняється 1 2 3 4 тим, що R , R , R і R незалежно вибирають із групи, що складається з -Н, С1-20алкілу, С2С2-20алкоксіалкілу, C7-20алкоксіарилу, 20алкенілу, С2-20алкінілу, С3-30циклоалкілу, С430(циклоалкіл)алкілу, С4-30(циклоалкеніл)алкілу, С9С3-30циклоалкенілу, С430(циклоалкініл)алкілу, 30циклоалкінілу, С7-30арилалкілу, С7-30алкіларилу, С6-30арилу, С6-30гетероциклілалкілу, С630алкілгетероциклілу та С5-30гетероциклілу. 28. Сполука за п. 23 або 24, яка відрізняється 1 2 3 4 тим, що R , R , R і R незалежно вибирають із групи, що складається з -Н, первинного або вторинного С1-6алкілу, С2-6алкенілу, С1-6алкоксіС16алкілу, С1-6алкоксіС5-10арилу, С5-7циклоалкілу, С5С4-11циклоалкенілС111циклоалкілС1-6алкілу, С8-12циклоалкінілС1-6алкілу, С56алкілу, C5-7циклоалкінілу, С6-11арилС17циклоалкенілу, C1-6алкілС6-11арилу, С6-11арилу, С56алкілу, С1-6алкілС512гетероциклілС1-6алкілу, 12гетероциклілу та С5-12гетероциклілу. 29. Сполука за п. 23 або 24, яка відрізняється 1 2 3 4 тим, що R , R , R і R є однаковими. 30. Сполука за п. 23 або 24, яка відрізняється 1 2 3 4 тим, що X і Y являють собою С та R , R , R і R є однаковими та їх вибирають з групи, що складається з метилу, етилу, н-пропілу, втор-пропілу, нбутилу, втор-бутилу, трет-бутилу, бензилу, фенілу та метоксифенілу. сово придушувати вірусну реплікацію, якщо застосовується сам по собі. Недостатня активність лікарського засобу, неузгодженість, обмежене проникнення в тканини та обмеження за специфічністю лікарського засобу в межах визначених типів клітин може пояснювати неповну супресію чуттєвих вірусів. Крім того, ВІЛ є у високому ступені гетерогенним вірусом. Клінічна значимість зазначеної гетерогенності виявляється завдяки здатності вірусу уникати імунологічного впливу, переносити селек 7 тивний вплив лікарських засобів і адаптуватися до різних типів клітин та умов росту. Тому, різноманітність є основною перешкодою для фармакологічного або імунологічного контролю інфекції вірусу імунодефіциту людини. Одним з вирішальних етапів у життєвому циклі ретровірусу є процесинг білкових попередників за допомогою аспарагінової протеази. Так, наприклад, у випадку вірусу ВІЛ білок gag-pol піддається процесингу протеазою ВІЛ. Коректний процесинг білкових попередників за допомогою аспарагінової протеази необхідний для збірки інфекційного віріона, у такий спосіб роблячи аспарагінову протеазу привабливою мішенню для противірусної терапії. Зокрема, для лікування ВІЛ протеаза ВІЛ є привабливою мішенню. Інгібітори протеази ВІЛ (ІП) звичайно вводяться пацієнтам зі СНІДом у поєднанні з іншими сполуками проти ВІЛ, такими як, наприклад, нуклеозидні інгібітори зворотної транскриптази (НІЗТ), ненуклеозидні інгібітори зворотної транскриптази (НнІЗТ), нуклеотидні інгібітори зворотної транскриптази (НІЗТ) або інші інгібітори протеази. Незважаючи на той факт, що зазначені засоби проти ретровірусів є дуже корисними, вони мають загальне обмеження, а саме, ферменти-мішені вірусу ВІЛ здатні видозмінюватися таким чином, що відомі лікарські засоби стають менш ефективними або навіть неефективними проти зазначених видозмінених вірусів ВІЛ. Або, іншими словами, вірус ВІЛ здобуває навіть підвищену резистентність проти загальнодоступних лікарських засобів. У пошуках сполук, що здатні задовольняти потреби медицини при лікуванні ВІЛ, були одержані сульфаніламідні похідні загальної формули (А) та було виявлено, що вони мають широкий вірусологічний діапазон із незначним коливанням у ступені резистентності, тобто розходження в активності вірусного інгібування у випадку ВІЛ дикого типу і мутантних штамів ВІЛ (WO 2004003817, WO 2003106461, WO 2003097616, WO 2003090691, WO 2003090690, WO 2003078438, WO 2003076413, WO 2003070976, WO 2003064406, WO 2003057173, WO 2003053435, WO 2003049746, EP 1265073, WO 2002092595, WO 2002083657, WO 2002081478, WO 2001025240, WO 9967417, WO 9967254, Ohtaka et al. Protein Science (2002), 11(8), 1908-1916, Gatanaga et al. Journal of Biological Chemistry (2002), 277(8), 9525961, Ghosh et al. Antiviral Research (2002), 54(1), 29-36, Yoshimura et al. Journal of Virology (2002), 76(3), 1349-1358, Ghosh et al. Farmaco (2001), 56(12), 29-32, Ghosh et al. Bioorganic & Medicinal Chemistry Letters (1998), 8(6), 687-690). 94391 8 Незважаючи на отримані результати в рівні техніки, існує безперервна потреба в поліпшенні інгібіторів протеази ВІЛ. Такі поліпшені інгібітори протеази ВІЛ можуть бути одержані, якщо досягнення медичної хімії уможливлюють одержання хімічних варіантів. Сполуки загальної формули (А) одержують у рівні техніки шляхом реакції сполучення із застосуванням гексагідрофуро[2,3b]фуран-3-олу як проміжної сполуки. Подальше дослідження фармакофору гексагідрофуро[2,3b]фурану як сполуки-основи для нових та поліпшених інгібіторів протеази ВІЛ дотепер було обмежено, оскільки недостатньо знань, як одержати варіанти заміщення гексагідрофуро[2,3-b]фуран-3олу. Відповідно до першого аспекту, даний винахід відноситься до сполуки структури (І), включаючи стереоізомери і солі. У відповідності з другим аспектом, даний винахід відноситься до сполуки формули (II), включаючи стереоізомери і солі, в якій X і Y незалежно вибирають із Si і С; та 1 2 3 4 R , R , R і R незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів. Відповідно до третього аспекту, даний винахід відноситься до сполуки формули (III), включаючи стереоізомери і солі, в якій X і Y незалежно вибирають із Si і С; та 1 2 3 4 R , R , R і R незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів. Відповідно до четвертого аспекту, даний винахід відноситься до сполуки формули (IV), включаючи стереоізомери і солі, в якій 9 X і Y незалежно вибирають із Si і С; та 1 2 3 4 R , R , R і R незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів. Відповідно до п'ятого аспекту, даний винахід відноситься до способу одержання сполуки структури (І), що включає введення сполуки формули (II) в умови зняття захисту із спирту, та одержана таким чином проміжна сполука із знятими захисними групами піддається внутрішньомолекулярній циклізації. Відповідно до шостого аспекту, даний винахід відноситься до способу одержання сполуки формули (II), що включає окиснення сполуки формули (III). Відповідно до сьомого аспекту, даний винахід відноситься до способу одержання сполуки формули (III), що включає гідроборування сполуки формули (IV) та наступне окиснення одержаної таким чином гідроборованої проміжної сполуки. Відповідно до восьмого аспекту, даний винахід відноситься до способу одержання сполуки формули (IV), що включає взаємодію сполуки формули (V) або її стереоізомеру або солі, в якій X і Y незалежно вибирають із Si і С; та 1 2 3 4 R , R , R і R незалежно вибирають із групи, що складається з -Н та одновалентних вуглеводневих радикалів; з реагентом типу Вітига. У вищезгаданих сполуках формули (II), (III), 1 2 (IV) та (V) R і R можуть також бути взяті разом і утворювати двовалентний вуглеводневий ради1 2 кал, що позначається -R -R -. Аналогічно цьому, 3 4 R і R можуть також бути взяті разом і утворювати двовалентний вуглеводневий радикал, що позна3 4 чається -R -R -. Термін «стереоізомер» відноситься до представника групи сполук, що мають однакову молекулярну формулу (однакове число та тип атомів) і однакове поєднання, але які відрізняються розташуванням атомів у просторі. Стереоізомери включають енантіомери та діастереомери. Термін «одновалентний вуглеводневий радикал», що використовується в даного описі, відноситься до будь-якого одновалентного циклічного, гетероциклічного, лінійного, розгалуженого, насиченого або ненасиченого радикалу, що має основний вуглецевий ланцюг, що містить один або більше атомів водню, необов'язково з одним або 94391 10 більше гетероатомами в основному вуглецевому ланцюзі. Термін «одновалентний вуглеводневий радикал» призначений включати терміни «алкіл», «алкеніл», «алкініл», «циклоалкіл», «циклоалкеніл», «циклоалкініл», «алкоксіалкіл», «алкоксіарил», «(циклоалкіл)алкіл», «(циклоалкеніл)алкіл», «(циклоалкініл)алкіл», «гетероциклілалкіл», «алкілгетероцикліл», «гетероцикліл», «алкіларил», «арилалкіл» та «арил», визначені нижче. Термін «алкіл», що використовується в даному описі як група або частина групи, відноситься до лінійного або розгалуженого насиченого одновалентного вуглеводневого радикалу із зазначеним числом атомів вуглецю, необов'язково заміщеного галогеном. Наприклад, С1-3алкіл, як група або частина групи, означає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 1-3 атоми вуглецю, такі як метил, дифторметил, етил, 1-хлоретил, пропіл, 1-метилетил та т.п.; С1-4алкіл, як група або частина групи, означає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 1-4 атомів вуглецю, такі як група, описана для С1-3алкілу, та бутил, 2-бромбутил та т.п.; С2-4алкіл, як група або частина групи, означає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 2-4 атомів вуглецю, такі як етил, пропіл, 2хлорпропіл, 1-метилетил, бутил та т.п.; С1-6алкіл, як група або частина групи, означає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 1-6 атомів вуглецю, такі як групи, визначені для С1-4алкілу, і пентил, гексил, 2метилбутил, 2-хлор-1-метилбутил та т.п.; С1-9алкіл, як група або частина групи, означає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 1-9 атомів вуглецю, такі як групи, визначені для С1-6алкілу, і гептил, 3фторгептил, октил, ноніл, 2-метилгексил, 2метилгептил, децил та т.п.; С1-10алкіл, як група або частина групи, означає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 1-10 атомів вуглецю, такі як групи, визначені для C1-9алкілу, і децил, 2-метилноніл, 4бромдецил та т.п.; С1-20алкіл, як група або частина групи, означає вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 1-20 атомів вуглецю, такі як групи, визначені для С110алкілу, і ундецил, додецил, 2-етил-3-хлор до децил та т.п. Термін «алкеніл», що використовується в даному описі як група або частина групи, відноситься до лінійного або розгалуженого ненасиченого одновалентного вуглеводневого радикалу із зазначеним числом атомів вуглецю та характерною особливістю подвійним вуглець-вуглецевим зв'язком. Наприклад, термін «С2-3алкеніл», як група або частина групи, означає вуглеводневі радикали з 23 атомами вуглецю, що містять не менше, ніж один подвійний зв'язок, наприклад, етеніл, пропеніл та т.п.; термін «С2-5алкеніл», як група або частина групи, означає вуглеводневі радикали з 2-5 атомами вуглецю, що містять не менше, ніж один подвійний зв'язок, такі як групи, визначені для С23алкенілу, бутеніл, пентеніл та т.п.; термін «С 26алкеніл», як група або частина групи, означає 11 вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 2-5 атомів вуглецю, що містять не менше, ніж один подвійний зв'язок, такі як групи, визначені для С2-5алкенілу, гексеніл та т.п.; «С2-20алкеніл» являє собою вуглеводневий радикал з лінійним або розгалуженим ланцюгом, що має 2-20 атомів вуглецю і не менше, ніж один подвійний вуглець-вуглецевий зв'язок. Термін «алкініл», що використовується в даному описі як група або частина групи, відноситься до лінійного або розгалуженого ненасиченого або частково ненасиченого одновалентного вуглеводневого радикалу із зазначеним числом атомів вуглецю та характерною особливістю потрійним вуглець-вуглецевим зв'язком. Наприклад, термін «С23алкініл», як група або частина групи, означає вуглеводневі радикали з 2-3 атомами вуглецю, що містять не менше, ніж один потрійний зв'язок, такі як, наприклад, етиніл, пропініл та т.п.; термін «С25алкініл», як група або частина групи, означає вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 2-5 атомів вуглецю, що містять не менше, ніж один потрійний зв'язок, такі як групи, визначені для С2-3алкінілу, бутініл, пентініл та т.п.; термін «С2-6алкініл», як група або частина групи, означає вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають 2-6 атомів вуглецю, що містять не менше, ніж один потрійний зв'язок, такі як групи, визначені для С2-5алкінілу, гексініл та т.п.; «С2-20алкініл», являє собою вуглеводневий радикал з лінійним або розгалуженим ланцюгом, що має 2-20 атомів вуглецю і не менше, ніж один потрійний вуглець-вуглецевий зв'язок. Термін «циклоалкіл», що використовується в даному описі як група або частина групи, відноситься до циклічного насиченого одновалентного вуглеводневого радикалу із зазначеним числом атомів вуглецю. Наприклад, термін «С36циклоалкіл», як група або частина групи, є характерним для циклопропілу, циклобутилу, циклопентилу, циклогексилу; термін «С3-7циклоалкіл», як група або частина групи, є характерним для циклопропілу, циклобутилу, циклопентилу, циклогексилу, циклогептилу; «С3-30циклоалкіл» являє собою циклічний насичений одновалентний вуглеводневий радикал з 3-30 атомами вуглецю. Терміни «циклоалкеніл» та «циклоалкініл», що використовуються в даному описі як група або частина групи, відносяться до циклічного ненасиченого або частково ненасиченого одновалентного вуглеводневого радикалу. Циклоалкеніл характеризується не менше, ніж одним вуглецьвуглецевим подвійним зв'язком, а циклоалкініл характеризується не менше, ніж одним вуглецьвуглецевим потрійним зв'язком. Наприклад, «С330циклоалкеніл» являє собою циклічний ненасичений одновалентний вуглеводневий радикал з 3-30 атомами вуглецю і не менше, ніж одним вуглецьвуглецевим подвійним зв'язком. Крім того, наприклад, «С8-30циклоалкініл» являє собою циклічний ненасичений або частково ненасичений одновалентний вуглеводневий радикал з 8-30 атомами вуглецю і не менше, ніж одним вуглецьвуглецевим потрійним зв'язком. Термін «арил», що використовується в даному 94391 12 описі як група або частина групи, відноситься до циклічного ароматичного одновалентного вуглеводневого радикалу, такого як феніл та нафтил, необов'язково заміщеного одним або більше замісниками, такими як, наприклад, алкільна група, алкоксильна група або алкандіїльна група. Типовий приклад арилу, заміщеного алкандіїльною групою, остання визначається як двовалентна алкільна група, являє собою, наприклад, індан. Оскільки арильна група містить більше одного кільця, кільця можуть бути конденсованими, біциклічними або заміщеними фенілом, наприклад, біфеніл також призначений для включення у визначення арилу. Виходячи з вищенаведеного визначення, слід уточнити, що ароматична група в цілому необов'язково повинна бути ароматичною, але вона містить не менше, ніж одну ароматичну групу, таку як, наприклад, індан. Також, наприклад, «С630арил» являє собою циклічний ароматичний вуглеводневий радикал з 6-30 атомами вуглецю. Термін «гетероцикліл», що використовується в даному описі як група або частина групи, відноситься до циклічного насиченого, частково насиченого або ароматичного одновалентного вуглеводневого радикалу, що має не менше, ніж один гетероатом в основному ланцюзі такого циклічного вуглеводню, необов'язково заміщеного одним або більше замісниками, такими як, наприклад, алкільна група або алкілоксигрупа. Приклади гетероциклів включають, але не обмежуючи ними, дигідроізоксазоліл, фураніл, піридил, фталімідо, тієніл, піроліл, імідазоліл, піразоліл, тіазоліл, ізотіазоліл, оксазоліл, піролідиніл, піролініл, імідазолідиніл, імідазолініл, піразолідиніл, тетрагідрофураніл, піраніл, піроніл, піразиніл, пірадазиніл, піперидиніл, піперазиніл, морфолініл, тіонафтил, бензофураніл, ізобензофурил, індоліл, оксііндоліл, ізоіндоліл, індазоліл, індолініл, 7-азаіндоліл, ізоіндазоліл, бензопіраніл, кумариніл, ізокумариніл, хіноліл, ізохіноліл, нафтиридиніл, цинолініл, хіназолініл, піридопіридил, бензоксазиніл, хіноксадиніл, хроменіл, хроманіл, ізохроманіл, карболініл та т.п. Також, як приклад, «С5-30гетероцикліл» являє собою циклічний ароматичний або неароматичний вуглеводневий радикал, що має не менше, ніж один гетероатом в основному ланцюзі зазначеного циклічного вуглеводню і що має 5-30 атомів вуглецю в циклічному вуглеводні. Як зазначено у визначеннях, терміни, описані вище, можуть застосовуватися як частина більшої групи. Наприклад, термін «(циклоалкіл)алкіл», що використовується в даному описі, відноситься до алкільної групи з циклоалкільним замісником. Приєднання відбувається через алкільну групу. Такі групи мають зазначене число атомів вуглецю. Наприклад, «С4-30(циклоалкіл)алкіл» відноситься до алкільної групи з циклоалкільним замісником, де загальне число атомів вуглецю в (циклоалкіл)алкільній групі знаходиться в діапазоні між 4 і 30. Інший приклад включає С5-11циклоалкілС16алкіл і відноситься до С1-6алкільної групи з С511циклоалкільним замісником. Термін «(циклоалкеніл)алкіл», що використовується в даному описі, відноситься до алкільної 13 групи з циклоалкенільним замісником. Приєднання відбувається через алкільну групу. Такі групи мають зазначене число атомів вуглецю. Наприклад, «С4-30(циклоалкеніл)алкіл» відноситься до алкільної групи з циклоалкенільним замісником, де загальне число атомів вуглецю в (циклоалкеніл)алкільній групі знаходиться в діапазоні між 4 і 30. Інший приклад включає С5-11циклоалкенілС16алкіл і відноситься до С1-6алкільної групи з С 511циклоалкенільним замісником. Термін «(циклоалкініл)алкіл», що використовується в даному описі, відноситься до алкільної групи з циклоалкінільним замісником. Приєднання відбувається через алкільну групу. Такі групи мають зазначене число атомів вуглецю. Наприклад, «С9-30(циклоалкініл)алкіл» відноситься до алкільної групи з циклоалкінільним замісником, де загальне число атомів вуглецю в (циклоалкініл)алкільній групі знаходиться в діапазоні між 9 і 30. Інший приклад включає С8-11циклоалкінілС1-6алкіл і відноситься до С1-6алкільної групи з С811циклоалкінільним замісником. Термін «алкоксіалкіл», що використовується в даному описі, відноситься до алкільної групи, що має алкокси (також названий алкілокси) замісник. Приєднання відбувається через алкільну групу. Алкільна група і/або алкокси-група мають зазначене число атомів вуглецю. Наприклад, «С220алкоксіалкіл» відноситься до алкільної групи з алкоксизамісником, де загальне число атомів вуглецю в алкілоксіалкільній групі знаходиться в діапазоні між 2 і 20. Інший приклад включає С16алкоксіС1-6алкіл і відноситься до С1-6алкільної групи з С1-6алкокси замісником. Термін «алкоксіарил», що використовується в даному описі, відноситься до арильної групи, що має алкоксизамісник. Приєднання відбувається через арильну групу. Арильна група і/або алкоксигрупа мають зазначене число атомів вуглецю. Наприклад, «С7-20алкоксіарил» відноситься до арильної групи з алкокси замісником, де загальне число атомів вуглецю в алкілоксіарильній групі знаходиться в діапазоні між 7 і 20. Інший приклад включає С1-6алкоксіС5-10арил і відноситься до С510арильної групи з С1-6алкоксизамісником. Термін «алкіларил», що використовується в даному описі, відноситься до алкільної групи з арильним замісником. Приєднання відбувається через арильну групу. Такі групи мають зазначене число атомів вуглецю. Наприклад, «С730алкіларил» відноситься до арильної групи з алкільним замісником, де загальне число атомів вуглецю в алкіларильній групі знаходиться в діапазоні між 7 і 30. Інший приклад включає С1-6алкілС511арил і відноситься до С5-11арильної групи з С16алкільним замісником. Термін «арилалкіл», що використовується в даному описі, відноситься до арильної групи з алкільним замісником. Приєднання відбувається через алкільну групу. Такі групи мають зазначене число атомів вуглецю. Наприклад, «С730арилалкіл» відноситься до алкільної групи з арильним замісником, де загальне число атомів вуглецю в арилалкільній групі знаходиться в діапазоні між 7 і 30. Інший приклад включає С5-11арилС1 94391 6алкіл 14 і відноситься до С1-6алкільної групи з С5замісником. Термін «алкілгетероцикліл», що використовується в даному описі, відноситься до алкільної групи з гетероциклічним замісником. Приєднання відбувається через гетероциклічну групу. Такі групи мають зазначене число атомів вуглецю. Наприклад, «С2-30алкілгетероцикліл» відноситься до гетероциклічної групи з алкільним замісником, де загальне число атомів вуглецю в алкілгетероциклічній групі знаходиться в діапазоні між 2 і 30. Інший приклад включає С1-6алкілС1-11гетероцикл і відноситься до групи С1-11гетероцикл із С16алкільним замісником. Термін «гетероциклілалкіл», що використовується в даному описі, відноситься до гетероциклічної групи з алкільним замісником. Приєднання відбувається через алкільну групу. Такі групи мають зазначене число атомів вуглецю. Наприклад, «С2-30гетероциклілалкіл» відноситься до алкільної групи із гетероциклічним замісником, де загальне число атомів вуглецю в гетероциклілалкільній групі знаходиться в діапазоні між 2 і 30. Інший приклад включає С1-11гетероциклілС1-6алкіл і відноситься до С1-6алкільної групи із замісником C111гетероциклом. Термін «двовалентні вуглеводневі радикали», що використовується в даному описі, відноситься до двовалентних циклічних, гетероциклічних, з лінійним ланцюгом, розгалуженим ланцюгом, насичених або ненасичених радикалів, що містять основний вуглецевий ланцюг, що має один або більше атомів водню, необов'язково з одним або більше гетероатомами в основному вуглецевому ланцюзі. Термін «двовалентний вуглеводневий радикал» призначений включати терміни «алкандіїл», «алкендіїл», «алкіндіїл», «циклоалкандіїл», «циклоалкендіїл» та «циклоалкіндіїл». Термін «алкандіїл» визначається ідентично зазначеному для «алкіл», але є двовалентним замість одновалентного. Термін «алкендіїл» визначається ідентично зазначеному для «алкеніл», але є двовалентним замість одновалентного. Термін «алкіндіїл» визначається ідентично зазначеному для «алкініл», але є двовалентним замість одновалентного. Термін «циклоалкандіїл» визначається ідентично зазначеному для «циклоалкіл», але є двовалентним замість одновалентного. Термін «циклоалкендіїл» визначається ідентично зазначеному для «алкеніл», але є двовалентним замість одновалентного. Термін «циклоалкіндіїл» визначається ідентично зазначеному для «алкініл», але є двовалентним замість одновалентного. Термін «заміщений», що використовується в даному описі, передбачає включення всіх прийнятних замісників органічних сполук. У широкому аспекті, прийнятні замісники включають ациклічні і циклічні, розгалужені і нерозгалужені, карбоциклічні і гетероциклічні, ароматичні і неароматичні замісники органічних сполук. Прийнятні замісники можуть бути одним або більше та однаковими або різними для відповідних органічних сполук. Для цілей даного винаходу, гетероатоми, такі як азот, можуть мати замісники водні і/або будь-які прийнятні замісники органічних сполук, описані в даній 11арильним 15 заявці, що задовольняють валентностям гетероатомів. Не передбачається, що даний винахід обмежується будь-яким чином за допомогою прийнятних замісників органічних сполук. Термін «гетероатом», що використовується в даному описі, включає N, O та S. Сполуки та їх проміжні сполуки відповідно до даного винаходу можуть існувати в їх основній формі або у формі солі. Всі солі, що є або не є фармацевтично прийнятними, включені в обсяг даного винаходу. Сольові форми, які здатні утворювати сполуки та їх проміжні сполуки відповідно до даного винаходу, можуть підходящим чином бути одержані із застосуванням відповідних кислот, таких як, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад хлорводнева або бромводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота та т.п. кислоти; або органічні кислоти, такі як, наприклад, оцтова кислота, пропанова кислота, гідроксіоцтова кислота, молочна кислота, піровиноградна кислота, щавлева кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, птолуолсульфонова кислота, цикламова кислота, саліцилова кислота, п-аміносаліцилова кислота, памова кислота та т.п. кислоти; або із застосуванням органічних або неорганічних основ, для одержання солі з основами, таких як, наприклад, амонійні солі, четвертинні амонійні солі, солі з лужними та лужноземельними металами, наприклад, солі з літієм, натрієм, калієм, магнієм, кальцієм та т.п., солі з органічними основами, наприклад, солі бензатину, N-метилу, D-глюкаміну, гідрабаміну, та солі з амінокислотами, такими як, наприклад, аргінін, лізин та т.п. Зазначені кислотно-адитивні сольові форми можуть бути перетворені при обробці підходящою основою у форму вільної основи. І навпаки, зазначені основно-адитивні сольові форми можуть бути перетворені при обробці підходящою кислотою у форму вільної кислоти. X і Y переважно є однаковими. X і Y переважно являють собою C. 1 2 3 4 R , R , R і R переважно незалежно вибирають із групи, що складається з -Н, С1-20алкілу, С220алкенілу, С2-20алкоксіалкілу, С7-20алкоксіарилу, С2-20алкінілу, С3-30циклоалкілу, С430(циклоалкіл)алкілу, С4-30(циклоалкеніл)алкілу, С9С3-30циклоалкенілу, С430(циклоалкініл)алкілу, 30циклоалкінілу, С7-30арилалкілу, С7-30алкіларилу, С6-30арилу, С6-30гетероциклілалкілу, С630алкілгетероциклілу та С5-30гетероциклілу. 1 2 3 4 R , R , R і R переважно незалежно вибирають із групи, що складається з -Н, С1-16алкілу, С2С2-16алкоксіалкілу, С7-16алкоксіарилу, 16алкенілу, С2-16алкінілу, С3-20циклоалкілу, С420(циклоалкіл)алкілу, С4-20(циклоалкеніл)алкілу, C9С3-20циклоалкенілу, С420(циклоалкініл)алкілу, 20циклоалкінілу, С7-20арилалкілу, С7-20алкіларилу, С6-20арилу, С6-20гетероциклілалкілу, С620алкілгетероциклілу та С5-20гетероциклілу. 94391 16 1 2 3 4 R , R , R і R переважно незалежно вибирають із групи, що складається з -Н, первинного або вторинного С1-6алкілу, С2-6алкенілу, С1-6алкоксіС16алкілу, С1-6алкоксіС5-10арилу, С5-7циклоалкілу, С5С4-11циклоалкенілС111циклоалкілС1-6алкілу, С8-12циклоалкінілС1-6алкілу, С56алкілу, С5-7циклоалкінілу, С6-11арилС17циклоалкенілу, С1-6алкілС6-11арилу, С6-11арилу, С56алкілу, С1-6алкілС512гетероциклілС1-6алкілу, 12гетероциклілу та С5-12гетероциклілу. 1 2 3 4 Переважно, R , R , R і R є відмінними від -Н. 1 2 3 4 Переважно, R , R , R і R незалежно вибирають із групи, що складається з -Н, метилу, етилу, пропілу, бутилу, гексилу, циклогексилу, октилу, нонілу, додецилу, ейкозилу, норборнілу, адамантилу, вінілу, пропенілу, циклогексенілу, фенілетилу, фенілпропілу, метоксифенілу, етоксифенілу, фенілу, толілу, диметилфенілу, триметилфенілу, етилфенілу, пропілфенілу, біфенілу, нафтилу, метилнафтилу, антрилу, фенілантрилу, бензилфенілу, піренілу, тетрагідропіранілу, аценафтилу, феналенілу, ацеантриленілу, тетрагідронафтилу, індалілу, метоксипропілу, етоксіетилу, метоксиметилу, амілу, тритилу, метокситритилу, диметокситритилу, триметокситритилу, алілу, триметилсилілу, (трет-бутил)диметилсилілу та бензилу, включаючи їх ізомери. 1 2 3 4 Переважно, R , R , R і R незалежно вибирають із групи, що складається з метилу, етилу, нпропілу, втор-пропілу, н-бутилу, втор-бутилу, третбутилу, бензилу, фенілу та метоксифенілу. 1 2 Переважно, R і R є однаковими. Переважно, 3 4 R і R є однаковими. 1 2 3 4 Переважно, R , R , R і R є однаковими та вибирають з групи, що складається з метилу, етилу, н-пропілу, втор-пропілу та трет-бутилу. 1 2 3 4 Переважно, R , R , R і R всі являють собою етил. 1 2 Переважно, R і R , взяті разом, утворюють 1 2 3 4 3 4 R -R -; та R і R , взяті разом, утворюють -R -R -. 1 2 Переважно, R і R , взяті разом, утворюють 1 2 3 4 3 4 R -R -; та R і R , взяті разом, утворюють -R -R -, 1 2 3 4 та -R -R - і -R -R - кожен незалежно являє собою С1-20алкандіїл, С2-20алкендіїл, С4-20алкіндіїл, С3С4-20циклоалкендіїл і С820диклоалкандіїл, 20циклоалкіндіїл. 1 2 Переважно, R і R , взяті разом, утворюють 1 2 3 4 3 4 R -R -; та R і R , взяті разом, утворюють -R -R -, 1 2 3 4 та -R -R - і -R -R - є однаковими та вибирають з групи, що складається з С1-20алкандіїлу, С120алкендіїлу, С4-20алкіндіїлу, С3-20циклоалкандіїлу, С4-20циклоалкендіїлу та С8-20циклоалкіндіїлу. 1 2 3 4 Переважно, X i Y є однаковими, і R , R , R і R є однаковими. 1 2 3 Переважно, X і Y являють собою С, і R , R , R 4 і R є однаковими. 1 2 3 Переважно, X і Y являють собою С, і R , R , R 4 і R є однаковими та вибирають з групи, що складається з С1-20оалкілу, С2-20алкенілу, C220алкоксіалкілу, С7-20алкоксіарилу, С2-20алкінілу, С3С4-30(циклоалкіл)алкілу, С330циклоалкілу, С4-30циклоалкінілу, С730циклоалкенілу, С7-30алкіларилу, С6-30арилу, С630арилалкілу, С6-30алкілгетероциклілу та 30гетероциклілалкілу, С5-30гетероциклілу. 17 94391 1 2 3 Переважно, X і Y являють собою С, і R , R , R 4 і R є однаковими та вибирають з групи, що складається з С1-16алкілу, С2-16алкенілу, C216алкоксіалкілу, С7-16алкоксіарилу, С2-16алкінілу, С3С4-20(циклоалкіл)алкілу, С320циклоалкілу, С4-20циклоалкінілу, С720циклоалкенілу, С7-20алкіларилу, С6-20арилу, С620арилалкілу, С6-20алкілгетероциклілу та 20гетероциклілалкілу, С5-20гетероциклілу. 1 2 3 Переважно, X і Y являють собою С, і R , R , R 4 і R є однаковими та вибирають з групи, що складається з первинного або вторинного С1-6алкілу, C2-6алкенілу, С1-6алкоксіС1-6алкілу, С1-6алкоксіС510арилу, С5-7циклоалкілу, С5-11циклоалкілС1-6алкілу, С5-7циклоалкенілу, С5-7циклоалкінілу, С6-11арилC1С1-6алкілС6-11арилу, С6-11арилу, С56алкілу, С1-6алкілС512гетероциклілС1-6алкілу, 12гетероциклілу та С5-12гетероциклілу. 1 2 3 Переважно, X і Y являють собою С, і R , R , R 4 і R є однаковими та вибирають з групи, що складається з метилу, етилу, пропілу, бутилу, гексилу, циклогексилу, октилу, нонілу, додецилу, ейкозилу, норборнілу, адамантилу, вінілу, пропенілу, циклогексенілу, фенілетилу, фенілпропілу, метоксифенілу, етоксифенілу, фенілу, толілу, диметилфенілу, триметилфенілу, етилфенілу, пропілфенілу, біфенілу, нафтилу, метилнафтилу, антрилу, фенантрилу, бензилфенілу, піренілу, тетрагідропіранілу, аценафтилу, феналенілу, ацеантриленілу, тетрагідронафтилу, індалілу, метоксипропілу, етоксіетилу, метоксиметилу, амілу, тритилу, метокситритилу, диметокситритилу, триметокситритилу, алілу, триметилсилілу, (трет-бутил)диметилсилілу та бензилу, включаючи їх ізомери. 1 2 3 Переважно, X і Y являють собою С, і R , R , R 4 і R є однаковими та вибирають з групи, що складається з метилу, етилу, н-пропілу, втор-пропілу, н-бутилу, втор-бутилу, трет-бутилу, бензилу, фенілу та метоксифенілу. 1 2 3 Переважно, X і Y являють собою С, і R , R , R 4 і R є однаковими та вибирають з групи, що складається з метилу, етилу, н-пропілу, втор-пропілу та трет-бутилу. 1 2 3 4 Переважно, R , R , R і R являють собою етил. 1 2 Переважно, X і Y являють собою С, і R і R , 1 2 3 4 взяті разом, утворюють -R -R - та R і R , взяті 3 4 1 2 3 4 разом, утворюють -R -R -, та -R -R - і -R -R - є однаковими та вибирають з групи, що складається з С1-20алкандіїлу, С2-20алкендіїлу, С4-20алкіндіїлу, С3-20циклоалкандіїлу, С4-20циклоалкендіїлу та С820циклоалкіндіїла. 1 2 3 4 Коли X і Y являють собою Si, R , R , R і R переважно являють собою С1-20алкіл, більш переважно С1-6алкіл, ще більш переважно трет-бутил. Для позначення стереохімії сполук формули (І) по всьому тексту застосовується наступна нумерація біциклічної кільцевої системи. 18 Передбачається, що сполука (І) включає всі її переважні термодинамічно стабільні стереоізомери. Стереоізомери з цис-конфігурацією являють собоювсі стереоізомери, що мають атом водню при вуглеці в положенні 5 і атом водню при вуглеці в положенні 1 на тій самій стороні кільцевої системи, утвореної двома тетрагідрофурановими кільцями. Стереоізомери з транс-конфігурацією являють собою всі стереоізомери, що мають атом водню при вуглеці в положенні 5 і атом водню при вуглеці в положенні 1 на протилежних сторонах кільцевої системи, утвореної двома тетрагідрофурановими кільцями. Переважними є стереоізомери, що мають цис-конфігурацію. На основі одержання сполук формули (І) у термодинамічних умовах реакції та їх дослідження методом рентгеноструктурного аналізу було виявлено, що стереоізомери, що мають транс-конфігурацію, є термодинамічно менш стабільними в порівнянні з цисстереоізомерами. Зокрема, стереоізомери (Іа), (lb), (Ic) і (Id) є переважними. Сполуки формули (Ia) і (Ib) є енантіомерами. Сполуки формули (Ic) і (Id) є діастереоізомерами. Сполуки формули (Ic) і (Ia) є діастереоізомерами. Сполуки формули (Ic) і (Ib) є діастереоізомерами. Сполуки формули (Ia) і (Id) є діастереоізомерами. Сполуки формули (Ib) і (Id) є діастереоізомерами. Передбачається, що сполука формули (II) включає всі її стереоізомери. В залежності від 1 2 3 4 природи X, Y, R , R , R і R стереогенність центрального атому вуглецю, що несе альдегідну групу, може бути різною. Зокрема, переважними є стереоізомери, що використовують при одержанні сполук формули (Іа), (Іb), (Ic) і (Id), тобто сполуку формули (Іа) одержують зі сполуки (IIа), сполука (lIb) необхідна для одержання сполуки (Іb), суміш сполуки (IIс) і сполуки (IId) буде приводити до суміші сполук (Ic) і (Id), де сполука (IIс) може приводити до утворення сполуки (Ic) і сполуки (Id) та сполука (IId) може приводити до утворення сполуки (Ic) і сполуки (Id). 19 94391 20 суміш сполуки (IVc) і сполуки (IVd) буде в кінцевому рахунку приводити до суміші сполук (Ic) і (Id). Передбачається, що сполука формули (III) включає всі її стереоізомери. В залежності від 1 2 3 4 природи X, Y, R , R , R і R стереогенність центрального атому вуглецю, що несе гідроксіалкільну групу, може бути різною. Зокрема, переважними є стереоізомери, що використовують при одержанні сполук формули (Іа), (lb), (Ic) і (Id), тобто сполуку формули (Іа) у кінцевому рахунку одержують зі сполуки (IIIа), сполука (IIIb) необхідна для одержання в кінцевому рахунку сполуки (Іb), а суміш сполуки (IIIс) і сполуки (IIId) буде в кінцевому рахунку приводити до суміші сполук (Ic) і (Id), в якій сполука (IIIс) у кінцевому рахунку приводить до утворення сполуки (Ic) і сполука (IIId) у кінцевому рахунку приводить до утворення сполуки (Id). Передбачається, що сполука формули (IV) включає всі її стереоізомери. Зокрема, переважними є стереоізомери, що використовують при одержанні сполук формули (Іа), (lb), (Ic) і (Id), тобто сполуку формули (Іа) у кінцевому рахунку одержують зі сполуки (IVa), сполуку (IVb) необхідна для одержання в кінцевому рахунку сполуки (Іb), а Сполуки формули (II), що заслуговують на 1 2 увагу, є сполуками формули (II), в яких XR R та 3 4 YR R є ідентичними. Також сполуки формули (II), що заслуговують на увагу, є сполуками формули 1 2 3 4 (II), в яких X і Y являють собою C та R , R , R і R є ідентичними. Іншими сполуками формули (II), що заслуговують на увагу, є сполуками формули (II), в яких X і Y являють собою C та являють собою С120алкіл. Ще іншими сполуками формули (II), що заслуговують на увагу, є сполуками формули (II), в 1 2 3 4 яких X і Y являють собою C та R , R , R і R являють собою етил. Сполуками формули (III), що заслуговують на 1 2 увагу, є сполуками формули (III), в яких XR R та 3 4 YR R є ідентичними. Також сполуками формули (III), що заслуговують на увагу, є сполуками фор1 2 мули (III), в яких X і Y являють собою C та R , R , 3 4 R і R є ідентичними. Іншими сполуками формули (III), що заслуговують на увагу, є сполуками фор1 2 мули (III), в яких X і Y являють собою C та R , R , 3 4 R і R являють собою С1-20алкіл. Ще іншими сполуками формули (III), що заслуговують на увагу, є сполуками формули (III), в яких X і Y являють со1 2 3 4 бою C та R , R , R і R являють собою етил. Сполуками формули (IV), що заслуговують на 1 2 увагу, є сполуками формули (IV), в яких XR R та 3 4 YR R є ідентичними. Також сполуками формули (IV), що заслуговують на увагу, є сполуками фор1 2 мули (IV), в яких X і Y являють собою C та R , R , 3 4 R і R є ідентичними. Іншими сполуками формули (IV), що заслуговують на увагу, є сполуками фор1 2 мули (IV), в яких X і Y являють собою C та R , R , 3 4 R і R являють собою С1-20алкіл. Ще іншими сполуками формули (IV), що заслуговують на увагу, є сполуками формули (IV), в яких X і Y являють со1 2 3 4 бою C та R , R , R і R являють собою етил. 21 Підходящі агенти, що знімають захист, які застосовують при знятті захисних груп та наступної внутрішньомолекулярної циклізації сполук формули (II) у сполуки формули (І), вибирають з реагентів гідрогенолізу, фторидвмісних реагентів, кислот та основ, переважно, неорганічних кислот та органічних кислот, найбільше переважно, сульфокислот або карбонових кислот. Підходящі кислоти вибирають із групи, що складається з хлороводневої кислоти, бромоводневої кислоти, сірчаної кислоти, фосфорної кислоти, азотної кислоти, мурашиної кислоти, оцтової кислоти, пропіонової кислоти, бурштинової кислоти, гліколевої кислоти, молочної кислоти, яблучної кислоти, винної кислоти, трифтороцтової кислоти, глюконової кислоти, лимонної кислоти, малеїнової кислоти, фумарової кислоти, піровиноградної кислоти, фенілоцтової кислоти, бензойної кислоти, 4амінобензойної кислоти, антранілової кислоти, 4гідроксибензойної кислоти, саліцилової кислоти, 4аміносаліцилової кислоти, памової кислоти, нікотинової кислоти, метансульфонової кислоти, етансульфонової кислоти, гідроксіетансульфонової кислоти, бензолсульфонової кислоти, птолуолсульфонової кислоти, нафталінсульфонової кислоти, сульфанілової кислоти, циклогексилсульфамінової кислоти, камфорсульфонової кислоти, хлорсульфонової кислоти, піридиній паратолуолсульфонової кислоти та аскорбінової кислоти. Зняття захисних груп та наступна внутрішньомолекулярна циклізація сполук формули (II) переважно відбувається у водному розчині. Переважно, водний розчин містить один або більше органічних розчинників. Переважний органічний розчинник являє собою дихлорметан. Інші підходящі органічні розчинники можуть бути вибрані з 94391 22 групи, що складається із спиртів, переважно С1С10спиртів. Переважні спирти вибирають із групи, що складається з метанолу, етанолу, пропанолу, бутанолу, пентанолу, гексанолу та їх ізомерів. Можуть бути використані суміші одного або більше розчинників. Зняття захисних груп та наступна внутрішньомолекулярна циклізація переважно відбувається при температурі 0°-100°C, переважно при 10°50°C, переважно при приблизно 25°C. Зняття захисних груп та наступна внутрішньомолекулярна циклізація звичайно здійснюється протягом 10 хвилин - 4 доби в залежності від умов реакції. При дотриманні переважних умов, описаних вище, зняття захисних груп та наступна внутрішньомолекулярна циклізація відбувається, головним чином, повністю протягом приблизно 15 хвилин. Агенти окиснення, які застосовують при окисненні сполуки формули (III) у сполуку формули (II), включають агенти окиснення, які здатні перетворювати первинний спирт на альдегід. Переважні методи окиснення, які застосовують для окиснення сполуки формули (III) у сполуку формули (II), включають метод окиснення, опосередкованого диметилсульфоксидом. Диметилсульфоксид (DMSO) може бути активований реакцією з різними електрофільними реагентами, включаючи оксалілхлорид, дициклогексилкарбодіімід, сірчаний ангідрид, оцтовий ангідрид та Nхлорсукцинімід. Існує ряд оглядів, присвячених окисненню, опосередкованому диметилсульфоксидом (Lee, Comprehensive Organic Synthesis, Trost, В. M.; Fleming, I, Eds., Pergamon Press: New York, 1991, Vol. 7, p. 291-303. Tidwell, Т. Т. Synthesis 1990, 857-870. Tidwell, Т. Т. Organic Reactions 1990, 39, 297-557). 23 Окиснення сполук формули (III) у сполуки формули (II) переважно відбувається із використанням умов Сверна (Swern), Пфіцнера-Мофата (Pfitzner-Moffatt) або Париха-Доерінга (ParikhDoering), найбільше переважно умов ПарихаДерінга. Реакція Париха-Дерінга передбачає активацію диметилсульфоксиду комплексом сірчаний ангідрид-піридин та описана у Parikh J. P., Doering W. Е. J. Am. Chem. Soc, 1967, 89, 5505-5507. Окиснення по Сверну передбачає активацію диметилсульфоксиду при використанні оксалілхлориду або трифтороцтового ангідриду. Окиснення по Сверну описане в Mancuso A. J., Swern D. Synthesis, 1981,165-185. Окиснення по Пфіцнеру-Мофату передбачає активацію диметилсульфоксиду за допомогою діалкілкарбодіімідного реагенту, такого як дициклогексил, діізопропіл; та описано в Pfitzner К. E., Moffatt J. G. J. Am. Chem. Soc, 85, 3027 (1963). Метод окиснення, опосередкованого диметилсульфоксидом, дозволяє легко контролювати реакцію та окиснювати спирти до відповідних альдегідів з високими виходами, оскільки запобігається подальше окиснення одержаних альдегідів до відповідної карбонової кислоти. Окиснення сполук формули (III) до сполук формули (II) переважно відбувається в органічному розчиннику, переважно в інертному для реакції розчиннику. Підходящі розчинники вибирають із групи, що складається з вуглеводнів, хлорвмісних вуглеводнів, кетонів, полярних апротонних розчинників, ароматичних вуглеводнів та їх сумішей. Переважні інертні для реакції розчинники вибирають із групи, що складається з пентану, гексану, гептану, циклогексану, дихлорметану, 1,2дихлоретану, 1,1,2,2-тетрахлоретану, ацетону, метилетилкетону, ацетонітрилу, пропіонітрилу, бензолу, толуолу, хлорбензолу, ксилолу, простого ефіру, 1,4-діоксану, тетрагідрофурану та їх сумішей. Окиснення сполук формули (III) до сполук формули (II) переважно відбувається при температурі в інтервалі -50°C - 50°C, переважно нижче 25°C, найбільше переважно в інтервалі -10°C - 5°C. Окиснення сполук формули (III) до сполук формули (II) переважно здійснюється протягом 10 хвилин - 2 доби в залежності від умов реакції. При дотриманні переважних умов, зазначених вище, реакція окиснення відбувається, головним чином, повністю протягом приблизно 4 годин. При дотриманні найбільш переважних умов, згаданих вище, реакція окиснення відбувається, головним чином, повністю протягом приблизно 1,5 годин. Гідроборування та наступне окиснення сполук формули (IV) може протікати при будь-яких умовах, які сприяють перетворенню алкену в первинний спирт (III). Переважні умови включають реакцію сполук формули (IV) з підходящим борвмісним реагентом та наступною реакцією із застосуванням агента окиснення. Підходящі борвмісні реагенти для гідроборування сполук формули (IV) вибирають із групи, що складається з ВН3, С1-С6моно- або діалкілборанів, 94391 24 C6-С18біциклоалкілборанів, С6-С18арилборанів та їх сумішей. Переважні реагенти гідроборування вибирають із групи, що складається з ВН3, диметилборану, діетилборану, дипропілборану, 9борабіцикло[3.3.1]нонану [9-BBN], катехолборану, пінілборану, боролану та їх сумішей. Переважний борвмісний реагент включає діетилборан, що може бути одержаний in situ при змішуванні ВН3 і триетилборану. Реакція сполук формули (IV) з борвмісними реагентами переважно відбувається в присутності розчинника. Підходящі розчинники вибирають із групи, що складається з бензолу, толуолу, ксилолу, простого ефіру, 1,4-діоксану, тетрагідрофурану та їх сумішей. Найбільш переважним є тетрагідрофуран. Реакція сполук формули (IV) з борвмісними реагентами переважно відбувається при температурі в інтервалі 0°C - 50°C, переважно приблизно 25°C. Реакція сполук формули (IV) з борвмісними реагентами переважно здійснюється протягом 5 хвилин - 1 доби в залежності від умов реакції. При дотриманні переважних умов, зазначених вище, реакція, головним чином, повністю відбувається протягом приблизно 1 години. Слідом за реакцією сполук формули (IV) з борвмісними реагентами продукти реакції звичайно перетворюються на спирт у присутності агента окиснення. Підходящі агенти окиснення, включають пероксиди, зокрема пероксид водню. Окиснення переважно відбувається у водному лужному розчині. Підходящі речовини з основними властивостями включають карбонати лужних металів і гідроксиди лужних металів. Найбільш переважною основою є гідроксид натрію. Етап окиснення реакції гідроборування переважно відбувається при температурі в інтервалі від -20°C до 30°C, переважно при приблизно 0°C. Етап окиснення реакції гідроборування переважно відбувається протягом 5 хвилин - 1 доби в залежності від умов реакції. При дотриманні переважних умов, зазначених вище, реакція окиснення, власне кажучи, цілком відбувається протягом приблизно 2 годин. Одержання сполук формули (IV) на основі сполук формули (V), проведене по типу реакції Вітига, може здійснюватися із застосуванням класичної реакції Вітига або модифікованої реакції Вітига, такої як реакція Хорнера-Емонса (HornerEmmons) або реакція Вітига-Хорнера (WittigHorner). Переважні реагенти класичної реакції Вітига включають іліди фосфонію, що можуть бути одержані при взаємодії солі фосфонію та основи. Солі фосфонію можуть бути одержані, наприклад, із триарил фосфіну і галогенметану. Переважними є триС6-С20арилфосфіни, зокрема трифенілфосфін. Переважним галогенметаном є бромметан або хлорметан. Переважною основою є металорганічний реагент, що містить лужний метал, такий як гексаметилдисилазан натрію або літію. Одержання сполук формули (IV) на основі сполук формули (V), проведене по типу реакції Вітига, переважно здійснюється в органічному ро 25 зчиннику, переважно реакційно-інертному розчиннику. Підходящі розчинники вибирають із групи, що складається з вуглеводнів, хлорвмісних вуглеводнів, простих ефірів, полярних апротонних розчинників, ароматичних вуглеводнів та їх сумішей. Переважним розчинником є тетрагідрофуран. Одержання сполук формули (IV) на основі сполук формули (V), проведене по типу реакції Вітига, переважно відбувається при температурі в інтервалі від -50°C до 20°C, переважно при нижче 25°C, найбільше переважно в інтервалі від -10°C до 5°C. Інші типи реагентів Вітига замість ілідів фосфонію включають похідні фосфінової кислоти, реагент Теббе (Tebbe) або реагент Пете (Petais) і можуть бути використані відповідно до умов реакції, відомих з рівня техніки. Сполуки формули (IV) можуть бути одержані із застосуванням способу, ідентичного або аналогічного способу, описаному в Maleczka et al., Org Lett., 2002, 4(17), 2841-2844. Усі вищеописані способи можуть здійснюватися окремо або як послідовності реакцій. «Чисті стереоізомерні форми сполук», що згадуються в даному описі, визначаються як ізомери по суті вільні від інших енанті омерних і діастереомерних форм однієї і тієї ж загальної молекулярної структури зазначених сполук. Зокрема, термін «стереоізомерно чистий» відноситься до сполук із вмістом енантіомеру не менше, ніж 80 % (тобто мінімум 90 % одного ізомеру і максимум 10 % інших можливих ізомерів), до вмісту стереоізомеру 100% (тобто 100% одного ізомеру і відсутність інших ізомерів), більш переважно, сполук із вмістом стереоізомеру 90%, до 100%, ще більш переважно, із вмістом стереоізомеру 94 %, до 100 % і, 94391 26 найбільше переважно, із вмістом стереоізомеру 97 %, до 100 %. Терміни «енантіомерно чистий» і «діастереомерно чистий» варто розуміти подібним чином, але слід брати до уваги вміст енантіомеру, відповідно, вміст діастереомеру в суміші, про який йде мова. Якщо методика проведення реакції приводить до суміші енантіомерів, енантіомери можуть бути відділені один від іншого шляхом селективної кристалізації їх діастереомерних солей із оптично активними кислотами або основами. Прикладами цього є винна кислота, дибензоїлвинна кислота, дитолуоїлвинна кислота та камфорсульфокислота. Альтернативно, енантіомери можуть бути розділені хроматографічними методами із застосуванням хіральних нерухомих фаз. Чисті діастереомери суміші діастереомерів можуть бути одержані звичайними методами. Підходящим фізичними методами розділення, які можуть бути успішно застосовані, є, наприклад, селективна кристалізація та хроматографія, наприклад колоночна хроматографія. Чисті стереохімічно ізомерні форми сполук формули (І) можуть бути також одержані з відповідних чистих стереохімічно ізомерних форм відповідних вихідних сполук, за умови, що реакція відбувається стереоспецифічно. Наприклад, сполука формули (Іа) може бути одержана з чистого L-арабіту як вихідної сполуки, як показано на схемі В. Сполука формули (Ib) може бути одержана з чистого D-арабіту як вихідної сполуки. Застосування ксиліту або рибіту (або адоніту) як вихідної речовини буде приводити до суміші діастереомерів формули (Ic) і (Id), суміш яких може бути розділена із застосуванням методів розділення, добре відомих з рівня техніки. 27 Сполуки формули (І) можуть бути використані для синтезу нових інгібіторів протеази ВІЛ - кандидатів на лікарський засіб - відповідно до відомих з рівня техніки способів синтезу. Таким чином, даний винахід також відноситься до використання сполук формули (І) для одержання інгібіторів протеази ВІЛ і винахід також відноситься до інгібіторів протеази ВІЛ, одержаних при використанні сполуки формули (І) в ході хімічного одержання зазначених інгібіторів протеази ВІЛ, що демонструють антивірусну активність проти ВІЛ дикого типу і/або мутантних штамів ВІЛ, резистентних до доступних в даний час лікарських засобів. Наступні приклади ілюструють одержання характерних сполук за даним винаходом. Приклади Переважно, синтез сполуки (І) передбачає багатостадійний синтез, один із синтетичних маршрутів якого в цілому представлений нижче. Перші дві стадії детально описані Linclau et al (J. Org. Chem., 2003, 68, 1821-1826). Відповідно, перші дві стадії представлені нижче тільки як посилання. Синтез, підходящим чином, починається з регіоселективного захисту арабіту, ксиліту або рибіту, переважно арабіту. Арабіт має псевдо-С2симетрію (центральний атом вуглецю не є стереогенним) і зазначена симетрія зберігається в 1. В той час як арабіт є хіральним, ксиліт та рибіт є мезо-формами. На другому етапі, окиснення захищеного арабіту приводить до С2-симетричного (2S,4S)-1,2:4,5-бic(3,3-пентилідендіокси)-3пентанону. Переважно, на цьому етапі застосовується низька температура, оскільки це мінімізує епімеризацію в (2S,4R)-1,2:4,5-біс(3,3пентилідендіокси)-3 -пентанон. Далі використовуються наступні терміни: DCM - дихлорметан; THF - тетрагідрофуран; 94391 28 Ph - феніл; Py - піридин; DMSO - диметилсульфоксид; хв - хвилина; год - година; д. - день; Me - метил; Et - етил; CSA - хлорсульфонова кислота; PPTS - піридиній пара-толуолсульфонова кислота; NaHMDS - Na гексаметилдисилазан. Синтез цис-(4R,6R)-2,8-діокса-4,6дигідроксибіцикло[3.3.0]октану Етап І. Синтез (2S,4S)-1,2:4,5-ди-O-(3,3пентиліден)арабіту Киплячу суспензію L-арабіту (20,00 г, 131,5 ммоль) та 3,3-диметоксипентану (76,46 г, 578,4 ммоль) у THF (200 мл) перемішують протягом 15 хв. Додають CSA (9,16 г, 39,4 ммоль) і реакційну суміш перемішують при кипінні рівно 5 хв. Реакцію завершують додаванням NaOH (водн., 2М, 40 мл) при кипінні. Додають діетиловий ефір (50 мл) і воду (20 мл) та розділяють шари. Водну фазу екстрагують діетиловим ефіром (3 х 50 мл). Об'єднані органічні шари сушать над безводним Na2SO4, фільтрують та розчинник видаляють у вакуумі, одержуючи блідо-жовте масло. Неочищений продукт розчиняють у CH2Cl2 (200 мл) і додають триетиламін (20 мл). Суміш нагрівають до кипіння і додають бурштиновий ангідрид (3,40 мг, 34,0 ммоль). Реакційну суміш нагрівають при кипінні 29 протягом 1,5 год. і потім гасять NаНСО3 (водн., насич., 200 мл) при температурі кипіння. Після охолодження шари розділяють і водний шар екстрагують CH2Cl2 (2 х 100 мл). Об'єднані органічні фази промивають насиченим розчином солі (100 мл), сушать над безводним Na2SO4, фільтрують та випарюють з одержанням блідо-жовтого масла. Очищення за допомогою колоночної хроматографії (гексан/ацетон 80:20) надає (2S,4S)-1,2:4,5-диO-(3,3-пентиліден)арабіт у вигляді блідо-жовтого масла (28,18 г, 74%). []D -5,8 (с 2,5, CHCl3, 25°C). 1 13 Спектри H та C ЯМР відповідають описаним даним у Linclau В. et al., J. Org. Chem., 2003, 68,1821. Етап 2. Синтез (2S,4S)-1,2:4,5-біс(3,3пентилідендіокси)-3-пентанону У двугорлій круглодонній колбі (А) на 500 мл перемішують розчин 1,2:4,5-ди-Oізопентиліденового ацеталю (10,00 г, 34,7 ммоль) у CH2Cl2 (100 мл) і DMSO (50 мл) при 0°С. У двугорлій круглодонній колбі (В) на 250 мл перемішують розчин комплексу SO3піридин (16,56 г, 104,0 ммоль) та триетиламіну (17,9 мл, 128,3 ммоль) у CH2Cl2 (50 мл) і DMSO (50 мл) при 0 °С протягом 10 хв. Вміст колби (В) потім переносять через канюлю в колбу (А) протягом 10 хв. Потім реакційну суміш перемішують при 0°C протягом 5 годин. Реакційну суміш потім виливають у суміш насиченого водного розчину NH4Cl:вода:діетиловий ефір:пентан (1:1:1:1, 600 мл). Шари розділяють і водний шар екстрагують сумішшю діетилового ефіру:пентану (1:1, 2x150 мл). Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують та випарюють з одержанням неочищеного продукту у вигляді блідо-жовтого масла. Очищення за допомогою колоночної хроматографії (гексан/етилацетат 90:10) надає (2S,4S)-1,2:4,5біс(3,3-пентилідендіокси)-3-пентанон у вигляді безбарвного масла (9,20 г, 93 %). []D 68,8 (с 0,31, 1 13 CHCl3, 25°C). Спектри H та C ЯМР відповідають описаним даним у Linclau В. et al., J. Org. Chem., 2003, 68, 1821. Етап 3. Синтез (2R,4R)-ди-O-(3,3-пентиліден)3-дезокси-3-метилен-арабіту До суспензії броміду, що перемішується, метилтрифенілфосфонію (21,20 г, 59,36 ммоль) у THF (100 мл) при 0°C додають NaHMDS (56,4 мл, 56,4 ммоль, 1,0М в THF). Одержану жовту суспензію перемішують протягом 10 хв. Розчин С2симетричного кетону (8,5 г, 29,7 ммоль), розчиненого в THF (20 мл), потім додають по краплях та 94391 30 суміш перемішують при 0°C протягом 4 год. Потім реакційну суміш виливають у воду (150 мл) і екстрагують CH2Cl2 (3 х 100 мл). Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують та випарюють. Очищення за допомогою колоночної хроматографії (гексан/етил ацетат 90:10) надає (2S,4S)-ди-O-(3,3-пентиліден)-3-дезокси-3метиленарабіт у вигляді безбарвного масла (8,30 мг, 98%) (Maleczka et al., Organic Letters, 2002, 4(17), 2841-2844). Rf 0,16 (гексан/етилацетат 95:5). 1 []D -86,9 (с 1,33, CHCl3, 25°C). H ЯМР (400 МГц, CDCl3) 5,30 (2Н, д, J = 1,0 Гц), 4,52 (2Н, м), 4,19 (2Н, дд, J = 8,0, 6,0 Гц), 3,56 (2Н, т, J = 8,0 Гц), 1,74-1,60 (8Н, м), 0,92 (6Н, т, J = 7,5 Гц) і 0,90 (6Н, т, J = 7,5 Гц). Етап 4. Синтез (2R,4R)-ди-O-(3,3-пентиліден)3-дезокси-3-гідроксиметиларабіту Розчин триетилборгідриду (10,2 мл, 1,0М в THF) і боргідриду (1,7 мл, 1,0M в THF) перемішують при кімнатній температурі протягом 1 год. Додають розчин С2-симетричного алкену (968 мг, 3,40 ммоль) у THF (7 мл) і реакційну суміш перемішують протягом 2 д. Реакційну суміш потім обережно додають по краплях до суміші, що перемішується, NaOH (водн., 3М):Н2O2 (водн., 27 мас %):CH2Cl2 (1:1:1, 90 мл) при 0°C і перемішують протягом 2 год. Шари розділяють і водний шар екстрагують CH2Cl2 (3х30 мл). Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують та випарюють з одержанням неочищеного продукту у вигляді безбарвного масла. Очищення за допомогою колоночної хроматографії (гексан/ацетон 85:15) надає (2R,4R)-ДИ-O-(3,3-пентиліден)-3дезокси-3-гідроксиметиларабіт у вигляді безбарвного масла (950 мг, 92 %). RF 0,28 (гексан/ацетон 1 80:20). []D -9,7 (с 1,06, CHCl3, 25°С). H ЯМР (300 МГц, CDCl3) д 4,24-4,11 (2Н, м), 4,12 (1H, дд, J = 8,1, 5,9 Гц), 3,96 (1Н, тд, J = 8,8, 5,9 Гц), 3,74-3,66 (3Н, м), 3,61 (1H, дд, J = 8,8, 8,1 Гц), 2,63 (1Н, шир.с), 1,84 (1H, м), 1,67-1,54 (8Н, м), 0,897 (3Н, т, J = 7,35 Гц), 0,890 (3Н, т, J = 7,35 Гц), 0,87 (3Н, т, J = 7,35 Гц) і 0,86 (3Н, т, J = 7,35 Гц). Етап 5. Синтез (2R,4R)-ди-O-(3,3-пентиліден)3-дезокси-3-формиларабіту У двугорлій круглодонній колбі (А) на 250 мл перемішують розчин «псевдо»-С2-симетричного первинного спирту з етапу 4 (1,90 г, 6,28 ммоль) у CH2Cl2 (30 мл) і DMSO (15 мл) при 0°С. У двугорлій круглодонній колбі (В) на 100 мл перемішують ро 31 94391 32 зчин комплексу SO3піридин (3,00 г, 18,9 ммоль) і триетиламіну (3,2 мл, 23,2 ммоль) у CH2Cl2 (30 мл) і DMSO (15 мл) при 0°C протягом 10 хв. Вміст колби (В) потім переносять через канюлю в колбу (А) протягом 10 хв. Потім реакційну суміш перемішують при 0°C протягом 1,5 годин. Реакційну суміш потім виливають у суміш насиченого водного розчину NH4Cl:вода:діетиловий ефір:пентан (1:1:1:1, 100 мл). Шари розділяють і водний шар екстрагують сумішшю діетилового ефіру:пентану (1:1, 2x100 мл). Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують та випарюють з одержанням неочищеного продукту у вигляді безбарвного масла. Очищення за допомогою колоночної хроматографії (гексан/ацетон 95:5) надає (2R,4R)-ди-O-(3,3-пентиліден)-3-дезокси-3формиларабіт у вигляді безбарвного масла (1,809 г, 96%). Rf 0,52 (гексан/ацетон 80:20). []D +39,5 (с 1 0,40, CHCl3, 23°C). H ЯМР (300 МГц, CDCl3) д 9,83 (1Н, д, J = 1,5 Гц), 4,37 (1Н, тд, J = 7,7, 5,9 Гц), 4,28-4,18 (3Н, м), 3,82 (1Н, м), 3,54 (1Н, м), 2,60 (1Н, м), 1,69-1,50 (8Н, м), 0,90-0,82 (12Н, м). Етап 6. Синтез цис-(4R,6R)-2,8-діокса-4,6дигідроксибіцикло[3.3.0]октану До розчину, що перемішується, «псевдо»-С2симетричного альдегіду (6,9 г, 22,97 ммоль) у 70 мл дихлорметану при кімнатній температурі додають 7,7 мл суміші трифтороцтової кислоти і води (9:1; об/об). Через 15 хв розчинник видаляють у вакуумі і неочищений продукт випарюють разом із толуолом. Очищення за допомогою колоночної хроматографії (дихлорметан/метанол 9:1) надає цис-(4R,6R)-2,8-діокса-4,6дигідроксибіцикло[3.3.0]октан у вигляді білого осаду (2,844 г, 85 %). Rf 0,24 (CH2Cl2/MeOH 90:10). 1 []D +45,8 (с 0,61, MeOH, 24°C). H ЯМР (400 МГц, ДМСО-d6) д 5,62 (1Н, д, J = 5,5 Гц), 5,22 (1H, д, J = 4,5 Гц), 4,85 (1Н, д, J = 4,5 Гц), 4,43 (1H, т, J = 4,0 Гц), 4,29 (1Н, м), 3,79 (1H, д, J = 9,5 Гц), 3,78 (1H, дд, J = 9,0, 2,5 Гц), 3,68 (1Н, д, J = 9,5 Гц), 3,28 (1H, м) і 2,57 (1H, дд, J = 9,0, 5,0 Гц). Наступні етапи 7-10 (представлені на схемі 1 як етапи g-j) описують синтез цис-(4R,6R)-4бензилокси-2,8-діокса-6гідроксибіцикло[3.3.0]октану (10), виходячи з цис(4R,6R)-2,8-діокса-4,6дигідроксибіцикло[3.3.0]октану (6). Схема 1. Синтез (3R,3а,4R,6а)-3бензилгексагідрофуро[23-b]фуран-4-олу (10) а. і. CSA (30% мольн.), DMP (4.4 екв.), THF, кипіння, 5 хв.; іі. Бурштиновий ангідрид, СН2СІ2, Et3N, кипіння, 1,5 год, 68 %; b. SO3піридин (3 екв.), ДМСО, Et3N, CH2Cl2, 0°C, 5 год, 96 %; с. Ph3PCH3Br (2 екв.), NaHMDS (1,9 екв.), THF, 0°С, 4 год, 95 %; d. Et3B (3 екв.), BH3 (0,5 екв.), THF, к. т., 2 d, 81 %; е. SO3піридин (3 екв.), ДМСО, Et3N, CH2Cl2, 0°C, 1,5 год, 93 % ; f. TFA, CH2Cl2, H2O, 85 %; g. TBDPSO (4 екв.), DMAP (0,8 екв.), імідазол (8 екв.), DMF. к. т., 79 %; h. NH4Cl (4 екв.), CH3OH, к. т., 40 %; і. BnBr (3 екв.), Na (3 екв.), TBAI (0,2 екв.), THF, 0°C, 65 %; j. TBAF (1,5 екв.), THF, к. т., 73 %. Список скорочень BnBr - бензилбромід CSA - камфорсульфокислота д - дублет дд - дублет дублетів дт - дублет триплетів 33 DMAP - 4-диметиламінопіридин DMF - диметилформамід DMP - диметоксипентан DMSO (ДМСО) - диметилсульфоксид EtOAC - етилацетат м - мультиплет NaHMDS - гексаметилдисилазан натрію к. т. - кімнатна температура с - синглет т - триплет TBAF - фторид тетрабутиламонію TBAI - йодид тетрабутиламонію TBDPSCl - трет-бутилдифенілсиліл хлорид TFA - трифтороцтова кислота THF - тетрагідрофуран Етап 7. Синтез цис-(4R,6R)-2,8-діокса-4,ббіс(трет-бутилдифеніл-силанокси)біцикло [3.3.0] октану До розчину діолу 6 (100 мг, 0,68 ммоль), імідазолу (372 мг, 5,48 ммоль) і DMAP (66 мг, 0,54 ммоль) у DMF (10 мл) додають третбутилдифенілсилілхлорид (0,72 мл, 2,74 ммоль) і перемішують при кімнатній температурі протягом доби. Розчинник видаляють у вакуумному роторному випарнику при 40°C і залишок очищають за допомогою колоночної хроматографії (гексан/ацетон 95/5). Наступне очищення методом препаративної ВЕРХ (гексан/ацетон 95/5) надає цис-(4R,6R)-2,8-діокса-4,6-біс(третбутилдифенілсиланокси)біцикло[3.3.0]октан у вигляді безбарвного масла (337 мг, 79 %). Rf 0,24 (гексан/ацетон 95/5). []D -10,5 (с 4,24, CHCl3, 24 1 °С). H ЯМР (400 МГц, CDCl3) д 7,73-7,70 (4Н, м), 7,57-7,52 (4Н, м), 7,49-7,33 (12Н, м), 5,89 (1Н, д, J = 5,0 Гц), 4,96 (1Н, д, J = 2,5 Гц), 4,36 (1Н, дт, J = 9,5, 6,8 Гц), 4,01 (1H, дд, J = 9,5, 1,0 Гц), 3,93 (1Н, дд, J = 9,5, 3,0 Гц), 3,40 (1Н, дд, J = 9,5, 6,5 Гц), 3,34 (1Н, дд, J = 9,5, 7,0 Гц), 2,94 (1H, дд, J = 9,0, 5,0 Гц), 1,12 (9Н, с), 0,91 (9Н, с) м.д. Етап 8. Синтез цис-(4R,6R)-2,8-діокса-4гідрокси-6-(трет-бутилдифеніл-силанокси)біцикло [3.3.0] октану Метод А До розчину сполуки 7, що перемішується, (47 мг, 0,075 ммоль) у метанолі (1,5 мл) при кімнатній температурі додають NH4F (22 мг, 0,6 ммоль). Через чотири дні розчинник видаляють у вакуумі та очищають методом колоночної хроматографії (гексан/ЕtOАс 85:15) з одержанням цис-(4R,6R)-2,8діокса-4-гідрокси-6-(третбутилдифенілсиланокси)біцикло[3.3.0]октану (8) у вигляді безбарвного масла (13 мг, 45 %). Rf 0,76 (гексан/ацетон 5:5). []D +18 (с 0,25, CHCl3, 27°C). 1 H ЯМР (400 МГц, CDCl3) д 7,71-7,62 (4Н, м), 7,497,39 (6Н, м), 5,71 (1Н, д, J = 5,0 Гц), 4,83 (1Н, д, J = 94391 34 3,5 Гц), 4,48 (1Н, дт, J = 7,0, 9,0 Гц), 4,12 (1Н, дд, J = 4,0, 10,0 Гц), 3,97 (1H, д, J = 10,0 Гц), 3,69 (1H, дд, J = 7,0, 9,0 Гц), 3,48 (1Н, т, J = 8,5 Гц), 2,61 (1Н, дд, J = 5,0, 9,0 Гц), 1,92 (1Н, с), 1,11 (9Н, с) м.д. Метод В До розчину діолу 6 (8,633 г, 0,059 моль), імідазолу (32,174 г, 0,472 моль), DMAP (5,773 г, 0,047 моль) у DMF (200 мл) додають третбутилдифенілсилілхлорид (66,18 мл, 0,236 моль) і перемішують при кімнатній температурі протягом доби. Як тільки реакція завершиться, додають 200 мл Et2O і 500 мл води. Шари розділяють і органічний шар промивають 300 мл води і 300 мл насиченого розчину солі, сушать над безводним Na2SO4, фільтрують і розчинник видаляють у вакуумі з одержанням неочищеного продукту у вигляді безбарвного масла. Неочищений продукт розчиняють у 400 мл метанолу і додають NH4F (8,752 г, 0,236 моль). Реакцію перемішують при температурі кипіння 2,5 год, потім розчинник видаляють у вакуумі. Очищення неочищеного продукту за допомогою колоночної хроматографії (гексан/ацетон 90:10, 85:15 і потім 100% ацетону) з одержанням одна за одною захищеної сполуки 7 (чистою не виділяли), цис-(4R,6R)-2,8-діокса-4-гідрокси-6-(третбутилдифеніл-силанокси)біцикло[3.3.0]октану (8) у вигляді безбарвного олії (10,03 г, 44 %) і незахищеної сполуки 6 (1,59 г, 18 %). Етап 9. Синтез цис-(4R,6R)-4-бензилокси-2,8діокса-6-(трет-бутилдифенілсиланокси)біцикло[3.3.0 ] октану До суспензії NaH, що перемішується, (268 мг, 7 ммоль, 60 % в маслі) у 3 мл THF при 0°C додають розчин спирту 8 (900 мг, 2,34 ммоль) у 9 мл THF. Через 10 хв додають бензилбромід (0,84 мл, 7 ммоль) і TBAI (177 мг, 0,47 ммоль) та реакцію перемішують при 0°С. Після завершення реакції через 4 години додають по краплях 2 мл води, для того щоб погасити надлишок NaH, і розчинник видаляють у вакуумі. Очищення неочищеного продукту за допомогою колоночної хроматографії (гексан/AcOEt 95:5) надає ЦИС-(4R,6R)-4-бензилокси2,8-діокса-6-(третбутилдифенілсиланокси)біцикло[3.3.0]октан (9) у вигляді безбарвного масла (725 мг, 65 %). RF 0,62 (гексан/AcOEt 7:3). []D -10,6 (с 0,7, CHCl3, 25°С). 1 H ЯМР (400 МГц, CDCl3) д 7,58-7,50 (4Н, м), 7,39-7,18 (11Н, м), 5,64 (1Н, д, J = 5,3 Гц), 4,56 (1Н д, J = 3,4 Гц), 4,40 (1H, д, J = 12,0 Гц), 4,37 (1Н, м), 4,32 (1H, д, J = 11,7 Гц), 4,11 (1H, J = 10,0 Гц), 3,98 (1Н, дд, J = 9,8, 10,2 Гц), 3,55 (1Н, дд, J = 8,7, 6,8 Гц), 3,36 (1Н, т, J = 8,7 Гц), 2,76 (1Н, дд, J = 5,3, 9,0 35 Гц), 0,98 (9Н, с) м.д. Етап 10. Синтез цис-(4R,6R)-4-бензилокси-2,8діокса-6-гідрокси-біцикло[3.3.0] октану 94391 формули: або До розчину сполуки 9, що перемішується, (532 мг, 1,12 ммоль) у 20 мл THF при кімнатній температурі додають TBAF (1,68 мл, 1,68 ммоль, 1M в THF). Через 10 хв розчинник видаляють у вакуумі та очищають «неочищений» продукт за допомогою колоночної хроматографії (гексан/AcOEt 80:20) з одержанням цис-(4R,6R)-4-бензилокси-2,8-діокса6-гідрокси-біцикло[3.3.0]октану (10) у вигляді білої твердої речовини (194 мг, 73 %). Rf 0,58 (гек1 сан/ацетон 5:5). []D +74 (с 0,15, CHCl3, 27°C). H ЯМР (400 МГц, CDCl3) 7,34-7,28 (5Н, м), 5,83 (1Н, д, J = 5,0 Гц), 4,55 (3Н, м), 4,48 (1Н, д, J = 3,8 Гц), 4,13 (1Н, д, J = 10,0 Гц), 4,00 (2Н, м), 3,62 (1H, дд, J = 7,0, 9,0 Гц), 2,93 (1Н, дд, J = 5,0, 8,0 Гц), 1,79 (1Н, ушир.с) м.д. Крім одержання сполуки (10), описаного вище, одержували також додаткові сполуки загальної До розчину, що перемішується, триетиламіну (43 мг, 423 мкмоль) і біс-(2,5-діоксопіролидин-1ил)ефіру вугільної кислоти (11) (58 мг, 226 мкмоль) у CH2Cl2 (5 мл) додають (10) (50 мг, 212 мкмоль). Суміш перемішують при кімнатній температурі протягом 4 годин. Додають 4-аміно-N-(3-аміно-2гідрокси-4-фенілбутил)-Nізобутилбензолсульфонамід (12) (83 мг, 212 мкмоль) однією порцією. Суміш перемішують протягом ночі при кімнатній температурі. Суміш потім розділяють за допомогою колоночної хроматографії, використовуючи CH2Cl2 CH2Cl2/MeOH (NH3) 97-3 як елюент. Після випарювання одержують (13) (53 мг, 81 мкмоль, 38 %) у вигляді білої твердої речовини. 36 в якій R=OBn (= сполуці 10), OPh, OCH2CN, або відповідно. Етап 11. Синтез 4бензилоксигексагідрофуро[2,3-b]фуран-3-ілового ефіру {3-[(4-амінобензолсульфоніл)ізобутиламіно]1-бензил-2-гідрокси-пропіл}карбамінової кислоти (13) + 1 PX-MC (М+Н) : 654; H ЯМР (400 МГц, CDCl3) д 7,54 (2Н, д, J = 8,68 Гц), 7,39-7,14 (10Н, м), 6,67 (2Н, д, J = 8,61 Гц), 5,8 (1Н, д, J = 5,18 Гц), 5,12 (1Н, ддд, J =11,87 Гц, J = 6,06 Гц, J = 5,81 Гц), 4,95 (1Н, д, J =8,54 Гц), 4,37 (1Н, д, J = 11,8 Гц), 4,26 (1H, д, J = 11,8 Гц), 4,15 (2Н, ушир.с), 4,08 (1H, д, J = 10,1 Гц) 3,98 (1H, дд, J = 10,0, J = 6,1 Гц), 3,913,80 (3Н, м), 3,75-3,50 (3Н, м), 3,12 (1Н, дд, J = 15,07, J = 8,43), 3,05-2,9 (4Н, м), 2,84-2,74 (2Н, м), 1,81 (1Н, септет, J = 6,62), 0,87 (3Н, д, J = 6,58), 0,45 (3Н, д, J = 6,58 Гц). Одержані таким чином сполуки досліджувалися в біологічному тесті на антивірусну активність. Як приклад далі приведений результат тесту сполуки (13): 4-бензилоксигексагідрофуро[2,3 37 94391 b]фуран-3-ілового ефіру {3-[(4амінобензолсульфоніл)ізобутиламіно]-1-бензил-2гідроксипропіл} карбамінової кислоти, у той час як еталонний препарат застосовували сполуку, названу TMC 114 або дарунавір, наступної хімічної структури, новий інгібітор протеази в стадії клінічних досліджень для лікування ВІЛ-інфекції. Дарунавір має наступну хімічну назву: (3R,3а,6а)-гексагідрофуро[2,3-b]фуран-3-іл-N[(1S,2R)-1-бензил-2-гідрокси-3-(N-1ізобутилсульфаніламідо) пропіл] карбамат 38 ють, що сполуки виявляють потенційну анти-ВІЛактивність проти лабораторного штаму ВІЛ дикого типу (WT IIIВ-2-001) та декількох мутантних штамів ВІЛ, названих як мутанти 1, 2, 3 і 4 у таблицях 1 і 2 відповідно. Дослідження на клітинах здійснювали у відповідності із наступною методикою. ВІЛ- або псевдо-інфіковані клітини MT4-LTREGFP інкубували протягом трьох днів у присутності згаданих вище сполук у різній концентрації. При інфікуванні вірусний білок tat активує репортер GFP. Наприкінці періоду інкубації вимірювали сигнал GFP. У контрольних зразках з вірусом (за відсутності будь-якого інгібітору) одержали максимальний сигнал флуоресценції. Інгібуючу активність сполуки досліджували за допомогою інфікованих вірусом клітин та обчислювали значення ЕС50. Зазначені значення являють собою кількість сполуки, необхідну для захисту 50 % клітин від вірусної інфекції. Дані, представлені в таблиці 1, містять значення рЕС50, що представляє собою негативний логарифм значень ЕС50. Сполуки тестувались на клітинах із застосуванням клітин MT4-LTR-EGFP для визначення антивірусної активності. Дослідження демонстру Таблиця 1 № сполуки TMC 114 13 Дикий тип 8,17 8,8 Мутант 1 8,09 8,0 Вірусні мутантні штами 1-4, що використовувалися для тестування, мали мутації, представле Мутант 2 6,10 6,5 Мутант 3 7,05 6,9 Мутант 4 5,43 5,7 ні в таблиці 2. Таблиця 2 Мутант 1 Мутант 2 Мутант 3 Мутант 4 V003I, L010I, V032T, L033M, E035D, S037Y, М046І, R057R/K, Q058E, L063P, К070Т, A071V, I072V, I084V, L089V V003I, V032I, L035D, М036І, S037N, К043Т, М046І, I047V, I050V, K055R, І057К, I062V, L063P, A071L, V082I, I085V, L090M, 1093L V003I, L0101, I013V, G016A/G, L019I, L033F, S037N, М0461,1050V, F053L, I054V, K055R, L063P, A071V, G073C, V077I/V, V082A, L090M V003I, L010F, I013V, V032T, S037N, М0461, I047V, I050V, L063P, A071V, 1084V, L089V, Т091А, Q092R Комп’ютерна верстка А. Крулевський Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProtease inhibitor precursor synthesis
Автори англійськоюLinclau Bruno
Назва патенту російськоюСинтез предшественника ингибитора протеазы
Автори російськоюЛинкло Бруно
МПК / Мітки
МПК: C07D 493/04, A61K 31/34, A61P 31/12
Мітки: інгібітора, протеази, попередника, синтез
Код посилання
<a href="https://ua.patents.su/19-94391-sintez-poperednika-ingibitora-proteazi.html" target="_blank" rel="follow" title="База патентів України">Синтез попередника інгібітора протеази</a>
Попередній патент: Застосування похідних індолінонів, призначених для лікування або попередження ідіопатичного фіброзу легенів
Наступний патент: Електронна система і спосіб поповнення рахунку кредитних карток
Випадковий патент: Майонез функціонального призначення












