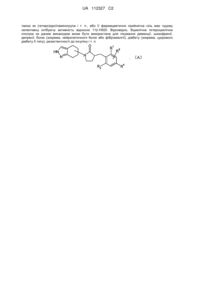
Біциклічна гетероциклічна сполука
Номер патенту: 112327
Опубліковано: 25.08.2016
Автори: Кавакамі Сімпей, Кавано Норіюкі, Сакураі Мінору, Сіраісі Нобуюкі, Морітомо Хіроюкі, Хамагуті Ватару, Судзукі Такаюкі, Морітомо Аяко, Секіока Рюіті
Формула / Реферат
1. Сполука, представлена формулою (І), або її фармацевтично прийнятна сіль,
[Хімічна структура 15]
 , (I)
, (I)
символи в формулі являють собою наступне:
кільце А: 5-6-членний моноциклічний гетероцикл, який може бути заміщений і як гетероатом містить тільки атоми азоту; де атоми в положенні, яким кільце конденсоване з сусіднім кільцем, являють собою атоми вуглецю,
R1: нижчий алкіл, галоген-нижчий алкіл або циклоалкіл, який може бути заміщений,
R2: галоген або нижчий алкіл,
R3: арил, гетероарил або нижчий алкілен-гетероарил; де кожний арил і гетероарил, представлений R3, може бути заміщений,
n: ціле число від 0 до 3, і
пунктирна лінія означає одинарний зв'язок або подвійний зв'язок.
2. Сполука або її фармацевтично прийнятна сіль за п. 1, де n дорівнює 0.
3. Сполука або її фармацевтично прийнятна сіль за п. 2, де R1 являє собою циклопропіл.
4. Сполука або її фармацевтично прийнятна сіль за п. 3, де біциклічне кільце, яке утворене кільцем А, конденсованим з сусіднім кільцем, являє собою 4,5,6,7-тетрагідроіндазол-5-іл.
5. Сполука або її фармацевтично прийнятна сіль за п. 4, де
R3 являє собою феніл, індоліл або індазоліл, які можуть бути заміщені, відповідно, групою, вибраною з Групи Q,
Група Q являє собою групу, що складається з галогену, нижчого алкілу, галоген-нижчого алкілу, -OR0, нижчого алкілен-OR0, -S-нижчого алкілу, арилу, гетероциклічної групи і нижчої алкілен-гетероциклічної групи (де арил і гетероциклічна група в Групі Q можуть бути заміщені галогеном, ціано, нижчим алкілом, -OR0 або оксо), і
R0 являє собою -Н або нижчий алкіл.
6. Сполука або її фармацевтично прийнятна сіль за п. 5, де
R3 являє собою феніл, який може бути заміщений групою, вибраною з групи, що складається з
(і) фенілу або піридилу, які можуть бути заміщені, відповідно, галогеном або ціано,
(іі) галогену,
(ііі) нижчого алкілу і
(iv) -О-нижчого алкілу.
7. Сполука або її фармацевтично прийнятна сіль за п. 5,
де R3 являє собою індоліл, який може бути заміщений нижчим алкілом або -О-нижчим алкілом.
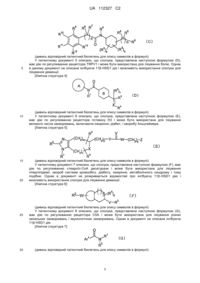
8. Сполука або її фармацевтично прийнятна сіль за п. 1, яка вибрана з групи, що складається з
(-)-N-циклопропіл-4-ізопропокси-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)бензаміду,
(-)-2'-ціано-N-циклопропіл-6'-фтор-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)біфеніл-4-карбоксаміду,
N-циклопропіл-1-метил-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)-1Н-індол-4-карбоксаміду,
N-циклопропіл-7-метокси-1-метил-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)-1Н-індол-4-карбоксаміду,
2'-ціано-N-циклопропіл-4'-фтор-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)біфеніл-4-карбоксаміду,
2'-ціано-N-циклопропіл-3-фтор-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)біфеніл-4-карбоксаміду,
N-циклопропіл-2',6'-дифтор-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)біфеніл-4-карбоксаміду,
N-циклопропіл-4-(3,5-дифторпіридин-4-іл)-N-(4,5,6,7-тетрагідро-2Н-індазол-5-іл)бензаміду і
N-циклопропіл-4-ізопропокси-2-метокси-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)бензаміду
або їх фармацевтично прийнятної солі.
9. Сполука або її фармацевтично прийнятна сіль за п. 1, яка являє собою
(-)-N-циклопропіл-4-ізопропокси-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)бензамід
або його фармацевтично прийнятну сіль.
10. Сполука або її фармацевтично прийнятна сіль за п. 1, яка являє собою
(-)-2'-ціано-N-циклопропіл-6'-фтор-N-(4,5,6,7-тетрагідро-1Н-індазол-5-іл)біфеніл-4-карбоксамід або його фармацевтично прийнятну сіль.
11. Фармацевтична композиція, що містить:
сполуку або її фармацевтично прийнятну сіль за будь-яким з пп. 1-10 і фармацевтично прийнятний носій.
12. Фармацевтична композиція за п. 11, яка являє собою агент, що інгібує 11b-гідроксистероїдну дегідрогеназу 1 типу.
13. Фармацевтична композиція за п. 11, яка являє собою засіб для профілактики або лікування деменції, шизофренії, депресії або болю.
14. Фармацевтична композиція за п. 11, яка являє собою засіб для профілактики або лікування деменції.
15. Фармацевтична композиція за п. 11, яка являє собою засіб для профілактики або лікування болю.
16. Застосування сполуки або її фармацевтично прийнятної солі за будь-яким з пп. 1-10 при отриманні агента, що інгібує 11b-гідроксистероїдну дегідрогеназу 1 типу, або засобу для профілактики або лікування деменції, шизофренії, депресії або болю.
17. Застосування сполуки або її фармацевтично прийнятної солі за будь-яким з пп. 1-10 для профілактики або лікування деменції, шизофренії, депресії або болю.
18. Сполука або її фармацевтично прийнятна сіль за будь-яким з пп. 1-10 для профілактики або лікування деменції, шизофренії, депресії або болю.
19. Спосіб профілактики або лікування деменції, шизофренії, депресії або болю, що включає введення ефективної кількості сполуки або її фармацевтично прийнятної солі за будь-яким з пп. 1-10 пацієнту.
Текст
Реферат: [Задача] Розробка сполуки, яка може бути використана як активний інгредієнт фармацевтичної композиції для лікування захворювань, пов'язаних з 11-гідроксистероїдною дегідрогеназою 1 типу, таких як деменція, шизофренія, депресія, біль (зокрема, нейропатичний біль або фіброміалгія), діабет (зокрема, цукровий діабет II типу, резистентності до інсуліну і тому подібні). [Засоби для рішення задачі] Було виявлено, що біциклічна гетероциклічна сполука (біциклічний гетероцикл, утворений, коли циклогексанове кільце конденсоване з 5-6-членним моноциклічним гетероциклом, який містить тільки атом азоту як гетероатоми), заміщена ациламіногрупою, UA 112327 C2 (12) UA 112327 C2 такою як (гетеро)ароїламіногрупа і т. п., або її фармацевтично прийнятна сіль має чудову селективну інгібуючу активність відносно 11-HSDl. Відповідно, біциклічна гетероциклічна сполука за даним винаходом може бути використана для лікування деменції, шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу), резистентності до інсуліну і т. п. UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОПИС Галузь техніки Даний винахід стосується біциклічної гетероциклічної сполуки або її фармацевтично прийнятної солі, яка може бути використана як активний інгредієнт фармацевтичної композиції, наприклад, фармацевтичної композиції для лікування захворювань, пов'язаних з 11βгідроксистероїдною дегідрогеназою 1 типу (11β-HSD1), таких як деменція (зокрема, деменція альцгеймерівського типу), шизофренія, депресія, біль (зокрема, нейропатичний біль або фіброміалгія), діабет (зокрема, цукровий діабет II типу) і резистентність до інсуліну. Передумови винаходу Глюкокортикоїд виробляється наднирковими залозами. Крім того, глюкокортикоїд перетворюється в активну форму з неактивної форми на тканинному рівні і діє на тканині за допомогою його рецепторів. 11β-гідроксистероїдна дегідрогеназа (11β-HSD) являє собою фермент, який каталізує це перетворення, і відомо, що існують два підтипи ферменту. 11β-гідроксистероїдної дегідрогенази 1 типу (11β-HSD1) є ферментом, який перетворює неактивну форму в активну форму і сильно експресується в печінці, і 11β-гідроксистероїдна дегідрогеназа 2 типу (11β-HSD2) є ферментом, який перетворює активну форму в неактивну форму і сильно експресується в нирках. 11β-HSD1 відомий також як такий, що сильно експресується в головному мозку, але 11βHSD2 практично не експресується в головному мозку (Thekkepat С. Sandeep et al., Proceedings of the National Academy of Science, 2004, Vol. 101, р. 6734-6739). Як наявність зв'язку між глюкокортикоїдом і деменцією у пацієнтів були отримані підтвердження про збільшення рівня активного глюкокортикоїду (кортизолу) в слині або крові пацієнтів з хворобою Альцгеймера (Giubilei F. et al., Journal of neuroscience research, 2001, Vol. 66, р. 262-265, Zeynel А Erkut et al., Neuropsychopharmacology, 2004, Vol. 29, р. 152-157), кореляція між HPA аксіальним порушенням (John G. Csernansky et al., The American Journal of Psychiatry, 2006, Vol. 163, р. 2164-2169), а також рівнем кортизолу і значенням індексу атрофії головного мозку і тому подібного (Giubilei F. et al., Journal of neuroscience research, 2001, Vol. 66, р. 262-265). Крім того, було підтверджено, що введення препарату кортизолу або глюкокортикоїду здоровому індивідууму або пацієнту з хворобою Альцгеймера індукує мовний розлад або порушення пам'яті (A. H. Young et al., Psychopharmacology, 1999, Vol. 145, р. 260266, P. S. Aisen et al., Neurology, 2000, Vol. 54, р, 588-593). Більш того як зв'язок між 11β-HSD1 і пізнавальною здатністю, повідомлялося про дію по поліпшенню вербальної пам'яті при введенні неселективного інгібітора 11β-HSD пацієнту з цукровим діабетом II типу (Thekkepat С. Sandeep et al., Proceeding of National Academy of Science, 2004, Vol. 101, р. 6734-6739), а також про дію по ослабленню когнітивного розладу у дорослих мишей з нокаутованим геном 11β-HSD1 (Joyce L., W. Yau et al., Proceeding of the National Academy of Science, 2001, Vol. 98, р. 4716-4721) і тому подібне. У зв'язку з цим очікується, що інгібітор 11β-HSD1 буде придушувати дію глюкокортикоїду в мозку шляхом інгібування перетворення глюкокортикоїду в активний вид, і, відповідно, може бути використаний для лікування когнітивного розладу, викликаного глюкокортикоїдом. Крім того, що стосується деменції, очікується, що інгібітор 11β-HSD1 буде послабляти захворювання центральної нервової системи, такі як шизофренія (X. Y. Zhang et al., Neuropsychopharmacology, 2005, Vol. 30, р, 1532-1538), депресія (Bernard J. Carroll et al., Archives of General Psychiatry, 1981, Vol. 38, р. 15-22), тривожність (Veen G. et al., Metabolism, 2009, Vol. 58, р. 821-827), посттравматичний стресовий розлад (PTSD) (Charney D. S. et al., Archives of General Psychiatry, 1993, Vol. 50, р. 295-305), синдром дефіциту уваги з гіперактивністю (AD/HD) (Hong H. J. et al., Yonsei Medical Journal, 2003, Vol. 44, р. 608-614), панічний розлад (Angelika E. et al., Neuropsychopharmacology, 2006, Vol. 31, р. 2515-2522), порушеннясну (Andersen M. L. et al., Journal of sleep research, 2005, Vol. 14, р. 83-90), які тісно пов'язані зі стресом і виявляють розлад ГГА-осі або збільшують рівень кортизолу в плазмі. У зв'язку з цим, як підтвердження наявності зв'язку між 11β-HSD1 і метаболічними розладами, відоме підвищення активності 11β-HSD1 в жировій тканині людини, що страждає ожирінням (Rask E. et al., The Journal of Clinical Endocrinology & Metabolism, 2001, Vol. 86, р. 1418-1421), і повідомлялося, що активність 11β-HSD1 тісно корелює з BMI як індексом ожиріння, HOMA-IR як індексом резистентності до інсуліну, і рівнем глюкози в крові натщесерце (Lindsay R. S. et al., The Journal of Clinical Endocrinology & Metabolism, 2003, Vol. 88, р. 2738-2744). Повідомлялося також, що надекспресія 11β-HSD1 у трансгенних мишей селективно в жировій тканині показує збільшення рівня глюкокортикоїду в жировій тканині і резистентність до інсуліну, вісцеральне ожиріння, гіперліпідемію і гіпертензію (Masuzaki H. et al., Science, 2001, Vol. 294, р. 2166-2170, Masuzaki H. et al., The Journal of Clinical Investigation, 2003, Vol. 112, р. 83-90), і, що 1 UA 112327 C2 5 10 15 20 25 30 35 40 миші з нокаутованим геном 11β-HSD1 показують поліпшення толерантності до глюкози, зниження рівнів тригліцеридів в крові і підвищення рівнів HDL-холестерину (Morton N. M. et al., The Journal of Biological Chemistry, 2001, Vol. 276, р. 41293-41300). У зв'язку з цим очікується, що селективний інгібітор 11β-HSD1 придушує дію глюкокортикоїду в тканині шляхом інгібування перетворення глюкокортикоїду в активний тип, і, отже, може бути використаний для лікування метаболічних аномалій, таких як гіперглікемія, резистентність до інсуліну, ожиріння, гіперліпідемія і гіпертензія, викликана глюкокортикоїдом. Повідомлялося також, що неселективний інгібітор 11β-HSD, карбеноксолон, поліпшує недостатню секрецію інсуліну, викликану доданням неактивного глюкокортикоїду до β-клітин підшлункової залози щурів (Davani B. et al., The Journal of Biological Chemistry, 2000, Vol. 275, р. 34841-34844), таким чином, передбачається, що інгібітор 11β-HSD1 має можливість ослаблення не тільки резистентності до інсуліну, але також і гіперглікемії шляхом сприяння секреції інсуліну. Крім того, повідомляється, що сполука триазолу, яка має інгібуючу 11β-HSD1 дію, є ефективним в моделі лігатури спінального нерва як на тваринній моделі нейропатичного болю, так і на тваринній моделі фіброміалгії, викликаної повторним введенням резерпіну (патентний документ 1), таким чином, передбачається, що інгібітор 11β-HSD1 є ефективним для лікування болю, зокрема, нейропатичного болю і фіброміалгії. Приклади інших захворювань, пов'язаних з 11β-HSD1, включають остеопороз (Cooper M. S. et al., Bone, 2000, Vol. 27, р, 375-381) і глаукому (Rauz S. et al., Investigative Opthalmology & Visual Science, 2001, Vol. 42, р, 2037-2042), і очікується, що інгібітор 11β-HSD1 буде ефективним для послаблення вказаних захворювань. У патентному документі 2 описано, що сполука, представлена наступною формулою (А), має інгібуючу 11β-HSD1 дію і може бути використана для лікування захворювань, таких як діабетичні захворювання і метаболічний синдром. Однак, в сполуці, група, відповідна амідній групі сполуки за даною заявкою, являє собою циклічний амід. [Хімічна структура 1] (дивись відповідний патентний бюлетень для опису символів в формулі) У патентному документі 3 описано, що сполука, представлена наступною формулою (В), має дію по регулюванню гідроксистероїдних дегідрогеназ, таких як 11β-HSD1, і може бути використана для лікування великого числа захворювань, включаючи діабет, метаболічний синдром і деменцію. Однак вказана сполука не включає кільце, відповідне кільцю А сполуки за даною заявкою. [Хімічна структура 2] (дивись відповідний патентний бюлетень для опису символів в формулі) У патентному документі 4 описано, що сполука, представлена наступною формулою (С), має інгібуючу дію у відношенні 11β-HSD1, 11β-HSD2, 17β-HSD3 і тому подібних і може бути використана для лікування великого числа захворювань, включаючи діабет, метаболічний синдром і деменцію. Однак дана сполука не включає кільце, відповідне кільцю А сполуки за даною заявкою. [Хімічна структура 3] 2 UA 112327 C2 5 10 15 20 25 30 (дивись відповідний патентний бюлетень для опису символів в формулі) У патентному документі 5 описано, що сполука, представлена наступною формулою (D), має дію по регулюванню рецептора TRPV1 і може бути використана для лікування болю. Однак в даному документі не описана інгібуюча 11β-HSD1 дія і можливість використання сполуки для лікування деменції. [Хімічна структура 4] (дивись відповідний патентний бюлетень для опису символів в формулі) У патентному документі 6 описано, що сполука, представлена наступною формулою (Е), має дію по регулюванню рецептора гістаміну H3 і може бути використана для лікування великого числа захворювань, включаючи ожиріння, діабет, і хворобу Альцгеймера. [Хімічна структура 5] (дивись відповідний патентний бюлетень для опису символів в формулі) У патентному документі 7 описано, що сполука, представлена наступною формулою (F), має дію по регулюванню стеароїл-СоА десатурази і може бути використана для лікування гіперліпідемії, хвороб системи кровообігу, діабету, ожиріння, метаболічного синдрому і тому подібне. Однак в документі не розкривається відомостей про інгібуючу 11β-HSD1 дію і можливість використання сполуки для лікування деменції. [Хімічна структура 6] (дивись відповідний патентний бюлетень для опису символів в формулі) У патентному документі 8 описано, що сполука, представлена наступною формулою (G), має дію по регулюванню рецептора C5A і може бути використана для лікування різних запальних захворювань і імунологічних захворювань. Однак в документі не описана інгібуюча 11β-HSD1 дія. [Хімічна структура 7] (дивись відповідний патентний бюлетень для опису символів в формулі) 3 UA 112327 C2 5 10 15 20 25 30 35 40 45 У патентному документі 9 описано, що сполука, представлена наступною формулою (Н), має антибактерійну активність і може бути використана для лікування інфекції. Однак в документі не описана інгібуюча 11β-HSD1 дія і можливість використання сполуки для лікування деменції. [Хімічна структура 8] (дивись відповідний патентний бюлетень для опису символів в формулі) Рівень техніки Патентний документ Патентний документ 1: Міжнародна публікація WO2012/033070 Патентний документ 2: Міжнародна публікація WO2007/124254 Патентний документ 3: Міжнародна публікація WO2007/145834 Патентний документ 4: Міжнародна публікація WO2008/088540 Патентний документ 5: Міжнародна публікація WO2007/069773 Патентний документ 6: Міжнародна публікація WO01/068652 Патентний документ 7: Міжнародна публікація WO2007/050124 Патентний документ 8: Міжнародна публікація WO03/082826 Патентний документ 9: Міжнародна публікація WO2006/105289 Опис винаходу Технічна задача Задачі, що вирішуються винаходом Даний винахід стосується нової сполуки, яка може бути використана як активний інгредієнт фармацевтичної композиції, наприклад, фармацевтичної композиції для лікування захворювань, пов'язаних з 11β-гідроксистероїдною дегідрогеназою 1 типу, таких як деменція (зокрема, деменція альцгеймерівського типу), шизофренія, депресія, біль (зокрема, нейропатичний біль або фіброміалгія), діабет (зокрема, цукровий діабет II типу), резистентність до інсуліну і тому подібних. Засоби для рішення задач Автори даного винаходу провели ретельні дослідження відносно сполуки, що має інгібуючу 11β-HSD1 дію, що дозволяє чекати поліпшення стану при деменції (зокрема, деменції альцгеймерівського типу), шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабеті (зокрема, цукровому діабеті II типу) і резистентності до інсуліну. В результаті було виявлено, що біциклічна гетероциклічна сполука (біциклічний гетероцикл утворюється, коли циклогексанове кільце конденсоване з 5-6-членним моноциклічним гетероциклом, що містить тільки атом азоту у вигляді гетероатому), заміщене ациламіногрупою, такою як (гетеро)ароїламіногрупа, або її фармацевтично прийнятна сіль має чудову селективну інгібуючу дію у відношенні 11β-HSD1, що дозволило створити даний винахід. Таким чином, даний винахід стосується сполуки формули (I) або її солі і фармацевтичної композиції, що містить сполуку формули (I) або її сіль і допоміжну речовину. [Хімічна структура 9] символи в формулі являють собою наступні: кільце А: 5-6-членний моноциклічний гетероцикл, який може бути заміщений і як гетероатом містять тільки атоми азоту; де атоми в положенні, коли кільце конденсоване з сусіднім кільцем, являють собою атоми вуглецю, 1 R : нижчий алкіл, галоген-нижчий алкіл або циклоалкіл, який може бути заміщений, 2 R : галоген або нижчий алкіл, 4 UA 112327 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 R : арил, гетероарил або нижчий алкілен-гетероарил; де кожний арил і гетероарил, 3 представлений R , може бути заміщений, n: ціле число від 0 до 3, і пунктирна лінія означає одинарний зв'язок або подвійний зв'язок. Крім того, даний винахід стосується фармацевтичної композиції, яка містить сполуку формули (I) або її сіль і призначена для лікування деменції (зокрема, деменції альцгеймерівського типу), шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу) і резистентності до інсуліну. Крім того, фармацевтична композиція включає агент, який включає сполуку формули (I) або її сіль і призначений для лікування деменції (зокрема, деменції альцгеймерівського типу), шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу) і резистентності до інсуліну. Більше того, даний винахід стосується застосування сполуки формули (I) або її солі при отриманні фармацевтичної композиції для лікування деменції (зокрема, деменції альцгеймерівського типу), шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу) і резистентності до інсуліну; застосуванню сполуки формули (I) або її солі для лікування деменції, шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу) і резистентності до інсуліну; сполуки формули (I) або її солі для лікування деменції (зокрема, деменції альцгеймерівського типу), шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу) і резистентності до інсуліну; і способу лікування деменції, шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу) і резистентності до інсуліну, який включає введення ефективної кількості сполуки формули (I) або її солі суб'єкту. Крім того, "суб'єкт" стосується людини або іншої тварини, якій потрібна профілактика або лікування вказаних вище захворювань. Як інший варіант здійснення винаходу "суб'єкт" стосується людини, якій потрібна профілактика або лікування вищезгаданих захворювань. Таким чином, даний винахід стосується (1) Фармацевтичної композиції, що містить сполуку формули (I) або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій; (2) Фармацевтичної композиції згідно з (1), яка являє собою інгібітор 11β-гідроксистероїдної дегідрогенази 1 типу; (3) Фармацевтичної композиції згідно з (1), яка являє собою засіб для профілактики або лікування деменції, шизофренії, депресії або болю; (4) Фармацевтичної композиції згідно з (1), яка являє собою засіб для профілактики або лікування деменції; (5) Фармацевтичної композиції згідно з (1), яка являє собою засіб для профілактики або лікування болю; (6) Застосуванню сполуки формули (I) або її фармацевтично прийнятної солі при отриманні інгібітору 11β-гідроксистероїдної дегідрогенази 1 типу або засобу для профілактики або лікування деменції, шизофренії, депресії або болю; (7) Застосуванню сполуки формули (I) або її фармацевтично прийнятної солі для профілактики або лікування деменції, шизофренії, депресії або болю; (8) Сполуки формули (I) або її фармацевтично прийнятної солі для профілактики або лікування деменції, шизофренії, депресії або болю; (9) Спосіб профілактики або лікування деменції, шизофренії, депресії або болю, що включає введення ефективної кількості сполуки формули (I) або її солі пацієнту. Ефекти винаходу Сполука формули (I) або її сіль має інгібуючу 11β-HSD1 дію і може бути використана як засіб для профілактики і/або лікування деменції (зокрема, деменції альцгеймерівського типу), шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу), резистентності до інсуліну і тому подібне.) Варіанти здійснення винаходу Тут і далі даний винахід детально описаний в деталях. У даному описі "нижчий алкіл" стосується лінійного або розгалуженого алкілу, що має від 1 до 6 атомів вуглецю (тут і далі, скорочено C1-6), наприклад, метилу, етилу, н-пропілу, ізопропілу, н-бутилу, ізобутилу, втор-бутилу, трет-бутилу, н-пентилу, н-гексилу або тому подібне. Як інший варіант здійснення винаходу нижчий алкіл являє собою C1-4 алкіл, і, згідно з ще одним варіантом здійснення винаходу, нижчий алкіл являє собою метил, етил, н-пропіл або ізопропіл. 5 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Нижчий алкілен" стосується лінійного або розгалуженого C 1-6 алкілену, наприклад, метилену, етилену, триметилену, тетраметилену, пентаметилену, гексаметилену, пропілену, метилметилену, етилетилену, 1,2-диметилетилену, 1,1,2,2-тетраметилетилену або тому подібним. Як інший варіант здійснення винаходу нижчий алкілен являє собою C 1-4 алкілен, і, згідно з ще одним варіантом здійснення винаходу, нижчий алкілен являє собою метилен, етилен або триметилен. "Галоген" стосується F, Cl, Br або I. "Галоген-нижчий алкіл" стосується нижчого алкілу, заміщеного одним або декількома атомами галогену. Як інший варіант здійснення винаходу галоген-нижчий алкіл являє собою нижчий алкіл, заміщений від 1 до 5 атомами галогену, і, згідно з ще одним варіантом здійснення винаходу, галоген-нижчий алкіл являє собою фторметил, дифторметил, трифторметил, 2фторетил, 1,1-дифторетил, 2,2-дифторетил, 2,2,2-трифторетил, пентафторетил або тому подібне. "Циклоалкіл" стосується насиченої C 3-10 вуглеводневої кільцевої групи, яка може мати місток. Циклоалкіл являє собою, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, адамантил або тому подібне. Як інший варіант здійснення винаходу циклоалкіл являє собою C3-8 циклоалкіл, і, згідно з ще одним варіантом здійснення винаходу, циклоалкіл являє собою циклопропіл, циклобутил, циклопентил або циклогексил. "Арил" стосується моно- - трициклічної C6-14 ароматичної вуглеводневої кільцевої групи, наприклад, фенілу, нафтилу, 5-тетрагідронафтилу, 6-тетрагідронафтилу, 4-інденілу, 1флуоренілу або тому подібному. Як інший варіант здійснення винаходу арил являє собою феніл або нафтил, і, згідно з ще одним варіантом здійснення винаходу, арил являє собою феніл. "Гетероцикл" стосується 3-15-членної, або, як інший варіант здійснення винаходу, 5-10членної моно- - трициклічної гетероциклічної групи, що містить від 1 до 4 гетероатомів, вибраних з кисню, сірки і азоту. Гетероцикл включає насичені кільцеві, ароматичні кільцеві і циклічні групи, утворені, коли вказані кільця є частково гідрованими. Сірка або азот у вигляді атома кільця можуть бути окиснені з утворенням оксиду або діоксиду. Гетероцикл являє собою, зокрема, піридил, піроліл, піразиніл, піримідиніл, піридазиніл, імідазоліл, триазоліл, триазиніл, тетразоліл, тіазоліл, піразоліл, ізотіазоліл, оксазоліл, ізоксазоліл, тіадіазоліл, оксадіазоліл, тієніл, фурил, індоліл, ізоіндоліл, бензімідазоліл, індазоліл, хіноліл, ізохіноліл, хіназолініл, хіноксалініл, нафтилідил, цинолініл, фталазиніл, бензотіазоліл, бензізотіазоліл, бензотіадіазоліл, бензоксазоліл, бензізоксазоліл, бензофураніл, бензотієніл, карбазоліл, дибензо[b, d]фураніл, дибензо[b, d]тієніл, азетидиніл, піролідиніл, піперидил, піперазиніл, азепаніл, діазепаніл, морфолініл, тіоморфолініл, тетрагідропіридиніл, оксетаніл, тетрагідрофураніл, тетрагідропіраніл, діоксоланіл, діоксаніл, тетрагідротіопіраніл, індолініл, тетрагідрохіноліл, тетрагідроізохіноліл, дигідробензімідазоліл, тетрагідробензімідазоліл, тетрагідроіндазоліл, тетрагідрохіноксалініл, тетрагідроцинолініл, дигідрохіноксалініл, дигідробензоксазоліл, дигідробензоксазиніл, дигідробензофурил, 1,3-бензодіоксоліл, хроманіл, хроменіл, метилендіоксифеніл, етилендіоксифеніл, динуклідиніл або тому подібне. Як інший варіант здійснення винаходу гетероцикл являє собою 5-10-членну моно- або біциклічну гетероциклічну групу, і, згідно з ще одним варіантом здійснення винаходу, гетероцикл являє собою піридил, тіазоліл, тієніл, фурил, індоліл, бензотієніл, індазоліл, піролідиніл, морфолініл, оксетаніл або тетрагідропіраніл. "Гетероарил" стосується, крім вищезгаданих "гетероциклів", 5-15-членної, або, як інший варіант здійснення винаходу, 5-10-членної від моно- до трициклічної ароматичної гетероциклічної групи, що містить від 1 до 4 гетероатомів, вибраних з кисню, сірки і азоту. Сірка або азот у вигляді атома кільця можуть бути окиснені з утворенням оксиду або діоксиду. Гетероарил, зокрема, являє собою піридил, піроліл, піразиніл, піримідиніл, піридазиніл, імідазоліл, триазоліл, триазиніл, тетразоліл, тіазоліл, піразоліл, ізотіазоліл, оксазоліл, ізоксазоліл, тіадіазоліл, оксадіазоліл, тієніл, фурил, індоліл, ізоіндоліл, бензімідазоліл, індазоліл, хіноліл, ізохіноліл, хіназоліл, хіноксалініл, нафтилідил, цинолініл, фталазиніл, бензотіазоліл, бензизотіазоліл, бензотіадіазоліл, бензоксазоліл, бензізоксазоліл, бензофураніл, бензотієніл, карбазоліл, бензо[b, d]фураніл, бензо[b, d]тієніл або тому подібне. Як інший варіант здійснення винаходу гетероарил являє собою 5-10-членний моно- або біциклічний гетероарил, і, згідно з ще одним варіантом здійснення винаходу, гетероарил являє собою 5-6-членний моноциклічний гетероарил. Як інший варіант здійснення винаходу гетероарил являє собою піридил, тіазоліл, тієніл, фурил, індоліл, бензотієніл або індазоліл. "5-6- членний моноциклічний гетероцикл, що містить тільки атом азоту у вигляді гетероатому", стосується, не тільки вищезгаданих "гетероциклів", але також і 5-6-членної моноциклічної гетероциклічної групи, що містить тільки 1-3 атоми азоту як гетероатоми, і що 6 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 включає насичене кільце, ароматичне кільце і циклічні групи, утворені, коли вказані кільця частково гідровані. Азот у вигляді кільцевого атома може бути окиснений з утворенням оксиду. Моноциклічний гетероцикл, зокрема, являє собою піроліл, піразоліл, імідазоліл, триазоліл, піридил, піридазиніл, піримідиніл, піразиніл або триазиніл. Як інший варіант здійснення винаходу моноциклічний гетероцикл являє собою піразоліл, піридазиніл або піримідиніл. У даному описі слова "може бути заміщений" означають, що група є незаміщеною або містить від 1 до 5 замісників. Крім того, слово "заміщений" означає, що група містить від 1 до 5 замісників. Коли група містить множину замісників, вказані замісники можуть бути одними і тими ж або відрізнятися один від одного. 2 «(R )n-» в циклогексановому кільці або в циклогексеновому кільці у вигляді біциклічного кільця, яке утворюється, коли кільце А конденсоване з сусіднім циклогексановим кільцем або 2 циклогексеновим кільцем, означає, що кільце заміщене n групами, представленими R , в частині циклогексанового кільця або циклогексенового кільця у вигляді біциклічного кільця, яке утворюється, коли кільце А конденсоване з сусіднім циклогексановим кільцем або циклогексеновим кільцем (де кільце є незаміщеним, коли n являє собою 0). Коли n являє собою 2 множину, відповідні замісники, представлені R , можуть бути одними і тими ж, або відрізнятися один від одного. Приклади замісника в "5-6-членному моноциклічному гетероциклі, що містить тільки атом азоту у вигляді гетероатому", яке може бути заміщене в кільці А, включають групу, вибрану з 0 0 галогену, нижчого алкілу, галоген-нижчого алкілу, -OR , -O-галоген-нижчого алкілу і оксо (де R являє собою -H або нижчий алкіл, те ж саме використовується тут і далі). 3 Приклади замісника в "арилі" або "гетероарилі", які можуть бути відповідно заміщеними в R , включають групу, вибрану з наступної Групи G. 0 0 Група G: галоген, ціано, нижчий алкіл, галоген-нижчий алкіл, -N(R )2, -OR -, -O-галогеннижчий алкіл, -O-(нижчий алкіл, заміщений циклоалкілом), -(нижчий алкілен, який може бути 0 заміщений галогеном)-OR , нижчий алкілен-О-циклоалкіл, нижчий алкілен-О-аріл, нижча 0 0 алкілен-О-гетероциклічна група, нижчий алкілен-N(R )2, нижчий алкілен-CO2R , нижчий алкілен0 С(О)N(R )2, -S-нижчий алкіл, -S(О)-нижчий алкіл, -S(О)2-нижчий алкіл, нижчий алкілен-S-нижчий 0 алкіл, нижчий алкілен-S(О)-нижчий алкіл, нижчий алкілен-S(О)2-нижчий алкіл, -CO2R , 0 C(О)N(R )2, циклоалкіл, арил, гетероциклічна група, нижчий алкілен-циклоалкіл, нижчий алкіленарил, нижча алкілен-гетероциклічна група, -O-циклоалкіл, -O-арил, -O-гетероциклічна група, -Oнижчий алкілен-арил і -O-нижча алкілен-гетероциклічна група. У даному документі арил і гетероциклічна група в Групі G можуть бути, відповідно, заміщені 0 галогеном, ціано, нітро, нижчим алкілом, галогеном-нижчим алкілом, -OR , -O-галоген-нижчим 0 0 0 алкілом, нижчим алкілен-OR , -S(О)2-нижчим алкілом, циклоалкілом, -CO2R , -C(О)N(R )2 або оксо, і циклоалкіл в Групі G може бути заміщений галогеном або нижчим алкілом. 0 Альтернативно, дві групи в Групі G можуть утворювати нижчий алкілен, -N(R )-нижчий 0 алкілен або нижчий алкілен-N(R )- в комбінації. Приклади іншого варіанту замісника в "арилі" або "гетероарилі", які можуть бути, відповідно, 3 заміщені в R , включають групу, вибрану з наступної Групи Q. 0 0 Група Q: галоген, нижчий алкіл, галоген-нижчий алкіл, -OR , нижчий алкілен-OR , -S-нижчий алкіл, арил, гетероциклічна група і нижча алкілен-гетероциклічна група. У даному документі арил і гетероциклічна група в Групі Q можуть бути заміщені галогеном, 0 ціано, нижчим алкілом, -OR або оксо. Приклади ще одного варіанту замісника в "арилі" або "гетероарилі", які можуть бути, 3 відповідно, заміщені в R , включають групу, вибрану з (i) фенілу або піридилу, які можуть бути, відповідно, заміщені галогеном або ціано, (ii) галогену, (iii) нижчого алкілу і (iv) -O-нижчого алкілу. 1 Приклади замісника в "циклоалкілі", який може бути заміщений в кільці R , включають галоген, нижчий алкіл і тому подібне. Варіанти здійснення сполуки за даним винаходом, представленої формулою (I) представлені далі. 1 (1) Сполука, в якій R являє собою метил, етил, н-пропіл, ізопропіл або циклопропіл, як 1 інший варіант здійснення винаходу сполуки, в якій R являє собою циклопропіл (2) Сполука, в якій біциклічне кільце, утворене, коли кільце А конденсоване з сусіднім кільцем, являє собою 4,5,6,7-тетрагідроіндазол-5-іл, який може бути заміщений галогеном, 0 нижчим алкілом, галоген-нижчим алкілом, -OR або -O-галоген-нижчим алкілом, як інший варіант здійснення винаходу сполуки, в якій біциклічне кільце, утворене, коли кільце А конденсоване з сусіднім кільцем, являє собою 4,5,6,7-тетрагідроіндазол-5-іл (3) Сполука, в якій n являє собою 0 7 UA 112327 C2 3 5 10 15 20 25 30 35 40 45 50 55 (4) Сполука, в якій R являє собою арил або гетероарил, який може бути, відповідно, заміщений групою, вибраною з Групи Q, 3 як інший варіант здійснення винаходу сполука, в якій R являє собою феніл, індоліл або індазоліл, які можуть бути, відповідно, заміщені групою, вибраною з Групи Q, 3 як інший варіант здійснення винаходу сполука, в якій R являє собою феніл, який може бути заміщений групою, вибраною з (i) фенілу або піридилу, які можуть бути, відповідно, заміщені галогеном або ціано, (ii) галогену, (iii) нижчого алкілу і (iv) -O-нижчого алкілу; згідно з ще одним 3 варіантом здійснення винаходу, сполука, в якій R являє собою феніл, який може бути заміщений фенілом, заміщеним галогеном або ціано і може бути далі заміщений галогеном; як 3 інший варіант здійснення винаходу сполука, в якій R являє собою феніл, який може бути заміщений фенілом, заміщеним галогеном або ціано в 4-ому положенні і може бути далі 3 заміщений галогеном; і як інший варіант здійснення винаходу сполука, в якій R являє собою феніл, який може бути заміщений 2-ціанофенілом, який може бути заміщений галогеном в 4-ом положенні і може бути далі заміщений галогеном, 3 як інший варіант здійснення винаходу сполука, в якій R являє собою феніл, заміщений нижчим алкілом або -O-нижчим алкілом; і як інший варіант здійснення винаходу сполука, в якій 3 R являє собою феніл, заміщений -O-нижчим алкілом, 3 як інший варіант здійснення винаходу сполука, в якій R являє собою індоліл, який може бути заміщений нижчим алкілом або -O-нижчим алкілом, і як інший варіант здійснення винаходу 3 сполука, в якій R являє собою індол-4-іл, який може бути заміщений нижчим алкілом або -Oнижчим алкілом (6) Сполука, яка являє собою комбінацію двох або декількох груп відповідно до вищезгаданих варіантів здійснення винаходу від (1) до (5) Як конкретні варіанти здійснення комбінації двох або декількох груп відповідно до вищезгаданих варіантів здійснення винаходу від (1) до (5) варіант здійснення (6) показаний в наступних прикладах (a)-(f). (a) Сполука, представлена формулою (I), в якій n являє собою 0 1 (b) Сполука, згідно з (a), в якій R являє собою циклопропіл (с) Сполука, згідно з (b), в якій біциклічна група, утворена, коли кільце А конденсоване з сусіднім кільцем, являє собою 4,5,6,7-тетрагідроіндазол-5-іл 3 (d) Сполука, згідно з (с), в якій R являє собою феніл, індоліл або індазоліл, які можуть бути, відповідно, заміщені групою, вибраною з Групи Q 3 (е) Сполука, згідно з (d), в якій R являє собою феніл, який може бути заміщений групою, вибраною з групи, що включає (i) феніл або піридил, які можуть бути, відповідно, заміщені галогеном або ціано, (ii) галоген, (iii) нижчий алкіл і (iv) -O-нижчий алкіл 3 (f) Сполука, згідно з (d), в якій R являє собою індоліл, який може бути заміщений нижчим алкілом або -O-нижчим алкілом Приклади конкретних сполук, що охоплюються даним винаходом, включають наступні сполуки: Сполука, вибрана з групи, що включає (-)-N-циклопропіл-4-ізопропокси-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)бензамід, (-)-2’-ціано-N-циклопропіл-6’-фтор-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)біфеніл-4карбоксамід, N-циклопропіл-1-метил-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)-1H-індол-4-карбоксамід, N-циклопропіл-7-метокси-1-метил-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)-1H-індол-4карбоксамід, 2’-ціано-N-циклопропіл-4’-фтор-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)біфеніл-4-карбоксамід, 2’-ціано-N-циклопропіл-3-фтор-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)біфеніл-4-карбоксамід, N-циклопропіл-2",6’-дифтор-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)біфеніл-4-карбоксамід, N-циклопропіл-4-(3,5-дифторпіридин-4-іл)-N-(4,5,6,7-тетрагідро-2H-індазол-5-іл)бензамід, і N-циклопропіл-4-ізопропокси-2-метокси-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)бензамід Сполука формули (I) може мати таутомери або геометричні ізомери, в залежності від типу замісника. У даному описі сполука формули (I) в деяких випадках описана тільки в одній формі ізомеру. Однак даний винахід включає інші ізомери, розділені ізомери або їх суміш. Наприклад, 4,5,6,7-тетрагідроіндазол-5-іл в даному винаході описаний у вигляді таутомеру одного з наступних (А) і (В), але таутомери обох (А) і (В) також включені в даний винахід. [Хімічна структура 10] 8 UA 112327 C2 5 10 15 20 25 30 35 40 45 (* являє собою точку приєднання) Крім того, в деяких випадках сполука формули (I) має асиметричні атоми вуглецю або хиральну вісь і тому може бути представлена у вигляді оптичного ізомеру. Даний винахід включає окремі оптичні ізомери сполуки формули (I) або їх суміш. Даний винахід також включає фармацевтично прийнятні проліки сполуки, представленої формулою (I). Фармацевтично прийнятні проліки належать до сполук, що мають групу, яка може бути перетворена в аміногрупу, гідроксильну групу, карбоксильну групу або тому подібну шляхом сольволізу або в фізіологічних умовах. Приклади груп, які утворюють проліки, включають групи, описані в Prog. Med., 5, 2157-2161 (1985), або в "Pharmaceutical Research and Development", (Hirokawa Publishing Company, 1990), Vol. 7, Drug Design 163-198. Сіль сполуки формули (I) стосується фармацевтично прийнятної солі сполуки формули (I), і являє собою сіль додання кислоти або сіль додання основи, в залежності від типу замісника. Конкретні приклади солей включають солі додання кислот з неорганічною кислотою, такою як хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, азотна кислота або фосфорна кислота, або з органічною кислотою, такою як мурашина кислота, оцтова кислота, пропіонова кислота, щавлева кислота, малонова кислота, янтарна кислота, фумарова кислота, малеїнова кислота, молочна кислота, яблучна кислота, мигдалева кислота, винна кислота, дибензоїл-винна, дитолуоїл-винна, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, п-толуолсульфонова кислота, аспарагінова кислота або глутамінова кислота, солі з неорганічною основою, такі як солі натрію, калію, магнію, кальцію або алюмінію, або з органічною основою, такою як метиламін, етиламін, етаноламін, лізин або орнітин, солі з різними амінокислотами і амінокислотними похідними, такими як ацетиллейцин, солі амонію і тому подібні. (Спосіб отримання) Сполука формули (I) або її сіль може бути отримана шляхом застосування різних відомих способів синтезу, використовуючи характерні особливості, зумовлені їх основною структурою або видом замісників. У той же час, в залежності від типу функціональної групи, в деяких випадках може бути ефективною попередня заміна функціональної групи на відповідну захисну групу (група, яка може бути легко перетворена в функціональну групу) протягом періоду від стадії вихідного продукту до стадії проміжної сполуки. Приклади захисної групи включають захисні групи, описані в книзі Wuts (P. G. M. Wuts) і Greene (T. W. Greene), "Greene's Protective Groups in Organic Synthesis (4th edition, 2006)» і тому подібних. Захисна група може бути використана, будучи відповідним чином вибраною відповідно до реакційних умов. У цьому методі захисна група вводиться, щоб провести реакцію, і потім захисна група може бути необов'язково видалена, внаслідок чого може бути отримана бажана сполука. Крім того, проліки сполуки формули (I) можуть бути отримані шляхом введення конкретної групи в процес зі стадії вихідного матеріалу до стадії проміжної сполуки таким же чином, як і вказана вище захисна група, або далі здійснюючи реакцію, використовуючи отриману сполуку формули (I). Реакцію можна провести, застосовуючи способи, відомі фахівцеві в даній галузі, такі як загальновідомі методи етерифікації, амідування і дегідратації. Тут і далі будуть описані типові способи отримання сполуки формули (I). Кожний спосіб отримання може бути здійснений з посиланням на посилальний документ, включений у відповідний опис. Більше того, спосіб отримання за даним винаходом не обмежується наступними прикладами. (Спосіб отримання 1) [Хімічна структура 11] 9 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 Сполука (I) за даним винаходом може бути отримана шляхом реакції амідування між сполукою (1) і сполукою (2). У даній реакції сполуки (1) і (2) використовуються в рівній кількості, або одна сполука використовується в надмірній кількості в порівнянні з іншою. Суміш вказаних сполук звичайно перемішують протягом від 0,1 годин до 5 днів при температурному режимі від охолоджування до нагрівання, переважно, при температурі від -20 °C до 60 °C, в розчиннику, інертному по відношенню до реакції, в присутності конденсуючого агента. Хоча це спеціально не обмежується, приклади розчинника, що використовується в даному документі, включають ароматичні вуглеводні, такі як бензол, толуол і ксилол, галогеновані вуглеводні, такий як дихлорметан, 1,2-дихлоретан і хлороформ, прості ефіри, такі як діетиловий ефір, тетрагідрофуран (ТГФ), діоксан і диметоксіетан, N, N-диметилформамід (ДМФ), диметилсульфоксид (ДМСО), етилацетат, ацетонітрил, воду і суміші вказаних речовин. Приклади конденсуючого агента включають 1-(3-диметиламінопропіл)-3-етилкарбодіімід, дициклогексилкарбодіімід, 1,1'-карбонілдіімідазол, азид дифенілфосфату і оксихлорид фосфору, і гексафторфосфат N-[(диметиламіно)(3H-[1,2,3]триазо[4,5,-b]піридин-3ілокси)метиліден]-N-метилметанамінію (HATU), але даний винахід не обмежується вказаними агентами. Для здійснення реакції в деяких випадках є переважним використання добавки (наприклад, 1-гідроксибензотриазолу). Зручним є проведення реакції в присутності органічної основи, такої як триетиламін, N, N-діізопропілетиламін або N-метилморфолін, або неорганічної основи, такої як карбонат калію, карбонат натрію або гідроксид калію, з точки зору можливості здійснення м'якого проведення реакції. Крім того, можливе також використання способу по перетворенню карбонової кислоти (1) в реакційноспроможне похідне і далі взаємодія його з аміном (2). Приклади реакційноспроможного похідного карбонової кислоти включають галогенангідриди кислот, що утворюються при взаємодії карбонової кислоти з галогенуючим агентом, таким як оксихлорид фосфору або тіоніл хлорид, змішані ангідриди кислот, що утворюються при взаємодії карбонової кислоти з ізобутилхлорформіатом або тому подібним, і реакційно-активний складний ефір, що утворюється при конденсації карбонової кислоти з 1-гідроксибензотриазолом або тому подібним. Реакція між цими реакційноспроможними похідними і сполукою (2) може бути проведена в розчиннику, інертному по відношенню до реакції, такому як галогеновані вуглеводні, ароматичні вуглеводні або прості ефіри, в умовах від охолоджування до нагрівання, переважно, при температурі від -20 °C до 60 °C. Більше того, якщо кільце А являє собою піразол, то в деяких випадках ефективним для здійснення реакції з використанням сполуки (2) може бути введення захисної групи, такої як етоксикарбонілокси, трет-бутоксикарбоніл, бензилоксикарбоніл або бензилоксиметил, і подальше видалення захисту, для отримання сполуки (I) за даним винаходом. Як реакція з видалення захисних груп може бути використаний, наприклад, спосіб, описаний в книзі Wuts (P. G. M. Wuts) і Greene (T. W. Greene), "Greene's Protective Groups in Organic Synthesis (4th edition, 2006)». (Спосіб отримання 2) [Хімічна структура 12] Сполука (I-a) за даним винаходом може бути отримана шляхом взаємодії сполуки (3) із сполукою (4) і подальшого здійснення реакції циклізації між продуктом і гідразином. Взаємодія між сполукою (3) і сполукою (4) може бути здійснена в присутності основи, такої як триетиламін, шляхом використання сполуки (3) і сполуки (4) в рівній кількості або з використанням однієї сполуки в надмірній кількості в порівнянні з іншою, без застосування розчинника або в розчиннику, інертному по відношенню до реакції, при нагріванні. Вибір розчинника ніяк не обмежується в тих рамках, поки розчинник залишається інертним по відношенню до реакції, але можуть бути використані, наприклад, прості ефіри, ароматичні вуглеводні і тому подібне. 10 UA 112327 C2 5 10 15 20 25 30 35 40 Реакція циклізації між продуктом, отриманим при взаємодії між сполукою (3), сполукою (4) і гідразином, може бути здійснена без застосування розчинника або в розчиннику, інертному по відношенню до реакції, при нагріванні. Вибір розчинника ніяк не обмежується в тих рамках, поки розчинник залишається інертним по відношенню до реакції, але можуть бути використані, наприклад, прості ефіри, ароматичні вуглеводні, спирти, такі як метанол і етанол, вода і тому подібне. Крім того, деякі сполуки, представлені формулою (I), також можуть бути отримані, виходячи із сполуки за даним винаходом, отриманої способом, описаним вище, довільно комбінуючи стадії, як це може здійснити фахівець в даній галузі, такі як ацилування, реакція заміщення, окиснення, відновлення, гідроліз і амідування. Вихідні продукти, що використовуються для отримання сполуки за даним винаходом, можуть бути отримані, наприклад, наступним способом, способом, описаним в препаративному прикладі далі, відомими способами або способами, які ясні фахівцеві в даній галузі, або шляхом застосування їх модифікованих методів. (Синтез вихідних продуктів 1) [Хімічна структура 13] Сполука (2) може бути отримана шляхом реакції відновного амінування між сполукою (5) і сполукою (6). У даній реакції сполука (5) і сполука (6) використовуються в рівній кількості, або одна з вказаних сполук використовується в надмірній кількості в порівнянні з іншою. Суміші вказаних речовин звичайно перемішують протягом від 0,1 годин до 5 днів при температурі -45 °C при нагріванні до кипіння із зворотним холодильником, переважно, при температурі від 0 °C до кімнатної температури в розчиннику, інертному по відношенню до реакції, в присутності відновника. Хоча це спеціально не обмежується, приклади розчинника, що використовується в даному документі, включають спирти, такі як метанол і етанол, прості ефіри, такі як діетиловий ефір, тетрагідрофуран, діоксан і диметоксіетан, і суміші вказаних речовин. Приклади відновника включають ціаноборгідрид натрію, триацетоксиборгідрид натрію, боргідрид натрію і тому подібне. Переважним є проведення реакції в присутності дегідратуючого агента, такого як молекулярні сита або кислота, така як оцтова кислота, хлористоводнева кислота або у деяких випадках комплексу титаній(IV) ізопропоксид. У залежності від реакції, імін отримують шляхом конденсації сполук (5) і (6), і в деяких випадках він може бути виділений у вигляді стабільної проміжної сполуки. У цьому випадку сполука (2) може бути отримана шляхом відновної реакції іміну проміжної сполуки. Крім того, замість обробки сполуки відновником, реакцію можна здійснити в розчиннику, такому як метанол, етанол або етилацетат, в присутності або за відсутності кислоти, такої як оцтова кислота або хлористоводнева кислота, шляхом використання каталізатора відновлення (наприклад, паладію на вуглеці або нікелю Ренея). У цьому випадку переважним є проведення реакції в атмосфері водню при тиску від нормального до 50 атм, при температурному режимі від охолоджуванні до нагрівання. (Синтез вихідних продуктів 2) [Хімічна структура 14] 11 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 Сполука (3) може бути отримана шляхом синтезу сполуки (8) реакцією амідування між сполукою (1) і сполукою (7) і подальшим видаленням захисних груп у похідного кеталю, сполуки (8). Реакція амідування може бути здійснена таким же чином, як і в способі отримання 1. Для видалення захисних груп у кеталю може бути використаний спосіб, описаний Wuts (P. G. M. Wuts) і Greene (T. W. Greene) в книзі "Greene's Protective Groups in Organic Synthesis (4th edition, 2006)». Сполуку формули (I) виділяють у вигляді вільної сполуки, її солі, гідрату, сольвату або поліморфної речовини і очищають. Сіль сполуки формули (I) може бути отримана шляхом реакції отримання солей з використанням загальновідомого способу. Виділення і очищення виконують із застосуванням загальних хімічних операцій, таких як екстракція, фракційна кристалізація і різні типи фракційної хроматографії. Різні ізомери можуть бути отримані шляхом підбору відповідних вихідних сполук або можуть бути розділені з використанням відмінностей в фізико-хімічних характеристиках між ізомерами. Наприклад, оптичний ізомер може бути отриманий шляхом звичайного оптичного розділення (наприклад, фракційною кристалізацією з отриманням діастереомерної солі з оптично активною основою або кислотою, або шляхом хроматографії з використанням хиральної колонки) рацемічної суміші, або може бути отриманий з відповідної оптично активної вихідної сполуки. Фармакологічна активність сполуки формули (I) була підтверджена за допомогою наступного дослідження. Метод дослідження 1: Дослідження по визначенню інгібуючої активності 11β-HSD1/11βHSD2 у людини Інгібуючу 11β-HSD1 активність визначали в наступному порядку. При цьому ферментну реакцію і аналіз здійснювали з використанням 384-ямкового планшета. Фермент був отриманий відповідно до літературного джерела (Walker E. A. et al., Journal of Biological Chemistry, 2001, Vol. 276, р. 21343-21350). Реакційну суміш обробляли таким методом, за яким різні концентрації сполуки, що досліджується, додавали в реакційну рідину, що містить 10 мМ буфер з фосфорною кислотою (pH 6,6), 200 нМ кортизон, 40 мкМ відновлений никотинамідаденіндинуклеотидфосфат (NADPH) і рекомбінантний людський 11β-HSD1, потім інкубували протягом однієї години при кімнатній температурі (10 мкл/ямка). Сполуку, що досліджується, розчиняли в диметилсульфоксиді (ДМСО), і концентрацію ДМСО встановлювали таким чином, щоб вона становила 1 % в реакційній рідині. Після ферментної реакції визначали кортизол з використанням гомогенної флуоресценції з часовим розрізненням (HTRF) для вимірювання інгібуючої фермент активності. Додавали мічений XL-665 кортизол, що містить 400 мкМ карбеноксолон і антитіло до міченого криптатом кортизолу (CIS bio international), відповідно, на планшет по 5 мкл/ямка, потім інкубували протягом 2 годин при кімнатній температурі, і далі визначали інтенсивність флуоресценції з використанням флуороспектрометра (торгова назва: Discovery, виробництво PerkinElmer Inc.), розраховуючи, таким чином, інгібуючу активність по співвідношенню інтенсивності флуоресценції між двома довжинами хвиль (665 нМ/620 нМ). Інгібуючу 11β-HSD2 активність визначали таким же чином, як і при вимірюванні інгібуючої 11β-HSD1 активності, за винятком умов ферментної реакції. Ферментну реакцію здійснювали таким методом, при якому різні концентрації речовин, що досліджуються, додавали в реакційну рідину, що містить 40 мМ трис-солянокислотний буфер (Трис-HCl) (pH 8,0), 200 нМ кортизолу, 200 мкМ никотинамідаденіндинуклеотиду (NAD) і рекомбінантну людську 11β-HSD2, потім інкубували протягом 2 годин при температурі 37 °C (10 мкл/ямка). Результати вимірювань були обраховані шляхом отриманнясереднього із значень для трьох ямок в одних і тих же умовах. Співвідношення, отримане, коли замість сполуки, що досліджується, додавали ДМСО, розглядали як 0 %, і співвідношення, отримане, коли 11βHSD1 або 11β-HSD2 не додавали, розглядали як складаюче 100 %, внаслідок чого концентрація, при якій сполука, що досліджується, придушує активність ферменту на 50 %, була розрахована як IC50 інгібуючої активності сполуки. Значення IC 50 типових сполук за даним винаходом показані в наступній таблиці 1. При цьому Прик. означає номер прикладу. 12 UA 112327 C2 [Таблиця 1] Прик. 1 5 7-1 8-1 27 30 81 132 159 176 190 216 228 237 5 10 15 Людська 11β-HSD1 (IC50/мкМ) 0,048 0,056 0,018 0,026 0,062 0,028 0,024 0,038 0,040 0,088 0,025 0,043 0,053 0,040 Людська 11β-HSD2 (IC50/мкМ) >30 >3 >30 >3 >3 >30 >30 >30 Згідно з представленими вище результатами, було підтверджено, що деякі сполуки за даним винаходом виявляють сильну інгібуючу активність по відношенню до 11β-HSD1, і інгібуюча 11β-HSD1 активність є селективною в порівнянні з 11β-HSD2. Метод дослідження 2: Тест на спонтанне безладне порушення поведінки, індуковане скополаміном Лікарські засоби, що досліджуються, вводили перорально самцям мишей ddY віком 5-7 тижнів. 10 хвилин потому тваринам внутрішньоочеревинно вводили скополамін при 0,5 мг/кг. Через 20 хвилин тварин вміщували в Y-лабіринт, що має рукава однієї і тієї ж довжини і проходить в трьох напрямах, і залишали їх вільно досліджувати протягом 8 хвилин. Під час розвідки підраховували спонтанну поведінку чергування рукавів (вводячи різні перемички 3 рази підряд) для розрахунку швидкості спонтанного чергування (поведінка спонтанне чергування/(число разів з того, що поступає-2)×100), тим самим, оцінюючи ефективність препарату. Результати для типових сполук за даним винаходом показані в таблиці 2. [Таблиця 2] Прик. 7-1 8-1 20 25 30 35 Доза, поліпшуюча мінімальну швидкість спонтанного чергування (мг/кг) 1,0 0,3 Відповідно до наведених вище результатів було підтверджено, що деякі сполуки за даним винаходом є ефективними для лікування деменції. Метод дослідження 3: Дослідження на моделі лігатури спінального нерва Дане дослідження здійснювали згідно з Pain, 1992, Vol. 50, р 355-363. Шкіру і м'язи в зоні попереку щурів (SD, самці, 5-6 тижневого віку) вирізали під анестезією із застосуванням пентобарбіталу, і поперековий поперечний паросток L6 видаляли для експозиції поперекових нервів. Спінальні нерви L5 і L6 зшивали шовковою ниткою, і потім рану зашивали. Процедуру здійснювали з лівого боку. Крім того, у випадку псевдооперації рани зашивали без виконання лігування нервів. Ефективність лікарського засобу оцінювали в післяопераційні дні 7-12 за допомогою дослідження з нитками фон Фрея. Граничну величину реакції визначали відповідно до методу, описаного в Journal of Neuroscience Methods, 1994, Vol. 53, р 55-63. Шляхом використання 8 типів ниток фон Фрея (від 0,41 г до 15,14 г), підошву лап задньої кінцівки щура стимулювали і визначали 50 % реакцію відсмикування методом "вгору і вниз". Дослідження починали при тиску ниток, що становить 2,04 г, і, коли реакцію відсмикування кінцівок підтверджували, це розглядали як "відповідь". За день до оцінки ефективності лікарських засобів тварини, що показують зменшення граничної величини за допомогою дослідження з нитками фон Фрея, були вибрані заздалегідь, і 13 UA 112327 C2 5 тварин розподіляли на групи таким чином, щоб різниця середньої величини граничного значення між відповідними групами була скороченою. Речовину, що досліджується, суспендували в 0,5 % розчині метилцелюлози і вводили перорально за 1 годину до оцінки ефективності препарату. Речовину, що досліджується, оцінювали шляхом обчислення показника поліпшення в групі, обробленій речовиною, що досліджується, при умові, що граничне значення для кінцівки, яку піддавали процедурі, в групі псевдооперованих тварин, приймали за 100 %, а граничне значення для кінцівки, яку піддавали процедурі, в групі оперованих тварин, оброблених розчинником, приймали за 0 %. Результати для типових сполук за даним винаходом показані в таблиці 3. 10 [Таблиця 3] Прик. 7-1 8-1 15 20 25 30 35 40 Показник поліпшення % (доза, що вводиться) 52 (1 мг/кг) 73 (1 мг/кг) Відповідно до наведених вище результатів було підтверджено, що деякі сполуки за даним винаходом можуть бути використані для лікування нейропатичного болю. Метод дослідження 4: Дослідження на моделі з фіброміалгією, викликаною повторним введенням резерпіну Це дослідження здійснювали згідно з Pain, 2009, Vol. 146, стор. 26-33, шляхом використання щурів (SD, самці, 7-ми тижневого віку). Граничну величину м'язової чутливості визначали відповідно до методу Schafers et al. (Pain, 2003, Vol. 104, стор. 579-588). Стимулюючий тиск, що повільно підвищується до 250 г, застосовували до литкового м'яза правої задньої лапи щура. Величина мінімального стимулюючого тиску, при якому щур демонструє реакцію відсмикування у відповідь на стимулюючий тиск на праву задню лапу, визначали як граничну величину м'язової чутливості (г). Вимірювання здійснювали 3 рази для кожного моменту часу, і середню величину приймали як виміряне значення. Розчинник (0,5 % водний розчин оцтової кислоти) або резерпін (1 мг/кг) вводили підшкірно в задню частину щурів один раз на день протягом трьох днів. Доза, що вводиться, і розчинника, і резерпіну становила 1 мл на 1 кг маси тіла тварини. Через 6 днів після початку введення розчинника або резерпіну визначали граничну величину м'язової чутливості кожного щура, і щурів розподіляли на групи таким чином, щоб різниця середньої величини граничного значення між відповідними групами була скороченою. Оцінку ефективності препарату здійснювали на наступний день. Речовину, що досліджується, суспендували в 0,5 % розчині метилцелюлози і вводили перорально. Через 30, 60 і 120 хвилин після введення визначали граничне значення больової м'язової чутливості. Здоровим щурам препарат не вводили, а визначали тільки граничне значення больової м'язової чутливості. Ефективність лікарського засобу визначав експериментатор, який не знав, яким чином препарат був введений тварині. Речовину, що досліджується, оцінювали шляхом підрахунку показника поліпшення в групі, якій вводили речовину, що досліджується, за умови, що граничне значення больової м'язової чутливості здорового щура, виміряне в будь-якому з моментів часу 30, 60 і 120 хвилин після введення, приймали за 100 %, а граничне значення больової м'язової чутливості у резерпін-обробленого щура, якому вводили розчинник, приймали за 0 %. Результати для типових сполук за даним винаходом показані в таблиці 4. [Таблиця 4] Прик. 7-1 8-1 45 Максимальна міра поліпшення % (доза, що застосовується) 82(10 мг/кг) 104(10 мг/кг) Розрахований момент часу (хв.) 60 60 Відповідно до наведених вище результатів було підтверджено, що деякі сполуки за даним винаходом можуть бути використані для лікування фіброміалгії. Метод дослідження 5: Фармакокінетичне дослідження 0,5 % Суспензію метилцелюлози, що містить речовину, що досліджується, вводили перорально самцям мишей у віці 5 тижнів, і, через деякий час після введення, відбирали кров і мозкову тканину. Відібраний зразок крові обробляли гепарином натрію, і потім відділяли плазму, 14 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 отримуючи, таким чином, зразок плазми. Крім того, до відібраного зразка тканини мозку додавали буфер з фосфорною кислотою (pH 7,0) в кількості, яка перевищувала масу мозкової тканини в 4 рази, отримуючи, таким чином, 20 %-ний гомогенат тканини мозку. Концентрації відповідних речовин, що досліджуються в плазмі і тканині мозку визначали з використанням LCMS/MS. Через одну годину вводили сполуку за прикладом 8-1 в дозі 1 мг/кг, концентрація речовини в плазмі була 153 нг/мл, і концентрація в тканині мозку була 58 нг/мл. Метод дослідження 6: Фармакокінетичне дослідження при навантаженні кортизоном 0,5 % Розчин метилцелюлози або 0,5 % суспензію метилцелюлози, що містять речовину, що досліджується, вводили перорально самцям мишей ddY у віці 5 тижнів. Через 30 хвилин внутрішньоочеревинно вводили кортизон при 1 мг/кг, і 20 хвилин опісля відбирали тканину мозку. До відібраного зразка тканини мозку додавали буфер з фосфорною кислотою (pH 7,0) в кількості, яка перевищувала масу мозкової тканини в 9 разів, отримуючи, таким чином, 10 %-ний гомогенат тканини мозку. Кількість кортизолу в гомогенаті тканині мозку визначали з допомогою ELISA, і розраховували міру інгібування внаслідок дії речовини, що досліджується, за умови, що кількість кортизолу, отримана після перорального введення миші з 0,5 %-ною метилцелюлозою, розглядалася як 100 %. Коли сполуку за прикладом 8-1 вводили перорально в дозі 1 мг/кг, була отримана міра інгібування 43 %. Внаслідок відповідних досліджень, описаних вище, було підтверджено, що сполука за даним винаходом має інгібуючу 11β-HSD1 дію. Даний результат ясно показує, що сполука за даним винаходом може бути використана як активний інгредієнт фармацевтичної композиції для профілактики або лікування захворювань, таких як деменція (зокрема, деменція альцгеймерівського типу), шизофренія, депресія, біль (зокрема, нейропатичний біль або фіброміалгія), діабет (зокрема, цукровий діабет II типу), резистентність до інсуліну, ожиріння, гіперліпідемія, гіпертензія, остеопороз і глаукома, зокрема, для лікування деменції (зокрема, деменції альцгеймерівського типу), шизофренії, депресії, болю (зокрема, нейропатичного болю або фіброміалгії), діабету (зокрема, цукрового діабету II типу) і резистентності до інсуліну. Крім того, як інший варіант здійснення винаходу сполука за даним винаходом може бути використана як активний інгредієнт фармацевтичної композиції для профілактики і/або лікування деменції (зокрема, деменції альцгеймерівського типу), шизофренії і депресій. Згідно з ще одним варіантом здійснення винаходу сполука за даним винаходом може бути використана як активний інгредієнт фармацевтичної композиції для попередження і/або лікування деменції (зокрема, деменції альцгеймерівського типу). Згідно з ще одним варіантом здійснення винаходу, сполука за даним винаходом може бути використана як активний інгредієнт фармацевтичної композиції для попередження і/або лікування болю (зокрема, нейропатичного болю або фіброміалгії). Фармацевтична композиція, що містить один або два, або більше видів сполуки формули (I) або її сіль як активний інгредієнт, може бути отримана з використанням наповнювачів, широко відомих з попереднього рівня техніки, тобто широко відомими методами з використанням наповнювачів або носіїв для лікарських засобів. Композицію можна вводити в будь-якій формі, наприклад, шляхом перорального введення з використанням таблетки, пілюлі, капсули, гранул, порошку або рідин, і парентерального введення з використанням препарату для ін'єкцій, такого як розчин для внутрішньосуглобної ін'єкції, внутрішньовенної ін'єкції і внутрішньом'язової ін'єкції, супозиторіїв, очних крапель, очної мазі, трансдермальної рідини, мазі, трансдермального пластиру, трансмукозальної рідини, трансмукозального пластиру або інгаляції. Як тверду композицію для перорального введення використовують таблетки, порошки, гранули і тому подібне. У такій твердій композиції один або два, або більше видів активних інгредієнтів змішують з, щонайменше, одним видом інертного наповнювача. Композиція може містити інертні добавки, наприклад, змазку, розпушувач, стабілізатор і допоміжну речовину для розчинення, відповідно до звичайних методів. Таблетка або пілюля може необов'язково бути покрита цукром або плівкою з розчинної в шлунку або кишечнику речовини. Рідка композиція для перорального введення включає фармацевтично прийнятний колоїдний розчин, розчин, суспензію, сироп, еліксир або тому подібне, і містить звичайно інертний розріджувач, що використовується, наприклад, очищену воду або етанол. У доповнення до інертного розріджувача, рідка композиція може містити допоміжну речовину, таку як солюбілізатор, зволожувач або суспензію, підсолоджувач, коригент смаку, ароматизатор і консервант. Препарат для ін'єкцій для парентерального введення містить стерильний водний або неводний розчин, суспензію або колоїдний розчин. Приклади водного розчину включають дистильовану воду для ін'єкцій і фізіологічний розчин. Приклади неводного розчину включають 15 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 спирти, такі як етанол. Ці композиції можуть додатково містити речовину, регулюючу тонічність, консервант, зволожувач, емульгатор, диспергатор, стабілізатор або солюбілізатор. Їх стерилізують, наприклад, фільтруванням, при якому фільтрують через фільтр, затримуючий бактерії, змішуванням з протимікробним агентом або опроміненням. Крім того, вони можуть бути використані на стадії отримання у вигляді стерильної твердої композиції, що розчиняється, або суспендується в стерильній воді або стерильному розчиннику для ін'єкцій перед застосуванням. Приклади засобів для зовнішнього застосування включають мазі, пластир, крем, желе, припарки, спрей, лосьйон, очні краплі, очну мазь і тому подібне. Засіб для зовнішнього застосування містить основи мазей і лосьйонів, що звичайно використовуються, водну або неводну рідку композицію, суспензію, емульсію і тому подібне. Трансмукозальні засоби, такі як засоби для інгаляції і засоби для введення через ніс, використовують в твердій, рідкій або напівтвердій формі, і вони можуть бути отримані способами, відомими з попереднього рівня техніки. Наприклад, відповідним чином можуть бути додані відомий наповнювач, рН регулятор, консервант, поверхнево-активна речовина, змащувальна речовина, стабілізатор, загусник або тому подібне. Для введення можуть бути використані відповідні пристрої для інгаляції або інсуфляції. Наприклад, за допомогою відомого пристрою, такого як інгалятор або розпилювач з виміряними дозами, сполуку можна вводити окремо або вводити в складі порошкоподібної лікарської композиції, або у вигляді розчину або суспензії, які являють собою поєднання сполуки з фармацевтично прийнятним носієм. Для однократного або багаторазового введення можуть бути використані інгалятор для сухого порошку і тому подібне, і сухий порошок або капсули, що містить порошок. Альтернативно, сполуку можна вводити у вигляді аерозолю під тиском з використанням відповідної речовини для ежекції, наприклад, відповідного газу, такого як хлорфторалкан або діоксид вуглецю. Звичайно, у випадку перорального введення, відповідна добова доза складає приблизно від 0,001 мг/кг до 100 мг/кг маси тіла, переважно, від 0,1 мг/кг до 30 мг/кг, і, більш переважно, від 0,1 мг/кг до 10 мг/кг, яку вводять один раз або два-чотири рази у вигляді розділених доз. У випадку внутрішньовенного введення відповідна добова доза складає приблизно від 0,0001 мг/кг до 10 мг/кг маси тіла, яку вводять один раз або декілька разів у вигляді розділених доз. Крім того, трансмукозальний засіб вводять один раз на день або декілька разів на день у вигляді розділених доз, в дозі близько від 0,001 мг/кг до 100 мг/кг маси тіла. Дозу відповідним чином визначають в кожному випадку з урахуванням симптомів, віку, статі і т.д. Фармацевтична композиція за даним винаходом містить один або декілька типів сполуки формули (I) і її солі як активного інгредієнта, в кількості від 0,01 % до 100 % по масі, і від 0,01 % до 50 % по масі як варіант здійснення, навіть якщо кількість змінюється в залежності від способу введення, лікарської форми, місця введення і типу наповнювача або добавки. Сполука формули (I) може бути використана одночасно з агентом для лікування або попередження різних захворювань, які вважаються захворюваннями, при яких сполука формули (I) є ефективною. При одночасному використанні сполука і агент можуть бути введені одночасно, введені послідовно один за одним або введені з бажаним проміжком часу. Препарат для одночасного введення може являти собою комбінаційний лікарський засіб або окремі препарати. Приклади Тут і далі, спосіб отримання сполуки формули (I) описаний більш детально, основуючись на прикладах, але даний винахід не обмежується сполукою, описаною в наступних прикладах. Крім того, спосіб отримання вихідних сполук буде показаний в препаративних прикладах. Спосіб отримання сполуки формули (I) не обмежується способами отримань конкретних прикладів, представлених далі. Сполука формули (I) також може бути отримана шляхом комбінування вказаних способів отримання або за допомогою способу, який добре відомий фахівцеві в даній галузі. Крім того, в прикладах, препаративних прикладах і таблицях описаних далі, в деяких випадках будуть використані наступні абревіатури. PEx: номер препаративного прикладу, Ex: номер прикладу, Структура: структурна формула (коли є множина структурних формул, це означає, що сполука являє собою суміш вказаних сполук), Дані: фізичні дані (EI: EI-MS; ESP+: ESI-MS (Pos); ESN-; ESI-MS (Neg); CI+: CI-MS (Pos); APCI/ESP+: означає одночасне вимірювання APCI (Pos) і ESI (Pos); ЯМР-ДМСО-d6: δ (м.ч.) 1 1 характеристичного піка H-ЯМР в ДМСО-d6, ЯМР-CDCl3: δ (м.ч.) характеристичного піка H-ЯМР в CDCl3, [α] D: питоме оптичне обертання в D-лінії натрію), Увага: вказівка (Sal: сіль (HCl: гідрохлорид, якщо ця абревіатура не вказується для сполуки, це означає, що сполука не містить HCl, і цифра, яка стоїть перед сіллю, вказує на співвідношення в складі; наприклад, якщо 16 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполука описана як 2HCl, це означає, що сполука являє собою дигідрохлорид, Хиральний: це означає, що, хоча сполука описана у вигляді плоскої структури, оскільки його стерична структура є неясною, сполука є хиральною), Syn: спосіб отримання (цифра вказує, що сполука була отримана з використанням відповідного вихідного продукту таким же чином, як сполука за прикладом, що має номер, як номер сполуки за прикладом; коли перед номером є Р, це означає, що сполука була отримана з використанням відповідного вихідного продукту таким же чином, як і сполука за препаративним прикладом, що має той же номер, що і номер препаративного прикладу; коли є множина номерів, це показує, що сполука була отримана шляхом здійснення способів отримання в порядку від способу отримання, відповідного попередньому номеру), PSyn: спосіб отримання (це означає, що сполука була отримана з використанням відповідного вихідного продукту таким же чином, як сполука за препаративним прикладом, що має такий же номер, як номер препаративного прикладу; коли є множина номерів, це показує, що сполука була отримана шляхом здійснення способів отримання в порядку від способу отримання, відповідного попередньому номеру)). Препаративний приклад 1 Гексафторфосфат N-[(диметиламіно)(3H-[1,2,3])(триазоло[4,5-b]піридин-3-ілокси)метиліден]N-метилметанамінію (HATU) (235 мг) і діізопропілетиламін (184 мг) додавали до розчину в ДМФ (2 мл) 4-ізопропокси-2-метоксибензойної кислоти (100 мг) і гідрохлориду бензил-5(циклопропіламіно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату (165 мг), потім перемішували протягом ночі при температурі 60 °C. Після цього в реакційну суміш додавали воду, здійснювали екстракцію з використанням етилацетату, потім промивали водою і насиченим сольовим розчином, у вказаному порядку, і сушили над безводним сульфатом магнію, отримуючи, таким чином, сирий продукт. Отриманий сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (від 30 % до 100 %, етилацетат/гексан), отримуючи, таким чином, бензил-5-[циклопропіл(4-ізопропокси-2-метоксибензоїл)аміно]-4,5,6,7-тетрагідро2H-індазол-2-карбоксилат (140 мг). Препаративний приклад 2 До суспензії 2'-ціано-6'-фторбіфеніл-4-карбонової кислоти (470 мг) в дихлорметані (9 мл) при температурі 0 °C додавали оксаліл хлорид (0,167 мл) і одну краплю ДМФ, потім перемішували протягом 3 годин при кімнатній температурі. Після цього реакційну рідину знову охолоджували до 0 °C, додавали діізопропілетиламін (0,61 мл) і потім додавали по краплях розчин трет-бутил5-(циклопропіламіно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату (450 мг) в дихлорметані (4,5 мл), потім перемішували протягом 2 годин при кімнатній температурі. У реакційну рідину додавали воду, здійснювали екстракцію з використанням етилацетату, потім промивали насиченим водним розчином гідрокарбонату натрію і насиченим сольовим розчином, у вказаному порядку, і сушили над безводним сульфатом магнію, отримуючи, таким чином, сирий продукт. Сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (від 30 % до 100 %, етилацетат/гексан), отримуючи, таким чином, трет-бутил-5-{[(2'-ціано-6'фторбіфеніл-4-іл)карбоніл](циклопропіл)аміно}-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилат (700 мг). Препаративний приклад 3 До розчину 1-(2-метоксіетил)-1H-індол-4-карбонової кислоти (125 мг) і 1H-1,2,3бензотриазолу (900 мг) в дихлорметані (2 мл) при кімнатній температурі додавали тіоніл хлорид (890 мг). Після перемішування протягом 2 годин при кімнатній температурі нерозчинну речовину видаляли шляхом фільтрування, потім промивали невеликою кількістю толуолу. До фільтрату додавали безводний сульфат магнію, потім перемішували і потім тверду речовину видаляли шляхом фільтрування, і фільтрат концентрували. Отриманий залишок розчиняли в дихлорметані (3 мл) і додавали до розчину трет-бутил-5-(циклопропіламіно)-4,5,6,7-тетрагідро2H-індазол-2-карбоксилату (150 мг) і ізопропілетиламіну (150 мг) в дихлорметані (2 мл), потім перемішували протягом 16 годин при кімнатній температурі. Реакційну рідину розбавляли етилацетатом і промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином. Отриманий органічний шар сушили над безводним сульфатом магнію, потім фільтрували і концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан:етилацетат=10:0-4:6), отримуючи, таким чином, трет-бутил-5-(циклопропіл{[1-(2-метоксіетил)-1H-індол-4-іл]карбоніл}аміно)-4,5,6,7тетрагідро-2H-індазол-2-карбоксилат (34 мг) у вигляді безбарвної маслянистої речовини. Препаративний приклад 4 Водний розчин (3 мл) тетракіс(трифенілфосфін)паладію (115 мг) і карбонату натрію (530 мг) додавали до розчину 2-бром-3-фторбензонітрилу (667 мг) і 4-(метоксикарбоніл)фенілборонової кислоти (600 мг) в діоксані (20 мл), потім перемішували протягом ночі при температурі 100 °C в 17 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 атмосфері аргону, після цього охолоджували до кімнатної температури, розбавляли етилацетатом, промивали насиченим сольовим розчином і сушили над безводним сульфатом магнію. Розчинник упарювали при зниженому тиску. Твердий отриманий сирий продукт промивали діізопропіловим ефіром і сушили при зниженому тиску, отримуючи, таким чином, метил-2'-ціано-6'-фторбіфеніл-4-карбоксилат (740 мг). Препаративний приклад 5 В атмосфері газоподібного аргону трис(дибензиліденацетон)дипаладій (14 мг) і тетрафторборат три-трет-бутилфосфонію (11 мг) додавали до суміші 2-бром-3фторбензонітрилу (150 мг), пінаколового ефіру 4-метоксикарбоніл-2-метилфенілборонової кислоти (259 мг), фториду калію (144 мг), ТГФ (1,8 мл) і води (0,23 мл), потім перемішували протягом 14 годин при кімнатній температурі. Реакційну рідину концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-2'-ціано-6'-фтор-2-метилбіфеніл-4карбоксилат (70 мг). Препаративний приклад 6 Суміш 4-бром-3,5-дихлорпіридину (357 мг), 4-метоксикарбонілфеніл боронової кислоти (236 мг), комплексу 1,1'-біс(дифенілфосфіно)фероцен-паладій(II)дихлорид-дихлорметан (107 мг), фториду цезію (398 мг) і 1,2-диметоксіетану (3,5 мл) перемішували при нагріванні протягом однієї години при температурі масляної бані 80 °C в атмосфері газоподібного аргону, потім охолоджували до кімнатної температури. Реакційну рідину концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-4-(3,5-дихлорпіридин-4-іл)бензоат (298 мг). Препаративний приклад 7 Трис(дибензиліденацетон)дипаладій (24 мг) і 2-дициклогексилфосфіно-2',6'диметоксибіфеніл (43 мг) додавали до суміші метил-3,5-диметил-4{[(трифторметил)сульфоніл]окси}бензоату (409 мг), 2-ціанофенілборонової кислоти (385 мг), фосфату трикалію (835 мг) і толуолу (2,6 мл) в атмосфері газоподібного аргону, потім перемішували при нагріванні протягом 3 годин при температурі масляної бані 110 °C і охолоджували до кімнатної температури. У реакційну рідину додавали воду, потім розбавляли етилацетатом, промивали насиченим сольовим розчином, сушили і далі концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-2'-ціано-2,6-диметилбіфеніл-4-карбоксилат (347 мг). Препаративний приклад 8 Діізопропіламід літію (2,0 M розчин в суміші гептан/ТГФ/етилбензол, 5,57 мл) додавали до розчину 3,5-дифторпіридину (1,26 г) в ТГФ (7,5 мл) в атмосфері газоподібного аргону при температурі -78 °C на бані сухий лід/ацетон, потім перемішували протягом 0,5 годин і далі додавали хлорид цинку (1,55 г), потім знову перемішували протягом 0,5 годин при тій же температурі. Після підвищення температури до кімнатної додавали етил-4-бромбензоат (0,50 г) в розчині N-метилпіролідин-2-ону (NMP) (7,5 мл) і тетракіс(трифенілфосфін)паладію (0,50 г), потім перемішували при нагріванні протягом 8 годин при температурі масляної бані 100 °C і охолоджували до кімнатної температури. У реакційну рідину додавали 1 М соляну кислоту, і потім осад, що утворився, збирали шляхом фільтрування, отримуючи, таким чином, 4-(3,5дифторпіридин-4-іл)бензойну кислоту (препаративний приклад 8-1, 80 мг). Фільтрат розбавляли етилацетатом і потім промивали насиченим сольовим розчином, потім сушили і далі концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, етил-4-(3,5-дифторпіридин-4іл)бензоат (препаративний приклад 8-2, 83 мг). Препаративний приклад 9 В атмосфері газоподібного аргону н-бутиллітій (1,63 M розчин н-гексану, 2,41 мл) додавали до розчину 3-хлор-5-фторпіридину (517 мг) в ТГФ (3,0 мл) з охолоджуванням при температурі 78 °C на бані сухий лід/ацетон, потім перемішували протягом 0,5 годин, і далі додавали хлорид цинку (0,5 M розчин ТГФ, 7,86 мл), потім знову перемішували протягом 0,5 годин при тій же температурі. Після підвищення температури до кімнатної додавали розчин етил-4бромбензоату (300 мг) в ТГФ (3,0 мл) і тетракіс(трифенілфосфін)паладій (303 мг), потім перемішували при нагріванні протягом 16 годин при температурі масляної бані 60 °C і охолоджували до кімнатної температури. У реакційну рідину додавали 1 М соляну кислоту, потім розбавляли етилацетатом, промивали насиченим сольовим розчином, сушили і потім концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії 18 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 на силікагелі (гексан/етилацетат), отримуючи, таким чином, етил-4-(3-хлор-5-фторпіридин-4іл)бензоат (194 мг). Препаративний приклад 10 (Трибутилфосфораніліден)ацетонітрил (1,38 г) додавали до суміші метил-1H-індол-4карбоксилату (500 мг), (3-метилоксетан-3-іл)метанолу (583 мг) і толуолу (15 мл) в атмосфері газоподібного аргону, потім кип'ятили із зворотним холодильником протягом ночі і потім охолоджували до кімнатної температури. Реакційну рідину концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-1-[(3-метилоксетан-3-іл)]-1H-індол-4-карбоксилат (700 мг). Препаративний приклад 11 60 %-ний гідрид натрію (134 мг) повільно додавали до розчину метил-1H-індол-4карбоксилату (507 мг) в ДМФ (5 мл) при охолоджуванні на крижаній бані, потім перемішували протягом 30 хвилин. Додавали 2-(2-оксопіролідин-1-іл)етилметансульфонат (660 мг), і температуру повільно підвищували до кімнатної, потім перемішували протягом 5 годин. Після цього реакційну рідину виливали у воду, потім екстрагували етилацетатом, промивали насиченим сольовим розчином, сушили над безводним сульфатом магнію і концентрували при зниженому тиску. Залишок очищали на колонці з силікагелем, отримуючи, таким чином, метил1-[2-(2-оксопіролідин-1-іл)етил]-1H-індол-4-карбоксилат (260 мг). Препаративний приклад 12 Карбонат калію (196 мг) і 1-йодпропан (482 мг) додавали до розчину метил-1H-індазол-4карбоксилату (250 мг) в ДМФ (2,5 мл), потім перемішували протягом ночі при кімнатній температурі. Після цього в реакційну рідину додавали воду, потім екстрагували етилацетатом і промивали насиченим сольовим розчином, отримуючи, таким чином, сирий продукт. Отриманий сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-1-пропіл-1H-індазол-4-карбоксилат (130 мг). Препаративний приклад 13 2,2'-Диметилоксиран (412 мг) і карбонат цезію (1,4 г) додавали до розчину метил-1H-індол-4карбоксилату (500 мг) в ДМФ (10 мл), потім перемішували протягом однієї години при температурі 100 °C. Після цього додавали додатково 2,2'-диметилоксиран (411 мг), потім перемішували протягом однієї години, потім охолоджували до кімнатної температури. Реакційну рідину концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-1-(2-гідрокси2-метилпропіл)-1H-індол-4-карбоксилат (560 мг). Препаративний приклад 14 трет-Бутоксид калію (241 мг) при охолоджуванні льодом додавали до розчину метил-7метокси-1H-індол-4-карбоксилату (220 мг) в ДМФ (2,2 мл), потім перемішували протягом 30 хвилин. Після цього додавали йодметан (183 мг), потім перемішували протягом 3 годин при кімнатній температурі. У реакційну рідину додавали воду, потім екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили над безводним сульфатом магнію, отримуючи, таким чином, сирий продукт. Отриманий сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-7-метокси-1-метил-1H-індол-4-карбоксилат (200 мг). Препаративний приклад 15 Карбонат калію (55 мг) при кімнатній температурі додавали до розчину трет-бутил-5{циклопропіл[(6-гідрокси-1-бензотіофен-3-іл)карбоніл] аміно}4,5,6,7-тетрагідро-2H-індазол-2карбоксилату (120 мг) в ацетоні (3 мл), потім перемішували протягом 30 хвилин. При охолоджуванні льодом додавали йодметан (25 мкл), потім перемішували протягом 14 годин при кімнатній температурі. У реакційну рідину додавали воду, потім екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили над безводним сульфатом магнію. Далі тверду речовину фільтрували, розчин концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, отримуючи, таким чином, трет-бутил-5-{циклопропіл[(6-метокси-1-бензотіофен-3-іл)карбоніл]аміно}-4,5,6,7тетрагідро-2H-індазол-2-карбоксилат (35 мг). Препаративний приклад 16 При охолоджуванні льодом в атмосфері газоподібного аргону розчин 1M тетрабутиламоній фториду в ТГФ (3,45 мл) додавали до суміші метил-5-метокси-1-(триізопропілсиліл)-1H-індол-4карбоксилату (1,04 г) і ТГФ (10 мл), потім перемішували протягом однієї години при тій же температурі. Додавали йодметан (0,897 мл), потім перемішували протягом однієї години при тій же температурі і потім протягом 12 годин при кімнатній температурі. Реакційну рідину 19 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 розбавляли етилацетатом і промивали водою і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-5метокси-1-метил-1H-індол-4-карбоксилат (205 мг). Препаративний приклад 17 До розчину етил-2-ацетил-4-оксопентаноату (1,00 г) в толуолі (20 мл) додавали 2,6дифторбензиламін (0,710 мл) і гідрат п-толуолсульфонової кислоти (70 мг), потім перемішували протягом 14 годин при температурі 110 °C. Реакційну суміш охолоджували до кімнатної температури і додавали насичений водний розчин гідрокарбонату натрію, потім екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили над безводним сульфатом магнію, і розчинник упарювали. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат=100/0-85/15), отримуючи, таким чином, етил-1-(2,6-дифторбензил)-2,5-диметил-1H-пірол-3-карбоксилат (1,073 г) у вигляді твердої речовини блідо-жовтого кольору. Препаративний приклад 18 2,4-дихлоранілін (1,37 г) додавали до розчину етил-2-ацетил-4-оксопентаноату (1,50 г) в оцтовій кислоті (10 мл), потім перемішували протягом 14 годин при температурі 100 °C. Реакційну суміш концентрували і потім до залишку додавали насичений водний розчин гідрокарбонату натрію, потім екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили над безводним сульфатом магнію, і потім розчинник упарювали. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат=100/0-90/10), отримуючи, таким чином, етил-1-(2,4-дихлорфеніл)-2,5диметил-1H-пірол-3-карбоксилат (1,469 г) у вигляді маслянистої речовини жовтого кольору. Препаративний приклад 19 До розчину етил-2-метил-1-(2-метилфеніл)-1,4,5,6-тетрагідроциклопента[b]пірол-3карбоксилату (840 мг) в етанолі (10 мл) додавали 4 M водний розчин гідроксиду літію (5 мл), потім перемішували протягом 2,5 днів при температурі 80 °C. У реакційну рідину додавали 1 М соляну кислоту (20 мл), потім екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили над безводним сульфатом магнію, і потім розчинник упарювали. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат=100/0-80/20 або 60/40), отримуючи, таким чином, 2-метил-1-(2-метилфеніл)1,4,5,6-тетрагідроциклопента[b]пірол-3-карбоксилат (225 мг) у вигляді твердої речовини блідожовтого кольору. Препаративний приклад 20 До суспензії метил-2'-ціано-6'-фторбіфеніл-4-карбоксилату (730 мг) в етанолі (11 мл) при кімнатній температурі додавали 5 M водний розчин гідроксиду натрію (5,7 мл), потім перемішували протягом 30 хвилин при температурі 70 °C, потім охолоджували. Реакційну рідину підкисляли з використанням 1 М соляної кислоти. Осад збирали шляхом фільтрування, промивали водою і концентрували при зниженому тиску, отримуючи, таким чином, 2'-ціано-6'фторбіфеніл-4-карбонову кислоту (560 мг). Препаративний приклад 21 До розчину метил-1-(2-оксопропіл)-1H-індол-4-карбоксилату (260 мг) і триметил(трифтор)силану (240 мг) в ТГФ (2,6 мл) при охолоджуванні льодом додавали по краплях 1 M розчин N, N,N-трибутилбутан-1-амоній фториду (TBAF) в ТГФ (1,12 мл), потім перемішували протягом ночі при кімнатній температурі. Після цього в реакційну рідину додавали 1 М соляну кислоту, потім перемішували протягом 30 хвилин і екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином гідрокарбонату натрію і насиченим сольовим розчином, у вказаному порядку, і сушили над безводним сульфатом магнію, потім концентрували при зниженому тиску, отримуючи, таким чином, сирий продукт. Отриманий сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-1-(3,3,3-трифтор-2-гідрокси-2метилпропіл)-1H-індол-4-карбоксилат (230 мг). Препаративний приклад 22 До розчину 3-бром-4-фтор-1-бензотіофену (1,4 г) в діетиловому ефірі (20 мл) при температурі -70 °C в потоку азоту додавали по краплях н-бутиллітій (1,65 M розчин в ТГФ) (4,1 мл), потім перемішували протягом 30 хвилин при температурі -70 °C. Після цього реакційну рідину вміщували на сухий лід. Далі реакційну рідину охолоджували до кімнатної температури, розчинник концентрували при зниженому тиску. До залишку додавали воду, потім промивали гексаном. Додавали 1 М соляну кислоту для нейтралізації водного шара, потім екстрагували етилацетатом. Далі органічний шар сушили над безводним сульфатом магнію, тверду речовину 20 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 видаляли шляхом фільтрування, потім концентрували при зниженому тиску. Додавали діетиловий ефір, потім перемішували, і тверду речовину збирали шляхом фільтрування і сушили при зниженому тиску при температурі 40 °C, отримуючи, таким чином, 4-фтор-1бензотіофен-3-карбонову кислоту (0,57 г). Препаративний приклад 23 До розчину N-циклопропіл-1-(3-метоксипропіл)- N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)-1Hіндол-4-карбоксаміду (130 мг) в дихлорметані (1,3 мл) при охолоджуванні льодом в атмосфері аргону додавали трибромід бору (3,76 мл, 1 М розчин), потім перемішували протягом 60 годин при кімнатній температурі. Після цього додавали воду, потім екстрагували етилацетатом. Органічний шар сушили над безводним сульфатом магнію, тверду речовину видаляли шляхом фільтрування, потім концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ:метанол=10:0-9:1), отримуючи, таким чином, 1-(3-бромпропіл)-N-циклопропіл-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)-1H-індол-4карбоксамід (68 мг). Препаративний приклад 24 Суміш бензилциклопропіл(4-оксоциклогексил)карбамату (18,4 г), 1,1-диметокси-N, Nдиметилметанаміну (40 мл) і триетиламіну (40 мл) перемішували при нагріванні протягом 30 хвилин при температурі масляної бані 140 °C, і легколеткі продукти упарювали. Після цього додавали 1,1-диметокси-N, N-диметилметанамін (40 мл) і триетиламін (40 мл), потім перемішували при нагріванні протягом 30 хвилин при температурі 140 °C. Використовуючи відповідні реагенти в кількості 200 мл всього, описану вище процедуру повторювали 5 разів. Реакційну рідину концентрували при зниженому тиску, і до залишку додавали етанол (100 мл) і гідразин гідрат (10,1 мл), потім перемішували протягом 60 годин при кімнатній температурі. Після цього реакційну рідину розбавляли етилацетатом, потім промивали водою 3 рази і потім насиченим сольовим розчином, сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отримуючи, таким чином, бензилциклопропіл(4,5,6,7-тетрагідро-1H-індазол-5-іл)карбамат (15,0 г). Препаративний приклад 25 Трис(дибензиліденацетон)дипаладій (18 мг) і 2-дициклогексилфосфіно-2',6'диметоксибіфеніл (33 мг) додавали до суміші 2-бром-3,5-дифторпіридину (250 мг), [4(метоксикарбоніл)[феніл]боронату (180 мг), фосфату трикалію (637 мг) і толуолу (1,8 мл) в атмосфері газоподібного аргону, потім перемішували при нагріванні протягом 4 годин при температурі масляної бані 110 °C, і потім реакційну рідину охолоджували до кімнатної температури. У реакційну рідину додавали воду, потім розбавляли етилацетатом, промивали насиченим сольовим розчином, сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-4-(3,5-дифторпіридин-2-іл)бензоат (249 мг). Препаративний приклад 26 Триацетокси боргідрид натрію (5,41 г) і оцтову кислоту (2,19 мл) додавали до суміші (3,45 г) бензил-5-оксо-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату і його регіоізомеру, циклопропіламіну (0,878 мл) і 1,2-дихлоретану (70 мл) в атмосфері газоподібного аргону, потім перемішували протягом 18 годин при кімнатній температурі. У реакційну рідину додавали воду, потім перемішували протягом 2 годин при кімнатній температурі, і після цього встановлювали pH на рівні 8, використовуючи насичений водний розчин бікарбонату, далі рідину розділяли. Органічний шар сушили і потім концентрували при зниженому тиску. До суміші залишку і етилацетату (100 мл) додавали розчин 4 M хлористого водню в діоксані (4,15 мл), потім перемішували протягом однієї години при кімнатній температурі. Осад збирали шляхом фільтрування і промивали етилацетатом, отримуючи, таким чином, суміш (3,26 г) моногідрохлориду бензил-5-(циклопропіламіно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату і його регіоізомеру. Препаративний приклад 27 1 М соляну кислоту (100 мл) при охолоджуванні льодом додавали до суміші бензилциклопропіл(1,4-діоксаспіро[4,5]дец-8-іл)карбамату (23,1 г) і ТГФ (200 мл), потім перемішували протягом 48 годин при кімнатній температурі. Після цього додавали 1 М соляну кислоту (100 мл), потім знову перемішували протягом 10 годин при кімнатній температурі. Реакційну рідину розбавляли етилацетатом, потім рідину розділяли. Органічний шар промивали насиченим водним розчином хлориду амонію і насиченим сольовим розчином і сушили, потім концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії 21 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 на силікагелі (гексан/етилацетат), отримуючи, таким чином, бензилциклопропіл(4оксоциклогексил)карбамат (18,4 г). Препаративний приклад 28 Діізопропілетиламін (9,59 мл) і бензилоксикарбоніл хлорид (6,40 мл) при охолоджуванні льодом в атмосфері газоподібного аргону додавали до суміші 1',4',6',7'-тетрагідроспіро[1,3діоксолан-2,5'-індазол] (6,73 г) і ТГФ (70 мл), потім перемішували протягом 3 годин при охолоджуванні льодом. Реакційну рідину розбавляли етилацетатом і далі промивали водою і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, бензил-6',7'-дигідроспіро[1,3-діоксолан-2,5'індазол]-2'(4'Н)-карбоксилат (11,1 г). Препаративний приклад 29 Триетиламін (35,3 мл), бензилхлоркарбонат (29,0 мл) і 4-диметиламінопіридин в каталітичній кількості при охолоджуванні льодом в атмосфері газоподібного аргону додавали до суміші N-циклопропіл-1,4-діоксаспіро[4,5]декан-8-аміну (20 г) і дихлорметану (200 мл), потім перемішували протягом однієї години при охолоджуванні льодом і після цього протягом 12 годин при кімнатній температурі. Реакційну рідину розбавляли хлороформом і потім промивали 1 М соляною кислотою, водою і насиченим водним розчином бікарбонату натрію, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, бензилциклопропіл(1,4-діоксаспіро[4,5]дец-8-іл)карбамат (23,9 г). Препаративний приклад 30 Суміш (17,1 г) трет-бутил-5-{[(бензилокси)карбоніл](циклопропіламіно}-4,5,6,7-тетрагідро-2Hіндазол-2-карбоксилату і його регіоізомеру, 10 %-ний паладій на підкладці з активованого вугілля (1,7 г) і етанол (200 мл) перемішували протягом 2 годин при кімнатній температурі в атмосфері водню під тиском в 1 атм. 10 %-ний паладій на підкладці з активованого вугілля видаляли з реакційної рідини шляхом фільтрування, і потім фільтрат концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отримуючи, таким чином, суміш (10,5 г) моногідрохлориду трет-бутил-5(циклопропіламіно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату і його регіоізомеру. Препаративний приклад 31 Суміш трет-бутилдикарбонату (13,7 г) і дихлорметану (100 мл) додавали до суміші бензилциклопропіл(4,5,6,7-тетрагідро-1H-індазол-5-іл)карбамату (18,0 г) і дихлорметану (200 мл) в атмосфері газоподібного аргону, потім перемішували протягом 12 годин при кімнатній температурі. Після цього додавали суміш трет-бутилдикарбонату (5,3 г) і дихлорметану (10 мл), потім знову перемішували протягом 24 годин при кімнатній температурі. Реакційну рідину концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/етилацетат), отримуючи, таким чином, суміш (17,1 г) трет-бутил-5{[(бензилокси)карбоніл] (циклопропіламіно}-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату і його регіоізомеру. Препаративний приклад 32 Триетиламін (635 мкл) і ди-трет-бутилдикарбонат (597 мг) додавали до розчину 4'[циклопропіл(4,5,6,7-тетрагідро-1H-індазол-5-іл)карбамоїл]біфеніл-2-карбонової кислоти (366 мг) в ТГФ (3,7 мл), потім перемішували протягом 16 годин при кімнатній температурі. У реакційну рідину додавали воду, потім розбавляли етилацетатом, промивали насиченим сольовим розчином, сушили і потім концентрували при зниженому тиску, отримуючи, таким чином, 4’-{[2-(трет-бутоксикарбоніл)-4,5,6,7-тетрагідро-2H-індазол-5-іл](циклопропіл) карбамоїл}біфеніл-2-карбонову кислоту (300 мг). Гексафторфосфат N-[(диметиламіно)(3H[1,2,3]триазолo[4,5-b]піридин-3-ілокси)метиліден]-N-метилметанамінію (HATU) (57 мг), діізопропілетиламін (19 мг) і 4-диметиламінопіридин в каталітичній кількості додавали до розчину 4’-{[2-(трет-бутоксикарбоніл)-4,5,6,7-тетрагідро-2H-індазол-5-іл](циклопропіл)карбамоїл} біфеніл-2-карбонової кислоти (50 мг) в ДМФ (1,2 мл), потім перемішували протягом ночі при температурі 60 °C. Після цього в реакційну рідину додавали воду, потім екстрагували етилацетатом, промивали водою і насиченим сольовим розчином, у вказаному порядку, і сушили над безводним сульфатом магнію, отримуючи, таким чином, сирий продукт. Отриманий сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (від 30 % до 100 %, етилацетат/гексан), отримуючи, таким чином, трет-бутил-5-(циклопропіл{[2'(диметилкарбамоїл)[біфеніл-4-іл]карбоніл}аміно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилат (30 мг). Препаративний приклад 33 22 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 До суміші метил-2-метил-1H-індол-4-карбоксилату (1,17 г) і ацетонітрилу (20 мл) при охолоджуванні льодом додавали 1-(хлорметил)-4-фтор-1,4-діазоніабіцикло[2,2,2]октан дитетрафторборат (2,36 г), потім перемішували протягом 3 годин при кімнатній температурі. Реакційну рідину розбавляли етилацетатом і промивали насиченим водним розчином гідрокарбонату натрію, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат і потім гексан/хлороформ), отримуючи, таким чином, метил-3-фтор-2-метил-1H-індол-4-карбоксилат (102 мг). Препаративний приклад 34 N-етил-N-ізопропілпропан-2-амін (4,08 мл) і бензилхлорметиловий ефір (0,792 мл) при охолоджуванні льодом в атмосфері газоподібного аргону додавали до суміші 3'-метил-1',4',6',7'тетрагідроспіро[1,3-діоксолан-2,5'-індазолу] (925 мг) і дихлорметану (20 мл), потім перемішували протягом 4,5 годин при кімнатній температурі. Реакційну рідину розбавляли етилацетатом і потім промивали водою, насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, суміш (1,11 г) 1'-[(бензилокси)метил]-3'-метил1',4',6',7'-тетрагідроспіро[1,3-діоксолан-2,5'-індазол] і його регіоізомеру. Препаративний приклад 35 До суміші 1-(8-гідрокси-1,4-діоксаспіро[4,5]дец-7-ен-7-іл)етанону (1,03 г) і етанолу (10 мл) додавали гідразин гідрат (0,756 мл), потім перемішували протягом 12 годин при кімнатній температурі. Реакційну рідину розбавляли етилацетатом і потім промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску, отримуючи, таким чином, 3'-метил-1',4',6',7'тетрагідроспіро[1,3-діоксолан-2,5'-індазол] (948 мг). Препаративний приклад 36 Суміш бензилциклопропіл(3-оксо-2,3,5,6,7,8-гексагідроцинолін-6-іл)карбамату (172 мг) і трихлориду фосфору (0,50 мл) перемішували при нагріванні протягом 3,5 годин при температурі масляної бані 100 °C в атмосфері газоподібного аргону і потім охолоджували до кімнатної температури. Реакційну рідину виливали в крижану воду, потім екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином бікарбонату натрію, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отримуючи, таким чином, бензил-(3-хлор-5,6,7,8тетрагідроцинолін-6-іл)циклопропіл карбамат (74 мг). Препаративний приклад 37 Суміш бензил-5-[циклопропіл(4-гідроксибензоїл)аміно]-4,5,6,7-тетрагідро-2H-індазол-2карбоксилату (80 мг), (R)-(-)-2-бутанолу (19 мкл), трифенілфосфіну (63 мг) і ТГФ (1,0 мл) охолоджували крижаною водою в атмосфері газоподібного аргону і додавали діізопропілазодикарбоксилат (40 %-ний розчин в толуолі, 127 мкл), і температуру підвищували до кімнатної, потім перемішували протягом 6 годин. Реакційну рідину концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, бензил-5-[{4-[(2S)-бутан-2ілокси]бензоїл}(циклопропіл)аміно]-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилат (18 мг). Препаративний приклад 38 Фторид тетрабутиламонію (1 М розчин в ТГФ, 742 мкл) додавали до розчину бензил-5(циклопропіл{4-[(триетилсиліл)окси]бензоїл}аміно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату (270 мг) в ТГФ (6,0 мл), потім перемішували протягом 3 днів при кімнатній температурі. Реакційну рідину концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, бензил-5[циклопропіл(4-гідроксибензоїл)аміно]-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилат (129 мг). Препаративний приклад 39 Суміш метил-1H-індазол-4-карбоксилату (505 мг), йодбензолу (1,17 г), йодиду міді(I) (107 мг), транс-N, N'-диметилциклогексан-1,2-діаміну (161 мг), фосфату трикалію (1,22 г) і діоксану (5 мл) перемішували при нагріванні протягом 8 годин при температурі масляної бані 95 °C. Реакційну рідину охолоджували до кімнатної температури, потім розбавляли етилацетатом і промивали водою і насиченим сольовим розчином. Органічний шар сушили і концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-1-феніл-1H-індазол-4-карбоксилат (345 мг). Препаративний приклад 40 23 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розчин трифтороцтової кислоти (111 мг) в дихлорметані (0,8 мл) при охолоджуванні льодом додавали по краплях до діетилцинку (1 М розчин в дихлорметані, 0,97 мл), потім перемішували протягом 20 хвилин. Після цього в реакційну рідину додавали по краплях розчин дийодметану (274 мг) в дихлорметані (0,8 мл), і потім температуру підвищували до кімнатної температури, потім перемішували протягом 20 хвилин. Після цього при охолоджуванні льодом додавали по краплях розчин метил-1-[2-(вінілокси)етил]-1H-індазол-4-карбоксилату (120 мг) в дихлорметані (0,8 мл), і температуру повільно підвищували до кімнатної температури, потім перемішували протягом ночі. У реакційну рідину додавали воду, потім екстрагували хлороформом. Органічний шар промивали насиченим водним розчином гідрокарбонату і насиченим сольовим розчином, у вказаному порядку, і сушили над безводним сульфатом магнію, потім концентрували при зниженому тиску і очищали за допомогою колонкової хроматографії на силікагелі, отримуючи, таким чином, метил-1-[2-(циклопропілокси)етил]-1H-індазол-4-карбоксилат (30 мг). Препаративний приклад 41 При кімнатній температурі N-бромсукцинімід (1,125 г) додавали до розчину (1-бензотіофен6-ілокси)(трет-бутил)дифенілсилану (2,34 г) в хлороформі (20 мл), потім перемішували протягом 60 годин. Після цього додавали воду, потім екстрагували хлороформом, і органічний шар концентрували. Далі залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан), отримуючи, таким чином, [(3-бром-1-бензотіофен-6-іл)окси](третбутил)дифенілсилан (1,16 г) у вигляді безбарвної маслянистої речовини. Препаративний приклад 42 трет-Бутил(хлор)дифенілсилан (4,9 мл) додавали по краплях до розчину 1-бензотіофен-6олу (2,5 г) і діізопропілетиламіну в дихлорметані (20 мл) при охолоджуванні льодом, потім перемішували протягом 16 годин при кімнатній температурі. Додавали насичений водний розчин хлориду амонію, потім екстрагували хлороформом, сушили над безводним сульфатом магнію. Після цього розчинник упарювали. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат=10:0-95:5), отримуючи, таким чином, (1бензотіофен-6-ілокси)(трет-бутил)дифенілсилан (5,37 г) у вигляді безбарвної маслянистої речовини. Препаративний приклад 43 До трет-бутил-5-(циклопропіл{[2'-(метоксикарбоніл)біфеніл-4-іл]карбоніл}аміно)-4,5,6,7тетрагідро-2H-індазол-2-карбоксилату (470 мг) в суміші метанолу (2 мл) і ТГФ (2 мл) при кімнатній температурі додавали 4 M водний розчин гідроксиду натрію (2 мл), потім перемішували протягом ночі. Після цього в реакційну рідину додавали 1 М соляну кислоту для нейтралізації, і розчинник упарювали при зниженому тиску, отримуючи, таким чином, 4'[циклопропіл(4,5,6,7-тетрагідро-1H-індазол-5-іл)карбамоїл]біфеніл-2-карбонову кислоту (366 мг). Препаративний приклад 44 До суміші N-циклопропіл-4-ізопропіл-N-[4-(піролідин-1-іл)циклогекс-3-ен-1-іл бензаміду (630 мг), діізопропілетиламіну (0,367 мл) і хлороформу (17 мл) в атмосфері газоподібного аргону додавали ацетил хлорид (0,140 мл), потім перемішували протягом 26 годин при кімнатній температурі. У реакційну рідину додавали 1 М соляну кислоту, потім перемішували протягом однієї години при кімнатній температурі і додавали етилацетат для здійснення розділення рідини. Органічний шар промивали водою і насиченим сольовим розчином, у вказаному порядку, і сушили, потім концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/етилацетат), отримуючи, таким чином, N-(3ацетил)-4-гідроксициклогекс-3-ен-1-іл)-N-циклопропіл-4-ізопропіл бензамід (203 мг). Препаративний приклад 45 До суміші N-циклопропіл-4-ізопропіл-N-(4-оксоциклогексил) бензаміду (500 мг), безводного сульфату магнію (1,5 г) і толуолу (5 мл) в атмосфері газоподібного аргону додавали піролідин (0,846 мл), потім перемішували протягом 24 годин при кімнатній температурі. Сульфат магнію видаляли з реакційної рідини шляхом фільтрування, потім концентрували при зниженому тиску і сушили, отримуючи, таким чином, N-циклопропіл-4-ізопропіл-N-[4-(піролидин-1-іл)циклогекс-3ен-1-іл] бензамід (640 мг). Препаративний приклад 46 Суміш етил-2-ацетамід-3-оксобутаноату (400 мг), бензиламіну (0,700 мл) і оцтової кислоти (4 мл) нагрівали при кип'ятінні із зворотним холодильником протягом 28 годин. Оцтову кислоту упарювали з реакційної рідини при зниженому тиску, потім розбавляли хлороформом і промивали водою. Органічний шар сушили і потім концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отримуючи, таким чином, етил-1-бензил-2,5-диметил-1H-імідазол-4-карбоксилат (384 мг). Препаративний приклад 47 24 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 Оптичне розділення рацемічного трет-бутил-5-(циклопропіламіно)-4,5,6,7-тетрагідро-2Hіндазол-2-карбоксилату (228 мг) здійснювали за допомогою надкритичної флюїдної хроматографії (колонка: Chiralpak AY-H 10×250 мм, виробництво DAICEL CORPORATION, рухома фаза: зріджений вуглекислий газ/0,1 % діетиламін в метанолі). У результаті отримували оптично активний трет-бутил-5-(циклопропіламіно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилат (препаративний приклад 47-1, 80,8 мг), що має час втримання 6,49 хв., і оптично активний третбутил-5-(циклопропіламіно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилат (Препаративний приклад 47-2, 88,8 мг), що має час втримання 9,32 хв. Препаративний приклад 48 Суміш N-циклопропіл-4-ізопропіл-N-(4-оксоциклогексил)бензаміду (1 г), 1,1-диметокси-N, Nдиметилметанаміну (2 мл) і триетиламіну (2 мл) перемішували при нагріванні протягом 30 хвилин при температурі масляної бані 140 °C, і легколеткі продукти упарювали. Після цього додавали 1,1-диметокси-N, N-диметилметанамін (2 мл) і триетиламін (2 мл), потім перемішували при нагріванні протягом 30 хвилин при температурі масляної бані 140 °C. Використовуючи відповідні реагенти в кількості 10 мл всього, описану вище процедуру повторювали 5 разів. Реакційну рідину концентрували при зниженому тиску. До залишку додавали етанол (10 мл) і гідрохлорид О-метілізосечовини (769 мг), потім перемішували протягом однієї години при кімнатній температурі, нагрівали протягом 21 годин при температурі масляної бані 60 °C, перемішували при нагріванні протягом 12 годин при температурі масляної бані 80 °C і охолоджували до кімнатної температури. Реакційну рідину розбавляли етилацетатом і потім промивали водою і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отримуючи, таким чином, бензилциклопропіл(2-метокси-5,6,7,8-тетрагідрохіназолін-6-іл)карбамат (204 мг). Препаративний приклад 49 1,65 M Розчин н-бутиллітію в гексані (6,96 мл) додавали до суміші N-ізопропілпропан-2-аміну (1,62 мл) і ТГФ (30 мл), охолоджуючи на бані ацетон/сухий лід в атмосфері газоподібного аргону, потім перемішували протягом 30 хвилин при тій же температурі. Додавали суміш бензилциклопропіл(4-оксоциклогексил)карбамату (3 г) і ТГФ (26 мл), і температуру повільно підвищували до температури охолоджування льодом протягом 3 годин, потім перемішували протягом 10 хвилин при тій же температурі. Потім додавали триамід гексаметилфосфату (HMPA) (1,83 мл) і етил ціаноформіат (1,13 мл), охолоджуючи при цьому на бані ацетон/сухий лід, потім перемішували протягом однієї години при тій же температурі. Реакційну рідину розбавляли етилацетатом і потім промивали водою і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, етил-5-{[(бензилокси)карбоніл](циклопропіл)аміно}-2-гідроксициклогекса-1-ен-1карбоксилат (692 мг). Препаративний приклад 50 Суміш бензилциклопропіл(4-оксоциклогексил)карбамату (500 мг) і гідрату гліоксилової кислоти (160 мг) перемішували при нагріванні протягом 23 годин при температурі 50 °C в атмосфері газоподібного аргону. Після цього додавали оцтову кислоту (0,5 мл), потім перемішували при нагріванні протягом 21 години при температурі масляної бані 50 °C і потім протягом 7 годин при температурі масляної бані 100 °C. Після цього додавали оцтову кислоту (1 мл) і гідразин гідрат (0,127 мл), потім перемішували при нагріванні протягом 18 годин при температурі масляної бані 100 °C, і потім реакційну рідину охолоджували до кімнатної температури. Реакційну рідину розбавляли етилацетатом і потім промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отримуючи, таким чином, бензилциклопропіл(3-оксо-2,3,5,6,7,8-гексагідроцинолін-6-іл)карбамат (343 мг). Препаративний приклад 51 До суміші (117 мг) бензилциклопропіл(2-метил-3-оксо-2,3,4,5,6,7-гексагідро-1H-індазол-5іл)карбамату і його регіоізомеру і дихлорметану (2 мл) при охолоджуванні льодом в атмосфері газоподібного аргону додавали пірідин (0,030 мл) і етилхлорформіат (0,036 мл), потім перемішували протягом 2 годин при тій же температурі. Реакційну рідину розбавляли етилацетатом і потім промивали насиченим водним розчином хлориду амонію і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), 25 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 отримуючи, таким чином, етил-5-{[(бензилоксикарбоніл](циклопропіл)(аміно}-2-метил-3-оксо2,3,4,5,6,7-тетрагідро-1H-індазол-1-карбоксилат (117 мг).) Препаративний приклад 52 Суміш етил-5-{[(бензилокси)карбоніл](циклопропіламіно}-2-гідроксициклогекс-1-ен-1карбоксилату (210 мг), метилгідразину (0,062 мл) і етанолу (4 мл) перемішували при нагріванні протягом 3 годин і потім охолоджували до кімнатної температури. Реакційну рідину концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отримуючи, таким чином, суміш (129 мг) бензилциклопропіл(2-метил-3-оксо-2,3,4,5,6,7-гексагідро-1H-індазол-5-іл)карбамату і його регіоізомеру. Препаративний приклад 53 До суміші 4-бром-5-метокси-1H-індолу (1,0 г) і ДМФ (10 мл) при охолоджуванні льодом в атмосфері газоподібного аргону додавали трет-бутоксид калію (0,596 г), потім перемішували протягом однієї години при кімнатній температурі. Після охолоджування на крижаній бані додавали хлор(триізопропіл)силан (1,13 мл), потім перемішували протягом 2 годин при тій же температурі. Реакційну рідину розбавляли етилацетатом і потім промивали водою (3 рази) і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, 4-бром-5-метокси-1-(триізопропілсиліл)-1H-індол (1,72 г). Препаративний приклад 54 До суміші 4-бром-5-метокси-1-(триізопропілсиліл)-1H-індолу (1,47 г) і ТГФ (30 мл) додавали розчин 1,62 M н-бутиллітію в гексані (2,85 мл), при цьому охолоджуючи на бані сухий лід/ацетон в атмосфері газоподібного аргону, потім перемішували протягом 50 хвилин при тій же температурі. Додавали диметилкарбонат (0,647 мл), і температуру підвищували до температури охолоджування льодом протягом 8 годин. Реакційну рідину розбавляли етилацетатом і потім промивали водою і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-5-метокси-1(триізопропілсиліл)-1H-індол-4-карбоксилат (1,00 г). Препаративний приклад 55 До розчину етил-5-{[(бензилокси)карбоніл](циклопропіл)аміно}-2-гідроксициклогекса-1-ен-1карбоксилату (478 мг) в етанолі (10 мл) додавали гідразин гідрат (133 мг), потім нагрівали при кип'ятінні із зворотним холодильником протягом 3 годин. Після цього реакційну рідину виливали у воду, здійснювали екстракцію 3 рази з використанням хлороформу. Органічний шар сушили над безводним сульфатом магнію і концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі (метанол/хлороформ), отримуючи, таким чином, бензилциклопропіл(3-оксо-2,3,4,5,6,7-гексагідро-1H-індазол-5іл)карбамат (308 мг). Препаративний приклад 56 До розчину 3-метил-1H-індол-4-карбоксилату (500 мг) в ДМФ (5 мл) при охолоджуванні льодом додавали трет-бутоксид калію (705 мг), потім перемішували протягом 40 хвилин. Після цього додавали йодметан (1,2 г), потім перемішували протягом ночі при кімнатній температурі. У реакційну рідину додавали воду, потім екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили над безводним сульфатом магнію, отримуючи, таким чином, сирий продукт. Отриманий сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, метил-3диметил-1H-індол-4-карбоксилат (480 мг). Препаративний приклад 57 Воду (1,5 мл), 2-ціанофеніл боронову кислоту (231 мг), трифенілфосфін (45 мг) і карбонат натрію (416 мг) додавали, у вказаному порядку, до розчину 4-бром-3-хлорбензойної кислоти (308 мг) в 1,4-діоксані (10 мл), потім перемішували при нагріванні протягом 3 годин при температурі 100 °C в атмосфері аргону. У реакційну рідину додавали воду, потім екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію і сушили над сульфатом магнію, отримуючи, таким чином, сирий продукт. Отриманий сирий продукт очищали за допомогою колонкової хроматографії на силікагелі (гексан/етилацетат), отримуючи, таким чином, 2-хлор-2'-ціанобіфеніл-4-карбонову кислоту (363 мг). Сполуки за препаративними прикладами 58-432, показані в таблицях, описані далі, були отримані таким же способом, як і в препаративних прикладах 1-57. Структури сполук за 26 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 60 препаративнимми прикладами показані в таблицях 5-81, а фізико-хімічні дані і спосіб отримання сполук показані в таблицях 82-92, відповідно. Приклад 1 Трифтороцтову кислоту (260 мг) додавали до розчину трет-бутил-5-{[(2'-ціанобіфеніл-4іл)карбоніл](циклопропіл)аміно}-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату (110 мг) в дихлорметані (1,1 мл), потім перемішували протягом 2 годин при кімнатній температурі. Після цього розчинник упарювали при зниженому тиску, потім розбавляли етилацетатом і промивали насиченим водним розчином гідрокарбонату натрію і насиченим сольовим розчином, у вказаному порядку. Органічний шар сушили над безводним сульфатом магнію і концентрували при зниженому тиску. Отриманий залишок очищали на колонці з силікагелем (метанол/хлороформ), отримуючи, таким чином, 2'-ціано-N-циклопропіл-N-(4,5,6,7-тетрагідро1H-індазол-5-іл)біфеніл-4-карбоксамід (66 мг). Приклад 2 Розчин 4 M хлористий водень/етилацетат (2 мл) додавали до трет-бутил-5-(циклопропіл{[1(2-фторетил)-1H-індол-4-іл]карбоніл}аміно)-4,5,6,7-тетрагідро-2H-індазол-2-карбоксилату (95 мг) в суміші етилацетату (1,9 мл) і етанолу (0,48 мл) при кімнатній температурі, потім перемішували протягом 2 годин. Після цього реакційну рідину концентрували при зниженому тиску і підлуговували з використанням насиченого водного розчину гідрокарбонату натрію, потім екстрагували етилацетатом. Органічний шар промивали насиченим сольовим розчином і сушили над безводним сульфатом магнію, потім концентрували при зниженому тиску. Залишок очищали на колонці з силікагелем (0 %-10 % метанол/хлороформ), і потім додавали розчин 4 M хлористий водень/етилацетат, потім упарювали розчинник при зниженому тиску, отримуючи, таким чином, гідрохлорид N-циклопропіл-1-(2-фторетил)-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)1H-індол-4-карбоксаміду (44 мг). Приклад 3 Суміш трет-бутил-5-(циклопропіл{[1-(1-фенілетил)-1H-індазол-4-іл]карбоніл}аміно)-4,5,6,7тетрагідро-2H-індазол-2-карбоксилату (184 мг), трифтороцтової кислоти (0,25 мл) і дихлорметану (5 мл) перемішували протягом ночі при кімнатній температурі. Реакційну рідину виливали в насичений водний розчин бікарбонату натрію, і здійснювали екстракцію з використанням хлороформу. Органічний шар сушили і потім концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), потім розчиняли в етилацетаті. Додавали розчин 4 M хлористий водень/етилацетат, і осад, що утворився, збирали шляхом фільтрування, отримуючи, таким чином, гідрохлорид N-циклопропіл-1-(1-фенілетил)-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)-1Hіндазол-4-карбоксаміду (60 мг). Приклад 4 До суміші 1-бензил-1H-індол-2-карбонової кислоти (140 мг) і дихлорметану (5 мл) додавали оксаліл хлорид (100 мкл) і ДМФ (20 мкл), потім перемішували протягом однієї години при кімнатній температурі, і потім розчинник упарювали при зниженому тиску. До отриманого азеотропною відгонкою осаду додавали дихлорметан (5 мл) і сушили з використанням толуолу, і потім додавали моногідрохлорид трет-бутил-5-(циклопропіламіно)-4,5,6,7-тетрагідро-2Hіндазол-2-карбоксилату (150 мг) і триетиламін (200 мкл) при температурі 0 °C, потім перемішували протягом 20 годин при кімнатній температурі. Реакційну рідину розбавляли етилацетатом і потім промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. До залишку додавали 4 М розчин хлористий водень/етилацетат (5 мл), потім перемішували протягом 24 годин при кімнатній температурі. Розчинник упарювали з реакційної рідини при зниженому тиску, і до отриманого залишку додавали етилацетат, потім промивали насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином, у вказаному порядку, сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/етилацетат), отримуючи, таким чином, 1-бензил-Nциклопропіл-N-(4,5,6,7-тетрагідро-2H-індазол-5-іл)-1H-індол-2-карбоксамід (217 мг). Приклад 5 До розчину бензил-5-[циклопропіл(4-ізопропокси-2-метоксибензоїл) аміно]-4,5,6,7тетрагідро-2H-індазол-2-карбоксилату (140 мг) в тетрагідрофурані (1,4 мл) додавали 5 M водний розчин гідроксиду натрію, потім перемішували протягом 2 годин при кімнатній температурі. Після цього реакційну рідину нейтралізували за допомогою 1 М соляної кислоти, потім екстрагували хлороформом, концентрували при зниженому тиску і очищали за допомогою колонкової хроматографії на силікагелі, отримуючи, таким чином, N-циклопропіл-4-ізопропокси2-метокси-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл) бензамід (40 мг). 27 UA 112327 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 6 Трибромід бору (1 М розчин в ТГФ, 5,3 мл) додавали по краплях до розчину бензил-5-{[(2'ціано-6'-фтор-3-метоксибіфеніл-4-іл)карбоніл] (циклопропіл)аміно}-4,5,6,7-тетрагідро-2Hіндазол-2-карбоксилату (300 мг) в дихлорметані (3 мл) при охолоджуванні льодом, потім перемішували протягом 3 днів при кімнатній температурі. Після цього реакційну рідину виливали у воду і злегка підлуговували з використанням насиченого водного розчину гідрокарбонату натрію, потім екстрагували хлороформом і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (метанол/хлороформ), отримуючи, таким чином, 2'-ціано-N-циклопропіл-6'-фтор-3-гідрокси-N-(4,5,6,7-тетрагідро-1Hіндазол-5-іл)біфеніл-4-карбоксамід (180 мг). Приклад 7 Оптичне розділення рацемічного 2'-ціано-N-циклопропіл-6'-фтор-N-(4,5,6,7-тетрагідро-1Hіндазол-5-іл)біфеніл-4-карбоксаміду (500 мг) здійснювали за допомогою надкритичної флюїдної хроматографії (колонка: AS-H, елююючий розчинник: зріджений вуглекислий газ/етанол=80/20, швидкість потоку: 12 мл/хв.). У результаті отримували (-)-2'-ціано-N-циклопропіл-6'-фтор-N(4,5,6,7-тетрагідро-1H-індазол-5-іл)біфеніл-4-карбоксамід (210 мг) (приклад 7-1) і (+)-2'-ціано-Nциклопропіл-6'-фтор-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)біфеніл-4-карбоксамід (190 мг) (приклад 7-2). Приклад 8 Оптичне розділення рацемічного N-циклопропіл-4-ізопропокси-N-(4,5,6,7-тетрагідро-1Hіндазол-5-іл)бензаміду (450 мг) здійснювали за допомогою надкритичної флюїдної хроматографії (колонка: AY-H, елююючий розчинник: зріджений вуглекислий газ/етанол=7/3, швидкість потоку: 10 мл/хв.). У результаті отримували (-)-N-циклопропіл-4-ізопропокси-N(4,5,6,7-тетрагідро-1H-індазол-5-іл)бензамід (190 мг) (приклад 8-1) і (+)-N-циклопропіл-4ізопропокси-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)бензамід (187 мг) (приклад 8-2). Приклад 9 До розчину 1-(3-бромпропіл)-N-циклопропіл-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)-1H-індол4-карбоксаміду (65 мг) в суміші 1,4-діоксан (1 мл)/вода (0,25 мл) при кімнатній температурі додавали трифторацетат срібла (45 мг), потім перемішували протягом 40 годин при кімнатній температурі. Додавали етанол, і нерозчинну речовину видаляли шляхом фільтрування з використанням целіту. Розчин концентрували при зниженому тиску, додавали насичений водний розчин гідрокарбонату натрію, потім екстрагували етилацетатом. Розчинник концентрували при зниженому тиску, і залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол=10:0-9:1), отримуючи, таким чином, Nциклопропіл-1-(3-гідроксипропіл)-N-(4,5,6,7-тетрагідро-1H-індазол-5-іл)-1H-індол-4-карбоксамід (18 мг). Приклад 10 Суміш N-циклопропіл-4-ізопропіл-N-(4-оксоциклогексил)бензаміду (500 мг), 1,1-диметокси-N, N-диметилметанаміну (1 мл) і триетиламіну (1 мл) перемішували при нагріванні протягом 30 хвилин при температурі масляної бані 140 °C, і легколеткі продукти упарювали. Після цього додавали 1,1-диметокси-N, N-диметилметанамін (1 мл) і триетиламін (1 мл), потім перемішували при нагріванні протягом 30 хвилин при температурі масляної бані 140 °C. Використовуючи відповідні реагенти в кількості 5 мл всього, описану вище процедуру повторювали 5 разів. Реакційну рідину концентрували при зниженому тиску. До залишку додавали етанол (2,5 мл) і гідразин гідрат (0,243 мл), потім перемішували протягом 12 годин при кімнатній температурі. Реакційну рідину розбавляли етилацетатом і потім промивали водою (3 рази) і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отримуючи, таким чином, N-циклопропіл-4-ізопропіл-N-(4,5,6,7тетрагідро-2H-індазол-5-іл)бензамід (380 мг). Приклад 11 О-(7-Азабензотриазол-1-іл)-N, N,N',N'-тетраметилуроній гексафторфосфат (113 мг), діізопропілетиламін (0,127 мл) і 4-диметиламінопіридин в каталітичній кількості додавали до суміші моногідрохлориду N-циклопропіл-5,6,7,8-тетрагідроцинолін-6-аміну (56 мг), 1-метил-1Hіндол-4-карбонової кислоти (52 мг) і ДМФ (2 мл) в атмосфері газоподібного аргону, потім перемішували при нагріванні протягом 60 годин при температурі масляної бані 60 °C, і потім отриманий продукт охолоджували до кімнатної температури. Реакційну рідину розбавляли етилацетатом і потім промивали водою (3 рази) і насиченим сольовим розчином, у вказаному порядку, потім сушили і концентрували при зниженому тиску. Залишок очищали за допомогою 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBicyclic heterocyclic compound
Автори англійськоюKawakami, Shimpei, Sakurai, Minoru, Kawano, Noriyuki, Suzuki, Takayuki, Shiraishi, Nobuyuki, Hamaguchi, Wataru, Sekioka, Ryuichi, Moritomo, Hiroyuki, Moritomo, Ayako
Автори російськоюКаваками Симпэй, Сакураи Минору, Кавано Нориюки, Судзуки Такаюки, Сираиси Нобуюки, Хамагути Ватару, Секиока Рюити, Моритомо Хироюки, Моритомо Аяко
МПК / Мітки
МПК: A61P 3/04, C07D 409/12, A61K 31/4439, A61K 31/4184, A61P 25/18, C07D 413/12, C07D 403/14, A61K 31/517, C07D 409/14, C07D 231/56, A61P 25/04, A61P 3/06, A61P 19/10, A61P 3/10, A61K 31/416, A61K 31/4192, C07D 405/12, C07D 417/14, A61K 31/4709, A61P 43/00, A61P 27/06, A61K 31/506, A61K 31/5377, C07D 401/12, C07D 405/14, A61K 31/4245, C07D 403/12, A61K 31/437, A61K 31/497, C07D 471/04, A61K 31/502, C07D 401/14, A61P 25/24, A61P 25/28
Мітки: гетероциклічна, сполука, біциклічна
Код посилання
<a href="https://ua.patents.su/191-112327-biciklichna-geterociklichna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Біциклічна гетероциклічна сполука</a>
Попередній патент: Засоби, що викликають апоптоз, для лікування злоякісних новоутворень і імунних і аутоімунних захворювань
Наступний патент: Ментолвмісний курильний виріб
Випадковий патент: Велосипедне колесо