Спосіб одержання заміщеної анілінової сполуки та проміжні сполуки для його здійснення
Формула / Реферат
1. Спосіб одержання заміщеної анілінової сполуки, представленої наступною загальною формулою (6):
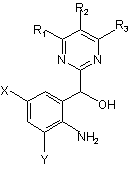 , (6)
, (6)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, який відрізняється тим, що включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3):
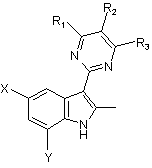 , (3)
, (3)
де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4):
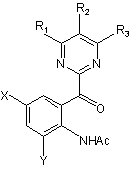 , (4)
, (4)
де R1, R2, R3, X і Y мають такі ж значення, як вказані вище; і Ас є ацетильною групою, і обробку даної сполуки за допомогою відновлення і деацетилювання.
2. Спосіб за п. 1, який відрізняється тим, що спочатку здійснюють обробку сполуки формули (4) за допомогою відновлення з одержанням 2-(піримідин-2-ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5):
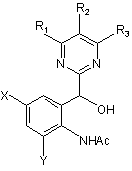 , (5)
, (5)
де R1, R2, R3, X, Y та Ac мають такі ж значення, як вказані вище,
і послідовно проводять деацетилювання.
3. Спосіб за п. 2, який відрізняється тим, що відновлення сполуки формули (4) здійснюють без її виділення.
4. Спосіб за п. 1, який відрізняється тим, що спочатку проводять деацетилювання сполуки формули (4) з одержанням аміносполуки, представленої наступною загальною формулою (7):
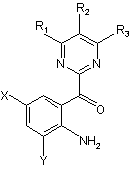 , (7)
, (7)
де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, і з подальшим її відновленням.
5. Спосіб за будь-яким пп. 1-4, який відрізняється тим, що відновлення проводять боргідридом натрію.
6. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що заміщену індольну сполуку, представлену наступною загальною формулою (3):
 , (3)
, (3)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, одержують взаємодією (піримідин-2-іл)-2-пропанонової сполуки, представленої наступною загальною формулою (1):
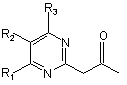 , (1)
, (1)
де R1, R2 і R3 мають такі ж значення, як вказані вище, з гідразиновою сполукою, представленою наступною загальною формулою (2):
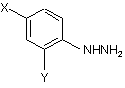 , (2)
, (2)
де Х і Y мають такі ж значення, як вказані вище, у присутності кислоти.
7. Спосіб одержання аміносполуки, представленої наступною загальною формулою (7):
 , (7)
, (7)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, який відрізняється тим, що включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3):
 , (3)
, (3)
де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4):
 , (4)
, (4)
де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище; і Ас є ацетильною групою, і деацетилювання даної сполуки.
8. Спосіб одержання 2-(піримідин-2-ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5):
 , (5)
, (5)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою, який відрізняється тим, що включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3):
 , (3)
, (3)
де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4):
 , (4)
, (4)
де R1, R2, R3, X, Y і Ас мають такі ж значення, як вказані вище, і відновлення даної сполуки.
9. Спосіб за п. 8, який відрізняється тим, що відновлення сполуки формули (4) здійснюють без її виділення.
10. Спосіб за п. 8, де відновлення проводять боргідридом натрію.
11. Спосіб одержання заміщеної індольної сполуки, представленої загальною формулою (3):
 , (3)
, (3)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, що включає взаємодію (піримідин-2-іл)-2-пропанонової сполуки, представленої наступною загальною формулою (1):
 , (1)
, (1)
де R1, R2 та R3 мають такі ж значення, як вказані вище, з гідразиновою сполукою, представленою наступною загальною формулою (2):
 , (2)
, (2)
де Х і Y мають такі ж значення, як вказані вище, у присутності кислоти.
12. Спосіб за п. 1, який відрізняється тим, що ацетанілідну сполуку, представлену загальною формулою (4), одержують шляхом окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3):
 , (3)
, (3)
де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, що приводить до розкриття індольного кільця.
13. Спосіб за п. 4, який відрізняється тим, що аміносполуку, представлену загальною формулою (7), одержують шляхом деацетилювання ацетанілідної сполуки, представленої наступною формулою (4):
 , (4)
, (4)
де R1, R2, R3, X і Y мають такі ж значення, як вказані вище; і Ас означає ацетильну групу.
14. Спосіб одержання заміщеної анілінової сполуки, представленої наступною загальною формулою (6):
 , (6)
, (6)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, який відрізняється тим, що включає відновлення аміносполуки, представленої наступною загальною формулою (7):
 , (7)
, (7)
де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище.
15. Спосіб за п. 2, який відрізняється тим, що 2-(піримідин-2-ілгідроксиметил)ацетанілідну сполуку, представлену загальною формулою (5), одержують шляхом відновлення ацетанілідної сполуки, представленої наступною загальною формулою (4):
 , (4)
, (4)
де R1, R2, R3, X, Y і Ac мають такі ж значення, як вказані вище.
16. Спосіб за п. 14, який відрізняється тим, що відновлення проводять боргідридом натрію.
17. Спосіб за п. 15, який відрізняється тим, що відновлення проводять боргідридом натрію.
18. Спосіб за будь-яким з пп. 2 або 3, який відрізняється тим, що заміщену анілінову сполуку, представлену загальною формулою (6), одержують шляхом деацетилювання 2-(піримідин-2-ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5):
 , (5)
, (5)
де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище; і Ас є ацетильною групою.
19. 2-Метоксиметилфенілгідразин формули
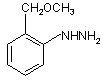 .
.
20. 1-(4,6-Диметоксипіримідин-2-іл)-2-пропанон формули
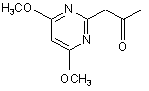 .
.
21. Заміщена індольна сполука, представлена наступною загальною формулою (3):
 , (3)
, (3)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену.
22. Заміщена ацетанілідна сполука, представлена наступною загальною формулою (4):
 , (4)
, (4)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою,
за умови виключення сполуки, в якій Х являє собою Сl; Y, R1, R2 і R3 являють собою водень.
23. 2-(Піримідин-2-ілгідроксиметил)ацетанілідна сполука, представлена наступною загальною формулою (5):
 , (5)
, (5)
де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою.
Текст
1. Спосіб одержання заміщеної анілінової сполуки, представленої наступною загальною формулою (6): 2 3 76127 4 3. Спосіб за п. 2, який відрізняється тим, що відбонільну групу, алкілкарбоксамідну групу, нітрогновлення сполуки формули (4) здійснюють без її рупу, арильну групу, арилалкільну групу, арилоквиділення. сигрупу, атом галогену або атом водню; і Х і Y ко4. Спосіб за п. 1, який відрізняється тим, що спожний незалежно означає атом водню, алкільну чатку проводять деацетилювання сполуки формугрупу, алкоксигрупу, алкоксіалкільну групу, галогели (4) з одержанням аміносполуки, представленої налкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, який відрізнянаступною загальною формулою (7): R ється тим, що включає окислення заміщеної R R індольної сполуки, представленої наступною загаN N льною формулою (3): 2 1 3 X R3 N NH2 Y , (7) де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, і з подальшим її відновленням. 5. Спосіб за будь-яким пп. 1-4, який відрізняється тим, що відновлення проводять боргідридом натрію. 6. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що заміщену індольну сполуку, представлену наступною загальною формулою (3): N H , (3) де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4): Y R2 R1 N R3 N R3 N N X R2 R1 R2 R1 O N X O X NHAc N H , (3) де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, одержують взаємодією (піримідин-2-іл)-2-пропанонової сполуки, представленої наступною загальною формулою (1): Y R3 R2 O N R N , (1) де R1, R2 і R3 мають такі ж значення, як вказані вище, з гідразиновою сполукою, представленою наступною загальною формулою (2): 1 X NHNH2 Y , (2) де Х і Y мають такі ж значення, як вказані вище, у присутності кислоти. 7. Спосіб одержання аміносполуки, представленої наступною загальною формулою (7): R2 R2 R1 R3 N N X OH NHAc , (5) де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою, який відрізняється тим, що включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): Y R2 R1 R3 N N X R1 R3 N N X O NH2 , (7) де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарY , (4) де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище; і Ас є ацетильною групою, і деацетилювання даної сполуки. 8. Спосіб одержання 2-(піримідин-2ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5): Y N H Y , (3) де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4): 5 R2 R1 R3 N N 76127 6 (7), одержують шляхом деацетилювання ацетанілідної сполуки, представленої наступною формулою (4): R2 R1 X R3 O N NHAc Y , (4) де R1, R2, R3, X, Y і Ас мають такі ж значення, як вказані вище, і відновлення даної сполуки. 9. Спосіб за п. 8, який відрізняється тим, що відновлення сполуки формули (4) здійснюють без її виділення. 10. Спосіб за п. 8, де відновлення проводять боргідридом натрію. 11. Спосіб одержання заміщеної індольної сполуки, представленої загальною формулою (3): O NHAc Y , (4) де R1, R2, R3, X і Y мають такі ж значення, як вказані вище; і Ас означає ацетильну групу. 14. Спосіб одержання заміщеної анілінової сполуки, представленої наступною загальною формулою (6): R2 R3 R1 R2 R1 N X N N R3 N X N OH X NH2 N H , (6) де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, який відрізняється тим, що включає відновлення аміносполуки, представленої наступною загальною формулою (7): Y , (3) де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену, що включає взаємодію (піримідин-2-іл)-2-пропанонової сполуки, представленої наступною загальною формулою (1): Y R2 R3 R2 R1 O N R3 N R N , (1) де R1, R2 та R3 мають такі ж значення, як вказані вище, з гідразиновою сполукою, представленою наступною загальною формулою (2): N 1 X NHNH2 Y , (2) де Х і Y мають такі ж значення, як вказані вище, у присутності кислоти. 12. Спосіб за п. 1, який відрізняється тим, що ацетанілідну сполуку, представлену загальною формулою (4), одержують шляхом окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): X O NH2 Y , (7) де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище. 15. Спосіб за п. 2, який відрізняється тим, що 2(піримідин-2-ілгідроксиметил)ацетанілідну сполуку, представлену загальною формулою (5), одержують шляхом відновлення ацетанілідної сполуки, представленої наступною загальною формулою (4): R2 R1 R2 R1 R3 N N X R3 N O N NHAc X N H Y , (3) де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище, що приводить до розкриття індольного кільця. 13. Спосіб за п. 4, який відрізняється тим, що аміносполуку, представлену загальною формулою Y , (4) де R1, R2, R3, X, Y і Ac мають такі ж значення, як вказані вище. 16. Спосіб за п. 14, який відрізняється тим, що відновлення проводять боргідридом натрію. 17. Спосіб за п. 15, який відрізняється тим, що відновлення проводять боргідридом натрію. 18. Спосіб за будь-яким з пп. 2 або 3, який відрізняється тим, що заміщену анілінову сполуку, 7 76127 8 представлену загальною формулою (6), одержу22. Заміщена ацетанілідна сполука, представлена ють шляхом деацетилювання 2-(піримідин-2наступною загальною формулою (4): R ілгідроксиметил)ацетанілідної сполуки, представR R леної наступною загальною формулою (5): 2 1 R2 3 N R1 N R3 X N O N NHAc X OH NHAc Y , (5) де R1, R2, R3, Х і Y мають такі ж значення, як вказані вище; і Ас є ацетильною групою. 19. 2-Метоксиметилфенілгідразин формули CH2OCH3 NHNH2 . 20. 1-(4,6-Диметоксипіримідин-2-іл)-2-пропанон формули H3CO N N O OCH3 . 21. Заміщена індольна сполука, представлена наступною загальною формулою (3): Y , (4) де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою, за умови виключення сполуки, в якій Х являє собою Сl; Y, R1, R2 і R3 являють собою водень. 23. 2-(Піримідин-2-ілгідроксиметил)ацетанілідна сполука, представлена наступною загальною формулою (5): R2 R2 R1 R1 R3 N R3 N N N X X OH N H NHAc , (3) де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену. , (5) де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і Х і Y кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою. Даний винахід відноситься до способу одержання заміщеної анілінової сполуки, яка може використовуватись як проміжна сполука у виробництві, наприклад, хімікатів для сільського господарства і лікарських препаратів. У наш час відомо, що деякі з сульфонанілідних похідних, що містять 4,6-диметоксипіримідин, володіють високою гербіцидною активністю [див. японський патент JP-A-11-60562 і міжнародну публікацію WO00/06553]. Крім того, також відомо, що при одержанні вказаних похідних заміщену анілінову сполуку застосовують як основну проміжну сполуку. До теперішнього часу описані способи одержання заміщеної анілінової сполуки, яка є основною проміжною сполукою для сульфонанілідного похідного, що володіє високою гербіцидною активністю, [див. японський патент JP-A-7-48359, між народну публікацію WO96/41799]. Кожний вказаний спосіб здійснюється реакцією, яка є невигідною для виробництва; тому, бажано розробити спосіб, за допомогою якого можна вигідно виготовляти у промисловості вказаний заміщений анілін. Для розв'язання вищезгаданої проблеми заявник даного винаходу провів відповідне дослідження. Внаслідок дослідження було виявлено, що задана заміщена анілінова сполука може бути одержана взаємодією, наприклад, (піримідин-2-іл)2-пропанонової сполуки з гідразиновою сполукою у присутності кислоти з утворенням заміщеної індольної сполуки, окислення заміщеної індольної сполуки, що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, і відновлення ацетанілідної сполуки, переважно боргідридом натрію, або деацетилювання амідного фрагмента, тобто, одержані дані свідчать про те, Y Y 9 76127 10 що зазначена вище проблема може бути вирішеналкільну групу, карбоксильну групу, алкоксикарна. Одержані дані дозволили завершити даний бонільну групу або атом галогену), який відрізнявинахід. ється тим, що спосіб включає окислення заміщеної Даний винахід детально описаний нижче. індольної сполуки, представленої наступною загаВказана вище проблема вирішена, головним льною формулою (3): чином, при включенні наступних винаходів з [1] по [14]. [1] Спосіб одержання заміщеної анілінової (3) сполуки, представленої наступною загальною формулою (6): (6) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену), який відрізняється тим, що спосіб включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4): (4) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище; і Ас є ацетильною групою), відновлення даної сполуки з одержанням 2-(піримідин-2ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5): (5) (3) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4): (де R1, R2, R3, Χ, Υ і Ас мають такі ж визначення, як дані вище) і послідовне проведення деацетилювання. [3] Спосіб одержання заміщеної анілінової сполуки, представленої наступною загальною формулою (6): (6) (4) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище; і Ас є ацетильною групою), і обробку даної сполуки за допомогою відновлення і деацетилювання. [2] Спосіб одержання заміщеної анілінової сполуки, представленої наступною загальною формулою (6): (6) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галоге (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену), який відрізняється тим, що спосіб включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): (3) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої лою (4): 11 наступною 76127 загальною 12 форму(7) (4) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище; і Ас є ацетильною групою), відновлення даної сполуки без її виділення з одержанням 2-(піримідин-2-ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5): (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), і подальше проведення відновлення. [5] Спосіб одержання заміщеної анілінової сполуки згідно з будь-яким з вищезгаданих способів 1-4, де заміщену індольну сполуку, представлену наступною загальною формулою (3): (3) (5) (де Rb R2, R3, Χ, Υ і Ас мають такі ж визначення, як дані вище), і послідовне проведення деацетилювання. [4] Спосіб одержання заміщеної анілінової сполуки, представленої наступною загальною формулою (6): (6) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену), який відрізняється тим, що спосіб включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): (3) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4): (4) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище; і Ас є ацетильною групою), деацетилювання даної сполуки з одержанням аміносполуки, представленої наступною загальною формулою (7): (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену), одержують шляхом взаємодії, у присутності кислоти, 2(піримідин-2-іл)-2-пропанонової сполуки, представленої наступною загальною формулою (1): (1) (де R1, R2 і R3 мають такі ж визначення, як дані вище), з гідразиновою сполукою, представленою наступною загальною формулою (2): (2) (де X і Υ мають такі ж визначення, як дані вище). [6] Спосіб одержання аміносполуки, представленої наступною загальною формулою (7): (7) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену), який відрізняється тим, що спосіб включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): 13 76127 14 (3) (5) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4): (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою), який відрізняється тим, що спосіб включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): (4) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище; і Ас є ацетильною групою), і деацетилювання даної сполуки. [7] Спосіб одержання 2-(піримідин-2ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5): (3) (5) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою), який відрізняється тим, що спосіб включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4): (4) (де R1, R2, R3, Χ, Υ і Ас мають такі ж визначення, як дані вище), і відновлення даної сполуки без її виділення. [9] Спосіб одержання заміщеної індольної сполуки, представленої наступною загальною формулою (3): (3) (3) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), що приводить до розкриття індольного кільця з одержанням ацетанілідної сполуки, представленої наступною загальною формулою (4): (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену), який відрізняється тим, що спосіб включає взаємодію, у присутності кислоти, (піримідин-2-іл)-2пропанонової сполуки, представленої наступною загальною формулою (1): (4) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище; і Ас є ацетильною групою), і відновлення даної сполуки. [8] Спосіб одержання 2-(піримідин-2ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5): (1) (де R1, R2 і R3 мають такі ж визначення, як дані 15 76127 16 вище), з гідразиновою сполукою, представленою (де R1, R2, R3, X і Υ мають такі ж визначення, наступною загальною формулою (2): як дані вище; і Ас є ацетильною групою). [12] Спосіб одержання заміщеної анілінової (2) сполуки, представленої наступною загальною формулою (6): (де X і Υ мають такі ж визначення, як дані вище). [10] Спосіб одержання ацетанілідної сполуки, (6) представленої наступною загальною формулою (4): (4) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою), який відрізняється тим, що спосіб включає окислення заміщеної індольної сполуки, представленої наступною загальною формулою (3): (3) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище), що приводить до розкриття індольного кільця. [11] Спосіб одержання аміносполуки, представленої наступною загальною формулою (7): (7) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену), який відрізняється тим, що спосіб включає деацетилювання ацетанілідної сполуки, представленої наступною загальною формулою (4): (4) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену), який відрізняється тим, що спосіб включає відновлення аміносполуки, представленої наступною загальною формулою (7): (7) (де R1, R2, R3, X і Υ мають такі ж визначення, як дані вище). [13] Спосіб одержання 2-(піримідин-2ілгідроксиметил)ацетанілідної сполуки, представленої наступною загальною формулою (5): (5) (де R1, R2 і R3 кожний незалежно означає алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу, алкілкарбоксамідну групу, нітрогрупу, арильну групу, арилалкільну групу, арилоксигрупу, атом галогену або атом водню; і X і Υ кожний незалежно означає атом водню, алкільну групу, алкоксигрупу, алкоксіалкільну групу, галогеналкільну групу, карбоксильну групу, алкоксикарбонільну групу або атом галогену; і Ас є ацетильною групою), який відрізняється тим, що спосіб включає відновлення ацетанілідної сполуки, представленої наступною загальною формулою (4): (4) (де R1, R2, R3, Χ, Υ і Ас мають такі ж визначення, як дані вище). [14] Спосіб одержання заміщеної анілінової сполуки, представленої наступною загальною формулою (6): 17 76127 18 група, метоксіетильна група, етоксіетильна група або тому подібне; (С1-С6)галогеналкільну групу з прямим або розгалуженим ланцюгом, таку як фто(6) рметильна група, дифторметильна група, трифторметильна група або тому подібне; карбоксильну групу; (С1-С6)алкоксикарбонільну групу з, прямим (де R1, R2 і R3 кожний незалежно означає алкіабо розгалуженим ланцюгом, таку як метоксикарльну групу, алкоксигрупу, алкоксіалкільну групу, бонільна група, етоксикарбонільна група або тому галогеналкільну групу, карбоксильну групу, алкокподібне; (С1-С6)алкілкарбоксамідну групу з прясикарбонільну групу, алкілкарбоксамідну групу, мим або розгалуженим ланцюгом, таку як метилнітрогрупу, арильну групу, арилалкільну групу, карбоксамідна група, етилкарбоксамідна група або арилоксигрупу, атом галогену або атом водню; і X і тому подібне; нітрогрупу; арильну групу, таку як Υ кожний незалежно означає атом водню, алкільну фенільна група або тому подібне; арил(С1групу, алкоксигрупу, алкоксіалкільну групу, галогеС6)алкільну групу з прямим або розгалуженим налкільну групу, карбоксильну групу, алкоксикарланцюгом, таку як фенілметильна група, фенілебонільну групу або атом галогену), який відрізнятильна група або тому подібне; арилоксигрупу, ється тим, що спосіб включає деацетилювання 2таку як феноксигрупа, нафтоксигрупа або тому (піримідин-2-ілгідроксиметил)ацетанілідної сполуподібне; атом галогену, такий як атом брому, атом ки, представленої наступною загальною формухлору, атом фтору, атом йоду або тому подібне; лою (5): або атом водню. Тому, як (піримідин-2-іл)-2-пропанонову сполуку, представлену загальною формулою (1), що використовується на стадії 1, потрібно особливо (5) згадати, наприклад, 1-(піримідин-2-іл)-2-пропанон, 1-(4,6-диметилпіримідин-2-іл)-2-пропанон, 1-(4,6диметоксипіримідин-2-іл)-2-пропанон, 1-(4,6(де R1, R2, R3, X і Υ мають такі ж визначення, диметокси-5-метилпіримідин-2-іл)-2-пропанон, 1як дані вище; і Ас є ацетильною групою). (4,6-диметокси-5-етилпіримідин-2-іл)-2-пропанон, Даний винахід детально описаний нижче. 1-(4,6-диметокси-5-нітропіримідин-2-іл)-2У способі згідно з даним винаходом, описаним пропанон, 1-(4,6-дихлорпіримідин-2-іл)-2у пункті [1] (в даному тексті термін "спосіб згідно з пропанон, 1-(4,6-диметокси-5даним винаходом" має одне і те ж значення, якщо етоксикарбонілпіримідин-2-іл)-2-пропанон і 1-(4,6не указано особливо), застосовують заміщену індіетоксипіримідин-2-іл)-2-пропанон. (Піримідин-2дольну сполуку, представлену загальною формуіл)-2-пропанонова сполука, представлена загальлою (3), як сирий матеріал. Вказана заміщена інною формулою (1), має таутомери, і будь-який з дольна сполука, представлена загальною таутомерів може бути використаний у способі згідформулою (3), може бути одержана взаємодією но з даним винаходом. Однак у даному описі стру(піримідин-2-іл)-2-пропанонової сполуки, предстактура сполуки зображена у вигляді 2вленої загальною формулою (1), з гідразиновою пропанонового похідного, як видно у загальній сполукою, представленою загальною формулою формулі (1), і назвою сполуки є 2-пропанонове (2), у присутності кислоти. Отже, спочатку описупохідне, як видно вище. ють стадію (стадія 1) одержання заміщеної індольВказані (піримідин-2-іл)-2-пропанонові сполуної сполуки, представленої загальною формуки, представлені загальною формулою (1), є відолою (3). мими сполуками або сполуками, які можуть бути Насамперед описані (піримідин-2-іл)-2одержані з сирого матеріалу, такого як 2пропанонова сполука, представлена загальною фенілсульфоніл-4,6-диметилпіримідин або тому формулою (1), і гідразинова сполука, представлеподібне, згідно зі способом, наприклад, [описаним на загальною формулою (2), які використовують як у публікації Chemical & Pharmaceutical Bulletin, сирі матеріали. p.152 (1982)]. (Піримідин-2-іл)-2-пропанонова споУ (піримідин-2-іл)-2-пропаноновій сполуці, лука, представлена загальною формулою (1), представленій загальною формулою (1), R1, R2 і R3 включає в себе нові сполуки, наприклад, 1-(4,6кожний може незалежно містити від 1 до 6 атомів диметоксипіримідин-2-іл)-2-пропанон, і дана сповуглецю (в даному тексті, атоми вуглецю, коли їх лука є сирим матеріалом, що використовується в кількість складає, наприклад, від 1 до 6 атомів одержанні заміщеної анілінової сполуки, представуглецю, представлені абревіатурою "С1-С6") і вленої загальною формулою (6). являти собою (С1-С6)алкільну групу з прямим або Тим часом, у загальній формулі (2) X і Υ кожрозгалуженим ланцюгом, таку як метильна група, ний незалежно може являти собою (С1етильна група, н-пропільна група, ізопропільна С6)алкільну групу з прямим або розгалуженим група, н-бутильна група, втор-бутильна група, ланцюгом, таку як метильна група, етильна група, трет-бутильна група, н-пентильна група, нн-пропільна група, ізопропільна група, н-бутильна гексильна група або тому подібне; (С1група, втор-бутильна група, трет-бутильна група, С6)алкоксигрупу з прямим або розгалуженим ланн-пентильна група, н-гексильна група або тому цюгом, таку як метоксигрупа, етоксигрупа, нподібне; (С1-С6) алкоксигрупу з прямим або розпропоксигрупа, ізопропоксигрупа або тому подібне; галуженим ланцюгом, таку як метоксигрупа, еток(С1-С6)алкоксі(С1-С6)алкільну групу з прямим або сигрупа, н-пропоксигрупа, ізопропоксигрупа або розгалуженим ланцюгом, таку як метоксиметильна тому подібне; (С1-С6)алкоксі(С1-С6)алкільну групу 19 76127 20 з прямим або розгалуженим ланцюгом, таку як Застосування кислоти Льюїса, такої як хлористий метоксиметильна група, метоксіетильна група, цинк, трифтористий бор або тому подібне, є переетоксіетильна група або тому подібне; (С1важним. Кількість кислоти, що застосовується на С6)галогеналкільну групу з прямим або розгалустадії, може бути будь-якою кількістю, оскільки женим ланцюгом, таку як фторметильна група, вона не розкладає утворену заміщену індольну дифторметильна група, трифторметильна, група сполуку, представлену загальною формулою (3); або тому подібне; карбоксильну групу; (С1однак кількість може складати від 0,001 до 10 моС6)алкоксикарбонільну групу з прямим або розгалей, переважно від 0,1 до 2 молей намоль гідралуженим ланцюгом, таку як метоксикарбонільна зинової сполуки, представленої загальною форгрупа, етоксикарбонільна група або тому подібне; мулою (2). атом галогену, такий як атом брому, атом хлору, Стадію 1 одержання заміщеної індольної споатом фтору, атом йоду або тому подібне; або атом луки, представленої загальною формулою (3), водню. можна виконати у достатній мірі навіть в умовах Тому, як гідразинову сполуку, представлену без розчинника, але можна провести з викорисзагальною формулою (2), що використовується на танням розчинника. Розчинник, що застосовується стадії 1, потрібно особливо згадати, наприклад, у даній реакції, може бути будь-яким розчинником, фенілгідразин, 2-метилфенілгідразин, 4за умови, що він не впливає на реакцію. У зв'язку з метилфенілгідразин, 2,4-диметилфенілгідразин, 2цим можна згадати, наприклад, ароматичні вуглеетилфенілгідразин, 4-етилфенілгідразин, 4водні, такі як толуол, ксилол, хлорбензол і тому ізопропілфенілгідразин, 2-метоксифенілгідразин, подібне; галогеновані аліфатичні вуглеводні, такі 4-метоксифенілгідразин, 2як дихлорметан, хлороформ і тому подібне; скламетоксиметилфенілгідразин, 4дні ефіри оцтової кислоти, такі як метил ацетат, метоксиметилфенілгідразин, 4етилацетат, бутилацетат і тому подібне; апротонні трифторметилфенілгідразин, 2-гідразинбензойну полярні розчинники, такі як диметилформамід, кислоту, 4-метоксикарбонілфенілгідразин і 2диметилацетамід, N-метилпіролідон, тетраметилхлорфенілгідразин. сечовина, гексаметилфосфотриамід (НМРА) і тому Гідразинова сполука, представлена загальною подібне; розчинники типу простого ефіру, такого як формулою (2), може знаходитись у вільній формі діетиловий ефір, тетрагідрофуран, діоксан і тому або у вигляді солі (наприклад, у вигляді хлоргідраподібне; і аліфатичні вуглеводні, такі як пентан, нту або сульфату). гексан і тому подібне. Ароматичні вуглеводні, такі Гідразинова сполука, представлена загальною як толуол і тому подібне, є переважними. Вказані формулою (2), є відомою сполукою або сполукою, розчинники можуть бути використані у вигляді одяка може бути одержана з відповідного сирого ного розчинника або у вигляді змішаного розчинаніліну згідно зі способом, [наприклад, описаним у ника з будь-яким складом суміші. Можна викориспублікації Journal of Organic Chemistry, тати будь-яку кількість розчинника, оскільки вона p.2849(1972)]. дозволяє достатнє перемішування реакційної сисУ зв'язку з цим, з гідразинових сполук, предтеми, але кількість звичайно складає від 0,5 до 20 ставлених загальною формулою (2), 2літрів, переважно від 1 до 10 літрів намоль гідраметоксиметилфенілгідразин є новою сполукою. зинової сполуки, представленої загальною форНа стадії 1 для одержання заміщеної індольної мулою (2). сполуки, представленої загальною формулою (3), Температура реакції, що застосовується на молярне співвідношення гідразинової сполуки, стадії 1 одержання заміщеної індольної сполуки, представленої загальною формулою (2), і (піриміпредставленої загальною формулою (3), складає, дин-2-іл)-2-пропанонової сполуки, представленої наприклад, від 0°С до температури флегми роззагальною формулою (1), може знаходитись на чинника, що використовується, переважно від будь-якому рівні для здійснення взаємодії між 0°Сдо120°С. двома сполуками. Однак (піримідин-2-іл)-2Особливого обмеження відносно часу провепропанонову сполуку, представлену загальною дення реакції, що використовується на стадії 1 формулою (1), використовують у кількості, наприодержання заміщеної індольної сполуки, предстаклад, звичайно від 0,5 до 3 молей, переважно 1-2 вленої загальною формулою (3), не існує, однак молей намоль гідразинової сполуки, представлепереважний час проведення реакції складає від ної загальною формулою (2). 0,5 години до 12 годин. На стадії 1 одержання заміщеної індольної Заміщена індольна сполука, представлена засполуки, представленої загальною формулою (3), гальною формулою (3), яка може бути одержана здійснюють із застосуванням кислоти. Як приклади на стадії 1, є новою сполукою і використовується кислоти, що використовується, можуть бути мінеяк проміжна сполука для сульфонанілідного похідральні кислоти, такі як хлористоводнева кислота, ного, яке, як відомо, володіє високою гербіцидною сірчана кислота і тому подібне; оцтові кислоти, такі активністю і є ефективним. як оцтова кислота, трифтороцтова кислота і тому Спосіб згідно з даним винаходом включає стаподібне; кислоти Льюїса, такі як хлористий цинк, дію (стадія 2) окислення індольного кільця у одертрифтористий бор і тому подібне; сульфонові кисжаної вище заміщеної індольної сполуки, предсталоти, такі як р-толуолсульфокислота і тому подібвленої загальною формулою (3), що приводить до не; фосфорні кислоти, такі як поліфосфорна кисрозкриття кільця з одержанням заміщеної ацетанілота і тому подібне; галогенні сполуки фосфору, лідної сполуки, представленої загальною формутакі як трихлористий фосфор і тому подібне; і кислі лою (4), а також стадії послідовної обробки ацетаіонообмінні смоли, такі як Amberlist і тому подібне. нілідної сполуки, представленої загальною 21 76127 22 формулою (4), за допомогою відновлення і деацегляді одного розчинника або у вигляді змішаного тилювання з одержанням кінцевого продукту, тоброзчинника будь-якого складу суміші. Може бути то заміщеної анілінової сполуки, представленої використана будь-яка кількість розчинника, за загальною формулою (6). Будь-яка з реакцій відумови, що вона забезпечує достатнє перемішуновлення і деацетилювання може бути проведена вання реакційної системи, але кількість звичайно першою. Тому, опис даний у наступному порядку, складає від 0,5 до 20 літрів, переважно від 1 до 10 після стадії 2 слідує стадія (стадія 3) взаємодії літрів намоль заміщеної індольної сполуки, предацетанілідної сполуки, представленої загальною ставленої загальною формулою (3). формулою (4), з переважним боргідридом натрію з Температура реакції на стадії 2 може складаодержанням 2-(піримідин-2ти, наприклад, від -20°С до температури флегми ілгідроксиметил)ацетанілідної сполуки, представрозчинника, що використовується, але переважленої загальною формулою (5), і стадія (стадія 4) ною є температура від -10°С до 60°С. деацетилювання амідного фрагмента 2Особливих обмежень відносно часу проведен(піримідин-2-ілгідроксиметил)ацетанілідної сполуня реакції на стадії 2 немає. Однак переважний ки, представленої загальною формулою (5), одерчас проведення реакції складає від 0,5 години до жаної на стадії 3, при цьому одержують кінцевий 12 годин. продукт, тобто заміщену анілінову сполуку, предЗаміщені ацетанілідні сполуки, представлені ставлену загальною формулою (6). загальною формулою (4), одержані на стадії 2, є Стадія 2 являє собою стадію окислення заміновими сполуками і застосовуються як проміжна щеної індольної сполуки, представленої загальсполука для сульфонанілідного похідного, яке заною формулою (3), одержаної на стадії 1, що пристосовують, як відомо, як гербіцид. водить до розкриття індольного кільця з Таким чином, може бути одержана заміщена одержанням заміщеної ацетанілідної сполуки, ацетанілідна сполука, представлена загальною представленої загальною формулою (4). У зв'язку формулою (4). з цим, у загальній формулі (3) R1, R2, R3, X і Υ маЯк ацетанілідну сполуку, представлену загають такі ж визначення, як дані вище. льною формулою (4), потрібно особливо згадати, Окислювачем, що застосовується на стадії 2, наприклад, 2-(4,6-диметоксипіримідин-2може служити озон; неорганічні перекиси, такі як ілкарбоніл)ацетанілід, 2-(4,6-диметоксипіримідинперекис водню і тому подібне; органічні перекиси, 2-ілкарбоніл)-6-метилацетанілід, 2-(4,6такі як надоцтова кислота, надбензойна кислота, диметоксипіримідин-2-ілкарбоніл)-6m-хлорнадбензойна кислота і тому подібне; окисетилацетанілід, 2-(4,6-диметоксипіримідин-2ли металів, такі як перманганат калію, перйодат ілкарбоніл)-6-метоксиметилацетанілід, 2-(4,6натрію, вольфрамат натрію, молібдат амонію і диметоксипіримідин-2-ілкарбоніл)-4тому подібне; і повітря. Переважним є озон. Вкаметилацетанілід, 2-(4,6-диметоксипіримідин-2зані окислювачі можуть забезпечити достатню ілкарбоніл)-4-етилацетанілід, 2-(4,6взаємодію навіть при використанні окислювачів у диметоксипіримідин-2-ілкарбоніл)-4вигляді одного окислювача, але можуть бути заметоксиметилацетанілід, 2-(4,6стосовані в будь-якому складі суміші. На стадії диметоксипіримідин-2-ілкарбоніл)-4окислення даного способу окислювач може викохлорацетанілід, 2-(4,6-диметоксипіримідин-2ристовуватись у будь-якій кількості, за умови, що ілкарбоніл)-6-хлорацетанілід, 2-(4,6окислювач не руйнує утворену заміщену ацетанідиметоксипіримідин-2-ілкарбоніл)-4лідну сполуку, представлену загальною формулою фторацетанілід і 2-(4,6-диметоксипіримідин-2(4), але звичайно кількість складає від 0,1 до 20 ілкарбоніл)-6-фторацетанілід. молей, переважно від 1 до 10 молей намоль заміЗаміщену ацетанілідну сполуку, представлену щеної індольної сполуки, представленої загальзагальною формулою (4), одержану на стадії 2, ною формулою (3). можна згодом використати на стадії 3 без виділенНа стадії 2 реакцію звичайно здійснюють з виня або очищення. Тобто, заміщену індольну спокористанням розчинника. Може бути використаний луку, представлену загальною формулою (3), підбудь-який розчинник, за умови, що він не впливає дають окисленню і розкриттю кільця на стадії 2 за на реакцію. У зв'язку з цим, потрібно згадати, надопомогою, наприклад, озону або тому подібного, і приклад, складні ефіри оцтової кислоти, такі як послідовно піддають відновленню на стадії З, опиметилацетат, етилацетат, бутилацетат і тому посаному пізніше, за допомогою переважно боргіддібне; галогеновані аліфатичні вуглеводні, такі як риду натрію в одній і тій же посудині; тим самим, 2дихлорметан, хлороформ і тому подібне; аромати(піримідин-2-ілгідроксиметил)ацетанілідна сполучні вуглеводні, такі як толуол, ксилол, хлорбензол і ка, представлена загальною формулою (5), може тому подібне; аліфатичні вуглеводні, такі як пенбути легко одержана і подальша обробка окислютан, н-гексан і тому подібне; апротонні полярні вача, що використовується, є також легкою. Тому, розчинники, такі як формамід, диметилформамід, з точки зору легкості проведення процесу, і так диметилацетамід і тому подібне; нітрили, такі як далі, переважно у промисловому масштабі застоацетонітрил і тому подібне; розчинники типу проссовувати спосіб, що включає в себе стадію такого того ефіру, такі як діетиловий ефір, тетрагідрофуокислення і розкриття кільця і стадію такого відноран, діоксан, диглим і тому подібне; спирти, такі як влення безперервно в одній і тій же посудині. метанол, етанол і тому подібне; карбонові кислоти, Стадія 3 являє собою стадію відновлення ацетакі як оцтова кислота і тому подібне; кетони, такі танілідної сполуки, представленої загальною фояк ацетон, метилізобутилкетон і тому подібне; і рмулою (4), переважно за допомогою боргідриду вода. Розчинники можуть бути використані у винатрію з одержанням 2-(піримідин-2 23 76127 24 ілгідроксиметил)ацетанілідної сполуки, представНа стадії 4 2-(піримідин-2леної загальною формулою (5). У цьому випадку, у ілгідроксиметил)ацетанілідну сполуку, представзагальній формулі (4) R1, R2, R3, X і Υ мають такі ж лену загальною формулою (5), одержану на стадії визначення, як дані вище. 3, піддають деацетилюванню амідного фрагмента На стадії 3 молярне співвідношення заміщеної з одержанням заданої кінцевої сполуки, тобто заацетанілідної сполуки, представленої загальною міщеної анілінової сполуки, представленої загальформулою (4), і боргідриду натрію може знаходиною формулою (6). У цьому випадку, в загальній тись на будь-якому рівні, однак кількість боргідриформулі (5) R1, R2, R3, X і Υ мають такі ж визнаду натрію може складати від 0,5 до 20 молей, печення, як дані вище. реважно від 1 до 10 молей намоль заміщеної Вказане деацетилювання переважно здійснюацетанілідної сполуки. ють з використанням основи у зв'язку зі стабільнісРеакцію на стадії 3 звичайно проводять з витю заданого продукту. користанням розчинника. Розчинник, що викорисЯк основу, що застосовується у реакції на статовується на стадії 3, може бути будь-яким роздії 4, потрібно згадати, наприклад, гідроокиси лужчинником, за умови, що він не впливає на реакцію. них металів, такі як гідроокис натрію, гідроокис У цьому зв'язку потрібно згадати, наприклад, арокалію і тому подібне; гідроокиси лужноземельних матичні вуглеводні, такі як толуол, ксилол, хлорметалів, такі як гідроокис барію і тому подібне; бензол і тому подібне; складні ефіри оцтової кискарбонати, такі як карбонат калію, карбонат натрію лоти, такі як метилацетат, етилацетат, і тому подібне; і органічні аміни, такі як 1,8бутилацетат і тому подібне; спирти, такі як метадіазабіцикло[5.4.0]ундец-7-ен і тому подібне. З нол, етанол, 1-пропанол, 2-пропанол, 1-бутанол і перерахованих основ переважними є гідроокиси тому подібне; апротонні полярні розчинники, такі лужних металів, такі як гідроокис натрію, гідроокис як диметилформамід, диметилацетамід і тому покалію і тому подібне. дібне; розчинники типу простого ефіру, такі як діеКількість основи, що використовується на статиловий ефір, тетрагідрофуран, діоксан і тому події 4, може знаходитись на будь-якому рівні, за дібне; аліфатичні вуглеводні, такі як пентан, нумови, що вона не руйнує утворену заміщену анігексан і тому подібне; поліетиленгліколі, такі як лінову сполуку, представлену загальною формуполіетиленгліколь (PEG)-400 і тому подібне; і воду. лою (6). Однак кількість звичайно складає від 0,1 Розчинники можуть бути використані у вигляді до 30 молей, переважно від 0,5 до 10 молей наодного розчинника або у вигляді змішаного розмоль 2-(піримідин-2-ілгідроксиметил)ацетанілідної чинника будь-якого складу суміші. Може бути висполуки, представленої загальною формулою (5). користана будь-яка кількість розчинника, за умови, Реакцію на стадії 4 можна здійснювати з викощо вона дозволяє достатнє перемішування реакристанням розчинника. Розчинник, який застосоційної системи, але кількість звичайно складає від вують на стадії 4, не є критичним, за умови, що він 0,5 до 20 літрів, переважно від 1 до 10 літрів нане погіршує взаємодію. У зв'язку з цим потрібно моль заміщеної ацетанілідної сполуки, представзгадати, наприклад, ароматичні вуглеводні, такі як леної загальною формулою (4). толуол, ксилол, хлорбензол і тому подібне; спирти, Температура реакції на стадії 3 може складатакі як метанол, етанол і тому подібне; апротонні ти, наприклад, від -15°С до температури флегми полярні розчинники, такі як диметилформамід, розчинника, що використовується, але переваждиметилацетамід і тому подібне; розчинники типу ною є температура від -5°С до 60°С. простого ефіру, такі як діетиловий ефір, тетрагідОсобливих обмежень відносно часу проведенрофуран, діоксан і тому подібне; аліфатичні вугленя реакції на стадії 3 немає, але переважним чаводні, такі як пентан, н-гексан і тому подібне; полісом проведення реакції є від 0,5 години до 24 гоетиленгліколі, такі як поліетиленгліколь (PEG)-400 дин. і тому подібне; і воду. Розчинники можуть бути У цьому випадку, на стадії 3 переважно виковикористані у вигляді одного розчинника або у ристати боргідрид натрію через стабільність реавигляді змішаного розчинника будь-якого складу генту, а також внаслідок того, що реагент викориссуміші. Може бути використана будь-яка кількість товують також для подальшої обробки розчинника, за умови, що забезпечується достатнє окислювача, що застосовується на стадії 2, який перемішування реакційної системи, але кількість здійснює окислювальне розкриття кільця заміщезвичайно складає від 0,5 до 20 літрів, переважно ної індольної сполуки. Однак відновлення на стадії від 1 до 10 літрів намоль 2-(піримідин-23 не обмежується тільки відновленням боргідриілгідроксиметил)ацетанілідної сполуки, представдом натрію і може бути проведене, наприклад, леної загальною формулою (5). шляхом каталітичного гідрування (як каталізатор Температура реакції на стадії 4 може складаможуть бути використані паладій на вугіллі [Pd/C], ти, наприклад, від -15°С до температури флегми платина на вугіллі [Pt/C], каталізатор Ренея (нарозчинника, що використовується, однак переважприклад, нікель Ренея) або металевий каталізано температура складає від -5°С до 100°С. тор, що звичайно використовується для каталітичЧас проведення реакції на стадії 4 не є суттєного відновлення), відновлення вим фактором, однак переважно він складає від літійалюмінійгідридом або відновлення дибора0,5 години до 24 годин. ном. Як описано раніше, будь-яка з реакцій віднов2-(Піримідин-2-ілгідроксиметил)ацетанілідна лення і деацетилювання ацетанілідної сполуки, сполука, представлена загальною формулою (5), представленої загальною формулою (4), може одержана на стадії 3, може як така бути викорисбути здійснена першою. Тому, далі описуються в тана на наступній стадії 4 без виділення. наступному порядку, стадія (стадія 0) деацетилю 25 76127 26 вання ацетанілідної сполуки, представленої загаколь (PEG)-400 і тому подібне. Вказані розчинники льною формулою (4), з одержанням аміносполуки, можуть бути використані у вигляді одного типу представленої загальною формулою (7), і стадія розчинника або у вигляді суміші двох або більше (стадія 6) відновлення аміносполуки, представлетипів розчинників. ної загальною формулою (7), з одержанням кінцеКоли реакцію на стадії 5 здійснюють з викоривого продукту, тобто заміщеної анілінової сполуки, станням спирту як розчинника, спирт може взаєпредставленої загальною формулою (6). модіяти з карбонільною групою заданого продукту Стадія 5 являє собою стадію проведення соі може бути утворена ацетальна сполука. У такому льволізу заміщеної ацетанілідної сполуки, предвипадку додають воду в присутності кислоти або ставленої загальною формулою (4), яка одержана реакційну суміш виливають у воду і перемішують на стадії 2, з використанням кислоти з одержанням протягом періоду часу від декількох хвилин до 48 аміносполуки, представленої загальною формугодин, тим самим видалення ацеталю можна легко лою (7). здійснити і заданий продукт може бути одержаний. Прикладами кислоти, що використовується на Може бути використана будь-яка кількість розстадії 5, можуть служити мінеральні кислоти, такі чинника, за умови, що розчинник дозволяє достатяк хлористоводнева кислота, сірчана кислота і нє перемішування реакційної системи, однак кільтому подібне; кислоти Льюїса, такі як трифторискість може складати від 0,5 до 5 літрів, переважно тий бор і тому подібне; оцтові кислоти, такі як оцвід 1 до 3 літрів намоль заміщеної ацетанілідної това кислота, трифтороцтова кислота і тому подісполуки, представленої загальною формулою (4). бне; сульфонові кислоти, такі як рТемпература реакції на стадії 5 може складатолуолсульфокислота і тому подібне; і кислі іонооти, наприклад, від 0°С до температури флегми бмінні смоли, такі як Amberlist і тому подібне. Перозчинника, що використовується і переважно реважними кислотами є хлористоводнева кислота складає від 0 до 120°С. або сірчана кислота. Час проведення реакції на стадії 5 не є суттєМоже бути використана будь-яка кількість кисвим, однак, переважно він складає від 0,5 години лоти, що використовується на стадії 5, за умови, до 24 годин. що вона не руйнує утворену аміносполуку, предСтадія 6 являє собою стадію відновлення одеставлену загальною формулою (7), однак кількість ржаної вище аміносполуки, представленої загалькислоти звичайно складає від 0,1 до 10 молей, ною формулою (7), за допомогою боргідриду напереважно від 0,5 до 5 молей намоль заміщеної трію з одержанням кінцевого продукту, тобто ацетанілідної сполуки, представленої загальною заміщеної анілінової сполуки, представленої загаформулою (4). льною формулою (6). Схема реакції і умови її проРеакцію на стадії 5 здійснюють у присутності ведення є приблизно такими, як на стадії 3. розчинника. Як розчинник можуть служити вода і Одержаний таким чином кінцевий продукт, С1-С6 спирти з прямим або розгалуженим ланцютобто заміщена анілінова сполука, представлена гом, такі як етанол, метанол і тому подібне. Кільзагальною формулою (6), стає важливим проміжкість розчинника може становити 1моль або більним продуктом у виробництві хімікатів для сільсьше намоль заміщеної ацетанілідної сполуки, кого господарства і лікарських препаратів. представленої загальною формулою (4), і може Крім того, даний винахід також надає нові спобути, наприклад, звичайно від 0,1 до 10 літрів, пелуки. реважно від 0,5 до 10 літрів намоль заміщеної Як описано раніше, з гідразинових сполук, ацетанілідної сполуки, представленої загальною представлених загальною формулою (2), 2формулою (4). Кількість розчинника розрізнюється метоксиметилфенілгідразин є новою сполукою і в залежності від типу і кількості кислоти, що викоможе бути одержаний з відповідного сирого аніліну ристовується на стадії 5, але може бути такою, що згідно, наприклад, зі способом, [описаним у публірН реакційної системи стає приблизно 4 або менкації Journal of Organic Chemistry, p.2849 (1972)]. ше, переважно 2 або менше, більш переважно 1 Крім того, з (піримідин-2-іл)-2-пропанонових або менше. сполук, представлених загальною формулою (1), Реакція на стадії 5 може протікати в достатній 1-(4,6-диметоксипіримідин-2-іл)-2-пропанон є номірі при використанні одного з вищеперелічених вою сполукою і може бути одержаний з сирого розчинників. Однак реакцію також можна здійснюматеріалу, такого як 2-фенілсульфоніл-4,6вати шляхом подальшого додавання іншого роздиметоксипіримідин, або тому подібного згідно, чинника. наприклад, зі способом, [описаним в публікації Розчинник, який використовують для додаванChemical & Pharmaceutical Bulletin, p.152 (1982)]. ня до реакційної суміші на стадії 5, може бути Дана сполука має таутомери, і всі таутомери будь-яким розчинником, за умови, що він не ославключені у даний винахід. бляє реакцію сольволізу на стадії 5. У зв'язку з Крім того, заміщена індольна сполука, предцим, потрібно згадати, наприклад, ароматичні вугставлена загальною формулою (3), є новою сполеводні, такі як толуол, ксилол, хлорбензол і тому лукою і може бути одержана за допомогою стадії подібне; апротонні полярні розчинники, такі як ди1. У даному випадку, в загальній формулі (3) R1, метилформамід, диметилацетамід і тому подібне; R2, R3, X і Υ мають такі ж визначення, як дані вирозчинники типу простого ефіру, такі як діетиловий ще. ефір, тетрагідрофуран, діоксан і тому подібне; У наступній таблиці 1 наведені приклади зааліфатичні вуглеводні, такі як пентан, н-гексан і міщеної індольної сполуки, представленої загальтому подібне; нітрили, такі як ацетонітрил і тому ною формулою (3). Однак сполука згідно з даним подібне; і поліетиленгліколі, такі як поліетиленглівинаходом не обмежується тільки вказаними при 27 76127 28 кладами і включає в себе всі сполуки, представлеілгідроксиметил)ацетанілідна сполука, представні загальною формулою (3). лена загальною формулою (5), також є новою споТим часом, символи, показані у таблиці 1, малукою і може бути одержана за допомогою стадії 3 ють наступні значення (те ж саме відноситься до [або прямо із заміщеної індольної сполуки, преднаступних таблиць). ставленої загальною формулою (3), без допомоги Me: метильна група заміщеної ацетанілідної сполуки, представленої Et: етильна група загальною формулою (4)]. У цьому випадку, у заMOM: метоксиметильна група гальній формулі (5) R1, R2, R3, X і Υ і Ас мають такі МеО: метоксигрупа ж визначення, як дані вище. ЕtO: етоксигрупа У наступній таблиці 3 наведені приклади 2і-Pr: ізопропільна група (піримідин-2-ілгідроксиметил)ацетанілідної сполуСООМе: метоксикарбонільна група ки, представленої загальною формулою (5). Однак NO2: нітрогрупа сполука згідно з даним винаходом не обмежується CF3: трифторметильна група вказаними прикладами і включає в себе всі сполуNHAc: ацетамідна група ки, представлені загальною формулою (5). Таблиця 1 Сполука X Υ R1 R2 No. 3-1 Η Η OMe Η 3-2 Me Η Me Η 3-3 Η Me OMe Η 3-4 Η Et Η Η 3-5 Me Me OMe ΝΟ2 3-6 Η МеО OMe Me 3-7 EtO Η OMe СООМе 3-8 Η MOM OMe Η 3-9 СІ Η OEt Η 3-10 Η F Η NHAc 3-11 Η COOH Cl Η 3-12 СООМе Η Η MOM 3-13 Me СООМе Η CF3 3-14 СІ Me OMe Η 3-15 i-Pr Η OMe Η 3-16 СІ Me OMe Η 3-17 і-Рr Η OMe Η 3-18 Η Et ОМе Η R3 OMe Me OMe Η OMe OMe OMe OMe OEt Η Cl Η Η OMe OMe OMe ОМе ОМе Точка плавлення (°С) 182-184 145-147 176-189 179-181 156-158 90-95 Крім того, заміщена ацетанілідна сполука, представлена загальною формулою (4), також є новою сполукою і може бути одержана за допомогою стадії 2. У даному випадку, у загальній формулі (3) R1, R2, R3, X і Υ і Ас мають такі ж визначення, як дані вище. У наступній таблиці 2 наведені приклади заміщеної ацетанілідної сполуки, представленої загальною формулою (4). Таблиця 2 Сполука No. 4-1 4-2 4-3 4-4 4-5 4-6 4-7 4-8 4-9 4-10 4-11 4-12 4-13 4-14 4-15 4-16 4-17 4-18 Крім X Υ R1 Η Η OMe Me Η Me Η Me OMe Η Et Η Me Me OMe Η MeO OMe EtO Η OMe Η MOM OMe СІ Η OEt Η F Η Η COOH Cl COOMe Η Η Me COOMe Η СІ Me OMe i-Pr Η OMe СІ Me OMe ОМе Η OMe Η Et OMe того, R2 R3 Η Η Η Η ΝΟ2 Me COOMe Η Η NHAc Η MOM CF3 Η Η Η Η Η OMe Me OMe Η OMe OMe OMe OMe OEt Η Cl Η Η OMe OMe OMe OMe OMe Точка плавлення (°С) 151-153 147-150 142-144 136-137 139-142 2-(піримідин-2 Таблиця 3 Сполука No. 5-1 5-2 5-3 5-4 5-5 5-6 5-7 5-8 5-9 5-10 5-11 5-12 5-13 5-14 5-15 5-16 5-17 X Υ Η Η Me Η Η Me Η Et Me Me Η MeO EtO Η Η MOM СІ Η Η F Η COOH COOMe Η Me COOMe СІ Me i-Pr Η СІ Η OMe Η R1 R2 R3 OMe Me OMe OMe OMe OMe OMe OMe OEt Η Cl Η Η OMe OMe OMe OMe Η Η Η Η ΝΟ2 Me COOMe Η Η NHAc Η MOM CF3 Η Η Η Η OMe Me OMe OMe OMe OMe OMe OMe OEt Η Cl Η Η OMe OMe OMe OMe Точка плавлення (°С) 143-147 79-82 121-123 122-125 Нижче наведений приклад схеми реакції одержання сульфонанілідної сполуки (яка може стати гербіцидом) із заміщеної анілінової сполуки, представленої загальною формулою (6), яку одержують зі сполуки, представленої загальною формулою (1), через сполуки різних загальних формул. Як показано у вищенаведеній схемі реакції, спосіб згідно з даним винаходом і сполука згідно з даним винаходом є вельми придатними для виробництва сульфонанілідної сполуки, яку використовують як ефективний інгредієнт гербіциду. Далі спосіб одержання сполуки згідно з даним винаходом описується більш конкретно за допомогою прикладів. У прикладах показник заломлення n20D вказує на те, що показник заломлення вимірювали при 20°С з використанням натрієвої D лінії. Газову хроматографію проводили, використовуючи колонку G-250 (40м), продукт компанії (Zai) Kagaku Busshitsu Hyoka Kenkyu Kiko (раніше, Kagakuhin Kensa Kyokai). Високоефективну рідинну хроматографію проводили, використовуючи колонку YMC-A312 (продукт К.К. YMC), і як елюент використали суміш ацетонітрил/0,05% розчин фосфорної кислоти. Приклад 1 Одержання 2-метоксиметилфенілгідразину 29 76127 30 У 50мл концентрованої хлористоводневої кис(широкий с, 1Н), 8,57 (д, 1Н). лоти розчиняли 6,86г (50ммоль) 2Приклад 4 (стадія 2) метоксиметиланіліну. Розчин охолоджували до Одержання 2(4,6-диметоксипіримідин-210°С. Крім того, до розчину додавали краплями ілкарбоніл)-6-етилацетаніліду розчин нітриту натрію (4,14г, 60ммоль), розчиненоУ реактор завантажували 0,7г (2,4ммоль) 3го у воді (50мл), при цьому температуру підтриму(4,6-диметоксипіримідин-2-іл)-2-метил-7вали від -10°С до 0°С. Потім додавали краплями етиліндолу і 10мл етилацетату. Потім впускали розчин 44,6г (235ммоль) двохлористого олова, озон при температурі від 0°С до 10°С протягом 2 розчиненого у концентрованій хлористоводневій годин. По закінченні реакції реакційну суміш нагрікислоті (50мл), при вказаній вище температурі вали до кімнатної температури і концентрували. У протягом 1 години. По закінченні додавання розрезультаті одержували 0,75г (2,3ммоль) 2-(4,6чину краплями перемішування виконували при диметоксипіримідин-2-ілкарбоніл)-6поступовому збільшенні температури приблизно етилацетаніліду. Вихід: 95%. Точка плавлення: від до 20°С. Потім додавали краплями 10% водний 139,3 до 142, 3°С. розчин гідроокису натрію для досягнення рН розМС m/е: 329 (М+) чину, рівного 14, після чого здійснювали екстракЯМP (CDCl3/TMS), δ (м.д.): цію толуолом. Толуольний шар промивали водою і 1,25 (τ, 3Н), 2,17 (с, ЗН), 2,69 (кв, 2Н), 3,95 (с, концентрували при зниженому тиску, використо6Н), 6,16 (с, 1H), від 7,2 до 7,3 (м, 1Н), від 7,4 до вуючи роторний випарник, з одержанням 5,40г 7,6 (м, 2Н), 8,95 (широкий с, 1Н). (35,5ммоль) рідкого 2Приклад 5 (стадія 3) метоксиметилфенілгідразину. Вихід: 71%. Одержання 2-(4,6-диметоксипіримідин-2МС т/е 152 (М+) ілгідроксиметил)-6-етилацетаніліду ЯМР (CDCl3/TMS), δ (м.д.): У реактор вміщували 1,0г (3,03ммоль) 2-(4,63,8 (с, 3Н), 4,46 (с, 2Н), від 7,1 до 7,4 (м, 7Н) диметоксипіримідин-2-ілкарбоніл)-6ІЧ (пластина NaCl, см-1): 3350 (NH) етилацетаніліду і 20мл етанолу. Вміст реактора Приклад 2 охолоджували до 5°С або нижче. Потім додавали Одержання 1-(4,6-диметоксипіримідин-2-іл)-20,13г (3,65ммоль) боргідриду натрію і перемішувапропанону 0 ли при тій же температурі протягом 1 години. ПоУ реактор вміщували 16,0г (0,4моль) 60% гідтім реакційну суміш нагрівали до кімнатної темпериду натрію, 400мл THF і 43,6г (0,2моль) 4,6ратури. По закінченні реакції додавали водний диметокси-2-метансульфонілпіримідину. Вміст розчин хлористого амонію і проводили екстракцію реактора нагрівали до 30°С. Крім того, у реактор етилацетатом. Органічний шар концентрували з додавали краплями 39,4 г (0,68моль) ацетону з одержанням 0,82г (2,48ммоль) 2-(4,6подальшим проведенням реакції протягом 2 годин. диметоксипіримідин-2-ілгідроксиметил)-6По закінченні реакції додавали 350мл води і проетилацетаніліду. Вихід: 82%. Точка плавлення: від водили екстракцію 500мл етилацетату. Етилаце143 до 147°С. татний шар концентрували. Концентрат піддавав МС m/е:331(М+) дистиляції при зниженому тиску з одержанням 8,8г ЯМР (CDCl3/TMS), δ (м.д.): (44,9ммоль) 1-(4,6-диметоксипіримідин-2-іл)-21,24 (τ, 3Н), 2,22 (с, ЗН), 2,64 (кв, 2Н), 3,97 (с, пропанону. Показник заломлення n20D: 1,5181. 6Н), 4,88 (д, 1H), 5,89 (д, 1Н), 5,95 (с, 1H), від 7,2 MC m/e: 196 (М+) до 7,5 (м, 3Н), 9,25 (широкий с, 1H). ЯМР (CDCl3/TMS), δ (м.д.): Приклад 6 (стадія 4) 2,03 (с), 2,26 (с), 3,86 (с), 3,91 (с, 6Н), 5,40 (с), Одержання 2-(4,6-диметоксипіримідин-25,73 (с), 5,91 (с, 1H). ілгідроксиметил)-6-етиланіліну Приклад 3 (стадія 1) У реактор вміщували 0,1г (0,30ммоль) 2-(4,6Одержання 3-(4,6-диметоксипіримідин-2-іл)-2диметоксипіримідин-2-ілгідроксиметил)-6метил-7-етиліндолу етилацетаніліду, 2мл метанолу і 2мл води. ПереУ реактор завантажували 2,4г (12,2ммоль) 1мішування здійснювали при 70°С протягом 6 го(4,6-диметоксипіримідин-2-іл)-2-пропанону, 1,7г дин. По закінченні реакції проводили високоефек(9,98ммоль) хлоргідрату 2-етилфенілгідразину, тивну рідинну хроматографію. У результаті 1,4г (10,2ммоль) хлористого цинку і 10мл толуолу одержували 2-(4,6-диметоксипіримідин-2з подальшим кип'ятінням із зворотним холодильілгідроксиметил)-6-етиланіліну з виходом 65%. ником протягом 2 годин. По закінченні реакції реаПриклад 7 (стадія 1) кційну суміш охолоджували до кімнатної темпераОдержання 3-(4,6-диметоксипіримідин-2-іл)-2тури. Крім того, додавали воду і етилацетат, і метил-7-метоксиметиліндолу фази розділяли. Етилацетатний шар концентруваУ реактор завантажували 6,2г (31,6ммоль) 1ли. Концентрат піддавали розділенню за допомо(4,6-диметоксипіримідин-2-іл)-2-пропанону, 4,8г гою колонкової хроматографії на силікагелі (роз(31,5ммоль) 2-метоксиметилфенілгідразину, 4,76г чинник для розділення: суміш н-гексан/етилацетат) (34,9ммоль) хлористого цинку і 60мл толуолу. Рез одержанням 2,38г (8,01ммоль) 3-(4,6акційну суміш кип'ятили із зворотним холодильнидиметоксипіримідин-2-іл)-2-метил-7-етиліндолу. ком протягом 2 годин. По закінченні реакції реакВихід: 80,3%. Точка плавлення: від 90,3 до 94,8°С. ційну суміш охолоджували до кімнатної МС m/е: 297 (М+) температури. Потім додавали воду і етилацетат, і ЯМР (CDCl3/TMS), δ (м.д.): фази розділяли. Етилацетатний шар концентрува1,38 (τ, 3Н), 2,87 (кв, 2Н), 2,96 (с, 3Н), 4,08 (с, ли. Утворені кристали промивали діізопропіловим 6Н), 5,85 (с, 1Н), 7,03 (д, 1Н), 7,18 (τ, 1H), 8,18 ефіром з одержанням 4,57г (14,6ммоль) 3-(4,6 31 76127 32 диметоксипіримідин-2-іл)-2-метил-7кип'ятінням із зворотним холодильником протягом метоксиметиліндолу. Вихід: 46%. 1 години. Реакційну суміш залишали охолоджуваМС m/е:313(М+) тись, і потім додавали етилацетат і воду, щоб розЯМР (CDCl3/TMS), δ (м.д.): чинити всю реакційну суміш. Маслянистий шар 2,95 (с, 3Н), 3,34 (с, ЗН), 4,06 (с, 6Н), 4,74 (с, промивали водою, відділяли і сушили над сіллю 2Н), 5,81 (с, 1Н), від 7,0 до 7,1 (м, 3Н), 8,65 (д, 1H). Глаубера. Утворений маслянистий шар концентОдержаний 3-(4,6-диметоксипіримідин-2-іл)-2рували при зниженому тиску з одержанням тверметил-7-метоксиметиліндол може бути використадої речовини оранжевого кольору. Тверду речовиний у реакції на стадії 2 на основі прикладу 4. ну перекристалізовували з метанолу з Приклад 8 (стадія 2) одержанням 1,37г (5,1ммоль) 3-(4,6Одержання 2-(4,6-диметоксипіримідин-2диметоксипіримідин-2-іл)-2-метиліндолу. Вихід: ілкарбоніл)-6-метоксиметил ацетаніліду 62%. Точка плавлення: від 182 до 184°С. У реактор вміщували 1,0г (31,9ммоль) 3-(4,6МС m/е: 269 (М+) диметоксипіримідин-2-іл)-2-метил-7ЯМР (CDCl3/TMS), δ (м.д.): метоксиметиліндолу і 40мл етилацетату. У вказану 2,94 (с, 3Н), 4,06 (с, 6Н), 5,81 (с, 1Н), 7,1 (м, суміш впускали озон при температурі від 0°С до 2H), 7,3 (м, 1H), 8,7 (м, 1Н) 10°С протягом 4 годин. По закінченні реакції вміст ІЧ (KВr, см-1): 3490 (NH), 1570 реактора нагрівали до кімнатної температури і Одержаний 3-(4,6-диметоксипіримідин-2-іл)-2концентрували. Залишок піддавали колонковій метиліндол може бути використаний у реакції на хроматографії на силікагелі (розчинник для роздістадії 2 згідно з прикладом 4 або прикладом 8. лення: суміш н-гексан/етилацетат) з одержанням Приклад 11 (стадія 2) 0,40г (11,6ммоль) 2-(4,6-диметоксипіримідин-2Одержання 2-(4,6-диметоксипіримідин-2ілкарбоніл)-6-метоксиметилацетаніліду. Точка ілкарбоніл)ацетаніліду плавлення: від 147 до 150°С. Вихід: 36,4%. У реактор завантажували 0,8г (3,0ммоль) 3МС m/е: 345 (М+) (4,6-диметоксипіримідин-2-іл)-2-метиліндолу, 30мл ЯМР (CDCl3/TMS), δ (м.д.): ацетону і 8мл води. Потім додавали 1,5г 2,13 (с, 3Н), 3,39 (с, 3Н), 3,94 (с, 6Н), 4,47 (с, (9,9ммоль) перманганату калію і 2,29г (10,7ммоль) 2Н). 6,15 (с, 1H), 7,26 (τ, 1H), 7,60 (д, 2H), 7,63 (д, перйодату натрію, і взаємодію здійснювали при 1H), 9,29 (широкий, 1Н). кімнатній температурі протягом 12 годин. По закінОдержаний 2-(4,6-диметоксипіримідин-2ченні реакції суміш фільтрували. Фільтрат піддаілкарбоніл)-6-метоксиметилацетанілід може бути вали екстрагуванню етилацетатом. Етилацетатний використаний у реакції на стадії 3 згідно з приклашар концентрували. Залишок промивали ізопропідом 5. ловим ефіром з одержанням 0,57г (1,9ммоль) 2Приклад 9 (безперервна процедура на стадії 3 (4,6-диметоксипіримідин-2-ілкарбоніл)ацетаніліду. і стадії 4 в одному і тому ж реакторі) Вихід: 63%. Одержання 2-(4,6-диметоксипіримідин-2МС m/е:301(М+) ілкарбоніл)-6-метоксиметиланіліну ЯМР (CDCl3/TMS), δ (м.д.): У реактор вміщували 1,0г (2,9ммоль) 2-(4,62,28 (с, 3Н), 3,96 (с, 6Н), 6,16 (с, 1H), 7,06 (т, диметоксипіримідин-2-ілкарбоніл)-61H), 7,27 (широкий, 1Н), 7,59 (д, 1Н), 8,78 (д, 1Н) метоксиметилацетаніліду і 20мл етанолу з подаІЧ (KВr, см-1): 3270 (NH), 1700, 1660 (С=О) льшим охолоджуванням до 5°С або нижче. Потім у Одержаний 2-(4,6-диметоксипіримідин-2реактор вміщували 0,5г (13,5ммоль) боргідриду ілкарбоніл)ацетанілід може бути використаний у натрію. Перемішування виконували при тій же тереакції на стадії 3 згідно з прикладом 5 або прикмпературі протягом 1 години. Потім суміш нагріваладом 9. ли до кімнатної температури. По закінченні реакції Приклад 12 (стадія 1) додавали водний розчин хлористого амонію і проОдержання 3-(4,6-диметоксипіримідин-2-іл)водили екстракцію етилацетатом. Органічний шар 2,7-диметиліндолу концентрували. До залишку додавали 20мл води і У 20мл толуолу розчиняли 0,77г (3,9ммоль) 10,4г (7,1ммоль) гідроокису калію з подальшим пе(4,6-диметоксипіримідин-2-іл)-2-пропанону і 0,69г ремішуванням при 70°С протягом 2 годин. По за(4,3ммоль) хлоргідрату 2-метилфенілгідразину. До кінченні реакції реакційну суміш охолоджували до розчину додавали 0,64г (4,7ммоль) хлористого кімнатної температури і додавали 50мл етилацецинку з подальшим кип'ятінням із зворотним холотату і 50мл води для здійснення екстракції. Оргадильником протягом 2 годин. Реакційну суміш занічний шар концентрували і концентрат піддавали лишали охолоджуватись, і потім додавали етилаколонковій хроматографії на силікагелі (розчинник цетат і воду, щоб розчинити всю реакційну суміш. для розділення: суміш н-гексан/етилацетат) з одеМаслянистий шар промивали водою, відділяли і ржанням 0,35г (1,48ммоль) 2-(4,6сушили над сіллю Глаубера. Маслянистий шар, диметоксипіримідин-2-ілгідроксиметил)-6що утворився, концентрували при зниженому тисметоксиметиланіліну. Вихід: 51%. ку, використовуючи роторний випарник, з одерПриклад 10 (стадія 1) жанням твердої речовини оранжевого кольору. Одержання 3-(4,6-диметоксипіримідин-2-іл)-2Тверду речовину обробляли сумішшю етилацеметиліндолу тат/н-гексан з одержанням 0,38г (1,34ммоль) 3В 10мл толуолу розчиняли 1,61г (8,2ммоль) 1(4,6-диметоксипіримідин-2-іл)-2,7-диметиліндолу. (4,6-диметоксипіримідин-2-іл)-2-пропанону і 1,08г Вихід: 34%. Точка плавлення: від 145 до 147°С. (10ммоль) фенілгідразину. До розчину додавали МС m/е: 283 (М+) 1,36г (10ммоль) хлористого цинку з подальшим ЯМР (CDCl3/TMS), δ (м.д.): 33 76127 34 2,47 (с, 3Н), 2,90 (с, 3Н), 4,05 (с, 6Н), 5,83 (с, ратури і концентрували. Залишок піддавали газо1H), 6,98 (д, 1H), 7,13 (т, 1H), 8,15 (д, 1Н), 8,50 (д, вій хроматографії. У результаті одержували 2-(4,61H) диметоксипіримідин-2-ілкарбоніл)-6ІЧ (см-1): 3350 (NH) метилацетанілід з виходом 63%, виходячи з його Одержаний 3-(4,6-диметоксипіримідин-2-іл)частки від загальної площі піків. 2,7-диметиліндол може бути використаний у реакПриклад 17 (стадія 2) ції на стадії 2 згідно з прикладом 4 або прикладом Одержання 2-(4,6-диметоксипіримідин-28 або прикладом 12. ілкарбоніл)-6-етилацетаніліду Приклад 13 (стадія 2) У реактор вміщували 0,5г (1/7ммоль) 3-(4,6Одержання 2-(4,6-диметоксипіримідин-2диметоксипіримідин-2-іл)-2-метил-7-етиліндолу, ілкарбоніл)ацетаніліду 10мл ацетону і 5мл води. У реактор додавали пеУ реактор вміщували 1,0г (3,7ммоль) 3-(4,6рманганат калію і перйодат натрію і перемішували диметоксипіримідин-2-іл)-2-метиліндолу, 30мл при кімнатній температурі для здійснення взаємоацетону і 15мл води. У реактор додавали 3,0г дії. Реакційну суміш піддавали газовій хроматог(19ммоль) перманганату калію, і взаємодію здійсрафії. У результаті одержували 2-(4,6нювали при кімнатній температурі протягом 12 диметоксипіримідин-2-ілкарбоніл)-6годин. По закінченні реакції реакційну суміш піддаетилацетанілід з виходом 47%, виходячи з його вали газової хроматографії. У результаті одержучастки від загальної площі піків. вали 2-(4,6-диметоксипіримідин-2Приклад 18 (стадія 3) ілкарбоніл)ацетаніліду з виходом 74%, виходячи з Одержання 2-(4,6-диметоксипіримідин-2його частки від загальної площі піків. ілгідроксиметил)-6-метоксиметилацетаніліду Приклад 14 (стадія 2) У реактор вміщували 1,7г (4,9ммоль) 2-(4,6Одержання 2-(4,6-диметоксипіримідин-2диметоксипіримідин-2-ілкарбоніл)-6ілкарбоніл)-6-метилацетаніліду метоксиметилацетаніліду і 20мл етанолу. Вміст У реактор вміщували 283мг (1,0ммоль) 3-(4,6реактора охолоджували до 5°С або нижче. У реакдиметоксипіримідин-2-іл)-2,7-диметиліндолу і тор додавали 0,4г (10,8ммоль) боргідриду натрію, і 15мл ацетону. У реактор додавали 790мг суміш перемішували при тій же температурі протя(5,0ммоль) перманганату калію і 214мг (1,0ммоль) гом 1 години для здійснення взаємодії. Потім суперйодату натрію, і взаємодію здійснювали протяміш нагрівали до кімнатної температури. По закінгом 12 годин. По закінченні реакції реакційну суміш ченні реакції додавали водний розчин хлористого фільтрували. Фільтрат екстрагували етилацетаамонію і здійснювали екстрагування етилацетатом. Етилацетатний шар концентрували. Залишок том. Органічний шар концентрували з одержанням промивали ізопропіловим ефіром з одержанням 1,32г (3,8ммоль) 2-(4,6-диметоксипіримідин-280мг (0,25ммоль) 2-(4,6-диметоксипіримідин-2ілгідроксиметил)-6-метоксиметилацетаніліду. Виілкарбоніл)-6-метилацетаніліду. Вихід: 25%. Точка хід: 78%. Точка плавлення: від 19 до 82°С. плавлення: від 151 до 153°С. МС m/е: 347 (М+) + МС m/е: 315 (M ) ЯМР (CDCl3/TMS), δ (м.д.): ЯМР (CDCl3/TMS), δ (м.д.): 2,24 (с, 3Н), 3,38 (с, 3Н), 3,97 (с, 6Н), 4,45 (кв, 2,47 (с, 3Н), 2,90 (с, 3Н), 4,05 (с, 6Н), 5,83 (с, 2Н), 4,87 (д, 1Н), 5,90 (д, 1H), від 7,2 до 7,3 (м, 1H), 1H), 6,98 (д, 1Н), 7,13 (т, 1H), 8,15 (широкий, 1H), 7,46 (д, 2Н), 9,41 (широкий с, 1H). 8,50 (д, 1Н). Одержаний 2-(4,6-диметоксипіримідин-2Одержаний 2-(4,6-диметоксипіримідин-2ілгідроксиметил)-6-метоксиметилацетанілід може ілкарбоніл)-6-метилацетанілід може бути викорисбути використаний у реакції на стадії 4 згідно з таний у реакції на стадії 3 згідно з прикладом 5 або прикладом 6. прикладом 9. Приклад 19 (безперервна процедура на стадії Приклад 15 (стадія 2) 2 і стадії 3 в одному і тому ж реакторі) Одержання 2-(4,6-диметоксипіримідин-2Одержання 2-(4,6-диметоксипіримідин-2ілкарбоніл)ацетаніліду ілгідроксиметил)-6-етилацетаніліду У реактор вміщували 0,27г (10ммоль) 3-(4,6У реактор вміщували 1,0г (3,37ммоль) 3-(4,6диметоксипіримідин-2-іл)-2-метиліндолу і 10мл диметоксипіримідин-2-іл)-2-метил-7-етиліндолу і етилацетату. Потім впускали озон при температурі 20мл етилацетату. Вміст реактора охолоджували від 0°С до 10°С протягом 3 годин. По закінченні до 5°С або нижче .Потім впускали озон при темпереакції реакційну суміш нагрівали до кімнатної ратурі від 0°С до 10°С протягом 2 годин. По закінтемператури і концентрували. Залишок піддавали ченні реакції додавали 20мл етанолу. Крім того, газовій хроматографії. У результаті одержували 2додавали 0,25г (6,76ммоль) боргідриду натрію і (4,6-диметоксипіримідин-2-ілкарбоніл)ацетанілід з перемішували протягом 1 години. По закінченні виходом 88%, виходячи з його частки від загальної реакції реакційну суміш нагрівали до кімнатної площі піків. температури. Для проведення екстрагування доПриклад 16 (стадія 2) давали водний розчин хлористого амонію і етилаОдержання 2-(4,6-диметоксипіримідин-2цетат. Органічний шар концентрували, і концентілкарбоніл)-6-метилацетаніліду рат піддавали колонковій хроматографії на У реактор вміщували 3-(4,6силікагелі (розчинник для розділення: суміш ндиметоксипіримідин-2-іл)-2,7-диметиліндол і етигексан/етилацетат) з одержанням 0,26г лацетат. Потім впускали озон при температурі від (0,79.ммоль) 2-(4,6-диметоксипіримідин-20°С до 10°С протягом 3 годин. По закінченні реакілгідроксиметил)-6-етилацетаніліду. Вихід: 27,4%. ції реакційну суміш нагрівали до кімнатної темпеОдержаний 2-(4,6-диметоксипіримідин-2 35 76127 36 ілгідроксиметил)-6-етилацетанілід може бути виз подальшим кип'ятінням із зворотним холодилькористаний у реакції на стадії 4 згідно з приклаником протягом 1 години. По закінченні реакції дом 6. реакційну суміш підлуговували гідроокисом натрію, Приклад 20 (безперервна процедура на стадії після чого проводили екстрагування етилацета3 і стадії 4 в одному і тому ж реакторі) том. Етилацетатний шар концентрували. Залишок Одержання 2-(4,6-диметоксипіримідин-2піддавали газовій хроматографії. У результаті буілгідроксиметил)-6-метоксиметиланіліну ло підтверджене утворення 2-(4,6У реактор вміщували 1,0г (2,9ммоль) 2-(4,6диметоксипіримідин-2-ілкарбоніл)аніліну. Перетдиметоксипіримідин-2-ілкарбоніл)-6ворення: 100% (виходячи з його частки від загальметоксиметилацетаніліду, одержаного відповідно ної площі піків при газовій хроматографії). до прикладу 8, і 20мл етанолу. Вміст реактора Приклад 23 (стадія 5) охолоджували до 5°С або нижче. У реактор додаОдержання 2-(4,6-диметоксипіримідин-2вали 0,5г (13,5ммоль) боргідриду натрію з подаілкарбоніл)-6-метоксиметиланіліну льшим перемішуванням при тій же температурі У реакторі змішували 50мл метанолу і 10мл протягом 1 години. Потім суміш нагрівали до кімконцентрованої сірчаної кислоти. У реактор доданатної температури. По закінченні реакції додававали 1,0г (2,9ммоль) 2-(4,6-диметоксипіримідин-2ли водний розчин хлористого амонію і здійснюваілкарбоніл)-6-метоксиметилацетаніліду з подальли екстрагування етилацетатом. Органічний шар шим кип'ятінням із зворотним холодильником при концентрували. До залишку додавали 20мл мета65°С протягом 4 годин. Потім реакційну суміш занолу і 1,5г (26,8ммоль) гідроокису калію. Суміш лишали охолоджуватись до кімнатної температуперемішували при 70°С протягом 2 годин. По зари. Потім додавали 50мл води і перемішували при кінченні реакції реакційну суміш охолоджували до температурі приблизно 20°С протягом ночі. По кімнатної температури і додавали 50мл етилацезакінченні реакції реакційну суміш виливали у воду тату і 50мл води для проведення екстрагування. і проводили екстрагування етилацетатом. ЕтилаОрганічний шар концентрували. Концентрат піддацетатний шар концентрували. Залишок піддавали вали колонковій хроматографії на силікагелі (розколонковій хроматографії з одержанням 0,30г чинник для розділення: суміш н-гексан/етилацетат) (1ммоль) 2-(4,6-диметоксипіримідин-2-ілкарбоніл)з одержанням 0,24г (0,79ммоль) 2-(4,66-метоксиметиланіліну. Вихід: 34%. диметоксипіримідин-2-ілгідроксиметил)-6Приклад 24 (безперервна процедура на стадії метоксиметиланіліну. Вихід: 27,1%. 2 і стадії 5 в одному і тому ж реакторі) ЯМР (CDCl3/TMS), δ (м.д.): Одержання 2-(4,6-диметоксипіримідин-23,31 (с, 3Н), 3,94 (с, 6Н), 4,51 (дд, 2Н), 4,66 ілкарбоніл)аніліну (широкий с, 1Н), 5,15 (широкий с, 2Н), 5,84 (с, 1Н), У реактор вміщували 0,60г (22ммоль) 3-(4,65,93 (с, 1H), 6,71 (т, 1Н), від 6,7 до 6,8 (м, 1Н), від диметоксипіримідин-2-іл)-2-метиліндолу і 20мл 6,9 до 7,1 (м, 1Н), від 7,2 до 7,3 (м, 1H). етилацетату. У реактор впускали озон при темпеПриклад 21 (безперервна процедура на стадії ратурі від 0°С до 10°С протягом 4 годин. Для підт2 і стадії 3 в одному і тому ж реакторі) вердження зникнення 3-(4,6-диметоксипіримідинОдержання 2-(4,6-диметоксипіримідин-22-іл)-2-метиліндолу і завершення реакції проводиілгідроксиметил)-6-метоксиметилацетаніліду ли тонкошарову хроматографію. Потім реакційну У реактор вміщували 1,0г (3,19ммоль) 3-(4,6суміш нагрівали до кімнатної температури і концедиметоксипіримідин-2-іл)-2-метил-7нтрували. До концентрату додавали 20мл метанометоксиметиліндолу і 20мл етилацетату. Вміст лу і 5мл 6 N хлористоводневої кислоти і нагрівали реактора охолоджували до 5°С або нижче. Потім із зворотним холодильником протягом 1 години. впускали озон при температурі від 0°С до 10°С По закінченні реакції реакційну суміш охолоджувапротягом 3 годин. По закінченні реакції додавали ли до кімнатної температури. Потім додавали 20мл етанолу. Крім того, додавали 0,5г 100мл води. Суміш підлуговували водним розчи(13,5ммоль) боргідриду натрію з подальшим переном гідроокису натрію, і проводили екстрагування мішуванням протягом 1 години. По закінченні реаетилацетатом. Органічний шар концентрували. кції реакційну суміш нагрівали до кімнатної темпеКонцентрат піддавали колонковій хроматографії з ратури, і додавали водний розчин хлористого одержанням 0,26г (10ммоль) 2-(4,6амонію і етилацетат для проведення екстрагувандиметоксипіримідин-2-ілкарбоніл)аніліну. ня. Органічний шар концентрували. Концентрат Вихід: 46%. піддавали колонковій хроматографії з одержанням МС m/е: 259 (М+) 0,18г (0,52ммоль) 2-(4,6-диметоксипіримідин-2ЯМР (CDCl3/TMS), δ (м.д.): ілгідроксиметил)-6-метоксиметилацетаніліду. Ви3,99 (с, 6Н), 6,18 (с, 1H), 6,42 (широкий, 2H), хід: 16,3%. від 6,5 до 6,6 (м, 1H), 6,70 (д, 1Н), від 7,2 до 7,3 (м, Одержаний 2-(4,6-диметоксипіримідин-21Н), 7,40 (д, 1Н). ілгідроксиметил)-6-метоксиметилацетанілід може Приклад 25 (стадія 1) бути використаний у реакції на стадії 4 відповідно Одержання 5-хлор-3-(4,6-диметоксипіримідиндо прикладу 6. 2-іл)-2-метиліндолу Приклад 22 (стадія 5) До 80мл толуолу додавали 8,0г (40ммоль) 1Одержання 2-(4,6-диметоксипіримідин-2(4,6-диметоксипіримідин-2-іл)-2-пропанону і 7,9г ілкарбоніл)аніліну (44ммоль) хлоргідрату 4-хлорфенілгідразину. До У реактор вміщували 0,57г (1,9ммоль) 2-(4,6суміші додавали 6,54г (48ммоль) хлористого циндиметоксипіримідин-2-ілкарбоніл)ацетаніліду, ку. Потім суміш кип'ятили із зворотним холодиль10мл метанолу і 5мл 6N хлористоводневої кислоти ником протягом 2 годин. Реакційну суміш залиша 37 76127 38 ли охолоджуватись. Потім додавали етилацетат і (44ммоль) хлоргідрату 4-метоксифенілгідразину. воду, щоб розчинити всю реакційну суміш. ОрганіДо суміші додавали 6,0г (44ммоль) хлористого чний шар промивали водою, відділяли і сушили цинку. Потім реакційну суміш кип'ятили із зворотнад сіллю Глаубера. Відділений органічний шар ним холодильником протягом 2 годин. Реакційну концентрували при зниженому тиску, використосуміш залишали охолоджуватись. До реакційної вуючи роторний випарник, з одержанням 10,2г суміші додавали етилацетат і воду, щоб розчинити (33,7ммоль) 5-хлор-3-(4,6-диметоксипіримідин-2всю реакційну суміш. Маслянистий шар промивали іл)-2-метиліндолу. Вихід: 84%. Точка плавлення: водою, відділяли і сушили над сіллю Глаубера. від 179 до 18ГС. Відділений органічний шар концентрували при МС m/е: 303 (М+) зниженому тиску, використовуючи роторний випаЯМР (CDCl3/TMS), δ (м.д.): рник, з одержанням 8,0г (26,7ммоль) 3-(4,62,91 (с, 3Н), 4,04 (с, 6Н), 5,82 (с, 1Н), 7,1 (м, диметоксипіримідин-2-іл)-5-метокси-2-метиліндолу 1H), 7,3 (м, 1H), 8,7 (м, 1Н) у вигляді твердої речовини оранжевого кольору. ІЧ (KВr, см-1): 3510 (NH), 1580 Вихід: 67%. Крім того, здійснювали перекристаліПриклад 26 (стадія 2) зацію з толуолу. Точка плавлення: від 182 до Одержання 4-хлор-2-(4,6-диметоксипіримідин184°С. 2-ілкарбоніл)ацетаніліду МС m/е: 299 (M+) У реактор вміщували 6,1г (20ммоль) 5-хлор-3ЯМР (CDCl3/TMS), δ (м.д.): (4,6-диметоксипіримідин-2-іл)-2-метиліндолу, 2,87 (с, 3Н). 3,89 (с, 3Н), 4,07 (с, 6Н), 5,84 (с, 200мл ацетону і 100мл води. У реактор додавали 1Н), 6,9 (м, 1Н), 7,2 (м, 1Н). 8,2 (широкий, 1Н), 8,7 19,0г (120ммоль) перманганату калію і 8,6г (с, 1H). (40ммоль) перйодиту натрію. Реакцію здійснювали ІЧ (см-1): 3340 (NH), 1570. при кімнатній температурі протягом 16 годин. По Приклад 29 (стадія 2) закінченні реакції проводили фільтрування. ФільтОдержання 2-(4,6-диметоксипіримідин-2рат екстрагували етилацетатом. Етилацетатний ілкарбоніл)-4-метоксіацетаніліду шар концентрували. Концентрат очищали колонУ реактор вміщували 6,0г (20ммоль) 3-(4,6ковою хроматографією на силікагелі (суміш ндиметоксипіримідин-2-іл)-5-метокси-2гексан/етилацетат =4/1) з одержанням 1,8г метиліндолу, 200мл ацетону і 100мл води. У реак(5,4ммоль) 4-хлор-2-(4,6-диметоксипіримідин-2тор додавали 19,0г (120ммоль) перманганату каілкарбоніл)ацетаніліду. Вихід: 27%. Точка плавлію і 8,6г (40ммоль) перйодату натрію. Взаємодію лення: від 142 до 144°С. здійснювали при кімнатній температурі протягом МС m/е: 335 (М+) 16 годин. По закінченні реакції проводили фільтЯМР (CDCl3/TMS), δ (м.д.): рування. Фільтрат екстрагували етилацетатом. 2,27 (с, 3Н), 3,98 (с, 6Н), 6,20 (с, 1Н), 7,56 (кв, Етилацетатний шар концентрували. Залишок очи1H), 7,69 (м, 1H), 8,76 (д, 1Н) щали колонковою хроматографією на силікагелі ІЧ (KВr, см-1): 3320 (NH), 1700,1660 (C=O) (суміш н-гексан/етилацетат =4/1) з одержанням Приклад 27 (стадія 3) 0,9г (2,7ммоль) 2-(4,6-диметоксипіримідин-2Одержання 4-хлор-2-(4,6-диметоксипіримідинілкарбоніл)-4-метоксіацетаніліду. Вихід: 14%. 2-ілгідроксиметил)ацетаніліду МС m/е: 331 (М+) У реактор вміщували 1,00г (3,0ммоль) 4-хлорЯМР (CDCl3/TMS), δ (м.д.): 2-(4,6-диметоксипіримідин-22,25 (с, 3Н), 3,74 (с, 3Н), 3,96 (с, 6Н), 6,17 (с, ілкарбоніл)ацетаніліду і 20мл етанолу. Вміст реак1Н), від 7,1 до 7,2 (м, 2Н), 8,7 (д, 1Н) тора охолоджували до 5°С або нижче. У реактор ІЧ (см-1): 3250 (NH), 1690, 1650 (С=О). додавали 0,25г (6,6ммоль) боргідриду натрію. СуПриклад 30 (стадія 3) міш перемішували при тій же температурі протяОдержання 2-(4,6-диметоксипіримідин-2гом 1 години. Потім температуру підвищували до ілгідроксиметил)-4-метоксіацетаніліду кімнатної температури. По закінченні реакції додаУ реактор вміщували 0,66г (2,0ммоль) 2-(4,6вали водний розчин хлористого амонію і проводидиметоксипіримідин-2-ілкарбоніл)-4ли екстрагування етилацетатом. Органічний шар метоксіацетаніліду і 10мл етанолу. Вміст реактора концентрували. Концентрат очищали колонковою охолоджували до 5°С або нижче. У реактор додахроматографією на силікагелі (суміш нвали 0,17г (4,4ммоль) боргідриду натрію. Суміш гексан/етилацетат =1/1) з одержанням 0,69г перемішували при тій же температурі протягом 1 (2,0ммоль) 4-хлор-2-(4,6-диметоксипіримідин-2години. Потім суміш нагрівали до кімнатної темпеілгідроксиметил)ацетаніліду. Вихід: 68%. Точка ратури. По закінченні реакції додавали водний плавлення: від 121 до 123°С. розчин хлористого амонію і проводили екстрагуЯМР (CDCl3/TMS), δ (м.д.): вання етилацетатом. Органічний шар концентру2,22 (с, 3Н), 3,98 (с, 6Н), 4,89 (д, 1H), 5,81 (д, вали. Концентрат очищали колонковою хроматог1H), 5,89 (с, 1H), 7,2 (м, 1H), 7,5 (м, 1Н), 7,8 (д, 1H), рафією на силікагелі (суміш н-гексан/етилацетат 9,72 (широкий, 1Н) =2/3) з одержанням 0,55г (1,6.ммоль) 2-(4,6-1 ІЧ (KВr, см ): 3430 (ΝΗ), 3300 (ОН), 1700,1600 диметоксипіримідин-2-ілгідроксиметил)-4(С=О). метоксіацетаніліду. Вихід: 82%. Точка плавлення: Приклад 28 (стадія 1) від 122°С до.125°С. Одержання 3-(4,6-диметоксипіримідин-2-іл)-5ЯМР (CDCl3/TMS), δ (м.д.): метокси-2-метиліндолу 2,21 (с, 3Н), 3,80 (с, 3Н), 3,97 (с, 6Н), 4,87 (д, До 80мл толуолу додавали 8,0г (40ммоль) 11Н). 5,84 (д, 1Н), 5,96 (с, 1Н), 6,8 (м, 1Н), 7,07 (д, (4,6-диметоксипіримідин-2-іл)-2-пропанону і 7,7г 1H), 7,69 (кв, 1Н), 9,49 (широкий, 1Н). 39 76127 40 ІЧ (см-1): 3470 (ΝΗ), 3250 (ОН), 1670, 1600 дним сульфатом натрію і концентрували з одер(С=О). жанням 0,91г (0,0030моль) 2-(4,6Приклад 31 (стадія 6) диметоксипіримідин-2-ілгідроксиметил)-6Одержання 2-(4,6-диметоксипіримідин-2метоксиметиланіліну. Вихід: 90%. Одержаний 2ілгідроксиметил)-6-метоксиметиланіліну (4,6-диметоксипіримідин-2-ілгідроксиметил)-6У реактор вміщували 1,0г (0,0033моль) 2-(4,6метоксиметиланілін піддавали інструментальному диметоксипіримідин-2-іл)карбоніл-6аналізу, і показали, що дані відповідали даним для метоксиметиланіліну і 50мл етанолу. У реактор сполук, описаних у прикладах. додавали 0,125г (0,0033моль) боргідриду натрію Промислове застосування при охолоджуванні льодом (10°С або нижче). СуЗгідно з даним винаходом одержана 2міш перемішували при кімнатній температурі про(піримідин-2-ілгідроксиметил)ацетанілідна сполутягом 2 годин. По закінченні реакції до реакційної ка, яка є важливим проміжним продуктом для сусуміші додавали насичений водний розчин хлорильфонанілідної сполуки, що виявляє чудову гербістого амонію для підкислення суміші. Потім додацидну дію, а також представлений промисловий вали етилацетат для здійснення екстрагування. спосіб одержання заміщеної анілінової сполуки з Органічний шар промивали водою і насиченим використанням вказаної вище ацетанілідної сполуводним розчином хлористого натрію у вказаному ки як проміжного продукту. порядку. Потім органічний шар сушили над безво Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for producing a substituted aniline compound and intermediates for realizing thereof
Назва патенту російськоюСпособ получения замещенного анилинового соединения и промежуточные соединения для его осуществления
МПК / Мітки
МПК: C07D 239/26, C07D 239/42, C07D 239/30, C07D 403/04, C07D 239/52, C07C 243/00
Мітки: одержання, проміжні, здійснення, спосіб, заміщеної, анілінової, сполуки
Код посилання
<a href="https://ua.patents.su/20-76127-sposib-oderzhannya-zamishheno-anilinovo-spoluki-ta-promizhni-spoluki-dlya-jjogo-zdijjsnennya.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщеної анілінової сполуки та проміжні сполуки для його здійснення</a>
Попередній патент: Емульсинвакцина асоційована інактивована проти ньюкаслської хвороби, інфекційного бронхіту курей та синдрому зниження несучості-76
Наступний патент: Застосування інгібітора рецептора прогестерону для лікування стероїдрезистентного раку молочної залози
Випадковий патент: Прокатний стан з пристроєм охолодження та спосіб прокатки












