Композиція простагландину (варіанти), застосування композиції для лікування еректильної дисфункції у чоловіків
Номер патенту: 79759
Опубліковано: 25.07.2007
Автори: Буюктімкін Надір, Буюктімкін Сервет, Йіджер Джеймс Л.
Формула / Реферат
1. Напівтверда композиція, що включає в себе
вазоактивний простагландин;
підсилювач проникнення через шкіру, який є членом групи, що складається з алкіл-2-(N-заміщений амін)алканоату, (N-заміщений амін)алканолалканоату, їх фармацевтично прийнятних солей і їх суміші;
розріджуваний при зсуві полісахарид;
ліпофільну сполуку, яка є членом групи, що складається з C1-C8-аліфатичного спирту, C8-С30-аліфатичного складного ефіру і їх суміші; і
систему кислотного буфера.
2. Напівтверда композиція за п. 1, в якій вазоактивний простагландин вибраний з групи, що складається з PGE1, PGA1, PGB1, ![]() , 19-гідрокси-РGА1, 19-гідрокси-РGD1, PGE2, PGA2, PGB2, 19-гідрокси-РGА2, 19-гідрокси-РGВ2, РGЕ3, РGF3 і їх сумішей.
, 19-гідрокси-РGА1, 19-гідрокси-РGD1, PGE2, PGA2, PGB2, 19-гідрокси-РGА2, 19-гідрокси-РGВ2, РGЕ3, РGF3 і їх сумішей.
3. Напівтверда композиція за п. 1, в якій розріджуваний при зсуві полісахарид має в'язкість від приблизно 5000 сантипуаз до приблизно 20000 сантипуаз.
4. Напівтверда композиція за п. 1, в якій розріджуваний при зсуві полісахарид має в'язкість від приблизно 7000 сантипуаз до приблизно 13000 сантипуаз.
5. Напівтверда композиція за п. 1, в якій розріджуваний при зсуві полісахарид являє собою модифіковану галактомананову смолу.
6. Напівтверда композиція за п. 5, в якій модифікована галактомананова смола являє собою модифіковану гуарову камедь.
7. Напівтверда композиція за п. 1, в якій ліпофільна сполука являє собою щонайменше один C8-С30-аліфатичний складний ефір.
8. Напівтверда композиція за п. 1, в якій ліпофільна сполука являє собою щонайменше один складний ефір гліцерину, вибраний з групи, що складається з моногліцеридів, дигліцеридів, тригліцеридів і їх сумішей.
9. Напівтверда композиція за п. 1, в якій ліпофільна сполука являє собою щонайменше один складний ефір гліцерину, вибраний з групи, що складається з гліцерилмоноолеату, триолеану, триміристину, тристеарину і їх сумішей.
10. Напівтверда композиція за п. 1, в якій система кислотного буфера забезпечує буферну величину рН вказаної композиції в межах від приблизно 3 до приблизно 6,5.
11. Напівтверда композиція за п. 1, де композиція додатково містить емульгатор, вибраний з групи, що складається з складних ефірів сахарози, складних ефірів поліоксіетиленсорбітану, довголанцюгових спиртів і складних ефірів гліцерину.
12. Напівтверда композиція за п. 1, в якій емульгатор являє собою щонайменше один складний ефір гліцерилу, вибраний з групи, що складається з гліцерилмоноолеату, триолеану, триміристину, тристеарину і їх сумішей.
13. Напівтверда композиція за п. 1, де композиція додатково містить віддушку.
14. Напівтверда композиція за п. 1, де композиція додатково містить до приблизно 5 % міртенолу від загальної маси композиції.
15. Напівтверда композиція за п. 1, де композиція додатково містить консервант.
16. Напівтверда композиція за п. 1, де композиція додатково містить місцевий анестетик.
17. Застосування напівтвердої композиції простагландину, що містить вазоактивний простагландин;
підсилювач проникнення через шкіру, який є членом групи, що складається з алкіл-2-(N-заміщений амін)алканоату, (N-заміщений амін)алканолалканоату, їх фармацевтично прийнятних солей і їх суміші;
розріджуваний при зсуві полісахарид;
ліпофільну сполуку, яка є членом групи, що складається з C1-C8-аліфатичного спирту, C8-С30-аліфатичного складного ефіру і їх суміші; і
систему кислотного буфера для виготовлення фармацевтичної композиції для лікування еректильної дисфункції у пацієнта, який потребує вказаного лікування; при якому фармацевтичну композицію вводять в fossa navicularis пацієнта.
18. Застосування за п. 17, де розріджуваний при зсуві полісахарид являє собою модифіковану галактомананову смолу.
19. Застосування за п. 18, де модифікована галактомананова смола являє собою модифіковану гуарову камедь.
20. Застосування за п. 17, де ліпофільна сполука являє собою щонайменше один C8-С30-аліфатичний складний ефір.
21. Застосування за п. 17, де ліпофільна сполука являє собою щонайменше один складний ефір гліцерину, вибраний з групи, що складається з моногліцеридів, дигліцеридів, тригліцеридів і їх сумішей.
22. Застосування за п. 17, де ліпофільна сполука являє собою щонайменше один складний ефір гліцерину, вибраний з групи, що складається з гліцерилмоноолеату, триолеану, триміристину, тристеарину і їх сумішей.
23. Застосування за п. 17, де система кислотного буфера забезпечує буферну величину рН вказаної композиції в межах від приблизно 3 до приблизно 6,5.
24. Застосування за п. 17, де композиція додатково включає в себе емульгатор, вибраний з групи, що складається з складних ефірів сахарози, складних ефірів поліоксіетиленсорбітану, довголанцюгових спиртів і складних ефірів гліцерину.
25. Застосування за п. 17, де емульгатор являє собою щонайменше один складний ефір гліцерину, вибраний з групи, що складається з гліцерилмоноолеату, триолеану, триміристину, тристеарину і їх сумішей.
26. Застосування за п. 17, де композиція додатково містить віддушку.
27. Застосування за п. 17, де композиція додатково містить до приблизно 5 % міртенолу від загальної маси композиції.
28. Застосування за п. 17, де композиція додатково містить консервант.
29. Застосування за п. 17, де композиція додатково містить місцевий анестетик.
30. Композиція простагландину Е1, що містить простагландин E1, придатний для введення в fossa navicularis, що включає в себе
модифіковану галактомананову смолу, що розріджується при зсуві;
простагландин, вибраний з групи, що складається з PGE1, його фармацевтично прийнятних солей, його ефірів з нижчими алкілами і їх сумішей;
від приблизно 0,5 процента до приблизно 10 процентів DDAIP або його фармацевтично прийнятної солі від загальної маси композиції;
від приблизно 0,5 процента до приблизно 10 процентів від загальної маси композиції нижчого спирту, вибраного з групи, що складається з етанолу, пропанолу, ізопропанолу і їх сумішей;
від приблизно 0,5 процента до приблизно 10 процентів складного ефіру, вибраного з групи, що складається з етиллаурату, ізопропілміристату, ізопропіллаурату і їх сумішей від загальної маси композиції; і
систему кислотного буфера.
31. Композиція за п. 30, що додатково містить емульгатор, вибраний з групи, що складається з складних ефірів сахарози, складних ефірів поліоксіетиленсорбітану, довголанцюгових спиртів і складних ефірів гліцерину.
32. Композиція за п. 30, де вказаний емульгатор являє собою стеарат сахарози.
33. Композиція за п. 30, де емульгатор включає в себе щонайменше один складний ефір гліцерину, вибраний з групи, що складається з гліцерилмоноолеату, триолеану, триміристину, тристеарину і їх сумішей.
34. Композиція за п. 30, де композиція додатково містить віддушку.
35. Композиція за п. 30, де композиція додатково містить до приблизно 5 % міртенолу від загальної маси композиції.
36. Композиція за п. 30, де композиція додатково містить консервант.
37. Композиція за п. 30, де композиція додатково містить місцевий анестетик.
Текст
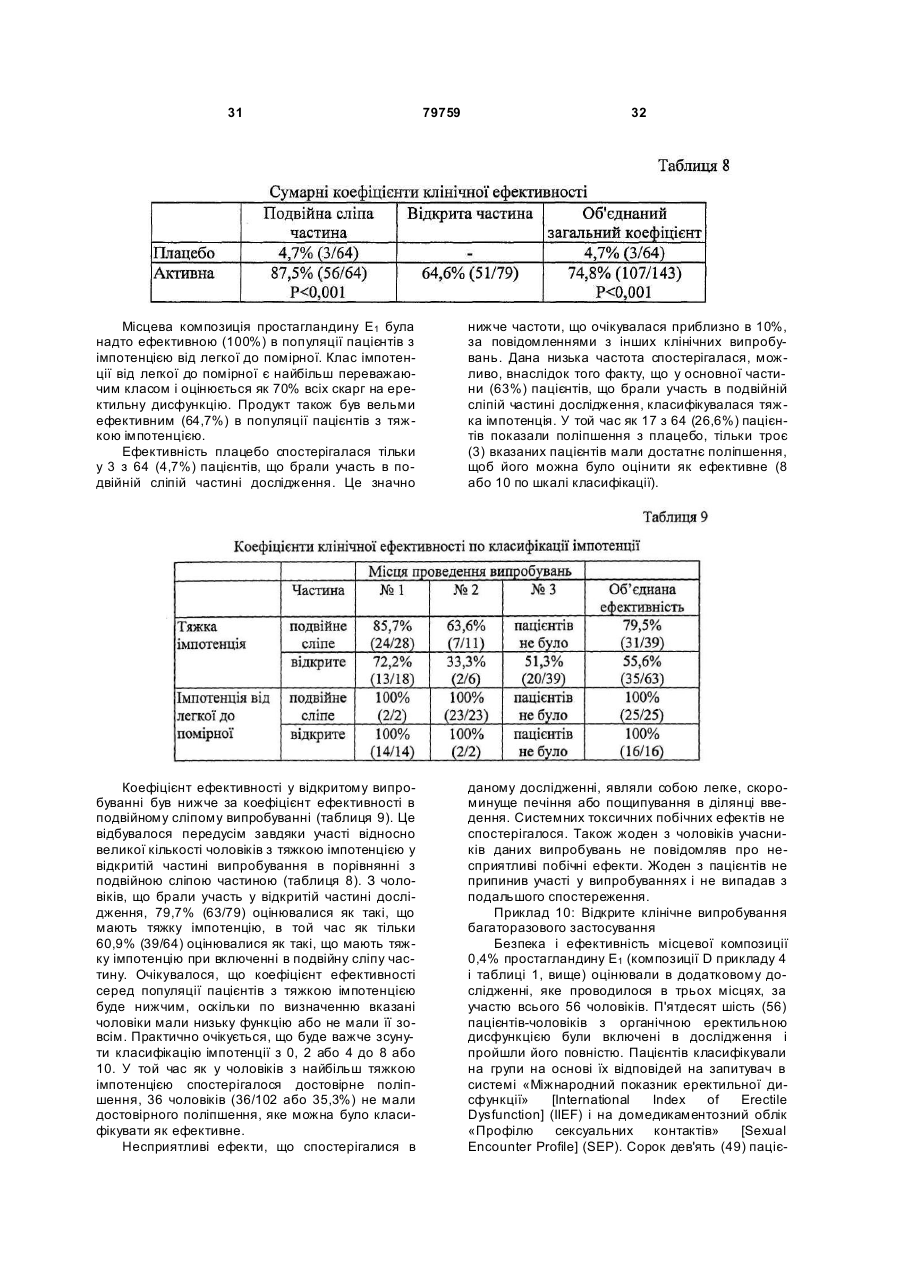
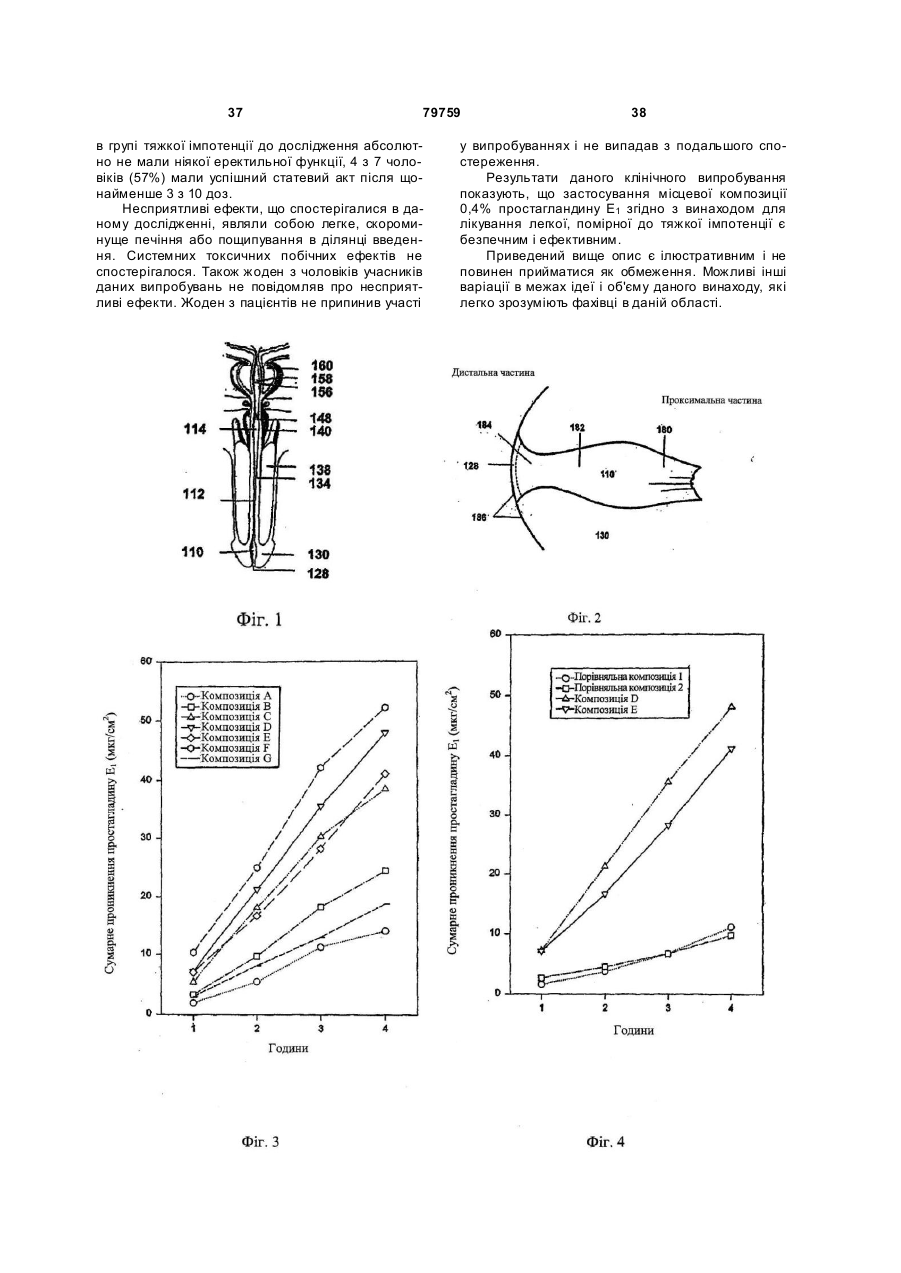
1. Напівтверда композиція, що включає в себе вазоактивний простагландин; підсилювач проникнення через шкіру, який є членом групи, що складається з алкіл-2-(N-заміщений амін)алканоату, (N-заміщений амін)алканолалканоату, їх фармацевтично прийнятних солей і їх суміші; розріджуваний при зсуві полісахарид; ліпофільну сполуку, яка є членом групи, що складається з C1-C8-аліфатичного спирту, C8-С30аліфатичного складного ефіру і їх суміші; і систему кислотного буфера. 2. Напівтверда композиція за п. 1, в якій вазоактивний простагландин вибраний з групи, що складається з PGE1, PGA1 , PGB 1, PGF1a , 19-гідроксиРGА1, 19-гідрокси-РGD1, PGE2 , PGA2, PGB2 , 19гідрокси-РGА2 , 19-гідрокси-РGВ2, РGЕ3 , РGF3 і їх сумішей. 3. Напівтверда композиція за п. 1, в якій розріджуваний при зсуві полісахарид має в'язкість від приблизно 5000 сантипуаз до приблизно 20000 сантипуаз. 4. Напівтверда композиція за п. 1, в якій розріджуваний при зсуві полісахарид має в'язкість від приблизно 7000 сантипуаз до приблизно 13000 сантипуаз. 5. Напівтверда композиція за п. 1, в якій розріджуваний при зсуві полісахарид являє собою модифіковану галактомананову смолу. 6. Напівтверда композиція за п. 5, в якій модифікована галактомананова смола являє собою модифіковану гуарову камедь. 2 (19) 1 3 79759 4 ліпофільну сполуку, яка є членом групи, що складається з C1-C8-аліфатичного спирту, C8-С30аліфатичного складного ефіру і їх суміші; і систему кислотного буфера для виготовлення фармацевтичної композиції для лікування еректильної дисфункції у пацієнта, який потребує вказаного лікування; при якому фармацевтичну композицію вводять в fossa navicularis пацієнта. 18. Застосування за п. 17, де розріджуваний при зсуві полісахарид являє собою модифіковану галактомананову смолу. 19. Застосування за п. 18, де модифікована галактомананова смола являє собою модифіковану гуарову камедь. 20. Застосування за п. 17, де ліпофільна сполука являє собою щонайменше один C8-С30аліфатичний складний ефір. 21. Застосування за п. 17, де ліпофільна сполука являє собою щонайменше один складний ефір гліцерину, вибраний з групи, що складається з моногліцеридів, дигліцеридів, тригліцеридів і їх сумішей. 22. Застосування за п. 17, де ліпофільна сполука являє собою щонайменше один складний ефір гліцерину, вибраний з групи, що складається з гліцерилмоноолеату, триолеану, триміристину, тристеарину і їх сумішей. 23. Застосування за п. 17, де система кислотного буфера забезпечує буферну величину рН вказаної композиції в межах від приблизно 3 до приблизно 6,5. 24. Застосування за п. 17, де композиція додатково включає в себе емульгатор, вибраний з групи, що складається з складних ефірів сахарози, складних ефірів поліоксіетиленсорбітану, довголанцюгових спиртів і складних ефірів гліцерину. 25. Застосування за п. 17, де емульгатор являє собою щонайменше один складний ефір гліцерину, вибраний з групи, що складається з гліцерилмоноолеату, триолеану, триміристину, тристеарину і їх сумішей. 26. Застосування за п. 17, де композиція додатково містить віддушк у. 27. Застосування за п. 17, де композиція додатково містить до приблизно 5 % міртенолу від загальної маси композиції. 28. Застосування за п. 17, де композиція додатково містить консервант. 29. Застосування за п. 17, де композиція додатково містить місцевий анестетик. 30. Композиція простагландину Е1, що містить простагландин E1, придатний для введення в fossa navicularis, що включає в себе модифіковану галактомананову смолу, що розріджується при зсуві; простагландин, вибраний з групи, що складається з PGE1, його фармацевтично прийнятних солей, його ефірів з нижчими алкілами і їх сумішей; від приблизно 0,5 процента до приблизно 10 процентів DDAIP або його фармацевтично прийнятної солі від загальної маси композиції; від приблизно 0,5 процента до приблизно 10 процентів від загальної маси композиції нижчого спирту, вибраного з групи, що складається з етанолу, пропанолу, ізопропанолу і їх сумішей; від приблизно 0,5 процента до приблизно 10 процентів складного ефіру, вибраного з групи, що складається з етиллаурату, ізопропілміристату, ізопропіллаурату і їх сумішей від загальної маси композиції; і систему кислотного буфера. 31. Композиція за п. 30, що додатково містить емульгатор, вибраний з групи, що складається з складних ефірів са харози, складних ефірів поліоксіетиленсорбітану, довголанцюгових спиртів і складних ефірів гліцерину. 32. Композиція за п. 30, де вказаний емульгатор являє собою стеарат сахарози. 33. Композиція за п. 30, де емульгатор включає в себе щонайменше один складний ефір гліцерину, вибраний з групи, що складається з гліцерилмоноолеату, триолеану, триміристину, тристеарину і їх сумішей. 34. Композиція за п. 30, де композиція додатково містить віддушку. 35. Композиція за п. 30, де композиція додатково містить до приблизно 5 % міртенолу від загальної маси композиції. 36. Композиція за п. 30, де композиція додатково містить консервант. 37. Композиція за п. 30, де композиція додатково містить місцевий анестетик. Даний винахід відноситься до композицій і способів лікування еректильної дисфункції і, більш конкретно, до способів і фармацевтичних композицій для інтранавікулярного введення судинорозширювальних лікарських засобів в човноподібну ямку (fossa navicularis) пацієнта. Термін «імпотенція» використовується для позначення нездатності чоловічого особня до виникнення і підтримки ерекції статевого члена, достатньої для здійснення задовільного статевого акту. Термін «еректильна дисфункція» був запропонований як більш точний термін «для позначення нездатності чоловічого особня до досягнення ерекції статевого члена як частини усього багатоком понентного процесу чоловічої статевої функції». [Droller, M.J. et al. Impotence. Consensus Development Conference Statement, National Institutes of Health (1993)]. Еректильну дисфункцію можуть викликати психологічні причини (психогенна еректильна дисфункція) або органічні причини або поєднання і тих, і інших. Органічні причини включають в себе фізіологічну, нервову, судинну і гормональну патологію або їх комбінації. В нормальній фізіології ерекції беруть участь нервові імпульси, які подають сигнал до розслаблення певним м'я зам. Вказані м'я зи, будучи в скороченому стані, обмежують кровотік через артерії 5 79759 статевого члена. Будучи розслабленими, вказані м'язи дозволяють кровотоку значно збільшитися. Підвищений кровотік переповнює три групи еректильної тканини всередині статевого члена кров'ю, і статевий член стає менш м'яким. Переповнена кров'ю еректильна тканина і м'язова структура статевого члена здавлюють сусідні вени, обмежуючи відтік крові з статевого члена. Обмеження відтоку крові з статевого члена посилює і підтримує ерекцію. Дефіцит деяких гормонів, таких як тестостерон, або підвищення рівнів інших гормонів, таких як пролактин, може викликати еректильну дисфункцію. Багато які лікарські засоби, такі як діуретики, антигіпертензивні засоби, протисудомін засоби, наркотики, алкоголь і психотропні лікарські засоби, можуть викликати еректильну дисфункцію як побічний ефект. [Murra y, F.T. et al. Amer. J. Medical Sci. 309:99-109 (1995)]. Пошкодження нервів і кровоносних судин також може бути органічною причиною еректильної дисфункції. Хворобливі процеси можуть включати в себе декілька аспектів. Наприклад, діабет, який викликає пошкодження як нервів, так і кровоносних судин, може викликати еректильну дисфункцію. Значна частина всіх чоловіків, страждаючих діабетом, може страждати еректильною дисфункцію. Способи, запропоновані для лікування еректильної дисфункції, включають в себе зовнішні пристрої, сексуальну терапію, хірургічну імплантацію внутрішніх протезів, ін'єкцію лікарських засобів безпосередньо в статевий член, і місцеве нанесення лікарських засобів. Жоден з вказаних підходів не є повністю ефективним. Під зовнішніми пристроями маються на увазі турнікети [див. патент США №2818855] і зовнішньо застосовні вакуумні засоби, які сприяють ерекції. У той час як деякі клініцисти вважають зовнішньо застосовні вакуумні засоби, які сприяють ерекції, засобом для лікування першого вибору, деякі пацієнти не хочуть використовувати подібні пристрої. [O'Keefe, Μ., et al. Medical Clinics of North America 79: 415-434 (1995)]. Як було встановлено спочатку Masters і Johnson, сексуальна терапія була ефективною, але більш пізні дослідження не виявили вражаючих результатів. Фрейдистська терапія не виявилася привабливою альтернативою для пацієнтів. [Vickers, M.A., et al. J. Urology 149:1258-1261 (1993)]. Деякий час застосовувалися хірургічно імплантовані механічні пристрої, такі як шарнірні або тверді стрижні, пружинні або гідравлічні протези. Введення лікарських засобів, що впливають на ерекцію і посилюють ерекцію, описано [LaTorre в патенті США №4127118]. У вказаному патенті описаний спосіб лікування чоловічої імпотенції шляхом ін'єктування в статевий член відповідного судинорозширювального засобу, зокрема, адреноблокатору, або засобу, що розслабляє гладку мускулатуру, для впливу на ерекцію і посилення ерекції. Пізніше [Voss et al. в патенті США №4801587] описують нанесення мазі для лікування імпотенції. Мазь складається з судинорозширювальних лікар 6 ських засобів папаверину, гідралазину, нітропрусиду натрію, феноксибензаміну або фентоламіну і носія, який сприяє всмоктуванню головного агента через шкіру. У [патенті США №5256652], виданому El-Rashidy, описане застосування водної місцевої композиції судинорозширювального лікарського засобу, такого як папаверин, спільно з гідроксипропіл-b-циклодекстрином. Простагландин E1 являє собою похідне простаноєвої кислоти, жирної кислоти з 20 атомів вуглецю, представлене формулою: і його можна придбати, наприклад, у Chinoin Pharmaceutical and Chemical Works Ltd. (Будапешт, Угорщина) під назвою «Alprostadil USP». Простагландин E1 являє собою судинорозширювальний агент, придатний для підтримки кровоносних судин у відкритому стані, і, отже, для лікування, серед інших захворювань, захворювання периферичних судин. Незважаючи на те, що потенційні переваги від черезшкірної доставки простагландину E1 давно визнані, зусилля з розробки місцевої композиції для доставки простагландину, що раніше робилися, не були повністю успішними. В одній комерційно доступній формі [MUSE®, Vi vus, Menlo Park CA], альпростадил вводять у вигляді гранули, що осаджується в уретрі, з використанням аплікатору з порожнистим стржинем довжиною 3,2см і діаметром 3,5мм [Padma-Nathan, Η., et al., N. Engl. J. Med., 336: 1-7 (1997), див. Фіг.1]. У проведеній на базі своєї країни частини дослідження Padma-Nathan et al., що стосується лікування, було виявлено, що 32,7% пацієнтів (10,8% введений), що отримували MUSE®, скаржилися на біль в статевому члені, а у 5,1% спостерігалися незначні травми уретри, в порівнянні з 3,3% і 1,0%, відповідно, пацієнтів, що отримували плацебо. Частота вказаних побічних ефектів в подальших випробуваннях варіювала: біль в статевому членові, викликана MUSE®, у 17-23,6% введений, в порівнянні з 1,7% в групі плацебо, і незначні кровотечі з уретри у 4,8% пацієнтів [Peterson, CA., et al., J. Ural., 159: 1523-1528 (1998)]. В дослідженні на європейській популяції 31% пацієнтів, що отримували MUSE®, повідомляли про болі в статевому членові або відчутті печіння, 4,8% повідомляли про кровотечу з уретри і 2,9% повідомляли про сильні болі в сіменниках [Porst, Η., Int. J. Impot. Res., 9:187-192 (1997)]. Процент пацієнтів, які відреагували на лікування MUSE®, що визначалося наявністю щонайменше однієї ерекції, достатньої для статевого акту, як повідомлялося, становив 43% (Porst, 1997), 65,9% [Padma-Nathan et al., 1997] і 70,5% [Peterson et al., 1998], хоча в опублікованому коментарі видавців було висловлено припущення, що процент пацієнтів, які відреагували на лікування в останніх двох дослідженнях, більш точно становив 30-40% [Benson, G., J. Urol., 159: 1527-1528 (1998)]. Зокрема, в цей час не існує комерційного дже 7 79759 рела місцевої напівтвердої композиції, яка є придатною без підтримуючого пристрою, такого як пластир, липка смужка і т.п. Наприклад, в [патенті США №5380760], виданому Wendel et al., описана місцева композиція простагландину, яка включає в себе чутливий до тиску липкий листок поліізобутилену. Діючи самостійно, більшість лікарських засобів, включаючи композиції простагландину, не проникають в шкіру в достатній мірі, щоб забезпечити рівні концентрації лікарського засобу, порівнянні з тими, які отримують при інших шляха х введення лікарського засобу. Для того, щоб подолати дану проблему, в місцеві композиції лікарського засобу звичайно включають підсилювач проникнення в шкіру. Підсилювачі проникнення в шкіру також називають підсилювачами всмоктування, акселерантами, ад'ювантами, солюбілізаторами, промоторами всмоктування і т.п. Як би вони не називалися, вказані агенти служать поліпшенню всмоктування лікарського засобу через шкіру. Ідеальні підсилювачі проникнення не тільки збільшують потік лікарського засобу через шкіру, але і здійснюють це без подразнення, сенсибілізації або пошкодження шкіри. Крім цього, ідеальні підсилювачі проникнення не повинні несприятливим чином впливати на фізичні властивості доступних лікарських форм (наприклад, крему або гелю) або на косметичну якість місцевої композиції. Велика кількість сполук оцінювалася на предмет їх е фективності для підвищення швидкості проникнення лікарських засобів через шкіру. Див., наприклад, роботу [Percutaneous Penetration Enhancers, Maibach H.I. and Smith H.E. (вид.), CRC Press, Inc., Boca Raton, FL. (1995)], в якій простежується застосування і випробування різних підсилювачів проникнення через шкіру, і [Buyuktimkin et al., Chemical Means of Transdermal Drug Permeation Enhancement в Transdermal and Topical Drug Delivery Systems, Gosh так як, Pfister W.R., Yum S.I. (вид.), Interpharm Press Inc., Buffalo Grove, IL. (1997)]. Повністю успішна місцева або черезслизова композиція для простагландину E1 досі не ідентифікована і комерційно не доступна. На жаль, простагландин E1 легко трансформується перегрупуванням і іншими реакціями. Вказана відносна нестабільність ускладнює спроби створення композиції для інтранавікулярної доставки. У даному винаході, що відноситься до вказаних проблем, створені спосіб і композиції для інтранавікулярної доставки напівтвердої, стійкої до розділення і хімічно стабільної композиції для відносно швидкої, уповільненої доставки судинорозширювального лікарського засобу, переважно простагландину E1. Даний винахід відноситься до композицій і способів для лікування еректильної дисфункції шляхом інтранавікулярного нанесення фармацевтичної композиції на статевий член ссавця. В іншому аспекті даний винахід відноситься до композицій для виготовлення фармацевтичної композиції для лікування еректильної дисфункції, при якому фармацевтичну композицію наносять в fossa navicularis статевого члена. 8 Даний винахід відноситься до способів лікування еректильної дисфункції, що мають на увазі стадію вміщення в fossa navicularis пацієнта ефективної індукуючої ерекцію кількості композиції простагландину E1 напівтвердої консистенції. Композиція включає в себе судинорозширювальний агент, переважно простагландин E1 підсилювач проникнення, полісахарид, що розріджується при зсуві, ліпофільну сполуку і систему кислотного буфера. Підсилювач проникнення являє собою алкіл-2-(N-заміщений амін)алканоатний складний ефір, (N-заміщений амін)алканолалканоат або їх суміш. Ліпофільна сполука може являти собою С 1С8-аліфатичний спирт, С8-С30-аліфатичний складний ефір або їх суміш. Композиція включає в себе буферну систему, що забезпечує буферну величину pH вказаної композиції в межах приблизно від 3 до 7,4. Переважна величина pH складає приблизно від 3,0 до 7,4, більш переважно -приблизно від 3,0 до 6,4, найбільш переважно - приблизно від 3,5 до 6,0. Інтранавікулярне внесення судинорозширювальний композиції згідно з даним винаходом, тобто всередину fossa navicularis, створює ряд переваг в порівнянні з нанесенням подібної композиції на поверхню шкіри статевого члена або нанесенням композиції в межах більш проксимальної частини "pars spongiosa" уретри. Fossa navicularis являє собою природну розширену камеру, зручно адаптовану для прийому і утримання напівтвердих лікарських засобів. Напівтвердий лікарський засіб, такий як композиція згідно з даним винаходом, будучи вміщеним в ямку, зустрічає більш високий опір до протікання через звужені виходи з даного простору, зовнішній отвір і уретру. Опір потоку пропорційний добутку площі поперечного перерізу шляху і до вжини шляху. Вистілка fossa navicularis являє собою некератинізований багатошаровий плоский епітелій, що забезпечує збільшення проникності в порівнянні з кератинізованим епітелієм поверхні шкіри зовні статевого члена. Застосування короткого аплікатора з наконечником, який закінчується в анатомічних межах fossa navicularis, є менш інвазивним, ніж проведення більш довгого аплікатора на декілька сантиметрів вгору (або проксимальніше) у власно губчасту частину уретри. Відповідний аплікатор описаний в [патенті США №6224573], виданому Yeager et al., включеному в цей документ як посилання, в тому, що стосується теми, яка розглядається. Переважно, аплікатор включає в себе резервуар, що містить індукуючу ерекцію кількість напівтвердої композиції простагландину E1. Більш переважно, аплікатор являє собою одноразовий пристрій і містить однократну дозу напівтвердої композиції простагландину E1. В одному варіанті здійснення даного винаходу кількість композиції згідно з винаходом, що не містить активного інгредієнту, займає положення в аплікаторі між однократною дозою напівтвердої композиції простагландину E1 і наконечником аплікатора. У подібному варіанті здійснення даного винаходу застосування аплікатора приводить до розміщення композиції, що не містить активний 9 79759 інгредієнт, в проксимальній fossa navicularis і дистальній частині власно губчастої частини уретри, фізично обмежуючи однократну дозу напівтвердої композиції простагландину E1 вказаною fossa navicularis. До аплікатора звичайно додається інструкція по застосуванню, вміщена у всі х або деяких з вказаних місць: на упаковці, що містить аплікатор, на вставці упаковки і на зовнішній поверхні самого аплікатора. Відносно високий вміст глікогену і бактерійної флори в fossa navicularis створює природно більш низьке значення pH в даному просторі, таким чином, що композиції з відносно більш низькими значеннями pH в таких межах кислотності, які забезпечують підвищення розчинності простагландину E1 можуть легко переноситися пацієнтами без надмірного подразнення тканин. Fossa navicularis також являє собою найбільш імунологічно захищену ділянку в порівнянні з прилеглою ділянкою pars spongiosa власне губчастої частини уретри. Вміщення наконечника аплікатора в анатомічних межах fossa navicularis, таким чином, представляє менше ризику подолання природних бар'єрів до захворювання штучно переносимими контамінантами, наприклад, з поверхні статевого члена, безпосередньо у власно губчасту частину уретри. Фармацевтична композиція, відповідна для інтранавікулярного нанесення, включає в себе простагландин E1 підсилювач проникнення, модифіковану полісахаридну смолу, ліпофільну сполуку і систему кислотного буфера. Підсилювач проникнення являє собою алкіл-2-(N-заміщений амін)алканоатний складний ефір, (N-заміщений амін)алканолалканоат або їх суміш. Ліпофільна сполука може являти собою С 1-С8-аліфатичний спирт, С8-С30-аліфатичний складний ефір або їх суміш. Композиція включає в себе буферну систему, що забезпечує величину pH буфера вказаної композиції в межах приблизно від 3 до 7,4. Якщо бажано, можна включати в композицію стабілізатори, консерванти і емульгатори. Композиції згідно з винаходом можуть приймати форму напівтвердого агента, відповідного для інтранавікулярного нанесення. При застосуванні як інтранавікулярного агента дані композиції відрізняються відносно високим проникненням в glans penis і біодоступністю простагландину без непотрібного передозування простагландину. Композиція також викликає менше подразнення, сенсибілізацію і пошкодження місцевих тканин. У переважному варіанті здійснення даного винаходу композиції доставляють в fossa navicularis за допомогою відповідного аплікатора, що містить однократну дозу. Інші і додаткові цілі, задачі, ознаки, переважні варіанти здійснення і т.п. будуть очевидні для фахівців з даного опису і прикладеної формули винаходу. Короткий опис малюнків У малюнках Фіг.1 являє собою схему анатомічної побудови статевого члена людини в подовжньому перерізі; Фіг.2 являє собою схему анатомічних деталей 10 дистальної частини статевого члена людини в подовжньому перерізі; Фіг.3 являє собою графік кумулятивного проникнення простагландину Е1 через скинену шкіру змії семи композицій простагландину Е1 виготовлених відповідно до даного винаходу; і Фіг.4 являє собою порівняльний графік кумулятивного проникнення простагландину E1 через скинену шкіру змії двох композицій простагландину Е1, виготовлених відповідно до даного винаходу, і дво х порівняльних композицій. Несподівано було встановлено, що напівтверду композицію простагландину Е1, відповідну для лікування еректильної дисфункції, можна вигідно вміщувати в природно збільшений простір, безпосередньо проксимальний по відношенню до зовнішнього отвору уретри, fossa navicularis. Fossa navicularis являє собою обмежену ділянку, ідеально відповідну для нанесення фармацевтичних композицій. Вказаний простір вистелений некератинізованим багатошаровим плоским епітелієм і, таким чином, відрізняється від поверхні шкіри, що покриває головку і іншу частину ста тевого члена, а також від багатошарового циліндричного епітелію вистілки власне уретри. Було встановлено, що введення композиції згідно з винаходом в fossa navicularis володіє несподівано високою ефективністю і низькою частотою місцевих побічних ефектів. Fossa navicularis являє собою природний простір, який можна адаптувати для нанесення і утримання фармацевтичних композицій. Напівтвердий лікарський засіб, такий як композиція згідно з винаходом, будучи вміщеним в ямку, зустрічає більш високий опір до протікання через звужені виходи з даного простору, зовнішній отвір і уретру. Так, напівтвердий лікарський засіб, що має належно підібрану в'язкість, природним шляхом утримується всередині ямки, полегшуючи всмоктування активних агентів, таких як судинорозширювальні засоби і т.п. Fossa navicularis являє собою частину природної захисної системи, яка захищає організм від інфекції. Fossa navicularis являє собою найбільш імунологічно захищену ділянку в порівнянні з прилеглою ділянкою pars spongiosa власне губчастої частини уретри. Вміщення напівтвердого лікарського засобу в анатомічних межах fossa navicularis, таким чином, не порушує природних бар'єрів для захворювання штучно переносимими контамінантами, наприклад, з поверхні статевого члена, безпосередньо у власно губчасту частину уретри. Як відмічалося вище, fossa navicularis природним чином зберігає бактерійну флор у, яка підтримує кисле значення pH. На Фіг.1 зображені основні межі будови статевого члена людини. Fossa navicularis 110 в головці статевого члена 130 являє собою природне розширення просвіту чоловічої уретри, яке тягнеться дистально до зовнішнього отвору уретри 128 і проксимально до висячої ділянки уретри 112 (яка також називається ділянкою "pars spongiosa" уретри), частини уретри, яка проходить через corpus spongiosum 134. Бульбарна уретра 114 розташована проксимально по відношенню до висячої ді 11 79759 лянки уретри і проходить через м'яз bulbospongiosus 140. Більше проксимально можна бачити отвір бульбоуретральних залоз (куперових залоз) 148 в стінці уретри. Більш проксимально уретра проходить через передміхурову залозу 160, де в стінці уретри видні отвори сім'явикидального протоку 156 і передміхурової маточки 158. На Фіг.2 зображена докладна будова fossa navicularis 110. Зовнішній отвір уретри 128 є дистальною межею fossa navicularis. Зовні шкіра головки статевого члена покрита кератинізованим багатошаровим плоским епітелієм 186 [Pudney, J., and Anderson, DJ., (1995) Immunobiology of the human penile urethra, Amer. J. Path., 147: 155-165] і проксимально відмежовується різким переходом (пунктирна лінія) до некератинізованого багатошарового плоского епітелію без глікогену 184, який характерний для вистілки дистальної fossa navicularis. Fossa navicularis проксимально розширяється, і вистілка змінюється на некератинізований багатошаровий плоский епітелій з глікогеном 182. Як вважають, глікоген на даній ділянці підтримує бактерійну флору, яка знижує pH в даній ділянці і вносить свій внесок в природний захист від інфекції. [Holstein, A.F., et al., (1991). Different epithelia in the distal human male urethra, Cell Tiss. Res. 264: 2332]. Вказаний некератинізований багатошаровий плоский епітелій з глікогеном контролюється гормонами, і його площа збільшується при підвищенні рівнів естрогенів [Holstein, et al., 1991]. Проксимальна fossa navicularis вужчає і вистилається багатошаровим циліндричним епітелієм 180. Напівтверда композиція згідно з винаходом має належно підібрану в'язкість, так, що композиція природно утримується всередині fossa navicularis. Напівтверда композиція може демонструвати н'ютонівські і нен'ютонівські реологічні характеристики, тобто такі, при яких істинна в'язкість залежить від швидкості зсуву, прикладеного до композиції. Переважно, композиція має реологічні властивості «розрідження при зсуві». Термін «розрідження при зсуві», що використовується в цьому документі, відноситься до зменшення істинної в'язкості (співвідношення дотичного напруження і швидкості зсуву) у міру зростання швидкості зсуву, незалежно від того, чи є зменшення істинної в'язкості незалежним від часу (псевдопластичним), залежним від часу (тиксотропним) або пов'язаним межею текучості, що визначається як зусилля, яке повинне бути перевищене, перш ніж почнеться течія [пластичність Bingham і генералізована пластичність Bingham]. Див. [Harris, J., & Wilkinson, W.L., "Non-newtonian Fluid", стор.856-858, в роботі Parker, S.P., вид., McGraw-Hill Encyclopedia of Physics, друге видання, McGraw-Hill, Нью-Йорк, 1993p.]. Відповідна в'язкість знаходиться в межах приблизно від 5000 сантипуаз до 20000 сантипуаз, переважно, приблизно від 7000 сантипуаз до 13000 сантипуаз. Спосіб згідно з винаходом також забезпечує відносно неінвазивний аплікатор. Коли він використовується для внесення ефективної, індукуючої ерекцію кількості композиції простагландину Е1 в fossa navicularis, наконечник аплікатора не вихо 12 дить за анатомічні межі fossa navicularis. Переважно, наконечник аплікатора не входить в статевий член більш ніж приблизно на два сантиметри від зовнішнього отвору, більш переважно, не більш ніж приблизно на один сантиметр, найбільш переважно, не більш ніж приблизно на 0,5 сантиметра. Переважно, аплікатор включає в себе резервуар, що містить індукуючу ерекцію кількість напівтвердої композиції, що містить щонайменше один судинорозширювальний лікарський засіб, переважно композицію простагландину Е1. Більш переважно, аплікатор являє собою одноразовий пристрій і містить однократну дозу напівтвердої композиції судинорозширювального лікарського засобу. До аплікатору звичайно додається інструкція по застосуванню, вміщена у всі х або деяких з вказаних місць: на упаковці, що містить аплікатор, на вставці упаковки і на зовнішній поверхні самого аплікатора. Фармацевтична композиція згідно з винаходом включає в себе щонайменше один судинорозширювальний лікарський засіб, переважно простагландин Е1 алкіл(N-заміщений амін) складний ефір, полісахарид, що розріджується при зсуві, ліпофільну сполуку і систему кислотного буфера. Відповідні вазоактивні агенти включають в себе, без обмеження ними, нітрат, такий як нітрогліцерин, ізосорбіддинітрат, еритритилтетранітрат, амілнітрат, нітропрусид натрію, молсидомін, лінсидомінхлоргідрат ("SIN-1") і S-нітрозо-N-ацетил4,1-пениціламін ("SNAP"); амінокислоти, такі як Lаргінін; a-блокатори тривалої і короткої дії, такі як феноксибензамін, дибенамін, доксазозин, теразозин, фентоламін, толазозин, празозин, тримазозин, альфузозин, тамзулозин і індорамін; судинорозширювальні натуральні рослинні композиції і їх біологічні екстракти, такі як gosyajinki-gan, Satureja obovata, bai-hua qian-hu, lipotab, saiboku-to, вінпоцетин, Gingko biloba, bacopa, Gynosteirana pentaphyllum, gypenosides, Evodia rutaecarpa, рутекарпін, дегідроеводіамін, dan-shen, корінь salviae miltiorrhizae, shosaikoto, плід Zizyphi, ginseng і їх суміші [патент США №6007824]; алкалоїди ріжків, такі як ерготамін і аналоги ерготаміну, наприклад, ацетергамін, бразерголін, бромергурид, ціанерголін, делорготрил, дисулергін, ергоновіну малеат, ерготаміну тартрат, етисулергін, лерготрил, лізергід, мезулергін, метерголін, метерготамін, ніцерголін, перголід, пропізергід, протергурид і тергурид; антигіпертензивні агенти, такі як діазоксид, гідралазин і міноксидил; судинорозширювальні лікарські засоби, такі як німодепін, пінацидил, цикланделат, дипіридамол і ізоксуприн; хлорпромазин; галоперидол; йохімбін; тразодон; натуральні простагландини, такі як PGE1, PGA1 , PGB1 , PGF 1a, 19гідрокси-PGA1 , 19-гідрокси-РСВ1, PGE2, PGA2, PGB2, 19-гідрокси-РGА2, 19-гідрокси-РGВ2, PGE3, PGF3a ; напівсинтетичні або синтетичні похідні натуральних простагландинів, включаючи карбопрост трометамін, динопрост трометамін, динопростон, ліпопрост, гемепрост, метенопрост, сульпростон і тіапрост; і вазоактивні інтестинальні пептиди. Празозин, простагландин Е1 і простагландин Е2 є особливо переважними вазоактивними агентами для застосування в зв'язку з даним спо 13 79759 собом. Крім цього, може бути бажаним одночасне введення двох або більше вазоактивних агентів, і в деяких випадках може бути отриманий синергічний ефект. Як було встановлено, комбінація празозину і простагландину Е1 є особливо вигідною в цьому відношенні; останній лікарський засіб, як виявилося, діє по відношенню до празозину як підсилювач проникнення, тобто він збільшує швидкість, з якою празозин проникає через шкіру або слизову оболонку в кровотік. Простагландин Е1 добре відомий фахівцям. У літературних джерелах можна знайти відомості про його фармакологічні властивості, побічні ефекти і нормальні межі доз. Див., наприклад, [Physician's Desk Reference, 51-е вид. (1997), The Merck Index, 12-е вид., Merck & Co., N.J. (1996) і Martindale The Extra Pharmacopoeia, 28-e вид., Лондон, The Pharmaceutical Press (1982)]. Простагландин Е1, а також інші сполуки, згадані в цьому документі, включають в себе і фармацевтично прийнятні похідні, включаючи фізіологічно сумісні солі і їх складноефірні похідні. Кількість простагландину Е1 в фармацевтичних композиціях згідно з винаходом являє собою терапевтично ефективну кількість і при необхідності змінюється відповідно до бажаної дози, лікарської форми (наприклад, супозиторій або місцевий препарат) і конкретної форми простагландину Е1 що використовується. Термін «простагландин», що використовується в цьому документі, відноситься до вільної кислоти простагландину і її фармацевтично прийнятних похідних, включаючи простагландин Е1 (PGE1), його фармацевтично прийнятні солі і ефіри з нижчими алкілами (термін "нижчий алкіл", що використовується в цьому документі, означає прямий або розгалужений алкіл, що містить від одного до чотирьох атомів вуглецю). Композиція звичайно містить приблизно від 0,001 процента до 1 процента простагландину Е1, звичайно містить приблизно від 0,05 процента до 1 процента простагландину Е1, переважно, приблизно від 0,1 процента до 0,5 процентів, від загальної маси композиції. Важливим компонентом згідно з винаходом є підсилювач проникнення. Підсилювач проникнення являє собою алкіл-2-(N-заміщений амін)алканоат, (N-заміщений амін)алканолалканоат або їх суміш. Для зручності опису алкіл-2-(N-заміщений амін)алканоати і (N-заміщений амін)алканолалканоати можна згадувати під загальною назвою алкіл(N-заміщений амін) складні ефіри. Алкіл-2-(N-заміщений амін)алканоати, відповідні для даного винаходу, можна представити таким чином де n являє собою ціле число приблизно від 4 до 18; R являє собою член групи, що складається з водню, С1-С7-алкілу, бензилу і фенілу; R1 і R2 14 являють собою члени групи, що складається з водню і С1-С7-алкілу; і R3 і R4 являють собою члени групи, що складається з водню, метилу і етилу. Переважними є алкіл(N,N-двозаміщений амін)алканоати, такі як С4-С18-алкіл (Ν,Νдвозаміщений амін)ацетати і С 4-С18-алкіл (Ν,Νдвозаміщений амін)пропіонати і їх фармацевтично прийнятні солі і похідні. Приклади конкретних алкіл-2-(N,N-двозаміщених амін)алканоатів включають в себе додецил-2-(N,N-диметиламін)пропіонат (DDAIP); і додецил-2-(N,N-диметиламін)ацетат (DDAA); Алкіл-2-(N,N-двозаміщений амін)алканоати відомі. Наприклад, додецил-2-(N,Nдиметиламін)пропіонат (DDAIP) можна придбати у компанії Steroids, Ltd. (Чикаго, IL). Крім цього, алкіл-2-(N,N-двозаміщений амін)алканоати можна синтезувати з більше легко доступних сполук, як описано в патенті США №4980378, виданому Wong et al., який включений в цей документ як посилання в тому, що відноситься до питання, яке розглядається. Як описано у вказаному патенті, алкіл-2-(N,N-двозаміщений амін)алканоати можна легко отримати за допомогою двостадійного синтезу. На першій стадії отримують хлорацетати довголанцюгових алкілів реакцією відповідних довголанцюгових алканолів з хлорметилхлорформіатом або подібною сполукою в присутності відповідної основи, такої як триетиламін, звичайно у відповідному розчиннику, такому як хлороформ. Реакцію можна зобразити таким чином: де R, R3, R4 і n визначені вище. Температур у реакції можна вибрати з температури приблизно від 10 градусів Цельсію до 200 градусів Цельсію або кипіння із зворотним холодильником; переважною є кімнатна температура. Використання розчинника не є обов'язковим. Якщо розчинник використовується, можна вибрати цілий ряд органічних розчинників. Подібно цьому, вибір основи не є принциповим. Переважні основи включають в себе третинні аміни, такі як триетиламін, піридин і т.п. Час реакції звичайно складає приблизно від однієї години до трьох днів. На другій стадії хлорацетат довголанцюгового 15 79759 алкілу конденсують з відповідним аміном, згідно з схемою: де n, R, R1 R2, R3 і R4 і визначені вище. Як основа звичайно використовується надлишок амінового реагенту, а реакцію зручно проводити у відповідному розчиннику, такому як ефір. Дана друга стадія переважно протікає при кімнатній температурі, хоча температуру можна змінювати. Час реакції звичайно складає приблизно від однієї години до декількох днів. Для підготовки отриманого ефіру для використання в фармацевтичній сполуці можна застосовувати звичайні методики очищення. Відповідні (N-двозаміщений амін)алканолалканоати можна представити наступною формулою: де n являє собою ціле число в межах приблизно від 5 до 18; у являє собою ціле число в межах приблизно від 0 до 5; і R 1, R2, R3, R4, R5, R6 , і R7 являють собою члени групи, що складається з водню, С1-С8-алкілу і C1-C8-арилу; і R8 являє собою член групи, що складається з водню, гідроксилу, С1-С8-алкілу і С 1-С8-арилу. Переважними є (N-двозаміщений амін)алканолалканоати, такі як складні ефіри С 5С18-карбонових кислот і їх фармацевтично прийнятні солі. Приклади конкретних (Ν,Ν-двозаміщений амін)алканолалканоатів включають в себе 1-(N,Nдиметиламін)-2-пропанолдодеканоат(DАІРD); (Ν,Ν-двозаміщений амін)алканолалканоати легко отримують шляхом взаємодії відповідного 16 аміноалканолу з лауроїлхлоридом в присутності триетиламіну. Розчинник, такий як хлороформ, є необов'язковим, але переважним. Наприклад, 1(N,N-диметиламін)-2-пропанол може взаємодіяти з лауроїлхлоридом в хлороформі і в присутності триетиламіну з утворенням 1-(N, N-диметиламін)2-пропанолдодеканоат (DAIPD). Серед відповідних підсилювачів проникнення для даного винаходу звичайно переважним є DDAIP. Підсилювач проникнення присутній в кількості, достатній для посилення проникнення простагландину E1 в тканину. Конкретну кількість при необхідності змінюють відповідно до бажаної швидкості вивільнення і конкретної використовуваної форми простагландину E1. Звичайно вказана кількість знаходиться в межах приблизно від 0,5 процента до 10 процентів від загальної маси композиції. Переважно, підсилювач проникнення складає приблизно від 2 до 5 процентів від загальної маси композиції. Натуральні і модифіковані полісахаридні смоли також є важливим інгредієнтом даної композиції. Прикладами відповідних смол є смоли, що входять в категорію модифікованих галактомананових смол. Галактомананова смола являє собою вуглеводний полімер, що містить одиниці Dгалактозу і D-манозу або інші похідні вказаного полімеру. Існ ує відносно велика кількість галактомананів, які розрізнюються за складом, в залежності від свого походження. Галактомананова смола характеризується лінійною структурою одиниць bD-манопіранозилу, пов'язаних (1®4). Одночленні a-D-манопіранозильні одиниці, пов'язані (1®6) з головним ланцюгом, присутні у вигляді бічних гілок. Галактомананові смоли включають в себе гуарову камедь, яка являє собою розпилений ендосперм насіння однієї з двох бобових рослин [Cyamposis tetragonalobus і psoraloids] і камедь бобів локусти, яку знаходять в ендоспермі насіння ріжкового дерева [Ceratonia siliqua].) Відповідні модифіковані полісахаридні смоли включають в себе ефір натуральних або заміщених полісахаридних смол, такий як карбоксиметилові ефіри, гідроксипропілові ефіри, етиленгліколеві ефіри і пропіленгліколеві ефіри. Прикладом заміщеної полісахаридної смоли є метилцелюлоза. Переважною модифікованою полісахаридною смолою є модифікована гуарова камедь. Відповідні полісахариди, що розріджуються при зсуві, включають в себе, не обмежуючись ними, гуарові камеді, модифіковані гуарові камеді, камеді бобів локусти, ксанатанові камеді, карбоксиметилцелюлозу, метилцелюлозу, гідроксипропілметилцелюлозу, гідроксіетилцелюлозу і гідроксипропілцелюлозу. Переважні полісахариди, що розріджуються при зсуві, являють собою натуральні і модифіковані галактомананові смоли, включаючи модифіковані гуарові камеді. Інші приклади відповідних смол включають в себе агарову камедь, карагенову камедь, камедь гати, камедь караї, рамзанову камедь і ксантанову камедь. Композиції згідно з винаходом можуть містити суміш різних смол або суміш смол і кисло 17 79759 тних полімерів. Смоли і галактомананові смоли, зокрема, являють собою добре відомі матеріали. Див., наприклад, [Industrial Gums: Polysaccharides & Their Derivatives, Whistler R.L. and BeMiller J.N. (вид.), 3е вид., Academic Press (1992) і Davidson R.L., Handbook of Water-Soluble Gums & Resins, McGraw-Hill, Inc]. Більшість смол є комерційно доступними в різних формах, звичайно у вигляді порошку, і готовими для використання в харчових продуктах і місцевих композиціях. Наприклад, камедь бобів локусти в порошкоподібній формі є в продажу від компанії Tic Gums Inc. [Beicam, MD]. Якщо полісахаридні смоли присутні в композиції, їх кількість складає приблизно від 0,1 процента до 5 процентів від загальної маси композиції, переважно приблизно від 0,5 процента до 3 процентів. В одному переважному варіанті здійснення даного винаходу полісахаридна смола присутня в кількості 2,5% мас. Показові композиції представлені в прикладах нижче. Необов'язковою альтернативою полісахаридній смолі є поліакриловий кислотний полімер. Загальна сукупність поліакрилових кислотних полімерів відома під загальною назвою «карбомер». Карбомер являє собою поліакриловий кислотний полімер, в малій мірі зшитий з поліалкеніловим поліефіром. Його можна придбати у компанії B.F. Goodrich Company (Akron, Ohio) під назвою "Carbopol™". Особливо переважним рядом карбомеру є "Carbopol 940". Інші поліакрилові кислотні полімери, відповідні для застосування в практиці даного винаходу, є комерційно доступними під назвами "Pemulen™" [B.F. Goodrich Company] і "Polycarbophil™" [A.H. Robbins, Richmond, VA]. Полімери Pemulen™ являють собою співполімери С 10-С30 алкілакрилатів і одного або більше мономерів акрилової кислоти, метакрилової кислоти або одного з їх простих ефірів, зшитого з аліловим ефіром сахарози або аліловим ефіром пентаеритритолу. Полімер Polycarbophil™ являє собою поліакрилову кислоту, зшиту з дивінілгліколем. При наявності полімерів поліакрилової кислоти вони складають приблизно від 0,5 процента до 5 процентів від загальної маси композиції. Відповідні полімери поліакрилової кислоти, що розріджуються при зсуві, включають в себе псевдопластичні полімери і співполімери поліакрилової кислоти. Іншим важливим компонентом даного винаходу є ліпофільна сполука. В одному варіанті здійснення даного винаходу термін "ліпофільна сполука", що використовується в цьому документі, відноситься до агента, який є одночасно ліпофільним і гідрофільним. С1-С8-аліфатичні спирти, С2С30 аліфатичні складні ефіри і їх суміші можуть служити ліпофільною сполукою. Прикладами відповідних спиртів є етанол, н-пропанол і ізопропанол, в той час як відповідними складними ефірами є етилацетат, бутилацетат, етиллаурат, метилпропіонат, ізопропілміристат і ізопропілпальмітат. Термін "аліфатичний спирт", що використовується в цьому документі, включає в себе поліоли, такі як гліцерин, пропіленгліколь і поліетиленгліколі. Суміш спирту і складного ефіру є переважною і, зок 18 рема, суміш етанолу і е тиллаурату є переважною. В одному варіанті здійснення даного винаходу С2-С30-аліфатичні складні ефіри і їх суміші, що містять ліпофільну сполуку, включають в себе C8С30-аліфатичні складні ефіри гліцерину, вибрані з групи, що складається з моногліцеридів, дигліцеридів, тригліцеридів і їх сумішей. Відповідні аліфатичні складні ефіри включають в себе ефір гліцерину і насичених жирних кислот, ненасичених жирних кислот і їх сумішей. Відповідні насичені жирні кислоти включають в себе капронову кислоту, каприлову кислоту, капринову кислоту, ла уринову кислоту, міристинову кислоту, пальмітинову кислоту, стеаринову кислоту, арахінову кислоту, бегенову кислоту і лігноцеринову кислоту. Відповідні ненасичені жирні кислоти включають в себе олеїнову кислоту, лінолеву кислоту і ліноленову кислоту. Відповідні складні ефіри гліцерину включають в себе гліцерилмоноолеат, триолеан, триміристин і тристеарин, переважно триміристин. Необхідна концентрація ліпофільної сполуки змінюється відповідно до інших чинників, таких як бажана напівтверда консистенція і бажані ефекти, що прискорюють проникнення через шкіру. Зручно, якщо концентрація ліпофільної сполуки складає приблизно від 0,5 процента до 40 процентів від загальної маси композиції. Переважна місцева композиція містить ліпофільну сполуку в межах від 7 процентів до 40 процентів від загальної маси композиції. У випадку, коли використовують суміш аліфатичного спирту і аліфа тичного складного ефіру, відповідна кількість спирту складає приблизно від 0,5 процента до 10 процентів. В одному переважному варіанті здійснення даного винаходу кількість спирту складає приблизно від 5 процентів до 15 процентів, в той час як аліфатичний складний ефір складає приблизно від 2 процентів до 15 процентів (також від загальної маси композиції). В іншому переважному варіанті здійснення даного винаходу кількість спирту складає приблизно від 5 процентів до 10 процентів, в той час як аліфатичний складний ефір складає приблизно від 0 процентів до 10 процентів (також від загальної маси композиції). Необов'язковим, але переважним компонентом даного винаходу є емульгатор. Незважаючи на те, що він не є принциповим чинником, число гідрофільно-ліпофільного балансу відповідного емульгатора буде складати більше 10. Складний ефір сахарози і, зокрема, стеарат сахарози, можуть служити емульгаторами для місцевої композиції згідно з винаходом. Стеарат сахарози є добре відомим емульгатором, і його можна придбати з різних комерційних джерел. У випадку, коли використовується емульгатор, стеарат сахарози переважно присутній в кількості приблизно до 2 процентів від загальної маси композиції. Переважну кількість емульгатора стеарату са харози також можна виразити як масове співвідношення емульгатора і полїсахаридної смоли. Співвідношення емульгатора і смоли 1 до 6 є переважним, а співвідношення 1 до 4 є найбільш переважним для отримання бажаної напівтвердої консистенції і стійкості до розділення. Інші емульгатори також є відповідними і вклю 19 79759 чають в себе ефір поліоксіетиленсорбітану, довголанцюгові спирти, переважно цетостеариловий спирт, і гліцериди жирних кислот. Відповідні ефіри поліоксіетиленсорбітану включають в себе монолаурат [Tween 20, Span 20], монопальмітат [Τween 40], моностеарат [Tween 60] і моноолеат [Tween 80], а також їх суміші. Переважні гліцериди жирних кислот включають в себе гліцерилмоноолеат, триолеан, триміристин і тристеарин. Даний винахід додатково включає в себе систему кислотного буфера. Системи кислотного буфера служать для підтримки або створення pH композицій в межах бажаних величин. Термін «буферна система» або «буфер», що використовується в цьому документі, означає агент, що розчиняється у воді або агенти, які, коли вони знаходяться у водному розчині, стабілізують вказаний розчин від великих змін pH (або концентрації або активність іонів водню), коли до нього додають кислоти або основи. Агент або агенти, що розчиняються у воді, які, таким чином, відповідальні за стійкість до змін pH від початкового буферного значення pH в межах, вказаних вище, добре відомі фа хівцям. У той час як існують численні інші відповідні буфери, такі як ацетатні буфери, моногідрат фосфату калію довів свою ефективність в композиціях згідно з винаходом. Відповідні концентрації буфера знаходяться в межах приблизно від 0,005 Μ до 1,0 М. Переважні концентрації буфера знаходяться в межах приблизно від 0,05 Μ до 0,2 М. У деяких переважних варіантах здійснення даного винаходу концентрація буфера становить 0,1 М. Кінцева величина pH фармацевтичної композиції згідно з винаходом може варіювати в межах фізіологічно сумісних значень. Необхідно, щоб кінцева величина pH не подразнювала шкіру. Не виходячи за межі вказаних обмежень, можна підібрати величину pH для поліпшення стабільності простагландину Е1 і підбору консистенції, якщо це потрібно. В одному варіанті здійснення даного винаходу переважна величина pH складає приблизно від 3,0 до 7,4, більш переважно - приблизно від 3,0 до 6,5, найбільш переважно - приблизно від 3,5 до 6,0. Компонентом композиції, що залишився, є вода, яку необхідно очистити. Композиція містить воду в межах приблизно від 50 до 90 процентів від загальної маси композиції. Конкретна кількість присутньої води не є принциповою, однак необхідно підбирати її таким чином, щоб отримати бажану консистенцію і/або концентрацію інших компонентів. Крім того, можна додавати відомі підсилювачі черезшкірного проникнення, якщо це бажано. Прикладами є диметилсульфоксид (DMSO), диметилацетамід (DMA), 2-піролідон, Ν,Ν-діетил-мтолуамід (DEET), 1-додецилазациклогептан-2-он [Azone™, зареєстрований товарний знак компанії Nelson Research], Ν,Ν-диметилформамід, Nметил-2-піролідон, тіогліколят кальцію, оксазолідинон, похідні діоксолану, похідні лаурокапраму і макроциклічні підсилювачі, такі як макроциклічні кетони. Стабілізатори простагландину E1 фарбувальні 20 агенти, реологічні агенти і консерванти можна додавати до такої міри, щоб вони надмірно не обмежували проникнення простагландину E1 через шкіру і не впливали несприятливим чином на бажану напівтверду консистенцію. Передбачуваними лікарськими формами напівтвердої фармацевтичної композиції згідно з винаходом є креми, гелі, мазі, колоїдні суспензії і т.п., включаючи також, без обмеження, композиції, відповідні для застосування з черезшкріними пластирами і подібними пристроями. Інгредієнти, перераховані вище, можна комбінувати в будь-якому порядку і будь-яким способом, внаслідок чого виходить стабільна композиція, що включає в себе простагландин E1 рівномірно диспергований в напівтвердій композиції. Один доступний підхід до виготовлення вказаних композицій має на увазі рівномірне диспергування полісахаридної смоли (або поліакрилової кислоти) в заздалегідь змішаному розчині вода/буфер, а потім ретельну гомогенізацію (тобто перемішування) отриманої суміші («частина А»). Якщо в композиції присутній емульгатор, його додають до розчину вода/буфер до диспергування полісахаридної смоли. Для доведення величини pH частини А до бажаного рівня можна використати будь-який відповідний спосіб, наприклад, додання концентрованих фосфорної кислоти або гідроксиду натрію. Окремо простагландин E1 розчиняють при перемішуванні в ліпофільній сполуці, яка сама по собі може бути сумішшю спиртів, складних ефірів або спирту і складного ефіру. Потім додають підсилювач проникнення. Альтернативно, коли ліпофільна сполука містить і спирт, і складний ефір, простагландин E1 можна розчиняти в спирті перед доданням підсилювача проникнення, після чого додають складний ефір. У будь-якому випадку отримана суміш являє собою суміш, яка містить простагландин E1 («частина В»). Кінцева стадія включає в себе відносно повільне додання (наприклад, по краплях) частини В в частину А при постійному перемішуванні. Отримана місцева композиція при порівнянні демонструє переваги, описані вище, включаючи поліпшене проникнення і біодоступність простагландину Ε ι без передозування лікарського засобу, менше пошкодження шкіри і пов'язане з ним запалення і підвищену гнучкість в доступних лікарських формах. Вказані композиції можна застосовувати для пролонгованого лікування захворювання периферичних судин, чоловічої імпотенції і інших порушень, які лікуються простагландином E1 в той же час уникаючи низької біодоступності і швидкого хімічного розкладання, пов'язаних з іншими способами доставки. Нанесення простагландину E1 в місцевій композиції за даним винаходом на шкіру пацієнта дозволяє безперервно вводити заздалегідь певну кількість простагландину E1 і уникати небажаних ефектів, що виникають після однократного або багаторазових введень більш високих доз шляхом ін'єкції. Шляхом забезпечення уповільненої швидкості дозування рівень простагландину E1 в тканині-мішені пацієнта можна краще підтримувати в оптимальних терапевтичних ме 21 79759 жах. В одному варіанті здійснення даний винахід відноситься до композиції, що містить приблизно від 0,01 процента до 5 процентів модифікованої полісахаридної смоли; 05001%-1% простагландину, вибраного з групи, що складається з PG E1, його фармацевтично прийнятних солей, його ефіру з нижчими алкілами і їх сумішей; приблизно від 0,5 процента до 10 процентів DDAIP або його солей; приблизно від 0,5 процента до 10 процентів нижчого спирту, вибраного з групи, що складається з етанолу, пропанолу, ізопропанолу і їх сумішей; приблизно від 0,5 процента до 10 процентів складного ефіру, вибраного з групи, що складається з етиллаурату, ізопропілміристату, ізопропіллаурату і їх сумішей; від маси композиції, і кислотний буфер. Переважно композиція включає в себе також близько 2 процентів стеарату сахарози. Необов'язково, композиція також містить приблизно до 5 процентів емульгатора, переважно приблизно до 2 процентів емульгатора. Відповідні емульгатори включають в себе гліцерилмоноолеат, триолеан, триміристин і тристеарин. Переважним емульгатором є триміристин. Практичне здійснення даного винаходу показане на наступних прикладах. Вказані приклади ілюструють даний винахід, але не обмежують його об'єм. Варіації терапевтичних композицій, які не надають несприятливого впливу на ефективність простагландину E1 будуть очевидні для фахівця і входять в обсяг даного винаходу. Наприклад, додаткові інгредієнти, такі як забарвлюючі агенти, антимікробні консерванти, емульгатори, віддушки, стабілізатори простагландину E1 і т.п., можна включати в склад композицій, якщо композиції, що виходять, будуть зберігати бажані властивості, як описано вище. У разі своєї присутності консерванти звичайно додають в кількостях приблизно від 0,05 до 0,30%. Відповідні консерванти включають в себе метилпарабени (метил РАВА), пропілпарабени (пропіл РАВА) і бутилгідрокситолуол (ВНТ). Відповідні віддушки і ароматичні агенти відомі фахівцям; відповідний ароматичний агент являє собою приблизно до 5 процентів миртенолу, переважно приблизно 2 проценти миртенолу від загальної маси композиції. Композиції згідно з винаходом можуть також містити малу кількість, приблизно від 0,01 до 4% мас, місцевого анестетика, якщо це бажано. Типові місцеві анестетики містять лідокаїн, диклонін, дибукаїн, їх фармацевтично прийнятні солі і суміші. В одному переважному варіанті здійснення даного винаходу місцевий анестетик являє собою приблизно 0,5 процента диклоніну від загальної маси композиції. Якщо не вказано інше, кожну композицію виготовляють звичайним змішуванням відповідно позначених компонентів. Приклад 1: Місцева композиція А простагландину E1 Композицію А виготовляли таким чином. Частину А композиції виготовляли розчиненням 0,4 масових частин простагландину E1 [Alprostadil USP] в 5 масових частинах етилового спирту. Потім 5 масових частин додецил-2-(N,N 22 диметиламін)пропіонату домішували в розчин спирт-простагландин E1 з подальшим доданням 5 масових частин етиллаурату. Частину В виготовляли, починаючи з розчину вода/буфер, pH5,5. Розчин вода/буфер отримували доданням до очищеної води моногідрату фосфату калію в кількості, достатній для отримання ОД Μ розчину. pH розчину вода/буфер доводили до 5,5 розчином сильної основи (1Η гідроксидом натрію) і сильної кислоти (1Η фосфорною кислотою). Буферний розчин становив приблизно 80 частин всієї композиції. Всі частини, перераховані в даному описі, являють собою масові частини. До буферного розчину додавали 0,5 масових частин етиллаурату. Потім камедь бобів локусти (у вигляді порошку) диспергували в буферному розчині і гомогенізували з використанням гомогенізатора. У таблиці 1 нижче наведений перелік інгредієнтів. Отримана композиція являла собою напівтвердий препарат, який легко розподіляється, придатний для нанесення на шкіру, що не вимагає використання підтримуючих пристроїв, таких як пластири і липкі смужки. Композиція була гомогенною на зовнішній вигляд і стійкою до розділення. Приклади додаткових композицій B-Η виготовляли таким же способом, з використанням компонентів, перерахованих в таблиці 1. Як відмічалося вище, в інших варіантах здійснення даного винаходу, таких як композиція Н, композиція може включати в себе модифіковану полісахаридну смолу, якщо зручно, модифіковану галактомананову смолу, таку як гуарова камедь. Альтернативно, замість полісахаридної смоли можна використати поліакриловий полімер. Композицію А оцінювали на предмет проникнення в шкіру з використанням скиненої шкіри змії як модельного бар'єру. Скинену шкіру змії отримували з віварію Канзаського університету. Головну і хвостову частини видаляли, шкіру розділяли випадковим способом на експериментальні частини, а потім гідратували шляхом просочення. Зразки потім оцінювали з використанням дифузійних осередків типу Franz (площа поверхні 1,8см 2). Конкретно, шматочки шкіри закріпляли на верхній частині рецепторного осередку вертикального вузла дифузійних осередків, в який був вбудований маленький магнітний стрижень і який був наповнений ізотонічним буфером. Над шматочком шкіри вміщували герметичне покриття, а потім донорський осередок. Обидва осередки щільно скріпляли один з одним. Відомі кількості композицій наносили на дно маленького флакона з кришкою (маса 0,5 грама), який точно відповідав донорському осередку, щоб гарантувати однорідний розподіл. Флакони вміщували на шкіру в донорському осередку. Для того, щоб зменшити випаровування інгредієнтів, донорський осередок і флакон прикріпляли один до одного водонепроникною клейкою стрічкою. Осередки переносили на водяну баню, що перемішується (32 градуси по Цельсію). Зразки витягували з осередків кожну годину протягом чотирьох годин і аналізували на концентрацію простагландину E1; зміни концентрації відображали проникаючу кількість. Тести з множи 23 79759 ною зразків шкіри дали результати, які були усереднені. Обговорення використання скиненої шкіри змії для оцінки проникнення лікарських засобів [див. в патенті США №4771004, виданому Higuchi], який включений в цей документ як посилання, в тому, що стосується питання, яке розглядається. Простагландин E1 проникав швидко, з відносно підтримуваною швидкістю протягом чотирьох годин. Результати вивчення проникнення представлені в таблиці 2, нижче, і на Фіг.3. Приклад 2: Місцева композиція В простагландину E1 Композицію В виготовляли з використанням інгредієнтів, перерахованих в таблиці 1, нижче. Композиція В містила більше простагландину E1 ніж композиція А. Не дивлячись на більший вміст лікарського засобу, композиція В мала схожу напівтверду консистенцію і однорідний зовнішній вигляд. Проникнення простагландину E1 вимірювали, як описано в прикладі 1. Композиція В забезпечувала відносно швидку, підтримувану доставку простагландину E1. Результати представлені в таблиці 2, нижче, і на Фіг.3. Приклад 3: Місцева композиція С простагландину E1 Композицію С виготовляли з використанням інгредієнтів, перерахованих в таблиці 1, нижче. Композиція С містила більше простагландину E1 ніж композиція А або В. Підвищений вміст лікарського засобу впливав незначним чином або не надавав впливу на консистенцію або зовнішній вигляд, які значною мірою співпадали з вказаними параметрами композицій А і В. Проникнення простагландину E1 також вимірювали, як описано в прикладі 1. Композиція С також забезпечувала відносно швидку, підтримувану доставку простагландину E1. Результати представлені в таблиці 2, нижче, і на Фіг.3. Приклад 4: Місцева композиція D простагландину E1 Композицію D виготовляли з використанням інгредієнтів, перерахованих в таблиці 1, нижче. Рівень простагландину E1 знову був підвищений 24 без істотного впливу на сприятливу консистенцію і стійкість до розділення. Проникнення простагландину E1 також вимірювали, як описано в прикладі 1. Результати представлені в таблиці 2, нижче, і на Фіг.3. Приклад 5: Місцева композиція Ε простагландину E1 Композицію Ε виготовляли з використанням інгредієнтів, перерахованих в таблиці 1, нижче. Для оцінки відновлювальності композицій згідно з винаходом рецептуру для композиції D знову застосовували для композиції Е. Відновлювальність була практично підтверджена сприятливою консистенцією і стійкістю до розділення композиції Е. Проникнення простагландину E1 також вимірювали, як описано в прикладі 1. Композиція Ε також забезпечувала відносно швидку і підтримувану доставку простагландину E1. Результати представлені в таблиці 2, нижче, і на Фіг.3. Приклад 6: Місцева композиція F простагландину E1 В композиції F рівень простагландину E1 знову був підвищений. Конкретні інгредієнти перераховані в таблиці 1. Сприятлива консистенція і стійкість до розділення не поменшали. Результати аналізу проникнення представлені в таблиці 2, нижче, і на Фіг.3. Приклад 7: Місцева композиція G простагландину E1 Композицію G виготовляли з використанням інгредієнтів, перерахованих в таблиці 1. Для композиції G повторювали процедуру композиції F, за винятком того, що складноефірний компонент (етиллаурат) був опущений, а рівень етанолу був збільшений на відповідну кількість. Отримана композиція також легко розподілялася, мала напівтверду консистенцію, однорідний зовнішній вигляд і стійкість до розділення. Результати аналізу проникнення представлені в таблиці 2, нижче, і на Фіг.3. Будучи все ще сприятливими, дані результати відображають відносну перевагу композицій згідно з винаходом, в яких є ліпофільна сполука, що містить як складноефірний компонент, так і спиртовий компонент. 25 79759 26 Приклад 8: Порівняння властивостей проникнення У таблиці 2 показана сумарна кількість простагландину E1, що проникає кожну годину протягом 4 годин, для кожного прикладу композиції згідно з винаходом. Вказані дані демонструють здатність даного винаходу доставляти лікарський засіб простагландину E1 через шкіру. Фіг.3 являє собою графік, побудований за даними, наведеними в таблиці 1. Достовірно, і як показано в графічній формі, композиції згідно з винаходом забезпечують ефективне проникнення через шкіру відносно швидко і з підтримуваною швидкістю. Сумарне проникнення підвищувалося з підвищенням вмісту простагландину E1 в композиції, що служила його джерелом. Для подальшої оцінки ефективності композицій згідно з винаходом були виготовлені порівняльні композиції. Перший порівняльний приклад (порівняльний приклад 1) виготовляли так само, як композиції D і Е, за винятком того, що підсилювач проникнення DDAIP був опущений. Для другого порівняльного прикладу (порівняльний прикладі) DDAIP також був опущений, але рівень етанолу був збільшений на відповідну кількість. Конкретні інгредієнти представлені в таблиці 3, нижче. Проникнення простагландину E1 вимірювали, як описано в прикладі 1. Результати представлені в таблиці 4, нижче. 27 Дані таблиці 4 графічно порівнюються з прикладами композицій, що мають один і той же вміст простагландину E1 композиціями D і Ε на Фіг.4. Дані по проникненню показують, що композиції згідно з винаходом сильно виграють від присутності підсилювача проникнення DDAIP. Приклад 9: Подвійне сліпе з однократним застосуванням і відкрите клінічні випробування Безпека і ефективність місцевої композиції (композиція D прикладу 4 і таблиці 1, вище), що містить 0,4% мас, простагландину E1 (простагландин E1 або альпростадил), оцінювали загалом на 143 чоловіках в трьох установах. Дане дослідження складалося з подвійної сліпої, з контролем плацебо, перехресної частини і відкритої частини. У подвійну сліпу, з контролем плацебо частину дослідження увійшло 64 чоловіки (таблиця 5, нижче). Сімдесят дев'ять (79) чоловіків увійшло у відкриту частину дослідження (таблиця 5, нижче). Нижче підсумоване обговорення результатів клінічних випробувань. Критерії включення 1. Чоловіки, вік 21-70 років. 2. Документально підтверджений анамнез еректильної дисфункції, що визначається як нездатність досягати і підтримувати ерекцію достатньої для статевого акту ригідності, внаслідок психогенних, неврогенних або васкулогенних причин, протягом попередніх 6 місяців. У дану груп у могли входити пацієнти, які могли ще мати деяку кількість ерекцій, достатніх для статевого акту, але не постійно, що є типовою скаргою у віці виникнення імпотенції від легкої до помірної, у чоловіків. Діагноз еректильної дисфункції основувався на анамнезі і фізикальному обстеженні. Критерії виключення 1. Анамнез стриктури або обструкції уретри. 2. Будь-яке поєднання фактів з анамнезу, фізикального обстеження або скринінгових досліджень, які вказували на попередні порушення функції серця, печінки і/або нирок (такі як застійна серцева недостатність, нестабільна стенокар 79759 28 дія або недавній гострий інфаркт міокарда, неконтрольований діабет, еректильна дисфункція гормонального походження), які, з точки зору дослідника, могли вплинути на результати випробувань. 3. Анамнез оперативного втручання на статевому членові, включаючи імплантати статевого члена, простатектомію або рак передміхурової залози, травми статевого члена, включаючи параплегію або тетраплегію. 4. Будь-який стан, який міг привести до приапізму, такий як серповидноклітинна анемія, множинна мієлома або лейкоз. 5. Гіпертензія (в положенні сидячи діастолічний тиск > 90 або систолічний тиск > 150), що вимагає лікування препаратами, які не є інгібіторами ангіотензинперетворювального ферменту (інгібіторами АПФ). 6. Наявність захворювання, що передається статевим шляхом, за результатами фізикального обстеження. 7. Застосування ін'єкції в кавернозні тіла або зовнішнього еректильного пристрою протягом 4 тижнів до входження в дане випробування. 8. Хвороба Пейроні або будь-який пальпований фіброзний шрам або бляшка на статевому члені, ознаки вигину при набуханні і стимуляції ригідності або аномалія шкіри або слизової оболонки головки статевого члена. 9. Будь-яке супутнє медикаментозне лікування, про яке відомо, що воно перешкоджає сексуальній активності, таке як прийом антидепресантів, деяких антигіпертензивних агентів, седативних засобів, гормонів і деяких лікарських засобів для лікування алергії. 10. Отримання будь-якого експериментального лікування протягом 30 днів від моменту входження в дане випробування. 11. Нездатність або небажання дати інформовану згоду. Популяція пацієнтів в даному дослідженні складалася з чоловіків у віці 49-70 років. 29 79759 30 Клінічну ефективність оцінювали за історією хвороби пацієнта і оцінними анкетами для пацієнта до і після медикаментозного лікування, з використанням шестибальної шкали класифікації (таблиця 6). Кожному пацієнту давали одне (1) плацебо і одну (1) активну дозу перехресно з періодом, вільним від випробувань від 5 до 7 днів, в подвійній сліпій частині дослідження. У відкритій частині пацієнтам давали тільки одну (1) активну дозу. Клінічний набір був упакований в контейнери, що містять одну дозу, що складається з 250мг (маса нетто) крему і 1,0мг простагландину E1. Коефіцієнт ефективності відповіді визначали як кількість чоловіків, які мали ерекцію, достатню для статевого акту, із загальної кількості чолові ків. Для того, щоб результат розцінювався як успішний, після введення дози необхідно було набрати від 8 до 10 балів, або пацієнт повинен був мати статевий акт. При статистичному аналізі порівнювали набрані бали до і після, з використанням парного tкритерію. Статистично достовірна різниця (Р
ДивитисяДодаткова інформація
Назва патенту англійськоюProstaglandin compositions and methods of treatment for male erectile dysfunction
Назва патенту російськоюКомпозиция простагландина (варианты), применение композиции для лечения эректильной дисфункции у мужчин
МПК / Мітки
МПК: A61P 15/10, A61K 31/557
Мітки: лікування, композиція, застосування, чоловіків, композиції, дисфункції, еректильної, варіанти, простагландину
Код посилання
<a href="https://ua.patents.su/20-79759-kompoziciya-prostaglandinu-varianti-zastosuvannya-kompozici-dlya-likuvannya-erektilno-disfunkci-u-cholovikiv.html" target="_blank" rel="follow" title="База патентів України">Композиція простагландину (варіанти), застосування композиції для лікування еректильної дисфункції у чоловіків</a>
Попередній патент: Блок акустичний для ультразвукового контролю зварних швів труб
Наступний патент: Кодовий замок-блокувальник
Випадковий патент: Спосіб вимірювання коефіцієнта направленого відбиття поверхні