Похідні піперидину, спосіб їх отримання та фармацевтична композиція на їх основі
Номер патенту: 81014
Опубліковано: 26.11.2007
Автори: Спрінґторп Брайан, Лангерст Крістофер, Кеффрі Мойа, Перрі Мет'ю, Моучел Тобіас
Формула / Реферат
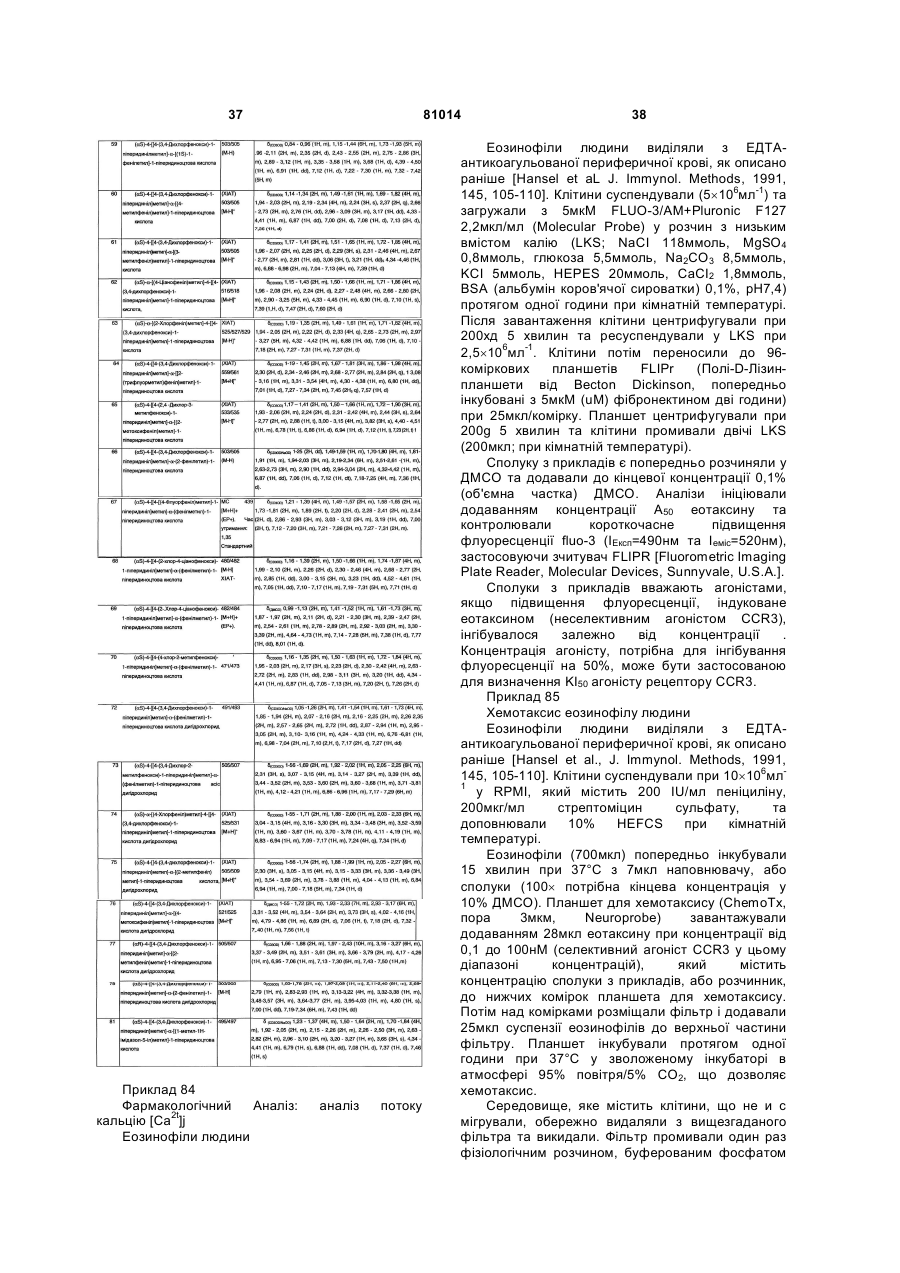
1. Похідні піперидину загальної формули (І):
 , (I)
, (I)
де:
Rа та Rb незалежно представляють гідроген або С1-4алкіл або Rа утворює частину кільця, як визначено нижче;
Rс - гідроген або гідроксил;
Х - СН2, С(О), О, S, S(О), S(О)2 або NR3;
Z - СНRd(СН2)n;
n дорівнює 0 або 1;
Rd - гідроген, С1-4алкіл, гідроксил або С1-4алкокси;
R1 - гідроген, С1-6алкіл, арил або гетероцикліл;
R2 - арил або гетероцикліл;
де, якщо не встановлено інакше, вищезгадані арил та гетероцикліл, як варіант, заміщено замісником: галоген, ціано, нітро, гідроксил, оксо, S(О)рR4, ОС(О)NR5R6, NR7R8, NR9С(О)R10, NR11С(О)NR12R13, S(О)2NR14R15, NR16S(О)2R17, С(О)NR18R19, С(О)R20, СО2R21, NR22СО2R23, С1-6алкіл, СF3, С1-6алкоксі(С1-6)алкіл, С1-6алкокси, ОСF3, С1-6алкоксі(С1-6)алкокси, С1-6алкілтіо, С2-6алкеніл, С2-6алкініл, С3-10циклоалкіл (сам, як варіант, заміщений С1-4алкілом або оксо), метилендіокси, дифлуорметилендіокси, феніл, феніл(С1-4)алкіл, фенокси, фенілтіо, феніл(С1-4)алкокси, гетероцикліл, гетероцикліл(С1-4)алкіл, гетероциклілокси або гетероцикліл(С1-4)алкокси; де будь-який з вищезгаданих фенілу та гетероциклілу, як варіант, заміщено замісником: галоген, гідроксил, нітро, S(О)q(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3;
або Z, R2 та Rа разом з атомом карбону, до якого Z та Rа приєднані, утворюють кільце;
р та q незалежно дорівнюють 0, 1 або 2;
R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R18, R19, R20, R21 та R22 незалежно представляють гідроген, С1-6алкіл (як варіант, заміщений замісником: галоген, гідроксил або С3-10циклоалкіл), СН2(С2-6алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3) або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3);
альтернативно NR5R6, NR7R8, NRІ2R13, NRІ4R15, NR18R19 можуть незалежно утворювати 4-7-членне гетероциклічне кільце азетидину, піролідину, піперидину, азепіну, морфоліну або піперазину, останній, як варіант, заміщено С1-4алкілом на дистальному нітрогені;
R4, R17 та R23 незалежно представляють С1-6алкіл (як варіант, заміщений замісником: галоген, гідроксил або С3-10циклоалкіл), СН2(С2-6алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3) або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3);
R3 - гідроген, С1-6алкіл або бензил;
або їх N-оксиди; або їх фармацевтично прийнятні солі або сольвати.
2. Сполука формули (І) за п. 1, де Х - О.
3. Сполука формули (І) за п. 1 або 2, де арильні та гетероциклільні частини R1 та R2 є, як варіант, незалежно заміщеними замісником: галоген, ціано, нітро, гідроксил, оксо, S(О)рR4, ОС(О)NR5R6, NR7R8, NR9С(О)R10, NR11С(О)NR12R13, S(О)2NR14R15, NR16S(О)2R17, С(О)NR18R19, С(О)R20, СО2R21, NR22СО2R23, С1-6алкіл, СF3, С1-6алкоксі(С1-6)алкіл, С1-6алкокси або ОСF3; р дорівнює 0, 1 або 2; R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R18, R19, R20, R21 та R22 незалежно представляють гідроген, С1-6алкіл (як варіант, заміщений галогеном) або феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2, S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2, ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2, СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3); та R4, R17 та R23 незалежно представляють С1-6алкіл (як варіант, заміщений галогеном) або феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2, S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2, ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2, СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3).
4. Сполука формули (І) за будь-яким з пп. 1, 2 або 3, де R1 - феніл, як варіант, заміщений замісником: галоген, ціано, С1-4алкіл або С1-4алкокси.
5. Сполука формули (І) за будь-яким з пп. 1, 2, 3 або 4, де Rа - гідроген.
6. Сполука формули (І) за будь-яким з пп. 1, 2, 3, 4 або 5, де Rb - гідроген або метил.
7. Сполука формули (І) за будь-яким з пп. 1, 2, 3, 4, 5 або 6, де Rс - гідроген.
8. Сполука формули (І) за будь-яким з попередніх пунктів, де Rd - гідроген, гідроксил або С1-4алкіл.
9. Сполука формули (І) за будь-яким з попередніх пунктів, де Z - СН2, СН2СН2, СНСН3 або СНОН.
10. Сполука формули (І) за будь-яким з попередніх пунктів, де R2 - феніл або гетероцикліл, як варіант, заміщений замісником: галоген, ціано, нітро, гідроксил, NR7R8, С1-6алкіл (як варіант, заміщений галогеном), С1-6алкокси (що, як варіант, заміщено галогеном), S(О)р(С1-6алкіл), S(О)rСF3 або S(О)2NR14R15; р та r незалежно дорівнюють 0, 1 або 2; та R7, R8, R14 і R15 незалежно представляють гідроген, С1-6алкіл (як варіант, заміщений замісником: галоген, гідроксил або С3-10циклоалкіл), СН2(С2-5 алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2, S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3) або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2, S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3); або альтернативно NR7R8 або NR14R15 можуть незалежно утворювати 4-7-членне гетероциклічне кільце азетидину, піролідину, піперидину, азепіну, морфоліну або піперазину, останній, як варіант, заміщено С1-4алкілом на дистальному нітрогені.
11. Сполука формули (І) за будь-яким з попередніх пунктів, де R2 представляє феніл або гетероцикліл, як варіант, заміщений замісником: галоген, ціано, гідроксил, С1-4алкіл, С1-4 галогеналкіл або С1-4алкокси.
12. Сполука формули (І) за будь-яким з попередніх пунктів, де гетероцикліл представляє індоліл, імідазоліл, тієніл або піридиніл.
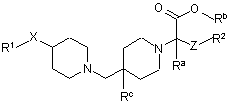
13. Спосіб отримання сполуки формули (І) за п. 1, за яким здійснюють:
взаємодію сполуки формули (ІІ):
 (II)
(II)
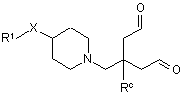
зі сполукою формули (ІІІ):
 (III)
(III)
у присутності NаВН(ОАс)3 або NаВН3(СN) у придатному розчиннику при придатній температурі; або
коли Rb не є гідрогеном, у присутності NаВН(ОАс)3, у присутності придатної основи у придатному розчиннику при придатній температурі.
14. Спосіб отримання сполуки формули (І) за п. 1, за яким:
за умови, коли Rа представляє Н, здійснюють взаємодію сполуки формули (ІХ):
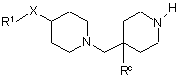 (IX)
(IX)
зі сполукою формули (Х):
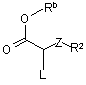 , (X)
, (X)
де L є придатною відщеплюваною групою, у придатному розчиннику у присутності основи при температурі у діапазоні від 0 °С до 30 °С.
15. Спосіб отримання сполуки формули (І) за п. 1, за яким:
коли Rа представляє Н, здійснюють гідроліз сполуки формули (ХІV):
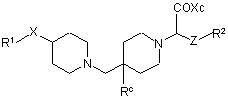 , (XIV)
, (XIV)
де Хс є допоміжною хіральною групою, у придатному розчиннику, при температурі між 10 °С і температурою кипіння розчинника під зворотним холодильником.
16. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль або сольват за п. 1 та фармацевтично придатні ад’ювант, розріджувач або носій.
17. Сполука формули (І) або її фармацевтично прийнятна сіль або сольват за п. 1 для застосування у терапії.
18. Сполука формули (І) або її фармацевтично прийнятна сіль або сольват за п. 1 для виготовлення медикаменту для застосування у терапії.
19. Спосіб лікування опосередкованого хемокіном хворобливого стану у ссавця, потерпаючого від названої хвороби або при її ризику, який полягає у введенні ссавцю у разі необхідності такого лікування терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі або сольвату за п. 1.
Текст
1. Похідні піперидину загальної формули (І): O O Rb C2 2 (19) 1 3 утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3); альтернативно NR5R6, NR7R8, NRІ2R13, NRІ4R15, NR18R19 можуть незалежно утворювати 4-7-членне гетероциклічне кільце азетидину, піролідину, піперидину, азепіну, морфоліну або піперазину, останній, як варіант, заміщено С1-4алкілом на дистальному нітрогені; R4, R17 та R23 незалежно представляють С1-6алкіл (як варіант, заміщений замісником: галоген, гідроксил або С3-10циклоалкіл), СН2(С2-6алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 вище), S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1С(О)N(С1-4алкіл)2 (ці алкіли можуть 4алкіл), поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), СО2Н, СО2(С1-4алкіл), NНС(О)(С14алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3) або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), ціано, С1-4алкіл, С14алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 вище), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3); R3 - гідроген, С1-6алкіл або бензил; або їх N-оксиди; або їх фармацевтично прийнятні солі або сольвати. 2. Сполука формули (І) за п. 1, де Х - О. 3. Сполука формули (І) за п. 1 або 2, де арильні та гетероциклільні частини R1 та R2 є, як варіант, незалежно заміщеними замісником: галоген, ціано, нітро, гідроксил, оксо, S(О)рR4, ОС(О)NR5R6, NR7R8, NR9С(О)R10, NR11С(О)NR12R13, 14 15 16 17 S(О)2NR R , NR S(О)2R , С(О)NR18R19, С(О)R20, СО2R21, NR22СО2R23, С1-6алкіл, СF3, С1-6алкоксі(С16)алкіл, С1-6алкокси або ОСF3; р дорівнює 0, 1 або 2; R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R18, R19, R20, R21 та R22 незалежно представляють гідроген, С1-6алкіл (як варіант, заміщений галогеном) або феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С14алкіл), N(С1-4алкіл)2, S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2, ціано, С14алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2, СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С14 17 та R23 незалежно 4алкіл), СF3 або ОСF3); та R , R представляють С1-6алкіл (як варіант, заміщений галогеном) або феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С14алкіл), N(С1-4алкіл)2, S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2, ціано, С1 81014 4алкіл, 4 С1-4алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2, СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С14алкіл), СF3 або ОСF3). 4. Сполука формули (І) за будь-яким з пп. 1, 2 або 3, де R1 - феніл, як варіант, заміщений замісником: галоген, ціано, С1-4алкіл або С1-4алкокси. 5. Сполука формули (І) за будь-яким з пп. 1, 2, 3 або 4, де Rа - гідроген. 6. Сполука формули (І) за будь-яким з пп. 1, 2, 3, 4 або 5, де Rb - гідроген або метил. 7. Сполука формули (І) за будь-яким з пп. 1, 2, 3, 4, 5 або 6, де Rс - гідроген. 8. Сполука формули (І) за будь-яким з попередніх пунктів, де Rd - гідроген, гідроксил або С1-4алкіл. 9. Сполука формули (І) за будь-яким з попередніх пунктів, де Z - СН2, СН2СН2, СНСН3 або СНОН. 10. Сполука формули (І) за будь-яким з попередніх пунктів, де R2 - феніл або гетероцикліл, як варіант, заміщений замісником: галоген, ціано, нітро, гідроксил, NR7R8, С1-6алкіл (як варіант, заміщений галогеном), С1-6алкокси (що, як варіант, заміщено галогеном), S(О)р(С1-6алкіл), S(О)rСF3 або S(О)2NR14R15; р та r незалежно дорівнюють 0, 1 або 2; та R7, R8, R14 і R15 незалежно представляють гідроген, С1-6алкіл (як варіант, заміщений замісником: галоген, гідроксил або С310циклоалкіл), СН2(С2-5 алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2, S(О)2(С14алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R7 та R8 нижче), ціано, С1-4алкіл, С1-4алкокси, С(О)NН2, С(О)NН(С1С(О)N(С1-4алкіл)2 (ці алкіли можуть 4алкіл), поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), СО2Н, СО2(С1-4алкіл), NНС(О)(С14алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3) або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NН2, NН(С1-4алкіл), N(С1-4алкіл)2, S(О)2(С1-4алкіл), S(О)2NН2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), ціано, С1-4алкіл, С14алкокси, С(О)NН2, С(О)NН(С1-4алкіл), С(О)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R7 та R8 нижче), СО2Н, СО2(С1-4алкіл), NНС(О)(С1-4алкіл), NНS(О)2(С1-4алкіл), С(О)(С1-4алкіл), СF3 або ОСF3); або альтернативно NR7R8 або NR14R15 можуть незалежно утворювати 4-7-членне гетероциклічне кільце азетидину, піролідину, піперидину, азепіну, морфоліну або піперазину, останній, як варіант, заміщено С1-4алкілом на дистальному нітрогені. 11. Сполука формули (І) за будь-яким з попередніх пунктів, де R2 представляє феніл або гетероцикліл, як варіант, заміщений замісником: галоген, ціано, гідроксил, С1-4алкіл, С1-4 галогеналкіл або С1-4алкокси. 12. Сполука формули (І) за будь-яким з попередніх пунктів, де гетероцикліл представляє індоліл, імідазоліл, тієніл або піридиніл. 13. Спосіб отримання сполуки формули (І) за п. 1, за яким здійснюють: взаємодію сполуки формули (ІІ): 5 81014 O R1 X N O Rc (II) зі сполукою формули (ІІІ): O O Rb H2N Z R2 X N Z R2 N (III) у присутності NаВН(ОАс)3 або NаВН3(СN) у придатному розчиннику при придатній температурі; або коли Rb не є гідрогеном, у присутності NаВН(ОАс)3, у присутності придатної основи у придатному розчиннику при придатній температурі. 14. Спосіб отримання сполуки формули (І) за п. 1, за яким: за умови, коли Rа представляє Н, здійснюють взаємодію сполуки формули (ІХ): H X R1 N N Rc (IX) зі сполукою формули (Х): Rb O Z R2 L де L є придатною відщеплюваною групою, у придатному розчиннику у присутності основи при температурі у діапазоні від 0 °С до 30 °С. 15. Спосіб отримання сполуки формули (І) за п. 1, за яким: коли Rа представляє Н, здійснюють гідроліз сполуки формули (ХІV): COXc R1 Ra O 6 , (X) Представлений винахід стосується похідних піперидину, що мають фармацевтичну активність, способів отримання таких похідних, фармацевтичних композицій, які містять такі похідні та застосування таких похідних як активних терапевтичних засобів. Фармацевтично активні похідні піперидину розкрито [у WO 99/38514, WO 99/04794 та WO 00/35877]. Гістамін, 2-(4-імідазоліл)-етиламін, є основним аміном та утворюється із гістидину гістидиндкарбоксилазою. Його знайдено у більшості тканин тіла, але у високих концентраціях він присутній у легенях, шкірі та у шлунковокишковому тракті. На клітинному рівні запальні клітини, як-то тучні клітини та базофіли зберігають велику кількість гістаміну. Зрозуміло, що ця дегрануляція тучних клітин та базофілів та наступне вивільнення гістаміну є фундаментальним механізмом, відповідальним за клінічні прояви алергічного процесу. Гістамін реалізує свою дію впливом на специфічні сполучені з G-білком рецепторів гістаміну, яких є Rc , (XIV) де Хс є допоміжною хіральною групою, у придатному розчиннику, при температурі між 10 °С і температурою кипіння розчинника під зворотним холодильником. 16. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль або сольват за п. 1 та фармацевтично придатні ад’ювант, розріджувач або носій. 17. Сполука формули (І) або її фармацевтично прийнятна сіль або сольват за п. 1 для застосування у терапії. 18. Сполука формули (І) або її фармацевтично прийнятна сіль або сольват за п. 1 для виготовлення медикаменту для застосування у терапії. 19. Спосіб лікування опосередкованого хемокіном хворобливого стану у ссавця, потерпаючого від названої хвороби або при її ризику, який полягає у введенні ссавцю у разі необхідності такого лікування терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі або сольвату за п. 1. три головні типи Н1, Н2 та Н3, Агоністи гістаміну Н1 охоплюють найбільший клас медикаментів, застосованих у лікуванні пацієнтів з алергічними розладами, наприклад, ринітом або кропивницею. Агоністи Н1 є корисними у регулюванні алергічного відгуку, наприклад, блокуванням дії гістаміну на після-капілярну венулу гладенького м'язу, що призводить до зниження судинної проникності, ексудації та набряку. Агоністи також блокують дію гістаміну на рецептори Н1, на ноцицептивні нервові волокна с-типу, що призводить до зниження сверблячки та чхання. Хемокінами є хемотактичні цитокіни, які вивільняються багатьма різноманітними клітинами, що приваблюють макрофаги, Τ клітини, еозинофіли, базофіли та нейтрофіли до місць запалення, а також грають роль у дозріванні клітин імунної системи. Хемокіни грають важливу роль у імунних та запальних відгуках у різних хворобах та розладах, охоплюючи астму та алергічні хвороби, а також автоімунні патології, як-то ревматоїдний артрит та атеросклероз. Ці малі секретовані молекули є зростаючим суперсімейством білків 7 81014 розміром 8-14кДа, які характеризуються збереженням чотирьох цистеїнових мотифів (функціональних послідовностей). Суперсімейство хемокіну може бути розділеним на дві головні групи, які представляють характерні структурні мотифи, сімейства Cys-X-Cys (C-X-C, або α) та Cys-Cys (C-C, або β). Це встановлено на основі вставки одиничної амінокислоти між NHпроксимальною парою залишків цистеїну та подібності послідовностей. Хемокіни С-Х-С залучають кілька сильнодіючих хемоатрактантів та активаторів нейтрофілів, як-то інтерлейкін-8 (IL-8) та нейтрофіл-активувальний пептид 2 (ΝΑΡ-2). Хемокіни С-С залучають потужні хемоатрактанти моноцитів та лімфоцитів, але не нейтрофілів, як-то моноцитарні хемотактичні білки людини 1-3 (МСР-1, МСР-2 та МСР-3), RANTES (Regulated на Activation, Normal T Expressed та Secreted), еотаксин та запальні білки макрофагів 1α та 1β (МІР-1α та ΜΙΡ-1β). Дослідження показали, що дії хемокінів опосередковані підсімействами зв'язаних з Gбілками рецепторів, серед яких є рецептори, позначені CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10, CXCR1, CXCR2, CXCR3 та CXCR4. Ці рецептори є гарними цілями для розробки ліків, оскільки засоби, які модулюють ці рецептори, будуть корисними у лікуванні розладів та хвороб, що наведені вище. Відомо, що вірусні інфекції викликають запалення легень. Було показано експериментально, що звичайна застуда підвищує вироблення еотаксину слизовою оболонкою дихальних шляхів. Закапування еотаксину у ніс може імітувати деякі ознаки та симптоми застуди. (See, GreiffL et al Allergy (1999) 54(11) 1204-8 [Експериментальне підвищення виробки еотаксину слизовою оболонкою при звичайній застуді у атопічних індивідуумів] та Kawaguchi Μ et al Int. Arch. Allergy Immunol. (2000) 122 SI 44 [Експресія еотаксину епітеліальними клітинами нормальних дихальних шляхів після інфікування вірусом А].) Представлений винахід пропонує сполуку формули (І): (I) де: Ra та Rb незалежно представляють гідроген або С1-4алкіл, або Ra утворює частину кільця як визначено нижче; Rc представляє гідроген або гідроксил; Х-СН2, С(О), О, S, S(O), S(O)2 або NR3; Z-CHRd(CH2)n; n дорівнює 0 або 1: Rd представляє гідроген, С1-4алкіл, гідроксил або С1-4алкокси;. R1 представляє гідроген, С1-4алкіл, арил або гетероцикліл; R2 представляє арил або гетероцикліл; 8 де, якщо не встановлено інакше, вищезгадані арил та гетероцикліл, як варіант, заміщено замісником: галоген, ціано, нітро, гідроксил, оксо, S(O)pR4, OC(O)NR5R6, NR7R8, NR9C(O)R10, 11 12 13 14 15 NR C(O)NR R , S(O)2NR R , NR16S(O)2R17, C(O)NR18R19, C(O)R20, CO2R21, NR22CO2R23, С1CF3, С1-6алкоксиС1-6алкіл, С1-6алкокси, 6алкіл, OCF3, С1-6алкокси(С1-6)алкокси, С1-6алкілтю, С2С2-6алкініл, С3-10циклоалкіл (сам, як 6алкеніл, варіант, заміщений С1-4алкілом або оксо), метилендіокси, дифлуорметилендіокси, феніл, феніл(С1-4)алкіл, фенокси, фенілтіо, феніл(С1гетероцикліл(С1-4)алкіл, 4)алкокси, гетероцикліл, гетероциклілокси або гетеро цикл(С1-4)алкокси; де будь-який із тільки вищезгаданих фенілу та гетероциклілу є, як варіант, заміщено замісником: галоген, гідроксил, нітро, S(O)q(С1-4)алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл), S(O)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для Rs та R6 нижче), ціано, С1-4алкіл, С14алкокси, C(O)NH2, С(О)NН(С1-4алкіл), С(О)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NНС(O)(С1-4алкіл), NHS(O)2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3; або Ζ, R2 та Ra разом з атомом карбону, до якого Ζ та Ra приєднані, формують кільце; р та q незалежно дорівнюють 0, 1 або 2; R5, R6,R7, R8, R9, R10 R11, R12, R13,R14, R15, R16, R18, R19, R20, R21 та R22 незалежно представляють гідроген, С1-6алкіл (як варіант, заміщений замісником: галоген, гідроксил або С310циклоапкіл), СН2(С2-6алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NН(С1-4алкiл), N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), S(О)2(С1-4алкіл), S(O)2NH2, S(O)2NH(C1—4алкіл), S(O)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), ціано, С1-4алкіл, С1-4алкокси, C(O)NH2, C(O)NH(С1-4aлкiл), С(О)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NHC(O)(С1-4алкіл), NHS(O)2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3 або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NН(С1N(С1-4алкіл)2 (ці алкіли можуть 4алкіл), поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), S(О)2(С1-4алкіл), S(O)2NH2, S(О)2NН(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), ціано, С1-4алкіл, С14алкокси, C(O)NH2, C(O)NH(С1-4алкіл), С(О)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NHC(O)(С1-4алкіл), NHS(O)2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3); альтернативно NR5R6, NR7R8, NR12R13, NR14R15, NR18R19 можуть незалежно утворювати 47-членне гетероциклічне кільце азетидину, піролідину, піперидину, азепіну, морфоліну або піперазину, останнє, як варіант, заміщено С14алкілом на дистальному нітрогені; 9 R4, R17 та R23 незалежно представляють С16алкіл (як варіант, заміщений замісником: галоген, гідроксил або С3-10циклоалкіл), СН2С2-6алкеніл), среніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NH(C1-4алкіл), N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 вище), S(O)2(С1-4алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл), S(O)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), ціано, С1-4алкіл, С1-4алкокси, C(O)NH2, C(O)NH(С1С(О)N(С1-4алкіл)2 (ці алкіли можуть 4алкіл), поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), СО2Н, СО2(С1-4алкіл), NHC(O)(С14алкіл), NНS(O) 2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3) або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NH(С1-4алкіл), N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 і R6 вище), S(О)2(С1-4алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл), S(O)2N(C1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), ціано, С1-4алкіл, С14алкокси, C(O)NH2, C(O)NH(С1-4алкіл), С(О)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 вище), СО2Н, СО2(С1-4алкіл), NHC(O)(С1-4алкіл), NHS(O)2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3); R3 представляє гідроген, С1-6алкіл або бензил; або її N-оксид; або її фармацевтично прийнятна сіль або сольват. Деякі сполуки представленого винаходу можуть існувати у різних ізомерних формах (як-то енантіомери, діастреоізомери, геометричні ізомери або таутомери). Представлений винахід передбачає усі такі ізомери та їх суміші в усіх співвідношеннях. Придатні солі залучають кислотно-адитивні солі, як-то хлорид, дихлорид, бромід, фосфат, сульфат, ацетат, діацетат, фумарат, малєат, тартрат, цитрат, оксалат, метансульфонат або птолуолсульфонат. Сполуки винаходу можуть існувати як сольвати (як-то гідрати) та представлений винахід передбачає усі такі сольвати. Галоген охоплює флуор, хлор, бром та йод. Галогеном є, наприклад, флуор або хлор. Алкіли та їх частини мають лінійні або розгалужені ланцюги та містять, наприклад, від 1 до 6 (як-то від 1 до 4) атомів карбону. Прикладами алкілів є метил, етил, н-пропіл, ізопропіл або третбутил. Алкіл, як варіант, заміщений галогеном та галогеналкілом, містить алкільну частину та один або більше (наприклад від 1 до 6) однакових або різних атомів галогену. Алкілом, як варіант, заміщеним галогеном та галогеналкілом є, наприклад, CF3, Алкеніли та алкініли містять, наприклад, від 2 до 6 (як-то від 2 до 4) атомів карбону. Прикладами груп алкенілу є вініл або аліл; та прикладом алкінілу є пропаргіл. Арил охоплює феніл та нафтил та у одному втіленні винаходу є, наприклад, фенілом. У одному втіленні циклоалкіли містять від 3 до 10 (як-то від 3 до 8, наприклад від 3 до 6) атомів 81014 10 карбону та є моно-, ди- або трициклічними. Цикпоалкілом є, наприклад, циклопропіл, циклопентил, циклогексил, норборніл або камфорил. Кільце циклоалкілу є, як варіант, конденсованим з кільцем бензолу (наприклад, утворюючи кільцеву систему біцикпо[4,2,0]окта1,3,5-триєнілу або інданлу). У подальшому втіленні циклоапкіл є моноциклічним. Гетероцикліл представляє ароматичне або неароматичне 5- або 6-членне кільце, як варіант, конденсоване з одним або більше іншими кільцями, які містять принаймні один гетероатом, вибраний із групи, яка містить нітроген, оксиген та сульфур; або його N-оксид, або S-оксид або Sдіоксид. Гетероциклілом є, наприклад, фурил, тієніл (також відомий як тіофеніл), піроліл, 2,5дигідропіроліл, тіазоліл, піразоліл, оксазоліл, ізоксазоліл, імідазоліл, піперидиніл, морфолініл, піридиніл, дигідропіридиніл (наприклад у частині 6оксо-1,6-дигідро-піридинілу), піримідиніл, індоліл, 2,3-дигідроіндоліл, бензо[b]фурил (також відомий як-бензфурил), бенз[b]тієніл (також відомий як бензтієніл або бензтіофеніл), 2,3дигідробенз[b]тієніл (наприклад у частині 1-діоксо2,3-дигідробенз[b]тієнілу), індазоліл, бензімідазоліл, бензтріазоліл, бензоксазоліл, бензтіазоліл (наприклад у частині 1Н-бензтіазол-2он-ілу), 2,3-дигідробензтіазоліл (наприклад у частині 2,3-дигідробензтіазол-2-он-ілу), 1,2,3бензотіадіазоліл, імідазопіридиніл (як-то імідазо[1,2-a]піридиніл), тієно[3,2-b]піридин-6-іл, 1,2,3-бензоксадіазоліл, бензо[1,2,3]тіадіазоліл, 2,1,3-бензотіадіазоліл, бензофуразан (також відомий як 2,1,3-бензоксадіазоліл), хіноксалініл, дигідро-1-бензопіриліуміл (наприклад у частині кумаринілу або хромонілу), 3,4-дигідро-1Н-2,1бензотіазиніл (наприклад у частині 2-діоксо-3,4дигідро-1Н-2,1-бензотіазинілу), піразолопіридин (наприклад 1Н-піразоло[3,4-b]піридиніл), пурин (наприклад у частині 3,7-дигідро-пурин-2,6-діон-8ілу), хінолініл, ізохінолініл, дигідроізохінолініл (наприклад у частині 2Н-ізохінолін-1-одн-ілу), нафтиридиніл (наприклад [1,6]нафтиридиніл або [1,8]нафтиридиніл), дигідро[1,8]нафтиридиніл (наприклад у частині 1Н-[1,8]нафтиридин-4-однілу), бензотіазиніл, дигідробензотіазиніл (наприклад у частині 4Н-бензо[1,4]тіазин-3-он-ілу), бензо[d]імідазо[2,1-b]тіазол-2-іл або дибензотіофеніл (також відомий як дибензотієніл) або їх N-оксид, або S-оксид або S-діоксид. N-оксид сполуки формули (1) є, наприклад, 1окси-[1,4']піперидиніл-1'-ільною сполукою. У одному особливому аспекті винахід пропонує сполуку формули (І), де Ra та Rb незалежно представляють гідроген або С1-4алкіл або Ra утворює частину кільця, як визначено нижче; Rc представляє гідроген або гідроксил; XСН2, С(О), О, S, S(O), S(O)2 або NR3; Ζ-(СН2)n; n дорівнює 1 або 2; R1 представляє гідроген, С12 4алкіл, арил або гетероцикліл; R є арилом або гетероциклілом; де, якщо не встановлено інакше, вищезгадані арил та гетероцикліл, як варіант, заміщено замісником: галоген, ціано, нітро, гідроксил, оксо, S(O)pR4, OC(O)NR5R6, NR7R8, NR9C(O)R10, NR11C(O)NR12R13, S(O)2NR14R15, 11 NR16S(O)2R17, C(O)NR18R19, C(O)R20, CO2R21, NR22CO2R23, С1-6алкіл, CF3, С1-6алкокси(С1-6)алкіл, С1-6алкокси, OCF3, С1-6алкокс(С1-6)алкокси, С16алкілтіо, С2-6алкеніл, С2-6алкініл, С3-10циклоалкіл (сам, як варіант, заміщений С1-4алкілом або оксо), метилендіокси, дифлуорметилендіокси, феніл, феніл(С1-4)алкіл, фенокси, фенілтіо, феніл(С1гетероцикліл(С1-4)aлкіл, 4)алкокси, гетероцикліл, гетероциклілокси або гетероцикліл(С1-4)алкокси; де будь-який із тільки вищезгаданих фенілу та гетероциклілу є, як варіант, заміщено замісником: галоген, гідроксил, нітро, S(O)q(С1-4алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл), S(O)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для Rs та R6 нижче), ціано, С1-4алкіл, С14алкокси, C(O)NH2, C(O)NH(С1-4алкіл), С(О)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NHC(O)(С1-4aлкiл), NНS(O)2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3; або Ζ, R2 та Ra разом з атомом карбону, до якого Ζ та Ra приєднані, формують кільце; p та q незалежно дорівнюють 0,1 або 2; R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, 16 R , R18, R19, R20, R21 та R22 незалежно представляють гідроген, С1-6алкіл (як варіант, заміщений замісником: галоген, гідроксил або С310циклоалкіл), СН2(С2-6алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NH(С1-4алкіл), N(C1-4алкіл)2, S(O)2(С14алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл), S(O)2N(C1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 нижче), ціано, С1-4алкіл, С1-4алкокси, C(O)NH2, C(O)2NH(С1С(О)N(С1-4алкіл)2 (ці алкіли можуть 4алкіл), поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО2(С1-4алкіл), NHC(O)(С14алкіл), NHS(O)2(C1-4алкіл), С(O)(С1-4алкіл), CF3 або OCF3 або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NH(C1-4алкіл), N(С1-4алкіл)2, S(O)2(C1-4алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл), S(О)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 нижче), ціано, С1-4алкіл, С14алкокси, C(O)NH2, C(O)NH(С1-4алкіл), С(О)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 нижче), СО2Н, СО(С1-4алкіл), NHC(O)(С1-4алкіл), NHS(O)2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3); альтернативно NR5R6, NR7R8, NR12R13, NR14R15, NR18R19, можуть незалежно утворювати 4-7членне гетероциклічне кільце азетидину, піролідину, піперидину, азепіну, морфоліну або піперазину, останній, як варіант, заміщено С14 17 та R23 4алкілом на дистальному нітрогені; R , R незалежно представляють С1-6алкіл (як варіант, заміщений замісником: галоген, гідроксил або С310циклоалкіл), СН2С2-6алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NH(С1-4алкіл), N(C1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), S(O)2(C1-4алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл), S(O)2N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), ціано, С1-4алкіл, С1 81014 4алкокси, 12 C(O)NH2, C(O)NH(С1-4алкіл), C(O)N(C1(ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R6 та R6 вище), СО2Н, СО2(С1-4алкіл), NHC(O)(С1-4алкіл), NHS(O)2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3) або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NH(С1N(С1-4алкіл)2 (ці алкіли можуть 4алкіл), поєднуватися, утворюючи кільце, як описано для R5 andR6 вище), S(O)2(С1-4алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл), S(O)2N(C1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R5 та R6 вище), ціано, С1-4алкіл, С14алкокси, C(O)NH2, C(O)NH(С1-4алкіл), C(O)N(С1(ці алкіли можуть поєднуватися, 4алкіл)2 утворюючи кільце, як описано для R5 та R6 вище), СО2Н, СО2(С1-4алкіл), NHC(O)(С1-4алкіл), NHS(O)2(С1-4алкіл), С(О)(С1-4алкіл), CF3 або OCF3); R3 представляє гідроген, С1-4алкіл або бензил; або її N-оксид; або її фармацевтично прийнятна сіль або сольват. У подальшому аспекті винахід пропонує сполуку формули (І), де X-О. В іншому аспекті винаходу вищезгадані арильні (наприклад феніл) та. гетероциклільні частини R1 та R2, як варіант, незалежно заміщені одним із групи: галоген, ціано, нітро, гідроксил, оксо, S(O)рR4, OC(O)NR5R6, NR7R8, NR9C(O)R10 NR11C(O)NR12R13, S(O)2NR14R15, NR16S(O)2R17, C(O)NR18R19, C(O)R20, CO2R21, NR22CO2R23, C16алкіл, CF3, C1-6алкокси(C1-6)алкіл, C1-6алкокси або OCF3; р дорівнює 0, 1 або 2; R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R18, R19, R20, R21 та R22 незалежно представляють гідроген, C1-6алкіл (як варіант, заміщений галогеном) або феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NН(C1-4алкіл), N(C1-4алкіл)2, S(O)2(C14алкіл), S(O)2NH2, S(O)2NH(C1-4алкіл), S(O)2N(C14алкіл)2, ціано, C1-4алкіл, С1-4алкокси, C(O)NH2, C(O)NH(C1-4алкіл), С(О)N(C1-4алкіл)2, СО2Н, СО2(C1-4алкіл), NHC(O)(C1-4алкіл), NHS(O)2(C14 17 і 4алкіл), C(O)(C1-4алкіл), CF3 або OCF3); та R , R R23 незалежно представляють C1-6алкіл (як варіант, заміщений галогеном) або феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NH(C1-4алкіл), N(С1-4алкіл)2, S(О)2(С14алкіл), S(O)2NH2, S(O)2NH(C1-4алкіл), S(O)2N(C14алкіл)2, ціано, C1-4алкіл, C1-4алкокси, C(O)NH2, C(O)NH(C1-4алкіл), Ο(Ο)Ν(C1-4алкіл)2, СО2Н, СО2(С1-4алкіл), NHC(O)(C1-4алкіл), NНS(O)2(C14алкіл), С(О)(C1-4алкіл), CF3 або OCF3). Коли Z, R2 та Ra разом з атомом карбону, до якого Ζ та Ra приєднані, формують кільце, кільцем є, наприклад, 2,3-дигідро-1Н-інден-2-ільне кільце. У ще одному аспекті R1 представляє феніл, як варіант, заміщений (наприклад незалежно моноабо двічі заміщений) одним із групи: галоген (наприклад хлор або флуор), ціано, C1-4алкіл (наприклад метил) або C1-4алкокси (наприклад метокси). У подальшому аспекті R1 представляє феніл, як варіант, заміщений (наприклад незалежно моно- або дизаміщений) замісниками з групи: галоген (наприклад хлор або флуор), C1-4алкіл 4алкіл)2 13 (наприклад метил) або C1-4алкокси (наприклад метокси). У наступному аспекті R1 представляє феніл, як варіант, заміщений (наприклад одним, двома або трьома однаковими або різними) замісниками з групи: флуор, хлор, ціано, С1-4алкіл (наприклад метил) або C1-4алкокси (наприклад метокси). В іншому аспекті R1 представляє феніл, як варіант, заміщений (наприклад одним, двома або трьома однаковими або різними) замісниками з групи: флуор, хлор, C1-4алкіл (наприклад метил) або C1-4алкокси (наприклад метокси). У ще одному аспекті R3 представляє феніл, заміщений одним, двома або трьома (наприклад двома або трьома) замісниками, незалежно вибраними із групи: флуор, хлор, ціано та метил. У подальшому аспекті R1 представляє феніл, заміщений одним, двома або трьома (наприклад двома або трьома) замісниками, незалежно вибраними із групи: флуор, хлор та метил. Наприклад, R1 представляє 3,4-дихлорфеніл, 2,4-дихлор-3-метилфеніл, 3,4-дихлор-2метилфеніл, 2,4-дихлорфеніл, 4-хлор-2метилфеніл або 4-флуорфеніл. У наступному аспекті винаходу Ra представляє гідроген. В іншому аспекті винаходу Rc представляє гідроген або метил. У ще одному аспекті Rb представляє гідроген. У подальшому аспекті винаходу Rc представляє гідроген. У наступному аспекті винаходу Rd представляє гідроген, гідроксил або C1-4алкіл (якто метил). В іншому аспекті Ζ-СН2, СН2СН2, СНСН3 або СНОН. У подальшому аспекті Ζ-СН2, В іншому аспекті R2 представляє феніл або гетероцикліл, як варіант, заміщений замісником: галоген, ціано, нітро, гідроксил, NR7R8, C1-6алкіл (як варіант, заміщений замісником: галоген), C16алкокси (що, як варіант, заміщено галогеном), S(O)p(C1-6алкілом), S(O)rCF3 або S(O)2NR14R15; p та r незалежно представляють 0, 1 або 2; та R7, R8, R14 та R15 незалежно представляють гідроген, C16алкіл (як варіант, заміщений замісником: галоген, гідроксил або С3-10циклоалкіл), СН2(С2-5алкеніл), феніл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, ΝH2, NН(С1-4алкіл), N(С14алкіл)2, S(O)2(С1-4алкіл), S(O)2NH2, S(O)2NH(С1S(O)2N(С1-4алкіл)2 (ці алкіли можуть 4алкіл), поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), ціано, С1-4алкіл, С1-4алкокси, C(O)NH2, C(O)NH(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), СО2Н, CO2(С1-4алкіл), NHC(O)(С1-4алкіл), NHS(O)2(С1-4алкіл), С(О)(С14алкіл), CF3 або OCF3) або гетероцикліл (сам, як варіант, заміщений замісником: галоген, гідроксил, нітро, NH2, NH(С1-4aлкіл), N(С1-4алкіл)2, S(O)2(С14алкіл), S(O)2NH2, S(O)2NH(С1-4алкіл)( S(O)2N(С14алкіл)2(ці алкіли можуть поєднуватися, утворюючи кільце, як описано для R7 та R8 нижче), ціано, С14алкіл, С1-4алкокси, C(O)NH2) С(О)NН(С1-4алкіл), С(О)N(С1-4алкіл)2 (ці алкіли можуть поєднуватися, 81014 14 утворюючи кільце, як описано для R7 та R8 нижче), СО2Н, СО2(С1-4алкіл), NHC(С1-4aлкіл), NHS(O)2(С1С(О)(С1-4алкіл), CF3 або OCF3); або 4алкіл),альтернативно NR7R8 або NR14R15 можуть незалежно формувати 4-7-членне гетероциклічне кільце азетидину, піролідину, піперидину, азепіну, морфоліну або піперазину, останній, як варіант, заміщено С1-4алкілом на дистальному нітрогені. У ще одному аспекті винаходу R2 представляє феніл або гетероцикліл, як варіант, заміщений замісником: галоген (як-то флуор або хлор), ціано, гідроксил, С1-4алкіл (як-то метил), С1-4галогеналкіл (як-то CF3) або С1-4алкокси (як-то метокси). У подальшому аспекті R2 представляє феніл або гетероцикліл, як варіант, заміщений замісником: галоген (як-то флуор або хлор), С14алкіл (як-то метил), С1-4галогеналкіл (як-то CF3) або С1-4алкокси (як-то метокси). У наступному аспекті R2 представляє феніл, як варіант, заміщений замісником: галоген (як-то флуор або хлор), ціано, гідроксил, або С1-4алкіл (як-то метил). В іншому аспекті гетероцикліл є індоліл, імідазоліл, тієніл або піридиніл. У ще одному аспекті представлений винахід пропонує сполуку формули (І), де: Rc представляє гідроген; X-О; Ζ-СН2; R1 представляє феніл, заміщений галогеном (наприклад одним або двома атомами хлору) або С1-4алкіл (наприклад метил); R2 представляє феніл або гетероцикліл, як варіант, заміщений замісником: галоген (як-то флуор або хлор), С1-4алкіл (як-то метил), С14галогеналкіл (як-то CF3) або С1-4алкокси (як-то метокси); Rb представляє гідроген та гетероцикліл представляє індоліл, імідазоліл, тієніл або піридиніл. Rfl представляє гідроген. У подальшому аспекті представлений винахід пропонує сполуку формули (І), де: Ra та Rc є гідрогенами; Rb представляє гідроген або С1-4алкіл (як-то метил або трет-бутил); X-О; Ζ-СН2, СН2СН2, СНСН3 або СНОН; R1 представляє феніл, заміщений замісником: галоген (наприклад одним або двома атомами хлору), ціано або С1-4алкіл (наприклад метил); R2 представляє феніл або гетероцикліл, як варіант, заміщений замісником: галоген (як-то флуор або хлор), ціано, гідроксил, С1-4алкіл (як-то метил), С1-4галогеналкіл (як-то CF3) або С1-4алкокси (як-то метокси); та гетероцикліл представляє індоліл, імідазоліл, тієніл або піридиніл; або її сіль (як-то дигідрохлорид). Сполуки представленого винаходу можна отримати як описано нижче. Сполуку формули (І) можна отримати реакцією сполуки формули (II) (II) з сполукою формули (III): (III) у присутності NaBH(OAc)3 або NaBH3(CN) у придатному розчиннику (наприклад, аліфатичному 15 81014 спирті, як-то метанол або етанол) при придатній температурі (як-то у діапазоні від 0°С до 30°С). Альтернативно сполука формули (І), де Ro є не гідрогеном, можна отримати реакцією сполуки формули (II) з сполукою формули (III), де Rb є не гідрогеном, у присутності NaBH(OAc)3 у присутності придатної основи (як-то триетиламін) у придатному розчиннику (як-то тетрагідрофуран) при придатній температурі, (як-то у діапазоні від 0°С до 30°С). Для сполуки формули (І): - коли Rb представляє гідроген, названу сполуку можна перетворити у сполуку винаходу, де Rb не є гідрогеном, стандартним способом етерифікації, добре відомим у рівні техніки; та - коли R не є гідрогеном, названу сполуку можна перетворити у сполуку винаходу, де Rb представляє гідроген, стандартним способом гідролізу естеру, добре відомим у рівні техніки. Такі способи описано у студентських підручниках органічної хімії [як-то Advanced Organic Chemistry by J March, 5th edition Μ В Smith та J March, Wiley, 2001]. Сполуку формули (II) можна отримати реакцією сполуки формули (IV): (IV) з плюмбум тетраацетатом у присутності натрій карбонату у дихлорметані. Сполуку формули (IV) можна отримати відновленням сполуки формули (V): (V) бораном у тетрагідрофурані при нагріванні під зворотним холодильником. Сполуку формули (V) можна отримати окисненням сполуки формули (VI): (VI) осмій тетроксидом у присутності Nметилморфолін N-оксиду (NMMO) у водному ацетоні при температурі навколишнього середовища (наприклад 10-30°С). Сполуку формули (VI) можна отримати сполученням сполуки формули (VII): (VII) та сполуки формули (VIII): (VIII) у відповідних умовах (як-то EDCI/НОВТ/DMAP) у дихлорметані при температурі навколишнього середовища (наприклад 10-30°С). 16 Альтернативно сполуку формули (І), де Ra представляє, N можна отримати реакцією сполуки формули (IX) зі сполукою формули (X), де L є придатною відщеплюваною групою (наприклад бромід, трифлат або метансульфонат), у придатному розчиннику, наприклад дихлорметані, при температурі у діапазоні від 0°С до 30°С, у присутності основи (як-то три(С1-4алкіл)аміну, наприклад, триетиламіну або основи Hunig'a). Сполуку формули (IX) можна отримати зняттям захисту зі сполуки формули (XI): (XI) наприклад, застосовуючи трифлуорцтову кислоту у придатному розчиннику (як-то дихлорметані) або застосовуючи джерело гідрогенхлориду у придатному розчиннику (як-то діоксані). Сполуку формули (XI), де Rc є гідрогеном, можна отримати реакцією сполуки формули (VII) з сполукою формули (XII): (XII) у присутності NaBH(OAc)3 та оцтової кислоти у придатному розчиннику (як-то тетрагідрофурані або дихлорметані). Сполуку формули (XI), де Rc є гідроксилом, можна отримати реакцією сполуки формули (XI) з сполукою формули (XIII). (XIII) у придатному розчиннику (як-то С1спирті, наприклад етанолі) при температурі (від 0°С до 30°С, як-то від 15°С до 30°С). Альтернативно сполуку формули (І), де Ra представляє Н, можна отримати гідролізом сполуки формули (XIV), де Хс представляє хіральний допоміжний засіб добре відомого у рівні техніки типу (наприклад (4R,5S)-1,5-диметил-4фенілімідазолідин-2-он, (4,Н)-4-(фенілметил)-2оксазолідинон, (4S)-4-(фенілметил)-2оксазолідинон або (3аR,6S,7аS)-гексагідро-8,8диметил-3Н-3а,6-метано-2,1-бензізотіазол-2,2діоксид), наприклад, з водним натрій гідроксидом у придатному розчиннику (як-то аліфатичному спирті, наприклад метанолі), при температурі між 10°С та температурі кипіння розчиннику під зворотним холодильником, звичайно приблизно при 45°С, 6аліфатичному (XIV) 17 81014 Сполуку формули (XIV) можна отримати депротонуванням сполуки формули (XV), наприклад, літій гексаметилдисилазидом, при температурі між-78°С та 0°С, а далі реакцією з сполукою формули (XVI). при температурі між78°С та 0°, звичайно при-20°С. (XV) (XVI) Сполуку формули (XV) можна отримати реакцією сполуки формули (IX) з сполукою формули (XVII) у придатному розчиннику, наприклад тетрагідрофурані у присутності основи, наприклад, водного натрій гідрогенкарбонату при температурі навколишнього середовища. (XVII) Наступні сполуки формули (І) можна отримати пристосуванням шляхів, описаних вище, способів, описаних у рівні техніки, або нижченаведених прикладів. Сполуки формули (III), VII), (VIII) та (XVII) можна отримати, застосуванням або пристосуванням способів, описаних у рівні техніки. Отримання різних феноксипіперидинів [описано у WO 01/77101]. У вищеописаних способах може бути бажаним або необхідним захистити кислотну групу або гідроксил, або іншу потенційно реакційну групу. Придатні захисні групи та подробиці способів додавання та видалення таких груп можна знайти у ["Protective Groups in Organic Synthesis", 3rd Edition (1999) by Greene та Wuts]. В іншому аспекті представлений винахід пропонує способи отримання сполук формули (I). Сполуки формули (І) мають активність як фармацевтичні засоби, особливо як модулятори активності рецептору хемокіну (наприклад CCR3), та можуть бути застосованими у лікуванні автоімунних, запальних, проліферативних або гіперпроліферативних хвороб або імунологічно опосередкованих хвороб (охоплюючи відторгнення трансплантованих органів або тканин і синдром набутого імунодефіциту (СНІД)). Прикладами цих станів є: (1) (дихальний тракт) обструктивні хвороби дихальних шляхів, охоплюючи: хронічну обструктивну хворобу легень (COPD) (як-то незворотну COPD); астму {як-то бронхіальну, алергічну, ендогенну бронхіальну, екзогенну бронхіальну або пилову астму, особливо хронічну або застарілу астму (наприклад, пізню астму або гіперреактивність дихальних шляхів)}; бронхіт (якто еозинофільний бронхіт); гострий, алергічний, атрофічний риніт або хронічний риніт, охоплюючи риніт з утворенням казеозних мас, гіпертрофічний риніт, гнійний риніт, сухий риніт або медикаментозний риніт; мембранний риніт, охоплюючи крупозний, фібринозний або псевдомембранний риніт або золотушний риніт; сезонний риніт, охоплюючи нервову нежить (сінна 18 лихоманка) або вазомоторний риніт; саркоїдоз; легені фермера та пов'язані з цим хвороби; носовий поліпоз; фіброзна пухлина легень, ідіопатична інтерстиціальна пневмонія, протикашльова активність, лікування хронічного кашлю, асоційованого з запальними станами дихальних шляхів або ятрогенний змушений кашель; (2) (кістяк та суглоби) артрити, охоплюючи ревматичний, інфекційний, автоімунний, серонегативні спондилоартропатії (як-то анкілозуючий спондиліт, псоріазний артрит або хвороба Рейтера), хвороба Бекхета, синдром Сьоргена або системний склероз; (3) (шкіра та очі) псоріаз, атопічний дерматит, контактний дерматит або інші екзематозні дерматити, себорейний дерматит, плоский лишай, пемфігус, булезний пемфігус, булезний епідермоліз, кропивниця, ангІоgерма, еритемний васкуліт, шкірна еозинофілія, увеїт, гніздова алопеція, виразка роговиці або вісняний кон'юнктивіт; (4) (шлунково-кишковий тракт) хвороба черевної порожнини, проктит, еозинофільний гастроентерит, мастоцитоз, хвороба Крона, виразковий коліт, хвороба подразненого кишечнику або алергії, залежні від їжі, які маютьдію поза травним трактом (наприклад мігрень, риніт або екзема); (5) (відторгнення алотрансплантату) гостре та хронічне, наприклад, після трансплантації нирок, серця, печінки, легень, кісткового мозку, шкіри або роговиці; або хронічна хвороба "трансплантат проти "хазяїна"; та/або (6) (інші тканини або хвороби) хвороба Альцгеймера, розсіяний склероз, атеросклероз, синдром набутого імунодефіциту (СНІД), вовчакові розлади (як-то червоний вовчак або системний червоний вовчак), еритематоз, тиреоїдит Хашимото, злоякісна міастенія, діабет типу І, нефротичний синдром, еозинофільний фасцит, синдром гіпер-lgE, лепра (як-то лепроматозна лепра), хвороба зубів, синдром Цезарі, ідіопатична тромбоцитарна пупура або розлади менструального циклу; Сполуки формули (І) або її фармацевтично прийнятна сіль або сольват є також агоністами Н1 (і тому можуть бути застосованими у лікуванні алергічних розладів); і також можуть бути застосованими для регулювання ознаки та/або симптому, які звичайно відносять до застуди (наприклад ознака та/або симптом загальної застуди або грипу або іншої асоційованої з дихальним вірусом інфекції). Відповідно подальшій особливості представленого винаходу передбачено спосіб лікування опосередкованого хемокіном хворобливого стану (наприклад хворобливого стану, опосередкованого CCR3) у ссавця, як-то людини, страждаючого від названого хворобливого стану або при його ризику, який залучає застосування до ссавця у разі необхідності такого лікування терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі або сольвату. 19 Відповідно іншій особливості представленого винаходу передбачено спосіб протидії Н1 у ссавця, як-то людини, страждаючої від опосередкованого Н1 хворобливого стану або при його ризику, який містить застосування до ссавця у разі необхідності такого лікування терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі або сольвату. Відповідно наступній особливості представленого винаходу передбачено спосіб лікування ознаки та/або симптому, що звичайно відносять до застуди, у ссавця, як-то людини, страждаючої від названого хворобливого стану або при його ризику, який містить застосування до ссавця у разі необхідності такого лікування терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі або сольвату. Винахід також пропонує сполуку формули (І), або її фармацевтично прийнятну сіль або сольват для застосування у терапії. В іншому аспекті винахід пропонує застосування сполуки формули (І) або її фармацевтично прийнятної солі або сольвату у виготовленні медикаменту для застосування у терапії (наприклад, корегування активності рецептору хемокіну (наприклад, активності рецептору CCR3), протидії Н1 або лікуванні ознаки та/або симптому, який звичайно відносять до як застуди). Винахід подалі пропонує застосування сполуки формули (І) або її фармацевтично придатної солі у виготовленні медикаменту для застосування у лікуванні: (1) (дихальний тракт) обструктивні хвороби дихальних шляхів, охоплюючи: хронічну обструктивну хворобу легень (COPD) (як-то незворотну COPD); астму {як-то бронхіальну, алергічну, ендогенну бронхіальну, екзогенну бронхіальну або пилову астму, особливо хронічну або застарілу астму (наприклад, пізню астму або гіперреактивність дихальних шляхів)}; бронхіт (якто еозинофільний бронхіт}; гострий, алергічний, атрофічний риніт або хронічний риніт, охоплюючи риніт з утворенням казеозних мас, гіпертрофічний риніт, гнійний риніт, сухий риніт або медикаментозний риніт; мембранний риніт, охоплюючи крупозний, фібринозний або псевдомембранний риніт або золотушний риніт; сезонний риніт, охоплюючи нервову нежить (сінна лихоманка) або вазомоторний риніт; саркоїдоз; легені фермера та пов'язані з цим хвороби; носовий поліпоз; фіброзна пухлина легень, ідіопатична інтерстиціальна пневмонія, протикашльова активність, лікування хронічного кашлю, асоційованого з запальними станами дихальних шляхів або ятрогенний змушений кашель; (2) (кістяк та суглоби) артрити, охоплюючи ревматичний, інфекційний, автоімунний, серонегативні спондилоартропатії (як-то анкілозуючий спондиліт, . псоріазний артрит або хвороба Рейтера), хвороба Бекхета, синдром Сьоргена або системний склероз; 81014 20 (3) (шкіра та очі) псоріаз, атопічний дерматит, контактний дерматит або інші екзематозні дерматити, себорейний дерматит, плоский лишай, пемфігус, булезний пемфігус, булезний епідермоліз, кропивниця, ангІоgерма, еритемний васкуліт, шкірна еозинофілія, увеїт, гніздова алопеція, виразка роговиці або вісняний кон'юнктивіт; (4) (шлунково-кишковий тракт) хвороба черевної порожнини, проктит, еозинофільний гастроентерит, мастоцитоз, хвороба Крона, виразковий коліт, хвороба подразненого кишечнику або алергії, залежні від їжі, які мають дію поза травним трактом (наприклад мігрень, риніт або екзема); (5) (відторгнення алотрансплантату) гостре та хронічне, наприклад, після трансплантації нирок, серця, печінки, легень, кісткового мозку, шкіри або роговиці; або хронічна хвороба "трансплантат проти "хазяїна"; та/або (6) (інші тканини або хвороби) хвороба Альцгеймера, розсіяний склероз, атеросклероз, . синдром набутого імунодефіциту (СНІД), вовчакові розлади (як-то червоний вовчак або системний червоний вовчак), еритематоз, тиреоїдит Хашимото, злоякісна міастенія, діабет типу І, нефротичний синдром, еозинофільний фасцит, синдром гіпер-lgE, лепра (як-то лепроматозна лепра), хвороба зубів, синдром Цезарі, ідіопатична тромбоцитарна пупура або розлади менструального циклу; у ссавців (наприклад, людини). У подальшому аспекті винахід пропонує сполуку формули (І), або її фармацевтично придатну сіль для застосування у лікуванні астми {як-то бронхіальної, алергічної, ендогенної бронхіальної, екзогенної бронхіальної або пилової астми, особливо хронічної або застарілої астми (наприклад пізньої астми або гіперреактивності дихальних шляхів)}; або риніту {охоплюючи гострий, алергічний, атрофічний або хронічний риніт, як-то риніт з утворенням казеозних мас, гіпертрофічний риніт, гнійний риніт, сухий риніт або медикаментозний риніт; мембранний риніт, охоплюючи крупозний, фібринозний або псевдомембранний риніт або золотушний риніт; сезонний риніт, охоплюючи нервову . нежить (сінна лихоманка) або вазомоторний риніт}. У наступному аспекті сполука формули (І, або її фармацевтично придатна сіль є корисними у лікуванні астми. Представлений винахід також пропонує застосування сполуки формули (І), або її фармацевтично придатної солі у виготовленні медикаменту для застосування у лікуванні астми {як-то бронхіальної, алергічної, ендогенної бронхіальної, екзогенної бронхіальної або пилової астми, особливо хронічної або застарілої астми (наприклад пізньої астми або гіперреактивності дихальних шляхів)}; або риніту {охоплюючи гострий, алергічний, атрофічний або хронічний риніт, як-то риніт з утворенням казеозних мас, гіпертрофічний риніт, гнійний риніт, сухий риніт або медикаментозний риніт; мембранний риніт, охоплюючи крупозний, фібринозний або 21 псевдомембранний риніт або золотушний риніт; сезонний риніт, охоплюючи нервову нежить (сінна лихоманка) або вазомоторний риніт}. Для застосування сполуки винаходу або її фармацевтично прийнятної солі або ° сольвату для терапевтичного лікування ссавця, як-то людини, названу складову звичайно формують відповідно стандартній фармацевтичній практиці як фармацевтичну композицію. Тому в іншому аспекті представлений винахід пропонує фармацевтичну композицію, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль або сольват (активна складова) та фармацевтично придатний ад'ювант, розріджувач або носій. У подальшому аспекті представлений винахід пропонує спосіб отримання названої композиції, яка охоплює змішування активної складової з фармацевтично придатним ад'ювантом, розріджувачем або носієм. Залежно від способу застосування, фармацевтична композиція повинна, наприклад, містити від 0,05 до 99мас.%, як-то від 0,05 до 80мас.%, наприклад, від 0,10 до 70мас.%, як-то від 0,10 до 50мас.%, активної складової, усі мас-відсотки надано на основі загальної маси композиції. Фармацевтичні композиції цього винаходу можна застосовувати стандартним способом для хворобливого стану, що потребує лікування, наприклад, місцевим (як-то до легень та/або дихальних шляхів або до шкіри), пероральним, ректальним або-парентеральним. Для цього сполуки цього винаходу можна формувати способами, відомими у рівні техніки. Придатна фармацевтична композиція цього винаходу є композицією, придатною для перорального застосування у одиничній формі дозування, наприклад таблетці або капсулі, яка містить між 0,1мг та 1г активної складової. Кожний пацієнт може отримувати, наприклад, дозу від 0,01мг/кг до 100мг/кг, наприклад, у діапазоні від 0,1мг/кг до 20мг/кг активної складової, при застосуванні, наприклад, від 1 до 4 разів на добу. Винахід подалі стосується комбінованого лікування, де сполуку формули (1) або її фармацевтично придатну сіль, сольват або естер, здатний до гідролізу in vivo, або фармацевтичну композицію або рецептуру, що містить сполуку формули (1), застосовують одночасно або послідовно, або як комбінований препарат, з іншим терапевтичним засобом або засобами для лікування одного або більше перерахованих станів. Зокрема, для лікування запальних хвороб (але не обмежуючись ними) з групи: ревматоїдний артрит, остеоартрит, астма, алергічний риніт, хронічна обструктивна хвороба легень (COPD), псоріаз, та запальна кишкова хвороба, сполуки винаходу можна комбінувати з засобами із групи: нестероїдні протизапальні засоби (подалі NSAID), охоплюючи неселективні інгібітори циклооксигенази (СОХ)-1/СОХ-2, застосовані локально або системно (як-то піроксикам, диклофенак, пропіонові кислоти, як-то напроксен, флурбіпрофен, фенопрофен, кетопрофен та 81014 22 ібупрофен, фенамати, як-то мефенамінова кислота, індометацин, суліндак, азапропазон, піразолон, як-то фенілбутазон, саліцилати, як-то аспірин); селективні інгібітори СОХ-2 (як-то мелоксикам, целекоксиб, рофекоксиб, валдекоксиб, лумарококсиб, парекоксиб та еторикоксиб); циклооксигеназу інгібуючі донори оксиду азоту (CINOD); глюкокортикостероїди (застосовані місцевим, пероральним, внутрішньом'язовим, внутрішньовенним, або внутрішньосуглобовим шляхами); метотрексат, лефлуномід; гідроксихлорхін, d-пеніциламін, ауранофін або інші парентеральні або пероральні препарати золота; анальгетики; діацереїн; внутрішньосуглобовими терапіями, як-то похідними гіалуронової кислоти, та харчовими добавками, як-то глюкозамін. Представлений винахід подалі стосується комбінування сполуки винаходу з цитокіном або агоністом чи антагоністом функції цитокіну, (охоплюючи засоби, які діють на ситальні провідні шляхи цитокіну, як-то модулятори системи SOCS), охоплюючи альфа-, бета-, та гамма-інтерферони; інсуліноподібні фактори росту типу І (IGF-1); інтерлейкіни (IL), охоплюючи EL1-17, та агоністи або інгібітори інтерлейкіну, як-то анакінра; інгібітори фактору некрозу пухлин альфа (TNF-α), як-то анти-TNF монокпональні антитіла (наприклад інфліксимаб; адалімумаб, та CDP-870) та агоністи рецептору TNF, охоплюючи молекули імуноглобуліну (як-то етанерцепт) та засоби низькомолекулярної маси, як-то пентоксифулін. Представлений винахід подалі стосується комбінування сполуки винаходу модуляторами функції рецептору хемокіну, як-то агоністи CCR1, CCR2, CCR2A, CCR2B, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 та CCR11 (для сімейства С-С); CXCR1, CXCR2, CXCR3, CXCR4 та CXCR5 (для сімейства С-Х-С) та CX3CR1 для сімейства С-Х3-С. Представлений винахід подалі стосується комбінування сполуки винаходу з інгібітором матриксу металопротеаз (MMPs), тобто стромелізини, колагенази, та желатинази, а також агреканази ; зокрема колагеназа-1 (ММР-1), колагеназа-2 (ММР-8), колагеназа-3 (ММР-13), стромелізин-1 (ММР-3), стромелізин-2 (ММР-10) та стромелізин-3 (ММР-11), та ММР-9 та ММР-12, охоплюючи засоби, як-то доксициклін. Представлений винахід подалі стосується комбінування сполуки винаходу з інгібітором біосинтезу лейкотриєну, інгібітором 5ліпоксигенази (5-LO) або агоністом активуючого 5ліпоксигеназу білку (FLAP), як-то; зилейтон; АВТ761; фенлейтон; тепоксалін; Abbott-79175; Abbott85761; N-(5-заміщений)-тіофен-2алкілсульфонаміди; 2,6-ди-третбутилфенолгідразони; метокситетрагідропірани, як-то Zeneca ZD-2138; сполука SB-210661; сполуки піридинілзаміщеного 2-ціанонафталіну, як-то L739,010; сполуки 2-ціанохіноліну, як-то L-746,530; сполуки індолу та хіноліну, як-то МК-591, МК-886, та BAY x 1005, Представлений винахід подалі стосується комбінування сполуки винаходу з агоністом 23 рецептору для лейкотриєнів (LT) В4, LTC4, LTD4, та LTE4, вибраних із групи, що складається з фенотіазин-3-1s, як-то L-651,392; амідиносполук, як-то CGS-25019c; бензоксаламінів, як-то онтазоласт; бензолкарбоксиімідамідів, як-то BDL 284/260; та сполук, як-то зафірлукаст, аблукаст, монтелукаст, пранлукаст, верлукаст (МК-679), RG12525, Ro-245913, іралукаст (CGP 45715А), та BAY x 7195, Представлений винахід подалі стосується комбінування сполуки винаходу з інгібітором фосфодіестерази (PDE), як-то метилксантини, охоплюючи теофілін та амінофілін; та інгібіторів неселективного PDE-ізоферменту, охоплюючи інгібітори PDE4 та інгібітори ізоформу PDE4D, та інгібітори PDE5, Представлений винахід подалі стосується комбінування сполуки винаходу з агоністами рецептору гістаміну типу 1, як-то цетиризин, лоратадин, деслоратадин, фексофенадин, акривастин, терфенадин, астемізол, азеластин, левокарбастин, хлорфенірамін, прометазин, циклізин та мікроластин, застосований перорально, локально або парентерально. Представлений винахід подалі стосується комбінування сполуки винаходу з інгібітором протонних насосів (як-то омепразол) або агоністом рецептору гастрозахисного гістаміну типу 2. Представлений винахід подалі стосується комбінації сполуки винаходу з агоністами рецептору гістаміну типу 4, Представлений винахід подалі стосується комбінування сполуки винаходу з судинозвужувальним симпатомиметичним засобом агоністу адреноцептору альфа-1/альфа2, як-то пропілгекседрин, фенілефрин, фенілпропаноламін, ефедрин, псевдоефедрин, нафазолін гідрохлорид, оксиметазолін гїдрохлорид, тетрагідрозолін гідрохлорид, ксилометазолін гідрохлорид, трамазолін гідрохлорид, і етилнорепінефрин гідрохлорид. Представлений винахід подалі стосується комбінування сполуки винаходу з антихолінергічними засобами, охоплюючи агоністи мускаринового рецептору (М1, М2, та М3), як-то атропін, хіоскін, глікрпіролат, іпратропіум бромід, тіотропіум бромід, окситропіум бромід, пірензепін, та телензепін. Представлений винахід подалі стосується комбінування сполуки винаходу з агоністом бетаадреноцептера (охоплюючи підтипи бетарецептора 1-4), як-то ізопреналін, салбутамол, формотерол, салметерол, тербуталін, орципреналін, бутолтерол месилат, та пірбутерол, охоплюючи її хіральні енантіомери. Представлений винахід подалі стосується комбінування сполуки винаходу з хромоном, охоплюючи натрій хромоглікат та недохроміл натрію. Представлений винахід подалі стосується комбінування сполуки винаходу з глюкокортикоїдом, як-то фунісолід, тріамцинолонацетонід, бекпометазондипропіонат, будесонід, флутиказонпропіонат, циклесонід та мометазонфуроат. 81014 24 Представлений винахід подалі стосується комбінування сполуки винаходу з засобом, що корегує рецептори ядерних гормонів, як-то PPAR. Представлений винахід подалі стосується комбінування сполуки винаходу з імуноглобуліном (Іg) або препаратом Іg, або агоністом чи антитілом, корегуючими функцію Іg, як-то анти-ІgЕ (наприклад, омалізумаб). Представлений винахід подалі стосується комбінування сполуки винаходу з іншими системно або локально застосованими протизапальними засобами, охоплюючи талідамід та його похідні, ретиноїди, дитранол та калципотріол. Представлений винахід подалі стосується комбінування сполуки винаходу з комбінаціями аміносаліцилатів та сульфапіридину, як-то сульфасалазин, месалазин, балсалазид та олсалазин; та імуномодуляторних засобів, як-то тіопурин, та кортикостероїдів, як-то будезонід. Представлений винахід подалі стосується комбінування сполуки винаходу з протибактеріальним засобом, охоплюючи похідні пеніциліну, тетрацикліни, макроліди, бета-лактами, флуорхінолони, метронізадол та дихальні аміноглікозиди; та противірусні засоби охоплюючи ацикловір, фамцикловір, валацикловір, ганцикловір, цидофовір; амантадин, римантадин; рибавірин; занамавір та оселтамавір; інгібітори протеази, як-то індинавір, нелфінавір, ритонавір, та сакуїнавір; інгібітори нуклеозидної зворотної транскриптази, як-то диданозин, ламівудин, ставудин, залцитабін, зидовудин; інгібітори ненуклеозидної зворотної транскриптази, як-то невірапин, ефавіренз. Представлений винахід подалі стосується комбінування сполуки винаходу з серцевосудинними засобами, як-то блокатори кальцієвого каналу, блокатори бета-адреноцептеру, інгібітори ангіотензин-перетворюючого ферменту (АСЕ), агоністи рецептору ангіотензину-2; ліпідознижуючі засоби, як-то статини та фібрати; модулятори морфології клітин крові, як-то пентоксифулін; тромболітики, та антикоагулянти, охоплюючи інгібітори агрегації тромбоцитів. Представлений винахід подалі стосується комбінування сполуки винаходу з CNS засобами, як-то антидепресанти (як-то сертралін), ліки проти хвороби Паркінсона (як-то депреніл, L-допа, ропінорол, праміпексол, інгібітори МАОВ, як-то селегін та расагілін, інгібітори комР, як-то тасмар, інгібітори А-2, інгібітори перепоглинання допаміну, агоністик NMDA, агоністи нікотину, агоністи допаміну та інгібітори нероналоксиду азоту синтази), та ліки проти хвороби Альцгеймера, якто донепезил, ривастигмін, тафин, інгібітори СОХ2, пропентофулін або метрифонат. Представлений винахід подалі стосується комбінування сполуки винаходу з засобами для лікування гострого та хронічного болю, охоплюючи анальгетики центрально- та периферичнодіючі, якто аналоги та похідні опіоїдів, карбамазепін, фенітоїн, натрій валпроат, амітриптилін та інші антидепресантні засоби, парацетамол та нестероїдні протизапальні засоби. 25 Представлений винахід подалі стосується комбінування сполуки винаходу з перентерально або локально-застосованими (охоплюючи дихальні) локальними анестезувальними засобами, як-то лігнакан та аналоги. Сполуки представленого винаходу також можуть бути застосованими у комбінації з протиостеопорозними засобами, охоплюючи гормональні засоби, як-то ралоксифен, та біфосфонати, як-то алендронат. Представлений винахід подалі стосується комбінування сполуки винаходу з сполуками із групи: (і) інгібітори триптази; (іі) агоністи тромбоцитактивуючого фактору (PAF); (ііі) інгібітори інтерлейкінперетворюючого ферменту (ICE); (iv) інгібітори IMPDH; (ν) інгібітори адгези молекул, охоплюючи агоністів VLA-4; (vi) катепсини; (vii) інгібітори кінази. Охоплюючи, але не обмежуючись, інгібітори тирозинкіназ (як-то Btk, Itk, Jak3 MAP приклади інгібіторів могли б залучати Гефітиніб, Іматиніб месилат), Серин/треонінкінази (охоплюючи але не обмежуючись, інгібітори МАРкіназ, як-то р38, JNK, протеїнкіназ А, В та С та ІKK) та кінази, залучені у регулювання циклу клітин (як-то але не обмежуючись до цилінзалежних кіназ); (viii) інгібітори глюкоза-6 фосфатдегідрогеназ; (іх) агоністи кінін-В1-та В2рецептору; (х) засоби проти подагри, наприклад, колхіцин; (хі) інгібітори ксантиноксидази, наприклад, алопуринол; (хіі) урикозуретичні засоби, наприклад, пробенцид, сульфінпіразон та бензбромарон; (хііі) засоби посилення секреції гормони росту; (xiv) фактор трансформування росту (TGFp); (xv) тромбоцитопохідний факсгор росту (PDGF); (xvi) фактор росту фібробластів, наприклад, основний фактор росту фібробластів (bFGF); (xvii) фактор стимуляції колоній фанулоцитів-макрофагів (GM-CSF); (xviii) крем капсацину; (хіх) агоністи рецептору тахікініну NK1 та NK3, як-то група, що складається з NKP-608C; SB-233412 (талнетант); та D-4418; (хх) інгібітори еластази, як-то група, що складається з UT-77 та ZD-0892; (ххі) інгібітори ферменту перетворення TNF-альфа (ТАСЕ); (ххіі) інгібітори індукованої оксидом нітрогену синтази (iNOS) або (ххііі) гомологічна рецептору хемоатрактантну молекула, експресована клітинами ТН2, (як-то агоністи CRTH2) (xxiv) інгібітори р38 (xxv) засіб корегування функції Toll-подібних рецепторів (TLR) та (xxvi) засоби корегування активності пуринергічних рецепторів, як-то Р2Х7; (xxvii) інгібітори факторів активації транскрипції, як-то NFkB, API, та STATS. Сполуки винаходу можна також застосовувати у комбінації з існуючими терапевтичними засобами для лікування раку. Придатні засоби застосовано у комбінації, що залучає: (і) антипрофілеративні/антинеопластичні ліки та їх комбінації, які застосовують у медичній онкології, як-то алкілувальні засоби (наприклад цис-платин, карбоплатин, циклофосфамід, нітроген-мустард, мелфалан, хлорамбуцил, бусульфан та нітрозосечовина); антиметаболіти (наприклад антифлати, як-то флуорпіримідиноподібні-5-флуорурацил та тегафур, ралтитрексед, метотрексат, 81014 26 цитозинарабінозид, гідроксисечовина, гемцитабін та паклітаксел; протипухлинні антибіотики (наприклад антрацикліноподібні адріаміцин, блеоміцин, доксорубіцин, дауноміцин, епірубіцин, ідарубіцин, мітоміцин-С, дактиноміцин та мітраміцин); антимітотичні засоби (наприклад (vinca) вінкалкалоїдоподібні вінкристин, вінбластин, віндезин та вінорелбін та таксоїдоподібні таксол та таксотер); та інгібітори топоізомерази (наприклад епіподофілотоксиноподібні етопосид та теніпосид, амсакрин, топотекан та камптотецини); (іі) цитостатичні засоби, як-то антиоестрогени (наприклад тамоксифен, тореміфен, ралоксифен, дролоксифен та йодксифен), регулятори оестрогензнижувального рецептору (наприклад фулвестрант), антиандрогени (наприклад бікалутамід, флутамід, нілутамід та ципротеронацетат), агоністи LHRH або агоністи LHRH (наприклад госерелін, лейпрорелін та бусерелін), прогестогени (наприклад мегестролацетат), інгібітори ароматази (наприклад, як анастрозол, летрозол, воразол та екземестан) та інгібітори 5α-редуктази, як-то фінастерид; (ііі) Засоби, які інгібують інвазію клітин раку (наприклад інгібітори металопротеїнази типу маримастату та інгібітори функції рецептору активатору плазмогену урокінази); (iv) інгібітори функції фактору росту, наприклад, такі інгібітори залучають антитіла фактору росту, антитіла рецептору фактору росту (наприклад антитіло анти-ербб2 трастузумаб та антитіло анти-ербб1 цетуксимаб [С225]), інгібітори фарнезилтрансферази, інгібітори тирозинкінази та інгібітори серин/треонінкінази, наприклад, інгібітори сімейства епідермального фактору росту (наприклад, інгібітори EGFR сімейства тирозинкінази, як-то N-(3-хлор-4-флуорфеніл)-7метокси-6-(3-морфолінопропокси)хіназолін-4-амін (гефітиніб, AZD1839), N-(3-етинілфеніл)-6,7-біс(2метоксиетокси)хіназолін-4-амін (eriotinib, OSI-774) та 6-акриламідо-N-(3-хлор-4-флуорфеніл)-7-(3морфолінопропокси)хіназолін-4-амін (Сl1033)), наприклад, інгібітори сімейства тромбоцитпохідного фактору росту та наприклад інгібітори сімейства фактору росту гепатоциту; (ν) антиангіогенні засоби, як-то ті, які інгібують дії фактору росту, (наприклад антитіло антисудиноендотеліального фактору росту клітини бевацизумаб, сполуки, як-то ті, що розкрито у [International Patent Applications WO 97/22596, WO 97/30035, WO 97/32856 та WO 98/13354]) та сполуки, що працюють за іншими механізмами (наприклад ліномід, інгібітори функції інтегріну ανβ3 та ангіостатин); (vi) судино-ушкоджувальні засоби, як-то комбрестатин А4 та сполуки, розкриті у [International Patent Applications WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 та WO 02/08213]; (vii) антисенсорне лікування, наприклад, ті, що спрямовані на цілі, перераховані вище, як-то ISIS 2503, антисенсорний анти-ras; 27 (viii) підходи генного лікування, охоплюючи, наприклад, підходи до заміщення аберантних генів, як-то аберантного р53, або аберантного BRCA1, або BRCA2, GDEPT (лікування проліками ген-спрямованого ферменту) підхід, як-то ті, що застосовують цитозиндеаміназу, тимідинкіназу або фермент бактеріальної нітроредуктази та підходи, що підвищують толерантність пацієнта до хіміотерапії або радіотерапії, як-то терапії при генній резистентності до багатьох ліків; та (іх) імунотерапевтичні підходи, охоплюючи, наприклад, підхід ex-vivo та in-vivo для підвищення імуногенності клітин пухлини пацієнта, як-то трансфекція цитокінами, як-то інтерлейкіном 2, інтерлейкіном 4 або фактором стимуляції колоній гранулоцитів-макрофаговів, підхід до зниження анергії Т-клітин, підходи із застосуванням трансфектованих імунних клітин, як-то трансфектованих цитокінами дендритичних клітин, підходи із застосуванням цитокін-трансфектованих пухлинних клітинних ліній та підхід із застосуванням антиідіотипічних антитіл. Винахід тепер необхідно ілюструвати наступними необмеженими прикладами, в яких, якщо не встановлено інакше: (і) дані 1Н ЯМР наведено як величини дельта для головних визначальних протонів, приведені у частках на мільйон (млн-1) відносно тетраметилсилану (TMS) як внутрішнього стандарту, визначеного при 300МГц або 400МГц, застосовуючи пердейтерований ДМСО-D6 (CD3SOCD3) або CDCI3 як розчинник, якщо не встановлено інакше; (іі) мас-спектри (МС) вимірюють в режимі хімічної іонізації (СІ) з енергією електронів 70 електронвольт, застосовуючи пряму експозицію проби; де вказана іонізація здійснена електронним ударом (ЕУ) або бомбардуванням швидкими атомами (БША); де приведено величини m/z, що надано головним чином тільки для іонів, які вказують вихідну масу, якщо не встановлено інакше, масу іону наведено як масу позитивного іону-(М+Н)+; (ііі) назви заголовних та підзаголовних сполук з прикладів та способів названо, застосовуючи програму покажчика назв від Advanced Chemistry Development inc, version 6,00; (iv) якщо не встановлено інакше, зворотнофазову ВЕРХ проведено, застосовуючи зворотнофазову силікагелеву колонку "Symmetry", "NovaPak" або "Xerra"; (ν) для аналітичної ВЕРХ застосовано наступні умови: Зворотно-фазова аналітична ВЕРХ (Hewlett Packard Series 1100), застосовуючи колонку 3,5мкм; колонку 4,6´50мм Waters "Symmetry" C8, застосовуючи 0,1% амоній ацетат/ацетонітрил градієнти при 2мл/хвил. приведено як % водного стандартний від 75% до 5% протягом 3 хвилин швидкий від 45% до 5% протягом 2,5 хвилин середньошвидкий від 65% до 5% протягом 2,5 хвилин повільний від 95% до 50% протягом 2,5 хвилин 81014 28 зверхповільний від 100% до 80% протягом 2,5 хвилин; та (vi) застосовано наступні скорочення: НОВТ ДМСО ВЕРХ EDCI DMAP TFA хвил h 1-гідроксибензотриазол диметилсульфоксид рідинна хроматографія високого тиску 1-етил-3-(3-диметиламінопропіл)карбодіімід Ν,Ν-диметиламінопіридин трифлуорцтова кислот хвилини годин Інтермедіат 1 4-[[4-(3,4-Дихлорфенокси)-1піперидиніл]метил]-1,2-циклопентандіол а) 1-(3-Циклопентен-1-ілкарбоніл)-4-(3,4дихлорфенокси)-піперидин 3,4-Дихлорфеноксипіперидин (3,09г) розчиняли у дихлорметані (80мл) додавали НОВТ (1,77г) та DMAP (0,44г), супроводжувані розчином 3-циклопентен-1-карбонової кислоти (1,45г) у дихлорметані (5мл). Додавали EDCI (2,45г) та розчин перемішували 60 годин. Додавали воду (100мл) та фази відокремлювали. Водну фазу екстрагували дихлорметаном (2´40мл). Органічні фази поєднували, сушили (MgSO4), фільтрували та випарювали, що дало сполуку підзаголовка (3,40г), яку застосовано без подальшого очищення. МС [М+Н]+ (ЕР+) 340/342. 1 Н ЯМР δ(CDCI3) 4,47-4,53 (1Н, m), 5,67 (2Н, s), 7,33 (1Н, d), 6,73 (1Н, dd), 7,02 (1Н, d), 3,62-3,84 (3Н, m), 3,44-3,52 (1Н, m), 3,33 (1Н, d), 2,68-2,77 (2Н, m), 2,54-2,64 (2Н, m), 1,88-1,99 (2Н, m), 1,731,86 (2Н, m). b) 4-[[4-(3,4-Дихлорфенокси)-1піперидиніл]карбоніл]-1,2-циклопентандіол 1-(3-Циклопентен-1-ілкарбоніл)-4-(3,4дихлорфенокси)-піперидин (1,33г) розчиняли у ацетоні (30мл) та воді (20мл). Додавали Nметилморфолін N-оксид (1,12г), супроводжуваний розчином осмій тетроксидом (1мл 2,5% у 2метилпропан-2-олі) та суміш перемішували 60 годин. Додавали водний розчин натрій метабісульфіту (40мл, saturated) супроводжуваний дихлорметаном (50мл) та фази відокремлювали. Органічні фази промивали розчином амоній хлориду, сушили, фільтрували та-концентрували. Залиш очищали хроматографією, елюючи дихлорметаном: метанолом (24:1 потім 37:3), що дало сполуку підзаголовка як суміш ізомерів: Менш полярний ізомер (0,31г): МС [М+Н]+ (ЕР+) 374/376. 1 Н ЯМР δ(CDCI3) 1-79-1,98 (6Н, m), 2,12-2,22 (2Н, m), 3,23 (1Н, tt), 3,49-3,56 (1Н, m), 3,65-3,79 (3Н, m), 3,93 (1Н, d), 3,99-4,08 (3Н, m), 4,53 (1Н, tt), 6,77 (1Н, dd), 7,02 (1Н, d), 7,34 (1Н, d). Більш полярний ізомер (0,71г): МС [М+Н]+ (ЕР+) 374/376. 1 Н ЯМР δ(CDCI3) 1,73-1,86 (2Н, m), 1,86-2,00 (4Н, m), 2,07-2,16 (2Н, m), 2,50-2,60 (2Н, m), 3,39 (1Н, tt), 3,42-3,48 (1Н, m), 3,61-3,78 (3Н, m), 4,22-4,27 (2Н, m), 4,47-4,53 (1Н, m), 6,77 (1Н, dd), 7,01 (1Н, d), 7,33 (1Н, d). с) 4-[[4-(3,4-Дихлорфенокси)-1піперидиніл]метил]-1,2-циклопентандіол 29 Більше полярний ізомер 4-[[4-(3,4дихлорфенокси)-1-піперидиніл]карбоніл]-1,2циклопентандіолу (0,71г) розчиняли у розчині борану у тетрагідрофурані (16мл 1М розчин) та суміш нагрівали під зворотним холодильником 1,5 годин. Додавали метанол (10мл) та розчин нагрівали під зворотним холодильником 1 годину. Летючі складові випарювали та залишок загружали у ВЕРХ SCX-контейнер у метанол та елювали метанолом, потім 0,7М аміаком у метанол, що дало названу сполуку (0,73г) як олію. МС [M+H]+ (EP+) 360/362 (стандартний градієнт, час утримання 1,33). Подібне лікування неголовним ізомером 4-[[4(3,4-дихлорфенокси)-1-піперидиніл]карбоніл]-1,2циклопентандюлу (0,30г) дало названу сполуку (0,26г) як олію. МС [М+Н]+ (ЕР+) 360/362 (стандартний градієнт, час утримання 1,33). Наступні сполуки отримали подібними шляхами, починаючи з придатного феноксипіперидину: Інтермедіат 2 3 81014 30 1 Н ЯМР δ(CDCI3) 1,10 (2H, qd), 1,60(1H, qквінтет), 1,73-1,83 (4H, m), 1,90-2,01 (2Н, m), 2,16-2,26 (4Н, m), 2,55-2,70 (4Н, m), 3,09 (2Н, d), 4,24 (1Н, d квінтет), 6,75 (1Н, dd), 6,99 (1Н, d), 7,27(1H, d) Наступні інтермедіати отримали подібно із придатного арилоксипіперидину або арилметилпіперидину: Інтермедіат Назва 5 4-[(4-Флуорфеніл)метил)-1-(4піперидинілметил)-піперидин М+Н Час утримання (умови) 291 1,75 (стандартний) 6 4-(4-хлор-2-метилфенокси)-1-(4піперидинілметил)-піперидин 7 323/325 3-хлор-4-[1-(4піперидинілметил)-4піперидиніл]окси]-бензонітрил 334/336 8 2-хлор-4-[[1-(4піперидинілметил)-4- МС [M+H] (EP+) 334/336 Назва піперидиніл]окси]-бензонітрил 4-[[4-(2,4-Дихлор-3-метилфенокси)-1-піперидиніл]метил]-1,2-циклопентандіол 374/376 4-[[4-(3,4-Дихлор-2-метилфенокси)-1-піперидиніл]метил]-1,2-циклопентандіол 374/376 Інтермедіат 4 4-(3,4-Дихлорфенокси)-1-(4піперидинілметил)-піперидин a) 1,1-Диметилетил 4-[[4-(3,4-дихлорфенокси)1-піперидиніл]метил]-1-піперидинкарбоксилат 4-(3,4-Дихлорфенокси)піперидин (1,27г) розчиняли у тетрагідрофурані (20мл); до розчину додавали оцтову кислоту (0,5мл) та 1,1диметилетил 4-форміл-1-піперидинкарбоксилат (1,43г). Реакційну суміш перемішували при кімнатній температурі 30 хвилин потім додавали натрій триацетоксиборгідрид (1,53г) та суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш заливали у 2М розчин натрій гідроксиду (50мл) та продукт екстрагували етером. Етер промивали розсолом, сушили, фільтрували та випарювали. Сиру речовину очищали флешхроматографією (елюючи 979:20:1 дихлорметаном: метанолом: водним аміаком), що дало сполуку підзаголовка (2,15г): МС 443/445 [М+Н]+(ЕР+) 1 Н ЯМР δ(CDCI3) 1,06 (2Н, ddd), 1,45 (9Н, s), 1,61-1,82 (5Н, m), 1,92-1,98 (2Н, m), 2,16-2,27 (4Н, m), 2,65-2,73 (4Н, m), 4,08 (2Н, d), 4,25 (1Н, dq), 6,75 (1Н, dd), 6,99 (1Н, d), 7,30 (1Н, d). b) 4-(3,4-Дихлорфенокси)-1-(4піперидинілметил)-піперидин 1,1 Диметилетил4-[[4-(3,4-дихлорфенокси)-1піперидиніл]метил]-1-піперидинкарбоксилат (1,0г) додавали до суміші 20% TFA у дихлорметані (20мл) та суміш перемішували при кімнатній температурі 1 годину. Розчинник видаляли випарюванням та додавали 2М розчин натрій гідроксиду (25мл) до залишку. Продукт екстрагували етилацетатом. Органічну фазу промивали розсолом, сушили, фільтрували та випарювали, що дало названу сполуку (0,5г). МС 343(045 [M+H]+ (EP+). Інтермедіат 9 (4S,5R)-1-[[4-[[4-(3,4-Диxлopфeнoкcи)-1пiпepидинiл]мeтил]-1-пiпepидинiл]aцeтил]-3,4диметил-5-феніл-2-імідазолідинон. 2,6-Лутидин (18,26мл) додавали до перемішуваної суспензії (4R,5S)-1,5-диметил-4фенілімідазолідин-2-ону (27,33г) у безводному тетрагідрофурані (300мл) при 0°С під нітрогеном. Бромацетил бромід (11,95мл) додавали через 5 хвилин та суміш перемішували подалі 15 хвилин. Додавали насичений водний розчин натрій гідрокарбонату (300мл), супроводжуваний by 4(3,4-дихлорфенокси)-1-(4піперидинілметил)піперидином (44,86г), та суміш перемішували 24 години при температурі навколишнього середовища. Додавали воду (300мл) та суміш екстрагували третбутилметиловим етером (300мл). Органічні екстракти сушили над безводним сульфатом, фільтрували та випарювали під зниженим тиском. Залишок суспендували у трет-бутилметиловому етері (300мл) та перемішували 3 доби. Отриману тверду речовину фільтрували, промивали третбутилметиловим етером (3´50мл) та сушили у під зниженим тиском, що дало названу сполуку (45,65г) як тверду речовину. МС (ΧΙΑT) 573/575 [M+H]+. 1 H ЯМР δ(DMCO) 0,67 (3Н, d), 1,02 (2Н, qd), 1,371,45 (1Н, m), 1,55-1,62 (4Н, m), 1,85-2,63 (2Н, m), 2,02 (1Н, t), 2,10 (2Н, d), 2,10-2,19 (3Н, m), 2,582,63 (2Н, m), 2,70 (3Н, s), 2,78 (2Н, d), 3,60 (1Н, d), 3,78 (1Н, d), 3,96 (1Н, dt), 4,39-4,46 (1Н, m), 5,28 (1Н, d), 6,97 (1Н, dd), 7,12 (2Н, d), 7,23 (1Н, d), 7,27 (1Н, t), 7,35 (2Н, t), 7,48 (1Н, d), (містить 1 еквівалент (4R,5S)-1,5-Диметил-4фенілімідазолідин-2-он). Приклад 1 δ(CD3OD+ДMC 1,62(2Н, m (2H, d), 2 m), 7,01 (2 δ(CDCI3) 1,0 (4H,m), 1, (4H,m), 3 7,06 (1H, δ(CD3OD) 1, d), 2,37-2 3,30 (2H, (1H, m), 7 δ(CD3OD) 1(2H, m), 2 m), 3,11-3 7,21 (1H, 31 (αS)-Метил 4-[[4-(2,4-дихлор-3-метилфенокси)1-піперидиніл]метил]-а-(фенілметил)-1піперидинацетат 4-[[4-(2,4-Дихлор-3-метилфенокси)-1піперидиніл]метил]-1,2-цикпопентандіол (0,30г) розчиняли у дихлорметані (7мл) та додавали натрій карбонат (0,282г). Суспензію охолоджували до 0°С, Додавали свинець тетраацетат (0,389г) через 20 хвилин. Суміш перемішували 40 хвилин при 0°С. Суспензію фільтрували через тампон з бавовняного волокна у розчин гідрохлориду метилового естеру, L-фенілаланіну (0,173г), триетиламіну (0,13мл), оцтової кислоти (0,06мл), натрій триацетоксиборгідриду (0,376г) та тетрагідрофурану (12мл). Реакційну суміш потім перемішували 16 годин при кімнатній температурі, заливали у насичений водний розчин натрій гідрокарбонату (50мл), екстрагували у етилацетат (3x5мл), промивали розсолом (50мл), сушили (MgSO4), фільтрували, та концентрували. Залишок очищали на хроматографічній колонці, елюючи етилацетатом та подалі очищали ВЕРХ (градієнт амоній ацетат/ацетонітрил від 40:60 до 5:95), що дало названу сполуку (0,205г). МС[М+Н]+ (ЕР+) 519/521 Приклади 2-31 у таблиці 1 (нижче) отримали способом із Прикладу 1, застосовуючи придатний діол та попередник естеру амінокислоти. Приклад 32 (αS) Метил 4-[[4-[(4-флуорфеніл)метил]-1піперидиніл]метил]-α-(фенілметил)-1піперидинацетат До перемішуваного охолоджуваного льодом розчину метил-(R)-3-феніллактату (0,191г) та порошкових 4А молекулярних сит (0,27г) у дихлорметані (2мл) додавали трифлуорметансульфоновий ангідрид (0,195мл). Через 10 хвилин додавали 2,6-лутидин (0,27мл), що призводило до утворення глибокого червоного забарвлення. Реакційну суміш перемішували 40 хвилин при 0°С. Додавали суміш 4-[[4-[(4флуорфеніл)метил]-1піперидиніл]метилпіперидину (0,28г) та 4А молекулярних сит (0,1г) у дихлорметані (1,5мл). Через 2 хвилини додавали триетиламін (0,323мл) та реакції дозволяли нагріватися до кімнатної температури протягом ночі. Реакційну суміш розбавляли етилацетатом та фільтрували. Фільтрат концентрували у вакуумі та очищали на колонці флеш-хроматографією, елюючи етилацетатом, що дало тверду жовту речовину (0,53г). Час утримання: 2,37 хвилин (Стандартний). МС 453 [М+Н]+ (ЕР+). 1 Н ЯМР δ(CD3OD) 1,43-1,58 (2Н, m), 1,70-1,89 (6R, m), 2,31 (1Н, td), 2,42 (1Н, td), 2,61 (2Н, d), 2,80-3,03 (9Н, m), 3,03-3,10 (1Н, m), 3,43-3,50 (3Н, m), 3,55 (3Н, s), 7,01 (2Н, ddd), 7,14-7,28 (7Н, m). Приклади 33-35 у таблиці І (нижче) отримали способом із Прикладу 32, застосовуючи придатні аміни. Приклад 36;. 81014 32 (αS) Метил 4-[[4-(3,4-дихлорфенокси)-1піперидиніл]метил]-α-[(2-гідроксифеніл)метил]-1піперидинацетат (αS) Метил 4-[[4-(3,4-дихлорфенокси)-1піперидиніл]метил]-α-[(2-метоксифеніл)метил]-1піперидинацетат (120мг) у дихлорметані (6мл) охолоджували до-78°С під нітрогеном, та додавали краплями 1М розчин бор триброміду у дихлорметані (9мл). Суміш потім перемішували при-78°С 30 хвилин та потім при-5°С 30 хвилин. Реакційну суміш потім обережно гасили метанолом (20мл), дозволяли нагріватися до кімнатної температури та летючі видаляли у вакуумі. Залишок очищали зворотно-фазовою ВЕРХ, застосовуючи від 75:25 до 5:95 0,1% водний амоній ацетат/ацетонітрил через 6 хвилин, відповідно до колонок. Це дало 67мг названої сполуки як олії. РХ/МС: 43 1,77 (швидкий), m/z 521/523 (М+Н). Приклад 37 (αS)-4-[[4-(2,4-Дихлор-3-метилфенокси)-1піперидиніл]метил]-α-(фенілметил)-1піперидиноцтова кислота Метил 4-[[4-(2,4-дихлор-3-метилфенокси)-1піперидиніл]метил]-α-(фенілметил)-(α1S)-1піперидинацетат (Приклад 1, 0,205г), 6М соляну кислоту (20мл) та 2-пропанол (5мл) нагрівали разом при 80°С 24 години, потім охолоджували та концентрували під зниженим тиском. Залишок очищали ВЕРХ (градієнт амоній ацетат/ацетонітрил від 75:25 до 5:95), що дало названу сполуку (0,113г). МС [М+Н]+(ХІАТ+) 505/507, 1 Н ЯМР δ(CD3OD) 1,33-1,45 (2Н, m)( 1,71-1,82 (3Н, m), 1,84-1,97 (4Н, m), 2,28 (2Н, d), 2,35 (3Н, s), 2,37-2,47 (2Н, m), 2,66-2,76 (2Н, m), 2,87 (2Н, q), 3,07-3,19 (2Н, m), 3,40 (1Н, d), 3,50 (1H, d), 3,63 (1H, t), 4,35-4,44 (1H, m), 6,86 (1H, d), 7,09-7,27 (6Н, m). Приклади 38-70 у таблиці II (нижче) отримали, застосовуючи спосіб Прикладу 37 із придатного естеру (див. таблиця 1 за виключенням, наприклад, 58, який отримали з (±) метил 4-[[4(3,4-дихлорфенокси)-1-піперидиніл]метил]-α-[(R)[[(1,1диметилетил)диметилсиліл]окси]фенілметил]-(α1 S)-1-піперидинацетату [1H ЯМР δ(CDCI3) 0,24 (6Н, s), 1,07 (9Н, s), 1,351,47 (2Н, m), 1,67-1,74 (1Н, m), 1,88-2,06 (4Н, m), 2,15-2,24 (2Н, m), 2,38-2,49 (4Н, m), 2,60 (1Н, t), 2,70 (1Н, t), 2,86-2,94 (2Н, m), 3,12 (1Н, d), 3,36 (1Н, d), 3,64 (3Н, s), 4,36 (1Н, q), 4,44-4,51 (1Н, m), 5,19 (1Н, d), 6,99 (1Н, dd), 7,23 (1Н, d), 7,43-7,57 (6Н, m)] отримано подібно до Прикладу 1 від придатної захищеної гідроксиамінокислоти). Приклад 71 (αS)-4-[[4-(2,4-Дихлор-3-метилфенокси)-1піперидиніл]метил]-α-(фенілметил)-1піперидиноцтової кислоти дигідрохлорид (αS)-4-[[4-(2,4-Дихлор-3-метилфенокси)-1піперидиніл]метил]-α-(фенілметил)-1піперидиноцтову кислоту (Приклад 12, 0,062г) суспендували у ацетонітрилі (5мл) та додавали розчин хлорводню у 1,4-діоксані (4М, 5мл). Суспензію концентрували під зниженим тиском, та 33 процес знов повторювали, що дало названу сполуку (0,048г). МС [М+Н]+ (ХІАТ+) 505/507. 1 Н ЯМР δ(DMSO) 1,43-1,65 (2Н, m), 1,98-2,11 (4Н, m), 2,18-2,30 (3Н, m), 2,41 (3Н, s), 2,44-2,56 (4Н, m), 2,99-3,13 (6Н, m), 3,43-3,51 (1Н, m), 3,56-3,61 (1Н, m), 3,64-3,74 (1Н, m), 4,83-4,91 (1Н, m), 7,19 (1Н, t), 7,27 (3Н, d), 7,30-7,36 (2Н, m), 7,42 (1Н, d). Приклади 72-78 у таблиці II отримали із придатного естеру (див. Приклад 1 або таблицю I) способом Прикладу 37 та або сіль від етапу гідроліз кристалізували та виділяли фільтрацією або продукт через хроматографію перетворювали у сіль способом Прикладу 71, Приклад 79 (α1S)-4-[[4-(3,4-Дихлорфенокси-1піперидиніл]метил]-α-[(2-гідроксифеніл)метил]-1піперидиноцтова кислота (αS) Метил 4-[[4-(3,4-дихлорфенокси)-1піперидиніл]метил]-α-[(2-гідроксифеніл)метил]-1піперидинацетат (Приклад 36, 67мг) перемішували у метанолі (4мл) при кімнатній температурі під нітрогеном. До цього додавали краплями розчин літій гідроксиду (22мг) у воді (1мл), у температур нижче 30°С, Суміш потім перемішували при кімнатній температурі 20 годин. Летючі видаляли у вакуумі та залишок очищали ВЕРХ, застосовуючи градієнт 0,1% водного амоній ацетату/ацетонітрилу від 95:5 до 5:95, що дало названу сполуку як тверду речовину (48мг). МС: 505/507 (М+Н). 1 Н ЯМР δ(CD3OD) 1,19-1,37 (2Н, m), 1,52-1,62 (1Н, m), 1,70-1,83 (4Н, m), 1,94-2,03 (2Н, m), 2,23 (2Н, d), 2,30 (2Н, t), 2,42 (1Н, t), 2,66-2,74 (2Н, m), 2,86 (1Н, dd), 2,98-3,09 (2Н, m), 3,15 (2Н, d), 3,22 (1Н, t), 4,32-4,42 (1Н, m), 6,42 (1Н, t), 6,61 (1Н, dd), 6,82-6,89 (2Н, m), 7,04 (1Н, dd), 7,07 (1H,d), 7,36 (1H,d). Приклад 80 (αS)-4-[[4-(3,4-Дихлорфенокси)-1піперидиніл]метил]-α-(2-тієнілметил)-1піперидиноцтова кислота 4-[[4-(3,4-Дихлорфенокси)-1піперидиніл]метил]-1,2-циклопентандіол (0,20г) розчиняли у дихлорметані (10мл) та додавали натрій карбонат (0,212г). Суспензії охолоджували до 0°С. через 20 хвилин додавали свинець тетраацетат (0,248г). Суміш перемішували 40 хвилин при 0°С. МС [M+H]+ (EP+) 358/360. Суспензію фільтрували через бавовнянововняний тампон у розчин α-аміно-(α2S)-2тіофенпропанової кислоти (0,94г) та оцтової кислоти (0,1мл) в етанолі (10мл). Додавали натрій триацетоксиборгідрид (0,198г) та реакційну суміш перемішували 16 годин при кімнатній температурі. Розчинник випарювали та залишок перерозчиняли у ацетонітрилі та фільтрували. Це очищали ВЕРХ (градієнт амоній ацетат/ацетонітрил від 95% до 50%), що дало названу сполуку (0,048г) МС [М+Н]+(ЕР+) 495/497. 1 Н ЯМР δ(CD3OD) 1,18-1,34 (3Н, m), 1,52-1,61 (1Н, m), 1,71-1,81 (4Н, m), 1,95-2,03 (2Н, m), 2,212,25 (2Н, m), 2,26-2,52 (4Н, m), 2,66-2,74 (2Н, m), 2,91-3,15 (4Н, m), 4,34-4,41 (1Н, m), 6,83-6,90 (3Н, m), 7,08 (1Н, d), 7,12 (1H, dd), 7,37 (1H, d). 81014 34 Приклад 81 у таблиці II отримали способом Прикладу 80, застосовуючи придатну амінокислоту. Приклад 82 2-[4-[[4-(3,4-Дихлорфенокси)-1піперидиніл]метил]-1-піперидиніл]-2,3-дигідро-1Нінден-2-карбонова кислота 4-[[4-(3,4-Дихлорфенокси)-1піперидиніл]метил]-1,2-циклопентандіол (0,20г) розчиняли у дихлорметані (10мл) та додавали натрій карбонат (0,212г). Суспензію охолоджували до 0°С. Через 20 хвилин додавали свинець тетраацетат (0,248г). Суміш перемішували 40 хвилин при 0°С. МС [М+Н]+(ЕР+) 358/360. Суспензію фільтрували через бавовнянововняний тампон у розчин 2-аміно-2,3дигідро-1Н-інден-2-карбонової кислоти гідрохлориду (0,117г), соляної кислоти (0,1мл), триетиламіну (0,1мл) та метанолу (10мл). Додавали натрій ціаноборгідрид (0,052г) та реакційну суміш перемішували 16 годин при кімнатній температурі. Реакційну суміш розбавляли насиченим розчином натрій гідрокарбонату. Водну фазу екстрагували дихлорметаном. Органічні фази сушили (MgSO4, фільтрували та випарювали, та залишок перерозчиняли у ацетонітрилі. Це очищали ВЕРХ (градієнт амоній ацетат/ацетонітрил від 95% до 50%). Названу сполуку кристалізували із фракцій ВЕРХ та збирали, що дало чистий продукт (7мг). МС [М+Н]+ (ЕР+) 503/505. 1 Н ЯМР δ(CD3OD) 1,21-1,36 (5Н, m), 1,55-1,62 (1Н, m), 1,72-1,81 (2Н, m), 1,94-2,05 (2Н, m), 2,162,25 (2Н, m), 2,25-2,40 (3Н, m), 2,66-2,74 (2Н, m), 2,90-3,03 (4Н, m), 3,66 (1Н, s), 3,70 (1Н, s), 4,344,41 (1Н, m), 6,88 (1Н, dd), 7,01-7,12 (5Н, m), 7,37 (1Н, d). Приклад 83 (αS)-4-[[4-(3,4-Дихлорфенокси)-1піперидиніл]метил]-α-[(2-метилфеніл)метил]-1піперидиноцтова кислота Розчин літій гексаметилдисилазиду у тетрагідрофурані (1М, 131мл) додавали краплями через 30 хвилин до перемішуваної суспензії (4S,5R)-1-[[4-[[4-(3,4-дихлорфенокси)-1піперидиніл]метил]-1-піперидиніл]ацетил]-3,4диметил-5-феніл-2-імідазолідинону (45,65г) та 2метилбензилбромід (16,3мл) у безводному тетрагідрофурані (130мл) при -20°С під нітрогеном. Подалі через 20 годин при -20°С додавали воду (300мл), суміш нагрівали до кімнатної температури і потім екстрагували третбутилметиловим етером (300мл). Органічні екстракти сушили над безводним магній сульфатом, фільтрували та випарювали під зниженим тиском. Залишок розчиняли у тетрагідрофурані (800мл) потім додавали метанол (103мл) та розчин літій гідроксиду моногідрату (3,01г) у воді (194мл). Суміш перемішували при 50°С 16 годин потім подалі додавали літій гідроксид моногідрат (3,01г). Подалі через 4 години при 50°С суміш охолоджували до кімнатної температури. Додавали воду (600мл), третбутилметиловий етер (800мл) та амоній ацетат 35 (200г). Суміш швидко перемішували 3 доби потім осад збирали фільтрацією двохфазової суміші. Тверду речовину промивали водою (50мл) потім трет-бутилметиловим етером (50мл) та сушили у вакуумі при 50°С, що дало названу сполуку (8,90г) МС (ХІАТ) 503/505 [М-Н]+. 1 Н ЯМР δ(CD3OD + NaOD) 1,18-1,35 (2Н, m), 1,521,62 (1Н, m), 1,72-1,82 (4Н, m), 2,23 (2Н, d), 1,952,05 (2Н, m), 2,26-2,42 (7Н, m), 2,63-2,75 (2Н, m), 2,91 (1Н, dd), 3,00 (1Н, d), 3,05-3,10 (2Н, m), 3,15 (1Н, dd), 4,37-4,42 (1Н, m), 6,88 (1Н, dd), 6,98-7,10 (4Н, m), 7,21-7,23 (1Н, m), 7,37 (1H,d). 81014 36 37 Приклад 84 Фармакологічний Аналіз: кальцію [Са2t]j Еозинофіли людини 81014 аналіз потоку 38 Еозинофіли людини виділяли з ЕДТАантикоагульованої периферичної крові, як описано раніше [Hansel et aL J. Immynol. Methods, 1991, 145, 105-110]. Клітини суспендували (5´106мл-1) та загружали з 5мкМ FLUO-3/AM+Pluronic F127 2,2мкл/мл (Molecular Probe) у розчин з низьким вмістом калію (LKS; NaCI 118ммоль, MgSO4 0,8ммоль, глюкоза 5,5ммоль, Na2CO3 8,5ммоль, KСІ 5ммоль, HEPES 20ммоль, СаСІ2 1,8ммоль, BSA (альбумін коров'ячої сироватки) 0,1%, рН7,4) протягом одної години при кімнатній температурі. Після завантаження клітини центрифугували при 200хд 5 хвилин та ресуспендували у LKS при 2,5´106мл-1. Клітини потім переносили до 96коміркових планшетів FLIPr (Полі-D-Лізинпланшети від Becton Dickinson, попередньо інкубовані з 5мкМ (uМ) фібронектином дві години) при 25мкл/комірку. Планшет центрифугували при 200g 5 хвилин та клітини промивали двічі LKS (200мкл; при кімнатній температурі). Сполуку з прикладів є попередньо розчиняли у ДМСО та додавали до кінцевої концентрації 0,1% (об'ємна частка) ДМСО. Аналізи ініціювали додаванням концентрації А50 еотаксину та контролювали короткочасне підвищення флуоресценції fluo-3 (ІЕкcп=490нм та Іеміс=520нм), застосовуючи зчитувач FLIPR [Fluorometric Imaging Plate Reader, Molecular Devices, Sunnyvale, U.S.A.]. Сполуки з прикладів вважають агоністами, якщо підвищення флуоресценції, індуковане еотаксином (неселективним агоністом CCR3), інгібувалося залежно від концентрації . Концентрація агоністу, потрібна для інгібування флуоресценції на 50%, може бути застосованою для визначення KІ50 агоністу рецептору CCR3. Приклад 85 Хемотаксис еозинофілу людини Еозинофіли людини виділяли з ЕДТАантикоагульованої периферичної крові, як описано раніше [Hansel et al., J. Immynol. Methods, 1991, 145, 105-110]. Клітини суспендували при 10´106мл1 у RPMI, який містить 200 IU/мл пеніциліну, 200мкг/мл стрептоміцин сульфату, та доповнювали 10% HEFCS при кімнатній температурі. Еозинофіли (700мкл) попередньо інкубували 15 хвилин при 37°С з 7мкл наповнювачу, або сполуки (100´ потрібна кінцева концентрація у 10% ДМСО). Планшет для хемотаксису (ChemoTx, пора 3мкм, Neuroprobe) завантажували додаванням 28мкл еотаксину при концентрації від 0,1 до 100нМ (селективний агоніст CCR3 у цьому діапазоні концентрацій), який містить концентрацію сполуки з прикладів, або розчинник, до нижчих комірок планшета для хемотаксису. Потім над комірками розміщали фільтр і додавали 25мкл суспензії еозинофілів до верхньої частини фільтру. Планшет інкубували протягом одної години при 37°С у зволоженому інкубаторі в атмосфері 95% повітря/5% СО2, що дозволяє хемотаксис. Середовище, яке містить клітини, що не и с мігрували, обережно видаляли з вищезгаданого фільтра та викидали. Фільтр промивали один раз фізіологічним розчином, буферованим фосфатом 39 (P6S), який містить 5ммоль EDTA для видалення будь-яких прилиплих клітин. Клітини, що мігрували через фільтр, гранулювали центрифугуванням (300хg за 5 хвилин при кімнатній температурі) та фільтр видаляли та надосадковий шар переносили до кожної комірки 96-коміркового планшета (Costar). Видалені клітини лізували додаванням 28мкл PBS, що містить 0,5% Triton ´100, супроводжуваний двома циклами заморожування/відтавання. Клітинний лізат потім додавали до надосадкового шару. Кількість еозинофілів, що мігрували, визначали способом [Strath et al., J. Immynol. Methods, 1985, 83, 209] виміром активності еозинофілу пероксидази у надосадковому шарі. Сполуки з прикладів вважають агоністами опосередкованого еотаксином хемотаксису еозинофілів людини, якщо концентраціний відгук на еотаксин зрушено праворуч на контрольній кривій. Вимірювання концентрації еотаксину, потрібної для отримання 50% хемотаксису у присутності або відсутності сполуки, дає можливість обчислити виражену афінність сполуки стосовно CCR3, Приклад 86 Ізольована трахея морської свинки [Див., наприклад, Harrison, R.W.S., Carswell, Η. & Young, J.M. (1984) European J. Pharmacol., 106, 405-409,] Самця-альбіноса морської свинки DunkinHartley (250г) убивали цервікальним вивихом та видаляли всю трахею. Після очищення від прилиплої сполучної тканини трахею розрізали на шість кільцевих сегментів, кожний шириною у три хрящових стрічки і потім підвішували у ваннах для органів по 20мл, що містили розчин КребсаГенслейта такого складу (ммоль): NaCI 117,6, NaH2PO4 0,9, NaHCO3 25,0, MgSO4 1,2, KCI 5,4, CaCI2 2,6 та глюкоза 11,1, Буфер витримували при 37°С та насичували 5% СО2 в оксигені. До розчину Кребса додавали індометацин (2,8мкМ), щоб запобігти розвитку тонусу гладенького м'яза завдяки синтезу продуктів циклоксигенази. Кільця трахеї підвішували між двома паралельними вольфрамовими дротовими гаками, один приєднано до балкового ізометричного динамометричного датчика Ормеда, а інший - до стаціонарної опори у ваннах для органів. Зміни ізометричної сили реєстрували на 2-канальному діаграмному самописі з плоскою платформою Sekonic. Експериментальні протоколи Перед початком кожного експерименту до тканин прикладали силу 1г і це відновлювали через 60 хвилин урівноваження до досягнення стійкого тонусу спокою. Потім будували криву дії накопичуваної концентрації гістаміну (Е/[А]) при підвищенні на 0,5 Іоg10-одиниці у кожній тканині. Потім тканини промивали та приблизно через 30 хвилин додавали тест-сполуку або наповнювач (20% ДМСО). Через 60 хвилин інкубаційного перІоgу робили другу криву Е/[А] для гістаміну. Отримані відгуки реєстрували як^відсоток максимуму першої кривої. Дані аналізу 81014 40 Дані експериментальної кривої Е/[А] аналізували з метою визначення дієвості (величин р[А50] гістаміну у відсутності та присутності тестсполуки. Афінність (рА2) величин тест-сполуки потім розраховували, застосовуючи наступне рівняння: Іоg(r-1)=Іоg[В]+рА2 де r=[А]50 у присутності тест-сполуки/[А]50 у відсутності агоністу, а [В] - концентрація тестсполуки. Знайдено, що сполуки Прикладів є агоністами Н1, Приклад 87 Активність зв'язування рецептору гістаміну Н1 сполуками винаходу оцінено конкурентним заміщенням 1нМ [3Н]-піриламіну (Amersham, Bucks, Product code TRK 608, індивідуальна активність 30Кі/ммоль) до 2мкг мембран, отриманих із рекомбінантних клітин СНО-К1, експресуючих рецептор Н1 людини (Euroscreen SA, Brussels, Belgium, Product code EP-390-M), в аналітичному буфері (50ммоль Tris pH7,4 міст 2ммоль МgСІ2, 250ммоль сахарози та 100ммоль NaCI) протягом одної години при кімнатній температурі. Наступні сполуки винаходу дали інгібування зв'язування [3Н] піриламіну: Приклад 37 38 40 41 45 42 43 44 50 53 56 57 58 59 66 71 72 73 74 78 80 81 Н1рКі 7,5 7,5 7,0 7,0 7,7 7,0 7,3 7,3 6,8 7,5 8,0 7,9 7,7 6,9 7,2 7,2 6,8 7,2 7,2 7,5 6,9 6,6 6,4
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperidine derivatives, process for the preparation thereof and pharmaceutical composition based thereon
Автори англійськоюCaffrey Moya, Luckhurst Christopher, Mochel Tobias, Perry Matthew
Назва патенту російськоюПроизводные пиперидина, способ их получения и фармацевтическая композиция на их основе
Автори російськоюКеффри Мойа, Лангерст Кристофер, Моучел Тобиас, Перри Метью
МПК / Мітки
МПК: C07D 401/14, C07D 211/26, C07D 409/14
Мітки: композиція, піперидину, отримання, похідні, фармацевтична, спосіб, основі
Код посилання
<a href="https://ua.patents.su/20-81014-pokhidni-piperidinu-sposib-kh-otrimannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні піперидину, спосіб їх отримання та фармацевтична композиція на їх основі</a>
Попередній патент: Сполуки для лікування розладів метаболізму
Наступний патент: Спосіб керування приводом скребкового конвеєра з планетарним редуктором та привід скребкового конвеєра з планетарним редуктором
Випадковий патент: Вальцьовий верстат