Антимікобактеріальна фармакологічна композиція та спосіб її одержання
Номер патенту: 82782
Опубліковано: 12.05.2008
Автори: Арора Судершан Кумар, Сінха Нееліма, Сінха Ракеш, Упадхйайа Рам Шанкар
Формула / Реферат
1. Антимікобактеріальна комбінація, що містить терапевтично ефективну кількість N-(3-[[4-(3-трифторметилфеніл)піперазиніл]метил]-2-метил-5-феніл-піроліл)-4-піридилкарбоксаміду формули (І) чи його фармацевтично прийнятної нетоксичної солі
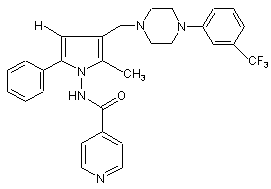 , (I)
, (I)
і терапевтично ефективну кількість одного чи декількох антитуберкульозних речовин, вибраних із групи, що складається з ізоніазиду, рифампіцину, етамбутолу і піразинаміду.
2. Антимікобактеріальна фармацевтична композиція, що містить антимікобактеріальну комбінацію за п.1 в суміші з фармацевтично прийнятним наповнювачем.
3. Антимікобактеріальна фармацевтична композиція відповідно до п.2, де фармацевтично прийнятний наповнювач вибраний з антиоксиданта, інертного розчинника, поверхнево-активної речовини, змащувального агента і замутнювача.
4. Антимікобактеріальна комбінація відповідно до п.1, для ефективного лікування туберкульозу.
5. Антимікобактеріальна комбінація відповідно до п.1, для лікування мікобактеріальних захворювань/клітин, вибраних з чутливих і мультирезистентних штамів Mycobacterium tuberculosis, Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. kansasaii та інших родинних мікобактеріальних видів.
6. Антимікобактеріальна композиція відповідно до п.2, для лікування туберкульозу.
7. Антимікобактеріальна композиція відповідно до п.2, для лікування мікобактеріальних захворювань/клітин, вибраних з чутливих і мультирезистентних штамів Mycobacterium tuberculosis, Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. kansasaii та інших родинних мікобактеріальних видів.
8. Антимікобактеріальна комбінація відповідно до п.1, що цілком ліквідує чутливі та резистентні до лікарських засобів M. tuberculosis по закінченні лікування.
9. Антимікобактеріальна композиція відповідно до п.2, що повністю ліквідує чутливі та резистентні до лікарських засобів M. tuberculosis по закінченні лікування.
10. Спосіб одержання антимікобактеріальної фармацевтичної композиції, що містить сполучення сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі
 , (I)
, (I)
і одного чи декількох антитуберкульозних лікарських засобів першого ряду, за допомогою методу грануляції, методу вологої грануляції чи методу прямого пресування.
11. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль і рифампіцин.
12. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль і ізоніазид.
13. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль, ізоніазид і рифампіцин.
14. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль, ізоніазид, рифампіцин і піразинамід.
15. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль, піразинамід і етамбутол.
16. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль, рифампіцин і піразинамід.
17. Комбінація відповідно до п 1, що містить 12,5 або 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 20,0 мг/кг рифампіцину.
18. Комбінація відповідно до п.1, що містить 12,5 або 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25,0 мг/кг ізоніазиду.
19. Комбінація відповідно до п.1, що містить 12,5 чи 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25,0 мг/кг ізоніазиду і 20,0 мг/кг рифампіцину .
20. Комбінація відповідно до п.1, що містить 12,5 чи 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25,0 мг/кг ізоніазиду, 20,0 мг/кг рифампіцину і 150,0 мг/кг піразинаміду.
21. Комбінація відповідно до п.1, що містить 12,5 чи 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі, 150,0 мг/кг піразинаміду і 100,0 мг/кг етамбутолу.
22. Комбінація відповідно до п.1, що містить 3,12, 6,25 чи 12,5 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі, 250,0 мг/кг ізоніазиду, 20,0 мг/кг рифампіцину і 150,0 мг/кг піразинаміду.
23. Комбінація відповідно до п.1, що містить 3,12, 6,25 чи 12,5 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі, 20,.0 мг/кг рифампіцину і 150,0 мг/кг піразинаміду.
Текст
1. Антимікобактеріальна комбінація, що містить терапевтично ефективну кількість N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміду формули (І) чи його фармацевтично прийнятної нетоксичної солі C2 2 (19) 1 3 H N N HN CH3 O 82782 N CF 3 (I) N , і одного чи декількох антитуберкульозних лікарських засобів першого ряду, за допомогою методу грануляції, методу вологої грануляції чи методу прямого пресування. 11. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль і рифампіцин. 12. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль і ізоніазид. 13. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль, ізоніазид і рифампіцин. 14. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль, ізоніазид, рифампіцин і піразинамід. 15. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль, піразинамід і етамбутол. 16. Комбінація відповідно до п.1, що містить сполуку формули (І) чи його фармацевтично прийнятну нетоксичну сіль, рифампіцин і піразинамід. Дійсний винахід стосується комбінації, що містить ефективну кількість N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної солі й одного чи декількох протитуберкульозних препаратів першого ряду для лікування туберкульозу, включаючи мультирезистентні форми туберкульозу і латентний туберкульоз. Даний винахід також відноситься до фармацевтичних композицій, що містять комбінацію ефективної кількості N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (1) чи його фармацевтично прийнятної солі з одним чи декількома препаратами першого ряду для лікування туберкульозу в суміші з одним чи декількома прийнятними наповнювачами. Дана композиція може бути використана для лікування туберкульозу, включаючи мультирезистентні форми туберкульозу і латентний туберкульоз. Даний винахід також відноситься до способу лікування туберкульозу, включаючи мультирезистентні форми туберкульозу і латентний туберкульоз. В усьому світі туберкульоз залишається головною причиною смерті. Щорічно реєструється приблизно 8 мільйонів випадків активної форми туберкульозу з 3 мільйонами смертельних випадків на рік. Вважається, що близько 1,7 мільярдів чоловік 4 17. Комбінація відповідно до п 1, що містить 12,5 або 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 20,0 мг/кг рифампіцину. 18. Комбінація відповідно до п.1, що містить 12,5 або 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25,0 мг/кг ізоніазиду. 19. Комбінація відповідно до п.1, що містить 12,5 чи 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25,0 мг/кг ізоніазиду і 20,0 мг/кг рифампіцину . 20. Комбінація відповідно до п.1, що містить 12,5 чи 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25,0 мг/кг ізоніазиду, 20,0 мг/кг рифампіцину і 150,0 мг/кг піразинаміду. 21. Комбінація відповідно до п.1, що містить 12,5 чи 25,0 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі, 150,0 мг/кг піразинаміду і 100,0 мг/кг етамбутолу. 22. Комбінація відповідно до п.1, що містить 3,12, 6,25 чи 12,5 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі, 250,0 мг/кг ізоніазиду, 20,0 мг/кг рифампіцину і 150,0 мг/кг піразинаміду. 23. Комбінація відповідно до п.1, що містить 3,12, 6,25 чи 12,5 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі, 20,.0 мг/кг рифампіцину і 150,0 мг/кг піразинаміду. (третина населення світу) є носіями латентної інфекції Mycobacterium tuberculosis [Kochi, A. Tubercle. 1991, 72, 1-6]. Індивідууми з латентною формою туберкульозу мають ризик реактивації хвороби протягом життя від 2 до 23% [Parrish, NM., Dick, JD., and Bishai, WR., Trends. Microbial. 1980, 6, 107-112]. Крім того, захворювання імунної системи, включаючи вірусну інфекцію імунодефіциту людини (ВІЛ) значно збільшує ризик реактивації туберкульозу. Виникнення патогенів, стійких до дії лікарських речовин, приводить до того, що застосовувана в даний час схема лікування є дуже складною й у багатьох випадках зовсім неефективна. Лікування мультирезистентних форм туберкульозу є складним, захворювання часто приводить до високого рівня смертності, особливо в країнах, що розвиваються. Передбачається, що в наступні двадцять років біля одного мільярда чоловік будуть заражені туберкульозом, при цьому 35 мільйонів чоловік стануть жертвою захворювання [WHO Fact Sheet No. 104, Global Alliance For TB Drug Development: Executive Summary of the Scientific Blueprint for TB Development; http://www.who.int/inffs/en/fact104.html]. 3 виникненням туберкульозу, пов'язаного з ВІЛ, масштаби захворювання досягли розмірів, що лякають, на сьогоднішній день туберкульоз є одним зі смертельно небезпечних захворювань. Всесвітня організація охорони здоров'я (ВООЗ) в якості пріоритетної задачі визнало 5 82782 необхідність контролю туберкульозної інфекції для запобігання поширення штамів, стійких до дії лікарських засобів. Однієї з проблем існуючої туберкульозної терапії є виведення M. tuberculosis із дрімаючої або латентної форми. Так, у той час як лікування активної форми туберкульозу за допомогою традиційно призначуваної комбінованої схеми прийому лікарських засобів значно знижує бактеріальне навантаження, частина бактерій переходять у латентну форму і підтримують свою життєдіяльність в організмі хазяїна протягом місяців і років без яких-небудь явних проявів захворювання. Однак пізніше бактерії можуть реактивуватися, що приводить знову до розвитку туберкульозу в активній формі. Рецидив туберкульозу в даний час розглядається як результат реактивації латентних організмів, що підтримують свою життєдіяльність в організмі хазяїна [Stead, WW., Am. Re v. Respir. Dis., 1982, 95, 729-745; Stead, WW., Kerby, GR., Schleuter, and Jordahl, CW., Ann. Intern. Med., 1968, 68, 731-745]. Першим лікарським засобом, використаним для боротьби з M. tuberculosis, був стрептоміцин у 1944 році, що, як було виявлено, інгібує зростання M. Tuberculosis. Протягом останніх тридцяти років у клінічну практику було введено декілька класів сполук, таких як: а) Рифаміцини тривалої дії, наприклад, рифапентин, рифабутин і рифалазил [Javis, В., Lamb, HM., Drugs, 1998, 56, 607-616; McGregor, MM., Olliaro, P., Wolmarans, L., Am. J. Respir. Crit. Care Med., 1996, 154, 1462-1467; Shoen, CM., DeStefano, MS., Cynamon, MH., CHn. Infect. Dis., 2000, 30(Suppl. 3), S288-S29]; б) Сполуки фторхінолона, наприклад, левофлоксацин, моксифлоксацин ігатифлоксацин [Ji, В., Lounis, N., Truffot-Pernot, C, Grosset., Anti Microb. Agents Chemother., 1995, 39, 1341-1344; Miya zaki, E., Mi ya zaki, M., Chen, JM., Chaisson, RE., Bishai, WR., Anti Microb. Agents Chemother., 1999, 43, 8589; Fung-Tome, J., Minassian, В., Kolek, В., Washo, Т., Huczko, E., Boner, D., AntiMicrob. Agents Chemother., 2000, 45, 437-446]; в) Сполуки оксазолідинона [Cynamon, MH., Klemens, SP., Sharpe, CA., Chase, SC, AntiMicrob. Agents Chemother., 1999, 43, 1189-1191]; і г) Ніроімімдазопірани [Strover, CK., Warrener, P., VanDevabter, D., Nature, 2000, 405, 962-966]. Проте, жодна з цих сполук не проявила бажаної здатності до ефективного лікування мультирезистентних форм та/або латентного туберкульозу. Рифапентиин і рифалазил виявили ефективність у лікуванні туберкульозу при введенні малих доз лікарських засобів (інтермітуюча терапія), і повідомляється, що сполучення цих двох лікарських засобів є більш ефективним у запобіганні латентного туберкульозу, ніж рифампіцин. Проте, завдяки тому, що ці лікарські засоби мають такий самий фармакофор, як у рифампіцина, їхній спектр дії, спрямований проти резистентних штамів, не набагато ширше, ніж у рифампіцина. Ці молекули досить неефективні проти мультирезистентних штамів M. Tuberculosis. Крім того, доведена токсичність багатьох з цих речовин. 6 Ряд лікарських препаратів, такі як парааміносаліцилова кислота, ізоніазид, піразинамід, етамбутол, етіонамід, рифампіцин та інші, використовувалися як окремо, так і в комбінації для лікування туберкульозу. Було виявлено, ці лікарські засоби є більш ефективними, ніж стрептоміцин у лікуванні пацієнтів, заражених штамами, резистентними до стрептоміцину, що ознаменувало початок нової ери в ефективному лікуванні туберкульозу. На сьогоднішній день терапія туберкульозу складається з введення комбінації чотирьох лікарських засобів першого ряду, а саме ізоніазид, рифампіцин, етамбутол і піразинамід, що вводяться окремо у виді окремої виготовленої лікарської форми або у виді фіксованої дозованої комбінації. Для ефективного лікування вищезгадані чотири лікарських засоби першого ряду вводяться пацієнту в початковій чи індукційній фазі, протягом якої лікарські засоби приймають у комбінації для того, щоб убити швидкозростаючу популяцію M. Tuberculosis і запобігти виникнення резистентності до лікарських препаратів. Далі йде фаза продовження захворювання, протягом якої вводяться бактерицидні лікарські засоби, а саме ізоніазид, рифампіцин і піразинамід, для того, щоб убити популяцію M. Tuberculosis, що ділиться періодично [Jindani, A., Aber, VR., Edwards, EA., Mitchison, DA., Am. Rev. Respir. Dis., 1980, 121, 39-49; Grosset, J., Tubercule., 1978, 59, 287-297; East African/British Medical Research Council Study in Am. Rev. Respir. Dis., 1977, 115, 3-8; Singapore Tuberculosis Service/British Medical Research Council in Am. Rev. Respir. Dis., 1979, 119, 579-585; British Thoracic Society and Tuberculosis Association in Am. Rev. Respir. Dis., 1982, 126, 460-462; Snider, DE., Rogowski, J., Zierski, M., Bek, E., Long, MW., Am. Rev. Respir. Dis., 1982, 125, 265-267]. Незважаючи на те, що вищезгадане сполучення лікарських засобів першого ряду забезпечує лікування, спрямоване проти чутливи х штамів M. Tuberculosis, протягом від 4 до 6 місяців, така комбінована терапія не завжди є успішною, особливо у випадку пацієнтів, інфікованих мультирезистентними штамами. До того ж тривала терапія здійснюється протягом шести місяців і в більшості випадків приводить до неприємних побічних ефектів. Крім того, відносно тривалий курс лікування найчастіше дотримується не в повній мірі. Таке недотримання курсу лікування в більшості випадків приводить до несприятливого результату лікування в результаті розвитку резистентності до лікарських засобів. З іншого боку, лікарські засоби другої лінії, такі як циклосерин, клофазамін, капреоміцин і т.д., використовувані для лікування, є більш дорогими, можуть приводити до небезпечних побічних ефектів і є менш ефективними в порівнянні з препаратами першого ряду. Заміщені похідні піролу представляють інший клас сполук, що імовірно є антимікобактеріальними агентами. Багато похідних піролу були синтезовані і протестовані на антитуберкульозну активність [Deidda, D., et. al., Antimicrob. Agents Chemother., 1998, 3035-3037; Biava, M., et. al., J. 7 82782 Med. Chem Res., 1999, 19-34; Biava, M., et. al., Bioorg. & Med. Chem. Lett., 1999, 9, 2983-2988; Cerreto, F., et. al., Eur. J. Med. Chem., 1992, 27, 701-708; Gillet, C, et. al., Eur. J. Med. Chem.-ChiMica Therapeutica., 1976, 11(2), 173-181; Raagno. R., et. al., Bioorg. & Med. Chem., 2000, 8, 1423-1432]. У кращому випадку сполуки, розкриті в даних публікаціях, є кандидатами в лікарські засоби, а не лікарськими засобами, тому що публікації не містять згадувань про їх дію in vivo і токсичності сполук, розкритих у даних п ублікаціях, використовуваних проти експериментального туберкульозу у модельних тварин. Отже, ці сполуки представляють скоріше науковий, ніж комерційний інтерес. Таким чином, існує гостра необхідність розробити більш нові схеми лікування, які будуть використовуватися для того, щоб запобігати, лікувати та/або скорочувати туберкульоз та/або ліквідувати загрозу розвитку мультирезистентних форм та/або латентного туберкульозу. Альтернативна схема лікування повинна мати переваги в порівнянні з вже існуючою схемою для того, щоб: а) скоротити загальну тривалість лікування та/або значно зменшити загальну кількість прийомів лікарських засобів; б) забезпечить ефективне лікування мультирезистентних форм захворювання; в) забезпечити більш ефективне лікування латентного туберкульозу; і г) мінімізувати або запобігти побічним ефектам. У нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1) ми описали деякі заміщені похідні піролу і їх фармацевтично прийнятні солі, що, як було показано, володіють доброю інгібуючою дією стосовно чутливих і резистентних до лікарських засобів штамам M. Tuberculosis. Величина мінімальної інгібуючої концентрації (MIK) деяких найбільш активних сполук, що володіють інгібуючою дією на чутливі і резистентні до лікарських засобів штами M. Tuberculosis, знаходилась в діапазоні від 0,12 до 0,5мкг/мл. Деякі компоненти також демонстрували in vivo терапевтично значиму активність у випадку тварин, інфікованих M. Tuberculosis, а також було виявлено, що ці сполуки безпечні, тому що мають величину середньої летальної дози (LD50) близько 700мг/кг тіла миші, у той час як ізоніазид має величину середньої летальної дози 133мг/кг. Більш того, сполуки демонструють гарний фармакокинетичний профіль. Об'єкт даної міжнародної заявки No. PCT/IN02/00189 (WO 04/026828 A1) включений у даний опис за допомогою посилання. Дані винахідники знайшли, що ряд похідних піролу, розкритих у міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), забезпечують синергічний ефект при використанні в сполученні з деякими лікарськими засобами першого ряду, таким чином, забезпечуючи новий спосіб лікування туберкульозу, включаючи мультирезистентні форми і латентний туберкульоз. Спосіб лікування, описаний в даній заявці, має переваги в порівнянні зі схемою лікування, що існує на даному рівні техніки. 8 Об'єктом винаходу є забезпечити комбінацію, що містить один чи декілька похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1) і одне чи декілька інших протитуберкульозних лікарських засобів для ефективного лікування туберкульозу, включаючи мультирезистентні форми і латентний туберкульоз. Також об'єктом даного винаходу є забезпечити нову комбінацію, що містить синергічно ефективну кількість похідних піролу, розкритих у міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і ефективну кількість одного чи декількох протитуберкульозних лікарських засобів першого ряду. Іншим об'єктом даного винаходу є забезпечити комбінації, що містить один чи декілька похідних піролу, розкритих у міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один чи декілька інших протитуберкульозних лікарських засобів, що є ефективною в лікуванні мікобактеріальних захворювань та/або інгібуванні клітин, включаючи один чи декілька чутливи х чи резистентних до лікарських засобів штамів Mycobacterium tuberculosis, Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. kansasaii, але не обмежуючи ними, чи інші родинні мікобактеріальні види. Також об'єктом даного винаходу є забезпечити ефективне лікування туберкульозу. Ще одним об'єктом є скоротити тривалість лікування від шести місяців. Також об'єктом є забезпечити лікування туберкульозу, що включає введення пацієнту, що потребує даного лікування, комбінації, що містить похідні піролу, розкриті в нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один чи декілька протитуберкульозних лікарських засобів першого ряду. Також об'єктом є забезпечити лікування туберкульозу, яке приводить до повної ліквідації чутливих і резистентних до лікарських засобів штамів, що включає введення пацієнту, що потребує даного лікування, комбінації, що містить похідні піролу, розкриті в нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один чи декілька протитуберкульозних лікарських засобів першого ряду. Також об'єктом даного винаходу є забезпечити ефективне лікування туберкульозу, яке приводить до повної ліквідації чутливих і резистентних до лікарських засобів M. Tuberculosis, що включає введення пацієнту, що потребує даного лікування, комбінації, що містить похідні піролу, розкриті в нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), з одним чи декількома протитуберкульозними лікарськими засобами першого ряду. Також об'єктом даного винаходу є забезпечити ефективне лікування туберкульозу, яке приводить до повної ліквідації чутливих і резистентних до лікарських засобів штамів, таких як Mycobacterium tuberculosis, Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. kansasaii чи інші родинні мікобактеріальні види, лікування включає введення пацієнту, що потребує даного лікування, комбінації, що містить похідні піролу, розкриті в 9 82782 нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один чи декілька протитуберкульозних лікарських засобів першого ряду. Також об'єктом даного винаходу є забезпечити спосіб лікування та/або інгібування одного чи декількох мультирезистентих штамів, включаючи M. tuberculosis Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. Kansasaii, але не обмежуючись ними, та інші родинні мікобактеріальні види, при цьому спосіб лікування включає введення пацієнту, що потребує даного лікування, фармацевтичної композиції, що містить комбінацію похідних піролу, розкритих у міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), з одним чи декількома протитуберкульозними лікарськими засобами першого ряду. Також об'єктом даного винаходу є забезпечити спосіб для запобігання рецидивів туберкульозу після скасування лікування, що включає введення пацієнту, що потребує даного лікування, комбінації, що містить похідні піролу, розкриті в нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один чи декілька протитуберкульозних лікарських засобів першого ряду. Також об'єктом даного винаходу є забезпечити спосіб для запобігання рецидивів інфекції M. tuberculosis після скасування лікування, що включає введення пацієнту, що потребує даного лікування, комбінації, що містить похідні піролу, розкриті в нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один чи декілька протитуберкульозних лікарських засобів першого ряду. Також іншим об'єктом даного винаходу є забезпечити фармацевтичну композицію, що містить комбінацію похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), з одним чи декількома протитуберкульозними лікарськими засобами першого ряду для ефективного лікування туберкульозу, включаючи мультирезистентні види і латентний туберкульоз. Іншим об'єктом даного винаходу є забезпечити фармацевтичну композицію, що містить синергічно ефективну кількість похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), у комбінації з одним чи декількома протитуберкульозними лікарськими засобами першого ряду. Ще одним об'єктом даного винаходу є забезпечити фармацевтичну композицію, що містить комбінацію похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), з одним чи декількома протитуберкульозними лікарськими засобами першого ряду, що є ефективною для лікування мікобактеріальних захворювань та/або інгібування клітин, що включають один чи більш чутливи х і мультирезистентних штамів Mycobacteriun tuberculosis, Myсоbacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. Kansasaii, але не обмежуються ними, та інші родинні мікобактеріальні види. Іншим об'єктом даного винаходу є забезпечити ефективне лікування туберкульозу, що включає введення пацієнту, що потребує такого лікування, 10 фармацевтичній композиції, що містить комбінацію похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), з одним чи декількома протитуберкульозними лікарськими засобами першого ряду. Ще одним об'єктом є забезпечити лікування туберкульозу, що приведе до повної ліквідації чутливих і резистентних до лікарських засобів штамів, лікування включає введення пацієнту, що потребує даного лікування, фармацевтичній композиції, що містить комбінацію похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один чи декілька протитуберкульозних лікарських засобів першого ряду. Ще одним об'єктом даного винаходу є забезпечити лікування туберкульозу, що приведе до повної ліквідації чутливи х і резистентних до лікарських засобів M. tuberculosis, при цьому лікування включає введення пацієнту, що потребує даного лікування, фармацевтичній композиції, що містить комбінацію похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), з одним чи декількома протитуберкульозними лікарськими засобами першого ряду. Ще одним об'єктом даного винаходу є забезпечити лікування туберкульозу, що приведе до повної ліквідації одного чи декількох чутливих і резистентних до лікарських засобів штамів, таких як Mycobacterium tuberculosis, Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. kansasaii чи інших родинних мікобактеріальних видів, при цьому лікування включає введення пацієнту, що потребує даного лікування, фармацевтичній композиції, що містить комбінацію, яка включає похідні піролу, розкриті в нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один або декілька протитуберкульозних лікарських засобів першого ряду. Також об'єктом даного винаходу є забезпечити спосіб для запобігання рецидивів туберкульозу після скасування лікування, що включає введення пацієнту, що потребує даного лікування, комбінації, що містить похідні піролу, розкриті в нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), і один або кілька протитуберкульозних лікарських засобів першого ряду. Також об'єктом даного винаходу є забезпечити спосіб запобігання рецидиву інфекції M. tuberculosis після скасування лікування, що включає введення пацієнту, що потребує даного лікування, фармацевтичної композиції, що містить комбінації похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), з одним або декількома протитуберкульозними лікарськими засобами першого ряду. Також іншим об'єктом даного винаходу є забезпечити спосіб лікування та/або інгібування одного чи декількох мультирезистентних штамів, що включають M. tuberculosis Mycobacterium avium внутрішньоклітинний комплекс, M. fortutium, M. Kansasaii, але не обмежуються ними, а також родинні мікобактеріальні види, при цьому лікування включає введення пацієнту, що потребує даного лікування, фармацевтичній композиції, що містить комбінацію похідних піролу, розкритих у нашій 11 82782 міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), з одним чи декількома протитуберкульозними лікарськими засобами першого ряду. Ще одним об'єктом даного винаходу є забезпечити процес приготування композиції, що містить ефективну кількість похідних піролу, розкритих у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), у комбінації з одним чи декількома протитуберкульозними лікарськими засобами першого ряду. Таким чином, даний винахід стосується антимікобактеріальної комбінації, що містить терапевтично активну кількість N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (1) чи його фармацевтично прийнятну нетоксичну сіль і терапевтично ефективну кількість одного чи декількох протитуберкульозних лікарських засобів першого ряду, вибраних із групи, що включає ізоніазид, рифампіцин, етамбутол і піразинамід. Далі відповідно до винаходу забезпечується процес приготування антимікобактеріальної фармацевтичної композиції, що містить комбінацію речовини формули (1) чи його фармацевтично прийнятної солі і один чи декілька антитуберкульозних лікарських засобів першого ряду, за допомогою методу грануляції, методу вологої грануляції і методу прямого пресування. Даний винахід також забезпечує антимікобактеріальну комбінацію, що містить терапевтично ефективну кількість N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (1) сполуки формули (1) чи його фармацевтично прийнятної нетоксичної солі і терапевтично ефективну кількість одного чи декількох протиботуберкулезних лікарських засобів першого ряду, що вибрані з ізоніазида, рифампіцина, етамбутола і піразинаміда для лікування 12 мультирезистентних форм туберкульозу, включаючи латентний туберкульоз. Даний винахід забезпечує антимікобактеріальну комбінацію, що містить терапевтично ефективну кількість N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (1) чи його фармацевтично прийнятної нетоксичної солі і терапевтично ефективну кількість одного чи декількох протитуберкульозних лікарських засобів першого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда для лікування мікобактеріальних захворювань та/або інгібування клітин, що включають чутли ві і резистентні до лікарських засобів штами Mycobacteriun tuberculosis, Mycobacterium avium — внутрішньоклітинний комплекс, M. fortutium, M. Kansasaii, але не обмежуються ними, та інші родинні мікобактеріальні види. За невеликим винятком технічні і наукові терміни, використовувані тут, мають значення, зрозумілі фахівцю в даній галузі. Будь-які методи і матеріали, подібні тим, що описано тут, можуть використовува тися на практиці чи з метою тестування даного винаходу. За винятком зазначених у протилежному значенні, будь-яке використання таких слів, як "що включає", "утримуючий", "складається з", "що має" і подібних, означає "включають без обмежень" і не повинно тлумачитися як ті, що обмежують якінебудь загальні твердження, що передують такому використанню, конкретними чи подібними елементами або питаннями, що безпосередньо йдуть за таким використанням. Варіанти здійснення даного винаходу не є взаємовиключними, а можуть бути реалізовані в різних комбінаціях. Описані варіанти здійснення даного винаходу і запропоновані варіанти представлені для ілюстрації, а не для того, щоб обмежувати даний винахід, і викладені в прикладеному пункті формули винаходу. Для цілей даного винаходу нижче визначені наступні терміни. Термін "введення" сполуки, чи комбінації композиції повинні розумітися як забезпечення пацієнта, що потребує лікування, сполукою, комбінацією чи композицією або проліками. Термін "спільне введення" тут означає окреме чи спільне введення індивідуальних сполук, що присутні в комбінації, разом чи окремо. Під спільним введенням можна також розуміти сполучення введення двох чи більш сполук комбінації разом з іншими сполуками комбінації, що вводяться чи окремо, а також використовуючи різні варіанти введення. Окреме введення кожної сполуки, у різний час і різними шляхами, може також розгляда 13 82782 тися як спільне введення. Спільне введення може також включати комбіноване введення двох чи більш сполук комбінації, якщо введення кожного окремого компонента відбувається тим самим шляхом. Наприклад, якщо шлях введення всіх окремих компонентів у комбінації є однаковим, наприклад, пероральний шлях введення, то з однієї чи декількох індивідуальних сполук в комбінації може бути вигото влена дозована форма, призначена для того самого шляху введення. Термін "спільне введення" може також означати введення одного чи декількох сполук композиції разом (наприклад, в окремих дозованих формах) чи одного чи декількох сполук окремо. Термін "композиція", тут означає продукт, що містить визначені інгредієнти, а також продукт, що є прямим чи непрямим результатом комбінації заданих компонентів. Термін "композиція" може включати окрему чи сполуку більш однієї сполуки. "Композиція" може включати один чи декілька активних інгредієнтів. Термін "повна ліквідація" означає відсутність виявленої при посіві мікобактерії після визначеного інкубаційного періоду в органах-мішенях, а саме легенях і селезінці інфікованих тварин чи індивідуумів, що одержують лікування відповідно до даного винаходу. Термін "наповнювач" означає компонент фармацевтичного продукту чи композиції, що не є активним інгредієнтом, такий як наповнювач, розчинник, носій та інше. Наповнювачі, придатні для готування фармацевтичної композиції, є переважно фармацевтично прийнятними. Термін "фармацевтично прийнятний" тут означає, що переносник, наповнювач чи носій повинний бути сумісним з іншими інгредієнтами сполуки і не повинні мати шкідливу дію для реципієнта.Термін "фармацевтична композиція" охоплює продукт, що містить активний інгредієнт(и), фармацевтично прийнятний наповнювач(і), а також будь-який продукт, що є прямим чи непрямим результатом комбінації, комплексування й агрегування будь-яких двох чи більше інгредієнтів чи результатом інших типів чи реакцій взаємодій одного чи декількох інгредієнтів та/або наповнювачів. Відповідно, фармацевтичні композиції даного винаходу можуть включати будь-які композиції, приготовлені при змішуванні активного інгредієнту, додаткового активного інгредієнту(ів) і фармацевтично прийнятного наповнювача. Термін "синергізм" чи "синергічний" включає наступне (і) кількість або дозування, при яких окрему сполуку, активний інгредієнт чи лікарський засіб може бути введено в меншій дозі, якщо є присутнім у комбінації з одним чи декількома іншими активними інгредієнтами, сполуками чи лікарськими засобами, ніж доза, необхідна при його введенні окремо; та/або (іі) властивість/час, при яких окремий активний інгредієнт, сполука чи лікарський засіб, що присутній у комбінації, проявляють більш високу ефективність, а також приводять до зменшення часу лікування, у порівнянні з даними параметрами, що спостерігаються при їх окремому введенні, 14 але не обмежується цим. Наша міжнародна заявка No. PCT/IN02/00189 (WO 04/026828 A1) розкриває похідні піролу, які виявляють антимікобактеріальну активність. Було виявлено, що ці похідні мають переваги в порівнянні з раніше відомими сполуками, що стане очевидним з даних про їх ефективність і низьку токсичності in vivo . Виявлено, що з усі х дев'яноста окремих сполук, розкритих тут, сполука № 12, тобто N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксамід і її фармацевтично прийнятні нетоксичні солі, визначені в даній заявці як сполуки формули (І), виявляють добру антибактеріальну дію проти чутли вих і мультирезистентних штамів M. Tuberculosis Необхідно відзначити, що посилання на сполуку формули (І) включає їх фармацевтично прийнятні кислотно-адитивні солі. Відповідні солі формуються як органічними, так і неорганічними кислотами і включають солі, сформовані малеїновою, фумаровою, бензойною, асорбіновою, памовою, бурштиновою, саліциловою, метансульфоновою, етандісульфоновою, оцтовою, пропіоновою, винною, лимонною, глюконовою, стеариновою, пальмітиновою, ітаконовою, гліколевою, параамінобензойною, глютамовою, бензосульфоновою, бензолсульфоновою, пара-толуолсульфоновою, фосфорною, сірчаною, азотною, соляною, бромисто-водневою кислотами і т.д. Виявлено, що терапевтично ефективна кількість сполуки формули (І) має необхідні антитуберкульозні властивості. Проте, якщо сполука формули (І) вводиться разом з будь-яким з антитуберкульозних лікарських засобів першого ряду, наприклад, ізоніазидом, рифампіцином, етамбутолом і піразинамідом, має місце синергічний ефект. Під синергічним ефектом мається на увазі те, що терапевтичний ефект спільного введення сполуки формули (І) і одного чи декількох антитуберкульозних лікарських засобів першого ряду, зазначених вище, є більш сильним у порівнянні з терапевтичним ефектом, що спостерігається при окремому введенні як ефективної кількості сполуки (І), так і ефективної кількості кожного з антитуберкульозних лікарських засобів першого ряду. Крім того терапевтичний ефект спільного введення сполуки формули (І) і одного чи декількох вищезгаданих антитуберкульозних лікарських засобів першого ряду вище в порівнянні з терапевтичним ефектом, отриманим при введенні антитуберкульозних лікарських засобів першого ряду в сполученні один з одним. 15 82782 Подібний синергізм має переваги в тому, що передбачає введення кожного компонента в комбінації в меншій кількості в порівнянні з тією кількістю, що була б необхідною при їх окремому введенні. Таким чином, дана терапія може призначатися індивідуумам, що, наприклад, не сприймають адекватно введення одного компонента в максимальному дозуванні. Таким чином, було виявлено, що спільне введення сполук піролу формули (І) і одного чи декількох речовин, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, діє таким чином, що приводить до підвищення ефективності лікування туберкульозу в порівнянні з дією, що обумовлена окремим введенням сполуки формули (І) і антитуберкульозних лікарських засобів першого ряду чи введенням антитуберкульозних лікарських засобів першого ряду в сполученні один з одним. Було виявлено, що спільне введення сполук піролу формули (І) і одного чи декількох сполук, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, приводить до повної ліквідації туберкульозу в порівнянні з неповною ліквідацією, що спостерігається при окремому введенні сполуки формули (І) і антитуберкульозних лікарських засобів першого ряду або при введенні антитуберкульозних лікарських засобів першого ряду в сполученні один з одним. Термін «повна ліквідація» означає, що жодна мікобактерія, що виявляється при посіві, не може бути зареєстрована в органах-мішенях, а саме, в легенях або селезінці інфікованих тварин після проведення курсу лікування комбінацією за даним винаходом. Відзначається, що по закінченні лікування інфікованих тварин за відомою схемою лікарського лікування, тобто, сполученням одного чи декількох антитуберкульозних лікарських засобів першого ряду, таких як етамбутол, ізоніазид, піразинамід і рифампіцин, значна кількість туберкульозних паличок, що виявляються при посіві, реєструється в органах-мішенях, тобто легенях і селезінці. Це видно з даних, приведених нижче в Таблицях X, XI, і XII. Один з методів кількісного визначення мікобактерій, що виявляються при посіві, включає забій після закінчення терміну лікування тварин, що отримали дане лікування, при цьому органимішені, тобто легені і селезінку, забирають у стерильних умовах, гомогенизують у стерильному середовищі, і серійно розведений у десять разів гомогенат поміщають у чашку Петрі. Гомогенат, що залишився, висівається із судини гомогенізатора в чашку Петрі, що містить середовище, з метою підрахунку загальної кількості. Після закінчення інкубаційного періоду не відзначається ріст мікобактерій, що може розглядатися як повна ліквідація M. Tuberculosis. Для кількісного аналізу виявлених при посіві мікобактерії фахівцями в даній області використовуються інші відомі методи. Існуючий метод лікування туберкульозу включає використання комбінації ізоніазида, рифампіцина, піразинаміда і етамбутола в кількості 25.0, 20.0 , 150.0 і 100.0мг/кг ваги тіла відповідно, що еквівалентно введенню загальної кількості лікарських засобів 295мг/кг [Enquire, JAF., Jann, LC, and 16 Cynamon, MH., Antimicrob Agents Chemother. 2002, 46, 1022-1025; Anne, MJ., Lenerts, A., Sharon, EC, Chemielewski AJ., and Cynamon MH., Antimicrob. Agents Chemother., 1999, 43, 2356-2360; Cynamon MH., and Klemens, SP., Antuticrob. Agents Chemother., 1996, 40, 298-301]. На відміну від цього в одному з варіантів здійснення даного винаходу терапевтичний ефект лікування, що використовує сполуку формули (І) у сполученні з антитуберкульозними лікарськими засобами першого ряду, може досягатися при менших кількостях ізоніазида, рифампіцина, піразинаміда і етамбутола, ніж загальна кількість 295мг/кг. Наприклад, в одному з варіантів здійснення може бути введена загальна кількість ізоніазида, рифампіцина, піразинаміда і етамбутола близько 200мг/кг, що є меншою дозою в порівнянні з кількістю, що використовується в існуючому методі лікування. Крім того, при введенні окремих компонентів у меншому дозуванні, у багатьох випадках можна мінімізувати або уникнути побічних ефектів. Коротко, комбінація спільного введення сполуки формули (І) з одним чи декількома відомими антитуберкульозними лікарськими засобами першого ряду вводить у практику новий спосіб лікування туберкульозу, про який раніше не повідомлялося. Також було виявлено, що вищезгадана комбінація модулює відповідь резистентних до лікарських засобів штамів M. Tuberculosis і є "швидкодіючої" комбінацією. Таким чином, час, витрачений на забезпечення повної та ефективної ліквідації M. Tuberculosis із організма індивідуума, значно знижується в порівнянні з часом, витраченим при використанні відомих препаратів, використовуваних в існуючи х методах лікування, як при використанні їх по окремості, так і в сполученні один з одним. Виявлено, що в одному з варіантів здійснення лікування за допомогою комбінації за даним винаходом було витрачено тільки одну третину часу, що була витрачена на лікування, що включає традиційно призначувану схему з використанням комбінації антитуберкульозних лікарських засобів першого ряду. Більш значним є те, що наші дослідження показали, що при введенні комбінації компонента формули (І) з відомими антитуберкульозними препаратами, такими як рифампіцин і піразинамід, спостерігається збільшення приблизно в дванадцять разів значення С mах (максимальна концентрація) сполуки формули (І) у крові. Подібні поліпшення спостерігаються у випадку параметрів Т1/2 (час напіввиведення) і AUC (площа під кривою залежності концентрації препарату від часу). Істотним є те, що виявлено, що в одному з варіантів здійснення даного винаходу комбінація сполуки формули (І) чи його фармацевтично прийнятної солі й одного чи декількох антитуберкульозних препаратів першого ряду запобігає рецидиву мікобактеріальної інфекції після припинення лікування. Введення по окремості кожної речовини, у різний час і різними шляхами, у деяких випадках може бути корисним. Таким чином, компоненти в комбінації, тобто похідні піролу формули (І) і один 17 82782 чи декілька антитуберкульозних препаратів першого ряду необов'язково повинні вводиться фактично одночасно чи в будь-якому порядку. Введення повинне бути синхронізовано за часом в такий спосіб, щоб пік фармакокинетичного ефекту однієї сполуки збігався з піком фармакокинетичного ефекту іншої сполуки. Всі активні інгредієнти можуть бути представлені у вигляді окремих дозованих форм, які можна вводити по черзі. Іншим варіантом є те, що у випадку однакового шляху введення (наприклад, перорального) дві чи кілька активних сполук можуть бути представлені у виді окремої форми для спільного введення, однак обидва методи спільного введення є частиною того самого терапевтичного курсу чи схеми лікування. В одному варіанті здійснення даного винаходу сполука піролу формули (І) і антитуберкульозні препарати першого ряду вводяться спільно перорально й окремо за допомогою відповідних дозованих форм. Речовини, комбінації і композиції за даним винаходом виготовляють з використанням відповідних фармацевтично прийнятних наповнювачів. Лікування туберкульозу включає спільне введення пацієнту, що потребує такого лікування антимікобактеріальної комбінації, що містить терапевтично ефективну кількість N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі і терапевтично ефективну кількість одного чи декількох антитуберкульозних препаратів, вибраних з ізоніазида, рифампіцина, етамбутола. У ще одному варіанті здійснення даний винахід забезпечує ефективне лікування туберкульозу за скорочений час лікування. В одному прикладі даного винаходу час лікування скорочується до двох-трьох місяців. В іншому прикладі даного винаходу спостерігалася повна ліквідація чутливи х і резистентних до лікарських засобів штамів, що викликають туберкульоз. Прикладами чутливи х і резистентних до лікарських засобів штамів є M. tuberculosis, Mycobacterium avium — внутрішньоклітинний комплекс, M. fortutium, M. Kansasaii й інші родинні мікобактеріальні види. В одному варіанті даний винахід забезпечує метод запобігання рецидиву туберкульозу після припинення лікування. Метод включає спільне введення пацієнту, що потребує такого лікування, антимікобактеріальної комбінації, що містить терапевтично ефективну кількість N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) 18 чи його фармацевтично прийнятної нетоксичної солі і терапевтично ефективну кількість одного чи декількох антитуберкульозних препаратів першого ряду, вибраних з ізоніазида, рифампіцина і піразинаміда. Рецидив може бути результатом реактивації дрімаючих чи латентних чутливих чи мультирезистентних штамів Mycobacterium tuberculosis, Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. kansasaii та інших родинних мікобактеріальних видів. В іншому варіанті даний винахід забезпечує синергічну антимікобактеріальну комбінацію, що містить синергічно ефективну кількість сполуки N(3-[[4-(3-трифторметилфеніл)піперазиніл]метил]-2метил-5-феніл-піроліл)-4-піридилкарбоксаміда формули (І) або його фармацевтично прийнятної нетоксичної солі і терапевтично ефективну кількість одного чи декількох антитуберкульозних препаратів першого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда для лікування туберкульозу, включаючи мультирезистентні види і латентний туберкульоз. Іншим варіантом даного винаходу є здійснення терапевтично синергічного ефективного лікування туберкульозу, що включає спільне введення пацієнту, що потребує такого лікування, кількостей: (і) сполуки формули (І) чи його фармацевтично прийнятних нетоксичних солей; (іі) одного чи декількох антибактеріальних препаратів, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда. де кількість (і), взятого окремо, і кількості ізоніазида, рифампіцина, етамбутола і піразинаміда, взятих окремо, є недостатніми для досягнення синергічного терапевтично ефективного рівня лікування туберкульозу, але при цьому комбінований ефект доз (і) і одного чи декількох сполук, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, є більш високим, ніж сума рівнів терапевтичних ефектів лікування туберкульозу, що досягаються при окремому застосуванні доз (і) та ізоніазида, рифампіцина, етамбутола і піразинаміда. 19 82782 20 У ще одному варіанті даний винахід забезпечує антимікобактеріальну фармацевтичнукомпозицію, що містить комбінацію терапевтично ефективної кількості N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі з терапевтично ефективною кількістю одного чи декількох анти туберкульозних препаратів першого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, в суміші з фармацевтично прийнятним наповнювачем для лікування туберкульозу. Дана композиція може бути використана для лікування мультирезистентних форм туберкульозу і латентного туберкульозу. В одному з варіантів даний винахід забезпечує антимікобактеріальну фармацевтичну композицію, що містить комбінацію терапевтично ефективної кількості N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі з терапевтично ефективною кількістю одного чи декількох антитуберкульозних препаратів першого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, в суміші з фармацевтично прийнятним наповнювачем для лікування мікобактеріальних захворювань та/або інгібування однієї чи декількох клітин, включаючи чутливі і мультирезистентні штами Mycobacterium tuberculosis, Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. kansasaii, але не обмежуючись ними, і інші родинні види. В іншому варіанті даний винахід забезпечує метод, корисний для запобігання рецидиву туберкульозної інфекції після припинення лікування, що включає спільне введення пацієнту, що потребує такого лікування, антимікобактеріальної фармацевтичної композиції, що містить терапевтично ефективну кількість N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі з терапевтично ефективною кількістю одного чи декількох антитуберкульозних препаратів першого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, в суміші з фармацевтично прийнятним наповнювачем. Рецидив може бути результатом реактивації дрімаючих або латентних чутливи х і мультирезистентних штамів Mycobacterium tuberculosis, Mycobacterium avium - внутрішньоммолекулярний комплекс, M. fortutium, M. kansasaii і інших родинних мікобактеріальних видів. У ще одному варіанті даний винахід забезпечує е фективний спосіб лікування туберкульозу, що не тільки забезпечує скорочення часу лікування до двох-трьох місяців, але й приводить до повної ліквідації чутливи х і резистентних до лікарських препаратів M. tuberculosis, даний спосіб лікування включає спільне введення пацієнту, що потребує такого лікування, антимікобактеріальної фармацевтичної композиції, що містить комбінацію терапевтично ефективної кількості N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі з терапевтично ефективною кількістю одного чи декількох антитуберкульозних препаратів першого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, в суміші з фармацевтично прийнятним наповнювачем. В іншому варіанті даний винахід забезпечує синергічну антимікобактеріальну композицію, що містить комбінацію синергічно ефективної кількості N-(3-[[4-(3-трифторметилфеніл)піперазиніл]метил]2-метил-5-феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі з терапевтично ефективною кількістю одного чи декількох антитуберкульозних препаратів пер 21 82782 шого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, в суміші з фармацевтично прийнятним наповнювачем для лікування туберкульозу, включаючи мультирезистентні форми і латентний туберкульоз. В одному варіанті даний винахід забезпечує спосіб лікування та/або інгібування одного чи декількох мультирезистентних штамів, вибраних з M. tuberculosis Mycobacterium avium - внутрішньоклітинний комплекс, M. fortutium, M. kansasaii, але не обмежуючись ними, і родинних видів, при цьому спосіб включає введення комбінації терапевтично ефективної кількості N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі з терапевтично ефективною кількістю одного чи декількох антитуберкульозних препаратів першого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, в суміші з фармацевтично прийнятним наповнювачем. В іншому варіанті даний винахід забезпечує процес готування антимікобактеріальної фармацевтичної композиції, що містить комбінацію терапевтично ефективної кількості N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі з терапевтично ефективною кількістю одного чи декількох антитуберкульозних препаратів першого ряду, вибраних з ізоніазида, рифампіцина, етамбутола і піразинаміда, в суміші з фармацевтично прийнятним наповнювачем для лікування туберкульозу, включаючи мультирезистентні форми і латентний туберкульоз. Фармацевтична композиція, що містить комбінацію N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда формули (І) чи його фармацевтично прийнятної нетоксичної солі з одним чи декількома антитуберкульозними препаратами першого ряду, може бути введена переважно перорально. Пероральний спосіб введення може бути здійснений за допомогою таблетованої форми, що містить зазначені інгредієнти в домішці з одним чи декількома фармацевтично 22 прийнятними наповнювачами. Сполука з пероральним способом введення є корисною для забезпечення точного дозування, швидкого розподілу лікарського засобу і суттєво сприяє дотриманню пацієнтами схеми лікування. Фармацевтично прийнятні наповнювачі, що можуть бути використані в сполуці або в композиції, включають один чи декілька агентів, вибраних з антиоксидантів, наповнювачів, інертних розчинників, поверхнево-активних речовин, а також відомі добавки, такі як змащувальні речовини і замутнювачі. Антиоксиданти, що можуть бути використані, включають аскорбінову кислоту, бутильований гідроксіанізол, бутильований гідрокситолуол, фумарову кислоту, оксибурштинову кислоту, пропілгалат, аскорбат натрію, метабісульфіт натрію і т.д., але не обмежуються ними. Інертні розчинники, що можуть бути використані, включають карбонат кальцію, сульфат кальцію, декстрати, двохосновний фосфат кальцію, гідрогенізовану рослинну олію, карбонат магнію, оксид магнію, манітол, мікрокристалічну целюлозу, поліметакрилати, порошкоподібну целюлозу, желатинований крохмаль, сорбітол, крохмаль, трьохосновний фосфат кальцію і т.п., але не обмежуються ними. Поверхнево-активні речовини, які можуть бути використані у фармацевтичній композиції, включають іонні поверхнево-активні речовини, наприклад, докузат натрію (діоктил сульфосукцинат натрію), лаурил сульфат натрію і т.п. чи неіонні поверхнево-активні речовини, наприклад, гліцерил моноолеат, поліоксиетилен і т.п. або жирнокислотні ефіри сорбітану, наприклад, полісорбат 80, полівініловий спирт і т.п., але не обмежуються ними. Придатні змащувальні речовини, що можуть бути використані у фармацевтичній композиції, включають стеарат магнію, стеарилфумарат натрію, гідрогенізовану рослинну олію, гідрогенізовану касторову олію, гідрогенізовану бавовняну олію, стеаринову кислоту і стеарат кальцію, колоїдний діоксид кремнію і подібне, але не обмежуються ними. Змащувальні речовини, обрані таким чином, щоб забезпечувати ефективн у змащувальну дію. Наприклад, типова сполука містить змащувальну речовину в кількості від 0% до 10% від маси. У варіанті здійснення винаходу сполука містить змащувальну речовину в кількості від 0,2% до 2% від маси. Придатні замутнювачі, що можуть використовуватися у фармацевтичній композиції, включають діоксид титану, тальк, колоїдний діоксид кремнію і т.п., але не обмежуються ними. Фармацевтична композиція у виді фіксованої дозованої комбінації, що містить сполуку формули (І) і один чи декілька антитуберкульозних сполук, при цьому фармацевтично прийнятні носії можуть бути приготовлені відомими в даній області способами. Наприклад, таблетка з даною комбінацією може бути приготовлена за допомогою кожного з наступних методів, що не обмежують даний винахід, а саме 23 82782 і) Метод сухої грануляції: цей метод включає фільтрацію відповідних активних інгредієнтів і фармацевтичних наповнювачів, після чого проводиться грануляція отриманої порошкоподібної суміші за допомогою пресування у відсутності нагрівання і розчинників [Pharmaceutical Dosage Forms : Tablets, Vol. I, Page 173, ed. H. A. Lieberman, Marcel Dekker Inc., 1980]. ii) Метод вологої грануляції: цей метод включає фільтрацію відповідних активних інгредієнтів і фармацевтичних наповнювачів, отримані частки склеюють між собою за допомогою в'язкої речовини для одержання гранульованого продукту з поліпшеними характеристиками плинності і збільшеною здатністю злипатися під тиском. ііі) Метод прямого пресування: цей метод включає пряме пресування відповідних активних інгредієнтів і фармацевтичних наповнювачів без будь-якої попередньої обробки [The Pharmaceutical Codex, Principle and Practice of Pharmaceutics; page 10, ed. W. Lund, The Council of the Royal Pharmaceutical Society of Great Britain]. Деякі приклади даного винаходу, комбінації і фармацевтичні композиції яких включають наступні суміші, що не обмежують даний винахід, а саме а) Сполука формули (І) чи його фармацевтично прийнятна нетоксична сіль і рифампіцин. б) Сполука формули (І) чи його фармацевтично прийнятна нетоксична сіль і ізоніазид. в) Сполука формули (І) чи його фармацевтично прийнятна нетоксична сіль, ізоніазид і рифампіцин. г) Сполука формули (І) чи його фармацевтично прийнятна нетоксична сіль, ізоніазид, рифампіцин і піразинамід. д) Сполука формули (І) чи його фармацевтично прийнятна нетоксична сіль, піразинамід і етамбутол. є) Сполука формули (І) чи його фармацевтично прийнятна нетоксична сіль, рифампіцин і піразинамід. Інші приклади даного винаходу, комбінації і фармацевтичні композиції яких включають наступні суміші, що не обмежують даний винахід, а саме а) 12.5 або 25.0мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 20.0мг/кг рифампіцина. б) 12.5 чи 25.0мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25.0мг/кг ізоніазида. в) 12.5 чи 25.0мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25.0мг/кг ізоніазида і 20.0мг/кг рифампіцина. г) 12.5 чи 25.0мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі і 25.0мг/кг ізоніазида, 20.0мг/кг рифампіцина і 150.0мг/кг піразинаміда. д) 12.5 чи 25.0мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі, 150.0мг/кг піразинаміда і 100.0мг/кг етамбутола. є) 3.12, 6.25 чи 12.5 мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної 24 солі, 250.0мг/кг ізоніазида, 20.0мг/кг рифампіцина і 150.0мг/кг піразинаміда. ж) 3.12, 6.25 чи 12.5мг/кг сполуки формули (І) чи його фармацевтично прийнятної нетоксичної солі, 20.0мг/кг рифампіцина і 150.0мг/кг піразинаміда. Синтез сполук формули (І) Сполука формули (І) і його фармацевтично прийнятні солі можуть бути синтезовані будь-яким відомим методом, включаючи метод, розкритий у нашій міжнародній заявці No. PCT/IN02/00189 (WO 04/026828 A1), що включена в даний опис посиланням, але не обмежується ним. Приклад приготування N-(3-[[4-(3трифторметил феніл)піперазиніл]метил]-2-метил5-феніл-піроліл)-4-піридилкарбоксаміда викладений нижче: Приготування N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда Крок 1 1-(4-хлорофеніл)пентан-1,4-діон До ретельно перемішаної суспензії безводного хлориду алюмінію (27,0г, 205,9ммоль) у 126мл хлорбензолу був по каплях доданий оксопентаноїлхлорид (23,0г, 171,6ммоль), протягом 30-35 хвилин при кімнатній температурі (25-30°C). Реакційна суміш перемішувалася при зазначеній температурі протягом 1години. Після декомпозиції реакційної суміші при додаванні твердого льоду і соляної кислоти (10мл) тверді частки, які осіли, були відфільтровані, і фільтрат був випарений у роторному випарнику для повного видалення розчинника. Осад був розчинений в етилацетаті (400мл), відмитий водою (2х100мл), сольовим розчином (100мл) і висушений на безводному сульфаті натрію, а розчинник випарений. Отриманий неочищений продукт піддали хроматографії на силікагелі (з розміром комірки сита 100-200), з використанням хлороформу в якості елюенту, отримали 8,6г (24,07%) названої сполуки. Крок 2 N-(5-метил-2-фенілпіроліл)-4 піридилкарбоксамід Суміш 1-(хлорфеніл)пентан-1,4-діона (6,0г, 28,50ммоль, отриманого в Кроці 1) і ізонікотинового гідразида (4,30г, 31,35ммоль) у бензолі (6,0мл) дефлегмували на молекулярних ситах. Через 2години бензол був вилучений при зниженому тиску й осад був розчинений в етилацетаті, відмитий водою (2х100мл) і сольовим розчином (1х50мл). Шар етилацетату був висушений на безводному сульфаті натрію і розчинник випарений. Отриманий неочищений продукт був очищений за допомогою колончатої хроматографії на силікагелі (з розміром комірки сита 100-200), з використанням 0,2% хлороформу в якості елюенту, при цьому отримали 3,50г (39,42%) названої сполуки. Крок 3 N-(3-{[4-(3трифторметилфеніл)піперазиніл]метил}-2-метил5-фенілпіроліл)-4-піридилкарбоксамід До перемішаного розчину N-(5-метил-2фенілпіроліл)-4піридилкарбоксаміда (0,300г, 1,083ммоль, отриманому в Кроці 2) в ацентонітри 25 82782 лі (5,0мл) була по каплях додана суміш 1-(3трифторметилфеніл)піперазин гідрохлориду (0,288м, 1,083ммоль), 40% формальдегіду (0,032г, 1,083ммоль) і оцтової кислоти (0,09мл). Після завершення додавання реакційна суміш перемішувалася при кімнатній температурі протягом 4годин. Отримана суміш була нейтралізована гідроксидом натрію (20% водяного розчину) і екстрагована етилацетатом (2х50мл). Зв'язаний екстракт етилацетату був відмитий водою (2х25мл), сольовим розчином (1х20мл) і висушений у безводному сульфа ті натрію, розчинник був випарений. Метод тонкошарової хроматографії неочищеного продукту визначив дві плями, що були виділені за допомогою колончатої хроматографії на силікагелі (з розміром комірки сита 100-200). Більш полярна сполука, що вимивається при використанні 80% суміші етилацетату і гексану, було отримано в кількості 24,34% (0,130г) і було ідентифіковано як N-(3-{[4-(3трифторметилфеніл)піперазиніл]метил}-2-метил5-фенілпіроліл)-4-піридилкарбоксамід m.р.80-82°С, мас-спектрометрія: m/z 520 (M+1) 1 H ЯМР(ядерно-магнітний резонанс)(СDСl3, δ): 2:13 (s, 3H5CH3), 2.60 (bs, 4Н, 2xN-CH 2), 3.18 (bs, 4Н, 2xN-CH 2), 3.41 (s, 2Н, N-CH 2), 6.24 (s, 1H, Н-4), 6.97-7.03 (4Н, m, Ar), 7.22-7.29 (m, 5H, Ar), 7.53 (d, 2Н, J=6Hz, кільце піридилу), 8.50 (bs, 1,NH D2O здатний заміщатися), 8.70 (d, 2H, J=6Hz, кільце піридилу). Фармакологічне тестування Попередня оцінка антимікобактеріальної дії сполуки формули (І) була описана в нашій міжнародній заявці No. PCT/IN02/00189, що знаходиться у розгляді. Проведені після цього мікробіологічні, токсикологічні і фармакокинетичні дослідження детально описані тут. Сполука формули (І), використана в описаних нижче тестах, є хлористоводневою сіллю сполуки формули (І) (хлористоводнева сіль N-(3-[[4-(3трифторметилфеніл)піперазиніл]метил]-2-метил-5феніл-піроліл)-4-піридилкарбоксаміда). Дослідження in vitro Метод розведення агару для визначення мінімальної інгібуючої концентрації Мінімальна інгібуюча концентрація (MIK) окремих сполук стосовно штамів мікобактерії визначалася з посиланням на метод розведення агару відповідно до вказівок NCCLS-M24-T2. Сполуки розчиняли в ДМСО (діметилсульфоксиді) і розводили в два рази для одержання десяти серійних розведень кожного компонента. Відповідні об"єми компонентів вносять у двох повторах в ча шки Петрі з агаровим середовищем Middlebrook7H10 з додаванням 10% Middle brook, збагаченої олеїновою кислотою, альбуміном, декстрозою (OADC) при концентраціях від 0,03мкг/мл до 16мкг/мл. Тест-організми (мікобактеріальні штами) були вирощені на середовищі Middle brook 7H9, що містить 0,05% Tween-80 і 10% ADC (азодикарбонамід) добавки. Після 7 днів інкубації при 37°C мутність культури доводили до 1.0 за стандартом 1.0 Макфарленд (McFarland), мікроорганізми були додатково розведені в 10 разів стерильною водою, 26 що містить 0,10% Tween-80. Отримана мікобактеріальна суспензія була посіяна плямами (35мкл/пляма) у ча шки Петрі з середовищем 7Н10, доповненим лікарським засобом. Чашки Петрі були герметично закриті і проінкубовані при 37°C у вертикальному положенні протягом 3-4 тижнів. MIK реєстр увалася як найменше розведення сполуки, при якому спостерігалося повне інгібування росту контрольних організмів. Контрольні ізоляти включали клінічні ізоляти, що були в основному чутливими/резистентними до одного чи декількох антитуберкульозних препаратів. Відповідні стандартні штами і контрольні препарати були включені в кожну груп у тесту. Антимікобактеріальна дія сполуки формули (І) Дія in vitro, що демонструє хлористоводнева сіль сполуки формули (І) (хлористоводнева сіль N(3-[[4-(3-трифторметилфеніл)піперазиніл]метил]-2метил-5-феніл-піроліл)-4-піридилкарбоксаміда) проти приблизно 200 чутливих і резистентних клінічних ізолятів M. Tuberculosis, представлено в Таблиці І. Мікобактеріальна активність сполуки формули (І) Фіг.1 показує криву загибелі для сполуки формули (І), що діє проти M. tuberculosis H 37RV. Фіг.2 показує криву загибелі для сполуки формули (І) у комбінації з відомими антитуберкульозними препаратами. Фіг.3 показує криву загибелі для сполуки формули (І) у комбінації з відомими антитуберкульозними препаратами. Для визначення того, чи є інгібіторна активність сполуки формули (І) бактерицидною чи статичною, культура M. tuberculosis була проінкубована в присутності різних концентрацій (1X, 2 Х, 4 Х, 8Х, 16 Х MIK) сполуки формули (І). Фіксований об'єм (0,1мл) культури відбирався щодня з усіх колб протягом 21 дня. Зразки були десятикратно розведені і поміщені в середовище Middle brook 7H10 для визначення кількості туберкульозних бактерій. Концентрація і час досягнення 3 log зниження кількості M. tuberculosis у порівнянні з необробленим контролем може розглядатися як бактерицидна концентрація. Виявлено, що сполука формули (І) виявляє дозозалежну здатність убивати M. tuberculosis і тому сполука є бактерицидною (3 log зниження кількості життєздатних організмів) при концентрації 8X i 16Х MIK. Крива загибелі для сполуки формули (І) проти штаму M. tuberculosis H37 Rv, визначена за методом визначення кількості життєздатних організмів, відображена на Фіг.1. Синергічні дослідження 27 82782 Синергічний ефект сполуки формули (І) у комбінації був визначений за допомогою методу розведення в рідкому живильному середовищі мікрометодом в планшетах у комбінації з відомими антитуберкульозними препаратами. Для тесту на синергізм серійне розведення сполуки формули (І) було додано до мікобактеріальної культури в присутності інших антитуберкульозних препаратів, а саме ізоніазіда, рифампиіцина, етамбутола і моксифлоксацина. Через 28 днів усі чашки Петрі були проаналізовані на повну відсутність росту бактерій на стінках чашок, що містять різні комбінації лікарських засобів. Використання найбільш слабкого розведення комбінації не демонструє видимий ріст бактерій, що може розглядатися як величина параметру MIK для цієї комбінації. Сполука може розглядатися як така, що володіє синергізмом з іншими препаратами, якщо MIK окремої сполуки поліпшується в чотири рази чи більше. Було виявлено, що сполука формули (І) виявляє синергічну дію з рифампіцином у методі мікророзведення живильного середовища in vitro, a також адитивний ефект із етамбутолом, проте не було виявлено ефекту в присутності ізоніазиду, як показано в Таблиці II. Дослідження окремих сполук або їх комбінацій in vivo Ефективність сполуки формули (І) також була оцінена на мишачій моделі туберкульозу легень. Культури Mycobacterium tuberculosis були вирощеними на живильному Middle середовищі Brook 7H9, що містить 0,05% Tween-80 і 10% ADC добавки при 37°С протягом 7 днів. Для інокуляції тварин суспензійну культур у була деаглютинована за допомогою короткочасної обробки ультразвуком, осадили і розлучили відповідно живильним середовищем 7Н9 для одержання концентрації 1x107 КУО (колонієутворюючи х одиниць)/0,2мл. В дослідженні були використані самки аутбредних швейцарських мишей-альбіносів віком чотири тижні, які містилися в клітках-мікроізоляторах в умовах, позбавлених патогенів, з 3 рівнем біологічної безпеки. Інфікування проводилося за допомогою внутрішньовенного введення в хвосто ву вену 0,2мл деаглютинованої суспензії M. tuberculosis. 28 Далі інфіковані миші були безсистемно розподілені в шістьох різних групах. Лікування починалося через 14 днів після інфікування. Для лікування сполука формули (І) та ізоніазид були розчинені в стерильній воді, а рифампіцин був розчинений у 10% ДМСО (діметилсульфоксид) і розведений водою. Препарати готували щоранку безпосередньо перед введенням. Терапія тривала 5/7 днів на тиждень протягом одного місяця. Всі агенти вводилися через зонд і були дозовані в кількості 50, 25 або 12.5мг/кг ваги тіла. Контрольна група тварин, що були інфіковані, але не одержали лікування , була забита на початку лікування (ранній контроль) чи по закінченні лікування (пізній контроль). Миші були забиті шляхом зсуву в шийних хребцях через 5 днів після останнього введення дози лікарського засобу. Селезінки і праві легені були забрані в стерильних умовах і гомогенізировані в гомогенізаторі тканин. Як мінімум 4-6 серійних десятикратні розведення гомогенізату були поміщені в селективне агарове середовище Middle brook 7H1 1 у чашки Петрі в двох повторах. Кількість колоній реєструвалося після інкубації при 37°С протягом 4 днів. Кількість життєздатних бактерій було перераховано на величину Log10. Достовірним розглядалось 2 Log зниження життєздатних бактерій при дії сполук в порівнянні з контролем. Тривалі експерименти в умовах in vivo були застосовані для оцінки активності сполуки формули (І) у монотерапії і лікуванні в сполученні з антитуберкульозними препаратами першого ряду, такими як ізоніазид, рифампіцин, етамбутол і піразинамід. У цих дослідженнях були проаналізовані часові відрізки, тобто один, два, три місяці лікування. Результати вивчення ефективності in vivo Було виявлено, що подібна монотерапія зі сполукою формули (І) приводить до достовірного (більше 2 log) зниженню кількості життєздатних бактерій в органах-мішенях у порівнянні з контрольними тваринами, як зазначено в Таблиці III. Сполука формули (І) демонструє 2 log зниження в органах тварин, що одержали лікування в дозуванні 12.5мг/кг ваги тіла тварин, інфікованих чутливими/резистентними штамами M. tuberculosis, тоді як ізоніазид демонстрував таке ж зниження бактеріального навантаження в концентрації 25 мг/кг або більше у випадку чутливого штаму, але не був е фективним у випадку резистентних штамів у концентрації вище 50мг/кг. Крім того, дослідження для визначення тривалого ефекту лікування (два чи три місяці) сполукою формули (І) показали, що відбувається зниження мікобактеріального навантаження в органах-мішенях. Повна відсутність мікобактерій реєструється в 33% тварин, що одержували лікування протягом трьох місяців. Результати представлені в Таблиці IV і Таблиці V відповідно. 29 82782 30 Фармакокинетичні дослідження Попередні фармакокинетичні дослідження сполуки формули (І) були проведені на мишах і собаках для визначення біодоступності, а також рівнів сполук, що досягаються і підтримуються у сироватці. Результати досліджень, приведені в Таблиці VI, показують, що сполука формули (І) є біодоступною (56.40%) і має кращий час напіввиведення і Сmах, ніж ізоніазид, і тривалий час затримується в сироватці в концентрації, більшій, ніж величина MIK. Дослідження токсичності Гостра токсичність сполуки формули (І) була визначена в гризунів шляхом перорального введення. Було виявлено, що LD50 (середня летальна доза) складає 700мг/кг у мишей і 793мг/кг у щурів, що є поліпшеним показником у порівнянні з показниками LD50 для ізоніазиду. Результати представлені в Таблиці VII. Крім того, було виявлено, що сполука формули (І) не є мутагенною для всіх бактеріальних штамів, використаних у тесті Еймса на визначення мутагенності. Експерименти для демонстрації антимікобактеріальної активності сполуки формули (І) у комбінації з одним або декількома антитуберкульозними препаратами Активність комбінації in vitro Бактерицидний ефект комбінації сполуки формули (І) з одним чи декількома антитуберкульоз 31 82782 ними препаратами першого ряду був визначений у параметрах дози і часу лікування. Фармакокинетичні дослідження Попередні фармакокинетичні дослідження сполуки формули (I) були проведені на мишах і собаках для визначення біодоступності, а також рівней сполук досягнутих і підтриманих в сироватці. Ефективність комбінації сполуки формули (І) з відомими антитуберкульозними препаратами in vi vo, виявлена на мишачій моделі після лікування протягом одного місяця, представлена в Таблиці VIII. Крім того, лікування протягом трьох місяців приводить до повної відсутності росту бактерій в органах 66% тварин, інфікованих чутливими/ резистентними штамами M.tuberculosis, що одержали лікування комбінацією сполуки формули (І) із двома чи трьома відомими антитуберкульозними препаратами, такими як ізоніазид, рифампіцин і піразинамід. Ефективність комбінації сполуки формули (І) з відомими антитуберкульозними препаратами in vi vo, виявлена на мишачій моделі після лікування протягом двох місяців, представлена в Таблиці IX. Крім того, лікування протягом трьох місяців приводить до повної відсутності росту бактерій у тварин, інфікованих чутливими/ резистентними штамами M.tuberculosis, що одержали лікування комбінацією сполуки формули (І) із двома чи трьома відомими антитуберкульозними препаратами, такими як ізоніазид, рифампіцин і піразинамід. Ефективність комбінації сполуки формули (І) з відомими антитуберкульозними препаратами in vi vo, виявлена на мишачій моделі після лікування протягом трьох місяців, представлена в Таблиці X. Важливо те, що виявлено, що більш низькі дози сполуки формули (І), тобто 12.5, 6.25 і 3.12мг/кг у комбінації з відомими антитуберкульозними препаратами, такими як ізоніазід, рифампіцин і піра 32 зинамід, виявляють гарну ефективність in vivo і приводять до повної ліквідації інфекції в органах тварин, інфікованих чутливими/ резистентними штамами M.tuberculosis, після двох місяців лікування. Результати приведені в Таблиці XI. 33 82782 34 35 Крім того, результат ефективності тривалого лікування інфікованою тварин in vivo комбінацією сполуки формули (І) з ізоніазідом, рифампіцином і піразинамідом приведений у Таблиці XII. Крім того, результатом ефективності лікування мишей in vivo комбінацією, що містить сполуку формули (І) із двома відомими антитуберкульозними препаратами, наприклад, рифампіцином і піразинамідом, протягом двох місяців є зниження мікобактеріального навантаження в органахмішенях, як показано в Таблиці XIII. 82782 36 (І)= Сполука з формулою(І) ; RIF = Рифампіцин ; PYR = Піразинамід Фармакокинетичні дослідження комбінації Попередні фармакологічні дослідження комбінації сполуки формули (І) з рифампіцином і піразинамідом були проведені на мишах і собаці для визначення біодоступності та рівнів комбінації сполук, що досягнуті та підтримуються у сироватці. Результати дослідження, приведені в таблиці XIV, показують, що при введенні комбінації сполуки формули (І) з рифампіцином і піразинамідом спостерігається приблизно дванадцятикратне збільшення параметра С mах сполуки формули (І) у крові. Подібне поліпшення показників спостерігається для параметрів T1/2 (час напіввиведення) і AUC (площі під кривої залежності концентрації від часу). Ці результати приведені в Таблиці XIV. (І)= Сполука формули (І); RIF = Рифампіцин ; PYR = Піразинамід Дослідження гострої токсичності комбінації Комбінація сполуки формули (І) з ізоніазідом, рифампіцином і піразинамідом вводилася швейцарським мишам-альбіносам у формі окремої пероральної дози. Миші знаходилися під спостереженням протягом 14 днів. Не було виявлено ніяких клінічних симптомів або випадків смертності. Миші були забиті на 15 день, але в жодному органі не 37 82782 було виявлено ніяких патологічних змін. Попередні результати показані в Таблиці XV. Крім того, комбінація сполуки формули (І) з відомим антитуберкульозним препаратом першого ряду є негенотоксичною, тому що було виявлено, що комбінація дає негативний результат у in vi vo мікроядерному тесті. З вищевикладеного обговорення стає очевидним, що комбінації і фармацевтична композиція за даним винаходом, що містить комбінацію N-(3-[[4(3-трифторметилфеніл)піперазиніл]метил]-2метил-5-феніл-піроліл)-4-піридилкарбоксамід формули (І) або його фармацевтично прийнятну нетоксичну сіль із традиційно призначуваними антитуберкульозними препаратами першого ряду, наприклад, ізоніазідом, рифампіцином, етамбутолом і піразинамідом, а) забезпечує високоефективне лікування туберкульозу, включаючи латентний туберкульоз і мультирезистентні форми, яке перевершує за своєю ефективністю лікування, що досягається при використанні традиційно призначуваних препаратів; б) на відміну від традиційно призначуваних препаратів дані комбінації і композиції є більш ефективними в лікуванні мікобактеріальних захворювань та/або інгібуванні клітин, включаючи чутливі і мультирезистентні штами Mycobacterium tuberculosis, Mycobacterium avium — внутрішньоклітинний комплекс, M. fortutium, M. kansasaii, але не обмежуючись ними, та інші родинні микобактеріальні види; 38 в) на відміну від традиційно призначуваних препаратів дані комбінації і композиції є більш ефективними в запобіганні рецидиву інфекції M. tuberculosis після припинення лікування; г) є швидкодіючими, внаслідок цього значно скорочують час, необхідний для повної й ефективної ліквідації Mycobacterium з організму індивідуума в порівнянні з часом, витраченим при лікуванні традиційно використовуваними в медичній практиці препаратами, що вводяться як окремо, так і комбінації один з одним. Час лікування комбінацією або фармацевтичною композицією складає лише одну третю від часу лікування традиційно призначуваними препаратами за умови повної ліквідації чутливих і резистентних до лікарських засобів штамів M. tuberculosis; д) виявлено, що терапевтично ефективні кількості сполуки формули (І) забезпечує синергічний ефект при його спільному введенні і деякими з традиційно призначуваних антитуберкульозних препаратів першого ряду, такими як ізоніазід, рифампіцин, етамбутол і піразинамід. Даний синергічний ефект є більш виражений, ніж терапевтичний ефект, отриманий при введенні ефективної кількості як компонента (І) або терапевтично ефективної кількості будь-якого з антитуберкульозних препаратів, що вводиться окремо. Крім того терапевтичний ефект спільного введення сполуки формули (І) і вищезгаданих антитуберкульозних препаратів першого ряду є більш виражений, ніж терапевтичний ефект, отриманий при введенні антитуберкульозних препаратів першого ряду в комбінації один з одним; є) зазначений синергізм має перевагу в тому, що дозволяє вводити кожний з компонентів комбінації в меншій кількості, ніж та, що необхідна при введенні по окремості, що робить більш ефективним лікування пацієнтів, що не сприймають адекватно введення одного з компонентів у максимальній дозі; та/або ж) можливість введення окремих компонентів у менших кількостях, що стосується тих випадків, коли комбінований ефект приводить до додаткової мінімізації побічних ефектів, зв'язаних із традиційно призначуваною терапією. 39 Комп’ютерна в ерстка І.Скворцов а 82782 Підписне 40 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAntimycobacterial pharmaceutical composition and method for its obtaining
Автори англійськоюArora Sudershan Kumar, Sinha Neelima, Sinha Rakesh, Upadhyaya Ram Shankar
Назва патенту російськоюАнтимикобактериальной фармакологическая композиция и способ ее получения
Автори російськоюАрора Судершан Кумар, Синха Неелима, Синха Ракеш, Упадхйайа Рам Шанкар
МПК / Мітки
МПК: A61K 9/16, A61K 31/496, A61K 31/131, A61P 31/06, A61K 31/4409, A61K 45/06, A61K 9/20, A61K 31/4965
Мітки: фармакологічна, композиція, спосіб, одержання, антимікобактеріальна
Код посилання
<a href="https://ua.patents.su/20-82782-antimikobakterialna-farmakologichna-kompoziciya-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Антимікобактеріальна фармакологічна композиція та спосіб її одержання</a>
Попередній патент: Спосіб вимірювання вмісту горючих газів та пристрій для його реалізації
Наступний патент: Спосіб одержання залізовуглецевого розплаву, зокрема розплаву сталі
Випадковий патент: Спосіб використання сільськогосподарських земель, забруднених свинцем і кадмієм












