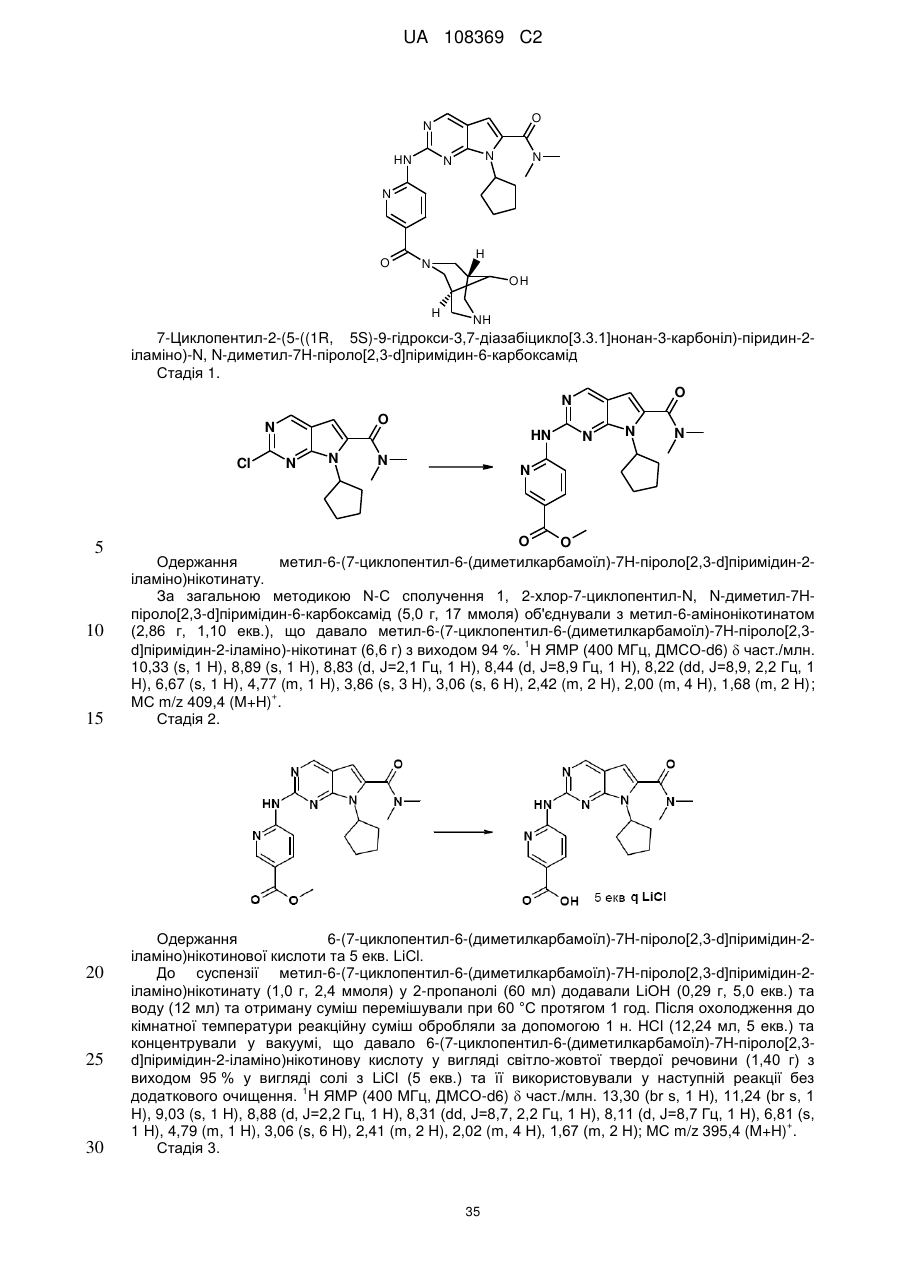
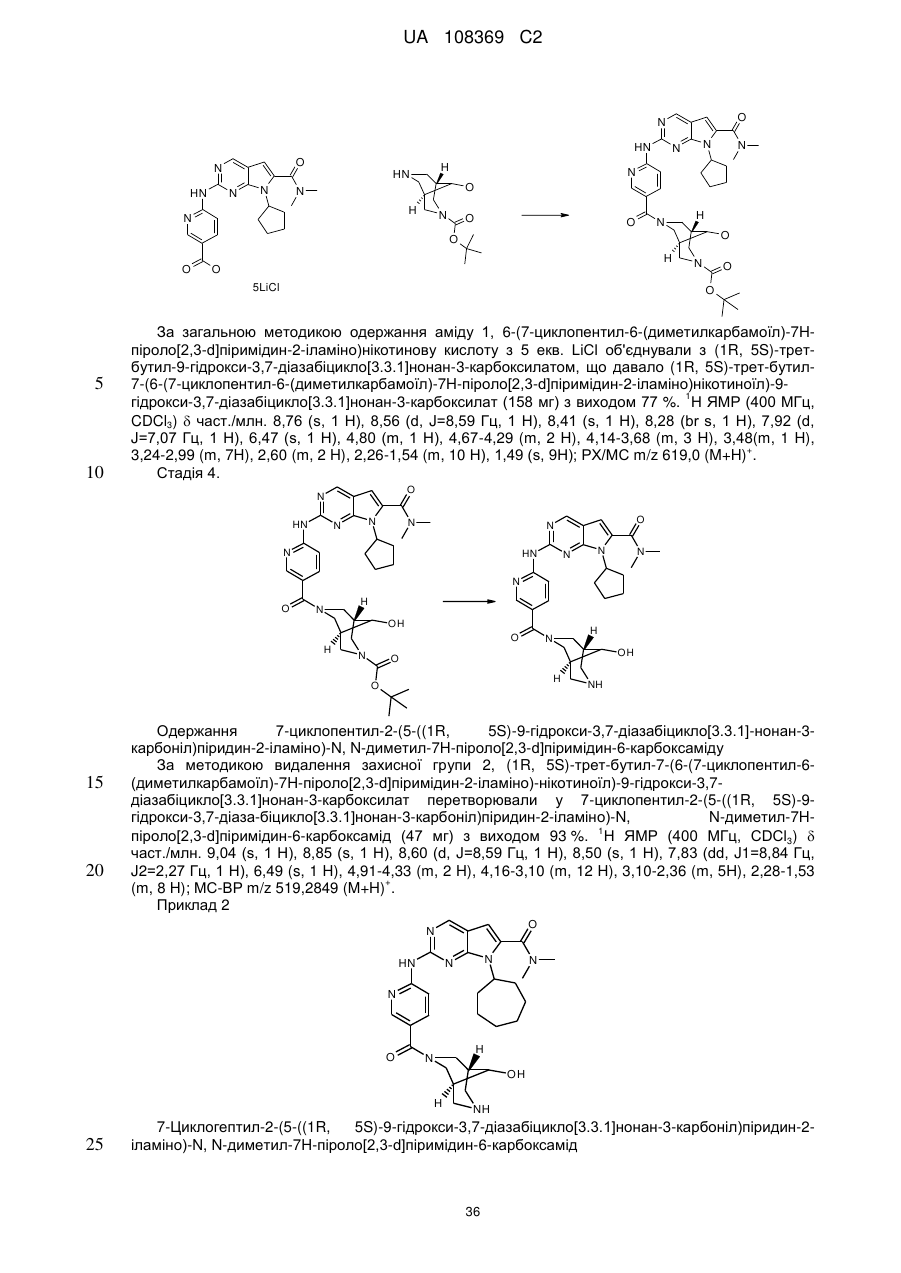
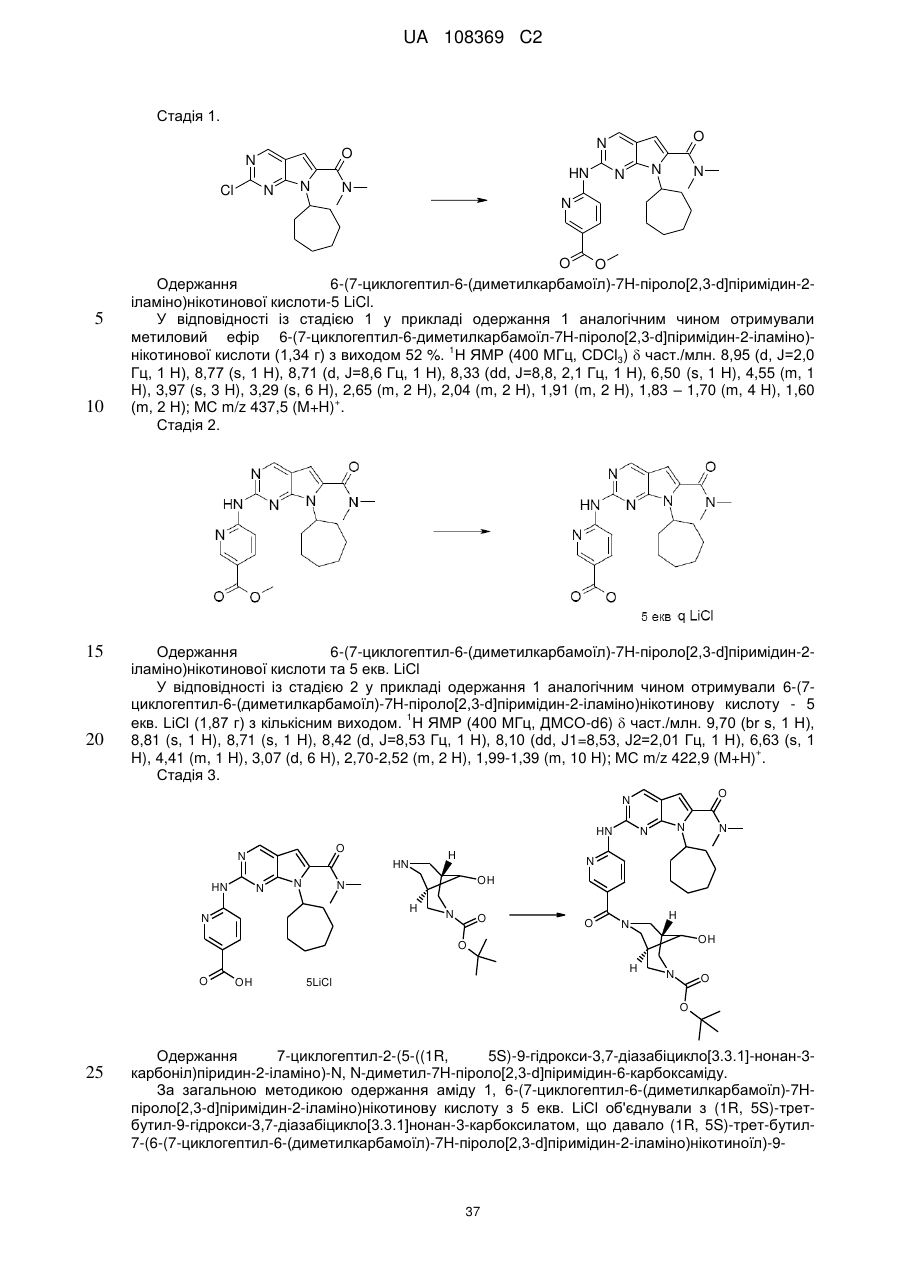
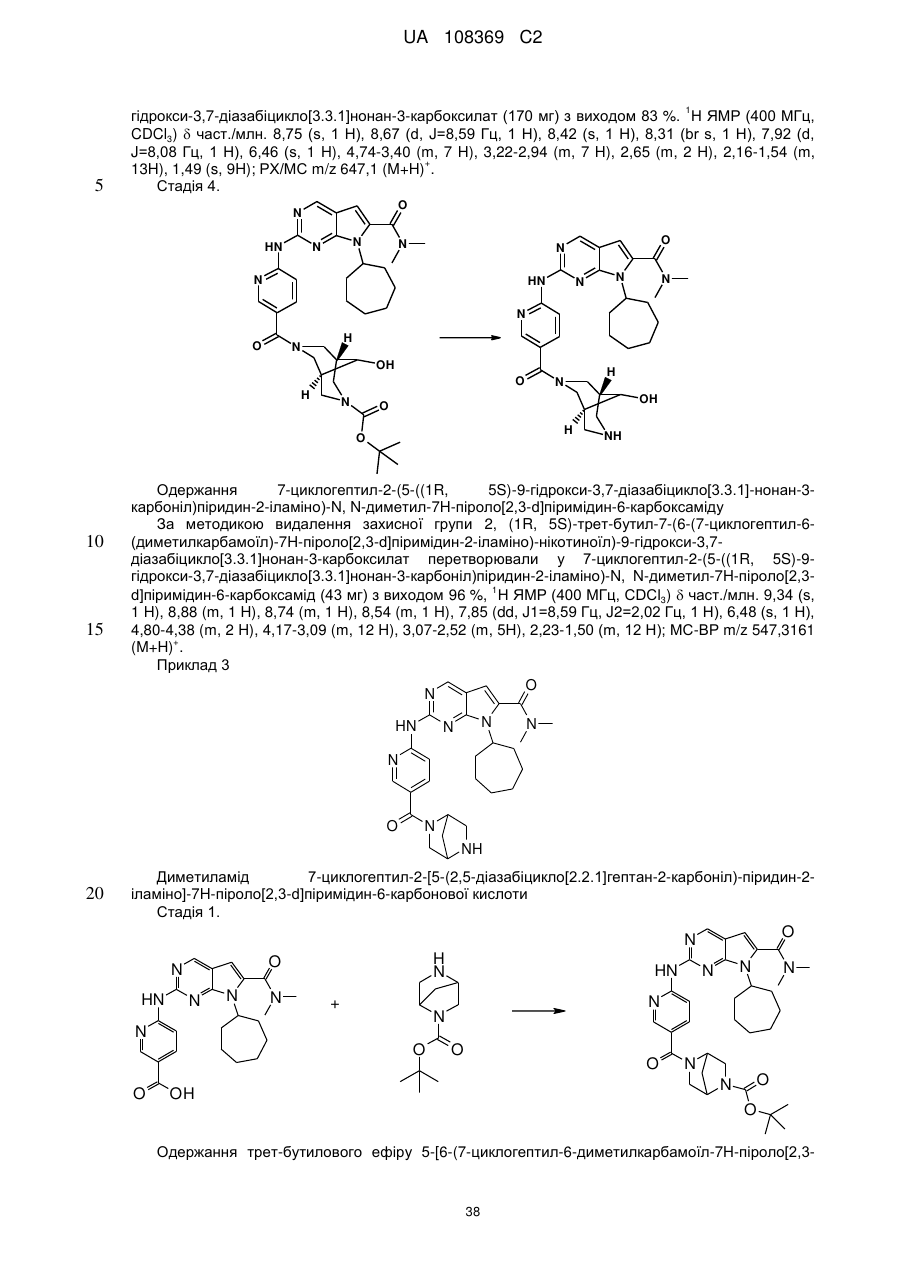
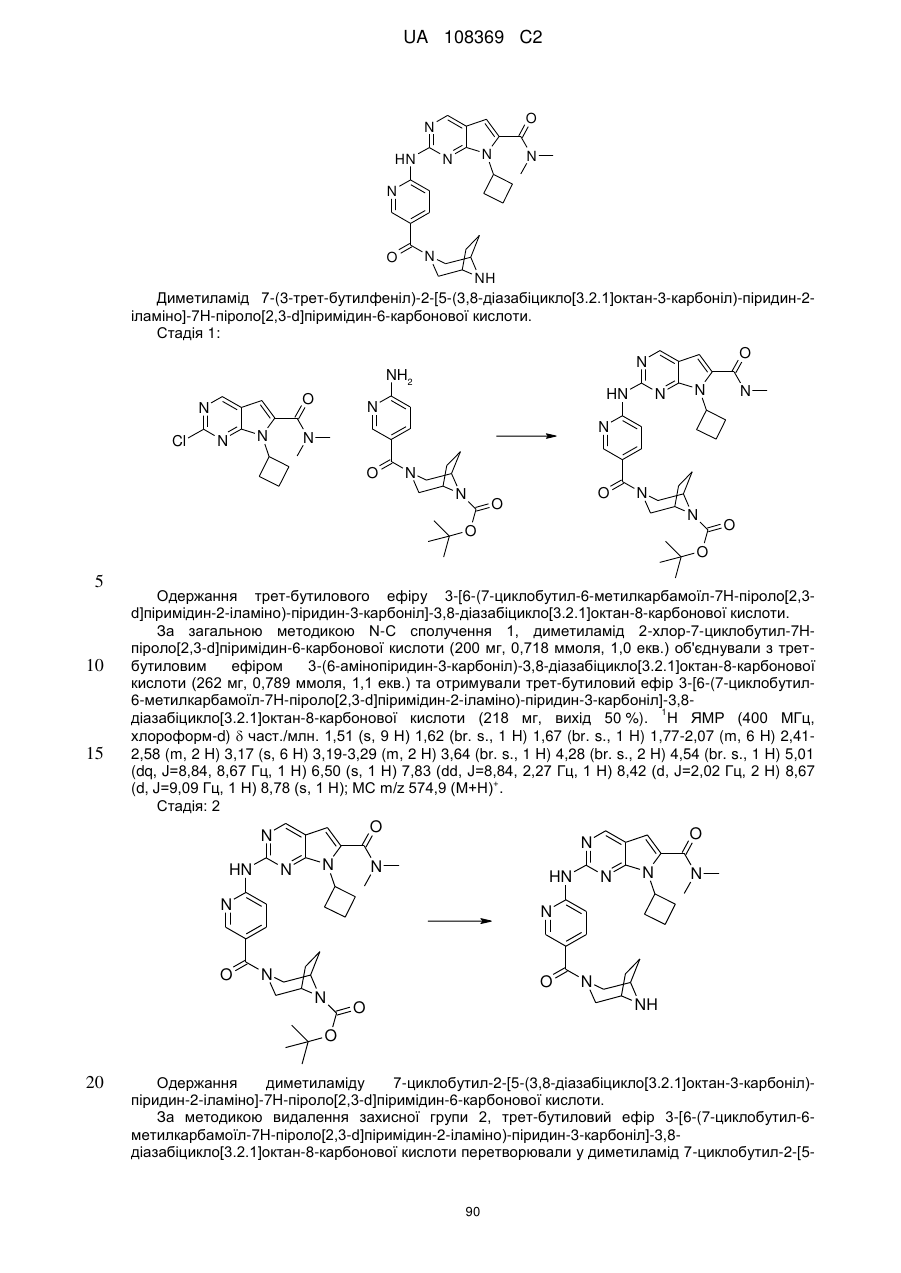
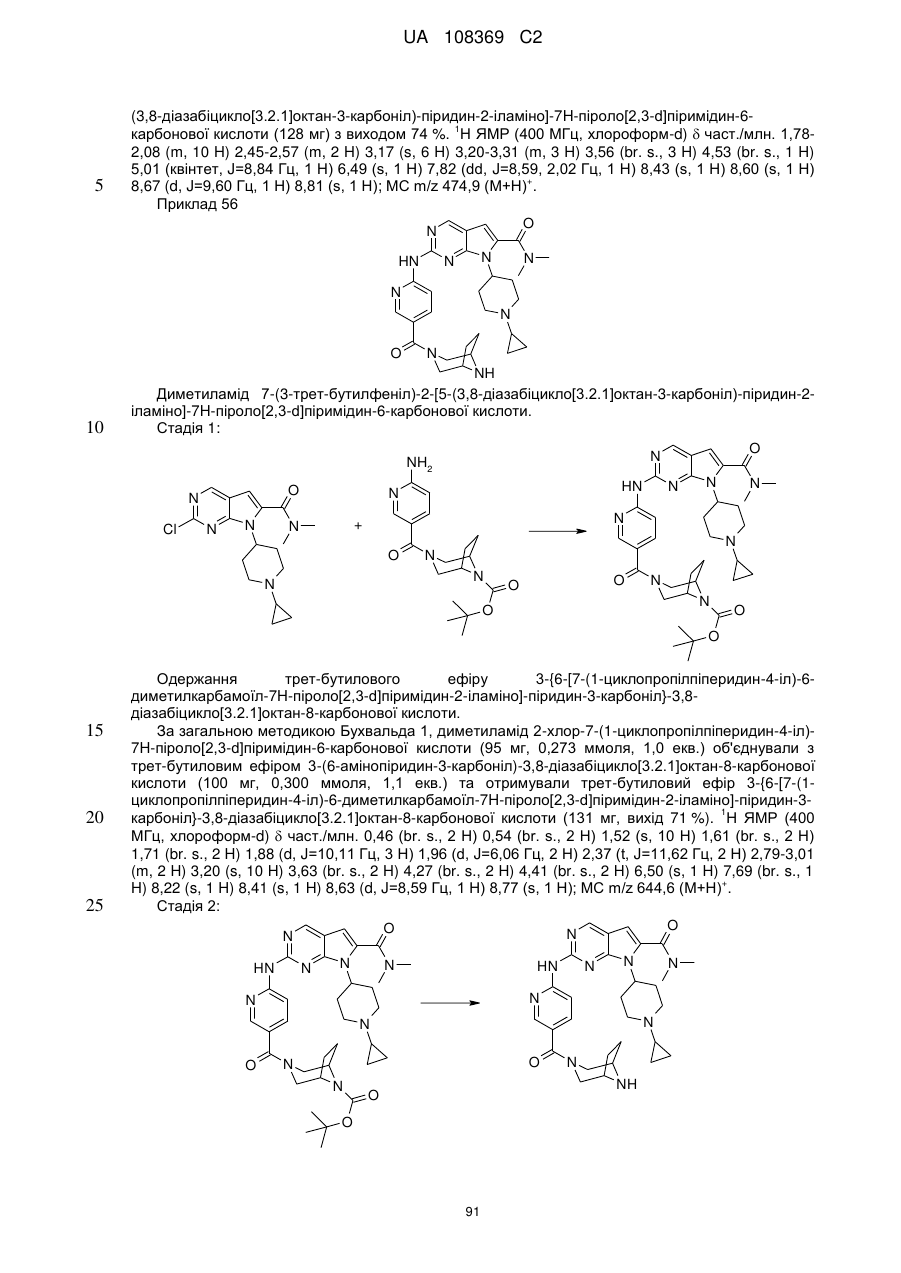
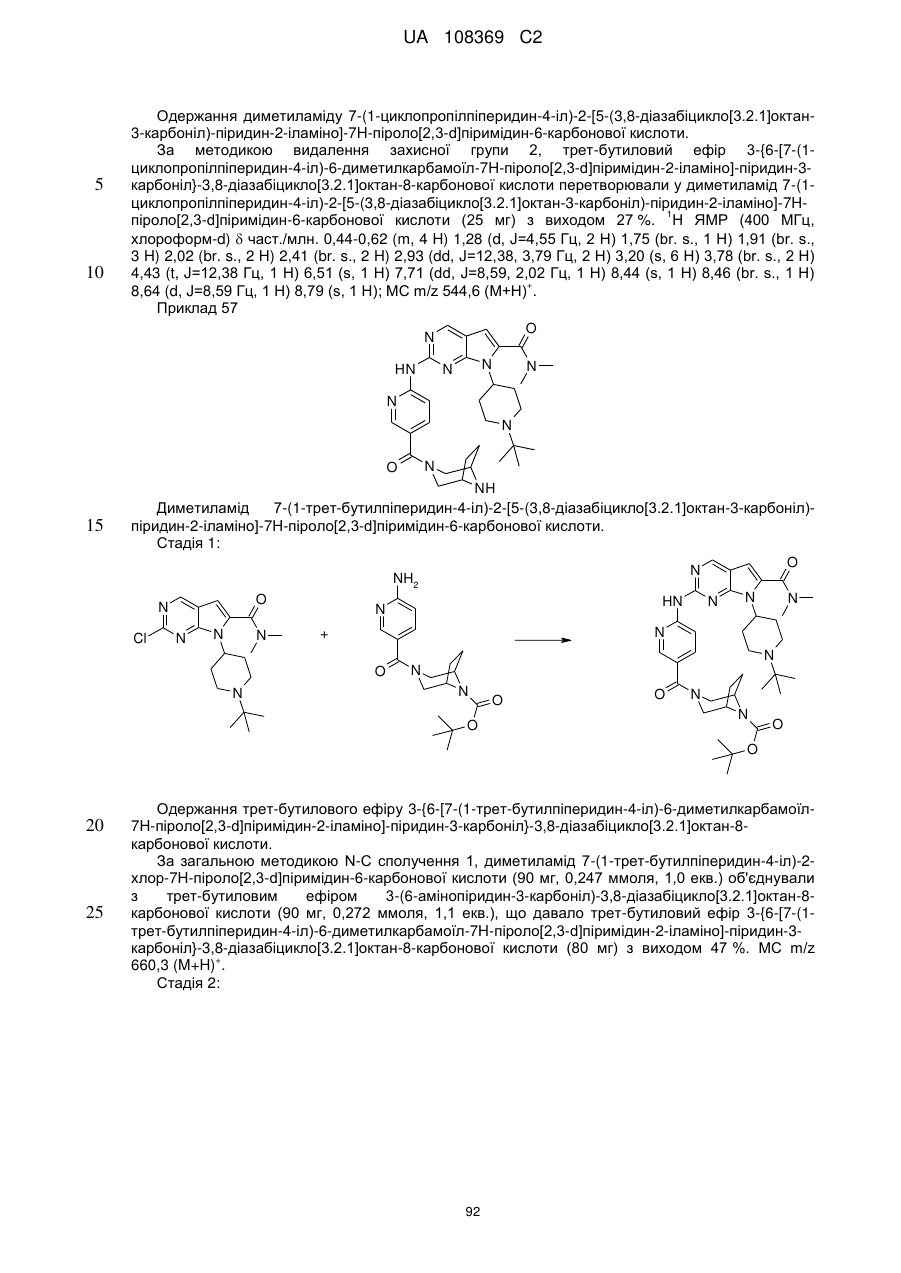
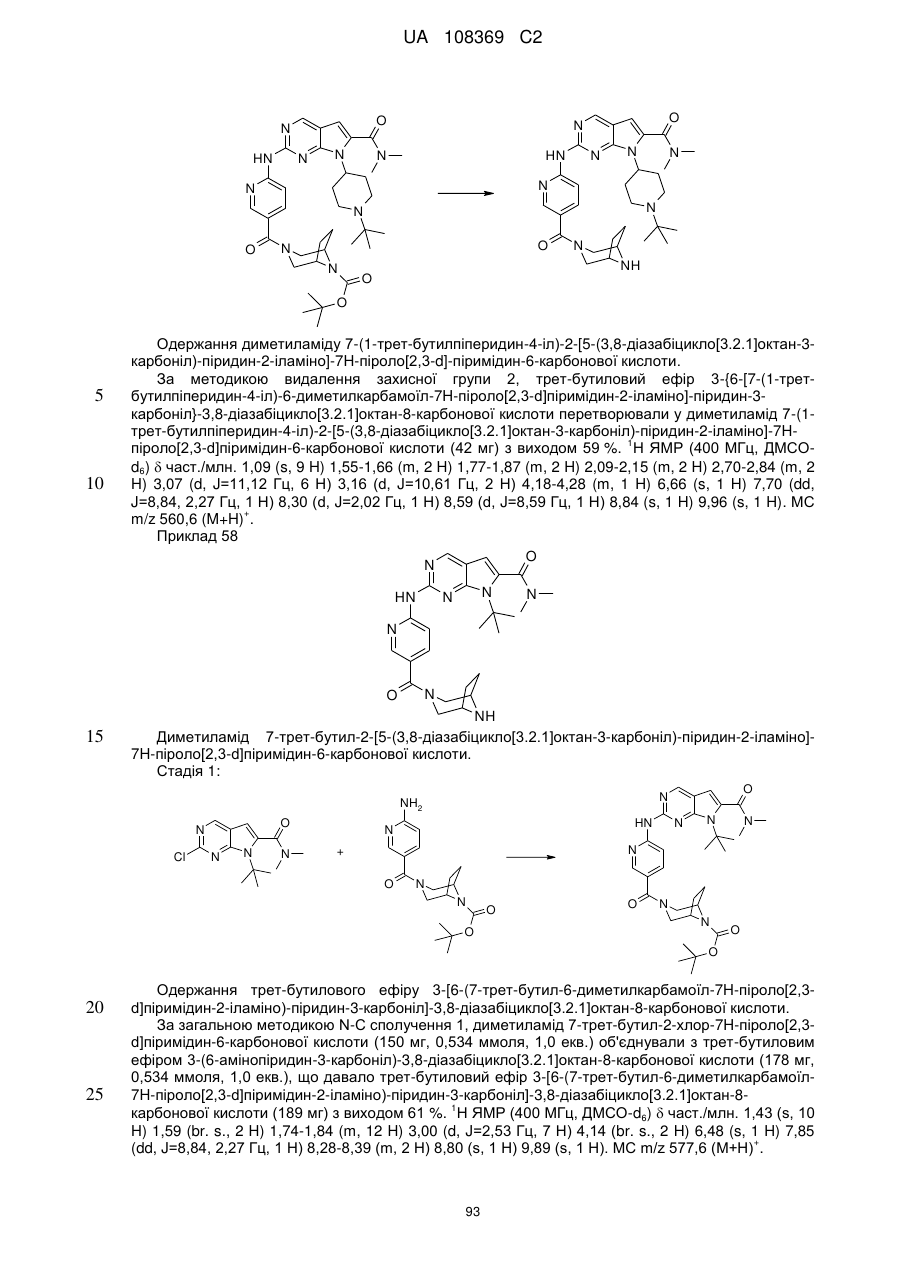
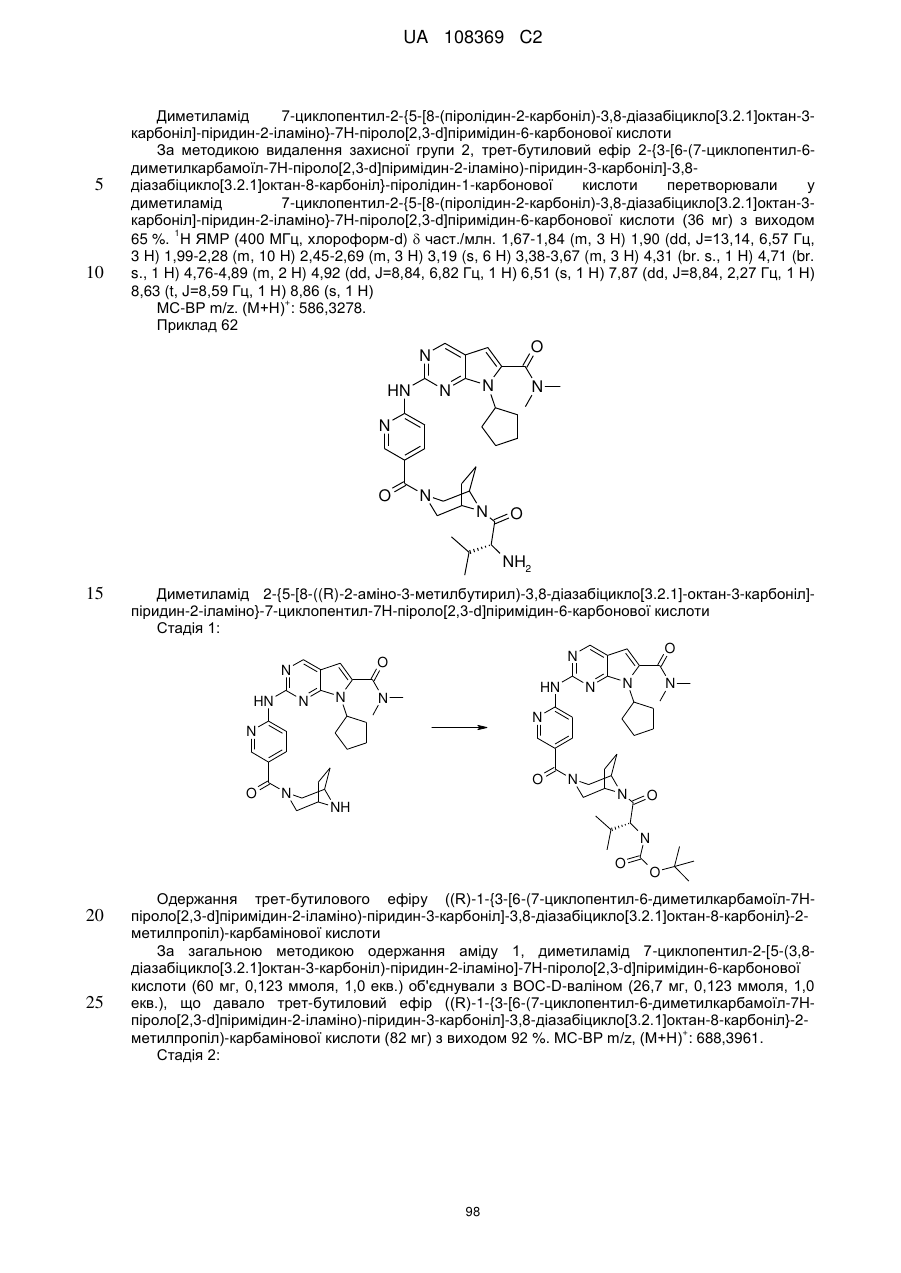
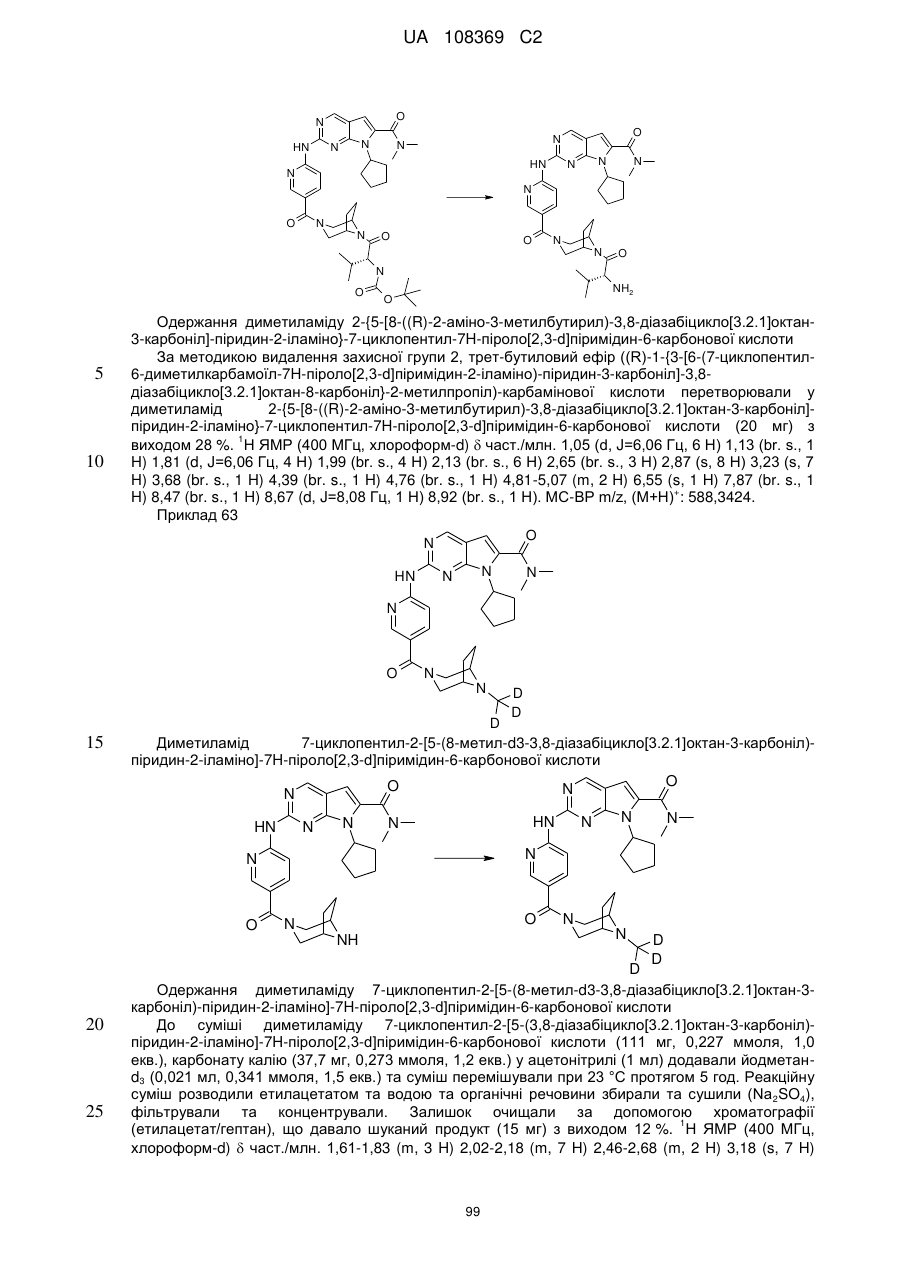
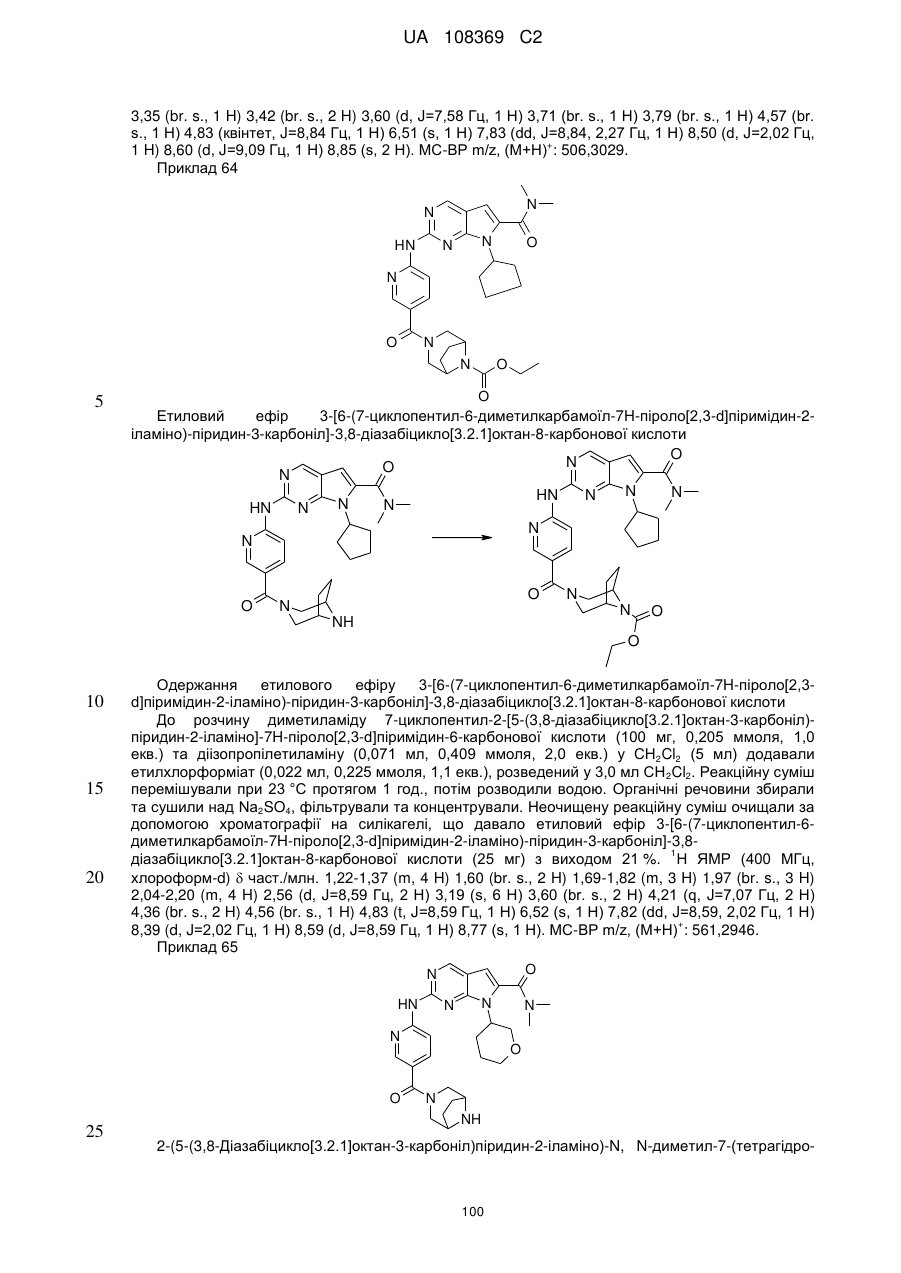
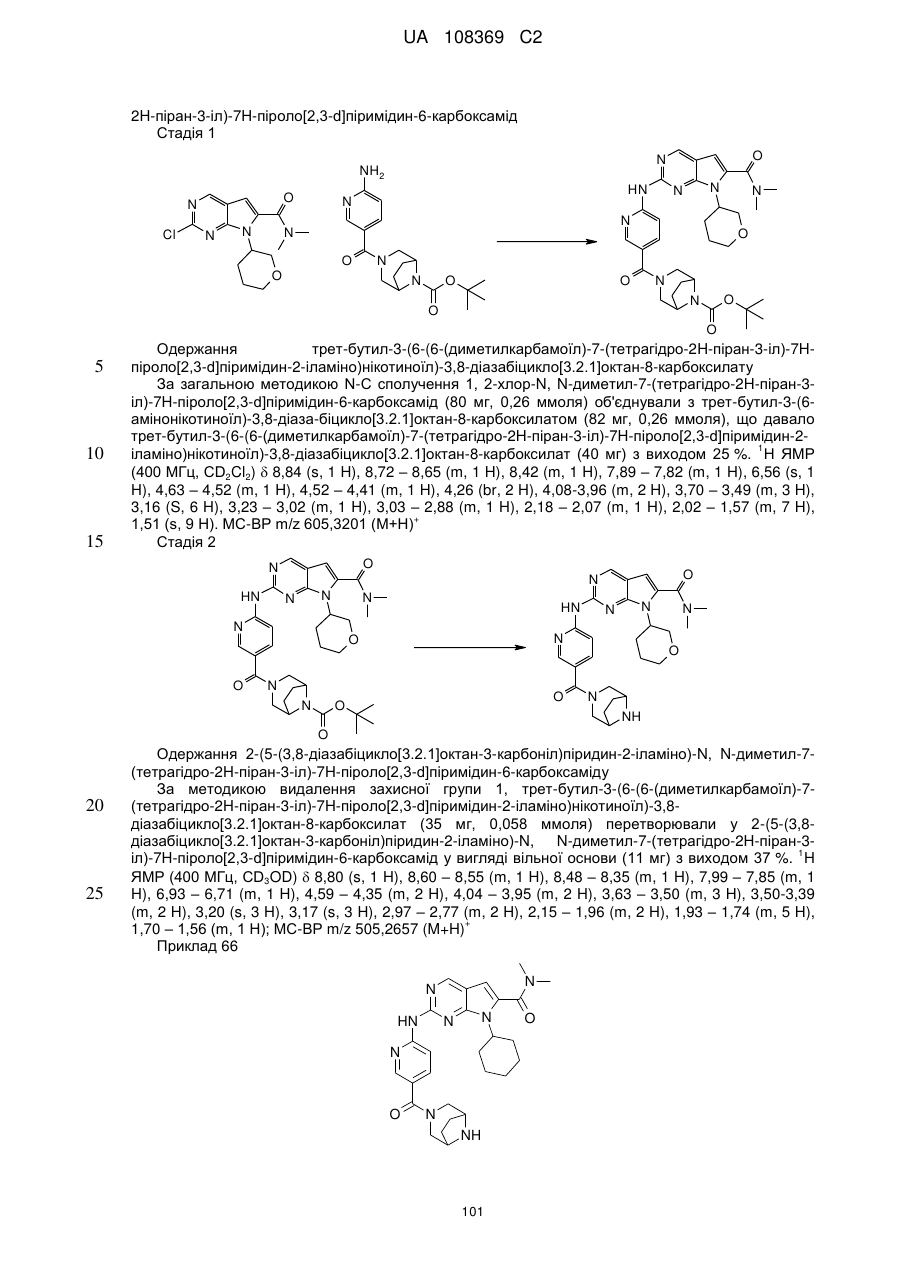
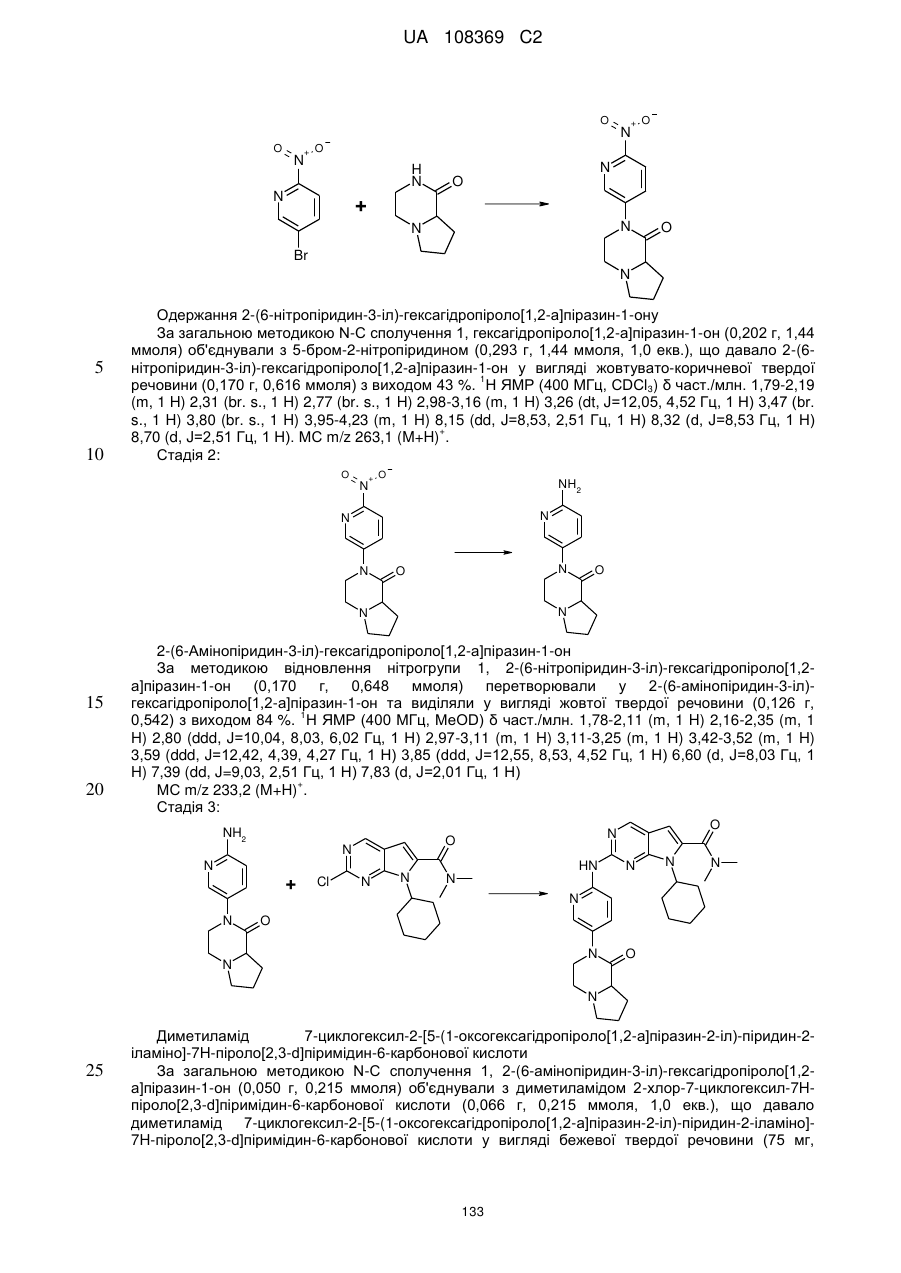
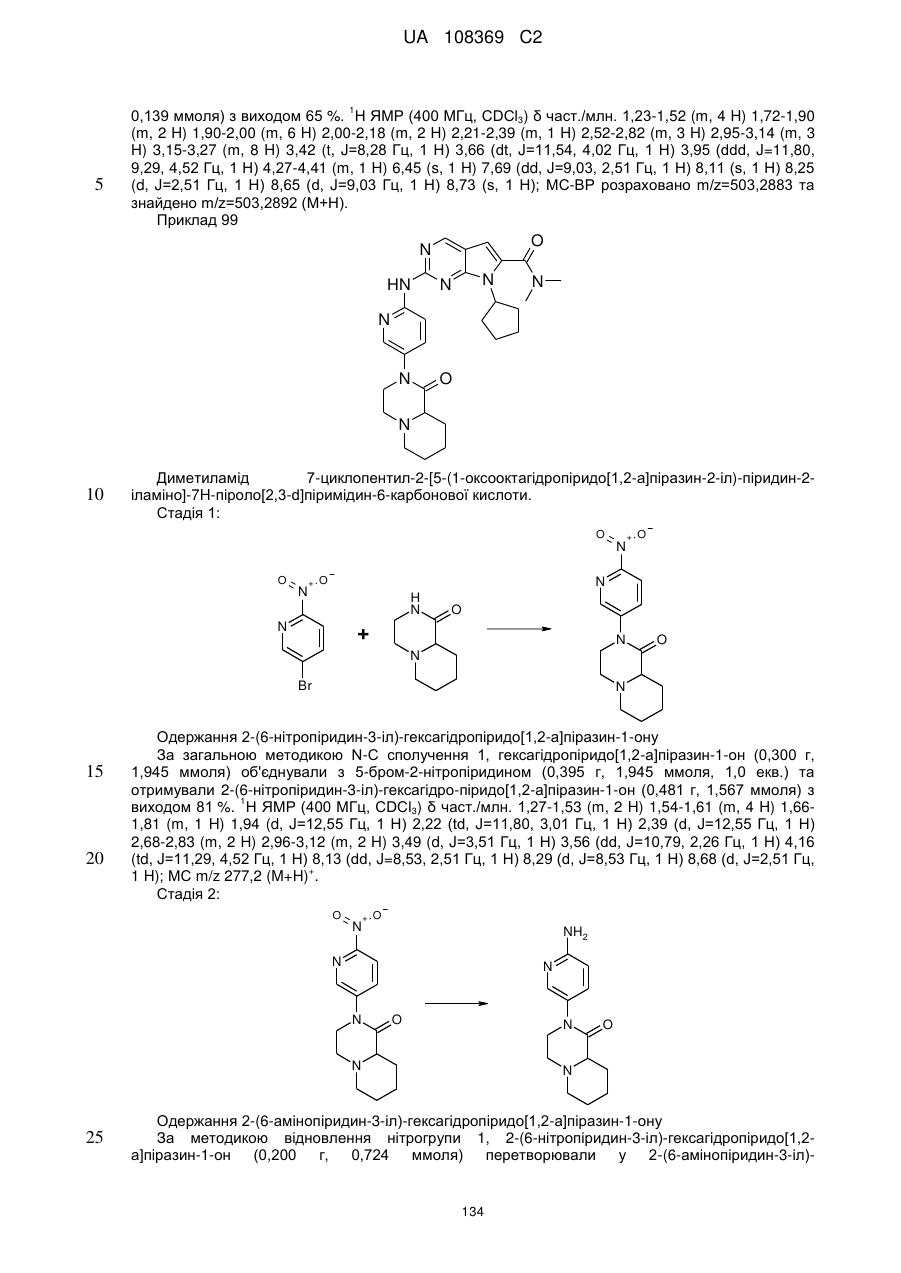
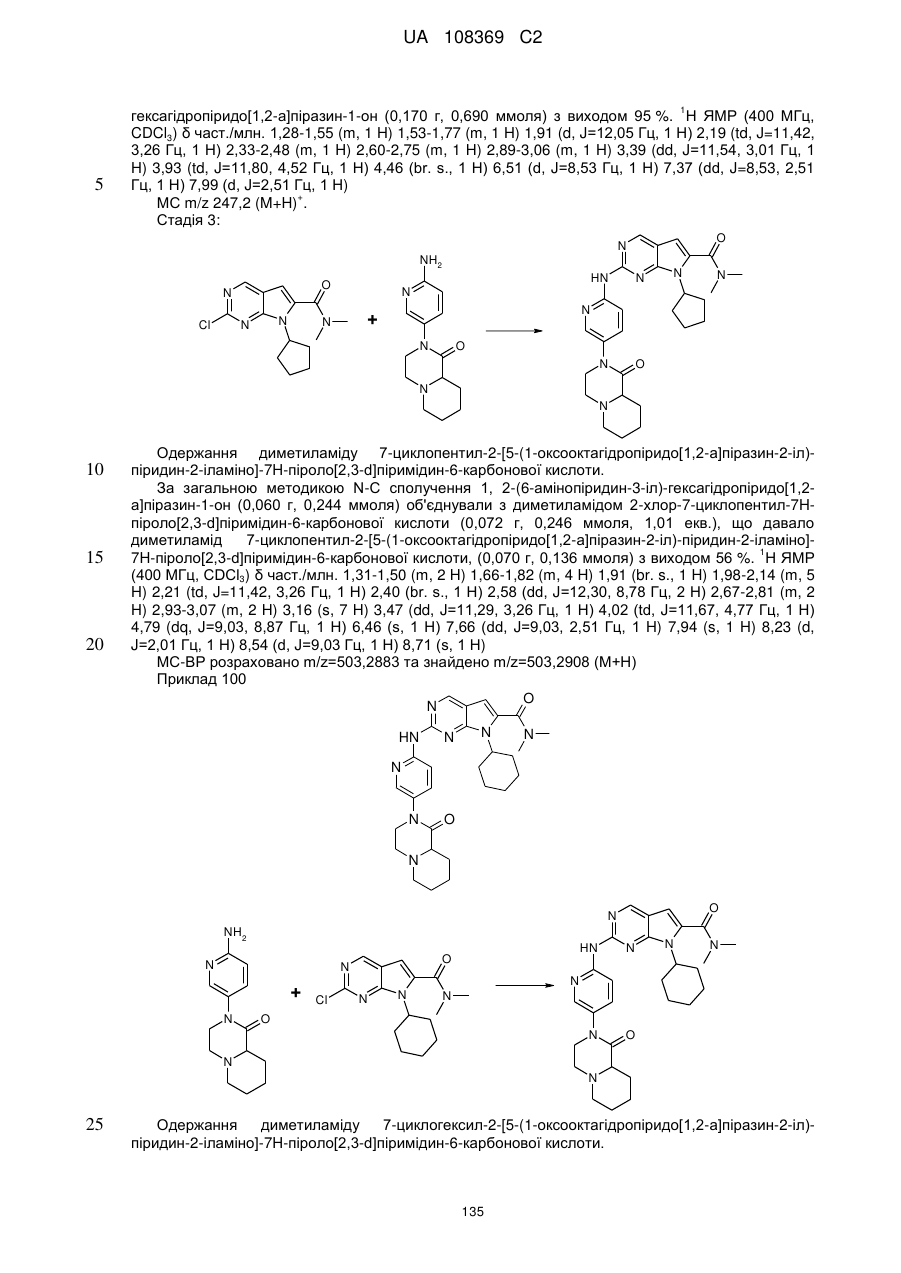
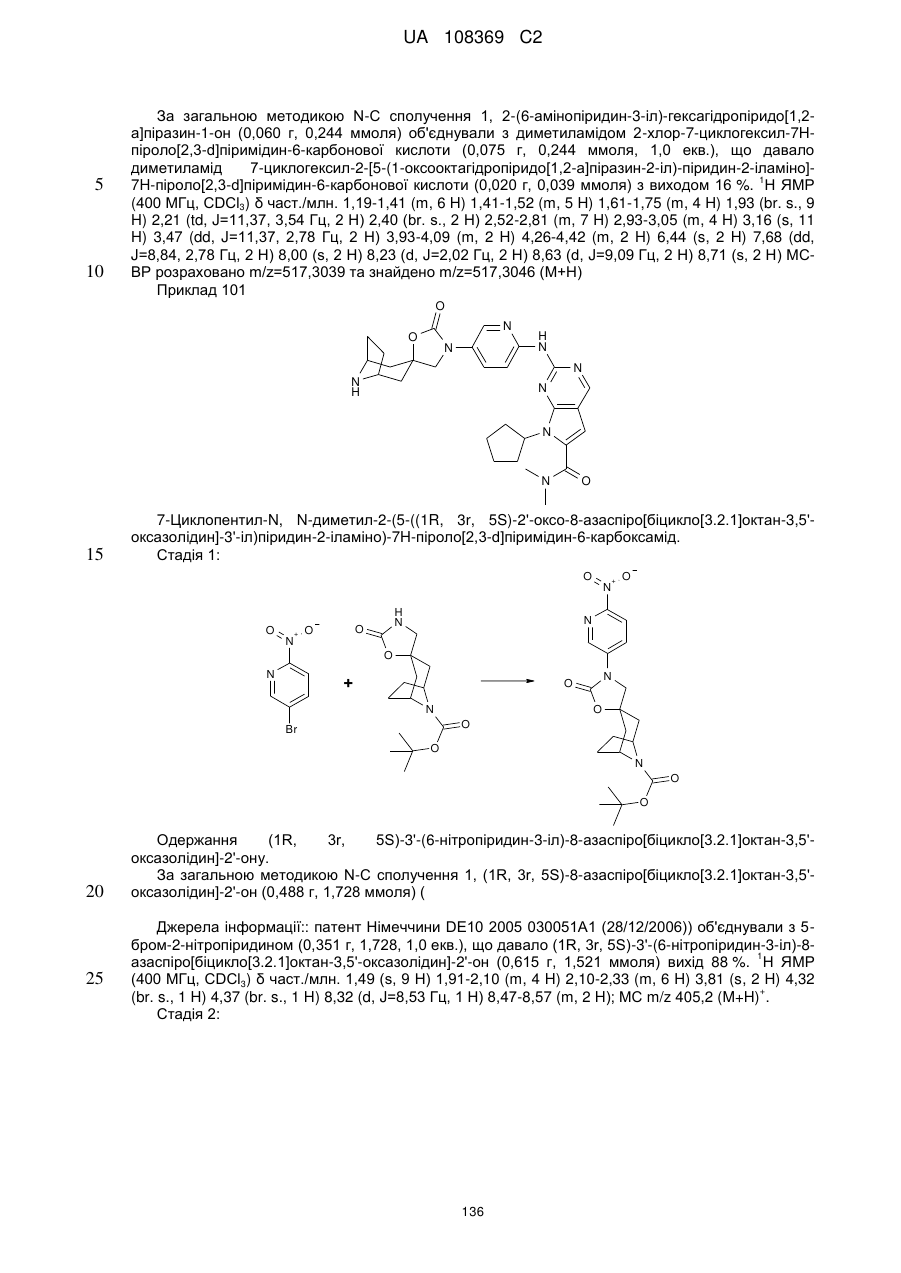
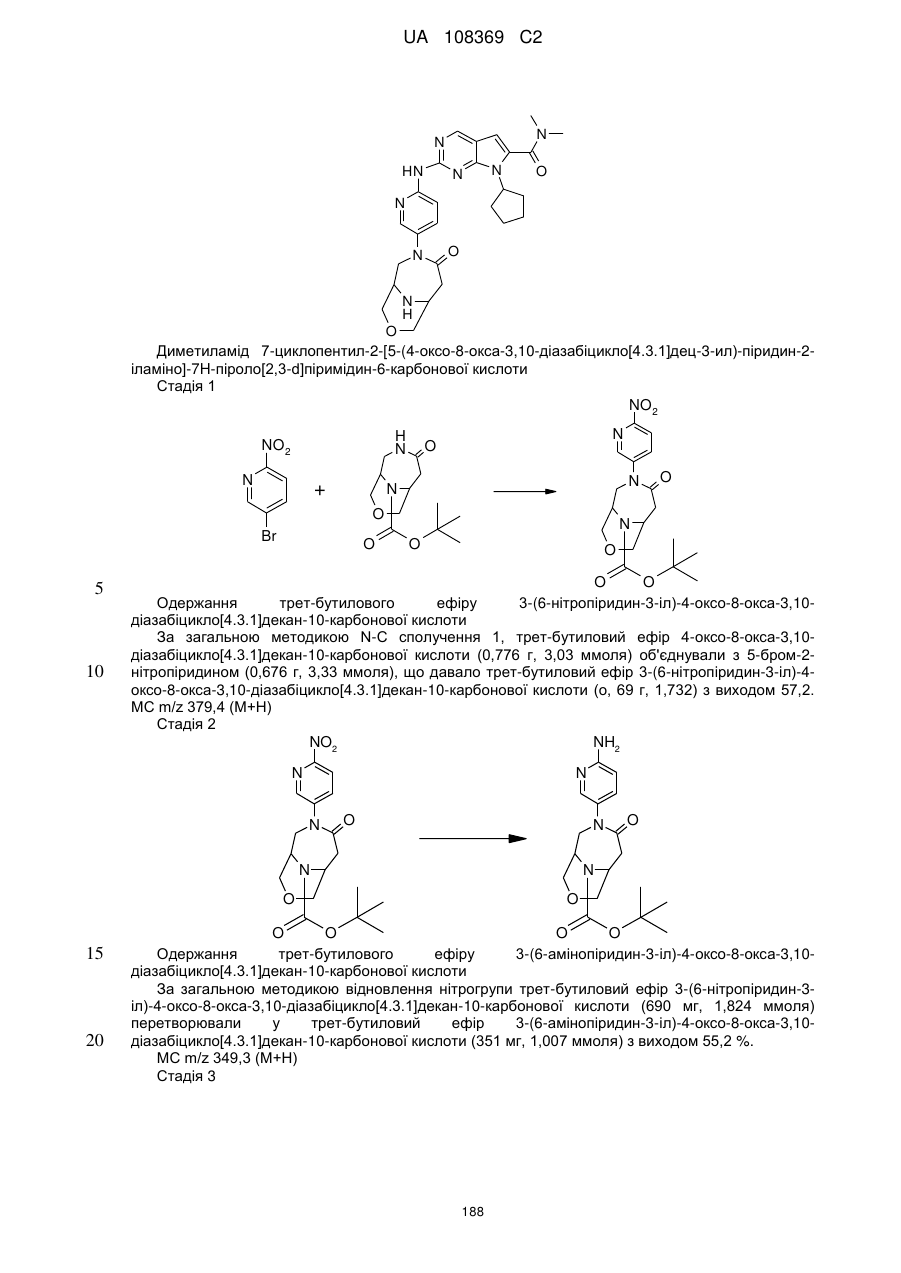
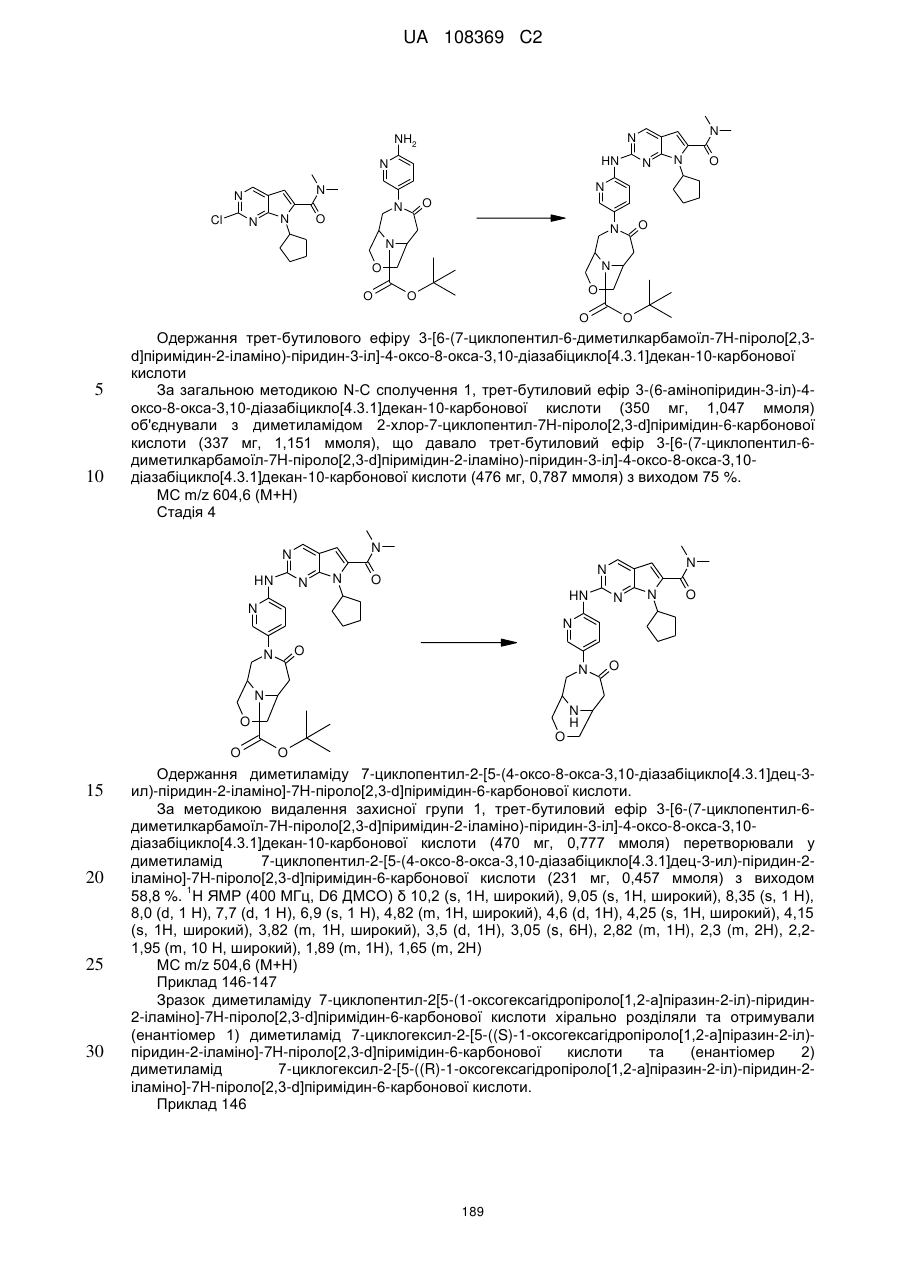
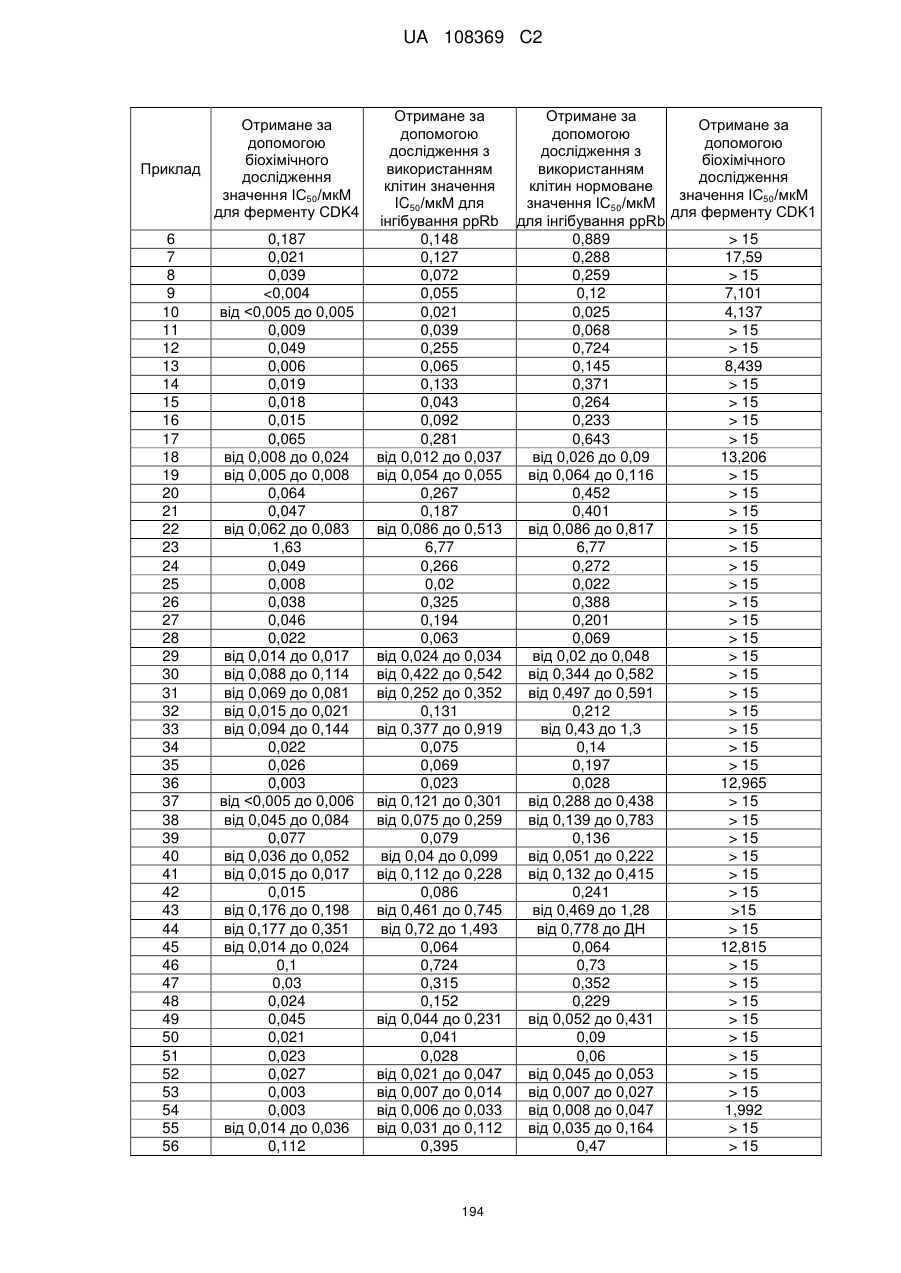
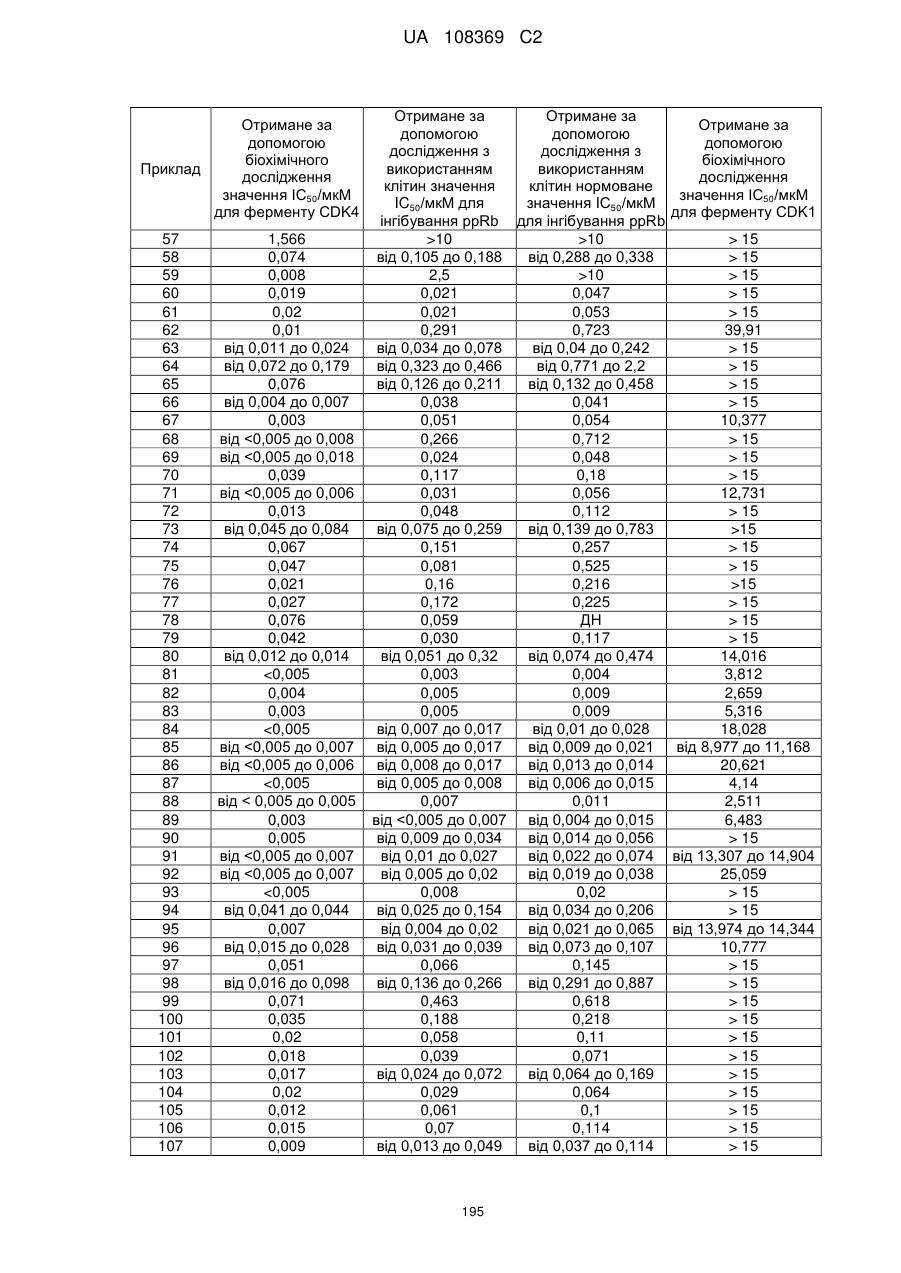
Піролопіримідини як інгібітори cdk4/6
Номер патенту: 108369
Опубліковано: 27.04.2015
Автори: Джіралдес Джон Уільям, Чо Йонг Шін, Левелл Джуліан, Брейн Крістофер Томас, Перез Лоренс Блес, Луцціо Майкл, Янг Фен, Вонг Япінг, Лагу Барат
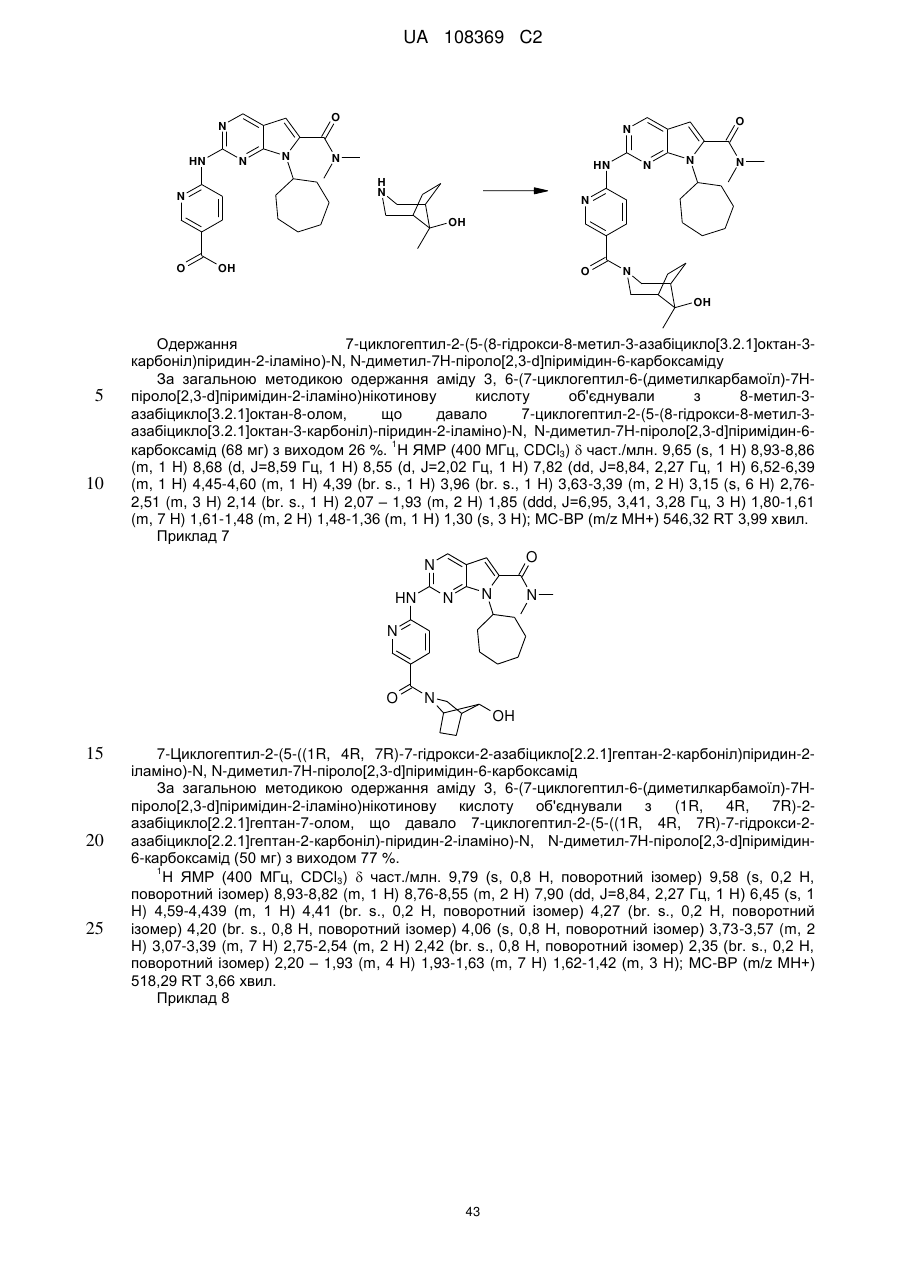
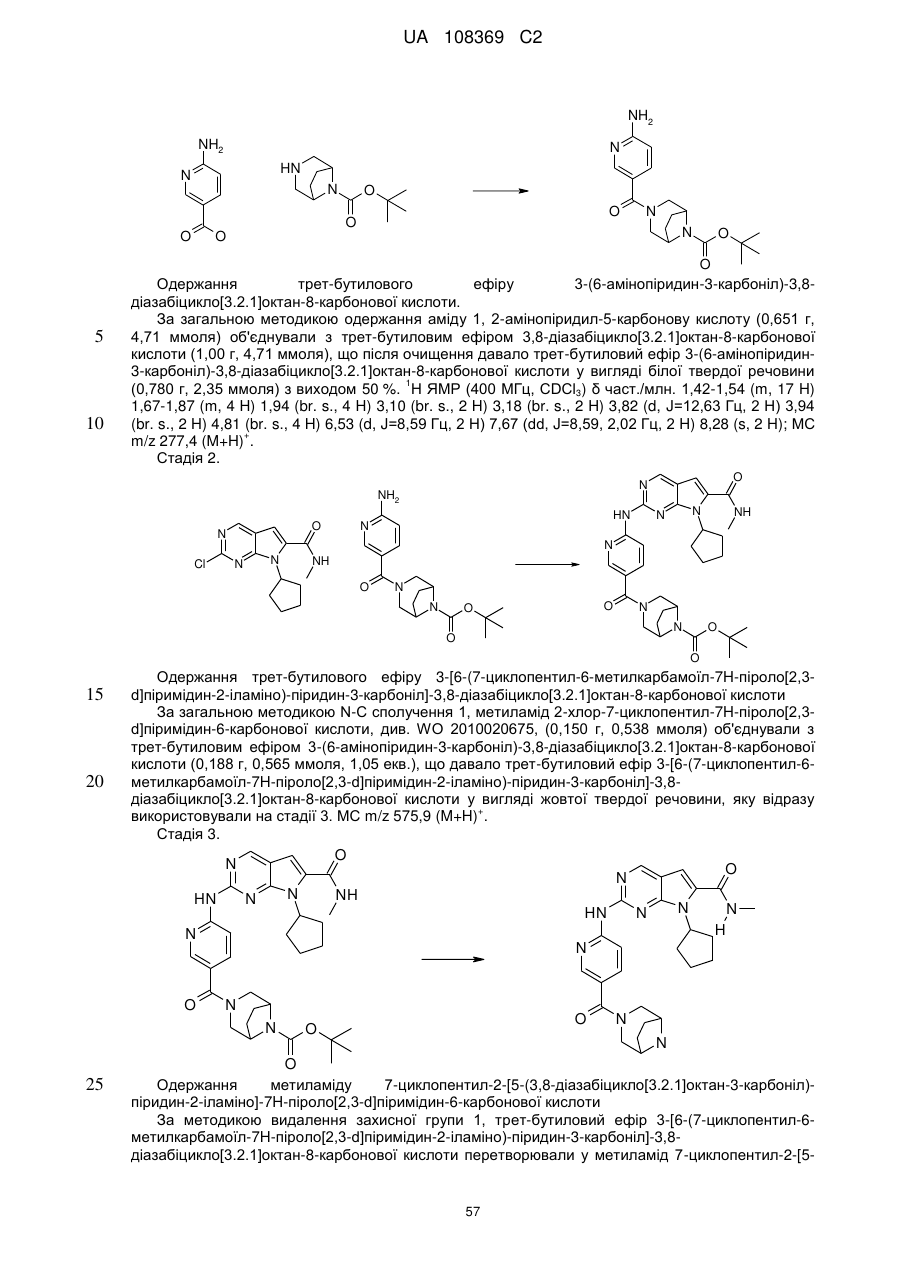
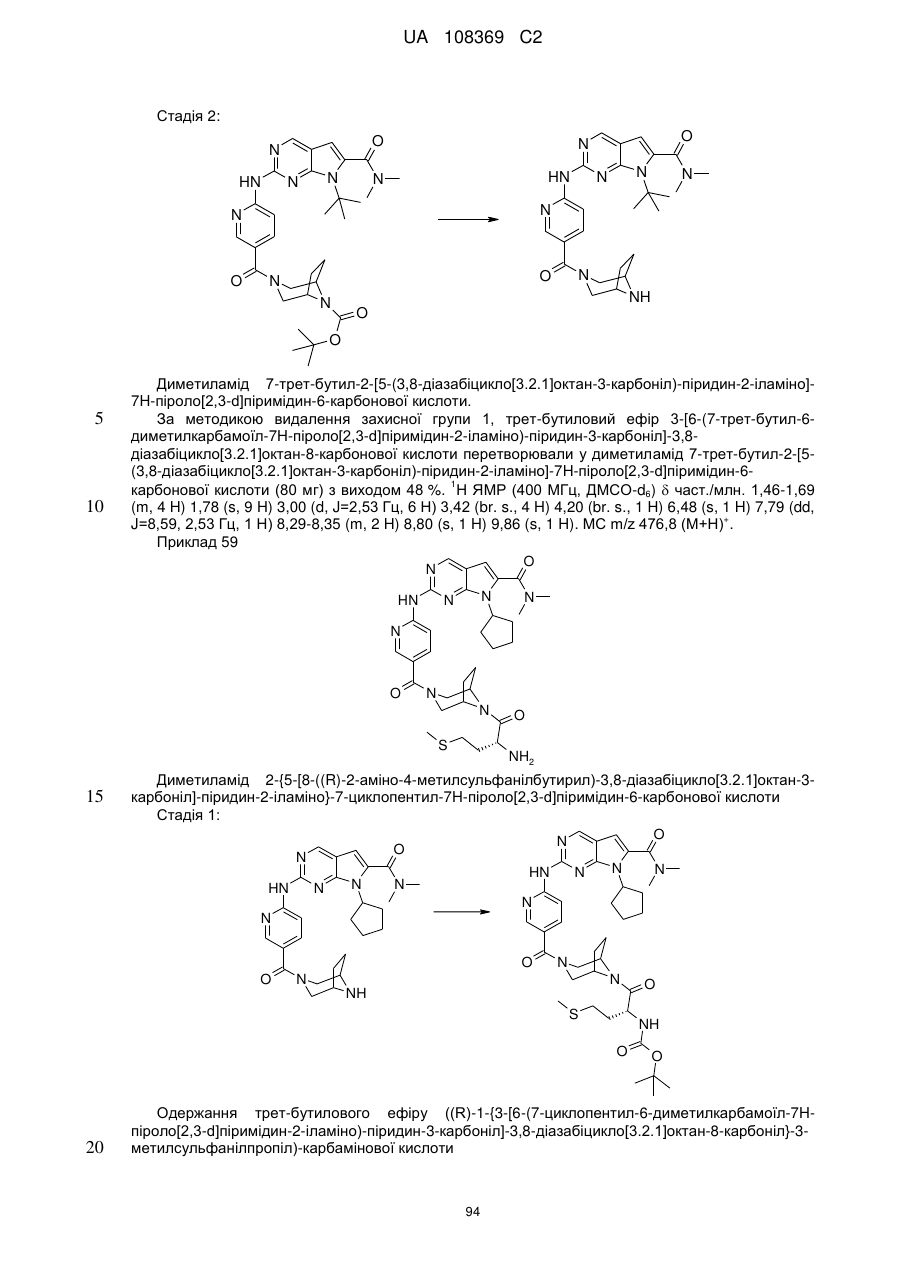
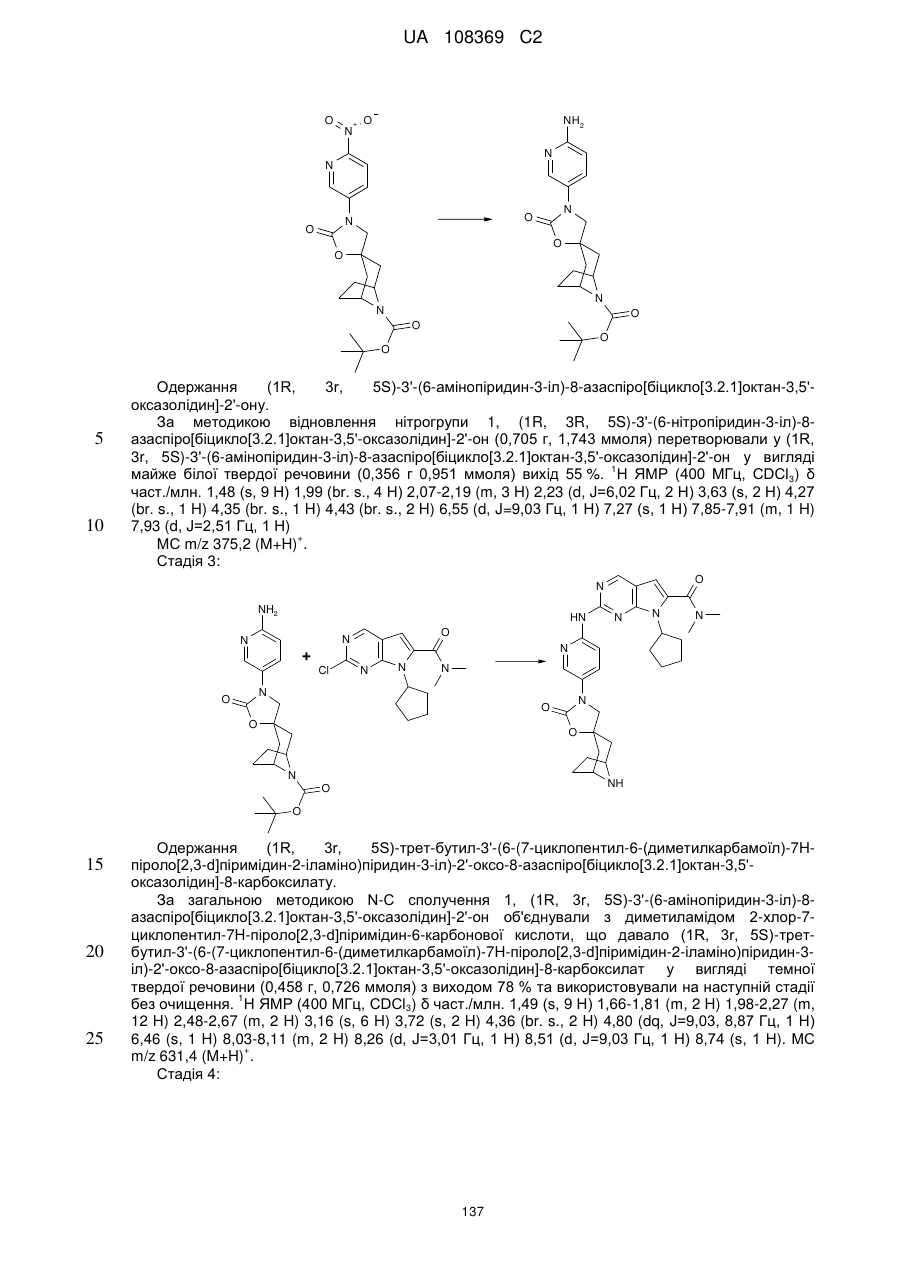
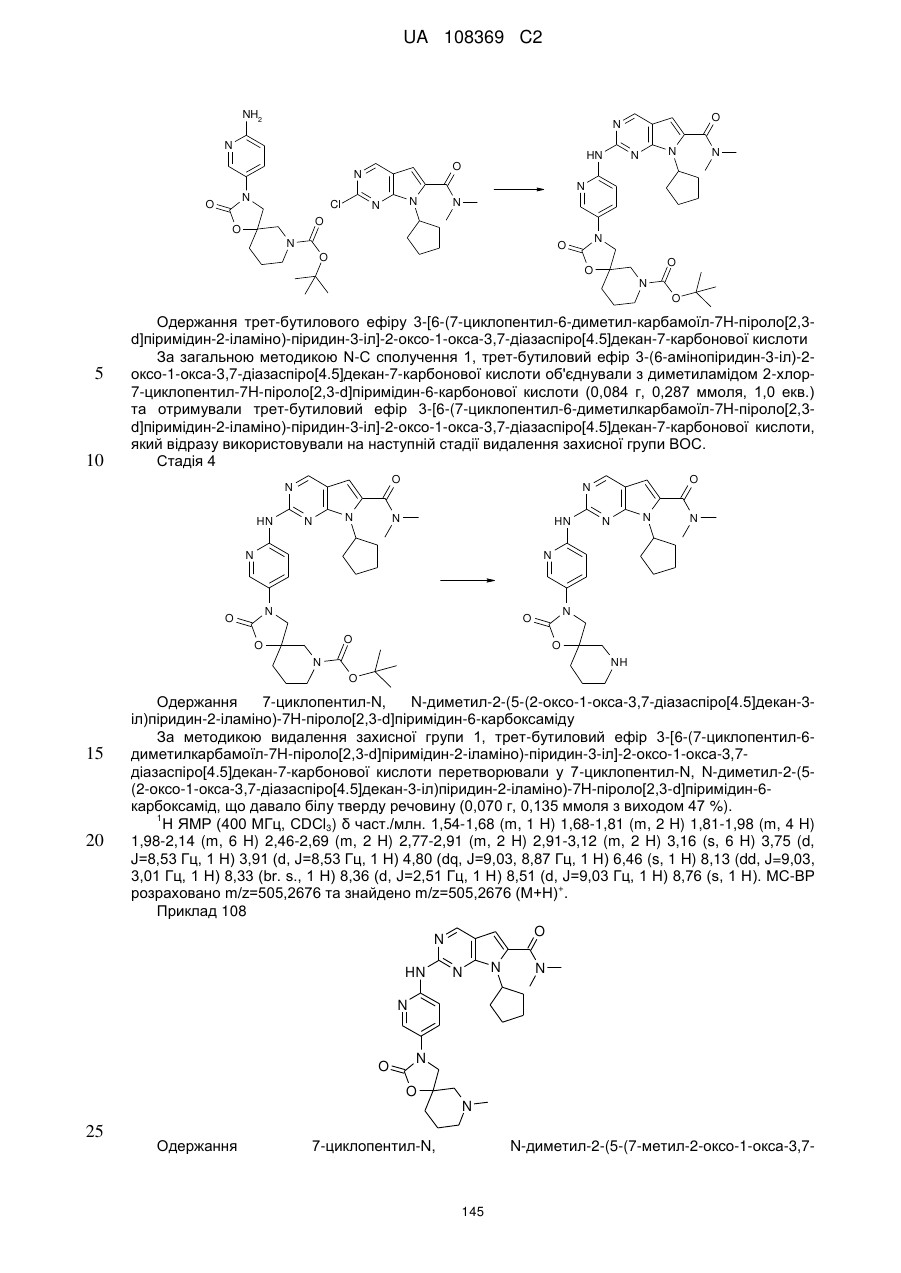
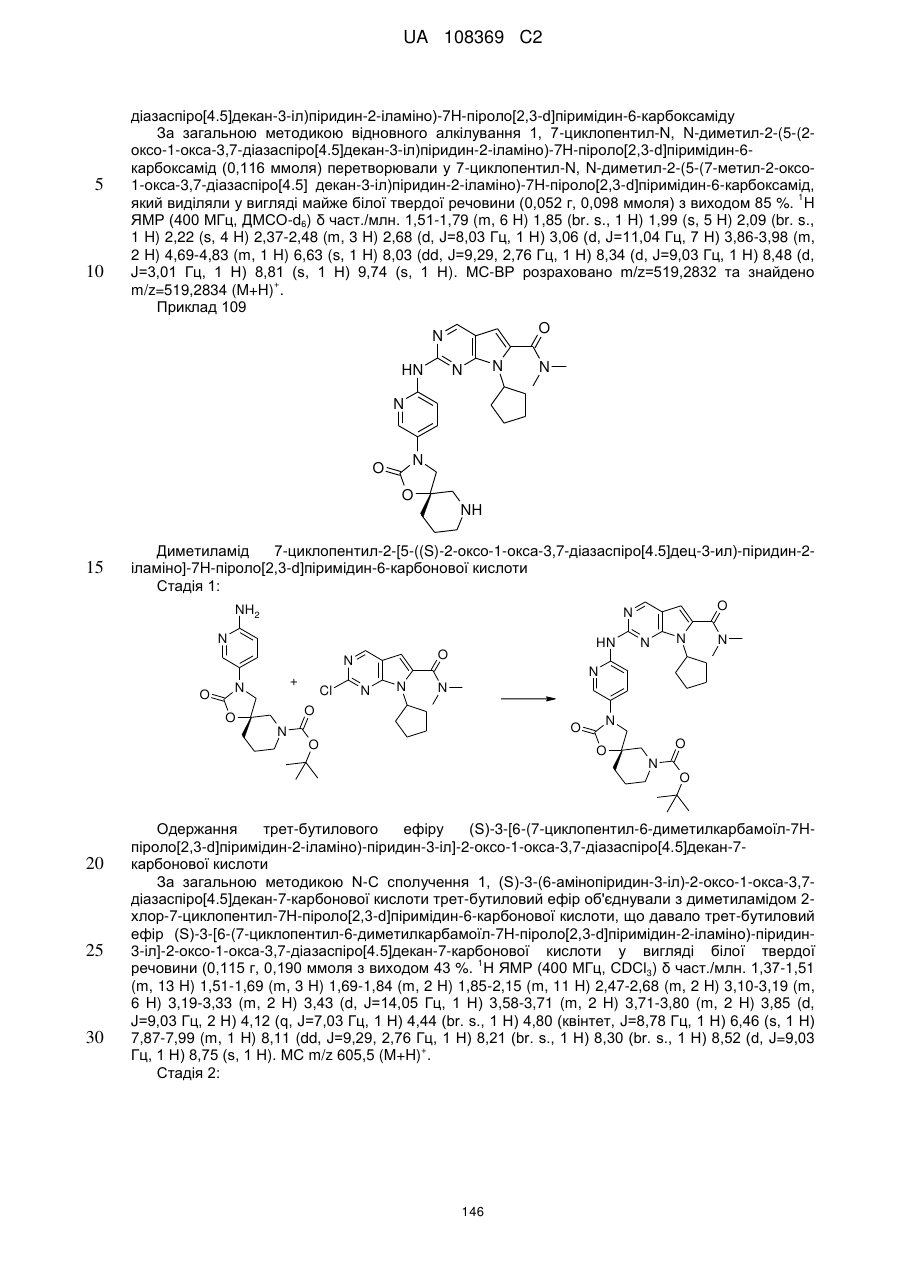
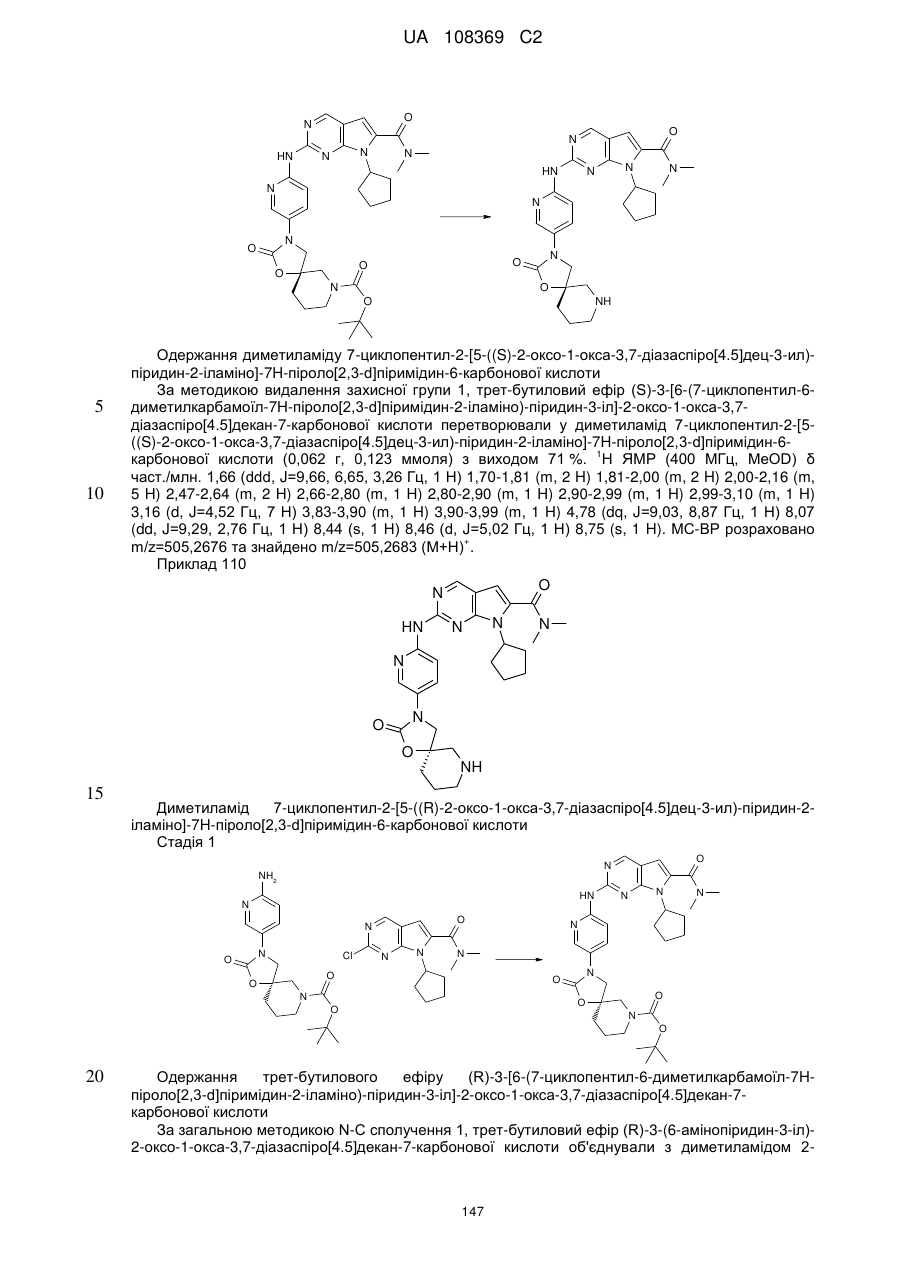
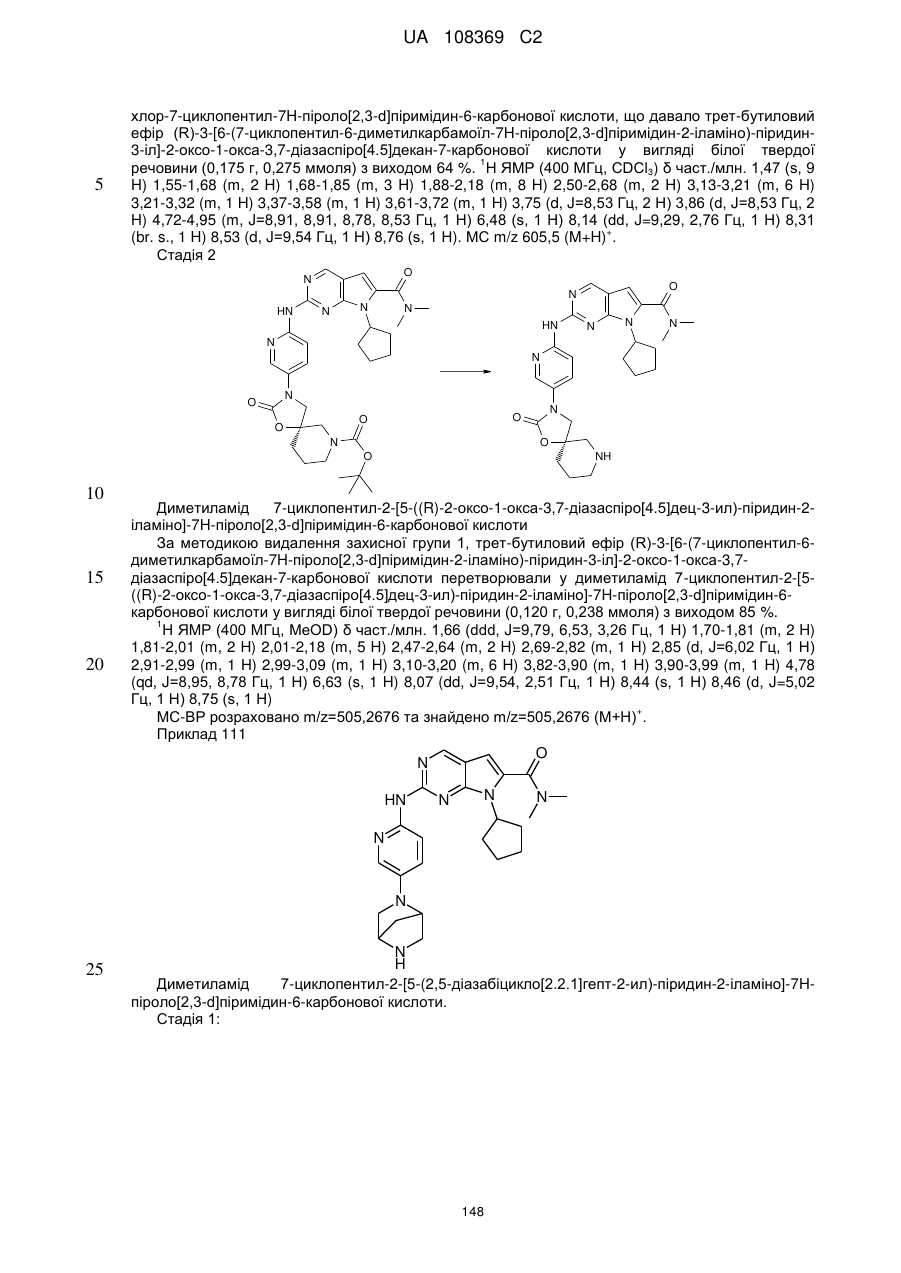
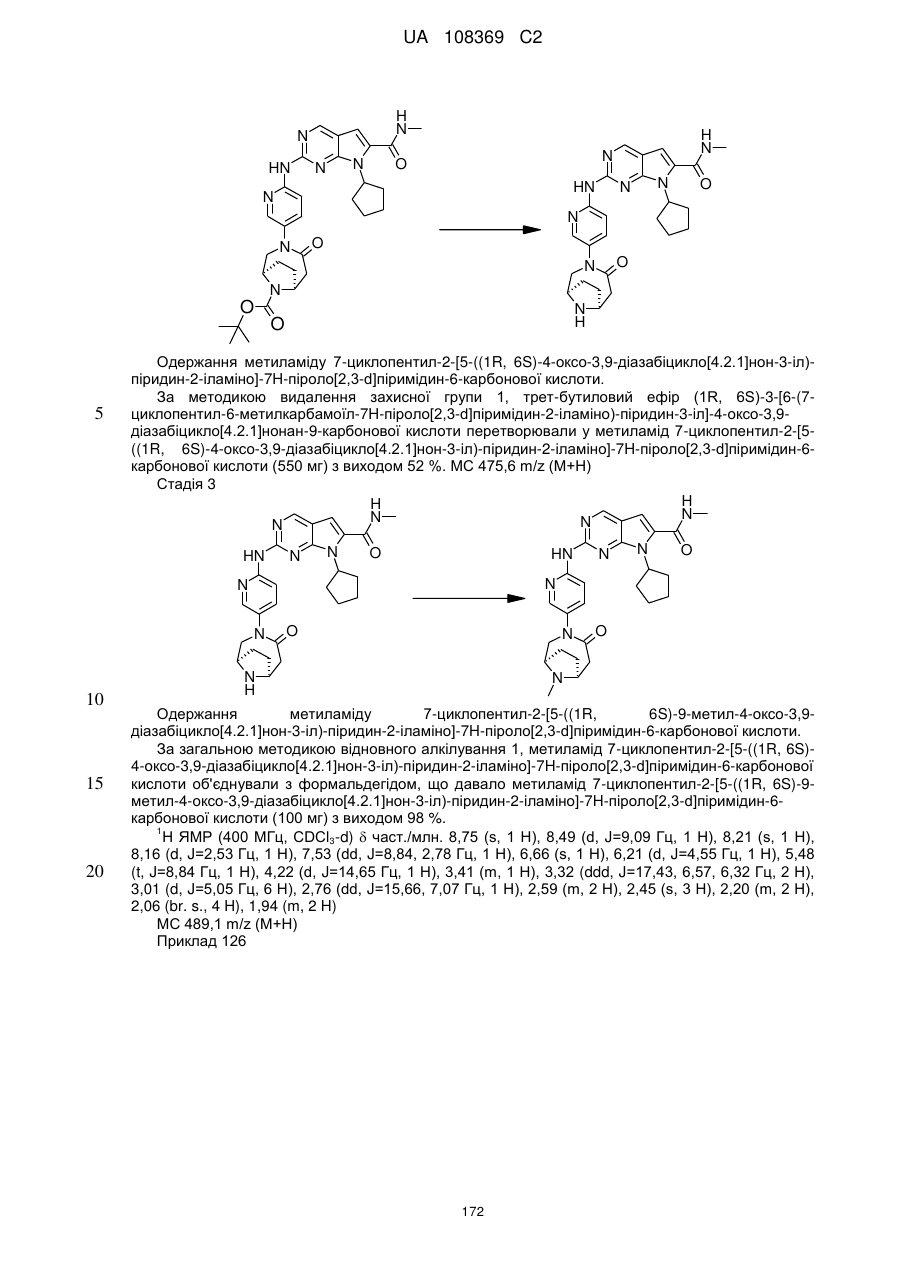
Формула / Реферат
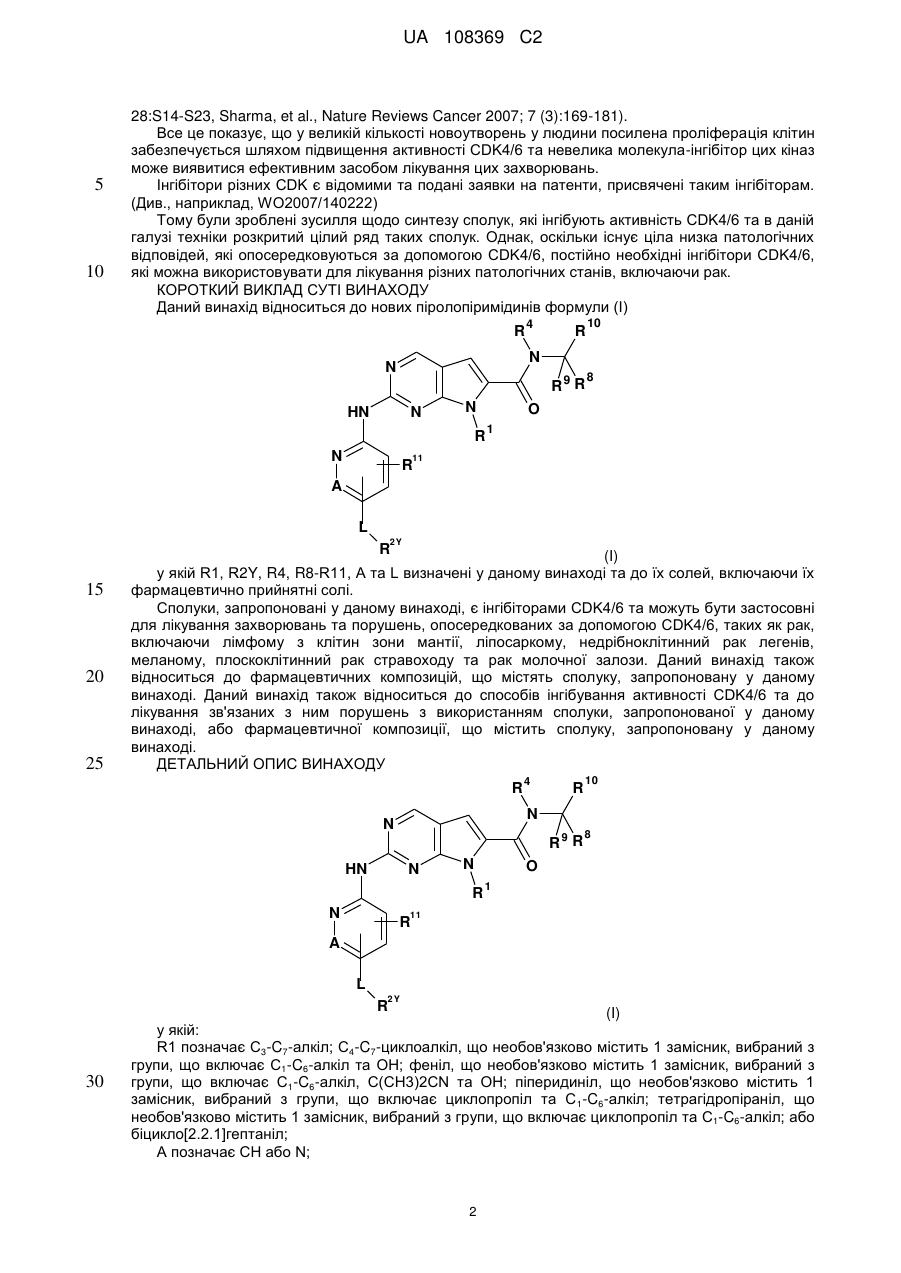
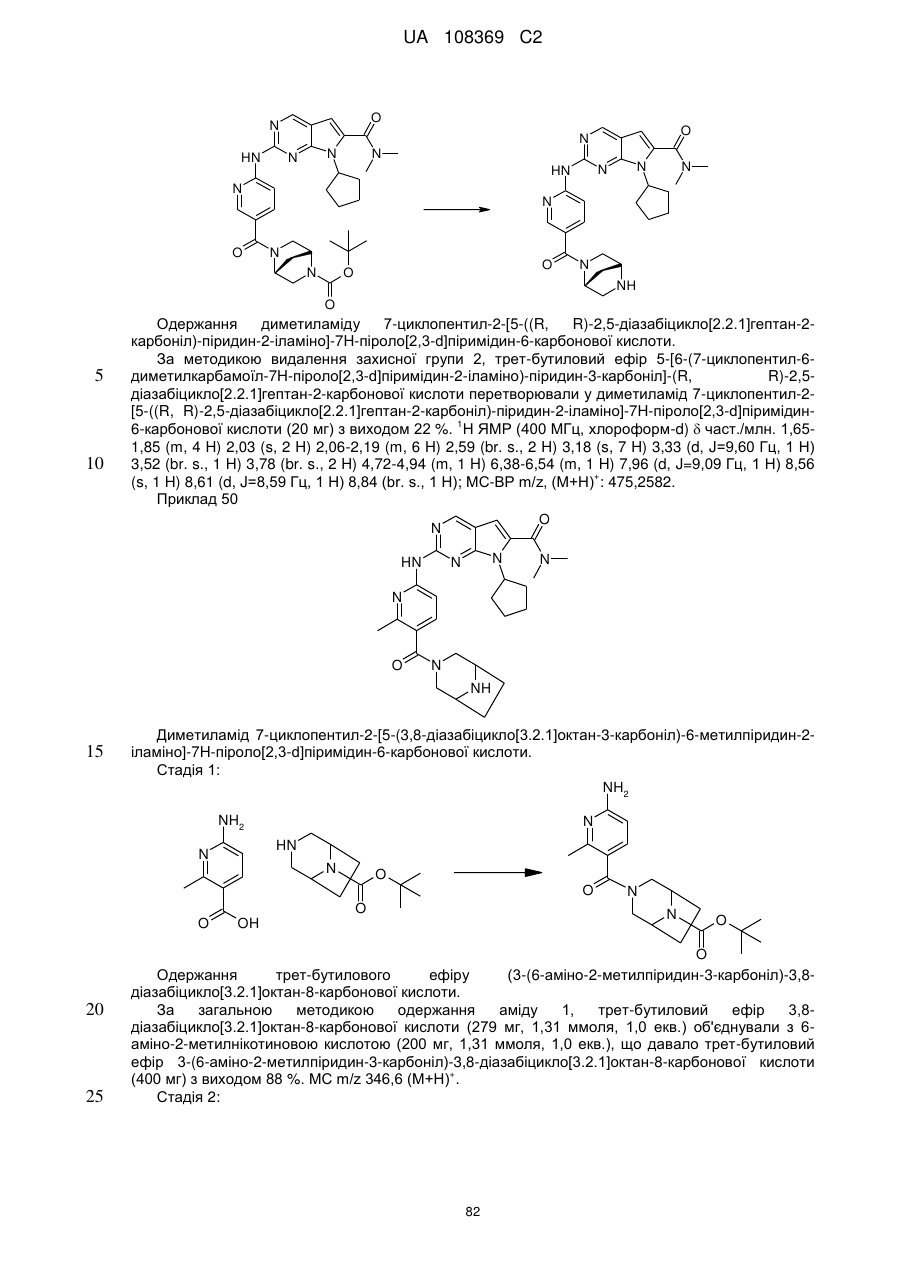
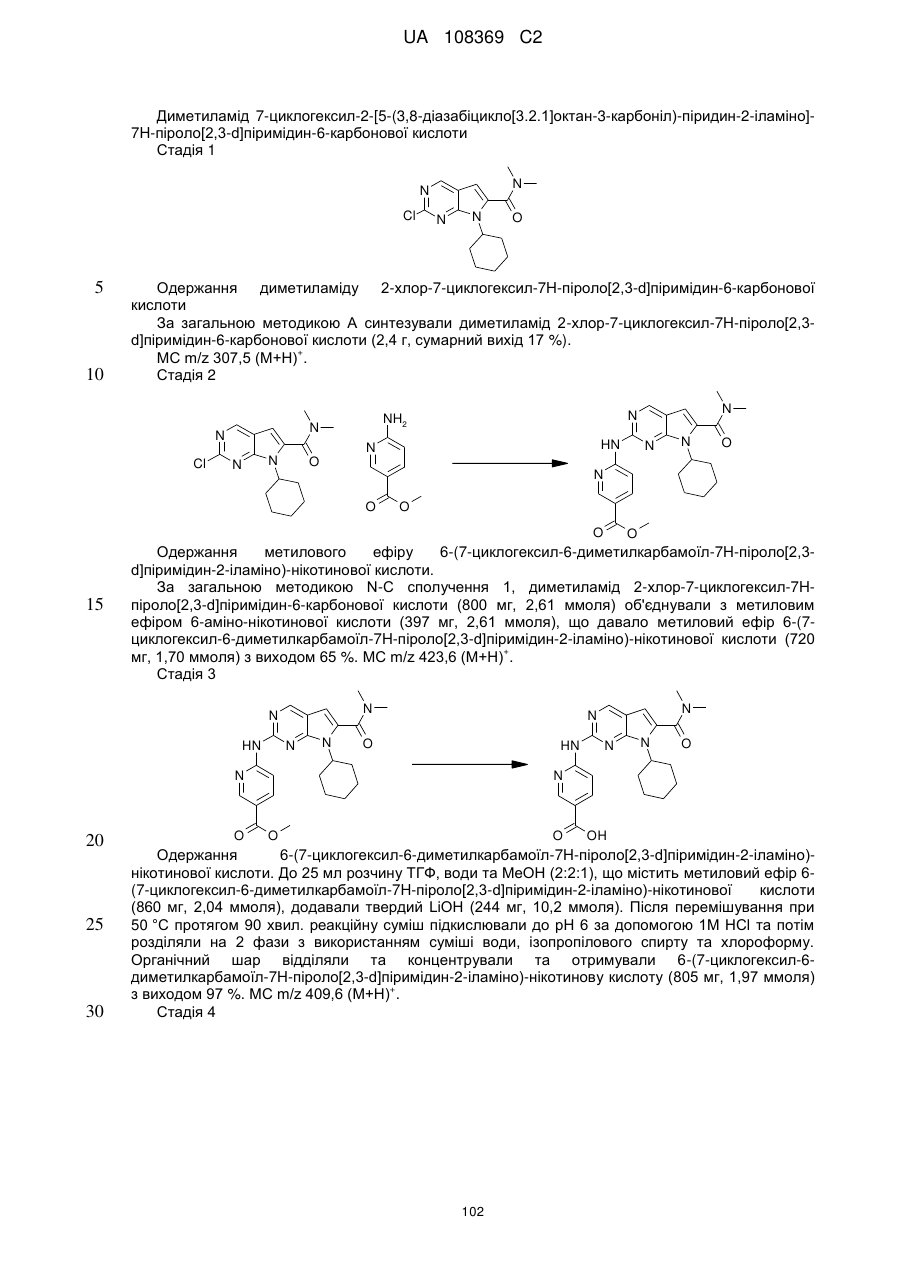
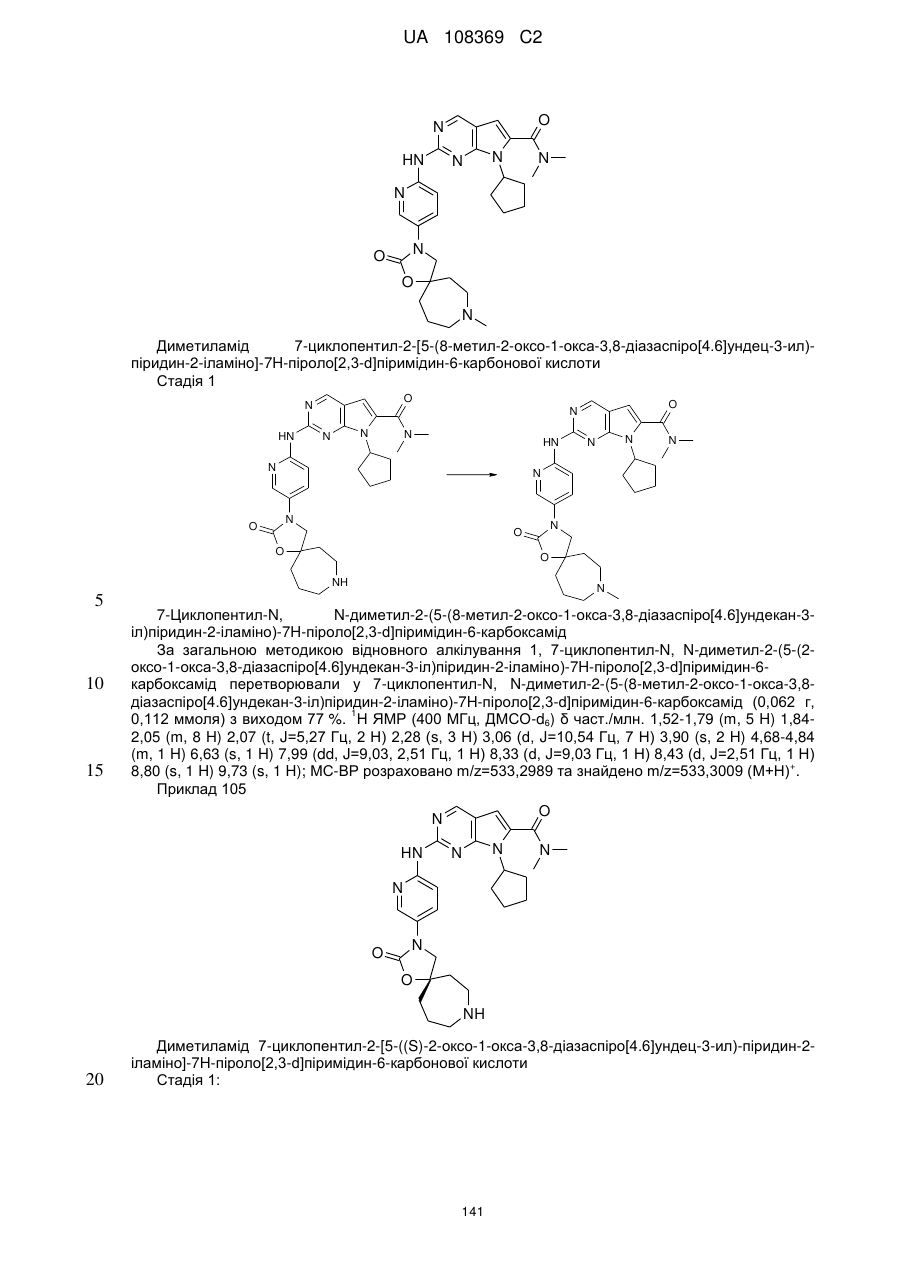
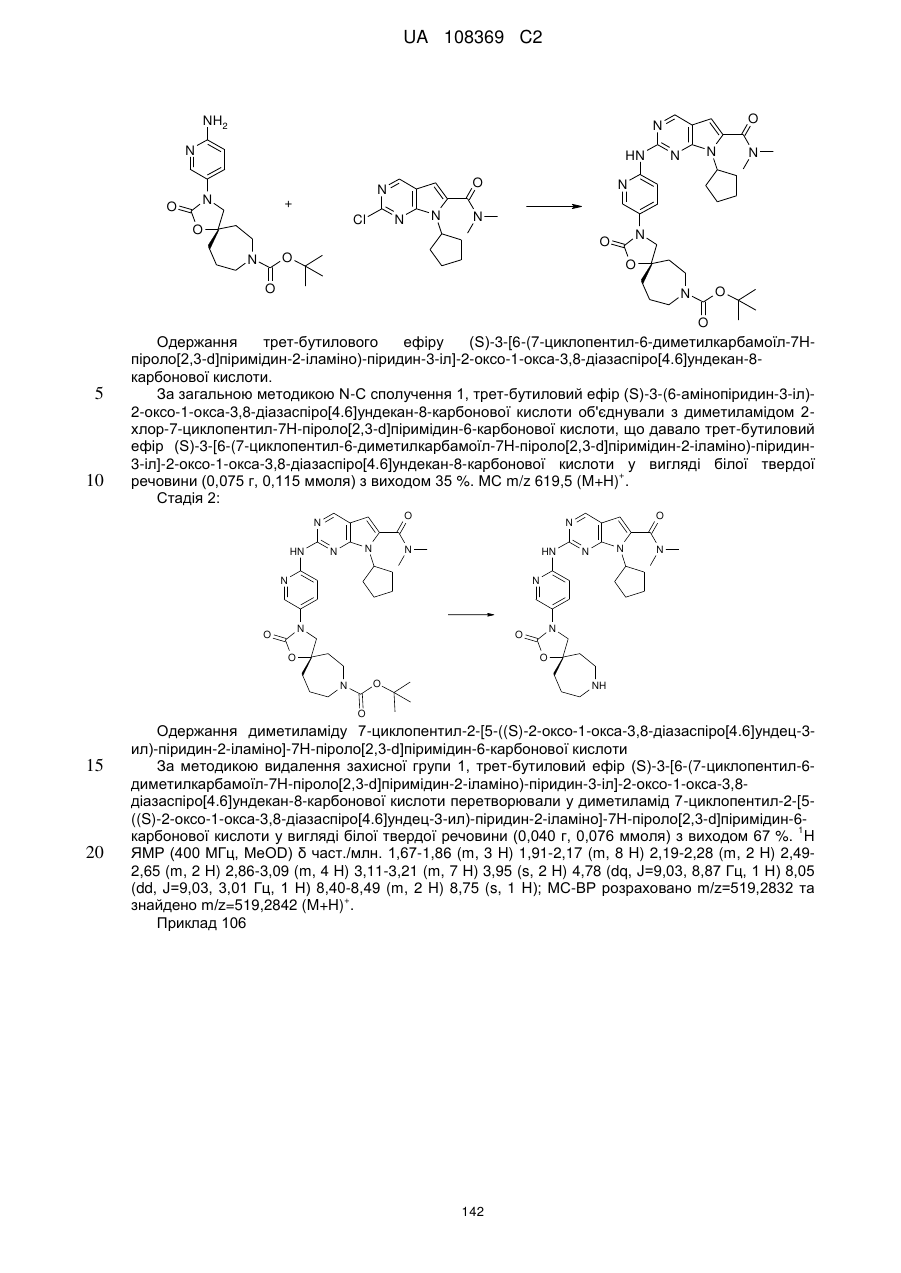
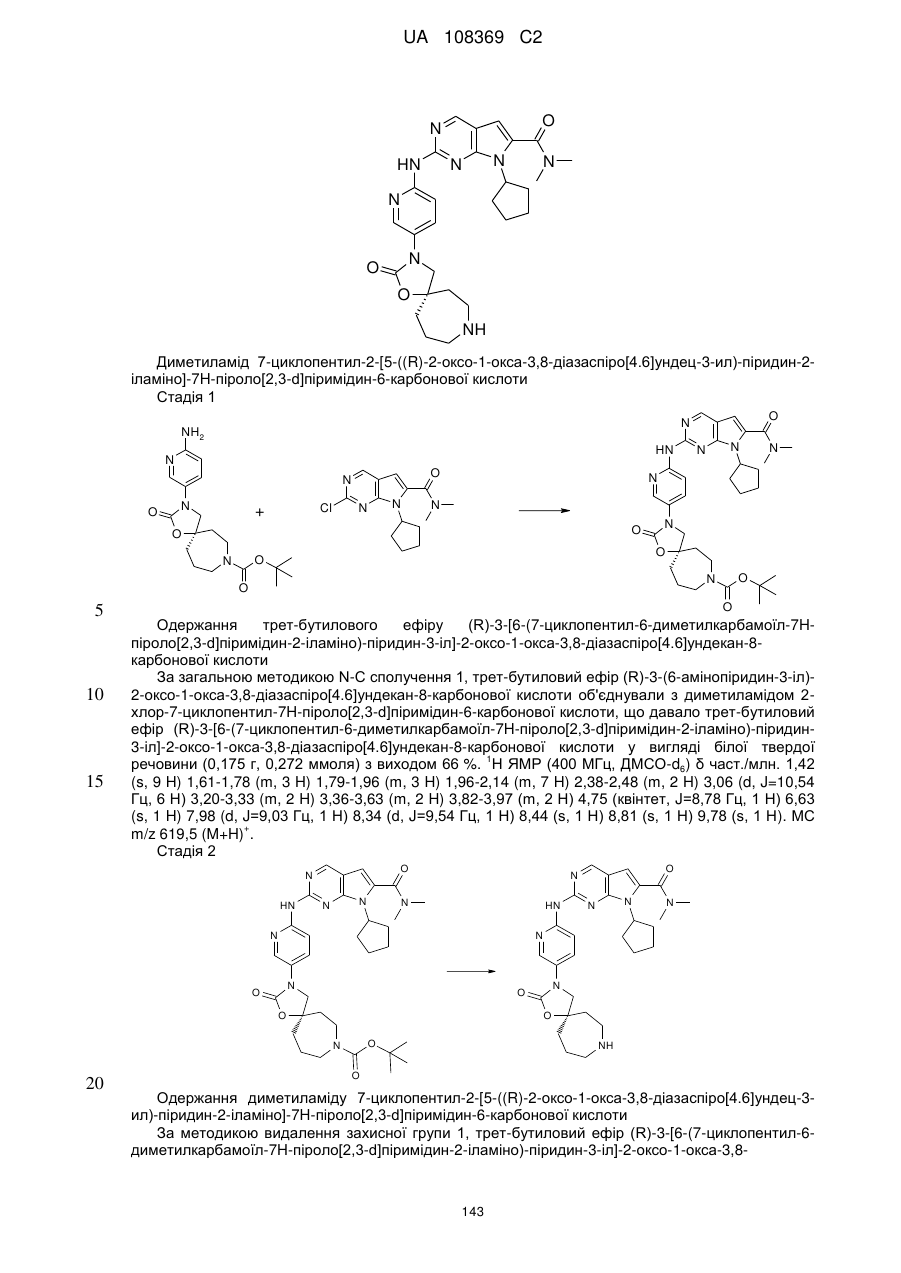
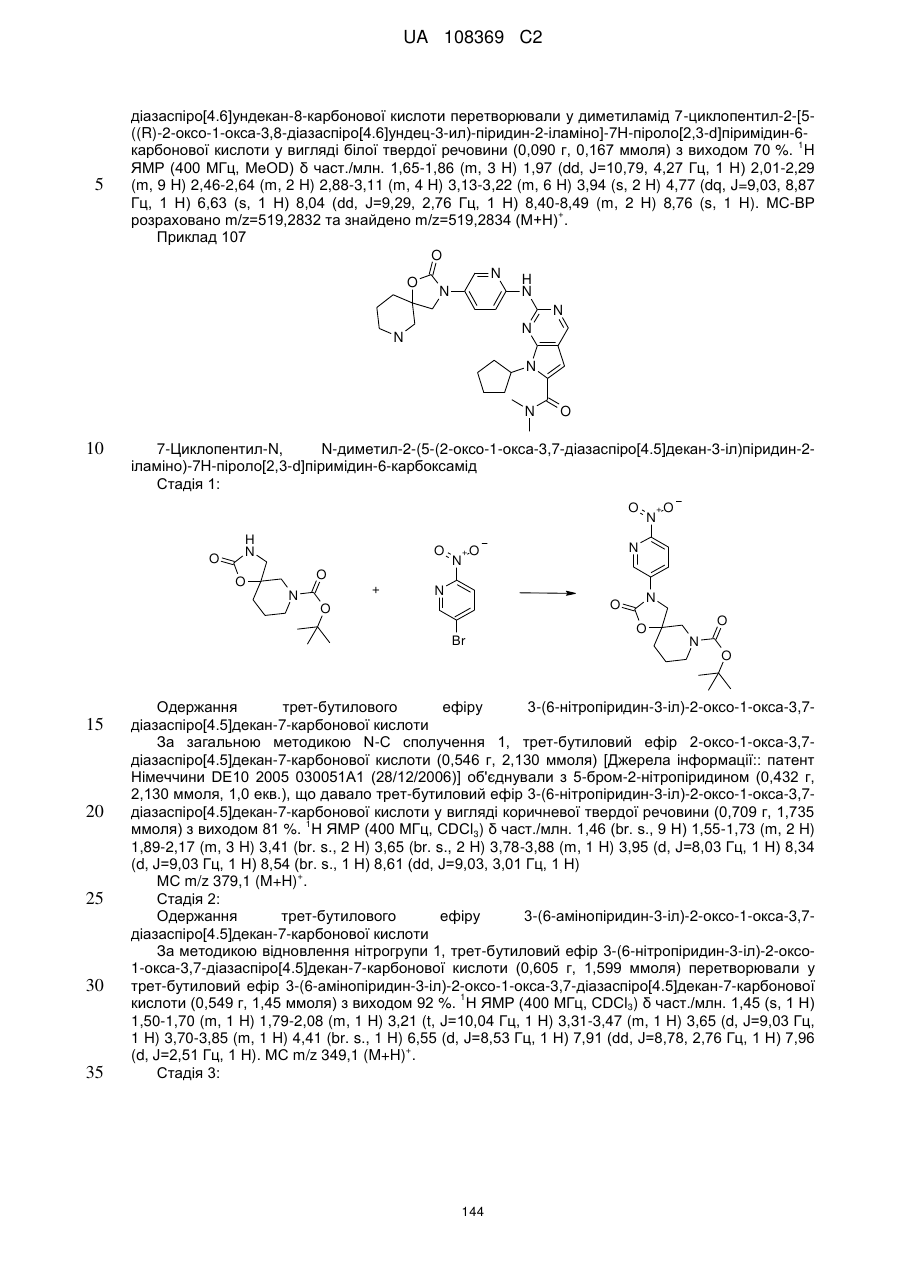
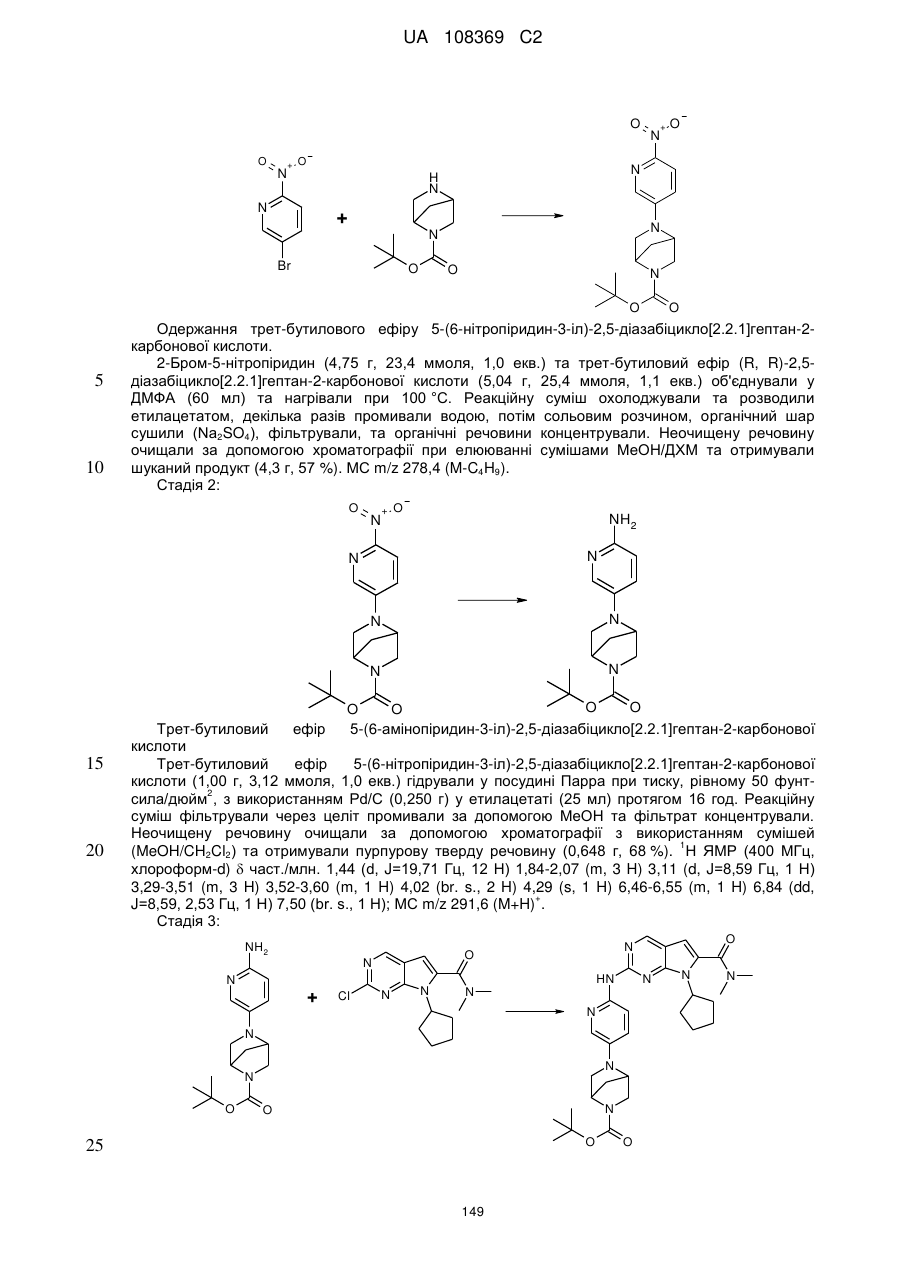
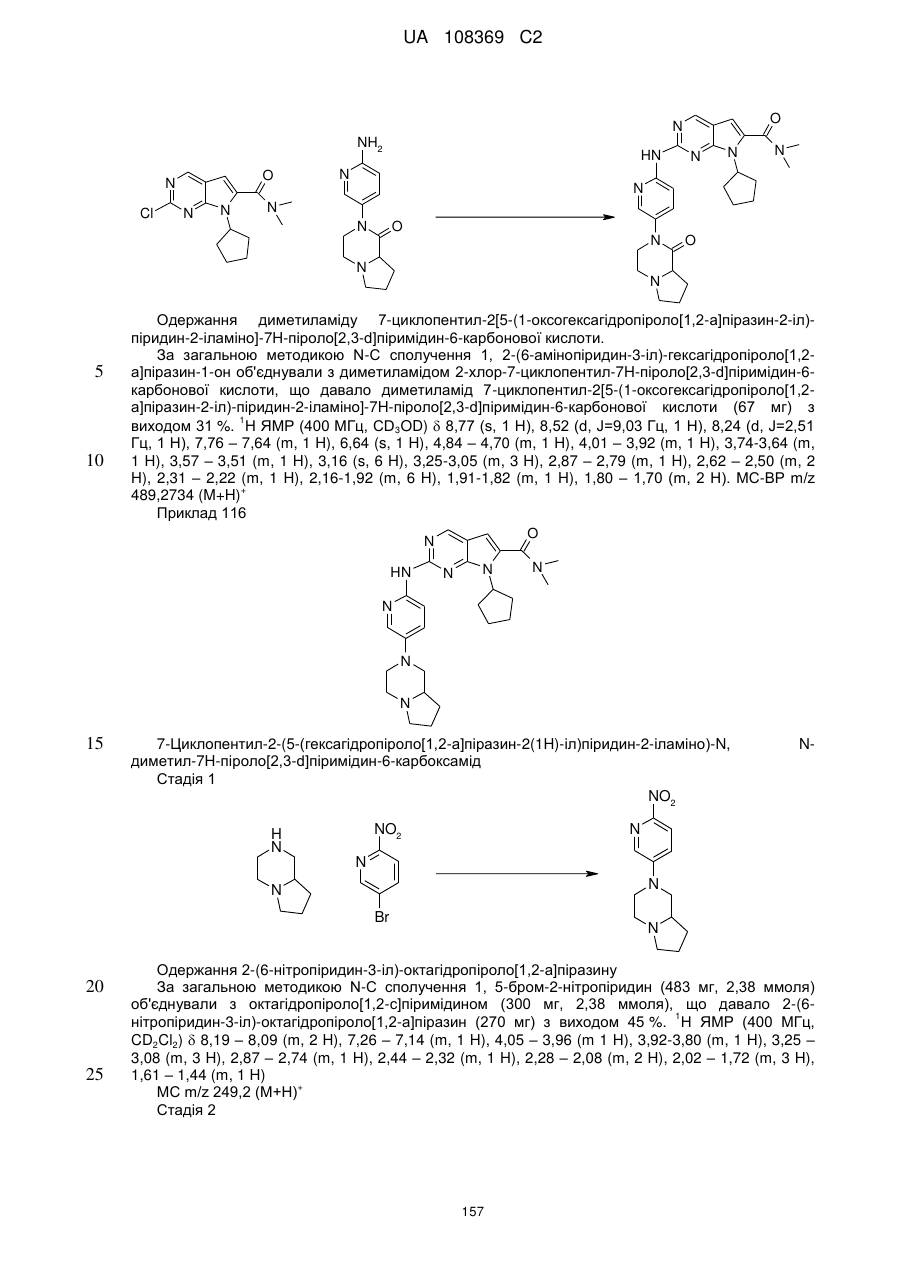
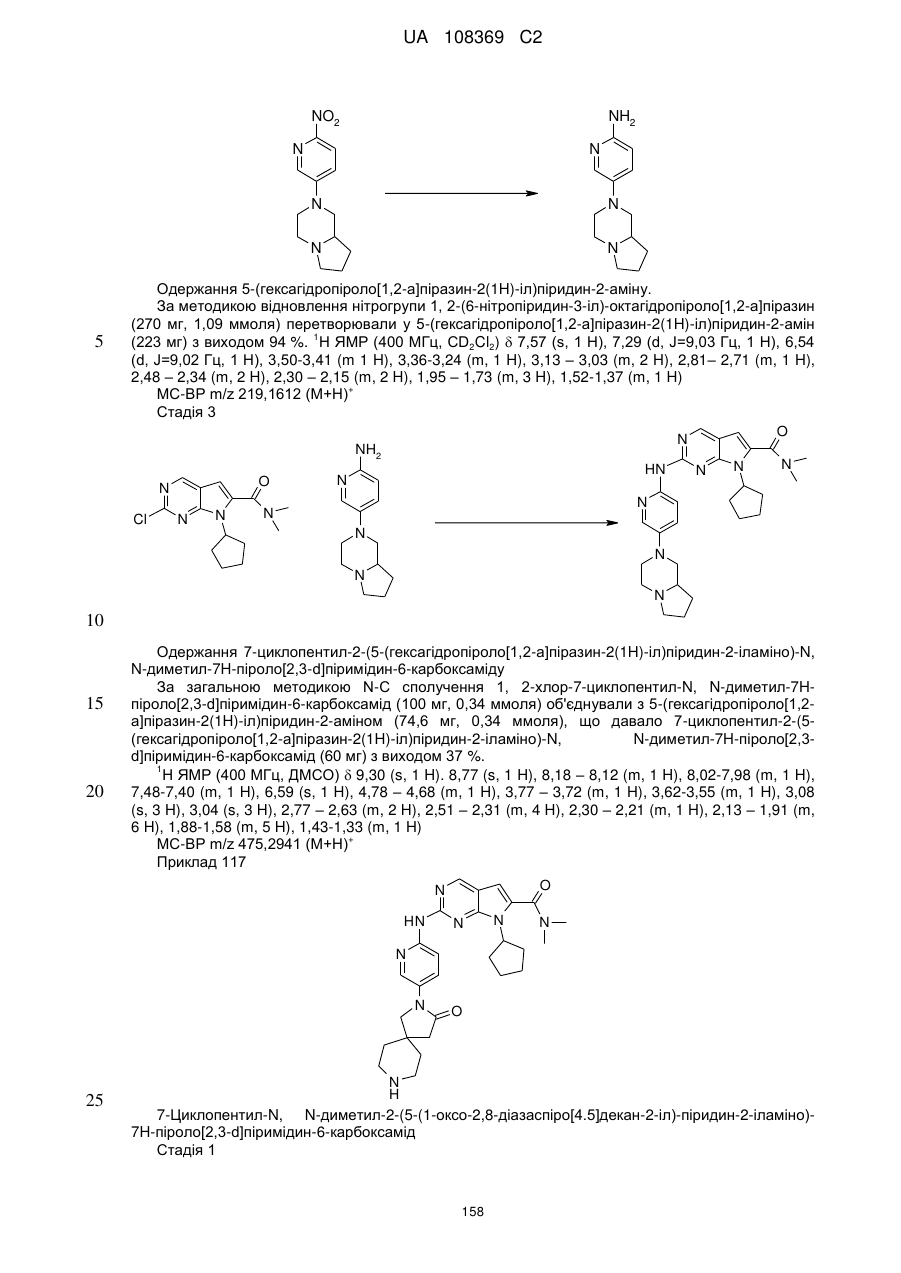
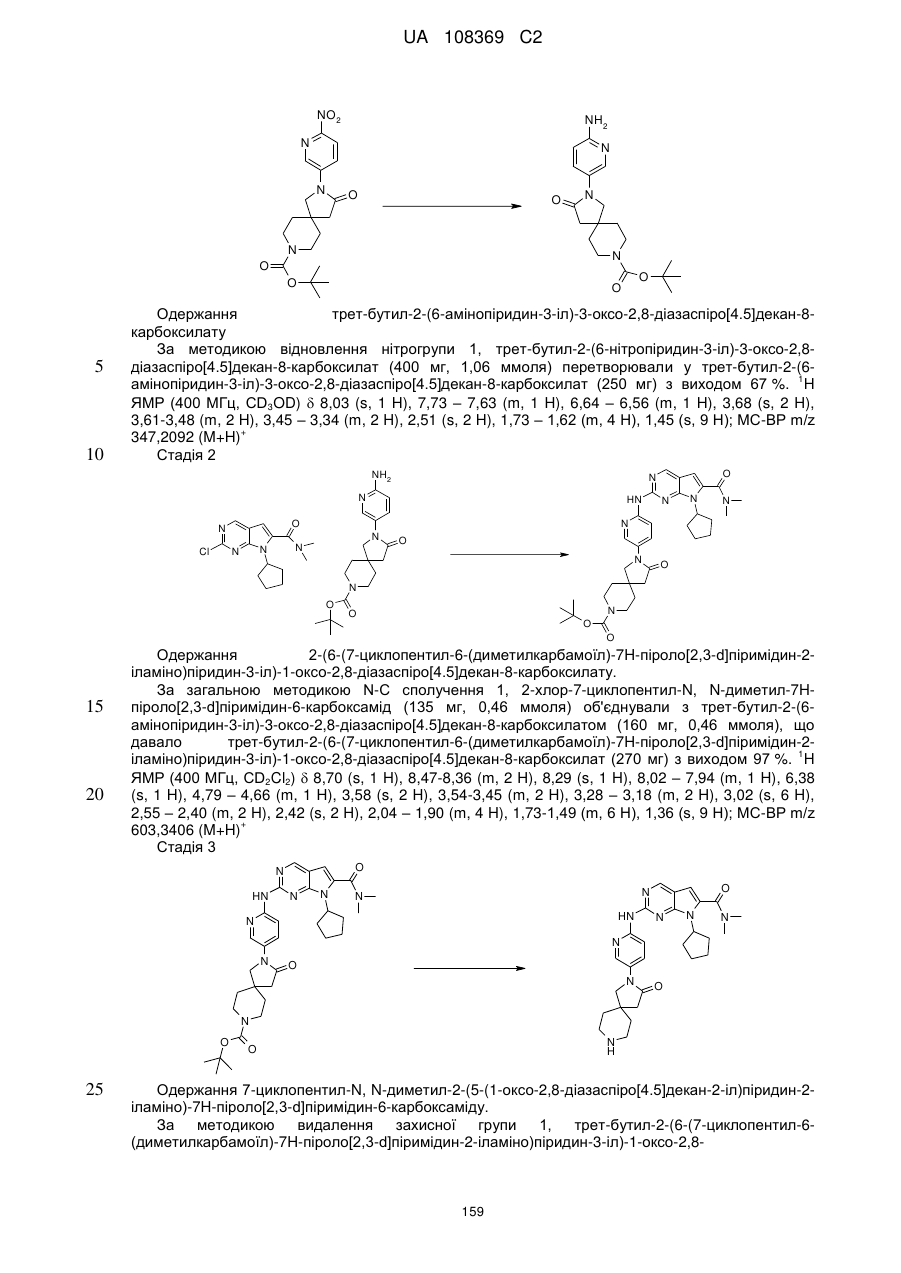
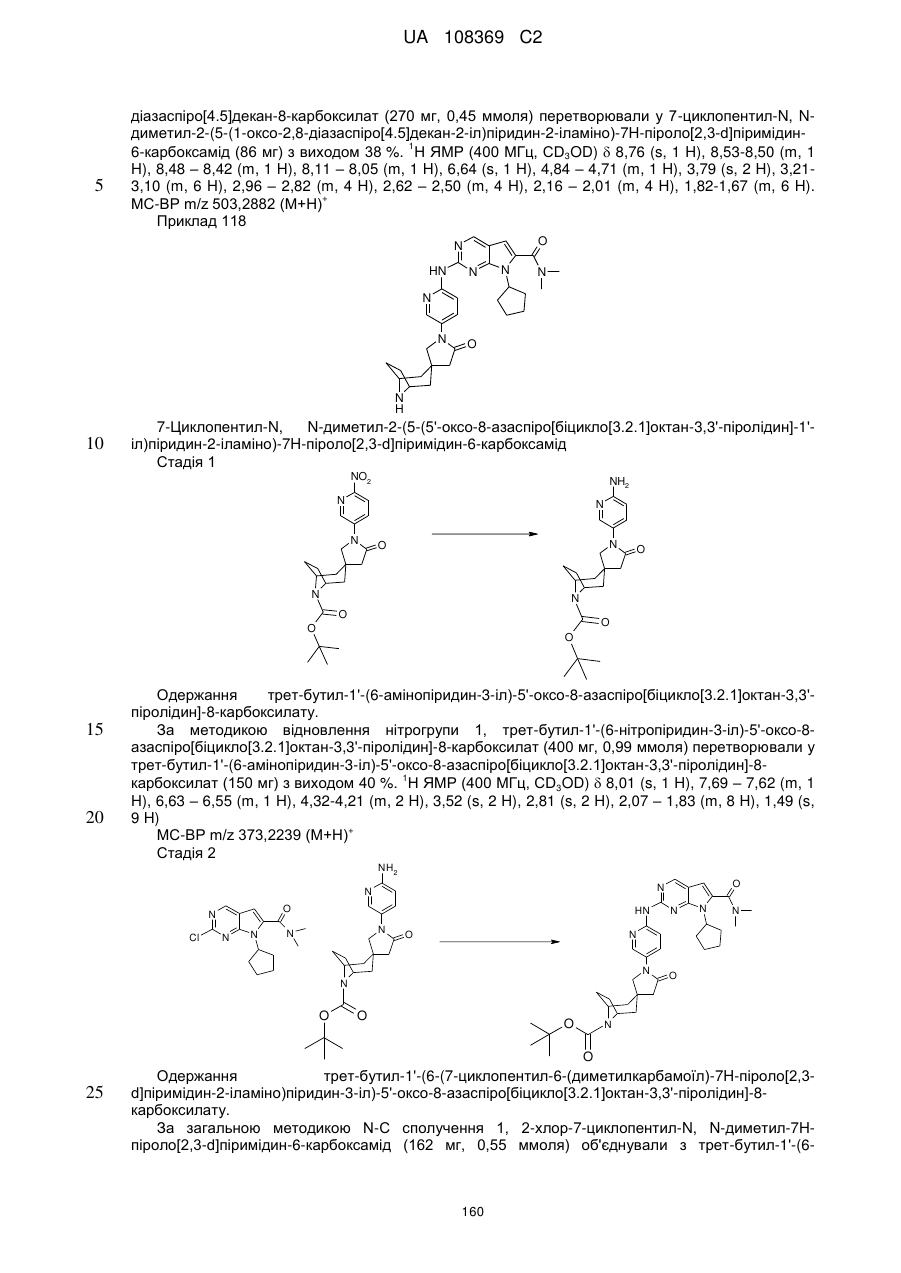
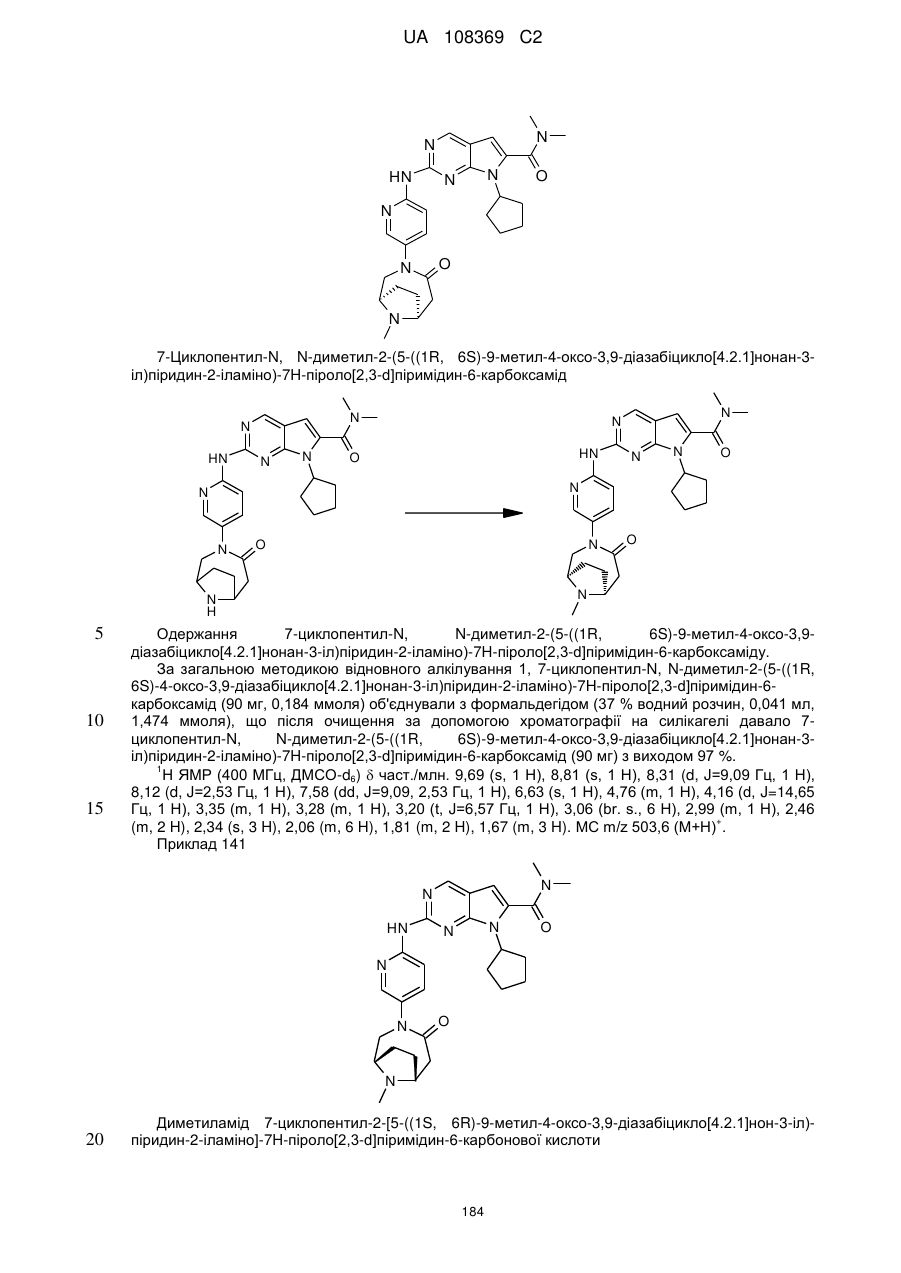
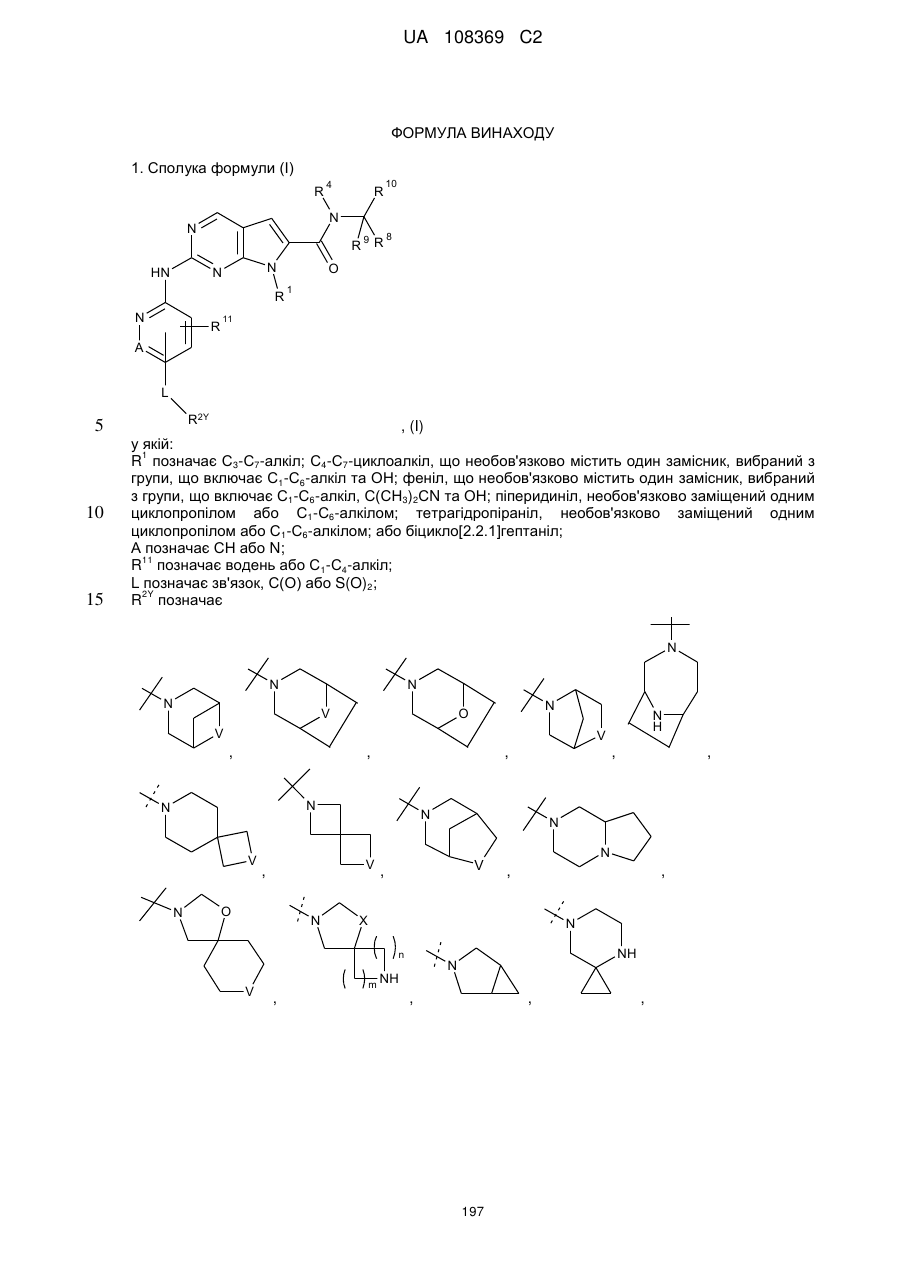
1. Сполука формули (І)
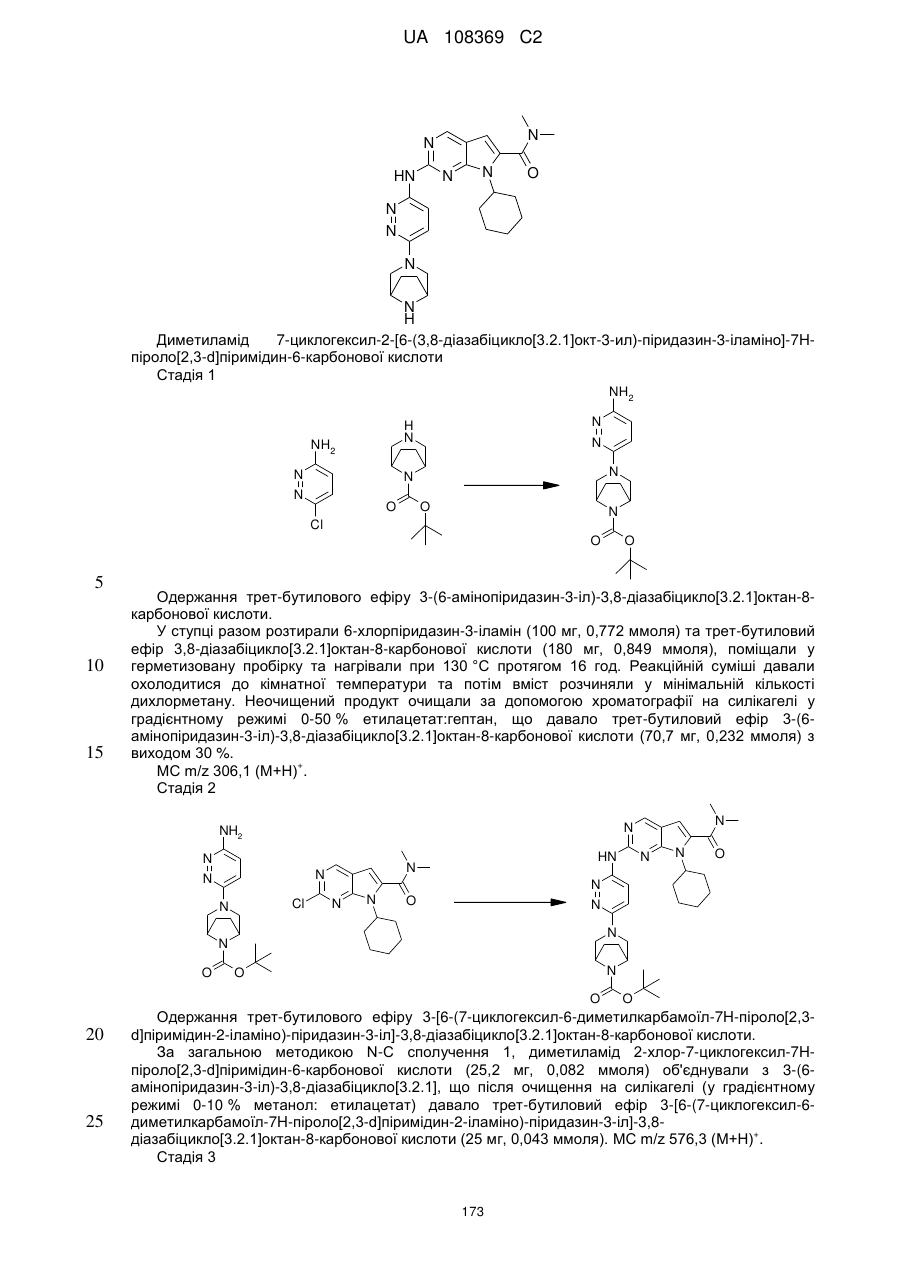
 , (I)
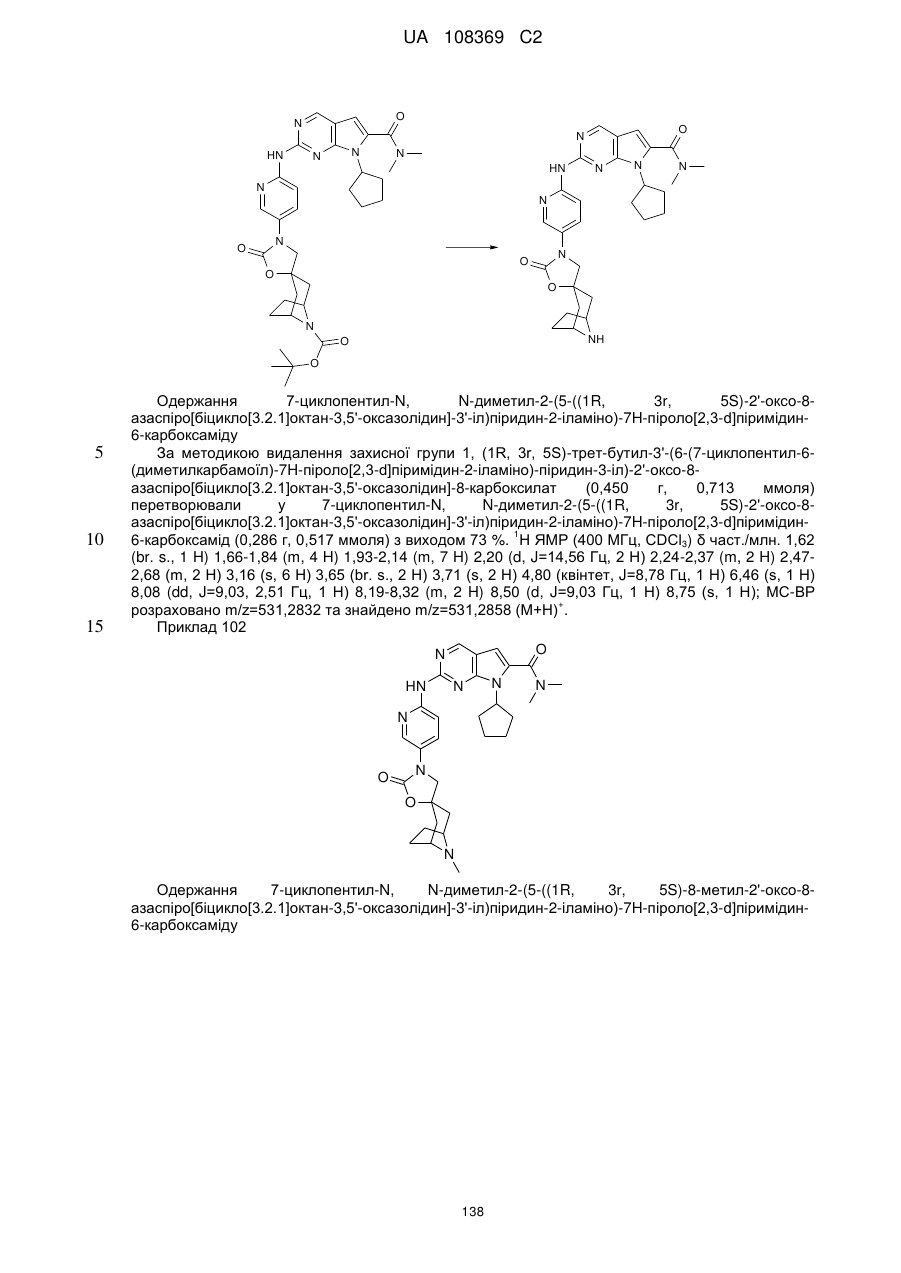
, (I)
у якій:
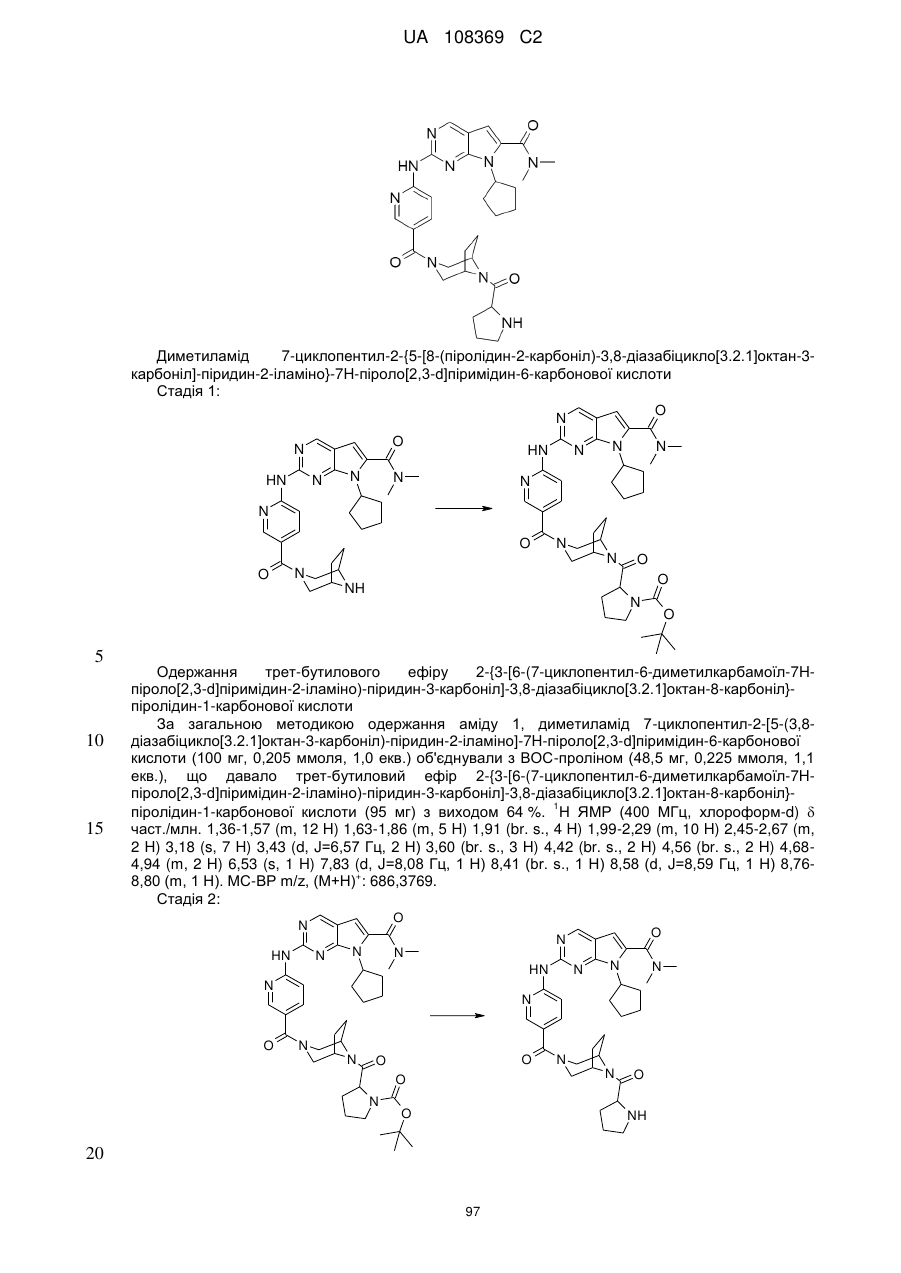
R1 позначає С3-С7-алкіл; С4-С7-циклоалкіл, що необов'язково містить один замісник, вибраний з групи, що включає С1-С6-алкіл та ОН; феніл, що необов'язково містить один замісник, вибраний з групи, що включає С1-С6-алкіл, С(СН3)2СN та ОН; піперидиніл, необов'язково заміщений одним циклопропілом або С1-С6-алкілом; тетрагідропіраніл, необов'язково заміщений одним циклопропілом або С1-С6-алкілом; або біцикло[2.2.1]гептаніл;
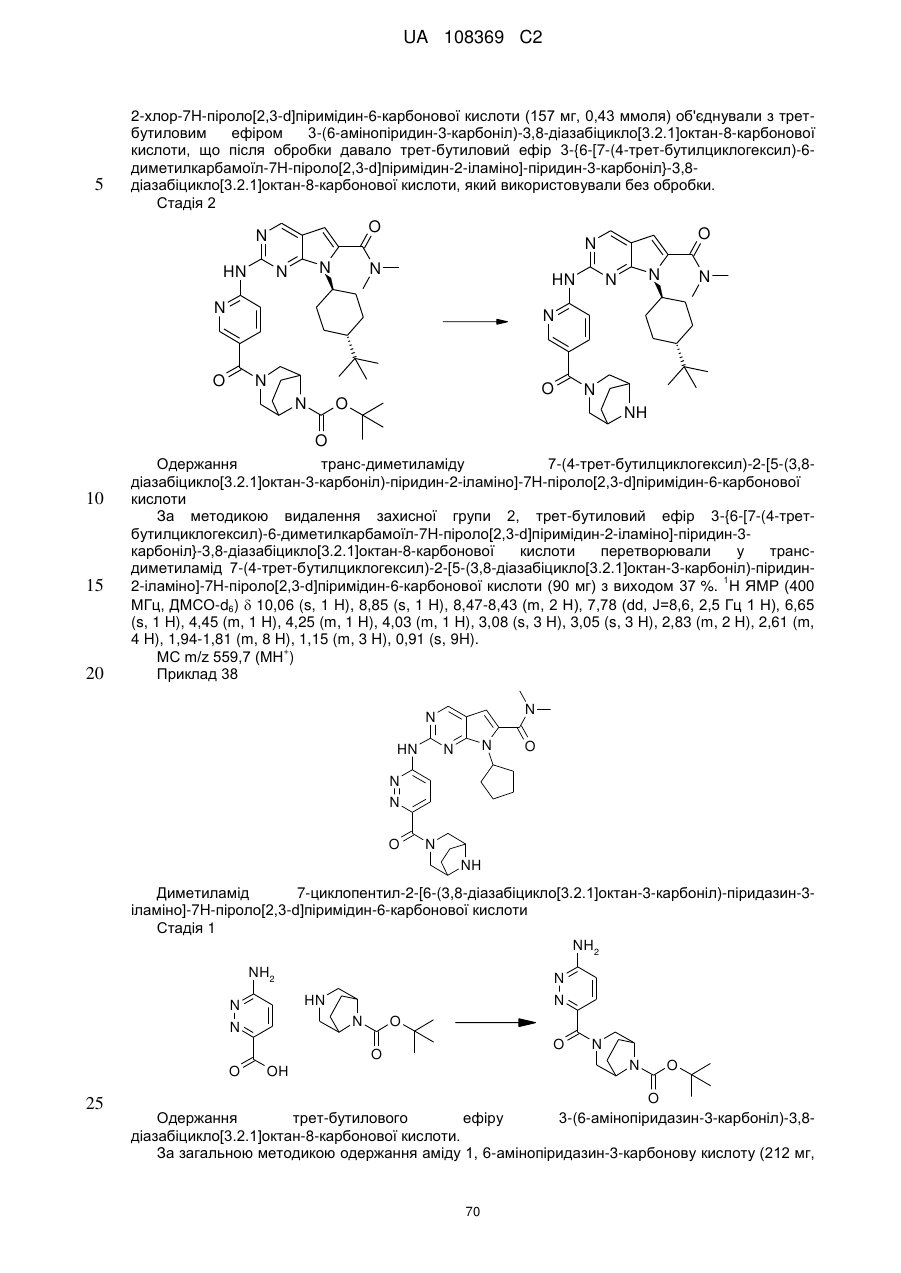
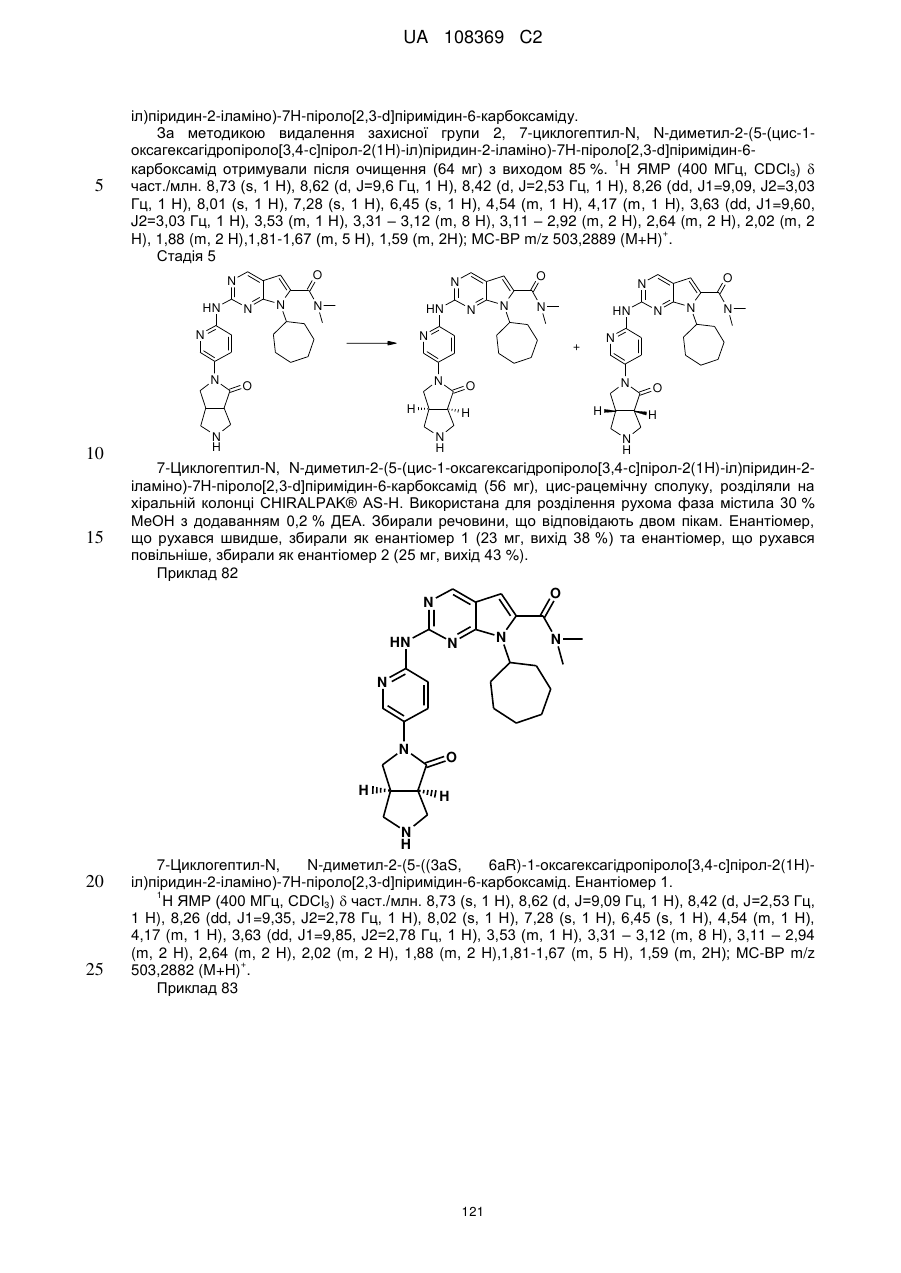
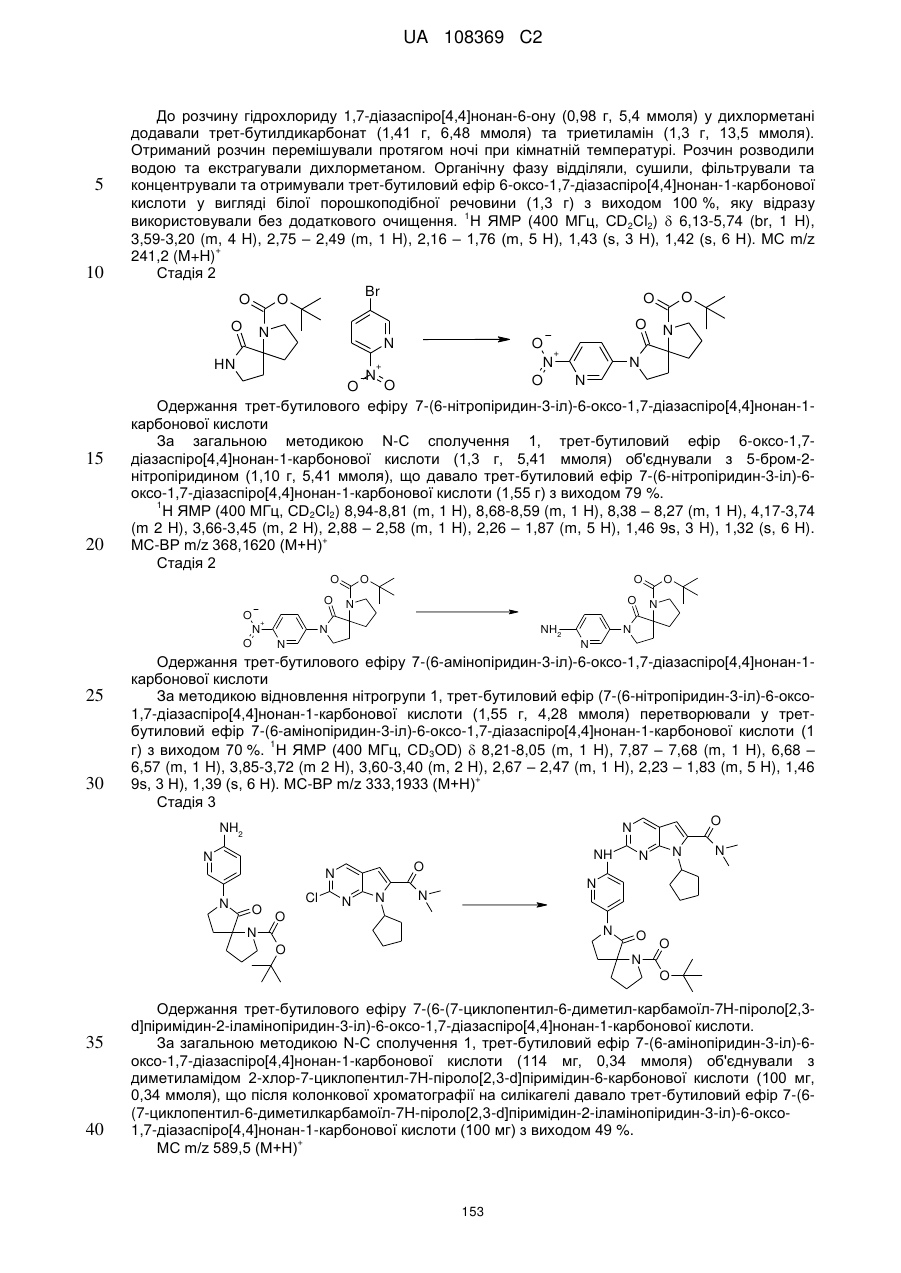
А позначає СН або N;
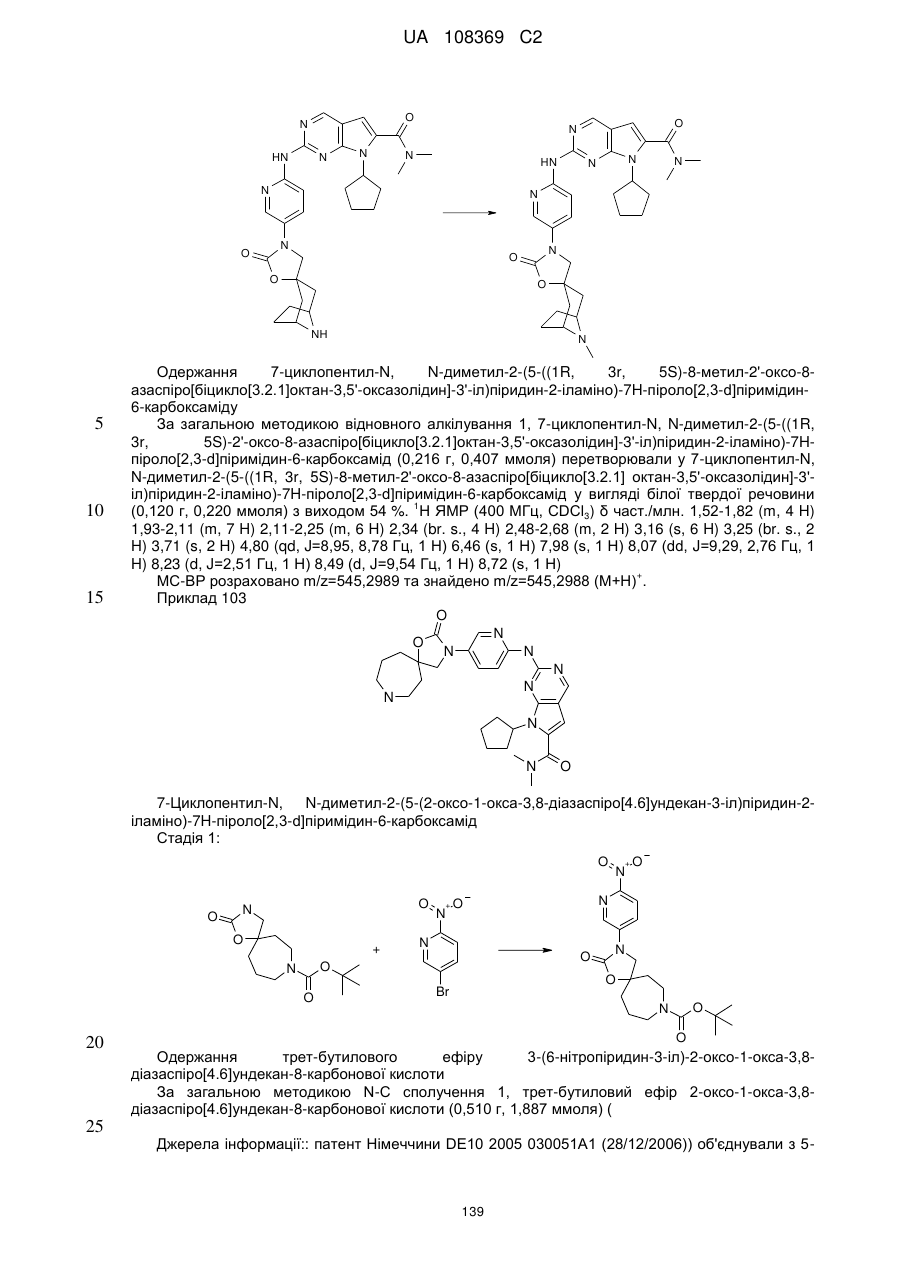
R11 позначає водень або С1-С4-алкіл;
L позначає зв'язок, С(О) або S(O)2;
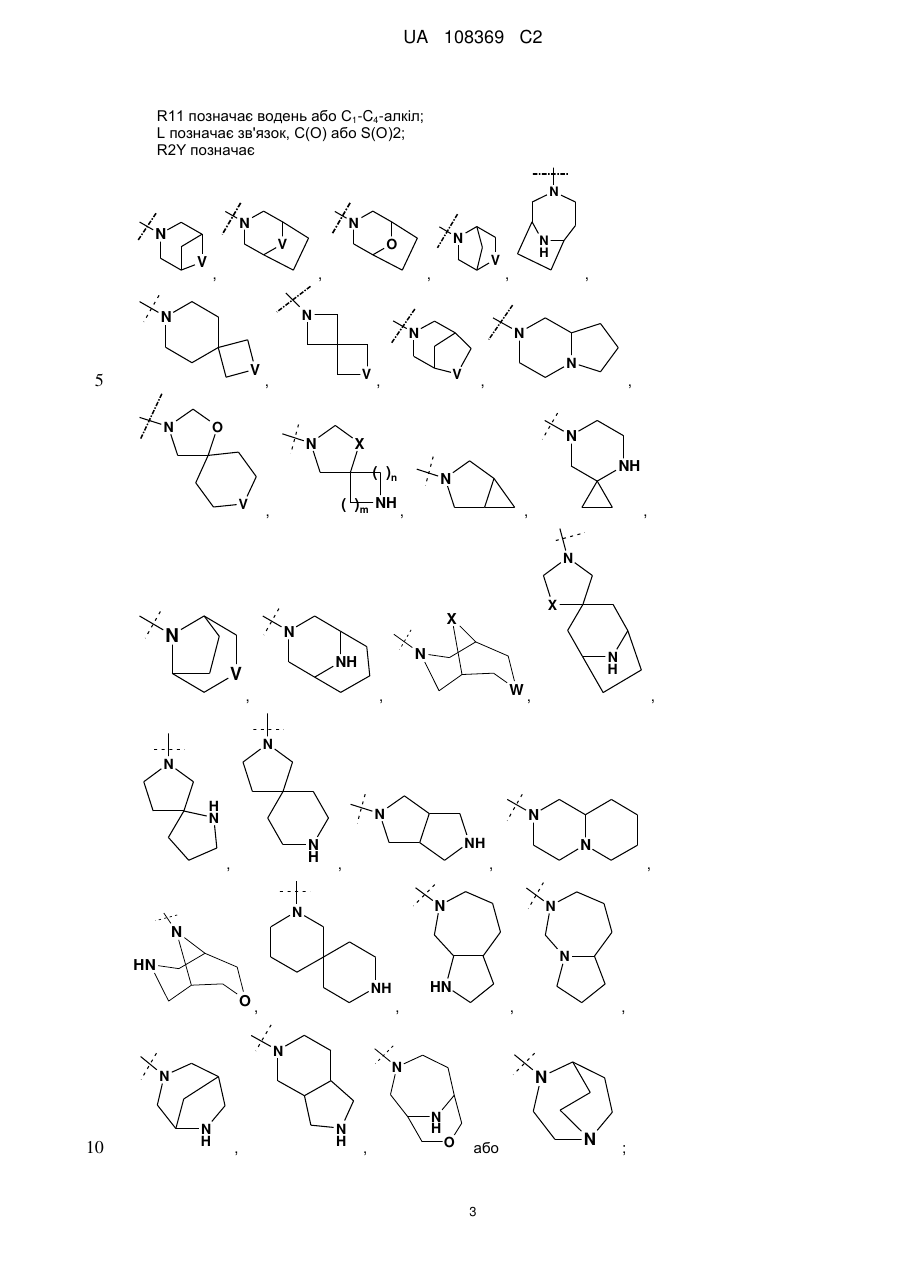
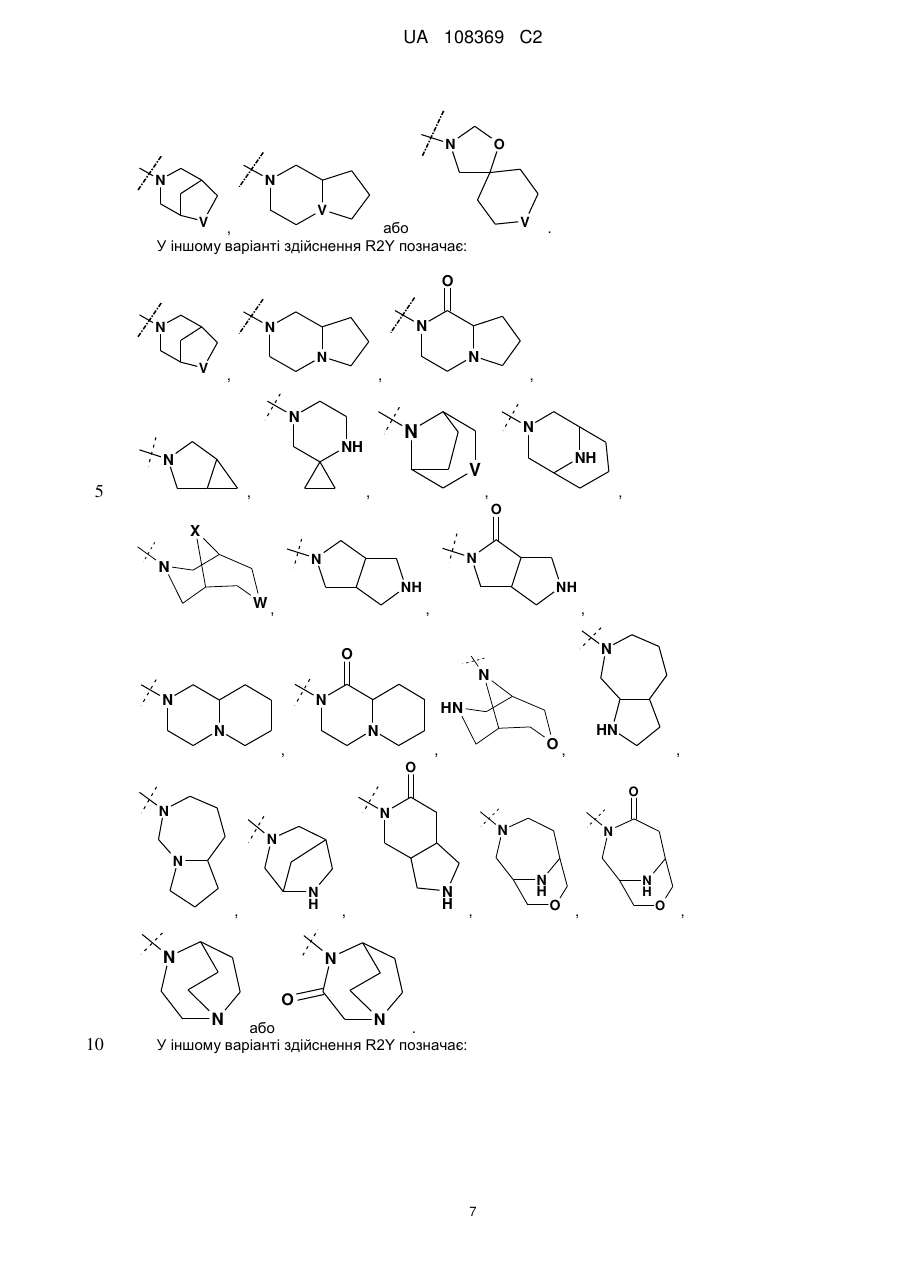
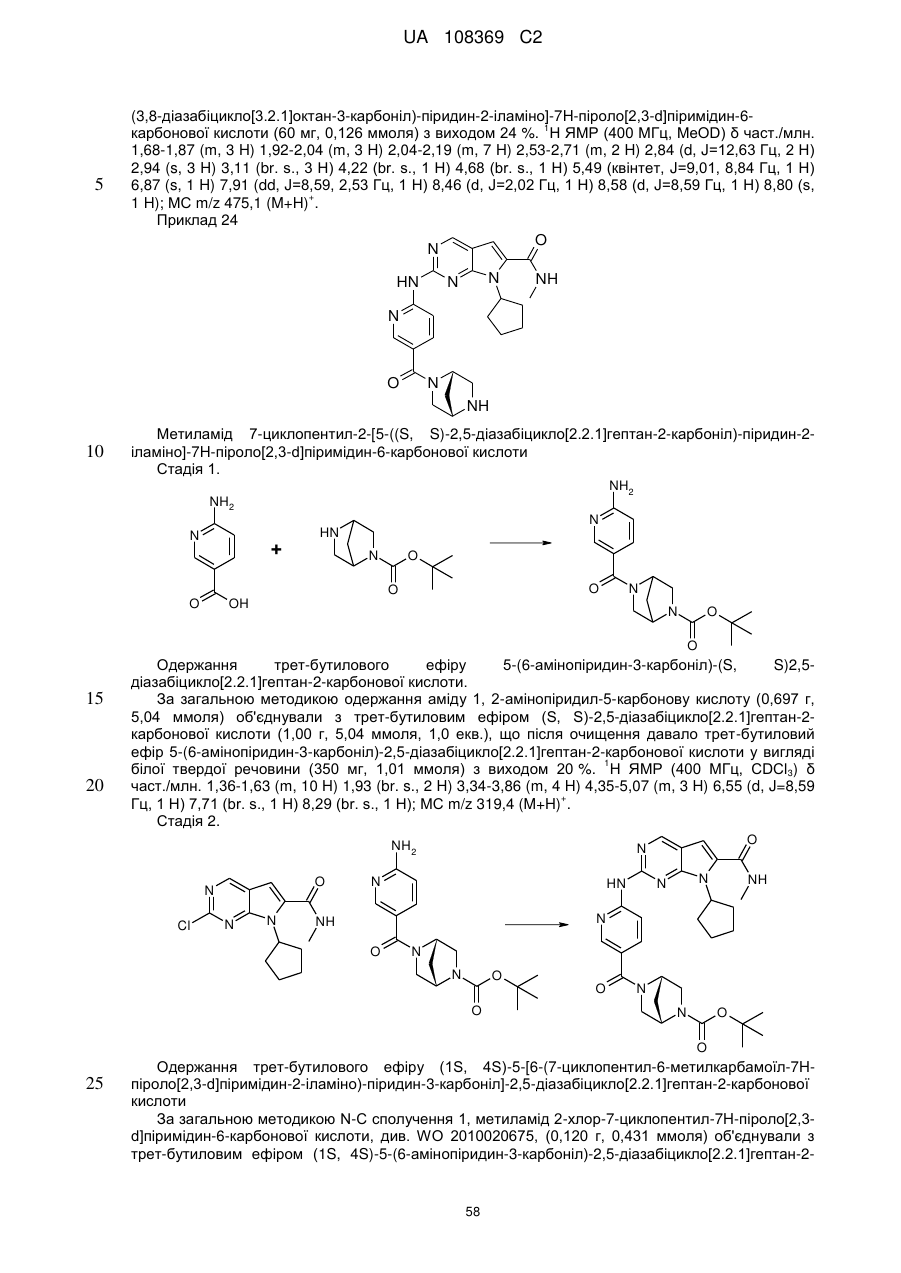
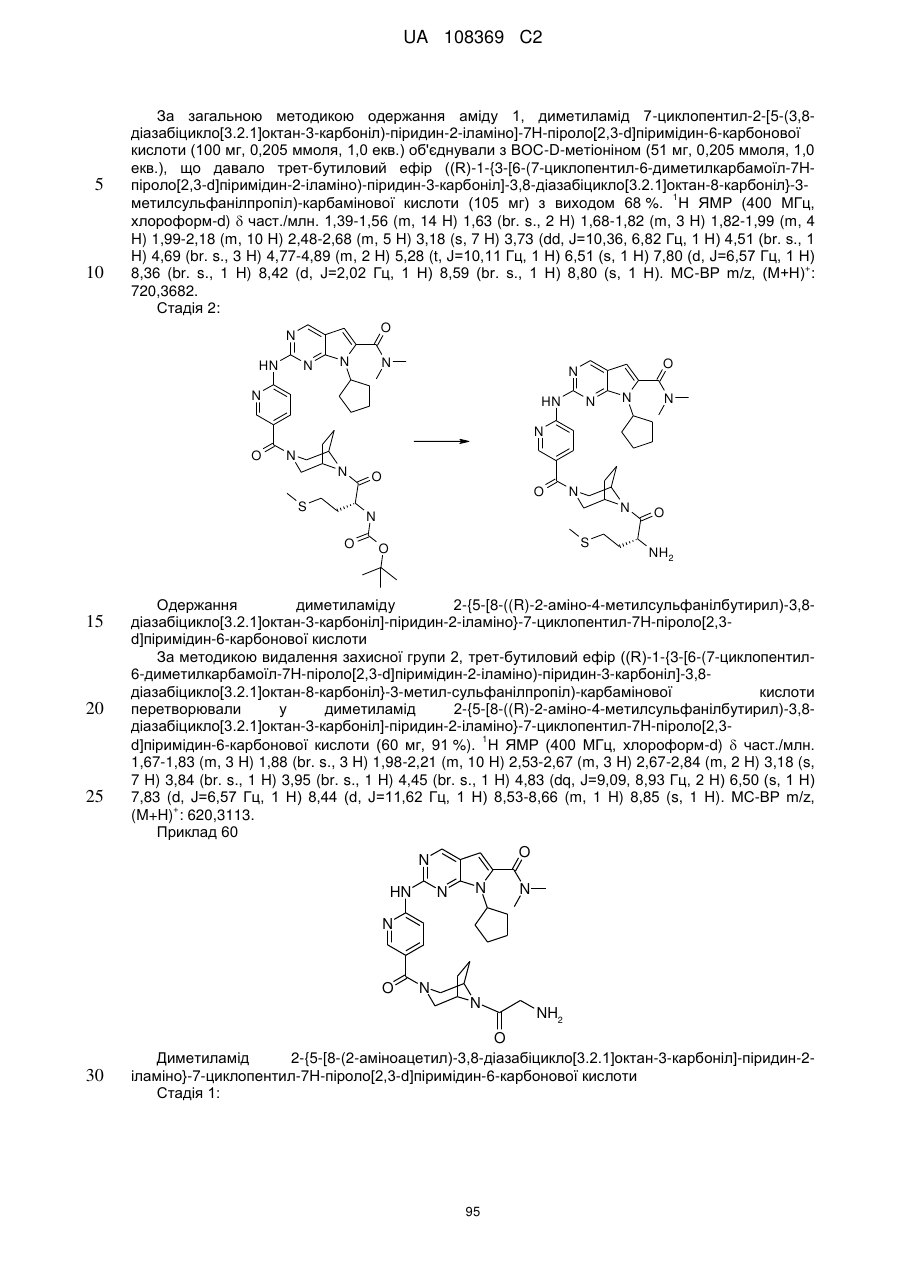
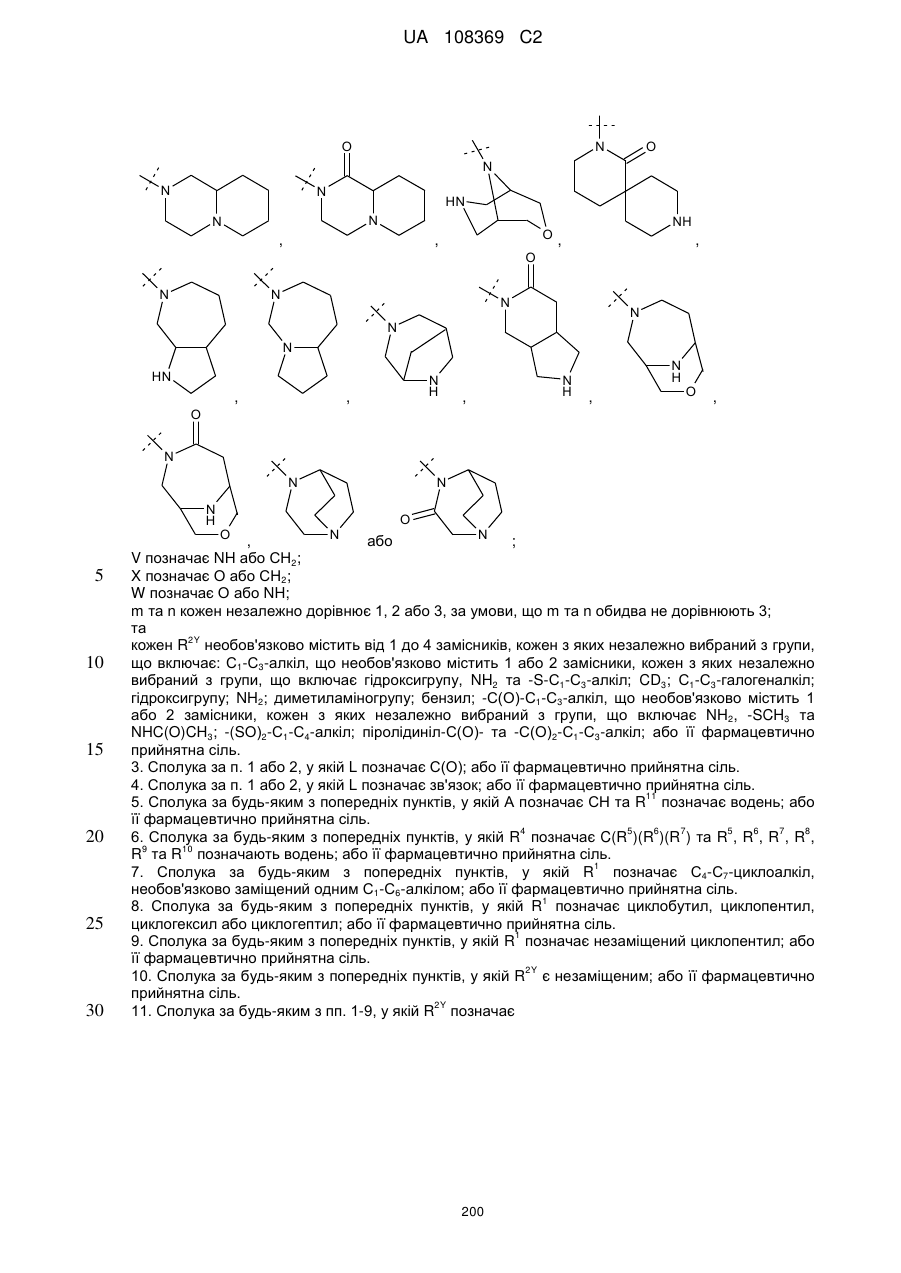
R2Y позначає
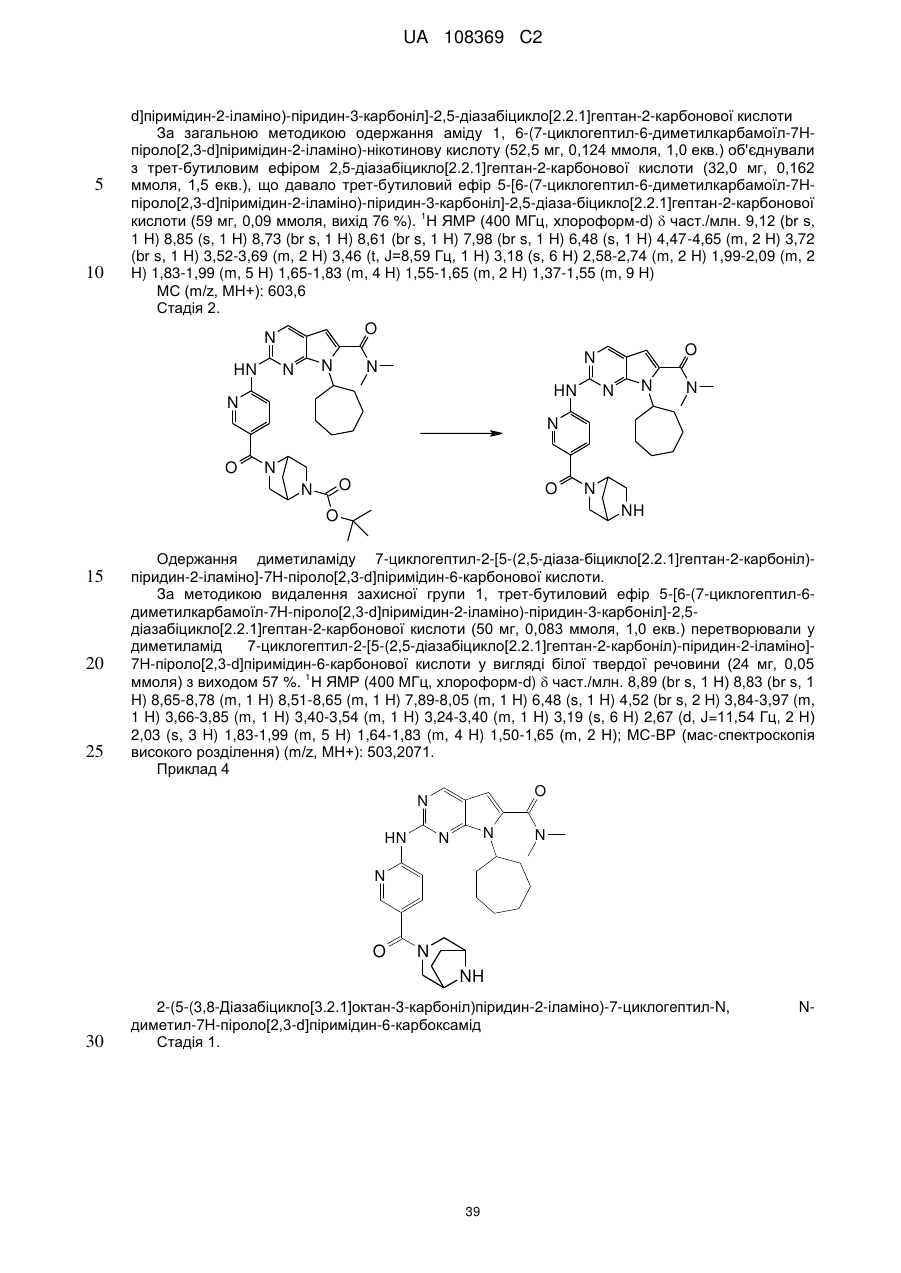
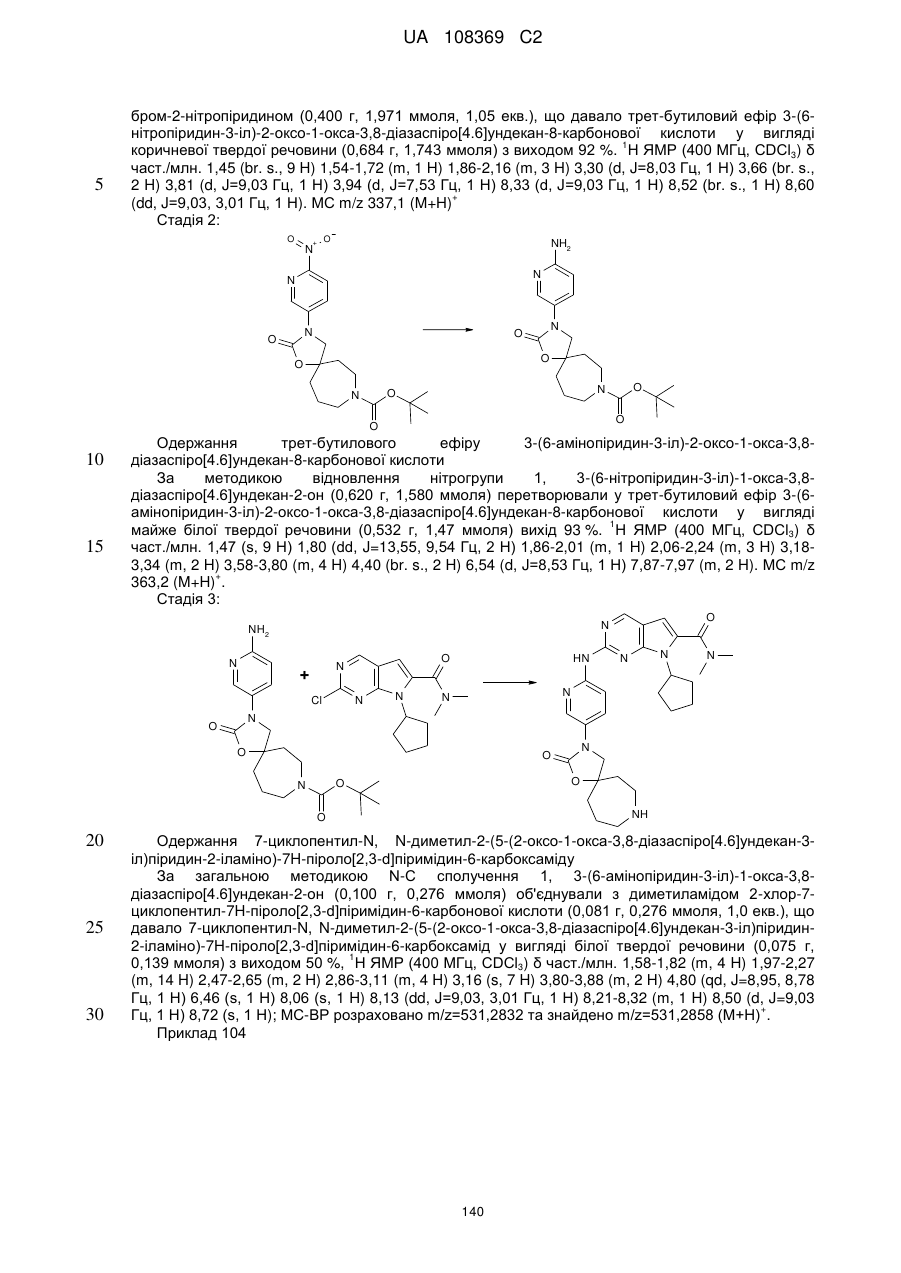
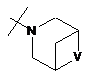 ,
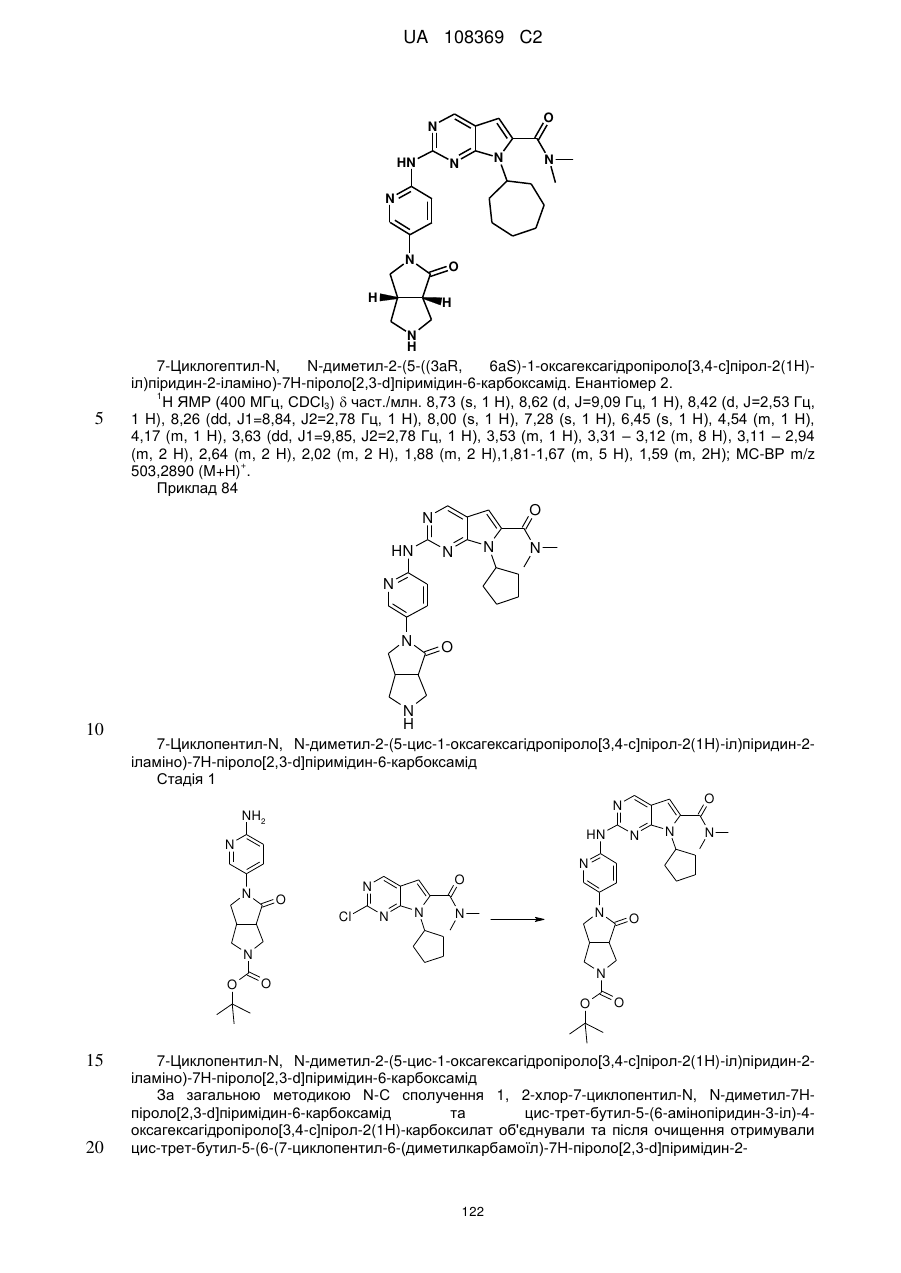
, 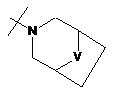 ,
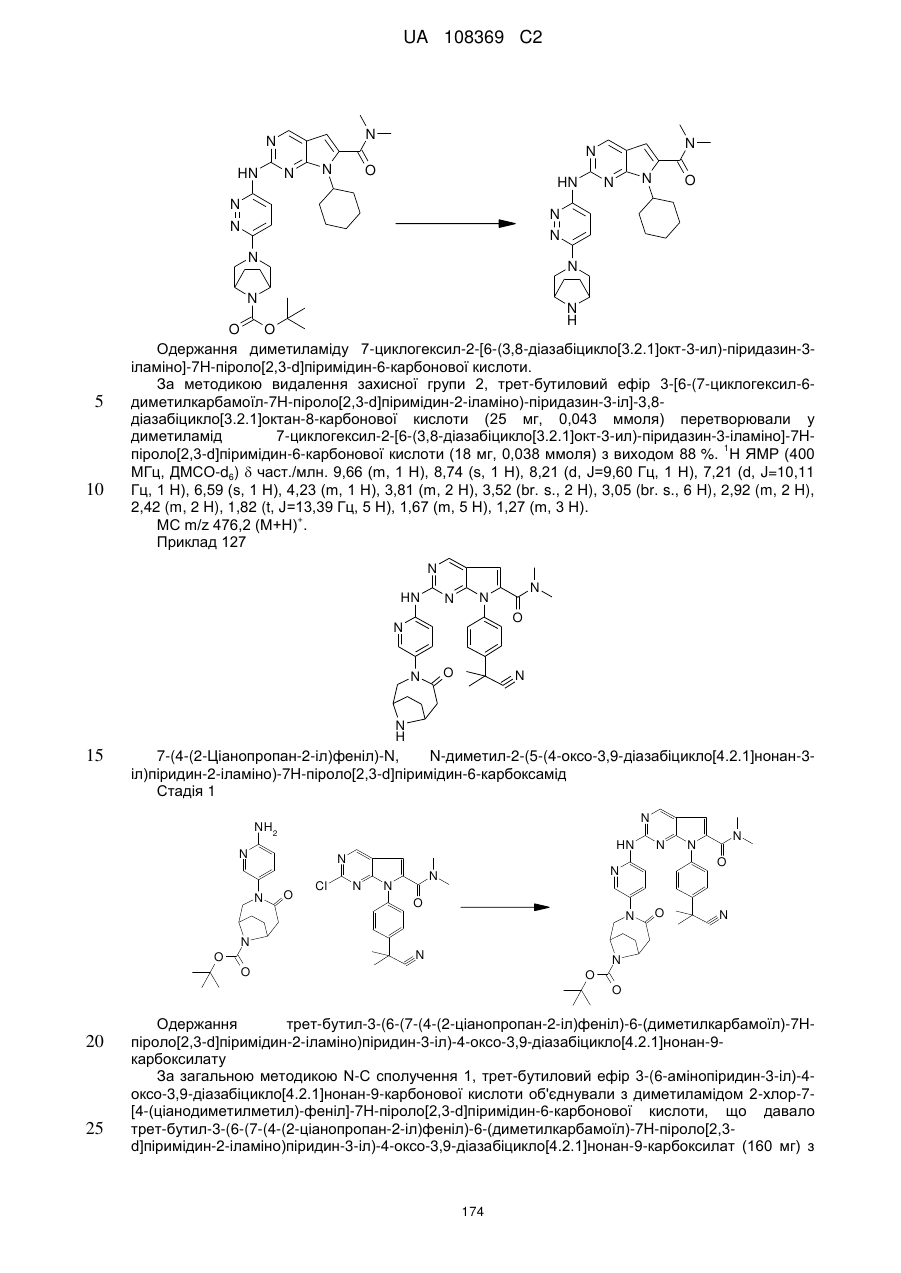
,  ,
, 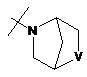 ,
, 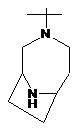 ,
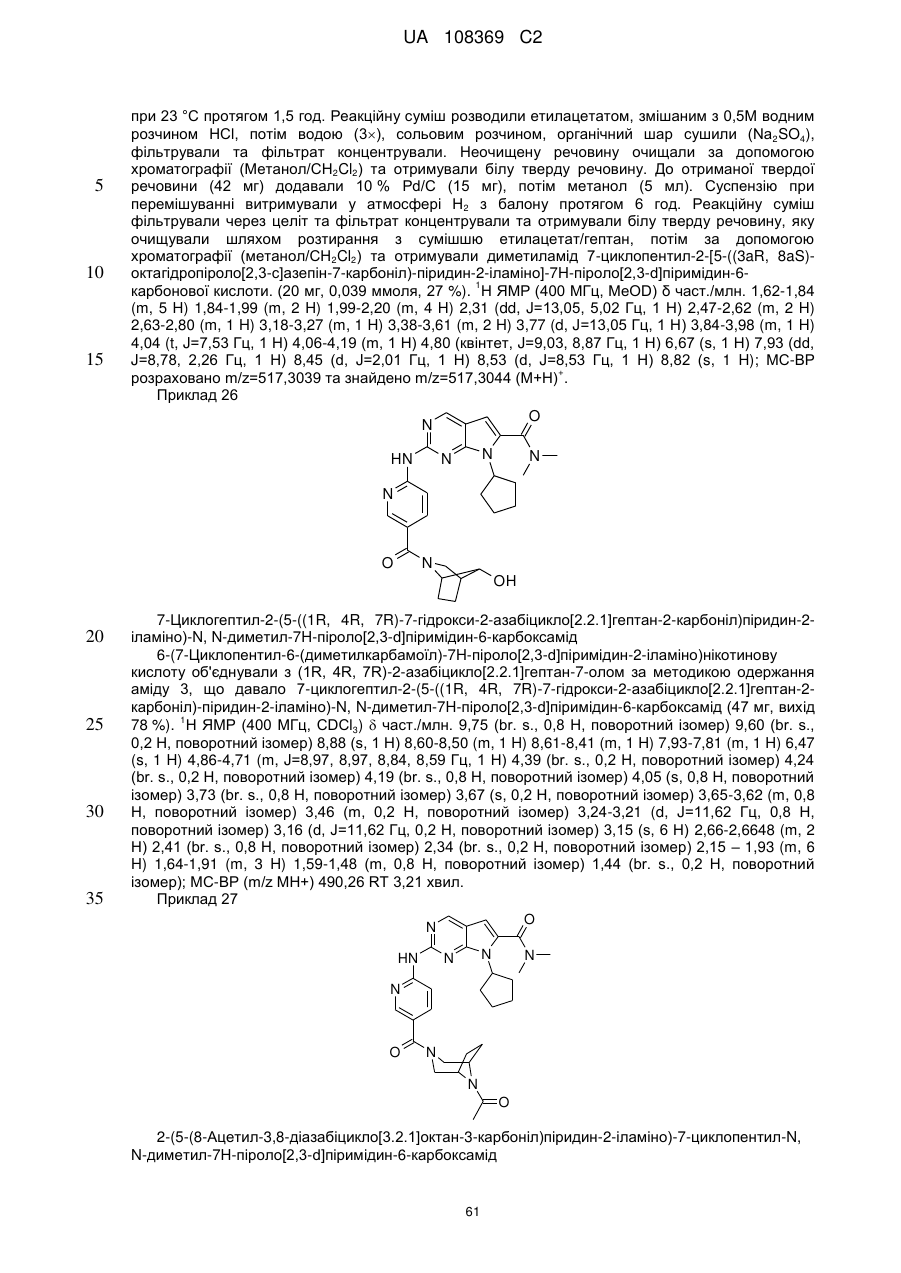
,
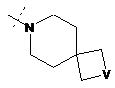 ,
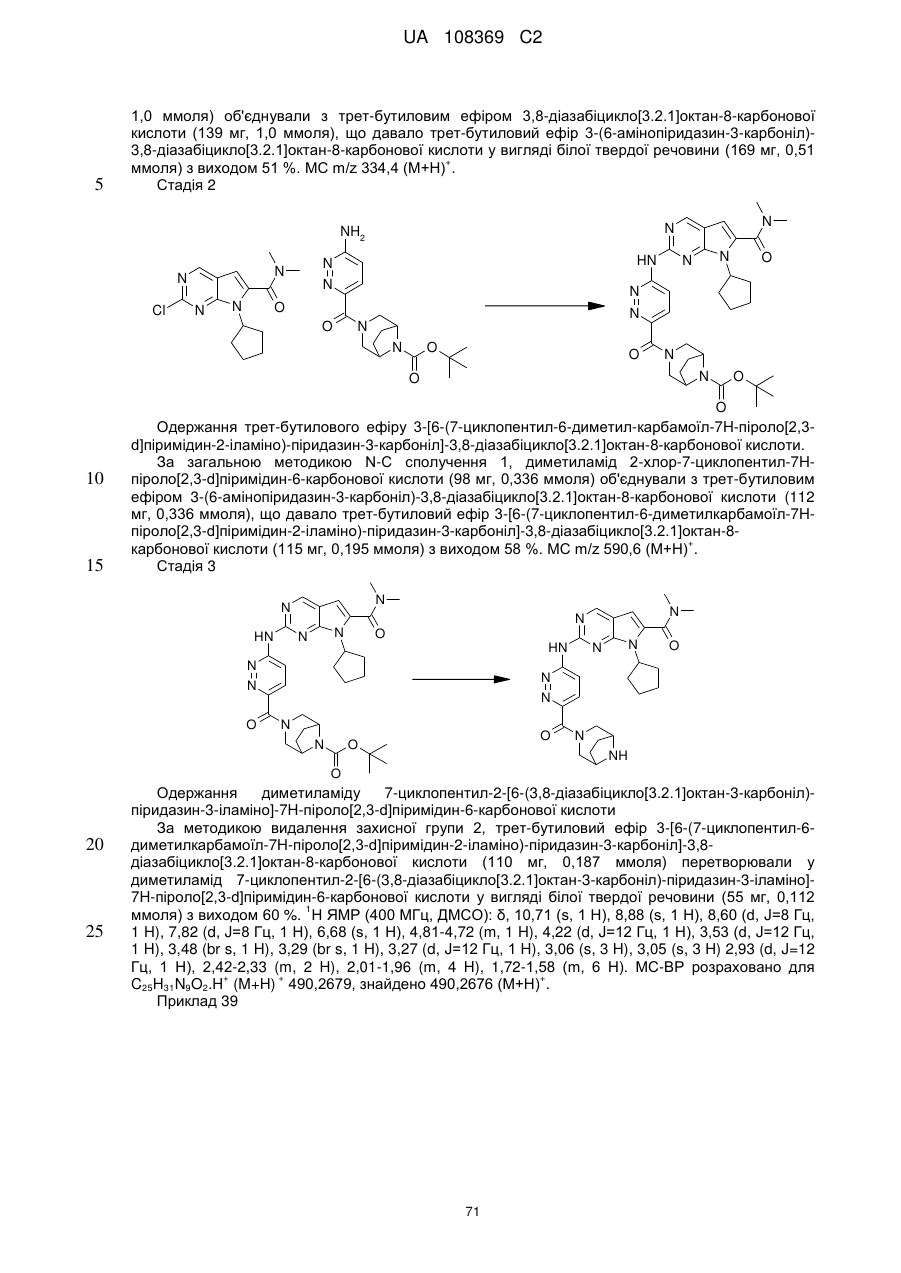
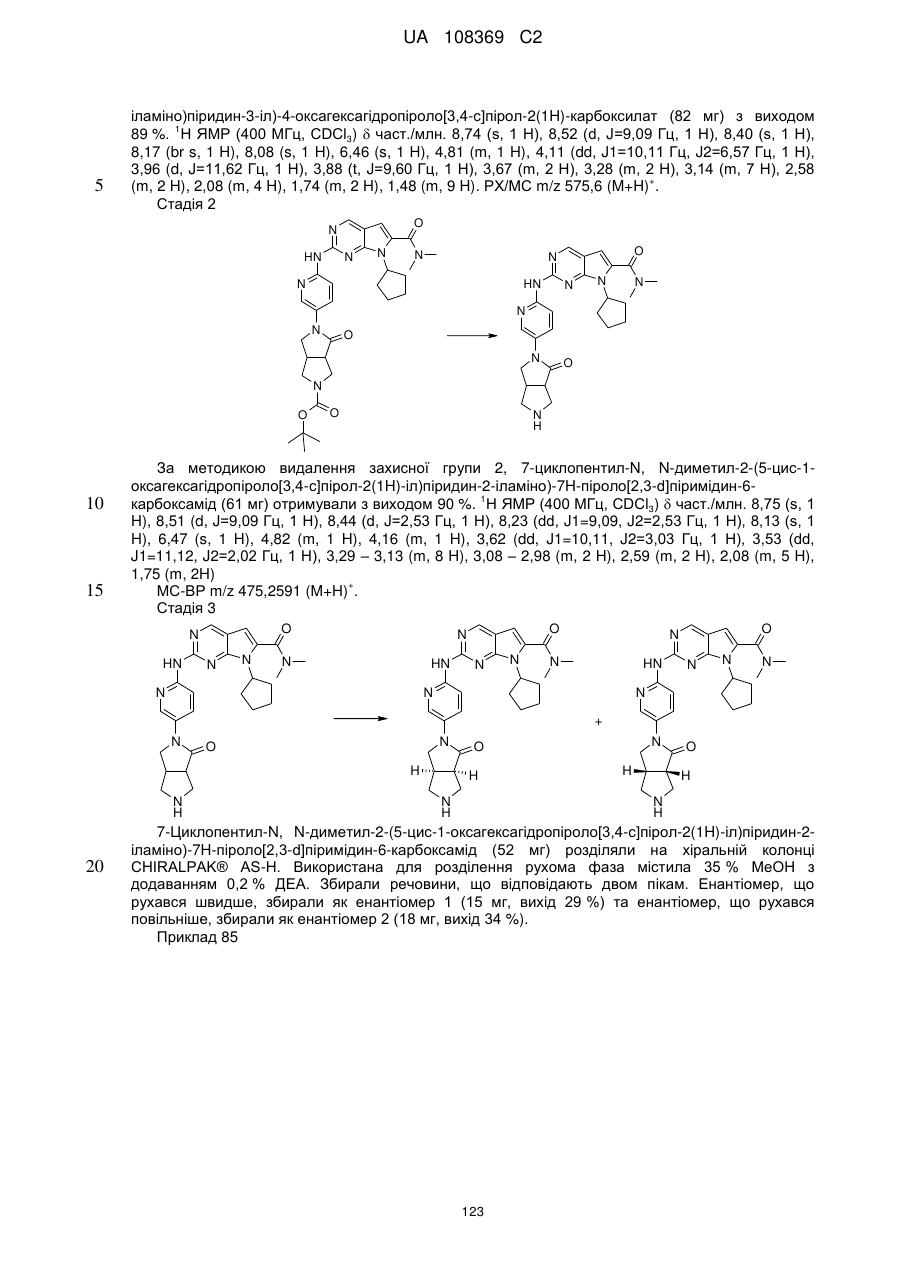
, 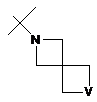 ,
, 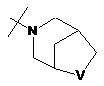 ,
, 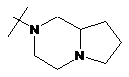 ,
,
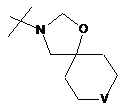 ,
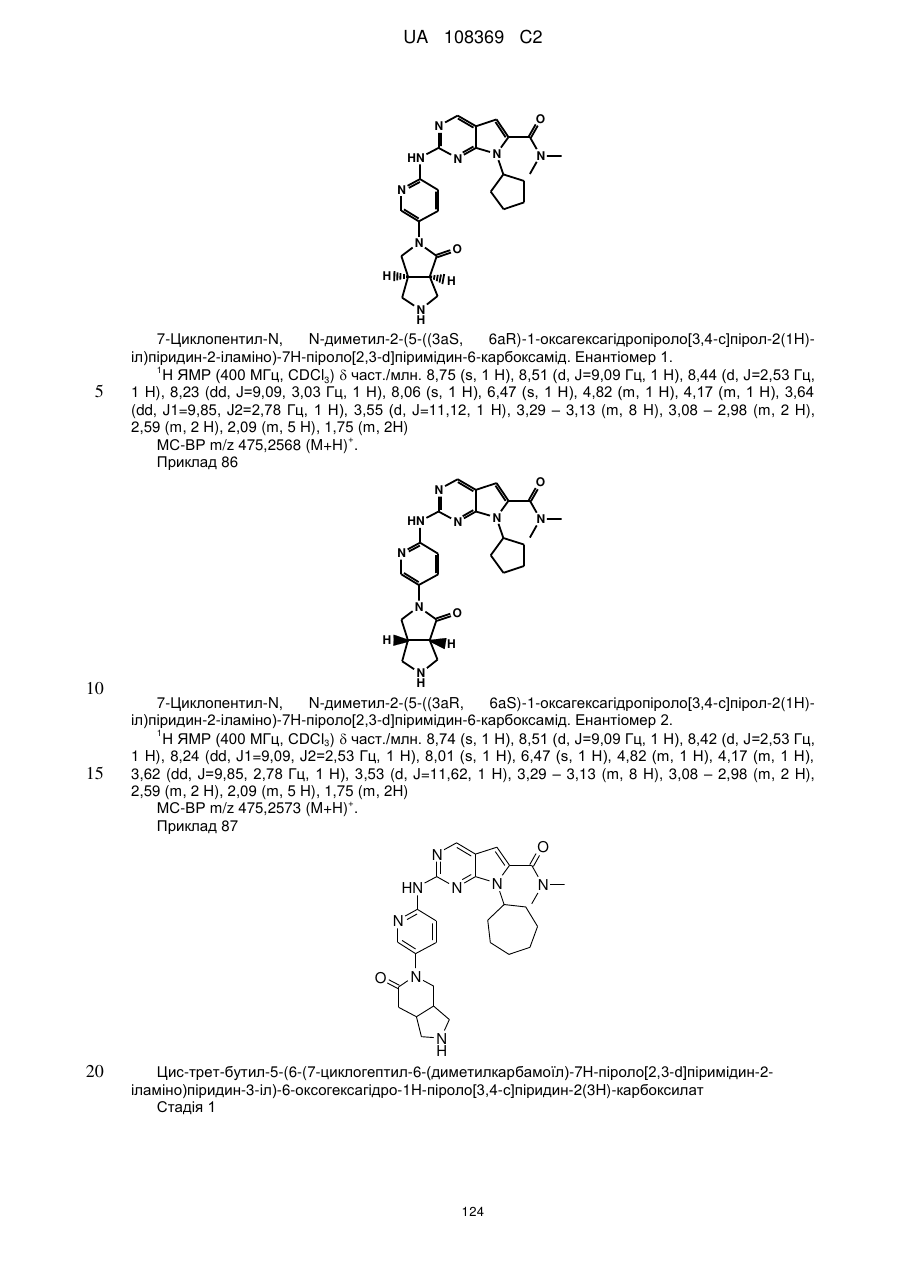
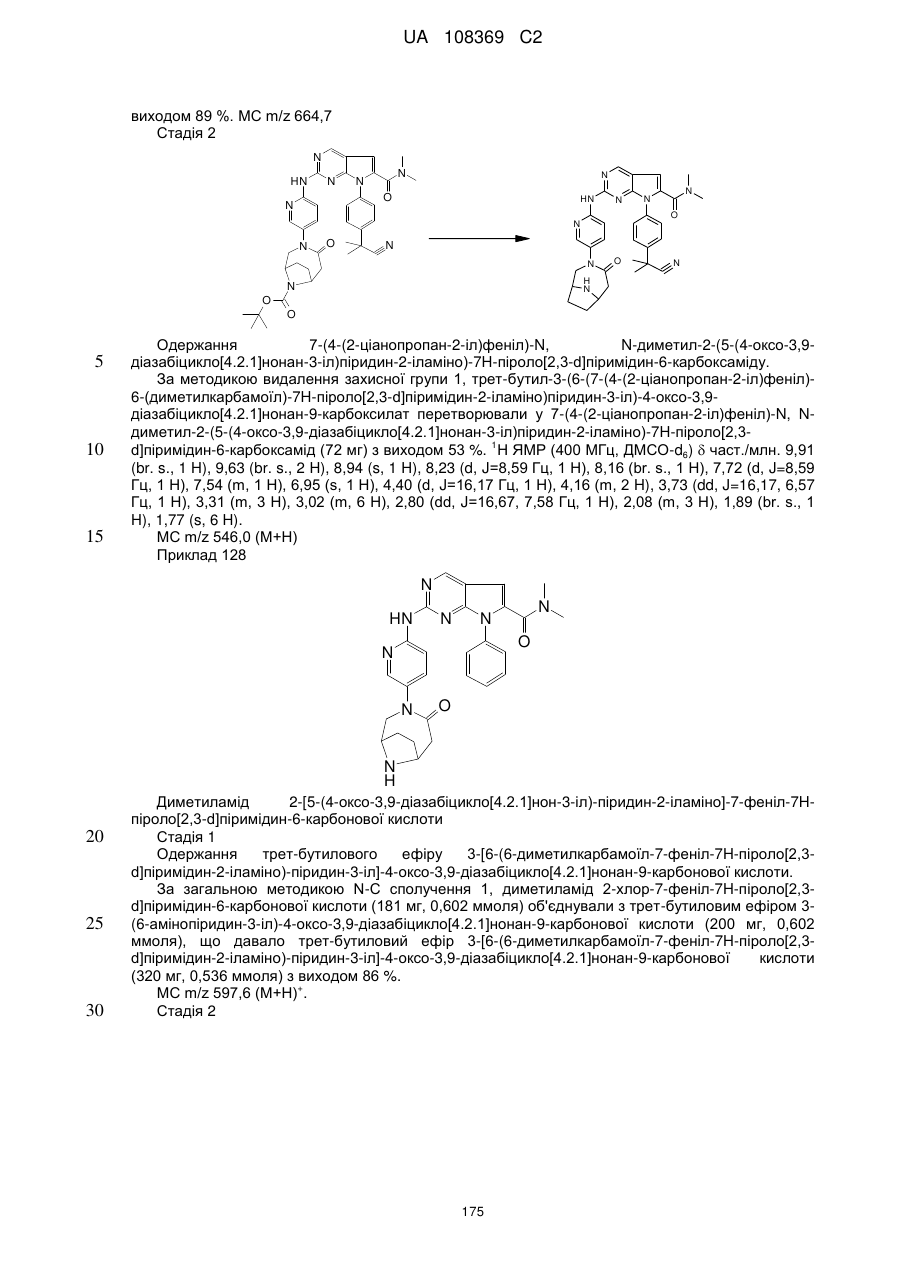
,  ,
, 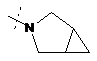 ,
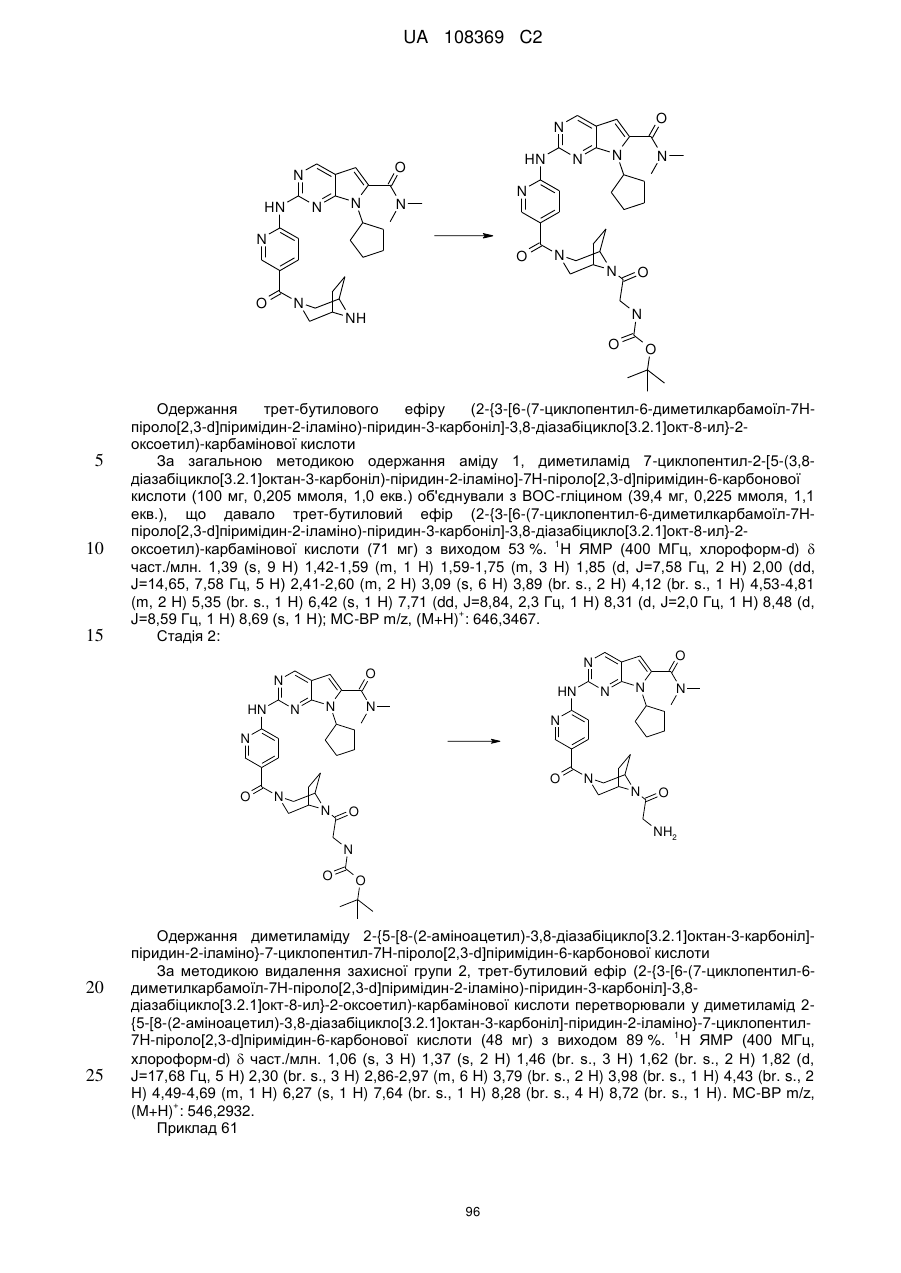
, 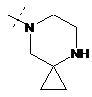 ,
,
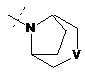 ,
, 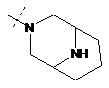 ,
, 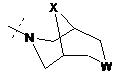 ,
,  ,
, 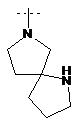 ,
,
 ,
, 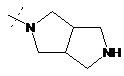 ,
, 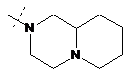 ,
, 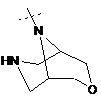 ,
,
 ,
, 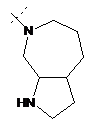 ,
, 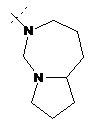 ,
, 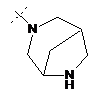 ,
,  ,
,
 або
або  ;
;
V позначає NH або СН2;
X позначає О або СН2;
W позначає О або NH;
m та n кожен незалежно дорівнює 1, 2 або 3, за умови, що m та n обидва не дорівнюють 3; кожен R2Y необов'язково містить від 1 до 4 замісників, кожен з яких незалежно вибраний з групи, що включає: С1-С3-алкіл, що необов'язково містить 1 або 2 замісники, кожен з яких незалежно вибраний з групи, що включає гідроксигрупу, NH2 та -S-С1-С3-алкіл; CD3; галоген; оксогрупу; С1-С3-галогеналкіл; гідроксигрупу; NH2; диметиламіногрупу; бензил; -С(О)-С1-С3-алкіл, що необов'язково містить 1 або 2 замісники, кожен з яких незалежно вибраний з групи, що включає NH2, -SCH3 та NНС(О)СН3; -S(О)2-С1-С4-алкіл; піролідиніл-С(О)- та -С(О)2-С1-С3-алкіл;
R4 позначає водень, дейтерій або C(R5)(R6)(R7); та
R5, R6, R7, R8, R9 та R10 всі незалежно позначають Н або дейтерій; або її фармацевтично прийнятна сіль.
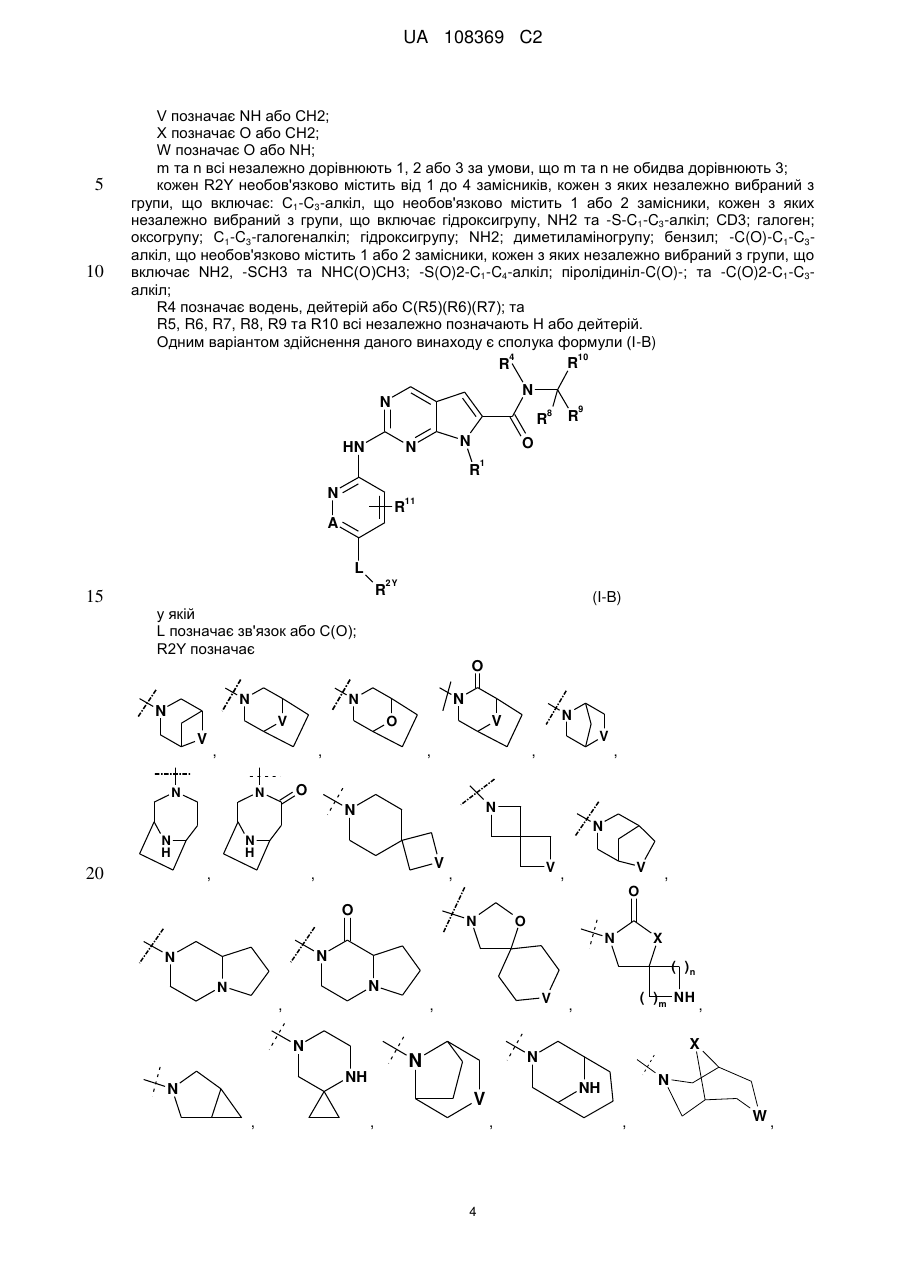
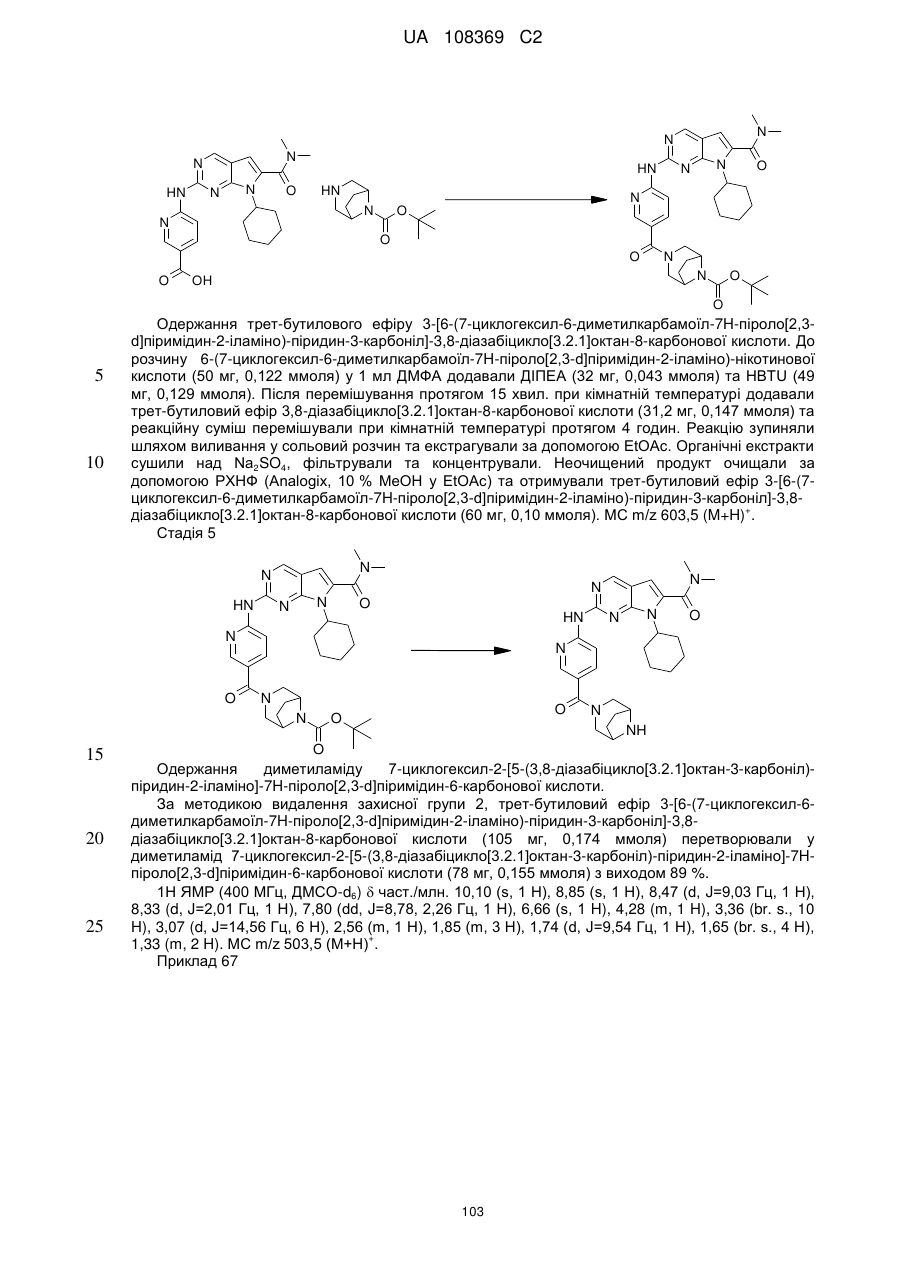
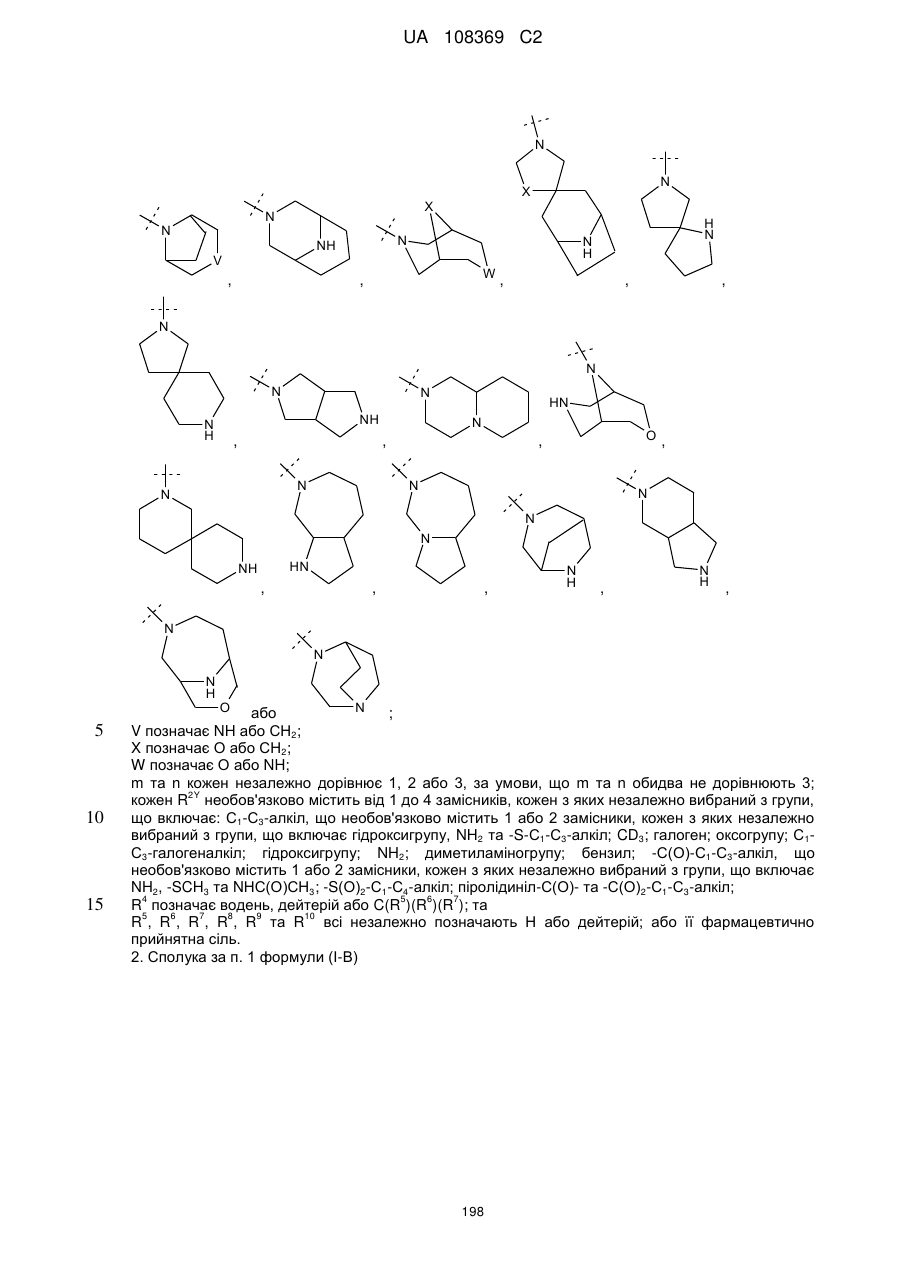
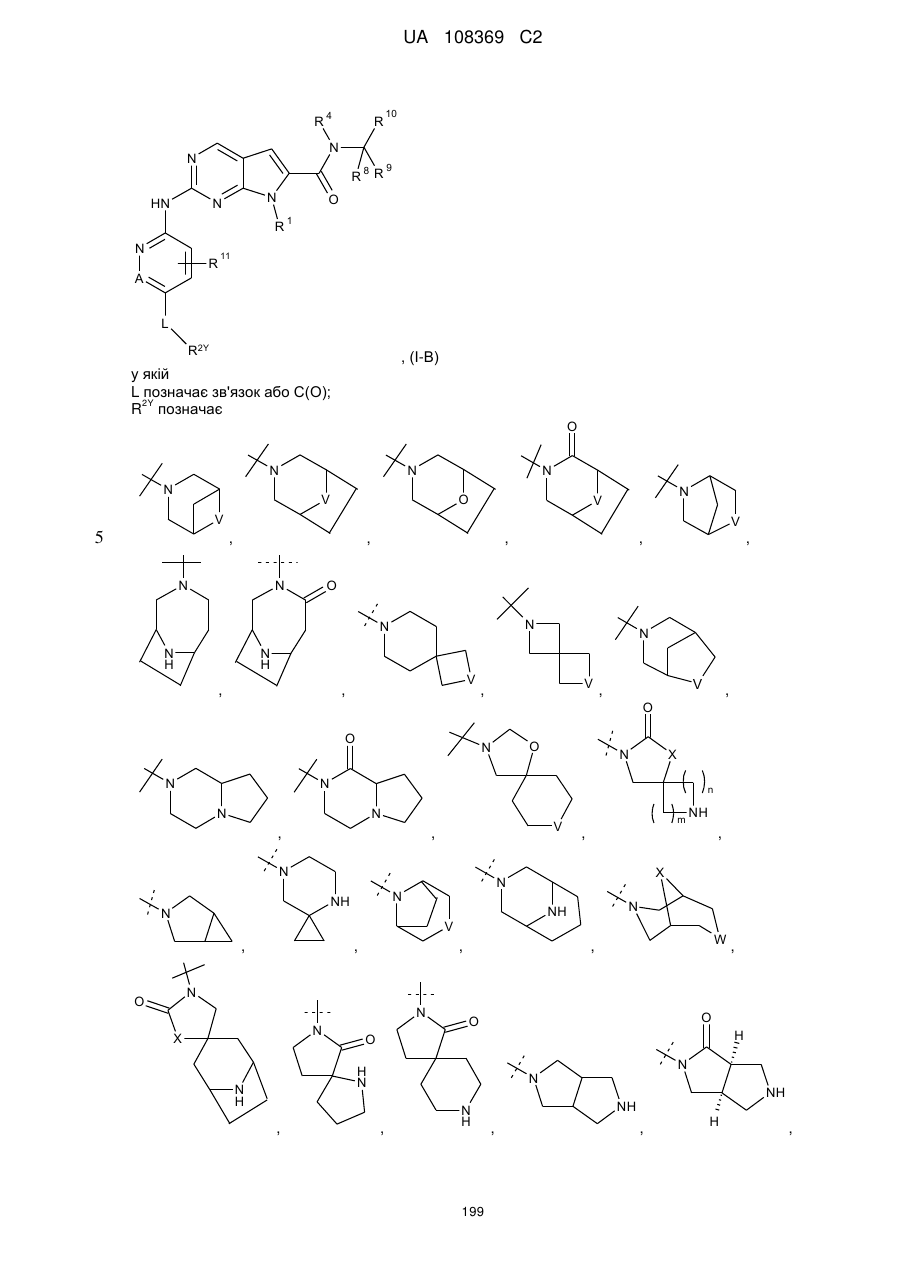
2. Сполука за п. 1 формули (І-В)
 , (І-В)
, (І-В)
у якій
L позначає зв'язок або С(О);
R2Y позначає
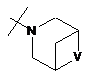 ,
, 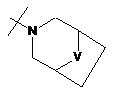 ,
,  ,
, 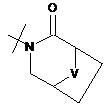 ,
, 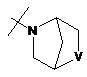 ,
,
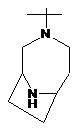 ,
, 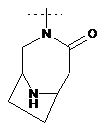 ,
, 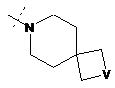 ,
, 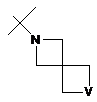 ,
, 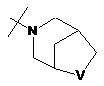 ,
,
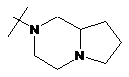 ,
,  ,
,  ,
, 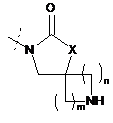 ,
,
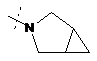 ,
, 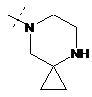 ,
, 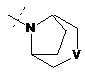 ,
, 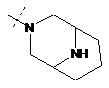 ,
, 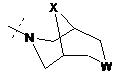 ,
,
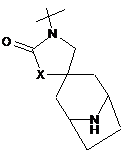 ,
, 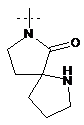 ,
, 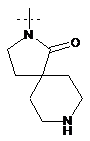 ,
, 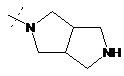 ,
, 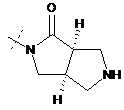 ,
,
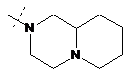 ,
, 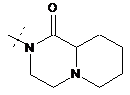 ,
, 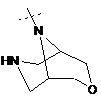 ,
, 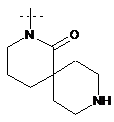 ,
,
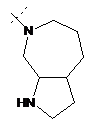 ,
, 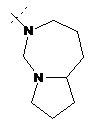 ,
, 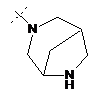 ,
,  ,
,  ,
,
 ,
,  або
або 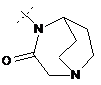 ;
;
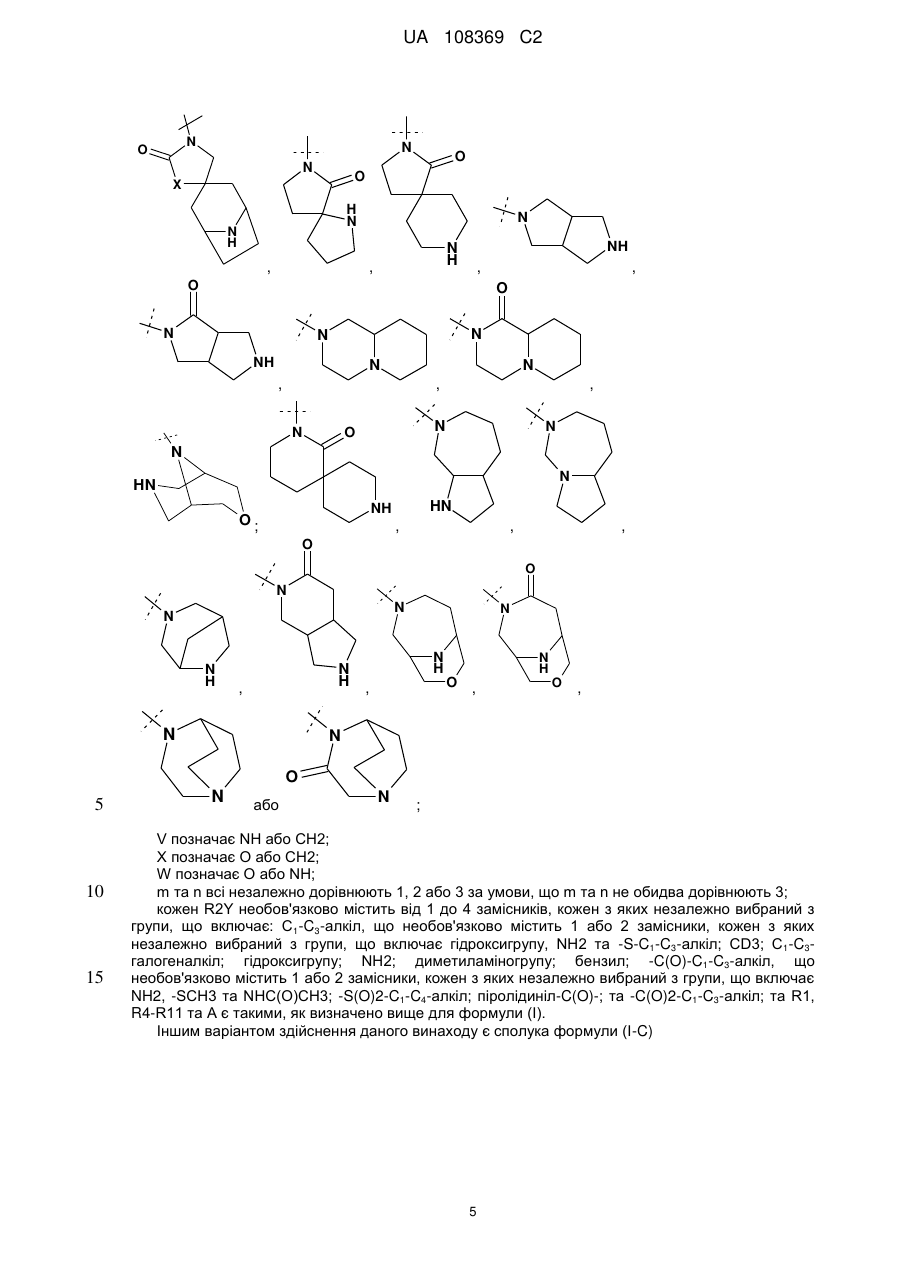
V позначає NH або СН2;
X позначає О або СН2;
W позначає О або NH;
m та n кожен незалежно дорівнює 1, 2 або 3, за умови, що m та n обидва не дорівнюють 3;
та
кожен R2Y необов'язково містить від 1 до 4 замісників, кожен з яких незалежно вибраний з групи, що включає: С1-С3-алкіл, що необов'язково містить 1 або 2 замісники, кожен з яких незалежно вибраний з групи, що включає гідроксигрупу, NH2 та -S-С1-С3-алкіл; CD3; С1-С3-галогеналкіл; гідроксигрупу; NH2; диметиламіногрупу; бензил; -С(О)-С1-С3-алкіл, що необов'язково містить 1 або 2 замісники, кожен з яких незалежно вибраний з групи, що включає NH2, -SCH3 та NHC(O)CH3; -(SО)2-С1-С4-алкіл; піролідиніл-С(О)- та -С(О)2-С1-С3-алкіл; або її фармацевтично прийнятна сіль.
3. Сполука за п. 1 або 2, у якій L позначає С(О); або її фармацевтично прийнятна сіль.
4. Сполука за п. 1 або 2, у якій L позначає зв'язок; або її фармацевтично прийнятна сіль.
5. Сполука за будь-яким з попередніх пунктів, у якій А позначає СН та R11 позначає водень; або її фармацевтично прийнятна сіль.
6. Сполука за будь-яким з попередніх пунктів, у якій R4 позначає C(R5)(R6)(R7) та R5, R6, R7, R8, R9 та R10 позначають водень; або її фармацевтично прийнятна сіль.
7. Сполука за будь-яким з попередніх пунктів, у якій R1 позначає С4-С7-циклоалкіл, необов'язково заміщений одним С1-С6-алкілом; або її фармацевтично прийнятна сіль.
8. Сполука за будь-яким з попередніх пунктів, у якій R1 позначає циклобутил, циклопентил, циклогексил або циклогептил; або її фармацевтично прийнятна сіль.
9. Сполука за будь-яким з попередніх пунктів, у якій R1 позначає незаміщений циклопентил; або її фармацевтично прийнятна сіль.
10. Сполука за будь-яким з попередніх пунктів, у якій R2Y є незаміщеним; або її фармацевтично прийнятна сіль.
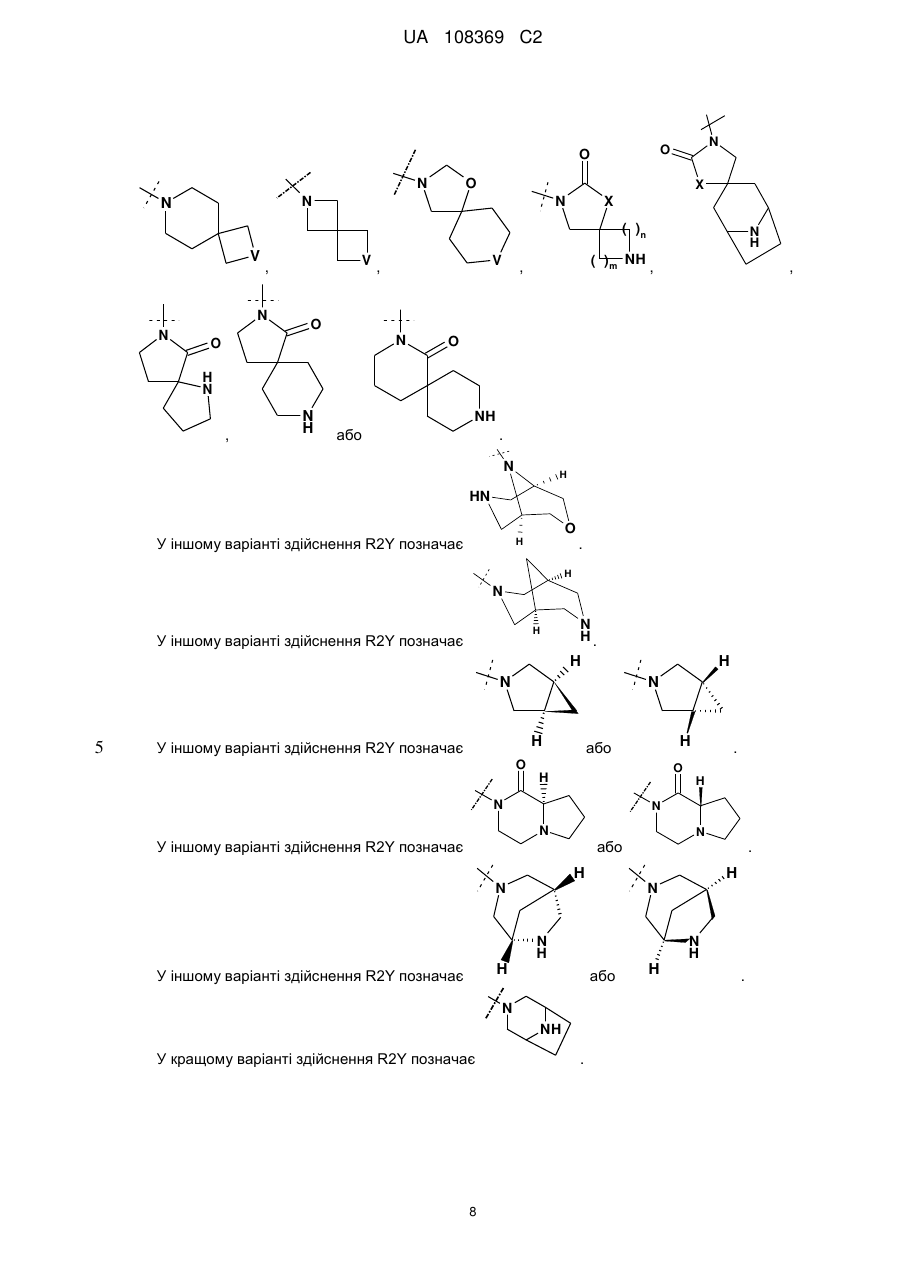
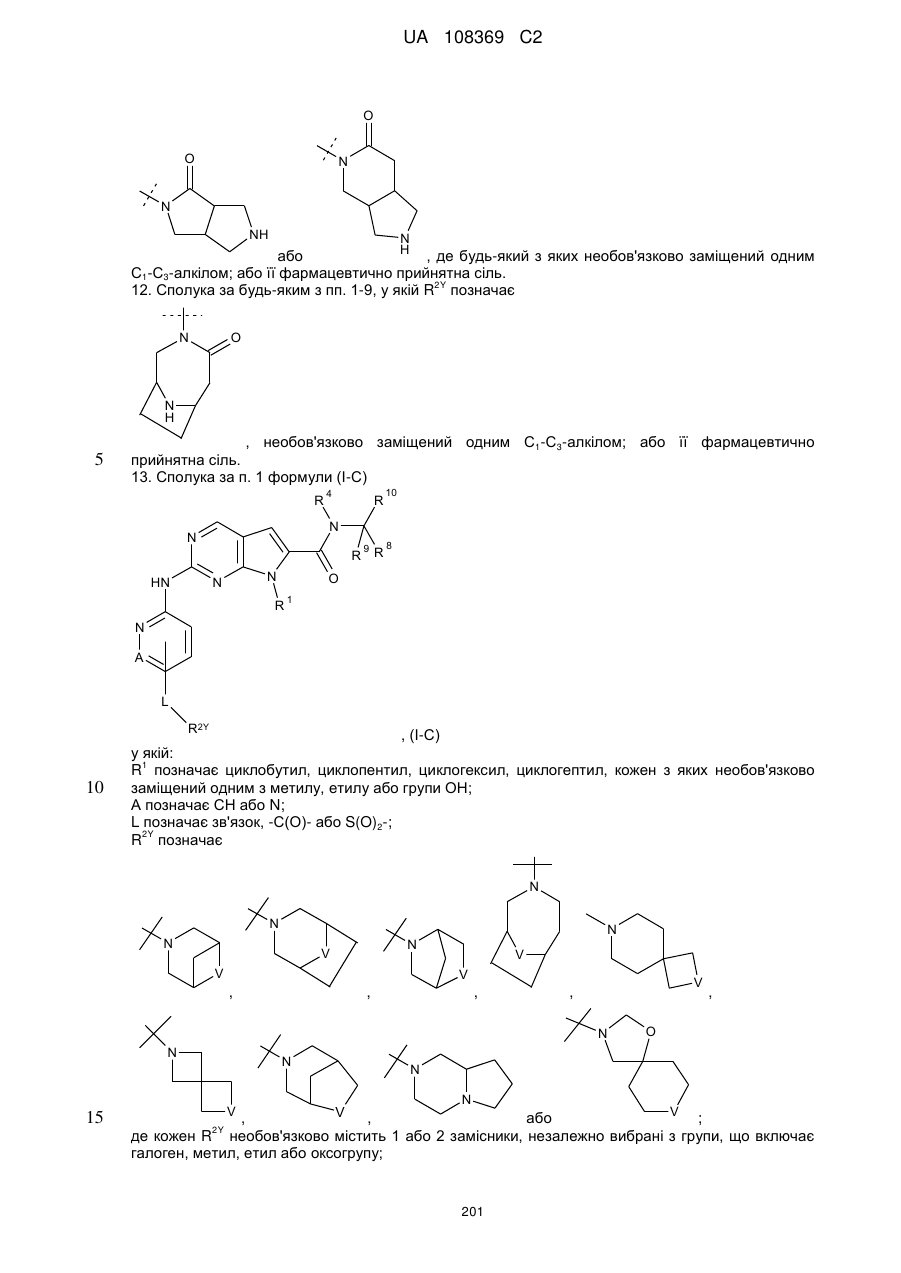
11. Сполука за будь-яким з пп. 1-9, у якій R2Y позначає
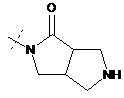 або
або  , де будь-який з яких необов'язково заміщений одним С1-С3-алкілом; або її фармацевтично прийнятна сіль.
, де будь-який з яких необов'язково заміщений одним С1-С3-алкілом; або її фармацевтично прийнятна сіль.
12. Сполука за будь-яким з пп. 1-9, у якій R2Y позначає
 , необов'язково заміщений одним С1-С3-алкілом; або її фармацевтично прийнятна сіль.
, необов'язково заміщений одним С1-С3-алкілом; або її фармацевтично прийнятна сіль.
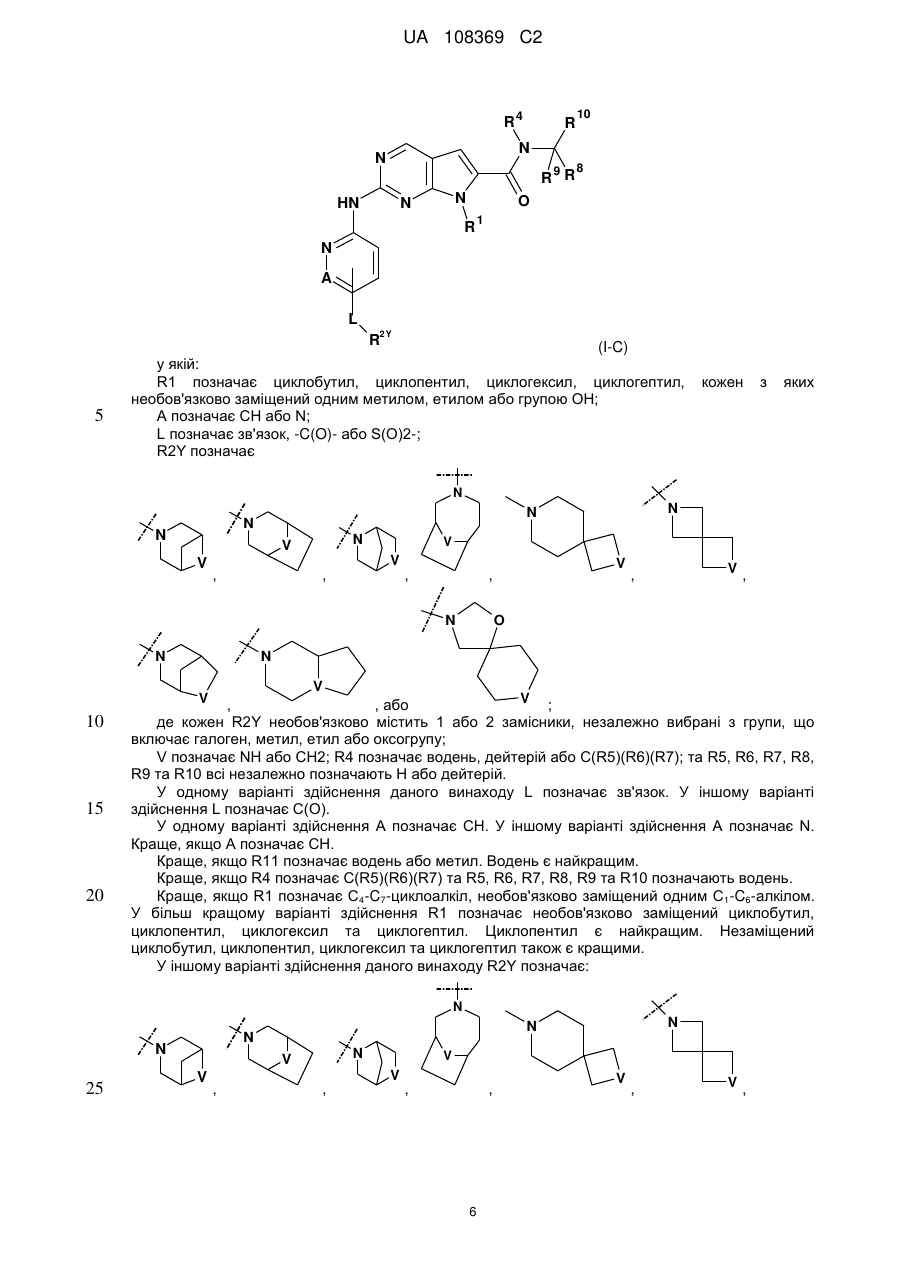
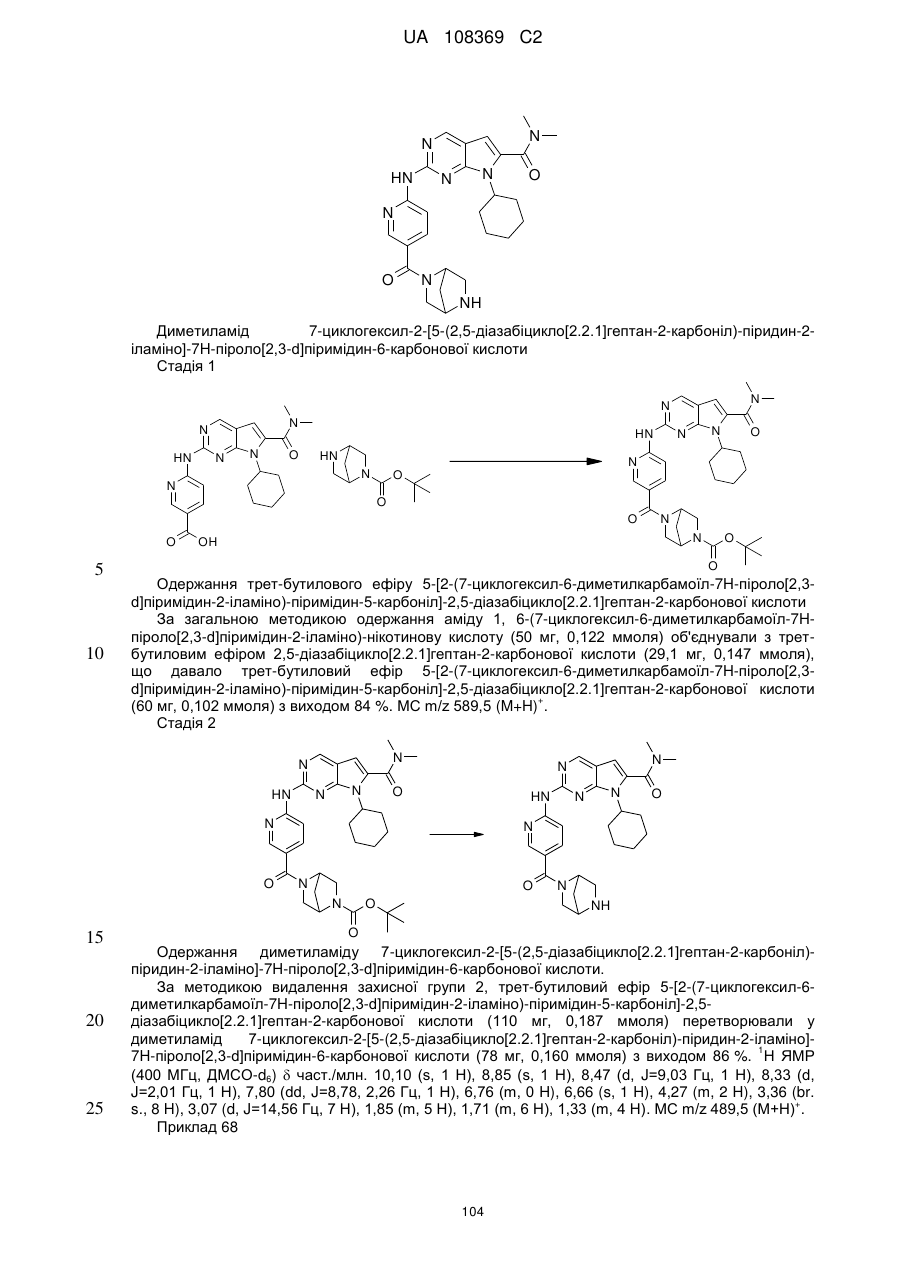
13. Сполука за п. 1 формули (І-С)
 , (І-С)
, (І-С)
у якій:
R1 позначає циклобутил, циклопентил, циклогексил, циклогептил, кожен з яких необов'язково заміщений одним з метилу, етилу або групи ОН;
А позначає СН або N;
L позначає зв'язок, -С(О)- або S(O)2-;
R2Y позначає
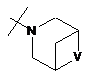 ,
, 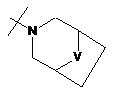 ,
, 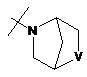 ,
, 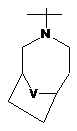 ,
, 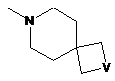 ,
,
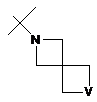 ,
, 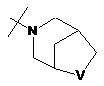 ,
, 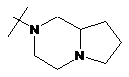 або
або  ;
;
де кожен R2Y необов'язково містить 1 або 2 замісники, незалежно вибрані з групи, що включає галоген, метил, етил або оксогрупу;
V позначає NH або СН2;
R4 позначає водень, дейтерій або C(R5)(R6)(R7); та
R5, R6, R7, R8, R9 та R10 всі незалежно позначають Н або дейтерій; або її фармацевтично прийнятна сіль.
14. Сполука за п. 13, у якій А позначає СН; або її фармацевтично прийнятна сіль.
15. Сполука за п. 14, у якій L позначає зв'язок; або її фармацевтично прийнятна сіль.
16. Сполука за п. 14, у якій L позначає -С(О)-; або її фармацевтично прийнятна сіль.
17. Сполука за п. 15 або 16, у якій R4 позначає СН3 та R8, R9 та R10 позначають Н; або її фармацевтично прийнятна сіль.
18. Сполука за п. 17, у якій R1 позначає циклопентил; або її фармацевтично прийнятна сіль.
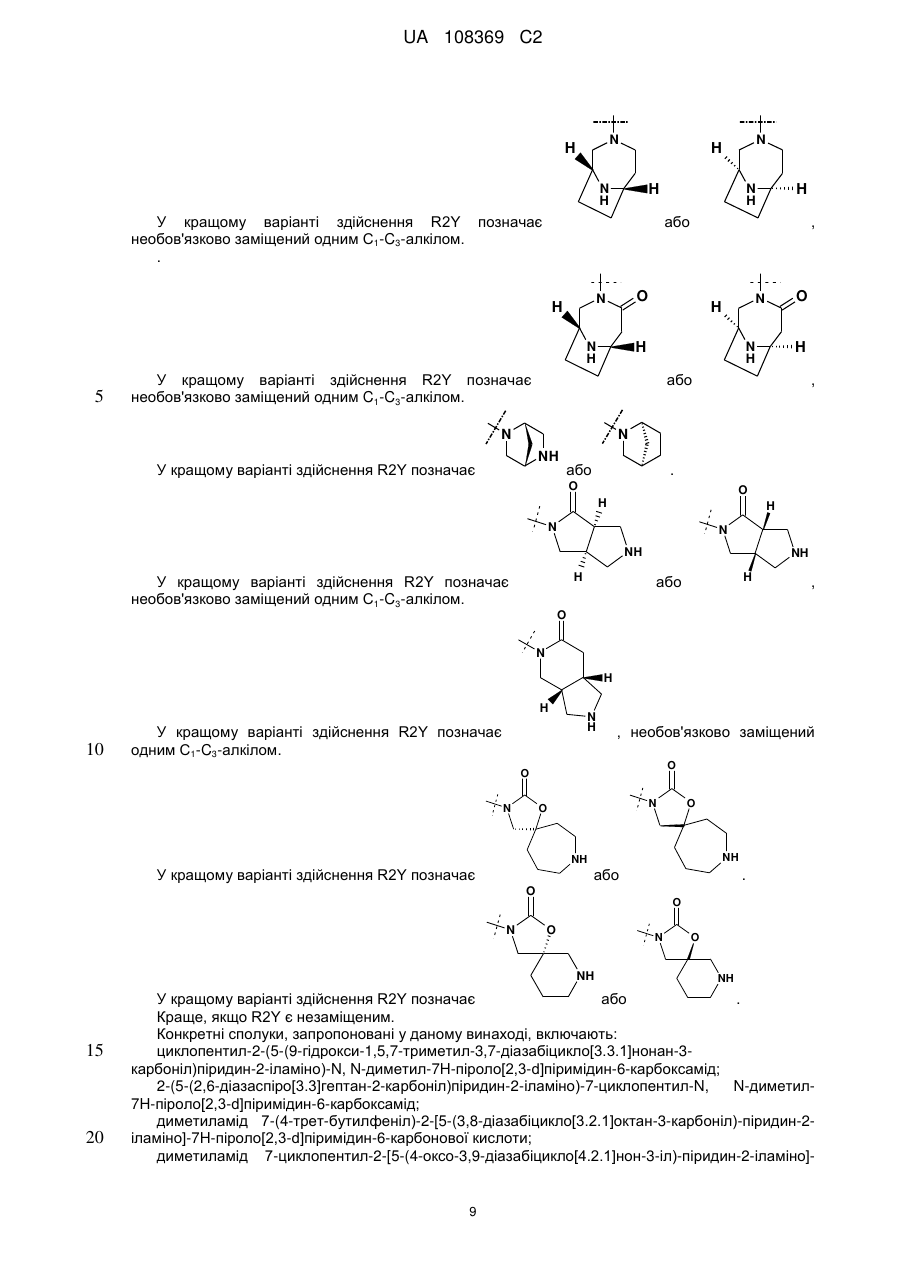
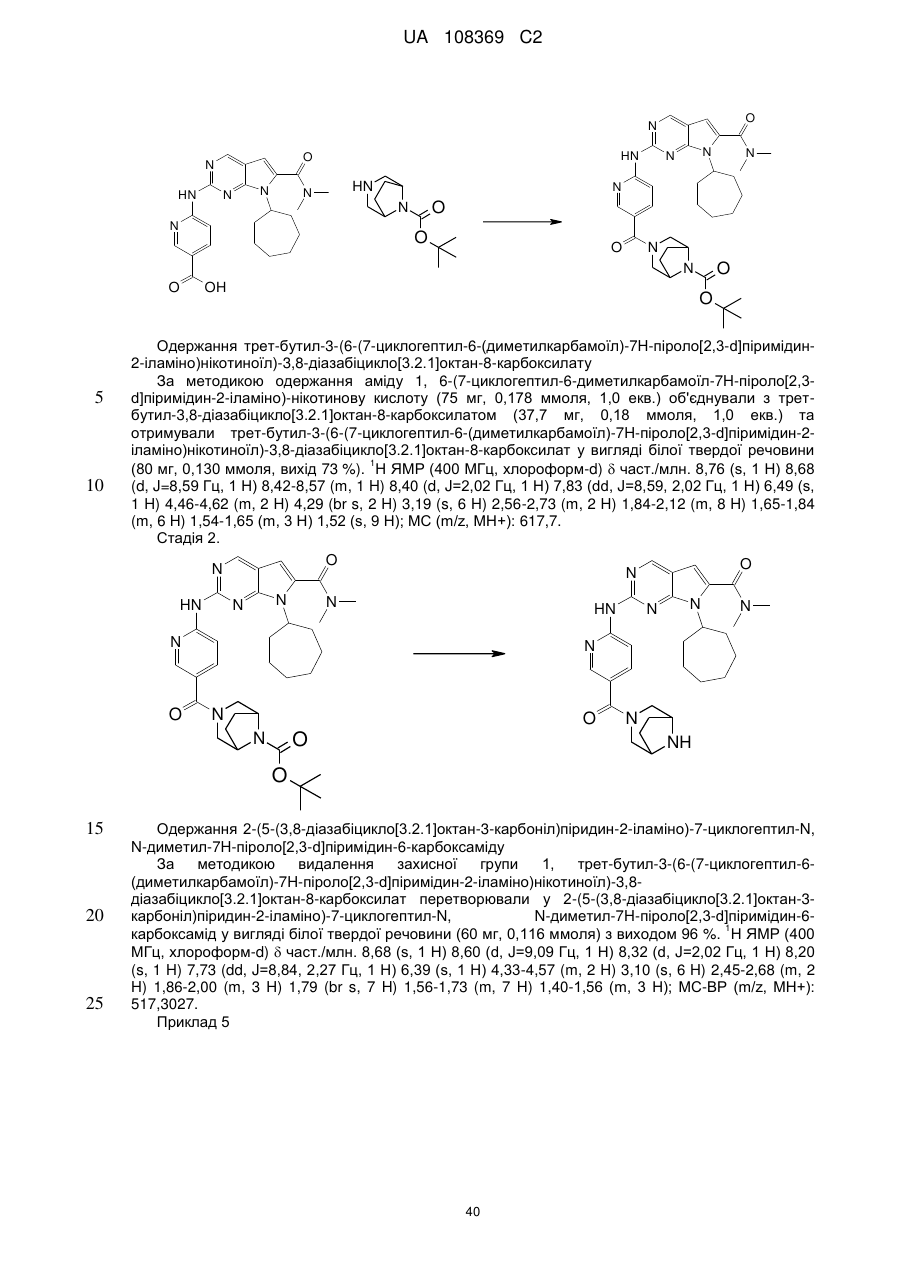
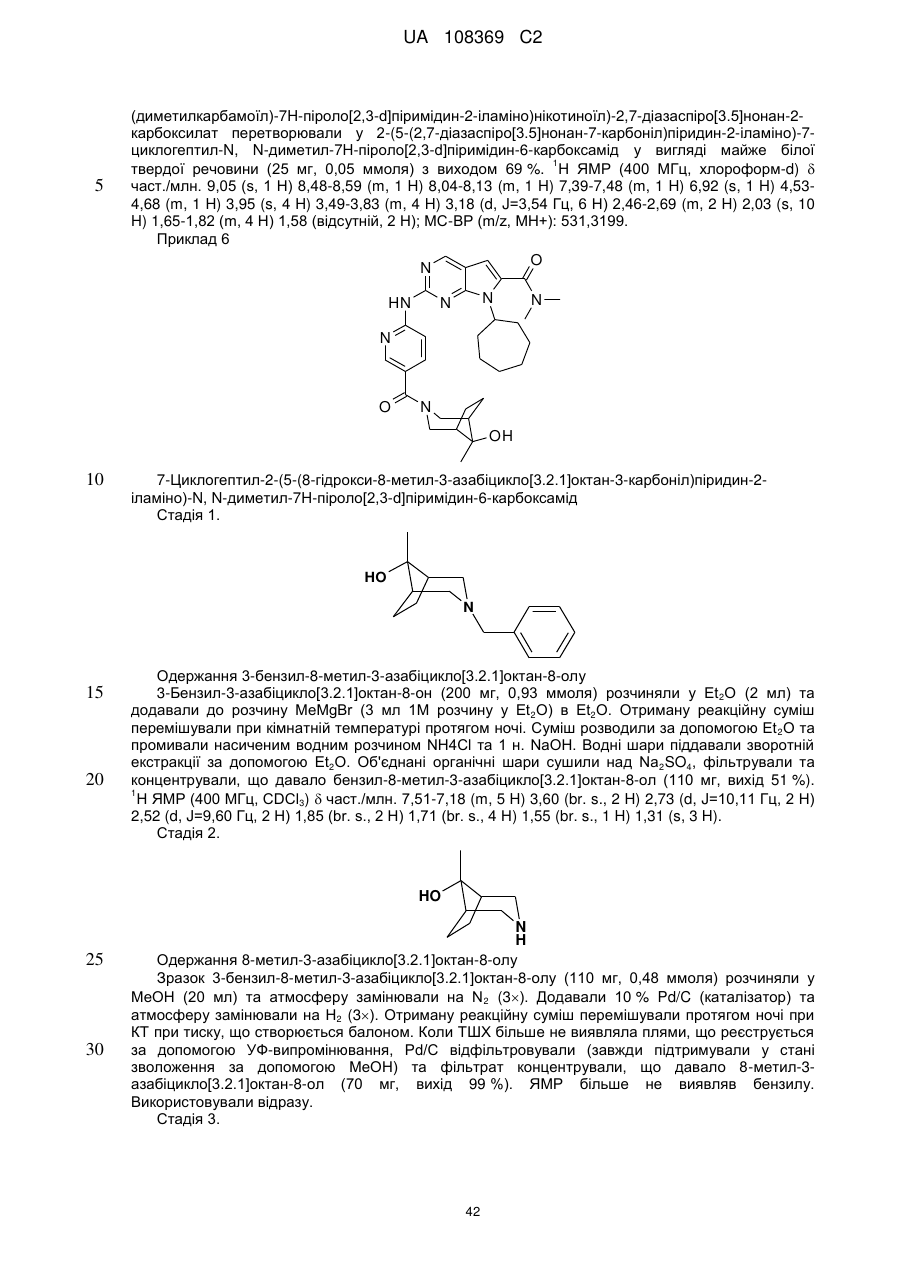
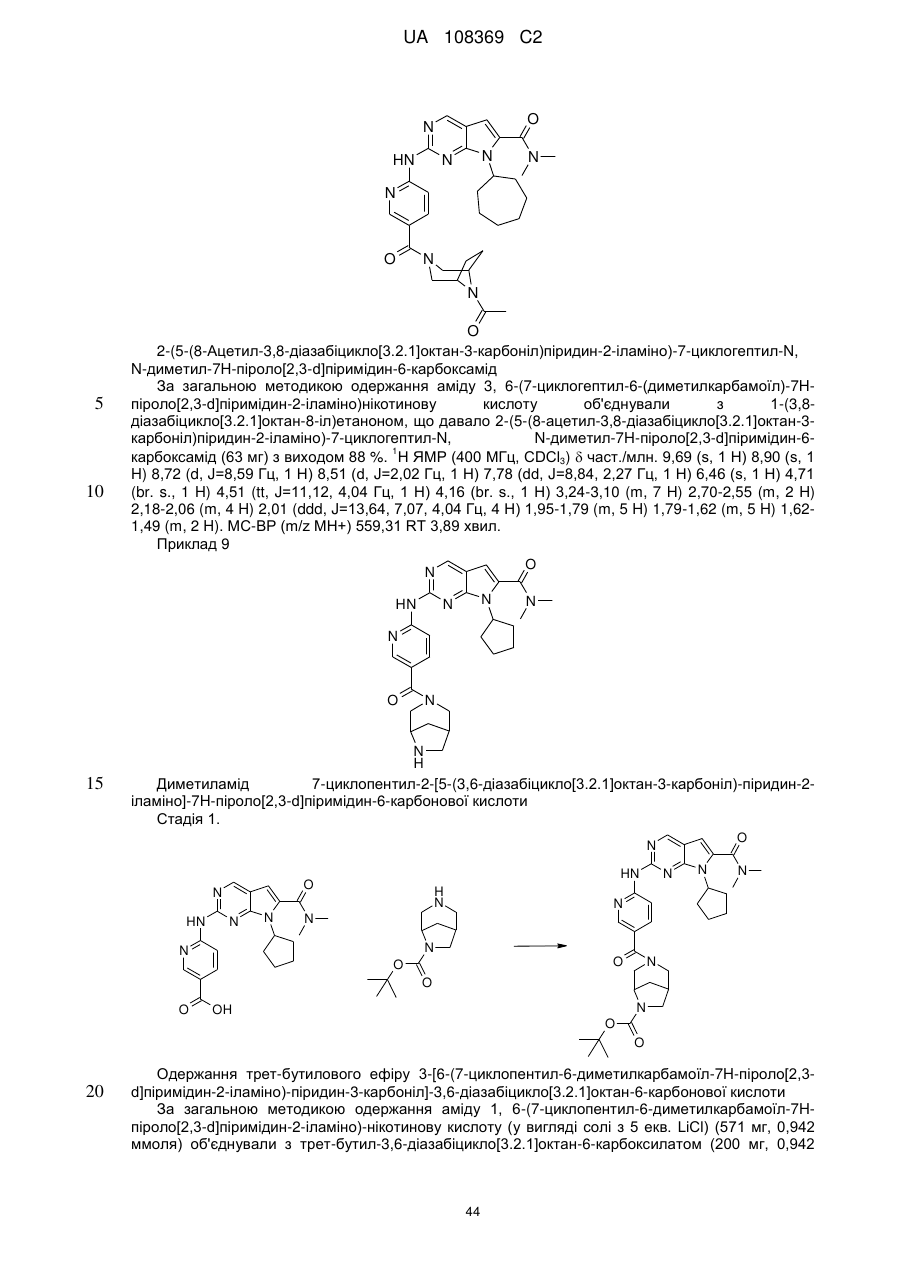
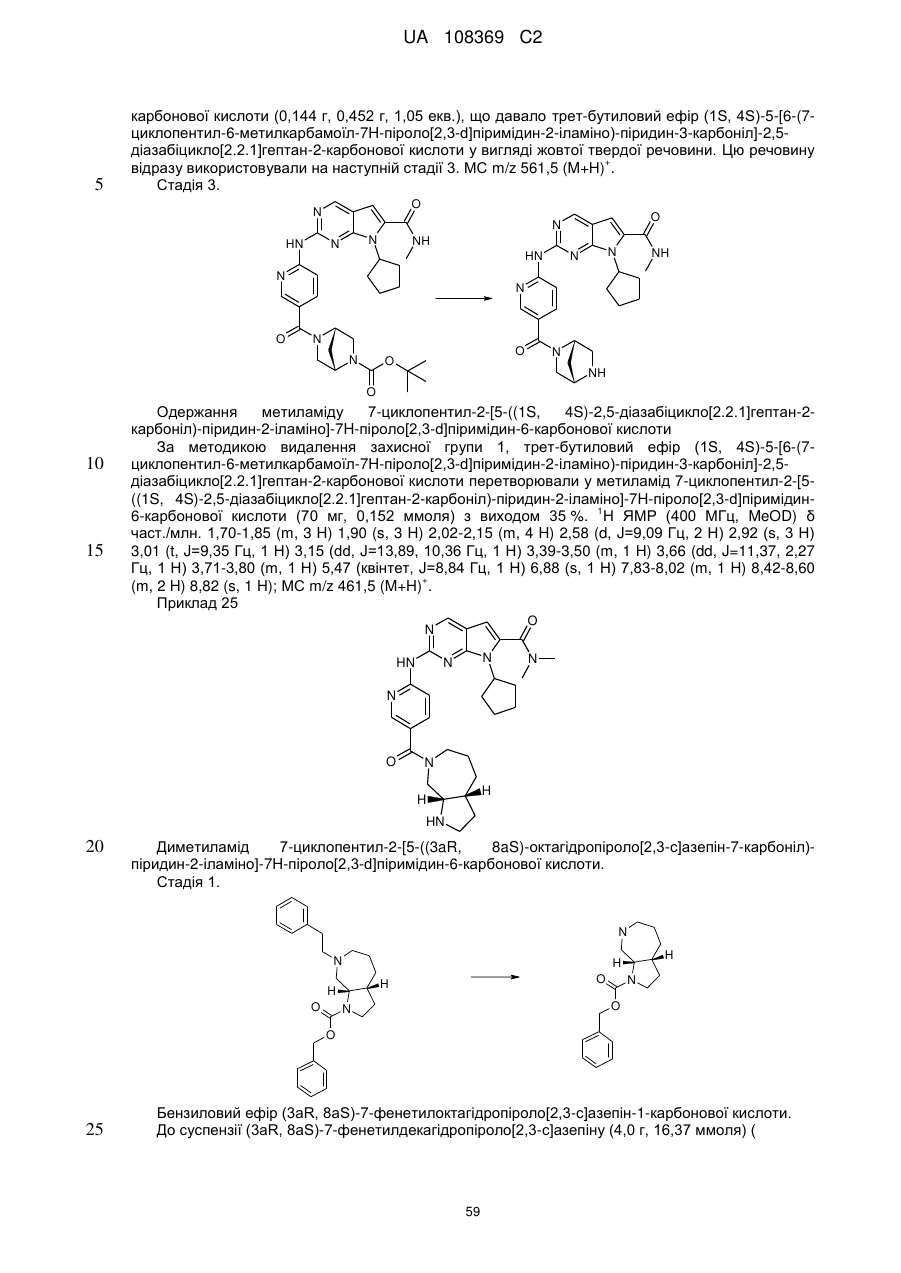
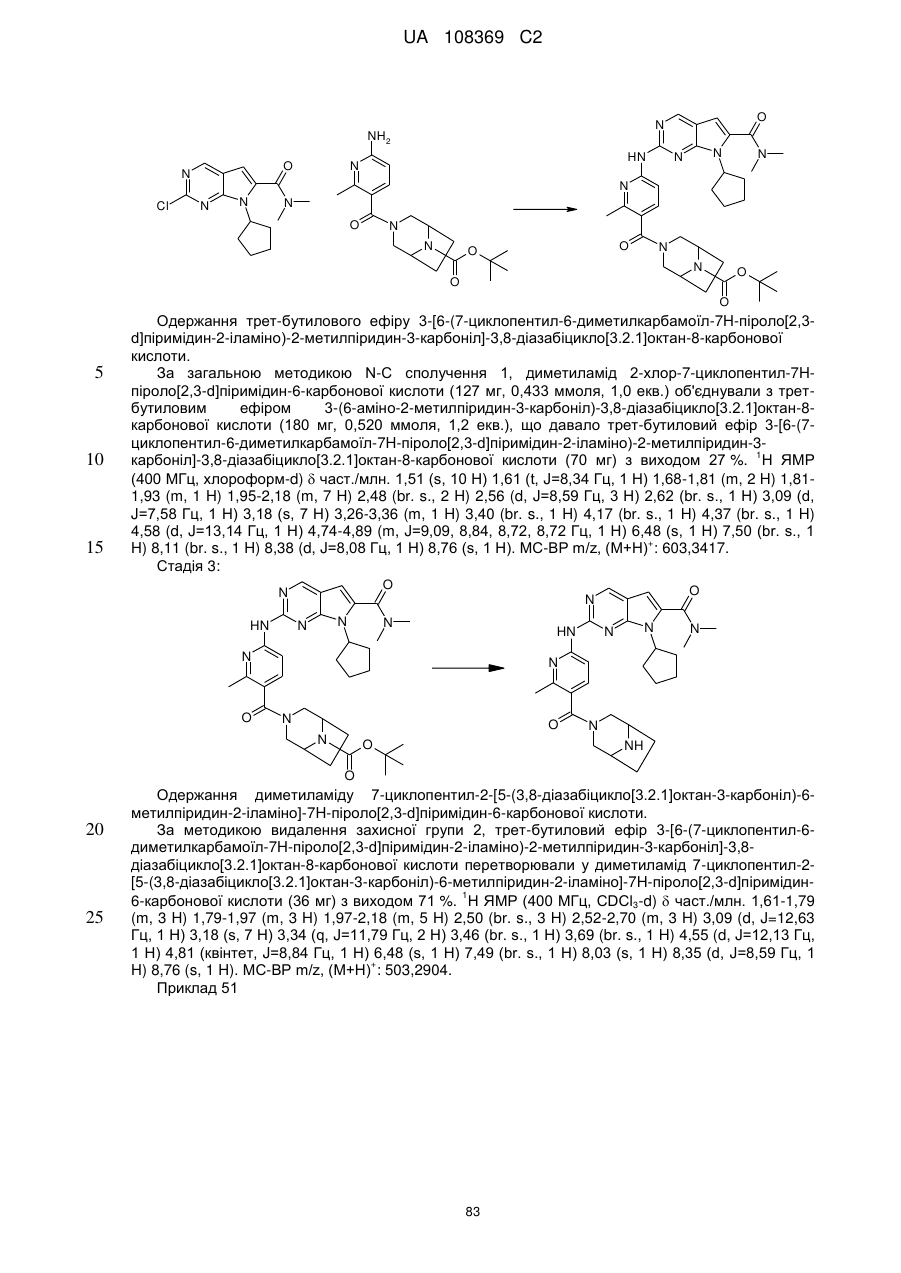
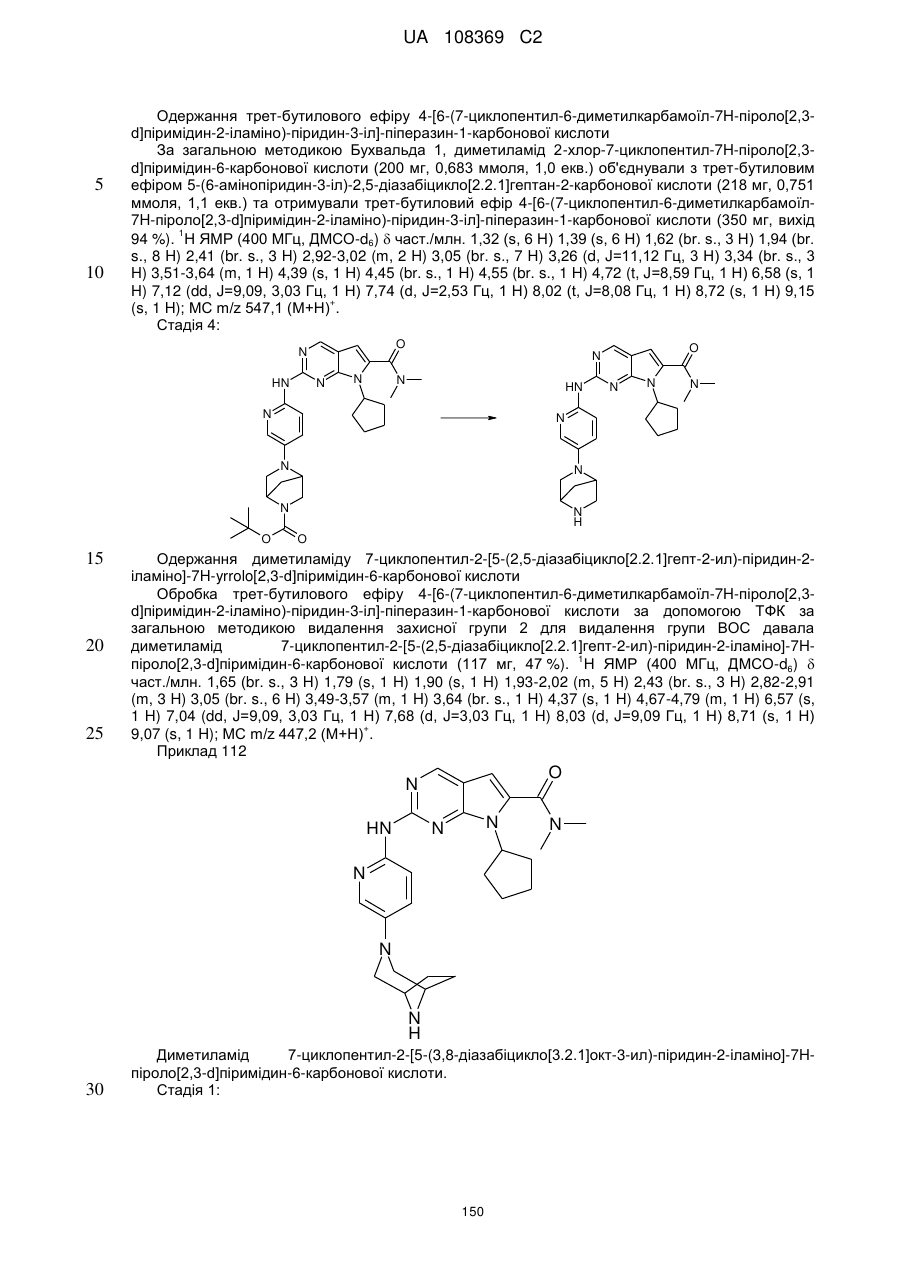
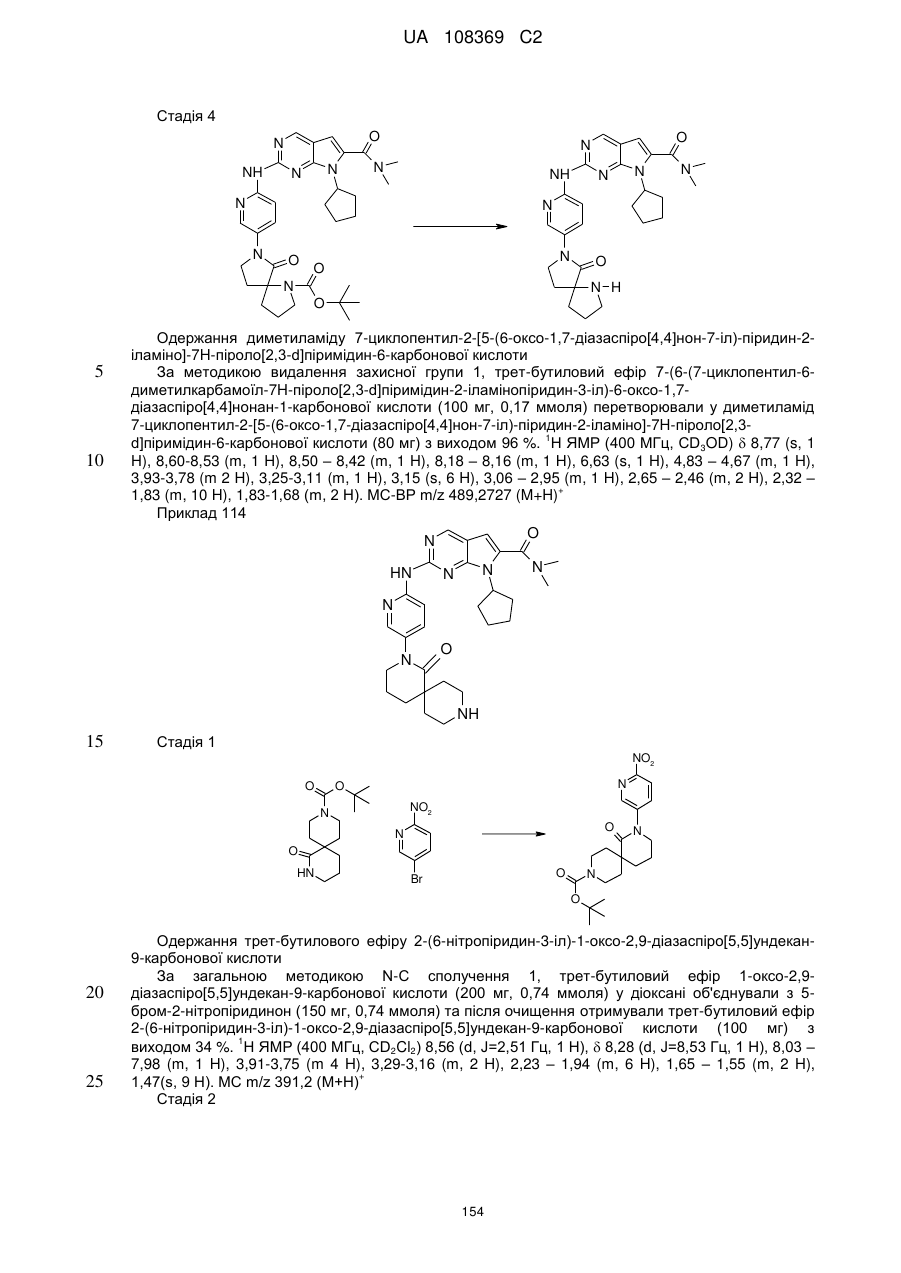
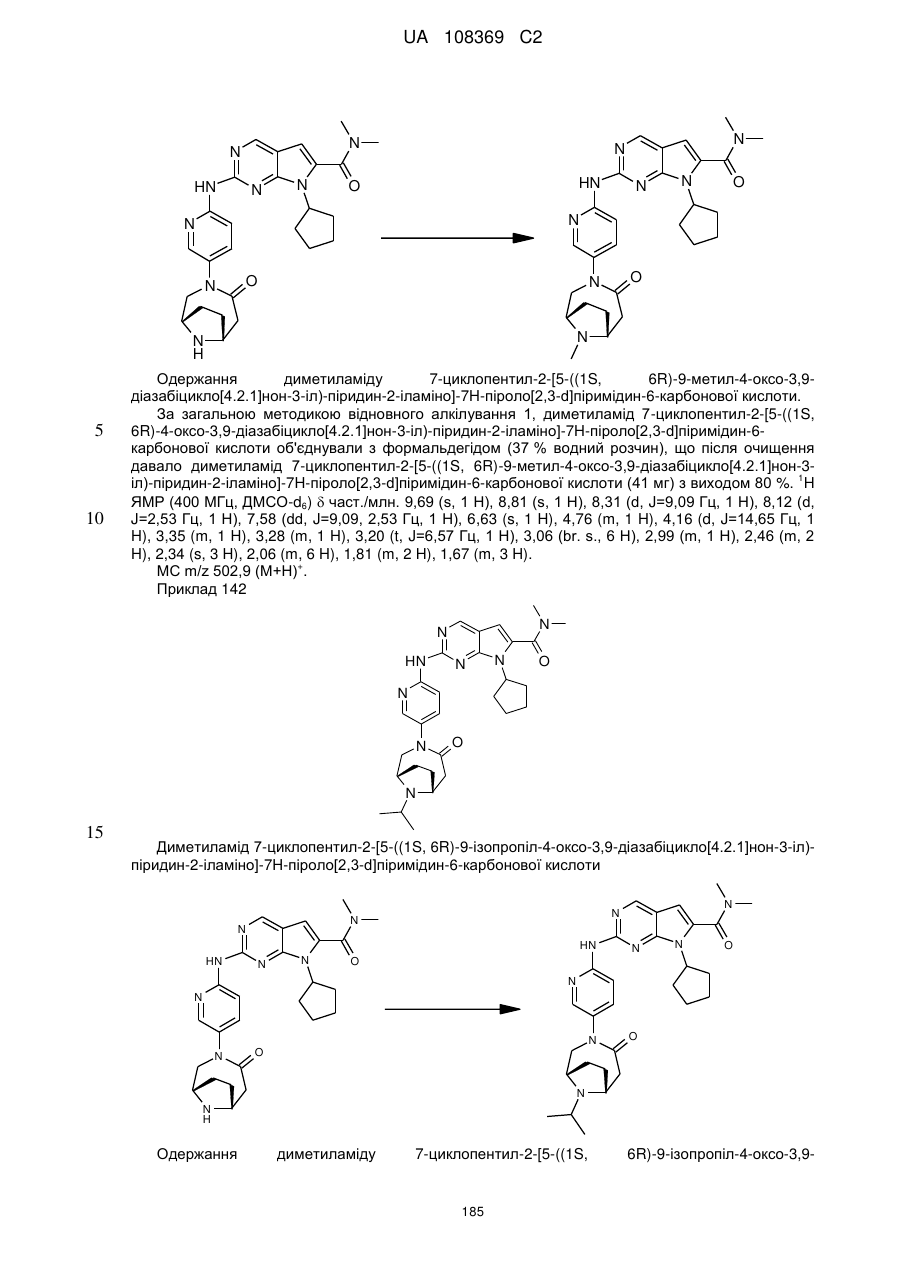
19. Сполука за п. 13, вибрана з групи, що включає:
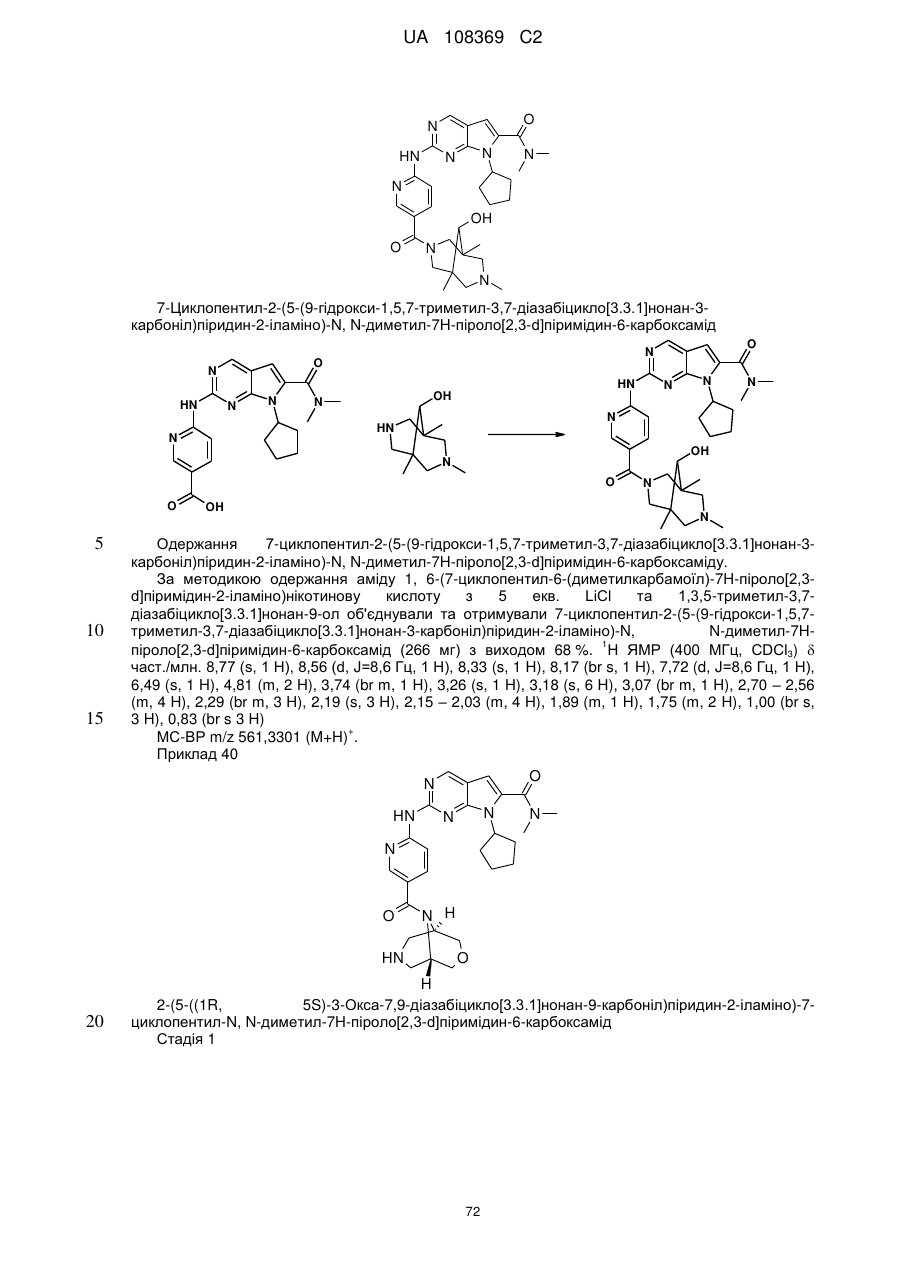
циклопентил-2-(5-(9-гідрокси-1,5,7-триметил-3,7-діазабіцикло[3.3.1]нонан-3-карбоніл)піридин-2-іламіно)-N,N-диметил-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
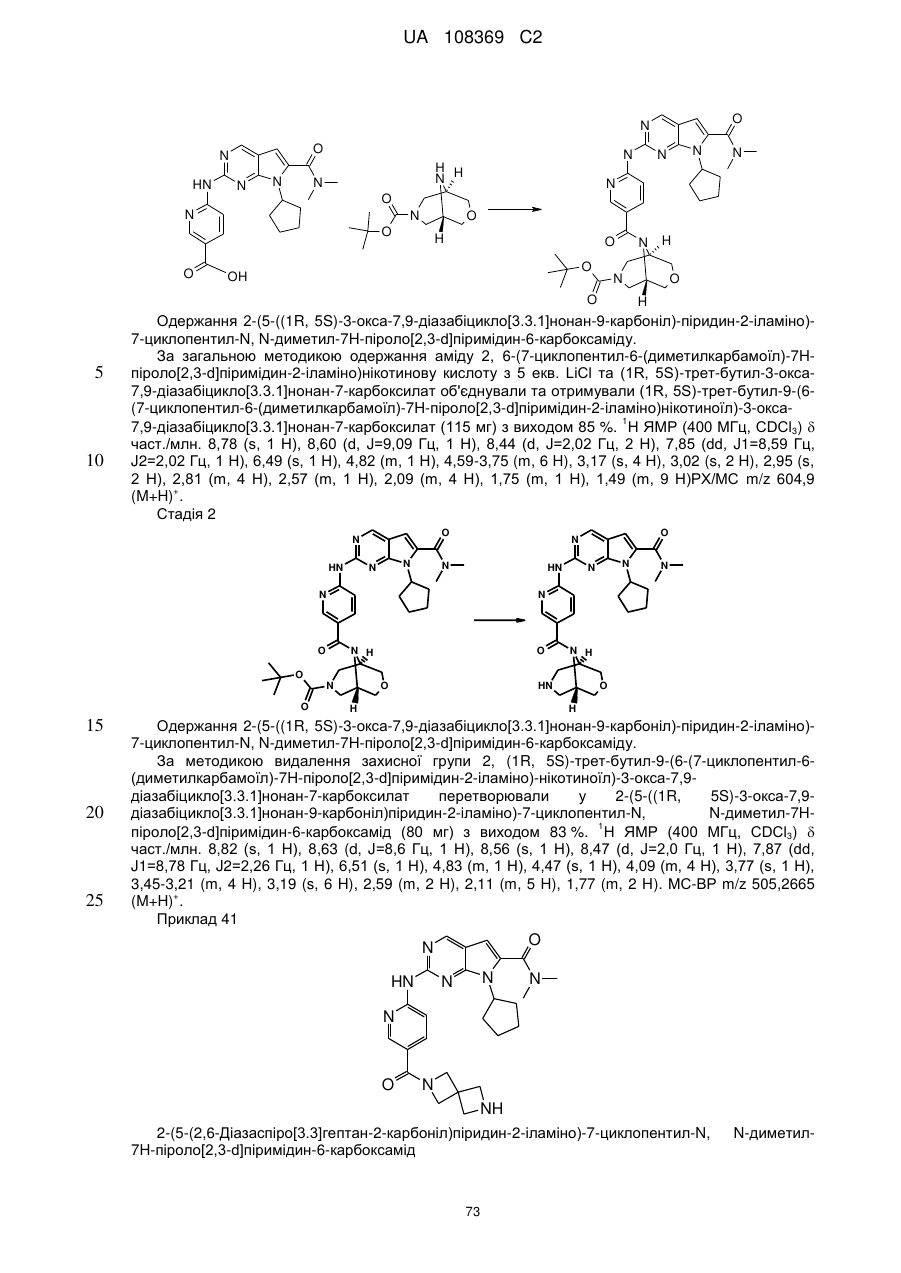
2-(5-(2,6-діазаспіро[3.3]гептан-2-карбоніл)піридин-2-іламіно)-7-циклопентил-N,N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксамід;
диметиламід 7-(4-трет-бутилфеніл)-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
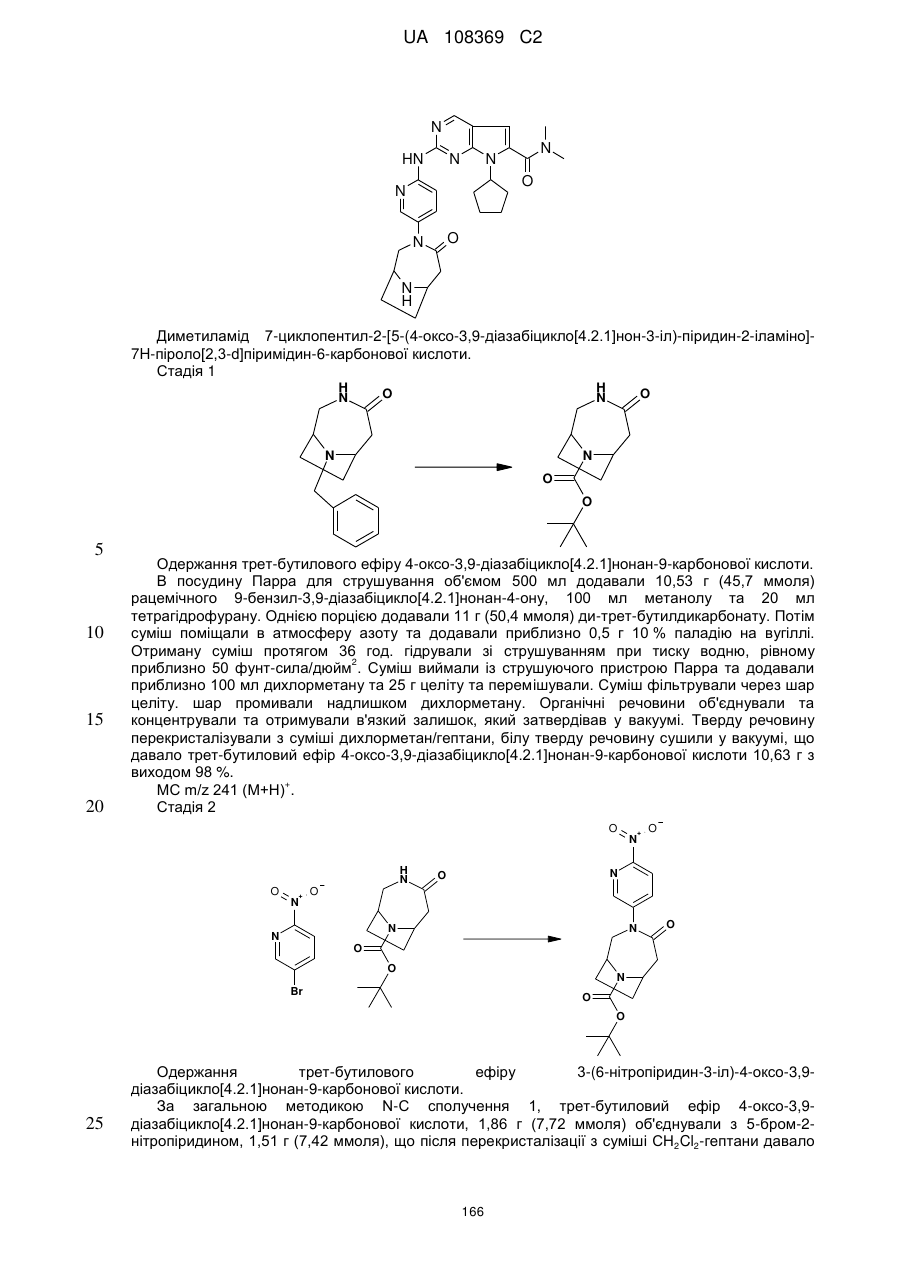
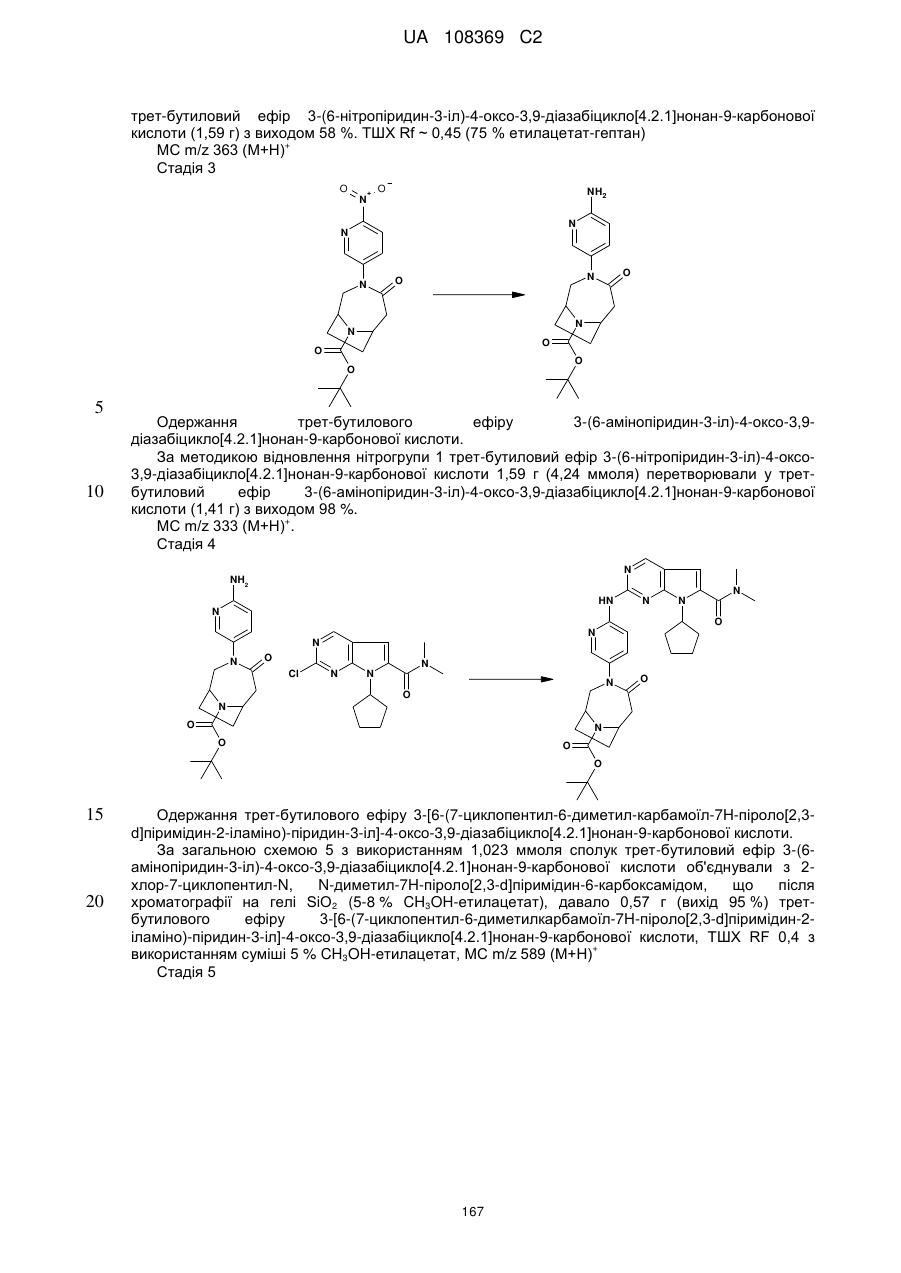
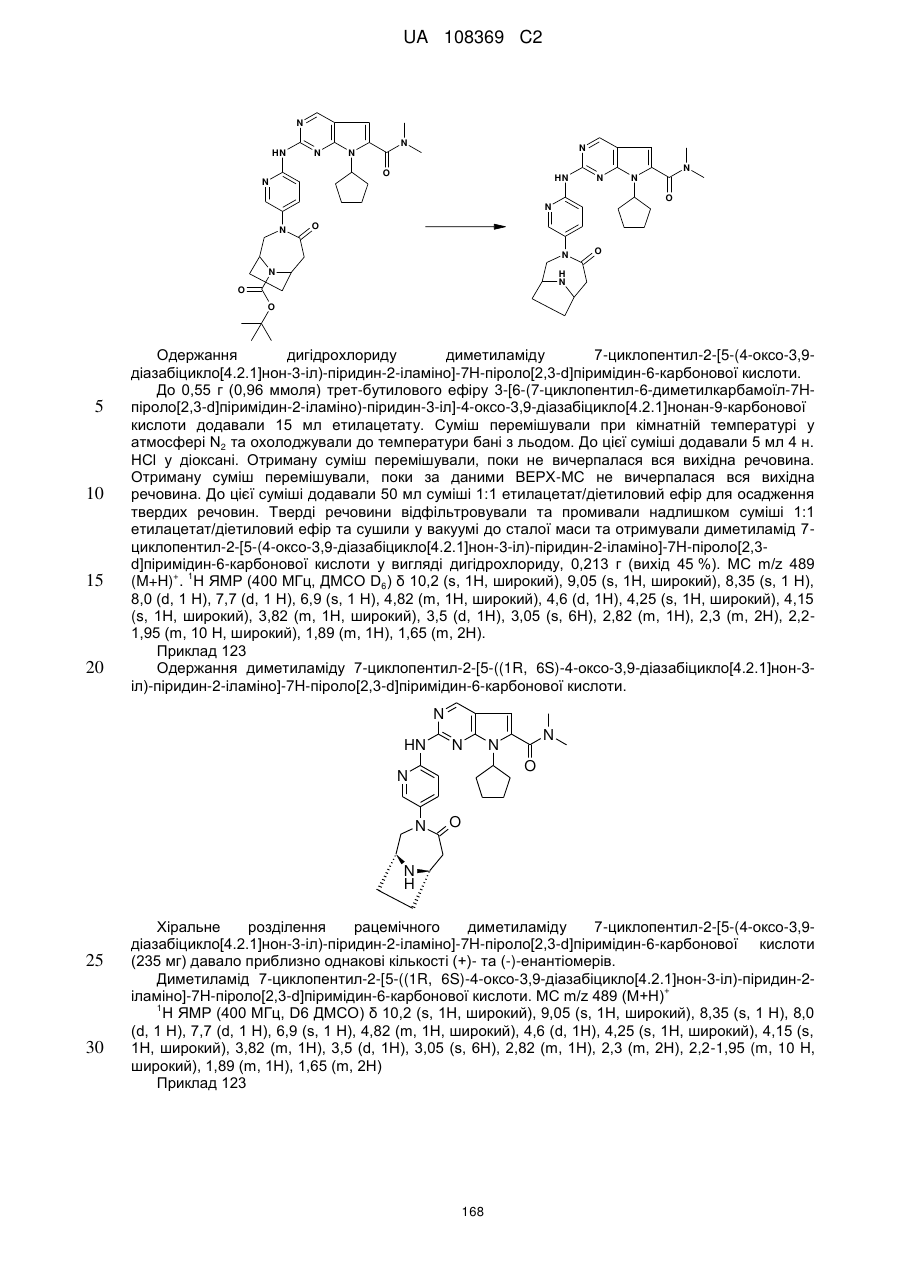
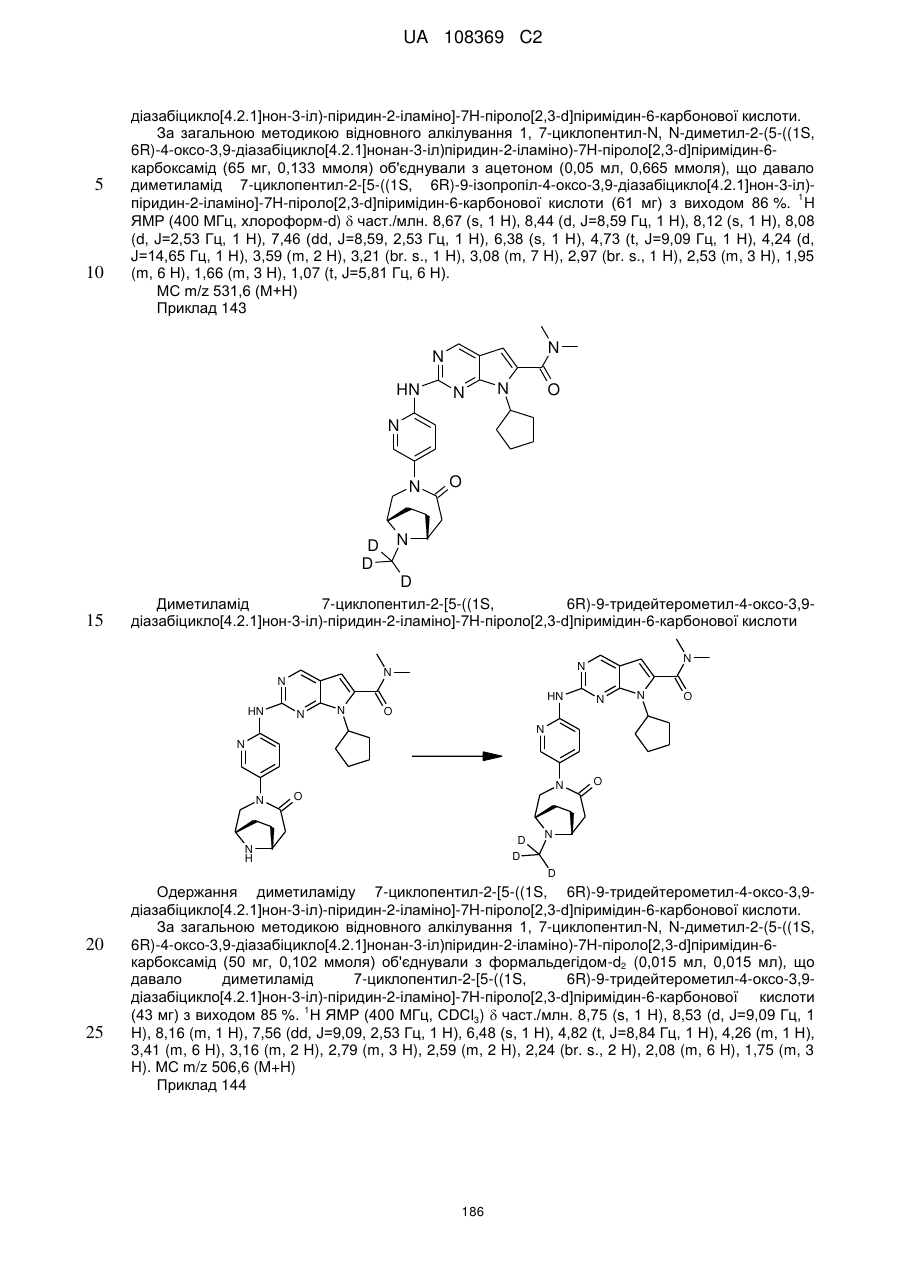
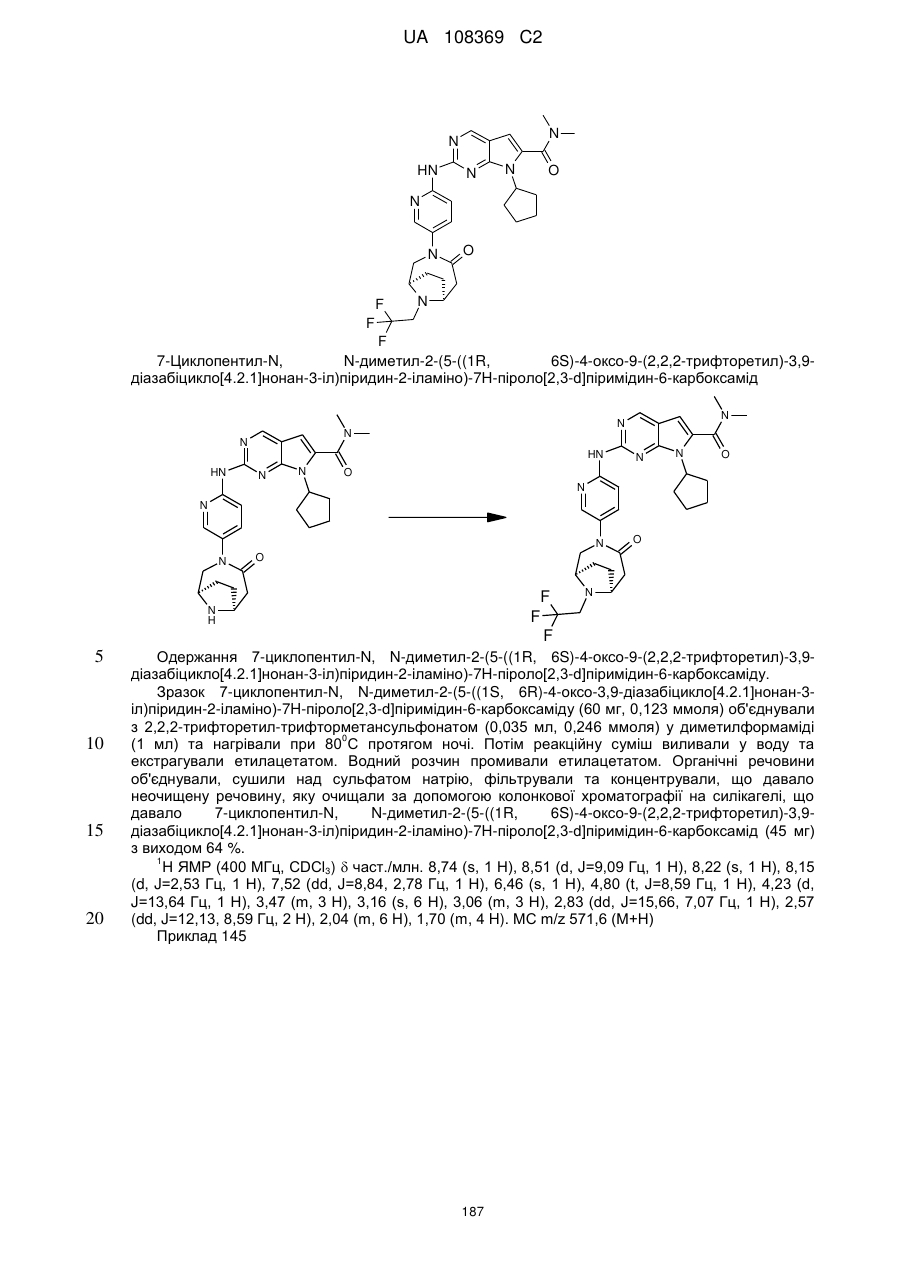
диметиламід 7-циклопентил-2-[5-(4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
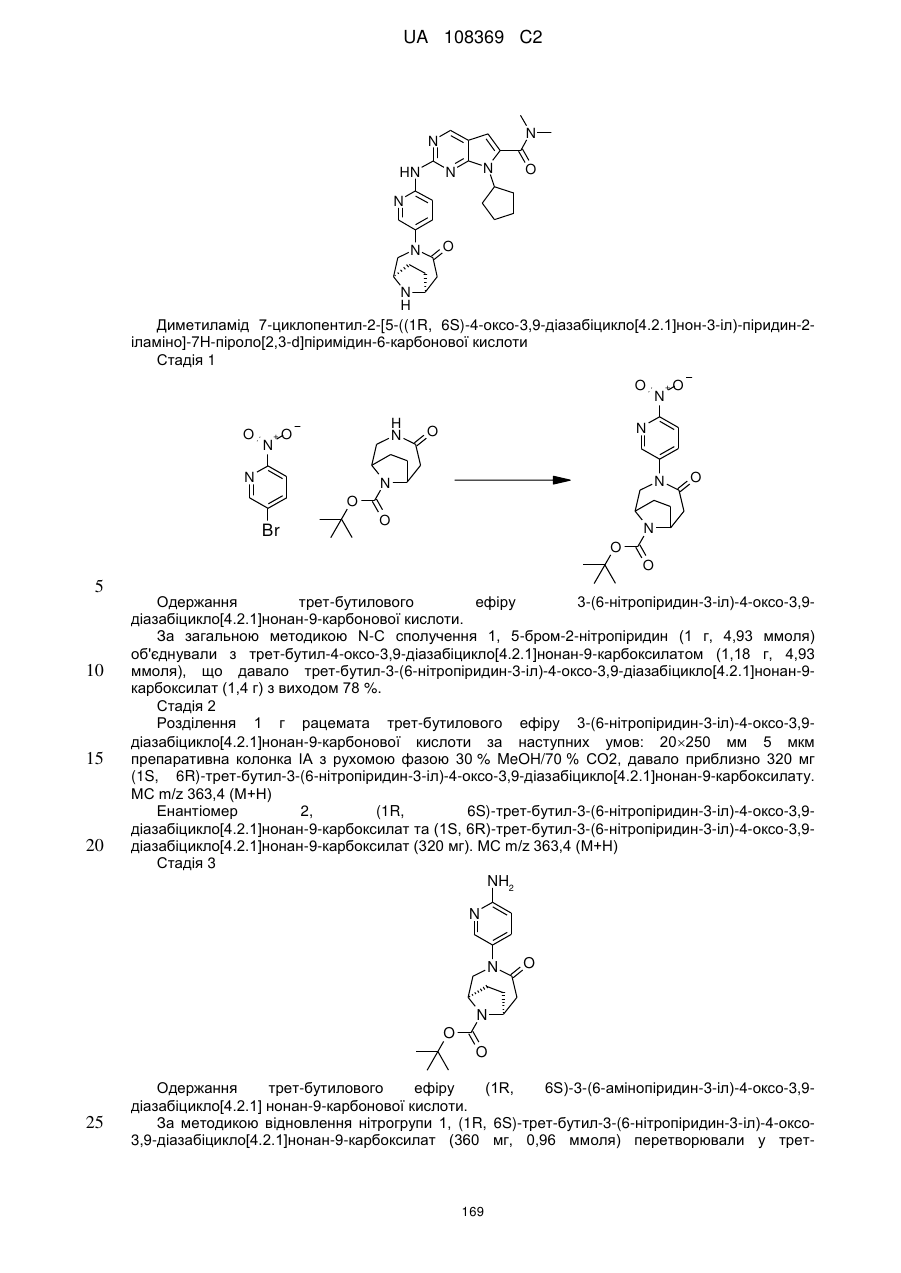
диметиламід 7-циклопентил-2-[5-((1R,6S)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
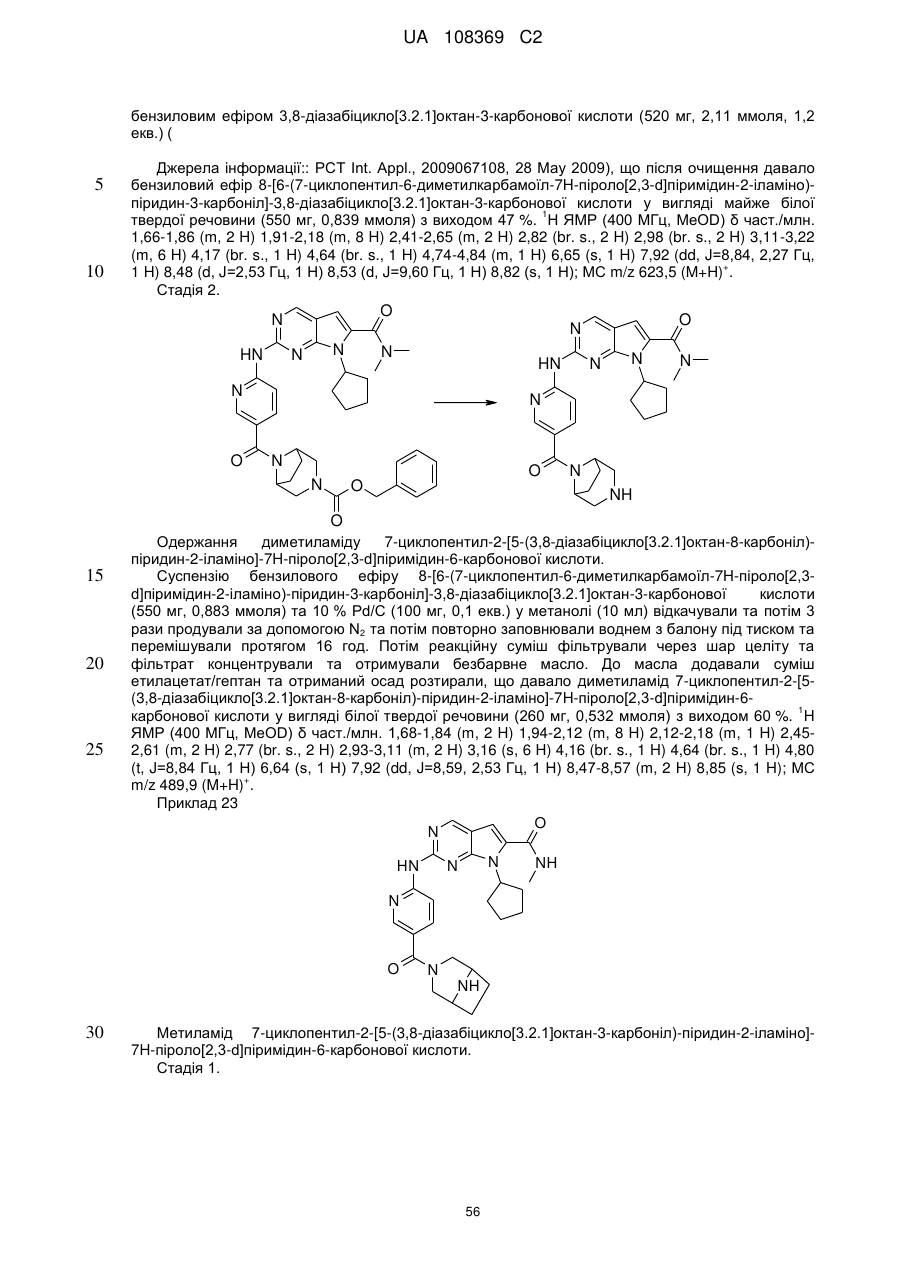
диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклогептил-2-[5-(2,5-діазабіцикло[2.2.1]гептан-2-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-8-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
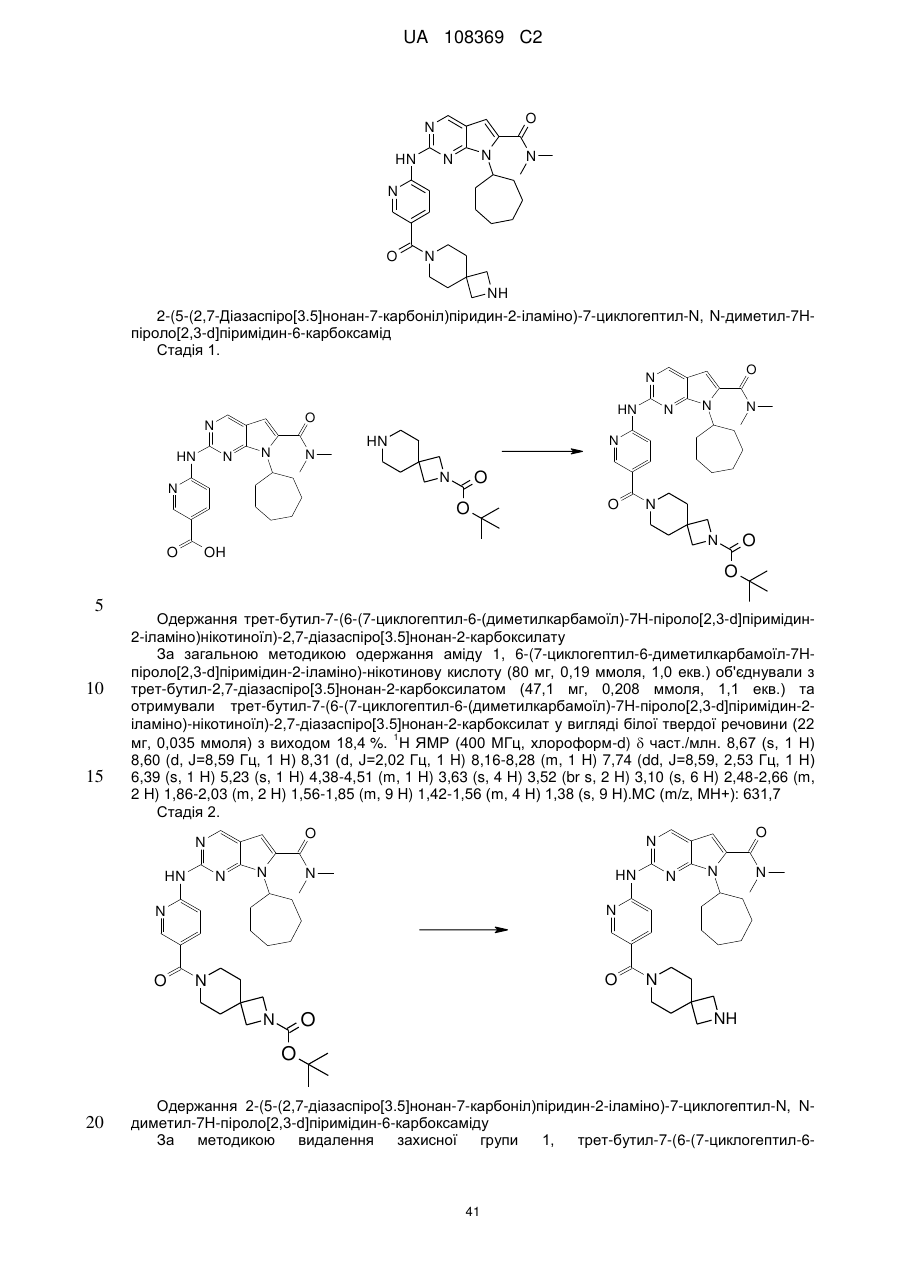
2-(5-(2,7-діазаспіро[3.5]нонан-7-карбоніл)піридин-2-іламіно)-7-циклогептил-N,N-диметил-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
диметиламід 7-циклопентил-2-[5-(8-метил-3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
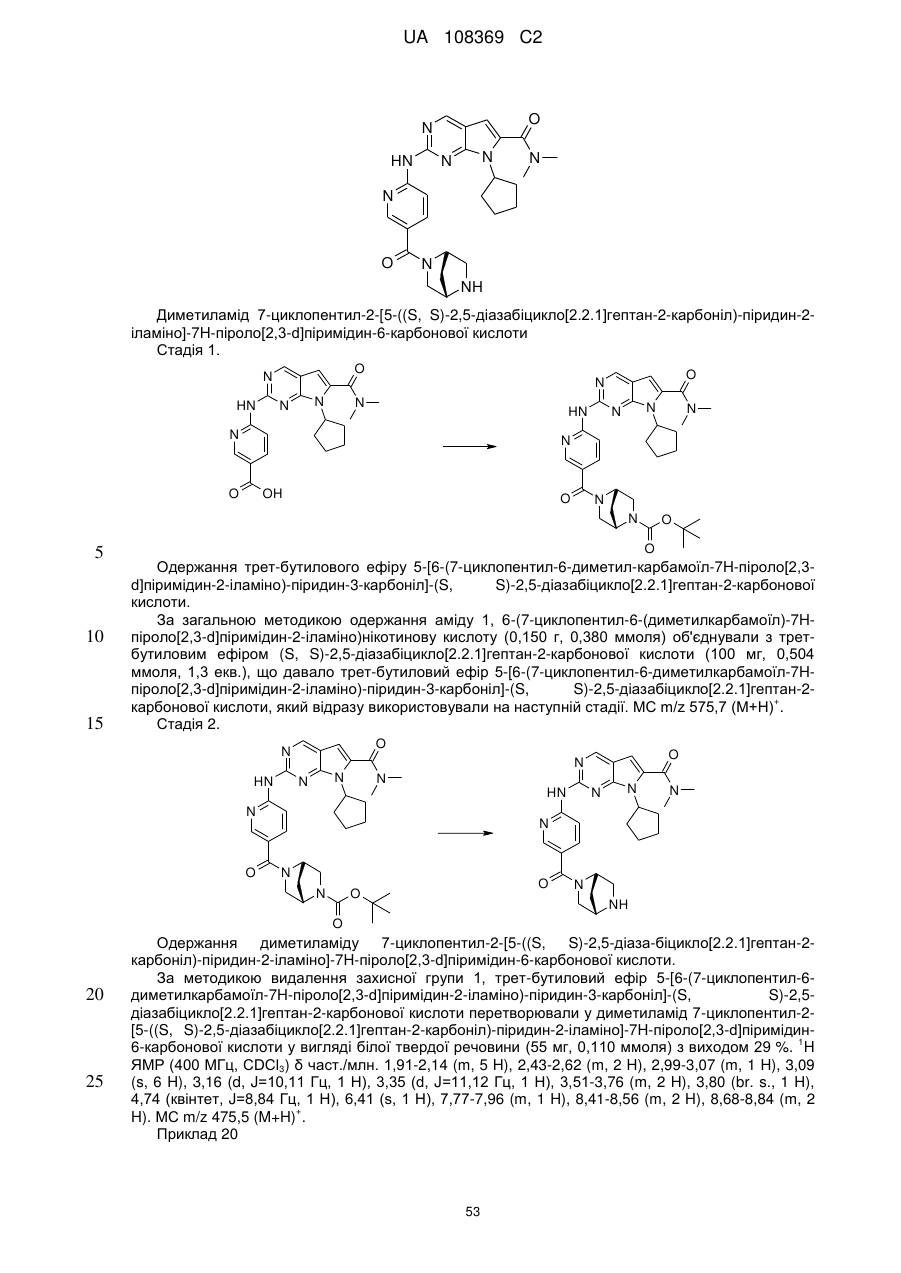
метиламід 7-циклопентил-2-[5-((S,S)-2,5-діазабіцикло[2.2.1]гептан-2-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-(3-трет-бутилфеніл)-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
2-(5-((1R,5S)-3-окса-7,9-діазабіцикло[3.3.1]нонан-9-карбоніл)піридин-2-іламіно)-7-циклопентил-N,N-диметил-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
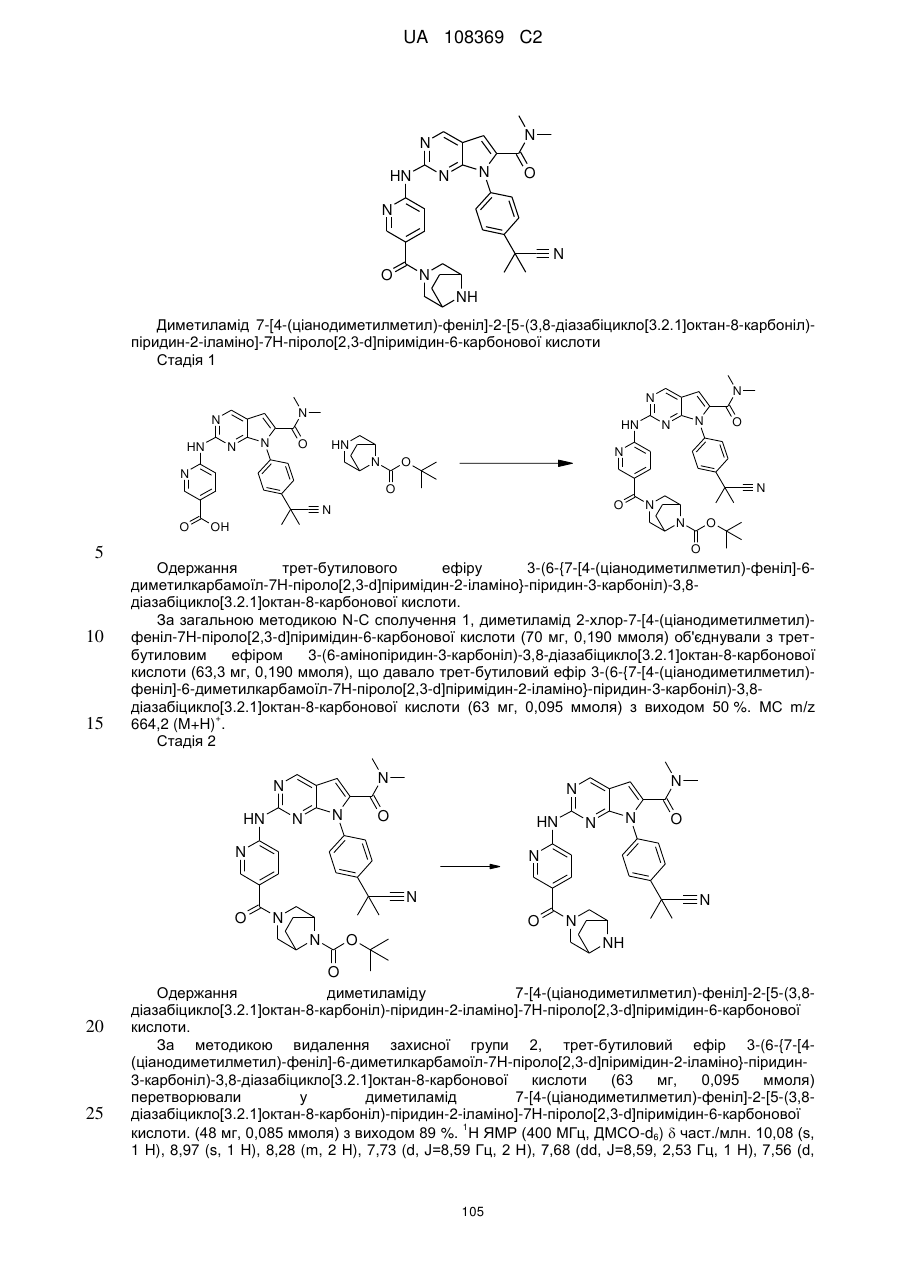
диметиламід 7-[4-(ціанодиметилметил)-феніл]-2-[5-(3,8-діазабіцикло[3.2.1]октан-8-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-((1S,6R)-3,9-діазабіцикло[4.2.1]нонан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-((1R,6S)-3,9-діазабіцикло[4.2.1]нонан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-(3,6-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
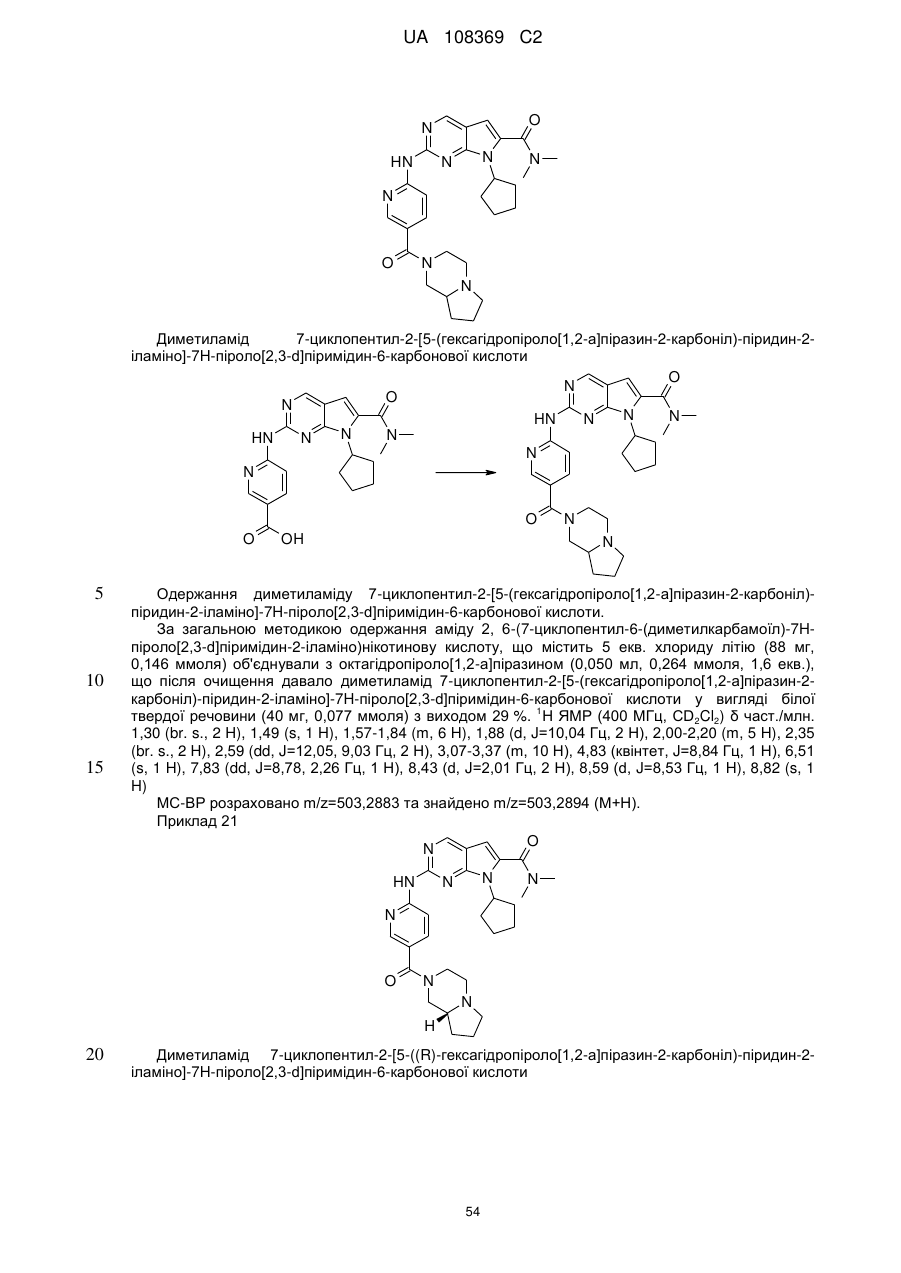
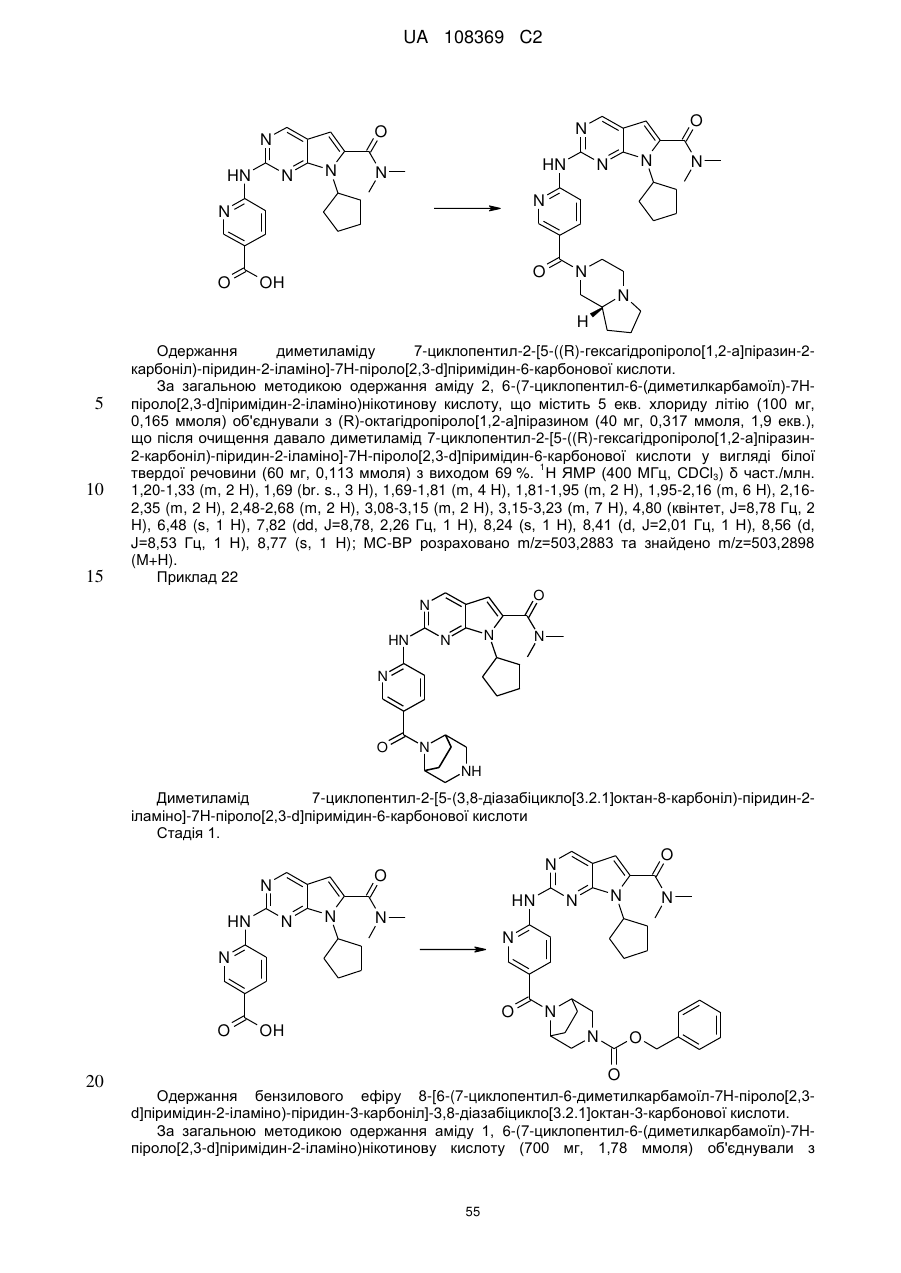
диметиламід 7-циклопентил-2-[5-(гексагідропіроло[1,2-а]піразин-2-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
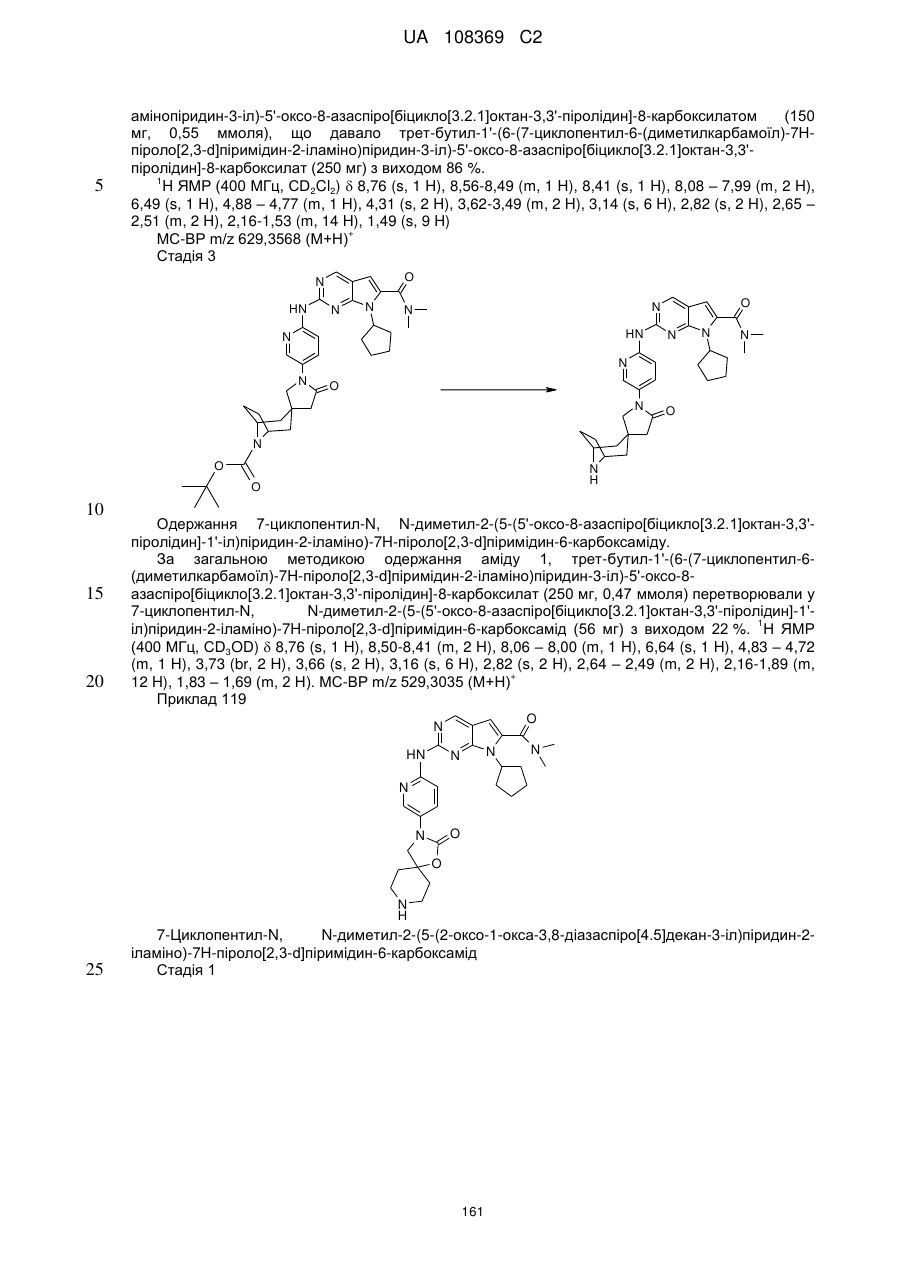
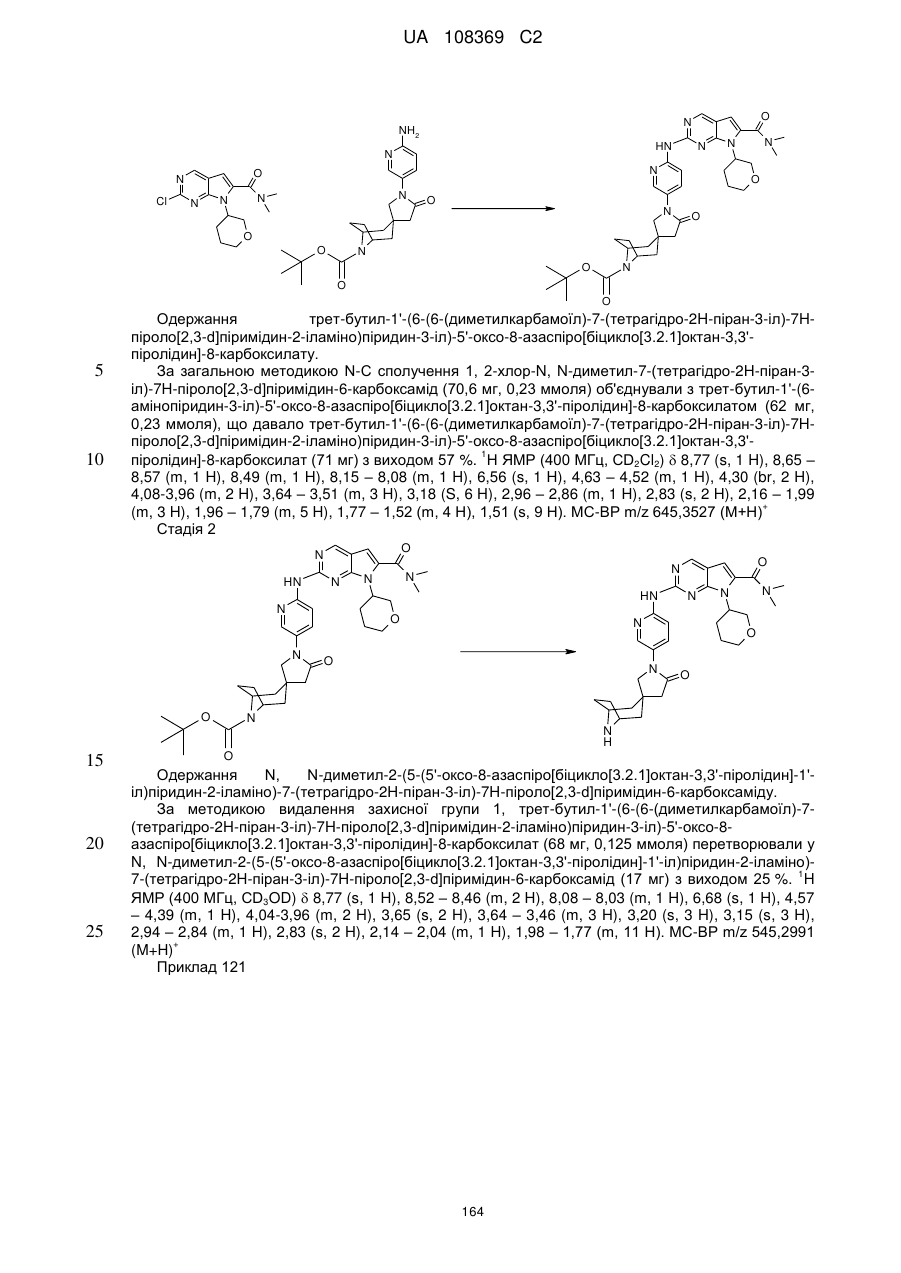
7-циклопентил-N,N-диметил-2-(5-(5'-оксо-8-азаспіро[біцикло[3.2.1]октан-3,3'-піролідин]-1'-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
диметиламід 7-циклопентил-2-[5-(1-оксогексагідропіроло[1,2-а]піразин-2-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
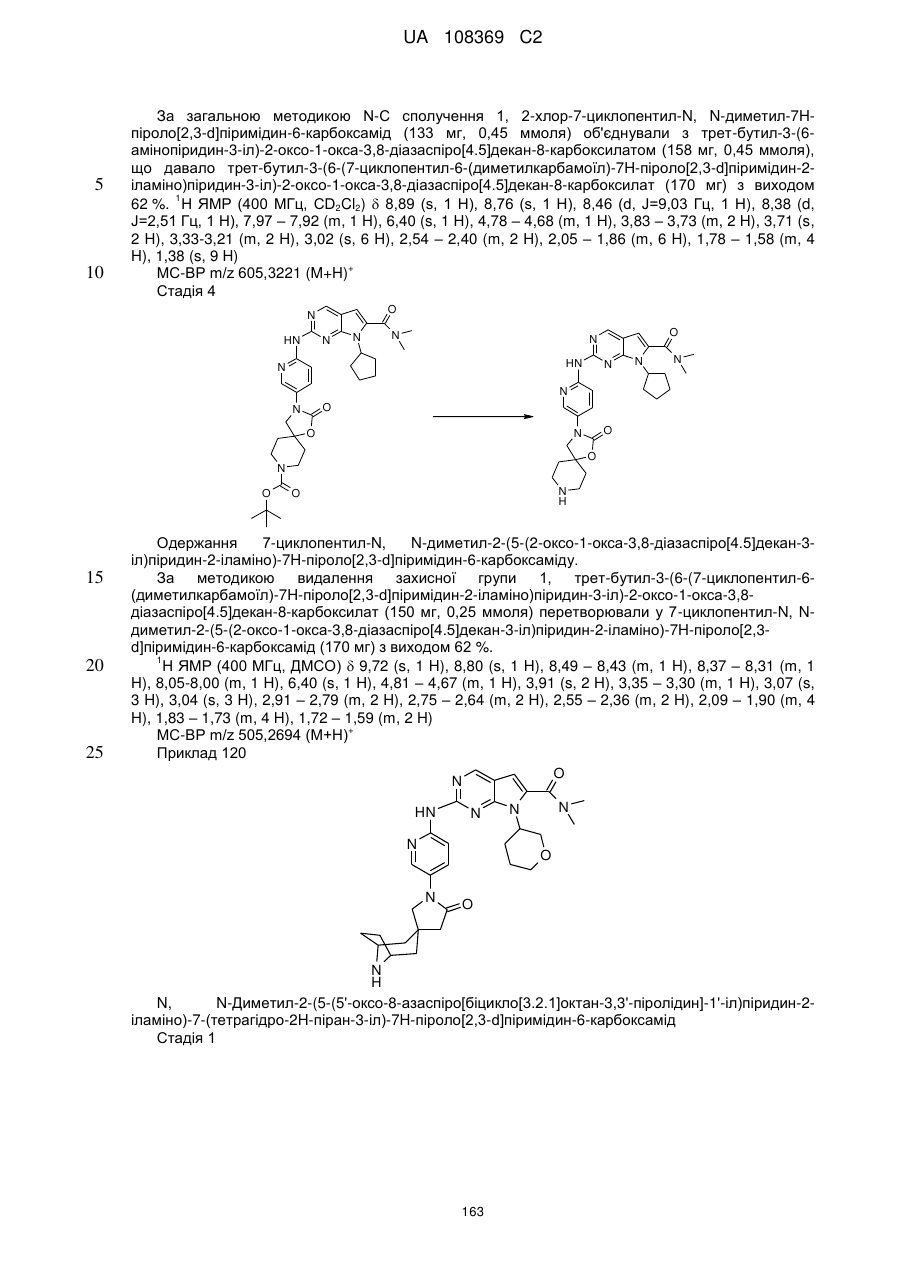
7-циклопентил-N,N-диметил-2-(5-(2-оксо-1-окса-3,8-діазаспіро[4.5]декан-3-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
диметиламід 7-циклопентил-2-[5-((1S,6R)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
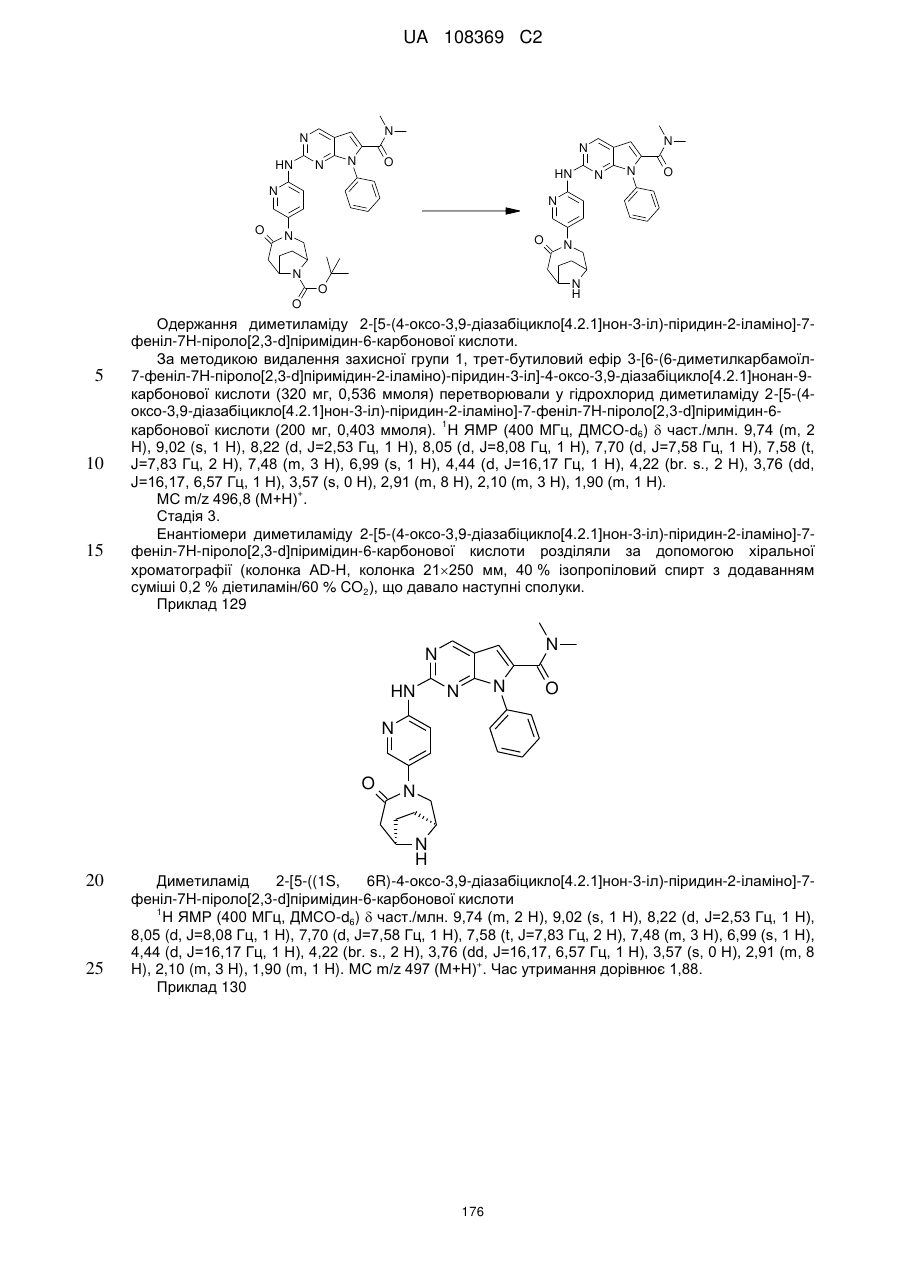
диметиламід 2-[5-(4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7-феніл-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти та
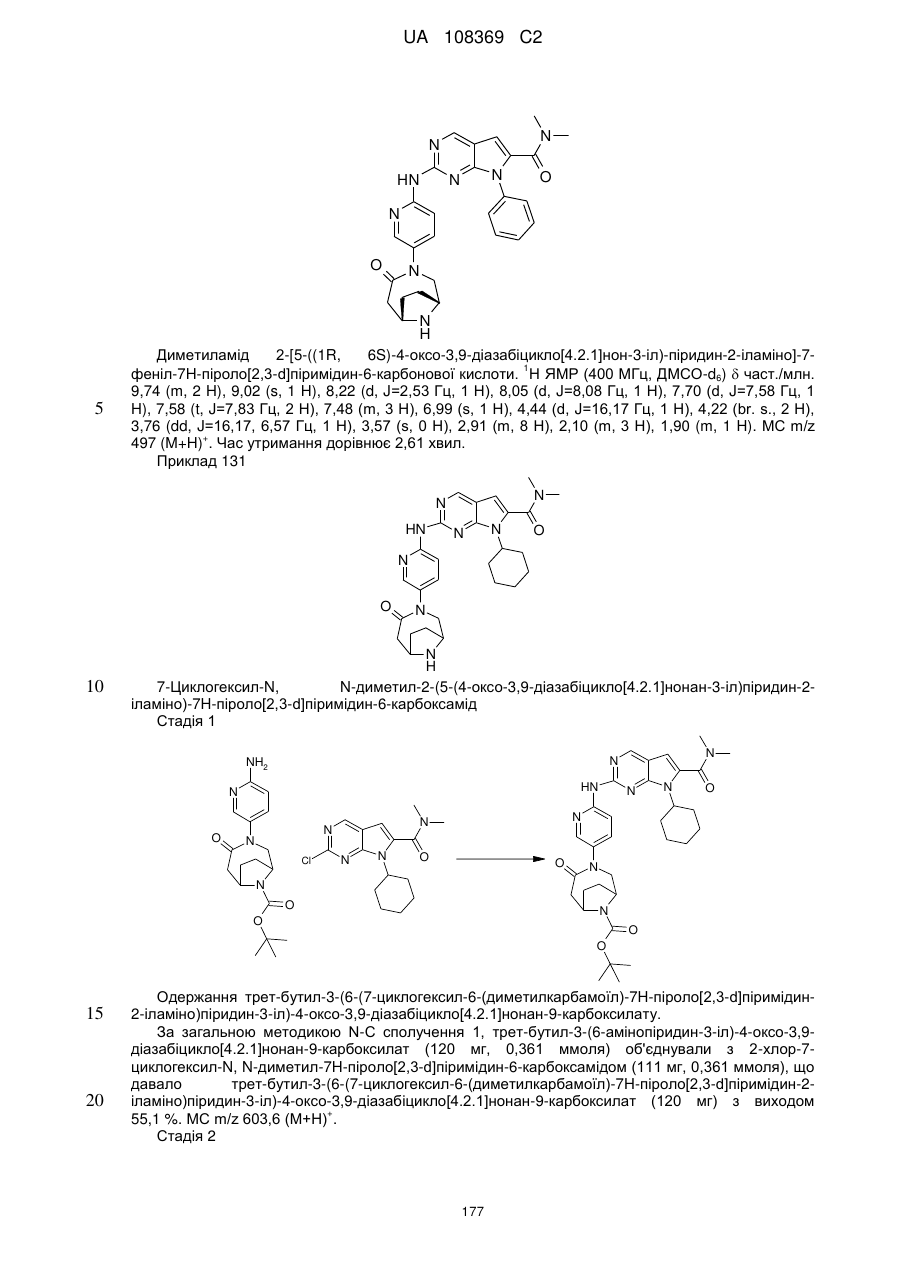
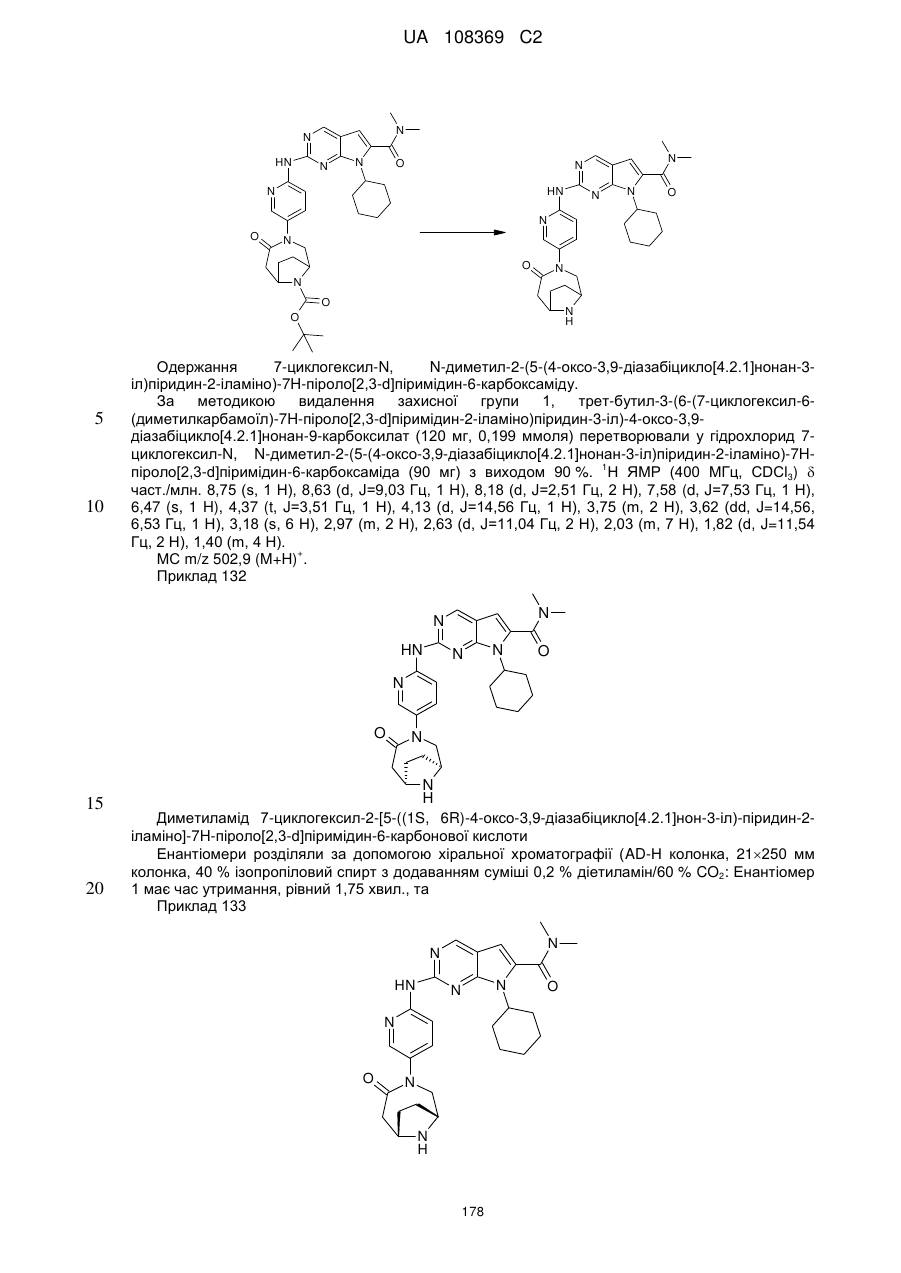
7-циклогексил-N,N-диметил-2-(5-(4-оксо-3,9-діазабіцикло[4.2.1]нонан-3-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
або її фармацевтично прийнятна сіль.
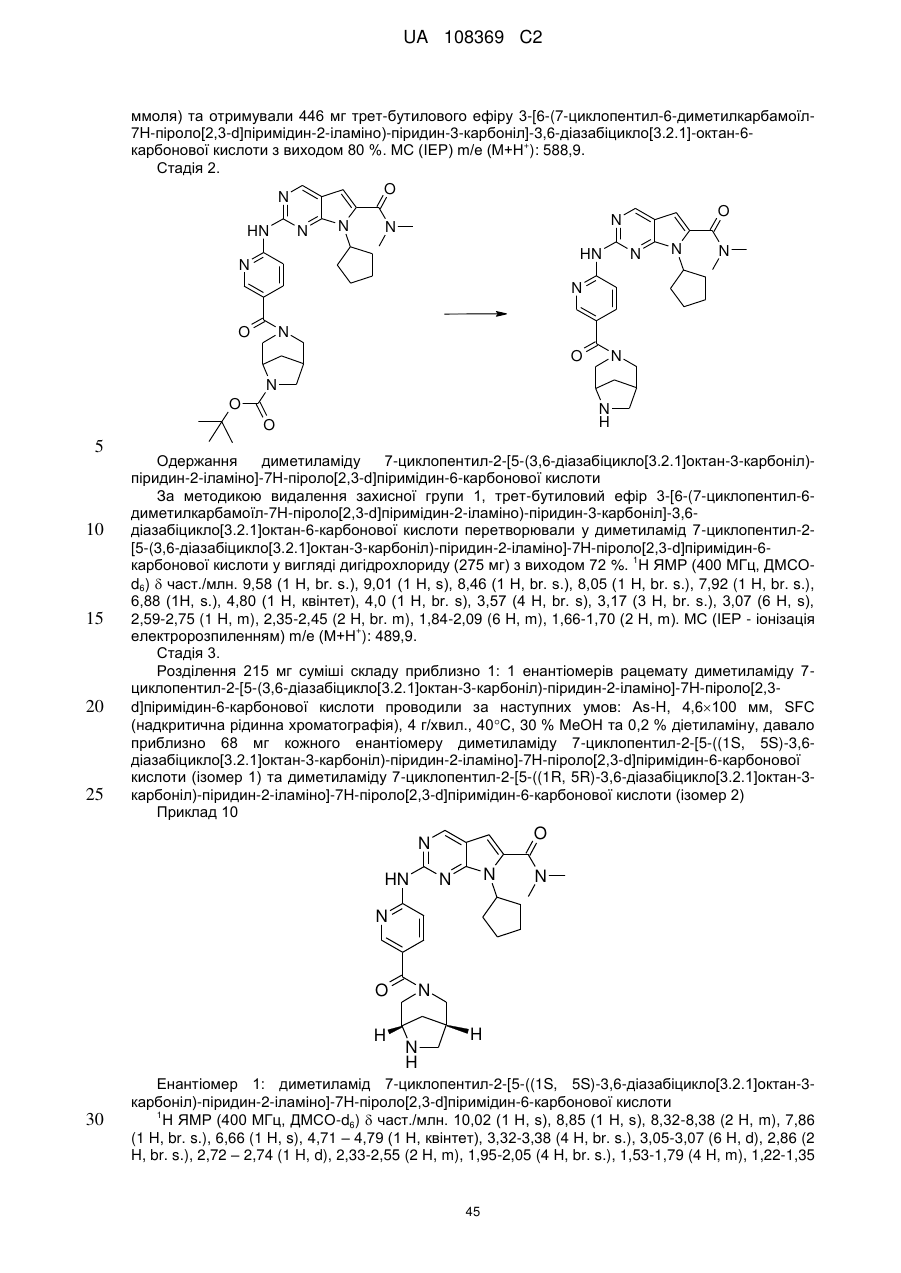
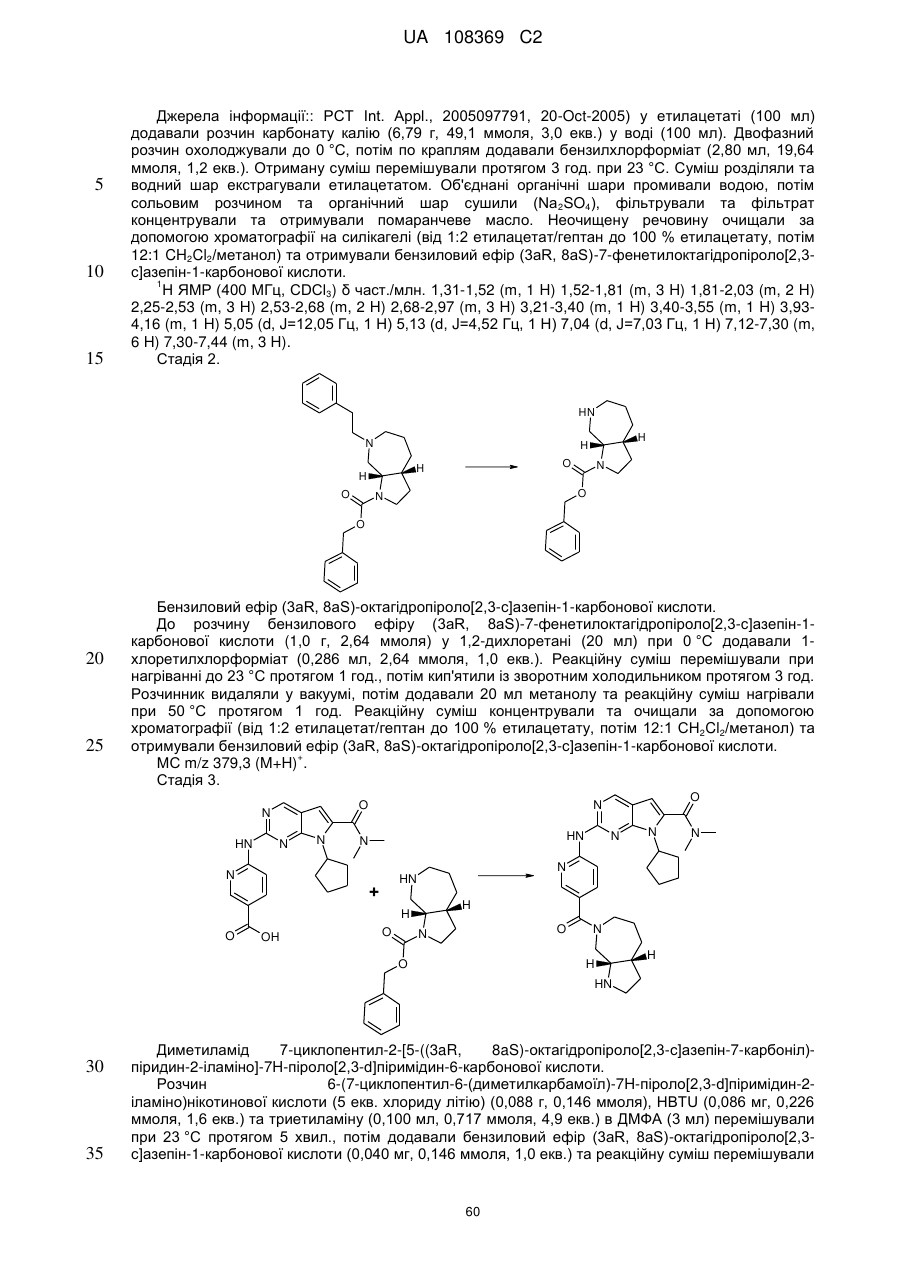
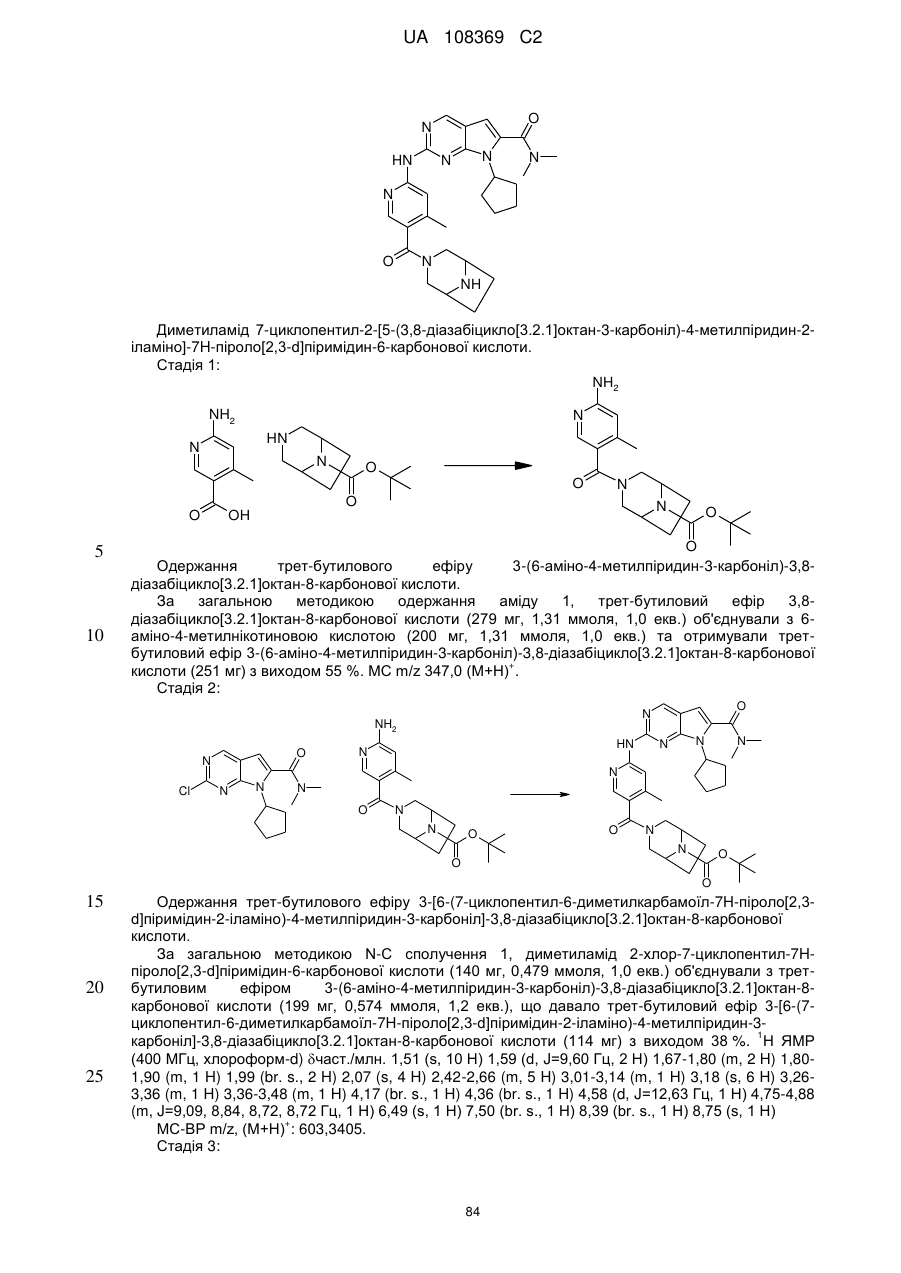
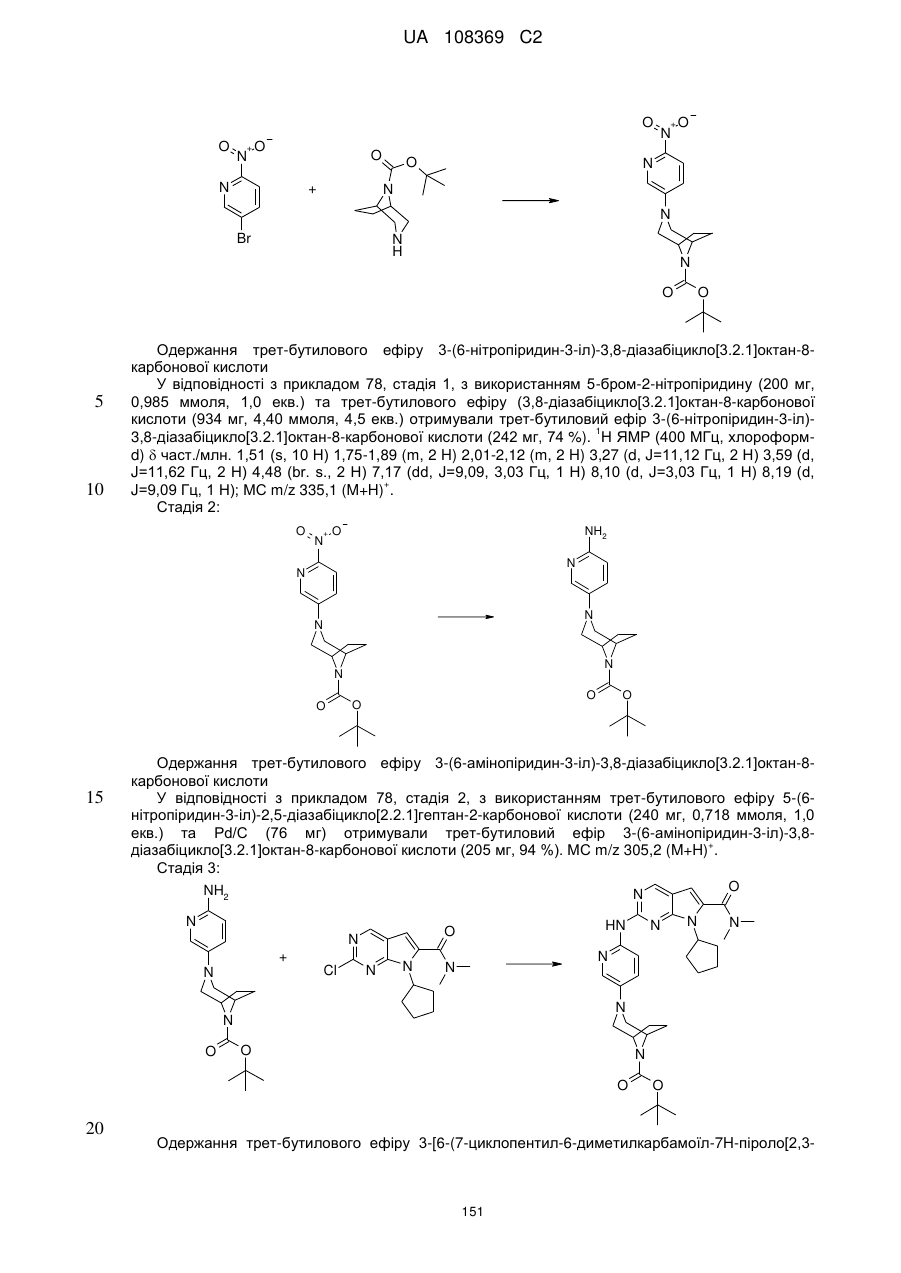
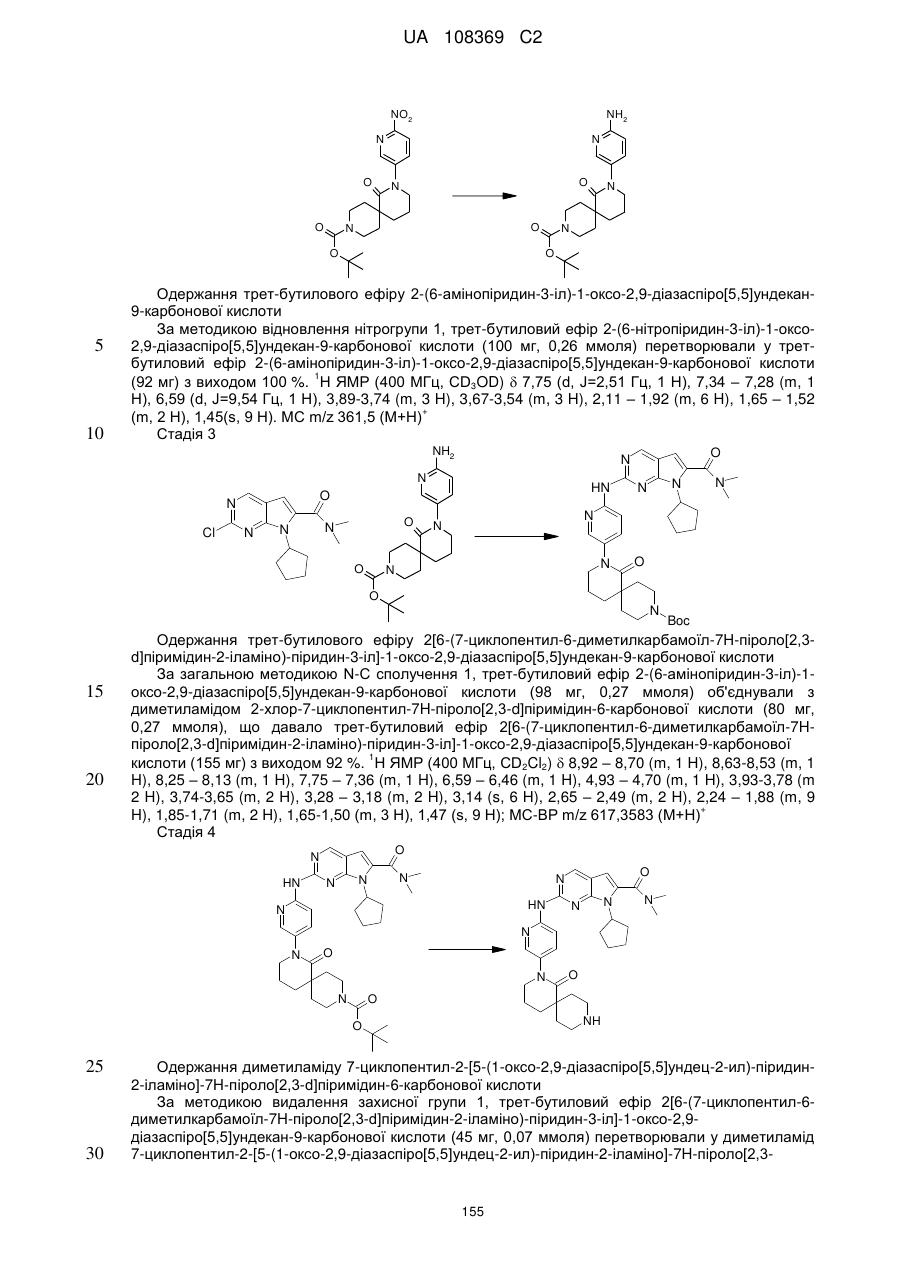
20. Сполука за п. 1, вибрана з групи, що включає:
диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-((S,S)-2,5-діазабіцикло[2.2.1]гептан-2-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-((1R,6S)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-((1S,5S)-3,6-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
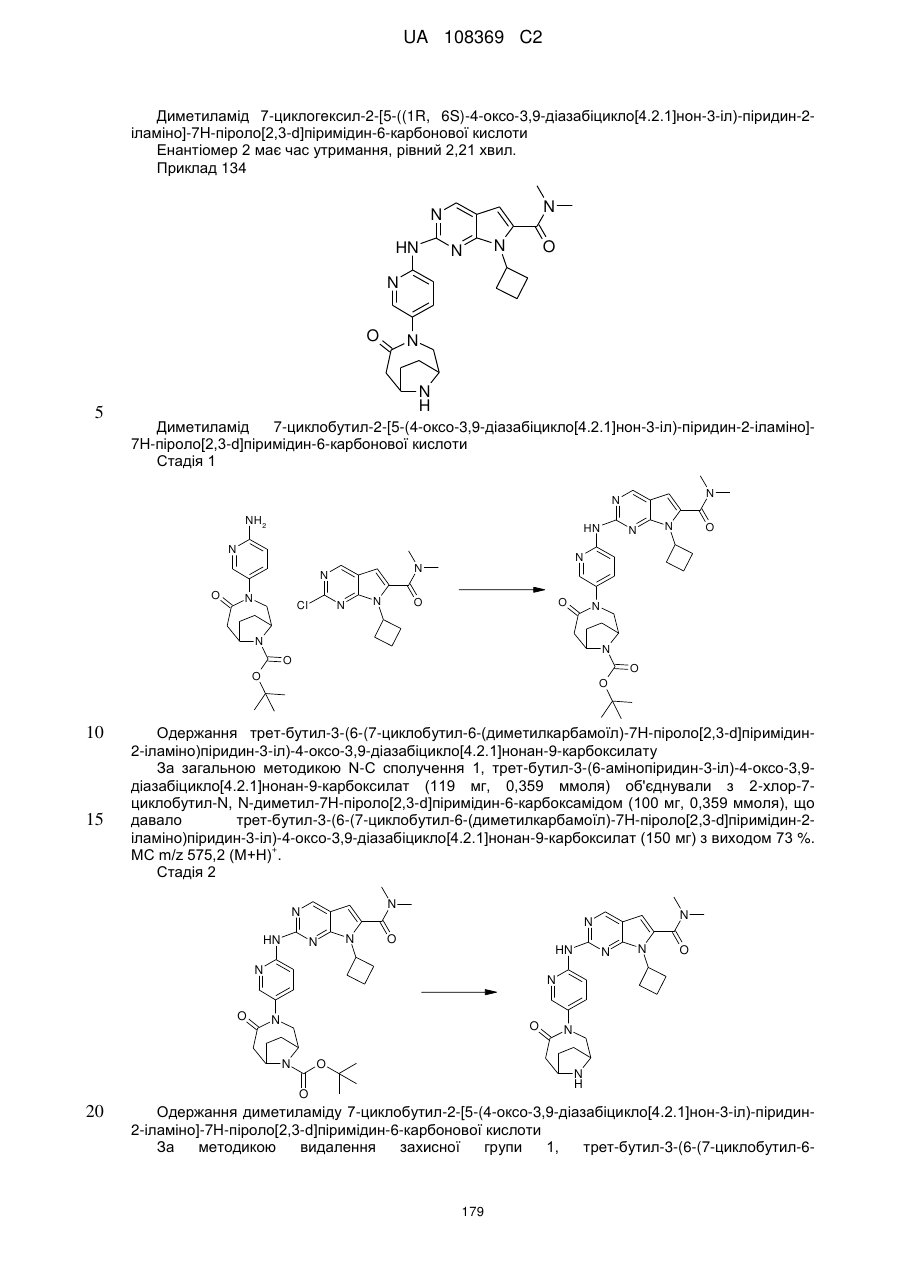
диметиламід 7-циклобутил-2-[5-((1S,6R)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклогексил-2-[5-((1R,6S)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-6-метилпіридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-4-метилпіридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
диметиламід 7-циклопентил-2-[5-(3,9-діазабіцикло[3.3.1]нонан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти;
7-циклопентил-N,N-диметил-2-(5-(3-оксо-1,4-діазабіцикло[3.2.2]нонан-4-іл)-піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід та
7-циклопентил-N,N-диметил-2-(5-((1R,6S)-9-метил-4-оксо-3,9-діазабіцикло[4.2.1]нонан-3-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
або її фармацевтично прийнятна сіль.
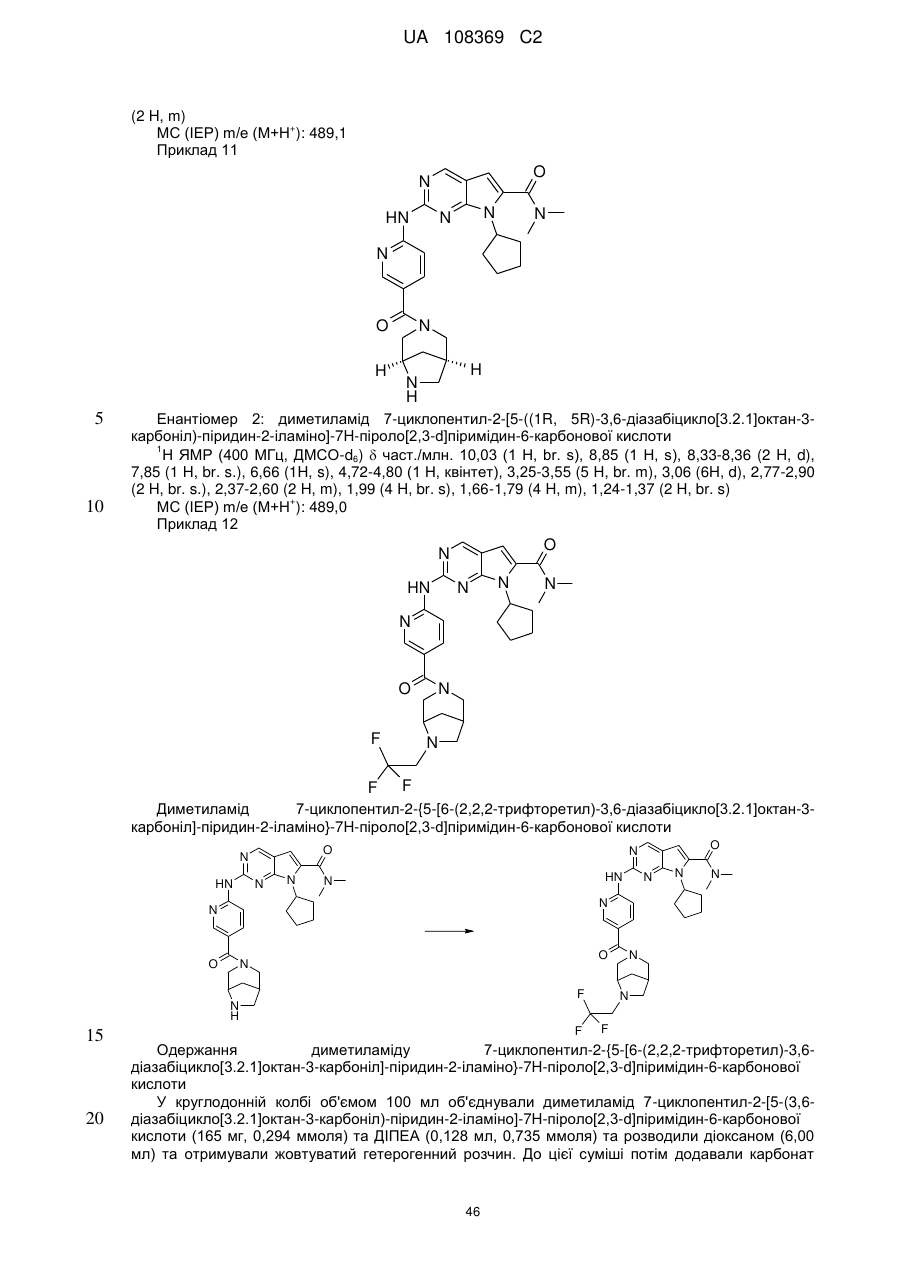
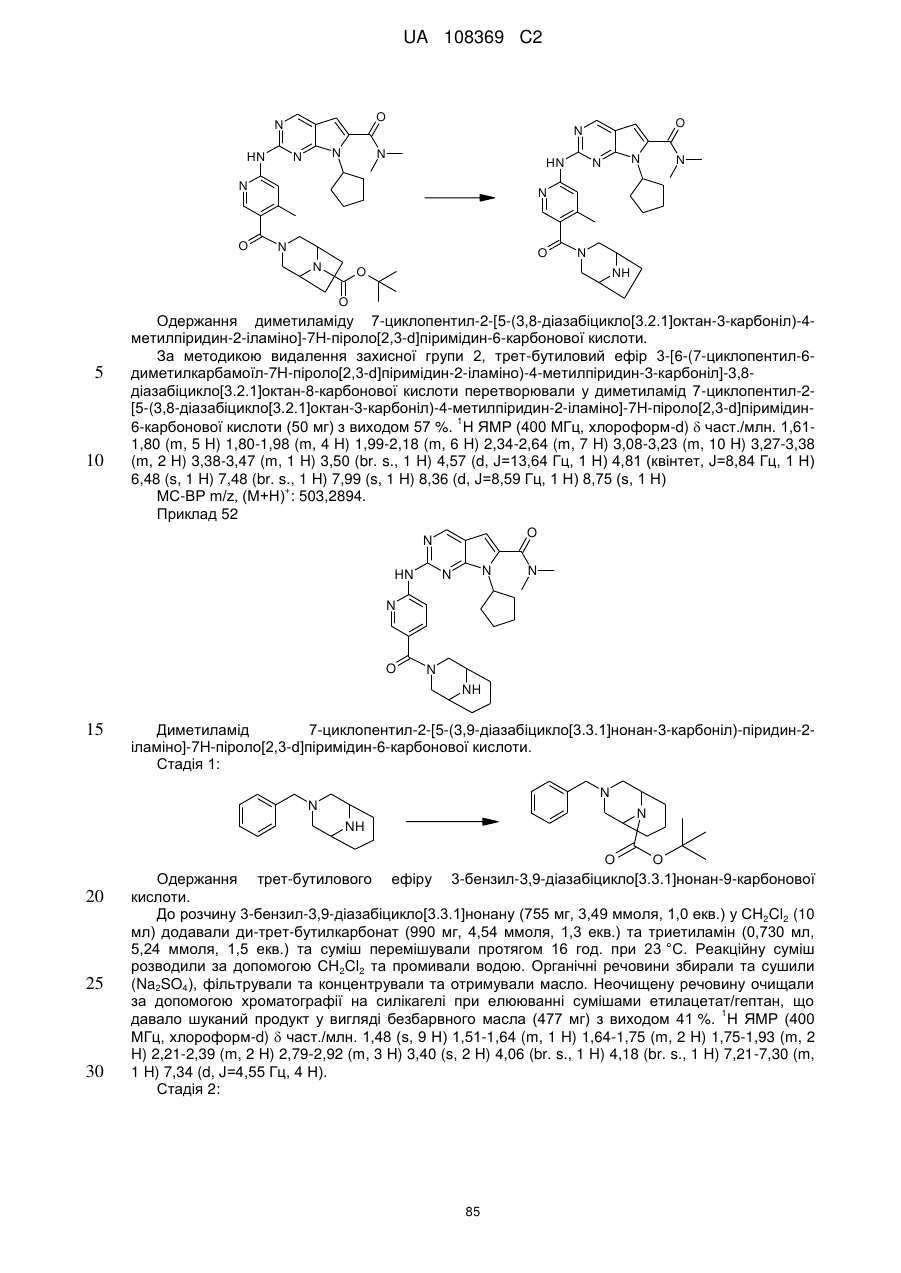
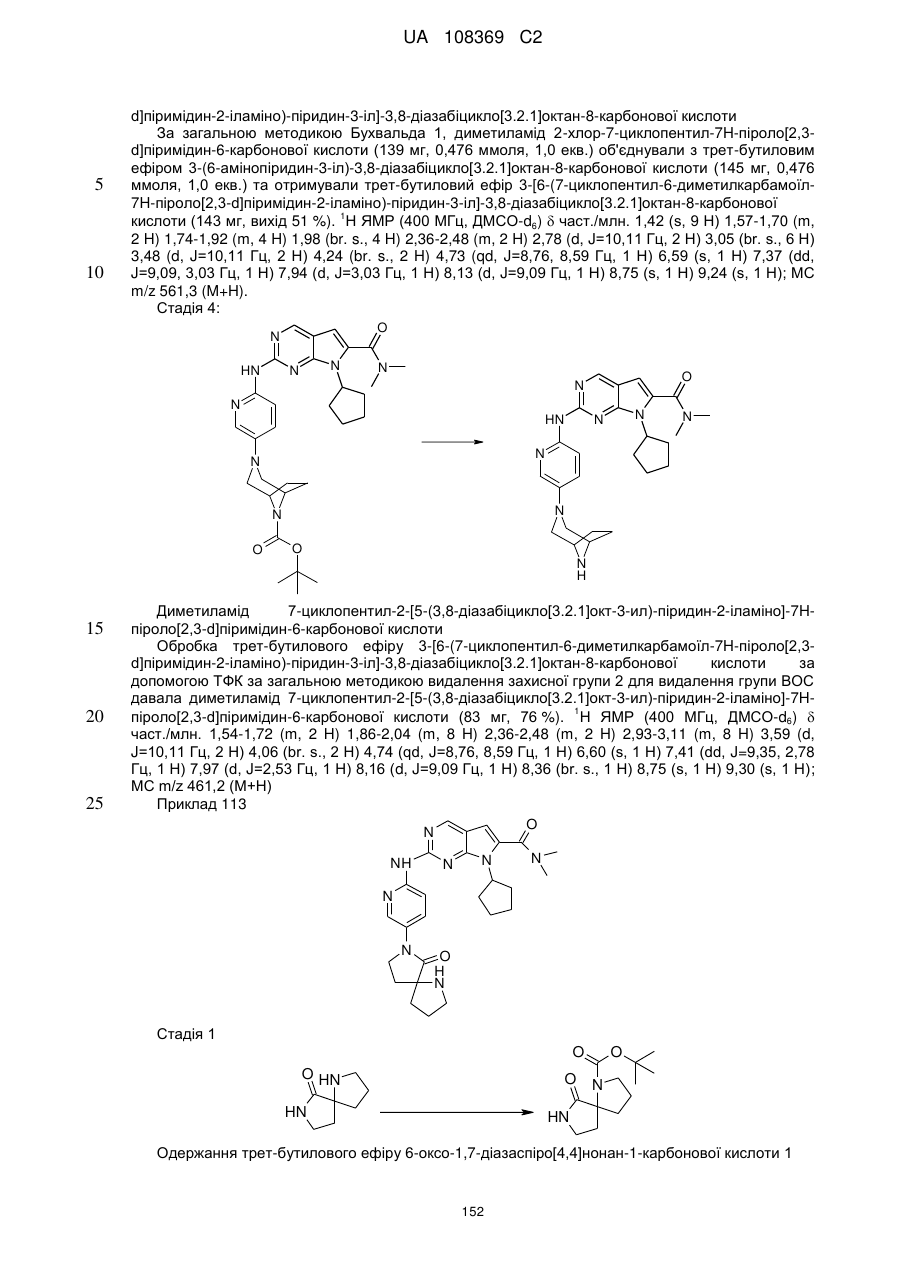
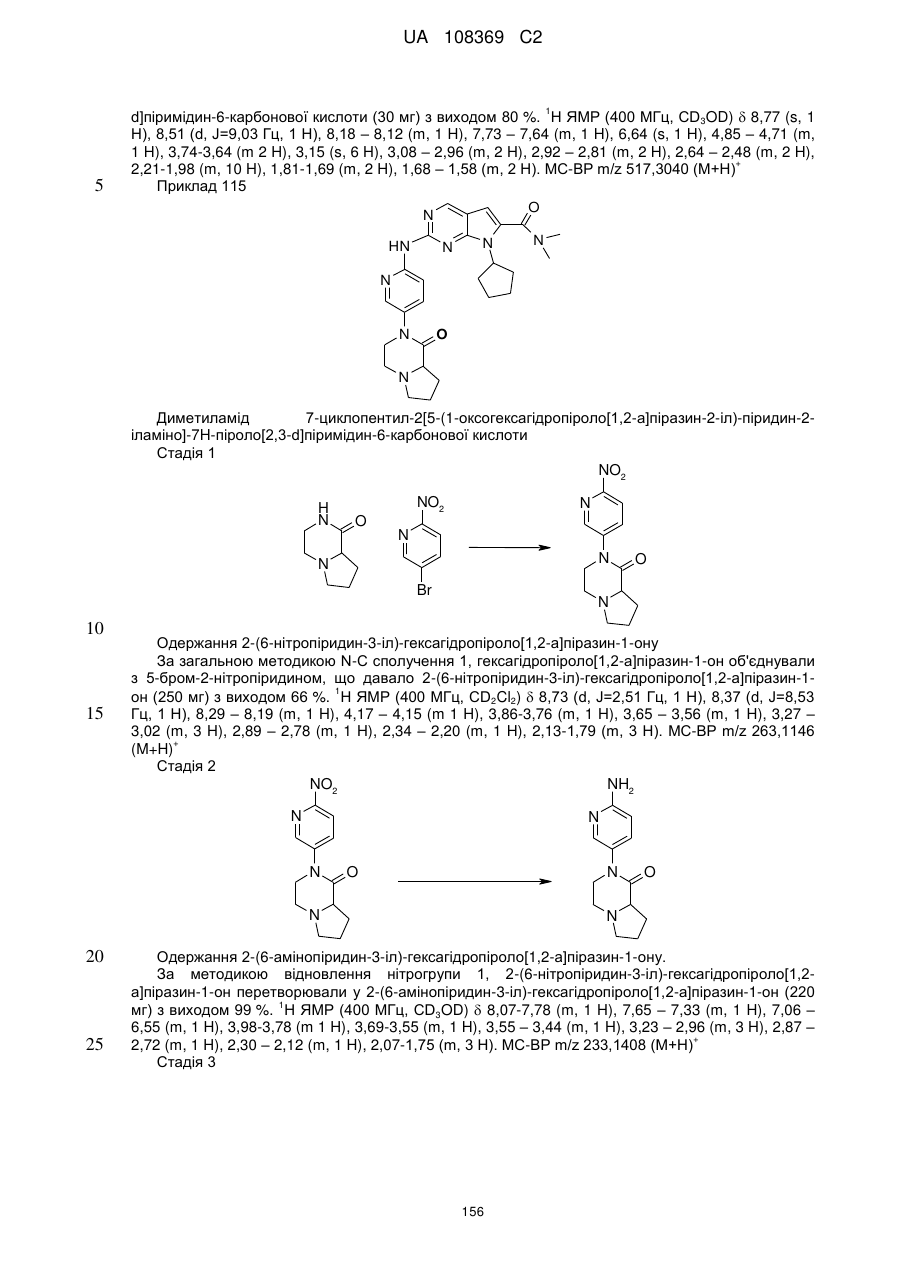
21. Сполука за п. 1, вибрана з групи, що включає:
7-циклопентил-N,N-диметил-2-(5-((3аS,6аR)-1-оксогексагідропіроло[3,4-с]пірол-2(1Н)-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
7-циклопентил-N,N-диметил-2-(5-((3аR,6аS)-1-оксогексагідропіроло[3,4-с]пірол-2(1Н)-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
7-циклогептил-N,N-диметил-2-(5-(цис-6-оксотетрагідро-1Н-піроло[3,4-с]піридин-5(6Н,7Н,7аН)-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
7-циклoпeнтил-N,N-димeтил-2-(5-(циc-6-oкcoтeтpaгiдpo-1H-пipoлo[3,4-c]пipидин-5(6Н,7Н,7аН)-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
7-циклопентил-N,N-диметил-2-(5-(цис-6-оксотетрагідро-1Н-піроло[3,4-с]піридин-5(6Н,7Н,7аН)-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід та
7-циклопентил-N,N-диметил-2-(5-((3аR,6аS)-5-метил-1-оксогексагідропіроло[3,4-с]пірол-2(1Н)-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
або її фармацевтично прийнятна сіль.
22. Сполука за п. 1, вибрана з групи, що включає:
7-циклопентил-N,N-диметил-2-(5-((1R,3R,5S)-2'-оксо-8-азаспіро[біцикло[3.2.1]октан-3,5'-оксазолідин]-3'-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
7-циклопентил-N,N-диметил-2-(5-(2-оксо-1-окса-3,8-діазаспіро[4.6]ундекан-3-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
7-циклопентил-N,N-диметил-2-(5-(2-оксо-1-окса-3,7-діазаспіро[4.5]декан-3-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід;
диметиламід 7-циклопентил-2-[5-((S)-2-оксо-1-окса-3,7-діазаспіро[4.5]дец-3-ил)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти та
диметиламід 7-циклопентил-2-[5-((R)-2-оксо-1-окса-3,7-діазаспіро[4.5]дец-3-ил)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти; або її фармацевтично прийнятна сіль.
23. Фармацевтична композиція, що містить сполуку за будь-яким з попередніх пунктів або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій або інертний наповнювач.
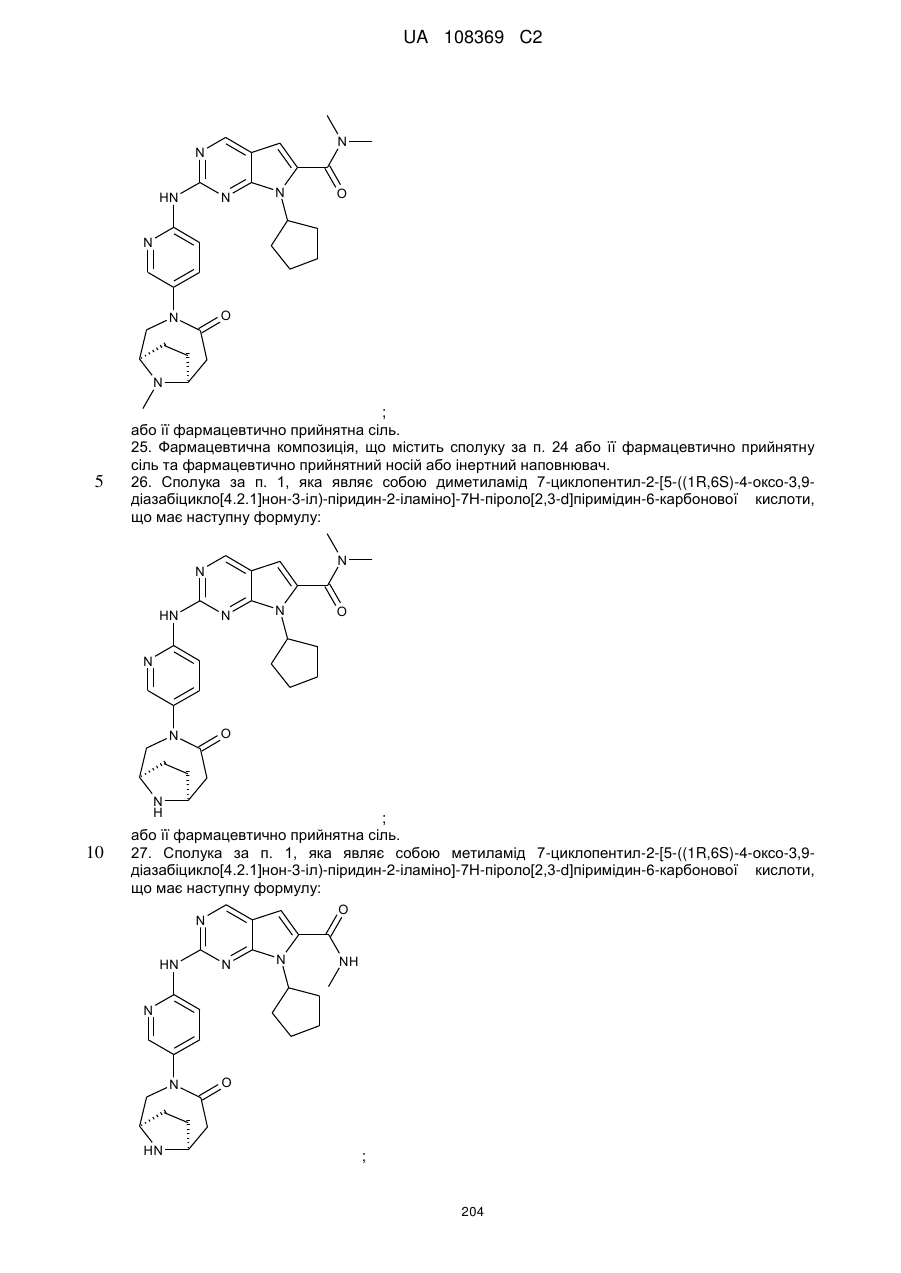
24. Сполука за п. 1, яка являє собою 7-циклопентил-N,N-диметил-2-(5-((1R,6S)-9-метил-4-оксо-3,9-діазабіцикло[4.2.1]нонан-3-іл)піридин-2-іламіно)-7Н-піроло[2,3-d]піримідин-6-карбоксамід, що має наступну формулу:
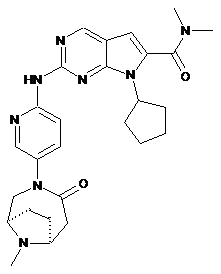 ;
;
або її фармацевтично прийнятна сіль.
25. Фармацевтична композиція, що містить сполуку за п. 24 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій або інертний наповнювач.
26. Сполука за п. 1, яка являє собою диметиламід 7-циклопентил-2-[5-((1R,6S)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти, що має наступну формулу:
 ;
;
або її фармацевтично прийнятна сіль.
27. Сполука за п. 1, яка являє собою метиламід 7-циклопентил-2-[5-((1R,6S)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти, що має наступну формулу:
 ;
;
або її фармацевтично прийнятна сіль.
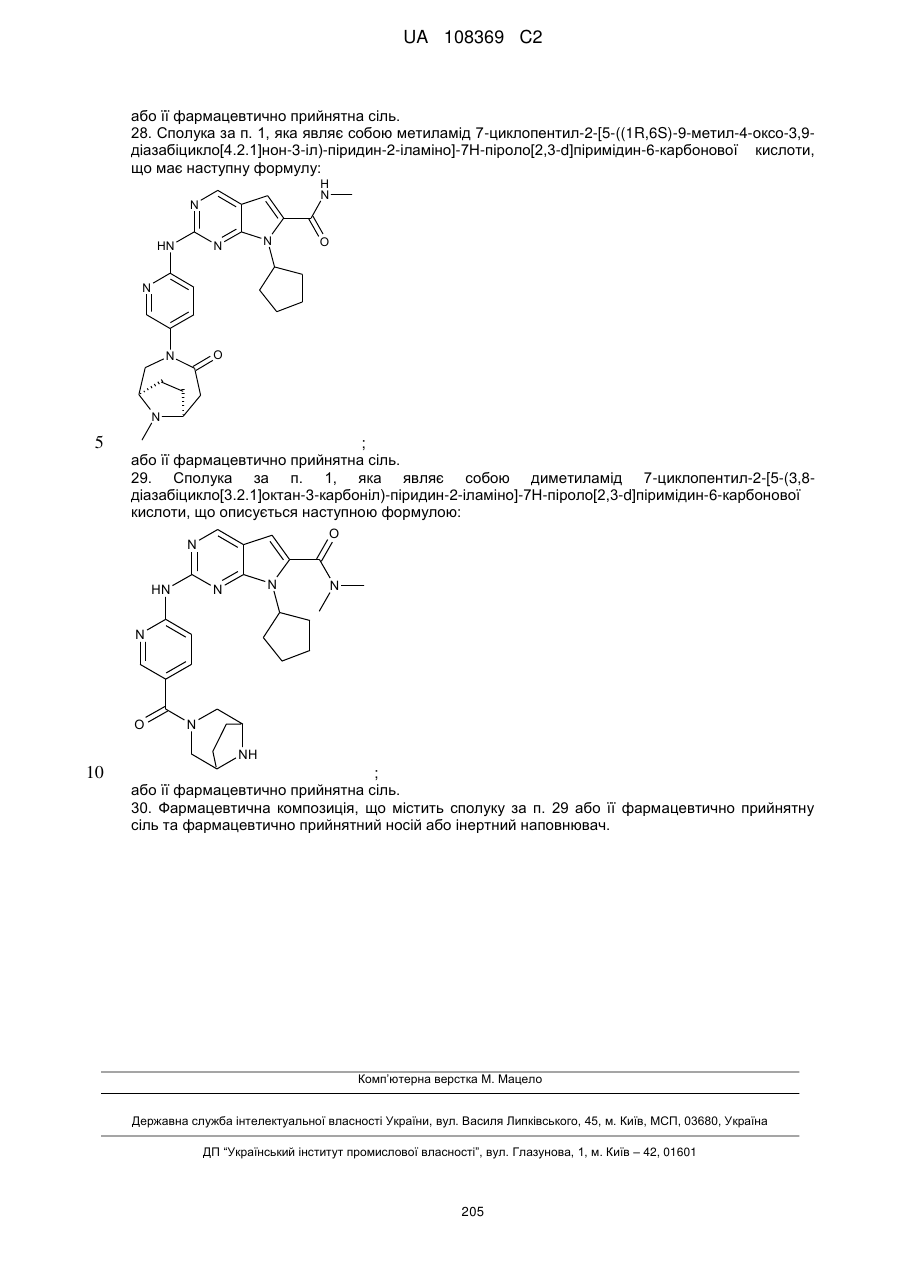
28. Сполука за п. 1, яка являє собою метиламід 7-циклопентил-2-[5-((1R,6S)-9-метил-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти, що має наступну формулу:
 ;
;
або її фармацевтично прийнятна сіль.
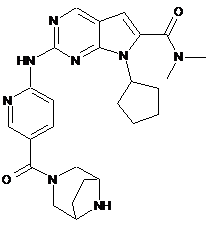
29. Сполука за п. 1, яка являє собою диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2-іламіно]-7Н-піроло[2,3-d]піримідин-6-карбонової кислоти, що описується наступною формулою:
 ;
;
або її фармацевтично прийнятна сіль.
30. Фармацевтична композиція, що містить сполуку за п. 29 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій або інертний наповнювач.
Текст
Реферат: У заявці описані нові піролопіримідини формули (І) UA 108369 C2 (12) UA 108369 C2 R 8 9 R R N N R N 10 R N N HN 4 R O 1 11 A L R2Y , (I) 1 2Y 4 8 11 у якій R , R , R , R -R , A та L визначені у даному винаході, та їх солі, включаючи їх фармацевтично прийнятні солі. Сполуки, запропоновані у даному винаході, є інгібіторами CDK4/6 та їх можна використовувати для лікування захворювань та порушень, опосередкованих за допомогою CDK4/6, таких як рак, включаючи лімфому з клітин зони мантії, ліпосаркому, недрібноклітинний рак легенів, меланому, плоскоклітинний рак стравоходу та рак молочної залози. У заявці також описані фармацевтичні композиції, що містять сполуку, запропоновану у даному винаході. У заявці також описані способи інгібування активності CDK4/6 та лікування пов'язаних з ними порушень з використанням сполуки, запропонованої у даному винаході, або фармацевтичної композиції, що містить сполуку, запропоновану у даному винаході. R 4 R N N 9 R R HN N N R N 10 8 O 1 11 R A L 2Y R , (I) UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ ВІДНОСИТЬСЯ ВИНАХІД Даний винахід відноситься до нових піролопіримідинів та фармацевтичних композицій, що містять їх, точніше, до піролопіримідинів та фармацевтичних композицій, що містять їх, які є інгібіторами CDK4/6. Даний винахід також відноситься до застосування цих сполук та композицій для лікування гіперпроліферативних порушень, таких як рак. РІВЕНЬ ТЕХНІКИ Протікання клітинного циклу ссавців є строго регульованим процесом, у якому перехід через різні фази протікає строго регульованим чином та проходить через множину певних контрольних точок. Білок ретинобластоми (pRb) є білком контрольної точки для переходу з фази G1 у фазу S. pRb асоціюється з сімейством факторів транскрипції E2F для попередження їх активності за відсутності відповідних стимулів росту (Див. Ortega et al., Biochimica et Biophysica Acta-Reviews on Cancer 2002; 1602 (1):73-87; Shapiro, Journal of Clinical Oncology 2006; 24 (11):1770-1783). При стимулюванні мітогеном клітини, що знаходяться у спокої, починають переходити у фазу S за допомогою знову синтезованих D-циклінів, які є активаторами циклінзалежних кіназ 4 та 6 (CDK4/6). Після зв'язування з циклінами CDK4/6 дезактивує білок pRb шляхом фосфорилювання. Фосфорилювання pRb приводить до вивільнення E2F, призначених для прямої транскрипції генів, необхідних для фази S. Для повної дезактивації pRb необхідно фосфорилювання обома циклінами D-CDK4/6 та E-CDK2. Показано, що фосфорилювання за допомогою CDK4/6 по специфічним сайтам pRb (Ser780, Ser795) необхідне для фосфорилювання циклінами E-CDK2. (Див. Lundberg et al., Molecular and Cellular Biology 1998;18 (2):753-761). На додаток до D-циклінів активність CDK4/6 регулюється за допомогою p16, що кодується геном INK4a, який інгібує активність кінази. (Див. Kamb et al., Science 1994; 264 (5157):436-440). Білки CIP/KIP, які є інгібіторами цикліну E-CDK2, також зв'язуються з комплексом циклін D-CDK4/6 та це приводить до додаткової дезактивації CDK2 шляхом ізоляції білків CIP/KIP від їх мішені. (Див. Sherr et al., Genes & Development 1999; 13 (12):1501-1512). Тому циклін D-CDK4/6 є ключовим ферментним комплексом, який регулює перехід від фази G1 до фази S. При раку шлях D-циклін-CDK4/6-INK4a-pRb повсюдно порушується для забезпечення проліферації клітин. У більшості випадків (~80 %) при раку зберігається функціональний pRb та використовуються різні механізми для підвищення активності кінази CDK4/6. (Див. Ortega et al., Biochimica et Biophysica Acta-Reviews on Cancer 2002; 1602 (1):73-87; Shapiro, Journal of Clinical Oncology 2006; 24 (11):1770-1783)). При лімфомі з клітин зони мантії (MCL) циклін D1 піддається транслокації у промотор IgH (t11:14), що приводить до конститутивної експресії білку, що приводить до активації CDK4/6 (Див. Amin, et al., Archives of Pathology & Laboratory Medicine 2003; 127 (4):424-431; Oudat, et al., Modern Pathology 2001; 14 (1):175A). Ця транслокація спостерігається у >90 % випадків MCL та вважається патогномонічною для захворювання. Dциклін також піддається транслокації у 20 % множинних мієлом. (Див. Bergsagel et al. Immunological Reviews 2003; 194 (1):96-104) На додаток до транслокації вміст D-цикліну також можна збільшити за допомогою ампліфікації або надекспресії та прикладами цього можуть служити плоскоклітинний рак стравоходу, при якому є значною ампліфікація цикліну D1 (Див. Jiang, et al., Cancer Research 1992; 52 (10):2980-2983), та рак молочної залози, при якому є частою надекспресія цикліну D1 (Див. Arnold et al., Journal of Clinical Oncology 2005). Активність кінази CDK4/6 також можна підвищити за допомогою ампліфікації самого гену CDK4 та сумісної ампліфікації генів CDK4 та MDM2 та це спостерігається майже у всіх випадках дедиференційованих ліпосарком. (Див. Sirvent, et al., American Journal of Surgical Pathology 2007; 31 (10):1476-1489). Генетичний інгібітор CDK4/6 також часто інактивується при раку для забезпечення активації CDK4/6 та приклади такого раку включають недрібноклітинний рак легенів, меланому та рак підшлункової залози (Brambilla, et al., Journal of Pathology 1999; 188 (4):351-360; Cowgill et al., American Journal of Surgery 2003; 186 (3):279-286; Gazzeri, et al., Oncogene 1998; 16 (4):497-504; Kamb et al., Science 1994; 264 (5157):436-440; Ortega et al., Biochimica et Biophysica Acta-Reviews on Cancer 2002; 1602 (1):73-87). На додаток до цих генетичних дефектів, безпосередньо зв'язаних з шляхом D-циклінCDK4/6-INK4a-pRb, активність кіназ CDK4/6 також може підвищитися онкогенними абераціями мітогенних шляхів, що збільшує експресію D-цикліну. Приклади включають ампліфікації EGFR при недрібноклітинному раку легенів (NSCLC), активацію мутацій K-Ras при раку підшлункової залози, мутації V600E B-Raf при меланомі та інактивацію PTEN при раку товстої кишки (Див. Dailey, et al., Cytokine & Growth Factor Reviews 2005; 16 (2):233-247; Engelman, Nature Reviews Cancer 2009; 9 (8):550-562; Garcia-Echeverria, Purinergic Signalling 2009; 5 (1):117-125, GraySchopfer et al., Cancer and Metastasis Reviews 2005; 24 (1):165-183, John, et al., Oncogene 2009; 1 UA 108369 C2 5 10 28:S14-S23, Sharma, et al., Nature Reviews Cancer 2007; 7 (3):169-181). Все це показує, що у великій кількості новоутворень у людини посилена проліферація клітин забезпечується шляхом підвищення активності CDK4/6 та невелика молекула-інгібітор цих кіназ може виявитися ефективним засобом лікування цих захворювань. Інгібітори різних CDK є відомими та подані заявки на патенти, присвячені таким інгібіторам. (Див., наприклад, WO2007/140222) Тому були зроблені зусилля щодо синтезу сполук, які інгібують активність CDK4/6 та в даній галузі техніки розкритий цілий ряд таких сполук. Однак, оскільки існує ціла низка патологічних відповідей, які опосередковуються за допомогою CDK4/6, постійно необхідні інгібітори CDK4/6, які можна використовувати для лікування різних патологічних станів, включаючи рак. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Даний винахід відноситься до нових піролопіримідинів формули (I) R 4 R 10 N N 9 R R HN N N O R N 8 1 11 R A L 2Y R 15 20 25 (I) у якій R1, R2Y, R4, R8-R11, A та L визначені у даному винаході та до їх солей, включаючи їх фармацевтично прийнятні солі. Сполуки, запропоновані у даному винаході, є інгібіторами CDK4/6 та можуть бути застосовні для лікування захворювань та порушень, опосередкованих за допомогою CDK4/6, таких як рак, включаючи лімфому з клітин зони мантії, ліпосаркому, недрібноклітинний рак легенів, меланому, плоскоклітинний рак стравоходу та рак молочної залози. Даний винахід також відноситься до фармацевтичних композицій, що містять сполуку, запропоновану у даному винаході. Даний винахід також відноситься до способів інгібування активності CDK4/6 та до лікування зв'язаних з ним порушень з використанням сполуки, запропонованої у даному винаході, або фармацевтичної композиції, що містить сполуку, запропоновану у даному винаході. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ R 4 R N N 9 R R HN N N R N 10 8 O 1 11 R A L 2Y R 30 (I) у якій: R1 позначає C3-C7-алкіл; C4-C7-циклоалкіл, що необов'язково містить 1 замісник, вибраний з групи, що включає C1-C6-алкіл та OH; феніл, що необов'язково містить 1 замісник, вибраний з групи, що включає C1-C6-алкіл, C(CH3)2CN та OH; піперидиніл, що необов'язково містить 1 замісник, вибраний з групи, що включає циклопропіл та C 1-C6-алкіл; тетрагідропіраніл, що необов'язково містить 1 замісник, вибраний з групи, що включає циклопропіл та C1-C6-алкіл; або біцикло[2.2.1]гептаніл; A позначає CH або N; 2 UA 108369 C2 R11 позначає водень або C1-C4-алкіл; L позначає зв'язок, C(O) або S(O)2; R2Y позначає N N N N N O V N H V V , , , , , N N N V 5 N N V, , N V , , O N N X ( )n V ( )m NH , NH N , , , N N N X X N NH V , N H W, , , N N H N N N H , N NH , N , , N N N N N HN HN NH O, , , , N N N 10 N H , N H N N H , O або 3 N ; UA 108369 C2 5 10 V позначає NH або CH2; X позначає O або CH2; W позначає O або NH; m та n всі незалежно дорівнюють 1, 2 або 3 за умови, що m та n не обидва дорівнюють 3; кожен R2Y необов'язково містить від 1 до 4 замісників, кожен з яких незалежно вибраний з групи, що включає: C1-C3-алкіл, що необов'язково містить 1 або 2 замісники, кожен з яких незалежно вибраний з групи, що включає гідроксигрупу, NH2 та -S-C1-C3-алкіл; CD3; галоген; оксогрупу; C1-C3-галогеналкіл; гідроксигрупу; NH2; диметиламіногрупу; бензил; -C(O)-C1-C3алкіл, що необов'язково містить 1 або 2 замісники, кожен з яких незалежно вибраний з групи, що включає NH2, -SCH3 та NHC(O)CH3; -S(O)2-C1-C4-алкіл; піролідиніл-C(O)-; та -C(O)2-C1-C3алкіл; R4 позначає водень, дейтерій або C(R5)(R6)(R7); та R5, R6, R7, R8, R9 та R10 всі незалежно позначають H або дейтерій. Одним варіантом здійснення даного винаходу є сполука формули (I-B) 10 4 R R N N 9 8 R R N N HN O 1 R N 11 R A L 2Y 15 R (I-B) у якій L позначає зв'язок або C(O); R2Y позначає O N N N N V N V O V V , , N , , , O N N N N N H 20 N H , V , V, , V , O O N O N X N N ( )n N N , N , , 4 , X N NH V , ( )m NH , N N NH N V , , W, UA 108369 C2 N O N N O O X H N N H , N NH N H , , O , O N N N NH N N , , N , N O N N N HN HN NH O; , , , O O N N N N H N H , N N N H N H O , , O , N O 5 10 15 N або N ; V позначає NH або CH2; X позначає O або CH2; W позначає O або NH; m та n всі незалежно дорівнюють 1, 2 або 3 за умови, що m та n не обидва дорівнюють 3; кожен R2Y необов'язково містить від 1 до 4 замісників, кожен з яких незалежно вибраний з групи, що включає: C1-C3-алкіл, що необов'язково містить 1 або 2 замісники, кожен з яких незалежно вибраний з групи, що включає гідроксигрупу, NH2 та -S-C1-C3-алкіл; CD3; C1-C3галогеналкіл; гідроксигрупу; NH2; диметиламіногрупу; бензил; -C(O)-C1-C3-алкіл, що необов'язково містить 1 або 2 замісники, кожен з яких незалежно вибраний з групи, що включає NH2, -SCH3 та NHC(O)CH3; -S(O)2-C1-C4-алкіл; піролідиніл-C(O)-; та -C(O)2-C1-C3-алкіл; та R1, R4-R11 та A є такими, як визначено вище для формули (I). Іншим варіантом здійснення даного винаходу є сполука формули (I-C) 5 UA 108369 C2 R 4 R 10 N N 9 R R HN N N 8 O R 1 N A L 2Y R 5 (I-C) у якій: R1 позначає циклобутил, циклопентил, циклогексил, циклогептил, необов'язково заміщений одним метилом, етилом або групою OH; A позначає CH або N; L позначає зв'язок, -C(O)- або S(O)2-; R2Y позначає кожен з яких N N N V V V V , , , 15 20 V, , O N V V ; , або де кожен R2Y необов'язково містить 1 або 2 замісники, незалежно вибрані з групи, що включає галоген, метил, етил або оксогрупу; V позначає NH або CH2; R4 позначає водень, дейтерій або C(R5)(R6)(R7); та R5, R6, R7, R8, R9 та R10 всі незалежно позначають H або дейтерій. У одному варіанті здійснення даного винаходу L позначає зв'язок. У іншому варіанті здійснення L позначає C(O). У одному варіанті здійснення A позначає CH. У іншому варіанті здійснення A позначає N. Краще, якщо A позначає CH. Краще, якщо R11 позначає водень або метил. Водень є найкращим. Краще, якщо R4 позначає C(R5)(R6)(R7) та R5, R6, R7, R8, R9 та R10 позначають водень. Краще, якщо R1 позначає C4-C7-циклоалкіл, необов'язково заміщений одним C1-C6-алкілом. У більш кращому варіанті здійснення R1 позначає необов'язково заміщений циклобутил, циклопентил, циклогексил та циклогептил. Циклопентил є найкращим. Незаміщений циклобутил, циклопентил, циклогексил та циклогептил також є кращими. У іншому варіанті здійснення даного винаходу R2Y позначає: V 10 V , N N N N N , N N 25 N V V V V , N N N , , , 6 V , V, UA 108369 C2 N N O N V , або У іншому варіанті здійснення R2Y позначає: V V . O N N N N N V , , N N N NH N , NH V 5 , , , , O X N N N NH NH W, , , N O N N N HN N N , HN O, , , O O N N N N N N N H , N , N H N H , N O N 10 N або . У іншому варіанті здійснення R2Y позначає: 7 N H O , O , UA 108369 C2 N O X N N N O O N X ( )n V N N V V, , ( )m NH , N H , , O N O O H N , N H NH або . N H HN O У іншому варіанті здійснення R2Y позначає H . H N H У іншому варіанті здійснення R2Y позначає N H. H H N 5 N H У іншому варіанті здійснення R2Y позначає H або O . O H H N N N У іншому варіанті здійснення R2Y позначає N або . H H N N N H N H H У іншому варіанті здійснення R2Y позначає або N NH У кращому варіанті здійснення R2Y позначає 8 . H . UA 108369 C2 N H H N H У кращому варіанті здійснення R2Y позначає необов'язково заміщений одним C1-C3-алкілом. . H N H або , O N H O N H H N H 5 N H H N H У кращому варіанті здійснення R2Y позначає необов'язково заміщений одним C1-C3-алкілом. або , N N NH У кращому варіанті здійснення R2Y позначає або . O O H H N N NH H У кращому варіанті здійснення R2Y позначає необов'язково заміщений одним C1-C3-алкілом. NH H або , O N H H 10 N H У кращому варіанті здійснення R2Y позначає одним C1-C3-алкілом. , необов'язково заміщений O O N N O O NH NH У кращому варіанті здійснення R2Y позначає або . O O N O N NH 15 20 O NH У кращому варіанті здійснення R2Y позначає або . Краще, якщо R2Y є незаміщеним. Конкретні сполуки, запропоновані у даному винаході, включають: циклопентил-2-(5-(9-гідрокси-1,5,7-триметил-3,7-діазабіцикло[3.3.1]нонан-3карбоніл)піридин-2-іламіно)-N, N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксамід; 2-(5-(2,6-діазаспіро[3.3]гептан-2-карбоніл)піридин-2-іламіно)-7-циклопентил-N, N-диметил7H-піроло[2,3-d]піримідин-6-карбоксамід; диметиламід 7-(4-трет-бутилфеніл)-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-(4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно] 9 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-((1R, 6S)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклогептил-2-[5-(2,5-діазабіцикло[2.2.1]гептан-2-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-8-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; 2-(5-(2,7-діазаспіро[3.5]нонан-7-карбоніл)піридин-2-іламіно)-7-циклогептил-N, N-диметил-7Hпіроло[2,3-d]піримідин-6-карбоксамід; диметиламід 7-циклопентил-2-[5-(8-метил-3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин2-іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; метиламід 7-циклопентил-2-[5-((S, S)-2,5-діазабіцикло[2.2.1]гептан-2-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-(3-трет-бутилфеніл)-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; 2-(5-((1R, 5S)-3-окса-7,9-діазабіцикло[3.3.1]нонан-9-карбоніл)піридин-2-іламіно)-7циклопентил-N, N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксамід; диметиламід 7-[4-(ціанодиметилметил)-феніл]-2-[5-(3,8-діазабіцикло[3.2.1]-октан-8карбоніл)-піридин-2-іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-((1S, 6R)-3,9-діазабіцикло[4.2.1]нонан-3-карбоніл)-піридин2-іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-((1R, 6S)-3,9-діазабіцикло[4.2.1]нонан-3-карбоніл)-піридин2-іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-(3,6-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-(гексагідропіроло[1,2-a]піразин-2-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; 7-циклопентил-N, N-диметил-2-(5-(5'-оксо-8-азаспіро[біцикло[3.2.1]октан-3,3'-піролідин]-1'іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; диметиламід 7-циклопентил-2[5-(1-оксогексагідропіроло[1,2-a]піразин-2-іл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; 7-циклопентил-N, N-диметил-2-(5-(2-оксо-1-окса-3,8-діазаспіро[4.5]декан-3-іл)піридин-2іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; диметиламід 7-циклопентил-2-[5-((1S, 6R)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 2-[5-(4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2-іламіно]-7-феніл-7Hпіроло[2,3-d]піримідин-6-карбонової кислоти; та 7-циклогексил-N, N-диметил-2-(5-(4-оксо-3,9-діазабіцикло[4.2.1]нонан-3-іл)піридин-2іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід. Кращі сполуки, запропоновані у даному винаході, включають сполуки, вибрані з групи, що включає: диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-((S, S)-2,5-діазабіцикло[2.2.1]гептан-2-карбоніл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-((1R, 6S)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-((1S, 5S)-3,6-діазабіцикло[3.2.1]октан-3-карбоніл)-піридин2-іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклобутил-2-[5-((1S, 6R)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклогексил-2-[5-((1R, 6S)-4-оксо-3,9-діазабіцикло[4.2.1]нон-3-іл)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-6-метилпіридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-(3,8-діазабіцикло[3.2.1]октан-3-карбоніл)-4-метилпіридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; диметиламід 7-циклопентил-2-[5-(3,9-діазабіцикло[3.3.1]нонан-3-карбоніл)-піридин-2 10 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; 7-циклопентил-N, N-диметил-2-(5-(3-оксо-1,4-діазабіцикло[3.2.2]нонан-4-іл)піридин-2іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; та 7-циклопентил-N, N-диметил-2-(5-((1R, 6S)-9-метил-4-оксо-3,9-діазабіцикло[4.2.1]нонан-3іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід. Кращі сполуки, запропоновані у даному винаході, включають сполуки, вибрані з групи, що включає: 7-циклопентил-N, N-диметил-2-(5-((3aS, 6aR)-1-оксагексагідропіроло[3,4-c]пірол-2(1H)іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; 7-циклопентил-N, N-диметил-2-(5-((3aR, 6aS)-1-оксагексагідропіроло[3,4-c]пірол-2(1H)іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; 7-циклогептил-N, N-диметил-2-(5-(цис-6-оксотетрагідро-1H-піроло[3,4-c]піридин-5(6H, 7H, 7aH)-іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; 7-циклопентил-N, N-диметил-2-(5-(цис-6-оксотетрагідро-1H-піроло[3,4-c]піридин-5(6H, 7H, 7aH)-іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; 7-циклопентил-N, N-диметил-2-(5-(цис-6-оксотетрагідро-1H-піроло[3,4-c]піридин-5(6H, 7H, 7aH)-іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; та 7-циклопентил-N, N-диметил-2-(5-((3aR, 6aS)-5-метил-1-оксагексагідро-піроло[3,4-c]пірол2(1H)-іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід. Кращі сполуки, запропоновані у даному винаході, включають сполуки, вибрані з групи, що включає: 7-циклопентил-N, N-диметил-2-(5-((1R, 3r, 5S)-2'-оксо-8-азаспіро[біцикло[3.2.1]октан-3,5'оксазолідин]-3'-іл)піридин-2-іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; 7-циклопентил-N, N-диметил-2-(5-(2-оксо-1-окса-3,8-діазаспіро[4.6]ундекан-3-іл)піридин-2іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; 7-циклопентил-N, N-диметил-2-(5-(2-оксо-1-окса-3,7-діазаспіро[4.5]декан-3-іл)піридин-2іламіно)-7H-піроло[2,3-d]піримідин-6-карбоксамід; диметиламід 7-циклопентил-2-[5-((S)-2-оксо-1-окса-3,7-діазаспіро[4.5]дец-3-ил)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти; та диметиламід 7-циклопентил-2-[5-((R)-2-оксо-1-окса-3,7-діазаспіро[4.5]дец-3-ил)-піридин-2іламіно]-7H-піроло[2,3-d]піримідин-6-карбонової кислоти. Терміни та визначення При використанні у даному винаході термін "алкіл" означає повністю насичений розгалужений або нерозгалужений вуглеводневий фрагмент, що містить від 1 до 6 атомів вуглецю (C1-C6-алкіл), від 3 до 7 атомів вуглецю (C3-C7-алкіл), від 1 до 4 атомів вуглецю (C1-C4алкіл) або від 1 до 3 атомів вуглецю (C1-C3-алкіл). Типові приклади алкілів включають, але не обмежуються тільки ними, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, третбутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 3,3-диметилпропіл, гексил, 2метилпентил тощо. При використанні у даному винаході термін "циклоалкіл" означає неароматичні карбоциклічні кільця, які частково або повністю гідровані та можуть являти собою одиничне кільце, біциклічне кільце, трициклічне кільце або спіранове кільце, якщо не зазначено інше, циклоалкіл означає циклічні вуглеводневі групи, що містять 3-14 атомів вуглецю. Циклоалкільні групи також означають циклічні вуглеводневі групи, що містять від 3 до 9 кільцевих атомів вуглецю, або від 4 до 7 кільцевих атомів вуглецю. Типові моноциклічні вуглеводневі групи включають, але не обмежуються тільки ними, циклопропіл, циклобутил, циклопентил, циклопентеніл, циклогексил, циклогексеніл, циклогептил та т. п. Типові біциклічні вуглеводневі групи включають борніл, індил, гексагідроіндил, тетрагідронафтил, декагідронафтил, біцикло[2.1.1]гексил, біцикло[2.2.1]гептил, біцикло[2.2.1]гептеніл, 6,6диметилбіцикло[3.1.1]гептил, 2,6,6-триметилбіцикло[3.1.1]гептил, біцикло[2.2.2]октил та т. п. Типові трициклічне вуглеводневі групи включають адамантил та т. п. "Дейтерій" або "D", або "d" означає ізотоп водню, ядро якого містить один протон та один нейтрон. Якщо зазначено, що у конкретному положенні знаходиться дейтерій, слід розуміти, що вміст дейтерію в цьому положенні більше, ніж природний вміст дейтерію (звичайно 0,015 %). Якщо не зазначено інше, тоді, якщо зазначено, що у положенні знаходиться "D" або "дейтерій", слід розуміти, що в положенні знаходиться дейтерій при вмісті, що перевищує природний вміст дейтерію. При використанні у даному винаході термін "галоген" означає фтор, хлор, бром та йод. При використанні у даному винаході термін "галогеналкіл" означає алкільну групу, у якій щонайменше один атом водню, прижднаний до атому вуглецю алкільної групи, замінений на 11 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 галоген, переважно фтор. Приклади галогеналкільних груп включають моно-, ди-, та трифторметил, моно-, ди-, та трихлорметил, моно-, ди-, три-, тетра- та пентафторетил та моно-, ди-, три-, тетра- та пентахлоретил. При використанні у даному винаході термін "необов'язково заміщений" показує, що група, така як алкіл, циклоалкіл або конкретна група R може бути незаміщеною або містить один або більшу кількість замісників, визначених у даному винаході. Термін "заміщена" застосовний до групи показує, що атом водню, приєднаний до атому групи, є заміщеним. Слід розуміти, що термін "заміщений" включає непряму вказівку на те, що таке заміщення відповідає допустимій валентності заміщеного атому та заміснику; та що заміщення приводить до стабільній сполуці (тобто воно не піддається самовільному перетворенню, наприклад, шляхом перегрупування, циклізації або відщеплення. У деяких варіантах здійснення один атом може містити більше одного заміснику, якщо таке заміщення відповідає допустимій валентності атому. Підходящі замісники визначені у даному винаході для кожної заміщеної або необов'язково заміщеної групи. Термін "сполуки, запропоновані у даному винаході" (якщо спеціально не зазначено інше) означає сполуки формули (I) та їх солі, включаючи фармацевтично прийнятні солі сполук, а також всі стереоізомери (включаючи діастереоізомери та енантіомери), таутомери та ізотопномічені сполуки. Сольвати та гідрати звичайно вважаються фармацевтичними композиціями сполук, запропонованих у даному винаході. При використанні у даному винаході позначення та умови, що використовуються в цих методиках, схемах та прикладах, узгоджуються з використовуваними у сучасній науковій літературі, наприклад, у Journal of the American Chemical Society або the Journal of Biological Chemistry. Якщо не зазначено інше, то всі вихідні речовини одержували від комерційних постачальників та використовували без додаткового очищення. В прикладах та описі можуть використовуватися наступні абревіатури. АЦН ацетонітрил AcOH оцтова кислота BnBr бензилбромід boc трет-бутоксикарбоніл C градуси Цельсія КДІ карбонілдіімідазол КСК камфорсульфонова кислота Cs2CO3 карбонат цезію Да Дальтони ДІБАГ, ДІБАГ-H діізобутилалюмінійгідрид ДІПЕА діізопропілетиламін ДІПК N, N'-діізопропілкарбодіімід ДМФ N, N-диметилформамід ДМІ 1,3-диметил-2-імідазолідинон ПДМ перйодинан Десса-Мартіна ДЦК N, N-дициклогексилкарбодіімід ДХЕ дихлоретан ДХМ дихлорметан ДМАП 4-диметиламінопіридин ДМСО диметилсульфоксид EtOAc етилацетат EtOH етанол екв. еквіваленти г. газоподібна речовина год. година ГАТУ O-(7-азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронійгексафторфосфат ГМФА гексаметилфосфорамід HCl хлористоводнева кислота imid. імідазол K градуси Кельвіна KHMDS гексаметилдисилілазид калію K2CO3 карбонат калію ДАЛ діізопропіламід літію LiBH4 борогідрид літію LHMDS гексаметилдисилазид літію 12 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 РХ рідинна хроматографія РХ/МС рідинна хроматографія - мас-спектроскопія M молярна концентрація MeCN ацетонітрил MeOH метанол MgSO4 сульфат магнію МГц мегагерц хвил. хвилина NaBH4 борогідрид натрію N нормальна концентрація ЯМР ядерний магнітний резонанс Pd/C паладій на вугіллі ПЕГ(750) O-(2-аміноетил)-O'-метилполіетиленгліколь 750; NH2(CH2CH2O)nCH3; CAS# [8050664-5]; Fluka 07964; середня молекулярна маса = 750 ПС полістирол Py піридин част/млн частин на мільйон ОФ обернена фаза КТ кімнатна температура Rt час утримання s тверда речовина ТБС трет-бутилдиметилсиліл ТМС триметилсиліл ТБАФ тетрабутиламонійфторид TBTU O-бензотриазол-1-іл-N, N,N" N’-тетраметилуронійтетрафторборат ТШХ тонкошарова хроматографія ТЕА триетиламін ТФК трифтороцтова кислота ТГФ тетрагідрофуран год. година хвил. хвилина m/z відношення маси до заряду МС мас-спектроскопія ЯМР ядерний магнітний резонанс Спеціаліст у даній галузі техніки повинен розуміти, що можна одержати солі, включаючи фармацевтично прийнятні солі сполук формули (I). При використанні у даному винаході терміни "сіль" або "солі" означає сіль приєднання з кислотою або основою сполуки, запропонованої у даному винаході. Термін "фармацевтично прийнятні солі" означає солі, які зберігають біологічну ефективність та характеристики сполук, запропонованих у даному винаході, та які звичайно не є небажаними у біологічному або іншому відношенні. Тому даний винахід також відноситься до солей, переважно фармацевтично прийнятних солей сполук формули (I). Фармацевтично прийнятні солі приєднання з кислотами, які можна одержати з неорганічними кислотами та органічними кислотами, включають, наприклад, ацетат, аспартат, бензоат, безилат, бромід/гідробромід, бікарбонат/карбонат, бісульфат/сульфат, камфорсульфонат, хлорид/гідрохлорид, хлортеофілонат, цитрат, етандисульфонат, фумарат, глюцептат, глюконат, глюкуронат, гіппурат, гідройодид/йодид, ізетіонат, лактат, лактобіонат, лаурилсульфат, малат, малеат, малонат, манделат, мезилат, метилсульфат, нафтоат, напзилат, нікотинат, нітрат, октадеканоат, олеат, оксалат, пальмітат, памоат, фосфат/гідрофосфат/дигідрофосфат, полігалактуронат, пропіонат, стеарат, сукцинат, сульфосаліцилат, тартрат, тозилат та трифторацетат. Неорганічні кислоти, з яких можна одержати солі, включають, наприклад, хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту та т. п. Органічні кислоти, з яких можна одержати солі, включають, наприклад, оцтову кислоту, пропіонову кислоту, гліколеву кислоту, щавлеву кислоту, малеїнову кислоту, малонову кислоту, бурштинову кислоту, фумарову кислоту, винну кислоту, лимонну кислоту, бензойну кислоту, мигдальну кислоту, метансульфонову кислоту, етансульфонову кислоту, толуолсульфонову кислоту, сульфосаліцилову кислоту та т. п. Фармацевтично прийнятні солі приєднання з основами можна одержати з неорганічними та органічними основами. Неорганічні основи, з яких можна утворювати солі, включають, наприклад, солі амонію та 13 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 металів груп I-XII Періодичної системи. У деяких варіантах здійснення солями є солі натрію, калію, амонію, кальцію, магнію, заліза, срібла, цинку та міді; особливо підходящі солі включають солі амонію, калію, натрію, кальцію та магнію. Органічні основи, з яких можна утворювати солі, включають, наприклад, первинні, вторинні та третинні аміни, заміщені аміни, включаючи природні заміщені аміни, циклічні аміни, основні іонообмінні смоли та т. п. Деякі органічні аміни включають ізопропіламін, бензатин, холін, діетаноламін, діетиламін, лізин, меглумін, піперазин та трометамін. Фармацевтично прийнятні солі, запропоновані у даному винаході, можна синтезувати з вихідної сполуки, основного або кислотного фрагменту за звичайними хімічними методиками. Звичайно такі солі можна одержати за реакцією вільних кислотних форм цих сполук із стехіометричною кількістю відповідної основи (такої як гідроксид, карбонат, бікарбонат та т. п. Na, Ca, Mg або K) або за реакцією вільних основних форм цих сполук із стехіометричною кількістю відповідної кислоти. Такі реакції звичайно проводять у воді або у органічному розчиннику або у їх суміші. Звичайно, якщо це можливо, кращими є неводні середовища, такі як ефір, етилацетат, етанол, ізопропанол або ацетонітрил. Переліки додаткових підходящих солей приведені, наприклад, у публікаціях "Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985); та у "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Сполуки формули (I) можуть містити один або більшу кількість асиметричних центрів (що також називаються хіральними центрами) та тому можуть існувати у вигляді окремих енантіомерів, діастереоізомерів або інших стереоізомерних форм, або у вигляді їх сумішей. Хіральні центри, такі як хіральні атоми вуглецю, також можуть міститися у заміснику, такому як алкільна група. Якщо стереохімічна конфігурація хірального центру, що міститься у формулі (I) або у будь-якій хімічній структурі, приведеній у даному винаході, не вказана, тоді мається на увазі, що структура описує будь-який стереоізомер або їх суміші. Таким чином, сполуки формули (I), що містять один або більшу кількість хіральних центрів, можна використовувати у вигляді рацемічних сумішей, енантіомерно збагачених сумішей або у вигляді енантіомерно чистих окремих стереоізомерів. При використанні у даному винаході термін "ізомери" означає різні сполуки, які мають одну і ту ж молекулярну формулу. Крім того, при використанні у даному винаході термін "оптичний ізомер" або "стереоізомер" означає будь-яку з різних стереоізомерних конфігурацій, які можуть існувати для даної сполуки, запропонованої у даному винаході, та включає геометричні ізомери. Слід розуміти, що замісник може бути приєднаний до атому вуглецю, що є хіральним центром. Тому даний винахід включає енантіомери, діастереоізомери та рацемати сполуки. "Енантіомери" являють собою пару стереоізомерів, які є дзеркальними зображеннями, що не накладаються одне на інше. Суміш двох енантіомерів складу 1:1 називається "рацемічною" сумішшю. Цей термін використовується для позначення рацемічної суміші, якщо це є підходящим. "Діастереоізомери" є стереоізомерами, які містять не менше двох асиметричних атомів, але які не є дзеркальними зображеннями один іншого. Абсолютну стереохімічну конфігурацію описують за допомогою R-S системи Кана-Інгольда-Прелога. Якщо сполука є чистим енантіомером, тоді стереохімічну конфігурацію кожного хірального атому вуглецю можна описати, як R або S. Розділені сполуки, абсолютна конфігурація яких не встановлена, можна описати за допомогою символів (+) або (-) в залежності від напрямку, у якому вони обертають площину поляризації світла при довжині хвилі лінії D натрію (право- та лівообертальні). Деякі сполуки, описані у даному винаході, містять один або більшу кількість асиметричних центрів та тому можуть утворювати енантіомери, діастереоізомери та інші стереоізомерні форми, абсолютну стереохімічну конфігурацію яких можна позначити, як (R)- або (S)-. У обсяг даного винаходу входять всі такі можливі ізомери, включаючи рацемічні суміші, оптично чисті форми та суміші проміжного складу. Оптично активні (R)- та (S)-ізомери можна одержати за допомогою хіральних синтонів або хіральних реагентів або виділити за звичайними методиками. Будь-які отримані рацемати кінцевих продуктів або проміжних продуктів можна розділити на оптичні антиподи за відомими методиками, наприклад, шляхом розділення солей їх діастереоізомерів, отриманих з оптично активною кислотою або основою, виділення оптично активної кислотної або основної сполуки. Зокрема, таким чином можна використовувати фрагмент основи, щоб розділити сполуки, запропоновані у даному винаході, на оптичні антиподи, наприклад, за допомогою фракційної кристалізації солі, утвореної з оптично активною кислотою, наприклад, винною кислотою, дибензоїлвинною кислотою, діацетилвинною кислотою, ди-O, O'-п-толуїлвинною кислотою, мигдальною кислотою, яблучною кислотою або камфор-10-сульфоновою кислотою. Рацемічні продукти також можна розділити за допомогою хіральної хроматографії, наприклад, 14 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 високоефективної рідинної хроматографії (ВЕРХ) з використанням хірального сорбенту. Якщо сполука, запропонована у даному винаході, містить подвійний зв'язок, тоді замісники можуть знаходитися у E або Z конфігурації. Якщо сполука являє собою дизаміщений циклоалкіл, тоді замісники циклоалкілу можуть знаходитися в цис- або транс-конфігурації. Мається на увазі, що у обсяг даного винаходу входять всі таутомерні форми. Будь-який асиметричний атом (наприклад, вуглецю та т. п.) сполуки (сполук), запропонованої у даному винаході, може знаходитися у рацемічній або енантіомерно збагаченій формі, наприклад, у (R)-, (S)- або (R, S)-конфігурації. У деяких варіантах здійснення кожен асиметричний атом характеризується енантіомерним надлишком у (R)- або (S)-конфігурації, що становить не менше 50 %, енантіомерним надлишком, що становить не менше 60 %, енантіомерним надлишком, що становить не менше 70 %, енантіомерним надлишком, що становить не менше 80 %, енантіомерним надлишком, що становить не менше 90 %, енантіомерним надлишком, що становить не менше 95 %, або енантіомерним надлишком, що становить не менше 99 %. Замісники атомів, що утворюють кратний зв'язок, якщо це можливо, можуть знаходитися у цис- (Z)- або транс (E)-формі. З використанням відмінностей фізико-хімічних характеристик компонентів будь-які отримані суміші ізомерів можна розділити на чисті або в основному чисті геометричні або оптичні ізомери, діастереоізомери, рацемати, наприклад, за допомогою хроматографії та/або фракційної кристалізації. 2 Заміщення більш важкими ізотопами, переважно дейтерієм (тобто H або D), може забезпечити деякі терапевтичні переваги, обумовлені їх більш високою метаболічною стабільністю, наприклад, збільшеною тривалістю напіввиведення in vivo або можливістю використання менших доз, або покращенням терапевтичного індексу. Слід розуміти, що у цьому контексті дейтерій розглядається як замісник у сполуці, запропонованій у даному винаході. Концентрацію такого більш важкого ізотопу, зокрема, дейтерію, можна визначити за допомогою коефіцієнта ізотопного збагачення. Термін "коефіцієнт ізотопного збагачення" при використанні у даному винаході означає відношення вмісту ізотопу до вмісту конкретного ізотопу у природі. Якщо замісник у сполуці, запропонованій у даному винаході, означає дейтерій, тоді така сполука характеризується коефіцієнтом ізотопного збагачення для кожного позначеного атому дейтерію, рівним не менше 3500 (вміст дейтерію для кожного позначеного атому дейтерію дорівнює 52,5 %), не менше 4000 (вміст дейтерію дорівнює 60 %), не менше 4500 (вміст дейтерію дорівнює 67,5 %), не менше 5000 (вміст дейтерію дорівнює 75 %), не менше 5500 (вміст дейтерію дорівнює 82,5 %), не менше 6000 (вміст дейтерію дорівнює 90 %), не менше 6333,3 (вміст дейтерію дорівнює 95 %), не менше 6466,7 (вміст дейтерію дорівнює 97 %), не менше 6600 (вміст дейтерію дорівнює 99 %) або не менше 6633,3 (вміст дейтерію дорівнює 99,5 %). Додатково до наведених в даному винаході сполук, що містять дейтерій, мають на увазі, що будь-яка формула, представлена в даному винаході, також характеризує немічені форми, та ізотопно-мічені форми сполук. Ізотопно-мічені сполуки мають структури, зображені формулами, наведеними у даному винаході, з тією відмінністю, що один або більша кількість атомів замінені атомом, що має зазначену атомну масу або масове число. Приклади ізотопів, які можна включити в сполуки, запропоновані у даному винаході, включають ізотопи водню, вуглецю, 2 3 11 13 14 15 18 31 32 35 36 125 азоту, кисню, фосфору, фтору та хлору, такі як H, H, C, C, C, N, F P, P, S, Cl, I відповідно. В об'єм даного винаходу входять різні ізотопно-мічені сполуки, запропоновані у 3 13 14 даному винаході, наприклад, в які включені радіоактивні ізотопи, такі як H, C, та C. Такі 14 ізотопно-мічені сполуки придатні для вивчення метаболізму (що місять C), дослідження 2 3 кінетики реакцій (що місять, наприклад, H або H), в методологіях детектування та візуалізації, таких як позитронна емісійна томографія (ПЕТ) або однофотонна емісійна комп'ютерна томографія (ОФЕКТ), включаючи дослідження розподілення лікарського засобу або субстрату в 18 тканинах або променеву терапію пацієнтів. Зокрема, сполука, що містить F або мічена ним сполука може бути особливо бажаною для досліджень за допомогою ПЕТ або ОФЕКТ. Ізотопномічені сполуки, запропоновані у даному винаході, та їх проліки зазвичай можна отримати за методиками, розкритими в схемах або в прикладах та синтезах, описаних нижче, шляхом заміни реагенту, що не містить ізотопу на легкодоступний ізотопно-мічений реагент. Ізотопно-збагачені сполуки, запропоновані у даному винаході, I зазвичай можна отримати за стандартними методиками, відомими спеціалістам у даній галузі техніки, або за методиками, аналогічними описаним в доданих прикладах та синтезах, шляхом використання відповідного ізотопно-міченого реагенту замість використовуваного раніше неміченого реагенту. Крім того, сполуки, запропоновані у даному винаході, включаючи їх солі, також можна отримати в формі їх гідратів або з включенням інших розчинників, використовуваних для їх кристалізації. Сполуки, запропоновані у даному винаході, за своєю природою або отриманою 15 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 структурою можуть утворювати сольвати з фармацевтично прийнятними розчинниками (включаючи воду); тому в об'єм даного винаходу входять сольватовані та несольватовані форми. Термін "сольват" означає молекулярний комплекс сполуки, запропонованої у даному винаході (включаючи її фармацевтично прийнятні солі) з однією або більшою кількістю молекул розчинника. Такими молекулами розчинника є ті, що зазвичай використовуються в фармацевтиці, для яких відомо, що вони нетоксичні для реципієнту, наприклад, вода, етанол та т. п. Термін "гідрат" означає комплекс, у якому молекулою розчинника є вода. Крім того, фармацевтично прийнятні сольвати в контексті даного винаходу включають такі, в яких розчинник, використаний при кристалізації, може бути ізотопно-заміщеним, наприклад, D2O, d6ацетон, d6-ДМСО. Даний винахід також відноситься до проліків сполук, запропонованих у даному винаході, які in vivo перетворюються в сполуки, запропоновані у даному винаході. Проліки являють собою активну або неактивну сполуку, яка після введення суб'єкту хімічно змінюється внаслідок фізіологічного впливу in vivo, такого як гідроліз, метаболізм та т. п., з перетворенням в сполуку, запропоновану у даному винаході. Методики приготування та застосування проліків та їх придатність добре відомі спеціалістам у даній галузі техніки. Проліки можна за характером розділити на дві не ексклюзивні категорії, проліки-біологічні попередники та проліки-носії. Див. публікацію The Practice of Medicinal Chemistry, Ch. 31-32 (Ed. Wermuth, Academic Press, San Diego, Calif., 2001). Зазвичай проліки-біологічні попередники є сполуками, які неактивні або мають низьку активність у порівнянні з активною лікарською сполукою, та містять одну або більшу кількість захисних груп, і перетворюються в активну форму внаслідок метаболізму або сольволізу. Як активна форма ліків, так і будь-який продукт метаболізму, що вивільниться, повинні мати прийнятно низьку токсичність. Проліки-носії являють собою лікарські сполуки, які містять фрагмент-переносник, наприклад, який покращує усмоктування або локалізує вивільнення в центрі (центрах) дії. Для таких проліків-носіїв бажано, щоб зв'язок між лікарським фрагментом та фрагментом-переносником був ковалентним, проліки були неактивними або менш активними, ніж лікарська сполука, та будь-який фрагмент-переносник, який вивільнюється був в прийнятному ступені нетоксичним. У випадку проліків, для яких фрагмент-переносник призначений для посилення всмоктування, вивільнення фрагменту-переносника зазвичай повинно бути швидким. В інших випадках бажано використовувати фрагмент, який забезпечить повільне вивільнення, наприклад, деякі полімери або інші фрагменти, такі як циклодекстрини. Проліки-носії, наприклад, можна використовувати для покращення однієї або більшої кількості наступних характеристик: збільшення ліпофільності, збільшення тривалості фармакологічного впливу, покращення специфічності на ділянці впливу, зменшення токсичності та побічних реакцій та/або покращення характеристик лікарського препарату (наприклад, стабільності, розчинності в воді, пригнічення небажаних органолептичних або фізико-хімічних характеристик). Наприклад, ліпофільність можна збільшити шляхом етерифікації (a) гідроксигруп ліпофільними карбоновими кислотами (наприклад, карбоновою кислотою, що містить щонайменше один ліпофільний фрагмент) або (b) карбоксигруп ліпофільними спиртами (наприклад, спиртом, що містить щонайменше один ліпофільний фрагмент, наприклад, аліфатичними спиртами). Типовими проліками є, наприклад, ефіри вільних карбонових кислот з S-ацилпохідними тіолів та O-ацилпохідними спиртів або фенолів, де ацил відповідає значенню, визначеному в даному винаході. Придатними проліками часто є фармацевтично прийнятні складні ефіри, які шляхом гідролізу в фізіологічних умовах перетворюються у вихідну карбонову кислоту, наприклад, нижчі алкілові складні ефіри, циклоалкілові складні ефіри, нижчі алкенілові складні ефіри, бензилові складні ефіри, моно- або дизаміщені нижчі алкілові складні ефіри, такі як α(аміно, моно- або ди-нижчі-алкіламіно-, карбокси-, нижчі алкоксикарбоніл)-нижчі алкілові складні ефіри, α-(нижчі алканоїлокси-, нижчі алкоксикарбоніл- або ди-нижчі алкіламінокарбоніл)нижчі алкілові складні ефіри, такі як півалоїлоксиметиловий ефір та т. п, які зазвичай застосовують у даній галузі техніки. Крім того, аміни маскують шляхом утворення арилкарбонілоксиметилпохідних, які in vivo розщеплюються естеразами з вивільненням вільного лікарського засобу та формальдегіду (Bundgaard, J. Med. Chem. 2503 (1989)). Крім того, лікарські засоби, що місять кислу групу NH, таку як імідазольну, імідну, індольну та т. п., маскують за допомогою N-ацилоксиметильних груп (Bundgaard, Design of Prodrugs, Elsevier (1985)). Гідроксигрупи маскують шляхом утворення складних та простих ефірів. В EP 039051 (Sloan and Little) розкриті проліки, які являють собою основи Манніха гідроксамових кислот, їх одержання та застосування. Композиції Іншим об'єктом даного винаходу є фармацевтична композиція, що містить сполуку формули 16 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 (I) або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій. Фармацевтичну композицію можна приготувати для конкретних шляхів введення, таких як пероральне введення, парентеральне введення та ректальне введення та т. п. Крім того, фармацевтичні композиції, запропоновані у даному винаході, можна приготувати в твердій формі (включаючи без накладання обмежень капсули, таблетки, пілюлі, гранули, порошки або супозиторії) або в рідкій формі (включаючи без накладання обмежень розчини, суспензії або емульсії). Фармацевтичні композиції можна піддати звичайній фармацевтичній обробці, такій як стерилізація, та/або вони можуть містить звичайні інертні розріджувачі, змащуючі агенти або буферні агенти, а також допоміжні речовини, такі як консерванти, стабілізатори, змочуючі агенти, емульгатори та буферні агенти та т. п. Зазвичай фармацевтичні композиції є таблетками або капсулами з желатину, що включають активний інгредієнт, а також a) розріджувачі, наприклад, лактозу, декстрозу, сахарозу, маніт, сорбіт, целюлозу та/або гліцин; b) змащуючі агенти, наприклад, діоксид кремнію, тальк, стеаринову кислоту, її магнієву або кальцієву сіль та/або поліетиленгліколь; для таблеток також c) зв'язувальні агенти, наприклад, алюмосилікат магнію, крохмальна паста, желатин, трагакантову камедь, метилцелюлозу, натрієву сіль карбоксиметилцелюлози та/або полівінілпіролідон; за необхідності d) розпушувачі, наприклад, крохмалі, агар, альгінову кислоту або її натрієву сіль, або шипучі суміші; та/або e) абсорбенти, барвники, ароматизатори та підсолоджувачі. На таблетки за методиками, відомими у даній галузі техніки, можна нанести плівкове покриття або ентеросолюбільне покриття. Композиції, придатні для перорального введення, містять сполуку, запропонована у даному винаході, у ефективній кількості у вигляді таблеток, коржів, водних або масляних суспензій, порошків або гранул, що диспергуються, емульсій, твердих або м'яких капсул або сиропів, або еліксирів. Композиції, призначені для перорального застосування, отримують за будь-якою методикою, відомою у даній галузі техніки для приготування фармацевтичних композицій, і такі композиції можуть містити один або більшу кількість агентів, вибраних з групи, що включає підсолоджувачі, ароматизатори, барвники та консерванти, щоб отримати фармацевтично привабливі препарати з приємним смаком. Таблетки можуть містити активний інгредієнт в суміші з нетоксичними фармацевтично прийнятними інертними наповнювачами, які є придатними для виготовлення таблеток. Цими інертними наповнювачами є, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючі та розрихлюючі агенти, наприклад, кукурудзяний крохмаль або альгінова кислота; зв'язуючі агенти, наприклад, крохмаль, желатин або камедь акації; та змащуючі агенти, наприклад, стеарат магнію, стеаринова кислота або тальк. Таблетки не містять покриття або на них за відомими методиками наносять покриття для затримки розпаду та всмоктування в шлунково-кишковому тракті, що забезпечує безперервний вплив протягом більш тривалого періоду часу. Наприклад, можна використовувати таку уповільнюючи речовину, як гліцерилмоностеарат або гліцерилдистеарат. Препарати для перорального застосування також можуть являти собою капсули з твердого желатину, в яких активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або капсули з м'якого желатину, в яких активний інгредієнт змішаний з водою або масляним середовищем, наприклад, арахісовим маслом, рідким парафіном або оливковою олією. Деякі композиції для ін'єкцій являють собою ізотонічні водні розчини або суспензії, а супозиторії переважно готують з емульсій або суспензій жирів. Зазначені композиції можна стерилізувати та/або додавати до них допоміжні речовини, такі як консервучі, змочуючі або емульгуючі агенти, стимулятори розчинення, солі для регулювання осмотичного тиску та/або буферні агенти. Крім того, вони також можуть містити інші терапевтично цінні речовини. Зазначені композиції отримують за звичайними технологіями змішування, гранулювання або нанесення покриттів і вони містять приблизно 0,1-75 % або містять приблизно 1-50 % активного інгредієнту. Композиції, придатні для черезшкірного введення, містять ефективну кількість сполуки, запропонованої у даному винаході, з носієм. Носії, придатні для черезшкірного введення, включають усмоктувальні фармакологічно прийнятні розчинники, що сприяють проникненню через шкіру реципієнта. Наприклад, пристрої для черезшкірного введення являють собою пов'язку, що включає захисний шар, резервуар, що містить сполуку необов'язково з носіями, необов'язково бар'єр, що регулює доставку сполуки через шкіру реципієнта з заданою швидкістю протягом пролонгованого періоду часу, та засобу закріплення пристрою на шкірі. Композиції, придатні для місцевого введення, наприклад, на шкіру або в очі, включають водні розчини, суспензії, мазі, креми, гелі або композиції, що розпилюються, наприклад, для 17 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 подання у вигляді аерозолю та т. п. Такі пристрої місцевої дії є особливо придатними для впливу на шкіру, наприклад, для лікування рака шкіри, наприклад, для використання профілактичних засобів в сонцезахисних кремах, лосьйонах, аерозольних препаратах та т. п. Тому вони є особливо придатними для використання в засобах місцевої дії, включаючи косметичні, добре відомі у даній галузі техніки. Вони можуть містити солюбілізатори, стабілізатори, агенти, що регулюють тонічність, буферні агенти та консерванти. При використанні у даному винаході місцеве введення також може являти собою інгаляційне або назальне введення. Зазвичай його можна провести у вигляді сухого порошку (окремо або у вигляді суміші, наприклад, сухої суміші з лактозою, у вигляді сумішей з компонентами, наприклад, з фосфоліпідами) за допомогою інгалятору для сухих порошків або у вигляді аерозольного спрею, який подають з контейнера, що знаходиться під тиском, за допомогою насосу, розпилюючого пристрою, атомізатору або пристрою типа небулайзер з використанням або без використання прийнятного пропеленту. Даний винахід також відноситься до безводних фармацевтичних композицій та дозованих форм, що включають сполуки, запропоновані у даному винаході, як активні інгредієнти, оскільки вода може сприяти розкладання деяких сполук. Безводні фармацевтичні композиції та дозовані форми, запропоновані у даному винаході, можна отримати з використанням безводних інгредієнтів або інгредієнтів з низькою вологістю в умовах низької вологості. Безводну фармацевтичну композицію можна приготувати та зберігати так, щоб вона залишалась безводною. У відповідності з цим безводні композиції пакують в матеріали, для яких відомо, що вони захищають від впливу води, так щоб їх можна було включити в придатні набори препаратів. Приклади придатних пакувальних засобів включають, але не обмежуються тільки ними, герметично запаювану фольгу, пластмаси, контейнери для разових доз (наприклад, флакони), блістерні упаковки та стрічкові упаковки. Даний винахід також відноситься до фармацевтичних композицій та дозованих форм, які включають один або більшу кількість агентів, які регулюють швидкість, з якою буде розкладатися сполука, запропонована у даному винаході як активний інгредієнт. Такі агенти, які у даному винаході називають "стабілізаторами", включають, але не обмежуються тільки ними, антиоксиданти, такі як аскорбінова кислота, буферні агенти, агенти, що регулюють pH та сольові буферні агенти і т. п. Способи застосування Сполуки, запропоновані у даному винаході, є інгібіторами CDK4/6 і тому можуть бути придатні для лікування захворювань, за яких основна патологія (щонайменше частково) опосередковується CDK4/6. Такі захворювання включають рак та інші захворювання, за яких відбувається порушення проліферації, апоптоз або диференціації клітин. Таким чином, сполуки, запропоновані у даному винаході, можуть бути придатні для лікування пухлин RB+ve (протеїнпозитивна ретинобластома), включаючи пухлини, що місять мутації в Ras, Raf, рецепторах факторів росту або в яких надекспресуються рецептори факторів росту. Сполуки, запропоновані у даному винаході, також можуть бути придатні для лікування пухлин з ампліфікацією генів CDK4 та CDK6, а також, пухлин, в яких надекспресуються партнери циклінів циклінзалежних кіназ. Сполуки, запропоновані у даному винаході, також можуть бути придатні для лікування пухлин RB–ve. Сполуки, запропоновані у даному винаході, також можуть бути придатні для лікування пухлин з генетичними абераціями, які активують активність кінази CDK4/6. Вони включають, але не обмежуються тільки ними, ракові захворювання з транслокаціями D-цикліну, такі як лімфома з клітин зони мантії та множинна мієлома, ампліфікаціями D-цикліну, такі як рак молочної залози та плоскоклітинний рак стравоходу, ампліфікаціями CDK4, такі як ліпосаркома, ампліфікаціями або надекспресуваннями CDK6, такі як T-клітинна лімфома та інактивацією p16, такі як меланома, недрібноклітинний рак легенів та рак підшлункової залози. Для використання у лікуванні також можна розглядати сполуки, запропоновані у даному винаході, які можуть бути придатні для лікування ракових захворювань, які містять генетичні аберації в регуляторах, що знаходяться в оберненому напрямку D-циклінів, де дефекти призводять до збільшення вмісту D-циклінів. Вони включають, але не обмежуються тільки ними, гострий мієлолейкоз з активацією FLT3, ракові захворювання молочної залози з надекспресуванням Her2/neu, незалежністю віт ER або з потрійним негативним фенотипом, ракові захворювання товстої кишки з активуючими мутаціями шляху PI3K або WNT, меланоми з активуючими мутаціями шляху MAPK, недрібноклітинний рак легенів з активуючими абераціями шляху EGFR та ракові захворювання підшлункової залози з активуючими абераціями шляху MAPK, включаючи мутації K-ras. Приклади ракових захворювань, які можна лікувати сполукою, запропонованою у даному 18 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаході, включають, але не обмежуються тільки ними, карциному, наприклад, карциному сечового міхура, молочної залози, товстої кишки (наприклад, колоректальні карциноми, такі як аденокарцинома товстої кишки та карцинома товстої кишки), нирок, епідермісу, печінки, легенів (наприклад, аденокарцинома, дрібноклітинний рак легенів та недрібноклітинні карциноми легенів), стравоходу, жовчного міхура, яєчників, підшлункової залози (наприклад, екзокринна карцинома підшлункової залози), шлунку, шийки матки, щитовидної залози, носа, голови та шиї, передміхурової залози та шкіри (наприклад, плоскоклітинна карцинома). Інші приклади ракових захворювань, які можна лікувати сполукою, запропонованою у даному винаході, включають гематопоетичні пухлини лімфоїдного походження (наприклад, лейкоз, гострий лімфоцитарний лейкоз, лімфома з клітин зони мантії, хронічний лімфоцитарний лейкоз, B-клітинну лімфому (таку як дифузну крупноклітинну B-клітинну лімфому), T-клітинна лімфома, множинна мієлома, ходжкінську лімфому, неходжкінську лімфому, волосатоклітинну лімфому та лімфому Беркітта; гематопоетичні пухлини мієлоїдного походження, наприклад, гострі та хронічні мієлогенні лейкози, мієлодиспластичний синдром та промієлоцитарний лейкоз. Інші ракові захворювання включають фолікулярний рак щитовидної залози; пухлину мезенхімальної етіології, наприклад, фібросаркому або рабдоміосаркому; пухлину центральної або периферичної нервової системи, наприклад, астроцитому, нейробластому, гліому або шванному; меланому; семиному; тератокарциному; остеосаркому; пігментну ксеродерму; ретинобластому; кератокантому; фолікулярний рак щитовидної залози; та саркому Капоші. Одна група ракових захворювань включає ракові захворювання молочної залози людини (наприклад, первинні пухлини молочної залози, рак молочної залози без ураження лімфатичних вузлів, інвазивні аденокарциноми протоків молочної залози, неендометриоїдні ракові захворювання молочної залози); та ракові захворювання ендометрію. Друга підгрупа ракових захворювань, за яких особливу терапевтичну перевагу можуть забезпечити сполуки, що мають інгібуючу активність по відношенню до CDK4/6, включають мультиформну гліобластому, Tклітинний ОЛЛ (гострий лімфоцитарний лейкоз), саркоми, сімейну меланому та меланому. Інгібітори CDK4/6 також можуть бути придатні для лікування вірусних інфекцій, наприклад, викликаних вірусом герпесу, поксвірусом, вірусом Епштейна-Барра, вірусом Сіндбіс, аденовірусом, ВИЛ (вірус імунодефіциту людини), ВПЛ (вірус папіломи людини), HCV (вірус гепатиту С) та ЦМВЛ (цитомегаловірус людини); для попередження розвитку СНІД (синдром набутого імунодефіциту) у інфікованих шляхом ВІЛ індивідуумів; хронічних запальних захворювань, наприклад, системної червоної вовчанки, автоімунно обумовленого гломерулонефриту, ревматоїдного артриту, псоріазу, запальної хвороби кишечнику та автоімунного цукрового діабету; серцево-судинних захворювань, наприклад, гіпертрофії серця, рестенозу, атеросклерозу; нейродегенеративних порушень, наприклад, хвороби Альцгеймера, пов'язаного зі СНІД слабоумства, хвороби Паркінсона, бокового аміотрофічного склерозу, пігментної дегенерації сітчатки, атрофії остистих м'язів та дегенерації мозочку; гломерулонефриту; мієлодиспластичних синдромів, інфарктів міокарда, пов'язаних з ішемічним ураженням, удару та реперфузійного ураження, аритмії, атеросклерозу, викликаних токсином або пов'язаних з алкоголем захворювань печінки, захворювань крові, наприклад, хронічної анемії та апластичної анемії; дегенеративних захворювань опорно-рухового апарату, наприклад, остеопорозу та артриту, чутливого до аспірину риносинуситу, муковісцидозу, розсіяного склерозу, захворювань нирок, захворювань очей, включаючи вікову дегенерацію жовтої плями, увеїту та болю при раці. Способи лікування, запропоновані у даному винаході, включають введення суб'єкту, який потребує такого лікування, сполуки формули (I) або її фармацевтично прийнятної солі у терапевтично ефективній кількості. Окремі варіанти здійснення даного винаходу включають способи лікування будь-якого з зазначених вище порушень або захворювань шляхом введення суб'єкту, який цього потребує, формули (I) або її фармацевтично прийнятної солі у ефективній кількості. Термін "терапевтично ефективну кількість" сполуки, запропонованої у даному винаході, означає кількість сполуки, запропонованої у даному винаході, яка приводить до біологічної або медичної реакції суб'єкта, наприклад, зменшення або інгібування активності ферменту або білку, або полегшує симптоми, полегшує патологічні стани, уповільнює або затримує прогресування захворювання, або попереджає захворювання і т. п. В одному необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" означає кількість сполуки, запропонованої у даному винаході, яка при введенні суб'єкту ефективна (1) щонайменше для часткового послаблення, пригнічення, попередження та/або полегшення протікання патологічного стану або порушення, або захворювання, опосередкованого за допомогою CDK4/6, або (ii) пов'язаного з активністю CDK4/6, або (iii) що характеризується активністю 19 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 (нормальної або аномальної) CDK4/6; або (2) для зменшення або інгібування активності CDK4/6; або (3) для зменшення або інгібування експресії CDK4/6. В іншому необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" означає кількість сполуки, запропонованої у даному винаході, яка при введені в клітину або тканину або в неклітинний біологічний матеріал або середовище ефективна щонайменше для часткового зменшення або інгібування активності CDK4/6; або щонайменше для часткового зменшення або інгібування експресії CDK4/6. Значення терміну "терапевтично ефективна кількість", проілюстроване для наведеного вище варіанту здійснення CDK4/6, таким само чином стосується будь-яких інших відповідних білків/пептидів/ферментів. При використанні у даному винаході термін "суб'єкт" означає тварину. Зазвичай твариною є ссавець. Суб'єкт також означає наприклад, приматів (наприклад, людей, чоловіків та жінок), корів, овець, кіз, коней, собак, кішок, кроликів, щурів, мишей, риб, пташок і т. п. У деяких варіантах здійснення суб'єктом є примат. В інших варіантах здійснення суб'єктом є людина. При використанні у даному винаході термін "лікує" або "лікування" будь-якого захворювання або порушення у одному варіанті здійснення означає покращення протікання захворювання або порушення (тобто уповільнення або зупинку або послаблення розвитку захворювання або щонайменше одного з його клінічних симптомів). У іншому варіанті здійснення "лікує" або "лікування" означає покращення щонайменше одного фізичного параметру, включаючи ті, які можуть не відчуватися пацієнтом. У ще одному варіанті здійснення "лікує" або "лікування" означає зміну протікання захворювання або порушення, фізичну (наприклад, стабілізацію симптому, що проявляється), або фізіологічну, (наприклад, стабілізацію фізикального параметру), або як одне так і інше. У ще одному варіанті здійснення "лікує" або "лікування" означає попередження або затримку початку або розвитку, або прогресування захворювання або порушення. При використанні у даному винаході суб'єкт "потребує" лікування, якщо лікування зробить на такий суб'єкт сприятливий біологічний або медичний вплив або покращить якість його життя. Фармацевтична композиція або комбінація, запропонована у даному винаході, може містити у разовій дозі приблизно 1-1000 мг активних інгредієнтів для суб'єкта масою приблизно 50-70 кг або приблизно 1-500 мг, або приблизно 1-250 мг, або приблизно 1-150 мг, або приблизно 0,5100 мг, або приблизно 1-50 мг активних інгредієнтів. Терапевтично ефективна доза сполуки, фармацевтичної композиції або їх комбінацій залежить від виду суб'єкта, маси тіла, віку та індивідуального стану, порушення або захворювання, що піддається лікуванню, та його важкості. Лікар, клініцист або ветеринар із загальною підготовкою повинен легко визначити ефективну кількість кожного з активних інгредієнтів, необхідну для попередження, лікування або пригнічення прогресування порушення або захворювання. Зазначені вище характеристики доз можна визначити за допомогою проведених in vitro та in vivo досліджень, переважно з використанням ссавців, наприклад, мишей, щурів, собак, мавп, або ізольованих органів, тканин та їх препаратів. Сполуки, запропоновані у даному винаході, можна використовувати in vitro у вигляді розчинів, наприклад, переважно водних розчинів, та in vivo ентерально, парентерально, переважно внутрішньовенно, наприклад, у вигляді суспензії -3 -9 або водного розчину. Доза in vitro може знаходитися у діапазоні приблизно від 10 до 10 М. Терапевтично ефективна кількість in vivo в залежності від шляху введення може знаходитися у діапазоні приблизно 0,1-500 мг/кг, переважно приблизно 1-100 мг/кг. Одним варіантом здійснення даного винаходу є спосіб модулювання активності CDK4/6 у суб'єкта, що включає введення суб'єкту сполуки формули (I) або її фармацевтично прийнятної солі у терапевтично ефективній кількості. Іншим варіантом здійснення даного винаходу є спосіб лікування порушення або захворювання, опосередкованого за допомогою CDK4/6 у суб'єкта, який цього потребує, що включає введення суб'єкту сполуки формули (I) або її фармацевтично прийнятної солі у терапевтично ефективній кількості. Іншим варіантом здійснення даного винаходу є спосіб лікування порушення або захворювання, опосередкованого за допомогою CDK4/6, у суб'єкта, який потребує лікування, що включає введення сполуки формули (I) або її фармацевтично прийнятної солі у терапевтично ефективній кількості, у якому порушення або захворювання вибране з групи, що включає карциноми з генетичними абераціями, які активують активність кінази CDK4/6. Вони включають, але не обмежуються тільки ними, ракові захворювання з транслокаціями D-цикліну, такі як лімфома з клітин зони мантії та множинна мієлома, ампліфікаціями D-цикліну, такі як рак молочної залози та плоскоклітинний рак стравоходу, ампліфікаціями CDK4, такі як ліпосаркома, ампліфікаціями або надекспресуваннями CDK6, такі як T-клітинна лімфома та інактивацією p16, такі як меланома, недрібноклітинний рак легенів та рак підшлункової залози. 20 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 Іншим варіантом здійснення даного винаходу є застосування сполуки формули (I) або її фармацевтично прийнятної солі для лікування порушення або захворювання, опосередкованого за допомогою CDK4. Іншим варіантом здійснення даного винаходу є застосування сполуки формули (I) або її фармацевтично прийнятної солі для лікування у суб'єкта порушення або захворювання, опосередкованого за допомогою CDK4, у якому порушення або захворювання вибране з групи, що включає карциноми з генетичними абераціями, які активують активність кінази CDK4/6. Вони включають, але не обмежуються тільки ними, ракові захворювання з транслокаціями D-цикліну, такі як лімфома з клітин зони мантії та множинна мієлома, ампліфікаціями D-цикліну, такі як рак молочної залози та плоскоклітинний рак стравоходу, ампліфікаціями CDK4, такі як ліпосаркома, ампліфікаціями або надекспресуваннями CDK6, такі як T-клітинна лімфома та інактивацією p16, такі як меланома, недрібноклітинний рак легенів та рак підшлункової залози. Іншим варіантом здійснення даного винаходу є сполука формули (I) або її фармацевтично прийнятна сіль, призначена для застосування як лікарський засіб. Іншим варіантом здійснення даного винаходу є застосування сполуки формули (I) або її фармацевтично прийнятної солі для приготування лікарського засобу, призначеного для лікування порушення або захворювання, опосередкованого за допомогою CDK4/6, у якому порушення або захворювання вибране з групи, що включає карциноми з генетичними абераціями, які активують активність кінази CDK4/6. Вони включають, але не обмежуються тільки ними, ракові захворювання з транслокаціями D-цикліну, такі як лімфома з клітин зони мантії та множинна мієлома, ампліфікаціями D-цикліну, такі як рак молочної залози та плоскоклітинний рак стравоходу, ампліфікаціями CDK4, такі як ліпосаркома, ампліфікаціями або надекспресуваннями CDK6, такі як T-клітинна лімфома та інактивацією p16, такі як меланома, недрібноклітинний рак легенів та рак підшлункової залози. Комбінації Сполуки, запропоновані у даному винаході, можна вводити одночасно з одним або більшою кількістю інших терапевтичних засобів або до або після їх введення. Сполуки, запропоновані у даному винаході, можна вводити окремо, таким же або іншим шляхом введення, або разом у одній і тій же фармацевтичній композиції з іншими засобами. У одному варіанті здійснення даний винахід відноситься до продукту, що містить сполуку формули (I) або її фармацевтично прийнятну сіль та щонайменше один інший терапевтичний засіб, у вигляді об'єднаного препарату для одночасного, окремого або послідовного застосування для лікування. У одному варіанті здійснення лікуванням є лікування захворювання або патологічного стану, опосередкованого інгібуванням CDK4/6. Продукти, що являють собою об'єднаний препарат, включають композицію, що містить сполуку, запропоновану у даному винаході, та інший терапевтичний засіб (засоби) разом у одній фармацевтичній композиції, або сполуку, запропоновану у даному винаході, та інший терапевтичний засіб (засоби) у розділеній формі, наприклад, у формі набору. У одному варіанті здійснення даний винахід відноситься до фармацевтичної композиції, що містить сполуку формули (I) або її фармацевтично прийнятну сіль та інший терапевтичний засіб (засоби). Фармацевтична композиція необов'язково може містити фармацевтично прийнятний інертний наповнювач, описаний вище. У одному варіанті здійснення даний винахід відноситься до набору, що містить дві або більшу кількість окремих фармацевтичних композицій, щонайменше одна з яких містить сполуку формули (I) або її фармацевтично прийнятну сіль. У одному варіанті здійснення набір включає пристосування для окремого зберігання зазначених композицій, таке як контейнер, розділений флакон або розділений пакет з фольги. Прикладом такого набору є блістерна упаковка, яку зазвичай використовують для пакування таблеток, капсул тощо. Набір, запропонований у даному винаході, можна застосовувати для введення різних дозованих форм, наприклад, перорально та парентерально, для введення окремих композицій з різними інтервалами, або для запобігання взаємодії окремих композицій однієї від іншої. Щоб сприяти дотриманню пацієнтом режиму лікування, набір, запропонований у даному винаході, зазвичай включає настанови щодо введення. В комбінованій терапії, запропонованій у даному винаході, сполука, запропонована у даному винаході, та інший терапевтичний засіб можуть бути виготовлені та/або приготовлені одним і тим же або різними виробниками. Крім того, сполука, запропонована у даному винаході, та інший терапевтичний засіб можуть бути об'єднані у комбінованому засобі: (i) до передачі комбінованого продукту лікарям (наприклад, у випадку набору, що включає сполуку, запропоновану у даному винаході, та інший терапевтичний засіб); (ii) самими лікарями (або під керівництвом лікаря) незадовго до введення; (iii) у самому пацієнті, наприклад, під час 21 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовного введення сполуки, запропонованої у даному винаході, та іншого терапевтичного засобу. У відповідності з цим даний винахід відноситься до застосування сполуки формули (I) або її фармацевтично прийнятної солі для лікування захворювання або патологічного стану, опосередкованого інгібуванням CDK4/6, у якому лікарський засіб приготовлено для введення разом з іншим терапевтичним засобом. Даний винахід також відноситься до застосування іншого терапевтичного засобу для лікування захворювання або патологічного стану, опосередкованого інгібуванням CDK4/6, при якому лікарський засіб вводять разом із сполукою, запропонованою у даному винаході. Даний винахід також відноситься до сполуки формули (I) або її фармацевтично прийнятної солі, призначеної для застосування у способі лікування захворювання або патологічного стану, опосередкованого інгібуванням CDK4/6, у якому сполуку формули (I) приготовлено для введення разом з іншим терапевтичним засобом. Даний винахід також відноситься до іншого терапевтичного засобу, призначеного для застосування у способі лікування захворювання або патологічного стану, опосередкованого інгібуванням CDK4/6, у якому інший терапевтичний засіб приготовлено для введення разом із сполукою формули (I) або її фармацевтично прийнятною сіллю. Даний винахід також відноситься до сполуки формули (I) або її фармацевтично прийнятної солі, призначеної для застосування у способі лікування захворювання або патологічного стану, опосередкованого інгібуванням CDK4/6, у якому сполуку формули (I) або її фармацевтично прийнятну сіль вводять разом з іншим терапевтичним засобом. Даний винахід також відноситься до іншого терапевтичного засобу, призначеного для застосування у способі лікування захворювання або патологічного стану, опосередкованого інгібуванням CDK4/6, у якому інший терапевтичний засіб вводять разом із сполукою формули (I). Даний винахід також відноситься до застосування сполуки формули (I) або її фармацевтично прийнятної солі для лікування захворювання або патологічного стану, опосередкованого за допомогою CDK4/6, при якому пацієнту попередньо (наприклад, не пізніше, ніж за 24 год.) вводили інший терапевтичний засіб. Даний винахід також відноситься до застосування іншого терапевтичного засобу для лікування захворювання або патологічного стану, опосередкованого за допомогою CDK4/6, при якому пацієнта попередньо (наприклад, не пізніше, ніж за 24 год.) лікували сполукою формули (I) або її фармацевтично прийнятною сіллю. У одному варіанті здійснення інший терапевтичний засіб вибрано з групи, що включає протизапальний, антипроліферативний, хіміотерапевтичний засіб, імунодепресант, протираковий, цитотоксичний засіб або інгібітор кінази, що не є сполукою, запропонованою у даному винаході, або її сіллю. Інші приклади засобів, які можна вводити у комбінації зі сполуками, запропонованими у даному винаході, включають, але не обмежуються тільки ними, інгібітор PTK, циклоспорин A, CTLA4-Ig, антитіла, вибрані з групи, що включає антитіла до ICAM-3, антитіла до рецептору IL-2, антитіла до CD45RB, антитіла до CD2, антитіла до CD3, антитіла до CD4, антитіла до CD80, антитіла до CD86 та моноклональні антитіла OKT3, засоби, що блокують взаємодію між CD40 та gp39, білки злиття, утворені з CD40 та gp39, інгібітори NFкапа B функції, нестероїдні протизапальні лікарські засоби, стероїди, сполуки золота, антипроліферативні засоби, FK506, мікофенолятмофетил, цитотоксичні лікарські засоби, інгібітори TNF-α, антитіла до TNF або до розчинного рецептору TNF, рапаміцин, інгібітори mTor, лефлунімід, інгібітори циклооксигенази-2, паклітаксел, цисплатин, карбоплатин, доксорубіцин, карміноміцин, даунорубіцин, аміноптерин, метотрексат, метоптерин, мітоміцин C, ектеїнасцидин 743, порфіроміцин, 5-фторурацил, 6-меркаптопурин, гемцитабін, цитозинарабінозид, подофілотоксин, етопозид, етопозид фосфат, теніпозид, мелфалан, вінбластин, вінкристин, лейрозидин, епотилон, віндезин, лейрозин, інгібітор B-Raf, інгібітор MEK інгібітор, PI3K, інгібітор HSP90, інгібітор CDK1, інгібітор CDK2, інгібітор CDK5, інгібітор CDK7, інгібітор CDK8, інгібітор CDK9, інгібітор EGFR, інгібітор FGFR, інгібітор PDGFR, інгібітор Her2/neu, інгібітор FLT3, антагоністи андрогену, глюкокортикоїди та рецептори простерону, інгібітор SMO, інгібітор WNT, інгібітор Bcl, інгібітор IAP, інгібітор Mcl, інгібітор MDM2, інгібітор p52, інгібітори протеосоми (Велкаде) або їх похідні. Конкретні окремі комбінації, які можуть забезпечити конкретні терапевтичні переваги, включають сумісне лікування пацієнтів, що страждають на лімфому з клітин зони мантії або рак підшлункової залози, інгібіторами mTOR, такими як еверолімус. Сполуку, запропоновану у даному винаході, також можна використовувати у комбінації з іншими засобами, наприклад, з додатковим інгібітором протеїнкінази, який є або не є сполукою, запропонованою у даному винаході, для лікування у суб'єкта порушення, пов'язаного з протеїнкіназою. Термін "комбінація" означає фіксовану комбінацію у одній разовій дозованій формі або набір компонентів для сумісного введення, при якому сполука, запропонована у 22 UA 108369 C2 5 10 15 20 25 30 35 даному винаході, та компонент комбінації можна вводити незалежно у один і той же час або окремо через проміжки часу, що, зокрема приводить до того, що компоненти комбінації проявляють сумісний, наприклад, синергетичний вплив або будь-яку їх комбінацію. Сполуки, запропоновані у даному винаході, можна вводити одночасно або послідовно, з протизапальним, антипроліферативним, хіміотерапевтичним засобом, імунодепресантом, протираковим, цитотоксичним засобом або інгібітором кінази, що не є сполукою формули I або її фармацевтично прийнятною сіллю. Інші приклади засобів, які можна вводити у комбінації зі сполуками, запропонованими у даному винаході, включають, але не обмежуються тільки ними, PTK інгібітор, циклоспорин A, CTLA4-Ig, антитіла, вибрані з групи, що включає антитіла до ICAM-3, антитіла до рецептору IL-2, антитіла до CD45RB, антитіла до CD2, антитіла до CD3, антитіла до CD4, антитіла до CD80, антитіла до CD86 та моноклональні антитіла OKT3, засоби, що блокують взаємодію між CD40 та gp39, білки злиття, утворені з CD40 та gp39, інгібітори NFкапа B функції, нестероїдні протизапальні лікарські засоби, стероїди, сполуки золота, антипроліферативні засоби, FK506, мікофенолятмофетил, цитотоксичні лікарські засоби, інгібітори TNF-α, антитіла до TNF або до розчинного рецептору TNF, рапаміцин, лефлунімід, інгібітори циклооксигенази-2, паклітаксел, цисплатин, карбоплатин, доксорубіцин, карміноміцин, даунорубіцин, аміноптерин, метотрексат, метоптерин, митоміцин C, ектеїнасцидин 743, порфіроміцин, 5-фторурацил, 6-меркаптопурин, гемцитабін, цитозинарабінозид, подофілотоксин, етопозид, етопозид фосфат, теніпозид, мелфалан, вінбластин, вінкристин, лейрозидин, епотилон, віндезин, лейрозин або їх похідні. Сполука, запропонована у даному винаході, та будь-який додатковий засіб можна приготувати в окремих дозованих формах. Альтернативно, для зменшення кількості дозованих форм, що вводять пацієнту, сполуку, запропоновану у даному винаході, та будь-який додатковий засіб можна приготувати разом у будь-якій комбінації. Наприклад, сполуку-інгібітор, запропоновану у даному винаході, можна приготувати у одній дозованій формі та додатковий засіб можна приготувати разом у іншій дозованій формі. Будь-які окремі дозовані форми можна вводити одночасно або у різні моменти часу. Альтернативно, композиція, запропонована у даному винаході, містить додатковий засіб, описаний у даному винаході. Кожен компонент може міститися у окремих композиціях, комбінаціях композицій або у одній композиції. Загальні методики синтезу та проміжні продукти Загальна методика N-C сполучення 1 або R R R 10 9 R R N N R O 8 9 R R HN N N N R A R 10 N N NH2 N N Cl 4 4 8 O 1 N 1 A L 2Y R L 2Y R Структура 1 40 Структура 2 Формула (I) У підходящій посудині для проведення реакції у підходящому розчиннику (такому як, але не обмежуючись тільки ним, діоксан) об'єднували сполуки структури 1 (1 екв.) та сполуки загальної структури 2 (1 екв.). До цього отриманого розчину додавали ацетат паладію(II) (0,1 екв.), ліганд, такий як БІНАФ (2,2'-біс(дифенілфосфіно)-1,1'-бінафтил), XPhos або XantPhos (0,15 екв.), та карбонат цезію (1,5 екв.). Потім через реакційну суміш обережно пропускали азот (приблизно 23 UA 108369 C2 5 10 15 20 25 30 35 від 5 до 10 хвил.). Потім отриману реакційну суміш нагрівали на масляній бані або у 0 мікрохвильовій печі при температурі, рівній приблизно від 100 до 130 C, протягом підходящого періоду часу, поки аналіз за допомогою ТШХ або ВЕРХ МС не показував, що реакція закінчилася. Реакційну суміш усували від джерела тепла та їй давали охолодитися. Потім суміш обробляли шляхом додавання підходящого розчиннику, такого як дихлорметан або етилацетат. Нерозчинні речовини видаляли фільтруванням та органічний фільтрат екстрагували водою. Водну фазу піддавали зворотній екстракції. Органічні фази об'єднували, сушили над сульфатом натрію або магнію, фільтрували та концентрували та отримували залишок. Неочищений залишок очищали за допомогою хроматографії на силікагелі з використанням підходящої рухомої фази, що давало шуканий проміжний продукт або сполуку формули (I). Методика відновлення нітрогрупи 1 У підходящу посудину для проведення реакції поміщали сполуку структури 3. Для розчинення сполуки структури 3 використовували підходящий розчинник, такий як метанол, етилацетат, тетрагідрофуран або суміші цих розчинників. До цієї отриманої суміші та у потоці азоту додавали каталізатор, такий як паладій на вугіллі або гідроксид паладію (вміст металу на вугіллі або підходящій підкладці становить від 5 до 20 %) від 5 до 10 мол. % у перерахунку на вміст структури 3. Потім отриману суміш продували та перемішували у атмосфері водню. Після того, як за даними ТШХ або РХ/МС вся вихідна речовина перетворювалася у продукт, посудину для проведення реакції від'єднували від джерела водню та продували азотом для видалення решти водню. Реакційну суміш фільтрували через шар целіту у потоці азоту та промивали додатковою кількістю розчиннику, такого як дихлорметан або метанол. Фільтрати об'єднували та концентрували та отримували залишок. Залишок сушили у вакуумі до сталої маси. Отриману речовину використовували без обробки у наступній реакції або очищали за допомогою перекристалізації або хроматографії на силікагелі та потім використовували у наступній реакції. Методики одержання амідів формули 1 Приведені нижче загальні методики використовували для сполучення карбонових кислот структури 5 з амінами з одержанням відповідних амідів структури 6. Загальна методика одержання аміду 1 До розчину карбонової кислоти (1,01 ммоля) у ДМФА (5 мл) додавали O-(бензотриазол-1-іл)N, N,N",N’-тетраметилуронійгексафторфосфат (HBTU, 580 мг, 1,53 ммоля, 1,5 екв.) та N, Nдіізопропілетиламін (0,55 мл, 3,0 екв.) та отриману суміш перемішували при кімнатній температурі протягом приблизно 5 хвил. До отриманої суміші додавали амін (1,18 ммоля. 1,1 екв.). Отриману суміш перемішували при кімнатній температурі протягом підходящого періоду 24 UA 108369 C2 5 10 15 20 25 30 35 40 45 50 55 60 часу, необхідного для закінчення реакції за даними ТШХ або РХ/МС, та потім розводили етилацетатом та послідовно промивали за допомогою 0,5M HCl, водою, сушили над Na2SO4, фільтрували та концентрували. Шукану сполуку відразу використовували на наступній стадії без додаткового очищення або очищали за допомогою хроматографії на силікагелі з використанням підходящої рухомої фази та потім відразу використовували у наступній реакції. Загальна методика одержання аміду 2 До розчину карбонової кислоти (у вигляді солі з 5 екв. LiCl) (1 ммоль, 1 екв.) у ДМФА (5 мл) додавали O-(бензотриазол-1-іл)-N, N,N",N’-тетраметилуронійгексафторфосфат (HBTU, 580 мг, 1,53 ммоля, 1,5 екв.) та N, N-діізопропілетиламін (0,55 мл, 3,0 екв.) та отриману суміш перемішували при кімнатній температурі протягом приблизно 5 хвил. До отриманої суміші додавали амін (1,18 ммоля. 1,1 екв.). Суміш перемішували при кімнатній температурі протягом підходящого періоду часу, необхідного для закінчення реакції за даними ТШХ або РХ/МС, та потім розводили етилацетатом та послідовно промивали за допомогою 0,5M HCl, водою, сушили над Na2SO4, фільтрували та концентрували. Шукану сполуку використовували відразу на наступній стадії без додаткового очищення або очищали за допомогою хроматографії на силікагелі з використанням підходящої рухомої фази та потім відразу використовували у наступній реакції. Загальна методика одержання аміду 3 До розчину карбонової кислоти (1 екв., яка містила 5 екв. LiCl) у 1 мл ДМА (диметилацетамід) або ДМФА додавали O-(бензотриазол-1-іл)-N, N,N",N’тетраметилуронійтетрафторборат (TBTU, 1 екв.) та отриманий розчин перемішували протягом приблизно 10 хвил. Потім додавали ще 3 мл дихлорметану (кінцева концентрація ~0,03M), амін (1 екв.) та ДІПЕА (4 екв.) та перемішували при КТ, поки за даними ТШХ або РХ/МС реакція не закінчилася. Реакційну суміш розводили дихлорметаном, промивали водою та потім сольовим розчином. Об'єднані водні шари піддавали зворотній екстракції дихлорметаном. Об'єднані органічні шари сушили над сульфатом натрію або сульфатом магнію, потім фільтрували, потім концентрували та на кінець очищали за допомогою колонкової хроматографії на силікагелі з використанням підходящої рухомої фази та потім відразу використовували у наступній реакції. Загальна методика одержання аміду 4 До суспензії/розчину суміші карбонової кислоти (з 5 екв. LiCl) (1 екв.) у ДМА/ДХМ (1:4, 0,07M) додавали O-(бензотриазол-1-іл)-N, N,N",N’-тетраметилуронійтетрафторборат (TBTU, 1,5 екв., загальна методика B1) або O-(бензотриазол-1-іл)-N, N,N",N’тетраметилуронійгексафторфосфат (HBTU, 1,5 екв., загальна методика B2) та отриману суміш перемішували при кімнатній температурі протягом 5 хвил. Реакційну суміш обробляли розчином аміну (1 екв.) в суміші ДМА/ДХМ (1:4, 0,07M) або суспензією солі з HCl аміну (1,0 екв.) та бікарбонату натрію (1,5 екв.) в суміші ДМА/ДХМ (1:4, 0,07M). Отриману суміш обробляли N, Nдіізопропілетиламіном (4,0 екв.) та перемішували при кімнатній температурі протягом 1 год. Реакційну суміш розводили етилацетатом, промивали водою, сушили над Na 2SO4, фільтрували та концентрували. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі з використанням підходящої рухомої фази та потім використовували у наступній реакції. Загальні методики видалення захисних груп з проміжних продуктів З проміжних продуктів, які містили захисні групи, необхідні для синтезу сполук формули (I), ці захисні групи видаляли за стандартними методиками, описаними у публікації "Protective rd Groups in Organic Synthesis, 3 Edition, by Green and Wutts. Методика видалення захисної групи 1: Видалення BOC за допомогою HCl При перемішуванні до розчину аміну, що містить захисну групу BOC, - сполуки формули 1 (1 ммоль) у дихлорметані (4 мл) або іншому підходящому розчиннику при кімнатній температурі додавали 4M розчин HCl у діоксані (2,54 мл, 10,2 ммоля, 10 екв.). Реакційну суміш перемішували при кімнатній температурі, поки за даними РХ/МС або ТШХ не вичерпалася вся вихідна речовина. Потім реакційну суміш фільтрували та промивали розчинником, таким як дихлорметан, етилацетат або діетиловий ефір. Залишок збирали та переносили у воду, підлужували за допомогою 1M NaOH та екстрагували дихлорметаном або сумішшю 20 % ізопропіловий спирт-дихлорметан. Об'єднані органічні шари сушили над Na 2SO4, фільтрували та концентрували при зниженому тиску та отримували залишок. Неочищений залишок очищали за допомогою хроматографії на силікагелі з використанням підходящої рухомої фази та потім відразу використовували у наступній реакції. Методика видалення захисної групи 2: Видалення BOC за допомогою трифтороцтової кислоти При перемішуванні до холодного 0 °C розчину аміну, що містить захисну групу BOC, 25 UA 108369 C2 5 10 15 20 25 30 35 сполуки формули 1 (1 ммоль) у дихлорметані (4 мл) або іншому підходящому розчиннику 0 додавали 4 мл безводної трифтороцтової кислоти. Реакційну суміш перемішували при 0 C та їй давали нагрітися до кімнатної температури та перемішували, поки за даними РХ/МС або ТШХ не вичерпалася вся вихідна речовина. Потім реакційну суміш концентрували у вакуумі та отримували в'язкий залишок. Залишок екстрагували сумішшю дихлорметану та насиченого розчину бікарбонату натрію. Водний розчин піддавали зворотній екстракції дихлорметаном. У випадку дуже полярних амінів як розчинник для екстракції органічних речовин використовували суміш 20 % ізопропіловий спирт-дихлорметан. Органічні фракції об'єднували та сушили над Na2SO4, фільтрували та концентрували при зниженому тиску та отримували залишок. Об'єднані органічні шари сушили над сульфатом натрію або магнію, фільтрували та концентрували при зниженому тиску та отримували залишок. Неочищений залишок очищали за допомогою хроматографії на силікагелі з використанням підходящої рухомої фази та потім відразу використовували у наступній реакції. Методика видалення захисної групи 3: Видалення BOC за допомогою трифтороцтової кислоти Розчин аміну, що містить захисну групу BOC, - сполуки формули 1 в CH2Cl2 (0,1M) при кімнатній температурі обробляли таким же об'ємом трифтороцтової кислоти та перемішували при кімнатній температурі протягом 1,0 год. Реакційну суміш концентрували у вакуумі та обробляли порціями 7 н. NH3 у MeOH до нейтральної реакції суміші. Отриману суміш концентрували та отримували в'язкий залишок. Потім отриманий залишок очищали за допомогою препаративної ВЕРХ або хроматографії на силікагелі з використанням 7 н. NH3 у MeOH/CH2Cl2 та потім відразу використовували у наступній реакції. Загальна методика відновного амінування Сполуку формули (I) (1 екв.), що містить первинну або вторинну аміногрупу, разом з надлишком (від 3 до 8 екв.) альдегіду (наприклад, формальдегіду, 37 % водний розчин) або кетону (наприклад, ацетону) об'єднували у підходящому розчиннику, такому як тетрагідрофуран, та перемішували при КТ протягом 1 год. над сульфатом магнію (1 екв.). Потім однією порцією додавали триацетоксиборогідрид натрію (2 екв.) та реакційну суміш перемішували, поки за даними ТШХ або РХ/МС не вичерпалася вся вихідна речовина. Потім реакцію зупиняли та переносили у етилацетат, нейтралізували насиченим розчином Na2CO3, та промивали сольовим розчином. Водні шари піддавали зворотній екстракції етилацетатом. Органічні шари об'єднували та сушили над Na2SO4. У випадку дуже полярних амінів як розчинник для екстракції використовували розчин 20 % ізопропанол-хлороформ. Леткі речовини видаляли та отриманий залишок очищали за допомогою хроматографії на силікагелі з використанням підходящої рухомої фази, що давало шуканий кінцевий продукт. Методики одержання проміжних продуктів, 2-хлор-7 R1-N, N-диметил-7H-піроло[2,3d]піримідин-6-карбоксамідів. O N Cl N N N 1 R 40 2 хлор-7 R2-N, N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксамід Проміжний продукт 1: O N Cl N N N Одержання 2-хлор-7-циклогептил-N, N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксаміду Стадія 1 26 UA 108369 C2 5 10 15 20 25 30 35 До розчину 5-бром-2,4-дихлорпіримідину (13,41 г, 58,8 ммоля) у EtOAc (100 мл) додавали ДІПЕА (13 мл, 1,3 екв.), потім циклогептанамін (8,6 мл, 1,1 екв.) та отриману суміш перемішували при кімнатній температурі протягом 5 днів. Реакційну суміш розводили за допомогою EtOAc (350 мл), промивали водою (100 мл), сольовим розчином (2100 мл), сушили над Na2SO4, фільтрували та концентрували. Неочищений продукт (18,1 г) використовували у 1 наступній реакції без очищення. H ЯМР (400 МГц, CD3OD) 8,10 (s, 1 H), 4,17 (септет, J=4,6 Гц, + 1 H), 1,94 (m, 2 H), 1,77 – 1,51 (m, 10 Гц); МС m/z 305,3 (M+H) Стадія 2 Одержання 3-(2-хлор-4-(циклогептиламіно)піримідин-5-іл)проп-2-ін-1-олу До жовтого розчину 5-бром-2-хлор-N-циклогептилпіримідин-4-аміну (18,1 г, 55,5 ммоля) у ТГФ (200 мл) додавали пропаргіловий спирт (4,5 мл, 1,4 екв.) та розчин тетрабутиламонійфториду у ТГФ (1 M, 130 мл, 2,3 екв.) та отриману коричневу суміш обробляли потоком азоту протягом 15 хвил. (пропускали через розчин). Потім суміш обробляли біс(трифенілфосфін)паладій(II)хлоридом (2,09 г, 0,054 екв.) та кип'ятили із зворотним холодильником протягом 5 год. Після охолодження, реакційну суміш фільтрували через шар целіту (промивали за допомогою EtOAc ~350 мл). Фільтрат концентрували для видалення ТГФ, додатково розводили за допомогою EtOAc (повний об'єм 250 мл), промивали насиченим розчином NaHCO3 (2150 мл) та водою (150 мл), сушили над Na2SO4, фільтрували та концентрували. Розтирання залишку з ацетоном та CH2Cl2 давало 3-(2-хлор-41 (циклогептиламіно)піримідин-5-іл)проп-2-ін-1-ол (8,65 г) з виходом 56 %. H ЯМР (400 МГц, CD3OD) 7,98 (s, 1 H), 4,45 (s, 2 H), 4,19 (септет, J=4,5 Гц, 1 H), 1,95 (m, 2 H), 1,77 – 1,52 (m, 10 + Гц); МС m/z 280,4 (M+H) Стадія 3 Одержання (2-хлор-7-циклогептил-7H-піроло[2,3-d]піримідин-6-іл)-метанолу. До суспензії 3-(2-хлор-4-(циклогептиламіно)піримідин-5-іл)проп-2-ін-1-олу (8,64 г, 30,9 ммоля) у ТГФ (200 мл) додавали розчин ТБАФ в ТГФ (1 M, 66 мл, 2,1 екв.) та отриману суміш нагрівали при 63ºC протягом 5 год. Реакційну суміш концентрували для видалення ТГФ, розводили за допомогою EtOAc (350 мл), промивали водою (140 мл) та сольовим розчином (140 мл), сушили над Na2SO4, фільтрували та концентрували. Розтирання залишку з iPrOH, CH 2Cl2 та MeCN з наступним очищенням маточного розчину за допомогою колонкової хроматографії (EtOAc/гептан від 20 до 100 %) давало (2-хлор-7-циклогептил-7H-піроло[2,3-d]піримідин-61 іл)метанол (6,24 г) з виходом 72 %. H ЯМР (400 МГц, CDCl3) 8,69 (s, 1 H), 6,45 (s, 1 H), 4,83 (s, + 2 H), 4,61 (m, 1 H), 2,54 (m, 2 H), 1,98 – 1,86 (m, 4 H), 1,73 – 1,55 (m, 6 H); МС m/z 280,4 (M+H) Стадія 4 27 UA 108369 C2 5 10 15 Одержання 2-хлор-7-циклогептил-N, N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксаміду До розчину (2-хлор-7-циклогептил-7H-піроло[2,3-d]піримідин-6-іл)метанолу (6,24 г, 22,3 ммоля) у ДМФА (100 мл) додавали розчин диметиламіну у ТГФ (2 M, 46 мл, 4,1 екв.) та ціанід натрію (1,04 г, 0,95 екв.) та отриману суміш перемішували при кімнатній температурі протягом 4 хвил. Реакційну суміш обробляли чотирма порціями діоксиду марганцю (100,4 г, 45 екв.) протягом 1 год. та перемішували протягом ще 1 год. Реакційну суміш фільтрували через шар целіту (промивали за допомогою EtOAc 600 мл). Фільтрат промивали водою (200 мл). Водну фазу екстрагували за допомогою EtOAc (2150 мл). Об'єднані органічні речовини промивали за допомогою 4 % водним розчином NaCl (2250 мл), сушили над Na2SO4, фільтрували та концентрували у вакуумі. Розтирання залишку з MeCN з наступним очищенням маточного розчину за допомогою колонкової хроматографії (EtOAc/гептан від 30 до 100 %) давало 2-хлор1 7-циклогептил-N, N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксамід (6,07 г) з виходом 85 %. H ЯМР (400 МГц, CDCl3) 8,81 (s, 1 H), 6,52 (s, 1 H), 4,63 (tt, J=11, 4,0 Гц, 1 H), 3,20 (s, 3 H), 3,11 (s, + 3 H), 2,52 (m, 2 H), 1,99 (m, 2 H), 1,88 (m, 2 H), 1,70 (m, 4 H), 1,58 (m, 2 H) МС m/z 321,5 (M+H) Проміжний продукт 2: 2-Хлор-7-циклогексил-N, N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксамід отримували за методикою, аналогічною використаній для одержання проміжного продукту 1. O N Cl 20 25 30 35 40 N N N Стадія 1 1 (5-Бром-2-хлорпіримідин-4-іл)-циклогексиламін (23,2 г, вихід 78 %): H ЯМР (400 МГц, ДМСО-d6) част./млн. 1,01-1,17 (m, 1 H) 1,20-1,31 (m, 3 H) 1,35-1,50 (m, 2 H) 1,60 (d, J=12,5 Гц, 1 H) 1,65-1,83 (m, 4 H) 3,89 (ddd, J=7,8, 3,8, 3,5 Гц, 1 H) 7,26 (d, J=8,0 Гц, 1 H) 8,22 (s, 1 H); МС m/z + 290,4 (M) . Стадія 2 1 3-(2-Хлор-4-циклогексиламінопіримідин-5-іл)-проп-2-ін-1-ол (9,1 г, вихід 43 %): H ЯМР (400 МГц, ДМСО-d6) част./млн. 1,14 (t, J=12,9 Гц, 1 H) 1,23-1,49 (m, 4 H) 1,62 (d, J=13,1 Гц, 1 H) 1,671,88 (m, 4 H) 3,83-3,99 (m, 1 H) 4,35 (d, J=6,1 Гц, 2 H) 5,37 (t, J=5,8 Гц, 1 H) 7,00 (d, J=8,1 Гц, 1 H); + МС m/z 266,3 (M+H) . Стадія 3 1 (2-Хлор-7-циклогексил-7H-піроло[2,3-d]піримідин-6-іл)-метанол (7,3 г, вихід 81 %): H ЯМР (400 МГц, ДМСО-d6) част./млн. 1,28 (t, J=12,6 Гц, 1 H) 1,33-1,48 (m, 2 H) 1,70 (d, J=12,1 Гц, 1 H) 1,78-1,93 (m, 4 H) 2,34-2,48 (m, 2 H) 4,24-4,42 (m, 1 H) 4,67 (d, J=5,1 Гц, 2 H) 5,50 (t, J=5,6 Гц, 1 H) + 6,55 (s, 1 H) 8,82 (s, 1 H); МС m/z 266,5 (M+H) . Стадія 4 Диметиламід 2-хлор-7-циклогексил-7H-піроло[2,3-d]піримідин-6-карбонової кислоти (0,85 г, 1 вихід 64 %): H ЯМР (400 МГц, ДМСО-d6) част./млн. 1,22 (br. s., 1 H) 1,36 (d, J=13,6 Гц, 2 H) 1,66 (br. s., 1 H) 1,85 (d, J=10,6 Гц, 4 H) 2,30 (dd, J=12,4, 3,3 Гц, 2 H) 3,04 (d, J=17,2 Гц, 6 H) 4,34 + (br. s., 1 H) 6,80 (s, 1 H) 8,97 (s, 1 H); МС m/z 307,3 (M+H) . Проміжний продукт 3: 2-Хлор-7-циклопентил-N, N-диметил-7H-піроло[2,3-d]піримідин-6-карбоксамід отримували за методикою, аналогічною використаній для одержання проміжного продукту 1, та він є описаною у літературі сполукою (див. WO 2010/020675) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrolopyrimidine compounds as inhibitors of cdk4/6
Автори англійськоюBrain, Christopher, Thomas, Cho, Young Shin, Giraldes, John, William, Lagu, Bharat, Levell, Julian, Luzzio, Michael, Perez, Lawrence, Blas, Wang, Yaping, Yang, Fan
Автори російськоюБрейн Кристофер Томас, Чо Йонг Шин, Джиралдес Джон Уильям, Лагу Барат, Левелл Джулиан, Луццио Майкл, Перез Лоренс Блес, Вонг Япинг, Янг Фен
МПК / Мітки
МПК: A61K 31/519, C07D 487/04, C07D 519/00, C07B 59/00, A61P 35/00
Мітки: піролопіримідини, інгібітори
Код посилання
<a href="https://ua.patents.su/207-108369-pirolopirimidini-yak-ingibitori-cdk4-6.html" target="_blank" rel="follow" title="База патентів України">Піролопіримідини як інгібітори cdk4/6</a>
Попередній патент: 2-[1-(2,5-диметилфеніл)-1н-тетразол-5-ілсульфаніл]-n-фенілацетамід, що проявляє антивірусну активність відносно вірусу грипу h1n1
Наступний патент: Установка для виробництва зневодненого етанолу
Випадковий патент: Спосіб меліорації темно-каштанових грунтів при зрошенні водами підвищеної мінералізації