Піролопіримідини як інгібітори протеїнкінази
Номер патенту: 76760
Опубліковано: 15.09.2006
Автори: Халлі Френк, Депре Стефані Даніель, Едвардз Майкл, Педгріфт Брайан Леслі, Алдос Девіс Джон, Амендола Шеллі, Маджид Тахір Надім, Маклей Лейн МакФарлан, Бодуен Бернар, Едлін Кріс, Кокс Пол Джозеф
Формула / Реферат
1. Сполука формули
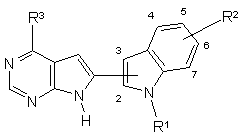 , (I)
, (I)
в якій
R1 являє собою водень, -C(=О)-NY1Y2, -C(=О)-R5, -SO2-NY1Y2, -SO2-R7,
-C(=О)R7, або
R1 являє собою алкеніл, алкенілокси, алкіл, алкініл, арил, гетероарил, гетероциклоалкіл, циклоалкіл або циклоалкілалкіл, кожен із яких необов'язково заміщений однією або декількома групами, вибраними з арилу, циклоалкілу, ціано, галогену, гетероарилу, гетероциклоалкілу, -СНО, або 5-, 6- або 7-членним циклічним ацетальпохідним такого -СНО, -C(=O)-NY1Y2, -C(=О)-OR5, -NY1Y2, -N(R6)-С(=О)-R7, -N(R6)-C(=О)-NY3Y4, -N(R6)-SО2-R7, -N(R6)-SO2-NY3Y4, -OR7,
-C(=О)-R7, гідрокси, алкокси і карбокси;
R2 являє собою одну або декілька груп, вибраних з водню, ацилу, алкілендіокси, алкенілу, алкенілокси, алкінілу, арилу, ціано, галогену, гідрокси, гетероарилу, гетероциклоалкілу, нітро, R4, -C(=O)-NY1Y2, -C(=O)-OR5, -NY1Y2, -N(R6)-C(=O)-R7, -N(R6)-C(=O)-NY3Y4, -N(R6)-C(=O)-OR7, -N(R6)-SO2-R7, -N(R6)-SO2-NY3Y4, -SO2-NY1Y2 і -ZR4;
R3 являє собою H, ціано, галоген, гідрокси, нітро, R4, NY1Y2, -ZR4, -C(=O)-OR5, -C(=O)-R7, -C(=O)-NY1Y2, -N(R8)-C(=O)-R4, -N(R8)-C(=O)-NY1Y2, -N(R8)-C(=O)-OR5, -SO2-NY3Y4 або -N(R8)-SO2-R7, або
R3 являє собою арил, гетероарил, алкеніл або алкініл, кожен із яких необов'язково заміщений однією або декількома групами, вибраними з арилу, ціано, галогену, гідрокси, гетероарилу, гетероциклоалкілу, нітро, -C(=O)-NY1Y2, -C(=O)-OR5, -NY1Y2, -N(R6)-C(=O)-R7, -N(R6)-C(=O)-NY3Y4, -N(R6)-C(=O)-OR7, -N(R6)-SO2-R7, -N(R6)-SO2-NY3Y4, -SO2-NY1Y2 і -ZR4;
R4 являє собою алкіл, циклоалкіл або циклоалкілалкіл, кожен із яких необов'язково заміщений однією або декількома групами, вибраними з арилу, циклоалкілу, ціано, галогену, гетероарилу, гетероциклоалкілу, гідрокси, -СНО, або 5-, 6- або 7-членним циклічним ацетальпохідним такого -СНО, -C(=O)-NY1Y2, -C(=О)-OR5, -NY1Y2, -N(R6)-С(=О)-R7, -N(R6)-C(=О)-NY3Y4, -N(R6)-SО2-R7, -N(R6)-SO2-NY3Y4, -OR7 і -C(=О)-R7, де R4 необов'язково переривається з групою, вибраною з О, S(О)n і NR6;
R5 являє собою водень, алкіл, алкеніл, арил, арилалкіл, гетероарил або гетероарилалкіл;
R6 являє собою водень або нижчий алкіл;
R7 являє собою алкіл, арил, арилалкіл, циклоалкіл, циклоалкілалкіл, гетероарил, гетероарилалкіл, гетероциклоалкіл або гетероциклоалкілалкіл;
R8 являє собою водень або нижчий алкіл;
Y1 і Y2 незалежно являють собою водень, алкеніл, арил, циклоалкіл, гетероарил або алкіл, необов'язково заміщений однією або декількома групами, вибраними з арилу, галогену, гетероарилу, гідрокси, -C(=O)-NY3Y4, -C(=О)-OR5, -NY3Y4, -N(R6)-С(=О)-R7, -N(R6)-C(=О)-NY3Y4, -N(R6)-SО2-R7, -N(R6)-SO2-NY3Y4, і -OR7; або група –NY1Y2 може утворювати циклічний амін;
Y3 і Y4 незалежно являють собою водень, алкеніл, алкіл, арил, арилалкіл, циклоалкіл, гетероарил або гетероарилалкіл; або група –NY3Y4 може утворювати циклічний амін;
Z являє собою О або S(O)n;
n дорівнює нулю або цілому числу 1 або 2; або
N-оксид, проліки, кислотна біоізостера, фармацевтично прийнятна сіль або сольват такої сполуки; або N-оксид, проліки або кислотна біоізостера такої солі або сольвату.
2. Сполука за п. 1, в якій R1 являє собою водень, С1-4алкіл, С1-4алкіл, заміщений галогеном, С1-4алкіл, заміщений гідрокси, С1-4алкіл, заміщений –N(R6)C(=O)-R7, С1-4алкіл, заміщений –C(=O)-NY1Y2 або циклоалкілалкіл, заміщений гідрокси.
3. Сполука за п. 1, в якій R1 являє собою водень, -СН3, -СН2СН3, -СН2СF3 або
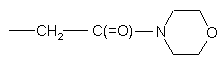 .
.
4. Сполука за п. 1, в якій R1 являє собою водень.
5. Сполука за будь-яким із пп. 1-4, в якій R2 являє собою карбокси або кислотну біоізостеру, гідрокси, алкіл, заміщений карбокси, гетероарил, або R2 являє собою -OR4, де R4 являє собою алкіл, -OR4, де R4 являє собою алкіл або циклоалкілалкіл, заміщений однією або декількома гідроксигрупами, -OR4, де R4 являє собою алкіл, заміщений однією або декількома алкоксигрупами, -OR4, де R4 являє собою алкіл або циклоалкіл, заміщений однією або декількома карбоксигрупами, -OR4, де R4 являє собою циклоалкіл, заміщений –C(=O)-NY1Y2, або R2 являє собою -C(=O)-R, де R являє собою алкіл, або R2 являє собою -С(=O)-NY1Y2 або –N(R6)-C(=O)-R7.
6. Сполука за будь-яким із пп. 1-4, в якій R2 являє собою –ОСН3 або -СОNНС(СН3)2СН2OН.
7. Сполука за будь-яким із пп. 1-4, в якій R2 являє собою –ОСН3.
8. Сполука за будь-яким із пп. 1-7, в якій R3 являє собою водень, ціано, необов'язково заміщений арил, необов'язково заміщений гетероарил, алкіл, алкіл, заміщений одним або декількома атомами галогену, алкіл, заміщений -С(=O)-NY1Y2, алкіл, заміщений -OR7, або R3 являє собою -ZR4, -C(=O)-OR5, -С(=О)-NY1Y2 або –NY1Y2.
9. Сполука за будь-яким із пп. 1-7, в якій R3 являє собою водень, ціано, піридил, трифторметил, -СН2-СН2-С(=O)NНСН3, -OCF2H, -C(=O)-NH-C(CH3)2-СН2OН або
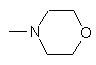 .
.
10. Сполука за будь-яким із пп. 1-7, в якій R3 являє собою –ОСН3.
11. Сполука за будь-яким із пп. 1-10, в якій R2 приєднаний у положенні 5 індольного кільця.
12. Сполука за будь-яким із пп. 1-11, в якій група
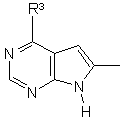 приєднана у положенні 3 індольного кільця.
приєднана у положенні 3 індольного кільця.
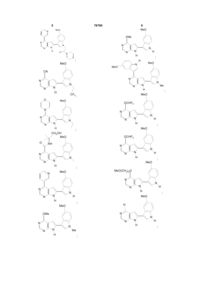
13. Сполука за п. 1, що являє собою
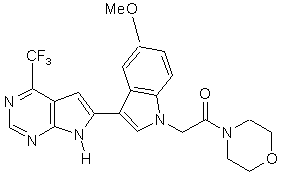 ;
;
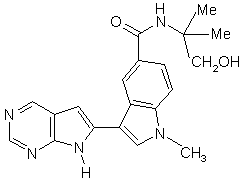 ;
;
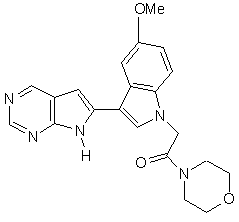 ;
;
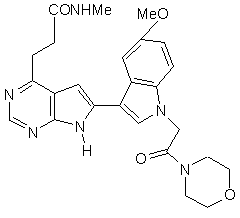 ;
;
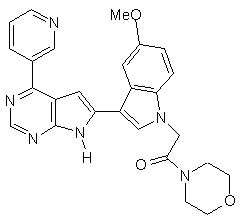 ;
;
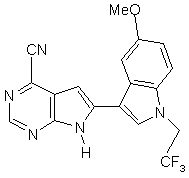 ;
;
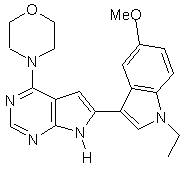 ;
;
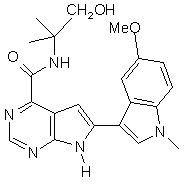 ;
;
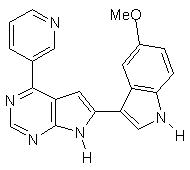 ;
;
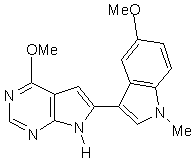 ;
;
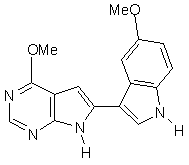 ;
;
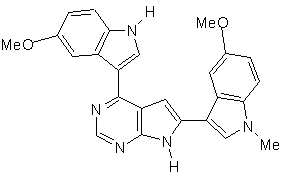 ;
;
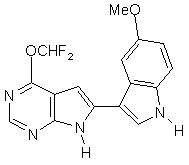 ;
;
 ;
;
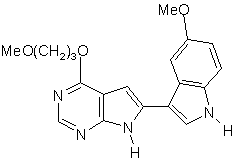 ;
;
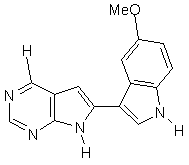 ;
;
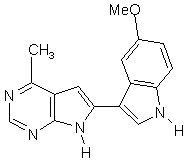 ;
;
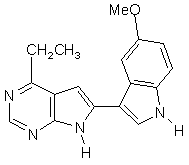 ;
;
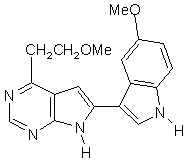 ;
;
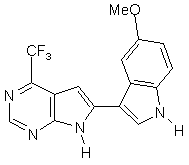 ;
;
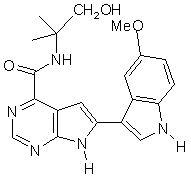 ;
;
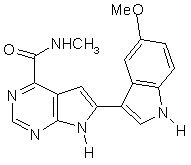 ;
;
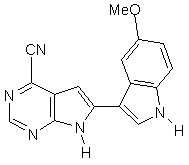 ;
;
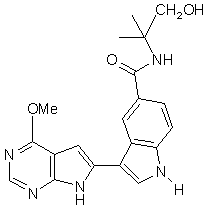 ;
;
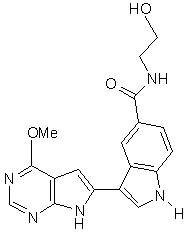 ;
;
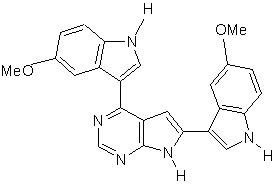 ;
;
або N-оксид, проліки, фармацевтично прийнятну сіль або сольват такої сполуки; або N-оксид або проліки такої солі або сольвату.
14. Сполука за п. 1, що являє собою
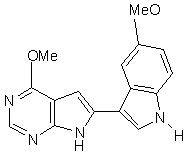 ,
,
N-оксид, проліки, фармацевтично прийнятну сіль або сольват такої сполуки;
або N-оксид або проліки такої солі або сольвату,
15. Фармацевтична композиція, що містить фармацевтично ефективну кількість сполуки за будь-яким із пп. 1-14, разом з одним або декількома фармацевтично прийнятними носіями або ексципієнтами.
16. Спосіб лікування пацієнта, схильного до або страждаючого від станів, які можуть бути поліпшені внаслідок введення інгібітора каталітичної активності Syk, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, або фармацевтично ефективної кількості композиції за п. 15.
17. Спосіб лікування запального захворювання у пацієнта, який цього потребує, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, або фармацевтично ефективної кількості композиції за п. 15.
18. Спосіб лікування пацієнта, схильного до або страждаючого від станів, які можуть бути поліпшені внаслідок введення інгібітора каталітичної активності FAK, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, або фармацевтично ефективної кількості композиції за п. 15.
19. Спосіб лікування пацієнта, схильного до або страждаючого від станів, які можуть бути поліпшені внаслідок введення інгібітора каталітичної активності KDR, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, або фармацевтично ефективної кількості композиції за п. 15.
20. Спосіб лікування пацієнта, схильного до або страждаючого від станів, які можуть бути поліпшені внаслідок введення інгібітора каталітичної активності Aurora2, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, або фармацевтично ефективної кількості композиції за п. 15.
21. Спосіб лікування раку у пацієнта, який цього потребує, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, або фармацевтично ефективної кількості композиції за п. 15.
22. Спосіб за п. 17, в якому запальне захворювання являє собою астму, запальний дерматоз, алергічний риніт, алергічний кон'юнктивіт або запалення суглобів.
23. Спосіб за п. 17, в якому запальне захворювання являє собою астму, псоріаз, герпетиформний дерматит, екзему, некротизуючий васкуліт, шкірний васкуліт, бульозну хворобу, алергічний риніт, алергічний кон'юнктивіт, артрит, ревматоїдний артрит, артрит корової краснухи, псоріатичний артрит або остеоартрит.
24. Спосіб лікування хронічної обструктивної хвороби легень у пацієнта, який цього потребує, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, або фармацевтично ефективної кількості композиції за п. 15.
25. Спосіб за п. 21, в якому види раку, що піддаються лікуванню, включають колоректальний рак, рак передміхурової, молочної, щитовидної залози, рак шкіри, рак прямої кишки або рак легень.
Текст
1. Сполука формули C2 2 (19) 1 3 76760 4 N(R6)-SO2-NY3Y4, і -OR7; або група –NY1Y2 може або R2 являє собою -С(=O)-NY1Y2 або –N(R6)утворювати циклічний амін; C(=O)-R7. 3 4 Y і Y незалежно являють собою водень, алкеніл, 6. Сполука за будь-яким із пп. 1-4, в якій R2 являє алкіл, арил, арилалкіл, циклоалкіл, гетероарил або собою –ОСН3 або -СОNНС(СН3)2СН2OН. гетероарилалкіл; або група –NY3Y4 може утворю7. Сполука за будь-яким із пп. 1-4, в якій R2 являє вати циклічний амін; собою –ОСН3. Z являє собою О або S(O)n; 8. Сполука за будь-яким із пп. 1-7, в якій R3 являє n дорівнює нулю або цілому числу 1 або 2; або собою водень, ціано, необов'язково заміщений N-оксид, проліки, кислотна біоізостера, фармацеварил, необов'язково заміщений гетероарил, алкіл, тично прийнятна сіль або сольват такої сполуки; алкіл, заміщений одним або декількома атомами або N-оксид, проліки або кислотна біоізостера тагалогену, алкіл, заміщений -С(=O)-NY1Y2, алкіл, кої солі або сольвату. заміщений -OR7, або R3 являє собою -ZR4, -C(=O)2. Сполука за п. 1, в якій R1 являє собою водень, OR5, -С(=О)-NY1Y2 або –NY1Y2. С1-4алкіл, С1-4алкіл, заміщений галогеном, С19. Сполука за будь-яким із пп. 1-7, в якій R3 являє собою водень, ціано, піридил, трифторметил, 4алкіл, заміщений гідрокси, С1-4алкіл, заміщений – N(R6)C(=O)-R7, С1-4алкіл, заміщений –C(=O)-NY1Y2 СН2-СН2-С(=O)NНСН3, -OCF2H, -C(=O)-NHабо циклоалкілалкіл, заміщений гідрокси. C(CH3)2-СН2OН або 3. Сполука за п. 1, в якій R1 являє собою водень, СН3, -СН2СН3, -СН2СF3 або N O CH2 C(=O) N O . 4. Сполука за п. 1, в якій R1 являє собою водень. 5. Сполука за будь-яким із пп. 1-4, в якій R2 являє собою карбокси або кислотну біоізостеру, гідрокси, алкіл, заміщений карбокси, гетероарил, або R2 являє собою -OR4, де R4 являє собою алкіл, -OR4, де R4 являє собою алкіл або циклоалкілалкіл, заміщений однією або декількома гідроксигрупами, OR4, де R4 являє собою алкіл, заміщений однією або декількома алкоксигрупами, -OR4, де R4 являє собою алкіл або циклоалкіл, заміщений однією або декількома карбоксигрупами, -OR4, де R4 являє собою циклоалкіл, заміщений –C(=O)-NY1Y2, або R2 являє собою -C(=O)-R, де R являє собою алкіл, . 10. Сполука за будь-яким із пп. 1-7, в якій R3 являє собою –ОСН3. 11. Сполука за будь-яким із пп. 1-10, в якій R2 приєднаний у положенні 5 індольного кільця. 12. Сполука за будь-яким із пп. 1-11, в якій група R3 N N N H приєднана у положенні 3 індольного кільця. 13. Сполука за п. 1, що являє собою OMe MeO CF3 N O N N N N N N N N H O H O N ; O H N O Me ; Me CONHMe MeO CH2OH N N N N N H N CH3 N ; N H O N O ; 5 76760 6 MeO MeO N OMe N N N N N N H O N N N O H H ; ; H MeO MeO N MeO CN N N N N N N Me H H O N N CF3 ; MeO ; MeO OCHF2 N N N N N H H N N H ; MeO ; CH2OH MeO O N N OCHF2 NH N N N N N H H N ; N N MeO H ; MeO(CH2)3O MeO N N N N N N N N N H H H ; MeO H ; H MeO N OMe N N N H N N N H N Me ; H ; 7 76760 8 CH2OH MeO CH3 O N NH OMe N N N H N H N ; N H N MeO H ; HO CH2CH3 N N N NH O N H H OMe ; MeO N N CH2CH2OMe N H N H ; H N N N N OMe N H H MeO ; MeO N N CF3 N N H H N N N N або N-оксид, проліки, фармацевтично прийнятну сіль або сольват такої сполуки; або N-оксид або проліки такої солі або сольвату. 14. Сполука за п. 1, що являє собою H H ; ; CH2OH MeO MeO NH O OMe N N N N N H H N ; N MeO NHCH3 O N N N N H H ; MeO CN N N N N H H ; N H H , N-оксид, проліки, фармацевтично прийнятну сіль або сольват такої сполуки; або N-оксид або проліки такої солі або сольвату, 15. Фармацевтична композиція, що містить фармацевтично ефективну кількість сполуки за будьяким із пп. 1-14, разом з одним або декількома фармацевтично прийнятними носіями або ексципієнтами. 16. Спосіб лікування пацієнта, схильного до або страждаючого від станів, які можуть бути поліпшені внаслідок введення інгібітора каталітичної активності Syk, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, або фармацевтично ефективної кількості композиції за п. 15. 17. Спосіб лікування запального захворювання у пацієнта, який цього потребує, що включає введення зазначеному пацієнту фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-14, 9 76760 10 або фармацевтично ефективної кількості композицієнту фармацевтично ефективної кількості сполуції за п. 15. ки за будь-яким із пп. 1-14, або фармацевтично 18. Спосіб лікування пацієнта, схильного до або ефективної кількості композиції за п. 15. страждаючого від станів, які можуть бути поліпше22. Спосіб за п. 17, в якому запальне захворюванні внаслідок введення інгібітора каталітичної актиня являє собою астму, запальний дерматоз, алервності FAK, що включає введення зазначеному гічний риніт, алергічний кон'юнктивіт або запаленпацієнту фармацевтично ефективної кількості ня суглобів. сполуки за будь-яким із пп. 1-14, або фармацевти23. Спосіб за п. 17, в якому запальне захворюванчно ефективної кількості композиції за п. 15. ня являє собою астму, псоріаз, герпетиформний 19. Спосіб лікування пацієнта, схильного до або дерматит, екзему, некротизуючий васкуліт, шкірстраждаючого від станів, які можуть бути поліпшений васкуліт, бульозну хворобу, алергічний риніт, ні внаслідок введення інгібітора каталітичної актиалергічний кон'юнктивіт, артрит, ревматоїдний вності KDR, що включає введення зазначеному артрит, артрит корової краснухи, псоріатичний пацієнту фармацевтично ефективної кількості артрит або остеоартрит. сполуки за будь-яким із пп. 1-14, або фармацевти24. Спосіб лікування хронічної обструктивної хвочно ефективної кількості композиції за п. 15. роби легень у пацієнта, який цього потребує, що 20. Спосіб лікування пацієнта, схильного до або включає введення зазначеному пацієнту фармастраждаючого від станів, які можуть бути поліпшецевтично ефективної кількості сполуки за будьні внаслідок введення інгібітора каталітичної актияким із пп. 1-14, або фармацевтично ефективної вності Aurora2, що включає введення зазначеному кількості композиції за п. 15. пацієнту фармацевтично ефективної кількості 25. Спосіб за п. 21, в якому види раку, що піддасполуки за будь-яким із пп. 1-14, або фармацевтиються лікуванню, включають колоректальний рак, чно ефективної кількості композиції за п. 15. рак передміхурової, молочної, щитовидної залози, 21. Спосіб лікування раку у пацієнта, який цього рак шкіри, рак прямої кишки або рак легень. потребує, що включає введення зазначеному па Даний винахід відноситься до заміщених піролопіримідинів, їхнього одержання, фармацевтичних композицій, що містять зазначені сполуки, а також до їхнього фармацевтичного застосування для лікування хворобливих станів, які можуть бути модульовані інгібуванням протеїнкіназ. Протеїнкінази беруть участь у процесах передачі сигналів, що контролюють активацію, ріст і диференціацію клітин у відповідь на позаклітинні медіатори і на зміни в навколишньому середовищі. У цілому, зазначені кінази поділяються на декілька груп: кінази, що переважно фосфорилюють залишки серину і/або треоніну, і кінази, що переважно фосфорилюють залишки тирозину [S.K. Hanks and T. Hunter, FASEB. J., 1995, 9, p.576-596]. Серин/треонінкінази включають, наприклад, ізоформи протеїнкінази С [А.С. Newton, J. Biol. Chem., 1995, 270, p.28495-28498] і групу циклінзалежних кіназ, таких як cdc2 [J. Pines, Trends in Biochemical Sciences, 1995, 18, p.195-197]. Тирозинкінази включають рецептори фактора росту, сполучні мембрани, такі як рецептор епідермального фактора росту [S. Iwashita and M. Kobayashi, Cellular Signalling, 1992, 4, p.123-132], а також цитозольні безрецепторні кінази, такі як p56tck, p59fYn, ZAP70 і csk кінази [С. Chan et al., Ann. Rev. Immunol., 1994, 12, p.555-592]. Надмірно висока активність протеїнкінази спостерігається при багатьох захворюваннях, що виникають внаслідок ненормальної клітинної функції. Вона може виникнути прямо або опосередковано, наприклад, внаслідок збою правильних контрольних механізмів кінази, викликаного, наприклад, мутацією, надекспресією або неправильною активацією ферменту; чи надмірним або недостатнім продукуванням цитокінів або факторів росту, та кож беручи участь у трансдукції сигналів у прямому або зворотному напрямку від кінази. Очікується, що у всіх зазначених випадках селективне інгібування дії кінази може відігравати позитивну роль. Syk являє собою 72-кДа цитоплазматичну протеїнтирозинкіназу, що експресується у багатьох кровотворних клітинах і яка є суттєвим елементом декількох каскадів, що зв'язують рецептори антигену з клітинними відповідями. Таким чином, Syk відіграє центральну роль у сигналізації рецептора IgE з високою афінністю, Fc Rl, в тучних клітинах і в антигені рецептора, що сигналізує в Т- і В-лімфоцитах. Шляхи трансдукції сигналу в тучних, Т- і В-клітинах мають загальні ознаки. Лігандзв'язувальний домен рецептора не має внутрішньої активності тирозинкінази. Однак вони взаємодіють із трансдукуючими субодиницями, що містять тирозиновий імунорецептор на основі мотивів активації (ІТАМ) [М. Reth, Nature, 1989, 338, p.383-384]. Зазначені мотиви присутні як у -, так і в -субодиницях Fc Rl, в -субодиниці рецептора Т-клітини (TCR), а також у субодиницях IgG і IgG рецептора В-клітини (BCR). [N.S. van Oers and A. Weiss, Seminars in Immunology, 1995, 7, p.227-236]. Після зв'язування антигену і мультимеризації залишки ІТАМ фосфорилюються протеїнтирозинкіназами із родини Src. Syk належить до унікального класу тирозинкіназ, що має двотандемні домени Src гомології 2 (SH2) і С-кінцевий каталітичний домен. Зазначені домени SH2 з високою афінністю зв'язуються з ІТАМ, і така SН2-опосередкована асоціація Syk з активованим рецептором стимулює активність Syk кінази і локалізує Syk у плазматичній мембрані. У мишей з дефіцитом Syk дегрануляція тучних 11 76760 12 клітин інгібується, дозволяючи висловити припуклітин. Численні дослідження в галузі пухлинного щення про те, що вона є важливою метою для ангіогенезу протягом останніх двох десятиріч вирозробки агентів, що стабілізують тучні клітини явили ряд терапевтичних мішеней, включаючи [P.S. Costello, Oncogene, 1996, 13, p.2595-2605]. кінази, протеази та інтегрини, що призвело до відПодібні дослідження показали важливу роль Syc в криття багатьох нових антиангіогенних агентів, BCR і TCR сигналізації [A.M. Cheng, Nature, 1995, включаючи інгібітори KDR, деякі з яких у даний час 378, p.303-306, (1995), і D.H. Chu et al, проходять клінічні випробування (Jekunen et al., Immunological Reviews, 1998, 165, p.167-180]. ВиCancer Treatment Rev., 1997, 23, 263-286). Інгібітоявляється, що Syk також бере участь у виживанні ри ангіогенезу можуть бути використані як першоеозинофілів у відповідь на IL-5 і GM-CSF [S. чергові, допоміжні або навіть профілактичні засоYousefi et al., J. Exp. Med., 1996, 183, p.1407-1414]. би, що попереджують виникнення або повторний Незважаючи на ключову роль Syk у тучній клітині, ріст злоякісних пухлин. BCR і Т-клітинній сигналізації, є мало відомостей Декілька білків, що беруть участь у сегрегації про механізм передачі Syk ефекторів у прямому хромосом і збиранні веретен, були ідентифіковані напрямку. Виявилося, що два адаптерні білки, в дріжджах і дрозофілах. Розрив таких білків призBLNK (лінкер-білок В-клітини, SLP-65) і SLP-76, є водить до неправильної сегрегації хромосом і субстратами Syk у В-клітинах і тучних клітинах, утворення монополярних або розірваних веретен. відповідно, і зумовлюють розподіл Syk з ефектоДо зазначених кіназ відносяться Ір11 і aurora кінарами у прямому напрямку [М. Ishiai et al., Immunity, зи з S. cerevisiae і дрозофіли, відповідно, які необ1999, 10, p.117-125, і L.R. Hendricks-Taylor et al., J. хідні для розділення центросом і сегрегації хромоBiol. Chem., 1997, 272, p.1363-1367]. Крім того, сом. Один людський гомолог Ір11 дріжджів був Syk, виявляється, відіграє важливу роль у сигнанедавно клонований та охарактеризований різнильному шляху CD40, який, у свою чергу, відіграє ми лабораторіями. Така кіназа, названа Aurora2, важливу роль у проліферації В-клітин [М. Faris et STK15 або ВТАК, належить до родини сеal., J. Exp. Med., 1994, 179, p.1923-1931]. рин/треонінкінази. Bischoff et al. показали, що Syk також бере участь в активації тромбоцитів, Aurora2 є онкогенною й ампліфікується при колощо стимулюється через низьку афінність IgG реректальному раку людини (ЕМВО J., 1998, 17, цептора (Fc гамма-RIIA) або яка стимулюється 3052-3065). Її присутність також була підтверджеколагеном [F. Yanaga et al., Biochem. J, 1995, 311, на прикладами при ракових захворюваннях, що (Pt. 2), p.471-478]. включають епітеліальні пухлини, таких як рак моФокальна адгезійна кіназа (FAK) являє собою лочної залози. безрецепторну тирозинкіназу, що бере участь в Даний винахід передбачає заміщені піролопіінтегринопосередкованих сигнальних трансдукційримідини формули (І), здатні інгібувати одну або них шляхах. FAK співлокалізується з інтегринами у декілька протеїнкіназ, більш переважно, FAK, фокальних контактних сайтах і активації FAK, при KDR, Syk кіназу або Aurora2, особливо Syk кіназу, цьому виявилося, що фосфорилювання її тирозином у багатьох видах клітин залежить від інтегринів, що зв'язуються з їхніми позаклітинними лігандами. Результати декількох досліджень підтверджують гіпотезу про те, що інгібітори FAK можуть бути корисними при лікуванні раку. Наприклад, клітини з дефіцитом FAK слабо мігрують у відповідь на хемотаксичні сигнали і надекспресія С-кінцевого домену FAK блокує клітинне розповсюдження, а також хемотаксичну міграцію (Sieg et al., J. Cell Science, 1999, 112, 2677-2691; Richardson A. and Parsons Т., Cell, 1997, 97, 221в якій 231); крім того, пухлинні клітини, оброблені антизR1 являє собою водень, -C(=O)-NY1Y2, містовими олігонуклеотидами FAK, втрачають здаC(=O)R5, -SO2-NY1Y2, -SO2-R7, -C(=O)R7, або R1 тність до приєднання і піддаються апоптозу (Xu et може являти собою алкеніл, алкенілокси, алкіл, al., Cell Growth Differ., 1996, 4, 413-418). Була опиалкініл, арил, гетероарил, гетероциклоалкіл, циксана надекспресія FAK при раку передміхурової лоалкіл або циклоалкілалкіл, кожен із яких необозалози, молочної залози, щитовидної залози, пряв'язково заміщений однією або декількома групамої кишки і легень. Рівень експресії FAK прямо ми, вибраними з арилу, циклоалкілу, ціано, корелює з пухлинами, що демонструють найагрегалогену, гетероарилу, гетероциклоалкілу, -СНО сивніший фенотип. (або його 5-, 6- або 7-членного циклічного ацетаАнгіогенез або утворення нових кровоносних льпохідного), -C(=O)-NY1Y2, -C(=O)-OR5, -ΝΥ1Υ2, судин внаслідок росту з уже існуючої судинної сітN(R6)-C(=O)-R7, -N(R6)-C(=O)-NY3Y4, -N(R6) -SO2ки має основне значення для ембріонального розR7, -N(R6)-SO2-NY3Y4, -OR7, -C(=O)-R7, гідрокси, витку і органогенезу. Ненормальна підвищена неалкокси і карбокси; оваскуляризація спостерігається при R2 являє собою одну або декілька груп, вибраревматоїдному артриті, діабетичній ретинопатії і них із водню, ацилу, алкілендіокси, алкенілу, алкепід час розвитку пухлини (Folkman, Nat. Med., нілокси, алкінілу, арилу, ціано, галогену, гідрокси, 1995, 1, 27-31). Ангіогенез є складним багатоступігетероарилу, гетероциклоалкілу, нітро, R4, -C(=O)нчастим процесом, що включає активацію, міграNY1Y2, -C(=O)-OR5, -ΝΥ1Υ2, -N(R6)-C(=O)-R7, -N(R6)цію, проліферацію і виживання ендотеліальних C(=O)-NY3Y4, -N(R6)-C(=O)-OR7, -N(R6)-SO -R7, 2 13 76760 14 N(R6)-SO2-NY3Y4, -SO2NY1Y2 і -ZR4; такі значення: R3 являє собою Η, ціано, галоген, гідрокси, ні"Пацієнт" відноситься до людей та інших ссавтро, R4, ΝΥ1Y2, -ZR4, -С(=О)-OR5, -C(=O)-R7, ців. C(=O)-NY1Y2, -N(=R8)-C(=O)-R4, -N(=R8)-C(=O)"Кислотна біоізостера" означає групу, що має NY1Y2, -N(R8)-C(=O)-OR5, -SO2-NY3Y4 або -N(R8)хімічну і фізичну подібність, яка забезпечує явно 7 3 SO2-R , або R являє собою арил, гетероарил, подібні біологічні властивості, з карбоксигрупою алкеніл або алкініл, кожен із яких необов'язково [див. Lipinsky, Annual Reports in Medicinal заміщений однією або декількома групами, вибраChemistry, 1986, 21, p.283, "Bioisosterism In Drug ними з арилу, ціано, галогену, гідрокси, гетероариDesign"; Yun, Hwahak Sekye, 1993, 33, p.576-579, лу, гетероциклоалкілу, нітро, -C(=O)-NΥ1Υ2, -C(=O)"Application of Bioisosterism To New Drug Design"; OR5, -NY1Y2, -N(R6)-C(=O)-R7, -N(R6)-C(=O)-NY3Y4, Zhao, Huaxue Tongbao, 1995, p.34-38, "Bioisosteric N(R6)-C(=O)-R7, -N(R6)-SO2-R7, -N(R6)-SO2-NY3Y4, Replacement and Development Of Lead Compounds SO2-ΝΥ1Υ2 або -ZR4; In Drug Design"; Graham, Theochem., 1995, 343, R являє собою алкіл, циклоалкіл або циклоалp.105-109, "Theoretical Studies Applied To Drug кілалкіл, кожен із яких необов'язково заміщений Design: ab initio Electronic Distributions In однією або декількома групами, вибраними з ариBioisosteres"]. Приклади відповідних кислотних лу, циклоалкілу, ціано, галогену, гетероарилу, гебіоізостер включають: -C(=O)-NHOH, -C(=O)тероциклоалкілу, гідрокси, -СНО (або його 5-, 6CH2OH, -C(=O)-CH2SH, -C(=O)-NH-CN, сульфо, або 7-членного циклічного ацетальпохідного), фосфоно, алкілсульфонілкарбамоїл, тетразоліл, C(=O)-NY1Y2, -C(=O)-OR5, -NY1Y2, -N(R6)-C(=O)-R7, арилсульфонілкарбамоїл, гетероарилсульфоніл-N(R6)-C(=O)-NY3Y4, -N(R6)-SO2-R7, -N(R6)-SO2карбамоїл, N-метоксикарбамоїл, 3-гідрокси-3NY3Y4, -OR7 і -C(=O)-R7; R4 також може необов'язциклобутен-1,2-діон, 3,5-діоксо-1,2,4ково перериватися групою, вибраною з О, S(O)n, оксадіазолідиніл або гетероциклічні феноли, такі NR6; як 3-гідроксіізооксазоліл і 3-гідрокси-1R5 являє собою водень, алкіл, алкеніл, арил, метилпіразоліл. арилалкіл, гетероарил або гетероарил алкіл; "Ацил" означає Η-CO- або алкіл-СО-групу, в R6 являє собою водень або нижчий алкіл; якій алкілгрупа має зазначені в даному описі знаR7 являє собою алкіл, арил, арилалкіл, циклочення. алкіл, циклоалкілалкіл, гетероарил, гетероарилал"Ациламіно" означає ацил-NH-групу, в якій кіл, гетероциклоалкіл або гетероциклоалкілалкіл; ацил має зазначені в даному описі значення. R8 являє собою водень або нижчий алкіл; "Алкеніл" означає аліфатичну вуглеводневу Y1 і Y2 незалежно являють собою водень, алгрупу, що містить подвійний зв'язок вуглецькеніл, арил, циклоалкіл, гетероарил або алкіл, невуглець, яка може бути прямою або розгалуженою, обов'язково заміщений однією або декількома грущо має від 2 до 15 атомів вуглецю в ланцюгу. Пепами, вибраними з арилу, галогену, гетероарилу, реважні алкенілгрупи мають від 2 до 12 атомів гідрокси, -C(=O)-NY3Y4, -C(=O)-OR5, -NY3Y4, -N(R6)вуглецю в ланцюгу; більш переважно - від 2 до 6 C(=O)-R7, -N(R6)-C(=O)-NY3Y4, -N(R6)-SO2-R7, атомів вуглецю (наприклад, від 2 до 4 атомів вугN(R6)-SO2-NY3Y4 і -OR7; або група -NY1 Υ2 може лецю) в ланцюгу. "Розгалужений" в даному описі утворювати циклічний амін; означає, що одна або декілька нижчих алкілгруп, Υ3 і Υ4 незалежно являють собою водень, алтаких як метил, етил або пропіл, приєднані до лікеніл, алкіл, арил, арилалкіл, циклоалкіл, гетероанійного ланцюга; у цьому випадку - до лінійного рил або гетероарилалкіл; або група -ΝΥ3Υ4 може алкенільного ланцюга. "Нижчий алкеніл" означає утворювати циклічний амін; від 2 до 4 атомів вуглецю в ланцюгу, який може Ζ являє собою О або S(O)n; бути прямим або розгалуженим. Приклади алкеніn дорівнює нулю або цілому числу 1 або 2; лгруп включають етеніл, пропеніл, н-бутеніл, ізоі їхні відповідні N-оксиди, і їхні проліки, і їхні бутеніл, 3-метилбут-2-еніл, н-пентеніл, гептеніл, кислотні біоізостери; а також фармацевтично приоктеніл, циклогексилбутеніл і деценіл. йнятні солі і сольвати (наприклад, гідрати) таких "Алкенілокси" являє собою алкеніл-О-групу, в сполук, і їхні N-оксиди, і їхні проліки, і їхні кислотні якій алкеніл має зазначені в даному описі значенбіоізостери; разом з одним або декількома фарня. Прикладом алкенілоксигруп є алілокси. мацевтично прийнятними носіями або ексципієн"Алкокси" являє собою алкіл-О-групу, в якій тами. алкілгрупа має зазначені в даному описі значення. У даному описі термін "сполуки даного винаПриклади алкоксигруп включають дифторметокси, ходу" і подібні йому вирази означають описані виметокси, трифторметокси, етокси, н-пропокси, ізоще сполуки формули (І) і включають також проліпропокси, н-бутокси і гептокси. ки, фармацевтично прийнятні солі і сольвати, "Алкоксикарбоніл" являє собою алкіл-О-СОнаприклад, гідрати, там, де це дозволяє контекст. групу, в якій алкілгрупа має зазначені в даному Подібним чином, посилання на проміжні сполуки, описі значення. Приклади алкоксикарбонілгруп незалежно від того, чи є вони самі об'єктом домавключають метокси- і етоксикарбоніл. гань, відноситься також до їхніх солей і сольватів Якщо не зазначено інакше, "алкіл" означає там, де це дозволяє контекст. Для уточнення, там, аліфатичну вуглеводневу групу, яка може мати де це дозволяє контекст, в описі іноді наводяться прямий або розгалужений ланцюг, що має прибликонкретні випадки, однак такі випадки є чисто ілюзно від 1 до 15 атомів вуглецю в ланцюгу, необостративними і не виключають інші випадки. в'язково заміщених одним або декількома атомами Якщо не зазначено інакше, то у тексті опису галогену. Конкретні алкілгрупи мають від 1 до 6 даного винаходу нижченаведені терміни мають атомів вуглецю. "Нижчий алкіл" як група або час 15 76760 16 тина нижчої алкокси, нижчої алкілтіо, нижчої алкіллькома замісниками арилгруп, які можуть бути сульфініл або нижчої алкілсульфонілгрупи ознаоднаковими або різними, при цьому "замісник аричає, якщо не зазначено інакше, аліфатичну вуглелгрупи" включає, наприклад, ацил, ациламіно, алводневу групу, яка може мати прямий або кокси, алкоксикарбоніл, алкілендіокси, алкілсульрозгалужений ланцюг, що має від 1 до 4 атомів фініл, алкілсульфоніл, алкілтіо, ароїл, ароїламіно, вуглецю. Приклади алкілгруп включають метил, арил, арилалкілокси, арилалкілоксикарбоніл, ариетил, н-пропіл, ізо-пропіл, н-бутил, втор-бутил, тлалкілтіо, арилокси, арилоксикарбоніл, арилсульбутил, н-пентил, 3-пентил, гептил, октил, ноніл, фініл, арилсульфоніл, арилтіо, карбокси (або кисдецил і додецил. Ілюстративні алкілгрупи, заміщелотна біоізостера), ціано, галоген, гетероароїл, ні одним або декількома атомами галогену, вклюгетероарил, гетероарилалкілокси, гетероароїламічають трифторметил. но, гетероарилокси, гідрокси, нітро, трифторметил, "Алкілен" означає аліфатичний двовалентний -NY3Y4, -CONY3Y4, -SO2NY3Y4, -NY3-С(=О)алкіл, радикал, одержаний з алкілгрупи з прямим або NY3-SO2алкіл або алкіл, необов'язково заміщений розгалуженим ланцюгом, в якому алкілгрупа має арилом, гетероарилом, гідрокси або -NY3Y4. зазначені в даному описі значення. Приклади ал"Арилалкіл" означає арилалкілгрупу, в якій кіленрадикалів включають метилен, етилен і триарильний і алкільний залишки мають зазначені метилен. раніше значення. Переважні арил алкіл групи міс"Алкілендіокси" означає -О-алкілен-О-групу, в тять залишок С1-4алкілу. Приклади арилалкілгруп якій алкілен має зазначені вище значення. Приквключають бензил, 2-фенетил і нафталінметил. лади алкілендіоксигруп включають метилeндіокси "Арилалкілокси" означає арилалкіл-О-групу, в та етилендіокси. якій арилалкілгрупи мають зазначені раніше зна"Алкілсульфініл" означає алкіл-SO-групу, в чення. Приклади арилалкілоксигруп включають якій алкілгрупа має зазначені раніше значення. бензилокси і 1- або 2-нафталінметокси. Переважними алкілсульфінілгрупами є такі групи, "Арилалкілоксикарбоніл" означає арилалкіл-Ов яких алкілгрупа являє собою С1-4алкіл. СО-групу, в якій арилалкілгрупи мають зазначені "Алкілсульфоніл" означає алкіл-SО2-групу, в раніше значення. Прикладом арилалкілоксикарбоякій алкілгрупа має зазначені раніше значення. нілгрупи є бензилоксикарбоніл. Переважними алкілсульфонілгрупами є такі групи, "Арилалкілтіо" означає арилалкіл-S-групу, в в яких алкілгрупа являє собою С1-4алкіл. якій арилалкілгрупа має зазначені раніше значен"Алкілсульфонілкарбамоїл" означає алкіл-SО2ня. Прикладом арилалкілтіогрупи є бензилтіо. NН-С(=О)-групу, в якій алкілгрупа має зазначені "Арилокси" означає арил-О-групу, в якій арилраніше значення. Переважними алкілсульфонілкагрупа має зазначені раніше значення. Приклади рбамоїлгрупами є такі групи, в яких алкілгрупа арилоксигруп включають фенокси і нафтокси, кожявляє собою С1-4алкіл. на з яких необов'язково заміщена. "Алкілтіо" означає алкіл-S-групу, в якій алкілг"Арилоксикарбоніл" означає арил-О-С(=О)рупа має зазначені раніше значення. Приклади групу, в якій арилгрупа має зазначені раніше знаалкілтіогруп включають метилтіо, етилтіо, ізопрочення. Приклади арилоксикарбонілгруп включають пілтіо і гептилтіо. феноксикарбоніл і нафтоксикарбоніл. "Алкініл" означає аліфатичну вуглеводневу "Арилсульфініл" означає арил-SO-групу, в якій групу, що містить потрійний зв'язок вуглецьарилгрупа має зазначені раніше значення. вуглець, яка може мати прямий або розгалужений "Арилсульфоніл" означає арил-SО2-групу, в ланцюг, що містить від 2 до 15 атомів вуглецю. якій арилгрупа має зазначені раніше значення. Переважні алкінілгрупи мають від 2 до 12 атомів "Арилсульфонілкарбамоїл" означає aprni-SO2вуглецю у ланцюгу, найбільш переважно - від 2 до NH-C(=O)-групу, в якій арилгрупа має зазначені 6 атомів вуглецю (наприклад, від 2 до 4 атомів раніше значення. вуглецю). Приклади алкініл гру π включають ети"Арилтіо" означає арил-S-групу, в якій арилгніл, пропініл, н-бутиніл, ізо-бутиніл, 3-метилбут-2рупа має зазначені раніше значення. Приклади иніл і н-пентиніл. арилтіогруп включають фенілтіо і нафтилтіо. "Ароїл" означає арил-СО-групу, в якій арилг"Азагетероарил" означає ароматичний карборупа має зазначені в даному описі значення. Прициклічний залишок, що має від 5 до 10 кільцевих клади ароїлгруп включають бензоїл і 1- та 2членів, в якому одним із кільцевих членів є азот, а нафтоїл. інші кільцеві члени вибрані з вуглецю, кисню, сірки "Ароїламіно" означає ароїл-NH-групу, в якій і азоту. Приклади азагетероарилгруп включають ароїл має зазначені раніше значення. бензімідазоліл, імідазоліл, індазолініл, індоліл, "Арил" як група або частина групи означає: (і) ізохінолініл, піридил, піримідиніл, піроліл, хінолініл, необов'язково заміщений моноциклічний або поліхіназолініл і тетрагідроіндолізиніл. циклічний ароматичний карбоциклічний залишок, "Циклічний амін" означає 3-8-членну моноцикщо має від 6 до 14 атомів вуглецю, такий як феніл лічну циклоалкільну кільцеву систему, в якій один або нафтил; або (іі) необов'язково заміщений, часіз кільцевих атомів вуглецю замінений на азот і яка тково насичений поліциклічний ароматичний кар(і) може також містити додаткову гетероатомвмісну боциклічний залишок, в якому арильна і циклоалгрупу, вибрану з О, S, SO2 або NY5 (де Y5 являє кільна або циклоалкенільна група сконденсовані собою водень, алкіл, арил, арилалкіл, -C(=O)-R7, разом, утворюючи циклічну структуру, таку як тетC(O)-OR7 або -SO2R7); і (іі) може бути сконденсорагідронафтильне, інденільне або інданільне кільвана з додатковими арильними (наприклад, феніце. За винятком спеціально обумовлених випадків, льними), гетероарильними (наприклад, піридильарилгрупи можуть бути заміщені одним або декіними), гетероциклоалкільними або 17 76760 18 циклоалкільними кільцями для одержання біциклілметил. чної або трициклічної кільцевої системи. Приклади "Гетероарилалкілокси" означає гетероарилалциклічних амінів включають піролідин, піперидин, кіл-О-групу, в якій гетероарилалкілгрупа має заморфолін, піперазин, індолін, піріндолін, тетрагідзначені раніше значення. Приклади гетероарилалрохінолін і тому подібні групи. кілоксигруп включають необов'язково заміщений "Циклоалкеніл" означає неароматичну монопіридилметокси. циклічну або поліциклічну кільцеву систему, що "Гетероарилокси" означає гетероарил-О-групу, містить щонайменше один подвійний зв'язок вугв якій гетероарилгрупа має зазначені раніше зналець-вуглець, і що має від 3 до 10 атомів вуглецю. чення. Приклади гетероарилоксигруп включають Приклади моноциклічних циклоалкенільних кілець необов'язково заміщений піридилокси. включають циклопентеніл, циклогексеніл і цикло"Гетероарилсульфонілкарбамоїл" означає гегептеніл. тероарил-SО2-NН-С(=О)-групу, в якій гетероарилг"Циклоалкіл" означає насичену моноциклічну рупа має зазначені раніше значення. або біциклічну кільцеву систему, що має від 3 до "Гетероциклоалкіл" означає: (і) циклоалкілгру10 атомів вуглецю, необов'язково заміщену оксо. пу, що має від 3 до 7 кільцевих членів і містить Приклади моноциклічних циклоалкільних кілець один або декілька гетероатомів або гетероатомввключають С3-8циклоалкільні кільця, такі як цикломісних груп, вибраних із О, S і NY5, яка може бути пропіл, циклопентил, циклогексил і циклогептил. необов'язково заміщена оксо; (іі) частково насиче"Циклоалкілалкіл" означає циклоалкілалкілгний поліциклічний гетерокарбоциклічний залишок, рупу, в якій циклоалкільні і алкільні залишки мають в якому арильне (або гетероарильне) кільце, кожраніше зазначені значення. Приклади моноциклічне з яких необов'язково заміщене одним або декіних циклоалкілалкілгруп включають циклопропіллькома "замісниками арилгруп", і гетероциклоалкіметил, циклопентилметил, циклогексилметил і лгрупа сконденсовані разом, утворюючи циклічну циклогептилметил. структуру. (Приклади таких груп включають хро"Галоген" означає фтор, хлор, бром або йод. маніл, дигідробензофураніл, індолініл і піріндолініл Переважними є фтор і хлор. групи). "Гетероароїл" означає гетероарил-С(=О)"Гетероциклоалкілалкіл" означає гетероциклогрупу, в якій гетероарилгрупа має зазначені в даалкілалкілгрупу, в якій залишки гетероциклоалкілу ній заявці значення. Приклади гетероарилгруп та алкілу мають зазначені раніше значення. включають піридилкарбоніл. "Проліки" означають сполуку, яка перетворю"Гетероароїламіно" означає гетероароїл-NHється in vivo метаболічними шляхами (наприклад, rpyny, в якій гетероарильний залишок має зазнагідроліз) на сполуку формули (І), включаючи її Nчені раніше значення. оксиди. Наприклад, складний ефір сполуки фор"Гетероарил" як група або частина групи ознамули (І), що містить гідроксигрупу, може бути печає: (і) необов'язково заміщений ароматичний моретворений гідролізом in vivo на батьківську моленоциклічний або поліциклічний органічний заликулу. Альтернативно, складний ефір сполуки шок, що має приблизно від 5 до 10 кільцевих формули (І), що містить карбоксигрупу, може бути членів, в якому один або декілька кільцевих членів перетворений гідролізом in vivo на батьківську моявляє(-ють) собою елемент(-и), відмінні від вуглелекулу. цю, наприклад, азот, кисень або сірку (приклади Придатні складні ефіри сполук формули (І), що таких груп включають бензімідазоліл, бензтіазоліл, містять гідроксигрупу, включають, наприклад, ацефурил, імідазоліл, індоліл, індолізиніл, ізоксазоліл, тати, цитрати, лактати, тартрати, малонати, оксаізохінолініл, ізотіазоліл, оксадіазоліл, піразиніл, лати, саліцилати, пропіонати, сукцинати, фумарапіридазиніл, піразоліл, піридил, піримідиніл, піроти, малеати, метилен-біс- -гідроксинафтоати, ліл, хіназолініл, хінолініл, 1,3,4-тіадіазоліл, тіазогентисати, ізетіонати, ди-п-толуоїлтартрати, металіл, тієніл і триазолілгрупи, необов'язково заміщені нсульфонати, етансульфонати, бензолсульфонаодним або декількома замісниками арилгруп, що ти, п-толуолсульфонати, циклогексилсульфамати і мають вищезазначені значення, за винятком осохінати. бливо обумовлених випадків); (іі) необов'язково Придатні складні ефіри сполук формули (І), що заміщений, частково насичений полі циклічний містять карбоксигрупу, описані, наприклад, [F.J. гетерокарбоциклічний залишок, в якому гетероаLeinweber, Drug Metab. Res., 1987, 18, p.379]. рил і циклоалкіл або циклоалкенілгрупа сконденПридатні складні ефіри сполук формули (І), що совані разом, утворюючи циклічну структуру (примістять у залишку -L1-Y як карбоксигрупу, так і гідклади таких груп включають пірінданілгрупи, роксигрупу, включають лактони, які утворюються необов'язково заміщені одним або декількома "завнаслідок втрати води між зазначеними карбокси і місниками арилгруп", що мають вищезазначені гідроксигрупами. Приклади таких лактонів вклюзначення, за винятком особливо обумовлених вичають капролактони і бутиролактони. падків). Необов'язкові замісники включають один Особливо корисний клас складних ефірів споабо декілька "замісників арилгруп", що мають вилук формули (І), що містять гідроксигрупу, може щезазначені значення, за винятком особливо обубути одержаний з кислотних залишків, вибраних із мовлених випадків. залишків, описаних [Bundgaard et al., J. Med. "Гетероарилалкіл" означає гетероарилалкілгChem., 1989, 32, p.2503-2507], які включають зарупу, в якій гетероарильні і алкільні залишки маміщені (амінометил)бензоати, наприклад, діалкіють зазначені раніше значення. Переважні гетероламіно-метилбензоати, в яких дві алкілгрупи моарилалкілгрупи містять залишок С1-4алкілу. жуть бути з'єднані разом і/або перервані атомом Приклади гетероарилалкілгруп включають піридикисню або необов'язково заміщеним атомом азоту, 19 76760 20 наприклад, алкілованим атомом азоту, більш конгідроксинафтоати, гентисати, ізетіонати, ди-пкретно, (морфолінометил)бензоати, наприклад, 3толуоїлтартрати, метансульфонати, етансульфоабо 4-(морфолінометил)бензоати, і (4нати, бензолсульфонати, п-толуолсульфонати, алкілпіперазин-1-іл)бензоати, наприклад, 3- або 4циклогексилсульфамати і хінати. (4-алкілпіперазин-1-іл)бензоати. Крім того, що вони можуть бути корисними як Якщо сполука даного винаходу містить карбоактивні сполуки самі по собі, солі сполук даного ксигрупу або досить кислотну біоізостеру, то мовинаходу можуть бути використані для очищення жуть бути одержані адитивні солі основи, які є сполук, наприклад, завдяки використанню різної просто більш зручною формою для застосування; розчинності солей і батьківських сполук, побічних на практиці застосування сольової форми за свопродуктів і/або вихідних матеріалів способами, єю суттю є рівносильним застосуванню вільної добре відомими фахівцям у даній галузі техніки. кислотної форми. Основи, які можуть бути викориЗ посиланням на вищенаведену формулу (І), стані для одержання їхніх адитивних солей, перенаступні угруповання є конкретними і переважважно включають такі основи, які після сполучення ними: з вільною кислотою призводять до одержання фаR1 може, зокрема, являти собою: рмацевтично прийнятних солей, тобто солей, каті(і) водень; они яких нетоксичні для пацієнта у фармацевтич(іі) С1-4алкіл [наприклад, -СН3 або СН2СН3]; них дозах, таким чином, що корисна інгібуюча дія, (ііі) С1-4алкіл, заміщений галогеном [наприклад, яку чинить вільна основа, не усувається побічними -CH2CF3]; діями, які чинять катіони. Фармацевтично прийня(iv) С1-4алкіл, заміщений гідрокси [наприклад, тні солі, що включають солі, які одержують із соСН2ОН, -СН2СН2ОН або -CH2CH2CH2OH]; лей лужних і лужноземельних металів, в обсязі (ν) С1-4алкіл, заміщений -N(R6)C(=O)-R7 [наданого винаходу включають солі, які одержують із приклад, -CH2CH2CH2NHC(=O)-СН3]; таких основ: гідрид натрію, гідроксид натрію, гідро(vi) С1-4алкіл, заміщений -Ο(=Ο)-ΝΥ1Y2 [наприксид калію, гідроксид кальцію, гідроксид алюмінію, клад, гідроксид літію, гідроксид магнію, гідроксид цинку, аміак, етилендіамін, N-метилглюкамін, лізин, аргінін, орнітин, холін, Ν,Ν'-дибензилетилендіамін, хлорпрокаїн, діетаноламін, прокаїн, Nбензилфенетиламін, діетиламін, піперазин, або трис(гідроксиметил)амінометан, гідроксид тетра(vii) циклоалкілалкіл, заміщений гідрокси [наметиламонію і т.п. приклад, Деякі із сполук даного винаходу є основними, і такі сполуки можуть бути використані у вигляді вільної основи або у вигляді її фармацевтично прийнятної кислотно-адитивної солі. Кислотно-адитивні солі є більш зручною формою для застосування; на практиці застосування сольової форми за своєю суттю є рівносильним Особливо переважними є сполуки формули (І), застосуванню вільної основної форми. Кислоти, які в яких R1 являє собою водень, -СН3, -СН2СН3, можуть бути використані для одержання їхніх адиCH2CF3 або тивних солей, переважно включають такі кислоти, які після сполучення з вільною основою призводять до одержання фармацевтично прийнятних солей, тобто солей, аніони яких нетоксичні для пацієнта в фармацевтичних дозах таким чином, що корисна інгібуюча дія, яку чинить вільна осноЩе більш переважно R1 являє собою водень. ва, не усувається побічними діями, які чинять аніR2 може, зокрема, являти собою: они. Незважаючи на те, що переважними є фар(і) карбокси або кислотну біоізостеру (напримацевтично прийнятні солі зазначених основних клад, сполук, всі кислотно-адитивні солі можуть бути використані як джерела вільної основної форми, навіть у тому випадку, якщо одержання конкретної солі per se бажане тільки у вигляді проміжного продукту, як, наприклад, у тому випадку, коли сіль одержують тільки з метою очищення та ідентифікації, або коли її застосовують як проміжну сполуку (іі) гідрокси; для одержання фармацевтично прийнятної солі (ііі) алкіл, заміщений карбокси [наприклад, іонообмінним способом. Фармацевтично прийнятні СН2СН2СО2Н]; солі в обсязі даного винаходу включають солі, що одержують із мінеральних та органічних кислот, і включають гідрогалоїди, наприклад, гідрохлориди і гідроброміди, сульфати, фосфати, нітрати, суль(iv) гетероарил [наприклад, або фамати, ацетати, цитрати, лактати, тартрати, мапіридил]; лонати, оксалати, саліцилати, пропіонати, сукци(ν) -OR4, в якому R4 являє собою алкіл [напринати, фумарати, малеати, метилен-біс- клад, -ОСН ]; 3 21 76760 22 (vi) -OR4, в якому R4 являє собою алкіл або ци(ν) алкіл (наприклад, метил або етил); клоалкіл, заміщений однією або декількома гідрок(vi) алкіл, заміщений одним або декількома сигрупами [наприклад, -ОСН2СН2ОН, атомами галогену (наприклад, трифторметил); ОСН2СН2СН2ОН, -ОСН(СН3)СН2ОН, (vii) алкіл, заміщений -C(=O)-NY1Y2, особливо ОСН2СН(ОН)СН3, -ОСН2СН(ОН)СН2ОН або CH2-CH2-C(=O)NHCH3; 7 (viii) алкіл, заміщений -OR (наприклад, -CH2CH2-OCH3); (іх) -ZR4, особливо -ОСН3, -ОСН2СН3, -OCF2H або -ОСН2-СН2-ОСН3; (х) -C(=O)-OR5, особливо -С(=О)-ОН; (хі) -C(=O)-NY1Y2, особливо -C(=O)NHCH3 або C(=O)-NH-C(CH3)2-CH2OH; і (vii) -OR4, в якому R4 являє собою алкіл, заміщений однією або декількома алкоксигрупами [наприклад, -ОСН(СН3)СН2ОСН3]; (viii) -OR4, в якому R4 являє собою алкіл або циклоалкіл, заміщений однією або декількома карбоксигрупами [наприклад, -ОСН2СО2Н, ОСН(СН3)СО2Н або (хіі) -ΝΥ1Н2, особливо . Особливо переважними є сполуки формули (І), в яких R3 являє собою водень, ціано, піридил, трифторметил, CH2-CH2-C(=O)NHCH3, -OCF2H, -C(=O)-NH С(СН3)2-СН2ОН або . Ще більш переважно R3 являє собою -ОСН3. R2 переважно приєднаний у положення 5 індольного кільця. (іх) -OR4, в якому R4 являє собою циклоалкіл, заміщений -C(=O)-NY1Y2 [наприклад, або (х) -C(=O)-R, в якому R являє собою алкіл [наприклад, -С(=О)-СН3]; (хі) -C(=O)-NY1Y2 [наприклад, -CONH2, CONHCH3, -CONHCH(CH2OH)2, -CONHCH2CH2OH, -CONHC(CH3)2CH2OH, -CONHCH2CH2OCH3, CONHCH2CH2CONH2, -CONHCH2C(CH3)2OH або або (xii) -N(R6)-C(=O)-R7 [наприклад, NHC(=O)CH3]. Особливо переважними є сполуки формули (І), в яких R2 являє собою -ОСН3 або CONHC(CH3)2CH2OH. Ще більш переважно R2 являє собою -ОСН3. R3 може, зокрема, являти собою: (і) водень; (іі) ціано; (ііі) необов'язково заміщений арил (наприклад, феніл); (iv) необов'язково заміщений гетероарил (наприклад, необов'язково заміщений піридил або необов'язково заміщений індоліл, особливо або Група переважно приєднана у положення 3 індольного кільця. Мають на увазі, що даний винахід включає всі придатні комбінації згадуваних тут конкретних і переважних угруповань. Особливо переважними сполуками даного винаходу є такі сполуки: 23 і відповідні N-оксиди, і їхні про ліки; а також фармацевтично прийнятні солі і сольвати (наприклад, гідрати) таких сполук і їхні N-оксиди і проліки. Особливо переважними сполуками даного винаходу є: 76760 24 4-метокси-6-(5-метокси-1-Н-індол-3-іл)-7Нпіроло[2,3-а]піримідин; і відповідні N-оксиди, і їхні проліки; а також фармацевтично прийнятні солі і сольвати (наприклад, гідрати) таких сполук і їхні N-оксиди і проліки. Сполуки даного винаходу виявляють корисну фармакологічну активність і, відповідно, можуть бути введені у фармацевтичні композиції і використані для лікування пацієнтів, що страждають на певні медичні порушення. Таким чином, даний винахід передбачає, відповідно до подальшого аспекту, сполуки даного винаходу і композиції, що містять сполуки даного винаходу, для застосування в терапії. Сполуки, що входять до обсягу даного винаходу, відповідно до тестів, описаних у літературі, а також описуваних нижче методик in vitro, блокують каталітичну активність кінази, при цьому передбачається, що одержані результати тестів корелюють з фармакологічною активністю у людей та інших ссавців. Таким чином, подальший варіант здійснення даного винаходу передбачає сполуки даного винаходу, а також композиції, що містять сполуки даного винаходу, для застосування при лікуванні пацієнта, схильного до або страждаючого від станів, які можуть бути поліпшені введенням інгібіторів протеїнкінази (наприклад, Syk, FAK, KDR або Aurora2), зокрема, інгібітора Syk кінази. Наприклад, сполуки даного винаходу є корисними при лікуванні запальних захворювань, наприклад, астми; запальних дерматозів (наприклад, псоріазу, герпетиформного дерматиту, екземи, некротизуючого і шкірного васкуліту, бульозної хвороби); алергічного риніту та алергічного кон'юнктивіту; запалення суглобів, включаючи артрит, ревматоїдний артрит та інших артритичних станів, таких як ревматоїдний спондиліт, подагричний артрит, травматичний артрит, артрит корової краснухи, псоріатичний артрит і остеоартрит. Дані сполуки також корисні при лікуванні хронічної обструктивної хвороби легень (ХОХЛ), гострого синовіту, аутоімунного діабету, аутоімунного енцефаломієліту, коліту, атеросклерозу, захворювання периферичних судин, сердечно-судинного захворювання, розсіяного склерозу, рестенозу, міокардиту, лімфом Вклітин, системного червоного вовчака, хвороби "трансплантат проти хазяїна" та інших захворювань, пов'язаних з відторгненням трансплантата, різних видів раку і пухлин (таких як колоректальний рак, рак передміхурової, молочної, щитовидної залози, рак прямої кишки і легень), а також запального захворювання кишечнику. Крім того, дані сполуки корисні як пухлинні антиангіогенні агенти. Особливим варіантом здійснення терапевтичних способів даного винаходу є лікування астми. Іншим особливим варіантом здійснення тера 25 76760 26 певтичних способів даного винаходу є лікування ристані розріджувачі, такі як сахароза, етанол, псоріазу. поліетиленгліколь, пропіленгліколь, гліцерин і хлоІншим особливим варіантом здійснення терароформ або їхні суміші. певтичних способів даного винаходу є лікування Для парентерального введення застосовують запалення суглобів. емульсії, суспензії або розчини продуктів даного Іншим особливим варіантом здійснення теравинаходу у рослинній олії, наприклад, кунжутній певтичних способів даного винаходу є лікування олії, арахісовій олії або оливковій олії, або воднозапального захворювання кишечнику. органічні розчини, такі як вода і пропіленгліколь, у Іншим особливим варіантом здійснення тераскладних органічних ефірах для ін'єкцій, таких як певтичних способів даного винаходу є лікування етилолеат, а також стерильних водних розчинах різних видів раку і пухлин. фармацевтично прийнятних солей. Розчини солей Згідно з подальшими особливостями даного продуктів даного винаходу особливо підходять при винаходу, передбачається спосіб лікування людивведенні внутрішньом'язових або підшкірних ін'єкни або тварини, схильної до або страждаючої від цій. Водні розчини, які також містять розчини состанів, які можуть бути поліпшені введенням інгібілей у чистій дистильованій воді, можуть бути виторів протеїнкінази (наприклад, Syk, FAK, KDR або користані для внутрішньовенного введення за Aurora2), наприклад, вищеописаних станів, що умови, що їхній рН відповідним чином доведений, включає введення пацієнту ефективної кількості що вони правильно забуферені і перетворені на сполуки даного винаходу або композиції, що місізотонічні із застосуванням достатньої кількості тить сполуки даного винаходу. "Ефективна кільглюкози або хлориду натрію, і що вони піддані кість" означає кількість сполуки даного винаходу, стерилізації нагріванням, опроміненням або мікщо ефективно інгібує каталітичну активність пророфільтрацією. теїнкінази, такої як Syk, FAK, KDR або Aurora2, і Для місцевого застосування можуть бути витаким чином забезпечує бажану терапевтичну дію. користані гелі (на основі води або спирту), креми Лікування відповідно до даного опису включає або мазі, що містять сполуки даного винаходу. профілактичне лікування, а також лікування встаЗазначені сполуки також можуть бути введені у новлених станів. гелеву або матричну основу для застосування у До обсягу даного винаходу також включені вигляді пластиру, що забезпечує контрольоване фармацевтичні композиції, що містять, щонаймевивільнення сполуки через трансдермальний банше, одну сполуку даного винаходу в поєднанні з р'єр. фармацевтично прийнятним носієм або ексципієнДля введення шляхом інгаляції сполуки даного том. винаходу можуть бути розчинені або суспендовані Сполуки даного винаходу можуть бути введені у придатному носії для використання у розпилюбудь-якими відповідними способами. На практиці вачі або аерозолі, суспензії або розчині, або мосполуки даного винаходу можуть бути введені пажуть бути абсорбовані або адсорбовані на придарентерально, локально, ректально, перорально тному твердому носії для використання в або інгаляційно, особливо пероральним способом. інгаляторі з сухим порошком. Композиції даного винаходу можуть бути одеТверді композиції для ректального введення ржані відомими способами із застосуванням одновключають супозиторії, одержані згідно з відомими го або декількох фармацевтично прийнятних ад'юспособами, які містять щонайменше одну сполуку вантів або ексципієнтів. Ад'юванти включають, даного винаходу. серед іншого, розріджувачі, стерильні водні сереВідсотковий вміст активного інгредієнта в комдовища і різні нетоксичні органічні розчинники. позиціях даного винаходу може бути різним, при Композиції можуть мати вигляд таблеток, пілюль, цьому необхідно, щоб він становив частину, яка гранул, порошків, водних розчинів або суспензій, забезпечує відповідне дозування. Очевидно, що розчинів для ін'єкцій, еліксирів або сиропів, і моприблизно в один і той же час можуть бути введені жуть містити один або декілька агентів, вибраних декілька одиничних дозованих форм. Доза, що із групи, що включає підсолоджувачі, смакові резастосовується, визначається лікарем і залежить човини, барвники або стабілізатори для одержанвід бажаної терапевтичної дії, способу введення, ня фармацевтично прийнятних препаратів. Вибір тривалості лікування і стану пацієнта. носія і вмісту в ньому активної речовини звичайно Для дорослих дози звичайно складають прибвизначають відповідно до розчинності і хімічних лизно від 0,001 до 50, переважно - приблизно від властивостей активної сполуки, конкретного спо0,001 до 5мг/кг маси тіла на добу при інгаляції; собу введення і запобіжних засобів, яких дотриприблизно від 0,01 до 100, переважно - від 0,1 до муються у фармацевтичній практиці. Наприклад, 70, більш переважно - від 0,5 до 10мг/кг маси тіла для одержання таблеток можуть бути використані на добу при пероральному введенні; і приблизно ексципієнти, такі як лактоза, цитрат натрію, карбовід 0,001 до 10, переважно - від 0,01 до 1мг/кг манат кальцію, фосфат дикальцію і дезінтегруючі си тіла на добу при внутрішньовенному введенні. агенти, такі як крохмаль, альгінова кислота і деякі У кожному конкретному випадку дози визначають складні силікати у поєднанні з лубрикантами, тавідповідно до чинників, властивих пацієнту, що кими як стеарат магнію, лаурилсульфат натрію і піддається лікуванню, таких як вік, маса, загальний тальк. Для одержання капсул переважним є викостан здоров'я та інші характеристики, які можуть ристання лактози і високомолекулярних поліетивплинути на ефективність медичного продукту. ленгліколів. Одержувані водні суспензії можуть Сполуки даного винаходу можуть вводитися з містити емульгувальні агенти або агенти, що поленеобхідною частотою з метою одержання бажаногшують суспендування. Також можуть бути викого терапевтичного ефекту. Деякі пацієнти можуть 27 76760 28 швидко відповідати на більш високу або низьку відповідних сполук формули (І), в яких R2 і R3 мадозу, при цьому для них набагато нижчі підтримують вищезазначені значення, a R1 являє собою ючі дози можуть виявитися адекватними. Для інводень, із відповідним галоїдалкілом R2-X2, в якоших пацієнтів може знадобитися тривале лікуванму R2 являє собою необов'язково заміщений алкіл, ня на рівні від 1 до 4 доз на добу, відповідно до а X2 являє собою галоген. Дана взаємодія особлифізіологічних потреб кожного конкретного пацієнво підходить для одержання сполук формули (І), в та. Загалом, активний продукт може вводитися яких R1 являє собою морфоліноацетил. перорально від 1 до 4 разів на добу. Безумовно, Сполуки даного винаходу можуть бути також для деяких пацієнтів може знадобитися не більше одержані шляхом взаємного перетворення інших однієї або двох доз на добу. сполук даного винаходу. Сполуки даного винаходу можуть бути одерТаким чином, наприклад, сполуки формули (І), жані внаслідок застосування або адаптації відомих що містять карбоксигрупу, можуть бути одержані способів, що включають використовувані до цього гідролізом відповідного складного ефіру. Гідроліз часу або описані в літературі способи, наприклад, може бути доцільно здійснений шляхом лужного способи, описані [R.C. Larock, Comprehensive гідролізу із застосуванням основи, такої як гідрокOrganic Transformations, VCH Publishers, 1989]. сид лужного металу, наприклад, гідроксид літію, У взаємодіях, що описуються нижче, може буабо карбонат лужного металу, такий як карбонат ти потрібним захист реакційноздатних функціонакалію, у присутності суміші водного/органічного льних груп, наприклад, гідрокси, аміно, іміно, тіо розчинника із застосуванням органічних розчинниабо карбоксигруп, у тих випадках, коли їхня присуків, таких як діоксан, тетрагідрофуран або метатність бажана у кінцевому продукті, для того щоб нол, при температурі приблизно від температури уникнути їхньої небажаної участі у взаємодіях. навколишнього середовища до температури деМожуть бути використані відомі захисні групи відфлегмації. Гідроліз складного ефіру може бути повідно до стандартної практики; приклади наветакож здійснений у результаті кислотного гідролізу дені в [T.W. Greene, P.G.M. Wuts, "Protective із застосуванням неорганічної кислоти, такої як Groups in Organic Chemistry", John Wiley and Sons, хлористоводнева кислота, у присутності суміші 1991]. водного/інертного органічного розчинника із застоСполуки формули (І), де R1, R2 і R3 мають висуванням органічних розчинників, таких як діоксан щезазначені значення, одержують взаємодією або тетрагідрофуран, при температурі приблизно сполук формули (XXVIII): від 50 до 80°С. Як інший приклад, сполуки формули (І), що містять карбоксигрупу, можуть бути одержані внаслідок каталізованого кислотою видалення третбутилгрупи відповідних складних трет-бутилових ефірів із застосуванням стандартних реакційних умов, наприклад, взаємодії з трифтороцтовою кислотою при температурі, близькій до кімнатної температури. Як інший приклад, сполуки формули (І), що містять карбоксигрупу, можуть бути одержані вна3 і в якій R має вищезазначені значення, а X явслідок гідрогенізації відповідних складних бензиляє собою атом галогену, переважно йоду, або лових ефірів. Взаємодія може бути здійснена у трифлатну групу, із сполуками формули (XXIX): присутності форміату амонію і відповідного металічного каталізатора, наприклад, паладію, на підкладці з інертного носія, такого як вуглець, переважно у розчиннику, такому як метанол або етанол, і при температурі, близькій до температури дефлегмації. Взаємодія може бути альтернативно здійснена у присутності відповідного металічного каталізатора, наприклад, платини або паладію, на підкладці з інертного носія, такого як вуглець, переважно у розчиннику, такому як метанол або етанол. в якій R1 і R2 мають вищезазначені значення. Як інший приклад процесу взаємного перетвоРеакція сполучення може бути доцільно здійснена, рення, сполуки формули (І), що містять групу наприклад, у присутності комплексного металічноC(=O)-NY1Y2, можуть бути одержані шляхом поєдго каталізатора, такого як тетранання сполук формули (І), що містять карбоксигрукис(трифенілфосфін)паладій(0) і бікарбонат напу, з аміном формули ΗΝΥ1Y2 для одержання амітрію, у водному диметилформаміді при дного зв'язку внаслідок звичайного процесу температурі до температури дефлегмації. Дану пептидного зв'язування, наприклад, сполучення у реакцію доцільно здійснювати з піролом NH у споприсутності О-(7-азабензотриазол-1-іл)-1,1,3,3луці (XXVIII), захищеній, наприклад, тозилгрупою, тетраметилуронію гексафторфосфату і триетилата індолом NH у сполуці (XXIX), захищеній, наприміну (або діізопропілетиламіну) в тетрагідрофурані клад, трет-бутоксикарбонілгрупою. (або диметилформаміді) при кімнатній температуСполуки формули (І), в яких R2 і R3 мають вирі. Дана методика особливо застосовна для одерщезазначені значення, a R1 являє собою необов'яжання (і) сполук формули (І), в яких R3 являє созково заміщений алкіл, одержують взаємодією 29 76760 30 бою -C(=O)-NY1Υ2, або (іі) сполук формули (І), в в якій R1 являє собою алкіл, алкеніл, циклоаляких R2 являє собою -C(=O)-NY1Y2. Сполучення кіл, гетероциклоалкіл або алкіл, заміщений також може бути здійснене взаємодією сполук фоC(=O)NY1Y2, -OR7, -C(=O)-OR7, -ΝΥ1Y2, a X4 являє рмули (І), що містять карбоксигрупу, з N-оксидом собою галоген, переважно, бром, із застосуванням N-{(диметиламіно)(1Н-1,2,3-триазоло[4,5стандартних умов алкілування, наприклад, описаb]піридин-1-іл)метилен}-N-метилметанамінію гекних вище. сафторфосфату у присутності відповідної основи, Як інший приклад процесу взаємного перетвотакої як діізопропілетиламін, в інертному розчинрення, сполуки формули (І), що містять сульфокнику, такому як диметилформамід, і при темперасидні зв'язки, можуть бути одержані окисленням турі, близькій до кімнатної температури, з подальвідповідних сполук формули (І), що містять -Sшою взаємодією з аміном формули HNY1Y2 зв'язки. Наприклад, окислення може бути доцільно (хлорид амонію може бути використаний для одездійснене за допомогою взаємодії з пероксикислоржання сполук формули (І), що містять групу тою, наприклад, 3-хлорпербензойною кислотою, C(=O)-NH2). Сполучення також може бути здійснепереважно в інертному розчиннику, наприклад, не взаємодією сполук формули (І), що містять кардихлорметані, переважно при кімнатній або близьбоксигрупу, з 2-(1Н-бензотриазол-1-іл)-1,1,3,3кій до неї температурі, або, альтернативно, за дотетраметилуронію гексафторфосфатом у сухому помогою вторинного кислого пероксомоносульфадиметилформаміді з подальшою взаємодією з ту калію в середовищі, такому як водний метанол, аміном формули ΗΝΥ1Y2 у присутності діізопропізабуферений до приблизно рН 5, при температурі летиламіну. приблизно від 0°С до кімнатної температури. ДаЯк інший приклад процесу взаємного перетвоний спосіб є переважним для сполук, що містять рення, сполуки формули (І), що містять групу кислотно-лабільну групу. СН2ОН, можуть бути одержані внаслідок відновЯк інший приклад процесу взаємного перетволення відповідних сполук формули (І), що містять рення, сполуки формули (І), що містять сульфоногрупу -СНО або -CO2R7 (де R7 являє собою нижчий ві зв'язки, можуть бути одержані окисленням відалкіл). Наприклад, відновлення може бути доцільповідних сполук формули (І), що містять -S- або но здійснене взаємодією з літійалюміній гідридом сульфоксидні зв'язки. Наприклад, окислення може в інертному розчиннику, такому як тетрагідрофубути доцільно здійснене взаємодією з пероксикисран, і при температурі приблизно від кімнатної лотою, наприклад, 3-хлорпербензойною кислотою, температури до температури дефлегмації. переважно в інертному розчиннику, наприклад, Як інший приклад процесу взаємного перетводихлорметані, переважно при кімнатній або близьрення, сполуки формули (І), в яких R2 являє собою кій до неї температурі. гідрокси, можуть бути одержані взаємодією відпоЯк інший приклад процесу взаємного перетвовідних сполук формули (І), в яких R1 являє собою рення, сполуки формули (І), що містять ціаногрупу, метокси, з кислотою Льюїса, такою як трибромід можуть бути одержані взаємодією відповідних бору, в інертному розчиннику, такому як дихлорсполук формули (І), що містять групу -C(=O)-NH2, з метан, і при температурі приблизно від 0°С до кімпентахлоридом фосфору у присутності триетиланатної температури. міну. Взаємодія може бути доцільно здійснена в Як інший приклад процесу взаємного перетвоінертному розчиннику, такому як тетрагідрофуран, рення, сполуки формули (І), в яких R2 являє собою при температурі, близькій до температури дефле-OR4 (де R4 являє собою необов'язково заміщений гмації. алкіл, циклоалкіл, циклоалкілалкіл, гетероциклоаЯк інший приклад процесу взаємного перетволкіл або гетероциклоалкілалкіл), можуть бути одерення, сполуки формули (І), що містять групу ржані алкілуванням відповідних сполук формули C(=Ο)-ΝΗ2, можуть бути одержані взаємодією від(І), в яких R2 являє собою гідрокси, із сполуками повідних сполук формули (І), що містять ціаногруформули (XXX): пу, з перекисом водню у присутності гідроксиду R4-X3 (XXX) натрію. Взаємодія може бути доцільно здійснена в в якій R4 має зазначені вище значення, а X3 метанолі при температурі, близькій до кімнатної являє собою галоген, переважно, атом брому, або температури. тозилгрупу, із застосуванням стандартних умов Як інший приклад процесу взаємного перетвоалкілування. Алкілування, наприклад, може бути рення, сполуки формули (І), в яких R3 являє собою здійснене у присутності основи, такої як карбонат -ΝΥ1Υ2 (де Υ1 і Υ2 мають вищезазначені значення), лужного металу (наприклад, карбонат калію або можуть бути одержані взаємодією відповідних карбонат цезію), алкоксид лужного металу (наприсполук формули (І), в яких R3 являє собою галоген клад, третинний бутоксид калію) або гідрид лужно(наприклад, хлор), з аміном формули ΗΝΥ1Υ2 (де го металу (наприклад, гідрид натрію), в диметилΥ1 і Υ2 мають зазначені вище значення). формаміді або диметилсульфоксиді при Як інший приклад процесу взаємного перетвотемпературі приблизно від 0 до 100°С. рення, сполуки формули (І), в яких R3 являє собою Як інший приклад процесу взаємного перетвоціано, можуть бути одержані взаємодією сполук 1 1 рення, сполуки формули (І), в яких R являє собою формули (І), в яких X являє собою галоген, переалкіл, алкеніл, циклоалкіл, гетероциклоалкіл або важно, хлор, з ціанідом цинку у присутності пороалкіл, заміщений -C(=O)NY1Y2, -OR7, -C(=O)-OR7, шку цинку, комплексу [1',1ΝΥ1Y2, можуть бути одержані алкілуванням відпобіс(дифенілфосфіно)фероцен]дихлорпаладію(II) і відних сполук формули (Іа), в яких R1 являє собою дихлорметану (каталітична кількість) і Ν,Νводень, із відповідним галоїдом формули (XXXI): диметилацетаміду при температурі приблизно до R1-X4 (XXXI) 150°С. 31 76760 32 Як інший приклад процесу взаємного перетвовинаходу можуть бути одержані взаємодією вільрення, сполуки формули (І), що містять групу ної кислоти з відповідною основою внаслідок заC(=O)-OR5 (в якій R5 має вищезазначені значення), стосування або модифікації відомих способів. Наможуть бути одержані взаємодією відповідних приклад, основно-адитивні солі сполук даного сполук формули (І), що містять групу -С(=О)-ОН, зі винаходу можуть бути одержані або шляхом роз5 5 спиртами формули R -OH. Наприклад, якщо R чинення вільної кислоти у воді або водному спирявляє собою трет-бутил, то взаємодія може бути товому розчині, або іншому придатному розчиннидоцільно здійснена у присутності 1,1'ку, що містить відповідну основу, і виділення солі карбонілдіімідазолу і 1,8-діазабіцикло[5.4.0]ундецвнаслідок упарювання розчину, або шляхом взає7-ену при температурі, близькій до кімнатної теммодії вільної кислоти і основи в органічному розператури. чиннику, у цьому випадку сіль виділяється безпоНеобхідно брати до уваги, що сполуки даного середньо або може бути одержана внаслідок винаходу можуть містити асиметричні центри. Такі концентрування розчину. асиметричні центри можуть незалежно один від Вихідні матеріали і проміжні сполуки можуть одного перебувати в R- або S-конфігурації. Фахівбути одержані внаслідок застосування або адапцям у даній галузі техніки зрозуміло, що певні спотації відомих способів, наприклад, способів, опилуки даного винаходу можуть також мати геометсаних у порівняльних прикладах або їхніх очевидричну ізомерію. Також мають на увазі, що даний них хімічних еквівалентах. винахід включає окремі геометричні ізомери і стеПроміжні сполуки формули (XXVIII), в яких R3 реоізомери, а також їхні суміші, включаючи рацемає вищезазначені значення, X1 являє собою йод, мічні суміші, сполук вищенаведеної формули (І). а пірол NH захищений тозилгрупою, можуть бути Такі ізомери можуть бути виділені з їхніх сумішей одержані відповідно до схеми 1. внаслідок застосування або адаптації відомих способів, наприклад, способів хроматографії і перекристалізації, або вони можуть бути одержані окремо з відповідних ізомерів їхніх проміжних сполук. Згідно з подальшими особливостями даного винаходу, адитивні солі кислоти сполук даного винаходу можуть бути одержані взаємодією вільної основи з відповідною кислотою внаслідок застосування або модифікації відомих способів. НаТак, наприклад, сполуки формули (XXXIV) моприклад, кислотно-адитивні солі сполук даного жуть бути одержані: винаходу можуть бути одержані або шляхом роз(і) взаємодією сполук формули (XXVII) з парачинення вільної основи у воді або водному спиртолуолсульфонілхлоридом у присутності водного товому розчині, або іншому придатному розчиннигідроксиду натрію і сульфату тетрабутиламонію в ку, що містить відповідну кислоту, і виділення солі інертному розчиннику, такому як толуол, при кімвнаслідок упарювання розчину, або шляхом взаєнатній температурі; модії вільної основи і кислоти в органічному роз(іі) подальшою обробкою одержаної сполуки чиннику, у цьому випадку сіль виділяється безпоформули (XXVIII) бутиллітієм у тетрагідрофурані середньо або може бути одержана внаслідок при температурі близько -78°С; концентрації розчину. (ііі) взаємодією одержаного аніона з йодом. Кислотно-адитивні солі сполук даного винахоПроміжні сполуки формули (XXVIII), в якій R3 ду можуть бути одержані із солей внаслідок застоявляє собою гетероарил, можуть бути одержані сування або адаптації відомих способів. Напривзаємодією сполук формули (XXVIII), в якій R3 явклад, батьківські сполуки даного винаходу можуть ляє собою галоген, наприклад, хлор, з бораном бути одержані з їхніх кислотно-адитивних солей формули R3BEt2, в якій R3 являє собою гетероавнаслідок обробки лугом, наприклад, водним розрил. Взаємодія може бути доцільно здійснена у чином бікарбонату натрію або водним розчином присутності тетракис(трифенілфосфін)паладію(0) і аміаку. карбонату калію в тетрагідрофурані при темпераСполуки даного винаходу можуть бути одертурі до температури дефлегмації. Дана взаємодія жані з їхніх основно-адитивних солей внаслідок особливо підходить для одержання сполук форзастосування або модифікації відомих способів. мули (XXVIII), в якій R3 являє собою піридил. Наприклад, батьківські сполуки даного винаходу Проміжні сполуки формули (XXVIII), в якій R3 можуть бути одержані з їхніх основно-адитивних являє собою гетероарил, можуть бути також одесолей внаслідок обробки кислотою, наприклад, ржані взаємодією сполук формули (XXVIII), в якій хлористоводневою кислотою. R3 являє собою галоген, наприклад хлор, з гетеСполуки даного винаходу можуть бути доцільроарилбороновими кислотами формули R3B(OH)2 но одержані або утворені в ході процесу даного у присутності тетравинаходу у вигляді сольватів (наприклад, гідратів). кис(трифенілфосфін)паладію(0) і водного бікарбоГідрати сполук даного винаходу можуть бути доцінату натрію в диметилформаміді при температурі льно одержані перекристалізацією з суміші воднодо температури дефлегмації. Дана взаємодія осого/органічного розчинника із застосуванням оргабливо підходить для одержання сполук формули нічних розчинників, таких як діоксан, (XXVIII), в якій R3 необов'язково являє собою затетрагідрофуран або метанол. міщений індоліл. Згідно з подальшими особливостями даного Проміжні сполуки формули (XXVIII), в якій R3 винаходу, основно-адитивні солі сполук даного 33 76760 34 являє собою OR4, де R4 має вищезазначені значення, можуть бути одержані взаємодією сполук формули (XXVIII), в якій R3 являє собою галоген, наприклад хлор, із сполуками формули R4ONa (одержані взаємодією спирту формули R4OH з , R2 являє собою -ОМе, R3 явнатрієм) при температурі близько 65°С. Дана взаємодія особливо підходить для одержання сполук формули (XXVIII), в якій R3 являє собою ОМе. Далі даний винахід проілюстрований прикладами, однак він не обмежується нижченаведеними ілюстративними і порівняльними прикладами. ляє собою -CF3, група приєднана в Умови для здійснення високоефективної ріположенні 3 індольного кільця, а група R2 приєддинної хроматографії-мас-спектрометрії (LC-MS) з нана в положенні 5 індольного кільця, представметою визначення часу утримування (RT) такі: лену формулою (II): Спосіб А: колонка Hypersil BDS С-18 (4,6мм 50мм), що працює з оберненою фазою в умовах градієнтного елюювання сумішами (А) води, що містить 0,05% трифтороцтової кислоти і (В) ацетонітрилу, що містить 0,05% трифтороцтової кислоти, як градієнт рухомої фази: (0,00 хвилин 100%А:0%В; лінійний градієнт до 100%В протягом 2 хвилин; потім утримання до 3,5 хвилин); швидкість потоку 1мл/хвилину з приблизно 0,25мл/хвилину розщепленням на масспектрометрі; об'єм впорскування 10мкл; довжина хвилі детектора Hewlett Packard Model НР1100 Series UV 200нм; визначення розсіювання світла при випаровуванні (ELS) - температура 46°С, тиск одержують відповідно до наступної схеми: азоту 4бара. Спосіб В: модель інжектора Gilson 251 із застосуванням колонки Hypersil HyPURITY С-185мкм (4,6мм 50мм), що працює в умовах градієнтного елюювання сумішами (А) води, що містить 0,05% трифтороцтової кислоти і (В) ацетонітрилу, що містить 0,05% трифтороцтової кислоти, як градієнт рухомої фази: (0,00 хвилин 95%А:5%В; лінійний градієнт до 95%В протягом 4 хвилин; потім до 5%В протягом 4,5 хвилин; потім утримання до 6 хвилин); об'єм впорскування 5мкл і швидкість потоку 1 мл/хвилину до УФ детектора (DAD) з подальшим приблизно 0,100мл/хвилину розщепленням на мас-спектрометрі (позитивний електроспрей) із залишком - до детектора ELS. Спосіб С: прилад для визначення мікромаси, модель LCT, з'єднаний із приладом моделі HP 1100. Надлишок сполуки визначають, застосовуючи HP фотодіодний антенно-гратчастий детектор, модель G1315A, в діапазоні довжин хвиль 200600нм, і детектор розсіювання світла при випаровуванні Sedex, модель 65. Дані мас-спектра одержують у діапазоні від 180 до 800. Дані аналізують, застосовуючи комп'ютерну програму Micromass MassLynx. Розділення здійснюють на колонці Hypersil BDS С18 (4,6мм 50мм) з розміром частинок 3мкм, з елююванням лінійним градієнтом від 5 до 90% ацетонітрилу, що містить 0,05% (об./об.) трифтороцтової кислоти, у воді, що містить 0,05% (і) обробка 7Н-піроло[2,3-b]піримідину (1) 3(об./об.) трифтороцтової кислоти, протягом 3,5 хлорпербензойною кислотою у дихлорметані при хвилин зі швидкістю потоку 1мл/хвилину. Загальна температурі близько 0°С для одержання 7Нтривалість роботи, включаючи урівноваження копіроло[2,3-b]піримiдин-N-оксиду (2); лонки, становить 7 хвилин. (іі) взаємодія сполуки (2) з оксибромідом фосПриклад 1 фору при температурі близько 50°С для одержан2-[5-Метокси-3-(4-трифторметил-7Ння 4-бром-7Н-піроло[2,3-b]піримідину (3); піроло[2,3-b]піримідин-6-іл)індол-1-іл]-1-морфолін(ііі) взаємодія сполуки (3) з 44-ілетанон толуолсульфонілхлоридом у присутності сульфату 1 Сполуку формули (І), в якій R являє собою 35 76760 тетрабутиламонію і водного гідроксиду натрію в толуолі для одержання 4-бром-7Н-піроло[2,3b]піримідину (4); (iv) взаємодія сполуки (4) з трифторметилтриметилсиланом у присутності фториду калію і йодиду міді (І) у диметилформаміді при температурі близько 60°С для одержання 7-(толуол-4сульфоніл)-4-трифторметил-7Н-піроло[2,3b]піримідину (5); (ν) обробка сполуки (5) діізопропіламідом літію у тетрагідрофурані при температурі близько -78°С із подальшою взаємодією одержуваного аніона з йодом для одержання 6-йод-7-(толуол-4сульфоніл)-4-трифторметил-7Н-піроло[2,3b]піримідину (6); (vi) поєднання сполуки (6) з 1-третбутилоксикарбоніл-5-метокси-1H-індол-3бороновою кислотою у присутності тетракис(трифенілфосфін)паладїю(0) і бікарбонату натрію у водному диметилформаміді при температурі, близькій до температури дефлегмації, і видалення трет-бутилоксикарбонілзахисної групи з подальшою обробкою метилйодидом у присутності гідриду натрію в тетрагідрофурані для одержання 6-(5-метокси-1Н-індол-3-іл)-7-(толуол-4сульфоніл)-4-трифторметил-7Н-піроло[2,3b]піримідину (7); (vii) видалення тозилзахисної групи у сполуці (7) обробкою гідроксидом калію в метанолі для одержання 6-(5-метокси-1Н-індол-3-іл)-4трифторметил-7Н-піроло[2,3-b]піримідину (8); і (viii) алкілування сполуки (8) 4-(2хлорацетил)морфоліном у присутності гідриду натрію в диметилформаміді для одержання 2-[5метокси-3-(4-трифторметил-7Н-піроло[2,3b]піримідин-6-іл)індол-1-іл]-1-морфолін-4ілетанону (II). Приклад 2 (2-Гідрокси-1,1-диметилетил)амід 1-метил-3(7Н-троло[2,3-b]піримідин-6-іл)-1Н-індол-5карбонової кислоти Сполуку формули (І), в якій R1 являє собою СН3, R2 являє собою , R3 являє собою -Н, група приєднана в положенні 3 індольного кільця, а група R2 приєднана в положенні 5 індольного кільця, представлену формулою (III): 36 одержують відповідно до наступної схеми: (і) взаємодія сполуки (9) з 4толуолсульфонілхлоридом у присутності сульфату тетрабутиламонію і водного гідроксиду натрію в толуолі для одержання сполуки (10); (іі) обробка сполуки (10) діізопропіламідом літію в тетрагідрофурані при температурі близько 78°С із подальшою взаємодією одержуваного аніона з йодом для одержання сполуки (11); (ііі) поєднання сполуки (11) з і-третбутилоксикарбоніл-5-метокси-Ш-індол-3бороновою кислотою (12) у присутності тетракис(трифенілфосфін)паладію(0) і бікарбонату натрію у водному диметилформаміді при температурі, близькій до температури дефлегмації, і видалення трет-бутилоксикарбонілзахисної групи з подальшою обробкою метилйодидом у присутності гідриду натрію в тетрагідрофурані для одержання 6-[(1-метил-5-карбометоксііндол)-3-іл]-7Нпіроло[2,3-b]піримідину (13); (iv) обробка сполуки (13) водним метанольним гідроксидом калію при температурі кипіння із зворотним холодильником для одержання 6-[(1метил-5-карбоксііндол)-3-іл]-7Н-піроло[2,3b]піримідину (14); і 37 76760 38 (ν) поєднання сполуки (14) з 2-гідрокси-1,1видалення трет-бутилоксикарбонілзахисної групи диметилетиламіном у присутності О-(7для одержання 6-[(5-метоксііндол)-3-іл]-7-(толуолазабензотриазол-1-іл)-1,1,3,3-тетраметилуронію 4-сульфоніл)-7Н-піроло[2,3-b]піримідину (16); гексафторфосфату і діізопропілетиламіну в диме(іі) обробка сполуки (16) водним метанольним тилформаміді для одержання (2-гідрокси-1,1гідроксидом калію при температурі кипіння із зводиметилетил)аміду 1-метил-3-(7Н-піроло[2,3ротним холодильником для одержання 6-[(5b]піримідин-6-іл)-1Н-індол-5-карбонової кислоти метоксііндол)-3-іл]-7Н-піроло[2,3-b]піримідину (17); (III). і Приклад 3 (ііі) взаємодія сполуки (17) з гідридом натрію в 2-{[5-Метокси-3-(7Н-піроло[2,3-b]піримідин-6диметилформаміді з подальшою взаємодією з іл)індол-1-іл]-1-морфолін-4-ілі-етанон морфолінамідом 2-бромоцтової кислоти для одеСполуку формули (І), в якій R1 являє собою ржання 2-{[5-метокси-3-(7Н-піроло[2,3-b]піримідин6-іл)індол-1-іл]-1-морфолін-4-іл}-етанону (IV). Приклад 4 Сполуку формули (І), в якій R1 являє собою CH2CF3, R2 являє собою -ОМе, R3 являє собою , R2 являє собою ОМе, R являє собою -Н, група приєднана в положенні 3 індольного кільця, а група R2 приєднана в положенні 5 індольного кільця, представлену формулою (IV): CN, група приєднана в положенні 3 індольного кільця, а група R2 приєднана в положенні 5 індольного кільця, представлену формулою (VII): одержують відповідно до наступної схеми: одержують відповідно до наступної схеми: (і) сполучення 6-йод-7-(толуол-4-сульфоніл)7Н-піроло[2,3-b]піримідину (11), 1-третбутилоксикарбоніл-5-метоксііндол-3-боронової кислоти (15) у присутності тетракис(трифенілфосфін)паладію(0) і бікарбонату натрію у водному диметилформаміді при температурі, близькій до температури дефлегмації, і (і) взаємодія сполук (18) і (19) у присутності карбонату калію і йодиду натрію для одержання 39 76760 40 сполуки (20); (іі) взаємодія сполуки (20) з тіосечовиною у присутності етоксиду натрію в етанолі для одержання сполуки (21); (ііі) циклізація сполуки (21) шляхом нагрівання в толуолі за умов, близьких до дефлегмації, для одержання сполуки (22); (iv) взаємодія сполуки (22) з оксибромідом фосфору для одержання 4-бром-7Н-піроло[2,3b]піримідину (23); (ν) взаємодія сполуки (23) з 4толуолсульфонілхлоридом у присутності сульфату (і) взаємодія сполуки (26) з гідридом натрію в тетрабутиламонію і водного гідроксиду натрію в тетрагідрофурані з подальшою взаємодією з метолуолі для одержання сполуки (24); тилйодидом для одержання сполуки (29); (vi) обробка сполуки (24) діізопропіламідом лі(іі) взаємодія сполуки (29) з оксидом вуглецю у тію в тетрагідрофурані при температурі близько присутності паладію в метанолі при температурі 78°С з подальшою взаємодією одержуваного аніокипіння із зворотним холодильником для одержанна з йодом для одержання сполуки (25); ня сполуки (30); (vii) поєднання сполуки (25) з і-трет(ііі) обробка сполуки (30) водним метанольним бутилоксикарбоніл-5-метоксііндол-3-бороновою гідроксидом калію при температурі кипіння із звокислотою у присутності тетраротним холодильником для одержання сполуки кис(трифенілфосфін)паладію(0) і бікарбонату на(31); і трію у водному диметилформаміді при температу(iv) поєднання сполуки (31) з 2-гідрокси-1,1рі, близькій до температури дефлегмації, і диметилетиламіном у присутності О-(7видалення трет-бутилоксикарбонілзахисної групи азабензотриазол-1-іл)-1,1,3,3-тетраметилуронію для одержання 4-бром-6-[(5-метоксііндол)3-іл]гексафтор-фосфату і діізопропілетиламіну в диме7(тоулол-4-сульфоніл)-7Н-піроло[2,3-b]піримідину тилформаміді для одержання сполуки (IX). (26); Приклад 6 (viii) взаємодія сполуки (26) з гідридом натрію Сполуку формули (І), в якій R1 являє собою в тетрагідрофурані з подальшою взаємодією з 2трифторйодетаном для одержання сполуки (27); (їх) взаємодія сполуки (27) з ціанідом цинку у присутності паладію в Ν',Ν-диметиланіліні при температурі близько 140°С для одержання сполуки (28); і , R2 являє собою -ОМе, R3 (х) обробка сполуки (28) водним метанольним гідроксидом калію при температурі кипіння із зворотним холодильником для одержання сполуки являє собою , група формули (VII). Приклад 5 Сполуку формули (І), в якій R1 являє собою СН3, R2 являє собою -ОМе, R3 являє собою , група приєднана в положенні 3 індольного кільця, а група R2 приєднана в положенні 5 індольного кільця, представлену формулою (IX): одержують відповідно до наступної схеми: приєднана в положенні 3 індольного кільця, а група R2 приєднана в положенні 5 індольного кільця, представлену формулою (V): одержують відповідно до наступної схеми: 41 (і) взаємодія сполуки (26) з метилакрилатом у присутності ацетату паладію, трифенілфосфіну і триетиламіну при температурі близько 110°С для одержання сполуки (32); (іі) гідрогенізація сполуки (32) у присутності паладію на вуглеці для одержання сполуки (33); (ііі) обробка сполуки (33) водним метанольним гідроксидом калію при температурі кипіння із зворотним холодильником для одержання кислоти (34); (iv) поєднання сполуки (34) з метиламіном у присутності О-(7-азабензотриазол-1-іл)-1,1,3,3тетраметилуронію гексафторфосфату і діізопропілетиламіну в диметилформаміді для одержання сполуки (35); і (ν) алкілування сполуки (35) 4-(2хлорацетил)морфоліном у присутності гідриду натрію в диметилформаміді для одержання сполуки (V). Приклад 7 Сполуку формули (І), в якій R1 являє собою , R2 являє собою -ОМе, R3 яв ляє собою , група приєднана в положенні 3 індольного кільця, а група R2 приєднана в положенні 5 індольного кільця, представлену формулою (VI): 76760 42 одержують відповідно до наступної схеми: (і) поєднання сполуки (26) з піридин-3бороновою кислотою у присутності тетракис(трифенілфосфін)паладію(0) і бікарбонату натрію у водному диметилформаміді при температурі, близькій до температури дефлегмації, для одержання 4-(піридин-3-іл)-6-[(5-метоксііндол)-3іл]-7-(толуол-4-сульфоніл)-7Н-піроло[2,3b]піримідину (36); (іі) обробка сполуки (36) водним метанольним гідроксидом калію при температурі кипіння із зворотним холодильником для одержання сполуки (37) (приклад 9); і (ііі) алкілування сполуки (37) (приклад 9) 4-(2хлорацетил)морфоліном у присутності гідриду натрію в диметилформаміді для одержання 2-[5метокси-3-(4-(піридин-3-іл)-7Н-піроло[2,3b]піримідин-6-іл)індол-1-іл]морфолін-4-ілетанону (VI). Приклад 8 Сполуку формули (І), в якій R1 являє собою СН2СНз, R2 являє собою -ОМе, R3 являє собою , група приєднана в положенні 3 індольного кільця, а група R2 приєднана в положенні 5 індольного кільця, представлену формулою (VIII): одержують відповідно до наступної схеми: 43 (і) алкілування сполуки (26) з етил йодидом у присутності гідриду натрію в диметилформаміді для одержання сполуки (38); (іі) взаємодія сполуки (38) з морфоліном у мікрохвильовій печі при температурі близько 200°С в , , -трифтортолуолі для одержання сполуки (39); і (ііі) обробка сполуки (39) водним метанольним гідроксидом калію при температурі кипіння із зворотним холодильником для одержання сполуки (VIII). Приклад 9 6-(5-Метокси-1Н-індол-3-іл)-4-піридин-3-іл-7Нпіроло[2,3-d]піримідин Розчин 6-йод-7-[(4-метилфеніл)сульфоніл]-4піридин-3-іл-7Н-піроло[2,3-d]піримідину [260мг, порівняльний приклад 1] і 1-трет-бутилкарбоксил5-метокси-1Н-індол-3-боронової кислоти [178мг, порівняльний приклад 12] у диметилформаміді (10мл) обробляють тетракистрифенілфосфіном паладію (13мг) і двовуглекислим натрієм (8мг). Реакційну суміш перемішують при температурі кипіння із зворотним холодильником протягом 2 годин і дають їй можливість охолодитися до кімнатної температури. Розчин упарюють при зниженому тиску і залишок розподіляють між водою та етилацетатом. Органічну фазу відділяють, потім сушать над сульфатом магнію та упарюють при зниженому тиску. Залишок піддають колонковій флеш-хроматографії на двоокисі кремнію, елююючи сумішшю етилацетату і метанолу (95:5, об./об.) для одержання 6-(5-метокси-1Н-індол-3-іл)-4піридин-3-іл-7Н-піроло[2,3-d]піримідину (20мг) у 76760 44 вигляді аморфної твердої речовини. MS: 342 [МН]+, LC-MS (спосіб A) RT=2,57 хвилини. Приклад 10 4-Метокси-6-(5-метокси-1-метил-1Н-індол-3іл)-7Н-піроло[2,3-d]піримідин Розчин 4-метокси-6-(5-метокси-1-метил-1Ніндол-3-іл)-7-[(4-метилфеніл)-сульфоніл]-7Нпіроло[2,3-d]піримідину [361мг, порівняльний приклад 4] в метанолі (20мл) обробляють гідроксидом калію (1,53г). Реакційну суміш перемішують протягом 16 годин при кімнатній температурі і піддають кипінню із зворотним холодильником протягом години. Розчин упарюють при зниженому тиску і залишок розподіляють між водою та етилацетатом. Органічну фазу відділяють, потім сушать над сульфатом магнію та упарюють при зниженому тиску. Залишок розтирають з діетиловим ефіром, одержуючи 4-метокси-6-(5-метокси-1-метил-1Ніндол-3-іл)-7Н-піроло[2,3-d]піримідин (155мг) у вигляді твердої речовини з температурою плавлення 184°С. MS: 309 [МН]+. Приклад 11 4-Метокси-6-(5-метокси-1Н-індол-3-іл)-7Нпіроло[2,3-d]піримідин Розчин 4-метокси-6-(5-метокси-1Н-індол-3-іл)7-[(4-метилфеніл)сульфоніл]-7Н-піроло[2,3d]піримідину [448мг, порівняльний приклад 5] у метанолі (15мл) обробляють гідроксидом калію (1,96г). Реакційну суміш перемішують протягом 2 годин при кімнатній температурі і розчинник випарюють при зниженому тиску. Залишок розподіляють між водою та етилацетатом. Органічну фазу відділяють, потім сушать над сульфатом магнію та упарюють при зниженому тиску. Залишок піддають колонковій флеш-хроматографії на двоокисі кремнію, елююючи сумішшю етилацетату і циклогексану (80:20, об./об.) для одержання 4-метокси-6-(5метокси-1Н-індол-3-іл)-7Н-піроло[2,3-d]піримідину (320мг) у вигляді жовтої твердої речовини з температурою плавлення >260°С. MS: 295 [МН]+. Приклад 12 4-(5-Метокси-1Н-індол-3-іл)-6-(5-метокси-1метил-1Н-індол-3-іл)-7Н-піроло[2,3-d]піримідин 45 76760 46 мішшю етилацетату і метанолу (90:10, об./об.), а також сумішшю етилацетату і циклогексану (50:50, об./об.) для одержання зазначеної у заголовку сполуки (2,5мг) у вигляді твердої аморфної речовини. MS: 351 [МН]+. LC-MS (Спосіб В) RT=3,05 хвилини. Порівняльний приклад 3 4-Хлор-7-[(4-метилфеніл)сульфоніл1-7Нпіроло[2,3-d]піримідин Розчин 4-хлор-7Н-піроло[2,3-d]піримідину [посилання: Gerster, John F.; Hinshaw, Barbara С; Robins, Roland K.; Townsend, Leroy B. Study of Розчин 4-(5-метокси-1-[(4electrophylic substitution in the pyrrolo[2,3метилфеніл)сульфоніл]-1Н-індол-3-іл)-6-(5d]pyrimidine ring. J. Heterocycl. Chem. (1969), (2), метокси-1-метил-1H-індол-3-іл)-7-[(4207-213] (20г) і пара-толуолсульфонілхлориду метилфеніл)сульфоніл]-7Н-піроло[2,3-d](28,6г) в толуолі (1л) обробляють розчином гідрокпіримідину [93мг, порівняльний приклад 9] у метасиду натрію (50г) у воді (800мл), а також сульфанолі (5мл) обробляють гідроксидом калію (249мг). том тетрабутиламонію (462мг). Розчин енергійно Реакційну суміш перемішують протягом 16 годин перемішують при кімнатній температурі протягом 2 при кімнатній температурі. Розчин упарюють при годин і розподіляють між етилацетатом і розсолом. зниженому тиску і залишок розподіляють між етиОрганічну фазу відділяють, потім сушать над сулацетатом і водою. Органічну фазу відділяють, льфатом магнію та упарюють при зниженому тиспотім сушать над сульфатом магнію та упарюють ку. Залишок піддають колонковій флешпри зниженому тиску. Залишок очищають за допохроматографії на двоокисі кремнію, елююючи грамогою ВЕРХ, одержуючи 4-(5-метокси-1Н-індол-3дієнтом етилацетату і циклогексану (від 50:50 до іл)-6-(5-метокси-1-метил-1Н-індол-3-іл)-7Н80:20, об./об.) для одержання зазначеної у заголопіроло[2,3-d]піримідин (9мг) у вигляді смоли. MS: вку сполуки (2,5г) у вигляді твердої речовини з 424 [МН]+. LC-MS (Спосіб В) RT=3,15 хвилини. температурою плавлення 143°С. LC-MS (Спосіб В) Порівняльний приклад 1 RT=2,78 хвилини. 6-Йод-7-[(4-метилфеніл)сульфоніл1-4-піридинПорівняльний приклад 4 3-іл-7Н-піроло[2,3-d]піримідин 4-Метокси-6-(5-метокси-1-метил-1H-індол-3До розчину 7-[(4-метилфеніл)сульфоніл]-4іл)-7-[(4-метилфеніл)сульфоніл]-7Н-піроло[2,3піридин-3-іл-7Н-піроло[2,3-d]піримідину [1г, порівd]піримідин няльний приклад 2] у тетрагідрофурані (20мл) при До розчину 4-метокси-6-(5-метокси-1Н-індол-3-78°С по краплях додають розчин бутиллітію в іл)-7-[(4-метилфеніл)-сульфоніл]-7Н-піроло[2,3гексані (2мл, 1,6М) в інертній атмосфері. Розчин d]піримідину [448г, порівняльний приклад 5] у диперемішують при зазначеній температурі протягом метилформаміді (20мл) додають гідрид натрію 1,5 години і до нього додають йод (796мг). Реак(44мг, 60% дисперсія в маслі) і метилйодид ційну суміш перемішують при температурі -78°С (156мг) в інертній атмосфері. Розчин перемішують протягом ще 1 години і дають їй можливість нагріпротягом 1 години при кімнатній температурі і розтися до кімнатної температури. Реакційну суміш чинник випарюють при зниженому тиску. Залишок розподіляють між етилацетатом і водним розчирозподіляють між водою та етилацетатом. Органіном сульфіту натрію. Органічну фазу відділяють, чну фазу відділяють, потім сушать над сульфатом потім сушать над сульфатом магнію та упарюють магнію та упарюють при зниженому тиску. Залипри зниженому тиску. Залишок піддають колонкошок піддають колонковій флеш-хроматографії на вій флеш-хроматографії на двоокисі кремнію, двоокисі кремнію, елююючи сумішшю етилацетату елююючи градієнтом етилацетату і циклогексану і циклогексану (30:70, об./об.) для одержання за(50:50, до 100, об./об.) для одержання зазначеної значеної у заголовку сполуки (260мг) у вигляді у заголовку сполуки (260мг) у вигляді твердої амотвердої аморфної речовини. MS: 464 [МН]+. LC-MS рфної речовини. MS: 477 [МН]+. LC-MS (Спосіб В) (Спосіб В) RT=4,39 хвилини. RT=3,26 хвилини. Порівняльний приклад 5 Порівняльний приклад 2 4-Метокси-6-(5-метокси-1Н-індол-3-іл)-7-[(47-[(4-Метилфеніл)сульфоніл]-4-піридин-3-ілметилфеніл)сульфоніл]-7Н-піроло[2,3-d]піримідин 7Н-піроло[2,3-d]піримідин Розчин 6-йод-4-метокси-7-[(4Розчин 4-хлор-7-[(4-метилфеніл)сульфоніл]метилфеніл)сульфоніл]-7Н-піроло[2,3-d]піримідину 7Н-піроло[2,3-d]піримідину [4г, порівняльний прик[1,98г, порівняльний приклад 6] і 1-третлад 3] і діетил-3-піридилборану (2,1г) у тетрагідбутилкарбоксил-5-метокси-1Н-індол-3-боронової рофурані (180мл) обробляють тетракистрифенілкислоти [1,26г, порівняльний приклад 12] у димефосфіном паладію (0,65г) і карбонату калію (3,59г). тилформаміді (40мл) послідовно обробляють наРозчин перемішують при температурі кипіння із сиченим водним розчином бікарбонату натрію зворотним холодильником протягом 24 годин і (10мл) і тетракистрифенілфосфіном паладію упарюють при зниженому тиску. Залишок розподі(165мг). Реакційну суміш перемішують при темпеляють між етилацетатом і розсолом. Органічну ратурі кипіння із зворотним холодильником протяфазу відділяють, потім сушать над сульфатом гом 3 годин і розчинник випарюють при зниженому магнію та упарюють при зниженому тиску. Залитиску. Залишок розподіляють між етилацетатом і шок двічі піддають колонковій флешводою. Органічну фазу відділяють, потім сушать хроматографії на двоокисі кремнію, елююючи су 47 76760 48 над сульфатом магнію та упарюють при зниженоПорівняльний приклад 9 му тиску. Залишок піддають колонковій флеш4-(5-Метокси-1-[(4-метилфеніл)сульфоніл]-1Нхроматографії на двоокисі кремнію, елююючи суіндол-3-іл)-6-(5-метокси-1-метил-1Н-індол-3-іл)-7мішшю етилацетату і циклогексану (50:50, об./об.) [(4-метилфеніл)сульфоніл1-7Н-піроло[2,3для одержання зазначеної у заголовку сполуки d]піримідин (1,8г) у вигляді сірої твердої речовини з темпераДо розчину 4-(5-метокси-1-[(4турою плавлення 131°С. MS: 450 [МН]+. метилфеніл)сульфоніл]-1Н-індол-3-іл)-6-(5Порівняльний приклад 6 метокси-1Н-індол-3-іл)-7-[(46-Йод-4-метокси-7-[(4-метилфеніл)сульфоніл]метилфеніл)сульфоніл]-7Н-піроло[2,3-d]піримідину 7Н-піроло[2,3-d]піримідин [270мг, порівняльний приклад 10] у диметилфорДо розчину 4-метокси-7-[(4маміді (10мл) додають гідрид натрію (10мг, 60% метилфеніл)сульфоніл]-7Н-піроло[2,3-d]піримідину дисперсія в маслі) і метилйодид (0,025мл) в інерт[2,23г, порівняльний приклад 7] у тетрагідрофурані ній атмосфері. Розчин перемішують протягом 16 (35мл) при температурі -78°С по краплях додають годин при кімнатній температурі і розчинник випарозчин бутиллітію в гексані (5мл, 1,6М) в інертній рюють при зниженому тиску. Залишок розподіляатмосфері. Розчин перемішують при температурі ють між водою та етилацетатом. Органічну фазу 70°С протягом години і додають йод (2,05г). Реаквідділяють, потім сушать над сульфатом магнію та ційну суміш перемішують при температурі -70°С упарюють при зниженому тиску. Залишок піддають протягом ще 1 години, дають їй можливість нагріколонковій флеш-хроматографії на двоокисі кремтися до кімнатної температури і розподіляють між нію, елююючи сумішшю етилацетату і циклогексаетилацетатом і водним розчином сульфіту натрію. ну (50:50, об./об.) для одержання зазначеної у заОрганічну фазу відділяють, потім сушать над суголовку сполуки (93мг) у вигляді твердої аморфної льфатом магнію та упарюють при зниженому тисречовини. MS: 732 [МН]+. LC-MS (Спосіб В) ку, одержуючи зазначену в заголовку сполуку RT=4,68 хвилини. (2,64г) у вигляді твердої аморфної речовини. MS: Порівняльний приклад 10 430 [МН]+. LC-MS (Спосіб В) RT=4,15 хвилини. 4-(5-Метокси-1-[(4-метилфеніл)сульфоніл]-1НПорівняльний приклад 7 індол-3-іл)-6-(5-метокси-1Н-індол-3-іл)-7-[(44-Метокси-7-[(4-метилфеніл)сульфоніл1-7Нметилфеніл)сульфоніл]-7Н-піроло[2,3-d]піримідин піроло[2,3-d]піримідин Розчин 4-хлор-6-йод-7-[(4Розчин 4-хлор-7Н-піроло[2,3-d]піримідину [1,2г, метилфеніл)сульфоніл]-7Н-піроло[2,3-d]піримідину порівняльний приклад 8] і пара[1,72г, порівняльний приклад 11] і 1-треттолуолсульфонілхлориду (1,77г) в толуолі (60мл) бутилкарбоксил-5-метокси-1Н-індол-3-боронової обробляють розчином гідроксиду натрію (3,2г) у кислоти [1,26г, порівняльний приклад 12] у димеводі (30мл), а також сульфатом тетрабутиламонію тилформаміді (36,5мл) послідовно обробляють (27мг). Розчин енергійно перемішують при кімнатнасиченим водним розчином бікарбонату натрію ній температурі протягом 4 годин і розподіляють (9,1мл) і тетракистрифенілфосфіном паладію між етилацетатом і розсолом. Органічну фазу від(0,3г). Реакційну суміш перемішують при темпераділяють, потім сушать над сульфатом магнію та турі кипіння із зворотним холодильником протягом упарюють при зниженому тиску. Залишок піддають 2 годин, і розчинник випарюють при зниженому колонковій флеш-хроматографії на двоокисі кремтиску. Залишок розподіляють між етилацетатом і нію, елююючи градієнтом етилацетату і циклогекводою. Органічну фазу відділяють, потім сушать сану (від 50:50 до 80:20, об./об.) для одержання над сульфатом магнію та упарюють при зниженозазначеної у заголовку сполуки (2,23г) у вигляді му тиску. Залишок піддають колонковій флешаморфної твердої речовини. MS: 304 [МН]+. LC-MS хроматографіїна двоокисі кремнію, елююючи су(Спосіб В) RT=3,88 хвилини. мішшю етилацетату і циклогексану (30:70, об./об.) Порівняльний приклад 8 для одержання зазначеної у заголовку сполуки 4-Метокси-7Н-піроло[2,3-d]піримідин (270мг) у вигляді смоли. MS: 718 [МН]+. LC-MS До розчину метоксиду натрію, одержаного (спосіб В) RT=4,44 хвилини. внаслідок поступового додавання натрію (2г) до Порівняльний приклад 11 метанолу (100мл) в інертній атмосфері, додають 4-Хлор-6-йод-7-[(4-метилфеніл)сульфоніл]-7Н4-хлор-7Н-піроло[2,3-d]піримідин [посилання: піроло[2,3-d]піримідин Gerster, John F.; Hinshaw, Barbara С; Robins, До розчину 4-хлор-7-[(4Roland K.; Townsend, Leroy B. Study of electrophylic метилфеніл)сульфоніл]-7Н-піроло[2,3-d]піримідину substitution in the pyrrolo[2,3-d]pyrimidine ring. J. [5,4г, порівняльний приклад 3] в тетрагідрофурані Heterocycl. Chem. (1969), (2), 207-13] (3,5г). Розчин (96мл) при температурі -78°С по краплях додають перемішують при температурі 65°С протягом 16 розчин бутиллітію в гексані (12,1мл, 1,6М) в інертгодин, а потім розподіляють між етилацетатом і ній атмосфері. Розчин перемішують при темперарозсолом. Органічну фазу відділяють, потім сутурі -78°С протягом 3 годин і додають йод (8,9г). шать над сульфатом магнію та упарюють при зниРеакційну суміш перемішують при температурі женому тиску. Залишок піддають колонковій 78°С протягом 2 годин і дають їй можливість нагріфлеш-хроматографії на двоокисі кремнію, елююютися до кімнатної температури. Реакційну суміш чи сумішшю етилацетату і циклогексану (50:50, розподіляють між етилацетатом і водним розчиоб./об.) для одержання зазначеної у заголовку ном сульфіту натрію, сушать над сульфатом магсполуки (1,2г) у вигляді аморфної твердої речовинію, а розчинник випарюють при зниженому тиску. ни. MS: 150 [МН]+. LC-MS (Спосіб В) RT=2,39 хвиЗалишок піддають колонковій флеш-хроматографії лини. на двоокисі кремнію, елююючи градієнтом етила 49 76760 50 цетату і циклогексану (50:50, до 100, об./об.) для обох флуорофорів, XL-665 і Еu-K, наведений в [G. одержання зазначеної у заголовку сполуки (1,52г) Mathis et al., Anticancer Research, 1997, 17, p.3011у вигляді аморфної твердої речовини. MS: 434 3014]. Специфічний довготривалий сигнал XL-665, [МН]+. LC-MS (Спосіб В) RT=4,26 хвилини. одержуваний тільки при фосфорилюванні синтеПорівняльний приклад 12 тичного пептиду Syk, вимірюють на апараті для 1-Трет-бутилкарбоксил-5-метокси-1Н-індол-3прочитання планшетів LJL Biosystems Analyst AD. боронова кислота Інгібування активності syk сполуками даного винаРозчин складного трет-бутилового ефіру 3ходу виражають у вигляді відсоткової величини бром-5-метоксііндол-1-карбонової кислоти [50г, інгібування контрольної активності, що виявляєтьпорівняльний приклад 13], що перемішується в ся при відсутності досліджуваних сполук. Конкреттетрагідрофурані (800мл), в атмосфері азоту обні переважні сполуки даного винаходу інгібують робляють трибутилборатом (49,5мл), потім охолоактивність syk з ІС50 в інтервалі від 100 мікромолів джують до температури -100°С, після чого обробдо 100 наномолів. Особливо переважні сполуки ляють розчином н-бутиллітію в гексанах (94мл, даного винаходу інгібують активність syk з ІС50 в 2,5М), підтримуючи температуру нижче -90°С. Заінтервалі від 1 мікромоля до 100 наномолів. кінчивши додавання, суміші дають можливість 2. Антигеніндукована дегрануляція клітин баповільно нагрітися до кімнатної температури прозофільного лейкозу у щурів (RBL) тягом години, а потім гасять її, додаючи лід (10г). 2.1. Клітинна культура, мічення клітин RBLОрганічну фазу видаляють при зниженому тиску, а 2H3 і здійснення дослідження залишок розподіляють між етилацетатом (500мл) і Клітини RBL-2H3 тримають у колбах Т75 при водою (400мл). Органічний шар сушать над сультемпературі 37°С і 5% СО2 і пересіюють кожні 3-4 фатом магнію, а потім упарюють, одержуючи задні. Для збирання клітин використовують 5мл тризначену в заголовку сполуку у вигляді твердої репсину-ЕДТА, промиваючи колбу один раз, потім у човини кремового кольору (28г). MS: 314 кожну колбу додають по 5мл трипсину та інкубу[MH+Na]+. LC-MS (Спосіб С) RT=4,07 хвилини. ють при кімнатній температурі протягом 2 хвилин. Порівняльний приклад 13 Клітини переносять у пробірку з 14-мл середовиСкладний трет-бутиловий ефір 3-бром-5щем, центрифугують зі швидкістю 1100об./хв. при метоксііндол-1-карбонової кислоти кімнатній температурі протягом 5 хвилин і знову До розчину 5-метоксііндолу (10г) в сухому дипіддають суспендуванню до 2 105/мл. Клітини семетилформаміді (150мл) при температурі навконсибілізують, додаючи до кожних 10мл клітин 1мкл лишнього середовища по краплях додають бром DNP-специфічного IgE. У кожну ямку плоскодонно(4мл), пересвідчившись у тому, що температура не го 96-ямкового планшета (40000клітин/ямку) допідіймається вище приблизно 30°С. Суміш відразу дають по 200мкл клітин, після чого планшет інкуж обробляють триетиламіном (28мл) і 4бують протягом ночі при температурі 37°С і 5% диметиламінопіридином (0,5г), а потім розчином СО2. Наступного дня сполуки одержують у 100% ди-трет-бутилдикарбонату (18г) у сухому диметиДМСО при 10мМ. Потім кожну сполуку розводять лформаміді (80мл), продовжуючи перемішування 1:100 у буфері для аналізів, а потім знову розвоще протягом 4 годин. Реакційну суміш упарюють, а дять у 1% ДМСО-буфері для аналізів для одерзалишок розподіляють між етилацетатом (250мл) і жання кінцевої концентрації, що становить 0,03водою (200мл). Водний шар екстрагують етилаце30мкМ. У кожну ямку додають по 80мкл буфера татом (100мл). Об'єднані органічні фази промивадля аналізів, а потім по 10мкл розведених сполук, ють водою (100мл), потім розсолом (100мл), після після чого протягом 5 хвилин здійснюють інкубучого сушать над сульфатом магнію та упарюють. вання. У кожну ямку додають по 10мкл DNP-HSA Залишок піддають колонковій флеш-хроматографії (100нг/мл) та інкубують при температурі 37°С (без на двоокисі кремнію, елююючи сумішшю пентану СО2) протягом 30 хвилин. Як один вид контролю та етилацетату (19:1, об./об.) для одержання задо ряду ямок додають тільки 1% ДМСО (без спозначеної у заголовку сполуки (23,4г) у вигляді безлуки) для визначення загального рівня вивільненбарвної твердої речовини з температурою плавня. Як інший вид контролю до іншого ряду ямок лення 111-112°С. замість DNP-HSA додають буфер для визначення Методика тестів in vitro для Syk величини фону аналізу. Через 30 хвилин надоса1. Інгібуюча дія сполук на Syk кіназу дові рідини переносять у новий 96-ямковий планІнгібуючу дію сполук на Syk кіназу визначають, шет. У кожну ямку планшета для досліджень дозастосовуючи флуоресцентний аналіз із розділендають по 50мкл над осадової рідини. У кожну ямку ням у часі. додають по 100мкл розчину субстрату та інкубуКаталітичний домен Syk кінази (залишки A340ють при температурі 37°С протягом 90 хвилин. З N635) експресують у вигляді злитого білка у дріжметою припинення реакції додають 50мкл 0,4Μ джових клітинах і очищають до гомогенного стану. розчину гліцину і планшет прочитують при 405нм Активність кінази визначають у 50мМ Трис-НСІ на апараті для прочитання планшетів Molecular буфера, рН 7,0, що містить 50мМ NaCl, 5мМ Devices SpectraMax 250. MgCl2, 5мМ МnСl2, 1мкМ аденозинтрифосфату і 2.2. Підрахунок результатів 10мкМ синтетичного пептиду Біотин-( -аланін)3(і) Підраховують середнє ±SD (стандартне відDЕЕDYЕІРР-NН2. Ферментативні реакції припиняхилення) кожного набору ямок із трьох повторів. ють, додаючи буфер, що містить 0,4Μ KF, 133мМ (іі) Максимальна відповідь означає позитивні ЕДТА, рН 7,0, що містить кон'югат стрептавідинуконтрольні ямки, що містять антиген (100нг/мл) без ХL665 і моноклональне фосфоспецифічне антитісполуки. ло, кон'юговане з криптатом європію (Еu-K). Опис (ііі) Мінімальна відповідь означає контрольні 51 76760 52 ямки, що містять буфер (без антигену) і не містять і підраховують ІС50 сполуки, використовуючи комсполуки. п'ютерну програму Prism GraphPad і нелінійний (iv) Застосовуючи дані величини як максимум регресійний аналіз найменших квадратів. (100%) і мінімум (0%), відповідно, одержують ексСполуки даного винаходу інгібують антигенінпериментальні дані для визначення відсоткової дуковану дегрануляцію клітин базофільного лейвеличини максимальної відповіді (позначеної як % козу щурів (RBL) з ЕС50 в інтервалі від 100 до 1 контролю). мікромолів. (ν) Будують криву залежності відповіді від дози Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrole pyrimidines as protein kinase inhibitors
Автори англійськоюMadgid Takhir Nadim, Edlin Kris, Pedgrift Bryan Lesley, Halley Frank, Edwards Michael
Назва патенту російськоюПирролопиримидины в качестве ингибиторов протеинкиназы
Автори російськоюМаджид Тахир Надим, Эдлин Крис, Педгрифт Брайан Лесли, Халли Фрэнк, Эдвардз Майкл
МПК / Мітки
МПК: A61P 27/14, A61P 9/00, A61P 37/08, C07D 487/04, A61K 31/5377, A61P 29/00, A61P 17/06, A61P 43/00, A61P 19/02, A61P 35/00, A61P 11/00, A61P 17/00, A61K 31/519, A61P 11/06, A61P 11/02
Мітки: піролопіримідини, інгібітори, протеїнкінази
Код посилання
<a href="https://ua.patents.su/26-76760-pirolopirimidini-yak-ingibitori-protenkinazi.html" target="_blank" rel="follow" title="База патентів України">Піролопіримідини як інгібітори протеїнкінази</a>
Попередній патент: П’єзоелектричний двигун
Наступний патент: Спосіб синтезу тропенолу для його одержання в промисловому масштабі
Випадковий патент: Спосіб виготовлення мульчі