Заміщені бензиламінопіперидини, фармацевтична композиція та спосіб лікування
Формула / Реферат
1. Замещенные бензиламинопиперидины общей формулы (1):
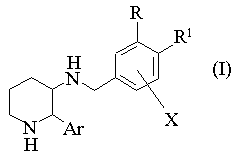
и их фармацевтически приемлемые соли, где
R представляет собой галоген-С1-С8-алкил, галоген-С2-С8-алкенил, галоген-С2-С8-алкинил или галоген-С1-С8-алкил, замещенный гидрокси-или С1-С8-алкокси-группой; R1 представляет собой атом водорода, атом галогена или С1-С6-алкокси-группу; или
R и R1 вместе с двумя атомами углерода, общими для бензольного кольца и заместителей R и R1, образуют конденсированный С4-С6-циклоалкил, где один атом углерода необязательно заменен атомом кислорода, и где один или два атома углерода необязательно имеют до пяти заместителей, выбираемых из числа атома галогена, С1-С6-алкила и галоген-С1-С6-алкила;
Χ представляет собой С1-С6-алкокси-, галоген-С1-С6-алкокси-, фенокси-группу или атом галогена; и
Ar представляет собой фенильную группу, необязательно замещенную атомом галогена.
2. Соединение по п. 1, где Χ представляет собой атом галогена, метокси-, дифторметокси-, трифторметокси- или фенокси-группу и находится в положении 2 фенильного кольца; а Аr представляет собой фенил.
3. Соединение по п. 2, где Χ представляет собой метокси-, дифторметокси- или трифторметокси-группу.
4. Соединение по п. 2 или 3, где R представляет собой С1-С6-алкил, гидрокси-С1-С6-алкил, C2-C6-алкенил, C2-С6-алкинил, причем эти группы замещены двумя-семью атомами галогена; a R1 представляет собой атом водорода или метокси-группу.
5. Соединение по п. 2 или 3, где R и R1 вместе с двумя атомами углерода, общими для бензольного кольца и заместителей R и R1, образуют конденсированный С4-C6-циклоалкил в котором один атом углерода необязательно заменен атомом кислорода и в котором один или два атома углерода могут необязательно иметь до четырех заместителей, выбираемых из числа атома фтора и трифторметильной группы.
6. Соединение по п. 1 общей формулы (Ia):
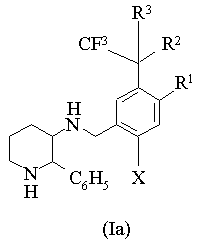 ,
,
где R1 представляет собой атом водорода, атом галогена или метокси-группу; R2 и R3 независимо друг от друга выбирают из группы, включающей атом галогена, С1-С6-алкил, С2-С6-алкенил и С2-С6-алкинил, или R2 и R3 вместе образуют С1-С6-алкилиден, где алкильный, алкенильный, алкинильный и алкилиденовый фрагменты необязательно содержат до семи атомов галогена;
или R1 и R2 вместе образуют конденсированный С4-С6-циклоалкил, в котором один атом углерода необязательно заменен атомом кислорода, причем С4-С6-циклоалкил необязательно замещен заместителями в количестве до четырех, выбираемыми из группы, включающей атом галогена, С1-С4-алкил и галоген-С1-С4-алкил.
7. Соединение по п. 4, где R представляет собой С1-С6-aлкил гидрокси-С1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, причем эти группы замещены двумя-тремя атомами фтора.
8. Соединение по п. 7, где R представляет собой С1-С6-алкил, замещенный двумя-тремя атомами фтора.
9. Соединение по п. 4, где R представляет собой С1-С6-алкил, гидрокси-С1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, причем эти группы замещены четырьмя-семью атомами фтора.
10. Соединение по п. 7, где R представляет собой трифторметил, дифторэтил, трифторэтил, трифторизопропил, трифтор-трет-бутил, трифтор-1,1-диметилметил-3-бутинил или 2-хлортрифторизопропил.
11. Соединение по п. 4, где R представляет собой пентафторэтил, пентафторпропил, пентафторизопропенил, гексафторизопропил, гептафторизопропил, гексафтор-2-гидрооксиизопропил или гексафтортрет-бутил.
12. Соединение по п. 5, где R и R1 вместе с двумя атомами углерода, общими для бензольного кольца и заместителей R и R1, образуют трифторциклопентил, трифторметилциклогексил, дифторциклогексил или дифтордиметилциклогексил.
13. Соединение по п. 7, выбираемое из группы, включающей:
(2S,3S)-3-(2-Фтор-5-(трифторметил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(2-Хлор-5-(трифторметил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(2-Метокси-5-(трифторметил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(2-Фенокси-5-(трифторметил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(5-(1,1-Дифторэтил)-2-(трифторметокси)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(5-(1,1-Дифторэтил)-2-метоксибензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(2-Метокси-5-(2,2,2-трифторэтил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(2-Метокси-5-(1-(трифторметил)этил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-[5-(1,1-Диметил-4,4,4-трифтор-2-бутинил)-2-метоксибензил]амино-2-фенилпиперидин или его соли;
(2S,3S)-3-[5-(1,1-Диметил-2,2,2-трифторэтил)-2-метоксибензиламино]-2-фенилпиперидин или его соли;
(2S,3S)-3-(2,4-Диметокси-5-(2,2,2-трифторэтил)бензил)амино-2-фенилпиперидин или его соли; и
(2S,3S)-3-[5-[1-Хлор-(1-трифторметил)этил]-2-метоксибензиламино]-2-фенилпиперидин или его соли.
14. Соединение по п. 9, выбираемое из группы, включающей:
(2S,3S)-2-Фенил-3-(5-(2,2,2-трифтор-1-(трифторметил)этил)-2-метоксибензил)аминопиперидин или его соли;
(2S,3S)-2-Фенил-3-(5-(1,2,2,2-тетрафтор-1-(трифторметил)этил)-2-метоксибензил)аминопиперидин или его соли;
(2S,3S)-3-(2-Метокси-5-(1,1,2,2,2-пентафторэтил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-2-Фенил-3-(5-(2,2,2-трифтор-1-метил-1-(трифторметил)этил)-2-метоксибензил) аминопиперидин или его соли;
(2S,3S)-3-(5-(2,2-Дифтор-1-(трифторметил)этенил]-2-метоксибензил]амино-2-фенилпиперидин или его соли; и
(2S,3S)-3-(2-Метокси-5-(2,2,2-трифтор-1-гидрокси-1-(трифторметил)этил)бензил)амино-2-фенилпиперидин или его соли.
15. Соединение по п. 12, выбираемое из группы, включающей:
(2S,3S)-3-[5-Метокси-1-(трифторметил)индан-6-ил)метиламино]-2-фенилпиперидин или его соли;
(2S,3S)-3-((6-Метокси-1-(трифторметил)-1,2,3,4-тетрагидронафталин-7-ил)метил)амино-2-фенилпиперидин или его соли; и
(2S,3S)-3-((2,2-Дифтор-6-метокси-1,2,3,4-тетрагидронафталин-7-ил)метил)амино-2-фенилпиперидин или его соли.
16. Соединение по п. 10, выбираемое из группы, включающей:
(2S,3S)-3-(2-Метокси-5-(трифторметил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(2-Метокси-5-(2,2,2-трифторэтил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(2-Метокси-5-(1-(трифторметил)этил)бензил)амино-2-фенилпиперидин или его соли;
(2S,3S)-3-(5-(1,1-Дифторэтил)-2-(трифторметокси)бензил)амино-2-фенилпиперидин или его соли; и
(2S,3S)-3-[5-(1,1-Диметил-2,2,2-трифторэтил)-2-метоксибензиламино]-2-фенилпиперидин или его соли.
17. Соединение по п. 12, которое представляет собой
(2S,3S)-2-фенил-3-(5-(2,2,2-трифтор-1-(трифторметил)этил)-2-метоксибензил)аминопиперидин или его соли.
18. Соединение по п. 15, которое представляет собой
(2S,3S)-3-[5-метокси-1-(трифторметил)индан-6-ил)метиламино]-2-фенилпиперидин или его соли.
19. Способ лечения или профилактики желудочно-кишечного расстройства, расстройства центральной нервной системы, воспалительного заболевания, рвоты, недержания мочи, боли, мигрени, солнечной эритемы, болезней, расстройств и неблагоприятных состояний, вызванных Helicobacter pylori, или заболеваний кровеносных сосудов у млекопитающего, отличающийся тем, что он включает введение указанному млекопитающему терапевтически эффективного количества соединения по п. 1.
20. Фармацевтическая композиция для лечения или профилактики желудочно-кишечного расстройства, расстройства центральной нервной системы, воспалительного заболевания, рвоты, недержания мочи, боли, мигрени, солнечной эритемы, болезней, расстройств и неблагоприятных состояний, вызванных Helicobacter pylori, или заболеваний кровеносных сосудов у млекопитающего, которая содержит терапевтически эффективное количество соединения по п. 1 и фармацевтически приемлемый носитель.
Текст
1 Замещенные бензиламинопиперидины общей формулы (1) R R1 положении 2 фенильного кольца, а Аг представляет собой фенил 3 Соединение по п 2, где X представляет собой метокси-, дифторметокси- или трифторметоксигруппу 4 Соединение по п 2 или 3, где R представляет собой Сі-Сб-алкил, гидрокси-Сі-Сє-алкил, Сг-Сєалкенил, Сг-Сє-алкинил, причем эти группы замещены двумя-семью атомами галогена, a R1 представляет собой атом водорода или метоксигруппу 5 Соединение по п 2 или 3, где R и R1 вместе с двумя атомами углерода, общими для бензольного кольца и заместителей R и R1, образуют конденсированный С4-Сб-циклоалкил в котором один атом углерода необязательно заменен атомом кислорода и в котором один или два атома углерода могут необязательно иметь до четырех заместителей, выбираемых из числа атома фтора и трифторметильной группы 6 Соединение по п 1 общей формулы (la) R3 (I) и их фармацевтически приемлемые соли, где R представляет собой галоген-Сі-Св-алкил, галоген-Сг-Св-алкенил, галоген-Сг-Св-алкинил или галоген-С-і-Сз-алкил, замещенный гидрокси-или d Cs-алкокси-группой, R1 представляет собой атом водорода, атом галогена или Сі-Сє-алкоксигруппу, или R и R1 вместе с двумя атомами углерода, общими для бензольного кольца и заместителей R и R1, образуют конденсированный С4-Сб-циклоалкил, где один атом углерода необязательно заменен атомом кислорода, и где один или два атома углерода необязательно имеют до пяти заместителей, выбираемых из числа атома галогена, С-і-Сєалкила и галоген-Сі-Сє-алкила, X представляет собой Сі-Сє-алкокси-, галоген-Сг Сє-алкокси-, фенокси-группу или атом галогена, и Аг представляет собой фенильную группу, необязательно замещенную атомом галогена 2 Соединение по п 1, где X представляет собой атом галогена, метокси-, дифторметокси-, трифторметокси- или фенокси-группу и находится в О 3 CF . X (1а) 1 где R представляет собой атом водорода, атом галогена или метокси-группу, R2 и R3 независимо друг от друга выбирают из группы, включающей атом галогена, Сі-Сє-алкил, Сг-Сє-алкенил и C-zСє-алкинил, или R2 и R3 вместе образуют С-і-Сєалкилиден, где алкильный, алкенильный, алкинильный и алкилиденовый фрагменты необязательно содержат до семи атомов галогена, или R1 и R вместе образуют конденсированный С4-Сб-циклоалкил, в котором один атом углерода необязательно заменен атомом кислорода, причем С4-Сб-циклоалкил необязательно замещен заместителями в количестве до четырех, выбираемыми из группы, включающей атом галогена, СгС4-алкил и галоген-Сі-С4-алкил 00 00 48981 7 Соединение по п 4, где R представляет собой Сі-Сб-алкил гидрокси-Сі-Сє-алкил, Сг-Сє-алкенил или Сг-Сб-алкинил, причем эти группы замещены двумя-тремя атомами фтора 8 Соединение по п 7, где R представляет собой СгСб-алкил, замещенный двумя-тремя атомами фтора 9 Соединение по п 4, где R представляет собой Сі-Сб-алкил, гидрокси-Сі-Сб-алкил, Сг-Сє-алкенил или Сг-Сб-алкинил, причем эти группы замещены четырьмя-семью атомами фтора 10 Соединение по п 7, где R представляет собой трифторметил, дифторэтил, трифторэтил, трифторизопропил, трифтор-трет-бутил, трифтор-1,1диметилметил-3-бутинил или 2хлортрифторизопропил 11 Соединение по п 4, где R представляет собой пентафторэтил, пентафторпропил, пентафторизопропенил, гексафторизопропил, гептафторизопропил, гексафтор-2-гидрооксиизопропил или гексафтортрет- бутил 12 Соединение по п 5, где R и R1 вместе с двумя атомами углерода, общими для бензольного кольца и заместителей R и R1, образуют трифторциклопентил, трифторметилциклогексил, дифторциклогексил или дифтордиметилциклогексил 13 Соединение по п 7, выбираемое из группы, включающей (23,33)-3-(2-Фтор-5-(трифторметил)бензил)амино2-фенилпиперидин или его соли, (23,33)-3-(2-Хлор-5-(трифторметил)бензил)амино2-фенилпиперидин или его соли, (2S,3S)-3-(2-MeTOKCH-5(трифторметил)бензил)амино-2-фенил пиперидин или его соли, (2S,3S)-3-(2-0>eHOKCH-5(трифторметил)бензил)амино-2-фенил пиперидин или его соли, (23,33)-3-(5-(1,1-Дифторэтил)-2(трифторметокси)бензил)амино-2фенилпиперидин или его соли, (23,33)-3-(5-(1,1-Дифторэтил)-2метоксибензил)амино-2-фенилпиперидин или его соли, (2S,3S)-3-(2-MeTOKCH-5-(2,2,2трифторэтил)бензил)амино-2-фенил пиперидин или его соли, (2S,3S)-3-(2-MeTOKCH-5-(1 (трифторметил)этил)бензил)амино-2фенилпиперидин или его соли, (23,33)-3-[5-(1,1-Диметил-4,4,4-трифтор-2бутинил)-2-метоксибензил]амино-2фенилпиперидин или его соли, (23,33)-3-[5-(1,1-Диметил-2,2,2-трифторэтил)-2метоксибензиламино]-2-фенилпиперидин или его соли, (23,33)-3-(2,4-Диметокси-5-(2,2,2трифторэтил)бензил)амино-2-фенил пиперидин или его соли, и (23,33)-3-[5-[1-Хлор-(1-трифторметил)этил]-2метоксибензиламино]-2-фенилпиперидин или его соли 14 Соединение по п 9, выбираемое из группы, включающей (23,33)-2-Фенил-3-(5-(2,2,2-трифтор-1(тр и фтор мети л) эти л)-2 метоксибензил)аминопиперидин или его соли, (23,33)-2-Фенил-3-(5-(1,2,2,2-тетрафтор-1(тр и фтор мети л) эти л)-2метоксибензил)аминопиперидин или его соли, (2S,3S)-3-(2-MeTOKCH-5-(1,1,2,2,2пентафторэтил)бензил)амино-2-фенилпиперидин или его соли, (23,33)-2-Фенил-3-(5-(2,2,2-трифтор-1-метил-1(трифторметил)этил)-2-метоксибензил) аминопиперидин или его соли, (23,33)-3-(5-(2,2-Дифтор-1(трифторметил)этенил]-2-метоксибензил]амино-2фенилпиперидин или его соли, и (23,33)-3-(2-Метокси-5-(2,2,2-трифтор-1-гидрокси1-(трифторметил)этил)бензил)амино-2фенилпиперидин или его соли 15 Соединение по п 12, выбираемое из группы, включающей (23,33)-3-[5-Метокси-1-(трифторметил)индан-6ил)метиламино]-2-фенилпиперидин или его соли, (2S,3S)-3-((6-MeTOKCH-1 -(трифторметил)-1,2,3,4тетрагидронафталин-7-ил)метил)амино-2фенилпиперидин или его соли, и (23,33)-3-((2,2-Дифтор-6-метокси-1,2,3,4тетрагидронафталин-7-ил)метил)амино-2фенилпиперидин или его соли 16 Соединение по п 10, выбираемое из группы, включающей (2S,3S)-3-(2-MeTOKCH-5(трифторметил)бензил)амино-2-фенил пиперидин или его соли, (2S,3S)-3-(2-MeTOKCH-5-(2,2,2трифторэтил)бензил)амино-2-фенил пиперидин или его соли, (2S,3S)-3-(2-MeTOKCH-5-(1 (трифторметил)этил)бензил)амино-2фенилпиперидин или его соли, (23,33)-3-(5-(1,1-Дифторэтил)-2(трифторметокси)бензил)амино-2фенилпиперидин или его соли, и (23,33)-3-[5-(1,1-Диметил-2,2,2-трифторэтил)-2метоксибензиламино]-2-фенилпиперидин или его соли 17 Соединение по п 12, которое представляет собой (23,33)-2-фенил-3-(5-(2,2,2-трифтор-1(тр и фтор мети л) эти л)-2метоксибензил)аминопиперидин или его соли 18 Соединение по п 15, которое представляет собой (23,33)-3-[5-метокси-1-(трифторметил)индан-6ил)метиламино]-2-фенилпиперидин или его соли 19 Способ лечения или профилактики желудочнокишечного расстройства, расстройства центральной нервной системы, воспалительного заболевания, рвоты, недержания мочи, боли, мигрени, солнечной эритемы, болезней, расстройств и неблагоприятных состояний, вызванных Hehcobacter pylori, или заболеваний кровеносных сосудов у млекопитающего, отличающийся тем, что он включает введение указанному млекопитающему терапевтически эффективного количества соединения по п 1 20 Фармацевтическая композиция для лечения или профилактики желудочно-кишечного расстройства, расстройства центральной нервной 48981 системы, воспалительного заболевания, рвоты, недержания мочи, боли, мигрени, солнечной эритемы, болезней, расстройств и неблагоприятных состояний, вызванных Hehcobacter pylori, или за болеваний кровеносных сосудов у млекопитающего, которая содержит терапевтически эффективное количество соединения по п1 и фармацевтически приемлемый носитель Цей винахід стосується заміщених бензиламінопіперидинових сполук, які представляють інтерес у галузі медичної хімії та хіміотерапії Більш конкретно, винахід стосується ряду заміщених піперидинових сполук, а також їх фармацевтичне прийнятних солей, які мають особливе значення зважаючи на їх здатність до антагонізму речовини Р Ці сполуки можуть використовуватись при лікуванні шлунково-кишкового захворювання, захворювання центральної нервової системи (ЦНС), запального захворювання, нетримання сечі, болю мігрені, сонячної еритеми, захворювань кровоносних судин, розладів й несприятливих станів, спричинених Hehcobacter pylori та ш , зокрема захворювань ЦНС ссавця, зокрема людини R являє собою галоген-Сі-Св-алкіл, галогенСг-Св-алкеніл, галоген-Сг-Св-алкініл або галогенCi-Cs-алкіл, заміщений гідрокси- або Ci-Csалкокси-групою, R1 являє собою атом водню, атом галогену або Сі-Сє-алкокси-групу, або R та R1 разом з двома атомами вуглецю, спільними для бензольного кільця й замісників R та R1, утворюють конденсований С^Сє-цикпоалкіл, де один атом вуглецю необов'язково замінений атомом кисню, і де один чи два атоми вуглецю необовчязко-во мають до п'яти замісників, що вибираються з-поміж атому галогену, Сі-Сє-алкілу та галоген-Сі-Сє-алкілу, X являє собою Сі-Сє-алкокси-, галоген-Сі-Сєалкокси-, фенокси-групу або атом галогену, та Аг являє собою фенільну групу, необов'язково заміщену атомом галогену Піперидинові сполуки цього винаходу формули (І) виявляють високу антагоністичну активність відносно до Речовини Р, зокрема високу активність проти захворювань ЦНС, і, отже, можуть використовуватись для лікування шлунковокишкового розладу, захворювання центральної нервової системи, запального захворювання, блювання, нетримання сечі, болю, мігрені, сонячної еритеми, розвитку захворювань кровоносних судин або розладів і несприятливих станів, спричинених Hehcobacter pylori, ссавця, особливо людини Таким чином, цей винахід пропонує фармацевтичну композицію для лікування шлунковокишкового розладу, розладів центральної нервової системи, запального захворювання, блювання, нетримання сечі, мігрені, сонячної еритеми, захворювань кровоносних судин, розладів і несприятливих станів, викликаних Hehcobacter pylori та ш , зокрема захворювань ЦНС ссавця, особливо людини, яка містить терапевтичне ефективну КІЛЬКІСТЬ сполуки формули (І) та фармацевтичне прийнятний носій У цьому винаході термін "галоген-Сі-Св-алкіл" використовується для позначення ЛІНІЙНОГО, розгалуженого або циклічного Ci-Cs-алкільного радикалу, заміщеного одним чи кількома атомами галогену (тобто, CL, F, І або Вг), включаючи, але не обмежуючись лише ними, трифторметил, дифторетил, трифторетил, пента-фторетил, трифторизопропил, тетрафторизопропил, пентафторизо-пропил, гексафторизопропил та гептафторизопропил та подібні до них радикали, Термін мгалоген-Сг-Св-алкеніл" використовується для позначення ЛІНІЙНОГО, розгалуженого або циклічного Сг-Св-алкенільного радикалу, заміщеного одним чи кількома атомами галогену (тобто, СІ, F, І або Вг), включаючи, але не обмежуючись лише ними, 3,3,3-трифторпропеніл, 1,1 Речовина Р являє собою природний ундекапептид, що належить до тахікітинового сімейства пептидів, причому останні мають таку назву внаслідок їх швидкої стимулюючої дії на гладкі мускульні тканини Тобто, речовина Р є фармацевтичне активним нейропептидом, який продукується у ссавців (первісне було виділено з кишки) та має характерну амінокислотну ПОСЛІДОВНІСТЮ, ЩО її описано D F Veber et al у патенті США 4680283 Широке залучення речовини Р т а інших тахікіншів до фізіологи численних захворювань достатньо повно проілюстроване у цій галузі Наприклад, речовина Р, як нещодавно показано, залучається у передачу болю або мігрені, а також у захворювання центральної нервової системи, такі як тривожний стан й шизофренія, в респіраторні та запальні захворювання, такі як ядуха і ревматоїдні артрити, ВІДПОВІДНО, а також в шлунково-кишкові розлади й захворювання шлунково-кишкового тракту типу виразкових КОЛІТІВ та хвороби Крона, та ш Також повідомляється, що тахікінінові антагоністи можуть бути корисними при лікуванні алергічних станів, при імунорегуляцм, вазодилатацм, бронхоспазмі, рефлекторному або нейронному контролі внутрішніх органів та старечого недоумства типу хвороби Альцгеймера, блюванні, сонячній еритемі та інфекціях, спричинених Hehcobacter pylori В міжнародних публікаціях WO 93/01170, WO 93/00331 та WO 93/11110 розкрито широкий спектр піперидинових похідних як тахікінінові антагоністи, такі як антагоністи речовини Р Цей винахід пропонує заміщені піперидини такої загальної формули (І) X 0) та їх фармацевтичне прийнятні солі, де 48981 диметил-4,4,4-трифторбутеніл та подібні до них радикали, термін "галоген-Сг-Св-алкініл" використовується для позначення ЛІНІЙНОГО, розгалуженого або циклічного Сг-Св-алкінільного радикалу, заміщеного одним чи кількома атомами галогену (тобто, СІ, F, І або Вг), включаючи, але не обмежуючись лише ними, 3,3,3-трифторпропиніл, 1,1-диметил-4,4, 4трифторбутиніл та подібні до них радикали, і ермін "галоген-Сі-Св-алкокси" використовується для позначення ЛІНІЙНОГО, розгалуженого або циклічного Ci-Cs-алкоксильного радикалу, заміщеного одним чи кількома атомами галогену (тобто, СІ, F, І або Вг), включаючи, але не обмежуючись лише ними, дифторметокси-, трифторметокси-, 2,2,2трифторетокси-групи та подібні до них В ХІМІЧНІЙ формулі (І) R більш прийнятне являє собою Сі-Сб-алкіл, пдрокси-Сі-Сб-алкіл, Сг-Сє-алкеніл або Сг-Сєалкініл, в яких алкільний, алкенільний або алкінільний фрагменти заміщені двома-сьома атомами галогену В більш прийнятному варіанті втілення цього винаходу замісник R являє собою Сі-Сє-алкіл, пдрокси-Сі-Сб-алкіл, Сг-Сє-алкеніл або Сг-Сє-алкініл, більш прийнятне Сі-Сб-алкіл, причому ці групи заміщені двома-трьома атомами фтору Прикладами замісника R є трифторметил, дифторетил, трифторетил, трифто-ризопропил, трифтор-третбутил, трифтор-1,1-диметилметил-3-бутиніл та 2хлортрифторизопропил В іншому більш прийнятному варіанті втілення цього винаходу R являє собою Сі-Сє-алкіл, пдрокси-Сі-Сб-алкіл, Сг-Сє-алкеніл або Сг-Сє-алкініл, причому ці групи заміщені чотирма-сьома атомами фтору Прикладами замісника R є пентафторетил, пентафторпропил, пентафторизопропеніл, гексафторизопропил, гептафторизопропил, гексафтор2-пдроксмзо-пропил та гексаф-тор-третбутил Замісник R1 більш прийнятно являє собою атом водню або метокси-групу, ще більш прийнятне - атом водню В іншому більш прийнятному варіанті втілення цього винаходу замісники R та R1 разом з двома атомами вуглецю, спільними для бензольного кільця та замісників R та R1, утворюють конденсований С4-Сб-циклоалкіл, де один атом вуглецю необов'язково замінений атомом кисню Один або два атому вуглецю С4-Сб-циклоалкільноі групи можуть необов'язково мати до чотирьох замісників, ще більш прийнятне один-два замісники, які вибирають з-поміж атому фтору та трифторметильної групи Ще більш прийнятно R та R1 разом з двома атомами вуглецю, спільними для бензольного кільця та замісників R та R1, утворюють трифторметил циклопентил, трифторметил циклогексил, дифторциклогексил або дифтордиметилциклогексил Замісник X більш прийнятне являє собою атом галогену, метокси-, дифторметокси, трифторметокси або фенокси-групу, ще більш прийнятне метокси-, дифторметокси- або трифторметокси-групу, і найбільш прийнятне - метокси-групу Більш прийнятно X знаходиться в позиції 2 фенільного кільця Аг більш прийнятно являє собою фенільну групу 8 Інша більш прийнятна група сполук цього винаходу складається з сполук формули (Іа) CF Де R1 являє собою атом водню, атом галогену або метокси— групу, та R2 та R3 незалежно один від одного вибирають з групи, яка включає атом галогену, Сі-Сб-алкіл, Сг-Сє-алкеніл та Сг-Сєалкініл або R2 та R3 разом утворюють Сг-Сєалкіліден, де алкільний, алкенільний, алкінільний та алкіліденовий фрагменти необов'язково містять до семи атомів галогену, Або R1 та R2 разом утворюють конденсований С4-Сб-циклоалкіл, в якому один атом вуглецю необов'язково замінений атомом кисню, причому С4Сб-Циклоалкіл необов'язково заміщений замісниками КІЛЬКІСТЮ до чотирьох, що вибираються з групи, яка включає атом галогену, Сі-С4-алкіл і галоген-Сі-С4-алкіл В зазначених сполуках більш прийнятною стереохімічною конфігурацією є (2S.3S) Більш прийнятну групу окремих сполук цього винаходу складають такі сполуки (2S,3S)-3-(2-0>Top-5(трифторметил)бензил)амшо-2-фенілпіперидин або його солі, (2S,3S)-3-(2-Xnop-5(трифторметил)бензил)амшо-2-фенілпіперидин або його солі, (2S,3S)-3-(2-MGTOKCH-5(трифторметил)бензил)амшо-2-фенілпіперидин або його солі, (23,33)-3-(2-Фенокси-5-(трифторметил)бензил амшо-2-фенілпіперидин або його солі, (23,33)-3-(5-(І,1-Дифторетил)-2(трифторметокси)бензил) амшо-2-фенілпіперидин або його солі, (25,33)-3-(5-(1,1-Дифторетил)-2метоксибензил)амшо-2-фнппрдин або його солі, (2S,3S)-3-(2-MeTOKCH-5-(2,2,2трифторетил)бензил)амшо-2-фнппрдин або його солі, (2S,3S)-3-(2-MeTOKCH-5-(1 (трифторметил)етил)бензил)амшо-2фенілпіперидин або його солі, (23,33)-3-[5-(І,1-Диметил-4,4,4-трифтор-2бутиніл)-2-мтсбзил]амшо-2-фенілпіперидин або його солі, (23,33)-3-[5-(І,І-Диметил-2,2,2-трифторетил)-2мтсбзлмно]-2-фенілпіперидин або його солі, (23,33)-3-(2,4-Диметокси-б-(2,2, 2трифторетил)бензил)амшо-2-фенілпіперидин або його солі, і (23,33)-3-[5-[1-Хлор-(1-трифторметил)етил]-2мтсбзлмно]-2-фенілпіперидин або його солі Інша більш прийнятна група окремих сполук цього винаходу включає такі сполуки (23,33)-2-Феніл-3-(5-(2,2,2-трифтор-1 10 48981 (три фтор мети л етил)-2метоксибензил)амшопіперидин або його солі, (2S,3S)-2-OeHin-3-(5-(1,2, 2, 2-тетрафтор-1(тр и фтор метил етил) -2 метоксибензил)амшопіперидин або його солі, (2S,3S)-3-(2-MeTOKCH-5-(1,1,2,2, 2пентафторетил)бензиламшо-2-фенілпіперидин або його солі, (2S,3S)-2-4>eHin-3-(5-(2, 2, 2-трифтор-1-метил1 -(три фтор мети л етил) -2метоксибензил)амшопіперидин або його солі, (23,33)-3-[5-[2,2-Дифтор1(трифторметил)етеніл)-2-мтсбзил]амшо-2фенілпіперидин або його солі, та (23,33)-3-(2-Метокси-5-(2,2,2-трифтор-1пдрокси-1-(трифторметіл)етил)бензил)амшо2фенілпіперидин або його солі Іншою більш прийнятною групою окремих сполук цього винаходу є така група (23,33)-3-[5-Метокси-І-(трифторметил)шдан-6іл)метиламшо]-2-фенілпіперидин або його солі, (23,33)-3-((6-Метокси-1-(трифторметил)1,2,3,4-тетрапдронафталін-7-іл)метил)амшо-2фенілпіперидин або його солі, та (23,33)-3-((2,2-Дифтор-6-метокси-1,2,3,4тетрапдронафталін-7-іл)метил)амшо-2фенілпіперидин або його солі Піперидинові сполуки формули (І) цього винаходу можна одержати згідно з наведеними нижче схемами реакцій Якщо не відзначається особливо, то в схемах реакції замісники R, Хта Аг набувають визначених вище значень Схема А-І 1 н Щ) Аг ОНС (Ш) *' Сі ^М ГО На Схемі А-І зображено метод одержання сполук формули (І) шляхом відновного амінування сполуки формули (III) сполукою формули (II) Відновлення може здійснюватись за допомогою каталітичного гідрування або деякими гідридними реагентами в інертному відносно до реакції розчиннику Каталітичне гідрування може проводитись в присутності металевого каталізатора, такого як паладій або нікель Ренея Прийнятні гідридні реагенти включають борпдриди, такі як борпдрид натрію (ІЧаВЬЦ), ціанборпдрид натрію (NaBbbCN) та триацетоксиборпдрид натрію (І\ІаВ(ОАС)зН), борани, реагенти на основі алюмінію та триалкілсилани Прийнятні розчинники включають полярні розчинники, такі як метанол, етанол, метиленхлорид, тетрапдрофуран (ТГФ), діоксан та етилацетат Цю реакцію як правило проводять при температурі від -78°С до температури кипіння розчинника із зворотним холодильником, більш прийнятне в інтервалі від О до 25°С, протягом від 5 хвилин до 48 годин, більш прийнятне від 0,5 до 12 годин З іншого боку, піперидинові сполуки формули (І) цього в-инаходу можна одержати згідно з схе мою А-І Схема А-II Аг ав (де Z являє собою групу, що відходить, таку як атом галогену або сульфонатна група, включаючи тозилатнута мезила-тну) Згідно З Схемою А-ІІ сполуки формули (І) цього винаходу можна одержати реакцією сполуки формули (IV) з сполукою (II) Сполуку (IV) може бути оброблено сполукою (II) в присутності основи (наприклад, К2СО3 або ІЧагСОз) в полярному розчиннику (наприклад, метанолі, етанолі, ізопропиловому спирті, ТГФ, діоксані, диметилформамиді (ДМФА) або диметилсульфоксиді (ДМСО) Цю реакцію як правило проводять при температурі від 78°С до температури кипіння розчинника із зворотним холодильником, більш прийнятне в інтервалі від 0 до 25°С, протягом від 5 хвилин до 48 годин, більш прийнятно від 0,5 до 12 годин Сполуку (IV) може бути отримано відновленням альдегіду ф-ормули (III) з подальшим перетворенням гідроксильної групи одержаної сполуки на групу, що відходить, Z Відновлення альдегіду (III) може здійснюватись з використанням різноманітних відновлювальних агентів в інертному відносно до реакції розчиннику Прийнятні системи відновлювальний агент/розчинник включають борпдрид натрію (ІЧаВЬЦ) в метанолі або етанолі, б-орпдрид ЛІТІЮ (L1BH4) в ТГФ або діетиловому ефірі, літій-ал-юміній гідрид (LiAlbU), ЛІТІЙтриетоксіалюмінійпдрид (LiAI(OEt)sH), літій-третбутоксіалюмшійпдрид (LiAI(Obu-t)sH) або гідрид алюмінію (АІНз) в ТГФ або діетиловому ефірі, та ізобутилалюмінійпдрид (і-ВиАІЬЬ) або дмзопропилалюміні-йпдрид (ДІПАЛГ) в дихлорметані, ТГФ або н-гексані Цю реакцію як правило проводять при температурі від -20 до 25°С протягом від 15 хвилин до 12 годин Потім гідроксильну групу одержаної сполуки перетворюють на групу, що відходить Z (наприклад, на галоген, такий як хлор, бром, йод або фтор, або сульфонатну групу, включаючи тозилатну або мезилатну) Перетворення гідроксильної групи в групу, що відходить Z, може здійснюватись згідно з методами, відомими фахівцям у цій галузі Наприклад, коли Z являє собою сульфонатну групу, таку як тозилатна або мезилатна, гідроксильну сполуку вводять в реакцію з сульфонатом в присутності піридину або триетиламшу в дихлорметані Якщо Z являє собою галоген, такий як хлор або бром, то гідроксильну сполуку можна обробити SOX2 (X являє с-обою СІ або Вг) в присутності піридину Сполуку формули (III) можна одержати згідно з наведеною нижче схемою В-І 11 Схема В-1 12 48981 Схема В-ІІ Сольволіз ОНС (V) Сполуку формули (III) можна одержати прямим або непрямим формілюванням сполуки формули (V) Для цього можна використати будь-який з відомих у цій галузі методів введення формільної групи у бензольне кільце Наприклад, пряме формілювання може здійснюватись обробкою сполуки (V) прийнятним формілюв-альним агентом в присутності підхожого каталізатора Прийнятними системами формілювальний агент/каталізатор с дихлорм-етил-метиловий ефір/хлорид титану (IV) (СЬСНОСНз/ТіСЦ), три-фтороцтова кислота (СРзС02ІН)/гексаметилентетрамін (умови реакції Дуффа) та хлорокис фосфору (РОСІ3)/ДМФА (умови реакції Вільсмайєра) Непряме формілювання може здійснюватись шляхом галогенування сполуки (V), заміщенням атому галогену на ці-аногрупу з подальшим відновленням отриманої ціанозаміщеної сполуки Галогенування може здійснюватись за методикою, описаною в статті G A Olah etal J Org Chern , 58, 3194 (1993) Заміщення атому галогену на ціаногрупу можна проводити методами, наведеними в публікаціях D М Tschaem et al Synth Cornnun , 24, 887 (1994), К Takagi et al, Bull Chem Soc Jpn r 64, 1118 (1991) Відновлення може здійснюватись в присутності дизопропилалюмінійпдриду (ДІПАЛГ) у дихлормет-ані або нікелю Ренея в мурашиній кислоті ВИХІДНІ речовини формули (V) є відомими та комерційне доступними сполуками або можуть бути синтезовані відомими методами Наприклад, сполуку формули (V), де X являє собою алко-ксигрупу, можна одержати шляхом О-алкілування ВІДПОВІДНИХ сполук (V), де X являє собою пдроксигрупу, в присутності основи (наприклад, NaH або КН) в підхожому розчиннику (наприклад, ДМСО, ДМФА та ТГФ) Сполуку (V) також можна одержати іншими методами, які описано в наведених нижче літературних посиланнях (A) трифторметилювання, J Am Chem Soc , III, 393-395(1989), (B) трет-алкілювання, Angew Chem Int Ed Enql , 19, No 11 900-901 (1980), (C) хемоселективне та позиційно-специфічне метилювання трет -алкілгалогенидів метилтитаном (IV) Angew Chem Int Ed Engl , 19, No 11 901-902 (1980), та фторування кетонів, Organic Reaction (1988), 35 Крім того, замісник R у сполуці формули (III) може бути замінений на будь-який бажаний замісник R" (наприклад, CF2CF3 або CF2CH3) за методиками, відомими кваліфікованим у цій галузі фахівцям, наприклад, згідно з такою схемою В-ІІ А = ацеталь, СН тощо На схемі В-ІІ ВИХІДНІ сполуки формули (VI) являють собою ВІДОМІ сполуки, що їх можна одержати згідно з методиками, о-писаними, наприклад, в публікації Collect Czech Chem Соттип , 52, 980 (1987), або в публікації Bull Chem Soc Jpn , 51, 2435(1978) Наприклад, сполуку формули (VI), де А являє собою CN та -замісник R являє собою алкілкарбоніл (див , (Collect Czech Chem Соттип , 52, 980 (1987)), може піддаватись тюкеталі-зацм, за якою йде заміщення, з одержанням сполуки формули (VII) (див , J Org Chem , 51, 3508 (1986)) Сполука формули (VI), де А являє собою ацеталь та замісник R являє собою атом галогену (див , Bull Chem Soc Jpn , 51, 2435 (1978)), може піддаватись алкілюванню з одержанням сполуки формули (VII) (див , Synthetic Сотт 18, 965 (1988)) Потім сполука формули (VII) може піддаватись сольволізу або відновленню в підхожих реакційних умовах з одержанням сполуки формули (VIII), де замісник R перетворено на замісник R" (наприклад, CF2CF3 CF2CH3) (див , J Org Chem , 24, 627 (1959) та Protective group in organic synthesis, John Wiley and sons, me , 180 та 191 (1991)) З іншого боку, сполуку формули(І) можна одержати згідно з наведеною нижче Схемою А-ІІІ Схема А-III а н введення групи Н Аг (Ю 1 у Гідрогеноліз Y Аг COitBu (X) ї R 0 Н С COjtBu Бі.дновлювальне алкіяювання (XI) • ^ Q «"Аг ' _ CChtBu СШ) Зняття захисної групи (І) Схема А-ІІІ ілюструє одержання сполук формули (І) 3 цієї схеми видно, що N-захищену сполуку формули (IX) (Аг являє собою феніл або аналогічну групу) може бути перетворено при обробці (трет -ВиОСО)20(Вос20) в присутності основи, такої як бікарбонат натрію (NaHCOs) або триетиламш (EtsN), в сполуку формули (X) Сполуку (X) піддають пдрогенолізу з о-держанням сполуки формули 48981 14 13 (XI) (де замісник Аг=феніл) Інший спосіб введення Піперидинові сполуки цього винаходу, що таN-захисноі групи в сполуку формули (IX) може кож містять -кислотні групи, здатні утворювати бути здійснено шляхом обробки карбобензоксихосновні солі з різноманітними фармацевтичне лоридом (Cbz-CI-)B присутності основи, такої як прийнятними катіонами Прикладами таких солей бікарбонат натрію (ІЧаНСОз) або триетиламш є солі лужних або лужноземельних металів і особ(EtsN), коли замісник Аг являє собою феніл Гідроливо солі натрію та калію Такі солі одержують за геноліз можна провести при обробці Н2 або форзвичайними методиками міатом амонію (HCO2NH4) в присутності металевоХІМІЧНІ ОСНОВИ, ЩО їх використовують як реагего каталізатора, такого як паладій на вугіллі нти при отриманні фармацевтичне прийнятних (наприклад, 20%-ний паладій на вугіллі) в підхоосновних солей цього винаходу, являють собою жому розчиннику Потім сполуку (XI) піддають відоснови, що дають нетоксичні основні солі з описановному амінуванню, як це показано на Схемі А-І ними тут кислими піперидиновими похідними Ці Сполуку (XII) може бути перетворено на сполуку нетоксичні основні солі включають солі, отримані з формули (І) обробкою -кислотним каталізатором, таких фармацевтичне прийнятних катіонів, як натаким як хлористий водень (НСІ) в -метанолі, конц трій, калій, кальцій, магній та ш Такі солі можна соляна кислота в етилацетаті або CF3CO2H в одержати при обробці зазначених вище кислих дихлорметані піперидинових сполук водними розчинами, які містять необхідний фармацевтичне прийнятний катіСполуку формули (І) та проміжні сполуки, наон, з подальшим упарюванням отриманого розчиведені в поданих вище реакційних схемах, можна ну досуха, більш п-рийнятно за пониженого тиску виділити й очистити за -допомогою звичайних меЗ іншого боку, вони можуть -готуватись при змішутодик, таких як перекристалізація або хроматогванні розчинів в нижчих спиртах кислих сполук та рафічний розподіл алкоксиду бажаного лужного металу та упарюванОскільки піперидинові сполуки цього винаходу ні одержуваного розчину досуха у спосіб, аналогімають принаймні два асиметричні центри, вони чний до описаного вище В будь-якому випадку здатні існувати в різноманітних стереоізомерних більш прийнятним є використання формах або конфігураціях Отже, сполуки можуть стехіометричних кількостей реагентів для того, існувати в поділених (+)- та (-)-оптично активних щоб забезпечити повноту протікання реакції та формах, а також у вигляді їх сумішей Цей винахід максимальний вихід кінцевого продукту включає всі ці форми Індивідуальні ізомери можна одержати у ВІДОМІ способи, такі як оптичний розподіл, оптично селективні реакції або хроматографічний розподіл на стадії кінцевого -продукту або його проміжних сполук Оскільки піперидинові сполуки цього винаходу є основними сполуками, всі вони здатні утворювати велику КІЛЬКІСТЬ різноманітних солей з різними неорганічними та органічними к-ислотами Хоча такі солі повинні бути фармацевтично прийнятними для введення тваринам, часто на практиці бажано -спочатку виділити піперидинову основу з реакційної суміші у вигляді фармацевтичне неприйнятної солі, потім просто перетворити на вільну основу шляхом обробки лужним реагентом та після цього перетворити вільну основу на фармацевтичне п-рийнятну кислотно-адитивну сіль Кислотно-адитивні солі піперидинових основних сполук цього винаходу легко утворюються -при обробці основної сполуки по суті еквівалентною КІЛЬКІСТЮ вибраної мінеральної або органічної кислоти у водному розчиннику або в прийнятному органічному розчиннику, такому як метанол або етанол При обережному упарюванні розчинника легко виділяють бажану сіль Кислоти, що використовують при отриманні фармацевтичне прийнятних кислотно-адитивних солей названих вище піперидинових основних сполук, являють собою кислоти, які дають нетоксичні кислотно-адитивні солі, наприклад, солі, що містять фармацевтичне прийнятні аніони, такі як пдрохлорид, пдробромід, пдройодид, нітрат, сульфат або бісульфат, фосфат або кислий фосфат, ацетат, лактат, цитрат або кислий цитрат, тартрат або бітартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, етан сул ьфонат, бензолсульфонат, п-толуолсульфонат та памоат (тобто, 1, 1 і метилен-біс-(2-пдрокси-3-нафтоат) Активні піперидинові сполуки цього винаходу виявляють значну активність в зв'язуванні рецептора речовини Р, і, отже, мають значення при лікуванні великого спектру КЛІНІЧНИХ станів, що характеризуються присутністю надлишку зазначеної речовини Р Такі стани включають шлунковокишкові розлади, розлади центральної нервової системи, запальні захворювання, блювання, нетримання сечі, біль, мігрень або розвиток кровоносних судин у ссавця, особливо у людини Для лікування -блювання такі сполуки можуть більш прийнятне використовуватись в поєднанні з антагоністами 5НТз-рецепторів Активні піперидинові сполуки формули (І) цього винаходу можуть вводитись ссавцю перорально, парентерально або локально В загальному випадку ці сполуки найбільш прийнятне вводити людині у дозах, що лежать в інтервалі приблизно від 0,3 до 750мг на день, хоча обов'язково будуть існувати -варіанти залежно від ваги та стану пацієнта та вибраного конкретного способу введення Однак рівень доз, що знаходиться -в інтервалі приблизно від 0,06 до 2мг на кг ваги на день, є найбільш бажаним для застосування Однак, все ж можуть мати місце різні зміни залежно від виду тварини, яка потребує л-ікування, та її індивідуальної реакції на зазначений медичний засіб, а також від типу вибраної фармацевтичної рецептури та періоду часу і інтервалу, протягом яких вводять ліки В деяких випадках можуть бути прийнятні рівні доз, нижче нижньої межі названого інтервалу, хоча в інших випадках можуть використовуватись ще більш високі дози без прояву будь-яких побічних ефектів, за умови, що такі більш високі дози спочатку поділено на кілька маленьких доз для застосування протягом всього дня Сполуки цього винаходу можуть вводитись 48981 16 15 окремо або в поєднанні з фармацевтичне прийнякремів, желе, гелів, паст, мазей та інших подібних тними носіями або розріджувачами у будь-який з рецептур, за стандартними фармацевтичними названих вище способів введення, і таке введення технологіями може здійснюватись у вигляді єдиної дози або у Активність сполук цього винаходу як антагонівигляді кратних доз Більш конкретно, нові терапестів речовини Р визначають за їх спроможністю втичні агенти цього винаходу можуть вводитись у інгібувати зв'язування речовини Р до їх рецепторвигляді цілого ряду різних лікарських форм, тобто, них сайтів в СНО-клітинах, що виявляють NK1 вони можуть бути об'єднані з різними фаррецептор або клітини ІМ-9, з використанням радіомацевтично прийнятними інертними носіями у виактивних лігандів Активність описаних піперидигляді таблеток, капсул, лепішок, пастилок, твердих нових сполук як антагоністів речовини Р оцінюють леденців, порошків, аерозолів, кремів, мазей, свіза допомогою стандартної методики оцінки, опичок, желе, гелів, паст, лосьйонів, протирань, водсаної М A Cascien et al (The Journal of Immunolних суспензій, розчинів для ІНЧЄКЦІЙ, еліксирів, сиogy, 133, 3260 (1984)) Цей метод по суті включає ропів тощо До таких носив належать тверді визначення концентрації індивідуальної сполуки, розріджувачі або наповнювачі, стерильне водне необхідної для зменшення на 50% КІЛЬКОСТІ лігансередовище та різні не-токсичні органічні розчиндів речовини Р з радіоактивною міткою у їх рецепники тощо Крім того, пероральні фармацевтическі торних сайтів в зазначених ізольованих тканинах композиції можуть бути ВІДПОВІДНИМ образом підкорови або клітинах ІМ-9, в результаті чого одерсолоджені та/або можуть містити добавки, що кожують характеристичні значення ICs0 для кожної ригують смак і запах В загальному випадку такі сполуки, яку випробовують Якщо говорити більш лікарські форми містять те-рапевтично ефективні конкретно, то визначають інгібування [3H]SPКІЛЬКОСТІ сполук цього винаходу в концентрації звчязування ІМ-9 клітинами людини сполуками в приблизно від 5,0 до 70% мас буфері для оцінки [50мМ Tns-HCI (рН 7,4), 1мМ МпСЬ, 0,02% бичачий сироватковий альбумін, баДля перорального застосування можуть викоцитрацин (40мкг/мл), лейпептин (4мкг/мл), хімосристовуватись таблетки, що містять різні наповтатин (2мкг/мл) та фосфорамідон (30мкг/мл)] Реанювачі, такі як мікрокристалічна целюлоза, цитрат кцію ІНІЦІЮЮТЬ шляхом додання кліток в буфер для натрію, карбонат кальцію, дикальцій фосфат та оцінки, що містить 0,56нМ [3H]SP та різні концентгліцин, разом з різними диспергаторами, такими як рації сполук (загальний об'єм 0,5 мл), та шкубують крохмаль, більш прийнятне кукурудзяний, картопротягом 120 хвилин при 4°С Інкубування зупипляний крохмаль та крохмаль з тапюки, альпнова няють шляхом фільтрування на фільтрах GF/B (які кислота та деякі комплексні силікати, а також із попередньо занурено в 0,1%-ний поліетиле-німін звчязувальними речовинами для гранулювання на 2 години) Неспецифічне зв'язування визначатипу полівінілпіролідону, сахарози, желатина та ють за радіоактивністю, що залишалася в присутаравійської камеді Крім того, дуже часто при табності 1 мкМ SP Фільтри приміщують у трубки та летуванні корисно застосовувати змащувальні підраховують радіоактивність за допомогою рідинагенти, такі як стеарат магнію, лаурилсульфонат ного сцинтиляційного лічильника натрію і тальк Тверді композиції аналогічного типу можуть використовуватись як наповнювачі желаНесприятливий вплив на зв'язувальну спорідтинових капсул, більш прийнятні матеріали в цьоненість Са2+-каналів визначають у дослідженні по му випадку містять лактозу або молочний цукор, а зв'язуванню верапамілу в препаратах серцевих також високомолекулярні поліети-ленгліколі Коли мембран щурів Більш конкретно, зв'язування ведля перорального застосування необхідні водні рапамілу здійснюють згідно з описом Reynolds et розчини та/або еліксири, активний інгредієнт може al , (J Pharmacol Exp Ther 237, 731, 1986) Інкубути змішано з різними підсолоджувальними або бацію ІНІЦІЮЮТЬ доданням тканини у трубки, що агентами, які коригують смак та запах, речовинами містять 0,25нМ [ Н]десметоксиверапамілу та різні або барвниками, що забарвлюють, та, якщо це є концентрації сполук (загальний об'єм, 1 мл) Небажаним, емульгуючими та/або суспендую-чиими специфічне зв'язування визначають за зв'язуванагентами, а також з такими розріджувачами як ням радюлігандів, що залишилися в присутності 3вода, етанол, пропиленгліколь, гліцерин та їх різні ЮмкМ метоксиверапамілу поєднання Активність сполук цього винаходу щодо розладів центральної нервової системи визначають у Для парентерального застосування можуть тесті на постукування лап, індукованому [SAR , використовуватись розчини сполуки цього винахоMet (O2)11] -речовиною Р, у карлікової піщанки Каду або в кунжутному або арахісовому маслі, або в рлікових піщанок піддають легкій анестезії ефіром водному пропіленгліколі Водні розчини повинні, та розкривають черепну поверхню Безпосередньо якщо це необхідно, мати певне значення рН в боковий шлуночок голкою 25 розміру, введеною (більш прийнятно рН > 8), а розріджувач має бути на 3,5см нижче ламбди, вводять [SAR , Met(02)11]ІЗОТОНІЧНИМ Такі водні розчини прийнятні для внуречовину Р або розчинник (5 мкл) Після ін'єкції трішньовенних ІНЧЄКЦІЙ, Масляні розчини прийнятпіщанок приміщують в 2-х літрову склянку та споні для міжсуглобних, внутрішнньом"язових та підстерігають за постукуванням задніх лап, що пошкірних ІНЧЄКЦІЙ Отримання всіх цих розчинів за вторюється В цьому методі випробувань перевістерильних умов може легко здійснюватись за рено деякі сполуки, отримані в наведених нижче стандартними фармацевтичними методиками, Прикладах В результаті встановлено, що сполуки добре відомими кваліфікованим у цій галузі фахівцього винаходу мають добру антагоністичну актицям Крім того, при лікуванні запальних станів шківність відносно до Речовини Р, зокрема доброю ри також можливо місцеве застосування сполук активністю проти захворювань ЦНС, при сприятцього винаходу, які можна одержати у вигляді 48981 18 17 ливих метаболітичних властивостях Більш конк1Н), 3,61 (д, J=15,0l~4, 1H), 3,46 (д, J=15,0l~4, 1H), ретно, при порівнянні, наприклад, тр и фтор метил3,28-3,22 (м, 1Н), 2,86-2,76 (м, 2Н), 2,08-2,03 (м, та гексафторизопропилбензил1Н), 1,95-1,78 (м, 1Н), 1,69-1,57 (м, 1Н), 1,48-1,44 (м, 1Н) амінопіперидинових сполук (Приклади 3 та 5, ВІДПОВІДНО) з ВІДПОВІДНИМИ незаміщеними галогеном Приклад 2 сполуками, виявлено, що галогензаміщені сполуки Отримання дипдрохлориду (2S,3S)-3-(2-xnopвиявляють несподівано підвищену активність про5-(трифторметил)бензил)амшо-2-фенілпіперидину ти захворювань ЦНС (Сполука 3) Період напіввиведення сполук цього винаходу До суспензії Сполуки 1 (150мг, О.бОммоля) та визначають в препаратах мікросом печінки люди2-фтор-5-(трифторметил)бензальдепду (126мг, ни Тобто, сполуку (1мкМ) шкубують з об'єднаними 0,60 ммоля)в сухому СН2СІ2 (бмл) при перемішумікросомами печінки людини (2,0мг/мл), НАДФ ванні в атмосфері азоту та при кімнатній темпера(NADP) (1,3 мМ), НАДВ (NADH) (0,93мМ), глюкозатурі додають порціями ІЧаВН(ОАс)з (179мг, 6-фосфатом (З.ЗмМ), МдСІ2 (З.ЗмМ) та глюкоза-60,84ммоля) фосфатдепдрогеназою (8 одиниць на мл) в сумаРеакційну суміш перемішують при кімнатній рному об'ємі 1,2мл ЮОмМ калійфосфатного бутемпературі протягом 17 годин Суміш підлуговуферу, рН 7,4 При різних часових точках (0,5, 10, ють насиченим водним розчином ІЧаНСОз, екстраЗО та 60 хвилин) ЮОмкл-проби додають до ацетогують СН2СІ2, сушать MgS04 та концентрують, нітрильного розчину (1,0мл), що містить внутрішній одержують сирий (2S,3S)-3-(2-xnop-5стандарт Осаджений білок ВІДДІЛЯЮТЬ В центри(трифторметил)бензил)амшо-2-фенілпіперидин у фузі (3000 X д, 5 хвилин) Надосадову рідину анавигляді безбарвного масла Отримане масло очилізують за допомогою поєднання РХ-МС Поєдщають за допомогою хроматографії, одержують нання РХ-МС складається з системи високочистий (2S, 3S)-3-(2-xnop-5ефективної рідинної хроматографії Hewlett Pack(трифторметил)бензил)амшо-2-фенілпіперидин у ard НР1090 та Sciex API-Ill Зразки (Юмкл) впорсвигляді безбарвного масла (135мг) Продукт розкують за допомогою автопробовідборника в колонбавляють етилацетатом, додають НСІ-МеОН та ку Hewlett Packard ODS-Hypersil (2,1 X 20мм) концентрують Білу тверду речовину перекристаліРухома фаза складається з 80% ацетонітрилу в зовують з МеОН, одержують Сполуку 3 у вигляді ЮмМ ацетаті амонію Результати вимірів API-Ill білої кристалічної речовини (64мг, 24,1%) аналізують за допомогою детектора для моніториТ пл 200-210°С нгу складових реакцій (MRM) Спектр 1Н-ЯМР (CDCI3, вільна основа) 7,40Приклад 1 7,22 (м, 8Н), 3,91 (д, J=2,2I~4, 1Н), 3,66 (д, J=15,0l~4, 1Н), 3,50 (д, J=15,0l~4, 1Н), 3,29-3,23 (м, Одержання дипдрохлориду (23,33)-3-(2-фтор1Н), 2,86-2,76 (м, 2Н), 2,10-2,05 (м, 1Н), 1,97-1,80 5-(трифторметил)бензил)амшо-2-фенілпіперидину (м, 1Н), 1,70-1,58 (м, 1Н), 1,51-1,45 (м, 1Н) (Сполука 2) (І) Дипдрохлорид (23,33)-2-фенілпіперидин-3Приклад З аміну (Сполука І) Отримання дипдрохлориду (2S,3S)-3-(2метокси-5-(трифторметил)бензил)амшо-2Цю сполуку одержують згідно з методиками, фенілпіперидину (Сполука 5) описаними в публікації ЕР 558156 (II) Дипдрохлорид (23,ЗЭ)-3-(2-фтор-5(I) 2-Метокси-5-(трифторметил)бензальдепд (Сполука 4) (трифторметил)бензил)амшо-2-фенілпіперидину (Сполука 2) До охолоджуваного льодом розчину NaOMe (904мг, 4,68 ммоля) при перемішуванні додають До суспензії Сполуки 1 (150мг, О.бОммоля) та порціями 2-фтор-5-(трифторметил)бензальдепд 2-фтор-5-(трифторметил)бензальдепду (11 бмг, (500мг, 2,60ммоля) Використану крапельну лійку 0,60 ммоля) в сухому СН2СІ2 (бмл) при перемішупромивають ТГФ Отриману суспензію перемішуванні в атмосфері азоту та при кімнатній темперають при кімнатній температурі протягом 5 годин турі додають порціями NaBH (ОАс)з (179мг, Реакційну суміш нейтралізують оцтової кислотою 0,84ммоля) Реакційну суміш перемішують при (0,3мл, 5,0ммоля), розчинник упарюють До тверкімнатній температурі протягом 6,5 годин Суміш дого залишку додають воду та суміш екстрагують підлуговують насиченим водним розчином СН2СІ2 Об'єднані дихлорметанові екстракти проІЧаНСОз, екстрагують СН2СІ2, сушать MgS04 та мивають насиченим водним розчином ІЧаНСОз, концентрують, одержують сирий (2S,3S)-3-(2сушать MgS04 та концентрують, одержують сире фтор-5-(трифторметил)бензил)амшо-2Сполучення 4 у вигляді білої твердої речовини фенілпіперидин увигляді безбарвного масла МаПродукт очищають препаративною тонкошаровою сло очищають за допомогою хроматографії, одерхроматографією, одержують Сполуку 4 у вигляді жують чистий (2S,3S)-3-(2-xnop-5білої кристалічної речовини (363мг, 68,4%) (трифторметил)бензил)амшо-2-фенілпіперидии у вигляді безбарвного масла (75мг) Отриманий Спектр 1Н-ЯМР (CDCI3) 10,47 (с, 1Н), 8,11 (д, продукт розбавляють етилацетатом, додають НСІJ=2,2I~4, 1Н), 7,80 (дд, J=8,8, 2,2Гц, 1Н), 7,10 (д, МеОН та концентрують Білу тверду речовину пеJ=8,8I~4, 1Н), 4,01 (с, ЗН) рекристалізовують з суміші МеОН-ефір, одержу(II) Дипдрохлорид (2S,3S)-3-)2-MeTOKCH-5ють Сполуку 2 у вигляді білої кристалічної речови(трифторметил)бензил)амшо2-фенілпіперидину ни (67мг, 26,3%) (Сполука 5) Т пл 195-203°С До суспензії Сполуки 1 (150мг, О.бОммоля) та Сполуки 4 (123мг, О.бОммоль) в сухому СН2СІ2 Спектр 1Н-ЯМР (CDCI3, вільна основа) 7,42(бмл) в атмосфері азоту при перемішуванні та при 7,22 (м, 7Н), 6,99 (т, J=8,8I~4, 1Н), 3,90 (д, J=,2,2I~4, 19 кімнатній температурі додають порціями NaBH(Oac)3 (179мг, 0,84ммоля) Реакційну суміш перемішують при кімнатній температурі протягом 3,5 годин Суміш підлуговують насиченим водним розчином ІЧаНСОз, екстрагують СН2СІ2, сушать MgSCU та концентрують, одержують сирий (2S.3S)3-(2-метокси-5-(трифторметил)бензил)амшо-2фенілпіперидин у вигляді безбарвного масла Отримане масло очищають хроматографією, виділяють чистий (2S, 3S)-3-(2-мето кс и-5трифторметіл)-бензил)амшо-2-фенілпіперидин у вигляді безбарвного масла (95мг) Продукт розбавляють етилацетатом, додають НСІ-МеОН та концентрують Білу тверду речовину перекристалізовують з суміші МеОН-ефір, одержують Сполуку 5 у вигляді білої кристалічної речовини (85мг, 32,4%) Т пл 228-233°С Спектр 1Н-ЯМР (CDCI3, вільна основа) 7,40 (т, J=8,8I~4, 1Н), 7,34-7,23 (м, 6Н), 6,71 (д, J=8,8I~4, 1Н), 3,92 (д, J=2,2I~4, 1Н), 3,66 (д, и=14,ЗГц, 1Н), 3,52 (с, ЗН), 3,42 (д, J=14,3I~4, 1Н), 3,33-3,29 (м, 1Н), 2,87-2,77 (м, 2Н), 2,12-1,90 (м, 2Н), 1,66-1,56 (м, 1Н), 1,48-1,43 (м, 1Н) Приклад 4 Отримання дипдрохлориду (2S,3S)-3-(2фенокси-5-(трифторметил)бензил)амшо-2фенілпіперидину (Сполука 7) (I) 2-Фенокси-5-(трифторметил)бензальдепд (Сполука 6) До розчину 2-хлор-5(трифторметил)бензальдепду (500мг, 2,40ммоля)в ДМФА (5мл) при перемішуванні додають фенол (226мг, 2,40ммоля), К2СОз (663мг, 4,79ммоля) Реакційну суспензію перемішують при кімнатній температурі протягом 1 години, потім при 80°С протягом 1,5 години Реакційну суміш нейтралізують оцтовою кислотою (0,5мл), розчинник упарюють До твердого залишку додають воду та суміш екстрагують СН2СІ2- Об'єднані дихлорметанові екстракти промивають насиченим водним розчином ІЧаНСОз, сушать MgS04 та концентрують, одержують сиру Сполуку 6 у вигляді жовтого масла Масло очищають хроматографією, одержують Сполучення 6 у вигляді жовтого масла (466мг, 72,9%) Спектр 1Н-ЯМР (CDCI3) 10,58 (с, 1Н), 8,21 (д, J=2,6I~4, 1Н), 7,70 (дд, J=8,8, 2,6Гц, 1Н), 7,50-7,42 (м, 2Н), 7,31-7,25 (м, 1Н), 7,16-7,10 (м, 2Н), 6,93 (д, J =8, 8,1 Н) (II) Дипдрохлорид (23,33)-3-(2-фенокси-5(трифторметил)бензил)амшо-2-фенілпіперидину (Сполука 7) До суспензії Сполуки 1 (150мг, О.бОммоля) та Сполуки 6 (160мг, 0,60ммоля)в сухому СН2СІ2 (бмл) в атмосфері азоту при перемішуванні та при кімнатній температурі додають порціями NaBH (ОАС)з (179мг, 0,84ммоля) Реакційну суміш перемішують при кімнатній температурі протягом З годин Суміш підлуговують насиченим водним розчином ІЧаНСОз, екстрагують СН2СІ2, сушать MgS04 та концентрують, одержують сирий (2S/3S)-3-(2фенокси-5-(трифторметил)бензил)амшо-2фенілпіперидин у вигляді жовтого масла Його очищають хроматографією, одержують чистий (23,33)-3-(2-фенокси-5-(трифторметил) бензиламшо-2-фенілпіперидин у вигляді жовтого масла 48981 20 (135мг) Продукт розбавляють етилацетатом, додають НСІ-МеОН та концентрують Білу тверду речовину перекристалізовують з суміші МеОНефір Одержують Сполуку 7 у вигляді білої кристалічної речовини (108мг, 36,0%) Т пл 190-197°С Спектр 1Н-ЯМР (CDCI3, вільна основа) 7,397,18 (м, 8Н), 7,15-7,09 (м, 2Н), 6,79-6,71 (м, ЗН), 3,90 (д, J=2,2I~4, 1Н), 3,66 (д, J=14,7I~4, 1H), 3,51 (д, J=14,7I~4, 1Н), 3,28-3,23 (м, 1Н), 2,90 (д, и=2,6Гц, 1Н), 2,66 (дт, J=12,l, 2,9Гц, ІН),2,11-2,06 (м,1Н), 1,96-1,81 (м, 1Н), 1,69-1,56 (м, 1Н), 1,461,41 (м, 1Н) Приклад 5 Отримання дипдрохлориду(23,33)-2-феніл-3(5-(2,2,2-трифтор-1-(трифторметил)етил)-2- метоксибензин) амінопіперидину (Сполука 15) (І)4-(2,2,2-Трифтор-1(трифторметил)етил)анізол (Сполука 8) Це сполучення одержують згідно з методиками, описаними в J Am Chem Soc , 820 (1972) (І1)5-(2,2,2)-Трифтор-1-(трифторметил)етил)2-метоксибензальдепд (Сполука 9) До розчину, що охолоджується льодом Сполуки 8 (650мг, 2,5ммоля)в сухому СН2СІ2 (15мл) при перемішуванні додають чистий ТіСЦ (950мг, 5,0ммоля), потім додають СЬСНОМе (600мг, 5,0ммоля) По закінченні додання суміш перемішують при кімнатній температурі протягом 5 годин, виливають в НгО (60 мл) та екстрагують СН2СІ2 Об'єднані екстракти сушать (Na2S04)Ta концентрують в вакуумі, одержують жовте масло, що його очищають колонковою хроматографією на силікагелі, одержують Сполучення 9 (650 мг, 90%) Спектр 1Н-ЯМР (CDCI3) 10,47 (с, 1Н), 7,867,08 (м, ЗН) , 4,05 (геп, J=8I~4, 1H), 3,98 (с, ЗН) (III) (2S,3S)-3-(2-MeTOKCH6eH3mr)aMiHO-2фенілпіперидин (Сполука 10) Цю сполуку одержують згідно з методиками, описаними в публікації WO 93-01170 (IV)(2S,3S)-1 трет -Бутоксикарбоніл-3-(2метоксибензил) амінопіперидин (Сполука 11) До охолоджуваної льодом суміші сполуки 10 (10г, 27 ммолей), ЗМ водного NaOH (36мл, 110 ммолей)та трет-BuOH (15мл) при перемішуванні додають (т-ВиОСО)2О (7,4г, 34 ммоль) Після перемішування при кімнатній температурі протягом ночі суміш екстрагують AcOEt Об'єднані етилацетати і шари промивають НгО та насиченим водним розчином NaCI, сушать (Na2S04)Ta концентрують в вакуумі, одержують Сполуку 11 (11г, вихід КІЛЬКІСНИЙ) у вигляді блідо жовтого масла Спектр 1Н-ЯМР (CDCI3) 7,58 (ушир, д, Д=7,3 Гц2Н), 7,36-7,16 (м, 5Н), 6,89 (ддд, J =7, 5,7, 5,1, 1 Гц, 1Н), 6,81 (дд, J =8, 4,0, 8Гц, 1Н), 5,47 (ушир, с, 1Н), 3,96 (дм, J=13, 4Гц, 1Н), 3,87 (д, J=13, 6Гц, 1Н), 3,79 (д, J=13, 6Гц, 1Н), 3,70 (с, ЗН), 3,10-2,99 (м, 1Н), 2,94 (дд, J=12,5, 3,4 Гц, 1Н), 1,87-1,74 (м, 2Н), 1,74-1,40 (м, ЗН), 1,41 (с, 9Н) Цю сполуку використовують на наступній стадії без додаткового очищення (V) (2S,3S)-3-AMIHO-1 трет-бутоксикарбоніл-2 фенілпіперидин (Сполука 12) Суміш Сполуки 11 (11г), 20%-го Pd (OH)2/C 48981 22 21 ((3,1г) та МеОН (90мл) перемішують в атмосфері (2,2,2-трифтор-1-(трифторметил)етил)-2ЬІ2 при кімнатній температурі протягом ночі Після метоксибензил)амшопіперидин додання додаткової КІЛЬКОСТІ 20%-ГО Pd (OH)2/C (Сполука 15) (0,55г) перемішування в атмосфері ЬЬ при кімнатДо розчину сполуки 14 (160мг)з СН2СІ2 (Юмл) ній температурі продовжують протягом трьох днів додають надлишок 10%-воі суміші НСІ-МеОН Каталізатор відфільтровують з використанням (бмл) Після упарювання розчинника в вакуумі зацеліту та ретельно промивають МеОН Об'єднані лишок перекристалізовують з ізофталевої кислоти, метанольні фільтрати та промивні розчини концеодержують Сполуку 15 (130мг, 83%, три ступені) у нтрують в вакуумі, одержують сиру Сполуку 9 вигляді безбарвних кристалів (8,6г, вихід КІЛЬКІСНИЙ) Тпл 290-294°С Сполуку 9 розчиняють в ЕЮН (20мл) і потім до Приклад 6 одержаного розчину при кімнатній температурі в Одержання дипдрохлориду (23,33)-2-феніл-3одну порцію додають теплий розчин фумарової (5-(1,2,2,2-тетрафтор-1 - (три фтор метил) етил) -2кислоти (1,6г, 13,5ммоля) в ЕЮН (20мл) Кристаметоксибензил) амінопіперидину (Сполука 18) ли, що випадають в осад, відфільтровують, про(I) 4-(1,2,2,2-Тетрафтор-1мивають льодяним ЕЮН та сушать в вакуумі при (трифторметил)етил)анізол (Сполука 16) 50°С, одержують напівфумарат (2S,3S)-3-aMmo-1Цю сполуку одержують згідно з методиками, (трет -бутоксикарбоніл)-2-фенілпіперидину (6,1г, описаними в Nippon Kagakn Kaishi, 2351 (1973) 68%) у вигляді білих коротких голок (II) (5-(1,2,2,2-Тетрафтор-1Після охолодження льодом до суспензії на(трифторметил)етил)-2-метоксибензилальдепд півфумарата (1,2г, 3,7ммоля)в НгО додають 20%(Сполука 17) ний водний розчин NaOH до отримання основний Цю сполуку одержують з сполуки 16 за метосуміші Потім суміш екстрагують AcOEt Об'єднані дикою, аналогічною методикою отримання сполуки етилацетатні екстракти промивають насиченим 9 водним розчином NaCI, сушать (Na2S04) та концеСпектр 1Н-ЯМР (CDCI3) 10,49 (с, 1Н), 8,13нтрують в вакуумі, одержують Сполуку 12 (0,95г, 7,12 (м, ЗН), 4,02 (с, ЗН) 93%) (III) Дипдрохлорид (28,38)-2-феніл-3-(5Спектр 1Н-ЯМР (CDCI3) 7,47-7,39 (м, 2Н), 7,37(1,2,2,2-тетрафтор-1-(трифторметил)етил)-27,23 (м, 5Н), 5,19 (ушир, д, J=6,2I~4, 1Н), 4,00 (дм, метоксибензил)амшопіперидину (Сполука 18) J=13,0 Гц, 1Н), 3,25-3,05 (м, 2Н), 1,94-1,83 (м, 1Н), Цю сполуку одержують з Сполуки 1 та Сполуки 1,83-1,56 (м, 4Н), 1,36 (с, 9Н), 1,32 (ушир, с, 2Н) 17 за методикою, аналогічною методиці отримання сполуки 2 (VI) (2S,3S)-1 трет-Бутоксикарбоніл-2-феніл-З(5-(2,2,2-трифтор-1-(трифторметил)етил)-2Т пл 265-270°С метоксибензил) Спектр 1Н-ЯМР (CDCI3, вільна основа) 7,446,72 (м, 8Н), 3,96-2,75 (м, 6Н), 3,53 (с, ЗН), 2,89(Сполука 13) 1,40 (м, 4Н) До розчину, що охолоджується льодом, Сполуки 12 (ЮОмг, О.Зммоля) та Сполуки 9 (ЮОмг, 0,3 Мас-спектр (вільна основа) 464 (М+) ммоля)в сухому СН2СІ2 (Юмл) при перемішуванні Приклад 7 в одну порцію додають NaBH (ОАс)з (210мг, Одержання дипдрохлориду (2S,3S)-3-(5-(1,1 Іммоль) Потім суміш перемішують при кімнатній дифторетил-2-(трифторметокси) бензил) аміно- 2 температурі протягом 20 годин Суміш виливають фенілпіперидину в водний розчин ІЧаНСОз, екстрагують СН2СІ2 Об'(Сполука 28) єднані екстракти сушать (Na2S04) та концентрують (I) 3-Йод-4-(трифторметокси)бензальдепд у вакуумі, одержують Сполуку 13 у вигляді жовтого (Сполука 19) масла (170мг) Трифторметансульфокислоту (18,бмл, Спектр 1Н-ЯМР (CDCI3) 7,61-6,82 (м, 8Н), 5,45 0,21ммоля) краплями при охолодженні льодом в (ушир, 1Н), 4,08-3,65 (м, ЗН), 3,74 (с, ЗН), 3,10атмосфері N2 додають до N-йодсукциніміду (10,4 2,96 (м, 6Н), 1,90-1,20 (м, 4Н), 1,39 (с, 9Н) г, 46,3ммоля) До отриманої темно-синій суміші краплями та при охолоджуванні льодом додають Отриману сполука використовують на наступ4-(трифторметокси)бензальдепд (4,0 г, ній стадії без додаткового очищення 21,0ммоль) Після перемішування при кімнатній 0/И)(23,33)-2-Феніл-3-(5-(2,2,2-трифтор-1температурі протягом 4 годин реакційну суміш (тр и фтор мети л) етил)-2виливають в льодяну воду (50мл) Суміш екстраметоксибензил)амшопіперидин (Сполука 14) гують СН2СІ2 Об'єднані розчини промивають водДо розчину Сполуки 13 (170мг)в AcOEt (6мл) ним розчином (ЧагЭгОЗ, водним розчином ІЧагСОз додають конц НСІ (1мл) Суміш перемішують при та розсолом, сушать (MgS04), обробляють активокімнатній температурі протягом 45 хвилин, виливаним деревним вугіллям і концентрують в вакуувають в водний розчин ІЧаНСОз, екстрагують мі, одержують сиру Сполуку 19 (6,56г, 99%) у виСН2СІ2 Об'єднані екстракти сушать (Na2S04)Ta гляді блідо-оранжевого масла, що спонтанно стає концентрують у вакуумі, одержуючи Сполуку 14 твердим при стоянні у холодильнику (довгі ГОЛКИ) (160мг) у вигляді жовтого масла Одержану сполуку використовують на наступній Спектр 1Н-ЯМР (CDCI3) 7,36-6,68 (м, 8Н), стадії без додаткового очищення 3,95-3,26 (м, 5Н), 3,55 (с, ЗН), 2,89-1,40 (м, 6Н) Мас-спектр 446 (М+) Спектр 1Н-ЯМР (CDCI3) 9,95 (с, 1Н), 8,39 (д, Отриману сполуку використовують на наступJ=I,9I~4, 1Н), 7,91 (дд, J=8,5, 1,9Гц, 1Н), 7,41 (пк, ній стадії без додаткового очищення J=8,5, 1,2 Гц, 1Н) (VIII) Дипдрохлорид (2S,3S)-2-0>eHin-3-(5(II) 3-Ціано-4-(трифторметокси)бензальдепд 23 48981 (Сполука 20) До суспензії Сполуки 19 (6,85г, 21,7ммоля) та ціаніду цинку (4,07г, 34,7ммоля) в сухому ДМФА (35мл) при переміщуванні при кімнатній температурі порціями додають тетракіс(трифенілфосфш)паладій (О) (3,00г, 2,60ммоля) Реакційну суміш нагрівають при 100°С протягом 9 годин Реакційну суміш розбавляють сумішшю толуолу (100мл) та 2М водного NH3 (ЮОмл) Органічний шар ВІДДІЛЯЮТЬ ВОДНИЙ шар розбавляють толуолом (ЮОмл), фільтрують через шар целіту та осад на фільтрі промивають толуолом ВІДДІЛЯЮТЬ органічний шар та водний шар екстрагують толуолом Об'єднаний розчин промивають 2М водним ІЧНз (50мл) та розсолом, сушать (MgSO^Ta концентрують в вакуумі, одержують сирий продукт у вигляді блідо-рудого масла Сирий продукт очищають колонковою хроматографією на силікагелі (елюент гексанетилацетат, 10 1-5 1), одержують Сполуку 20 (2,87г, 62%)у ВИГЛЯДІ блідо-жовтого масла Спектр 1Н-ЯМР (CDCI3) 10,04 (с, 1Н), 8,26 (д, J=I,4I~4, 1Н), 8,19 (дд, J=8,4, 1,4Гц, 1Н), 7,59 (пк, J=8,4, 1,8Гц, 1Н) (III) 5-(1-Пдроксіетил)-2(трифторметокси)бензонітрил (Сполука 21) До розчину Сполуки 20 (2,59г, 12,0ммоля) в сухому ТГФ (25мл) при перемішуванні та охолодженні льодом в атмосфері N2 додають MeMgBr (4,42мл, 13,2ммоля, З,ОМ розчин в діетиловому ефірі) Реакційну суміш перемішують при 0°С протягом 1 години та потім протягом 2 годин при кімнатній температурі Суміш при охолоджуванні льодом розбавляють насиченим розчином NH4CI (20мл) Суміш екстрагують ефіром Об'єднані розчини промивають розсолом, сушать (MgS04), та концентрують в вакуумі, одержують Сполуку 21 (2,78г, вихід КІЛЬКІСНИЙ) у вигляді жовтого масла Отриману сполуку застосовують на наступній стадії без додаткового очищення Спектр 1Н-ЯМР (CDCI3) 7,75 (д, J =2, 2Гц, 1Н), 7,66 (дд, J=8,7, 2,2Гц, 1Н), 7,39 (пк, J=8,7, 1,7Гц, 1Н), 5,03-4,90 (м, 1Н), 2,02 (ушир, с, 1Н), 1,51 (д, J=6,6I~4, 3H) (IV) З-Ціано-4(трифторметокси)ацетофенон (Сполука 22) До розчину Сполуки 21 (2,78г, 12,0ммоля)в сухому СН2СІ2 (ЮОмл) при перемішуванні та при кімнатній температурі порціями додають оксид марганцю (І\/)(активований, 13,9г) Суміш кипчятять з зворотним холодильником протягом 2,5 годин Після охолоджування до кімнатної температури суміш фільтрують через шар целіту та каталізатор промивають СН2СІ2 Фільтрат та промивні розчини концентрують в вакуумі, одержують сиру Сполуку 22 (2,31г, 84%)у вигляді жовтої твердої речовини Отриману сполуку використовують на наступній стадії без додаткового очищення Спектр 1Н-ЯМР (CDCI3) 8,66 та 8,31 (кожен д, и=2,2Гц, всього 1Н), 8,24 та 8,17 (кожний дд, J=8,8, 2,2 Гц, всього 1Н), 7,54-7,47 та 7,46-7,39 (кожний м, всього 1Н), 2,66 та 2,65 (кожний з, всього ЗН) (V) 2-Метил-2-(3-ціано-4(трифторметокси)феніл)-1,3- дитюлан (сполука 23) До розчину сполуки 22 (2,31г, 10,1ммоля)в сухому СН2СІ2 (ЗОмл) при перемішуванні та при кім 24 натній температурі додають 1,2-етандитюл (1,42 г, 15,1ммоля) та ефірат трифтори-ду бора (1,14 г, 8,1ммоля) Реакційну суміш перемішують при кімнатній температурі протягом 15 годин Суміш розбавляють 5%-ним водним розчином NaOH (40мл) та ВІДДІЛЯЮТЬ органічний шар Водний шар екстрагують СН2СІ2, Об'єднаний розчин промивають розсолом, сушать (MgS04)Ta концентрують в вакуумі, одержуючи сирий продукт у вигляді пурпурного масла Сирий продукт очищають колонковою хроматографією на силікагелі (елюент гексанетилацетат, 50 1-20 1), одержують Сполуку 23 (2,61г, 85%)у вигляді пурпурного масла Спектр 1Н-ЯМР (CDCI3) 8,15(д, J=2,6I~4, 1H), 8,03 (дд, J=8,8, 2,6Гц, 1Н), 7,32 (дд, J=8,8, 1,5Гц, 1Н), 3,58-3,44 (м, 2Н), 3,43-3,28 (м, 2Н), 2,13 (с, ЗН) (VI) 5-(1 Д-Дифторетил)-2(трифторметокси)бензонітрил (Сполука 24) До суспензії 1,3-дибром-5,5диметилгидантошу (ДБГ)(1,07 г, 3,73ммоля) в сухому СН2СІ2 (8мл) при перемішуванні та при -78°С (ацетон-сухйй лід) додають HF-піридин (0,95 ші, 4,11ммоля) До цієї суміші при тій самій температурі додають розчин Сполуки 23 (570мг, 1,87ммоля)в сухому СН2СІ2 (4мл) Реакційну суміш перемішують при-78°С протягом 10 хвилин та потім протягом ЗО мин при кімнатній температурі Отриману суміш виливають в насичений водний розчин ІЧаНСОз (40мл) та перемішують при кімнатній температурі протягом 15 хвилин Суміш фільтрують через шар целіту та осад на фільтрі промивають ефіром Органічний шар ВІДДІЛЯЮТЬ та водний шар екстрагують ефіром Об'єднаний розчин промивають 10%-ним водним розчином НСІ та розсолом, сушать (MgS04) та концентрують в вакуумі, одержують сирий продукт (670мг) Сирий продукт очищають за допомогою препаративної тонкошарової хроматографії (ТСХ)(елюент гексанетилацетат, 5 1), одержують Сполуку 24 (408мг, 87%) у вигляді жовтого масла Спектр ^Н-ЯМР (CDC13) 7,88-7,85 (м, 1Н), 7,83-7,76 (м, 1Н), 7,51-7,43 (м, 1Н), 1,94 (т, J=18,3I~4, ЗН) ІЧ-спектр (плівка) 2245, 1619, 1504, 1417, 1391, 1272, 1265, 1212, 1185, 1120, 924, 844 (VI І) 5-(1,1 -Дифторетил)-2(трифторметокси)бензальдепд (Сполука 25) До розчину Сполуки 24 (1,31 г, 5,22ммоля)в сухому СН2СІ2 (20мл) при перемішуванні та при охолоджуванні льодом додають розчин дизобутилалюмінійпдриду (ДІПАПГ) (6,20мл, 6,26ммоля, 1,01М розчин в толуолі) Реакційну суміш перемішують при температурі 0°С протягом 3 годин До суміші додають НгО (бмл), та потім 6М водний розчин НСІ (20мл) та перемішують при кімнатній температурі протягом 1,5 годин Органічний шар ВІДДІЛЯЮТЬ та водний шар екстрагують СН2СІ2 Об'єднаний розчин промивають насиченим водним розчином NaHS04 та розсолом, сушать (MgS04) та концентрують у вакуумі, одержуючи сирий продукт Сирий продукт очищають за допомогою колонкової хроматографії на силікагелі (елюент гексан-етил ацетат, 50 1-30 1), одержують Сполуку 25 (1,17 г, 88%) у вигляді жовтого масла 48981 26 25 Спектр 1Н-ЯМР (CDCI3) 10,39 (с, 1Н), 8,15Одержання мономанделату (2S,3S)-3-(5-(1,18,08 (м, 1Н), 7,86-7,78 (, 1Н), 7,48-7,40 (м, 1Н), 1,95 дифторктил)-2-метоксибензил)амшо-2(т, J=18,3, ЗН) фенілпіперидину (Сполука 37) ІЧ-спектр (плівка) 1702, 1618, 1499, 1390, (I) 2-Бром-5-(1-пдроксиетил)анізол (Сполука 1269, 1212, 1180, 1115, 923 29) (VIII) (2S,3S)-1-TpeT-ByTOKCHKap6oHin-3-(5-(1,1Цю сполуку одержують з З-бром-4дифторетил)-2-(трифторметокси)бензил)амшо-2метоксибензальдепда за методикою, аналогічною фенілпіперидин (Сполука 26) методиці отримання сполуки 21 До розчину сполуки 12 (500мг, 1,81ммоля) та Спектр ^Н-ЯМР (CDCI3) 7,57 (д, J =2, 2Гц, 1Н), Сполуки 25 (552мг, 2,17ммоля) в сухому СН2СІ2 7,28 (дд, J= 8,4, 2,2Гц, 1Н), 6,88 (д, J=8,4I~4, 1H), (Юмл) при перемішуванні та при кімнатній темпе4,84 (кв, J=6,2I~4, 1Н), 3,89 (с, 1Н), 1,78 (ушир, с, ратурі порціями додають тріацетокси-борпдрид 1Н), 1,47 (д, J=6,2I~4, ЗН) натрію (1,15г, 5,43ммоля) До цієї суміші при тій (II) З-Бром-4-метосіацетофенон (Сполука ЗО) самій температурі додають оцтову кислоту (109мг, за методикою, аналогічною методиці отримання 1,81ммоля) Реакційну суміш перемішують при сполуки 22 кімнатній температурі протягом 66 годин та при Спектр 1Н-ЯМР (CDCI3) 8,17 (д, J =2, 2Гц, 1Н), охолоджуванні льодом підлуговують до рН 10-11 з 7.92 (дд, J=8,4, 2,2Гц, 1Н), 6,94 (д, J=8,4I~4, 1H) , використанням 10%-го водного розчину NaOH 3,97 (с, ЗН), 2,56 (с, ЗН) Органічний шар ВІДДІЛЯЮТЬ та водний шар екстра(III) З-Ціано-4-метоксіацетофенон (Сполука 31) гують СН2СІ2 Об'єднаний розчин промивають розЦю сполуку одержують з Сполуки ЗО за метосолом, сушать (MgS04) та концентрують в вакуумі, дикою, аналогічною до методики отримання споодержують сирий продукт (1,46г)у вигляді блідолуки 20 жовтого масла Отриману сполуку використовують Спектр 1Н-ЯМР (CDCI3) 8,21-8,14 (м, 2Н), на наступній стадії без додаткового очищення (IX) 7,09-7,01 (М, 1Н), 4,02 (с, ЗН), 2,58 (с, ЗН) (IV) 2(2S,3S)-3-(5-(l, 1 -Дифгоретил)-2Метил-2-(3-ціано-4-метоксифеніл)-1,3-Дитюлан (трифторметокси)бензил) амшо-2-фенілпіперидин (Сполука 27) До розчину сполуки 26 (660мг, 1,25ммоля)в етилацетаті (бмл)при перемішуванні та при охолодженні льодом додають конц водну НСІ (2мл) Реакційну суміш перемішують при кімнатній температурі протягом 50 хвилин Суміш при охолодженні льодом підлуговують до рН 10-11 з використанням 10%-го водного розчину NaOH Органічний шар ВІДДІЛЯЮТЬ та водний шар екстрагують AcOEt Об'єднаний розчин промивають розсолом, сушать (MgS04) та концентрують в вакуумі, одержують сирий продукт у вигляді блідо-жовтого масла Сирий продукт очищають за допомогою колонкової хроматографії на силікагелі (елюент дихлор-метанметанол, 20 1), одержують Сполуку 27 (360мг, 70%) у вигляді жовтого масла Спектр 1Н-ЯМР (CDCI) 7,40-7,30 (м, 7М), 7,177,10 (м, 1Н), 3,91 (д, J=2,2I~4, 1Н), 3,61 (д, J=15,0l~4,1Н), 3,47 (д, J=15, ОГц, 1Н), 3,30-3,20 (м, 1Н), 2,89-2, 73 (м, 2Н), 2,13-2,00 (м, 1Н), 1,97-1,71 (м, 1Н), 1,82 (т, J=18,l Гц, ЗН), 1,70-1,55 (м, 1Н), 1,53-1,40 (м, 1Н) ІЧ-спектр (плівка) 3340, 1605, 1497, 1454, 1419, 1387, 1354, 1309, 1259, 1250, 1221, 1173, 1118, 920, 874, 834, 753, 702 (X) Дипдрохлорид(28,38)-3-(5-(1ДДифторетил)-2-(трифгорметокси)бе-нзил)амшо-3фенілпіперидину (Сполука 28) Сполуку 27 (360мг, 0,87ммоля) обробляють метанолом, насиченим НСІ(20мл), розчинник упарюють в вакуумі, одержують сирий продукт у вигляді білої твердої речовини Сирий продукт перекристалізовують з суміші етанол-діетиловий ефір, одержують Сполуку 28 (370мг, 87%)у вигляді білої твердої речовини Т пл 172-174°С ІЧ-спектр (КВг) 3435, 1607, 1573, 1512, 1458, 1303, 1264, 1208, 1173, 1124, 924, 906, 826, 747, 698 Приклад 8 (Сполука 23) Цю сполуку одержують з Сполуки 31 за методикою, що є аналогічною методиці отримання Сполуки 23 Спектр 1Н-ЯМР (CDCI3) 7,98 (д, J =2, 6Гц, 1Н), 7.93 (дд, J=8,8, 2,6Гц, 1Н), 6,91 (д, и=8,8Гц, 1Н), 3,93 (с, ЗН), 3,53-3,32 (м, 4Н), 2,11 (с, ЗН) (V) 5-(1,1-Дифторетил)-2-метоксибензонітрил (Сполука 33) До суспензії N-йодсукциніміда (12,5г, 55,7ммоля) в сухому СН2СІ2 (60мл) при перемішуванні та при -78°С (ацетон— сухий лід) додають HF-піридин (6,81мл, ЗО.бммоля), а потім при тій самій температурі розчин Сполуки 32 (3,50г, 13,9ммоля)в сухому СН2СІ2 (Юмл) Реакційну суміш перемішують при -78'С протягом 10 хвилин та потім протягом ЗОхвил при температурі-10'С (метанол-лід) Суміш виливають в насичений водний розчин ІЧаНСОз (ЮОмл) та перемішують при кімнатній температурі протягом 2 годин Суміш фільтрують через шар це-літута осад на фільтрі промивають СН2СІ2 Органічний шар ВІДДІЛЯЮТЬ та водний шар екстрагують СН2СІ2- Об'єднаний розчин промивають насиченим водним розчином [ЧагЭгОз, 10%-ним водним розчином НСІ та розсолом, сушать (MgS04) та концентрують в вакуумі, одержують сирий продукт у вигляді жовтого масла Сирий продукт очищають за допомогою колонкової хроматографії на силікагелі (елюент гексанетилацетат, 5 1), одержують Сполуку 33 (2,67г, 97%)у вигляді жовтого масла Спектр ^Н-ЯМР (CDCI3) 7,73-7,65 (м, 2Н), 7,02 (д, и=8,4Гц, 1Н), 3,97 (с, ЗН), 1,91 (т, и=18,0Гц, ЗН) (VI) 5-(1,1-Дифторетил)-2-метоксибензальдепд (Сполука 34) Цю сполуку одержують з Сполуки 33 за методикою, аналогічною методиці отримання сполуки 25 Спектр 1Н-ЯМР (CDCI3) 10,47 (с, ІН), 7,97 (д, и=2,6Гц, 1Н), 7,72 (дд, J=8,8, 2,6Гц, 1Н), 7,05 (д, и=8,8Гц, 1Н), 3,97 (с, ЗН), 1,93 (т, J=,, ЗН) (VII) 48981 28 27 Реакційну суміш нагрівають при 140°С (внутрішня (2S,3S)-1-TpeT-ByroKCHKap6oHin-3-(5-(1,1 дифторетил)-2-(метоксибензил)амшо-2фенілпіперидин (Сполука 35) Цю сполуку одержують з Сполук 12 та 34 за методикою, аналогічною методиці отримання сполуки 26, та використовують на наступній стадії без додаткового очищення (VIII) (23,33)-3-(5-(1,1-дифторетил)-2(метоксибензил)амшо-2-фенілпіперидин (Сполука 36) Цю сполуку одержують з Сполуки 35 за методикою, аналогічною методиці отримання сполуки 27 Спектр 1Н-ЯМР (CDCI3) 7,35-7,18 (м, 6Н), 7,15 (д, J=2,2I~4, 1H), 6,68 (д, J =8, 4, Гц, 1Н), 3,89 (д, J =2, 2Гц, 1Н), 3,66 (д, 3 =13, 9Гц, 1Н), 3,49 (с, ЗН), 3,41 (д, 3=13, 9Гц, 1Н), 3,22-3,20 (м, 1Н), 2,86-2,72 (м, 2Н), 2,18-2,05 (м, 1Н), 2,02-1,81 (м, 1Н), 1,86 (о? и=18,0Гц, ЗН), 1,72 (ушир, с, 2Н), 1,75-1,52 (м, 1Н), 1,47-1,35 (м, 1Н) ІЧ-спектр (плівка) 3335, 1614, 1502, 1451, 1385, 1308, 1280, 1252, 1174, 1123, 1030, 923, 901, 870, 816, 751, 701 (IX) Мономанделат (2S,3S)-3-(5(I, 1-Дифторетил)-2-метоксибензил)амшо-2фенілпіперидину (Сполука 37) До розчину сполуки 36 (179мг, 0,50ммоля)в етанолі (Змл) при кімнатній температурі додають (Р)-(-)-мигдалеву кислоту (75,4мг, 0,50ммоля) Після упарювання в вакуумі розчинника отриманий залишок перекристалізовують з суміші етанол— діетиловий ефір, одержують Сполуку 37 (168мг, 66%)у ВИГЛЯДІ білої твердої речовини Т пл 177-179 С ІЧ-спектр (плівка) 3400, 1615, 1576, 1506, 1473, 1454, 1399, 1384, 1362, 1345, 1318, 1249, 1172, 1115, 1054, 1028, 900, 756, 742, 698 Приклад 9 Одержання дипдрохлориду (2S,3S)-3-(2метокси-5-(1,1,2,2,2 -пентафторетил) бензил) аміно-2-фенілпіперидину (Сполука 43) Суміш 5-бром-о-анісового альдегіду (10,0г, 46,5ммоля), пропан-1,3-дюлу (3,90г, 51,2ммоля)та BF3-Et20 (0,15мл) в толуолі (50мл) кип'ятять з зворотним холодильником в приладі Дина-Старка протягом 3 годин Реакційну суміш охолоджують, розбавляють ефіром Органічний шар промивають послідовно насиченим водним розчином ІЧаНСОз, водою та розсолом, сушать (MgS04) та концентрують в вакуумі, одержують сирий продукт Залишок переганяють, одержують Сполуку 38 (10,7г, 84%) у вигляді безбарвного масла Т пл 124-125°С/0,23-0,25мм рт ст Спектр 1Н-ЯМР (CDCI3) 7,74 (д, и=2,6Гц, 1Н), 7,39 (дд, J=8,8, 2,6Гц, 1Н), 6,74 (А, и=8,8Гц, 1Н), 5.81 (с, 1Н), 4,31-4,17 (м, 2Н), 4,06-3,91 (м, 2Н), 3.82 (с, ЗН), 2,35-2,10 (м, 1Н), 1,50-1,35 (м, 1Н) (II) 2-(2-Метокси-5-(1,1,2,2,2,пентафторетил)феніл)-1,3-дюксан (Сполука 39) В круглодонну колбу на 50мл, що має насадку Дина-Старка та зворотній холодильник, приміщують Сполуку 38 (1,0г, З.ббммоля), пентафторпропюнат натрію (1,29г, 6,95ммоля), йодид МІДІ (І) (1,46г, 7,69 ммоля)та ДМФА (15мл)-толуол (бмл) Суспензію нагрівають до 120-140°С (температура бані) та толуол (бмл) вилучають дистиляцією температура)протягом 15 годин Суміш розбавляють сумішшю вода (40мл)-толуол (15мл)етилацетат (60мл), Суміш фільтрують крізь шар целіту та осад на фільтрі промивають етилацетатом Фільтрат промивають водою, розсолом, сушать (MgSO^Ta концентрують в вакуумі, одержують сирий продукт Сирий продукт очищають за допомогою колонкової хроматографії на силікагелі (елюент гексан-етил ацетат, 10 1-5 1), одержують Сполуку 39 (1,07г) у вигляді блідо-жовтого масла Спектр ^Н-ЯМР (CDCI3) 7,87 (д, и=2,2Гц, 1Н), 7,53 (дд, J=8,8, 2,2Гц, 1Н), 6,96 (д, и=8,8Гц, 1Н), 5,85 (с, 1Н), 4,26 (дд, и=ІІ,0,4,4Гц, 2Н), 4,00 (тд, J=12,3, 2,2Гц, 2Н), 3,89 (с, ЗН), 2,36-2,15 (м, 1Н), 1,50-1,38 (м, 1Н) (І И)(2-Метокси-5-(1,1,2,2,2пентафторетил)бензальдепд (Сполука 40) До розчину сполуки 39 (1,0г) в ацетоні (ЗОмл) при перемішуванні та при кімнатній температурі додають конц НСІ (4мл) Реакційну суміш перемішують при кімнатній температурі протягом 5 годин Розчинник упарюють в вакуумі та залишок екстрагують ефіром Об'єднаний розчин промивають насиченим водним розчином NaHS04 та розсолом, сушать (MgS04) та концентрують в вакуумі, одержують сирий продукт (790 мг) у вигляді жовтої твердої речовини Сирий продукт очищають за допомогою колонкової хроматографії на силікагелі (елюент гексан-ізопропиловий ефір, 10 1-3 1), одержують Сполуку 40 (275мг) у вигляді жовтої твердої речовини Спектр 1Н-ЯМР (CDCI3) 10,48 (с, 1Н), 8,08 (д, и=2,2Гц, 1Н), 7,77 (дд, J=8,8, 2,2Гц, 1Н), 7,13 (д, J=8,8, Гц, 1Н), 4,02 (с, ЗН) (IV) (2S,3S)-1-TpeT -Бутоксикарбоніл-3-(2метокси-5-(1,1,2,2,2-пентафторетил)бензил)амшо2-фенілпіперидин (Сполука 41) Цю сполуку одержують з Сполук 12 та 40 за методикою, аналогічною методиці отримання сполуки 26, та використовують на наступній стадії без додаткового очищення (V) (28,38)-3-(2-метокси-5-(1,1,2,2,2пентафторетил)бензил амшо-2-фенілпіперидин (Сполука 42) Цю сполуку одержують з Сполуки 41 по методиці, аналогічній методиці отримання сполуки 27 Спектр 1Н-ЯМР (CDCI3) 7,38 (дд, J=8,4, 2,2Гц, 1Н), 7,34-7,18 (м, 6Н), 6,74 (д, J =8, 4Гц, 1Н), 3,90 (д, J=2, 2Гц, 1Н), 3,69 (д, J= 14,3, Гц, 1Н), 3,53 (с, ЗН), 3,40 (д, и=14,ЗГц, 1Н), 3,34-3,24 (м, 1Н), 2,882,74 (м, 2Н), 2,15-1,83 (м, 4Н), 1,69-1,53 (м, 1Н), 1,50-1,38 (м, 1Н) ІЧ-спектр (плівка) 3330, 1614, 1501, 1460, 1334, 1304, 1275, 1258, 1203, 1145, 1119, 1096, 1029, 1004, 870, 815, 746, 700 Пентафторетил)бензил) аміно-2фенілпіперидину (Сполука 43) Цю сполуку одержують з сполуки 42 за методикою, аналогічною методиці отримання сполуки 28 Т пл 201-202°С ІЧ-спектр (КВг) 3455, 1617, 1554, 1506, 1453, 1443, 1416, 1337, 1282, 1258, 1221, 1202, 1180, 1148, 1131, 1091, 1010, 744,693 Приклад 10 29 48981 ЗО 3,24 (м, 1Н),), 3,20 (KB, J=ll, 0,2 Н), 2,88-2,73 (М, 2Н), 2,20-1,85 (м, 4Н), 1,68-1,52 (м, 1Н), 1,50-1,37 (м, 1Н) ІЧ-спектр (плівка) 3450, 1614, 1500, 1465, 1445, 1430, 1359, 1328, 1263, 1249, 1237, 1128, 1103, 1074, 1031, 854, 822, 810, 773, 746, 700, 672 (VI) Дипдрохлорид (2S,3S)-3-(2-MeTOKCH-5(2,2,2-трифторетил)бензил)амшо-2фенілпіперидину (Сполука 49) Цю сполуку одержують з Сполуки 48 по методиці, аналогічній методиці отримання сполуки 28 Т пл 209-210°С ІЧ-спектр (КВг) 3450, 1552, 1506, 1451, 1441, 1415, 1369, 1333, 1260, 1241, 1170 1132, 1086, 1030, 978, 807, 748, 693 Приклад 11 Отримання дипдрохлориду (2S,3S)-3-(2метокси-5-(1 -трифторметил)бензил) аміно-2фенілпіперидину (Сполука 55) (I) 1 -(4-Метоксифеніл)-1 (трифторметил)етилбромід (Сполука 50) Цю сполуку одержують згідно з методикою, описаної в J Am Chem Soc, 104,211 (1982) (II) 1-(4-Метоксифеніл)-1-(трифторметил)етан (Сполука 51) Цю сполуку одержують з Сполуки 50 за методикою, аналогічною методиці отримання Сполуки 45 Спектр 1Н-ЯМР (CDCI3) 7,28-7,19 (м, 2Н), 6,936,84 (м, 2Н), 3,81 (с, ЗН), 3,48-3,27 (м, 1Н), 1,48 (д, J=7,0 Гц, ЗН) (III) 2-Метокси-5-(1(трифторметил)етил)бензальдепд (Сполука 52) Цю сполуку одержують з Сполуки 51 за методикою, аналогічною методиці отримання Сполуки 46 Спектр 1Н-ЯМР (CDCIs) 10,46 (с, 1Н), 7,79 (д, J=2,6, Гц, 1Н), 7,52 (дд, J=8,8, 2,6Гц, 1Н), 7,00 (д, J=8,8, Гц, 1Н), 3,94 (с, ЗН), 3,53-3,32 (м, 1Н), 1,50 (д, J=7,3, Гц, ЗН) (ІУ)(28,38)-1-трет-бутоксикарбоніл-3-(2метокси-5-(1-(трифторметил)етил)бензил)амшо-2фенілпіперидин (Сполука 53) Цю сполуку одержують з Сполук 12 та 52 за методикою, аналогічною методиці отримання споСпектр 1Н-ЯМР (CDCI3) 10,46 (с, 1Н), 7,76 (д, луки 26, та використовують на наступній стадії без J=2,2, Гц, 1Н), 7,49 (дд, J=8,8, 2,2Гц, 1Н), 7,00 (д, додаткового очищення J=8,8 Гц, 1Н), 3,95 (с, ЗН), 3,34 (KB, J=10,6, Гц, 2Н) (V) (2S,3S)-3-(2-MeTOKCH-5-(1 (трифторметил)етил)бензил) аміно-2(IV) (28,38)-1-трет -Бутоксикарбоніл-3-(2фенілпіперидин (Сполука 54) метокси-5-(2,2,2-трифторетил)бензил)амшо-2фенілпіперидин (Сполука 47) Цю сполуку одержують з Сполуки 53 по методиці, аналогічній методиці отримання Сполуки 27 Цю сполуку одержують з Сполук 12 та 46 за методикою, аналогічною методиці отримання споСпектр 1Н-ЯМР (CDCI3) 7,35-7,19 (м, 5Н), луки 26, та використовують на наступній стадії без 7,13-7,05 (м, 1Н), 6,91-6,86 (м, 1Н), 6,68-6,61 (м, додаткового очищення 1Н), 3,91 (д, J=2,2 Гц, 1Н), 3,75-3,15 (м, 7Н), 2,882,73 (м, 2Н), 2,30-1,85 (м, 4Н), 1,70-1,51 (м, 1Н), (V) (2S,3S)-3-(2-MeTOKCH-5-(2,2,21,50-1,35 (м, 1Н), 1,42 (д, J=7,3 Гц, ЗН) трифторетил)бензил)амі-но-2-фенілпіперидин (Сполука 48) ІЧ-спектр (плівка) 3330, 1612, 1500, 1462, Цю сполуку одержують з сполуки 47 за мето1385, 1349, 1331, 1295, 1250, 1171, 1157, 1122, дикою, аналогічною методиці отримання Сполуки 1082, 1049, 1031, 995, 805, 747, 701 27 (VI) Дипдрохлорид (2S,3S)-3-(2-MeTOKCH-5-(1(тр и фтор метил) етил) бензил) аміно-2Спектр 1Н-ЯМР (CDCI3) 7,35-7,20 (м, 5Н), 7,06 фенілпіперидину (Сполука 55) (дд, J=8,4, 1,8Гц, 1Н), 6,84 (д, J=I,8I~4, 1Н), 6,65 (д, J=8,4 Гц, 1Н), 3,90 (д, и=2,2Гц, 1Н),), 3,68 (д, J =14, Цю сполуку одержують з Сполуки 54 за мето3Гц, 1Н), 3,49 (с, ЗН), 3,42 (д, J=14, 3Гц, 1Н), 3,35дикою, аналогічною методиці отримання сполуки Одержання дигідрохлориду(23,33)-3-(2метокси-5-(2,2,2-трифторетил)бензил)амшо-2фенілпіперидину (Сполука 49) (I) 1-(4-Метоксифеніл)-2,2,2трифторетилбромід (Сполука 44) Цю сполуку одержують згідно з методикою, описаною в J Am Chem Soc , III, 1455 (1989) (II) 1-(4-Метоксифеніл)-2,2,2-трифторетан (Сполука 45) Розчин сполуки 44 (1,08г, 4,00ммоль) в етанолі (20мл) гідрують на 10%-вому Pd/C (800мг) при атмосферному тиску протягом 16 годин Каталізатор відфільтровують через шар целіту та осад на фільтрі промивають СН2СІ2 Об'єднаний розчин промивають розбавленим розсолом та розсолом, сушать (MgSCU) та концентрируют в вакуумі, одержують сире Сполука 45 (760мг, вихід КІЛЬКІСНИЙ) у вигляді блідо-жовтого масла Спектр ^Н-ЯМР (CDCIs), 7,24-7,17 (м, 2Н), 6,936,84 (м, 2Н), 3,81 (с, ЗН), 3,30 (KB, J =10, 9, Гц, 2Н) (III) 2-Метокси-5-(2,2,2трифторетил)бензальдепд (Сполука 46) До розчину сполуки 45 (760мг, 4,00ммоль)в сухому СН2СІ2 (50мл) при перемішуванні та при охолоджуванні льодом за допомогою шприцу додають ТіСЦ (1,67г, 8,80ммоля) Через 15 хвилин до цієї суміші при тій самій температурі додають розчин дихлорметил метилового ефіру (920мг, 8,00ммолей) в сухому СН2СІ2 (5мл) Реакційну суміш перемішують при 0 3 протягом 15 хвилин та потім при кімнатній температурі протягом 1,5 годин Суміш при охолоджуванні льодом розбавляють водою (20мл) та перемішують при кімнатній температурі протягом 15 хвилин Органічний шар ВІДДІЛЯЮТЬ та водний шар екстрагують СН2СІ2 Об'єднаний розчин промивають насиченим водним розчином NaHCO- та розсолом, сушать (MgS04) та концентрують в вакуумі, одержують сирий продукт у вигляді жовтого масла Сирий продукт очищають за допомогою колонкової хроматографії на силікагелі (елюент гексанетилацетат, 40 1-20 1), одержують Сполуку 46 (500мг, 57%) у вигляді безбарвної твердої речовини (у вигляді голок) 48981 32 7,25 (м, 6Н), 7,10 (д, J=2,6I~4, 1H), 6,67 (дд, 28 и=8,4Гц, 1Н), 4,04-4,01 (м, 1Н), 3,78 (д, J=13,9I~4, Т пл 217-218°С 1Н), 3,53-3,38 (м, 2Н), 3,45 (с, ЗН), 2,96-2,83 (м, ІЧ-спею-p (КВг) 3450, 1554, 1505, 1465, 1453, 2Н), 2,30-1,60 (м, 4Н), 1,58 (с, 6Н) 1442, 1417, 1334, 1253, 1169, 1159, 1144, 1120, 1083, 1050, 1030,748, 693 Елементний аналіз СгбНгэРзМгО^НС! Розрахованого С 59,65, Н 6,21, М 5,56 Знайдено,% С Приклад 12 59,38, Н 6,27, М 5,55 Отримання дипдрохлориду (28,35)-3-[(5-(1,1диметил-4,4,4 трифтор-2-бутиніл)-2Приклад 13 метоксибензил) ] амшо-2-фенілпіперидину (СполуОтримання дипдрохлориду (2S,3S)-3-[(5ка 60) Метокси-1-трифторметил) шдан-6-іл) метиламіне] -2-фенілпіперидину (I) 4-(1,1-Диметил-2-пропиніл)анізол (Сполука 56) (Сполука 61) Цю сполуку одержують згідно з методикою, (I) 1 -Гідрокси-5-метокси-1 описаною в Tetrahedron Lett, 4163 (1977) (трифторметил)шдан (Сполука 52) (II) 4-(1,1-Диметил-4,4,4-трифтор-2До розчину 5-метокси-1 -інданона (1,00г, бутиніл)анізол (Сполука 57) 6,17ммоля) та трифторметилтриметилсилану (1,32г, 9,26 ммоля) в сухому ТГФ (15мл) при переДо розчину Сполуки 56 (0,22г, 1,26ммоля)в мішуванні та охолоджуванні льодом додають 1,0М ТГФ (8мл) при перемішуванні та при -78°С в атморозчин тетрабутиламонійфториду в ТГФ (0,05мл) сфері N2 додають H-BULI (1,69 М розчин в гексані, Реакційну масу перемішують при кімнатній темпе0,82мл, 1,39ммоля), потім нагрівають до 0°С та ратурі протягом 21 години До суміші додають 1н перемішують протягом 1 години Додають SНСІ (20мл) та перемішують при кімнатній темпера(трифторметурі протягом 25 годин Реакційну масу розбавлятил)дибензотюфенілтрифторметансульфонат ють сумішшю СНгСЬ-вода Органічний шар ВІДДІ(1,01г, 2,52 ммоля) та перемішують протягом З ЛЯЮТЬ та водний шар екстрагують СН2СІ2годин при 0°С Суміш гасять доданням водного Об'єднаний розчин промивають водою та розсоІЧаНСОз та екстрагують СН2СІ2 Об'єднані органічні лом, сушать (MgS04) та концентрують в вакуумі, шари сушать MgS04, фільтрують та концентрують одержують сирий продукт у вигляді темно-жовтого Отриманий залишок очищають хроматографуванмасла Сирий продукт очищають за допомогою ням на S1O2, одержують Сполуку 57 (38мг, 13%) у колонкової хроматографії на силікагелі (елюент вигляді безбарвного масла 1 гексан етилацетат, 5 1-3 1), одержують Сполуку Спектр -ЯМР (CDCI3) 7,37 (д, и=8,8Гц, 2Н), 62 (1,05г, 73%)у вигляді жовтого масла 6,88 (д, и=8,8Гц, 2Н), 3,80 (с, ЗН), 1,62 (с, 6Н) (III) 5-(1Д-Диметил-4,4,4-трифтор-2-бутиніл)-2Спектр 1Н-ЯМР (CDCI3) 7,39 (A, J=8 4ГЦ, 1Н), метокси-бензальдепд 6,88-6,75 (М, 2Н), 3,81 (с, ЗН), 3,17-2,86 (м, 2Н), 2,74-2,57 (м, 1Н), 2,43-2,34 (м, 1Н), 2,32-2,15 (м, (Сполука 58) 1Н) Цю сполуку одержують з Сполуки 57 за методикою, аналогічною методиці отримання сполуки (II) 6-Метокси-3-(трифторметил)шдан (Сполука 9 63) Спектр 1-ЯМР (CDCI3) 10,47 (с, 1Н), 7,87 (д, До сполуки 62 (850мг, З.ббммоля) при переміJ=2,9I~4, 1Н), 7,71 (дд, J=8,8, 2,9Гц, 1Н), 7,01 (д, шуванні та охолоджуванні льодом додають РВгз и=8,8Гц, 1Н), 3,94 (с, ЗН), 1,64 (с, 6Н) (9,90г, Зб.бммоля) Реакційну суміш перемішують при 80°С протягом 6 годин Суміш при охолоджу(IV) (28,38)-1-трет-Бутоксикарбоніл-3-[5-(1,1ванні льодом розбавляють водою та екстрагують Диметил-4,4,4-трифтор-2-бутиніл)-2СН2СІ2 Об'єднаний розчин промивають насичеметоксибензил]амшо-2 фенілпіперидин (Сполука ним розчином ІЧаНСОз та розсолом, сушать 59) (MgS04) та концентрують в вакуумі, одержують Цю сполуку одержують з Сполуки 58 та Сполусирий продукт у вигляді жовтого масла Сирий ки 12 за методикою, аналогічною методиці отрипродукт очищають колонкової хроматографії на мання сполуки 13 1 силікагелі (елюент гексан етил ацетат, 50 1-40 1) Спектр -ЯМР (CDCI3) 7,62-7,53 (м, 2Н), 7,36Одержують Сполуку 63 (727мг, 93%)у вигляді жов7,20 (м, 5Н), 6,78 (д, J=,, 1Н), 5,53-5,42 (м, 1Н), того масла 4,01-3,88 (м, 1Н), 3,83 (с, 2Н), 3,70 (с, ЗН), 3,132,93 (м, 2Н), 1,92-1,35 (м, 4Н), 1,60 (с, ЗН), 1,59 (с, Спектр 1Н-ЯМР (CDCI3), 7,46-7,38 (м, 1Н), ЗН), 1,40 (с, 9Н) 7,10-7,05 (м, 1Н), 6,90 (дд, J=8,4, 2,6Гц, 1Н), 6,876,81 (м, 1Н), 3,84 (с, ЗН), 3,50-3,47 (м, 2Н) (\/)Дипдрохлорид(23,33)-3-[5-(1,1-Диметил4,4,4-трифтор-2-бутиніл)2-метоксибензил]амшо (III) 5-Метокси-1-(трифторметил)шдан (Сполуфенілпіперидин (Сполука 60) ка 64) До розчину Сполуки 59 (34мг, 0,064ммоля) в Розчин сполуки 63 (180мг, 0,84ммоля) в етаAcOEt (8мл) додають надлишок НСІ-МеОН Суміш нолі (5мл) гідрують на 10%-вому Pd-C (90мг) при перемішують протягом 18 годин і потім упарюють атмосферному тиску протягом 4,5 годин Каталізав вакуумі, твердий залишок перекристалі-зовують тор відфільтровують через шар целіту та осад на з суміші MeOH-Et20, одержують Сполуку 60 (24мг, фільтрі промивають СН2СІ2 Об'єднаний розчин 75%)у вигляді білого твердого продукту промивають розбавленим розсолом та розсолом, сушать (MgS04) та концентрують в вакуумі, одерТ пл 225-227°С жують сиру Сполуку 64 (147мг, 81%) у вигляді свіІЧ-спектр (КВг) 3440, 2980, 2935, 2350, 2275, тло-жовтого масла 1558, 1504, 1455, 1416, 1293, ИЗО см 1 Спектр 1Н-ЯМР (вільна основа, CDCI3) 7,38Спектр 1Н-ЯМР (CDCI3) 7,36-7,20 (М, 1Н), 31 48981 34 33 6,88-6,69 (м, 2Н), 3,90-3,62 (м, 4Н), 3,20-2,80 (м, (III) 5-(1,1-Диметил-2,2,2-трифторетил)-22Н), 2,48-2,19 (м, 2Н) метоксибензальдепд (Сполука 71) (IV) 6-Форміл-5-метокси-1 Цю сполуку одержують з суміші Сполук 69 та (трифторметил)шдан (Сполука 65) 70 за методикою, аналогічною методиці отримання сполуки 46 Цю сполуку одержують з Сполуки 64 за методикою, аналогічною методиці отримання сполуки Отриману сиру сполуку очищають за допомо46 гою препаративної ТХШ (елюент гексан етилацетат, 6 1), Одержують Сполуку 71 (75мл) у вигляді Спектр 1Н-ЯМР (CDCI3) 10,41 (с, 1Н), 7,85 (с, світло-жовтого масла 1Н), 6,90 (с, 1Н), 3,93 (с, ЗН), 3,90-3,70 (м, 1Н), 3,24-2,87 (м, 2Н), 2,50-2,20 (м, 2Н) Спектр 1Н-ЯМР (CDCI3) 10,47 (с, 1Н), 7,95 (д, J=2,6I~4, 1Н), 7,74-7,64 (м, 1Н), 6,99 (д, J=8,8I~4, (V)(2S,3S)-1-TpeT-ByroKCHKap6oHin-3-[(51Н), 3,94 (с, ЗН), 1,57 (с, 6Н) Метокси-1-трифторметил)ін-дан-6-іл)метиламшо]2-фенілпіперидин (Сполука 66) (IV)(2S,3S)-1-TpeT-ByroKCHKap6oHin-3-[5-(1,1диметил-2,2,2-трифторетил)-2Цю сполуку одержують з Сполук 12 та 65 за метоксибензиламшо]-2-фенілпіперидин (Сполука методикою, аналогічною до методики отримання 72) сполуки 26 На наступній стадії вона використовується без додаткового очищення Цю сполуку одержують з Сполуки 12 та Сполуки 71 за методикою, аналогічною методиці отри(VI) (2S,3S)-3-[(5-MeTOKCH-1 мання сполуки 26 (трифторметил)індан-6-іл)метиламшо]-2фенілпіперидин (Сполука 67) Сполуку використовують на наступній стадії без додаткового очищення Цю сполуку одержують з Сполуки 66 за методикою, аналогічною методиці отримання сполуки (V) (2S,3S)-3-[5-(1,1-flHMeTHn-2,2,227 трифгоретил)-2-метоксибензиламшо]-2Спектр 1Н-ЯМР (CDCI3) 7,37-7,17 (м, 5Н), 6,99 фенілпіперидин (Сполука 73) (уш З, 1Н), 6,58 та 6,56 (кожен с, всього 1Н), 3,91 Цю сполуку одержують з Сполуки 72 по мето(д, J=2,2I~4, 1Н), 3,82-3,60 (м, 2Н), 3,44 (с, ЗН), 3,39 диці, аналогічній методиці отримання сполуки 27 (д, J=13,9I~4, 1Н), 3,39-3,24 (м, 1Н), 3,10-2,72 (м, Спектр1Н-ЯМР (CDCI3), 7,35-7,16 (м, 6Н), 7,154Н), 2,56 (уш З, 2Н), 2,43-1,85 (м, 4Н), 1,71-1,35 7,08 (м, 1Н), 6,65 (д, J=8,8 Гц, ІН), 3,91 (д, J=2,2I~4, (м, 2Н) 1Н), 3,69 (д, J=13,9 Гц, 1Н), 3,48 (с, ЗН), 3,41 (д, J=13,9 Гц, 1Н), 3,36-3,22 (м, 1Н), 2,90-2,71 (м, 2Н), (VII) Дипдрохлорид (2S,3S)-3-[(5-MeTOKCH-12,44 (уш с, 2Н), 2,20-1,85 (м, 2Н), 1,70-1,35 (м, 2Н), (трифторметил)індан-6-іл)метиламшо]-21,49 (с, 6Н) (VI) Дипдрохлорид (28,38)-3-[5-(1,1фенілпіперидину (Сполука 61) диметил-2,2,2-трифторетил)-2Цю сполуку одержують з Сполуки 67 за метометоксибензиламшо]-2-фенілпіперидин (Сполука дикою, аналогічною методиці отримання сполуки 68) 28 Тпл 213-214°С Цю сполуку одержують з Сполуки 73 за методикою, аналогічною методиці отримання сполуки 2 ІЧ-спектр (КВг) 3435, 1623, 1579, 1560, 1498, 8 1464, 1452, 1434, 1421, 1368, 1297, 1271, 1170, 1138, 1103, 1034,749, 694 Т пл 220-221 °С Приклад 14 ІЧ-спектр (КВІ) 3425, 1564, 1511, 1469, 1453, 1442, 1420, 1400, 1290, 1255, 1187, 1174, 1131, Отримання дипдрохлориду (2S,3S)-3-[5-(1,11101, 1027, 749,691 диметил-2,2,2-трифторетил) -2метоксибензиламшо] -2-фенілпіперидину Приклад 15 (Сполука 68) Отримання дипдрохлориду (23,33)2-феніл-3(5-(2,2,2-трифтор-1 -метил-1 -трифторметил )етил) (S) 4-(1 -(Хлор-1 -метил-222-2-метоксибензил) амінопіперидину (Сполука 78) трифторетил)анізол (Сполука 69) Цю сполуку одержують згідно з методикою, (І) 4-(2,2-Дифтор-1описаною в публікації JP 62634034 (трифторметил)етеніл)анізол (Сполука 74) (II) 4-(1Д-Диметил-2,2,2-трифторетил)анізол Цю сполуку одержують згідно з методиками, (Сполука 70) описаними в публікації J Am Chem Soc, 820 (1972) До сполуки ТіСЦ (57мг, 0,30ммоля)в сухому СН2СІ2 (5мл) при перемішуванні та -78°С додають (ІІ)4-(2,2,2-Трифтор-1-метил-1 за допомогою шприцу розчин (1,05моля/л) ZnMe2 (трифторметил)етил)анізол (Сполука 75) (0,87мл, 0,91 ммоля)в толуолі Через 15 хвилин до Суміш сполуки 74 (570мг, 2,4ммоля), Mel отриманої суміші додають розчин Сполука 69 (430мг, З.Оммоля) та CsF (760мг, 5,0ммоля)в (217мг, 0,91ммоля) в сухому СН2СІ2 (5мл) при тій ДМФА (4мл) перемішують при 80°С протягом З самій температурі Реакційну суміш перемішують днів Суміш розбавляють водою Органічний шар при -78°С протягом 1 години та нагрівають до кімВІДДІЛЯЮТЬ, а водний шар екстрагують СН2СІ2натної температури Через 2 години суміш розбавОб'єднаний розчин сушать (Na2S04)Ta концентруляють водою та перемішують протягом 10 хвилин ють в вакуумі, одержують сирий продукт, що очиОб'єднаний розчин промивають розсолом, сушать щають колонковою хроматографією на силікагелі (MgSO^Ta концентрують в вакуумі, одержують сиОдержують Сполуку 75 (70мг, 10%) у вигляді жоврий продукт (200 мл) (Сполука 69 70=1 2,4)у витого масла гляді світло-жовтого масла На наступній стадії Спектр1Н-ЯМР (CDCI3) 7,53-6,90 (м, 4Н), 4,85 цей продукт використовують без додаткового (с, ЗН), 3,50-3,42 (м, ЗН) очищення (III) 5-(2,2,2-Трифтор-1-метил-1 35 (трифторметил)етил)-2-метоксибензальдепд (Сполука 76) Цю сполуку одержують з Сполуки 75 по методиці, аналогічній методиці отримання Сполуки 9 Спектр1Н-ЯМР (CDCI3) 10,49 (с, 1Н), 8,09-7,08 (м, ЗН), 4,02 (с, ЗН), 3,51-3,45 (м, ЗН) (IV) (2S,3S)-1-TpeT -Бутоксикарбоніл-2-феніл-З(5-(2,2,2-трифтор-1 метил-1 (три фтор метил) етил)2-метоксибензил]-амшопіперидин (Сполука 77) Цю сполуку одержують з Сполуки 12 та Сполуки 76 за методикою, аналогічною методиці отримання Сполуки 26 На наступній стадії цю сполуку використовують без додаткового очищення Спектр 1Н-ЯМР (CDCI3) 7,62-6,86 (м, 8Н), 4,062,95 (м, 9Н), 3,78 (с, ЗН), 1,91-1,30 (м, 4Н), 1,35 (с, 9Н) (\/)Дипдрохлорид(23,33)-2-феніл-3-(5-(2,2,2трифтор-1 метил-1 (три-фторметил)етил)-2метоксибензил)амшопіперидину (Сполука 78) Цю сполуку одержують з Сполуки 77 за методикою, аналогічною методиці отримання Сполуки 60 Т пл 267-270°С Приклад 16 Отримання дипдрохлориду (25,38)-3-[5-[2,2,дифтор-1-трифторметил) етеніл - 2 - метоксибензил ] аміно - 2 -фенілпіперидину (Сполука 81) (I) 5-[2,2-Дифтор-1-(трифторметил)етеніл]-2метоксибензальдепд (Сполука 79) Цю сполуку одержують з сполуки 74 за методикою, аналогічною методикою отримання Сполуки 9 Спектр 1Н-ЯМР (CDCI3) 10,47 (с, 1Н), 7,81 (д, J=2,2I~4, 1Н), 7,51 (дд, J=8,4, 2,2Гц, 1Н), 7,06 (д, и=8,4Гц, 1Н), 3,98 (с, ЗН) (II) (28,38)-1-трет -Бутоксикарбоніл-3-[5-[2,2дифгор-1-(трифторметил)етеніл]-2метоксибензил]амшо-2-фенілпіперидин (Сполука 80) Цю сполуку одержують з сполуки 79 за методикою, аналогічною методиці отримання сполуки 13 Спектр1Н-ЯМР (CDCI3) 7,63-7,55 (м, 2Н) , 7,37-7,15 (м, 5Н), 6,83 (д, J=,, 1Н), 5,53-5,42 (м, 1Н), 4,02-3,92 (М, 1Н), 3,83 (с, 2Н), 3,74 (с, ЗН), 3,12-2,94 (м, 2Н), 1,94-1,40 (м, 4Н), 1,40 (с, 9Н) (III) Дипдрохлорид (23,33)-3-[5-[2,2-дифтор-1(трифторметил)етеніл1-2-метоксибензил]амшо-2енілпіперидину (Сполука 81) Цю сполуку одержують з сполуки 80 за методикою, аналогічною методиці отримання сполуки 60 Т пл 235-237°С Спектр1Н-ЯМР (вільна основа, CDCI3) 7,357,18 (м, 5Н), 7,15-7,07 (м, 1Н), 6,89-6,86 (М, 1Н), 6,70 (д, J=8,4 Гц, 1Н), 3,91 (д, J=2,6 Гц, 1Н), 3,69 (д, J=14,7 Гц, 1Н), 3,53 (с, ЗН), 3,42 (д, J=14,7 Гц, 1Н), 3,36-3,24 (м, 1Н), 2,88-2,75 (м, Н), 2,18-1,40 (м, 4Н) Приклад 17 Отримання дипдрохлориду(23,33)-3-(2,4диметокси-5-(2,2,2,-трифторетил)бензил)амшо-2 фенілпіперидину (Сполука 87) (І) 1-(2,4-Диметоксифеніл)-2,2,2трифторетанол (Сполука 82) Цю сполуку одержують з 2,4 48981 36 диметоксибензальдепду за методикою, аналогічною методиці отримання сполуки 62 Спектр1Н-ЯМР (CDCI3) 7,32-6,48 (м, ЗН), 7,81 (квінтет, и=7Гц, 1Н), 3,85 (с, ЗН), 3,82 (с, ЗН), 3,42 (ди=8Гц, 1Н) (II) 1-(2,4-Диметоксифеніл)-2,2, 2трифторетилбромід (Сполука 83) Цю сполуку одержують з Сполуки 82 за методикою, аналогічною методиці отримання Сполуки 44 Спектр 1Н-ЯМР (CDCI3) 7,58-6,42 (м, ЗН), 5,81 (KB, J=ll Гц, 1Н), 3,88 (с, ЗН), 3,86 (с, ЗН), (III) 1-2,4-Диметоксифеніл-2,2,2-трифторетан (Сполука 84) Цю сполуку одержують з Сполуки 83 за методикою, аналогічною методиці отримання Сполуки 45 Спектр 1Н-ЯМР (CDCI3) 7,20-6,45 (м, ЗН), 3,82 (с, ЗН), 3,81 (с, ЗН), 3,37 (KB, J =11 Гц, 2Н) (IV) (2,4-Диметоксифеніл)-5-(2,2,2трифторетил)бензальдепд (Сполука 85) Цю сполуку одержують з Сполуки 84 за методикою, аналогічною методиці отримання Сполуки 46 Спектр1Н-ЯМР (CDCI3) 10,20 (с, 1Н), 7,77 (с, 1Н), 6,46 (с, 1Н), 3,94 (с, ЗН), 3,38 (кв, J=ll,2 H) (У)(23,33)-1-трет-Бутоксикарбоніл-3-(2,4диметокси-5-(2,2,2,-трифгоретил)бензил)амшо-2фенілпіперидин (Сполука 86) Цю сполуку одержують з Сполуки 12 та Сполуки 85 за методикою, аналогічною методиці отримання сполуки 13 На наступній стадії отримана сполука використовують без додаткового очищення Спектр 1Н-ЯМР (CDCI3) 7,62-7,20 (м, 5Н), 7,04 (с, 1Н), 6,42 (с, 1Н), 4,00-2,92 (м, 8Н), 3,83 (с, ЗН), 3,71 (с, ЗН), 1,90-1,30 (м, 4Н), 1,39 (с, 9Н), (УІ)Дипдрохлорид(23,33)-3-(2,4-диметокси-5(2,2,2,-трифторетил)бензил)амшо-2фенілпіперидину (Сполука 87) Цю сполуку одержують з Сполуки 86 за методикою, аналогічною методиці отримання Сполуки 60 Спектр1Н-ЯМР (вільна основа CDCI3) 7,407,00 (м, 5Н), 6,80 (с, 1Н), 6,27 (с, 1Н), 3,90-2,72 (м, 8Н), 3,80 (с, ЗН), 3,49 (с, ЗН), 2,15-1,20 (м, 4Н) Приклад 18 Отримання дипдрохлориду (2S,3S)-3-( (6метокси-1-(трифторметил) -1,2,3,4 тетрапдронафталш - 7 - іл) метил) аміно-2енілпіперидину (Сполука 94) (I) 1-Гідрокси-6-метокси-І-(трифторметил)-1,2, 3,4-тетрапдронафталш (Сполука 88) Цю сполуку одержують з 6-метокси-Ітетралону за методикою, аналогічною методиці отримання сполуки 62 Спектр1Н-ЯМР (CDCI3) 7,61 (д, и=8,8Гц, 1Н), 6,80 (дд, J=8,8, 2,6Гц, 1Н), 6,66 (д, 3 =2 5Гц, 1Н), 3,80 (с, ЗН), 2,90-2,66 (м, 2Н), 2,30 (с, 1Н), 2,401,75 (м, 4Н) (II) 6-Метокси-1-(трифторметил)-3,4дипдронафталш (Сполука 89) Цю сполуку одержують з Сполуки 88 за методикою, аналогічною методиці отримання Сполуки 37 63 Спектр 1Н-ЯМР (CDCI3) 7,39-7,28 (м, 1Н), 6,806,70 (м, 2Н), 6,61-6,52 (м, 1Н), 3,81 (с, ЗН), 2,842,72 (м, 2Н), 2,46-2,30 (м, 2Н) (III) 6-Метокси1-(трифторметил)-1,2,3,4тетрапдронафталш (Сполука 90) Цю сполуку одержують з сполуки 89 ВІДПОВІДНО до методики, аналогічній методиці отримання сполуки 64 Спектр1Н-ЯМР (CDCI3) 7,26 (д, J =8, 4Гц, 1Н), 6,74 (дд, J= 8,4, 2,9Гц, 1Н), 6,66 (д, J=2,9I~4, 1H), 3,79, ЗН), 3,57-3,36 (м, 1Н), 2,90-2,62 (м, 2Н), 2,201,60 (с, 4Н) (IV) 7-Форміл-6-метокси- 1-трифторметил)1,2,3,4-тетрапдро-нафталін (Сполука 91) Цю сполуку одержують з сполуки 90 за методикою, аналогічною методиці отримання сполуки 46 Спектр1Н-ЯМР (CDCI3) 10,39 (с, 1Н), 7,81 (с, 1Н), 6,74 (с, 1Н), 3,91 (с, ЗН), 3,60-3,40 (М, 1Н), 2,98-2,70 (м, 2Н), 2,27-1,65 (м, 4Н) (V)(2S,3S)-1-TpeT-ByroKCHKap6oHin-3-((6метокси-1-трифторметил)-1,2,3,4тетрапдронафталін-7-іл)метил)амшо-2фенілпіперидин (Сполука 92) Цю сполуку одержують з Сполук 12 та 91 за методикою, аналогічною методиці отримання сполуки 26 На наступній стадії и використовують без додаткового очищення (\Л)(23,33)-3-((6-метокси-1-(трифторметил)1,2,3,4-тетрапдронафталін-7-іл)метил)амшо-2фенілпіперидин (Сполука 93) Цю сполуку одержують з сполуки 92 за методикою, аналогічною методиці отримання сполуки 27 Спектр 1Н-ЯМР (CDCI3) 7,38-7,17 (м, 5Н), 6,94 (с, 1Н), 6,42 та 6,39 (кожен с, всього 1Н), 3,90 (д, J=l,5 Гц, 1Н), 3,73-3,58 (м, 1Н), 3,50-3,23 (м, 6Н), 2,90-2,60 (м, 4Н), 2,39 (уш с, 2Н), 2,20-1,52 (м, 7Н), 1,50-1,34 (м, 1Н) (\/ІІ)Дигідрохпорид(23,33)-3-((6-метокси-1(трифгорметил)-1,2,3,4-тетрапдронафталш-7іл)метил)амшо-2-фенілпіперидину (Сполука 94) Цю сполуку одержують з Сполуки 93 за методикою, аналогічною методиці отримання сполуки 28 Т пл 227-230°С ІЧ-спектр (КВг) 3435, 1624, 1587, 1561, 1507, 1466, 1452, 1433, 1420, 1336, 1260, 1247, 1171, 1138, 1116, 1106, 1044, 979, 834, 748, 693 Приклад 19 Отримання дипдрохлориду (25,38)-3-((2,2дифтор-6-метокси -1,2,3,4 -тетрапдронафтал ш - 7 - іл) метил) аміно - 2 -фенілпіперидину (Сполука 98) (1)6-Метокси-2,2-дифто-1,2,3,4тетрапдронафталш (Сполука 95) До розчину 6-метокси-2-тетралону (352мг, 2,00ммоля) в сухому СН2СІ2 (5мл) при перемішуванні та при кімнатній температурі додають діетиламшотрифторсульфонат (366мг, 2,27ммоля) Реакційну суміш перемішують при температурі кипіння з зворотним холодильником протягом 7 48981 38 годин Суміш розбавляють насиченим розчином ІЧаНСОз та екстрагують СН2СІ2 Об'єднаний розчин сушать (MgSO4) та концентрують в вакуумі, одержують сирий продукт у вигляді жовтого масла Сирий продукт очищають за допомогою колонкової хроматографії на силікагелі (елюент гексан етилацетат, (25 1), одержують Сполуку 95 (181мг, 46%) у вигляді жовтого масла Спектр 1Н-ЯМР (CDCI3) 7,00 (д, J =8, 1 Гц, 1Н), 6,75 (дд, J=8,4, 2,9Гц, 1Н), 6,68 (д, J =2,6Гц, 1Н), 3,78 (с, ЗН), 3,18 (т, J =15, ОГц, 2Н), 2,98 (т, и=7,0Гц, 2Н), 2,27-2,11 (м, 2Н) (II) 7-Форміл-6-метокси-2,2-дифтор-1,2,3,4тетрапдронафталш (Сполука 96) До розчину Сполуки 95 (90мг, 0,45ммоля) в сухому СН2СІ2 (Юмл) при перемішуванні та при температурі -78°С за допомогою шприцу додають ТіСЬ (104мг, 0,55ммоля) Через 15 хвилин при тій самій температурі додають дихлормети л метиловий ефір (636мг, 0,55ммоля) Реакційну суміш перемішують при -78°С протягом 2 годин Суміш розбавляють водою (Юмл) при охолодженні льодом та перемішують при кімнатній температурі протягом 15 хвилин Органічний шар ВІДДІЛЯЮТЬ та водний шар екстрагують СН2СІ2- Об'єднаний розчин сушать (MgS04) та концентрують в вакуумі, одержують сирий продукт у вигляді жовтого масла Сирий продукт очищають колонковою хроматографією на силікагелі (елюент гексан етилацетат, (10 1) Одержують Сполуку 96 (44 мг, 43%)у вигляді жовтого масла Спектр1Н-ЯМР (CDCI3) 10,39 (с, 1Н), 7,56 (с, 1Н), 6,75 (с, 1Н), 3,91 (с, ЗН), 3,21 (т, и=14,7Гц, 2Н), 3,05 (т, и=7,0Гц, 2Н), 2,30-2,15 (м, 2Н) (III)(2S,3S)-1-трет-Бугоксикарбоніл-3-((2,2дифтор-6-метокси-1,2,3,4-тетрапдронафталш-7іл)метил)амшо-2-фенілпіперидин (Сполука 97) Цю сполуку одержують з сполуки 96 та Сполуки 12 за методикою, аналогічною методиці отримання сполуки 13 Спектр 1Н-ЯМР (CDCI3) 7,58 (д, и=7,ЗГц, 2Н), 7,34-7,25 (м, ЗН), 6,90 (с, 1Н), 6,56 (с, 1Н), 5,49 (с, 1Н), 3,97-3,71 (м, ЗН), 3,68 (с, ЗН), 3,14 (т, J=15,0 Гц, 2Н), 3,08-2,93 (м, 4Н), 2,24-2,09 (м, 2Н), 1,811,53 (М, 4Н), 1,42 (с, 9Н) (ІДипдрохпорид(23,33)-3-((2,2-дифтор-6метокси-1,2,3,4-тетрапдронафгалш-7іл)метил)амшо-2-феншІіперидину (Сполука 98) Цю сполуку одержують з Сполуки 97 за методикою, аналогічною методиці отримання сполуки 60 Спектр1Н-ЯМР (CDCI3) 7,35-7,29 (м, 5Н), 6,64 (с, 1Н), 6,43 (с, 1Н), 3,94 (с, 1Н), 3,71-3,27 (м, ЗН), 3,44 (с, ЗН), 3,07 (т, J=15,4f4, 2H), 2,93 (т, J=6, 9Гц, 2Н), 2,88-2,77 (м, 2Н), 2,25-1,90 (м, 4Н), 1,75-1,43 (м, 2Н) Приклад 20 Отримання дипдрохлориду (2S,3S)-3-(2метокси-5-(2,2,2-трифтор-1 -пдрокси-1 - (трифторметил) етил) бензил) аміно-2 -фенілпіперидину (Сполука 101) (І) 4-(2,2,2-Трифтор-1 -пдрокси-1 (трифторметил)етил)анізол (Сполука 99) Цю сполуку одержують згідно з методиками, описаними в журналі "Известия Академии Наук 39 48981 40 J=2,9I~4, 1Н), 7,97-7,87 (м, 1Н), 7,05 (д, J=8,8I~4, 1Н), 3,98 (с, ЗН), 2,15 (с, ЗН) (II) 2-Метокси-5-(2,2,2-трифтор-1-пдрокси-1(трифторметил)етил)бензальдепд (N)(2S,3S)-1-TpeT-ByTOKCHKap6oHin-3-[5-[(1(Сполука 100) хлор-1-(трифгорметил)етил]-2метоксибензиламшо-2-фенілпіперидин Цю сполуку одержують з Сполуки 99 за методикою, аналогічною методиці отримання Сполуки (Сполука 103) 9 Цю сполуку одержують з сполуки 12 та Сполуки 102 за методикою, аналогічною методиці отриСпектр 1Н-ЯМР (CDCI3) 10,47 (с, 1Н), 8,29мання Сполуки 26 На наступній стадії и викорис7,03 (м, ЗН), 4,05 (с, 1Н), 3,99 (с, ЗН) товують без додаткового очищення Дипдрохлорид(23,33)-2-метокси-3-(5-(2,2,2трифтор-1 -пдрокси-1 (lll)(2S,3S)-3-[5-[(1-xnop-1(трифгорметил)етил)бензил)амшо-2(трифгорметил)етил]-2-метоксибензиламшо-2фенілпшеридину (Сполука 101) фенілпіперидин Цю сполуку одержують з сполуки 100 та Спо(Сполука 104) луки 1 за методикою, аналогічною методиці отриЦю сполуку одержують з сполуки 103 за метомання сполуки 2 дикою, аналогічною методиці отримання сполуки 27 Спектр1Н-ЯМР (вільна основа, CDCI3) 7,666,65 (м, 8Н), 4,02-2,75 (м, 6Н), 3,57 (с, ЗН), 3,47 (с, Спектр1Н-ЯМР (CDCI3) 7,50-7,15 (м, 7Н), 6,721Н), 2,20-1,25 (м, 4Н) 6,62 (м, 1Н), 3,89 (д, J=2,2I~4, 1Н), 3,75-3,60 (м, 1Н), 3,51 (с, ЗН), 3,40 (д, J=14,3I~4, 1H), 3,35-3,21 Т пл 299-302°С (м, 1Н), 2,90-2,71 (м, 2Н), 2,20-1,80 (м, 7Н), 1,70Приклад 21 1,35 (м, 2Н) Отримання дипдрохлориду (28,38)-3-[5-[(1хлор-1-(трифторметил )етил] -2(І\/)Дигідрохлорид(23,33)-3-[5-[(1 -хлор-1 метоксибензиламшо] -2(трифторметил)етил]-2-метоксибензиламшо]-2фенілпіперидину (Сполука 105) фенілпіперидину (Сполука 105) (І) 5- [(1 -Хлор-1 - (три фтор мети л) етил)-2Цю сполуку одержують з Сполуки 104 за меметоксибензальдепд тодикою, аналогічною методиці отримання Сполуки 28 (Сполука 102) Цю сполуку одержують з Сполуки 69 по метоХІМІЧНІ структури сполук, отриманих в Прикладиці, аналогічній методиці отримання Сполуки 46 дах 1 -21, подано в Таблиці 1 Спектр 1Н-ЯМР (CDCI3) 10,47 (с, 1Н), 8,06 (д, СССР", Сер ХІМІЯ, 659 (1979) Таблиця 1 №Пр 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Аг СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб R три фтор метил три фтор метил три фтор метил три фтор метил 2,2,2-трифтор-1-(трифторметил) етил 1,2,2,2-тетрафтор-1-(трифторметил) етил 1,1-дифторетил 1,1 -дифторетил 1,1,2,2,2-пентафторетил 2,2,2-трифторетил і-(трифторметил) етил 1,1-диметил-4,4,4-трифтор-2-бутиніл 1,1 -диметил-2,2,2- трифторетил 2,2,2-трифтор-1-метил-1-(трифторметил) етил 2,2-дифтор-1-(трифторметил) етеніл 2,2,2 -трифторетил R1 Н Н н н н н н н н н н н н н н н R-R1 X F СІ ОСНз ос 6 н 5 ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз CH(CF3)(CH2)2 ОСНз ОСНз ОСНз ОСНз ОСНз Продовження таблиці 1 18 ОСНз CH(CF3)(CH2)3 OCH 41 19 с6н5 20 СеН 5 21 с6н5 48981 42 2,2,2-трифтор-1-пдрокси-1-( трифторметил) етил 1-хлор-1-( трифторметил) етил н CHCF2(CH2)2 ОСНз ОСНз ОСНз Примітки * Замісник X знаходиться в позиції 2 бензольного кільця **Стереохімія 2-арил і 3-бензиламіно - (2S.3S) Сполуки, наведені в Таблицях 2 та 3 отримані з використанням ВІДПОВІДНИХ ВИХІДНИХ речовин методами, описаними в Прикладах 10, 13, 14, 17, 18 або 19 Таблиця 2 Аг СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб R 3,3,3 -трифторпропил 1, 1-диметил-З, 3, 3 -трифторпропил 2,2,3,3,3-пентафторпропил 1,1-диметил-2,2,3,3,3-пентафторпропил 3,3,3-трифтор-1-пропеніл 2-трифторметил-3,3,3-трифтор-1-пропеніл 1-метил-3,3,3-трифтор-1-пропеніл 1-метил-2-трифторметил-3,3,3-трифтор-1-пропеніл 1 -трифторметилциклопропил 1 -трифторметилциклобутил 1 -трифторметилциклопентил 1-трифторметилциклогексил 2- (трифторметил) циклопропил 2 - (трифторметил ) циклобутил 2- (трифторметил) циклопентил 2- (трифторметил )циклогексил 2,2,2-трифторетил 1,1,2,2,2-пентафторетил 2,2,26-трифторетил 2,2,2-трифторетил 1,1,2,2,2, -пентафторетил 1,1,2,2,2, -пентафторетил 1 -пдрокси-2,2,2-трифторетил 1-метокси-2,2,2-трифторетил 2,2 -біс (трифторметил )циклобутил 1- (трифторетил) етеніл Примітки * Замісник X знаходиться в позиції 2 бензольного кільця ** Стереохімія 2-арил і 3-бензиламіно - (2S.3S) R1 Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н F F Н Н н н н н н н X ОСНЗ ОСНЗ ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСН(СНз)2 OCF3 ОСН(СНз)2 ОСНз ОСНз ОСНз ОСНз 43 48981 44 Таблиця З Аг СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб СєНб Аг СєНб СєНб СєНб СєНб R-R' CH 2 C(CF 3 )2CH 2 CH 2 CH(CF 3 )CH 2 CH 2 C(CF 3 )(CH 3 )CH 2 CH 2 C(CF 3 ) 2 (CH 2 ) 2 CH 2 CH(CF 3 )(CH 2 ) 2 CH(CF 3 )CH 2 O C(CF 3 ) 2 (CH 2 ) 2 C(CF 3 )(CH 3 )(CH 2 ) 2 C(CF 3 ) 2 (CH 2 ) 3 C(CF 3 )(CH 3 )(CH 2 ) 3 R-R' CH 2 CF 2 CH 2 CH 2 CF 2 (CH 2 ) 2 C(CH 3 ) 2 CF 2 CH 2 ) C(CH 3 ) 2 CF 2 (CH 2 ) 2 Примітки * Замісник X знаходиться в позиції 2 бензольного кільця ** Стереохімія 2-арил і 3-бензиламіно - ( 2S.3S) ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 X OCH3 OCH3 ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз ОСНз X ОСНз ОСНз ОСНз ОСНз
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted benzylaminopiperidines, pharmaceutical composition and method of treatment
Назва патенту російськоюЗамещенные бензиламинопиперидины, фармацевтическая композиция и способ лечения
МПК / Мітки
МПК: A61P 25/00, A61K 31/445, A61K 31/451, A61P 43/00, C07D 211/56
Мітки: фармацевтична, бензиламінопіперидини, композиція, спосіб, лікування, заміщені
Код посилання
<a href="https://ua.patents.su/22-48981-zamishheni-benzilaminopiperidini-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Заміщені бензиламінопіперидини, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Двокомпонентна композиція для стимуляції формування твердих структур кісток, в тому числі відновлення зубної емалі
Наступний патент: Бі-датчик контролю аварійного режиму роботи двох фільтрів-7
Випадковий патент: Електроакустичний перетворювач












