Спірооксетанові похідні урацилвмісних нуклеозидів
Номер патенту: 105790
Опубліковано: 25.06.2014
Автори: Тахрі Абделла, ван Хооф Стівен Моріс Пола, Ху Лілі, Йонкерс Тім Хьюго Марія, Рабуассон П'єр Жан-Марі Бернар, Вандік Кун
Формула / Реферат
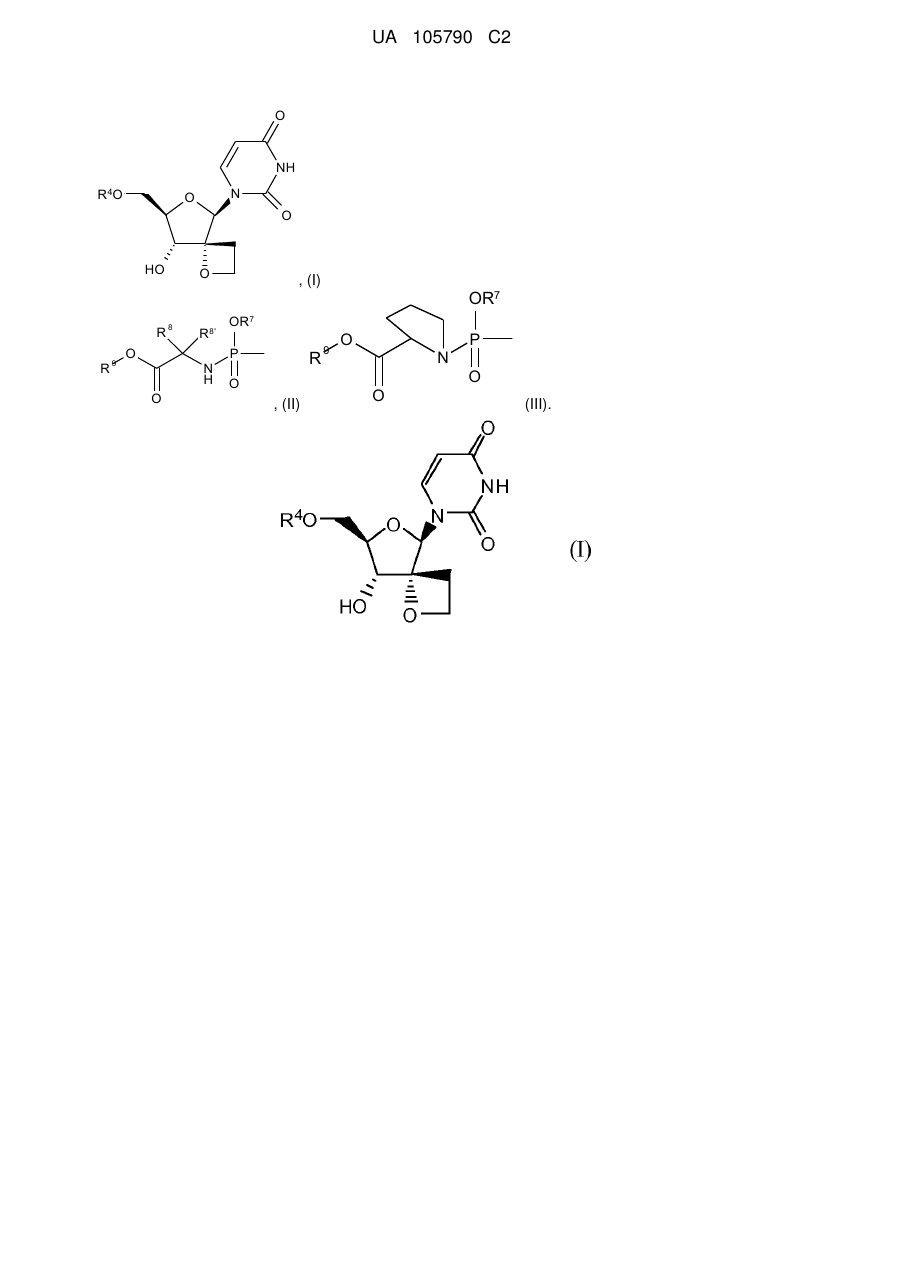
1. Сполука формули І:
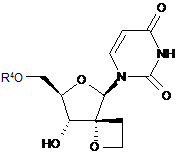 , (I)
, (I)
включаючи її будь-які можливі стереоізомери, де:
R4 є монофосфатною, дифосфатною або трифосфатною складноефірною групою; або R4 є групою формули
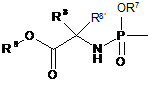 або
або  ;
;
R7 є фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, С3-С6алкенілу, C1-C6алкокси-, гідрокси- і аміногруп; або R7 є нафтилом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, С3-C6алкенілу, C1-C6алкокси-, гідрокси- і аміногруп; або R7 є індолілом, необов'язково заміщеним однією C1-C6алкілоксикарбонільною групою і, необов'язково, ще додатковими 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, С3-C6алкенілу, C1-C6алкокси-, гідрокси- і аміногруп;
R8 є воднем, C1-C6алкілом, бензилом або фенілом;
R8' є воднем, C1-C6алкілом, бензилом або фенілом; або
R8 і R8' разом з атомом вуглецю, до якого вони приєднані, утворюють С3-C7циклоалкіл;
R9 є С1-С10алкілом, С3-C7циклоалкілом або феніл-C1-C6алкілом, де фенільний фрагмент у фенілі або феніл-C1-C6алкілі необов'язково заміщений 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з гідрокси, C1-C6алкокси, аміно, моно- і діC1-C6алкіламіно;
або її фармацевтично прийнятна сіль або сольват.
2. Сполука за п. 1, де R4 є групою формули
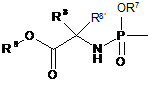 .
.
3. Сполука за будь-яким з пп. 1, 2, де R7 є фенілом, необов'язково заміщеним галогеном або однією або двома C1-C6алкільними групами, або R7 є нафтилом або індолілом.
4. Сполука за будь-яким з пп. 1, 2, де R7 є фенілом, необов'язково заміщеним галогеном або двома C1-C6алкільними групами, або R7 є нафтилом.
5. Сполука за будь-яким з пп. 1, 2, де R7 є фенілом або нафтилом.
6. Сполука за будь-яким з пп.1-5, де R8 є воднем, і R8' є воднем або C1-C6алкілом.
7. Сполука за будь-яким з пп. 1-6, де R8 є воднем, і R8' є метилом або етилом.
8. Сполука за будь-яким з пп. 1-7, де R9 є C1-C6алкілом або бензилом.
9. Сполука за будь-яким з пп. 1-7, де R9 є н-бутилом або бензилом.
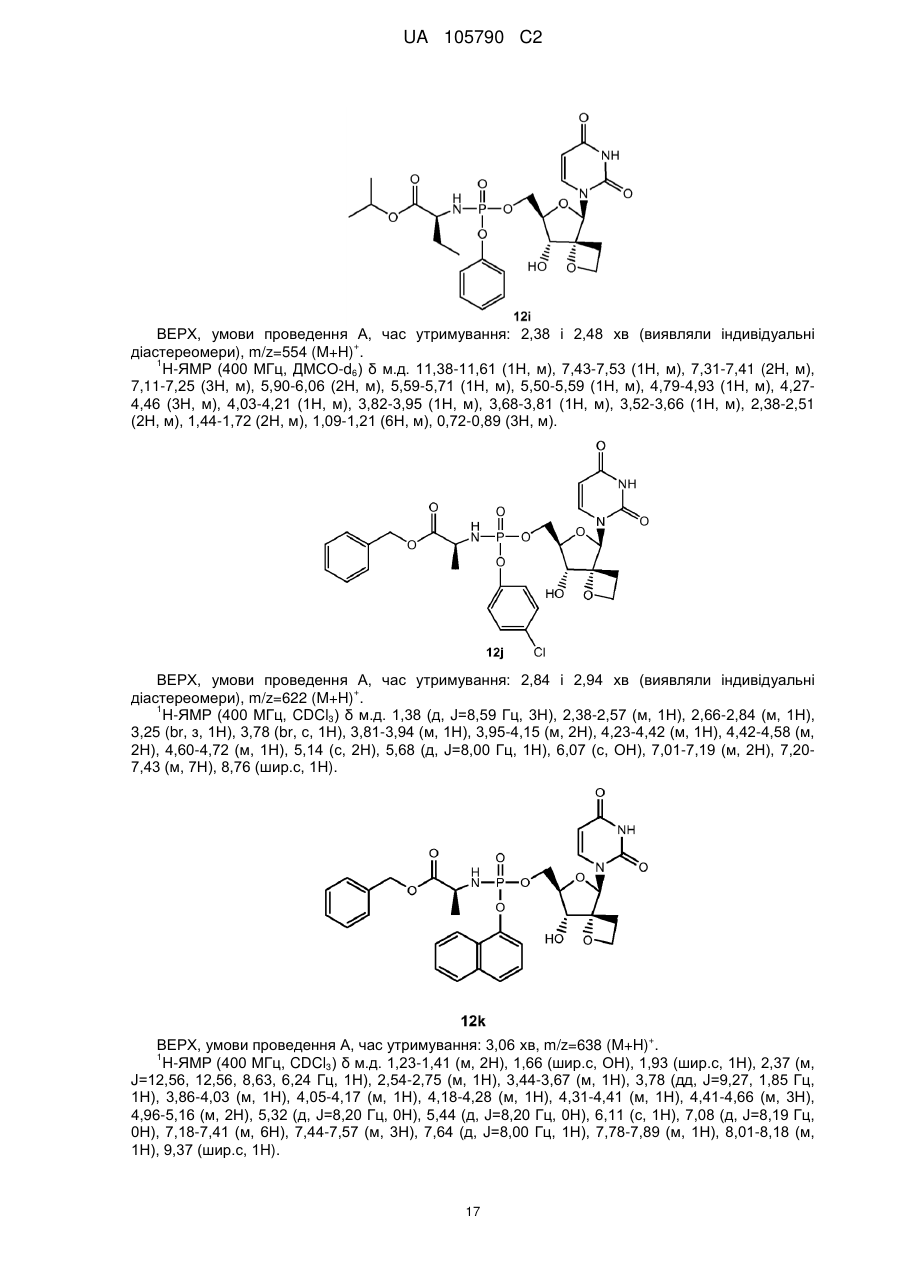
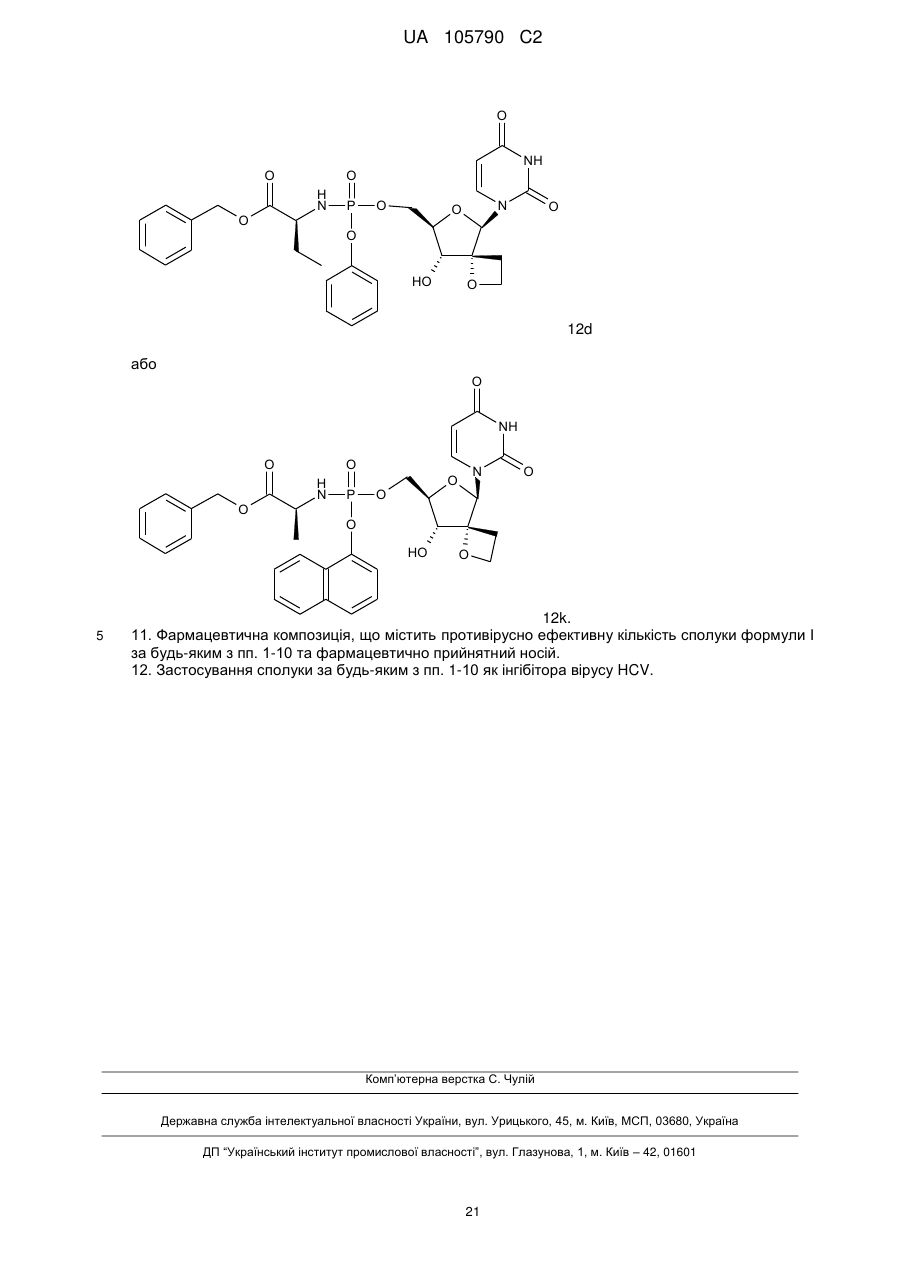
10. Сполука за п. 1, де сполука формули І є:
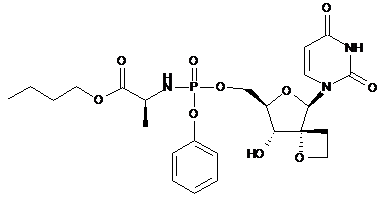 , 12a
, 12a
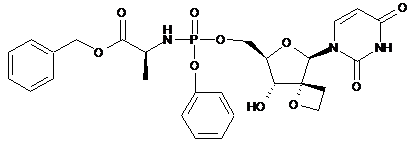 , 12с
, 12с
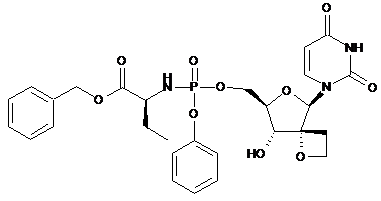 12d
12d
або
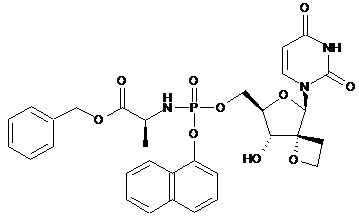 12k.
12k.
11. Фармацевтична композиція, що містить противірусно ефективну кількість сполуки формули І за будь-яким з пп. 1-10 та фармацевтично прийнятний носій.
12. Застосування сполуки за будь-яким з пп. 1-10 як інгібітора вірусу HCV.
Текст
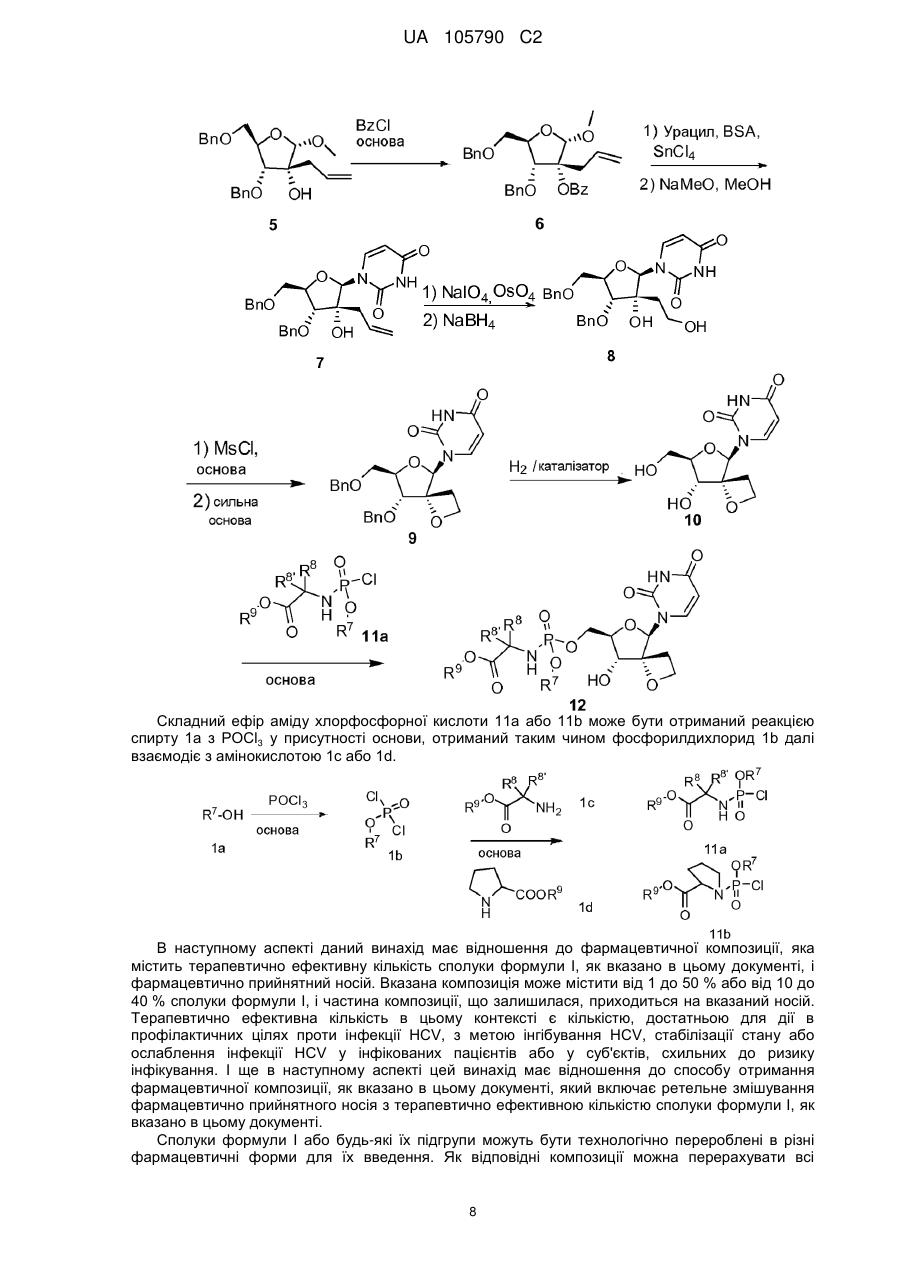
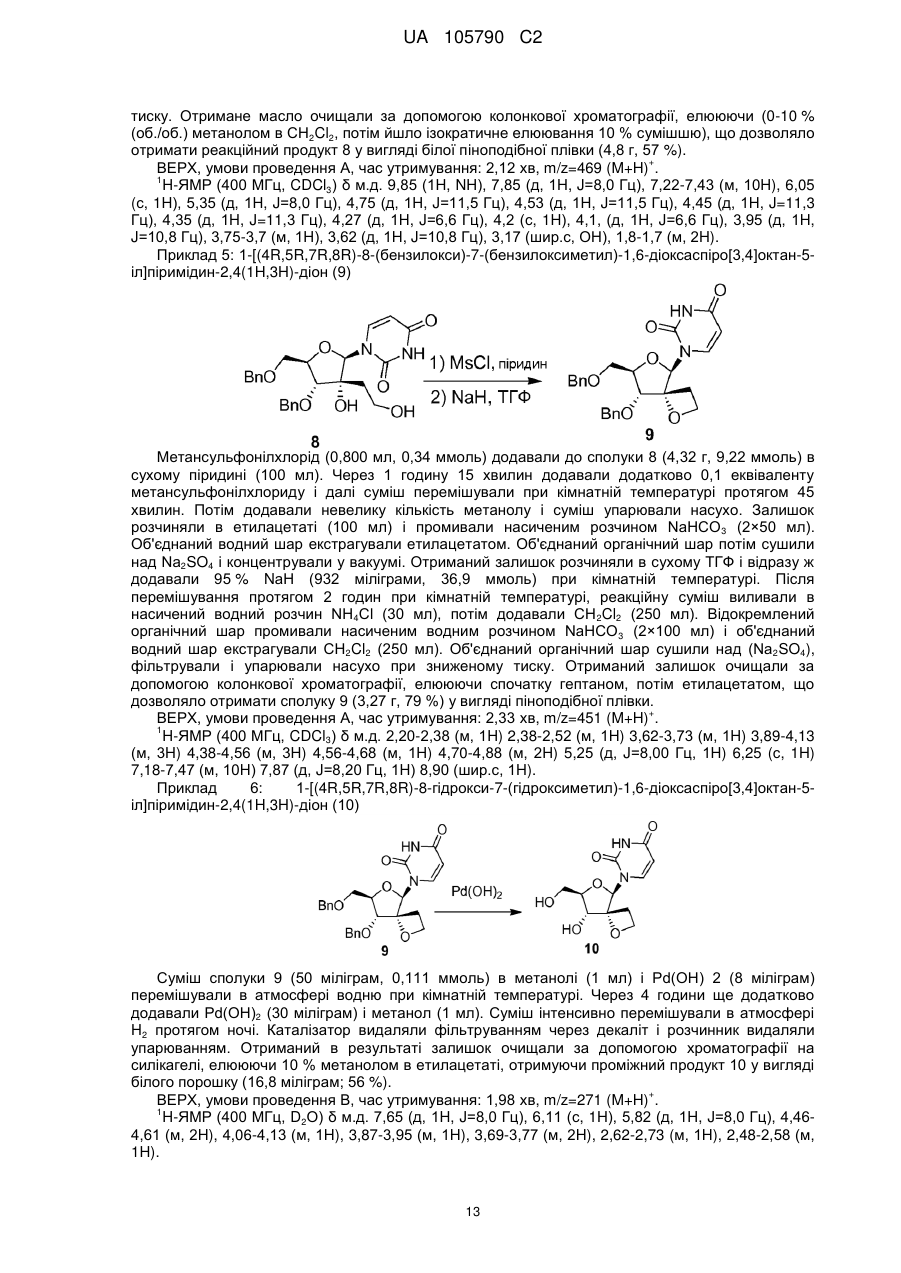
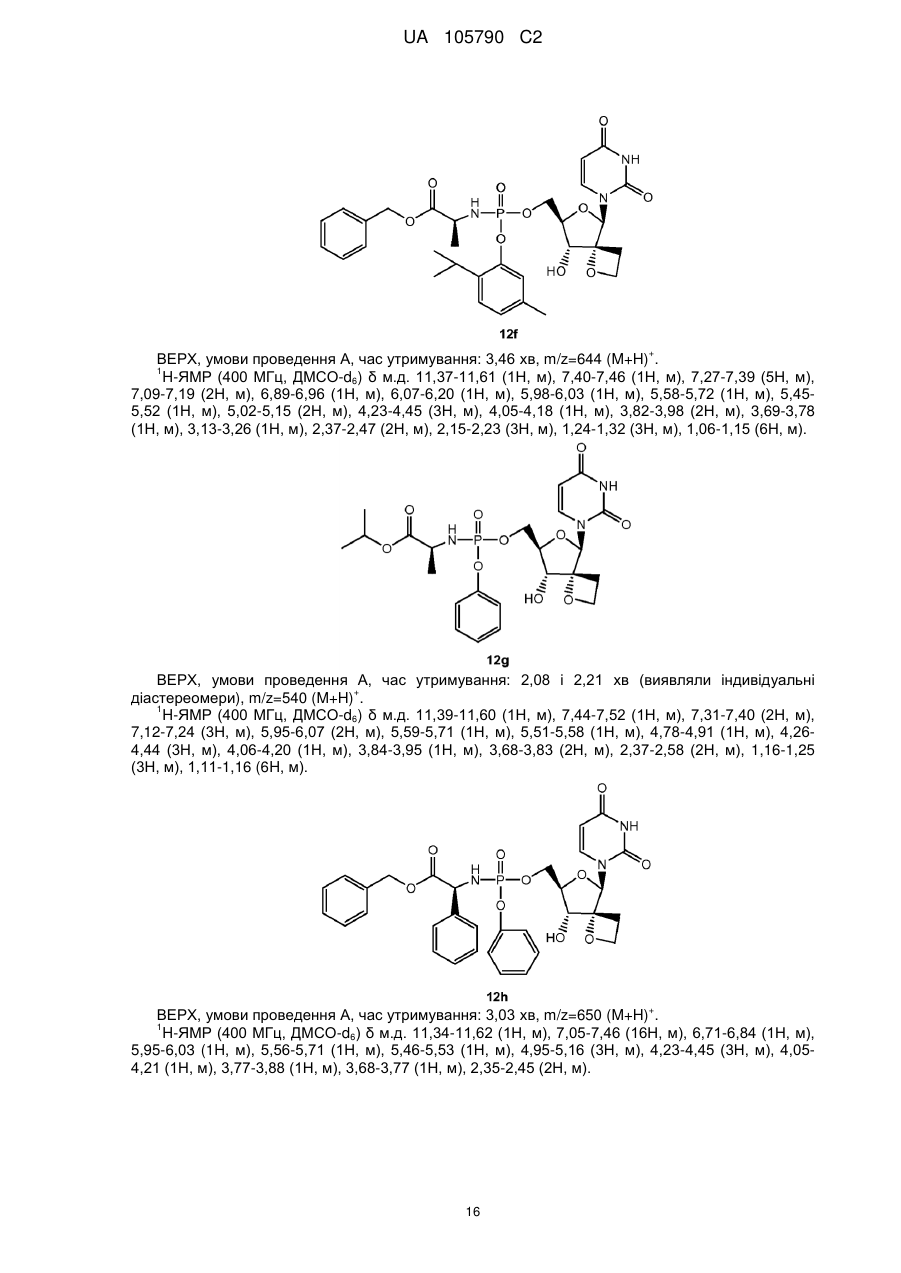
Реферат: 4 Описані сполуки формули (І), включаючи їх будь-які можливі стереоізомери, де: R є 4 монофосфатною, дифосфатною або трифосфатною складноефірною групою; або R є групою 7 формули (II) або формули (III), R є необов'язково заміщеним фенілом, необов'язково 8 8' заміщеним нафтилом або необов'язково заміщеним індолілом; R і R є воднем, С1-С6алкілом, 8 8' 9 бензилом або фенілом; або R і R утворюють С3-C7циклоалкіл; R є С1-С10алкілом, С3C7циклоалкілом, фенілом або феніл-C1-C6алкілом, де фенільний фрагмент у фенілі або фенілC1-C6алкілі необов'язково заміщений; або їх фармацевтично прийнятна сіль або сольват; технології отримання лікарських засобів і застосування сполук формули (І) як інгібіторів вірусу HCV. UA 105790 C2 (12) UA 105790 C2 O NH R4O N O O HO O , (I) OR7 R R 9 O 8 R8' N H O OR7 P R O , (II) 9 O N O P O (III). UA 105790 C2 Попередній рівень техніки Винахід відноситься до спірооксетанових похідних урацилвмісних нуклеозидів, які є інгібіторами вірусу гепатиту C (HCV). HCV представляє собою одноланцюговий (+) РНК вірус, що належить до родини вірусів Flaviviridae, до роду гепатовірусів. Фрагмент NS5B полігену РНК кодує РНК-залежну РНКполімеразу (RdRp), яка необхідна для реплікації вірусу. Як наслідок первинної гострої інфекції, у більшості інфікованих пацієнтів розвивається хронічний гепатит через те, що відбувається реплікація HCV переважно в гепатоцитах, але без очевидного цитопатичного прояву. Зокрема, недолік інтенсивної дії Т-лімфоцитів у відповідь і сильна схильність вірусу до мутації, очевидно, сприяють високій швидкості розвитку хронічного інфекційного процесу. Хронічний гепатит може розвиватися у фіброз печінки, що призводить до цирозу, кінцевої стадії захворювання печінки, та в HCC (гепатоклітинну карциному), що робить його основною причиною необхідності трансплантації печінки. Існує шість основних генотипів HCV і більше 50 підтипів, які географічно по-різному розподілені. HCV генотипу 1 є переважаючим генотипом в Європі і США. Екстенсивна генетична гетерогенність HCV обумовлює суттєві ускладнення при діагностиці та при вивченні симптомів перебігу хвороби, що можливо пояснює труднощі при створенні вакцини і недостатню дієвість терапії, що існує на даний час. Передача HCV може відбуватися при контакті із зараженою кров'ю або препаратами крові, наприклад, унаслідок переливання крові або внутрішньовенного застосування лікарського препарату. Впровадження діагностичних тестів, які застосовують при проведенні скринінгу крові, призводить до тенденції зниження числа випадків пост-інфузійного HCV. Не дивлячись на те, що забезпечується повільний розвиток кінцевої стадії захворювання печінки, існуючі інфекції будуть залишатися, представляючи собою серйозну медичну проблему та економічний тягар на десятиліття. Терапія HCV, що існує на даний час, базується на (пегильованому) інтерфероні-альфа (IFNα) в комбінації з рибавірином. Така комбінована терапія дає підтримуючий вірусологічний контроль у більш як 40 % пацієнтів, інфікованих HCV генотипу 1, і, приблизно, у 80 % пацієнтів, інфікованих HCV генотипів 2 та 3. Окрім обмеженої ефективності проти HCV генопипу 1, така комбінована терапія має суттєві побічні ефекти і погано переноситься багатьма пацієнтами. Більшість побічних ефектів включають подібні грипу симптоми, гематологічні порушення і психоневрологічні симптоми. Отже, існує потреба в більш ефективних, зручних та таких, що краще переносяться, методах лікування. Досвід застосування лікарських препаратів проти HIV, зокрема, інгібіторів HIV протеази, показує, що недостатньо оптимальна фармакокінетика і складний режим дозування негайно призводять до ненавмисних невдач в дотриманні терапевтичних рекомендацій. Це, у свою чергу, означає, що на 24 годині сама нижча точка концентрації (мінімум концентрації в плазмі) для відповідних лікарських препаратів при HIV стані часто опускається нижче IC 90 або ED90 граничної величини для більшої частини доби. Слід приняти до уваги, що на 24 годині самий нижчий рівень значень, принаймні, для IC 50, і реальніше, для IC90 або ED90, дуже важливий для стримування прояву мутантів, які "ухилилися" від лікарського препарату. Досягнення необхідної фармакокінетики і метаболізму лікарського препарату, які забезпечують такі самі нижчі рівні значень, визначають точні перспективи дизайну лікарського препарату. RdRp, що кодується фрагментом NS5B, є суттєвим для реплікації одноланцюгової (+) РНК HCV геному. Цей фермент викликає особливий інтерес у фахівців в області медичної хімії. Відомі як нуклеозидні, так і ненуклеозидні інгібітори NS5B. Нуклеозидні інгібітори можуть діяти як термінатор ланцюга біосинтезу або як конкурентний інгібітор, або обома способами. Щоб бути активними, нуклеозидні інгібітори повинні поглинатися клітиною і перетворюватися in vivo в трифосфати. Це перетворення в трифосфати звичайно здійснюється за допомогою клітинних кіназ, які привносять додаткові структурні вимоги до потенційного інгібітору нуклеозидної полімерази. Крім того, це обмежує пряму оцінку нуклеозидів в якості інгібіторів реплікації HCV при випробуваннях на клітинах, здатних до фосфорилювання in situ. Декілька спроб було зроблено для виявлення нуклеозидів, які є інгібіторами HCV RdRp, але, не дивлячись на те, що для невеликої кількості сполук почали проводити клінічні випробування, жодна сполука не пройшла до кінця реєстрації. У числі проблем, із-за яких нуклеозиди, які мають своєю мішенню HCV, стикаються з труднощами їх просування, представляються наступні: токсичність, мутагенність, відсутність селективності, низька ефективність, низька біологічна доступність, недостатньо оптимальні режими дозування і великі маса пігулки і вартість товару, що виходять в результаті. 1 UA 105790 C2 Існує потреба в інгібіторах HCV, які можуть подолати недоліки терапії HCV, яка існує на даний час, такі, як побічні ефекти, обмежена ефективність, виникнення стійкості і відсутність дотримання режиму терапії, а також і сприяти стійкій вірусологічній відповіді. Даний винахід відноситься до групи інгібуючих HCV похідних 1-(8-гідрокси-7-(гідроксиметил)1,6-діоксаспіро[3.4]октан-5-іл)піримідин-2,4-діону з корисними властивостями, що стосуються одного або декількох нижченазваних параметрів: антивірусна ефективність, сприятливий профіль розвитку стійкості, відсутність токсичності і генотоксичності, придатна фармакокінетика і фармакодинаміка, і простота приготування препарату і введення. Спірооксетанові похідні нуклеозидів, а саме, 1-(2-O,2-C-етано-β-D-рибофуранозил)тимін і 1-(2-O,2-C-етано-β-Dрибофуранозил)урацил, описані в Org. Biomol. Chem., 2003, 3514-3526. Ці сполуки тестували проти HIV, але не було виявлено активності. Сполуки винаходу також можуть бути перспективні завдяки тому факту, що у них відсутня активність проти інших вірусів, а саме, проти HIV. HIV-інфіковані пацієнти часто страждають від супутніх інфекцій, таких як HCV. Лікування таких пацієнтів за допомогою інгібітору HCV, який також інгібує і HIV, може призвести до появи стійких до HIV штамів. Опис суті винаходу В одному аспекті даний винахід відноситься до сполук, які можуть бути представлені формулою I: включаючи будь-які їх можливі стереоізомери, де: 4 4 R є монофосфатною, дифосфатною або трифосфатною складноефірною групою; або R є групою формули або 7 R є фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, С1-С6алкілу, С3-С6алкенілу, С1-С6алкокси-, гідрокси- і 7 аміно-груп; або R є нафтилом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, С1-С6алкілу, С3-С6алкенілу, С1-С6алкокси-, 7 гідрокси- і аміно-груп; або R є індолілом, необов'язково заміщеним однією С1-С6алкілоксикарбонільною групою і, необов'язково, ще додатковими 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, С1-С6алкілу, С3-С6алкенілу, С1-С6алкокси-, гідрокси- і аміно-груп; 8 R є воднем, С1-С6алкілом, бензилом або фенілом; 8 R ' є воднем, С1-С6алкілом, бензилом або фенілом; або 8 8 R і R ' разом з атомом вуглецю, до якого вони приєднані, утворюють С3-С7циклоалкіл; 9 R є C1-C10алкілом, C3-C7циклоалкілом, фенілом або феніл-C1-C6алкілом, де фенільний фрагмент, у фенілі або феніл-C1-C6алкілі, є необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з гідрокси, C1-C6алкокси, аміно, моно- і диC1-C6алкіламіно; або до їх фармацевтично прийнятних солей або сольватів. Додатково, в іншому аспекті винахід стосується застосування сполук формули I, як вказано в цьому документі, для інгібування HCV. Альтернативно передбачається застосування для виробництва лікарського засобу сполуки формули I, як вказано в цьому документі; для інгібування HCV. 8 Група -NH-C(R8)(R ')-C(=O) - може утворити амінокислотний залишок, який включає природні і неприродні амінокислотні залишки. Переважно цікавими є гліцин (Gly) і 8 диметилгліцин (Dmg). Також представляють інтерес такі амінокислотні залишки, в яких R ' є 8 воднем. Коли в останньому випадку R відмінний від водню, амінокислотний залишок має 2 UA 105790 C2 хіральний центр і конфігурація при асиметричному атомі вуглецю може відповідати Lамінокислоті. Приклади включають залишки аланіну (Ala), валіну (Val), ізолейцину (Ile) αамінобутанової кислоти (ABA, так званої як 2-аміномасляної кислоти або етилгліцину), фенілаланіну (Phe) та фенілгліцину (Phg), а саме, L-Ala, L-Val, L-Ile, L-ABA, L-Phe і L-Phg. 8 8 Прикладом амінокислотного залишку, в якому R і R ' разом з атомом вуглецю, до якого вони приєднані, утворюють C3-C7циклоалкіл, є залишок 1,1-циклопропіламінокислоти. Аналогічно, група утворює залишок проліну, переважно, залишок L-проліну. Підгрупи сполук формули I представляють собою такі сполуки формули I або підгрупи 4 сполук формули I, як визначено в цьому документі, в яких R є групою формули . Підгрупи сполук формули I представляють собою такі сполуки формули I або підгрупи сполук формули I, як визначено в цьому документі, в яких: 7 (a) R є фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, C3-C6алкенілу, C1-C6алкокси-, гідрокси- і 7 аміно-груп; або R є нафтилом, необов'язково заміщеним галогеном, C1-C6алкілом або 7 C1-C6алкоксигрупою; або R є індолілом; 7 (b) R є фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, C3-C6алкенілу, C1-C6алкокси-, гідрокси- і 7 7 аміно-груп; або R є нафтилом; або R є індолілом; 7 (c) R є фенілом, необов'язково заміщеним 1 або 2 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, C3-C6алкенілу, C1-C6алкокси-, гідрокси- і 7 7 аміно-груп; або R є нафтилом; або R є індолілом; 7 (d) R є фенілом, необов'язково заміщеним 1 або 2 замісниками, кожен з яких, незалежно 7 один від одного, вибирають з галогену, C1-C6алкілу, C3-C6алкенілу і C1-C6алкоксигрупи, або R є нафтилом; 7 (e) R є фенілом, необов'язково заміщеним галогеном або 1 або 2 C1-C6алкільними 7 радикалами, або R є нафтилом; 7 (f) R є фенілом, галогенфенілом, диC1-C4алкілфенілом або нафтилом; 7 (g) R є фенілом; 7 (h) R є нафтилом; 7 (i) R є 5-індолілом. 7 В одному варіанті здійснення винаходу R є індолілом, необов'язково заміщеним на його атомі азоту однією C1-C6алкілоксикарбонільною групою і, необов'язково, заміщеним на його вуглецевих атомах додатковими 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, C3-C6алкенілу, C1-C6алкокси-, гідрокси- і аміно-груп. 7 У наступному далі варіанті здійснення винаходу група R , будучи індолілом в сполуках 7 формули I або в будь-яких сполуках їх підгрупи, є 5-індолілом, або група R , будучи N-C1-C6алкілоксикарбоніліндолілом, є N-трет-бутилоксикарбоніл-5-індолілом, а саме, N-третбутилоксикарбоніл-5-індолілом. Індолільна група, в тому випадку, коли вона приєднана по 5положенню, може бути представлена таким чином: 7a 7a , де R є воднем або C1-C6алкілоксикарбонілом, або, зокрема, R є 7a воднем, C1-C4алкілоксикарбонілом, або, в ще більш окремому випадку, R є воднем або третбутилоксикарбонілом. В наступному далі варіанті здійснення винаходу група індолілу в сполуках 7a формули I або в будь-яких сполуках їх підгрупи, є 5-індолілом (тобто де R є воднем). Підгрупи сполук формули I представлені такими сполуками формули I або підгрупами сполук формули I, як визначено в цьому документі, в яких 8 8 (a) R є метилом і R ' є метилом; або 3 UA 105790 C2 8 8 (b) R є воднем і R ' є фенілом, C1-C6алкілом або C1-C4алкілом, таким як метил, етил, ізопропіл або ізобутил. Підгрупи сполук формули I є такими сполуками формули I або підгрупами сполук формули I, як визначено в цьому документі, в яких фрагмент є гліцилом, диметилгліцилом, α-амінобутирилом, фенілгліцином, ізолейцилом, аланілом, фенілаланілом або валілом (відповідно, Gly, Dmg, ABA, Phg, Ile, Ala, Phe або Val; а саме, L-ABA, L-Phg, L-Ile, L-Ala, L-Phe або L-Val). Підгрупи сполук формули I представлені такими сполуками формули I або підгрупами 8 сполук формули I, як визначено в цьому документі, в яких R є воднем, C1-C6алкілом, бензилом 8 або фенілом; і R ' є воднем, C1-C6алкілом, бензилом або фенілом. Підгрупи сполук формули I представлені такими сполуками формули I або підгрупи сполук формули I, як визначено в цьому документі, в яких фрагмент 8 8 має структуру у якій R є воднем і R ' є воднем, фенілом, C1-C6алкілом, бензилом; або 8 8 R є воднем і R ' є воднем або C1-C6алкілом; 8 8 R є воднем і R ' є C1-C2алкілом; 8 8 R є воднем і R ' є метилом. 8 8 В одному варіанті здійснення винаходу R і R ' разом з атомом вуглецю, до якого вони приєднані, утворюють C3-C7циклоалкіл; або, зокрема, утворюють C3-C4циклоалкіл; або, зокрема, утворюють циклопропіл. Підгрупи сполук формули I представлені такими сполуками формули I або підгрупами сполук формули I, як визначено в цьому документі, в яких 9 (a) R є C1-C6алкілом, бензилом або фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з гідрокси, C1-C6алкокси, аміно, моно- і диC1-C6алкіламіно-груп; 9 (b) R є C1-C6алкілом або бензилом; 9 (c) R є C1-C6алкілом; 9 (d) R є C1-C4алкілом; 9 (e) R є метилом, етилом або трет-бутилом; 9 (f) R є C3-C7циклоалкілом. Представляють інтерес сполуки 12a, 12b, 12c, 12d, 12e, 12f, 12g, 12h, 12i, 12j, 12k, 12l, 12m, згадані в розділі "Приклади", а також і фармацевтично прийнятні кислотно-аддитивні солі цих сполук. Особливий інтерес представляють сполуки 12a, 12c, 12d і 12k, або у вільній формі (тобто не у формі солі) цих сполук, або у вигляді їх фармацевтично прийнятних кислотноаддитивних солей. Сполуки формули I мають декілька центрів хіральності, а саме, при атомах вуглецю 1', 3' і 4'. Не дивлячись на те, що стереохімія у цих атомів вуглецю визначена, сполуки можуть демонструвати, принаймні, 75 %, переважно, принаймні, 90 %, а також на додаток до 95 % або до 98 %, енантіомерної чистоти для кожного хірального центру. 4 UA 105790 C2 4 Хіральність також може мати місце в замісниках, таких, для яких R є , який 8 8 8 може мати хіральність у атома вуглецю, який несе R (коли R і R ' різні), і у атома фосфору. Фосфорний хіральний центр може бути представлений як RР або як SР, або як суміш таких стереоізомерів, включаючи рацемати. Діастереомери, походження яких можливе в результаті наявності хірального фосфорного центру і хірального атома вуглецю, також можуть існувати. Додатково, в іншому аспекті винахід представляє сполуку формули I або її фармацевтично прийнятну сіль, гідрат або сольват для застосування при лікуванні або профілактиці (або у виробництві лікарського засобу для лікування або профілактики) HCV інфекції. Типові генотипи HCV в контексті лікування або профілактики, відповідно до винаходу, включають генотип 1b (переважаючий в Європі) або 1a (переважаючий в Північній Америці). Винахід також представляє спосіб лікування або профілактики HCV інфекції, а саме, для випадків генотипу 1a або 1b. Сполуки формули I представлені у вигляді конкретного стереоізомера, за винятком стереоізомеризації при фосфорному атомі фосфорамідатної групи. Абсолютну конфігурацію таких сполук можна визначити, використовуючи способи, відомі в даній області техніки, такі як, наприклад, дифракція рентгенівських променів або ЯМР, та/або по причетності до вихідних речовин з відомою стереохімією. Фармацевтичні композиції, відповідно до винаходу, переважно будуть включати стереоізомерно чисті форми вказаного стереоізомера індивідуальної сполуки формули I. Стереоїзомерно чисті форми сполук і проміжних продуктів, які згадуються в цьому документі, визначаються як ізомери, по суті вільні від інших енантіомерних або діастереомерних форм таких же базових молекулярних структур вказаних сполук або проміжних продуктів. А саме, термін "стереоізомерно чисті" має відношення до сполук або до проміжних продуктів, які мають стереоізомерний надлишок, принаймні, від 80 % (тобто мінімум 90 % одного ізомеру і максимум 10 % інших можливих ізомерів) і до стереоізомерного надлишку 100 % (тобто 100 % одного ізомеру і повна відсутність інших), конкретніше, має відношення до сполук або до проміжних продуктів, які мають стереоізомерний надлишок від 90 і до 100 %, ще конкретніше, до тих, що мають стереоізомерний надлишок від 94 і до 100 %, і найконкретніше, до тих, що мають стереоізомерний надлишок від 97 і до 100 % або від 98 до 100 %. Терміни "енантіомерно чисті" і "діастереоізомерно чисті" слід розуміти аналогічним чином, але в такому разі як такі, що мають відношення до енантіомерного надлишку і до діастереоізомерного надлишку, відповідно, при аналізі суміші. Чисті стереоізомерні форми сполук і проміжних продуктів цього винаходу можуть бути отримані за допомогою застосування методик, відомих в даній області техніки. Наприклад, енантіомери можуть бути відокремлені один від одного за допомогою селективної кристалізації їх діастереомерних солей з оптично активними кислотами або основами. Їх приклади представляють собою винну кислоту, дибензоїлвинну кислоту, дитолілвинну кислоту та камфорсульфонову кислоту. Альтернативно, енантіомери можуть бути розділені хроматографічними методами з використанням хіральних нерухомих фаз. Вказані хімічно чисті стереоізомерні форми також можуть бути отримані з відповідних хімічно чистих стереоізомерних форм підібраних вихідних речовин, за умови, що реакція протікає стереоспецифічно. Переважно, в тому випадку, коли необхідно отримати певний стереоізомер, вказану сполуку синтезують за допомогою стереоспецифічних способів отримання. Для цих способів переважно використовувати енантіомерно чисті вихідні речовини. Діастереомернірацемати сполук формули I можуть бути отримані в розділеному вигляді за допомогою загальноприйнятих способів. Відповідні фізичні способи розділення, які успішно можуть бути використані, представлені, наприклад, селективною кристалізацією і хроматографією, наприклад, колонковою хроматографією. Фармацевтично прийнятні кислотно-аддитивні солі включають терапевтично активні нетоксичні форми сполук формули I, отримані у вигляді кислотно-аддитивних солей або основно-аддитивных солей. Представляють інтерес і вільні, тобто несольові форми сполук формули I або будь-якої підгрупи сполук формули I, вказаних в цьому документі. Фармацевтично прийнятні кислотно-аддитивні солі можуть бути зазвичай отримані за допомогою обробки основної форми відповідною кислотою. Відповідні кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад, хлористоводнева або бромистоводнева кислота, сірчана, азотна, фосфорна і подібні до них кислоти; або органічні кислоти, такі як, наприклад, оцетова, пропіонова, гідроксиоцтова, молочна, піровиноградна, щавлева (тобто етандіова), малонова, янтарна (тобто бутандіова кислота), 5 UA 105790 C2 малеїнова, фумарова, яблучна (тобто гідроксибутандіова кислота), винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова кислота, саліцилова, п-аміносаліцилова, памова кислота і подібні до них кислоти. І навпаки, вказані сольові форми при обробці відповідною основою можуть бути перетворені у вільні основні форми. Сполуки формули I, які містять кислотний протон, можуть також бути перетворені в їх нетоксичні аддитивні сольові форми металу або аміну за допомогою обробки відповідними органічними або неорганічними основами. Відповідні основні сольові форми включають, наприклад, амонійні солі, солі лужного або лужноземельного металу, наприклад, літієві, натрієві, калієві, магнієві, кальцієві солі і подібні до них, солі з органічними основами, наприклад, бензатинові, N-метил-D-глюкамінові, гідрабамінові солі і солі з амінокислотами, такими як, наприклад, аргінін, лізин і подібні до них. Термін "сольвати" охоплює будь-які фармацевтично прийнятні сольвати, які сполуки формули I, а також і їх солі здатні утворити. Такі сольвати представлені, наприклад, гідратами, алкоголятами, наприклад, етанолятами, пропанолятами і подібними до них. Деякі сполуки формули I також можуть існувати у вигляді їх таутомерних форм. Наприклад, таутомерні форми амідних груп (-C(=O)-NH-) представляють собою іміноспирти (-C(ОН)=N-), які можуть стати стабільнішими в кільцевих структурах ароматичного характеру. Урідінова основа є прикладом такої форми. Такі форми, не дивлячись на те, що вони точно не вказані в структурних формулах, представлених в цьому документі, маються на увазі включеними в об'єм даного винаходу. Як використовується в цьому документі, "C1-C4алкіл", як група або частина групи, означає насичені лінійні або з розгалуженим ланцюгом вуглеводневі радикали, які мають від 1 до 4 атомів вуглецю, такі як, наприклад, метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-1пропіл, 2-метил-2-пропіл. "C1-C6алкіл" охоплює C1-C4алкільні радикали і їх більш високі гомологи, що мають 5 або 6 атомів вуглецю, такі як, наприклад, 1-пентил, 2-пентил, 3-пентил, 1гексил, 2-гексил, 2-метил-1-бутил, 2-метил-1-пентил, 2-етил-1-бутил, 3-метил-2-пентил і подібні до них. Серед C1-C6алкілів представляють інтерес C1-C4алкіли. "C1-C10алкіл" охоплює C1-C6алкільні радикали і їх більш високі гомологи, що мають 7, 8, 9 або 10 атомів вуглецю, такі як, наприклад, гептил, 2-гептил, 3-гептил, 2-метилгексил, октил, 2-октил, 3-октил, ноніл, 2-ноніл, 3-ноніл, 2-бутилпентил, децил, 2-децил і подібні до них. Серед C1-C10алкілів представляють інтерес C1-C6алкіл, C1-C2алкіл, що позначаються як метил та етил. "C1-C6алкокси" означає радикал -O-C1-C6алкіл, в якому C1-C6алкіл є таким, як визначено вище. Приклади C1-C6алкокси є метокси, етокси, н-пропокси або ізопропокси. "C3-C6циклоалкіл" включає циклопропіл, циклобутил, циклопентил і циклогексил. Особливий інтерес представляє циклопропіл. Термін "C3-C6алкеніл", як група або частина групи, означає насичені лінійні і з розгалуженим ланцюгом вуглеводневі радикали, які мають насичені вуглець-вуглецеві зв'язки і, принаймні, один подвійний зв'язок, і які мають від 3 до 6 атомів вуглецю, такі як, наприклад, 1-пропеніл, 2пропеніл (або аліл), 1-бутеніл, 2-бутеніл, 3-бутеніл, 2-метил-2-пропеніл, 2-пентеніл, 3-пентеніл, 2-гексеніл, 3-гексеніл, 4-гексеніл, 2-метил-2-бутеніл, 2-метил-2-пентеніл і подібні до них. Серед C3-C6алкенілів представляє інтерес C3-C4алкеніл. Серед C3-C6алкенілів або C3-C4алкенілів представляють інтерес такі радикали, які мають один подвійний зв'язок. Термін "галоген" є загальним для фтору, хлору, брому і йоду. В одному варіанті здійснення винаходу термін "феніл-C1-C6алкіл" є бензилом. Як використовується в цьому документі, термін ‘(=O)’ або "оксо" утворює карбонільний фрагмент в тому випадку, коли він приєднаний до вуглецевого атома. Слід зауважити, що атом може бути заміщений оксо-группою лише коли валентність цього атома дає таку можливість. Термін "монофосфатний, дифосфатний або трифосфатний складний ефір" відноситься до груп: , , . В тому випадку, коли положення радикала в молекулярному фрагменті не визначене (наприклад, замісник у фенілі) або представлене зв'язками, жорстко не закріпленими, тоді такий радикал може бути розташований на будь-якому атомі такого фрагмента, якщо структура, що виходить в результаті, є хімічно стабільна. В тому випадку, коли можливість зміни розташування в молекулі присутня більш ніж в одному варіанті, тоді кожне конкретне розташування забезпечується незалежно. 6 UA 105790 C2 Кожний раз, коли він використовується в цьому документі, термін "сполуки формули I" або "представлені тут сполуки" або аналогічні терміни, мається на увазі, що він включає сполуки формули I, включаючи можливі стереоізомерні хімічні форми і їх фармацевтично прийнятні солі і сольвати. Даний винахід також включає ізотопномічені сполуки формули I або будь-якої підгрупи формули I, в яких один або декілька атомів замінено на ізотоп, що відрізняється від такого 2 звичайного, виявленого в природі. Приклади таких ізотопів включають ізотопи водню, такі як H і 3 11 13 14 13 15 15 17 18 H; вуглецю, такі як C, C і C; азоту, такі як N і N; кисню, такі як O, O і O; фосфору, 31 32 35 18 36 75 такі як P і P, сірки, такий як S; фтору, такий як F; хлору, такий як Cl; брому, такі як Br, 76 77 82 123 124 125 131 Br, Br і Br; і йоду, такі як I, I, I і I. Ізотопномічені сполуки винаходу можуть бути отримані за допомогою таких способів, які аналогічні способам, описаним в цьому документі, при використанні відповідних ізотопномічених реагентів або вихідних речовин, або за допомогою методик, відомих в даній області техніки. Вибір ізотопу, що включається в ізотопномічені сполуки, залежить від конкретного застосування цієї сполуки. Наприклад, для проведення біологічних випробувань розподілу в тканинах використовують включення таких 3 14 радіоактивних ізотопів, як H або C. Для приладів, які отримують зображення за рахунок 11 радіоактивного випромінювання, буде придатний позитрон-випромінюючий ізотоп, такий як C, 18 13 15 F, N або O. Включення дейтерію може забезпечити велику метаболічну стабільність, що призводить в результаті, наприклад, до зростання in vivo періоду напіввиведення сполуки або до зниження необхідного дозування. Методики синтезу Вихідна речовина 1-[(4R, 5R, 7R, 8R)-8-гідрокси-7-(гідроксиметил)-1,6-діокса-спіро[3.4]октан5-іл]піримідин-2,4(1Н, 3H)-діон 10 може бути отриманий описаним нижче шляхом. Проміжний продукт 4 може бути отриманий, як описано в Org. Lett., 2007, 9, 3009-3012, і введений в реакцію з аллилмагнійбромідом, з отриманням проміжного продукту 5. Гідроксильна група в останньому бензоїлюється за допомогою бензоілхлориду у присутності основи, наприклад, триалкіламіну, такого як триетиламін або N,N-диметилпіридин-4-амін (DMAP), в результаті виходить проміжний продукт 6. Останній проміжний продукт активують за допомогою кислоти Л'юіса, а саме, за допомогою SnCl4, і вводять в реакцію з силільованим урацилом, отриманим, наприклад, при реакції урацила з N,O-біс[триметилсиліл]ацетамідом (BSA). Ця реакція призводить до проміжного продукту 7, в якому подвійний зв'язок в аллильній групі окислюють до альдегіду тетраоксидом осмію у присутності перйодату, цей альдегід згодом відновлюють до відповідного спирту 8. Мезилювання останнього за допомогою мезилхлориду у присутності основи, наприклад, піридину, з подальшою обробкою сильною основою, такою як гідрид натрію, в результаті призводить до утворення оксетану. Видалення бензильних груп з 9, наприклад, за допомогою водню у присутності каталізатора на основі благородного металу, наприклад, гідроксиду паладію, призводить до отримання проміжного продукту 10. Останній може бути введений в реакцію зі складним ефіром аміду хлорфосфорної кислоти 11a або 11b у присутності основи, наприклад, N-метилиімідазолу (NMI). або. Вищеописані реакції ілюстративно представлені на схемі, приведеній нижче. 7 UA 105790 C2 Складний ефір аміду хлорфосфорної кислоти 11а або 11b може бути отриманий реакцією спирту 1a з POCl3 у присутності основи, отриманий таким чином фосфорилдихлорид 1b далі взаємодіє з амінокислотою 1c або 1d. В наступному аспекті даний винахід має відношення до фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки формули I, як вказано в цьому документі, і фармацевтично прийнятний носій. Вказана композиція може містити від 1 до 50 % або від 10 до 40 % сполуки формули I, і частина композиції, що залишилася, приходиться на вказаний носій. Терапевтично ефективна кількість в цьому контексті є кількістю, достатньою для дії в профілактичних цілях проти інфекції HCV, з метою інгібування HCV, стабілізації стану або ослаблення інфекції HCV у інфікованих пацієнтів або у суб'єктів, схильних до ризику інфікування. І ще в наступному аспекті цей винахід має відношення до способу отримання фармацевтичної композиції, як вказано в цьому документі, який включає ретельне змішування фармацевтично прийнятного носія з терапевтично ефективною кількістю сполуки формули I, як вказано в цьому документі. Сполуки формули I або будь-які їх підгрупи можуть бути технологічно перероблені в різні фармацевтичні форми для їх введення. Як відповідні композиції можна перерахувати всі 8 UA 105790 C2 композиції, які зазвичай вживаються для лікарських засобів, що вводяться систематично. Для отримання фармацевтичних композицій цього винаходу ефективну кількість індивідуальної сполуки, необов'язково у вигляді сольової форми або металокомплексу, в якості активного інгредієнту об'єднують з фармацевтично прийнятним носієм, який додають шляхом ретельного змішування, причому цей носій може бути в широко різноманітних формах, залежно від форми лікарського засобу, необхідної для введення. Такі фармацевтичні композиції бажані у вигляді одиничної дозованої форми, зручної, зокрема, для перорального, ректального, черезшкірного введення або для парентеральної ін'єкції. Наприклад, при отриманні композицій у вигляді дозованої форми для перорального введення можна застосовувати будь-яке загальноприйняте фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти і подібні до них, в разі прероральних рідких препаратів, таких як суспензії, сиропи, еліксири, емульсії і розчини; або тверді носії, такі як крохмалі, цукри, каолін, лубриканти, звязуючі речовини, дезинтегруючі агенти і подібні до них - у випадку порошків, пілюль, капсул і пігулок. Із-за простоти їх введення пігулки і капсули представляють собою пероральні одиничні дозовані форми, які мають найбільшу перевагу, для яких природно застосовуються тверді фармацевтичні носії. Для парентеральних композицій носій, як правило, буде включати стерильну воду, принаймні, в якості найбільшої своєї складової, проте можуть бути включені й інші інгредієнти, наприклад, для збільшення солюбілізації. Розчини для ін'єкцій, наприклад, можуть бути виготовлені таким чином, що в них носій включає сольовий розчин, розчин глюкози або суміш розчину сольового і розчину глюкози. Суспензії для ін'єкцій також можуть бути отримані, в цьому випадку можуть застосовуватися відповідні рідкі носії, суспендуючі агенти, і подібні до них речовини. Також враховуються тверді форми препаратів, призначені для перетворення на рідку форму препарату безпосередньо перед вживанням. У композиціях, придатних для введення через шкіру, носій необов'язково включає речовину, що збільшує проникнення, і відповідний зволожуючий агент, необов'язково об'єднаний з відповідними допоміжними речовинами будьякої природи при їх невеликому кількісному вмісті, причому ці допоміжні речовини не додають вираженої шкідливої дії на шкіру. Сполуки даного винаходу можуть також вводитися за допомогою пероральної інгаляції або інсуффляції у формі розчину, суспензії або сухого порошку з використанням будь-якої системи доставки відповідно до відомого рівня техніки. Особливо переважною представляється розробка технології отримання вищезазначених фармацевтичних композицій у вигляді одиничної дозованої форми для простоти введення і для рівномірності дозування. Одинична дозована форма, як використовується в цьому документі, означає фізично дискретні одиниці, придатні в якості унітарних дозувань, причому кожна одиниця містить заздалегідь визначену кількість активного інгредієнта, розраховану, щоб викликати необхідний терапевтичний ефект у поєднанні з відповідним фармацевтичним носієм. Приклади таких одиничних дозованих форм представлені пігулками (включаючи пігулки з насічкою або покриті оболонкою пігулки), капсулами, пілюлями, суппозиторіями, пакетиками з порошком, пластинками, розчинами або суспензіями для ін'єкцій і подібними до них, та їх сегреговані множені одиниці. Сполуки формули I проявляють активність проти HCV і можуть застосовуватися при лікуванні і профілактиці інфекції HCV або захворювань, пов'язаних з HCV. Останні включають прогресуючий фіброз печінки, запалення і некроз, що ведуть до цирозу, останньої стадії захворювання печінки, і гепато-целюлярну карциному (HCC). Більш того, ряд сполук цього винаходу, як передбачається, активні проти тих штамів HCV, які піддалися мутації. Крім того, багато сполук цього винаходу демонструють сприятливий фармакокинетический профіль і мають привабливі властивості відносно біодоступності, включаючи прийнятний період напіввиведення, AUC (площа під кривою) і максимальні значення, і відсутні несприятливі прояви, такі як недостатньо швидкий прояв дії і затримка ноходження в тканинах. Противірусна активність in vitro, проти HCV, для сполук формули I може бути протестована на клітинній моделі HCV в системі контролю реплікації, базуючись на публікації Lohmann et al. (1999) Science 285:110-113, з подальшими модифікаціями, описаними в роботі Krieger et al. (2001) Journal of Virology 75: 4614-4624 (включені в цей документ шляхом посилання), що далі представлено в розділі прикладів. Ця модель, не дивлячись на те, що вона не є всеосяжною моделлю інфекції HCV, є широко визнаною на даний момент як надійна та ефективна модель автономної реплікації РНК HCV. Слід прийняти до уваги, що важливо бачити відмінність між сполуками, які специфічно втручаються у функціонування HCV, і тими сполуками, які здійснюють вплив у вигляді цитотоксичних або цитостатичних ефектів на моделі реплікації HCV, і результатом цього є процес зменшення біосинтезу РНК HCV або/і концентрації зв'язаного з цим ферменту. Біологічні випробування, відомі в області визначення цитотоксичності на клітинному рівні, базуються, наприклад, на активності мітохондріальних ферментів з 9 UA 105790 C2 використанням фарбників, які флуоресціюють при окислювально-відновних процесах, таких як резазурин. Більш того, прилад для підрахунку клітин показує наявність характеристики неселективного інгібування активності зв'язаного з цим гена, такого як ген люциферази світляка. Придатні типи клітин, які можна забезпечити за допомогою стабільної трансфекції геномрепортером люциферази, у якого експресія залежить від конститутивноактивного генного промотера, і такі клітини можна використовувати як лічильник, що проводить відбір з виключенням неселективних інгібіторів. Завдяки їх проти-HCV властивостям, сполуки формули I, включаючи будь-які можливі стереоізомери, їх фармацевтично прийнятні аддитивні солі або сольвати, є придатними для застосування для лікування теплокровних тварин, і особливо, людей, інфікованих HCV, і для профілактики інфекцій HCV. Сполуки даного винаходу відповідно можуть застосовуватися як лікарський засіб, а саме, як проти-HCV або як HCV-інгібуючий лікарський засіб. Даний винахід також пов'язаний із застосуванням даних сполук у виробництві лікарського засобу для лікування або профілактики інфекції HCV. В іншому додатковому аспекті даний винахід пов'язаний із способом лікування теплокровних тварин, і особливо людини, інфікованих HCV або таких, що ризикують стати інфікованими HCV, причому вказаний спосіб включає введення проти-HCV ефективної кількості сполуки формули I, як вказано в цьому документі. Вказане застосування в якості лікарського засобу або спосіб лікування включає систематичне введення HCVінфіцкованим пацієнтам або суб'єктам, схильним до інфекції HCV, кількості засобу, ефективної для протидії умовам, пов'язаним з інфекцією HCV. В загальному випадку передбачається, що противірусна ефективна добова кількість повинна складати від, приблизно, 1 до, приблизно, 200 мг/кг або, приблизно, від 5 до, приблизно, 175 мг/кг, або, приблизно, від 10 до, приблизно, 150 мг/кг, або, приблизно, від 20 до, приблизно, 100 мг/кг, або, приблизно, від 50 до, приблизно, 75 мг/кг маси тіла. Середня величина добових доз може бути отримана шляхом множення цих добових кількостей приблизно на 70. Може бути доцільним вводити необхідну дозу у вигляді двох, трьох, чотирьох або у вигляді більшої кількості суб-доз з визначеними інтервалами протягом дня. Вказані субдози можуть бути виготовлені у вигляді одиничних дозованих форм, наприклад, що містять, приблизно, від 1 до, приблизно, 5000 міліграм або, приблизно, від 50 до, приблизно, 3000 міліграм, або, приблизно, від 100 до, приблизно, 1000 міліграм, або, приблизно, від 200 до, приблизно, 600 міліграм, або, приблизно, від 100 до, приблизно, 400 міліграм активного інгредієнта на одиничну дозовану форму. Термін "приблизно", який тут використовується, має значення, добре відоме фахівцеві в даній області техніки. У деяких конкретних варіантах здійснення винаходу термін "приблизно" може бути пропущений і тоді мають на увазі точну кількість. В інших прикладах здійснення винаходу термін "приблизно" означає, що число, наступне за терміном "приблизно" потрапляє в діапазон ±15 % або - в діапазон ±10 %, або - в діапазон ±5 %, або - в діапазон ±1 % від вказаного числового значення. ПРИКЛАДИ Нижчеприведені схеми призначені всього лише для ілюстративних цілей і не призначені для обмеження об'єму винаходу. Результати аналізу за допомогою поєднання методів рідинної хроматографії і масспектрометрії (LC-MS) отримували з використанням будь-якого з нижчеприведених методів. Дані ЯМР-спектрів отримували на спектрофотометрі Bruker 400 МГц. ВЕРХ, умови проведення A Система: Waters Alliance 2695 Колонка: Waters XTerra 2,5 мкм 4,6×50 мм; температура колонки: 55 °C; швидкість елюювання: 2 мл/хв Рухома фаза A: 10 мМ ацетату амонію+0,1 % HCOOH в H2O Рухома фаза B: CH3CN 10 UA 105790 C2 Час 0,00 3,00 4,20 4,30 5,40 %А 85 5 5 85 85 %В 15 95 95 15 15 ВЕРХ, умови проведення B Система: Waters Alliance 2695 Колонка: Hypercarb 3 мкм 4,6×50 мм; температура колонки: 50 °C; швидкість елюювання: 2 мл/хв Рухома фаза A: 10 мМ ацетату амонію в H2O/CH3CN 1/9 Рухома фаза B: 10 мМ ацетату амонію в H2O/CH3CN 9/1 Час 0,00 3,00 4,20 4,30 5,40 5 %А 0 100 100 0 0 %В 100 0 0 100 100 Приклад 1: (2S,3R,4R,5R)-3-аллил-4-(бензилокси)-5-(бензилоксиметил)-2метокситетрагідрофуран-3-ол (5) В атмосфері аргону до розчину 4 (отриманому згідно Org. Lett., 2007, 9, 3009-3012) в сухому тетрагідрофурані (ТГФ; 400 мл) при -78 °C, додавали аллилмагнійбромід (400 мл, 400 ммоль, 1,0 M в діетиловому ефірі). Після перемішування реакційної маси при -78 °C протягом 4 годин реакційну масу залишали перемішуватися при кімнатній температурі протягом 2 годин. Реакцію обережно гасили за допомогою насиченого водного розчину хлориду амонію. Суміш екстрагували дихлорметаном, і органічний шар промивали соляним розчином. Розчинник видаляли і залишок очищали за допомогою хроматографії на силікагелі (600 г силікагеля), елююючи в градієнті від 15 до 20 % етилацетату в гексані, отримували реакційний продукт 5 у вигляді безбарвного масла (32,9 г, 70 %). + ВЕРХ, умови проведення A, час утримування: 2,97 хв, m/z=402 (M+NH4) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 7,38-7,20 (м, 10H), 5,84-5,97 (м, 1H), 5,12 (д, 1H, J=10,2 Гц), 5,01 (д, 1H, J=17,2 Гц), 4,74 (д, 1H, J=12,3 Гц), 4,56 (с, 1H), 4,53-4,40 (м, 3H), 4,05-4,11 (м, 1H), 3,32-3,53 (м, 4H), 3,44 (с, 3H), 2,37 (дд, 1H, J=14,3, 6,7 Гц), 2,25 (дд, 1H, J=14,3, 7,6 Гц). Приклад 2: (2S,3R,4R,5R)-3-аллил-4-(бензилокси)-5-(бензилоксиметил)-2метокситетрагідрофуран-3-ілбензоат (6) До розчину сполуки 5 (26,6 г, 69,2 ммоль) в сухому дихлорметані (500 мл) при кімнатній температурі додавали N,N-диметилпіридин-4-амін (DMAP; 2,113 г, 17,30 ммоль), триетиламін (217 мл, 1557 ммоль) і бензоілхлорид (18,05 мл, 156 ммоль). Через 1 годину додавали додатково бензоілхлорид (6 мл) і DMAP (2,1 г). Суміш перемішували протягом 5 днів. Реакційну суміш потім перемішували з 1 н. HCl і екстрагували дихлорметаном. Органічні шари об'єднували і промивали насиченим водним розчином NaHCO 3, потім слідувало промивання сольовим розчином. Після сушки за допомогою MgSO 4, фільтрування і упарювання летких компонентів отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі (400 г силікагеля), елююючи спочатку гептаном і потім сумішшю, що містить до 15 % 11 UA 105790 C2 етилацетату в гептані, отримували реакційний продукт у вигляді масла (у вигляді суміші зі сполукою 5). Суміш ще раз очищали, використовуючи як елюент CH 2Cl2 (400 г силікагеля). Чисті фракції збирали і проміжний продукт 6 отримували у вигляді безбарвного масла (13,05 г, 39 %). + ВЕРХ, умови проведення A, час утримування: 3,41 хв, m/z=457 (M-OMe) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 8,1 (д, 2H, J=7,9 Гц), 7,68-7,28 (м, 13H), 5,84-5,77 (м, 1H), 5,12 (д, 1H, J=16 Гц), 4,95 (д, 1H, J=16 Гц), 4,92 (д, 1H, J=12,3 Гц), 4,56 (д, 1H, J=12,3 Гц), 4,48 (д, 1H, J=11,6 Гц), 4,40 (д, 1H, J=11,6 Гц), 4,2 (м, 1H), 3,85 (д, 1H, J=6,2 Гц), 3,53 (д, 1H, J=10,8 Гц), 3,7 (с, 3H), 3,45 (дд, 1H, J=10,8, 6,2 Гц), 3,25 (дд, 1H, J=15,5, 7,3 Гц), 2,45 (дд, 1H, J=15,5, 7,3 Гц). Приклад 3: 1-[(2R,3R,4R,5R)-3-аллил-4-(бензилокси)-5-(бензилоксиметил)-3гідрокситетрагідрофуран-2-іл]піримідин-2,4(1Н,3Н) -діон (7) Біс(триметилсиліл) ацетамід (BSA; 29,2 мл, 118 ммоль) додавали до суміші сполуки 6 (14,0 г, 23,1 ммоль) і урацила (5,99 г, 53,4 ммоль) в безводому ацетониітрилі (300 мл). Реакційну суміш кип'ятили із зворотним холодильником протягом 1 години і прозорий розчин залишали охолоджуватися до кімнатної температури. Хлорид олова (11,55 мл, 99 ммоль) додавали по краплях при кімнатній температурі і суміш далі перемішували протягом 1 години. Суміш потім перемішували при кипінні із зворотним холодильником протягом 1,5 години і знову охолоджували до кімнатної температури. Етилацетат (250 мл) додавали, потім додавали насичений водний розчин NaHCО3 (250 мл) і суміш перемішували протягом 15 хвилин. Після фільтрування через целіт, органічний шар відділяли і промивали насиченим водним розчином NaHCО3 (250 мл). Об'єднаний водний шар екстрагували етилацетатом (250 мл) і об'єднаний органічний шар сушили (MgSO4), фільтрували і упарювали насухо при зниженому тиску. Отримане в результаті жовте масло розчиняли в метанолі і додавали 25 % метанолят натрію (25 мл). Перемішування продовжували протягом ночі. Додатково додавали 25 % метанолят натрію (15 мл) і перемішування продовжували протягом ночі. Додавали оцетову кислоту (30 мл) і розчинник видаляли. Залишок очищали за допомогою колонкової хроматографії з елюентом, що змінюється від гептан/етилацетат, 50:50 до 100 % етилацетату. Проміжний продукт 7 (9,38 г, 76 %) був отриманий у вигляді безбарвного масла. + ВЕРХ, умови проведення A, час утримування: 2,49 хв, m/z=465 (M+H) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 8,39 (1H, NH), 7,75 (д, 1H, J=8,0 Гц), 7,22-7,43 (м, 10H), 6,05 (с, 1H), 5,71-5,84 (м, 1H), 5,35 (д, 1H, J=8,0 Гц), 5,00-5,11 (м, 2H), 4,70 (д, 1H, J=11,5 Гц), 4,53 (д, 1H, J=11,5 Гц), 4,47 (д, 1H, J=11,1 Гц), 4,47 (д, 1H, J=11,1 Гц), 4,11-4,16 (м, 1H), 4,04 (д, 1H, J=8,0 Гц), 3,81-3,87 (м, 1H), 3,45-3,52 (м, 1H), 3,17 (шир.с, ОН), 2,15-2,33 (м, 2H). Приклад 4: 1-[(2R,3R,4R,5R)-4-(бензилокси)-5-(бензилоксиметил)-3-гідрокси-3-(2гідроксиетил)тетрагідрофуран-2-іл]піримідин-2,4(1Н, 3Н)-діон (8) До перемішуваного розчину 7 (7,8 г, 16,79 ммоль) в суміші ТГФ (10 мл) і H2O (10 мл) додавали перйодат натрію (11,17 г, 52,2 ммоль), потім додавали тетраоксид осмію(VIII) (2 мл, 2,5 мас./об. % у трет-бутанолі, 0,168 ммоль) і перемішування продовжували протягом 2 годин при кімнатній температурі. Додавали воду (100 мл) і проводили екстракцію етилацетатом (2×50 мл). Органічний шар промивали насиченим водним розчином NaHCO 3 (2×30 мл). Об'єднаний водний шар екстрагували етилацетатом і об'єднаний органічний шар сушили над Na 2SO4, фільтрували і упарювали насухо при зниженому тиску. Отримане масло розчиняли в суміші ТГФ (100 мл) і H2O (20 мл) і додавали натрійборгідрид (1,361 г, 36,0 ммоль). Реакційну суміш перемішували протягом ночі при кімнатній температурі, після чого додавали воду (100 мл) і проводили екстракцію етилацетатом (2×50 мл). Об'єднаний органічний шар промивали насиченим водним розчином NaHCO3, об'єднані водні шари екстрагували етилацетатом, і об'єднані органічні шари сушили над Na2SO4, фільтрували і упарювали насухо при зниженому 12 UA 105790 C2 тиску. Отримане масло очищали за допомогою колонкової хроматографії, елююючи (0-10 % (об./об.) метанолом в CH2Cl2, потім йшло ізократичне елюювання 10 % сумішшю), що дозволяло отримати реакційний продукт 8 у вигляді білої піноподібної плівки (4,8 г, 57 %). + ВЕРХ, умови проведення A, час утримування: 2,12 хв, m/z=469 (M+H) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 9,85 (1H, NH), 7,85 (д, 1H, J=8,0 Гц), 7,22-7,43 (м, 10H), 6,05 (с, 1H), 5,35 (д, 1H, J=8,0 Гц), 4,75 (д, 1H, J=11,5 Гц), 4,53 (д, 1H, J=11,5 Гц), 4,45 (д, 1H, J=11,3 Гц), 4,35 (д, 1H, J=11,3 Гц), 4,27 (д, 1H, J=6,6 Гц), 4,2 (с, 1H), 4,1, (д, 1H, J=6,6 Гц), 3,95 (д, 1H, J=10,8 Гц), 3,75-3,7 (м, 1H), 3,62 (д, 1H, J=10,8 Гц), 3,17 (шир.с, ОН), 1,8-1,7 (м, 2H). Приклад 5: 1-[(4R,5R,7R,8R)-8-(бензилокси)-7-(бензилоксиметил)-1,6-діоксаспіро[3,4]октан-5іл]піримідин-2,4(1H,3H)-діон (9) Метансульфонілхлорід (0,800 мл, 0,34 ммоль) додавали до сполуки 8 (4,32 г, 9,22 ммоль) в сухому піридині (100 мл). Через 1 годину 15 хвилин додавали додатково 0,1 еквіваленту метансульфонілхлориду і далі суміш перемішували при кімнатній температурі протягом 45 хвилин. Потім додавали невелику кількість метанолу і суміш упарювали насухо. Залишок розчиняли в етилацетаті (100 мл) і промивали насиченим розчином NaHCO 3 (2×50 мл). Об'єднаний водний шар екстрагували етилацетатом. Об'єднаний органічний шар потім сушили над Na2SO4 і концентрували у вакуумі. Отриманий залишок розчиняли в сухому ТГФ і відразу ж додавали 95 % NаH (932 міліграми, 36,9 ммоль) при кімнатній температурі. Після перемішування протягом 2 годин при кімнатній температурі, реакційну суміш виливали в насичений водний розчин NH4Cl (30 мл), потім додавали CH 2Cl2 (250 мл). Відокремлений органічний шар промивали насиченим водним розчином NaHCO 3 (2×100 мл) і об'єднаний водний шар екстрагували CH2Cl2 (250 мл). Об'єднаний органічний шар сушили над (Na2SO4), фільтрували і упарювали насухо при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії, елююючи спочатку гептаном, потім етилацетатом, що дозволяло отримати сполуку 9 (3,27 г, 79 %) у вигляді піноподібної плівки. + ВЕРХ, умови проведення A, час утримування: 2,33 хв, m/z=451 (M+H) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 2,20-2,38 (м, 1H) 2,38-2,52 (м, 1H) 3,62-3,73 (м, 1H) 3,89-4,13 (м, 3H) 4,38-4,56 (м, 3H) 4,56-4,68 (м, 1H) 4,70-4,88 (м, 2H) 5,25 (д, J=8,00 Гц, 1H) 6,25 (с, 1H) 7,18-7,47 (м, 10H) 7,87 (д, J=8,20 Гц, 1H) 8,90 (шир.с, 1H). Приклад 6: 1-[(4R,5R,7R,8R)-8-гідрокси-7-(гідроксиметил)-1,6-діоксаспіро[3,4]октан-5іл]піримідин-2,4(1H,3H)-діон (10) Суміш сполуки 9 (50 міліграм, 0,111 ммоль) в метанолі (1 мл) і Pd(ОН) 2 (8 міліграм) перемішували в атмосфері водню при кімнатній температурі. Через 4 години ще додатково додавали Pd(ОН)2 (30 міліграм) і метанол (1 мл). Суміш інтенсивно перемішували в атмосфері H2 протягом ночі. Каталізатор видаляли фільтруванням через декаліт і розчинник видаляли упарюванням. Отриманий в результаті залишок очищали за допомогою хроматографії на силікагелі, елююючи 10 % метанолом в етилацетаті, отримуючи проміжний продукт 10 у вигляді білого порошку (16,8 міліграм; 56 %). + ВЕРХ, умови проведення B, час утримування: 1,98 хв, m/z=271 (M+H) . 1 H-ЯМР (400 МГц, D2О) δ м.д. 7,65 (д, 1H, J=8,0 Гц), 6,11 (с, 1H), 5,82 (д, 1H, J=8,0 Гц), 4,464,61 (м, 2H), 4,06-4,13 (м, 1H), 3,87-3,95 (м, 1H), 3,69-3,77 (м, 2H), 2,62-2,73 (м, 1H), 2,48-2,58 (м, 1H). 13 UA 105790 C2 Приклад 7: метил-2-(хлор(фенокси) фосфориламіно)-2-метилпропіонат (11) Розчин фенілдихлорфосфату (1,0 экв., 13,0 ммоль, 1,9 мл) і метил-α-аміноізобутирату гідрохлориду (1,0 экв., 13,0 ммоль, 2,0 г) в CH2Cl2 (80 мл) охолоджували до -80 °C. Сухі N,Nдиізопропілетиламін (DIPEA; 2,0 экв., 26,0 ммоль, 4,3 мл) додавали по краплях. Через 2 години реакційну масу нагрівали до кімнатної температури і розчинник видаляли при зниженому тиску. Додавали сухий діетиловий ефір і осад фільтрували, і двічі промивали сухим діетиловим ефіром в атмосфері аргону. Фільтрат упарювали насухо, отримуючи сполуку 11, яку зберігали у вигляді 0,90 M розчину в сухому тетрагідрофурані (ТГФ) при -18 °C. Приклад 8: метил 2-[[[(4R,5R,7R,8R)-5-(2,4-діоксо-3,4-дигідропіримідин-1(2H)-іл)-8-гідрокси1,6-діоксаспіро[3.4]октан-7-іл]метокси](фенокси) фосфориламіно]-2-метилпропаноат (12e) До розчину сполуки 10 (1,0 экв., 0,28 ммоль, 75 міліграм) в сухому ТГФ (3 мл) додавали 1метилімідазол (NMI; 12,0 экв., 3,33 ммоль, 0,27 мл) при кімнатній температурі. Розчин проміжного продукту 11 (1,4 экв., 0,39 ммоль, 0,43 мл) додавали по краплях і суміш перемішували при кімнатній температурі протягом 1 години. Реакційну суміш тричі промивали 0,5 M HCl. Органічний шар сушили над MgSO 4 і концентрували у вакуумі. Залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: 0-10 % метанол в CH2Cl2), отримуючи сполуку 12e (24 міліграми, вихід 15 %, чистота 95 %) у вигляді суміші діастереомерів. + ВЕРХ, умови проведення A, час утримування: 1,49 хв, m/z=526 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,33 (с, 3H), 1,37 (с, 3H), 2,42-2,43 (м, 2H), 3,56 (с, 3H), 3,70-3,79 (м, 1H), 3,80-3.88 (м, 0,4H), 3,88-3,96 (м, 0,6H), 4,09-4,20 (м, 1H), 4,26-4,48 (м, 3H), 5,505,56 (м, 1H), 5,61-5,69 (м, 1H), 5,88-5,97 (м, 1H), 5,97-6,04 (м, 1H), 7,12-7,24 (м, 3H), 7,31-7,41 (м, 2H), 7,44 (д, J=8,22 Гц, 0,4H), 7,52 (д, J=8,02 Гц, 0,6H), 11,49 (шир.с, 1H). Приклад 9 Використовуючи методику, аналогічну вищесказаній, були отримані перераховані нижче сполуки. В кожному випадку аналіз проводили для сумішей діастереомерів. + ВЕРХ, умови проведення A, час утримування: 2,00 хв, m/z=602 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,71-0,83 (м, 3H), 1,45-1,73 (м, 2H), 2,33-2,48 (м, 2H), 3,59-3,80 (м, 2H), 3,79-3,96 (м, 1H), 4,04-4,19 (м, 1H), 4,24-4,47 (м, 3H), 4,98-5,14 (м, 2H), 5,47 14 UA 105790 C2 5,57 (м, 1H), 5,58-5,73 (м, 1H), 5,96-6,03 (м, 1H), 5,96-6,03 (м, 1H), 7,09-7,22 (м, 3H), 7,27-7,39 (м, 7H), 7,44 (д, J=8,02 Гц, 0,5H), 7,48 (д, J=8,22 Гц, 0,5H), 11,50 (шир.с, 1H). + ВЕРХ, умови проведення A, час утримування: 1,92 хв, m/z=588 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,19-1,29 (м, 3Н), 2,38-2,46 (м, 2Н), 3,53-3,97 (м, 3Н), 4,06-4,20 (м, 1Н), 4,26-4,46 (м, 3Н), 5,05-5,14 (м, 2Н), 5,49-5,59 (м, 1Н), 5,61-5,73 (м, 1Н), 5,886,05 (м, 1Н), 6,07-6,18 (м, 1Н), 7,09-7,23 (м, 3Н), 7,30-7,40 (м, 7Н), 7,43-7,51 (м, 1Н), 11,51 (шир.с, 1H). + ВЕРХ, умови проведення A, час утримування: 2,00 хв, m/z=568 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,79-0,93 (м, 9Н), 1,20-1,32 (м, 3Н), 2,33-2,50 (м, 2Н), 3,63-3,70 (м, 1Н), 3,71-3,80 (м, 2Н), 3,80-3,93 (м, 2Н), 4,04-4,21 (м, 1Н), 4,23-4,46 (м, 3Н), 5,495,59 (м, 1Н), 5,58-5,72 (м, 1Н), 5,94-6,03 (м, 1Н), 6,02-6,14 (м, 1Н), 7,11-7,25 (м, 3Н), 7,32-7,39 (м, 2Н), 7,41-7,53 (м, 1Н), 11,51 (шир.с, 1H). + 5 ВЕРХ, умови проведення A, час утримування: 1,88 хв, m/z=554 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 0,77-0,93 (м, 3Н), 1,14-1,25 (м, 3Н), 1,24-1,37 (м, 2Н), 1,41-1,62 (м, 2Н), 2,35-2,47 (м, 2Н), 3,63-3,92 (м, 3Н), 3,92-4,06 (м, 2Н), 4,05-4,21 (м, 1Н), 4,234,46 (м, 3Н), 5,48-5,59 (м, 1Н), 5,59-5,72 (м, 1Н), 5,89-6,15 (м, 2Н), 7,09-7,25 (м, 3Н), 7,31-7,41 (м, 2Н), 7,43-7,52 (м, 1Н), 11,51 (шир.с, 1H). 15 UA 105790 C2 + ВЕРХ, умови проведення A, час утримування: 3,46 хв, m/z=644 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,37-11,61 (1Н, м), 7,40-7,46 (1Н, м), 7,27-7,39 (5Н, м), 7,09-7,19 (2Н, м), 6,89-6,96 (1Н, м), 6,07-6,20 (1Н, м), 5,98-6,03 (1Н, м), 5,58-5,72 (1Н, м), 5,455,52 (1Н, м), 5,02-5,15 (2Н, м), 4,23-4,45 (3Н, м), 4,05-4,18 (1Н, м), 3,82-3,98 (2Н, м), 3,69-3,78 (1Н, м), 3,13-3,26 (1Н, м), 2,37-2,47 (2Н, м), 2,15-2,23 (3Н, м), 1,24-1,32 (3Н, м), 1,06-1,15 (6Н, м). ВЕРХ, умови проведення A, час утримування: 2,08 і 2,21 хв (виявляли індивідуальні + діастереомери), m/z=540 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,39-11,60 (1Н, м), 7,44-7,52 (1Н, м), 7,31-7,40 (2Н, м), 7,12-7,24 (3Н, м), 5,95-6,07 (2Н, м), 5,59-5,71 (1Н, м), 5,51-5,58 (1Н, м), 4,78-4,91 (1Н, м), 4,264,44 (3Н, м), 4,06-4,20 (1Н, м), 3,84-3,95 (1Н, м), 3,68-3,83 (2Н, м), 2,37-2,58 (2Н, м), 1,16-1,25 (3Н, м), 1,11-1,16 (6H, м). + ВЕРХ, умови проведення A, час утримування: 3,03 хв, m/z=650 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,34-11,62 (1Н, м), 7,05-7,46 (16Н, м), 6,71-6,84 (1Н, м), 5,95-6,03 (1H, м), 5,56-5,71 (1Н, м), 5,46-5,53 (1Н, м), 4,95-5,16 (3Н, м), 4,23-4,45 (3Н, м), 4,054,21 (1Н, м), 3,77-3,88 (1Н, м), 3,68-3,77 (1Н, м), 2,35-2,45 (2Н, м). 16 UA 105790 C2 ВЕРХ, умови проведення A, час утримування: 2,38 і 2,48 хв (виявляли індивідуальні + діастереомери), m/z=554 (M+H) . 1 H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,38-11,61 (1Н, м), 7,43-7,53 (1Н, м), 7,31-7,41 (2H, м), 7,11-7,25 (3Н, м), 5,90-6,06 (2Н, м), 5,59-5,71 (1Н, м), 5,50-5,59 (1Н, м), 4,79-4,93 (1Н, м), 4,274,46 (3Н, м), 4,03-4,21 (1Н, м), 3,82-3,95 (1Н, м), 3,68-3,81 (1Н, м), 3,52-3,66 (1Н, м), 2,38-2,51 (2Н, м), 1,44-1,72 (2Н, м), 1,09-1,21 (6Н, м), 0,72-0,89 (3Н, м). ВЕРХ, умови проведення A, час утримування: 2,84 і 2,94 хв (виявляли індивідуальні + діастереомери), m/z=622 (M+H) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 1,38 (д, J=8,59 Гц, 3Н), 2,38-2,57 (м, 1Н), 2,66-2,84 (м, 1Н), 3,25 (br, з, 1Н), 3,78 (br, с, 1Н), 3,81-3,94 (м, 1Н), 3,95-4,15 (м, 2Н), 4,23-4,42 (м, 1Н), 4,42-4,58 (м, 2Н), 4,60-4,72 (м, 1Н), 5,14 (с, 2Н), 5,68 (д, J=8,00 Гц, 1Н), 6,07 (с, ОН), 7,01-7,19 (м, 2Н), 7,207,43 (м, 7Н), 8,76 (шир.с, 1H). + ВЕРХ, умови проведення A, час утримування: 3,06 хв, m/z=638 (M+H) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 1,23-1,41 (м, 2Н), 1,66 (шир.с, ОН), 1,93 (шир.с, 1Н), 2,37 (м, J=12,56, 12,56, 8,63, 6,24 Гц, 1Н), 2,54-2,75 (м, 1Н), 3,44-3,67 (м, 1Н), 3,78 (дд, J=9,27, 1,85 Гц, 1Н), 3,86-4,03 (м, 1Н), 4,05-4,17 (м, 1Н), 4,18-4,28 (м, 1Н), 4,31-4,41 (м, 1Н), 4,41-4,66 (м, 3Н), 4,96-5,16 (м, 2Н), 5,32 (д, J=8,20 Гц, 0Н), 5,44 (д, J=8,20 Гц, 0Н), 6,11 (с, 1Н), 7,08 (д, J=8,19 Гц, 0Н), 7,18-7,41 (м, 6Н), 7,44-7,57 (м, 3Н), 7,64 (д, J=8,00 Гц, 1Н), 7,78-7,89 (м, 1Н), 8,01-8,18 (м, 1Н), 9,37 (шир.с, 1H). 17 UA 105790 C2 ВЕРХ, умови проведення A, час утримування: 2,48 і 2,59 хв (виявляли індивідуальні + діастереомери), m/z=554 (M+H) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 0,92 (д, J=5,46 Гц, 5H), 1,28-1,45 (м, 2H), 1,48-2,02 (м, 2H), 2,38-2,56 (м, 1H), 2,64-2,87 (м, 1H), 3,67-4,17 (м, 5H), 4,28-4,58 (м, 2H), 4,66 (шир.с, 1H), 5,60-5,70 (м, H), 6,19 (с, 1H), 7,10-7,49 (м, 6H), 8,56 (шир.с, 1H). + ВЕРХ, умови проведення A, час утримування: 2,61 хв, m/z=608 (M+H) . 1 H-ЯМР (400 МГц, CDCl3) δ м.д. 2,40-2,56 (м, 1H), 2,67-2,82 (м, 1H), 3,29 (шир.с, 1H), 3,713,97 (м, 4H), 3,97-4,10 (м, 1H), 4,32-4,44 (м, 1H), 4,45-4,59 (м, 2H), 4,61-4,70 (м, 1H), 5,16 (с, 2H), 5,68 (д, J=7,80 Гц, 1H), 6,10 (д, J=6,44 Гц, 1H), 7,10-7,19 (м, 2H), 7,24-7,30 (м, 3H), 7,30-7,42 (м, 5H), 8,82 (шир.с, 1H). БІОЛОГІЧНІ ПРИКЛАДИ Проведення дослідження реплікона Сполуки формули I перевіряли на наявність активності при інгібуванні реплікації РНК HCV в біологічних випробуваннях на клітинах. Випробування використовували для демонстрації того, що сполуки формули I інгібують клітинну реплікацію для клітинної лінії, яка містить HCV, також відомої як HCV реплікони. Випробування на клітинах базувалися на експресії гена у складі біцистронної конструкції, як описано в роботі Lohmann et al. (1999) Science vol. 285 pp. 110-113, з використанням модифікацій, описаних в роботі Krieger et al. (2001) Journal of Virology 75: 46144624, при стратегії багатоцільового скринінгу. По суті справи, спосіб полягав в наступному. При біологічних випробуваннях використовували стійко трансфіковану клітинну лінію Huh-7 luc/neo (яка далі в цьому документі позначається як Huh-Luc). Ця клітинна лінія містить кодуючу РНК експресуєму біцистронну конструкцію, яка включає NS3-NS5B фрагменти дикого типу немутантного HCV типу 1b, отримані при трансляції на ділянці внутрішньої посадки рибосоми (IRES) з вірусу енцефаломіокардиту (EMCV), що знаходяться перед ділянкою репортерного гена (FfLR люциферази), і ділянку гена селектованого маркера (neo , неоміцинфосфотрансферази). На обмежуючих конструкцію 5'- і 3'-кінцях містяться NTR (нетрансльовані ділянки) генома HCV R генотипу 1b. Функціонуюча культура клітин, що містять реплікон, у присутності G418 (neo ) залежить від процесу реплікації РНК вірусу HCV. Стійко трансфековані репліконом клітини, в яких експресується HCV РНК, що має високий рівень автономної реплікації, яка кодує, окрім всього іншого, люциферазу, застосовували для скринінгу антивірусних властивостей сполук. Клітини, які містять реплікон, висівали в 384-лункові планшети у присутності тестованих і контрольних сполук, які додавали в різних концентраціях. Далі проводили інкубацію протягом 18 UA 105790 C2 5 трьох днів, HCV реплікацію визначали за допомогою вимірювання активності люциферази (використовуючи стандартні субстрати і реагенти для аналізу люциферази, і мікропланшетну установку для візуалізації Perkin Elmer ViewLux™ ultraHTS). Клітини, які містять реплікон, в контрольних культурах мали високий рівень експресії гена люциферази за відсутності будьякого інгібітора. Інгибіторну активність сполуки відносно активності люциферази контролювали на клітинах Huh-Luc, забезпечуючи можливість побудови графічної залежності "доза характеристика отриманої активності" для кожної тестованої сполуки. Величини EC50 розраховували, ці величини представляють собою кількість сполуки, яка потрібна для зниження рівня визначаємої люциферазної активності на 50 %, або, конкретніше, представляють здатність генетично зв'язаного з HCV реплікона РНК до реплікації. Результати Таблиця 1 показує результати аналізу реплікона (EC50, реплікон) і результати аналізу цитотоксичності (CC50 (мкM) (Huh-7)), отримані для сполук наведених вище прикладів Крім того, вказана HIV активність (EC50 HIV (мкM)) і клітинна токсичність для HIV клітинної лінії (CC50 (мкM) (MT-4)). Таблиця 1 Номер сполуки 12а 12b 12с 12d 12e 12f 12g 12h 12i 12j 12k 12l 12m EC50 (мкM) HCV 3,4 3,7 5,6 5,5 23,4 8,7 17,8 79,64 >96 0,7 2,0 0,44 7,17 CC50 (мкM) (Huh-7) EC50 (мкM) HIV >98 >98 >98 >98 >98 >98 >98 >98 >98 >98 18,7 >98 >98 >98 >88 >98 >98 >98 >98 >98 >98 >76,8 >98 >98 >98 >98 CC50 (мкM) (MT-4) >98 >98 >98 >98 >98 1,3 >98 >98 >98 >98 >98 >98 >98 ФОРМУЛА ВИНАХОДУ 10 1. Сполука формули І: O NH R4O N O O HO O , (I) включаючи її будь-які можливі стереоізомери, де: 4 R є монофосфатною, дифосфатною або трифосфатною складноефірною групою; або групою формули R R 15 9 O 8 R8' N H O 4 є OR7 OR7 P R R 9 O N P O O або ; 7 R є фенілом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, С3-С6алкенілу, C1-C6алкокси-, гідрокси- і аміногруп; 7 або R є нафтилом, необов'язково заміщеним 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, С3-C6алкенілу, C1-C6алкокси-, гідрокси- і O 19 UA 105790 C2 7 5 10 аміногруп; або R є індолілом, необов'язково заміщеним однією C1-C6алкілоксикарбонільною групою і, необов'язково, ще додатковими 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з галогену, C1-C6алкілу, С3-C6алкенілу, C1-C6алкокси-, гідрокси- і аміногруп; 8 R є воднем, C1-C6алкілом, бензилом або фенілом; 8' R є воднем, C1-C6алкілом, бензилом або фенілом; або 8 8' R і R разом з атомом вуглецю, до якого вони приєднані, утворюють С3-C7циклоалкіл; 9 R є С1-С10алкілом, С3-C7циклоалкілом або феніл-C1-C6алкілом, де фенільний фрагмент у фенілі або феніл-C1-C6алкілі необов'язково заміщений 1, 2 або 3 замісниками, кожен з яких, незалежно один від одного, вибирають з гідрокси, C1-C6алкокси, аміно, моно- і діC1-C6алкіламіно; або її фармацевтично прийнятна сіль або сольват. 4 2. Сполука за п. 1, де R є групою формули R R 9 O 8 R8' N H OR7 P O O 15 20 . 7 3. Сполука за будь-яким з пп. 1, 2, де R є фенілом, необов'язково заміщеним галогеном або 7 однією або двома C1-C6алкільними групами, або R є нафтилом або індолілом. 7 4. Сполука за будь-яким з пп. 1, 2, де R є фенілом, необов'язково заміщеним галогеном або 7 двома C1-C6алкільними групами, або R є нафтилом. 7 5. Сполука за будь-яким з пп. 1, 2, де R є фенілом або нафтилом. 8 8' 6. Сполука за будь-яким з пп. 1-5, де R є воднем, і R є воднем або C1-C6алкілом. 8 8' 7. Сполука за будь-яким з пп. 1-6, де R є воднем, і R є метилом або етилом. 9 8. Сполука за будь-яким з пп. 1-7, де R є C1-C6алкілом або бензилом. 9 9. Сполука за будь-яким з пп. 1-7, де R є н-бутилом або бензилом. 10. Сполука за п. 1, де сполука формули І є: O O H N O NH O P O N O O O HO O , 12a 25 O O O O H N P O O N NH O O HO O , 12с 20 UA 105790 C2 O O H N O NH O P O N O O O HO O 12d або O NH O O O H N P N O O O O HO 5 O 12k. 11. Фармацевтична композиція, що містить противірусно ефективну кількість сполуки формули І за будь-яким з пп. 1-10 та фармацевтично прийнятний носій. 12. Застосування сполуки за будь-яким з пп. 1-10 як інгібітора вірусу HCV. Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Назва патенту англійськоюUracyl spirooxetane nucleosides
Автори англійськоюJonckers, Tim, Hugo, Maria, Raboisson Pierre Jean-Marie Bernard, Vandyck, Koen, van Hoof, Steven, Maurice, Paula, Hu, Lili, Tahri, Abdellah
Автори російськоюЙонкерс Тим Хьюго Мария, Рабуассон Пьер Жан-Мари Бернар, Вандик Кун, ван Хооф Стивен Морис Пола, Ху Лили, Тахри Абделла
МПК / Мітки
МПК: A61K 31/7072, C07H 19/10, C07H 19/06
Мітки: урацилвмісних, спірооксетанові, нуклеозидів, похідні
Код посилання
<a href="https://ua.patents.su/23-105790-spirooksetanovi-pokhidni-uracilvmisnikh-nukleozidiv.html" target="_blank" rel="follow" title="База патентів України">Спірооксетанові похідні урацилвмісних нуклеозидів</a>
Наступний патент: Пристрій для приготування напою з харчової речовини
Випадковий патент: Пристрій для вимірювання величини розвалу і сходження коліс автомобілів