Гетероциклічні сполуки бензодіоксолу або бензодіоксепіну як інгібітори фосфодіестераз
Формула / Реферат
1. Сполука загальної формули І
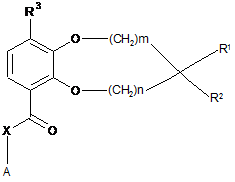 , I
, I
де
кожний з m і n незалежно являє собою 0 або 1;
R1 і R2, разом з атомом вуглецю, до якого вони приєднані, утворюють гетероциклічне кільце, що містить один або два гетероатоми, вибрані з кисню, сірки, -S(O)- і -S(O)2-;
R3 являє собою -CHF2, -CF3, -OCHF2, -OCF3, -SCHF2 або -SCF3;
X являє собою зв'язок, -СН2- або -NH-;
А являє собою арил, циклоалкіл, циклоалкеніл, арилалкіл, гетероарил, гетероарилалкіл, гетероциклоалкіл або гетероциклоалкеніл, необов'язково заміщений одним або декількома однаковими або різними замісниками, вибраними з R4; і
R4 являє собою водень, аміно, тіоксо, алкіл, галогеналкіл, гідроксіалкіл, алкокси, галогеналкокси, галоген, оксо, тіа або гідрокси;
або її фармацевтично прийнятна сіль, гідрат або сольват.
2. Сполука за п. 1, де X являє собою -СН2- або -NH-.
3. Сполука за п. 1 або 2 загальної формули IIа
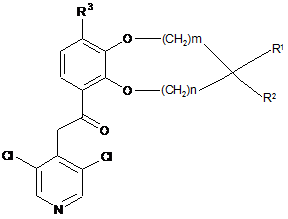 IIa
IIa
або IIb
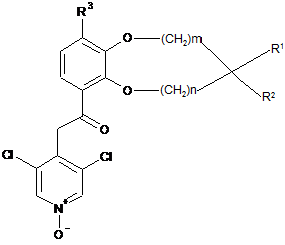 , IIb
, IIb
де m, n, R1, R2 і R3 є такими, як визначено в п. 1.
4. Сполука за п. 1, 2 або 3, де як m, так і n дорівнюють 0.
5. Сполука за п. 1, 2 або 3, де як m, так і n дорівнюють 1.
6. Сполука за будь-яким з пп. 1-5, де R3 являє собою -OCHF2 або -OCF3.
7. Сполука за п. 6, де R3 являє собою -OCHF2.
8. Сполука за будь-яким з пп. 1-5, де R3 являє собою -SCHF2 або -SCF3.
9. Сполука за будь-яким з пп. 1-8, де R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють 4-, 5- або 6-членне гетероциклічне кільце.
10. Сполука за п. 9, де гетероциклічне кільце являє собою тетрагідропіран, оксетан, [1,3]діоксолан, [1,3]діоксан, тетрагідротіопіран, тетрагідротіопіран-1,1-діоксид, тетрагідротіопіран-1-оксид, тетрагідротіофен, [1,3]-дитіан, тіетан, [1,3]-дитіан-1,3-діоксид, тіетан-1-оксид або тіетан-1,1-діоксид.
11. Сполука за п. 9, де гетероциклічне кільце містить один гетероатом.
12. Сполука за п. 11, де гетероатом являє собою кисень або -S(O)2.
13. Сполука за п. 1, 2 або 3, вибрана з групи, що складається з
2-(3,5-дихлорпіридин-4-іл)-1-{9-дифторметоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-оксетан]-6-іл}етанону (сполука 101),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-{9-дифторметоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-оксетан]-6-іл}етанону (сполука 102),
2-(3,5-дихлорпіридин-4-іл)-1-{9-дифторметоксиспіро[2Н-1,5-бензодіоксепін-3(41-1),4'-тетрагідропіран]-6-іл}етанону (сполука 103),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-{9-дифторметоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),4'-тетрагідропіран]-6-іл}етанону (сполука 104),
2-(3,5-дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4-іл)етанону (сполука 105),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-терагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4-іл)етанону (сполука 106),
2-(3,5-дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 107),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран-1',1'-діоксид]-4-ил)етанону (сполука 108),
2-(3,5-дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран-1',1'-діоксид]-4-ил)етанону (сполука 109),
N-(3,5-дихлор-4-піридил)-7-дифторметокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-карбаміду (сполука 110),
N-(3,5-дихлор-1-оксо-4-піридил)-7-(дифторметокси)-1',1'-діоксоспіро[1,3-бензодіоксол-2,4'-тіан]-4-карбоксаміду (сполука 111).
14. Сполука за будь-яким з пп. 1-13 для застосування в терапії.
15. Сполука за будь-яким з пп. 1-13 для застосування при лікуванні запальних захворювань, таких як бронхіальна астма, COPD, алергічний риніт і нефрит; аутоімунних захворювань, таких як ревматоїдний артрит, множинний склероз, хвороба Крона і системний червоний вовчак; захворювань центральної нервової системи, таких як депресія, амнезія і деменція; патології органів, пов'язаної з ішемічним рефлюксом, що викликається серцевою недостатністю, шоку і цереброваскулярних захворювань і тому подібне; діабету, стійкого до інсуліну; поранень; раку; проліферативних і запальних розладів шкіри, таких як псоріаз, запалення епідермісу, акне, дерматит, атопічний дерматит, себорейний дерматит, контактний дерматит, кропивниця, прурит і екзема; та інших станів шкіри, таких як облисіння, атрофія шкіри, атрофія шкіри, що викликається стероїдами, старіння шкіри і фотостаріння шкіри.
16. Фармацевтична композиція, що містить як терапевтично активний інгредієнт сполуку за будь-яким з пп. 1-13 і фармацевтично прийнятний носій або зв'язуюче.
17. Композиція за п. 16, де фармацевтично прийнятний носій або зв'язуюче являє собою речовину, яка придатна для перорального введення.
18. Композиція за п. 16 або 17, що додатково містить один або декілька додаткових терапевтично активних інгредієнтів.
19. Спосіб запобігання, лікування або послаблення запального захворювання або стану, що включає введення пацієнту, який потребує цього, терапевтично ефективної кількості сполуки за будь-яким з пп. 1-13.
20. Спосіб за п. 19, де захворювання або стан вибирають з групи, що складається із запальних захворювань, таких як бронхіальна астма, COPD, алергічний риніт і нефрит; аутоімунних захворювань, таких як ревматоїдний артрит, множинний склероз, хвороба Крона і системний червоний вовчак; захворювань центральної нервової системи, таких як депресія, амнезія і деменція; патології органів, пов'язаної з ішемічним рефлюксом, що викликається серцевою недостатністю, шоку і цереброваскулярних захворювань і тому подібне; діабету, стійкого до інсуліну; поранень; раку; проліферативних і запальних розладів шкіри, таких як псоріаз, запалення епідермісу, акне, дерматит, атопічний дерматит, себорейний дерматит, контактний дерматит, кропивниця, прурит і екзема; та інших станів шкіри, таких як облисіння, атрофія шкіри, атрофія шкіри, що викликається стероїдами, старіння шкіри і фотостаріння шкіри.
21. Спосіб за п. 19 або 20, де сполуку вводять пероральним способом.
Текст
Реферат: Сполуки загальної формули (І), де кожний з m і n незалежно являє собою 0 або 1; R1 і R2, разом з атомом вуглецю, до якого вони приєднані, утворюють гетероциклічне кільце, що містить один або два гетероатоми, вибрані з кисню, сірки, -S(O)- і -S(O)2-; R3 являє собою -CHF2, -CF3, OCHF2, -OCF3, -SCHF2 або -SCF3; X являє собою зв'язок, -СН2- або -ΝΗ-; А являє собою арил, циклоалкіл, циклоалкеніл, арилалкіл, гетероарил, гетероарилалкіл, гетероциклоалкіл або UA 109140 C2 (12) UA 109140 C2 гетероциклоалкеніл, необов'язково заміщений одним або декількома однаковими або різними замісниками, вибраними з R4; і R4 являє собою водень, аміно, тіоксо, алкіл, галогеналкіл, гідроксіалкіл, алкокси, галогеналкокси, галоген, оксо, тіа або гідрокси; або їх фармацевтично прийнятні солі, гідрати або сольвати, як виявлено, демонструють активність інгібування PDE4 і з цієї причини можуть бути корисними при лікуванні запальних захворювань і розладів. UA 109140 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується нових сполук з інгібіторною активністю відносно фосфодіестераз, а також їх застосування як терапевтичні агенти для лікування запальних захворювань і станів. Рівень техніки Фосфодіестерази являють собою ферменти, які каталізують гідроліз циклічного AMP і/або циклічного GMP в клітинах 5-AMP і 5-GMP, відповідно, і як такі, вони є критичними відносно клітинного регулювання рівнів cAMP або cGMP. З 11 фосфодіестераз, ідентифікованих до теперішнього часу, фосфодіестераза (PDE) 4, PDE7 і PDE8 є селективними відносно cAMP. PDE4 є найбільш важливим модулятором cAMP, експресованих в імунних і запальних клітинах, таких як нейтрофіли, макрофаги і Т-лімфоцити (Z. Huang and J. A. Mancini, Current Med. Chem. 13, 2006, pp. 3253-3262). Оскільки cAMP є ключовим другим месенджером при модулюванні запальних реакцій, PDE4, як виявлено, регулює запальні реакції запальних клітин за допомогою модулювання прозапальних цитокінів, таких як TNFα, IL-2, IFN-γ, GM-CSF і LTB4. Інгібування PDE4, отже, стає привабливою метою для терапії запальних захворювань, таких як астма, хронічне обструктивне пульмонарне захворювання (COPD), ревматоїдний артрит, атопічний дерматит, хвороба Крона і тому подібне (M.D. Houslay et al., Drug Discovery Today 10 (22), 2005, pp. 1503-1519). Оскільки пацієнти з атопічним дерматитом (AD) мають підвищену активність PDE, інгібування PDE4 представляло б також, мабуть, життєздатне лікування для AD (Journal of Investigative Dermatology (1986), 87(3), 372-6). Сімейство генів PDE4 складається щонайменше з чотирьох генів: А, В, С і D, які мають високий ступінь гомології (V. Boswell Smith and D. Spina, Curr. Opinion Investig. Drugs 6(11), 2006, pp. 1136-1141). Чотири ізоформи PDE4 по-різному експресуються в різних типах тканин і клітин. Так, PDE4B переважно експресується в моноцитах і нейтрофілах, але не в корі головного мозку і не в епітеліальних клітинах, в той час як PDE4D експресується в легенях, корі головного мозку, мозочку і Т-лімфоцитах (С. Kroegel and M. Foerster, Exp. Opinion Investig. Drugs 16(1), 2007, pp. 109-124). Вважається, що інгібування PDE4D в мозку асоціюється з негативними впливами, виявленими при клінічному введенні інгібіторів PDE4, передусім, з нудотою і блюванням, в той час як інгібування PDE4B асоціюється з протизапальними впливами (B. Lipworth, Lancet 365, 2005, pp. 167-175). Однак інгібітори PDE, розроблені до теперішнього часу, як вважається, не є специфічними відносно будь-якої з чотирьох ізоформ PDE4. Численні інгібітори PDE4 досліджують відносно їх терапевтичного впливу на запальні захворювання, передусім, на астму, запальне захворювання шлунка і COPD. Перший з них теофілін, являє собою слабкий, неселективний інгібітор фосфодіестерази, що використовується при лікуванні респіраторних захворювань, таких як астма і COPD. Лікування теофіліном може, однак, давати як помірні, так і важкі негативні впливи, наприклад, аритмію і конвульсії, що обмежують клінічне застосування теофіліну (Kroegel and Foerster, вище). Оскільки фосфодіестераза залишається привабливою метою для протизапальної терапії, дещо інших, більш селективних інгібіторів PDE4 розроблені і досліджені в клінічних умовах. Клінічна розробка багатьох інгібіторів PDE4 першого покоління, таких як роліпрам, перервана через побічні впливи, що обмежують дозу, передусім через нудоту і блювання. Інгібітори PDE4 другого покоління СО значно менш вираженими негативними впливами знаходяться в цей час на клінічних випробуваннях (Houslay, вище). Розроблені останнім часом інгібітори PDE-4 описані, наприклад, в EP 0771794 і EP 0943613. WO 96/31476 описує 4-заміщені-3,5-дихлорпіридини, що структурно розрізнюються, які є інгібіторами фосфодіестерази циклічного AMP. WO 2008/104175 описує 4-заміщені сполуки 3,5-дихлорпіридину, де замісник містить спіробензодіоксольну або бензодіоксепінову гетероциклічну кільцеву систему. Ці сполуки описані як інгібітори PDE4 і призначені для місцевого введення, оскільки вони піддаються деградації, коли вводяться перорально. Огляд доклінічних і клінічних випробувань з селективними інгібіторами PDE4, включаючи інгібітори, наприклад, призначені для лікування атопічного дерматиту і псоріазу, з'явився нещодавно в Inflammation & Allergy: Drug Targets, 2007, 6(1), 17-26. Все ще є потреба в розробці нових інгібіторів PDE4, які мають більш сприятливе терапевтичне вікно, тобто менші негативні впливи при пероральному введенні, в той же час зберігаючи свій терапевтичний протизапальний вплив. Суть винаходу Автори несподівано виявили, що сполуки за даним винаходом демонструють інгібіторну активність відносно PDE4 при пероральному введенні і можуть бути корисними як терапевтичні агенти для системного лікування запальних алергічних захворювань, таких як бронхіальна астма, COPD, алергічний риніт і нефрит; аутоіммунних захворювань, таких як ревматоїдний 1 UA 109140 C2 5 10 15 20 25 30 35 40 45 50 артрит, множинний склероз, хвороба Крона і системний червоний вовчак; захворювань центральної нервової системи, таких як депресія, амнезія та деменція; патології органів, пов'язаної з ішемічним рефлюксом, що викликається серцевою недостатністю, шоку і цереброваскулярних захворювань, і тому подібне; діабету, стійкого до інсуліну; поранень та інших захворювань, де запалення грає роль в етіології або розвитку захворювання. Сполуки за даним винаходом можуть також бути корисними при запобіганні, лікуванні або послабленні різних захворювань, таких як шкірні захворювання або стани, такі як проліферативні та запальні пошкодження шкіри і, зокрема, псоріазу, запалення епідермісу, облисіння, атрофії шкіри, атрофії шкіри, що викликається стероїдами, старіння шкіри, фотостаріння шкіри, акне, дерматиту, атопічного дерматиту, себорейного дерматиту, контактного дерматиту, кропивниці, пруриту і екземи. Відповідно, даний винахід стосується сполуки загальної формули I , де кожний з m і n незалежно являє собою 0 або 1; R1 і R2 - разом з атомом вуглецю, до якого вони приєднані, утворюють гетероциклічне кільце, що містить один або два гетероатоми, вибраних з кисню, сірки, -S(О)- і -S(О)2-; R3 являє собою -CHF2, -CF3, -OCHF2, -OCF3, -SCHF2 або -SCF3; X являє собою зв'язок, -CH2-, або -NH-; А являє собою арил, циклоалкіл, циклоалкеніл, арилалкіл, гетероарил, гетероарилалкіл, гетероциклоалкіл або гетероциклоалкеніл, необов'язково заміщені одним або декількома однаковими або різними замісниками, вибраними з R4; і R4 являє собою водень, аміно, тіоксо, алкіл, галогеналкіл, гідроксіалкіл, алкокси, галогеналкокси, галоген, оксо, тіа або гідрокси; або до їх фармацевтично прийнятної солі, гідрату або сольвату. Сполуки схожої хімічної структури відомі з WO 2008/104175. Ці сполуки, як правило, відомі як такі, що швидко метаболізуються і дезактивуються при системному/пероральному введенні, оскільки метокси група (R3=OCH3) розщеплюється до гідроксильної групи (R3=OH), як показано в прикладі 15. Однак в сполуках за даним винаходом метаболізм R 3 і, отже, дезактивація істотно уповільнена. Таким чином, наприклад, коли А являє собою 3,5-дихлорпіридин, сполуки формули IIa метаболізуються до метаболічно більш стабільного і активного н-оксиду (IIb), а коли А являє собою 3,5-дихлорпіридин-N-оксид, сполуки, як правило, є метаболічно стабільними, роблячи сполуки корисними для системного, зокрема, перорального введення дивись приклад 15. В іншому аспекті даний винахід стосується сполук загальної формули I для використання в терапії. Докладний опис винаходу Визначення Термін "вуглеводневий радикал" призначений для позначення радикала, що містить тільки атоми водню і вуглецю, він може містити одну або декілька подвійних і/або потрійних зв'язків вуглець-вуглець і він може містити циклічні залишки в поєднанні з розгалуженими або лінійними залишками. Вказаний вуглеводень містить 1-20 атомів вуглецю, а переважно, містить 1-12, наприклад, 1-6, наприклад, 1-4, наприклад, 1-3, наприклад, 1-2 атому вуглецю. Термін включає алкіл, алкеніл, циклоалкіл, циклоалкеніл, алкініл і арил, арилалкіл. Термін "арил" призначений для позначення радикала з ароматичних карбоциклічних кілець, що містить 6-20 атомів вуглецю, наприклад, 6-14 атомів вуглецю, переважно 6-10 атомів вуглецю, зокрема, з 5- або 6-членних кілець, необов'язково конденсованих карбоциклічних кілець щонайменше з одним ароматичним кільцем, таким як феніл, нафтил, інденіл і інданіл. Термін "гетероарил" призначений для позначення радикалів з гетероциклічних ароматичних кілець, що містять 1-6 гетероатомів (вибраних з О, S і N) і 1-20 атомів вуглецю, наприклад, 1-5 гетероатомів і 1-10 атомів вуглецю, наприклад, 1-5 гетероатомів і 1-6 атомів вуглецю, 2 UA 109140 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, 1-5 гетероатомів і 1-3 атомів вуглецю, зокрема, з 5- або 6-членних кілець з 1-4 гетероатомами, вибраними з О, S і N, або необов'язково конденсованих біциклічних кілець з 1-4 гетероатомами, і де щонайменше одне кільце є ароматичним, наприклад, піридилу, хінолілу, ізохінолілу, індолілу, тетразолілу, тіазолілу, імідазолілу, піразолілу, оксазолілу, ізоксазолілу, тієнілу, піразинілу, ізотіазолілу, бензимідазолілу і бензофуранілу. У даному контексті термін "алкіл" призначений для позначення радикала, одержаного, коли один атом водню видаляють з вуглеводню. Вказаний алкіл містить 1-20, переважно 1-12, наприклад, 1-6, наприклад, 1-4 атомів вуглецю. Термін включає підкласи нормального алкілу (налкіл), вторинного і третинного алкілу, такого як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізопентил, гексил та ізогексил. Термін "циклоалкіл" призначений для позначення насиченого циклоалканового радикала, що містить 3-20 атомів вуглецю, переважно 3-10 атомів вуглецю, зокрема, 3-8 атомів вуглецю, наприклад, 3-6 атомів вуглецю, включаючи конденсовані біциклічні кільця, наприклад, циклопропілу, циклобутилу, циклопентилу, циклогексилу або циклогептилу. Термін "гетероциклоалкіл" призначений для позначення циклоалканового радикала, як описано вище, де один або декілька атомів вуглецю замінені гетероатомами, що містить 1-19 атомів вуглецю, наприклад, 2-4 атомів вуглецю, що додатково містить 1-6 гетероатомів, переважно 1, 2 або 3 гетероатоми, вибраних з О, N або S, який може необов'язково бути однократно або двократно окисненим, наприклад, [1,3]діоксолу, оксетану, [1,3]діоксолану, [1,3]діоксану, тетрагідротіопірану, тетрагідротіопіран-1,1-діоксиду, тетрагідротіопіран-1-оксиду, піперидину, тетрагідротіофену, [1,3]дитіану, тіетану, [1,3]дитіан-1,3-діоксиду або тіетан-1-оксиду, або що містить конденсовані біциклічні кільця з 1-4 гетероатомами, де щонайменше одне кільце містить гетероатом, і де інше кільце може являти собою, наприклад, карбоциклічне кільце, наприклад, ізоіндоліл. Термін "циклоалкеніл" призначений для позначення моно-, ди- три- або тетраненасищених неароматичних циклічних вуглеводневих радикалів, що містять 3-20 атомів вуглецю, включаючи конденсовані біциклічні кільця, як правило, які містять 3-10 атомів вуглецю, наприклад, 3, 4, або 6 атомів вуглецю, наприклад, циклопропенілу, циклобутенілу, циклопентенілу, циклогексенілу, циклогептенілу. Термін "гетероциклоалкеніл" призначений для позначення циклоалкенового радикала, як описано вище, де один або декілька атомів вуглецю замінені гетероатомами, що містить 1-19 атомів вуглецю, наприклад, 2-4 атомів вуглецю, що додатково містить 1-6 гетероатомів, переважно 1, 2 або 3 гетероатоми, вибраних з О, N, або S, включаючи конденсовані біциклічні кільця з 1-4 гетероатомами, де щонайменше одне кільце містить гетероатом і де інше кільце може являти собою, наприклад, карбоциклічне кільце, наприклад, дигідрофуранилу або 2,5дигідро-1H-піролілу. Термін "арилалкіл" призначений для позначення арильного радикала, як визначено вище, ковалентно приєднаного до алкільної групи, наприклад, бензилу. Термін "гетероарилалкіл" призначений для позначення гетероарильного радикала, як визначено вище, ковалентно приєднаного до алкільної групи. Термін "галоген" призначений для позначення замісника з 7-ої головної групи Періодичної таблиці, такого як фтор, хлор, бром і йод. Термін "галогеналкіл" призначений для позначення алкільної групи, як визначено вище, заміщеної одним або декількома атомами галогену, як визначено вище, наприклад, дифторметилу. Термін "гідроксіалкіл" призначений для позначення алкільної групи, як визначено вище, заміщеної однією або декількома гідроксигрупами, наприклад, гідроксиметилу, гідроксіетилу, гідроксипропілу. Термін "алкокси" призначений для позначення радикала формули -OR', де R' являє собою алкіл, як показано вище, наприклад, метокси, етокси, н-пропокси, ізопропокси, бутокси і тому подібне. Термін "алкоксикарбоніл" призначений для позначення радикала формули -C(О)-O-R', де R' являє собою алкіл, як показано вище, наприклад, метоксикарбонілу, етоксикарбонілу, нпропоксикарбонілу, ізопропоксикарбонілу і тому подібне. Термін "алкілкарбоніл" призначений для позначення радикала формули -C(О)-R', де R' являє собою алкіл, як показано вище, наприклад, етаноїлу, ацетилу. Термін "гетероциклічне кільце" призначене для позначення гетероарилу, гетероциклоалкілу і гетероциклоалкенілу, де один або декілька атомів вуглецю замінені гетероатомами, що містить 1-19 атомів вуглецю, наприклад, 2-4 атомів вуглецю, що додатково містить 1-6 гетероатомів, переважно 1, 2 або 3 гетероатоми, вибраних з О, N, або S, який може бути необов'язково 3 UA 109140 C2 5 10 15 20 25 30 35 однократно або двократно окисненим, наприклад, [1,3]діоксолу, оксетану, [1,3]діоксолану, [1,3]діоксану, тетрагідротіопірану, тетрагідротіопіран-1,1-діоксиду, тетрагідротіопіран-1-оксиду, піперидину, тетрагідротіофену, [1,3]-дитіану, тіетану, [1,3]-дитіан-1,3-діоксиду або тіетан-1оксиду, або що включає конденсовані біциклічні кільця з 1-4 гетероатомами, де щонайменше одне кільце містить гетероатом і де інше кільце може, наприклад, являти собою карбоциклічне кільце, наприклад, ізоіндолілу. Термін "фармацевтично прийнятна сіль" призначений для позначення солей, одержаних за допомогою взаємодії сполуки формули I з відповідною неорганічною або органічною кислотою, такою як хлористоводнева, бромистоводнева, йодистоводнева, сірчана, азотна, фосфорна, мурашина, оцтова, 2,2-дихлороцтова, адипінова, аскорбінова, L-аспарагінова, L-глютамінова, галактарова, молочна, малеїнова, L-яблучна, фталева, лимонна, пропіонова, бензойна, глутарова, глюконова, D-глюкуронова, метансульфонова, саліцилова, бурштинова, малонова, винна, бензолсульфонова, етан-1,2-дисульфонова, 2-гідрокси етансульфонова кислота, толуолсульфонова, сульфамінова або фумарова кислота. Фармацевтично прийнятні солі сполуки формули I можуть також бути одержані за допомогою взаємодії з відповідною основою, такою як гідроксид натрію, гідроксид калію, гідроксид магнію, гідроксид кальцію, гідроксид срібла, аміак або що-небудь подібне, або з відповідними нетоксичними амінами, такими як нижчі алкіламіни, наприклад, триетиламін, гідрокси-нижчі алкіламіни, наприклад, 2гідроксіетиламін, біс-(2-гідроксіетил)амін, циклоалкіламіни, наприклад, дициклогексиламін або бензиламіни, наприклад, N, N'-дибензилетилендіамін і дибензиламін, або з L-аргініном або Lлізином. Солі, одержані за допомогою взаємодії з відповідною основою, включають, але, не обмежуючись цим, солі натрію, солі холіну, солі 2-(диметиламіно)етанолу, солі 4-(2гідроксіетил)морфоліну, солі L-лізину, солі н-(2-гідроксіетил)піролідину, солі етаноламіну, солі калію, солі тетрабутиламонію, солі бензилтриметиламонію, солі цетилтриметиламонію, солі тетраметиламонію, солі тетрапропіламонію, солі тріс(гідроксиметил)амінометану, солі н-метилD-глюкаміну, солі срібла, солі бензетонію і солей триетаноламіну. Термін "сольват" призначений для позначення частинок, одержаних за допомогою взаємодії між сполукою, наприклад, сполукою формули I, і розчинником, наприклад, спиртом, гліцеролом або водою, де вказані частинки знаходяться в твердій формі. Коли розчинник являє собою воду, вказані частинки згадуються як гідрат. Варіанти здійснення даного винаходу У переважних варіантах здійснення даний винахід стосується сполук загальної формули I, де X являє собою -CH2- або -NH-. В іншому варіанті здійснення даний винахід стосується сполук загальної формули IIa або IIb 4 UA 109140 C2 5 10 15 20 25 30 35 40 45 , де m, n, R1, R2 і R3 є такими, як описано вище. В одному з варіантів здійснення як m, так і n в формулі IIa і IIb дорівнюють 0. В іншому варіанті здійснення як m, так і n в формулі IIa і IIb дорівнюють 1. В одному з варіантів здійснення R3 являє собою -OCHF2 або -OCF3, наприклад, -OCHF2. В іншому варіанті здійснення R3 являє собою -SCHF2 або -SCF3. В одному з варіантів здійснення R1 і R2, разом з атомом вуглецю, до якого вони приєднані, утворюють 4-, 5- або 6-членне гетероциклічне кільце. Гетероциклічне кільце може містити один гетероатом, наприклад, вибраний з кисню або -S(О)2. Конкретні приклади гетероциклічного кільця являють собою тетрагідропіран, оксетан, [1,3]діоксолан, [1,3]діоксан, тетрагідротіопіран, тетрагідротіопіран-1,1діоксид, тетрагідротіопіран-1-оксид, тетрагідротіофен, [1,3]дитіан, тіетан, [1,3]дитіан-1,3-діоксид, тіетан-1-оксид або тіетан-1,1-діоксид. Конкретні приклади сполук за даним винаходом являють собою: 2-(3,5-Дихлорпіридин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін-3(4H),3'оксетан]-6-іл}етанон (сполука 101) 2-(3,5-Дихлор-1-оксидо-піридин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін3(4H),3'-оксетан]-6-іл}етанон (сполука 102) 2-(3,5-Дихлорпіридин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін-3(41-1), 4'тетрагідропіран]-6-іл}етанон (сполука 103) 2-(3,5-Дихлор-1-оксидо-піридин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін3(4H),4'-тетрагідропіран]-6-іл}етанон (сполука 104) 2-(3,5-Дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол2,4'-(4H)-піран]-4-іл)етанон (сполука 105) 2-(3,5-Дихлор-1-оксидо-піридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-терагідро-спіро[1,3бензодіоксол-2,4'-(4H)-піран]-4-іл)етанон (сполука 106) 2-(3,5-Дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол2,4'-(4H)-тіопіран]-4-іл)етанон (сполука 107) 2-(3,5-Дихлор-1-оксидо-піридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-тіопіран-1',1'-діоксид]-4-іл)етанон (сполука 108) 2-(3,5-Дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол2,4'-(4H)-тіопіран-1',1'-діоксид]-4-іл)етанон (сполука 109) N-(3,5-Дихлор-4-піридил)-7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'(4H)-тіопіран]-4-карбамід (сполука 110) N-(3,5-дихлор-1-оксо-4-піридил)-7-(дифторметокси)-1',1'-діоксо-спіро[1,3-бензодіоксол-2,4'тіан]-4-карбоксамід (сполука 111) Сполуки за даним винаходом можуть, як правило, мати молекулярну масу нижче 800 Дальтон, наприклад, нижче 750 Дальтон, наприклад, нижче 700 Дальтон або нижче 650, 600, 550 або 500 Дальтон. Сполуки за даним винаходом можуть бути одержані в кристалічній формі або безпосередньо за допомогою концентрування з органічного розчинника, або за допомогою кристалізації або перекристалізації з органічного розчинника або суміші вказаного розчинника і співрозчинника, який може бути органічним або неорганічним, таким як вода. Кристали можуть бути виділені по суті в формі, яка не містить розчинник, або як сольват, такий як гідрат. Даний винахід охоплює всі кристалічні модифікації і форми, а також їх суміші. Сполуки за даним винаходом можуть містити або не містити асиметрично заміщені (хіральні) атоми вуглецю, які приводять до існування ізомерних форм, наприклад, енантіомерів 5 UA 109140 C2 5 10 15 20 25 30 35 40 45 50 55 60 і, можливо, діастереомерів. Даний винахід стосується всіх таких ізомерів або в чистій формі, або у вигляді їх суміші (наприклад, рацемати). Чисті стереоізомерні форми сполук і проміжних сполук за даним винаходом можуть бути одержані за допомогою застосування процедур, відомих в даній галузі. Різні ізомерні форми можуть бути розділені за допомогою фізичних методів розділення, таких як селективна кристалізація і за допомогою хроматографічних методик, наприклад, рідинної хроматографії з використанням хіральних нерухомих фаз. Енантіомери можуть бути відділені один від одного за допомогою селективної кристалізації їх діастереомерних солей з оптично активними амінами, такими як 1-ефедрин. Альтернативно, енантіомери можуть бути відділені за допомогою хроматографічних технологій з використанням хіральних нерухомих фаз. Вказані чисті стереоізомерні форми можуть також бути одержані з відповідних чистих стереоізомерних форм відповідних вихідних матеріалів, за умови, що реакція відбувається стереоселективно або стереоспецифічно. Є переважним, якщо бажаним є конкретний стереоізомер, що вказана сполука буде синтезуватися за допомогою стереоселективних або стереоспецифічних способів одержання. Ці способи будуть переважно використовувати хіральні чисті вихідні матеріали. Сполуки за даним винаходом, необов'язково, в комбінації з іншими активними сполуками, можуть бути корисними для лікування шкірних захворювань або станів, або гострих або хронічних розладів з пошкодженнями шкіри, зокрема, для лікування проліферативних і запальних розладів шкіри, псоріазу, раку, запалення епідермісу, облисіння, атрофії шкіри, атрофії шкіри, що викликається стероїдами, старіння шкіри, фотостаріння шкіри, акне, дерматиту, атопічного дерматиту, себорейного дерматиту, контактного дерматиту, кропивниці, пруриту і екземи. Крім того, що вони корисні для лікування людей, сполуки за даним винаходом можуть бути також корисними для ветеринарного лікування тварин, включаючи ссавців, таких як коні, велика рогата худоба, вівці, свині, собаки і кішки. Для застосування в терапії сполуки за даним винаходом, як правило, знаходяться в формі фармацевтичної композиції. Отже, даний винахід стосується фармацевтичної композиції, що містить сполуки формули Ia або Ib, необов'язково, разом з одним або декількома іншими терапевтично активними сполуками, разом з фармацевтично прийнятним ексципієнтом або зв'язуючим. Ексципієнт повинен бути "прийнятним", тобто бути сумісним з іншими інгредієнтами композицій і не шкідливим для того, хто її приймає. Зручно, щоб активний інгредієнт становив 0,05-99,9 % маси препарату. У вигляді одиничної дозованої форми сполука може вводитися один або декілька разів в день через відповідні інтервали, що завжди залежать, однак, від стану пацієнта, і згідно з розпорядженням, яке робить лікуючий лікар. Зручно, щоб одинична дозована форма препарату містила в межах між 0,1 мг і 1000 мг, переважно, в межах між 1 мг і 100 мг, наприклад, 5-50 мг сполуки формули I. Відповідне дозування сполуки за даним винаходом буде залежати, серед іншого, від віку і стану пацієнта, від важкості захворювання, яке повинно лікуватися і від інших факторів, добре відомих практикуючому лікареві. Сполука може вводитися або перорально, або парентерально, або місцевим чином відповідно до різних тимчасових графіків дозування, наприклад, щодня або з тижневими інтервалами. Як правило, одна доза буде становити в межах від 0,01 до 400 мг/кг маси тіла. Сполука може вводитися як болюс (тобто вся щоденна доза вводиться за один раз) або в розділених дозах два або більше разів на день. У контексті місцевого лікування може бути більш прийнятним згадка "використовуваної одиничної дози", яка означає окрему дозу, яку можна вводити пацієнту і яка може бути зручною при поводженні і упаковуванні, яка залишається у вигляді фізично і хімічно стабільної окремої дози, що містить або активний матеріал сам по собі, або його суміш з твердими або рідкими фармацевтичними розріджувачами або носіями. Термін "використовувана одинична доза", в поєднанні з місцевим застосуванням означає унітарну, тобто окрему дозу, яку можна вводити місцевим чином пацієнту при нанесенні на квадратний сантиметр інфікованої площі від 0,1 мг до 10 мг, а переважно від 0,2 мг до 1 мг активного інгредієнта, що розглядається. Передбачається також, що в певних режимах лікування може бути вигідним введення через більш тривалі інтервали, наприклад, через день, кожний тиждень або через ще більш тривалі інтервали. Якщо лікування включає введення іншої терапевтично активної сполуки, рекомендується проконсультуватися з Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9th Ed., J.G. Hardman and L.E. Limbird (Eds.), McGraw-Hill 1995, відносно корисного дозування вказаних сполук. 6 UA 109140 C2 5 10 15 20 25 30 35 40 45 50 55 60 Введення сполуки за даним винаходом разом з однією або декількома іншими активними сполуками може здійснюватися або одночасно, або послідовно. Препарати включають, наприклад препарати в формі, придатній для перорального (включаючи уповільнене або розподілене за часом вивільнення), ректального, парентерального (включаючи підшкірне, внутрішньочеревне, внутрішньом'язове, внутрішньосуглобове і внутрішньовенне), трансдермального, офтальмічного, місцевого, дермального, назального або букального введення. Місцеве введення препарату, що заявляється, є особливо придатним для застосування. Препарати можуть зручно бути представлені в стандартній дозованій формі і можуть бути одержані за допомогою будь-якого зі способів, добре відомих в галузі фармації, наприклад, як описано в Remington, The Science and Practice of Pharmacy, 20th ed., 2000. Всі способи включають стадію приведення активного інгредієнта в асоціацію з носієм, який становить один або декілька допоміжних інгредієнтів. Як правило, препарати виготовляють за допомогою приведення активного інгредієнта в однорідну і дрібнодисперсну асоціацію з рідким носієм або дрібнодисперсним твердим носієм, або як з тим, так з іншим, а потім, якщо це необхідно, формування продукту у вигляді бажаного препарату. Препарати за даним винаходом, придатні для перорального введення, можуть знаходитися в формі окремих одиниць, таких як капсули, саше, таблетки або пастилки, кожна з них містить задану кількість активного інгредієнта; в формі порошку або гранул; в формі розчину або суспензії у водній рідині або неводній рідині, такій як етанол або гліцерин; або в формі емульсії типу масло-в-воді, або емульсії типу вода-в-маслі. Такі олії можуть являти собою їстівні олії, такі, наприклад, як бавовняна олія, кунжутна олія, кокосова олія або арахісова олія. Придатні для використання диспергуючі або суспендуючі агенти для водних суспензій включають синтетичні або природні смоли, такі як смола трагаканту, альгінат, смола акації, декстран, натрій карбоксиметилцелюлоза, желатин, метилцелюлоза, гідроксипропілметилцелюлоза, гідроксипропілцелюлоза, карбомери і полівінілпіролідон. Активні інгредієнти також можуть вводитися в формі болюсу, електуарію або пасти. Таблетка може бути виготовлена за допомогою пресування або формування активного інгредієнта необов'язково разом з одним або декількома допоміжними інгредієнтами. Пресовані таблетки можуть бути одержані за допомогою пресування у відповідній машині активного інгредієнта (інгредієнтів) в сипкій формі, такій як порошок або гранули, необов'язково змішаного СО зв'язувальною речовиною, такою, наприклад, як лактоза, глюкоза, крохмаль, желатин, смола акації, смола трагаканту, альгінат натрію, карбоксиметилцелюлоза, метилцелюлоза, гідроксипропілметилцелюлоза, поліетиленгліколь, віск або будь-що подібне; лубрикантом, таким, наприклад, як олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію, або що-небудь подібне; з дезинтегрантом, таким, наприклад, як крохмаль, метилцелюлоза, агар, бентоніт, натрій кроскармелоза, натрій крохмаль гліколят, кросповідон, або що-небудь подібне, або з диспергуючим агентом, таким як полісорбат 80. Формовані таблетки можуть бути одержані за допомогою формування, у відповідній машині, суміші порошкоподібного активного інгредієнта і відповідного носія, зволоженого інертним рідким розріджувачем. Препарати для ректального введення можуть знаходитися в формі супозиторіїв, в яких сполуки за даним винаходом змішують з твердими продуктуми, які мають низьку температуру плавлення водорозчинними або нерозчинними, такими як олія какао, гідровані рослинні олії, поліетиленгліколь або складний ефір жирних кислот і поліетиленгліколів, в той час як еліксири можуть бути одержані з використанням міристилпальмітату. Зручно, щоб препарати, придатні для парентерального введення, містили стерильний олійний або водний препарат активних інгредієнтів, який переважно є ізотонічним з кров'ю пацієнта, наприклад, ізотонічний сольовий розчин, ізотонічний розчин глюкози або буферний розчин. Препарат може бути зручним стерилізувати, наприклад, за допомогою фільтрування через фільтр, який утримує бактерії, додавання до препарату стерилізуючого агента, опромінення препарату або нагрівання препарату. Ліпосомні препарати, як описано, наприклад, в Encyclopedia of Pharmaceutical Technology, vol.9, 1994, також є придатними для парентерального введення. Альтернативно, сполуки формули I можуть бути представлені як стерильний, твердий препарат, наприклад, порошок, одержаний сушінням виморожування, який легко розчиняється в стерильному розчиннику безпосередньо перед використанням. Трансдермальні препарати можуть знаходитися в формі пластиру або пов'язки. Препарати, придатні для офтальмічного введення, можуть знаходитися в формі стерильного водного препарату активних інгредієнтів, який може знаходитися в 7 UA 109140 C2 5 10 15 20 25 30 35 40 45 50 55 60 мікрокристалічній формі, наприклад, в формі водної мікрокристалічної суспензії. Ліпосомні препарати або біодеградовані полімерні системи, наприклад, як описано в Encyclopedia of Pharmaceutical Technology, vol.2, 1989, також можуть використовуватися, щоб представити активний інгредієнт для офтальмічного введення. Препарати, придатні для місцевого або офтальмічного введення, включають рідкі або напіврідкі препарати, такі як лініменти, лосьйони, гелі, спреї, піни, емульсії типу масло-в-воді або типу вода-в-маслі, такі як креми, мазі або пасти; або розчини або суспензії, такі як краплі. Композиції для офтальмічного лікування можуть переважно додатково містити циклодекстрин. Для місцевого введення сполука формули I може, як правило, бути присутня в кількості від 0,01 до 20 % мас. композиції, наприклад, 0,1 % приблизно до 10 %, але може також бути присутня в кількості приблизно до 50 % композиції. Препарати, придатні для назального або букального введення, включають порошок, саморозпилюваний і препарати, що розпилюються, такі як аерозолі і атомайзери. Такі препарати описані більш детально, наприклад, в Modern Pharmaceutics, 2nd ed., G.S. Banker and C.T. Rhodes (Eds.), page 427-432, Marcel Dekker, New York; Modern Pharmaceutics, 3th ed., G.S. Banker and C.T. Rhodes (Eds.), page 618-619 and 718-721, Marcel Dekker, New York і в Encyclopedia of Pharmaceutical Technology, vol. 10, J. Swarbrick and J.C. Boylan (Eds), page 191221, Marcel Dekker, New York. У доповнення до вказаним вище інгредієнтів, препарати сполуки формули I можуть включати один або декілька додаткових інгредієнтів, таких як розріджувачі, буфери, ароматизуючі агенти, барвник, поверхово-активні агенти, загущувальні агенти, консерванти, наприклад, метилгідроксибензоат (включаючи антіоксиданти), емульгуючі агенти і тому подібне. Коли активний інгредієнт вводиться в формі солей з фармацевтично прийнятними нетоксичними кислотами або основами, переважні солі є, наприклад, легко водорозчинними або трохи розчинними у воді для одержання конкретної і відповідної швидкості поглинання. Фармацевтична композиція може додатково містити один або декілька інших активних компонентів, що звичайно використовуються при лікуванні шкірних захворювань або станів, наприклад, вибраних з групи, що складається з глюкокортикоїдів, вітаміну D і аналогів вітаміну D, антигістамінних препаратів, антагоністів фактора активації тромбоцитів (PAF), антихолінергічних агентів, метилксантинів, β-адренергічних агентів, інгібіторів COX-2, саліцилатів, індометацину, флуфенамату, напроксену, тимегадину, солей золота, пеніциламіну, агентів, які понижують рівень холестерину в сироватці, ретиноїдів, солей цинку, саліцилазосульфапіридину та інгібіторів кальцинуріну. Даний винахід описується більш детально в прикладах, які йдуть далі, які ні в якому випадку не призначені для обмеження об'єму даного винаходу згідно з формулою винаходу. Способи одержання Сполуки за даним винаходом можуть бути одержані рядом способів, добре відомих фахівцям в галузі синтезу. Сполуки формули I можуть, наприклад, бути одержані з використанням реакцій і технологій, наведених нижче, разом з способами, відомими в галузі синтетичної органічної хімії, або їх варіантів, як зрозуміло фахівцеві в даній галузі. Переважні способи включають, але, не обмежуючись цим, ті, які описані нижче. Реакції здійснюють в розчинниках, відповідних використовуваним реагентам і матеріалам і придатних для здійснюваних перетворень. Також, необхідно зрозуміти, що в способах синтезу, описаних нижче, всі запропоновані умови реакції, включаючи вибір розчинника, атмосфери реакції, температури реакції, тривалості експерименту і процедур витягування здійснюють для одержання умов, стандартних для цієї реакції, які повинні бути очевидні фахівцям в даній галузі. Не всі сполуки, що потрапляють в даний клас, можуть бути сумісними з деякими з умов реакції, необхідних в деяких з описуваних способів. Такі обмеження на замісники, які є сумісними з умовами реакції, будуть легко зрозумілі фахівцям в даній галузі, і можна використовувати альтернативні способи. Вихідні матеріали або являють собою відомі сполуки, які є комерційно доступними, або вони можуть бути одержані за допомогою рутинних способів синтезу, добре відомих фахівцям в даній галузі. Сполуки за даним винаходом або будь-яка проміжна сполука можуть бути очищені, з потреби, з використанням стандартних способів, добре відомих фахівцям в галузі синтетичної органічної хімії, наприклад, способів, описаних в "Purification of Laboratory Chemicals", 5th ed. 2003. Вихідні матеріали або являють собою відомі комерційно доступні сполуки, або вони можуть бути одержані за допомогою рутинних способів синтезу, добре відомих фахівцям в даній галузі. Загальні процедури, приклади приготування і приклади 8 UA 109140 C2 1 5 13 Спектри H ядерного магнітного резонансу (ЯМР) реєструють при 300 МГц, а спектри C ЯМР - при 75,6 МГц. Значення хімічного зсуву (δ, в м. д.) приводяться у вказаному розчиннику відносно внутрішнього стандарту тетраметилсілану (δ=0,00) або хлороформу (δ=7,25), або до 13 дейтерованого хлороформу (δ=76,81 для C ЯМР). Приводиться значення мультиплету, або певного дублету (д), триплету (т), квартету (кв)), або немає (м) в зразковій середній точці, якщо не вказаний діапазон, (ушир. с) означає уширений синглет. Використовувані органічні розчинники звичайно є безводними. Хроматографію здійснюють на силікагелі 60 Merck (0,0400,063 мм). Вказані відношення розчинників стосуються об'єм:об'єм, якщо не вказане інше. В описі використовують наступні абревіатури: 10 DCM DMF DMSO Et EtOAc год. л LDA LiHMDS м Me MeOH ЯМР ppt к. т. TsCl THF об'єм. 15 20 25 30 35 Дихлорметан N, N'-диметилформамід диметилсульфоксид етил етилацетат годин літр літій діізопропіламід літій гексаметилдисилазід мілі метил метанол ядерний магнітний резонанс преципітат кімнатна температура п-толуолсульфонілхлорид тетрагідрофуран По об'єму Препаративна ВЕРХ/МС Препаративну ВЕРХ/МС здійснюють на системі Dionex APS з двома препаративними насосами Shimadzu PP150 і мас-спектрометром Thermo MSQ Plus. Колонка: Waters XTerra С-18, 150 мм × 19 мм, 5 мкм; система розчинників: А = вода (0,1 % мурашиної кислоти) і В = ацетонітрил (0,1 % мурашиної кислоти); швидкість потоку = 18 мл/хв; спосіб (10 хв): спосіб з лінійним градієнтом, що змінюється від 10 % В до 100 % В за 6 хвилин, і з витримуванням при 100 % В протягом ще 2 хвилин. Фракції збирають на основі іонних слідів відповідних іонів і сигналу PDA (високочутливого фотоприймача) (240-400 нм). Аналітична ВЕРХ/МС Спосіб А: Аналітичну ВЕРХ/МС здійснюють на системі Dionex APS з аналітичним насосом P680A і мас-спектрометром Thermo MSQ Plus. Колонка: Waters XTerra С-18, 150 мм × 4,6 мм, 5 мкм; система розчинників: А = вода (0,1 % мурашиної кислоти) і В = ацетонітрил (0,1 % мурашиної кислоти); швидкість потоку = 1,0 мл/хв; спосіб (10 хв): спосіб з лінійним градієнтом, що змінюється від 10 % В до 100 % В за 6,6 хвилин, і з витримуванням при 100 % В протягом ще 1,5 хвилин. Спосіб В: Аналітичну ВЕРХ/МС здійснюють на системі, що складається з Waters 2795 HPLC, мас-спектрометра Micromass ZQ, Waters 996 PDA. Колонка: Waters XTerra С-18, 50 мм × 3,0 мм, 5 мкм; система розчинників: А = вода:ацетонітрил 95:5 (0,05 % мурашиної кислоти) і В = ацетонітрил (0,05 % мурашиної кислоти); швидкість потоку = 1,0 мл/хв; спосіб (8 хв): спосіб з лінійним градієнтом, що змінюється від 10 % В до 100 % В за 6,0 хвилин, і з витримуванням при 100 % В протягом 1 хвилини. Загальна процедура одержання: Сполуки за даним винаходом можуть, наприклад, бути одержані таким чином. Сполуки загальної формули IIa і IIb, де n, m, R1, R2 є такими, як визначено вище, і R3=OCF2H, можуть бути одержані таким чином: 9 UA 109140 C2 5 10 15 20 25 30 . Вихідні матеріали формули 3a одержують згідно з СО стандартними процедурами, відомими фахівцям в даній галузі (WO 2008/104175). Селективне деалкілування 3a з використанням сірчистого нуклеофілу, наприклад, трет-додецилмеркаптану, дає 4a. Взаємодія сполук формули 4a з натрій хлордифторацетатом в присутності основи, наприклад, K2CO3, у відповідному розчиннику, такому як DMF, при температурах від кімнатної температури до 140 °C дає сполуки формули IIa. Окиснення IIa за допомогою 3-хлорпербензойної кислоти або суміші H2O2/метилтриоксореній(VII) у відповідному розчиннику, такому як DCM, дає сполуки загальної формули IIb. Сполуки загальної формули I, де X=-NH-, можуть, наприклад, бути одержані, як описано в WO 2008/104175, який тим самим включається як посилання, і, як описано в прикладі 10 і в прикладі 11, в даній заявці. Одержання 1 2-(3,5-Дихлорпіридин-4-іл)-1-{9-гідрокси-спіро[2H-1,5-бензодіоксепін-3(4H),3'-оксетан]-6іл}етанон (сполука 401) . До розчину 2-(3,5-дихлорпіридин-4-і)-1-{9-метокси-спіро[2H-1,5-бензодіоксепін-3(4H),3'оксетан]-6-іл}етанону (272 мг, 0,7 моль) в безводному DMF (4 мл) додають K 2CO3 (916 мг, 7 моль) і трет-додецилмеркаптан (3,12 мл, 13 моль). Суміш нагрівають при перемішуванні при 140 °C в герметичній пробірці протягом 16 годин. Суміші дають можливість охолодитися до кімнатної температури, і додають воду (20 мл). Після нейтралізації за допомогою 4 н HCl суміш екстрагують DCM. Об'єднану органічну фазу промивають насиченим розчином солі, сушать над MgSO4 і випарюють досуха при зниженому тиску. Хроматографія дає продукт 401. 1 Η ЯМР (300 МГц, DMSO) δ 8,65 (с, 2H), 7,36 (д, J=8,8 Гц, 1H), 6,68 (д, J=8,8 Гц, 1H), 4,64 (с, 2H), 4,54 (с, 2H), 4,53-4,42 (м, 4H), 4,33 (с, 2H). Приклад 1 2-(3,5-Дихлорпіридин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін-3(4H),3'оксетан]-6-іл}етанон (сполука 101) . 10 UA 109140 C2 5 10 15 20 25 30 35 До розчину 2-(3,5-дихлорпіридин-4-іл)-1-{9-гідрокси-спіро[2H-1,5-бензодіоксепін-3(4H),3'оксетан]-6-іл}етанону [401] (1,66 г, 4,2 моль) в DMF (12 мл) і воді (1,3 мл) додають K2CO3 (1,45 г, 10,5 моль) і натрій хлордифторацетат (1,28 г, 8,4 моль). Суміш нагрівають в атмосфері аргону при перемішуванні при 100 °C в герметичній пробірці протягом 1,5 години. Додатково додають 950 мг натрію хлордифторацетату, і нагрівання продовжують протягом 1 години. Додатково додають 950 мг натрію хлордифторацетату і 1,45 г K2CO3, нагрівання продовжують протягом 5 годин. Додатково додають 950 мг натрію хлордифторацетату і 1,45 г K 2CO3, нагрівання продовжують протягом 2 годин. Суміші дають можливість охолодитися до кімнатної температури, додають воду (200 мл) і pH доводять до 3, використовуючи 4 н HCl. Суміш екстрагують DCM, і об'єднану органічну фазу промивають насиченим розчином солі, сушать над MgSO4 і випарюють досуха при зниженому тиску. Хроматографія дає 793 мг продукту 101. 1 H ЯМР (300 МГц, CDCl3) δ 8,51 (с, 2H), 7,46 (д, J=8,7 Гц, 1H), 6,96 (д, J=8,7 Гц, 1H), 6,64 (т, J=74 Гц, 1H), 4,68-4,56 (м, 8H), 4,56-4,46 (ушир. с, 2H). Приклад 2 2-(3,5-Дихлор-1-оксидо-пірідин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін3(4H),3'-оксетан]-6-іл}етанон (сполука 102) . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін3(4H),3'-оксетан]-6-іл}етанону [101] (792 мг, 1,8 моль) в DCM (15 мл) додають 3хлорпербензойну кислоту (1,2 г, 7 моль), і суміш перемішують при кімнатній температурі протягом 4 годин. Додатково додають 3-хлорпербензойну кислоту (0,6 г, 3,5 моль) і перемішування продовжують протягом 16 годин. Реакційну суміш промивають Na 2CO3 і з часом - насиченим розчином солі, сушать над MgSO4 і випарюють досуха при зниженому тиску. Хроматографія дає майже чистий продукт, який з часом суспендують в EtOAc і відфільтровують з одержанням 464 мг 102 1 H ЯМР (300 МГц, CDCl3) δ 8,22 (с, 2H), 7,47 (д, J=8,8 Гц, 1H), 6,97 (д, J=8,8 Гц, 1H), 6,63 (т, J=74 Гц, 1H), 4,70-4,59 (м, 6H), 4,56 (ушир. с, 2H), 4,52 (ушир. с, 2H). Одержання 2 2-(3,5-Дихлорпіридин-4-іл)-1-{9-гідрокси-спіро[2H-1,5-бензодіоксепін-3(4H),4'тетрагідропіран]-6-іл}етанон (сполука 402) . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-{9-метокси-спіро[2H-1,5-бензодіоксепін-3(4H),4'тетрагідропіран]-6-іл}етанону (351 мг, 0,8 моль) в безводному DMF (6 мл) додають K 2CO3 (1,1 г, 8 моль) і трет-додецилмеркаптан (3,8 мл, 16 моль). Суміш нагрівають при перемішуванні при 140 °C в герметичній пробірці протягом 22 годин. Суміші дають можливість охолодитися до кімнатної температури, і додають воду. Після нейтралізації за допомогою 4 н HCl суміш екстрагують DCM (2×50 мл). Об'єднану органічну фазу екстрагують двічі 2 н NaOH. Водну фазу 11 UA 109140 C2 5 10 15 20 25 30 двічі промивають DCM, нейтралізують за допомогою 4 н HCl і на закінчення екстрагують DCM. Органічну фазу промивають насиченим розчином солі, сушать над MgSO 4 і випарюють досуха при зниженому тиску. Хроматографія дає продукт 402 у вигляді жовтого порошку (118 мг) 1 H ЯМР (300 МГц, CDCl3) δ 8,49 (с, 2H), 7,51 (д, J=8,8 Гц, 1H), 6,70 (д, J=8,8 Гц, 1H), 6,30 (с, 1H), 4,60 (с, 2H), 4,27 (с, 2H), 4,21 (с, 2H), 3,91-3,55 (м, 4H), 1,76 (т, J=5,5 Гц, 4H). Приклад 3 2-(3,5-Дихлорпіридин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін-3(4H),4'тетрагідропіран]-6- іл}етанон (сполука 103) . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-{9-гідрокси-спіро[2H-1,5-бензодіоксепін-3(4H),4'тетрагідропіран]-6-іл}етанону [402] (118 мг, 0,28 моль) в безводному DMF (6 мл) додають K2CO3 (76 мг, 0,55 моль) і натрій хлордифторацетат (84 мг, 0,55 моль). Суміш нагрівають в атмосфері аргону при перемішуванні при 100 °C в герметичній пробірці протягом 1,5 години. Додатково додають K2CO3 (76 мг, 0,55 моль) і натрій хлордифторацетат (84 мг, 0,55 моль), і перемішування продовжують при 80 °C протягом 6 годин. Суміші дають можливість охолодитися до кімнатної температури, додають воду, і суміш нейтралізують, використовуючи 4 н HCl. Суміш екстрагують DCM, і об'єднану органічну фазу промивають насиченим розчином солі, сушать над MgSO4 і випарюють досуха при зниженому тиску. Хроматографія дає 40 мг продукту 103. 1 H ЯМР (300 МГц, CDCl3) δ 8,50 (с, 2H), 7,44 (д, J=8,7 Гц, 1H), 6,91 (д, J=8,7 Гц, 1H), 6,63 (т, J=74 Гц, 1H), 4,62 (с, 2H), 4,27 (с, 2H), 4,22 (с, 2H), 3,87-3,58 (м, 4H), 1,85-1,62 (м, 4H). Приклад 4 2-(3,5-Дихлор-1-оксидо-пірідин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін3(4H),4'-тетрагідропіран]-6- іл}етанон (сполука 104) . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-{9-дифторметокси-спіро[2H-1,5-бензодіоксепін3(4H),4'-тетрагідропіран]-6-іл}етанону [103] (37 мг, 0,08 моль) в DCM (3 мл) додають 3хлорпербензойну кислоту (54 мг, 0,3 моль), і суміш перемішують при кімнатній температурі протягом 16 годин. Додатково додають 3-хлорпербензойну кислоту (27 мг, 0,18 моль), і перемішування продовжують протягом 5 годин. Реакційну суміш промивають Na 2CO3, а з часом - насичену розчином солі, сушать над MgSO4 і випарюють досуха при зниженому тиску. Хроматографія дає 33 мг продукту 104. 1 H ЯМР (600 МГц, CDCl3) δ 8,21 (с, 2H), 7,45 (д, J=8,8 Гц, 1H), 6,93 (д, J=8,7 Гц, 1H), 6,64 (т, J=74 Гц, 1H), 4,55 (с, 2H), 4,28 (с, 2H), 4,24 (с, 2H), 3,86-3,61 (м, 4H), 1,89-1,64 (м, 4H). 12 UA 109140 C2 Одержання 3 2-(3,5-Дихлорпіридин-4-іл)-1-(7-гідрокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'-(4H)піран]-4-іл)етанон (сполука 403). 5 10 15 20 25 30 . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-піран]-4-іл)етанону (325 мг, 0,8 моль) в безводному DMF (5 мл) додають K2CO3 (1,1 г, 8 моль) і трет-додецилмеркаптан (3,7 мл, 16 моль). Суміш нагрівають при перемішуванні при 140 °C в герметичній пробірці протягом 16 годин. Суміші дають можливість охолодитися до кімнатної температури, і додають воду. Після нейтралізації за допомогою 4 н HCl суміш екстрагують DCM (2×50 мл). Об'єднану органічну фазу екстрагують двічі 2 н NaOH. Водну фазу промивають двічі DCM, нейтралізують за допомогою 4 н HCl і на закінчення екстрагують DCM (3×75 мл). Органічну фазу сушать над MgSO 4 і випарюють досуха при зниженому тиску. Хроматографія дає продукт 403 у вигляді білого порошку (192 мг). 1 H ЯМР (300 МГц, DMSO) δ 8,65 (с, 2H), 7,95 (с, 1H), 7,25 (д, J=9,0 Гц, 1H), 6,56 (д, J=8,9 Гц, 1H), 4,59 (с, 2H), 3,92-3,67 (м, 4H), 2,21-1,94 (м, 4H). Приклад 5 2-(3,5-Дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол2,4'-(4H)-піран]-4-іл)етанон (сполука 105) . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-гідрокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-піран]-4-іл)етанону [403] (188 мг, 0,47 моль) в безводному DMF (10 мл) додають K2CO3 (98 мг, 0,7 моль) і натрій хлордифторацетат (108,5 мг, 0,7 моль). Суміш нагрівають в атмосфері аргону при перемішуванні при 100 °C в герметичній пробірці протягом 45 хв. Додатково додають K2CO3 (65 мг, 0,47 моль) і натрій хлордифторацетат (72 мг, 0,47 моль), і перемішування продовжують при 100 °C протягом 30 хв. Суміші дають можливість охолодитися до кімнатної температури, фільтрують і випарюють досуха при зниженому тиску. Очищення за допомогою ВЕРХ дає 89 мг продукту 105. 1 H ЯМР (300 МГц, CDCl3) δ 8,52 (с, 2H), 7,46 (д, J=9,1 Гц, 1H), 6,81 (д, J=9,0, 1H), 6,74 (т, J=73 Гц, 1H), 4,60 (с, 2H), 4,05-3,83 (м, 4H), 2,21 (т, J=5,5 Гц, 4H). Приклад 6 2-(3,5-Дихлор-1-оксидо-пірідин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-піран]-4-іл)етанон (сполука 106) 13 UA 109140 C2 5 10 15 20 25 30 . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-піран]-4-іл)етанону [105] (89 мг, 0,2 моль) в дихлорметані (4 мл) додають 30 % H2O2 (68 мкл, 0,6 моль) і метилтриоксореній (VII) (25 мг). Суміш перемішують при кімнатній температурі протягом ночі, додають MnO2 (5 мг) і перемішують протягом 10 хв. Після фільтрування і випарювання досуха при зниженому тиску стандартне очищення за допомогою ВЕРХ дає 33 мг продукту 106. 1 H ЯМР (300 МГц, CDCl3) δ 8,22 (с, 2H); 7,46 (д, J=9,1 Гц, 1H), 6,81 (д, J=9,1 Гц, 1H), 6,74 (т, J=73 Гц, 1H), 4,53 (с, 2H), 4,08-3,88 (м, 4H) 2,21 (т, J=5,5 Гц, 4H). Одержання 4 2-(3,5-Дихлорпіридин-4-іл)-1-(7-гідрокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'-(4H)тіопіран]-4-іл)етанон (сполука 404) . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-тіопіран]-4-іл)етанону (8,3 g, 19,5 моль) в безводному DMF (80 мл) додають K2CO3 (27 г, 195 моль) і трет-додецилмеркаптан (92 мл, 390 моль). Суміш нагрівають при перемішуванні при 140 °C в герметичній пробірці протягом 21 години. Додатково додають K2CO3 (13 г) і трет-додецилмеркаптан (45 мл). Перемішування продовжують протягом додаткових 5 годин. Суміші дають можливість охолодитися до кімнатної температури, і додають воду. Після нейтралізації за допомогою 4 н HCl суміш екстрагують DCM (3×200 мл). Об'єднану органічну фазу промивають насиченим розчином солі, сушать над MgSO 4 і випарюють досуха при зниженому тиску. Флеш-хроматографія дає сирий продукт, який повторно розчиняють в DCM, а з часом двічі екстрагують 2 н NaOH. Водну фазу двічі промивають DCM, нейтралізують за допомогою 4 н HCl, а на закінчення екстрагують DCM (3×150 мл). Органічну фазу промивають насиченим розчином солі, сушать над MgSO 4 і випарюють досуха при зниженому тиску. Хроматографія дає 2,56 г продукту 404. 1 H ЯМР (300 МГц, CDCl3) δ 8,52 (с, 2H), 7,38 (д, J=9,0 Гц, 1H), 6,54 (д, J=9,0 Гц, 1H), 4,60 (с, 2H), 2,94-2,77 (м, 4H), 2,46-2,15 (м, 4H). Приклад 7 2-(3,5-Дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-терагідро-спіро[1,3-бензодіоксол2,4'-(4H)-тіопіран]-4-іл)етанон (сполука 107) 14 UA 109140 C2 5 10 15 20 25 . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-гідрокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-тіопіран]-4-іл)етанону [404] (4,27 г, 10,4 моль) в безводному DMF (120 мл) додають K2CO3 (2,16 г, 15,6 моль) і натрій хлордифторацетат (2,47 г, 15,6 моль). Суміш нагрівають в атмосфері аргону при перемішуванні при 100 °C протягом 40 хв. Суміші дають можливість охолодитися до кімнатної температури, додають воду (500 мл) і екстрагують EtOAc (2×400 мл). Об'єднану органічну фазу промивають водою (500 мл) і насиченим розчином NaCl (150 мл) з подальшим сушінням над Na2SO4 і випарюють досуха при зниженому тиску. Хроматографія дає 2,64 г продукту 107 жовто-білого порошку. 1 H ЯМР (400 МГц, DMSO) δ 8,67 (с, 2H), 7,61-7,09 (м, 2H), 6,93 (д, J=9,0 Гц, 1H), 4,67 (с, 2H), 3,05-2,74 (м, 4H), 2,42-2,16 (м, 4H). Приклад 8 2-(3,5-Дихлор-1-оксидо-пірідин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-тіопіран-1',1'-діоксид]-4-іл)етанон (сполука 108). . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-тіопіран]-4-іл)етанону [107] (2,64 г, 5,7 моль) в хлороформі (40 мл) повільно додають розчин 3-хлорпербензойної кислоти (5,76 г, 25,7 моль) в хлороформі (50 мл), підтримуючи температуру в межах між 21 °C і 24 °C. Суміш перемішують при кімнатній температурі протягом 19 годин і додають до розчину NaHCO 3 (водний розчин). Органічну фазу промивають водним розчином NaCl. Водні фази екстрагують DCM. Об'єднані органічні фази сушать над Na2SO4 і випарюють досуха при зниженому тиску. Хроматографія дає 1,95 г продукту 108 у вигляді білого порошку. 1 H ЯМР (300 МГц, CDCl3) δ 8,23 (с, 2H), 7,52 (д, J=9,1 Гц, 1H), 6,89 (д, J=9,1 Гц, 1H), 6,70 (т, J=72 Гц, 1H), 4,48 (с, 2H), 3,50-3,18 (м, 4H), 2,83-2,55 (м, 4H). Одержання 5 2-(3,5-Дихлорпіридин-4-іл)-1-(7-гідрокси-2',3',5',6'-тетрагідро-спіро[1,3-бензо-діоксол-2,4'(4H)-тіопіран-1',1'-діоксид]-4-іл)етанон (сполука 405) 15 UA 109140 C2 5 10 15 20 25 30 . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-тіопіран-1',1'-діоксид]-4-іл)етанону (415 мг, 0,91 моль) в безводному DMF (10 мл) додають K2CO3 (1,25 г, 9,1 моль) і трет-додецилмеркаптан (4,3 мл, 18 моль). Суміш нагрівають при перемішуванні при 140 °C в герметичній пробірці протягом 16 годин. Суміші дають можливість охолодитися до кімнатної температури, і додають воду. Після нейтралізації за допомогою 4 н HCl суміш екстрагують EtOAc (2×50 мл). Об'єднану органічну фазу екстрагують двічі 2 н NaOH. Водну фазу промивають двічі EtOAc, нейтралізують за допомогою 4 н HCl і на закінчення екстрагують EtOAc (2×100 мл). Органічну фазу промивають насиченим розчином солі, сушать над MgSO4 і випарюють досуха при зниженому тиску. Хроматографія дає 204 мг продукту 405. 1 H ЯМР (300 МГц, DMSO) δ 8,65 (с, 2H), 7,95 (с, 1H), 7,28 (д, J=9,0 Гц, 1H), 6,59 (д, J=8,9 Гц, 1H), 4,64 (с, 2H), 3,6-3,3 (м, 4H), 2,65-2,50 (м, 4H). Приклад 9 2-(3,5-Дихлорпіридин-4-іл)-1-(7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол2,4'-(4H)-тіопіран-1',1'-діоксид]-4-іл)етанон (сполука 109) . До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-гідрокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-тіопіран-1',1'-діоксид]-4-іл)етанону [405] (202 мг, 0,45 моль) в безводному DMF (10 мл) додають K2CO3 (126 мг, 0,9 моль) і натрій хлордифторацетат (139 мг, 0,9 моль). Суміш нагрівають в атмосфері аргону при перемішуванні при 100 °C протягом 1 години. Додатково додають K2CO3 (63 мг, 0,45 моль) і натрій хлордифторацетат (69 мг, 0,45 моль), і реакційну суміш нагрівають протягом додаткової години. Суміші дають можливість охолодитися до кімнатної температури, фільтрують і випарюють досуха при зниженому тиску. Хроматографія дає 69 мг продукту 109. 1 H ЯМР (300 МГц, CDCl3) δ 8,53 (с, 2H), 7,52 (д, J=9,1 Гц, 1H), 6,89 (д, J=9 Гц, 1H), 6,69 (т, J=72 Гц, 1H), 4,56 (с, 2H), 3,56-3,15 (м, 4H), 2,91-2,50 (м, 4H). Одержання 6 7-Дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'-(4H)-тіопіран]-4-карбонова кислота . 16 UA 109140 C2 5 10 15 20 25 30 Метил 7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'-(4H)-тіопіран]-4карбоксилат (437 мг) розчиняють в суміші метанолу (5 мл) і THF (5 мл), і додають 1 M водний розчин гідроксиду літію (3,9 мл). Складний ефір розщеплюється через 1 годину при 50 °C. Розчин охолоджують до кімнатної температури і підкисляють за допомогою 2 н сірчаної кислоти (1,95 мл), і продукт екстрагують EtOAc. 7-Дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3бензодіоксол-2,4'-(4H)-тіопіран]-4-карбонову кислоту одержують після видалення розчинників при зниженому тиску. Одержання 7 4-Нітрофеніл7-дифторметокси-2',3,5,6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'-(4H)-тіопіран]4-карбоксилат. . 7-Дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'-(4H)-тіопіран]-4-карбонову кислоту (344 мг) розчиняють в сухому DMF (3 мл). Додають 4-нітрофенол (226 мг), етилдиметиламінопропілкарбодіімід гідрохлорид (312 мг) і N, N-диметил-4-амінопіридин (198 мг). Після перемішування при кімнатній температурі протягом 20 годин виділення водного продукту реакції за допомогою простого трет-бутилметилового ефіру і хроматографії органічних сполук при градієнті від 0 до 40 % EtOAc в пентані дає вказану в заголовку сполуку у вигляді олії. Приклад 10 N-(3,5-Дихлор-4-піридил-7-Дифторметокси-2',3',5',6,-тетрагідро-спіро[1,3-бензодіоксол-2,4'(4H)-тіопіран]-4-карбамід . 4-Нітрофеніл7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'-(4H)-тіопіран]4-карбоксилат (250 мг) і 3,5-дихлор-4-амінопіридин (129 мг) розчиняють в сухому THF, 5 мл, в атмосфері аргону. Додають гідрид натрію (50 % суспензію в олії), 40 мг, і суміш залишають при перемішуванні протягом ночі. Витягування водного продукту реакції за допомогою EtOAc і хроматографії при градієнті від 0 до 60 % EtOAc в пентані дають вказану в заголовку сполуку. 1 H ЯМР (300 МГц, CDCl3) δ 8,64 (с, 1H), 8,57 (с, 2H), 7,63 (д, J=9,0 Гц, 1H), 6,86 (д, J=9,1 Гц, 1H), 6,73 (т, J=72 Гц, 1H), 3,03-2,81 (м, 4H), 2,49-2,29 (м, 4H). Приклад 11 N-(3,5-дихлор-1-оксо-4-піридил)-7-(дифторметокси)-1',1'-діоксо-спіро[1,3-бензодіоксол-2,4'тіан]-4-карбоксамід 17 UA 109140 C2 5 10 15 20 25 30 35 40 45 50 . N-(3,5-Дихлор-4-піридил)-7-дифторметокси-2',3',5',6'-тетрагідро-спіро[1,3-бензодіоксол-2,4'(4H-тіопіран]-4-карбамід (157 мг) розчиняють в мурашиній кислоті, (1 мл) і охолоджують на льоду. При перемішуванні по краплинах додають перекис водню (~50 %) (0,260 мл). Одержаний розчин підтримують при кімнатній температурі протягом ночі. Розчин виливають у воду і екстрагують три рази DCM. Екстракти концентрують при зниженому тиску і очищають за допомогою хроматографії в градієнті від 0 до 10 % метанолу в DCM, одержуючи вказану в заголовку сполуку. 1 H ЯМР (300 МГц, DMSO) δ 9,46 (с, 1H), 8,76 (с, 2H), 7,46 (д, J=8,9 Гц, 1H), 7,39 (т, J=73, 5 Гц, 1H), 6,98 (д, J=9,1 Гц, 1H), 3,76-3,56 (м, 2H), 3,34 (м, 2H), 2,75-2,53 (м, 4H). Приклад 12: Наступні далі сполуки, де X=-NH-, можуть, наприклад, бути одержані, як описано в WO 2008/104175, і як описано в прикладі 10 і прикладі 11 в даній заявці: N-(3,5-дихлор-4-піридил)-6-(дифторметокси)спіро[2,4-дигідро-1,5-бензодіоксепін-3,3'оксетан]-9-карбоксамід N-(3,5-дихлор-1-оксидо-піридин-1-іній-4-іл)-6-(дифторметокси)спіро[2,4-дигідро-1,5бензодіоксепін-3,3'-оксетан]-9-карбоксамід N-(3,5-дихлор-4-піридил)-6-(дифторметокси)спіро[2,4-дигідро-1,5-бензодіоксепін-3,4'тетрагідропіран]-9-карбоксамід N-(3,5-дихлор-1-оксидо-піридин-1-іній-4-іл)-6-(дифторметокси)спіро[2,4-дигідро-1,5бензодіоксепін-3,4'-тетрагідропіран]-9-карбоксамід N-(3,5-дихлор-4-піридил)-7-(дифторметокси)спіро[1,3-бензодіоксол-2,4'-тетрагідропіран]-4карбоксамід N-(3,5-дихлор-1-оксидо-піридин-1-іній-4-іл)-7-(дифторметокси)спіро[1,3-бензодіоксол-2,4'тетрагідропіран]-4-карбоксамід N-(3,5-дихлор-4-піридил)-7-(дифторметокси)-1',1'-діоксо-спіро[1,3-бензодіоксол-2,4'-тіан]-4карбоксамід N-(3,5-дихлор-1-оксидо-піридин-1-іній-4-іл)-6-(дифторметокси)-1',1'-діоксо-спіро[2,4-дигідро1,5-бензодіоксепін-3,3'-тіетан]-9-карбоксамід N-(3,5-дихлор-4-піридил)-6-(дифторметокси)-1',1'-діоксо-спіро[2,4-дигідро-1,5-бензодіоксепін3,3'-тіетан]-9-карбоксамід N-(3,5-дихлор-4-піридил)-6-(дифторметокси)спіро[2,4-дигідро-1,5-бензодіоксепін-3,3'-тіетан]9-карбоксамід N-(3,5-дихлор-1-оксидо-піридин-1-іній-4-іл)-6-(дифторметокси)спіро[2,4-дигідро-1,5бензодіоксепін-3,3'-тіетан]-9-карбоксамід N-(3,5-дихлор-4-піридил)-6-(дифторметокси)спіро[2,4-дигідро-1,5-бензодіоксепін-3,3'-тіетан]9-карбоксамід. Приклад 13 Наступні далі сполуки можуть синтезуватися, як описано в загальній процедурі одержання в даній заявці: 2-(3,5-дихлор-4-піридил)-1-[6-(дифторметокси)спіро[2,4-дигідро-1,5-бензодіоксепін-3,3'тіетан]-9-іл]етанон 2-(3,5-дихлор-1-оксидо-піридин-1-іній-4-іл)-1-[6-(дифторметокси)-1',1'-діоксо-спіро[2,4дигідро-1,5-бензодіоксепін-3,3'-тіетан]-9-іл]етанон 2-(3,5-дихлор-4-піридил)-1-[6-(дифторметокси)-1',1'-діоксо-спіро[2,4-дигідро-1,5бензодіоксепін-3,3'-тіетан]-9-іл]етанон 2-(3,5-дихлор-1-оксидо-піридин-1-іній-4-іл)-1-[6-(дифторметокси)спіро[2,4-дигідро-1,5бензодіоксепін-3,3'-тіетан]-9-іл]етанон. Приклад 14 Аналіз за допомогою PDE4 Рекомбінантні PDE4 людини (Genbank accession no NM_006203) інкубують протягом 1 години, разом із досліджуваною сполукою при концентраціях до 10 мкМ, разом з cAMP cAMP -5 (1×10 M) і з малою кількістю (0,021 мілібекреля) радіоактивно міченого cAMP. У кінці 18 UA 109140 C2 5 інкубування розщеплення субстрату оцінюють по зв'язуванню продукту AMP з кульками SPA, які генерують хемілюмінесценцію, коли зв'язуються з радіоактивним трасером. Продукт AMP інгібують зв'язування радіоактивного трасера з кульками, і люмінесцентний сигнал зникає. Результати обчислюють як молярні концентрації, що приводять до 50 % інгібування розщеплення субстрату, в порівнянні з контрольними зразками, і виражають як IC50 (M). Результати показані в Таблиці 1, нижче. Таблиця 1 Сполука 101 102 103 104 105 106 108 109 110 111 10 15 20 25 30 35 IC50 (PDE4) 6 нМ 13 нМ 6 нМ 4 нМ 7 нМ 5 нМ 16 нМ 13 нМ 2 нМ 106 нМ Приклад 15 Фармакокінетичні аналізи in vivo Одному щуру дозують перорально (5 мг/кг, розчиненого в DMSO/H 2O/пропіленгліколі [1:5:4]), і зразки крові відбирають з під'язичного венозного сплетення через 30 хв, 1 годину, 2 години, 4 години і 6 годин. Зразки крові відбирають в пробірки для виділення сироватки BD Vacutainer SST, сироватку відділяють за допомогою центрифугування, переносять в пробірки Micronics, а потім аналізують. Параметри мас-спектрометра (API5000 series) оптимізують для аналізу конкретних сполук і здійснюють інжекцію препаратів, що досліджуються для підтвердження правомірності використання встановленого загального методу хроматографії. Загальний метод оснований на аналізі з швидким градієнтом (2,5 хв) на колонці C18, де рухомі фази становлять метанол, ацетат амоній, мурашина кислота і вода. Стандарти приготовляють в сироватці щура, щоб перекрити аналітичний діапазон від 0,1 до 300 нг/мл. Стандарти, контрольну сироватку і зразки, що досліджуються наносять на 96лунковий планшет з глибокою лунки і осаджують за допомогою додавання ацетонітрилу, що містить внутрішній стандарт. Зразки аналізують на системі РХ-МС/МС, звичайно протягом ночі. Інтегрування і кількісне визначення здійснюють на основі співвідношення між речовиною, що аналізується і внутрішнім стандартом, використовуючи програмне забезпечення Analyst version 1,5. Фармакокінетичне параметри обчислюють з використанням стандартного документа Excel. Фармакокінетичний профіль сполуки 101 у щурів in vivo, описаного в WO 2008/104175, і сполуки 105 і 106, описаних в прикладах 5 і 6, відповідно: пероральне дозування сполуки 101 з WO 2008/104175-5 мг/кг: Cmax для сироватки
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzodioxole or benzodioxepine heterocyclic compounds phosphodiesterase inhibitors
Автори англійськоюNielsen, Simon, Feldbaek
Автори російськоюНильсэн Симон Фельдбэк
МПК / Мітки
МПК: A61K 31/4436, C07D 493/10, A61P 37/00, A61P 35/00, A61K 31/443, C07D 495/10, A61P 25/00, A61P 9/00, A61P 17/00, A61P 11/00, A61K 31/4433
Мітки: фосфодіестераз, бензодіоксепіну, сполуки, бензодіоксолу, інгібітори, гетероциклічні
Код посилання
<a href="https://ua.patents.su/24-109140-geterociklichni-spoluki-benzodioksolu-abo-benzodioksepinu-yak-ingibitori-fosfodiesteraz.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні сполуки бензодіоксолу або бензодіоксепіну як інгібітори фосфодіестераз</a>
Попередній патент: Застосування та композиції
Наступний патент: Трансгенна рослина зі збільшеним рівнем рослинного крохмалю
Випадковий патент: Спосіб підвищення міцності драглів сульфатованих полісахаридів












