Хінолінові похідні та їх використання як мікобактеріальних інгібіторів, спосіб їх одержання, фармацевтична композиція на їх основі, проміжна сполука
Номер патенту: 82198
Опубліковано: 25.03.2008
Автори: Вене Марк Гастон, Оддс Франк Кристофер, Жільмон Жером Еміль Жорж, ван Гестель Йозеф Франс Елізабета, Верньє Даніель Ф.Ж., Декран Лоренс Франсуаз Бернадетт, Чока, Імре Крістіан Франсіс, Андрієс, Конраад Йозеф Лодевійк Марсель
Формула / Реферат
1. Сполука загальної Формули (Ia) або загальної Формули (Іb)
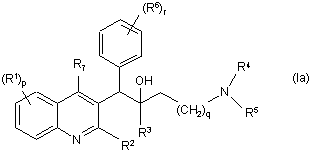 ,
,
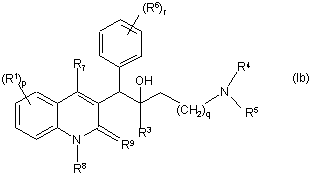 ,
,
її фармацевтично прийнятні кислотно-адитивні або основно-адитивні солі, стереохімічно ізомерні форми, таутомерні форми та N-оксидні форми, де:
R1 позначає гідроген, галоїд, галоїдалкіл, ціаногрупу, гідроксильну групу, Аr, Het, алкіл, алкоксигрупу, алкілтіогрупу, алкоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді-(Аr)-алкіл,
р позначає ціле число, яке дорівнює нулю, 1, 2, 3 або 4,
R2 позначає гідроген, гідроксильну групу, тіогрупу, алкоксигрупу, алкоксіалкоксигрупу, алкілтіогрупу, моно- або ді(алкіл)аміногрупу або радикал формули 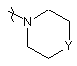 ,
,
у якій Y позначає СН2, О, S, NH або N-алкіл,
R3 позначає алкіл, Аr, Аr-алкіл, Het або Het-алкіл,
q позначає ціле число, яке дорівнює нулю, 1, 2, 3 або 4,
R4 та R5 кожний незалежно позначають гідроген, алкіл або бензил, або
R4 та R5 разом з N, до якого вони приєднані, можуть утворювати радикал, вибраний з групи, що складається з піролідинілу, 2H-піролілу, 2-піролінілу, 3-піролінілу, піролілу, імідазолідинілу, піразолідинілу, 2-імідазолінілу, 2-піразолінілу, імідазолілу, піразолілу, триазолілу, піперидинілу, піридинілу, піперазинілу, імідазолідинілу, піридазинілу, піримідинілу, піразинілу, триазинілу, морфолінілу та тіоморфолінілу, необов'язково заміщеного алкілом, галоїдом, галоїдалкілом, гідроксильною групою, алкоксигрупою, аміногрупою, моно- або діалкіламіногрупою, алкілтіогрупою, алкоксіалкілом, алкілтіоалкілом та піримідинілом,
R6 позначає гідроген, галоїд, галоїдалкіл, гідроксильну групу, Аr, алкіл, алкоксигрупу, алкілтіогрупу, алкоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді-(Аr)-алкіл,
або
два віцинальні радикали R6 можуть разом утворювати бівалентний радикал формули =С-С=С=С-,
r позначає ціле число, яке дорівнює 0, 1, 2, 3, 4 або 5, і
R7 позначає гідроген, алкіл, Аr або Het,
R8 позначає гідроген або алкіл,
R9 позначає оксогрупу, або
R8 та R9 разом утворюють радикал =N-СН=СН-, де
алкіл позначає лінійний або розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону, або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, приєднаний до лінійного або розгалуженого насиченого вуглеводневого радикала, який містить від 1 до 6 атомів карбону, причому кожний атом карбону може бути необов'язково заміщений галоїдом, гідроксильною групою, алкоксигрупою або оксогрупою,
Аr позначає гомоцикл, вибраний з групи, що складається з фенілу, нафтилу, аценафтилу, тетрагідронафтилу, кожний з яких є необов'язково заміщеним 1, 2 або 3 замісниками, причому кожний замісник є незалежно вибраним з групи, що складається з гідроксильної групи, галоїду, ціаногрупи, нітрогрупи, аміногрупи, моно- або діалкіламіногрупи, алкілу, галоїдалкілу, алкоксигрупи, галоїдалкоксигрупи, карбоксилу, алкоксикарбонілу, амінокарбонілу, морфолінілу та моно- або діалкіламінокарбонілу,
Het позначає моноциклічний гетероцикл, вибраний з групи, що складається з N-феноксипіперидинілу, піролілу, піразолілу, імідазолілу, фуранілу, тієнілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піридинілу, піримідинілу, піразинілу та піридазинілу, або біциклічний гетероцикл, вибраний з групи, що складається з хінолінілу, хіноксалінілу, індолілу, бензімідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, бензофуранілу, бензотієнілу, 2,3-дигідробензо[1,4]діоксинілу або бензо[1,3]діоксолілу, причому кожний моноциклічний та біциклічний гетероцикл може необов'язково бути заміщеним на атомі карбону 1, 2 або 3 замісниками, вибраними з групи, що складається з галоїду, гідроксильної групи, алкілу або алкоксигрупи,
галоїд позначає замісник, вибраний з групи, що складається з флюору, хлору, брому та йоду, і
галоїдалкіл позначає лінійний або розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, де один або більше атомів карбону є заміщеними одним або кількома атомами галоїду.
2. Сполука за п. 1, яка відрізняється тим, що:
R1 позначає гідроген, галоїд, ціаногрупу, Аr, Het, алкіл та алкоксигрупу;
р позначає ціле число, яке дорівнює нулю, 1, 2, 3 або 4;
R2 позначає гідроген, гідроксильну групу, алкоксигрупу, алкоксіалкоксигрупу, алкілтіогрупу або радикал формули  ,
,
де Y позначає О;
R3 позначає алкіл, Аr, Аr-алкіл або Het;
q позначає ціле число, яке дорівнює нулю, 1, 2, або 3;
R4 та R5 кожний незалежно позначають гідроген, алкіл або бензил; або
R4 та R5 разом з N, до якого вони приєднані, можуть утворювати радикал, вибраний з групи, що складається з піролідинілу, імідазолілу, триазолілу, піперидинілу, піперазинілу, піразинілу, морфолінілу та тіоморфолінілу, необов'язково заміщений алкілом та піримідинілом;
R6 позначає гідроген, галоїд або алкіл; або
два віцинальні радикали R6 можуть разом утворювати бівалентний радикал формули =С-С=С=С-;
r позначає ціле число, яке дорівнює 1; та
R7 позначає гідроген;
R8 позначає гідроген або алкіл;
R9 позначає оксогрупу; або
R8 та R9 разом утворюють радикал =N-СН=СН-, де
алкіл позначає лінійний або розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону; або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону; або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, приєднаний до лінійного або розгалуженого насиченого вуглеводневого радикала, який містить від 1 до 6 атомів карбону; причому кожний атом карбону може бути необов'язково заміщеним галоїдом або гідроксильною групою;
Аr позначає гомоцикл, вибраний з групи, що складається з фенілу, нафтилу, аценафтилу, тетрагідронафтилу, кожний з яких є необов'язково заміщеним 1, 2 або 3 замісниками, причому кожний замісник незалежно вибраний з групи, що складається з галоїду, галоїдалкілу, ціаногрупи, алкоксигрупи та морфолінілу;
Het позначає моноциклічний гетероцикл, вибраний з групи, що складається з N-феноксипіперидинілу, фуранілу, тієнілу, піридинілу, піримідинілу; або біциклічний гетероцикл, вибраний з групи, що складається з бензотієнілу, 2,3-дигідробензо[1,4]діоксинілу або бензо[1,3]діоксолілу; де кожний моноциклічний та біциклічний гетероцикл може необов'язково бути заміщеним на атомі карбону 1, 2 або 3 алкільними замісниками; і
галоїд позначає замісник, вибраний з групи, що складається з атому фтору, хлору та брому.
3. Сполука за пп. 1 або 2, яка відрізняється тим, що R6 позначає гідроген, алкіл або галоїд.
4. Сполука за п. 3, яка відрізняється тим, що R6 позначає гідроген.
5. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R1 позначає гідроген, галоїд, Аr, алкіл або алкоксигрупу.
6. Сполука за п. 5, яка відрізняється тим, що R1 позначає галоїд.
7. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що р дорівнює 1.
8. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R2 позначає гідроген, алкоксигрупу або алкілтіогрупу.
9. Сполука за п. 8, яка відрізняється тим, що R2 позначає алкілоксигрупу.
10. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R3 позначає нафтил, феніл або тієніл, кожний з яких є необов'язково заміщеним 1 або 2 замісниками.
11. Сполука за п. 10, яка відрізняється тим, що R3 позначає нафтил або феніл.
12. Сполука за п. 11, яка відрізняється тим, що R3 позначає нафтил.
13. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що R3 позначає Аr-алкіл.
14. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що q дорівнює 3.
15. Сполука за будь-яким з пп. 1-13, яка відрізняється тим, що q дорівнює 0, 1 або 2.
16. Сполука за п. 15, яка відрізняється тим, що q дорівнює 1.
17. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R4 та R5 кожний незалежно позначають гідроген або алкіл.
18. Сполука за п. 17, яка відрізняється тим, що R4 та R5 кожний незалежно позначає метил.
19. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R7 позначає гідроген або метил.
20. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що r дорівнює 0, 1 або 2.
21. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що, незалежно один від одного, R1 позначає гідроген, галоїд, Аr, алкіл або алкоксигрупу, р дорівнює 1, R2 позначає гідроген, алкоксигрупу або алкілтіогрупу, R3 позначає нафтил, феніл або тієніл, кожний з яких є необов'язково заміщеним 1 або 2 замісниками, вибраними з групи, що складається з галоїду та галоїдалкілу, q дорівнює 0, 1, 2 або 3, R4 та R5 кожний незалежно позначає гідроген або алкіл, або R4 та R5 разом з N, до якого вони приєднані, утворюють радикал, вибраний з групи, що складається з імідазолілу, триазолілу, піперидинілу, піперазинілу та тіоморфолінілу, R6 позначає гідроген, алкіл або галоїд, r дорівнює 0 або 1, та R7 позначає гідроген.
22. Сполука за п. 21, яка відрізняється тим, що, незалежно один від одного, R1 позначає атом брому, R2 позначає алкоксигрупу, R3 позначає нафтил або феніл, q дорівнює 1, R4 та R5 кожний незалежно позначає гідроген, метил або етил, та R6 позначає гідроген.
23. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що алкіл позначає лінійний або розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону.
24. Сполука за будь-яким з пп. 1-23, яка відрізняється тим, що сполука є сполукою формули (Іа).
25. Сполука за п. 1, яка відрізняється тим, що вона є:
1-(6-бром-2-метоксихінолін-3-іл)-2-(3,5-дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2-олом,
1-(6-бром-2-метоксихінолін-3-іл)-4-диметиламіно-2-нафталін-1-іл-1-фенілбутан-2-олом,
1-(6-бром-2-метоксихінолін-3-іл)-2-(2,5-дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2-олом,
1-(6-бром-2-метоксихінолін-3-іл)-2-(2,3-дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2-олом,
1-(6-бром-2-метоксихінолін-3-іл)-4-диметиламіно-2-(2-флюорфеніл)-1-фенілбутан-2-олом,
1-(6-бром-2-метоксихінолін-3-іл)-4-диметиламіно-2-нафталін-1-іл-1-п-толілбутан-2-олом,
1-(6-бром-2-метоксихінолін-3-іл)-4-метиламіно-2-нафталін-1-іл-1-фенілбутан-2-оломта
1-(6-бром-2-метоксихінолін-3-іл)-4-диметиламіно-2-(3-флюорфеніл)-1-фенілбутан-2-олом,
її фармацевтично прийнятні кислотно-адитивні або основно-адитивні солі, стереохімічно ізомерні форми, таутомерні форми та N-оксидні форми.
26. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою
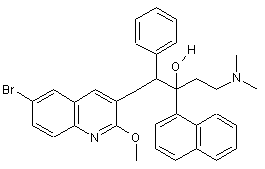 ;
;
або її фармацевтично прийнятна кислотно-адитивна або основно-адитивна сіль, стереохімічно ізомерна форма або N-оксидна форма.
27. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою
 ;
;
або її фармацевтично прийнятна кислотно-адитивна або основно-адитивна сіль.
28. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою
 ;
;
або її фармацевтично прийнятна кислотно-адитивна сіль.
29. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою
 ;
;
або її стереохімічно ізомерна форма.
30. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою
 ;
;
або її N-оксидна форма.
31. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою
 .
.
32. Сполука за п. 31, яка відрізняється тим, що вона є діастереоізомером А з температурою плавлення 210 °С, його фармацевтично прийнятною кислотно-адитивною або основно-адитивною сіллю або стереохімічно ізомерною формою.
33. Сполука за п. 31, яка відрізняється тим, що вона є діастереоізомером А з найвищим чисельним значенням рIC50 у M.smegmatis аналізі відносно іншого діастереоізомеру В даної формули або його фармацевтично прийнятною кислотно-адитивною або основно-адитивною сіллю або стереохімічно ізомерною формою.
34. Сполука за п. 31, яка відрізняється тим, що вона є сумішшю (1R, 2S) та (1S, 2R) енантіомерів 1-(6-бромо-2-метоксихінолін-3-іл)-4-диметиламіно-2-нафтален-1-іл-1-фенілбутан-2-олу.
35. Сполука за п. 31, яка відрізняється тим, що вона є енантіомерною формою з найнижчим чисельним значенням МІС у М. tuberculosis аналізі відносно іншої енантіомерної форми даної формули або її фармацевтично прийнятною кислотно-адитивною або основно-адитивною сіллю.
36. Сполука за п. 31, яка відрізняється тим, що вона є енантіомерною формою з найнижчим чисельним значенням МІС у М.tuberculosis аналізі відносно іншої енантіомерної форми даної формули.
37. Сполука за п. 31, яка відрізняється тим, що вона є енантіомерною формою з найвищим чисельним значенням рIC50 у M.smegmatis аналізі відносно іншої енантіомерної форми даної формули або її фармацевтично прийнятною кислотно-адитивною або основно-адитивною сіллю.
38. Сполука за п. 31, яка відрізняється тим, що вона є енантіомерною формою з найвищим чисельним значенням рIC50 у M.smegmatis аналізі відносно іншої енантіомерної форми даної формули.
39. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою
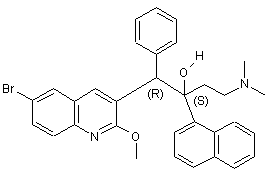 .
.
40. Сполука за будь-яким з пп. 1-39 для застосування як лікарський засіб.
41. Фармацевтична композиція, що містить фармацевтично прийнятний носій та як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-39.
42. Застосування сполуки за будь-яким з пп. 1-39 або фармацевтичної композиції за п. 41 для виробництва лікарського засобу для лікування мікобактеріальних захворювань.
43. Застосування сполуки за будь-яким з пп. 1-39 або фармацевтичної композиції за п. 41 для лікування мікобактеріальних захворювань.
44. Спосіб лікування пацієнта, який страждає на мікобактеріальну хворобу або має ризик її виникнення, в якому вводять пацієнту терапевтично ефективну кількість сполуки за будь-яким з пп. 1-39 або фармацевтичної композиції за п. 41.
45. Спосіб одержання сполуки за п. 1, який відрізняється тим, що сполуку формули (II) піддають реакції зі сполукою формули (III) відповідно до наступної реакції:
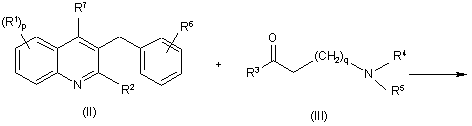
де R1, р, R2, R3, q, R4, R5, R6 та R7 визначені у Формулі (Іа).
46. Сполука наступної формули
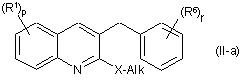 ,
,
де R1, R6, р та r визначені у Формулі (Іа), та де Х є S або О та Alk є алкільною групою, визначеною у п. 1.
47. Сполука за п. 46, яка відрізняється тим, що Х є О.
48. Сполука за п. 47, яка відрізняється тим, що вона має наступну формулу
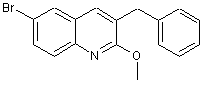 .
.
Текст
1. Сполука загальної Формули (Ia) або загальної Формули (Іb) 2 3 82198 р позначає ціле число, яке дорівнює нулю, 1, 2, 3 або 4, R2 позначає гідроген, гідроксильну групу, тіогрупу, алкоксигрупу, алкоксіалкоксигрупу, алкілтіогрупу, моно- або ді(алкіл)аміногрупу або N Y радикал формули , у якій Y позначає СН2, О, S, NH або Nалкіл, R3 позначає алкіл, Аr, Аr-алкіл, Het або Het-алкіл, q позначає ціле число, яке дорівнює нулю, 1, 2, 3 або 4, R4 та R5 кожний незалежно позначають гідроген, алкіл або бензил, або R4 та R5 разом з N, до якого вони приєднані, можуть утворювати радикал, вибраний з групи, що складається з піролідинілу, 2Hпіролілу, 2-піролінілу, 3-піролінілу, піролілу, імідазолідинілу, піразолідинілу, 2-імідазолінілу, 2піразолінілу, імідазолілу, піразолілу, триазолілу, піперидинілу, піридинілу, піперазинілу, імідазолідинілу, піридазинілу, піримідинілу, піразинілу, триазинілу, морфолінілу та тіоморфолінілу, необов'язково заміщеного алкілом, галоїдом, галоїдалкілом, гідроксильною групою, алкоксигрупою, аміногрупою, моно- або діалкіламіногрупою, алкілтіогрупою, алкоксіалкілом, алкілтіоалкілом та піримідинілом, R6 позначає гідроген, галоїд, галоїдалкіл, гідроксильну групу, Аr, алкіл, алкоксигрупу, алкілтіогрупу, алкоксіалкіл, алкілтіоалкіл, Аr-алкіл або ді-(Аr)-алкіл, або два віцинальні радикали R6 можуть разом утворювати бівалентний радикал формули =СС= С= С-, r позначає ціле число, яке дорівнює 0, 1, 2, 3, 4 або 5, і R7 позначає гідроген, алкіл, Аr або Het, R8 позначає гідроген або алкіл, R9 позначає оксогрупу, або R8 та R9 разом утворюють радикал =NСН=СН-, де алкіл позначає лінійний або розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону, або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, приєднаний до лінійного або розгалуженого насиченого вуглеводневого радикала, який містить від 1 до 6 атомів карбону, причому кожний атом карбону може бути необов'язково заміщений галоїдом, гідроксильною групою, алкоксигрупою або оксогрупою, Аr позначає гомоцикл, вибраний з групи, що складається з фенілу, нафтилу, аценафтилу, тетрагідронафтилу, кожний з яких є необов'язково заміщеним 1, 2 або 3 замісниками, причому кожний замісник є незалежно вибраним з групи, що складається з гідроксильної групи, галоїду, 4 ціаногрупи, нітрогрупи, аміногрупи, моно- або діалкіламіногрупи, алкілу, галоїдалкілу, алкоксигрупи, галоїдалкоксигрупи, карбоксилу, алкоксикарбонілу, амінокарбонілу, морфолінілу та моно- або діалкіламінокарбонілу, Het позначає моноциклічний гетероцикл, вибраний з групи, що складається з Nфеноксипіперидинілу, піролілу, піразолілу, імідазолілу, фуранілу, тієнілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піридинілу, піримідинілу, піразинілу та піридазинілу, або біциклічний гетероцикл, вибраний з групи, що складається з хінолінілу, хіноксалінілу, індолілу, бензімідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, бензофуранілу, бензотієнілу, 2,3-дигідробензо[1,4]діоксинілу або бензо[1,3]діоксолілу, причому кожний моноциклічний та біциклічний гетероцикл може необов'язково бути заміщеним на атомі карбону 1, 2 або 3 замісниками, вибраними з групи, що складається з галоїду, гідроксильної групи, алкілу або алкоксигрупи, галоїд позначає замісник, вибраний з групи, що складається з флюору, хлору, брому та йоду, і галоїдалкіл позначає лінійний або розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, де один або більше атомів карбону є заміщеними одним або кількома атомами галоїду. 2. Сполука за п. 1, яка відрізняється тим, що: R1 позначає гідроген, галоїд, ціаногрупу, Аr, Het, алкіл та алкоксигрупу; р позначає ціле число, яке дорівнює нулю, 1, 2, 3 або 4; R2 позначає гідроген, гідроксильну групу, алкоксигрупу, алкоксіалкоксигрупу, алкілтіогрупу N Y або радикал формули , де Y позначає О; R3 позначає алкіл, Аr, Аr-алкіл або Het; q позначає ціле число, яке дорівнює нулю, 1, 2, або 3; R4 та R5 кожний незалежно позначають гідроген, алкіл або бензил; або R4 та R5 разом з N, до якого вони приєднані, можуть утворювати радикал, вибраний з групи, що складається з піролідинілу, імідазолілу, триазолілу, піперидинілу, піперазинілу, піразинілу, морфолінілу та тіоморфолінілу, необов'язково заміщений алкілом та піримідинілом; R6 позначає гідроген, галоїд або алкіл; або два віцинальні радикали R6 можуть разом утворювати бівалентний радикал формули =СС= С= С-; r позначає ціле число, яке дорівнює 1; та R7 позначає гідроген; R8 позначає гідроген або алкіл; 5 R9 позначає оксогрупу; або R8 та R9 разом утворюють радикал =NСН=СН-, де алкіл позначає лінійний або розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону; або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону; або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, приєднаний до лінійного або розгалуженого насиченого вуглеводневого радикала, який містить від 1 до 6 атомів карбону; причому кожний атом карбону може бути необов'язково заміщеним галоїдом або гідроксильною групою; Аr позначає гомоцикл, вибраний з групи, що складається з фенілу, нафтилу, аценафтилу, тетрагідронафтилу, кожний з яких є необов'язково заміщеним 1, 2 або 3 замісниками, причому кожний замісник незалежно вибраний з групи, що складається з галоїду, галоїдалкілу, ціаногрупи, алкоксигрупи та морфолінілу; Het позначає моноциклічний гетероцикл, вибраний з групи, що складається з Nфеноксипіперидинілу, фуранілу, тієнілу, піридинілу, піримідинілу; або біциклічний гетероцикл, вибраний з групи, що складається з бензотієнілу, 2,3-дигідробензо[1,4]діоксинілу або бензо[1,3]діоксолілу; де кожний моноциклічний та біциклічний гетероцикл може необов'язково бути заміщеним на атомі карбону 1, 2 або 3 алкільними замісниками; і галоїд позначає замісник, вибраний з групи, що складається з атому фтору, хлору та брому. 3. Сполука за пп. 1 або 2, яка відрізняється тим, що R6 позначає гідроген, алкіл або галоїд. 4. Сполука за п. 3, яка відрізняється тим, що R6 позначає гідроген. 5. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R1 позначає гідроген, галоїд, Аr, алкіл або алкоксигрупу. 6. Сполука за п. 5, яка відрізняється тим, що R1 позначає галоїд. 7. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що р дорівнює 1. 8. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R2 позначає гідроген, алкоксигрупу або алкілтіогрупу. 9. Сполука за п. 8, яка відрізняється тим, що R2 позначає алкілоксигрупу. 10. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R3 позначає нафтил, феніл або тієніл, кожний з яких є необов'язково заміщеним 1 або 2 замісниками. 11. Сполука за п. 10, яка відрізняється тим, що R3 позначає нафтил або феніл. 12. Сполука за п. 11, яка відрізняється тим, що R3 позначає нафтил. 13. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що R3 позначає Аr-алкіл. 14. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що q дорівнює 3. 82198 6 15. Сполука за будь-яким з пп. 1-13, яка відрізняється тим, що q дорівнює 0, 1 або 2. 16. Сполука за п. 15, яка відрізняється тим, що q дорівнює 1. 17. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R4 та R5 кожний незалежно позначають гідроген або алкіл. 18. Сполука за п. 17, яка відрізняється тим, що R4 та R5 кожний незалежно позначає метил. 19. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що R7 позначає гідроген або метил. 20. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що r дорівнює 0, 1 або 2. 21. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що, незалежно один від одного, R1 позначає гідроген, галоїд, Аr, алкіл або алкоксигрупу, р дорівнює 1, R2 позначає гідроген, алкоксигрупу або алкілтіогрупу, R3 позначає нафтил, феніл або тієніл, кожний з яких є необов'язково заміщеним 1 або 2 замісниками, вибраними з групи, що складається з галоїду та галоїдалкілу, q дорівнює 0, 1, 2 або 3, R4 та R5 кожний незалежно позначає гідроген або алкіл, або R4 та R5 разом з N, до якого вони приєднані, утворюють радикал, вибраний з групи, що складається з імідазолілу, триазолілу, піперидинілу, піперазинілу та тіоморфолінілу, R6 позначає гідроген, алкіл або галоїд, r дорівнює 0 або 1, та R7 позначає гідроген. 22. Сполука за п. 21, яка відрізняється тим, що, незалежно один від одного, R1 позначає атом брому, R2 позначає алкоксигрупу, R3 позначає нафтил або феніл, q дорівнює 1, R4 та R5 кожний незалежно позначає гідроген, метил або етил, та R6 позначає гідроген. 23. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що алкіл позначає лінійний або розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону. 24. Сполука за будь-яким з пп. 1-23, яка відрізняється тим, що сполука є сполукою формули (Іа). 25. Сполука за п. 1, яка відрізняється тим, що вона є: 1-(6-бром-2-метоксихінолін-3-іл)-2-(3,5дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2олом, 1-(6-бром-2-метоксихінолін-3-іл)-4-диметиламіно2-нафталін-1-іл-1-фенілбутан-2-олом, 1-(6-бром-2-метоксихінолін-3-іл)-2-(2,5дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2олом, 1-(6-бром-2-метоксихінолін-3-іл)-2-(2,3дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2олом, 1-(6-бром-2-метоксихінолін-3-іл)-4-диметиламіно2-(2-флюорфеніл)-1-фенілбутан-2-олом, 1-(6-бром-2-метоксихінолін-3-іл)-4-диметиламіно2-нафталін-1-іл-1-п-толілбутан-2-олом, 1-(6-бром-2-метоксихінолін-3-іл)-4-метиламіно-2нафталін-1-іл-1-фенілбутан-2-оломта 7 82198 1-(6-бром-2-метоксихінолін-3-іл)-4-диметиламіно2-(3-флюорфеніл)-1-фенілбутан-2-олом, її фармацевтично прийнятні кислотно-адитивні або основно-адитивні солі, стереохімічно ізомерні форми, таутомерні форми та N-оксидні форми. 26. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою 8 H O N H O N Br N H O N Br ; або її стереохімічно ізомерна форма. 30. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою H O N O ; або її N-оксидна форма. 31. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою H O або її фармацевтично прийнятна адитивна або основно-адитивна сіль. 28. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою H O Br N Br O ; кислотно N O O ; або її фармацевтично прийнятна кислотноадитивна або основно-адитивна сіль, стереохімічно ізомерна форма або N-оксидна форма. 27. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою N N Br N O ; або її фармацевтично прийнятна кислотноадитивна сіль. 29. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою Br N N O . 32. Сполука за п. 31, яка відрізняється тим, що вона є діастереоізомером А з температурою плавлення 210 °С, його фармацевтично прийнятною кислотно-адитивною або основно-адитивною сіллю або стереохімічно ізомерною формою. 33. Сполука за п. 31, яка відрізняється тим, що вона є діастереоізомером А з найвищим чисельним значенням рIC50 у M.smegmatis аналізі відносно іншого діастереоізомеру В даної формули або його фармацевтично прийнятною кислотно-адитивною або основно-адитивною сіллю або стереохімічно ізомерною формою. 34. Сполука за п. 31, яка відрізняється тим, що вона є сумішшю (1R, 2S) та (1S, 2R) енантіомерів 1-(6-бромо-2-метоксихінолін-3-іл)-4диметиламіно-2-нафтален-1-іл-1-фенілбутан-2олу. 35. Сполука за п. 31, яка відрізняється тим, що вона є енантіомерною формою з 9 82198 найнижчим чисельним значенням МІС у М. tuberculosis аналізі відносно іншої енантіомерної форми даної формули або її фармацевтично прийнятною кислотно-адитивною або основноадитивною сіллю. 36. Сполука за п. 31, яка відрізняється тим, що вона є енантіомерною формою з найнижчим чисельним значенням МІС у М.tuberculosis аналізі відносно іншої енантіомерної форми даної формули. 37. Сполука за п. 31, яка відрізняється тим, що вона є енантіомерною формою з найвищим чисельним значенням рIC50 у M.smegmatis аналізі відносно іншої енантіомерної форми даної формули або її фармацевтично прийнятною кислотно-адитивною або основноадитивною сіллю. 38. Сполука за п. 31, яка відрізняється тим, що вона є енантіомерною формою з найвищим чисельним значенням рIC50 у M.smegmatis аналізі відносно іншої енантіомерної форми даної формули. 39. Сполука за п. 1, яка відрізняється тим, що вона є сполукою формули (Іа), яка може бути представлена формулою Br (R) N для виробництва лікарського засобу для лікування мікобактеріальних захворювань. 43. Застосування сполуки за будь-яким з пп. 1-39 або фармацевтичної композиції за п. 41 для лікування мікобактеріальних захворювань. 44. Спосіб лікування пацієнта, який страждає на мікобактеріальну хворобу або має ризик її виникнення, в якому вводять пацієнту терапевтично ефективну кількість сполуки за будьяким з пп. 1-39 або фармацевтичної композиції за п. 41. 45. Спосіб одержання сполуки за п. 1, який відрізняється тим, що сполуку формули (II) піддають реакції зі сполукою формули (III) відповідно до наступної реакції: R7 (R1)p R6 O + N (CH2)q R3 R4 N R2 R5 (II) (III) де R1, р, R2, R3, q, R4, R5, R6 та R7 визначені у Формулі (Іа). 46. Сполука наступної формули (R1) p (R6)r (II-a) H O 10 N N (S) O . 40. Сполука за будь-яким з пп. 1-39 для застосування як лікарський засіб. 41. Фармацевтична композиція, що містить фармацевтично прийнятний носій та як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-39. 42. Застосування сполуки за будь-яким з пп. 1-39 або фармацевтичної композиції за п. 41 Даний винахід стосується нових заміщених хінолінових похідних, придатних для лікування мікобактеріальних захворювань,особливо, захворювань, спричинених патогенними мікобактеріями, такими як Мусоbacterium tuberculosis, Μ.bovis, Μ.avium та М.marinum. Mycobacterium tuberculosis є збудником туберкульозу (ТБ), серйозної та потенційно смертельної інфекції, поширеної в усьому світі. За оцінками Всесвітньої організації охорони здоров'я, більш ніж 8 мільйонів людей інфікуються ТБ кожного року і 2 мільйони людей вмирають від туберкульозу щорічно. За останні десять років захворюваність на ТБ зросла на 20% в усьому світі, причому найбільше потерпають найбідніші X-Alk , де R , R , р та r визначені у Формулі (Іа), та де Х є S або О та Alk є алкільною групою, визначеною у п. 1. 47. Сполука за п. 46, яка відрізняється тим, що Х є О. 48. Сполука за п. 47, яка відрізняється тим, що вона має наступну формулу Br 1 6 N O . країни. Якщо ці тенденції зберігатимуться, то захворюваність на ТБ зросте на 41% у наступні двадцять років. Через п'ятдесят років після винайдення ефективної хіміотерапії, ТБ залишається найголовнішою, після СНІД, причиною смертності дорослих людей у світі. Епідемія ТБ ускладнюється появою зростаючої кількості штамів з множинною лікарською резистентністю, та смертельний симбіоз з ВІЛ. У ВІЛ-позитивних осіб, інфікованих ТБ, імовірність розвитку активного ТБ у 30 разів вище, ніж у ВІЛнегативних, і ТБ є причиною смерті кожної третьої людини з ВІЛ/СНІД у світі. Всі існуючі підходи до лікування туберкульозу включають використання комбінацій численних 11 агентів. Наприклад, схема, рекомендована Міністерством охорони здоров'я, освіти та соціального забезпечення США, є комбінацією ізоніазиду, рифампіцину та піразинаміду протягом двох місяців, з насипним застосуванням самих лише ізоніазиду та рифампіцину протягом ще чотирьох місяців. Приймання цих лікарських засобів триває протягом ще семі місяців для пацієнтів, інфікованих ВІЛ. Для пацієнтів, інфікованих штамами М. tuberculosis з множинною лікарською резистентністю, до комбінованої терапії додають такі агенти, як етамбутол, стрептоміцин, канаміцин, амікацин, капреоміцин, етіонамід, циклосерин, ципрофоксацин та офлоксацин. Не існує єдиного агента, що був би ефективним у клінічному лікуванні туберкульозу, ані комбінації агентів, яка забезпечувала б можливість курса лікування тривалістю менш ніж шість місяців. В медицині існує велика потреба у нових лікарських засобах, що дозволили б удосконалити сучасні методи лікування шляхом створення схем лікування, які сприяють їхньому дотриманню пацієнтами та установами, що надають медичні послуги. Кращим способом досягти цього є коротші схеми лікування та схеми, які, потребують меншого нагляду. Більша частина корисного ефекту від лікування виявляється протягом перших 2 місяців, під час інтенсивної, або бактерицидної, фази, коли вводять разом чотири лікарські засоби; бактеріальне навантаження різко зменшується і пацієнти стають неінфекційними. Фаза продовження, або стерилізації, довжиною від 4 до 6 місяців, потрібна для знищення бацил, що вижили, та зменшення ризику рецидиву. Дуже корисним був би сильнодіючий стерилізуючий лікарський засіб, який скорочує курс лікування до 2 місяців чи менше. Потрібні також лікарські засоби, які сприяють дотриманню схеми лікування завдяки потребі в менш інтенсивному догляді. Очевидно, найбільш корисною була б сполука, яка зменшує як загальну тривалість лікування, так і частоту введення лікарського засобу. Епідемія ТБ ускладнюється зростаючим поширенням штамів з множинною лікарською стійкістю, або МЛС-ТБ. Вважається, що на МЛС-ТБ приходиться до чотирьох процентів всіх випадків хвороби у світі, резистентних до найбільш ефективних засобів з чотирипрепаратного стандарту - ізоніазиду та рифампіцину. МЛС-ТБ має летальний кінець при відсутності лікування і не може бути в достатньому ступені вилікований протягом стандартного курсу терапії, так що курс лікування потребує до 2 років застосування ліків "другої лінії". Ці лікарські засоби є часто токсичними, дорогими та малоефективними. При відсутності ефективної терапії, інфекційні пацієнти з МЛС-ТБ продовжують поширювати хворобу, спричинюючи нові випадки інфекції штамами МЛСТБ. В медицині існує велика потреба в новому лікарському засобі з новим механізмом дії. який, вірогідно, демонструє активність проти МЛСштамів. Метою даного винаходу є створення, нових сполук, зокрема, заміщених хінолінових похідних, 82198 12 які мають здатність інгібувати ріст мікобактерій і тому є придатними для лікування мікобактеріальних захворювань, особливо, захворювань, спричинених патогенними мікобактеріями, такими як Mycobacterium tuberculosis, Μ.bovis, Μ.avium та Μ.marinum. Заміщені хіноліни були вже розкриті у патенті США №5965572 для лікування антибіотикрезистентних інфекцій та у WO 00/34265 для інгібування росту бактеріальних мікроорганізмів. Жодна з цих публікацій не розкриває заміщених хінолінових похідних у відповідності до даного винаходу. Даний винахід стосується нових заміщених хінолінових похідних формули (Іа) чи формули (Іb) їхніх фармацевтично прийнятних солей приєднання кислоти чи основи, їхніх стереохімічно ізомерних форм, їхніх таутомерних форм та їхніх N-оксидних форм, у яких: R1 позначає гідроген, галоїд, галоїдалкіл, ціаногрупу, гідроксильну групу, Аr, Het, алкіл, алкоксигрупу, алкілтіогрупу, алкоксіалкіл, алкілтіоалкіл, Ar-алкіл чи ді-(Аr)-алкіл; p позначає ціле число, яке дорівнює нулю, 1, 2, 3 чи 4; R2 позначає гідроген, гідроксильну групу, тіогрупу, алкоксигрупу, алкоксіалкоксигрупу, алкілтіогрупу, моно- чи ді(алкіл)аміногрупу або радикал формули , де Υ позначає СН2, О, S, NH чи N-алкіл; R3 позначає алкіл, Аr, Аr-алкіл, Het чи Hetалкіл; q позначає ціле число, яке дорівнює нулю, 1, 2, 3 чи 4; R4 та R5 кожний незалежно позначають гідроген, алкіл чи бензил; або R4 та R5 разом з N, до якого вони приєднані, можуть утворювати радикал, вибраний з групи, що складається з піролідинілу, 2Н-піролілу, 2піролінілу, 3-піролінілу, піролілу, імідазолідинілу, піразолідинілу, 2-імідазолінілу, 2-піразолінілу, імідазолілу, піразолілу, триазолілу, піперидинілу, 13 піридинілу, піперазинілу, імідазолідиніл, піридазинілу, піримідинілу, піразинілу, триазинілу, морфолінілу та тіоморфолінілу, необов'язково, заміщеного алкілом, галоїдом, галоїдалкілом, гідроксильною групою, алкоксигрупою, аміногрупою, моночи діалкіламіногрупою, алкілтіогрупою, алкоксіалкілом, алкілтіоалкілом та піримідинілом; R6 позначає гідроген, галоїд, галоїдалкіл, гідроксильну групу, Аr, алкіл, алкоксигрупу, алкілтіогрупу, алкоксіалкіл, алкілтіоалкіл, Аr-алкіл чи ді-(Аr)-алкіл; або два віцинальні радикали R6 можуть разом утворювати бівалентний радикал формули =С-С=С=С-; r позначає ціле число, яке дорівнює 0, 1, 2, 3, 4 чи 5; і R7 позначає гідроген, алкіл, Аr чи Het; R8 позначає гідроген чи алкіл; R9 позначає оксогрупу; або R8 та R9 разом утворюють радикал =N-CH=CH. Алкіл позначає лінійний чи розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону; або позначає циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону; або позначає циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, приєднаний до лінійного чи розгалуженого насиченого вуглеводневого радикала, який містить від 1 до 6 атомів карбону; причому кожний атом карбону може бути необов'язково заміщений галоїдом, гідроксильною групою, алкоксигрупою чи оксогрупою; Аr позначає гомоцикл, вибраний з групи, що складається з фенілу, нафтилу, аценафтилу, тетрагідронафтилу, кожний з яких є необов'язково заміщеним 1, 2 чи 3 замісниками, причому кожний замісник незалежно вибраний з групи, що складається з гідроксильної групи, галоїду, ціаногрупи, нітрогрупи, аміногрупи, моно- чи діалкіламіногрупи, алкілу, галоїдалкілу, алкоксигрупи, галоїдалкоксигрупи, карбоксилу, алкоксикарбонілу, амінокарбонілу, морфолінілу та моно- чи діалкіламінокарбонілу; Het позначає моноциклічний гетероцикл, вибраний з групи, що складається з Nфеноксипіперидинілу, піролілу, піразолілу, імідазолілу, фуранілу, тієнілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піридинілу, піримідинілу, піразинілу та піридазинілу; або біциклічний гетероцикл, вибраний з групи, що складається з хінолінілу, хіноксалінілу, індолілу, бензімідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, бензофуранілу, бензотієнілу, 2,3-дигідробензо[1,4]діоксинілу чи бензо[1,3]діоксолілу; причому кожний моноциклічний та біциклічний гетероцикл може необов'язково бути заміщеним на атомі карбону 1, 2 чи 3 замісниками, вибраними з групи, що складається з галоїду, гідроксильної групи, алкілу чи алкоксигрупи; галоїд позначає замісник, вибраний з групи, що складається з флюору, хлору, брому та йоду, і галоїдалкіл позначає лінійний чи розгалужений насичений вуглеводневий радикал, який містить 82198 14 від 1 до 6 атомів карбону, чи циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, де один чи більше атомів карбону є заміщеними одним чи кількома атомами галоїду. Сполуки формули (Іа) та (Іb) є спорідненими, тобто, наприклад, сполука формули (Іb), у якій R9 позначає оксогрупу, є таутомерним еквівалентом сполуки формули (Іа), у якій R2 позначає гідроксильну групу (кето-енольний таутомеризм). В рамках цієї заявки, алкіл позначає лінійний чи розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону; або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону; або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, приєднаний до лінійного чи розгалуженого насиченого вуглеводневого радикала, який містить від 1 до 6 атомів карбону; причому кожний атом карбону може бути необов'язково заміщений галоїдом, гідроксильною групою, алкоксигрупою чи оксогрупою. Краще, алкіл позначає метил, етил чи циклогексил метил. В рамках цієї заявки, Аr позначає гомоцикл, вибраний з групи, що складається з фенілу, нафтилу, аценафтилу, тетрагідронафтилу, кожний з яких є необов'язково заміщеним 1, 2 чи 3 замісниками, де кожний замісник незалежно вибраний з групи, що складається з гідроксильної групи, галоїду, ціаногрупи, нітрогрупи, аміногрупи, моно- чи діалкіламіногрупи, алкілу, галоїдалкілу, алкоксигрупи, галоїдалкоксигрупи, карбоксилу, алкоксикарбонілу, амінокарбонілу, морфолінілу та моно- чи діалкіламінокарбонілу. Краще, Аr позначає нафтил чи феніл, кожний з яких є необов'язково заміщеним 1 чи 2 галоїдними замісниками. В рамках цієї заявки, Het позначає моноциклічний гетероцикл, вибраний з групи, що складається з N-феноксипіперидинілу, піролілу, піразолілу, імідазолілу, фуранілу, тієнілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піридинілу, піримідинілу, піразинілу та піридазинілу; або біциклічний гетероцикл, вибраний з групи, що складається з хінолінілу, хіноксалінілу, індолілу, бензімідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, бензофуранілу, бензотієнілу, 2,3дигідробензо[1,4]діоксинілу чи бензо[1,3]діоксолілу; причому кожний моноциклічний та біциклічний гетероцикл може необов'язково бути заміщеним на атомі карбону 1, 2 чи 3 замісниками, вибраними з групи, що складається з галоїду, гідроксильної групи, алкілу чи алкоксигрупи. Краще, Het позначає тієніл. В рамках цієї заявки, галоїд позначає замісник, вибраний з групи, що складається з флюору, хлору, брому та йоду, а галоїдалкіл позначає лінійний чи розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону, або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, причому один чи більше атомів карбону є заміщеними одним чи кількома атомами 15 галоїду. Краще, галоїд є бромом, флюором чи хлором і, краще, галоїдалкіл є трифлюорметилом. Краще, винахід стосується сполуки формули (Іа) та (Іb), у якій: R1 позначає гідроген, галоїд, ціаногрупу, Аr, Het, алкіл та алкоксигрупу; p позначає ціле число, яке дорівнює нулю, 1, 2, 3 чи 4; R2 позначає гідроген, гідроксильну групу, алкоксигрупу, алкоксіалкоксигрупу, алкілтіогрупу чи радикал формули , де Υ позначає О; R3 позначає алкіл, Аr, Аr-алкіл чи Het; q позначає ціле число, яке дорівнює нулю, 1, 2, чи 3; R4 та R5 кожний незалежно позначають гідроген, алкіл чи бензил; або R4 та R5 разом з N, до якого вони приєднані, можуть утворювати радикал, вибраний з групи, що складається з піролідинілу, імідазолілу, триазолілу, піперидинілу, піперазинілу, піразинілу, морфолінілу та тіоморфолінілу, необов'язково заміщеного алкілом та піримідинілом; R6 позначає гідроген, галоїд чи алкіл; або два віцинальні радикали R6 можуть разом утворювати бівалентний радикал формули =СС= С= С-; r позначає ціле число, яке дорівнює 1; і R7 позначає гідроген; R8 позначає гідроген чи алкіл; R9 позначає оксогрупу; або R8 та R9 разом утворюють радикал =N-CH=CH. Алкіл позначає лінійний чи розгалужений насичений вуглеводневий радикал, який містить від 1 до 6 атомів карбону; або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону; або циклічний насичений вуглеводневий радикал, який містить від 3 до 6 атомів карбону, приєднаний до лінійного чи розгалуженого насиченого вуглеводневого радикала, який містить від 1 до 6 атомів карбону; причому кожний атом карбону може бути необов'язково заміщений галоїдом чи гідроксильною групою; Аr позначає гомоцикл, вибраний з групи, що складається з фенілу, нафтилу, аценафтилу, тетрагідронафтилу, кожний з яких є необов'язково заміщеним 1, 2 чи 3 замісниками, причому кожний замісник, незалежно, вибраний з групи, що складається з галоїду, галоїдалкілу, ціаногрупи, алкоксигрупи та морфолінілу; Het позначає моноциклічний гетероцикл, вибраний з групи, що складається з Nфеноксипіперидинілу, фуранілу, тієнілу, піридинілу, піримідинілу; або біциклічний гетероцикл, вибраний з групи, що складається з бензотієнілу, 2,3-дигідробензо[1,4]діоксинілу чи бензо[1,3]діоксолілу; де кожний моноциклічний та біциклічний гетероцикл може необов'язково бути заміщеним на атомі карбону 1, 2 чи 3 алкільними замісниками; і галоїд позначає замісник, вибраний з групи, що складається з флюору, хлору та брому. 82198 16 Для сполук будь-якої з формул (Іа) та (Іb), краще, R1 позначає гідроген, галоїд. Аr, алкіл чи алкоксигрупу. Ще краще, R1 позначає галоїд. Найкраще, R1 позначає бром. Краще, p дорівнює 1. Краще, R2 позначає гідроген, алкоксигрупу чи алкілтіогрупу. Ще краще, R2 позначає алкоксигрупу. Найкраще, R2 позначає метилоксигрупу. Краще, R3 позначає нафтил, феніл чи тієніл, кожний з яких є необов'язково заміщеним 1 чи 2 замісниками, які краще є галоїдом чи галоїдалкілом, найкраще, галоїдом. Ще краще, R3 позначає нафтил чи феніл. Найкраще, R3 позначає нафтил. Краще, q дорівнює нулю, 1 чи 2. Ще краще, q дорівнює 1. Краще, R4 та R5 позначають кожний незалежно гідроген чи алкіл, ще краще, гідроген, метил чи етил, найкраще, метил. Краще, R4 та R5 разом з Ν, до якого вони приєднані, утворюють радикал, вибраний з групи, що складається з імідазолілу, триазолілу, піперидинілу, піперазинілу та тіоморфолінілу, необов'язково заміщеного алкілом, галоїдом, галоїдалкілом, гідроксильною групою, алкоксигрупою, алкілтіогрупою, алкоксіалкілом чи алкілтіоалкілом, краще, заміщеного алкілом, найкраще, заміщеного метилом чи етилом. Краще, R6 позначає гідроген, алкіл чи галоїд. Найкраще, R6 позначає гідроген. Краще, r дорівнює 0, 1 чи 2. Краще, R7 позначає гідроген чи метил. Для сполук, які відповідають лише формулі (Іb), краще, R8 позначає алкіл, краще, метил, і R9 позначає оксиген. Цікавою групою сполук є такі сполуки формули (Іа), їхні фармацевтично прийнятні солі приєднання кислоти чи основи, їхні стереохімічно ізомерні форми, їхні таутомерні форми та їхні Nоксидні форми, у яких R1 позначає гідроген, галоїд, Аr, алкіл чи алкоксигрупу, p=1, R2 позначає гідроген, алкоксигрупу чи алкілтіогрупу, R3 позначає нафтил, феніл чи тієніл, кожний з яких є необов’язково заміщеним 1 чи 2 замісниками, вибраними з групи, що складається з галоїду та галоїдалкілу, q=0, 1, 2 чи 3, R4 та R5 позначають кожний незалежно гідроген чи алкіл, або R4 та R5 разом з N, до якого вони приєднані, утворюють радикал, вибраний з групи, що складається з імідазолілу, триазолілу, піперидинілу, піперазинілу та тіоморфолінілу, R6 позначає гідроген, алкіл чи галоїд, r дорівнює 0 чи 1, і R7 позначає гідроген. Найкраще, сполука є: 1-(6-бром-2-метоксихінолін-3-іл)-2-(3,5дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2олом; 1-(6-бром-2-метоксихінолін-3-іл)-4диметиламіно-2-нафталін-1-іл-1-фенілбутан-2олом; 1-(6-бром-2-метоксихінолін-3-іл)-2-(2,5дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2олом; 17 1-(6-бром-2-метоксихінолін-3-іл)-2-(2,3дифлюорфеніл)-4-диметиламіно-1-фенілбутан-2олом; 1-(6-бром-2-метоксихінолін-3-іл)-4диметиламіно-2-(2-флюорфеніл)-1-фенілбутан-2олом; 1-(6-бром-2-метоксихінолін-3-іл)-4диметиламіно-2-нафталін-1-іл-1-п-толілбутан-2олом; 1-(6-бром-2-метоксихінолін-3-іл)-4-метиламіно2-нафталін-1-іл-1-фенілбутан-2-олом; та 1-(6-бром-2-метоксихінолін-3-іл)-4диметиламіно-2-(3-флюорфенід)-1-фенілбутан-2олом, їхніми фармацевтично прийнятними солями приєднання кислоти чи основи, їхніми стереохімічно ізомерними формами, їхніми таутомерними формами та їхніми N-оксидними формами. Фармацевтично прийнятні солі приєднання кислоти визначені як такі, що включають терапевтично активні нетоксичні форми солей приєднання кислоти, що можуть бути утворені сполуками будь-якої з формул (Іа) та (Іb). Зазначені солі приєднання кислот можуть бути одержані шляхом обробки основної форми сполук будь-якої з формул (Іа) та (Іb) відповідними кислотами, наприклад, неорганічними кислотами, наприклад, галоїдводневою кислотою, зокрема, хлористоводневою кислотою, бромистоводневою кислотою, сірчаною кислотою, азотною кислотою та фосфорною кислотою; органічними кислотами, наприклад, оцтовою кислотою, гліколевою кислотою, пропіоновою кислотою, молочною кислотою, піровиноградною кислотою, щавлевою кислотою, малоновою кислотою, бурштиновою кислотою, малеїновою кислотою, фумаровою кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, метансульфоновою кислотою, етансульфоновою кислотою, бензолсульфоновою кислотою, птолуолсульфоновою кислотою, цикламовою кислотою, саліциловою кислотою, паміносаліциловою кислотою та памоєвою кислотою. Сполуки будь-якої з формул (Іа) та (Іb), які містять кислотні протони, можуть бути також перетворені на їхні терапевтично активні нетоксичні форми солей приєднання основ шляхом обробки відповідними органічними та неорганічними основами. Відповідні основні сольові форми включають, наприклад, амонієві солі, солі лужних та лужноземельних металів, зокрема, солі літію, натрію, калію, магнію та кальцію, солі з органічними основами, наприклад, бензатином, К-метил-D-глюкаміном, солі гідрабаміну, та солі з амінокислотами, наприклад, аргініном та лізином. Навпаки, зазначені сольові форми приєднання кислоти чи основи можуть бути перетворені на вільні форми шляхом обробки відповідною основою чи кислотою. Термін сіль приєднання в тому значенні, що використовується в рамках цієї заявки, включає також сольвати, які можуть бути утворені 82198 18 сполуками будь-якої з формул (Іа) та (Іb), а також їхніми солями. Такі сольвати є, наприклад, гідратами та алкоголятами. Термін "стереохімічно ізомерні форми" в тому значенні, що використовується тут, визначає всі можливі ізомерні форми, які можуть мати сполуки будь-якої з формул (Іа) та (Іb). Якщо не визначено чи вказано інше, хімічна назва сполуки позначає суміш всіх можливих стереохімічно ізомерних форм, причому зазначені суміші містять всі діастереомери та енантіомери базової молекулярної структури. Більш конкретно, стереогенні центри можуть мати R- чи Sконфігурацію; замісники на бівалентних циклічних (частково) насичених радикалах можуть мати цисчи транс-конфігурацію. Стереохімічно ізомерні форми сполук будь-якої з формул (Іа) та (Іb) мають напевно входити до обсягу даного винаходу. Згідно з номенклатурними правилами CAS, якщо у молекулі присутні два стереогенні центри відомої абсолютної конфігурації, то дескриптор R чи S присвоюється (за правилом послідовностей Кана-Інголда-Прелога) хіральному центру з найменшим номером, який є базовим центром. Конфігурація другого стереогенного центра вказується за допомогою відносних дескрипторів [R*,R*] чи [R*,S*], де R* завжди визначається як базовий центр, і [R*,R*] позначає центри з однаковою хіральністю, a [R*,S*] позначає центри з різною хіральністю. Наприклад, якщо хіральний центр з найменшим номером у молекулі має Sконфігурацію, а другий центр - R, то стереодескриптор буде записаний як S-[R*,S*]. Якщо використовуються позначення "α" та "β": положення замісника, який має найвищий пріоритет, на асиметричному атомі карбону в кільцевій системі, яка має найменшій номер кільця, довільно завжди визначається як "α"положення по відношенню до середньої площі, утвореної кільцевою системою. Положення замісника з найвищим пріоритетом на іншому асимметричному атомі карбону в кільцевій системі по відношенню до положення замісника з найвищим пріоритетом на базовому атомі позначається як "α", якщо він знаходиться з того самого боку від середньої площі, утвореної кільцевою системою, або як "β", якщо він знаходиться з іншого боку середньої площі, утвореної кільцевою системою. Сполуки будь-якої з формул (Іа) та (Іb) та деякі проміжні сполуки завжди мають щонайменше два стереогенні центри у своїй структурі, що може приводити до утворення щонайменше 4 стереохімічно різних структур. Таутомерні форми сполук будь-якої з формул (Іа) та (Іb) мають включати такі сполуки будь-якої з формул (Іа) та (Іb), у яких, наприклад, енольна група перетворена на кетогрупу (кето-енольний таутомеризм). N-оксидні форми сполук будь-якої з формул (Іа) та (Іb) мають включати такі сполуки будь-якої з формул (Іа) та (Іb), у яких один чи кілька атомів нітрогену є окисненими до так званого N-оксиду, 19 зокрема, такі N-оксиди, у яких нітроген амінового радикала є окисненим. Сполуки будь-якої з формул (Іа) та (Іb), одержані описаними нижче способами, можуть бути синтезовані у формі рацемічної суміші енантіомерів, які можуть бути відокремлені один від одного за допомогою відомих фахівцям методик розділення. Рацемічні сполуки будь-якої з формул (Іа) та (Іb) можуть бути перетворені на відповідні діастереомерні сольові форми реакцією з придатною хіральною кислотою. Зазначені діастереомерні сольові форми згодом розділяють, наприклад, шляхом селективної чи фракційної кристалізації, і енантіомери вивільняють з них за допомогою лугів. Альтернативний спосіб розділення енантіомерних форм сполук будь-якої з формул (Іа) та (Іb) включає використання рідинної хроматографії з хіральною нерухомою фазою. Зазначені чисті стереохімічно ізомерні форми можуть бути також одержані з відповідних чистих стереохімічно ізомерних форм відповідних вихідних матеріалів, за умови, що реакція відбувається стереоспецифічно. Краще, якщо потрібний конкретний ізомер, то зазначену сполуку одержують стереоспецифічними методами синтезу. Ці методи краще включають використання енантіомерно чистих вихідних матеріалів. Винахід також включає похідні сполуки (які звичайно називають "проліками") фармакологічно активних сполук за винаходом, які деградують in vivo з утворенням сполуки за винаходом. Проліки звичайно (але не завжди) мають нижчу активність по відношенню до цільових рецепторів, ніж сполуки, до яких вони деградують. Проліки є особливо корисними, якщо бажана сполука має хімічні чи фізичні властивості, які роблять її введення складним та неефективним. Наприклад, бажана сполука може бути малорозчинною, вона може погано транспортуватися крізь мукозальний епітелій, або може мати небажано короткий час напіввиведення з плазми. Більш детальне обговорення проліків можна знайти у Stella, V.J. et al., "Prodrugs", Drug Delivery Systems, 1985, pp.112176, та Drugs, 1985, 29, pp.455-473. Форми проліків фармакологічно-активних сполук за винаходом будуть загалом сполуками будь-якої з формул (Іа) та (Іb), їхніми фармацевтично прийнятними солями приєднання кислоти чи основи, їхніми стереохімічно ізомерними формами, їхніми таутомерними формами та їхніми N-оксидними формами, кислотна група яких є етерифікованою чи амідованою. Такі етерифіковані кислотні групи є групами формули –COORx, де Rx позначає С1-6алкіл, феніл, бензил чи одну з таких груп: Амідовані групи включають групи формули CONRyRz, де Ry позначає Н, С1-6-алко, феніл чи бензил, і Rz позначає -ОН, Н, С1-6-алкіл, феніл чи бензил. 82198 20 Сполуки за винаходом, які містять аміногрупу, можуть бути дериватизовані за допомогою кетону чи альдегіду, такого як формальдегід, з утворенням основи Манніха Ця основа гідролізується у водному розчині з кінетикою реакції першого порядку. Несподівано було продемонстровано, що сполуки за винаходом є придатними для лікування мікобактеріальних захворювань, зокрема, захворювань, спричинених патогенними мікобактеріями, такими як Mycobacterium tuberculosis, Μ.bovis, M.avium та Μ.mаrіnum. Даний винахід, таким чином, стосується також сполук будь-якої з формул (Іа) та (Іb), визначених вище, їхніх фармацевтично прийнятних солей приєднання кислоти чи основи, їхніх стереохімічно ізомерних форм, їхніх таутомерних форм та їхніх N-оксидних форм, призначених для використання як лікарський засіб. Винахід також стосується композиції, яка включає фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки за винаходом. Сполуки за винаходом можуть входити до складу композицій різних фармацевтичних форм, призначених для введення. Як відповідні композиції можуть бути названі всі композиції, що звичайно застосовуються для системного введення лікарських засобів. Для виготовлення фармацевтичних композицій за даним винаходом, ефективну кількість певної сполуки, необов'язково, у формі солі приєднання, як активний інгредієнт, поєднують з утворенням гомогенної суміші з фармацевтично прийнятним носієм, який може набувати різноманітних форм у залежності від форми препарату, бажаної для введення. Ці фармацевтичні композиції, бажано, є дозованими лікарськими формами для разового введення, придатними, зокрема, для введення перорально або шляхом парентеральної ін'єкції. Наприклад, при виготовленні композицій у вигляді дозованих форм для перорального введення, може бути використане будь-яке звичайне фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти і т.п., у випадку рідких препаратів для перорального введення, таких як суспензії, сиропи, еліксири, емульсії та розчини; або тверді носії, такі як крохмалі, цукри, каолін, розріджувачі, змащувальні речовини, зв'язуючі, розпушувальні агенти і т.п., у випадку порошків, пілюль, капсул та таблеток. Через простоту введення, таблетки та капсули є найкращими дозованими лікарськими формами для перорального введення, для яких, очевидно, використовуються тверді фармацевтичні носії. Для парентеральних композицій, носій буде звичайно включати стерильну воду, принаймні, здебільшого, хоч можуть бути включені інші інгредієнти, наприклад, для поліпшення розчинності. Можуть бути виготовлені, наприклад, розчини для ін'єкцій, у яких носій включає сольовий розчин, розчин глюкози чи суміш сольового та глюкозного розчинів. Можуть бути виготовлені також суспензії для ін'єкцій, у яких можуть бути використані відповідні рідкі носії, суспендувальні агенти і т.п. 21 Винахід також включає препарати у твердій формі, які мають бути перетворені, незабаром до використання, на препарати у рідкій формі. У залежності від способу введення, фармацевтична композиція буде, краще, включати від 0,05 до 99 % мас, ще краще, від 0,1 до 70% мас, активного інгредієнта, та від 1 до 99,95% мас, ще краще, від 30 до 99,9% мас, фармацевтично прийнятного носія, причому всі значення процентного вмісту вказані по відношенню до загальної кількості композиції. Фармацевтична композиція може додатково містити різні інші інгредієнти, відомі фахівцям, наприклад, змащувальну речовину, стабілізатор, буферний агент, емульгатор, агент регулювання в'язкості, поверхнево-активну речовину, консервант, ароматизатор чи барвник. Особливо краще, вищезгадані фармацевтичні композиції виготовляють у формі разових дозованих лікарських форм для простоти введення та однаковості доз. Разова дозована лікарська форма в тому значенні, що використовується тут, стосується фізично відокремлених одиниць, придатних для використання як разові дози, причому кожна одиниця містить попередньо визначену кількість активного інгредієнта, розраховану на досягнення бажаного терапевтичного ефекту, у поєднанні з потрібним фармацевтичним носієм. Прикладами таких разових дозованих лікарських форм є таблетки (включаючи таблетки з надрізом чи таблетки з покриттям), капсули, пілюлі, пакетики з порошками, облатки, супозиторії, розчини чи суспензії для ін'єкцій і т.п., та їхні кратні частки. Добова доза сполуки за винаходом буде, звичайно, змінюватися у залежності від використовуваної сполуки, способу введення, бажаного лікувального ефекту та мікобактеріального захворювання. Однак, загалом, задовільні результати будуть одержані при введенні сполуки за винаходом у добовій дозі, що не перевищує 1 грам, наприклад, в інтервалі від 10 до 50мг/кг ваги тіла. Крім того, даний винахід стосується також використання сполуки будь-якої з формул (Іа) та (Іb), їхніх фармацевтично прийнятних солей приєднання кислоти чи основи, їхніх стереохімічно ізомерних форм, їхніх таутомерних форм та їхніх N-оксидних форм, а також будь-якої з їхніх вищезгаданих фармацевтичних композицій для виробництва лікарського засобу для лікування мікобактеріальних захворювань. Згідно з цим, в іншому аспекті винахід передбачає спосіб лікування пацієнта, що страждає на мікобактеріальну хворобу чи має ризик її виникнення, який включає введення пацієнту терапевтично ефективної кількості сполуки чи фармацевтичної композиції за винаходом. Сполуки за винаходом можуть загалом бути одержані шляхом послідовності стадій, кожна з яких є відомою фахівцям. Зокрема, сполуки формули (Іа) можуть бути одержані шляхом проведення реакції проміжної сполуки формули (II) з проміжною сполукою 82198 22 формули (III) у відповідності до такої схеми реакції (1): з використанням BuLi у суміші DIPA та ТГФ, де всі змінні мають значення, визначені у формулі (Іа). Перемішування може підвищити швидкість реакції. Реакція може бути зручно проведена при температурі в інтервалі від -20 до -70°С. Вихідні матеріали та проміжні сполуки формули (II) та (III) є сполуками, які є комерційно доступними або можуть бути одержані згідно із звичайними процедурами синтезу, загальновідомими фахівцям. Наприклад, проміжні сполуки формули (ІІ-а) можуть бути одержані за такою схемою реакції (2): де всі змінні мають значення, визначені у формулах (Іа) та (Іb). Схема реакції (2) включає стадію (а), на якій відповідно заміщений анілін вводиться до реакції з відповідним ацилхлоридом, таким як 3-фенілпропіонілхлорид, 3флюорбензолпропіонілхлорид чи пхлорбензолпропіонілхлорид, у присутності придатної основи, такої як триетиламін, та придатного інертного по відношенню до реакції розчинника, такого як метиленхлорид чи етилендихлорид. Реакція може зручно бути проведена при температурі в інтервалі від кімнатної температури до температури кипіння зі зворотним холодильником. На наступній стадії (b) адукт, одержаний на стадії (а), вводиться до реакції з фосфорилхлоридом (РОСl3) у присутності Ν,Ν-диметилформаміду (формілювання за Вільсмайєром-Хааком з наступною циклізацією). Реакція може зручно бути проведена при температурі в інтервалі від кімнатної температури до температури кипіння зі зворотним холодильником. На наступній стадії (с) вводять певну групу R3, де R3 позначає радикал алкоксигрупи чи алкілтіогрупи, шляхом проведення реакції проміжної сполуки, одержаної на стадії (b), зі сполукою Χ-AIk, де X=S чи О, і АІк 23 позначає алкільну групу, визначену у формулах (Іа) та (Іb). Проміжні сполуки формули (ІІ-b) можуть бути одержані у відповідності до реакційної схеми (3), у якій на першій стадії (а) заміщений індол-2,3-діон вводиться до реакції із заміщеним 3фенілпропіональдегідом у присутності придатної основи, такої як гідроксид натрію (реакція Пфітцингера), після чого карбонову кислоту на наступній стадії (b) декарбоксилюють при високій температурі у присутності придатного інертного по відношенню до реакції розчинника, такого як дифеніловий ефір. Очевидно, що у описаних вище та нижче реакціях, реакційні продукти можуть бути виділені з реакційного середовища і, якщо треба, додатково очищені методами, загальновідомими фахівцям, такими як екстракція, кристалізація та хроматографія. Далі, очевидно, що продукти реакції, які існують у більш ніж одній енантіомерній формі, можуть бути виділені з їхньої суміші відомими методами, зокрема, препаративною хроматографією, такою як препаративна ВЕРХ. Типово, сполуки формули (Іа) та (Іb) можуть бути розділені на їхні ізомерні форми. Проміжні сполуки формули (III) є сполуками, які є комерційно доступними або можуть бути одержані у відповідності до звичайних процедур синтезу, загальновідомих фахівцям. Наприклад, проміжні сполуки формули (ІII-а), у якій R3 позначає Аr, заміщений s замісниками R10, де кожний R10 є незалежно вибраним з групи, що складається з гідроксильної групи, галоїду, ціаногрупи, нітрогрупи, аміногрупи, моно- чи діалкіламіногрупи, алкілу, галоїдалкілу, алкоксигрупи, галоїдалкоксигрупи, карбоксилу, алкоксикарбонілу, амінокарбонілу, морфолінілу та моно- чи діалкіламінокарбонілу, і s позначає ціле число, яке дорівнює нулю, 1, 2 чи 3, можуть бути одержані у відповідності до такої схеми реакції (4): Реакційна схема (4) включає стадію (а), на якій відповідно заміщений феніл вводять до реакції Фріделя-Крафта з відповідним ацилхлоридом, таким як 3-хлорпропіонілхлорид чи 4 82198 24 хлорбутирилхлорид, у присутності придатної кислоти Льюїса, такої як АlСl3, FeCl3, SnCl4, ТіС14 чи ZnCl2, та придатного інертного по відношенню до реакції розчинника, такого як метиленхлорид чи етилендихлорид. Реакція може зручно бути проведена при температурі в інтервалі від кімнатної температури до температури кипіння зі зворотним холодильником. На наступній стадії (b) вводять аміногрупу (-NR4R5) шляхом проведення реакції проміжної сполуки, одержаної на стадії (а), з первинним чи вторинним аміном. Наведені далі приклади ілюструють даний винахід, не обмежуючи його. Для деяких сполук абсолютна стереохімічна конфігурація стереогенного атома (атомів) карбону не була визначена експериментально. В цих випадках, стереохімічно ізомерну форму, яку було виділено першою, позначали як "А", а другу - як "В", без додаткового визначення дійсної стереохімічної конфігурації. Однак, зазначені ізомерні форми "А" та "В" можуть бути однозначно охарактеризовані кваліфікованим фахівцем за допомогою відомих методів, таких як, наприклад, рентгенівська дифракція. Метод виділення детально описаний далі. Тут та надалі, "ДМФ" позначає Ν,Νдиметилформамід, "DIPE" позначає діізопропіловий ефір, і "ТГФ" позначає тетрагідрофуран. А. Синтез проміжних сполук Приклад А1 Синтез проміжної сполуки 1 Бензолпропаноїлхлорид (0,488моль) додають по краплях при кімнатній температурі до розчину 4-бромбензоламіну (0,407моль) у Et3N (70мл) та СН2Сl2 (700мл) і суміш перемішують при кімнатній температурі протягом ночі. Суміш виливають у воду з концентрованим NH4OH та екстрагують СН2Сl2. Органічний шар осушають (MgSO4), фільтрують і розчинник випаровують. Залишок кристалізують з діетилового ефіру. Залишок (119,67г) розводять у СН2Сl2 і промивають 1Н НСl. Органічний шар осушають (MgSO4), фільтрують і розчинник випаровують. Вихід: 107,67г проміжної сполуки 1. Синтез проміжної сполуки 9 Проміжну сполуку 9 одержують аналогічно, у такий саме спосіб, як проміжну сполуку 1, але з використанням 4-метилбензолпропаноїлхлориду. Приклад А2 Синтез проміжної сполуки 2 25 Реакцію проводять двічі. Додають РОСl3 (1,225моль) по краплях при 10°С до ДМФ (0,525моль). Потім додають при кімнатній температурі проміжну сполуку 1 (одержану згідно з А1) (0,175моль). Суміш перемішують протягом ночі при 80°С, виливають на лід та екстрагують СН2Сl2. Органічний шар осушають (MgSO4), фільтрують і розчинник випаровують. Продукт використовують без додаткової очистки. Вихід: (77,62г; вихід =67%). Синтез проміжної сполуки 10 Проміжну сполуку 10 одержують аналогічно, у такий саме спосіб, як проміжну сполуку 2, починаючи з проміжної сполуки 9 (одержаної згідно з А1). Приклад A3 Синтез проміжної сполуки 3 Суміш проміжної сполуки 2 (одержаної згідно з А2) (0,233моль) у CH3ONa (30%) в метанолі (222,32мл) та метанол (776мл) перемішують та кип’ятять зі зворотним холодильником протягом ночі, а потім виливають на лід та екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/циклогексан 20/80, а потім 100/0; 20-45мкм). Чисті фракції збирають і розчинник випаровують. Вихід: 25г проміжної сполуки З (Вихід =33%; т.пл. 84°С) у вигляді білого порошку. Синтез проміжної сполуки 11 Проміжну сполуку 11 одержують аналогічно, у такий саме спосіб, як проміжну сполуку 3, починаючи з проміжної сполуки 10 (одержаної згідно з А2). Приклад А4 Синтез проміжної сполука 4 Суміш проміжної сполуки 2 (одержаної згідно з А2) (0,045моль) у NaOEt 21% в етанолі (50мл) та етанол (150мл) перемішують та кип'ятять зі зворотним холодильником протягом 12 годин. Суміш виливають на лід та екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Вихід: 15,2г проміжної сполуки 4 (98%). Приклад А5 82198 26 Синтез проміжної сполуки 5 Суміш 5-бром-1Н-індол-2,3-діону (0,28моль) у 3Н NaOH (650мл) перемішують та нагрівають при 80°С протягом 30хв., а потім охолоджують до кімнатної температури. Додають бензолпропаналь (0,28моль) і суміш перемішують та кип'ятять зі зворотним холодильником протягом 12 годин. Суміш залишають охолонути до кімнатної температури та підкислюють до рН=5 за допомогою НОАс. Осад відокремлюють на фільтрі, промивають Н2О та висушують (вакуум). Вихід: 50г проміжної сполуки 5 (52%). Приклад А6 Синтез проміжної сполуки 6 Суміш проміжної сполуки 5 (одержаної згідно з А5) (0,035моль) у дифеніловому ефірі (100мл) перемішують та нагрівають при 300°С протягом 8 годин, а потім залишають охолонути до кімнатної температури. Цю процедуру проводять чотири рази. Чотири суміші об'єднують, а потім очищають хроматографією на колонці з силікагелем (елюент: СН2Сд2/СН3ОН 100/0, потім 99/1). Чисті фракції збирають і розчинник випаровують. Вихід: 25,6г проміжної сполуки 6 (61%). Приклад А7 Синтез проміжних сполук 7 та 8 Додають по краплях н-BuLi 1,6М (0,13моль) при -10°С під потоком N2 до суміші N-(1метилетил)-2-пропанаміну (0,13моль) у ТГФ (300мл). Суміш перемішують при -10°С протягом 20хв., а потім охолоджують до -70°С. Додають по краплях розчин проміжної сполуки 3 (одержаної згідно з A3) (0,1моль) у ТГФ (300мл). Суміш перемішують при -70°С протягом 45хв. Додають по краплях розчин 2-(3-оксо-3-фенілпропіл)-1Нізоіндол-1,3(2Н)-діону (0,13моль) у ТГФ (300мл). Суміш перемішують при -70°С протягом 1год., потім доводять до -40°С, перемішують при -40°С протягом 2 годин, гідролізують при -40°С за допомогою Н2О та екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (40г) очищають хроматографією на колонці з 27 силікагелем (елюент: циклогексан/ЕtOАс 85/15). Дві чисті фракції збирають та їхні розчинники випаровують. Вихід: 1,8г проміжної сполуки 7 (3%) та 5,3г проміжної сполуки 8 (9%). Приклад А8 Синтез проміжних сполук 12 та 13 Суміш хлориду алюмінію (34,3г, 0,257моль) та 3-хлорпропіонілхлориду (29,7г, 0,234моль) у дихлоретані (150мл) перемішують при 0°С. Додають розчин нафталіну (30г, 0,234моль) у дихлоретані (50мл). Суміш перемішують при 5°С протягом 2 годин та виливають у воду з льодом. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (56г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/СН2Сl2: 60/40; 20-45мкм). Дві фракції збираюnь і розчинник випаровують, одержуючи проміжну сполуку 12 (31г; вихід =61%) у вигляді маслянистої рідини. Другу фракцію (14г) розводять у DIPE, одержуючи проміжну сполуку 13 (8,2г; вихід =16%; т.пл. 68°С) у вигляді блідо-жовтої твердої речовини. Приклад А9 Синтез проміжної сполуки 14 Суміш проміжної сполуки 12 (одержаної згідно з А8) (3г; 0,0137 моль), N-бензилметиламіну (2мл; 0,0150моль) в ацетонітрилі (100мл) перемішують при 80°С протягом 2 годин. При кімнатній температурі (RT) додають воду. Суміш екстрагують СН2Сl2. Органічний шар відокремлюють та осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (6г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/Ме0Н: 97/3; 20-45мкм), одержуючи ВВ1 (4,2г; кількісний вихід) у вигляді маслянистої рідини, проміжна сполука 14. Приклад А10 Синтез проміжної сполуки 15 82198 28 Суміш 3,5-дифлюорацетофенону (комерційно доступний) (25г; 0,16моль), діетиламіну гідрохлориду (52г; 0,64моль), параформальдегіду (19г; 0,63моль) у конц. НСl (5мл) та етанолу (300мл) перемішують при 80°С протягом 16 годин. Суміш випаровують до сухого залишку і залишок розводять у 3Н НСl (50мл). Цю суміш екстрагують Et2O (3×30ил). Органічний шар збирають та підлуговують К2СО3 (10% водн.). Органічний шар осушають над MgSO4 та випаровують. Продукт проміжну сполуку 15, у вигляді маслянистої рідини]ц- використовують без додаткової очистки на наступній стадії (23,7г; вихід: 69%). В. Синтез кінцевих сполук Приклад В1 Синтез кінцевих сполук 1, 2, 3 та 4 Додають повільно н-BuLi 1,6М (0,067моль) при -20°С під потоком N2 до розчину N-(1-метилетил)2-пропанаміну (0,067моль) у ТГФ (100 мл). Суміш охолоджують до -70°С. Додають повільно розчин проміжної сполуки 3 (одержаної згідно з A3) (0,122моль) у ТГФ (200 мл). Суміш перемішують при -70°С протягом 30хв. Додають повільно розчин 3-(диметиламіно)-1-феніл-1-пропанону (0,146моль) у ТГФ (100мл). Суміш перемішують при -70°С протягом 1год., потім гідролізують при 30°С льодяною водою та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (67г) очищають хроматографією на колонці з силікагелем (елюент: CH2CI 2/CH3OH/NH4OH 99/1/0,1; 20-45мкм). Дві чисті фракції збирають та їхні розчинники випаровують. Фракцію 1 (7,2г) кристалізують з DIPE. Осад відокремлюють на фільтрі та осушають. Вихід: 6,5г діастереоізомеру А (кінцева сполука 3) (т.пл. 172°С) (10%) у вигляді білої твердої речовини. Фракцію 2 (13г) кристалізують з 2-пропанону та діетилового ефіру. Осад відокремлюють на фільтрі та осушають. Вихід: 11г діастереоізомеру В (кінцева сполука 4) (т.пл. 170°С) (17%) у вигляді білої твердої речовини. Частину фракції кінцевої сполуки 3 (4г) розділяють на її енантіомери хроматографією на колонці (елюент: гексан/2-пропанол 99,9/0,1; колонка: CHIRACEL OD). Дві чисті фракції збирають та їхні розчинники випаровують. Залишок кристалізують з пентану. Осад відокремлюють на фільтрі та висушують. Вихід: 0,7г енантіомеру А1 (кінцева сполука 1) (т.пл. 194°С) та 0,6г енантіомеру А2 29 (кінцева сполука 2) (т.пл. 191°С) у вигляді білої твердої речовини. Приклад В2 Синтез кінцевих сполук 5 та 6 Додають повільно н-BuLi 1,6М (0,048моль) при -20°С до розчину N-(1-метилетил)-2-пропанаміну (0,048 моль) у ТГФ (70мл). Суміш знов охолоджують до -70°С. Додають повільно розчин проміжної сполуки 4 (одержаної згідно з А4) (0,044 моль) у ТГФ (150мл). Суміш перемішують при 70°С протягом 30хв. Додають повільно розчин 3(диметиламіно)-1-феніл-1-пропанону (0,053 моль) у ТГФ (100мл). Суміш перемішують при -70°С протягом 1год., гідролізують при -30°С льодяною водою та екстрагують ЕЮ Ас. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (23,5г) очищають хроматографією на колонці з силікагелем (елюент: CH2CI 2/CH3OH/NH4OH 99,5/0,5/0,1; 15-40мкм). Дві чисті фракції збирають та їхні розчинники випаровують. Залишок кристалізують з DIPE. Осад відокремлюють на фільтрі та висушують. Вихід: 0,7г кінцевої сполуки 5 (3%) (т.пл. 162°С) у вигляді білої твердої речовини та 1г кінцевої сполуки 6 (5%) (т.пл. 74°С) у вигляді білої твердої речовини. Приклад В3 Синтез кінцевих сполук 7 та 8 Додають н-BuLi (1,6М) (0,070моль) по краплях при -30°С під потоком N2 до розчину >Ц1метилетил)-2-пропанаміну (0,070 моль) у ТГФ (70мл). Суміш перемішують при -20°С протягом 30хв., а потім охолоджують до -70°С. Додають по краплях розчин проміжної сполуки 6 (одержаної згідно з А6) (0,046моль) у ТГФ (130мл). Суміш перемішують при -70°С протягом 45хв. Додають по краплях розчин 3-(диметиламіно)-1-феніл-1пропанону (0,056моль) у ТГФ (100мл). Суміш перемішують при -70°С протягом 2 годин, гідролізують водою з льодом та екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. 82198 30 Залишок (23,6г) очищають хроматографією на колонці з силікагелем (елюент: CH2Cl2/CH3OH/NH4OH 99/1/0,1; 15-40мкм). Збирають дві чисті фракції та їхні розчинники випаровують. Фракцію 1 (4г) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 1,7г кінцевої сполуки 7 (т.пл. 98°С) (7,6%). Фракцію 2 (3,5г) кристалізують з діетилового ефіру/ЕЮАс. Осад відокремлюють на фільтрі та висушують. Вихід: 2,2г кінцевої сполуки 8 (т.пл. 180°С) (9,8%) у вигляді білої твердої речовини. Приклад В4 Синтез кінцевої сполуки 9 Суміш проміжної сполуки 8 (одержаної згідно з А7) (0,009моль) та гідразину (0,01моль) в етанолі (70мл) перемішують та кип'ятять зі зворотним холодильником протягом 1год. Розчинник випаровують до сухого залишку. Залишок розчиняють у СН2Сl2. Органічний розчин промивають 10%-ним К2СО3, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (5г) очищають хроматографією на колонці з силікагелем (елюент· CH2Cl2/CH3OH/NH4OH 97/3/0,1; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Залишок кристалізують з діетилового ефіру Осад відокремлюють на фільтрі та висушують. Вихід: 2,6г кінцевої сполуки 9 (т.пл. 204°С) (62%) у вигляді блідо-жовтої твердої речовини. Приклад В5 Синтез кінцевої сполуки 10 Додають при кімнатній температурі СН3І (0,0033моль) до розчину кінцевої сполуки 4 (одержаної згідно з В1) (0,003моль) у 2-пропаноні (15мл). Осад відокремлюють на фільтрі та висушують. Вихід: 1,2г кінцевої сполуки 10 (т.пл. 198°С) (62%)у вигляді блідо-жовтої твердої речовини. Приклад В6 Синтез кінцевої сполуки 11 31 82198 32 енантіомерів, діастереоізомер А (кінцева сполука 14) очищають хіральною хроматографією на силікагелі (елюент: гексан//ЕЮН; 99,95/0,05). Дві фракції збирають і розчинник випаровують. Вихід: 0,233г енантіомеру А1 (кінцева сполука 12) (т.пл. 118°С) у вигляді білої твердої речовини та 0,287г енантіомеру А2 (кінцева сполука 13) (т.пл. 120°С) у вигляді білої твердої речовини. Приклад В8 Синтез кінцевих сполук 67, 68, 110 та 111 Розчин 3-хлорпероксибензойної кислоти (0,0069моль) у СН2Сl2 (35мл) додають по краплях при кімнатній температурі до розчину кінцевої сполуки 4 (одержаної згідно з В1) (0,0069моль) у СН2Сl2 (35мл). Суміш перемішують при кімнатній температурі протягом 1год., промивають 10%-ним К2СО3, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 1,8г кінцевої сполуки 11 (т.пл. 208°С) у вигляді білої твердої речовини. Приклад В7 Синтез кінцевих сполук 12, 13, 14 та 15 Додають н-BuLi 1,6М (0,05моль) повільно при 20°С під потоком N2 до розчину N-(1-метилетил)-2пропанаміну (0,05моль) у ТГФ (80мл). Суміш перемішують при -20°С протягом 15 хвилин, а потім охолоджують до -70°С. Додають повільно розчин проміжної сполуки 3 (одержаної згідно з A3) (0,046моль) у ТГФ (150мл). Суміш перемішують при -70°С протягом 30 хвилин. Додають повільно розчин 0,055моль 3(диметиламіно)-1-(1-нафтил)-1-пропанону у ТГФ (120мл). Суміш перемішують при -70°С протягом 3 годин, гідролізують при -30 °С льодяною водою та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (29г) очищають хроматографією на колонці з силікагелем (елюент: CH2CI 2/CH3OH/NH4OH; 99,5/0,5/0,1; 15-35мкм). Дві фракції збирають і розчинник випаровують. Вихід: 3г фракції 1 та 4,4г фракції 2. Фракції 1 та 2 кристалізують окремо з DIPE. Осад відокремлюють на фільтрі та висушують, вихід: 2,2г діастереоізомеру А кінцевої сполуки 14 (Вихід: 9%; т.пл. 210°С) у вигляді білої твердої речовини та 4г діастереоізомеру В кінцевої сполуки 15 (Вихід: 16%; т.пл. 244°С) у вигляді білої твердої речовини. Для одержання відповідних Додають повільно н-BuLi 1,6М (0,067моль) при -20°С під потоком N2 до розчину N-(1-метилетил)2-пропанаміну (0,0104моль) у ТГФ (50мл). Суміш охолоджують до -70°С. Додають повільно розчин проміжної сполуки 3 (одержаної згідно з A3) (0,0087моль) у ТГФ (50мл). Суміш перемішують при -70°С протягом 30хв. Додають повільно розчин 3-(диметиламіно)-1-(2,5-дифлюорфеніл)-1пропанону (0,0122моль) у ТГФ (20мл). Суміш перемішують при -70°С протягом 1год., потім гідролізують при -30°С льодяною водою та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (6,3г) очищають хроматографією на колонці з силікагелем (елюент: CH2CI 2/CH3OH/NH4OH 98/2/0,2; 20-45мкм). Дві чисті фракції збирають та їхні розчинники випаровують. Фракцію 1 (1,2г) кристалізують з Et2O. Осад відокремлюють на фільтрі та висушують. Вихід: 0,63г діастереоізомеру А (кінцева сполука 67) (т.пл. 60°С; вихід =13%) у вигляді білої твердої речовини. Фракцію 2 (1г) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,64г діастереоізомеру В (кінцева сполука 68) (т.пл. 208°С; вихід =14%). Очищають 0,63г діастереоізомеру А на колонці chiracel AD (елюент: гептан/ізо-РЮН 99,95/0,05). Збирають дві фракції, які відповідають енантіомеру А1 (кінцева сполука 110, 0,13г; т.пл. 167°С) у вигляді білої твердої речовини та енантіомеру А2 (кінцева сполука 111, 0,086г) у вигляді маслянистої рідини. Приклад В9 Синтез кінцевих сполук 38, 39, 108 та 109 33 Додають повільно н-BuLi 1,6М (0,04моль) при 20°С під потоком N2 до розчину N-(1-метилетил)-2пропанаміну (0,04моль) у ТГФ (50мл). Суміш охолоджують до -70°С. Додають повільно розчин проміжної сполуки 3 (одержаної згідно з A3) (0,037моль) у ТГФ (100мл). Суміш перемішують при -70 °С протягом 30хв. Додають повільно розчин 3-(диметиламіно)-1-(3-флюорфеніл)-1пропанону (0,044моль) у ТГФ (50мл). Суміш перемішують при -70°С протягом 1год., потім гідролізують при -30°С льодяною водою та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (20г) очищають хроматографією на колонці з силікагелем (елюент: CH2Cl2/CH3OH/NH4OH 99,5/0,5/0,1; 15-40мкм). Збирають три чисті фракції та їхні розчинники випаровують. Фракцію 1 (2,8г) кристалізують з DIPE. Осад відокремлюють на фільтрі та висушують. Вихід: 1,45г (7%) діастереоізомеру А (кінцева сполука 38) (т.пл. 198°С) у вигляді білої твердої речовини. Фракцію 2 (3,4г) кристалізують з DPE. Осад відокремлюють на фільтрі та висушують. Вихід: 1,55г (8%) діастереоізомеру В (кінцева сполука 39) (т.пл. 207°С) у вигляді білої твердої речовини. Частину фракції кінцевої сполуки 38 (1г) розділяють на її енантіомери хіральною хроматографією (елюент: гексан/2пропанол 99,9/0,1; колонка: CHIRACEL OD). Збирають дві чисті фракції та їхні розчинники випаровують. Залишок кристалізують з пентану. Осад відокремлюють на фільтрі та висушують. Вихід: 0,3г енантіомеру А1 (кінцева сполука 108) (т.пл. 160°С) у вигляді білої твердої речовини та 0,26г енантіомеру А2 (кінцева сполука 109) (т.пл. 156°С) у вигляді білої твердої речовини. Приклад В10 Синтез кінцевих сполук 71 та 72 Додають повільно н-BuLi 1,6М (0,0042моль) при -20°С під потоком N2 до розчину N-(1метилетил)-2-пропанаміну (0,0042моль) у ТГФ 82198 34 (20мл). Суміш охолоджують до -70°С. Додають повільно розчин проміжної сполуки 9 (одержаної згідно з А1) (0,0038моль) у ТГФ (50мл). Суміш перемішують при -70°С протягом 30хв. Додають повільно розчин 3-(диметиламіно)-1-(1-нафтил)-1пропанону (0,0059моль) у ТГФ (20мл). Суміш перемішують при -70°С протягом 1год., потім гідролізують при -30°С льодяною водою та екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (2,2г) очищають хроматографією на колонці з силікагелем (елюент: CH2CI 2/CH3OH/NH4OH 99/1/0,1; 15-40мкм). Дві чисті фракції збирають та їхні розчинники випаровують. Фракцію 1 (0,17г) кристалізують з Et2O. Осад відокремлюють на фільтрі та висушують. Вихід: 0,05г діастереоізомеру А (кінцева сполука 71) (т.пл. 174°С; вихід =3%) у вигляді білої твердої речовини. Фракцію 2 (0,27г) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,053г діастереоізомеру В (кінцева сполука 72) (т.пл. 178°С; вихід =4%) у вигляді білої твердої речовини. Приклад В11 Синтез кінцевої сполуки 99 Розчин 3-хлорпероксибензойної кислоти (0,0036моль) у СН2Сl2 (10мл) додають по краплях при кімнатній температурі до розчину кінцевої сполуки 12 (енантіомер А1) (одержаної згідно з В7) (0,0069 моль) у СН2Сl2 (35мл). Суміш перемішують при кімнатній температурі протягом 1год., промивають К2СО3 10%, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,16г кінцевої сполуки 99 (т.пл. 218°С; вихід =78%) у вигляді білої твердої речовини. Приклад В12 Синтез кінцевої сполуки 110 Додають повільно н-BuLi 1,6М (0,0075моль) при -20°С під потоком N2 до розчину N-(1метилетил)-2-пропанаміну (0,0075моль) у ТГФ (30мл). Суміш охолоджують до -70°С. Додають повільно розчин проміжної сполуки 3 (одержаної згідно з A3) (0,0062моль) у ТГФ (20мл). Суміш перемішують при -70°С протягом 30хв. Додають повільно розчин 0,0075моль проміжної сполуки 14 (одержаної згідно з Приклад А9) у ТГФ (10мл). 35 Суміш перемішують при -70°С протягом 90 хвилин, потім гідролізують при -30°С льодяною водою та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (3г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 90/10; 15-40мкм). Кінцеву сполуку 110 (1,5г; вихід =38%) одержують у вигляді маслянистої рідини. Приклад В13 Синтез кінцевих сполук 111 та 112 Додають 1-хлоретилхлорформіат (0,25мл, 0,0023моль) при кімнатній температурі під азотом до розчину похідного 111 (1,5г, 0,0023 моль) у дихлорметані (30мл). Суміш перемішують при 80°С протягом 1год. Розчинник випаровують і додають метанол (15мл). Суміш перемішують та кип'ятять зі зворотним холодильником протягом 30 хвилин. Після випаровування, залишок (1,49г) очищають хроматографією на колонці з силікагелем (15-40мкм). Першу зібрану фракцію кристалізують з DIPE, одержуючи діастереоізомер А кінцевої сполуки 111 (0,168г; т.пл. 204°С, вихід =13%). Друга зібрана фракція відповідає діастереоізомеру В кінцевої сполуки 112 (0,298г; т.пл. 225°С; вихід =23%). Приклад В14 Синтез кінцевих сполук 113 та 114 Додають повільно н-BuLi 1,6М (3,5мл; 0,0056моль) при -20°С під потоком N2 до розчину N-(1-метилетил)-2-пропанаміну (770мкл; 0,0055моль) у ТГФ (20мл). Суміш охолоджують до -70°С. Додають повільно розчин проміжноїі сполуки 3 (одержаної згідно з A3) (1,5г; 0,0047моль) у ТГФ (20мл). Суміш перемішують при -70°С протягом 30хв. Додають повільно розчин проміжної сполуки 15 (1г; 0,0047моль) у ТГФ (10мл). Суміш перемішують при -70°С протягом 3 годин, а потім гідролізують при -30°С льодяною водою та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (2,8г) очищають хроматографією на колонці з силікагелем (елюент: 82198 36 CH2CI 2/CH3OH/NH4OH 99/1/0,1; 15-40мкм). Збирають дві чисті фракції та їхні розчинники випаровують. Фракцію 1 (0,149г) кристалізують з DIPE, одержуючи кінцеву сполуку 113 (0,14г; т.пл. 185°С; вихід =6%) у вигляді білого порошку. Фракцію 2 (0,14г) кристалізують з Et2O, одержуючи кінцеву сполуку 114 (0,14г; т.пл. 210°С; вихід =6%) у вигляді білого порошку. Приклад В15 Синтез кінцевих сполук 115, 116, 117 та 118 Додають повільно н-BuLi 1,6М (4,6мл; 0,0074моль) при -20°С під потоком N2 до розчину N-(1-метилетил)-2-пропанаміну (1мл; 0,0071моль) у ТГФ (20мл). Суміш охолоджують до -70°С. Додають повільно розчин проміжної сполуки 15 (одержаної згідно з А10) (2г; 0,0061моль) у ТГФ (10мл). Суміш перемішують при -70°С протягом 30хв. Додають повільно розчин 3-(диметиламіно)1-(3,5-дифлюорфеніл)-1-пропанону (одержаного згідно з А10) (2г; 0,0094моль) у ТГФ (15мл). Суміш перемішують при -70°С протягом 2 годин, потім гідролізують при -30°С за допомогою 10%-ного водн. NH4C1 та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (4,5г) очищають хроматографією на колонці з силікагелем (елюент: CH2Cl2/iзо-PrOH/NH4OH 99,5/0,5/0,05; 15-40мкм). Збирають дві чисті фракції та їхні розчинники випаровують. Фракцію 1 (0,67г; вихід =20%) кристалізують з DIPE, одержуючи кінцеву сполуку 115 (0,29г; т.пл. 192 °С; вихід =9%) у вигляді білого порошку. Фракцію 2 (0,46г) кристалізують з Et2O, одержуючи кінцеву сполуку 116 (0,22г; т.пл. 224°С; вихід =7%) у вигляді білого порошку. З 0,1г кінцевої сполуки 115, виділяють кінцеві сполуки 116 та 117 (енантіомери) на колонці CHIRACEL OD (елюент: гептан/ізо-РrOН 99,9/0,1; 15-40мкм). Збирають дві фракції та кристалізують з Еt2О, одержуючи кінцеву сполуку 116 (0,05г; т.пл. 161°С; вихід =100%) у вигляді білого порошку та кінцеву сполуку 117 (0,043г; т.пл. 158°С; вихід =98%) у вигляді білого порошку. У відповідності до описаних вище методів були одержані такі кінцеві сполуки: 37 82198 38 39 82198 40 41 82198 42 43 С. Фармакологічні приклади C.1. In vitro спосіб тестування сполук проти Μ.tuberculosis Плоскодонні стерильні 96-лункові пластикові мікротитрувальні планшети заповнюють 100мкл бульйонного живильного середовища Мідлбрука (Middlebrook) (1×). Після цього додають до ряду парних лунок у колонці 2 маточні розчини (10× кінцева досліджувана концентрація) сполук в об'ємі 25мкл для оцінки їхнього впливу на бактеріальний ріст. Серійні п'ятикратні розведення роблять безпосередньо на мікротитрувальних планшетах у колонках з 2 до 11 за допомогою спеціальної роботизованої системи (Zymark Corp., Hopkinton, MA). Кінчики піпеток заміняють після кожних 3 розведень для уникнення похибок піпетування для сильно гідрофобних сполук. До кожного мікротитру вального планшета були включені необроблені контрольні зразки з інокулятом (колонка 1) та без нього (колонка 12). Приблизно 5000КУО (колонієутворювальних одиниць) (CFU) Mycobacterium tuberculosis (штам H37RV) на лунку в об'ємі 100мкл бульйонного живильного середовища Мідлбрука (їх) додають у ряди з А до Н, за винятком колонки 12. Такий саме об'єм бульйонного живильного середовища без інокуляту додають до колонки 12 у рядах з А до Н. Культури інкубують при 37°С протягом 7 днів у зволоженій атмосфері (інкубатор з відкритим повітряним клапаном та безперервною вентиляцією). За один день до кінця інкубування, через 6 днів після інокуляції, додають до всіх лунок резазурин (1:5) в об'ємі 20мкл і планшети інкубують протягом ще 24 годин при 37°С. В день 7 бактеріальний ріст кількісно вимірюють методом флюорометрії. Флуоресценцію зчитують за допомогою флюорометра з комп'ютерним керуванням (Spectramax Gemini EM, Molecular Devices) на довжині хвилі збудження 530нм та довжині хвилі емісії 590нм. Розраховують процент інгібування росту, забезпечуваний сполуками, стандартними методами і обчислюють мінімальну інгібуючу концентрацію (МІС) (представлену як ІС90, виражену в мікрограмах/мл). Результати наведені в Таблиці 5. С.2. In vitro спосіб тестування сполук на антибактеріальну активність проти штаму Μ.smegmatis ATCC607 Плоскодонні стерильні 96-лункові пластикові мікротитрувальні планшети заповнюють 180мкл стерильної деіонізованої води з добавкою 0,25% бичачого сироваткового альбуміну (BSA). Після цього додають до ряду парних лунок у колонці 2 82198 44 маточні розчини (7,8× кінцева досліджувана концентрація) сполук в об'ємі 45мкл для оцінки їхнього впливу на бактеріальний ріст. Серійні п'ятикратні розведення (45мкл у 180мкл) роблять безпосередньо на мікротитрувальних планшетах у колонках з 2 до 11 за допомогою спеціальної роботизованої системи (Zymark Corp., Hopkinton, MA). Кінчики піпеток заміняють після кожних З розведень для зменшення похибок піпетування для сильно гідрофобних сполук. До кожного мікротитрувального планшета були включені необроблені контрольні зразки з інокулятом (колонка 1) та без нього (колонка 12). Приблизно 250КУО на лунку бактеріального інокуляту в об'ємі 100мкл у 2,8× бульйонного живильного середовища Мюллера-Хінтона додають до рядів з А до Н, за винятком колонки 12. Такий саме об’єм бульйонного живильного середовища без інокуляту додають до колонки 12 в рядах з А до Н. Культури інкубують при 37°С протягом 48 годин у зволоженій атмосфері з 5% СО2 (інкубатор з відкритим повітряним клапаном та безперервною вентиляцією). Наприкінці інкубування, через два дні після інокуляції, бактеріальний ріст кількісно вимірюють методом флюорометрії. Після цього додають аламар синій (Alamar Blue) (10×) до усіх лунок в об'ємі 20мкл і планшети інкубують протягом ще 2 годин при 50°С. Флуоресценцію зчитують за допомогою флюорометра з комп'ютерним керуванням (Cytofluor, Biosearch) на довжині хвилі збудження 530нм та довжині хвилі емісії 590нм (коефіцієнт підсилення 30). Розраховують % інгібування росту, забезпечуваний сполуками, стандартними методами. Величини pIC 50 визначали як 50%-ну інгібуючу концентрацію бактеріального росту. Результати наведені в Таблиці 5. Таблиця 5 Результати in vitro скринінгу сполук за винаходом по відношенню до М.tuberculosis (МІС) та М.smegmatis (pIC50) Сп. № 118 174 12 115 69 71 113 5 32 109 16 37 67 110 164 183 208 98 216 МІС 0,01 0,06 0,07 0,07 0,13 0,14 0,27 0,33 0,33 0,33 0,34 0,34 0,34 0,34 0,36 0,36 0,38 0,51 0,85 РІС50 9,1 6,8 8,7 8,6 8,5 8,5 8,6 7,8 7,4 8,2 6,8 7,9 8,6 8,5 7,9 8,3 7,9 7,9 8,0 45 26 22 203 28 30 179 135 91 188 24 63 65 66 17 111 117 196 75 76 45 46 227 94 225 35 190 191 80 102 121 165 79 15 72 180 82 205 36 103 192 44 64 19 195 52 172 31 134 92 83 62 27 6 33 38 39 181 182 41 215 220 82198 1,00 1,11 1,15 1,41 1,46 1,48 1,50 1,51 1,60 1,62 1,64 1,69 1,69 1,71 1,71 1,71 1,71 1,74 1,74 1,76 1,76 1,76 1,77 1,80 1,82 1,85 1,85 2,11 2,21 2,21 2,26 2,43 2,78 3,59 3,73 3,90 4,56 5,40 5,54 5,98 6,01 6,54 6,72 6,82 7,06 7,30 7,31 7,52 7,55 7,78 7,79 7,97 8,23 8,27 8,30 8,30 8,30 8,30 8,51 8,52 8,52 7,2 7,2 8,0 7,3 7,8 7,0 7,4 7,5 7,2 7,2 6,7 5,7 4,7 6,5 6,4 6,7 6,6 7,9 5,9 8,0 6,4 7,5 7,9 6,6 6,8 6,5 6,5 7,1 6,5 5,9 6,6 7,2 6,5 6,9 6,6 7,1 7,2 6.4 5,9 6,5 5.9 5,8 6,5 6,5 6,4 5,7 5,8 6,5 6,5 5,8 5,9 5,9 5,8 6,0 7,9 6.1 6,9 6,3 5,9 6,2 5,3 46 116 138 47 48 84 85 23 14 218 228 77 141 142 226 99 101 212 206 204 197 162 193 176 156 201 175 119 10 18 152 147 151 86 21 58 136 95 125 97 25 96 40 73 8 127 189 57 222 93 9 61 229 87 120 20 11 81 137 219 56 114 8,58 8,58 8,65 8,65 8,76 8,76 8,79 8,80 8,80 8,80 8,93 9,03 9,03 9,03 9,06 9,06 9,08 9,09 9,14 9,25 9,28 9,47 9,50 9,68 9,77 10,19 10,20 10,26 10,60 10,93 11,36 13,76 16,02 16,17 16.49 16,81 16,87 18,01 20,17 20,36 21,24 21,38 23,49 23,83 25,26 25,43 25,77 30,35 35,31 37,92 39,04 40,09 40,23 40,60 40,63 41,42 42,14 42,23 42,69 43,01 43,01 6,6 6,6 6,5 5,8 7,0 5.9 6,4 6,8 6,6 5,1 7,2 7,3 6,2 5,5 7,9 5,8 6,0 6,5 5,4 6,6 7,0 5,6 6.8 5,3 5,7 6,5 7,8 5,6 6,7 5,8 7,4 5,0 6,9 5,4 6,8 6,2 6,9 4,4 5,9 5,2 6,2 4,7 8,0 5,7 6,9 5,5 5,4 8,0 4,8 4,5 4,5 7,1 5,0 5,9 5,9 4,6 5,4 4,6 5,8 7,2 5,9 47 167 13 107 217 221 224 42 43 131 29 78 55 88 100 34 170 171 163 129 132 194 199 7 207 149 202 130 143 70 144 157 49 50 53 54 112 123 124 153 106 126 148 186 173 187 122 74 89 90 128 133 145 146 139 140 158 223 161 198 210 211 43,01 44,13 44.13 44,13 44,13 44,13 44,34 44,34 44,45 44,46 44,76 44,77 45,40 45,40 45,66 46,19 46,19 46,51 47,31 47,31 47,31 47,47 47,54 48,05 48,50 48,98 50,32 50,39 52,35 52,46 52,46 52,85 52,85 52,94 52,94 54,15 54,75 54,75 54,77 55,55 56,96 56,96 56,96 57,85 57,85 58,16 59,00 59,06 59,06 59,56 59,56 59,56 59,56 59,76 59,76 59,76 60,56 61,16 61,16 61,16 61,16 82198 5,5 6,7 5.8 6,9 6,5 4,9 6,3 4,4 6,9 5,9 5,8 5,1 6,8 7,1 5,1 5,6 4,3 5,9 4,7 4,4 4,9 6,5 4,6 5,2 5,1 4,8 5,3 6,9 5,8 7,0 5,6 5.4 5,0 5,1 4,1 5,5 4,2 5,3 5,3 6,2 5,2 4,9 4,5 4,7 4,0 4,8 6.5 6,4 5.3 4,0 5,1 5,3 4,8 4,1 5,8 5,3 5,7 4,0 4,3 6,1 4,1 48 150 155 166 200 209 177 178 154 1 2 3 4 51 59 60 68 104 105 108 63,44 67,45 67,45 67,47 67,47 67,65 67,65 68,95 не визначено не визначено не визначено не визначено не визначено не визначено не визначено не визначено не визначено не визначено не визначено 5,7 4,9 4,1 4,9 4,0 4,0 4,5 4,9 7,3 6,8 6,7 5,7 5,8 5,1 5,6 6,4 6,6 6,0 7,0
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinoline derivatives and using of them as micobacterial inhibitors, process for preparation thereof, pharmaceutical composition based on claimed compounds, and transient compound
Автори англійськоюvan Gestel Jozef Frans Elisabetha, Guillemont Jerome Emile George, VENET MARC GASTON, DECRANE LAURENCE FRANCOISE BER, Vernier Daniel F.J., ODDS FRANK CHRISTOPHER
Назва патенту російськоюХинолиновые производные и их использование в качестве микобактериальных ингибиторов, способ их получения, фармацевтическая композиция на их основе, промежуточное соединение
Автори російськоюван Гестель Йозеф Франс Элизабета, Жильмон Жером Эмиль Жорж, Венэ Марк Гастон, Декран Лоренс Франсуаз Бернадетт, Вернье Даниэль Ф.Ж., Оддс Франк Кристофер
МПК / Мітки
МПК: C07D 471/04, C07D 215/36, C07D 409/04, C07D 215/227, C07D 521/00, C07D 409/06, C07D 401/12, A61P 31/06, C07D 215/48, C07D 401/06, C07D 405/04, C07D 405/06
Мітки: сполука, одержання, проміжна, спосіб, композиція, похідні, основі, фармацевтична, мікобактеріальних, інгібіторів, хінолінові, використання
Код посилання
<a href="https://ua.patents.su/24-82198-khinolinovi-pokhidni-ta-kh-vikoristannya-yak-mikobakterialnikh-ingibitoriv-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-na-kh-osnovi-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Хінолінові похідні та їх використання як мікобактеріальних інгібіторів, спосіб їх одержання, фармацевтична композиція на їх основі, проміжна сполука</a>
Попередній патент: Спосіб одержання гранульованого сульфату алюмінію
Наступний патент: Похідні заміщеного азаіндолоксооцтового піперазину, що мають противірусну активність, та фармкомпозиція на їх основі
Випадковий патент: Смуговий розпушувач ґрунту












