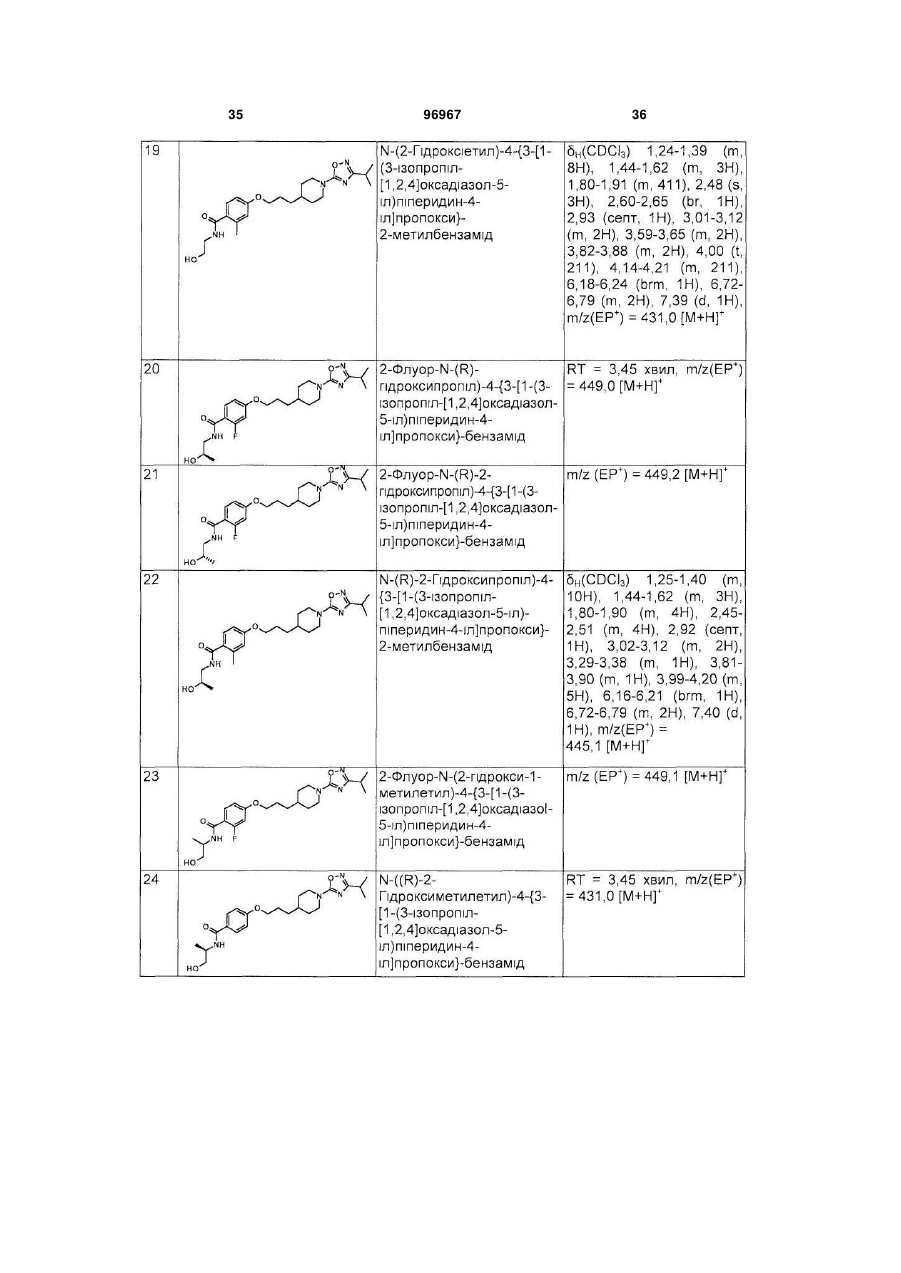
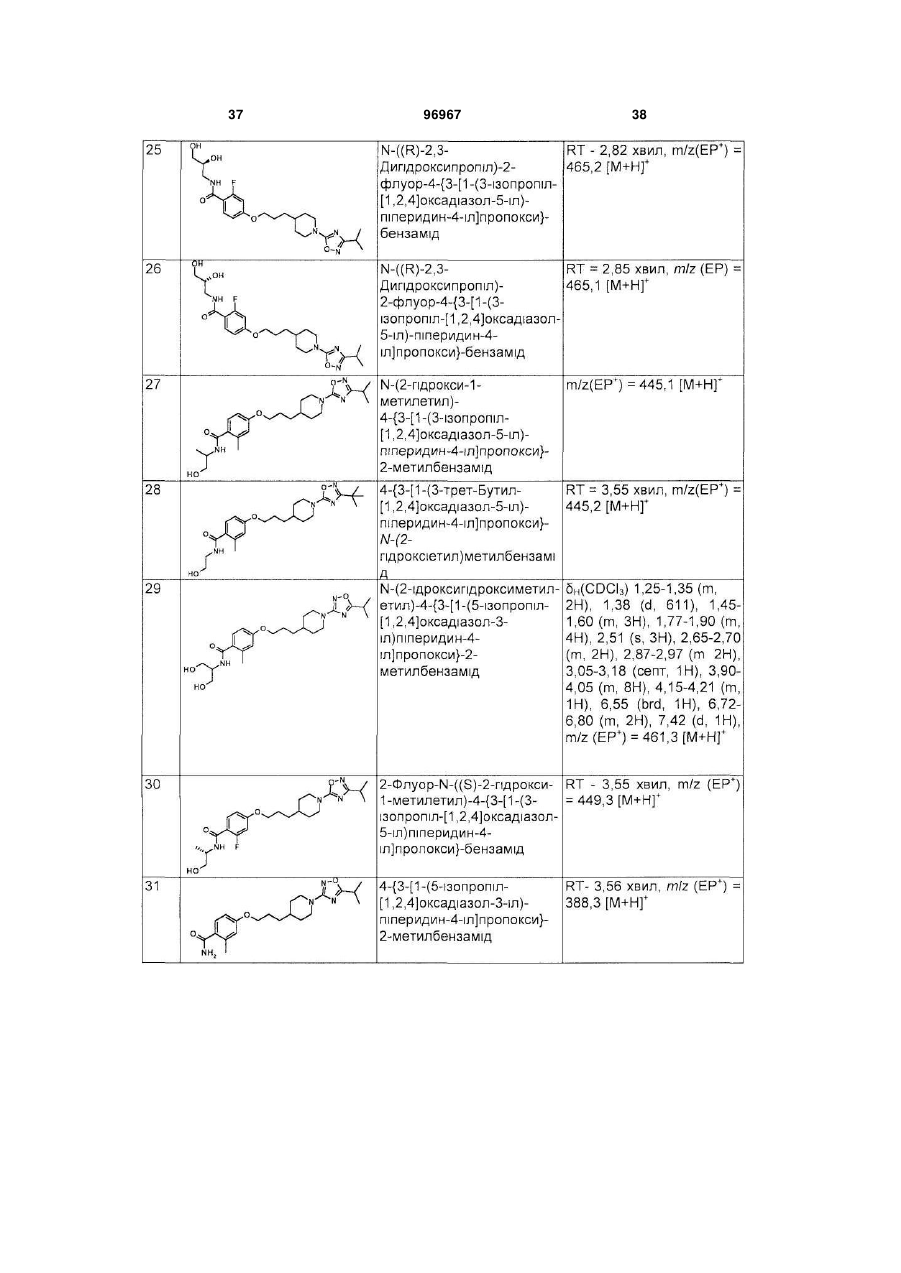
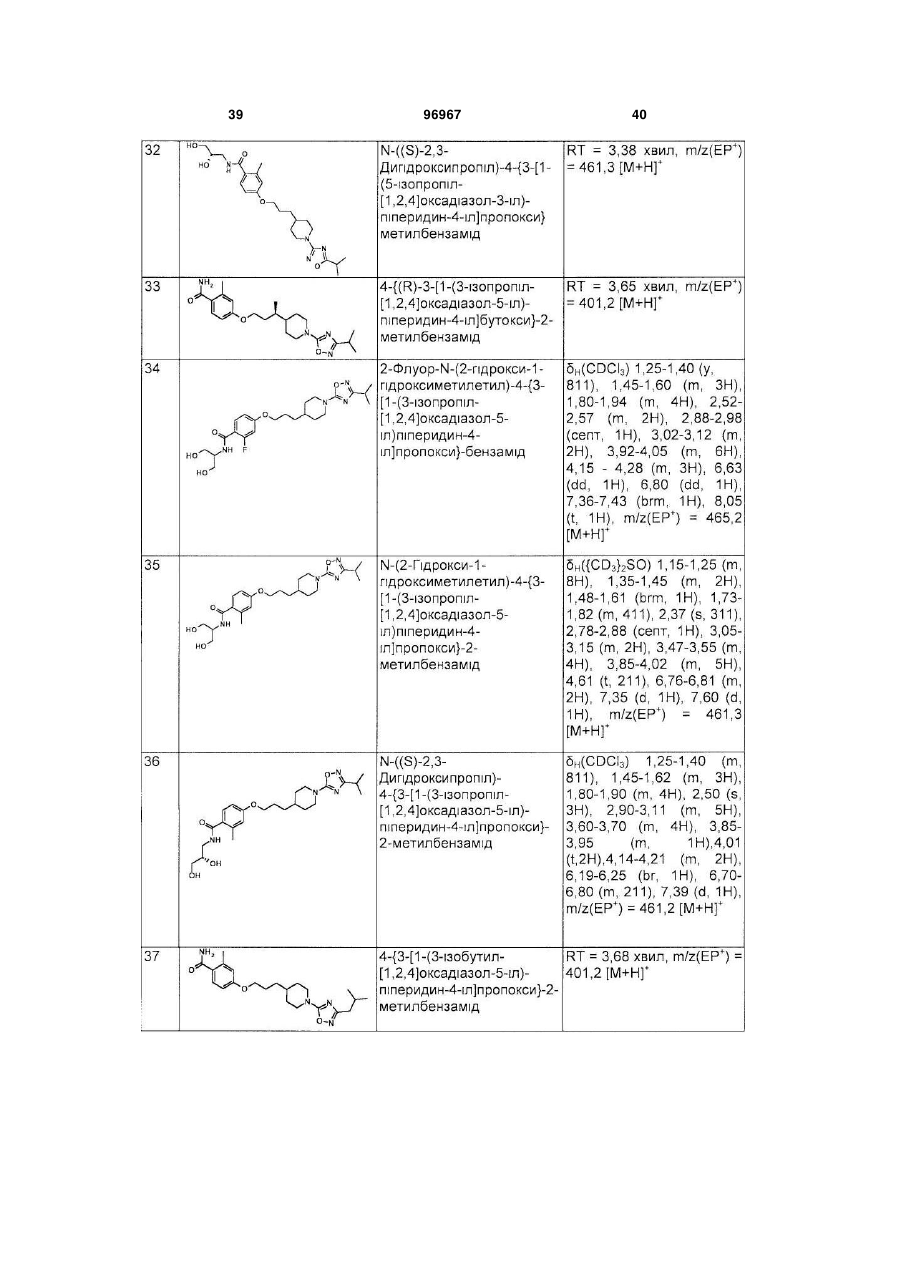
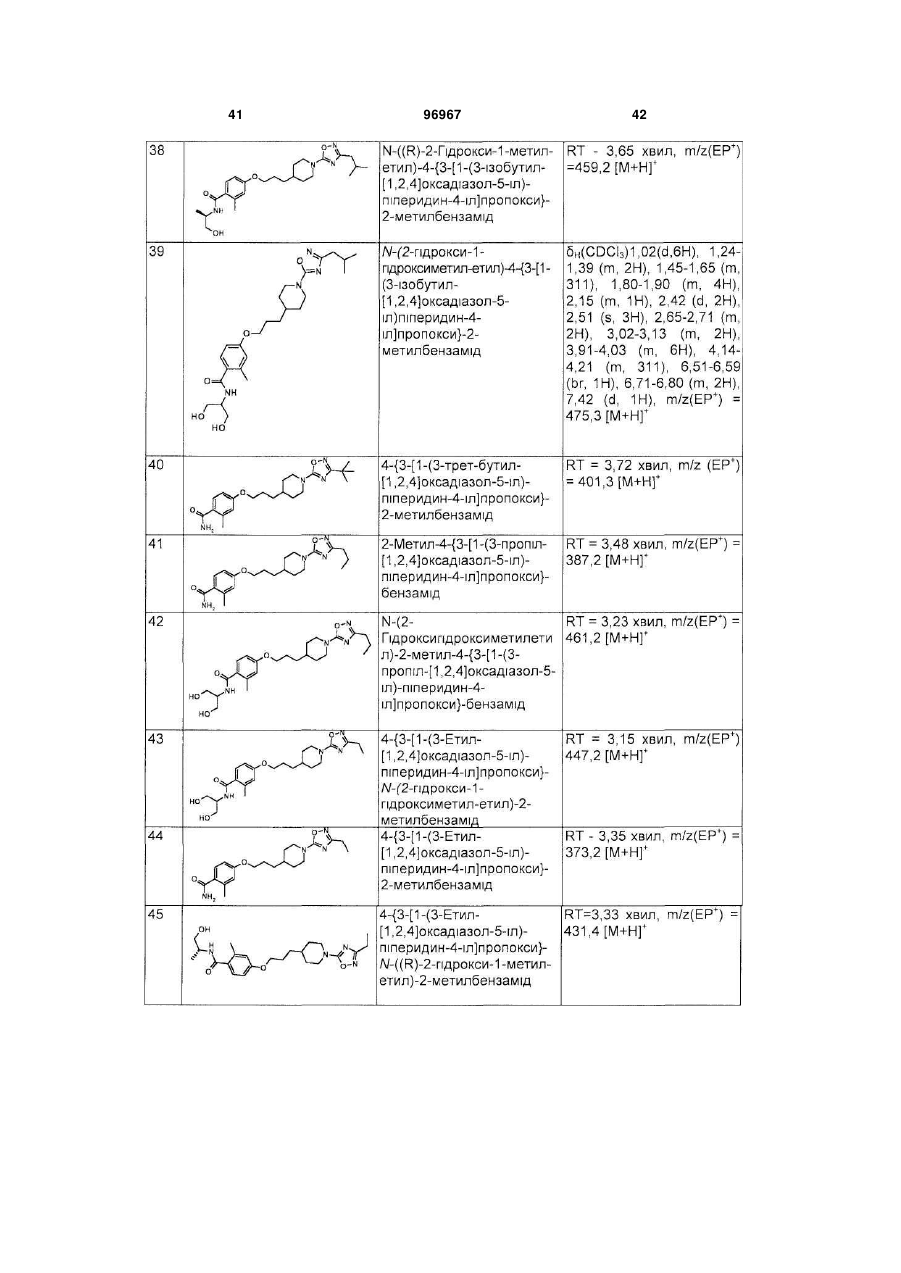
Піперидинові агоністи gpcr
Номер патенту: 96967
Опубліковано: 26.12.2011
Автори: Свейн Сімон Ендрю, Фіфе Метт'ю Колін Тор, Кейлі Джон, Джеваратнам Реваті Перпетуа, Бертрам Ліза Сара
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятна сіль:
 , (I)
, (I)
де один з X та Y - О, а інший - N;
R1 - -CONHR5;
R2 - гідроген, галоген або метил;
R3 - гідроген або метил;
R4 - С2-5алкіл; та
R5 - гідроген, C1-3алкіл, або С2-3алкіл, заміщений гідроксилом.
2. Сполука за п. 1, або її фармацевтично прийнятна сіль, де X - О.
3. Сполука за п. 1, або її фармацевтично прийнятна сіль, де Y - О.
4. Сполука за будь-яким з пп. 1-3, або її фармацевтично прийнятна сіль, де R2 - гідроген, флуор, хлор або метил.
5. Сполука за п. 4 або її фармацевтично прийнятна сіль, де R2 - гідроген.
6. Сполука за п. 4 або її фармацевтично прийнятна сіль, де R2 - флуор.
7. Сполука за п. 4 або її фармацевтично прийнятна сіль, де R2 - хлор.
8. Сполука за п. 4 або її фармацевтично прийнятна сіль, де R2 - метил.
9. Сполука за будь-яким з пп. 1-8, або її фармацевтично прийнятна сіль, де R3 - гідроген.
10. Сполука за будь-яким з пп. 1-8, або її фармацевтично прийнятна сіль, де R3 - метил.
11. Сполука за п. 10 або її фармацевтично прийнятна сіль, де R3 - метил, а утворений стереоцентр має (R)-конфігурацію.
12. Сполука за будь-яким з пп. 1-11 або її фармацевтично прийнятна сіль, де R4 - С3-4алкіл.
13. Сполука за п. 12 або її фармацевтично прийнятна сіль, де R4 є н-пропіл, ізопропіл, або трет-бутил.
14. Сполука за п. 13 або її фармацевтично прийнятна сіль, де R4 - С3алкіл.
15. Сполука за п. 14 або її фармацевтично прийнятна сіль, де R4 - ізопропіл.
16. Сполука за будь-яким з пп. 1-15 або її фармацевтично прийнятна сіль, де R5 – С1-3алкіл або С2-3алкіл, заміщений гідроксилом.
17. Сполука за п. 16 або її фармацевтично прийнятна сіль, де R5 - С2-3алкіл, заміщений гідроксилом.
18. Сполука за п. 17 або її фармацевтично прийнятна сіль, де R5 - 2-гідроксіетил, 2-гідрокси-1-метилетил, 2,3-дигідроксипропіл або 2-гідрокси-1-гідроксиксиметилетил.
19. Сполука за п. 18 або її фармацевтично прийнятна сіль, де R5 - 2-гідрокси-1-метилетил.
20. Сполука формули (І) або її фармацевтично прийнятна сіль, де сполуку вибрано з групи:
2-флуор-N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-флуор-N-((R)-2-гідрокси-1-метилетил)бензамід;
4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пpoпoкcи}-N-((R)-2-гiдpoкси-1-метилетил)-2-метилбензамід;
4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-N-етил-2-флуорбензамід;
4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-флуор-N-(2-гідроксіетил)бензамід;
4-{3-[1-(5-трет-бутил[1,2,4]оксадіазол-3-іл)-піперидин-4-іл]пропокси}-2-флуор-N-((R)-2-гiдpoкcи-1-метилетил)бензамід;
2-флyop-N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропокси}бензамід;
2-флyop-N-(2-гідроксіетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
N-((R)-2-гiдpoкcи-1-мeтилeтил)-4-{(R)-3-[1-(3-iзoпpoпiл[1,2,4]oкcaдiaзoл-5-іл)піперидин-4-іл]бутокси}-2-метилбензамід;
2-флyop-N-((R)-2-гiдpoкcи-1-мeтилeтил)-4-{(R)-3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]бутокси}бензамід;
N-(2-гідроксиетил)-4-{3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропокси}-2-метилбензамід;
2-флуор-N-(2-гідроксіетил)-4-{3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропокси}бензамід;
2-флуор-N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(3-пропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
2-флyop-N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(5-пропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропокси}бензамід;
2-флуор-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}бензамід;
4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2-метилбензамід;
2-флуор-N-((R)-2-гідроксипропіл)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
2-флуор-N-((S)-2-гідроксипропіл)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
N-((R)-2-гідроксипропіл)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-метилбензамід;
2-флуор-N-(2-гідрокси-1-метилетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
N-((R)-2-гiдpoкcи-1-метилетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
N-((S)-2,3-дигідроксипропіл)-2-флуор-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}бензамід;
N-((S)-2,3-дигідроксипропіл)-2-флуор-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}бензамід;
N-(2-гідрокси-1-метилетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-метилбензамід;
4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-N-(2-гідроксіетил)-2-метилбензамід;
N-(2-гідрокси-1-гідроксиметилетил)-4-{3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропокси}-2-метилбензамід;
2-флуор-N-((S)-2-гідрокси-1-метилетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
4-{3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)-піперидин-4-іл]пропокси}-2-метилбензамід;
N-((S)-2,3-дигідроксипропіл)-4-{3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)-піперидин-4-іл]пропокси}-2-метилбензамід;
4-{(R)-3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]бутокси}-2-метилбензамід;
2-флуор-N-(2-гідрокси-1-гідроксиметилетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
4-{3-[1-(3-ізобутил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-метилбензамід;
N-((R)-2-гідрoкси-1-метилетил)-4-{3-[1-(3-ізобутил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-метилбензамід;
N-(2-гідрокси-1-гідроксиметилетил)-4-{3-[1-(3-ізобутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2-метилбензамід;
4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-метилбензамід;
2-метил-4-{3-[1-(3-пропіл[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}бензамід;
N-(2-гідрокси-1-гідроксиметилетил)-2-метил-4-{3-[1-(3-пропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід;
4-{3-[1-(3-етил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-N-(2-гідрокси-1-гідроксиметилетил)-2-метилбензамід;
4-{3-[1-(3-етил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-метилбензамід або
4-{3-[1-(3-етил[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-N-(2-гідроксіетил)-2-метилбензамід.
21. N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)-піперидин-4-іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль.
22. N-((R)-2-гiдpoкcи-1-метилетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4-іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль.
23. N-(2-гідроксіетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль.
24. N-(2-гідрокси-1-гідроксиметилетил)-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль.
25. N-((S)-2,3-дигідроксипpoпіл)-4-{3-[1-(3-iзoпpoпіл[1,2,4]oкcaдiaзoл-5-іл)-піперидин-4-іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль.
26. 4-{3-[1-(3-етил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-N-((R)-2-гідрокси-1-метилетил)-2-метилбензамід або його фармацевтично прийнятна сіль.
27. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-26 або її фармацевтично прийнятну сіль, та фармацевтично прийнятний носій.
28. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 або її фармацевтично прийнятної солі, у виробництві медикаменту для лікування хвороби чи стану, в яких грає роль GPR119.
29. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 або її фармацевтично прийнятної солі, у виробництві медикаменту для регулювання насичення.
30. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 у виробництві медикаменту для лікування ожиріння.
31. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 у виробництві медикаменту для лікування діабету.
32. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 у виробництві медикаменту для лікування метаболічного синдрому (синдром X), порушеної толерантності до глюкози, гіперліпідемії, гіпертригліцеридемії, гіперхолестеринемії, низьких рівнів ХВГ або гіпертензії.
33. Сполука за будь-яким з пп. 1-26 або її фармацевтично прийнятна сіль, для застосування як медикаменту.
34. Сполука за будь-яким з пп. 1-26 або її фармацевтично прийнятна сіль, для застосування у виробництві медикаменту для лікування або відвернення хвороби чи стану, вказаного в будь-якому з пп. 28-32.
35. Сполука за будь-яким з пп. 1-26 або її фармацевтично прийнятна сіль для застосування у лікуванні або відверненні хвороби чи стану, вказаного в будь-якому з пп. 28-32.
36. Спосіб отримання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому проводять реакцію сполуки формули (XIV):
 (XIV)
(XIV)
з аміном формули R5NH2,
де R2, R3, R4, R5, X та Y визначені в п. 1.
Текст
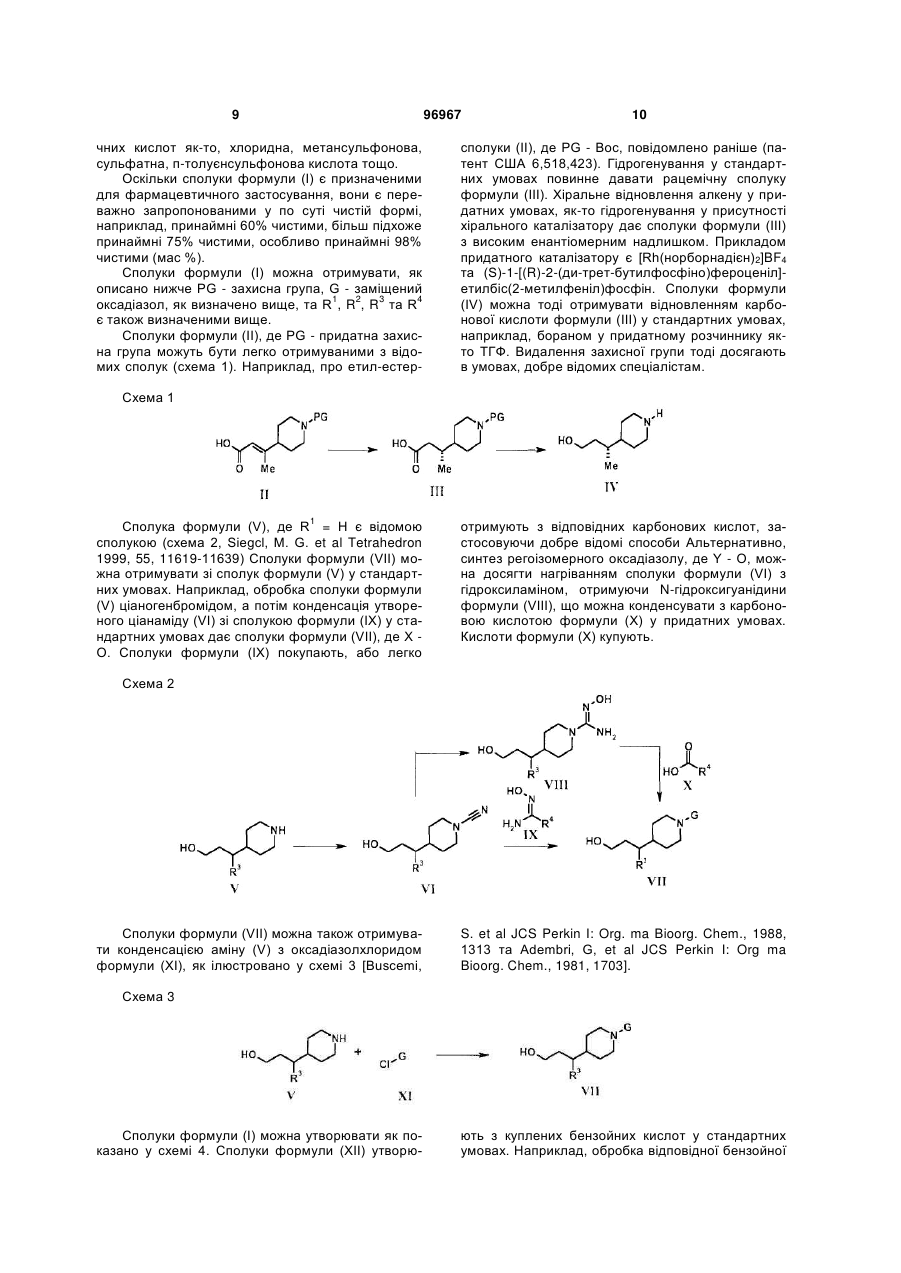
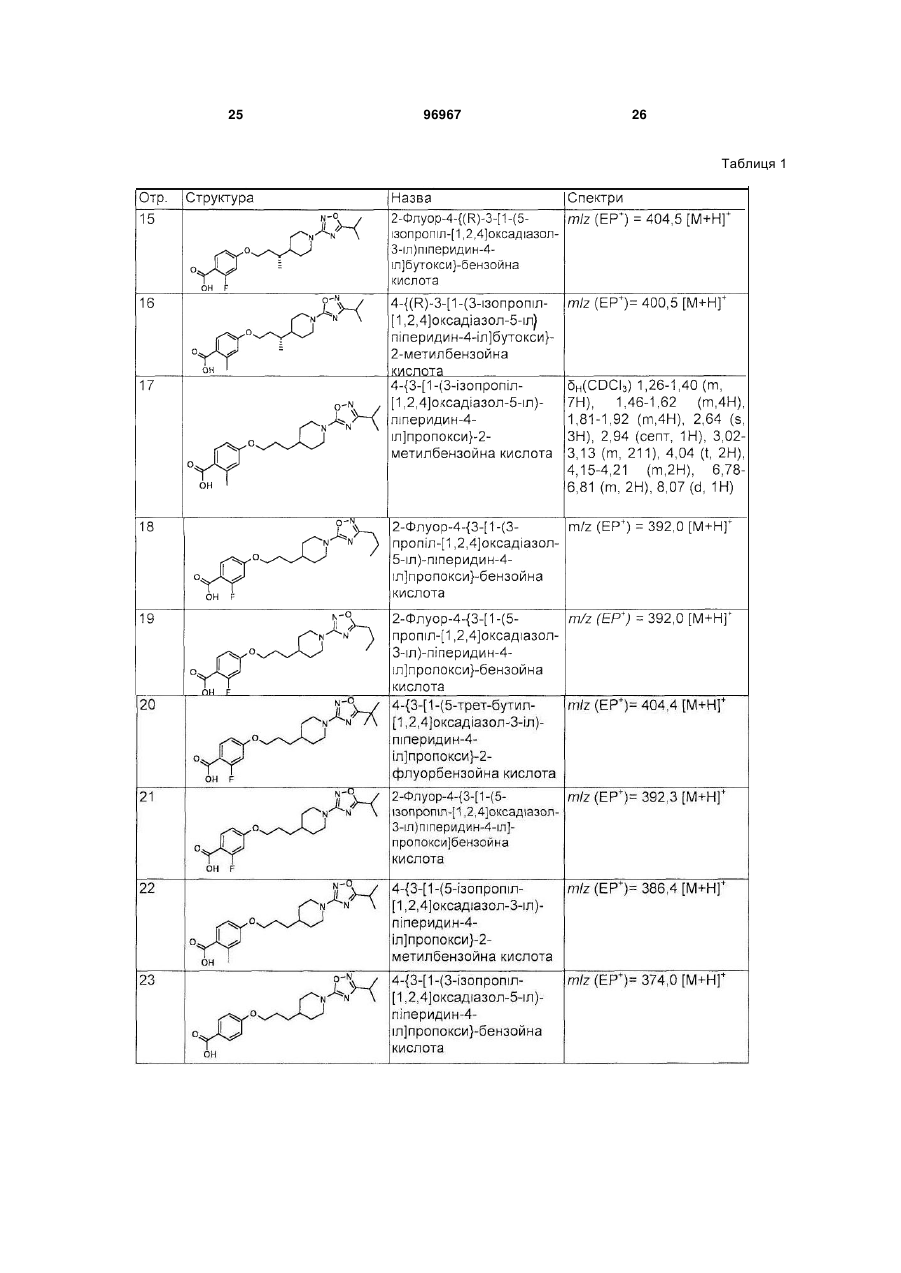
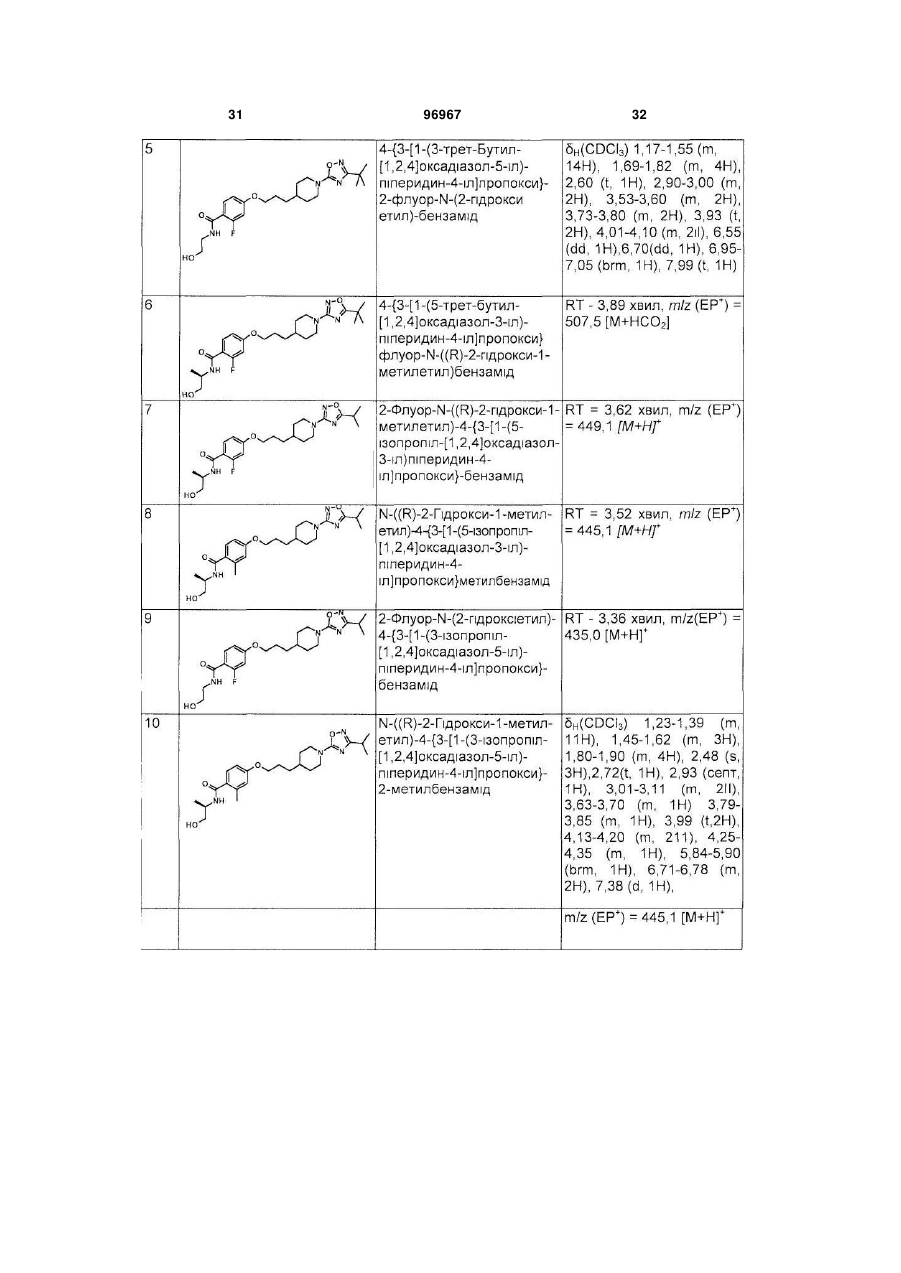
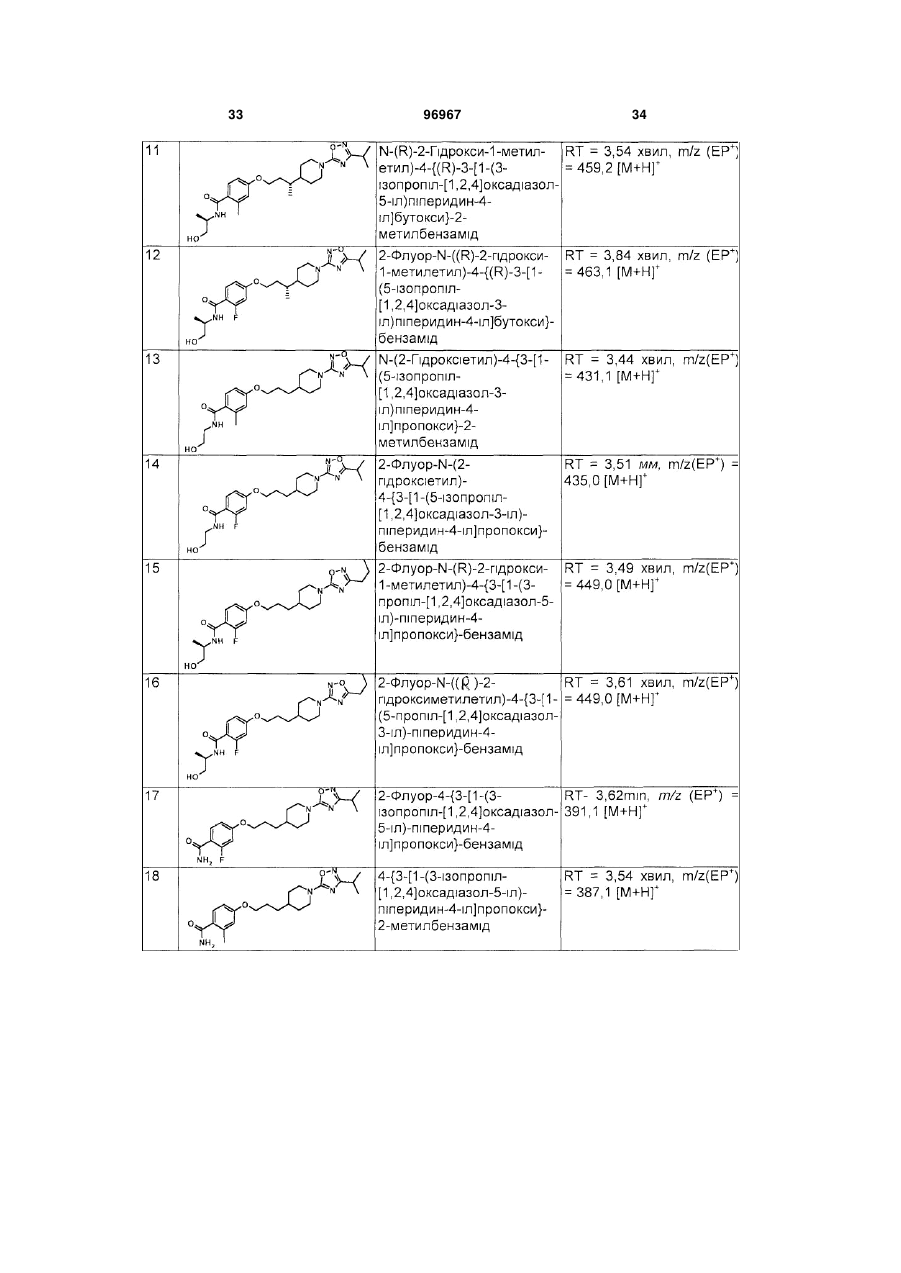
1. Сполука формули (І) або її фармацевтично прийнятна сіль: C2 2 (19) 1 3 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2-флуор-N-((R)-2гідрокси-1-метилетил)бензамід; 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пpoпoкcи}-N-((R)-2-гiдpoкси-1метилетил)-2-метилбензамід; 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-N-етил-2-флуорбензамід; 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2-флуор-N-(2гідроксіетил)бензамід; 4-{3-[1-(5-трет-бутил[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропокси}-2-флуор-N-((R)-2гiдpoкcи-1-метилетил)бензамід; 2-флyop-N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(5ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4іл]пропокси}бензамід; 2-флyop-N-(2-гідроксіетил)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; N-((R)-2-гiдpoкcи-1-мeтилeтил)-4-{(R)-3-[1-(3iзoпpoпiл[1,2,4]oкcaдiaзoл-5-іл)піперидин-4іл]бутокси}-2-метилбензамід; 2-флyop-N-((R)-2-гiдpoкcи-1-мeтилeтил)-4-{(R)-3-[1(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4іл]бутокси}бензамід; N-(2-гідроксиетил)-4-{3-[1-(5ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4іл]пропокси}-2-метилбензамід; 2-флуор-N-(2-гідроксіетил)-4-{3-[1-(5ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4іл]пропокси}бензамід; 2-флуор-N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(3пропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; 2-флyop-N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(5пропіл[1,2,4]оксадіазол-3-іл)піперидин-4іл]пропокси}бензамід; 2-флуор-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід; 4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин4-іл]пропокси}-2-метилбензамід; 2-флуор-N-((R)-2-гідроксипропіл)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; 2-флуор-N-((S)-2-гідроксипропіл)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; N-((R)-2-гідроксипропіл)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}-2-метилбензамід; 2-флуор-N-(2-гідрокси-1-метилетил)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; N-((R)-2-гiдpoкcи-1-метилетил)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; N-((S)-2,3-дигідроксипропіл)-2-флуор-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}бензамід; N-((S)-2,3-дигідроксипропіл)-2-флуор-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}бензамід; 96967 4 N-(2-гідрокси-1-метилетил)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}-2-метилбензамід; 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-N-(2-гідроксіетил)-2метилбензамід; N-(2-гідрокси-1-гідроксиметилетил)-4-{3-[1-(5ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4іл]пропокси}-2-метилбензамід; 2-флуор-N-((S)-2-гідрокси-1-метилетил)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; 4-{3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропокси}-2-метилбензамід; N-((S)-2,3-дигідроксипропіл)-4-{3-[1-(5ізопропіл[1,2,4]оксадіазол-3-іл)-піперидин-4іл]пропокси}-2-метилбензамід; 4-{(R)-3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]бутокси}-2-метилбензамід; 2-флуор-N-(2-гідрокси-1-гідроксиметилетил)-4-{3[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; 4-{3-[1-(3-ізобутил[1,2,4]оксадіазол-5-іл)-піперидин4-іл]пропокси}-2-метилбензамід; N-((R)-2-гідрoкси-1-метилетил)-4-{3-[1-(3ізобутил[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}-2-метилбензамід; N-(2-гідрокси-1-гідроксиметилетил)-4-{3-[1-(3ізобутил[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}-2-метилбензамід; 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2-метилбензамід; 2-метил-4-{3-[1-(3-пропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензамід; N-(2-гідрокси-1-гідроксиметилетил)-2-метил-4-{3[1-(3-пропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензамід; 4-{3-[1-(3-етил[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}-N-(2-гідрокси-1-гідроксиметилетил)-2метилбензамід; 4-{3-[1-(3-етил[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}-2-метилбензамід або 4-{3-[1-(3-етил[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}-N-(2-гідроксіетил)-2-метилбензамід. 21. N-((R)-2-гідрокси-1-метилетил)-4-{3-[1-(5ізопропіл[1,2,4]оксадіазол-3-іл)-піперидин-4іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль. 22. N-((R)-2-гiдpoкcи-1-метилетил)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)-піперидин-4іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль. 23. N-(2-гідроксіетил)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль. 24. N-(2-гідрокси-1-гідроксиметилетил)-4-{3-[1-(3ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль. 25. N-((S)-2,3-дигідроксипpoпіл)-4-{3-[1-(3iзoпpoпіл[1,2,4]oкcaдiaзoл-5-іл)-піперидин-4іл]пропокси}-2-метилбензамід або його фармацевтично прийнятна сіль. 5 96967 6 26. 4-{3-[1-(3-етил[1,2,4]оксадіазол-5-іл)піперидин4-іл]пропокси}-N-((R)-2-гідрокси-1-метилетил)-2метилбензамід або його фармацевтично прийнятна сіль. 27. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-26 або її фармацевтично прийнятну сіль, та фармацевтично прийнятний носій. 28. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 або її фармацевтично прийнятної солі, у виробництві медикаменту для лікування хвороби чи стану, в яких грає роль GPR119. 29. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 або її фармацевтично прийнятної солі, у виробництві медикаменту для регулювання насичення. 30. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 у виробництві медикаменту для лікування ожиріння. 31. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 у виробництві медикаменту для лікування діабету. 32. Застосування ефективної кількості сполуки за будь-яким з пп. 1-26 у виробництві медикаменту для лікування метаболічного синдрому (синдром X), порушеної толерантності до глюкози, гіперліпідемії, гіпертригліцеридемії, гіперхолестеринемії, низьких рівнів ХВГ або гіпертензії. 33. Сполука за будь-яким з пп. 1-26 або її фармацевтично прийнятна сіль, для застосування як медикаменту. 34. Сполука за будь-яким з пп. 1-26 або її фармацевтично прийнятна сіль, для застосування у виробництві медикаменту для лікування або відвернення хвороби чи стану, вказаного в будь-якому з пп. 28-32. 35. Сполука за будь-яким з пп. 1-26 або її фармацевтично прийнятна сіль для застосування у лікуванні або відверненні хвороби чи стану, вказаного в будь-якому з пп. 28-32. 36. Спосіб отримання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому проводять реакцію сполуки формули (XIV): Заявлений винахід стосується сполучених з Gбілком агоністів рецептору (GPCR). Зокрема, заявлений винахід стосується агоністів GPCR, що є корисними для лікування ожиріння, наприклад, як регулятори насичення, метаболічного синдрому та для лікування діабету. Ожиріння характеризується надлишковою масою жирової тканини відносно розміру тіла. Клінічно, масу жиру оцінюють за індексом маси тіла 2 (ВМІ; мас(кг)/висота(м) ), або окружністю талії. Осіб вважають ожирілими, коли ВМІ є більше, ніж 30 та це є встановленими медичними висновками надлишкової маси. Загальновизнаною медичною точкою зору є те, що збільшена маса тіла, особливо як результат черевного жиру, є асоційованою зі збільшеним ризиком діабету, гіпертензією, хворобою серця, та рядом інших ускладнень здоров'я, як-то артрит, інсульт, хвороб жовчного міхура, м'язові та респіраторні проблеми, біль у спині та навіть деякі типи раку. Фармакологічні підходи до лікування ожиріння головним чином стосуються зменшення маси жиру зміною балансу між споживанням та витратами енергії. Багато досліджень ясно встановили зв'язок між ожирінням та схемами мозку, залученими у регуляції гомеостазу енергії. Безпосередні та опосередковані докази свідчать, що серотонінергічні, допамінергічні, адренергічні, холінергічні, ендоканабіноїдні, опіоїдні та гістамінергічні провідні шляхи на додаток до багатьох нейропептидних провідних шляхів (як-то, нейропептид Y та меланокортини) приймають участь у центрально му контролі споживання та витрат енергії. Гіпоталамічні центри є також здатними реагувати на периферійні гормони, залучені у підтримці маси тіла та ступеню ожиріння, як-то інсулін та лептин, та похідні від жирової тканини пептиди. Ліки, призначені при патофізіології, асоційованій із залежним від інсуліну діабетом типу І та незалежним від інсуліну діабетом типу II, мають багато можливих побічних дій та неадекватно реагують на дисліпідемію та гіперглікемію у високій пропорції пацієнтів. Лікування є часто сфокусованим на необхідності застосовувати пацієнтом дієту, вправи, гіпоглікемічні агенти та інсулін, але є постійна необхідність у нових антидіабетичних агентах, особливо агентах, що можуть бути краще толерантними з меншою шкідливою дією. Подібно, метаболічний синдром (синдром X) мають люди при високому ризику хвороби коронарних артерій, та характеризується рядом факторів ризику, у тому числі центральне ожиріння (надлишкова жирова тканина у черевному регіоні), нетолерантність до глюкози, високі тригліцериди та низький ЛВГ-холестерин, та високий тиск крові. Міокардіальна ішемія та мікросудинна хвороба є встановленою захворюваністю, асоційованою із нелікованим або погано контрольованим метаболічним синдромом. Є постійна необхідність у нових антидіабетичних агентах, особливо агентах, що є добре толерантними з меншою шкідливою дією. GPR119 (раніше позначений як GPR116) є GPCR, ідентифікованим як SNORF25 у X N Y R4 N O O R3 OH R2 5 (XIV) з аміном формули R NH2, 2 3 4 5 де R , R , R , R , X та Y визначені в п. 1. 7 96967 WO00/50562, котрий розкриває рецептори людини та щурів, US 6,468,756 також розкриває рецептор миші (№ AAN95194 (людини), AAN95195 (щурів) та ANN95196 (миші)). У людей GPR119 експресується у підшлунковій залозі, тонкому кишечнику, товстому кишечнику та жировій тканині Профіль експресії рецептору GPR119 людини показує його можливу перевагу як ціль для лікування ожиріння та діабету Міжнародні заявки на патент WO2005/061489, WO2006/070208, WO2006/067531 та WO2006/067532 розкривають гетероциклічні похідні як агоністи рецептору GPR119 Міжнародні заявки на патент PCT/GB2006/050176, PCT/GB2006/050177, PCT/GB2006/050178 та PCT/GB2006/050182 (опубліковані після дати пріоритету цієї заявки) розкривають наступні агоністи рецептору GPR119. Заявлений винахід стосується агоністів GPR119, котрі є корисними для лікування ожиріння, наприклад, як периферійні регулятори насичення, метаболічного синдрому та для лікування діабету. Сполуки формули (І) (I) або їх фармацевтично прийнятні солі, є агоністами GPR119 та є корисними для профілактичного або терапевтичного лікування ожиріння та діабету Заявлений винахід стосується сполуки формули (І), або її фармацевтично прийнятної солі. (I) (І), де один з X та Y - О, а інший - N; 1 5 R -CONHR ; 2 R - гідроген, галоген або метил; 3 R - гідроген або метил; 4 R - С2-5алкіл; а 5 R - гідроген, С1-3алкіл, або С2-3алкіл, заміщений гідроксигрупою. В одному втіленні винаходу X - О та у ще одному Y - О. X - переважно О Y - переважно N. 2 R , переважно, - гідроген, флуор, хлор або метил, кожний з котрих є окремим втіленням винахо2 ду R є краще метил або флуор, особливо метил. 3 В одному втіленні винаходу R - гідроген, а у 3 3 ще одному R – метил. R , переважно, - гідроген. 3 Коли R - метил, утворений стереоцентр переважно має (R)-конфігурацію. 8 4 R , переважно, - С3, 4 алкіл, особливо нпропіл, ізопропіл, або трет-бутил, краще С3алкіл, особливо ізопропіл. 5 Коли R - С2-3алкіл, заміщений гідроксигрупою, він може бути заміщеним одною або більше, на5 приклад, 1 або 2, переважно 1 групою R , переважно, - С1-3алкіл або С2-3алкіл, заміщений гідроксигрупою, краще С2-Залкіл, заміщений гідроксигрупою, наприклад, 2-гідроксіетил, 2-гідрокси-1-метилетил, 2,3-дигідроксипропіл або 2-гідрокси-1гідроксиметилетил, переважно 2-гідроксіетил або 2-гідрокси-1-метилетил, навіть краще 2-гідрокси-1метилетил, особливо (R)-2-гідрокси-1-метилетил. Тоді як кращі групи для кожної змінної загалом перераховані вище окремо для кожної змінної, кращі сполуки цього винаходу охоплюють ті, у котрих кілька або кожна змінна у формулі (I) є вибраною з кращої, більш кращої або особливо перерахованої групи для кожної змінної. Тому, цей винахід стосується усіх комбінацій кращих, більш кращих та особливо перерахованих груп. Конкретні сполуки винаходу, котрі можна згадати, є охопленими у прикладах та їх фармацевтично прийнятні солі. Як застосовувано тут, якщо не визначене інше, "алкіл" означає карбонові ланцюги, котрі можуть бути лінійними або розгалуженими або їх комбінаціями. Приклади алкілів охоплюють метил, етил, пропіл, ізопропіл, бутил, фтор- та трет-бутил та пентил. Термін "галоген"' охоплює флуор, хлор, бром, та йод, зокрема флуор або хлор, особливо флуор. Сполуки, описані тут, можуть містити один або більше асиметричних центрів та можуть таким чином мати діастереомери та оптичні ізомери. Заявлений винахід стосується усіх таких можливих діастереомерів, а також їх рацемічних сумішей, їх по суті чистих відокремлених енантюмерів, усіх можливих геометричних ізомерів, та їх фармацевтично прийнятних солей. Вищенаведена формула (І) є показаною без визначення стереохімії у деяких позиціях. Заявлений винахід стосується усіх стереоізомерів формули (І) та їх фармацевтично прийнятні солі. Крім того, суміші стереоізомерів, а також виділені конкретні стереоізомери є також охопленими. Протягом синтезу, застосовуваного для отримування таких сполук, або у застосуванні процедур рацемізації або епімеризації, відомих спеціалістам, продукти таких процедур можуть бути сумішшю стереоізомерів. Коли сполука формули (І) та її фармацевтично прийнятні солі існують у формі сольватів або поліморфних форм, заявлений винахід стосується будь-яких можливих сольватів або поліморфних форм. Тип розчиннику що утворює сольват, не є особливо обмеженим, якщо розчинник є фармакологічно прийнятним. Наприклад, можна застосовувати воду, етанол, пропанол, ацетон тощо. Термін "фармацевтично прийнятні солі" стосується солей, отримуваних з фармацевтично прийнятних нетоксичних основ або кислот. Солі, похідні від основ, охоплюють похідні від основ як-то, наприклад, солі калію та натрію тощо. Солі, похідні від фармацевтично прийнятних нетоксичних кислот, охоплюють похідні від неорганічних та органі 9 96967 чних кислот як-то, хлоридна, метансульфонова, сульфатна, п-толуєнсульфонова кислота тощо. Оскільки сполуки формули (І) є призначеними для фармацевтичного застосування, вони є переважно запропонованими у по суті чистій формі, наприклад, принаймні 60% чистими, більш підхоже принаймні 75% чистими, особливо принаймні 98% чистими (мас %). Сполуки формули (І) можна отримувати, як описано нижче PG - захисна група, G - заміщений 1 2 3 4 оксадіазол, як визначено вище, та R , R , R та R є також визначеними вище. Сполуки формули (II), де PG - придатна захисна група можуть бути легко отримуваними з відомих сполук (схема 1). Наприклад, про етил-естер 10 сполуки (II), де PG - Вос, повідомлено раніше (патент США 6,518,423). Гідрогенування у стандартних умовах повинне давати рацемічну сполуку формули (III). Хіральне відновлення алкену у придатних умовах, як-то гідрогенування у присутності хірального каталізатору дає сполуки формули (III) з високим енантіомерним надлишком. Прикладом придатного каталізатору є [Rh(норборнадієн)2]BF4 та (S)-1-[(R)-2-(ди-трет-бутилфосфіно)фероценіл]етилбіс(2-метилфеніл)фосфін. Сполуки формули (IV) можна тоді отримувати відновленням карбонової кислоти формули (III) у стандартних умовах, наприклад, бораном у придатному розчиннику якто ТГФ. Видалення захисної групи тоді досягають в умовах, добре відомих спеціалістам. Схема 1 1 Сполука формули (V), де R = Н є відомою сполукою (схема 2, Siegcl, M. G. et al Tetrahedron 1999, 55, 11619-11639) Сполуки формули (VII) можна отримувати зі сполук формули (V) у стандартних умовах. Наприклад, обробка сполуки формули (V) ціаногенбромідом, а потім конденсація утвореного ціанаміду (VI) зі сполукою формули (IX) у стандартних умовах дає сполуки формули (VII), де X О. Сполуки формули (IX) покупають, або легко отримують з відповідних карбонових кислот, застосовуючи добре відомі способи Альтернативно, синтез регоізомерного оксадіазолу, де Y - О, можна досягти нагріванням сполуки формули (VI) з гідроксиламіном, отримуючи N-гідроксигуанідини формули (VIII), що можна конденсувати з карбоновою кислотою формули (X) у придатних умовах. Кислоти формули (X) купують. Схема 2 Сполуки формули (VII) можна також отримувати конденсацією аміну (V) з оксадіазолхлоридом формули (XI), як ілюстровано у схемі 3 [Buscemi, S. et al JCS Perkin I: Org. ma Bioorg. Chem., 1988, 1313 та Adembri, G, et al JCS Perkin I: Org ma Bioorg. Chem., 1981, 1703]. Схема 3 Сполуки формули (І) можна утворювати як показано у схемі 4. Сполуки формули (XII) утворю ють з куплених бензойних кислот у стандартних умовах. Наприклад, обробка відповідної бензойної 11 кислоти триметилсилілдіазометан у придатному розчиннику, як-то, толуєн та метанол, приблизно при кімнатній температурі, дає естери формули (XII). Комбінування сполуки формули (XII) та формули (VII), застосовуючи умови Міцунобу, наприклад, у придатному розчиннику як-то ТГФ, між 0°С та кімнатною температурою, а потім додавання трифенілфосфіну та діізопропілазодикарбоксилату 96967 12 дає сполуки формули (XIII). Гідроліз естеру формули (XIII) у стандартних умовах, наприклад, застосовуючи водний літій гідроксид приблизно при кімнатній температурі, дає карбонові кислоти формули (XIV). Утворення амідного зв'язку у стандартних умовах, добре відоме спеціалістам, дає потрібні сполуки формули (І). Схема 4 Інші сполуки формули (І) можна отримувати способами, аналогічними описаним вище або відомими способами. Наступні деталі стосовно отримання сполук формули (І) є знайденими у прикладах. Згідно з наступним аспектом винаходу запропоновано спосіб продукування сполуки формули (І), або її фармацевтично прийнятної солі, як визначено вище, що полягає у сполученні сполуки формули (XIV): (XIV) 5 2 3 4 5 з аміном формули R NH2, де R R , R , R , X та Y є визначеними для формули (І) У цьому аспекті винаходу зрозуміло, що спосіб може застосовувати активоване похідне сполуки формули (XIV), наприклад, ацилгалогенід як-то ацилхлорид, змішаний ангідрид або активований естер. Сполуки формули (І) можна отримувати поодинці або як бібліотеки сполук, що містять принаймні 2, наприклад, 5 - 1000, сполук, а краще 10 100 сполук формули (І). Бібліотеки сполук можна отримувати комбінаторним підходом "розщеплення та змішування" або паралельним синтезом, застосовуючи хімію у розчинах або твердофазну хімію, застосовуючи процедури, відомі спеціалістам. У синтезі сполук формули (І), лабільні функціональні групи у інтермедіатах, наприклад, гідрокси карбокси та аміногрупи, можуть бути захищеними. Захисні групи можна видаляти на будь-якому етапі у синтезі сполук формули (І) або вони можуть бути на кінцевій сполуці формули (І). Вичерпне обговорення шляхів, у котрих різні лабільні функціональні групи можуть бути захищеними, та способи розщеплення утворених захищених похідних є, наприклад, у Protective Groups in Organic Chemistry, TW Greene та PGM Wuts, (1991) Wiley-lnterscience, nd New York, 2 edition. Будь-які нові інтермедіати, як-то визначені вище, можна застосовувати у синтезі сполук формули (І) та є тому також охопленими у рамках винаходу, наприклад, сполуки формул (XIII) та (XIV) або їх сіль або захищене похідне. Як показано вище сполуки формули (І) є корисними як агоністи GPR119, наприклад, для лікування та/або профілактики ожиріння та діабету. Для такого застосування сполуки формули (І) слід загалом застосовувати у формі фармацевтичної композиції. Винахід також стосується сполуки формули (І), або її фармацевтично прийнятної солі, для застосування як фармацевтичного засобу. Винахід також стосується фармацевтичної композиції, що містить сполуку формули (І), у комбінації з фармацевтично прийнятним носієм. Переважно композиція містить фармацевтично прийнятний носій та нетоксичну терапевтично ефективну кількість сполуки формули (І), або її фармацевтично прийнятної солі. Більш того, винахід також стосується фармацевтичної композиції для лікування хвороби модулюванням GPR119 у профілактичному або терапевтичному лікуванні ожиріння, наприклад, регуляцією насичення, або для лікування діабету, що містить фармацевтично прийнятний носій та нетоксичну терапевтично ефективну кількість сполуки формули (І), або її фармацевтично прийнятної солі. Фармацевтичні композиції можуть необов'язково містити інші терапевтичні складові. Композиції охоплюють придатні для перорального, ректа 13 льного, місцевого та парентерального (у тому числі підшкірного, внутрішньом'язового та внутрішньовенного) застосування, хоча найбільш придатний шлях у будь-якому випадку повинен залежати від конкретного хазяїна, та природи та суворості станів, для котрих активну складову застосовують. Фармацевтичні композиції можна зручно представляти у формі окремої дози та отримувати будьяким зі способів, добре відомих у рівні техніки. На практиці, сполуки формули (І), або їх фармацевтично прийнятні солі, можуть бути комбінованими як активні складові у суміші із фармацевтичним носієм звичайними фармацевтичними способами і можуть мати багато форм залежно від форми препарату, потрібної для застосування, наприклад, перорального або парентерального (у тому числі внутрішньовенного). Таким чином, фармацевтичні композиції можна представляти як окремі придатні для перорального застосування одиниці, як-то капсули, облатки або таблетки, що містять попередньо визначену кількість активної складової. Крім того, композиції можна представляти як порошок, як гранули, як розчин, як суспензію у водній рідині, як неводну рідину, як емульсію олива-у-воді, або як емульсію вода-в-оливі. На додаток до загальних дозованих форм представлених вище, сполуку формули (І), або її фармацевтично прийнятну сіль, можна також застосовувати засобами та/або постачання пристроями з регульованим вивільненням. Композиції можна отримувати будь-яким зі способів фармацевтики. Взагалі, такі способи мають етап асоціації активної складової з носієм з одної або більше необхідних складових. Взагалі, композиції отримують ретельним змішуванням активної складової з рідкими носіями або мілко подрібненими твердими носіями або обома, продукт можна тоді зручно формувати. Сполуки формули (І), або їх фармацевтично прийнятні солі, можуть також бути у фармацевтичних композиціях у комбінації з одною або більше іншими терапевтично активними сполуками. Застосовуваним фармацевтичним носієм може бути, наприклад, твердий, рідкий або газуватий. Приклади твердих носіїв охоплюють лактозу, білу глину, сахарозу, тальк, желатин, агар, пектин, гуміарабік, магній стеарат, та стеаринову кислоту. Прикладами рідких носіїв є цукор сироп, арахісова олія, оливкова олія та вода. Приклади газуватих носіїв охоплюють карбон діоксид та азот. При отримуванні композиції для пероральних дозованих форм можна застосовувати будь-які зручні фармацевтичні середовища Наприклад, воду, гліколі, оливи, спирти, приправи, консерванти, барвники, тощо можна застосовувати для утворення пероральних рідких препаратів, як-то суспензії, еліксири та розчини, тоді як носії, як-то крохмалі, цукри, мікрокристалічна целюлоза, розріджувачі, гранулювальні агенти, лубриканти, зв'язуючі, дезинтегратори, тощо можна застосовувати для утворення пероральних твердих препаратів, як-то порошки, капсули та таблетки. Внаслідок їх легкого застосування, таблетки та капсули є кращими пероральними окремими дозами, за допомогою чого є застосовуваними тверді фармацев 96967 14 тичні носії. Необов'язково, таблетки можна покривати стандартними водними або неводними способами. Таблетку, що містить композицію цього винаходу, можна отримувати пресуванням або відливанням, необов'язково з одною або більше допоміжними складовими. Пресовані таблетки можна отримувати пресуванням, у придатному апараті, активної складової у вільно сипучій формі, як-то порошок або гранули, необов'язково змішані зі зв'язуючим, лубрикантом, інертним розріджувачем, поверхнево-активною речовиною або диспергатором. Відлиті таблетки зробити можна відливанням у придатному апараті суміші порошкової сполуки зі зволоженим інертним рідким розріджувачем. Кожна таблетка переважно містить приблизно від 0,05 мг до 5 г активної складової та кожна облатка або капсула переважно містить приблизно від 0,05 мг до 5 г активної складової. Наприклад, композиція для перорального застосування до людей може містити приблизно від 0,5 мг до 5 г активного агенту, сполученого з підхожою та зручною кількістю носія, котра може змінюватися приблизно від 5 до 95 процентів загальної композиції. Форми окремих доз повинні загалом містити приблизно від 1 мг до 1 г активної складової, звичайно 25 мг, 50 мг, 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, 600 мг, 800 мг, або 1000 мг. Фармацевтичні композиції заявленого винаходу придатні для парентерального застосування, можна отримувати як розчини або суспензії активних сполук у воді. Придатний сурфактант може бути наявним, як-то, наприклад, гідроксипропілцелюлоза. Дисперсії можна також отримувати у гліцерині, рідкому поліетиленгліколі, та їх суміші в оливах. Крім того, консервант може бути наявним для попередження розвитку шкідливих мікроорганізмів. Фармацевтичні композиції заявленого винаходу, придатні для застосування ін'єкціями, охоплюють стерильні водні розчини або дисперсії. Більш того, композиції можуть бути у формі стерильних порошків для негайного виготовлення такого стерильного придатного для застосування ін'єкціями розчину або дисперсії. В усіх випадках кінцева придатна для застосування ін'єкціями форма повинна бути стерильною та ефективною рідиною для легкого застосування через шприц. Фармацевтичні композиції повинні бути стабільними в умовах виробництва та зберігання, таким чином, переважно повинні бути законсервованими проти забруднювальної дії мікроорганізмів, як-то бактерії та грибки. Носієм може бути розчинник або дисперсія, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь та рідкий поліетиленгліколь), рослинні олії, та їх придатні суміші. Фармацевтичні композиції заявленого винаходу можуть бути у формі, придатній для місцевого застосування, як-то, наприклад, аерозоль, крем, мазь, лосьйон, порошок, тощо. Крім того, композиції можуть бути у формі, придатній для застосування у трансдермальному пристрої. Ці композиції можна отримувати, застосовуючи сполуку формули (І), або й фармацевтично прийнятну сіль, за 15 допомогою звичайних способів обробки. Як приклад, крем або мазь отримують змішуванням гідрофільного матеріалу та води разом з приблизно 5-10 мас. % сполуки, для продукування крему або мазі, що має потрібну консистенцію. Фармацевтичні композиції цього винаходу можуть бути у формі, придатній для ректального застосування, де носій є твердим. Переважно суміш утворює окремі дози супозиторіїв. Придатні носії охоплюють масло-какао та інші матеріали, звичайно застосовувані у рівні техніки. Супозиторії можна зручно формувати спершу змішуванням композиції з розплавленим носієм, а потім охолодженням та формуванням в опоках. На додаток до вищезгаданих носіїв, фармацевтичні композиції, описані вище можуть містити, як підхожі, один або більше додаткових носіїв, як-то розріджувачі, буфери, приправи, зв'язуючі, поверхнево-активні агенти, лубриканти, консерванти (у тому числі антиоксиданти) тощо. Більш того, можуть бути складові для ізотонічності композиції з кров'ю. Композиції, що містять сполуку формули (І), або її фармацевтично прийнятні солі, можна також отримувати у порошковій або рідкій концентрованій формі. Загалом рівні доз порядку 0,01 мг/кг до 150 мг/кг на добу є корисними у лікуванні вищепоказаних станів, або альтернативно приблизно 0,5 мг – 7 г маси тіла на добу. Наприклад, ожиріння можна ефективно лікувати застосуванням приблизно від 0,01 до 50 мг/кг маси тіла на добу сполуки, або альтернативно приблизно 0,5 - 3,5 г 50 мг/кг на добу. Зрозуміло, однак, що певний рівень доз для будь-якого конкретного пацієнта повинен залежати від різних факторів, у тому числі віку, маси тіла, загального здоров'я, статі, дієти, часу застосування, шляху застосування, швидкості екскреції, комбінації ліків та суворості конкретної хвороби. Сполуки формули (І) можна застосовувати у лікуванні хвороб або станів, у котрих грає роль GPR119. Таким чином винахід також стосується способу лікування хвороби або стану, у котрих грає роль GPR119, що полягає у етапі застосування до суб'єкта при необхідності цього ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі. хвороби або стани котрих грає роль GPR119, охоплюють ожиріння та діабет. У контексті цієї заявки лікування ожиріння стосується лікування хвороб або станів, як-то ожиріння та інші розлади харчування асоційовані із надлишковим споживанням їжі, наприклад зменшенням апетиту та маси тіла, підтримки зменшення маси та попередження пригніченості та діабету (у тому числі діабету типу 1 та типу 2, порушеної толерантності до глюкози, резистентності до інсуліну та діабетичних ускладнень, як-то невропатія, нефропатія, ретинопатія, катаракти, серцево-судинні ускладнення та дисліпідемія). Та лікування пацієнтів, хто має анормальну сенситивність до жирів, призводячи до функціональної диспепсії. Сполуки винаходу можна також застосовувати для лікування метаболічних хвороб, як-то метаболічний синдром (синдром X), порушена толерантність до глюкози, 96967 16 гіперліпідемія, гіпертригліцеридемія, гіперхолестеринемія, низькі рівні ЛВГ та гіпертензія. Сполуки винаходу можуть мати переваги над сполуками, діючими за відмінними механізмами для лікування вищезгаданих розладів тим, що вони можуть давати захист бета-клітин, збільшені цАМФ та секрецію інсуліну та також повільне випорожнення шлунку. Сполуки винаходу можна також застосовувати для лікування станів, що характеризуються низькою масою кісток, як-то асостеопенія, остеопороз, ревматоїдний артрит, остеоартрит, хвороба зубів, втрата альвеолярних кісток, втрата остеотомічних кісток ідіопатична втрата кісток у дітей, хвороба Педжета, втрата кісток внаслідок метастатичного раку, остеолітичних уражень, викривлення хребта та втрата зросту. Винахід також стосується способу регуляції насичення, що має етап застосування до суб'єкта при необхідності цього ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі. Винахід також стосується способу лікування ожиріння, що має етап застосування до суб'єкта при необхідності цього ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі. Винахід також стосується способу лікування діабету, у тому числі Діабету типу 1 та типу 2, особливо діабету типу 2, що має етап застосування до пацієнта при необхідності цього ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі. Винахід також стосується способу лікування метаболічного синдрому (синдрому X), порушеної толерантності до глюкози, гіперліпідемії, гіпертригліцеридемії, гіперхолестеринемії, низьких рівнів ЛВГ або гіпертензії, що має етап застосування до пацієнта при необхідності цього ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі. Винахід також стосується сполуки формули (І), або її фармацевтично прийнятної солі, для застосування у лікуванні стану, який визначено вище. Винахід також стосується застосування сполуки формули (І), або її фармацевтично прийнятної солі у виробництві медикаменту для лікування стану, який визначено вище. У способах винаходу термін "лікування" охоплює терапевтичне та профілактичне лікування. Сполуки формули (І) можуть виявляти переважні властивості порівняно з відомими агоністами GPR119, наприклад, сполуки можуть виявляти поліпшену потужність або стабільність, або поліпшену розчинність, тим поліпшуючи властивості поглинання та біопридатність, або інші переважні властивості для сполук для застосування як фармацевтичних агентів. Сполуки формули (І), або їх фармацевтично прийнятні солі, можна застосовувати поодинці або у комбінації з одною або більше іншими терапевтично активними сполуками. Інші терапевтично активні сполуки можуть бути для лікування тої ж хвороби або стану, як сполуки формули (І) або відмінної хвороби або стану. Терапевтично активні 17 сполуки можна застосовувати одночасно, послідовно або окремо. Сполуки формули (І) можна застосовувати з іншими активними сполуками для лікування ожиріння та/або діабету, як-то, інсулін та аналоги інсуліну, інгібітори ліпази шлунку, інгібітори ліпази підшлункової залози, сульфоніл-уреаза та аналоги, бігуаніди, агоністи а2, глітазони, агоністи PPAR-, змішані агоністи PPAR-/, агоністи RXR, інгібітори окиснення жирних кислот, інгібітори глюкозидази, інгібітори дипептидил-пептидази IV, агоністи GLP-1, наприклад, аналоги та міметики GLP-1, [3-агоністи, інгібітори фосфодіестерази, агенти зниження ліпідів, інгібітори глікогенфосфорилази, агенти проти ожиріння, наприклад, інгібітори ліпази підшлункової залози, антагоністи МСН-1 та антагоністи (або зворотні агоністи) СВ-1, антагоністи аміліну, інгібітори ліпоксигенази, аналоги сомостатину, активатори глюкокінази, антагоністи глюкагону, агоністи передачі сигналів інсуліну, інгібітори РТР1В, інгібітори глюконеогенезу, антилуролітичні агенти, GSK. Інгібітори, агоністи рецептору галаніну, анорексичні агенти, агоністи рецептору ССК, лептин, серотонінергічні/допамінергічні ліки проти ожиріння, інгібітори перепоглинання, наприклад, сибутрамін, антагоністи CRF, CRF-зв'язувальні білки, тироміметичні сполуки, інгібітори альдоз-редуктази, антагоністи глюкокортикоїдного рецептору, інгібітори NHE-1 або інгібітори сорбітол-дегідрогенази. Комбінаційна терапія, що полягає у застосуванні сполуки формули (І), або її фармацевтично прийнятної солі, та принаймні одного іншого агенту проти ожиріння представляє ще один аспект винаходу. Заявлений винахід також стосується способу лікування ожиріння у ссавця, як-то людини, спосіб полягає у застосуванні ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі, та ще одного агенту проти ожиріння до ссавця при необхідності цього. Винахід також стосується застосування сполуки формули (І), або її фармацевтично прийнятної солі, та ще одного агенту проти ожиріння для лікування ожиріння. Винахід також стосується застосування сполуки формули (І), або її фармацевтично прийнятної солі, у виробництві медикаменту для застосування у комбінації з ще одним агентом проти ожиріння для лікування ожиріння. Сполуку формули (І), або її фармацевтично прийнятну сіль та інший агент проти ожиріння можна співзастосовувати або застосовувати послідовно або окремо. Співзастосування охоплює застосування композиції, котра містить сполуку формули (І), або її фармацевтично прийнятну сіль, та інший агент проти ожиріння, або одночасне або окреме застосування відмінних композицій кожного агенту. Де фармакологічні профілі сполуки формули (І), або її фармацевтично прийнятної солі та іншого агенту проти ожиріння дозволяють це, співзастосування двох агентів може бути кращим. Винахід також стосується застосування сполуки формули (І), або її фармацевтично прийнятної 96967 18 солі, та ще одного агенту проти ожиріння у виробництві медикаменту для лікування ожиріння. Винахід також стосується фармацевтичної композиції, що містить сполуку формули (І), або її фармацевтично прийнятну сіль, та ще один агент проти ожиріння, та фармацевтично прийнятний носій. Винахід також стосується застосування таких композицій у способах, описаних вище. Агоністи GPR119 мають конкретне застосування у комбінації з центрально діючими агентами проти ожиріння. Інший агент проти ожиріння для застосування у комбінаційній терапії згідно з цим аспектом винаходу, переважно, - модулятор СВ-1, наприклад, антагоніст або зворотний агоніст СВ-1. Приклади модуляторів СВ-1 охоплюють SR141716 (римонабант) та SLV-319 ((4S)-(-)-3-(4-хлорфеніл)-(Nметил-N-[(4-хлорфеніл)сульфоніл]-4-феніл-4,5дигідро-1Н-піразол-1-карбоксамід);, а також сполуки, розкриті у ЕР576357, ЕР656354, WO 03/018060, WO 03/020217, WO 03/020314, WO 03/026647, WO 03/026648, WO 03/027076, WO 03/040105, WO 03/051850, WO 03/051851, WO 03/053431, WO 03/063781, WO 03/075660, WO 03/077847, WO 03/078413, WO 03/082190, WO 03/082191, WO 03/082833, WO 03/084930, WO 03/084943, WO 03/086288, WO 03/087037, WO 03/088968, WO 04/012671, WO 04/013120, WO 04/026301, WO 04/029204, WO 04/034968, WO 04/035566, WO 04/037823 WO 04/052864, WO 04/058145, WO 04/058255, WO 04/060870, WO 04/060888, WO 04/069837, WO 04/069837, WO 04/072076, WO 04/072077, WO 04/078261 та WO 04/108728, та посиланнях, розкритих там. Інші хвороби або стани, у котрих GPR119 грає роль, охоплюють описані у WO 00/50562 та US 6,468,756, як-то, серцево-судинні розлади, гіпертензія, респіраторні розлади, анормальності вагітності, шлунково-кишкові розлади, імунні розлади, м'язоскелетні розлади, депресія, фобії, тривога, розлади настрою та хвороба Альцгеймера. Усі публікації, у тому числі, але без обмеження, патенти та заявки на патент, цитовані у цьому описі, є уведеними як посилання. Винахід описано з посиланням на наступні приклади, котрі є ілюстрацією, а не обмеженням рамок заявленого винаходу. ПРИКЛАДИ Матеріали та способи Хроматографію на колонці проводили на SiO2 (40-63 меш), якщо не визначене інше РХ-МС-дані отримували таким чином колонка Atlantis 3 С18 (3,0 × 20,0 мм, швидкість потоку = 0,85 мл/хв) елювання розчином H2O-CH3CN, що містить 0,1% НСО2Н протягом 6 хв з УФ-визначенням при 220 нм. Градієнт 0,0-0,3 хв 100% Н2О, 0,3-4,25 хв. Збільшення до 10% Н2О-90% CH3CN; 4,25-4,4 хв: Збільшення до 100% CH3CN; 4,4-4,9 хв: Утримування при 100% CH3CN; 4,9-6,0 хв: Повернення до 100% Н2О. Мас-спектри отримували, застосовуючи з іонізацією електророзпиленням у позитивному + (ЕР ) або негативному (ЕР ) режимах. Скорочення: Ас: Ацетил; n-Bu: n-Бутил; t-Bu: трет-Бутил; U1AD: Діізопропіл азодикарбоксилат; DIPEA: N,N-діізоопропілетиламін; ДМФ: диметил 19 формамід; EDCI: 1-(3-Диметиламінопропіл)-3етилкарбодіімід гідрохлорид; Et: Етил; HOBt: 1Гідроксибензотриазол; ІГ: Ізогексан; і-Pr: Ізопропіл; Me: Метил; Ph: Феніл; ЗФ-ВЕРХ: Зворотно-фазова високоефективна рідинна хроматографія; RT: Час утримання; ТГФ: Тетрагідрофуран. Синтези наступних сполук описані: 3-третБутил-5-хлор-[1,2,4]оксадіазол: WO 95/05368, трет-Бутил 4-((£)-2-етоксикарбоніл-1-метил-вініл)піперидин-1-карбоксилат: патент США 6,518,423, N-Гідроксіізобутирамідин: J. Org. Chem. 2003, 68, 7316-7321; Метил 2-флуор-4-гідроксибензоат: JComb. Chem. 2002, 3, 177-180, 3-Піперидин-4-ілпропан-1-оl та трет-бутил 4-(3гідроксипропіл)піперидин-1-карбоксилат: Tetrahedron 1999, 55, 11619-11639. Усі інші сполуки були з комерційних джерел. Отримання 1: 4-(3-Гідроксипропіл)піперидин-1карбонітрил Кашку NaHCO3 (35,2 г, 0,42 моль) у Н2О (70 мл) додавали при перемішуванні до розчину 3піперидин-4-ілпропан-1-олу (20,0 г, 0,14 моль) у СН2СІ2 при 0°С. Розчин BrCN (17,8 г, 0,17 моль) у СН2СІ2 (19 мл) додавали до реакційної суміші протягом 1 хв, тоді перемішування продовжували при 0°С протягом 0,5 годин. Реакційну суміш тоді перемішували при 20°С протягом 2 годин перед промивкою насиченим водним NaHCO3 та розсолом. СН2СІ2-розчин сушили (MgSO4), фільтрували та концентрували у вакуумі, отримуючи оливу, що розчиняли у невеликій кількості СН2СІ2, перед фільтруванням крізь шар SiO2, елюванням EtOAc. Фільтрат концентрували під зменшеним тиском, + отримуючи заголовну сполуку: m/z (ЕР ) = 169,1 + [М+Н] Отримання 2: N-Гідрокси-4-(3гідроксипропіл)піперидин-1-карбоксамідин Суміш 4-(3-гідроксипропіл)піперидин-1карбонітрилу (Отримання 1, 3,00 г, 17,8 ммоль), К2СО3 (2,46 г, 17,8 ммоль), та H2NOH-HCI (2,48 г, 35,7 ммоль) у ЕtOН (20 мл) та Н2О (30 мл) гріли при кипінні під зворотним холодильником протягом 16 годин ЕtOН видаляли у вакуумі, тоді водну фазу екстрагували EtOAc (5x). Водну фазу тоді насичали NaCI, перед екстрагуванням знов EtOAc (5x). Комбіновані органічні екстракти промивали розсолом перед сушкою (MgSO4), фільтрували, та концентрували, отримуючи заголовну сполуку: m/z + + (ЕР ) = 202,1 [М+H] . Отримання 3: 3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропан-1-ол 96967 20 DIPEA (3,25 г, 25,2 ммоль), N-гідрокси-4-(3гідроксипропіл)піперидин-1-карбоксамідин (Отримання 2, 1,54 г, 7,6 ммоль), та HOBt (1,29 г, 8,4 ммоль) додавали при перемішуванні до розчину ізомасляної кислоти (0,67 г, 7,6 ммоль) у безводному ДМФ (10 мл). Через 10 хв додавали EDCI (1,76 г, 9,2 ммоль), тоді перемішування продовжували протягом 16 годин. Реакційну суміш розбавляли Н2О, тоді суміш екстрагували EtOAc (2x). Комбіновані органічні екстракти промивали насиченим водним NaHCO3, H2O, та розсолом перед сушкою (MgSO4). Фільтрування та випарювання розчиннику дали жовту оливу, що обробляли PhMe. Суміш гріли при кипінні під зворотним холодильником протягом 0,5 години. Після охолодження реакційну суміш очищали хроматографією на колонці (ІГ-ЕtOАс, 2:3), отримуючи заголовну спо+ + луку m/z (ЕР ) = 254,1 [М+Н] Отримання 4: 3-[1-(5-Пропіл-[1,2,4]оксадіазол3-іл)піперидин-4-іл]пропан-1-ол Цю сполуку отримували з N-гідрокси-4-(3гідроксипропіл)піперидин-1-карбоксамідину (Отримання 2) та масляної кислоти, застосовуючи про+ цедури, подібні показаній в отриманні 3: m/z (ЕР ) + = 254,1 [М+Н] . Отримання 5: 3-[1-(5-трет-бутил[1,2,4]оксадіазол-3-іл)піперидин-4-іл]пропан-1-ол. Цю сполуку отримували з N-гідрокси-4-(3гідроксипропіл)піперидин-1-карбоксамідину (Отримання 2) та півалової кислоти, застосовуючи про+ цедури, подібні показаній в отриманні 3: m/z (ЕР ) + = 268,1 [М+Н] . Отримання 6: 3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропан-1-ол. ZnCl2 (1M у Et2O, 145 мл, 145 ммоль) додавали протягом 20 хв при перемішуванні до розчину 4-(3-гідроксипропіл)піперидин-1-карбонітрилу (Отримання 1,20,3 г, 121 ммоль) та Nгідроксіізобутирамідину (14,8 г, 145 ммоль) у EtOAc (290 мл) та ТГФ (270 мл). Через 2 години білий осад, що утворився, збирали та промивали ТГФ-EtOAc (1:1,50 мл) Цей осад розчиняли у EtOH (550 мл) та 12 М НСІ (70 мл), тоді розчин перемішували з нагріванням до 70°С протягом 16 годин. ЕtOН видаляли у вакуумі, залишок розбавляли Н2О, тоді рН доводили до 7 твердим NaHCO3.Суміш екстрагували EtOAc (3х), тоді комбіновані екстракти промивали розсолом перед сушкою (MgSO4). Фільтрування та видалення розчиннику + + дали заголовну сполуку m/z (ЕР ) = 254,1 [М+Н] Отримання 7: 3-[1-(3-Пропіл-[1 2,4]оксадіазол5-іл)піперидин-4-іл]пропан-1-ол 21 Цю сполуку отримували конденсацією 4-(3гідроксипропіл)піперидин-1-карбонітрилу (Отримання 1) з N-гідроксибутирамідином, застосовуючи процедури, подібні показаній в отриманні 6 m/z + (ЕР ) = 254,2 [М+ Н] Отримання 8: трет-бутил 4-((Е)-2-карбокси-1метилвініл)піперидин-1-карбоксилат Розчин трет-бутил 4-((Е)-2-етоксикарбоніл-1метилвініл)піперидин-1-карбоксилату (18,7 г, 62,9 ммоль) у МеОН (90 мл) та Н2О (25 мл) обробляли 2М NaOH (94,5 мл, 189,0 ммоль). Реакційну суміш перемішували протягом 16 годин, МеОН видаляли під зменшеним тиском, тоді залишок розподіляли між EtOAc та Н2О. Водний шар відокремлювали та підкислювали до рН 2 із 12М НСІ, перед екстрагуванням EtOAc (2х). Органічні екстракти промивали розсолом, сушили (MgSO4), фільтрували, та концентрували, тоді залишок перекристалізовували з EtOAc-ІГ, отримуючи заголовну + + сполуку m/z (EP ) = 268,3 [М+Н] . Отримання 9: трет-бутил 4-((R)-2-карбокси-1метилетил)піперидин-1-карбоксилат трет-Бутил 4-((E-2-карбокси-1метилвініл)піперидин-1-карбоксилат (Отримання 8, 130,0 г, 0,483 моль) поміщали у колбу для гідрогенування в атмосфері аргону, тоді додавали дегазований МеОН (400 мл). [Rh(норборнадієн);]BF4 (1,80 г, 4,81 ммоль) та (S)-1-[(R)-2-(ді-третбутилфосфіно)фероценіл]етилбіс(2метилфеніл)фосфін (2,90 г, 5,08 ммоль) поміщали у окрему колбу Шленка під аргоном, перед обробкою дегазованим МеОН (200 мл). Цю суміш каталізатору перемішували протягом 15 хв при температурі довкілля перед переносом у колбу для гідрогенування. Колбу Шленка промивали ще дегазованим МеОН (100 мл). Ці промивки переносили у колбу для гідрогенування, тоді ще додавали дегазований МеОН (300 мл). Колбу для гідрогенування закривали, аргон заміщали воднем, та тиск доводили до 1,05 бар. Реакційну суміш гріли до 35°С та перемішували. Через 48 годин реакцію зупиняли та зразок реакційної суміші аналізували ВЕРХ та 'Н ЯМР Перетворення було 100%, а енантіомерна чистота сирої (R)-кислоти була 98,2%, як з'ясовано наступним способом ВЕРХ: Колонка: CHIRALPAK AD-H (раніше застосовувано розчинники з вмістом CF3CO2H) 4,6 × 250 мм; Розчинник: С6Н14-і-РrOН (97:3 ізократичний:); Температура: 20°С; Швидкість потоку: 1 мл/хв; УФ-визначення (210, 230 нм); Зразок: 100 мкл реакційний розчин розчиняли в 1 мл МеОН. Час утримання: (S)кислота: 19,3 хв, (R)-кислота: 20,6 хв, вихідна еноєва кислот: 22,1 хв. Процедури виділення: МеОН 96967 22 випарювали, тоді сирий продукт гідрогенування розчиняли у трет-BuOMe та екстрагували водним NaOH. Водну фазу додавали до суміш 1М НСІ та EtOAc. Водну фазу ще екстрагували EtOAc, тоді комбіновані органічні екстракти промивали розсолом та сушили (MgSO4). Заголовну сполуку було виділено фільтруванням та повним видаленням розчиннику. Отримання 10: трет-Бутил 4-((R)-3-гідрокси-1метилпропіл)піперидин-1-карбоксилат ВН3ТГФ(1М, 15,7 мл, 15,7 ммоль) додавали краплями протягом 5 хв при перемішуванні до розчину трет-бутил 4-((R)-2-карбокси-1метилетил)піперидин-1-карбоксилату (Отримання 9 1,70 г, 6,3 ммоль) у безводному ТГФ при 0°С. Через 1 годину реакційну суміш обробляли Et2O, тоді із 2М НСІ. Органічний шар промивали розсолом перед сушкою (Na2SO4). Фільтрування, випарювання розчиннику, та хроматографія на колонці (EtOAc-CH2CI2, 1:3) дали заголовну сполуку: RT - 3 + + 17 хв, m/z (ЕР ) = 258,1 [М+Н] Отримання 11: 4-((R)-3-гідрокси-1метилпропіл)піперидин-1-карбонітрил Суміш трет-бутил 4-((R)-3-гідрокси-1метилпропіл)піперидин-1-карбоксилату (Отримання 10, 6,2 г, 14,9 ммоль) та 4 М НСІ у діоксані (10 мл) перемішували при температурі довкілля. Через 3 години розчинники видаляли під зменшеним тиском, отримуючи гідрохлорид (R)-3піперидин-4-іл-бутан-1-олу: Н ({CD3}2SO) 0,83 (d, 3Н), 1,19-1,28 (m, 1Н), 1,38-1,59 (m, 5Н), 1,64-1,76 (m, 2Н), 2,75-2,87 (m, 2H), 3,20-3,30 (m, 2Н), 3,353,60 (m, 411). При перемішуванні суміш цієї сполуки (0,93 г, 4,8 ммоль) та NaHCO3 (1,61 г, 19,2 ммоль) у СН2СІ2-Н2О (4:1, 15 мл) при 0°С обробляли розчином BrCN (0,61 г, 5,8 ммоль) у СН2СІ2 (2 мл) Реакційну суміш перемішували при 20°С протягом 2 годин перед розподіленням між Н2О та СН2СІ2. Органічну фазу відокремлювали та сушили (MgSO4). Фільтрування, випарювання розчиннику, та флеш-хроматографія (EtOAc) дали + заголовну сполуку: RT = 2,45 хв, m/z (ЕР ) - 183,1 + [М+Н] Отримання 12: (R)-3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]бутан-1-ол 23 Конденсація 4-((R)-3-гідрокси-1метилпропіл)піперидин-1-карбонітрилу (Отримання 11, 0,53 г, 2,9 ммоль) з Nгідроксіізобутирамідином (0,36 г, 3,5 ммоль), застосовуючи процедури, подібні показаній в отриманні 6, дала заголовну сполуку: RT = 2,92 хв, m/z + + (ЕР ) = 268,1 [М+Н] . Отримання 13: (R)-3-[1-(5-ізопропіл[1,2,4]оксадіазол-3-іл)піперидин-4-іл]бутан-1-ол Суміш 4-((R)-3-гідрокси-1метилпропіл)піперидин-1-карбонітрилу (Отримання 11, 1,00 г, 5,2 ммоль) та NH2OH (50 мас. % у Н2О, 0,63 мл, 10,4 ммоль) у EtOH (10 мл) перемішували при температурі довкілля протягом 30 хв. Реакційну суміш концентрували, азеотропуючи з PhMe (3х), отримуючи в'язку блідо-жовту оливу. Суміш цієї оливи, EDO (1,20 г, 6,22 ммоль), HOBt (0,77 г, 5,70 ммоль), ізомасляної кислоти (0,50 мл, 5,44 ммоль), та D1PEA (2,70 мл, 15,54 ммоль) у безводному ДМФ (10 мл) перемішували протягом 16 годин, перед розподіленням між Н2О та EtOAc. Органічний шар промивали насиченим водним NaHCO3 та розсолом перед сушкою (MgSO4), фільтрували, та концентрували. Залишок гріли при кипінні під зворотним холодильником у PhMe протягом 3 годин, тоді розчинники видаляли у вакуумі та залишок очищали флеш-хроматографією (ЕtOАс-СН2СІ2, 2:3), отримуючи заголовну сполуку: + + RT = 3,20 хв, m/z (ЕР ) = 268,1 [М+Н] Отримання 14: 2-Флуор-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}бензойна кислота 96967 24 DIAD (20,2 мл, 102,8 ммоль) додавали при перемішуванні до розчину метил 2-флуор-4гідроксибензоату (13,43 г, 79,1 ммоль), 3-[1-(3ізопропіл-[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропан-1-олу (Отримання 6, 20,00 г, 79,1 ммоль), та PPh3 (24,85 г, 95,0 ммопь) у безводному ТГФ. Через 30 хв розчинник видаляли у вакуумі, тоді залишок розтирали у порошок з ІГ-Et2O. Утворений твердий продукт фільтрували та промивали Et 2O. Комбіновані промивки та фільтрат концентрували під зменшеним тиском, тоді залишок очищали флеш-хроматографією (ЕtOАс-ІГ, 1:4) для створення метил 2-флуор-4-{3-[1-(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензоату. Цю сполуку перемішували з LіОН-Н2О (33,2 г, 791 ммоль) у МеОН (400 мл) та Н2О (100 мл) протягом 16 годин. МеОН випарювали під зменшеним тиском, тоді залишок розподіляли між 2М NaOH та Et2O. Водну фазу підкислювали до рН 2, перед екстрагуванням EtOAc. Органічні екстракти сушили (MgSO4), фільтрували, концентрували, та перекристалізовували з EtOAc, отримуючи заголовну сполуку: Н (CDCI3) 1,26-1,40 (m, 8Н), 1,46-1,62 (m, 3Н), 1,81-1,93 (m, 4Н), 2,95 (септ, 1Н), 3,02-3,12 (m, 2Н), 4,03 (t, 2Н), АА6-А22 (m, 211), 6,67 (dd, 1H), 6,78 (dd, 1H), 8,01 (t, 1H); + + m/z(EP ) = 392,0 [М+Н] Кислоти, перераховані у таблиці, 1 синтезували конденсацією Міцунобу підхожого фенолу з підхожим спиртом, а потім омиленням, застосовуючи процедури, подібні показаній в отриманні 14. 25 96967 26 Таблиця 1 27 Цю сполуку отримували конденсацією Міцунобу метил 2-флуор-4-гідроксибензоату з трет-бутил 4-(3-гідроксипропіл)піперидин-1-карбоксилат процедурами, подібними показаній в отриманні 14: + + m/z(EP ) = 396,3 [М+Н] . Отримання 25: 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2флуор-бензойна кислота Отримання 24: трет-Бутил 4-[3-(3-флуор-4метоксикарбонілфенокси)пропіл]піперидин-1карбоксилат Розчин трет-бутил 4-[3-(3-флуор-4метоксикарбонілфенокси)пропіл]піперидин-1карбоксилату (Отримання 24, 3,49 г, 8,83 ммоль) перемішували з 4М НСІ у діоксані (25 мл) протягом 1 години при 20°С. Розчинник видаляли, тоді залишок розтирали у порошок з Et2O, отримуючи гідрохлорид метил 2-флуор-4-(3-піперидин-4+ + ілпропокси)бензоату: m/z (ЕР ) = 296,1 [М+Н] . При 96967 28 перемішуванні розчин цієї сполуки (1,25 г, 3,8 ммоль) та К2СО3 (1,33 г, 9,5 ммоль) у безводному ДМФ (15 мл) обробляли розчином 3-третбутил-5-хлор-[1,2,4]оксадіазолу (0,76 г, 4,75 ммоль) у безводному ДМФ (10 мл) Через 1 годину додавали Н2О, тоді суміш екстрагували Et2O. Етерні екстракти промивали 1М НСІ, перед сушкою (MgSO4). Фільтрування та випарювання розчиннику дали метил 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2+ + флуорбензоат: m/z(EP ) = 420,1 [М+Н] Омилення цього естеру, застосовуючи процедури, подібні показаній в отриманні 14, дало заголовну сполуку + + m/z(EP ) = 404,5 [М+Н] . Отримання 26: 4-{3-[1-(3-трет-бутил[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси}-2метил-бензойна кислота Цю сполуку отримували з метил 4-гідрокси-2метилбензоату та трет-бутил 4-(3гідроксипропіл)піперидин-1-карбоксилату, застосовуючи процедури, подібні показаній в отриман+ + нях 24 та 25: m/z(EP ) = 400,5 [М+Н] Бензойні кислоти у таблиці 2 також отримували, застосовуючи процедури, подібні показаній в отриманнях 24 та 25 Таблиця 2 29 Приклад 1: 2-Флуор-N-((R)-2-гідрокси-1метилетил)-4-{3-[1 -(3-ізопропіл[1,2,4]оксадіазол-5-іл)піперидин-4-іл]пропокси} бензамід HOBt- H2O (8,76 г, 63,9 ммоль) додавали при перемішуванні до розчину 2-флуор-4-{3-[1-(3ізопропіл-[1,2,4]оксадіазол-5-іл)піперидин-4іл]пропокси}бензойної кислоти (Отримання 14, 20,00 г, 51,2 ммоль) та EDCI (12,21 г, 63,9 ммоль) у ТГФ (400 мл). Через 1 годину (R)-2-аміно-1 96967 30 пропанол (7,68 г, 102,4 ммоль) додавали, тоді перемішування продовжували при температурі довкілля протягом 4 годин. ТГФ видаляли у вакуумі, тоді залишок розчиняли у СН2СІ2. Розчин промивали 1М NaOH (2х) та 1М НСІ перед сушкою (MgSO4) Фільтрування, випарювання розчиннику, та перекристалізація з ЕtOАс дали заголовну сполуку:Н (CDCI3) 1,27-1,39 (m, 11Н), 1,47-1,61 (m, 3Н), 1,80-1,92 (m, 4Н), 2,81 (t, 1Н), 2,93 (септ, 1Н), 3,02-3,12 (m, 2Н), 3,64-3,71 (m, 1Н), 3,78-3,84 (m, 1Н), 4,02 (t, 2Н), 4,16-4,20 (m, 2Н), 4,30-4,40 (m, 1Н), 6,63 (dd, 1Н), 6,77-6,83 (m,2Н), 8,06 (t, 1Н), + + m/z(EP ) = 449,1 [М+Н] . Аміди, перераховані у таблиці 3 синтезували конденсацією підхожої кислоти з підхожим аміном, застосовуючи процедури, подібні показаній у прикладі 1. Таблиця 3 31 96967 32 33 96967 34 35 96967 36 37 96967 38 39 96967 40 41 96967 42 43 Сполуки винаходу також зробити можна, застосовуючи модифікацію процедур, описаних у прикладі 1 де розчинник є дихлорметаном, а не ТГФ, НОВТН2О реагує із EDCI до додавання карбонової кислоти, а додатковий амін, як-то триетиламін, додають протягом утворення амідного зв'язку для запобігання позбавлення від необхідності застосування надлишку аміну, наприклад, (Р)-2аміно-1-пропанолу. Біологічну активність сполук винаходу можна тестувати нижченаведеними аналізами: Репортерний аналіз на базі клітин дріжджів Репортерні аналізи на базі клітин дріжджів описані раніше у літературі [наприклад, дивись Miret J.J. et al, 2002, J Biol. Chem., 277: 6881-6887; Campbell R.M. et al, 1999, Bioorg. Med. Chem. Lett., 9:2413-2418; King K. et al, 1990, Science, 250: 121123); WO 99/14344; WO 00/12704; та US 6,100,042]. Коротше, клітини дріжджів створюють так, щоб ендогений G- дріжджів (GPA1) був вирізаним та заміщеним створеними химерами Gбілку, застосовуючи багато способів. Додатково, ендогенні GPCR, Ste3 дріжджів вирізані для гетерологічної експресії кращого GPCR ссавців. У дріжджах елементи шляху трансдукції сигналу феромону, котрі є збереженими в клітинах евкарютів (наприклад, мітоген-активований провідний шлях білкової кінази), дає експресію Fusl. Розміщенням (3-галактозидази (LacZ) під контролем промотеру Fusl (Fuslp), має бути розробленою система, за допомогою якої активація рецептору призводитиме до ферментативного зчитування. Клітини дріжджів були трансформованими адаптацією способу з літій ацетатом, описаного Agatep et al, [Agatep, R. et al, 1998, Transformation of Saccharomyccs ccrcvisiac by the lithium acetate/single-stranded carrier DNA/polyethylene glycol (LiAc/ss-DNA/PEG) protocol. Technical Tips Online, Trends Journals, Elsevier). Коротше, клітини дріжджів вирощували протягом ночі на планшетах з триптоном дріжджів (YT). Носій одиничноланцюгової ДНК (10 мкг), 2 мкг кожних двох репортерних плазмід Fuslp-LacZ (одна з URA маркером вибору та одна з TRP), 2 мкг GPR119 (рецептор людини або миші) у векторі експресії дріжджів (2 мкг початку реплікації) та буфер літій ацетат/поліетиленгліколь/ТЕ переносили піпеткою у тубу Еппендорфа. Плазміди експресії дріжджів, що містять контроль рецептор/не рецептор, мають маркер LEU. Клітини дріжджів інокулюють у цю суміш та реакцію проводять при 30°С протягом 96967 44 60 хв. Клітини дріжджів тоді піддавали тепловому шоку при 42°С протягом 15 хв. Клітини тоді промивали та наносили на планшети вибору. Планшети вибору мають визначені синтетичні середовища дріжджів мінус LEU, URA та TRP (SD-LUT). Після інкубування при 30°С протягом 2-3 діб, колонії, що вирощують на планшетах вибору, тоді тестували у LacZ-аналізі. Для виконання флуорометричних аналізів ферменту для -галактозидази клітини дріжджів, що несуть рецептор GPR119 людини або миші, вирощували протягом ночі у рідкому середовищі SDLUT до концентрації ненасичення (тобто клітини ще ділилися та не досягли ще стаціонарної фази) їх розбавляли у свіжому середовищі до оптимальної концентрації та 90 мкл клітин дріжджів додавали у 96-лункові чорні полістиренові планшети (Costar). Сполуки у ДМСО та розбавлені у розчині 10% ДМСО до 10Х концентрації, додавали до планшетів та планшети тримали при 30°С протягом 4 годин. Через 4 години субстрат для галактозидази додавали до кожної лунки. У цих експериментах було застосовано флуоресцеїнді((3-D-галактопіранозид) (FDG), субстрат для ферменту, що вивільняє флуоресцеїн, дозволяючи флуорометричне зчитування 20 мкл на лунку 500 мкМ FDG/2,5% Triton X100 додавали (детергент був необхідним для проникності клітин). Після інкубування клітин з субстратом протягом 60 хв, 20 мкл на лунку, додавали 1М натрій карбонат для припинення реакції та посилювали флуоресцентний сигнал. Планшети тоді зчитували у флуориметрі при 485/535 нм. Сполуки винаходу збільшували флуоресцентний сигнал принаймні - 1,5-кратно, відносно сигналу фону (тобто сигналу, отриманого у присутності 1% ДМСО без сполук). Сполуки винаходу, котрі збільшують принаймні 5-кратно, можуть бути кращими. Аналіз цАМФ Стабільну лінію клітин, що експресує рекомбінантний GPR119 людини було встановлено та цю лінію клітин було застосовано для дослідження дії сполук винаходу на внутрішньоклітинні рівні циклічного AMP (цАМФ). Клітинні моношари промивали буферованим фосфатом фізіологічним розчином та стимулювали при 37°С протягом 30 хв різними концентраціями сполук у стимулювальному буфері плюс 1 % ДМСО. Клітини тоді лізували та вміст цАМФ визначали, застосовуючи комплект цАМФ Perkin Elmer AlphaScreen (Amplified Luminescent 45 Proximity). Буфери та умови аналізу були, як описано у протоколі виробника. Сполуки винаходу залежно від концентрації збільшували внутрішньоклітинний рівень цАМФ та загалом мали ЕК50
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperidine gpcr agonists
Автори англійськоюBertram, Lisa, Sarah, Fyfe, Matthew, Colin, Thor, Jeevaratnam, Revathy, Perpetua, Keily, John, Swain, Simon, Andrew
Назва патенту російськоюПиперидиновые агонисты gpcr
Автори російськоюБертрам Лиза Сара, Фифе Меттью Колин Тор, Джеваратнам Ревати Перпетуа, Кейли Джон, Свейн Симон Эндрю
МПК / Мітки
МПК: C07D 413/04, A61P 3/04, A61P 3/10, A61K 31/454
Мітки: піперидинові, агоністи
Код посилання
<a href="https://ua.patents.su/24-96967-piperidinovi-agonisti-gpcr.html" target="_blank" rel="follow" title="База патентів України">Піперидинові агоністи gpcr</a>
Попередній патент: Спосіб трансакцій грошових коштів
Наступний патент: Пристрій для тиснення щонайменше двошарових плоских виробів, таких як туалетний папір, паперові серветки або подібні вироби
Випадковий патент: Електромагніт