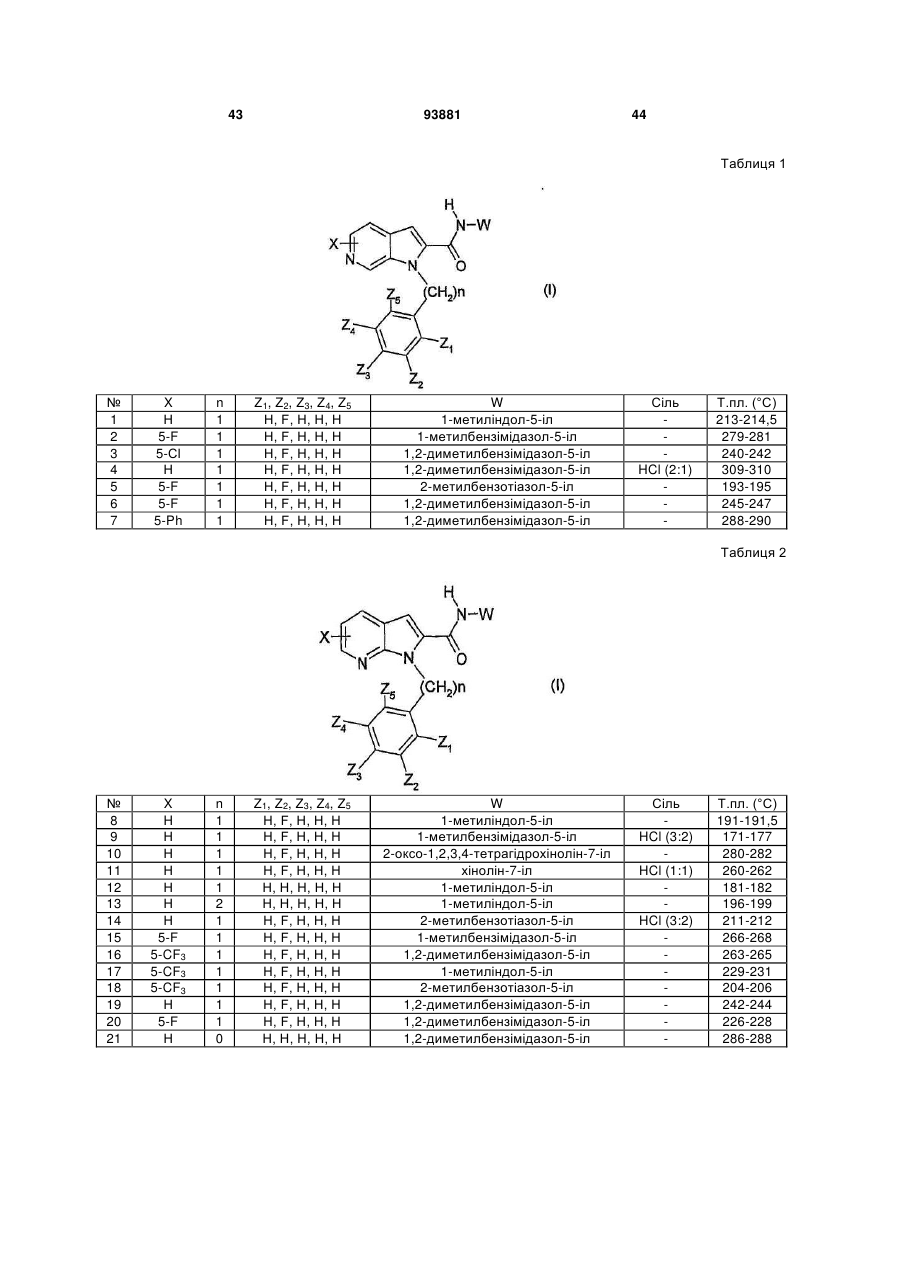
Похідні n-(арилалкіл)-1н-піролопіридин-2-карбоксамідів, їх одержання та застосування в терапії
Формула / Реферат
1. Сполука, що відповідає формулі (І):
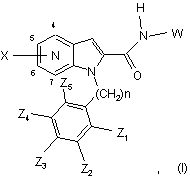
в якій
n дорівнює 0, 1, 2 або 3;
піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із атома галогену або (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)-фторалкоксилу, ціаногрупи, C(O)NR1R2, нітрогрупи, NR1R2, (С1-С6)-тіоалкілу, -S(О)-(С1-С6)-алкілу, -S(О)2-(С1-С6)-алкілу, SO2NR1R2, NR3COR4, NR3SO2R5 або арилу, причому арил може бути заміщений одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)-фторалкоксилу, нітрогрупи або ціаногрупи;
Z1, Z2, Z3, Z4 i Z5 означають, незалежно один від одного, атом водню або галогену або (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, (С1-С6)-алкоксил, (С1-С6)-фторалкоксил, ціаногрупу, С(О)NR1R2, нітрогрупу, NR1R2, (С1-С6)-тіоалкіл, -S(О)-(С1-С6)-алкіл, -S(О)2-(С1-С6)-алкіл, SO2NR1R2, NR3COR4, NR3SO2R5, арил-(С1-С6)-алкілен або арил, причому арил і арил-(С1-С6)-алкілен можуть бути заміщені одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)-фторалкоксилу, нітрогрупи або ціаногрупи;
R1 і R2 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, арил-(С1-С6)-алкілен або арил; або R1 і R2 разом з атомом азоту, який їх несе, утворюють азетидинову групу, піролідинову групу, піперидинову групу, азепінову групу, морфолінову групу, тіоморфолінову групу, піперазинову групу, гомопіперазинову групу, причому ця група може бути заміщена (С1-С6)-алкілом, (С3-С7)-циклоалкілом, (С3-С7)-циклоалкіл-(С1-С3)-алкіленом, арил-(С1-С6)-алкіленом або арилом;
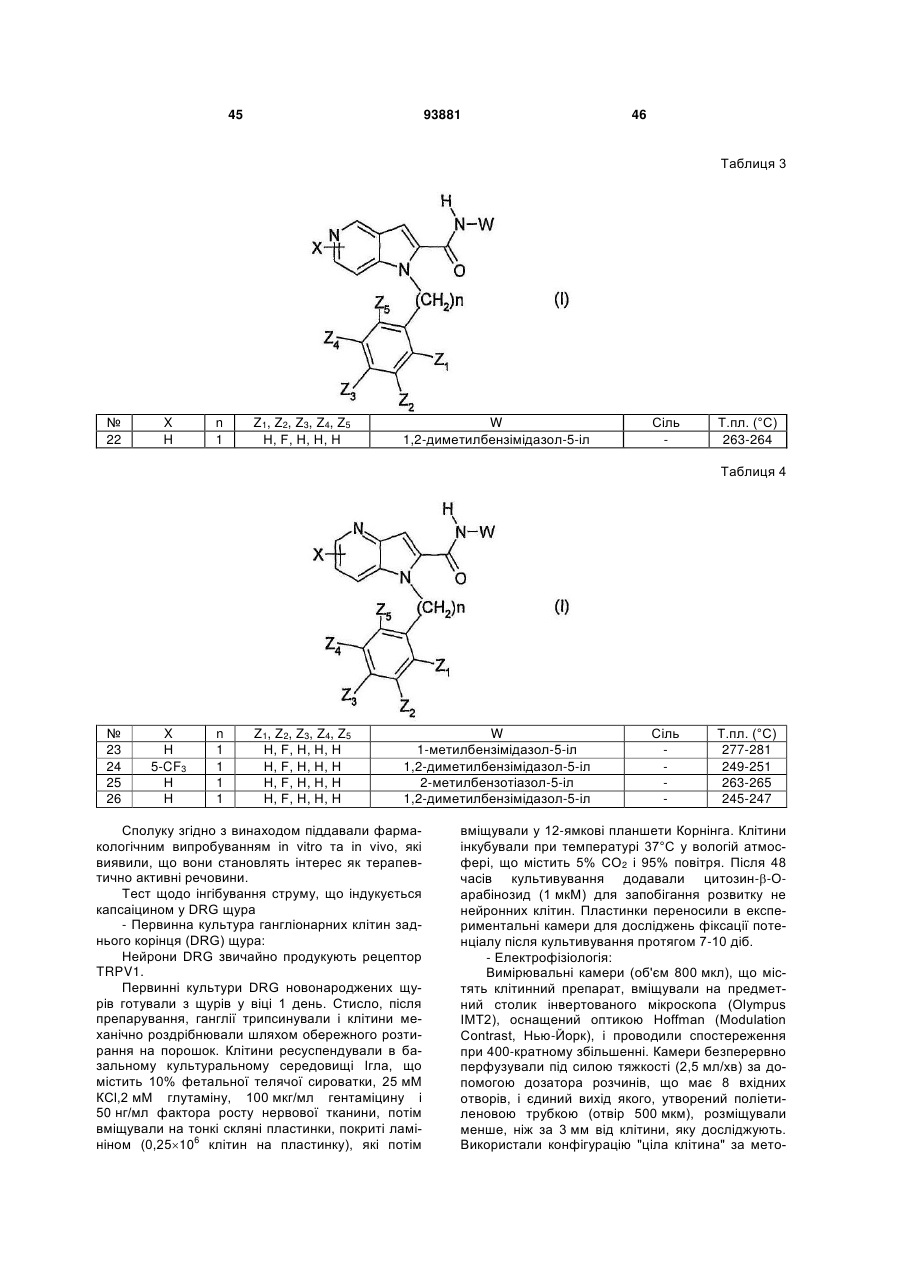
R3 і R4 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, арил-(С1-С6)-алкілен або арил;
R5 означає (С1-С6)-алкіл або арил;
W означає конденсовану біциклічну групу формули:
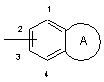 ,
,
зв'язану з атомом азоту в положеннях 1, 2, 3 або 4;
А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають з О, S або N;
причому
атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають з атома водню або (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, арилу, арил-(С1-С6)алкілену, оксогрупи або тіогрупи;
атом або атоми азоту А можуть бути заміщені радикалом R6, коли азот є суміжним з атомом вуглецю, заміщеним оксогрупою, або радикалом R7 в інших випадках;
R6 означає атом водню або (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, арил-(С1-С6)-алкілен або арил;
R7 означає атом водню або (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, арил-(С1-С6)-алкілен, (С1-С6)-алкіл-С(O)-, (С3-С7)-циклоалкіл(С1-С3)-алкілен-С(О)-, (С1-С6)-фторалкіл-С(О)-, (С3-С7)-циклоалкіл-С(О)-, арил-С(О)-, арил(С1-С6)-алкілен-С(О)-, (С1-С6)-алкіл-S(О)2-, (С1-С6)-фторалкіл-S(О)2-, (С3-С7)-циклоалкіл-S(О)2, (С3-С7)-циклоалкіл-(С1-С3)-алкілен-S(О)2-, арил-S(О)2-, арил-(С1-С6)-алкілен-S(О)2- або арил;
причому атом або атоми сірки гетероциклу А можуть бути в окисненій формі;
атом або атоми азоту гетероциклу А можуть бути в окисненій формі;
атом азоту в положенні 4, 5, 6 або 7 піролопіридину може бути в окисненій формі;
у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що n дорівнює 1 або 2; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату.
3. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із атома водню або галогену, або (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)-фторалкоксилу, нітрогрупи, NR1R2, (С1-С6)-тіоалкілу, -S(О)-(С1-С6)-алкілу, -S(О)2(С1-С6)-алкілу або арилу;
R1 і R2, незалежно один від одного, означають атом водню; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату.
4. Сполука формули (І) за будь-яким із п. 1 або 2, яка відрізняється тим, що піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із атома галогену або (С1-С6)-фторалкілу, або арилу; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату.
5. Сполука формули (І) за будь-яким із пп. 1-4, яка відрізняється тим, що Z1, Z2, Z3, Z4 i Z5 означають, незалежно один від одного, атом водню або галогену; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату.
6. Сполука формули (І) за будь-яким із пп. 1-5, яка відрізняється тим, що W вибирають із індолінілу, індолілу, ізоіндолілу, ізоіндолінілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, дигідробензотіофенілу, бензоксазолілу, дигідробензоксазолінілу, ізобензофуранілу, дигідроізобензофуранілу, бензімідазолілу, дигідробензімідазолілу, індазолілу, бензотіазолілу, ізобензотіазолілу, дигідроізобензотіазолілу, бензотриазолілу, хінолінілу, дигідрохінолінілу, тетрагідрохінолінілу, ізохінолінілу, дигідроізохінолінілу, тетрагідроізохінолінілу, бензоксазинілу, дигідробензоксазинілу, бензотіазинілу, дигідробензотіазинілу, цинолінілу, хіназолінілу, дигідрохіназолінілу, тетрагідрохіназолінілу, хіноксалінілу, дигідрохіноксалінілу, тетрагідрохіноксалінілу, фталазинілу, дигідрофталазинілу, тетрагідрофталазинілу, тетрагідробенз[b]азепінілу, тетрагідробенз[с]азепінілу, тетрагідробенз[е]азепінілу, тетрагідробензо[b][1,4]діазепінілу, тетрагідробензо[е][1,4]діазепінілу, тетрагідробензо[b][1,4]оксазепінілу або тетрагідробензо[b][1,4]тіазепінілу; причому атом або атоми вуглецю і/або азоту вищезгаданої групи W можуть бути заміщені, як зазначено у випадку загальної формули (І) за п. 1; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату.
7. Сполука формули (І) за будь-яким із пп. 1-5, яка відрізняється тим, що W означає конденсовану біциклічну групу формули:
 ,
,
зв'язану з атомом азоту в положеннях 1, 2, 3 або 4;
А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають з О, S або N; і
W вибирають із індолілу, бензімідазолілу, тетрагідрохінолінілу, хінолінілу, бензотіазолілу; і/або причому атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають із атома водню або (С1-С6)-алкілу, або оксогрупи; і/або причому атом або атоми азоту А можуть бути заміщені радикалом R6, коли азот є суміжним з атомом вуглецю, заміщеним оксогрупою, або радикалом R7 в інших випадках;
R6 означає атом водню;
R7 означає атом водню або (С1-С6)-алкіл;
у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату.
8. Спосіб одержання сполуки формули (І) за будь-яким із пп. 1-7, який відрізняється тим, що сполуку загальної формули (IV):
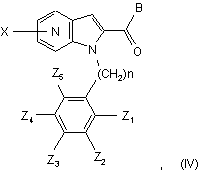
в якій Х1, Х2, Х3, Х4, Z1, Z2, Z3, Z4, Z5 і n мають значення, як зазначені у випадку загальної формули (І) за п. 1, і В означає (С1-С4)-алкоксил, вводять у взаємодію з амідом сполуки загальної формули (V):
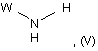
в якій W має значення, як зазначене у випадку загальної формули (І) за п. 1, при температурі кипіння зі зворотним холодильником розчинника, причому амід сполуки загальної формули (V) одержують шляхом попереднього впливу триметилалюмінію на сполуку загальної формули (V).
9. Спосіб одержання сполуки формули (І) за будь-яким із пп. 1-7, який відрізняється тим, що сполуку загальної формули (IV):

в якій Х1, Х2, Х3, Х4, Z1, Z2, Z3, Z4, Z5 і n мають значення, як зазначені у випадку загальної формули (І) за п. 1, і В означає гідроксильну групу, перетворюють у хлорангідрид кислоти шляхом впливу тіонілхлориду при температурі кипіння зі зворотним холодильником розчинника, потім тим, що одержану сполуку загальної формули (IV), в якій Х1, Х2, Х3, Х4, Z1, Z2, Z3, Z4, Z5 і n мають значення, як зазначені у випадку загальної формули (І) за п. 1, і В означає атом хлору,
вводять у взаємодію, у присутності основи, зі сполукою загальної формули (V):
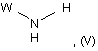
в якій W має значення, як зазначене у випадку загальної формули (І) за п. 1,
або ж тим, що здійснюють реакцію зв'язування між сполукою загальної формули (IV), в якій Х1, Х2, Х3, Х4, Z1, Z2, Z3, Z4, Z5 і n мають значення, як зазначені у випадку загальної формули (І) за п. 1, і В означає гідроксильну групу,
і сполукою загальної формули (V),
в якій W має значення, як зазначене у випадку загальної формули (І) за п. 1,
у присутності зв'язуючої речовини та основи, у розчиннику.
10. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким із пп. 1-7 або фармацевтично прийнятну сіль, гідрат або сольват сполуки формули (І).
11. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будь-яким із пп. 1-7 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також принаймні один фармацевтично прийнятний ексципієнт.
12. Застосування сполуки формули (І) за будь-яким із пп. 1-7 для одержання лікарського засобу, призначеного для профілактики або лікування патологій, в яких беруть участь рецептори типу TRPV1.
13. Застосування сполуки формули (І) за будь-яким із пп. 1-7 для одержання лікарського засобу, призначеного для профілактики або лікування болю, запалення, урологічних порушень, гінекологічних порушень, шлунково-кишкових порушень, респіраторних порушень, псоріазу, свербежу, дермальних іритацій, іритацій очей або слизових оболонок, герпесу, оперізувального лишаю, або лікування депресії або діабету.
Текст
1. Сполука, що відповідає формулі (І): H C2 2 (19) 1 3 А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають з О, S або N; причому атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають з атома водню або (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, арилу, арил-(С1-С6)алкілену, оксогрупи або тіогрупи; атом або атоми азоту А можуть бути заміщені радикалом R6, коли азот є суміжним з атомом вуглецю, заміщеним оксогрупою, або радикалом R7 в інших випадках; R6 означає атом водню або (С1-С6)-алкіл, (С3-С7)циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1С6)-фторалкіл, арил-(С1-С6)-алкілен або арил; R7 означає атом водню або (С1-С6)-алкіл, (С3-С7)циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1С6)-фторалкіл, арил-(С1-С6)-алкілен, (С1-С6)-алкілС(O)-, (С3-С7)-циклоалкіл(С1-С3)-алкілен-С(О)-, (С1С6)-фторалкіл-С(О)-, (С3-С7)-циклоалкіл-С(О)-, арил-С(О)-, арил(С1-С6)-алкілен-С(О)-, (С1-С6)алкіл-S(О)2-, (С1-С6)-фторалкіл-S(О)2-, (С3-С7)циклоалкіл-S(О)2, (С3-С7)-циклоалкіл-(С1-С3)алкілен-S(О)2-, арил-S(О)2-, арил-(С1-С6)-алкіленS(О)2- або арил; причому атом або атоми сірки гетероциклу А можуть бути в окисненій формі; атом або атоми азоту гетероциклу А можуть бути в окисненій формі; атом азоту в положенні 4, 5, 6 або 7 піролопіридину може бути в окисненій формі; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату. 2. Сполука формули (І) за п. 1, яка відрізняється тим, що n дорівнює 1 або 2; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату. 3. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із атома водню або галогену, або (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С1-С6)-фторалкілу, (С1-С6)алкоксилу, (С1-С6)-фторалкоксилу, нітрогрупи, NR1R2, (С1-С6)-тіоалкілу, -S(О)-(С1-С6)-алкілу, S(О)2(С1-С6)-алкілу або арилу; R1 і R2, незалежно один від одного, означають атом водню; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату. 4. Сполука формули (І) за будь-яким із п. 1 або 2, яка відрізняється тим, що піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із 93881 4 атома галогену або (С1-С6)-фторалкілу, або арилу; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату. 5. Сполука формули (І) за будь-яким із пп. 1-4, яка відрізняється тим, що Z1, Z2, Z3, Z4 i Z5 означають, незалежно один від одного, атом водню або галогену; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату. 6. Сполука формули (І) за будь-яким із пп. 1-5, яка відрізняється тим, що W вибирають із індолінілу, індолілу, ізоіндолілу, ізоіндолінілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, дигідробензотіофенілу, бензоксазолілу, дигідробензоксазолінілу, ізобензофуранілу, дигідроізобензофуранілу, бензімідазолілу, дигідробензімідазолілу, індазолілу, бензотіазолілу, ізобензотіазолілу, дигідроізобензотіазолілу, бензотриазолілу, хінолінілу, дигідрохінолінілу, тетрагідрохінолінілу, ізохінолінілу, дигідроізохінолінілу, тетрагідроізохінолінілу, бензоксазинілу, дигідробензоксазинілу, бензотіазинілу, дигідробензотіазинілу, цинолінілу, хіназолінілу, дигідрохіназолінілу, тетрагідрохіназолінілу, хіноксалінілу, дигідрохіноксалінілу, тетрагідрохіноксалінілу, фталазинілу, дигідрофталазинілу, тетрагідрофталазинілу, тетрагідробенз[b]азепінілу, тетрагідробенз[с]азепінілу, тетрагідробенз[е]азепінілу, тетрагідробензо[b][1,4]діазепінілу, тетрагідробензо[е][1,4]діазепінілу, тетрагідробензо[b][1,4]оксазепінілу або тетрагідробензо[b][1,4]тіазепінілу; причому атом або атоми вуглецю і/або азоту вищезгаданої групи W можуть бути заміщені, як зазначено у випадку загальної формули (І) за п. 1; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату. 7. Сполука формули (І) за будь-яким із пп. 1-5, яка відрізняється тим, що W означає конденсовану біциклічну групу формули: 1 2 A 3 4 , зв'язану з атомом азоту в положеннях 1, 2, 3 або 4; А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають з О, S або N; і W вибирають із індолілу, бензімідазолілу, тетрагідрохінолінілу, хінолінілу, бензотіазолілу; і/або причому атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають із атома водню або (С1-С6)-алкілу, або оксогрупи; і/або причому атом або атоми азоту А можуть бути заміщені радикалом R6, коли азот є суміжним з атомом вуглецю, заміщеним оксогрупою, або радикалом R7 в інших випадках; R6 означає атом водню; R7 означає атом водню або (С1-С6)-алкіл; у формі основи або адитивної солі з кислотою, а також у формі гідрату або сольвату. 8. Спосіб одержання сполуки формули (І) за будьяким із пп. 1-7, який відрізняється тим, що сполуку загальної формули (IV): 5 93881 B N X N Z5 O (CH2)n Z1 Z4 Z3 Z2 , (IV) в якій Х1, Х2, Х3, Х4, Z1, Z2, Z3, Z4, Z5 і n мають значення, як зазначено у випадку загальної формули (І) за п. 1, і В означає (С1-С4)-алкоксил, вводять у взаємодію з амідом сполуки загальної формули (V): W H N H , (V) в якій W має значення, як зазначено у випадку загальної формули (І) за п. 1, при температурі кипіння зі зворотним холодильником розчинника, причому амід сполуки загальної формули (V) одержують шляхом попереднього впливу триметилалюмінію на сполуку загальної формули (V). 9. Спосіб одержання сполуки формули (І) за будьяким із пп. 1-7, який відрізняється тим, що сполуку загальної формули (IV): B N X N Z5 O (CH2)n Z1 Z4 Z3 Z2 , (IV) в якій Х1, Х2, Х3, Х4, Z1, Z2, Z3, Z4, Z5 і n мають значення, як зазначено у випадку загальної формули (І) за п. 1, і В означає гідроксильну групу, перетворюють у хлорангідрид кислоти шляхом впливу тіонілхлориду при температурі кипіння зі зворот Об'єктом винаходу є сполуки, похідні N(арилалкіл)-1Н-піролопіридин-2-карбоксамідів, які мають антагоністичну активність in vitro та in vivo стосовно рецепторів типу TRPV1 (або VR1). Перший об'єкт винаходу стосується сполук, що відповідають нижченаведеній загальній формулі (І). 6 ним холодильником розчинника, потім тим, що одержану сполуку загальної формули (IV), в якій Х1, Х2, Х3, Х4, Z1, Z2, Z3, Z4, Z5 і n мають значення, як зазначено у випадку загальної формули (І) за п. 1, і В означає атом хлору, вводять у взаємодію, у присутності основи, зі сполукою загальної формули (V): W H N H , (V) в якій W має значення, як зазначено у випадку загальної формули (І) за п. 1, або ж тим, що здійснюють реакцію зв'язування між сполукою загальної формули (IV), в якій Х1, Х2, Х3, Х4, Z1, Z2, Z3, Z4, Z5 і n мають значення, як зазначено у випадку загальної формули (І) за п. 1, і В означає гідроксильну групу, і сполукою загальної формули (V), в якій W має значення, як зазначено у випадку загальної формули (І) за п. 1, у присутності зв'язуючої речовини та основи, у розчиннику. 10. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким із пп. 1-7 або фармацевтично прийнятну сіль, гідрат або сольват сполуки формули (І). 11. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будьяким із пп. 1-7 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також принаймні один фармацевтично прийнятний ексципієнт. 12. Застосування сполуки формули (І) за будьяким із пп. 1-7 для одержання лікарського засобу, призначеного для профілактики або лікування патологій, в яких беруть участь рецептори типу TRPV1. 13. Застосування сполуки формули (І) за будьяким із пп. 1-7 для одержання лікарського засобу, призначеного для профілактики або лікування болю, запалення, урологічних порушень, гінекологічних порушень, шлунково-кишкових порушень, респіраторних порушень, псоріазу, свербежу, дермальних іритацій, іритацій очей або слизових оболонок, герпесу, оперізувального лишаю, або лікування депресії або діабету. Інший об'єкт винаходу стосується способів одержання сполук загальної формули (І). Наступний об'єкт винаходу стосується застосування сполук загальної формули (І), зокрема, у лікарських засобах або у фармацевтичних композиціях. Сполуки згідно з винаходом відповідають загальній формулі (І): 7 93881 8 R3 і R4 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, арил-(С1-С6)-алкілен або арил; R5 означає (С1-С6)-алкіл або арил; W означає конденсовану біциклічну групу формули: в якій n дорівнює 0, 1,2 або 3; піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або що відрізняються один від одного, які вибирають із атома галогену або (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, ціаногрупи, C(O)NR1R2, нітрогрупи, NR1R2, (С1-С6)-тіоалкілу, -S(O)-(C1-C6)-алкілу, S(О)2-(С1-С6)-алкілу, SO2NR1R2, NR3COR4, NR3SO2R5 або арилу, причому арил може бути заміщений одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, нітрогрупи або ціаногрупи; Z1, Z2, Z3, Z4 i Z5 означають, незалежно один від одного, атом водню або галогену або (С1-С6)алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1С3)-алкілен, (С1-С6)-фторалкіл, (С1-С6)-алкоксил, (С1-С6)-фторалкоксил, ціаногрупу, С(О)NR1R2, нітрогрупу, NR1R2, (С1-С6)-тіоалкіл, -S(О)-(С1-С6)алкіл, -S(О)2-(С1-С6)-алкіл, SO2NR1R2, NR3COR4, NR3SO2R5, арил-(С1-С6)-алкілен або арил, причому арил і арил-(С1-С6)-алкілен можуть бути заміщені одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С3С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, нітрогрупи або ціаногрупи; R1 і R2 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, арил-(С1-С6)алкілен або арил; або R1 і R2 разом з атомом азоту, який їх несе, утворюють азетидинову групу, піролідинову групу, піперидинову групу, азепінову групу, морфолінову групу, тіоморфолінову групу, піперазинову групу, гомопіперазинову групу, причому ця група може бути заміщена (С1-С6)алкілом, (С3-С7)-циклоалкілом, (С3-С7)-циклоалкіл(С1-С3)-алкіленом, арил-(С1-С6)-алкіленом або арилом; зв'язану з атомом азоту в положеннях 1, 2, 3 або 4; А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають серед О, S або N; причому атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають із атома водню або (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, арилу, арил-(С1-С6)-алкілену, оксогрупи або тіогрупи; атом або атоми азоту А можуть бути заміщені радикалом R6, коли азот є суміжним з атомом вуглецю, заміщеним оксогрупою, або радикалом R7 в інших випадках; R6 означає атом водню або (С1-С6)-алкіл, (С3С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, арил-(С1-С6)-алкілен або арил; R7 означає атом водню або (С1-С6)-алкіл, (С3С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, арил-(С1-С6)-алкілен, (С1-С6)алкіл-С(О)-, (С3-С7)-циклоалкіл-(С1-С3)-алкіленС(О)-, (С1-С6)-фторалкіл-С(О)-, (С3-С7)-циклоалкілС(О)-, арил-С(О)-, арил-(С1-С6)-алкілен-С(О)-, (С1С6)-алкіл-S(О)2-, (С1-С6)-фторалкіл-S(О)2-, (С3-С7)циклоалкіл-S(О)2-, (С3-С7)-циклоалкіл-(С1-С3)алкілен-S(О)2-, арил-S(О)2-, арил-(С1-С6)-алкіленS(О)2- або арил. У сполуках загальної формули (І): - атом або атоми сірки гетероциклу А можуть бути в окисненій формі (S(O) або S(O)2); - атом або атоми азоту гетероциклу А можуть бути в окисненій формі (N-оксид); - атом азоту в положенні 4, 5, 6 або 7 піролопіридину може бути в окисненій формі (N-оксид). У рамках винаходу, у ролі прикладів групи W можна назвати наступні групи: індолініл, ізоіндолініл, індоліл, ізоіндоліл, бензофураніл, дигідробензофураніл, бензотіофеніл, дигідробензотіофеніл, бензоксазоліл, дигідробензоксазолініл, ізобензофураніл, дигідроізобензофураніл, бензімідазоліл, дигідробензімідазоліл, індазоліл, бензотіазоліл, ізобензотіазоліл, дигідро-ізобензотіазоліл, бензотриазоліл, хінолініл, дигідрохінолініл, тетрагідрохінолініл, ізохінолініл, дигідроізохінолініл, тетрагідроізохінолініл, бензоксазиніл, дигідробензоксазиніл, бензотіазиніл, дигідробензотіазиніл, цинолініл, хіназолініл, дигідрохіназолініл, тетрагідрохіназолініл, хіноксалініл, дигідрохіноксалініл, тетрагідрохіноксалініл, фталазиніл, дигідро-фталазиніл, тетрагідрофталазиніл, тетра 9 гідробенз[b]азепініл, тетрагідробенз[с]азепініл, тетрагідробенз[d]азепініл, тетрагідробензо[b][1,4]діазепініл, тетрагідробензо[е][1,4]діазепініл, тетрагідробензо[b][1,4]оксазепініл або тетрагідробензо[b][1,4]тіазепініл; причому ці групи можуть бути, за необхідності, заміщені, як зазначено у разі загальної формули (І). Серед сполук загальної формули (І), що є об'єктами даного винаходу, перша підгрупа сполук утворена сполуками, в яких n дорівнює 1 або 2. Серед сполук загальної формули (І), що є об'єктами даного винаходу, друга підгрупа сполук утворена сполуками, в яких піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із атома водню або галогену, такого як, наприклад, фтор, бром або хлор, або (С1-С6)-алкілу, такого як, наприклад, метил, пропіл, ізопропіл, втор-бутил, трет-бутил, пентил, (С3-С7)-циклоалкілу, як, наприклад, циклопентан або циклогексил, (С1-С6)фторалкілу, як, наприклад, трифторметил, (С1-С6алкоксилу, як, наприклад, метокси- або етоксигрупа, (С1-С6)-фторалкоксилу, як, наприклад, трифторметоксигрупа, нітрогрупи, NR1R2, (C1-C6)тіоалкілу, як, наприклад, тіометил, -S(О)-(С1-С6)алкілу, -S(О)2-(С1-С6)-алкілу, як, наприклад, -S(O)2CH3, або арилу, як, наприклад, феніл; R1 і R2, незалежно один від одного, означають атом водню. Серед сполук загальної формули (І), що є об'єктами даного винаходу, третя підгрупа сполук утворена сполуками, в яких піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7, наприклад, у положенні вуглецю 5, одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, наприклад, замісником X, який вибирають із атомів галогену, таких як, наприклад, атом хлору або фтору, або (С1-С6)фторалкілу, такого як, наприклад, трифторметил, або арилу, як, наприклад, феніл. Серед сполук загальної формули (І), що є об'єктами даного винаходу, четверта підгрупа сполук утворена сполуками, в яких піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із атома галогену або (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6) 93881 10 фторалкоксилу, ціаногрупи, C(O)NR1R2, нітрогрупи, NR1R2, (C1-С6)-тіоалкілу, -S(О)-(С1-С6)-алкілу, S(О)2-(С1-С6)-алкілу, SO2NR1R2, NR3COR4, NR3SO2R5 або арилу, причому арил може бути заміщений одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, нітрогрупи або ціаногрупи; R1 і R2 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, арил-(С1-С6)алкілен або арил; або R1 і R2 разом з атомом азоту, який їх несе, утворюють азетидинову групу, піролідинову групу, піперидинову групу, азепінову групу, морфолінову групу, тіоморфолінову групу, піперазинову групу, гомопіперазинову групу, причому ця група може бути заміщена (С1-С6)алкілом, (С3-С7)-циклоалкілом, (С3-С7)-циклоалкіл(С1-С3)-алкіленом, арил-(С1-С6)-алкіленом або арилом; R3 і R4 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, арил-(С1-С6)-алкілен або арил; R5 означає (С1-С6)-алкіл або арил. Серед сполук загальної формули (І), що є об'єктами даного винаходу, п'ята підгрупа сполук утворена сполуками, в яких Z1, Z2, Z3, Z4 i Z5 означають, незалежно один від одного, атом водню або галогену, наприклад, атом фтору. Серед сполук загальної формули (І), що є об'єктами даного винаходу, шоста підгрупа сполук утворена сполуками, в яких W вибирають із індолінілу, індолілу, ізоіндолілу, ізоіндолінілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, дигідробензотіофенілу, бензоксазолілу, дигідробензоксазолінілу, ізобензофуранілу, дигідроізобензофуранілу, бензімідазолілу, дигідробензімідазолілу, індазолілу, бензотіазолілу, ізобензотіазолілу, дигідроізобензотіазолілу, бензо-триазолілу, хінолінілу, дигідрохінолінілу, тетрагідрохінолінілу, ізохінолінілу, дигідроізохінолінілу, тетрагідроізохінолінілу, бензоксазинілу, дигідробензоксазинілу, бензотіазинілу, дигідробензотіазинілу, цинолінілу, хіназолінілу, дигідрохіназолінілу, тетрагідрохіназолінілу, хіноксалінілу, дигідрохіноксалінілу, тетрагідрохіноксалінілу, фталазинілу, дигідрофталазинілу, тетрагідрофталазинілу, тетрагідробенз[b]азепінілу, тетрагідробенз[с]азепінілу, тетрагідробенз[d]азепінілу, тетрагідробензо[и][1,4]діазепінілу, тетрагідробензо[е][1,4]діазепінілу, тетрагідробензо[b][1,4]-оксазепінілу або тетрагідробензо[b][1,4]тіазепінілу; причому атом або атоми вуглецю і/або азоту вищезгаданої групи W можуть бути заміщені, як зазначено у разі загальної формули (І). Серед сполук загальної формули (І), що є об'єктами даного винаходу, сьома підгрупа сполук утворена сполуками, в яких W означає конденсовану біциклічну групу формули: 11 зв'язану з атомом азоту в положеннях 1, 2, 3 або 4; А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають серед О, S або N; і W вибирають із індолілу, бензімідазолілу, тетрагідрохінолінілу, хінолінілу, бензотіазолілу; і/або причому атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають із атома водню або (С1-С6)-алкілу, такого як, наприклад, метил, або оксогрупи; і/або причому атом або атоми азоту А можуть бути заміщені радикалом R6, коли азот є суміжним з атомом вуглецю, заміщеним оксогрупою, або радикалом R7 в інших випадках; R6 означає атом водню; R7 означає атом водню або (С1-С6)-алкіл, наприклад, метил. Сполуки, в яких одночасно n, X, Z1, Z2, Z3, Z4, Z5 і W є такими, як зазначені у вищезгаданих підгрупах сполук загальної формули (І), утворюють восьму підгрупу. Серед сполук загальної формули (І), що є об'єктами даного винаходу, дев'ята група сполук утворена сполуками, в яких: n дорівнює 0, 1, 2 або 3; піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із атома галогену або (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, ціаногрупи, C(O)NR1R2, нітрогрупи, NR1R2, (С1-С6)-тіоалкілу, -S(О)-(С1-С6)-алкілу, S(О)2-(С1-С6)-алкілу, SO2NR1R2, NR3COR4, NR3SO2R5 або арилу, причому арил може бути заміщений одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, нітрогрупи або ціаногрупи; Z1, Z2, Z3, Z4 i Z5 означають, незалежно один від одного, атом водню або галогену або (С1-С6)алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1С3)-алкілен, (С1-С6)-фторалкіл, (С1-С6)-алкоксил, (С1-С6)-фторалкоксил, ціаногрупу, C(O)NR1R2, нітрогрупу, NR1R2, (С1-С6)-тіоалкіл, -S(О)-(С1-С6)алкіл, -S(О)2-(С1-С6)-алкіл, SO2NR1R2, NR3COR4, NR3SO2R5, арил-(С1-С6)-алкілен або арил, причому арил і арил-(С1-С6)-алкілен можуть бути заміщені одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С3 93881 12 С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, нітрогрупи або ціаногрупи; R1 і R2 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, арил-(С1-С6)алкілен або арил; або R1 і R2 разом з атомом азоту, який їх несе, утворюють азетидинову групу, піролідинову групу, піперидинову групу, азепінову групу, морфолінову групу, тіоморфолінову групу, піперазинову групу, гомопіперазинову групу, причому ця група може бути заміщена (С1-С6)алкілом, (С3-С7)-циклоалкілом, (С3-С7)-циклоалкіл(С1-С3)-алкіленом, арил-(С1-С6)-алкіленом або арилом; R3 і R4 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл або арил; R5 означає (С1-С6)-алкіл, арил-(С1-С6)-алкілен або арил; W означає конденсовану біциклічну групу формули: зв'язану з атомом азоту в положеннях 1, 2, 3 або 4; А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають серед О, S або N; причому атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають із атома водню або (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, арилу, арил-(С1-С6)-алкілену, оксогрупи або тіогрупи; атом або атоми азоту А можуть бути заміщені радикалом R6, коли азот є суміжним з атомом вуглецю, заміщеним оксогрупою, або радикалом R7 в інших випадках; R6 означає атом водню або (С1-С6)-алкіл, (С3С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, арил-(С1-С6)-алкілен або арил; R7 означає атом водню або (С1-С6)-алкіл, (С3С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, арил-(С1-С6)-алкілен, (С1-С6)алкіл-С(О)-, (С3-С7)-циклоалкіл(С1-С3)-алкіленС(О)-, (С1-С6)-фторалкіл-С(О)-, (С3-С7)циклоалкілС(О)-, арил-С(О)-, арил-(С1-С6)-алкілен-С(О)-, (С1С6)-алкіл-S(О)2-, (С1-С6)-фторалкіл-S(О)2-, (С3-С7)циклоалкіл-S(О)2-, (С3-С7)-циклоалкіл-(С1-С3)алкілен-S(О)2-, арил-S(О)2-, арил-(С1-С6)-алкіленS(О)2- або арил; за умови, що коли Z1, Z2, Z3, Z4 i Z5 означають одночасно атоми водню і коли піролопіридинове ядро являє собою піроло[3,2-b]піридин, можливо заміщений, тоді n дорівнює 2 або 3. Зі сполук загальної формули (І), що є об'єктами даного винаходу, можна назвати наступні сполуки: 13 N-(1-метил-1Н-індол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід; - N-(1-метил-1Н-бензімідазол-5-іл)-5-фтор-1[(3-фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід; - N-(1,2-диметил-1Н-бензімідазол-5-іл)-5-хлор1-[(3-фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід; N-(1,2-диметил-1Н-бензімідазол-5-іл)-1-[(3фторфеніл)метил]-1H-піроло[2,3-с]піридин-2карбоксамід; - N-(2-метил-1H-бензотіазол-5-іл)-5-фтор-1-[(3фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід; - N-(1,2-диметил-1Н-бензімідазол-5-іл)-5-фтор1-[(3-фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід; N-(1,2-диметил-1H-бензімідазол-5-іл)-5феніл-1-[(3-фторфеніл)метил]-1Н-піроло[2,3с]піридин-2-карбоксамід; N-(1-метил-1Н-індол-5-іл)-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксамід; N-(1-метил-1Н-бензімідазол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксамід; - N-(2-оксо-1,2,3,4-тетрагідрохінолін-7-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксамід; - N-(1хінолін-7-іл)-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксамід; - N-(1-метил-1Н-індол-5-іл)-1-(фенілметил)-1Hпіроло[2,3-b]піридин-2-карбоксамід; - N-(1-метил-1H-індол-5-іл)-1-(фенілетил)-1Нпіроло[2,3-b]піридин-2-карбоксамід; N-(2-метилбензотіазол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксамід; N-(1-метил-1H-бензімідазол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксамід; N-(1,2-диметил-1H-бензімідазол-5-іл)-5трифторметил-1-[(3-фторфеніл)метил]-1Нпіроло[2,3-b]піридин-2-карбоксамід; - N-(1-метил-1Н-індол-5-іл)-5-трифторметил-1[(3-фторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксамід; - N-(2-метилбензотіазол-5-іл)-5-трифторметил1-[(3-фторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксамід; N-(1,2-диметил-1Н-бензімідазол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксамід; - N-(1,2-диметил-1Н-бензімідазол-5-іл)-5-фтор1-[(3-фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксамід; N-(1,2-диметил-1Н-бензімідазол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[3,2-с]піридин-2карбоксамід; N-(1-метил-1Н-бензімідазол-5-іл)-1-[(3фторфеніл)метил]-1H-піроло[3,2-b]піридин-2карбоксамід; 93881 14 N-(1,2-диметил-1Н-бензімідазол-5-іл)-5трифторметил-1-[(3-фторфеніл)метил]-1Нпіроло[3,2-b]піридин-2-карбоксамід; -N-(2-метилбензотіазол-5-іл)-1-[(3фторфеніл)метил]-1H-піроло[3,2-b]піридин-2карбоксамід; -N-(1,2-диметил-1Н-бензімідазол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[3,2-b]піридин-2карбоксамід; -N-(1,2-диметил-1Н-бензімідазол-5-іл)-1(феніл)-1H-піроло[2,3-b]піридин-2-карбоксамід. Серед сполук загальної формули (І), що є об'єктами даного винаходу, одна підгрупа сполук утворена сполуками загальної формули (l'): в якій n дорівнює 1, 2 або 3; піролопіридинове ядро являє собою піроло[3,2-b]піридинову групу, піроло[3,2-с]піридинову групу, піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу; причому піролопіридинове ядро може бути заміщене в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, які вибирають із атома галогену або (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, ціаногрупи, C(O)NR1R2, нітрогрупи, NR1R2, (С1-С6)-тіоалкілу, -S(О)-(С1-С6)-алкілу, S(О)2-(С1-С6)-алкілу, SO2NR1R2, NR3COR4, NR3SO2R5 або арилу, причому арил може бути заміщений одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, нітрогрупи або ціаногрупи; Z1, Z2, Z3, Z4 i Z5 означають, незалежно один від одного, атом водню або галогену або (С1-С6)алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1С3)-алкілен, (С1-С6)-фторалкіл, (С1-С6)-алкоксил, (С1-С6)-фторалкоксил, ціаногрупу, С(О)NR1R2, нітрогрупу, NR1R2, (С1-С6)-тіоалкіл, -S(О)-(С1-С6)алкіл, -S(О)2-(С1-С6)-алкіл, SO2NR1R2, NR3COR4, NR3SO2R5, арил-(С1-С6)-алкілен або арил, причому арил і арил-(С1-С6)-алкілен можуть бути заміщені одним або декількома замісниками, які вибирають із галогену, (С1-С6)-алкілу, (С3-С7)-циклоалкілу, (С3С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)фторалкілу, (С1-С6)-алкоксилу, (С1-С6)фторалкоксилу, нітрогрупи або ціаногрупи; 15 R1 i R2 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, арил-(С1-С6)алкілен або арил; або R1 і R2 разом з атомом азоту, який їх несе, утворюють азетидинову групу, піролідинову групу, піперидинову групу, азепінову групу, морфолінову групу, тіоморфолінову групу, піперазинову групу, гомопіперазинову групу, причому ця група може бути заміщена (С1-С6)алкілом, (С3-С7)-циклоалкілом, (С3-С7)-циклоалкіл(С1-С3)-алкіленом, арил-(С1-С6)-алкіленом або арилом; R3 і R4 означають, незалежно один від одного, атом водню або (С1-С6)-алкіл, арил-(С1-С6)-алкілен або арил; R5 означає (С1-С6)-алкіл або арил; W означає конденсовану біциклічну групу формули: зв'язану з атомом азоту в положеннях 1, 2, 3 або 4; А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають серед О, S або N; причому атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають із атома водню або (С1-С6)-алкілу, (С3-С7)циклоалкілу, (С3-С7)-циклоалкіл-(С1-С3)-алкілену, (С1-С6)-фторалкілу, арилу, арил-(С1-С6)-алкілену, оксогрупи або тіогрупи; атом або атоми азоту А можуть бути заміщені радикалом R6, коли азот є суміжним з атомом вуглецю, заміщеним оксогрупою, або радикалом R7 в інших випадках; R6 означає атом водню або (С1-С6)-алкіл, (С3С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, арил-(С1-С6)-алкілен або арил; R7 означає атом водню або (С1-С6)-алкіл, (С3С7)-циклоалкіл, (С3-С7)-циклоалкіл-(С1-С3)-алкілен, (С1-С6)-фторалкіл, арил-(С1-С6)-алкілен, (С1-С6)алкіл-С(О)-, (С3-С7)-циклоалкіл-(С1-С3)-алкіленС(О)-, (С1-С6)-фторалкіл-С(О)-, (С3-С7)-циклоалкілС(О)-, арил-С(О)-, арил-(С1-С6)-алкілен-С(О)-, (С1С6)-алкіл-S(О)2-, (С1-С6)-фторалкіл-S(О)2-, (С3-С7)циклоалкіл-S(О)2-, (С3-С7)-циклоалкіл-(С1-С3)алкілен-S(О)2-, арил-S(О)2-, арил-(С1-С6)-алкіленS(О)2- або арил. Серед сполук загальної формули (l'), що є об'єктами даного винаходу, перша підгрупа сполук утворена сполуками, в яких n дорівнює 1 або 2. Серед сполук загальної формули (l'), що є об'єктами даного винаходу, друга підгрупа сполук утворена сполуками, в яких піролопіридинове ядро являє собою піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу, можливо заміщену в положенні вуглецю 4, 5, 6 і/або 7 одним або декількома замісниками X, однаковими або такими, що 93881 16 відрізняються один від одного, які вибирають із атома водню або галогену, як, наприклад, фтор, бром або хлор, або (С1-С6)-алкілу, як, наприклад, метил, пропіл, ізопропіл, втор-бутил, трет-бутил, пентил, (С3-С7)-циклоалкілу, як, наприклад, циклопентил або циклогексил, (С1-С6)-фторалкілу, як, наприклад, трифторметил, (С1-С6)-алкоксилу, як, наприклад, метокси- або етоксигрупа, (С1-С6)фторалкоксилу, як, наприклад, трифторметоксигрупа, нітрогрупи, NR1R2, (С1-С6)-тіоалкілу, як, наприклад, тіометил, -S(О)-(С1-С6)-алкілу, -S(О)2-(С1С6)-алкілу, як, наприклад, -S(O)2-CH3, або арилу, як, наприклад, феніл; R1 і R2, незалежно один від одного, означають атом водню. Серед сполук загальної формули (l'), що є об'єктами даного винаходу, третя підгрупа сполук утворена сполуками, в яких піролопіридинове ядро являє собою піроло[2,3-с]піридинову групу або піроло[2,3-b]піридинову групу, можливо заміщену в положенні вуглецю 4, 5, 6 і/або 7, наприклад, у положенні вуглецю 5, одним або декількома замісниками X, однаковими або такими, що відрізняються один від одного, наприклад, замісником X, вибираним із атома галогену, як, наприклад, атом хлору або фтору, або (С1-С6)-фторалкілу, як, наприклад, трифторметил. Серед сполук загальної формули (l'), що є об'єктами даного винаходу, четверта підгрупа сполук утворена сполуками, в яких Z1, Z2, Z3, Z4 i Z5 означають, незалежно один від одного, атом водню або галогену, наприклад, атом фтору. Серед сполук загальної формули (l'), що є об'єктами даного винаходу, п'ята підгрупа сполук утворена сполуками, в яких W вибирають з індолінілу, індолілу, ізоіндолілу, ізоіндолінілу, бензофуранілу, дигідробензофуранілу, бензотіофенілу, дигідробензотіофенілу, бензоксазолілу, дигідробензоксазолінілу, ізобензофуранілу, дигідроізобензофуранілу, бензімідазолілу, дигідробензімідазолілу, індазолілу, бензотіазолілу, ізобензотіазолілу, дигідроізобензотіазолілу, бензо-триазолілу, хінолінілу, дигідрохінолінілу, тетрагідрохінолінілу, ізохінолінілу, дигідроізохінолінілу, тетрагідроізохінолінілу, бензоксазинілу, дигідробензоксазинілу, бензотіазинілу, дигідробензотіазинілу, цинолінілу, хіназолінілу, дигідрохіназолінілу, тетрагідрохіназолінілу, хіноксалінілу, дигідрохіноксалінілу, тетрагідрохіноксалінілу, фталазинілу, дигідрофталазинілу, тетрагідрофталазинілу, тетрагідробенз[b]азепінілу, тетрагідробенз[с]азепінілу, тетрагідробенз[d]азепінілу, тетрагідробензо[b][1,4] діазепінілу, тетрагідробензо[е][1,4]діазепінілу, тетрагідробензо[b][1,4]-оксазепінілу або тетрагідробензо[b][1,4]тіазепінілу; причому атом або атоми вуглецю і/або азоту вищезгаданої групи W можуть бути заміщені, як зазначено у разі загальної формули (І). Серед сполук загальної формули (l'), що є об'єктами даного винаходу, шоста підгрупа сполук утворена сполуками, в яких W означає конденсовану біциклічну групу формули: 17 зв'язану з атомом азоту в положеннях 1, 2, 3 або 4; А означає 5-7-членний гетероцикл, що включає від одного до трьох гетероатомів, які вибирають серед О, S або N; і W вибирають з індолілу, бензімідазолілу, дигідрохінолінілу, хінолінілу, бензотіазолілу; і/або причому атом або атоми вуглеців А можуть бути заміщені однією або декількома групами, які вибирають із атома водню або (С1-С6)-алкілу, як, наприклад, метил; і/або причому атом або атоми азоту А можуть бути заміщені радикалом R7; R7 означає атом водню або (С1-С6)-алкіл, наприклад, метил. Сполуки, в яких одночасно n, X, Z1, Z2, Z3, Z4, Z5 і W є такими, як зазначені у вищезгаданих підгрупах сполук загальної формули (l'), утворюють сьому підгрупу. У рамках даного винаходу: - під (Ct-Cz), де t і z мають значення 1-7, розуміють вуглецевий ланцюг, який може включати від t до z атомів вуглецю, наприклад, (С1-С3)вуглецевий ланцюг, який може включати 1-3 атоми вуглецю; - під терміном "алкіл" розуміють лінійну або розгалужену насичену аліфатичну групу. Як приклади можна назвати метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пентил, і т.д.; - під терміном "алкілен" розуміють лінійну або розгалужену, насичену двовалентну групу, наприклад, (С1-С3)-алкілен означає лінійний або розгалужений двовалентний вуглецевий ланцюг з 1-3 атомами вуглецю, наприклад, метилен, етилен, 1метилетилен, пропілен; - під терміном "циклоалкіл" розуміють циклічну вуглецеву групу. Як приклади можна назвати циклопропіл, циклобутил, циклопентил, циклогексил, і т.д.; - під терміном "фторалкіл" розуміють алкільну групу, один або декілька атомів водню якої заміщені атомом фтору; - під терміном "алкоксил" розуміють -Оалкільний радикал, де алкільна група має вищезазначене значення; - під терміном "фторалкоксил" розуміють алкоксильну групу, один або декілька атомів водню якої заміщені атомом фтору; - під терміном "тіоалкіл" розуміють радикал -Sалкіл, де алкіл має вищезазначене значення; - під терміном "арил" розуміють циклічну ароматичну групу, що включає 6-10 атомів вуглецю. Як приклади арильних груп можна назвати феніл або нафтил; - під терміном "гетероцикл" розуміють 5-7членну насичену, частково ненасичену або арома 93881 18 тичну циклічну групу, що включає від одного до трьох гетероатомів, які вибирають серед О, S або N; - під атомом галогену розуміють фтор, хлор, бром або йод; - "оксо" означає "=О"; - "тіо" означає "=S". Сполуки формули (І) можуть включати один або декілька асиметричних атомів вуглецю. Отже, вони можуть існувати у формі енантіомерів або діастереоізомерів. Ці енантіомери, діастереоізомери, а також їхні суміші, включаючи сюди рацемічні суміші, становлять частину винаходу. Сполуки формули (І) можуть існувати у формі основи або адитивних солей із кислотами. Такі адитивні солі становлять частину винаходу. Ці солі переважно одержують із фармацевтично прийнятними кислотами, однак, солі інших кислот, придатні, наприклад, для очищення або виділення сполук формули (І), також становлять частину винаходу. Сполуки загальної формули (І) можуть знаходитися у формі гідратів або сольватів, а саме, у формі асоціацій або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати також становлять частину винаходу. У нижченаведеному контексті, під терміном "група, що видаляється" розуміють групу, яка може бути легко відщеплена від молекули за рахунок розриву гетеролітичного зв'язку, із видаленням електронної пари. Ця група також може бути легко замінена іншою групою, наприклад, під час реакції заміщення. Такими групами, що видаляються, є, наприклад, галогени або активована гідроксильна група, така, як метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат, і т.д. Приклади груп, що видаляються, а також посилання на їхнє одержання наведені в книзі J. March "Advances in Organic Chemistry", 5-е видання, Wiley Interscience, 2001. Згідно з винаходом, сполуки загальної формули (І) можна одержувати згідно зі способом, проілюстрованим на нижченаведеній схемі 1. Згідно зі схемою 1, сполуки загальної формули (IV) можуть бути одержані шляхом введення у взаємодію сполуки загальної формули (II), в якій X має значення, як зазначені у разі вищенаведеної загальної формули (І), і В означає (С1-С6)-алкоксил або гідроксил, зі сполукою загальної формули (III), в якій Z1, Z2, Z3, Z4, Z5 і n мають зазначені у разі вищенаведеної загальної формули (І) значення і R' означає групу, що видаляється, або гідроксильну групу, коли n дорівнює 1, 2 або 3, або R' означає групу, що видаляється, коли n дорівнює 0. Коли сполука загальної формули (III) є такою, що n дорівнює 1, 2 або 3 і R' означає групу, що видаляється, таку, як атом брому або йоду, реакція може бути здійснена у присутності основи, такої, як гідрид натрію або карбонат калію, у полярному розчиннику, такому, як диметилформамід, диметилсульфоксид або ацетон (n=1: Kolasa T., Bioorg. Med. Chem., 5(3), 507 (1997); n=2: Abramovitch R., Synth, Commun, 25(1), 1 (1995)). 19 Коли сполука загальної формули (III) є такою, що n дорівнює 1, 2 або 3 і R' означає гідроксильну групу, сполуки загальної формули (IV) можуть бути одержані шляхом введення у взаємодію сполуки загальної формули (II) зі сполукою загальної формули (III) у присутності фосфіну, такого, як трифенілфосфін, і реагенту, такого, як діетилазодикарбоксилат, у вигляді розчину в розчиннику, такому, як дихлорметан або тетрагідрофуран (О. Mitsonobu, Synthesis, 1-28 (1981)). Коли сполука загальної формули (III) є такою, що n дорівнює 0, R' означає групу, що видаляється, таку, як атом хлору, брому або йоду, реакція може бути здійснена при температурі в діапазоні від 80°С до 250°С, у присутності каталізатора на основі міді, такого, як бромід міді або оксид міді, а також основи, такої, як карбонат калію (Murakami Y., Chem. Pharm. Bull., 43(8), 1281 (1995)). Також 93881 20 можна використати більш м'які умови, описані S.L. Buchwald у J. Am. Chem. Soc, 124, 11684 (2002). У рамках винаходу, сполуки загальної формули (IV), в якій В означає (С1-С6)-алкоксил, можуть бути перетворені в сполуки загальної формули (IV), в якій В означає гідроксильну групу, згідно зі способами, відомими фахівцеві в даній галузі, наприклад, у присутності основи, такої, як гідроксид натрію, в розчиннику, такому, як метанол або етанол. У рамках винаходу, сполуки загальної формули (IV), в якій В означає гідроксильну групу, можуть бути перетворені в сполуки загальної формули (IV), в якій В означає (С1-С6)-алкоксил, згідно зі способами, відомими фахівцеві в даній галузі, наприклад, у присутності кислоти, такої, як сірчана кислота, у розчиннику, такому, як метанол або етанол. 21 У разі сполук загальної формули (IV), в якій В означає (С1-С6)-алкоксил, сполука загальної формули (І) може бути одержана шляхом введення у взаємодію сполуки загальної формули (IV), такої, як одержана вище, з амідом сполуки загальної формули (V), в якій W має значення, як зазначене у разі вищенаведеної загальної формули (І), при температурі кипіння зі зворотним холодильником розчинника, такого, як толуол. Амід алюмінію сполуки загальної формули (V) одержують шляхом попереднього впливу триметилалюмінію на аміни загальної формули (V). У разі сполук загальної формули (IV), в якій В означає гідроксильну групу, карбоксильна група попередньо може бути перетворена в групу галогенангідриду кислоти, такого, як хлорангідрид кислоти, шляхом впливу тіонілхлориду, при температурі кипіння зі зворотним холодильником розчинника, такого, як дихлорметан або дихлоретан. Сполуку загальної формули (І) тоді одержують шляхом введення у взаємодію сполуки загальної формули (IV), в якій В означає атом хлору, зі сполукою загальної формули (V), у присутності основи, такої, як триетиламін або карбонат калію. Альтернативно, сполуки загальної формули (IV), в якій В означає гідроксильну групу, можуть бути зв'язані зі сполуками загальної формули (V) у присутності зв'язувальної речовини, такої, як діалкілкарбодіімід, [(бензотриазол-1-іл)окси] [трис(піролідино)]фосфонійгексафторфосфат, діетилціанофосфонат або будь-якої іншої зв'язувальної речовини, відомої фахівцеві в даній галузі, у присутності основи, як триетиламін, у розчиннику, такому, як диметилформамід. На схемі 1, сполуки формул (II), (III) і (V) та інші реагенти, коли спосіб їх одержання не зазначений, є комерційно доступними, описаними в літературі або що одержуються аналогічно з численними способами, описаними в літературі (наприклад, М. Nazare та інш., Angew. Chem. Int. Ed., 43(34), 4526-4528 (2004); P.M. Fresneda та інш., Tetrahedron Lett., 41(24), 4777-4780 (2000); M.H. Fisher та інш., J. Heterocyclic Chem., 6, 775 (1969); D. Frydman та інш., J. Am. Chem. Soc, 87, 3530 (1965); L.N. Yakhontov, Tetrahedron Lett., 1909 (1969); G.P. Fagan та інш., J. Med. Chem., 31(5), 944 (1988); OSI Pharmaceuticals WO2004104001; WO03049702; US0149367; WO03068749; US20050131012). Сполуки загальних формул (II), (IV) або (І), в яких X означає алкільну групу, можуть бути одержані шляхом реакції зв'язування, каталізовану металом, таким, як паладій або залізо, яку здійснюють при використанні відповідних сполук загальних формул (II), (IV) або (І), в яких X означає атом галогену, наприклад, атом хлору, у присутності, наприклад, алкілмагнійгалогеніду або алкілцинкгалогеніду, згідно зі способами, описаними в літературі (наприклад, A. Furstner та інш., J. Am. Chem. Soc, 124(46), 13856 (2002); G. Quéguiner та інш., J. Org. Chem., 63(9), 2892 (1998)) або відомими фахівцеві в даній галузі. Сполуки загальних формул (II), (IV) і (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають ціаногрупу або арил, можуть бути одержані шляхом реакції зв'я 93881 22 зування, каталізованої металом, таким, як паладій, яку здійснюють при використанні відповідних сполук загальних формул (II), (IV) або (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають, наприклад, атом брому, у присутності триметилсилілціаніду або арилборонової кислоти, або будь-якими іншими способами, які описані в літературі або які відомі фахівцеві в даній галузі. Сполуки загальних формул (І), (II) і (IV), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають групу NR1R2, NR3COR4 NR3SO2R5, можуть бути одержані з відповідних сполук загальних формул (І), (II) і (IV), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають, наприклад, атом брому, шляхом реакції зв'язування, відповідно, з аміном, амідом або сульфонамідом, у присутності основи, фосфіну і каталізатора на основі паладію, згідно зі способами, які описані в літературі або які відомі фахівцеві в даній галузі. Сполуки загальних формул (II), (IV) і (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають групу C(O)NR1R2, можуть бути одержані з відповідних сполук загальних формул (II), (IV) або (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають ціаногрупу, згідно зі способами, які описані в літературі або які відомі фахівцеві в даній галузі. Сполуки загальних формул (II), (IV) і (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають групу -S(О)-алкіл або -S(О)2-алкіл, можуть бути одержані шляхом окислення відповідних сполук загальних формул (II), (IV) або (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають (С1-С6)-тіоалкіл, згідно зі способами, які описані в літературі або які відомі фахівцеві в даній галузі. Сполуки загальних формул (II), (IV) і (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають групу NR1R2, NR3COR4 NR3SO2R5, можуть бути одержані з відповідних сполук загальних формул (II), (IV) або (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають нітрогрупу, наприклад, шляхом відновлення, потім ацилювання або сульфонілування, згідно зі способами, які описані в літературі або які відомі фахівцеві в даній галузі. Сполуки загальних формул (II), (IV) і (І), в яких X, Z1, Z2, Z3, Z4 і/або Z5 означають групу SO2NR1R2, можуть бути одержані способом, аналогічним до такого, що описаний у Pharmazie, 45, 346 (1990), або згідно зі способами, які описані в літературі або які відомі фахівцеві в даній галузі. Сполуки загальної формули (І), в якій R7 означає атом водню, можуть бути одержані зі сполук загальної формули (І), в якій, наприклад, R7 означає фенілметил, шляхом гідрування в присутності каталізатора на основі паладію або будь-якими способами, які описані в літературі або які відомі фахівцеві в даній галузі. У нижченаведених прикладах описується одержання деяких сполук згідно з винаходом. Ці приклади не обмежують обсягу охорони винаходу і служать тільки для ілюстрації даного винаходу. Номери сполук, що наводяться в прикладах відповідають таким, зазначеним у таблиці 1. Елементні мікроаналізи, аналізи LC-MS (рідинна хроматографія в поєднанні з мас-спектрометрією), lЧспектри або ЯМР-спектри підтверджують структури одержаних сполук. 23 Приклад 1 (сполука №1) N-(1-Метил-1Н-індол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід 1.1. Етил-3-(3-нітропіридин-4-іл)-2оксопропіонат У тригорлу колбу місткістю 100 мл, оснащену магнітною мішалкою, що продувається азотом, вводять 3,1 г (22,44 ммоль) 4-метил-3нітропіридину і 16,39 г (112,22 ммоль) етилоксалату. Потім до реакційного середовища, що перемішується при кімнатній температурі, додають 3,69 мл (24,69 ммоль) 1,8діазабіцикло[5,4,0]ундец-7-ену. Реакційну суміш після цього перемішують при кімнатній температурі протягом 1 години, потім розводять сумішшю етилацетату (150 мл), води (100 мл) та оцтової кислоти (4 мл). Суміш екстрагують два рази етилацетатом. Об'єднані органічні фази промивають за допомогою 100 мл води, 100 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Сирий реакційний продукт потім розтирають на порошок у пентані, відфільтровують, потім нагрівають у петролейному ефірі, відфільтровують і висушують при зниженому тиску. Таким чином виділяють 3,9 г (16,37 ммоль) продукту, який використовують таким, який є, на наступній стадії. 1 Н-ЯМР (CDCІ3), (м. ч.): 9,4 (с, 1Н); 8,9 (д, 1H); 7,4 (д, 1Н) 4,65 (с, 2Н); 4,5 (кв, 2Н); 1,4(т, 3Н). 1.2. Етил-1H-піроло[2,3-с]піридин-2карбоксилат Спосіб А: До розчину 3,9 г (16,37 ммоль) продукту, одержаного на стадії 1.1, у 140 мл етанолу і 60 мл тетрагідрофурану, додають за один раз 60 мл водного насиченого розчину хлориду амонію і 5,48 г (98,2 ммоль) порошкоподібного заліза. Реакційну суміш потім перемішують при кип'ятінні зі зворотним холодильником протягом 2 годин. Охолоджений розчин фільтрують через целіт, який промивають декілька разів етилацетатом. Після концентрування фільтрату при зниженому тиску залишок обробляють водою та етилацетатом, органічну фазу промивають водним насиченим розчином хлориду натрію, потім сушать над сульфатом натрію. Виділяють першу частину, 0,7 г (3,68 ммоль), продукту. Водну фазу концентрують при зниженому тиску, залишок обробляють гарячим етилацетатом, осад видаляють шляхом відфільтровування і фільтрат знову концентрують. Одержаний залишок очищають хроматографією на колонці з силікагелем, елююючи сумішшю гептану та етилацетату. Одержують додаткові 0,7 г (3,68 ммоль) продукту. Спосіб В: До розчину 0,25 г (1,05 ммоль) продукту, одержаного на стадії 1.1, у 10 мл етанолу додають 0,11 г (0,1 ммоль) 10% паладію-на-вугіллі. Реакційну суміш гідрують при тиску 30 фунт/дюйм2 протягом 2 годин 30 хвилин при кімнатній температурі. Після відфільтровування через скловолокно, фільтрат випарюють при зниженому тиску та одержаний сирий продукт реакції перекристалізову 93881 24 ють з етанолу, одержуючи 0,08 г (0,42 ммоль) продукту. 1 Н-ЯМР (DMSO-D6), (м. ч.): 8,9 (с, 1H); 8,3 (д, 1H); 7,7 (дд, 1Н); 7,2 (д, 1Н); 4,4 (кв, 2Н); 1,4(т, 3Н). 1.3. Етил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-с]піридин-2-карбоксилат До розчину 2 г (10,52 ммоль) продукту, одержаного на стадії 1.2, у 105 мл безводного тетрагідрофурану, що підтримується в інертній атмосфері, додають послідовно, при перемішуванні, 2,03 г (15,77 ммоль) 3-фторбензилового спирту, потім 4,17 г (15,77 ммоль) трифенілфосфіну. Після цього додають, по краплях і при температурі 0°С, 2,83 г (15,77 ммоль) діетил-азодикарбоксилату. Реакційну суміш потім перемішують протягом 20 годин при кімнатній температурі, після чого концентрують при зниженому тиску. Одержане масло очищають послідовними хроматографіями на колонці з силікагелем, елююючи сумішшю гептану та етилацетату. Виділяють 1,9 г (6,37 ммоль) продукту. 1 Н-ЯМР (CDCІ3), (м. ч.): 8,8 (с, 1H); 8,3 (д, 1Н); 7,6 (д, 1Н); 7,2 (с, 1H); 7,1 (м, 1H); 6,85 (м, 2Н); 6,65 (м, 1Н); 5,8 (с, 2Н); 4,3 (кв, 2Н); 1,3 (т, 3Н). 1.4 N-(1-Метил-1H-індол-5-іл)-1-[(3фторфеніл)метил]-1H-піроло[2,3-с]піридин-2карбоксамід (сполука №1) При охолодженні, в атмосфері аргону і при перемішуванні магнітною мішалкою, до розчину 1,68 мл (3,35 ммоль) триметил-алюмінію в 5 мл безводного толуолу додають розчин 0,29 г (2,01 ммоль) 5-аміно-1-метиліндолу в 10 мл безводного толуолу. Реакційне середовище витримують при температурі 50°С протягом 15 хвилин. Потім повільно додають 0,5 г (1,68 ммоль) складного ефіру, одержаного на стадії 1.3, у вигляді розчину в 15 мл толуолу і протягом 20 годин кип'ятять зі зворотним холодильником. До охолодженого розчину додають лід, розведену соляну кислоту, потім етилацетат. Одержують нерозчинну частину, яку обробляють дихлорметаном і розчином гідроксиду натрію. Органічну фазу промивають водою, сушать і концентрують при зниженому тиску. Залишок очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану та етилацетату. Одержану тверду речовину розтирають на порошок при використанні петролейного ефіру, її відділяють шляхом фільтрації і висушують при зниженому тиску. Одержують 0,385 г очікуваного продукту. Температура плавлення: 213-214,5°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,45 (с, 1Н); 8,95 (с, 1H); 8,2 (д, 1Н); 7,95 (с, 1Н); 7,7 (д, 1H); 7,3 (м, 5Н); 7,0 (м, 3Н); 6,4 (д, 1H); 5,95 (с, 2Н); 3,75 (с, 3Н). Приклад 2 (сполука №2) N-(1-Метил-1Н-бензімідазол-5-іл)-5-фтор-1-[(3фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід 2.1. Етил-3-(2-фтор-5-нітропіридин-4-іл)-2оксопропіонат У тригорлу колбу місткістю 100 мл, оснащену магнітною мішалкою, що продувається азотом, вводять 2 г (12,81 ммоль) 2-фтор-4-метил-5нітропіридину і 9,36 г (32,03 ммоль) етилоксалату. Потім до реакційного середовища, що перемішу 25 ється при кімнатній температурі додають 2,11 мл (14,09 ммоль) 1,8-діазабіцикло[5,4,0]ундец-7-ену. Реакційну суміш після цього перемішують при кімнатній температурі протягом 4 годин. Потім додають суміш етилацетату (100 мл), води (40 мл) та оцтової кислоти (2 мл). Суміш екстрагують два рази етилацетатом. Об'єднані органічні фази промивають за допомогою 100 мл води, 100 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Залишок очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю гептану та етилацетату. Таким чином одержують 1,53 г продукту, який використовують таким, який є, на наступній стадії. 1 Н-ЯМР (DMCO-D6), (м. ч.): 8,9 (с, 1H); 7,9 (с, 1Н); 6,7 (с, 1H); 4,7 (с, ОН); 4.3 (кв, 2Н); 1,3 (т, 3Н); кето-енольна форма, що переважає. 2.2. Етил-5-фтор-1H-піроло[2,3-с]піридин-2карбоксилат До розчину 0,6 г (2,34 ммоль) продукту, одержаного на стадії 2.1, у 30 мл етанолу і 15 мл тетрагідрофурану, додають за один раз 15 мл водного насиченого розчину хлориду амонію і 0,39 г (7,03 ммоль) порошкоподібного заліза. Реакційну суміш потім перемішують при кип'ятінні зі зворотним холодильником протягом 3 годин. Охолоджений розчин фільтрують через целіт і фільтрат промивають декілька разів метанолом. Після концентрування при зниженому тиску залишок обробляють етилацетатом і водою. Водну фазу екстрагують етилацетатом, об'єднані органічні фази промивають за допомогою 100 мл водного насиченого розчину хлориду натрію, потім сушать над сульфатом натрію, відфільтровують і випарюють при зниженому тиску. Одержують 0,43 г (2,06 ммоль) продукту, що використовується таким, який є, на наступній стадії. 1 H-ЯМР (DMSO-D6), (м. ч.): 12,5 (с, NH); 8,5 (с, 1Н); 7,3 (с, 1H); 7,1 (с, 1Н); 4.4 (кв, 2Н); 1,35(т, 3Н). 2.3. Етил-5-фтор-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-с]піридин-2-карбоксилат До розчину 0,4 г (1,92 ммоль) продукту, одержаного на стадії 2.2, у 20 мл безводного тетрагідрофурану, що підтримується в інертній атмосфері, додають послідовно, при перемішуванні, 0,37 г (2,88 ммоль) 3-фторбензилового спирту, потім 0,76 г (2,88 ммоль) трифенілфосфіну. Після цього додають, по краплях і при температурі 0°С, 0,52 г (2,88 ммоль) діетилазодикарбоксилату. Реакційну суміш потім перемішують протягом 20 годин при кімнатній температурі, після чого концентрують при зниженому тиску. Одержане масло очищають хроматографією на колонці з силікагелем, елююючи сумішшю н-пентану і діетилового ефіру. Виділяють 0,49 г (1,55 ммоль) продукту, що використовується таким, який є, на наступній стадії. 1 Н-ЯМР (DMSO-D6), (м. ч.): 8,7 (с, 1Н); 8,5-7,1 (м, 6Н); 5,9 (с, 2Н); 4,3 (кв, 2Н); 1,25 (т, 3Н). 2.4. N-(1-Метил-1H-бензтідазол-5-іл)-5-фтор-1[(3-фторфеніл)метил]-1H-піроло[2,3-с]піридин-2карбоксамід (сполука 2) У тригорлу колбу місткістю 100 мл, охолоджену до температури 0°С і забезпечену перемішу 93881 26 ванням магнітною мішалкою, вводять, у потоці азоту, 0,3 г (2,05 ммоль) 5-аміно-1метилбензімідазолу і 10 мл безводного толуолу. До цього розчину потім повільно додають 1,58 мл (3,16 ммоль) 2М розчину триметилалюмінію в толуолі. Одержану реакційну суміш витримують в атмосфері азоту і перемішують при поступовому досягненні температури 70°С. Тоді додають, по краплях, протягом 5 хвилин, за допомогою краплинної лійки, розчин 0,5 г (1,58 ммоль) продукту, одержаного на стадії 2.3, у 10 мл безводного толуолу. Реакційну суміш після цього кип'ятять зі зворотним холодильником протягом 2 годин. До охолодженого до температури 0°С розчину потім додають 10 мл 1н соляної кислоти і 20 мл суміші води з льодом. Після перемішування протягом 1 години при кімнатній температурі, осад, що утворився, відфільтровують, промивають його водою, висушують його при зниженому тиску і перекристалізовують його з ізопропанолу. Одержують очікуваний продукт у вигляді твердої речовини жовтого кольору. Температура плавлення: 279-281°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,6 (с, 1Н); 8,65 (с, 1H); 8,15 (с, 1H); 8,05 (с, 1Н); 7,65 (м, 2Н); 7,35 (м, 3Н); 6,99 (м, 3Н); 5,9 (с, 2Н); 3,9 (с, 3Н). Приклад 3 (сполука №3) N-(1,2-Диметил-1H-бензімідазол-5-іл)-5-хлор1-[(3-фторфеніл)метил]-1H-піроло[2,3-с]піридин-2карбоксамід 3.1. Етил-3-(2-хлор-5-нітропіридин-4-іл)-2оксопропіонат У тригорлу колбу місткістю 100 мл, оснащену магнітною мішалкою, що продувається азотом, вводять 1г (5,79 ммоль) 2-хлор-4-метил-5нітропіридину і 4,23 г (28,94 ммоль) етилоксалату. Потім до реакційного середовища, що перемішується при кімнатній температурі додають 0,96 мл (6,4 ммоль) 1,8-діазабіцикло[5,4,0]ундец-7-ену. Реакційну суміш після цього перемішують при кімнатній температурі протягом 1 години, потім розводять сумішшю етилацетату (40 мл), води (30 мл) та оцтової кислоти (1 мл). Суміш екстрагують два рази етилацетатом. Об'єднані органічні фази промивають за допомогою 100 мл води, 100 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем, елююючи сумішшю гептану та етилацетату. Таким чином одержують 1,33 г (4,87 ммоль) очікуваного продукту у вигляді порошку рожевого кольору. 3.2. Етил-5-хлор-1Н-піроло[2,3-с]піридин-2карбоксилат До розчину 1,5 г (5,5 ммоль) продукту, одержаного на стадії 3.1, у 50 мл етанолу і 25 мл тетрагідрофурану, додають за один раз 25 мл водного насиченого розчину хлориду амонію і 0,92 г (16,5 ммоль) порошкоподібного заліза. Реакційну суміш потім перемішують при кип'ятінні зі зворотним холодильником протягом З годин. Охолоджений розчин фільтрують через целіт, фільтрат екстрагують етилацетатом, об'єднані органічні фази промивають за допомогою 100 мл водного насиченого розчину хлориду натрію, потім сушать над 27 сульфатом натрію, відфільтровують і випарюють при зниженому тиску. Продукт очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю н-гептану та етилацетату. Одержують 0,98 г (4,36 ммоль) очікуваного продукту у вигляді порошку білого кольору. 1 Н-ЯМР (CDCІ3), (м. ч.): 9,25 (с, NH); 8,75 (с, 1H); 7,70 (с, 1Н); 7,2 (д, 1Н); 4,5 (кв, 2Н); 1,4 (т, 3Н). 3.3. Етил-5-хлор-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-с]піридин-2-карбоксилат До розчину 0,25 г (1,11 ммоль) продукту, одержаного на стадії 3.2, у 10 мл безводного тетрагідрофурану, що підтримується в інертній атмосфері, додають послідовно, при перемішуванні, 0,21 г (1,67 ммоль) 3-фторбензилового спирту, потім 0,44 г (1,67 ммоль) трифенілфосфіну. Додають, по краплях і при температурі 0°С, 0,3 г (1,67 ммоль) діетилазодикарбоксилату. Реакційну суміш потім перемішують протягом 20 годин при кімнатній температурі, після чого концентрують при зниженому тиску. Одержане масло очищають хроматографією на колонці з силікагелем, елююючи сумішшю нгептану та етилацетату (50:50). Виділяють 0,32 г (0,96 ммоль) очікуваного продукту у вигляді порошку білого кольору. 1 Н-ЯМР (DMSO-D6), (м. ч.): 8,9 (с, 1H); 7,9 (с, 1H); 7,3 (с, 1Н); 7,25 (м, 1H); 7,1 (м, 1Н); 6,9 (м, 2Н); 5,9 (с, 2Н); 4,3 (кв, 2Н); 1,3 (т, 3Н). 3.4. 5-Хлор-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-с]піридин-2-карбонова кислота До розчину 0,3 г (0,9 ммоль) продукту, одержаного на стадії 3.3, у 10 мл етанолу додають 0,6 мл (1,17 ммоль) 2н розчину гідроксиду натрію. Реакційну суміш кип'ятять зі зворотним холодильником протягом 2 годин, потім концентрують досуха при зниженому тиску. Одержану тверду речовину розчиняють у 15 мл води. При температурі 0°С розчин підкисляють до значення рН=3 шляхом додавання оцтової кислоти і суміш перемішують протягом 30 хвилин. Осад, що випав, відфільтровують, промивають декілька разів водою, після чого висушують при зниженому тиску. Одержують 0,25 г (0,82 ммоль) очікуваного продукту у вигляді порошку білого кольору. 1 Н-ЯМР (DMSO-D6), (м. ч.): 8,9 (с, 1Н); 7,9 (с, 1Н); 7,3 (с, 1Н); 7,25 (м, 1Н); 7,1 (м, 1Н); 6,9 (м, 2Н); 5,9 (с, 2Н). 3.5. N-(1,2-Диметил-1H-бензімідазол-5-іл)-5хлор-1-[(3-фторфеніл)метил]-1H-піроло[2,3с]піридин-2-карбоксамід До розчину 0,25 г (0,82 ммоль) продукту, одержаного на стадії 3.4, у 20 мл безводного дихлорметану послідовно додають 0,43 г (0,82 ммоль) [(бензотриазол-1іл)окси][трис(піролідино)]фосфонійгексафторфосф ату, потім 0,17 г (0,98 ммоль) 5-аміно-1,2диметилбензімідазолу. До цього розчину потім по краплях додають 0,45 мл (2,46 ммоль) N,N(діізопропіл)етиламіну. Суміш перемішують протягом 2 годин при кімнатній температурі. Осад рожевого кольору, який утворюється, відфільтровують при використанні фільтра з плавленого пористого скла, промивають декілька разів дихлорметаном, потім висушують при зниженому тиску. Таким чи 93881 28 ном одержують 0,15 г очікуваного продукту у вигляді порошку білого кольору. Температура плавлення: 240-242°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,75 (с, 1Н); 8,85 (с, 1Н); 7,95 (с, 1H); 7,85 (с, 1Н); 7,5 (м, 2Н); 7,3 (м, 2Н); 6,95 (м, 2Н); 5,9 (с, 2Н); 3,75 (с, 3Н); 2,5 (с, 3Н). Приклад 4 (сполука №4) Гідрохлорид (2:1) N-(1,2-диметил-1Hбензімідазол-5-іл)-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-с]піридин-2-карбоксаміду До розчину 0,34 г (2 ммоль) 1,2-диметил-1H бензімідазолу в 20 мл безводного толуолу додають, в атмосфері азоту і при перемішуванні, 1,26 мл (2,51 ммоль) триметилалюмінію (2М розчин у толуолі). Через декілька хвилин додають розчин 0,5 г (1,68 ммоль) етил-1-[(3фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксилату, одержаного відповідно до методики, описаної у разі стадії 1.3. прикладу 1, у 40 мл безводного толуолу. Реакційне середовище кип'ятять зі зворотним холодильником протягом 3 годин. Після повернення до кімнатної температури, його виливають у суміш дихлорметану і води. Після видалення нерозчинної частини та екстракції водної фази дихлорметаном, об'єднані органічні фази промивають, сушать і концентрують при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Одержують 0,52 г (1,26 ммоль) очікуваного продукту. Температура плавлення: 255-257°С Відповідний гідрохлорид одержують шляхом введення у взаємодію 0,5 г (1,21 ммоль) продукту у формі основи, одержаного вище, у вигляді розчину в 30 мл суміші дихлорметану і метанолу (9:1) із 0,7 мл 4н розчину хлороводню в діоксані. Одержану сіль перекристалізовують із суміші етанолу і води (95:5). Одержують 0,27 г (0,55 ммоль) очікуваного продукту. Температура плавлення: 309-310°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 11,5 (с, NH); 9,6 (с, 1Н); 8,4-8,5 (с, 1Н); 8,3 (с, 2Н); 7,9 (м, 3Н); 7,4 (м, 2Н); 7,4 (д, 1H); 7,1 (м, 2Н); 6,1 (с, 2Н); 3,9 (с, 3Н), 2,9 (с, 3Н). Приклад 5 (сполука №8) N-(1-Метип-1Н-індол-5-іл)-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксамід 5.1. 2-(Бутилоксикарбоніламіно)-3метилпіридин У тригорлу колбу місткістю 500 мл, оснащену магнітною мішалкою, вводять 31 г (142,03 ммоль) ди-трет-бутилдикарбонату і 35 мл гексану, який доводять до температури кипіння зі зворотним холодильником. Тоді додають по краплях протягом періоду часу 2 години розчин 10 г (88,77 ммоль) 2-аміно-3-метилпіридину в 10 мл етилацетату. Кип'ятіння зі зворотним холодильником підтримують протягом 1 години після закінчення додавання. Після повернення до кімнатної температури, додають 20 мл гексану і осад білого кольору, що утворився після перемішування реакційної суміші, відділяють шляхом фільтрації, промивають гексаном і висушують при зниженому 29 тиску. Одержують 15,5 г (74,43 ммоль) кристалів білого кольору. 1 Н-ЯМР (CDCl3), (м. ч.): 8,3 (дд, 1H); 7,5 (дд, 1H); 7,4 (с, NH); 7,1 (ддд, 1Н); 2,3 (с, 3Н); 1,5 (с, 9Н). 5.2. Етил-1H-піроло[2,3-b]піридин-2карбоксилат У тригорлу колбу місткістю 250 мл, оснащену магнітною мішалкою і в якій підтримують атмосферу азоту, вводять 5 г (24,01 ммоль) продукту, одержаного на стадії 5.1, і 50 мл безводного тетрагідрофурану. Додають, по краплях і при підтримуванні температури нижче за 5°С, 30 мл (48,02 ммоль) 1,6М розчину бутиллітію в тетрагідрофурані. Після перемішування протягом 1 години при температурі 0°С, таким чином одержану літійорганічну похідну додають до розчину 7,08 г (48,02 ммоль) діетилоксалату в 50 мл безводного тетрагідрофурану, що підтримується при температурі -3°С. Потім реакційне середовище залишають стояти до підвищення температури до кімнатної. Після цього середовище виливають у розчин 25 мл 6н соляної кислоти, охолоджений до температури 0°С, підтримуючи температуру нижче за 10°С. Одержану суміш потім перемішують при температурі 50°С протягом 2 годин, потім при кімнатній температурі протягом ночі. Реакційне середовище доводять до рН=3 за допомогою гідроксиду натрію і екстрагують діетиловим ефіром. Органічну фазу сушать над сульфатом натрію, фільтрують її та випарюють її при зниженому тиску. Одержують 1,8 г (9,46 ммоль) продукту, що використовується таким, який є, на наступних стадіях. 1 Н-ЯМР (CDCl3), (м. ч.): 8,8 (дд, 1H); 8,15 (дд, 1H); 7,2 (м, 2Н); 4,5 (кв, 2Н); 1,5(т,3Н). 5.3. Етил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксилат Спосіб А: У тригорлу колбу місткістю 500 мл, оснащену магнітною мішалкою і в якій підтримують атмосферу аргону, вводять 1,64 г (41,01 ммоль) гідриду натрію, попередньо промитого н-пентаном, потім 180 мл безводного диметилформаміду. Додають, порціями, 6 г (31,55 ммоль) продукту, одержаного на стадії 5.2. Потім реакційне середовище витримують протягом 1 години при температурі 50°С. Після цього по краплях додають розчин 7,15 г (37,85 ммоль) 3-фторбензилброміду в 10 мл безводного диметилформаміду. Реакційну суміш потім перемішують при кип'ятінні зі зворотним холодильником протягом 16 годин. Охолоджений розчин розводять у суміші з 200 мл води з льодом і 200 мл етилацетату. Після декантації, водну фазу екстрагують етилацетатом і об'єднані органічні фази промивають послідовно за допомогою 100 мл води і 100 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержане масло очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану і н-гептану. Одержують 5,73 г продукту, який використовують таким, який є, на наступних стадіях. 93881 30 Спосіб В: До розчину 5,2 г (27,34 ммоль) продукту, одержаного на стадії 5.2, у 250 мл безводного тетрагідрофурану, що підтримується в інертній атмосфері, послідовно додають, при перемішуванні, 5,28 г (41 ммоль) 3-фторбензилового спирту, потім 10,87 г (41 ммоль) трифенілфосфіну. Після цього додають, по краплях і при температурі 0°С, 7,36 г (41 ммоль) діетилазодикарбоксилату. Реакційну суміш тоді перемішують протягом 20 годин при кімнатній температурі, потім концентрують при зниженому тиску. Додають суміш пентану і діетилового ефіру та осад видаляють шляхом відфільтровування. Після концентрування при зниженому тиску, одержане масло очищають послідовними хроматографіями на колонці з силікагелем. Виділяють 6,2 г продукту. 1 Н-ЯМР (CDCl3), (м. ч.): 8,6 (дд, 1H); 8,1 (дд, 1H); 7,4 (с, 1Н); 7,2 (м, 2Н); 6,95 (м, 3Н); 6,0 (с, 2Н); 4,4 (кв, 2Н); 1,4 (т, 3Н). 5.4. N-(1-Метил-1H-індол-5-іл)-1-[(3фторфеніл)метил]-1H-піроло(2,3-b]піридин-2карбоксамід При охолодженні, в атмосфері аргону і при перемішуванні магнітною мішалкою, до розчину 1,75 мл (3,50 ммоль) триметил-алюмінію в 5 мл безводного толуолу додають розчин 0,31 г (1,75 ммоль) 5-аміно-1-метиліндолу в 10 мл безводного толуолу. Реакційне середовище витримують при температурі 50°С протягом 2 годин. Потім додають 0,52 г (1,75 ммоль) складного ефіру, одержаного на стадії 5.3, у вигляді розчину в толуолі і протягом 5 годин кип'ятять зі зворотним холодильником. До охолодженого розчину додають етилацетат, суміш води з льодом, потім 1н соляну кислоту. Після декантації, водну фазу екстрагують етилацетатом. Об'єднані органічні фази промивають водою і насиченим розчином хлориду натрію, сушать і концентрують при зниженому тиску. Залишок очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану та етилацетату. Тверду речовину обробляють розчином гідроксиду натрію та етилацетатом, органічну фазу сушать над сульфатом натрію і концентрують її при зниженому тиску. Одержану тверду речовину розтирають на порошок при використанні петролейного ефіру, його відділяють шляхом фільтрації і висушують при зниженому тиску. Одержують 0,56 г очікуваного продукту. Температура плавлення: 191-191,5°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,3 (с, 1H); 8,45 (дд, 1Н); 8,2 (дд, 1H); 7,95 (с, 1Н); 7,35 (м, 3Н); 7,25 (м, 3Н); 6,95 (м, 3Н); 6,4 (д, 1H); 5,95 (с, 2Н); 3,75 (с, 3Н). Приклад 6 (сполука №9) Гідрохлорид (3:2) N-(1-метил-1Н-бензімідазол5-іл)-1-[(3-фторфеніл)метил]-1H-піроло[2,3b]піридин-2-карбоксаміду Виконують за методикою, описаною у разі стадії 5.4. прикладу 5, виходячи з 0,5 г (1,68 ммоль) етил-1-[(3-фторфеніл)метил]-1Нпіроло[2,3-b]піридин-2-карбоксилату, одержаного за методикою, описаною у разі стадії 5.3. прикладу 5, 1,68 мл (3,35 ммоль) 2М розчину триметилалюмінію в толуолі і 0,30 г (2,01 ммоль) 5-аміно-1 31 метилбензімідазолу. Після кип'ятіння зі зворотним холодильником протягом 3 годин і витримування протягом ночі при кімнатній температурі, додають суміш води з льодом і 1н соляну кислоту. Осад відділяють шляхом відфільтровування, промивають його водою і висушують його при зниженому тиску. Одержують 0,42 г (1,05 ммоль) продукту, який обробляють за допомогою 15 мл діетилового ефіру, до якого додають 1,1 мл 2н розчину хлороводню в діетиловому ефірі. Перемішують протягом ночі при кімнатній температурі, тверду речовину відфільтровують, промивають її діетиловим ефіром і висушують її при зниженому тиску. Одержують 0,48 г очікуваного продукту у формі гідрохлориду. Температура плавлення: 171-197°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,85 (с, NH); 9,5 (с, 1Н); 8,45 (м, 2Н); 8,25 (дд, 1H); 7,9 (м, 2Н); 7,6 (с, 1Н); 7,3 (м, 2Н); 6,9 (м, 3Н); 5,9 (с, 2Н); 4,0 (с, 3Н). Приклад 7 (сполука №10) N-(2-Оксо-1,2,3,4-тетрагідрохінолін-7-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксамід В атмосфері аргону і при перемішуванні магнітною мішалкою, до розчину 2,51 мл (5,03 ммоль) триметилалюмінію в 20 мл безводного толуолу додають 0,33 г (2,01 ммоль) 7-аміно-3,4дигідрохінолін-2(1Н)-ону. Реакційну суміш витримують при температурі 50°С протягом 30 хвилин. Потім повільно додають 0,5 г (1,68 ммоль) складного ефіру, одержаного на стадії 5.3 прикладу 5, у вигляді розчину в 5 мл толуолу і кип'ятять зі зворотним холодильником протягом 2 годин. До охолодженого розчину додають воду і розведену соляну кислоту. Осад відділяють шляхом фільтрації, промивають його водою і висушують його при зниженому тиску. Обробляють його дихлорметаном, органічну фазу промивають водою і насиченим розчином хлориду натрію, висушують її та концентрують її при зниженому тиску. Залишок очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану і метанолу. Виділяють 0,48 г (1,16 ммоль) очікуваного продукту. Температура плавлення: 280-282°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,45 (с, NH); 10,1 (с, NH); 8,45 (д, 1H); 8,2 (д, 1Н); 7,4 (м, 2Н); 7,3-6,8 (м, 7Н); 5,9 (с, 2Н); 2,8 (т, 2Н); 2,4 (т, 2Н). Приклад 8 (сполука №11) Гідрохлорид (1:1) N-(хінолін-7-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксаміду 8.1.1-[(3-фторфеніл)метил]-1H-піроло[2,3b]піридин-2-карбонова кислота Кип'ятять зі зворотним холодильником протягом 2 годин розчин 0,6 г (2,01 ммоль) складного ефіру, одержаного на стадії 5.3, і 0,23 г (4,02 ммоль) гідроксиду калію в 60 мл метанолу. Концентрують при зниженому тиску і залишок обробляють водою, яку підкисляють розведеною соляною кислотою. Осад відділяють шляхом фільтрації, промивають його водою і висушують його при зниженому тиску. Одержують 0,37 г продукту, 93881 32 який використовують таким, який є, на наступних стадіях. 8.2. Гідрохлорид (1:1) N-(хінолін-7-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксаміду У колбу місткістю 100 мл, оснащену магнітною мішалкою, вводять 0,37 г (1,37 ммоль) кислоти, одержаної на стадії 8.1, 40 мл дихлорметану і 1 мл (13,69 ммоль) тіонілхлориду. Таким чином одержану суспензію кип'ятять зі зворотним холодильником протягом 2 годин. Після випарювання розчинника при зниженому тиску, додають 50 мл безводного діетилового ефіру, 0,35 г (1,64 ммоль) 7-амінохіноліндигідрохлориду (WO-03/068749) і розчин 0,58 г (5,48 ммоль) карбонату натрію в 5 мл води. Реакційне середовище перемішують протягом ночі, і органічний розчинник випарюють при зниженому тиску. Додають воду, осад відділяють шляхом фільтрації. Одержану тверду речовину обробляють дихлорметаном, органічну фазу промивають водою і насиченим розчином хлориду натрію, сушать її над сульфатом натрію і концентрують її при зниженому тиску. Залишок очищають хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану та етанолу (95:5). Продукт обробляють за допомогою 20 мл діетилового ефіру та 1 мл 2н розчину хлороводню в діетиловому ефірі, потім розчин перемішують протягом ночі. Тверду речовину відділяють шляхом фільтрації, промивають її діетиловим ефіром. Знову промивають її гарячим етанолом. Після повернення до кімнатної температури, її відділяють шляхом фільтрації і висушують її в сушильній шафі при зниженому тиску. Одержують 0,19 г очікуваного продукту. Температура плавлення: 260-262°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 11,2 (с, 1H); 9,15 (д, 1H); 8,9 (м, 2Н); 8,5 (м, 1Н); 8,3 (м, 2Н); 8,15 (м, 1H); 7,85 (м, 1H); 7,65 (с, 1Н); 7,3 (м, 2Н); 6,9 (м, 3Н); 6,0 (с, 2Н). Приклад 9 (сполука №12) N-(1-Метил-1Н-індол-5-іл)-1-(фенілметил)-1Нпіроло[2,3-b]-піридин-2-карбоксамід Спочатку одержують етил-1-(фенілметил)-1Нпіроло[2,3-b]піридин-2-карбоксилат за методикою, описаною в прикладі 5.3В, виходячи з продукту, одержаного згідно з прикладом 5.2, і бензилового спирту. Потім виконують за методикою, описаною у разі стадії 5.4. прикладу 5, виходячи з етил-1(фенілметил)-1Н-піроло[2,3-b]піридин-2карбоксилату (1 екв.), 2М розчину триметилалюмінію в толуолі (1,5екв.) і 5-аміно-1-метиліндолу (1,2екв.). Сирий продукт реакції очищають шляхом хроматографії на колонці з силікагелем. Температура плавлення: 181-182°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,3 (1Н, NH); 8,45 (д, 1Н); 8,2 (д, 1H); 7,95 (с, 1H); 7,4-7,05 (м, 10Н); 6,4 (д, 1Н); 5,95 (с, 2Н), 3,8 (с, 3Н). Приклад 10 (сполука №13) N-(1-Метил-1H-індол-5-іл)-1-(фенілетил)-1Нпіроло[2,3-b]-піридин-2-карбоксамід Спочатку одержують етил-1-(фенілетил)-1Hпіроло[2,3-b]піридин-2-карбоксилат за методикою, описаною в прикладі 5.3В, виходячи з продукту, одержаного згідно з прикладом 5.2, і 2 33 фенілетанолу. Потім виконують за методикою, описаною у разі стадії 5.4. прикладу 5, виходячи з етил-1-(фенілетил)-1Н-піроло[2,3-b]піридин-2карбоксилату (1екв.), 2М розчину триметилалюмінію в толуолі (1,5екв.) і 5-аміно-1-метиліндолу (1,2екв.). Сирий продукт реакції очищають шляхом хроматографії на колонці з силікагелем. Температура плавлення: 196-199°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,25 (с, NH); 8,45 (д, 1Н); 8,15 (дд, 1H); 8,0 (с, 1H); 7,5-7,1 (м, 10Н); 6,45 (д, 1Н); 4,9 (т, 2Н); 3,8 (с, 3Н); 3,05 (т, 2Н). Приклад 11 (сполука №14) Гідрохлорид (3:2) N-(2-метилбензотіазол-5-іл)1-[(3-фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксаміду У колбу місткістю 100 мл, охолоджену до температури 0°С та забезпечену перемішуванням магнітною мішалкою, вводять, при продуванні азотом, 1,68 мл (3,35 ммоль) 2М розчину триметилалюмінію в толуолі і 20 мл безводного толуолу. Потім, маленькими порціями, додають 0,33 г (2,01 ммоль) 5-аміно-2-метилбензотіазолу. Реакційну суміш витримують при температурі 50°С протягом 30 хвилин, потім додають, по краплях протягом 5 хвилин, розчин 0,5 г (1,68 ммоль) складного ефіру, одержаного на стадії 5.3, у 20 мл безводного толуолу. Реакційну суміш після цього кип'ятять зі зворотним холодильником протягом 4 годин. До охолодженого до температури 0°С розчину потім додають 50 мл суміші води з льодом і 20 мл етилацетату. Після перемішування протягом 30 хвилин тверду речовину, що утворилася, видаляють шляхом фільтрації, промивають водою і етилацетатом. Після декантації, водну фазу екстрагують етилацетатом і об'єднані органічні фази промивають послідовно водою і водним насиченим розчином хлориду натрію, сушать над сульфатом натрію, після чого концентрують при зниженому тиску. Одержану тверду речовину очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану та етилацетату. Відповідний гідрохлорид одержують шляхом обробки розчином хлороводню в діетиловому ефірі. Виділяють 0,475 г очікуваного продукту. Температура плавлення: 211-212°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,65 (с, 1H); 8,5 (дд, 1Н); 8,4 (д, 1H); 8,2 (дд, 1Н); 7,95 (д, 1Н); 7,75 (дд, 1H); 7,5 (с, 1Н); 7,3 (м, 2Н); 6,9 (м, 3Н); 5,9 (с, 2Н); 2,8 (с, 3Н). Приклад 12 (сполука №15) N-(1-Метт-1H-бензімідазол-5-іл)-5-фтор-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксамід 12.1. 2-Аміно-3-йод-5-фторпіридин У двогорлу колбу місткістю 500 мл, оснащену магнітною мішалкою, вводять 5 г (44,6 ммоль) 2аміно-5-фторпіридину, 13,9 г (44,6 ммоль) сульфату срібла і 400 мл етанолу. Потім маленькими порціями додають 11,31 г (44,6 ммоль) порошкоподібного йоду. Перемішування продовжують при кімнатній температурі протягом 24 годин. Одержану суспензію жовтого кольору фільтрують, осад промивають етанолом і фільтрат концентрують 93881 34 при зниженому тиску. Таким чином одержаний залишок обробляють сумішшю етилацетату (200 мл) і розчину карбонату натрію (200 мл). Після розділення, органічну фазу промивають послідовно 25% водним розчином тіосульфату натрію, насиченим водним розчином хлориду натрію, потім сушать над сульфатом натрію і концентрують при зниженому тиску. Одержану тверду речовину очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю н-гептану та етилацетату. Одержують 2,67 г (11,22 ммоль) очікуваного продукту. 1 Н-ЯМР (DMSO-D6), (м. ч.): 7,95 (с, 1H); 7,85 (с, 1Н); 5,9 (с, NH2). 12.2. 5-фтор-1H-піроло[2,3-b]піридин-2карбонова кислота У запаювану пробірку місткістю 25 мл, оснащену магнітною мішалкою, що продувається аргоном, вводять 0,5 г (2,10 ммоль) 2-аміно-3-йод-5фторпіридину, одержаного на стадії 12.1, 0,55 г (6,3 ммоль) пірувінової кислоти, 0,71 г (6,3 ммоль) 1,4-діазабіцикло[2,2,2]октану (DABCO) і 15 мл безводного диметилформаміду. Через декілька хвилин додають 0,05 г (0,22 ммоль) ацетату паладію. Реакційну суміш витримують при перемішуванні і при пропусканні аргону протягом 20 хвилин, потім швидко запаюють і витримують при температурі 100°С протягом 2 годин 30 хвилин. Охолоджений розчин концентрують досуха при зниженому тиску. Залишок потім обробляють етилацетатом (100 мл) і водою (75 мл). Органічну фазу промивають водою, потім екстрагують два рази по 50 мл 2н водного розчину гідроксиду натрію. Лужні водні фази об'єднують, охолоджують до температури 0°С, після чого підкисляють шляхом додавання соляної кислоти (рН=3). Середовище екстрагують етилацетатом (4 рази по 50 мл), об'єднані органічні фази сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержують 0,158 г (0,88 ммоль) очікуваного продукту у вигляді порошку жовтого кольору. 1 Н-ЯМР (DMSO-D6), (м. ч.): 13,2 (с, 1H); 12,4 (с, 1H); 8,4 (д, 1H); 7,95 (дд, 1Н); 7,1(д, 1H). 12.3. Етил-5-фтор-1H-піроло[2,3-b]піридин-2карбоксилат У колбу місткістю 100 мл, оснащену магнітною мішалкою, вводять 0,2 г (1,11 ммоль) кислоти, одержаної на стадії 12.2, і 10 мл етанолу. Додають 1 мл концентрованої сірчаної кислоти до суміші, яку потім кип'ятять зі зворотним холодильником протягом 18 годин. Охолоджений розчин концентрують досуха при зниженому тиску. Залишок обробляють етилацетатом (50 мл), який промивають послідовно 1н водним розчином гідроксиду натрію (2 рази по 10 мл), водою (10 мл), потім водним насиченим розчином хлориду натрію. Органічну фазу сушать над сульфатом натрію, потім концентрують її при зниженому тиску. Виділяють 0,21 г очікуваного продукту. 1 Н-ЯМР (DMSO-D6), (м. ч.): 12,6 (с, NH); 8,4 (д, 1Н); 8,0 (дд, 1Н); 7,1 (д, 1Н); 4,35 (кв, 2Н); 1,35 (т, 3Н). 12.4. Етил-5-фтор-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксилат 35 До розчину 0,2 г (0,96 ммоль) продукту, одержаного на стадії 12.3, у 15 мл безводного тетрагідрофурану, що підтримується в інертній атмосфері, послідовно додають, при перемішуванні, 0,18 г (1,44 ммоль) 3-фторбензилового спирту, потім 0,39 г (1,44 ммоль) трифенілфосфіну. Після цього, по краплях і при температурі 0°С, додають 0,26 г (1,44 ммоль) діетилазодикарбоксилату. Реакційну суміш потім перемішують протягом 20 годин при кімнатній температурі, потім концентрують при зниженому тиску. Одержане масло очищають хроматографією на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Виділяють 0,26 г (0,82 ммоль) очікуваного продукту. 12.5. N-(1-Метил-1Н-бензімідазол-5-іл)-5-фтор1-[(3-фторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксамід У тригорлу колбу місткістю 100 мл, охолоджену до температури 0°С та забезпечену перемішуванням магнітною мішалкою, вводять, при продуванні азотом, 0,18 г (1,23 ммоль) 5-аміно-1метилбензімідазолу і 10 мл безводного толуолу. До цього розчину потім повільно додають 0,95 мл (1,90 ммоль) 2М розчину триметилалюмінію в толуолі. Одержану реакційну суміш витримують в атмосфері азоту і перемішують при поступовому досягненні температури 70°С. Тоді додають, по краплях і протягом 5 хвилин, за допомогою краплинної лійки, розчин 0,3 г (0,95 ммоль) продукту, одержаного на стадії 12.4, у 10 мл безводного толуолу. Реакційну суміш після цього кип'ятять зі зворотним холодильником протягом 5 годин, потім перемішують при кімнатній температурі протягом ночі. До охолодженого до температури 0°С розчину після цього додають 20 мл холодної води з подальшим додаванням 10 мл 1н соляної кислоти. Після перемішування протягом 1 години, осад відділяють шляхом фільтрації, промивають його водою і висушують його при зниженому тиску. Одержують 0,22 г (0,53 ммоль) очікуваного продукту у вигляді твердої речовини білого кольору. Температура плавлення: 266-268°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 9,5 (с, 1H); 8,5 (с, 1H); 7,9 (с, 2Н); 7,5 (м, 3Н); 7,3-6,8 (м, 5Н); 5,9 (с, 2Н); 3,95 (с, 3Н). Приклад 13 (сполука №16) N-(1,2-Диметил-1Н-бензімідазол-5-іл)-5трифторметил-1-[(3-фторфеніл)метил]-1Нпіроло[2,3-b]піридин-2-карбоксамід 13.1. 2-Аміно-3-йод-5-(трифторметил)піридин У двогорлу колбу місткістю 500 мл, оснащену магнітною мішалкою, вводять 2 г (12,34 ммоль) 2аміно-5-трифторметилпіридину, 3,85 г (12,34 ммоль) сульфату срібла і 80 мл етанолу. Потім до реакційного середовища, що перемішується при кімнатній температурі, маленькими порціями додають 3,13 г (12,34 ммоль) порошкоподібного йоду. Після цього реакційну суміш перемішують при кімнатній температурі протягом 48 годин. Одержану суспензію жовтого кольору фільтрують, осад промивають етанолом і фільтрат випарюють при зниженому тиску. Таким чином, одержаний залишок обробляють дихлорметаном (200 мл). Органічну фазу промивають послідовно 5% водним розчином гідроксиду натрію, водою, 93881 36 потім насиченим водним розчином хлориду натрію. Сушать її над сульфатом натрію і концентрують її при зниженому тиску. Одержану тверду речовину очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю н-гептану та етилацетату. Одержують 1,71 г (5,94 ммоль) продукту у вигляді порошку рожевого кольору. 1H-ЯМР (DMSO-D6), (м. ч.): 8,3 (с, 1Н); 8,1 (с, 1H); 6,8 (с, NH2). 13.2. 5-трифторметил-1H-піроло[2,3-b]піридин2-карбонова кислота У запаювану пробірку місткістю 25 мл, оснащену магнітною мішалкою, яка продувається аргоном, вводять 2 г (6,94 ммоль) продукту, одержаного на стадії 13.1, 1,51 г (20,83 ммоль) пірувінової кислоти, 2,41 г (20,83 ммоль) 1,4діазабіцикло[2,2,2]октану (DABCO) і 20 мл безводного диметилформаміду. Через декілька хвилин додають 2 г (8,91 ммоль) ацетату паладію. Реакційну суміш витримують при перемішуванні і при пропусканні аргону протягом 20 хвилин, потім швидко запаюють і витримують при температурі 110°С протягом 6 годин. Охолоджений розчин концентрують досуха при зниженому тиску. Залишок потім обробляють етилацетатом і водою. Після декантації, органічну фазу екстрагують два рази по 50 мл 2н водного розчину гідроксиду натрію. Лужні водні фази об'єднують, охолоджують до температури 0°С, після чого підкисляють шляхом додавання соляної кислоти (рН=3). Водну фазу екстрагують етилацетатом (4 рази по 50 мл), об'єднані органічні фази сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержують 0,67 г (2,91 ммоль) очікуваного продукту у вигляді порошку жовтого кольору, який використовують таким, який є, на наступних стадіях. 1 Н-ЯМР (DMSO-D6), (м. ч.): 12,8 (с, 1H); 8,7 (д, 1H); 8,5 (д, 1H); 7,2 (с, 1H). 13.3. Етил-5-трифторметил-1Н-піроло[2,3b]піридин-2-карбоксилат У колбу місткістю 100 мл, оснащену магнітною мішалкою, вводять 0,3 г (1,3 ммоль) кислоти, одержаної на стадії 13.2, і 50 мл етанолу. До цього розчину додають 0,5 мл концентрованої сірчаної кислоти. Реакційну суміш потім кип'ятять зі зворотним холодильником протягом 18 годин. Охолоджений розчин концентрують досуха при зниженому тиску. Залишок обробляють дихлорметаном (100 мл), органічну фазу промивають послідовно 1н водним розчином гідроксиду натрію (30 мл), водою (20 мл), потім водним насиченим розчином хлориду натрію. Сушать її над сульфатом натрію, потім концентрують її при зниженому тиску. Виділяють 0,29 г (1,12 ммоль) очікуваного продукту у вигляді порошку жовтого кольору. 1 Н-ЯМР (DMSO-D6), (м. ч.): 12,95 (с, NH); 8,8 (д, 1H); 7,3 (с, 1Н); 4,4 (кв, 2Н); 1,35 (т, 3Н). 13.4. Етил-5-трифторметил-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксилат До розчину 0,3 г (1,16 ммоль) продукту, одержаного на стадії 13.3, у 20 мл безводного тетрагідрофурану, що підтримується в інертній атмосфері, послідовно додають, при перемішуванні, 0,23 г (1,74 ммоль) 3-фторбензилового спирту, потім 37 0,46 г (1,74 ммоль) трифенілфосфіну. Після цього, по краплях, додають 0,31 г (1,74 ммоль) діетилазодикарбоксилату. Реакційну суміш потім перемішують протягом 20 годин при кімнатній температурі, потім концентрують при зниженому тиску. Одержане масло очищають хроматографією на колонці з силікагелем, елююючи сумішшю гептану та етилацетату. Виділяють 0,34 г (0,93 ммоль) очікуваного продукту. 1 Н-ЯМР (DMSO-D6), (м. ч.): 8,9 (д, 1H); 8,7 (д, 1H); 7,5 (с, 1H); 7,4-6,95 (м, 2Н); 6,85 (м, 2Н); 5,9 (с, 2Н); 4,3 (кв, 2Н); 1,3 (т, 3Н). 13.5. N-(1,2-Диметил-1H-бензімідазол-5-іл)-5трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксамід У тригорлу колбу місткістю 100 мл, охолоджену до температури 0°С і забезпечену перемішуванням магнітною мішалкою, вводять, при продуванні азотом, 0,17 г (1 ммоль) 5-аміно-1,2диметилбензімідазолу і 10 мл безводного толуолу. До цього розчину потім повільно додають 0,77 мл (1,54 ммоль) 2М розчину триметилалюмінію в толуолі. Одержану реакційну суміш витримують в атмосфері азоту і перемішують при поступовому досягненні температури 70°С. При цій температурі додають, по краплях і протягом 5 хвилин, розчин 0,3 г (0,77 ммоль) продукту, одержаного на стадії 13.4, у 10 мл безводного толуолу. Реакційну суміш після цього кип'ятять зі зворотним холодильником протягом 4 годин. До охолодженого до температури 0°С розчину потім додають 20 мл холодної води. Після перемішування протягом 90 хвилин, осад, який утворюється, екстрагують три рази етилацетатом (350 мл) і об'єднані органічні фази промивають послідовно за допомогою 20 мл водного насиченого розчину гідрокарбонату натрію, 40 мл води і 20 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержану тверду речовину очищають хроматографією на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану і метанолу. Одержану тверду речовину перекристалізовують із суміші ізопропанолу та етанолу (9:1), одержуючи 0,23 г (0,48 ммоль) очікуваного продукту у вигляді кристалів білого кольору. Температура плавлення: 263-265°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 11 (с, 1H); 8,85 (с, 1Н); 8,75 (с, 1H); 8,3 (с, 1Н); 7,9 (м, 2Н); 7,7 (с, 1Н); 7,3 (м, 1H); 6,95 (м, 3Н); 5,95 (с, 2Н); 3,9 (с, 3Н); 2,8 (с, 3Н). Приклад 14 (сполука №18) N-(2-Метил-1Н-бензотіазол-5-іл)-5трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксамід Виконують за методикою, описаною у разі стадії 13.5 прикладу 13, виходячи з 0,35 г (0,96 ммоль) етил-5-трифторметил-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксилату (приклад 13.4) і 0,17 г (1,06 ммоль)5аміно-2-метилбензотіазолу. Виділяють 0,34 г очікуваної сполуки. Температура плавлення: 204-206°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,78 (с, 1H); 8,8 (с, 1Н); 8,7 (с, 1H); 8,31 (с, 1Н); 7,97 (д, 1Н); 7,71 (д, 93881 38 1H); 7,6 (с, 1Н); 7,28 (м, 1H); 6,95 (м, 3Н); 5,95 (д, 2Н); 2,8 (с, 3Н). Приклад 15 (сполука №19) N-(1,2-Диметил-1H-бензімідазол-5-іл)-1-[(3фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2карбоксамід Виконують, за методикою, описаною в прикладі 11, виходячи з 0,4 г (1,34 ммоль) етил-1-[(Зфторфеніл)метил]-1H-піроло[2,3-b]піридин-2карбоксилату (приклад 5.3) і 0,25 г (1,61 ммоль) 5аміно-1,2-диметилбензімідазолу. Виділяють 0,477 г очікуваної сполуки. Температура плавлення: 242-244°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 2,49 (с, 3Н); 3,69 (с, 3Н); 5,91 (с, 2Н); 6,94 (м, 3Н); 7,22 (м, 2Н); 7,39 (м, 3Н); 7,79 (с, 1H); 8,19 (дд, 1Н); 8,41 (д, 1H); 10,31 (с, 1Н). Приклад 16 (сполука №6) N-(1,2-Диметил-1Н-бензімідазол-5-іл)-5-фтор1-[(3-фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід Виконують за методикою, описаною у разі стадії 2.4 прикладу 2, виходячи з 0,3 г (0,95 ммоль) етил-5-фтор-1-[(3-фторфеніл)метил]-1Нпіроло[2,3-с]піридин-2-карбоксилату (приклад 2.3) і 0,183 г (1,14 ммоль) 5-аміно-1,2диметилбензімідазолу. Виділяють 0,21 г очікуваної сполуки. Температура плавлення: 245-247°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,59 (с, 1H); 8,62 (с, 1Н); 7,91 (с, 1Н); 7,4 (м, 5Н); 7,01 (м, 3Н); 5,91 (с, 2Н); 3,71 (с, 3Н); 2,49 (с, 3Н). Приклад 17 (сполука №5) N-(2-Метил-1H-бензотіазол-5-іл)-5-фтор-1-[(3фторфеніл)метил]-1Н-піроло[2,3-с]піридин-2карбоксамід Виконують за методикою, описаною у разі стадії 2.4 прикладу 2, виходячи з 0,3 г (0,95 ммоль) етил-5-фтор-1-[(3-фторфеніл)метил]-1Нпіроло[2,3-с]піридин-2-карбоксилату (приклад 2.3) і 0,189 мг (1,14 ммоль) 5-аміно-2метилбензотіазолу. Виділяють 0,36 г очікуваної сполуки. Температура плавлення: 193-195°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,87 (с, 1H); 8,68 (с, 1Н); 8,32 (с, 1Н); 7,98 (д, 1H); 7,71 (д, 1Н); 7,35 (м, 3Н); 6,99 (м, 3Н); 5,9 (с, 2Н); 2,79 (с, 3Н). Приклад 18 (сполука №7) N-(1,2-Диметт-1Н-бензімідазол-5-іл)-5-феніл-1[(3-фторфеніл)метил]-1H-піроло[2,3-с]піридин-2карбоксамід 18.1. 4-Метил-5-нітро-2-фенілпіридин Протягом 12 годин кип'ятять зі зворотним холодильником суміш 2 г (11,59 ммоль) 2-хлор-4метил-5-нітропіридину, 1,41 г (11,59 ммоль) фенілборонової кислоти, 1,33 г (1,16 ммоль) тетракис(трифенілфосфін)паладію і 4 г (28,97 ммоль) карбонату калію у вигляді суспензії в 50 мл дегазованого діоксану. Суміш потім охолоджують, розводять за допомогою 50 мл етилацетату, послідовно промивають два рази по 20 мл води, потім за допомогою 20 мл насиченого розчину хлориду натрію, сушать над сульфатом натрію, фільтрують, потім концентрують при зниженому тиску. Одержаний залишок очищають хроматографією 39 на колонці з діоксидом кремнію (елюенти: гептан етилацетат), потім перекристалізовують з суміші ізопропанолу і діізопропілового ефіру. Таким чином, одержують 2,19 г твердої речовини жовтого кольору, яку використовують такою, яка є, при продовженні синтезу. 18.2. Етил-3-(5-нітро-2-фенілпіридин-4-іл)-2оксопропіонат При кімнатній температурі протягом 4 годин перемішують суміш з 1,3 г (6,07 ммоль) 4-метил-3нітро-2-фенілпіридину, одержаного на стадії 18.1, і 1,01 г (6,68 ммоль) 1,8-діазабіцикло[5,4,0]ундец-7ену в 4,14 мл діетилоксалату. Через цей час, суміш розводять за допомогою 30 мл етилацетату, 20 мл води і 2 мл оцтової кислоти. Одержаний розчин екстрагують два рази по 50 мл етилацетату. Об'єднані органічні фази промивають послідовно два рази по 20 мл води, потім за допомогою 20 мл насиченого розчину хлориду натрію, сушать над сульфатом натрію, фільтрують, потім концентрують при зниженому тиску. Одержаний залишок очищають хроматографією на колонці з діоксидом кремнію (елюенти: гептан - етилацетат). Таким чином, одержують 1,46 г очікуваного продукту у вигляді твердої речовини білого кольору. 18.3. Етил-5-феніл-1H-піроло[2,3-с]піридин-2карбоксилат Протягом 3 годин кип'ятять зі зворотним холодильником суміш із 1,3 г (4,3 ммоль) етил-3-(5нітро-2-фенілпіридин-4-іл)-2-оксопропіонату, одержаного на стадії 18.2, і 0,71 г (12,89 ммоль) порошкоподібного заліза в суміші 20 мл насиченого розчину хлориду амонію, 20 мл тетрагідрофурану і 40 мл етанолу. Реакційну суміш потім охолоджують, потім фільтрують через шар целіту. Фільтрат концентрують до третини його об'єму при зниженому тиску, після чого екстрагують три рази по 50 мл етилацетату. Об'єднані органічні фази послідовно промивають два рази по 20 мл води, потім за допомогою 20 мл насиченого розчину хлориду натрію, сушать над сульфатом натрію, фільтрують, після чого концентрують при зниженому тиску. Одержаний залишок очищають хроматографією на колонці з діоксидом кремнію (елюенти: гептан - етилацетат). Таким чином одержують 0,93 г очікуваного продукту у вигляді порошку бежевого кольору. 18.4. Етил-5-феніл-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-с]-піридин-2-карбоксилат До перемішуваного при температурі 0°С і в атмосфері аргону розчину 1 г (3,76 ммоль) етил-5феніл-1Н-піроло[2,3-с]піридин-2-карбоксилату, одержаного на стадії 18.3, у 30 мл безводного тетрагідрофурану послідовно додають 0,72 г (5,63 ммоль) 3-фторбензилового спирту, 1,47 г (5,63 ммоль) трифенілфосфіну, потім 1,01 г (5,63 ммоль) діетилазодикарбоксилату. Суміш потім перемішують протягом 20 годин при температурі 20°С, концентрують при зниженому тиску, потім очищають хроматографією на колонці з діоксидом кремнію (елюенти: гептан - етилацетат). Таким чином, одержують 1,1 г очікуваного продукту у вигляді порошку білого кольору. 93881 40 18.5. N-(1,2-Диметил-1H-бензімідазол-5-іл)-5феніл-1-[(3-фторфеніл)метил]-1H-піроло[2,3с]піридин-2-карбоксамід (сполука №7) У тригорлу колбу місткістю 100 мл, охолоджену до температури 0°С і забезпечену перемішуванням магнітною мішалкою, вводять, при продуванні азотом, 0,217 г (1,35 ммоль) 5-аміно-1,2диметилбензімідазолу і 5 мл безводного толуолу. До цього розчину потім повільно додають 0,84 мл (1,68 ммоль) 2М розчину триметилалюмінію в толуолі. Одержану реакційну суміш витримують в атмосфері азоту і перемішують при поступовому досягненні температури 70°С. При цій температурі додають, по краплях протягом 5 хвилин, розчин 0,42 г (1,12 ммоль) етил-5-феніл-1-[(3фторфеніл)метил]-1Н-піроло[2,3-с]-піридин-2карбоксилату, одержаного на стадії 18.4, у 10 мл безводного толуолу. Реакційну суміш потім кип'ятять зі зворотним холодильником протягом 4 годин. До охолодженого до температури 0°С розчину після цього додають 20 мл холодної води. Після перемішування протягом 90 хвилин, розчин екстрагують три рази етилацетатом (350 мл) і об'єднані органічні фази послідовно промивають за допомогою 20 мл насиченого водного розчину гідрокарбонату натрію, 40 мл води і 20 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержану тверду речовину розтирають на порошок у киплячому діізопропіловому ефірі, потім перекристалізовують із суміші ізопропанолу і метанолу (9:1), одержуючи 0,187 г очікуваного продукту у вигляді порошку бежевого кольору. Температура плавлення: 288-290°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,6 (с, 1Н); 9,08 (с, 1Н); 8,27 (с, 1H); 8,1 (д, 2Н); 7,98 (с, 1Н); 7,41 (м, 7Н); 7,01 (м, 3Н); 5,98 (с, 2Н); 3,71 (с, 3Н); 2,48 (с, 3Н). Приклад 19 (сполука №24) N-(1,2-Диметил-1H-бензімідазол-5-іл)-5трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[3,2-b]піридин-2-карбоксамід 19.1. 3-Аміно-2-йод-6-трифторметилпіридин Додають, декількома порціями, 1,56 г (6,17 ммоль) йоду до перемішуваної в атмосфері аргону при температурі 20°С суміші 1 г (6,17 ммоль) 3-аміно-6-трифторметилпіридину і 1,25 г (6,17 ммоль) сульфату срібла в 40 мл етанолу. Перемішування підтримують протягом 18 годин. Одержану суспензію жовтого кольору відфільтровують і промивають етанолом. Фільтрат концентрують при зниженому тиску, залишок обробляють за допомогою 100 мл дихлорметану. Органічну фазу послідовно промивають за допомогою 20 мл 5% водного розчину гідроксиду натрію і 20 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, концентрують при зниженому тиску, потім очищають хроматографією на колонці з діоксидом кремнію (елюенти: гептан - етилацетат). Таким чином, одержують 1,17 г очікуваного продукту, який використовують таким, який є, при продовженні синтезу. 41 19.2. 5-трифторметилпіроло[3,2-b]піридин-2карбонова кислота В атмосфері аргону, у пробірку, що запаюється, вводять 0,5 г (1,74 ммоль) 3-аміно-2-йод-6трифторметилгаридину, одержаного на стадії 19,1, 0,45 г (5,21 ммоль) пірувінової кислоти, 0,51 мл (5,21 ммоль) 1,4-діазабіцикло[2,2,2]октану і 10 мл безводного диметилформаміду. Розчин дегазують протягом декількох хвилин, потім додають 0,19 г (0,87 ммоль) ацетату паладію, пробірку закривають і кип'ятять зі зворотним холодильником при температурі 130°С протягом 4 годин. Потім охолоджений розчин концентрують при зниженому тиску, і одержаний залишок обробляють за допомогою 100 мл етилацетату. Органічну фазу послідовно промивають два рази по 50 мл 2н водного розчину гідроксиду натрію. Лужні водні фази об'єднують, охолоджують до температури 0°С, підкисляють шляхом додавання соляної кислоти, після чого екстрагують 4 рази по 50 мл етилацетату. Ці органічні фази об'єднують, промивають за допомогою 20 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержують 0,22 г продукту, який використовують таким, який є, на наступній стадії. 19.3. Етил-5-трифторметилпіроло[3,2b]піридин-2-карбоксилат 1 мл (18,71 ммоль) Концентрованої сірчаної кислоти додають до розчину 0,2 г (0,87 ммоль) 5трифторметилпіроло[3,2-b]піридин-2-карбонової кислоти, одержаної на стадії 19.2, у 10 мл етанолу. Перемішують при кип'ятінні зі зворотним холодильником протягом 20 годин, потім охолоджують розчин, який концентрують при зниженому тиску. Одержаний залишок потім обробляють за допомогою 50 мл дихлорметану, потім промивають послідовно за допомогою 20 мл водного насиченого розчину гідрокарбонату натрію, 40 мл води і 20 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержують 0,19 г продукту, який використовують таким, який є, на наступній стадії. 19.4. Етил-1-(3-фторбензил)-5трифторметилпіроло[3,2-b]піридин-2-карбоксилат До розчину 0,2 г (0,77 мл) етил-5трифторметилпіроло[3,2-b]піридин-2карбоксилату, одержаного на стадії 19.3, у 120 мл безводного тетрагідрофурану, що підтримується при температурі 0°С в атмосфері аргону, послідовно додають 0,13 мл (1,16 ммоль) 3фторбензилового спирту, 0,3 г (1,16ммоль) трифенілфосфіну, потім 0,2 г (1,16 ммоль) діетилазодикарбоксилату. Реакційну суміш перемішують протягом 20 годин при температурі 20°С, потім концентрують при зниженому тиску. Одержаний залишок очищають хроматографією на колонці з діоксидом кремнію (елюенти: гептан - етилацетат). Таким чином, одержують 0,21 г очікуваного продукту у вигляді масла жовтого кольору. 93881 42 19.5. N-(1,2-Диметил-1H-бензімідазол-5-іл)-5трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[3,2-b]піридин-2-карбоксамід (сполука №24) У тригорлу колбу місткістю 100 мл, охолоджену до температури 0°С і оснащену перемішуванням магнітною мішалкою, вводять, при продуванні азотом, 0,097 г (0,6 ммоль) 5-аміно-1,2диметилбензімідазолу і 5 мл безводного толуолу. До цього розчину потім повільно додають 0,41 мл (0,59 ммоль) 2М розчину триметилалюмінію в толуолі. Одержану реакційну суміш витримують в атмосфері азоту і перемішують при поступовому досягненні температури 70°С. При цій температурі додають, по краплях протягом 5 хвилин, розчин 0,2 г (0,55 ммоль) етил-1-(3-фторбензил)-5трифторметил-1Н-піроло[3,2-b]піридин-2карбоксилату, одержаного на стадії 19.4, у 10 мл безводного толуолу. Реакційну суміш потім кип'ятять зі зворотним холодильником протягом 18 годин. До охолодженого до температури 0°С розчину після цього додають 20 мл холодної води. Після перемішування протягом 90 хвилин, розчин екстрагують три рази етилацетатом (350 мл) і об'єднані органічні фази послідовно промивають за допомогою 20 мл насиченого водного розчину гідрокарбонату натрію, 40 мл води і 20 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, потім концентрують при зниженому тиску. Одержану тверду речовину розтирають на порошок у киплячому діізопропіловому ефірі, одержуючи, після висушування, 97 мг очікуваного продукту у вигляді порошку ясно-жовтого кольору. Температура плавлення: 249-251°С 1 Н-ЯМР (DMSO-D6), (м. ч.): 10,6 (с, 1H); 8,3 (д, 1H); 7,91 (с, 1H); 7,75 (д, 1H); 7,61 (с, 1Н); 7,49 (м, 2Н); 7,31 (м, 1H); 7,01 (м, 3Н); 5,95 (с, 2Н); 3,72 (с, 3Н); 2,48 (с, 3Н). У нижченаведених таблицях 1 і 2 представлені хімічні структури і фізичні властивості деяких сполук загальної формули (І) згідно з винаходом. У таблиці 1 ілюструються сполуки загальної формули (І), в якій піролопіридинове ядро являє собою можливо заміщений піроло[2,3-с]піридин. У таблиці 2 ілюструються сполуки загальної формули (І), в якій піролопіридинове ядро являє собою можливо заміщений піроло[2,3-b]піридин. У таблиці 3 ілюструються сполука загальної формули (І), в якій піролопіридинове ядро являє собою можливо заміщений піроло[3,2-с]піридин. У таблиці 4 ілюструються сполуки загальної формули (І), в якій піролопіридинове ядро являє собою можливо заміщений піроло[3,2-b]піридин. У цих таблицях: - у стовпчику "Т.пл." зазначаються температури плавлення продуктів у градусах Цельсія (°С); - у стовпчику "Сіль" знак "-" означає сполуку у формі вільної основи, тоді як "НСl" означає сполуку у вигляді гідрохлориду і зазначене в дужках співвідношення означає співвідношення (кислота:основа); - Ph означає фенільну групу. 43 93881 44 Таблиця 1 № 1 2 3 4 5 6 7 X Н 5-F 5-Сl Н 5-F 5-F 5-Ph n 1 1 1 1 1 1 1 Z1, Z2, Z3, Z4, Z5 Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н W 1-метиліндол-5-іл 1-метилбензімідазол-5-іл 1,2-диметилбензімідазол-5-іл 1,2-диметилбензімідазол-5-іл 2-метилбензотіазол-5-іл 1,2-диметилбензімідазол-5-іл 1,2-диметилбензімідазол-5-іл Сіль HCl (2:1) Т.пл. (°С) 213-214,5 279-281 240-242 309-310 193-195 245-247 288-290 Таблиця 2 № 8 9 10 11 12 13 14 15 16 17 18 19 20 21 X H Н Н Н Н Н Н 5-F 5-CF3 5-CF3 5-CF3 Н 5-F Н n 1 1 1 1 1 2 1 1 1 1 1 1 1 0 Z1, Z2, Z3, Z4, Z5 Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, H, Н, Н, Н Н, H, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, H, Н, Н, Н W 1-метиліндол-5-іл 1-метилбензімідазол-5-іл 2-оксо-1,2,3,4-тетрагідрохінолін-7-іл хінолін-7-іл 1-метиліндол-5-іл 1-метиліндол-5-іл 2-метилбензотіазол-5-іл 1-метилбензімідазол-5-іл 1,2-диметилбензімідазол-5-іл 1-метиліндол-5-іл 2-метилбензотіазол-5-іл 1,2-диметилбензімідазол-5-іл 1,2-диметилбензімідазол-5-іл 1,2-диметилбензімідазол-5-іл Сіль HCl (3:2) HCl (1:1) HCl (3:2) Т.пл. (°С) 191-191,5 171-177 280-282 260-262 181-182 196-199 211-212 266-268 263-265 229-231 204-206 242-244 226-228 286-288 45 93881 46 Таблиця 3 № 22 X H n 1 Z1, Z2, Z3, Z4, Z5 Н, F, Н, Н, Н W 1,2-диметилбензімідазол-5-іл Сіль Т.пл. (°С) 263-264 Таблиця 4 № 23 24 25 26 X Н 5-CF3 Н Н n 1 1 1 1 Z1, Z2, Z3, Z4, Z5 Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н Н, F, Н, Н, Н W 1-метилбензімідазол-5-іл 1,2-диметилбензімідазол-5-іл 2-метилбензотіазол-5-іл 1,2-диметилбензімідазол-5-іл Сполуку згідно з винаходом піддавали фармакологічним випробуванням in vitro та in vivo, які виявили, що вони становлять інтерес як терапевтично активні речовини. Тест щодо інгібування струму, що індукується капсаіцином у DRG щура - Первинна культура гангліонарних клітин заднього корінця (DRG) щура: Нейрони DRG звичайно продукують рецептор TRPV1. Первинні культури DRG новонароджених щурів готували з щурів у віці 1 день. Стисло, після препарування, ганглії трипсинували і клітини механічно роздрібнювали шляхом обережного розтирання на порошок. Клітини ресуспендували в базальному культуральному середовищі Ігла, що містить 10% фетальної телячої сироватки, 25 мМ КСl,2 мМ глутаміну, 100 мкг/мл гентаміцину і 50 нг/мл фактора росту нервової тканини, потім вміщували на тонкі скляні пластинки, покриті ламініном (0,25106 клітин на пластинку), які потім Сіль Т.пл. (°С) 277-281 249-251 263-265 245-247 вміщували у 12-ямкові планшети Корнінга. Клітини інкубували при температурі 37°С у вологій атмосфері, що містить 5% СО2 і 95% повітря. Після 48 часів культивування додавали цитозин--Оарабінозид (1 мкМ) для запобігання розвитку не нейронних клітин. Пластинки переносили в експериментальні камери для досліджень фіксації потенціалу після культивування протягом 7-10 діб. - Електрофізіологія: Вимірювальні камери (об'єм 800 мкл), що містять клітинний препарат, вміщували на предметний столик інвертованого мікроскопа (Olympus IMT2), оснащений оптикою Hoffman (Modulation Contrast, Нью-Йорк), і проводили спостереження при 400-кратному збільшенні. Камери безперервно перфузували під силою тяжкості (2,5 мл/хв) за допомогою дозатора розчинів, що має 8 вхідних отворів, і єдиний вихід якого, утворений поліетиленовою трубкою (отвір 500 мкм), розміщували менше, ніж за 3 мм від клітини, яку досліджують. Використали конфігурацію "ціла клітина" за мето 47 дом фіксації потенціалу. Піпетки з боросилікатного скла (опір 5-10 МОм) наближали до клітини завдяки п'єзоелектричному мікроманіпулятору 3D (Burleigh, PC1000). Загальні струми (мембранний потенціал, фіксований при -60 мВ) реєстрували за допомогою підсилювача Axopatch ID (Axon Instruments, Foster city, Каліфорнія), сполученого з персональним комп'ютером (ПК), керованим програмним забезпеченням Pclamp8 (Axon Instrument). Сліди струму реєстрували на папері та одночасно переводили в цифрову форму (частота вибірки 15-25 Гц) і переносили на жорсткий диск ПК. Введення 300 нМ розчину капсаіцину викликає в клітинах DRG (фіксоване при -70 мВ напруження) вхідний катіонний струм. З метою мінімізації десенсибілізації рецепторів, дотримувалися інтервалу мінімум одна хвилина між двома введеннями капсаіцину. Після контрольного періоду (стабілізація відповіді на один капсаіцин), тестовану сполуку вводили індивідуально в заданій концентрації (концентрація 10 нМ або 0,1 нМ) протягом 4-5 хвилин, під час яких здійснювали декілька тестів капсаіцин-сполука (досягнення максимального інгібування). Результати виражали в % інгібування контрольної відповіді на капсаіцин. Відсотки інгібування відповіді на капсаіцин (300 нМ) складали від 20% до 100% для найактивніших сполук згідно з винаходом, які тестують у концентраціях від 10 нМ до 0,1 нМ. Сполуки згідно з винаходом, отже, є ефективними антагоністами in vitro щодо рецепторів типу TRPV1. Тест щодо подразнення рогівки миші Подразнюючий характер капсаіцину легко помітний на рівні рогівки, оскільки цей орган являє собою один із найбільш пронизаних волокнами С. У даному контексті, згідно з попередніми експериментами, нанесення дуже незначної кількості капсаіцину (2 мкл при концентрації 160 мкМ) на поверхню рогівки тварини викликає деяку кількість стереотипних поведінок, пов'язаних із подразненням і які легко реєструвати. З них потрібно назвати: моргання ока, тертя ока, здійснюване передньою гомолатеральною лапою, тертя морди двома передніми лапами, чесання морди задньою гомолатеральною лапою. Тривалість цих поведінок не перевищує 2 хвилини спостереження, і тварина тоді знову повертається до своєї нормальної активності. Її зовнішній вигляд, крім того, також нормальний. Миша не живе в самоті в кутку зі скуйовдженими волосками і не виявляє ніякого симптому страждання, що спостерігається. Можна зробити висновок, що тривалість впливу капсаіцину в цих дозах менше 2 хвилин. Короткий виклад методології: Принципом серії експериментів є визначення, чи можуть сполуки згідно з винаходом впливати на поведінку у відповідь, що викликається даною кількістю капсаіцину. Капсаіцин спочатку розводили до концентрації 25 мМ у ДМСО і, для його кінцевого використання, розводили в 10% Твін 80 у фізіологічній сироватці. З контрольних досліджень випливає, що за цих умов розчинник не надає ніякого ефекту. 93881 48 На практиці, тестований продукт вводили перорально і в термін (час попередньої обробки: і), який залежить від фармакокінетичних даних, тварині закапували в око 2 мкл 160 мкМ розчину капсаіцину, приготованого як зазначено вище. Під час спостереження протягом 2 хвилин після закапування, зареєстрована деяка кількість тертя інстальованого ока гомолатеральною задньою лапою. У разі даної тварини, відсоток захисту розраховували таким чином: Р = 100 ((кількість почісувань, що спостерігаються / середня кількість почісувань обробленої розчинником групи) 100 Цей відсоток захисту усереднювали для кожної групи тварин (n = кількість тварин, що тестують за допомогою сполуки згідно з винаходом). Оцінені відсотки захисту, у разі цієї моделі, для найактивніших сполук згідно з винаходом, що використовуються в дозах 1-10 мг/кг (перорально), складали від 20% до 100% (див. приклад у таблиці 5): Таблиця 5 № сполу% P - (t) при 1 мг/кг (перорально) - (n=10) ки 15 50% - (1 година) Результати цих випробувань показують, що найактивніші сполуки згідно з винаходом блокують ефекти, що індукуються стимуляцією рецепторів TRPV1. Отже, сполуки згідно з винаходом можуть бути використані для одержання лікарських засобів, зокрема, для одержання лікарського засобу, призначеного для профілактики або лікування патологій, в яких беруть участь рецептори типу TRPV1. Таким чином, згідно з іншим із його аспектів, об'єктом винаходу є лікарські засоби, які включають сполуку формули (І) або фармацевтично прийнятну сіль або ще гідрат або сольват вищезгаданої сполуки. Ці лікарські засоби знаходять своє застосування в терапії, зокрема, у профілактиці і/або лікуванні болю і запалення; хронічного, невропатичного (травматичного, діабетичного, метаболічного, інфекційного, токсичного, індукованого протираковим лікуванням або гіатрогенного), (остео)артритного, ревматичного болю; фіброміалгій, болю в спині, пов'язаного з раковим захворюванням болю, невралгії лицьового нерва, головних болів, мігрені, зубного болю, опіку, сонячного удару, укусу або уколу, постгерпетичної невралгії, м'язового болю, нервової (центральної і/або периферичної) компресії, травм спинного мозку і/або головного мозку, ішемії (спинного мозку і/або головного мозку), нейродегенерації, геморагічних васкулярних порушень (спинного мозку і/або головного мозку), болю після інсульту. Сполуки згідно з винаходом можуть бути використані для одержання лікарського засобу, призначеного для профілактики і/або лікування урологічних порушень, таких, як гіперактивність сечового міхура, нестабільність сечового міхура, нетримання, невідкладне сечовипускання, нетримання сечі, 49 93881 цистит, ниркова коліка, тазова гіперчутливість і тазовий біль. Сполуки згідно з винаходом можуть бути використані для одержання лікарського засобу, призначеного для профілактики і/або лікування гінекологічних порушень, як вульводинія, болі, пов'язані з сальпінгітами, дисменореями. Ці продукти також можна використати для одержання лікарського засобу, призначеного для профілактики і/або лікування шлунково-кишкових порушень, таких, як гастроезофагеальний рефлюкс, виразка шлунка, виразка дванадцятипалої кишки, функціональна диспепсія, коліт, IBS, хвороба Крона, панкреатит, езофагіт, печінкова коліка. Сполуки згідно з винаходом також можуть бути використані для одержання лікарського засобу, призначеного для лікування діабету. Продукти згідно з даним винаходом також можуть бути придатними для профілактики і/або лікування респіраторних порушень, таких, як астма, кашель, хронічне обструктивне захворювання легень, бронхоконстрикція і запальні порушення. Ці продукти також можуть бути використані для профілактики і/або лікування псоріазу, свербежу, дермальних іритацій, іритацій очей або слизових оболонок, герпесу, оперізувального лишаю. Сполуки згідно з винаходом також можуть бути використані для одержання лікарського засобу, призначеного для лікування депресії. Відповідно до іншого із його аспектів, даний винахід стосується фармацевтичних композицій, що включають, як діючу речовину, сполуку згідно з винаходом. Ці фармацевтичні композиції містять ефективну дозу принаймні однієї сполуки згідно з винаходом або фармацевтично прийнятної солі, гідрату або сольвату вищезгаданої сполуки, а також принаймні один фармацевтично прийнятний ексципієнт. Вищезгадані ексципієнти вибирають, залежно від фармацевтичної форми і бажаного способу введення, серед звичайних ексципієнтів, які відомі фахівцеві в даній галузі. У фармацевтичних композиціях згідно з даним винаходом для перорального, під'язикового, підшкірного, внутрішньом'язового, внутрішньовенного, топічного, локального, інтратрахеального, інтраназального, черезшкірного або ректального введен Комп’ютерна верстка М. Ломалова 50 ня, діюча речовина вищенаведеної формули (І), або її можлива(ий) сіль, сольват або гідрат, може бути введена в стандартній лікарській формі, у суміші з класичними фармацевтичними ексципієнтами, тваринам і людям для профілактики або лікування порушень або захворювань, зазначених вище. Відповідні стандартні лікарські форми включають форми для перорального шляху введення, такі, як таблетки, м'які і тверді желатинові капсули, порошки, гранули і пероральні розчини або суспензії, форми для під'язикового, букального, інтратрахеального, внутрішньоочного, інтраназального введення, введення шляхом інгаляції, форми для топічного, черезшкірного, підшкірного, внутрішньом'язового або внутрішньовенного введення, форми для ректального введення та імплантати. Для топічного нанесення сполуки згідно з винаходом можна використовувати в кремах, гелях, мазях або лосьйонах. Як приклад, стандартна лікарська форма сполуки згідно з винаходом у вигляді таблетки може включати наступні інгредієнти: сполука згідно з винаходом 50,0 мг маніт 223,75 мг натрієва кроскармелоза 6,0 мг кукурудзяний крохмаль 15,0 мг гідроксипропілметилцелюлоза 2,25 мг стеарат магнію 3,0 мг Вищезазначені унітарні форми дозовані для можливості щоденного введення 0,001-30 мг діючої речовини на кг маси тіла, залежно від галенової форми. Можуть зустрічатися особливі випадки, де застосовні вищі або більш незначні дози; такі дози не входять у рамки винаходу. Згідно зі звичайною практикою, дозу, яка відповідає кожному пацієнту, визначає лікар залежно від способу введення, маси тіла і реакції у відповідь вищезазначеного пацієнта. Даний винахід, відповідно до інших його аспектів, також стосується способу лікування вищезгаданих патологій, який включає введення пацієнту ефективної дози сполуки згідно з винаходом або однієї(го) з її фармацевтично прийнятних солей або гідратів або сольватів. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюN-(arylalkyl)-1h-pyrrolopyridine-2-carboxamide derivatives, preparation and use thereof
Автори англійськоюDubois Laurent, Evanno Yannick, Malanda, Andre
Назва патенту російськоюПроизводные n-(арилалкил)-1н-пирролопиридин-2-карбоксамидов, их получение и применение b терапии
Автори російськоюДюбуа Лоран, Эванно Янник, Маланда Андрэ
МПК / Мітки
МПК: C07D 471/04, A61K 31/437, A61P 25/00
Мітки: n-(арилалкіл)-1н-піролопіридин-2-карбоксамідів, терапії, одержання, похідні, застосування
Код посилання
<a href="https://ua.patents.su/25-93881-pokhidni-n-arilalkil-1n-pirolopiridin-2-karboksamidiv-kh-oderzhannya-ta-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні n-(арилалкіл)-1н-піролопіридин-2-карбоксамідів, їх одержання та застосування в терапії</a>
Попередній патент: Електричний з’єднувач
Наступний патент: Піперидиніл-заміщені похідні ізохінолону як інгібітори rнo-кінази
Випадковий патент: Глазурувальне покриття