Пептиди, похідні від тромбоспондину-1, та способи лікування
Формула / Реферат
1. Пептид, який включає послідовність Хаа1-Хаа2-Хаа3-Хаа4-Хаа5-Хаа6-Хаа7-Хаа8-Хаа9-Хаа10-Хаа11-Хаа12-Хаа13-Хаа14-Хаа15, де Хаа1, Хаа2 та Хаа4 вибрані з групи, що складається з основних, нециклічних амінокислот, включаючи Arg та Lys; Хаа3, Хаа9, Хаа11, Хаа12 та Хаа15 вибрані з групи, що складається знейтральних, неполярних, великих та циклічних амінокислот, включаючи Phe, Тrр та Pro; Хаа5 вибраний з групи, що складається з нейтральних, полярних, великих та нециклічних амінокислот, включаючи Thr, Asn та Gln; Хаа6, Хаа7 та А14 вибрані з групи, що складається з кислотних амінокислот, включаючи Asp та Glu; і Хаа8, Хаа10 та Хаа13 вибрані з групи, що складається з нейтральних, полярних та маленьких амінокислот, включаючи Gly, Ser та Cys, або скорочений сегмент послідовності, що включає від 7 до 14 амінокислот.
2. Пептид за п. 1, що складається з 15-25 амінокислот.
3. Пептид за п. 1, що складається з 15-20 амінокислот.
4. Пептид за п. 1, де Хаа2 означає Arg.
5. Пептид за п. 1, де Хаа6 означає Asp.
6. Пептид за п. 1, де Хаа7 означає Asp.
7. Пептид за п. 1, де Хаа9 означає Тrр.
8. Пептид за п. 1, де Хаа12 означає Тrр.
9. Пептид за п. 1, де Хаа15 означає Тrр.
10. Пептид за п. 1, де Хаа2 означає Arg, Хаа7 означає Asp і Хаа9 означає Тrр.
11. Пептид, що складається з 15-25 амінокислот за п. 1, який включає послідовність Lys-Arg-Phe-Lys-Gln-Asp-Asp-Gly-Trp-Ser-Pro-Trp-Ser-Glu-Trp.
12. Пептид за п. 11, що складається з послідовності Lys-Arg-Phe-Lys-Gln-Asp-Asp-GIy-Trp-Ser-Pro-Trp-Ser-Glu-Trp.
13. Аміно- та/або карбоксильний скорочений сегмент пептиду за п. 12, де скорочений пептид складається з 8-14 амінокислотних залишків.
14. Пептид, що складається з 10-20 амінокислот за п. 1, який включає послідовність Asp-Xaa-Gly-Trp-Ser-Pro/His-Trp-Ser-Glu/Pro-Trp, де Хаа означає будь-яку амінокислоту.
15. Пептид, що складається з 10-20 амінокислот за п. 1, який включає послідовність Asp-Asp-Gly-Trp-Ser-Pro-Trp-Ser-Glu-Trp.
16. Пептид, що складається з 7-20 амінокислот за п. 1, який включає послідовність Asp-Xaa-Gly/Leu-Trp або Asp/Glu-Asp/Glu-Gly/Leu-Тrр або Asp-Asp/Glu-Gly/Leu-Trp, де Хаа означає будь-яку амінокислоту.
17. Пептид, що складається з 9-20 амінокислот за п. 1, який включає послідовність Lys-Arg-Phe-Lys-Gln-Asp/Glu-Xaa-Gly/Leu-Trp, де Хаа означає будь-яку амінокислоту.
18. Пептид, що складається з 8-20 амінокислот за п 1, який включає послідовність Lys-Arg-Phe-Lys-Asp/Glu-Xaa-Gly/Leu-Trp, де Хаа означає будь-яку амінокислоту.
19. Пептид, що складається з 10-20 амінокислот за п. 1, який включає послідовність Asp/Glu-Xaa1-Gly/Leu-Trp-Ser-Xaa2-Trp-Ser-Xaa3-Тrр, де Хаа1, Хаа2, та Хаа3 є будь-якими амінокислотами.
20. Пептид за п. 19, де Хаа1 означає Asp або Glu, Хаа2 означає Pro або His і Хаа3 означає Glu або Pro.
21. Пептид за будь-яким з попередніх пунктів, де пептид виявляє активність у стабілізації атеросклеротичних бляшок.
22. Пептид за будь-яким з попередніх пунктів, де пептид модулює TGF-β1 та/або ММР-9 активність шляхом взаємодії білок-білок.
23. Пептид за будь-яким з попередніх пунктів, де пептид включає одну чи більше модифікацій, вибраних з групи, що складається з неприродних амінокислот, D- або D,L-рацемічної суміші ізомерних форм, дисульфідного зв'язку (зв'язків), модифікацій карбокси- або амінокінця, кон'югації з біосумісними молекулами, включаючи жирні кислоти та ПЕГ, і хімічні заміщення амінокислоти.
24. Фармацевтично чиста композиція, яка включає пептид за будь-яким з попередніх пунктів.
25. Композиція, яка включає пептид за п. 1, де композицію готують для введення тваринам або як фармацевтичну композицію для введення людям.
26. Спосіб стабілізації атеросклеротичних бляшок та зниження частоти подій розриву бляшок, який включає введення тварині композиції або лікарського засобу, що включає пептид за будь-яким з попередніх пунктів.
27. Спосіб за будь-яким з попередніх пунктів, у якому пептид застосовують для лікування розладу з групи, що включає один чи більше розладів, вибраних з: інфаркт міокарда, інсульт та гостра ішемія кінцівок, або схильність до такого розладу.
Текст
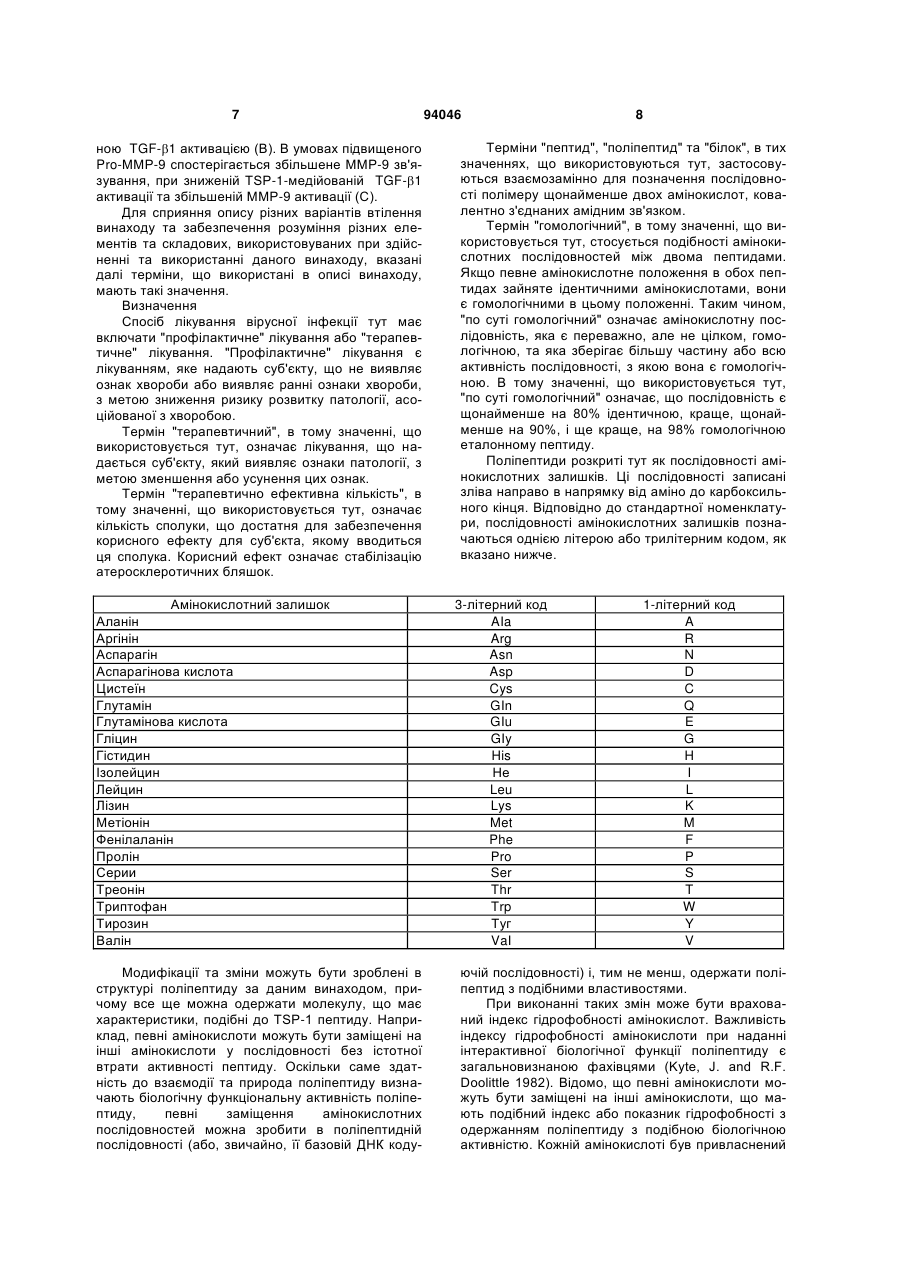
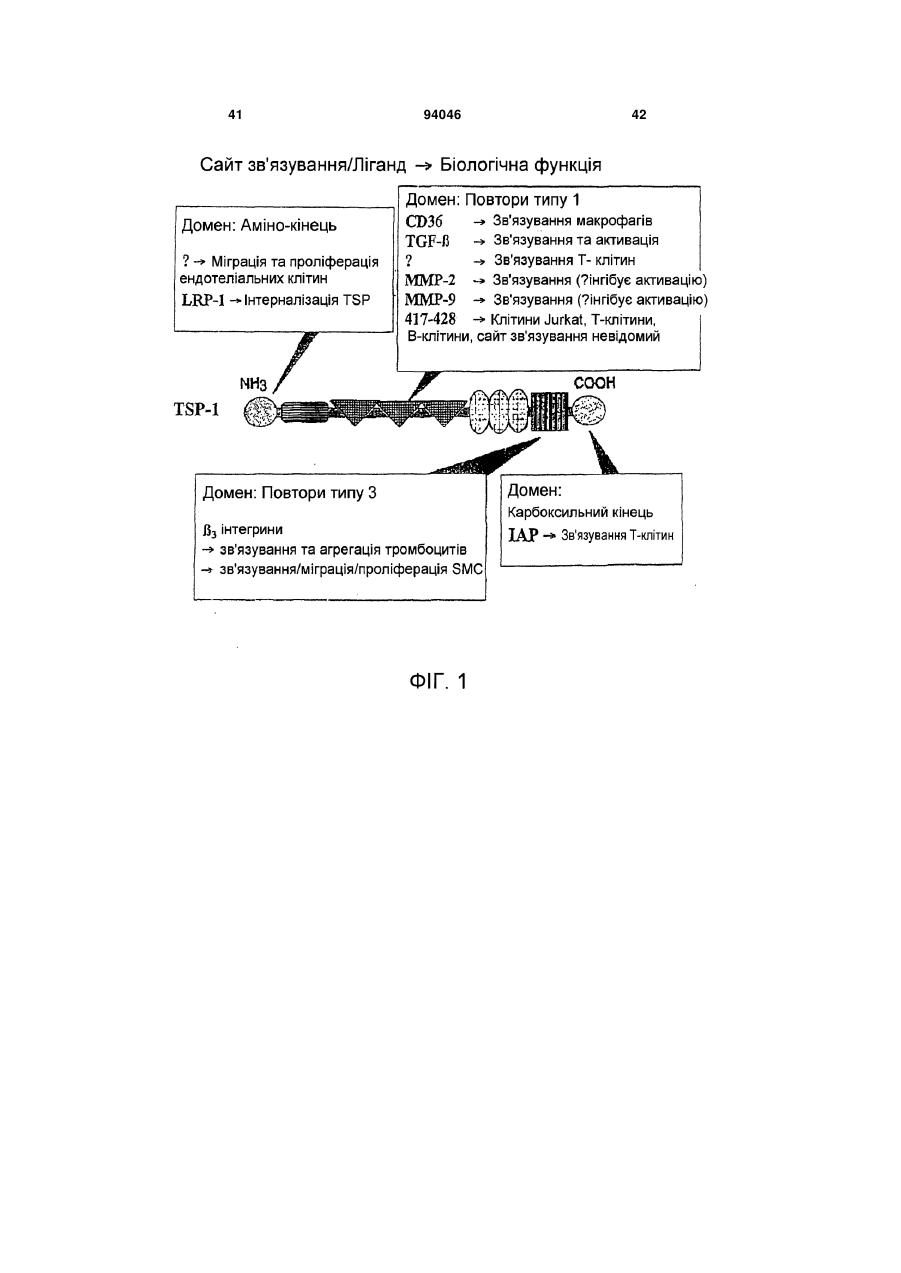
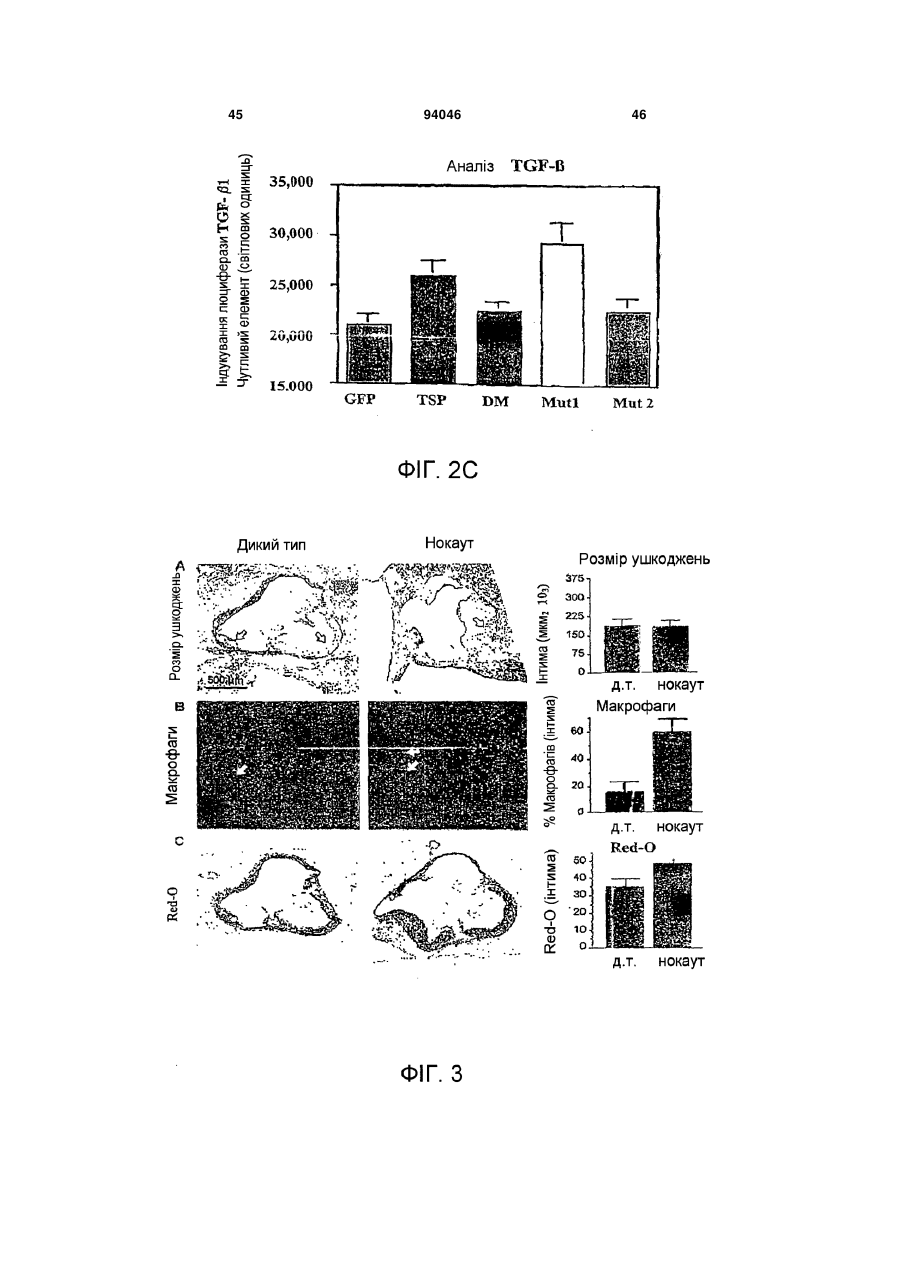
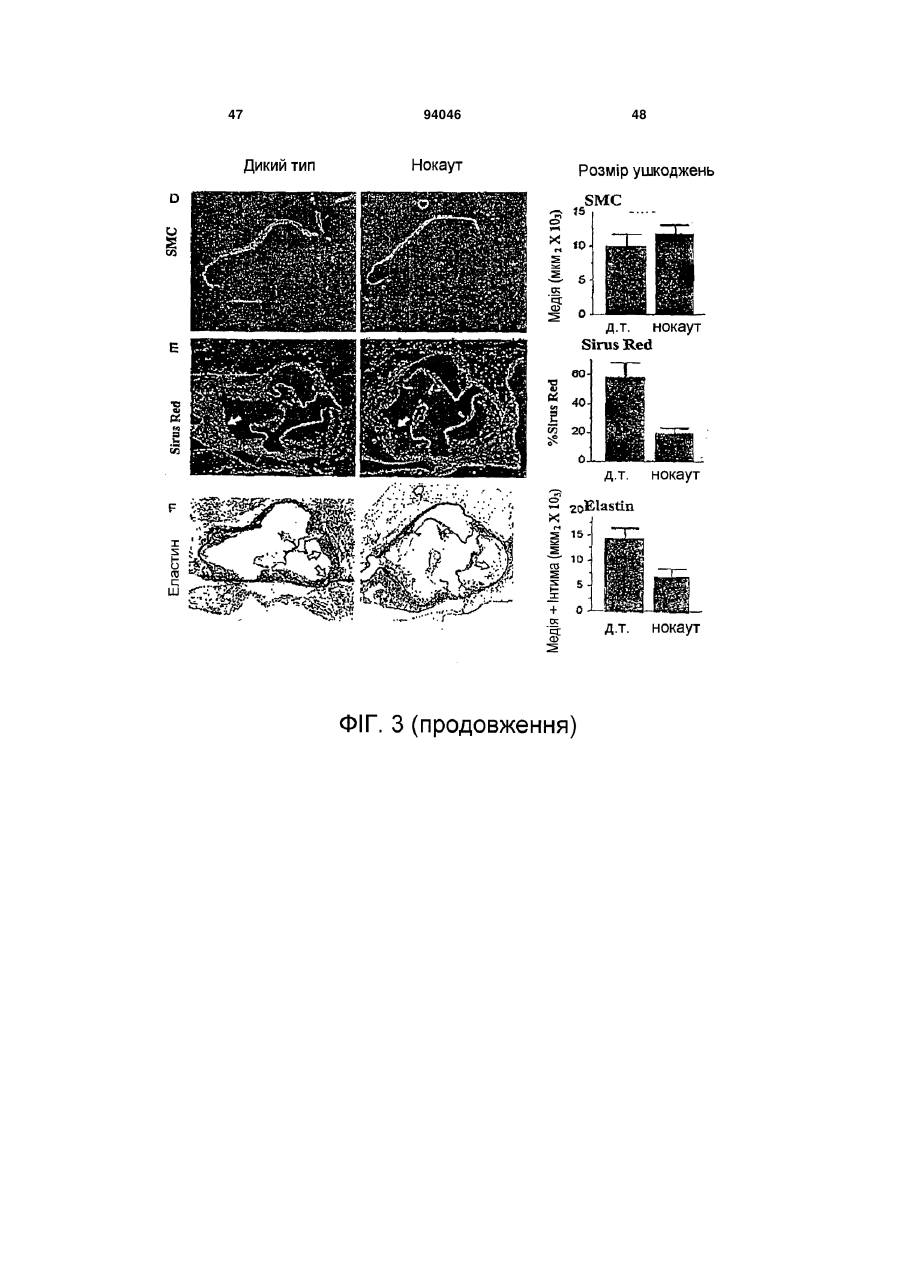
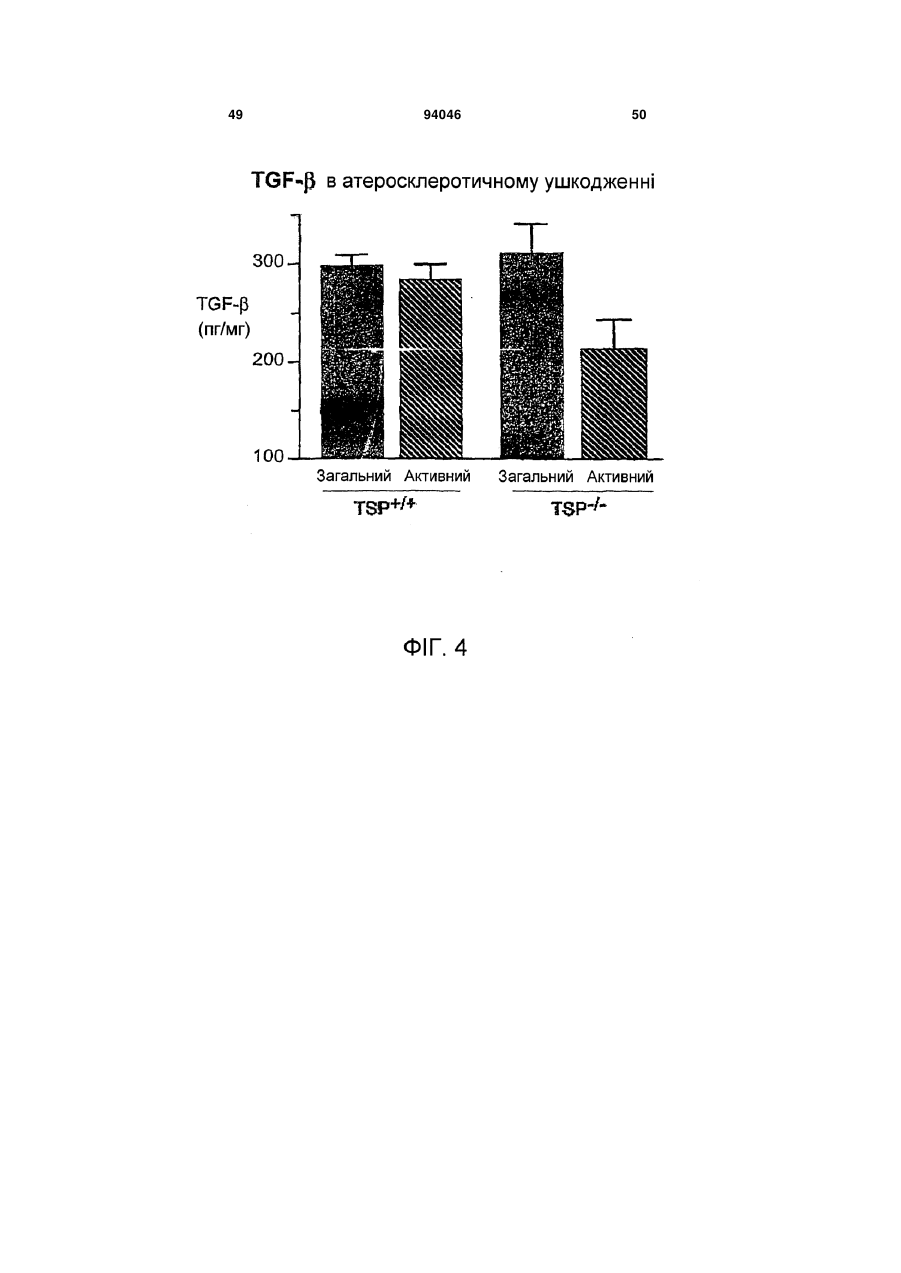
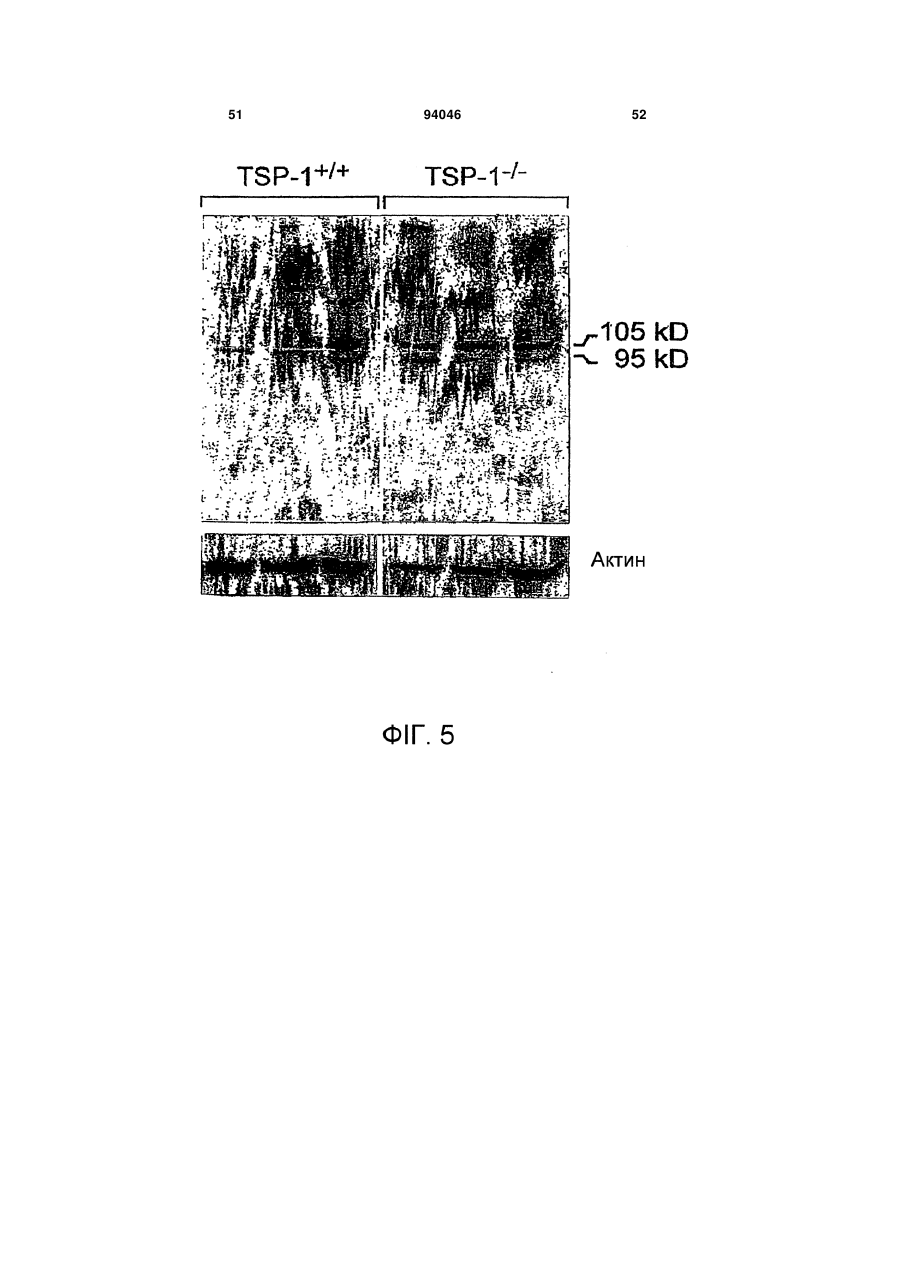
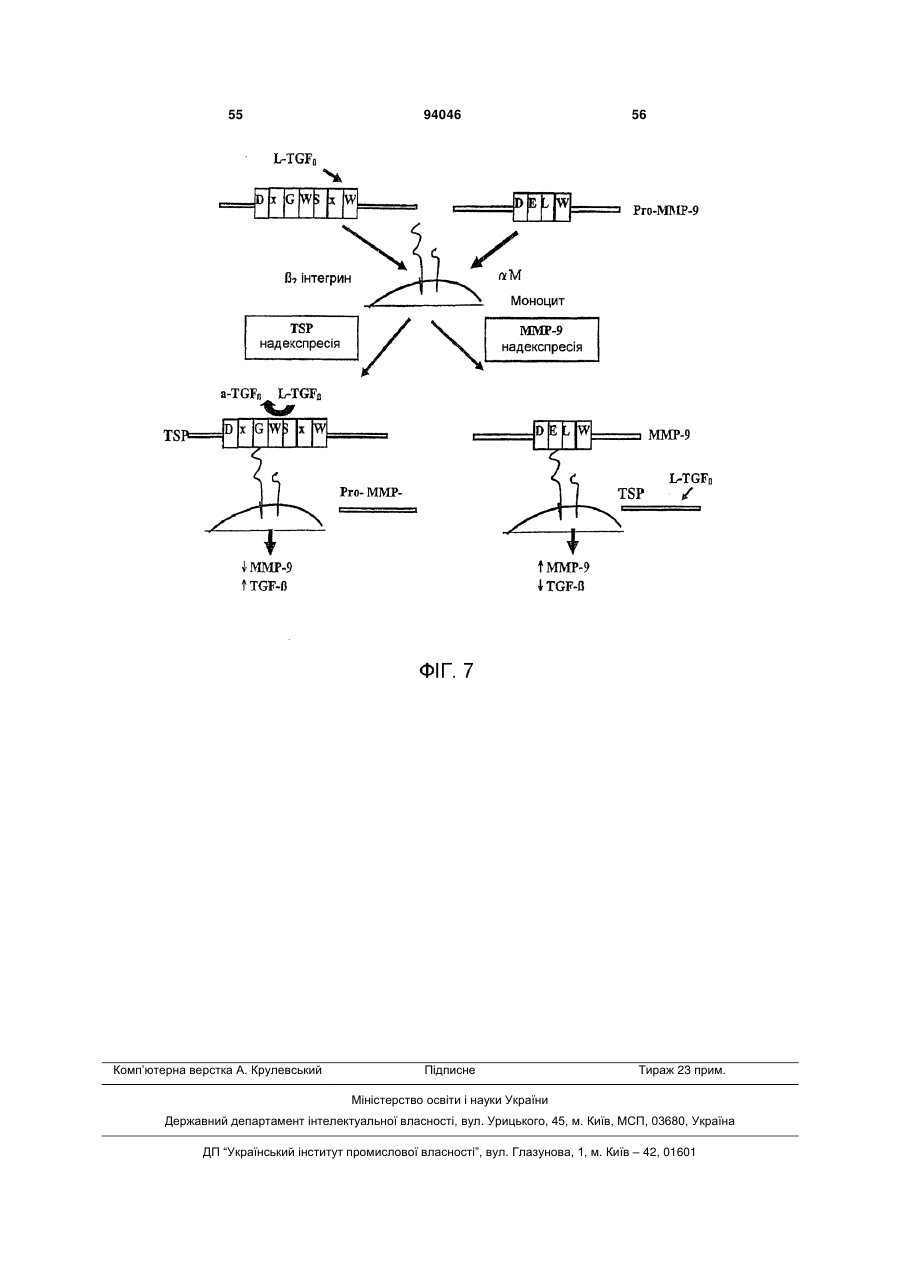
1. Пептид, який включає послідовність Хаа1Хаа2-Хаа3-Хаа4-Хаа5-Хаа6-Хаа7-Хаа8-Хаа9Хаа10-Хаа11-Хаа12-Хаа13-Хаа14-Хаа15, де Хаа1, Хаа2 та Хаа4 вибрані з групи, що складається з основних, нециклічних амінокислот, включаючи Arg та Lys; Хаа3, Хаа9, Хаа11, Хаа12 та Хаа15 вибрані з групи, що складається з нейтральних, неполярних, великих та циклічних амінокислот, включаючи Phe, Тrр та Pro; Хаа5 вибраний з групи, що складається з нейтральних, полярних, великих та нециклічних амінокислот, включаючи Thr, Asn та Gln; Хаа6, Хаа7 та А14 вибрані з групи, що складається з кислотних амінокислот, включаючи Asp та Glu; і Хаа8, Хаа10 та Хаа13 вибрані з групи, 2 (19) 1 3 94046 4 Gln-Asp/Glu-Xaa-Gly/Leu-Trp, де Хаа означає будьяку амінокислоту. 18. Пептид, що складається з 8-20 амінокислот за п. 1, який включає послідовність Lys-Arg-Phe-LysAsp/Glu-Xaa-Gly/Leu-Trp, де Хаа означає будь-яку амінокислоту. 19. Пептид, що складається з 10-20 амінокислот за п. 1, який включає послідовність Asp/Glu-Xaa1Gly/Leu-Trp-Ser-Xaa2-Trp-Ser-Xaa3-Тrр, де Хаа1, Хаа2, та Хаа3 є будь-якими амінокислотами. 20. Пептид за п. 19, де Хаа1 означає Asp або Glu, Хаа2 означає Pro або His і Хаа3 означає Glu або Pro. 21. Пептид за будь-яким з попередніх пунктів, де пептид виявляє активність у стабілізації атеросклеротичних бляшок. 22. Пептид за будь-яким з попередніх пунктів, де пептид модулює TGF-β1 та/або ММР-9 активність шляхом взаємодії білок-білок. 23. Пептид за будь-яким з попередніх пунктів, де пептид включає одну чи більше модифікацій, виб раних з групи, що складається з неприродних амінокислот, D- або D,L-рацемічної суміші ізомерних форм, дисульфідного зв'язку (зв'язків), модифікацій карбокси- або амінокінця, кон'югації з біосумісними молекулами, включаючи жирні кислоти та ПЕГ, і хімічні заміщення амінокислоти. 24. Фармацевтично чиста композиція, яка включає пептид за будь-яким з попередніх пунктів. 25. Композиція, яка включає пептид за п. 1, де композицію готують для введення тваринам або як фармацевтичну композицію для введення людям. 26. Спосіб стабілізації атеросклеротичних бляшок та зниження частоти подій розриву бляшок, який включає введення тварині композиції або лікарського засобу, що включає пептид за будь-яким з попередніх пунктів. 27. Спосіб за будь-яким з попередніх пунктів, у якому пептид застосовують для лікування розладу з групи, що включає один чи більше розладів, вибраних з: інфаркт міокарда, інсульт та гостра ішемія кінцівок, або схильність до такого розладу. Ця заявка претендує на переваги тимчасової заявки США № 60/693574, поданої 24 червня 2005 р. Даний винахід стосується способів лікування з використанням матриксно-клітинного (matricellular) білка тромбоспондину-1, TSP-1, та споріднених композицій для стабілізації атеросклеротичних бляшок і, тим самим, зниження частоти подій розриву бляшок, що приводять до, наприклад, інфаркту міокарда, інсульту та гострої ішемії кінцівок. Крім того, винахід стосується різних пептидів, включаючи певні синтетичні пептиди для використання при стабілізації бляшок в різних контекстах, включаючи хворобливі стани, згадані вище. Загрозливі для життя ускладнення атеросклерозу, такі як гострий інфаркт міокарда та інсульт, спричинені хронічним відкладанням холестерину та його окиснених фосфоліпідів, що індукують місцеве судинне запалення [1]. Атеросклеротичні ушкодження утворюються та прогресують в артеріальній стінці частково за рахунок взаємодій між її складовими, що належать до клітин та до позаклітинного матриксу (ПЗМ) [1-2]. З розвитком атеросклерозу відбуваються зміни як у клітинних, так і у ПЗМ-складових судинної стінки. ПЗМ визнаний як резервуар клітиннозв'язуючих білків та факторів росту, що впливають на поведінку клітин в атеросклеротичних ушкодженнях [3, 4]. Регуляція цих процесів в свою чергу може мати прямий вплив на взаємодії клітина-клітина та клітина-ПЗМ, які в свою чергу можуть впливати на фенотип атеросклеротичних бляшок, оскільки це може впливати на її схильність до розриву та наступну послідовність подій, таких як інфаркт міокарда та інсульт. Мінорні білкові компоненти ПЗМ, які забезпечують клітини специфічною контекстуальною інформацією про їх середовище, були названі "матриксно-клітинними" (matricellular) білками [4]. Матриксно-клітинні білки взаємодіють з іншими складовими ПЗМ, численними специфічними поверхневими клітинними рецепторами, а також фа кторами росту, модулюючи взаємодії клітинаматрикс. Ці білки модулюють клітинну функцію, але, мабуть, не робить прямого внеску в організацію або фізичні властивості структур, як інші компоненти ПЗМ, такі як фібрили, колаген та еластин [5]. Ці білки функціонують на поверхні поділу між позаклітинним матриксом та клітинною поверхнею, регулюючи клітинну поведінку. Крім того, у той час як структурні білки мають ключову роль в нормальному розвитку судин, матриксно-клітинні білки експресуються у дорослих судинах тільки під час ушкоджень [6]. Конкретніше, ці білки, мабуть, мають основною функцією відновлення тканин та діють контекстуально, впливаючи на клітинну функцію шляхом модуляції взаємодій клітина-матрикс. При цьому, якщо спрямоване руйнування структурних ПЗМ білків у зародкових клітинах призводить до тяжкого або летального фенотипів, нокаут генів, що кодують матриксно-клітинні білки, дає очевидно нормальний або майже незмінений фенотип [7-11]. TSP-1 є прототиповим матриксно-клітинним білком з численними зв'язуючими доменами [3, 12]. TSP-1 індукується під час ушкодження. Миші, гомозиготні по нуль-мутації в цьому білку, не мають значних дефектів розвитку; основним фенотипом у цих мишей є вогнища гострої та органної пневмонії в легенях. Однак в різних моделях хвороби існують чіткі фенотипи, приписувані цим мишам [10]. Наприклад, в моделях загоєння ран дефіцит TSP-1 асоційований зі зміною запальної клітинної відповіді та уповільненим загоєнням ран. Інші дослідження показали, що TSP-1 інгібує ангіогенез [13-19]. По суті, цільова експресія TSP-1 в неопластичних клітинах має клінічний інтерес, а її модифікація зараз оцінюється для використання на фазі Il клінічних випробувань [20]. Стосовно коронарної хвороби серця недавні кореляційні та описові дослідження дозволяють припустити, що TSP-1 може мати роль, хоч і невизначену та невідому, в атеросклерозі та інфаркті 5 міокарда [21, 22]. По-перше, дослідження генетичної варіації методом випадок-контроль дають змогу припустити, що місенс-мутація в цьому гені асоційована з підвищеним ризиком як атеросклерозу, так і інфаркту міокарда [21]. По-друге, патологічні дослідження з використанням людських зразків показали, що TSP-1 є присутнім в атеросклеротичних ушкодженнях, але не в нативній стінці судини [23, 24]. Однак, на сьогодні, значущість експресії TSP-1 у бляшці для атеросклеротичного фенотипу є невідомою. Даний винахід забезпечує способи з використанням TSP-1 та споріднені композиції для стабілізації атеросклеротичних бляшок та зниження схильності атеросклеротичних ушкоджень до розриву - в будь-якому судинному ложі (наприклад, коронарному, мозковому або периферичної кінцівки). Винахід також забезпечує композиції з використанням TSP-1 та споріднених пептидів, включаючи певні синтетичні пептиди, пов'язані з TSP-1. Такі пептиди є придатними для стабілізації бляшок в різних контекстах, включаючи хворобливі стани, такі як інфаркт міокарда, інсульт та гостра ішемія кінцівок. Деякі з цих пептидів включають одну чи більше послідовностей, пов'язаних з активними сайтами TSP-1 для регуляції, наприклад, TGF-1 та ММР-9 активності. В певних варіантах втілення, даний винахід пропонує пептидні послідовності (на основі TSP-1), що, як було знайдено, впливають на активацію ММР-9. Ми припускаємо, що механізм цієї активності включає унікальний 2-інтегринзв'язуючий сайт на TSP-1, який конкурує зі здатністю ММР-9 зв'язувати лейкоцити (переважно моноцити) в атеросклеротичних ушкодженнях. Крім того, в певних варіантах втілення, винахід пропонує пептидні послідовності на основі послідовностей у TSP-1, що, як відомо, регулюють активність TGF-1. Такі послідовності мають застосування для забезпечення стабільності бляшок. Зрештою, ми пропонуємо послідовності різних специфічних синтетичних пептидів на основі активних сайтів, що обговорюються вище, які імітують як TGF-1, так і ММР-9 активність TSP-1 та його ефект стабілізації бляшок in vivo. Фігура 1 зображує різні TSP-1 клітинні та цитокінзв'язуючі домени, які можуть мати безпосереднє значення в контексті атеросклеротичного ушкодження. Фігура 2 зображує TSR-1- та -2-зв'язуючі домени в TSP-1 та відповідних мутантах, створених в цих двох доменах. (А) Існують два гаданих TGF12 інтегринзв'язуючих домени в TSR-1 та TSR-2. Відзначимо, що ці два зв'язуючі домени є суміжними (та перекриваються на одну амінокислоту) з двома зв'язуючими доменами TGF-1. Ми мутували два DxGW мотиви, які позначені рамкою. (В) Використовуючи перехідну трансфекцію клітинних ліній мишачих макрофагів (Raw), ми знайшли, що TSP-1 знижує ММР-9 активність, р
ДивитисяДодаткова інформація
Назва патенту англійськоюThrombospondin-1 derived peptides and treatment methods
Автори англійськоюAgah, Ramtin
Назва патенту російськоюПептиды, производные от тромбоспондина-1, и способы лечения
Автори російськоюАгах Рамтин
МПК / Мітки
МПК: A61K 39/40, C07K 7/00, C07K 2/00, C07K 14/00, C07K 17/00, A61K 38/00, C07K 16/00, C07K 4/00
Мітки: пептиди, похідні, способи, тромбоспондину-1, лікування
Код посилання
<a href="https://ua.patents.su/28-94046-peptidi-pokhidni-vid-trombospondinu-1-ta-sposobi-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Пептиди, похідні від тромбоспондину-1, та способи лікування</a>
Попередній патент: Розчинний кавовий продукт
Наступний патент: Установка безперервного розливання
Випадковий патент: Спосіб одержання органо-мінерального добрива з пташиного посліду