3-(4-гетероарилциклогексиламіно)циклопентанкарбоксаміди як модулятори хемокінових рецепторів
Номер патенту: 83917
Опубліковано: 26.08.2008
Автори: Ксіа Майкл, Цао Ганьфен, Фен Хао, Чжен Чаншен, Меткаф Брайан, Ананд Раджан, Сюе Чу-Бяо, Гленн Джозеф
Формула / Реферат
1. Сполука формули І:
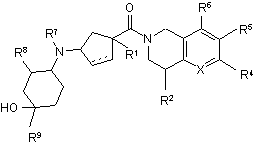 , І
, І
або її фармацевтично прийнятна сіль або проліки, де:
пунктирна лінія означає необов’язковий зв’язок;
X являє собою N, NО або CR3;
R1 являє собою С1-6 алкіл, (С0-6 алкіл )-О-(С1-6 алкіл), (С0-6 алкіл)-S-(C1-6 алкіл), (С0-6алкіл)-(С3-7 циклоалкіл)-(С0-6 алкіл), ОН, CO2R10, гетероцикліл, CN, NR10R12, NSO2R10, NCOR10, NCO2R10, NCOR10, CR11CO2R10, CR11OCOR10 або феніл;
R2 являє собою Н, ОН, галоген, С1-3 алкіл, NR10R12, CO2R10, CONR10R12, NR10COR11; OCONR10R12, NR10CONR10R12, гетероцикліл, CN, NR10-SO2-NR10R12, NR10-SO2-R12, SО2-NRl0R12 aбo оксо; де зазначений C1-3 алкіл є необов’язково заміщеним 1-6 замісниками, вибраними з F і ОН;
R3 являє собою Н, ОН, галоген, С1-6 алкіл, С1-6 алкокси, NR10R11, NR10CO2R11; NR10CONR10R11, NR10SO2NR10R11, NR10-SO2-R11, гетероцикліл, CN, CONR10R12, CO2R10, NО2, SR10, SOR10, SO2R10; або SO2-NR10R11;
R4 являє собою Н, C1-6 алкіл, CF3, OCF3, Cl, F, Br або феніл;
R5 являє собою C1-6 алкіл, С1-6 алкокси, СО-(С1-6 алкіл), С1-6тіоалкокси, піридил, F, Сl, Вr, С4-6 циклоалкіл, С4-6 циклоалкілокси, феніл, фенілокси, С3-6 циклоалкіл, С3-6 циклоалкілокси, гетероцикліл, CN або CO2R10; де зазначений С1-6 алкіл є необов’язково заміщеним одним або декількома ОН або F; де зазначені С1-6 алкокси, СО-(С1-6 алкіл) або С1-6 тіоалкокси є необов’язково заміщеними одним або декількома F; де зазначені піридил, феніл або фенілокси є необов’язково заміщеними одним або декількома замісниками, вибраними з галогену, CF3, С1-4 алкілу і CO2R10; де зазначені С3-6 циклоалкіл або С3-6 циклоалкілокси є необов’язково заміщеними одним або декількома F;
R6 являє собою Н, CF3, С1-6 алкіл, F, Сl або Вr;
R7 являє собою Н або С1-6 алкіл, необов’язково заміщені 1-3 замісниками, вибраними з галогену, ОН, СО2Н, СО2-(С1-6алкіл) або С1-3 алкокси;
R8 являє собою Н, С1-6 алкіл, F, С1-3 алкокси, С1-3 галогеналкокси, С3-6 циклоалкіл, С3-6 циклоалкілокси, ОН, CO2R10, OCOR10; де зазначений С1-6 алкіл є необов’язково заміщеним одним або декількома замісниками, вибраними з F, С1-3 алкокси, ОН або CO2R10;
або R7 і R8 разом утворюють місточкову групу С2-4 алкілен або -(С0-2 алкіл)-O-(С1-3 алкіл)- з утворенням 5-7-членного циклу;
R9 являє собою гетероцикліл, необов’язково заміщений 1-4 замісниками, вибраними з С1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR13, C(O)R14, C(O)OR13, C(O)NR15R16, NR15R16, NR15CONHR16, NR15C(O)R14, NR15C(O)OR13, S(O)R14, S(O)2R14, S(O)NR15Rl6 aбo SO2NR15R16;
R10 являє собою H, C1-6 алкіл, бензил, феніл або С3-6 циклоалкіл, де зазначені С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл є необов’язково заміщеними 1-3 замісниками вибраними з галогену, ОН, С1-3 алкілу, С1-3 алкокси, СО2Н, СО2-(С1-6 алкілу) і CF3;
R11 являє собою Н, ОН, С1-6 алкіл, С1-6 алкокси, бензил, феніл або С3-6 циклоалкіл, де зазначені С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл є необов’язково заміщеними 1-3 замісниками, вибраними з галогену, ОН, С1-3 алкілу, С1-3 алкокси, СО2Н, СО2-(С1-6 алкілу) і CF3;
R12 являє собою Н, С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл, де зазначені С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл є необов’язково заміщеними 1-3 замісниками, вибраними з галогену, ОН, С1-3 алкілу, С1-3 алкокси, CO2H, СО2-(С1-6 алкілу) і CF3;
R13 і R14 являють собою, кожний незалежно, Н, С1-6 алкіл, С1-6 галогеналкіл, С2-6 алкеніл, С2-6 алкініл, арил, циклоалкіл, арилалкіл або циклоалкілалкіл;
R15 і R16 являють собою, кожний незалежно, Н, С1-6 алкіл, С1-6 галогеналкіл, С2-6 алкеніл, С2-6 алкініл, арил, циклоалкіл, арилалкіл або циклоалкілалкіл;
або R15 і R16 разом з атомом N, до якого вони приєднані, утворюють 4-6 членну гетероциклільну групу.
2. Сполука за п. 1, де X являє собою N або NO.
3. Сполука за п. 1, де X являє собою CR3.
4. Сполука за п. 1, де R1 являє собою С1-6 алкіл.
5. Сполука за п. 1, де R1 являє собою 2-пропіл.
6. Сполука за п. 1, де R2 являє собою Н, ОН, галоген або С1-3 алкіл.
7. Сполука за п. 1, де R2 являє собою Н.
8. Сполука за п. 1, де R3 являє собою Н, ОН, галоген або С1-6 алкіл.
9. Сполука за п. 1, де R3 являє собою Н.
10. Сполука за п. 1, де R4 являє собою Н.
11. Сполука за п. 1, де R5 являє собою С1-6алкіл, заміщений 1-4 F.
12. Сполука за п. 1, де R5 являє собою CF3.
13. Сполука за п. 1, де R6 являє собою Н.
14. Сполука за п. 1 , де R7 являє собою Н.
15. Сполука за п. 1, де R8 являє собою Н.
16. Сполука за п. 1, де R9 являє собою гетероарил, необов’язково заміщений 1-4 замісниками, вибраними з С1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR13, C(O)R14, C(O)OR13, C(O)NR15R16, NR15R16, NR15CONHR16, NR15C(O)R14, NR15C(O)OR13, S(O)R14, S(O)2R14, S(O)NR15R16 або SO2NR15R16.
17. Сполука за п. 16, де зазначений гетероарил являє собою 5- або 6-членний гетеро арил, необов’язково заміщений 1-4 замісниками, вибраними з С1-6 алкілу, С2-6 алкенілу, С2.6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR13, C(O)R14, C(O)OR13, C(O)NR15R16, NR15R16, NR15CONHR16, NR15C(O)R14, NR15C(O)OR13, S(O)R14, S(O)2R14, S(O)NR15R16 або SO2NR15R16.
18. Сполука за п. 16. де зазначений гетероарил являє собою піридил, піримідиніл, піразиніл, піридазиніл або триазиніл, кожний необов’язково заміщений 1-4 замісниками, вибраними з С1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR13, C(O)R14, C(O)OR13, C(O)NR15R16, NR15R16, NR15CONHR16, NR15C(O)R14, NR15C(O)OR13, S(O)R14, S(O)2R14, S(O)NR15R16 або SO2NR15R10.
19. Сполука за п. 16, де зазначений гетероарил являє собою тієніл, фураніл, тіазоліл, оксазоліл або імідазоліл, кожний необов’язково заміщений 1-4 замісниками, вибраними з С1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR13, C(O)R14, C(O)OR13, C(O)NR15R16, NR15R16, NR15CONHR16, NR15C(O)R14, NR15C(O)OR13, S(O)R14, S(O)2R14, S(O)NR15R16 aбo SO2NR15R16.
20. Сполука за п. 16, де зазначений гетероарил являє собою тіазоліл, оксазоліл, піримідиніл або піридил, кожний необов’язково заміщений 1-3 групами F, Сl, Вr, І, метил, етил, метокси, етокси або трифторметил.
21. Сполука за п. 1, яка має формулу II:
 II.
II.
22. Сполука за п. 1, яка має формулу IIIа, ІІІb або IIIс:
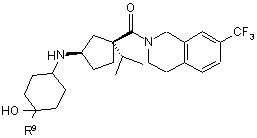 , IIIa
, IIIa
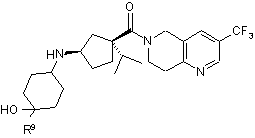 , IIIb
, IIIb
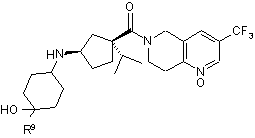 IIIc.
IIIc.
23. Сполука за п. 1, вибрана з наступних сполук:
4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл]карбоніл}циклопентил)аміно]-1-піридин-2-ілциклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл)карбоніл}циклопентил)аміно]-1-(1,3-оксазол-2-іл)циклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл]карбоніл}циклопентил)аміно]-1-піримідин-2-ілциклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-2-іл)циклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[3-(трифторметил)-7,8-дигідро-1,6-нафтиридин-6(5Н)-іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-2-іл)циклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл]карбоніл}циклопентил)аміно]-1-(4-метил-1,3-тіазол-2-іл)циклогексанол;
4-[((1S,3S)-3-ізопропіл-3-{[3-(трифторметил)-7,8-дигідро-1,6-нафтиридин-6(5Н)-іл]карбоніл}циклопентил)аміно]-1-(4-метил-1,3-тіазол-2-іл)циклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл]карбоніл}циклопентил)аміно]-1-(5-метил-1,3-тіазол-2-іл)циклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-5-іл)циклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[3-(трифторметил)-7,8-дигідро-1,6-нафтиридин-6(5Н)-іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-5-іл)циклогексанол;
4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4-дигідроізохінолін-2(1Н)-іл]карбоніл}циклопентил)аміно]-1-(2-метил-1,3-тіазол-5-іл)циклогексанол і
4-[((1R,3S)-3-ізопропіл-3-{[3-(трифторметил)-7,8-дигідро-1,6-нафтиридин-6(5Н)-іл]карбоніл}циклопентил)аміно]-1-(2-метил-1,3-тіазол-5-іл)циклогексанол;
або її фармацевтично прийнятна сіль.
24. Композиція, яка містить сполуку за будь-яким з пп. 1-23 і фармацевтично прийнятний носій.
25. Спосіб модуляції активності хемокінового рецептора, в якому вводять у контакт зазначений рецептор із сполукою за будь-яким з пп. 1-23.
26. Спосіб за п. 25, де зазначений рецептор являє собою CCR2.
27. Спосіб за п. 25, де зазначена модуляція відповідає інгібуванню.
28. Спосіб лікування захворювання, пов’язаного з експресією або активністю хемокінового рецептора в пацієнта, що включає в себе введення зазначеному пацієнтові терапевтично ефективної кількості сполуки за будь-яким з пп. 1-23.
29. Спосіб за п. 28, де зазначене захворювання являє собою запальне захворювання або імунне порушення.
30. Спосіб за п. 28, де зазначене захворювання являє собою ревматоїдний артрит, атеросклероз, вовчак, розсіяний склероз, невропатичний біль, відторгнення трансплантата, діабет або ожиріння.
31. Спосіб за п. 28 де зазначене захворювання являє собою рак.
32. Спосіб за п. 28, що додатково включає в себе введення протизапального засобу.
Текст
1. Сполука формули І: R6 O C2 2 (19) 1 3 83917 С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл є необов’язково заміщеними 1-3 замісниками, вибраними з галогену, ОН, С1-3 алкілу, С1-3 алкокси, СО2Н, СО2-(С1-6 алкілу) і CF3 ; R12 являє собою Н, С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл, де зазначені С 1-6 алкіл, бензил, феніл або С3-6 циклоалкіл є необов’язково заміщеними 1-3 замісниками, вибраними з галогену, ОН, С1-3 алкілу, С1-3 алкокси, CO2H, СО2-(С1-6 алкілу) і CF3; R13 і R14 являють собою, кожний незалежно, Н, С1-6 алкіл, С1-6 галогеналкіл, С2-6 алкеніл, С2-6 алкініл, арил, циклоалкіл, арилалкіл або циклоалкілалкіл; R15 і R16 являють собою, кожний незалежно, Н, С1-6 алкіл, С1-6 галогеналкіл, С2-6 алкеніл, С2-6 алкініл, арил, циклоалкіл, арилалкіл або циклоалкілалкіл; або R15 і R16 разом з атомом N, до якого вони приєднані, утворюють 4-6 членну гетероциклільну груп у. 2. Сполука за п. 1, де X являє собою N або NO. 3. Сполука за п. 1, де X являє собою CR3. 4. Сполука за п. 1, де R 1 являє собою С 1-6 алкіл. 5. Сполука за п. 1, де R 1 являє собою 2-пропіл. 6. Сполука за п. 1, де R2 являє собою Н, ОН, галоген або С1-3 алкіл. 7. Сполука за п. 1, де R 2 являє собою Н. 8. Сполука за п. 1, де R3 являє собою Н, ОН, галоген або С1-6 алкіл. 9. Сполука за п. 1, де R 3 являє собою Н. 10. Сполука за п. 1, де R4 являє собою Н. 11. Сполука за п. 1, де R 5 являє собою С1-6алкіл, заміщений 1-4 F. 12. Сполука за п. 1, де R5 являє собою CF3. 13. Сполука за п. 1, де R6 являє собою Н. 14. Сполука за п. 1 , де R7 являє собою Н. 15. Сполука за п. 1, де R8 являє собою Н. 16. Сполука за п. 1, де R9 являє собою гетероарил, необов’язково заміщений 1-4 замісниками, вибраними з С 1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR 13, C(O)R14, C(O)OR 13, C(O)NR 15R16, NR15R 16, 15 16 15 14 15 NR CONHR , NR C(O)R , NR C(O)OR 13, 14 14 15 16 S(O)R , S(O)2R , S(O)NR R або SO2NR15R16 . 17. Сполука за п. 16, де зазначений гетероарил являє собою 5- або 6-членний гетеро арил, необов’язково заміщений 1-4 замісниками, вибраними з С1-6 алкілу, С2-6 алкенілу, С2. 6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR13 , C(O)R14, C(O)OR 13, C(O)NR 15R16 , NR15R16, NR15CONHR16, NR15C(O)R14, NR15C(O)OR 13, S(O)R14, S(O)2R 14, S(O)NR15R16 або SO 2NR15R16. 18. Сполука за п. 16. де зазначений гетероарил являє собою піридил, піримідиніл, піразиніл, піридазиніл або триазиніл, кожний необов’язково заміщений 1-4 замісниками, вибраними з С 1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13 , SR13, C(O)R14, C(O)OR 13, C(O)NR15R16, NR15R16, NR15CONHR16, NR15C(O)R 14, NR15C(O)OR 13, S(O)R 14, S(O) 2R14 , S(O)NR15R16 або SO2NR15R10. 19. Сполука за п. 16, де зазначений гетероарил являє собою тієніл, фураніл, тіазоліл, оксазоліл або імідазоліл, кожний необов’язково заміщений 14 замісниками, вибраними з С1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, 4 NO2, OR13, SR 13, C(O)R14 , C(O)OR 13, C(O)NR15R 16, NR15R16, NR15CONHR16, NR15C(O)R 14, 15 13 14 14 NR C(O)OR , S(O)R , S(O) 2R , S(O)NR15R16 aбo SO2NR15R16. 20. Сполука за п. 16, де зазначений гетероарил являє собою тіазоліл, оксазоліл, піримідиніл або піридил, кожний необов’язково заміщений 1-3 групами F, Сl, Вr, І, метил, етил, метокси, етокси або трифторметил. 21. Сполука за п. 1, яка має формулу II: O 8 R HN CF3 N R1 (II.) X HO R9 22. Сполука за п. 1, яка має формулу IIIа, ІІІb або IIIс: O CF3 N HN (IIIa) HO R9 , O CF3 N HN (IIIb) N HO R9 , O HN CF3 N N O (IIIc). HO R9 23. Сполука за п. 1, вибрана з наступних сполук: 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-піридин-2ілциклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл)карбоніл}циклопентил)аміно]-1-(1,3-оксазол-2іл)циклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-піримідин-2ілциклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н) 5 83917 6 іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-2іл)циклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[3-(трифторметил)-7,8дигідро-1,6-нафтиридин-6(5Н)іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-2іл)циклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-(4-метил-1,3тіазол-2-іл)циклогексанол; 4-[((1S,3S)-3-ізопропіл-3-{[3-(трифторметил)-7,8дигідро-1,6-нафтиридин-6(5Н)іл]карбоніл}циклопентил)аміно]-1-(4-метил-1,3тіазол-2-іл)циклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-(5-метил-1,3тіазол-2-іл)циклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-5іл)циклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[3-(трифторметил)-7,8дигідро-1,6-нафтиридин-6(5Н)іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-5іл)циклогексанол; 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-(2-метил-1,3тіазол-5-іл)циклогексанол і 4-[((1R,3S)-3-ізопропіл-3-{[3-(трифторметил)-7,8дигідро-1,6-нафтиридин-6(5Н)іл]карбоніл}циклопентил)аміно]-1-(2-метил-1,3тіазол-5-іл)циклогексанол; або її фармацевтично прийнятна сіль. 24. Композиція, яка містить сполуку за будь-яким з пп. 1-23 і фармацевтично прийнятний носій. 25. Спосіб модуляції активності хемокінового рецептора, в якому вводять у контакт зазначений рецептор із сполукою за будь-яким з пп. 1-23. 26. Спосіб за п. 25, де зазначений рецептор являє собою CCR2. 27. Спосіб за п. 25, де зазначена модуляція відповідає інгібуванню. 28. Спосіб лікування захворювання, пов’язаного з експресією або активністю хемокінового рецептора в пацієнта, що включає в себе введення зазначеному пацієнтові терапевтично ефективної кількості сполуки за будь-яким з пп. 1-23. 29. Спосіб за п. 28, де зазначене захворювання являє собою запальне захворювання або імунне порушення. 30. Спосіб за п. 28, де зазначене захворювання являє собою ревматоїдний артрит, атеросклероз, вовчак, розсіяний склероз, невропатичний біль, відторгнення трансплантата, діабет або ожиріння. 31. Спосіб за п. 28 де зазначене захворювання являє собою рак. 32. Спосіб за п. 28, що додатково включає в себе введення протизапального засобу. Даний винахід стосується сполук, які модулюють активність хемокінових рецепторів, таких як CCR2. У деяких варіантах здійснення сполуки є селективними стосовно CCR2. Дані сполуки можуть застосовуватися, наприклад, для лікування захворювань, асоційованих з експресією або активністю хемокінового рецептора, таких як запальні захворювання, метаболічні захворювання з асоційованими характеристиками запалення, імунні захворювання і рак. Міграція і транспорт лейкоцитів із кровоносних судин у хворі тканини залучені в ініціацію нормальних запальних відповідей для боротьби із захворюванням. Процес, також відомий як мобілізація лейкоцитів, має також відношення до настання і розвитку запальних і аутоімунних захворювань. Отримана в результаті цих захворювань патологія є похідною від атаки захисних засобів імунної системи на свідомо нормальні тканини. Відповідно, запобігання і блокування мобілізації лейкоцитів для атаки на тканини при запальному захворюванні, метаболічному захворюванні, аутоімунному захворюванні і раку було б високоефективним підходом до терапевтичного втручання. Різні класи лейкоцитарних клітин, які залучені в клітинні імунні відповіді, включають моноцити, лімфоцити, нейтрофіли, еозинофіли, природні клітини-кілери, гучні клітини і базофіли. У більшості випадків моноцити і лімфоцити є класами лейкоцитів, які ініціюють, координують і підтримують хронічні запальні відповіді, і бажаним с блокування даних клітин від влучення в ділянки запалення. Лімфоцити залучають до ділянок тканин моноцити, які разом з лімфоцитами є відповідальними за більшість дійсних ушкоджень тканин, які відбуваються при запальному захворюванні. Відомо, що інфільтрація лімфоцитів і/або моноцитів приводить до широкого ряду хронічних, аутоімунних захворювань, а також відторгнення пересаджених органів. Ці захворювання включають, але без обмежень, ревматоїдний артрит, хронічний контактний дерматит, астму, гіпералергійні стани, запальне захворювання кишечнику, вовчак, системний червоний вовчак, розсіяний склероз, атеросклероз, псоріаз, саркоїдоз, ідіопатичний фіброз легенів, дерматоміозит, шкірний пемфігоїд і споріднені захворювання (наприклад, Pemphigus vulgaris, P. fallacious, P. erythematosls), гломерулонефрити, васкуліти, гепатит, діабет, відторгнення алотрансплантата і захворювання «трансплантата-протихазяїна». Вважають, що процес, за допомогою якого лейкоцити залишають кровотік. акумулюються в ділянках запалення і дають початок захворюванню, має, щонайменше три, стадії, які були описані як (1) ролінг, (2) активація/стійка адгезія і (3) трансендотеліальна міграція [Springer, T. A., Nature 346:425-433 (1990); Lawrence and Springer, Cell 65:859-873 (1991); Butcher, E. C, Cell 67:10331036 (1991)]. Друга стадія опосередкована на молекулярному рівні хемоатрактантними рецепторами. Хемоатрактантні рецептори на поверхні лейкоцитів зв'язують хемоатрактантні цитокіни, які секретуються клітинами на ділянці явного ушко 7 83917 дження або інфекції. Зв'язування з рецептором активує лейкоцити, збільшує адгезивність адгезійних молекул, які опосередковують трансендотеліальну міграцію, і стимулює спрямовану міграцію клітин у напрямку до джерела хемоатрактантного цитокіну. Хемотаксичні цитокіни (лейкоцитарні хемоатрактантні/активуючі фактори), також відомі як хемокіни, також відомі як інтеркрини і SIS-цитокіни, являють собою групу запальних/імуномодуляторних поліпептидних факторів з молекулярною масою 6-15кДа, які вивільняються великою розмаїтістю клітин, таких як макрофаги, моноцити, еозинофіли, нейтрофіли, фібробласти, клітини судинного ендотелію, епітеліальні клітини, клітини гладкої мускулатури і тучні клітини на ділянках запалення [даний огляд в Luster, New Eng. J Med., 338, 436-445 (1998) і Rollins, Blood, 90, 909928 (1997)]. Хемокіни також були описані в [Oppenheim, J. J. et al., Annu. Rev. Immunol., 9:617648 (1991); Schall and Bacon, Curr. Opin. Immunol, 6:865-873 (1994); Baggiolini, M., et al., and Adv. Immunol., 55:97-179 (1994)]. Хемокіни мають здатність стимулювати спрямовану міграцію клітин процес, відомий як хемотаксис. Хемокіни можуть бути згруповані у два основних підсімейства, на підставі того, чи є два амінокінцевих цистеїнових залишки безпосередньо суміжними (CC сімейство) або розділеними однією амінокислотою (CXC сімейство). Ці розходження корелюють із організацією двох підсімейств у два роздільних генних кластери. У межах кожного генного кластера хемокіни типово проявляють подібність послідовності в інтервалі між 25 і 60%. СХС-хемокіни, такі як інтерлейкін-8 (IL-8), нейтрофілактивуючий білок-2 (NAP2) і білок стимуляторної активності росту меланоми (MGSA) є хемотаксичними насамперед для нейтрофілів і Т-лімфоцитів, у той час як CCхемокіни, такі як RANTES, MIP-1a, MIP-1b, моноцитарні хемотаксичні білки (MCP-1, МСР-2, МСР-3, МСР-4 і МСР-5) і елтаксини (-1 і -2) є хемотаксичними для, серед інших клітинних типів, макрофагів, Т-лімфоцитів, еозинофілів, дендритних клітин і базофілів. Також існують хемокіни лімфотактин-1, лімфотактин-2 (обидва C-хемокіни) і фракталкін (СХХХС-хемокін), які не попадають в обидва з основних хемокінових підсімейств. MCP-1 (також відомий як MCAF (абревіатура для хемотаксичного і активуючого фактора макрофагів) або JE) являє собою СС-хемокін, який продукується моноцитами/макрофагами клітинами гладкої мускулатури, фібробластами, і клітинами судинного ендотелію, і викликає клітинну міграцію і клітинну адгезію моноцитів [див., наприклад Valente, A. J., et al., Biochemistry, 1988, 27, 4162; Matsushima, K., et al., J. Exp. Med., 1989, 169, 1485; Yoshimura, T., et al., J. Immunol., 1989, 142, 1956; Rollins, В. J., et al., Proc. Natl. Acad. Sci. USA, 1988, 85, 3738; Rollins, В. J., et al., Blood, 1991, 78, 1112; Jiang, Y, et al., J. Immunol., 1992, 148, 2423; Vaddi, K., ct al., J. Immunol., 1994, 153, 4721], Т-лімфоцити пам'яті [див., наприклад Carr, M. W., et al., Proc. Natl. Acad. Sci. USA, 1994, 91, 3652], T лімфоцити [див., наприклад Loetscher, P., et al., FASEB J., 1994, 8, 1055] клітини природних кілерів [див., на 8 приклад Loetscher, P., et al., J. Immunol., 1996, 156, 322; Allavena, P., et al., Eur. J. Immunol., 1994, 24, 3233], а також опосередкування вивільнення гістаміну базофілами [див., наприклад Alam, R., et al., J. Clin. Invest., 1992, 89, 723; Bischoff, S. C, et al., J. hxp. Med., 1992, 175, 1271; Kuna, P., et al., J. Exp. Med., 1992, 175, 489]. Крім того, повідомляється про високу експресію MCP-1 при захворюваннях, де, як вважають, акумуляція моноцитів/макрофагів і/або Т-клітин є важливою при ініціації або розвитку захворювань, таких як атеросклероз [див., наприклад Hayes, І. M., et al., Arterioscler. Thromb. Vase. Biol, 1998, 18, 397; Takeya, M., et al., Hum. Pathol., 1993, 24, 534; Yla-Herttuala, S., et al., Proc. Natl. Acad. Sci. USA, 1991, 88, 5252; Nelken, N. A., J. Clin. Invest., 1991, 88, 1121], ревматоїдний артрит [див., наприклад, Koch, A. E., et al., J. Clin. Invest., 1992, 90, 772; Akahoshi, Т., et al., Arthritis Rheum., 1993, 36, 762; Robinson, E., et al., Clin. Exp. Immunol., 101, 398], нефрит [див., наприклад, Noris, M., et al., Lab. Invest, 1995, 73, 804; Wada, T, at al., Kidney Int., 1996, 49, 761; Gesualdo, L, et al., Kidney Int., 1997, 51, 155], нефропатія [див., наприклад, Saitoh, A, et al., J. Clin. Lab. Anal, 1998, 12, 1; Yokoyama, H, et al., J. Leukoc. Biol., 1998, 63, 493], фіброз легенів, саркоїдоз легенів [див., наприклад, Sugiyama, Y, et al., Internal Medicine, 1997, 36, 856], астма [див., наприклад Karina, M, et al., J. In vest. Allergol. Clin. Immunol, 1997, 7, 254; Stephene, T. H., Am. J. Respir. Crit. Care Med, 1997, 156, 1377; Sousa, A. R, et al., Am. J. Respir. Cell Mol. Biol, 1994, 10, 142], розсіяний склероз [див., наприклад, McManus, C, et al., J. Neuroimmunol, 1998, 86, 20], псоріаз [див., наприклад, Gillitzer, R, et al., J. In vest. Dermatol, 1993, 101, 127], запальне захворювання кишечнику [див., наприклад, Grimm, M. C, et al., J. Leukoc. Biol, 1996, 59, 804; Reinecker, H. C, et al., Gastroenterology, 1995, 106, 40], міокардит [див., наприклад, Seino, Y, et al., Цитокін, 1995, 7, 301], ендометріоз [див., наприклад, Jolicoeur, C, et al., Am. J. Pathol, 1998, 152, 125], інтраперитонеальна адгезія [див., наприклад, Zeyneloglu, H. В, et al., Human Reproduktion. 1998, 13, 1194], застійна серцева недостатність [див., наприклад, Aurust, P, et al., Circulation, 1998, 97, 1136], хронічне захворювання печінки [див., наприклад, Marra, F, et al., Am. J. Pathol, 1998, 152, 423], вірусний менінгіт [див., наприклад, Lahrtz, F, et al., Eur. J. Immunol., 1997, 27, 2484], хвороба Кавасакі [див., наприклад, Wong, M.; et al., J. Rheumatol, 1997, 24, 1179] і сепсис [див., наприклад, Salkowski, C. A.; et al., Infect. Immun, 1998, 66, 3569]. Крім того, повідомляється, що антитіла проти MCP-1 проявляють інгібіторний ефект або терапевтичний ефект на тваринних моделях ревматоїдного артриту [див., наприклад, Schimmer, R. C, et al., J. Immunol, 1998, 160. 1466; Schrier, D. J, J. Leukoc. Biol, 1998, 63, 359; Ogata, H, et al., J. Pathol, 1997, 182, 106], розсіяного склерозу [див., наприклад, Karpus, W. J, et al., J. Leukoc. Biol, 1997, 62, 681], нефриту [див. наприклад. Lloyd, C. M., et al., J. Exp. Med, 1997, 185, 1371; Wada, T, et al., FASEB J., 1996, 10, 1418], астми [див., наприклад, Gonzalo, J.-A., et al., J. Exp. Med.,1998, 188, 157; Lukacs, N. W., J. Immunol., 1997, 158, 4398], атеросклерозу [див., 9 83917 наприклад, Guzman, L. A., et al., Circulation, 1993, 88 (suppl.), 1-371], гіперчутливості відкладеного типу [див., наприклад, Rand, M. L., et al., Am. J. Pathol., 1996, 148, 855], легеневої гіпертензії [див., наприклад, Kimura, H., et al., Lab. Invest., 1998, 78, 571] і інграперитонеальної адгезії [див., наприклад, Zeyneloglu, H. В., et al., Am. J. Obstet. Gynecol., 1998, 179, 438]. Також повідомляється, що пептидний антагоніст MCP-1, MCP-1 (9-76) інгібує артрит на мишачій моделі [див., Gong, J.-H., J. Exp., 4ed., 1997, 186, 131], а також дослідження на MCP1-дефіцитних мишах показали, що MCP-1 є істотно необхідними для мобілізації моноцитів in vivo [див., Lu, В., et al., J. Exp. Med., 1998, 187, 601; Gu, L., et al., Moll. Cell, 1998, 2, 275]. Хронічна обструктивна хвороба легенів (ХОХЛ) знаходиться в ряді найбільш частих причин смерті в західному суспільстві. Вона визначається прогресуючим погіршенням функції легені, тільки частково оборотним бронходилятаторними ліками. XOXЛ характеризується хронічним запаленням у дихальних шляхах або альвеолах, що відрізняється від того, що спостерігають при астмі, включаючи збільшення числа нейтрофілів, макрофагів, Т-клітин CD8+ і/або тучних клітин у с і інках повітряних шляхі в, альвеолярних фрагментах і судинній гладкій мускулатурі Вважають, що цитокіни, асоційовані з ХОХЛ, включають фактор некрозу пухлин (TNТ)-альфа, інтерферон (IFN)-гама, інтерлейкін (IL)-1 бета, IL-6, IL-8 і MCP-1. Відомо, що CCR2 є рецептором для MCP-1, і недавні дані підтверджують роль CP-1 і CCR2 у корекції дихальних шляхів і запаленні безпосередньо або через макрофаги. Таким чином, антагоністи CCR2 являють собою привабливий підхід до терапевтичного лікування ХОХЛ [De Boer, W. І., Chest, 2002, 121, 209S-218S]. Літературні джерела вказують, що хемокіни, такі як MCP-1 і MIP-1a, залучають моноцити і лімфоцити до ділянок захворювання і опосередковують їх активацію і, таким чином, вважають, що вони тісно залучені в ініціацію, розвиток і підтримку захворювань зі значною участю моноцитів і лімфоцитів, таких як атеросклероз, діабет, рестеноз, ревматоїдний артрит, псоріаз, астма, виразковий коліт, нефрит (нефропатія), розсіяний склероз, фіброз легенів, міокардит, гепатит, панкреатит, саркоїдоз, хвороба Крона, ендометріоз, конгестивна серцева недостатність, вірусний менінгіт, інфаркт мозку, нейропатія, хвороба Кавасакі і сепсис [див., наприклад, Rovin, B. H., et al., Am. J. Kidney. Dis., 1998, 31, 1065; Lloyd, C, et al., Curr. Opin. Nephrol. Hypertens., 1998, 7, 281; Conti, P., et al., Allergy and Asthma Proc, 1998, 19, 121; Ransohoff, R. M., et al., Trends Neurosci., 1998, 21, 154; MacDermott, R. P., et al., Inflammatory Bowel Diseases, 1998, 4, 54]. Хемокіни зв'язуються зі специфічними рецепторами на поверхні клітин, що належать до сімейства зв'язаних з G-білком семи трансмембранних доменних білків [огляд даний в Horuk, Trends Pharm. Sci., 15, 159-165 (1994)], які називають терміном "хемокінові рецептори". При зв'язуванні з їх родинними лігандами хемокінові рецептори передають внутрішньоклітинний сигнал через асоційо 10 вані тривимірні G-білки, що приводить разом з іншими відповідями, до швидкого збільшення концентрації внутрішньоклітинного кальцію, змін форми клітин, підвищеної експресії молекул клітинної адгезії, дегрануляції і стимуляції клітинної міграції. Гени, що кодують рецептори специфічних хемокінів, були клоновані, і відомо, що ці рецептори являють собою зв'язані з G-білком сім трансмембранних доменних білків, які є присутнім на різних популяціях лейкоцитів. Дотепер ідентифіковані щонайменше шість СХС-хемокінових рецепторів (CXCR1-CXCR6) і дев'ять CC-хемокінових рецепторів (CCR1-CCR8 і CCR10). Наприклад, IL-8 є лігандом для CXCR1 і CXCR2, MIP-1a є лігандом для CCR1 і CCR5, а МСР-1 є лігандом для CCR2A і CCR2B [для посилання, див., наприклад, Holmes, W. E., et al., Science 1991, 253, 1278-1280; Murphy P. M., et al., Science, 253, 1280-1283; Neote, K. et al., Cell, 1993, 72, 415-425; Charo, І. F., et al., Proc. Natl. Acad. Sci. USA, 1994, 91, 2752-2756; Yamagami, S., et al., Biochem. Biophys. Res. Commun., 1994, 202, 1156-1162; Combadier, C, et al., The Journal of Biological Chemistry. 1995, 270, 16491-16494, Power, C. A., et al., J. Biol. Chem., 1995, 270, 19495-19500; Samson, M., et al., Biochemistry, 1996, 35, 3362-3367; Murphy, P. M., Annual Review of Immunology, 1994, 12, 592-633]. Повідомлялося, що запалення легені і утворення гранульоми придушуються в CCR1-дефіцитних мишей [див. Gao, J.-L., et al., J. Exp. Med., 1997, 185, 1959; Gerard, C, et al., J. Clin. Invest., 1997, 100, 2022], і що мобілізація макрофагів і утворення атеросклеротичного ушкодження зменшується в CCR2-дефіцитних мишей [див. Boring, L., et al., Nature, 1998, 394, 894; Kuziel, W. A., et al., Proc. Natl. Acad. Sci., USA, 1997, 94, 12053; Kurihara, T., et al., J. Exp. Med., 1997, 186, 1757; Boring, L., et al., J. Clin. Invest., 1997, 100, 2552]. Хемокінові рецептори також відомі як співрецептори для входження вірусу, що приводить до вірусних інфекцій, таких як, наприклад, ВІЛінфекція. Зворотна транскрипція і процесинг білка є класичними стадіями життєвого циклу вірусу, що планується блокувати антиретровірусними терапевтичними засобами. Незважаючи на і є, що багато нових ліків, які як вважають, блокують входження вірусу, залишаються обіцяючими, у цей час не існує засобу, до якого ВІЛ-1 не був би здатний набути резистентності. Для генерації генетичної розмаїтості, що утворює основу для резистентності, потрібні множинні цикли реплікації вірусу. Комбінаційна терапія, у якій реплікація максимально придушується, залишається наріжним каменем лікування інгібіторами входження вірусу, як і іншими засобам. Вважають, що націлювання множинних стадій у межах процесу входження вірусу має потенціал для синергізму [Starr-Spires et al., Clin. Lab Med., 2002, 22(3), 681]. Входження ВІЛ-1 у клітини CD4(+) вимагає послідовних взаємодій глікопротеїнів оболонки вірусу з CD4 і співрецепторам, таким як хемокінові рецептори CCR5 і CXCR4. Прийнятний підхід для блокування цього процесу полягає в застосуванні низькомолекулярних антагоністів функції співрецептора. Молекула ТАК-779 являє собою один 11 83917 такий антагоніст CCR5, що діє для запобігання інфекції ВІЛ-1. ТАК-779 інгібує реплікацію ВІЛ-1 на стадію мембранного злиття за допомогою блокування взаємодії глікопротеїну поверхні gp120 з CCR5. Ділянка зв'язування для ТАК-779 на CCR5 розташована поблизу позаклітинної поверхні рецептора усередині порожнини, утвореної між трансмембранними спіралями 1, 2, 3 і 7 [Dragic et al., Proc Natl. Acad. Sci. USA, 2000, 97(10), 5639]. Вважають, що хемокінові рецептори CXCR4 і CCR5 можуть бути використані як співрецептори T клітинно-тропними (Х4) і макрофаг-тропними (R5) штамами ВІЛ-1, відповідно, для входження в їх клітини-хазяї. Розмноження штамів R5 ВІЛ-1 на лімфоцитах CD4 і макрофагах вимагає експресії співрецептора CCR5 на клітинній поверхні. Особи з браком CCR5 (CCR5 Дельта 32 гомозиготний генотип) э фенотипово нормальними і резистентними до інфекції ВІЛ-1. Входження вірусу може інгібуватися природним лігандом для CXCR4 (СХС-хемокін SDF-1) і CCR5 (CC-хемокіни RANTES, MIP-1альфа і MIP-1бета). Перша непептидна сполука, що взаємодіє із CCR5, а не з CXCR4, являє собою похідне четвертинного амонію, назване ТЛК-779, що також має високу, але мінливу активність проти BIЛ [De Clercq et al., Anti vir. Chem. Chemother. 2001, 12 Suppl. 1, 19]. SCH-C (SCH 351125) являє собою ще один низькомолекулярний інгібітор входження ВІЛ-1 через співрецептор CCR5. SCH-C, сполука оксимпіперидину, являє собою специфічний антагоніст CCR5, як визначено при аналізах зв'язування з множиною рецепторів і сигнальної трансдукції. Ця сполука специфічно інгібує ВІЛ-1-інфекцію, опосередковану CCR5 у клітинах U-87 асгрогліоми, але не вливає ніяк на інфекцію CXCR4-експресуючих клітин. [Strizki et al., Proc. Natl. Acad. Sci. USA, 2001, 98(22), 12718 or Tremblay et al., Antimicrobial Agents and Chemotherapy, 2002, 46(5), 1336]. AD101, хімічно споріднений з SCH-C, також інгібує входження вірусу імунодефіциту людини гипу 1 (ВІЛ-1) через людські CCR5. Було виявлено, що AD101 інгібує входження ВІЛ-1 через CCR5 макаки-резусу, у той час як SCH-C так не діє. Серед восьми залишків, які розрізняються при порівнянні версій співрецептора людини і макаки, тільки один, а саме, метіонін-198, відповідає за нечутливість CCR5 макаки до інгібування за допомогою SCH-C. Положення 198 знаходиться в CCR5 трансмембранній (TM) спіралі 5 і не розташоване в межах раніше визначеної ділянки зв'язування для AD101 і SCH-C, що включає залишки в TM спіралях 1, 2, 3 і 7. На підставі досліджень амінокислотних заміщень в CCR5, припустили, що область CCR5 поруч із залишком 198 може впливати на конформаційний стан цього рецептора. [Billick et al., 2004, J. Virol, 78 (8), 4134]. Ідентифікація сполук, які модулюють активність хемокінових рецепторів, представляє бажаний підхід до створення ліків для необхідної розробки фармакологічних засобів для лікування захворювань, асоційованих з активністю хемокінового рецептора. Сполуки за даним винаходом допомагають реалізовувати ці і інші потреби. Даний винахід надає сполуку формули І: 12 або її фармацевтично прийнятні солі або проліки, де складові елементи подані в даному описі. Даний винахід додатково надає композиції, що містять сполуку формули І і фармацевтично прийнятний носій. Даний винахід додатково надає способи модуляції активності хемокінового рецептора, що включають у себе контакт зазначеного рецептора із сполукою формули І. Даний винахід додатково надає способи лікування захворювання, асоційованого з експресією або активністю хемокінового рецептора в пацієнта, що включають у себе введення пацієнтові терапевтично ефективної кількості сполуки формули І. Даний винахід додатково надає застосування сполуки формули І у терапії. Даний винахід додатково надає застосування сполуки формули І для одержання лікарського засобу для застосування в терапії. Сполуки Даний винахід надає сполуки формули І: або її фармацевтично прийнятні солі або проліки, у яких: пунктирна лінія означає необов'язковий зв'язок; X являє собою N, NO або CR3; R1 являє собою С1-6 алкіл, (С0-6 алкіл)-О-(С1-6 алкіл), (С0-6 алкіл)-S-(С1-6 алкіл), (С0-6 алкіл)-(С3-7 циклоалкіл)-(С0-6 алкіл), OH, CO 2R10, гетероцикліл, CN, NR10R12, NSO 2R10 , NCOR 10, NCO2R10 , NCOR 10, CR11CO2R10 , CR11 OCOR10 або феніл; R2 являє собою H, OH, галоген, С1-3 алкіл, 10 12 NR R , CO 2R10 , CONR10R12, NR10COR 11; 10 12 10 10 12 OCONR R , NR CONR R , гетероцикліл, CN, NR10-SO2-NR10R12, NR10-SO2-R12, SO 2-NR10R12 або оксо; де зазначений С 1-3 алкіл є необов'язково заміщеним 1-6 замісниками, вибраними з F і OH; R3 являє собою H, OH, галоген, С1-6 алкіл, С1-6 алкокси, NR10R11, NR10CO 2R1'; NR10CONR10R 11, NR10SO2NR10R11, NR10-SO 2-R11 , гетероцикліл, CN, CONR10R12, CO2R 10, NO 2, SR10 , SOR10 , SO2R 10; або SO2-NR10R11; 13 83917 R4 являє собою H, С1-6 алкіл, CF3, OCF 3, Cl, F, Br або феніл; R5 являє собою С1-6 алкіл, С1-6 алкокси, CO(С1-6 алкіл), С1-6тіоалкокси, піридил, F, Cl, Br, С4-6 циклоалкіл, С4-6 циклоалкілокси, феніл, фенілокси, С3-6 циклоалкіл, С3-6 циклоалкілокси, гетероцикліл, CN, або CO2R10; де зазначений С 1-6 алкіл є необов'язково заміщеним одним або декількома OH або F; де зазначений С 1-66 алкокси, CO-(С1-6 алкіл) або С1-6 гіоалкокси є необов'язково заміщеними одним або декількома F; де зазначений піридил, феніл або фенілокси є необов'язково заміщеними одним або декількома замісниками, вибраними з галогену, CF 3, С1-4 алкіл і CO2R10; де зазначений С 3-6 циклоалкіл або С 3-6 циклоалкілокси є необов'язково заміщеними одним або декількома F; R6 являє собою H, CF3, С1- 6 алкіл, F, Cl або Br; R7 являє собою H або С 1-6 алкіл, необов'язково заміщені 1-3 замісниками, вибраними з галогену, OH, CO2H, CO 2-(С1-6 алкіл) або С 1-3 алкокси; R8 являє собою H, С1-6 алкіл, F, С1-3 алкокси, С1-3 галогеналкокси, С3-6 циклоалкіл, С3-6 циклоалкілокси, OH, CO2R10, OCOR10 ; де зазначений С1-6 алкіл є необов'язково заміщеним одним або декількома замісниками, вибраними з F, С1-3 алкокси, OH або CO2R10; або R7 і R8 разом утворюють місточкову груп у С2-4 алкілен або -(С0-2 алкіл)-О-(С1-3 алкіл)- з утворенням 5-7 членного циклу; R9 являє собою гетероцикліл, необов'язково заміщений 1-4 замісниками, вибраними з С 1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13 , SR13 , C(O)R14, C(O)OR 13, C(O)NR15R16, NR15R16, NR15CONHR16, NR15C(O)R 14, NR15C(O)OR 13, S(O)R 14, S(O) 2R14 , S(O)NR15R16 або SO2NR15R16; R10 являє собою H, С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл, де зазначені С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл є необов'язково заміщеними 1-3 замісниками вибраними з галогену, OH, С1-3 алкілу, С1-3 алкокси, CO2H, СО2-(С1-6 алкіл) і CF3; R11 являє собою H, OH, С1-6 алкіл, С1-6 алкокси, бензил, феніл або С 3-6 циклоалкіл, де зазначені С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл є необов'язково заміщеними 1-3 замісниками, вибраними з галогену, OH, С1-3 алкілу, С1-3 алкокси, CO2H, CO2-(С1-6 алкіл) і CF3; R12 являс собою H, С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл, де зазначені С1-6 алкіл, бензил, феніл або С3-6 циклоалкіл є необов'язково заміщеними 1-3 замісниками, вибраними з галогену, OH, С1-3 алкілу, С1-3 алкокси, CO2H, CO2-(С1-6 алкіл) і CF3; R13 і R14 являють собою кожний незалежно, H, С1-6 алкіл, С1-6 галогеналкіл, С2-6 алкеніл, С2-6 алкініл, арил, циклоалкіл, арилалкіл або циклоалкілалкіл; R15 і R16 являють собою кожний, незалежно H, С1-6 алкіл, С1-6 галогеналкіл, С2-6 алкеніл, С2-6 алкініл, арил, циклоалкіл, арилалкіл або циклоалкілалкіл; або R15 і R16 разом з атомом N, до якого вони приєднані, утворюють 4-6 членну гетероциклільну груп у. 14 У деяких варіантах здійснення X являє собою N або NO. У деяких варіантах здійснення X являє собою CR3. У деяких варіантах здійснення R1 являє собою С1-6 алкіл. У деяких варіантах здійснення R1 являє собою 2-пропіл. У деяких варіантах здійснення R2 являє собою H, OH, галоген або С 1-3 алкіл. У деяких варіантах здійснення R2 являє собою H. У деяких варіантах здійснення R3 являє собою H, OH, галоген або С 1-6 алкіл. У деяких варіантах здійснення R3 являє собою H. У деяких варіантах здійснення R4 являє собою H. У деяких варіантах здійснення R5 являє собою С1-6 алкіл, заміщений 1-4 F. У деяких варіантах здійснення R5 являє собою CF3. У деяких варіантах здійснення R6 являє собою H. У деяких варіантах здійснення R7 являє собою H. У деяких варіантах здійснення R являє собою H. У деяких варіантах здійснення R9 являє собою гетероарил, необов'язково заміщений 1-4 замісниками, вибраними з С 1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR13, C(O)R14, C(O)OR 13, C(O)NR15R 16, NR15R16, NR15CONHR16, NR15C(O)R 14, NR15C(O)OR 13, S(O)R14 , S(O)2R14, S(O)NR 15R16 або SO2NR15R16. У деяких варіантах здійснення R9 являє собою гетероарил, де гетероарил являє собою 5- або 6членний гетероарил, необов'язково заміщений 1-4 замісниками, вибраними з С 1-6 алкілу, С2-6 алкенілу, С 2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR13, SR 13, C(O)R14 , C(O)OR 13, C(O)NR15R 16, NR15R16, NR15CONHR16, NR15C(O)R 14, 15 13 14 14 NR C(O)OR , S(O)R , S(O) 2R , S(O)NR15R16 або SO2NR15R16. У деяких варіантах здійснення R9 являє собою гетероарил, де гетероарил являє собою піридил, піримідиніл, піразиніл, піридазиніл або триазиніл, кожний необов'язково заміщений 1-4 замісниками, вибраними з С 1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, галогену, С1-4 галогеналкілу, CN, NO2, OR 13, SR13, C(O)R14 , C(O)OR 13 , C(O)NR15R16, NR15R 16, NR15CONHR16, NR15C(O)R14, NR15C(O)OR 13, 14 14 15 16 S(O)R , S(O)2R , S(O)NR R або SO2NR15R16 . У деяких варіантах здійснення R9 являє собою гетероарил, де гетероарил являє собою іісніл, фураніл, тіазоліл, оксазоліл або імідазоліл, кожний необов'язково заміщений 1-4 замісниками, вибраними з С1-6 алкілу, С2-6 алкенілу, С2-6 алкінілу, іалогену, С1-4 галогеналкілу, CN, NO2, OR13, SR 13, C(O)R14, C(O)OR 13, C(O)NR15R16, NR15R 16, NR15CONHR16, NR15C(O)R14, NR15C(O)OR 13, S(O)R14, S(O)2R 14, S(O)NR 15R16 або SO2NR15R16 . У деяких варіантах здійснення R9 являє собою гетероарил, де зазначений гетероарил являє со 15 83917 бою тіазоліл, оксазоліл, піримідиніл або піридил, кожний необов'язково заміщений 1-3 замісниками із групи F, Cl, Br, І, метил, етил, метокси, eтокси або трифторметил. У деяких варіантах здійснення сполуки мають формулу II: У деяких варіантах здійснення сполуки мають формулу Illa, Illb або Illc: У різних місцях даного опису замісники сполук розкриті у вигляді гр уп або інтервалів. Конкретно мають на увазі, що даний винахід включає кожну індивідуальну підкомбінацію елементів таких груп і інтервалів. Наприклад, конкретно мають на увазі, що термін "C1-6 алкіл" індивідуально розкриває метил, етил, С3-алкіл, С4-алкіл, С5-алкіл і С 6-алкіл. Для сполук за винаходом, у яких змінний елемент з'являється більше одного разу, кожний змінний елемент може являти собою різний фрагмент, вибраний із групи Маркуша, що визначає даний змінний елемент. Наприклад, там, де описана структура, що має дві групи R, які одночасно присутні в тій самій сполуці; дві гр упи R можуть являти собою різні фрагменти, вибрані із групи Маркуша, визначеної для R. Додатково варто враховувати, що певні ознаки винаходу, які, для ясності, описані в контексті окремих варіантів здійснення, можуть також бути запропоновані в поєднанні з єдиним варіантом 16 здійснення. Навпаки, різні ознаки винаходу, які для стислості описані в контексті єдиного варіанта здійснення, можуть також бути запропоновані окремо або в будь-якій прийнятній субкомбінації. При використанні в даному описі мають на увазі, що термін "алкіл" стосується насиченої вуглеводневої групи, що є прямоланцюжковою або розгалуженою. Зразкові алкільні групи включають метил (Me), етил (Et), пропіл (наприклад, н-пропіл і ізопропіл), бутил (наприклад, н-бутил, ізобутил, трет-бутил), пентил (наприклад, н-нентил, ізопентил, неопентил), і т. п. Алкільна група може містити від 1 до приблизно 20, від 2 до приблизно 20, від 1 до приблизно 10, від 1 до приблизно 8, від 1 до приблизно 6, від 1 до приблизно 4 або від 1 до приблизно 3 атомів вуглецю. Як використовується в даному описі, термін "алкеніл" стосується алкільної групи, яка має один або більше подвійних вуглець-вуглецевих зв'язків. Зразкові алкенільні групи включають етеніл, пропеніл, циклогексеніл і т. п. Як використовується в даному описі, термін "алкініл" стосується алкільної групи, яка має один або більше потрійних вуглець-вуглецеви х зв'язків. Зразкові алкінільні групи включають етиніл, пропініл і т. п. Як використовується в даному описі, термін "галогеналкіл" стосується алкільної групи, що має один або декілька замісників - галогенів. Зразкові галогеналкільні групи включають CF3, C2F5, CHF2, CCl3, CHCl2, C2Cl5 і т. п. Як використовується в даному описі, термін "арил" стосується моноциклічних або поліциклічних (наприклад, що має 2, 3 або 4 спряжених цикли) ароматичних вуглеводнів, таких як, наприклад, феніл, нафтил, антраценіл, фенантреніл, інданіл, інденіл і т. п. У деяких варіантах здійснення арильні групи мають від 6 до приблизно 20 атомів вуглецю. Як використовується в даному описі, термін "циклоалкіл" стосується неаромаіичних карбоциклів, що включає циклізовані алкільні, алкенільні і алкінільні групи. Циклоалкільні групи можуть включати моно- або поліциклічні (наприклад, що мають 2, 3 або 4 спряжених цикли) циклічні системи, а також спіроциклічні системи. Зразкові циклоалкільні групи включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, циклогексадієніл, циклогсптатриєніл, норборніл, норпініл, норкарніл, адамантил і т. п. Також включені у визначення циклоалкілу фрагменти, які мають один або більше ароматичних циклів, сконденсованих (тобто, які мають загальний зв'язок) із циклоалкільним циклом, наприклад, бензопохідні пентану, пентену, гексану і т. п. У деяких варіантах здійснення, циклоалкільні групи можуть мати від приблизно 3 до приблизно 10 або приблизно від 3 до приблизно 7 циклоутворюючих атомів вуглецю. Як використовується в даному описі, термін "гетероцикліл" або "гетероцикл" стосується насиченого або ненасиченого циклічного вуглеводню, де один або більше із циклоутворюючих атомів вуглецю циклічного вуглеводню замінені на гетероатом, такий як O, S або N. Гетероциклільні групи 17 83917 можуть бути ароматичними (наприклад, "гетероарил") або неароматичними (наприклад, "гетероциклоалкіл"). Гетероциклільні і руни можуть також відповідати гідрованим і частково гідрованим гетероарильним і рунам. Гегероциклільні групи можуть включати моно- або поліциклічні (наприклад, що мають 2, 3 або 4 спряжених цикли) циклічні системи. Гетероциклільні групи можуть характеризуватися, що як такі, що мають 3-14 або 3-7 циклоутворюючих атомів. У деяких варіантах здійснення гетероциклільні групи можуть містити, на додаток щонайменше до одного гетероатому, від приблизно 1 до приблизно 13, від приблизно 2 до приблизно 10 або від приблизно 2 до приблизно 7 атомів вуглецю і можуть бути приєднані через атом вуглецю або гетероатом. У додаткових варіантах здійснення, гетероатом може бути окислений (наприклад, мати оксо- або сульфідозамісник) або атом азоту може бути кватернізований. Приклади і етероциклільних гр уп включають морфоліно, тіоморфоліно, піперазиніл, тетрагідрофураніл, тетрагідротієніл, 2,3-дигідробензофурил, 1,3бензодіоксол, бензо-1,4-діоксан, піперидиніл, піролідиніл, ізоксазолідиніл. ізотіазолідиніл, піразолідиніл, оксазолідиніл, тіазолідиніл, імідазолідиніл і т. п., а також кожну із груп, перерахованих нижче для "гетероарилу" і "гетероциклоалкілу." Додаткові приклади гетероциклів включають піримідиніл, фенантридиніл, фенантролініл, феназиніл, фенотіазиніл, феноксатіїиніл, феноксазиніл, фталазиніл, піперазиніл, піперидиніл, 3,6-дигідропіридил, 1,2,3,6-тетрагідропіридил, 1,2,5,6тетрагідропіридил, піперидоніл, 4-піперидоніл, піпероніл, птеридиніл, пуриніл, піраніл, піразиніл, піразолідиніл, піразолініл, піразоліл, піридазиніл, піридооксазол, піридоімідазол, піридотіазол, піридиніл, піридил, піримідиніл, піролідиніл, піролініл, 2Н-піроліл, піроліл, тетрагідрофураніл, тетрагідроізохінолініл, тетрагідрохінолініл, тетразоліл, 6Н1,2,5-тіадіазиніл, 1,2,3-тіадіазоліл, 1,2,4тіадіазоліл, 1,2,5-тіадіазоліл, 1,3,4-тіадіазоліл, тіантреніл, тіазоліл, тієніл, тієнотіазоліл, тієнооксазоліл, тієноімідазоліл, тіофеніл, триазиніл, 1,2,триазоліл, 1,2,4-триазоліл, 1,2,5-триазоліл, 1,3,4триазоліл, ксантеніл, октагідро-ізохінолініл, оксадіазоліл, 1,2,3-оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,5оксадіазоліл, 1,3,4-оксадіазоліл, оксазолідиніл, оксазоліл, оксазолідиніл, хіназолініл, хінолініл, 411-хінолізиніл, хіноксалініл, хінуклідиніл, акридиніл, азоциніл, бензімідазоліл, бензофураніл, бензотіофураніл, бензотіофеніл, бензоксазоліл, бензтіазоліл, бензтриазоліл, бензтетразоліл, бензізоксазоліл, бензізотіазоліл, бензімідазолініл, метилендіоксифеніл, морфолініл, нафтиридиніл, дека-гідрохінолініл, 2Н,6Н-1,5,2-дитіазиніл, дигідрофуро[2,3-b]тетрагідрофуран, фураніл, фуразаніл, карбазоліл, 4аН-карбазоліл, карболініл, хроманіл, хроменіл, цинолініл, імідазолідиніл, шідазолініл, імідазоліл, 1Н-індазоліл, індолеліл, індолініл, індолізиніл, індоліл, 3H-індоліл, ізобензофураніл, ізохроманіл, ізоіндазоліл, ізоіндолініл, ізоіндоліл, ізохінолініл, ізотіазоліл і ізоксазоліл. Додаткові приклади гетероциклів включають азегидин-1-іл, 2,5-дигідро-1Н-пірол-1-іл, піпериндин-1іл, піперазин-1-іл, піролідин-1-іл, ізохінол-2-іл, пі 18 ридин-1-іл, 3,6-дигідропіридин-1-іл, 2,3дигідроіндол-1-іл, 1,3,4,9-іетрагідрокарболін-2-іл, тієно[2,3-с]піридин-6-іл, 3,4,10,10а-тетрагідро-1Нпіразино[1,2-а]індол-2-іл, 1,2,4,4а,5,6-гексагідропіразино[1,2-а]хінолін-3-іл, піразино[1,2-а]хінолін-3іл, діазепан-1-іл, 1,4,5,6-тетрагідро-2Нбензо[f]ізохінолін-3-iл, 1,4,4а,5,6,10b-гексагідро-2Нбензо[f]ізохінолін-3-іл, 3,3а,8,8а-тетрагідро-1Н-2аза-циклопента[а]інден-2-іл і 2,3,4,7-тетрагідро-1Назепін-1-іл, азепан-1-іл. Як використовується в даному описі, термін "гетероарильні" групи стосується ароматичного гетероциклу, що має щонайменше один гетероатом як елемент циклу, такий як сірка, кисень або азот. Гетероарильні групи включають моноциклічні і поліциклічні (наприклад, що мають 2, 3 або 4 спряжених цикли) системи. Приклади гетероарильних груп включають без обмежень, піридил, піримідиніл, піразиніл, піридазиніл, триазиніл, фурил (фураніл), хіноліл, ізохіноліл, тієніл, імідазоліл, тіазоліл, індоліл, пірил, оксазоліл, бензофурил, бензотієніл, бензтіазоліл, ізоксазоліл, піразоліл, триазоліл, тетразоліл, індазоліл, 1,2,4-тіадіазоліл, ізотіазоліл, бензотієніл, пуриніл, карбазоліл, бензімідазоліл, індолініл і т. п. У деяких варіантах здійснення, гетероарильна група має від 1 до приблизно 20 атомів вуглецю, і в додаткових варіантах здійснення від приблизно 3 до приблизно 20 атомів вуглецю. У деяких варіантах здійснення, гетероарильна група містить від 3 до приблизно 14, від 3 до приблизно 7, або від 5 до 6 циклоутворюючих атомів. У деяких варіантах здійснення, гетероарильна група має від 1 до приблизно 4, від 1 до приблизно 3, або від 1 до 2 гетероатомів. Як використовується в даному описі, термін "гетероциклоалкіл" стосується неароматичних гетероциклів, що включає циклізовані алкільні, алкенільні і алкінільні групи, де один або більше із циклоутворюючих атомів вуглецю замінені на гетероатом, такий як атом O, N, або S. Зразкові "гетероциклоалкільні" групи включають морфоліно, тіоморфоліно, піперазиніл, тетрагідрофураніл, тетрагідротієніл, 2,3-дигідробензофурил, 1,3бензодіоксол, бензо-1,4-діоксан, піперидиніл, піролідиніл, ізоксазолідиніл, ізотіазолідиніл, піразолідиніл, оксазолідиніл, тіазолідиніл, імідазолідиніл і т. п. Також включені у визначення гетероциклоалкілу фрагменти, які мають один або більше ароматичних циклів, конденсованих (тобто які мають загальний зв'язок) з неароматичним гетероциклічних циклом, наприклад, фталімідил, нафталімідил і бензопохідні гетероциклів, таких як індоленова і ізоіндоленова групи. У деяких варіантах здійснення, гетероциклоалкільна група має від 1 до приблизно 20 атомів вуглецю, і в додаткових варіантах здійснення від приблизно 3 до приблизно 20 атомів вуглецю. У деяких варіантах здійснення, гетероциклоалкілька група містить від 3 до приблизно 14, від 3 до приблизно 7, або від 5 до 6 циклоутворюючих атомів. У деяких варіантах здійснення, гетероциклоалкільна група має від 1 до приблизно 4, від 1 до приблизно 3, або від 1 до 2 гетероатомів. У деяких варіантах здійснення, гетероциклоалкільна група містить від 0 до 3 подвійних зв'язків. У деяких варіантах здійснення, гетероцик 19 83917 лоалкільна група містить від 0 до 2 потрійних зв'язків. Як використовуються в даному описі, терміни "гало" або "галоген" включають фтор, хлор, бром і йод. Як використовується в даному описі, термін "алкокси" стосується -О-алкільної групи. Зразкові алкоксигрупи включають метокси, етокси, пропокси (наприклад, н-пропокси і ізопропокси), третбутокси і т. п. Як використовується в даному описі, термін "тіоалкокси" стосується -S-алкільної групи. Як використовується тут термін "галогеналкокси" стосується -O- галогеналкільної групи. Зразкова галогеналкоксигрупа являє собою OCF3. Як використовується в даному описі, термін "циклоалкілокси" стосується -O-циклоалкілу. Як використовується в даному описі, термін "аралкіл" стосується алкільної і руни, заміщеної арильною групою. Як використовується в даному описі, термін "циклоалкілалкіл" стосується алкільної групи, заміщеної циклоалкільною групою. Як використовується в даному описі, термін "гетероциклілалкіл" стосується алкільного фрагмента, заміщеного гетерокарбоциклільною групою. Зразкові гетероциклілалкільні групи включають "гетероарилалкіл" (алкіл, заміщений гетероарилом) і "гетероциклоалкілалкіл" (алкіл, заміщений гетероциклоалкілом). У деяких варіантах здійснення, гетероциклілалкільні групи мають від 3 до 24 атомів вуглецю на додаток до щонайменше одного циклоутворювального гетероатома. Як використовується в даному описі, термін "оксо" стосується =О. Сполуки, описані в даному описі, можуть бути асиметричними (наприклад, що мають один або більше стереоцентрів). Мають на увазі, що розглядаються всі стереоізомери, такі як енантіомери і діастереомери, якщо не зазначено інакше. Сполуки даного винаходу, які містять асиметрично заміщені атоми вуглецю, можуть бути виділені в оптично активній або рацемічних формах. Способи одержання оптично активних форм із оптично активних вихідних речовин відомі в даній галузі, як, наприклад, за допомогою поділу рацемічних сумішей або за допомогою стереоселективного синтезу. Багато геометричних ізомерів олефінів, C=N подвійних зв'язків, і т. п. можуть також бути присутніми у сполуках, описаних у даному документі, і всі такі стабільні ізомери розглядаються в даному винаході. Цис- і транс- геометричні ізомери сполук даного винаходу описані і можуть бути виділені у вигляді суміші ізомерів або як розділені ізомерні форми. Розділення рацемічних сумішей сполук може здійснюватися за допомогою кожною із численних способів, відомих у даній галузі. Зразковий спосіб включає фракційну перекристалізацію з використанням "хірального розділяючого агента", що є оптично активною, солеутворювальною органічною кислотою. Прийнятними розділяючими засобами для способів фракційної перекристалізації є. наприклад, такі оптично активні кислоти, як D- і Lформи винної кислоти, діацетилвинної кислоти, 20 дибензоїлвинної кислоти, мигдальної кислоти, яблучної кислоти, молочної кислоти або різні оптично активні камфорсульфонові кислоти, такі як b-камфорсульфонова кислота. Інші розділяючі засоби, придатні для способів фракційної кристалізації, включають стереоізомерно чисті форми aметилбензиламіну (наприклад, S- і R-форми, або діастереомерно чисті форми), 2-фенілгліцинол, норефедрин, ефедрин, H-метилефедрин, циклогексилетиламін, 1,2-діаміноциклогексан і т. п. Розділення рацемічних сумішей може також здійснюватися елююванням колонки, заповненої оптично активним розділяючим агентом (наприклад, динітробензоїлфенілгліцином). Прийнятна композиція елююючого розчинника може бути визначена фахівцем у даній галузі. Сполуки за винаходом також включають таутомерні форми, такі як кето-енольні таутомери. Сполуки за винаходом можуть також включати всі ізотопи атомів, що з устрічаються в проміжних сполуках або кінцевих сполуках. Ізотопи включають такі атоми, що мають однаковий атомний номер, але різні масові числа. Наприклад, ізотопи водню включають тритій і дейтерій. Фраза "фармацевтично прийнятні" використовується в даному описі для позначення тих сполук, речовин, композицій, і/або дозованих форм, які, у межах обгрунтованого медичного висновку, є придатними для застосування в контакті із тканинами людей і тварин без надлишкових токсичності подразнення, алергійної реакції або інших проблем або ускладнень, що відповідають раціональному співвідношенню сприятливий вплив/ризик. Даний винахід також включає фармацевтично прийнятні солі сполук, описаних у даному документі. Як використовується в даному описі, термін "фармацевтично прийнятні солі" стосується похідних розкритих сполук, де батьківську сполуку модифікують перетворенням існуючого фрагмента кислоти або основи в їх сольову форму. Приклади фармацевтично прийнятних солей включають, але без обмежень, мінеральні або органічні кислотні солі основних залишків, таких як аміни; лужні або органічні солі кислотних залишків, таких як карбонові кислоти; і т. п. Фармацевтично прийнятні солі даного винаходу включають загальноприйняті нетоксичні солі або четвертинні амонієві солі батьківської сполуки утворені, наприклад, з нетоксичних неорганічних або органічних кислот. Фармацевтично прийнятні солі даного винаходу можуть бути синтезовані з батьківської сполуки, що містить основний або кислотний фрагмент, загальноприйнятими хімічними способами. У цілому, такі солі можуть бути отримані взаємодією вільних кислотних або основних форм цих сполук зі стехіометричною кількістю відповідних основи або кислоти у воді або органічному розчиннику, або в їх суміші; звичайно є кращими неводні середовища, такі як ефір, етил ацетат, етанол, ізопропанол або ацетонітрил. Переліки прийнятних солей можна знайти в роботах [Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p.1418 і Journal of Pharmaceutical Science, 66, 2 (1977)], кожна з яких 21 83917 включена в даний опис у всій повноті як посилання. Даний винахід також включає проліки сполук, описаних у даному документі. Як він використовується в даному описі, термін "проліки" відноситься до будь-яких ковалентно зв'язаних носіїв, які вивільняють активні батьківські ліки, при введенні ссавцеві. Проліки можуть бути отримані модифікацією функціональної групи, яка присутня у сполуках, таким чином, що дані модифікації розщеплюються, або при рутинних маніпуляціях, або in vivo, до батьківських сполук. Проліки включають сполуки, у яких гідроксильні, аміно, сульфгідрильні або карбоксильні групи зв'язуються з будь-якою групою так, що при введенні ссавцеві, розщеплюються з утворенням вільної гідроксильної, аміно, сульфгідрильної або карбоксильної групи відповідно. Приклади проліків включають, але без обмеження зазначеними, ацетатні, форміатні і бензоатні похідні спиртової і амінної функціональних груп у сполуках за винаходом. Одержання і застосування проліків обговорюється [T. Higuchi і V. Stella, "Prodrugs as Novel Delivery Systems," Vol.14 of the A.C.S. Symposium Series, і в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association і Pergamon Press, 1987], які обидві включені в даний опис як посилання у всій повноті. Синтез Сполуки за винаходом, включаючи їх солі, гідрати і сольвати, можуть бути отримані з використанням відомих методів органічного синтезу і можуть бути синтезовані відповідно до кожного із численних можливих шляхів синтезу. Реакції для одержання сполук за винаходом можуть здійснюватися в прийнятних розчинниках, які можуть бути легко вибрані фахівцем, кваліфікованим в галузі органічною синтезу. Прийнятні розчинники можуть бути по суті нереакційноздатними стосовно вихідних речовин (реагентів), проміжних сполук або продуктів при температурах, при яких здійснюються реакції, наприклад, температурах, які можуть знаходитися в інтервалі від температури замерзання розчинника до температури кипіння розчинника. Дана реакція може здійснюватися в одному розчиннику або в суміші більш 22 ніж одного розчинника. Залежно від конкретної стадії реакції, можуть бути вибрані прийнятні розчинники для конкретної стадії реакції. Одержання сполуки за винаходом може включати захист різних хімічних груп і зняття захисних груп. Необхідність у захисті і знятті захисних груп і вибір відповідних захисних груп можуть бути легко визначені фахівцем у даній галузі. Хімію захисних груп можна знайти, наприклад, у роботі [T.W. Green і P.G.M. Wuts, Protective Groups in Organic Syn yhesis, 3rd. Ed., Wiley & Sons, Inc., New York (1999)], що включена в даний опис у всій повноті як посилання. Моніторинг реакцій можна проводити відповідно до будь-якого прийнятного способу, відомого у даній галузі. Наприклад, утворення продукту можна реєструвати спектроскопічними засобами, такими як спектроскопія ядерного магнітного резонансу (наприклад, 1H або 13C), інфрачервона спектроскопія, спектрофотометрія (наприклад, УФвидима) або мас-спектрометрія або хроматографією, такою як високоефективна рідинна хроматографія (ВЕРХ) або тонкошарова хроматографія. Зразкові шляхи синтезу сполук за винаходом надані на схемах 1-6 нижче, де складові елементи зображених формул визначені в даному документі. Проміжні сполуки формули 1-5 можуть бути отримані з використанням методики, описаної на схемі 1. Доступна для придбання карбонова кислота 1-1 може бути перетворена в складний ефір, такий як метиловий ефір, обробкою сумішшю йодометан/карбонат калію в ДМФА. Отриманий у результаті складний ефір 1-2 може бути підданий алкілуванню галогенідом, таким як йодид (R1І) з використанням основи, такої як гексаметилдисилазид літію (LHMDS), з одержанням алкілованого продукту 1-3 у вигляді суміші цис- і трансдіастереомерів (відношення 4:1). Мінорний трансдіастереомер може бути вилучений кристалізацією з наступним гідролізом складного ефіру до кислоти. Отриману в результаті енантіомерно кислоту 14 піддають гідруванню з використанням каталізатора, такого як Pd-C з одержанням насиченої карбонової кислоти 1-5. 23 83917 24 Проміжні сполуки формули 2-5 можуть бути отримані з використанням методик, представлених на схемі 2. Послідовне відновлення доступного для придбання 2-1 (наприклад, 4трифторметилфенілацетонітрилу) в амін гідруванням з використанням каталізатора, такого як нікель Ренея, ацилювання аміну трифтороцтовим ангідридом може приводити до одержання аміду 2-3. Отриманий у результаті амід може бути оброблений формальдегідом у присутності сильної кислоти, такої як сірчана кислота з одержанням циклізованого похідного тетрагідроізохіноліну 2-4. Видалення трифторацетильної групи обробкою карбонатом калію у воді і етанолі дає проміжну сполуку 2-5. Сполуки формули 3-9 (наприклад, 5-азатетрагідроізохінолін) можуть бути отримані відповідно до схеми 3. Доступна для придбання проміжна сполука формули 3-1 (наприклад, 5трифторметилпіридин-2-ол) може бути бромована обробкою бромом в оцтовій кислоті з утворенням проміжних сполук формули 3-2. Літіювання проміжних сполук формули 3-2 з використанням алкіллітію, такого як н-бутиллітій або трет-бутиллітій, з наступним гасінням ДМФА може приводити до одержання альдегіду 3-3. Альдегід може бути перетворений у ціаногрупу обробкою гідроксиламіном у присутності форміату натрію/мурашиної кислоти з одержанням проміжних сполук 3-4. Наступна конверсія гідроксилу в хлор (3-5), заміна хлору трет-бутилметилмалонатом дає складний діефір 3-6. Гідрування в присутності каталізатора, такого як нікель Ренея, відновлює ціаногрупу до аміну, який циклізується з метиловим складним ефіром з утворенням лактаму. Обробка лактаму сильною кислотою, такий як ТФОК (три фтороцтова кислота), видаляє трет-бутоксикарбонільний фрагмент. Отриманий у результаті лактам 3-8 відновлюють до аміну з використанням борану, що очищають за допомогою захисту аміну групою Вос. Видалення Вос з використанням кислоти, такої як HCl у діоксані, дозволяє одержати продукт 3-9. 25 83917 26 Проміжна сполука карбонової кислоти формули 1-5 може сполучатися з аміном формули 4-1 з використанням стандартного засобу утворення аміду, такого як PyBrор або ВОР. Коли X=N , отриманий у результаті амід 4-2 може бути окислений з використанням окислювача, такого як mCPBA з одержанням N-оксиду 4-4. Видалення групи Вос з 4-2 і 4-4 з використанням кислоти, такої як HCl у діоксані, приводить до одержання вільних амінів 43 і 4-5 відповідно. Циклогексанонові похідні формули 5-5 можуть бути о тримані з використанням послідовності, зображеної на схемі 5. Гетероцикл (R9-X; де X є H або галогеном) може бути літійований обробкою бутиллітієм, і отриманий у результаті аніон може бути погашений моноетиленкеталем 1,4циклогексанону (5-2) з одержанням спирту 5-3. Обробка 5-3 водною кислотою, такою як HCl у воді, перетворить кеталь у кетон. Алкілуванням отриманого в результаті кетону 5-4 обробкою LDA з наступним гасінням алкілгалогенідом, таким як R8І, одержують циклогексанонові похідні формули 5-5. Замісники на гетероциклі можуть бути присутніми перед літіюванням, або гетероцикл може бути дериватизирований на наступних стадіях відповідно до рутинних способів, таких як додаткові реакції літіювання, з утворенням сполук за винаходом. Сполуки за винаходом можуть бути зібрані, як показано на схемі 6. Відновлювальним амінуванням кетону формули 5-5 аміном формули 4-3 з використанням відновника, такого як триацетоксиборгідрид натрію одержують сполуки формули 6-1. Зв'язувальний амін 6-1 може бути необов'язково алкілований, ацилований, захищений і т. п. відповідно до рутинних способів з утворенням похідних формули 6-2. 27 83917 Способи У деяких варіантах здійснення, сполуки за винаходом можуть модулювати активність одного або більше хемокінових рецепторів. Термін "модулювати" означає здатність збільшувати або зменшувати активність рецептора. Відповідно, сполуки за винаходом можуть застосовуватися в способах модуляції хемокінового рецептора за допомогою контакту рецептора з будь-якою однією або декількома із сполук або композицій, описаних у даному документі. У деяких варіантах здійснення сполуки даного винаходу можуть діяти як інгібітори хемокінових рецепторів. У додаткових варіантах здійснення сполуки за винаходом можуть застосовуватися для модуляції активності хемокінового рецептора в особи, що потребує модуляції рецептора за допомогою введення модулюючої кількості сполуки формули І. Хемокінові рецептори, з якими зв'язуються дані сполуки і/або які піддають модулюванню, включають будь-який хемокіновий рецептор. У деяких варіантах здійснення, хемокіновий рецептор належить до СС-сімейства хемокінових рецепторів, що включає наприклад, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8 і CCR10. У деяких варіантах здійснення, хемокіновий рецептор являє собою CCR2. Сполуки за винаходом можуть бути селективними. Під "селективними" мають на увазі, що сполука зв'язується з хемокіновим рецептором або інгібує хемокіновий рецептор з більшою афінністю або активністю, відповідно, у порівнянні щонайменше з одним іншим хемокіновим рецептором. Сполуки за винаходом можуть бути селективними інгібіторами або лігандами CCR2, що означає, що сполуки за винаходом можуть зв'язуватися з CCR2 або інгібувати його з більшою афінністю або активністю, відповідно, ніж для ще одного хемокіиового рецептора, такого як щонайменше один з CCR1, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8 і CCR10. У деяких варіантах здійснення сполуки за винаходом мають селективність зв'язування або інгібування, більш високу для CCR2 у порівнянні з CCR5. У деяких варіантах здійснення сполуки за винаходом мають селективність зв'язування або інгібування, більш високу для CCR2 у порівнянні з CCR1. У деяких варіантах здійснення сполуки за винаходом мають селективність зв'язу 28 вання або інгібування, більш високу для CCR2 у порівнянні з будь-якими іншими CCR. Селективність може бути щонайменше приблизно 10кратною, щонайменше приблизно 20-краіною, щонайменше приблизно 50-краіною, щонайменше приблизно 100-кратною, щонайменше приблизно 200-кратною, щонайменше приблизно 500кратною або щонайменше приблизно 1000кратною. Спорідненість зв'язування і активність інгібування можуть бути виміряні відповідно до рутинних способів у даній галузі, таких як відповідно до аналізів, представлених в даному описі. Даний винахід додатково надає способи лікування захворювання або порушення, асоційованих з хемокіновим рецептором, в окремої особи (наприклад, пацієнта) за допомогою введення особі, що потребує такого лікування, терапевтично ефективної кількості або дози сполуки даного винаходу або її фармацевтичної композиції. Захворювання, асоційоване з хемокіновим рецептором, може включати будь-яке захворювання, порушення або стан, що безпосередньо або опосередковано пов'язане з експресією або активністю хемокіну або хемокінового рецептора. Захворювання, асоційоване з хемокіновим рецептором або хемокіном, може також включати будь-яке захворювання, порушення або стан, що може бути відвернене, полегшене або вилікуване за допомогою модуляції активності хемокінового рецептора. Приклади захворювань, порушень і станів, асоційованих з хемокінами або хемокіновим рецептором, включають запалення і запальні захворювання, метаболічні захворювання, імунні порушення і рак. У деяких варіантах здійснення, захворювання, асоційоване з хемокіновим рецептором, являє собою вірусну інфекцію, таку як ВІЛінфекція. Приклади запальних захворювань, включають захворювання, які мають запальний компонент, такі як астма, сезонний і цілорічний алергійний риніт, синусит, кон'юнктивіт, вікову плямисту дегенерацію, харчову алергію, скомброїдне отруєння, псоріаз, кропивницю, сверблячку, екзему, запальне захворювання кишечнику, іромбічне захворювання, запалення середнього вуха, цироз печінки, захворювання серця, хвороба Альцгеймера, сепсис, рестеноз, атеросклероз, діабет типу II, метаболічний синдром, розсіяний склероз, хворобу Крона, виразковий коліт, захворювання легенів, 29 83917 пов'язані з гіперчутливістю, індукований ліками фіброз легенів, хронічну обструктивну хворобу легенів (ХОХЛ), ревматоїдний артрит, нефрит, виразковий коліт, атиповий дерматит, інсульт, гостре ушкодження нерва, саркоїдоз, гепатит, ендометріоз, невропатичний біль, пневмонія з гіперчутливістю, еозинофільна пневмонія, гіперчутливість відкладеного типу, інтерстиціальна хвороба легенів (ILD) (наприклад, ідіопатичний фіброз легенів, або ILD, асоційовану з ревматоїдним артритом, системний червоний вовчак, анкілозуючий спондиліт, системний склероз, синдром Сегрена, поліміозит або дерматоміозит) і т. п. Приклади імунних порушень включають ревматоїдний артрит, псоріатичний артрит, системний червоний вовчак, тяжку псевдопаралітичну міастенію, юнацький діабет; гломерулонефрит, аутоімунний тиреоїдит, відторгнення пересадженого органа, що включає відторгнення алотрансплантата і захворювання трансплантат проти хазяїна. Приклади ракових захворювань включають різновиду раку, такі як рак молочної залози, рак яєчника, множинна мієлома і г. п., які характеризуються інфільтрацією макрофагів (наприклад, макрофагів, асоційованих з пухлиною або TAMs) у п ухлини або хворі тканини. Як використовується в даному описі, термін "контакт" стосується привнесення разом зазначених фрагментів у системі in vitro або системі in vi vo. Наприклад, "контакт" хемокінового рецептора із сполукою винаходу включає введення сполуки за даним винаходом особі або пацієнту, такому як людина, що має хемокіновий рецептор, а також, наприклад, введення сполуки за винаходом в зразок, що містить клітинний або очищений препарат, який містить хемокіновий рецептор. Як використовується в даному описі, термін "індивід" або "пацієнт", використовуваний взаємозамінно, стосується будь-якої тварини, включаючи людей, переважно мишей, пацюків, інших гризунів, кроликів, собак, кішок, свиней, великої рогатої худоби, овець, коней або приматів і, найбільше переважно людей. Як використовується в даному описі, фраза "терапевтично ефективна кількість" стосується кількості активної сполуки або фармацевтичного засобу, який викликає біологічну або медичну відповідь, що вважається значимим у тканині, системі, тварині, суб'єкті або людині з погляду дослідника, ветеринара, лікаря або іншого клініциста, що включає один або декілька з наступних випадків. (1) профілактика захворювання: наприклад, профілактика захворювання, стани або порушення в суб'єкта, що може бути схильний до захворювання, стану або порушення, але ще не зіштовхувався із захворюванням і не проявляв патологію і симптоматологію захворювання (необмежувальні приклади являють собою профілактику захворювань легенів, пов'язаних з гіперчутливістю, індукованого ліками фіброзу легенів, хронічної обструктивної хвороби легенів (ХОХЛ), захворювання трансплантат проти хазяїна і/або відторгнення алотрансплантата після трансплантації, вірусної інфекції, резистентності до інсуліну, атеросклерозу або профілактику алергійних реакцій, таких як ати 30 повий дерматит, гіперчутливість відкладеною типу або сезонний або цілорічний алергійний риніт); (2) інгібування захворювання і його розвитку; наприклад, інгібування захворювання, стану або порушення в суб'єкта, що зіштовхується або проявляє патологію або симптоматологію захворювання, стану або порушення (тобто припинення подальшого розвитку патології і/або симптоматології), таке як інгібування запального або аутоімунної відповіді при захворюваннях легенів, пов'язаних з гіперчутливістю, індукованому ліками фіброзі легенів, хронічній обструктивній хворобі легенів (ХОХЛ), ревматоїдному артриті, вовчаку або псоріазі або інгібування розвитку атеросклеротичних бляшок, хвороби Альцгеймера, плямистій дегенерації або розвитку резистентності до інсуліну до діабетичного стану, або інгібування пухлинного росту, або стабілізація вірусного навантаження у випадку вірусної інфекції; і (3) полегшення симптомів захворювання; наприклад, полегшення симптомів захворювання, стану або порушення в суб'єкта, що зіштовхується або проявляє патологію або симптоматологію захворювання, стану або порушення (тобто і повернення патології і/або симптоматології), таке як зменшення аутоімунної відповіді при захворюваннях легенів, пов'язаних з гіперчутливістю, індукованому ліками фіброзі легенів, хронічній обструктивній хворобі легенів (XOXЛ), ревматоїдному артриті, вовчаку або псоріазі, або зменшення пухлини, асоційованої з раком, або зниження вірусного навантаження у випадку вірусної інфекції. Один або більше додаткових фармацевтичних засобів таких як, наприклад, противірусні засоби, антитіла, протизапальні засоби, стимулятори секреції інсуліну і сенсибілізатори, засоби, що модулюють сироваткові ліпіди, і переносники ліпідів і/або імуносупресори можуть застосовуватися у поєднанні зі сполуками даного винаходу для лікування захворювання, порушення або станів, асоційованих з хемокіновими рецепторами. Засоби можуть бути об'єднані з даними сполуками у вигляді разової або безперервної лікарської форми або засоби можуть уводитися одночасно або послідовно у вигляді роздільних лікарських форм. Прийнятні противірусні засоби, передбачувані для застосування в сполученні зі сполуками даного винаходу, можуть містити в собі нуклеозидні і нуклеотидні інгібітори зворотної транскриптази (NRTIs), ненуклеозидні інгібітори зворотної транскриптази (NNRTIs), інгібітори протеаз, інгібітори входу, інгібітори злиття, інгібітори дозрівання і інші противірусні ліки. Приклади прийнятних NRTIs включають зидовудин (AZT); диданозин (dd1); зальциіабін (dd); ставудин (d4T); ламівудин (ЗТС); абакавір (1592U89); адефовір дипівоксил [bis(POM)-PMEA]; лобукавір (BMS-180194); ВСН-10652; емитрицитабін |(-)-FТС]; бета-L-FD4 (який також називається бета-L-D4C і бета-b-2', 3'-диклеокси-5-фторцитиден); DAPD, ((-)-бета-D-2,6,-діаміно-пурин діоксолан); і лоденозин (Fdd). Типові NNRTIs включають невірапін (BI-RG587); делавірадин (BHAP, U-90152); сфавіренц (DMP-266); PNU-142721; AG-1549; МКС-442 (1 31 83917 (етокси-метил)-5-(1-метилетил)-6-(фенілмеіил)(2,4(1Н,3H)піримідил недіон), і (+)-каланолід A (NSC-675451) і В Типові прийнятні інгібітори протеаз включають саквинавір (Ro 31-8959); ритонавір (АВТРЕТ-538); індинавір (МК-639); нелфінавір (AG-1343); ампренавір (141W94), лазинавір (BMS-234475); DMP450; BMS-2322623; АВТРЕТ-378; і AG-1 549. Інші противірусні засоби включають гідроксисечовину, рибавірин, IL-2, IL-12, псніафузид, енфувіртид, С-34, циклотриазадисульфонамід CADA, РА-457 і Yissum Project No. 11607. У деяких варіантах здійснення, протизапальні або аналгезуючі засоби, передбачувані для застосування в сполученні зі сполуками даного винаходу, можуть включати, наприклад, агоніст опіатів, інгібітор ліпоксигеназ, такий як інгібітор 5ліноксигенази, інгібітор циклооксигенази, такий як інгібітор циклооксигенази-2, інгібітор інтерлейкінів, такий як інгібітор інтерлейкіну-1, інгібітор ФНП, такий як інфліксимаб, етанерцепт або адалімумаб, антагоніст NNMA, інгібітор оксиду азоту або інгібітор синтезу оксиду азоту, нестероїдний протизапальний засіб або цитокін-супресорний протизапальний засіб, наприклад, такі як ацетамінофен, аспірин, кодеїн, фентаніл, ібупрофен, індометацин, кетодлолак, морфін, напроксен, фенацетин, піроксикам, стероїдний анальгетик, суфентаніл, сунліндак, тенідап і г. п. Подібним чином, розчинні сполуки можуть уводитися разом з болезаспокійливим засобом; потенціюючим засобом, таким як кофеїн, Н2-антагоніст, симетикон, гідроксид алюмінію або магнію; протинабряковим засобом, таким як фенілефрин, фснілпропаноламін, псевдоефедрин, оксиметазолін, епінефрин, нафазолін, ксилометазолін, пропілгекседфин або леводезоксіефедрин; засіб проти кашлю, такий як кодеїн, гідрокодон, караміфен, карбетапентан або декстраметорфан; діуретик; і седативний або неседативний антигістамінний засіб. У деяких варіантах здійснення, фармацевтичні засоби, передбачувані для застосування в сполученні із сполуками за даним винаходом можуть включати, але не обмежуючись ними (а) антагоністи VL A-4, такі як антагоністи, описані в [патенті CШA 5510332, W095/15973, W096/01644, W096/06108, W096/20216, W096/229661, W096/31206, W096/4078, W097/030941, W097/022897, WO 98/426567, W098/53814, W098/53817, W098/538185, W098/54207 і W098/58902]; (b) стероїди, такі як беклометазон, метилпреднізолон, бетаметазон, преднізон, дексаметазон і гідрокортізон; (с) імуносупресори, такі як циклоспорин, такролімус, рапарніцин і інші імуносупресори типу FK506; (d) антигістаміни (антагоністи НІ-гістаміну), такі як бромфенірамін, хлорфенірамін, дексахлорфенірамін, трипролідин, клемастин, дифенгідрамін, дифенілпіралін, трипеленамін, гідроксизин, метдилазин, прометазин, трименразин, азатадин, ципрогептадин, антазолін, феніраміну піриларнін, астернізол, терфенадин, лоратадин, цетиризин, фексфенадин, десеарбоетоксилоратадин і т. п; (е) нестероїдні антиастматики, такі як тербуталін, метапротеренол, фенотерол, ізоетаіїн, албутерол, бітолтерол, пірбутерол, 32 теофілін, кромолін натрію, атропін, бромід іпратропія. антагоністи лейкотриєнів (наприклад, зафірлукаст, монгелукаст, пранлукаст, іралукаст, побілукаст, SKB-106203), інгібітори біосинтезу лейкотриєнів (наприклад, зилейтон, BAY-1005); (f) нестероїдні протизапальні засоби (NSAIDs), такі як похідні пропіонової кислоти (наприклад, алмінопрофен, беноксапрофен, буклоксинова кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбіпрофен. ібупрофен, індопрофен, кетопрофен, міропрофен, напроксен, оксапрозин. пірпрофен, пранопрофен, супрофен, тіапрофенова кислота і тіоксапрофен), похідні оцтової кислоти (наприклад, індометацин, ацернетацин, аклофенак, клідинак, диклофенак, фенклофенак, фенклозинова кислота, фентіазак, фурофенак, ібуфенак, ізоксепак, окспинак, суліндак, тіопінак, толметин, зидометацин і зомерипак), похідні фенарнинової кислоти (флуфенапнінова кислота, меклофенамінова кислота, рнефенамінова кислота, ніфлумінова кислота і толфвенарнінова кислота), похідні біфенілкарбонової кислоти (дифлунізал і флуфенізал), оксикарни (ізоксикарн, піроксикам, судоксикам і теноксикан), саліцилати (ацетилсаліцилова кислота, сульфасалазин) і піразолони (апазон, безпіперилон, фепразон, мофебутазон, оксифенбутазон, фенілбутазон); (g) інгібітори циклооксигенази-2 (СОХ-2); (h) інгібітори фосфодіестерази типу IV (PDE-IV); (і) інші антагоністи хемокінових рецепторів, особливо, CXCR-4, CCR1, CCR2, CCR3 і CCR5; (j) засобу зниження холестерину, такі як інгібітори HMG-Co редуктази (ловастатин, сиривастатин і правастатин, флувастатин, аторвастатин і інші статини), секвестранти (холестирамін і колестипол), нікотинова кислота, похідні фенофібринової кислоти (гемфіброзил, клофібрат, фенофібрат і бензафібрат) і пробукол; (k) протизапальні біологічні засоби, такі як засоби анти-ФНП-терапії, антитіла проти IL-1 рецептора, CTLA-4Ig, проти CD20 і проти-VLA4; (І) протидіабетичні засоби, такі як інсулін, сульфонілсечовини, бігуаніди (метформін), інгібітори U.-глюкозидази (акарбози) і орлітазони (троглітазон і піоглітазон); (m) препарати бета інтерферону (інтерферон бета-1о., інтерферон бета-1 P); (n) інші сполуки, такі як аміносаліцилові кислоти, антиметаболіти, такі як азатіоприн і 6меркаптопурин і цитотоксичні протиракові хіміотерапевтичні засоби. Масове відношення сполуки даного винаходу до др угого активного інгредієнта може змінюватися і буде залежати від ефективної дози кожного інгредієнта. Наприклад, антагоніст CCR2 може застосовуватися в сполученні із протизапальним засобом при лікуванні запалення, метаболічного захворювання, аутоімунного захворювання, раку або вірусної інфекції для поліпшення відповіді на лікування в порівнянні з відповіддю на терапевтичний засіб окремо, без загострення його токсичних ефектів. Додаткові або синергетичні ефекти є бажаними результатами сполучення антагоніста CCR2 сьогодення винаходу з додатковим засобом. Фармацевтичні готові форми і дозовані форми При використанні як фармацевтичних засобів сполуки формули І можуть уводитися у вигляді фармацевтичних композицій. Ці композиції можуть 33 83917 бути отримані шляхом, добре відомим в галузі фармацевтики, і можуть уводитися різними шляхами, залежно від того, чи є бажаним місцеве або системне лікування, і від області, що підлягає лікуванню. Введення може бути місцевим (включаючи офтальмологічні і на слизисті мембрани, включаючи інтраназальну, вагінальну і ректальну доставку), легеневим (наприклад, інгаляцією або інсуфляцією порошків або аерозолів, включаючи розпилювач; інтратрахеальним, інтраназальним, епідермальним і черезшкірним), пероральним або парентеральним. Парентеральне введення включає внутрішньовенне, внутрішньоартеріальне, підшкірне, внутрішньочеревинне, внутрішньом'я зове або ін'єкційне або інфузійне; або внутрішньочерепне, наприклад, інтратекальне або внутрішньошлункове введення. Парентеральне введення може здійснюватися у вигляді разової болюсної дози або, наприклад, за допомогою безперервного перфузійного насоса. Фармацевтичні композиції і готові форми для місцевого введення можуть включати черезшкірні пластири, мазі, лосьйони, креми, гелі, краплі, супозиторії, спреї, рідини і порошки. Загальноприйняті фармацевтичні носії, водні, порошкові або масляні основи, загусники і т. п. можуть бути необхідними або бажаними. Можуть також застосовуватися презервативи з покриттям, рукавички і г. п. Даний винахід також включає фармацевтичні композиції, які містять як активний інгредієнт, одну або більше із сполук формули І, наведеної вище, у сполученні з одним або більше фармацевтично прийнятних носіїв. При створенні композицій винаходу активний інгредієнт типовим чином змішують із ексципієнтом, розбавляють ексципієнтом або поміщають усередину такого носія у вигляді, наприклад, капсули, саше, папірця або іншого контейнера. Коли ексципієнт служить як розріджувач, він може являти собою тверду, напівтверду або рідку речовину, що діє як переносник, носій або середовище для активного інгредієнта. Таким чином, композиції можуть бути представлені у вигляді таблеток, пігулок, порошків, коржів, саше, облаток, еліксирів, суспензій, емульсій, розчинів, сиропів, аерозолів (у вигляді твердої речовини або в рідкому середовищі), мазей, що містять, наприклад, аж до 10%мас. активної сполуки, м'яких і твердих желатинових капсул, супозиторіїв, стерильних розчинів для ін'єкцій і стерильно упакованих порошків. При одержанні готової форми активна сполука може бути розмелена з одержанням відповідного розміру частинок перед об'єднанням з іншими інгредієнтами. Якщо активна сполука є по суті нерозчинною, вона може бути розмелена до розміру частинок менше ніж 200меш. Якщо активна сполука є по суті водорозчинною, розмір частинок може бути відрегульований розмелом з одержанням по суті однорідного розподілу в готовій формі, наприклад, приблизно 40меш. Деякі приклади прийнятних ексципієнтів включають лактозу, декстрозу, сахарозу, сорбіт, маніт, крохмалі, камедь акації, фосфат кальцію, альгінати, трагакант, желатин, силікат кальцію, мікрокристалічну целюлозу, полівінілпіролідон, целюлозу, 34 воду, сироп і метилцелюлозу. Готові форми можуть додатково включати: змащувальні засоби, такі як тальк, стеарат магнію і мінеральне масло; зволожуючі засоби; емульгуючі і суспендуючі засоби; консерванти, такі як метил- і пропілгідроксибензоати; підсолоджувачі; і віддушки. Композиції винаходу можуть бути сформовані таким чином, щоб одержати швидке, уповільнене або відкладене вивільнення активного інгредієнта після введення пацієнту з використанням методик, відомих у даній галузі. Композиції можуть бути сформовані в одиничну дозовану лікарську форму, причому кожне дозування містить приблизно від 5 до приблизно 1000мг (1г), більш звичайно, приблизно від 100 до приблизно 500мг активного інгредієнта. Термін "одиничні дозовані форми" стосується фізично дискретних одиниць, придатних як разові дозування для людей і інших ссавців, причому кожна одиниця містить заздалегідь визначену кількість активної речовини для одержання бажаного терапевтичного ефекту, у сполученні з прийнятним фармацевтичним ексципієнтом. У деяких варіантах здійснення сполуки або композиції винаходу містять від приблизно 5 до приблизно 50мг активного інгредієнта. Рядовий фа хівець у даній галузі оцінить, що ці варіанти здійснення стосуються сполук або композицій, що містять від приблизно 5 до приблизно 10, від приблизно 10 до приблизно 15, від приблизно 15 до приблизно 20, від приблизно 20 до приблизно 25, від приблизно 25 до приблизно 30, від приблизно 30 до приблизно 35, від приблизно 35 до приблизно 40, від приблизно 40 до приблизно 45, або від приблизно 45 до приблизно 50мг активного інгредієнта. У деяких варіантах здійснення, сполуки або композиції винаходу містять від приблизно 50 до приблизно 500мг активного інгредієнта. Рядовий фа хівець у даній галузі оцінить, що ці варіанти здійснення ставляться до сполук або композицій, що містять від приблизно 50 до приблизно 75, від приблизно 75 до приблизно 100, від приблизно 100 до приблизно 125, від приблизно 125 до приблизно 150, від приблизно 150 до приблизно 175, від приблизно 175 до приблизно 200, від приблизно 200 до приблизно 225, від приблизно 225 до приблизно 250, від приблизно 250 до приблизно 275, від приблизно 275 до приблизно 300, від приблизно 300 до приблизно 325, від приблизно 325 до приблизно 350, від приблизно 350 до приблизно 375, від приблизно 375 до приблизно 400, від приблизно 400 до приблизно 425, від приблизно 425 до приблизно 450, від приблизно 450 до приблизно 475, або від приблизно 475 до приблизно 500мг активного інгредієнта. У деяких варіантах здійснення, сполуки або композиції винаходу містять від приблизно 500 до приблизно 1000мг активного інгредієнта. Рядовий фа хівець у даній галузі оцінить, що ці варіанти здійснення стосуються сполук або композицій, що містять від приблизно 500 до приблизно 550, від приблизно 550 до приблизно 600, від приблизно 600 до приблизно 650, від приблизно 650 до приблизно 700, від приблизно 700 до приблизно 750, 35 83917 від приблизно 750 до приблизно 800, від приблизно 800 до приблизно 850, від приблизно 850 до приблизно 900, від приблизно 900 до приблизно 950, або від приблизно 950 до приблизно 1000мг активного інгредієнта. Активна сполука може бути ефективною у широкому діапазоні дозування і, у цілому, вводиться у фармацевтично ефективній кількості. Варто розуміти, однак, що кількість сполуки, що вводить у дійсності, буде визначатися лікарем, відповідно до враховуваних обставин, що включають стан, який підлягає лікуванню, вибраний шлях введення, дійсну сполуку, що вводиться, вік, масу тіла і відповідь індивідуального пацієнта, тяжкість симптомів пацієнта і т. п. Для одержання твердих композицій, таких як таблетки, основний активний інгредієнт змішують із фармацевтичним ексципієнтом для утворення твердої композиції попередньої готової форми, що містить гомогенну суміш сполуки даного винаходу. Посилання на ці композиції попередньої готової форми як гомогенні означають, що активний інгредієнт звичайно рівномірно розподілений по всій композиції, таким чином, щоб композиція могла бути легко підрозділена на рівноефективні одиничні дозовані форми, такі як таблетки, пігулки і капсули. Ця тверда попередня готова форма далі підрозділяється на одиничні дозовані форми типу, описаного вище, що містять, наприклад, від 0,1 до приблизно 1000мг активного інгредієнта даного винаходу. Таблетки або пігулки даного винаходу можуть бути покриті або іншим способом складені з одержанням дозованої форми, що забезпечує перевагу пролонгованої дії. Наприклад, таблетка або пігулка може містити внутрішній компонент дозування і зовнішній компонент дозування, причому останній знаходиться у вигляді конверта для попереднього. Два компоненти можуть бути розділені ентеросолюбільним шаром, що служить для опору руйнуванню в шлунку і дозволяє внутрішньому компоненту проходити у дванадцятипалу кишку або мати затримане вивільнення. Для таких ентерасолюбільних шарів або покриттів можуть застосовуватися різноманітні речовини, причому такі речовини включають полімерні кислоти і суміші полімерних кислот з такими речовинами як шелак, цетиловий спирт і ацетат целюлози. Рідкі форми, у які сполуки і композиції даного винаходу можуть включатися для перорального введення або за допомогою ін'єкції, включають водні розчини, прийнятним чином ароматизовані сиропи, водні або масляні суспензії і ароматизовані емульсії з їстівними маслами, такими як бавовняне масло, кунжутна олія, кокосова олія або арахісове масло, а також еліксири і подібні фармацевтичні переносники. Композиції для інгаляції або інсуфляції включають розчини і суспензії у фармацевтично прийнятних, водних або органічних розчинниках або їх сумішах, і порошки. Рідкі або тверді композиції можуть містити прийнятні фармацевтично прийнятні ексципієнти, як описано вище. У деяких варіантах здійснення, композиції вводяться за допомогою перорального або назального респіраторного 36 шляху для місцевого або системного ефекту. Композиції можуть бути розпилені при використанні інертних газів. Розпилені розчини можуть вдихатися безпосередньо із розпилювального пристрою, або розпилювальний пристрій може приєднуватися до масок, що надягають на особу, або дихального приладу з навперемінним позитивним тиском. Композиції у вигляді розчину, суспензії або порошку можуть уводитися перорально або назально із пристроїв, які доставляють готову форму відповідним чином. Кількість сполуки або композиції, що вводить пацієнту, буде змінюватися залежно від того, що вводиться, мети введення, як, наприклад, профілактика або і ерапія, стану пацієнта, способу введення і т. п. У терапевтичних додатках, композиції можуть уводитися пацієнту, що вже страждає від захворювання в кількості, достатній для лікування або щонайменше часткового припинення симптомів захворювання і його ускладнень. Ефективні дози будуть залежати від стану захворювання, яке лікується, а також від висновку лікуючого клініциста залежно від таких факторів, як тяжкість захворювання, вік, маса тіла і загальний стан пацієнта і т. п. Композиції, що вводять пацієнту можуть бути представлені у вигляді фармацевтичних композицій, описаних вище. Ці композиції можуть бути стерилізовані загальноприйнятими методами стерилізації або можуть бути стерильно відфільтровані. Водні розчини можуть бути впаковані для застосування як такі або ліофілізовані, причому ліофілізований препарат поєднують зі стерильним водним носієм перед введенням. рН препаратів сполуки типово буде мати значення між 3 і 11, більш переважно від 5 до 9 і, найбільше переважно, від 7 до 8. Варто розуміти, що застосування деяких з вищевказаних ексципієнтів, носіїв або стабілізаторів буде приводити в результаті до утворення фармацевтичних солей. Терапевтичне дозування сполук даного винаходу може змінюватися відповідно, наприклад, до конкретного застосування, для якого проводиться лікування, шляхом введення сполуки, здоров'я і стану пацієнта і висновку лікаря. Пропорція або концентрація сполуки за винаходом у фармацевтичній композиції може змінюватися залежно від ряду факторів, що включають дозування, хімічні характеристики (наприклад, гідрофобність) і шлях введення. Наприклад, сполуки за винаходом можуть бути надані у водному фізіологічному буферному розчині, що містить приблизно від 0,1 до приблизно 10% м/об сполуки для парентерального введення. Деякі типові інтервали доз становлять від приблизно 1мкг/кг до приблизно 1г/кг маси тіла в день. У деяких варіантах здійснення, інтервал дози становить від приблизно 0,01мг/кг до приблизно 100мг/кг маси тіла в день. Дозування, імовірно, залежить від таких змінних, як тип і ступінь розвитку захворювання або порушення, загальний стан здоров'я конкретного пацієнта, відносна біологічна ефективність вибраної сполуки, ексципієнт готової форми і шлях її введення. Ефективні дози можуть бути екстрапольовані на підставі кривих доза 37 83917 відповідь, отриманих у результаті досліджень на тест-системах in vitro або тварин моделях. Сполуки за винаходом можуть також бути сформульовані в сполученні з одним або декількома додатковими активними інгредієнтами, які можуть включати будь-який фармацевтичний засіб, такий як антитіла, імуносупресори, протизапальні засоби, хіміотерапевтичені засоби, засоби, що знижують рівень ліпідів, засоби, що підвищують рівень ліпопротеїнів високої щільності (HDL), засоби стимуляції секреції інсуліну або сенсибілізатори, ліки, застосовувані для лікування ревматоїдного артриту і т. п. Режим лікування ревматоїдного артриту (PA) Пацієнти з ревматоїдним артритом (PA), що проходять агресивний курс лікування засобами модифікації захворювання (метотрексат, антималярійні препарати, золото, пеніциламін, сульфасалазин, дапсон, лефлунамід або біологічний засіб) можуть досягати змінюваних ступенів контролю захворювання, включаючи повні ремісії. Ці клінічні відповіді асоційовані з поліпшенням у стандартизованій бальній оцінці активності захворювання, конкретно критеріїв ACR, які включають: біль, функцію, кількість хворобливих суглобів, кількість опухлих суглобів, загальну оцінку пацієнта, загальну оцінку лікаря, лабораторні виміри запалення (CRP і ESR) і радіологічну оцінку структурного ушкодження суглоба. Вимагають введення ліків, модифікуючі захворювання, що протікає (DMARDs), для підтримки оптимального сприятливого ефекту. Хронічне дозування цих засобів пов'язане зі значною токсичністю і виснаженням захисних сил організму хазяїна. Додатково пацієнти часто стають несприйнятливими до конкретної терапії, і потрібен альтернативний режим. Із цих причин нова, ефективна терапія, що дозволяє скасува ти стандартні DMARDs, була б клінічно важливим досягненням. Пацієнти зі значною відповіддю на засоби анти-ФНП-терапії (інфликсимаб, етанерцент, адалімумаб), засоби анти-IL-1-терапії (кінарет) або інші антиревматичні ліки, модифікуючі захворювання, (DMARDs), включаючи, але не обмежуючись зазначеним, метотрексат, циклоспорин, солі золота, антималярійні препарати, пеніциламін або лефлунамід, які досягли клінічної ремісії захворювання, можуть проходити курс лікування речовиною, яка інгібує експресію і/або активність CCR2, включаючи, наприклад, нуклеїнові кислоти (наприклад, антисмислові або сиРНК молекули), білки (наприклад, антитіла проти CCR2), низькомолекулярні інгібітори (наприклад, сполуки, розкриті в даному описі, і інші інгібітори хемокінового рецептора, відомі в даній галузі). У деяких варіантах здійснення речовина, яка інгібує експресію і/або активність CCR2. являє собою низькомолекулярний інгібітор (або антагоніст) CCR2. Антагоніст CCR2 може дозуватися перорально q.d. або b.i.d при дозі, що не перевищує приблизно 500мг на день. Пацієнтам може бути скасована проведена терапія або зменшене її дозування, і лікування може підтримуватися антагоністом CCR2. Лікування пацієнтів сполученням антагоніста CCR2 і їх поточної терапії може здійс 38 нюватися, наприклад, протягом приблизно від одного до приблизно двох днів, перед перериванням або зниженням дози DMARD і продовженням лікування антагоністом CCR2. Є численні переваги заміни традиційних DMARDs антагоністами CCR2. Традиційні DMARDs мають серйозні кумулятивні дозообмежувальні побічні ефекти, найбільш частим з яких є ушкодження печінки, а також імуносупресорні дії. Очікують, що антагонізм CCR2 буде мати поліпшений тривалий профіль безпеки і не буде мати подібних імуносупресорних властивостей, асоційованих із традиційними DMARDs. Додатково, час напівжиття біологічних засобів типово становить дні або тижні, що с проблемою при розгляді несприятливих реакцій. Очікується, що час напівжиття перорально біодоступного антагоніста CCR2 буде становити порядок годин, так що ризик від тривалого впливу ліків після несприятливої події є дуже мінімальним, у порівнянні з біологічними засобами. Також застосовувані в цей час біологічні засоби (інфликсимаб, етанерцепт, адалімумаб, кінарет) звичайно дають або внутрішньовенно (в. в.), або підшкірно (п. ш.), що вимагає введення лікарем або само-ін'єкцію пацієнтом. Це приводить до можливості реакції від інфузії або реакцій на ділянці ін'єкції. Цих е фектів можна уникнути, використовуючи перорально антагоніст CCR2, що вводиться. Режим лікування діабету і резистентності до інсуліну Діабет типу 2 є однією із провідних причин захворюваності і смертності в західних країнах. У переважної більшості пацієнтів, захворювання характеризується дисфунцією панкреатичних бета-клітин, супроводжуваною резистентністю до інсуліну в печінці і у периферичних тканинах. На підставі первинних механізмів, які асоційовані із захворюванням, доступні два загальних класи пероральних терапій для лікування діабету типу 2: стимулятори секреції інсуліну (сульфонілсечовини, такі як глібурид) і сенсибілізатори інсуліну (метформін і тіазолідиндіони, такі як розиглітазон). Було показано комбінаційна терапія, яка спрямована на обидва механізми, керує метаболічними дефектами цього захворювання і у багатьох випадках можна показати, що вона знижує необхідність у введенні екзогенного інсуліну. Однак згодом, резистентність до інсуліну часто прогресує, приводячи до необхідності подальшого доповнення інсуліну. Крім того, було продемонстровано, що переддіабетичний стан, на який посилаються як на метаболічний синдром, характеризується порушеною переносимістю глюкози, особливо в сполученні з ожирінням. У більшості пацієнтів, у яких розвивається діабет типу 2, починається розвиток резистентності до інсуліну, причому в ци х пацієнтів має місце гіперглікемія, коли вони не можуть далі виносити ступінь гіперінсулінемії, необхідний для запобігання втрати гомеостазу глюкози. Настання компонента резистентності до інсуліну є у високому ступені передбачувальним відносно настання захворювання і асоційований зі збільшенням ризику розвитку діабету тип у 2, гіпертензії і коронарної хвороби серця. 39 83917 Одним з основних корелятів порушеної переносимості глюкози і розвитку від інсулінрезистентного стану до діабету типу 2 є наявність центрального ожиріння. Більшість пацієнтів з діабетом типу 2 є гладкими, і саме ожиріння асоційоване з резистентністю до інсуліну. Ясно, що центральне ожиріння є основним чинником ризику для розвитку резистентності до інсуліну, що веде до діабету типу 2, із припущенням, що сигнали від вісцерального жиру вносять вклад у розвиток резистентності до інсуліну і прогресування до захворювання. На додаток до секретованих білкових факторів ожиріння індукує клітинна запальна відповідь, при якій макрофаги, вироблені кістковим мозком, накопичуються в жирових депо, стаючи макрофагами жирової тканини. Макрофаги жирової тканини накопичуються пропорційно вимірам ожиріння. Макрофаги, інфільтровані тканиною, є джерелом багатьох запальних цитокінів, для яких була продемонстрована здатність індукувати резистентність до інсуліну в адипоцитах. Жирова тканина продукує MCP-1 пропорційно ожирінню, що дозволяє припустити, що його активність за допомогою передачі сигналів через CCR2 також може відігравати важливу роль у накопиченні макрофагів у жировій тканині. Невідомо, чи є взаємодія MCP-1/CCR2 безпосередньо відповідальною за мобілізацію моноцитів до жирового тканини, чи буде знижена мобілізація макрофагів до жирової тканини в людей безпосередньо приводити до зниженого вироблення протизапальних молекул і чи зв'язане вироблення прозапальних молекул безпосередньо з резистентністю до інсуліну. Пацієнти, у яких спостерігають резистентність до інсуліну або переддіабетичну (нормоглікемічну), або діабетичну (гіперглікемічну), можуть проходити курс лікування речовиною, що інгібує експресію і/або активність CCR2, включаючи, наприклад, нуклеїнові кислоти (наприклад, антисмислові або молекули малих інтерферуючих PHK-siRNA), білки (наприклад, антитіла проти CCR2), низькомолекулярні інгібітори (наприклад, сполуки, розкриті в даному описі, і інші інгібітори хемокінового рецептора, відомі в даній галузі). У деяких варіантах здійснення, речовина, яка інгібує експресію і/або активність CCR2 являє собою низькомолекулярний інгібітор (або антагоніст) CCR2. Антагоніст CCR2 може дозуватися перорально q.d. або b.i.d при дозі, що не перевищує приблизно 500мг на день. Пацієнтам може бути скасована проведена терапія або зменшене її дозування, і лікування може підтримуватися антагоністом CCR2. Альтернативно, лікування аніагоністом CCR2 може застосовуватися для доповнення поточної терапії, для посилення її ефективності або для запобігання розвитку в подальшу інсулінову залежність. Є численні переваги заміни або доповнення традиційних засобів антагоністами CCR2. Такі засоби можуть бути застосовними, наприклад, для запобігання розвитку від переддіабетичного, інсулінрезистентного стану до діабетичного стану. Такі засоби можуть знижувати або заміняти необхідність у застосуванні сенсибілізаторів інсуліну, з їх 40 властивими токсичними властивостями. Такі засоби можуть також знижувати необхідність у доповненні екзогенного інсуліну або пролонгувати період до настання цієї потреби. Режим лікування атеросклерозу Атеросклероз являє собою стан, який характеризується відкладенням жирових речовин у стінках артерій. Бляшка охоплює такі відкладення жирових речовин, холестерину, продуктів життєдіяльності клітин, кальцій і інші речовини, які вбудовуються у внутрішню вистилку артерії. Бляшки можуть виростати досить великими, щоб значно знижувати кровотік через артерію. Однак більше значне ушкодження відбувається, коли бляшка стає нестійкою і розривається. Бляшки, які розриваються, приводять до утворення тромбів, які можуть блокувати кровотік або руйнуватися і переміщатися до інших частин тіла. Якщо тромб блокує кровоносну судин у, що забезпечує постачання серця, він викликає серцевий напад. Якщо він блокує кровоносну судин у, що забезпечує постачання мозку, це викликає інсульт. Атеросклероз є повільним, комплексним захворюванням, що типово починається в дитинстві і часто прогресує в міру того, як люди стають старше. Високий рівень холестерину в крові є основним фактором ризику для коронарної хвороби серця. На підставі того, що холестерин є первинною композицією бляшки, розвиток утворення бляшки керується зниженням циркулюючого холестерину або підвищенням рівня холестеринпереносних ліпопротеїнів високої щільності (HDL). Циркулюючий холестерин може бути знижений, наприклад, інгібуванням його синтезу в печінці з використанням або зниженням надходження з їжі. Такі медикаменти, які діють через цей механізм, можуть включати лікарські засоби, які застосовують, щоб понизити високі рівні холестерину: поглиначі жовчних кислот, інгібітори синтезу ліпопротеїнів, інгібітори синтезу холестерину і похідні фібринової кислоти Рівні циркулюючих HDL можуть додатково бути збільшені, за допомогою введення, наприклад, пробуколу або високих доз ніацину. Було показано, що терапія, яка спрямована на множинні механізми, сповільнює розвиток захворювання і прогресування до розриву бляшки. Атеросклероз у типовому випадку супроводжується клітинною запальною відповіддю, при якій макрофаги, вироблені кістковим мозком, накопичуються в жирових смужках уздовж стінки судини, стаючи пінистими клітинами. Пінисті клітини є джерелом багатьох запальних цитокінів, для яких була продемонстрована здатність індукувати розвиток бляшки, і ферментів, які можуть стимулювати дестабілізацію бляшки. Атеросклеротична тканина також продукує MCP-1, що дозволяє припустити, що його активність за допомогою подачі сигналів через CCR2 також може відігравати важливу роль у накопиченні макрофагів у вигляді пінистих клітин у бляшках. Продемонстровано, що CCR2-/- миші мають значно знижений рівень макрофагів у жирових смужках, генерований як результат високожирової дієти або генетичної зміни в метаболізмі ліпідів. 41 83917 Пацієнт, у яких спостерігають високий циркулюючий холестерин, низькі HDL, або підвищений циркулюючий CRP, або в яких візуалізують присутність бляшки в стінці судини або з будь-якими іншими очевидними ознаками наявності атеросклерозу, можуть проходити курс лікування речовиною, яка інгібує експресію і/або активність CCR2, включаючи, наприклад, нуклеїнові кислоти (наприклад, молекули антисмислових або малих інтерферуючих PHK), білки (наприклад, антитіла про їй CCR2), низькомолекулярні інгібітори (наприклад, сполуки, розкриті в даному описі, і інші інгібітори хемокінового рецептора, відомі в даній галузі). У деяких варіантах здійснення, речовина, яка інгібує експресію і/або активність CCR2, являє собою низькомолекулярний інгібітор (або антагоніст) CCR2. Антагоніст CCR2 може дозуватися перорально q.d. або b.i.d при дозі, що не перевищує приблизно 500мг на день. Пацієнтам може бути скасована проведена їм терапія або зменшене її дозування, і лікування може підтримуватися антагоністом CCR2. Альтернативно, лікування антагоністом CCR2 може застосовуватися для доповнення поточної терапії з метою посилення її ефективності для, наприклад, запобігання розвитку бляшки, стабілізації вже сформованої бляшки або індукування регресії бляшки. C численні переваги заміни або доповнення традиційних засобів антагоністами CCR2. Такі засоби можуть бути застосовними, наприклад, для запобігання розвитку бляшки до стадії нестабільності з асоційованим ризиком розриву бляшки. Такі засоби можуть знижувати або заміняти необхідність у застосуванні ліків, що модифікують холестерин, або ліків підвищуючи х HDL, із властивими ним токсичними властивостями, що включають, але, не обмежуючись ними, гіперемію, ушкодження печінки і ушкодження м'яз, таке як міопатія. Такі засоби можуть також знижувати необхідність у хір ургічному втр учанні для відкриття стінки судини або пролонгувати період до цього втр учання або доти, коли буде потрібно застосування антикоагулянтів для обмеження ушкодження внаслідок можливого розриву бляшки. Мічені способи і способи аналітичного тестування Ще один аспект даного винаходу стосується сполук формули І, мічених флуоресцентним барвником, спіновою міткою, важким металом або радіоактивним ізотопом, які можуть бути корисні не тільки при візуалізації, але також в аналітичних тестах, як in vitro так і in vivo, для локалізації і кількісної оцінки хемокінового рецептора в зразках тканин, включаючи людські, і для ідентифікації лігандів хемокінового рецептора за допомогою інгібування зв'язування міченої сполуки. Відповідно, даний винахід включає аналітичні тести хемокінового рецептора, які містять такі мічені сполуки. Даний винахід додатково включає ізотопномічені сполуки формули І. "Ізотопно" або "радіоактивне-мічена" сполука являє собою сполуки за винаходом, де один або більше атомів заміщені або замінені атомом, що має атомну масу або масове число, відмінні від атомної маси або масового числа, що типово зустрічаються в природі (тоб 42 то природних). Прийнятні радіонукліди, які можуть бути включені в сполуки даного винаходу, включають, але, не обмежуючись ними, 2Н (також пишуть як D для дейтерію), 3H (також пишуть як T для тритію), 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18О, 18F, 35 S, 36CI, 82Br, 75Br, 76Br, 77Br, 123l, 124l, 125l, i 131l. Радіонуклід, що включають у розчинні мічені радіоактивним ізотопом сполуки буде залежати від конкретного застосування такої міченої радіоактивним ізотопом сполуки. Наприклад, для мічення in vitro хемокінового рецептора і тестів на конкурентне зв'язування, сполуки, які включають 3H, 14C, 82Br, 125 I, 131I, 35S у цілому, будуть найбільш застосовними. Для застосувань, пов'язаних з радіоактивною візуалізацією, 11C, 18 F, 125I, 123 I, 124I, 131I, 75Br, 76 Br або 77Br у цілому, будуть найбільш застосовними. Варто розуміти, що "радіоактивне-мічена" або "мічена сполука" являє собою сполуку, у яку включений щонайменше один радіонуклід. У деяких варіантах здійснення радіонуклід вибирають із групи, яка складає з 3H, 14C, 125І, 35S і 82Br. Синтетичні способи для введення радіоактивних ізотопів в органічні сполуки є застосовними до сполук за винаходом і добре відомі в даній галузі. Мічена радіоактивним ізотопом сполука за винаходом може застосовуватися в скринінговому аналітичному тесті для ідентифікації/оцінки сполуки. Загалом, знову синтезована або ідентифікована сполука (тобто тестована сполука) може бути оцінена з погляду її здатності знижувати зв'язування міченої радіоактивним ізотопом сполуки за винаходом з хемокіновим рецептором. Відповідно, здатність тестованої сполуки конкурувати з міченою радіоактивним ізотопом сполукою за зв'язування з хемокіновим рецептором безпосередньо корелює з його спорідненістю зв'язування. Набори Даний винахід також включає фармацевтичні набори, застосовні, наприклад, при лікуванні або запобіганні хемокін-асоційованого захворювання, які включають один або більше контейнерів, що містять фармацевтичну композицію, яка включає в себе терапевчично ефективну кількість сполуки формули І. Такі набори можуть додатково включати, якщо потрібно, один або більше з різних загальноприйнятих фармацевтичних компонентів набору, такі як, наприклад, контейнери з одним або більше фармацевтично прийнятними носіями, додаткові контейнери і т. д., як буде легко видно для фа хівців у даній галузі. Інструкції, або у вигляді вкладок або як етикетки, які вказують ввідні кількості компонентів, інструкції із введення і/або інструкції зі змішування компонентів можуть також бути включені в набір. Винахід буде описано більш детально за допомогою конкретних прикладів. Наступні приклади пропонуються для ілюстративних цілей, і мається на увазі, що вони не обмежують винахід ніяким чином. Кваліфіковані фахівці в даній галузі легко розпізнають розмаїтість некритичних параметрів, які можуть змінюватися або модифікуватися з одержанням по суті тих же результатів. Приклади 43 83917 44 MC розраховано для C15H25NO4 : (M+H)+ 284; знайдено 184,2 (М-Вос+Н)+. Стадія А-3 Приклад 1 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)3,4-дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-піридин-2ілциклогексанол Стадія A-1 Метил (1R,4S)-4-[(третбутоксикарбоніл)аміно]циклопент-2-ен-1карбоксилат До розчину (1R,4S)-4-[(третбутоксикарбоніл)аміно]циклопент-2-ен-1карбонової кислоти (10,0г, 44ммоль) у ДМФА (25мл) додають карбонат калію (6,33г, 45,8ммоль) з наступним додаванням метилйодиду (4,0мл, 64ммоль). Після перемішування при кімнатній температурі протягом ночі реакційну суміш розбавляють EtOAc. Розчин промивають водою чотири рази і насичений сольовий розчин один раз, сушать (MgSO4) і концентрують. Залишок сушать в умовах високого вакууму протягом ночі з одержанням сполуки заголовка (11г, 99%). MC розраховано для C12H19NO4 : (М+Н)+ 242; знайдено 142,1 (МВос+Н)+. 1H ЯМР (CDCl3) d 5,86 (м, 2Н), 4,90 (м, 1Н), 4,80 (м, 1Н), 3,72 (с, 3H), 3,50 (м, 1Н), 2,51 (м, 1Н), 1,86 (м, 1Н), 1,42 (с, 9Н). Стадія А-2 Метил (1S,4S)-4-[(трет-бутоксикарбоніл)аміно]1-ізопропілциклопент-2-ен-1- карбоксилат До 1,00M розчину гексаметилдисилазиду літію в ТГФ (202 мл) при -78°C додають розчин метил (1R,4S)-4-[(трет-бутоксикарбоніл)аміно]циклопент2-ен-1-карбоксилагу (22,10г, 91,59ммоль) у ТГФ (36,2мл) протягом 10хв. Розчин перемішують при 78°С протягом 30хв. перед додаванням ізопропілйодиду (10,0мл, 100ммоль) однією частиною. Суміш далі переносять у морозильну камеру, що працює при -24°C, і витримують протягом ночі. Реакцію гасять водяним розчином хлориду амонію і отриманий у результаті розчин екстрагують ефіром три рази Ефірні шари сушать над сульфатом натрію і упарюють у вакуумі. Залишок очищають флеш-хроматографією на оксиді кремнію з елююванням сумішшю 10% етилацетат/гексан з одержанням сполуки, зазначеного в заголовку (20,2г). (1S,4S)-4-[(трет-бутоксикарбоніл)аміно]-1ізопропілциклопент-2-ен-1-карбоиова кислота До розчину метил (1S,4S)-4-[(третбутоксикарбоніл)аміно]-1-ізопропілциклопент-2-ен1-карбоксилату (18,42г, 65ммоль) у ТГФ (500мл), метанолі (500мл) і воді (100мл) додають моногідрат гідроксиду літію (5,00г, 119ммоль). Суміш нагрівають при кип'ятінні зі зворотним холодильником протягом ночі. Через 18 годин, TШX показує наявність лише слідової кількості вихідної речовини. Органічні розчинники видаляють у вакуумі і водному шарі екстрагують ефіром (200мл) для видалення непрореагувавшої ви хідної речовини Водний шар підкисляють концентрованою HCl до рН=4 при охолодженні в бані з льодом. Отриманий у результаті розчин екстрагують метиленхлоридом три рази. Екстракти сушать над MgSO4 і концентрують із одержанням твердої речовини (17г). Тверду речовину розчиняють у гарячому етилацетаті (22мл) і до розчину додають гексани (550мл). Розчин повільно охолоджують до кімнатної температури перед перенесенням у морозильну камеру, що працює в інтервалі температур від -22 до 24°C. Через два дні кристали видаляють і рідину упарюють у вакуумі з одержанням необхідного продукту у вигляді білої пінистої твердої речовини (9,78г, 56%). MC розраховано для C4H23NO4: (М+Н)+ 270; знайдено 170,1 (М-Вос+Н)+. Стадія А-4 (1S,3R)-3-[(трет-бутоксикарбоніл)аміно]-1ізопропілциклопентанкарбонова кислота До розчину (1S,3R)-3-[(третбутоксикарбоніл)аміно]-1-ізопропілциклопент-2-eн1-карбонової кислоти (9,78г, 36,3ммоль) в етанолі (250мл) додають 10% паладію на вуглеці (550мг). Суміш струшують над воднем при 55фунт/кв. дюйм протягом ночі і фільтрують через целіт. Фільтрат упарюють у вакуумі з одержанням сполуки заголовка (9,45г, 96%). MC розраховано для C14H2sNO4: (M+H)+ 272; знайдено 172,1 (МВос+Н)+. Стадія B-1 2-[4-(Трифторметил)феніл]етанамін 45 83917 [4-(Трифторметил)феніл]ацетонітрил (10,0г, 54ммоль) розчиняють в 2,00M розчині аміаку в метанолі (100мл) у колбі Парра. До нього додають нікель Ренея (приблизно 1г). Суміш струшують над воднем (50фунт/кв. дюйм) протягом 20год. і фільтрують через целіт, що далі промивають метиленхлоридом декілька разів. Фільтрат концентрують із одержанням сполуки заголовка у вигляді твердої речовини. MC розраховано для C9H10F3N: (М+Н)+ 190: знайдено 173,1 (M+H-NH3)+. Стадія В-2 2,2,2-трифтор-N-{2-[4(трифторметил)феніл]етил}ацетамід До розчину 2-[4(трифторметил)феніл]етанаміну (9,7г, 44ммоль) і N,N-діізопропілетиламіну (13мл, 77ммоль) у метиленхлориді (80мл), охолодженому в бані з льодом, повільно додають трифтороцтовий ангідрид (9,05мл, 64ммоль) через шприц. Після перемішування в бані з льодом протягом 10хв. баню з льодом видаляють і перемішування продовжують протягом додаткових 30хв. Реакцію гасять додаванням води і отриманий у результаті розчин екстрагують метиленхлоридом двічі. Об'єднані екстракти промивають 1н HCl і насиченим сольовим розчином, суша ть (MgSO4), фільтрують і концентрують із одержанням неочищеного продукту (14,2г). Кристалізацією з EtOAc і гексанів одержують сполуку заголовка (8,5г, 68%) у вигляді білих голок. MC розраховано для C11H9F6NO: (М+Н)+ 286; знайдено 286,0. Стадія B-3 2-(трифторацетьиі)-7-(трифторметил)-1,2,3,4тетрагідроізохінолін 2,2,2-трифтор-N-{2-[4(трифторметил)феніл]етил}ацетамід (4,00г, 14ммоль) і параформальдегід (0,63г) об'єднують у колбі і розчиняють в оцтовій кислоті (11мл). Повільно додають сірчану кислоту (11мл). Суміш переходить із мутного розчину в прозорий і спостерігають екзотермічну реакцію. Через 40хв. колбу занурюють у баню з льодом. Реакцію гасять холодною водою, і отриманий у результаті розчин екстрагують EtOAc три рази. Об'єднані екстракти промивають водою, насиченим розчином бікарбонату натрію і насиченим сольовим розчином, сушать (MgSO 4), фільтрують і концентрують із одержанням жовтого масла (4,1г, 83%). MC розраховано для C12H9F6NO: (М+Н)+ 298; знайдено 298,0. Стадія В-4 46 7-(трифторметил)-1,2,3,4-тетрагідроізохінолін 2-(трифторацетил)-7-(трифторметил)-1,2,3,4тетрагідроізохінолін (4,1г, 12ммоль) розчиняюіь в етанолі (16,0мл). Додають карбонат калію (4,0г, 29ммоль) і воду (4мл) і суміш кип'ятять зі зворотним холодильником протягом 2 годин. Після охолодження, розчин розбавляють водою і екстрагують дихлорметаном чотири рази. Об'єднані екстракти сушать (MgSO4), фільтрують і концентрують. Очищенням хроматографією високого тиску на силікагелі з елююванням у градієнті від 100% А до 20% В (A=1%NH4ОH/5%MeОH/EtОAc; B=1%NH4OH/MeOH) протягом 13хв. одержують сполуку заголовка (1,4г, 59%). MC розраховано для C1OH10F 3N: (M+H)+ 202; знайдено 202,0. Стадія C-1 Трет-бутил ((1R,3S)-3-ізопропіл-3-{[7(трифторметил)-3,4-дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)карбамат До розчину 7-(трифторметил)-1,2,3,4тетрагідроізохіноліну (1,7г, 8,45ммоль) Стадії В-4, (1S,3R)-3-[(трет-бутоксикарбоніт)аміно]-1ізопропілциклопентанкарбонової кислоти (2,75г, 10,14ммоль) Стадії А-4, 4-диметиламінопіридину (0,70г, 5,73ммоль) і N,N-діізопропілетиламіну (7,0мл, 40,2ммоль) у метиленхлориді (30,0мл) додають гексафторфосфат бромотріс(піролідино)фосфонію (5,119г, 10,98ммоль). Після перемішування протягом 36 годин при кімнатній температурі, розчин концентрують у вакуумі. Залишок очищають колонковою хроматографією на оксиді кремнію з елююванням сумішшю 20% етилацетат/гексани з одержанням 2,1г (55%) необхідного продукту. MC розраховано для C24H33F 3N2O 3: (М+Н)+ 455; знайдено 355 (МВос+Н)+. Стадія С-2 (1R, 3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1H)іл]карбоніл}циклопентанамін Tрет-бутил ((1R,3S)-3-ізопропіл-3-{[7(трифторметил)-3,4-дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)карбамат (0,80г, 1,76ммоль) розчиняють в 4М розчині HCl в 1,4діоксані (10мл). Після перемішування протягом 2 годин, розчин упарюють у вакуумі з одержанням необхідного продукту (0,64г, 94%) у вигляді HCl солі. MC розраховано для C19H25F3N2 O: (М+Н)+ 355; знайдено 355,2. 47 83917 Стадія D-1 8-піридин-2-іл-1,4-діоксаспіро[4.5]декан-8-ол До розчину 2-бромпіридину (14г, 88,6ммоль) у безводному ефірі (300мл), охолодженому при 78°С повільно додають розчин 2,5М н-бутиллітію (36мл). Після додавання перемішування продовжують при -78°C протягом 1 години. До розчину повільно додають розчин 1,4-циклогександіону моноетиленкеталю (15г, 96ммоль) у безводному ефірі (300мл). По завершенні додавання суміші дають нагрітися до 0°C, і перемішування продовжують протягом 1 години. Реакцію гасять додаванням водного розчину (100мл) хлориду амонію (4,5г). Органічну фазу відділяють і водну фазу екстрагують метиленхлоридом 4 рази. Об'єднані органічні фази сушать MgSO4 і концентрують. Кристалізацією з EtOAc одержують 7г необхідного продукту. Матковий розчин рідину очищають на силікагелі з елююванням 10% МеОН/EtOAc з одержанням ще 3г необхідного продукту. MC розраховано для C13H17NO3: (М+Н)" 236; знайдено 236.0. Стадія D-2 4-гідрокси-4-(піридин-2-іл)циклогексанон Вищевказаний продукт розчиняють у ТГФ (30мл) і 3н розчині HCl у воді (30мл). Суміш перемішують при 50°C протягом 3 годин. Після охолодження до кімнатної температури, до розчину додають NaHCO3 при перемішуванні до закінчення виділення пухирців. Органічну фазу відділяють і водний шар екстрагують EtOAc три рази. Об'єднані органічні шари сушать над MgSO4 і концентрують. Залишок розіирають в EtOAc з одержанням 5,5г сполуки заголовка. MC розраховано для (M+H)+ 192; знайдено 192,0. Стадія D-3 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)3,4-дигідроізохінолін2(1H)іл]карбоніл}циклопентил)аміно] -1-піридин-2ілциклогексанол До розчину 4-гідрокси-4-піридин-2ілциклогексанону (42,3мг, 0,221ммоль) Сіадії D-2 і (1R,3S)-3-ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентанаміну (103мг, 0,221ммоль) Стадії С-2 в CH2Cl2 (8мл) додають триацетоксибо 48 ргідрид натрію (200мг, 1,0ммоль). Після перемішування при кімнатній температурі протягом ночі, реакцію гасять водяним розчином NaOH Розчин ексірагують CH2Cl2. Органічний шар концентрують у вакуумі. Залишок очищають за допомої ою ВЕРХ із одержанням двох діастереомерів. Ізомер 1: PXMC розрахований для C30H38F3N3O 2: (М+Н)+ 530; знайдено 530,1. Ізомер 2: MC знайдено 530,1. Приклад 2 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)3,4-дигідроізохінолін2(1Н)іл]карбоніл}циклопентил)аміно]-1-(1,3оксазол-2-іл)циклогексанол Стадія А 4-гідрокси-4-(1,3-оксазол-2-іл)циклогексанон До розчину 1,3-оксазолу (2,0мл, 30,41ммоль) у ТГФ (20мл) додають 1,0М розчин борану в ТГФ (30,4мл) при кімнатній температурі. Суміш перемішуюіь протягом 1 години перед охолодженням до -78°С. До вищевказаного розчину додають 1,6М розчин н-бутиллітію в гексані (19мл). Після перемішування при -78°C протягом однієї години, додають розчин 1,4-діокса-спіро[4.5]декан-8-ону (5,22г, 33,45ммоль) у TГФ (10мл). Після перемішування при -78°С протягом 5 годин, реакцію гасять додаванням ЗМ розчини HCl у воді (40мл). Отриманий у результаті розчин перемішуюіь при кімнатній температурі протягом ночі, нейтралізують карбонатом калію і екстрагують EtOAc три рази. Об'єднані екстракти сушать над MgSO 4 і конценірують. Очищенням флеш-хроматографією на оксиді кремнію з елююванням MOAc одержують необхідний продукт (3,9г, 70%). PX-MC розраховано для C9H11NO3: (M-H)+ 182; знайдено 182,0. Стадія В 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)3,4-дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-(1,3-оксазол-2іл)циклогексанол До розчину (1R,3S)-3-ізопропіл-3-{[7(трифторметил)-3,4-дигідроізохінолін-2(1Н)іл]карбоніл}циклопентанаміну (113,0мг, 49 83917 0,3188ммоль) Стадії С-2 прикладу 1 у ГГФ (1мл) додають 4-гідрокси-4-(1,3-оксазол-2іл)циклогексанон (80,3мг, 0,443ммоль) з наступним додаванням триетилетиламіну (0,5мл, 3,6ммоль) і, нарешті, триацетоксиборгідриду натрію (135мг, 0,638ммоль) Після перемішування протягом ночі реакцію гасять додаванням розчину NaOH. Отриманий у результаті розчин екстрагують метиленхлоридом. Екстракт сушать над MgSO4 і упарюють у вакуумі. Залишок очищають флешхроматографією з елююванням EtOAc/1%NH4OH з одержанням двох ізомерів. Ізомер 1:73мг. MC розраховано для C28H36F3N3 O3: (М+Н)+ 520; знайдено 520,1. Ізомер 2:56мг. MC знайдено 520,1. Приклад 3 4-[(( 1R,3S)-3-ізопропіл-3-{[7-(трифторметил)3,4-дигідроізохінолін-2(1H)іл]карбоніл}циклопентил)аміно]-1-піримідин-2ілциклогексанол Стадія А 8-тримідил-2-іл-1,4-діокса-спіро[4.5]декан-8-ол До розчину 2-бромпіримідину (0,20г, 1,258ммоль) у безводному метиленхлориді (3,0мл) по краплях додають 1,6М н-бутиллітію в гексані (0,86мл) при -78°С. Реакційну суміш перемішують протягом 29хв. при -78°C і по краплях додають 1,4діокса-спіро[4.5]декан-8-он (0,196г, 1,26ммоль) в CH2Cl2 (3мл). Реакційну суміш перемішують при 78°C протягом 50хв. і гасять водяним розчином NН4Cl. Після нагрівання до кімнатної температури, суміш екстрагують CH2Cl2 три рази. Об'єднані екстракти сушать над MgSO4, фільтрують і концентрують у вакуумі з одержанням 0,50г неочищеного продукту. Очи щенням колонковою хроматографією на силікагелі з елююванням 0®50% EtOAc у гексанах одержують 0,159г (54%) необхідного продукту у вигляді світло-коричневої жовтої твердої речовини. MC (М+Н)+ 237,2. Стадія В 4-гідрокси-4-піримідин-2-ілциклогексанон До продукту зі Стадії А (190ммоль, 44г) у ТГФ (200мл) додають водний розчин НСІ (300ммоль, 100мл). Реакційну суміш перемішують протягом 2 днів і екстрагують, використовуючи діетиловий ефір. Водний шар далі нейтралізують, використовуючи водний розчин NaOH (50%) до одержання 50 рН 11 і екстрагують, використовуючи EtOAc (6´300мл). Органічні шари поєднують і сушать над MgSO4 і концентрують у вакуумі. Залишок очищають флеш-хроматографією на оксиді кремнію с одержанням необхідного кетону (18г, 49%). MC (М+Н)+ 193,1. Стадія C 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)3,4-дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-піримідин-2ілциклогексанол До розчину 4-гідрокси-4-піримідин-2ілциклогексанону (59,8мг, 0,31ммоль) і (1R,3S)-3ізопропіл-3-{[7-(трифторметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентанаміну (110мг, 0,31ммоль) Стадії С-2 Прикладу 1 в CH2Cl2 (10мл) додають триацетоксиборгідрид натрію (131мг, 0,62ммоль). Після перемішування протягом ночі додають ще триацетоксиборгідриду натрію для доведення кількості еквівалентів відновника до 5 еквівалентів. Після перемішування протягом ще 5 годин реакцію гасять водним розчином NaOH. Отриманий у результаті розчин екстрагують EtOAc три рази. Об'єднані екстракти сушать над MgSO4 і концентрують. Очищенням флеш-хроматографією з наступною ВЕРХ одержують два ізомери. Ізомер 1 і ізомер 2: MC розраховано для C29H37F3N4 O2: (М+Н)+ 531; знайдено 531,1. Приклад 4 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)3,4-дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-2іл)циклогексаном Стадія А 8-(1,3-тіазол-2-іл)-1,4-діоксаспіро[4.5]декан-8ол 1,6М розчин н-бутиллітію в гексанах (8,1мл, 12,92ммоль) додають до розчину тіазолу (1,0г, 11,75ммоль) у ТГФ (10мл) при -78°С при перемішуванні під N2. Після перемішування при -78°C 51 83917 протягом 1 години, розчин 1,4-циклогександіону моноетиленкеталю (1,84г, 11,75ммоль) у ТГФ (10мл) додають до розчину через шприц і перемішування продовжують протягом 3 годин при -78°С. Додають воду (5мл), і реакційну суміш нагрівають до кімнатної температури і екстрагують, використовуючи EtOAc три рази. Об'єднані органічні шари сушать (MgSO4), фільтрують, концентрують у вакуумі і хроматографують з одержанням 2,53г (89%) необхідної сполуки. MC (М+Н)+=242,2. Стадія В 4-гідрокси-4-(1,3-тіазол-2-іл)циклогексанон Розчин 8-(1,3-тіазол-2-іл)-1,4діоксаспіро[4.5]декан-8-олу (1,0г, 4,14ммоль) в 20мол суміші ТГФ/3н HCl (1:1) перемішують протягом 1 години при 50°C. Після охолодження до кімнатної температури, суміш обробляють Na2CO3 до рН 8 і екстрагують EtOAc три рази. Об'єднані органічні шари промивають насиченим розчином NaCl, сушать (MgSO4), і концентрують із одержанням 0,80г (98%) сполуку заголовка. MC (М+Н)+=198,2. Стадія C 4-[((1R,3S)-3-ізопропіл-3-{[7-(трифторметил)3,4-дигідроізохінолін-2(1Н)іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-2іл)циклогексанол До розчину трифторацетатної солі (1R,3S)-3ізопропіл-3-{[7-(трифіорметил)-3,4дигідроізохінолін-2(1Н)іл]карбоніл}циклопентанаміну (46,8мг, 0,132ммоль) і 4-гідрокси-4-(1,3-тіазол-2-іл)циклогексанону (30,4мг, 0,154ммоль) у дихлормегані (10мл) додають триетиламін (23,6мкл, 0,169ммоль) з наступним додаванням триацетоксиборгідриду натрію (56мг, 0,26ммоль) при кімнатній температурі. Після перемішування протягом ночі суміш розбавляють дихлорметаном і нейтралізують NaHCO3. Органічний шар промивають насиченим сольовим розчином, сушать над Na2SO4 і концентрують. Залишок очищають флеш-хроматографією на оксиді кремнію з одержанням двох ізомерів. Ізомер 1 і ізомер 2: PX-MC розраховано для C28H36F 3N3O 2 S: (М+Н)+ 536; знайдено 536,2. 52 Приклад 5 4-[((1R,3S)-3-ізопропіл-3-{[3-(трифторметил)7,8-дигідро-1,6-нафтиридин-6(5Н)іл]карбоніл}циклопентил)аміно]-1-(1,3-тіазол-2іл)циклогексанол Стадія A-1 3-бром-5-(трифторметил)піридин-2-ол До розчину 5-(трифторметил)піридин-2-олу (10,52г, 62ммоль) і ацетату натрію (5,29г, 64ммоль) у крижаній оцтовій кислоті (38мл) додають бром (3,36мл, 65ммоль) при кімнатній температурі. Білий мутний розчин повільно переходить у прозорий коричневий розчин, що нагрівають при 80°C протягом 2,5 годин. Суміші дають остудитися до кімнатної температури і далі упарюють при зниженому тиску. Залишок нейтралізують насиченим розчином NaHCO3 до рН=8. Отриманий у результаті розчин екстрагують EtOAc три рази. Об'єднані екстракти суша ть над MgSO 4, фільтрують, упарюють у вакуумі з одержанням 15,1г (99,8%) неочищеного продукіу (15,1 і, 98,8%) у вигляді білої твердої речовини. PX-MC розраховано для C6H3Br3NO: (М+Н)+ 241,9; знайдено 241,9/243,9. Стадія А-2 2-гідрокси-5-(трифторметил)нікотинальдегід 3-бром-5-(трифіорметил)піридин-2-ол (8,20г, 31,2ммоль) додають невеликими часшнами до суспензії гідриду натрію (0,8575г, 33,94ммоль) у безводному ТГФ (76мл) при кімнатній температурі. Після повного додавання, реакційну суміш охолоджують до -78°С і обробляють 1,7М розчином трет-бутиллтію в пентані (40,0мл), що додають по краплях через шприц протягом періоду, який дорівнює 15хв. Після перемішування протягом 5хв., повільно додають безводний ДМФА (8,16мл. 105ммоль), підтримуючи при цьому температуру нижче -50°C. Реакційну суміш далі перемішують протягом ночі, даючи їй нагрітися до кімнатної температури. Отриману в результаті сві тлокоричневу суміш гасять додаванням насиченого розчину NH4Cl. рН розчину регулюють до 9-10 додаванням водного розчину NaHCO3. Отриманий у результаті розчин екстрагують EtOAc чотири рази. Об'єднані екстракти сушать (MgSO4), фільтр ують і концентрують із одержанням коричневого твердого нсочиїцсною продукту (7,33г, >100% вихід неочищеного продукту). MC розраховано для C7H4F3NO2 (M-t H)+ 192; знайдено 192,1. Стадія А-3 53 83917 2-гідрокси-5-(трифторметил)нікотинонітрил Суміш 2-гідрокси-5(трифторметил)нікотинальдегіду (3,80г, 17,9ммоль) (приблизно 90% чистота), форміату натрію (1,46г, 20,8ммоль), гідрохлориду гідроксиламіну (1,47г, 20,8ммоль) у мурашиній кислоті (36,6мл) перемішують при кімнатній температурі протягом 2 годин (мутний коричневий розчин) і далі нагрівають при кип'ятінні зі зворотним холодильником протягом ночі (спочатку прозорий коричневий розчин, далі знову мутний). Після охолодження до кімнатної температури реакційну суміш гасять водою і екстрагують EtOAc три рази. Об'єднані орі анічні шари промивають водою, сушать над MgSO4, фільтрують і концентрують у вакуумі з одержанням 3,03г (90%) необхідного неочищеного продукту (приблизно 75% чистоти) у вигляді коричневої твердої речовини. MC розраховано для C7H3F3N2O: (M+Н)+ 189; знайдено 189,0. Стадія А-4 2-хлор-5-(трифторметил)нікотинонітрил До суміші фосфорилхлориду (1,28мл, 13,6ммоль) і хіноліну (0,834мл, 6,92ммоль) додають 2-гідрокси-5-(трифторметил)нікотинонітрил (2,93г, 11,7ммоль) (неочищений, 75% чистоти). Отриману в результаті суміш нагрівають при кип'я тінні зі зворотним холодильником протягом 4 годин. Після охолодження до 100°C, повільно додають воду (7,0мл). Суміш далі охолоджують до кімнатної температури і обережно нейтралізують насиченим розчином NaHCO3. Отриманий у результаті розчин екстрагують ЕtOAc три рази і органічні шари поєднують, сушать над MgSO 4, фільтрують, упарюють у вакуумі. Неочищений продукт (2,35г) очищають флеш-хроматографією (15:85 EtOAc/гексани) з одержанням 1,81г (75%) необхідної сполуки у вигляді гемно-коричневої твердої речовини (>85% чистоти). Стадія А-5 Трет-бутил метил [3-ціано-5(трифторметил)піридин-2-іл]малонат До суспензії гідриду натрію (0,752г, 29,8ммоль) у ТГФ (18мл) під азотом додають по краплях розчин трет-бутилметилмалонату (3,18мл, 17,9ммоль) у безводному ТГФ (15мл) шприцом протягом періоду 15хв. Реакційну суміш перемішують протягом 30хв. перед повільним додаван 54 ням розчину 2-хлор-5(трифторметил)нікотинонітрилу (4,0г, 14,5ммоль) у ТГФ (30мл). Після перемішування при кімнатній температурі протягом ночі, реакційну суміш гасять водяним розчином NH4Cl. ТГФ видаляють у вакуумі і водяний розчин екстрагують EtOAc три рази. Об'єднані органічні шари сушать над MgSO4, фільтрують, упарюють у вакуумі. Неочищений коричневий продукт (7,1г) очищають флешхроматографією (10:90 EtOAc/гексани) з одержанням 4,20г (84%) необхідного продукту у вигляді жовтого масла. PX-MC розраховано для C15H15F 3N2O 4: (М+Н)+ 345: знайдено 245,0 (MCO2tBu+H+1)+. Стадія А-6 Трет-бутил 7-оксо-3-(трифторметил)-5,6,7,8тетрагідро-1,6-нафтиридин-8-карбоксилат До розчину трет-бутилметил [3-ціано-5(трифторметил)піридин-2-іл]малонату (4,02г, 11,7ммоль) в етанолі (60мл) додають суспензію нікелю Ренея (0,60г, 10ммоль). Суміш переносять в апарат Парра і гідрують в атмосфері водню при 40фунт/кв.дюйм протягом ночі. Суспензію фільтрують через целіт і фільтрат упарюють у вакуумі с одержанням 3,68г (99,6%) необхідного продукту у вигляді жовтого масла. PX-MC розраховано для C14H15F 3N2O 3: (М+Н)+ 317; знайдено 217,1 (MCO2tBu+H+1)+. Стадія А-7 3-(трифторметил)-5,8-дигідро-1,6-нафтиридин7(6Н)-он До розчину трет-бутил 7-оксо-3(трифторметил)-5,6,7,8-тетрагідро-1,6нафтиридин-8-карбоксилату (3,60г, 11,4ммоль) у метиленхлориді (14мл) додають трифтороцтову кислоту (6,75мл) і отриману в результаті суміш перемішують при кімнатній температурі протягом 0,5 годин. Розчин упарюють при зниженому тиску і залишок розчиняють в CH2Cl2. Суміш нейтралізують повільним додаванням насиченого розчину NaHCO3 і органічний шар видаляють. Водний шар екстрагують CH2Cl2 чотири рази, і об'єднані органічні шари сушать над MgSO4, фільтрують, упарюють у вакуумі з одержанням 2,45г (100%) необхідного продукту у вигляді жовюї твердої речовини. PX-MC розраховано для C9H7F3N2O: (М+Н)+ 217; знайдено 217,0. Стадія А-8 55 83917 3-(трифторметил)-5,6,7,8-тетрагідро-1,6нафтиридин До жовтої суспензії 3-(трифторметил)-5,8дигідро-1,6-нафтиридин-7(6Н)-ону (2,08г, 9,62ммоль) у ТГФ (14мл) додають повільно 1,0M розчин борану в ТГФ (48,5мл) і отриманий у результаті прозорий жовтий розчин перемішують при кімнатній температурі в атмосфері N2 протягом ночі. Після реакції протягом ночі, виявляють два піки. Основний пік (>80%) являє собою борановий комплекс, мінорний пік є піком необхідного продукту (
ДивитисяДодаткова інформація
Назва патенту англійською3-(4-heteroarylcyclohexylamino) cyclopentanecarboxamides as modulators of chemokine receptors
Автори англійськоюXue Chu-Biao, Zheng Changsheng, Cao Ganfeng, Feng Hao, Xia Michael, Anand Rajan, Glenn Joseph, Metcalf Brian
Назва патенту російською3-(4-гетероарилциклогексиламино)циклопентанкарбоксамиды как модуляторы хемокиновых рецепторов
Автори російськоюСюе Чу-Бяо, Чжен Чаншен, Цао Ганьфен, Фен Хао, Ксиа Майкл, Ананд Раджан, Гленн Джозеф, Меткаф Брайан
МПК / Мітки
МПК: C07D 471/02, A61K 31/4745, A61K 31/47
Мітки: модулятори, хемокінових, рецепторів, 3-(4-гетероарилциклогексиламіно)циклопентанкарбоксаміди
Код посилання
<a href="https://ua.patents.su/33-83917-3-4-geteroarilciklogeksilaminociklopentankarboksamidi-yak-modulyatori-khemokinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">3-(4-гетероарилциклогексиламіно)циклопентанкарбоксаміди як модулятори хемокінових рецепторів</a>
Попередній патент: Кришка для посудини
Наступний патент: Шихта для виготовлення вогнетривких виробів із стабілізованого і моноклінного діоксиду цирконію
Випадковий патент: Ультрафіолетовий стерилізатор для портативних цифрових пристроїв та аксесуарів












