1-піразоліл-3-(4-((2-анілінопіримідин-4-іл)окси)нафталін-1-іл)-сечовини як інгібітори p38 map-кінази
Номер патенту: 113289
Опубліковано: 10.01.2017
Автори: Оніонс Стюарт Томас, Чаррон Кетрін Елізабет, Лонгшоу Алістер Іан, Філльєрс Вальтер, Кінг-Андервуд Джон, Іто Казухіро, Копманс Алекс, Брукс Руді
Формула / Реферат
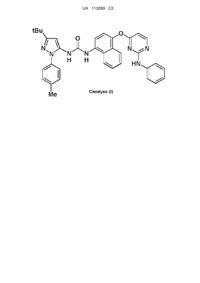
1. Сполука формули (І)
 (І)
(І)
або її фармацевтично прийнятна сіль, включаючи всі її стереоізомери і таутомери.
2. Сполука за п. 1 у вигляді вільної основи.
3. Сполука за п. 2 у вигляді безводної вільної основи в твердій кристалічній формі.
4. Сполука за п. 3, де сполука формули (І) у вигляді безводної вільної основи в твердій кристалічній формі характеризується порошковою дифракційною рентгенограмою, як показано на Фігурі 1 (Форма А).
5. Сполука за п. 3, де сполука формули (І) у вигляді безводної вільної основи в твердій кристалічній формі характеризується порошковою дифракційною рентгенограмою, яка має один, два, три, чотири, п'ять, шість або сім піків, вибраних із (± 0,2) 10,3, 15,2, 17,5, 23,1, 24,6, 26,7 і 27,4 градусів 2-тета.
6. Сполука за п. 3, де сполука формули (І) у вигляді безводної вільної основи в твердій кристалічній формі характеризується порошковою дифракційною рентгенограмою, як показано на Фігурі 2 (Форма В).
7. Сполука за п. 3, де сполука формули (І) у вигляді безводної вільної основи в твердій кристалічній формі характеризується порошковою дифракційною рентгенограмою, яка має один, два, три, чотири, п'ять, шість, сім або всі вісім піків, вибраних із (± 0,2) 3,9, 6,1, 11,8, 14,3, 16,7, 18,3, 18,7 і 28,9 градусів 2-тета.
8. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-7, в поєднанні з одним або більше фармацевтично прийнятними розчинниками або носіями.
9. Спосіб лікування стану, вибраного з групи: ХОХЛ (включаючи хронічний бронхіт і емфізему), астма, бронхіальна астма удітей, кістозний фіброз, саркоїдоз, ідіопатичний легеневий фіброз, алергічний риніт, риніт, синусит, алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне відносно ревматоїдного артриту або остеоартриту, ревматоїдний артрит, панкреатит, кахексія, інгібування росту і метастаз пухлин, включаючи недрібноклітинну карциному легені, карциному молочної залози, карциному шлунка, колоректальні карциноми, злоякісну меланому і респіраторні вірусні інфекції у пацієнтів із хронічними станами або у імунокомпрометованих пацієнтів, який включає введення пацієнту ефективної кількості сполуки формули (І) за будь-яким із пп. 1-7.
10. Комбінований продукт, який містить:
(A) сполуку формули (І) за будь-яким з пп. 1-7; і
(B) інший терапевтичний засіб,
де кожний із компонентів (А) і (В) приготований в суміші з фармацевтично прийнятним розріджувачем або носієм;
де вказана комбінація може являти собою як одиночний фармацевтичний склад, так і набір-із-компонентів.
11. Комбінований продукт за п. 10, який відрізняється тим, що іншим терапевтичним засобом є антивірусною терапією, такою як занамівір або озельтамівір.
Текст
Реферат: Винахід стосується сполуки формули (І), яка є інгібітором сімейства р38 міоген-активованих протеїнкіназних ферментів, і її застосування в лікуванні, зокрема в фармацевтичних комбінаціях, особливо в лікуванні запальних захворювань, зокрема запальних захворювань легень, таких як астма і ХОХЛ. UA 113289 C2 (12) UA 113289 C2 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід стосується сполук, які є інгібіторами сімейства p38 мітоген-активованих протеїнкіназних ферментів (що згадуються в даному документі як p38 MAP інгібітори кінази), наприклад, альфа і гамма кіназ їх підтипів, і Syk кіназ, і Src сімейства тирозинкіназ, і їх застосування в терапії, зокрема в фармацевтичних комбінаціях, особливо при лікуванні запальних захворювань, зокрема, запальних захворювань легень, таких, як астма і ХОХЛ, так само, як і запальних захворювань шлунково-кишкового тракту, таких, як неспецифічний виразковий коліт і хвороба Крона, і очей, таких, як увеїт. Рівень техніки Для чотирьох p38 МАРК ізоформ (альфа-, бета-, гамма- і дельта- відповідно) було визначено, що кожна відображає різні моделі тканинної експресії у людини. Р38 МАРК-альфа і бета-ізоформи виявлені повсюдно в тілі, присутні в багатьох різних типах клітин. Альфаізоформа добре описана з точки зору її ролі в запаленні. Хоча дослідження із застосуванням хіміко-генетичного підходу на мишах показали, що p38 MAPK-бета-ізоформа не грає ролі в запаленні (O'Keefe, S.J. et al., J. Biol. Chem., 2007, 282(48):34663-71.), вона може бути залучена до больових механізмів за допомогою регуляції експресії COX2 (Fitzsimmons, B.L. et al., Neuroreport, 2010, 21(4):313-7). Ці ізоформи інгібуються рядом раніше описаних низькомолекулярних сполук. Ранні класи інгібіторів були високотоксичними внаслідок широкого розподілу в тканинах цих ізоформ, що призводило до багатьох побічних ефектів від цих сполук. Крім того, розробка значної кількості інгібіторів була припинена в зв'язку з неприйнятними профілями безпеки в клінічних дослідженнях (Pettus, L.H. and Wurz, R.P., Curr. Top. Med. Chem., 2008, 8(16):1452-67.). Всі ці несприятливі ефекти залежать від хемотипу, і сполуки мають різні моделі кіназної селективності, токcичності, які спостерігаються, можуть бути більше зв'язані зі структурою, ніж засновані на механізмі p38. Менше відомо про р38 МАРК-гамма і -дельта-ізоформи, які, на відміну від альфа- і бетаізоферментів, експресуються в конкретних тканинах і клітинах. p38 МАРК-дельта ізоформа експресується більш сильно в підшлунковій залозі, яєчках, легені, тонкій кишці і нирці. Вона також присутня в достатній кількості в макрофагах і визначається в нейтрофілах, CD4+ Тклітинах і в ендотеліальних клітинах (Shmueli, O. et al., Comptes Rendus Biologies, 2003, 326(1011):1067-1072; Smith, S. J. Br. J. Pharmacol., 2006, 149:393-404; Hale, K. K., J. Immunol., 1999, 162(7):4246-52; Wang, X. S. et al., J. Biol. Chem., 1997, 272(38):23668-23674.). Дуже мало відомо про розподіл p38 МАРК-гамма, хоча вона експресується більш сильно в головному мозку, скелетних м'язах і серці, а також у лімфоцитах і макрофагах (Shmueli, O. et al., Comptes Rendus Biologies, 2003, 326(10-11):1067-1072; Hale, K. K., J. Immunol., 1999, 162(7):4246-52; Court, N. W. et al., J. Mol. Cell. Cardiol, 2002, 34(4):413-26; Mertens, S. et al., FEBS Lett., 1996, 383(3):273-6.). Селективні низькомолекулярні інгібітори p38 МАРК-гамма і p38 МАРК-дельта зараз відсутні, хоч одна раніше відкрита сполука, BIRB 796, як відомо, має пан-ізоформну інгібуючу активність. Інгібування р38 МАРК-гамма і -дельта-ізоформ спостерігається при більш високих концентраціях цієї сполуки, ніж необхідних для інгібування р38 МАРК-альфа і р38-бета (Kuma, Y., J. Biol. Chem., 2005, 280:19472-19479.). В доповнення, BIRB 796 також порушував фосфорилування р38 МАР-кіназ або JN-кіназ вищою кіназою МКК6 або MKK4. Кума обговорював можливість того, що конформаційна зміна, спричинена зв'язуванням інгібітора з МАРК-білком, може впливати на структуру і сайта фосфорилування, і сайта докінгу для вищого активатора, тим самим погіршуючи фосфорилування р38 МАР-кіназ або JN-кіназ. р38 МАР-кінази, як вважають, грають головну роль у багатьох сигнальних шляхах, які залучені до ініціювання і підтримки хронічного, постійного запалення при хворобі людини, наприклад, при важкій астмі і ХОХЛ (Chung, F., Chest, 2011, 139(6):)(1470-1479.). Зараз існує достатньо літератури, яка показує, що р38 МАР-кіназу активує ряд прозапальних цитокінів, і що її активація призводить до збільшення кількості і вивільнення додаткових прозапальних цитокінів. Дійсно, дані деяких клінічних досліджень демонструють позитивні зміни в активності захворювання у пацієнтів під час лікування інгібіторами р38 МАР-кінази. Наприклад, Smith описує інгібуючий ефект інгібіторів р38 МАР-кінази на TNF-альфа (але не IL-8), вивільнених із МКПК людини. Застосування інгібіторів р38 МАР-кінази для лікування хронічної обструктивної хвороби легень (ХОХЛ) також було запропоновано. Низькомолекулярні інгібітори, орієнтовані на р38 МАРК-альфа/-бета, довели ефективність у зниженні різних параметрів запалення в клітинах і в тканинах, отриманих від пацієнтів із ХОХЛ, які переважно несприйнятливі до кортикостероїдів (Smith, S.J., Br. J. Pharmacol., 2006, 149:393-404.), а також в різних in vivo тваринних моделях (Underwood, D.C. et al., Am. J. Physiol., 2000, 279:L895-902; Nath, Р. et al., Eur. J. Pharmacol., 2006, 544:160-167.). Irusen і його колеги також запропонували можливе залучення р38 МАРК 1 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 60 альфа/-бета в кортикостероїдну несприйнятливість за допомогою зниження спорідненості глюкокортикоїдного рецептора (ГР) в ядрах (Irusen, Е. et al., J. Allergy Clin. lmmunol., 2002, 109:649-657.). Клінічний досвід з рядом інгібіторів р38 МАР-кінази, включаючи AMG548, BIRB 796, VX702, SCIO469 і SCIO323, був описаний (Lee, M.R. and Dominguez, С., Current Med. Chem., 2005, 12:2979-2994.). ХОХЛ являє собою стан, при якому основне запалення, як повідомляється, є істотно стійким до протизапальної дії інгаляційних кортикостероїдів. Отже, кращою стратегією для лікування ХОХЛ буде розробка втручання, яке має як властиву протизапальну дію, так і здатність збільшувати чутливість тканини легень хворих ХОХЛ до інгаляційних кортикостероїдів. У недавній публікації Mercado (Mercado, N., et al., Mol. Pharmacol., 2011, 80(6):1128-1135.) показано, що заглушення р38 МАРК-γ має потенціал, щоб відновити сприйнятливість до кортикостероїдів. Отже, може бути подвійна вигода для пацієнтів при застосуванні інгібітора р38 MAP-кінази для лікування ХОХЛ і важкої форми астми. Проте, основною перешкодою на шляху використання інгібіторів р38 МАР-кінази при лікуванні хронічних запальних захворювань людини була гостра токсичність, яка спостерігається у пацієнтів, що привело до висновку з клінічного дослідження багатьох сполук, включаючи всі ті, спеціально згадані вище. Багато пацієнтів із діагнозом астма або ХОХЛ продовжують страждати від неконтрольованих симптомів і від загострень їх медичного стану, що може призвести до госпіталізації. Це відбувається незважаючи на застосування найпрогресивніших схем лікування, які є в цей час, що включають комбіновані продукти з інгаляційних кортикостероїдів і β-агоністів тривалої дії. Дані, накопичені за останнє десятиріччя, показують, що нездатність ефективно керувати основним компонентом запального захворювання в легенях є найбільш імовірною причиною, яка спричинює загострення. Враховуючи встановлену ефективність кортикостероїдів як протизапальних агентів і, зокрема, інгаляційних кортикостероїдів при лікуванні астми, ці отримані дані спровокували інтенсивне вивчення. Отримані дослідження показали, що деякі несприятливі чинники навколишнього середовища викликають кортикостероїдо-несприйнятливі запальні зміни в легенях пацієнтів. Прикладом може бути реакція у відповідь, що виникає з вірусно-опосередкованих інфекцій верхніх дихальних шляхів (ІВДШ), яка має особливе значення в збільшенні захворюваності, пов'язаної з астмою і ХОХЛ. Епідеміологічні дослідження виявили тісний зв'язок між вірусними інфекціями верхніх дихальних шляхів і значною частиною загострень, перенесених пацієнтами з уже діагностованими хронічними захворюваннями органів дихання. Деякі з найбільш переконливих даних в цьому відношенні виводяться з подовжніх досліджень дітей, які страждають від астми (Papadopoulos, N.G., Papi, А., Psarras, S. and Johnston, S.L., Paediatr. Respir. Rev, 2004, 5(3):255260.). Різноманітність додаткових досліджень підтверджує висновок, що вірусна інфекція може прискорити загострення і збільшити тяжкість захворювання. Наприклад, експериментальні клінічні інфікування риновірусом, як повідомлялося, викликали бронхіальну гіперреактивність до гістаміну в астматиків, яка не відповідає на лікування кортикостероїдами (Grunberg, K., Sharon, R.F., et al., Am. J. Respir. Crit. Care Med., 2001, 164(10):1816-1822.). Ще одне свідчення походить від зв'язку, який спостерігається між загостреннями захворювання у пацієнтів з кістозним фіброзом і РВЛ-інфекціями (Wat, D., Gelder, С., et al., J. Cyst. Fibros, . 2008, 7:320-328.). Також узгоджується з цим масивом даних виявлення того, що респіраторні вірусні інфекції, зокрема риновірус, являють собою незалежний чинник ризику, що негативно корелює з 12-місячним коефіцієнтом виживаності в педіатрії, у реципієнтів трансплантата легені (Liu, M., Worley, S., et al., Transpl. Infect. Dis. 2009, 11(4):304-312.). Клінічні дослідження показують, що вірусне навантаження пропорційне до симптомів, які спостерігаються, і ускладнень і, непрямо, до тяжкості запалення. Наприклад, після експериментального інфікування риновірусом симптоми нижніх дихальних шляхів і бронхіальна гіперреактивність значно корелюють із вірусним навантаженням (Message, S.D., Laza-Stanca, V., et al., PNAS, 2008; 105(36):13562-13567.). Аналогічним чином, за відсутності інших вірусних агентів риновірусні інфекції були звичайно пов'язані з інфекціями нижніх дихальних шляхів і свистячого дихання, коли вірусне навантаження було високим в імунокомпетентних педіатричних пацієнтів (Gerna, G., Piralla, А., et al., J. Med. Virol, . 2009, 81(8):1498-1507.). Цікаво, недавно було повідомлено, що попередній вплив на риновірус знижував цитокінову відповідь, викликану бактеріальними продуктами в альвеолярних макрофагах людини (Oliver, B.G., Lim, S., et al., Thorax, 2008, 63:519-525.). Крім того, інфікування носових епітеліальних клітин риновірусом, як було задокументовано, сприяє адгезії бактерій, зокрема S. aureus і Н. influenzae (Wang, J.H., Kwon, H.J. and Yong, J.J., The Laryngoscope, 2009, 119(7):1406-1411.). Такі клітинні ефекти можуть сприяти збільшенню імовірності пацієнтів, які страждають від інфекції нижніх дихальних шляхів, яка слідує за інфекцією у верхніх дихальних шляхах. 2 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно, терапевтично обґрунтовано зосередити увагу на здатності нових втручань для зниження вірусного навантаження в різних in vitro системах, як сурогатного прогностичного чинника їх користі в клінічних умовах. Групи високого ризику, для яких риновірусна інфекція у верхніх дихальних шляхах може призвести до серйозних вторинних ускладнень, не обмежена пацієнтами з хронічними респіраторними захворюваннями. Вони включають в себе, наприклад, імунокомпрометованих, схильних до інфекції нижніх дихальних шляхів, а також пацієнтів, що перенесли хіміотерапію, які стикаються з гострою лихоманкою, яка загрожує життю. Крім того, було передбачено, що інші хронічні захворювання, такі, як діабет, пов'язані з компрометованою імунозахисною реакцією. Це збільшує як імовірність набування інфекції респіраторного тракту, так і госпіталізації в результаті (Peleg, A.Y., Weerarathna, T., et al., Diabetes Metab. Res. Rev., 2007, 23(1):3-13; Kornum, J.B., Reimar, W., et al., Diabetes Care, 2008, 31(8):1541-1545.). У той час, як вірусні інфекції верхніх дихальних шляхів є причиною значної захворюваності і смертності у пацієнтів з основним захворюванням або іншими чинниками ризику, вони також являють собою значний тягар охорони здоров'я у загальній популяції, і є основною причиною пропущених днів у школі і втраченого часу на робочому місці (Rollinger, J.M. and Schmidtke, M., Med. Res. Rev., 2010, Doi 10.1002/med.20176.). Ці міркування дають зрозуміти, що нові лікарські засоби, які мають підвищену ефективність порівняно з сучасними терапіями, терміново потрібні для профілактики і лікування риновірус-опосередкованих інфекцій верхніх дихальних шляхів. Загалом, стратегії, прийняті для відкриття поліпшених антивірусних агентів, орієнтовані на різні білки, які продукує вірус, як на точку терапевтичного втручання. Проте, широкий спектр риновірусних серотипів змушує продовжувати цей надзвичайно складний підхід і може пояснити, чому сьогодні лікарський засіб для профілактики і лікування риновірусних інфекцій досі не схвалений яким-небудь регулюючим органом. Вхід вірусу в клітину-хазяїна пов'язаний з активацією ряду внутрішньоклітинних сигнальних шляхів, які, як належить, грають важливу роль в ініціюванні запальних процесів (огляд Ludwig, S, 2007; Signal Transduction, 7:81-88.) і вірусного поширення та подальшого вивільнення. Одним з таких механізмів, як було визначено, який грає роль у поширенні вірусу грипу in vitro, є активація фосфоїнозитид-3-кінази/Akt шляху. Повідомлялося, що цей сигнальний шлях активується NS1-білком вірусу (Shin, Y.K., Liu, Q. et al., J. Gen. Virol., 2007, 88:13-18.), і що його інгібування знижує титри потомства вірусу (Ehrhardt, С., Marjuki, Н. et al., Cell Microbiol, 2006, 8:1336-1348.). Крім того, MEK-інгібітор U0126, як було задокументовано, інгібує вірусне поширення, не спричиняючи появи резистентних варіантів вірусу (Ludwig, S., Wolff, Т. et al., FEBS Lett., 2004, 561(1-3):37-43.). Зовсім недавно дослідження, спрямовані на інгібування Syk-кінази, продемонстрували, що фермент грає важливу роль у забезпеченні входу риновірусу в клітини, а також вірус-індукованій запальній відповіді, зокрема підвищенні ICAM-1 (Sanderson, M.P., Lau, C.W. et al., Inflamm. Allergy Drug Targets, 2009, 8:87-95.). Активність Syk, як повідомляється, контролюється с-Src у ролі вищої кінази при РВЛ-інфекції (Lau, С. et al., J. Immunol., 2008, 180(2):870-880.). Невелика кількість досліджень показала, що пов'язує активацію клітинної Src (Src1 або p60-Src) або сімейства кіназ Src з інфікуванням вірусами. Вони включають в себе доповідь про те, що аденовірус викликає PI3-кіназну опосередковану активацію Akt через с-Srcзалежний механізм. Крім того, було припущено, що індукування Риновірусом-39 продукції IL-8 в епітеліальних клітинах залежить від активації Src-кінази (Bentley, J.K., Newcomb, D.C., J. Virol., 2007, 81:1186-1194.). Нарешті, було запропоновано, що активація Src-кінази залучена до індукції продукції муцину риновірусом-14 в епітеліальних клітинах і підслизових залозах (Inoue, D. і Yamaya, М., Respir. Physiol. Neurobiol., 2006, 154(3):484-499.). Раніше було відкрито, що сполуки, які інгібують активність обох с-Src і Syk-кіназ, є ефективними засобами проти реплікації риновірусів (Charron, C.E. et al., WO 2011/158042), і що сполуки, які інгібують p59-HCK, ефективні проти реплікації вірусу грипу (Charron, C.E. et al., WO 2011/070369). З причин, викладених вище, сполуки, призначені для лікування хронічних респіраторних захворювань, які поєднують ці невід'ємні властивості з інгібуванням р38 МАРК, як очікується, будуть особливо ефективні. Деякі інгібітори р38 МАРК також були описані як інгібітори реплікації респіраторносинцитіального вірусу (Cass, L. et al., WO 2011/158039.). Крім того, потрібно зазначити, що інгібітор р38 МАРК, як було встановлено, забезпечує перевагу для пацієнтів із ЗЗК після одного тижня лікування, яке не було стійким протягом чотирьох тижнів курсу лікування (Schreiber, S. et al., Clin. Gastro. Hepatology, 2006, 4:325-334.). У доповнення до виконання головної ролі в сигнальних подіях клітини, які контролюють активність прозапальних шляхів, кіназні ферменти в цей час також визнані такими, що 3 UA 113289 C2 5 10 15 20 25 30 регулюють активність низки клітинних функцій. Серед тих, які обговорювалися останнім часом, присутні підтримка цілісності ДНК (Shilo, Y. Nature Reviews Cancer, 2003, 31155-168.) і координація складних процесів клітинного поділу. Ілюстрацією останніх даних є публікація, що описує вплив набору інгібіторів, які діють на так звані "кінази Олахарські", на частоту утворення мікроядер in vitro (Olaharsky, A.J. et al., PLoS Comput. Biol., 2009, 5(7):e1000446.). Формування мікроядер залучене в або пов'язане з порушенням мітотичних процесів, і тому небажаним є вияв потенційної токсичності. Інгібування глікоген синтази кінази 3α (GSK3α), як було виявлено, є надзвичайно важливим чинником, який збільшує імовірність інгібітора кінази сприяти утворенню мікроядер. Недавно також повідомлялося, що інгібування кінази GSK3β РНКінтерференцією сприяє формуванню мікроядер (Tighe, А. et al., BMC Cell Biology, 2007, 8:34.). Може бути можливим пом'якшити негативні наслідки, які виникають від взаємодій лікарських засобів з кіназами Олахарські, такими, як GSK3α, шляхом оптимізації дози і/або шляхом зміни способу введення. Проте, було б більш вигідно визначити терапевтично корисні молекули, які демонструють низьку або невиявну активність відносно цих побічних ферментів і, отже, спричиняють малі або взагалі не спричиняють порушення мітотичних процесів, як було виміряно при аналізі мітозу. Як видно з обговорення літератури, цитованої вище в даному документі, залишається необхідність визначити і розробити нові інгібітори р38 МАР-кінази, які мають поліпшений терапевтичний потенціал порівняно з доступними зараз методами лікування. Бажаними є сполуки, які виявляють дуже добрий терапевтичний індекс, забезпечуючи, щонайменше, той же дійовий ефект, що і у попередніх агентів, але, в одному або декількох аспектах, є менш токсичними при відповідній терапевтичній дозі. Метою даного винаходу, отже, є надання таких нових сполук, які інгібують ферментативну активність р38 МАР-кінази, наприклад, з деякими особливостями підтипу разом з Syk-кіназою і тирозинкіназами в межах сімейства Src (зокрема, с-Src), які за допомогою цього мають добрі протизапальні властивості, і є придатними для застосування в терапії. Сполука (I) виявляє велику тривалість дії і/або стійкість дії порівняно з раніше відкритим алостеричним інгібітором р38 МАР-кінази BIRB 796 (Pargellis, С. et al., Nature Struct. Biol., 2002, 9(4):268-272.). Додатковий варіант здійснення надає така нова сполука в одній або декількох твердих кристалічних формах, які мають високу хімічну і фізичну стабільність, що придатна для приготування у вигляді інгаляційних лікарських засобів. Суть винаходу Таким чином, в одному аспекті винаходу пропонується сполука формули (I): 35 40 45 50 або її фармацевтично прийнятна сіль або сольват, включаючи всі її стереоізомери і таутомери. "Сполука формули (I)" також може згадуватися в даному документі як "Сполука (I)". В іншому аспекті даного винаходу надається Сполука (I), як визначено вище, у вигляді вільної основи. В іншому аспекті даного винаходу надається Сполука (I), як визначено вище, у вигляді безводної вільної основи. В іншому аспекті даного винаходу надається Сполука (I), як визначено вище, у вигляді безводної вільної основи в твердій кристалічній формі. У ще одному аспекті даного винаходу надається Сполука (I), як визначено вище, у вигляді безводної вільної основи в твердій кристалічній поліморфній формі А. У ще одному аспекті даного винаходу надається Сполука (I), як визначено вище, у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В. Короткий опис креслень 4 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 Фігура 1 показує спектр порошкової рентгенівської дифракції (ПРД), отриманий від зразка Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі А. Фігура 2 відображає спектр ПРД, отриманий від зразка Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В після мікронізації. Фігура 3 виявляє результати термогравіметричного аналізу зразка Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В після мікронізації. Фігура 4 представляє графіки ізотерми динамічної сорбції парів (ДСП), отримані від зразка Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В після мікронізації. Фігура 5 представляє результати експерименту з визначення гістерезису, проведеного над зразком Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В після мікронізації, для того, щоб визначити ступінь і швидкість абсобції/десорбції вологи згодом проти змін у відносній вологості. Фігура 6 являє собою інфрачервоний (ІК) спектр, отриманий від зразка Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В після мікронізації. Фігура 7 показує термічний аналіз зразка Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В (мікронізований) шляхом диференціальної сканувальної калориметрії (ДСК). Детальний опис винаходу Сполука формули (I), розкрита в даному описі, являє собою 1-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)-3-(4-(2-(феніламіно)піримідин-4-ілокси)нафталін-1-іл)сечовину. Приклади солей Сполуки (I) включають всі фармацевтично прийнятні солі, такі, як, без обмеження, кислотноадитивні солі сильних мінеральних кислот, таких, як солі HCl і HBr, і адитивні солі сильних органічних кислот, таких, як метансульфонова кислота. У ролі використовуваного в даному документі нижче, визначення сполуки формули (I) призначене для включення солей, сольватів і всіх таутомерів вказаної сполуки, якщо контекст спеціально не вказує інше. Приклади сольватів включають гідрати. Винахід, представлений в даному документі, поширюється на проліки за сполукою формули (I), тобто сполуки, які руйнуються і/або метаболізуються in vivo, щоб надати активну сполуку формули (I). Загальні приклади проліків включають прості складні ефіри, і інші складні ефіри, такі, як змішані карбонатні складні ефіри, карбамати, глікозиди, прості ефіри, ацетали і кетали. Винахід охоплює всі ізотопні похідні Сполуки (I). Таким чином, винахід охоплює сполуки, які є сполуками за Сполукою (I), що мають один або більше атомів, які були заміщені атомом, що має атомну масу або масове число, відмінні від атомної маси або масового числа, які найчастіше зустрічаються в природі, або в якому частка атома, що має атомну масу або масове число, які зустрічаються менш часто в природі, була збільшена (остання концепція називається "ізотопним збагаченням"). Таким чином, сполуки за даним винаходом включають ті, в яких певний атом є таким, що зустрічається в природі, або ізотопом, що не зустрічається в природі. В одному варіанті здійснення ізотоп являє собою стабільний ізотоп. Таким чином, сполуки за даним винаходом, включають, наприклад, сполуки, які містять дейтерій і тому подібні. Таким чином, в одному варіанті здійснення за винаходом Сполука (I) містить збагачений рівень дейтерію в одному або більше атомах водню (наприклад, для даного атома водню рівень ізотопу дейтерію перевищує 20 %, 50 %, 75 %, 90 %, 95 % або 99 % від числа). Приклади інших ізотопів, які можуть бути включені в Сполуку (I) або збагачені в Сполуці (I), включають ізотопи 3 11 13 14 15 18 123 125 водню, вуглецю, азоту, кисню, фтору, йоду і хлору, такі, як H, С, С, С, N, F, I або I, які можуть бути такими, що зустрічаються в природі, або ізотопами, які не зустрічаються в природі. У ще одному аспекті даного винаходу наданий один або більше метаболітів сполуки формули (I), зокрема, метаболіт, який зберігає одне або більше терапевтичних дій сполуки формули (I). Метаболіт, як використовується в даному описі, являє собою сполуку, яка продукується in vivo внаслідок метаболізму сполуки формули (I), такі як, без обмеження, окислювальні метаболіти і/або метаболіти, отримані, наприклад, у результаті О-деалкілування. Даний винахід також поширюється на всі поліморфні форми сполук, визначених у даному документі. Шлях, придатний для отримання сполуки формули (I), показаний нижче (Схема 1). 5 UA 113289 C2 5 10 15 20 25 30 Захисні групи можуть бути необхідні, щоб захистити хімічно чутливі групи протягом однієї або декількох із реакцій, описаних вище, щоб забезпечити, що процес може бути проведений і/або є результативним. Таким чином, якщо бажано або необхідно, проміжні сполуки можуть бути захищені використанням звичайних захисних груп. Захисні групи і засоби для їх видалення описані в "Protective Groups in Organic Synthesis" авторів Theodora W. Greene і Peter G. M. Wuts, опубліковано John Wiley & Sons Inc; 4th Rev Ed., 2006, ISBN-10: 0471697540. Детальне отримання Сполуки (I) надане в Прикладі 1. Нові проміжні сполуки, як описано в даному описі, складають аспект даного винаходу. В іншому аспекті даного винаходу надана Сполука (I) у вигляді безводної вільної основи в твердій кристалічній формі. У ще одному аспекті даного винаходу надана Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі А, яка може бути отримана, наприклад, шляхом кристалізації Сполуки (I) з ізопропілацетату. В окремому аспекті даного винаходу надана Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В, яка може бути отримана, наприклад, шляхом кристалізації Сполуки (I) з ацетону і води. Типове співвідношення ацетону і води, придатне для цього процесу, знаходиться між 5:1 і 200:1, наприклад, близько 10:1. Крім того, форма В може бути отримана шляхом кристалізації Сполуки (I) з одного ацетону. Детальне отримання Сполуки (I) у вигляді безводної вільної основи в твердих кристалічних поліморфних формах А і В надане в Прикладах 1 і 3 Експериментального розділу відповідно. У ще одному аспекті даного винаходу властивості твердого стану Сполуки (I) можуть бути поліпшені шляхом подальших стадій суспендування або перекристалізації, для отримання, наприклад, матеріалу з поліпшеною морфологією і/або такого, який містить знижений рівень залишкового розчинника. Наприклад, залишковий розчинник може бути видалений зі Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В шляхом суспендування Сполуки (I) в поліморфній формі В у воді або, як альтернатива, шляхом подальшої перекристалізації з ацетону. Детальний опис зразкової процедури суспендування наданий в Прикладі 3а Експериментального розділу. В одному варіанті здійснення надана тверда кристалічна поліморфна форма А Сполуки (I) у вигляді безводної вільної основи, що має спектр ПРД по суті як показано на Фігурі 1. Метод отримання даних ПРД описаний в Аналітичних методах, і ці дані обговорені в Прикладі 5. 6 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, надана Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі А, що має спектр ПРД з щонайменше одним (наприклад, одним, двома, трьома, чотирма, п'ятьма, шістьома, сімома, вісьмома, дев'ятьма, десятьма, одинадцятьма, дванадцятьма, тринадцятьма, чотирнадцятьма, п'ятнадцятьма або всіма шістнадцятьма) піком(ами) при 7,8; 8,7; 10,3; 11,2; 12,4; 15,2; 16,2; 17,5; 19,7; 20,8; 22,6; 23,1; 24,6; 25,5; 26,7; 27,4 (±0,2 градуса, 2-тета значення), ці піки є характеристикою твердої кристалічної поліморфної форми А. Піки при 10,3; 15,2; 17,5; 23,1; 24,6; 26,7 і 27,4 особливо характерні для твердої кристалічної поліморфної форми А і, отже, є переважним, щоб щонайменше один (наприклад, один, два, три, чотири, п'ять, шість або всі сім) з цих піків спостерігався в спектрі ПРД. В іншому варіанті здійснення надана тверда кристалічна поліморфна форма В Сполуки (I) у вигляді безводної вільної основи (мікронізованої), яка має спектр ПРД по суті як показано на Фігурі 2. Спосіб мікронізації описаний в Прикладі 4, і спосіб отримання даних ПРД описаний в Аналітичних методах, і ці дані обговорені в Прикладі 5. Таким чином, тут надана Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В (мікронізованої), яка має порошкову дифракційну рентгенограму з щонайменше одним (наприклад, одним, двома, трьома, чотирма, п'ятьма, шістьома, сімома, вісьмома, дев'ятьма, десятьма, одинадцятьма, дванадцятьма, тринадцятьма, чотирнадцятьма, п'ятнадцятьма, шістнадцятьма, сімнадцятьма або всіма вісімнадцятьма) піком(ами) при 3,9; 6,1; 7,7; 8,6; 10,9; 11,8; 12,7; 14,3; 15,9; 16,7; 18,3; 18,7; 19,9; 20,9; 22,0; 22,6; 25,2; 28,9 (±0,2 градуса, 2-тета значення), ці піки є характеристикою твердої кристалічної поліморфної форми В. Піки при 3,9; 6,1; 11,8; 14,3; 16,7; 18,3; 18,7 і 28,9 особливо характерні для твердої кристалічної поліморфної форми В і, отже, є переважним, щоб щонайменше один (наприклад, один, два, три, чотири, п'ять, шість, сім або всі вісім) з цих піків спостерігався в спектрі ПРД. Температури плавлення Сполуки (I) у вигляді безводної вільної основи в твердих кристалічних поліморфних формах А і В були визначені із застосуванням методу диференціальної сканувальної калориметрії, як описано в Прикладі 6. Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі А, як було виявлено, має температуру плавлення 191,6 °C, а Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В, як було виявлено, має температуру плавлення 214 °C. Поліморфна форма В, як було також встановлено, має більш високу теплоту плавлення, ніж поліморфна форма А. Як пояснено в Прикладі 6, ці результати передбачають, що поліморфна форма В термодинамічно більш стабільна, ніж поліморфна форма А. Фізична і хімічна стабільності Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В були досліджені, результати яких розкриті в даному документі. Для того, щоб оцінити фізичну стабільність, Сполуку (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В було мікронізовано за методикою, описаною в Прикладі 4, і зразки отриманого матеріалу зберігали у відкритих контейнерах і піддавали різним температурам і відносній вологості навколишнього середовища. Фізичні властивості і стабільності зразків були досліджені за допомогою методів ТГА, ДСК, ДПС, ІК-спектроскопії і ПРД. Повні експериментальні методики наведені в розділі Загальні Методики, і результати наведені в Прикладі 7 (Таблиця 8). Як обговорювалося в Прикладі 7, Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В (мікронізована), як було встановлено, має хорошу фізичну стабільність. Ті ж експериментальні методики були також проведені із застосуванням Сполуки (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В у немікронізованій формі, і результати виявилися по суті аналогічні тим, які були отримані для мікронізованого матеріалу, тобто Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В і в мікронізованій, і в немікронізованій формі, як було встановлено, має хорошу фізичну стабільність. Для того, щоб оцінити хімічну стабільність, Сполуку (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В було мікронізовано за методикою, описаною в Прикладі 4. Мікронізовані зразки зберігали у відкритих контейнерах і піддавали різним температурам і відносній вологості навколишнього середовища. Хімічні стабільності зразків аналізували методом ВЕРХ. Результати наведені в Прикладі 8 (Таблиця 9), де вказано, що Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній формі В після мікронізації, як було виявлено, хімічно стабільна, хоча деяка чутливість до світла була помічена. Внаслідок досліджень твердого стану, описаних в даному документі, можна зробити висновок, що Сполука (I) у вигляді безводної вільної основи в твердій кристалічній поліморфній 7 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 формі В може бути мікронізована, і що отриманий в результаті матеріал має хорошу фізичну і хімічну стабільність. Сполука формули (I) є інгібітором р38 МАР-кінази (особливо альфа-підтипу), і в одному аспекті ця сполука корисна при лікуванні запальних захворювань, наприклад, ХОХЛ і/або астми. Несподівано виявилося, що ця сполука виявляє велику тривалість дії і/або стійкість дії порівняно з раніше описаним інгібітором р38 МАР-кінази BIRB796. Стійкість дії в даному контексті стосується швидкості дисоціації або константи дисоціації сполуки від мішені (такої, як рецептор). Низька швидкість дисоціації може призвести до стійкості. Низька швидкість дисоціації в поєднанні з високою швидкістю асоціації, як правило, надає сильнодіючі терапевтичні об'єкти. Сполука формули (I), як очікується, буде сильнодіючою in vivo. Як правило, сполуки попереднього рівня техніки, розроблені на сьогодні, були призначені для перорального введення. Ця стратегія включає оптимізацію сполук, які досягають своєї тривалості дії відповідним фармакокінетичним профілем, тим самим забезпечуючи те, що достатньо висока концентрація лікарського засобу встановлюється і підтримується між дозами, щоб надати клінічну перевагу. Неминучим наслідком такого підходу є те, що всі тканини тіла, а особливо печінка і кишечник, піддаються над-терапевтичним активним концентраціям препарату, в будь-якому випадку вони піддаються несприятливій дії при захворюванні, яке лікують. Альтернативна стратегія полягає в розробці парадигм лікування, в яких препарат подається безпосередньо до запаленого органу (місцева терапія). Хоч такий підхід не підходить для лікування всіх хронічних запальних захворювань, він був широко використаний при легеневих захворюваннях (астма, ХОХЛ), шкірних захворюваннях (атопічний дерматит і псоріаз), захворюваннях носа (алергічний риніт) і шлунково-кишкових розладах (неспецифічний виразковий коліт). При місцевій терапії ефективність може бути досягнута або шляхом забезпечення того, що лікарський засіб має стійку тривалість дії і зберігається у відповідному органі, щоб мінімізувати ризики системної токсичності, або шляхом отримання складу, який створює "резервуар" активного лікарського засобу, що здатний зберігати його бажані ефекти. Перший підхід підтверджений прикладом антихолінергічного лікарського засобу тіотропію (Спіріва). Цю сполуку вводять місцево в легені для лікування ХОХЛ, і вона має виключно високу спорідненість до свого рецептора-мішені, що призводить до дуже повільної швидкості дисоціації, і, отже, стійкої тривалості дії. В одному аспекті даного винаходу сполука формули (I) особливо підходить для місцевої доставки, такої, як місцева доставка в легені, зокрема, для лікування респіраторних захворювань, наприклад, хронічних респіраторних захворювань, таких як ХОХЛ і/або астма. В одному варіанті здійснення сполука формули (I) є придатною для сенсибілізації пацієнтів до лікування кортикостероїдами, тих, хто стали несприйнятливі до таких схем лікування. Сполука формули (I) також може бути корисна для лікування ревматоїдного артриту. Сполука формули (I) може мати противірусні властивості, наприклад, здатність запобігати інфікуванню клітин (наприклад, респіраторних епітеліальних клітин) пікорнавірусами, зокрема, риновірусами, грипом або респіраторно-синцитіальним вірусом. Таким чином, сполука, як вважають, являє собою противірусний засіб, зокрема, придатний для профілактики, лікування або полегшення пікорнавірусних інфекцій, таких, як риновірусна інфекція, грип або респіраторно-синцитіальний вірус. В одному варіанті здійснення сполука формули (I) здатна зменшувати запалення, індуковане вірусною інфекцією, такою, як риновірусна інфекція, і особливо вірусні інфекції, які призводять до вивільнення цитокінів, таких, як IL-8, особливо in vivo. Ця активність може, наприклад, бути перевірена in vitro, використовуючи аналіз риновірус-індукованого IL-8, як описано в Прикладах в даному документі. В одному варіанті здійснення сполука формули (I) здатна зменшити експресію ICAM1, індуковану риновірусом, особливо in vivo. ICAM1 являє собою рецепторний механізм, який застосовується так званою великою борозенкою риновірусних серотипів для інфікування клітин. Ця активність може бути виміряна, наприклад, способом, описаним в Прикладах в даному документі. Очікується, що вказані вище властивості роблять сполуку формули (I) особливо придатною для застосування при лікуванні і/або профілактиці загострень запальних захворювань, зокрема, вірусних загострень у пацієнтів з одним або декількома з наступних хронічних захворювань, 8 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 таких, як застійна серцева недостатність, ХОХЛ, астма, діабет, рак і/або в імуносупресованих пацієнтів, наприклад, після трансплантації органа. Зокрема, сполука формули (I) може бути корисна при лікуванні одного або більше порушень дихальних функцій, зокрема ХОХЛ (включаючи хронічний бронхіт і емфізему), астми, педіатричної астми, кістозного фіброзу, саркоїдозу, ідіопатичного фіброзу легень, алергічного риніту, риніту, синуситу, особливо астми і ХОХЛ (включаючи хронічний бронхіт і емфізему). Сполука формули (I) також може бути корисна при лікуванні одного або більше станів, які можна лікувати шляхом місцевої або локальної терапії, включаючи алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне відносно ревматоїдного артриту або остеоартриту. Крім того, очікується, що сполука формули (I) може бути корисна при лікуванні деяких інших станів, включаючи ревматоїдний артрит, панкреатит, кахексію, інгібуванні росту і метастаз пухлин, включаючи недрібноклітинну карциному легені, карциному молочної залози, карциному шлунка, колоректальні карциноми і злоякісну меланому. Сполука формули (I) може бути корисна при лікуванні очних захворювань або розладів, зокрема алергічного кон'юнктивіту, кон'юнктивіту, діабетичної ретинопатії, макулярного набряку (включаючи вологий макулярний набряк і сухий макулярний набряк), післяопераційного запалення катаракти або, зокрема, увеїту (зокрема заднього, переднього і панувеїту). Сполука формули (I) може бути корисна при лікуванні шлунково-кишкових захворювань або розладів, включаючи неспецифічний виразковий коліт або хворобу Крона. Сполука формули (I) може також повторно сенсибілізувати стан пацієнта для лікування кортикостероїдами, коли стан пацієнта став несприйнятливим до них. Крім того, даний винахід надає фармацевтичну композицію, яка містить сполуку відповідно до даного винаходу, необов'язково в поєднанні з одним або більше фармацевтично прийнятними розріджувачами або носіями. Даний винахід також надає спосіб отримання такої фармацевтичної композиції, яка містить змішування інгредієнтів. Розріджувачі і носії можуть включати ті, які придатні для парентерального, перорального, місцевого, через слизові оболонки і ректального введення. Як згадувалося вище, такі композиції можуть бути отримані, наприклад, для парентерального, підшкірного, внутрішньом'язового, внутрішньовенного, інтраартикулярного або періартикулярного введення, зокрема в формі рідких розчинів або суспензій; для перорального введення, зокрема в формі таблеток або капсул; для місцевого, наприклад, легеневого або інтраназального введення, зокрема у вигляді порошків, носових крапель або аерозолів, і трансдермального введення; для введення через слизову оболонку, наприклад, букального, сублінгвального або через слизову оболонку піхви, і для ректального введення, наприклад, у вигляді супозиторіїв. Композиції можуть бути зручним чином введені в одиничній дозованій формі, і можуть бути отримані будь-яким зі способів, добре відомих у фармацевтичній сфері, наприклад, як описано в Remington's Pharmaceutical Sciences, 17-е вид., Mack Publishing Company, Easton, PA., (1985). Склади для парентерального введення можуть містити як допоміжні речовини воду або фізіологічний розчин, алкіленгліколі, такі, як пропіленгліколь, поліалкіленгліколі, такі, як поліетиленгліколь, олії рослинного походження, гідрогенізований нафталін і їм подібні. Композиції для назального введення можуть бути твердими і можуть містити допоміжні речовини, наприклад, лактозу або декстран, або можуть являти собою водні або масляні розчини для використання в формі назальних крапель або дозованих спреїв. Для букального введення типові допоміжні речовини включають цукор, стеарат кальцію, стеарат магнію, прежелатинізований крохмаль і їм подібні. Композиції, придатні для перорального введення, можуть містити один або більше фізіологічно сумісних носіїв і/або допоміжні речовини, і можуть бути в твердій або рідкій формі. Таблетки і капсули можуть бути приготовані зі зв'язувальними агентами, наприклад, сиропом, гуміарабіком, желатином, сорбітом, трагакантом або полівінілпіролідоном; наповнювачами, такими, як лактоза, сахароза, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцин; змащувальними речовинами, такими, як стеарат магнію, тальк, поліетиленгліколь або діоксид кремнію; і поверхнево-активними речовинами, такими, як лаурилсульфат натрію. Рідкі композиції можуть містити звичайні добавки, такі, як суспендувальні агенти, наприклад, сироп сорбіту, метилцелюлозу, сироп цукру, желатин, карбоксиметилцелюлозу або харчові жири; емульгатори, такі, як лецитин або гуміарабік; рослинні олії, такі, як мигдалева олія, кокосова олія, масло печінки тріски або арахісова олія; консерванти, такі, як бутильований гідроксіанізол 9 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 (BHA) і бутильований гідрокситолуол (BHT). Рідкі композиції можуть бути вміщені, наприклад, в желатинові капсули, щоб надати одиничну дозовану лікарську форму. Тверді пероральні дозовані форми включають таблетки, капсули з твердими двостулковими оболонками і м'які еластичні желатинові (SEG) капсули. Сухий склад оболонки звичайно містить приблизно 40-60 %-у масову концентрацію желатину, приблизно 20-30 %-у концентрацію пластифікатору (таких, як гліцерин, сорбіт або пропіленгліколь) і приблизно 30-40 %-у концентрацію води. Інші матеріали, такі, як консерванти, барвники, замутнювачі і ароматизатори також можуть бути присутнім. Рідкий наповнювальний матеріал включає твердий лікарський засіб, який був розчинений, солюбілізований або диспергований (із суспендувальними агентами, такими, як бджолиний віск, гідрогенізована рицинова олія або поліетиленгліколь 4000), або рідкий лікарський засіб у середовищах або комбінаціях середовищ, таких, як мінеральне масло, рослинні олії, тригліцериди, гліколі, поліоли і поверхнево-активні речовини. Відповідно, сполуку формули (I) вводять місцево в легені. Тому автори винаходу надали, відповідно до винаходу, фармацевтичну композицію, яка містить Сполуку (I) за винаходом, необов'язково в поєднанні з одним або більше прийнятними для місцевого застосування розріджувачами або носіями. Місцеве введення в легені може бути досягнуте шляхом використання аерозольного складу. Аерозольні склади звичайно містять активний інгредієнт, суспендований або розчинений у відповідному аерозольному пропеленті, такому, як хлорфторвуглець (CFC) або гідрофторвуглець (HFC). Придатні CFC-пропеленти включають трихлормонофторметан (пропелент 11), дихлоротетрафторметан (пропелент 114) і дихлордифторметан (пропелент 12). Придатні HFC-пропеленти включають тетрафторетан (HFC-134a) і гептафторпропан (HFC-227). Пропелент звичайно містить 40-99,5 %, наприклад, 40-90 % за масою від загальної композиції для інгаляції. Склад може містити наповнювачі, включаючи співрозчинники (наприклад, етанол) і поверхнево-активні речовини (наприклад, лецитин, сорбітантріолеат і тому подібні). Аерозольні склади упаковані в балони, і придатна доза доставляється за допомогою дозуючого клапана (наприклад, запропонованим Bespak, Valois або 3М). Місцеве введення в легені може бути також досягнуте шляхом застосування складу не під тиском, такого, як водний розчин або суспензія. Його можна вводити з допомогою небулайзера. Небулайзери можуть бути портативними або непортативними. Місцеве введення в легені також може бути досягнуте шляхом застосування сухого порошкового складу. Сухий порошковий склад буде містити сполуку за винаходом у тонкоподрібненій формі, як правило, з масмедіанним аеродинамічним діаметром (MMAД) 1-10 мкм. Склад звичайно містить прийнятний для місцевого введення розріджувач, такий, як лактоза, звичайно більшого розміру частинок, наприклад, MMAД 50 мкм або більше, наприклад, 100 мкм або більше. Альтернативним прийнятним для місцевого введення розріджувачем є маніт. Приклади систем доставки сухого порошку включають SPINHALER, DISKHALER, TURBOHALER, DISKUS і CLICKHALER. Інші приклади систем сухих порошкових інгаляційних систем включають ECLIPSE, ROTAHALER, HANDIHALER, AEROLISER, CYCLOHALER, REEZHALER/NEOHALER, FLOWCAPS, TWINCAPS, X-CAPS, TURBOSPIN, ELPENHALER, TURBUHALER, MIATHALER, TWISTHALER, NOVOLIZER, SKYEHALER, сухий порошковий інгалятор ORIEL, MICRODOSE, ACCUHALER, PULVINAL, EASYHALER, ULTRAHALER, TAIFUN, PULMOJET, OMNIHALER, GYROHALER, TAPER, CONIX, XCELOVAIR і PROHALER. Один аспект винаходу стосується сухого порошкового фармацевтичного складу для інгаляції, який містить: (i) Сполуку (I) яка являє собою 1-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)-3-(4-(2-(феніламіно)піримідин-4ілокси)нафталін-1-іл)сечовину або її фармацевтично прийнятну сіль, включаючи всі її 10 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 стереоізомери і таутомери, в конкретній формі (наприклад, тверда кристалічна Форма В) у ролі активного інгредієнта; (ii) мікрочастинки лактози у ролі носія; і (iii) мікрочастинки металевої солі стеаринової кислоти, такої, як магнію стеарат. Винахід також надає інгаляційний пристрій, який містить одну або більше доз вказаного складу. Сполука формули (I) має терапевтичну активність. У ще одному аспекті даний винахід надає сполуку за винаходом для застосування як лікарського засобу. Таким чином, у ще одному аспекті даний винахід надає сполуку, як описано в даному документі, для застосування в лікуванні одного або більше із вказаних вище станів. У ще одному аспекті даний винахід надає застосування Сполуки (I), як описаний в даному документі, для виготовлення лікарського засобу для лікування одного або більше із вказаних вище станів. У ще одному аспекті даний винахід надає спосіб лікування одного або більше із вказаних вище станів, який включає введення суб'єкту ефективної кількості Сполуки (I) за даним винаходом або фармацевтичної композиції, що містить цю сполуку. Слово "лікування" призначене для охоплення як профілактики, так і терапевтичного лікування. Сполука (I) за даним винаходом також може бути введена в поєднанні з одним або більше іншими активними інгредієнтами, наприклад, активними інгредієнтами, придатними для лікування вказаних вище станів. Наприклад, можливі комбінації для лікування порушень дихальних функцій включають комбінації зі стероїдами (наприклад, будезонідом, беклометазону дипропіонатом, флутиказону пропіонатом, мометазону фуроатом, флутиказону фуроатом), бета-агоністами (наприклад, тербуталіном, сальбутамолом, сальметеролом, формотеролом) і/або ксантинами (наприклад, теофіліном). Інші придатні активні інгредієнти включають антихолінергічні засоби, такі, як тіотропій, і противірусні агенти, такі, як, але не обмежуючись ними, занамівір або озельтамівір, наприклад, у вигляді фосфату. Інші противірусні засоби включають перамівір і ланінамівір. Інші можливі комбінації для лікування порушень дихальних функцій включають комбінації зі стероїдами, такими, як флунізолід, циклезонід і тріамцінолон; бета-агоністами, такими, як бамбутерол, левалбутерол, кленбутерол, фенотерол, броксатерол, індакатерол, репротерол, прокатерол і вілантерол; мускариновими антагоністами (наприклад, іпратропієм, тіотропієм, окситропієм, глікопіронієм, глікопіролатом, аклідинієм, троспієм) і антагоністами лейкотрієнів (наприклад, зафірлукастом, пранлукастом, зілеутоном, монтелукастом). Потрібно розуміти, що будь-який із вищезазначених активних інгредієнтів може бути використаний у формі фармацевтично прийнятної солі. В одному варіанті здійснення сполука формули (I) й інший активний інгредієнт(и) скомбіновані в одному і тому ж фармацевтичному складі. В іншому варіанті здійснення інший активний інгредієнт(и) вводять в один або більше окремий фармацевтичний склад. Таким чином, ще один аспект даного винаходу надає комбінований продукт, який містить: (А) сполуку за даним винаходом (тобто сполуку формули (I), як визначено вище, або її фармацевтично прийнятну сіль); і (В) інший терапевтичний засіб, в якому кожний із компонентів (А) і (В) приготовляється в суміші з фармацевтично прийнятним розріджувачем або носієм. У цьому аспекті даного винаходу комбінований продукт може являти собою як одиночний (комбінація) фармацевтичний склад або набір-із-компонентів. Таким чином, цей аспект даного винаходу охоплює фармацевтичний склад, який містить сполуку за даним винаходом і інший терапевтичний засіб у суміші з фармацевтично прийнятним розріджувачем або носієм (цей склад далі в даному документі згадується як "комбінований препарат"). Він також включає в себе набір компонентів, які містять компоненти: (i) фармацевтичний склад, який містить сполуку за даним винаходом в суміші з фармацевтично прийнятним розріджувачем або носієм, і (ii) фармацевтичний склад, який містить інший терапевтичний засіб, в суміші з фармацевтично прийнятним розріджувачем або носієм, де кожний із компонентів (i) та (ii) наданий у формі, придатній для введення в поєднанні з іншим. Компонент (i) з набору компонентів являє собою, таким чином, компонент (А), вказаний вище, в суміші з фармацевтично прийнятним розріджувачем або носієм. Аналогічним чином, 11 UA 113289 C2 5 10 15 20 25 компонент (ii) являє собою компонент (В), вказаний вище, в суміші з фармацевтично прийнятним розріджувачем або носієм. Інший терапевтичний засіб (тобто компонент (В), вказаний вище) може являти собою, наприклад, будь-який з активних інгредієнтів, вказаних вище, для лікування порушень дихальних функцій. Дані, представлені нижче, відносно антивірусних властивостей сполуки формули (I), свідчать про те, що інші противірусні терапії в поєднанні зі сполукою формули (I), були б корисні при лікуванні або профілактиці вірусно-індукованих загострень (наприклад, респіраторних вірусних інфекцій), від яких страждають пацієнти із захворюваннями дихальних шляхів, такими, як ХОХЛ і/або астма і/або одним або більше показаннями, перерахованими вище. Таким чином, в одному аспекті надається застосування Сполуки (I) в поєднанні з антивірусною терапією, такою як, але не обмежуючись ними, занамівір або озельтамівір (наприклад, озельтамівіру фосфат) при лікуванні або профілактиці респіраторних вірусних інфекцій, від яких страждають пацієнти із захворюваннями дихальних шляхів, такими, як ХОХЛ і/або астма. Автори даного винаходу також вважають, що інші противірусні терапії в поєднанні зі Сполукою (I) могли би бути корисні для лікування або профілактики вірусно-індукованих загострень (наприклад, респіраторних вірусних інфекцій) у пацієнтів із хронічними станами, відмінними від захворювань дихальних шляхів, наприклад, такими станами, як застійна серцева недостатність, діабет, рак, або станами, від яких страждають імуносупресовані пацієнти, наприклад, після трансплантації органа. Таким чином, в іншому аспекті надане застосування сполуки за винаходом у комбінації з противірусною терапією, такою, як, але не обмежуючись ними, занамівір або озельтамівір (наприклад, озельтамівіру фосфат), при лікуванні або профілактиці респіраторних вірусних інфекцій у хворих із хронічними станами, такими, як застійна серцева недостатність, діабет, рак, або станами, від яких страждають імуносупресовані пацієнти, наприклад, після трансплантації органа. ЕКСПЕРИМЕНТАЛЬНИЙ РОЗДІЛ Скорочення, які використовуються в даному описі, визначені нижче (Таблиця 1). Будь-які невизначені абревіатури призначені для передачі їх загальноприйнятого значення. Таблиця 1 Скорочення AcOH aq АТФ РБАЛ BEGM шир. БСА CatCartо CDI ХОХЛ CXCL1 д DCM DMSO ДСК d-U937 клітини ДПС + (ES ) Et EtOAc ФТС ФРПЕ GSK3α ЛКЕБ год. крижана оцтова кислота водний аденозин-5'-трифосфат рідина бронхоальвеолярного лаважу середовище для росту бронхіальних епітеліальних клітин широкий бичачий сироватковий альбумін каталітичний картридж 1,1- карбоніл-діімідазол хронічна обструктивна хвороба легень хемокін (C-X-C мотив) ліганд 1 дублет дихлорметан диметилсульфоксид диференціальна сканувальна калориметрія PMA-диференційовані U-937 клітини динамічна парова сорбція іонізація електророзпиленням, позитивний етил етилацетат фетальна теляча сироватка флуоресцентне резонансне перенесення енергії глікоген синтаза кіназа 3α первинні клітини епітелію бронхів людини година(и) 30 12 UA 113289 C2 Продовження таблиці 1 Скорочення HRP РВЛ ICAM-1 ІК JNK KC Kd ЛПС + (M+Н) MAPK MAPKAP-K2 Me MeCN MeOH МГц хв. MIP1α ММАD MOI т.пл. MTT m/z: ЯМР МКПК PBS Рh ФГА PMA pTSA кв. кімн.темп. ЗФ ВЕРХ РСВ s нас. SCX SDS SNAr t TCID50 ТГА THF TNFα ПРД 5 10 пероксидаза хріну риновірус людини молекула 1 внутрішньоклітинної адгезії інфрачервоний с-Jun N-кінцева кіназа кератиноцитний хемоатрактант константа дисоціації ліпополісахарид протонований молекулярний іон мітоген протеїнактивована протеїнкіназа мітоген-активований білок кіназа-активована протеїнкіназа 2 метил ацетонітрил метанол мегагерц хвилина(и) макрофагальний запальний білок 1 альфа масовий середній аеродинамічний діаметр множинність інфекції точка плавлення 3-(4,5-диметилтіазол-2-іл)-2,5-дифенілтетразолій бромід відношення маси до заряду ядерний магнітний резонанс (спектроскопія) мононуклеари периферичної крові фосфат-буферизований фізіологічний розчин феніл фітогемаглютинін форболміристатацетат 4-метилбензолсульфокислота квартет кімнатна температура зворотно-фазова високоефективна рідинна хроматографія респіраторний синцитіальний вірус синглет насичений катіонний обмін на твердому носії (смола) натрію додецилсульфат нуклеофільне ароматичне заміщення триплет 50 % інфекційна доза тканинної культури термогравіметричний аналіз тетрагідрофуран фактор некрозу пухлин альфа порошкова рентгенівська дифракція Загальні методики Всі вихідні речовини і розчинники були отримані або з комерційних джерел, або приготовані відповідно до літератури, що цитується. Якщо не вказане інше, всі реакційні суміші перемішували. Органічні розчини звичайно сушили над безводним сульфатом магнію. Гідрування проводили в проточному реакторі Thales H-cube при вказаних умовах. Колонкову хроматографію проводили на заздалегідь наповнених силікагелем (230-400 mesh, 40-63 мкм) картриджах із застосуванням вказаної кількості. SCX був придбаний у Supelco і оброблений 1Мю соляною кислотою перед використанням. Якщо не вказане інше, реакційну суміш для очищення спочатку розбавляли МеОН і підкисляли декількома краплями AcOH. Цей розчин 13 UA 113289 C2 5 10 15 20 25 30 35 40 45 50 55 завантажували безпосередньо в SCX і промивали МеОН. Бажаний продукт потім елюювали промиванням 1 %-м NH3 в МеОН. Препаративна зворотно-фазова високоефективна рідинна хроматографія: колонка Agilent Scalar C18, 5 мкм (21,2×50 мм), швидкість потоку 28 мл/хв., елюйована градієнтом H2О-MeCN, який містить 0,1 % по об'єму мурашиної кислоти, протягом 10 хв., застосовуючи УФдетектування при 215 і 254 нм. Інформація про градієнт: 0,0-0,5 хв.; 95 % H2О-5 % MeCN; 0,5-7,0 хв.; змінили з 95 % H2О-5 % MeCN до 5 % H2О-95 % MeCN; 7,0-7,9 хв.; тримали при 5 % H2О95 % MeCN; 7,9-8,0 хв.; повернули до 95 % H2О-5 % MeCN; 8,0-10,0 хв.; тримали при 95 % H2О5 % MeCN. Аналітичні методи Зворотно-фазова високоефективна рідинна хроматографія: (Спосіб 1): колонка Agilent Scalar C18, 5 мкм (4,6×50 мм) або Waters Xbridge C18, 5 мкм (4,6×50 мм), швидкість потоку 2,5 мл/хв., елюйована градієнтом H2О-MeCN, що містить 0,1 % по об'єму мурашиної кислоти (Спосіб 1 кислотний) або NH3 (Спосіб 1 основний) протягом 7 хв., застосовуючи УФдетектування при 215 і 254 нм. Інформація про градієнт: 0,0-0,1 хв., 95 % H2О-5 % MeCN; 0,1-5,0 хв., змінили з 95 % H2О-5 % MeCN до 5 % H2О-95 % MeCN; 5,0-5,5 хв., тримали при 5 % H2О95 % MeCN; 5,5-5,6 хв., тримали при 5 % H2О-95 % MeCN, швидкість потоку збільшили до 3,5 мл/хв.; 5,6-6,6 хв., тримали при 5 % H2О-95 % MeCN, швидкість потоку 3,5 мл/хв.; 6,6-6,75 хв., повернули до 95 % H2О-5 % MeCN, швидкість потоку 3,5 мл/хв.; 6,75-6,9 хв., тримали при 95 % H2О-5 % MeCN, швидкість потоку 3,5 мл/хв.; 6,9-7,0 хв., тримали при 95 % H2О-5 % MeCN, швидкість потоку зменшили до 2,5 мл/хв. Зворотно-фазова високоефективна рідинна хроматографія: (Спосіб 2): колонка Agilent Scalar C18, 1,8 мкм (4,6×30 мм) при 40 °C; швидкість потоку 2,5-4,5 мл/хв., елюйована градієнтом H2О-MeCN, що містить 0,1 % по об'єму мурашиної кислоти протягом 4 хв., застосовуючи УФ-детектування при 254 нм. Інформація про градієнт: 0-3,00 хв., змінили з 95 % H2О-5 % MeCN до 5 % H2О-95 % MeCN; 3,00-3,01 хв., тримали при 5 % H2О-95 % MeCN, швидкість потоку збільшили до 4,5 мл/хв.; 3,01-3,50 хв., тримали при 5 % H2О-95 % MeCN; 3,503,60 хв., повернули до 95 % H2О-5 % MeCN, швидкість потоку зменшили до 3,5 мл/хв.; 3,60-3,90 хв., тримали при 95 % H2О-5 % MeCN; 3,90-4,00 хв., тримали при 95 % H2О-5 % MeCN, швидкість потоку зменшили до 2,5 мл/хв. 1 Н ЯМР-спектроскопія: Спектри були отримані на спектрометрі Bruker Avance III на частоті 400 МГц, застосовуючи залишковий недейтерований розчинник як зразок. Динамічна парова сорбція: Графіки були отримані із застосуванням Систем Поверхневих Вимірювань динамічної парової сорбції моделі DVS-1, використовуючи близько 10 мг зразка. Зміну маси записали з урахуванням вологості повітря при 25 °C і визначили, застосовуючи наступні параметри: сушка: 60 хв. під сухим азотом; рівновага: 60 хв./крок; інтервал даних: 0,05 % або 2,0 хв. Точки вимірювання відносної вологості [RH %] були наступними: перший набір: 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 90, 80, 70, 60, 50, 40, 30, 20, 10, 5; другий набір: 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 90, 80, 70, 60, 50, 40, 30, 20, 10, 5, 0. Порошкова рентгенівська дифракція: Графіки були отримані на дифрактометрі PANalytical (Philips) X'PertPRO MPD, оснащеному Cu LFF рентгенівською трубкою (45 кВ, 40 мА; БреггБрентано; обертальна установка), і були отримані із застосуванням Cu Kα випромінювання при наступних умовах вимірювання: режим сканування: безперервний; діапазон сканування: від 3 до 50° 2θ; розмір кроку: 0,02°/крок; час підрахунку: 30 сек./крок; час повороту обертача: 1 сек.; шлях падіння променя: програмна розбіжність щілини: 15 мм; щілина Солера: 0,04 рад; променевий шаблон: 15 мм; проміжна щілина: 1°; ножовий промінь: +; дифрагований шлях променя: довгий проміжний щит: +; щілина Солера: 0,04 рад; Ni фільтр: +; детектор: X'Celerator. Зразки готували шляхом нанесення на тримач зразка з нульовим фоном. Інфрачервона спектроскопія: Мікро-затухаюче загальне відображення (microATR) було використане і зразок аналізували, застосовуючи придатне microATR-комплектуюче і наступні умови вимірювання: апарат: Thermo Nexus 670 FTIR спектрометр; кількість сканувань: 32; -1 -1 дозвіл: 1 см ; діапазон довжин хвиль: 4000-400 см ; детектор: DTGS з вікнами з KBr; променерозщіплювач: Ge на KBr; що мікро-ATR-комплектуюче: Harrick Split Pea з кристалом Si. Диференціальна сканувальна калориметрія: Дані були зібрані на TA-Instruments Q1000 MTDSC, обладнаному блоком охолоджування RCS. Як правило, 3 мг кожної сполуки в стандартній алюмінієвій TA-Instrument кюветі для зразків нагрівали при 10 °C/хв. від 25 °C до 300 °C. Продування азотом при 50 мл/хв. підтримували над зразком. Термогравіметричний аналіз: Дані були зібрані на термогравіметрі TA-Instruments Q500. Як правило, 10 мг кожного зразка переносили в заздалегідь зважену алюмінієву кювету і нагрівали 14 UA 113289 C2 5 при 20 °C/хв. від навколишньої температури до 300 °C або
ДивитисяДодаткова інформація
Назва патенту англійською1-pyrazolyl-3-(4-((2-anilinopyrimidin-4-yl)oxy)napththalen-1-yl)ureas as p38 map kinase inhibitors
Автори англійськоюIto, Kazuhiro, Charron, Catherine Elizabeth, King-Underwood, Johm, Onions, Stuart Thomas, Longshaw, Alistair Ian, Broeckx, Rudy, Filliers, Walter, Copmans, Alex
Автори російськоюИто Казухиро, Чаррон Кэтрин Элизабет, Кинг-Андервуд Джон, Онионс Стюарт Томас, Лонгшоу Алистер Иан, Брукс Руди, Филльерс Вальтер, Копманс Алекс
МПК / Мітки
МПК: A61K 31/4155, C07D 491/10, A61K 31/506, C07D 403/12
Мітки: map-кінази, 1-піразоліл-3-(4-((2-анілінопіримідин-4-іл)окси)нафталін-1-іл)-сечовини, інгібітори
Код посилання
<a href="https://ua.patents.su/34-113289-1-pirazolil-3-4-2-anilinopirimidin-4-iloksinaftalin-1-il-sechovini-yak-ingibitori-p38-map-kinazi.html" target="_blank" rel="follow" title="База патентів України">1-піразоліл-3-(4-((2-анілінопіримідин-4-іл)окси)нафталін-1-іл)-сечовини як інгібітори p38 map-кінази</a>
Попередній патент: Trpv1 антагоністи, що містять дигідроксизамісник, і їх застосування
Наступний патент: Застосування гемоглобіну або міоглобіну, завантаженого на його ділянку зв’язування кисню монооксидом вуглецю, для зовнішньої обробки ран
Випадковий патент: Композиція для полоскання ротової порожнини, яка вміщує хлористий цетилпіридин та амфотерний сурфактант