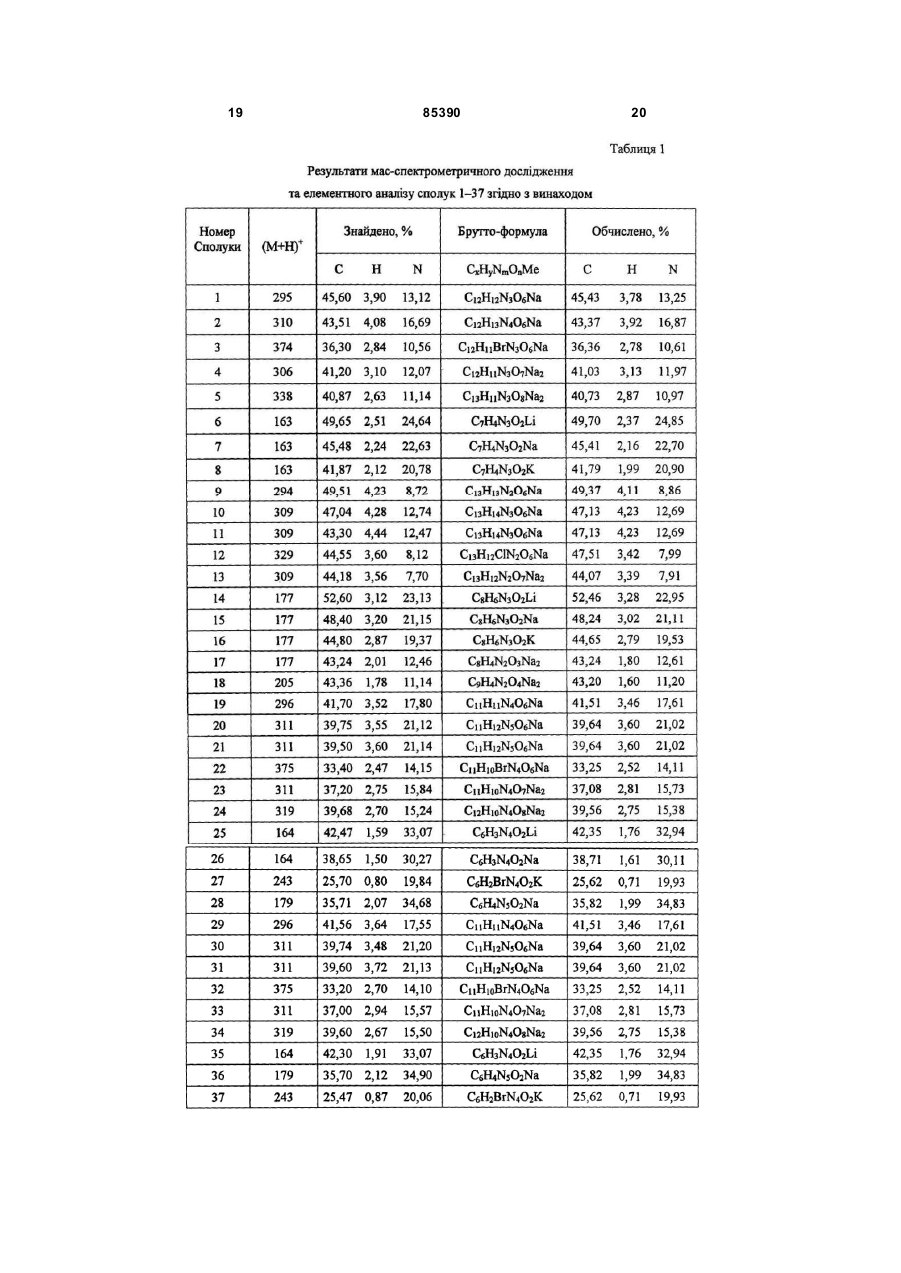
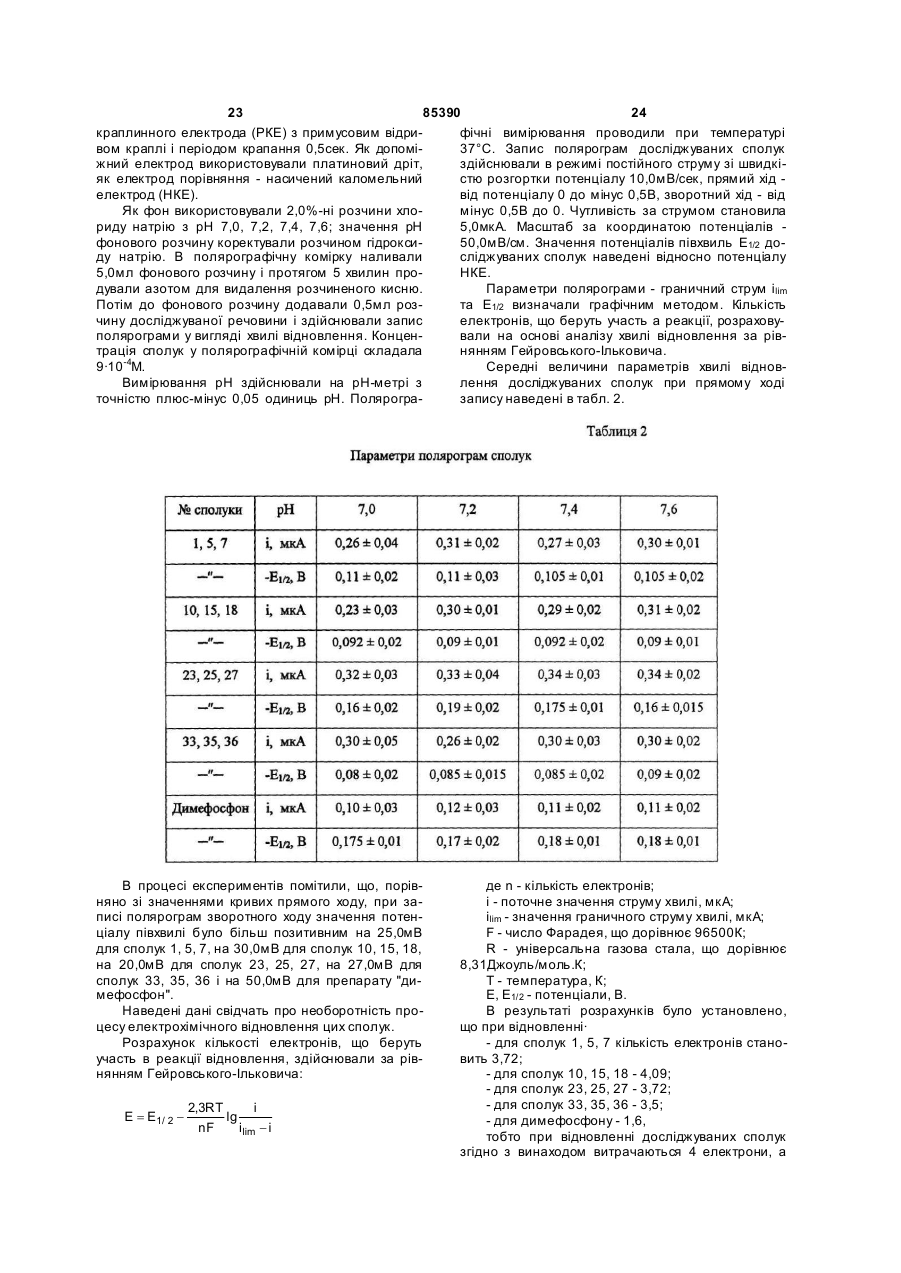
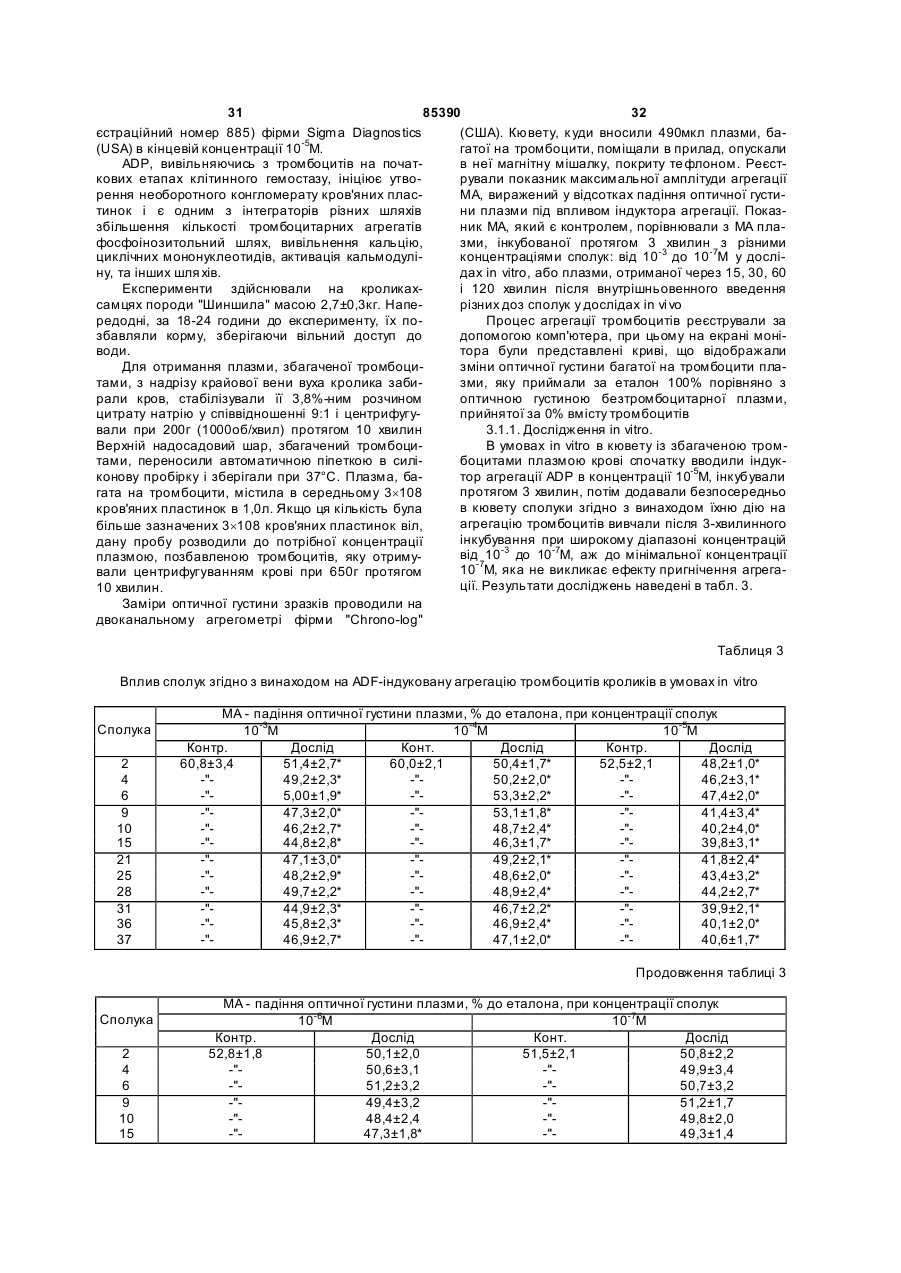
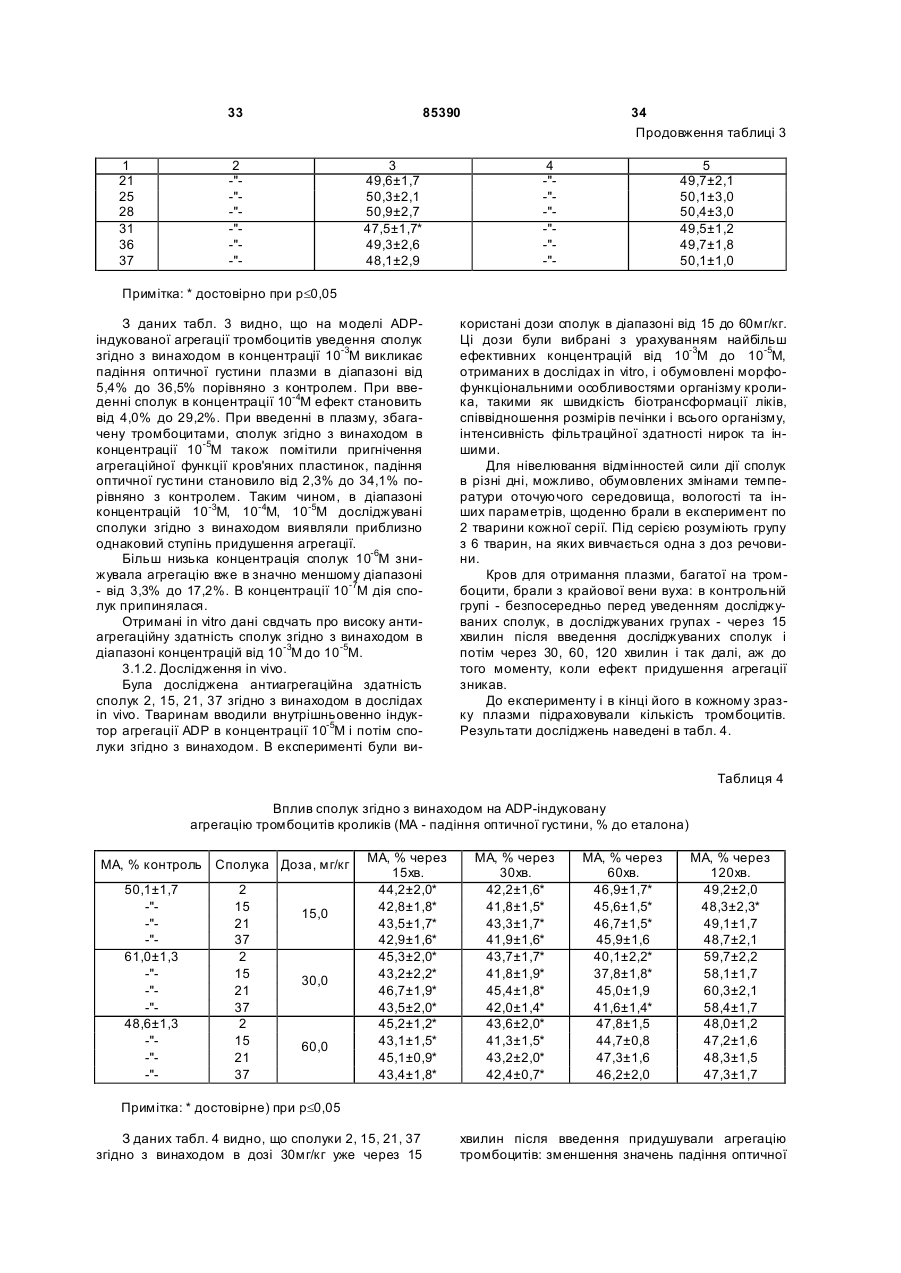
Циклічні біоізостери похідних пуринової системи і фармацевтична композиція на їх основі
Номер патенту: 85390
Опубліковано: 26.01.2009
Автори: Журавльов Сєргєй Владіміровіч, Жілов Валєрій Хажмуратовіч, Полосін Владімір Міхайловіч, Марков Алєксандр Ніколаєвіч
Формула / Реферат
1. Циклічний біоізостер похідних пуринової системи, який має загальну структурну формулу:
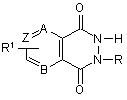 ,
,
де R = 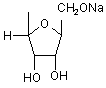 , Li, Na, K,
, Li, Na, K,
R1 = -Н, -NH2, -Вr, -Сl, -ОН, -СООН,
В = -N=, -CH=, Z = -СН=-N=,
А = -N= при В = -N=, Z = -СН-,
А = -СН= при В = -N, =Z=-СН-,
A = -СН= при В = -N=, Z = -N=,
А = -СН= при В = -СН=, Z = -СН=,
А = -СН= при В = -СН=, Z = -N=,
та його фармакологічно прийнятні солі, що мають нормалізуючий вплив на внутрішньоклітинні процеси.
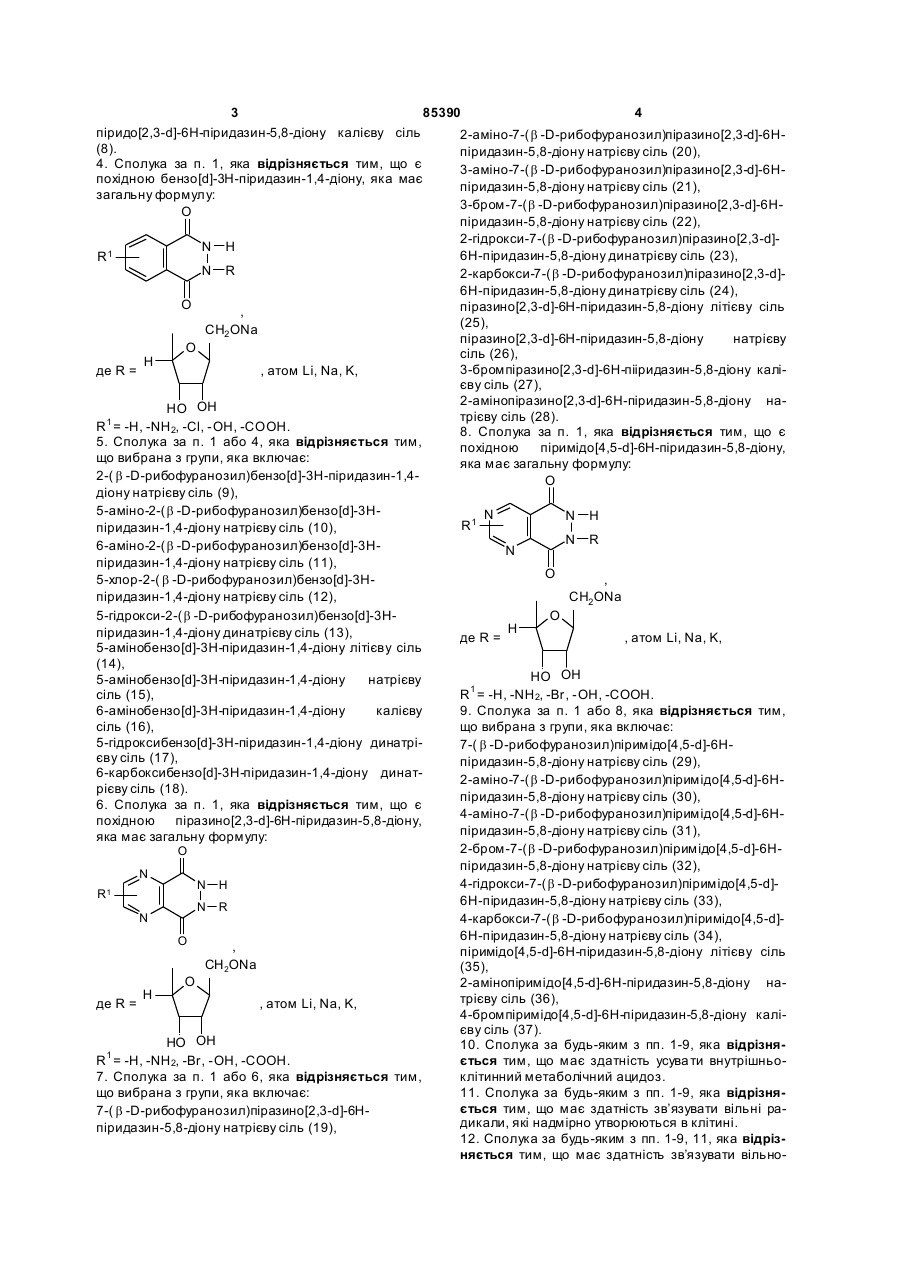
2. Сполука за п. 1, яка відрізняється тим, що є похідною піридо[2,3-d]-6Н-піридазин-5,8-діону, яка має загальну формулу:
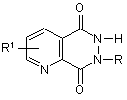 ,
,
де R = 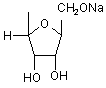 , атом Li, Na, K,
, атом Li, Na, K,
R1 = -Н, -NH2, -Вr, -ОН, -СООН.
3. Сполука за п. 1 або 2, яка відрізняється тим, що вибрана з групи, що включає:
7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (1),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (1),
4-аміно-7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (2),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (2),
3-бром-7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (3),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (3),
4-гідрокси-7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (4),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (4),
3-карбокси-7-(![]() -D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (5),
-D-рибофуранозил)піридо[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (5),
піридо[2,3-d]-6Н-піридазин-5,8-діону літієву сіль (6),
піридо[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (7),
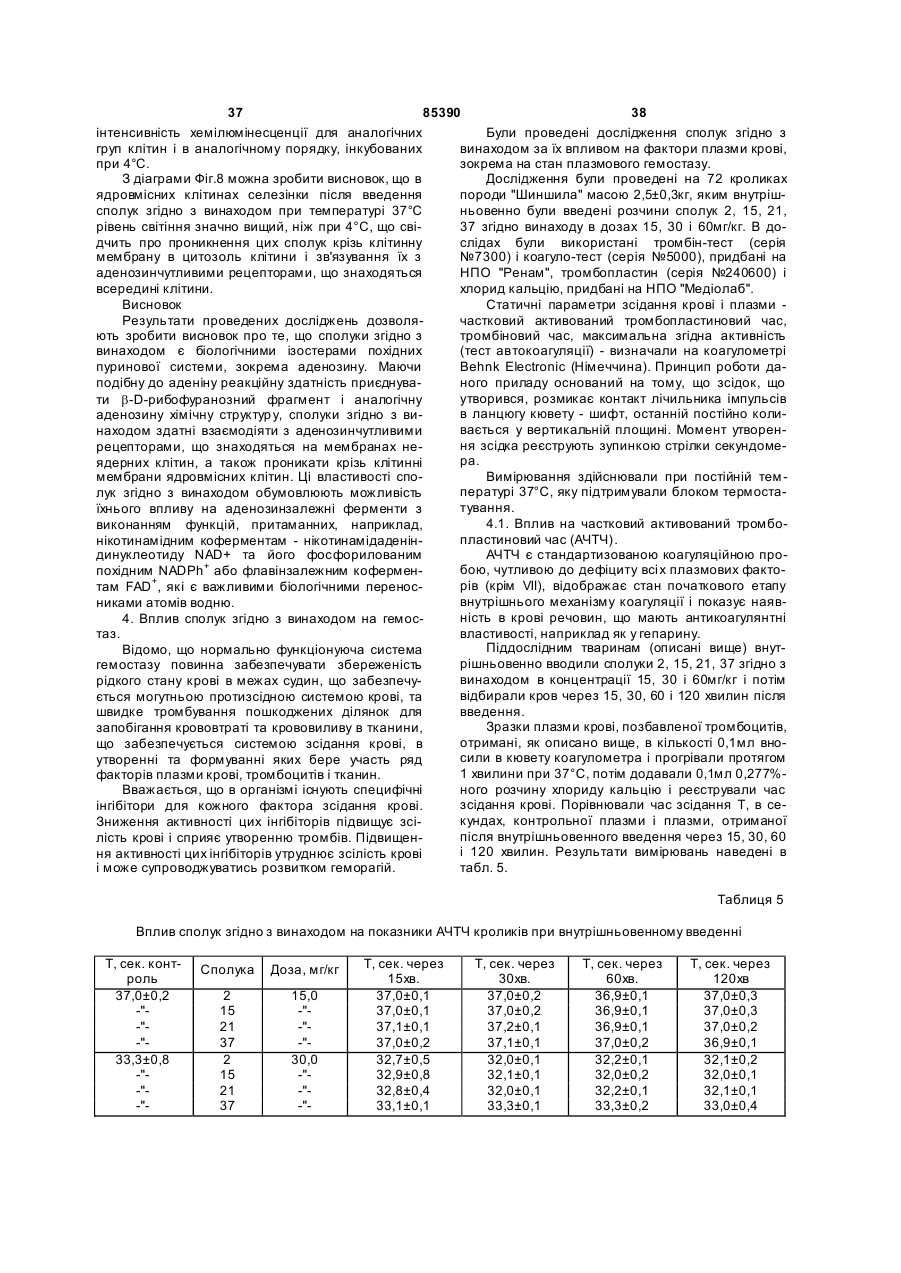
піридо[2,3-d]-6Н-піридазин-5,8-діону калієву сіль (8).
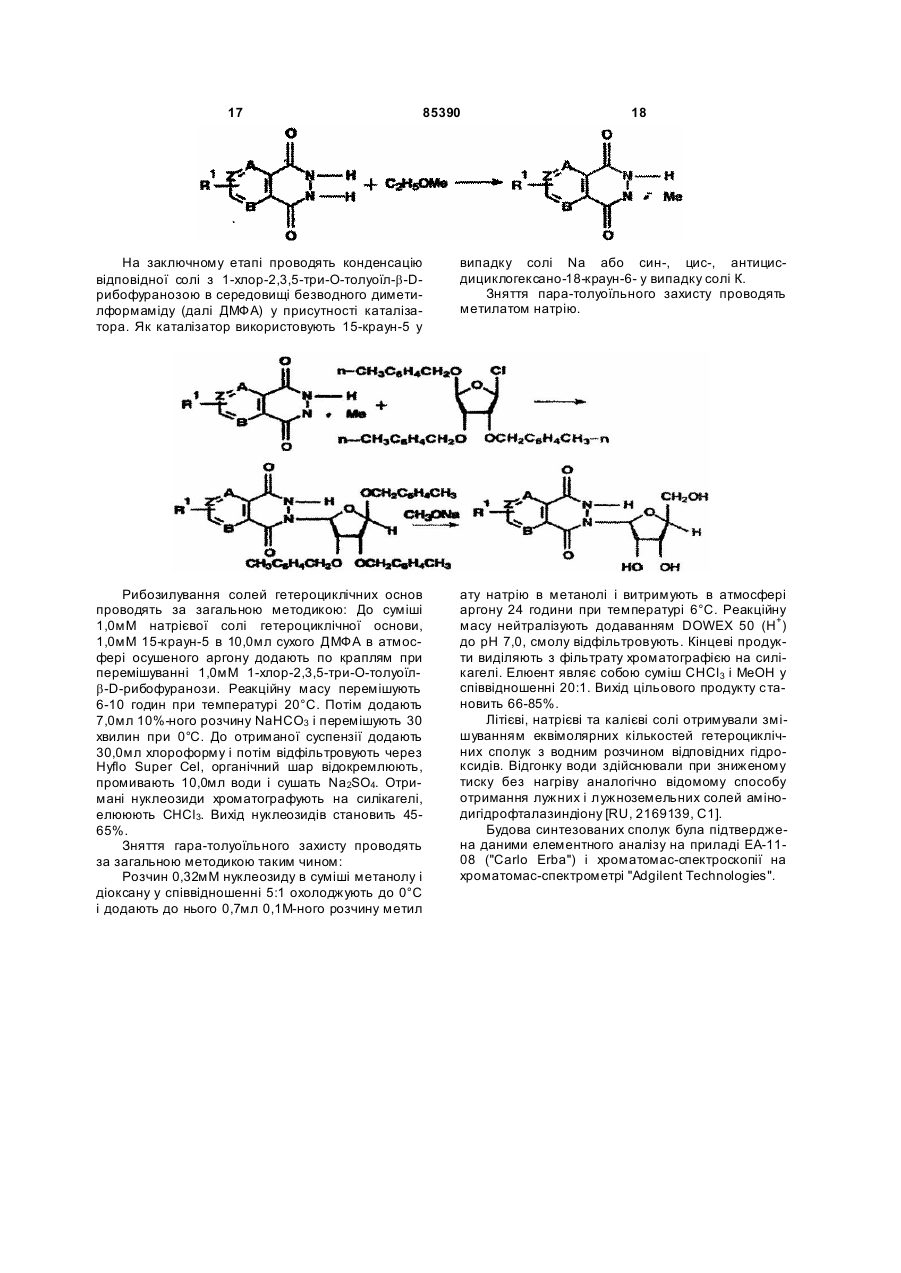
4. Сполука за п. 1, яка відрізняється тим, що є похідною бензо[d]-3Н-піридазин-1,4-діону, яка має загальну формулу:
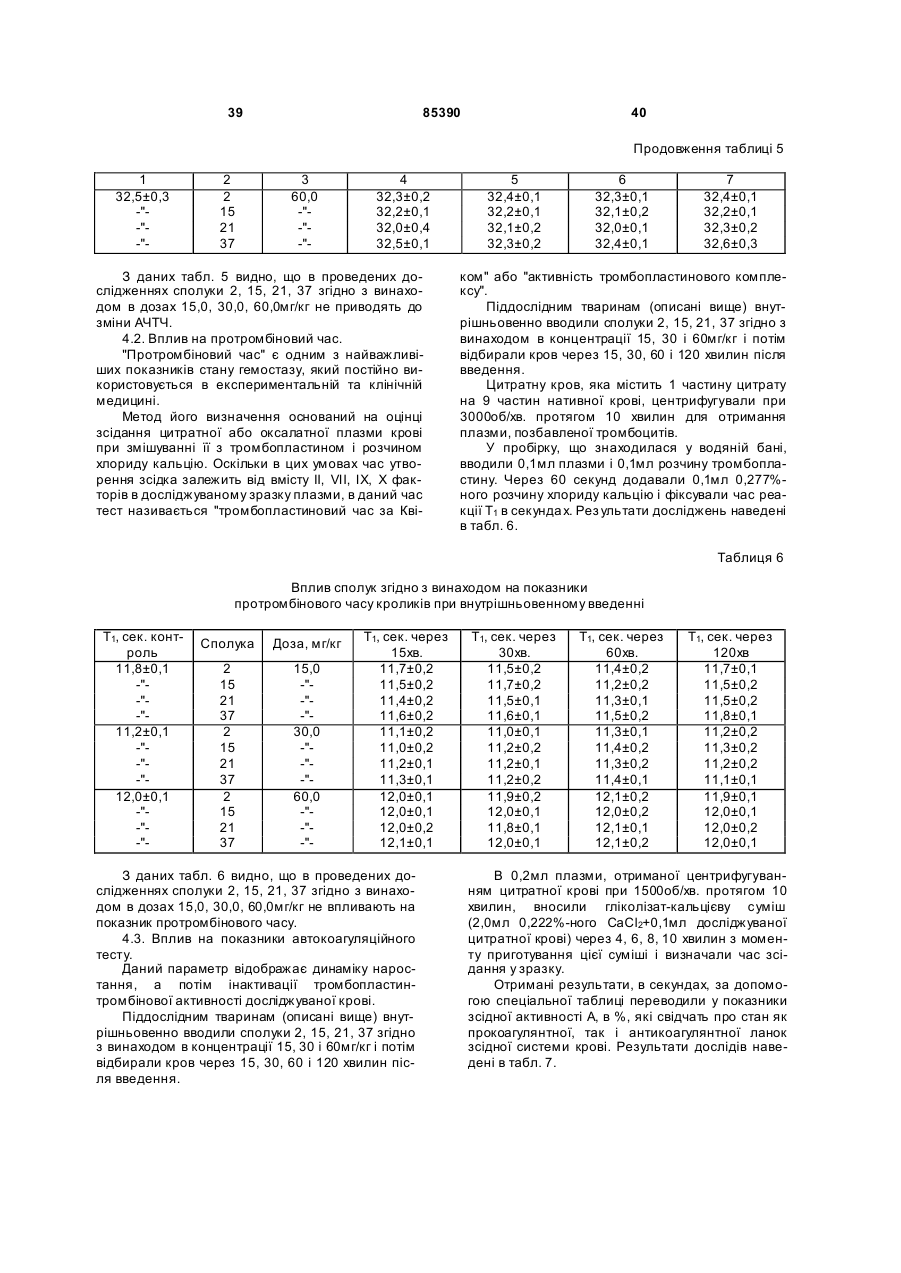
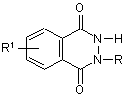 ,
,
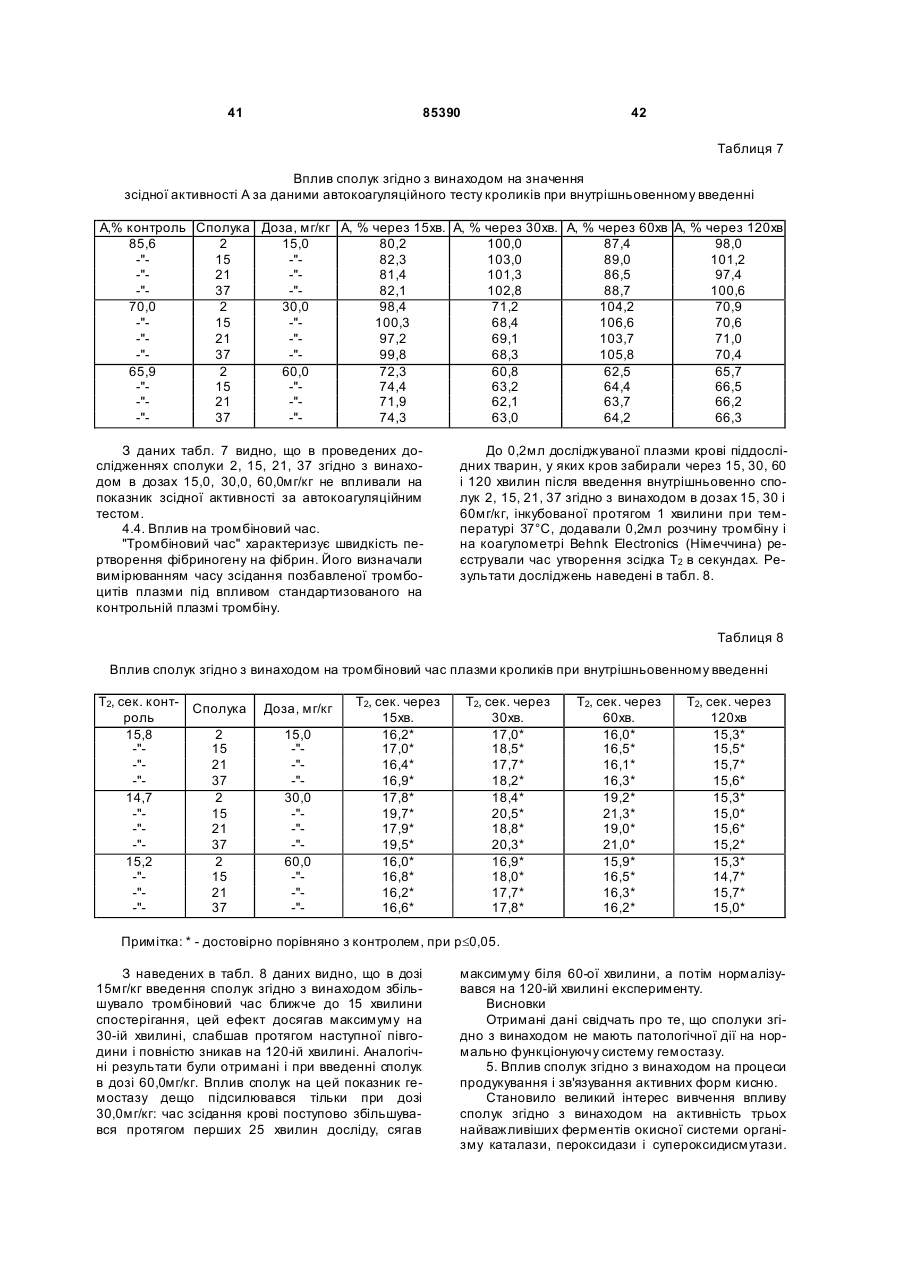
де R = 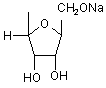 , атом Li, Na, K,
, атом Li, Na, K,
R1 = -Н, -NН2, -Сl, -ОН, -СООН.
5. Сполука за п. 1 або 4, яка відрізняється тим, що вибрана з групи, яка включає:
2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (9),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (9),
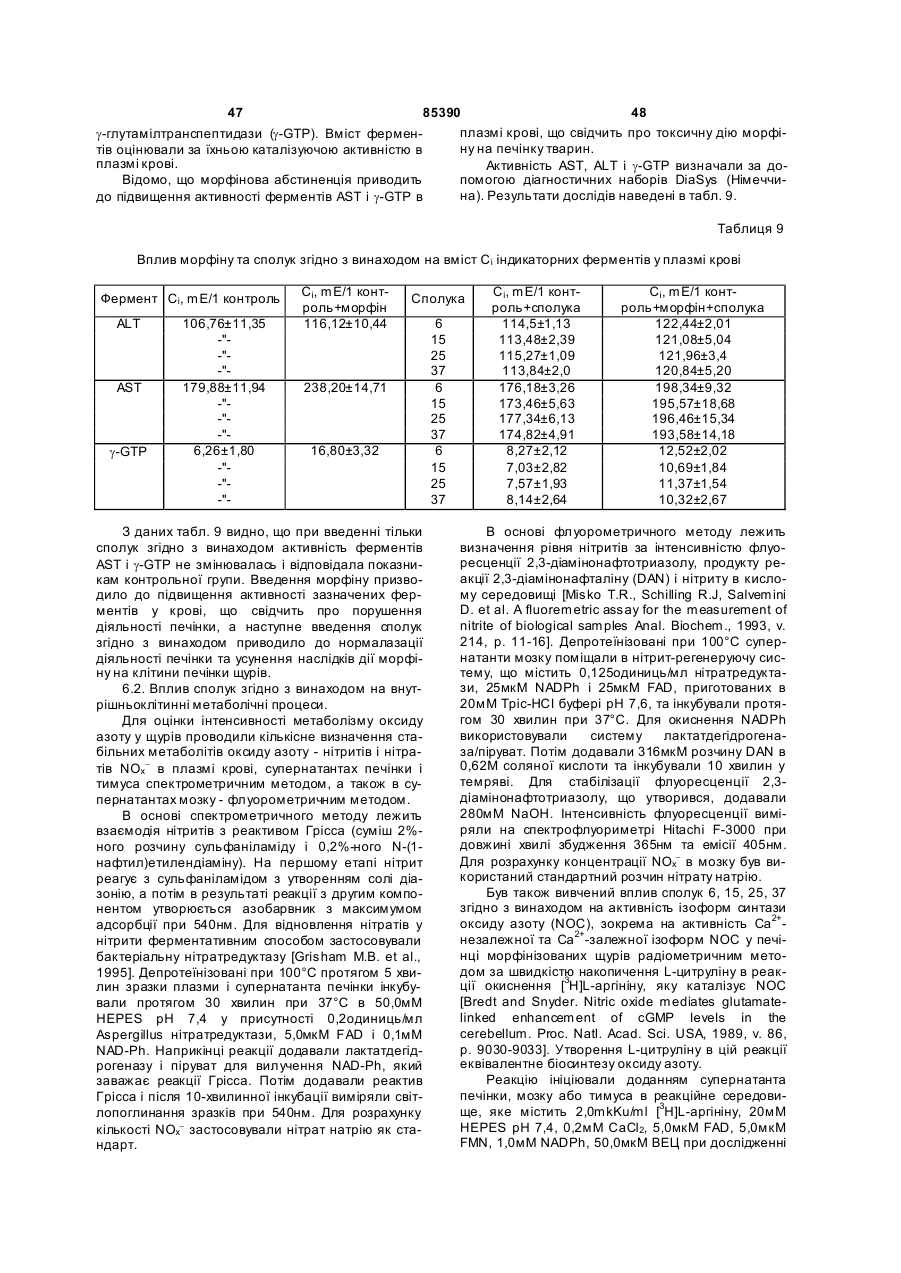
5-аміно-2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (10),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (10),
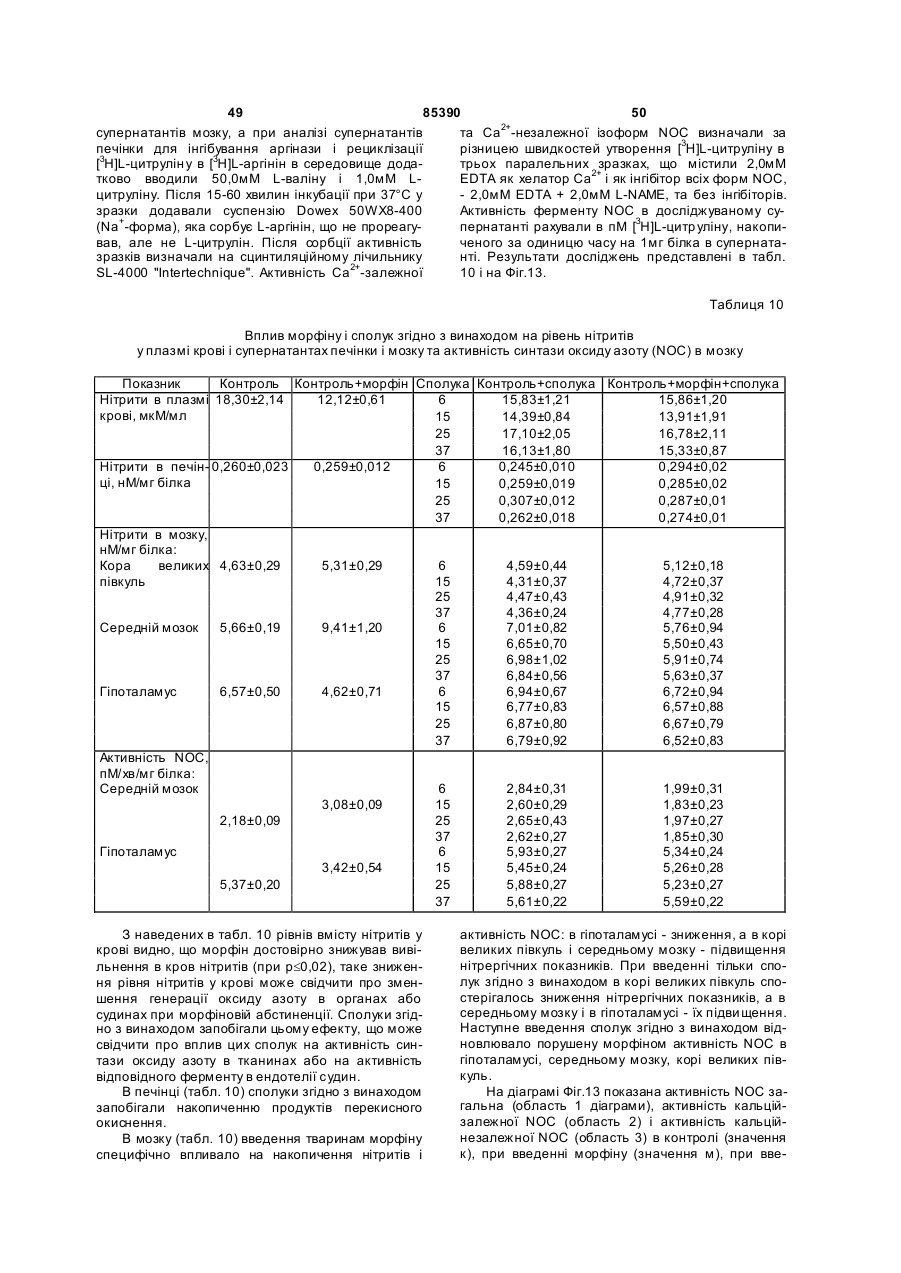
6-аміно-2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (11),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (11),
5-хлор-2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (12),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону натрієву сіль (12),
5-гідрокси-2-(![]() -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (13),
-D-рибофуранозил)бензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (13),
5-амінобензо[d]-3Н-піридазин-1,4-діону літієву сіль (14),
5-амінобензо[d]-3Н-піридазин-1,4-діону натрієву сіль (15),
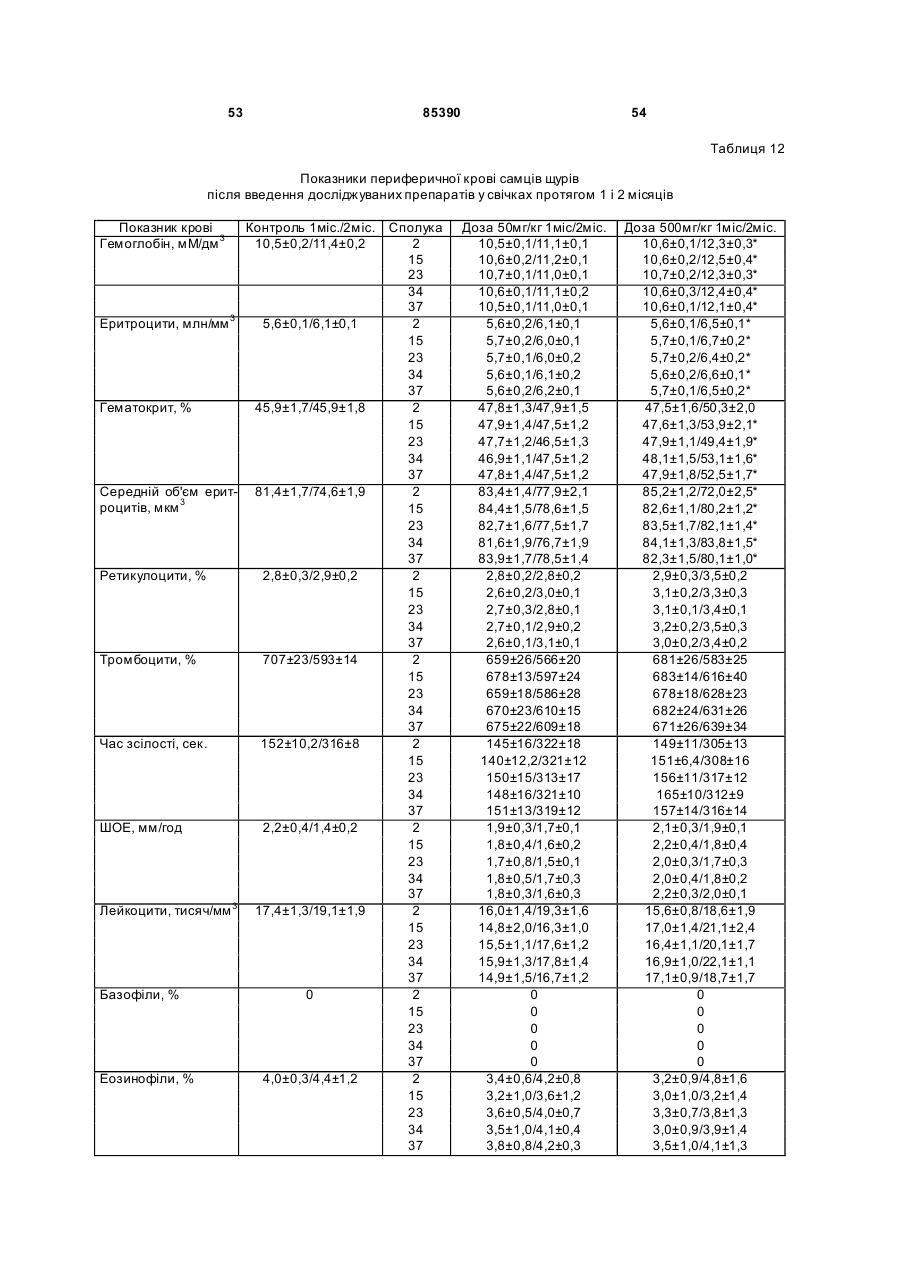
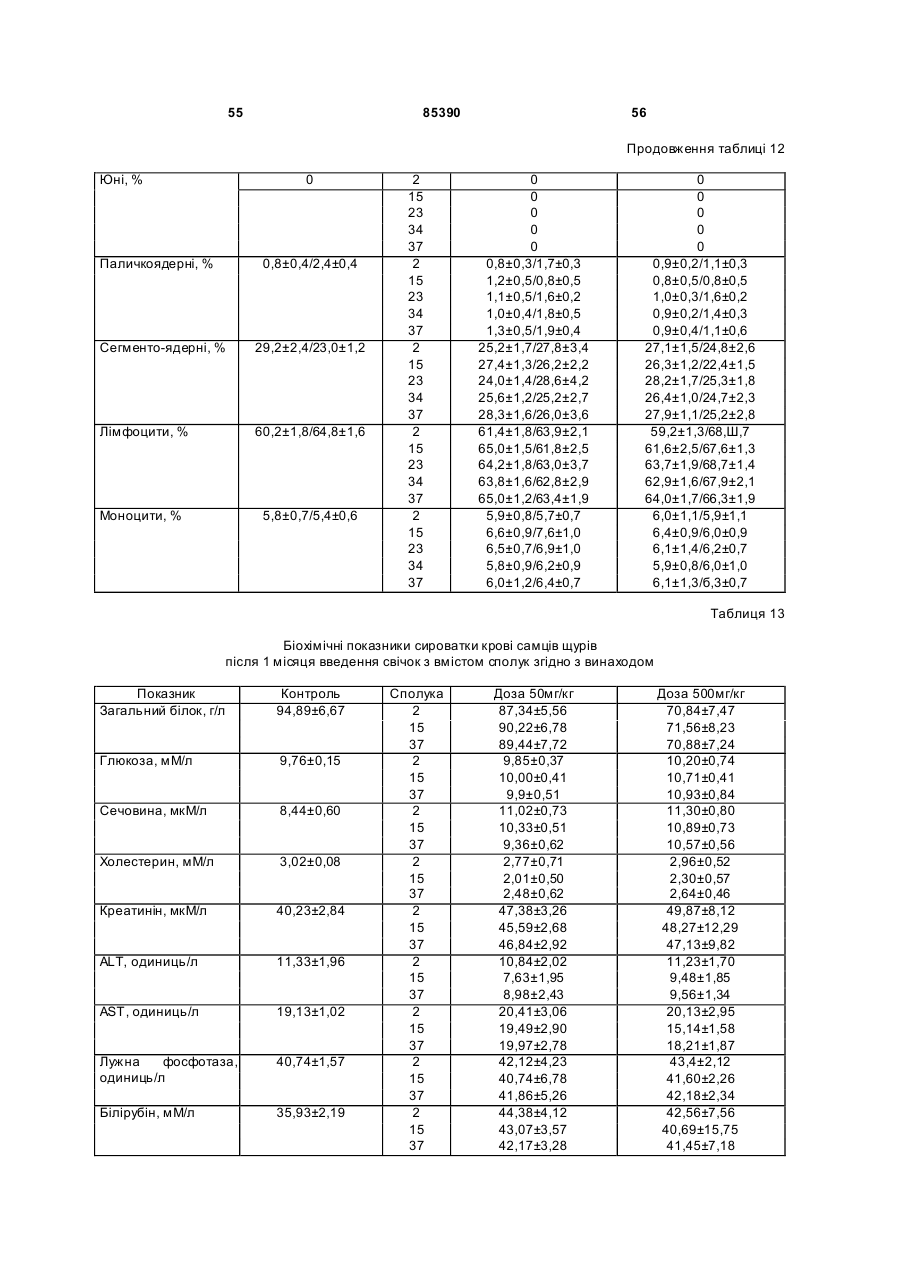
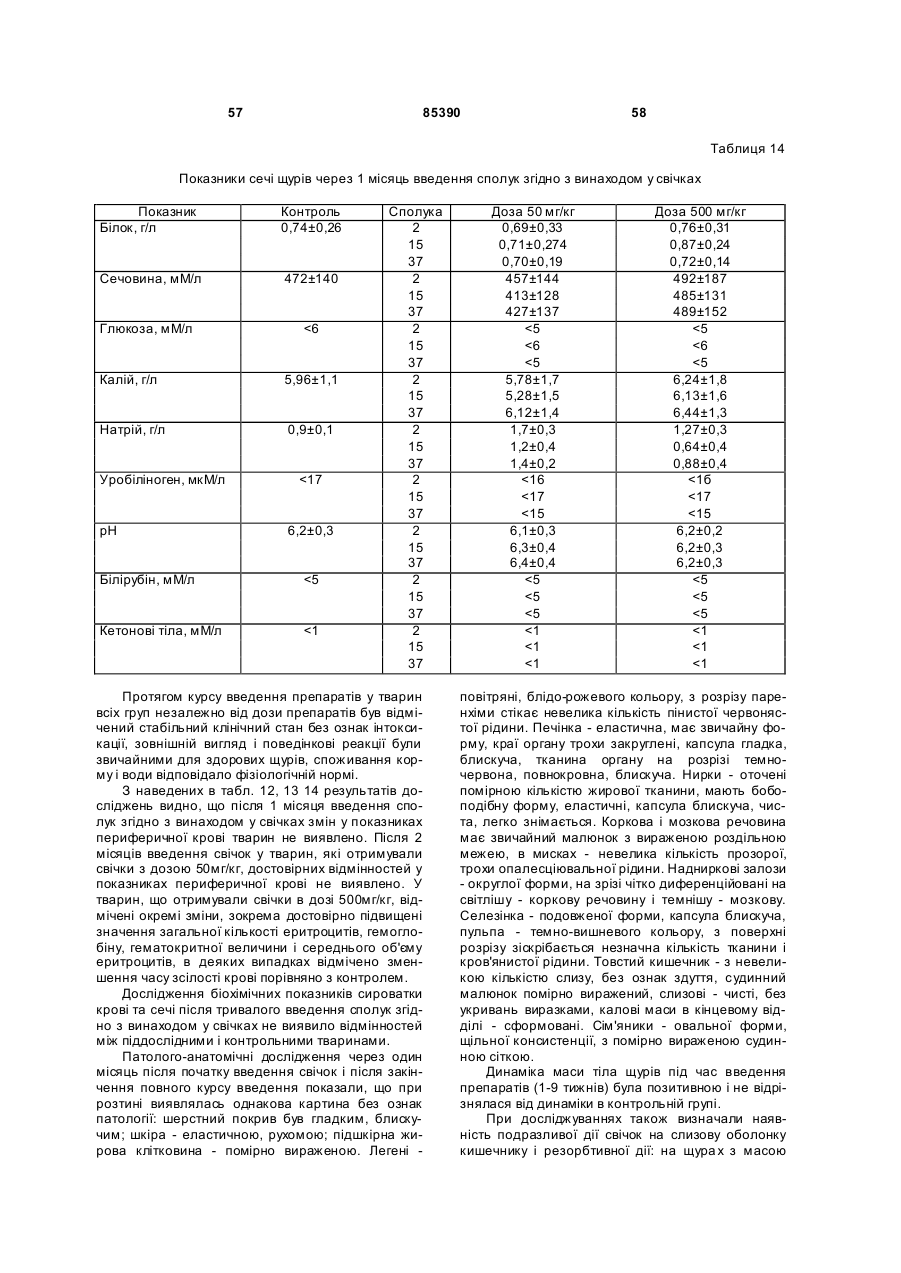
6-амінобензо[d]-3Н-піридазин-1,4-діону калієву сіль (16),
5-гідроксибензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (17),
6-карбоксибензо[d]-3Н-піридазин-1,4-діону динатрієву сіль (18).
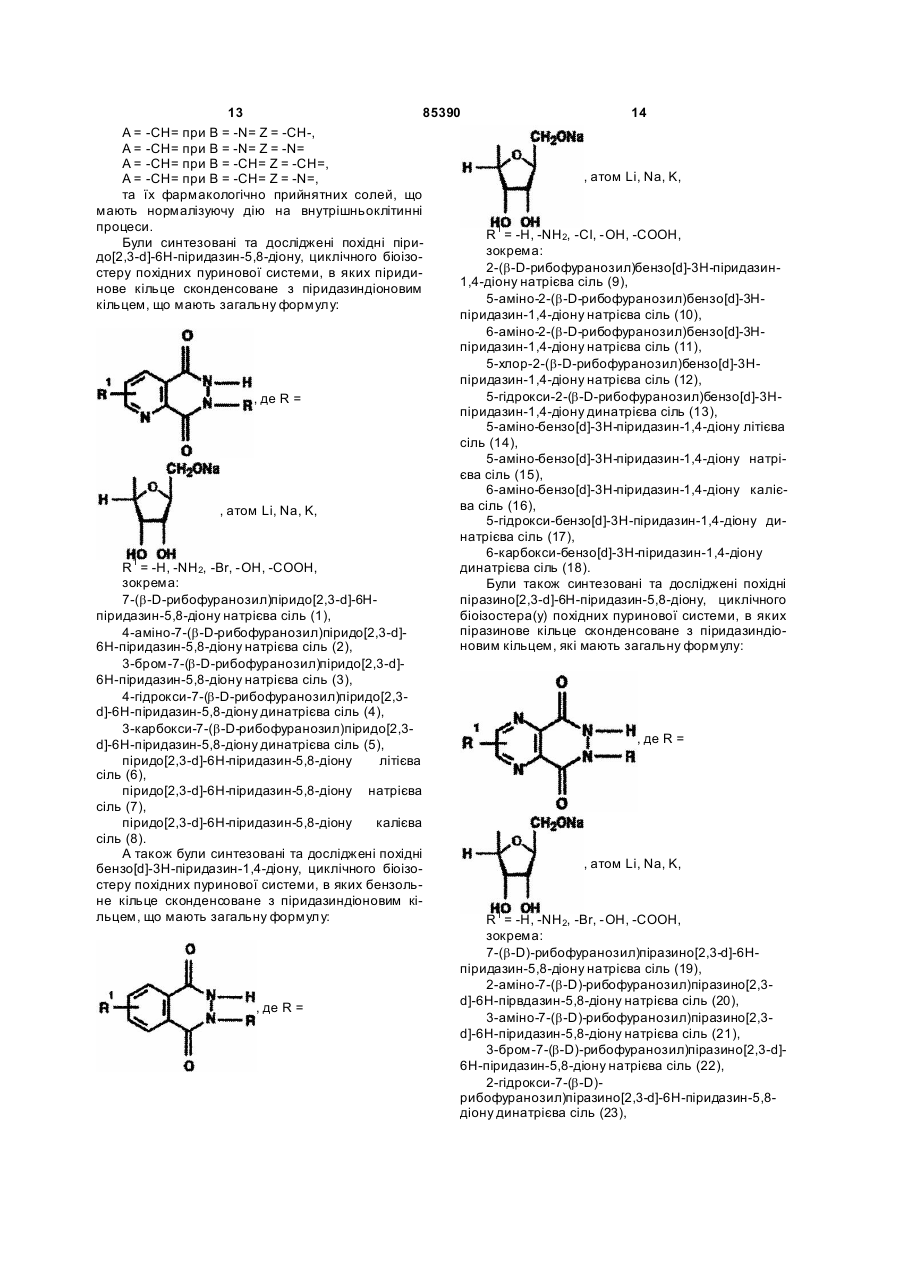
6. Сполука за п. 1, яка відрізняється тим, що є похідною піразино[2,3-d]-6Н-піридазин-5,8-діону, яка має загальну формулу:
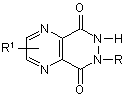 ,
,
де R = 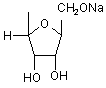 , атом Li, Na, K,
, атом Li, Na, K,
R1 = -H, -NH2, -Br, -ОН, -СООН.
7. Сполука за п. 1 або 6, яка відрізняється тим, що вибрана з групи, яка включає:
7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (19),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (19),
2-аміно-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (20),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (20),
3-аміно-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (21),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (21),
3-бром-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (22),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (22),
2-гідрокси-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (23),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (23),
2-карбокси-7-(![]() -D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (24),
-D-рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8-діону динатрієву сіль (24),
піразино[2,3-d]-6Н-піридазин-5,8-діону літієву сіль (25),
піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (26),
3-бромпіразино[2,3-d]-6Н-пііридазин-5,8-діону калієву сіль (27),
2-амінопіразино[2,3-d]-6Н-піридазин-5,8-діону натрієву сіль (28).
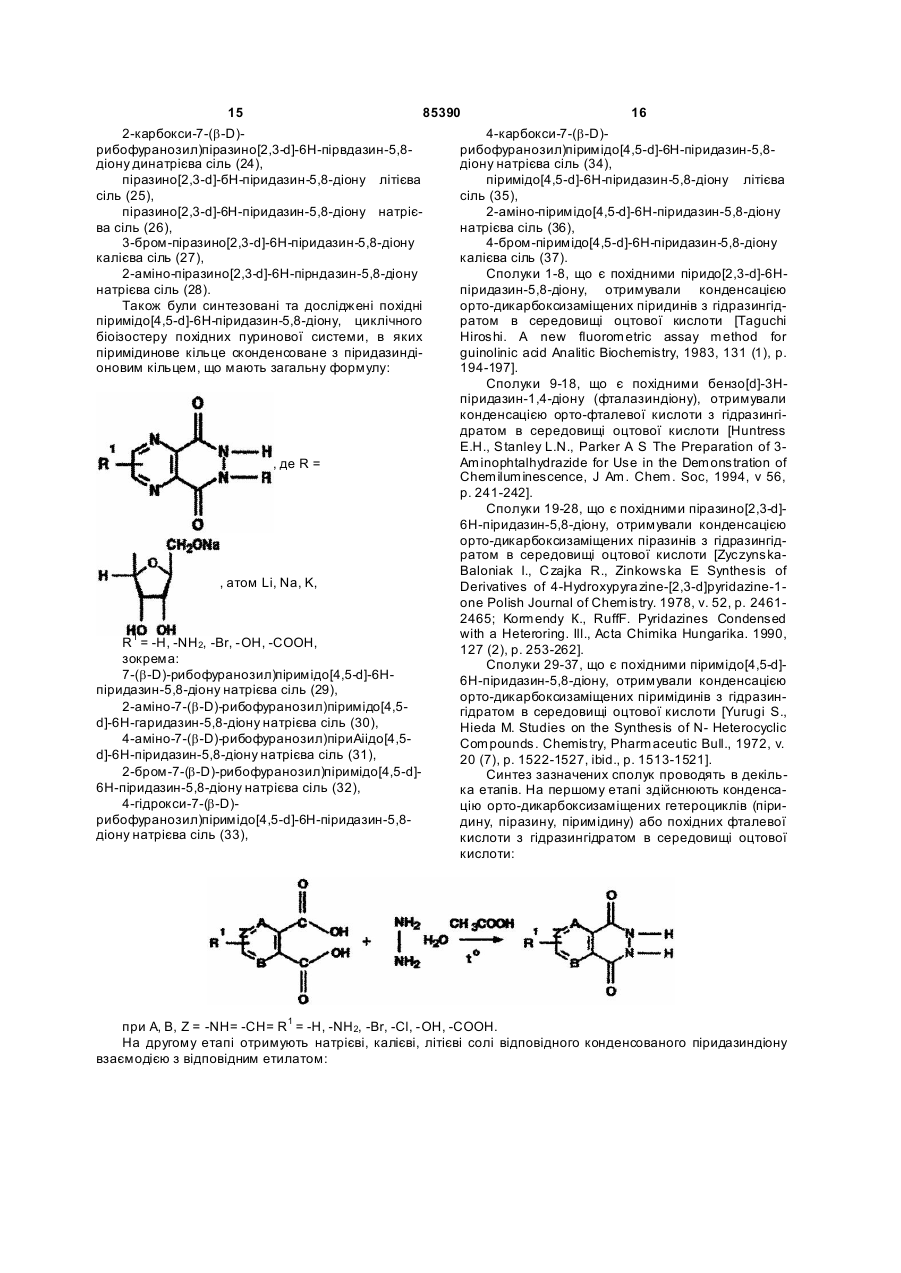
8. Сполука за п. 1, яка відрізняється тим, що є похідною піримідо[4,5-d]-6Н-піридазин-5,8-діону, яка має загальну формулу:
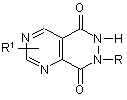 ,
,
де R = 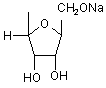 , атом Li, Na, K,
, атом Li, Na, K,
R1 = -H, -NH2, -Br, -ОН, -СООН.
9. Сполука за п. 1 або 8, яка відрізняється тим, що вибрана з групи, яка включає:
7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (29),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (29),
2-аміно-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (30),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (30),
4-аміно-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (31),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (31),
2-бром-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (32),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (32),
4-гідрокси-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (33),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (33),
4-карбокси-7-(![]() -D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (34),
-D-рибофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (34),
піpимiдo[4,5-d]-6H-пipидaзин-5,8-дioнy літієву сіль (35),
2-амінопіримідо[4,5-d]-6Н-піридазин-5,8-діону натрієву сіль (36),
4-бромпіримідо[4,5-d]-6Н-піридазин-5,8-діону калієву сіль (37).
10. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що має здатність усувати внутрішньоклітинний метаболічний ацидоз.
11. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що має здатність зв’язувати вільні радикали, які надмірно утворюються в клітині.
12. Сполука за будь-яким з пп. 1-9, 11, яка відрізняється тим, що має здатність зв’язувати вільнорадикальні форми кисню, які надмірно утворюються в клітині.
13. Сполука за будь-яким з пп. 1-9, 11, яка відрізняється тим, що має здатність нормалізувати нітрергічні механізми клітин.
14. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що має здатність взаємодіяти з аденозинчутливими рецепторами.
15. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що має здатність взаємодіяти з аденозинчутливими рецепторами на мембрані неядерних клітин.
16. Сполука за будь-яким з пп. 1-9, 15, яка відрізняється тим, що має здатність знижувати агрегацію тромбоцитів.
17. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що має здатність взаємодіяти з аденозинчутливими рецепторами всередині ядровмісних клітин.
18. Сполука за будь-яким з пп. 1-13, яка відрізняється тим, що має гепатопротекторну дію.
19. Фармацевтична композиція, що містить біологічно активний інгредієнт і фармацевтично прийнятний носій, яка відрізняється тим, що як біологічно активний інгредієнт містить сполуку за будь-яким з пп. 1-18 в ефективній кількості.
20. Композиція за п. 19, яка відрізняється тим, що як активний інгредієнт містить сіль сполуки за будь-яким з пп. 1-9.
21. Композиція за п. 19 або 20, яка відрізняється тим, що активний інгредієнт вибраний з групи, яка включає солі лужних і лужноземельних металів.
22. Композиція за п. 20, яка відрізняється тим, що активний інгредієнт вибраний з групи, яка включає гідрохлориди, гідроброміди, сульфати, фосфати, цитрати, тартрати, фумарати, оксалати, малеати, ацетати, нітрати.
23. Композиція за будь-яким з пп. 19-21, яка відрізняється тим, що активний інгредієнт являє собою композицію солей, вибраних з групи, що включає солі лужних і лужноземельних металів, у будь-якому їх кількісному співвідношенні.
24. Композиція за будь-яким з пп. 19, 20, 22, яка відрізняється тим, що активний інгредієнт являє собою композицію солей, вибраних з групи, що включає гідрохлориди, гідроброміди, сульфати, фосфати, цитрати, тартрати, фумарати, оксалати, малеати, ацетати, нітрати, у будь-якому їх кількісному співвідношенні.
25. Композиція за будь-яким з пп. 19-24, яка відрізняється тим, що містить біологічно активний інгредієнт в ліпосомальній формі.
26. Композиція за будь-яким з пп. 19-25, яка відрізняється тим, що фармацевтично прийнятний носій являє собою композицію, що містить фармакологічно активні добавки.
27. Композиція за п. 26, яка відрізняється тим, що фармакологічно активні добавки вибрані з групи, яка включає стабілізатори, диспергатори, ароматизатори, емульгатори, провідники, засоби підвищення біодоступності.
28. Композиція за будь-яким з пп. 19-27, яка відрізняється тим, що являє собою активний інгредієнт у фармацевтично прийнятному рідкому носії або розчиннику.
29. Композиція за п. 28, яка відрізняється тим, що рідкий носій вибраний з групи, яка включає воду, фізіологічну рідину, буферні розчини.
30. Композиція за будь-яким з пп. 19-27, яка відрізняється тим, що являє собою тонкодисперсний порошок активного інгредієнта, необов’язково у фармацевтично прийнятному рідкому носії або розчиннику.
31. Композиція за будь-яким з пп. 19-30, яка відрізняється тим, що пристосована для введення способом, вибраним з групи, що включає ентеральне, парентеральне, інгаляційне, ректальне, вагінальне, нашкірне, черезшкірне, інтраназальне введення, введення шляхом аплікації.
32. Композиція за будь-яким з пп. 19-31, яка відрізняється тим, що пристосована для місцевого введення.
33. Композиція за будь-яким з пп. 19-32, яка відрізняється тим, що пристосована для доставки до місця введення за допомогою пристрою.
34. Композиція за будь-яким з пп. 19-33, яка відрізняється тим, що пристосована для введення активним способом.
35. Композиція за будь-яким з пп. 19-33, яка відрізняється тим, що пристосована для введення пасивним способом.
36. Композиція за будь-яким з пп. 19-33, яка відрізняється тим, що являє собою спонтанно диспергований концентрат.
37. Композиція за будь-яким з пп. 19-33, яка відрізняється тим, що виготовлена у лікарській формі, яка забезпечує регульоване вивільнення активних інгредієнтів композиції.
38. Композиція за будь-яким з пп. 19-37, яка відрізняється тим, що додатково містить один або декілька агентів, які змінюють швидкість вивільнення активного інгредієнта.
39. Композиція за будь-яким з пп. 19-38, яка відрізняється тим, що пристосована для введення в дозованій кількості.
40. Композиція за будь-яким з пп. 19-39, яка відрізняється тим, що пристосована для застосування у твердому, напівтвердому, рідкому, суспензійному, аерозольному вигляді.
41. Композиція за будь-яким з пп. 19-40, яка відрізняється тим, що пристосована для розміщення у фармацевтично прийнятних засобах аплікації.
42. Композиція за будь-яким з пп. 2-31, яка відрізняється тим, що пристосована для введення у лікарській формі, вибраній з групи, що включає таблетки, гранулят, кульки, порошки, капсули, ампули, сухі препарати, яким перед застосуванням надається форма розчину або емульсії, свічки, тампони, мазі, гелі, золі, розчини для ін’єкцій, суспензії, емульсії, краплі, сиропи, пластири, аплікації, плівки, аерозолі, спреї.
Текст
1. Циклічний біоізостер похідних пуринової системи, який має загальну структурну формулу: O 2 3 85390 4 піридо[2,3-d]-6Н-піридазин-5,8-діону калієву сіль 2-аміно-7-( b -D-рибофуранозил)піразино[2,3-d]-6Н(8). піридазин-5,8-діону натрієву сіль (20), 4. Сполука за п. 1, яка відрізняється тим, що є 3-аміно-7-( b -D-рибофуранозил)піразино[2,3-d]-6Нпохідною бензо[d]-3Н-піридазин-1,4-діону, яка має піридазин-5,8-діону натрієву сіль (21), загальну формулу: 3-бром-7-( b -D-рибофуранозил)піразино[2,3-d]-6НO піридазин-5,8-діону натрієву сіль (22), 2-гідрокси-7-( b -D-рибофуранозил)піразино[2,3-d]N H 6Н-піридазин-5,8-діону динатрієву сіль (23), R1 N R 2-карбокси-7-( b -D-рибофуранозил)піразино[2,3-d]6Н-піридазин-5,8-діону динатрієву сіль (24), O піразино[2,3-d]-6Н-піридазин-5,8-діону літієву сіль , (25), CH2 ONa піразино[2,3-d]-6Н-піридазин-5,8-діону натрієву O сіль (26), H 3-бромпіразино[2,3-d]-6Н-пііридазин-5,8-діону каліде R = , атом Li, Na, K, єву сіль (27), 2-амінопіразино[2,3-d]-6Н-піридазин-5,8-діону наHO OH трієву сіль (28). 1 R = -Н, -NН2, -Сl, -ОН, -СООН. 8. Сполука за п. 1, яка відрізняється тим, що є 5. Сполука за п. 1 або 4, яка відрізняється тим, похідною піримідо[4,5-d]-6Н-піридазин-5,8-діону, що вибрана з групи, яка включає: яка має загальну формулу: 2-( b -D-рибофуранозил)бензо[d]-3Н-піридазин-1,4O діону натрієву сіль (9), 5-аміно-2-( b -D-рибофуранозил)бензо[d]-3НN N H R1 піридазин-1,4-діону натрієву сіль (10), N R 6-аміно-2-( b -D-рибофуранозил)бензо[d]-3НN піридазин-1,4-діону натрієву сіль (11), O 5-хлор-2-( b -D-рибофуранозил)бензо[d]-3Н, піридазин-1,4-діону натрієву сіль (12), CH2 ONa 5-гідрокси-2-( b -D-рибофуранозил)бензо[d]-3НO H піридазин-1,4-діону динатрієву сіль (13), де R = , атом Li, Na, K, 5-амінобензо[d]-3Н-піридазин-1,4-діону літієву сіль (14), HO OH 5-амінобензо[d]-3Н-піридазин-1,4-діону натрієву сіль (15), R1 = -H, -NH 2, -Br, -ОН, -СООН. 6-амінобензо[d]-3Н-піридазин-1,4-діону калієву 9. Сполука за п. 1 або 8, яка відрізняється тим, сіль (16), що вибрана з групи, яка включає: 5-гідроксибензо[d]-3Н-піридазин-1,4-діону динатрі7-( b -D-рибофуранозил)піримідо[4,5-d]-6Нєву сіль (17), піридазин-5,8-діону натрієву сіль (29), 6-карбоксибензо[d]-3Н-піридазин-1,4-діону динат2-аміно-7-( b -D-рибофуранозил)піримідо[4,5-d]-6Нрієву сіль (18). піридазин-5,8-діону натрієву сіль (30), 6. Сполука за п. 1, яка відрізняється тим, що є 4-аміно-7-( b -D-рибофуранозил)піримідо[4,5-d]-6Нпохідною піразино[2,3-d]-6Н-піридазин-5,8-діону, піридазин-5,8-діону натрієву сіль (31), яка має загальну формулу: 2-бром-7-( b -D-рибофуранозил)піримідо[4,5-d]-6НO піридазин-5,8-діону натрієву сіль (32), N 4-гідрокси-7-( b -D-рибофуранозил)піримідо[4,5-d]N H R1 6Н-піридазин-5,8-діону натрієву сіль (33), N R N 4-карбокси-7-( b -D-рибофуранозил)піримідо[4,5-d]6Н-піридазин-5,8-діону натрієву сіль (34), O , піpимiдo[4,5-d]-6H-пipидaзин-5,8-дioнy літієву сіль CH 2ONa (35), O 2-амінопіримідо[4,5-d]-6Н-піридазин-5,8-діону наH трієву сіль (36), де R = , атом Li, Na, K, 4-бромпіримідо[4,5-d]-6Н-піридазин-5,8-діону калієву сіль (37). HO OH 10. Сполука за будь-яким з пп. 1-9, яка відрізняR1 = -H, -NH2, -Br, -ОН, -СООН. ється тим, що має здатність усува ти внутрішньо7. Сполука за п. 1 або 6, яка відрізняється тим, клітинний метаболічний ацидоз. що вибрана з групи, яка включає: 11. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що має здатність зв’язувати вільні ра7-( b -D-рибофуранозил)піразино[2,3-d]-6Ндикали, які надмірно утворюються в клітині. піридазин-5,8-діону натрієву сіль (19), 12. Сполука за будь-яким з пп. 1-9, 11, яка відрізняється тим, що має здатність зв’язувати вільно 5 85390 6 радикальні форми кисню, які надмірно утворюють28. Композиція за будь-яким з пп. 19-27, яка відріся в клітині. зняється тим, що являє собою активний інгреді13. Сполука за будь-яким з пп. 1-9, 11, яка відрізєнт у фармацевтично прийнятному рідкому носії няється тим, що має здатність нормалізувати нітабо розчиннику. рергічні механізми клітин. 29. Композиція за п. 28, яка відрізняється тим, що 14. Сполука за будь-яким з пп. 1-9, яка відрізнярідкий носій вибраний з групи, яка включає воду, ється тим, що має здатність взаємодіяти з аденофізіологічну рідину, буферні розчини. зинчутливими рецепторами. 30. Композиція за будь-яким з пп. 19-27, яка відрі15. Сполука за будь-яким з пп. 1-9, яка відрізнязняється тим, що являє собою тонкодисперсний ється тим, що має здатність взаємодіяти з аденопорошок активного інгредієнта, необов’язково у зинчутливими рецепторами на мембрані неядерфармацевтично прийнятному рідкому носії або них клітин. розчиннику. 16. Сполука за будь-яким з пп. 1-9, 15, яка відріз31. Композиція за будь-яким з пп. 19-30, яка відріняється тим, що має здатність знижувати агрегазняється тим, що пристосована для введення цію тромбоцитів. способом, вибраним з групи, що включає ентера17. Сполука за будь-яким з пп. 1-9, яка відрізняльне, парентеральне, інгаляційне, ректальне, вагіється тим, що має здатність взаємодіяти з аденональне, нашкірне, черезшкірне, інтраназальне зинчутливими рецепторами всередині ядровмісних введення, введення шляхом аплікації. клітин. 32. Композиція за будь-яким з пп. 19-31, яка відрі18. Сполука за будь-яким з пп. 1-13, яка відрізнязняється тим, що пристосована для місцевого ється тим, що має гепатопротекторну дію. введення. 19. Фармацевтична композиція, що містить біоло33. Композиція за будь-яким з пп. 19-32, яка відрігічно активний інгредієнт і фармацевтично прийнязняється тим, що пристосована для доставки до тний носій, яка відрізняється тим, що як біологічмісця введення за допомогою пристрою. но активний інгредієнт містить сполуку за будь34. Композиція за будь-яким з пп. 19-33, яка відріяким з пп. 1-18 в ефективній кількості. зняється тим, що пристосована для введення 20. Композиція за п. 19, яка відрізняється тим, що активним способом. як активний інгредієнт містить сіль сполуки за 35. Композиція за будь-яким з пп. 19-33, яка відрібудь-яким з пп. 1-9. зняється тим, що пристосована для введення 21. Композиція за п. 19 або 20, яка відрізняється пасивним способом. тим, що активний інгредієнт вибраний з групи, яка 36. Композиція за будь-яким з пп. 19-33, яка відрівключає солі лужних і лужноземельних металів. зняється тим, що являє собою спонтанно диспер22. Композиція за п. 20, яка відрізняється тим, що гований концентрат. активний інгредієнт вибраний з групи, яка включає 37. Композиція за будь-яким з пп. 19-33, яка відрігідрохлориди, гідроброміди, сульфати, фосфати, зняється тим, що виготовлена у лікарській формі, цитрати, тартрати, фумарати, оксалати, малеати, яка забезпечує регульоване вивільнення активних ацетати, нітрати. інгредієнтів композиції. 23. Композиція за будь-яким з пп. 19-21, яка відрі38. Композиція за будь-яким з пп. 19-37, яка відрізняється тим, що активний інгредієнт являє созняється тим, що додатково містить один або бою композицію солей, вибраних з групи, що декілька агентів, які змінюють швидкість вивільвключає солі лужних і лужноземельних металів, у нення активного інгредієнта. будь-якому їх кількісному співвідношенні. 39. Композиція за будь-яким з пп. 19-38, яка відрі24. Композиція за будь-яким з пп. 19, 20, 22, яка зняється тим, що пристосована для введення в відрізняє ться тим, що активний інгредієнт являє дозованій кількості. собою композицію солей, вибраних з групи, що 40. Композиція за будь-яким з пп. 19-39, яка відрівключає гідрохлориди, гідроброміди, сульфати, зняється тим, що пристосована для застосування фосфа ти, цитрати, тартрати, фумарати, оксалати, у твердому, напівтвердому, рідкому, суспензійномалеати, ацетати, нітрати, у будь-якому їх кількісму, аерозольному вигляді. ному співвідношенні. 41. Композиція за будь-яким з пп. 19-40, яка відрі25. Композиція за будь-яким з пп. 19-24, яка відрізняється тим, що пристосована для розміщення у зняється тим, що містить біологічно активний інгфармацевтично прийнятних засобах аплікації. редієнт в ліпосомальній формі. 42. Композиція за будь-яким з пп. 2-31, яка відріз26. Композиція за будь-яким з пп. 19-25, яка відріняється тим, що пристосована для введення у зняється тим, що фармацевтично прийнятний лікарській формі, вибраній з групи, що включає носій являє собою композицію, що містить фарматаблетки, гранулят, кульки, порошки, капсули, амкологічно активні добавки. пули, сухі препарати, яким перед застосуванням 27. Композиція за п. 26, яка відрізняється тим, що надається форма розчину або емульсії, свічки, фармакологічно активні добавки вибрані з групи, тампони, мазі, гелі, золі, розчини для ін’єкцій, суяка включає стабілізатори, диспергатори, аромаспензії, емульсії, краплі, сиропи, пластири, аплікатизатори, емульгатори, провідники, засоби підвиції, плівки, аерозолі, спреї. щення біодоступності. 7 85390 Винахід відноситься до медицини, зокрема до фармацевтичних композицій для лікування різних захворювань, точніше - до лікарських засобів, що мають виражену нормалізуючу дію на внутрішньоклітинні процеси, зокрема усунення внутрішньоклітинного метаболічного ацидозу і зв'язування вільних радикалів, що надмірно утворюються. Відомо, що гомеостатичними параметрами, що забезпечують виживання організму і нерозривно пов'язані між собою, є, головним чином, вміст газів O2 і СО 2 у крові, вміст електролітів Na+, K+, Сl+, НСО3- та кислотно-основний стан клітини. Вміст газів у крові характеризує окисно-відновні процеси в клітині, кисень є важливим учасником процесу окиснення, а діоксид вуглецю - продуктом окисних реакцій. Електроліти складають основу позаклітинного і внутрішньоклітинного середовища, основу для клітинної інтеграції, для функціонування нервової і м'язової тканин. Вміст іонів водню Н + об'єктивно характеризує кислотно-основну рівновагу: іони водню забезпечують зв'язок між електролітами і газами крові за допомогою буферної системи (НСО3- - СО2). Крім того, від вмісту іонів водню Н+ залежить діяльність ферментативних систем: ферменти зазвичай найбільш активні у вузькому діапазоні концентрації іонів водню. Для кожного ферменту існує певний інтервал значень рН, в якому фермент виявляє максимальну активність, наприклад для α-амілази слини і для каталази рН 6,8-7,0, уреази рН 7,0-7,2, для трипсину рН 7,5-8,5, за межами цих інтервалів активність ферментів різко знижується. Вплив змін рН середовища на стан молекули ферменту обумовлений, зокрема, ступенем іонізації СООН-груп дикарбонових амінокислот, SH-груп цистеїну, імідазольного азоту гістидину, NН2-гр упи лізину та інших гр уп. При значній відмінності рН середовища від оптимальних значень ферменти зазнають конформаційних змін, що призводять до втрати активності внаслідок денатурації або зміни заряду молекули ферменту. При різних значеннях рН середовища активний центр ферменту може бути в частково іонізованому або неіонізованому стані, що позначається на третинній структурі білка і, відповідно, на формуванні активного фермент-субстратного комплексу. Крім того, рН середовища впливає і на ступінь іонізації субстратів і коферментів. Для клітини важливим є підтримання кислотно-лужної рівноваги - утворення іонів водню Н + та їх виведення з клітини. Абсолютне або відносне збільшення концентрації водневих іонів в середовищі робить його кислим, а зменшення - лужним. Концентрація Н+ в плазмі крові при нормальному стані організму становить приблизно 10-7. Значення рН крові є дуже стабільним, в нормі воно коливається від рН 7,35 до рН 7,45. Відхилення рН призводить до порушення функціонування клітин і, перш за все, їх численних ферментних систем, зміни спрямованості та інтенсивності окисновідновних процесів, наприклад здатності гемоглобіну зв'язувати і віддавати кисень. При цьому змінюються всі обмінні процеси і, в першу чергу, водного та електролітного обміну, порушується чутливість клітинних рецепторів, змінюється про 8 никність мембран, нервово-м'язова збудливість і провідність. У підтриманні сталості нормальних для життєдіяльності значень рН крові і тканин беруть участь фізіологічні системи: легені, печінка, нирки, шлунковий тракт, і буферні системи: гемоглобінова, бікарбонатна, білкова і фосфатна. Буферні системи достатньо ефективно і швидко відвертають зсув кислотно-основної рівноваги, але вони не в змозі підтримувати її протягом тривалого періоду без участі фізіологічних систем. У випадках, коли можливості вищеназваних компенсаційних систем по підтриманню концентрації іонів водню вичерпані, порушується кислотно-основна рівновага, і при цьому можуть виникати два різних стани: ацидоз, коли концентрація іонів водню вища за оптимальну концентрацію, тобто рН нижчий, ніж оптимальні значення, і алкалоз. Зниження рН нижче 6,8 є несумісним із життям. Метаболічний ацидоз - найбільш тяжка і найчастіша форма порушення кислотно-основного стану. Причинами метаболічного ацидозу можуть бути гіпоксії будь-якого походження: екзогенна, циркуляторна, дихальна, тканева, гемічна, а також цукровий діабет, голодування, лихоманка, ниркова недостатність, довготривала діарея, широкі запалення, наприклад перитоніт, передозування хлориду кальцію, та інші захворювання. До компенсації ацидозу підключаються нирки і печінка: активується ацидо- та амоніогенез в ниркових канальцях, якщо метаболічний ацидоз не є наслідком ниркової недостатності, а також підсилюється реасорбція бікарбонату в нирках і виділення його з печінки. Концентрація іонів K+ в плазмі, як правило, збільшується внаслідок їх витиснення з клітин іонами Н+. Білки, зв'язуючи іони Н +, вивільняють у плазму іони K+ і Na+. Підвищення осмотичного тиску плазми за рахунок гіпернатріємії сприяє переміщенню води з клітин і розвитку гіперосмолярного синтроду. При метаболічному ацидозі виникають і патологічні зміни: судини, як правило, розширюються при помірному зниженні рН і звужуються при вираженому ацидозі, при зменшенні судинного тонусу артеріальний і венозний тиск знижується, зменшується венозне повернення крові до серця, в результаті чого зменшується ударний і хвилинний об'єм серця. Зменшується чутливість міокардіоцитів до іонів кальцію і до адреналіну, що супроводжується зниженням скоротливої здатності міокарда. Гіперкаліємія з вмістому плазмі іонів K+ більше 5,2мМ/л спричиняє порушення нервовом'язової збудливості і провідності і обумовлює такі симптоми, як підвищення тонусу поперечносмугастої мускулатури, блювота, діарея, психічні розлади, порушення чутливості, брадикардію, екстрасистолію. При підвищенні концентрації іонів K+ в плазмі більше 7,5мМ/л можливий розвиток мерехтіння шлуночків серця та зупинка його в діастолі, а також параліч скелетної мускулатури. Підсилюється агрегація і аглютинація тромбоцитів, мікротромби, що виникають, ще більше порушують мікро 9 85390 10 циркуляцію, збільшуючи гіпоксію, викликають потивності клітин. Тому, використовуючи знання про рушення метаболічних процесів і підсилюють ацивеличину рН i і про шляхи і методи підтримання доз. цього параметра в певному діапазоні, можна ефеВ результаті порушення діяльності серця, пективно впливати на внутрішньоклітинні процеси. риферичного кровообігу вторинно порушується Наприклад, відомі дослідження по розробці ліфункція нирок, печінки, центральної нервової сискарських препаратів, здатних вибірково накопичутеми. У тяжких випадках розвивається кома, може ватися в клітинах пухлин, що відрізняються від настати зупинка дихання. нормальних клітин за величиною рН i [Tannock LA, При надмірному зниженні рН в клітині - менше Rotin D. Acid pH in tumors and its potential for 6,8 - руйнуються лізосоми, і клітини піддаються therapeutiv exploration. Cancer Res., 1989, v. 49, p. аутолізу під впливом лізосомальних ферментів. 4373-4384; Stabbs M, Rodrigues L., Howl F.A., Wang Розробка достовірних методів прижиттєвої рНI., Joeng K.-S., Veech R.L., Griffiths J.R. Metabolic метрії клітин дозволила встановити, що зміни внуconsequences of a reversed pH gradient in rat трішньоклітинного рНi супроводжують багато найtumors. Cancer Res., 1994, v. 54, p. 4011-4016]. важливіших процесів на клітинному рівні. Ряд факМожливість прогнозованої зміни внутрішньоторів свідчить про те, що для нормальної клітинного рНi має важливе практичне значення життєдіяльності клітин і тканин організму підтридля регуляції внутрішньоклітинного метаболізму. мання рНi у певному діапазоні є необхідним. ПриТому розробка фармацевтичних композицій, чиною цього може бути, зокрема, висока чутлиздатних ефективно підвищувати рН i, є досить аквість основних клітинних ферментів до значення туальною задачею. рНi. Так, відомо, що активність одного з ключових Відоме застосування залізовмісних сполук, в ферментів гліколізу 6-фосфо фруктокінази тому числі цитрату і ацетату заліза та їх комбінації, [2.7.1.11] зростає у десятки разів при збільшенні в умовах гіперфосфатемії як засобу утримання рНi середовища на 0,2 одиниці [Trump B.F., фосфор у і корекції метаболічного ацидозу при Berezesky I.K. The role of altered [Ca2+]i regulation in нирковій недостатності [US, 5753706] на основі apoptosis, oncosis and necrosis. Biochem. Biophys. абсорбції увібраних фосфа тів у кишечнику. Acta, 1996, v. 1313, p. 173-178]. Відома ветеринарна композиція для лікування Активність піруваткарбоксилази [6.4.1.1], фосмолочнокислого ацидозу або запобігання йому, форилази [2.4.1.1], каталізуючої метаболізм глікояка містить альфа-2-адреноцепторні антагоністи з гену, також залежить від величини рНi, та їх діяльгрупи імідазолінів, бензодіоксанімідазолінів і бенність інгібується при підвищенні рН i цитоплазми зофурохінолінів [US, 5196432]. [Roos Α., Boron W.F. Intracellular pH. Physiol. Rev., Відомий спосіб захисту клітин людини від не1981, v. 61, p. 296-434]. оборотних порушень, викликаних молочнокислим Відомо, що існує кореляція між процесами ацидозом внаслідок кисневої недостатності, переприкріплення клітин субстрату, підвищенням рНi і важно клітин ценральної нервової системи, який запуском механізму проліферації мінімально полягає у введенні в організм нетоксичної сполуки, трансформованих клітин [Акопов B.C., Гробова здатної проникати крізь мембрану клітини або доМ.Е., Ко шевой Ю.В. Вн утриклеточный рНi и сублати гематоенцефалічний бар'єр, яка може здійсстратная зависимость пролиферации фибропласнювати захисну буферну функцію в клітині і тканитов китайского хомячка. Цитология, 1991, 33 (7), с. нах, перешкоджаючи підвищенню концентрації 86-94; Gillies R.G., Martinez-Zaguilan R., Peterson іонів водню, підтримуючи при цьому рН у фізіолоE.P., Perona R. The role of intracellular pH in гічно прийнятних межах (не нижче 6,8), з групи, що mammalian cell proliferation. Cell. Physiol. Biochem., включає NH2CH2CH2SO3H, NH21992, 2, p. 159-179; Akatov V.S., Grobova M.E. C(NH)NH(CH2)2SO3H або NH2Acti vation of intracellular pH regulating systems upon C(NH)NH(CH2)2SO3Na [US, 5312839, А]. cell adhesion to solid substrate. Biol. Membr., 1993, Відоме застосування похідних 1,4v. 6, p. 917-934]. бензоксазину як лікарського засобу для лікування Було показано, що у макрофагів зниження рНi захворювань, викликаних внутрішньоклітинним інгібує продукування супероксиду і фагоцитувальацидозом при міокардіальній ішемії [US, 5597820, ну активність. Крім того, при активації фагоцитів А]. відбувається вивід протонів, що приводить до підВідомий препарат гемодинамічної дії, що яввищення рНi [Kapus Α., Romanek R., Qu Α. Υ., ляє собою водний розчин декстрану з молекулярRotstein O.O., Grinstein S.A. pH-sensitive and ною масою 40000 з додаванням солей: натрію voltage-dependent proton conductance in the plasma хлориду, калію хлориду, магнію хлориду, кальцію membrane of macrofages. J. Gen. Physiol., 1993, v. хлориду і натрію ацетату, для нормалізації кислот102 (4), p. 723-760]. но-основної рівноваги та електролітного балансу Зміна рНi розглядається як можливий медіатор [RU, 2185173, С2]. Велика концентрація набору розпластування і хемотаксису нейтрофілів, і стросолей порівняно з препаратами декстран 40 (USA) га кореляція рНi необхідна для успішного виконані декстран 70 (USA) краще компенсує дефіцит соня ними мікробіоцидної функції [Demaurex Ν., лей крові і міжтканинної рідини, ефективніше кореDowney G., Waddell Т., Grinstein S. Intracellular pH ктує метаболічний ацидоз. Припускають, що наregulator during spreading of human neutrophils, J. трію ацетат при введенні в організм включається в Cell. Biol., 1996, v. 133, p. 1381-1402]. обмін речовин і аніон СН3СОО- перетворюється на На основі вищеперелічених даних можна зроводу та вуглекислий газ, а катіон Na+ взаємодіє з бити достовірний висновок про те, що підвищення недоокисненими кислотними продуктами метабовнутрішньоклітинного рНi служить показником аклізму і відновлює рН середовища. Однак віднов 11 85390 12 лення рН середовища не завжди приводить до Відомий лікарський препарат "димефосфон", необоротного відновлення рНi клітини. що містить як активну речовину диметиловий ефір Відоме застосування намациту (карбостимулі1,1-диметил-3-оксобутилфосфонової кислоти ну), що містить бікарбонат, солі магнію, марганцю і [Ма шковский М.Д. Лекарственные средства. Μ., цинку і цитрат натрію для інтегральної корекції Медицина, 1993, ч. II, с. 137-140], антацидна дія метаболічного ацидозу, при цьому активність преякого пов'язана з активацією метаболічних процепарату обумовлена взаємодією вуглекислоти з сів, регуляцією кислотно-основного стану організферментними білками, що приводить до зміни му, в тому числі при пневмонії, гострих респіратоактивності ферментів щодо комплексу реакцій рних захворюваннях. Однак при застосуванні карбоксилювання і декарбоксилювання в тканипрепарату виникають диспепсичні розлади. нах, іони магнію, марганцю і цинку активують карРозробка лікарських препаратів, що усувають боксилази, а цитрат натрію служить субстратом внутрішньоклітинний метаболічний ацидоз і нордля реакцій циклу трикарбонових кислот, ліпогенемалізують внутрішньоклітинні процеси, є досить зу [RU, 2014077, С1]. актуальною задачею. Відомий спосіб лікування хвороби АльцгеймеМетою даного винаходу є створення лікарсьра, викликаної порушенням бета-амілоїдкого засобу для корекції порушень внутрішньокліпептидного метаболізму, що є результатом внуттинних процесів. рішньоклітинного ацидозу, або коливання рН від При створенні винаходу було поставлене занормального значення рН 7,3 і кислотним внутрівдання створення лікарського засобу на основі шньоклітинним рН між 5,0 і 7,0, що полягає у ввесполук, що мають біологічну активність нормалізаденні пацієнту фармакологічно ефективної кількоції кислотно-основного стану клітини за рахунок сті лужної сполуки або буфера, здатного підняти виводу з клітини надмірної кількості протонів і підвнутрішньоклітинний рН від рН 7,0 до до рН 7,1-7,4 вищення тим самим рНi клітини, нормалізації діяі подолати гематоенцефалічний бар'єр, пройти льності ферментативних систем, нормалізації крізь клітинну мембрану, зменшити концентрацію спрямованості та інтенсивності оксино-відновних іонів водню і мати рКа від 6,8 до 11,4, а саме спопроцесів, здатність взаємодіяти з аденозинчутлилук з групи гуанідиноетан сульфату, гуанідиноетан вими рецепторами на мембрані і всередині клітисульфонової кислоти та інших [US, 5723496]. ни, а також здатність зв'язувати вільні радикали, Відомий бікарбонат натрію, який застосовують що надмірно утворюються. при різних захворюваннях, що супроводжуються Як біологічно активні сполуки, що мають необвираженим ацидозом, для боротьби з ацидозом хідні для реалізації поставленого завдання власпри хірургічних втручаннях, а також застосовують тивості, були розглянуті похідні конденсованих як антацидний засіб при підвищеній кислотності піридазиндіонових систем, які, на думку авторів, шлункового соку, при виразковій хворобі шлунка і можуть мати циклічний ізостеризм відносно адедванадцятипалої кишки. Однак при його застосунозину, оскільки вони містять кільцеві системи, ванні необхідно враховувати, що тривале його схожі з аденозином за розмірами і за характером введення в організм може призвести до некомпенелектронної густини. сованого алкалозу, супроводжуваному тяжкими Автори припустили, що конденсовані піридапорушеннями кислотно-основного стану крові. зиндіонові системи завдяки схожій з аденозином Відомий препарат трисамін, що як активну ребудові можуть мати подібну реакційну здатність в човину містить три(оксиметил)амінометан, який є організмі, здатні приєднувати b-D-рибофуранозні антацидом системної дії [US, 5256660, А]. Застофрагменти, взаємодіяти з чутли вими до аденозину совують трисамін при гострих і хронічних захворюрецепторами і проникати крізь клітинну мембрану, ваннях, які супроводжуються метаболічним і змітобто можуть бути біологічними ізостерами аденошаним ацидозом. Препарат застосовують зину. Одночасно вони є електрохімічно активними внутрішньовенно у вигляді 3,66%-ного розчину. сполуками з достатньо низькими потенціалами Трисамін зв'язує велику кількість іонів Н + і вивовідновлення і можуть приєднувати 2-4 протони і дить їх з сечею, тому його застосовують тільки при електрони, усуваючи тим самим внутрішньоклітиннормальній функції нирок, з іншого боку, трисамін ний метаболічний ацидоз. сприяє збільшенню вмісту іонів НСО3- в крові. ОдПоставлене завдання було вирішене виявленнак трисамін протипоказаний при порушенні видіням циклічних біоізостерів пуринової системи, що льної функції нирок і порушеннях функції печінки. мають загальну формулу: Оскільки препарат викликає також пригнічення дихання, то хворим з недостатністю вентиляції легенів його вводять тільки в умовах керованого або допоміжного дихання. В даний час в медичній практиці усунення ме, де R = , таболічного ацидозу здійснюють кількома етапами. На початковому етапі застосовують розчини бікарбонату натрію або трисамін. На наступному етапі проводять заходи, спряLi, Na, K, мовані на нормалізацію гемодинаміки і газообміну, на поліпшення мікроциркуляції крові та обмінних R1 = -Н, -NH 2, -Br, -СІ, -ОН, -СООН, процесів в організмі, корекцію електролітного дисВ = -N= -СН=, Ζ = -СН= -Ν= балансу, а головне - на усунення причини, що виА = -Ν= при В = -Ν= Ζ = -СН-, кликала зсув кислотно-основної рівноваги. 13 85390 14 А = -СН= при В = -Ν= Ζ = -СН-, А = -СН= при В = -Ν= Ζ = -Ν= А = -СН= при В = -СН= Ζ = -СН=, , атом Li, Na, K, А = -СН= при В = -СН= Ζ = -Ν=, та їх фармакологічно прийнятних солей, що мають нормалізуючу дію на внутрішньоклітинні процеси. R1 = -Η, -ΝΗ2, -СІ, -ОН, -СООН, Були синтезовані та досліджені похідні піризокрема: до[2,3-d]-6Н-піридазин-5,8-діону, циклічного біоізо2-(b-D-рибофуранозил)бензо[d]-3H-піридазинстеру похідних пуринової системи, в яких піриди1,4-діону натрієва сіль (9), нове кільце сконденсоване з піридазиндіоновим 5-аміно-2-(b-D-рибофуранозил)бензо[d]-3Hкільцем, що мають загальну формулу: піридазин-1,4-діону натрієва сіль (10), 6-аміно-2-(b-D-рибофуранозил)бензо[d]-3Hпіридазин-1,4-діону натрієва сіль (11), 5-хлор-2-(b-D-рибофуранозил)бензо[d]-3Hпіридазин-1,4-діону натрієва сіль (12), 5-гідрокси-2-(b-D-рибофуранозил)бензо[d]-3H, де R = піридазин-1,4-діону динатрієва сіль (13), 5-аміно-бензо[d]-3H-піридазин-1,4-діону літієва сіль (14), 5-аміно-бензо[d]-3H-піридазин-1,4-діону натрієва сіль (15), 6-аміно-бензо[d]-3H-піридазин-1,4-діону калієва сіль (16), , атом Li, Na, K, 5-гідрокси-бензо[d]-3H-піридазин-1,4-діону динатрієва сіль (17), 6-карбокси-бензо[d]-3H-піридазин-1,4-діону R1 = -Н, -NH 2, -Br, -ОН, -СООН, динатрієва сіль (18). зокрема: Були також синтезовані та досліджені похідні 7-(b-D-рибофуранозил)піридо[2,3-d]-6Нпіразинo[2,3-d]-6Н-піридазин-5,8-діону, циклічного піридазин-5,8-діону натрієва сіль (1), біоізостера(у) похідних пуринової системи, в яких піразинове кільце сконденсоване з піридазиндіо4-аміно-7-(b-D-рибофуранозил)піридо[2,3-d]новим кільцем, які мають загальну формулу: 6Н-піридазин-5,8-діону натрієва сіль (2), 3-бром-7-(b-D-рибофуранозил)піридо[2,3-d]6Н-піридазин-5,8-діону натрієва сіль (3), 4-гідрокси-7-(b-D-рибофуранозил)піридо[2,3d]-6Н-піридазин-5,8-діону динатрієва сіль (4), 3-карбокси-7-(b-D-рибофуранозил)піридо[2,3, де R = d]-6Н-піридазин-5,8-діону динатрієва сіль (5), піридо[2,3-d]-6Н-піридазин-5,8-діону літієва сіль (6), піридо[2,3-d]-6Н-піридазин-5,8-діону натрієва сіль (7), піридо[2,3-d]-6Н-піридазин-5,8-діону калієва сіль (8). А також були синтезовані та досліджені похідні бензо[d]-3H-піридазин-1,4-діону, циклічного біоізостеру похідних пуринової системи, в яких бензольне кільце сконденсоване з піридазиндіоновим кільцем, що мають загальну формулу: , де R = , атом Li, Na, K, R1 = -Η, -NH 2, -Br, -OH, -COOH, зокрема: 7-(b-D)-рибофуранозил)піразино[2,3-d]-6Нпіридазин-5,8-діону натрієва сіль (19), 2-аміно-7-(b-D)-рибофуранозил)піразинo[2,3d]-6Н-пірвдазин-5,8-діону натрієва сіль (20), 3-аміно-7-(b-D)-рибофуранозил)піразино[2,3d]-6Н-піридазин-5,8-діону натрієва сіль (21), 3-бром-7-(b-D)-рибофуранозил)піразино[2,3-d]6Н-піридазин-5,8-діону натрієва сіль (22), 2-гідрокси-7-(b-D)рибофуранозил)піразино[2,3-d]-6Н-піридазин-5,8діону динатрієва сіль (23), 15 85390 16 2-карбокси-7-(b-D)4-карбокси-7-(b-D)рибофуранозил)піразино[2,3-d]-6Н-пірвдазин-5,8рибофуранозил)піримідo[4,5-d]-6Н-піридазин-5,8діону динатрієва сіль (24), діону натрієва сіль (34), піразино[2,3-d]-бН-піридазин-5,8-діону літієва піримідо[4,5-d]-6Н-піридазин-5,8-діону літієва сіль (25), сіль (35), піразино[2,3-d]-6Н-піридазин-5,8-діону натріє2-аміно-піримідo[4,5-d]-6Н-піридазин-5,8-діону ва сіль (26), натрієва сіль (36), 3-бром-піразино[2,3-d]-6Н-піридазин-5,8-діону 4-бром-піримідo[4,5-d]-6Н-піридазин-5,8-діону калієва сіль (27), калієва сіль (37). 2-аміно-піразино[2,3-d]-6Н-пірндазин-5,8-діону Сполуки 1-8, що є похідними піридо[2,3-d]-6Ннатрієва сіль (28). піридазин-5,8-діону, отримували конденсацією Також були синтезовані та досліджені похідні орто-дикарбоксизаміщених піридинів з гідразингідпіримідо[4,5-d]-6Н-піридазин-5,8-діону, циклічного ратом в середовищі оцтової кислоти [Taguchi біоізостеру похідних пуринової системи, в яких Hiroshi. A new fluorometric assay method for піримідинове кільце сконденсоване з піридазиндіguinolinic acid Analitic Biochemistry, 1983, 131 (1), p. оновим кільцем, що мають загальну формулу: 194-197]. Сполуки 9-18, що є похідними бензо[d]-3Hпіридазин-1,4-діону (фталазиндіону), отримували конденсацією орто-фталевої кислоти з гідразингідратом в середовищі оцтової кислоти [Huntress E.H., Stanley L.N., Parker A S The Preparation of 3Aminophtalhydrazide for Use in the Demonstration of , де R = Chemiluminescence, J Am. Chem. Soc, 1994, ν 56, p. 241-242]. Сполуки 19-28, що є похідними піразино[2,3-d]6Н-піридазин-5,8-діону, отримували конденсацією орто-дикарбоксизаміщених піразинів з гідразингідратом в середовищі оцтової кислоти [ZyczynskaBaloniak I., C zajka R., Zinkowska E Synthesis of , атом Li, Na, K, Derivatives of 4-Hydroxypyra zine-[2,3-d]pyridazine-1one Polish Journal of Chemistry. 1978, ν. 52, p. 24612465; Kormendy К., RuffF. Pyridazines Condensed with a Heteroring. Ill., Acta Chimika Hungarika. 1990, 1 R = -Η, -ΝΗ2, -Br, -ОН, -СОOH, 127 (2), p. 253-262]. зокрема: Сполуки 29-37, що є похідними піримідо[4,5-d]7-(b-D)-рибофуранозил)піримідо[4,5-d]-6Н6Н-піридазин-5,8-діону, отримували конденсацією піридазин-5,8-діону натрієва сіль (29), орто-дикарбоксизаміщених піримідинів з гідразин2-аміно-7-(b-D)-рибофуранозил)піримідо[4,5гідратом в середовищі оцтової кислоти [Yurugi S., d]-6Н-гаридазин-5,8-діону натрієва сіль (30), Hieda Μ. Studies on the Synthesis of N- Heterocyclic 4-аміно-7-(b-D)-рибофуранозил)піриАіідо[4,5Compounds. Chemistry, Pharmaceutic Bull., 1972, v. d]-6Н-піридазин-5,8-діону натрієва сіль (31), 20 (7), p. 1522-1527, ibid., p. 1513-1521]. 2-бром-7-(b-D)-рибофуранозил)піримідо[4,5-d]Синтез зазначених сполук проводять в декіль6Н-піридазин-5,8-діону натрієва сіль (32), ка етапів. На першому етапі здійснюють конденса4-гідрокси-7-(b-D)цію орто-дикарбоксизаміщених гетероциклів (піририбофуранозил)піримідо[4,5-d]-6Н-піридазин-5,8дину, піразину, піримідину) або похідних фталевої діону натрієва сіль (33), кислоти з гідразингідратом в середовищі оцтової кислоти: при А, В, Ζ = -ΝΗ= -СН= R1 = -Η, -ΝΗ2, -Br, -Cl, -ОН, -СООН. На другому етапі отримують натрієві, калієві, літієві солі відповідного конденсованого піридазиндіону взаємодією з відповідним етилатом: 17 85390 18 На заключному етапі проводять конденсацію відповідної солі з 1-хлор-2,3,5-три-О-толуоїл-b-Dрибофуранозою в середовищі безводного диметилформаміду (далі ДМФА) у присутності каталізатора. Як каталізатор використовують 15-краун-5 у випадку солі Na або син-, цис-, антицисдициклогексано-18-краун-6- у випадку солі К. Зняття пара-толуоїльного захисту проводять метилатом натрію. Рибозилування солей гетероциклічних основ проводять за загальною методикою: До суміші 1,0мМ натрієвої солі гетероциклічної основи, 1,0мМ 15-краун-5 в 10,0мл сухого ДМФА в атмосфері осушеного аргону додають по краплям при перемішуванні 1,0мМ 1-хлор-2,3,5-три-О-толуоїлb-D-рибофуранози. Реакційну масу перемішують 6-10 годин при температурі 20°С. Потім додають 7,0мл 10%-ного розчину NaHCO3 і перемішують 30 хвилин при 0°С. До отриманої суспензії додають 30,0мл хлороформу і потім відфільтровують через Hyflo Super Cel, органічний шар відокремлюють, промивають 10,0мл води і сушать Na2SO4. Отримані нуклеозиди хроматографують на силікагелі, елююють СНСl3. Вихід нуклеозидів становить 4565%. Зняття гара-толуоїльного захисту проводять за загальною методикою таким чином: Розчин 0,32мМ нуклеозиду в суміші метанолу і діоксану у співвідношенні 5:1 охолоджують до 0°С і додають до нього 0,7мл 0,1М-ного розчину метил ату натрію в метанолі і витримують в атмосфері аргону 24 години при температурі 6°С. Реакційну масу нейтралізують додаванням DOWEX 50 (Н+) до рН 7,0, смолу відфільтровують. Кінцеві продукти виділяють з фільтрату хроматографією на силікагелі. Елюент являє собою суміш СНСl3 і МеОН у співвідношенні 20:1. Вихід цільового продукту становить 66-85%. Літієві, натрієві та калієві солі отримували змішуванням еквімолярних кількостей гетероциклічних сполук з водним розчином відповідних гідроксидів. Відгонку води здійснювали при зниженому тиску без нагріву аналогічно відомому способу отримання лужних і лужноземельних солей амінодигідрофталазиндіону [RU, 2169139, С1]. Будова синтезованих сполук була підтверджена даними елементного аналізу на приладі ЕА-1108 ("Carlo Erba") і хроматомас-спектроскопії на хроматомас-спектрометрі "Adgilent Technologies". 19 85390 20 21 85390 22 Синтезовані сполуки являють собою безбарвні електрохімічного відновлення, причому при знаабо жовтуваті кристалічні речовини з температученнях потенціалів півхвилі E1| 2 від мінус 0,09В до рою плавлення більше 300°С. мінус 0,2В. Поставлене завдання було також вирішене Для порівняння можна навести приклад електрозробкою фармацевтичної композиції, що містить рохімічного відновлення коферменту NAD+, здійсяк активний інгредієнт циклічні біоізостери похіднюваний при E1| 2=-0,32В, в якому в молекулу NAD+ них пуринової системи згідно з винаходом. включаються 2 електрони і один протон, а другий Далі винахід пояснюється викладом результапротон залишається в середовищі: тів проведених досліджень біологічної активності циклічних біоізостерів похідних пуринової системи згідно з винаходом, що не обмежують їх застосування і не виходять за межі формули винаходу, і кресленнями, що додаються, на яких: У флавінових коферментах FAD+, активною Фіг.1а - калібрувальні криві залежності інтенчастиною молекули якого є ізо алоксазинове кільсивностей флуоресцентності розчинів флуоросцеце, в результаті відновлення при потенціалі E1| 2=їну та клітин миші ΝIH 3Τ3. 0,05В найчастіше спостерігається приєднання Фіг.1б - калібрувальна крива для визначення двох протонів і дво х електронів одночасно. рНi в клітинах миші ΝΙΗ 3Τ3. Відновлені форми цих коферментів NADH і Фіг.2 - залежність рН i клітини від рН середоFADH транспортують водень і електрони до дихавища. льного ланцюга мітохондрій або інших енергоспФіг.3 - зміна рНi клітини при зміні рН середоряжувальних мембран. вища із сироваткою крові після введення в сереВ дихальному ланцюгу мітохондрій розташодовище сполук згідно з винаходом. вані цитохроми b, c1, с, а та a3 в порядку зростання Фіг.4 - зміна рНi клітини при зміні рН середоабсолютної величини їхнього окисно-відновного вища без сироватки крові після введення в серепотенціалу, установленого в умовах рН 7,0, довище сполук згідно з винаходом. t=25°С: Фіг.5 - зміна рН i фібробластів у прикріпленому b(Fe3+)E1| 2=+0,07В, c1(Fe3+)E1| 2=+0,23В, 3+ розпластаному стані після введення в середовище c(Fe )E1| 2=+0,25В, a(Fe3+)E1| 2=+0,29В, сполук згідно з винаходом. 3+ a3(Fe )E1| 2=+0,55В, Фіг.6 - інтенсивність хемілюмінесценції ІН суякі відіграють важливу роль в процесі тканинспензії еритроцитів після інкубування зі сполуками ного дихання. згідно з винаходом при 37°С і при 4°С. Цитохром а являє собою термінальну ділянку Фіг.7а - інтенсивність хемілюмінесценції ІН судихального ланцюга - цитохромоксидазу, яка здійспензії еритроцитів після інкубування зі сполуками снює окиснення цитохрому с з утворенням води. згідно з винаходом в концентраціях 10-11-10-8М. Елементарний акт являє собою двоелектронне Фіг.7б - інтенсивність хемілюмінесценції ІН сувідновлення одного атома кисню, при цьому кожна спензії еритроцитів після інкубування зі сполуками молекула кисню взаємодіє з двома електронотразгідно з винаходом і додавання аденозину. нспортними ланцюгами. При транспортуванні кожФіг.8 - інтенсивність хемілюмінесценції ІН кліної пари електронів у внутрішньомітохондріальнотин селезінки після інкубування при 37°С і при 4°С му просторі може накопичуватися до 6 протонів. зі сполуками згідно з винаходом. Зміна співвідношення кількості протонів і електроФіг.9 - вплив сполук згідно з винаходом на акнів може призводити до порушення процесів ткативність супероксиддисмутази. нинного дихання. Фіг.10 - вплив сполук згідно з винаходом на Авторами було встановлено, що кожна молеутворення супероксидаіон радикалів в клітинах. кула сполук 1-37 згідно з винаходом здатна прониФіг.11 - вплив сполук згідно з винаходом на аккати у внутрішньоклітинний простір і, маючи окистивність каталази. но-відновний потенціал, порівнянний з Фіг.12 - вплив сполук згідно з винаходом на акпотенціалами електрохімічного відновлення наветивність пероксидази еритроцитів. дених вище процесів, необоротно приєднувати до Фіг.13 - вплив сполук згідно з винаходом на ак4 електронів і протонів, сприяючи тим самим інтетивність NOC. нсифікації процесів тканинного дихання і значному З опублікованих раніше даних відомо, що цикзменшенню метаболічного внутрішньоклітинного лічні гідразиди або не піддаються полярографічацидозу. ному відновленню, або відновлюються в достат1. Електрохімічна активність сполук згідно з ньо жорстких кислих або лужних умовах при винаходом. достатньо високих потенціалах півхвилі E1| 2>1,0В Були проведені дослідження електрохімічної [Seo Ε., Kuwana Т. Polarography of cyclic активності сполук згідно з винаходом. Hydrazides. J. Electroanal. Chem., 1963, v. 6, p. 417Були досліджені водні розчини сполук 1, 5, 7, 418; Lund H. Polarographic and electropreparative 10, 15, 18, 23, 25, 27, 33, 35, 36 згідно з винаходом reduction of 1(2H)-phthalazinones, 2,3-dihydro-1,4з початковою концентрацією 1·10-2М/л і, для порівphthalazindiones and related compounds. Coll. няння, розчин препарату "димефосфон" в такій Czechoslow. Chem. Com., 1965, v. 30, p. 4237самій початковій концентрації. 4249]. Дослідження проводили на універсальному Однак авторами було встановлено, що сполуполярографі ПУ-1 з двокоординатним самописом ки 1-37 згідно з винаходом, які є солями лужних типу "ЛКД" з використанням триелектродної терметалів циклічних гідразидів, мають здатність до мостатованої полярографічної комірки і ртутного 23 85390 24 краплинного електрода (РКЕ) з примусовим відрифічні вимірювання проводили при температурі вом краплі і періодом крапання 0,5сек. Як допомі37°С. Запис полярограм досліджуваних сполук жний електрод використовували платиновий дріт, здійснювали в режимі постійного струму зі швидкіяк електрод порівняння - насичений каломельний стю розгортки потенціалу 10,0мВ/сек, прямий хід електрод (НКЕ). від потенціалу 0 до мінус 0,5В, зворотний хід - від Як фон використовували 2,0%-ні розчини хломінус 0,5В до 0. Чутливість за струмом становила риду натрію з рН 7,0, 7,2, 7,4, 7,6; значення рН 5,0мкА. Масштаб за координатою потенціалів фонового розчину коректували розчином гідрокси50,0мВ/см. Значення потенціалів півхвиль E1/2 доду натрію. В полярографічну комірку наливали сліджуваних сполук наведені відносно потенціалу 5,0мл фонового розчину і протягом 5 хвилин проНКЕ. дували азотом для видалення розчиненого кисню. Параметри полярограми - граничний струм і lim Потім до фонового розчину додавали 0,5мл розта E1/2 визначали графічним методом. Кількість чину досліджуваної речовини і здійснювали запис електронів, що беруть участь а реакції, розраховуполярограми у вигляді хвилі відновлення. Конценвали на основі аналізу хвилі відновлення за рівтрація сполук у полярографічній комірці складала нянням Гейровського-Ільковича. 9·10-4M. Середні величини параметрів хвилі відновВимірювання рН здійснювали на рН-метрі з лення досліджуваних сполук при прямому ході точністю плюс-мінус 0,05 одиниць рН. Полярогразапису наведені в табл. 2. В процесі експериментів помітили, що, порівняно зі значеннями кривих прямого ходу, при записі полярограм зворотного ходу значення потенціалу півхвилі було більш позитивним на 25,0мВ для сполук 1, 5, 7, на 30,0мВ для сполук 10, 15, 18, на 20,0мВ для сполук 23, 25, 27, на 27,0мВ для сполук 33, 35, 36 і на 50,0мВ для препарату "димефосфон". Наведені дані свідчать про необоротність процесу електрохімічного відновлення цих сполук. Розрахунок кількості електронів, що беруть участь в реакції відновлення, здійснювали за рівнянням Гейровського-Ільковича: E = E1/ 2 2,3RT i lg nF ilim - i де n - кількість електронів; і - поточне значення струму хвилі, мкА; ilim - значення граничного струму хвилі, мкА; F - число Фарадея, що дорівнює 96500К; R - універсальна газова стала, що дорівнює 8,31Джоуль/моль.К; Τ - температура, К; Е, E1/2 - потенціали, В. В результаті розрахунків було установлено, що при відновленні· - для сполук 1, 5, 7 кількість електронів становить 3,72; - для сполук 10, 15, 18 - 4,09; - для сполук 23, 25, 27 - 3,72; - для сполук 33, 35, 36 - 3,5; - для димефосфону - 1,6, тобто при відновленні досліджуваних сполук згідно з винаходом витрачаються 4 електрони, а 25 85390 26 при відновленні димефосфону - 2 електрони, з також середовище, забуферене 5,0мМ HEPES та чого можна зробити висновок, що сполуки згідно з 15,0мМ бікарбонату без сироватки або з доданням винаходом виявляють більшу, ніж димефосфон, 5,0% сироватки. Підрахунок клітин здійснювали за здатність до необоротного приєднання електронів. допомогою гемоцитометра. Частку клітин, що заБули проведені дослідження біологічної активгинули, визначали за забарвленням трипановим ності сполук згідно з винаходом. синім. 2. Вплив сполук згідно з винаходом на рН i кліВимірювання внутрішньоклітинного рН i провотини. дили за допомогою барвників FDA (Sigma) і Відомо багато механізмів, які забезпечують BCECF-AM (Calbiochem) на мікроспектрофлуорирегуляцію рНi, в тому числі Na+/H+ обмінники, лометрі за відомою методикою [Кошевой Ю.В., Акакалізовані в плазматичній мембрані, Na-залежний і тов B.C., Гробова ME. Микроспектрофлуориметр для измерения внутриклеточного рН (МИКрН). Na-незалежний НСО3-/Сl- обмінники, що забезпечують збільшення рН i цитозолю клітини, а також Приборы и оборудование для исследований в области физико-химической биологии и биотехнолоСl-/НСО3- обмінники, що забезпечують зниження гии. Пущино, 1990, с. 8-14]. рНi цитозолю, переносники комплексів іонів Na+ з Клітини при температурі 37°С забарвлювали монокарбоксилатами, протонні помпи Н+- ATF-ази протягом 5 хвилин 5,0мкМ FDA, який безпосередта інші [Ganz M.B. et al. Argininvasopression ньо перед забарвлюванням готували з 10,0мМ enhances рНi regulation in the presence of НСО3- by розчину в ацетоні шляхом розведення протягом 30 stimulating three acid-base transport systems. хвилин у фосфа тному буфері до 0,1мМ, або Nature, 1989, v. 337, p. 648-651]. 2,0мкМ 1,0мМ-ного розчину BCECF-AM в DMSO. У зв'язку з подібністю біохімічних механізмів Використовували дво хвильовий метод визнарізних типів клітин можна зробити висновок, що, чення рНi щодо інтенсивностей флуоресценції якщо якийсь агент змінює внутрішньоклітинний рНi клітин на двох довжинах хвиль [Акатов B.C. и др. у певному типі клітин, то, в зв'язку з подібністю Внутриклеточный рН и субстратная зависимость механізмів регуляції рНi, цей самий агент буде пролиферации фибропластов китайского хомячка. викликати зміну рН i і в інших типах клітин. ЗокреЦитология, 1991, 33 (7), с. 86-94]. Флуоресценцію ма, якщо сполуки згідно з винаходом викликають викликали світлом з l=490нм, емісію реєстрували зміну рНi фібропластів, то вони можуть впливати одночасно за допомогою двох фотопомножувачів на рНi макрофагів і нейтрофілів. на довжинах хвиль l=535нм, l=570нм. Визначали Відомо, що активація макрофагів пов'язана з значення К - відношення флуоресценції на двох продукуванням і екструзією протонів, з активацією систем транспортування протонів з клітини за додовжинах хвиль з відніманням фонової влуоресценції середовища безпосередньо біля досліджупомогою протонних помп, Nа+/Н+-обмінників, сисваних клітин, для 40-60 окремих клітин, яке потім тем транспортування бікарбонату [Rogachev В., усереднювали з визначенням похибки вимірюванHausmann M.J., Julzari R, Weiler H., Holmes C, Falct ня. Використовували термостатований столик, D., Chaimovitz C, Douvdevani A. Effect of bicarbonatbased dialysis solution on intracellular pH (рНi) and який дозволяє здійснювати вимірювання при температурі 37°С Враховували фотодинамічне поTNF-alpha production by peritoneal macrophages. шкодження забарвлених клітин при тривалому Perit. Dial. Int., 1997, Nov-Dec, 17 (6), p. 543-553; безперервному освітленні збуджувальним світлом. Bidani Α., Heming T.A Effect of concanavalin A on Показання знімали з ділянки препарату, експоноNa+-depended and Na+-independed mechanism for H+ extrusion in alveolar macrophages. Lung., 1998, ваного не більше 5 хвилин. Калібрування приладів 176 (1), p. 25-31; Swallow C.J., Grinstein S., Калібрувальні криві для визначення абсолютSudsbury R.A., Rotstein O.D. Relative roles of Na +/H+ них значень рНi за величиною К будували за меexchange and vacuolar-type Н+ ATPases in тодикою Томаса [Thomas J.A., Bushbaum R.N., regulating cytoplasmic pH and function in murine peritoneal macrophages J. Cell. Physiol, 1993, Zimniak Α., Racker Ε Intracellular рН measurements in Ehrlich ascites tumor cells utilizing spectroscopic 157(3), p. 453-460]. probe generated in situ. Biochemistry, 1979, v. 18, p. Наприклад, активізація механізмів підвищення 2210-2218], для чого забарвлені клітини, оброблерНi цитозолю клітини, наприклад Nа+/Н+ні протягом 5-10 хвилин карбоксикислотою нігериантипортера, необхідна для підвищення активності нейтрофілів, в тому числі їхньої мікробіоцидної цином (Calbiochem) в концентрації 5-10мкг/мл, поміщали в розчин з високим вмістом калію активності, оскільки зниження рНi цитозолю блокує (130мМ KСl, 1,0мМ MgCl2, 20,0мМ HEPES) і знафункціональну активність нейтрофілів. ченнями рН від 6,2 до 7,6. Виміряли значення К в 2.1. Вплив сполук згідно з винаходом на рНi середовищах з різним рН, вважаючи, що рНi клітин фібропластів. Був вивчений вплив сполук згідно з винаходом співпадає з рН середовища внаслідок дії нігерицину, який обмінює іони калію на протони і при висона внутрішньоклітинний рН i ембріональних фіброкому вмісті калію в середовищі врівноважує знапластів миші NIH-3T3, отриманих із Всеросійської чення рН середовища і клітин Для контролю колекції клітинних культур Інституту цитології РАН, стабільності показань приладу використовували Санкт-Петербург. Клітини вирощували в середовищі ДМЕМ (Sigma), яка містить 2,2г/л бікарбонату калібрувальні криві, побудовані за флуоресценції того самого середовища з додаванням 5,0мкМ натрію з додаванням 80,0мкг/мл гентаміцину і флуоресцеїну або BCECF. 10,0%-ної ембріональної телячої сироватки, при Коректність методики підтверджували в дослітемпературі 37°С в атмосфері, що містить 5,0% дах по вимірянню значень рН i клітин, оброблених діоксиду вуглецю. Для дослідів використовували 27 85390 28 протонофором моненсином, який підвищує рНi ченнях рН середовища приблизно 8,5 або більше клітин за рахунок обміну іонів натрію на протони, а в клітині спостерігається підйом рНi до оптимальтакож по встановленню залежності змін рН i від них значень і вище (рН, 6,9-7,1). зміни рН середовища. Величину рН середовища Відомо, що сироватка крові містить ростові (рН0) установлювали в середовищі ДМЕМ без сифактори, які здатні викликати підйом рН i. Щоб оціроватки, яке містило 5мМ HEPES і 15мМ бікарбонити стан і можливості приладу, а також для порінату, шля хом титрування НСl або КОН. Час інкувняння з дією препарату, оцінювали вплив сировабації клітин в середовищі із заданим значенням рН тки на величину рНi фібропластів у суспензії. Для становило не менше 10 хвилин, що є достатнім цього виміряли рН i перед доданням і через 20 часом для встановлення рівноваги рН i клітин з рН хвилин після додання 10% сироватки. Виявлено, середовища [Li J., Eastman A. Apoptosis in an що після додання сироватки рН i підвищувався на interleukin-2-depended cytotoxic T-l ymphocyte cell 0,15 одиниць. За сукупністю 11 дослідів величина line in associated with intracellular acidification. J. рНi фібропластів у суспензії із сироваткою станоBiol. Chem., 1995, v. 270, p. 3203-3211]. вила 6,94±0,01 (12 вимірювань), а без сироватки На графіку Фіг.1a представлені калібрувальні 6,85±0,01 (14 вимірювань). Вимірювання здійснюзалежності величини К - відношення інтенсивносвали с використанням FDA i BCECF-AM. тей флуоресценції при 530 і 570нм розчинів флуоЯк відомо, Nа+-iонофор моненсин викликає ресцеїну, які мають рН в діапазоні 6,4-7,5 (крива підсилене надходження в клітини Na+ і вихід про1), і клітин миші NIH 3T3, навантажених FDA і потонів, що веде до зростання рН i. Наприклад, в кліміщених у розчини, що містять KСl, нігерицин і тинах мишей NSO і NIH 3T3 введення 1-5мкМ мозабеферені HEPES в діапазоні рН 6,5-7,5 (крива ненсину протягом 15-20 хвилин викликає 2). Як видно з графіків, калібрувальні залежності підвищення рН, на 0,2 одиниць [Соловьева М.Е., для клітин NIH 3T3 зсунуті вправо на 0,1 одиниць Акатов B.C., Ле щенко В.В., Кудрявцев В.А. Ме харН відносно калібрувальних кривих розчинів флунизм гибели клеток миеломы NS/o в культуре. Изоресцеїну. По мірі вимірювання впливу сполук вестия РАН, 1998, с. 194-189], що добре узгоджузгідно з винаходом на рН i контролювали сталість ється з даними літератури [Zhu W.-H., Loh T.-T. калібрування приладу по розчинах флуоресцеїну, Effects of Nа+/Н+ antiport and intracellular pH in the а перерахування значень К в рН i для клітин, наваregulation of HL-60 cell apoptosis. Biochem. Biophys. нтажених FDA, здійснювали по кривій 2. Протягом Acta, 1995, v. 1269, p. 122-128]. При перевірці цьоодного дня калібрування зберігалося з точністю го результату помітили, що додання в середовище ±0,05 одиниць рН, а протягом місяця роботи - з з сироваткою 10мкМ моненсину викликає зростанточністю ±0,1 одиниць рН. ня рНi на 0,12 одиниць. На графіку Фіг.16 показане калібрування для Отримані результати про вплив сироватки і клітин, навантажених барвником BCECF-AM, помоненсину на рНi показують достовірність покаміщених в розчин з KCl, нагерицином і буфером зань приладу і служать орієнтиром для порівняння HEPES (рН 6,5-7,5). Цю калібрувальну залежність ефектів, що їх викликають сполуки згідно з винавикористовували для визначення рН, в клітинах, ходом. навантажених BCECF-AM. При цьому використо2.1.2. Дослідження впливу сполук згідно з вивували різні барвники, оскільки відомо, що при находом на рНi фібропластів. забарвленні FDA може показувати значення рН не На діаграмі Фіг.3 представлені результати дотільки цитозолю, але й мітохондрій, тоді як сліджень зміни DрНi фібропластів ΝΙΗ3Τ3 в ростоBCECF-AM є індикатором рН, головним чином, вому середовищі DME, що містить 10,0% сироватцитозолю. ки крові (область 1), через 20 хвилин після 2.1.1. Оцінка залежності рНi фібропластів від додання в це середовище сполуки зі сполук 7, 15, рН позаклітинного середовища. 18, 23, 35, 36 в різних концентраціях: 0,02мкг/мл Для оцінки можливого впливу сполук згідно з (область 3), 0,2мкг/мл (область 4), 2,0мкг/мл (обвинаходом на підвищення рН i клітини за рахунок ласть 5), 20,0мкг/мл (область 6), зліва направо, підвищення рН середовища вивчали залежність відповідно, величини DрНi при введенні в середорНi фібропластів від рН середовища. вище сполук 7, 15, 18, 23, 35, 36 і, для порівняння, Клітини забарвлювали барвником BCECF-AM і при введенні в середовище 10мкМ моненсину (обвиміряли рН i після 10 хвилин інкубації в середоласть 2). вищі з відповідним значенням рН. Установлено, що сполуки згідно з винаходом в На графіку Фіг.2 показана залежність рНi фібконцентрації 0,02мкг/мл не викликали підвищення ропластів мишей ΝIΗ 3T3 від рН середовища. РерНi. При концентрації сполук 20,0мкг/мл зростання зультати досліджень показали, що в оптимальноскладало в середньому 0,05 одиниць рН, але дому для клітинних процесів фізіологічному діапазоні стовірно не відрізнялося від нуля через великий рН середовища від 6,9-7,0 до 7,4-7,5 рНi підтримурозкид результатів. При концентрації 0,2 і ється на постійному рівні. По мірі зменшення рН 2,0мкг/мл сполуки викликали достовірне збільшенсередовища нижче 6,9 рНi падає, і при цьому кліня рНi цитозолю клітини в середньому на 0,10 і тини не здатні підтримувати рівень рН i в оптима0,12 одиниць рН, відповідно, аналогічне підвищенльному фізіологічному діапазоні. ню, яке спостерігали при додаванні сироватки або Також було встановлено, що при рН середомоненсину. вища ви ще оптимального фізіологічного даіпазону На діаграмі Фіг.4 показані результати дослівеличина рНi не зростає, а падає, що можна поясджень зміни рНi клітин через 20 хвилин після донити включенням якихось адаптаційних механізмів дання таких самих сполук в концентраціях клітини. І тільки при сублетальних для клітин зна0,02мкг/мл (область 1 діаграми), 0,2мкг/мл (об 29 85390 30 ласть 2), 2,0мкг/мл (область 3), 20,0мкг/мл (обТаким чином, показано, що сполуки згідно з ласть 4), 200мкг/мл (область 5) і 1000мкг/мл (обвинаходом в концентраціях 0,2, 2,0, 20мкг/мл виласть 6), відповідно зліва направо, при введенні кликають підвищення рН i цитозолю фібропластів сполук 7, 15, 18, 23, 35, 36 в середовище DME без як у прикріпленому стані, так і в суспензії, незалесироватки крові при відсутності розчинних в сережно від наявності в середовищі ростових факторів довищі ростових факторів, цитокінів. В цих умовах і цитокінів сироватки крові. Величина підвищення досліджувані сполуки в концентрації 2,0 і рНi, викликана цими сполуками, порівнянна з ве20,0мкг/мл достовірно підвищували рН i в середличиною, яка спостерігається при дії ростових фаньому на 0,08 одиниць рН і не було виявлено докторів сироватки або іонофора моненсину - відостовірного впливу на рНi сполук згідно з винахомого агента підвищення рН цитоплазми. дом при концентрації 0,02, 0,2,200 і 1000мкг/мл. 3. Взаємодія сполук згідно з винаходом з адеНа діаграмі Фіг.5 показані результати дослінозинчутливими рецепторами. джень впливу введення в середовище сполук згідПри порівняльному аналізі хімічної структури но з винаходом в концентраціях 2,0мкг/мл (обсполук згідно з винаходом - похідних бенласть 2) і 20,0мкг/мл (область 3) на рНi зо[d]піридазиндіону, піридо[2,3-d]піридазиндіону, фібропластів у прикріпленому розпластаному стапіразино[2,3-d]піридазиндіону і піримідо[4,5ні в області 2 і 3 зліва направо зміна відповідно d]піридазиндіону - були зроблені припущення про для сполук 7, 15, 18, 23, 35, 36 і, для порівняння, циклічний ізостеризм цих сполук та інших похідних вплив уведення 10,0мкМ моненсину (область 1). пуринової системи - аденіну, гуаніну, гіпоксантину. Це дослідження виконали тому, що в умовах in Аналіз їхньої стр уктури дозволяє зробити висновок vi vo фібропласти зазвичай прикріплюються і розпро те, що всі перелічені похідні є конденсованими пластуються на елементах тканинного матриксу. гетероциклічними сполуками, що мають схожий Виявилось, що в цьому випадку досліджувані спорозподіл електронної густини. Моделі Стюарталуки в концентрації 2,0 і 20,0мкг/мл також виклиБріглеба та описані вище реакції рибозилування кають достовірне підвищення рН i в середньому на сполук згідно з винаходом переконливо доводять, 0,10 і 0,07 одиниць рН, аналогічне підвищенню, що b-d-рибофуранозний фрагмент може приєднуяке спостерігається під впливом моненсину. ватись до атома азоту піридазиндіонового фрагВисновки менту будь-якого з перелічених гетероциклів. Отримані результати показують, що в середоОтримані дані дозволили припустити, що сполуки вищі з сироваткою крові, у присутності ростових згідно з винаходом можуть мати і схожу з похіднифакторів і цитокінів, сполуки 7, 15, 18, 23, 35, 36 ми пуринової системи біологічну активність, зокзгідно з винаходом викликають достовірне підвирема мати ізотропність до аденозинчутливи х рещення рНi цитозолю ембріональних фібропластів цепторів, а відмінності, що є в структурі і розподілі мишей лінії ΝlΗ 3T3: в концентраціях 0,2мкг/мл - в p-електронної хмари молекул, дозволяють припуссередньому на 0,1 одиниць рН, а в концентраціях кати наявність додаткової біологічної активності, 2,0мкг/мл - в середньому на 0,12 одиниць рН, і не якої не мають похідні пуринової системи - аденін, ініціюють зміни рНi при концентрації 0,02 і гуанін, гіпоксантин. 20,0мкг/мл. Величина зростання рНi, викликана 3.1. Взаємодія сполук згідно з винаходом з введенням сполук згідно з винаходом, порівнянна аденозинчутливими рецепторами тромбоцитів. з тією, що спостерігається при дії ростових фактоОдним з прикладів, що підтверджують вірогідрів сироватки крові або іонофора моненсину - віну подібність структури сполук згідно з винаходом домого агента, що викликає збільшення рН i цитодо структури аденозину, є зменшення агрегації золю. тромбоцитів. В середовищі без сироватки крові сполуки згіВ даний час як засоби, що пригнічують агрегадно з винаходом в концентрації 2,0мкг/мл і в концію тромбоцитів і поліпшують мікроциркуляцію, центрації 20,0мкг/мл достовірно підвищували рН i відома незначна кількість лікарських препаратів, фібропластів миші лінії NIH 3T3 в середньому на наприклад ацетилсаліцилова кислота, дипірида0,08 одиниць рН і не було виявлено достовірного мол, індобуфен, пентоксифілін, клопідогрел і тиквпливу на рНi сполук згідно з винаходом в конценлопідин. При цьому ефективність їх не у всіх випатраціях 0,02, 0,20, 200 і 1000мкг/мл. дках буває достатньо високою, а використання їх Сполуки згідно з винаходом в концентрації супроводжується побічними проявами через їхню 2,0мкг/мл і в концентрації 20,0мкг/мл достовірно ульцерогенність, гепатотоксичність, алергізувальні індукували збільшення рН i цитозолю прикріплених властивості та інші небажані ефекти. до позаклітинного матриксу фібропластів миші Були проведені дослідження впливу сполук лінії NIH 3T3 в середньому на 0,08 одиниць рН. згідно з винаходом на агрегацію тромбоцитів, індуВсі сполуки згідно з винаходом в концентрації ковану попереднім введенням розчину індуктора принаймні до 2,0мкг/мл не викликали зміни рН агрегації, при конкуруючому введенні сполук згідно середовища з сироваткою крові, і їхній вплив на з винаходом. рНi фібропластів не пов'язаний зі зміненням ними Агрегація тромбоцитів вивчалася методом БорН середовища. рна, в основі якого лежить визначення змін оптичДодавання сполук згідно з винаходом в конценої густини плазми, збагаченої тромбоцитами, нтрації до 2,0мкг/мл в середовище з 10,0% сиропісля її інкубації з індуктором агрегації. ватки при початковому рН середовища 7,2±0,1 не Як індуктор агрегації була вибрана аденозинвикликало підвищення рН середовища при вимідифосфорна кислота (ADP), визнана ендогенним рюванні з точністю до 0,03 одиниць рН. фактором агрегації. Використовували зразок (ре 31 85390 32 єстраційний номер 885) фірми Sigma Diagnostics (США). Кювету, к уди вносили 490мкл плазми, ба(USA) в кінцевій концентрації 10-5М. гатої на тромбоцити, поміщали в прилад, опускали ADP, вивільняючись з тромбоцитів на початв неї магнітну мішалку, покриту те флоном. Реєсткових етапах клітинного гемостазу, ініціює утворували показник максимальної амплітуди агрегації рення необоротного конгломерату кров'яних пласМА, виражений у відсотках падіння оптичної густитинок і є одним з інтеграторів різних шляхів ни плазми під впливом індуктора агрегації. Показзбільшення кількості тромбоцитарних агрегатів ник МА, який є контролем, порівнювали з МА плафосфоінозитольний шлях, вивільнення кальцію, зми, інкубованої протягом 3 хвилин з різними циклічних мононуклеотидів, активація кальмодуліконцентраціями сполук: від 10-3 до 10-7М у досліну, та інших шля хів. дах in vitro, або плазми, отриманої через 15, 30, 60 Експерименти здійснювали на кроликахі 120 хвилин після внутрішньовенного введення самцях породи "Шиншила" масою 2,7±0,3кг. Наперізних доз сполук у дослідах in vi vo редодні, за 18-24 години до експерименту, їх поПроцес агрегації тромбоцитів реєстрували за збавляли корму, зберігаючи вільний доступ до допомогою комп'ютера, при цьому на екрані моніводи. тора були представлені криві, що відображали Для отримання плазми, збагаченої тромбоцизміни оптичної густини багатої на тромбоцити платами, з надрізу крайової вени вуха кролика забизми, яку приймали за еталон 100% порівняно з рали кров, стабілізували її 3,8%-ним розчином оптичною густиною безтромбоцитарної плазми, цитрату натрію у співвідношенні 9:1 і центрифугуприйнятої за 0% вмісту тромбоцитів вали при 200г (1000об/хвил) протягом 10 хвилин 3.1.1. Дослідження in vitro. Верхній надосадовий шар, збагачений тромбоциВ умовах in vitro в кювету із збагаченою тромтами, переносили автоматичною піпеткою в силібоцитами плазмою крові спочатку вводили індукконову пробірку і зберігали при 37°С. Плазма, батор агрегації ADP в концентрації 10-5М, інкубували протягом 3 хвилин, потім додавали безпосередньо гата на тромбоцити, містила в середньому 3´108 в кювету сполуки згідно з винаходом їхню дію на кров'яних пластинок в 1,0л. Якщо ця кількість була агрегацію тромбоцитів вивчали після 3-хвилинного більше зазначених 3´108 кров'яних пластинок віл, інкубування при широкому діапазоні концентрацій дану пробу розводили до потрібної концентрації від 10-3 до 10-7М, аж до мінімальної концентрації плазмою, позбавленою тромбоцитів, яку отриму10-7Μ, яка не викликає ефекту пригнічення агрегавали центрифугуванням крові при 650г протягом ції. Результати досліджень наведені в табл. 3. 10 хвилин. Заміри оптичної густини зразків проводили на двоканальному агрегометрі фірми "Chrono-log" Таблиця 3 Вплив сполук згідно з винаходом на ADF-індуковану агрегацію тромбоцитів кроликів в умовах in vitro Сполука 2 4 6 9 10 15 21 25 28 31 36 37 ΜΑ - падіння оптичної густини плазми, % до еталона, при концентрації сполук 10-3М 10-4М 10-5М Контр. Дослід Конт. Дослід Контр. Дослід 60,8±3,4 51,4±2,7* 60,0±2,1 50,4±1,7* 52,5±2,1 48,2±1,0* -"49,2±2,3* -"50,2±2,0* -"46,2±3,1* -"5,00±1,9* -"53,3±2,2* -"47,4±2,0* -"47,3±2,0* -"53,1±1,8* -"41,4±3,4* -"46,2±2,7* -"48,7±2,4* -"40,2±4,0* -"44,8±2,8* -"46,3±1,7* -"39,8±3,1* -"47,1±3,0* -"49,2±2,1* -"41,8±2,4* -"48,2±2,9* -"48,6±2,0* -"43,4±3,2* -"49,7±2,2* -"48,9±2,4* -"44,2±2,7* -"44,9±2,3* -"46,7±2,2* -"39,9±2,1* -"45,8±2,3* -"46,9±2,4* -"40,1±2,0* -"46,9±2,7* -"47,1±2,0* -"40,6±1,7* Продовження таблиці 3 Сполука 2 4 6 9 10 15 ΜΑ - падіння оптичної густини плазми, % до еталона, при концентрації сполук 10-6М 10-7М Контр. Дослід Конт. Дослід 52,8±1,8 50,1±2,0 51,5±2,1 50,8±2,2 -"50,6±3,1 -"49,9±3,4 -"51,2±3,2 -"50,7±3,2 -"49,4±3,2 -"51,2±1,7 -"48,4±2,4 -"49,8±2,0 -"47,3±1,8* -"49,3±1,4 33 1 21 25 28 31 36 37 85390 2 -"-"-"-"-"-" 3 49,6±1,7 50,3±2,1 50,9±2,7 47,5±1,7* 49,3±2,6 48,1±2,9 34 Продовження таблиці 3 4 -"-"-"-"-"-" 5 49,7±2,1 50,1±3,0 50,4±3,0 49,5±1,2 49,7±1,8 50,1±1,0 Примітка: * достовірно при p£0,05 З даних табл. 3 видно, що на моделі ADPіндукованої агрегації тромбоцитів уведення сполук згідно з винаходом в концентрації 10-3Μ викликає падіння оптичної густини плазми в діапазоні від 5,4% до 36,5% порівняно з контролем. При введенні сполук в концентрації 10-4Μ ефект становить від 4,0% до 29,2%. При введенні в плазму, збагачену тромбоцитами, сполук згідно з винаходом в концентрації 10-5Μ також помітили пригнічення агрегаційної функції кров'яних пластинок, падіння оптичної густини становило від 2,3% до 34,1% порівняно з контролем. Таким чином, в діапазоні концентрацій 10-3Μ, 10-4Μ, 10-5Μ досліджувані сполуки згідно з винаходом виявляли приблизно однаковий ступінь придушення агрегації. Більш низька концентрація сполук 10-6Μ знижувала агрегацію вже в значно меншому діапазоні - від 3,3% до 17,2%. В концентрації 10-7Μ дія сполук припинялася. Отримані in vitro дані свдчать про високу антиагрегаційну здатність сполук згідно з винаходом в діапазоні концентрацій від 10-3Μ до 10-5М. 3.1.2. Дослідження in vivo. Була досліджена антиагрегаційна здатність сполук 2, 15, 21, 37 згідно з винаходом в дослідах in vivo. Тваринам вводили внутрішньовенно індуктор агрегації ADP в концентрації 10-5Μ і потім сполуки згідно з винаходом. В експерименті були ви користані дози сполук в діапазоні від 15 до 60мг/кг. Ці дози були вибрані з урахуванням найбільш ефективних концентрацій від 10-3Μ до 10-5М, отриманих в дослідах in vitro, і обумовлені морфофункціональними особливостями організму кролика, такими як швидкість біотрансформації ліків, співвідношення розмірів печінки і всього організму, інтенсивність фільтрацйної здатності нирок та іншими. Для нівелювання відмінностей сили дії сполук в різні дні, можливо, обумовлених змінами температури оточуючого середовища, вологості та інших параметрів, щоденно брали в експеримент по 2 тварини кожної серії. Під серією розуміють групу з 6 тварин, на яких вивчається одна з доз речовини. Кров для отримання плазми, багатої на тромбоцити, брали з крайової вени вуха: в контрольній групі - безпосередньо перед уведенням досліджуваних сполук, в досліджуваних групах - через 15 хвилин після введення досліджуваних сполук і потім через 30, 60, 120 хвилин і так далі, аж до того моменту, коли ефект придушення агрегації зникав. До експерименту і в кінці його в кожному зразку плазми підраховували кількість тромбоцитів. Результати досліджень наведені в табл. 4. Таблиця 4 Вплив сполук згідно з винаходом на ADP-індуковану агрегацію тромбоцитів кроликів (МА - падіння оптичної густини, % до еталона) МА, % контроль Сполука Доза, мг/кг 50,1±1,7 -"-"-"61,0±1,3 -"-"-"48,6±1,3 -"-"-" 2 15 21 37 2 15 21 37 2 15 21 37 15,0 30,0 60,0 МА, % через 15хв. 44,2±2,0* 42,8±1,8* 43,5±1,7* 42,9±1,6* 45,3±2,0* 43,2±2,2* 46,7±1,9* 43,5±2,0* 45,2±1,2* 43,1±1,5* 45,1±0,9* 43,4±1,8* МА, % через 30хв. 42,2±1,6* 41,8±1,5* 43,3±1,7* 41,9±1,6* 43,7±1,7* 41,8±1,9* 45,4±1,8* 42,0±1,4* 43,6±2,0* 41,3±1,5* 43,2±2,0* 42,4±0,7* МА, % через 60хв. 46,9±1,7* 45,6±1,5* 46,7±1,5* 45,9±1,6 40,1±2,2* 37,8±1,8* 45,0±1,9 41,6±1,4* 47,8±1,5 44,7±0,8 47,3±1,6 46,2±2,0 МА, % через 120хв. 49,2±2,0 48,3±2,3* 49,1±1,7 48,7±2,1 59,7±2,2 58,1±1,7 60,3±2,1 58,4±1,7 48,0±1,2 47,2±1,6 48,3±1,5 47,3±1,7 Примітка: * достовірне) при p£0,05 З даних табл. 4 видно, що сполуки 2, 15, 21, 37 згідно з винаходом в дозі 30мг/кг уже через 15 хвилин після введення придушували агрегацію тромбоцитів: зменшення значень падіння оптичної 35 85390 36 густини МА склало від 17,5% до 34,9% порівняно з залежить від температури, що, згідно з відомими контролем. Цей ефект зберігався на досягнутому даними, відповідає умовам рецепторного зв'язурівні ще 15 хвилин, а потім дещо підсилювався до вання. 60 хвилини від початку досліду. Відновлення почаНа другій стадії дослідів відмиті еритроцити інткового значення МА реєстр ували наприкінці спокубували при температурі 37°С з розчинами спостерігання після закінчення 120 хвилин. лук згідно з винаходом в концентрації від 10-11 до При збільшенні дози до 60мг/кг відмічали ана10-8Μ протягом 5-30 хвилин, потім відмивали фізілогічну картину, хоча здатність тромбоцитів до ологічним розчином двократним центрифугувансклеювання (МА) знижувалась до діапазону 1,7ням на холоді, в отриману суспензію додавали 17,5% порівняно з контролем. Ефект зниження розчин аденозину в концентрації 10-6-10-4Μ та інагрегації через 30 хвилин досліду зберігався в кубували протягом 15 хвилин, потім відмивали діапазоні 3,5-20,1% і зникав приблизно на 120 фізіологічним розчином двократним центрифугухвилині спостерігання. ванням на холоді. Отриману суспензію еритроциДоза 15мг/кг зменшувала ефект дії індуктора тів зі зв'язаними з ними сполуками згідно з винаагрегації в діапазоні від 6,8% до 23% в перші 30 ходом поміщали в децинормальний розчин NaOH хвилин експерименту. Ефект зниження агрегації з додаванням перекису водню в кінцевій концентзникав приблизно на 120 хвилині досліду. рації 10-7М. Проводили вимірювання інтенсивності Висновки хемілюмінесценції. Результати дослідів представРезультати проведених досліджень свідчать лені на Фіг.7а і 7б. про те, що сполуки згідно з винаходом при внутріНа діаграмі Фіг.7а показана величина інтенсишньовенному введенні в дозах 15, 30, 60мг/кг мавності хемілюмінесценції ІН протягом 3 хвилин в ють виражений антиагрегаційний ефект, триваконтролі (область 0) і після інкубування еритроцилість якого становить приблизно 2 години. тів зі сполуками 2, 15, 21, 37 згідно з винаходом 3.2. Взаємодія сполук згідно з винаходом з (на діаграмі відповідно в областях зліва направо) аденозинчутливими рецепторами еритроцитів. при 37°С при концентрації сполук від 10-11Μ до 108 Були проведені дослідження взаємодії сполук Μ. 2, 15, 21, 37 згідно з винаходом з аденозинчутлиНа діаграмі Фіг.7б показана величина інтенсивими рецепторами еритроцитів мишей лінії вності хемілюмінесценції Ін протягом 3 хвилин BALB/c, самок віком 8-12 місяців. після інкубування еритроцитів зі сполуками 2, 15, Була визначена залежність інтенсивності хе21, 37 (зліва направо в областях) при температурі мілюмінесценції сполук згідно з винаходом в луж 37°С (область 0) і з додаванням аденозину в конному середовищі - децинормальному розчині центрації 10-6М, 10-5 М і 10-4 М. NaOH у присутності перекису водню, який є ініціаЯк видно з отриманих даних, аденозин в контором процесу хемілюмінесценції. Хемілюмінесцентраціях 10-6-10-4Μ знижує зв'язування сполук центні дослідження проводили на хемілюмінометрі згідно з винаходом з еритроцитами у 1,5 раза, що "ЛКБ". може бути результатом конкурентного зв'язування Еритроцити периферичної крові мишей спочаз рецепторами одного виду. тку тричі відмивали фізіологічним розчином при Висновки центрифугуванні і потім розводили у розчині ХенкТаким чином, було показано, що сполуки згідса без глюкози 10 об'ємами дистильованої води і но з винаходом виявляють ізотропність до аденовикористовували в досліді негайно. зинових рецепторів, які знаходяться як на тромбоНа першій стадії дослідів відмиті еритроцити цитах, так і на еритроцитах. інкубували при температурі 37°С або при 4°С з 3.3. Взаємодія сполук згідно з винаходом з ядрозчинами сполук згідно з винаходом в концентровмісними клітинами. рації від 10-7Μ до 10-5 Μ протягом 5-30 хвилин, поБули досліджені особливості взаємодії сполук тім відмивали фізіологічним розчином двократним згідно з винаходом з ядровмісними клітинами на центрифугуванням на холоді. Отриману суспензію прикладі клітин селезінки мишей лінії BALB/c віком еритроцитів зі зв'язаними з ними сполуками згідно 8-12 місяців. з винаходом поміщали в децинормальний розчин Клітини селезінки очищали центрифугуванням NaOH з додаванням перекису водню в кінцевій в градієнті густини фіколу, відмивали центрифугуконцентрації 10-7Μ. Проводили вимірювання інтенванням і суспендували в розчині Хенкса. Потім сивності хемілюмінесценції. Контролем служила клітини селезінки інкубували зі сполуками 6, 15, суспензія еритроцитів без введення сполук згідно з 25, 37 в кінцевій концентрації 10-5Μ протягом 30 винаходом. хвилин при температурі 37°С або 4°С, потім двічі Результати дослідів представлені на діаграмі відмивали центрифугуванням на холоді. Після Фіг.6, де показані величини інтенсивності хемілюцього проводили хемілюмінесцентні дослідження мінесценції ІН протягом 3 хвилин суспензії еритрона хемілюмінометрі "ЛКБ" аналогічно описаним цитів в контролі (лінії "к") при температурі інкубувище. вання 37°С (безперервні лінії на діаграмі) і 4°С Отримані результати представлені на діаграмі (пунктирні лінії на діаграмі) і те саме в дослідах Фіг.8, де в області 1 показана інтенсивність хеміпісля інкубування з досліджуваними сполуками люмінесценції ІН клітин селезінки, інкубованих при (зліва направо для сполук 2, 15, 21, 37) при 37°С температурі 37°С без досліджуваних сполук (конт(безперервні лінії) і при 4°С (пунктирні лінії) в конроль, значення перше зліва) і клітин селезінки, центрації Ki від 10-7Μ, 10-6 Μ і 10-5 Μ. Результати інкубованих зі сполуками згідно з винаходом (зліва показують, що зв'язування сполук згідно з винахонаправо, починаючи з другого значення, відповіддом з еритроцитами периферичної крові мишей не но для сполук 6, 15, 25 і 37), а в області 2 показана 37 85390 38 інтенсивність хемілюмінесценції для аналогічних Були проведені дослідження сполук згідно з груп клітин і в аналогічному порядку, інкубованих винаходом за їх впливом на фактори плазми крові, при 4°С. зокрема на стан плазмового гемостазу. З діаграми Фіг.8 можна зробити висновок, що в Дослідження були проведені на 72 кроликах ядровмісних клітинах селезінки після введення породи "Шиншила" масою 2,5±0,3кг, яким внутрішсполук згідно з винаходом при температурі 37°С ньовенно були введені розчини сполук 2, 15, 21, рівень світіння значно вищий, ніж при 4°С, що сві37 згідно винаходу в дозах 15, 30 і 60мг/кг. В додчить про проникнення цих сполук крізь клітинну слідах були використані тромбін-тест (серія мембрану в цитозоль клітини і зв'язування їх з №7300) і коагуло-тест (серія №5000), придбані на аденозинчутливими рецепторами, що знаходяться НПО "Ренам", тромбопластин (серія №240600) і всередині клітини. хлорид кальцію, придбані на НПО "Медіолаб". Висновок Статичні параметри зсідання крові і плазми Результати проведених досліджень дозволячастковий активований тромбопластиновий час, ють зробити висновок про те, що сполуки згідно з тромбіновий час, максимальна згідна активність винаходом є біологічними ізостерами похідних (тест автокоагуляції) - визначали на коагулометрі пуринової системи, зокрема аденозину. Маючи Behnk Electronic (Німеччина). Принцип роботи даподібну до аденіну реакційну здатність приєднуваного приладу оснований на тому, що зсідок, що утворився, розмикає контакт лічильника імпульсів ти b-D-рибофуранозний фрагмент і аналогічну в ланцюгу кювету - шифт, останній постійно колиаденозину хімічну структур у, сполуки згідно з вивається у вертикальній площині. Момент утвореннаходом здатні взаємодіяти з аденозинчутливими ня зсідка реєструють зупинкою стрілки секундомерецепторами, що знаходяться на мембранах нера. ядерних клітин, а також проникати крізь клітинні мембрани ядровмісних клітин. Ці властивості споВимірювання здійснювали при постійній температурі 37°С, яку підтримували блоком термосталук згідно з винаходом обумовлюють можливість тування. їхнього впливу на аденозинзалежні ферменти з 4.1. Вплив на частковий активований тромбовиконанням функцій, притаманних, наприклад, пластиновий час (АЧТЧ). нікотинамідним коферментам - нікотинамідаденіндинуклеотиду NAD+ та його фосфорилованим АЧТЧ є стандартизованою коагуляційною пробою, чутливою до дефіциту всі х плазмових фактопохідним NADPh+ або флавінзалежним коферменрів (крім VII), відображає стан початкового етапу там FAD+, які є важливими біологічними переносвнутрішнього механізму коагуляції і показує наявниками атомів водню. ність в крові речовин, що мають антикоагулянтні 4. Вплив сполук згідно з винаходом на гемостаз. властивості, наприклад як у гепарину. Піддослідним тваринам (описані вище) внутВідомо, що нормально функціонуюча система рішньовенно вводили сполуки 2, 15, 21, 37 згідно з гемостазу повинна забезпечувати збереженість винаходом в концентрації 15, 30 і 60мг/кг і потім рідкого стану крові в межах судин, що забезпечувідбирали кров через 15, 30, 60 і 120 хвилин після ється могутньою протизсідною системою крові, та швидке тромбування пошкоджених ділянок для введення. Зразки плазми крові, позбавленої тромбоцитів, запобігання крововтраті та крововиливу в тканини, отримані, як описано вище, в кількості 0,1мл внощо забезпечується системою зсідання крові, в сили в кювету коагулометра і прогрівали протягом утворенні та формуванні яких бере участь ряд 1 хвилини при 37°С, потім додавали 0,1мл 0,277%факторів плазми крові, тромбоцитів і тканин. Вважається, що в організмі існують специфічні ного розчину хлориду кальцію і реєстрували час зсідання крові. Порівнювали час зсідання Т, в сеінгібітори для кожного фактора зсідання крові. кундах, контрольної плазми і плазми, отриманої Зниження активності цих інгібіторів підвищує зсіпісля внутрішньовенного введення через 15, 30, 60 лість крові і сприяє утворенню тромбів. Підвищені 120 хвилин. Результати вимірювань наведені в ня активності цих інгібіторів утруднює зсілість крові і може супроводжуватись розвитком геморагій. табл. 5. Таблиця 5 Вплив сполук згідно з винаходом на показники АЧТЧ кроликів при внутрішньовенному введенні Τ, сек. контроль 37,0±0,2 -"-"-"33,3±0,8 -"-"-" Сполука Доза, мг/кг 2 15 21 37 2 15 21 37 15,0 -"-"-"30,0 -"-"-" Τ, сек. через 15хв. 37,0±0,1 37,0±0,1 37,1±0,1 37,0±0,2 32,7±0,5 32,9±0,8 32,8±0,4 33,1±0,1 Т, сек. через 30хв. 37,0±0,2 37,0±0,2 37,2±0,1 37,1±0,1 32,0±0,1 32,1±0,1 32,0±0,1 33,3±0,1 Т, сек. через 60хв. 36,9±0,1 36,9±0,1 36,9±0,1 37,0±0,2 32,2±0,1 32,0±0,2 32,2±0,1 33,3±0,2 Т, сек. через 120хв 37,0±0,3 37,0±0,3 37,0±0,2 36,9±0,1 32,1±0,2 32,0±0,1 32,1±0,1 33,0±0,4 39 85390 40 Продовження таблиці 5 1 32,5±0,3 -"-"-" 2 2 15 21 37 3 60,0 -"-"-" 4 32,3±0,2 32,2±0,1 32,0±0,4 32,5±0,1 З даних табл. 5 видно, що в проведених дослідженнях сполуки 2, 15, 21, 37 згідно з винаходом в дозах 15,0, 30,0, 60,0мг/кг не приводять до зміни АЧТЧ. 4.2. Вплив на протромбіновий час. "Протромбіновий час" є одним з найважливіших показників стану гемостазу, який постійно використовується в експериментальній та клінічній медицині. Метод його визначення оснований на оцінці зсідання цитратної або оксалатної плазми крові при змішуванні її з тромбопластином і розчином хлориду кальцію. Оскільки в цих умовах час утворення зсідка залежить від вмісту II, VII, IX, X факторів в досліджуваному зразку плазми, в даний час тест називається "тромбопластиновий час за Кві 5 32,4±0,1 32,2±0,1 32,1±0,2 32,3±0,2 6 32,3±0,1 32,1±0,2 32,0±0,1 32,4±0,1 7 32,4±0,1 32,2±0,1 32,3±0,2 32,6±0,3 ком" або "активність тромбопластинового комплексу". Піддослідним тваринам (описані вище) внутрішньовенно вводили сполуки 2, 15, 21, 37 згідно з винаходом в концентрації 15, 30 і 60мг/кг і потім відбирали кров через 15, 30, 60 і 120 хвилин після введення. Цитратну кров, яка містить 1 частину цитрату на 9 частин нативної крові, центрифугували при 3000об/хв. протягом 10 хвилин для отримання плазми, позбавленої тромбоцитів. У пробірку, що знаходилася у водяній бані, вводили 0,1мл плазми і 0,1мл розчину тромбопластину. Через 60 секунд додавали 0,1мл 0,277%ного розчину хлориду кальцію і фіксували час реакції Т1 в секунда х. Рез ультати досліджень наведені в табл. 6. Таблиця 6 Вплив сполук згідно з винаходом на показники протромбінового часу кроликів при внутрішньовенному введенні Т1, сек. контроль 11,8±0,1 -"-"-"11,2±0,1 -"-"-"12,0±0,1 -"-"-" Сполука Доза, мг/кг 2 15 21 37 2 15 21 37 2 15 21 37 15,0 -"-"-"30,0 -"-"-"60,0 -"-"-" Т1, сек. через 15хв. 11,7±0,2 11,5±0,2 11,4±0,2 11,6±0,2 11,1±0,2 11,0±0,2 11,2±0,1 11,3±0,1 12,0±0,1 12,0±0,1 12,0±0,2 12,1±0,1 З даних табл. 6 видно, що в проведених дослідженнях сполуки 2, 15, 21, 37 згідно з винаходом в дозах 15,0, 30,0, 60,0мг/кг не впливають на показник протромбінового часу. 4.3. Вплив на показники автокоагуляційного тесту. Даний параметр відображає динаміку наростання, а потім інактивації тромбопластинтромбінової активності досліджуваної крові. Піддослідним тваринам (описані вище) внутрішньовенно вводили сполуки 2, 15, 21, 37 згідно з винаходом в концентрації 15, 30 і 60мг/кг і потім відбирали кров через 15, 30, 60 і 120 хвилин після введення. Т1, сек. через 30хв. 11,5±0,2 11,7±0,2 11,5±0,1 11,6±0,1 11,0±0,1 11,2±0,2 11,2±0,1 11,2±0,2 11,9±0,2 12,0±0,1 11,8±0,1 12,0±0,1 Т1, сек. через 60хв. 11,4±0,2 11,2±0,2 11,3±0,1 11,5±0,2 11,3±0,1 11,4±0,2 11,3±0,2 11,4±0,1 12,1±0,2 12,0±0,2 12,1±0,1 12,1±0,2 Т1, сек. через 120хв 11,7±0,1 11,5±0,2 11,5±0,2 11,8±0,1 11,2±0,2 11,3±0,2 11,2±0,2 11,1±0,1 11,9±0,1 12,0±0,1 12,0±0,2 12,0±0,1 В 0,2мл плазми, отриманої центрифугуванням цитратної крові при 1500об/хв. протягом 10 хвилин, вносили гліколізат-кальцієву суміш (2,0мл 0,222%-ного СаСl2+0,1мл досліджуваної цитратної крові) через 4, 6, 8, 10 хвилин з моменту приготування цієї суміші і визначали час зсідання у зразку. Отримані результати, в секундах, за допомогою спеціальної таблиці переводили у показники зсідної активності А, в %, які свідчать про стан як прокоагулянтної, так і антикоагулянтної ланок зсідної системи крові. Результати дослідів наведені в табл. 7. 41 85390 42 Таблиця 7 Вплив сполук згідно з винаходом на значення зсідної активності А за даними автокоагуляційного тесту кроликів при внутрішньовенному введенні А,% контроль Сполука Доза, мг/кг А, % через 15хв. А, % через 30хв. А, % через 60хв А, % через 120хв 85,6 2 15,0 80,2 100,0 87,4 98,0 -"15 -"82,3 103,0 89,0 101,2 -"21 -"81,4 101,3 86,5 97,4 -"37 -"82,1 102,8 88,7 100,6 70,0 2 30,0 98,4 71,2 104,2 70,9 -"15 -"100,3 68,4 106,6 70,6 -"21 -"97,2 69,1 103,7 71,0 -"37 -"99,8 68,3 105,8 70,4 65,9 2 60,0 72,3 60,8 62,5 65,7 -"15 -"74,4 63,2 64,4 66,5 -"21 -"71,9 62,1 63,7 66,2 -"37 -"74,3 63,0 64,2 66,3 З даних табл. 7 видно, що в проведених дослідженнях сполуки 2, 15, 21, 37 згідно з винаходом в дозах 15,0, 30,0, 60,0мг/кг не впливали на показник зсідної активності за автокоагуляційним тестом. 4.4. Вплив на тромбіновий час. "Тромбіновий час" характеризує швидкість пертворення фібриногену на фібрин. Його визначали вимірюванням часу зсідання позбавленої тромбоцитів плазми під впливом стандартизованого на контрольній плазмі тромбіну. До 0,2мл досліджуваної плазми крові піддослідних тварин, у яких кров забирали через 15, 30, 60 і 120 хвилин після введення внутрішньовенно сполук 2, 15, 21, 37 згідно з винаходом в дозах 15, 30 і 60мг/кг, інкубованої протягом 1 хвилини при температурі 37°С, додавали 0,2мл розчину тромбіну і на коагулометрі Behnk Electronics (Німеччина) реєстрували час утворення зсідка Т2 в секундах. Результати досліджень наведені в табл. 8. Таблиця 8 Вплив сполук згідно з винаходом на тромбіновий час плазми кроликів при внутрішньовенному введенні Т2, сек. контроль 15,8 -"-"-"14,7 -"-"-"15,2 -"-"-" Сполука Доза, мг/кг 2 15 21 37 2 15 21 37 2 15 21 37 15,0 -"-"-"30,0 -"-"-"60,0 -"-"-" Т2, сек. через 15хв. 16,2* 17,0* 16,4* 16,9* 17,8* 19,7* 17,9* 19,5* 16,0* 16,8* 16,2* 16,6* Т2, сек. через 30хв. 17,0* 18,5* 17,7* 18,2* 18,4* 20,5* 18,8* 20,3* 16,9* 18,0* 17,7* 17,8* Т2, сек. через 60хв. 16,0* 16,5* 16,1* 16,3* 19,2* 21,3* 19,0* 21,0* 15,9* 16,5* 16,3* 16,2* Т2, сек. через 120хв 15,3* 15,5* 15,7* 15,6* 15,3* 15,0* 15,6* 15,2* 15,3* 14,7* 15,7* 15,0* Примітка: * - достовірно порівняно з контролем, при p£0,05. З наведених в табл. 8 даних видно, що в дозі 15мг/кг введення сполук згідно з винаходом збільшувало тромбіновий час ближче до 15 хвилини спостерігання, цей ефект досягав максимуму на 30-ій хвилині, слабшав протягом наступної півгодини і повністю зникав на 120-ій хвилині. Аналогічні результати були отримані і при введенні сполук в дозі 60,0мг/кг. Вплив сполук на цей показник гемостазу дещо підсилювався тільки при дозі 30,0мг/кг: час зсідання крові поступово збільшувався протягом перших 25 хвилин досліду, сягав максимуму біля 60-ої хвилини, а потім нормалізувався на 120-ій хвилині експерименту. Висновки Отримані дані свідчать про те, що сполуки згідно з винаходом не мають патологічної дії на нормально функціонуючу систему гемостазу. 5. Вплив сполук згідно з винаходом на процеси продукування і зв'язування активних форм кисню. Становило великий інтерес вивчення впливу сполук згідно з винаходом на активність трьох найважливіших ферментів окисної системи організму каталази, пероксидази і супероксидисмутази. 43 85390 44 Ці ферменти доступні для визначення в крові люнокислотний склад ліпідних молекул в клітинній дини і тварин і відображають три різних рівні інакмембрані. тивації активних форм кисню - перекису водню, Відомо, що циклічні гідразиди ароматичних і супероксидних радикалів і проміжних форм їх обгетероциклічних ортодикарбонових кислот здатні міну взаємодіяти з активними формами кисню, зокрема Вільне окиснення протікає за участю вільносупероксид-аніонами, гідроксильними радикалами радикальних форм кисню, які утворюються в проі гідроперекисними радикалами НО2-·, що харакцесі одноелектронного відновлення кисню і, перш теризується явищем хемілюмінесценції зазначеза все, супероксид-аніон радикала кисню О2-. Цей них циклічних гідразидів [Brenton P.D. Mechanistic радикал може утворюватись і при зміні умов функAspect of Diazaquinone Chemiluminescence. Aust. J. ціонування дихального ланцюга, і під впливом Chem., 1984, v. 37, p. 1001-1008]. ультрафіолетових променів, а також при взаємодії Автори винаходу провели дослідження можкисню з іонами металів змінної валентності, частіливості сполук згідно з винаходом, які мають, як ше за все - із залізом Fe2+ і може продукуватися в було показано вище, здатність проникати крізь клітинах ферментами, такими, як ксантиноксидаза коітинну мембрану, зв'язувати надмірно продукоабо NADPhH-оксидаза. Він є високореакційною вані супероксид-аніони кисню. сполукою, яка внаслідок високої гідрофільності не 5.1. Вплив сполук згідно з винаходом на актиможе залишати клітину і накопичується в цитозолі вність SOD зв'язування супероксид-аніон радикаклітини. лів. Живі клітини мають системи захисту від підБули проведені дослідження впливу сполук вищеного продукування вільних радикалів. Ферзгідно з винаходом на активність зв'язування супемент супероксиддисмутаза SOD перетворює супероксид-аніонів кисню супероксиддисмутазою SOD. роксиданіон радикал кисню на менш Принцип методу оснований на конкуренції реакційноздатний і більш гідрофобний пероксид SOD або сполук згідно з винаходом з нітросинім водню Н 2О2. Пероксид водню є субстратом для тетразолієм (TTNB) за супероксид-аніони, що каталази і глутатіонзалежних пероксидаз, які катаутворюються при аеробній реакції NAD-Η і фенолізують його перетворення на молекули води. Позинметосульфату (FMS). Відомо, що у присутності силене генерування вільних радикалів супровоSOD відновлення TTNB знижується. У разі взаєджує патологічні стани, наприклад хвороба модії сполук згідно з винаходом із супероксидПаркінсона, хвороба Альцгеймера, а також процеаніон радикалами відновлення TTNB також буде си біологічного старіння. Однак повне придушення знижуватись [Nishikimi Μ., Rao N.A. and Yagi K. The процесу перекисних процесів у тканинах недоцільoccurrence of superoxide anion in the reaction of не, оскільки вільні радикали мають корисні власreduced phenasine methosulfate and molecular тивості. Вони індукують апоптоз, беруть участь у oxygen. Biochem. Biophys. Res. Commun., 1972, v. формуванні клітинного імунітету, регулюють жир46, p. 849-855]. Процес можна представити такою схемою: Інтенсивність генерації і перехоплення супероксид-аніон радикала реєстрували при 560нм за ступенем блокування супероксиддисмутазою або досліджуваними сполуками реакції відновлення TTNB. При цьому активність SOD або досліджуваних сполук згідно з винаходом оцінювали, приймаючи за одиницю активності 50%-не інгібування утворення TTNB відновленого. Активність SOD в залежності від впливу сполук згідно з винаходом виражали в одиницях за хвилину в перерахуванні на 1мг лізату еритроцитів. Еритроцити мишей лінії BALB/c, самок віком 3 місяці, відмивали при центрифугуванні та лізували 10 об'ємами дистильованої води. Гемолізат потім інкубували протягом 30 хвилин при 37°С зі сполуками 3, 15, 23, 37 згідно з винаходом в різних концентраціях, мкМ: 10,0; 50,0; 100,0, і виміряли активність SOD. Результати досліджень представ лени на графіках Фіг.9, де криві 1, 2, 3, 4 показують активність SOD Asod після інкубування, відповідно, зі сполуками 3, 15, 23, 37. З графіків Фіг.9 видно, що присутність сполук згідно з винаходом дозозалежно інгібує активність SOD, що пояснюється конкурентним зв'язуванням супероксид-аніон радикалів сполуками згідно з винаходом. 5.2. Вплив на продукування супероксид-аніон радикалів. Були проведені дослідження можливого впливу сполук 3, 15, 23, 37 згідно з винаходом в концентраціях 10, 50, 100мкМ на утворення супероксиданіон радикалів в реакції NAD-F + FMS + TTNB. Вплив оцінювали за зміною оптичної густини розчинів при утворенні TTNB відновленого. Використовували НСТ в кінцевій концентрації 0,7мМ, FMS - 33мкМ, NAD-Η - 70мкМ і досліджувані сполуки в різних концентраціях в розчині Хенкса. Реакційну масу інкубували 10 хвилин при температурі 37°С. Зміну світлопропускної здатності С реакційної суміші фіксували на спектрофотометрі при 560нм і оцінювали у відсотках відносно прийнятої за еталон світлопропускної здатності в моделі реакції NAD-F + FMS + TTNB з використанням за 45 85390 46 мість сполук згідно з винаходом SOD еритроцитів 10,0мкг/мл (на графіках не показано) спостеріга98% чистоти (рекомбінантна SOD людини). Реється аналогічна залежність. зультати іспитів представлені на графіках Фіг.10, Висновки де криві 1, 2,3, 4 показують вплив сполук відповідТаким чином, сполуки згідно з винаходом здійно 3, 15, 23, 37 на активність SOD. снюють виражений вплив на активність найважлиЗ графіків Фіг.10 видно, що досліджувані сповіших ферментів окисної системи організму - каталуки дозозалежно зв'язують супероксид-аніон ралази, пероксидази і супероксиддисмутази, при дикали, що утворюються. цьому вплив на кінетику ферментів має коливаль5.3. Вплив сполук згідно з винаходом на актиний характер з обмеженою амплітудою, що вказує вність каталази і пероксидази. на регулюючий характер дії сполук згідно з винаВ основі методів визначення активності катаходом і перевід ферментів в режим активної адаплази лежить кількісне визначення швидкості протації до нових умов. Крім того, визначена здатність цесу розкладу перекису водню, який є специфічсполук згідно з винаходом взаємодіяти з активниним субстратом для цього ферменту. Були ми формами кисню, які надмірно продукуються в проведені дослідження процесів конкурентної взаклітині. ємодії сполук 3, 15, 23, 36 згідно з винаходом з 6. Вплив сполук згідно з винаходом на розвиперекисом водню. ток окисного стресу. Для визначення активності каталази автори Відомо, що в умовах окисного стресу, викливинаходу використовували метод спектрофотомеканого надмірним утворенням в клітинах активних тричної реєстрації продуктів, що утворюються в форм кисню або реакційно активних метаболітів процесі взаємодії перекису водню з молібдатом азоту в клітині змінюється багато біохімічних покаамонію. Це реакція є специфічною і такою, що зників крові та порушуються нітрергічні механізми швидко перебігає, в результаті якої утворюються клітин. стійкі продукти. Як модель створення окисного стресу в клітиДо 0,1мл гомолізованих еритроцитів крові минах була вибрана модель морфінової абстиненції шей лінії BALB/c додавали 2,0мл 0,03%-ного розу щурів, яка є аналогом героїнової абстиненції чину перекису водню (еталон) або готували таку людини. саму суміш з доданням однієї зі сполук 3, 15, 23, Фізичну залежність від морфіну моделювали 36 згідно з винаходом в концентраціях 1,0 або на самцях-щурах Wistar масою 250-350г віком 6 10,0мкг/мл (дослід), а потім в різних дослідах чемісяців ін'єкуванням внутрішньочеревинно морфірез 10, 20, 30, 60, 90, 120 хвилин додавали 1,0мл ну гідрохлориду протягом 6 днів 2 рази на добу (в 4%-ного розчину молібдату амонію. Реакція су10.00 годин і 20.00 годин) в дозах із зростанням за проводжується швидким і необоротним розкладом схемою, мг/кг: 10, 10; 20, 20; 40, 40; 60, 60; 80, 80; перекису водню і утворенням кольорових продук100, 100 [Rahman S., Ali Khan R, Kumar A. тів. Світлопоглинання отриманих розчинів виміряExperimental study of the morphine deaddiction ли при 410нм, товщині кювети 1,0см, в контрольній properties of Delphinium denudatum Wall//BMC кюветі використовували дистильовану воду. Complement Altern. Med. 2002, v. 29, p. 1-6; Dum J., Результати досліджень представлені на графіBlasig I, Herz A. Buprenorphine: demonstration of ках Фіг.11, активність каталази показана у відносphysical dependence liability. Eur. J. Pharmacol., них величинах АК. Криві 1, 2, 3, 4 відображають 1981, v. 70, p. 293-300]. вплив відповідно сполук 3, 15, 23, 36 в концентраВ експериментах були проведені досліди на ції 1,0мкг/мл на активність каталази протягом часу щурах в серіях по 7 тварин на кожну сполуку згідно t експерименту. Для концентрації 10,0мкг/мл залез винаходом. Контрольною групою служили неможність аналогічна (на графіку не показана). рфінізовані тврини, без введення сполук згідно з Визначення активності пероксидази становить винаходом. Першу дослідну гр уп у складали твазначний інтерес в клінічній практиці. Для її визнарини, морфінізовані за вищезазначеною методичення застосували метод, оснований на окисненні кою, другу гр упу - тварини, яким вводили тільки індигокарміну в слабокислому середовищі. сполуки 6, 15, 25, 37 згідно з винаходом внутріДо 2,0мл ацетатного буферного розчину додашньом'язово в дозі 20,0мг/кг три рази упродовж вали 0,1мл осаду гомолізованих еритроцитів крові доби, третю - морфінізовані тварини, яким тричі мишей лінії BALB/c, додавали 2,0мл 0,03%-ного протягом доби, яка йшла слідом після останньої розчину перекису водню (контроль) або готували дози морфіну, вводили сполуки 6, 15, 25, 37 згідно таку саму суміш з доданням сполук 3, 15, 23, 36 з винаходом внутрішньом'язово в дозі 20,0мг/кг. згідно з винаходом в концентраціях 1,0 або Потім щурів декапітували, кров з сонних артерій 10,0мкг/мл (дослід), а потім в різних дослідах чезбирали в пробірки з розчином EDTA як антикоарез 10, 20, 30, 60, 90, 120 хвилин додавали 1,0мл гулянта, центрифугували при 1500г протягом 15 індигокарміну. Відмічали час реакції з індигокарміхвилин при 4°С. ном в секундах за зміною переходу забарвлення 6.1. Вплив сполук згідно з винаходом на актирозчину з синього через зелене у безколірне, потім вність ферментів у плазмі крові. в рожеве. В дослідах час закінчення реакції відміДля оцінки можливої гепатопротекторної дії чали при переході кольору забарвлення у безколісполук згідно з винаходом в умовах розвитку окисрний. ного стресу в клітинах печінки, був досліджений Отримані результати представлені у відносних впливсполук згідно з винаходом на найважливіші величинах АР на графіках Фіг.12, криві 1, 2, 3, 4 біохімічні показники крові, зокрема на вміст у пладля сполук відповідно 3, 15, 23, 36 згідно з виназмі крові індикаторних ферментів аспартатамінотходом в концентрації 1,0мкг/мл, для концентрації рансферази (AST), аланінамінотрасферази (ALT), 47 85390 48 плазмі крові, що свідчить про токсичну дію морфіg-глутамілтранспептидази (g-GTP). Вміст ферменну на печінку тварин. тів оцінювали за їхньою каталізуючою активністю в плазмі крові. Активність AST, ALT і g-GTP визначали за доВідомо, що морфінова абстиненція приводить помогою діагностичних наборів DiaSys (Німеччина). Результати дослідів наведені в табл. 9. до підвищення активності ферментів AST і g-GTP в Таблиця 9 Вплив морфіну та сполук згідно з винаходом на вміст Ci індикаторних ферментів у плазмі крові Фермент Сі, mЕ/1 контроль ALT AST g-GTP 106,76±11,35 -"-"-"179,88±11,94 -"-"-"6,26±1,80 -"-"-" Сі, mЕ/1 контроль+морфін 116,12±10,44 Сполука 238,20±14,71 16,80±3,32 З даних табл. 9 видно, що при введенні тільки сполук згідно з винаходом активність ферментів AST і g-GTP не змінювалась і відповідала показникам контрольної групи. Введення морфіну призводило до підвищення активності зазначених ферментів у крові, що свідчить про порушення діяльності печінки, а наступне введення сполук згідно з винаходом приводило до нормалазації діяльності печінки та усунення наслідків дії морфіну на клітини печінки щурів. 6.2. Вплив сполук згідно з винаходом на внутрішньоклітинні метаболічні процеси. Для оцінки інтенсивності метаболізму оксиду азоту у щурів проводили кількісне визначення стабільних метаболітів оксиду азоту - нітритів і нітратів NOx- в плазмі крові, супернатантах печінки і тимуса спектрометричним методом, а також в супернатантах мозку - флуорометричним методом. В основі спектрометричного методу лежить взаємодія нітритів з реактивом Грісса (суміш 2%ного розчину сульфаніламіду і 0,2%-ного N-(1нафтил)етилендіаміну). На першому етапі нітрит реагує з сульфаніламідом з утворенням солі діазонію, а потім в результаті реакції з другим компонентом утворюється азобарвник з максимумом адсорбції при 540нм. Для відновлення нітратів у нітрити ферментативним способом застосовували бактеріальну нітратредуктазу [Grisham Μ.В. et al., 1995]. Депротеїнізовані при 100°С протягом 5 хвилин зразки плазми і супернатанта печінки інкубували протягом 30 хвилин при 37°С в 50,0мМ HEPES рН 7,4 у присутності 0,2одиниць/мл Aspergillus нітратредуктази, 5,0мкМ FAD і 0,1мМ NAD-Ph. Наприкінці реакції додавали лактатдегідрогеназу і піруват для вилучення NAD-Ph, який заважає реакції Грісса. Потім додавали реактив Грісса і після 10-хвилинної інкубації виміряли світлопоглинання зразків при 540нм. Для розрахунку кількості NOx- застосовували нітрат натрію як стандарт. 6 15 25 37 6 15 25 37 6 15 25 37 Сі, mЕ/1 контроль+сполука 114,5±1,13 113,48±2,39 115,27±1,09 113,84±2,0 176,18±3,26 173,46±5,63 177,34±6,13 174,82±4,91 8,27±2,12 7,03±2,82 7,57±1,93 8,14±2,64 Сі, mЕ/1 контроль+морфін+сполука 122,44±2,01 121,08±5,04 121,96±3,4 120,84±5,20 198,34±9,32 195,57±18,68 196,46±15,34 193,58±14,18 12,52±2,02 10,69±1,84 11,37±1,54 10,32±2,67 В основі флуорометричного методу лежить визначення рівня нітритів за інтенсивністю флуоресценції 2,3-діамінонафтотриазолу, продукту реакції 2,3-діамінонафталіну (DAN) і нітриту в кислому середовищі [Misko T.R., Schilling R.J, Salvemini D. et al. A fluoremetric assay for the measurement of nitrite of biological samples Anal. Biochem., 1993, v. 214, p. 11-16]. Депротеїнізовані при 100°С супернатанти мозку поміщали в нітрит-регенеруючу систему, що містить 0,125одиниць/мл нітратредуктази, 25мкМ NADPh і 25мкМ FAD, приготованих в 20мМ Тріс-НСІ буфері рН 7,6, та інкубували протягом 30 хвилин при 37°С. Для окиснення NADPh використовували систему лактатдегідрогеназа/піруват. Потім додавали 316мкМ розчину DAN в 0,62Μ соляної кислоти та інкубували 10 хвилин у темряві. Для стабілізації флуоресценції 2,3діамінонафтотриазолу, що утворився, додавали 280мМ NaOH. Інтенсивність флуоресценції виміряли на спектрофлуориметрі Hitachi F-3000 при довжині хвилі збудження 365нм та емісії 405нм. Для розрахунку концентрації NOx- в мозку був використаний стандартний розчин нітрату натрію. Був також вивчений вплив сполук 6, 15, 25, 37 згідно з винаходом на активність ізоформ синтази оксиду азоту (NOC), зокрема на активність Са 2+незалежної та Са 2+-залежної ізоформ NOC у печінці морфінізованих щурів радіометричним методом за швидкістю накопичення L-цитруліну в реакції окиснення [3Н]L-аргініну, яку каталізує NOC [Bredt and Snyder. Nitric oxide mediates glutamatelinked enhancement of cGMP levels in the cerebellum. Proc. Natl. Acad. Sci. USA, 1989, v. 86, p. 9030-9033]. Утворення L-цитруліну в цій реакції еквівалентне біосинтезу оксиду азоту. Реакцію ініціювали доданням супернатанта печінки, мозку або тимуса в реакційне середовище, яке містить 2,0mkKu/ml [3Н]L-аргініну, 20мМ HEPES рН 7,4, 0,2мМ CaCl2, 5,0мкМ FAD, 5,0мкМ FMN, 1,0мМ NADPh, 50,0мкМ ВЕЦ при дослідженні 49 85390 50 супернатантів мозку, а при аналізі супернатантів та Са2+-незалежної ізоформ NOC визначали за печінки для інгібування аргінази і рециклізації різницею швидкостей утворення [3Н]L-цитруліну в [3Н]L-цитрулін у в [3Н]L-аргінін в середовище додатрьох паралельних зразках, що містили 2,0мМ тково вводили 50,0мМ L-валіну і 1,0мМ LEDTA як хелатор Са2+ і як інгібітор всіх форм NOC, цитруліну. Після 15-60 хвилин інкубації при 37°С у - 2,0мМ EDTA + 2,0мМ L-NAME, та без інгібіторів. зразки додавали суспензію Dowex 50WX8-400 Активність ферменту NOC в досліджуваному су(Nа+-форма), яка сорбує L-аргінін, що не прореагупернатанті рахували в пМ [3Н]L-цитр уліну, накопивав, але не L-цитрулін. Після сорбції активність ченого за одиницю часу на 1мг білка в супернатазразків визначали на сцинтиляційному лічильнику нті. Результати досліджень представлені в табл. SL-4000 "Intertechnique". Активність Са 2+-залежної 10 і на Фіг.13. Таблиця 10 Вплив морфіну і сполук згідно з винаходом на рівень нітритів у плазмі крові і супернатантах печінки і мозку та активність синтази оксиду азоту (NOC) в мозку Показник Контроль Контроль+морфін Сполука Контроль+сполука Контроль+морфін+сполука Нітрити в плазмі 18,30±2,14 12,12±0,61 6 15,83±1,21 15,86±1,20 крові, мкМ/мл 15 14,39±0,84 13,91±1,91 25 17,10±2,05 16,78±2,11 37 16,13±1,80 15,33±0,87 Нітрити в печін- 0,260±0,023 0,259±0,012 6 0,245±0,010 0,294±0,02 ці, нМ/мг білка 15 0,259±0,019 0,285±0,02 25 0,307±0,012 0,287±0,01 37 0,262±0,018 0,274±0,01 Нітрити в мозку, нМ/мг білка: Кора великих 4,63±0,29 5,31±0,29 6 4,59±0,44 5,12±0,18 півкуль 15 4,31±0,37 4,72±0,37 25 4,47±0,43 4,91±0,32 37 4,36±0,24 4,77±0,28 Середній мозок 5,66±0,19 9,41±1,20 6 7,01±0,82 5,76±0,94 15 6,65±0,70 5,50±0,43 25 6,98±1,02 5,91±0,74 37 6,84±0,56 5,63±0,37 Гіпоталамус 6,57±0,50 4,62±0,71 6 6,94±0,67 6,72±0,94 15 6,77±0,83 6,57±0,88 25 6,87±0,80 6,67±0,79 37 6,79±0,92 6,52±0,83 Активність NOC, пМ/хв/мг білка: Середній мозок 6 2,84±0,31 1,99±0,31 3,08±0,09 15 2,60±0,29 1,83±0,23 2,18±0,09 25 2,65±0,43 1,97±0,27 37 2,62±0,27 1,85±0,30 Гіпоталамус 6 5,93±0,27 5,34±0,24 3,42±0,54 15 5,45±0,24 5,26±0,28 5,37±0,20 25 5,88±0,27 5,23±0,27 37 5,61±0,22 5,59±0,22 З наведених в табл. 10 рівнів вмісту нітритів у крові видно, що морфін достовірно знижував вивільнення в кров нітритів (при p£0,02), таке зниження рівня нітритів у крові може свідчити про зменшення генерації оксиду азоту в органах або судинах при морфіновій абстиненції. Сполуки згідно з винаходом запобігали цьому ефекту, що може свідчити про вплив цих сполук на активність синтази оксиду азоту в тканинах або на активність відповідного ферменту в ендотелії судин. В печінці (табл. 10) сполуки згідно з винаходом запобігали накопиченню продуктів перекисного окиснення. В мозку (табл. 10) введення тваринам морфіну специфічно впливало на накопичення нітритів і активність NOC: в гіпоталамусі - зниження, а в корі великих півкуль і середньому мозку - підвищення нітрергічних показників. При введенні тільки сполук згідно з винаходом в корі великих півкуль спостерігалось зниження нітрергічних показників, а в середньому мозку і в гіпоталамусі - їх підви щення. Наступне введення сполук згідно з винаходом відновлювало порушену морфіном активність NOC в гіпоталамусі, середньому мозку, корі великих півкуль. На діаграмі Фіг.13 показана активність NOC загальна (область 1 діаграми), активність кальційзалежної NOC (область 2) і активність кальційнезалежної NOC (область 3) в контролі (значення к), при введенні морфіну (значення м), при вве 51 85390 52 денні тільки сполук 6, 15, 23, 37 (група С), і при тваринам приводило до нормалізації активності введенні сполук згідно з винаходом після введенкальцій-залежної NOC і до збільшення активності ня морфіну (група D), відповідно, зліва направо в кальцій-незалежної NOC вище початкового рівня, областях 1, 2, 3, 4. що приводило до підвищення загальної активності Результати досліджень дозволяють зробити ферменту NOC. висновок, що в печінці активність ізоформ NOC Був також досліджений вплив сполук згідно з достовірно змінювалась під дією морфіну. Поріввинаходом на стан тимуса щурів: контрольна груняно з контролем загальна активність NOC у морпа, дослідна група морфінізованих тварин, дослідфінізованих щурів і щурів, які отримали тільки спона група тварин, ін'єкованих сполуками згідно з луки згідно з винаходом, не змінювалась. Однак винаходом, і дослідна група тварин, морфінізовавведення морфіну викликало підвищення активноних і потім ін'єкованих сполуками згідно з винахості кальцій-залежної форми NOC і зниження актидом. Експеримент проводили аналогічно описановності кальцій-незалежної форми NOC. A введенму ви ще. Результати наведені в табл. 11. ня сполук згідно з винаходом морфінізованим Таблиця 11 Вплив морфіну та сполук згідно з винаходом на стан тимуcа Показник Контроль Маса тимуса, 230±14 мг Введення морфіну Сполука Введення сполуки Введення морфіну та сполуки 145±9 6 242±17 207±14 15 298±25 214±12 25 254±14 218±17 37 263±21 228±15 Нітрити, 0,331±0,041 0,511±0,05 6 0,424±0,04 0,419±0,02 нмол/мг білка 15 0,407±0,02 0,383±0,02 супернатанта 25 0,417±0,02 0,396±0,02 37 0,410±0,01 0,387±0,01 З даних, наведених в табл. 11, видно, що морфінова абстиненція викликає інволюцію тимуса, а сполуки згідно з винаходом повністю запобігають цьому ефекту морфіну. Крім того, сполуки згідно з винаходом запобігають накопиченню нітритів у тимусі. Висновки Таким чином, можна зробити висновок, що сполуки згідно з винаходом мають гепатопротекторну дію: запобігають підвищенню активності ферментів AST і g-GTP і купірують окисний стрес в печінці. Крім того, сполуки згідно з винаходом запобігають інволюції тимуса, впливають на різні ізоформи. синтази оксиду азоту, здійснюючи корекцію порушених нітрергічних механізмів у печінці, відділах мозку і тимусі. 7. Оцінка загальнотоксичної дії сполук згідно з винаходом. Загальнотоксична дія сполук згідно з винаходом була вивчена в хронічному експерименті на щурах при введенні щурам сполук у формі свічок, що містили як активний інгредієнт сполуки згідно з винаходом: 5% активного інгредієнта в свічковій основі, отриманій сплавленням на водяній бані Вітепсола марок Н-15 і W-35 в рівних кількостях. Досліди проводили на інбредних щурах. Тварин для експерименту відбирали в групу методом випадкової вибірки з урахуванням маси тіла як визначального показника, по 24 самця або 24 самки на один препарат із досліджуваних в одній дозі сполук 2, 15, 23, 34, 37. За 4-5 годин до ректального введення препарату тваринам припиняли давати корм, маніпуляції з тваринами приводили до рефлекторного акту дефекації, що звільняла порожнину прямої кишки. В експериментах використовували дві дози препаратів - 50мг/кг і 500мг/кг. Свічки перед уведенням розм'якшували розігрівом на водяній бані в скляній склянці при температурі 38-39°С, набирали в туберкуліновий шприц об'ємом 1мл, приєднували до шприца голку з оливою і вводили свічкову масу в пряму кишку тваринам на глибину 1,52,0см. Тваринам контрольної групи вводили стерильне медичне вазелінове масло в об'ємі, що відповідав об'єму досліджуваної свічки. Повний курс введення препаратів тваринам склав 2 місяці. Комплекс лабораторних діагностичних досліджень проводили через місяць після початку введення препарату тваринам - посередині курсу (8 тварин), через два місяці - після закінчення курсу (8 тварин) і через три місяці - після закінчення відновлювального періоду тривалістю один місяць (8 тварин). Масу тіла щурів протягом першого місяця введення препарату визначали щотижня, а потім - один раз на два тижні. На основі динаміки показника маси тіла тварини робили корекцію об'єму препарату, який вводили, з урахуванням досліджуваної дози. Результати досліджень наведені в табл. 12, 13, 14. 53 85390 54 Таблиця 12 Показники периферичної крові самців щурів після введення досліджуваних препаратів у свічках протягом 1 і 2 місяців Показник крові Гемоглобін, мМ/дм 3 Контроль 1міс./2міс. Сполука 10,5±0,2/11,4±0,2 2 15 23 34 37 Еритроцити, млн/мм 3 5,6±0,1/6,1±0,1 2 15 23 34 37 Гематокрит, % 45,9±1,7/45,9±1,8 2 15 23 34 37 Середній об'єм ерит- 81,4±1,7/74,6±1,9 2 роцитів, мкм 3 15 23 34 37 Ретикулоцити, % 2,8±0,3/2,9±0,2 2 15 23 34 37 Тромбоцити, % 707±23/593±14 2 15 23 34 37 Час зсілості, сек. 152±10,2/316±8 2 15 23 34 37 ШОЕ, мм/год 2,2±0,4/1,4±0,2 2 15 23 34 37 Лейкоцити, тисяч/мм 3 17,4±1,3/19,1±1,9 2 15 23 34 37 Базофіли, % 0 2 15 23 34 37 Еозинофіли, % 4,0±0,3/4,4±1,2 2 15 23 34 37 Доза 50мг/кг 1міс/2міс. 10,5±0,1/11,1±0,1 10,6±0,2/11,2±0,1 10,7±0,1/11,0±0,1 10,6±0,1/11,1±0,2 10,5±0,1/11,0±0,1 5,6±0,2/6,1±0,1 5,7±0,2/6,0±0,1 5,7±0,1/6,0±0,2 5,6±0,1/6,1±0,2 5,6±0,2/6,2±0,1 47,8±1,3/47,9±1,5 47,9±1,4/47,5±1,2 47,7±1,2/46,5±1,3 46,9±1,1/47,5±1,2 47,8±1,4/47,5±1,2 83,4±1,4/77,9±2,1 84,4±1,5/78,6±1,5 82,7±1,6/77,5±1,7 81,6±1,9/76,7±1,9 83,9±1,7/78,5±1,4 2,8±0,2/2,8±0,2 2,6±0,2/3,0±0,1 2,7±0,3/2,8±0,1 2,7±0,1/2,9±0,2 2,6±0,1/3,1±0,1 659±26/566±20 678±13/597±24 659±18/586±28 670±23/610±15 675±22/609±18 145±16/322±18 140±12,2/321±12 150±15/313±17 148±16/321±10 151±13/319±12 1,9±0,3/1,7±0,1 1,8±0,4/1,6±0,2 1,7±0,8/1,5±0,1 1,8±0,5/1,7±0,3 1,8±0,3/1,6±0,3 16,0±1,4/19,3±1,6 14,8±2,0/16,3±1,0 15,5±1,1/17,6±1,2 15,9±1,3/17,8±1,4 14,9±1,5/16,7±1,2 0 0 0 0 0 3,4±0,6/4,2±0,8 3,2±1,0/3,6±1,2 3,6±0,5/4,0±0,7 3,5±1,0/4,1±0,4 3,8±0,8/4,2±0,3 Доза 500мг/кг 1міс/2міс. 10,6±0,1/12,3±0,3* 10,6±0,2/12,5±0,4* 10,7±0,2/12,3±0,3* 10,6±0,3/12,4±0,4* 10,6±0,1/12,1±0,4* 5,6±0,1/6,5±0,1* 5,7±0,1/6,7±0,2* 5,7±0,2/6,4±0,2* 5,6±0,2/6,6±0,1* 5,7±0,1/6,5±0,2* 47,5±1,6/50,3±2,0 47,6±1,3/53,9±2,1* 47,9±1,1/49,4±1,9* 48,1±1,5/53,1±1,6* 47,9±1,8/52,5±1,7* 85,2±1,2/72,0±2,5* 82,6±1,1/80,2±1,2* 83,5±1,7/82,1±1,4* 84,1±1,3/83,8±1,5* 82,3±1,5/80,1±1,0* 2,9±0,3/3,5±0,2 3,1±0,2/3,3±0,3 3,1±0,1/3,4±0,1 3,2±0,2/3,5±0,3 3,0±0,2/3,4±0,2 681±26/583±25 683±14/616±40 678±18/628±23 682±24/631±26 671±26/639±34 149±11/305±13 151±6,4/308±16 156±11/317±12 165±10/312±9 157±14/316±14 2,1±0,3/1,9±0,1 2,2±0,4/1,8±0,4 2,0±0,3/1,7±0,3 2,0±0,4/1,8±0,2 2,2±0,3/2,0±0,1 15,6±0,8/18,6±1,9 17,0±1,4/21,1±2,4 16,4±1,1/20,1±1,7 16,9±1,0/22,1±1,1 17,1±0,9/18,7±1,7 0 0 0 0 0 3,2±0,9/4,8±1,6 3,0±1,0/3,2±1,4 3,3±0,7/3,8±1,3 3,0±0,9/3,9±1,4 3,5±1,0/4,1±1,3 55 85390 56 Продовження таблиці 12 Юні, % 0 Паличкоядерні, % 0,8±0,4/2,4±0,4 Сегменто-ядерні, % 29,2±2,4/23,0±1,2 Лімфоцити, % 60,2±1,8/64,8±1,6 Моноцити, % 5,8±0,7/5,4±0,6 2 15 23 34 37 2 15 23 34 37 2 15 23 34 37 2 15 23 34 37 2 15 23 34 37 0 0 0 0 0 0,8±0,3/1,7±0,3 1,2±0,5/0,8±0,5 1,1±0,5/1,6±0,2 1,0±0,4/1,8±0,5 1,3±0,5/1,9±0,4 25,2±1,7/27,8±3,4 27,4±1,3/26,2±2,2 24,0±1,4/28,6±4,2 25,6±1,2/25,2±2,7 28,3±1,6/26,0±3,6 61,4±1,8/63,9±2,1 65,0±1,5/61,8±2,5 64,2±1,8/63,0±3,7 63,8±1,6/62,8±2,9 65,0±1,2/63,4±1,9 5,9±0,8/5,7±0,7 6,6±0,9/7,6±1,0 6,5±0,7/6,9±1,0 5,8±0,9/6,2±0,9 6,0±1,2/6,4±0,7 0 0 0 0 0 0,9±0,2/1,1±0,3 0,8±0,5/0,8±0,5 1,0±0,3/1,6±0,2 0,9±0,2/1,4±0,3 0,9±0,4/1,1±0,6 27,1±1,5/24,8±2,6 26,3±1,2/22,4±1,5 28,2±1,7/25,3±1,8 26,4±1,0/24,7±2,3 27,9±1,1/25,2±2,8 59,2±1,3/68,Ш,7 61,6±2,5/67,6±1,3 63,7±1,9/68,7±1,4 62,9±1,6/67,9±2,1 64,0±1,7/66,3±1,9 6,0±1,1/5,9±1,1 6,4±0,9/6,0±0,9 6,1±1,4/6,2±0,7 5,9±0,8/6,0±1,0 6,1±1,3/б,3±0,7 Таблиця 13 Біохімічні показники сироватки крові самців щурів після 1 місяця введення свічок з вмістом сполук згідно з винаходом Показник Загальний білок, г/л Контроль 94,89±6,67 Глюкоза, мМ/л 9,76±0,15 Сечовина, мкМ/л 8,44±0,60 Холестерин, мМ/л 3,02±0,08 Креатинін, мкМ/л 40,23±2,84 ALT, одиниць/л 11,33±1,96 AST, одиниць/л 19,13±1,02 Лужна фосфотаза, одиниць/л 40,74±1,57 Білірубін, мМ/л 35,93±2,19 Сполука 2 15 37 2 15 37 2 15 37 2 15 37 2 15 37 2 15 37 2 15 37 2 15 37 2 15 37 Доза 50мг/кг 87,34±5,56 90,22±6,78 89,44±7,72 9,85±0,37 10,00±0,41 9,9±0,51 11,02±0,73 10,33±0,51 9,36±0,62 2,77±0,71 2,01±0,50 2,48±0,62 47,38±3,26 45,59±2,68 46,84±2,92 10,84±2,02 7,63±1,95 8,98±2,43 20,41±3,06 19,49±2,90 19,97±2,78 42,12±4,23 40,74±6,78 41,86±5,26 44,38±4,12 43,07±3,57 42,17±3,28 Доза 500мг/кг 70,84±7,47 71,56±8,23 70,88±7,24 10,20±0,74 10,71±0,41 10,93±0,84 11,30±0,80 10,89±0,73 10,57±0,56 2,96±0,52 2,30±0,57 2,64±0,46 49,87±8,12 48,27±12,29 47,13±9,82 11,23±1,70 9,48±1,85 9,56±1,34 20,13±2,95 15,14±1,58 18,21±1,87 43,4±2,12 41,60±2,26 42,18±2,34 42,56±7,56 40,69±15,75 41,45±7,18 57 85390 58 Таблиця 14 Показники сечі щурів через 1 місяць введення сполук згідно з винаходом у свічках Показник Білок, г/л Контроль 0,74±0,26 Сечовина, мМ/л 472±140 Глюкоза, мМ/л
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclic bioisosters of a purine system derivatives and pharmaceutical composition based thereon
Автори англійськоюZhylov Valerii Khazhmuratovych, Zhuravliov Serhei Vladimirovich, Markov Aleksandr Nikolaevich, Polosin Vladimir Mikhailovich
Назва патенту російськоюЦиклические биоизостеры производных пуриновой системы и фармацевтическая композиция на их основе
Автори російськоюЖИЛОВ Валерий Хажмуратович, Журавлев Сергей Владимирович, Марков Александр Николаевич, Полосин Владимир Михайлович
МПК / Мітки
МПК: A61K 31/502, A61P 7/02, A61K 31/519, C07D 237/32, C07D 487/04, C07H 19/06, A61K 31/7072
Мітки: фармацевтична, композиція, основі, пуринової, системі, циклічні, біоізостери, похідних
Код посилання
<a href="https://ua.patents.su/34-85390-ciklichni-bioizosteri-pokhidnikh-purinovo-sistemi-i-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Циклічні біоізостери похідних пуринової системи і фармацевтична композиція на їх основі</a>
Попередній патент: Застосування циклічних біоізостерів похідних пуринової системи для лікування розладів, викликаних порушеннями нітрергічної і дофамінергічної систем
Наступний патент: Пристрій для слідкувального компандування частотного діапазону звукових сигналів
Випадковий патент: Спосіб створення тривимірних анімаційних фільмів