Антагоністи рецептора глюкагону, композиція, що містить такі сполуки, і їх застосування
Номер патенту: 96308
Опубліковано: 25.10.2011
Автори: Кім Роналд М., Пармі Емма Р., Біттнер Емі Р., Сінз Крістофер Джозеф, Росоер Кіт Дж., Тата Джеймс Р., Чан Цзиан, Стелмак Джон Е.
Формула / Реферат
1. Сполука, представлена формулою І:
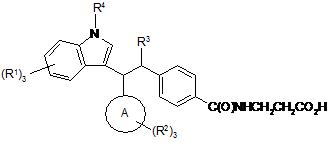 ,
,
або її фармацевтично прийнятна сіль або сольват, де
кільце А є фенільною або нафтильною групою;
кожен R1 і R2 є Н або вибраний із групи, що складається з галогену, CN, ОН, NO2, CO2Ra, NRaRb, S(O)рRa, С1-10алкілу, С2-10алкенілу або С1-10алкокси, де алкільна й алкенільна частини груп С1-10алкілу, С2-10алкенілу і С1-10алкокси необов'язково заміщені 1-5 атомами галогену аж до пергалогену; і далі необов'язково заміщені 1 групою, вибраною з ОН, оксо і С1-6алкокси;
р дорівнює 0, 1 або 2;
кожен Ra і Rb незалежно є Н або С1-4алкілом, необов'язково заміщеним 1-5 атомами галогену аж до пергалогену; і далі необов'язково заміщеним 1 групою, вибраною з ОН, оксо і С1-6алкокси;
R3 є С1-6алкілом або С2-6алкенілом, кожен необов'язково заміщений 1-5 атомами галогену аж до пергалогену, і далі необов'язково заміщений 1 групою, вибраною з ОН, оксо і С1-6алкокси, і
R4 є Н або С1-4алкілом, необов'язково заміщеним 1-3 атомами галогену аж до пергалогену і 1 фенільним кільцем.
2. Сполука за п. 1, де кільцем А є феніл.
3. Сполука за п. 1, де кільцем А є нафтил.
4. Сполука за п. 1, де кожен R1 є Н або його вибирають із групи, що складається з галогену, вибраного з фтору і хлору; SСН3; CN, С1-6алкілу, С2-4алкенілу і С1-6алкокси, де алкільна й алкенільна частини груп SСН3, С1-6алкілу, С2-4алкенілу і С1-6алкокси необов'язково заміщені 1-3 атомами фтору.
5. Сполука за п. 4, де кожен R1 є Н або його вибирають із групи, що складається з фтору, хлору; SСН3; CN, С1-6алкілу, С2-4алкенілу і С1-6алкокси, де алкільна й алкенільна частини груп SСН3, С1-6алкілу, С2-4алкенілу і С1-6алкокси необов'язково заміщені 1-3 атомами фтору.
6. Сполука за п. 5, де кожен R1 є Н або його вибирають із групи, що складається з фтору, хлору; SСН3; CN, С1-4алкілу і OСН3, де алкільна частина груп SСН3, С1-4алкілу і ОСН3 необов'язково заміщена 1-3 атомами фтору.
7. Сполука за п. 1, де кожен R2 є Н або його вибирають із групи, що складається з галогену, вибраного з фтору і хлору; SСН3; CN, С1-6алкілу, С2-4алкенілу і С1-6алкокси, де алкільна й алкенільна частини груп SСН3, С1-6алкілу, С2-4алкенілу і С1-6алкокси необов'язково заміщені 1-3 атомами фтору.
8. Сполука за п. 7, де кожен R2 є Н або його вибирають із групи, що складається з фтору, хлору; SСН3; CN, С1-6алкілу, С2-4алкенілу і С1-6алкокси, де алкільна й алкенільна частини груп SСН3, С1-6алкілу, С2-4алкенілу і С1-6алкокси необов'язково заміщені 1-3 атомами фтору.
9. Сполука за п. 8, де кожен R2 є Н або його вибирають із групи, що складається з фтору, хлору; SСН3; CN, С1-4алкілу і ОСН3, де алкільна частина груп SCH3, С1-4алкілу і ОСН3 необов'язково заміщена 1-3 атомами фтору.
10. Сполука за п. 1, де R3 вибирають із групи, що складається з СН3, етилу, н-пропілу, н-, втор- і трет-бутилу й алілу.
11. Сполука за п. 1, де R4 вибирають із групи, що складається з Н, Me, Et, н-пропілу, н-бутилу і бензилу.
12. Сполука за п. 1, де кільце А є фенільною або нафтильною групою;
кожний з R1 і R2 є Н або його вибирають із групи, що складається з галогену, вибраного з фтору і хлору; SСН3; CN, С1-6алкілу, С2-4алкенілу і С1-6алкокси, де алкільна й алкенільна частини груп SСН3, С1-6алкілу, С2-4алкенілу і С1-6алкокси необов'язково заміщені 1-3 атомами фтору;
R3 вибирають із групи, що складається з СН3, етилу, н-пропілу, н-, втор- і трет-бутилу й алілу, і
R4 вибирають із групи, що складається з Н, Me, Et, н-пропілу, н-бутилу і бензилу.
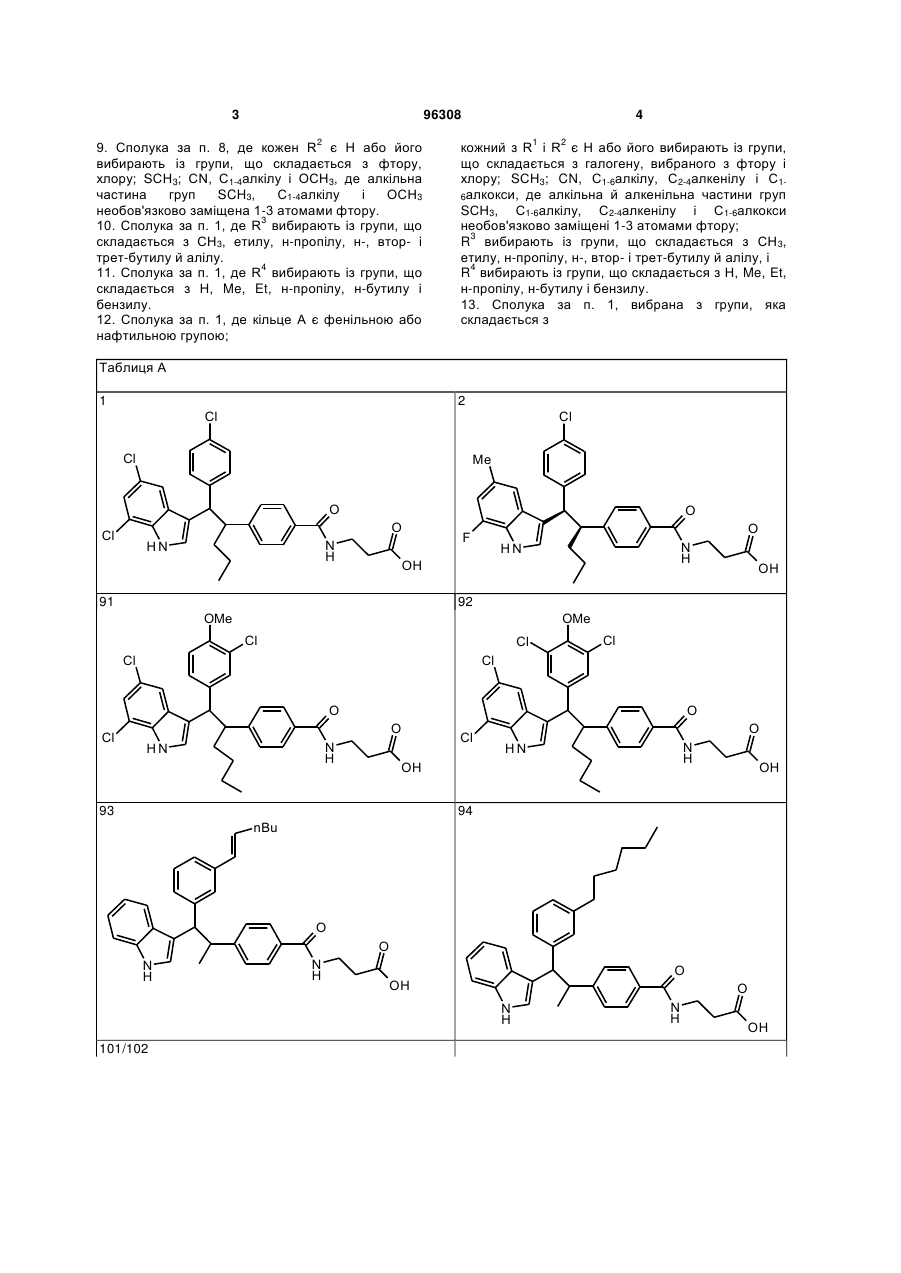
13. Сполука за п. 1, вибрана з групи, яка складається з
Таблиця А
1
2


91
92


93
94


101/102

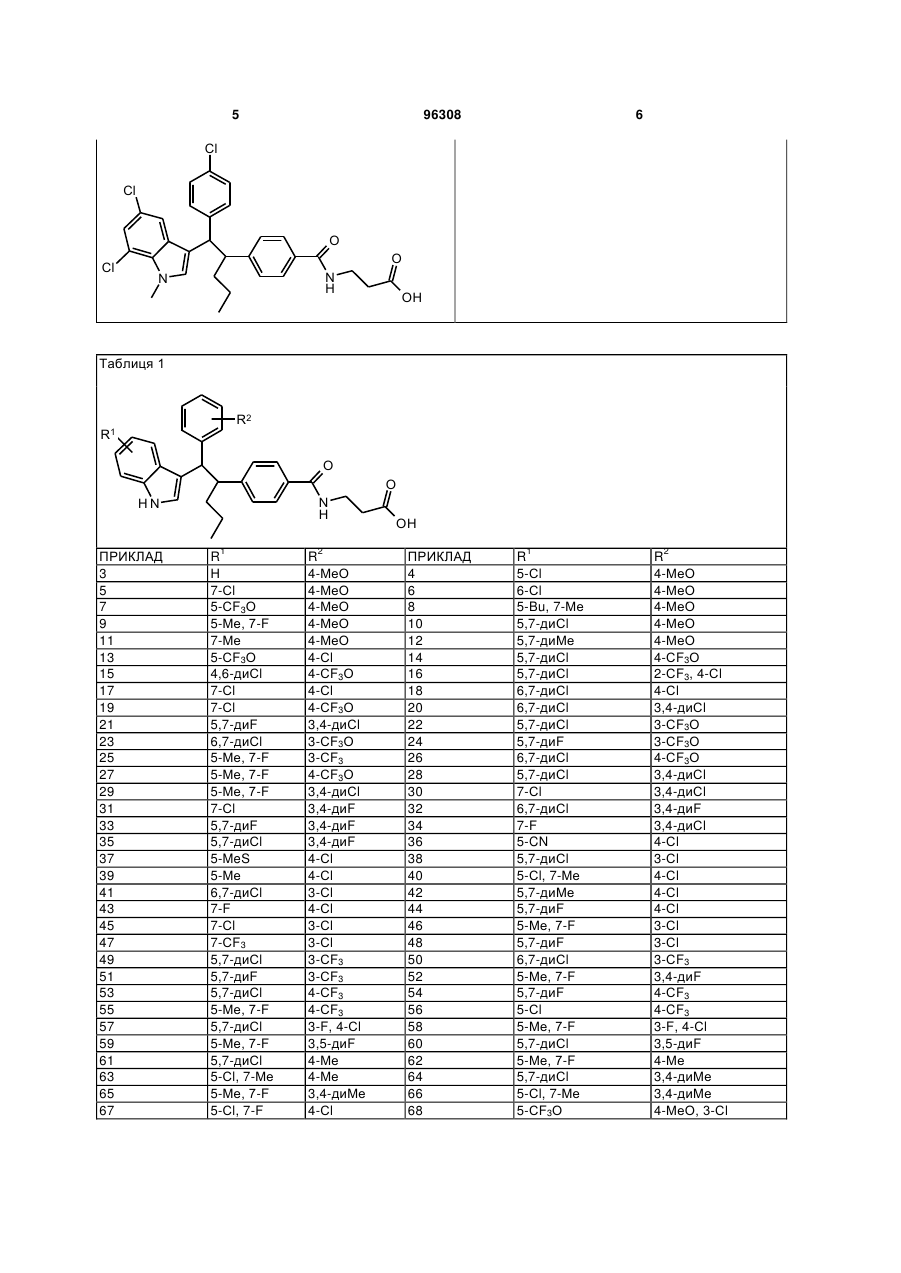
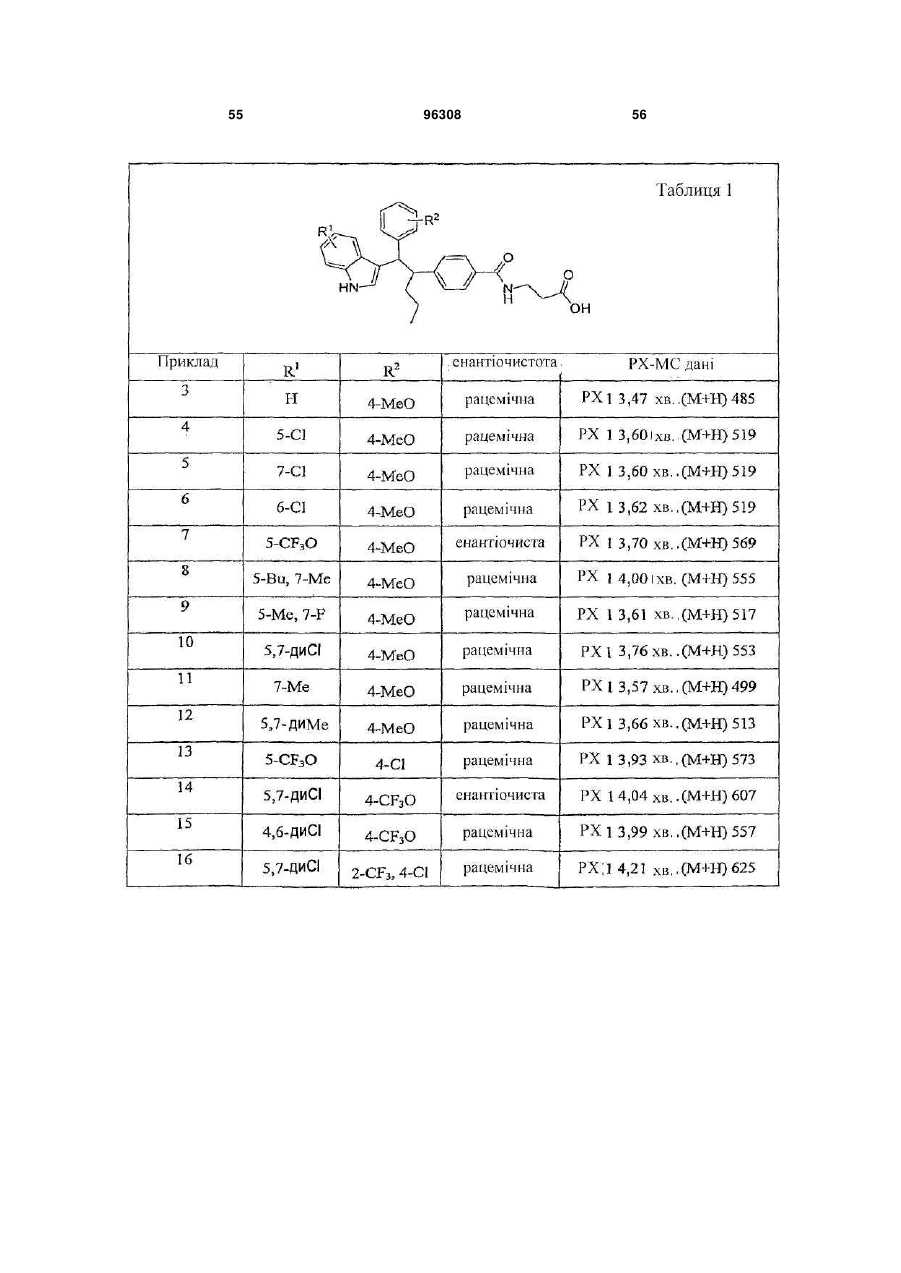
Таблиця 1

ПРИКЛАД
R1
R2
ПРИКЛАД
R1
R2
3
Н
4-МеО
4
5-Сl
4-МеО
5
7-Сl
4-МеО
6
6-Сl
4-МеО
7
5-СF3О
4-МеО
8
5-Bu, 7-Ме
4-МеО
9
5-Ме, 7-F
4-МеО
10
5,7-диСl
4-МеО
11
7-Ме
4-МеО
12
5,7-диМе
4-МеО
13
5-СF3О
4-Сl
14
5,7-диСl
4-СF3О
15
4,6-диСl
4-СF3О
16
5,7-диСl
2-СF3, 4-Сl
17
7-Сl
4-Сl
18
6,7-диСl
4-Сl
19
7-Сl
4-СF3О
20
6,7-диСl
3,4-диСl
21
5,7-диF
3,4-диСl
22
5,7-диСl
3-СF3О
23
6,7-диСl
3-СF3О
24
5,7-диF
3-СF3О
25
5-Ме, 7-F
3-СF3
26
6,7-диСl
4-СF3О
27
5-Ме, 7-F
4-СF3О
28
5,7-диСl
3,4-диСl
29
5-Ме, 7-F
3,4-диСl
30
7-Сl
3,4-диСl
31
7-Сl
3,4-диF
32
6,7-диСl
3,4-диF
33
5,7-диF
3,4-диF
34
7-F
3,4-диСl
35
5,7-диСl
3,4-диF
36
5-CN
4-Сl
37
5-MeS
4-Сl
38
5,7-диСl
3-Сl
39
5-Ме
4-Сl
40
5-Сl, 7-Ме
4-Сl
41
6,7-диСl
3-Сl
42
5,7-диМе
4-Сl
43
7-F
4-Сl
44
5,7-диF
4-Сl
45
7-Сl
3-Сl
46
5-Ме, 7-F
3-Сl
47
7-СF3
3-Сl
48
5,7-диF
3-Сl
49
5,7-диСl
3-СF3
50
6,7-диСl
3-СF3
51
5,7-диF
3-СF3
52
5-Ме, 7-F
3,4-диF
53
5,7-диСl
4-СF3
54
5,7-диF
4-СF3
55
5-Ме, 7-F
4-СF3
56
5-Сl
4-CF3
57
5,7-диСl
3-F, 4-Сl
58
5-Ме, 7-F
3-F, 4-Сl
59
5-Ме, 7-F
3,5-диF
60
5,7-диСl
3,5-диF
61
5,7-диСl
4-Ме
62
5-Ме, 7-F
4-Ме
63
5-Сl, 7-Ме
4-Ме
64
5,7-диСl
3,4-диМе
65
5-Ме, 7-F
3,4-диМе
66
5-Сl, 7-Ме
3,4-диМе
67
5-Сl, 7-F
4-Сl
68
5-СF3О
4-МеО, 3-Сl
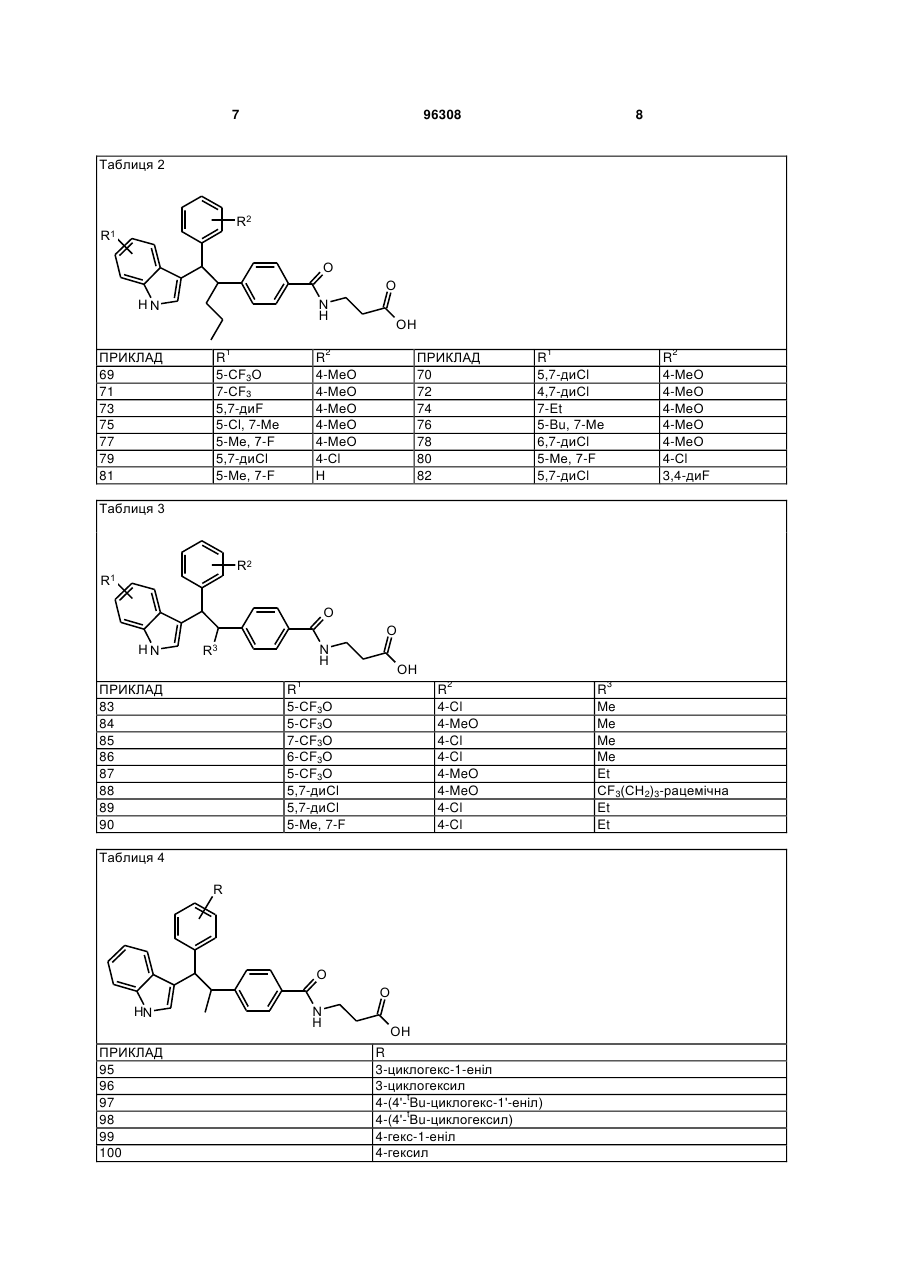
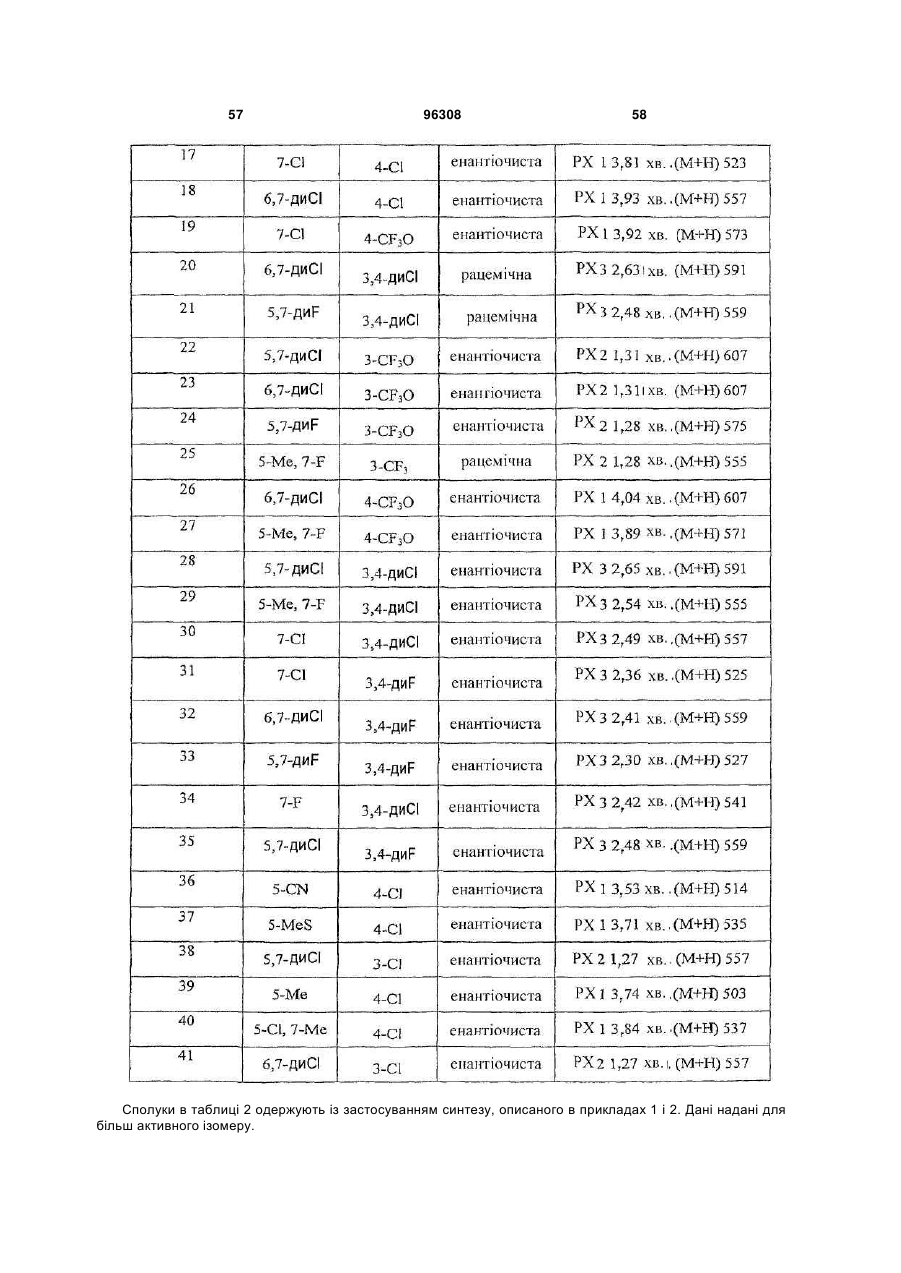
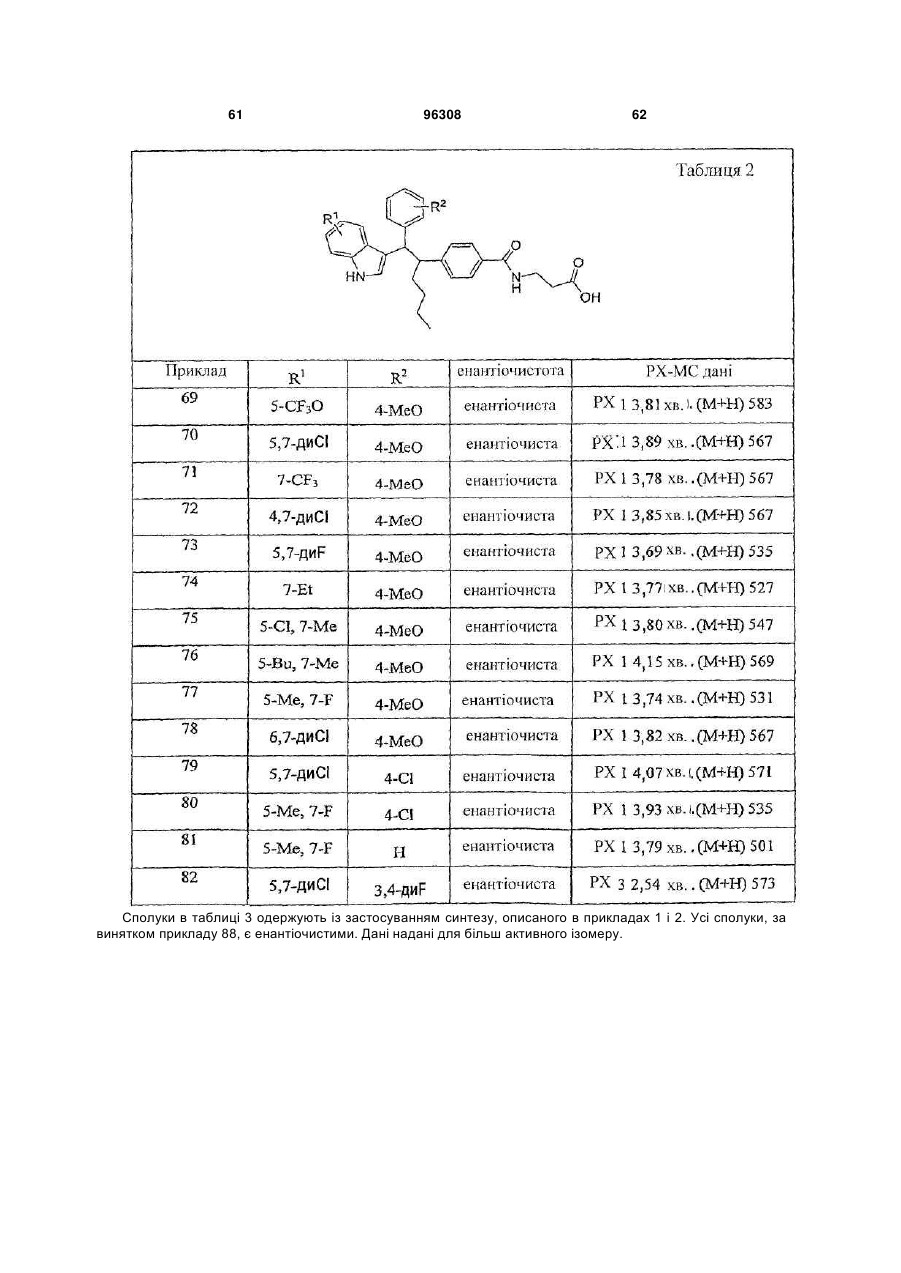
Таблиця 2

ПРИКЛАД
R1
R2
ПРИКЛАД
R1
R2
69
5-СF3О
4-МеО
70
5,7-диСl
4-МеО
71
7-СF3
4-МеО
72
4,7-диСl
4-МеО
73
5,7-диF
4-МеО
74
7-Et
4-МеО
75
5-Сl, 7-Ме
4-МеО
76
5-Bu, 7-Ме
4-МеО
77
5-Ме, 7-F
4-МеО
78
6,7-диСl
4-МеО
79
5,7-диСl
4-Сl
80
5-Ме, 7-F
4-Сl
81
5-Ме, 7-F
Н
82
5,7-диСl
3,4-диF
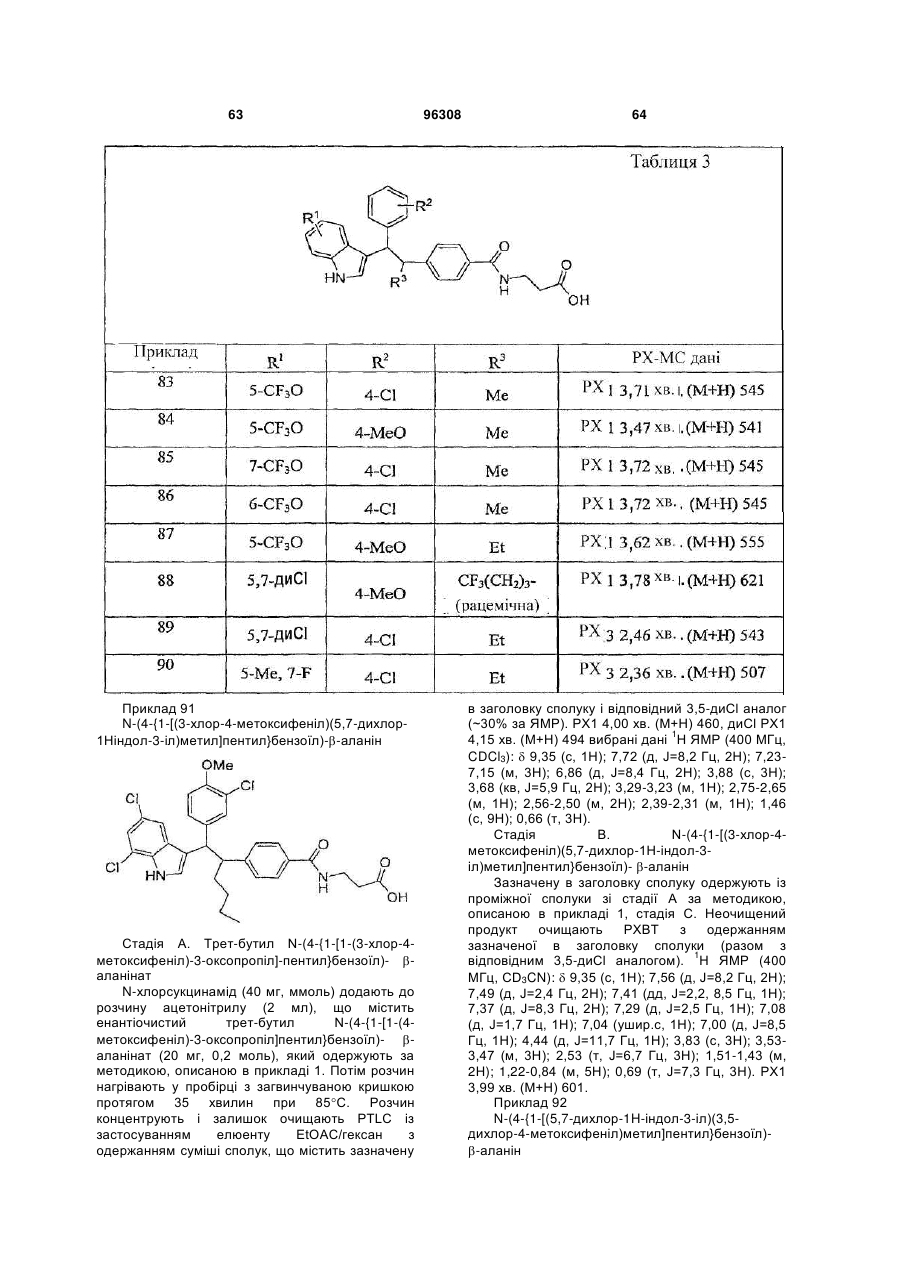
Таблиця 3
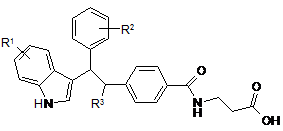
ПРИКЛАД
R1
R2
R3
83
5-СF3О
4-Cl
Me
84
5-СF3О
4-MeO
Me
85
7-СF3О
4-Cl
Me
86
6-СF3О
4-Cl
Me
87
5-СF3О
4-MeO
Et
88
5,7-диСl
4-MeO
СF3(СН2)3-рацемічна
89
5,7-диСl
4-Cl
Et
90
5-Ме, 7-F
4-Cl
Et
Таблиця 4

ПРИКЛАД
R
95
3-циклогекс-1-еніл
96
3-циклогексил
97
4-(4'-tBu-циклoгeкc-1'-еніл)
98
4-(4'-tВu-циклогексил)
99
4-гекс-1-еніл
100
4-гексил
Таблиця 5

ПРИКЛАД
R1
R2
R3
R4
103 (рацемічна)
Me
4-Cl
Bn
H
104 (рацемічна)
n-Pr
4-Сl
n-Pr
5,7-диСl
105 (енантіомер 1)
n-Pr
4-CF3O
Me
5,7-диСl
106 (енантіомер 2)
n-Pr
4-СF3О
Me
5,7-диСl
107 (енантіомер 1)
n-Bu
4-MeO
Me
5.7-диСl
108 (енантіомер 2)
n-Bu
4-MeO
Me
5,7-диСl
Таблиця 6
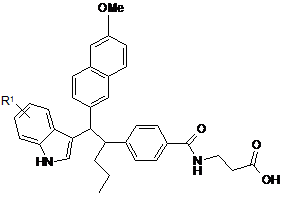
ПРИКЛАД
R1
ПРИКЛАД
R1
109
7-Сl
110
5-Сl
111
5-СF3О
112
5,7-диСl
113
6,7-диСl
114
5-Ме, 7-F
115
7-СF3
або її фармацевтично прийнятні солі або сольвати.
14. Фармацевтична композиція, яка містить сполуку за п. 1 у сполученні з фармацевтично прийнятним носієм.
15. Спосіб лікування цукрового діабету 2 типу у ссавця, що потребує такого лікування, який включає введення зазначеному пацієнту сполуки за п. 1 у кількості, ефективній для лікування зазначеного цукрового діабету 2 типу.
16. Спосіб затримання настання цукрового діабету 2 типу у ссавця, що потребує цього, який включає введення зазначеному пацієнту сполуки за п. 1 у кількості, ефективній для затримання настання цукрового діабету 2 типу.
17. Спосіб лікування гіперглікемії, діабету або резистентності до інсуліну у ссавця, що потребує такого лікування, який включає введення зазначеному пацієнту ефективної кількості сполуки за п. 1.
18. Спосіб лікування інсулінонезалежного цукрового діабету у ссавця, що потребує такого лікування, який включає введення зазначеному пацієнту ефективної протидіабетичної кількості сполуки за п. 1.
19. Спосіб лікування ожиріння у ссавця, що потребує такого лікування, який включає введення зазначеному пацієнту сполуки за п. 1 у кількості, ефективній для лікування ожиріння.
20. Спосіб лікування синдрому Х у ссавця, що потребує такого лікування, який включає введення зазначеному пацієнту сполуки за п. 1 у кількості, ефективній для лікування синдрому X.
21. Спосіб лікування жирового розладу, вибраного з групи, що складається з дисліпідемії, гіперліпідемії, гіпертригліцеридемії, гіперхолестеринемії, низького ЛПВГ і високого ЛПНГ у ссавця, що потребує такого лікування, який включає введення зазначеному пацієнту сполуки за п. 1 у кількості, ефективній для лікування зазначених жирових розладів.
22. Спосіб лікування атеросклерозу у ссавця, що потребує такого лікування, який включає введення зазначеному пацієнту сполуки за п. 1 у кількості, ефективній для лікування атеросклерозу.
23. Спосіб лікування стану, вибраного з групи, що складається з (1) гіперглікемії, (2) низкої стійкості до глюкози, (3) резистентності до інсуліну, (4) ожиріння, (5) жирових розладів, (6) дисліпідемії, (7) гіперліпідемії, (8) гіпертригліцеридемії, (9) гіперхолестеринемії, (10) низьких рівнів ЛПВГ, (11) високих рівнів ЛПНГ, (12) атеросклерозу і його ускладнень, (13) судинного рестенозу, (14) панкреатиту, (15) ожиріння черевної порожнини, (16) нейродегенеративного захворювання, (17) ретинопатії, (18) нефропатії, (19) невропатії, (20) синдрому Х і інших станів і захворювань, компонентом яких є резистентність до інсуліну, у ссавця, що потребує такого лікування, який включає введення зазначеному пацієнту сполуки за п. 1 у кількості, ефективній для лікування зазначеного стану.
Текст
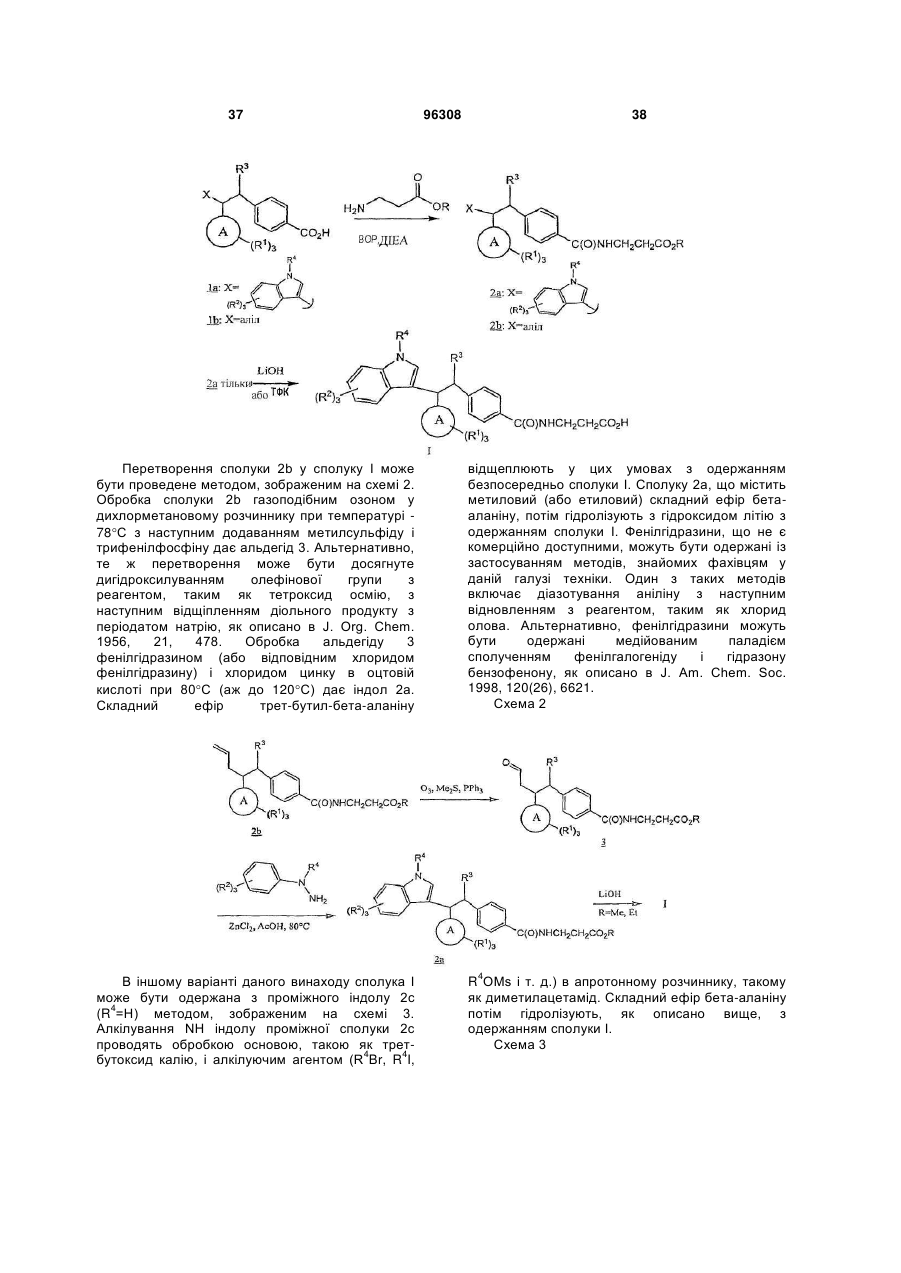
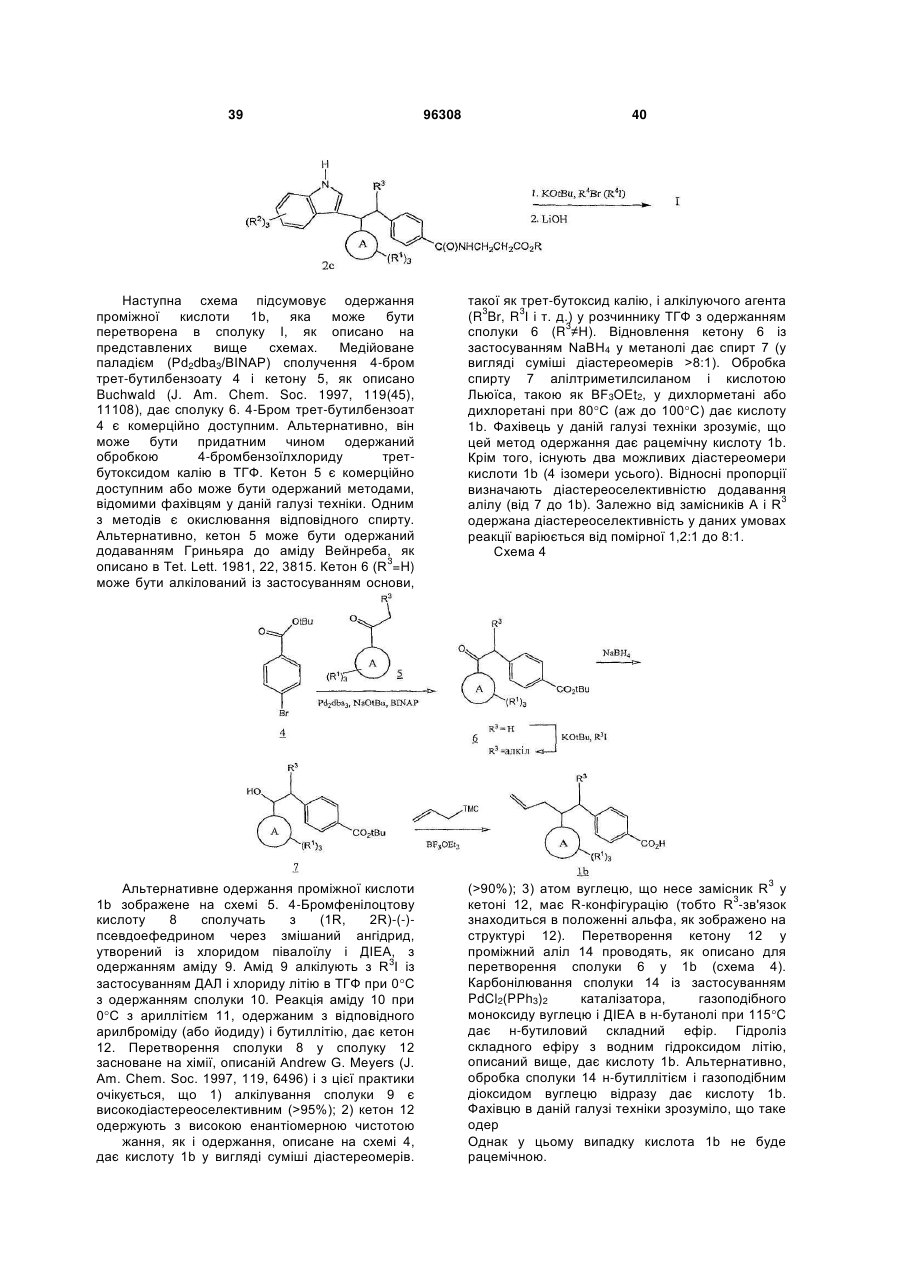
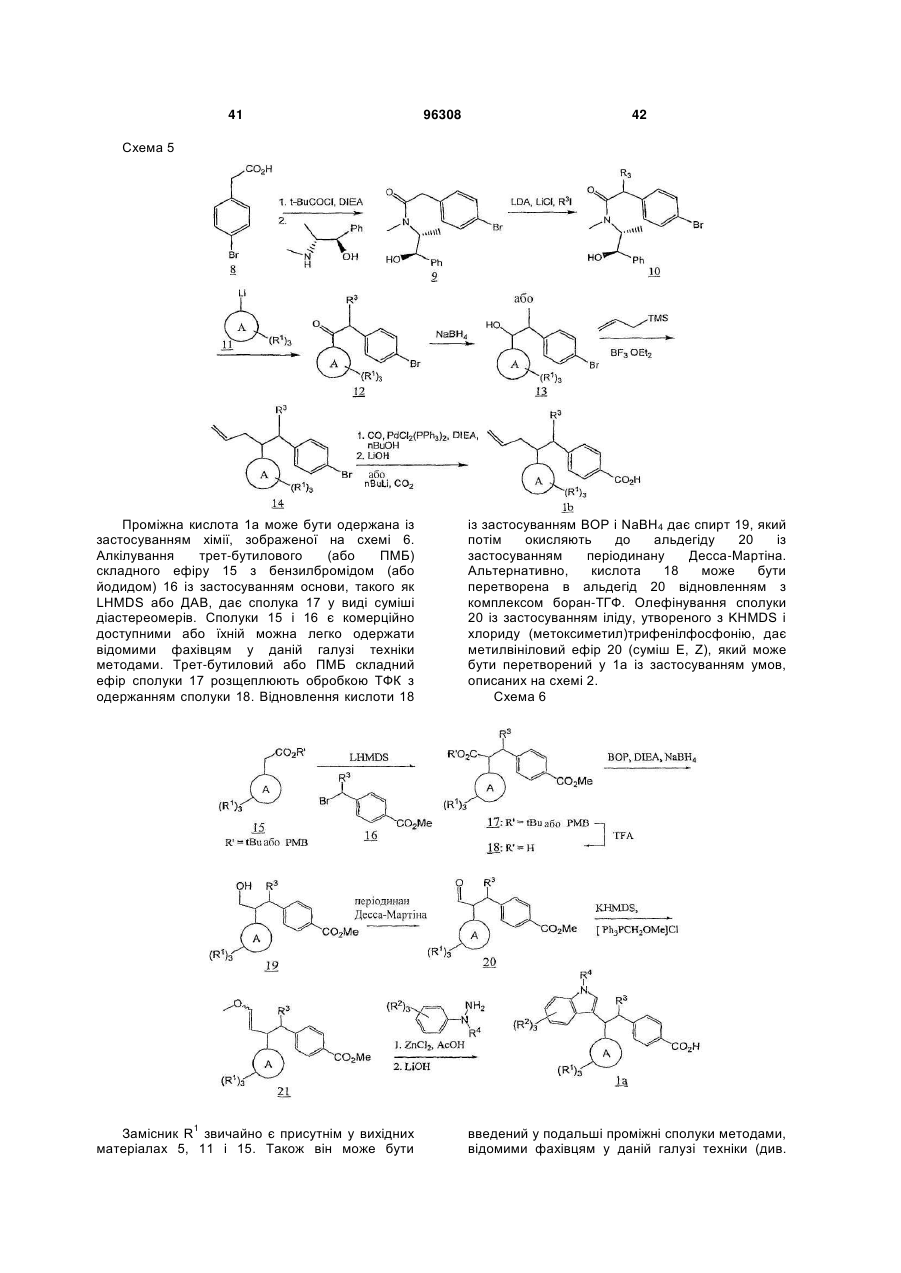
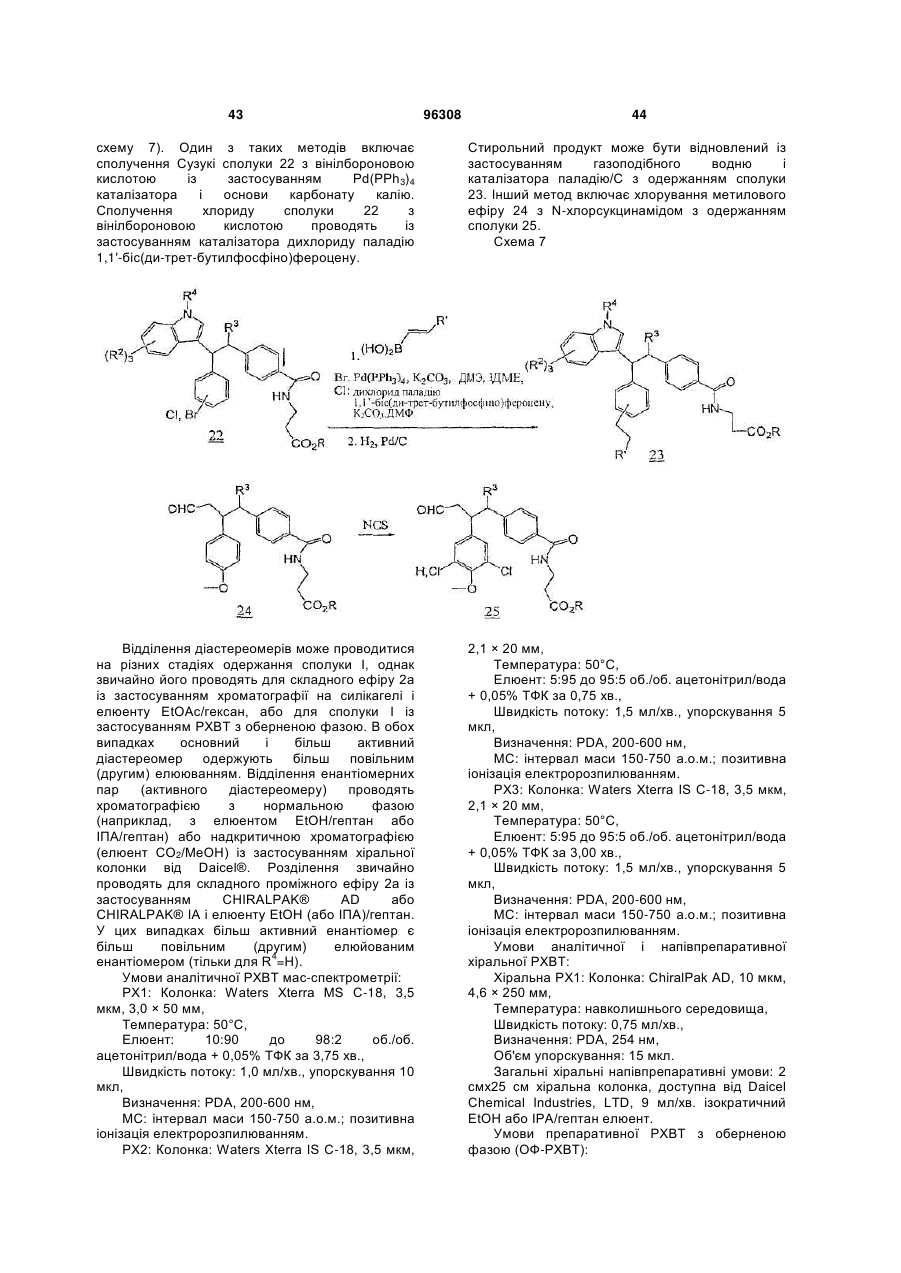
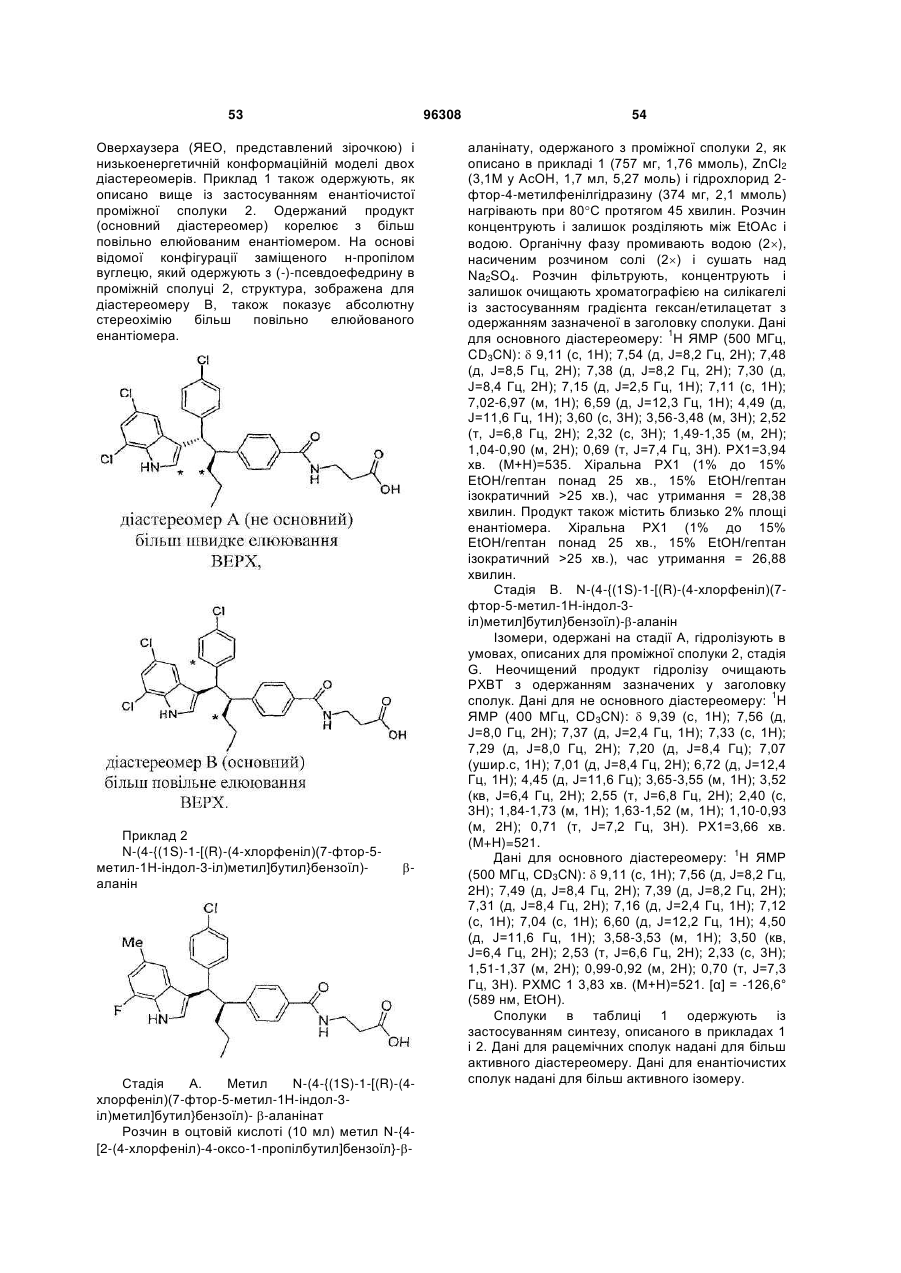
інгібітори 11β HSD-1 (11-бетагідроксистероїдної дегідрогенази 1), такі як BVT 3498, BVT 2733, і такі, як описані в WO 01/90091, WO 01/90090, WO 01/90092, і патенті № US 6730690 і публікації США № 2004-0133011, що включені сюди як посилання повністю; і (58) амінорекс; (59) амфехлорал; (60) амфетамін; (61) бензфетамін; (62) хлорфентермін; (63) клобензорекс; (64) клофорекс; (65) кломінорекс; (66) клортермін; (67) циклекседрин; (68) декстроамфетамін; (69) дифеметоксидин, (70) N-етиламфетамін; (71) фенбутразат; (72) фенізорекс; (73) фенпропорекс; (74) флудорекс; (75) флумінорекс; (76) фурфурилметиламфетамін; (77) левамфетамін; (78) левофацетоперан; (79) мефенорекс; (80) метамфепрамон; (81) метамфетамін; (82) норпсевдоефедрин; (83) пенторекс; (84) фендиметразин; (85) фенметразин; (86) піцилорекс; (87) фітофарм 57; (88) зонізамід, (89) нейромедин U і його аналоги або похідні, (90) оксинтомодулін і його аналоги або похідні, (91) антагоністи рецептора нейрокініну-1 (антагоністи NK-1), такі, як описані в патентах США № 5162339, 5232929, 5242930, 5373003, 5387595, 5459270, 5494926, 5496833 і 5637699; і 96308 22 (92) Кнекса; і (e) агенти, що сприяють відмові від паління, такі як агоніст нікотину або частковий агоніст нікотину, такий як вареніклін, або інгібітор моноаміноксидази (MAOI), або інший активний інгредієнт, який демонструє ефективність у сприянні відмові від паління тютюну; наприклад, антидепресант, такий як, біпропіон, доксепін, орнортриптилін; або анксиолітик, такий як біспірон або клонідин. Конкретні сполуки, застосовувані в сполученні зі сполукою відповідно до даного винаходу, включають симвастатин, мевастатин, езетиміб, аторвастатин, ситагліптин, метформін, сибутрамін, орлістат, Кнексу, топірамат, налтрексон, буприопіон, фентермін і лозартан, лозартан з гідрохлортіазидом. Конкретні антагоністи/зворотні агоністи СВ1, застосовувані в сполученні зі сполукою відповідно до даного винаходу, включають описані в WO 03/077847, включаючи: N-[3-(4-хлорфеніл)-2(S)-феніл-1(S)-метилпропіл]-2(4-трифторметил-2-піримідилокси)-2метилпропанамід, N-[3-(4-хлорфеніл)-2-(3ціанофеніл)-1-метилпропіл]-2-(5-трифторметил-2піридилокси)-2-метилпропанамід, N-[3-(4хлорфеніл)-2-(5-хлор-3-піридил)-1-метилпропіл]-2(5-трифторметил-2-піридилокси)-2метилпропанамід і їх фармацевтично прийнятні солі; а також описані в WO 05/000809, що включають 3-{1-[біс(4-хлорфеніл)метил]азетидин3-іліден}-3-(3,5-дифторфеніл)-2,2диметилпропаннітрил, 1-{1-[1-(4-хлорфеніл)пентил]азетидин-3-іл}-1-(3,5-дифторфеніл)-2метилпропан-2-ол, 3-((S)-(4-хлорфеніл){3-[(1S)-1(3,5-дифторфеніл)-2-гідрокси-2метилпропіл]азетидин-1-іл}метил)бензонітрил, 3((S)-(4-хлорфеніл){3-[(1S)-1-(3,5-дифторфеніл)-2фтор-2-метилпропіл]азетидин-1іл}метил)бензонітрил, 3-((4-хлорфеніл){3-[1-(3,5дифторфеніл)-2,2-диметилпропіл]азетидин-1іл}метил)бензонітрил, 3-((1S)-1-{1-[(S)-(3ціанофеніл)(4-ціанофеніл)метил]азетидин-3-іл}-2фтор-2-метилпропіл)-5-фторбензонітрил, 3-[(S)-(4хлорфеніл)(3-{(1S)-2-фтор-1-[3-фтор-5-(4H-1,2,4триазол-4-іл)феніл]-2-метилпропіл}азетидин-1іл)метил]бензонітрил і 5-((4-хлорфеніл){3-[(1S)-1(3,5-дифторфеніл)-2-фтор-2метилпропіл]азетидин-1-іл}метил)тіофен-3карбонітрил і їх фармацевтично прийнятні солі; а також 3-[(S)-(4-хлорфеніл)(3-{(1S)-2-фтор-1-[3фтор-5-(5-оксо-4,5-дигідро-1,3,4-оксадіазол-2іл)феніл]-2-метилпропіл}азетидин-1іл)метил]бензонітрил, 3-[(S)-(4-хлорфеніл)(3-{(1S)2-фтор-1-[3-фтор-5-(1,3,4-оксадіазол-2-іл)феніл]-2метилпропіл}азетидин-1-іл)метил]бензонітрил, 3[(S)-(3-{(1S)-1-[3-(5-аміно-1,3,4-оксадіазол-2-іл)-5фторфеніл]-2-фтор-2-метилпропіл}азетидин-1іл)(4-хлорфеніл)метил]бензонітрил, 3-[(S)-(4ціанофеніл)(3-{(1S)-2-фтор-1-[3-фтор-5-(5-оксо-4,5дигідро-1,3,4-оксадіазол-2-іл)феніл]-2метилпропіл}азетидин-1-іл)метил]бензонітрил, 3[(S)-(3-{(1S)-1-[3-(5-аміно-1,3,4-оксадіазол-2-іл)-5фторфеніл]-2-фтор-2-метилпропіл}азетидин-1іл)(ціанофеніл)метил]бензонітрил, 3-[(S)-(4ціанофеніл)(3-{(1S)-2-фтор-1-[3-фтор-5-(1,3,4 23 оксадіазол-2-іл)феніл]-2-метилпропіл}азетидин-1іл)метил]бензонітрил, 3-[(S)-(4-хлорфеніл)(3-{(1S)2-фтор-1-[3-фтор-5-(1,2,4-оксадіазол-3-іл)феніл]-2метилпропіл}азетидин-1-іл)метил]бензонітрил, 3[(1S)-1-(1-{(S)-(4-ціанофеніл)[3-(1,2,4-оксадіазол-3іл)феніл]метил}азетидин-3-іл)-2-фтор-2метилпропіл]-5-фторбензонітрил, 5-(3-{1-[1(дифенілметил)азетидин-3-іл]-2-фтор-2метилпропіл}-5-фторфеніл)-1H-тетразол, 5-(3-{1[1-(дифенілметил)азетидин-3-іл]-2-фтор-2метилпропіл}-5-фторфеніл)-1-метил-1H-тетразол, 5-(3-{1-{1-(дифенілметил)азетидин-3-іл]-2-фтор-2метилпропіл}-5-фторфеніл)-2-метил-2Н-тетразол, 3-[(4-хлорфеніл)(3-{2-фтор-1-[3-фтор-5-(2-метил2H-тетразол-5-іл)феніл]-2-метилпропіл}азетидин1-іл)метил]бензонітрил, 3-[(4-хлорфеніл)(3-{2фтор-1-[3-фтор-5-(1-метил-1H-тетразол-5іл)феніл]-2-метилпропіл}азетидин-1іл)метил]бензонітрил; 3-[(4-ціанофеніл)(3-{2-фтор1-[3-фтор-5-(1-метил-1H-тетразол-5-іл)феніл]-2метилпропіл}азетидин-1-іл)метил]бензонітрил, 3[(4-ціанофеніл)(3-{2-фтор-1-[3-фтор-5-(2-метил-2Hтетразол-5-іл)феніл]-2-метилпропіл}азетидин-1іл)метил]бензонітрил, 5-{3-[(S)-{3-[(1S)-1-(3-бром-5фторфеніл)-2-фтор-2-метилпропіл]азетидин-1іл}(4-хлорфеніл)метил]феніл}-1,3,4-оксадіазол2(3H)-он, 3-[(1S)-1-(1-{(S)-(4-хлорфеніл)[3-(5-оксо4,5-дигідро-1,3,4-оксадіазол-2іл)феніл]метил}азетидин-3-іл)-2-фтор-2метилпропіл]-5-фторбензонітрил, 3-[(1S)-1-(1-{(S)(4-ціанофеніл)[3-(5-оксо-4,5-дигідро-1,3,4оксадіазол-2-іл)феніл]метил}азетидин-3-іл)-2фтор-2-метилпропіл]-5-фторбензонітрил, 3-[(1S)-1(1-{(S)-(4-ціанофеніл)[3-(1,3,4-оксадіазол-2іл)феніл]метил}азетидин-3-іл)-2-фтор-2метилпропіл]-5-фторбензонітрил, 3-[(1S)-1-(1-{(S)(4-хлорфеніл)[3-(1,3,4-оксадіазол-2іл)феніл]метил}азетидин-3-іл)-2-фтор-2метилпропіл]-5-фторбензонітрил, 3-((1S)-1-{1-[(S)[3-(5-аміно-1,3,4-оксадіазол-2-іл)феніл](4хлорфеніл)метил]азетидин-3-іл}-2-фтор-2метилпропіл)-5-фторбензонітрил, 3-((1S)-1-{1-[(S)[3-(5-аміно-1,3,4-оксадіазол-2-іл)феніл](4ціанофеніл)метил]азетидин-3-іл}-2-фтор-2метилпропіл)-5-фторбензонітрил, 3-[(1S)-1-(1-{(S)(4-ціанофеніл)[3-(1,2,4-оксадіазол-3іл)феніл]метил}азетидин-3-іл)-2-фтор-2метилпропіл]-5-фторбензонітрил, 3-[(1S)-1-(1-{(S)(4-хлорфеніл)[3-(1,2,4-оксадіазол-3іл)феніл]метил}азетидин-3-іл)-2-фтор-2метилпропіл]-5-фторбензонітрил, 5-[3-((S)-(4хлорфеніл){3-[(1S)-1-(3,5-дифторфеніл)-2-фтор-2метилпропіл]азетидин-1-іл}метил)феніл]-1,3,4оксадіазол-2(3H)-он, 5-[3-((S)-(4-хлорфеніл){3[(1S)-1-(3,5-дифторфеніл)-2-фтор-2метилпропіл]азетидин-1-іл}метил)феніл]-1,3,4оксадіазол-2(3H)-он, 4-{(S)-{3-[(1S)-1-(3,5дифторфеніл)-2-фтор-2-метилпропіл]азетидин-1іл}[3-(5-оксо-4,5-дигідро-1,3,4-оксадіазол-2іл)феніл]метил}бензонітрил і їх фармацевтично прийнятні солі. Конкретні антагоністи NPY5, застосовувані в сполученні зі сполукою відповідно до даного винаходу, включають 3-оксо-N-(5-феніл-2піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин] 96308 24 1'-карбоксамід, 3-оксо-N-(7трифторметилпіридо[3,2-b]піридин-2іл)спіро[ізобензофуран-1(3H),4'-піперидин]-1'карбоксамід, N-[5-(3-фторфеніл)-2-піримідиніл]-3оксоспіро-[ізобензофуран-1(3H),4'-піперидин]-1'карбоксамід, транс-3'-оксо-N-(5-феніл-2піримідиніл)спіро[циклогексан-1,1'(3'H)ізобензофуран]-4-карбоксамід, транс-3'-оксо-N-[1(3-хіноліл)-4-імідазоліл]спіро[циклогексан-1,1'(3'Н)ізобензофуран]-4-карбоксамід, транс-3-оксо-N-(5феніл-2-піразиніл)спіро[4-азаізобензофуран1(3H),1'-циклогексан]-4'-карбоксамід, транс-N-[5-(3фторфеніл)-2-піримідиніл]-3-оксоспіро[5азаізобензофуран-1(3H),1'-циклогексан]-4'карбоксамід, транс-N-[5-(2-фторфеніл)-2піримідиніл]-3-оксоспіро[5-азаізобензофуран1(3H),1'-циклогексан]-4'-карбоксамід, транс-N-[1(3,5-дифторфеніл)-4-імідазоліл]-3-оксоспіро[7азаізобензофуран-1(3H),1'-циклогексан]-4'карбоксамід, транс-3-оксо-N-(1-феніл-4піразоліл)спіро[4-азаізобензофуран-1(3H),1'циклогексан]-4'-карбоксамід, транс-N-[1-(2фторфеніл)-3-піразоліл]-3-оксоспіро[6азаізобензофуран-1(3H),1'-циклогексан]-4'карбоксамід, транс-3-оксо-N-(1-феніл-3піразоліл)спіро[6-азаізобензофуран-1(3H),1'циклогексан]-4'-карбоксамід, транс-3-оксо-N-(2феніл-1,2,3-триазол-4-іл)спіро[6азаізобензофуран-1(3H),1'-циклогексан]-4'карбоксамід і їх фармацевтично прийнятні солі. Конкретні інгібітори ACC-1/2, застосовувані в сполученні зі сполукою відповідно до даного винаходу, включають 1'-[(4,8-диметоксихінолін-2іл)карбоніл]-6-(1H-тетразол-5-іл)спіро[хроман-2,4'піперидин]-4-он; півалат (5-{1'-[(4,8диметоксихінолін-2-іл)карбоніл]-4оксоспіро[хроман-2,4'-піперидин]-6-іл}-2Hтетразол-2-іл)метилу; 5-{1'-[(8-циклопропіл-4метоксихінолін-2-іл)карбоніл]-4-оксоспіро[хроман2,4'-піперидин]-6-іл}нікотинова кислота; 1'-(8метокси-4-морфолін-4-іл-2-нафтоїл)-6-(1Hтетразол-5-іл)спіро[хроман-2,4'-піперидин]-4-он; і 1'-[(4-етоксі-8-етилхінолін-2-іл)карбоніл]-6-(1Hтетразол-5-іл)спіро[хроман-2,4'-піперидин]-4-он і їх фармацевтично прийнятні солі і складні ефіри. Конкретні антагоністи MCН1R сполук, застосовувані в сполученні зі сполукою відповідно до даного винаходу, включають 1-{4-[(1етилазетидин-3-іл)окси]феніл}-4-[(4фторбензил)окси]піридин-2(1Н)-он, 4-[(4фторбензил)оксі]-1-{4-[(1-ізопропілазетидин-3іл)окси]феніл}піридин-2(1H)-он, 1-[4-(азетидин-3ілокси)феніл]-4-[(5-хлорпіридин-2іл)метокси]піридин-2(1H)-он, 4-[(5-хлорпіридин-2іл)метоксі]-1-{4-[(1-етилазетидин-3іл)окси]феніл}піридин-2(1H)-он, 4-[(5-хлорпіридин2-іл)метокси]-1-{4-[(1-пропілазетидин-3іл)окси]феніл}-піридин-2(1H)-он і 4-[(5хлорпіридин-2-іл)метокси]-1-(4-{[(2S)-1етилазетидин-2-іл]метокси}феніл)піридин-2(1H)-он або їх фармацевтично прийнятні солі. Конкретні інгібітори DP-IV, застосовувані в сполученні зі сполукою відповідно до даного винаходу, вибирають з 7-[(3R)-3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8 25 тетрагідро-1,2,4-триазолo[4,3-a]піразину. Зокрема, сполуку формули I переважно об'єднують з 7[(3R)-3-аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3(трифторметил)-5,6,7,8-тетрагідро-1,2,4триазолo[4,3-a]піразином і його фармацевтично прийнятною сіллю. Конкретні антагоністи/зворотні агоністи H3 (гістаміну H3), застосовувані в сполученні зі сполукою відповідно до даного винаходу, включають описані в WO 05/077905, включаючи 3{4-[(1-циклобутил-4-піперидиніл)окси]феніл}-2етилпіридо[2,3-d]-піримідин-4(3H)-он, 3-{4-[(1циклобутил-4-піперидиніл)окси]феніл}-2метилпіридо[4,3-d]піримідин-4(3H)-он, 2-етил-3-(4{3-[(3S)-3-метилпіперидин-1іл]пропокси}феніл)піридо[2,3-d]піримідин-4(3H)-он, 2-метил-3-(4-{3-[(3S)-3-метилпіперидин-1іл]пропокси}феніл)піридо[4,3-d]піримідин-4(3H)-он, 3-{4-[(1-циклобутил-4-піперидиніл)окси]феніл}-2,5диметил-4(3H)-хіназолінон, 3-{4-[(1-циклобутил-4піперидиніл)окси]феніл}-2-метил-5-трифторметил4(3H)-хіназолінон, 3-{4-[(1-циклобутил-4піперидиніл)окси]феніл}-5-метокси-2-метил-4(3H)хіназолінон, 3-{4-[(1-циклобутилпіперидин-4іл)окси]феніл}-5-фтор-2-метил-4(3H)-хіназолінон, 3-{4-[(1-циклобутилпіперидин-4-іл)окси]феніл}-7фтор-2-метил-4(3H)-хіназолінон, 3-{4-[(1циклобутилпіперидин-4-іл)окси]феніл}-6-метокси2-метил-4(3H)-хіназолінон, 3-{4-[(1циклобутилпіперидин-4-іл)окси]феніл}-6-фтор-2метил-4(3H)-хіназолінон, 3-{4-[(1циклобутилпіперидин-4-іл)окси]феніл}-8-фтор-2метил-4(3H)-хіназолінон, 3-{4-[(1-циклопентил-4піперидиніл)окси]феніл}-2-метилпіридо[4,3d]піримідин-4(3H)-он, 3-{4-[(1циклобутилпіперидин-4-іл)окси]феніл}-6-фтор-2метилпіридо[3,4-d]піримідин-4(3H)-он, 3-{4-[(1циклобутил-4-піперидиніл)окси]феніл}-2етилпіридо[4,3-d]піримідин-4(3H)-он, 6-метокси-2метил-3-{4-[3-(1піперидиніл)пропокси]феніл}піридо[3,4d]піримідин-4(3H)-он, 6-метокси-2-метил-3-{4-[3-(1піролідиніл)пропокси]феніл}піридо[3,4-d]піримідин4(3H)-он, 2,5-диметил-3-{4-[3-(1піролідиніл)пропокси]феніл}-4(3H)-хіназолінон, 2метил-3-{4-[3-(1-піролідиніл)пропокси]феніл}-5трифторметил-4(3H)-хіназолінон, 5-фтор-2-метил3-{4-[3-(1-піперидиніл)пропокси]феніл}-4(3H)хіназолінон, 6-метокси-2-метил-3-{4-[3-(1піперидиніл)пропокси]феніл}-4(3H)-хіназолінон, 5метокси-2-метил-3-(4-{3-[(3S)-3-метилпіперидин-1іл]пропокси}феніл)-4(3H)-хіназолінон, 7-метокси-2метил-3-(4-{3-[(3S)-3-метилпіперидин-1іл]пропокси}феніл)-4(3H)-хіназолінон, 2-метил-3(4-{3-[(3S)-3-метилпіперидин-1-іл]пропокси}феніл)піридо[2,3-d]піримідин-4(3H)-он, 5-фтор-2-метил-3(4-{3-[(2R)-2-метилпіролідин-1-іл]пропокси}феніл)4(3H)-хіназолінон, 2-метил-3-(4-{3-[(2R)-2метилпіролідин-1-іл]пропокси}феніл)піридо[4,3d]піримідин-4(3H)-он, 6-метокси-2-метил-3-(4-{3[(2R)-2-метилпіролідин-1-іл]пропокси}феніл)-4(3H)хіназолінон, 6-метокси-2-метил-3-(4-{3-[(2S)-2метилпіролідин-1-іл]пропокси}феніл)-4(3H)хіназолінон і їх фармацевтично прийнятні солі. Конкретні агоністи CCK1R, застосовувані в 96308 26 сполученні зі сполукою відповідно до даного винаходу, включають 3-(4-{[1-(3-етоксифеніл)-2-(4метилфеніл)-1H-імідазол-4-іл]карбоніл}-1піперазиніл)-1-нафтойну кислоту; 3-(4-{[1-(3етоксифеніл)-2-(2-фтор-4-метилфеніл)-1Німідазол-4-іл]карбоніл}-1-піперазиніл)-1-нафтойну кислоту; 3-(4-{[1-(3-етоксифеніл)-2-(4-фторфеніл)1H-імідазол-4-іл]карбоніл}-1-піперазиніл)-1нафтойну кислоту; 3-(4-{[1-(3-етоксифеніл)-2-(2,4дифторфеніл)-1H-імідазол-4-іл]карбоніл}-1піперазиніл)-1-нафтойну кислоту і 3-(4-{[1-(2,3дигідро-1,4-бензодіоксин-6-іл)-2-(4-фторфеніл)-1Hімідазол-4-іл]карбоніл}-1-піперазиніл)-1-нафтойну кислоту і їх фармацевтично прийнятні солі. Конкретні агоністи MC4R, застосовувані в сполученні зі сполукою відповідно до даного винаходу, включають 1) (5S)-1'-{[(3R, 4R)-1-третбутил-3-(2,3,4-трифторфеніл)піперидин-4іл]карбоніл}-3-хлор-2-метил-5-[1-метил-1-(1-метил1H-1,2,4-триазол-5-іл)етил]-5H-спіро[фуро[3,4b]піридин-7,4'-піперидин]; 2) (5R)-1’-{[(3R, 4R)-1трет-бутил-3-(2,3,4-трифторфеніл)піперидин-4іл]карбоніл}-3-хлор-2-метил-5-[1-метил-1-(1-метил1Н-1,2,4-триазол-5-іл)етил]-5H-спіро[фуро[3,4b]піридин-7,4'-піперидин]; 3) 2-(1'-{[(3S, 4R)-1-третбутил-4-(2,4-дифторфеніл)піролідин-3іл]карбоніл}-3-хлор-2-метил-5H-спіро[фуро[3,4b]піридин-7,4'-піперидин]-5-іл)-2метилпропаннітрил; 4) 1'-{[(3S, 4R)-1-трет-бутил-4(2,4-дифторфеніл)піролідин-3-іл]карбоніл}-3-хлор2-метил-5-[1-метил-1-(1-метил-1H-1,2,4-триазол-5іл)етил]-5H-спіро[фуро[3,4-b]піридин-7,4'піперидин]; 5) N-[(3R, 4R)-3-({3-хлор-2-метил-5-[1метил-1-(1-метил-1Н-1,2,4-триазол-5-іл)етил]-1'H, 5H-спіро[фуро[3,4-b]піридин-7,4'-піперидин]-1'іл}карбоніл-4-(2,4-дифторфеніл)циклопентил]-Nметилтетрагідро-2H-піран-4-амін; 6) 2-[3-хлор-1'({(1R, 2R)-2-(2,4-дифторфеніл)-4[метил(тетрагідро-2H-піран-4іл)аміно]циклопентил}карбоніл)-2-метил-5Hспіро[фуро[3,4-b]піридин-7,4'-піперидин]-5-іл]-2метилпропаннітрил і їх фармацевтично прийнятні солі. Далі, антагоністи рецептора нейрокініну-1 (NK-1) можуть переважно застосовуватися зі сполукою відповідно до даного винаходу. Антагоністи рецептора NK-1, застосовувані відповідно до даного винаходу, описані в даній галузі техніки. Конкретні антагоністи рецептора нейрокініну-1, застосовувані в сполученні зі сполукою відповідно до даного винаходу, включають (±)-(2R3R, 2S3S)-N-{[2-циклопропокси5-(трифторметокси)феніл]метил}-2фенілпіперидин-3-амін; 2-(R)-(1-(R)-(3,5біс(трифторметил)феніл)етокси)-3-(S)-(4фторфеніл)-4-(3-(5-оксо-1Н, 4H-1,2,4триазолo)метил)морфолін; аперпітант; CJ17493; GW597599; GW679769; R673; RO67319; R1124; R1204; SSR146977; SSR240600; T-2328 і T2763 або їх фармацевтично прийнятні солі. Приклади інших агентів проти ожиріння, які можуть застосовуватися в сполученні зі сполукою формули I, описані в "Patent focus on new antiobesity agents", Exp. Opin. Ther. Patents. 10: 819831 (2000); "Novel anti-obesity drugs", Exp. Opin. Invest. Drugs, 9: 1317-1326 (2000) і "Recent 27 advances in feeding suppressing agents: potential therapeutic strategy for the treatment of obesity", Exp. Opin. Ther. Patents. 11: 1677-1692 (2001). Роль нейропептиду Y в ожирінні описана в Exp. Opin. Invest. Drugs, 9: 1327-1346 (2000). Ліганди канабіноїдного рецептора описані в Exp. Opin. Invest. Drugs, 9: 1553-1571 (2000). Інший цікавий аспект даного винаходу стосується способу лікування стану, вибраного з групи, що складається з гіперхолестеринемії, атеросклерозу, низьких рівнів ЛПВГ, високих рівнів ЛПНГ, гіперліпідемії, гіпертригліцеридемії і дисліпідемії, у ссавців, що потребують такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору HMG-Co редуктази. Більш переважно, інший цікавий аспект даного винаходу стосується способу лікування стану, вибраного з групи, що складається з гіперхолестеринемії, атеросклерозу, низьких рівнів ЛПВГ, високих рівнів ЛПНГ, гіперліпідемії, гіпертригліцеридемії і дисліпідемії, у ссавців, що потребують такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору HMG-Co редуктази, де інгібітором HMG-Co редуктази є статин. Навіть більш переважно, інший цікавий аспект даного винаходу стосується способу лікування стану, вибраного з групи, що складається з гіперхолестеринемії, атеросклерозу, низьких рівнів ЛПВГ, високих рівнів ЛПНГ, гіперліпідемії, гіпертригліцеридемії і дисліпідемії, у ссавців, що потребують такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору HMG-Co редуктази, де інгібітором HMG-Co редуктази є статин, вибраний із групи, що складається з ловастатину, симвастатину, правастатину, флувастатину, аторвастатину, ітавастатину, ZD-4522 і ривастатину. Інший цікавий аспект даного винаходу стосується способу зниження ризику розвитку стану, вибраного з групи, що складається з гіперхолестеринемії, атеросклерозу, низьких рівнів ЛПВГ, високих рівнів ЛПНГ, гіперліпідемії, гіпертригліцеридемії і дисліпідемії, і ускладнень таких станів, який включає введення ссавцю, що потребує такого лікування, терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору HMG-Co редуктази. Інший цікавий аспект даного винаходу стосується способу затримання настання або зниження ризику розвитку атеросклерозу у людини, що потребує такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору HMG-Co редуктази. Більш переважно, інший цікавий аспект даного винаходу стосується способу затримання настання або зниження ризику розвитку атеросклерозу у людини, що потребує такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки 96308 28 формули I, такої, як описано вище, і інгібітору HMG-Co редуктази, де інгібітором HMG-Co редуктази є статин. Навіть більш переважно, інший цікавий аспект даного винаходу стосується способу затримання настання або зниження ризику розвитку атеросклерозу у людини, що потребує такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору HMG-Co редуктази, де інгібітором HMG-Co редуктази є статин, вибраний із групи, що складається з ловастатину, симвастатину, правастатину, флувастатину, аторвастатину, ітавастатину, ZD-4522 і ривастатину. Ще більш переважно, інший цікавий аспект даного винаходу стосується способу затримання настання або зниження ризику розвитку атеросклерозу у людини, що потребує такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору HMG-Co редуктази, де інгібітором HMG-Co редуктази є симвастатин. Інший цікавий аспект даного винаходу стосується способу затримання настання або зниження ризику розвитку атеросклерозу у людини, що потребує такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору абсорбції холестерину. Більш переважно, інший цікавий аспект даного винаходу стосується способу затримання настання або зниження ризику розвитку атеросклерозу у людини, що потребує такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору абсорбції холестерину, де інгібітором абсорбції холестерину є езетемібе. Інший цікавий аспект даного винаходу стосується способу затримання настання або зниження ризику розвитку інших зазначених вище захворювань і станів у ссавця, що потребує такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору абсорбції холестерину. Більш переважно, інший цікавий аспект даного винаходу стосується способу затримання настання або зниження ризику розвитку інших зазначених вище захворювань і станів у ссавця, що потребує такого лікування, який включає введення пацієнту терапевтично ефективних кількостей сполуки формули I, такої, як описано вище, і інгібітору абсорбції холестерину, де інгібітором абсорбції холестерину є езетемібе. Інший цікавий аспект даного винаходу стосується фармацевтичної композиції, яка складається з (1) сполуки формули I, описаної вище; (2) сполуки, вибраної зі списку, представленого вище, у сполученні з фармацевтично прийнятним носієм. Одна з розглянутих фармацевтичних композицій складається зі сполуки формули I, як 29 96308 описано вище, або її фармацевтично прийнятної солі або сольвату, у сполученні з інгібітором DPPIV, вибраним із групи, що включає , , , або її фармацевтично прийнятної солі або сольвату, у сполученні з фармацевтично прийнятним носієм. Оптичні ізомери - діастереомери - геометричні ізомери - таутомери Багато сполук формули I містять один або більше асиметричних центрів і, таким чином, існують у вигляді рацематів і рацемічних сумішей, окремих енантіомерів, діастереомерних сумішей і окремих діастереомерів. Даний винахід включає всі такі ізомерні форми сполук у чистому вигляді й у вигляді сумішей. Деякі з описаних сполук містять олефінові подвійні зв'язки і, якщо не зазначено інакше, включають обидва, E і Z, геометричних ізомери. Деякі з описаних сполук можуть існувати з різними місцями приєднання водню і називаються таутомерами. Таким прикладом може бути кетон і його енольна форма, відомі як кетоенольні 30 таутомери. Окремі таутомери, а також їх суміші охоплені сполуками формули I. Солі і сольвати Солі і сольвати сполук формули I включені в даний винахід. Термін "фармацевтично прийнятні солі" стосується солей, одержаних з фармацевтично прийнятних практично нетоксичних основ або кислот, включаючи неорганічні або органічні основи і неорганічні або органічні кислоти, а також солей, які можуть бути перетворені у фармацевтично прийнятні солі. Солі, одержані з неорганічних основ, включають алюмінієві, амонієві, кальцієві, мідні, залізні, залізисті, літієві, магнієві, марганцевисті, марганцюватисті, калієві, натрієві, цинкові і подібні. Особливо переважними є амонієві, кальцієві, магнієві, калієві і натрієві солі. Солі, одержані з фармацевтично прийнятних органічних нетоксичних основ, включають солі первинних, вторинних і третинних амінів, заміщених амінів, включаючи природні заміщені аміни, циклічних амінів і лужних іонообмінних смол, таких як аргінін, бетаїн, кофеїн, холін, N, N'-дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2диметиламіноетанол, етаноламін, етилендіамін, Nетилморфолін, N-етилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, поліамінінові смоли, прокаїн, пурини, теобромін, триетиламін, триметиламін, трипропіламін, трометамін і подібні. Якщо сполуки відповідно до даного винаходу є основними, солі можуть бути одержані з фармацевтично прийнятних нетоксичних кислот, включаючи неорганічні й органічні кислоти. Такі кислоти включають оцтову, бензолсульфонову, бензойну, камфорсульфонову, лимонну, етансульфонову, фумарову, глюконову, глутамінову, бромистоводневу, хлористоводневу, ізетіонову, молочну, малеїнову, яблучну, мигдальну, метансульфонову, слизову, азотну, памову, пантотенову, фосфорну, бурштинову, сірчану, винну, п-толуолсульфонову кислоту і подібні. Особливо переважними є лимонна, бромистоводнева, хлористоводнева, малеїнова, фосфорна, сірчана і винна кислоти. Сольвати в даному описі стосуються сполуки формули I або її солі в сполученні з розчинником, таким як вода. Типові приклади включають гідрати, напівгідрати, тригідрати і подібні. Усі згадування сполук формули I включають фармацевтично прийнятні солі і сольвати. Даний винахід стосується способу інгібування активності глюкагону через протидію рецептору глюкагону, тим самим знижуючи швидкість глюконеогенезу і глікогенолізу і концентрацію глюкози в плазмі. Сполуки формули I можуть застосовуватися у виробництві лікарського засобу для профілактичного або терапевтичного лікування хворобливих станів у ссавців, пов'язаних з підвищеними рівнями глюкози, шляхом об'єднання сполуки формули I з носіями з одержанням лікарського засобу. 31 Дозування Профілактична або терапевтична доза сполуки формули I, звичайно, змінюється залежно від природи або тяжкості стану, що лікується, конкретної вибраної сполуки і способу її введення. Вона також варіюється залежно від віку, маси тіла і реакції конкретного пацієнта. Загалом, добова доза знаходиться в інтервалі від близько 0,001 мг до близько 100 мг на кг маси тіла, переважно від близько 0,01 мг до близько 50 мг на кг, і більш переважно від 0,1 до 10 мг на кг, однією або декількома дозами. Може бути необхідно в деяких випадках застосовувати дозування за межами цього інтервалу. Терміни "ефективна кількість", "ефективна проти діабету кількість" і інші терміни, застосовувані в даному описі стосовно кількості застосовуваної сполуки, стосуються доз, розрахованих з урахуванням будь-яких необхідних варіацій поза цим інтервалом, які визначаються лікуючим терапевтом. Типові дози сполук формули I, а також їх фармацевтично прийнятних солей і сольватів, для дорослої людини складають від близько 0,1 мг до близько 1,0 г на добу, переважно від близько 1 мг до близько 500 мг, однією або декількома дозами. Приклади придатних доз включають 0,1 мг, 1 мг, 2 мг, 5 мг, 10 мг, 20 мг, 40 мг, 50 мг, 75 мг, 100 мг, 150 мг, 200 мг, 250 мг, 500 мг, 1000 мг і подібні дози. Типові дози сполук, застосовуваних у сполученні зі сполуками формули I, відомі або їх визначення знаходиться в компетенції фахівця в даній галузі техніки з урахуванням представленого опису. Якщо застосовується внутрішньовенне або оральне введення, типове дозування складає від близько 0,001 мг до близько 100 мг (переважно від 0,01 мг до близько 10 мг) сполуки формули I на кг маси тіла на добу, і більш переважно від близько 0,1 мг до близько 10 мг сполуки I на кг маси тіла на добу. При застосуванні у сполученні з іншими агентами зазначені вище дози для антагоніста глюкагону вводяться разом зі звичайною дозою для іншого лікарського засобу. Наприклад, якщо застосовується інгібітор DPP-IV, такий, як описаний у патенті США № 6699871B1, інгібітор DPP-IV може застосовуватися в кількості від близько 1,0 мг аж до близько 1000 мг, переважно від близько 2,5 мг до близько 250 мг, і особливо переважно близько 50 мг або близько 100 мг, однією добовою дозою або декількома дозами придатним чином. Так само, якщо рецептор глюкагону застосовують у сполученні з антагоністом/зворотним агоністом CB1, антагоніст/зворотний агоніст CB1 може застосовуватися в кількості від близько 0,1 мг до близько 1000 мг, більш переважно в кількості від близько 1,0 мг до близько 100 мг і навіть більш переважно від близько 1,0 мг до близько 10 мг, і вводять однією дозою або декількома дозами придатним чином. Приклади доз антагоніста/зворотного агоніста CB1 включають 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг і 10 мг. Фармацевтичні композиції 96308 32 Як описано вище, фармацевтичні композиції містять сполуку формули I або її фармацевтично прийнятні солі або сольвати і фармацевтично прийнятний носій. Термін "композиція" охоплює продукт, що містить активні й інертні інгредієнти (фармацевтично прийнятні наповнювачі), які складають носій, а також будь-який продукт, який одержується, прямо або побічно, при об'єднанні, комплексуванні або агрегуванні двох або більше інгредієнтів, або при роз'єднанні одного або більше інгредієнтів, або при інших реакціях або взаємодіях між інгредієнтами. Переважно, композиція включає сполуку формули I у кількості, яка ефективна для лікування, попередження або затримання настання цукрового діабету 2 типу, у сполученні з фармацевтично прийнятним носієм. Можна використовувати будь-який придатний спосіб введення для доставки ссавцю, особливо людині, ефективної дози сполуки відповідно до даного винаходу. Наприклад, може застосовуватися оральне, ректальне, місцеве, парентеральне, очне, легеневе, назальне введення і подібні. Приклади дозованих форм включають таблетки, пастилки, дисперсії, суспензії, розчини, капсули, креми, мазі, аерозолі і подібні, де переважними є оральні таблетки. При одержанні оральних композицій може застосовуватися будь-яке звичайне фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти, смакові добавки, консерванти, барвники і подібні, для оральних рідин, наприклад, суспензій, еліксирів і розчинів; або носії, такі як крохмалі, цукри, мікрокристалічна целюлоза, розріджувачі, гранулюючі агенти, мастильні агенти, зв'язуючи агенти, агенти, що сприяють розкладанню, і подібні для оральних твердих композицій, наприклад, порошків, капсул і таблеток. Переважні тверді оральні композиції. Через простоту введення таблетки і капсули є найбільш переважними оральними лікарськими формами. При бажанні таблетки можуть мати покриття, нанесене стандартними водними і неводними методами. На додаток до стандартних лікарських форм, описаних вище, сполуки формули I також можуть вводитися засобами з контрольованим вивільненням і/або системами доставки, такими, як описані в патентах США № 3845770; 3916899; 3536809; 3598123; 3630200 і 4008719. Фармацевтичні композиції відповідно до даного винаходу, придатні для орального введення, можуть бути представлені у вигляді окремих форм, таких як капсули, крохмальні капсули або таблетки, кожна з який містить визначену кількість активного інгредієнта, у вигляді порошку або гранул або у вигляді розчину або суспензії у водній рідині, неводній рідині або емульсії масло-у-воді або вода-в-маслі. Такі композиції можуть бути одержані будь-яким придатним фармацевтичним методом. Усі такі методи включають стадію об'єднання активного інгредієнта(ів) з компонентами носія. Загалом, композиції одержують однорідним і ретельним змішуванням активного інгредієнта(ів) з рідким або тонкоподрібненим твердим компонентом носія, і 33 96308 потім, при необхідності, перетворенням суміші в бажану лікарську форму. Наприклад, таблетка може бути одержана пресуванням або формуванням. Пресовані таблетки можуть бути одержані пресуванням вільнотекучого порошку або гранул, що містять активний інгредієнт(и), необов'язково змішаного з одним або більше наповнювачами, наприклад, зв'язуючими агентами, мастильними агентами, розріджувачами, поверхнево-активними речовинами й агентами, що сприяють Суспензія для ін'єкцій (внутрішньом'язово) Сполука формули I Метилцелюлоза Tween 80 Бензиловий спирт Хлорид бензалконію Вода для ін'єкцій Капсула Сполука формули I Лактоза Стеарат Mg Усього мг/мл 10,0 5,0 0,5 9,0 1,0 до 1,0 мл 34 розкладанню. Формовані таблетки можуть бути одержані формуванням суміші порошкоподібної сполуки, зволоженої інертною рідиною. Бажано, кожна таблетка може містити, наприклад, від близько 0,1 мг до близько 1,0 г активного інгредієнта, і кожна крохмальна капсула або капсула містить від близько 0,1 мг до близько 500 мг активного інгредієнта. Далі представлені приклади фармацевтичних лікарських форм, які містять сполуку формули I: Таблетка Сполука формули I Мікрокристалічна целюлоза Повідон Прежелатинізований крохмаль Стеарат магнію Усього мг/капсула 25,0 735 1,5 600 мг Комбінована терапія Як описано вище, сполуки формули I можуть застосовуватися в сполученні з іншими лікарськими засобами, які застосовуються для лікування/попередження/затримання настання цукрового діабету 2 типу, а також інших захворювань і станів, описаних у даному описі, для яких застосовуються сполуки формули I. Можуть вводитися інші лікарські засоби способом і в кількості, застосовуваній звичайно, одночасно або послідовно зі сполукою формули I. Якщо сполуку формули I застосовують одночасно з одним або більше лікарськими засобами, переважне сполучення композиції, яка містить такі інші лікарські засоби на доповнення до сполуки формули I. Отже, фармацевтичні композиції відповідно до даного винаходу включають такі, котрі альтернативно містять один або більше інших активних інгредієнтів, на доповнення до сполуки формули I. Приклади інших активних інгредієнтів, що можуть бути об'єднані зі сполукою формули I, які вводяться окремо або в одній композиції, включають, але не обмежені ними: (a) бігуаніди (наприклад, буформін, метформін, фенформін), (b) агоністи PPAR (наприклад, троглітазон, піоглітазон, розиглітазон), (c) інсулін, (d) соматостатин, (e) інгібітори альфа-глюкозидази (наприклад, воглібоза, мігліт, акарбоза), (f) інгібітори DPP-IV, такі як ситагліптин, вільдагліптин, саксагліптин і подібні, такі, як описані в патенті США № 6699871B1, виданому 2 березня 2004 року, (g) модулятори LXR і (h) засоби, що підсилюють секрецію інсуліну (наприклад, ацетогексамід, карбутамід, хлорпропамід, гліборнурид, Аерозоль Сполука формули I Лецитин, NF рідка концентрація Трихлорметан, NF Дихлордифторметан, NF мг/таблетка 25,0 415 14,0 4,35 2,5 500 мг На контейнер 250 мг 1,2 мг 4,025 г 12,15 г гліклазид, глімерпірид, гліпізид, гліквідин, глізоксепід, глібурид, глігексамід, гліпінамід, фенбутамід, толазамід, толбутамід, толцикламід, натеглінід і репаглінід), і інгібітори CB1, такі як римонабант і сполуки, описані в WO 03/077847 A2, опублікованій 25 вересня 2003 року, і в WO 05/000809 A1, опублікованій 6 січня 2005 року. Масове відношення сполуки формули I до другого активного інгредієнта може варіюватися в широких межах і залежить від ефективної дози кожного активного інгредієнта. Загалом, застосовують ефективну дозу кожного. Таким чином, наприклад, якщо сполуку формули I об'єднують з агоністом PPAR, масове співвідношення сполуки формули I до агоніста PPAR звичайно складає від близько 1000:1 до близько 1:1000, переважно від близько 200:1 до близько 1:200. Сполучення сполуки формули I і інших активних інгредієнтів звичайно також входять у зазначені вище межі, але в кожному випадку повинна застосовуватися ефективна доза кожного активного інгредієнта. Для комбінованих продуктів сполука формули I може бути об'єднана з іншими активними інгредієнтами і потім додана до інгредієнтів носія; альтернативно, порядок змішування може бути змінений. Сполуки формули I можуть бути синтезовані відповідно до загальних схем, представлених 1 4 нижче, де R -R і A такі, як визначені вище, беручи до уваги конкретні приклади, які надані нижче. На схемах синтезу застосовувані абревіатури мають зазначені нижче значення, якщо не зазначено інакше. 35 96308 водн. = водний Bu=бутил, t-Bu=трет-бутил BOC, Boc (БОК, Бок)=трет-бутоксикарбоніл COD (ЦОД)=циклооктадієн CDI (КДІ)=карбонілдіімідазол DCC (ДЦК)=дициклогексилкарбодіімід DIEA (ДІЕА)=діізопропілетиламін DMAC, Dma (ДМАЦ, ДМА)= диметилацетамід EDC (ЕДК)=1-етил-3-(3диметиламінопропіл)карбодіімід dppf (дффф)=1,1'-біс(дифенілфосфіно)фероцен EtOAc=етилацетат eq. (экв.)=еквівалент(и) HOAc=оцтова кислота HOBT, HOBt (ГОБТ, ГОБт) = гідроксибензотриазол LHMDS=біс(триметилсиліл)амід літію MeOH=метанол Me=метил PBS (ФРФБ)=фізіологічний розчин фосфатного буфера Ph=феніл ТГФ=тетрагідрофуран C6H11=циклогексил iPr=ізопропіл 2,4-диClPh=2,4-дихлорфеніл 36 BuLi, n-BuLi=н-бутиллітій Bn і Bnzl=бензил CBZ, Cbz=бензилоксикарбоніл DCM (ДХМ)=дихлорметан DIAD (ДІАД)= діізопропілазодикарбоксилат DMAP (ДМАП)=4-диметиламінопіридин DMF (ДМФ)=N, N-диметилформамід EtOH=етанол FAB (БША)-мас-спектр=бомбардування швидкими атомами - мас-спектроскопія РХМС=рідинна хроматографія - мас-спектроскопія РХВТ=рідинна хроматографія високого тиску LAH (АГЛ)=алюмогідрид літію ESI (ІЕР)=іонізація електророзпилюванням MeCN, CH3CN=ацетонітрил Pd/C=паладій на активованому вугіллі TFA (ТФК)=трифтороцтова кислота NMe2=диметиламіно трифлат=трифторметансульфонат IPA (ІПА)=ізопропанол Py, Pyr=піридил PyBOP=гексафторфосфат бензотриазол-1ілокситрипіролідинфосфонію RT, rt (КТ, к.т.)=кімнатна температура Xantphos=4,5-біс(дифенілфосфіно)-9,9диметилксантен Pd2dba3= трис(дибензиліденацетон)-дипаладій(0) KOtBu=трет-бутоксид калію MgSO4=сульфат магнію BINAP=2,2-біс(дифенілфосфіно)-1,1'-бінафталін NaOtBu=трет-бутоксид натрію Na2SO4=сульфат натрію BOP=гексафторфосфат бензотриазол-1PBM (ПМБ)=параметоксибензил ілокситрис(диметиламіно)фосфонію LDA (ДАЛ)=діізопропіламід літію KHMDS=біс(триметилсиліл)амід калію NCS=N-хлорсукцинамід DME (ДМЕ)=1,2-диметоксіетан Сполуки відповідно до даного винаходу можуть бути одержані відповідно до методики, зазначеної в представлених нижче загальних схемах синтезу. В одному варіанті даного винаходу сполука I може бути одержана з кислоти 1a методом, зображеним на схемі 1. Проміжну сполуку карбонової кислоти 1а сполучать з комерційно доступним складним ефіром бета-аланіну (метиловим, етиловим або трет-бутиловим складним ефіром) із застосуванням гексафторфосфату бензотриазол-1ілокситрис(диметиламіно)фосфонію (BOP) і основи, звичайно N, N-діізопропілетиламіну (ДІЕА), у розчиннику, такому як N, Nдиметилформамід (ДМФ) або ацетонітрил, при температурі навколишнього середовища з одержанням сполуки 2a. Багато умов сполучення пептидів відомі і також можуть застосовуватися. Омилення складного ефіру бета-аланіну 2a (метилового, етилового і трет-бутилового) з одержанням сполуки I проводять з основою, такою як водний гідроксид літію (LiOH) або водний гідроксид натрію, у полярному розчиннику, такому як тетрагідрофуран, метанол, етанол або суміш подібних розчинників. Крім того, сполука 2a, що містить складний ефір третбутил-бета-аланіну, може бути перетворена в сполуку 1 із застосуванням кислоти, такої як оцтова кислота або трифтороцтова кислота (ТФК). Група бета-аланіну також може бути введена на більш ранній стадії одержання сполуки I (див. нижче). Це найбільше часто здійснюють із застосуванням проміжної алілкислоти 1b з одержанням проміжного складного ефіру бета-аланіну 2b. Сполуки очищають від небажаних побічних продуктів перекристалізацією, розтиранням, препаративною тонкошаровою хроматографією, флеш-хроматографією на силікагелі, як описано W.C. Still et al., J. Org. Chem. 1978 43, 2923, або РХВТ. Сполуки, очищені РХВТ з оберненою фазою, можуть бути виділені у вигляді відповідної солі. Очищення проміжних сполук проводиться тим же методом. Схема 1 37 96308 38 Перетворення сполуки 2b у сполуку I може бути проведене методом, зображеним на схемі 2. Обробка сполуки 2b газоподібним озоном у дихлорметановому розчиннику при температурі 78C з наступним додаванням метилсульфіду і трифенілфосфіну дає альдегід 3. Альтернативно, те ж перетворення може бути досягнуте дигідроксилуванням олефінової групи з реагентом, таким як тетроксид осмію, з наступним відщіпленням діольного продукту з періодатом натрію, як описано в J. Org. Chem. 1956, 21, 478. Обробка альдегіду 3 фенілгідразином (або відповідним хлоридом фенілгідразину) і хлоридом цинку в оцтовій кислоті при 80C (аж до 120С) дає індол 2a. Складний ефір трет-бутил-бета-аланіну відщеплюють у цих умовах з одержанням безпосередньо сполуки I. Сполуку 2a, що містить метиловий (або етиловий) складний ефір бетааланіну, потім гідролізують з гідроксидом літію з одержанням сполуки I. Фенілгідразини, що не є комерційно доступними, можуть бути одержані із застосуванням методів, знайомих фахівцям у даній галузі техніки. Один з таких методів включає діазотування аніліну з наступним відновленням з реагентом, таким як хлорид олова. Альтернативно, фенілгідразини можуть бути одержані медійованим паладієм сполученням фенілгалогеніду і гідразону бензофенону, як описано в J. Am. Chem. Soc. 1998, 120(26), 6621. Схема 2 В іншому варіанті даного винаходу сполука I може бути одержана з проміжного індолу 2c 4 (R =H) методом, зображеним на схемі 3. Алкілування NH індолу проміжної сполуки 2c проводять обробкою основою, такою як трет4 4 бутоксид калію, і алкілуючим агентом (R Br, R I, R OMs і т. д.) в апротонному розчиннику, такому як диметилацетамід. Складний ефір бета-аланіну потім гідролізують, як описано вище, з одержанням сполуки I. Схема 3 4 39 96308 40 Наступна схема підсумовує одержання проміжної кислоти 1b, яка може бути перетворена в сполуку I, як описано на представлених вище схемах. Медійоване паладієм (Pd2dba3/BINAP) сполучення 4-бром трет-бутилбензоату 4 і кетону 5, як описано Buchwald (J. Am. Chem. Soc. 1997, 119(45), 11108), дає сполуку 6. 4-Бром трет-бутилбензоат 4 є комерційно доступним. Альтернативно, він може бути придатним чином одержаний обробкою 4-бромбензоїлхлориду третбутоксидом калію в ТГФ. Кетон 5 є комерційно доступним або може бути одержаний методами, відомими фахівцям у даній галузі техніки. Одним з методів є окислювання відповідного спирту. Альтернативно, кетон 5 може бути одержаний додаванням Гриньяра до аміду Вейнреба, як 3 описано в Tet. Lett. 1981, 22, 3815. Кетон 6 (R =H) може бути алкілований із застосуванням основи, такої як трет-бутоксид калію, і алкілуючого агента 3 3 (R Br, R I і т. д.) у розчиннику ТГФ з одержанням 3 сполуки 6 (R ≠H). Відновлення кетону 6 із застосуванням NaBH4 у метанолі дає спирт 7 (у вигляді суміші діастереомерів >8:1). Обробка спирту 7 алілтриметилсиланом і кислотою Льюїса, такою як BF3OEt2, у дихлорметані або дихлоретані при 80С (аж до 100С) дає кислоту 1b. Фахівець у даній галузі техніки зрозуміє, що цей метод одержання дає рацемічну кислоту 1b. Крім того, існують два можливих діастереомери кислоти 1b (4 ізомери усього). Відносні пропорції визначають діастереоселективністю додавання 3 алілу (від 7 до 1b). Залежно від замісників A і R одержана діастереоселективність у даних умовах реакції варіюється від помірної 1,2:1 до 8:1. Схема 4 Альтернативне одержання проміжної кислоти 1b зображене на схемі 5. 4-Бромфенілоцтову кислоту 8 сполучать з (1R, 2R)-(-)псевдоефедрином через змішаний ангідрид, утворений із хлоридом півалоїлу і ДІЕА, з 3 одержанням аміду 9. Амід 9 алкілують з R I із застосуванням ДАЛ і хлориду літію в ТГФ при 0С з одержанням сполуки 10. Реакція аміду 10 при 0С з ариллітієм 11, одержаним з відповідного арилброміду (або йодиду) і бутиллітію, дає кетон 12. Перетворення сполуки 8 у сполуку 12 засноване на хімії, описаній Andrew G. Meyers (J. Am. Chem. Soc. 1997, 119, 6496) і з цієї практики очікується, що 1) алкілування сполуки 9 є високодіастереоселективним (>95%); 2) кетон 12 одержують з високою енантіомерною чистотою жання, як і одержання, описане на схемі 4, дає кислоту 1b у вигляді суміші діастереомерів. (>90%); 3) атом вуглецю, що несе замісник R у 3 кетоні 12, має R-конфігурацію (тобто R -зв'язок знаходиться в положенні альфа, як зображено на структурі 12). Перетворення кетону 12 у проміжний аліл 14 проводять, як описано для перетворення сполуки 6 у 1b (схема 4). Карбонілювання сполуки 14 із застосуванням PdCl2(PPh3)2 каталізатора, газоподібного моноксиду вуглецю і ДІЕА в н-бутанолі при 115C дає н-бутиловий складний ефір. Гідроліз складного ефіру з водним гідроксидом літію, описаний вище, дає кислоту 1b. Альтернативно, обробка сполуки 14 н-бутиллітієм і газоподібним діоксидом вуглецю відразу дає кислоту 1b. Фахівцю в даній галузі техніки зрозуміло, що таке одер Однак у цьому випадку кислота 1b не буде рацемічною. 3 41 96308 42 Схема 5 Проміжна кислота 1а може бути одержана із застосуванням хімії, зображеної на схемі 6. Алкілування трет-бутилового (або ПМБ) складного ефіру 15 з бензилбромідом (або йодидом) 16 із застосуванням основи, такого як LHMDS або ДАВ, дає сполука 17 у виді суміші діастереомерів. Сполуки 15 і 16 є комерційно доступними або їхній можна легко одержати відомими фахівцям у даній галузі техніки методами. Трет-бутиловий або ПМБ складний ефір сполуки 17 розщеплюють обробкою ТФК з одержанням сполуки 18. Відновлення кислоти 18 1 Замісник R звичайно є присутнім у вихідних матеріалах 5, 11 і 15. Також він може бути із застосуванням BOP і NaBH4 дає спирт 19, який потім окисляють до альдегіду 20 із застосуванням періодинану Десса-Мартіна. Альтернативно, кислота 18 може бути перетворена в альдегід 20 відновленням з комплексом боран-ТГФ. Олефінування сполуки 20 із застосуванням іліду, утвореного з KHMDS і хлориду (метоксиметил)трифенілфосфонію, дає метилвініловий ефір 20 (суміш E, Z), який може бути перетворений у 1а із застосуванням умов, описаних на схемі 2. Схема 6 введений у подальші проміжні сполуки методами, відомими фахівцям у даній галузі техніки (див. 43 96308 44 схему 7). Один з таких методів включає сполучення Сузукі сполуки 22 з вінілбороновою кислотою із застосуванням Pd(PPh3)4 каталізатора і основи карбонату калію. Сполучення хлориду сполуки 22 з вінілбороновою кислотою проводять із застосуванням каталізатора дихлориду паладію 1,1'-біс(ди-трет-бутилфосфіно)фероцену. Стирольний продукт може бути відновлений із застосуванням газоподібного водню і каталізатора паладію/С з одержанням сполуки 23. Інший метод включає хлорування метилового ефіру 24 з N-хлорсукцинамідом з одержанням сполуки 25. Схема 7 Відділення діастереомерів може проводитися на різних стадіях одержання сполуки I, однак звичайно його проводять для складного ефіру 2a із застосуванням хроматографії на силікагелі і елюенту EtOAc/гексан, або для сполуки I із застосуванням РХВТ з оберненою фазою. В обох випадках основний і більш активний діастереомер одержують більш повільним (другим) елююванням. Відділення енантіомерних пар (активного діастереомеру) проводять хроматографією з нормальною фазою (наприклад, з елюентом EtOH/гептан або ІПА/гептан) або надкритичною хроматографією (елюент CO2/MeOH) із застосуванням хіральної колонки від Daicel®. Розділення звичайно проводять для складного проміжного ефіру 2a із застосуванням CHIRALPAK® AD або CHIRALPAK® IA і елюенту EtOH (або ІПА)/гептан. У цих випадках більш активний енантіомер є більш повільним (другим) елюйованим 4 енантіомером (тільки для R =H). Умови аналітичної РХВТ мас-спектрометрії: РХ1: Колонка: Waters Xterra MS C-18, 3,5 мкм, 3,0 × 50 мм, Температура: 50°C, Елюент: 10:90 до 98:2 об./об. ацетонітрил/вода + 0,05% ТФК за 3,75 хв., Швидкість потоку: 1,0 мл/хв., упорскування 10 мкл, Визначення: PDA, 200-600 нм, МС: інтервал маси 150-750 а.о.м.; позитивна іонізація електророзпилюванням. РХ2: Колонка: Waters Xterra IS C-18, 3,5 мкм, 2,1 × 20 мм, Температура: 50°C, Елюент: 5:95 до 95:5 об./об. ацетонітрил/вода + 0,05% ТФК за 0,75 хв., Швидкість потоку: 1,5 мл/хв., упорскування 5 мкл, Визначення: PDA, 200-600 нм, МС: інтервал маси 150-750 а.о.м.; позитивна іонізація електророзпилюванням. РХ3: Колонка: Waters Xterra IS C-18, 3,5 мкм, 2,1 × 20 мм, Температура: 50°C, Елюент: 5:95 до 95:5 об./об. ацетонітрил/вода + 0,05% ТФК за 3,00 хв., Швидкість потоку: 1,5 мл/хв., упорскування 5 мкл, Визначення: PDA, 200-600 нм, МС: інтервал маси 150-750 а.о.м.; позитивна іонізація електророзпилюванням. Умови аналітичної і напівпрепаративної хіральної РХВТ: Хіральна РХ1: Колонка: ChiralPak AD, 10 мкм, 4,6 × 250 мм, Температура: навколишнього середовища, Швидкість потоку: 0,75 мл/хв., Визначення: PDA, 254 нм, Об'єм упорскування: 15 мкл. Загальні хіральні напівпрепаративні умови: 2 смх25 см хіральна колонка, доступна від Daicel Chemical Industries, LTD, 9 мл/хв. ізократичний EtOH або IPA/гептан елюент. Умови препаративної РХВТ з оберненою фазою (ОФ-РХВТ): 45 Колонка: Kromasil KR-10C8, 30 × 100 мм, Швидкість потоку: 50,0 мл/хв., або Колонка: YMC-PackPro C18, 20 × 150 мм, Швидкість потоку: 20,0 мл/хв., Елюент: ацетонітрил/вода + 0,1% ТФК, Градієнт: 90 до 100:0 об./об. ацетонітрил/вода + 0,1% ТФК за 10,0 хв., Температура: навколишнього середовища, Визначення: PDA, 254 нм. Препаративну тонкошарову хроматографію (PTLC, ПТШХ) проводять на тарілках 20 × 20см (силікагель товщиною 500 мкм) із застосуванням елюенту гексани/етилацетат. Хроматографію на силікагелі проводять на системі для проведення флеш-хроматографії Biotage Horizon із застосуванням градієнта гексан/етилацетат. Для повного розуміння даного винаходу нижче представлені приклади. Вони не повинні сприйматися як обмежуючі винахід яким-небудь чином. Проміжна сполука 1 Рацемічна 4-[2-(4-хлорфеніл)-1-пропілпент-4ен-1-іл]бензойна кислота Стадія A. Трет-бутил 4-[2-(4-хлорфеніл)-2оксоетил]бензоат Розчин у ТГФ (200 мл), що містить трет-бутил 4-бромбензоат (19,9 г, 77,6 ммоль), 4хлорацетофенон (10 г, 64,7 ммоль), Pd2dba3 (1,19 г, 1,29 ммоль), BINAP (1,6 г, 2,58 ммоль) і NaOtBu (8,7 г, 90,6 ммоль) кип'ятять зі зворотним холодильником в атмосфері аргону протягом приблизно 5 годин. Розчин концентрують і потім розділяють між EtOAc і водою. Органічну фазу промивають водою, насиченим розчином солі і сушать над Na2SO4. Фільтрований розчин концентрують і залишок очищають хроматографією на силікагелі з застосуванням градієнта гексан/EtOAc з одержанням зазначеної 1 в заголовку сполуки. H ЯМР (500 МГц, CDCl3): 7,95 (д, J=8,5 Гц, 2H); 7,93 (д, J=8,7 Гц, 2H); 7,43 (д, J=8,3 Гц, 2H); 7,29 (д, J=8,2 Гц, 2H); 4,30 (с, 2H); 1,58 (с, 9H). РХ1 4,01 хв. (M-tBu+H)=275. Стадія B. Трет-бутил 4-[1-(4хлорбензоїл)бутил]бензоат KOtBu (2,55 г, 22,7 ммоль) додають до охолодженого (льодяна баня) розчину ТГФ (40 мл), що містить проміжну сполуку зі стадії А (5,0 г, 15,15 ммоль). Через 10 хвилин по краплях додають н-пропілйодид (3 мл, 30,3 ммоль). Льодяну баню видаляють і реакцію відслідковують МС-РХВТ аналізом. Потім розчин 96308 46 розділяють (10:1 співвідношення діастереомерів. H ЯМР (400 МГц, CDCl3): 7,93 (д, J=8,3 Гц, 2H); 7,28 (д, J=8,4 Гц, 2H); 7,23 (д, J=8,4 Гц, 2H); 7,18 (д, J=8,4 Гц, 2H); 4,73 (д, J=7,8 Гц, 1H); 2,89-2,83 (м, 1H); 1,58 (с, 9H); 1,57-1,56 (м, 1H); 1,41-1,33 (м, 1H); 1,09-0,91 (м, 2H); 0,72 (т, J=7,3 Гц, 3H). РХ1 4,22 хв. (M-tBu-OH+H)=301. Стадія D. 4-[2-(4-Хлорфеніл)-1-пропілпент-4ен-1-іл]бензойна кислота Розчин 1,2-дихлоретану (20 мл), що містить проміжну сполуку зі стадії C (1,81 г, 4,84 ммоль), алілтриметилсилан (6,2 мл, 38,7 ммоль) і ефірат трифториду бору (1,84 мл, 14,5 ммоль) нагрівають при 80С протягом 1,5 години. Розчин охолоджують до кімнатної температури і повільно додають метанол (10 мл). Потім розчин концентрують і залишок розділяють між EtOAc і водним 1н HCl. Органічну фазу промивають водою, насиченим розчином солі і сушать над Na2SO4. Фільтрований розчин концентрують з одержанням зазначеної в заголовку сполуки (у вигляді близько 3:1 суміші діастереомерів), яку застосовують без подальшого очищення. Частину очищають для спектрального аналізу, 1 дані наведені для основного діастереомеру. H ЯМР (400 МГц, CDCl3): 8,07 (д, J=8,3 Гц, 2H); 7,30 (д, J=5,7 Гц, 2H); 7,28 (д, J=5,4 Гц, 2H); 7,08 (д, J=8,3 Гц, 2H); 5,42-5,32 (м, 1H); 4,79-4,66 (м, 2H); 2,83-2,77 (м, 2H); 2,11-2,05 (м, 2H); 1,43-1,29 (м, 2H); 1,00-0,80 (м, 2H); 0,68 (т, J=7,3 Гц, 3H). РХ1 4,08 хв. (M+H)=343. ЯМР експерименти (NOE, ЯЕО) для наступних сполук (див. приклад 1), одержаних із проміжної сполуки, показали наступну відносну стереохімію не основного й основного діастереомерів проміжної сполуки 1: 47 Проміжна сполука 2 4-[(1S, 2R)-2-(4-хлорфеніл)-1-пропілпент-4ен-1-іл]бензойна кислота Стадія A. 2-(4-Бромфеніл)-N-[(1R, 2R)-2гідрокси-1-метил-2-фенілетил]-N-метилацетамід Півалоїлхлорид (7,8 мл, 63,3 ммоль) по краплях додають до розчину ДХМ/ТГФ (100 мл/20 мл), що містить 4-бромфенілоцтову кислоту (13,59 г, 63,2 ммоль). Потім по краплях додають ДІЕА (11,0 мл, 63,1 ммоль) (екзотермічний процес). Після перемішування при кімнатній температурі протягом 1 години розчин повільно виливають у розчин ДХМ/ТГФ (100 мл/20 мл), що містить (1R, 2R)-(-)-псевдоефедрин (10,5 г, 63,5 ммоль) і ДІЕА (11,0 мл, 63,1 ммоль). Після перемішування протягом ночі при кімнатній температурі розчин концентрують і залишок розділяють між EtOAc і водою. Органічну фазу промивають водним 1н NaOH (2), водним 1н HCl (3), насиченим розчином солі і сушать над MgSO4. Розчин фільтрують і концентрують. Масляний залишок розбавляють 100 мл толуолу і концентрують. Залишок потім розчиняють в етиловому ефірі і розтирають з гексаном з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини. Сполука являє собою 3:1 суміш поворотних ізомерів аміду відповідно 1 до протонного ЯМР: H ЯМР (400 МГц, зірочка означає не основний ротамер, CDCl3): 7,42 (д, J=8,3 Гц, 2H); 7,39-7,27 (м, 5H); 7,11* (д, J=8,4 Гц, 2H); 7,04 (д, J=8,3 Гц, 2H); 4,64-4,42 (м, 1H); 4,07 96308 48 3,94 (м, 1H); 3,82-3,70 (м, 1H); 2,94* (с, 3H); 3,63 (с, 2H); 2,82 (с, 3H); 1,12 (д, J=7,0 Гц, 3H); 0,86* (д, 3H, J=7,0 Гц). РХ1 3,23 хв. (M+H)=362. Стадія B. 2-(4-Бромфеніл)-N-[(1R, 2R)-2гідрокси-1-метил-2-фенілетил]-Nметилпентанамід ТГФ (40 мл) додають до сухого хлориду літію (8 г, 189 ммоль) і діізопропіламіну (9,2 мл, 65,6 ммоль) в атмосфері аргону. Суспензію охолоджують до -78C і по краплях додають нBuLi (1,6M у гексані, 37,9 мл, 60,6 ммоль). Після перемішування протягом 5 хвилин розчин нагрівають до 0С. Через 5 хвилин розчин охолоджують до -78C і по краплях додають ТГФ розчин (45 мл), що містить проміжну сполуку зі стадії A (10,56 г, 29,15 ммоль). Потім розчин перемішують при -78C протягом 1 години і потім нагрівають до 0С. Через 15 хвилин по краплях додають н-пропілйодид (4,3 мл, 44,1 ммоль). Розчин перемішують при 0С приблизно 2 години. До реакційної суміші додають насичений водний NH4Cl і EtOAc. Фази розділяють і водну фазу екстрагують EtOAc. Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують. Масляний залишок розчиняють в етиловому ефірі/гексані (4/6) і фільтрують через тонкий шар силікагелю. Фільтрований розчин концентрують з одержанням зазначеної в заголовку сполуки. Сполука являє собою 3:1 суміш поворотних ізомерів аміду відповідно до 1 протонного ЯМР: H ЯМР (400 МГц, зірочка означає не основний ротамер, CDCl3): 7,42 (д, J=8,4 Гц, 2H); 7,41-7,27 (м, 5H); 7,08 (д, J=8,4 Гц, 2H); 4,56 (кв, J=6,7 Гц, 1H); 4,42 (ушир.с, 1H); 4,17-4,01* (м, 1H); 3,85* (т, J=7,1 Гц, 1H); 3,55 (т, J=7,2 Гц, 1H); 3,00* (с, 3H); 2,72 (с, 3H); 2,07-1,92 (м, 1H); 1,69-1,58 (м, 1H); 1,33-1,13 (м, 2H); 1,11 (д, J=7,0 Гц, 3H); 0,88 (т, J=7,3 Гц, 3H): 0,58* (д, J=6,9 Гц, 3H). РХ1 3,76 хв. (M+H)=404. Стадія C. 2-(4-Бромфеніл)-1-(4хлорpфеніл)пентан-1-он н-Бутиллітій (1,0M у ТГФ, 59 мл, 94,5 ммоль) по краплях додають до розчину ТГФ, що має температуру -78C (200 мл), який містить 4хлорбромбензол (22,63 г, 118,2 ммоль) в атмосфері аргону. Через 10 хвилин по краплях додають ТГФ розчин (30 мл) проміжної сполуки зі стадії В (15,88 г, 39,4 ммоль). Розчин нагрівають до 0С і перемішують протягом 30 хвилин. Потім по краплях додають діізопропіламін (5,6 мл, 39,4 ммоль). Через 10 хвилин реакційний розчин розбавляють 200 мл AcOH/етилового ефіру (1/10 по об'єму). Цю суміш розділяють між EtOAc і насиченим водним NaHCO3 (спінювання). Органічну фазу промивають насиченим водним NaHCO3, водою, насиченим розчином солі і сушать над Na2SO4. Фільтрований розчин концентрують і залишок очищають хроматографією на силікагелі із застосуванням градієнта гексан/EtOAc з одержанням зазначеної 1 в заголовку сполуки. H ЯМР (500 МГц, CDCl3): 7,86 (д, 2H, J=8,5 Гц); 7,41 (д, 2H, J=8,5 Гц); 7,37 (д, 2H, J=8,5 Гц); 7,15 (д, 2H, J=8,5 Гц); 4,45 (т, J=7,3 Гц, 1H); 2,15-2,07 (м, 1H); 1,81-1,73 (м, 1H); 49 1,33-1,19 (м, 2H); 0,91 (т, J=7,4 Гц, 3H). РХ1 4,25 хв. Не іонізовано. Стадія D. 2-(4-Бромфеніл)-1-(4хлорфеніл)пентан-1-ол Боргідрид натрію (917 мг, 24,25 ммоль) додають до розчину MeOH (25 мл), що містить проміжну сполуку зі стадії C (6,53 г, 18,66 моль). Після перемішування протягом 1 години при кімнатній температурі розчин концентрують і залишок розділяють між водою і EtOAc. Органічну фазу промивають водою, насиченим розчином солі і сушать над Na2SO4. Фільтрований розчин концентрують з одержанням зазначеної в заголовку сполуки у вигляді 8:1 суміші діастереомерів, яку застосовують на наступній 1 стадії без подальшого очищення. H ЯМР для основного діастереомеру (500 МГц, CDCl3): 7,44 (д, J=8,1 Гц, 2H); 7,30 (д, J=8,5 Гц, 2H); 7,19 (д, J=8,5 Гц, 2H); 7,07 (д, J=8,1 Гц, 2H); 4,71-4,68 (м, 1H); 2,81-2,74 (м, 1H); 1,56-1,48 (м, 1H); 1,42-1,32 (м, 1H); 1,12-0,95 (м, 2H); 0,75 (т, J=7,3 Гц, 3H). РХ1 4,00 хв. (M-OH)=335. Стадія E. 1-Бром-4-[2-(4-хлорфеніл)-1пропілпент-4-ен-1-іл]бензол Зазначену в заголовку сполуку одержують із проміжної сполуки зі стадії D із застосуванням умов, описаних для проміжної сполуки 1, стадія D. Зазначену в заголовку сполуку одержують у 1 вигляді 2,1:1 суміші діастереомерів. H ЯМР для основного діастереомеру (500 МГц, CDCl3): 7,44 (д, J=8,5 Гц, 2H); 7,28 (д, J=8,3 Гц, 2H); 7,05 (д, J=8,2 Гц, 2H); 7,02 (д, J=8,4 Гц, 2H); 5,46-5,35 (м, 1H); 4,82-4,71 (м, 2H); 2,77-2,62 (м, 2H); 2,14-2,02 (м, 2H); 1,35-1,25 (м, 2H); 1,05-0,89 (м, 2H); 0,67 (т, J=7,3 Гц, 3H). РХ1 4,66 хв. Не іонізовано. Стадія F. н-Бутил 4-[2-(4-хлорфеніл)-1пропілпент-4-ен-1-іл]бензоат Розчин н-бутанолу (5 мл), що містить проміжну сполуку зі стадії E (108 мг, 0,286 ммоль), ДІЕА (0,15 мл, 0,86 ммоль) і PdCl 2(PPh3)2 (376 мг, 0,06 ммоль) нагрівають при 115C в атмосфері моноксиду вуглецю (балон). Через 1 годину розчин охолоджують і концентрують. Залишок розчиняють у EtOAc і фільтрують. Залишок застосовують без подальшого очищення на наступній стадії. Частину очищають 1 для спектрального аналізу. H ЯМР для основного діастереомеру (500 МГц, CDCl3): 8,00 (д, J=8,3 Гц, 2H); 7,28 (д, J=8,4 Гц, 2H); 7,23 (д, J=8,3 Гц, 2H): 7,07 (д, J=8,4 Гц, 2H); 5,42-5,31 (м, 1H); 4,77-4,66 (м, 2H); 4,33 (т, J=6,6 Гц, 2H); 2,802,75 (м, 2H); 2,10-2,06 (м, 2H); 1,81-1,68 (м, 2H); 1,41-1,24 (м, 4H); 0,99 (т, J=7,4 Гц, 3H); 0,98-0,86 (м, 4H); 0,67 (т, J=7,3 Гц, 3H). РХ1 4,73 хв. (M+H)=399. Стадія G. 4-[(1S, 2R)-2-(4-хлорфеніл)-1пропілпент-4-ен-1-іл]бензойна кислота Розчин ТГФ/MeOH/води (8 мл/8 мл/3 мл), що містить проміжну сполуку зі стадії F (790 мг, 1,98 ммоль), і моногідрат гідроксиду літію (406 мг, 9,90 ммоль) перемішують протягом ночі при кімнатній температурі. Розчин концентрують, і нелетку частину розділяють між водною 2н хлористоводневою кислотою і EtOAc. Органічну фазу сушать над Na2SO4, фільтрують і 96308 50 концентрують з одержанням зазначеної в 1 заголовку сполуки. H ЯМР (500 МГц, ДМСО-d6): 7,90 (д, J=8,2 Гц, 2H); 7,39 (д, J=8,5 Гц, 2H); 7,36 (д, J=8,5 Гц, 2H); 7,26 (д, J=8,4 Гц, 2H); 5,36-5,26 (м, 1H); 4,71-4,60 (м, 2H); 2,94-2,84 (м, 2H); 2,132,07 (м, 1H); 1,95-1,87 (м, 1H); 1,42-1,34 (м, 1H); 1,19-1,11 (м, 1H); 0,85-0,77 (м, 2H); 0,60 (т, J=7,3 Гц, 3H). РХ3 2,57 хв. (M+H) 343. Альтернативно, зазначена в заголовку сполука може бути одержана з проміжної сполуки зі стадії E. Розчин трет-BuLi у пентані (1,7M, 3,08 мл, 5,23 ммоль) додають по краплях до розчину ТГФ (20,1 мл) проміжної сполуки зі стадії E (760 мг, 2,01 ммоль), охолодженого до -78C. Через 5 хвилин газ CO2 барботують протягом половини хвилини через розчин. Охолоджувальну баню видаляють і розчин нагрівають до кімнатної температури. Розчин потім розбавляють водним 2н HCl і екстрагують EtOAc (2). Об'єднані органічні фази сушать над Na2SO4, фільтрують і концентрують з одержанням зазначеної в заголовку сполуки. Абсолютна стереохімія не основного й основного діастереомерів проміжної сполуки 2 показана нижче. Ця структура заснована на відомій конфігурації заміщеного н-пропілом вуглецю, який одержують з (-)-псевдоефедрину, і експериментів ЯМР (ЯЕО) наступних сполук (див. приклад 1), одержаних із проміжної сполуки 2. Приклад 1 N-(4-{1-[(4-хлорфеніл)(5,7-дихлор-1H-індол-3іл)метил]бутил}бензоїл)--аланін Стадія A. Метил N-{4-[2-(4-хлорфеніл)-1пропілпент-4-ен-1-іл]бензоїл}--аланінат 51 Розчин ДМФ (20 мл), що містить проміжну сполуку 1 (1,66 г, 4,84 ммоль), гідрохлорид метил -аланінат (1,01 г, 7,26 ммоль), ДІЕА (4,3 мл, 24,2 ммоль) і BOP (3,21 г, 7,26 ммоль) перемішують при кімнатній температурі протягом 1,5 годин. Розчин розбавляють EtOAc і промивають водою, насиченим розчином солі і сушать над Na2SO4. Фільтрований розчин концентрують і залишок очищають хроматографією на силікагелі із застосуванням градієнта гексан/EtOAc з 1 одержанням зазначеної в заголовку сполуки. H ЯМР для основного діастереомеру (500 МГц, CDCl3): 7,72 (д, J=8,2 Гц, 2H); 7,28 (д, J=8,3 Гц, 2H); 7,22 (д, J=8,2 Гц); 7,07 (д, J=8,4 Гц, 2H); 6,856,81 (м, 1H); 5,41-5,31 (м, 1H); 4,77-4,66 (м, 2H); 3,75-3,70 (м, 2H); 3,73 (с, 3H); 2,81-2,72 (м, 2H); 2,67 (т, J=5,9 Гц, 2H); 2,10-2,05 (м, 2H); 1,40-1,29 (м, 2H); 0,98-0,85 (м, 2H); 0,66 (т, J=7,3 Гц, 3H). РХ1 4,03 хв. (M+H)=428. Стадія B. Метил N-{4-[2-(4-хлорфеніл)-4-оксо1-пропілбутил]бензоїл}--аланінат Охолоджений (-78°C) розчин ДХМ (20 мл), що містить проміжну сполуку зі стадії А (1,59 г, 3,72 ммоль) продувають озоном. Продування озоном проводять доти, поки не виявиться надлишок озону (голубий колір, 25 хв.) час утримання = 25,34 1 хвилини. H ЯМР (400 МГц, CD3CN): 9,36 (с, 1H); 7,54 (д, J=8,3 Гц); 7,48 (д, J=8,3 Гц, 2H); 7,47 (с, 1H); 7,37 (д, J=8,3 Гц, 2H); 7,31 (д, J=8,3 Гц, 2H); 7,29 (д, J=2,4 Гц, 1H); 7,07 (д, J=1,6 Гц, 1H); 7,02-6,95 (м, 1H); 4,49 (д, J=11,6 Гц, 1H); 3,60 (с, 3H); 3,58-3,47 (м, 3H); 2,52 (т, J=6,9 Гц, 2H); 1,521,35 (м, 2H); 1,01-0,90 (м, 2H); 0,69 (т, J=7,4 Гц, 3H). РХ1 4,16 хв. (M+H)=571. Дані для більш повільного елюйованого енантіомера (більш активного): хіральна РХ1: (1% - 15% EtOH/гептан за 25 хв., 15% EtOH/гептан ізократичний >25 хв.) час утримання 1 = 28,46 хвилин. H ЯМР (400 МГц, CD3CN): 9,37 (с, 1H); 7,54 (д, J=8,3 Гц); 7,48 (д, J=8,3 Гц, 2H); 7,47 (с, 1H); 7,37 (д, J=8,3 Гц, 2H); 7,31 (д, J=8,3 Гц, 2H); 7,29 (д, J=2,6 Гц, 1H); 7,07 (д, J=1,7 Гц, 1H); 7,02-6,95 (м, 1H); 4,49 (д, J=11,7 Гц, 1H); 3,60 (с, 3H); 3,58-3,47 (м, 3H); 2,53 (т, J=6,9 Гц, 2H); 1,52-1,35 (м, 2H); 1,01-0,90 (м, 2H); 0,69 (т, J=7,4 Гц, 3H). РХ1 4,16 хв. (M+H)=571. Стадія D. N-(4-{1-[(4-хлорфеніл)(5,7-дихлор1Н-індол-3-іл)метил]бутил}-бензоїл)- -аланін Ізомери, одержані на стадії С, гідролізують із застосуванням умов, описаних для проміжної сполуки 2, стадія G. Неочищений продукт гідролізу очищають РХВТ з одержанням зазначених у заголовку сполук. Дані для не основного діастереомеру 1 (рацемічного): H ЯМР (400 МГц, CD3CN): 9,66 (с, 1H); 7,71 (д, J=1,6 Гц, 1H); 7,56 (д, J=8,3 Гц, 2H); 7,51 (д, J=2,6 Гц, 1H); 7,29 (д, J=8,3 Гц, 2H); 7,22-7,18 (м, 3H); 7,08 (ушир.с, 1H); 7,02 (д, J=8,5 Гц, 2H); 4,46 (д, J=11,6 Гц, 1H); 3,62-3,50 (м, 3H); 2,56 (т, J=6,7 Гц, 2H); 1,78-1,68 (м, 1H); 1,62-1,52 (м, 1H); 1,09-0,91 (м, 2H); 0,71 (т, J=7,3 Гц, 3H). РХ1 3,87 хв. (M+H)=557. Дані для основного діастереомеру, більш 1 швидко елюйований енантіомер: H ЯМР (500 МГц, CD3CN): 9,38 (с, 1H); 7,55 (д, J=8,3 Гц, 2H); 7,48 (д, J=8,3 Гц, 2H); 7,47-7,46 (м, 1H); 7,37 (д, J=8,3 Гц, 2H); 7,31 (д, J=8,4 Гц, 2H); 7,28 (д, J=2,5 Гц, 1H); 7,06 (д, J=1,8 Гц, 1H); 7,05 (ушир.с, 1H); 4,50 (д, J=11,6 Гц, 1H); 3,55-3,47 (м, 3H); 2,52 (т, J=6,6 Гц, 2H); 1,49-1,38 (м, 2H); 0,99-0,91 (м, 2H); 0,69 (т, J=7,3 Гц, 3H). РХ1 4,03 хв. (M+H)=557. [α] = +118,2 (589 нм, EtOH). Дані для основного діастереомеру, більш повільно елюйований енантіомер (більш 1 активний): H ЯМР (500 МГц, CD3CN): 9,36 (с, 1H); 7,56 (д, J=8,3 Гц, 2H); 7,49 (д, J=8,7 Гц, 2H); 7,49-7,47 (м, 1H); 7,38 (д, J=8,3 Гц, 2H); 7,33 (д, J=8,5 Гц, 2H); 7,29 (д, J=2,5 Гц, 1H); 7,08 (д, J=1,7 Гц, 1H); 7,03 (ушир.с, 1H); 4,51 (д, J=11,7 Гц, 1H); 3,57-3,53 (м, 1H); 3,52-3,48 (м, 2H); 2,53 (т, J=6,7 Гц, 2H); 1,51-1,39 (м, 2H); 1,01-0,93 (м, 2H); 0,70 (т, J=7,3 Гц, 3H). РХ1 4,03 хв. (M+H)=557. [] = 105,72° (589 нм, EtOH). Відносна стереохімія двох діастереомерів прикладу 1 показана нижче. Розташування стереохімії засноване на ядерному ефекті 53 96308 Оверхаузера (ЯЕО, представлений зірочкою) і низькоенергетичній конформаційній моделі двох діастереомерів. Приклад 1 також одержують, як описано вище із застосуванням енантіочистої проміжної сполуки 2. Одержаний продукт (основний діастереомер) корелює з більш повільно елюйованим енантіомером. На основі відомої конфігурації заміщеного н-пропілом вуглецю, який одержують з (-)-псевдоефедрину в проміжній сполуці 2, структура, зображена для діастереомеру B, також показує абсолютну стереохімію більш повільно елюйованого енантіомера. Приклад 2 N-(4-{(1S)-1-[(R)-(4-хлорфеніл)(7-фтор-5метил-1Н-індол-3-іл)метил]бутил}бензоїл)аланін Стадія A. Метил N-(4-{(1S)-1-[(R)-(4хлорфеніл)(7-фтор-5-метил-1Н-індол-3іл)метил]бутил}бензоїл)- -аланінат Розчин в оцтовій кислоті (10 мл) метил N-{4[2-(4-хлорфеніл)-4-оксо-1-пропілбутил]бензоїл}- 54 аланінату, одержаного з проміжної сполуки 2, як описано в прикладі 1 (757 мг, 1,76 ммоль), ZnCl2 (3,1M у AcOH, 1,7 мл, 5,27 моль) і гідрохлорид 2фтор-4-метилфенілгідразину (374 мг, 2,1 ммоль) нагрівають при 80С протягом 45 хвилин. Розчин концентрують і залишок розділяють між EtOAc і водою. Органічну фазу промивають водою (2), насиченим розчином солі (2) і сушать над Na2SO4. Розчин фільтрують, концентрують і залишок очищають хроматографією на силікагелі із застосуванням градієнта гексан/етилацетат з одержанням зазначеної в заголовку сполуки. Дані 1 для основного діастереомеру: H ЯМР (500 МГц, CD3CN): 9,11 (с, 1H); 7,54 (д, J=8,2 Гц, 2H); 7,48 (д, J=8,5 Гц, 2H); 7,38 (д, J=8,2 Гц, 2H); 7,30 (д, J=8,4 Гц, 2H); 7,15 (д, J=2,5 Гц, 1H); 7,11 (с, 1H); 7,02-6,97 (м, 1H); 6,59 (д, J=12,3 Гц, 1H); 4,49 (д, J=11,6 Гц, 1H); 3,60 (с, 3H); 3,56-3,48 (м, 3H); 2,52 (т, J=6,8 Гц, 2H); 2,32 (с, 3H); 1,49-1,35 (м, 2H); 1,04-0,90 (м, 2H); 0,69 (т, J=7,4 Гц, 3H). РХ1=3,94 хв. (M+H)=535. Хіральна РХ1 (1% до 15% EtOH/гептан понад 25 хв., 15% EtOH/гептан ізократичний >25 хв.), час утримання = 28,38 хвилин. Продукт також містить близько 2% площі енантіомера. Хіральна РХ1 (1% до 15% EtOH/гептан понад 25 хв., 15% EtOH/гептан ізократичний >25 хв.), час утримання = 26,88 хвилин. Стадія B. N-(4-{(1S)-1-[(R)-(4-хлорфеніл)(7фтор-5-метил-1Н-індол-3іл)метил]бутил}бензоїл)--аланін Ізомери, одержані на стадії A, гідролізують в умовах, описаних для проміжної сполуки 2, стадія G. Неочищений продукт гідролізу очищають РХВТ з одержанням зазначених у заголовку 1 сполук. Дані для не основного діастереомеру: H ЯМР (400 МГц, CD3CN): 9,39 (с, 1H); 7,56 (д, J=8,0 Гц, 2H); 7,37 (д, J=2,4 Гц, 1H); 7,33 (с, 1H); 7,29 (д, J=8,0 Гц, 2H); 7,20 (д, J=8,4 Гц); 7,07 (ушир.с, 1H); 7,01 (д, J=8,4 Гц, 2H); 6,72 (д, J=12,4 Гц, 1H); 4,45 (д, J=11,6 Гц); 3,65-3,55 (м, 1H); 3,52 (кв, J=6,4 Гц, 2H); 2,55 (т, J=6,8 Гц, 2H); 2,40 (с, 3H); 1,84-1,73 (м, 1H); 1,63-1,52 (м, 1H); 1,10-0,93 (м, 2H); 0,71 (т, J=7,2 Гц, 3H). РХ1=3,66 хв. (M+H)=521. 1 Дані для основного діастереомеру: H ЯМР (500 МГц, CD3CN): 9,11 (с, 1H); 7,56 (д, J=8,2 Гц, 2H); 7,49 (д, J=8,4 Гц, 2H); 7,39 (д, J=8,2 Гц, 2H); 7,31 (д, J=8,4 Гц, 2H); 7,16 (д, J=2,4 Гц, 1H); 7,12 (с, 1H); 7,04 (с, 1H); 6,60 (д, J=12,2 Гц, 1H); 4,50 (д, J=11,6 Гц, 1H); 3,58-3,53 (м, 1H); 3,50 (кв, J=6,4 Гц, 2H); 2,53 (т, J=6,6 Гц, 2H); 2,33 (с, 3H); 1,51-1,37 (м, 2H); 0,99-0,92 (м, 2H); 0,70 (т, J=7,3 Гц, 3H). РХМС 1 3,83 хв. (M+H)=521. [α] = -126,6° (589 нм, EtOH). Сполуки в таблиці 1 одержують із застосуванням синтезу, описаного в прикладах 1 і 2. Дані для рацемічних сполук надані для більш активного діастереомеру. Дані для енантіочистих сполук надані для більш активного ізомеру. 55 96308 56 57 96308 58 Сполуки в таблиці 2 одержують із застосуванням синтезу, описаного в прикладах 1 і 2. Дані надані для більш активного ізомеру. 59 96308 60
ДивитисяДодаткова інформація
Назва патенту англійськоюGlucagon receptor antagonist compounds, composition comprising such compounds and use thereof
Автори англійськоюStelmach, John, E., Parmee, Emma, R., Tata, James, R., Rosauer, Keith, G., Kim, Ronald, M., Bittner, Amy, R., Chang, Jiang, Sinz, Christopher, Joseph
Назва патенту російськоюАнтагонисты рецептора глюкагона, композиция, которая содержит такие соединения, и их применение
Автори російськоюСтелмак Джон Е., Парми Эмма Р., Тата Джеймс Р., Росоер Кит Дж., Ким Роналд М., Биттнер Эми Р., Чан Цзиан, Синз Кристофер Джозеф
МПК / Мітки
МПК: A61P 3/06, A61P 3/04, A61P 3/10, A61P 9/10, C07D 209/18, A61K 31/404
Мітки: містить, застосування, рецептора, такі, антагоністи, глюкагону, сполуки, композиція
Код посилання
<a href="https://ua.patents.su/37-96308-antagonisti-receptora-glyukagonu-kompoziciya-shho-mistit-taki-spoluki-i-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антагоністи рецептора глюкагону, композиція, що містить такі сполуки, і їх застосування</a>
Попередній патент: Спосіб виготовлення тонкої литої сталевої стрічки та сталева композиція
Наступний патент: Хелати металів, які мають перфторований пег радикал, і їх застосування
Випадковий патент: Запірно-пломбувальний пристрій