Похідні конденсованого імідазолу, фармацевтична композиція на їх основі
Номер патенту: 76743
Опубліковано: 15.09.2006
Автори: Волпоул Крістофер, Янґ Хуа, Томашевскі Мірослав, Чен Юн-Шін
Формула / Реферат
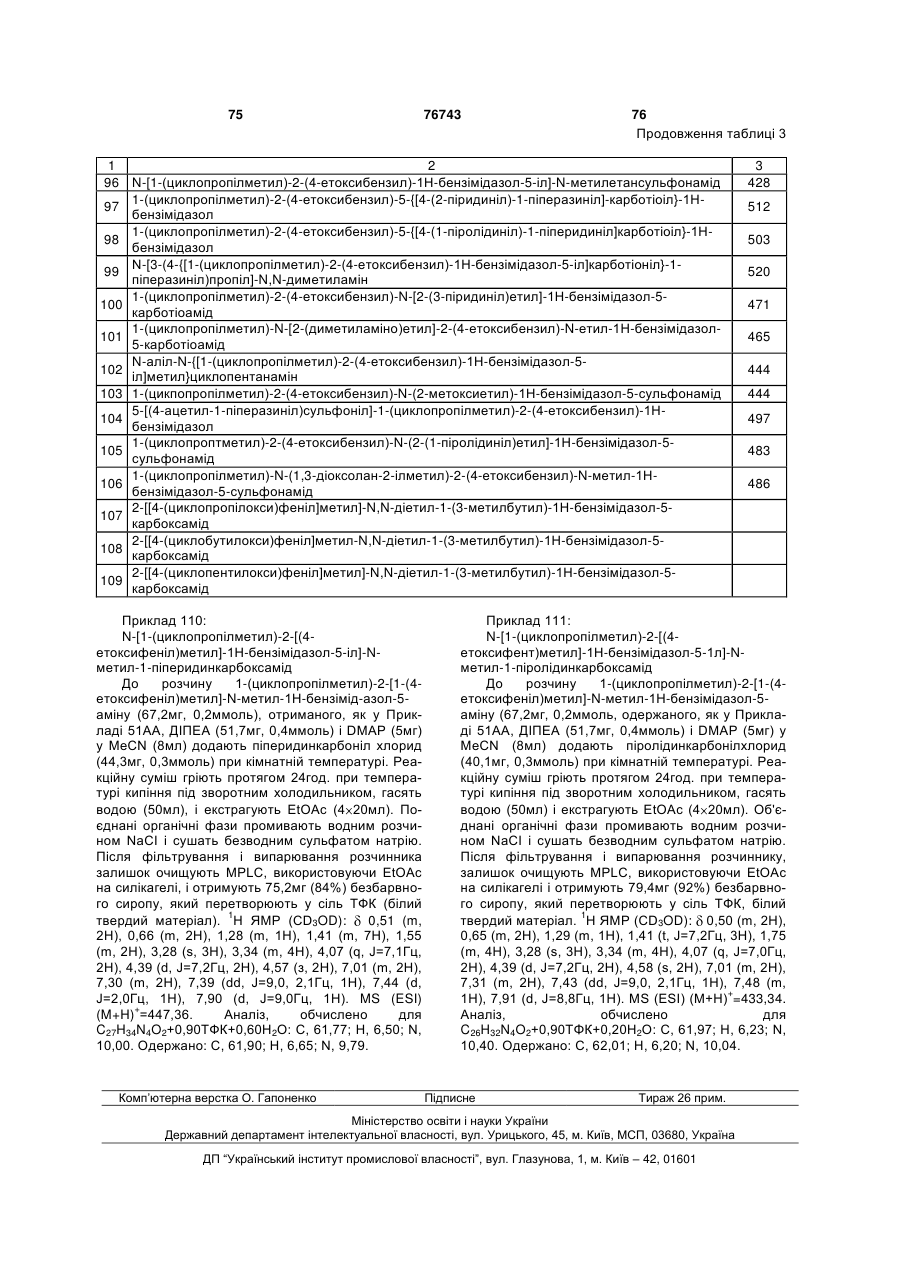
1. Сполука формули І або її фармацевтично прийнятна сіль:
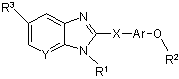 , I
, I
де
R1 вибрано з групи, яку складають -(С1-С8)алкіл, -(С2-С8)алкеніл, R42N(С1-С6)алкіл-, R42NC(=O)(C1-C6)алкіл-, R4О(С1-С6)алкіл-, R4OC(=O)(C1-C6)алкіл-, R4С(=О)(С1-С6)алкіл-, R4C(=O)NR4(C1-C6)алкіл-, R42NSO2(C1-C6)aлкiл-, R4CSO2NR4(C1-C6)алкіл- R42NC(=O)NR4(C1-С6)алкіл-, R42NSO2NR4(C1-C6)алкіл-, арил(С1-С6)алкіл-, ароїл(С1-С6)алкіл, гетероарил(С1-С6)алкіл, гетероароїл(С1-С6)алкіл, (C3-C8)гетероциклоалкіл(С1-С6)алкіл, біциклічний гетероарил(С1-С6)алкіл і біциклічний гетероароїл(С1-С6)алкіл;
компоненти R1 включають незаміщений -(С2-С8)алкеніл і -(С1-С8)алкіл, незаміщений або заміщений одним або декількома компонентами, незалежно вибраними з групи, яку складають галоген, ціаногрупа, ацетоксиметил і нітрогрупа;
Аr - як варіант, є заміщеним арильним компонентом;
R2 є -(С1-С6)алкілом, незаміщеним або заміщеним (на 1-6 карбонах) одним або декількома флуориновими замісниками, або є (С3-С6)циклоалкілом;
R3 вибрано з групи, яку складають:
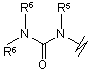 (a),
(a),
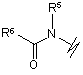 (b),
(b),
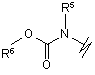 (c),
(c),
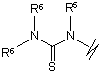 (d),
(d),
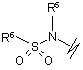 (e),
(e),
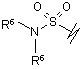 (f),
(f),
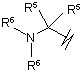 (g),
(g),
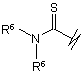 (h),
(h),
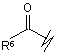 (i),
(i),
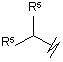 (j)
(j)
і
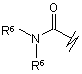 (k),
(k),
R4 - компонент, незалежно вибраний з групи, яку складають -Н, -(С1-С6)алкіл, -(С2-С6)алкеніл і -(С2-С6)алкініл;
компоненти R5 незалежно вибрано з групи, яку складають -Н, -(С1-С6)алкіл, -(С2-С6)алкеніл і гетероцикліл;
компоненти R6 незалежно вибрано з групи, яку складають -Н, -(С1-С6)алкіл, -(С2- С6)алкеніл і -(С1-С6)алканоїл, гетероцикліл, гетероцикліл(С1-С3)алкіл, арил, арил(С1-С3)алкіл, гетероарил, гетероарил(С1-Сз)алкіл, біциклічний гетероарил і біциклічний гетероарил(C1-С3)алкіл;
R5 і R6 можуть разом утворювати 5-7-членний гетероцикл;
X вибрано з групи, яку складають -C(R5)2-, -NR5-, С(=О)-, -СН2-СН2-, - СН=СН-, -О-, -C(R)(R')- і -S(O)n- (де n = 0, 1 або 2), де R і R' = (С1-С6)алкіл, OR" або Н, R" = Н або (С1-С6)алкіл; і
Y - С або N,
причому, якщо R1 є R42N(C1-C6)aлкіл-, де у обох випадках R4 – (С1-С6)алкіл, то тоді R3 не є ацетилом, -NH2 або ацетамідо.
2. Сполука за п. 1, яка відрізняється тим, що:
R1 вибрано з групи, яку складають -(С1-С8)алкіл, -(С2-С8)алкеніл, арил(С1-С6)алкіл, R42N(С1-С6)алкіл-, R4O(C1-C6)алкіл-, -гетероциклоалкіл(С1-С6)алкіл (де гетероцикліл є 4-8-членним кільцем з одним або більше гетероатомами, вибраними з нітрогену або оксигену) і гетеро-арил(С1-С6)алкіл;
причому арильний і гетероарильний компоненти R1 є незаміщеними або заміщеними -(С1-С6)алкілом або галогеном;
R2 вибрано з групи, яку складають -СН3, -СН2СН3, -СН(СН3)2 та CF3;
R3 вибрано з групи, яку складають:
 (a),
(a),
 (b),
(b),
 (d),
(d),
 (e),
(e),
 (f),
(f),
 (g),
(g),
 (h),
(h),
 (k),
(k),
Аr - арильний компонент, незаміщений або заміщений одним або декількома компонентами, незалежно вибраними з групи, яку складають (С1-С6)алкіл, галоген, трифлуорметил, ціано-, нітро-, гідроксигрупа і -OR4;
X вибрано з групи, яку складають -СН2-, -СН(СН3)-, -С(CH3)2, -CH(OH)-, NH-, N(CH3)-,-CH2CH2-, -C(=O)-, -S- та -О-;
коли Аr є фенілом або 6-членною гетероароматичною кільцевою системою, X розташовано на кільці Аr у співвідношеннi 1,4 відносно групи -O-R2;
коли Аr є 5-членною гетероароматичною кільцевою системою, X розташовано на кільці Аr у співвідношенні 1,3 відносно групи -O-R2;
R4 незалежно вибрано з групи, яку складають -Н і -(С1-С6)алкіл;
R5 незалежно вибрано з групи, яку складають -Н, -(С1-С6)алкіл і -(С2-С6)алкеніл; і
R6 незалежно вибрано з групи, яку складають -Н, -(С1-С6)алкіл, -(С2-С6)алкеніл і гетероарил;
причому зазначений гетероарил є незаміщеним або заміщеним -(С1-С6)алкілом.
3. Сполука за п. 1, яка відрізняється тим, що:
R1 вибрано з групи, яку складають циклопропілметил, етил, пропіл, аліл, ізопентил, бензил, метоксіетил, диметиламіноетил, 4-піридилметил, 2-піридилметил, 1-піролілетил, 1-морфоліноетил, 5-(2-метилтіазоліл), циклогексилметил, 2-піролідилметил, N-метил-2-піролідилметил, 2-піперидилметил, N-метил-2-піперидилметил, 3-тієнілметил, 2- тетрагідрофуранілметил, (2-нітротіофен-5-іл)метил, (1-метил-1Н-імідазол-2-іл)метил, (5-(ацетоксиметил)-2-фураніл)метил, (2,3-дигідро-1Н-ізоіндол-1-іл)метил і 5-(2-метилтіазоліл);
R2 вибрано з групи, яку складають -СН3, -СН2СН3, -СН(СН3)2 і CF3; R4- -(С1-С6)алкіл;
R5 вибрано з групи, яку складають -Н, -СН3, -СН2СН3, -СН=СН2 і -СН2-СН=СН2;
R6 вибрано з групи, яку складають -СН3, -СН2СН3, -СН=СН2, -СН2-СН=СН2, -СН2-СН2-СН=СН2, -СН2СН(СН3)2 і 5-метил-3-ізоксазол;
Аr - феніл або 6-членна гетероароматична кільцева система, кожний з яких може бути незаміщеним або заміщений одним або декількома компонентами, незалежно вибраними з групи, яку складають (С1-С6)алкіл, галоген, трифлуорметил, ціано-, нітро-, гідроксигрупа і -OR4;
X вибрано з групи, яку складають -СН2-, -СН2СН2-, -S-, -О-, -СH(CH3)-, -C(CH3)2-, -CH(OH)-, -NH-, -N(CH3)-, та –C(=O)-; та
X розташовано на кільці Аr у співвідношенні 1,4 відносно групи –O-R2.
4. Сполука за п. 1, яка відрізняється тим, що:
R2 - -СН2СН3;
Аr - незаміщений феніл або піридил;
X вибрано з групи, яку складають –CH2, -CH2CH2-, -S-, СН(СН3)-, -С(СН3)2-, -СН(ОН)-, - NH-, -N(CH3)- і -О-;
X розташовано на кільці Аr у співвідношенні 1,4 відносно групи -O-R2, і R4 - метил.
5. Сполука формули І за будь-яким з пп. 1 - 4, яка відрізняється тим, що її призначено для використання у терапії.
6. Сполука за п. 5, яка відрізняється тим, що терапією є терапія болю.
7. Використання сполуки за п. 1 для виготовлення медикаменту, призначеного для терапії болю.
8. Фармацевтична композиція, яка містить сполуку за п. 1 як активний інгредієнт разом з фармацевтично прийнятним носієм.
9. Спосіб терапії болю у теплокровної тварини, який включає введення зазначеній тварині, що потребує такої терапії, терапевтично ефективної кількості сполуки формули І, визначеної у п. 1.
Текст
1. Сполука формули І або її фармацевтично прийнятна сіль: R3 N X Ar O (І) N Y R2 R1 , де R1 вибрано з групи, яку складають -(С1-С8)алкіл, -(С2С8)алкеніл, R42N(С1-С6)алкіл-, R42NC(=O)(C1-C6)алкіл-, R4О(С1-С6)алкіл-, R4OC(=O)(C1-C6)алкіл-, R4С(=О)(С1С6)алкіл-, R4C(=O)NR4(C1-C6)алкіл-, R42NSO2(C14 4 4 C6)aлкiл-, R CSO2NR (C1-C6)алкіл- R 2NC(=O)NR4(C1С6)алкіл-, R42NSO2NR4(C1-C6)алкіл-, арил(С1-С6)алкіл-, ароїл(С1-С6)алкіл, гетероарил(С1-С6)алкіл, гетероароїл(С1-С6)алкіл, (C3-C8)гетероциклоалкіл(С1-С6)алкіл, біциклічний гетероарил(С1-С6)алкіл і біциклічний гетероароїл(С1-С6)алкіл; компоненти R1 включають незаміщений -(С2С8)алкеніл і -(С1-С8)алкіл, незаміщений або заміщений одним або декількома компонентами, незалежно вибраними з групи, яку складають галоген, ціаногрупа, ацетоксиметил і нітрогрупа; Аr - як варіант, є заміщеним арильним компонентом; R2 є -(С1-С6)алкілом, незаміщеним або заміщеним (на 1-6 карбонах) одним або декількома флуориновими замісниками, або є (С3-С6)циклоалкілом; R3 вибрано з групи, яку складають: UA (21) 2003108942 (22) 18.04.2002 (24) 15.09.2006 (86) PCT/SE02/00769, 18.04.2002 (31) 0101387-9 (32) 20.04.2001 (33) SE (46) 15.09.2006, Бюл. № 9, 2006 р. (72) Чен Юн-Шін , CA, Томашевскі Мірослав , CA, Волпоул Крістофер , CA, Ян Хуа , CA (73) АСТРАЗЕНЕКА АБ, SE (56) CHEMICAL ABSTRACTS, Vol: 71, Nr. 13, 29.09.19969, (COLUMBUS, Ohio, USA), SEKI, TERUYA; ET AL, '"2-Benzimidazolethiol derivatives. IV. Synthesis and analgesic effect of 1-(2diethylaminoethyl)-2-(p-ethoxyphenylthio)-5substituted, benzimidazole", p. 445, THE ABSTRACT №61291h CHEMICAL ABSTRACTS, Vol: 78, Nr. 1, 08.01.1973, (COLUMBUS, Ohio, USA), PAGLIETTI G; SPARATORE F, "Dialkylaminoalkylbenzimidazoles of pharmacological interest", p. 84, THE ABSTRACT №87u CHEMICAL ABSTRACTS, Vol: 77, Nr. 7, 14.08.1972, (COLUMBUS, Ohio, USA), PAGLIETTI, G. et al, "Dialkylaminoalkylbenzimidazoles of pharmacological interest.III", p. 479, THE ABSTRACT №48338h CHIM. THER., Vol: 2, Nr. 1, 1967, LECOLIER S; TROUILLER G, "New benzimidazoles with morphine activity. Nouveaux benzimidazoles doues d'activite morphinique", pp. 16-24 FR1481049 A, 10.04.1967 2 (19) 1 3 R6 N N R6 76743 4 R2 вибрано з групи, яку складають -СН3, -СН2СН3, СН(СН3)2 та CF3; R3 вибрано з групи, яку складають: R5 R6 R5 R5 R5 R6 O N O (a), (b), R5 R5 N O R6 N N O S (c), O R6 O R5 R6 N R6 R6 N R6 S O N O R5 O N R6 (f), (g), S R6 R6 (g), (h), R5 O N R6 R5 (i), (j) O R6 R6 N R6 і (k), R - компонент, незалежно вибраний з групи, яку складають -Н, -(С1-С6)алкіл, -(С2-С6)алкеніл і -(С2С6)алкініл; компоненти R 5 незалежно вибрано з групи, яку складають -Н, -(С1-С6)алкіл, -(С2-С6)алкеніл і гетероцикліл; компоненти R6 незалежно вибрано з групи, яку складають -Н, -(С1-С6)алкіл, -(С2- С6)алкеніл і -(С1С6)алканоїл, гетероцикліл, гетероцикліл(С1-С3)алкіл, арил, арил(С1-С3)алкіл, гетероарил, гетероарил(С1-Сз)алкіл, біциклічний гетероарил і біциклічний гетероарил(C 1-С3)алкіл; R5 і R6 можуть разом утворювати 5-7-членний гетероцикл; X вибрано з групи, яку складають -C(R5)2-, -NR5-, С(=О)-, -СН2-СН2-, - СН=СН-, -О-, -C(R)(R')- і -S(O)n(де n = 0, 1 або 2), де R і R' = (С1-С6)алкіл, OR" або Н, R" = Н або (С1-С6)алкіл; і Y - С або N, причому, якщо R1 є R42N(C1-C6)aлкіл-, де у обох випадках R4 – (С1-С6)алкіл, то тоді R3 не є ацетилом, -NH2 або ацетамідо. 2. Сполука за п. 1, яка відрізняється тим, що: R1 вибрано з групи, яку складають -(С1-С8)алкіл, (С2-С8)алкеніл, арил(С1-С6)алкіл, R42N(С1-С6)алкіл-, R4O(C1-C6)алкіл-, -гетероциклоалкіл(С1-С6)алкіл (де гетероцикліл є 4-8-членним кільцем з одним або більше гетероатомами, вибраними з нітрогену або оксигену) і гетеро-арил(С1-С6)алкіл; причому арильний і гетероарильний компоненти R1 є незаміщеними або заміщеними -(С1-С6)алкілом або галогеном; (e), R5 R6 S R6 N (b), R5 (d), O S R5 N S (f), O (a), R6 S R6 (e), N R6 O N R5 N (d), O N S O R6 R5 R6 R6 N R6 R6 R6 4 N O R6 N R6 (h), (k), Аr - арильний компонент, незаміщений або заміщений одним або декількома компонентами, незалежно вибраними з групи, яку складають (С1-С6)алкіл, галоген, трифлуорметил, ціано-, нітро-, гідроксигрупа і -OR4; X вибрано з групи, яку складають -СН2-, -СН(СН3)-, С(CH3)2, -CH(OH)-, NH-, N(CH3)-,-CH2CH2-, -C(=O)-, S- та -О-; коли Аr є фенілом або 6-членною гетероароматичною кільцевою системою, X розташовано на кільці Аr у співвідношеннi 1,4 відносно групи -O-R2; коли Аr є 5-членною гетероароматичною кільцевою системою, X розташовано на кільці Аr у співвідношенні 1,3 відносно групи -O-R2; R4 незалежно вибрано з групи, яку складають -Н і -(С1С6)алкіл; R5 незалежно вибрано з групи, яку складають -Н, (С1-С6)алкіл і -(С2-С6)алкеніл; і R6 незалежно вибрано з групи, яку складають -Н, (С1-С6)алкіл, -(С2-С6)алкеніл і гетероарил; причому зазначений гетероарил є незаміщеним або заміщеним -(С1-С6)алкілом. 3. Сполука за п. 1, яка відрізняється тим, що: R1 вибрано з групи, яку складають циклопропілметил, етил, пропіл, аліл, ізопентил, бензил, метоксіетил, диметиламіноетил, 4-піридилметил, 2піридилметил, 1-піролілетил, 1-морфоліноетил, 5-(2метилтіазоліл), циклогексилметил, 2піролідилметил, N-метил-2-піролідилметил, 2піперидилметил, N-метил-2-піперидилметил, 3тієнілметил, 2тетрагідрофуранілметил, (2нітротіофен-5-іл)метил, (1-метил-1Н-імідазол-2іл)метил, (5-(ацетоксиметил)-2-фураніл)метил, (2,3дигідро-1Н-ізоіндол-1-іл)метил і 5-(2-метилтіазоліл); R2 вибрано з групи, яку складають -СН3, -СН2СН3, СН(СН3)2 і CF3; R4- -(С1-С6)алкіл; R5 вибрано з групи, яку складають -Н, -СН3, -СН2СН3, СН=СН2 і -СН2-СН=СН2; 5 76743 6 R6 вибрано з групи, яку складають -СН3, -СН2СН3, X вибрано з групи, яку складають –CH2, -CH2CH2-, -S-, СН=СН2, -СН2-СН=СН2, -СН2-СН2-СН=СН2, СН(СН3)-, -С(СН3)2-, -СН(ОН)-, - NH-, -N(CH3)- і -О-; СН2СН(СН3)2 і 5-метил-3-ізоксазол; X розташовано на кільці Аr у співвідношенні 1,4 відАr - феніл або 6-членна гетероароматична кільцева носно групи -O-R2, і R4 - метил. система, кожний з яких може бути незаміщеним або 5. Сполука формули І за будь-яким з пп. 1 - 4, яка заміщений одним або декількома компонентами, відрізняється тим, що її призначено для використаннезалежно вибраними з групи, яку складають (С1ня у терапії. С6)алкіл, галоген, трифлуорметил, ціано-, нітро-, 6. Сполука за п. 5, яка відрізняється тим, що терапігідроксигрупа і -OR4; єю є терапія болю. X вибрано з групи, яку складають -СН2-, -СН2СН2-, -S-, 7. Використання сполуки за п. 1 для виготовлення -О-, -СH(CH3)-, -C(CH3)2-, -CH(OH)-, -NH-, -N(CH3)-, та – медикаменту, призначеного для терапії болю. C(=O)-; та 8. Фармацевтична композиція, яка містить сполуку X розташовано на кільці Аr у співвідношенні 1,4 відза п. 1 як активний інгредієнт разом з фармацевтичносно групи –O-R2. но прийнятним носієм. 4. Сполука за п. 1, яка відрізняється тим, що: 9. Спосіб терапії болю у теплокровної тварини, R2 - -СН2СН3; який включає введення зазначеній тварині, що Аr - незаміщений феніл або піридил; потребує такої терапії, терапевтично ефективної кількості сполуки формули І, визначеної у п. 1. Винахід стосується нових сполук та їх солей, які є агоністами рецептора СВ2. Ці сполуки можуть бути використані у терапії, зокрема, у терапії болю. Винахід стосується також способів виготовлення цих нових сполук, фармацевтичних композицій, що містять їх, і використання цих сполук у терапії, зокрема, у терапії болю. Відомими є два канабіоїдні рецептори: один з них експресується, головним чином, у центральній нервовій системі (СВ1), а другий локалізується на периферії, головним чином, у клітинах і тканинах, що походять від імунної системи (СВ2) [див. Abood і Martin Int. Rev, of Neu-robio. 39, 197-221, 1996]. В той час, як агоністи рецептора СВ1 і змішані агоністи є високоефективними у антиноцицептичних моделях на тваринах, не було знайдено можливості у будь-якій мірі відділити бажану аналгезійну дію від небажаної побічної дії на центральну нервову систему (ЦНС). Відомо, що медіатором цієї дії є рецептор СВ1. Деякі дослідження вказують на важливу роль СВ2 у патофізіології. Зокрема, Munro et.al. [Nature 365 61-65 (1993)] виявили, що експресія СВ2 індукується в умовах активації імунних клітин. Hanus et. al [PNAS 96M4228-14233 (1999)] нещодавно показали, що агоніст СВ2 має антизапальну і периферійну аналгезійну дію. Крім того, Mazzari et. al. [Soc. Neurosci. Abstr. 23 652 (1995)] показали, що активування СВ2 інгібує механічну гіпералгезію, пов'язану з травмою нерва. Ці результати показують, що рецептор СВ2 є цінним об'єктом досліджень, спрямованих на відкриття нових аналгетиків, вільних від побічної дії, пов'язаної з звичайними канабіоїдними агоністами (наприклад, тетрагідроканабінолом (ТГК)), і медіатором якої є СВ1. Крім того, оскільки локалізація рецепторів СВ2 обмежується периферією, можна сподіватись, що селективні агоністи СВ2 можуть послаблювати біль психоактивної побічної дії і без потенційно відчутної центральної дії, притаманної канабіміметикам або опіатам. Ідентифіковані існуючі аналгетики мають багато вад, серед яких слід відзначити низьку фарма кокінетику і втрату аналгезійної активності при введенні системічними шляхами. Об'єктом винаходу є сполуки формули І і їх фармацевтично прийнятні солі, діастереомери, енантіомери і їх суміші. де R1 обрано з групи, яку складають -(С1-С8)алкіл, -(С2-С8)алкеніл, R42N(С1-С6)алкіл-, R42МС(=О)(С1С6)алкіл-, R4О(С1-С6)алкіл-, R4ОС(=О)(С1-С6)алкіл-, R4С(=О)(С1-С6)алкіл-, R4C(=O)NR4(С1-С6)алкіл-, 4 R NSO2(С1-С6)алкіл-, R4CSO2NR4(С1-С6)алкіл-, R42NC(=O)NR4(С1-С6)алкіл-, R42NSO2NR4(С1С6)алкіл-, арил(С1-С6)алкіл-, ароїл(С1-С6)алкіл, гетероарил(С1-С6)алкіл, гетероароїл(С1-С6)алкіл, гетероциклоалкіл(С1-С6)алкіл, біциклічний гетероарил(С1-С6)алкіл і біциклічний гетероароїл(С1С6)алкіл; Компоненти R1 включають незаміщений -(С2С8)алкеніл і -(С1-С8)алкіл, незаміщений або заміщений одним або декількома компонентами, незалежно обраними з групи, яку складають галоген, ціаногрупа, ацетоксиметил і нітрогрупа; Аr - як варіант, заміщений арильний компонент; R2 - -(С1-С6)алкіл, незаміщений або заміщений (на 1-6 карбонах) одним або декількома флуориновими замісниками, або (С1-С6)циклоалкіл; R3 обрано з групи, яку складають: 7 76743 8 разоліл, 1,2,3-тіадіазоліл, 1,2,3-оксадіазоліл, 1,2,4тріазоліл, 2,4-тіадіазоліл, 1,2,4-оксадіазоліл, 1,3,4тріазоліл, 1,3,4-тіадіазоліл, і 1,3,4 оксадіазоліл. 6-членною гетероароматичною кільцевою системою є моноциклічна ароматична кільцева система, яка має на кільці 6 атомів і 1, 2 або 3 з цих атомів є N. Бажано обирати 6-членні гетероароматичні кільцеві системи з групи, яку складають піридил, піразиніл, піримідиніл, тріазиніл і пірадазиніл. Біциклічною гетероароматичною кільцевою системою є кільцева система з двома 5- або 6членними гетероароматичними кільцями або феніл і 5- або 6-членне гетеро-ароматичне кільце, або феніл і гетероциклільне кільце, або 5- або 6членне гетероароматичні кільце і гетероциклільне кільце; з'єднана кільцевим злиттям зазначена біциклічна гетероароматична кільцева система включає 8-12 кільцевих атомів, з яких 1, 2 або 3 4 R - компонент, незалежно обраний з групи, незалежно обрані серед Ν, Ο і S. яку складають -Н, -(С1-С6)алкіл, -(С2-С6)алкеніл і Біциклічні гетероароматичні кільцеві системи (С2-С6)алкініл; бажано вибирати з групи, яку складають індол, 4 4 NR 2 включає сполуки, у яких NR 2 утворює геіндолін, хінолін, тетрагідрохінолін, ізохінолін, теттероциклічну кільцеву систему, наприклад, пірол, рагідроізохінолін, 1,4-бензодіоксан, кумарин, дигіпіперидин, піперазин або піролідинон; дрокумарин, бензофуран, 2,3-дигідробензофуран, 5 Компонент R незалежно обрано з групи, яку 1,2-бензізоксазол, бензотіофен, бензоксазол, бенскладають -Н, -(С1-С6)алкіл, -(С2-С6)алкеніл і гетезтіазол, бензімідазол, бензотріазол, піролізидин і роцикліл; хінолізидин. 5 5 NR 2 включає сполуки, у яких NR 2 утворює геГетероциклільний або гетероциклільний комтероциклічну кільцеву систему, наприклад, пірол, понент є насиченою або частково насиченою кільпіперидин, піперазин або піролідинон; цевою системою з 3-7 кільцевими атомами, серед Компонент R6 незалежно обрано з групи, яку яких 1, 2 або 3 незалежно вибрані серед Ν, Ο і S. складають: -Н, -(С1-С6)алкіл, -(С2-С6)алкеніл і -(С1Гетероциклільний компонент бажано вибирати С6)алканоїл, гетероцикліл, гетероцикліл(С1з групи, яку складають азиридин, оксиран, тііран, С3)алкіл, арил, арил(С1-С3)алкіл, гетероарил, гетеацетидин, оксетан, тіетан, піролідин, піролін, імідароарил(С1-С3)алкіл, біциклічний гетероарил і біцизотидин, піразотидин, діоксолан, сульфолан 2,3клічний гете-роарил(С1-С3)алкіл; дигідрофураніл, 2,5-дигідрофураніл, тетрагідро5 6 R і R можуть разом утворювати 5-7-членний фураніл, тіофаніл, піперидин, піперазин, морфогетероцикл, наприклад, пірол, піперидин, піпералін, 2,3-дигідропіраніл, тетрагідропіраніл, 1,4зин, піролідинон, гомопіперазин або гексаметиледигідропіридиніл, 1,4-діоксаніл, 1,3-діоксаніл, діокнімін; саніл, гомопіперидиніл, гомопіперазиніл, 1,35 5 X обрано з групи, яку складають -C(R )2-, -NR діоксепан, 4,7-дигідро-1,3-діоксепін, і гексаметиле, С(=О)-, -СН2-СН2-, - СН=СН-, -О-, -C(R)(R')- і ноксид. 1 S(O)n- (де n=0, 1 або 2), R і R - (С1-С6)алкіл, OR" Ароматичні, гетероароматичні, гетероциклільні або Н, R" - Η або (С1-С6)алкіл; і Υ - С або N. і біциклічні гетероароматичні компоненти є незаТермін алкіл тут включає прямий ланцюг, розміщеними або заміщеними на карбонах кільця, галужений ланцюг і циклічні замісники, наприклад, бажано, компонентом, незалежно вибраним з груметил, етил, n-пропіл, ізопропіл, n-бутил, ізобутил, пи, яку складають галоген, трифлуорметил, ціано-, t-бутил, циклопропілметил і циклопентил, а компонітро-, гідроксигрупа, -NR42, -C(=O)OR4, -C(=O)R4, ненти можуть знаходитись будь-де на алкільному C(=O)NR4, -NR4C(=O)R4, -(С1-С6)алкіл, -(С2ланцюгу, і, таким чином, аміно(С1-С6)алкіл включає С6)алкеніл, -(С2-С6)алкініл, -OR4, -SR4, -SO2R4, ок1-амінопропіл і 2-амінопропіл. со(=O), iмінo(=NR4), тio(=S) і оксиміно(=N-OR4). Термін галоген включає флуор, хлор, бром і Атоми нітрогену кільця у 5-членних гетероаіод. Термін арильний компонент включає ароматироматичних, гетероциклільних або біциклічних чні карбоцикли, 5-членні гетероароматичні кільцеві гетероароматичних кільцевих системах є незамісистеми, 6-членні гетероароматичні кільцеві сисщеними або заміщеними, якщо таке заміщення є теми і біциклічні гетероароматичні кільцеві систехімічно можливим без кватернізації зазначеного ми. нітрогену кільця, бажано, компонентом, незалежно Ароматичний карбоцикл включає феніл і нафобраним з групи, яку складають -(С1-С6)алкіл і тил. 4 C(=O)R . 5-членною гетероароматичною кільцевою сисЗамісники -(С1-С6)алкіл, -(С2-С6)алкеніл і -(С1темою є С6)алканоїл є незаміщеним або заміщеними на Бажано вибирати 5-членні гетероароматичні одному або більше карбонах компонентами, незакільцеві системи з групи, яку складають тієніл, фулежно вибраними з групи, яку складають галоген, рил, піроліл, імідазоліл, тіазоліл, оксазоліл, пірагідроксил, -OR4 і -NR42. золіл, ізотіазоліл, ізоксазоліл, 1,2,3-тріазоліл, тетЗрозуміло, що, коли сполуки винаходу містять 9 76743 10 один або більше хіральних центрів, вони можуть коли Аr - 5-членна гетероароматична кільцева існувати і бути ізольовані як енантіомерична або система, X розташовано на кільці Аr у співвіднодіастереомерична форма, або як рацемічна суміш шення 1,3 відносно групи -O-R2; сполук формули І, яка діє як агоніст СВ2. Синтез R4 незалежно обрано з групи, яку складають оптично активних форм може бути здійснений з Н і -(С1-С6)алкіл; 5 використанням стандартних методів органічної R незалежно обрано з групи, яку складають хімії, наприклад, хіральним хроматографічним Н, -(С1-С6)алкіл і -(С2-С6)алкеніл; і розділенням рацематів, синтезом з оптично активR6 незалежно обрано з групи, яку складають них вихідних матеріалів або асиметричним синтеН, -(С1-С6)алкіл, -(С2-С6)алкеніл і гетероарил; зом. причому зазначений гетероарил є незаміщеСлід відзначити, що певні сполуки винаходу ним або заміщеним -(С1-С6)алкілом. можуть існувати як геометричні ізомери, наприБільш бажаними є сполуки винаходу формули клад, Е- і Z-ізомери алкенів. Винахід включає таІ, у яких: кож будь-який геометричний ізомер сполуки форR1 обрано з групи, яку складають циклопропімули І, який діє як агоніст СВ2, і таутомери лметил, етил, пропіл, аліл, ізопентил, бензил, месполуки формули І. токсиетил, диметиламіноетил, 4-піридилметил, 2Зрозуміло, що певні сполуки винаходу можуть піридилметил, 1-піролілетил, 1-морфоліноетил, існувати у сольватованій, наприклад, гідрованій, і у циклогексилметил, 2-піролідилметил, N-метил-2несольватованій формі. Зрозуміло також, що випіролідилметил, 2-піперидилметил, N-метил-2нахід включає всі такі соль-ватовані форми сполупіперидилметил, 3-тієнілметил, 2ки формули І, які діють як агоністи СВ2. тетрагідрофуранілметил, (2-нітротіофен-5У бажаному втіленні формули І, якщо R1 іл)метил, (1-метил-1Н-імідазол-2-іл)метил, (5R42N(С1-С6)алкіл-, де у обох випадках R4 - -(С1(ацетоксиметил)-2-фураніл)метил, (2,3-дигідро-1НС6)алкіл, то R3 має бути обрана серед компонентів ізоіндол-1-іл)метил і 5-(2-метилтіазоліл); (див. вище) (а), (с), (d), (e), (f), (r), (h), і (k), і, як ваR2 обрано з групи, яку складають -СН3, ріант, (b) і (і) (за винятком випадку, коли R6 - -(С1СН2СН3, -СН(СН3)2 і CF3; С6)алкіл (зокрема, метил, наприклад, R3 - ацетил R4- -(С1-С6)алкіл; або ацетамід) і (j) (за винятком варіанту, коли R5 R5 обрано з групи, яку складають -Н, -СН3, Η у обох випадках, наприклад, коли R3 - первинний СН2СН3, -СН=СН2 і -СН2-СН=СН2; амін). R6 обрано з групи, яку складають -СН3, Бажаними є сполуки винаходу, у яких: СН2СН3, -СН=СН2, -СН2-, -СН=СН2, -СН2-СН2R1 обрано з групи, яку складають -(С1-С8)алкіл, СН=СН2, -СН2СН(СН3)2 і 5-метил-3-ізоксазол; 4 -(С2-С6)алкеніл, арил(С1-С6)алкіл, R 2N(С1Аr - феніл або 6-членна гетероароматична кіС6)алкіл-, R4О(С1-С6)алкіл-, -гетероциклоалкіл((С1льцева система, кожний з яких може бути незаміС6)алкіл (4-8-членний) і гетероарил(С1-С6), щеним або заміщений одним або декількома компричому арильна і гетероарильна компоненти понентами, незалежно обраними з групи, яку R1 є незаміщеними або заміщеними -(С1складають (С1-С6)алкіл, галоген, трифлуорметил, С6)алкілом, ацетоксиметилом або галогеном; ціано-, нітро-, гідро-ксигрупа і -OR4; 2 R обрано з групи, яку складають -СН3, X обрано з групи, яку складають -СН2-, СН2СН3, -СН(СН3)2, (С3-С5)циклоалкіл і CF3; СН2СН2-3 -S-, -О-, -CC(O)-, -C(R)(R') і -N(R)-, де R і R3 обрано з групи, яку складають: R1 - (С1-С6)алкіл, OR", або Η і R" - Η або (С1С6)алкіл; причому X розташовано на кільці Аr у співвідношенні 1,4 відносно групи -O-R2. Найбільш бажаними є сполуки винаходу формули І, у яких: R - СН2СН3; Аr - незаміщений феніл або піридил; X обрано з групи, яку складають -СН2-, СН2СН2-, -S-, -О-, -C(R)(R')- і -N(R), де R і R1 - (С1С6)алкіл, OR", або Н, і R" - Η або (С1-С6)алкіл; X розташовано на кільці Аг у співвідношенні 1,4 відносно групи -O-R2 і R4 -метил. Аr - арильний компонент, незаміщений або У деяких бажаних сполуках X обрано з групи, заміщений одним або декількома компонентами, яку складають СН(СН3)-, -С(СН3)2-, -СН(ОН)-, -ΝΗнезалежно обраними з групи, яку складають (С1і -N(CH3)-, найкраще СН(СН3). С6)алкіл, галоген, трифлуо-рметил, ціано-, нітро-, Було виявлено, що сполуки винаходу проявгідроксигрупа і -OR4; ляють селективну активність на боці рецептора X обрано з групи, яку складають -СН2-, СВ2 і можуть бути використані для полегшення СН2СН2-, -С(=О), -S-, -О-, - C(R)(R') і N(R)-, де R і болю, зокрема, хронічного болю, наприклад, хроR1 -(С1-С6)алкіл, OR" або Η і R" - Η або (С1нічного запального болю, нейропатичного болю, С6)алкіл; спинного болю, ракового болю і cancer pain і вісколи Аr - феніл або 6-членна гетероароматичцерального болю. на кільцева система, X розташовано на кільці Аr у Сполуки винаходу можуть бути використані співвідношення 1,4 відносно групи -O-R2; також для лікування гострого болю і для полег 11 76743 12 шення інших хворобливих станів, у яких має місце композицію, що містить сполуку формули І або її дегенерація або дисфункція рецепторів СВ2. фармацевтично прийнятну сіль разом фармацевВ об'єм винаходу входять також солі сполук тично прийнятним носієм, призначену, зокрема, формули І. Взагалі, фармацевтично прийнятні солі для терапії болю. сполук винаходу можна одержати, використовуюКрім того, передбачено фармацевтичну комчи стандартні процедури, наприклад, реакцією позицію, що містить сполуку формули І або її фасполук достатньої лужності, наприклад, алкіламірмацевтично прийнятну сіль разом фармацевтичну, з відповідною кислотою, наприклад, НСІ або но прийнятним носієм, призначену для оцтовою кислотою, з одержанням фізіологічно використання при наявності описаних вище станів. прийнятного аніону. Можна також одержати сіль Терапія у контексті винаходу означає введення лужного металу (наприклад, натрію, калію або ліефективної кількості сполуки винаходу для полегтію) або лужноземельного металу (наприклад, шення наявного болісного стану, гострого або кальцію), обробляючи сполуку винаходу, що має хронічного, або повторного виникнення цього стапридатний кислотний протон, наприклад, карбонону. Це визначення включає також профілактичні ву кислоту або фенол, одним еквівалентом гідроктерапії для запобігання повторенню станів і просиду (наприклад, етоксиду або алкоксиду) лужного довження терапії у випадку хронічних розладів. або лужноземельного металу або відповідним луФармацевтичні композиції жним органічним аміном (наприклад, холіном або Нові сполуки винаходу можна вводити оральмеглуміном), у водному середовищі, з подальшим но, під'язично, внутрішньом'язово, підшкірно, лозвичайним очищенням. Винахід включає також кально інтраназально, внутрішньовенно, внутрішвикористання сполук винаходу у терапії. ньочеревно, внутрішньогрудинно, епідурально, Нові сполуки винаходу можуть бути викорисінтратекально, інтрацеребровентрикулярно і ін'єктані у терапії, зокрема, у терапії різних болісних цією у суглоби. станів, включаючи (але не лише) гострий біль, Бажаними шляхами введення є оральний, хронічний біль, нейропатичний біль, спинний біль, внутрішньовенний або внутрішньом'язовий. Дозураковий біль і вісцеральний біль. вання залежить від способу введення, гостроти При використанні у терапії теплокровних твазахворювання, віку і маси пацієнта і інших факторин, наприклад, людини, агоніст СВ2 має бути рів, які звичайно беруться до уваги лікарем при введений у формі звичайної фармацевтичної компризначенні режиму і дозування для даного конкпозиції, звичайно придатної для орального або ретного пацієнта. під'язичного введення, наприклад, у вигляді табДля приготування фармацевтичних композицій летки або капсули, для парентеральної ін'єкції з сполук винаходу можуть бути використані тверді (включаючи внутрішньовенні, підшкірні, внутрішабо рідкі фармацевтично прийнятні носи. Тверді ньом'язові і внутрішньосудинні ін'єкції і інфузію), композиції включають порошки, таблетки, диспернаприклад, у вигляді стерильних розчину, суспензії сні гранули, капсули, облатки і супозиторії. або емульсії для локального введення у мазі або Твердим носієм може бути одна або декілька кремі, або для ректального введення у вигляді, речовин, які можуть також діяти як розчинники, наприклад, супозиторію. Взагалі згадані вище комсмакові добавки, солюбілізатори, змащувачі, супозиції можуть бути приготовлені звичайними меспендуючі агенти, зв'язуючі, або дезінтератори тодами з використанням звичайних носіїв. Компотаблетки, а також матеріалом, що утворює оболозиції винаходу бажано виготовляти у формі нку. одиничних доз. У порошках тонко подрібнений носій разом з На практиці терапевтично ефективна кількість тонко подрібненим активним компонентом утвосполуки винаходу може бути визначена фахівцями рює суміш з необхідними зв'язуючими якостями і за такими відомими критеріями, як вік, маса і індиналежними пропорціями, компактних форми і розвідуальна реакція пацієнта з урахуванням особлимірів. востей захворювання, яке підлягає лікуванню і або Для приготування супозиторію легкоплавкий профілактиці. віск, наприклад, суміш жирної кислоти, гліцеридів і Винахід включає також використання описаних масла какао спочатку розплавляють і диспергують вище сполук формули І для виготовлення медикаактивний інгредієнт з перемішуванням. Розплавментів для терапії болю. лену гомогенну суміш вливають у форми належКрім того, винахід включає використання споних розмірів і залишають для охолодження і ствелук формули І для виготовлення медикаментів, рдження. призначених для терапії різних болісних станів, Придатними носіями можуть бути карбонат включаючи (але не лише) гострий біль, хронічний магнію, стеарат магнію, тальк, лактоза, цукор, пекбіль, нейропатичний біль, спинний біль, раковий тин, декстрин, крохмаль, трагакант, метилцелюлобіль і вісцеральний біль. за, натрійкарбоксиметилцелю-лоза, легкоплавкий Ще одним об'єктом винаходу є спосіб лікуванвіск, масло какао тощо. ня пацієнта, що страждає від будь-яких описаних Солі включають (але не лише) фармацевтично вище станів, згідно з яким пацієнту, що потребує прийнятні солі. Прикладами фармацевтично притакого лікування, вводять ефективну кількість спойнятних солей згідно з винаходом є: ацетат, бенлуки формули І. Крім того, винахід включає фарзолсульфонат, бензоат, бікарбонат, бітартрат, мацевтичну композицію, що містить сполуку форкарбонат, цитрат, фумарат, глюконат, глютамат, мули І або її фармацевтично прийнятну сіль разом гідробромід, гідрохлорид, лактат, малеат, мандефармацевтично прийнятним носієм. лат, мезилат, фосфат/дифосфат, саліцилат, сукЗокрема, винахід включає фармацевтичну цинат, сульфат, тартрат, холін, діетаноламін, ети 13 76743 14 лендіамін, меглумін, алюміній, кальцій, магній, калій, натрій і цинк. Прикладами фармацевтично неприйнятних солей є гідроіодид, перхлорат, тетрафлуорборат, літій. Бажаними фармацевтично прийнятними соде R2, Аr, і X подібні визначеним для формули лями є гідрохлориди, сульфати і бітартрати. ОсоІ, a L - -ОН або відщеплювальна група, наприклад, бливо бажаними є гідрохлориди і сульфати. Тергалогенід, О-тозил або О-мезил. Цю реакцію зручмін композиція включає суміш активного но проводити в інертному розчиннику, наприклад, компонента з матеріалом-носієм, що утворює оботолуолі при кімнатній температурі протягом лонку з формуванням капсули, яка містить актив20хвил. Після цього додають каталітичну кількість ний компонент (з носієм або без нього). Композиконцентрованої НСІ і суміш гріють 12год. при 85°С. цією може бути також облатка. Операція завершується екстрагуванням водою і Таблетки, порошки, облатки і капсули можна очищенням продукта нормальною або зворотновикористовувати як тверді дозовані форми для фазовою хроматографією. орального введення. Процес А2 Рідкі композиції включають розчини, суспензії і Процес А2 виготовлення сполуки загальної емульсії. Прикладом рідкої композиції для паренформули II включає такі операції: терального введення можуть бути стерильні водні Сполуки загальної формули IV або водо-пропіленгліколеві розчини активної сполуки. Рідкі композиції можуть бути приготовлені у поліетиленгліколевому розчині. Водні розчини для орального введення можна приготувати, розчинюючи активний компонент у воді з доданням належних забарвлювачів, смакових агентів, стабілізаторів і загущувачів за бажанням. Водні суспензії для орального використання де R1, R3 і Υ подібні визначеним для формули можна приготувати диспергуванням тонкоподрібІ, можуть бути відновлені до відповідного аніліну неного активного компонента у воді разом з в'яз(формули II) реакцією з гідрогеном під тиском 10ким матеріалом, наприклад, природними або син50фунтів/кв. дюйм (0,7-3,5ат). Цю реакцію зручно тетичними гумами, смолами, метилцелюлозою, проводити у інертному розчиннику, наприклад, натрійкарбоксиметилцелюлозою і іншими суспенетанолі, метанолі або ТГФ при кімнатній темперадуючими агентами, відомими у фармацевтиці. турі. Реакцію каталізують каталізатором - перехідБажано виготовляти фармацевтичні композиним металом, звичайно, 5-10%-м паладієм на тонції у формі одиничних доз, які містять належну кодисперсному вугіллі. кількість активного компонента. Такими формами Процес A3 можуть бути пакетовані композиції, з пакетами, що Процес A3 виготовлення сполуки загальної містять дискретні кількості композиції, наприклад, формули IV включає такі операції: пакетовані таблетки, капсули, і порошки в ампулах Сполуки загальної формули V: або пляшках. Одинична доза може бути капсулою, облаткою або таблеткою, або бути утвореною належною кількістю таких пакетів. Способи приготування Процес А1 Процес АІ виготовлення сполуки загальної формули І де R1, R3 і Υ є подібними визначеним для формули І, вводять у реакцію з первинним аміном. Цю реакцію зручно проводити у протонному розчиннику, наприклад, 80%-му етанолі при температурі 50-100°С. Процедура завершується екстрагуванням водою і очищенням нормальною хроматографією. включає такі операції: Сполуки загальної форПроцес А4 мули II Процес А4 виготовлення сполуки загальної формули III включає такі операції: Сполуки загальної формули VI: де R1, R3 і Y, подібні визначеним для формули і, можуть бути введені у реакцію з сполуками загальної формули III де R2, Аr, і X подібні визначеним для формулиі, a L - -ОН або відщеплювальна група, наприклад, галогенід, О-тозил або О-мезил, вводять в 15 76743 16 реакцію з галогенуючим агентом, наприклад, тіоніній температурі разом з третинним аміном, наприлхлоридом. Цю реакцію зручно проводити у інертклад, тріетиламіном або діізопропілетиламіном, ному розчиннику, наприклад, бензолі або толуолі який слугує для нейтралізації частоти. Продукт при температурі 25-100°С. Операція завершується зручно ізолювати екстракцією водою і очищувати видаленням розчинника під зниженим тиском і нормальною хроматографією. очищенням дистиляцією. Процес А8 Процес А5 Процес А8 виготовлення сполуки загальної Процес А5 виготовлення сполуки загальної формули XI включає такі операції: формули VI включає такі операції: Сполуки формули IX (Процес АІ або А7) Сполуки загальної формули VII (приготовлені у процесі А1) де R1, R2, Аr, X і Υ, подібні визначеним для формули І і виготовлені, виготовлені, як це було описано вище, гідролізують, використовуючи КОН. Цю реакцію зручно проводити у водній розчиняючій суміші, наприклад, етанол/воду при температурі флегми. Після нейтралізації продукт ізолюють фільтруванням охолодженої реакційної суміші. Процес А6 У іншому варіанті Процес А6 виготовлення сполуки загальної формули V включає такі операції: Сполуки загальної формули X (див. процес А1) де R1, R2, Аr, X і Υ, подібні визначеним для формули l і приготовлені, виготовлені, як це було описано вище, перетворюють у відповідну карбонову кислоту VIII гідролізом естеру X, з використанням водної основи, наприклад, гідроксиду натрію. Процес А7 Процес А7 виготовлення сполуки загальної формули IX включає такі операції: Сполуки формули VIII де R, R~, Аr, X і Y, подібні визначеним для формули І і приготовлені, як описано вище, перетворюють у відповідний амід реакцією з первинним або вторинним аміном у присутності кислотного активатора, наприклад, ГАТУ (гексафлуорфосфат O-(7-азабензотріазол-1-іл)-N,N,N',N'тетраметилуронію), ГБТУ (гексафлуорфосфат Обензотріазол-1-іл)-N,N,N',N'-тетраметилуронію або ТБТУ (тетрафлуорборат О-(1Н-бензотріазол-1-іл)N,N,N',N'-пентаметиленуронію). Реакцію зручно проводити у полярному апротонному розчиннику, наприклад, диметилформаміді (ДМФ), при кімнат де R1, R2, R, Аr, X і Y, подібні визначеним для формули І і приготовлені, виготовлені, як це було описано, перетворюють у відповідний тіоамід (Формули XI) реакцією з P2S5. Реакцію бажано проводити у піридині при температурі 100°. Продукт бажано ізолювати екстрагуванням водою декантованої частини реакційної суміші і очищувати нормальною хроматографією. Процес А9 Процес А9 виготовлення сполуки загальної формули XII включає такі операції: Сполуки формули VII (Процес АІ) де R1, R2, Аr, X і Y, подібні визначеним для формули І і приготовлені, виготовлені, як це було описано, каталітично відновлюють, використовуючи каталітичну кількість нікелю Рейні у 50%-ій водній мурашиній кислоті. Цю реакцію бажано проводити у кислотно-водній розчиняючій суміші, наприклад, у 50%-ій водній мурашиній кислоті при 90°С. Продукт бажано ізолювати фільтруванням охолодженої реакційної суміші через діатомову землю, концентрувати і очищувати нормальною хроматографією. ПроцесА10 Процес А10 виготовлення сполуки загальної формули XIII включає такі операції: Сполуки формули XII де R1, R2, R5, Аr, X і Y, подібні визначеним для формули І і приготовлені, виготовлені, як це було описано, піддають відновлювальному амінуванню, використовуючи первинний або вторинний амін у присутності належного відновлювача, наприклад, триацетоксиборгідриду натрію. Цю реакцію бажано проводити у ТГФ з 1-1,5 еквівалентами оцтової кислоти і 1-1,5 еквівалентами триацетоксиборгідриду натрію при кімнатній температурі. Продукт бажано ізолювати розкладанням боратного естеру 17 76743 18 дією 1N НСІ з подальшим екстрагуванням водою. формули l і виготовлені, як це було описано вище, Концентрування органічного екстракту дає сирий перетворюють у відповідний сульфонілхлорид продукт, очищення виконується нормальною хрореакцією з нітритом натрію у водній НСІ і оцтовій матографією. кислоті з одержанням проміжної діазонієвої солі. Процес А11 Цю реакцію бажано проводити при 5,2Гц, 4H), 3,55-3,20 (br m, 6H), 2,74 3C: (4-етоксифеніл)ацетилхлорид (t J=6,4Гц, 2H), 2,53 (br s, 4H), 1,22 (t, J=6,8Гц, 6Н). До перемішаного розчину (4MS (ESI) (M+H)+=351. етоксифеніл)оцтової кислоти (10,0г, 55,5ммоль) у 2C: 3-аміно-N,N-діетил-4-{[2-(4бензолі (100мл) додають тіонілхлорид (50мл, морфолініл)етил]аміно}бензамід 68,5ммоль) і реакційну суміш перемішують при Суміш N,N-діетил-4-{[2-(480°С 2год. Розчинник випарюють у вакуумі і сирий морфолініл)етил]аміно}нітробензаміду (1,10г, продукт очищують дистиляцією (86°С, тиск 3,14ммоль) і 10% Pd/C у МеОН (50мл) гідрогену0,4Торр), одержуючи бажану сполуку (10,39г, 94%) ють 2год. при 40фунт/кв. дюйм (2,8ат). Після завеу вигляді жовтого масла. MS метилестеру: MS ршення реакції реакційну суміш фільтрують через (ESI) (M+H)+=194. діатомову землю. Видалення розчинника дає ба3D: 2-(4-етоксибензил)-N,N-діетил-1-(2жану сполуку (0,958г, 95%), яку використовують метоксіетил)-1Н-бензімідазол-5-карбоксамід. без подальшого очищення. MS (ESI)(M+H)+=321. За процедурою 2D (42D: 2-(4-метоксибензил)-N,N-діетил-Н2-(4-m етоксифеніл)ацетилхлорид (0,107г, 0,539ммоль) карбоксамід). додають до 3-амiно-N,N-дiетил-4-[(2(4-тетоксифеніл)ацетилхлорид (0,063г, метоксiетил)aмiнo]бензаміду (0,130г, 0,490ммоль) 0,343ммоль) додають 3-аміно-N,N-діетил-{[2-(4у толуолі (2,5мл). Через 20хвил. додають одну морфолініл)етил]аміно}бензаміду (0,100г, краплю конц. НСІ і суміш гріють при 85°С 12год. 0,312ммоль) у оцтовій кислоті (2мл) і суміш переПісля звичайної обробки, сирий продукт очищують мішують при 95°С протягом ночі. Реакцію концентзворотно-фазовою ВТРХ і одержують бажану спорують у вакуумі і залишок вносять у ЕtOАс (15мл). луку як сіль ТФК (0,120г, 36%) у вигляді масла. 1Н Органічну фазу промивають 1N NaOH (2 8мл) і ЯМР (DMSO-d6): 7,86 (d, J=9,2Гц, 1Н), 7,63 (s, 1), об'єднані водні фази екстрагують ЕtOАс (2 15мл). 7,43 (d, 7=8,4Гц, 1Н), 7,25 (d, J=8,4Гц, 2Н), 6,90 (d, Об'єднані органічні фази сушать над MgSO4, фільJ=9,2Гц, 2H), 4,60 (t, J=4,8Гц, 2H), 4,47 (s, 2Н), 3,97 трують і концентрують у вакуумі. Сирий продукт (q, J=7,6Гц, 2H), 3,57 (m, 2Н), 3,40 (br s, 2H), 3,20 очищують зворотно-фазовою рідинною хроматог(br s, 2H),3,15 (s, 3H), 1,28 (t, J=7,6Гц, 3H), 1,07 (br рафією під високим тиском (HPLC - ВТРХ) і одерs, 6H). MS (ESI) (M+H)+=411. Аналіз: обчислено жують бажану сполуку у вигляді солі три1 для C24H31N3O3+2,2ТФК+0,6H2O: С, 50,82; Η, 5,17; флуороцтової кислоти (ТФК) (0,132г, 53%). Н ЯМР Ν, 6,26. Одержано: С, 50,85; Η, 5,30; Ν, 6,06. (DMSO-d6): 7,74 (d, J=8,0Гц, 1Н), 7,57 (s, 1H), Приклад 4: 7,34 (d, J=8,0Гц, 1Н), 7,25 (d, J=8,0Гц, 2Н), 6,91 (d, 1-[2-(ацетиламіно)етил]-2-(4-етоксибензил)J=8,0Гц, 2Н), 4,64 (t, J=7,6Гц, 2H), 4,36 (s, 2Н) 3,76 N,N-дiетил-1Н-бензімідазол-5-карбоксамід (brs, 2Н), 3,71 (s, 3Н), 3,35 (br s, 4H), 3,20 (br s, 6H), 4А: 4-{[2-(ацетиламіно)етил]аміно}-N,N-діетил1,07 (br s, 6H). MS (ESI) (M+H)+=451. Аналіз: Обчи3-нітробензамід слено для С26Н34N4О3+3,0ТФК+0,6Н2О: С, 47,84; Н, За загальною процедурою 2В суміш N,N4,79; N, 6,97. Одержано: С, 47,83; Н, 4,83; N, 6,96. діетилфлуор-5-нітробензаміду (0,200г, Приклад 3: 0,833ммоль), N-(2-аміноетил)ацетаміду (0,077г, 2-(4-eтoкcибeнзил)-N,N-дieтил-1-(20,757ммоль) у 80%-му водному ЕtOН (5мл) гріють мeтoкcиeтил)-1H-бeнзiмiдaзoл-5-кapбoкcaмiд. при 90°С протягом ночі. Після обробки сирий про3А: N,N-діетил-4-[(2-метоксіетил)аміно]-3дукт очищують хроматографією на колонці силіканітробензамід гелю (100% EtOAc до 5% МеОН/EtOAc) і одержуЗа загальною процедурою 2В суміш N,Nють бажану сполуку (0,152г, 63%) у вигляді діетил-4-флуор-3-нітробензаміду (0,200г, яскравожовтої твердої речовини. 1Н ЯМР (CDCI3): 0,833ммоль), 2-метоксіетанаміну (0,065мл, 8,27 (d перекриває br s, J=2,0Гц, 2Н), 7,55 (del, 0,757ммоль) у 80%-му водному ЕtOН (5мл) гріють J=8,4Гц, J=2,0Гц, 1Н), 6,99 (d, J=92Гц, 1Н), 6,06 (br при 90°С протягом ночі. Далі сирий продукт очиs, 1H), 3,58-3,50 (m, 4H), 3,44 (br s, 4H), 2,02 (s, щують хроматографією на колонці силікагелю 3Н), 1,22 (t, J=7,2Гц, 6Н). MS (ES1) (M+H)+=323. (33% ЕtOАс/гексани до 50% ЕtOАс/гексани) і оде4В: 4-{[2-(aцeтилaмiнo)eтил]aмiнo}-3-aмiнoржують бажану сполуку (0,191г, 85%) у вигляді N,N-діетилбензамід яскравожовтої твердої речовини. 1Н ЯМР (CDCI3): За процедурою 2С суміш 4-((28,34 (s, 1Η), 8,28 (d, J=2,8Гц, 1Н), 7,56 (dd, (ацетиламіно)етил]аміно]-N,N-діетил-3J=8,4Гц, J=1,6Гц, 1Н), 6,91 (d, J=9,2Гц, 1Н), 3,69 (t, 29 76743 30 нітробензаміду (0,150г, 0,465ммоль) і 10% Pd/C у етоксифеніл)ацетилхлорид (0,092г, 0,465ммоль) EtOAc (15мл) пдрогенують протягом ночі при додають до етил-3-{2-аміно-440фунт/кв. дюйм (2,8ат). Звичайна обробка дає [(діетиламіно)карбоніл]анілін}пропаноату (0,130г, бажану сполуку (0,164г, 100%), яку використову0,423ммоль) у толуолі (2,5мл). Через 20 хвил. додають одну краплю конц. НСІ і суміш гріють при ють без подальшого очищення. 1Н ЯМР (CDCI3): 85°С 12год. Після обробки сирий продукт очищу6,83 (dd, J=8,0Гц, J=2,0Гц, 1Н), 6,76 (d, J=2,0Гц, ють зворотно-фазовою ВТРХ (разом з трансесте1Н), 6,53 (d, 8,4Гц, 1Н), 6,26 (br t, 1H), 3,53 (q, рифікацією МеОН) і одержують бажану сполуку як J=5,6Гц, 2Н), 3,43 (br s, 4H), 3,23 (t, J=5,6Гц, 2Н), сіль ТФК (0,084г, 30%) у вигляді масла. 1Н ЯМР 1,99 (s, 3Н), 1,17 (t, J=6,4Гц, 6Н). MS (ESI) + (M+H) =293. (DMSO-d6): 7,88 (d, J=9,2Гц, 1Н), 7,62 (s, 1H), 4C: 1-[2-(ацетиламіно)етил]-2-(47,41 (d, J=5,4Гц, 1Н), 7,25 (d, J=8,0Гц, 2H), 6,90 (d, етоксибензил)-N,N-діетил-1Н-бензімідазол-5J=8,4Гц, 2Н), 4,59 (t, J=6,4Гц, 2Н), 4,49 (s,2H), 3,97 карбоксамід (q, J=6,4Гц, 2Н), 3,55 (s, 3Н), 3,40 (brs, 2H), 3,16 За загальною процедурою 2D (4(brs, 2H), 2,77 (t, J=6,4Гц, 2H), 1,28 (t, J=7,6Гц, 3Н), етоксифеніл)ацетилхлорид (0,097г, 0,490ммоль) 1,07 (br s, 6H). MS (ESI) (M+H)+=438. Аналіз: обчидодають до 4-{[2-(ацетиламіно)етил]аміно}-3слено для C25H31N3O4+1,8ТФК+0,8Н2О: С, 52,27; Η, аміно-N,N-діетилбензаміду (0,130г, 0,445ммоль) у 5,28; Ν, 6,39. Одержано: С, 52,31; Η, 5,22; Ν, 6,37. толуолі (2,5мл). Через 20хвил. додають одну краПриклад 6: плю конц. НСІ і суміш гріють при 85°С 12год. Після 1-(2-аміноетил)-2-(4-етоксибензил)-N,N-діетилзвичайної обробки сирий продукт очищують зво1Н-бензімщазол-5-карбоксамід ротно-фазовою ВТРХ і одержують бажану сполуку 6А: Трет-бутил 2-{4-[(діетиламіно)карбоніл]-2як сіль ТФК (0,042г, 14%) (тверда речовина). 1Н нітроаніліно}етилкарбамат За загальною процедурою 2В суміш N,NЯМР (DMSO-d6): 8,01 (t, J=5,6Гц, 1Н), 7,81 (d, діетил-4-флуор-5-нітробензаміду (0,200г, J=8,4Гц, 1Н), 7,63 (s, 1), 7,45 (d, J=8,4Гц, 1Н), 7,26 0,833ммоль) і трет-бутил 2-аміноетилкарбамату (d, J=8,4Гц, 2H), 6,90 (d, J=8,4Гц, 2H), 4,43 (m, 4H), (0,121г, 0,757ммоль) у 80%-му водному ЕtOН 3,97 (q, 7=7,2Гц, 2Н), 3,40 (br s, 2H), 3,38 (t, (3мл) гріють при 85°С протягом ночі. Після обробJ=4,8Гц, 2H), 3,20 (br s, 2H), 3,15 (s, 3H), 1,61 (s, ки сирий продукт очищують рекристалізацією з 3H), 1,28 (t, J=7,2Гц, 3Н), 1,06 (br s, 6H). MS (ESI) EtOAc і одержують бажану сполуку (0,165г; 57%) у (M+H)+=437. Аналіз: обчислено для вигляді яскравожовтої твердої речовини. 1Н ЯМР C25H32N4O3+2,1ТФК+0,8Н2О: С, 50,80; Η, 5,21; Ν, (CDCI3): 8,31 (br s, 1H), 8,29 (d, J=1,6Гц, 1Н), 7,57 8,11. Одержано: С, 50,87; Η, 5,87; Ν, 8,09. Приклад 5: (dd, J=9,6Гц, J=2,0Гц, 1Н), 6,97 (d, J=9,6Гц, 1H), Метил-3-[5-[(діетиламіно)карбоніл]-2-(44,83 (br s, 1H), 3,55-3,40 (m, SH), 1,47 (s, 9HJ, 1,22 етоксибензил)-1Н-бензімідазол-1-іл]-пропаноат (t, J=7,6Гц, 6Н). MS (ESI) (M+H)+=381. 5А: Етил 3-{4-[(діетиламіно)карбоніл]-26B: Трет-бутил 2-{2-аміно-4нітроанілін}пропаноат [(діетиламіно)карбоніл]аніліно}етилкарбамат За загальною процедурою 2В суміш N,NЗа загальною процедурою 2С суміш третдіетил-4-флуор-3-нітробензаміду (0,200г, бутил 2-{4-[(діетиламіно)карбоніл]-20,833ммоль) і етил 3-амінопропаноату (0,116г, нітроаніліно}етилкарбамату (0,155г, 0,407ммоль) і 0,757ммоль) у 80%-му водному ЕtOН (5мл) гріють 10% Pd/C у EtOAc (15мл) гідрогенують протягом при 90°С протягом ночі. Після обробки сирий проночі при 40фунт/кв. дюйм (2,8ат). Звичайна обробдукт очищують хроматографією на колонці силікака дає бажану сполуку (0,164г), яку використовугелю (50% EtOAc/гексани до 100% EtOAc) і одерють без подальшого очищення. 1Н ЯМР (CDCI3): 1 жують бажану сполуку (0,162г, 63%). Н ЯМР 6,85 (dd, J=8,4Гц, J=1,6Гц, 1Н), 6,80 (d, J=2,0Гц, (CDCI3): 8,34 (br t, J=5,6Гц, 1Н), 8,29 (d, J=2,0Гц, 1H), 6,57 (d, J=7,6Гц, 1H), 4,87 (brs, 1Н), 3,48-3,38 1H), 7,58 (dd, J=8,4Гц, J=2,0Гц, 1H), 6,92 (d, (br s, 6H), 3,27 (t, J=5,6Гц, 2H), 1,46 (s, 9H), 1,18 (t, J=9,2Гц, 1H), 4,21 (q, J=7,2Гц, 2H), 3,69 (q, J=6,4Гц, J=6,8Гц, 6Н). MS (ESI) (M+H)+=351. 2Н), 3,44 (br s, 4H), 2,72 (t, J=6,4Гц, 2Н), 1,30 (t, 6C: 1-(2-аміноетил)-2-(4-етоксибензил)-N,N7=6,4Гц, 3Н), 1,22 (t, J=6,8Гц, 6Н). MS (ESI) діетил-1Н-бензімідазол-5-карбоксамід (M+H)+=338. За загальною процедурою 2D (45В: Етил-3-{2-аміно-4етоксифеніл)ацетилхлорид (0,085г, 0,424ммоль) [(діетиламіно)карбоніл]аніліно}пропаноат додають до трет-бутил 2-{2-аміноЗа загальною процедурою 2С суміш етил 3-{4[(діетиламіно)карбоніл]аніліно}етилкарбамату [(діетиламіно)карбоніл]-2-нітроаніліно}пропаноату (0,135г, 0,385ммоль) у толуолі (2,5мл). Через (0,150г, 0,445ммоль) і 10% Pd/C у EtOAc (15мл) 20хвил. додають одну краплю конц. НСІ і суміш гідрогенують протягом ночі при 40фунт/кв. дюйм гріють при 85°С 12год. Після обробки сирий про(2,8ат). Звичайна обробка дає бажану сполуку дукт очищують зворотно-фазовою ВТРХ і одержу(0,158г), яку використовують без подальшого очиють бажану сполуку як сіль ТФК (0,123г, 44%) у щення. 1Н ЯМР (CDCI3): 6,86 (dd, J=8,4Гц, вигляді білої твердої речовини. 1Н ЯМР (CD3OD): J=2,0Гц, 1Н), 6,80 (d, J=2,0Гц, 1Н), 6,62 (d, J=8,4Гц, 7,91 (d, J=8,4Гц, 1Н), 7,73 (s, 1H), 7,57 (dd, J=8,4Гц, 1Н), 4,18 (q, J=7,2Гц, 2Н), 3,46 (t перекриває br s, J=2,0Гц, 2Н), 7,30 (d, J=8,4Гц, 2Н), 6,97 (d, J=8,4Гц, J=5,6Гц, 6Н), 2,66 (t, 7=6,8Гц, 2Н), 1,28 (t, J=7,2Гц, 2Н), 4,75 (t, J=6,8Гц, 2H), 4,55 (s, 2H), 4,03 (q, 3Н), 1,18 (t, J=6,8Гц, 6Н). MS (ESI) (M+H)+=308. J=6,8Гц, 2H), 3,58 (br s, 2H), 3,36 (t, J=6,4Гц, 2H), 5C: Метил 3-[5-[(діетиламіно)карбоніл]-2-(43,29 (br s, 2H), 1,37 (t, J=6,4Гц, 3Н), 1,27 (br s, 3H), етоксибензил)-1Н-бензімідазол-1-іл]-пропаноат 1,12 (br s, 3H). MS (ESI) (M+H)+=395. Аналіз: обчиЗа загальною процедурою 2D (4слено для C23H30N4O2+2,8ТФК+0,8H2O: С, 47,17; Η, 31 76743 32 4,76; Ν, 7,69. Одержано С, 47,16; Η, 4,80; Ν, 7,52. 3H), 1,04 (br s, 3H). MS (ESI) (M+H)+=366. Аналіз: Приклад 7: обчислено для C22H27N3O2+2,1ТФК+0,2H2O: С, 1-{2-[aцeтил(мeтил)aмiнo]eтил}-2-(451,71; Η, 4,89; Ν, 631. Одержано С, 51,73; Η, eтoкcибeнзил)-N,N-дieтил-1H-бeнзiмiдaзoл-54,82;Ν, 6,93. карбоксамід Приклад 9 До розчину продукту 6С, ТФК солі 1-(22-(4-етоксибензил)-N,N-діетил-1-(2аміноетил)-2-(4-етоксибензил)-N,N-діетил-1Нфенілетил)-1 Н-бензімідазол-5-карбоксамід бензімідазол-5-карбоксаміду (0,085г, 0,117ммоль) і 9А: Ν,N-діетил-3-нітро-4-[(2тріетиламіну (0,070мл, 0,50ммоль) у СН2СІ2 (3мл) фенілетил)аміно]бензамід додають ацетилхлорид (0,015г, 0,200ммоль) і суЗа загальною процедурою 2В суміш N,Nміш перемішують при кімнатній температурі діетил-4-флуор-3-нітробензаміду (0,125г, 15хвил. Суміш промивають насиченим водним 0,521ммоль) і 2-фенілетанаміну (0,065мл, NaHСО3, розсолом і органічну фазу сушать над 0,521ммоль) у 80%-му водному ЕtOН (3мл) гріють MgSO4, фільтрують і концентрують у вакуумі. при 85°С 4год. Звичайна обробка дає бажану споСирий продукт розчиняють у ДМФ (2мл), долуку (0,170г, 96%), яку використовують без подадають NaH (60%-а дисперсія у маслі, 0,005г, льшого очищення. MS (ESI) (M+H)*=342. 0,217ммоль) і суміш перемішують при кімнатній 9В: 3-аміно-N,N-діетил-[(2температурі 20хвил. Розчинник випарюють у вакуфенілетил)аніліно]бензамід умі і залишок вносять у EtOAc. Органічну фазу За загальною процедурою 2С суміш N,Nпромивають насиченим водним NaHCO3 і розсодіетил-3-нітро-4-[(2фенілетил)аміно]-бензаміду лом, сушать над MgSO4, фільтрують і концентру(0,170г, 0,498ммоль) і 10% Pd/C у EtOAc (10мл) ють у вакуумі. Сирий продукт очищують зворотногідрогенують при 40фунт/кв. дюйм (2,8ат). Звичайфазовою ВТРХ і одержують бажану сполуку як на обробка дає бажану сполуку (0,156г), яку викосіль ТФК (0,017г, 26%) у вигляді білої твердої реристовують без подальшого очищення. MS (ESI) (M+H)+=312. човини. 1Н ЯМР (CD3OD): 7,97 (d, J=8,4Гц, 1Н), 9С: 2-(4-етоксибензил)-N,N-діетил-1-(27,69 (s, 1H), 7,59 (d, J=7,2Гц, 1Н), 7,33 (d, J=8,4Гц, фенілетил)-1Н-бензимідазол-5-карбоксамід. 2Н), 6,96 (d, J=8,4Гц, 2Н), 4,66 (t, J=6,0Гц, 2Н), 4,60 За загальною процедурою 2Е (4(s, 2H), 4,02 (q, J=7,11Гц, 2Н), 3,72 (t, J=6,0Гц, 2Н), етоксифеніл)ацетилхлорид (0,105г, 0,530ммоль) 3,56 (br, 2H), 3,28 (br, 4Н), 3,06 (s, 3Н), 1,79 (s, 3Н), додають до 3-аміно-N,N-діетил-4-[(21,36 (t, J=8,6Гц, 3Н), 1,25 (br, 3Н), 1,10 (br, 3Н). MS фенілетил)аміно]бензаміду (0,150г, 0,482ммоль) у (ESI) (M+H)+=451. оцтовій кислоті (2мл) і суміш перемішують при Приклад 8: 90°С протягом ночі. Після обробки сирий продукт 2-(4-етоксибензил)-N,N-діетил-1-метил-1Ночищують зворотно-фазовою ВТРХ і одержують бензімідазол-5-карбоксамід бажану сполуку як сіль ТФК (0,100г, 36%) у вигляді 8А: Ν,Ν-діетил-4-(метиламіно)-3-нітробензамід пурпурової твердої речовини. 1H ЯМР (DMSO-d6): За загальною процедурою 2В суміш N,Nдіетил-4-флуор-3-нітробензаміду (0,125г, 7,74 (d, J=8,4Гц, 1Η), 7,62 (s, 1H), 7,34 (d, 0,521ммоль), і метиламіногідрохлориду (0,035г, J=7,2Гц, 1Н), 7,24-7,19 (m, 5H), 7,10 (d, J=8,4Гц, 0,521ммоль) у 80%-му водному ЕtOН (3мл) гріють 2Н), 6,91 (d, J=8,4Гц, 2H), 4,56 (t, J=7,2Гц, 2H), 4,23 при 85°С 4год. Звичайна обробка дає бажану спо(s, 2Н), 3,97 (q, 6,8Гц, 2Н), 3,40 (br s, 2Н), 3.I9 (br S, луку (0,130г, 100%), яку використовують без пода2H), 2,86 (t, J=7,2Гц, 2H), 1,28 (t, J=6,8Гц, 3Н), 1,08 льшого очищення. MS (ESI) (M+H)+=252. (br s, 6H). MS (ESI) (M+H)+=456. Аналіз: обчислено 8В: 3-аміно-N,N-діетил-4для C29H33N3O2+1,0ТФК+0,2Н2O С, 64,96; Η, 6,05; (метиламіно)бензамід Ν, 7,33. Одержано С, 65,05; Η, 6,09; Ν, 7,29. За загальною процедурою 2С суміш N,NПриклад 10: діетил-4-(метиламіно)-3-нітробензаміду (0,130г, 2-(4-етоксибензил)-N,N-діетил-1-[2-(10,517ммоль) і 10% Pd/C у EtOAc (10мл) гідрогенупіперидиніл)етил]-1Н-бензімідазол-5-карбоксамід ють при 40фунт/кв. дюйм (2,8ат). Звичайна оброб10A: N,N-діетил-3-нітро-4-{[2-(1ка дає бажану сполуку (0,124г), яку використовупіперидиніл)етил]аміно}бензамід ють без подальшого очищення. MS (ESI) За загальною процедурою 2В суміш N,N(M+H)*=222. діетил-флуор-5-нітробензаміду (1,0г, 4,2ммоль) і 28С: 2-(4-етоксибензил)-N,N-діетил-1-метил-1Н(1-піперидиніл)етанаміну (0,564мл, 3,96ммоль) у бензімідазол-5-карбоксамід 80%-му водному ЕtOН (30мл) гріють при 85°С За загальною процедурою 2D (410год. Після звичайної обробки, сиру суміш розчиетоксифеніл)ацетилхлорид (0,119г, 0,596ммоль) няють у 1N НСІ (40мл) і промивають СН2СІ2 додають до 3-аміно-N,N-діетил-4(2 10мл). Водний шар підлужують 5Ν NaOH (10мл) (метиламіно)бензаміду (0,120г, 0,542ммоль) у оці екстрагують СН2СІ2 (3 10мл). Об'єднані органічні товій кислоті (2мл) і суміш перемішують при 90°С фази сушать над Na2SO4, фільтрують і концентпротягом ночі. Після обробки сирий продукт очирують у вакуумі і одержують бажану сполуку щують зворотно-фазовою ВТРХ і одержують ба(0,800г, 57%) у вигляді яскравожовтої твердої режану сполуку як сіль ТФК (0,057г, 26%) у вигляді човини, яку використовують без подальшого очи1 червоного масла. Н ЯМР (DMSO-d6): 7,90 (d, щення. 1Н ЯМР (CDCI3): 8,64 (br s, 1H), 8,25 (d, J=8,4Гц, 1Н), 7,70 (s, 1H), 7,49 (d, J=8,4Гц, 1Н), J=2,4Гц, 1H), 7,53 (d, J=8,8Гц, 1H), 6,82 (d, J=8,8Гц, 7,29 (d, J=8,4Гц, 2Н), 6-92 (d, J=8,4Гц, 2Н), 4,50 (s, 1H), 3,41 (brs, 4H), 3,35 (brs, 2H), 2,64 (br S, 2H), 2H), 3,98 (q, J=7,6Гц, 2H), 3,93 (s, 3Н), 3,42 (bra, 2,53 (br s, 4H), 1,61 (br s, 4H), 1,44 (br s, 2H), 1,19 2Н), 3,14 (br s, 2H), 1,28 (t, J=6,8Гц, 3Н), 1,11 (br s, (t, J=7,0Гц, 6Н). 33 76743 34 10B: 3-аміно-N,N-діетил-4-{[2-(1J=12,0Гц, J=9,6Гц, 2H), 2,28-2,19 (m, 7H), 1,17 (m, піперидиніл)етил]аміно}бензамід 8H). MS (ESI) (M+H)+=293. За загальною процедурою 2С суміш N,N11C: 1-[2-(диметиламіно)-1-метилетил]-2-(4діетил-3-нітро-4-{[2-(1-піперидиніл)етоксибензил)-N,N-діетил-1Н-бензімідазол-5етил]аміно}бензаміду (0,800г, 2,30ммоль) і 10% карбоксамід Pd/C у EtOAc (30мл) гідрогенують 24год. при За загальною процедурою 2D розчин 1М (430фунт/кв. дюйм (2,1ат). Звичайна обробка дає етоксифеніл)ацетилхлориду у толуолі (0,095мл, бажану сполуку (0,724г, 99%), яку використовують 0,095ммоль) додають до 3-амiно-4-{[2без подальшого очищення. (диметиламiно)-1-метилетил]амiно}-N,N10С: 2-(4-етоксибензил)-N,N-діетил-1-[2-(1діетилбензаміду (0,025г, 0,0856ммоль) у толуолі піперидиніл)етил]-1Н-бензімідазол-5-карбоксамід (1,0мл). Через 20хвил. додають одну краплю конц. За загальною процедурою 2D розчин 1Μ (4НСІ і суміш гріють при 85°С протягом ночі. Після етоксифеніл)ацетилхлориду у толуолі (0,095мл, обробки сирий продукт очищують зворотно0,095ммоль) додають 3-аміно-N,N-діетил-4-{[2-(1фазовою ВТРХ і одержують бажану сполуку як піперидиніл)етил]аміно}бензаміду (0,027г, сіль ТФК (0,024г, 38%). 1Н ЯМР (CD3OD): 7,96 (d, 0,856ммоль) у толуолі (1,0мл). Через 20хвил. доJ=8,4Гц, 1Н), 7,72 (s, 1H), 7,47 (d, J=7,6Гц, 2Н), дають одну краплю конц. НСІ і суміш гріють при 7,24 (m, 2H), 6,94 (m, 2Н), 5,20 (br s, 1H), 4,50 (s 85°С протягом ночі. Після обробки сирий продукт 2H), 4,03-3,95 (m, 3Н), 3,77 (dd, J=14,0Гц, J=5,6Гц, очищують зворотно-фазовою ВТРХ і одержують 1H), 3,56 (br s, 2H), 3,28 (m, 2H), 2,81 (s, 6H), 1,56 1 бажану сполуку як сіль ТФК (0,026г, 39%). Н ЯМР (d, J=6,8Гц, 3Н), 1,35 (t, J=6,4Гц, 3Н), 1,25 (br s, (CD3OD): 7,89 (d, J=8,0Гц, 1Н), 7,70 (S, 1H), 7,52 3H), 1,14 (br s, 3H). MS (ESI) (M+H)+=437. Аналіз: (d, J=8,4Гц, 1Н), 7,27 (d, J=7,6Гц, 2Н), 6,96 (d, обчислено для C26H36N4O2+2,5ТФК+0,7Н2O: С, J=7,2Гц, 2Н), 4,52 (s, 2H), 4,02 (q, J=7,6Гц, 2H), 50,71; Н, 5,48; N, 7,63. Одержано: С, 50,76; Н, 5,46; 3,56 (br s, 4H), 3,34 (t, J=7,6Гц, 2H), 3,28 (br s, 4H), N, 7,61. 3,00 (br s, 2H),1,88 (br s, 4H), 1,53 (br s, 2H), 1,36 (t, Приклад 12: J=6,4Гц, 3H), 1,25 (br s, 3H), 1,11 (br s, 3H). MS 1-(циклопропілметил-2-(4-етоксибензил)-N,N(ESI) (M+H)+=463. Аналіз: обчислено для діетил-1Н-бензімідазол-5-карбоксамід C28H38N4O2+2,6ТФК+0,5Н2О: С, 51,92; Н, 5,46; N, 12А: 4-[(циклопропілметил)аміно]-N,N-діетил7,29. Одержано: С, 51,94; Н, 5,43; N,7,25. 3-нітробензамід Приклад 11: За загальною процедурою 2В Ν,Ν-діетил-41-[2-(диметиламіно)-1-метилетил]-2-(4флуор-3-нітробензамід (0,823г, 3,42ммоль) і цикетоксибензил)-N,N-дiетил-1Н-бензімідазол-5лопропілметанамін (0,39мл, 4,50ммоль) у 80%-му карбоксамід водному етанолі (17мл) перемішують при 85°С 11А: 4-{[2-(диметиламіно)-1-метилетил]аміно}16год. Сирий продукт (1,00г), оранжеву тверду N,N-діетил-3-нітробензамід речовину, використовують у подальших операціях. 1 Суміш Ν,Ν-діетил-4-флуор-3-нітробензаміду Н ЯМР (CD3OD): 8,23 (d, J=2,0Гц, 1Н), 7,55 (dd, (0,500г, 2,08ммоль), Ν,Ν-диметил-1,2J=9,2Гц, 7=2,0Гц, 1Н), 7,09 (d, J=9,2Гц, 1Н), 3,47 пропандіаміну (0,636г, 6,24ммоль), ДІПЕА (2,2мл, (br s, 3Н), 3,31 (q, J=2,0Гц, 2Н), 3,27 (d, J=6,4Гц, 12,5ммоль) і ДМФ (12мл) перемішують 4год. при 2Н), 1,23 (перекриття t i m, J=7,0Гц, 7H), 0,68-0,60 кімнатній температурі. Реакцію концентрують у (m, 2H), 0,40-0,34 (m, 2H). MS (ESI) (M+H)+=292. вакуумі, залишок розчиняють у 2N NaOH (30мл) і 12B: 3-аміно[(циклопропілметил)аміно]-N,Nекстрагують СН2СІ2 (3 40мл). Об'єднані органічні діетилбензамід фази промивають розсолом (10мл), сушать над За загальною процедурою 2С 4MgSO4, фільтрують і концентрують у вакуумі. Сиру [(циклопропілметил)аміно]-N,N-діетил-3реакційну суміш очищують хроматографією на нітробензамід (1,00г) гідрогенують 24год. і одерколонці силікагелю (100% СН2СІ2 до 5% Межують бажану сполуку (0,889г) у вигляді зеленокоОН/СН2СІ2) і одержують бажану сполуку (0,621г, ричневої твердої речовини. Сирий продукт вико93%) у вигляді яскравожовтої твердої речовини. 1Н ристовують у подальших операціях. 1Н ЯМР ЯМР (CDCI3): 8,33 (d, J=6,4Гц, 1Н), 8,27 (d, (CD3OD): 6,72-6,78 (m, 2H), 6,58 (d, J=8,4Гц, 1Н), J=2,0Гц, 1Н), 7,55 (dd, J=8,8Гц, J=2,0Гц, 1H), 6,91 3,43 (br s, 4H)3 2,99 (d, J=6,4Гц, 2Н), 1,18 (перек(d, J=9,6Гц, 1Н), 3,79 (heptet, J=7,2Гц, 1Н), 3,45 (br риття br t і m, J=6,4Гц, 7H), 0,59-0,52 (m, 2Н), 0,30d, J=5,2Гц, 4Н), 2,55 (dd, 7 J=12,0Гц, J=7,6Гц, 1H), 0,24 (m, 2Н). MS (ESI) (M+H)+=262. 2,39 (dd, J=12,4Гц, J=5,8Гц, 1H), 2,29 (s, 6H), 1,69 12C: 1-(циклопропілметил)-2-(4-етоксибензил)(br s, 1H), 1,31 (d, J=6,8Гц, 2Н), 1,22 (t, J=7,4Гц, N,N-діетил-1Н-бензімідазол-5-карбоксамід 6Н). MS (ESI) (M+H)+=323. За загальною процедурою 2D (411 В: 3-аміно-4-{[2-(диметиламіно)4етоксифеніл)ацетилхлорид (0,109г, 0,547ммоль) метилетил]аміно}-N,N-діетилбензамід додають до 5-аміно-4-[(циклопропілметил)аміно]За загальною процедурою 2С суміш 4-{[2N,N-діетилбензаміду (0,130г, 0,497ммоль) у оцто(диметиламіно)-1-метилетил]аміно-N,N-діетил-5вій кислоті (2мл) і суміш перемішують при 90°С нітробензамід (0,516г, 1,60ммоль) і 10% Pd/C у протягом ночі. Після обробки сирий продукт очиEtOAc (20мл) гідрогенують протягом ночі при щують зворотно-фазовою ВТРХ і одержують ба35фунт/кв. дюйм (2,45ат). Звичайна обробка дає жану сполуку як сіль ТФК (0,042г, 14%) у вигляді бажану сполуку (0,408г, 87%), яку використовують масла. 1Н ЯМР (DMSO-d6): 7,59 (d, J=8,4Гц, 1Н), 1 без подальшого очищення. Н ЯМР (CDCI3): 6,82 7,30 (s, 1H), 7,08 (d, J=7,2Гц, 1Н), 6,91 (d, J=9,2Гц, (dd, J=8,0Гц, J=2,0Гц,1Н), 6,77 (d, J=2,4Гц, 1H), 2Н), 6,53 (d, J=8,4Гц, 2Н), 4,14 (s, 2Н), 3,97 (d, 6,62 (d, J=8,0Гц, 1H), 3,52-336 (m, 6H), 2,52 (dd, J=7,2Гц, 2Н), 3,60 (q, J=6,4Гц, 2Н), 3,04 (br s, 2Н), 35 76743 36 2,80 (br s, 2H), 0,90 (t, J=6,4Гц, 3Н), 0,78 (br m, 7H), діетил-3-нітробензамід 0,10-0,03 (m, 4H). MS (ESI) (M+H)+=406. Аналіз: За загальною процедурою 2В N,N-діетил-4обчислено для C25H31N3O2+1,9ΤΦΚ: С, 55,60; Η, флуор-3-нітробензамід (0,534г, 2,22ммоль) і N1,N15,33; Ν, 6,75. Одержано: С, 55,51; Η, 5,25; Ν, 6,74. диметил-1,2-етандіамін (0,22мл, 2,02ммоль) переПриклад 13: мішують при 85°С 14год. Сирий продукт очищують 1-(циклопропілметил)-2-[(6-етокси-3розчиненням у 1Ν НСІ і екстрагуванням Et2O піридин)метил]-N,N-діетил-1Н-бензімідазол-5(2 15мл). Водну фазу доводять до рН 11 дією 5N карбоксамід NaOH іекстрагують СН2СІ2 (4 15мл). Об'єднані 13А: (6-етокси-3-піридиніл)оцтова кислота фази СН2СІ2 сушать над MgSO4, фільтрують і конДо розчину (6-хлор-3-піридиніл)оцтової кислоцентрують у вакуумі і одержують бажану сполуку ти (0,094г, 0,545ммоль) у ЕtOН (1,6мл) додають (0,560г, 82%) у вигляді оранжевого масла. 1Н ЯМР 3,1Μ EtONa у ЕtOН (0,7мл, 2,17ммоль) і реакційну (CD3OD): 8,22 (d, J=2,8Гц, 1Н), 7,56 (dd, J=8,4Гц, суміш перемішують при 100°С 24год., після чого J=2,8Гц, 1H), 7,09 (d, J=8,4Гц, 1H), 3,53-3,40 (передодають з надлишком NaH (60%-на дисперсія у криття t, J=6,4Гц, і br s, 6H), 2,67 (t, J=6,4Гц, 2H), маслі) разом з 1мл ЕtOН і гріють при 100°С протя2,33 (s, 6H), 1,22 (t, J=7,6Гц, 6Н). MS (ESI) гом 96год. Розчинник випарюють у вакуумі і зали(M+H)+=309. шок вносять у діетилетер (5мл). Органічну фазу 14B: 3-аміно-4-{[2-(диметиламіно)етилиаміно}промивають розбавленою НСІ (2 2мл) і розсолом N,N-діетилбензамід (2мл), сушать над MgSO4, фільтрують і концентЗа загальною процедурою 2С 4-{[2рують у вакуумі і одержують бажану сполуку (диметиламіно)етил]аміно}-N,N-діетил-3(0,081г, 82%) у вигляді блідокоричневої твердої нітробензамід (0,560г, 1,82ммоль) гідрогенують речовини, яку використовують без подальшого 3гол. і одержують бажану сполуку (0,531г) у вигляочищення. 1Н ЯМР (CDCI3): 10,06 (br s, 1H), 8,06 ді зелено-коричневої твердої речовини. Сирий (s, 1H), 7,55 (d, J=9,2Гц, 1Н), 6,72 (d, J=8,4Гц, 1H), продукт використовують у подальших операціях. 1 4,30 (q, J=6,1Гц, 2H), 3,58 (s,2H) 1,38 (t, J=8,0, 3H). Н ЯМР (CD3OD): 6,77, 6,76 (перекриття s і dd, MS (ESI) (M+H)+=182. J=6,4Гц, J=2,0Гц, 2Н), 6,61 (d, J=8,4Гц, 1Н), 3,45 (br 13B: 1-(циклопропілметил)-2-[(6-етокси-3s, 4Н), 3,29 (t, J=6,4Гц, 2H), 2,66 (t, J=6,4Гц, 2H), піридиніл)метил]-N,N-діетил-1Н-бензімідазол-52,34 (s, 6Н), 1,19 (brt, J=6,8Гц, 6Н). MS (ESI) карбоксамід (M+H)+=279. До перемішаного розчину (6-етокси-314C: 1-[2-(диметиламіно)етил]-2-[2-(4піридиніл)оцтової кислоти (0,081г, 0,448ммоль) у етоксифеніл)етил]-N,N-діетил-1Н-бензімідазол-5ДМФ (2мл) додають O-(7-азабензотріазол-1-іл)карбоксамід N,N,N',N'-тетраметилуронійгексафлуорфосфату За загальною процедурою 13В змішують 3-(4(ГАТУ) (0,178г, 0,468ммоль) і ДІПЕА (0,156мл, етоксифеніл)пропанову кислоту (0,0386г, 0,895ммоль) і реакційну суміш перемішують при 0,198ммоль), ГАТУ (0,0756г, 0,199ммоль), ДІПЕА кімнатній температурі 10хвил. Додають 3-аміно-4(0,047мл, 0,27ммоль), і 4-{[2[(циклопропілметил)аміно]-N,N-діетилбензамід (диметиламіно)етил]аміно}-N,N-діетил-3(0,111г, 0,448ммоль) і суміш перемішують 1год. амінобензамід (0,0503г, 0,180ммоль). Сирий пропри кімнатній температурі. Суміш розбавляють дукт очищують хроматографією на силікагелі (9:1 EtOAc (15мл), промивають насиченим NаНСО3 СН2СІ2:МеOН) і одержують бажану сполуку (8мл) і розсолом (8мл), сушать над MgSO4 і конце(0,0284г, 36%). 1Н ЯМР (CD3OD): 7,64 (s, 1Н), нтрують у вакуумі, одержуючи сирий амід, який 7,53 (d, J=8,4Гц, 1Н), 7,29 (d, J=8,4Гц, 1H), 7,06 (d, використовують без подальшого очищення. J=8,4Гц, 2Н), 6,78 (d, J=8,4Гц, 2Н), 4,14 (t, J=8,0Гц, Цей сирий інтермедіат розчиняють у оцтовій 2Н), 3,96 (q, J=7,2Гц, 2H), 3,57 (br s, 2H), 3,35 (br s, кислоті (5мл) і суміш гріють при 90°С протягом 2H), 3,21-3,10 (m, 4H), 2,43 (t, J=7,6Гц, 2H), 2,26 (s, ночі. Реакційну суміш концентрують і залишок вно6H), 1,34 (t, J=7,2Гц, 3H), 1,26, 1,16 (2 перекриття сять у EtOAc (15мл). Органічну фазу промивають br s, 6H). 13C ЯМР (CD3OD): 174,03, 159,16, 1N NaOH (2 8мл) і розсолом (8мл), сушать над 158,09, 142,67, 136,55, 133,78, 132,24, 130,54, MgSO4 і концентрують у вакуумі. Сирий продукт 122,10, 117,34, 115,65, 111,44, 64,43, 58,74, 45,80, очищують хроматографією на колонці силікагелю 45,16, 42,64, 41,00, 34,46, 30,53,15,18, 14,43, 13,12. (2% МеОН/EtOAc) і одержують бажану сполуку MS (ESI) (M+H)+=437. Сіль HCI готують з Еt2О, як (0,111г, 65%) у вигляді коричневої твердої речовибілу тверду речовину після ліофілізації. Аналіз: ни. 1Н ЯМР (CDCI3): 8,05 (s, 1Н), 7,75 (s, 1Н), 7,49 обчислено для С26Н36N4О2·2,8НСІ·2,2Н2O: С, 54,00; (d, J=8,4Гц, 1Н), 7,38-730 (m, 2H), 6,68 (d, J=8,4Гц, Н, 7,53; N, 9,69. Одержано: С, 54,12; Н, 7,53; N, 1H), 4,32 (qd, J=7,2Гц, J=2,2Гц, 2H), 4,25 (s, 2Н), 9,36. 3,55 (br s, 2H), 3,38 (br s, 2H), 1,38 (td, J=6,8Гц, Приклад 15: J=2,0Гц, 3H), 1,22 (br s, 6H), 1,12-1,03 (m, 1H), 0,601-(циклопропіл метил)-2-[2-(40,54 (m, 2H), 0-33-0,28 (m, 2H). MS (ESI) етоксифеніл)етил]-N,N-діетил-1Н-бензімідазол-5(M+H)+=407. Аналіз: обчислено для карбоксамід. C24H28N4O2+0,2H2O: С, 70,63; Η, 7,01; Ν, 13,73. За загальною процедурою 13В змішують 3-(4Одержано: С, 70,83; Η, 7,50; Ν, 13,67. етоксифеніл)пропанову кислоту (0,0409г, Приклад 14: 0,211ммоль), ГАТУ (0,0801г, 0,211ммоль), ДІПЕА 1-[2-(диметиламіно)етил]-2-[2-(4(0,050мл, 0,29ммоль), і 3-аміно-4етоксифеніл)етил]-N,N-діетил-1Н-бензимідазол-5[(циклопропілметил)аміно]-N,N-діетилбензамід карбоксамід. (0,0500г, 0,191ммоль). Сирий продукт очищують 14А: 4-{[2-(диметиламіно)етил]аміно}-N,Nколонною хроматографією (19:1 СН2СІ2:МеOН) і 37 76743 38 одержують бажану сполуку (0,0457г, 57%). 1H ЯМР піридинілметил)аміно]бензамід За загальною процедурою 2В N,N-діетил-4(CD3OD): 7,64 (s, 1H), 7,55 (d, J=8,4Гц, 1Н), 7,27 флуор-3-нітробензамід (0,272г, 1,13ммоль) і 4(d, J=8,4Гц, 1Н), 7,08 (d, J=8,4Гц, 2Н), 6,77 (d, піридинілметанамін (0,11мл, 1,12ммоль) переміJ=8,4Гц, 2Н), 3,97 (d, J=7,2Гц, 2Н), 3,95 (q, J=6,8Гц, шують при кімнатній температурі 87год. Сирий 2Н), 3,57 (br s, 2H), 3,34 (br s, 2H), 3,23-3,07 (m, продукт очищують, колонною хроматографією 4H), 1,34 (t, 7=6,4Гц, 3Н), 1,36-1,02 (надіарріпд 2 x (100% EtOAc, 9:1 СН2СІ2:МеОН) і одержують баbr s і m, 7H), 0,55-0,46 (m, 2H), 0,40-0,32 (m, 2H). 13 жану сполуку (0,181г, 60%). 1Н ЯМР (CD3OD): C ЯМР (CD3OD): 174,08, 159,08, 157,72, 142,60, 8,49 (d, J=6,4Гц, 2Н), 8,27 (d, J=2,8Гц, 1H), 7,50136,95, 133,70, 132,03, 130,46, 121,97, 117,21, 7,42 (m, 3Н), 6,87 (d, J=8,4Гц, 1H), 4,77 (s, 2Н), 3,44 115,59, 111,83, 64,41, 48,69, 45,15, 40,98, 34,38, (br s, 4H), 1,21 (t, J=7,2Гц; 6Н). MS (ESI) 30,54, 15,18, 14,43, 13,12, 12,15, 4,54. MS (ESI) (M+H)+=329. (M+H)+=420. Сіль HCI готують з Et2O, як білу твер17B: 3-аміно-N,N-діетил-[(4ду речовину після ліофілізації. Аналіз: обчислено піридинілметил)аміно]бензамід для С26Н33N3О2·1,0НСІ·0,8Н2O: С, 66,38; Н, 7,63; N, За загальною процедурою 2С N,N-діетил-38,93. Одержано: С, 66,35; Н, 7,60; N, 8,81. нпро-4-[(4-піроидинілметил)-аміно]бензамід Приклад 16: (0,181г, 0,551ммоль) гідрогенують 20год. і одер2-(4-етоксибензил)-N,N-діетил-1-ізопентил-1Нжують бажану сполуку (0,172г) у вигляді в'язкого бензімідазол-5-карбоксамід коричневого масла. Сирий продукт використову16А: N,N-діетил-4-(ізопентиламіно)-3нітробензамід ють у подальших операціях. 1Н ЯМР (CD3OD): За загальною процедурою 2В N,N-діетил-48,45 (d, J=6,8Гц, 2Н), 7,46 (d, J=6,4Гц, 2Н), 6,79 (d, флуро-3-нітробензамід (1,077г, 4,48ммоль) і 3J=2,0Гц, 1Н), 6,64 (dd, J=7,2Гц, J=2,0Гц, 1Н), 6,36 метил-1-бутанамін (0,68мл, 5,83ммоль) перемішу(d, J=8,4Гц, 1Н), 4,51 (s, 2H), 3,42 (brs, 4H), 1,17 ють при 85°С 14год. і одержують бажану сполуку (brt, 6H). MS (ESI) (M+H)+=299 (1,425г) у вигляді оранжевого масла. Сирий про17C: 2-(4-етоксибензил)-N,N-діетил-1-(4дукт використовують у подальших операціях. 1Н піридинілметил)-1Н-бензимідазол-5-карбоксамід. За загальною процедурою 13В змішують феЯМР (CD3OD): 8,22 (d, J=2,0Гц, 1Н), 7,56 (dd, ніл)оцтову кислоту (0,0364г, 0,202ммоль), ГАТУ J=9,2Гц, J=2,0Гц, 1H), 7,09 (d, J=9,2Гц, 1H), 3,52(0,0768г, 0,202ммоль), ДІПЕА (0,048мл, 3,40 (br m, 6H), 1,83-1,72 (m, 1H), 1,64 (q, J=7,6Гц, 0,28ммоль), і 3aмiнo-N,N-діетил-4-[(42Н), 1,23 (t, J=7,6Гц, 6Н), 1,01 (d, J=6,8Гц, 6Н). MS піридинілметил)аміно]бензамід (0,0548г, (ESI) (M+H)+=308. 0,184ммоль). Сирий продукт очищують зворотно16B: 3-аміно-N,N-діетил-4фазовою HPLC (градієнт: 10-50% CH3CN у Н2О) і (ізопентиламіно)бензамід одержують бажану сполуку (0,0459г, 36%) як сіль За загальною процедурою 2С N,N-діетил-4ТФК. Цей матеріал ліофілізують з Н2O/діоксану і (ізопентиламіно)-3-нітробензамід (1,425г, одержують білу тверду речовину. 1Н ЯМР 4,64ммоль) гідрогенують 41год. і одержують бажану сполуку (1,312г) у вигляді синьої твердої речо(CD3OD): 8,60 (br s, 2H), 7,87 (s, 1H), 7,70 (d, вини. Сирий продукт використовують у подальших J=8,4Гц, 1Н)3 7,52 (dd, J=8,4Гц, J=2,0Гц, 1H), 7,42 (d, J=5,6Гц, 2H), 7,13 (d, J=8,4Гц, 2H), 6,71 (d, операціях. 1Н ЯМР (CD3OD): 6,78-6,74 (m, 2Н), J=9,6Гц, 2H), 6,06 (s, 2H), 4,54 (s, 2H), 3,93 (q, 6,58 (d, J=8,4Гц, 1H), 3,45 (br s, 4H), 3,17 (t, J=7,2Гц, 2H), 3,59 (br s, 2H), 3,31 (br s, 2H), 1,35 (t, J=7,6Гц, 2Н), 1,83-1,72 (m, 1H), 1,59 (q, J=12Гц, 7=6,8Гц, ЗН); 1,38-1,04 (2 x br s, 6H). MS (ESI) 2Н), 1,19 (t, J=6,4Гц, 6Н), 0,98 (d, J=6,4Гц, 6Н). MS (M+H)+=443. Аналіз: обчислено для (ESI) (M+H)+=278. C27H30N4O2·2,1ΤΦК·0,8Н2О: С, 53,81; Η, 4,88; Ν, 16C: 2-(4-етоксибензил)-N,N-діетил-18,04. Одержано: С, 53,74; Η, 4,89; Ν, 8,07. ізопентил-1Н-бензімідазол-5-карбоксамід Приклад 18: За загальною процедурою 13В змішують (42-(4-етоксибензоїл)-N,N-діетил-1-ізопентилетоксифеніл)оцтову кислоту (0,110г, 0,612ммоль), 1Н-бензімідазол-5-карбоксамід ГАТУ (0,233г, 0,611ммоль), ДІПЕА (0,15мл, MnO2 (0,641г, 7,37ммоль) додають з перемі0,86ммоль), і 3-аміно-ІN,N-діетил-4шуванням до розчину 2-(4-етоксибензилл)-N,N(ізопентиламіно)бензамід (0,154г, 0,556ммоль). діетил-1-ізопентил-1Н-бензімідазол-5Сирий продукт очищують колонною хроматографікарбоксаміду (0,211г, 0,500ммоль) у сухому діокєю (19:1 СН2СІ2:МеOН) і одержують бажану сполусані (4мл) у атмосфері нітрогену. Реакцію розігріку (0,211г, 90%). 1Н ЯМР (CD3OD): 7,67 (s, 1Н), вають 50°С. Через 64год. додають ще МnО2 7,50 (d, J=8,4Гц, 1Н), 7,30 (dd, J=8,4Гц, J=2,0Гц, (0,600г, 6,90ммоль) і гріють при 50°С ще 24год., 1Н), 7,16 (d, J=9,2Гц, 2Н), 6,86 (d, J=8,4Гц, 2Н), після чого охолоджують до кімнатної температури, 4,28 (s, 2H), 4,12 (m, 2H); 3,98 (q, J=7,6Гц, 2Н), 3,57 розбавляють СН2СІ2 і фільтрують через діатомову (brs, 2H), 3,34 (br s, 2H), 1,62-1,48 (m, 1H), 1,34 (t, землю. Тверді речовини промивають додатковим J=7,6Гц, 3Н), 1,36-1,07 (перекриття 2 x br s і m, СН2СІ2 і фільтрат концентрують, одержуючи сирий 5H), 0,88 (d, J=6,8Гц, 6Н). MS (ESI) (M+H)+=422. продукт. Очищення колонною хроматографією (1:1 Аналіз: обчислено для O26Η35Ν3Ο2·1,7ΤΦК·0,2Η2Ο: EtOAc:гептан) дає бажану сполуку (0,139г, 64%) у С, 57,05; Η, 6,04; Ν, 6,79. Одержано: С, 57,11;Η, вигляді в'язкого безбарвного масла. 1Н ЯМР 6,09; Ν, 6,69. (CD3OD): 8,19 (d, J=9,6Гц, 2Н), 7,83 (s, 1H), 7,72 Приклад 17: (d, J=8,4Гц, 1Н), 7,48 (dd, J=8,4Гц, J=1,6Гц, 1Н), 2-(4-етоксибензил)-N,N-діетил-1-(47,01 (d, J=9,2Гц, 2Н), 4,53 (dd, J=7,6Гц, J=7,2Гц, піримідинілметил)-1Н-бензімідазол-5-карбоксамід 2Н), 4,13 (q, J=6,4Гц, 2Н), 3,58 (brs, 2Н), 3,36 (brs, 17А: N,N-діетил-3-нітро-4-[(4 39 76743 40 2H), 1,78-1,70 (m, 2H), 1,72-1,56 (m, 1Н), 1,41 (t, влений (4-етоксифеніл)ацетилхлорид (з 793мг J=7,2Гц, 3Н), 1,34-1,10 (2 x br s, 6H), 0,94 (d, кислоти, 4,4 ммоль) і сирий 3-аміно-4[(циклопропілметил)аміно]бензонітрил (750мг, J=6,8Гц, 6Н).13С flMP(CD3OD): 185,72, 173,32, 4,01ммоль) гріють у оцтовій кислоті (НОАс) протя165,47, 149,57, 142,00, 137,18, 134,65, 133,57, гом ночі. Після обробки сирий залишок очищують 130,19, 124,88, 119,93, 115,31, 112,75, 65,10, 45,12, хроматографією на колонці силікагелю і одержу44,94, 41,00, 40,13, 27,18, 22,79, 14,99, 14,46, ють чистий продукт (1,04г, 78%) у вигляді білуватої 13,12. MS (ESI) (M+H)+=436. Аналіз: обчислено для С26Н33N3О3·0,5Н2О: С, 70,24; Η, 7,71; Ν, 9,45. Одетвердої речовини. 1Н ЯМР (400ΜГц, CDCI3): 8,08 ржано: С, 70,40; Η, 7,64; Ν, 8,97. (s, 1H), 7,50 (d, J=8,4Гц, 1Н), 7,38 (d, J=8,4Гц, 1Н), Приклад 19: 7,14 (d, J=8,4Гц, 2Н), 6,84 (d, J=8,4Гц, 2Н), 4,29 (s, 2-(4-етоксибензоіл)-N,N-діетил-1-ізопентил-1Н2H), 4,01 (d, J=7,6Гц, 2Н), 3,96 (q, J=7,6Гц, 2Н), бензімідазол-5-карбоксамід 1,39 (t, J=7,6Гц, 3Н), 1,04-1,00 (m, 1Н), 0,58-0,53 Реагент Лоусона (0,0963г, 0,238ммоль) дода(m, 2H), 0,29-0,25 (m, 2H). MS (ESI) (M+H)+=332. ють з перемішуванням до розчину 2-(4Аналіз. C21H21N3O·0,1H2O: С, 75,50; Η, 6,41; Ν, етоксибензоїл)-N,N-діетил-1-ізопентил-1Н12,61. Одержано: С, 75,76; Η, 6,72; Ν, 12,45. бензімідазол-5-карбоксаміду (0,0451г, 0,104ммоль) 20D: 1-(циклопропілметил)-2-(4-етоксибензил)у сухому толуоле (5мл) у атмосфері нітрогену. 1Н-бензімідазол-5-карбонова кислотa. Реакцію гріють під зворотним холодильником проДо розчину 1-(циклопропілметил)-2-(4тягом 0,5год., охолоджують до кімнатної темпераетоксибензил)-1Н-бензімідазол-5-карбонітрилу тури і концентрують. Залишок очищують колонною (500мг, 1,51ммоль) у 1:1 ЕtOН:Н2O (16мл) додають хроматографією (3:1 гексани: EtOAc) і одержують КОН (338мг, 6,04ммоль). Суміш витримують під бажану сполуку (0,0137г, 29%) у вигляди склоподізворотним холодильником 36год. і підкислюють 1N НСІ до рН 6,0, осад збирають фільтруванням і бної жовтої твердої речовини. 1Н ЯМР (CD3OD): одержують білу тверду речовину (520мг, 99%), яку 8,19 (d, J=9,2Гц, 2Н), 7,67 (d, J=8,4Гц, 1Н), 7,64 (s, використовують без подальшого очищення. Аналі1H), 7,36 (d, J=8,4Гц, 1Н), 7,06 (d, J=9,2Гц, 2Н), тично чисту сполуку одержують рекристалізацією з 4,55 (dd, J=8,4Гц, J=7,2Гц, 2Н), 4,17 (q, J=7,6Гц, ЕtOН:Н2O. 1Н ЯМР (400ΜГц, CD3OD): 8,25 (s, 4Н), 3,53 (q, J=H,6Гц, 2Н), 1,80-1,71 (m, 2H), 1,711,58 (m, 1H), 1,44 (t, J=7,6Гц, 3Н), 1,41 (t, ,7=7,6Гц, 1H), 7,89 (d, J=8,4Гц, 1Н), 7,47 (d, J=8,4Гц, 1Н), 3Н), 1,17 (t, J=1,6Гц, 3Н), 0,97 (d, J=6A Гц, 6Н). 13С 7,18 (d, J=8,2Гц, 2Н), 6,82 (d, J=8,2Гц, 2Н), 4,28 (s, 2H), 4,06 (d, J=6,8Гц, 2Н), 3,89 (q, J=7,6Гц, 2Н), ЯМР (CD3OD): 201,23, 185,95, 165,57, 149,55, 1,32 (t, J=7,6Гц, 3Н), 1,06-0,92 (m, 1H), 0,50-0,48 141,87, 141,18, 136,28, 134,64, 130,31, 124,56, (m, 2H), 0,32-0,26 (m, 2H). MS (ESI) (M+H)+=351. 118,20, 115,41, 112,36, 65,15, 47,48, 44,89, 40,18, Аналіз: обчислено для C21H22N2O3·0,7HCI: С, 27,20, 22,77, 14,95, 14,07, 11,44. MS (ESI) 67,09; Н, 6,09; N, 7,45. Одержано: С, 66,98; Н, 6,31; (M+H)+=452. Аналіз: обчислено для N, 7,09. C26H33N3O2S·0,3H2O: С, 68,33; Η, 7,41; Ν, 9.,19. 20Е: N-циклогексил-1-(циклопропілметил)-2-(4Одержано: С, 68,44; Η, 7,52; Ν, 9,01. етоксибензил)-N-метил-1Н-бензімідазол-5Приклад 20: карбоксамід N-циклoгeкcил-1-(циклoпpoпiлмeтил)-2-(41-(циклопропілметил-2-(4-етоксибензил)-1Нeтoкcибeнзил)-N-мeтил-1H-бeнзiмiдaзoл-5бензімідазол-5-карбонову кислоту (80мг, карбоксамід 0,228ммоль) розчиняють у ДМФ (2мл) і додають 20А: 4-[(циклопропілметил)аміно]-3ГАТУ (104мг, 0274ммоль) і потім ДІПЕА (48мкл, нітробензонітрил 0,274ммоль). Після перемішування протягом За загальною процедурою 2В 733мг 10хвил. додають циклогексилметиламін (4,42ммоль) 4-флуоро-3-нітробензонітрил у 80%(0,456ммоль) і суміш перемішують протягом ночі. му водному етанолі (20мл) додають до циклопроСуміш розбавляють EtOAc (50мл), промивають пілметиламіну (377мг, 5,3ммоль) при кімнатній насиченим NaHCO3 (2 10мл) і Н2О (2 10мл), сутемпературі. Суміш перемішують при 60°С 3год. перед обробкою. Сирий продукт (920мг, 96%) вишать над MgSO4 і концентрують, одержуючи амід. користовують без подальшого очищення у наступСирий залишок очищують хроматографією на колонці силікагелю і одержують чистий продукт, який ній операції. 1Н ЯМР (400ΜГц, CDCI3): 8,52 (s, обробляють розчином 1Μ НСІ у діетилетері для 1H), 8,51-8,47 (br, 1H), 7,59 (d, J=8,4Гц, 1H), 6,90 одержання солі НСІ у вигляді білої твердої речо(d, J=8,4Гц, 1Н), 3,22-3,20 (m, 2H), 1,25-1,15 (m, 1H), 0,73-0,59 (m, 2H), 0,42-0,35 (m, 2H). MS (ESI)[2 вини (93мг, 78%). 1Н ЯМР (400ΜГц, CD3OD): 7,66 x (Μ+Η)+]:436. (s, 1H), 7,58 (d, J=8,0Гц, 1Н), 7,30 (d, J=8,0Гц, 1Н), 20В: 3-аміно-47,16 (d, J=8,6Гц, 2Н), 6,84 (d, J=8,6Гц, 2Н), 4,30 (s, [(циклопромілметил)аміно]бензонітрил 2H), 4,10-4,04 (m, 5H), 3,96 (q, J=7,6Гц, 2Н), 3,66За загальною процедурою 2С сирий 43,54 (m, 1H), 1,90-1,50 (m, 10H), 1,33 (t, J=7,6Гц, [(циклопропілметил)аміно]-3-нітробензонітрил 3Н), 1,10-0,98 (m, 1H), 0,50-0,42 (m, 2H), 0,32-0,27 (920мг, 4,24ммоль) гідрогенують 2год. (35фунт/кв. (m, 2H). MS (ESI) (M-H)+=446. Аналіз: обчислено дюйм = 2,45ат) у 40мл EtOAc і одержують 750мг для C28H35N3O2·2,2HCI: С, 63,96; Η, 7,13; Ν, 7,99. сирого продукта (95%), який використовують без Одержано: C, 64,11; Η, 7,24; Ν, 7,73. подальшого очищення у наступній операції. MS Приклад 21: (ESI) (M+H)+=188. 1-(циклопропілметил)-2-(4-етоксибензил)-5-(120C: 1-(циклопропілметил)-2-(4-етоксибензил)піролідинілкарбоніл)-1Н-бензімідазол 1Н-бензімідазол-5-карбонітрил За загальною процедурою 20Е 1За загальною процедурою 2D щойно пригото(циклопропілметил)-2-(4-етоксибензил)-1Н 41 76743 42 бензімідазол-5-карбонову кислоту (80мг, За загальною процедурою 13В 360мг 0,228ммоль) розчиняють у ДМФ (2мл) і додають (1,48ммоль) [5-(бензилокси)-2-піридиніл]оцтової ГАТУ (104мг, 0,274ммоль) і потім ДІПЕА (48мл, кислоти з'єднують з 3-аміно-40,274ммоль). Після перемішування (10мін) дода[(циклопропілметил)аміно]-бензонітрилом, викориють піролідин (0,456ммоль) і суміш перемішують стовуючи ГАТУ. Цей інтермедіат гріють у НОАс протягом ночі. Сирий залишок після обробки очи(20мл) при 90°С протягом ночі. Після концентрації щують хроматографією на колонці силікагелю і сирий залишок очищують хроматографією на силіодержують чистий продукт, який обробляють 1Μ кагелі і одержують чистий продукт (230мг, 40% за розчином НСІ розчином у діетилі для одержання 2 операції) у вигляді масла. MS (ESI) (M+H)+=395. солі НСІ у вигляді твердої речовини (82мг, 79%). 23С: 1-(циклопропілметил)-2-[(5-гідрокси-21 піридиніл)метил]-1Н-бензімідазол-5-карбонітрил Н ЯМР (400ΜГц, CD3OD): 7,85 (s, 1H), 7,59 (d, До розчину 2-{[5-(бензилокси)-2J=8,6Гц, 1Н), 7,48 (d, J=8,6Гц, 1Н), 7,18 (d, J=8,1Гц, піридиніл]метил}-1-(циклопропілметил)-1Н2Н), 6,87 (d, J=8,1Гц, 2Н), 4,32 (s, 2H), 4,07 (d, бензімідазол-5-карбонітрилу (200мг, 0,51ммоль) у J=6,8Гц, 2Н), 4,00 (q, J=7,6Гц, 2Н), 3,64 (t, J=7,2Гц, ЕtOН (10мл) додають 10% Pd/C (20мг). Суміш гід2Н), 3,53 (t, J=7,2Гц,2Н), 2,06-1,96 (m, 2H), 1,96рогенують протягом ночі (40фунт/кв. дюйм = 1,85 (m, 2H), 1,36 (t, J=7,6Гц, 3Н), 1,10-1,04 (m, 1H), 2,8ат). Після фільтрування і концентрування оде0,52-0,46 (m, 2H),0,34-0,28 (m, 2H). MS (ESI) ржують сирий продукт у вигляді блідожовтого мас(M+H)+=404. Аналіз: обчислено для ла (120мг, 77%), яке використовують без подальC25H29N3O2·1,5НСІ: С, 65,53; Η, 6,71; Ν, 9,17. Одешого очищення. MS (ESI) (M+H)+=305. ржано: С, 65,48; Η, 6,77; Ν, 8,75. 23D: 1-(циклопропілметил)-2-[(5-етокси-2Приклад 22: піридил)метил]-1Н-бензімідазол-5-карбонітрил 1-(циклопропілметил)-2-(4-етоксибензил}-5-(1До розчину 1-(циклопропілметил)-2-{(5піролідинілкарботіоніл)-1Н-бензімідазол гідрокси-2-піридиніл)метил]-1Н-бензімідазол-5До розчину вільної бази 1-(циклопропілметил)карбонітрилу (120мг, 0,394ммоль) у DMSO (1мл) 2-(4-етоксибензил)-5-(1-піролідинілкарбоніл)-1Ндодають MeONa (25%-й у МеОН/0,47ммоль). Після бензімідазол (Приклад 21, з 80мг 1перемішування при кімнатній температурі протя(циклопропілметил)-2-(4-етоксибензил)-1Нгом 30хвил. МеОН видаляють у вакуумі і додають бензімідазол-5-карбонової кислоти) у піридині Etl (0,47ммоль). Суміш перемішують при кімнатній (2мл) додають P2S5 (507мг, 1,14ммоль). Суміш температурі протягом ночі, розчин розбавляють гріють при 100°С 24год. і охолоджують до кімнатної температури. Після декантування надосадну H2O (10мл), екстрагують EtOAc (2 20мл), промирідину концентрують і залишок розбавляють вають Н2О (2 10мл) і сушать над MgSO4. Залишок EtOAc (20мл), промивають 1N NaOH (2 10мл) і після випарювання очищують хроматографією на колонці силікагелю і одержують чистий продукт у Н2О (2 10мл). Органічний шар сушать над MgSO4 і вигляді масла (84мг, 64%). 1Н ЯМР (400ΜГц, випарюють. Сирий залишок очищують хроматографією на колонці силікагелю і одержують масло CDCI3): 8,19 (d, J=3,0Гц, 1H), 8,04 (s, 1H), 7,49 (d, (59мг, 62% для 2 операцій). 1Н ЯМР (400ΜГц, J=8,4Гц, 1Н), 7,42 (d, J=8,4Гц, 1H), 7,24 (d, J=8,8Гц, 1H), 7,13 (dd, J=10,0Гц, J=2,8Гц, 1H), 4,47 (s, 2H), CD3OD): 7,70 (s, 1H), 7,39 (d, J=S.O Гц, 1Н), 7,28 4,15 (d, J=6,8Гц, 2H), 4,04 (q, J=7,0Гц, 2H), 1,41 (t, (d, J=8,0Гц, 1Н), 7,12 (d, J=8,4Гц, 2Н), 6,81 (d, J=7,0Гц, 3Н), 1,14-1,08 (m, 1H), 0,60-0,54 (m, 2H), J=8,4Гц, 2Н), 4,27 (s, 2Н), 4,08-3,95 (m, 4H), 3,89 (d, 0,36-0,30 (m, 2H). MS (ESI) (M+H)+=333. J=6,8Гц, 2Н), 3,57 (t, J=7,2Гц, 2Н), 2,14-2,03 (m, 23E: 1-(циклопропілметил)-2-[(5-етокси-22H), 2,00-1,92 (m, 2H), 1,38 (t, J=7,2Гц, 3Н), 1,06піридиніл)метил]-1Н-бензімідазол-5-карбонова 0,98 (m, 1H), 0,54-0,48 (m, 2H), 0,28-0,22 (m, 2H). кислота. MS (ESI) (M+H)+=420. До розчину 1-(циклопропілметил)-2-[(5-етоксиПриклад 23: 2-піридиніл)метил]-1Н-бензімідазол-51-(циклопропілметилІ)-2-[(5-етокси-2карбонітрилу (400мг, 1,203ммоль) у 1:1 ЕtOН:Н2O піридиніл)метил]-5-(1-піролідиніл-карбоніл)-1Н(12мл) додають КОН (269мг, 4,81ммоль). Суміш бензімідазол витримують під зворотним холодильником 36год. і 23А: [5-(бензилокси)-2-піридиніл]оцтова кислопідкислюють 1N НСІ до рН~6,0, осад (397мг, 94%) та використовують у подальшій операції без подальДо розчину 1,45г (6,46ммоль) [5-(бензилокси)шого очищення. MS (ESI) (M-H)+=352. 2-піридиніл]ацетонітрилу (одержаного у опер. 6 з 23F: 1-(циклопропілметил)-2-[(5-етокси-26-метил-3-пірилинолу [див. W.M. Golebiewski і J.T. піридиніл)метил]-5-(1-піролідиніл-карбоніл)-1НWrobel, Bull. Pol. Acad. Sci., 1990, 38, 17] у МеОН бензімідазол. (9мл) додають 25%-q NaOH (3мл). Реакційну суЗа загальною процедурою 20Е, 1міш перемішують під зворотним холодильником (циклопропілметил)-2-[(5-етокси-2-піридиніл)протягом 48год. Після охолодження більшу частиметил]-1Н-бензімідазол-5-карбонову кислоту ну МеОН видаляють у вакуумі, додають воду (80мг, 0,228ммоль) розчиняють у ДМФ (2мл) і до(10мл) і водний розчин промивають діетилетером дають ГАТУ (104мг, 0,274ммоль) додають і потім (2 10мл) і потім підкислюють (рН ~ 6,0). Суміш ДІПЕА (48мл, 0,274ммоль). Після перемішування екстрагують EtOAc (3 20мл), сушать над MgSO4 і (10хвил.) додають піролідин і суміш перемішують концентрують, одержуючи блідожовті кристали протягом ночі. Сирий залишок після обробки очи(1,4г, 89%). MS (ESI) (M+H)+=244. щують, використовуючи зворотно-фазову препа23В: 2-{[5-(бензилокси)-2-піридиніл]метил}-1ративну ВТРХ, і одержують сіль ТФК у вигляді бі(циклопропілметил)-1Н-бензімідазол-5лої твердої речовини (42мг, 37%). 1Н ЯМР карбонітрил 43 76743 44 До розчину 1-(циклопропілметил)-2-(4(400ΜГц, CD3OD): 8,18 (d, J=2,8Гц, 1Н), 7,98 (d, етоксибензил)-1Н-бензімідазол-5-карбальдегіду J=9,2Гц, 1Н), 7,87 (s, 1H), 7,72 (dd, J=9,2Гц, (2,32г, 6,94ммоль) у ТГФ (60мл) при 0°С додають J=2,0Гц, 1Н), 7,52 (d, J=9,2Гц, 1Н), 7,46 (dd, 3М метилмагнійбромід у ТГФ (13,9мл, 41,7ммоль) і J=9,2Гц, J=2,8Гц, 1Н), 4,89 (s, 2H), 4,43 (d, J=6,8Гц, суміш перемішують при 0°С 90 хвил. Додають во2Н), 4,09 (q, J=7,2Гц, 2Н), 3,60 (t, J=7,6Гц, 2Н), 3,44 ду (50мл) і суміш перемішують 10хвил. перед екс(t, J=7,6Гц, 2Н), 2,02-1,94 (m, 2Н), 1,92-1,86 (гл, трагуванням EtOAc (3 100мл). Об'єднані органічні 2Н), 1,37 (t, J=7,2Гц, 3Н), 1,30-1,22 (m, 1H), 0,640,58 (m, 2H), 0,48-0,44 (m, 2H). MS (ESI) фази промивають розсолом (50мл), сушать над (M+H)+=405. Аналіз: обчислено для MgSO4, фільтрують і концентрують у вакуумі. ДоC24H28N4O2·0,8ΤΦК·0,2Η2Ο: С, 55,32; Η, 5,12; Ν5 дають СН2СІ2 (5мл), одержану суспензію фільтру9,49. Одержано: С, 55,30; Η, 4,91; Ν, 9,23. ють, тверду речовину промивають СН2СІ2 (2мл), Приклад 24: сушать і одержують бажану сполуку (1,915г, 79%) 1-(циклопропілметил)-2-(4-етоксибензил)-5-(4у вигляді білої твердої речовини. 1Н ЯМР (CDCI3): морфолінілметил)-1Н-бензімідазол 7,74 (s, 1H), 7,31 (S, 2H), 7,12 (d, J=8,4Гц, 2Н), 24А: 1-(циклопропілметил)-2-(4-етоксибензил)6,79 (d, J=S.O Гц, 2Н), 5,03 (q, J=6,3Гц, 2Н), 4,27 (s, 1Н-бензімідазол-5-карбальдегід 2Н), 3,98 (q, J=6,8Гц, 2H) 3,90 (d, J=6,4112, 2H), До розчину 1-(циклопропілметил)-2-(42,33 (br s, 1H), 1,56 (d, J=6,4Гц, 3Н), 1,38 (t, етоксибензил)-1Н-бензімідазол-5-карбонітрилу J=7,0Гц, 3Н), 1,05-0,99 (m, 1H), 0,53-0,48 (m, 2H), (0,049г, 0,149ммоль) у 50%-ій водній мурашиній 0,26-0,23 (m, 2H). MS (ESI) (M+H)+=35,1. Аналіз: кислоті (1мл) додають каталітичну кількість нікелю обчислено для C22H26N2O2: С, 75,40; Η, 7,48; Ν, Рейні (50%-а суспензія у воді) і суміш гріють при 7,99. Одержано: С, 75,22; Η, 7,32; Ν, 7,99. 90°С 6год., суміш фільтрують через діатомову зе25В: 1-[1-(циклопропілметил)-2-(4млю і промивають EtOAc. Розчинник випарюють у етоксибензил)-1Н-бензімідазол-5-іл]етанон вакуумі і залишок вносять у EtOAc (5мл). ОрганічДо суміші 1-[1-(циклопропілметил)-2-(4ну фазу промивають 1N NaOH (2 2мл) і розсолом етоксибензил)-1Н-бензімідазол-5-іл]етанолу (1,35г, (2мл), сушать над MgSO4, фільтрують і концент3,86ммоль), N-метилморфолін-N-оксиду (0,497г, рують у вакуумі. Сирий продукт очищують хрома4,24ммоль) і 4А молекулярних сит (2,0г) у СН2СІ2 тографією на колонці силікагелю (40% (10мл) додають перрутенат тетрапропіламонію EtOAc/гексани) і одержують бажану сполуку (0,068г, 0,193ммоль) і суміш перемішують при кім(0,041г, 82%) у вигляді білої твердої речовини. 1Н натній температурі 90хвил. Додають Nметилморфолін-N-оксид (0,124г, 1,06ммоль) і ацеЯМР (ацетон-d6): 10,16 (s, 1Н), 8,29 (s, 1Н), 7,90 тонітрил (1мл) і суміш перемішують при кімнатній (d, J=8,4Гц, 1Н), 7,76 (d, J=8,4Гц, 1Н), 7,34 (d, температурі протягом ночі. Розчинник концентруJ=8,4Гц, 2Н), 6,94 (d, J=8,4Гц, 2Н), 4,44 (s, 2H), ють у вакуумі і сирий продукт очищують хроматог4,24 (d, J=6A Гц, 2Н) 4,07 (g, J=6,8Гц, 2Н), 1,40 (t, рафією на колонці силікагелю (30% EtOAc/гексани J=7,0Гц, 3Н), 1,27-1,14 (m, 1H), 0,58-0,49 (m, 2H), до 60% EtOAc/гексани) і одержують бажану сполу0,48-0,38 (m, 2Н). MS(ESI)(M+H)+=335. ку (0,880г, 65%) у вигляді білої твердої речовини. 24В: 1-(циклопропілметил)-2-(4-етоксибензил)1 5-(4-морфолінілметил)-1Н-бензімідазол Н ЯМР (CDCI3): 8,34 (s, 1H), 7,94 (dd, J=8,4Гц, До розчину 1-(циклопропілметил)-2-(4J=2,0Гц, 1Н), 7,35 (d, J=8,4Гц, 1Н), 7,15 (d, J=8,4Гц, етоксибензил)-1Н-бензімідазол-5-карбальдегіду 2Н), 6,91 (dd, J=6,4Гц, J=2,0Гц, 2Н), 4,29 (s, 2Н), (0,077г, 0,231ммоль) і оцтової кислоти (0,135мл, 3,98 (q, J=1,2Гц, 2Н) 3,41 (d, J=6,8Гц, 2Н), 2,67 (s, 0,236ммоль) у ТГФ (0,25мл) додають тріацетокси3Н), 1,38 (t, J=7,0Гц, 3Н), 1,07-1,00 (m, 1Н), 0,55боргідрид натрію (0,245г, 0268ммоль) і суміш пе0,51 (m,-2H), 0,29-0,26 (m, 2H). 13C ЯМР(CDCI3): ремішують при кімнатній температурі 6год. Дода198,71, 159,01, 156,43, 143,29, 140,01, 132,68, ють воду (2мл) і 1N НСl (5мл) і суміш перемішують 130,44, 128,67, 123,50, 121,95, 115,83, 110,73, 10хвил. перед промиванням EtOAc (2 5мл). Вод64,38, 49,23, 34,63, 27,63, 15,76, 11,99, 5,20. MS ний шар підлужують 5N NaOH (5мл) і екстрагують (ESI) (M+H)+=349. Аналіз: обчислено для C22H24N2O2+0,1H2O: С, 75,44; Η, 6,96; Ν, 8,00. EtOAc (3 10мл). Об'єднані органічні фази промиОдержано: С, 75,48; Η, 7,13; Ν, 8,01. вають розсолом (5мл), сушать над MgSO4, фільтПриклад 26: рують і концентрують у вакуумі. Сирий продукт Метил-1-(циклопропілметил)-2-(4очищують хроматографією на колонці силікагелю етоксибензил)-1Н-бензімідазол-5-ілкарбамат (5% МеОН/EtOAc) і одержують бажану сполуку 26Α: Метил-4-флуор-3-нітрофенілкарбамат (0,0445г, 47%), яку розчиняють у 1М НСІ у діетилеДо перемішаного розчину 4-флуор-3тері і одержують після випарювання розчинника нітроаніліну (10,30г, 65,97ммоль), ДІПЕА (15,00мл, сіль НСІ у вигляді масла. 1Н ЯМР (вільна основа, 86,11ммоль) у СН2СІ2 (150мл) додають краплями CDCI3): 7,68 (s, 1Н), 728-7,23 (m, 2Н), 7,14 (d, метилхлорформат (6,86г, 72,59ммоль) при 0°С. J=8,4Гц, 2H), 6,81 (d,J=8,4Гц, 2Н), 4,26(s, 2Н), 3,98 Реакцію залишають досягти кімнатної температу(q, J=7,2Гц, 2Н), 3,88 (d, 6,4Н), 3,72-3,65 (m, 4H) ри і перемішують при кімнатній температурі протя3,63 (s, 2H), 2,53-2,44 (m, 4H), 1,38 (t, J=8,6Гц, 3Н), гом ночі. Суміш розбавляють СН2СІ2 (100мл), про1,07-1,00 (m, 1Η), 0,53-0,48 (m, 2H), 0,29-0,22 (m, мивають 3Ν НСІ (50мл), розсолом (20мл) і сушать 2H). MS (ESI) (M+H)+=406. над сульфатом натрію. Видалення розчинника дає Приклад 25: сирий карбамат у вигляді світлокоричневої твердої 1-[1-(циклопропілметил)-2-(4-етоксибензил)речовини (13,03г, 92%). 1Н-бензімідазол-5-іл]етанон 26В: Метил 4-[(циклопропілметил)аміно]-325А: 1-[1-(циклопропілметил)-2-(4нітрофенілкарбамат етоксибензил)-1Н-бензімідазол-5-іл]етанол 45 76743 46 За загальною процедурою 2В до метил-4лом і сушать над Na2SO4. Після концентрування флуор-3-нітрофенілкарбамату (6,50г, 30,35ммоль, залишок очищують препаративною ВТРХ і одерз попередньої операції) у 80%-му водному етанолі жують бажаний матеріал як сіль ТФК (40мг, 24%), (100мл) додають циклопропанметиламін (5,00мл, яку розчиняють у Н2О (10мл), нейтралізують наси57,65ммоль) при кімнатній температурі. Реакційну ченим NaHCO3 і екстрагують Et2O (2 20мл). Об'єсуміш гріють при 60°С протягом ночі. Після звиднаний етерний розчин промивають розсолом, чайної обробки осаджений сирий продукт збирасушать над Na2SO4 і концентрують. Вільну основу + ють (8,21г). MS (ESI) (M+H) =266. перетворюють у її сіль з НСІ (20мг). 1Н ЯМР 26С: Метил-3-аміно-4(CD3OD): 7,86 (br., 1Н), 7,62 (br., 1Н), 7,45 (br., [(циклопропілметил)аміно]фенілкарбамат 1Н), 7,24 (d, J=8,4Гц, 2Н), 6,93 (d, J=8,4Гц, 2Н), За загальною процедурою 2С метил-44,53 (s, 2H), 4,34 (d, J=6,8Гц, 2H), 4,00 (q, J=7,0 Гц, [(циклопропілметил)аміно]-3-нітрофеніл-карбамат 2H), 3,50 (s, 3Н), 2,26 (s, 3Н), 1,34 (t, J=7,0Гц, 3Н), (8,21г) гідрогенують у етилацетаті (100мл) з ката1,26-1,16 (m, 1H), 0,62-0,55 (m, 2H), 0,46-0,40 (m, лізатором 10% Pd/C (500мг) при 15-25фунт/кв. 2H). MS (ESI) (M+H)+=445. Аналіз: обчислено для дюйм у Н2 (1-2ат) протягом 1год. Реакційну суміш C26H28N4O3·1,15HCI: С, 64,19; Η, 5,92; Ν, 11,51. фільтрують через діатомову землю, і видалення Одержано: С, 64,59; Η, 5,74; Ν, 10,97. розчинника дає бажаний діамін (4,0г, 56% для 2 Приклад 28: опер.). Цей матеріал використовують без подальІзопропіл-1-(циклопропілметил)-2-(4шого очищення. MS (ESI) (M+H)*=236. етоксибензил)-1Н-бензімідазол-5-іл26D: Метил-1-(циклопропілметил)-2-(4метил)карбамат етоксибензил)-1Н-бензімідазол-5-іл-карбамат. До розчину 1-(циклопропілметил)-2-(4За загальною процедурою 13В змішують меетоксибензил)-N-метил-1Н-бензімідазол-5-аміну тил-3-аміно-4-((циклопропілметил)аміно](67мг, 0,20ммоль) і Et2N (0,1мл) у СН2СІ2 (3мл) фенілкарбамат (4,0г, 17,0ммоль), ДІПЕА (5мл), 4додають ізопропілхлорформат (1М у толуолі, етоксифенілоцтову кислоту (3,06г, 17,0ммоль) і 0,24мл, 0,24ммоль) при кімнатній температурі. ГАТУ (7,10г, 18,7ммоль). Бажаний продукт (3,34г, Реакційну суміш перемішують при кімнатній тем52%) осаджують з реакційної суміші. 1Н ЯМР (CD): пературі протягом ночі і гасять насиченим NaHCO3 7,65 (d, d=2,0Гц, 1Н), 7,37 (br., 1H), 7,26 (d, (1мл). Суміш розбавляють Et2O (30мл), промиваJ=4Гц), 7,12 (d, J=9,0Гц, 2H), 6,81 (d, J=9,0Гц, 2H), ють насиченим NaHCO3 і розсолом, сушать над 6,74 (br., 1H), 4,25 (s, 2H), 3,98 (q, J=7,4Гц, 2Н), Na2SO4 і концентрують. Залишок очищують препа3,87 (d, J=7,2Гц, 2H), 3,79 (s, 3Н), 1,38 (t, J=7,4Гц, ративною ВТРХ і одержують сіль ТФК (10мг, 9%). 1 3Н), 1,05-0,97 (m, 1H), 0,52-0,47 (m, 2H), 0,25-0,20 НЯМР (CD3OD): 7,87 (d, J=8,4Гц, 1Н), 7,62 (d, + (m, 2H). MS (ESI) (M+H) =380. J=1,6Гц, 1Н), 7,50 (dd, J=1,6, 8,4Гц, 1Н), 7,24 (d, Приклад 27: J=8,4Гц, 2Н), 6,93 (d, J=8,4Гц, 2Н), 4,95-4,85 (m, N-[1-(циіслолропілметил)-2-(4-етоксибензил)1H), 4,54 (s, 2H), 4,35 (d, J=7,2Гц, 2Н), 4,01 (q, 1Н-бензімідазол-5-іл]-N,5-диметил-3J=6,8Гц, 2H), 3,31 (s, 3Н), 1,343 (t, J=6,8Гц, 3Н), ізоксазолкарбоксамід 1,27-1,19 (m, 1H), 1,19 (d, J=5,6Гц, 6H), 0,63-0,56 27A: 1-(циклопропілметил)-2-(4-етоксибензил)(m, 2H), 0,47-0,42 (m, 2H). MS (ESI) (M+H)+=422. N-метил-1Н-бензімідазол-5-амін Аналіз: обчислено для Метил-1-(циклопропілметил)-2-(4С25Н31N3О3·1,35ТФК·0,05Н2О: С, 57,72; Н, 5,67; N, етоксибензил)-1Н-бензімідазол-5-ілкарбамат 7,29. Одержано: С, 57,68; Н, 5,33; N, 7,23. (1,65г, 4,35ммоль) додають порціями до холодного Приклад 29: (0°С) розчину АІН3 (~0,3М), щойно приготовленого (2S)-N-[1-(циклопропілметил)-2-(4доданням краплями конц. розчин H2SO4 (0,80г, етоксибензил)-1Н-бензімідазол-5-іл]-N,1-диметил8,10ммоль) до 1М LiAIH4 у ТГФ (16мл, 16ммоль), у 2-піролідинкарбоксамід ТГФ (30мл) при 0°С. Реакційну суміш перемішують До перемішаного розчину 1при кімнатній температурі протягом ночі і потім (циклопропілметил)-2-(4-етоксибензил)-N-метилгасять обережним доданням EtOAc (5мл), Н2О 1Н-бензімідазол-5-аміну (80мг, 0,24ммоль) у ДМФ (3мл) і Et2O (100мл) у Na2SO4·5H2O (10г). Реакцій(3мл) додають ДІПЕА (0,2мл) і (2S)-1-метил-2ну суміш перемішують до одержання прозорого піролідинкарбонову кислоту (80мг, 0,62ммоль). розчину і тверду речовину відфільтрують. ФільтРеакційну суміш перемішують при кімнатній темрат сушать над Na2SO4 і концентрують у вакуумі, пературі 5хвил. і додають ГАТУ (280мг, одержуючи бажану сполуку, яку використовують 0,73ммоль). Реакційну суміш перемішують при без подальшого очищення. кімнатній температурі протягом ночі, додають на27В: Nr-[1-(циклопропілметил)-2-(4сичений NaHCO3 (1мл) і Н2О (20мл) і суміш екстраетоксибензил)-1Н-бензімідазол-5-іл]-N,5-диметилгують EtOAc (220мл). Об'єднані екстракти проми3-ізоксазолкарбоксамід вають насиченим NaHCO3 (5мл) і розсолом, До розчину 1-(циклопропілметил)-2-(4сушать над Na2SO4 і концентрують у вакуумі. Одеетоксибензил)-N-метил-1Н-бензімідазол-5-аміну ржаний амід очищують препаративною ВТРХ і (100мг, 0,30ммоль) і Еt3N (200мг, 0,20ммоль) у одержують сіль ТФК (18мг, 13%). MS (ESI) СН2СІ2 (5мл) додають 5-метил-3(M+H)+=447. ізоксазолкарбонілхлорид (0,1мл) при кімнатній Приклад 30: температурі. Реакційну суміш перемішують при N'-трет-бутил-N-[1-(циклопропілметил)-2-(4кімнатній температурі протягом ночі і гасять насиетоксибензил)-1Н-бензімідазол-5-іл]-Nченим NaHCO3 (1мл). Суміш розбавляють Et2O метилмочевина (30мл), промивають насиченим NaHCO3 і розсоТрет-бутилізоціанат (0,1мл) додають до роз 47 76743 48 чину 1-(циклопропілметил)-2-(4-етоксибензил)-N32D: N-[1-(циклопропілметил)-2-(4метил-1Н-бензімідазол-5-аміну (34мг, 0,10ммоль) етоксибензил)-1Н-бензімідазол-5-іл]ацетамід у етиленхлориді (5мл), і реакційну суміш гріють За загальною процедурою 13В, N-{3-аміно-4при 60°С протягом ночі. Сирий продукт очищують [(циклопропілметил)аміно]феніл}ацетамід (5,50г, флеш-хроматографією на силікагелі (EtOAc) і оде25,11ммоль), ДІПЕА (6,50мл, 37,5ммоль), 41 ржують бажану мочевину (26мг, 59%). Н ЯМР етоксифенілоцтову кислоту (5,40г, 30,0ммоль) і ГАТУ (11,40г, 30,0ммоль) у ДМФ (100мл) перемі(CDCI3): Вільна основа 7,61 (d, J=2,0Гц, 1Н), 7,33 шують при кімнатній температурі протягом ночі і (d, J=8,4Гц, 1Н), 7,16 (d, J=8,4Гц, 2Н), 7,10 (dd, одержують бажаний продукт (4,5г, 86%). 1Н ЯМР J=2,0, 8,4Гц, 1Н), 6,83 (d, J=8,4Гц, 2Н), 4,28 (s, 1H), 4,27 (s, 2.H), 4,00 (q, J=7,0Гц, 2H), 3,93 (d, J=6,8Гц, (CD3OD): 7,89 (s, 1H), 7,44-716 (m, 2Н), 7,13 (d, 2Н), 3,26 (s, 3Н), 1,40 (t, J=7,0Гц, 3Н), 1,28-1,20 (m, J=8,4Гц, 2H), 6,83 (d, J=8,4Гц, 2H), 4,25 (s, 2Н), 1H), 1,25 (s, 9H), 0,58-0,53 (m, 2H), 0,31-0,26 (m, 4,03-3,94 (m, 4Н), 2,14 (s, 3Н), 1,34 (t, J=7,0Гц, 3Н), 2H). MS (ESI) (M+H)+=435. Сіль НСІ готують, вико1,06-0,96 (m, 1H), 0,48-0,41 (m, 2H), 0,29-0,22 (m, ристовуючи НСІ у діетилетері. 2H). MS (ESI) (M+H)+=364. Аналіз: обчислено для Аналіз: обчислено для C22H25N3O2·1,5H2Ο: С, 67,67; Η, 7,23;Ν, 10,76. ОдеC26H34N4O2·1,20НСI·1,10С2Н6О: С, 64,03; Н, 7,96; ржано: С, 67,50; Η, 7,12; Ν, 10,65. N, 10,59. Одержано: С, 64,10; Н, 7,53; N, 10,30. 32Ε: N-алiл-N-[1-(циклопроп1лметил)-2-(4Приклад 31: етоксибензил)-1Н-бензімідазол-5-іл]ацетамід N-[1-(циклопропілметил)-2-(4-етоксибензил)Алілбромід (0,3мл) додають до добре перемі1Н-бензімідазол-5-іл]-N'-(2-метоксифенілі-Nшаного двофазного розчину 50%-го КОН (5мл), Νметилтіомочевина [1-(циклопропілметил)-2-(4-етоксибензил)-1Н1-ізотіоціанат-2-метоксибензол (100мг, бензімідазол-5-іл]ацетаміду (545мг, 1,50ммоль) і n0,61ммоль) додають до розчину 1Bu4NBr (64мг, 0,2ммоль) у СН2СІ2 (15мл) при кім(циклопропілметил)-2-(4-етоксибензил)-N-метилнатній температурі під нітрогеном. Реакційну су1Н-бензімідазол-5-аміну (100ммоль, 0,30ммоль) у міш перемішують при кімнатній температурі 2год., ДМФ (5мл). Реакційну суміш гріють при 50°С пророзбавляють Н2О (30мл) і екстрагують СН2СІ2 тягом ночі. Сирий продукт ізолюють після вида(2 50мл). Екстракти об'єднують і промивають налення розчинника і очищують хроматографією на сиченим NaHCO3, розсолом і сушать над Nа2SO4. силікагелі (EtOAc/CH2Cl2 1:1), одержуючи бажаний Видалення розчинника дає жовтуватий залишок 1 продукт (85мг, 57%). НЯМР (CDCI3): вільна осно(530мг), який очищують флеш-хроматографією на ва 8,26 (dd, J=2,0, 8,4Гц, 1Н), 7,74 (d, J=2,0Гц, силікагелі (МеОН/СН2СІ2,1:10) і одержують про1Н), 7,50 (s, 1Н), 7,43 (d, J=8,4Гц, 1Н), 7,20 (dd, дукт (510мг, 84%). 1Н ЯМР (CDCI3): 7,54 (d, J=1,6, 8,4Гц, 1Н), 7,15 (d, J=8,4Гц, 2Н), 7,08-7,02 J=2,0Гц, 1Н), 7,31 (d, J=8,4Гц, 1Н), 7,16 (d, J=8,4Гц, (m, 1H), 6,98-6,92 (m, 1H), 6,83 (d, J=8,4Гц, 2Н), 2Н), 7,02 (dd, J=2,0, 8,4Гц, 1H), 6,84 (d, J=8,4Гц, 6,75 (d, J=8,4Гц, 1Н), 4,29 (s, 2Н), 4,00 (q, J=7,0Гц, 2H) 5,98-5,84 (m, 1H), 5,12-5,04 (m,2H), 4,34 (d, 2Н), 3,96 (d, J=6,8Гц, 2Н), 3,80 (s, 3Н), 3,58 (s, 3Н), J=5,6Гц, 2H), 4,27 (a, 2H), 4,01 (q, J=7,6Гц, 2Н), 1,37 (t, J=7,0Гц, 3Н), 1,10-1,00 (m, 1Н), 0,59-0,52 3,93 (d, J=6,4Гц, 2Н), 1,88 (s,3H), 1,39 (t, J=7,6Гц, (m, 2Н), 0,32-0,25 (m, 2Н). MS (ESI) (M+H)+=501. 3Н), 1,10-1,00 (m, 1H), 0,59-0,52 (m,2H), 0,31-0,26 Приклад 32: (m,2H). MS (ESI) (M+H)+=404. Сіль НСІ готують з N-аліл-N-[1-(циклопропілметил)-2-(4НСІ у діетилетері. Аналіз: обчислено для етоксибензил)-1Н-бензімідазол-5-іл}ацетамід C25Η29Ν3Ο2·ΗCI·1,5Η2O: С, 64,24; Η, 7,07; Ν, 8,99. 32А:N-(4-флуор-3-нітрофеніл)ацетамід Одержано: С, 63,96; Η, 6,80; N,8,84. 4-флуор-3-нітроанілін (45,0г) додають порціяПриклад 33: ми до оцтового ангідриду (150мл) при кімнатній N-аліл-1-(циклопропілметил)-2-(4температурі. Реакційну суміш перемішують при етоксибензил)-1Н-бензімідазол-5-амін кімнатній температурі 2год. Бажаний продукт осаДо розчину N-аліл-1-(циклопропілметил)-2-(4джують, збирають і сушать у вакуумі (42,0г, 70%). етоксибензил)-1Н-бензімідазол-5-іл]ацетаміду 32В: N-{4-[(циклопропілметил)аміно]-3(510мг) у ЕtOН (20мл) додають 20%-й КОН (20мл). нітрофеніл}ацетамід Реакційну суміш гріють під зворотним холодильниЗа загальною процедурою 2В до розчину N-(4ком протягом ночі і потім охолоджують до кімнатфлуор-3-нпрофеніл)ацетаміду (15,4г, 77,7ммоль) у ної температури. Суміш концентрують у вакуумі до 80%-му водному етанолі (150мл) додають циклопприблизно 20мл і екстрагують СН2СІ2 (2 100мл). ропанметиламін (10мл) при кімнатній температурі. Об'єднані екстракти промивають розсолом, сушать Реакційну суміш гріють під зворотним холодильнинад Na2SO4 і концентрують у вакуумі. Залишок ком протягом ночі і після охолодження до кімнаточищують хроматографією на силікагелі ної температури додають Н2О (300мл) і бажаний (СН2СІ2:МеOН 25:1) і одержують блідожовте масло продукт осаджують у вигляді оранжевої твердої (400мг, 87%). 1 речовини (18г, 92%). Н ЯМР (CD3OD): 8,03 (br., 1Н), 7,64 (br., 1Н), 32С: N-{3-аміно-47,54 (br., 1Н), 7,28 (d, J=8,4Гц, 2Н), 6,96 (d, [(циклопропілметил)аміно]феніл}ацетамід J=8,4Гц, 2Н), 6,03-5,92 (m, 1H), 5,43 (d, J=24,8Гц, За загальною процедурою 2С N-{41Н), 5,40 (d, J=18,8Гц, 1Н), 4,59 (s, 2H), 4,41 (d, [(циклопропілметил)аміно]-3-нітрофеніл}ацетамід J=7,6Гц, 2Н), 4,04 (d, J=6,4Гц, 2Н), 4,03 (q, J=6,4Гц, (7,0г, 28ммоль) гідрогенують у етилацетаті (300мл) 2Н), 1,36 (t, J=6,4Гц, 3Н), 1,30-1,18 (m, 1H), 0,66з 10% Pd/C (0,8г) при 25фунт/кв. дюйм Н2 (2,1ат) у 0,58 (m, 2H), 0,50-0,42 (m, 2H). MS (ESI) шейкері Парра. Після обробки бажаний продукт (M+H)+=362. Сіль НСІ готують з НСІ у діетилетері. ізолюють (5,5г, 89%) Аналіз: обчислено для C23H27N3O·2НСІ·1,25Н2О: С, 49 76743 50 60,46; Н, 6,89; N, 9,19. Одержано: С, 60,53; Н, 6,64; подальшого очищення. N, 8,89. 35С: Метил 5-аміно-6Приклад 34: [(циклопропілметил)аміно]нікотинат 1-[1-(циклопропілметил)-2-(4-етоксибензил)За загальною процедурою 2С метил 61Н-бензімідазол-5-іл]-2-піролідинон [(циклопропілметил)аміно]-5-нітронікотинат (1,5г) 34А: 1-[1-(циклопропілметил)-2-(4гідрогенують у етилацетаті (50мл) з 10% Pd/C етоксибензил)-1Н-бензімідазол-5-амін (100мг) при 20фунт/кв. дюйм (1,4ат) Н2 у шейкері Розчин N-[1-(циклопропілметил)-2-(4Парра протягом 2год. Реакційну суміш фільтрують етоксибензил)-1Н-бензімідазол-5-іл-ацетаміду через діатомову землю і розчинник видаляють, (727мг, 2ммоль) у 1:1 20% КОН:ЕtOН (20мл) переодержуючи діамін (1,12г), який використовують без мішують під зворотним холодильником протягом подальшого очищення. ночі. Після охолодження суміш підкислюють 1N 35D: Метил-3-(циклопропілметил)-2-(4НС1 до рН ~ 6,0 і осад збирають фільтруванням, етоксибензил)-3Н-імідазо[4,5-b]піридин-6одержуючи бажаний продукт у вигляді блідожовтої карбоксилат твердої речовини (611мг 95%). За загальною процедурою 13В змішують меMS(ESI)(M+H)*=322. тил 5-аміно-6-[(циклопропілметил)-аміно]нікотинат 34В: 1-[1-(циклопропілметил)-2-(4(950мг, 4,3ммоль), ДІПЕА (1,1мл), 4етоксибензил)-1Н-бензімідазол-5-іл]-2-піролідинон етоксифенілоцтову кислоту (850мг, 4,72ммоль) і До 1-[1-(циклопропілметил)-2-(4ГАТУ (1,80, 4,74ммоль) у ДМФ (15мл). Сирий проетоксибензил)-1Н-бензімідазол-5-аміну (72мг, дукт очищують флеш-хроматографією на силіка0,22ммоль) і ДІПЕА (150мкл) у СН2СІ2 (3мл) додагелі (EtOAc) і одержують бажаний продукт (530мг, ють 4-бромбутирилхлорид (40мл, 0,35ммоль). Ре34%). 1 акцію перемішують при кімнатній температурі Н ЯМР (CDCI3): 9,00 (d, J=2,0Гц, 1H), 8,61 3год. і додають 50%-й КОН (3мл) і n-Bu4NBr (5мг). (d, J=2,0Гц, 1H), 7,17 (d, J=8,0Гц, 2Н), 6,84 (d, Реакцію енергійно перемішують 4год., розбавляJ=8,0Гц, 2H), 4,33 (s, 2Н), 4,06 (d, J=7,2Гц, 2H), ють Н2О (10мл) і екстрагують СН2СІ2 (2 20мл). 4,00 (q, J=7,0Гц, 2H), 3,97 (s, 3Н), 1,39 (t, J=7,0Гц, Об'єднані екстракти промивають Н2О, розсолом, 3Н), 1,16-1,06 (m, 1H), 0,52-0,45 (m, 2H), 0,44-0,38 сушать над Na2SO4 і концентрують у вакуумі, оде(m, 2H). ржуючи сирий лактам, який очищують препарати35Е: 3-(циклопропілметил)-2-(4-етоксибензил)вною рідинною хроматографією і потім препарати3Н-імідазо[4,5-b]піридин-6-карбонова кислота. вною ВТРХ і одержують бажаний продукт як сіль До розчину метил 3-(циклопропілметил)-2-(4етоксибензил)-3Н-імідазо[4,5-b]піридин-6ТФК (11мг, 10%). 1Н ЯМР (СD3ОD): 8,14 (d, карбоксилату (260мг, 0,71ммоль) у ТГФ/МеОН (1:1, J=2,0Гц, 1Н), 7,91 (d, J=9,2Гц, 1Н), 7,80 (dd, J=2,0, 6мл) додають 1N NaOH (3мл, 3ммоль). Реакційну 9,2Гц, 1Н), 7,26 (d, J=9,2Гц, 2Н), 6,95 (d, J=9,2Гц, суміш перемішують при кімнатній температурі 2Н), 4,56 (s, 2Н), 4,37 (d, J=6,4Гц, 2Н), 4,03 (t, 3год. і концентрують у вакуумі. Залишок розчиняJ=7,6Гц, 2Н), 4,01 (q, J=6,8Гц, 2Н), 2,63 (t, J=8,4Гц, ють у воді (10мл) і підкислюють доданням 1N роз2Н), 2,20 (tt, J=7,6, 8,4Гц, 2Н), 1,36 (t, J=6,8Гц, 3Н), чину НСІ до рН=5. Тверду речовину збирають 1,28-1,18 (m, 1H), 0,64-0,57 (m, 2H), 0,49-0,42 (m, 2H). MS (ESI) (M+H)+=390. Аналіз: обчислено для (230мг) і фільтрат екстрагують EtOAc (2 50мл). С23Н27N3О·2ТФК·0,1Н2О: С, 61,80; Н, 5,63; N, 8,32. Екстракти сушать над Na2SO4 і концентрують у Одержано: С, 61,75; Н, 5,30; N, 7,99. вакуумі, одержуючи додаткову порцію продукта Приклад 35: (20мг). 1 3-(циклопропілметил)-2-(4-етоксибензил)-N,NН ЯМР (CD3OD): 8,93 (d, J=1,6Гц, 1H), 8,50 діетил-3Н-імідазо[4,5-b]піридин-6-карбоксамід (d, J=1,6Гц, 1H), 7,15 (d, J=9,2Гц, 2Н), 6,82 (d, 35А: 6-[(циклопропілетил)аміно]-5J=9,2Гц, 2Н), 4,33 (s, 2H), 4,11 (d, J=6,4Гц, 2Н), нітронікотинова кислота 3,95 (q, J=7,2Гц, 2Н), 1,31 (t, J=7,2Гц, 3Н), 1,16-1,03 Циклопропанметиламін (1,70г, 23,90ммоль) (m, 1H), 0-43-0,32 (m, 4H). додають до розчину 6-хлор-5-нітронікотинової ки35F: 3-(циклопропілметил)-2-(4-етоксибензил)слоти (1,12г, 5,53ммоль) у МеОН (25мл) при кімнаN,N-діетил-3Н-імідазо[4,5-b]-піридин-6-карбоксамід тній температурі. Реакційну суміш перемішують До перемішаного розчину 3при кімнатній температурі 2год. і концентрують у (циклопропілметил)-2-(4-етоксибензил)-3Нвакуумі. Залишок розчиняють у Н2О (20мл) і розімідазо[4,5-b]піридин-6-карбонової кислоти (150мг, чин підкислюють доданням 3N НСІ до рН=3. Суміш 0,43ммоль) у ДМФ (5мл) додають ДІПЕА (0,12мл, екстрагують EtOAc і СН2СІ2 (2 100мл) і об'єднані 0,69ммоль) і діетиламін (60мкл, 0,58ммоль). Реакекстракти промивають розсолом, сушать над ційну суміш перемішують при кімнатній темпераNa2SO4, концентрують у вакуумі і одержують жовту турі 5хвил. і додають ГАТУ (200мг, 0,53ммоль). тверду речовину (1,30г), яку використовують без Реакційну суміш перемішують при кімнатній темподальшого очищення. пературі протягом ночі і потім вливають у льодяну 35В: Метил 6-((циклопропілметил)аміно]-5воду (20мл) з перемішуванням. Суміш екстрагують нітронікотинат ЕtOАс (100мл) і екстракт промивають водою 6-[(циклопропілметил)аміно]-5-нітронікотинову (20мл), сушать над Na2SO4, і концентрують у вакукислоту (1,30г) розчиняють у МеОН/толуолі (1:1, умі. Залишок очищують флеш-хроматографією на 60мл) і краплями додають TMSCHN2. Реакційну силікагелі (EtOAc/МеОН, 20:1) і одержують бажасуміш перемішують при кімнатній температурі проний амід (115мг, 64%), який перетворюють у відтягом ночі і концентрують у вакуумі, одержуючи повідну сіль НСІ у діетилетері з метанолом як сирий метил-естер (1,5г), який використовують без співрозчинником. 1Н ЯМР (СD3OD): 8,46 (d, 51 76743 52 J=2,0Гц, 1Н), 8,04 (d, J=2,0Гц, 1Н), 7,21 (d, (0,4ммоль) і піридин (0,5мл) у СН2СІ2 (4мл). Суміш J=S,4Гц, 2Н), 6,88 (d, J=8,4Гц, 2Н), 4,46 (s, 2Н), перемішують при кімнатній температурі протягом 4,24 (d, J=7,2Гц, 2Н), 3,98 (q, J=7,0Гц, 2Н), 3,57 (br, ночі і ізолюють бажаний продукт як сіль НСІ після 2H), 3,32 (br, 2H), 1,33 (t, J=7,0Гц, 3Н), 1,32-1,10 колонної хроматографії і обробки 1М розчином (m, 7Н), 0,56-0,44 (m, 4H). MS (ESI) (M+H)+=423. НСІ у діетилетері (59мг, 75%). 1Н ЯМР (400ΜГц, Аналіз: обчислено для C24H30N4O2·HCI·0,20CH3OH: CD3OD): 8,02 (s, 1Η), 7,71 (d, J=8,6Гц, 1H), 7,64 С, 64,68; Η, 7,07; Ν, 12,48. Одержано: С, 65,07; Η, (d, J=8,6Гц, 1H), 7,13 (d, J=8,8Гц, 2Н), 6,83 (d, 7,13; N,12,13. J=8,8Гц, 2H), 4,80 (s, 3Н), 4,31 (s, 2Н), 4,10 (d, Приклад 36: J=7,2Гц, 2H), 3,95 (q, J=8,0Гц, 2Н), 3,04 -2,96 (m, N-циклопентил-1-(циклопропілметил)-2-(44H), 2,50-2,44 (m, 4H), 1,32 (t, J=8,0Гц, 3Н), 1,08етоксибензил)-1Н-бензімідазол-5-сульфонамід 0,98 (m, 1H), 0,47-0,43 (m, 2Н), 0,31-0,26 (m, 2H). 36А: 1-(циклопропілметил)-2-(4-етоксибензил)MS (ES1) (M+H)+: 469. Аналіз: обчислено для 1Н-бензімідазол-5-сульфонілхлорид С25Н32N4О3S·2,7НСІ·0,4Н2О:С, 52,29; Н, 6,23; N, До суміші конц. НСІ (0,6мл) і НОАс (0,18мл) 9,76. Одержано: С, 52,54; Н, 6,21; N, 8,67. додають 1-(циклопропілметил)-2-(4-етоксибензил)Приклад 38: 1Н-бензімідазол-5-амін (193мг, 0,6ммоль). Суміш 1-(циклопропілметил)-2-(4-етоксибензил)-Nперемішують і охолоджують до -10°С, повільно етил-1Н-бензімідазол-5-сульфонамід додають розчин NaNO2 (44,8мг, 0,65ммоль) у воді За загальною процедурою 36В використову(0,065мл) і суміш перемішують між -10 °С і -5°С ють 1-(циклопропілметил)-2-(4-етоксибензил)-1Нпротягом 45хвил. У окремій колбі бульбашками бензімідазол-5-сульфонілхлорид (з 0,2ммоль аніпротягом 30хвил. вводять SO2 у оцтову кислоту лінового пропрепарату), етиламін (2М розчин у (0,6мл). Додають СuСІ (15мг) і бульбашками ввоТГФ, 0,4ммоль) і піридин (0,5мл) у СН2СІ2 (4мл). дять ще SO2, доки жовто-зелена суспензія не стаСуміш перемішують при кімнатній температурі не блакитно-жовтою. Суміш, що містить мідь, охопротягом ночі і ізолюють бажаний продукт як сіль лоджують до 10°С і краплями з перемішуванням НСІ після колонної хроматографії і обробки 1М додають діазотизаційну суміш. Після додання всієї розчином НСІ у діетилетері (61мг, 87%). 1Н ЯМР солі діазонію суміш вливають у льодяну воду (400ΜГц, CD3OD): 8,28 (s, 1H), 7,78 (d, J=8,0Гц, (1:1,4мл) і екстрагують ДХМ (3 15мл), промивають 1Н), 7,42 (d, J=8,0Гц, 1Н), 7,15 (d, J=8,5Гц, 2H), водою (2 10мл), сушать над MgSO4 і концентру6,83 (d, J=8,8Гц, 2Н), 4,32 (s, 2H), 4,02-3,93 (m, 4H), ють, одержуючи жовте масло (190мг, 78%), яке 3,06-2,98 (m, 2H), 1,38 (t, J=7,6Гц, 3Н), 1,10 (t, використовують без подальшого очищення. MS J=8,0Гц, 3Н), 1,07-1,00 (m, 1H), 0,55-0,52 (m, 2H), (ESI) (М+Н)+=405. 6,30-0,24 (m, 2H). MS (ESI) (M+H)+=414. Аналіз: 36В: N-циклопентил-1-(циклопропілметил)-2обчислено для C24H27N3O3S·1,1НСІ: С, 58,25; Н, (4-етоксибензил)-1Н-бензімідазол-5-сульфонамід 6,24; N, 9,26. Одержано: С, 58,19; Н, 6,73; N, 8,62. До сирого розчину 1-(циклопропілметил)-2-(4Приклад 39: етоксибензил)-1Н'-бензімідазол-52-(4-етоксианіліно)-N,N-діетил-1-ізопентил-1Нсульфонілхлориду (з 0,2ммоль анілінового пробензімідазол-5-карбоксамід препарату) у ДХМ (4мл) додають . циклопентилаРозчин метил 4-етоксифенілдитіокарбамату мін (0,4ммоль) і потім піридин (0,5мл). Суміш пе(0,0274г, 0,121ммоль) у ДМФ (0,2мл) додають до ремішують при кімнатній температурі протягом суміші 3-аміно-N,N-діетил-4ночі. Додають воду (10мл) і суміш екстрагують (ізопентиламіно)бензаміду (0,0334г, 0,120ммоль) і оксиду червоної ртуті (II) (0,0261г, 0,121ммоль) у СН2СІ2 (2 10мл), сушать над MgSO4 і концентруДМФ (0,2мл). Суспензію енергійно перемішують ють. Залишок очищують хроматографією на колопротягом 5,5год. і додають ще порцію оксиду чернці силікагелю і одержують чистий продукт, який воної ртуті (II) (0,0130г, 0,0600ммоль). Після переобробляють 1Μ розчином НСІ у діетилетері і одемішування протягом 16год. реакцію розбавляють ржують сіль НСІ (62мг, 81%). 1Н ЯМР (400ΜГц, 9:1 СН2СІ2/МеOН, вносять у невелику пробку силіCD3OD): 8,29 (s, 1H), 7,78 (d, J=8,0Гц, 1H), 7,42 кагелю і елююють тим же розчинником. Елюант (d, J=8,0Гц, 1Н), 7,16 (d, J=8,4Гц, 2Н), 6,84 (d, концентрують і залишок очищують зворотноJ=8,4Гц, 2Н), 4,32 (s, 2H), 4,02-3,94 (m, 4H), 3,62фазовою ВТРХ (градієнт: 20-70% CH3CN у Н2О), 3,58 (m, 1H), 1,80-1,74 (m, 2H), 1,64-1,56 (m, 2H), одержуючи бажану сполуку (0,0287г, 45%) як сіль 1,50-1,42 (m, 2H), 1,39 (t, J=8,2Гц, 3Н), 1,42-1,34 ТФК. Цей матеріал ліофілізують з Н2O/діоксан і (m, 2H), 1,08-1,00 (m, 1H), 0,58-0,54 (m, 2H), 0,30одержують білу тверду речовину. 1Н ЯМР 0,25 (m, 2H). MS (ESI) (M+H)+=454. Аналіз: обчис(CD3OD): 7,60 (d, ,7=8,4Гц, 1Н), 7,44-7,38 (2 наділено для С25Н31N3O3SO·3НСІ: С, 64,64; Н, 6,79; N, арріпд d, 3Н), 7,35 (s, - 1Н), 7,11 (d, J=9,2Гц, 2H), 9,05. Одержано: С, 64,45; Н, 6,97; N, 8,66. 4,32 (br t, J=7,2Гц, 2Н), 4,12 (q, J=7,6Гц, 2H), Приклад 37: 3,56(br s, 2H), 3,32 (br s, 2H), 1,85-1,76 (br m, 3H), 1-(циклопропілметил])-2-(4-етоксибензил)-51,43 (t, 7=7,6Гц, 3Н), 1,25 (br s, 3H), 1,14 (br s, 3H), [(4-метил-1-піперазиніл)сульфоніл]-1Н1,08 (d, J=6,4Гц, 6H). 13C ЯМР (CD3OD): 172,51, бензімідазол За загальною процедурою 36В використову160,57, 151,15, 134,20, 132,87, 130,29, 128,70, ють 1-(циклопропілметил)-2-(4-етоксибензил)-1Н128,44, 123,46, 117,18, 111,54, 111,23, 65,02, 45,07, бензімідазол-5-сульфонілхлорид (з 0,2ммоль ані43,16, 41,13, 37,49, 27,26, 22,76, 15,07, 14,35, лінового пропрепарату), 1-метилпіперазин 13,07. Аналіз: обчислено для MS (ESI) (M+H)+=423. 53 76743 54 EtOAc/гексани і одержують бажану сполуку (4,35г, Таблиця 2 86%). 1Н ЯМР (400ΜГц, CD3OD) 8,12 (d, J=8,8Гц, 1Н), 6,92 (s, 1H), 6,56 (d, J=8,8Гц, 1Н), 3,51 (q, Біологічні дані для Прикладів 40-62 J=7,2Гц, 2H),3,28 (m, 2H), 1,23 (t, J=72Гц, 3H), 1,13 (t, J=7,2Гц, 3Н). hCB2 IC50 hCB2 EC50 40C: N-[5-[(діетиламіно)карбоніл]-2Експеримент Emax (%) (нM) (нM) нітрофеніл]-4-етоксибензолацетамід До перемішаного розчину (100мл) 3-аміно-N,N40 2,8 1,2 74 діетил-4-нітробензаміду у толуолі (1,00г, 41 100 21 52 4,21ммоль) додають 4-етоксифенілацетилхлорид 42 23 5 76 (1,25г, 1,5екв.) і цинковий порошок (415мг, 1,5екв.). 43 26 2,8 100 Розчин перемішують при кімнатній температурі 44 18 1,7 106 протягом ночі. Додають ще 0,5екв. кислотного 45 448 123 101 хлориду і цинковий порошок і розчин перемішують 46 100 69 70 при кімнатній температурі 24год. Розчин фільтру47 3,3 1,4 70 ють через броунмілерит і промивають EtOAc. Ор48 27 9 33 ганічну фазу промивають насиченим розчином 49 32 6,8 67 NaHCO3 і розсолом і сушать над безводним 50 832 MgSO4. Сирий продукт очищують флеш52 22 7,8 41 хроматографією, використовуючи 1:1/гекс:EtOAc 53 36 6,7 46 на силікагелі і одержують бажаний продукт (1,52г, 54 15,5 3,4 66 90%). 1Н ЯМР (400Μ Гц, CDC3) 8,81 (s, 1H), 8,20 (d, J=8,8Гц, 1Н), 7,26 (m, 3Н), 7,15 (d, J=8,8Гц, 1Н), 55 715 6,94 (d, J=8,4Гц, 2Н), 4,06(q, J=7,2Гц, 2Н), 3,75 (s, 56 5,4 1,5 88 2H), 3,54 (q, J=6,8Гц, 2Н), 3,24 (q, J=6,8Гц, 2Н), 57 9,5 2,8 72 1,59 (brs, 1H), 1,42 (t, J=6,8Гц, 3Н), 1,25 (t, J=6,8Гц, 59 328 64 67 3Н), 1,16 (t, J=6,8Гц, 3Н). 60 970 40D: N-[2-аміно-5Кі hCB2-Sf9 61 [(діетиламіно)карбоніл]феніл]-4(n=2) 11,4 етоксибензолацетамід Кі hCB2-Sf9 62 N-[5-[(діетиламіно)карбоніл]-2-нітрофеніл]-4(n=2): 4,5 етоксибензолацетамід (1,00г, 2,50ммоль) розчиняють у EtOAc (50мл) з каталітичною кількістю Для експериментів 61 і 62 Кі виміряли з двох 10% Pd/C. Розчин струшують у атмосфері Н2 при сполук у платі. тиску 35фунт/кв. дюйм (2,45ат) при кімнатній температурі протягом ночі. Розчин фільтрують через Приклад 40 броунмілерит і розчинник концентрують. Аналіз 2-[(4-етоксмфеніл)метил]-N,N-діетил-1-(3LC/MS підтверджує чистоту бажаної сполуки тіенілметил)-1Н-бензімідазол-5-карбоксамід (>95%), яку можна використовувати у наступній 40А: N,N-діетил-3-флуор-4-нітробензамід операції. Вихід 927мг (99%); 1Н ЯМР (400ΜГц, 3-флуор-4-нітробензойну кислоту (5,0г, CDCI3) 7,54 (s, 1H), 7,25 (d, J=7,6Гц, 2Н), 7,07 (s, 27,0ммоль) витримують під зворотним холодиль1Н), 7,01 (d, J=8,0Гц, 1Н), 6,91 (d, J=7,2Гц, 2Н), ником у суміші 2:1 CH2Cla/SOCI2 (150мл) протягом 6,66 (d, J=8,4Гц, 1Н), 4,04 (q, J=6,8Гц, 2H), 3,69 (s, ночі. Розчинник концентрують і залишок розчиня2H), 3,39 (brs, 4H), 1,42 (t, J=6,8Гц, 3H),1,15 (brs, ють у СН2СІ2 (50мл). Краплями додають СН2СІ2 6H). розчин (50мл) діетиламіну (3,35мл, 1,2екв.) і трие40Е: 2-[(4-етоксифеніл)метил]-N,N-діетил-1-(3тиламіну (7,5мл, 2екв.) у холодний розчин (0°С) тіенілметил)-1Н-бензімідазол-5-карбоксамід хлоридної кислоти з перемішуванням. Розчин пеN-[2-аміно-5-[(діетиламіно)карбоніл]феніл]-4ремішують при кімнатній температурі 1год., проетоксибензолацетамід (100мг, 0,271ммоль) розчимивають 5%-м розчином KHSO4, насиченим розняють у 3мл 2:1 суміші DCE:AcOH. Додають тіочином NaHCO3, розсолом і сушать над безводним фен-3-карбоксальдегід (37мл, 1,5екв.) і розчин MgSO4. Хирий продукт очищують флешперемішують при кімнатній температурі 15хвил. хроматографією (2:1/гекс:EtOAc на силікагелі) і Додають розчин комплексу боран/піридин (55мл, 1 одержують бажану сполуку (5,10г, 79%); Н ЯМР 2екв.) і розчин перемішують при кімнатній темпе(400ΜГц, CDCI3) 8,12 (m, 1H), 7,29 (m, 2H), 3,56 ратурі 1год. Додають 5 крапель конц. НСІ і розчин (br d, 2H), 3,23 (brd, 2H), 1,27 (brs, 3Н), 1,15 (brs, перемішують при 85°С 3год. Розчин охолоджують 3Н). до кімнатної температури і розчинник концентру40В: 3-аміно-N,N-діетил-4-нітробензамід ють. Сирий продукт очищують зворотно-фазовою N,N-діетил-3-флуор-4-нітробензамід (5,1г, хроматографією (колонка CM 8) з градієнтом 1521,2ммоль) витримують під зворотним холодиль65% CH3N/H2O і ліофі-лізують. Бажаний продукт ником у суміші (1:2) NH4OH/EtOH (150мл) протягом ізолюють як сіль ТФК (118мг, 78%). 1Н ЯМР 48год. Розчин охолоджують до кімнатної темпера(400ΜГц, CD3OD) 7,78 (d, J=8,4Гц, 1Н), 7,70 (s, тури і розчинник концентрують. Розчин екстрагу1H), 7,48 (d, J=8,4Гц 1Н), 7,38 (m, 1H), 7,23 (s, 1H), ють (тричі) EtOAc. Об'єднані органічні фази про7,18 (d, J=7,2Гц, 2Н), 6,84 (m, 3Н), 5,69 (s, 2H), 4,53 мивають розсолом і сушать над безводним (s, 2H), 3,97 (q, J=7,2Гц, 2Н), 3,54 (br s, 2H), 3,27 MgSO4. Сирий продукт кристалізують з (brs, 2H), 1,34 (t, J=7,2Гц, 3Н), 1,23 (brs, 3Н), 1,10 55 76743 56 (br s, 3Н); MS (ESI) (M+H)+=448,32; Аналіз: обчис4,21 (m, 1H), 4,02 (q, J=7,2Гц, 2Н), 3,89 (m, 1H), лено для C26H29N3O2S+1,7ТФК+0,1H2O: С, 54,90; 3,73 (m, 1H), 3,57 (br d, 2H), 3,27 (br s, 2H), 2,18 (m, Η, 4,84; Ν, 6,53. Одержано: С, 54,88; Η, 4,86; Ν, 1H), 1,97 (m, 2H), 1,76 (m, 1H), 1,36 (t, J=7,2Гц, 3Н), 6,53. 1,26 (brs, 3Н), 1,11 (brs, 3H);MS (ESI) Приклад 41: (M+H)+=436,43; Аналіз: обчислено для 2-[(4-етоксифеніл)метил]-N,N-діетил-1-[(2R)-2C26H33N3O3+2,5ТФК+0,4H2O: С, 52,64; Η, 5,23; Ν, піролідинілметил]-1Н-бензімідазол-5-карбоксамід 6,06. Одержано: С, 52,59; Η, 5,08; Ν, 6,33. За процедурою 40Е використовують N-[2Приклад 43: аміно-5-[(діетиламіно)карбоніл]феніл]-4-етокси2-[(4-етоксифеніл)метил]-N,N-діетил-1-[[(2R)-1бензолацетамід (100мг, 0,270ммоль) і N-(третметил-2-піролідиніл]метил]-1Н-бензімідазол-5бутоксикарбоніл)-D-пролінал (76мл, 1,5екв.). Сикарбоксамід рий продукт очищують зворотно-фазовою хромаЗ'єднують N-[2-аміно-5тографією (колонка CM 18) з градієнтом 5-50% [(діетиламіно)карбоніл]феніл]-4CH3N/H2O і ліофілізують. Бажаний продукт ізолюетоксибензолацетамід (85мг, 0,230ммоль) і Nють як сіль ТФК (86мг, 78%). 1Н ЯМР (400МГц, (трет-бутоксикарбоніл)-D-пролінал (0,06мл, 1,5екв.) циклізують згідно з процедурою Прикладу CD3OD) 7,94 (d, J=8,8Гц, 1H), 7,70 (s, 1H), 7,55 (d, 40Е. Розчинник концентрують, залишок розчиняJ=8,4Гц, 1Н), 7,28 (d, J=8,8Гц, 2H), 6,94 (d, J=8,8Гц, ють у МеОН і додають 37%-ий водний формальде2H), 4,83 (d, J=7,2Гц, 2H), 4,55 (s, 2H), 4,02 (q, гід (кілька крапель, з надлишком) і потім ціаноборJ=7,2Гц, 2Н), 3,96 (m, 1H), 3,56 (br s, 2H), 3,48 (no, гідрид натрію (43мг, 3екв.). Розчин перемішують 1H), 3,27 (m, 3H), 2,24 (m, 1H), 2,14 (m, 1H), 2,04 при кімнатній температурі 1год. Сирий продукт (m, 1H), 1,87 (m, 1Н), 1,36 (t, J=7,2Гц, 3Н), 1,26 (br очищують зворотно-фазовою хроматографією s, 3Н), 1,11 (br s, 3H); MS (ESI) (M+H)+=435,45; (колонка С-18) з градієнтом 15-65% CH3CN/H2O і Аналіз: обчислено для ліофілізують, одержуючи бажану сполуку (46мг, C26H34N4O2+2,2ТФК+1,6H2O: С, 51,12; Η, 5,56; Ν, 7,84. Одержано: С, 51,12; Η, 5,62; Ν, 7,82. 36%) як сіль ТФК. 1Н ЯМР (400ΜГц, CD3OD) 7,80 Приклад 42: (d, J=8,8Гц, 1Н), 7,69 (s, 1H), 7,48 (d, J=8,4Гц, 1Н), 2-[(4-етоксифеніл)метил]-N,N-діетил-1-[[(2S)7,22 (d, J=8,8Гц, 2H), 6,92 (d, J=8,4Гц, 2H), 4,85 (m, тетрагідро-2-фураніл]метил]-1Н-бензімідазол-51Н), 4,66 (m, 1Н), 4,49 (s, 2Н), 4,01 (q, J=7,2Гц, 2H), карбоксамід 3,78 (br s, 2H), 3,56 (br s, 2H), 3,27 (br s, 3H), 2,95 Суміш N,N-діетил-4-флуор-3-нітробензаміду (s, 3H), 2,02 (m, 3H), 1,85 (m, 1H), 1,35 (t, J=7,2Гц, (120мг, 0,500ммоль), триетиламіну (0,105мл, 3H), 1,25 (brs, 3H), 1,11 (brs, 3H); MS (ESI) 1,5екв.) і S-(+)-тетрагідрофуриламіну (55мг, (M+H)+=449,45; Аналіз: обчислено для 1,1екв.) перемішують у 3мл ЕtOН при 85°С протяC27H36N4O2+2,4ТФК+1,1H2O: С, 51,47; Η, 5,51; Ν, гом 3год. Розчин охолоджують кімнатної темпера7,55. Одержано: С, 51,46; Η, 5,43; Ν, 7,67. тури і розчинник концентрують. Залишок розчиняПриклади 44 і 45: ють у EtOAc і промивають насиченим розчином 2-[(4-етоксифеніл)метил]-N,N-діетил-1-[[(1R)-1NaHСО3, розсолом і сушать над безводним метил-2-піперидиніл]метил]-1Η-бензімідазол-5MgSO4. Продукт приєднання очищують флешкарбоксамід і 2-[(4-етоксифеніл)метил]-N,N-діетилхроматографією з 3:1/гекс:EtOAc на силікагелі. 1-[[(2S)-1-метил-2-піперидиніл]метил]-1Нбензімідазол-5-карбоксамід Вихід 147мг (92%). 1Н ЯМР (400ΜГц, CDCI3) 8,35 За процедурою Прикладу 40Е використовують (s, 1H), 8,25 (s, 1H), 7,53 (d, J=8,8Гц, 1Н), 6,89 (d, N-[2-аміно-5-[(діетиламіно)карбоніл]-феніл]-4J=8,8Гц, 1Н), 4,17 (m, 1H), 3,92 (m, 1H), 3,82 (m, етокси-бензолацетамід (70мг, 0,189ммоль) і 2-N1H), 2,08 (m, 5H), 2,05 (m, 1H), 1,93(m,2H), 1,69 (трет-бутоксикарбоніл)-1(m,2H), 1,19 (t, J=6,8Гц, 3Н). піперидинкарбоксальдегід (52мг, 1,5екв.). Сирий Цю нітросполуку (125мг, 0,389ммоль) розчипродукт розчиняють у МеОН (3мл) з кількома краняють у 20мл EtOAc з каталітичною кількістю 10% плями льодяної оцтової кислоти. Додають з надPd/C. .Розчин струшують у атмосфері гідрогену під лишком 37% НСНО/Н2О і потім NaCNBH3 (24мг, тиском 40фунт/кв. дюйм (2,8ат) при кімнатній тем2екв.). Розчин перемішують при кімнатній темпепературі протягом 6год. Розчин фільтрують через ратурі 30хвил., розчинник концентрують і сирий броунмілерит і розчинник концентрують, одержуюпродукт очищують зворотно-фазовою хроматогчи бажаний анілін (113мг, 99%); MS (ESI) рафією (колонка С-18) з градієнтом 5-50% (M+H)+=292,31. CH3CN/H2O і ліофілізують, одержуючи бажаний Цей анілін (113мг, 0,388ммоль) разом з 4продукт як суміш двох енантіомерів. Продукт ізоетоксифенілацетилхлоридом (85мг, 1,1екв.) перелюють як сіль ТФК (53мг, 50%). Два енантіомери мішують у 2мл дихлоретану при кімнатній темперозділяють хіральною хроматографією з хіральратурі протягом 30хвил. Додають 5 краплин конц. ною колонкою AD з ізократним елюентом 30% НСІ і розчин перемішують при 85°С 3год. Розчин iPrOH/гексани, що містить 0,1% діетиламіну, і одеохолоджують до кімнатної температури і розчинржують два енантіомери 2-[(4-етоксифеніл)метил]ник концентрують. Сирий продукт очищують звоN,N-діетил-1-[[(2R)-1-метил-2-піперидиніл]метил]ротно-фазовою хроматографією (колонка С-18) з 1Н-бензімідазол-5-карбоксамід (20мг, 50%) і 2-[(4градієнтом 15-65% CH3CN/H2O і ліофілізують, етоксифеніл)метил]-N,N-діетил-1-[[(2S)-1-метил-2одержуючи бажаний продукт, який ізолюють як піперидиніл]-метил]-1Н-бензімідазол-5сіль ТФК (48мг, 69%); 1Н ЯМР (400ΜГц, CD3OD) карбоксамід (20мг, 50%). 7,99 (d, J=8,4Гц, 1Н), 7,68 (S, 1H), 7,58 (d, J=8,8Гц, Енантіомер: 2-[(4-етоксифеніл)метил]-N,N1Н), 7,28 (d, J=8,8Гц, 2Н), 6,97 (d, J=8,4Гц, 2Н), діетил-1-[[(2R)-1-метил-2-піперидиніл]метил]-1Н4,70 (d, J=14,8Гц, 1H), 4,60 (s, 2H), 4,51 (m, 1H), 57 76743 58 бензімідазол-5-карбоксамід: 1H ЯМР (400ΜГц, 47В: 1,1-ілетиловий естер (3-аміно-4нітрофеніл)метилкарбамової кислоти CD3OD) 7,71 (br s, 1H), 7,68 (s, 1H), 7,43 (d, До холодного розчину (0°С) t-BuOK (9,0г, J=8,4Гц, 1H), 7,21 (d, J=8,6Гц, 2H), 6,92 (d, J=8,6Гц, 4,5екв.) і СuСІ (176мг, 0,1екв.) у ДМФ (50мл) під N2 2H), 4,85 (s, 2H), 4,42 (s, 2H), 3,97 (q, J=7,2Гц, 2H), додають розчин 1,1-ілетилового естеру метил (43,55 (br s, 2H), 3,27 (m, 5H), 3,03 (s, 3H), 2,98 (br s, нітрофеніл)карбамової кислоти (4,49г, 17,8ммоль) і 1H), 1,85 (br s, 1H), 1,74 (m, 3H), 1,50 (br s, 1H), метоксиламінгідрохлориду (1,85г, 1,25екв.) у ДМФ 1,34 (t, J=7,2Гц, 3H), 1,25 (brs, 3H), 1,11 (brs,3H). (100мл). Розчин протягом 1год. доводять до кімнаMS (ESI) (M+H)+=463,51; Аналіз: C28H38N4O2 тної температури, гасять насиченим NH4CI і роз2,1ТФК+0,6H2O: C, 54,25; H, 5,84; N, 7,86. Одержачинник концентрують. Залишок розбавляють воно: С, 54,24; Η, 5,69; Ν, 8,17; ΒΤΡΦ k': 1,99 (колондою і екстрагують EtOAc. Органічну фазу ка: Chiral AD, градієнт 30% В 25хвил., потік промивають розсолом і сушать над безводним 1мл/хвил., 25°С; Розчинник А: 0,1% DEA у гексаMgSO4. Сирий продукт очищують флешнах, розчинник В: 0,1% DBA у іРrOН). хроматографією, використовуючи 2:1/гекс:EtOAc Енантіомер: 2-[(4-етоксифеніл)метил]-N,Nна силікагелі і одержують бажаний продукт (1,1діетил-1-[[(2S)-1-метил-2-піперидиніл]метил]-1Нілетиловий естер (3-аміно-4бензімідазол-5-карбоксамід: 1Н ЯМР, MS і елеменнітрофеніл)метил)карбамової кислоти, 1,10г, вихід тний аналіз, ідентичний до енантіомера; ВТРХ k': 4,97 (колонка: Chiral AD, градієнт 30% В 25хвил., 24%). 1Н ЯМР (400ΜГц, CDCI3) 8,06 (d, J=9,2Гц, потік 1мл/хвил., 25°С; Розчинник А: 0,1% DEA у 1Н), 6,78 (s, 1H), 6,67 (d, J=9,2Гц 1Н), 6,10 (br s, гексанах, розчинник В: 0,1% DBA у іРrОН). 2H), 3,28 (S, 3H), 1,50 (s, 9H). Приклад 46: 47C: 1,1-диметилетиловий естер [3-[[(42-[(4-етоксифеніл)гідроксиметил]-N,N-діетил-1етоксифеніл)ацетил]аміно]-4-нітрофеніл](3-метилбутил)-1Н-бензімідазол-5-карбоксамід метилкарбамової кислоти 2-[(4-етоксибензоїл)-N,N-діетил-1-(3До перемішаного у толуолі розчину (100мл) метилбугил)-1Н-бензімідазол-5-карбоксамід 1,1-ілетилового естеру (3-аміно-4(110мг, 0,252ммоль) розчиняють у 3мл ЕtOН. Донітрофеніл)метилкарбамової кислоти (1,10г, дають NaBH4, (12мг, 1,2екв.) і розчин перемішують 4,12ммоль) додають 4-етоксифенілацетилхлорид при кімнатній температурі протягом 1год. Розчин(980мг, 1,2екв.) і цинковий порошок (400мг, ник концентрують і залишок розчиняють у EtOAc. 1,5екв.). Розчин перемішують при кімнатній темпеОрганічну фазу промивають насиченим розчином ратурі протягом ночі. Додають ще 0,5екв. кислотNaHCO3, розсолом і сушать над безводним ного хлориду і цинкового порошку і розчин переMgSO4. Сирий продукт очищують зворотномішують при кімнатній температурі 24год. Розчин фазовою хроматографією (колонка С-18) з градієфільтрують через броунмілерит і промивають нтом 10-65% CH3CN/H2O і ліофілізують, одержуюEtOAc, органічну фазу промивають насиченим чи бажану сполуку. Продукт ізолюють як сіль ТФК розчином NaHCO3, розсолом і сушать над безводним MgSO4. Сирий продукт очищують флеш(102мг, 73%); 1Н ЯМР (400ΜГц, CD3OD) 7,85 (br хроматографією з 2:1/гекс:EtOAc на силікагелі і s, 2H), 7,62 (br s, 1H), 7,40 (br s, 2H), 7,01 (br s, 2H), одержують бажаний продукт (1,16,33 (br s, 1H), 4,29 (br s, 2H), 4,06 (br s, 2H), 3,62 диметилетиловий естер [3-[[(4(br s, 2H), 3,32 (br s, 2H), 1,55 (br, 2H), 1,38 (brs, етоксифеніл)ацетил]аміно]-4-нітрофеніл]3H), 1,30 (brs, 3H), 1,17 (brs, 2H), 0,90 (s, 3H), 0,83 метилкарбамової кислоти, 1,18г, вихід 67%); 1Н (s, 3H); MS (ESI) (M+H)+=438,30. Аналіз: обчислено для C26H35N3O3+1,2ТФК: С, 59,38; Η, 6,35; Ν, 7,32. ЯМР (400МГц, CDCI3) 8,77 (s, 1H), 8,11 (d, Одержано: С, 59,36; Η, 5,97; Ν, 7,37. J=9,2Гц, 1Н), 7,22 (m, ЗН), 6,93 (d, J=9,2Гц, 2H), Приклад 47: 4,40 (m, 2H), 3,75 (s, 2H), 3,33 (s, 3Н), 1,50 (s, 9H), N-[2-[(4-етоксифеніл)метил]-1-(3-тієнілметил)1,42 (t, J=6,8Гц, 3Н). 1Н-бензімідазол-5-іл]-N,3-диметил-бутанамід 47D: 4-етокси-N-[5-(метиламіно)-2-нітрофеніл]47А: 1,1-ілетиловий естер метил-(4бензолацетамід нітрофеніл)карбамової кислоти 1,1-диметилетиловий естер [3-[[(4До перемішаного розчину NaH (1,15г, 1,5екв., етоксифеніл)ацетил]аміно]-4-нітрофеніл]-метил60% у маслі) у сухому ДМФ (100мл) додають розкарбамової кислоти (1,10г, 2,56ммоль) перемішучин (25мл) N-метил-4-нітроаніліну (3,00г, ють у 15мл 1М НСІ/АсОН при кімнатній темпера19,7ммоль) у ДМФ при 0°С. Розчин перемішують турі протягом 2год. і розчинник концентрують. Запри 0°С 15хвил., додають розчин ди-третлишок розчиняють у EtOAc і промивають бутилдикарбонату (4,30г, 1,2екв.) у ДМФ (50мл) і насиченим розчином NaHCO3, розсолом і сушать розчин енергійно перемішують при кімнатній темнад безводним MgSO4. Продукт (845мг, 99%) випературі 3год., потім гасять насиченим розчином користовують у наступній операції. 1Н ЯМР NH4CI і розчинник концентрують. Залишок розчи(400МГц, CDCI3) 8,80 (d, J=9,2Гц, 1Н), 8,02 (s, няють у EtOAc і промивають насиченим розчином 1H), 7,25 (d, J=6,8Гц, 2H), 6,91 (d, J=8,4Гц, 2H), NaHCO3, розсолом і сушать над безводним 6,22 (d, J=9,2Гц, 1H), 4,74 (br d, 1H), 4,04 (q, MgSO4. Сирий продукт очищують флешJ=7,2Гц, 2H), 3,73 (s, 2H), 2,94 (s, 3H), 1,41 (t, хроматографією, використовуючи 4: 1/гекс:EtOAc J=12Гц, 3Н). на силікагелі, і одержують 4,50г (90%) бажаного 47Е: 4-етокси-N-[5-[метил(3-метил-11,1-ілетилового естеру метил-(4оксобутил)аміно]-2-нітрофеніл]бензолацетамід нітрофеніл)карбамової кислоти. 1Н ЯМР (400ΜГц, До розчину 1:1/DCE:CH3CN розчин (50мл) 4CDCI3) 8,19 (d, J=8,8Гц, 2Н), 7,46 (d, J=8,8Гц, 2H), етокси-N-[5-(метиламіно)-2-нітрофеніл]3,35 (s, 3Н), 1,51 (s, 9H). бензолацетаміде (845мг, 2,56ммоль) і DMAP 59 76743 60 (470мг, 1,5екв.) додають ізовалерилхлорид 1,98 (m, 3Н), 1,81 (m, 1Н), 1,33 (t, J=7,2Гц, 3Н), 0,78 (0,47мл, 1,5екв.). Розчин перемішують при кімнат(br s, 6H); MS (ESI) (M+H)+=449,50; Аналіз: обчисній температурі 48год., розчин промивають 5%-м лено для C27H36N4O2+2,3ТФК+1,8Н2О: С, 51,06; Н, KHSO4, насиченим NaHCO3, розсолом і сушать 5,68; N, 7,54. Одержано: С, 51,06; Н, 5,73; N, 7,26. над безводним MgSO4. Сирий продукт очищують Приклад 49: флеш-хроматографією з 7:1/СН2СІ2:1 одержують N-[1-[[5-[(ацетилокси)метил]-2-фураніл]метил]бажаний продукт (4-етокси-N-[5-[метил(3-метил-12-[(4-етоксифеніл)метил]-1Н-бензімідазол-5-іл]оксобутил)аміно]-2-нітрофеніл]бензолацетамід, N,3-диметилбутанамід За процедурою Прикладу 40Е використовують 1,06г, 99%). 1Н ЯМР (400МГц, CDCI3) 8,72 (s, 1H), 4-етокси-N-[2-амiно-5-[метил(3-метил-18,21 (d, J=8,8Гц, 1H), 7,26 (m, 3Н), 6,96 (m, 2H), оксобутил)аміно]феніл]бензолацетамід (75мг, 4,06 (m, 2H), 3,76 (s, 2H), 3,31 (s, 3Н), 2,15 (m, 3Н), 0,196ммоль) і 5-[(ацетилокси)метил]-21,42 (t, J=7,2Гц, 3Н), 0,88 (d, J=6,8Гц, 6Н). фуранкарбоксальдегід (50мг, 1,5екв.). Сирий про47F: 4-етокси-N-[2-аміно-5-[метил(3-метил-1дукт безпосередньо очищують зворотно-фазовою оксобутил)аміно]феніл]бензолацетамід хроматографією (колонка С-18), використовуючи 4-етокси-N-[5-[метил(3-метил-1градієнт 15-65% CH3CN/H2O, і ліофілізують. Бажаоксобутил)аміно]-2-нітрофеніл]бензолацетамід ну сполуку виділяють як відповідну сіль ТФК (63мг, (1,05г, 2,53ммоль) розчиняють у EtOAc (50мл) з каталітичною кількістю 10% Pd/C. Розчин струшу51%); 1Н ЯМР (400МГц, CD3OD) 8,01 (d, J=8,8Гц, ють у атмосфері Н2 під тиском 35фунт/кв. дюйм 1H), 7,64 (s, 1H), 7,49 (d, J=8,8Гц, 1Н), 7,27 (d, (2,8ат) при кімнатній температурі протягом ночі. J=8,4Гц, 2Н), 6,94 (d, J=8,4Гц, 2H), 6,50 (d, J=3,2Гц, Розчин фільтрують через броунмілерит і розчин1H), 6,39 (d, J=3,2Гц, 1H), 5,75 (s, 2H), 4,92 (s, 2H), ник концентрують. Аналіз LC/MS показав достатню 4,68 (s, 2H), 4,00 (q, J=7,2Гц, 2H), 3,27 (s, 3Н), 2,02 чистоту бажаної сполуки (>95%, 965мг, 99%). 1Н (m, 1H), 1,96 (brs, 5H), 1,36 (t, J=7,2Гц, 3Н), 0,79 (s, 6H); MS (ESI) (M+H)+=518,49; Аналіз: обчислено ЯМР (400МГц; CDCI3) 7,23 (d, J=8,8Гц, 2H), 7,12 для C30H35N3O5+1,6ТФК+0,6H2O: С, 56,10; Η, 5,36; (s, 1H), 7,00 (s, 1H), 6,93 (d, J=8,8Гц, 1H), 6,78 (m, Ν, 5,91. Одержано: С, 56,14; Η, 5,40; Ν, 5,95. 2H), 4,01 (q, J=7,0Гц, 2H), 3,69 (s, 2H), 3,13 (s, 3Н), Приклад 50: 2,05 (m, 1H), 1,93 (d, J=7,2Гц, 2Н), 1,39 (t, J=7,2Гц, N-[2-(4-етоксибензил)-1-[(2S)3Н), 0,78 (d, J=6,8Гц, 6Н). піролідинілметил]-1Н-бензімідазол-5-іл]-N'-N47G: N-[2-[(4-етоксифеніл)метил]-1-3ізопропіл)-мочевина тієнілметил)-1Н-(бензімідазол-5-іл]-N,350А: N-[5диметилбутанамід (метил[(ізопропіламіно)карбоніл]аміно)-2За процедурою Прикладу 40Е використовують нітросреніл]-4-етоксибензолацетамід 4-етокси-N-[2-аміно-5-[метил(3-метил-1Суміш 4-етокси-N-[5-(метиламіно)-2оксобутил)аміно]феніл]бензолацетамід (75мг, нітрофеніл]бензолацетаміду (2,20г, 6,69ммоль) у 0,196ммоль) і тіофен-3-карбоксальдегід (26мл, 1,2-дихлоретані (100мл) перемішують при кімнат1,5екв.). Сирий продукт очищують зворотноній температурі під нітрогеном як трифосген (1,99г, фазовою хроматографією (колонка С-18) з градіє6,69ммоль) і додають TEA (0,93мл, 6,69ммоль). нтом 15-65% CH3CN/H2O і ліофілізують. Бажану Через 30хвил. додають DMAP (817мг, 6,69ммоль) і сполуку ізолюють як сіль ТФК (55мг, 50%); 1Н ЯМР ізопропіламін (3,42мл, 40,0ммоль) і суміш перемі(400МГц, CD3OD) 7,54 (m, 2H), 7,30 (d, J=4,8Гц, шують протягом 16год. при 45°С. Суміш гасять 1H), 7,17 (d, J=8,4Гц, 1H), 7,12 (d, J=8,4Гц, 2H), насиченим водним розчином гідрокарбонату на7,05 (s, 1H), 6,80 (d, J=8,8Гц, 2Н), 6,70 (d, J=5,2Гц, трію (40мл) і шари розділяють. Водну фазу екстра1H), 5,48 (s, 2H), 4,35 (s, 2H), 3,95 (q, J=7,2Гц, 2Н), гують ДХМ (2 50мл) і органічні шари об'єднують, 3,23 (s, 3Н), 2,03 (br s, 1H), 1,94 (br s, 2H), 1,31 (t, промивають розсолом (50мл) і сушать сульфатом J=7,2Гц, 3Н), 0,76 (br s, 6H); MS (ESI) натрію. Тверді продукти відфільтровують і фільт(M+HT=462,43; Аналіз: обчислено для рат концентрують у вакуумі до залишку, який очиC21Η31Ν3Ο2S+0,7ΤΦК+0,5H2O: С, 61,97; Η, 5,99; Ν, щують хроматографією на колонці (75% EtOAc, 7,63. Одержано: С, 61,88; Η, 6,03; Ν, 7,62. 25% гептану на силікагелі), отримуючи бажану Приклад 48: N-[2-[(4-етоксифеніл)метил]-1-[(2Н)сполуку (2,44г, 88%). 1Н ЯМР (400МГц, CDCI3): піролідинілметил]-1Н-бензімідазол-5-іл]-N,31,14 (d, J=6,4, 6H), 1,38 (t, J=7,1Гц, 3H), 3,29 (s, диметилбутанамід 3H), 3,71 (s, 2H), 4,01 (q, J=7,1Гц, 2H), 4,70 (s, 1H), За процедурою Прикладу 40Е використовують 6,90 (d, J=8,8Гц, 2Н), 7,00 (dd, J=2,5, 9,2Гц, 1Н), 4-етокси-N-[2-аміно-5-[метил(3-метил-17,22 (d, J=8,8Гц, 2Н), 8,13 (d, J=9,2Гц, 1Н), 8,61 (d, оксобутил)аміно]феніл]бензолацетамід (75мг, J=2,5Гц, 1Н). MS (ESI) (M+H)+=415. 0,196ммоль) і N-(трет-бутоксикарбоніл)-D-оролінал 50B: N-[2-аміно-5(55мл, 1,5екв.). Сирий продукт безпосередньо [метил[[ізопропіламіно]карбоніл]аміно]феніл]-4очищують: зворотно-фазовою хроматографією етоксибензолацетамід (колонка С-18), використовуючи градієнт 5-50% Суміш N-[5CH3CN/H2O, і далі ліофілізують. Бажану сполуку [метил[[ізопропіламіно]карбоніл]аміно]-2виділяють як відповідну сіль ТФК (81мг, 73%). 1Н нітрофеніл]-4-етоксибензолацетаміде (190мг, 0,46ммоль) і 10% Pd/C у EtOAc (5,0мл) гідрогенуЯМР (CD3OD) 7,91 (d, J=8,8Гц, 1H), 7,59 (s, 1Н), ють протягом 4год. при тиску 30фунт/кв.дюйм 7,43 (4 J=8,8Гц, 1Н), 7,26 (d, J=8,8Гц, 2Н), 6,93 (d, (2,1ат). Суміш фільтрують через броунмілерит і J=8,8Гц, 2Н), 4,79 (d, J=7,2Гц, 2Н), 4,53 (s, 2Н), броунмілерит промивають EtOAc (2 10,0мл). Роз3,98 (q, J=7,2Гц, 2Н), 3,88 (m, 1H), 3,44 (m, 1H), 3,23 (s, 3Н), 2,18 (m, 1Н), 2,13 (m, 1Н), 2,05 (m, 2Н), чинник видаляють у вакуумі, отримуючи бажану
ДивитисяДодаткова інформація
Назва патенту англійськоюCondensed imidazole derivaties, pharmaceutical composition based thereon
Автори англійськоюTomaszewski Miroslaw, Walpole Christopher
Назва патенту російськоюПроизводные конденсированного имидазола, фармацевтическая композиция на их основании
Автори російськоюТомашевски Мирослав, Волпоул Кристофер
МПК / Мітки
МПК: C07D 521/00, C07D 235/12, C07D 403/04, C07D 405/06, C07D 401/06, A61K 31/5377, A61K 31/4709, C07D 401/12, C07D 403/12, C07D 235/30, A61K 31/496, A61K 31/454, C07D 413/12, A61K 31/4184, C07D 417/06, C07D 409/06, A61P 43/00, C07D 403/06, A61K 31/4439, C07D 471/04, A61P 25/04, C07B 61/00, A61K 31/437
Мітки: фармацевтична, композиція, похідні, імідазолу, конденсованого, основі
Код посилання
<a href="https://ua.patents.su/38-76743-pokhidni-kondensovanogo-imidazolu-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні конденсованого імідазолу, фармацевтична композиція на їх основі</a>