Похідні піперазинілпіперидину як антагоністи хемокінового рецептора
Номер патенту: 88466
Опубліковано: 26.10.2009
Автори: Ван Аньлай, Гленн Джозеф, Чень Ліхуа, Цао Ганьфен, Ананд Раджан, Мелоні Девід, Хуан Тайшен, Сюе Чу-Бяо, Меткаф Брайан, Чжан Ке
Формула / Реферат
1. Сполука формули І:
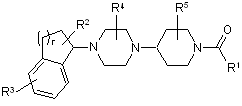 (I)
(I)
або її фармацевтично прийнятна сіль або проліки, у якій:
R1 являє собою гетероарил, необов'язково заміщений одним або декількома R6;
R2 являє собою Н, галоген, ціано, нітро, С1-С6алкіл, С1-С6галогеналкіл, С2-С6алкеніл, С2-С6алкініл, арил, гетероарил, С3-С7циклоалкіл, гетероциклоалкіл, SOR7, SO2R7, COR8, OR9, SR9, COOR9, NR10R11 або NR10COR8;
R3 являє собою F, Cl, Br, І, С1-С4галогеналкіл, С1-С4галогеналкокси або гетероарил;
R4 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл або С1-С6галогеналкіл;
R5 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл або С1-С6галогеналкіл;
R6 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, C1-С6алкокси, С1-С6-галогеналкокси, аміно, (С1-С6алкіл)аміно або ді(С1-С6алкіл)аміно;
R7 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, арил, гетероарил, С3-С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл, (С3-С7циклоалкіл)алкіл, гетероциклоалкілалкіл або NR12R13;
R8 являє собою H, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, арил, гетероарил, С3-С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл, (С3-С7циклоалкіл)алкіл, гетероциклоалкілалкіл або NR12R13;
R9 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, алкоксіалкіл, галогеналкоксіалкіл, арилоксіалкіл, гетероарилоксіалкіл, циклоалкілоксіалкіл, гетероциклоалкілоксіалкіл, арил, гетероарил, С3-С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл, (С3-С7циклоалкіл)алкіл або гетероциклоалкілалкіл;
R10 і R11 обидва незалежно являють собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, арил, гетероарил, С3-С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл, (С3-С7циклоалкіл)алкіл або гетероциклоалкілалкіл;
або R10 і R11 разом з атомом азоту, до якого вони приєднані, утворюють 3-, 4-, 5-, 6- або 7-членну гетероциклоалкільну групу;
R12 і R13 обидва незалежно являють собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, арил, гетероарил, С3-С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл, (С3-С7циклоалкіл)алкіл або гетероциклоалкілалкіл;
або R12 і R13 разом з атомом азоту, до якого вони приєднані, утворюють 3-, 4-, 5-, 6- або 7-членну гетероциклоалкільну групу;
r являє собою 1, 2 або 3.
2. Сполука за п. 1, у якій R1 являє собою 5-, 6-, 9- або 10-членну гетероарильну групу, що містить щонайменше один атом N, який утворює кільце, де зазначена 5-, 6-, 9- або 10-членна гетероарильна група необов'язково заміщена 1, 2, 3 або 4 групами R6.
3. Сполука за п. 1, у якій R1 являє собою:
 ,
,  ,
,  ,
,  ,
,
 ,
, 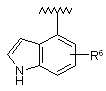 ,
, 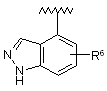 ,
,  ,
,
 ,
,  ,
, 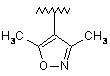 або
або  .
.
4. Сполука за п. 1, у якій R1 являє собою:
 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  або
або  .
.
5. Сполука за п. 1, у якій R1 являє собою:
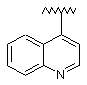 ,
, 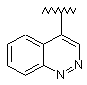 ,
, 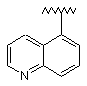 ,
,  ,
,
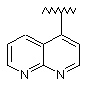 або
або  .
.
6. Сполука за п. 1, у якій R2 являє собою Н, С1-С6алкіл, С1-С6галогеналкіл, OR9, SR9 або NR10R11.
7. Сполука за п. 1, у якій R2 являє собою Н або OR9.
8. Сполука за п. 1, у якій R3 являє собою F, Вr, СF3 або 6- або 5-членний гетероарил.
9. Сполука за п. 1, у якій R4 являє собою С1-С6алкіл.
10. Сполука за п. 1, у якій R4 являє собою метил.
11. Сполука за п. 1, у якій R5 являє собою С1-С6алкіл.
12. Сполука за п. 1, у якій R5 являє собою метил.
13. Сполука за п. 1, що має формулу ІІа:
 , ІІа
, ІІа
або її фармацевтично прийнятна сіль або проліки.
14. Сполука за п. 13, у якій R1 являє собою:
 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  або
або  .
.
15. Сполука за п. 13, у якій R1 являє собою:
 ,
,  ,
,  ,
,  ,
,
 або
або  .
.
16. Сполука за п. 1 як агент, що вибірково зв'язується з CCR5, або інгібітор CCR5.
17. Сполука за п. 1, вибрана з:
5-({4-[(3S)-4-(5-бром-2,3-дигідро-1Н-інден-1-іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1-іл}карбоніл)-4,6-диметилпіримідину;
5-({4-[(3S)-4-(5-фтор-2,3-дигідро-1H-інден-1-іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1-іл}карбоніл)-4,6-диметилпіримідину;
5-({4-[(3S)-4-(6-бром-2,3-дигідро-1Н-інден-1-іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1-іл}карбоніл)-4,6-диметилпіримідину;
5-({4-[(3S)-4-(6-фтop-2,3-дигiдpo-1Н-інден-1-іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1-іл}карбоніл)-4,6-диметилпіримідину;
5-({4-[(3S)-4-(6-бром-1,2,3,4-тетрагідронафталін-1-іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1-іл}карбоніл)-4,6-диметилпіримідину;
5-({4-[(3S)-4-(7-бром-1,2,3,4-тетрагідронафталін-1-іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1-іл}карбоніл)-4,6-диметилпіримідину;
4,6-диметил-5-[(4-метил-4-{(3S)-3-метил-4-[6-(трифторметил)-2,3-дигідро-1Н-інден-1-іл]піперазин-1-іл}піперидин-1-іл)карбоніл]піримідину;
4,6-диметил-5-[(4-метил-4-{(3S)-3-метил-4-[5-(трифторметил)-2,3-дигідро-1H-інден-1-іл]піперазин-1-іл}піперидин-1-іл)карбоніл]піримідину;
1-((2S)-4-{1-[(4,6-диметилпіримідин-5-іл)карбоніл]-4-метилпіперидин-4-іл}-2-метилпіперазин-1-іл)-5-(трифторметил)індан-2-олу;
5-[(4-{(3S)-4-[2-мeтoкcи-5-(тpифтopмeтил)-2,3-дигiдpo-1H-iндeн-1-iл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідину;
дигідрохлориду 5-[(4-(3S)-4-[(1R,2R)-2-eтoкcи-5-(тpифтopмeтил)-2,3-дигiдpo-1H-інден-1-іл]-3-метилпіперазин-1-іл-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідину;
5-[(4-{(3S)-4-[(1R,2R)-2-(2-метоксіетокси)-5-(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідину;
4-[(4-{(3S)-4-[(1S,2R)-2-етокси-5-(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]циноліну;
4-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]хіноліну;
5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3-мeтилпiпepaзин-l-iл}-4-мeтилпiпepидин-1-iл)карбоніл]xiнoлiнy;
4-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(трифторметил)-2,3-дигідро-1H-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-1,8-нафтиридину;
5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]ізохіноліну;
5-[(4-{(3S)-4-[(1R,2R)-5-бром-2-етокси-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідину;
4-[(4-{(3S)-4-[(1R,2R)-5-бром-2-етокси-2,3-дигідро-1H-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]циноліну;
4-[(4-{(3S)-4-[(1R,2R)-5-бром-2-етокси-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-1,8-нафтиридину;
5-[(4-{(3S)-4-[(1R,2R)-5-бром-2-(піридин-2-ілокси)-2,3-дигідро-1H-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідину;
5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(1,3-тіазол-2-іл)-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідину;
5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-піридин-2-іл-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідину;
5-[(4-{(3S)-4-[3-метокси-5-(трифторметил)-2,3-дигідро-1H-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідину.
18. Композиція, що містить сполуку за будь-яким із пп. 1-17 і фармацевтично прийнятний носій.
19. Спосіб модулювання активності хемокінового рецептора, який включає введення у контактування зазначеного хемокінового рецептора із сполукою за будь-яким із пп. 1-17.
20. Спосіб за п. 19, у якому зазначений хемокіновий рецептор являє собою CCR5.
21. Спосіб за п. 19, у якому зазначене модулювання відповідає інгібуванню.
22. Спосіб за п. 19, у якому зазначена сполука являє собою вибірковий інгібітор CCR5.
23. Спосіб за п. 19, у якому зазначена сполука являє собою агент, що вибірково зв'язується з CCR5.
24. Спосіб лікування захворювання, асоційованого з експресією або активністю хемокінового рецептора в пацієнта, що включає введення зазначеному пацієнтові терапевтично ефективної кількості сполуки за будь-яким із пп. 1-17.
25. Спосіб за п. 24, у якому зазначений хемокіновий рецептор являє собою CCR5.
26. Спосіб за п. 25, у якому зазначена сполука являє собою вибірковий інгібітор CCR5 або агент, що вибірково зв'язується з CCR5.
27. Спосіб лікування захворювання або стану, вибраного із запального захворювання, імунного порушення і вірусної інфекції в пацієнта, що включає введення зазначеному пацієнтові терапевтично ефективної кількості сполуки за будь-яким із пп. 1-17.
28. Спосіб за п. 27, у якому зазначене захворювання або стан являє собою запальне захворювання.
29. Спосіб за п. 28, у якому зазначене захворювання або стан являє собою імунне порушення.
30. Спосіб за п. 28, у якому зазначене захворювання або стан являє собою вірусну інфекцію.
31. Спосіб за п. 30, у якому зазначена вірусна інфекція являє собою інфекцію ВІЛ.
32. Спосіб лікування інфекції ВІЛ у пацієнта, що включає введення зазначеному пацієнтові терапевтично ефективної кількості сполуки за будь-яким із пп. 1-17.
33. Спосіб за п. 32, що додатково включає одночасне або послідовне введення щонайменше одного противірусного агента.
34. Сполука, яка являє собою 5-[(4-(3S)-4-[(1R,2R)-2-eтoкcи-5-(тpифтopмeтил)-2,3-дигiдpo-1H-інден-1-іл]-3-метилпіперазин-1-іл-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідин або його фармацевтично прийнятну сіль.
35. Сполука за п. 34, яка являє собою 5-[(4-(3S)-4-[(1R,2R)-2-eтoкcи-5-(тpифтopмeтил)-2,3-дигiдpo-1H-інден-1-іл]-3-метилпіперазин-1-іл-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідин дигідрохлорид.
36. Сполука, яка являє собою 5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(1,3-тіазол-2-іл)-2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4-метилпіперидин-1-іл)карбоніл]-4,6-диметилпіримідин або його фармацевтично прийнятну сіль.
Текст
1. Сполука формули І: C2 2 (19) 1 3 88466 R6 N N N R6 , 11. Сполука за п.1, у якій R5 являє собою С1С6алкіл. 12. Сполука за п.1, у якій R5 являє собою метил. 13. Сполука за п.1, що має формулу ІІа: N , 4 R6 H3C R2 , r H3C N О N N R1 R6 R6 N N , R6 N , H3 C N R6 N H CH3 R6 , CH3 N N O N R6 R6 , N , 6 , N R6 N . N R6 N R6 , H3C N , N N O CH3 , R6 N N N N R6 N H3 C , CH3 N N 6 , N N N , , CH3 N N N N N R . або , 6. Сполука за п.1, у якій R2 являє собою Н, С1С6алкіл, С1-С6галогеналкіл, OR9, SR9 або NR10R11. 7. Сполука за п.1, у якій R2 являє собою Н або OR9. 8. Сполука за п.1, у якій R3 являє собою F, Вr, СF3 або 6- або 5-членний гетероарил. 9. Сполука за п.1, у якій R4 являє собою С1С6алкіл. 10. Сполука за п.1, у якій R4 являє собою метил. 6 N N N R або , . 16. Сполука за п.1 як агент, що вибірково зв'язується з CCR5, або інгібітор CCR5. 17. Сполука за п.1, вибрана з: 5-({4-[(3S)-4-(5-бром-2,3-дигідро-1Н-інден-1-іл)-3метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідину; 5-({4-[(3S)-4-(5-фтор-2,3-дигідро-1H-інден-1-іл)-3метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідину; 5-({4-[(3S)-4-(6-бром-2,3-дигідро-1Н-інден-1-іл)-3метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідину; 5-({4-[(3S)-4-(6-фтop-2,3-дигiдpo-1Н-інден-1-іл)-3метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідину; 5-({4-[(3S)-4-(6-бром-1,2,3,4-тетрагідронафталін-1іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідину; 5-({4-[(3S)-4-(7-бром-1,2,3,4-тетрагідронафталін-1іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідину; 4,6-диметил-5-[(4-метил-4-{(3S)-3-метил-4-[6(трифторметил)-2,3-дигідро-1Н-інден-1R6 N , , CH3 N N H3 C R6 R6 H3C 6 , N , N CH3 R або . 5. Сполука за п.1, у якій R1 являє собою: N CH3 N CH3 R або . 15. Сполука за п.13, у якій R1 являє собою: , N R6 O N , , CH3 , H3C H3 C R6 N R6 R6 N , R6 H3 C N N H3C N N O N або R , 4. Сполука за п.1, у якій R1 являє собою: R6 N R6 CH3 CH3 R6 , ІІа або її фармацевтично прийнятна сіль або проліки. 14. Сполука за п.13, у якій R1 являє собою: CH3 H3 C H3C R3 , H3 C N , H3C N H 6 5 іл]піперазин-1-іл}піперидин-1іл)карбоніл]піримідину; 4,6-диметил-5-[(4-метил-4-{(3S)-3-метил-4-[5(трифторметил)-2,3-дигідро-1H-інден-1іл]піперазин-1-іл}піперидин-1іл)карбоніл]піримідину; 1-((2S)-4-{1-[(4,6-диметилпіримідин-5-іл)карбоніл]4-метилпіперидин-4-іл}-2-метилпіперазин-1-іл)-5(трифторметил)індан-2-олу; 5-[(4-{(3S)-4-[2-мeтoкcи-5-(тpифтopмeтил)-2,3дигiдpo-1H-iндeн-1-iл]-3-метилпіперазин-1-іл}-4метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідину; дигідрохлориду 5-[(4-(3S)-4-[(1R,2R)-2-eтoкcи-5(тpифтopмeтил)-2,3-дигiдpo-1H-інден-1-іл]-3метилпіперазин-1-іл-4-метилпіперидин-1іл)карбоніл]-4,6-диметилпіримідину; 5-[(4-{(3S)-4-[(1R,2R)-2-(2-метоксіетокси)-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-іл}-4-метилпіперидин-1іл)карбоніл]-4,6-диметилпіримідину; 4-[(4-{(3S)-4-[(1S,2R)-2-етокси-5-(трифторметил)2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}4-метилпіперидин-1-іл)карбоніл]циноліну; 4-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(трифторметил)2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}4-метилпіперидин-1-іл)карбоніл]хіноліну; 5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(трифторметил)2,3-дигідро-1Н-інден-1-іл]-3-мeтилпiпepaзин-l-iл}-4мeтилпiпepидин-1-iл)карбоніл]xiнoлiнy; 4-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(трифторметил)2,3-дигідро-1H-інден-1-іл]-3-метилпіперазин-1-іл}4-метилпіперидин-1-іл)карбоніл]-1,8-нафтиридину; 5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(трифторметил)2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}4-метилпіперидин-1-іл)карбоніл]ізохіноліну; 5-[(4-{(3S)-4-[(1R,2R)-5-бром-2-етокси-2,3-дигідро1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідину; 4-[(4-{(3S)-4-[(1R,2R)-5-бром-2-етокси-2,3-дигідро1H-інден-1-іл]-3-метилпіперазин-1-іл}-4метилпіперидин-1-іл)карбоніл]циноліну; 4-[(4-{(3S)-4-[(1R,2R)-5-бром-2-етокси-2,3-дигідро1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4метилпіперидин-1-іл)карбоніл]-1,8-нафтиридину; 5-[(4-{(3S)-4-[(1R,2R)-5-бром-2-(піридин-2-ілокси)2,3-дигідро-1H-інден-1-іл]-3-метилпіперазин-1-іл}4-метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідину; 5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-(1,3-тіазол-2-іл)2,3-дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}4-метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідину; 5-[(4-{(3S)-4-[(1R,2R)-2-етокси-5-піридин-2-іл-2,3дигідро-1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідину; 5-[(4-{(3S)-4-[3-метокси-5-(трифторметил)-2,3дигідро-1H-інден-1-іл]-3-метилпіперазин-1-іл}-4метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідину. 18. Композиція, що містить сполуку за будь-яким із пп.1-17 і фармацевтично прийнятний носій. 88466 6 19. Спосіб модулювання активності хемокінового рецептора, який включає введення у контактування зазначеного хемокінового рецептора із сполукою за будь-яким із пп.1-17. 20. Спосіб за п.19, у якому зазначений хемокіновий рецептор являє собою CCR5. 21. Спосіб за п.19, у якому зазначене модулювання відповідає інгібуванню. 22. Спосіб за п.19, у якому зазначена сполука являє собою вибірковий інгібітор CCR5. 23. Спосіб за п.19, у якому зазначена сполука являє собою агент, що вибірково зв'язується з CCR5. 24. Спосіб лікування захворювання, асоційованого з експресією або активністю хемокінового рецептора в пацієнта, що включає введення зазначеному пацієнтові терапевтично ефективної кількості сполуки за будь-яким із пп.1-17. 25. Спосіб за п.24, у якому зазначений хемокіновий рецептор являє собою CCR5. 26. Спосіб за п.25, у якому зазначена сполука являє собою вибірковий інгібітор CCR5 або агент, що вибірково зв'язується з CCR5. 27. Спосіб лікування захворювання або стану, вибраного із запального захворювання, імунного порушення і вірусної інфекції в пацієнта, що включає введення зазначеному пацієнтові терапевтично ефективної кількості сполуки за будь-яким із пп.1-17. 28. Спосіб за п.27, у якому зазначене захворювання або стан являє собою запальне захворювання. 29. Спосіб за п.28, у якому зазначене захворювання або стан являє собою імунне порушення. 30. Спосіб за п.28, у якому зазначене захворювання або стан являє собою вірусну інфекцію. 31. Спосіб за п.30, у якому зазначена вірусна інфекція являє собою інфекцію ВІЛ. 32. Спосіб лікування інфекції ВІЛ у пацієнта, що включає введення зазначеному пацієнтові терапевтично ефективної кількості сполуки за будь-яким із пп.1-17. 33. Спосіб за п.32, що додатково включає одночасне або послідовне введення щонайменше одного противірусного агента. 34. Сполука, яка являє собою 5-[(4-(3S)-4-[(1R,2R)2-eтoкcи-5-(тpифтopмeтил)-2,3-дигiдpo-1H-інден-1іл]-3-метилпіперазин-1-іл-4-метилпіперидин-1іл)карбоніл]-4,6-диметилпіримідин або його фармацевтично прийнятну сіль. 35. Сполука за п.34, яка являє собою 5-[(4-(3S)-4[(1R,2R)-2-eтoкcи-5-(тpифтopмeтил)-2,3-дигiдpo1H-інден-1-іл]-3-метилпіперазин-1-іл-4метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідин дигідрохлорид. 36. Сполука, яка являє собою 5-[(4-{(3S)-4[(1R,2R)-2-етокси-5-(1,3-тіазол-2-іл)-2,3-дигідро1Н-інден-1-іл]-3-метилпіперазин-1-іл}-4метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідин або його фармацевтично прийнятну сіль. 7 Даний винахід стосується сполук, які модулюють активність або зв'язуються з хемокіновими рецепторами, такими як CCR5. У деяких варіантах здійснення сполуки селективні відносно CCR5. Сполуки можуть використовуватися, наприклад, для лікування захворювань, асоційованих з експресією або активністю хемокінового рецептора, таких як запальні захворювання, імунні захворювання і вірусні інфекції. Міграція і доставка лейкоцитів із кровоносних судин в ушкоджені тканини залучена в ініціацію нормальних запальних реакцій, що протидіють розвитку захворювання. Даний процес, також відомий як рекрутування лейкоцитів, також стосується початку і прогресу загрозливого для життя запалення, а також ушкоджуючих аутоімунних захворювань. В результаті патологія даних захворювань с наслідком атаки захисних сил імунної системи організму на нормальні тканини. Відповідно до цього, профілактика і блокування рекрутування лейкоцитів у тканинімішені при запальному і аутоімунному захворюванні є дуже ефективним підходом терапевтичного втручання. Інші класи лейкоцитарних клітин, які залучені в клітинні імунні відповіді, включають моноцити, лімфоцити, нейтрофіли, еозинофіли і базофіли. У більшості випадків лімфоцити являють собою клас лейкоцитів, що ініціює, координує і підтримує хронічні запальні реакції, і потрібна блокада даних клітин від проникнення в ділянки запалення. Лімфоцити залучають у дані ділянки тканини моноцити, які, разом з лімфоцитами, відповідають за більшу частину ушкоджень тканини, які відбуваються при запальному захворюванні. Інфільтрація лімфоцитами і/або моноцитами, як відомо, приводить до різних хронічних аутоімунних захворювань, і також до відторгнення трансплантованого органа. Дані захворювання включають як необмежу вальні приклади ревматоїдний артрит, хронічний контактний дерматит, запальне захворювання кишечнику, вовчак, системний червоний вовчак, розсіяний склероз, атеросклероз, псоріаз, саркоїдоз, ідіопатичний фіброз легень, дерматоміозит, пемфігоїд шкіри і пов'язані захворювання (наприклад, викликані Pemphigus vulgaris, P. foliacious, P. crylhematosis), гломерулонефрити, васкуліти, гепатит, діабет, відторгнення алотрансплантата, і хвороба «трансплантат проти хазяїна». Процес, за допомогою якого лейкоцити залишають кров'яне русло, накопичуються в ділянках запалення і ініціюють захворювання, як думають, має щонайменше три стадії, описані як (1) прокатування, (2) активація/щільна адгезія і (3) міграція через ендотелій [Springer, Τ. Α., Nature 346: 425-433 (1990); Lawrence and Springer, Cell 65: 859-873 (1991); Butcher, E. C, Cell 67: 1033-1036 (1991)]. Друга стадія опосередковується на молекулярному рівні рецепторами хемоатрактангів. Рецептори хемоатрактантів на 88466 8 поверхні лейкоцитів потім зв'язуються із цитокінами-хемоатрактангами, які секретуються клітинами в ділянці ушкодження або інфекції. Зв'язування рецепторів активує лейкоцити, підвищує адгезивність молекул адгезії, які опосередковують трансендотеліальну міграцію і сприяють прямій міграції' клітин у напрямку джерела цитокіну-хемоатрактанту Цитокіни хемотаксису (лейкоцитарні хемоатрактанти/активуючі фактори) іакож відомі як хемокіни, також відомі як інтеркрини і SIS-цигокіни, являють собою групу запальних/імуномодулюючих поліпептидних факторів з молекулярною масою 615 кДа, які вивільняються різними клітинами, такими як макрофаги, моноцити, еозинофіли, нейтрофіли, фібробласти, ендотеліальні клітини судин, гладком'язеві клітини і тучні клітини в ділянках запалення (огляд в Luster, New Fng. J Med., 338, 436-445 (1998) і Rollins, Blood, 90, 909928 (1997)). Також хемокіни описані в Oppenheim, J. J. et al., Annu. Rev. Immunol., 9: 617-648 (1991); Schall and Bacon, Curr. Opin. Immunol., 6. 865-873 (1994); Baggiohni, Μ., et al., and Adv. Immunol, 55: 97-179 (1994). Хемокіни мають здатність стимулювати спрямовану міграцію клітин, процес, відомий як хемотаксис. Кожний хемокін місіить чотири залишки цистеїну (С) і два внутрішніх дисульфідних місточки Хемокіни можуть бути згруповані на два надсімейства на основі того, чи прилягають два аміно-кінцевих цистеїнових залишки безпосередньо один до одного (сімейсіво СС) або ж вони розділені однією амінокислотою (сімейство СХС). Дані відмінності корелюють із організацією даних двох надсімейств в окремі і енні кластери. У кожному генному кластері хемокіни звичайно характеризуються подібністю послідовності від 25 до 60%. СХС-хемокіни, такі як інтерлейкін-8 (IL-8), нейгрофілакгивуючий білок-2 (NAP-2) і білок з активністю по стимуляції росту меланоми (MGSA) мають хемотаксис переважно для нейтрофілів і Т-лімфоцитів, у той час як ССхемокіни, такі як RANTES, МІР-1α, ΜΙΡ-1β; білки хемотаксису моноцитів (МСР-1, МСР-2, МСР-3, МСР-4, і МСР-5) і еотаксини (-1 і -2), крім інших клітинних типів, характеризуються хемотаксисом відносно макрофагів, Т-лімфоцитів, еозинофілів, дендритних клітин і базофилів. Також існують хемокіни лімфогактин-1, лімфотактин-2 (обидва Схемокіни) і фракталкін (СХХХС-хсмокін), які не належать до головних хемокінових надсімейств. МСР-1 (також відомий як MCAF (скорочення від фактора активації і хемотаксису макрофагів) або JE) являє собою СС-хемокін, що продукується моноцитами/макрофагами, гладеньком'язевими клітинами, фібробластами, і клітинами ендотелію судин і викликають міграцію клітин і адгезію клітин моноциіів (див., наприклад, Valente, A. J., et al., Biochemistry, 1988, 27, 4162; Matsushima, K., et al., J. Exp. Med., 1989, 169, 1485; Yoshimura, Т., et al., J. Immunol., 1989, 142, 1956; Rollins, B. J., et al., Proc. Natl. Acad. Sci. USA, 1988, 85, 3738; Rollins, B. J., et al., Blood, 1991, 78, 1112; Jiang, Y., et al., J. Immunol., 1992, 148, 2423; Vaddi, K., et al., J. 9 Immunol., 1994, 153, 4721), Т-лімфоцитів пам'яті (див., наприклад, Carr, M. W., et al., Proc. Natl. Acad. Sci. USA, 1994, 91. 3652), T-лімфопигів (див., наприклад, Loetscher, P., et al., FASEB J., 1994, 8, 1055) і клітин-iiaiгральних кілсрів (див., наприклад, Loetscher, P., et al., J. Immunol., 1996, 156, 322; Allavena, P., et al., Eur. J. Immunol., 1994, 24, 3233), а також опосередковують вивільнення гістаміну базофілами (див., наприклад, Alam, R., et al., J. Clin. Invest., 1992, 89, 723; Bischoff, S. C, et al., J. Exp. Med., 1992, 175, 1271; Kuna, P., et al., J. Exp. Med., 1992, 175, 489). Крім того, про високий рівень експресії МСР-1 повідомляли при захворюваннях, де, як думають, нагромадження моноцитів/макрофагів і/або Т-клітин важливе при ініціації або прогресії захворювань, таких як атеросклероз (див., наприклад, Hayes, І. М., et al., Arterioscler. Thromb. Vase. Biol., 1998, 18, 397; Takeya, M. et al.. Hum. Pathol., 1993, 24, 534; YlaHerttuala, S., et al., Proc. Natl. Acad. Sci. USA, 1991, 88, 5252; Nelken, N. A.. J. Clin. Invest., 1991, 88, 1121), ревматоїдний артрит (див., наприклад, Koch, A. Ε., et al., J. Clin. Invest, 1992, 90, 772; Akahoshi, Т., et al., Arthritis Rheum., 1993, 36, 762; Robinson, E., et al., Clin. Exp. Immunol., 101, 398), нефрит (див., наприклад, Noris, M., et al., Lab. Invest, 1995, 73, 804; Wada, Т., at al., Kidney Int., 1996, 49, 761; Gesualdo, L., et al., Kidney Int., 1997, 51, 155), нефропатія (див., наприклад, Saitoh, Л., et al., J. Clin. Lab. Anal., 1998, 12, 1; Yokoyama, H., et al., J. Leukoc. Biol.. 1998, 63, 493), фіброз легенів, саркоїдоз легенів (див., наприклад, Sugiyama, Y., et al., Internal Medicine, 1997, 36, 856), астма (див., наприклад, Karina, Μ., et al., J. Invest. Allergol. Clin. Immunol., 1997, 7, 254; Stephene, Τ. Η., Am. J. Respir. Crit. Care Med, 1997, 156, 1377; Sousa, A. R, et al., Am. J. Respir. Cell Моl. Biol, 1994, 10, 142), розсіяний склероз (див, наприклад, McManus, C, et al., J. Neuroimmunol, 1998, 86, 20), псоріаз (див, наприклад, Gillitzer, R, et al., J. Invest. Dermatol., 1993, 101, 127), запальне захворювання товстої кишки (див, наприклад, Grimm, Μ. С, et al., J. Leukoc. Biol, 1996, 59, 804; Reinecker, H. C, et al., Gastroenterology, 1995, 106, 40), міокардит (див, наприклад, Seino, Υ, et al., Cytokine, 1995, 7, 301), ендомегріоз (див, наприклад, Jolicoeur, С, et al. Am. J. Pathol, 1998, 152, 125), внутрішньочеревинна адгезія (див, наприклад, Zeyneloglu, Η. Β , et al. Human Reproduction, 1998, 13, 1194), застійна серцева недостатність (див., наприклад, Aurust, P, et al. Circulation, 1998, 97, 1136), хронічне захворювання печінки (див, наприклад, Marra, F, et al. Am. J. Pathol, 1998, 152, 423), вірусний менінгіт (див, наприклад, Lahrtz, F, et al., Eur. J. Immunol, 1997, 27, 2484), хвороба Кавасакі (див, наприклад, Wong, M.; et al., J. Rheumatol, 1997, 24, 1179) і сепсис (див, наприклад, Salkowski, С. Α.; et al. Infect. Immun, 1998, 66, 3569). Більш того, антитіло проти МСР-1, як повідомлялося, характеризується інгібіторною дією або терапевтичною дією на іваринах-моделях ревматоїдного артриту (див, наприклад, Schimmer, R. С, et al., J. Immunol, 1998, 160, 1466; Schrier, D. J, J. Leukoc. Biol, 1998, 63, 359; Ogata, H, et al., J. Pathol, 1997, 182, 106), розсіяного склерозу (див, 88466 10 наприклад, Karpus, W. J, et al., J. Leukoc. Biol, 1997, 62, 681), нефриту (див, наприклад, Lloyd, С Μ, et al., J. Exp. Med, 1997, 185, 1371; Wada, T, et al., FASEB J, 1996, 10, 1418), астми (див., наприклад, Gonzalo, J.-A, et al., J. Exp. Med, 1998, 188, 157, Lukacs, N. W, J. Immunol., 1997, 158, 4398), атеросклерозу (див, наприклад, Guzman, L. A, et al. Circulation, 1993, 88 (suppl.), 1-371), гіперчутливості сповільненого типу (див, наприклад, Rand, M. L, et al. Am. J. Pathol, 1996, 148, 855), легеневої гіпертензії (див., наприклад, Kimura, H, et al. Lab. Invest, 1998, 78, 571), і внутрішньочеревинної адгезії (див, наприклад, Zeyneloglu, Η. В, et al. Am. J. Obstet. Gynecol., 1998, 179, 438). Також повідомлялося, що пептидний антагоніст МСР-1, МСР-1(9-76), інгібує артрит у експериментальних мишей (див. Gong, J.H., J. Exp., 4ed., 1997. 186, 131), також дослідження в дефіцитних по МСР-1 мишах показали, що МСР-1 є суттєвим для рекрутування моноцитів in vivo (див. Lu, В., et al., J. Exp. Med., 1998, 187, 601; Gu, L., etal., Moll. Cell, 1998, 2, 275). Література вказує на те, що хемокіни, такі як МСР-1 і МІР-1α приваблюють моноцити і лімфоцити в ділянки патології і опосередковують їхню активацію, і думають, що вони тісно залучені в ініціацію, прогресію і підтримку захворювань із безпосередньою участю моноцитів і лімфоцитів, таких як атеросклероз, повторний стеноз, ревматоїдний артрит, псоріаз, астма, виразковий коліт, нефрит (нефропагія), розсіяний склероз, легеневий фіброз, міокардит, гепатит, панкреатит, саркоїдоз, хвороба Крона, ендометріоз, застійна серцева недостатність, вірусний менінгіт, інсульт, невропатія, хвороба Кавасакі і сепсис (див., наприклад, Rovin, В. Н., et al., Am. J. Kidney. Dis., 1998, 31, 1065; Lloyd, C, et al., Curr. Opin. Nephrol. Hypertens., 1998, 7, 281; Conti, P, et al., Allergy and Asthma Proc, 1998, 19, 121; Ransohoff, R. M., et al., Trends Neurosci., 1998, 21, 154; MacDermott, R. P., et al., Inflammatory Bowel Diseases, 1998, 4, 54). Хемокіни зв'язуються зі специфічними рецепторами клітинної поверхні, що належать до сімейства зв'язаних з G-білком білків із сімома трансмембранними доменами (огляд в Horuk, Trends Pharm. Sci., 15, 159-165 (1994)), які називаються «хемокіновими рецепторами». Після зв'язування ліганду, що відповідає їм, хемокінові рецептори трансдукують внутрішньоклітинний сигнал через асоційовані тримерні G-білки, що приводить, серед інших реакцій, до швидкого підвищення внутрішньоклітинної концентрації кальцію, змінам у формі клітини, підвищеної експресії молекул клітинної адгезії, дегрануляції і здійснення міграції клітин. Гени, що кодують рецептори конкретних хемокінів, клонували, і відомо, що дані рецептори являють собою зв'язані з G-білком рецептори із сімома трансмембранними доменами, присутні на різних популяціях лейкоцитів. Дотепер іденінфікували щонайменше п'ять СХСхемокінових рецепторів (CXCR1-CXCR5) і вісім СС-хемокінових рецепторів (CCR1-CCR8). Наприклад, IL-8 являє собою ліганд CXCR1 і CXCR2, МІР-1α являє собою такий для CCR1 і 11 CCR5, а МСР-1 є лігандом для CCR2A і CCR2B (для посилання, див., наприклад, Holmes, W. Ε., et al. Science 1991, 253, 1278-1280; Murphy P. M., et al. Science, 253, 1280-1283; Neote, K. et al., Cell, 1993, 72, 415-425; Charo, I. F., et al., Proc. Natl. Acad. Sci. USA, 1994, 91, 2752-2756; Yamagami, S., et al., Biochem. Biophys. Res. Commun., 1994, 202, 1156-1162; Combadier, C, et al., The Journal of Biological Chemistry, 1995, 270, 16491-16494, Power, С Α., et al., J. Biol. Chem., 1995, 270, 1949519500; Samson, M., et al., Biochemistry, 1996, 35, 3362-3367; Murphy, P. M., Annual Review of Immunology, 1994, 12, 592-633). Повідомлялося, що запалення легенів і утворення іранулеми пригнічуються в CCR1-дефіцитних мишей (див. Gao, J.-L., et al., J. Exp. Med., 1997, 185, 1959; Gerard, C, et al., J. Clin. Invest., 1997, 100, 2022), і що рекрутування макрофагів і утворення атеросклеротичних ушкоджень знижувалося в дефіцитних по CCR2 мишей (див. Boring, L., et al., Nature, 1998, 394, 894; Kuziel, W Α., et al., Proc. Natl. Acad. Sci., USA, 1997, 94, 12053; Kurihara, Т., et al., J. Exp. Med., 1997, 186, 1757; Boring, L., et al., J. Clin. Invest, 1997, 100, 2552). Хсмокінові рецептори також відомі як співрецептори для проникнення вірусів, що приводить до вірусної інфекції, такої як, наприклад, інфекція ВІЛ. Зворотна транскрипція і процесинг білка являють собою класичні стадії вірусного жиггсвою циклу, що покликаний блокувати протиретровірусні терапевтичні засоби. Хоча багато нових лікарських засобів, які, як думають, блокують проникнення вірусів, залишаються перспективними, у цей час немає засобу, до якою ВІЛ-1 не здатний набути резистентності. Численні раунди реплікації віруса потрібні для генерування генетичної розмаїтості, що утворює основу стійкості. Комбінована терапія, при якій реплікація максимально пригнічена, залишається наріжним каменем лікування інгібіторами проникнення, а також іншими засобами. Спрямована дія на множинні стадії в процесі проникнення вірусу, як думають, має потенціал у плані синергії (Starr-Spires et al., Clin. Lab. Med., 2002, 22 (3), 681.) Проникнення ВІЛ-1 в CD4(+) клітини вимагає послідовних взаємодій вірусних оболонкових глікопротеїнів з CD4 і співрецептором, таким як хемокінові рецептори CCR5 і CXCR4. Підхід блокування даного процесу, що вселяє довіру, являє собою застосування низькомолекулярних антагоністів функції співрецептора. Молекула ТАК779 являє собою один з таких антагоністів CCR5, які запобігають інфекції ВІЛ-1. ТАК-779 інгібує реплікацію ВІЛ-1 на стадії злиття мембрани за рахунок блокування взаємодії глікопротеїну клітинної поверхні gp120 з CCR5. Ділянка зв'язування ТАК-779 на CCR5 розташована поблизу позаклітинної поверхні рецептора в порожнині, утвореній між трансмембранними спіралями 1, 2, 3 і 7 (Dragic et al., Proc. Natl. Acad. Sci. USA, 2000, 97(10), 5639). Хемокінові рецептори CXCR4 і CCR5, як думають, використовуються як сиіврецепгори 88466 12 штамами ВІЛ-1, тропними відносно Т-клітин (Х4) і макрофагів (R5), відповідно, для проникнення в їхні клітини хазяїна. Розмноження штамів R5 ВІЛ-1 на CD4 лімфоцитах і макрофагах вимагає експресії співрецептора CCR5 на клітинній поверхні. Суб'єкти, позбавлені CCR5 (гомозиготний фенотип CCR5 делыа 32), фенотипічно нормальні і стійкі до інфекції ВІЛ-1. Проникнення віруса може інгібуваіися натуральними лігандами CXCR4 (СХС-хемокін SDF-1) і CCR5 (СС-хемокіни RANTES, МІР-1альфа і МІР-1-бета). Перша непептидна сполука, що взаємодіє з CCR5, але не з CXCR4, являє собою похідне четвертинної солі амонію, називане ТАК-779, що також має потужну, але мінливу активність проти ВІЛ (De Clercq et al., Antivir. Chem. Chemother. 2001, 12 Suppl. 1, 19). SCН-C (SCH 351125) являє собою інший низькомолекулярний інгібітор проникнення ВІЛ-1 через співрецептор CCR5. SCH-C, сполуки оксимупіперидину, являє собою специфічний антагоніст CCR5, визначений у множинних аналізах зв'язування рецептора і трансдукції сигналу. Дана сполука специфічно інгібує інфекцію ВІЛ-1, опосередковану CCR5 у клітинах астрогліоми U87, але не має ефекту відносно інфекції клітин, що експресують CXCR4 (Strizki et al., Proc. Natl. Acad Sci. USA, 2001, 98(22), 12718 або Tremblay et al., Antimicrobial Agents and Chemotherapy, 2002, 46(5), 1336). ADI01, хімічно подібний до SCH-C, також інгібує проникнення віруса імунодефіциту людини типу 1 (ВІЛ-1) через людський CCR5 Виявлено, що AD101 інгібує проникнення ВІЛ-1 через CCR5 макаки-резуса, тоді як SCH-C цього не робить. Серед восьми залишків, які відрізняються в людському співрецсторі від білка макаки, тільки один, метіонін-198, робить внесок в інтенсивність інгібування CCR5 макаки за рахунок SCH-C. Положення 198 знаходиться в трансмембранній (ГМ) спіралі 5 CCR5 і не розташоване в раніше виявлених ділянках зв'язування AD101 і SCH-C, які торкаються залишків ТМ спіралей 1, 2, 3, і 7. Ґрунтуючись на дослідженнях амінокислотних замін в CCR5, передбачалося, що область CCR5 поблизу залишку 198 може впливати на конформаційний стан даного рецептора (Billick et al., 2004, J. Virol., 78(8), 4134). Відповідно, лікарські засоби, які інгібують зв'язування хемокінів з рецепторами, що відповідають їм, можуть використовуватися як фармацевтичні засоби, які інгібують дію хемокінів на клітини-мішені і/або блокують проникнення вірусів у клітини, що експресують дані рецептори. Ідентифікація сполук, які модулюю і ь активність хемокінових рецепторів або блокують зв'язування вірусних білків, представляє відмінний підхід до конструювання ліків для розробки фармакологічних засобів для лікування запальних захворювань, вірусних інфекцій і інших захворювань, асоційованих з активацією хемокінових рецепторів. Сполуки за даним винаходом можуть задовольнити ці і інші потреби. 13 Даний винахід стосується сполук формули І: або їх фармацевтично прийнятної солі або проліків, де замісники визначені тут. Даний винахід далі належить до композицій, що містять сполуки формули І і фармацевтично прийнятний носій. Даний винахід також належить до способів модулювання активності хемокшового рецептора, що включає взаємодію хемокінового рецептора із сполукою формули І. Даний винахід далі належить до способів лікування захворювання, асоційованого з експресією або активністю хемокінового рецептора в пацієнта, що включає введення зазначеному пацієнтові терапевтично ефективної кількості сполуки формули І. Даний винахід далі належить до способів лікування захворювання або стану, вибраного із запального захворювання, імунного порушення, і вірусної інфекції в пацієнта, що включає в себе введення зазначеному пацієнтові терапевтично ефективної кількості сполуки формули І. Даний винахід далі належить до способів лікування ВІЛ-інфекції в пацієнта, що включає введення зазначеному пацієнтові терапевтично ефективної кількості сполуки формули І. Даний винахід далі належить до застосування сполуки формули І у лікуванні. Даний винахід далі належить до застосування сполуки формули І для одержання лікарського засобу для застосування в лікуванні. Серед іншого, дана сполука належить до сполук формули І: або до їх фармацевтично прийнятної солі або проліків, де: R1 являє собою гетероарил, необов'язково заміщений одним або декількома R6; R2 являє собою Н. галоген, ціано, ні гро, С1С6алкіл, С1-С6галогеналкіл, С2-С6алкеніл, С2С6алкініл, арил, гетероарил, С3-С7циклоалкіл, гетероциклоалкіл. SOR7, SO2R7, COR8, OR9, SR9, COOR9, NR10R11 або NR10COR8; R3 являє собою F, СІ, Вr, І, С1-С4галогеналкіл, С1-С4галогеналкокси або гсгероарил; R4 являє собою Η, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл або С1-С6галогеналкіл; R5 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл або С1-С6галогеналкіл; R6 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, С1-С6алкокси, С1С6галогеналкокси, аміно, (С1-С6алкіл)аміно або ди(С1-С6алкіл)аміно; 88466 14 R7 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, арил, іетероарил, С3-С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл, (С3-С7циклоалкіл)алкіл, гетероциклоалкілалкіл або NR12R13; R8 являє собою Н, С1-С6алкіл, С1-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, арил, гетероарил, С3-С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл, (С3-С7циклоалкіл)алкіл, гетероциклоалкілалкіл, або NR12R13; R9 являє собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1-С6галогеналкіл, алкоксіалкіл, галогеналкоксіалкіл, арилоксіалкіл, гетероарилоксіалкіл, циклоалкілоксіалкіл, гетероциклоалкілоксіалкіл, арил, гетероарил, С3С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл; (С3-С7циклоалкіл)алкіл або гетероциклоалкілалкіл; R10 і R11 обидва незалежно являють собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1С6галогеналкіл, арил. гетероарил, С3С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл; (С3-С7циклоалкіл)алкіл або гетероциклоалкілалкіл; або R10 і R11 разом з атомом азоту, до якого вони приєднані, утворюють 3-, 4-, 5-, 6- або 7членну гетероциклоалкільну групу; R12 і Rb обидва незалежно являють собою Н, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С1С6галогсналкіл, арил, гетероарил, С3С7циклоалкіл, гетероциклоалкіл, арилалкіл, гетероарилалкіл; (С3-С7циклоалкіл)алкіл або гетероциклоалкілалкіл; або R12 і R13 разом з атомом азоту, до якого вони приєднані, утворюють 3-, 4-, 5-. 6- або 7члепну гстероциклоалкільну групу; і г являє собою 1, 2 або 3. У деяких варіантах здійснення R1 являє собою 5-, 6-, 9- або 10-членну гетероарильну групу, що містить щонайменше один атом N, що утворює кільце, де зазначена 5-, 6-, 9- або 10-членна гетероарильна група необов'язково заміщена 1, 2, 3 або 4 групами R6. У деяких варіантах здійснення R1 являє собою 9- або 10-членну гетероарильну групу, що містить щонайменше один атом N, що утворює кільце, де зазначена 6-члснна гетероарильна група необов'язково заміщена 1, 2, 3 або 4 групами R6. У деяких варіантах здійснення R1 являє собою 5- або 6-членну гетероарильну групу, що містить щонайменше один атом N, що утворює кільце, де зазначена 5-членна гетероарильна група необов'язково заміщена 1,2,3 або 4 групами R6. У деяких варіантах здійснення R1 являє собою 6-членну гетероарильну групу, що містить щонайменше один атом N, що утворює кільце, де зазначена 6-членна гетероарильна група необов'язково заміщена 1, 2, 3 або 4 групами R6. У деяких варіантах здійснення R1 являє собою 5-членну гетероарильну групу, що містить щонайменше один атом N, що утворює кільце, де зазначена 5-членна гетероарильна група необов'язково заміщена 1, 2, 3 або 4 групами R6. 15 У деяких варіантах здійснення R1 являє собою хінолініл, ізохінолініл, нафтиридиніл, індоліл, індазоліл, піридил, піримідиніл, N-оксопіридил, Nоксопіримідиніл, ізоксазол, піразол, піроліл, імідазоліл, оксазоліл або тіазоліл, причому кожний з них необов'язково заміщений 1, 2, 3 або 4 групами R6. У деяких варіантах здійснення R1 являє собою хінолініл, ізохінолініл, нафтиридиніл, піридил, піримідиніл, N-оксопіридил, ізоксазол або піразол, причому кожний з них необов'язково заміщений 1, 2, 3 або 4 групами R6. У деяких варіантах здійснення R1 являє собою піридил, піримідиніл, N-оксопіридил, Nоксопіримідиніл, ізоксазол, піразол, піроліл, імідазоліл, оксазоліл або тіазоліл, причому кожний з них необов'язково заміщений 1, 2, 3 або 4 групами R6. У деяких варіантах здійснення R1 являє собою піридил, піримідиніл, N-оксопіридил, ізоксазол або піразол, причому кожний з них необов'язково заміщений 1, 2, 3 або 4 групами R6. У деяких варіантах здійснення R1 являє собою: У деяких варіантах здійснення R1 являє собою: У деяких варіантах здійснення R1 являє собою: 88466 16 У деяких варіантах здійснення R1 являє собою: У деяких варіантах здійснення R1 являє собою: У деяких варіантах здійснення R2 являє собою Н, С1-С6алкіл, С1-С6галогеналкіл, OR9, SR9 або NR10R11. У деяких варіантах здійснення R2 являє собою Η або OR9. У деяких варіантах здійснення R3 являє собою F, Br, CF3, або 6- або 5-членний гетероарил. У деяких варіантах здійснення R3 являє собою F, Br, CF3, OCF3, тіазоліл, ніримідиніл, піридил. У деяких варіантах здійснення R3 являє собою F, Вr або CF3. У деяких варіантах здійснення R4 являє собою С1-С6алкіл. У деяких варіантах здійснення R4 являє собою метил. У деяких варіантах здійснення R5 являє собою С1-С6алкіл. У деяких варіантах здійснення R5 являє собою метил. У деяких варіантах здійснення r являє собою 1. У деяких варіантах здійснення r являє собою 2. У деяких варіантах здійснення сполуки за винаходом мають формулу llа або llb: У деяких варіантах здійснення сполук, що мають формулу llа або llb, R1 являє собою: У деяких варіантах здійснення R1 являє собою: 17 У деяких варіантах здійснення сполук, що мають формулу llа або llb, R1 являє собою: У деяких варіантах здійснення сполук, що мають формулу llа або llb, R1 являє собою: У деяких варіантах здійснення сполук, що мають формулу llа або llb, R1 являє собою: У деяких варіантах здійснення сполук, що мають формулу llа або llb, R2 являє собою Н, С1С6алкіл, С1-С6галогеналкіл, OR9, SR9 або NR10R11. У деяких варіантах здійснення сполук, що мають формулу llа або llb, R2 являє собою Η або OR9. У деяких варіантах здійснення сполук, що мають формулу llа або llb, R3 являє собою F. Br, CF3, 5- або 6-членний гетероарил. У деяких варіантах здійснення сполук, їло мають формулу IIа або IIb, R3 являє собою F, Вr, або CF3. Зрозуміло, що деякі характеристики винаходу, які для ясності описані в контексті окремих варіантів здійснення, можуть також надаватися в комбінації в одному варіанті здійснення. Навпаки, різні характеристики винаходу, які для стислості описані в контексті одного варіанта здійснення, можуть також надавати окремо або в будь-який прийнятній субкомбінації. Використовуваний тут термін «алкіл», як мається на увазі, стосується насиченої вуглеводневої групи, ланцюг якої нерозгалужений або розгалужений. Типові алкільні групи включають метил (Me), етил (Et), пропіл (наприклад, н-пропіл і ізопропіл), бутил (наприклад, н-бутил, ізобутил, втор-бутил, третбутил), пентил (наприклад, н-пентил, ізопентил, неопентил) тощо. Алкільна група може містити від 1 приблизно до 20, від 2 приблизно до 20, від 1 приблизно до 10, від 1 приблизно до 8, від 1 приблизно до 6, від 1 приблизно до 4, або від 1 приблизно до 3 атомів вуглецю. Використовуваний тут термін «алкеніл» стосується алькільної групи, що має один або декілька подвійних вуглець-вуглецевих зв'язків. Типові алкенільні групи включають етеніл. пропеніл, бутеніл, пентеніл, гексеніл, бутадієніл, пентадієніл, гексадієніл, тощо. Використовуваний тут термін «алкініл» стосується алкільної групи, що має один або 88466 18 декілька потрійних вуглець-вуглецевих зв'язків. Типові алкінільні групи включають етиніл, пропініл, бутиніл, пентиніл, тощо. Використовуваний тут термін «галогеналкіл» стосується алкільної групи, що має один або декілька галогенових замісників. Типові галогеналкільні групи включають CF3, C2F5, CHF2, ССl3, СНСl2, С2Сl5, тощо. Алкільна група, у якій всі атоми водню заміщені галогеновими атомами, може позначатися як «пергалогеналкіл». Типові пергалогеналкільні групи включають CF3 і C2F5. Використовуваний тут термін «арил» стосується моноциклічних або полі циклічних ароматичних вуглеводнів, таких як, наприклад, феніл, нафтил. антраценіл, фенантреніл, інданіл, інденіл, тощо. У деяких варіантах здійснення арильні групи мають від 6 приблизно до 18 вуглецевих атомів. Використовуваний тут термін «циклоалкіл» стосується неароматичних циклічних вуглеводнів, включаючи циклічні алкільні, алкенільні і алкінільні групи. Циклоалкільні групи можуть включати біабо поліциклічні кільцеві системи і можуть необов'язково містити ненасичені зв'язки. Типові циклоалкільні групи включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, циклогексадієніл, циклогептатриєніл, норборніл, норпініл, норкарніл, адамантил тощо. Також у визначення циклоалкілу включені радикали, які мають одне або декілька ароматичних кілець, конденсованих (тобто, що мають загальний зв'язок) із циклоалкільним кільцем, наприклад, бензопохідні циклопентану (інданіл), циклогексану (тетрагідронафтил), тощо. Цикліоалкільні групи можуть мати приблизно від 3 до 20, 3 до 12, або 3 до 7 вуглецевих атомів. Використовувані тут «гетероарильні» групи являють собою моноциклічні або поліциклічні ароматичні вуглеводні, що мають щонайменше один гетероатомний член кільця, такий як сірка, кисень або азот. Гетероарильні групи включають як необмежувальні приклади піридил, Nоксопіридил, піримідиніл, N-оксоніримідиніл, піразиніл, піридазиніл, триазиніл, нафтиридиніл, фурил, хіноліл, ізохіноліл, тієніл, імідазоліл, тіазоліл, індоліл, піроліл, оксазоліл, бензофурил, бензотієніл, бензтіазоліл, ізоксазоліл, піразоліл, триазоліл, тетразоліл, індазоліл, 1,2,4-тіадіазоліл, ізотіазоліл, бензотієніл, пуриніл, карбазоліл, бензімідазоліл, 2,3-дигідробензофураніл, 2,3дигідробензотієніл, 2,3-дигідробензотієніл-8-оксид, 2,3-дигідробензотієніл-8-діоксид, тощо. У деяких варіантах здійснення гетероарильні групи можуть мати від 1 приблизно до 20 вуглецевих атомів, і в подальших здійсненнях приблизно від 3 до 20 вуглецевих атомів. У деяких варіантах здійснення гетероарильні групи мають від 1 приблизно до 4, від 1 приблизно до 3 або від 1 до 2 гетероатомів. У деяких варіантах здійснення гетероарильна група має від 5 до 50, від 5 до 20, від 5 до 14 або від 5 до 7 членів кільця. У деяких варіантах здійснення гетероарильна група являє собою 5-, 6-, 9- або 10членну групу. У деяких варіантах здійснення 19 гетероарильна група містить щонайменше один кільцеутворювальний атом N. Використовуваний тут термін «гетероциклоалкіл» стосується неароматичного циклічного вуглеводню, включаючи циклічні алкільні, алкенільні і алкінільні групи, у якому один або декілька кільцеутворювальних атомів заміщені гетероатомом, таким як атом О, N або S. Типові гетероциклоалкільні групи включають піперидиніл, піролідиніл, морфолін, тетрагідрофураніл тощо. Також у визначення гетероциклоалкілу включені радикали, які мають одне або декілька ароматичних кілець, конденсованих (тобто, що мають загальний зв'язок) з нсароматичним гетероциклічним кільцем, наприклад, фталімідил, нафталімідил, піромелітиновий діімідил, фталаніл, і бензо-похідні насичених гетероциклів, таких як індоленова і ізоіндоленова групи. У деяких варіантах здійснення гетероциклоалкільна група має від 3 до 20, від 3 до 14 або від 3 до 7 членів кільця. Використовуваний тут термін «галоген» або «галогено» включає в себе фтор, хлор, бром і йод. Використовуваний тут термін «алкокси» стосується -О-алкільної групи. Типові алкоксигрупи включають метокси, етокси, пропокси (наприклад, н-пропокси і ізопропокси), трет-бутокси тощо. «Галогеналкокси» стосується –Ο-галогеналкільної групи. Використовуваний тут термін «арилалкіл» стосується алкільної групи, заміщеної щонайменше однією арильною групою. Типовою арилалкільною групою с бензил. Використовуваний тут термін «циклоалкілалкіл» стосується алкільної групи, заміщеної щонайменше однією циклоалкільною групою. Використовуваний тут термін «гетероарилалкіл» стосується алкільної групи, заміщеної щонайменше однією гетероарильною групою. Використовуваний тут термін «гетероциклоалкілалкіл» стосується алкільної групи, заміщеної щонайменше однією гетероциклоалкільною групою. Використовуваний тут термін «арилокси» стосується -О-арилу. Використовуваний тут термін «гетероарилокси» стосується -О-гетероарилу. Використовуваний тут термін «циклоалкілокси» стосується -О-циклоалкілу. Використовуваний тут термін «гетероциклоалкілокси» стосується -Огетероциклоалкілу. Використовуваний тут термін «алкоксіалкіл» стосується алкільної групи, заміщеної щонайменше однією алкоксигрупою. Типові алкоксіалкільні групи включають метоксиметил, метоксіетил, метоксипропіл тощо. Використовуваний тут термін «галогеналкоксіалкіл» стосується алкільної групи, заміщеної щонайменше однією галогеналкоксигрупою. 88466 20 Використовуваний тут термін «арилалкоксіалкіл» стосується алкільної групи, заміщеної щонайменше однією арилоксигрупою. Використовуваний тут термін «циклоалкілоксіалкіл» стосується алкільної групи, заміщеної щонайменше однією циклоалкілоксигрупою. Використовуваний тут термін «гетероарилоксіалкіл» стосується алкільної групи, заміщеної щонайменше однією гетероарилоксигрупою. Використовуваний тут термін «гетероциклоалкоксіалкіл» стосується алкільної групи, заміщеної щонайменше однією гетероциклоалкілоксигрупою. Використовуваний тут термін «аміно» стосується NH2. Подібним чином, термін «алкіламіно» стосується аміногрупи, заміщеної алкільною групою, а термін «діалкіламіно» стосується аміногрупи, заміщеної двома алкільними групами. Використовуваний тут термін «заміщений» вказує на те, що щонайменше один атом водню хімічної групи заміщений на радикал, що не належить до водню. Коли наведена тут хімічна група «заміщена», вона може мати до повного набору замісників, при забезпеченні того, що отримана в результаті сполука є стабільною або має стабільну структуру; наприклад, метальна група може бути заміщена 1, 2, або 3 замісниками, метиленова група може бути заміщена 1 або 2 замісниками, фенільна група може заміщатися 1, 2, 3, 4, або 5 замісниками, тощо. Описані тут сполуки можуть бути асиметричними (наприклад, мати один або декілька стереопенгрів). Маються на увазі всі стереоізомери, такі як енантіомери і діастереоізомери, крім зазначених інакше випадків. Сполуки за даним винаходом, які містять асиметрично заміщені атоми вуглецю, можуть виділятися в оптично активній формі або у вигляді рацемату. Способи одержання оптично активних форм із оптично активних вихідних матеріалів, наприклад, шляхом розрізнення рацемічних сумішей або шляхом стереоселективного синтезу, відомі в даній галузі. Багато геометричних ізомерів олефінів, подвійних зв'язків C=N, і тому подібного, також можуть бути присутніми в описаних тут сполуках, і всі такі стабільні ізомери стосуються даного винаходу. Цис- і транс-геометричні ізомери сполук за даним винаходом описані і можуть виділятися у вигляді суміші ізомерів або у вигляді окремих ізомерних форм. Розрізнення рацемічних сумішей сполук може проводитися будь-якими із численних способів, відомих у даній галузі. Типовий спосіб містить у собі фракційну перекристалізацію з використанням «кислоти, що розрізнює хіральність», що с оптично активною солеутворювальною органічною кислотою. Прийнятні розрізнювальні агенти для способів фракційної перекристалізації, являють собою, наприклад, оптично активні кислоти, такі як D- і L-форми винної кислоти, діацетилвинної кислоти, дибензоїлвинної кислоти, мигдальної кислоти, яблучної кислоти, молочної кислоти або 21 різних оптично активних камфорсульфонових кислот, таких як β-камфорсульфонова кислота. Інші розрізнювальні засоби, що підходять для способів фракційної перекристалізації, включаю і ь стереоізомерно чисті форми α-метилбензиламіну (наприклад, S- і R-форми, або діасіереомерно чисті форми), 2-фенілгліцинол, норефедрин, ефедрин, н-метилефедрин, циклогексилетиламін, 1,2-діаміноциклогексан тощо. Розрізнення рацемічних сумішей також може проводитися елюцісю на колонці, забитій оптично активним розрізнювальним агентом (наприклад, динітробензоїлфенілгліцином). Прийнятна композиція елююючого розчинника може визначатися фахівцем у даній галузі. Сполуки за винаходом також можуть включати таутомерні форми, такі як кето-енольні таутомери. Таутомерні форми можуть бути в рівновазі або стерично заблоковані в одній формі прийнятною заміною. Сполуки за винаходом також включають гідрати і сольвати. Сполуки за винаходом можуть також включати всі ізотопи атомів, що зустрічаються у вигляді проміжних сполук або кінцевих сполук. Ізотопи включають і і атоми, які мають те ж атомне число, але інші значення маси. Наприклад, ізотопи водню включають тритій і дейтерій. Вираз «фармацевтично прийнятний» застосовується тут для позначення тих сполук, матеріалів, композицій, і/або дозованих форм, які в рамках обґрунтованих медичних подань підходять для застосування в контакті із тканинами людських ісіоі і тварин без надлишкової токсичності, іритації, алергічної реакції, або інших проблем або ускладнень, порівнянний з обґрунтованим відношенням користь/ризик. Даний винахід також стосується фармацевтично прийнятних солей описаних іуг сполук. Використовуваний тут термін «фармацевтично прийнятні солі» сюсусгься похідних описаних сполук, де вихідна сполука модифікована перетворенням існуючого кислотного або основного залишку у форму йою солі. Приклади фармацевтично прийнятних солей включають як необмежувальні приклади мінеральні або органічні солі основних залишків, таких як аміни; лужні або органічні солі кислих залишків, таких як карбонові кислоти; тощо. Фармацевтично прийнятні солі за даним винаходом включають загальноприйняті не токсичні солі або четвертинні амонійні солі вихідної утвореної сполуки, наприклад, з нетоксичных неорганічних або органічних кислот. Фармацевтично прийнятні солі за даним винаходом можуть синтезуватися з вихідної сполуки, що містить основний або кислий радикал, загальноприйнятими хімічними методами. Загалом, такі солі можуть бути отримані шляхом взаємодії форм даних сполук у вигляді вільної кислоти або основи зі стехіометричною кількістю прийнятної основи або кислоти у воді або в органічному розчиннику або в їхній суміші; в основному, кращі неводні середовища, такі як простий ефір, етилацетат, етанол, ізопропанол, 88466 22 або ацетонітрил. Списки прийнятних солей знаходяться в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418 і в Journal of Pharmaceutical Science, 66, 2 (1977), причому кожне з даних джерел включене сюди повністю як посилання. Даний винахід також містить у собі проліки описаних гут сполук. Використовуваний тут термін «проліки» стосується будь-яких ковалентно зв'язаних носіїв, які вивільняють активні кінцеві ліки при введенні суб'єктові-ссавцеві. Проліки можуть бути отримані модифікацією функціональних груп, що є присутніми у сполуках таким шляхом, що модифікації відщеплюються, шляхом рутинних маніпуляцій або in vivo, від кінцевих сполук. Проліки включають сполуки, у яких гідроксильні, аміно-, сульфгідрильні або карбоксильні групи зв'язані з будь-якою групою, що при введенні суб'єктові-ссавцеві відщеплюється з утворенням вільної гідроксильної, аміно-, сульфгідрильної або карбоксильної групи, відповідно. Необмежувальні приклади пролікарських засобів включають ацетатні, форміатні і бензоатні похідні функціональних спиртових і аміногруп у сполуках по винаходу. Одержання і застосування проліків обговорюється в Τ lliguchi and V. Stella, "Pro-drugs as Novel Delivery Systems, " Vol.14 of the A.C.S Symposium Scries, і в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987. причому обидва дані джерела включені сюди повністю як посилання. Синтез Сполуки по винаходу, включаючи їхні солі, гідрати і сольвати, можуть бути отримані з використанням відомих способів органічного синтезу і можуть синтезуватися за кожним з можливих численних шляхів синтезу. Взаємодії для одержання сполук за винаходом можуть проводитися в прийнятних розчинниках, які можуть бути легко вибрані фахівцем в галузі органічного синтезу. Прийнятні розчинники, по суті, можуть не взаємодіяти з вихідними речовинами (реагентами), проміжними продуктами або продуктами при температурах проведення взаємодій, наприклад, при температурах, які можуть мінятися від температури плавлення до температури кипіння розчинника. Дана взаємодія може проводитися в одному розчиннику або в суміші більше одного розчинника. Залежно від конкретної стадії взаємодії, можуть бути вибрані прийнятні розчинники для конкретної стадії взаємодії. Одержання сполук за винаходом може включати захист або зняття захисту з різних хімічних груп.Потреба в захисті і знятті захисту і вибір прийнятних захисних груп може легко визначатися фахівцем у даній галузі. Відомості про хімію захисних груп можуть бути знайдені, наприклад, в Т. W. Green and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd. Ed., Wiley & Sons, Inc., New York (1999), причому дане джерело включене сюди повністю як посилання. 23 88466 24 Моніторинг взаємодій може проводитися будьяким відповідним способом, відомим у даній галузі. Наприклад, моніторинг утворення продукту може проводитися за допомогою спектроскопії, наприклад, шляхом спектроскопії ядерного магнітного резонансу (наприклад, 1H або 13С), інфрачервоної спектроскопії, спектрофотометрії (наприклад, УФ-видимої), або мас-спектрометрії, або шляхом хроматографії, такої як високоефективна рідинна хроматографія (ВЕРХ) або тонкошарова хроматографія. Типові шляхи синтезу сполук за винаходом наведені нижче на схемах 1-5, де складові члени зображених формул визначені в даному описі. Проміжні інданони формули 1-8 можуть синтезуватися з використанням процедур, показаних на схемі 1. Наприклад, бензальдегід 1-3 може утворитися депротонуванням бромбензолу (1-1) сильною основою, такою як 2,2,6,6гетрамегилпіперидин/н-бутиллітій з наступним гасінням, наприклад, за рахунок DMF. Альтернативно, бензальдегід 1-3 може утворитися відновленням бензонітрилу (1-2) з використанням відповідного відновлювального агента, такого як гідрид діізобутилалюмінію (DIBAL). Після відновлення альдегіду до спирту з використанням наступного відновлювального агента, такого як борогідрид натрію, отриманий спирт 1-4 може перетворюватися в хлорид обробкою прийнятним агентом, що хлорує, таким як тіонілхлорид. Заміщення хлориду 1-5 діетилмалонатом з використанням прийнятної основи (наприклад, гідриду натрію) приводить до одержання складного діефіру 1-6. Омилення складного діефіру з використанням основи, такої як гідроксид натрію, з наступним декарбоксилюванням, дає монокарбонову кислоту 1-7. Обробка 1-7 прийнятним циклізуючим агентом, таким як нбутиллітій, приводить до одержання циклічного продукту індан-1-ону 1-8. Проміжні продукти формули 2-6 можуть синтезуватися з використанням способів, показаних на схемі 2. Кетонове похідне формули 2-1 може піддаватися відновленню з використанням відповідного відновлювального агента, такого як борогідрид натрію, з одержанням спирту 2-2. Після перетворення спирту в хлорид з використанням відповідного агента, що хлорує, такого як SOCІ2, хлорид 2-3 взаємодіє з похідним піперазину формули 2-4 з одержанням 2-5. 25 88466 26 Видалення захисної групи Вос з використанням кислоти, такої як 4Η НСІ у діоксані приводить до одержання проміжних продуктів формули 2-6. Проміжні продукти формули 3-4 можуть бути отримані з використанням послідовності дій, показаної на схемі 3. Проміжний спирт 2-2 піддають дегідруванню в прийнятних умовах (наприклад, p-TsOH, кип'ятіння в толуолі зі зворотним холодильником) з одержанням індену 3-1. Епоксидування з використанням прийнятного окислювача, такого як трет-бутилгідропероксид дає епоксид 3-2. Відкриття кільця епоксиду піперазиновим похідним формули 2-4 надає 3-3. Алкілування спирту в 3-3 алкілуючим агентом, таким як алкілйодид (RI) з наступним видаленням Вос з використанням кислоти, дає проміжні продукти формули 3-4 (у якій R являє собою алкільну групу). Сполуки формули 4-4 можуть бути отримані процедурами, описаними на схемі 4. Взаємодія похідного піперазину формули 4-1 із захищеним піперидином формули 4-2 (Рr являє собою захисну групу аміногрупи, таку як Вос) надає похідне 4-3. Після видалення захисної групи аміногрупи (Рr) з використанням прийнятного реагенту (наприклад, кислоти, такої як 4 Η НСl у діоксані), отриманий вільний амін може бути приєднаний до карбонової кислоти з використанням відповідного агента приєднання, такого як ВОР, з одержанням сполук формули 4-4. 27 88466 28 Сполуки формули 5-4 можуть бути отримані з використанням процедур, описаних на схемі 5. Взаємодія похідного піперазину формули 5-1 із трет-бутил-4-оксо-1-піперидинкарбоксилатом з наступною обробкою ціанідом діетилалюмінію приводить до утворення ціанопохідного 5-2. Заміщення ціанового залишку бромідом метилмагнію дає 5-3. Після видалення Вос-групи з використанням кислоти, такої як 4Η НСl у діоксані, отриманий в результаті амін може приєднуватися до карбонової кислоти з використанням агента приєднання, такого як ВОР, з одержанням сполук формули 5-4. 4,6-диметилпіримідин-5-карбонові кислоти (65) можуть бути отримані з використанням процедур, показаних на схемі 6. Взаємодія етилацетоацетату з діетилацеталем кетену в присутності основи, такої як етоксид натрію, дає проміжний продукт 6-3. Циклізація 6-3 ацетатом формамідину надає етиловий складний ефір 6-4, що омилюється з одержанням карбонової кислоти 6-5. Альтернативно, сполуки формули І можуть синтезуватися з використанням процедур, показаних на схемах 7-9. Обробка літієм похідного бензальдегіду 7-1 за допомогою н-бутиллітію в присутності Ν,Ν,Ν'-триметилетан-1,2-діаміну з наступним гасінням алілбромідом надає похідне алілу 7-2. Після перетворення альдегіду в олефін обробкою Рh3РСН3Вr/н-ВuLi, 7-3 циклізують з використанням каталізатора Grubbs з одержанням похідного індену 7-4. Асиметричне епоксидування з використанням каталізатора Jacobsen приводить до одержання епоксиду 7-5. Алкілування 4-Вос-2-метилпіперазину 8-1 бензилбромідом з наступним видаленням Вос з використанням кислоти, такої як НСl, надає 8-3. Проміжний продукт 8-3 може перетворюватися в 84 з використанням способу, описаного на схемі 5. Видалення бензильної групи в 8-4 гідруванням з використанням каїалізагора Pd(OH)2 приводить до одержання проміжного продукту 8-5. 29 88466 30 Проміжні продукти 7-5 і 8-5 можуть конденсуватися при підвищеній температурі в такому розчиннику, як етанол, з утворенням проміжного продукту 9-1, як показано на схемі 9. Алкілування отриманого спирту R9I може проводитися з використанням основи, такої як гідрид натрію. Після видалення Вос-групи в 9-2, приєднання отриманого в результаті аміну до RCO2H з використанням агента приєднання, такого як EDCI, надає сполуки формули 9-3. Альтернативно, сполуки формули І можуть бути отримані, як показано на схемі 10. Похідне бензальдегіду 7-1 може алкілуватися обробкою нбутиллітієм у присутності N,N,N'-триметилетан1,2-діаміну з наступним гасінням акролеїном. Отриманий у результаті напівацеталь 10-1 може перетворюватися в олефін обробкою Рh3РСН3Вr/н-бутиллітієм. Циклізація з використанням каталізатора Grubbs дає похідне 3гідроксііндену 10-3, що може піддаватися окислюванню з використанням окислювача, такого як хлорхромат піридинію (РСС). Приєднання по Michael проміжного продукту 8-5 до отриманого в результаті кетону 10-4 дає проміжний продукт 105. Після відновлення кетону до спирту алкілування R9 і може проводитися з використанням основи, такої як гідрид натрію. Видалення Вос з наступним приєднанням до R1CO2H з використанням агента приєднання, такого як EDCI/HOBt, дає сполуки формули 10-7. Способи У деяких варіантах здійснення, сполуки за винаходом можуть змінювати активність одного або більше хемокінових рецепторів. Термін «змінювати» стосується здатності збільшувати або зменшувати активність рецептора. Відповідно, сполуки за винаходом можуть використовуватися в способах зміни хемокінових рецепторів шляхом контакту рецептора з однією або більше сполуками або сумішами, описаними тут. У деяких варіантах здійснення, сполуки за даним винаходом можуть діяти як інгібітори хемокінових рецепторів. В інших варіантах здійснення, сполуки за винаходом можуть застосовуватися для зміни активності хемокінових рецепторів індивідуума при необхідності зміни рецептора шляхом введення кількості, що змінює, сполуки формули І. У деяких варіантах здійснення, сполуки за винаходом можуть зв'язуватися з хсмокіновим рецептором таким чином, що блокують або інгібують зв'язування ендогенних і інших лігандів хемокінових рецепторів. У деяких варіантах здійснення, сполуки за винаходом можуть блокувати або інгібувати зв'язування екзогенних лігандів, що включають у себе вірусні білки, залучені в проникнення вірусу в клітини, що експресують хемокінові рецептори. Відповідно, сполуки за винаходом можуть блокувати проникнення вірусу і інгібувати вірусну інфекцію. У деяких варіантах здійснення, сполуки за винаходом можуть інгібувати інфікування вірусом імунодефіциту людини (ВІЛ) шляхом, наприклад, блокування взаємодії хемокінових рецепторів 31 (наприклад, CCR5) із глікопротеїном120 (gp120) ВІЛ. Хемокінові рецептори, з якими дані сполуки зв'язуються і/або змінюють їх, включають будь-які хемокінові рецептори. У деяких варіантах здійснення, хемокінові рецептори належать до сімейства хемокінових рецепторів СС, містячи в собі, наприклад, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7 і CCR8. У деяких варіантах здійснення, хемокіновим рецептором є CCR2. У деяких варіантах здійснення, хемокіновим рецептором є CCR5. Сполуки за винаходом можуть бути вибірковими. Під терміном «вибірковий» мається на увазі, що сполука зв'язується або інгібує один хемокіновий рецептор з більшою спорідненістю або силою, відповідно, у порівнянні з щонайменше одним іншим хемокіновим рецептором. Сполуки за винаходом можуть вибірково зв'язуватися з CCR5, що означає, що сполуки за винаходом можуть зв'язуватися з CCR5 з більшою спорідненістю, ніж з іншим хемокіновим рецептором, таким як щонайменше один з CCR1, CCR2, CCR3, CCR4, CCR6, CCR7 і CCR8. У деяких варіантах здійснення, сполуки за винаходом мають зв'язувальну вибірковість до CCR5, більшу, ніж до CCR2. У деяких варіантах здійснення, сполуки за винаходом мають зв'язувальну вибірковість до CCR5, більшу, ніж до CCR1. У деяких варіантах здійснення, сполуки за винаходом мають зв'язувальну вибірковість до CCR5, більшу, ніж до будь-яких інших CCR Вибірковість може бути щонайменше приблизно, 10-кратною щонайменше приблизно, 20-краіною щонайменше приблизно, 50-кратною щонайменше приблизно, 100-кратною щонайменше приблизно, 200-кратною щонайменше приблизно, 500кратною або щонайменше приблизно, 1000кратною. У деяких варіантах здійснення, сполуки за винаходом мають зв'язувальну спорідненість до CCR5, що щонайменше приблизно, 10-кратно щонайменше приблизно, 20-кратно щонайменше приблизно, 50-кратно щонайменше приблизно, 100-кратно щонайменше приблизно, 200-кратно щонайменше приблизно, 500-кратно або щонайменше приблизно, 1000-кратно перевищує зв'язувальну спорідненість до CCR1, CCR2 або до будь-якого іншого хемокінового рецептора. Зв'язувальна спорідненість може бути виміряна відповідно до рутинних способів, відомих в науці, таких, як аналізи, наведені тут. У деяких варіантах здійснення, сполуки за винаходом можуть бути вибірковими інгібіторами CCR5, тобто сполуки за винаходом можуть інгібувати активність CCR5 більш сильно, ніж щонайменше одного іншого хемокінового рецептора, такого як, наприклад, CCR1, CCR2, CCR3, CCR4, CCR6, CCR7 і CCR8. У деяких варіантах здійснення, сполуки за винаходом мають інгібуючу вибірковість до CCR5, більшу, ніж до CCR2. У деяких варіантах здійснення, сполуки за винаходом мають інгібуючу вибірковість до CCR5, більшу, ніж до CCR1. У деяких варіантах здійснення, сполуки за винаходом мають інгібуючу вибірковість до CCR5, більшу, ніж до будь-яких 88466 32 інших CCR Вибірковість може бути щонайменше приблизно. 10-кратною щонайменше приблизно, 20-кратною щонайменше приблизно, 50-кратною щонайменше приблизно, 100-кратною щонайменше приблизно, 200-кратною щонайменше приблизно, 500-крагною або щонайменше приблизно, 1000-кратною. У деяких варіантах здійснення, сполуки за винаходом мають інгібуючу спорідненість до CCR5, що щонайменше приблизно, 10-кратно щонайменше приблизно, 20-кратно щонайменше приблизно, 50кратно щонайменше приблизно, 100-кратно щонайменше приблизно, 200-кратно щонайменше приблизно, 500-кратно або щонайменше приблизно, 1000-крашо перевищує зв'язувальну спорідненість до CCR1, CCR2 або до будь-якого іншого хемокінового рецептора. Інгібуюча здатність може бути виміряна відповідно до рутинних способів, відомих в науці, таких, як аналізи, наведені тут. Інший аспект даного винаходу стосується способів лікування захворювань або порушень, пов'язаних з хемокіновими рецепторами, в індивідуума (наприклад, пацієнта) шляхом введення індивідуумові, при необхідності такого лікування, терапевтично ефективної кількості або дози сполуки за даним винаходом, або її фармацевтичного препарату. Захворювання, пов'язані з хемокіновими рецепторами, можуть включати будь-яке захворювання, порушення або умову, що прямо опосередковано пов'язане з експресією або активністю хемокінових рецепторів. Захворювання, пов'язані з хемокіновими рецепторами, можуть також включати будь-яке захворювання, порушення або умову, що може бути відвернене, вилікуване або перебіг якого може бути полегшений шляхом зміни активності хемокінових рецепторів. Захворювання, пов'язані з хемокіновими рецепторами, можуть, крім того, включати будь-яке захворювання, порушення або умову, що характеризується зв'язуванням інфекційного агента, такого як вірус або вірусний білок, з хемокіновими рецепторами. У деяких варіантах здійснення, захворювання, пов'язане з хемокіновими рецепторами, є ССR5зв'язаним захворюванням, таким як інфекція ВІЛ. Приклади захворювань, порушень або умов, пов'язаних з хемокіновими рецепторами, включають запалення або запальні захворювання, імунні порушення і вірусні інфекції. Приклади запальних захворювань включають захворювання, що мають запальний компонент, такі як астма, алергічний риніт, рестеноз, атеросклероз, множинний склероз, хвороба Крона, виразковий коліт, гіперчутливі захворювання легенів, алергічний пневмоніт, еозинофільна пневмонія, гіперчутливість уповільненого типу, астма, інтерстиціальна хвороба легенів (ІХЛ) (наприклад, ідіопагичний легеневий фіброз або ІХЛ, пов'язана з ревматоїдним артритом. системним червоним вовчаком, анкілозуючим спондилітом, системним склерозом, синдромом Шегрена, поліміозитом або дерматоміозитом) і подібні захворювання. Приклади імунних порушень включають ревматоїдний артрит, псоріатичний артрит, 33 системний червоний вовчак, злоякісну міастенію, юнацький діабет; гломерулонефрит, аутоімунний тиреоїдит, реакцію відторгнення трансплантата. що включає в себе відторгнення алотрансплантата і хворобу трансплантат-протихазяїна. Приклад вірусної інфекції включає в себе інфекцію ВІЛ. Використовуваний тут термін «взаємодія» стосується спільної доставки зазначених агентів у системі in vitro або in vivo. Наприклад, «взаємодія» хемокінових рецепторів із сполукою за винаходом включає в себе введення сполуки за даним винаходом індивідуумові або пацієнтові, наприклад, людині, що маг хемокінові рецептори, так само, як і, наприклад, введення сполуки за винаходом в зразок, що містить клітинний або очищений препарат, що містить хемокінові рецептори. Використовувані тут терміни «індивідуум» або «пацієнт», застосовувані поперемінно, стосуються будь-якої тварини, включаючи в себе ссавців, переважно мишей, щурів, інших гризунів, кроликів, собак, кішок, свиней, корів, овець, коней або приматів, а найбільш переважно - людей. Використовувана тут фраза «терапевтично ефективна кількість» стосується кількості активної сполуки або фармацевтичного агента, що викликає біологічну або медичну відповідь у тканині, системі, тварині, індивідуумі або людині, очікувана дослідником, ветеринаром, лікарем або іншим клініцистом, що включає в себе одне або більше з наступного: (1) запобіганнязахворюванню; наприклад, запобігання захворюванню, умові або порушенню в індивідуума, що може бути схильний до захворювання, умови або порушення, але ще не піддався йому, або не проявляє патологічних або симптоматичних ознак хвороби; (2) пригнічення захворювання; наприклад, пригнічення захворювання, умови або порушення в індивідуума, що піддався або проявляє патологічні або симптоматичні ознаки захворювання, умови або порушення (наприклад, припинення подальшого розвитку патології і/або симптоматології), таке як стабілізація вірусного навантаження у випадку вірусної інфекції; і (3) полегшення перебігу захворювання; наприклад, полегшення перебігу захворювання, умови або порушення в індивідуума, що піддався або проявляє патологічні або симптоматичні ознаки захворювання, умови або порушення (наприклад, зворотний розвиток патології і/або симптоматології), таке як зниження вірусного навантаження у випадку вірусної інфекції. Один або більше інших фармацевтичних агентів, таких як, наприклад, антивірусні агенти, антитіла, антизапальні агенти і/або імуносупресори можуть бути використані в комбінації із сполукою за даним винаходом для лікування захворювань, порушень або умов, пов'язаних з хемокіновими рецепторами. Агенти можуть комбінуватися з даними сполуками в єдиній формі дозування або можуть вводитися одночасно або окремо як особливі форми дозування. 88466 34 За припущенням, антивірусні агенти, придатні для використання в комбінації із сполуками за даним винаходом, можуть містити нуклеозидні і нуклеотидні інгібітори зворотної транскриптази (NRTIs), ненуклеозидні інгібітори зворотної іранскриитази (NNRTIs), інгібітори протеаз і інші антивірусні ліки. Приклад прийнятних NRTIs включає в себе зидовудин (AZT); диданозин (ddl); зальцитабін (dd); ставудин (d4T); ламівудин (ЗТС); абакавір (1592U89); дипівоксил адефовіру [bis(POM)PMEA]; лобукавір (BMS-180194); ВСН-10652; емітрициіабін f(-)-FTC]; бета-1-FD4 (також називаний бета-1-D4С і бета-1-2',3'-диклеокси-5фтороцитидин); DAPD, ((-)-бета-0-2,6,діамінопурин діоксолан); і лоденозин (Fdd). Типові прийнятні NNRTIs включають невірапін (BI-RG-587); делавірадин (ВНАР, U-90152); ефавіренц (DMP-266); PNU-142721; AG-1549; МKС-442 (1-(етокси-метил)-5-(1-метилетил)-6(фенілметил)-(2,4(1Н,3Н)-піримідин недіон); і (+)каланолід A (NSC-675451) і В. Типові прийнятні інгібітори протеаз включають саквінавір (Ro 31-8959): ритонавір (АВТ-538); індинавір (МК-639); нелфінавір (AG-1343); ампренавір (141W94); лазинавір (BMS-234475); DMP-450; BMS-2322623; АВТ-378; і AG-1549. Інші антивірусні агенти включають гідроксисечовину, рибавірин, IL-2, IL-12. пентафусид і Yissum Project No.11607. У деяких варіантах здійснення, протизапальні і знеболювальні агенти, які за припущенням можуть бути використані в комбінації із сполукою за даним винаходом, можуть містити, наприклад, опіатний агоніст, інгібітор ліпоксигенази, такий як інгібітор ліпоксигенази-5, інгібітор циклооксигенази, такий як інгібітор циклооксигснази-2, інгібітор інтерлейкіну, такий як інгібітор інтерлейкіну-І, антагоніст NNMA, інгібітор оксиду азоту або інгібітор синтезу оксиду азоту, нестероїдний протизапальний агент або цитокін-супресорний протизапальний агент, наприклад, такий, як ацетамінофен, аспірин, кодеїн, фентаніл, ібупрофен, індометацин, кеторолак, морфін, напроксен, фенацетин, піроксикам, стероїдні знеболювальні, суфентаніл, сунліндак, тенідап і подібні агенти. Подібним чином, необхідні сполуки можуть вводитися зі знеболювальним; з агентом, що потенціює, таким як кофеїн, Н2-антагоніст, симетикон, гідрохлорид алюмінію або магнію; із противонабряковим агентом, таким як фенілефрин, фенілпропаноламін, псевдоефедрин, оксиметазолін, епінефрин, нафазолін, ксилометазолін, пропілгекседфін або леводезоксіефедрин; із протикашльовим агентом, таким як кодеїн, гідрокодон, караміфен, карбетапентан або декстраметорфан; з діуретиком; і із седативним або неседативним антигістамінним агентом. В деяких варіантах здійснення, фармацевтичні агенти, які за припущенням можуть бути використані в комбінації із сполукою за даним винаходом, можуть містити (а) антагоністи VLA-4, такі як описані в патентах США 5510332, WО 95/15973, WО 96/01644, WО 96/06108, WО 35 96/20216, WО 96/229661, WО 96/31206, WО 96/4078, WО 97/030941, WО 97/022897, WО 98/426567, WО 98/53814, WО 98/53817, WО 98/538185, WО 98/54207, і WО 98/58902; (b) стероїди, такі як беклометазон, метилпреднізолон, бетаметазон, преднізон, дексаметазон і гідрокортизон, (с) імуносупресанти, такі як циклоспорин, такролімус, рапаміцин і інші імуносупресанти типу FK506; (d) антигістамінні агенти (антагоністи НІ-гістаміну), такі як бромофенірамін, хлорфенірамін, дексхлорфенірамін, трипролідин, клемастин, дифенгідрамін, дифенілпіралін, трипеленнамін, гідроксизин, метдилазин, прометазин, тримепразин, азатадин, ципрогептадин, антазолін, піриламін феніраміну, астемізол, терфенадин, лоратадин, цетиризин, фексофенадин, десербоетоксилоратадин і подібні агенти; (е) нестероїдні антиастматичні агенти, такі як тербуталін, метапротсренол, фенотерол, ізоетаїн, албуіерол, бітолтерол, пірбутерол, теофілін, кромолін натрію, атропін, бромід іпратропіуму. антагоністи лейкотриєнів (наприклад, зафірлукаст, монтелукаст, пранлукаст, іралукаст, побілукаст, SKB-106203), інгібітори біосинтезу лейкогриєнів (наприклад, зилейтон, BAY-1005); (f) нестероїдні протизапальні агенти (NSAIDs), такі як похідні пропіонової кислоти (наприклад, альмінопрофен, беноксапрофен, буклоксова кислота, карпрофен. фенбуфен, фенопрофен, флюпрофен, флюрбіпрофен, ібупрофен, індопрофен, кетопрофен. міропрофен, напроксен. оксапрозин, пірпрофен, пранопрофен, супрофен, тіапрофенова кислота і тіоксапрофен), похідні оцтової кислоти (наприклад, індометацин, ацеметацин, алклофенак, кліданак, диклофенак, фенклофенак, фенклозова кислота, фентіазак, фурофенак, ібуфенак, ізоксепак, окспінак, суліндак, тіопінак, толметин, зидометацин і зомепірак), похідні фенамової кислоти (флуфенамова кислота, меклофенамова кислота, мефенамова кислота, ніфлумова кислота і толфенамова кислота), похідні біфенілкарбоксилової кислоти (наприклад, дифлюнізал і флюфенізал), оксиками (ізоксикам, піроксикам, судоксикам і теноксикам), саліцилати (ацегилсаліцилова кислота, сульфазалазин) і піразолони (апазон, безпіперилон, фепразон, мофебутазон, оксифенбутазон, фенілбутазон); (g) інгібітори циклооксигенази-2 (СОХ-2); (h) інгібітори фосфодіестерази типу IV (PDB-IV); (і) інші антагоністи хемокінових рецепторів, особливо CXCR-4, CCRI, CCR2, CCR3 і CCR5; (j) агенти, що знижують рівень холестерину, такі як інгібітори ГМГ-КоА редуктази (ловастатин, симвастатин і правастатин, флювастатин, аторвастатин і інші статини), секвестранти (холестирамін і холестипол), нікотинова кислота, похідні фенофіброєвої кислоти (гемфіброзил, клофібрат, фенофібраг і бензафібрат) і пробукол; (k) антидіабетичні агенти, такі як інсулін, сульфонілсечовина, бігуаніди (метформін), інгібітори U-глюкозидази (акарбоза) і орлітазони (троглітазон і піоглітазон); (l) препарати бетаінтерферону (інтерферон бета-1о., інтерферон 88466 36 бета-1P); (m) інші сполуки, такі як аміносаліцилові кислоти, антиметаболіти, такі як азатіоприн і 6меркаптопурин, і цитотоксичні агенти ракової хіміотерапії. Вагове співвідношення сполуки за даним винаходом до другого активного інгредієнта може розрізнятися і залежить від ефективної дози кожного інгредієнта. Фармацевтичні прописи і форми дозування Сполуки формули І, коли використовуються як фармацевтичні препарати, можуть вводитися у формі фармацевтичних сумішей. Ці суміші готовлять способом, добре відомим у фармацевтичній науці, і вводять різними шляхами, залежно від того, місцеве або системне потрібне лікування і від галузі лікування. Введення може бути місцеве (що включає в себе внутрішньоочне і у слизові оболонки, включаючи інтраназальне, вагінальне і ректальне введення), пульмонарне (наприклад, шляхом інгаляції або інсуфляції порошків або аерозолів, що включають у себе небулайзер; інтратрахеальне, інтраназальне, епідермальне і трансдермальне). очне, оральне і парентеральне. Способи очного введення можуть включати місцеве введення (очні краплі), субкон'юнктивальні, періокулярні ін'єкції або ін'єкції в скловидне тіло, або введення через балонний катетер, або хірургічне введення в кон'юнктивальний мішок. Парентеральне введення включає в себе внутрішньовенні, внутріартеріальні, підшкірні, інтраперитонеальні або внутрім'язові ін'єкції або інфузії; або інтракраніальні, наприклад, інтратекальні або інтравентрикулярні, введення. Парентеральне введення може бути у формі одиничної болюсної дози або може проводитися, наприклад, за допомогою постійного перфузійного насоса. Фармацевтичні суміші і прописи для місцевого введення можуть включати трансдермальні пластири, мазі, лосьйони, креми, гелі, краплі, свічі, спреї, розчини і порошки. Загальноприйняті фармацевтичні носії на водній, порошковій або масляній основі, загусники і подібні речовини можуть бути необхідні або бажані. Даний винахід також включає в себе фармацевтичні суміші, які містять, як активні інгредієнти, одну або більше сполук формули І, зазначених вище, в комбінації з одним або більше фармацевтично придатним носієм При одержанні суміші за винаходом активний інгредієнт звичайно змішують із наповнювачем, розводять наповнювачем або поміщають у такий носій у формі, наприклад, капсули, пакета, паперу або іншого контейнера. Коли наповнювач використовують як розріджувач, він може бути густим, напівгустим або рідким, котрий діє як транспортний засіб, носій або середовище для активного інгредієнта. Таким чином, суміші можуть бути у формі таблеток, пігулок, порошків, ромбів, пакетів, еліксирів, суспензій, емульсій, розчинів, сиропів, аерозолів (на твердій або рідкій основі), мазей, що містять, наприклад, до 10% по вазі активного компонента, м'яких або твердих желатинових капсул, свіч, стерильних розчинів для ін'єкцій і стерильно упакованих порошків. 37 При приготуванні пропису активну сполуку обробляють для одержання частинок потрібного розміру перед комбінацією з іншими інгредієнтами. Якщо активна сполука переважно нерозчинна, її обробляють для одержання частинок розміром менше 200 мені Якщо активна сполука переважно водорозчинна, розмір частинок коректують шляхом обробки для досягнення по можливості однотипного розподілу в прописі, наприклад, близько 40меш. Деякі приклади прийнятних наповнювачів включають лактозу, декстрозу, сахарозу, сорбіт, маніт, крохмаль, аравійську камедь, фосфат кальцію, альгінати, трагакант, желатин, силікат кальцію, мікрокристалічну целюлозу, полівінілпіролідон, целюлозу, воду, сироп і метилцелюлозу. Пропис може додатково включати: лубрикантні агенти, такі як тальк, стеарат магнію і мінеральне масло; зволожувальні агенти; емульгуючі і суспендуючі агенти; і ароматизуючі агенти. Суміш за винаходом складають таким чином, щоб викликати швидке, тривале або відстрочене вивільнення активного інгредієнта після введення пацієнтові шляхом використання способів, відомих у науці. Суміш може бути виготовлена у вигляді стандартної лікарської форми, коли кожна доза містить від, приблизно, 5 до, приблизно, 100мг, частіше - від, приблизно, 10 до, приблизно, 30мг активного інгредієнта. Термін «стандартна лікарська форма» стосується фізично відособленої дози, придатної для окремого дозування людським суб'єктам і іншим ссавцям, при цьому кожна доза містить певну кількість активного матеріалу, розраховану для викликання бажаного терапевтичного ефекту, у сполученні із прийнятним фармацевтичним наповнювачем. Активна сполука може бути ефективною у широкому діапазоні дозувань і звичайно вводиться у фармацевтично ефективній кількості. Повинно бути зрозуміло, однак, що кількість сполуки, що вводиться, повинна бути визначена лікарем, відповідно до конкретних обставин, що включають у себе стан, що піддасться лікуванню, вибраний спосіб введення, конкретну сполуку, що вводиться, вік, вагу і індивідуальну відповідь пацієнта, тяжкість симптомів пацієнта тощо. Для одержання густих складів, таких як таблетки, основні активні компоненти змішують із фармацевтичним наповнювачем для формування густої попередньої суміші, що містить гомогенну суміш сполуки за даним винаходом. Коли попередню суміш оцінюють як гомогенну, активний інгредієнт звичайно рівномірно розподілений по всій суміші, так що суміш може бути легко розділена на однаково ефективні стандартні лікарські форми, такі як таблетки, пігулки і капсули. Цю густу попередню суміш потім розділяють на стандартні лікарські форми описаних вище типів, що містять від, наприклад, 0,1 до, наприклад, 500мг активного інгредієнта за даним винаходом. Таблетки або пігулки за даним винаходом покривають або іншим способом обробляють для того, щоб дана форма дозування могла проявити 88466 38 переваги продовженої дії. Наприклад, таблетки або пігулки можуть містити внутрішній і зовнішній компоненти дози, при цьому останній являє собою оболонку певного шаблона. Ці два компоненти можуть бути розділені внутрішнім шаром, що служить для запобігання від руйнування в шлунку і дозволяє внутрішньому компоненту потрапити в інтактному стані у дванадцятипалу кишку або вивільнитися через певний час. Різні матеріали можуть застосовуватися для створення таких внутрішніх шарів або покриттів, такі матеріали включають велику кількість полімерних кислот і сумішей полімерних кислот з такими матеріалами, як шелак, j(етиловий спирт і ацетат целюлози. Рідкі форми, у які сполуки і суміші за даним винаходом можуть включатися для введення усередину або через ін'єкцію, включають водні розчини, ароматизовані сиропи, водні або масляні суспензії, ароматизовані емульсії з їстівними маслами, такими як бавовняне масло, гірчичне масло, кокосове масло або арахісове масло, а також еліксири і подібні фармацевтичні носії. Суміші для інгаляції або інсуфляції включають розчини і суспензії у фармацевтично прийнятних, водних або органічних, розчинниках або їх суміші, і порошки. Рідкі або густі суміші можуть містити прийнятні фармацевтично придатні наповнювачі, як описано вище. У деяких варіантах здійснення, суміші вводять оральним або назальним респіраторним шляхом для місцевого або системного ефекту. Суміші розпорошують за допомогою інертних газів. Розпилені розчини вдихають безпосередньо з апарата розпилення, або апарат розпилення підключають до лицьової маски, або до апарата вентиляції легень з позитивним переміжним тиском. Розчини, суспензії або порошкові суміші вводять орально або назально за допомогою устаткування, що забезпечує доставку препарату належним способом. Кількість сполуки або суміші, що вводиться пацієнтові, буде варіювати залежно від того, що вводиться, мети введення, наприклад, профілактики або лікування, стану пацієнта, способу введення і подібних чинників. При терапевтичному застосуванні суміші вводять пацієнтові, що вже страждає на захворювання, у кількості, достатній для лікування або щонайменше часткового зменшення симптомів захворювання і його ускладнень. Ефективність доз буде залежати від умов захворювання, так само як висновок лікаря залежить від таких факторів, як тяжкість захворювання, вік, вага, загальний стан пацієнта і тому подібного. Суміші, що вводять пацієнтові, можуть бути у формі фармацевтичних сумішей, описаних вище. Ці суміші стерилізують загальноприйнятими способами стерилізації або шляхом фільтрації. Водні розчини упаковують для використання або у вихідному виді, або ліофілізують, ліофілізовані препарати перед введенням змішують зі стерильним водним носієм. Рівень рН препаратів сполуки звичайно буває між 3 і 11, більш переважно - від 5 до 9, і найбільше переважно від 7 до 8. Повинно бути зрозуміло, що 39 використання певних наповнювачів, носіїв або стабілізаторів буде позначатися на утворенні фармацевтичних солей. Терапевтична доза сполуки за даним винаходом буде варіювати залежно від, наприклад, конкретної мети, з якою застосовується лікування, способу введення сполуки, здоров'я і стану пацієнта і висновку лікаря, що призначає лікування. Пропорції або концентрації сполуки за винаходом у фармацевтичній суміші можуть варіювати залежно від великої кількості факторів, що включають у себе дозування, хімічні характеристики (наприклад, гідрофобність) і шлях введення. Наприклад, сполуку за винаходом застосовують для парентерального введення у вигляді розчину у водному фізіологічному буфері, що містить від, приблизно, 0,1 до, приблизно, 10% вага/об'єм сполуки. Деякі типові величини дозувань знаходяться у межах від, приблизно, 1мкг/кг до, приблизно, 1г/кг ваги тіла на день. У деяких варіантах здійснення, величини дозувань знаходяться у межах від. приблизно, 0,01мг/кг до, приблизно, 100мг/кг ваги тіла в день. Дозування залежить від таких особливостей, як тип і ступінь прогресування захворювання або порушення, загальний стан здоров'я конкретного пацієнта і шляху введення. Ефективні дози можуть бути екстрапольовані із кривих доза-відповідь, отриманих in vitro, або з тестових систем тваринних моделей. Сполуки за винаходом також можуть бути виготовлені в комбінації з одним або більше активними інгредієнтами, які можуть включати будь-який фармацевтичний агент, такий як антивірусні агенти, антитіла, імуносупресанти, протизапальні агенти і подібні агенти. У деяких варіантах здійснення, сполуки за винаходом можуть бути виготовлені в комбінації з одним або більше антивірусними агентами, що включають у себе інгібітори протеаз і інші агенти, використовувані в анти-ВІЛ терапії. Мічені сполуки і способи аналізу Інший аспект за даним винаходом стосується радіоактивно мічених сполук формули І, які будуть корисні не тільки в радіодіагностиці, але і у дослідженнях, як in vitro, так і in vivo, по локалізації і підрахунку хемокінових рецепторів у зразках тканини, що включають у себе тканини людини, і для ідентифікації лігандів хемокінових рецепторів шляхом інгібування зв'язування радіоактивно мічених сполук. Далі, даний винахід включає в себе ізотопномічені сполуки формули І. «Ізотопно» або «радіоактивно мічена» сполука є сполукою по винаходу, у якому один або більше атомів замінені або заміщені атомом, що має атомарну масу або атомарне число, що відрізняється від атомарної маси або атомарного числа, що виявляється в природі (тобто що звичайно зустрічається). Прийнятні радіонукліди, які можуть бути введені в сполуки за даним винаходом, включають, але не обмежуються ними, 2Н (також позначуваний як D, дейтерій), 3Н (також позначуваний як Т, тритій), 11 С, 1ЗС, 14С, 13N, 15N, 15О, 17О, 18О, 18F, 35S, 36CІ, 88466 82 40 Br, 75Вr, 76Вr, 77Вr, 123І, 124І, 125І і 131І. Введення того або іншого радіонукліда у вихідні радіоактивно мічені сполуки залежить від особливостей застосування цієї радіоактивно міченої сполуки. Наприклад, для досліджень по міченню і конкурентному зв'язуванню хемокінових рецепторів in vitro, найбільш корисні сполуки, що містять 3Н, 14С, 82Br, 125I, 131I, 35S. Для застосування в радіодіагностиці найбільш корисні сполуки, що містять 11С, 18F, 125І, 123І, 1241,1311,75Вr, 76Вr або 77Вr. Зрозуміло, що «радіоактивно міченою» або «міченою сполукою» є сполука, що містить щонайменше один радіонуклід. У деяких варіантах здійснення, радіонуклід вибирають із групи, що складається з 3Н, 14С, 1251,35S і 82Вr. Штучні способи введення радіоізотопів в органічні сполуки застосовні для сполук за винаходом і добре відомі в науці. Радіоактивно мічену сполуку за винаходом використовують у скринінгових дослідженнях для ідентифікаціі/оцінки сполук. У цілому, наново синтезована або ідентифікована сполука (наприклад, тестова сполука) може бути оцінена на здатність зменшувати зв'язування радіоактивно міченої сполуки за винаходом з чемокіновими рецепторами. Відповідно, здатність тестової сполуки конкурувати з радіоактивно міченою сполукою за зв'язування з хемокіновими рецепторами прямо корелює з її зв'язувальною здатністю. Набори Даний винахід також включає в себе фармацевтичні набори, застосовні, наприклад, у лікуванні або запобіганні хемокін-асоційованих захворювань або порушень, таких як інфекція ВІЛ, які включають один або більше контейнерів, що містять фармацевтичні суміші терапевтично ефективних кількостей сполуки формули І. Ці набори можуть також включати, при необхідності, один або більше різних загальноприйнятих компонентів фармацевтичних наборів, таких як, наприклад, контейнери з одним або більше фармацевтично прийнятними носіями, додаткові контейнери, і так далі, що очевидно фахівцеві в даній галузі науки. Інструкції, як у вигляді вкладишів, так і у вигляді наклейок, що вказують кількості компонентів для введення, рекомендації із введення і/або рекомендації зі змішування компонентів також можуть бути включені в набір. Винахід буде описано в більших деталях на спеціальних прикладах. Наступні приклади використані для ілюстративних цілей і не є обмеженнями винаходу будь-яким способом. Фахівець у даній галузі науки легко виявить багато некритичних параметрів, які можуть бути змінені або модифіковані з одержанням істотно схожих результатів. Приклади Приклад 1 5-({4-[(3S)-4-(5-Бром-2,3-дигідро-1Н-інден-1іл)-3-мегилпіперазин-1-іл]-4-мегилпіперидин-1іл}карбоніл)-4,6-диметилпіримідин 41 Стадія А 5-Бром-1-інданол До розчину 5-бром-1-інданону (2,0м, 9,5ммоль) в THF (20мл) додавали NaBH4 (0,5м, 12,8ммоль). Після перемішування при кімнатній температурі протягом ночі розчин гасили додаванням води. Отриманий у результаті розчин екстрагували двічі EtOAc. Об'єднані шари EtOAc сушили над Na2SO4 і концентрували у вакуумі з одержанням 2,0м зазначеної в заголовку сполуки у вигляді твердої речовини. MS розрахункова для С9Н9ВrO: (М+Н)+ 212,9; виявлено 194,9 (М+HН2О)+, 197,0 (М+Н-Н2О)+. Стадія В трет-Бутил-(3S)-3-метилпіперазин-1карбоксилам. До розчину (2S)-2-метилпіперазину (20,0г, 0,200моль) у метиленхлориді (300мл) і триетиламіні (20,4г, 0,202моль) додавали по краплях розчин ди-трет-бутилдикарбонату (44,0г, 0,202моль) в СН2СІ2 (100мл) протягом 5 годин. Суміш промивали водою, сольовим розчином і потім сушили над MgSO4 і концентрували. Колонкова хроматографія на силікагелі (10-20% МеОН в EtOAc) давала 32,0г (80%) зазначеної в заголовку сполуки у вигляді масла. Стадія С трет-Бутил-(3S)-4-(5-бром-2,3-дигідро-1Нінден-1-іл)-3-метилпіперазин-1-карбоксилат 5-Бром-1-інданол (1,0г, 4,7ммоль) стадії А розчиняли в тіонілхлориді (10мл). Після перемішування при кімнатній температурі протягом 2 годин розчин концентрували у вакуумі. Залишок розчиняли в DMF (10мл). До суміші додавали трет-бутил-(3S)-3-метилпіперазин-1карбоксилат (0,94г, 4,7ммоль), Nal (2г, 13ммоль) і триетиламін (1,5мл, 10ммоль). Отриманий у результаті розчин перемішували при 70°С протягом ночі. Після охолодження при кімнатній температурі додавали воду. Розчин двічі екстрагували EtOAc. Об'єднані шари EtOAc промивали сольовим розчином, сушили над MgSO4 і концентрували. Колонкова хроматографія на силікагелі (50% EtOAc у гексані) давала два ізомери. Ізомер 1 (ізомер, що швидко рухався): 0,36г; MS розрахункова для С19Н27ВrN2О2 (M+Н)+ 395; виявлена 395,1, 397,0. Ізомер 2 (ізомер, що повільно рухався): 0,33г; MS виявлена 395,1, 397,0. Стадія D 88466 42 трет-Бутііл-4-[(3S)-4-(5-бром-2,3-дигідро-1Нінден-1-іл)-3-метилпіперазин-1-іл]-4ціанопіперидин-1-карбоксилам Ізомер 1 зі стадії С (0,33г, 0,83ммоль) розчиняли в 4Η НСI у діоксані (4мл). Після перемішування при кімнатній температурі протягом 2год. розчин концешрували. Залишок розчиняли в СН2Сl2 (5мл). До нього додавали третбутил-4-оксо-1-піперидинкарбоксилат (0,17г, 0,85ммоль), Ті(Оі-Рr)4 (0,87мл) і триетиламін (0,6мл). Суміш перемішували при кімнатній температурі протягом ночі, і леткі речовини видаляли у вакуумі. Залишок розчиняли в THF (5мл). До суміші додавали 1,0Μ розчин ціаніду діетилалюмінію (1мл). Отриманий у результаті розчин перемішували при 30°С протягом 5год. і концентрували для забезпечення неочищеної зазначеної в заголовку сполуки (0,32г), що використовували для наступної реакції без очищення. MS розрахункова для C25H35BrN4O2: (M+H)+ 503; виявлено 503,1, 505,1. Стадія Е трет-Бутил-4-[(3S)-4-(5-бром-2,3-дигідро-1Нінден-1-іл)-3-метилпіперазин-1-іл]-4метилпіперидин-1-карбоксилам До розчину трет-бутил-4-[(3S)-4-(5-бром-2,3дигідро-1Н-інден-1-іл)-3-метилпіперазин-1-іл]-4ціанопіперидин-1-карбоксилату (0,32г, 0,64ммоль) в THF (2мл) додавали 3Μ розчину броміду метилмагнію (1,1мл, 3,3ммоль). Після перемішування при кімнатній температурі протягом ночі розчин концентрували. Очищення на силікагелі (2:1 гексан/EtOAc) дало зазначену в заголовку сполуку (0,25г). MS розрахункова для С25Н57ВrN3О2:(М+Н)+ 491; виявлено 491,2, 494,2. Стадія F (2S)-1-(5-Бром-2,3-дигідро-1Н-інден-1-іл)-2метил-4-(4-метилпіперидин-4-іл)піперазин Проміжний продукт, отриманий на стадії Ε (0,23г) розчиняли в розчині 4Η HСІ в діоксані (3мл). Після перемішування при кімнатній температурі протягом 2год., розчин концентрували для надання зазначеної в заголовку сполуки у вигляді солі тригідрохлориду (0,23г). MS розрахункова для C20H30BrN3: (Μ+H)+ 392; виявлено 392,2, 394,2. Стадія G 4,6-диметилпіримідин-5-карбонова кислота Етил-2-ацетил-3-етоксибут-2-еноат. Колбу з 4 горлечками обсягом 5л, оснащену механічною мішалкою, термоямкою, конденсером, лійкою для 43 додавання і виходом Ν2 заряджали етилацетоацетатом (493,1г, 483мл, 3,7931моль, 1,0екв.) і етоксидом натрію (3,1г, 0,046моль, 1,2 молярних %). Діетилацеталь кетену (880,0г, 1000мл, 7,5862моль, 2,0екв.) додавали протягом 1год. при підтримці температури взаємодії нижче за 22°С за рахунок зовнішнього охолодження. По завершенні додавання реакційну суміш нагрівали при 85°С±5°С протягом 7,5год. Жовто-коричневу реакційну суміш охолоджували до кімнатної температури і перемішували протягом ночі. Більшу частину низькокиплячих компонентів [EtOH, EtOAc, Ме(ОЕt)3] упарювали на роторному випарнику (температура бані ~65°С). Жовто-оранжеве масло, що залишилося, переганяли, збираючи фракцію з т.к. 100-107°С (1,8-2,1торр) з одержанням 675,2г (89%) продукту у вигляді жовтої рідини. Етил-4,6-диметилпіримідин-5-карбоксилат. Етил-2-ацетил-3-етоксибут-2-сноаі (10,7г, 0,0537моль), ацетат формамідину (5,6г, 0,054моль) і етоксид натрію (2,7Μ в етанолі, 20,0мл) змішували в етанолі (30мл), і суміш перемішували при 90°С протягом 4год. Реакційну суміш охолоджували, гасили водою і концентрували. Неочищений матеріал очищали тонкошаровою хроматографією на силікагелі, елююючи 10%, 50% етилацетат/гексан з одержанням необхідного продукту (7,4г, 76%) у вигляді жовтого масла. MS (ΕΙ) 181,1 (М+1). 1H ЯМР (300МГц, CDCI3) δ (м.ч.) 8,97 (с, 1Η), 4,44 (кв., 2H), 2,56 (с, 6Н), 1,42 (т, 3Н). 4,6-Диметилпіримідин-5-карбонова кислота. Етил-4,6-диметилпіримідин-5-карбоксилат (10,9г, 0,0605моль) змішували з розчином гідроксиду натрію (4,0г, 0,10моль) у воді (70мл). Суміш перемішували при кімнатній температурі протягом ночі. Водну реакційну суміш підкисляли концентрованою соляною кислотою, і потім концентрували до сухості. До даного залишку додавали ацетон (100мл). Нерозчинний хлорид натрію фільтрували і промивали метанолом (100мл). Фільтрат концентрували до сухості. Залишок промивали ACN з одержанням 8,5г (92%) продукту у вигляді твердої речовини. MS (ΕΙ) 153,1 (М+1). 1Н ЯМР (400МГц, CD3OD) δ (м.ч.) 8,89 (с, 1H), 2,56 (с, 6Н). Стадія Η 5-({4-[(3S)-4-(5-Бром-2,3-дигідро-1Н-інден-1іл)-3-метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідин До розчину тригідрохлориду (2S)-1-(5-бром2,3-дигідро-1Н-інден-1-іл)-2-мсгил-4-(4метилпіперидин-4-іл)піперазину (30мг, 0,06ммоль) і 4,6-димегилпіримідин-5-карбонової кислоти (9мг, 0,06ммоль) в DMF (2мл) додавали бензотриазол1-ілокситрис(диметиламіно)фосфонію гексафторфосфат (30мг, 0,06ммоль) з наступним додаванням триетиламіну (30мг, 0,3ммоль). Після перемішування при кімнатній температурі протягом 5год. суміш розбавляли EtОАс і 88466 44 розчином Na2CO3 у воді. Органічний шар відокремлювали, промивали кілька разів водою, сушили над Na2SO4 і концентрували. Очищення шляхом зворотно-фазової ВЕРХ і ліофілізації давало кінцевий продукт у виїляді солі ТФО (20мг) MS розрахункова для С27Н36ВrN5О: (М+Н)+ 526; виявлено 526,1, 528,1. Приклад 2 5-({4-[(3S)-4-(5-фгор-2,3-дигідро-1Н-інден-1-іл)3-метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідин Дану сполуку одержували, по суті, як описано в прикладі 1 з використанням прийнятних вихідних матеріалів. MS розрахункова для C27H36FN5O. (М+Н)+ 466; виявлено 466,2. Приклад 3 5-({4-[(38-4-(6-Бром-2,3-дигідро-1Н-інден-1-іл)3-метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідин Дану сполуку одержували, по суті, як описано в прикладі 1 з використанням прийнятих вихідних матеріалів MS розрахункова для C27H36BrN5O. (М+Н)+ 526, виявлено 526,1, 528,1 Приклад 4 5-({4-[(3S)-4-(6-Фтор-2,3-дигідро-1H-інден-1-іл)3-метилпіперазин-1-іл]-4-метилпіперидин-1іл}карбоніл)-4,6-диметилпіримідин Дану сполуку одержували, по суті, як описано в прикладі 1 з використанням прийнятних вихідних матеріалів. MS розрахункова для C27H36FN5O: (М+Н)+ 466; виявлено 466,2. Приклад 5 5-({4-[(3S)-4-(6-Бром-1,2,3,4тетрагідронафталін-1-іл)-3-метилпіперазин-1-іл]-4метилніиеридин-1-іл}карбоніл)-4,6диметилпіримідин Дану сполуку одержували, по суті, як описано в прикладі 1 з використанням прийнятних вихідних матеріалів. MS розрахункова для C28H38BrN5O: (M+H)+ 540; виявлено 540,2, 542,1. 45 88466 46 для C11H8BrF3O4: (M+Na)+. Приклад 6 5-({4-[(3S)-4-(7-Бром-1,2,3,4тетрагідронафталін-1-іл)-3-метилпіперазин-1-іл]-4метилніперидин-1-іл}карбоніл)-4,6диметилпіримідин Дану сполуку одержували, по суті, як описано в прикладі 1 з використанням прийнятних вихідних матеріалів. MS розрахункова для C28H38BrN5O: (М+Н) 540; виявлено 540,2, 542,1. Приклад 7 4,6-Диметил-5-[(4-метил-4-{(3S)-3-метил-4-[6(трифторметил)-2,3-дигідро-1H-інден-1іл]піперазин-1-іл}піперидин-1-іл)карбоніл]піримідин Стадія А Діетил-[2-бром-4(трифторметил)бензил]малонат У суспензію гідриду натрію (1,4г, 58ммоль) в DMF (37мл) при 10°С по краплях додавали етилмалонат (14г, 88ммоль). Після додавання суміш перемішували протягом 1год. при кімнатній температурі. До неї повільно додавали розчин 2бром-1-(хлорметилу)-4-(трифторметил)бензолу (10,0г, 36,6ммоль) в DMF (20мл). Після перемішування при кімнатній температурі протягом ночі суміш виливали в крижану воду (300мл). Отриманий у результаті розчин екстрагували двічі ефіром. Об'єднані екстракти промивали водою і сольовим розчином, сушили над MgSO4 і концентрували. Колонкова хроматографія на силікагелі (5-10% EtOAc у гексані) приводила до одержання зазначеної в заголовку сполуки у вигляді масла (13,5г, 93%). MS розрахункова для C15H16BrF3O4: (М+Н)+ 397; виявлено 397,0, 399,0. Стадія В 2-Бром-4-(трифторметил)бензил]малонова кислота До розчину діетил-[2-бром-4(трифторметил)бензил]малонату (13,5г, 34ммоль) в етанолі (60мл) і воді (28мл) додавали 5Μ розчину гідроксиду натрію у воді (20мл). Після перемішування при кімнатній температурі протягом ночі етанол видаляли у вакуумі. Водний розчин розбавляли додаванням великої кількості води і двічі екстрагували ефіром. Отриманий водний шар підкисляли до рН=3 концентрованою НСІ і екстрагували ефіром 3 рази. Об'єднані ефірні шари промивали водою і сольовим розчином, сушили над MgSO4 і концентрували з одержанням зазначеної в заголовку сполуки у вигляді білої твердої речовини (9,8г, 84%). MS розрахункова (М+Н)+ 341; виявлено 363 Стадія С 3-[2-Бром-4-(трифторметилфеніл]пропанова кислота [2-бром-4-(трифторметил)бензил]малонову кислоту (9,80г, 28,7ммоль) у круглодонній колбі нагрівали до 180°С, і продовжували нагрівання при 180°С протягом 1,5год. Після охолодження до кімнатної температури рідину розчиняли в ефірі. Отриманий розчин сушили над MgSO4 і концентрували. Тверду речовину промивали гексаном з утворенням зазначеної в заголовку сполуки (7,20г, 85%). MS розрахункова для C10H8BrF3O2: (M+H)+ 297; виявлено 297,0, 299,0. Стадія D 6-(Трифторметил)індан-1-он До розчину 3-[2-бром-4(трифторметил)феніл]пропанової кислоти (6,40г, 21,5ммоль) в THF (300мл) і гексану (80мл) при 78°С додавали 2,5Μ розчин н-бутиллітію в гексані (19мл). Після перемішування протягом 15хв. суміш виливали в розчин 2Η НСІ (150мл). Два шари розділяли, і водний шар екстрагували ефіром. Об'єднані органічні шари промивали розчином NaHCO3, водою, сольовим розчином, сушили над MgSO4 і концентрували. Колонкова хроматографія на силікагелі (10-20% EtOAC у гексані) приводила до одержання зазначеної в заголовку сполуки (2,2г, 51%) у вигляді масла. MS розрахункова для C10H7F3O: (Μ+Н)+ 201; виявлено 201,0. Стадія Ε 6-(Трифторметил) індан-1-ол До розчину 6-(трифторметил)індан-1-ону (2,20г, 11ммоль) в THF (30мл) додавали борогідрид натрію (0,50г, 13ммоль). Після перемішування протягом 30хв. повільно додавали метанол (10мл). Перемішування продовжували протягом 2год. Реакційну суміш гасили додаванням водного розчину хлориду амонію. Два шари розділяли і водний шар екстрагували ефіром. Об'єднані органічні шари промивали водою, сольовим розчином, сушили над MgSO4 і концентрували. Колонкова хроматографія на силікагелі (10-15% ЕtOАС у гексані) приводила до одержання зазначеної в заголовку сполуки (1,52г, 68%) у вигляді масла. MS розрахункова для C10H9F3O: (M+H)+ 203; виявлено 185,0 (М-Н2О+1)+. Стадія F 1-Хлор-6-(трифторметил)індан 47 6-(Трифторметил)індан-1-ол (1,52г, 7,5ммоль) розчиняли в гіонілхлориді (15мл). Після перемішування при кімнатній температурі протягом 2год. розчин концентрували у вакуумі з наданням зазначеної в заголовку сполуки (1,5г, 90%). Стадія G трет-Бутил-(3S)-3-метил-4-[6-(трифторметил)2,3-дигідро-1Н-інден-1-іл]піперазин-1-карбоксклат Розчин 1-хлор-6-(трифторметил)індану (1,52г, 6,89ммоль), трет-бутил-(3S)-3-метилпіперазин-1карбоксилату (2,1г, 10ммоль), йодиду натрію (3г, 20ммоль) і триетиламіну (3г, 30ммоль) в DMF (20мл) перемішували при 60°С протягом ночі. Після охолодження до кімнатної температури додавали воду. Отриманий у результаті розчин екстрагували двічі EtOAc. Об'єднані екстракти промивали водою і сольовим розчином, сушили над MgSO4 і концентрували. Колонкова хроматографія на силікагелі (10%-30% EtOAc у гексані) давала два ізомери. Ізомер 1:0,52г (коричневе масло). MS розрахункова для C20H27F3N2O2: (М+Н)+ 385; виявлено 385,2. Ізомер 2:0,41г (коричневе масло). MS: (M+H)+ 385,2. Стадія Н (2S)-2-Метил-1-[6-(трифторметт)-2,3-дигідро1Н-інден-1-іл]піперазин трет-Бутил-(3S)-3-метил-4[6-(трифторметил)-2,3-дигідро-1Н-інден-1іл]піперазин-1-карбоксилат (ізомер 1 зі стадії G, 0,52г, 1,4ммоль) розчиняли в 4Μ розчині НСІ в 1,4діоксані (10мл). Після перемішування при кімнатній температурі протягом 2год. розчин концентрували у вакуумі з наданням зазначеної в заголовку сполуки у вигляді солі дигідрохлориду (0,48г, 100%). MS розрахункова для C15H19F3N2: (M+H)+ 285; виявлено 285,1. Стадія І трет-Бутіиі-4-ціано-4-{(3S)-3-метил-4-[б(трифторметил)-2,3-дигідро-1Н-інден-1іл]піперазин-1-іл}піперидин-1-карбоксилат Дигідрохлорид (2S)-2-метил-1-[6(трифторметил)-2,3-дигідро-1Н-інден-1іл]піперазину (0,38г, 1,3ммоль) розчиняли в дихлорметані. Розчин промивали насиченим розчином NaHCO3, сушили над MgSO4 і концентрували. Залишок розчиняли в дихлорметані (20мл). До нього додавали трет 88466 48 бутил-4-оксо-1-піперидинкарбоксилат (0,32г, 1,6ммоль) і тетраізопропоксид титану (0,8г, 3ммоль). Суміш перемішували при кімнатній температурі протягом ночі і концентрували у вакуумі. Залишок розчиняли в THF (20мл). Додавали ціанід діетилалюмінію (0,18г, 1,6ммоль). Після перемішування при кімнатній температурі протягом 5год. розчин гасили додаванням води (3мл). Отриманий у результаті розчин фільтрували через целіт, і целіт промивали кілька разів дихлорметаном. Фільтрат сушили над MgSO4 і концентрували з одержанням зазначеної в заголовку сполуки (0,72г, 98%) у вигляді коричневого в'язкого масла. MS розрахункова для C26H35F3N4O2: (М+Н)+ 493; виявлено 493,2. Стадія J трет-Бутил-4-метил-4-{(3S)-3-метил-4-[6(трифторметил)-2,3-дигідро-1Н-інден-1-іл] піперазин-1-іл}піперидин-1-карбоксилат До розчину трет-бутил-4-ціано-4-{(3S)-3метил-4-[6-(трифторметил)-2,3-дигідро-1Н-інден-1іл]піперазин-1-іл}піперидин-1-карбоксилату (0,72г, 1,3ммоль) в ТHF (20мл) додавали 3Μ розчин броміду метилмагнію в ефірі (4,0мл). Після перемішування при кімнатній температурі протягом ночі реакцію гасили додаванням води. Отриманий у результаті розчин екстрагували двічі EtOAc. Об'єднані шари EtOAc сушили і концентрували. Колонкова хроматографія на силікагелі (20-30% EtOAc у гексані) надавала зазначену в заголовку сполуку (0,32 і, 50%) у вигляді в'язкого масла. MS розрахункова для C26H35F3N3O2:(M+H)+ 482; виявлено 482,3. Стадія K (2S)-2-Метил-4-(4-метилпіперидин-4-іл)-1-[б(трифторметил)-2,3-дигідро-1Н-інден-1іл]піперазин Трет-бутил-4-метил-4-{(3S)-3-метил-4-[6(трифторметил)-2,3-дигідро-1H-інден-1іл]піперазин-1-іл}піперидин-1-карбоксилат (0,32г, 0,6ммоль) розчиняли в 4Μ розчині НСІ в діоксані (8,0мл). Після перемішування при кімнатній температурі протягом 2год. розчин концентрували з одержанням зазначеної в заголовку сполуки (0,35г) у вигляді солі тригідрохлорид. MS розрахункова для C21Н30F3N3: (М+H)+ 382; виявлено 382,2. 49 Стадія L 4,6-Диметил-5-[(4-метил-4-{(3S)-3-метил-4-[6(трифторметил)-2,3-дигідро-1H-інден-1іл]піперазин-1-іл}піперидин-1-іл)карбоніл]піримідин До розчину тригідрохлориду (2S)-2-метил-4-(4метилпіперидин-4-іл)-1-[6-(трифторметил)-2,3дигідро-1Н-інден-1-іл]піперазину (100мг, 0,183ммоль), 4,6-диметилпіримідин-5-карбонової кислоти (67мг, 0,22ммоль) в DMF (5мл) додавали гексафторфосфат бензотриазол-1-ілокситрис(диметиламіно)фосфонію (97мг, 0,22ммоль), і потім триетиламін (90мг, 0,9ммоль). Після перемішування при кімнатній температурі протягом ночі додавали розчин NaHCO3 у воді. Отриманий у результаті розчин екстрагували двічі EtOAc. Об'єднані шари EtOAc промивали сольовим розчином, сушили над MgSO4 і концентрували. Колонкова хроматографія на силікагелі (10-20% МеОН в EtOAc) приводила до одержання зазначеної в заголовку сполуки (60мг) у вигляді масла. MS розрахункова для C28H36F3N5O: (М+Н)+ 516; виявлено 516,2. Приклад 8 4,6-Диметил-5-[(4-метил-4-{(3S)-3-метил-4-[5(трифторметил)-2,3-Дигідро-1Н-інден-1іл]піперазин-1-іл}піперидин-1-іл)карбоніл]піримідин Стадія А [2-Бром-5-(трифторметил)феніл]метанол До розчину 2-бром-5(трифторметил)бензонітрилу (10,0г, 40ммоль) у дихлорметані (100мл) по краплях додавали 1,0Μ розчин гідриду діізобутилалюмінію в гексані (48мл). Отриманий у результаті розчин перемішували в азоті при кімнатній температурі протягом 1год. і потім розбавляли додаванням ефіру (100мл). Після нагрівання на крижаній бані обережно додавали З Η розчин ПСІ, і суміш інтенсивно струшували при кімнатній температурі протягом 15 хвилин. Органічний шар промивали сольовим розчином, сушили (MgSO4) і упарювали. Отримане в результаті масло очищали тонкошаровою хроматографією (5% EtOAc/гексан) з одержанням 5г 2-бром-5трифторметилбензальдегіду. 1H-ЯМР (CDCІ3) δ 10,39 (с, 1Η), 8,18 (д, J=2Гц, 1Н), 7,82 (д, 1=8,8Гц, 1Н), 7,70 (дд, J=8,5Гц, 2Гц, 1Н). До суміші 2-бром-5(трифторметил)бензальдегіду (5г, 20ммоль) в THF (20мл) при 0°С додавали борогідрид натрію (0,8г, 20ммоль). Отриману в результаті суміш перемішували при 0°С до кімнатної температури протягом 1год. Реакцію гасили додаванням водного розчину NaHCO3. Отриманий у результаті розчин екстрагували двічі EtOAc. Об'єднані екстракти промивали сольовим розчином, сушили (MgSO4), фільтрували і концентрували з одержанням необхідного спирту у вигляді білої твердої речовини (4,4г). 1H-ЯМР (CDCІ3) δ 7,81 (с, 1H), 7,66 (д, J=8,3Гц, 1H), 7,42 (д, J=8,3Гц, 2Гц, 1H), 4,81 (д, J=6,3Гц, 2Н), 2,03 (м, 1H). 88466 50 Стадія В 1-Бром-2-(хлорметил)-4(трифторметил)бензол До [2-бром-5-(трифторметил)феніл]метанолу (4,4г, 17ммоль) додавали тіонілхлорид (5мл), отриману суміш перемішували при кімнатній температурі протягом 1год. Упарювання у вакуумі давало неочищений Продукт у вигляді масла. 1HЯМР (CDCІ3) δ 7,73 (д, J=8,3 Гц 1Н), 7,73 (д, J=2,0Гц, 1H), 7.53 (дд, J=8,5, 2,2Гц, 1Н), 5,66 (д, J=12,7Гц, 1Н), 5,46 (д, J=12,2 Гц). Стадія С Діетил-[2-бром-5(трифторметил)бензил]малонат До розчину етилмалонату (23г, 140ммоль) в DMF (70мл) при 0°С додавали гідрид натрію (3,9г, 60% у мінеральному маслі, 97ммоль), і отриману суміш перемішували при кімнатній температурі протягом 30хв. До суміші додавали розчин 1-бром2-(хлорметил)-4-(трифторметил)бензолу (16г, 60ммоль) в DMF (20мл) Реакційну суміш перемішували при кімнатній температурі протягом 3год. і гасили крижаною водою. Отриманий у результаті розчин екстрагували двічі EtOAc. Екстракти промивали сольовим розчином, сушили (MgSO4), фільтрували і концентрували. Неочищений матеріал очищали тонкошаровою хроматографією на силікагелі з елюцією від 3% до 5% EtOAc/гексан з одержанням необхідного продукту (15,2г, 64%) у вигляді масла. LC/MS розрахункова для С15Н16ВrF3O4:(М+Н)+ 397; виявлено 397,1/399,1. Стадія D 3-[2-Бром-5-(трифторметил)феніл]пропанова кислота До розчину діетил[2-бром-5(трифторметил)бензил]малонату (22,9г, 57,6ммоль) в етанолі (100мл) і воді (50мл) додавали 5Μ розчин гідроксиду натрію у воді (30мл). Суміш нагрівали до кип'ятіння зі зворотним холодильником протягом 2год. Етанол видаляли шляхом розпарювання. Водний шар екстрагували ефіром і потім підкисляли концентрованою НСІ до рН5, причому в цей час осаджувалася велика кількість білої твердої речовини. Тверду речовину збирали фільтрацією. Фільтрат екстрагували двічі етилацетатом, і екстракти промивали сольовим розчином, сушили (MgSO4) і концентрували з одержанням білої твердої речовини. Об'єднану тверду речовину декарбоксилювали нагріванням на масляній бані до 180°С приблизно протягом 1год. Отримане в результаті жовте масло охолоджували і поміщали у вакуум з одержанням необхідної монокислоти (11,5г, 67%). 51 LC/MS розрахункова для C10H8BrF3O2: (M+H)+ 297; виявлено 297,1/299,1. Стадія Ε 5-(Трифторметил)індан-1-он До розчину 3-[2-бром-5(трифторметил)феніл]пропанової кислоти (2,8г, 9,4ммоль) в THF (100мл) і гексані (20мл) при -78°С по краплях додавали 2,5Μ розчин н-бутиллітію в гексані (8,3мл). Після закінчення додавання реакцію гасили насиченим NH4CІ. Отриманий у результаті розчин екстрагували двічі етилацетатом. Екстракти промивали насиченим NaНСО3, сольовим розчином, сушили над MgSO4 і концентрували. Неочищений матеріал очищали тонкошаровою хроматографією на силікагелі з елюцією 10-20% EtOAc/гексан з одержанням необхідного продукту у вигляді білої твердої речовини (0,7г, 37%). LC/MS розрахункова для C10H7F3O: (M+H)+ 201; виявлено 201,1. Стадія F 5-(Трифторметил)індан-1-ол До розчину 5-(трифторметил)індан-1-ону (0,7г, 3ммоль) в THF (5мл), охолодженого на крижаній бані додавали борогідрид натрію (0,1г, 3ммоль) з наступним додаванням МеОН(1мл). Після перемішування протягом 30хв., реакцію гасили водним NaHCO3. Отриманий у результаті розчин екстрагували двічі EtOAc. Екстракти промивали сольовим розчином, сушили (MgSO4), фільтрували і концентрували. Неочищений матеріал очищали тонкошаровою хроматографією на силікагелі з елюцією 20% EtOAc/гексан з одержанням необхідного продукту (0,65г, 92%) у вигляді масла. LC/MS розрахункова для C10H9F3O: (М+Н)+ 203; виявлено 185,1 (М+Н-Н2О)+. Стадія G 4,6-Диметил-5-[(4-метил-4-{(3S)-3-метил-4-[5(трифторметил)-2,3-дигідро-1Н-інден-1-іл] піперазин-1-іл}піперидин-1-іл)карбоніл]піримідин Виходячи з 5-(трифторметил)індан-1-олу, зазначену в заголовку сполуку одержували по процедурах, описаних для прикладу 7. MS розрахункова для C28H36F3N5O: (М+H)+ 516; виявлено 516,2. Приклад 9 1-((2S)-4-{1-[(4,6-диметилпіримідиніл-5іл)карбоніл]-4-метилпіперидин-4-іл}-2метилпіперазин-1-іл)-5-(трифторметил)індан-2-ол Стадія А 88466 52 6-(Трифторметил)-1Н-інден Суміш 5-(трифторметил)індан-1-олу (1,6г, 7,9ммоль) і п-толуолсульфонової кислоти (0,02г, 0,1ммоль) у толуолі (20мл) кип'ятили зі зворотним холодильником через пастку Дина-Старка приблизно протягом 3год. Розчин концентрували у вакуумі, і залишок очищали шляхом тонкошарової хроматографії па силікагелі, елююючи 5% ЕtOАс/гексан з одержанням необхідного продукту у вигляді масла (1,4г, 96%). Стадія В 4-(Трифторметил)-6,6а-дигідро-1аНіндено[1,2-b]оксисен До розчину 6-(трифторметил)-1Н-індену (1,1г, 6ммоль) у безводному дихлорметані (80мл) при 78°С додавали 5,5Μ розчин третбутилгідропероксиду в н-декані (1,3мл) з наступним додаванням тетрахлориду титану (0,79мл, 7,2ммоль). Після перемішування при 78°С протягом 1год., отриманий у результаті коричневий розчин гасили сумішшю Еt2О/насичений розчин Na2SO3. Суміш перемішували при кімнатній температурі протягом 1год. із одержанням безбарвного розчину. Органічний шар розділяли і промивали сольовим розчином, сушили над MgSO4 і концентрували з одержанням неочищеного продукту (1,2г) у вигляді твердої речовини. LC/MS розрахункова для C10H7F3O:(M+H)+ 201; виявлено 201,0. Стадія С трет-Бутил-(3S)-4-[2-гідрокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-карбоксилат Суміш 4-(трифторметил)-6,6а-дигідро-1аНіндено[1,2-b]оксирену (1,2г, 6,0ммоль) і трет-бутил(3S)-3-метилпіперазин-1-карбоксилату (1,4г, 7,2моль) в етанолі (20мл) кип'ятили зі зворотним холодильником протягом ночі. Додавали ще 1 грам трет-бутил-(3S)-3-метилпіперазин-1карбоксилату. Суміш переносили в закупорений флакон і нагрівали до 95°С протягом 2 діб. Розчинник концентрували і залишок очищали тонкошаровою хроматографією з елюцією 25% EtOAc/гексан, з наступної елюцією 5% MeOH/EtOAc +0,5% концентрованого NH4OH. Виділяли два ізомери. Ізомер 1 (ізомер, що швидко рухається): 0,45г; MS розрахункова для C20H27F3N2O3 (М+Н)+ 401; виявлено 401,1. Ізомер 2 (ізомер, що повільно рухається): 0,38г; MS виявлена 401,1. 53 Стадія D 1-((2S)-4-{1-[(4,6-Диметпіримідин-5іл)карбоніл]-4-метилпіперидин-4-іл}-2метилпіперазин-1-іл)-5-(трифторметил)індан-2-ол Виходячи з трет-бутил-(3S)-4-[2-гідрокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-карбоксилату (ізомер 1 зі стадії С) зазначену в заголовку сполуку одержували з використанням процедур, подібних з описаними в прикладі 7. MS розрахункова для C28H36F3N5O2: (М+Н)+ 532; виявлено 532. Приклад 10 5-[(4-{(3S)-4-[2-метокси-5-(трифторметил)-2,3дигідро-1H-інден-1-іл]-3-метилпіперазин-1-іл}-4метилпіперидин-1-іл)карбоніл]-4,6диметилпіримідин Стадія А трет-Бутил (3S)-4-[2-метокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-карбоксилат До розчину трет-бутил-(3S)-4-[2-гідрокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-карбоксилату (ізомер 1 зі стадії С у прикладі 9) (50мг, 0,1ммоль) в THF (2мл) при 0°С додавали NaH (8мг, 60% у маслі, 0,2ммоль). Після перемішування протягом 10хв. додавали МеІ (28мг, 0,2ммоль). Суміш перемішували при температурі навколишнього середовища протягом 1год. і гасили водним NH4Cl. Отриманий у результаті розчин екстрагували двічі EtOAc. Екстракти промивали сольовим розчином, сушили (MgSO4), фільтрували і концентрували з одержанням неочищеного продукту. LC/MS розрахункова для C21Н29F3N2O3: (М+Н)+ 415; виявлено 415,2. Стадія В (2S)-1-[2-Метокси-5-(трифторметил)-2,3дигідро-1Н-інден-1-іл]-2-метилпіперазин До трет-бутил-(3S)-4-[2-метокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-карбоксилату (51,8мг, 0,125ммоль) додавали 4,0Μ розчин хлороводню в діоксані (2мл). Суміш перемішували при кімнатній температурі протягом 1год. і концентрували у вакуумі з одержанням зазначеної в заголовку сполуки у вигляді солі дигідрохлориду. LC/MS розрахункова для C16H22ClF3N2O: (М+Η)+ 351; виявлено 351,1. 88466 54 Стадія С трет-Бутил-4-{(3S)-4-[2-метокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1іл}-4-метилпіперидин-1карбоксилат До суміші (2S)-1-[2-метокси-5-(трифторметил)2,3-дигідро-1Н-інден-1-іл]-2-метилпіперазин гідрохлориду (44мг, 0,12ммоль) і трет-бутил-4оксо-1-піперидинкарбоксилату (25мг, 0,12ммоль) у метиленхлориді (2мл) додавали триетиламін (0,07мл, 0,5ммоль), з наступним додаванням тетраізопропоксиду титану (0,037мл, 0,12ммоль). Отриману в результаті суміш перемішували при кімнатній температурі протягом ночі і концентрували з наданням неочищеного енаміну. Неочищений енамін розчиняли в THF і обробляли 1,0Μ ціаніду діетилалюмінію в толуолі (0,15мл). Суміш перемішували при кімнатній температурі протягом ночі і гасили додаванням водного NаНСО3 і EtOAc. Отриманий у результаті розчин фільтрували через целіт. Фільтрат розділяли, і промивали органічний шар сольовим розчином, сушили (MgSO4), фільтрували і концентрували з одержанням неочищеної ціаносполуки. LC/MS: 523,2 (М+Н)+. Неочищену ціаносполуку розчиняли в THF і обробляли 3,0Μ розчином броміду метилмагнію в простому ефірі (0,2мл) при 0°С. Суміш перемішували при кімнатній температурі протягом 4год. Додавали ще 0,2мл розчину броміду метилмагнію, і суміш перемішували при кімнатній температурі протягом 2 діб. Реакцію гасили водним NaHCO3 і двічі екстрагували EtOAc. Екстракти промивали сольовим розчином, сушили (MgSO4), фільтрували і концентрували. Неочищений матеріал очищали тонкошаровою хроматографією на силікагелі з елюцією 25%, і потім 50% ЕtOАс/гексаном з одержанням зазначеної в заголовку сполуки (25мг). MS розрахункова для C27H40F3N3O3: (М+Н)+ 512; виявлено 512,2. Стадія D 5-[(4-{(3S)-4-[2-метокси-5-(трифторметил)-2,3дигідро-1Н-інден-1-іл)-3-метилпіперазин-1-іл}-4метилпіперидин1-іл)карбоніл]-4,6діметилпіримідин До трет-бутил-4-{(3S)-4-[2-метокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-іл}-4-метилпіперидин-1карбоксилату (0,02г, 0,04ммоль) додавали 4,0Μ розчин НСІ в 1,4-діоксані (2,0мл). Отриману в результаті суміш перемішували при кімнатній 55 88466 56 температурі протягом 1год., концентрували і упарювали у вакуумі до сухості. До зазначеного вище гідрохлориду аміну додавали DMF (2,0мл), 4,6-диметилптримідин-5карбонову кислоту (0,01г, 0,08ммоль), гексафторфосфат бензотриазол-1ілокситрис(диметиламіно)фосфонію (0,026г, 0,059ммоль) і триетиламін (0.02мл, 0,1ммоль). Після перемішування при кімнатній температурі протягом ночі реакційну суміш гасили водним NaHCO3 і екстрагували двічі ЕtOАс. Екстракти промивали сольовим розчином, сушили (MgSO4), фільтрували і концентрували. Неочищений матеріал очищали шляхом зворотно-фазової ВЕРХ (10-80% ацетонприл-вода з 0,05% TFA, 30хв., 10мл/хв.) з одержанням зазначеної в заголовку сполуки (25мг) у вигляді біс-солі TFA. LC/MS розрахункова для C29H38F3N5O2: (M+H)+ 546; виявлено 546,2. Приклад 11 5-[(4-(3S)-4-[(1R,2R)-2-етокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-іл-4-метилпіперидин-1іл)карбоніл]-4,6-диметилпіримідин дигідрохлорид 250мл лійку для додавання порційно. Після перемішування протягом 2 годин, реакцію гасили додаванням метанолу (100,0мл). Холодну баню видаляли, і суміш перемішували протягом 5 хвилин перед додаванням 6,00Μ розчину соляної кислоти (300,0мл) (рН=~7). Суміш додатково перемішували протягом 15 хвилин, після чого пропускали через целітну подушку, і нелітну подушку промивали ефіром. Насичений хлорид амонію (400мл) додавали і збирали органічну фазу. Водну фазу потім екстрагували 300мл ефіру. Об'єднану органічну фазу розбавляли 400мл насиченого хлориду амонію (400мл), 1Μ бікарбонату натрію (3´400мл) і сольовим розчином (400мл), і висушували над сульфатом магнію. Після видалення агента, що висушує, фільтрацією, фільтрат концентрували з використанням ротаційного випарника (скор. Rotovap) до одержання коричневої рідини. Подальше очищення проводили шляхом диетиляції до одержання 105,4г (85%) продукту. 1H-ЯМР (400МГц, CDCI,) δ (м.ч.) 10,22 (с, 1Н), 8,02 (д, 1Н), 7,80 (д, 1Н), 7,74 (с, 1Н), 6,02 (м, 1H), 5,06 (м, 1Н), 4,96 (м, 1Н), 3,89 (д, 2Н). Стадія А 2-аліл-4-(трифторметил)бензальдегід У висушений у термостаті 5 літровий флакон з 4 горлечками навколо дна, оснащений підвісною мішалкою, азотним шприцом, лійкою для додавання на 500мл, лійкою для додавання на 250мл і термометром, заряджали гетрагідрофуран (1400мл) і N,N,N'-триметилетан-1,2-діамін (105мл, 0,788моль). Розчин охолоджували до -40°С (сухий лід/ MeCN баня). н-Бутиллітій (1,6Μ у гексані, 510мл) додавали в 500мл лійку для додавання і потім додавали до вищевказаного розчину протягом 40 хвилин (від -40°С до -35°С). Безбарвний розчин набував світло-жовтого кольору. Потім холодну баню видаляли і реакційну суміш перемішували протягом 30 хвилин, поки вона не нагрівалася до температури -10°С. Реакцію охолоджували до -40°С, до -45°С і птрифторметилбензальдегід (77мл, 0,56М) додавали через шприц в 250мл лійку для додавання. Альдегід додавали по краплях протягом 15 хвилин, поки температура реакції залишалася на рівні від -40°С до -35°С. У процесі додавання реакція набувала коричневого кольору. Реакцію перемішували при температурі від -50°С до -40°С протягом 30 хвилин. Друге додавання 1,6Μ н-бутиллітію в гексані (400мл) проводили через 50 хвилин через лійку для додавання. Реакційну суміш залишали до підвищення температури до -25°С і витримували при від -20°С до -30°С протягом 3 годин, після чого бромід міді (І) (108м, 0,738моль) додавали безпосередньо через лійку для порошку. Холодну баню видаляли, і реакції дозволяли нагрітися при перемішуванні протягом додаткових 90 хвилин. Реакцію охолоджували до -30°С до -25°С і розчин броміду алілу (78мл, 0,90моль) у тетрагідрофурані (240мл) додавали по краплях протягом 40 хвилин через Стадія В 2-Аліл-4-(трифторметил}-1-вінілбензол Бромід трифенілметилфосфонію (182г, 0,508М) суспендували в діетилефірі (900мл, 8моль) і охолоджували до 0°С. н-Бутиллітій (1,60Μ у гексані, 289мл) швидко додавали через шприц і суміш, що вийшла, нагрівали до кімнатної температури і перемішували протягом ночі (18год.). Перемішування припиняли для осадження сухого осаду і переносили верхній світлий розчин через канюлю до розчину 2-аліл-4(трифторметил)бензальдегіду (99,0г, 0,462моль) у метиленхлориді (900мл), що перемішували при 0°С. Після додавання, крижану баню видаляли і суміш нагрівали кип'ятінням зі зворотним холодильником протягом приблизно 30 годин. Після охолодження до кімнатної температури оранжевий розчин концентрували, поки не залишалася невелика кількість розчинника. Силікагель додавали до розчину при помішуванні до утворення злегка в'язкої маси. Пентан (500мл) додавали для розчинення більш густих згустків. Суміш пропускали через силікагель у скляній пористій вакуумній лійці з використанням пентану (1,5л). Розчин пентану збирали в 3л флакон із круглим дном. Майже безбарвну рідину потім концентрували до одержання чистого дієну (78 і, 79,3%); 1H-ЯМР (400МГц, CDCI3) δ (м.ч.) 7,58 (д, 1Н), 7,45 (д, 1H), 7,41 (с, 1Н), 6,95 (дд, 1Н), 5,95 (м, 1Н), 5,72 (д, 1Н), 5,41 (д, 1Н), 5,11 (д, 1H), 5,00 (д, 1Н), 3,48 (д, 2Н). Стадія С 6-(Трифторметил)-1Н-інден Хлорид метилену (0,6л) додавали в 1л флакон, що містить 2-аліл-4-(трифторметил)-і 57 вінілбензол (80,0г, 0,377моль). Дихлорид біс(трициклоіексилфосфін)бензилідину рутенію(ІV) (каталізатор Grubbs, 1-ще покоління) (3,1г, 0,0038моль) додавали в розчин і отриманий у результаті розчин кип'ятили зі зворотним холодильником протягом ночі (18год.). Розчинник упарювали до одержання темного масла, що пропускали через силікагелеву подушку з використанням пентану. Після обережного видалення пентану, збирали 57г (82,8%) чистого продукту у вигляді світло-коричневого масла. 1HЯМР (400МГц, CDCI3) δ (м.ч.) 7,72 (с, 1Н), 7,55 (д, 1Н), 7,48 (д, 1Н), 6,93 (м, 1H), 6,74 (м, 1H), 3,46 (ушир, с, 1Н). Стадія D 4-(Трифторметил)-6,6а-дигідро-1аНіндено[1,2-b]оксирен До розчину 2Μ гіпохлориту натрію у воді (200мл) при 0°С додавали водний гідроксид натрію (1М, 40мл), N-оксид 4-(3-фенілпропіл)піридин (6,0г, 0,03М) і розчин хлориду (S,S)-(+)-N,N'-біс(3,5-дитрет-бутилсаліциліден)-1,2-циклогександіаміномарганцю(ІІІ) (4,13г, 0,00651моль) у дихлорметані (700мл). Отриманий коричневий розчин струшували протягом 15хв. при 0°С. До холодного розчину додавали розчин 6-(трифторметил)-1Ніндену (51г, 0,24моль) у дихлорметані (700мл) з одночасним додаванням водного гіпохлориту натрію (2М, 200мл). Реакцію проводили при 0°С, і коричневий розчин зберігав свій колір при додаванні індену. Через 4 години органічну фазу збирали і висушували над сульфатом натрію. Суміш пропускали через силікагель із використанням пентану. Після видалення розчинника одержували 42г (88%, 84% ее) епоксиду. 1H-ЯМР (400МГц, CDCI3) δ (м.ч.) 7,72 (с, 1Η), 7,55 (д, 1H), 7,48 (д, 1H), 6,93 (м, 1Н), 6,74 (м, 1Н). 3,46 (ушир, с, 1H). Стадія Е (2S)-1-Бензил-2-метилпіперазин трет-Бутил-(3S)-3-метилпіперазин-1карбоксилат (380,0г, 1,897М) і бромід бензилу (248мл, 2,09Μ) змішували в ацетонітрилі (440мл). Триетиламін (300,0мл, 2,152моль) обережно додавали, і суміш кип'ятили зі зворотним холодильником протягом ночі. Після охолодження суміші до кімнатної температури, сухий осад відфільтровували. Фільтрат концентрували. Залишок з'єднували із сухим осадом і розчиняли в хлориді метилену. Розчин хлориду метилену промивали 1N NaOH і висушували над сульфатом магнію. Після видалення розчинника залишок безпосередньо обробляли 6N HСІ при 0°С і, через 3 години, розчин залужували повільним додаванням сухого гідроксиду натрію. Отриману суміш екстрагували хлоридом метилену, і екстракт висушували над сульфатом магнію. Після видалення розчинника одержували 330г (91,4%) 88466 58 продукту. Продукт використовували безпосередньо в наступній стадії. 1H-ЯМР (400МГц, CDCI3) δ (м.ч.) 7,30 (м, 5Н), 4,05 (д, 1H), 3,15 (д, 1Н), 2,92 (м, 1Н), 2,83 (м, 2Н), 2,67 (м, 1Н), 2,60 (м, 1Н), 2,38 (м, 1Н), 2,36 (ушир, с, 2Н), 2,06 (м, 1H), 1,14 (д, 3Н). MS (EI) 191,1 (M+1). Стадія F трет-Бутил-4-[(3S)-4-бензил-3-метилпіперазин1-іл]-4-ціанопіперидин-1-карбоксилат В 5л флаконі (2S)-1-бензил-2-метилпіперазин (260,0г, 1,366Μ), дихлорометан (1000мл), третбутил-4-оксо-1-піперидинкарбоксилат (272г, 1,37моль) і тетраізопропоксид титану (480,0мл, 1,626моль) змішували і суміш перемішували при кімнатній температурі протягом 20 годин. Суміш охолоджували до 0°С і по краплях додавали ціанід діетилалюмінію в толуолі (1,0М, 1600мл). Отриману суміш перемішували при кімнатній температурі протягом 20 годин. Вміст реакції потім розділяли на два 5л флакони, у кожний флакон додавали 1л етилацетату, 500г бікарбонату натрію, 150г целіту, після чого їх охолоджували 40°С з використанням сухого льоду/ацетонітрилу. Потім у кожний флакон повільно додавали 200мл насиченого водного сульфату натрію при енергійному перемішуванні. Після повільного нагрівання реакційної суміші до кімнатної температури і перемішування протягом 4 годин, у кожний флакон додавали 1л метанолу. Після перемішування протягом ночі, реакційну суміш фільтрували через тонкий шар піску. Сухий залишок переносили назад в 5л флакон і перемішували з 3л метанолу протягом 5 годин, і нерозчинний сухий осад відфільтровували. Об'єднані фільтрати концентрували до сухого стану і додавали 3л хлориду метилену. Нерозчинний сухий осад відфільтровували. Фільтрат висушували над сульфатом магнію, розчинник видаляли до одержання 484г (88,9%) продукту у вигляді світло-жовтого сухого осаду. Неочищений продукт ретельно очищали і використовували безпосередньо в наступній стадії. 1H-ЯМР (400МГц, CDCI3) δ (м.ч.) 7,32 (м, 5Н), 4,04 (д, 1H), 3,95 (ушир, с, 2Н), 3,15 (д, 1Н), 3,15 (ушир, с, 2Н), 2,82 (м, 2Н), 2,73 (м, 2Н), 2,44 (м, 2Н), 2,25 (т, 1Н), 2,15 (м, 1Н), 2,05 (м, 1H), 1,66 (м, 1Н), 1,46 (с, 9Н), 1,17 (д, 3Н). MS (ΕΙ) 399,2 (M+1). Стадія G трет-Бутил-4-[(3S)-4-Бензил-3-метилпіперазин1-іл]-4-метилпіперидин-1-карбоксилат Розчин трет-бутил-4-[(3S)-4-бензил-3метилпіперазин-1-іл]-4-ціанопіперидин-1карбоксилагу (242г, 0,605моль) у тетрагідрофурані (1,5л) в 5л флаконі охолоджували до -40°С з 59 використанням сухого льоду/ацетонітрилу. Повільно додавали бромід метилмагнію (3,0Μ у тетрагідрофурані, 800мл). Після додавання, реакційну суміш повільно нагрівали до кімнатної температури і перемішували протягом ночі. Після охолодження до -40°С з використанням сухого льоду/ацетонітрилу, целіт (200г), і потім обережно додавали етилацетат (500мл). Після додавання суміш перемішували протягом 4 годин, поки температура повільно наростала до кімнатної температури. Реакційну суміш знову охолоджували до -40°С і додавали воду (200мл), а потім метанол (1,5л). Після перемішування при кімнатній температурі протягом ночі, суміш фільтрували через гонкий шар піску. Сухий залишок переносили назад в 5л флакон і перемішували з метанолом (2л) протягом 5 годин. Нерозчинний сухий осад відфільтровували. Об'єднані фільтрати концентрували до сухого стану. Додавали хлорид метилену (3,5л). Нерозчинний сухий осад відфільтровували. Фільтрат висушували над сульфатом магнію. Після видалення розчинника одержували 436г (92,6%) продукту у вигляді білого важкорозчинного сухого осаду. Неочищений продукт ретельно очищали і використовували безпосередньо в наступній стадії. MS (ΕΙ) 388,3 (М+Н). Стадія Н трет-Бутил-4-метил-4-[(3S)-3-метилпіперазин1-іл]піперидин-1-карбоксилат Розчин трет-бутил-4-[(3S)-4-бензил-3метилпіперазин-1-іл]-4-метилпіперидин-1карбоксилату (45,5г, 0,118моль) у метанолі (320мл) і оцтова кислота (35мл, ~5 еквівалентів) в 2,25л посудині Парра насичували Н2 до 60фунт/дюйм2 і суміш струшували протягом 18 годин. Реакційну суміш фільтрували через целітну подушку, і подушку промивали метанолом. Фільтрат концентрували у вакуумі. Залишкове масло розчиняли в DCM (500мл) і промивали водним гідроксидом натрію (300мл). Водну фазу обернено екстрагували хлоридом метилену (200мл). Змішаний органічний розчин промивали сольовим розчином (500мл), висушували над сульфатом натрію і розчинник видаляли у вакуумі до одержання 35г (100%) продукту у вигляді блідожовтого в'язкого масла, що повільно кристалізувалося. 1H-ЯМР (400МГц, CDCI3) δ (м.ч.) 3,44 (м, 2Н), 3,36 (м, 2Н), 2,97 (дт, 1Н), 2,84 (дд, 1H), 2,78 (м, 1H), 2,71 (ушир, д, 2Н), 2,16 (дт, 1H), 1,81 (т, 2Н), 1,76 (м, 1Н), 1,45 (с, 9Н), 1,34 (м, 3Н), 1,03 (д, 3Н), 0,90 (с, 3Н); MS (ΕΙ) 298,2 (M+1). Стадія І 88466 60 Сіль трет-бутил-4-(3S)-4-[((1R,2R)-2-гідрокси-5(трифторметил)-2,3-дигіоро-1Н-інден-1-іл]-3метилпіперазин-1-іл-4-метилпіперидин-1карбоксилат [(1R)-7,7-диметил-2оксобіцикло[2.2.1]гепт-1-ил]метансульфоновоі кислоти Суміш (1аS,6аR)-4-(трифторметил)-6,6адигідро-1аН-індено[1,2-b]оксирену (118,4г, 0,5917М) і трет-бутил-4-метил-4-[(3S)-3метилпіперазин-1-іл]піперидин-1-карбоксилату (160,00г, 0,53793моль) в етанолі (100мл) нагрівали до 70°С (температура масляної бані) протягом двох днів. Суміш концентрували і залишок пропускали через пластинку силікагелю з використанням етилацетату, що містить 1% триетиламіну. Після видалення розчинника одержували 267,67г спіненого сухою залишку. До цього залишку додавали ацетонітрил (500мл) і суміш перемішували протягом 30 хвилин. До зазначеної вище суміші відразу додавали суху [(1R)-7,7-диметил-2-оксобіцикло[2.2.1]гепт-1ил]метансульфонову кислоту (124,96г, 0,53793моль). Розчин повільно ставав прозорим, а потім випадав білий осад. Після перемішування протягом ночі, осад збирали шляхом фільтрації, промивали ацетонітрилом і висушували до одержання 232г продукту. Фільтрат нейтралізували і концентрували, крім того, проводили той же процес формування солі із залишком, для одержання додаткових 74г продукту. Загальний вихід становив 70%. MS (ΕΙ) 498,2 (M+1). Стадія J трет-Бутил-4-(3S)-4-((1R,2R)-2-гідрокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-іл-4-метилпіперидин-1карбоксилат Сіль трет-бутил-4-(3S)-4-[(1R,2R)-2-гідрокси-5(трифторметил)-2,3-дигідро-1Н-інден-1-іл]-3метилпіперазин-1-іл-4-метилпіперидин-1карбоксилат [(1R)-7,7-диметил-2оксобіцикло[2.2.1]гепт-1-ил]метансульфонової кислоти (512г, 0.701моль) розчиняли в 1Μ водного гідроксиду натрію (1л), і розчин екстрагували хлоридом метилену (2´2л). Об'єднані органічні шари висушували над сульфатом магнію і концентрували. Залишок потім висушували у високому вакуумі до одержання грязно-білого спіненого осаду (346г, 99,1%). MS (ΕΙ) 498,2 (M+1).
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperazinylpiperidine derivatives as chemokine receptor antagonists
Автори англійськоюXue Chu-Biao, Cao Ganfeng, Huang Taisheng, Chen Lihua, Zhang Ke, Wang Anlai, Meloni David, Anand Rajan, Glenn Joseph, Metcalf Brian
Назва патенту російськоюПроизводные пиперазинилпиперидина как антагонисты хемокинового рецептора
Автори російськоюСюе Чу-Бяо, Цао Ганьфен, Хуан Тайшен, Чень Лихуа, Чжан Ке, Ван Аньлай, Мелони Девид, Ананд Раджан, Гленн Джозеф, Меткаф Брайан
МПК / Мітки
МПК: A61K 31/495
Мітки: похідні, піперазинілпіперидину, рецептора, антагоністи, хемокінового
Код посилання
<a href="https://ua.patents.su/38-88466-pokhidni-piperazinilpiperidinu-yak-antagonisti-khemokinovogo-receptora.html" target="_blank" rel="follow" title="База патентів України">Похідні піперазинілпіперидину як антагоністи хемокінового рецептора</a>
Попередній патент: Пружинний привід
Наступний патент: Пристрій та спосіб для поліпшеної обробки um rlc даних
Випадковий патент: Носій запису та пристрій для сканування носія запису












