Похідні заміщеного піролопіридинону, корисні як інгібітори фосфодіестерази
Номер патенту: 72611
Опубліковано: 15.03.2005
Автори: Суі Жіхуа, Лантер Джеймс, Мейсілаг Марк Дж., Джіанг Вейквін, Гуан Джіхуа
Формула / Реферат
1. Сполука формули (І) або (II):
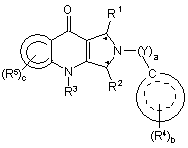 (I) або
(I) або
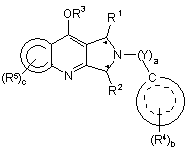 (II),
(II),
де
R1 є вибраним з групи, що складається з гідрогену, карбоксигрупи, -С(О)-С1-С6-алкілу, -С(О)-С1-С6-алкоксигрупи, -С(О)-NН-С1-С6-алкіл-NН2, -С(О)-NH-С1-С6-алкіл-NHRA, -С(О)-NН-С1-С6-алкіл-N(RA)2, -С(О)-NH2, -С(О)-NHRA, -С(О)-N(RA)2, С1-С6-алкіл-NН2, -С1-С6-алкіл-NНRA, -С1-С6-алкіл-N(RA)2, -NH-С1-С6-алкіл-N(RA)2;
де кожний RA є незалежно вибраним з групи, що складається з С1-С6-алкілу, арилу, С1-С6-аралкілу та гетероарилу, де арил, аралкіл або гетероарил може бути заміщеним, при потребі, RB у кількості від одного до трьох;
де кожний RB є незалежно вибраним з групи, що складається з галогену, нітрогрупи, ціаногрупи, С1-С6-алкілу, С1-С6-алкоксигрупи, С1-С6-алкілкарбонілу, карбоксі С1-С6-алкілу, С1-С6-алкілсульфонілу, трифторметилу, аміногрупи, ді(С1-С6-алкіл)аміногрупи, ацетиламіногрупи, карбоксіС1-С6-алкілкарбоніламіногрупи, гідроксіС1-С6-алкіламіногрупи, NНRA та N(RA)2;
R2 є вибраним з групи, що складається з С5-С10-алкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з галогену, гідроксигрупи, нітрогрупи, аміногрупи, NHRA або N(RA)2), арилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC), циклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RA), гетероарилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC) та гетероциклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC);
де RC є вибраним з групи, що складається з галогену, нітрогрупи, ціаногрупи, С1-С6-алкілу, С1-С6-алкоксигрупи, трифторметилу, трифторметоксигрупи, NH2, NH(С1-С6алкіл) та (NС1-С6алкіл)2;
R3 є вибраним з групи, що складається з гідрогену, С1-С6-алкілу, С1-С6алкілкарбонілу, С2-С6-алкенілкарбонілу та С2-С6алкінілкарбонілу;
b є цілим числом від 0 до 4;
R4 є вибраним з групи, що складається з галогену, гідроксигрупи, карбоксигрупи, оксогрупи, нітрогрупи, С1-С6-алкілу, С1-С6-алкоксигрупи, С1-С6-алкоксикарбонілу, трифторметилу, фенілу (де група фенілу може бути заміщеною, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), фенілсульфонілу, нафтилу, С1-С6-аралкілу, -O-аралкілу, (де група аралкілу може бути заміщеною, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), гетероарилу (де гетероарил може бути заміщеним, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), гетероциклоалкілу, NH2, NHRA, N(RA)2,
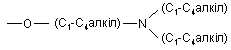 ,
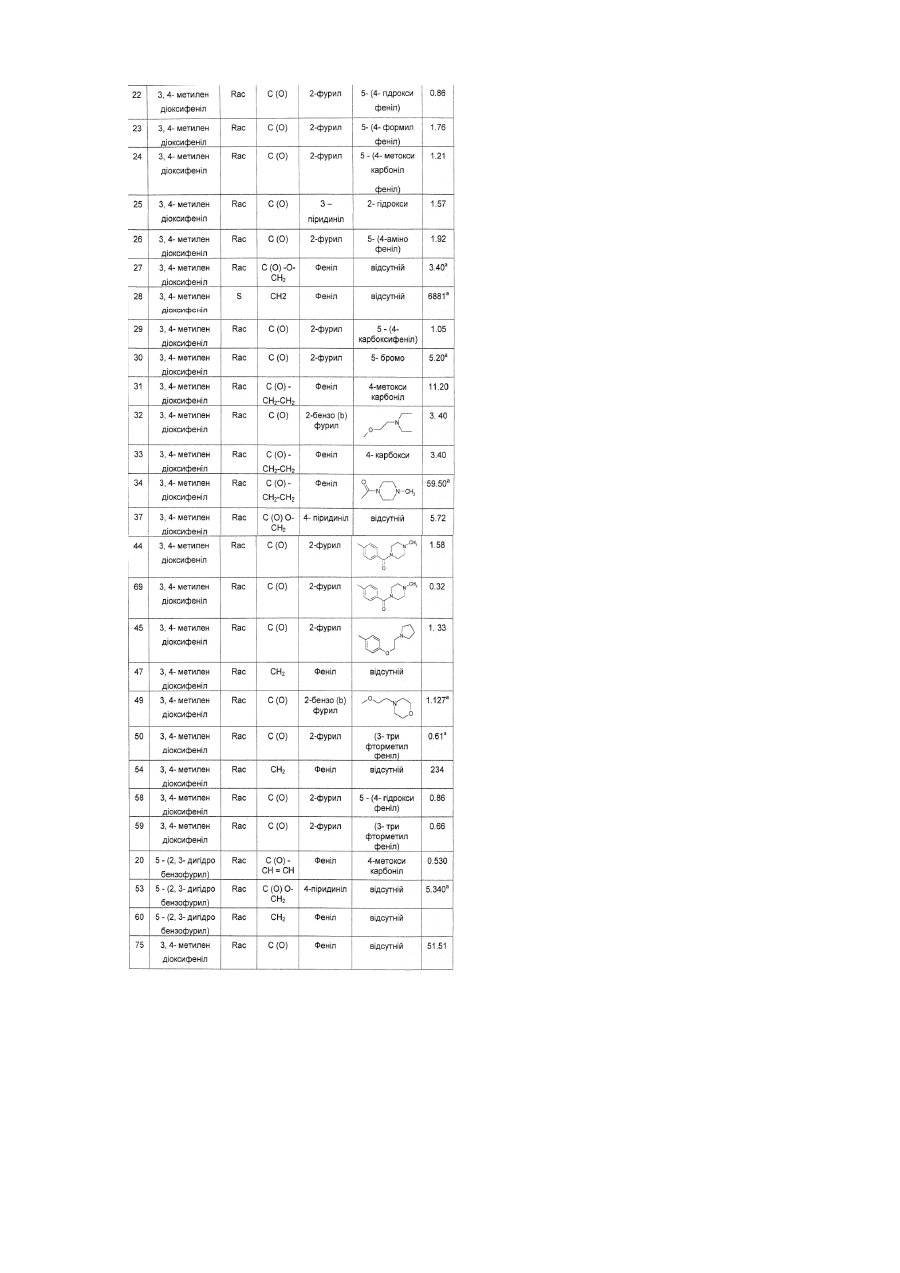
,
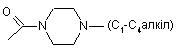 ,
,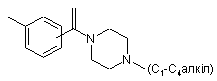 ,
,
![]() ,
,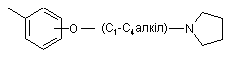 ,
,
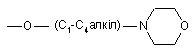 та
та 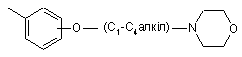 ,
,
де кожний RD є незалежно вибраним з галогену, гідроксигрупи, карбоксигрупи, оксогрупи, С1-С4-алкілу, С1-С4-алкілтіо, гідроксіС1-С4-алкілу, С1-С6-алкоксигрупи, С1-С4-алкоксикарбонілу, С1-С4-алкілкарбонілу, трифторметилу, трифторметоксигрупи, NH2, NHRA, N(RA)2, C(O)N(RA)2, ацетиламіногрупи, нітрогрупи, ціаногрупи, формілу, С1-С6-алкілсульфонілу, карбоксіС1-С6-алкілу та аралкілу;
с є цілим числом від 0 до 4;
R5 є незалежно вибраним з групи, що складається з галогену, нітрогрупи, гідроксигрупи, С1-С6-алкілу, С1-С6-алкокси групи, -NH2, -NHRA, -N(RA)2, -ORA, -C(O)NH2, -C(O)NHRA, -C(O)N(RA)2, -NHC(O)RA, -SO2NHRA, -SO2N(RA), де RA є таким, як визначено вище, фенілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB), гетероарилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB) та гетероциклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB);
а є цілим числом від 0 до 1;
Y вибраний з групи, що складається з -С1-С6-алкіл-, -С(О) -, -(С1-С6-алкіл)карбоніл-, -(С2-С6-алкеніл)карбоніл-, -(С2-С6-алкініл)карбоніл-, -карбоніл(С1-С6-алкіл)-, -карбоніл(С2-С6-алкеніл) -, -С(O)О(-С1-С6-алкіл)-, -С(S), -SO2-, -(С1-С6алкіл) сульфоніл-, -сульфоніл(С1-С6-алкіл) -, -C(О)NH-, -C(O)NH-(С1-С6-алкіл)-, -С(O)(С1-С6-циклоалкіл)- та -(С3-С7-циклоалкіл)-С(О)-;
![]() є вибраним з групи, що складається з фенілу, фурилу, тієнілу та піролілу;
є вибраним з групи, що складається з фенілу, фурилу, тієнілу та піролілу;
 є вибраним з групи, що складається з арилу, гетероарилу, циклоалкілу та гетероциклоалкілу;
є вибраним з групи, що складається з арилу, гетероарилу, циклоалкілу та гетероциклоалкілу;
за умови, що, коли R1 є гідрогеном, R3 є гідрогеном, b є 0, с є 0, а є 1, Y є -СН2-, ![]() є фенілом, а
є фенілом, а  є фенілом, у той час як R2 не є триметоксифенілом;
є фенілом, у той час як R2 не є триметоксифенілом;
та її фармацевтично прийнятні солі.
2. Сполука за пунктом 1, де R1 є гідрогеном,
R2 є вибраним з групи, яка складається з фенілу (заміщеного, при потребі, замісниками у кількості від одного до двох, незалежно вибраними з галогену, нітрогрупи, ціаногрупи, С1-С3-алкілу, С1-С3-алкоксигрупи, трифторметилу, трифторметоксигрупи, NH2, NН(С1-С3-алкіл) або (NС1-С3-алкіл)2), гетероарилу та гетероциклоалкілу,
R3 є вибраним з групи, що складається з гідрогену та С1-С4-алкілу, b є цілим числом від 0 до 4,
R4 є вибраним з групи, що складається з галогену, гідроксигрупи, карбоксигрупи, оксогрупи, С1-С4-алкілу, С1-С3-алкоксигрупи, С1-С3-алкоксикарбонілу, фенілу (заміщеного, при потребі, замісниками кількістю від одного до двох, незалежно вибраними з гідроксигрупи, карбоксигрупи, С1-С4-алкілу, С1-С4-алкілтіо, гідроксіС1-С4-алкілу, С1-С4алкоксигрупи, С1-С4-алкілоксикарбонілу, C(O)N(RA)2, трифторметилу, трифторметоксигрупи, аміногрупи, (С1-С4-алкіл)аміногрупи, ді(С1-С4-алкіл)аміногрупи, нітрогрупи, ціаногрупи або формілу), O-аралкілу, гетероарилу (заміщеного, при потребі, замісниками кількістю від одного до двох, незалежно вибраними з гідроксигрупи, карбоксигрупи, оксогрупи, С1-С3алкілу, С1-С3-алкоксигрупи, С1-С3-алкоксикарбонілу, C(O)N(RA)2, трифторметилу, трифторметоксигрупи, аміногрупи, нітрогрупи, С1-С3-алкілкарбонілу або С1-С4-аралкіл), гетероциклоалкілу,
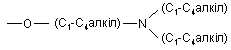 ,
,
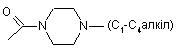 ,
,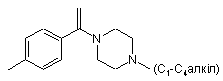 ,
,
![]() ,
,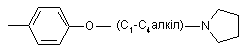 ,
,
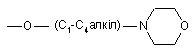 та
та 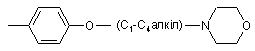 ,
,
с є О, а є цілим числом від 0 до 1,
Y є вибраним з групи, що складається з -С1-С4-алкіл-, -C(S)-, -С(О)-, -С(O)O-(С1-С4-алкіл)-, -С(O)-(С1-С4-алкіл)-, -С(О)-(С2-С4-алкеніл)-, С(О)-(С3-С7-циклоалкіл)- та -С(O)NН-(С1-С3-алкіл)-,
![]() є фенілом;
є фенілом;
 є вибраним з групи, що складається з фенілу, гетероарилу та гетероциклоалкілу,
є вибраним з групи, що складається з фенілу, гетероарилу та гетероциклоалкілу,
та її фармацевтично прийнятні солі.
3. Сполука за пунктом 2, де
R2 є вибраним з групи, що складається з 3,4-метилендіоксифенілу, 3,4-диметоксифенілу, 5-(2,3-дигідробензофурил), 3,4-дигідробензо-[1,4]-діоксин-6-ілу, 5-бензофурилу, 5-інданілу та 3-тієнілу,
R3 є вибраним з групи, що складається з гідрогену та метилу,
R4 є вибраним з групи, що складається з атома брому, гідроксигрупи, карбоксигрупи, оксогрупи, метилу, фенілу, 4-гідроксифенілу, 3-гідроксиметилфенілу, 4-гідроксиметилфенілу, 4-карбоксифенілу, 4-метилфенілу, 4-метоксифенілу, 3,4-диметоксифенілу, 4-метоксикарбонілу, 4-метоксикарбонілфенілу, 3-трифторметилфенілу, 4-ціанофенілу, 4-амінофенілу, 4-диметиламінофенілу, 3-нітрофенілу, 4-нітрофенілу, 4-формілфенілу, 4-метилтіофенілу, бензилоксигрупи, 2-піридинілу, 3-піридинілу, 4-піридинілу, N-окси-2-піридинілу, 3-тієнілу, 2-фурилу, 1-імідазолілу, 5 - (1-бензил-2-метилімідазоліл), 5 - (1, 2-диметилімідазоліл), 5-(1-метилімідазоліл), 5- (1-бензилімідазоліл), 3,4-метилендіоксифенілу,
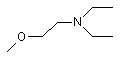 ,
,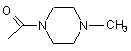 ,
,
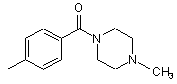 ,
,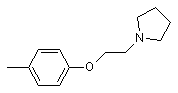 ,
,
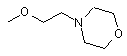 та
та 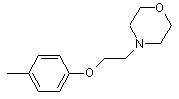 ,
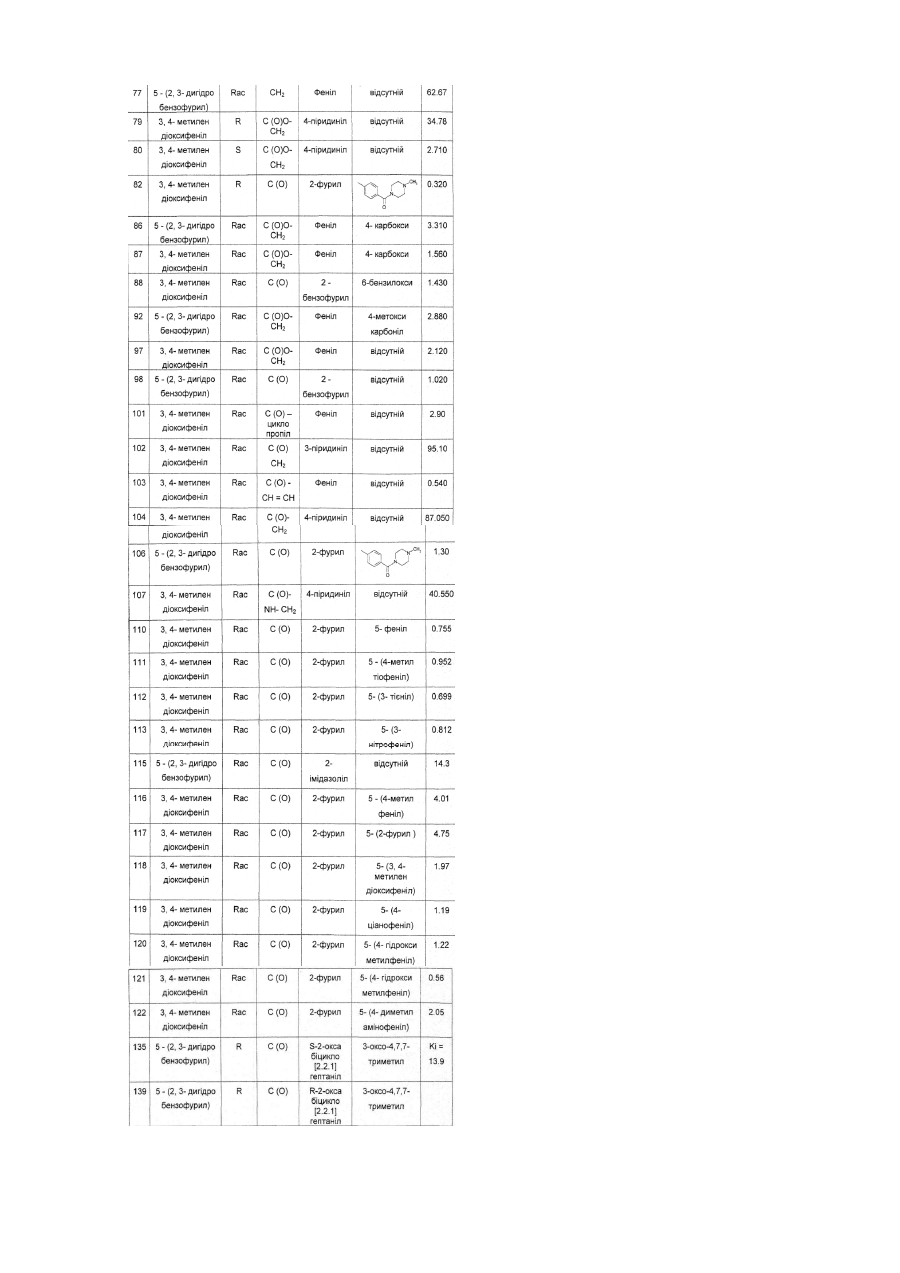
,
Y є вибраним з групи, що складається з -СН2-, -C(S)-, -С(О)-, -С(O)O-СН2-, С(O)-СН2СН2-, С(O)-СН=СН-, С(O)NH-CH2-, С(О)-циклопропілу та -С(O)СН2-,
 є вибраним з групи, що складається з фенілу, 2-фурилу, 2-бензо(b)фурилу, 2-піримідинілу, 2-піридинілу, 3-піридинілу, 4-піридинілу, 1-імідазолілу, 2-імідазолілу, 2-тіазолілу, та 2-оксабіцикло[2.2.1]гептанілу,
є вибраним з групи, що складається з фенілу, 2-фурилу, 2-бензо(b)фурилу, 2-піримідинілу, 2-піридинілу, 3-піридинілу, 4-піридинілу, 1-імідазолілу, 2-імідазолілу, 2-тіазолілу, та 2-оксабіцикло[2.2.1]гептанілу,
та її фармацевтично прийнятні солі.
4. Сполука за пунктом 3, де
R2 є вибраним з групи, що складається з 3, 4-метилендіоксифенілу, 5-(2,3-дигідробензофурил), 3,4-дигідробензо-[1,4] -діоксин-6-ілу, 3-тієнілу, 5-інданілу та 5-бензофурилу;
R3 є гідрогеном, b є цілим від 0 до 1,
R4 є вибраним з групи, що складається з 5-бромо, 2-гідроксигрупи, 6-гідроксигрупи, 4-карбоксигрупи, фенілу, 4-гідроксифенілу, 3-гідроксиметилфенілу, 4-гідроксиметилфенілу, 4-карбоксифенілу, 4-метилфенілу, 4-метилтіофенілу, 4-метоксифенілу, 3,4-диметоксифенілу, 4-метоксикарбонілу, 4-метоксикарбонілфенілу, 3-трифторметилфенілу, 4-амінофенілу, 4-диметиламінофенілу, 3-нітрофенілу, 4-нітрофенілу, 4-ціанофенілу, 4-формілфенілу, бензилоксигрупи, 2-піридинілу, 3-піридинілу, 4-піридинілу, 2-фурилу, 3-тієнілу, N-оксо-2-піридинілу, 1-імідазолілу, 5-(1-бензил-2-метилімідазоліл), 5-(1,2-диметилімідазоліл), 3,4-метилендіоксифенілу,
 ,
, ,
,
 ,
, та
та
 ,
,
Y є вибраним з групи, що складається з -С(О)-, -С(O)O-СН2-, С(O)-СН2СН2-, С(О)-СН=СН-, та -С(О)-циклопропілу;
 є вибраним з групи, що складається з фенілу, 2-фурилу, 2-бензо(b)фурилу, 2-піримідинілу, 2-піридинілу, 3-піридинілу, 4-піридинілу та 2-тіазолілу;
є вибраним з групи, що складається з фенілу, 2-фурилу, 2-бензо(b)фурилу, 2-піримідинілу, 2-піридинілу, 3-піридинілу, 4-піридинілу та 2-тіазолілу;
та її фармацевтично прийнятні солі.
5. Сполука за пунктом 4, де
R2 є вибраним з групи, що складається з 3,4-метилендіоксифенілу, 5-(2,3-дигідробензофурил), 3,4-дигідробензо-[1,4]-діоксин-6-ілу, 3-тієнілу, 5-інданілу та 5-бензофурилу;
R4 є вибраним з групи, що складається з 5-бромо, 2- гідроксигрупи, 6-гідроксигрупи, 4-карбоксигрупи, фенілу, 4-гідроксифенілу, 3-гідроксиметилфенілу, 4-гідроксиметилфенілу, 4-карбоксифенілу, 4-метилфенілу, 4-метилтіофенілу, 4-метоксифенілу, 3,4-диметоксифенілу, 4-метоксикарбонілу, 4-метоксикарбонілфенілу, 3-трифторметилфенілу, 4-амінофенілу, 4-диметиламінофенілу, 3-нітрофенілу, 4-нітрофенілу, 4-ціанофенілу, 4-формілфенілу, бензилоксигрупи, 2-піридинілу, 3-піридинілу, 4-піридинілу, 2-фурилу, 3-тієнілу, N-оксо-2-піридинілу, 1-імідазолілу, 5-(1-бензил-2-метилімідазоліл), 5-(1,2-диметилімідазоліл), 3,4-метилендіоксифенілу,
 ,
, ,
,
 та
та  ,
,
Y є вибраним з групи, що складається з -С(О)-, -С(O)O-СН2- та -С(O)-СН=СН;
та їі фармацевтично прийнятні солі.
6. Сполука за пунктом 5, де
R4 є вибраним з групи, що складається з 6-гідроксигрупи, 4-карбоксигрупи, фенілу, 4-гідроксифенілу, 3-гідроксиметилфенілу, 4-метилфенілу, 4-метилтіофенілу, 4-метоксифенілу, 3,4-диметоксифенілу, 4-метоксикарбонілу, 3-трифторметилфенілу, 3-нітрофенілу, 4-нітрофенілу, 2-піридинілу, 3-піридинілу, 4-піридинілу, N-оксо-2-піридинілу, 3-тієнілу, 5-(1-бензил-2-метилімідазоліл), 5-(1,2-диметилімідазоліл),
 та
та  ;
;
та її фармацевтично прийнятні солі.
7. Сполука за пунктом 6, де
R2 є вибраним з групи, що складається з 3,4-метилендіоксифенілу та 5-(2,3-дигідробензофурил);
R4 є вибраним з групи, що складається з гідроксигрупи, 4-метилфенілу, 4-метоксифенілу, 3,4-диметоксифенілу, 4-метоксикарбонілу, 3-трифторметилфенілу, 4-нітрофенілу, 2-піридинілу, 3-піридинілу,
 та
та  ,
,
Y є вибраним з групи, що складається з -С(О)- та -С(O)O-СН2-;
 є вибраним з групи, що складається з фенілу, 2-фурилу, 2-бензо(b)фурилу, 4-піридинілу, 2-піримідинілу та 2-тіазолілу;
є вибраним з групи, що складається з фенілу, 2-фурилу, 2-бензо(b)фурилу, 4-піридинілу, 2-піримідинілу та 2-тіазолілу;
та її фармацевтично прийнятні солі.
8. Сполука за пунктом 7, яка є вибраною з групи, що складається з
1,2,3,4-тетрагідро-2-[5-(3,4-диметоксифеніл)-піримідин-2-іл]-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону;
1,2,3,4-тетрагідро-2-[(4-піридиніл)метилоксикарбоніл]-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону;
1,2,3,4-тетрагідро-2-[5-(2-піридиніл)-піримідин-2-іл]-3-(3,4-дигідробензофураніл)-9Н-піроло-[3,4-b]хінолін-9-ону;
1,2,3,4-тетрагідро-2-[5-(4-метоксифеніл)-піримідин-2-іл]-3-(3,4-дигідробензофураніл)-9Н-піроло-[3,4-b]хінолін-9-ону;
1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-2-(5-(4-(1-(4-метил)-піперазинілкарбоніл)-феніл)-фуроїл)-9Н-піроло[3,4-b]хінолін-9-ону;
1,2,3,4-тетрагідро-2-[2,3'-біпіридин]-6'-іл-3-(2,3-дигідро-5-бензофураніл)-9Н-піроло[3,4-b]хінолін-9-ону;
1,2,3,4-тетрагідро-2-(2-піридиніл)-3-(2,3-дигідро-5-бензофураніл)-9Н-піроло[3,4-b]хінолін-9-ону;
та її фармацевтично прийнятні солі.
9. Сполука за пунктом 8, яка є вибраною з групи, що складається з
R-1,2,3,4-тетрагідро-2-[5-(3,4-диметоксифеніл)-піримідин-2-іл]-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону;
R-1,2,3,4-тетрагідро-2-[(4-піридиніл)метилоксикарбоніл]-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону;
R-1,2,3,4-тетрагідро-2-[5-(2-піридиніл)-піримідин-2-іл]-3-(3,4-дигідробензофураніл)-9Н-піроло-[3,4-b]хінолін-9-ону;
R-1,2,3,4-тетрагідро-2-[5-(4-метоксифеніл)-піримідин-2-іл]-3-(3,4-дигідробензофураніл)-9Н-піроло-[3,4-b]хінолін-9-ону;
R-1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-2-(5-(4-(1-(4метил)-піперазинілкарбоніл)-феніл)-фуроїл)-9Н-піроло[3,4-b]хінолін-9-ону;
R-1,2,3,4-тетрагідро-2-(2-піридиніл)-3-(2,3-дигідро-5-бензофураніл)-9Н-піроло[3,4-b]хінолін-9-ону;
та її фармацевтично прийнятні солі.
10. Сполука формули (І) або (II):
 (I) або
(I) або
 (II),
(II),
де
R1 є вибраним з групи, що складається з гідрогену, карбоксигрупи, -С(О)-С1-С6-алкілу, -С(О)-С1-С6-алкоксигрупи, -С(О)-NН-С1-С6-алкіл-NH2, -С(О)-NН-С1-С6-алкіл-NHRA, -С(О)-NН-С1-С6-алкіл-N(RA)2, -С(О)-NH2, -С(О)-NHRA, -С(О)-N(RA)2, С1-С6-алкіл-NH2, -С1-С6-алкіл-NНRA, -С1-С6-алкіл-N(RA)2, -NH-С1-С6-алкіл-N(RA)2;
де кожний RA є незалежно вибраним з групи, що складається з С1-С6-алкілу, арилу, С1-С6-аралкілу та гетероарилу, де арил, аралкіл або гетероарил може бути заміщеним, при потребі, RB у кількості від одного до трьох;
де кожний RB є незалежно вибраним з групи, що складається з галогену, нітрогрупи, ціаногрупи, С1-С6-алкілу, С1-С6-алкоксигрупи, С1-С6-алкілкарбонілу, карбоксіС1-С6-алкілу, С1-С6-алкілсульфонілу, трифторметилу, аміногрупи, ді(С1-С6-алкіл)аміногрупи, ацетиламіногрупи, карбоксіС1-С6-алкілкарбоніламіногрупи, гідроксіС1-С6-алкіламіногрупи, NHRA тa N(RA)2;
R2 є вибраним з групи, що складається з С5-С10-алкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з галогену, гідроксигрупи, нітрогрупи, аміногрупи, NHRA або N(RA)2), арилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC), циклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RA), гетероарилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC) та гетероциклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC);
де RC є вибраним з групи, що складається з галогену, нітрогрупи, ціаногрупи, С1-С6-алкілу, С1-С6-алкоксигрупи, трифторметилу, трифторметоксигрупи, NH2, NH(С1-С6алкіл) та (NС1-С6алкіл)2;
R3 є вибраним з групи, що складається з гідрогену, С1-С6-алкілу, С1-С6алкілкарбонілу, С2-С6-алкенілкарбонілу та С2-С6алкінілкарбонілу;
b є цілим числом від 0 до 4;
R4 є вибраним з групи, що складається з галогену, гідроксигрупи, карбоксигрупи, оксогрупи, нітрогрупи, С1-С6-алкілу, С1-С6-алкоксигрупи, С1-С6-алкоксикарбонілу, трифторметилу, фенілу (де група фенілу може бути заміщеною, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), фенілсульфонілу, нафтилу, С1-С6-аралкілу, -O-аралкілу, (де група аралкілу може бути заміщеною, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), гетероарилу (де гетероарил може бути заміщеним, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), гетероциклоалкілу, NH2, NHRA, N(RA)2,
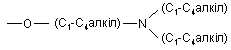 ,
,
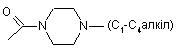 ,
, ,
,
![]() ,
,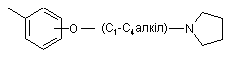 ,
,
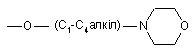 та
та 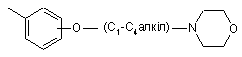 ,
,
де кожний RD є незалежно вибраним з галогену, гідроксигрупи, карбоксигрупи, оксогрупи, С1-С4-алкілу, С1-С4-алкілтіо, гідроксіС1-С4-алкілу, С1-С6-алкоксигрупи, С1-С4-алкоксикарбонілу, С1-С4-алкілкарбонілу, трифторметилу, трифторметоксигрупи, NH2, NHRA, N(RA)2, C(O)N(RA)2, ацетиламіногрупи, нітрогрупи, ціаногрупи, формілу, С1-С6-алкілсульфонілу, карбоксіС1-С6-алкілу та аралкілу;
с є цілим числом від 0 до 4;
R5 є незалежно вибраним з групи, що складається з галогену, нітрогрупи, гідроксигрупи, С1-С6-алкілу, С1-С6-алкоксигрупи, -NH2, -NHRA, -N(RA)2, -ORA, -C(O)NH2, -C(O)NHRA, -C(O)N(RA)2, -NНС(O)RA, -SO2NHRA, -SO2N(RA)2, де RA є таким, як визначено вище, фенілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB), гетероарилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB) та гетероциклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB);
а є цілим числом від 0 до 1;
Y вибраний з групи, що складається з -С1-С6алкіл-, -С(О)-, -(С1-С6-алкіл)карбоніл-, -(С2-С6-алкеніл)карбоніл-, -(С2-С6-алкініл)карбоніл-, -карбоніл(С1-С6-алкіл)-, -карбоніл(С2-С6-алкеніл)-, -С(O)О(-С1-С6-алкіл)-, -С(S)-, -SO2-, -(С1-С6алкіл)сульфоніл-, -сульфоніл(С1-С6-алкіл)-, -C(O)NH-, -C(O)NH-(С1-С6-алкіл)-, -С(O)(С3-С7-циклоалкіл)- та -(С3-С7-циклоалкіл)-С(О)-;
![]() є вибраним з групи, що складається з фенілу, фурилу, тієнілу та піролілу;
є вибраним з групи, що складається з фенілу, фурилу, тієнілу та піролілу;
 є вибраним з групи, що складається з арилу, гетероарилу, циклоалкілу та гетероциклоалкілу;
є вибраним з групи, що складається з арилу, гетероарилу, циклоалкілу та гетероциклоалкілу;
за умови, що, коли R1 є гідрогеном, R3 є гідрогеном, b є 0, с є 0, а є 1, Y є -СН2 -, ![]() є фенілом, а
є фенілом, а  є фенілом, у той час як R2 не є триметоксифенілом; та її фармацевтично прийнятні солі.
є фенілом, у той час як R2 не є триметоксифенілом; та її фармацевтично прийнятні солі.
11. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та сполуку за пунктом 1.
12. Спосіб лікування полової дисфункції у суб'єкта, який потребує такого лікування, що передбачає введення суб'єкту терапевтично ефективної кількості сполуки за пунктом 1.
13. Спосіб лікування полової дисфункції у суб'єкта, який потребує такого лікування, що передбачає введення суб'єкту терапевтично ефективної кількості композиції за пунктом 11.
14. Спосіб лікування полової дисфункції за пунктом 12, де полова дисфункція є чоловічою половою дисфункцією, чоловічою еректильною дисфункцією, імпотенцією, жіночою половою дисфункцією, жіночою дисфункцією полового збудження та жіночою половою дисфункцією, пов'язаною з кровотечею та виробництвом окису азоту в тканинах піхви та клітора.
15. Спосіб підвищення концентрації cGMP у тканинах полового члена у суб'єкта чоловічої статі, який потребує цього, що містить введення суб'єкту ефективної кількості сполуки за пунктом 1.
16. Спосіб лікування стану, вибраного з групи, що складається з чоловічої еректильної дисфункції (ED), імпотенції, жіночої дисфункції полового збудження, жіночої полової дисфункції, пов'язаної з кровотечею та виробництвом окису азоту в тканинах піхви та клітора, передчасних пологів, дисменореї, серцево-судинних захворювань, атеросклерозу, артеріальних оклюзивних захворювань, тромбозу, коронарного рестенозу, стенокардії, інфаркту міокарда, серцевого нападу, ішемічних серцевих захворювань, гіпертонії, легеневої гіпертонії, астми, синдрому переміжної кульгавості та діабетичних ускладнень у суб'єкта, який потребує такого лікування, що включає введення суб'єкту терапевтично ефективної кількості сполуки за пунктом 1.
Текст
Дана патентна заявка заявляє пріоритет по попередній патентній заявці Сполучених Штатів Америки серійний №60/204, 646, що подана 17 травня 2000 року, на яку в даному опису зроблено посилання. Даний винахід стосується нових похідних піролопіридинону, проміжних сполук, що в них використовуються, синтезу та фармацевтичних композицій, що містять сполуки та їх використання для лікування полової дисфункції. Сполуки даного винаходу є інгібіторами фосфодіестерази, які корисні для лікування полової дисфункції, більш особливо чоловічої еректільної дисфункції. Еректільну дисфункцію (ЕД) визначають як нездатність досягати або підтримувати ерекцію, досить стійку для задовільного полового акта. В даний час підраховано, що приблизно 7-8% чоловічого населення потерпає деякої міри від еректільної дисфункції, що тільки у Сполучених Штатах Америки еквівалентно, принаймні, 20 мільйонам чоловіків. Оскільки ймовірність еректільної дисфункції з віком збільшується, передбачається, що частка цього стану в майбутньому підвищиться, тому що зростає середній вік населення. Чоловіча еректільна дисфункція може бути наслідком психогенних та/або органічних факторів. Не зважаючи на те, що еректільна дисфункція є багатофакторною, деякі підгрупи серед чоловічого населення, більш ймовірно, мають ознаки цього захворювання. Зокрема, особливо високе поширення еректільна дисфункція має серед хворих діабетом, гіпертонією, серцевою хворобою та множинним склерозом. Крім того, хворі, які приймають деякі класи ліків, такі як гіпотензивні засоби, антидепресанти, седативні засоби та транквілізатори, більш схильні до того, щоб потерпати від еректільної дисфункції. Лікування від еректільної дисфункції включає ряд фармакологічних засобів, вакуумні пристрої та протези полового члена. Серед фармакологічних засобів в даний час на практиці використовуються папаверин, пентоламін алпростадил. Ці засоби ефективно діють тільки після прямого введення в половий член або внутрішньо-уретрального введення, та їх дія пов'язана з побічними ефектами, такими як пріапізм, фіброс, біль у половому члені та гематоми на місці введення. Вакуумні пристрої є нешкідливим альтернативним лікуванням від еректільної дисфункції. Ці пристрої викликають ерекцію, створюючи тиск нижче атмосферного навколо тіла полового члена, що приводить до збільшеного кровоточу в кавернозне тіло завдяки пасивної артеріальної ділатації. Не зважаючи на те, що ця форма терапії часто є успішною в еректільній дисфункції органічного початку, скарги включають відсутність спонтанності та час, пов'язаний з використанням механічного пристрою, та складності та дискомфорт з еякуляцією. Різні напівтверді або надувні протези полового члена використовуються з деяким успіхом, особливо чоловіками з діабетом. Ці пристрої взагалі беруть до уваги тоді, коли інші варіанти лікування зазнають невдачу, і вони пов'язані з підвищеним ризиком інфекції та ішемії. Нещодавно, інгібітор фосфодіестерази V (PDEV), сілденафіл (ViagraÒ), був схвалений Управлінням по санітарному нагляду за харчовими продуктами та медикаментами США, як перорально ефективний медичний засіб для лікування еректільної дисфункції. Сілденафіл, 5-[2-етокси-5-(4-метилпіперазин-1-ілсульфоніл)феніл]1-метил-3-н-пропіл-6,7-дигідро-1Н-піразоло[4,3-d]піримідин-7-он та ряд зв'язаних з ним аналогів, та їх використання як антистенокардитичних засобів описано в Патентах США 5,250,534 та 5,346,901. Використання сілденафілу та зв'язаних з ним аналогів для лікування чоловічої еректільної дисфункції описано в Міжнародній Публікації РСТ №WO 94/28902, виданої 22 грудня, 1994. У клінічних дослідженнях, цей лікарський засіб поліпшив полову функцію приблизно у 70% чоловіків, які потерпали від еректільної дисфункції психогенної або органічної етіології. Однак, цей лікарський засіб показав менш вражаючий ефект у тих хворих, які піддалися радикальної простатектоміі, з поліпшеними ерекціями у 43% хворих, з тих, що приймали сілденафіл проти 15% на плацебо. Крім того, використання сілденафілу пов'язане з декількома небажаними побічними ефектами, включаючи головний біль, гіперемію та порушення кольорового зору, які є результатом неселективних впливів на різні тканини. Незважаючи на ці недоліки, лікарський засіб розглядається хворими, як найкращий серед інших лікувань, які включають введення медичного засобу безпосередньо в половий член за допомогою ін'єкції, використання зовнішнього пристрою або хірургічної процедури. Daugan et. al, у Патенті США №5,859,009 та Європейському Патенті ЕР0740668В1 описують синтез серії тетрациклічних похідних сполук як інгібіторів циклічного гуанозин 3',5'монофосфату, особливо фосфодиестерази, та їх використання при лікуванні серцево-судинних захворювань. Daugan et. al., у Міжнародній Публікації WO97/03675 досліджують використання тетрациклічних похідних сполук для лікування імпотенції. Gapinaux, J.-F. et al., in TeTpahedron Letters 38 (17), (1997), стор.2997-3000 розкривають синтез похідних трициклічного хінолону шляхом окислювання 1,2,3,4-тетрагідро-β-карболінів. Pfenninger, Ε. у DE 2803541 та Патенті США №4,235,907 розкриває заміщені 9Н-піроло-[3,4-b]хінолін-9-они та їх використання при лікуванні алергійної астми. Сексуально стимульована ерекція полового члена є результатом комплексної взаємодії фізіологічних процесів, які включають центральну нервову систему, периферійну нервову систему та гладкий м'яз. Зокрема, вивільнення окису азоту з неадренергійних, нехолінергійних нервів та ендотелія ініціює гуанілілову циклазу та підвищує внутрішньоклітинні рівні cGMP у кавернозному тілі. Підвищення у внутрішньоклітинному cGMP знижує внутрішньоклітинні рівні кальцію, що приводить до трабекулярної релаксації гладкого м'яза, яка, у свою чергу, приводить до фізичного розширення об'єму та стиску підоболонкових венул, що приводить до ерекції полового члена. Фосфодіестераза V, знайдена у тромбоцитах людини та судинному гладкому м'язі, наводить на думку о ролі цього ферменту в стабілізації внутрішньоклітинних концентрацій cGMP у серцево-судинній тканині. Фактично, інгібітори фосфодіестерази V показали, що викликають ендотеліально-залежне розширення судин за допомогою потенціючого підвищення у внутрішньоклітинному cGMP, індукованого окисом азоту. Крім того, інгібітори фосфодіестерази V вибірково знижують легеневий артеріальний тиск у тваринних моделях застійної серцевої недостатності і легеневої гіпертонії. Отже на додаток до їх корисності для еректільної дисфункції, інгібітори фосдіестерази V, ймовірно, були б терапевтично корисними для станів, подібних зупинці серця, легеневої гіпертонії та ангіні. Очікується, що засоби, які підвищують концентрацію cGMP у тканині полового члена, або завдяки розширеному вивільненню, або зниженому розщепленню cGMP, будуть ефективними для лікування еректільної дисфункції. Внутрішньоклітинні рівні cGMP регулюються ферментами, що пов'язані з їх формуванням та розпадом, а саме, гуанілат циклаза та циклічні нуклеотидні фосфодіестерази (ФДЕ). Дотепер, описано, принаймні, дев'ять груп фосфодіестераз у ссавців, п'ять з який здатні до гідролізування активного cGMP до неактивного GMP при фізіологічних станах (ФДЕ І, II, V, VI та IX). Фосфодіестераза V є переважаючим ізоформом у кавернозному тілі людини. Тому інгібітори фосфодіестерази V, як очікується, підвищують концентрацію cGMP у кавернозному тілі, та збільшують тривалість та частоту ерекції полового члена. Додатково, вибіркові інгібітори фосфодіестерази, як відомо, є корисними для лікування різних захворювань та станів, включаючи чоловічу еректільну дисфункцію (ЕД), жіночу дисфункцію полового збудження, жіночу полову дисфункцію, зв'язану з кровотечею та виробництвом окису азоту в тканинах піхви та клітора, передчасні пологи, дисменорею, серцево-судинні захворювання, атеросклероз, артеріальні оклюзивні захворювання, тромбоз, коронарний рестеноз, стенокардію, інфаркт міокарда, зупинку серця, ішемічні серцеві захворювання, гіпертонію, легеневу гіпертонію, астму, синдром переміжної кульгавості та діабетичні ускладнення. Відповідно, метою даного винаходу є ідентифікація сполук, які підвищують концентрацію cGMP у тканині полового члена завдяки інгібуванню фосфодіестераз, зокрема фосфодіестерази V. Іншою метою винаходу є ідентифікація сполук, які є корисними для лікування полової дисфункції, зокрема еректільної дисфункції та/або імпотенції у тварин чоловічої статі, та/або полової дисфункції у тварин жіночої статі. Ще іншою метою винаходу є ідентифікація способів лікування полової дисфункції, зокрема еректільної дисфункції, використовуючи сполуки даного винаходу. Іншою метою винаходу є ідентифікація сполук, які є корисними для лікування станів захворювань, опосередкованих фосфодіестеразою V, таких як чоловіча еректильна дисфункція, жіноча полова дисфункція, серцево-судинні захворювання, атеросклероз, артеріальні оклюзивні захворювання, тромбоз, коронарний рестеноз, стенокардія, інфаркт міокарда, зупинка серця, ішемічні серцеві захворювання, гіпертонія, легенева гіпертонія, астма, синдром переміжної кульгавості та діабетичні ускладнення. Зараз ми описуємо серію похідних піролопіридинону зі здатністю інгібувати фосфодіестеразу типу V у аналізах ферменту. Даний винахід направлений на створення нових похідних сполук піролопіридинону, корисних як інгібітори фосфодіестерази. Більш особливо, даний винахід направлений на сполуки загальної формули (І) або (ІI): де R1 є вибраним з групи, що складається з гідрогену, карбокси групи, -С(О)-С1-С6-алкілу, -С(О)-С1-С6-алкокси групи, -С(О)-NH-С1-С6-алкіл-NH2, -С(О)-NH-С1-С6-алкіл-NHRA, -С(О)-NH-С1-С6-алкіл-N(RA)2, -С(О)-NH2, -С(О)NHRA, -С(О)-N(RA)2, С1-С6-алкіл-NН2, -С1-С6-алкіл-NHRА, -С1-С6-алкіл-N(RA)2, -NH-С1-С6-алкіл-N(RA)2; де кожний RA є незалежно вибраним з групи, що складається з С1-С6-алкілу, арилу, С1-С6-аралкілу та гетероарилу, де арил, аралкіл або гетероарил може бути заміщеним, при потребі, RB у кількості від одного до трьох; де кожний RB є незалежно вибраним з групи, що складається з галогену, нітро групи, ціано групи, С1-С6алкілу, С1-С6-алкокси групи, С1-С6-алкілкарбонілу, карбокси С1-С6-алкілу, С1-С6-алкілсульфонілу, трифторметилу, аміно групи, ди(С1-С6-алкіл) аміно групи, ацетиламіно групи, карбокси С1-С6алкілкарбоніламіно групи, гідроксиС1-С6-алкіламіно групи, NHRA та N (RA)2; R2 є вибраним з групи, що складається з С5-С10-алкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з галогену, гідрокси групи, нітро групи, аміно групи, NHRA або N (RA)2), арилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC), циклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RA), гетероарилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC) та гетероциклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RC); де RC є вибраним з групи, що складається з галогену, нітро групи, ціано групи, С1-С6-алкілу, С1-С6-алкокси групи, трифторметилу, трифторметокси групи, NH2, NH(С1-С6алкіл) та (NС1-С6алкіл)2; R3 є вибраним з групи, що складається з гідрогену, С1-С6-алкілу, С1-С6алкілкарбонілу, С2-С6алкенілкарбонілу та С 2-С6алкінілкарбонілу; b є цілим числом від 0 до 4; R4 є вибраним з групи, що складається з галогену, гідрокси групи, карбокси групи, оксо групи, нітро групи, С1-С6-алкілу, С1-С6-алкокси групи, С1-С6-алкоксикарбонілу, трифторметилу, фенілу (де група фенілу може бути заміщеною, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), фенілсульфонілу, нафтилу, С1-С6-аралкілу, -О-аралкілу, (де група аралкілу може бути заміщеною, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), гетероарилу (де гетероарил може бути заміщеним, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RD), гетероциклоалкілу, NН2, NHRA, N(RA)2 де кожний R є незалежно вибраним з галогену, гідрокси групи, карбокси групи, оксо групи, С1-С4-алкілу, С1С4-алкілтіо, гідроксиС1-С4алкілу, С1-С6-алкокси групи, С1-С4-алкоксикарбонілу, С1-С4-алкілкарбонілу, трифторметилу, трифторметокси групи, NH2 , NHRA, N(RA)2, C(O)N(RA)2, ацетиламіно групи, нітро групи, ціано групи, формілу, С1-С6-алкілсульфонілу, карбоксиСгСб-алкілу та аралкілу; с є цілим числом від 0 до 4; R5 є незалежно вибраним з групи, що складається з галогену, нітро групи, гідрокси групи, С1-С6-алкілу, С1С6-алкокси групи, -NH2, -NHRA, -N(RA)2, -ORA, -C(O)NH2, -C(O)NHRA, -C(O)N(RA)2, -NHC(O)RA, -SO2NHRA, SO2N(RA)2, де RA є таким, як визначено вище, фенілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB), гетероарилу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB) та гетероциклоалкілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з RB); а є цілим числом від 0 до 1; Υ вибраний з групи, що складається з -С1-С6-алкіл-, -С(О)-, -(С1-С6-алкіл) карбоніл-, -(С2-С6алкеніл)карбоніл-, -(С2-С6-алкініл)карбоніл-, -карбоніл(С1-С6-алкіл)-, -карбоніл(С2-С6-алкеніл)-, -С(О)О(-С1-С6алкіл)-, -С(S)-, -SO2-, -(С1-С6алкіл) сульфоніл-, -сульфоніл(С1-С6-алкіл)-, -C(O)NH-, -C(O)NH-(С1-С6-алкіл)-, С(О)С3-С7-Циклоалкіл)-та-(С3-С7-циклоалкіл)-С(О)-; є вибраним з групи, що складається з фенілу, фурилу, тієнілу та піролілу; є вибраним з групи, що складається з арилу, гетероарилу, циклоалкілу та гетероциклоалкілу; за умови, що, коли R1 є гідрогеном, R3 є гідрогеном, b є 0, с є 0, а є 1, Y є -СН2-, є фенілом, a фенілом, у той час як R2 не є триметоксифенілом, (тобто сполука не є 1,2,3,4-тетрагідро-2-(фенілметил)-3(3,4,5-триметоксифеніл)-9Н-піроло[3,4-b]хінолін-9-он); та її фармацевтично прийнятні солі. Ілюстрацією винаходу є фармацевтична композиція, яка включає фармацевтично прийнятний носій та будь-яку з описаних вище сполук. Ілюстрацією винаходу є фармацевтична композиція, одержана за допомогою змішування будь-якої з описаних вище сполук з фармацевтично прийнятним носієм. Ілюстрацією винаходу є спосіб одержання фармацевтичної композиції, що включає змішування будь-якої з описаних вище сполук та фармацевтично прийнятного носія. Ілюстрацією винаходу є спосіб лікування станів, вибраних з групи, яка складається з чоловічої еректільної дисфункції (ЕД), жіночої дисфункції полового збудження, жіночої полової дисфункції, зв'язаної з кровотечею та виробництвом окису азоту в тканинах піхви та клітора, передчасних пологів, дисменореї, серцево-судинних захворювань, атеросклерозу, артеріальних оклюзивних захворювань, тромбозу, коронарного рестенозу, стенокардії, інфаркту міокарда, серцевого приступу, ішемічних серцевих захворювань, гіпертонії, легеневої гіпертонії, астми, синдрому переміжної кульгавості та діабетичних ускладнень у суб'єкта, який потребує такого лікування, що включає введення суб'єкту ефективної кількості будь-якої з описаних вище сполук або фармацевтичних композицій. Прикладом винаходу є спосіб підвищення концентрації cGMP у тканині полового члена завдяки інгібуванню фосфодіестераз, зокрема фосфодіестерази V, у суб'єкта чоловічої статі, який потребує такого лікування, що включає введення суб'єкту ефективної кількості будь-якої з описаних вище сполук або фармацевтичних композицій, Подальшою ілюстрацією винаходу є спосіб одержання ендотеліалзалежного розширення судин за допомогою потенціючого підвищення у внутрішньоклітинному cGMP зниженому окисом азоту у суб'єкта, який потребує такого лікування, що включає введення суб'єкту ефективної кількості будь-якої з описаних вище сполук або фармацевтичних композицій. Прикладом винаходу є використання будь-якої з описаних вище сполук для одержання медикаментів для: (а) лікування полової дисфункції, зокрема чоловічої еректільної дисфункції, (b) імпотенції, що піддається лікуванню, (с) підвищення концентрації cGMP у тканині полового члена шляхом інгібування фосфодіестерази, зокрема фосфодіестерази V та/або (d) лікування станів, вибраних з групи, що складається з передчасних пологів, дисменореї, серцево-судинних захворювань, атеросклерозу, артеріальних оклюзивних захворювань, тромбозу, коронарного рестенозу, стенокардії, інфаркту міокарда, зупинки серця, ішемічних серцевих захворювань, гіпертонії, легеневої гіпертонії, астми, синдрому переміжної кульгавості та діабетичних ускладнень у суб'єкта, який потребує такого лікування. Даний винахід направлений на створення нових похідних піролопіридинону, корисних для лікування полової дисфункції, чоловічої еректільної дисфункції (ЕД). Не зважаючи на те, що сполуки даного винаходу є корисним насамперед для лікування чоловічої полової дисфункції або еректільної дисфункції, вони можуть також бути корисними для лікування жіночої полової дисфункції, наприклад, жіночої дисфункції полового збудження, жіночої полової дисфункції, зв'язаної з кровотечею та виробництвом окису азоту в тканині піхви та клітора, та передчасних пологів і дисменореї. Більш детально, сполуки даного винаходу є сполуками формули (I) або (II): де усі перемінні є такими, як визначено вище, та їх фармацевтично прийнятні солі. Переважно, R1 є гідрогеном. У переважному варіанті здійснення даного винаходу R2 є відібраним з групи, яка складається з фенілу (заміщеного, при потребі, замісниками у кількості від одного до трьох, незалежно вибраними з галогену, нітро групи, ціано групи, С1-С3-алкілу, С1-С3-алкокси групи, трифторметилу, трифторметокси групи, NH2, NН(С1-С3алкіл) або (NС1-С3-алкіл)2 ), гетероарилу та гетероциклоалкілу. Переважно, R2 є вибраним з групи, що складається з 3,4-метилендіоксифенілу, 3,4-диметоксифенілу, 5-(2,3-дигідробензофурил), 3,4-дигідробензо[1,4]-діоксин-6-іл, 5-бензофурилу, 5-інданілу та 3-тієнілу. Більш переважно, R2 є вибраним з групи, що складається з 3,4-метилендіоксифенілу, 5-(2,3-дигідробензофурил), 3,4-дигідробензо-[1,4]діоксин-6-ілу, 3тієнілу, 5-інданіл та 5-бензофурилу. Ще більш переважно, R2 є вибраним з групи, що складається з 3,4метилендіоксифеніл, 5-(2,3-дигідробензофурил), 3,4-дигідробензо-[1,4]-діоксин-6-ілу, 3-тієнілу, 5-інданілу та 5бензофурилу. Найбільш переважно, R2 є вибраним з групи, що складається з 3,4-метилендіоксифенілу та 5(2,3-дигідробензофурил). Переважно, R3 є вибраним з групи, що складається з гідрогену та С1-С4-алкілу. Більш переважно, R3 є вибраним з групи, що складається з гідрогену та метилу. Найбільш переважно, R3 є гідрогеном. Переважно, b є цілим числом від 0 до 4. Більш переважно b є цілим числом від 0 до 1. У варіанті реалізації даного винаходу, R4 є вибраним з групи, що складається з галогену, гідрокси групи, карбокси групи, оксо групи, С1-С4-алкілу, С1-С3-алкокси групи, С1-С3-алкоксикарбонілу, фенілу (заміщеного, при потребі, замісниками кількістю від одного до двох, незалежно вибраними з гідрокси групи, карбокси групи, С1-С4-алкілу, С1-С4-алкілтю, гідроксиС1-С4-алкілу, С1-С4алкокси групи, С1-С4-алкіоксикарбонілу, C(O)N(RA)2, трифторметилу, трифторметокси групи, аміно групи, (СгС4-алкіл)аміно групи, ди(СгС4-алкіл)аміно групи, нітро групи, ціано групи або формілу), О-аралкілу, гетероарилу (заміщеного, при потребі, замісниками кількістю від одного до двох, незалежно вибраними з гідрокси групи, карбокси групи, оксо групи, С1-С3алкілу, С1-С3-алкокси групи, С1-С3-алкоксикарбонілу, C(O)N(RA)2, трифторметилу, трифторметокси групи, аміно групи, нітро групи, С1-С3-алкілкарбонілу або С1-С4-аралкiл), гетероциклоалкілу, Переважно, R4 є вибраним з групи, що складається з атому брому, гідрокси групи, карбокси групи, оксо групи, метилу, фенілу, 4-гідроксифенілу, 3-гідрокси-метилфенілу, 4-гідроксиметилфенілу, 4-карбоксифенілу, 4метилфенілу, 4-метокси-фенілу, 3,4-диметоксифенілу, 4-метоксикарбонілу, 4-метоксикарбонілфенілу, 3трифторметилфенілу, 4-ціанофенілу, 4-амінофенілу, 4-диметиламінофенілу, 3-нітрофенілу, 4-нітрофенілу, 4формілфенілу, 4-метилтіофенілу, бензилокси групи, 2-піридинілу, 3-піридинілу, 4-піридинілу, N-окси-2піридиніл, 3-тієнілу, 2-фурилу, 1-імідазолілу, 5-(1-бензил-2-метилімідазоліл), 5-(1,2-диметилімідазоліл), 5-(1метил-імідазоліл), 5-(1-бензилімідазоліл), 3,4-метилендіоксифенілу, Більш переважно, R4 є вибраним з групи, що складається з 5-бромо, 2-гідрокси групи, 6-гідрокси групи, 4карбокси групи, фенілу, 4-гідроксифенілу, 3-гідрокси-метилфенілу, 4-гідроксиметилфенілу, 4-карбоксифенілу, 4-метилфенілу, 4-метил-тіофенілу, 4-метоксифенілу, 3,4-диметоксифенілу, 4-метоксикарбонілу, 4-метоксикарбонілфенілу, 3-трифторметилфенілу, 4-амінофенілу, 4-диметиламінофенілу, 3-нітрофенілу, 4-нітрофенілу, 4-ціанофенілу, 4-формілфенілу, бензилокси групи, 2-піридинілу, 3-піридинілу, 4-піридинілу, 2-фурилу, 3тієнілу, N-оксо-2-піридинілу, 1-імідазолілу, 5-(1-бензил-2-метилімідазоліл), 5-(1,2-диметилімідазоліл), 3,4метилен-діоксифенілу, Ще більш переважно, R4 є вибраним з групи, що складається з 5-бромо, 2-гідрокси групи, 6-гідрокси групи, 4-карбокси групи, фенілу, 4-гідроксифенілу, 3-гідрокси-метилфенілу, 4-гідроксиметилфенілу, 4карбоксифенілу, 4-метилфенілу, 4-метил-тіофенілу, 4-метоксифенілу, 3,4-диметоксифенілу, 4метоксикарбонілу, 4-метокси-карбонілфенілу, 3-трифторметилфенілу, 4-амінофенілу, 4-диметиламінофенілу, 3-нітрофенілу, 4-нітрофенілу, 4-ціанофенілу, 4-формілфенілу, бензилокси групи, 2-піридинілу, 3-піридинілу, 4піридинілу, N-оксо-2-піридинілу, 3-тієнілу, 2-фурилу, 1-імідазолілу, 5-(1-бензил-2-метилімідазоліл), 5-(1,2диметилімідазоліл), 3,4-метилен-діоксифенілу, Ще більш переважно, R4 є вибраним з групи, що складається з 6-гідрокси групи, 4-карбокси групи, фенілу, 4-гідроксифенілу, 3-гідроксиметилфенілу, 4-метилфенілу, 4-метилтіофенілу, 4-метоксифенілу, 3,4диметоксифенілу, 4-метокси-карбонілу, 3-трифторметилфенілу, 3-нітрофенілу, 4-нітрофенілу, 2-піридинілу, 3піридинілу, 4-піридинілу, N-оксо-2-піридинілу, 3-тієнілу, 5-(1-бензил-2-метилімідазоліл), 5-(1,2диметилімідазоліл), Найбільше переважно, R4 є вибраним з групи, що складається з гідрокси групи, 4-метилфенілу, 4метоксифенілу, 3,4-диметоксифенілу, 4-метоксикарбонілу, 3-трифторметилфенілу, 4-нітрофенілу, 2піридинілу, 3-піридинілу, У переважному варіанті здійснення с є 0. В іншому переважному варіанті здійснення а є цілим числом від 0 до 1. У варіанті здійснення даного винаходу, Υ є вибраним з групи, що складається з -С1-С4-алкіл-, -C(S)-, -С(О), -С(O)O-(С1-С4-алкіл)-, -С(О)-(С1-С4-алкіл)-, -С(O)-(С2-С4-алкеніл)-, С(О)-(С3-С7-циклоалкіл)- та -С(O)NH-(С1-С3алкіл)-. Переважно, Υ є вибраним з групи, що складається з-СН2-, -C(S)-, -С(О)-, -С(О)О-СН2-, С(О)-СН2СН2-, С(О)-СН=СН -, С(O)NH-CH2-, С(О)-циклопропілу та -С(О)СН2-. Більш переважно, Υ є вибраним з групи, що складається з -С(О)-, -С(О)О-СН2, С(О)-СН2СН2-, С(О)-СН=СН-, та -С(О)-циклопропілу. Ще більш переважно, Υ є вибраним з групи, що складається -С(О)-, -С(О)О-СН2-та-С(O)-СН=СН -. Найбільш переважно, Υ є вибраним з групи, що складається -С(О)- та -С(О)О-СН2-; Переважно, є фенілом; У варіанті здійснення даного винаходу є вибраним з групи, що складається з фенілу, гетероарилу та гетероциклоалкілу. Переважно, є вибраним з групи, що складається з фенілу, 2-фурилу, 2бензо(b)фурилу, 2-піримідинілу, 2-піридинілу, 3-піридинілу, 4-піридинілу, 1-імідазолілу, 2-імідазолілу, 2тіазолілу,та 2-окса-біцикло [2.2.1] гептанілу. Більш переважно, є вибраним з групи, що складається з фенілу, 2-фурилу, 2-бензо(b)фурилу, 2-піримідинілу, 2-піридинілу, 3-піридинілу, 4-піридинілу та 2-тіазолілу. Найбільш переважно, є вибраним з групи, що складається з 2-фурилу, 2-бензо(b)фурилу, 4-піридинілу, 2піримідинілу та 2-тіазолілу. Термін "галоген" включає йод, бром, хлор та фтор. Термін "алкіл", який або використовується окремо, або як частина групи замісника, позначає алкани з прямими або розгалуженими ланцюгами, що мають від 1 до 10 атомів карбону, або будь-яку кількість у межах цього діапазону. Наприклад, радикали алкілу включають метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, сек-бутил, т-бутил, н-пентил, 3-(2-метил)бутил, 2-пентил, 2-метилбутил, неопентил, н-гексил та 2метилпентил. Так само, алкенільні та алкінільні групи включають алкени та алкіни з прямими або розгалуженими ланцюгами, що мають від 2 до 10 атомів карбону, або будь-яку кількість у межах цього діапазону. Термін "алкокси" позначає радикал, який є оксигеновим простим ефіром, що сформований з описаних вище алкільних груп з прямими та розгалуженими ланцюгами. Наприклад, алкокси радикали включають метокси групу, етокси групу, н-пропокси групу, сек-бутокси групу, трет-бутокси групу, та інші їм подібні. Термін "арил" позначає ароматичну групу, таку як феніл, нафтил, та інші їм подібні. Термін "аралкіл" позначає алкільну групу заміщену арильною групою. Наприклад, бензил, фенілетил, та інші їм подібні. Так само термін "аралкеніл" позначає алкенільну групу, заміщену арильною групою, наприклад, фенілетиленіл, та інші їм подібні. Термін "гетероарил", що використовується у опису даного винаходу, являє собою стабільну п'яти-або шестичленну моноциклічну ароматичну кільцеву систему, яка містить гетероатоми кількістю від 1 до 3, незалежно вибраних з Ν, Ο або S; або будь-яку 9-або 10-членну біциклічну ароматичну кільцеву систему, яка містить атоми карбону та гетероатоми кількістю від одного до трьох, незалежно вибраних з Ν, Ο або S. Група "гетероарилу" може бути приєднаною при будь-якому гетероатомі або атомі карбону, з утворенням стабільної структури. Приклади прийнятних гетероарильних груп включають, але не обмежуються ними, піридиніл, піримідиніл, тієніл, фурил, імідазоліл, ізоксазоліл, оксазоліл, піразоліл, піразиніл, піроліл, тіазоліл, тіадіазоліл, тріазоліл, бензімідозаліл, бензофураніл, бензотієніл, бензіксозаліл, бензоксазоліл, індазоліл, індоліл, бензотіазоліл, бензотіадіазоліл, бензотріазоліл, хінолініл, ізохінолініл, пуриніл. Переважні гетероарильні групи включають піримідиніл, піридиніл, фурил, імідазоліл, бензофурил та тіазоліл. Термін "циклоалкіл", що використовується у описі даного винаходу, являє собою стабільну трьох-або вісьмичленну моноциклічну кільцеву структуру, яка складається з насичених атомів карбону. Відповідні приклади включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил. Термін "гетероциклоалкіл" являє собою стабільну насичену або частково насичену трьох-або вісьмичленну моноциклічну кільцеву структуру, що містить атоми карбону та від одного до чотирьох, переважно від одного до двох, гетероатомів незалежно вибраних з Ν, Ο або S; та будь-яке стабільне насичене, частково ненасичене або частково ароматичне 9-10-членне біциклічне кільце, що містить атоми карбону та від одного до чотирьох гетероатомів, незалежно вибраних з від Ν, Ο або S. Гетероциклоалкіл може бути приєднаний при будь-якому атомі карбону або гетероатомі, що приводить до створення стабільної структури. Відповідні приклади гетероциклоалкільних груп включають піролідиніліл, піразолідиніліл, піперидиніл, піперазиніл, морфолініл, дитіаніл, тритіаніл, діоксоланіл, діоксаніл, тіоморфолініл, 3,4 метилендіоксифеніл, 2,3-дигідробензофурил, 2,3-дигідробензо-[1,4]-діоксин-6-іл, 2,3-дигідро-фуро[2,3b]піридиніл, 1,2-(метилендіокси) циклогексан, інданіл, 2-окса-біцикло[2.2.1]гептаніл, та інші їм подібні. Переважні гетероциклоалкільні групи включають піперидиніл, піролідиніл, морфолініл, інданіл, 2-оксабіцикло[2.2.1]гептаніл, 3,4-метилендіоксифеніл, 2,3-дигідробензофурил та 2,3-дигідробензо-[1,4]діоксин-6-іл. Як використовується у описі даного винаходу, символ "*" позначає присутність стереогенного центра. Припускають, що визначення будь-якого замісника або змінної у конкретному місцеположенні в молекулі не залежить від їх визначень в інших місцеположеннях даної молекули. Зрозуміло, що замісники та схеми заміщення у сполуках даного винаходу можуть вибиратись звичайним фахівцем у даній галузі у такий спосіб, щоб забезпечити хімічну стабільність даних сполук та їх легкий синтез з використанням як відомих способів, так і способів, що викладені у даному винаході. Надалі припускають, що, коли b або с>1, відповідні замісники R4 або R5 можуть бути однаковими або різними. Якщо сполуки згідно з даним винаходом мають принаймні один хіральний центр, вони можуть відповідно існувати як енантіомери. Коли дані сполуки мають два або більшу кількість хіральних центрів, вони можуть додатково існувати як діастереомери. Зрозуміло, що всі такі ізомери та їх суміші входять в обсяг даного винаходу. Крім того, деякі кристалічні форми даних сполук можуть існувати як поліморфні модифікації, і як такі також призначені для включення у даний винахід. Крім того, деякі сполуки можуть утворювати сольвати з водою (тобто гідрати) або зі звичайними органічними розчинниками, і такі сольвати також призначені для включення в обсяг даного винаходу. Відповідно до стандартної номенклатури, що використовується у описі даного винаходу, кінцева частина замісника пишеться спочатку, потім наступні частини до місця приєднання. Таким чином, замісник "феніл С1С6алкіламінокарбоніл С1-С6-алкіл" відноситься до групи формули: Термін "полова дисфункція", який використовується у описі даного винаходу, включає чоловічу полову дисфункцію, чоловічу еректільну дисфункцію, імпотенцію, жіночу полову дисфункцію, жіночу дисфункцію полового збудження та жіночу полову дисфункцію, зв'язану з кровотечею та виробництвом окису азоту в тканинах піхви та клітора. Термін "суб'єкт", що використовується у описі даного винаходу, відноситься до тварин, переважно ссавців, найбільш переважно до людини, яка є об'єктом лікування, нагляду або експерименту. Термін "терапевтично ефективна кількість", що використовується у описі даного винаходу, означає кількість активної сполуки або фармацевтичного агенту, що дає біологічний або медичний відклик у тканинах системи, тварини або людини, що спостерігається дослідником, ветеринаром, медичним доктором або іншим клініцистом, включаючи полегшення симптомів хвороби або розладу, що лікується. Термін "композиція", що використовується у описі даного винаходу, відноситься до продукту, що містить точно встановлені компоненти у точно встановлених кількостях, так само як і будь-який продукт, що отримують, прямо або побічно, комбінацією точно встановлених компонентів у точно встановлених кількостях. Для використання у медицині солі сполук даного винаходу відносяться до нетоксичних "фармацевтично прийнятних солей". Проте інші солі можуть бути корисними у виготовленні сполук згідно з даним винаходом або їх фармацевтично прийнятних солей. Відповідні фармацевтично прийнятні солі сполук включають кислотно-адитивні солі, які може бути сформованими, наприклад, шляхом змішування розчину сполуки з розчином фармацевтично прийнятної кислоти, такої як соляна кислота, сірчана кислота, фумарова кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, бензойна кислота, лимонна кислота, винна кислота, вугільна кислота або фосфорна кислота. Крім того, там, де сполуки винаходу несуть кислотну складову, їх відповідні фармацевтично прийнятні солі можуть включати солі лужного металу, наприклад, солі натрію або калію; лужні солі лужноземельного металу, наприклад, солі кальцію або магнію; та солі сформовані відповідними органічними лігандами, наприклад, солі четвертинного амонію. Таким чином, зразки фармацевтично прийнятних солей включають наступні: ацетат, бензолсульфонат, бензоат, бікарбонат, бісульфат, бітартрат, борат, бромід, едетат кальцію, камсілат, карбонат, хлорид, клавуланат, цитрат, дихлоргідрат, едетат, едисілат, естолат, езилат, фумарат, глюцептат, глюконат, глютамат, гліколіларсанілат, гексилресорцинат, гідрабамін, бромгідрат, клоргідрат, гідроксинафтоат, йодид, ізетіонат, лактат, лактобіонат, лаурат, малат, малеат, манделат, мезилат, метилбромід, метилнітрат, метилсульфат, мукат, напсілат, нітрат, сіль N-метилглюкамін амонію, олеат, памоат (ембонат), палмітат, Пантотенат, фосфат/дифосфат, полігалактуранат, саліцилат, стеарат, сульфат, субацетат, сукцинат, танат, тартрат, теоклат, тозилат, тритіодид та валерат. Даний винахід включає у своєму обсязі проліки сполук даного винаходу. Взагалі, такі проліки будуть функціональними похідними сполук, які легко перетворюються в природних умовах у задану сполуку. Так, у способах лікування даного винаходу, термін "введення" повинен охоплювати лікування різних розладів описаною особливо розкритою сполукою, або сполукою, що не може бути особливо розкритою, але яка перетворюється в точно встановлену сполуку в природних умовах після введення пацієнту. Загальновідомі процедури для відбору та одержання відповідних похідних проліків описані, наприклад, у "Design Pipdrugs", під редакцією Н. Bundgaapd, Elsevier, 1985. Скорочення, які використовуються у описі даного винаходу, зокрема у Схемах та Прикладах, є такими: BINAP (R)-(+)-2,2'= Біс(дифенілфосфіно)-1,1’бінафтил Cmpd DBU DCC DCM DEAD D1PEA DMAP DMF DMSO dppp EDTA EtOAc EtOH Et3N Fmoc-NCS HEPES HPLC ID# KOt-Bu MeOH MCPBA NaOt-Bu n-Bu NMP Pd2bda3 Pd(dppf)(OAc)2 Pd(OAc)2 Pd(dppf)CI 2 Pd(PPh3)4 або Pd(Ph3)4 Ph PMSF PPh3 PyBrOP TEA TFA THF TLC TsOH SNP = Сполука 2,3,4,6,7,8,9,10= октагідропіримідо[1,2-а]азепін = 1,3-Дициклогексилкарбодімід = Дихлорметан Диетил діазепіндикарбоксилат = Діізопропілетиламін = Ν,Ν'-диметил-4-піридинамін = Ν,Ν'-диметилформамід = Диметил сульфоксид 1,3= Біс(дифенілфосфіно)пропан Етилендинітрилотетраоцтова = кислота = Етилацетат = Етанол = Триетиламін [(9Н-флуорен-9= ілметокси)карбоніл]-тіоціанат 2-[4-(2-гідроксиетил)= піперазиніл]етансульфокислота Рідинна хроматографія = високого тиску Ідентифікаційний номер = сполуки = T-бутоксид калія = Метанол 3-Хлоропероксибензойна = кислота = T-бутоксид натрію = н-Бутил = N-метал-2-піролідинон Трис(дибензиліден = ацетон)дипаладій(0) 1,1'-біс(дифенілфосфіно) = фероцен паладія діацетат = Паладія (II) ацетат 1,1'= біс(дифенілфосфіно)фероцен паладія дихлорид Паладія тетракис(трифеніл = фосфін) = Феніл Фенілметансульфонілу = фторид = Трифенілфосфін Бромо-трис-піролідино= фосфонію гексафторфосфат = Триетиламін = Трифтороцтова кислота = Тетрагідрофуран = Тонкошарова хроматографія = п-толуолсульфокислота = Натрію нітроціанид Сполуки формули (І), де R3 є гідрогеном, можуть бути одержаними відповідно двома альтернативними способами з відповідно заміщеної сполуки формули (III): де R1, R2, R5 та с є такими, як визначено раніше, яка є вибраною і використовується як вихідний реагент. Сполука формули (III) є відомою сполукою або сполукою, яку можна одержувати за допомогою відомих способів, наприклад, способу, описаному нижче у Схемі І: СХЕМА І Відповідно, сполуку формули (IV), відому сполуку або сполуку, що одержують за допомогою відомих способів, піддають реакції з відповідно заміщеним альдегідом формули (V), в органічному розчиннику, такому як DCM, THF, толуол та іншим їм подібним, у присутності кислого каталізатора, такого як TFA, tosic кислота та іншим їм подібним, що приводить до одержання відповідної сполука формули (IIІ). Взагалі, в першому з двох альтернативних способів, сполуки формули (І) можуть бути одержані, за допомогою реакції відповідно заміщеної сполуки формули (III), що дозволяє отримати відповідну похідну заміщеного піролопіридинону. У другому з двох альтернативних способів, сполуки формули (І) можуть бути одержані за допомогою початкової реакції відповідно заміщеної сполуки формули (III), що приводить до формування трициклічної складової ліролопіридинону, після введення додаткових замісників. Цей другий спосіб має особливу перевагу для одержання сполук формули (і), де Υ є -C(S), -С(О)O-RA або -С(О)RA. Більш особливо, сполуки формули (І), де R3 є гідрогеном, можуть бути одержані з відповідно заміщеної сполуки формули (III) у відповідності зі способами, описаними у Схемі 2. СХЕМА 2 У першому способі, відповідно заміщену сполуку формули (III) піддають реакції з відповідно заміщеною сполукою формули (VI), де X є галогеном, гідрокси групою, тозилатом, мезилатом, п-нітрофеноксидом або іншим їм подібним, переважно X є галогеном, гідрокси групою або п-нітрофеноксидом, у органічному розчиннику, такому як диметилформамід, тетрагідрофуран, дихлорметан, толуол, та іншим їм подібним, що приводить до формування відповідної сполуки формули (VII). Для сполук формули (І), де (Y)a є (Y)0 (тобто, де а є 0, так що Υ відсутній), реакційну суміш переважно нагрівають до температури більшої або рівної приблизно 100°С. Для сполук формули (І), де (Y)a є (Y)0 (тобто, де а є 0, так що Υ відсутній), а є піридинілом, реакційну суміш переважно каталізують при температурі в діапазоні приблизно 30-120°С с каталізатором, таким як Pd(OAc)2, Pd2dba3, Pd(dppf)CI2, та іншим їм подібнім, в органічному розчиннику, такому як 1, 4-діоксан, THF, DMF, DCM, толуол, та іншим їм подібним, що приводить до формування відповідної сполуки формули (VII)/ Сполуку формули (VII) надалі піддають реакції з окислювальним агентом, таким як NalO4, KO2, синглет оксигену, газ оксигену, озон, та іншими їм подібними, переважно газом оксигену, який застосовують при приблизно атмосферному тиску, що приводить до формування відповідної похідної піролопіридинону формули (Iа). Коли окислювальним агентом є газ оксигену, реакція виконують у присутності основи, такої як гідриду натрію, т-бутоксид калію, та іншим їм подібним. У альтернативному способі, наведеному на Схемі 2, відповідно заміщену сполуку формули (III) спочатку піддають реакції з окислювальним агентом, таким як NalO4, KO2, синглет оксигену, газ оксигену, озон, та іншими їм подібними, переважно газом оксигену, який застосовують при приблизно атмосферному тиску, що приводить до формування відповідної сполуки формули (VIII). Коли окислювальним агентом є газ оксигену, реакція виконують у присутності основи, такої як гідриду натрію, т-бутоксид калію, та іншим їм подібним. Сполуку формули (VIII) надалі піддають реакції з відповідно заміщеною сполукою формули (VI), де Xгалоген, гідрокси, тозилат, мезилат, р-нітро феноксидом та іншим їм подібним, переважно X є галогеном, гідрокси групою, тозилатом, мезилатом, п-нітрофеноксидом або іншим їм подібним, переважно X є галогеном, гідрокси групою або п-нітрофеноксидом, у органічному розчиннику, такому як диметилформамід, тетрагідрофуран, дихлорметан, толуол, та іншим їм подібним, необов'язково у присутності каталізатора, такого як DMAP, що приводить до формування відповідної похідної піролопіридинону формули (Іа). Для сполук формули (І), де (Y)a є (Y)0 (тобто, де а є 0, так що Υ відсутній), реакційну суміш переважно нагрівають до температури більшої або рівної приблизно 100°С. Для сполук формули де (Y)a є (Y)0 (тобто, де а є 0, так що Υ відсутній), а є піридилом, реакційну суміш переважно каталізують при температурі у діапазоні приблизно 30-120°С з каталізатором, таким як Pd(OAc)2, Pd2dba3, Pd(dppf)CI 2, та іншим їм подібним, в органічному розчиннику, такому як 1,4-діоксан, THF, DMF, DCM, толуол, та інші їм подібні, що приводить до формування відповідної сполуки формули (VII). Сполуки формули (VIII) можна отримати шляхом реакції сполуки формули (Іа) з газом гідрогену, де газ гідрогену застосовують при тиску у діапазоні від приблизно атмосферного тиску до приблизно 551,7968Па (80psi), у присутності каталізатора, такого як Pd, Pt, палладій на карбоні, та іншого їм подібного, в органічному розчиннику, такому як метанол, етанол, етилацетат, та іншим їм подібним. Тоді сполука формули (VIII) може бути надалі функціоналізованою, як описане вище. Сполуки формули (І), де b має значення 1 (тобто, де група, яка представлена є заміщеною одним замісником R4), може бути одержана з відповідно заміщеної сполуки формули (III), відповідно до трьох альтернативних способів. У першому способі, відповідно заміщену сполуку формули (III) спочатку перетворюють у відповідний піролопіридинон, згідно зі способом, описаним у Схемі 2, що супроводжується двома етапами заміщення при пірол нітрогені, як наведено у Схемі 3. СХЕМА 3 Зокрема, сполуку формули (VIII) піддають реакції з відповідно заміщеною сполукою формули (IX), де X є галогеном, у присутності основи, такої як TEA, DIPEA, та іншим їм подібним, в органічному розчиннику, такому як DMF, DCM, THF та іншим їм подібним, переважно при температурі у діапазоні від приблизно 20 до приблизно 150°С, що дає на виході відповідну сполуку формули (X). Сполуку формули (X) піддають реакції з відповідно заміщеної бористою кислотою формули (XI) або відповідно заміщеним трибутил-оловом формули (XII), що дає на виході відповідну сполуку формули (Іb). Коли вибраним реагентом є бориста кислота формули (XI), сполуку формули (X) піддають реакції в органічному розчиннику, такому як DMF, THF, діоксан, та інші їм подібні, у присутності каталізатора, такого як Pd(Ph3P)4, Pd(dppf) (ОАс)2, та інші їм подібні, переважно при температурі в діапазоні приблизно 80-150°С. Коли вибраним реагентом є трибутил-олово формули (XII), сполуку формули (X) піддають реакції у розчиннику, такому як DMF, у присутності каталізатора, такого як Pd(dppf) (ОАс)2. У другому способі, сполуку формули (III) спочатку заміщують бром заміщеним відповідний піролопіридинон, а потім надалі заміщують при , потім перетворюють у , як зображено на Схемі 4. СХЕМА 4 Більш особливо, відповідно заміщену сполуку формули (III) піддають реакції з відповідно заміщеною сполукою формули (XIII), де X є галогеном, у присутності основи типу TEA, DIPEA, та іншої їм подібної, в органічному розчиннику типу DMF, толуол, та іншим їм подібним, переважно при температурі в діапазоні від приблизно 100 до приблизно 150°С, що дає на виході відповідну сполуку формули (XIV). Сполуку формули (XIV) піддають реакції з окислювальним агентом, таким як NalO4, KO2, синглет оксигену, газ оксигену, озон, та іншим їм подібним, переважно газом оксигену, який застосовують при атмосферному тиску, що дозволяє одержати відповідну сполуку формули (XV). Сполуку формули (XV) піддають реакції з відповідно заміщеної бористою кислотою формули (XI) або відповідно заміщеним трибутил-оловом формули (XII), що дає на виході відповідну сполуку формули (Іс). Коли вибраним реагентом є бориста кислота формули (XI), сполуку формули (XV) піддають реакції в органічному розчиннику, такому як DMF, діоксан, вода, та інші їм подібні, у присутності каталізатора, такого як Pd(Ph3P)4, Pd(dppf) (ОАс)2, та інші їм подібні, переважно при температурі в діапазоні приблизно 80-160°С. Коли вибраним реагентом є трибутил-олово формули (XII), сполуку формули (XV) піддають реакції у розчиннику, такому як DMF, TEA, та інші їм подібні, у присутності каталізатора, такого як Pd(dppf) (OAc)2. У третьому способі, сполуку формули (III) спочатку заміщують бромзаміщеним при , надалі заміщеним R4 замісником, а потім перетворюють у відповідний піролопіридинон, як зображено на Схемі 5. СХЕМА 5 Більш особливо, сполуку формули (XIV) піддають реакції з відповідно заміщеної бористою кислотою формули (XI) або відповідно заміщеним трибутил-оловом формули (XII), що дає на виході відповідну сполуку формули (XVI). Коли вибраним реагентом є бориста кислота формули (XI), сполуку формули (XIV) піддають реакції в органічному розчиннику, такому як DMF, діоксан, вода, та інші їм подібні, у присутності каталізатора, такого як Pd(Ph3P)4, Pd(dppf)(OAc)2, та інші їм подібні, переважно при температурі в діапазоні приблизно 80120°С. Коли вибраним реагентом є трибутил-олово формули (XII), сполуку формули (XIV) піддають реакції у розчиннику, такому як DMF, діоксан, та інші їм подібні, у присутності каталізатора, такого як Pd(dppf)(OAc)2. Сполуку формули (XVI) піддають реакції з окислювальним агентом, таким як NalO4, КО2, синглет оксигену, газ оксигену, озон, та інші їм подібні, переважно газом оксигену, який застосовують при атмосферному тиску, що дозволяє одержати відповідну сполуку формули (Іс). є заміщеним 2, 3 або 4 Сполуки формули (І), де b є цілим числом, вибраним з 2, 3 та 4, (тобто, де групами R4), можуть аналогічно бути одержані згідно зі способами, описаними у Схемах 3, 4 та 5, з відповідним заміщенням групами що містить реагент, відповідним реагентом, де є заміщеним 2, 3 або 4 брому, при цьому групи брому послідовно піддають реакції, щоб об'єднати бажані групи R4. Сполуки формули (І), де (Y)a є С(О), може бути одержані у відповідності з двома альтернативними способами. У першому способі, сполуку піролопіридинону формули (VIII) спочатку заміщують відповідно вибраною карбоновою кислотою або хлорангідридом, що супроводжується подальшим заміщенням замісником R4, як описано у Схемі 6. СХЕМА 6 Більш особливо, відповідно заміщену сполуку піролопіридинону формули (VIII) піддають реакції з відповідно заміщеною карбоновою кислотою або хлорангідридом формули (XVIII), де W є ОН або СІ, в органічному розчиннику, такому як DMF, THF, діоксан, та інші їм подібні, та, коли W є ОН, у присутності каталізатора, такого як РуВrор, DCC, та інші їм подібні, а, коли W є СІ, у присутності основи, такої як TEA, DIPEA, та інші їм подібні, переважно при температурі в діапазоні від приблизно 0 до приблизно 30°С, що дає на виході відповідну сполуку формули (XVIII). Сполуку формули (XVIII) піддають реакції з відповідно заміщеною бористою кислотою формули (XI), в органічному розчиннику, такому як DIVIF, діоксан, вода, та інші їм подібні, у присутності каталізатора, такого як Pd(Ph3P)4, та інші їм подібні, переважно при температурі в діапазоні від приблизно 80 до приблизно 120°С, що дає на виході відповідну сполуку формули (Id). У другому способі, відповідно заміщену сполука формули (III) спочатку перетворюють у відповідний піролопіридинон, після чого слідують два етапи заміщення, використовуючи відповідно вибрану карбонову кислоту, після чого слідує бориста кислота або олово, як наведено у Схемі 7. СХЕМА 7 Більш особливо, відповідно заміщену сполуку формули (III) піддають реакції з відповідно заміщеною карбоновою кислотою формули (XVII), де W є галогеном або гідрокси групою, в органічному розчиннику, такому як TEA, DIPEA, та інші їм подібні, переважно при температурі в діапазоні приблизно 80-130°С, що дає на виході відповідну сполуку формули (XIX). Сполуку формули (XIX) піддають реакції з відповідно заміщеної бористою кислотою формули (XI) або відповідно заміщеним трибутил-оловом формули (XII), що дає на виході відповідну сполуку формули (XX). Коли вибраним реагентом є бориста кислота формули (XI), сполуку формули (XIX) піддають реакції в органічному розчиннику, такому як DMF, діоксан, вода, та інші їм подібні, у присутності каталізатора, такого як Pd(Ph3P)4, Pd(dppf)(OAc)2, та інші їм подібні, переважно при температурі в діапазоні приблизно 80-120°С. Коли вибраним реагентом є трибутил-олово формули (XII), сполуку формули (XIX) піддають реакції у розчиннику, такому як DMF, діоксан, та інші їм подібні, у присутності каталізатора, такого як Pd(dppf)(ОАс)2. Сполуку формули (XX) піддають реакції з окислювальним агентом, таким як NalO4, КО2, синглет оксигену, газ оксигену, озон, та інші їм подібні, переважно газом оксигену, що дає відповідну сполуку формули (Id), Сполуки формули (І), де R3 є іншим за гідроген, та сполуки формули (II), можуть бути одержані у відповідності зі способом, наведеним у Схемі 8. СХЕМА 8 Більш особливо, сполуку формули (Іа) піддають реакції з відповідно заміщеною сполукою формули (XXI), де X є галогеном, гідрокси групою, тозилатом; мезилатом, та іншими їм подібними, переважно X є галогеном, в органічному розчиннику, такому як THF, DMF, дихлорметан, толуол, та іншим їм подібним, переважно THF або DMF, що дає на виході суміш відповідно заміщеної сполуки формули (Іе) та відповідно заміщеної сполуки формули (II). Коли у сполуці формули (XXI), X є галогеном, реакцію переважно виконують у присутності органічної або неорганічної основи, такої як триетиламін, діізопропілетиламін, карбонат калію, гідрид натрію, гідроокис натрію та іншим їм подібним. Сполуки формули (Іе) та (II) переважно розділюють за допомогою відомих способів, таких як рекристалізація, колонкова хроматографія, рідинна хроматографія високого тиску, та інші їм подібні. Сполуки формули (VII), де Ya є Y0 (де Υ є відсутнім), а одержані у відповідності зі способом, який наведено у Схемі 9. є 2-(4-заміщеним) тіазолілом, можуть бути СХЕМА 9 Таким чином, відповідно заміщену сполука формули (III) піддають реакції з Fmoc-NCS, у органічному розчиннику, такому як DCM, DMF, THF, та інші їм подібні, переважно при кімнатній температурі, для одержання відповідної сполуки формули (XXII). Сполуку (XXII) піддають реакції з 20%-м піперидином, у спирті, такому як метанол, етанол, та інші їм подібні, для одержання відповідного аміну формули (XXIII). Амін формули (XXIII) піддають реакції з відповідно заміщеним a-гало метиловим кетоном формули (XXIV), у присутності органічного розчинника або суміші, таких як DMF, етанол : діоксан, та інших їм подібних, у присутності основи, такої як TEA, DIPEA, та інші їм подібні, переважно при температурі приблизно 70°С, для одержання відповідної сполуки формули (VIla). Специфічні діиастереомери сполук формули (І), точніше сполуки формули (І), де R1 є гідрогеном, та є бажаною R-конфігурація у хіральному центрі R2 зв'язана із піролопіридиноном, може бути одержані у· відповідності зі способом, наведеним у Схемі 10. СХЕМА 10 Таким чином, відповідно заміщену сполуку формули (XXV), відому сполуку або сполуку, одержану за допомогою відомих способів, де R1 є гідрогеном, а Аr є групою арилу, переважно нафтилу, більш переважно 1нафтилу, піддають реакції з відповідно заміщеним альдегідом, сполука формули (XXVI), в органічному розчиннику, такому як п-ксилол, о-ксилол, толуол, DMC, та іншим їм подібним, при температурі в діапазоні приблизно 25-270°С, під апротонними або протонними умовами, що дає на виході суміш відповідних діастереомерів сполук формули (XXVII) та (XXVIII). R-діастереомер, сполуку формули (XXVII), відділяють від сполуки формули (XXVIII) за допомогою рекристалізації або хроматографії на силікагелі. Сполуку формули (XXVII) (S-діастереомер) перетворюють у бажаний R-діастереомер, сполуку формули (XXVIII), шляхом перемішування сполуки формули (XXVII) у кислоті, такої як TFA, соляна, TsOH, та інших їм подібних, у присутності органічного розчинника, такого як типу СН2СІ 2, DCM, 1,4-діоксан, та інших їм подібних, що дає на виході бажаний R-діастереомер, сполуку формули (XXVIII). Сполуку формули (XXVIII) піддають реакції з окислювальним агентом, таким як газ оксигену, синглет кисню, КО2, NalO4, озон, та іншими їм подібним, переважно газом оксигену, піддають реакції приблизно атмосферному тиску, що дає на виході відповідну сполуку формули (XXIX). Коли окислювальним агентом є газ оксигену, реакція виконують у присутності основи, такої як гідрид натрію, т-бутоксид калію, та іншими їм подібними, у органічному розчиннику, такому як DMF, DMSO, NMP, та іншими їм подібними. Сполуку формули (XXIX) піддають реакції з відновлювальним агентом, таким як газ гідрогену, у присутності каталізатора, такого як палладій-на-карбоні, у полярному розчиннику, такому як метанол, етанол, та інших їм подібних, що дає на виході відповідну сполуку формули . Потім сполуку формули (VIlla) можна піддавати подальшої реакції, що дає на виході відповідну сполуку формули (І) у відповідності зі способом, наведеним у Схемі 3, що зображена вище. Для сполук формули (І), де R1 є іншим за гідроген, другий хіральний центр існує при зв'язку групи R1 з піролопіридиноном. Якщо специфічна орієнтація R1 групи є присутньою у вихідному реагенті, орієнтація сполуки формули (XXV) у наведеній вище Схемі 10, буде наслідком впливу перетворення діастереомерів. Коли способи отримання сполук згідно з даним винаходом дають суміші стереоізомерів, ці ізомери можуть бути розділені за допомогою звичайних способів, таких як препаративна хроматографія. Дані сполуки можуть бути одержані у рацемічній формі, або за допомогою енантіоспецифічного синтезу чи шляхом розщеплення можуть бути одержані окремі енантіомери. Дані сполуки можуть, наприклад, бути розщеплені на окремі енантіомери за допомогою стандартних методів, таких як утворення діастереомерних пар шляхом солеутворення з оптично активною кислотою, такою як (-)-ди-п-толуол-д-винна кислота та/або (-)-ди-п-толуолі-винна кислота після часткової кристалізації та регенерації вільної основи. Дані сполуки можуть бути також розкладені шляхом утворенням діастереомерних ефірів або амідів з наступним хроматографічним розділенням та вилученням побічної хіральної речовини. Як альтернатива, дані сполуки можуть бути розкладені використовуючи рідинну хроматографію високого тиску з використанням HPLC колонки. Під час будь-якого способу отримання сполук даного винаходу може виникнути потреба та/або бажання захистити чутливі або реакційні групи на будь-якій із відповідних молекул. Це може бути досягнуто за допомогою звичайних захисних груп, таких як описані у роботах Protective Groups in Organic Chemistry, ed. by J.F.W. McOmie, Plenum Press, 1973, та T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991. Дані захисні групи можуть бути вилучені на будь-якій зручній наступній стадії з використанням відомих у цій галузі способів. Корисність сполук для лікування полової дисфункції може бути визначена у відповідності до процедур, описаних у Прикладі 95, 96 та 97 даного опису. Таким чином, даний винахід призначений для створення способу лікування полової дисфункції, зокрема чоловічої еректільної дисфункції у суб'єкта, який має в цьому потребу, що включає введення будь-якої зі сполук, визначених у даному описі, у кількості, ефективної для лікування еректільної дисфункції. Сполука може бути введена пацієнту за допомогою будь-якого загальновідомого способу введення, включаючи, але не обмежуючись тільки ними, внутрішньовенне, пероральне, підшкірне, внутришньом'язове, інтрадермальне та парентеральне. Кількість сполуки, що є ефективною для лікування еректільної дисфункції встановлюється у межах від 0.01 до 20мг на кілограм ваги тіла суб'єкта. Даний винахід також призначений для створення фармацевтичних композицій, що включають одну або більшу кількість сполук даного винаходу у поєднанні з фармацевтично прийнятним носієм. Переважно ці композиції знаходяться у одиницях форми дозування, таких як таблетки, пігулки, капсули, порошки, гранули, стерильні парентеральні розчини або суспензії, дозовані аерозолі або рідкі розпилювачі, краплі, ампули, автоінжектори або супозиторії; для орального, парентерального, інтраназального, під'язичного або ректального введення, або для введення при інгаляції або інсуфляції. Альтернативно, композиція може бути представлена у формі, що відповідає щотижневому або щомісячному введенню; наприклад, нерозчинна сіль активної сполуки, така як сіль деканоату, може адаптованою для одержання складу для внутришньом'язової ін'єкції. Для одержання твердих композицій, таких як таблетки, основний активний інгредієнт змішують з фармацевтичним носієм, наприклад, загальновідомими наповнювачами для таблеток, такими як кукурудзяний крохмаль, лактоза, сахароза, сорбіт, тальк, стеаринова кислота, стеарат магнію, дикальцію фосфат або смола, та інших фармацевтичних розчинників, наприклад, вода, щоб сформувати попередній твердий склад композиції, який містить гомогенну суміш сполуки даного винаходу або її фармацевтично прийнятної солі. Коли зазначені попередні композиції називають гомогенними, мають на увазі, що активний інгредієнт є рівномірно диспергованим по всій даній композиції, так що дана композиція може бути легко розділена на однаково ефективні форми дозування, такі як таблетки, пілюлі та капсули. Потім дану попередню тверду композицію розділяють на одиничні форми дозування, такі як описано вище, що містять від приблизно 1мг до приблизно 1000мг активного інгредієнту даного винаходу. Таблетки або пілюлі, що містять нові композиції, можуть бути покритими іншими сполуками, що дає перевагу пролонгованої дії. Наприклад, таблетка або пілюля може включати внутрішній дозовий компонент та зовнішній дозовий компонент, останній у формі оболонки навколо першого. Зазначені компоненти можуть бути розділені ентеральним шаром, який захищає від розщеплення у шлунку та дозволяє внутрішньому компоненту проходити неушкодженим до дванадцятипалої кишки або забезпечує затримку його виділення. Для таких ентеральних шарів або покрить можуть використовуватися різні матеріали, такі матеріали включають ряд полімерних кислот з такими матеріалами як шелак, цетиловий спирт та ацетилцелюлоза. Рідкі форми, в які можуть бути включені нові композиції даного винаходу, для перорального введення або для ін'єкцій, включають, але не обмежуються тільки ними, водні розчини, відповідним чином ароматизовані сиропи, водні або олійні суспензії та ароматизовані емульсії з їстівними оліями, такими як бавовняна олія, кунжутна олія, кокосова або арахісова олія, так само як і еліксири та подібні їм фармацевтичні наповнювачі. Прийнятні суспендуючі агенти для водних суспензій включають синтетичні та природні смоли, такі як трагакант, гуміарабик, альгінат, декстран, карбоксиметилцелюлоза натрію, метилцелюлоза, полівінілпіролідон або желатин. Метод лікування полової дисфункції, зокрема еректільної дисфункції, описаний в даному винаході , може також бути виконаним, використовуючи фармацевтичну композицію, яка включає будь-яку із сполук, визначених у даному описі та фармацевтично прийнятний носи. Фармацевтична композиція може вміщувати приблизно від 1 до 1000мг, переважно приблизно від 1 до 200мг, сполуки, і може бути складеною у будь-якій формі, що відповідає обраному способу введення. Носії включають необхідні та інертні фармацевтичні наповнювачі, включаючи, але не обмежуючись тільки ними, зв'язуючі агенти, суспендуючі компоненти, мастило, ароматизатори, підсолоджувані, стабілізатори, барвники та покривні агенти. Композиції, прийнятні для перорального прийому включають тверді форми, такі як пігулки, таблетки, каплети, капсули (кожна включаючи склади безпосереднего вивільнення, встановленого вивільнення, вивільнення, що підтримується), гранули та порошки, та рідкі форми, такі як розчини, сиропи, еліксири, емульсії та суспензії. Форми, корисні для парентерального введення, включають стерильні розчини, емульсії та суспензії. Переважно, сполуки даного винаходу можуть вводитися як одна добова доза, або повна щоденна доза може вводитися в розділених дозах два, три або чотири рази на день. Крім того, сполуки даного винаходу можуть вводитися у інтраназальній формі шляхом топічного застосування відповідних інтраназальних носіїв, або через зовнішні частини тіла, які добре відомі звичайним фахівцям у цій галузі. При введенні у трансдермальній формі доставки, перевагу має безперервний режим введення дози у порівнянні з переривчастим режиму дозування. Наприклад, для перорального введення у вигляді таблетки або капсули, активний лікарського засіб може бути об'єднаним з оральним, нетоксичним фармацевтично прийнятним інертним носієм, таким як етиловий спирт, гліцерин, вода та інші їм подібні. Крім того, при бажанні або необхідності суміш також може включати прийнятні зв’язуючи агенти, любриканти та барвники. Відповідні зв’язуючи агенти включають, без обмеження, крохмаль, желатин, природний цукор, такий як глюкоза або бета-лактоза, цукристі речовини з кукурудзи, природні та синтетичні смоли, такі як гуміарабик, трагаканта або олеат натрію, стеарат натрію, стеарата магнію, бензоат натрію, ацетат натрію, хлорид натрію та інші їм подібні. Дезінтегратори включають, без обмеження, крохмаль, метилцеллюлозу, агар, бентоніт, ксантанову смолу та інші їм подібні. У рідкі форми можна додавати смакові добавки, суспендувальні або диспергуючі агенти, такі як синтетичні та натуральні гуми, наприклад, трагакант, гуміараік, метилцелюлоза та інші їм подібні. Для парентерального призначення, бажаними є стерильні суспензії та розчини, Ізотонічні препарати звичайно містять консерванти та застосовуються, коли бажаним є внутрішньовенне введення. Сполуки даного винаходу можуть також вводитися у вигляді ліпосомальних систем доставки, таких як маленькі уніламелярні бульбашки, великі уніламелярні бульбашки та мультиламелярні бульбашки. Ліпосоми можуть бути утворені з великої кількості фосфоліпідів, таких як холестерол, стеариламін і фосфатидилхолін. Сполуки даного винаходу можуть також доставлятися шляхом використання моноклональних антитіл як індивідуальних носіїв, з якими сполучені молекули сполуки. Сполуки даного винаходу також можуть сполучатися з розчинними полімерами, як носіями ліків. Такі полімери включають полівінвлпіролідон, пірановий кополімер, полігідроксипропіл-метакріламідофенол, полігідроксиетил-аспартамідофенол або поліетилен-оксидполілізин, заміщений пальмітоїловим залишком. Крім того, сполуки даного винаходу також можуть сполучатися з класом полімерів, що біоруйнуються, що є корисним для керованого вивільнення ліків, наприклад, полімолочна кислота, полі-епсилон-капролактам, полігідроксибутанова кислота, поліортоестери, поліацеталі, полідигідропірани, поліціанакрілати та перекресні та амфіпатичні блок-кополімери гідрогелів. Сполуки даного винаходу можуть вводитися в будь-якій з нижченаведених композицій відповідно до встановленого режиму дозування, що встановлений фахівцями, для лікування полової дисфункції, зокрема чоловічої еректільної дисфункції, де таке лікування необхідне. Доза продуктів може змінюватися у широких межах, від 0.01мг до 1.000мг на дорослу людину на день. Для перорального введення, композиції переважно застосовуються у вигляді таблеток, що містять приблизно 1.0, 5.0, 10,0, 50.0, 100, 250 і 500мг активного компоненту для симптоматичного регулювання дози для пацієнту, якого лікують. Ефективна кількість ліків звичайно досягається при дозуванні від приблизно 0.01мг/кг до приблизно 100мг/кг маси тіла на день. Переважним є дозування від приблизно 0.01мг/кг до приблизно 10мг/кг маси тіла на день, головним чином, від приблизно 0.01мг/кг до приблизно 3мг/кг маси тіла на день. Оптимальні дозування' для введення можуть бути легко визначені фахівцем у цій галузі, та можуть змінюватися в залежності від вибраної сполуки, сили препарату, режиму введення, та розвитку стану хвороби. Також певну роль можуть відігравати фактори, що залежать від конкретного пацієнта, наприклад його вік, вага, дієта або час призначення, що обумовлюють необхідність корекції дозування. Наступні Приклади наводяться для полегшення розуміння винаходу, та не призначені і не повинні розглядатися як обмеження винаходу, який розкривається у наведеній нижче формулі. Якщо інакше не зазначено, 1Н ЯМР виконували на пристрої Брукера (Bruker). ПРИКЛАД 1 1-(3,4-Метилендіоксифеніл)-2-бензил-2,3,4,9-тетрагідро-1Н-β-карболін До розчину 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Н-β-карболіну (одержаним у відповідності зі способом, розкритим в Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) (7.37г, 25ммоль) у сухому DMF (25моль) додавали триетиламін (3.52мл, 25ммоль) та бромистий бензил (3.00мл, 25ммоль). Суміш перемішували при температурі навколишнього середовища протягом ночі та додавали по краплях до розчину гідроокису натрію (25ммоль) у воді (200мл). Сформований осад відбирали за допомогою вакуумного фільтрування, промивали водою (двічі по 50мл), та висушували у вакуумі протягом ночі, що дало на виході продукт у вигляді вільно текучого порошку блідо-жовтого кольору. MS (m/z) 383 (МН+) 1 Н ЯМР (CDCд3) d 2.57-2.89 (серіям, 3Н), 3.18-3.23 (м, 1Н), 3.33 (д, J=13.7Гц, 1Н), 3.63 (д, J=13.7Гц, 1Н), 4.55 (с, 1Н), 5.94 (нд, J=2.2Гц, 2Н), 6.77-7.52 (серіям, 13Н). ПРИКЛАД 1А (R)-1-(3,4-Метилендіоксифеніл)-2-бензил-2,3,4,9-тетрагідро-1Η-b-карболін Дотримуючись процедури, яка описана у Прикладі 1, (R)-1-(3,4,-метилен-діоксифеніл)-2,3,4,9-тетрагідро1Η-β-карболін піддавали реакції для одержання вказаної у заголовку сполуки. MS (m/z) 383 (МН+) ПРИКЛАД 2 1-(2,3-Дигідробензофуран-5-іл)-2-бензил-2,3.4,9-тетрагідро-1Н-β-карболін Вказаний у заголовку продукт одержували у відповідності зі способом, описаним у Прикладі 1, використовуючи 1-(2,3-дигідробензофуран-5-іл)-2,3,4,9-тетрагідро-1Н-β-карболін як вихідний реагент. MS (m/z) 381 (МН+) 1 Н ЯМР (CDCI 3) d 2.59-2.90 (серіям, 3Н), 3.13-3.24 (м, 3Н), 3.33 (д, J=13.5Гц, 1Н), 3.93 (д, J=13.5Гц, 1Н), 4.56 (т, J=8.6Гц, 2Н), 6.75 (д, J=8.1Гц, 1Н), 7.05-7.35 (серіям, 10Н), 7.49-7.52 (м, 1H). ПРИКЛАД 2А (R)-1-(2,3-Дигідробензофуран-5-іл)-2-бензил-2,3,4,9-тетрагідро-1Η-b-карболін Дотримуючись процедури, яка описана у Прикладі 2, (R)-1-(2,3-дигідро-бензофуран-5-іл)-2,3,4,9тетрагідро-1Н-β-карболін піддавали реакції для одержання вказаної у заголовку сполуки. MS (m/z) 381 (МН+) {a}=-56.9 (с=0.62, СН3ОН) ПРИКЛАД 3 1,2,3,4-Тетрагідро-2-бензил-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3.4b]хінолін-9-он (№54) 1-(3,4-Метилендіоксифеніл)-2-бензил-2,3,4,9-тетрагідро-1Н-β-карболін (0.79г, 2.0ммоль) (одержаний як у Прикладі 1) розчинювали в сухому DMF (15мл). Додавали калію т-бутоксид (0.56г, 5.0ммоль), водночас пропускаючи крізь розчин оксиген за допомогою шприца. Суміш витримували при кімнатній температурі протягом однієї години та потім лляли на суміш 1N НСІ (5мл), води (35мл) та етилацетату (35мл). Ворсистий осад відбирали, вилучали органічний шар, та водний розчин екстрагували з етилацетатом (15мл). Екстрагований шар струшували та залишали на ніч. Наступного дня відбирали додаткову кількість продукту (як осад). Висушування комбінованих твердих речовин дало на виході продукт у вигляді порошку жовтого кольору. MS (m/z): 397 (МН+) 1 Н ЯМР (DMSO-D6) d 3.52 (дд, J=11.9,3Гц, 1Η), 3.63 (д, J=13.2Гц, 1Η), 3.84 (д, J=13.2Гц, 1Η), 3.93 (дд, J=11.9,3Гц, 1Η), 5.10 (с, 1Н), 6.05 (нд, J=3.4Гц, 2Н), 6.98 (с, 3Н), 7.26-7.36 (м, 6Н), 7.54-7.59 (м, 2Н), 8.10 (д, J=8Гц, 1H), 11.42 (с, 1H). ПРИКЛАД 3А (R)-1,2,3,4-Тетрагідро-2-бензил-3-(3,4-метилендіоксисреніл)-9Н-піроло[3,4-b]хінолін-9-он (№67) Дотримуючись процедури, яка описана у Прикладі 2, (R)-1-(3,4-метилен-діоксифеніл)-2-бензил-2,3,4,9тетрагідро-1Η-β-карболін піддавали реакції для одержання вказаної у заголовку сполуки. MS (m/z) 397 (МН+) ПРИКЛАД 4 1,2,3,4-Тетрагідро-2-бензил-3-(2,3-дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-он (№60) 1-(2,3-Дигідробензофуран-5-іл)-2-бензил-2,3,4,9-тетрагідро-1Η-β-карболін (одержаний як у Прикладі 2) (3.10г, 8.15ммоль) розчинювали у сухому DMF (20мл). Додавали калію т-бутоксид (0.56г, 5.0ммоль), водночас пропускаючи крізь розчин оксиген за допомогою шприца. Розчин перемішували протягом 1.5 годин. До реакційній суміші додавали розчин НСІ у простому ефірі (10мл, 2М), та розчин капали у воду, яку швидко перемішували. Отриману у результаті суспензію перемішували протягом ночі. Тверду речовину коричневого кольору відфільтровували та промивали водою. Фільтрат нейтралізували 1Ν NaOH, в результаті отримували осад жовтого кольору. Твердий розчин фільтрували, промивали водою, недовго висушували та частково розчиняли у суміші THF/метанол. Твердий осад фільтрували та промивали простим ефіром, що на виході продукт у вигляді твердої речовини блідо-жовтого кольору. MS (m/z) 395 (МН+) 1 Н ЯМР (DMSO-D6) d 3.19 (τ, J=8.7Гц, 2H), 3.53 (д, J=11.8Гц, 1Η), 3.61 (д, J=12.2Гц, 1Н), 3.82 (д, J=12.2Гц, 1Н), 3.92 (д, J=11.8Гц, 1Н), 4.55 (т, J=8.7Гц, 2Н), 5.08 (с, 1Н), 6.81 (д, J=8.1Гц, 1Н), 7.16-7.59 (серіям, 9Н), 8.10 (д, J=8.1Гц 1Н), 11.42 (с, 1H). ПРИКЛАД 4А (R)-1,2,3,4-Тетрагідро-2-бензил-3-(2,3-дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-он (№77) Дотримуючись процедури, яка описана у Прикладі 4, (R)-1-(2,3-дигідробензофуран-5-іл)-2-бензил-2,3,4,9тетрагідро-1Η-β-карболін піддавали реакції для одержання вказаної у заголовку сполуки. MS (m/z) 395 (МН+) [a]=-110.0°(с=0.43, СН3ОН); Рідинна хроматографія високого тиску Chiralpak OD 0.46x25см, 0.1% DEA/MeOH, Tr=5.36 0 хвилин. ПРИКЛАД 5 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он, сіль хлоргідрата (№4) Метод А: Сіль соляної кислоти До суспензії 1,2,3,4-тетрагідро-2-бензил-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону (одержаної як у Прикладі 3) (1.12г, 2.82ммоль) у метанолі (50мл) та 10% Pd/С (500мг) додавали соляну кислоту у розчині простого ефіру (1.41мл, 2N). Реакційну суміш перемішували під атмосферою гідрогену (310,2642Па) у приладі Парра (Parr) протягом 6 годин. Отриманий у результаті розчин фільтрували через Целіт, а концентрація у вакуумі, дала на виході продукт у вигляді твердої речовини зеленого кольору. MS (m/z) 307 (MH+) 1 H ЯМР (DMSO-D6) d 4.39-4.48 (м, 2Н), 6.09 (широка с, 3Н), 6.97-7.05 (м, 3Н), 7.40 (т, J=7.1Гц, 1Н), 7.607.71 (м, 2Н), 8,17 (д, J=8.0Гц, 1Н), 9.68 (с, 1Н), 11.13 (с, 1Н). Метод В: Вільна Основа 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболін, відому сполуку, (одержану відповідно до способу, розритому у Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) (15.35г, 52.5ммоль) розчинювали у сухому DMF (90мл). Трет-бутилат калію (10.02г, 89.3ммоль) вводили у вигляді однієї порції, і суспензію перемішували, поки не отримували прозорий розчин. Потім газ оксигену пропускали через розчин за допомогою голки для шприца протягом 50 хвилин. Реакція гасили шляхом додавання крижаної оцтової кислоти (5.11мл, 89.3ммоль) і виливали на діетиловий ефір (1л), у результаті чого отримали осад, який відбирали за допомогою фільтрації. Продукт очищували за допомогою флеш-хроматографії (0-50% ЕtOН/THF), що дало на виході продукт у вигляді порошку жовтого кольору. MS (m/z): 307 (МН+) 1 Н ЯМР (CD3OD) d 4.18 (д, J=13.7Гц, 1Η), 4.36 (д, J=13.7Гц, 1Н), 4.92 (широка с, 2Н), 5.43 (с, 1H), 5.92 (с, 1H), 6.74 (с, 1H), 6.81 (с, 1H), 7.36-7.70 (серіям, 4Н), 8.31 (д, J=8.6Гц, 1H). ПРИКЛАД 5А (R)-1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он, сіль хлоргідрата (№48) Дотримуючись процедури, яка описана в Прикладі 5, Метод A, (R)-1,2,3,4-тетрагідро-2-бензил-3-(3,4метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он піддавали реакції, щоб отримати вказану у заголовку сполуку. MS (m/z) 307 (МН+) ПРИКЛАД 6 1,2,3,4-Тетрагідро-3-(2,3-дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-он, сіль хлоргідрата Метод А: Сіль соляної кислоти Вказаний у заголовку продукт одержували відповідно до способу, описаному в Прикладі 4, із заміщенням відповідних реагентів. MS (m/z) 305 (МН+) 1 Н ЯМР (DMSO-D6) d 3.17-3.20 (м, 2Н), 4.38-4.60 (м, 4Н), 6.10 (с, 1Н), 6.85 (д, J=8.2Гц, 1Н), 7.21 (д, J=8.1Гц, 1Н), 7.30 (с, 1Н), 7.40 (т, J=7.1Гц, 1Н), 7.61 (т, J=8.2Гц, 1Н), 7.68 (д, J=7.2Гц, 1Н), 8.17 (д, J=8.9Гц, 1Н), 9.71 (с, 1Н), 11.17 (с, 1Н). Метод В: Вільна основа 1-(2,3-дигідро-5-бензофураніл)-2,3,4,9-тетрагідро-1Η-β-карболін (1.06г, 3.64ммоль), відому сполуку, (одержану відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 10, сторінка 25) розчинювали у сухому DMF (8мл). Трет-бутилат калію (829мг, 7.38ммоль) вводили у вигляді однієї порції, та суспензію перемішували, поки не отримували прозорий розчин. Потім газ оксигену пропускали через розчин за допомогою голки для шприца протягом 50 хвилин. Реакція гасили шляхом додавання крижаної оцтової кислоти (0.42мл, 7.34ммоль) і виливали на діетиловий ефір (50мл), у результаті чого отримали осад, який відбирали за допомогою фільтрації. Продукт очищували за допомогою флеш-хроматографії (0-50% МеОН/THF), що дало на виході продукт у вигляді порошку жовтого кольору. MS (m/z): 305 (МН+) 1 Н ЯМР (CD3OD) d 3.17 (т, J=8.7Гц, 2H), 3.29-3.31 (м, 2Η), 4.18 (д, J=12.9Гц, 1Η), 4.38 (д, J=12.9Гц, 1Η), 4.53 (т, J=8.7Гц, 2Η), 5.44 (с, 1Η), 6.74 (д, J=8.2Гц, 1Η), 7.07 (д, J=8.2Гц, 1Η), 7.13 (с, 1Η), 7.40 (т, J=7.9Гц, 1H), 7.54 (д, J=8.3Гц, 1Η), 7.65 (т, J=7.9Гц, 1Η), 8.29 (д, J=8.1Гц, 1Η). ПРИКЛАД 6А (R)-1,2,3,4-Тетрагідро-3-(2,3-дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-он, сіль хлоргідрата Дотримуючись процедури, яка описана у Прикладі 6, Метод A, (R)-1,2,3,4-тетрагідро-2-бензил-3-(2,3дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-он піддавали реакції, щоб отримати вказану у заголовку сполуку. MS (m/z) 305 (МН+) [a]=+39.0 (с=0.605,1% TFA у СН3ОН) ПРИКЛАД 7 (4-Піридиніл) метил-4-нітрофенілкарбонової кислоти складний ефір До розчину 4-піридинілкарбінолу (50ммоль) та триетиламіну (50ммоль) у сухому дихлорметані (100мл) додавали розчин 4-нітрофенілхлорформату (50ммоль). Реакційну суміш перемішували протягом ночі при температурі навколишнього середовища, що у результаті дало осад жовтого кольору, який вилучали за допомогою фільтрації та концентрували. Напівтвердий залишок обробляли THF (50мл), для того щоб сформувати осад білого кольору. Осад відбирали за допомогою фільтрації, концентрували та очищували за допомогою флеш-хроматографії (20% THF/СНСІ 3), що дало на виході продукт у вигляді твердої речовини оранжевого кольору. MS (m/z) 275 (МНҐ) 1 Н ЯМР (CDCI 3) d 5.33 (с, 2Н), 7.36 (д, J=5.8Гц, 2Н), 7.41 (д, J=9.4Гц, 2Н), 8.30 (д, J=9.4Гц, 2Н), 8.68 (д, J=5.8Гц, 2Н). ПРИКЛАД 8 6-(2-1-Морфоліно)етоксил-2-бензофуранкарбонова кислота Розчин 6-метокси-2-бензофуранкарбоксилат метилового ефіру (868мг, 4.52ммоль) у сухому бензолі обробляли трифенілфосфіном (1.18г, 4.52ммоль) та 1-(2-гідроксиетил)-тетрагідрооксазином (0.72мл, 4.57ммоль) під атмосферою аргону. При кімнатній температурі до реакційної суміші краплями додавали DEAD (0.55мл, 4.5ммоль). Розчин перемішували протягом ночі, концентрували у вакуумі та залишок очищували за допомогою флеш-хроматографії (0-10% МеОН/СНСІ 3). Очищений продукт піддавали омиленню протягом 3 годин у суміші (1:1) метанолу та водного розчину 1 N NaOH (80мл) при нагріванні з оберненим охолодженням. Реакційну суміш нейтралізували концентрованою соляною кислотою та концентрували, що дало на виході залишок, який розтирали в порошок з метанолом (20мл). Отриману у результаті сіль вилучали за допомогою фільтрації та концентрували, що дало на виході другий залишок, який аналогічно розтирали в порошок з THF. Третій залишок висушували під дією вакууму, що дало на виході продукт у вигляді порошку жовтого кольору. MS (m/z) 292 (МН+) 1 Н ЯМР (DMSO-D6) d 2.57 (широка с, 4Н), 2.87 (т, J=5.3Гц, 2Н), 3.64 (т, J=4.6Гц, 4Н), 4.23 (т, J=5.5Гц, 2Н), 6.97 (дд, J=8.7,2Гц, 1H), 7.31 (с, 1H), 7.53 (с, 1H), 7.63 (д, J=8.7Гц, 1H). ПРИКЛАД 9 1,3,4-Метилендіоксифеніл)-2-(трет-бутоксикарбоніл)-2,3.4,9-тетра-гідро-1Η-β-карболін До суспензії 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболіну (27.7г, 94.8ммоль) (одержаної відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) у сухому метанолі (300мл) додавали т-бутилпірокарбонат (25.0г, 114ммоль). Незабаром після додавання пірокарбонату сформувався прозорий розчин. Розчин перемішували при температурі навколишнього середовища протягом 1 години, що привело до формування осаду білого кольору. Тверду речовину відбирали за допомогою фільтрації, промивали сумішшю (1:1) діетиловий ефір: пентан, та висушували у вакуумі, що дало на виході продукт у вигляді твердої речовини білого кольору. MS(m/z):415(MNa+) 1 Н-ЯМР (СDСІ 3) d 1.53 (с, 9Н), 2.75-3.17 (серіям, 3Η), 4.22 (широкий, 1Η), 5.93 (с, 2 Η), 6.31 (широкий, 1Η), 6.64-6.72 (м, 2Η), 6.80 (с, 1Η), 7.12-7.33 (серіям, 3Η), 7.54 (д, J=7.7Гц, 1Η), 7.93 (широкий, 1Η); ПРИКЛАД 10 1-(3,4-МетилендіоксиФеніл)-2-(бензилоксикарбоніл)-2,3,4,9-тетрагідро-1Η-β-карболін До розчину 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболін (9.11г, 31.1ммоль) (одержаного відповідно до способу, який розкрито в Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) у сухому дихлорметані (100мл) додавали триетиламін (8.80мл, 63.1ммоль) та диметиламінопіридин (5мг), після чого краплями додавали бензилхлорформат (4.60мл, 30.6ммоль) протягом 30 хвилин. Реакційну суміш перемішували протягом 16 годин, перенесли до розділильної воронки, промивали 2Ν НСІ, соляним розчином, висушували над безводним сульфатом магнію та концентрували у вакуумі. Флеш-хроматографія дала на виході продукт у вигляді твердої речовини білого кольору. MS(m/z):425(M-1) 1 Н-ЯМР (CDCI 3) d 2.78-2.95 (широкийм, 2Н), 3.15-3.25 (м, 1H), 4.40 (широкий, 1Н), 5.14 (д, J=12.3Гц, 1Η), 5.22 (д, J=12.3Гц, 1Н), 5.90 (с, 2Η), 6.35 (широкий 1Η), 6.80 (широкий, 3Η), 7.09-7.35 (серіям, 8Н), 7.53 (д, J=7.6Гц, 1Η), 7.70 (широкий, 1Η); ПРИКЛАД 11 1-(3,4-Диметоксисреніл)-2,3,4,9-тетрагідро-1Н-β-карболін До розчину триптаміну (5.0г, 0.0312моль) та 3,4-диметокси бензальдегіду (5.7г, 0.0312моль) у СН2СІ 2 (220мл) додавали TFA (4.5мл, 0.0584моль). Глибоко синій розчин перемішували при кімнатній температурі потягом 20 годин. Реакційну суміш нейтралізували розчином NаНСО3 (4.9г, 0.0584моль) у Н2О (50мл) і органічний шар промивали соляним розчином (2x100мл). Реакційну суміш висушували з МgО4 та випаровували розчинник. Продукт відділяли за допомогою колонкової хроматографії (силікагель; СН3ОН:ЕtOАс=1:9) у вигляді жовтуватої олії, що повільно тверділа під час находження при кімнатній температурі. Температура плавлення: 146-148°С; MS (m/z) 307 (М-1), 309 (МН)+ 1 Н ЯМР (CDCI 3) d 2.70-2.92 (м, 2Н), 3.05 (м, 1Н), 3.31 (м, 1Н), 3.65 (с, 3Н), 3.81 (с, 3Н), 5.01 (с, 1Н), 6.72 (м, 2Н), 7.12 (м, 3Н), 7.52 (м, 1Н), 8.18 (с, 1Н) ПРИКЛАД 12 1-(3,4-Метилендіоксифеніл)-2-[5-(4-метоксифеніл)-піримідин-2-іл]-2,3,4,9тетрагідро-1Η-β-карболін 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболін (2.72г, 9.6ммоль) (одержаний відповідно до способу, який розкрито в Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) та 2-хлоро-5(4-метокси-феніл)піримідин (1.04м, 4.78ммоль) перемішували у DMF (20мл, безводний) при температурі 120°С протягом 16 годин. Отриману у результаті суміш гасили насиченим NH4CI, екстрагували з етилацетатом та висушували з МgО4. Розчинник реакційної суміші випаровували, а залишок очищували за допомогою колонкової хроматографії (силікагель, етилацетат:гексани=1:2), що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 200-202°С; MS (m/z): 477 (МН)+ 1 Н-ЯМР (DMSO-d6) d 2.71 (м, 2Η), 3.25 (м, 1Η), 3.78 (с, 3Η), 4.93 (д, J=12Гц, 1Η), 5.99 (д, J=5Гц, 2Η), 6.76 (д, J=8Гц, 1Η), 6.87 (д, J=8Гц, 2Η), 7.02 (д, J=9Гц, 2Η), 7.06 (д, J=7Гц, 1Η), 7.11 (с, 1Η), 7.31 (д, J=8Гц, 1Η), 7.46 (д, J=8Гц, 1Η), 7.59 (д, J=9Гц, 2Η), 8.74 (с, 2Н), 11.00 (с, 1H); ПРИКЛАД 13 1-(3,4-Метилендіоксифеніл)-2-[5-(3,4-диметоксифеніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Η-β-карболін Дотримуючись процедури, яку зазначено вище у Прикладі 12, 1-(3,4-метилен-діоксифеніл)-2,3,4,9тетрагідро-1Н-β-карболін (3.73г, 12.8ммоль) (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, Проміжна сполука 7, сторінка 24) та 2-хлоро-5-(3,4-диметоксилфеніл)піримідин (1.60г, 6.4ммоль) у DMF (50мл, безводний) піддавали реакції, що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 173-175°С; MS (m/z): 507 (МН)+ 1 Н ЯМР (CDCI 3) d 2.89 (д, J=15Гц, 1Η), 3.02 (м, 1Η), 3.39 (м, 1Η), 3.92, 3.94 (2с, 6Η), 5.03 (д, J=12Гц, 1Η), 5.92 (д, J=4Гц, 2Η), 6.71 (д, J=7Гц, 1Η), 6.87-7.32 (м, 6Η), 7.56 (д, J=7Гц, 2Η), 7.80 (с, 1Η), 8.56 (с, 2Н); ПРИКЛАД 14 1-(3,4-Метилендіоксифеніл)-2-[5-(4-метилфеніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Η-β-карболін Дотримуючись процедури, яку зазначено вище у Прикладі 12, 1-(3,4-метилендіоксифеніл)-2,3,4,9тетрагідро-1Н-β-карболін (2.19г, 7.5ммоль) (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, Проміжна сполука 7, сторінка 24) та 2-хлоро-5-(4-метилфеніл)піримідин (1.03м, 5ммоль) у толуолі (50мл, безводний) та DBU (0.9мл) піддавали реакції, що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z): 459 (МН)+ 1 Н-ЯМР (CDCI 3) d 2.43 (с, 3Η), 2.85 (д, J=14Гц, 1Η), 3.01 (т, J=12Гц, 1Н), 3.38 (т, J=12Гц, 1Η), 5.04 (дд, J=14Гц, 1Η), 5.88 (д, J=4Гц, 2Н), 6.73 (д, J=7Гц, 1H), 6.89 (д, J=7Гц, 1H), 7.02 (с, 1H), 7.25-7.50 (м, 7Н), 7.56 (д, J=7Гц, 1H), 7.79 (с, 1H), 8.54 (с, 2Н); ПРИКЛАД 15 1-(3,4-МетилендіоксисЬеніл)-2-(піридин-4-іл)метил-2,3,4,9-тетрагідро-1Η-β-карболін Розчин 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболіну (2.92г, 10ммоль) (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24), 4-піколілхлорид хлоргідрат (1.64г, 10ммоль) та DBU (3.1г, 20ммоль) у DMF (50мл) перемішували при кімнатній температурі протягом 16 годин. До реакційній суміші додавали воду (100мл) та етилацетат (100мл). Розчинену речовину, яка існувала у органічній фазі, очищували за допомогою колонкової хроматографії (силікагель, етилацетат), що дало на виході продукт у вигляді твердої речовини жовтуватого кольору. MS(m/z)382(M-1) 1 Н ЯМР (CDCI 3) d 2.65 (м, 1H), 2.75 (д, 1H), 2.88 (м, 1H), 3.15 (м, 1Н), 3.35 (д, J=15Гц, 1Η), 3.92 (д, J=15Гц, 1Η), 4.57 (с, 1Η), 5.94 (с, 1Н), 6.79 (д, J=8Гц, 1H), 6.89 (м, 2Н), 7.20-7.40 (м, 7Н), 7.51 (д, J=6Гц, 1H), 8.53 (д, J=7Гц, 1H); ПРИКЛАД 16 1-(3,4-Метилендіоксифеніл)-2-(піримідин-2-іл)-2,3,4,9-тетрагідро-1Н-β-карболін 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболін (2.3г, 8.0ммоль) (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) та 2хлорпіримідин (0.914г, 8.0ммоль) перемішували в безводному DMF (15мл) при температурі 140°С протягом 24 годин. Реакційну суміш розводили етилацетатом (100мл) та промивали насиченим водяним розчином NH4CI (100мл). Водний шар екстрагували з етилацетатом (2x50мл). Комбіновані органічні шари промивали соляним розчином (2x80мл) та висушували МgО4. Розчинники випаровували, і продукт відділяли за допомогою колонкової хроматографії (силікагель, ЕtOАс:Гексан=1:9) у вигляді твердої речовини жовтуватого кольору. Температура плавлення: 176-177°С; MS (m/z): 371 (МН)+, 369 (М-1); Аналітично обчислено для C22H18 N4O2, С 71.34, Η 4.90, Ν 15.13; Знайдене С 70.57, Η, 4.92, Ν 15.38 1 Η ЯМР (CDCI 3) d 2.71 (м, 1Н), 2.92 (м, 1Н), 3.29 (м, 1Н), 4.92 (дд, 1Η, J=14,7Гц), 5.91 (д, 2Η, J=6Гц), 6.43 (т, 1Н, J=6Гц), 6.63 (д, 1Н, J=10Гц), 6.81 (д, 1Н, J=10Гц), 6.95 (с, 1Н), 7.08 (м, 3Н), 7.21 (д, 1Н, J=8Гц), 7.54 (д, 1Н, J=10Гц), 8.12 (с, 1Н), 8.30 (д, 2Н, J=6Гц). ПРИКЛАД 17 1-(3,4-Метилендіоксифеніл)-2-[5-(4-хлорофеніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Η-β-карболін Дотримуючись процедури, яку зазначено вище у Прикладі 12, 1-(3,4-метилендіоксифеніл)-2,3,4,9тетрагідро-1Η-β-карболін (295мг, 1ммоль) (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) та 2-хлоро-5-(4-хлорофеніл)піримідин (113мг, 0.5ммоль) у DMF (5мл, безводний) піддавали реакції, що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z): 479 (МН+) 1 Н-ЯМР (CDCI 3) d 2.87 (дд, J=4,14Гц, 1Η), 3.01 (дт, J=5,12Гц, 1Н), 3.38 (дт, J=4, 14Гц, 1Η), 5.04 (дд, J=5,14Гц, 1Η), 5.91 (д, J=4Гц, 2Н), 6.73 (д, J=7Гц, 1H), 6.89 (д, J=7Гц, 1H), 7.00 (с, 1H), 7.20 (с, 1H), 7.25 (м, 2Н), 7.30 (д, J=7Гц, 1H), 7.40 (м, 4 Н), 7.56 (д, J=7Гц, 1H), 7.83 (с, 1H), 8.54 (с, 2Н); ПРИКЛАД 18 [5-(3,4-Диметоксифеніл)-піримідин-2-ілі-1-(3,4-диметоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболін Дотримуючись процедури, яку зазначено у Прикладі 16, 1-(3,4-метилен-діоксифеніл)-2,3,4,9-тетрагідро-1Ηβ-карболін (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) та 2-хлоро-5-(3,5-диметоксифеніл) піримідин піддавали реакції, що дало на виході тверду речовину білого кольору. Температура плавлення. 184-186°С; MS (m/z) 523 (МН+) 521 (М-1) 1 Н ЯМР (CDCI 3) d 2.81-3.20 (м, 2Н), 3.40 (м, 1Н), 3.71 (с, 3Н), 3.79 (с, 3Н), 3.88 (с, 3Н), 3.91 (с, 3Н), 5.01 (дд, 1Н, J=14Гц, 5Гц), 6.68 (д, 1Н, J=8Гц), 6.70-7.19 (м, 7Н), 7.28 (т, 1Н, J=8Гц), 7.52 (т, 1Н, J=8Гц), 8.20 (с, 1Н), 8.52 (с, 2Н); ПРИКЛАД 19 1,2,3,4-Тетрагідро-3-(3,4-диметоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он (№12) 1-(3,4-Диметоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболін (1.854г, 6.04ммоль) (одержаний як у Прикладі 11) та KOt-Bu (1.14г, 10.15ммоль) перемішували у DMF (60мл) при кімнатній температурі потягом 10 хвилин. Оксиген пропускали крізь розчин протягом 1 години. Реакційну суміш нейтралізували 1N розчина НСІ (10.15мл, 10.15ммоль), а воду вилучали у вакуумі як азеотроп з толуолом. Силікагель (~5г) додавали до залишкового розчину DMF, у супроводженні діетилового ефіру (600мл), що приводило до осадження продукту на силікагель. Діетиловий ефір зливали, а силікагель промивали діетиловим ефіром (2 χ 100мл). Після того, як розчинник зливали, а будь-які його залишки, що залишилися, випаровували, залишок очищували за допомогою колонкової хроматографії (силікагель; ЕtOH:ЕtOАс=1:9), що дало на виході продукт, у вигляді твердої речовини яскраво-жовтого кольору. Продукт перекристалізували з метанолу. Температура плавлення. 223-225°С; MS (m/z): 323 (МН+), 321 (М-1) 1 Н ЯМР (CD3OD) d 3.71 (с, 3Н), 3.88 (с, 3Н), 4.18 (д, 1Н, J=14Гц), 4.38 (д, 1Н, J=14Гц), 5.41 (с, 1 Η), 6.83 (м, 3Н), 7.39 (т, 1Н, J=7Гц), 7.58 (м, 2Н), 8.22 (д, 1Н, J=6Гц), 11.85 (с, 1H); ПРИКЛАД 20 1,2,3,4-тетрагідро-2-[5-(4-метоксифеніл)-піримідин-2-іл]-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4b]хінолін-9-он (№2) Гідрид натрію (60% у мінеральній олії, 36мг, 0.9ммоль) та 1-(3,4-метилендіоксифеніл)-2-[5-(4метоксифеніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Н-β-карболін (186мг, 0.39ммоль) (одержаний як у Прикладі 12) у DMF (10мл, безводний) перемішували при кімнатній температурі потягом 30 хвилин. Потім сухе повітря пропускали крізь розчин протягом 16 годин. Додавали етилацетат (100мл) та насичений NаНСО3, органічну фазу промивали водою, соляним розчином, та висушували МgО4. Розчинник випаровували і залишок розтирали в порошок з етилацетатом, що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 325-327°С; MS(m/z)491 (MH+)489(M-1) 1 Н ЯМР (DMSO-d6) d 3.77 (с, 3Η), 4,86 (д, J=12Гц, 1Η), 4.96 (дд, J=15Гц, 1Η), 5.98 (с, 2Η), 6.29 (д, J=2.5Гц, 1Η), 6.87 (д, J=8Гц, 1Η), 6.95 (д, J=9Гц, 2Η), 6.98 (с, 1Η), 7.02 (д, J=4Гц, 3Η), 7.34 (т, J=7Гц, 1Η), 7.57 (д, J=9Гц, 2Η), 7.63 (дд, J=8Гц, 3Η), 8.16 (д, J=8Гц, 1Н), 8.69 (широкий, с, 2Н); 11.85 (с, 1H); ПРИКЛАД 21 1,2,3,4-тетрагідро-2-[5-(3,4-диметоксифеніл)-піримідин-2-іл]-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4b]хінолін-9-он (№1) Гідрид натрію (60% у мінеральній олії, 40мг, 1.0ммоль) та 1-(3,4-метилен-діоксифеніл)-2-[5-(3,4диметоксифеніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Н-β-карболін (218мг, 0.43ммоль) (одержаний як у Прикладі 13) у DMF (10мл, безводний) перемішували при кімнатній температурі потягом 30 хвилин. Потім сухе повітря пропускали крізь розчин протягом 16 годин. Додавали етилацетат (100мл) та насичений NаНСО3, органічну фазу промивали водою, соляним розчином, та висушували МgО4. Розчинник випаровували і залишок очищували за допомогою хроматографії (силікагель, етилацетат), що дало на виході продукт у вигляді твердої речовини білого кольору. MS(m/z)521 (MH+);519(M-1) 1 Н ЯМР (DMSO-d6) d 3.77 (с, 3Η), 3.83 (с, 3Η), 4.86 (д, J=12Гц, 1Н), 4.96 (дд, J=15Гц, 1Η), 5.99 (с, 2Η), 6.31 (д, J=2.5Гц, 1H), 6.87 (д, J=8Гц, 1H), 6.95 (д, J=9Гц, 2Н), 6.98 (с, 1H), 7.02 (м, 1H), 7.17 (д, J=7Гц, 1H), 7.22 (с, 1H), 7.35 (т, J=7Гц, 1H), 7.62 (м, 2Н), 8.17 (д, J=8Гц, 1H), 8.74 (широкий, с, 2Н); 11.85 (с, 1Н); ПРИКЛАД 21А (S)-1,2,3,4-Тетрагідро-2-[5-(3,4-диметоксифеніл)-піримідин-2-іл]-3-(3,4-метилендиоксифеніл)-9Н-піроло[3,4-b]хінолін-9-он (№35) Дотримуючись процедури, яку зазначено у Прикладі 21, (S)-1-(3,4-метилен-діоксифеніл)-2-[5-(3,4диметоксифеніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Η-β-карболін піддавали реакції, що дало на виході вказану у заголовку сполуку. ПРИКЛАД 21В (R)-1,2,3,4-Тетрагідро-2-[5-(3,4-диметоксифеніл)-піримідин-2-ілі-3-(3,4-метилендиоксифеніл)-9Н-піроло[3,4-b]хінолін-9-он (№36) Дотримуючись процедури, яку зазначено у Прикладі 21, (R)-1-(3,4-метилен-діоксифеніл)-2-[5-(3,4диметоксифеніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Н-β-карболін піддавали реакції, що дало на виході вказану у заголовку сполуку. ПРИКЛАД 22 1,2,3,4-Тетрагідро-2-[5-(4-метилфеніл)-піримідин-2-іл]-3-(3,4-метилен-діоксифеніл)-9Н-піроло-[3,4b]хінолін-9-он (№7) Дотримуючись процедури, яку зазначено у Прикладі 21, гідрид натрію (60% у мінеральній олії, 43мг, 1.09ммоль) і 1-(3,4-метилендіоксифеніл)-2-[5-(4-метилфеніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Н-β-карболін (278мг, 0.60ммоль) (одержаний як у Прикладі 12) у DMF (15мл, безводний) піддавали реакції, що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z) 475 (МН+) 1 Н ЯМР (DMSO-d6) d 2.32 (с, 3Η), 4.86 (д, J=12Гц, 1Η), 4.96 (дд, J=15Гц, 1Η), 5.98 (с, 2Н), 6.30 (д, J=2.5Гц, 1H), 6.87 (д, J=8Гц, 1Н), 6.95 (д, J=9Гц, 2Н), 7.02 (д, J=4Гц, 3Н), 7.24 (д, J=7Гц, 2Н), 7.34 (т, J=7Гц, 1H), 7.407.65 (м, 3Н), 8.16 (д, J=8Гц, 1H), 8.69 (широкий, с, 2Н); 11.85 (с, 1H); ПРИКЛАД 23 1,2,3,4-Тетрагідро-[5-(3,4-диметоксифеніл)-піримідин-2-іл]-3-(3,4-диметоксифеніл)-9Н-піроло[3,4-b]хінолін9-он (№15) Дотримуючись процедури, яку зазначено вище у Прикладі 19, [5-(3,4-ди-метоксифеніл)-піримідин-2-іл]-1(3,4-диметоксифеніл)-2,3,4,9-тетрагідро-1Н-β-карболін (одержаний як у Прикладі 18),піддавали реакції, що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z) 535 (МН+), 537 (ΜΗ-) 1 Н ЯМР (CD3OD) d 3.74 (с, 3Н), 3.79 (с, 3Н), 3.80 (с, 3Н), 3.85 (с, 3Н), 5.0 (м, 2Н), 6.31 (с, 1Н), 6.75-7.15 (м, 5Н), 7.36 (т, 1Н, J=8Гц), 7.32 (д, 1Н, J=8Гц), 7.61 (м, 2Н), 8.29 (д, 1 Η, J=8Гц), 8.58 (с, 2Н); ПРИКЛАД 24 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-(піридин-4-іл)метил-9Н-піроло-[3,4-b]хінолін-9-он (№5) Дотримуючись процедури, яку зазначено вище у Прикладі 21, гідрид натрію (60% у мінеральній олії, 40мг, 1.0ммоль) та 1-(3,4-метилендиоксифеніл)-2-(піридин-4-іл)метил-2,3,4,9-тетрагідро-1Η-β-карболін (192мг, 0.50ммоль) (одержаний яку Прикладі 15) у DMF (10мл, безводний) піддавали реакції, що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z) 398 (MH+) 1 H ЯМР (DMSO-d6) d 3.58 (д, J=14Гц, 1Η), 3,76 (д, J=15Гц, 1Η), 3.88 (д, J=15Гц, 1Η), 4.01 (д, J=14Гц, 1Η), 5.17 (с, 1Η), 6.03 (с, 1Η), 6.97 (с, 3Η), 7.35 (м, 3Η), 7.60 (м, 2 Η), 7.34 (т, J=7Гц, 1 Η), 8.11 (д, J=8Гц, 1Η), 8.53 (д, J=6Гц 2Η), 11.45(с,1Η); ПРИКЛАД 25 1,2,3,4-Тетрагідро-2-(трет-бутоксикарбоніл)-3-(3,4-метилендіокси-феніл)-9Н-піроло-[3,4-b]хінолін-9-он (№3) 2-т-Бутоксикарбоніл-1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболін (4.09г, 10.4ммоль) (одержаний як у Прикладі 9) розчинювали в сухому DMF (100мл). Вводили т-бутоксид калію (2.55г, 22.7ммоль) у вигляді одної порції, і суспензію перемішували, поки не отримували прозорий розчин. Потім крізь розчин пропускали газ оксигену за допомогою голки для шприца протягом 16 годин. Реакцію гасили шляхом додавання крижаної оцтової кислоти (25ммоль) і виливали на суміш діетилового ефіру та води, що у результаті привело до утворення осаду, який відбирали за допомогою фільтрації. Продукт очищували за допомогою флеш-хроматографії (0-10% МеОН/СНСІ 3), що дало на виході продукт у вигляді твердої речовини білого кольору. MS(m/z):405(M-1) 1 Н-ЯМР (CDCI 3) d 1.38-1.65 (ряд с, 9Н), 4.79-4.88 (м, 2Н), 5.86-6.27 (серіям, 3Н), 6.71-7.50 (серіям, 7Н), 11.57 та 11.64 (с, 1H); ПРИКЛАД 26 1,2,3,4-Тетрагідро-2-(бензилоксикарбоніл)-3-(3,4-метилендіокси-феніл)-9Н-піроло-[3,4-b]хінолін-9-он (№27) 2-бензилоксикарбоніл-1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Н-β-карболін (3.63м, 8.51ммоль) (одержаний як у Прикладі 10) розчинювали у сухому DMF (25мл). Вводили т-бутоксид калію (2.55г, 22.7ммоль) у вигляді одної порції, і суспензію перемішували, поки не отримували прозорий розчин. Потім крізь розчин пропускали газ оксигену за допомогою голки для шприца протягом 16 годин. Реакцію гасили шляхом додавання крижаної оцтової кислоти (1.23мл, 21.0ммоль) і виливали в воду (250мл), що у результаті привело до утворення осаду, який відбирали за допомогою фільтрації. Продукт очищували за допомогою флешхроматографії (2-10% МеОН/СНСІ 3), що дало на виході продукт у вигляді порошку червоного кольору. MS(m/z):439(M-1) 1 Н-ЯМР (CDCI 3) d 4.63-5.18 (серіям, 4Н), 5.71-5.85 (серіям, 3Н), 6.54-6.72 (серіям, 3Н), 6.98-7.01 (м, 1Н), 7.25-7.57 (серіям, 7Н), 8. 27-8.32 (м, 1Н), 10.04 та 10.33 (с, 1Н); ПРИКЛАД 27 (Е)-4-3-Оксо-3-[1,2,3,4-тетрагідро-3-(2,3-дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-он-2-ілі-1пропенілі бензойна кислота, метиловий ефір (№20) A. Розчин (Е)-4-карбометокси-В-фенілакрилової кислоти (5.09м, 24.7ммоль) розчинювали у сухому THF (25мл) та оброблявся під атмосферою аргону з хлорангідридом щавлевої кислоти (3.00мл, 34.4ммоль) і додавали невелику кількість сухого DMF. Після нагрівання при температурі 50°С протягом 2 годин, реакційну суміш концентрували у вакуумі, що дало на виході хлорангідрид Е)-карбоксиметил-В-феніл акрилової кислоти у вигляді твердої речовини жовто-коричневого кольору. B. Продукт, одержаний у частині А (78мг, 0.35ммоль), додавали до розчину 1,2,3,4-тетрагідро-3-(2,3дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-ону (93.5мг, 0.31ммоль) (одержаний як у Прикладі 6), THF (3мл), триетиламіну (0.20мл, 1.43ммоль) та DMAP (5мг). Суміш перемішували протягом 16 годин при кімнатній температурі, розбавлювали 1Ν НСІ (10мл), і отриманий у результаті білий осад відбирали за допомогою фільтрації. Тверду речовину промивали водою (тричі), діетиловим ефіром (тричі) та висушували у вакуумі, що дало на виході продукт у вигляді твердої речовини світло-рожевого кольору. MS (m/z): 493 (MH+) 1 H-ЯМР (DMSO) d 3.10-3. Μ, 2H), 3.87 (с, 3Η), 4.43-4.52 (м, 2Η), 4.70-5.14 (серіям, 2Η), 6.23 та 6.61 (с, 1Η), 6.72-6.79 (м, 1Η), 7.07-8.19 (серіям, 12Н),10.69 та 10.77(с, 1Η). ПРИКЛАД 28 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-[5-(3-трифтор-метилфеніл)фуроїл]-9Н-піроло-[3,4b]хінолін-9-он (№13) До розчину 5-(3-трифторметилфеніл)-2-фуранкарбонової кислоти (80.44мг, 0.314ммоль) у суміші (1:1) DCM:THF (5мл, безводний) додавали оксалілхлорид (43.85мг, 0.345ммоль), а також дві краплі DMF. Суміш перемішували при кімнатній температурі протягом 1 години. Додавали суспензії 1,2,3,4-тетрагідро-3-(3,4метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону (96.2мг, 0.314ммоль) (одержаний як у Прикладі 5), триетиламіну (0.13мл) та DMAP (незначну кількість) у суміші (1:1) DCMTHF (5мл). Отриману у результаті суміш перемішували при кімнатній температурі протягом 16 годин. Додавали етилацетат (50мл), і розчин промивали водним розчином NаНСО3, соляним розчином, 1N НСІ, соляним розчином, а потім висушували MgSO4. Розчинник випаровували і залишок розтирали в порошок з етилацетатом, що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 219-221°С. MS (m/z): 545 (МН+), 567 (Μ+23), 543 (МH-) 1 Н-ЯМР (DMSO-d6) d 5.09 (д, J=14Гц, 1Η), 5.46 (д, J=14Гц, 1Η), 5.99 (с, 2Η), 6.39 (с, 1Η), 6.91 (д, J=8Гц, 1Η), 6.97 (д, J=9Гц, 1Η), 7.02 (с, 1Η), 7.33 (д, J=8Гц, 1Η), 7.38 (д, J=4Гц, 1Η), 7.43 (д, J=4Гц, 1Η), 7.60 (м, J=8Гц, 2Η), 7.77 (д, J=5Гц, 2Η), 8.16 (д, J=4Гц, 3Η), 11.55 (с, 1Η). ПРИКЛАД 29 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-(6-гідрокси-2-бензо-фуроїл)9Н-піроло[3,4-b]хінолін-9-он (№9) До розчину 6-гідрокси-2-бензофуранової кислоти (0.054г, 0.3ммоль) у тетрагідрофурані (5мл) при температурі 0°С краплями додавали оксалілхлорид (0.046г, 0.36ммоль), а також DMF (2 краплі). Розчин нагрівали до температури 25°С і перемішували протягом 30 хвилин, потім концентрували у вакуумі. Залишок розчинювали у тетрагідрофурані (5мл), і додавали до розчину 1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)9Н-піроло-[3,4-b]хінолін-9-ону (0.092г, 0.3ммоль) (одержаного як у Прикладі 5) у THF (5мл), триетиламіні (0.045г, 0.45ммоль) та 4-диметиламінопіридині (0.01г, каталізатор). Розчин перемішували протягом 20 годин при температурі 25°С, а потім концентрували у вакуумі. Отриманий у результаті неочищений залишок очищували за допомогою колонкової хроматографією (силікагель, елюйований 3% метанолом у дихлорметані), що дало на виході продукт у вигляді прозорої олії. 1 Н ЯМР (CD3OD): d 5.25 (д, J=15Гц, 1Н), 5.48 (д, J=15Гц, 1Н), 5.91 (с, 2Н), 6.45 (широка с, 1Н), 6.84 (м, 3Н), 6.93 (м, 2Н), 7.00 (с, 1Н), 7.25-7.89 (нечіткий добір фракцій м, 5Н), 8.32 (д, 1Н). ПРИКЛАД 30 (Е)-4-[3-Оксо-3-[1,2,3,4-тетрагідро-3-(3,4-метилендиоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он-2-іл]-1пропенілі бензойної кислоти метиловий ефір (№6) Дотримуючись процедури, яку зазначено у Прикладі 20, 1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-9Нпіроло-[3,4-b]хінолін-9-он (398мг, 1.30ммоль) (одержаний як у Прикладі 5) піддавали реакції із хлорангідридом (Е)-карбоксиметил коричної кислоти (301мг, 1.34ммоль),у присутності триетиламіна (0.54мл, 3.87ммоль) у суміші (1:1) дихлорметан:ТНР (40мл), що дало на виході продукт у вигляді твердої речовини жовтокоричневого кольору. MS(m/z):493(M-1) 1 Н-ЯМР (CD3OD) d 3.86 (с, 3Η), 4.69-5.29 (серіям, 2Η), 5.93-6.02 (м, 2Η), 6.27 та 6.62 (с, 1Η), 6.89-8.21 (серіям, 13Н), 9.50 та 11.96 (широка с, 1Н). ПРИКЛАД 31 1,2,3,4-Тетрагідро-2-(імідазол-1-іл)тіокарбоніл-3-(3,4-метиленди-оксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он (№18) До суспензії 1,1’-тіокарбонілдіімідазолу (0.192г, 1.08ммоль) у DMF (5мл, безводний) при температурі 0°С додавали 1,2,3,4-тетрагідро-3-(3,4-метилен-діоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он (0.30м, 0.98ммоль) (одержаний як у Прикладі 5). Суміш нагрівали до кімнатної температури і перемішували протягом 20 годин. Розчин розбавлювали водою і екстрагували у етилацетат. Органічні шари об'єднували промивали водним розчином NaHCO3 та соляним розчином, висушували МgО4 та концентрували у вакуумі, що дало на виході продукт у вигляді твердої речовини світло-жовто-коричневого кольору. Температура плавлення: 211-215°С (дек.). MS(m/z):415(M-1) 1 Н-ЯМР(СD3ОD) d 4.71-5.16 (м, 1Н), 5.46 (д, J=15Гц, 1Η), 6.36-7.17 (нечіткий добір фракційм, 5Н), 7.42 (м, 2Н), 7.52 (м, 1Н), 7.58 (м, 2Н), 8.28 (м, 1Н). ПРИКЛАД 32 (Е)-4-[3-Оксо-3-1,2,34-тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло[3,4-b]хінолін-9-он-2-іл]-1пропеніл]бензойна кислота (№8) (Е)-4-[3-Оксо-3-[1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он-2-іл]-1пропеніл] метиловий ефір бензойної кислоти (149мг, 0.30ммоль), (одержаний як у Прикладі 30) суспендували у суміші (1:1) 1N водний гідроокис натрію:метанол (10мл), нагрівали з оберненим охолодженням протягом 8 годин. Реакційну суміш обробляли водним розчином НСІ до значення водневого показника рН 1, що у результаті дало білий осад. Осад відбирали за допомогою фільтрації та промивали водою (30мл) та діетиловим ефіром (160мл), що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z): 481 (МН+) 1 H-ЯМР (DMSO) d 4.71-5.13 (серія д, 2Н), 5.95-5.98 (м, 2Н), 6.23 та 6.61 (с, 1Н), 6.84-7.78 (серіям, 10Н), 7.89-7.92 (м, 3Н), 8.13-8.17 (м, 1Н), 11.94 (широка с, 1Н). ПРИКЛАД 33 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-[5-(4-нітрофеніл)-фуроїл]-9Н-піроло[3.4-b]хінолін-9-он (№16) 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он (70.3мг, 0.229ммоль) (одержаний як у Прикладі 5), 5-(4-нітрофеніл)-2-фуранкарбонову кислоту (58.9мг, 0.25ммоль) та РуВrОР (0.118м, 0.25ммоль) перемішували у DMF (3мл) та DIPEA (0.088мл, 0.50ммоль) протягом 16 годин. Реакційну суміш виливали в етилацетат (80мл), і отриманий у результаті органічний шар промивали 1N водним розчином НСІ (3x50мл), насиченим водним розчином Na2CO3 (1 χ 50мл) та соляним розчином (1x50мл). Органічний шар висушували МgО4, а розчинник випаровували у вакуумі. Колонкова хроматографія залишку (силікагель, 5% СН3ОН/СН3СІ) дала продукт у вигляді порошку жовтого кольору. MS (m/z): 522 (МН+), 520 (М-1) 1 Н ЯМР (DMSO-d6) d 5.05 (д, 1Н, J=14Гц), 5.45 (д, 1Н, J=14Гц), 6.0 (с, 2Н), 6.42 (с, 1Н), 6.95 (м, 3Н), 7.327.41 (м, 2Н), 7.55-7.65 (м, 3Н), 8.12 (м, 3Н), 8.39 (м,2Н), 11.91 (с, 1Н). ПРИКЛАД 34 1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-2-[5-(4-амінофеніл)-фуроїл]-9Н-піроло[3,4-b]хінолін-9-он (№26) 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-([5-(4-нітрофеніл))фуроїл]-9Н-піроло[3,4-b]хінолін-9-он (25мг, 0.0479ммоль) (одержаний як у Прикладі 33) перемішували з 10% Pd на карбоні (5.1мг, 0.00479ммоль) під тиском Н2 (1 атмосфера) при кімнатній температурі протягом 14 годин. Розчинник випаровували і продукт, відділяли за допомогою препаративної TLC у вигляді порошку жовтого кольору. MS (m/z): 492 (МН+); 490 (М-1) 1 Н ЯМР (CD3OD) d 5.25 (д, 1Н, J=14Гц), 5.45 (д, 1Н, J=14Гц), 5.91 (с, 2Н), 6.45 (с, 1 Η), 6.70-8.60 (м, 13Н). ПРИКЛАД 35 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-[2-гідрокси-нікотіноїл)-9Н-піроло[3.4-b]-хінолін-9-он (№25) Дотримуючись процедури, яку зазначено у Прикладі 33, з відповідним заміщенням реагентів, отримували продукт у вигляді твердої речовини блідо-жовтого кольору. MS (m/z): 428 (МН+); 426 (М-1) 1 Н ЯМР (CD3OD) d 4.65 (д, J=14Гц), 5.10 (д, 1Н, J=14Гц), 5.85 (с, 2Н), 5.92 (с, 1Н), 6.50-7.10 (м, 3Н), 7.307.70 (м, 5Н), 8.25 (м, 2Н). ПРИКЛАД 36 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-[5-(4-метокси-феніл)-фуроїл]-9Н-піроло[3,4-b]-хінолін-9-он (№21) Дотримуючись процедури, яку зазначено у Прикладі 33, з відповідним заміщенням реагентів, отримували продукт у вигляді твердої речовини блідо-жовтого кольору. MS (m/z): 507 (МН+); 505 (М-1) 1 Н ЯМР (CDCI 3) d 3.85 (с, 3Н), 5.10 (д, 1Н, J=14Гц), 5.38 (д, 1Н, J=14Гц), 6.02 (с, 2Н), 6.41 (с, 1Η), 6.80-8.35 (м, 13Н), 11.80 (с, 1Η). ПРИКЛАД 37 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксиФеніл)-2-[5-(4-гідроксифеніл)фуроїл]-9Н-піроло[3.4-b]-хінолін-9-он (№22) Дотримуючись процедури, яку зазначено у Прикладі 33, з відповідним заміщенням реагентів, отримували продукт у вигляді твердої речовини блідо-жовтого кольору. MS (m/z): 493 (МН+); 491 (М-1) 1 Н ЯМР (DMSO-d6) d 5.05 (д, 1Н, J=14Гц), 5.15 (д, 1Н, J=14Гц), 5.75 (с, 2Н), 6.31 (с, 1 Η), 6.80-8.35 (м, 13Н), 11.60 (с, 1 Η). ПРИКЛАД 38 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-[5-(4-метоксикар-бонілфеніл)-фуроїл]-9Н-піроло[3,4-b]хінолін-9-он (№24) Дотримуючись процедури, яку зазначено у Прикладі 33, з відповідним заміщенням реагентів, отримували продукт у вигляді твердої речовини блідо-жовтого кольору. 1 Н ЯМР (DMSO-d6) d 4.10 (с, 3Н), 5.10 (д, 1Н, J=14Гц), 5.50 (д, 1Н, J=14Гц), 6.02 (с, 2Н), 6.45 (с, 1Н), 6.808.35 (м, 13Н); ПРИКЛАД 39 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-[5-(4-формілфеніл)-фуроїл]-9Н-піроло[3,4-b]-хінолін-9-он (№23) Дотримуючись процедури, яку зазначено у Прикладі 33, з відповідним заміщенням реагентів, отримували продукт у вигляді твердої речовини блідо-жовтого кольору. MS (m/z): 503 (М-1) 1 Н ЯМР (DMSO-d6) d 5.10 (д, 1Н, J=14Гц), 5.55 (д, 1Н, J=14Гц), 6.02 (С, 2Н), 6.45 (с, 1Η), 6.80-8.35 (м, 13Н). ПРИКЛАД 40 (Ε)-4-[3-Оксо-3-[1,2,3,4-тетрагідро-3-(3,4-метилендиохфеніл)-4-метил-9Н-піроло-[3,4-b]хінолін-9-он-2-іл]-1пропенілі бензойна кислота, метиловий ефір (№63) та (Ε)-4-[3-Оксо-3-[1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-9-метокси-9Н-піроло-[3,4-b]хінолін-2-ілі-1пропеніл] бензойна кислота, метиловий ефір (№64) Розчин (Е)-4-[3-Оксо-3-[1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он-2-іл]-1пропеніл] метиловий ефір бензойної кислоти (349мг, 0.62ммоль) (одержаний як у Прикладі 30), та йодометан (0.060мл, 0.96ммоль) у сухому ацетоні (10мл) обробляли безводним вуглекислим калієм (241мг, 1.74ммоль) та нагрівали з оберненим охолодженням протягом 3 годин під атмосферою аргону. Реакційну суміш концентрували у вакуумі, і залишок очищували за допомогою флеш-хроматографії (0-10% метанол у дихлорметані), що дало на виході суміш N-та О-метильованих продуктів. Суміш N-та О-метильованих продуктів розділяли за допомогою колонкової хроматографії (0-10% MeOH/DCM), що дало на виході N-метильований продукт (Е)-4-[3-Оксо-3-[1,2,3,4-тетрагідро-3-(3,4метилендіоксифеніл)-4-метил-9Н-піроло-[3,4-b]хінолін-9-он-2-іл]-1-пропеніл]бензойна кислота, метиловий ефір у вигляді твердої речовини жовто-коричневого кольору. MS(m/z);509(M-1) 1 Н-ЯМР (GDCI 3) d 3.55 (с, 3Η), 3.93 (с, 3Η), 5.10 (м, 2Η), 5.94 (нд, J=3.7Гц, 2Η), 6.53 (с, 1Η), 6.78 (д, J=7.9Гц, 1Η), 6.86-6.96 (м, 3Η), 7.44-7.76 (серіям, 6Η), 8.05 (д, J=8.2Гц, 2Η), 8.55 (д, J=7.4Гц). та О-метильований продукт (Е)-4-[3-Оксо-3-[1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-4-метокси-9Нпіроло-[3,4-b]хінолін-9-он-2-іл]-1-пропеніл]бензойна кислота, метиловий ефір у вигляді твердої речовини рожевого кольору. MS(m/z):509(M-1) 1 Н-ЯМР (CDCI 3) d 3.93 (с, 3Η), 4.38 (с, 3Η), 5.45 (д, J=17.1Гц 1Η), 5.64 (д, J=17.1Гц, 1Η), 5.91 (с, 2Η), 6.26 (с, 1Η), 6.75-7.09 (серія д, 4Н), 7.39-8.23 (серіям, 9Н). ПРИКЛАД 41 1,2,3,4-Тетрагідро-2-(піримідин-2-іл)-3-(3,4-метилендіоксифеніл)-9Н-піроло[3,4-b]хінолін-9-он (№11) До розчину 1-(3,4-метилендіоксифеніл)-2-(піримідин-2-іл)-2,3,4,9-тетрагідро-1Н-β-карболіну (0.153г, 0.415ммоль) (одержаний як у Прикладі 16) у безводному DMF (4.1мл) додавали КOtBu (0.079м, 0.70ммоль, 1.7екв.). Через 5 хвилин крізь розчин пропускали газ оксигену протягом 1 години. До реакційній суміші додавали діетиловий ефір (45мл), і надосадочну рідину зливали. До ; залишку додавали соляний розчин (2мл), а значення рН встановлювали на рівні 7 за допомогою додавання декількох крапель 1Ν HC.L Воду вилучали у вакуумі як азеотроп з толуолом. Отриманий у результаті темно-червоний залишок розчинювали у мінімальній кількості THF, та очищували за допомогою колонкової хроматографії (силікагель; ЕtOH:СН2СІ 2=1:9), що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z): 383 (М-1); 385 (МН+) 1 Н ЯМР (DMSO-d6) d 4.84 (дд, 2Н, J=14Гц, 10Гц), 5.98 (с, 2Н), 6.25 (с, 1Н), 6.69 (т, 1Н, J=5Гц), 6.85 (д, 1Н, J=8Гц), 6.92 (д, 1Н, J=8Гц), 7.00 (с, 1Н), 7.33 (т, 1Н, J=7Гц), 7.60 (м, 2Н), 8.15 (д, 1Н, J=8Гц), 8.41 (широкий с, 2Н), 11.9 (с, 1Н). ПРИКЛАД 42 1,2,3,4-Тетрагідро-2-(піримідин-2-іл)-3-(3,4-метилендиохфеніл)-9Н-піроло[3,4-b]хінолін-9-он (№11) 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он (100мг, 0.3265ммоль) (одержаний як у Прикладі 5) та 2-хлор-піримідин (38мг, 0.3265ммоль) перемішували в DMF (2.5мл) при температурі 100°С протягом 16 годин. Розчинник вилучали під дією вакууму і залишок очищували за допомогою колонкової хроматографії (силікагель, 5% ; СН3ОН/СН3СІ), що дало на виході продукт у вигляді маслянистої речовини жовтого кольору. Розтирання в порошок маслянистої речовини з МеОН дало продукт у вигляді твердої речовини блідо-жовтого кольору. MS(m/z):383(M-1);385(MH+) 1 Н ЯМР (DMSO-d6) d 4.84 (дд, 2Н, J=14Гц, 10Гц), 5.98 (с, 2Н), 6.25 (с, 1Н), 6.69 (τ, 1Н, J=5Гц), 6.85 (д, 1Η, J=8Гц), 6.92 (д, 1Н, J=8Гц), 7.00 (с, 1Н), 7.33 (т, 1Н, J=7Гц), 7.60 (м, 2Н), 8.15 (д, 1Н, J=8Гц), 8.41 (широка с, 2Н), 11.9 (с, 1Н). ПРИКЛАД 43 1.2.3.4-Тетрагідро-2-[(4-піридиніл)метилоксикарбоніл]-3-(3,4метилен-діоксиФеніл)-9Н-піроло-[3,4-b]хінолін 9-он, сіль хлоргідрату (№37) Суміш 1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он, сіль хлоргідрату (101мг, 0.33ммоль) (одержана як у Прикладі 5), (4-піридиніл) метил-4-нітрофенілкарбонової кислоти ефір (106мг, 0.38ммоль) (одержаний як у Прикладі 7) та триетиламін (2екв.) нагрівали з оберненим охолодженням протягом 1 годин. Реакційну суміш концентрували у вакуумі та очищували за допомогою флеш-хроматографії (0-10% МеОН/СНСІ 3). Відповідну сіль формували шляхом осадження розчину метанолу вільної основи з розчином НСІ-ефір. MS (m/z) 442 (МН+) 1 Н ЯМР (CD3OD) d 5.02-5.62 (серіям, 4Н), 5.93-6.00 (м, 2Н), 6.23 та 6.44 (с, 1Н), 6.82-7.04 (м, 3Н), 7.71-7.90 (м, 4Н), 8.12 (д, J=6.2Гц, 1Η), 8.44 (с, 1Η), 8.78 (с, 1Η), 8.84 (с, 1Η). ПРИКЛАД 44 1,2,3,4-Тетрагідро-2-[(4-піридиніл)метилоксикаобонілі-3-(2,3-дигідоо-бензофуран-5-іл)-9Н-піроло-[3.4b]хінолін-9-он (№53) Дотримуючись процедури, яку зазначено у Прикладі 36, 1,2,3,4-тетрагідро-3(2,3-дигідробензофуран-5-іл)9Н-піроло-[3,4-b]хінолін-9-он, сіль хлоргідрату (одержану як у Прикладі 6) та (4-піридиніл)метил-4нітрофенілкарбонової кислоти ефір (одержаний як у Прикладі 7) піддавали реакції, що дало на виході продукт у вигляді твердої речовини світло-рожевого кольору. MS (m/z) 440 (МН+) 1 Н ЯМР (DMSO-d6) d 2.82-2.94 (м, 2Н), 4.35-5.26 (серіям, 6Н), 5.91 (с, 1Н) 6.45-7.58 (серія м, 9Н), 8.30-8.46 (м, 2Н), 12.26 (широкий, 1Н). ПРИКЛАД 45 1,2,3,4-Тетрагідро-2-[[5[-2-(4-морФолініл)етоксиі-2-бензофурил]карбоніл]-3(3,4-метилендіоксифеніл)-9Нпіроло-r3,4-blхінолін-9-онLгідросhlordе сіль (№49) 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-он, сіль хлоргідрату (222мг, 0.65ммоль) (підготовлений як у Приклад 5) і 6-[2-(1-Морфоліно)етокси]-2-бензофуранкарбонова кислота (209мг, 0.72ммоль) (підготовлений як у Прикладі 8) був зважений у сухому THF (10мл). До цієї суміші був доданий РуВrOР (358мг, 0.77ммоль) і триетиламін (0.40мл, 2.87ммоль). Суміш розмішували протягом ночі під атмосферою аргону та концентрували у вакуумі. Очищення залишку за допомогою флеш-хроматографії (010% МеОН/СНСІ 3) дала вільну основу. Відповідна сіль була сформована за допомогою осадження розчину метану вільної основи з розчином НСІ-ефіру. MS (m/z) 580 (МН+) 1 Н ЯМР (DMSO-d6) d 3.17-3.24 (м, 2Н), 3.52-3.61 (м, 4Н), 3.80 (т, J=11.7Гц, 2Н), 3.98 (д, J=12.1Гц, 2Н), 4.53 (широка с, 1Н), 5.10 (д, J=13.3Гц, 1Η), 5.40 (д, J=13.3Гц, 1Η), 6.00 (с, 2Η), 6.42 (с, 1Η), 6.90-7.08 (серіям, 4Н), 7.32-7.66 (серіям, 4Н), 7.73 (д, J=8.5Гц, 1Η), 8.16 (д, J=8.0Гц, 1Н), 10.81 (с, 1Н), 12.06 (с, 1Н). ПРИКЛАД 46 1-(2,3-дигідробензофураніл)-2-[5-(4-метоксифеніл)-піримідин-2-ілі-2,3,4,9-тетрагідро-1Η-β-карболін 1-(2,3-дигідробензо-5-фураніл)-2,3,4,9-тетрагідро-1Η-β-карболін (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 10, сторінка 25) (3.35м, 11.54ммоль), 5-(4метокси-феніл)-2-хлоропіримідин (м 2,55, 11.54ммоль), та Ν.Ν-діізопропілетиламін (3.5мл) перемішували в DMF (10мл, безводний) при температурі 120°С протягом 16 годин. Отриману у результаті суміш гасили 10% Na та екстрагували з етилацетатом. Органічний шар промивали 10% NaCI, соляним розчином, а потім висушували МgО4. Розчинник реакційної суміші випаровували, отриманий у результаті залишок розтирали в порошок з СН2СІ 2 та фільтрували. Фільтрат очищували за допомогою колонкової хроматографії (силікагель, етилацетат: гексан и=4:6), що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 242-243°С MS (m/z): 475 (МН+), 483 (М-1) 1 Н-ЯМР (DMSO-d6) d 2.50 (с, 1Η), 2.83 (м, 2Η), 3.12 (т, J=8.7Гц, 2Н), 3.24 (м, 1Н), 3.78 (с, 3Н), 4.49 (т, J=8.7Гц, 2Н), 4.90 (д, J=12Гц, 1Н), 6.72 (д, J=8.2Гц, 1Н), 7.03 (м, 4Н), 7.06 (д, J=7Гц, 1Н), 7.17 (д, J=9.3Гц, 2Н), 7.30 (д, J=8Гц, 1Н), 7.46 (д, J=7.6Гц, 1Н), 7.59 (д, J=8.6Гц, 2Н), 8.73 (с, 2Н), 11.00 (с, 1Н) ПРИКЛАД 47 1,2,3,4-Тетрагідро-2-[5-(4-метоксифеніл)-піримідин-2-іл]-3-(3,4-дигідробензофураніл)-9Н-піроло-[3,4b]хінолін-9-он (№39) Гідрид натрію (60% у мінеральній олії, 87мг, 2.18ммоль) та 1-(2,3-дигідро-5-бензофураніл)-2,3,4,9тетрагідро-2-[5-(4-метоксифеніл)-2-піримідиніл]-1Η-β-карболін (450мг, 0.95ммоль) (одержаний як у Прикладі 46) в DMF (30мл, безводний) перемішували при кімнатній температурі протягом 30 хвилин. Потім сухе повітря пропускали крізь розчин протягом 16 годин. Потім до розчину додавали етилацетат (200мл). Отриману у результаті суміш промивали 10% розчином NaCI, соляним розчином, а потім висушували MgSO4. Розчинник випаровували і залишок розтирали в порошок з етилацетатом, що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 301-302°С; MS (m/z) 489 (МН+); 487 (М-1) 1 Н ЯМР (DMSO-d6) d 3.11 (т, J=8.7Гц, 2Н), 3.77 (с, 3Н), 4.47 (т, J=8.7Гц, 2Н), 4.89 (м, 2Н), 6.29 (с, 1Н), 6.72 (д, J=8.1Гц, 1Н), 6.95 (д, J=8.7Гц, 2Н), 7.29 (м, ЗН), 7.57 (д, J=8.6Гц, 2Н), 7.64 (д, J=8.2Гц, 2Н), 8.16 (д, J=8.0Гц, 1Н), 8.67 (с, 2Н), 11.87 (с, 1Н). ПРИКЛАД 47А (R)-1,2,3,4-Тетрагідро-2-[5-(4-метоксифеніл)-піримідин-2-іл]-3-(3,4-дигідробензофураніл)-9Н-піроло-[3,4b]хінолін-9-он (№66) (R)-1,2,3,4-тетрагідро-3-(2,3-дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-он (0.23г, 0.678ммоль) (одержаний як у Прикладі 6А), та 5-(4-метоксифеніл)-2-хлоропіримідин (0.167г, 0.758ммоль) перемішували з діізопропіл-етил аміном (0.33мл) та KF (44.8мг, 0.758ммоль) у DMF (5мл) при температурі 60°С протягом 36 годин. Реакційну суміш розбавлювали СН2СІ 2 (75мл) та ЕtOАс (75мл). Потім промивали 1N водного розчину HCL (3x100мл). Потім промивали соляним розчином (2x100мл). Після висушування над МgО4, це концентрували, що дало маслянисту речовину жовтого кольору. Неочищений продукт очищували за допомогою силікагель колонки, що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z): 499 (МН+), 497 (М-1) 1 Н ЯМР d CDCI 3 3.02 (т, 2Н, J=11.7Гц), 3.82 (с, 3Н), 4.44 (т, 2Н, J=11.7Гц), 4.95 (д, 1Н, J=15.6Гц), 5.08 (д, 1Н, J=15.6Гц), 6.24 (с, 1Н), 6.62 (д, 1Н, J=7.8Гц), 6.92 (д, 2Н, J=7.8Гц), 7.14-7.61 (м, 7Н), 8.45 (м, 3Н), 9.65 (с, 1Н) Rf=0.47 (10% CH3OH/CHCI 3). Елементарний аналіз: для C30H24N4O3, розрахований % С 73.76, % Н 4.95,%N 11.47, % О 9.82; знайдений % С 73.73, % Н 4.87, % N 11.40, % О 9.65. ПРИКЛАД 48 (R)-1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-[5-(3-три-фторметилфеніл)фуро-2-іл]-9Н-піроло-[3,4b]хінолін-9-он (№50) До розчину 5-(3-трифторметилфеніл)-2-фуранкарбонової кислоти (504.4мг, 1.97ммоль) у суміші (1:1) DCM:THF (10мл, безводний) додавали оксалілхлорид (275мг, 2.17ммоль), а також дві краплі DMF. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин. До реакційної суміші додавали триетиламін (1.1мл), DMAP (незначну кількість) та суспензію енантіомерно чистого 1,2,3,4-тетрагідро-3-(3,4метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону (603мг, 1.97ммоль) (одержаного як у Прикладі 5А), у суміші (1:1) DCMTHF (10мл). Отриману у результаті суміш перемішували при кімнатній температурі протягом 16 годин. Додавали етилацетат (100мл) і розчин промивали водним розчином NаНСО3, соляним розчином, 1N HCL, соляним розчином, а потім висушували МgSО4. Розчинник реакційної суміші випаровували і залишок розтирали в порошок з етилацетатом, що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 219-221°С MS (m/z): 545 (МН+), 543 (М-1). 1 Н-ЯМР (DMSO-d6) d 5.09 (д, J=13Гц, 1Η), 5.47 (д, J=13Гц, 1Η), 6.00 (с, 2Η), 6.39 (с, 1Η), 6.91 (д, J=8Гц, 1Η), 6.97 (д, J=8Гц, 1Η), 7.02 (с, 1Η), 7.33 (д, J=7Гц, 1Η), 7.38 (д, J=4Гц, 1Η), 7.43 (д, J=4Гц, 1Η), 7.60 (м, J=8Гц, 2Η), 7.77 (д, J=5Гц, 2Η), 8.16 (д, J=5Гц, 3Η), 11.90 (с, 1Η) ПРИКЛАД 49 1-(2,3-Дигідробензофураніл)-2-[5-(2-піридиніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Η-β-карболін 1-(2,3-дигідробензофураніл)-2,3,4,9-тетрагідро-1Η-β-карболін (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 10, сторінка 25) (1.35г, 4.66ммоль), 2-хлоро5-(2-піридиніл)-піримідин (893мг, 4.66ммоль) та Ν,Ν-діізпропілетиламін (1.4мл) перемішували в DMF (10мл, безводний) при температурі 120°С протягом 16 годин. Отриману у результаті суміш гасили 10% NaCI та концентрували з етилацетатом. Екстрагований органічний шар промивали 10% NaCI, соляним розчином, а потім висушували МgО4. Розчинник реакційної суміші випаровували і залишок очищували за допомогою колонкової хроматографії (силікагель, етилацетат:гексани=4:6), що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 170-171°С MS (m/z): 446 (МН+), 444 (М-1) 1 Н-ЯМР (DMSO-d6) d 2.85 (д, J=5Гц, 2Н), 3.12 (т, J=8.7Гц, 2H), 3.27 (д, J=12.4Гц, 1Н), 4.96 (д, J=12.6Гц, 1Н), 6.72 (д, J=8.2Гц, 1Н), 6.99 (т, J=7.4Гц, 1Н), 7.07 (т, J=7.1Гц, 2Н), 7.21 (с, 2Н), 7.31 (д, J=8.2Гц, 2Н), 7.47 (д, J=7.6Гц, 1Н), 7.85 (д, J=7.8Гц, 1Н), 7.93 (д, J=8Гц, 1Н), 8.62 (д, J=4.5Гц, 1Н), 9.13 (с, 2Н), 11.01 (с, 1Н). ПРИКЛАД 50 1,2,3,4-Тетрагідро-2-[5-(2-Піридиніл)-піримідин-2-іл]-3-(3,4-дигідро-бензофураніл)-піроло-[3,4-b]хінолін-9-он (№61) Гідрид натрію (60% у мінеральній олії, 182мг, 4.55ммоль) та 1-(2,3-ди-гідро-5-бензофураніл)-2,3,4,9тетрагідро-2-[5-(2-піридиніл)-2-піримідиніл]-1Η-β-карболін (16176-23 () 882мг, 1.98ммоль) (одержаний яку Прикладі 49) у DMF (30мл, безводний) перемішували при кімнатній температурі протягом 30 хвилин. Крізь реакційну суміш пропускали сухе повітря протягом 16 годин. Додавали етилацетат (200мл) і отриману у результаті суміш промивали 10% розчином NaCI, соляним розчином, а потім висушували МgО4. Розчинник реакційної суміші випаровували і залишок розтирали в порошок з етилацетатом, що дало на виході продукт у вигляді твердої речовини білого кольору. Температура плавлення: 201-203°С MS (m/z) 460 (МН+); 458 (М-1) 1 Н ЯМР (DMSO-d6) d 3.11 (т, J=8.5Гц, 2Н), 4.46 (т, J=8.5Гц, 2Н), 4.91 (м, 2Н), 6.34 (с, 1Н), 6.73 (д, J=8.1Гц, 1Н), 7.31 (м, 4Н), 7.59 (т, J=8.6Гц, 2Н), 7.84 (д, J=7.1Гц, 1Н), 7.91 (д, J=7.7Гц, 1Н), 8.16 (д, J=7.9Гц, 1Н), 8.60 (д, J=4.5Гц, 1Н), 8.98 (с, 1Н), 9.12 (с, 2Н), 11.90 (с, 1Н). ПРИКЛАД 50А (R)-1,2,3,4-Тетрагідро-2-[5-(2-Піридиніл)-піримідин-2-іл]-3-(3,4-ди-гідробензофураніл)-піроло-[3,4-b]хінолін9-он (№65) A. 1-метил-5-(2-піридиніл)-2-(1Н)піримідон Суміш 2-(2-піридиніл) малондіальдегіду (5г, 0.0335моль), метилсечовини (4.72г, 0.0637моль) та толуол сульфокислоти (450мг) нагрівали з оберненим охолодженням у толуолі (100мл) у приладі, оснащеному сепаратором для відділення води протягом 4 годин. Суміш охолоджували, і осад фільтрували. Тверду речовину розтирали в порошок з водою і перекристалізували з етанолу, що дало на виході продукт. MS m/z (M+H) 188 1 Н ЯМР (DMSO-d6) d 7.48 (м, 1Н), 7.98 (м, 1Н), 8.18 (д, J=8.0Гц, 1Н), 8.75 (с, 1 Η), 9.41 (с, 2Н). B. 2-хлоро-5-(2-піридиніл)піримідин Суміш 1-метил-5-(2-піридиніл)-2(1Н)піримідону (8.994м, 0.048моль), пентахлорид фосфору (2.156м, 0.0104моль), та хлорангідрид фосфору (24мл) нагрівали з оберненим охолодженням при температурі 120°С протягом 8 годин. РОСl3 дистилювали під зниженим тиском. Залишок охолоджували до кімнатної температури, і додавали поталу воду. Суміш екстрагували з ЕtOАс, органічний шар промивали 15 розчином % NaCI, соляним розчином та висушували над МдО4. Розчинник дистилювали під зниженим тиском, що дало тверду речовину. Для водного шару встановлювали рН 6-7, використовуючи насичений Na2CO3, потім екстрагували з ЕtOАс. Органічний шар промивали 15% NaCI, соляним розчином, висушували над МgО4. Розчинник дистилювали під зниженим тиском, що дало на виході тверду речовину. Після розтирання в порошок з МеОН, отримували додатковий продукт. MS m/z (Μ+Η) 192 1 Η ЯМР (DMSO-d6) d 3.56 (с, 3Н), 7.33 (м, 1Η), 7.89 (д, J=8.8Гц, 2Н), 8.61 (д, J=4.7Гц, 1Н), 8.95 (с, 1Н), 9.31 (с, 1Н). С. (R)-1,2,3,4-тетрагідро-2-[5-(2-піридиніл)-піримідин-2-іл]-3-(3,4-дигідробензофураніл)-9Н-піроло-[3,4b]хінолін-9-он Суміш (R)-1,2,3,4-Тетрагідро-3-(2,3-дигідробензофуран-5-іл)-9Н-піроло-[3,4-b]хінолін-9-он, сіль хлоргідрату (1.273г, 0.00373моль) (одержану у прикладі 6А), 2-хлоро-5-(2-піридиніл) піримідину (0.714г, 0.00373моль), KF (0.216г, 0.00373моль), та діізопропіленетиламіну (2.27мл) у DMF (45мл) нагрівали при температурі 55°С протягом 4 годин. Додавали ЕtOАс і суміш була промивали 0.5Ν лимонної кислоти, потім 15% NaCI, соляним розчином та висушували над MgSO4. Розчинник дистилювали під зниженим тиском, що дало тверду речовину. Тверду речовину розчинювали у 10% метанолі у дихлорметані та очищували за допомогою колонкової хроматографії (ЕtOАс до 10% СН3ОН у ЕtOАс), що дало на виході вказану у заголовку сполуку. Температура плавлення 231-233 С MS m/z (Μ+Η) 460 1 Η ЯМР (DMSO-d6) d 3.11 (д, J=8.7Гц, 2Η), 4.46 (д, J=8.7Гц, 2Н), 4.92 (м, 2Н), 6.34 (д, J=1.6Гц, 1Н), 6.73 (д, J=8.1Гц, 1Н), 7.28 (м, 4Н), 7.59 (м, 2Н), 7.82 (м, 1Н), 7.91 (д, J=8.0,1Н), 8.16 (д, J=8.0,1Ή), 8.60, J=4.5Гц, 1Н), 8.98 (с, 1Н), 9.12 (с, 1Н), 11.92 (с, 1Н). Вказану у заголовку сполуку розчинювали в метанолі, та додавали один еквівалент 0.02М метансульфокислоти (у метанолі). Розчинник дистилювали під зниженим тиском, що дало на виході сіль метансульфокислоти. [a]=-236. 2 (С=1.0333г/дЛ, СН3ОН). ПРИКЛАД 51 2-хлоро-5-бромопіримідин 2-хлоро-5-бромопіримідин одержували з 2-гідроксипіримідин (придбаний у Frotier Scientific Inc.) відповідно до процедури, розкритої у Патенті США US Patent No. 5,693,611, препарат 6, колонка 17. ПРИКЛАД 52 1-(3,4-Метилендіоксифеніл)-2-(5-бромопіримідин-2-іл)-2,3,4,9-тетрагідро-1Η-β-карболін До розчину 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Η-β-карболіну (4.38г, 15.0ммоль) (одержаний відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) та 2-хлоро-5-бромопіримідин (2.90г, 15.0ммоль) (одержаний як у Прикладі 51) у сухому дегазованому DMF (30мл) додавали Ν,Ν-діізопропіленетиламін (4.2мл, 30ммоль). Суміш нагрівали при температурі 120-130°С протягом ночі. Потім суміш охолоджували та розбавлювали етилацетатом. Розчин промивали 0.5Ν лимонною кислотою, водою та соляним розчином, потім висушували над Na2SO4 та концентрували у вакуумі. Очищення за допомогою випарювальної колонки(силікагель, гексан:етилацетат=6:1, за масою, а також гексан : етилацетат=4:1, за масою) дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z) 451 та 449 (МН+), 447 та 449 (М-1). 1 Н ЯМР (CDCI 3) d 2.82-3.02 (м, 2Η), 3.30-3.40 (м, 1Η), 4.92 (дд, J=18.1Гц, 1Η), 5.92 (д, J=3.2Гц 2Η), 6.72 (д, J=8.0Гц, 1Η), 6.85 (д, J=8.0Гц, 1Η), 6.95 (с, 1Η), 7.02 (с, 1Η), 7.13-7.21 (м, 2Η), 7.30 (д, J=7.7Гц, 1Η), 7.55 (д, J=7.5Гц, 1Η), 7.73 (с, 1 Η), 8.34 (с, 2 Η). ПРИКЛАД 53 1,2,3,4-Тетрагідро-2-(5-бромопіримідин-2-іл]-3-(3,4-метилендіокси-феніл)-9Н-піроло-[3,4-b]хінолін-9-он (№55) Спосіб А: Розчин 1-(3,4-метилендіоксифеніл)-2-(5-бромопіримідин-2-іл)-2,3,4,9-тетрагідро-1Η-β-карболіну (1.0г, 2.2ммоль) (одержаний як у Прикладі 52) у сухому DMF (40мл) охолоджували у ванні з льодом. Додавали Na (60% у мінеральній олії, 0.18г, 4.4ммоль) і суміш перемішували при температурі 0°С протягом 45 хвилин. Крізь розчин пропускали сухе повітря і суміші дозволяли нагрітися до кімнатної температури протягом ночі. Реакційну суміш гасили водою та екстрагували з етилацетатом. Органічну фаза промивали соляним розчином та водою, потім висушували над Na2SO4, концентрували, та очищували за допомогою випарювальної колонки (силікагель, гексан : етилацетат=1:1, за масою, а також чистий етилацетат), що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z) 465 та 463 (МН+), 463 та 461 (М-1). 1 Н ЯМР (DMSO-d6) d 4.80 (д, J=8.2Гц, 1Н), 4.89 (дд, J=6.8Гц, 1Н), 5.98 (с, 2Н), 6.20 (с, 1Н), 6.85-6.93 (м, 2Н), 6.98 (с, 1Н), 7.34 (т, J=7.3Гц, 2Η), 7.57-7.64 (м, 3Н), 8.15 (д, J=8.0Гц, 2Η). Спосіб В: До розчину 1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону (31мг, 0.1ммоль) (одержаного як у Прикладі 5, вільна основа) та 2-хлоро-5-бромопіримідину (19мг, 0.1ммоль) (одержаного як у Приклад 51) у сухому дегазованому DMF (2мл) додавали Ν,Ν-діізопропілетиламін (28мкл, 0.2ммоль). Суміш нагрівали при температурі 120-130°С протягом ночі. Розчин охолоджували, розбавлювали етилацетатом та промивали 0.5Ν лимонною кислотою, водою та соляним розчином, потім висушували над Na2SO4 та концентрували у вакуумі. Очищення за допомогою випарювальної колонки (силікагель, гексан : етилацетат=1:1, за масою, а також чистий етилацетат), що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z) 465 та 463 (МН+), 463 та 461 (М-1). Н ЯМР (DMSO-d6) d 4.80 (д, J=8.2Гц, 1Η), 4.89 (дд, J =6.8Гц, 1Η), 5.98 (с, 2Н), 6.20 (с, 1Н), 6.85-6.93 (м, 2Н), 6.98 (с, 1Н), 7.34 (т, J=7.3Гц, 2Н), 7.57-7.64 (м, 3Н), 8.15 (д, J=8.0Гц, 2Н). ПРИКЛАД 54 1,2,3,4-Тетрагідро-2-[5-(3-піридиніл)-піримідин-2-іл]-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9он (№56) Спосіб А: Перемішану суміш ацетату палладія (II) (0.8мг, 3.6мкмоль)та 1,1’-біс(дифенілфосфіно)фероцену (dppf) 2.4мг, 4.3мкмоль) у сухому DMF (1.0мл) нагрівали до температури 50°С протягом 15 хвилин і потім охолоджували. До розчину додавали 1,2,3,4-тетрагідро-2-(5-бромопіримідин-2-іл)-3-(3,4-метилендіоксифеніл)9Н-піроло-[3,4-b]хінолін-9-он (20мг, 43мкмоль) (одержаний як у Прикладі 53), піридин-3-бористу кислоту (6.0мг, 43мкмоль) та триетиламін (8мкл, 60мкмоль) і суміш нагрівали до температури 90°С протягом 16 годин. Розчин розбавлювали етилацетатом та фільтрували крізь паперовий фільтр. Органічну фазу промивали соляним розчином та водою, а потім висушували над Na2SO4. До розчину додавали невелику кількість силікагелю і розчин висушували у вакуумі. Очищення за допомогою випарювальної колонки (силікагель, розчин 10% гідроокису амонію у воді: ацетонитрил=1:10, за масою) дало продукт у вигляді твердої речовини білого кольору. MS(m/z)460(M-1). 1 Н ЯМР (DMSO-d6) d 4.88 (д, J=4.1Гц, 1Η), 4.99 (д, J=4.1Гц, 1Η), 5.99 (с, 2Η), 6.31 (с, 1Н), 6.88 (д, J=7.9Гц, 1Н), 6.96 (д, J=8,1Гц, 1Н), 7.04 (с, 1Н), 7.34 (т, J=6.9Гц, 1Н), 7.43-7.50 (м, 1Н), 7.56-7.70 (м, 2Н), 8.08 (д, J=8.0Гц, 1Н), 8.16 (д, J=7.9Гц, 1Н), 8.53 (д, J=4.1Гц, 1Н), 8.72-8.82 (широкий, 1Н), 8.89 (с, 2Н), 11.87 (с, 1Н). Спосіб В: Розчин 1-(3,4-метилендіоксифеніл)-2-[5-(3-піридиніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Η-β-карболіну (100мг, 0.22ммоль) (одержаного як у Прикладі 55), у сухому DMF (4.0мл) охолоджували у ванні з льодом. Додавали Na (60% у мінеральній олії, 31мг, 0.78ммоль) і суміш перемішували при температурі 0°С протягом 45 хвилин. Крізь розчин пропускали сухе повітря і суміші дозволяли нагріватися до кімнатної температури протягом ночі. Реакція гасили водою та екстрагували етилацетатом. Органічну фазу промивали соляним розчином та водою, потім висушували над Nа2SО4, сконцентрували та очищували за допомогою випарювальної колонки (силікагель, розчин 10% гідроокису амонію у водкацетонітрил=1:10, за масою), що дало продукт у вигляді твердої речовини білого кольору. MS(m/z)460(M-1). 1 Н ЯМР (DMSO-d6) d 4.88 (д, J=4.1Гц, 1Η), 4.99 (д, J=4.1Гц, 1Η), 5.99 (с, 2Н), 6.31 (с, 1Н), 6.88 (д, J=7.9Гц, 1Н), 6.96 (д, J=8.1Гц 1Н), 7.04 (с, 1Н), 7.34 (т, J=6.9Гц, 1Н), 7.43-7.50 (м, 1Н), 7.56-7.70 (м, 2Н), 8.08 (д, J=8.0Гц, 1Н), 8.16 (д, J=7.9Гц, 1Н), 8.53 (д, J=4.1Гц, 1Н), 8.72-8.82 (бр, 1Н), 8.89 (с, 2Н), 11.87 (с, 1Н). ПРИКЛАД 55 1-(3,4-Метилендіоксифеніл)-2-[5-(3-піридиніл)-піримідин-2-іл]-2,3,4,9-тетрагідро-1Η-β-карболін Розмішану суміш ацетату палладія (II) (27мг, 0.12ммоль) та 1,1'-біс(дифенілфосфіно)фероцену (dppf) (83мг, 0.15ммоль) у сухому DMF (20мл) нагрівали до температури 50°С протягом 15 хвилин, а потім охолоджували. До розчину додавали 1-(3,4-метилендіоксифеніл)-2-(5-бромопіримідин-2-іл)-2,3,4,9-тетрагідро1Η-β-карболін (674мг, 1.5ммоль) (одержаний як у Прикладі 52), піридин-3-бористу кислоту (203мг, 1.7ммоль) та триетиламін (0.3мл, 2.1ммоль), і суміш нагрівали до температури 90°С протягом 16 годин. Розчин розбавлювали етилацетатом і фільтрували крізь паперовий фільтр. Органічну фазу промивали соляним розчином і водою, потім висушували над Na2SO4. До розчину додавали невелику кількість силікагелю і розчин висушували у вакуумі. Очищення за допомогою випарювальної колонки (силікагель, гексан:етилацетат 1:1, за масою, а також гексан: етилацетат=1:2, за масою) дало продукт у вигляді твердої речовини білого кольору. MS (m/z) 448 (МН+) та 446 (М-1). 1 Н ЯМР (CDCI 3) d 2.85-3.10 (м, 2Н), 3.33-3.48 (м, 1Н), 5.06 (дд, J=8.5Гц, 1Η), 5.94 (д, J=4.7,2Н), 6.73 (д, J=8.0, 1Н), 6.90 (д, J=8.0, 1Н), 7.02 (с, 1Н), 7.13-7.23 (м, 2Н), 7.32-7.42 (м, 2Н), 7.56 (д, J=7.4Гц, 1Н), 7.79-7.84 (м, 2Н), 8.58 (с, 1Н), 8.60 (с, 2Н), 8.77 (с, 1Н). ПРИКЛАД 56 1,2,3,4-Тетрагідро-2-[5-(4-піримідиніл)-піримідин-2-іл]-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін9-он (№57) Розмішану суміш 1,2,3,4-тетрагідро-2-(5-бромопіримідин-2-іл)-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4b]хінолін-9-ону (46мг, 0.1ммоль) (одержаного як у Прикладі 53), (РРh3)4Рd (3.5мг, 3.0,моль) та 4-три-н-бутилстанілпіридину (37мг, 0.1ммоль) у сухому DMF (2.0мл) нагрівали при температурі 140°С протягом 12 годин. Додавали велику кількість каталізатора (3.5мг) і суміш нагрівали з оберненим охолодженням протягом 4 годин, а потім охолоджували. Розчин розбавлювали етилацетатом і фільтрували крізь паперовий фільтр. Органічну фазу промивали соляним розчином і водою, потім висушували над Na2SO4. До розчину додавали невелику кількість силікагелю і розчин висушували у вакуумі. Очищення за допомогою випарювальної колонки (силікагель, чистий ацетонітрил, а також 10% розчин гідроокису амонію у воді:ацетонітрил=1:10, за масою) дало продукт у вигляді твердої речовини білого кольору. MS (m/z) 460 (М-1). 1 Н ЯМР (DMSO-d6) d 4.93 (д, J=4.2Гц, 1Η), 5.00 (д, J=4.2Гц, 1Η), 6.01 (с, 2Η), 6.33 (с, 1Η), 6.90 (д, J=8.0Гц, 1Η), 6.98 (д, J=8.0Гц, 1Η), 7.05 (с, 1Н), 7.34 (широкий, 1Н), 7.62 (широкий, 2Н), 7.77 (д, 2Н), 8.19 (д, J=7.9Гц, 1Н), 8.61 (широкий, 2Н), 8.78 (широкий, 1Н), 9.00 (широкий, 1Н). ПРИКЛАД 57 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-(2-бромо)-фуроїл)-9Н-піроло[3.4-b]хінолін-9-он (№30) 5-бромо-2-фуранкарбонову кислоту (1.44г, 7.54ммоль) у THF (20мл) перемішували з хлорангідридом щавлевої кислоти (1.06мл, 7.54ммоль) при кімнатній температурі. До суміші був додавали 2 краплі DMF, що приводило до енергійної реакції з виділенням газу. Після того, як виділення газу припинилося, додаткову 1 кількість хлорангідриду щавлевої кислоти (0.1мл, 0.71ммоль) вводили за допомогою шприца, і суміш перемішували при кімнатній температурі протягом 10 хвилин, а потім перемішували при температурі 90°С протягом 10 хвилин. Розчинник та надлишковий оксалілхлорид вилучали у вакуумі, що у результаті дало тверду кристалічну речовину блідо-жовтого кольору. До твердої речовини додавали THF (20мл) та розчин 3(2,3-дигідро-5-бензофуран)-1,2,3,4-тетрагідро-9Н-піроло[3,4-b]хінолін-9-ону (2.1г) (одержаний як у Прикладі 6) у THF (20мл). До реакційної суміші потім додавали Et3N (4.55мл, 32.6ммоль) та каталітичну кількість DMAP (40мг). Додавали декілька крапель DMF, що приводило до утворення прозорої реакційної суміші. Реакційну суміш перемішували при кімнатній температурі протягом 4 годин. Розчинник реакційної суміші випаровували, що у результаті дало твердий залишок. Залишок повторно розчинювали у СНСІ 3 (200мл), промивали водою (3x200мл), і органічний шар висушували над МgО4. Органічний розчинник випаровували, що дало на виході продукт у вигляді твердої речовини жовтуватого кольору. MS (m/z): 480, (МН+), 478 (М-1) 1 Н ЯМР СОСІ 3 d 5.03 (д, 1Н, J=15.5Гц), 5.23 (д, 1Н, J=15.5Гц), 5.85 (д, 2Н, J=8.0Гц), 6.40 (м, 2Н), 6.56 (м, 1Η), 6.81 (м, 2Н), 7.00 (д, 1Н, J=4.3Гц), 7.32 (т, 1Н, J=8.6Гц), 7.53 (т, 1Н, J=8.6Гц), 7.65 (д, 1Н, J=8.6Гц), 8.38 (д, 1Н, J=8.6Гц), 12.8 (с, 1Н). ПРИКЛАД 58 4-(4-Метил)-піперазинілкарбоніл бензолбориста кислота 4-Карбоксибензолбористу кислоту (0.332г, 2ммоль), 1-метилпіперазин (0.22мл, 2ммоль) та РуВrOР (0.9334г, 2ммоль) перемішували з DIPEA (0.696г, 4ммоль) у DMF (7мл) при кімнатній температурі протягом 16 годин. Препаративна TLC (10% МеОН/СНСІ 3) дала продукт у вигляді твердої речовини білого кольору. MS (m/z): 251 (МН+), 249 (М-1) 1 Н ЯМР CD3OD d 2.36 (с, 3Н), 2.43 (с, 2Н), 2.57 (с, 2Н), 3.51 (с, 2Н), 3.82 (с, 2Н), 7.34 (с, 2Н), 7.76 (с, 2Н). ПРИКЛАД 59 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл-2-(5-(4-(1-(4-метил)-піперазинілкарбоніл)-феніл)-фуроїл)-9Нпіроло[3,4-b]хінолін-9-он (№44) 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-(5-(2-бромо-фуроїл)-9Н-піроло[3,4-b]хінолін-9-он (59.6мг, 0.12ммоль) (одержаний як у Прикладі 57), перемішували з Pd(PPh3)4 (7.37мг, 0.0062ммоль) у діоксані (5.5мл), пропускаючи крізь розчин N2 протягом 10 хвилин. Потім додавали розчин 4-(4-метил)-піперазиніл-карбоніл бензол бористої кислоти (37.0мг, 0.15ммоль) та К2СО3 (51.5мг, 0.37ммоль) у Н2О (1.1мл). Реакційну суміш перемішували при температурі 100°С протягом 1 години. Розчинник випаровували, залишок очищували за допомогою препаративної TLC (10% МеОН/СНСІ 3), а потім розтирали в порошок з сумішшю простий ефір/МеОН (15мл /1мл), що дало на виході продукт у вигляді порошку блідо-жовтого кольору. MS (m/z): 603 (МН+), 601 (М-1) 1 Н ЯМР CD3OD d 2.32 (с, 3Н), 2.53-2.62 (м, 4Н), 3.53 (широка с, 2Н), 3.83 (широка с, 2Н), 5.17 (д, 1Н, J=15.5Гц), 5.41 (д, 1Н, J=15.5Гц), 5.83 (с, 2Н), 6.22 (с, 1Н), 6.70 (м, 1Н), 6.82 (м, 2Н), 7.03 (м, 1Н), 7.25-7.34 (м, 2Н), 7.46-7.56 (м, 4Н), 7.93 (д, 2Н, J=8.6Гц), 8.31 (д, 2Н, J=8.6Гц). ПРИКЛАД 59А (R)-1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл-2-(5-(4-(1-(4-метил)-піперазинілкарбоніл)-феніл)-фуроїл)9Н-піроло[3,4-b]хінолін-9-он (№69) А. 5-(4-(4-метил)-піперазинілкарбонілфеніл)фуранкарбонова кислота, метиловий ефір Суміш 4-(4-метил)-піперазинілкарбоніл бензол бористої кислоти (одержаний як у Прикладі 58) (1.31г, 5.28ммоль), метилбромофуранкарбоновий ефір (1.08г, 5.28ммоль (одержаний з 5-бромофуранкарбонової кислоти у HGI/MeOH протягом 5 годин при кімнатній температурі) дегазували шляхом пропускання N2 у діоксані (45мл) та Н2О (9мл) протягом 10 хвилин. До цього розчину додавали Pd(PPh3)4 (0.627г, 0.528ммоль) та К2СО3 (2.185г, 15.84ммоль). Розчин перемішували при температурі 100°С протягом 3 годин. Розчинник випаровували і залишок розчинювали у СН2СІ 2 (100мл). Розчин промивали соляним розчином (3x100мл), висушували над МgО4, концентрували під дією вакууму, а неочищений продукт очищували за допомогою колонки силікагелю (5% СН3ОН/СНСІ 3), що дало на виході продукт у вигляді твердої речовини жовтого кольору. MS(m/z):315(MH+),313(M-1) 1 Н ЯМР d CDC13 2.32-2.48 (м, 7Н), 3.48 (с, 2Н), 3.80 (с, 2Н), 3.92 (с, 3Н,), 6.81 (д, 1Н, J=2.0Гц), 7.24 (д, 1Н, J=2.0Гц), 7.49 (д, 2Н, J=7.9Гц), 7.83 (д, 2H, J=7.9Гц) Rf=0.51 (10% СН3ОН/СНСІ 3). В. 5-(4-(4-метил)-піперазинілкарбонілфеніл)фуранкарбонова кислота До продукту з етапу А (5-(4-(4-метил)-піперазинілкарбонілфенілу)фуран-карбонова кислота, метиловий ефір) (1.08г, 3.29ммоль), розчиненого у THF (98.7мл) додавали LiOH (16.45мл, 0.2N у Н2О). Розчин перемішували при кімнатній температурі протягом 3.5 годин і нейтралізували за допомогою НСl (3.29мл, 1.0Μ в ефірі). Після концентрування, неочищений матеріал використовували без подальшого очищення. MS (m/z): 329 (MH+), 327 (M-1) 1 H ЯМР CD3OD d 2.35 (с, 3Н), 2.36-2.58 (br с, 4Н,), 3.48 (с, 2Н), 3.85 (с, 2Н), 6.90 (д, J=2.0Гц), 7.02 (д, 1Н, J=2.0Гц), 7.46 (д, 2Н, J=7.9Гц), 7.95 (д, 2Н, J=7.9Гц) С. (R)-1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-(5-[4-(1-(4-метил)-піперазинілкарбоніл)феніл]фуроїл)-9Н-піроло[3,4-b]хінолін-9-он (№69) Суміш R-1,2,3,4-тетрагідро-3-(3,4-метилендіоксифеніл)-9Н-піроло-[3,4-b]хінолін-9-ону, сіль хлоргідрату (1.12г, 3.29ммоль) (одержана як у Прикладі 5А), та продукті етапу В (1.034г, 3.29ммоль) перемішували з РуВгоР (1.535г, 3.29ммоль) та діізопропілетиламіном (1.716мл, 9.87ммоль) у DMF (30мл) при кімнатній температурі протягом 12 годин. Реакційну суміш розбавлювали СН2СІ 2 (75мл) та ЕtOАс (75мл). Розчин очищували на колонці силікагелю (чистий СН2СІ 2, до 2.5% СН3ОН/СН2СІ 2), що дало на виході продукт у вигляді твердої речовини жовтуватого кольору. MS (m/z): 603 (МН+), 601 (М-1) 1 Н ЯМР CD3OD d 2.32 (с, 3Н), 2.43-2.55 (м, 4Н), 3.53 (br с, 2Н), 3.83 (br с, 2Н), 5.25 (д, 1Н, J=15.5Гц), 5.51 (д, 1Η, J=15.5Гц), 5.87 (с, 2Н), 6.29 (с, 1Н), 6.70 (м, 1Н), 6.82 (м, 2Н), 7.08 (м, 1Н), 7.20-7.39 (м, 2Н), 7.46-7.58 (м, 4Н), 8.01 (д, 2Н, J=8.6Гц), 8.31 (д, 2Н, J=8.6Гц) HPLC Chiralpak OD 4.6x250мм, 1% DEA/MEOH, Тr=4.846 хвилин) ПРИКЛАД 60 1,2,3,4-Тетрагідро-3-(3,4-метилендиохфеніл)-2-(5-(2-(4-гідрокси)феніл)-фуроїл)-9Н-піроло[3,4-b]хінолін-9он, сіль натрію (сіль Na №22) Дотримуючись процедури, яку зазначено вище у Прикладі 59, з відповідним заміщенням реагентів, продукт отримували у вигляді твердої речовини жовтуватого кольору. MS (m/z): 493 (МН+), 491 (М-1) 1 Н ЯМР CDCI 3 d 5.21 (д, 1Н, J=15.6Гц), 5.57 (д, 1Н, J=15.6Гц), 6.12 (с, 2Н), 6.51 (с, 2Н) 6.68 (д, 1Н, J=4.1Гц), 6.98-7.14 (м, 4Н), 7.38 (с, 1Н), 7.48 (т, 1Н, J=8.6Гц), 7.62-7.79 (м, 4Н), 8.08 (с, 1Н), 8.28 (д, 1Н, J=8.6Гц). ПРИКЛАД 61 (4-(2-(1-піролідиніл)етокси)Феніл)бориста кислота (Одержаний відповідно до процедури, описаної Ноуе, Т. R. та Chen, Μ. у J. Org. Chem. 1996, 61,7940.) До розчину 1-[2-(4-бромофенокси)етил]-піролідину (2.70д, 10ммоль) у THF (40мл) додавали н-бутиллітій (6.9мл, 1.6 у гексанах, 11ммоль) при температурі - 78°С. Реакційна суміш перемішували при температурі 78°С протягом 15 хвилин, а потім при температурі 0°С протягом 15 хвилин. Потім до реакційної суміші додавали триметилборат (2.5мл, 22ммоль) при температурі 0°С. Суміш поступово нагрівати до кімнатної температури протягом ночі. Метилборат у реакційній суміші гідролізували за допомогою реакції з насиченим водним розчином NH4CI (100m) при кімнатній температурі протягом 30 хвилин. Верхній органічний шар відбирали. Водяний шар екстрагували СНСІ 3 (2x100мл). Органічні шари об'єднували, промивали соляним розчином (2x100мл) та висушували МgО4. Розчинник випаровували, що дало у результаті густу олію, яку очищували за допомогою колонкової хроматографії (10% МеОН/СНСІ 3 та 1% Еt3N), що дало на виході продукт у вигляді твердої речовини білого кольору. MS (m/z): 236 (МН+), 234 (М-1) 1 Н ЯМР CD3OD d 1.81 (м, 4Н), 2.67 (м, 4Н), 2.89 (т, 2Н, J=6.0Гц), 4.08 (τ, 2Н, J=6.0Гц), 6.74 (д, 2Н, J=8.6Гц), 7.62 (д, 2Н, J=8.6Гц), ПРИКЛАД 62 1,2,3,4-Тетрагідро-3-(3,4-метилендіоксифеніл)-2-(5-(4-(2-(1-піролідиніл)етокси)феніл)-фуроїл)-9Нпіроло[3,4-b]хінолін-9-он (№45) Дотримуючись процедури, яку зазначено вище у Прикладі 59, з відповідним заміщенням реагентів, отримували продукт у вигляді твердої речовини жовтуватого кольору. MS (m/z): 590, (МН+), 588 (М-1) 1 Н ЯМР CDCI 3 d 2.18 (с, 4Н), 2.55 (с, 4Н), 2.75 (м, 2Н), 2.90 (м, 2Н), 4.67 (д, 1Н, J=15.6Гц), 4.82 (д, 1Н, J=15.6Гц), 5.18 (с, 2Н), 5.81 (м, 1Н), 6.08 (м, 1Н), 6.21 (с, 2Н), 6.35 (с, 1Н), 6.60 (с, 1Н), 6.82 (м, 3Н), 6.92 (м, 1Н), 7.04 (м, 1Н), 7.21 (с, 2Н), 7.62 (д, 1Н, J=8.6Гц). ПРИКЛАД 63 3-(2,3-Дигідро-5-бензосрураніл)-1,2,3,4-тетрагідро-2-(бензил)-9Н-піроло[3,4-b]хінолін-9-он (№60) 1-(2,3-Дигідро-5-бензофураніл)-2-бензил-2,3,4,9-тетрагідро-1Н-β-карболін (одержаний як у Прикладі 2) (5.25г, 13.81ммоль), двоокис калію (3.92г, 55.24ммоль) та 18-crown-6 (3.65г, 13.81ммоль) зміщували з DMF (100m) у колбі об'ємом 200мл. Реакційну суміш утримували при кімнатній температурі протягом ночі. Реакційну суміш повільно додавали в окрему колбу об'ємом 500мл, яка вміщувала суміш ЕtOАс (172мл), Н2О (172мл) та 1N водного розчину HCL (50мл). Спостерігали як суміш виділяла маленькі бульбашки газу. Реакційну суміш перемішували при температурі 0°С протягом 30 хвилин, у результаті чого сформувався осад на поверхні двох рідких шарів. Осад відбирали за допомогою фільтрації, промивали Н2О (20мл), а потім висушували у вакуумній печі, що дало на виході продукт у вигляді твердої речовини жовтуватого кольору. MS (m/z): 395, (МН+), 393 (М-1). 1 Н ЯМР CDCI 3 d 3.12 (т, 2Н, J=8.7Гц), 3.50-3.65 (м, 2Н), 3.99 (д, 1Н, J=13.0Гц), 4.22 (д, 1Н, J=13.0Гц), 4.55 (т, 2Н, J=8.7Гц), 4.91 (с, 1Η), 6.74 (д, 1Н, J=8.7Гц), 7.11-7.32 (м, 9Н), 7.48 (т, 1Н, J=8.7Гц), 8.30 (т, 1Н, J=8.7Гц) ПРИКЛАД 64 3-(3,4-Метилендіоксифеніл)-1,2,3,4-тетрагідро-2-[5(-3трифторметил)феніл-2-фуроїл]-9Н-піроло[3,4b]хінолін-9-он (№13) Дотримуючись процедури, яку зазначено у Прикладі 63, з відповідним заміщенням реагентів, 1-(3,4метилендіоксифеніл)-2-бензил-2,3,4,9-тетрагідро-1Н-β-карболін (0.381г, 0.719ммоль) піддавали реакції, що дало на виході продукт у вигляді твердої речовини жовтуватого кольору. Замічено, що для повного формування осаду, треба підтримувати кімнатну температуру двох рідких реакційних сумішей протягом 48 годин, ніж протягом ночі. MS (m/z): 545 (МН+), 567 (Μ+23), 543 (М-1) 1 Н-ЯМР (DMSO-d6) d 5.09 (д, J=14Гц, 1Η), 5.46 (д, J=14Гц, 1Η), 5.99 (с, 2Η), 6.39 (с, 1Η), 6.91 (д, J=8Гц, 1Η), 6.97 (д, J=9Гц, 1Η), 7.02 (с, 1Η), 7.33 (д, J=8Гц, 1Η), 7.38 (д, J=4Гц, 1Η), 7.43 (д, J=4Гц, 1Η), 7.60 (м, J=8Гц, 2Η), 7.77 (д, J=5Гц, 2Η), 8.16 (д, J=4Гц, 3Η), 11.55 (с, 1Η). ПРИКЛАД 65 1-(3,4-Метилендіоксифеніл)-2-[4-(4-метоксифеніл)тіазол-2-іл]-2,3,4,9-тетрагідро-1Η-β-карболін А. 1-(3,4-Метилендіоксифеніл)-2-[3-(фторенілметилоксикарбоніл)тіо-карбомоїл]-2,3,4,9-тетрагідро-1Н-βкарболін Суміш 1-(3,4-метилендіоксифеніл)-2,3,4,9-тетрагідро-1Н-β-карболіну (2.66г, 9.08ммоль) (одержаного відповідно до способу, який розкрито у Міжнародній Публікації WO97/43287, проміжна сполука 7, сторінка 24) та Fmoc-ізотіоціанату (2.82г, 10.14ммоль) розчинювали у сухому дихлорметане (50мл). Суміш перемішували
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of substituted pyrrolopyridinone useful as phosphodiesterase inhibitors
Назва патенту російськоюПроизводные замещенного пиролопиридинона, полезные как ингибиторы фосфодиэстеразы
МПК / Мітки
МПК: A61P 11/06, A61P 43/00, A61P 3/10, A61P 15/08, A61P 15/02, A61P 9/04, A61K 31/5377, A61K 31/506, A61P 15/06, A61P 15/10, A61P 9/12, A61P 9/10, A61P 7/02, C07D 471/04, A61K 31/496, A61K 31/4709, A61P 9/00, A61P 15/00, A61K 31/437
Мітки: корисні, заміщеного, піролопіридинону, фосфодіестерази, похідні, інгібітори
Код посилання
<a href="https://ua.patents.su/42-72611-pokhidni-zamishhenogo-pirolopiridinonu-korisni-yak-ingibitori-fosfodiesterazi.html" target="_blank" rel="follow" title="База патентів України">Похідні заміщеного піролопіридинону, корисні як інгібітори фосфодіестерази</a>
Попередній патент: Спосіб видалення вісмуту з розплавленого свинцю за допомогою сплавів кальцій-магній
Наступний патент: Пасажирський вагон з кондиціонером
Випадковий патент: Спосіб підготовки води для дифузійних установок