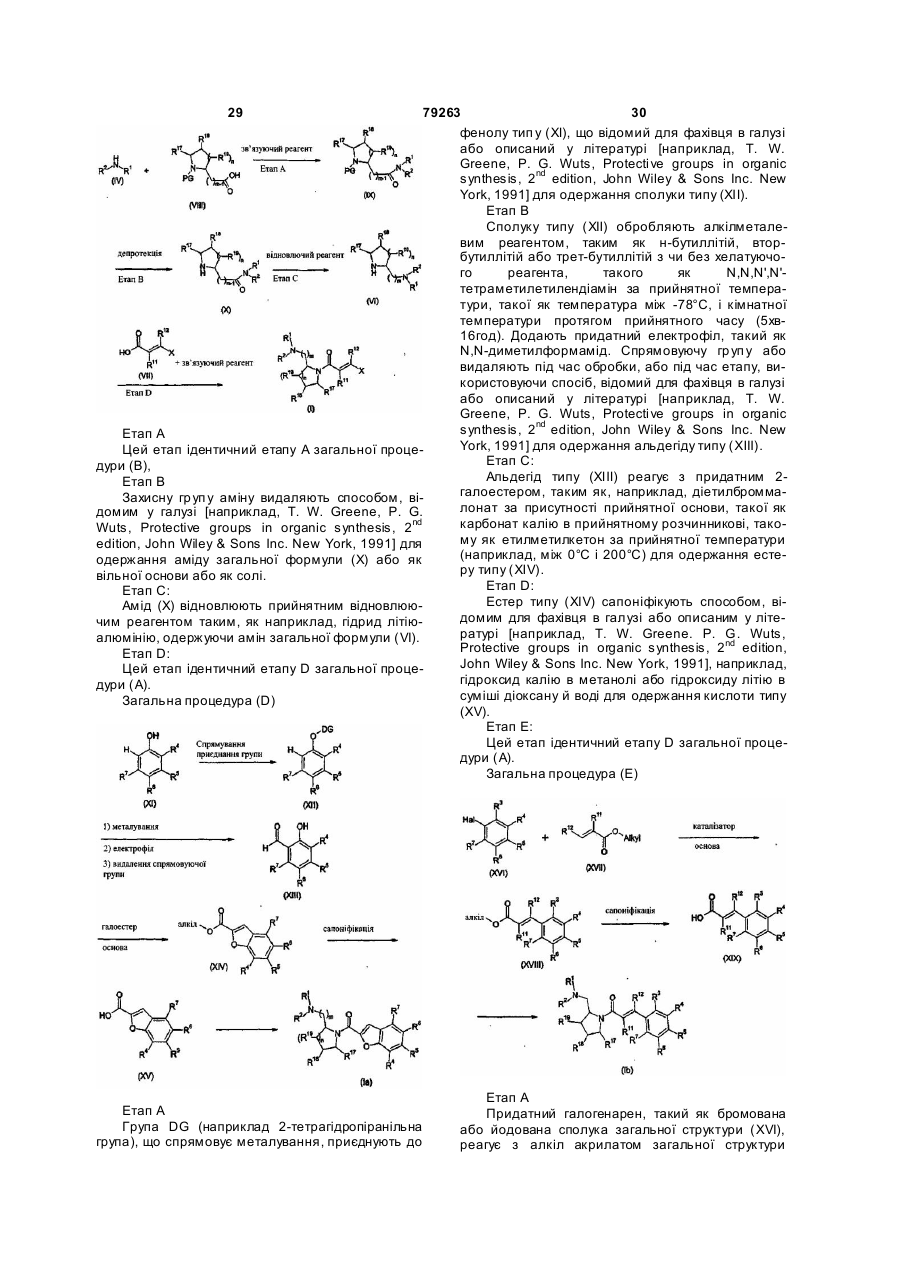
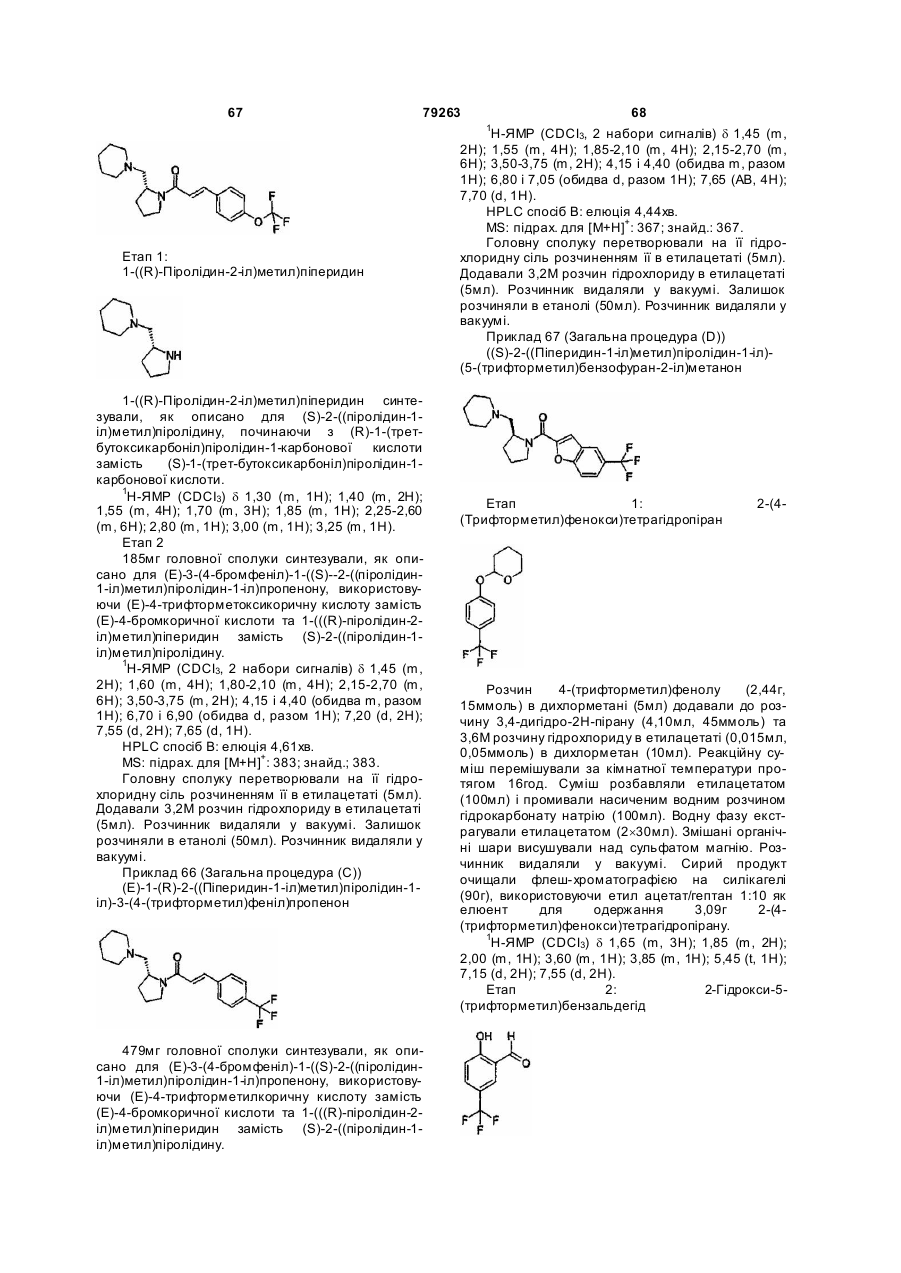
Аміди аміноалкілзаміщених азетидинів, піролідинів, піперидинів та азепанів, фармацевтична композиція на їх основі та їх використання
Формула / Реферат
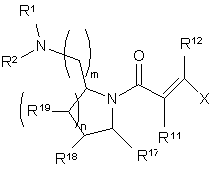
1. Сполука загальної формули (І):
 ,
,
(I)
де
m - це 1, 2 або 3,
n - це 0, 1, 2 або 3,
R1 і R2 незалежно є воднем, С1-6-алкілом, С2-6-алкенілом або С2-6-алкінілом, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену та гідроксилу, або
С3-8-циклоалкілом або С5-8-циклоалкенілом, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, C1-6-алкілу, С2-6-алкенілу та С2-6-алкінілу,
або R1 і R2 разом утворюють С3-6-алкіленовий міст або С3-6-алкеніленовий міст, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу,
R11 і R12 незалежно є воднем, С1-6-алкілом, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з С3-8-циклоалкілу, C5-8-циклоалкенілу, галогену та гідроксилу, або
С3-8-циклоалкілом або С5-8-циклоалкенілом, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу,
Х - це
 ,
,
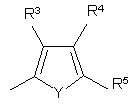 ,
,
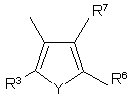 ,
,
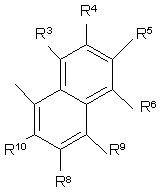 ,
,
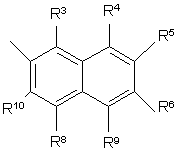 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
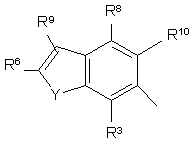
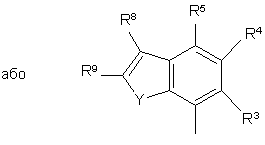 ,
,
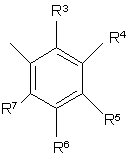
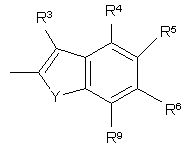
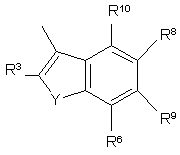
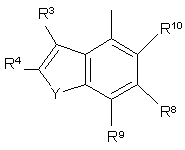
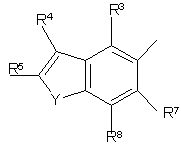
R3, R4, R5, R6, R7, R8, R9 i R10 незалежно є
воднем, галогеном, ціано, -NR15R16, гідроксилом, карбамоїлом, карбоксилом, -СF3, -OCF3, карбоксилом, амідино, гуанідино або нітро, або
C1-6-алкокси, C1-6-алкілом, С1-7-алканоїлом, С1-6-алкілкарбамоїлом, ді-С1-6-алкілкарбамоїлом, С1-6-алкілоксикарбонілом, С1-6-алкілтіо, С1-6-алкілсульфінілом, С1-6-алкілсульфонілом, арилом, ароїлом, арилокси, арилоксикарбонілом, арилтіо, арилсульфінілом або арилсульфонілом, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано і -NR15R16,
R15 і R16 незалежно є воднем або карбамоїлом,
С1-6-алкілом, який може за бажанням бути заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно, або
С3-8-циклоалкілом, С5-8-циклоалкенілом, С1-6-алкілкарбамоїлом, ді-С1-6-алкілкарбамоїлом або С1-6-алкілоксикарбонілом, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано, аміно, С1-6-алкілу, С2-6-алкенілу та С2-6-алкінілу,
або R15 і R16 разом утворюють С3-6-алкіленовий міст або С3-6-алкеніленовий міст, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу,
або два або кілька з R3 і R4, R4 і R5, R5 і R6, R6 і R7, R7 і R8, R8 і R9, R9 i R6, і R8 і R10 разом утворюють міст, вибраний з -ОСН2О-, -OCН2CH2O-, -ОСН2СН2СН2О- і С3-5-алкілену,
або R11 і R3, R11 і R7, або R11 і R10 разом утворюють міст, вибраний з -О-, -S-, -CH2-, -С(=О)-, -СН(ОН)-, -NR13-, -OCH2- і -CН2O-,
R13 - це водень,
С1-6-алкіл, який може за бажанням бути заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно,
С3-8-циклоалкіл або С5-8-циклоалкеніл, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано, аміно, С1-6-алкілу, С2-6-алкенілу та С2-6-алкінілу,
-Y - це -СН2, -С(=О)-, -NR14-, -O-, -S-, -СН2О-, -OCH2- або -СН(ОН)-,
R14 - це водень,
С1-6-алкіл, який може за бажанням бути заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно,
С3-8-циклоалкіл або С5-8-циклоалкеніл, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано та аміно,
R17 - це водень, С1-6-алкіл, С2-6-алкеніл або С2-6-алкініл,
R18 і R19 - це незалежно є водень, галоген, гідроксил, аміно, С1-6-алкіл, С2-6-алкеніл або С2-6-алкініл,
а також будь-яка її діастереомерна або енантіомерна або таутомерна
форма, включаючи їх суміші, або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка відрізняється тим, що R1 - це водень,
С1-6-алкіл за бажанням заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену та гідроксилу, або
R1 і R2 разом утворюють С3-6-алкіленовий міст або С3-6-алкеніленовий міст, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу
3. Сполука за п. 2, яка відрізняється тим, що R1 - це
С1-6-алкіл, або
R1 і R2 разом утворюють С3-6-алкіленовий міст або С3-6-алкеніленовий міст, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу.
4. Сполука за п. 3, яка відрізняється тим, що R1 - це
С1-6-алкіл, або
R1 і R2 разом утворюють С3-6-алкіленовий міст, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу.
5. Сполука за п. 4, яка відрізняється тим, що R1 - це
С1-6-алкіл, або
R1 і R2 разом утворюють С4-5-алкіленовий міст, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу.
6. Сполука за п. 5, яка відрізняється тим, що R1 - це
С1-6-алкіл, або
R1 i R2 разом утворюють С4-5-алкіленовий міст.
7. Сполука за п. 6, яка відрізняється тим, що R1 i R2 разом утворюють С4-5-алкіленовий міст.
8. Сполука за п. 7, яка відрізняється тим, що R1 i R2 разом утворюють С4-алкіленовий міст.
9. Сполука за п. 7, яка відрізняється тим, що R1 i R2 разом утворюють С5-алкіленовий міст.
10. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що m - це 1.
11. Сполука за будь-яким з пп. 1-10, яка відрізняється тим, що n - це 1 або 2.
12. Сполука за п. 11, яка відрізняється тим, що n - це 1.
13. Сполука за будь-яким з пп. 1-12, яка відрізняється тим, що Х - це
 ,
,
 ,
,
 ,
,
де R3, R4, R5, R6 та R7 такі, як визначено за п. 1.
14. Сполука за будь-яким з пп. 1-13, яка відрізняється тим, що -Y- - це -О- або -S-.
15. Сполука за п. 14, яка відрізняється тим, що -Y- це -О-.
16. Сполука за п. 13, яка відрізняється тим, що Х - це
 ,
,
де R3, R4, R5, R6 i R7 такі, як визначено за п. 1.
17. Сполука за будь-яким з пп. 1-16, яка відрізняється тим, що R3, R4, R5, R6 i R7 незалежно вибрані з
водню, галогену, ціано, -NR15R16, -CF3, -ОСF3 або нітро, де R15 i R16 такі, як визначено за п. 1,
С1-6-алкокси, С3-6-циклоалкілкарбонілу, арилу, гетероарилу, С3-8-циклоалканоїлу, С1-6-алкілсульфонілу або С1-6-алкілсульфоніл-О-, які можуть за бажанням бути заміщені на один або кілька галогенів,
або R4 i R5 разом утворюють -ОСH2О- міст,
або R11 і R3 разом утворюють міст, вибраний з -О- або -S-.
18. Сполука за п. 17, яка відрізняється тим, що R3, R4, R5, R6 i R7 незалежно вибрані з
водню, галогену, ціано, -СF3 або -ОСF3,
С1-6-алкокси, 1,2,4-триазолілу, циклопропаноїлу або С1-6-алкілсульфоніл-О-, які можуть за бажанням бути заміщені на один або кілька галогенів,
або R4 і R5 разом утворюють -OCH2O- міст,
або R11 і R3 разом утворюють міст, вибраний з -O-або -S-,
19. Сполука за п. 18, яка відрізняється тим, що R3, R4, R5, R6' R7 незалежно вибрані з
водню, галогену, ціано, -СF3 або -ОСF3,
-O-СН3, 1,2,4-триазолілу, -O-СН2СН3 або СН3-сульфоніл-O-, які можуть за бажанням бути заміщені на один або кілька галогенів,
або R11 і R3 разом утворюють міст, вибраний з -О- або -S-.
20. Сполука за п. 19, яка відрізняється тим, що R3, R4, R5, R6 i R7 незалежно вибрані з
водню, галогену, ціано, -СF3 або -ОСF3,
-O-СН3, -О-СН2СН3 або СН3-сульфоніл-O-,
або СF3-сульфоніл-O, -або R11 і R3 разом утворюють міст, вибраний з -O-або -S-.
21. Сполука за будь-яким з пп. 1-20, яка відрізняється тим, що R11 - це водень.
22. Сполука за будь-яким з пп. 1-21, яка відрізняється тим, що R12 - це водень або С1-6-алкіл.
23. Сполука за п. 22, яка відрізняється тим, що R12 - це водень або метил.
24. Сполука за будь-яким з пп. 1-23, яка відрізняється тим, що R15 - це водень.
25. Сполука за будь-яким з пп. 1-24, яка відрізняється тим, що R16 - це водень.
26. Сполука за будь-яким з пп. 1-25, яка відрізняється тим, що R17, R18 і R19 усі є воднем.
27. Використання сполуки за будь-яким з попередніх пп. 1-26 для одержання фармацевтичної композиції.
28. Фармацевтична композиція, що містить як активний інгредієнт принаймні одну сполуку за будь-яким з пп. 1-26 разом з одним або кількома фармацевтично прийнятними носіями або наповнювачами.
29. Фармацевтична композиція за п. 28 в одиничних дозованих формах, що містить від приблизно 0,05 мг до приблизно 1000 мг, краще, якщо від приблизно 0,1 мг до приблизно 500 мг, і найкраще від приблизно 0,5 мг до приблизно 200 мг сполуки за будь-яким з пп. 1-25.
30. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для лікування розладів і хвороб, пов'язаних з гістаміновим Н3-рецептором.
31. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для лікування хвороб і розладів, де інгібування гістамінового Н3-рецептора має цілющий вплив.
32. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції, що має антагоністичну активність або зворотну агоністичну активність щодо гістамінового Н3-рецептора.
33. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для зменшення ваги.
34. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для лікування надмірної ваги або ожиріння.
35. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для пригнічення апетиту або для викликання відчуття ситості.
36. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для запобігання та/або лікування розладів і хвороб, пов'язаних з надмірною вагою або ожирінням.
37. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для запобігання та/або лікування розладів, таких як булімія та пияцтво.
38. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для лікування IGT.
39. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для лікування діабету 2 типу.
40. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для гальмування або запобігання розвитку від IGT до діабету 2 типу.
41. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для гальмування або запобігання розвитку від неінсулінзалежного діабету 2 типу до інсулінзалежного діабету 2 типу.
42. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для лікування хвороб і розладів, де стимуляція гістамінового Н3-рецептора має цілющий вплив.
43. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції, що має агоністичну активність щодо гістамінового Н3-рецептора.
44. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для лікування алергічного риніту, виразки або втрати апетиту.
45. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для лікування хвороби Альцгеймера, нарколепсії або розсіяної уваги.
46. Спосіб лікування розладів або хвороб, пов'язаних з гістаміновим Н3-рецептором, в якому вводять суб'єкту за потреби ефективну кількість сполуки за будь-яким з пп. 1-26 або фармацевтичної композиції за п. 28 або 29.
47. Спосіб за п. 46, який відрізняється тим, що ефективна кількість сполуки становить у діапазоні від приблизно 0,05 мг до приблизно 2000 мг, краще, якщо від приблизно 0,1 мг до приблизно 1000 мг, і найкраще від приблизно 0,5 мг до приблизно 500 мг на день.
Текст
1. Сполука загальної формули (І): (13) (54) АМІДИ АМІНОАЛКІЛЗАМІЩЕНИХ АЗЕТИДИНІВ, ПІРОЛІДИНІВ, ПІП ЕРИДИНІВ ТА АЗ ЕПАНІВ, ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ НА ЇХ ОСНОВІ ТА ЇХ ВИКОРИСТАННЯ C2 ДО ПАТЕНТУ НА ВИНАХІД 3 79263 4 R11 і R12 незалежно є воднем, С1-6-алкілом, які рюють міст, вибраний з -ОСН2О-, -OCН2CH2O-, можуть за бажанням бути заміщені на один або ОСН2СН2СН2О- і С3-5-алкілену, кілька замісників, вибраних з С3-8-циклоалкілу, C5або R11 і R3, R11 і R7, або R11 і R10 разом утворюють міст, вибраний з -О-, -S-, -CH2-, -С(=О)-, 8-циклоалкенілу, галогену та гідроксилу, або С3-8-циклоалкілом або С 5-8-циклоалкенілом, які СН(ОН)-, -NR13-, -OCH 2- і -CН2 O-, можуть за бажанням бути заміщені на один або R13 - це водень, кілька замісників, вибраних з галогену та гідроС1-6-алкіл, який може за бажанням бути заміщексилу, ний на один або кілька замісників, вибраних з С3Х - це 8-циклоалкілу, С 5-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно, R С3-8-циклоалкіл або С 5-8-циклоалкеніл, які можуть R за бажанням бути заміщені на один або кілька R4 R3 R7 замісників, вибраних з галогену, гідроксилу, ціаR но, аміно, С1-6-алкілу, С2-6-алкенілу та С 2-6R R6 R5 R3 алкінілу, Y Y R , , , -Y - це -СН2, -С(=О)-, -NR14-, -O-, -S-, -СН2О-, R R R R4 R3 4 R OCH2- або -СН(ОН)-, R3 R5 R5 R14 - це водень, С1-6-алкіл, який може за бажанням бути заміщеR ний на один або кілька замісників, вибраних з С3Y R6 R 10 6 R R R 8-циклоалкілу, С 5-8-циклоалкенілу, галогену, гідR8 R9 R9 R роксилу, ціано та аміно, С3-8-циклоалкіл або С 5-8-циклоалкеніл, які можуть 3 R3 R R R4 за бажанням бути заміщені на один або кілька R10 R замісників, вибраних з галогену, гідроксилу, ціано R4 R R5 та аміно, Y Y Y R17 - це водень, С1-6-алкіл, С2-6-алкеніл або С 2-6R8 R R7 R R9 алкініл, R8 R18 і R19 - це незалежно є водень, галоген, гідро5 R ксил, аміно, С1-6-алкіл, С2-6-алкеніл або С2-6R8 R8 R9 R4 алкініл, R 10 а також будь-яка її діастереомерна або енантіоR6 R9 або мерна або таутомерна Y Y форма, включаючи їх суміші, або її фармацевтиR3 R3 , чно прийнятна сіль. 2. Сполука за п. 1, яка відрізняється тим, що R1 R3, R4, R5, R 6, R7 , R8, R9 i R10 незалежно є - це водень, воднем, галогеном, ціано, -NR15R16, гідроксилом, С1-6-алкіл за бажанням заміщений на один або карбамоїлом, карбоксилом, -СF3, -OCF3, карбоккілька замісників, вибраних з С3-8-циклоалкілу, С5силом, амідино, гуанідино або нітро, або 8-циклоалкенілу, галогену та гідроксилу, або C1-6-алкокси, C1-6-алкілом, С1-7-алканоїлом, С1-6R1 і R2 разом утворюють С 3-6-алкіленовий міст алкілкарбамоїлом, ді-С1-6-алкілкарбамоїлом, С1-6або С3-6-алкеніленовий міст, які можуть за баалкілоксикарбонілом, С1-6-алкілтіо, С1-6жанням бути заміщені на один або кілька замісалкілсульфінілом, С1-6-алкілсульфонілом, ариників, вибраних з галогену та гідроксилу лом, ароїлом, арилокси, арилоксикарбонілом, 3. Сполука за п. 2, яка відрізняється тим, що R1 арилтіо, арилсульфінілом або арилсульфонілом, - це які можуть за бажанням бути заміщені на один С1-6-алкіл, або або кілька замісників, вибраних з галогену, гідроR1 і R2 разом утворюють С 3-6-алкіленовий міст ксилу, ціано і -NR 15R16, або С3-6-алкеніленовий міст, які можуть за баR15 і R16 незалежно є воднем або карбамоїлом, жанням бути заміщені на один або кілька замісС1-6-алкілом, який може за бажанням бути заміників, вибраних з галогену та гідроксилу. щений на один або кілька замісників, вибраних з 4. Сполука за п. 3, яка відрізняється тим, що R1 С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, - це гідроксилу, ціано та аміно, або С1-6-алкіл, або С3-8-циклоалкілом, С5-8-циклоалкенілом, С1-6R1 і R2 разом утворюють С3-6-алкіленовий міст, які алкілкарбамоїлом, ді-С1-6-алкілкарбамоїлом або можуть за бажанням бути заміщені на один або С1-6-алкілоксикарбонілом, які можуть за бажанкілька замісників, вибраних з галогену та гідроням бути заміщені на один або кілька замісників, ксилу. вибраних з галогену, гідроксилу, ціано, аміно, С15. Сполука за п. 4, яка відрізняється тим, що R1 -алкілу, С2-6-алкенілу та С2-6-алкінілу, 6 - це або R15 і R16 разом утворюють С3-6-алкіленовий С1-6-алкіл, або міст або С3-6-алкеніленовий міст, які можуть за R1 і R2 разом утворюють С4-5-алкіленовий міст, які бажанням бути заміщені на один або кілька заміможуть за бажанням бути заміщені на один або сників, вибраних з галогену та гідроксилу, кілька замісників, вибраних з галогену та гідро3 4 4 5 5 6 6 або два або кілька з R і R , R і R , R і R , R і ксилу. R7, R7 і R8, R8 і R9, R9 i R6, і R8 і R10 разом утво3 4 7 5 6 4 3 5 6 10 9 8 10 3 6 5 79263 6 6. Сполука за п. 5, яка відрізняється тим, що R1 водню, галогену, ціано, -СF3 або -ОСF 3, - це -O-СН3, 1,2,4-триазолілу, -O-СН2СН3 або СН3С1-6-алкіл, або сульфоніл-O-, які можуть за бажанням бути заміR1 i R2 разом утворюють С4-5-алкіленовий міст. щені на один або кілька галогенів, 7. Сполука за п. 6, яка відрізняє ться тим, що R 1 i або R11 і R3 разом утворюють міст, вибраний з -О2 R разом утворюють С4-5-алкіленовий міст. або -S-. 8. Сполука за п. 7, яка відрізняє ться тим, що R 1 i 20. Сполука за п. 19, яка відрізняється тим, що R2 разом утворюють С4-алкіленовий міст. R3, R4, R5, R 6 i R7 незалежно вибрані з 1 9. Сполука за п. 7, яка відрізняє ться тим, що R i водню, галогену, ціано, -СF3 або -ОСF 3, R2 разом утворюють С5-алкіленовий міст. -O-СН3, -О-СН 2СН3 або СН 3-суль фоніл-O-, 10. Сполука за будь-яким з пп. 1-9, яка відрізняабо СF3-сульфоніл-O, -або R11 і R3 разом утвоється тим, що m - це 1. рюють міст, вибраний з -O-або -S-. 11. Сполука за будь-яким з пп. 1-10, яка відріз21. Сполука за будь-яким з пп. 1-20, яка відрізняється тим, що n - це 1 або 2. няється тим, що R11 - це водень. 12. Сполука за п. 11, яка відрізняє ться тим, що n 22. Сполука за будь-яким з пп. 1-21, яка відріз- це 1. няється тим, що R12 - це водень або С1-6-алкіл. 13. Сполука за будь-яким з пп. 1-12, яка відріз23. Сполука за п. 22, яка відрізняється тим, що няється тим, що Х - це R12 - це водень або метил. 24. Сполука за будь-яким з пп. 1-23, яка відрізR3 няється тим, що R15 - це водень. 4 R 25. Сполука за будь-яким з пп. 1-24, яка відрізR4 R3 R7 няється тим, що R16 - це водень. 26. Сполука за будь-яким з пп. 1-25, яка відрізR7 R5 няється тим, що R17, R 18 і R19 усі є воднем. 6 5 R R R3 Y R6 Y 27. Використання сполуки за будь-яким з попередніх пп. 1-26 для одержання фармацевтичної де R3, R4, R5, R 6 та R7 такі, як визначено за п. 1. композиції. 14. Сполука за будь-яким з пп. 1-13, яка відріз28. Фармацевтична композиція, що містить як няється тим, що -Y- - це -О- або -S-. активний інгредієнт принаймні одну сполуку за 15. Сполука за п. 14, яка відрізняється тим, що будь-яким з пп. 1-26 разом з одним або кількома Y- це -О-. фармацевтично прийнятними носіями або напов16. Сполука за п. 13, яка відрізняється тим, що нювачами. Х - це 29. Фармацевтична композиція за п. 28 в одиничних дозованих формах, що містить від приблизно R3 0,05 мг до приблизно 1000 мг, краще, якщо від 4 R приблизно 0,1 мг до приблизно 500 мг, і найкраще від приблизно 0,5 мг до приблизно 200 мг сполуки за будь-яким з пп. 1-25. R7 R5 30. Використання сполуки за будь-яким з пп. 1-26 R6 для одержання фармацевтичної композиції для , лікування розладів і хвороб, пов'язаних з гістаміновим Н3-рецептором. де R3, R4, R5, R 6 i R7 такі, як визначено за п. 1. 31. Використання сполуки за будь-яким з пп. 1-26 17. Сполука за будь-яким з пп. 1-16, яка відріздля одержання фармацевтичної композиції для няється тим, що R3 , R4, R5, R 6 i R7 незалежно лікування хвороб і розладів, де інгібування гіставибрані з мінового Н3-рецептора має цілющий вплив. водню, галогену, ціано, -NR15R16, -CF3 , -ОСF3 або 32. Використання сполуки за будь-яким з пп. 1-26 нітро, де R15 i R16 такі, як визначено за п. 1, для одержання фармацевтичної композиції, що С1-6-алкокси, С3-6-циклоалкілкарбонілу, арилу, має антагоністичну активність або зворотну агогетероарилу, С3-8-циклоалканоїлу, С1-6ністичну активність щодо гістамінового Н3алкілсульфонілу або С 1-6-алкілсульфоніл-О-, які рецептора. можуть за бажанням бути заміщені на один або 33. Використання сполуки за будь-яким з пп. 1-26 кілька галогенів, для одержання фармацевтичної композиції для або R4 i R5 разом утворюють -ОСH2О- міст, зменшення ваги. або R11 і R3 разом утворюють міст, вибраний з -О34. Використання сполуки за будь-яким з пп. 1-26 або -S-. для одержання фармацевтичної композиції для 18. Сполука за п. 17, яка відрізняється тим, що лікування надмірної ваги або ожиріння. R3, R4, R5, R 6 i R7 незалежно вибрані з 35. Використання сполуки за будь-яким з пп. 1-26 водню, галогену, ціано, -СF3 або -ОСF 3, для одержання фармацевтичної композиції для С1-6-алкокси, 1,2,4-триазолілу, циклопропаноїлу пригнічення апетиту або для викликання відчуття або С1-6-алкілсульфоніл-О-, які можуть за бажанситості. ням бути заміщені на один або кілька галогенів, 36. Використання сполуки за будь-яким з пп. 1-26 або R4 і R5 разом утворюють -OCH 2O- міст, для одержання фармацевтичної композиції для або R11 і R3 разом утворюють міст, вибраний з -Oзапобігання та/або лікування розладів і хвороб, або -S-, пов'язаних з надмірною вагою або ожирінням. 19. Сполука за п. 18, яка відрізняється тим, що R3, R4, R5, R 6' R7 незалежно вибрані з 7 79263 8 37. Використання сполуки за будь-яким з пп. 1-26 43. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для для одержання фармацевтичної композиції, що запобігання та/або лікування розладів, таких як має агоністичну активність щодо гістамінового булімія та пияцтво. Н3-рецептора. 38. Використання сполуки за будь-яким з пп. 1-26 44. Використання сполуки за будь-яким з пп. 1-26 для одержання фармацевтичної композиції для для одержання фармацевтичної композиції для лікування IGT. лікування алергічного риніту, виразки або втрати 39. Використання сполуки за будь-яким з пп. 1-26 апетиту. для одержання фармацевтичної композиції для 45. Використання сполуки за будь-яким з пп. 1-26 лікування діабету 2 тип у. для одержання фармацевтичної композиції для 40. Використання сполуки за будь-яким з пп. 1-26 лікування хвороби Альцгеймера, нарколепсії або для одержання фармацевтичної композиції для розсіяної уваги. гальмування або запобігання розвитку від IGT до 46. Спосіб лікування розладів або хвороб, пов'ядіабету 2 типу. заних з гістаміновим Н3-рецептором, в якому 41. Використання сполуки за будь-яким з пп. 1-26 вводять суб'єкту за потреби ефективну кількість для одержання фармацевтичної композиції для сполуки за будь-яким з пп. 1-26 або фармацевтигальмування або запобігання розвитку від неінсучної композиції за п. 28 або 29. лінзалежного діабету 2 типу до інсулінзалежного 47. Спосіб за п. 46, який відрізняється тим, що діабету 2 типу. ефективна кількість сполуки становить у діапазо42. Використання сполуки за будь-яким з пп. 1-26 ні від приблизно 0,05 мг до приблизно 2000 мг, для одержання фармацевтичної композиції для краще, якщо від приблизно 0,1 мг до приблизно лікування хвороб і розладів, де стимуляція гіста1000 мг, і найкраще від приблизно 0,5 мг до примінового Н3-рецептора має цілющий вплив. близно 500 мг на день. Цей винахід стосується нових амідів аміноалкілзаміщених азетидинів, піролідинів, піперидинів і азепанів, використання цих сполук як фармацевтичних композицій, фармацевтичних композицій, що містять сполуки, і способу лікування, який використовує ці сполуки та композиції. Ці сполуки виявляють високу й селективну зв'язуючу а фінність до гістамінового Н3-рецептора, проявляючи антагоністичну, зворотну агоністичну або агоністичну активність щодо гістамінового Н3-рецептора. У результаті сполуки є корисними для лікування хвороб і розладів, пов'язаних з гістаміновим Н3рецептором. Існування гістамінового Н3-рецептора було відомо протягом кількох років і рецептор викликає інтерес стосовно розвитку нових ліків. Нещодавно був клонований гістаміновий Н3-рецептор людини. Гістаміновий Н3-рецептор - це пресинаптичний ауторецептор, розташований як у центральній, так і периферичній нервовій системі, шкірі та в органах, таких як легені, тонкий кишечник, імовірно селезінка та кишково-шлунковий тракт. Нещодавні свідчення дозволяють припустити, що Н3рецептор виявляє внутрішню, конститутивну активність in vitro, а також in vivo (тобто він є активним за відсутності агоніста). Сполуки, що діють як незворотні агоністи можуть інгібувати цю активність. Було показано, що гістаміновий Н3-рецептор регулює вивільнення гістаміну, а також інших нейротрансмітерів, таких як серотонін і ацетилхолін. Антагоніст гістамінового Н3-рецептора або незворотний агоніст таким чином мав би підвищувати вивільнення цих нейротрансмітерів у мозку. Агоніст гістамінового Н3-рецептора, навпаки, призводить до інгібування біосинтезу гістаміну й інгібування вивільнення гістаміну, а також інших нейротрансмітерів, таких як серотонін і ацетилхолін. Ці дослідження дозволяють припустити, що агоністи гістамінового Н3-рецептора, незворотні агоністи та антагоністи могли б бути важливими медіато рами нейронної активності. Відповідно, гістаміновий Н3-рецептор є важливою мішенню для нової терапії. Сполуки, подібні до сполук цього винаходу, вже попередньо були одержані й їх біологічні властивості були досліджені, порівн. [WO 00/59880, WO 00/39081]. Проте, ці посилання ані описують, ані припускають, що ці сполуки можуть мати активність антагоністів або агоністів гістамінового Н3рецептора. Кілька публікацій описують одержання й використання агоністів і антагоністів гістамінового Н3рецептора. Більшість з них є похідними імідазолу. Проте, нещодавно було описано кілька безімідазольних лігандів гістамінового Н3-рецептора [див., наприклад, Linney et al. J. Med. Chem. 2000, 43, 2362-2370; US 6316475, WO 01/66534 і WO 01/74810]. Однак, ці сполуки відрізняються структурно від цих сполук. З точки зору зацікавленості галузі в агоністах гістамінового Н3-рецептора, незворотних агоністах і антагоністах, нові сполуки, які взаємодіють з гістаміновим Н3-рецептором, могли б бути високобажаним внеском у галузь. Цей винахід пропонує такий внесок у галузь, ви ходячи з відкриття, що новий клас амідів аміноалкілзаміщених азетидинів, піролідинів, піперидинів і азепанів має високу й специфічну афінність до гістамінового Н3рецептора. Завдяки їх взаємодії з гістаміновим Н3рецептором, ці сполуки є корисними за лікування великої кількості станів і розладів, де взаємодія з гістаміновим Н3-рецептором є цілющою. Таким чином, сполуки можуть використовуватися, наприклад, для лікування хвороб центральної нервової системи, периферичної нервової системи, серцево-судинної системи, легеневої системи, шлунково-кишкової системи та ендокринної системи. Визначення У структурних формулах, наведених у цьому 9 79263 10 винаході, наступні терміни мають нижченаведене вище. Характерними прикладами є форміл, ацезначення: тил, пропіоніл, бутаноїл, пентаноїл, гексаноїл, гепТермін "галоген" означає F, СІ, Вr або І. таноїл тощо. Термін "С1-6-алкіл", як використано в цьому Термін "С1-6-алкілкарбамоїл", як використано в винаході, означає насичену, розгалужену або нецьому винаході, стосується радикалу -С(=О)NН-С1розгалужену вуглеводневу груп у, що має від 1 до 6 6-алкіл, де С 1-6-алкіл є таким, як описано вище. атомів вуглецю. До типових С 1- 6-алкільних груп Характерними прикладами є метилкарбамоїл, належать, окрім іншого, метил, етил, н-пропіл, ізоетилкарбамоїл, ізопропілкарбамоїл, нпропіл, бутил, ізобутил, втор-бутил, трет-бутил, пропілкарбамоїл, бутилкарбамоїл, пентилкарбамопентил, ізопентил, гексил, ізогексил тощо. їл, гексилкарбамоїл тощо. Термін "С2-6-алкеніл", як використано в цьому Термін "ди- С1-6-алкілкарбамоїл", як викорисвинаході, означає розгалужену або нерозгалужену тано в цьому винаході, стосується радикалу вуглеводневу гр упу, що має від 2 до 6 атомів вугС(=О)N(С1-6-алкіл)2, де С1-6-алкіл є таким, як опилецю й принаймні один подвійний зв'язок. До присано вище. Потрібно розуміти, що С1-6-алкільні кладів таких груп належать, окрім іншого, етеніл, групи можуть бути однаковими або різними. Хара1-пропеніл, 2-пропеніл, ізопропеніл, 1,3-бутадієніл, ктерними прикладами є диметилкарбамоїл, ме1-бутеніл, 2-бутеніл, 1-пентеніл, 2-пентеніл, 1тилетилкарбамоїл, діетилкарбамоїл, діізопропілгексеніл, 2-гексеніл тощо. карбамоїл, ди-н-пропілкарбамоїл, Термін "С2-6-алкініл", як використано в цьому дибутилкарбамоїл, дипентилкарбамоїл, дигексилвинаході, означає розгалужену або нерозгалужену карбамоїл тощо. вуглеводневу гр упу, що має від 2 до 6 атомів вугТермін "С3-8-циклоалкіл", як використано в лецю й принаймні один потрійний зв'язок. До прицьому винаході, означає моноциклічну, карбоциккладів таких груп належать, окрім іншого, етиніл, лічну гр упу, що має від 3 до 8 атомів вуглецю. Ха1-пропініл, 2-пропініл, 1-бутиніл, 2-бутиніл, 1рактерними прикладами є циклопропіл, циклобупентиніл, 2-пентиніл, 1-гексиніл, 2-гексиніл тощо. тил, циклопентил, циклогексил, циклогептил, Термін "С3-6-алкілен", як використано в цьому циклооктил тощо. винаході, означає насичену, двовалентну, розгаТермін "С5-8-циклоалкеніл", як використано в лужену або нерозгалужену вуглеводневу груп у, що цьому винаході, означає моноциклічну, карбоцикмає від З до 6 атомів вуглецю. До типових С3-6лічну, неароматичну груп у, що має від 5 до 8 а тоалкіленових груп належать, окрім іншого, 1,2мів вуглецю й принаймні один подвійний зв'язок . пропілен, 1,3-пропілен, бутилен, ізобутиліден, пенХарактерними прикладами є циклопентеніл, циктилен, гексилен тощо. логексеніл, циклогептеніл, циклооктеніл тощо. Термін "С3-6-алкенілен", як використано в цьоТермін "С3-8-циклоалканоїл", як використано в му винаході, означає двовалентну, розгалужену цьому винаході, стосується радикалу -С(=О)-С3-8або нерозгалужену вугле водневу груп у, що має від циклоалкіл, де С 3-8-циклоалкіл є таким, як описано 3 до 6 атомів вуглецю й принаймні один подвійний вище. Характерними прикладами є циклопропанозв'язок. До типових С3-6-алкеніленових груп налеїл, циклобутаноїл, циклопентаноїл, циклогексаножать, окрім іншого, н-пропенілен, бутенілен, пенїл, циклогептаноїл, циклооктаноїл тощо. Термін тенілен, гексенілен тощо. "С3-8-циклоалкілкарбамоїл", як використано в цьоТермін "С1-6-алкокси", як використано в цьому му винаході, стосується радикалу -С(=О)NН-С3-8винаході, стосується радикалу -О-С1-6-алкіл, де С1циклоалкіл, де С 3-8-циклоалкіл є таким, як описано вище. Характерними прикладами є циклопропіл6-алкіл є таким, як описано вище. Характерними прикладами є метокси, етокси, н-пропокси, ізопрокарбамоїл, циклобутилкарбамоїл, циклопентилкапокси, бутокси, втор-бутокси, трет-бутокси, пенторбамоїл, циклогексилкарбамоїл, циклогептилкаркси, ізопентокси, гексокси, ізогексокси тощо. бамоїл, циклооктилкарбамоїл тощо. Термін "С3-8Термін "С1-6-алкілтіо", як використано в цьому циклоалкілоксикарбоніл", як використано в цьому винаході, стосується радикалу -S-С1-6-алкіл, де С 1винаході, стосується радикалу -С(=О)-О-С3-8циклоалкіл, де С 3-8-циклоалкіл є таким, як описано 6-алкіл є таким, як описано вище. Характерними прикладами є метилтіо, етилтіо, ізопропілтіо, нвище. Характерними прикладами є циклопропілокпропілтіо, бутилтіо, пентилтіо тощо. сикарбоніл, циклобутилоксикарбоніл, циклопентиТермін "С1-6-алкілсульфініл", як використано в локсикарбоніл, циклогексилоксикарбоніл, циклогецьому винаході, стосується радикалу -S(=О)-С1-6птилоксикарбоніл, циклооктилоксикарбоніл тощо. алкіл, де С1-6-алкіл є таким, як описано вище. ХаТермін "арил", як використано в цьому винаході, рактерними прикладами є метилсульфініл, етилстосується карбоциклічних ароматичних кільцевих сульфініл, ізопропілсульфініл, н-пропілсульфініл, систем, таких як феніл, біфеніліл, нафтил, антрабутилсульфініл, пентилсульфініл тощо. ценіл, фенантреніл, флуореніл, інденіл, пенталеТермін "С1-6-алкілсульфоніл", як використано в ніл, азуленіл тощо. Арил також стосується часткоцьому винаході, стосується радикалу -S(=О)2-С1-6во гідрогенованих похідних карбоциклічних алкіл, де С1-6-алкіл є таким, як описано вище. Хасистем, перерахованих вище. Необмежуючими рактерними прикладами є метилсульфоніл, етилприкладами таких частково гідрогенованих похідсульфоніл, ізопропілсульфоніл, нних є 1,2,3,4-тетрагідронафтил, 1,4-дигідронафтил пропілсульфоніл, бутилсульфоніл, пентилсульфотощо. Термін "арилокси", як використано в цьому ніл тощо. винаході, стосується радикалу -О-арил, де арил є Термін "С1-7-алканоїл", як використано в цьому таким, як описано вище. Необмежуючими приклавинаході, стосується радикалу -С(=О)Н або дами є фенокси, нафтокси, антраценілокси, фенаС(=О)С1-6-алкіл, де С 1-6-алкіл є таким, як описано нтренілокси, флуоренілокси, інденілокси тощо. 11 79263 12 Термін "ароїл", як використано в цьому винавинаході, означає терапію та піклування про паціході, стосується радикалу -С(=О)-арил, де арил є єнта з метою боротьби із хворобою, розладом або таким, як описано вище. Необмежуючими прикластаном. Термін стосується гальмування розвитку дами є бензоїл, нафтоїл, антраценілкарбоніл, фехвороби, розладу або стану, послаблення або понантренілкарбоніл, флуоренілкарбоніл, інденілкалегшення симптомів і ускладнень, та/або лікуванрбоніл тощо. ня або позбавлення від хвороби, розладу або стаТермін "арилтіо", як використано в цьому вину. В оптимальному варіанті пацієнтом для наході, стосується радикалу -S-арил, де арил є лікування є ссавець, зокрема, людина. таким, як описано вище. Необмежуючими приклаЦей винахід стосується сполуки загальної фодами є фенокси, нафтокси, антраценілтіо, фенанрмули (І): тренілтіо, флуоренілтіо, інденілтіо тощо. Термін "арилсульфініл", як використано в цьому винаході, стосується радикалу -S(=О)-арил, де арил є таким, як описано вище. Необмежуючими прикладами є фенілсульфініл, нафтилсульфініл, антраценілсульфініл, фенантренілсульфініл, флуоренілсульфініл, інденілсульфініл тощо. Термін "арилсульфоніл", як використано в цьому винаході, стосується радикалу -S(=О)2-арил, де арил є таким, як описано вище. Необмежуючими прикладами є фенілсульфоніл, нафтилсульфоде ніл, антраценілсульфоніл, фенантренілсульфоніл, m - це 1, 2 або 3, флуоренілсульфоніл, інденілсульфоніл тощо. n - це 0, 1, 2 або 3, Термін "гетероарил", як використано в цьому R1 і R2 незалежно є воднем, С1-6-алкілом, С2-6винаході, стосується гетероциклічних ароматичних алкенілом або С2-6-алкінілом, які можуть за бажанкільцевих систем, що містять один або кілька гетеням бути заміщені на один або кілька замісників, роатомів, вибраних з азоту, кисню і сірки, таких як вибраних з С 3-8-циклоалкілу, С5-8-циклоалкенілу, фурил, тієніл, піроліл, оксазоліл, тіазоліл, імідазогалогену та гідроксилу, або ліл, ізоксазоліл, ізотіазоліл, 1,2,3-триазоліл, 1,2,4С3-8-циклоалкілом або С 5-8-циклоалкенілом, які триазоліл, піраніл, піридил, піридазиніл, піримідиможуть за бажанням бути заміщені на один або ніл, піразиніл, 1,2,3-триазиніл, 1,2,4-триазиніл, кілька замісників, вибраних з галогену, гідроксилу, 1,3,5-триазиніл, 1,2,3-оксадіазоліл, 1,2,4С1-6-алкілу, С2-6-алкенілу та С2-6-алкінілу, оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4або R1 і R2 разом утворюють С 3-6-алкіленовий оксадіазоліл, 1,2,3-тіадіазоліл, 1,2,4-тіадіазоліл, міст або С3-6-алкеніленовий міст, які можуть за 1,2,5-тіадіазоліл, 1,3,4-тіадіазоліл, тетразоліл, тіабажанням бути заміщені на один або кілька замісдіазиніл, індоліл, ізоіндоліл, бензофурил, бензотіників, вибраних з галогену та гідроксилу, єніл, індазоліл, бензімідазоліл, бензотіазоліл, бенR11 і R12 незалежно є воднем, С1-6-алкілом, які зоізотіазоліл, бензоксазоліл, бензізоксазоліл, можуть за бажанням бути заміщені на один або пуриніл, хіназолініл, хінолізиніл, хінолініл, ізохінокілька замісників, вибраних з С 3-8-циклоалкілу, С5-8лініл, хіноксалініл, нафтиридиніл, птеридиніл, карциклоалкенілу, галоген у та гідроксилу, або базоліл, азепініл, діазепініл, акридиніл тощо. ГетеС3-8-циклоалкілом або С 5-8-циклоалкенілом, які роарил також стосується частково гідрогенованих можуть за бажанням бути заміщені на один або похідних гетероциклічних систем, перерахованих кілька замісників, вибраних з галогену та гідроксивище. Необмежуючими прикладами таких частколу, во гідрогенованих похідних є 2,3X - це дигідробензофураніл, піролініл, піразолініл, інданіл, індолініл, оксазолідиніл, оксазолініл, оксазепініл тощо. Термін "гетероароїл", як використано в цьому винаході, стосується радикалу -С(=О)-гетероарил, де гетероарил є таким, як описано вище. Термін "гетероарилокси", як використано в цьому винаході, стосується радикалу -Огетероарил, де гетероарил є таким, як описано вище. Певні з вищеописаних термінів можуть зустрічатися більше одного разу в стр уктурних формулах і щоразу кожний термін має бути визначений незалежно від інших. Термін "за бажанням заміщений", як використано в цьому винаході, означає, що дані групи є або незаміщеними або заміщеними на один або кілька визначених замісників. Якщо дані групи заміщені на більш ніж один замісник, замісники можуть бути однаковими або різними. Термін "лікування", як використано в цьому 13 79263 R3, R4, R5, R 6, R7 , R8, R9 і R10 незалежно є - воднем, галогеном, ціано, -NR15R16, гідроксилом, карбамоїлом, карбоксилом, -CF3, -OCF3, карбоксилом, амідино, гуанідино або нітро, або - С1-6-алкокси, С1-6-алкілом, С1-7-алканоїлом, С1-6-алкілкарбамоїлом, ди-С1-6-алкілкарбамоїлом, С1-6-алкілоксикарбонілом, С1-6-алкілтіо, С1-6алкілсульфінілом, С1-6-алкілсульфонілом, арилом, ароїлом, арилокси, арилоксикарбонілом, арилтіо, арилсульфінілом або арилсульфонілом, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано і -NR15R16, R15 і R16 незалежно є воднем або карбамоїлом, С1-6-алкілом, який може за бажанням бути заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С3-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно, або С3-8-циклоалкілом, С5-8-циклоалкенілом, С1-6алкілкарбамоїлом, ди-С1-6-алкілкарбамоїлом або С1-6-алкілоксикарбонілом, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано, аміно, С1-6алкілу, С2-6-алкенілу та С2- 6-алкінілу, або R15 і R16 разом утворюють С 3-6алкіленовий міст або С 3-6-алкеніленовий міст, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу, або двоє або кілька з R3 і R4, R4 і R5, R5 і R6, R6 7 і R , R7 і R8, R8 і R9, R9 і R6, і R8 і R10 разом утворюють міст, вибраний з -ОСН2О-, -OCH 2CH2O-, ОСН2СН2СН2О- і С3-5-алкілену, або R11 і R3, R11 і R7, або R11 і R10 разом утворюють міст, вибраний з -О-, -S-, -СН2-, -С(=О)-, СН(ОН)-, -NR13-, -ОСН2- і -СН2 О-, R13 - це водень, С1-6-алкіл, який може за бажанням бути заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно, С3-8-циклоалкіл або С 5-8-циклоалкеніл, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано, аміно, С1-6-алкілу, С2-6-алкенілу та С 2-6алкінілу, -Y- це -СН2, -С(=О)-, -NR14-, -О-, -S-, -СН2О-, ОСН2- або -СН(ОН)-, R14 - це водень, С1-6-алкіл, який може за бажанням бути заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно, 14 С3-8-циклоалкіл або С 5-8-циклоалкеніл, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано та аміно, R17 - це водень, С1-6-алкіл, С2-6-алкеніл або С26-алкініл, R18 і R19 - це незалежно є водень, галоген, гідроксил, аміно, С1-6-алкіл, С2-6-алкеніл або С2-6алкініл, а також будь-яка її діастереомерна або енантіомерна або таутомерна форма, включаючи їх суміші, або її фармацевтично прийнятна сіль. В одному втіленні R17, R18 і R19 усі є воднем. В іншому втіленні m - це 1. У ще одному втіленні n - це 1. У ще іншому втіленні R1 і R2 разом утворюють С3-6-алкіленовий міст і можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу. В одному втіленні R1 і R2 разом утворюють С 4алкіленовий міст і можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену та гідроксилу. У подальшому втіленні R1 і R2 разом утворюють С4-алкіленовий міст. В іншому втіленні R11 - це водень. У ще іншому втіленні R12 - це водень. В іншому втіленні X - це де R3, R4, R5, R6 і R7 є, як визначено для формули (І). В одному втіленні R3, R4, R5 , R6 і R7 є незалежно вибрані з водню, галогену, -CF3 і С1-6-алкокси. У подальшому втіленні чотири замісники R3, 4 R , R5, R 6 і R7 є воднем і останній замісник вибраний з галогену, -CF3 і С1-6-алкокси. Потрібно розуміти, що якщо n - це 2 або 3, R19 групи можуть бути однаковими або різними. В іншому аспекті винахід пропонує сполуки загальної формули (II): де m - це 1, 2 або 3, n - це 0, 1, 2 або 3, R1 і R2 - це незалежно водень, С1-6-алкіл, С2-6-алкеніл або С2-6-алкініл, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з С 3-8-циклоалкілу, С5-8циклоалкенілу, галоген у та гідроксилу, або С3-8-циклоалкіл або С 5-8-циклоалкеніл, які мо 15 79263 16 жуть за бажанням бути заміщені на один або кільалкілоксикарбоніл, які можуть за бажанням бути ка замісників, вибраних з галогену, гідроксилу, С1заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано, аміно, С1-6-алкілу, С2-66-алкілу, С 2-6-алкенілу та С 2-6-алкінілу, або R1 і R2 разом утворюють С 3-6-алкіленовий алкенілу та С 2-6-алкінілу, міст або С3-6-алкеніленовий міст і можуть за баабо R15 і R16 разом утворюють С 3-6жанням бути заміщені на один або кілька замісниалкіленовий міст або С 3-б-алкеніленовий міст, які ків, вибраних з галогену та гідроксилу, можуть за бажанням бути заміщені на один або R11 і R12 - це незалежно водень, кілька замісників, вибраних з галогену та гідроксиС1-6-алкіл, які можуть за бажанням бути замілу, щені на один або кілька замісників, вибраних з С3або двоє або кілька з R3 і R4, R4 і R5, R5 і R6, R6 7 і R , R7 і R8, R8 і R9, R9 і R6, і R8 і R10 разом утво8-циклоалкілу, С 5-8-циклоалкенілу, галогену та гідроксилу, або рюють міст, вибраний з -ОСН2О-, -ОСН2СН2О-, С3-8-циклоалкіл або С 5-8-циклоалкеніл, які моОСН2СН2СН2О- і С3-5-алкілену, жуть за бажанням бути заміщені на один або кільабо R11 і R3, R11 і R7 або R11 і R10 разом утвока замісників, вибраних з галогену та гідроксилу, рюють міст, вибраний з -О-, -S-, -СН2, -С(=О)-, Х - це СН(ОН)-, -NR13-, -ОСН2- і -СН2 О-, R13 - це водень, С1-6-алкіл, який може за бажанням бути заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно, С3-8-циклоалкіл або С 5-8-циклоалкеніл, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано, аміно, С1-6-алкілу, С2-6-алкенілу та С 2-6алкінілу, -Y- is -CH 2-, -C(=O)-, -NR14-, -О-, -S-, -СН2О-, ОСН2 або -СН(ОН)-, R14 - це водень, С1-6-алкіл, який може за бажанням бути заміщений на один або кілька замісників, вибраних з С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, гідроксилу, ціано та аміно, С3-8-циклоалкіл або С 5-8-циклоалкеніл, які можуть за бажанням бути заміщені на один або кілька замісників, вибраних з галогену, гідроксилу, ціано та аміно, R17 - це водень, С1-6-алкіл, С2-6-алкеніл або С2-алкініл, 6 R18 і R19 - це незалежно водень, галоген, гідроксил, аміно, С1-6-алкіл, С2-6-алкеніл або С2-6-алкініл, а також будь-яка її діастереомерна, енантіомерна або таутомерна форма, включаючи їх суміші, або її фармацевтично прийнятна сіль. R3, R4, R5, R 6, R7 , R8, R9 і R10 - це незалежно В іншому втіленні R1 - це водень, - водень, галоген, ціано, -NR15R16, гідроксил, С1-6-алкіл, за бажанням заміщений на один карбамоїл, карбоксил, -CF3, -OCF3 , карбоксил, або кілька замісників, вибраних з С3-8-циклоалкілу, амідино, гуанідино або нітро, або С5-8-циклоалкенілу, галогену та гідроксилу, або - С1-6-алкокси, С1-6-алкіл, С1-7-алканоїл, С1-6R1 і R2 разом утворюють С 3-6-алкіленовий міст алкілкарбамоїл, ди-С1-6-алкілкарбамоїл, С1-6або С3-6-алкеніленовий міст, які можуть за бажаналкілоксикарбоніл, С3-8-циклоалкіл, С3-8ням бути заміщені на один або кілька замісників, цикпоалканоїл, С3-8-циклоалкілкарбамоїл, С3-8вибраних з галогену та гідроксилу. циклоалкіл-оксикарбоніл, С1-6-алкілтіо, С1-6В іншому втіленні R1 - це С 1-6-алкіл, або алкілсульфініл, С1-6-алкілсульфоніл, С1-6R1 і R2 разом утворюють С 3-6-алкіленовий міст алкілсульфоніл-О-, арил, ароїл, арилокси, арилокабо С3-6-алкеніленовий міст, які можуть за бажансикарбоніл, арилтіо, арилсульфініл, арилсульфоням бути заміщені на один або кілька замісників, ніл, гетероарил, гетероароїл, або гетероарилокси, вибраних з галогену та гідроксилу. які можуть за бажанням бути заміщені на один В іншому втіленні R1 - це С 1-6-алкіл, або або кілька замісників, вибраних з галогену, гідро15 16 R1 і R2 разом утворюють С 3-6-алкіленовий міст, ксилу, ціано і -NR R , 15 16 які можуть за бажанням бути заміщені на один або R і R - це незалежно водень або карбамоїл, кілька замісників, вибраних з галогену та гідроксиС1-6-алкіл, який може за бажанням бути замілу. щений на один або кілька замісників, вибраних з В іншому втіленні R1 - це С 1-6-алкіл, або С3-8-циклоалкілу, С5-8-циклоалкенілу, галогену, R1 і R2 разом утворюють С 4-5-алкіленовий міст, гідроксилу, ціано та аміно, або які можуть за бажанням бути заміщені на один або С3-8-циклоалкіл, С5-8-циклоалкеніл, С1-6кілька замісників, вибраних з галогену та гідроксиалкілкарбамоїл, ди-С1-6-алкілкарбамоїл або С1-6 17 79263 лу. В іншому втіленні R1 - це С1-6-алкіл, або R1 і R2 разом утворюють С4-5-алкіленовий міст. В іншому втіленні R1 і R2 разом утворюють С 45-алкіленовий міст. В іншому втіленні R1 і R2 разом утворюють С 4алкіленовий міст. В іншому втіленні R1 і R2 разом утворюють С 5алкіленовий міст. В іншому втіленні m - це 1. В іншому втіленні n - це 1 або 2. В іншому втіленні n - це 1. В іншому втіленні X - це. де R3, R4, R5, R 6 і R7 такі, як визначено за п.1. В іншому втіленні -Υ- - це -О- або -S-. В іншому втіленні -Υ- - це -О-. В іншому втіленні X - це де R3, R4, R5, R 6 і R7 такі, як визначено за п.1 В іншому втіленні R3, R4, R5, R6 і R7 незалежно вибрані з - водню, галогену, ціано, -NR15R16, -CF3 , -OCF 3 або нітро, де R15 і R16 такі, як визначено за п.1 - С1-6-алкокси, С3-6-циклоалкілкарбонілу, арилу, гетероарилу, С3- 8-циклоалканоїлу, С1-6алкілсульфонілу, або С 1-6-алкілсульфоніл-О-, які можуть за бажанням бути заміщені на один або кілька галогенів, або R4 і R5 разом утворюють -ОСН2О- міст, або R11 і R3 разом утворюють міст, вибраний з -О-або -S-. В іншому втіленні R3, R4, R5, R6 і R7 є незалежно вибрані з - водню, галогену, ціано, -CF3 або -OCF3, - С1-6-алкокси, 1,2,4-триазолілу, циклопропаноїлу або С1-6-алкілсульфоніл-О-, які можуть за бажанням бути заміщені на один або кілька галогенів, або R4 і R5 разом утворюють -ОСН2О- міст, або R11 і R3 разом утворюють міст, вибраний з -О- або -S-. В іншому втіленні R3, R4, R5 , R6' R7 незалежно вибрані з - водню, галогену, ціано, -CF3 або -OCF3, - -О-СН3, 1,2,4-триазолілу, -О-СН 2СН3 або СН 3сульфоніл-О-, які можуть за бажанням бути заміщені на один або кілька галогенів або R11 і R3 разом утворюють міст, вибраний з -О-або-SВ іншому втіленні R3, R4, R5, R6 і R7 незалежно вибрані з 18 - водню, галогену, ціано, -CF3 або -OCF3, - -О-СН3, -О-СН2СН3 або СН3-сульфоніл-Оабо СF3-сульфоніл-Оабо R11 і R3 разом утворюють міст, вибраний з -О-або -S-. В іншому втіленні R11 - це водень. В іншому втіленні R12 - це водень або С1-6алкіл. В іншому втіленні R12 - це водень або метил. В іншому втіленні R15 - це водень. В іншому втіленні R16 - це водень. В іншому втіленні R17, R18 і R19 усі є воднем. Сполуки цього винаходу можуть хіральними й потрібно розуміти, що будь-які енантіомери, які є відокремлюваними, чистими або частково очищеними енантіомерами, або їх рацемічні суміші знаходяться в межах винаходу. Крім того, якщо подвійний зв'язок повністю або частково насиченої кільцевої системи чи більш ніж один центр асиметрії або зв'язок з обмеженою рухливістю присутній у молекулі, можуть бути утворені діастереомери. Потрібно розуміти, що будь-які діастереомери, такі як відокремлювані, чисті або частково очищені діастереомери або їх суміші, знаходяться в межах винаходу. Крім того, кілька сполук цього винаходу можуть існувати в різних таутомерних формах і потрібно розуміти, що будь-які таутомерні форми, які сполуки здатні утворювати, знаходяться в межах цього винаходу. Цей винахід також стосується фармацевтично прийнятних солей цих сполук. До таких солей належать фармацевтично прийнятні кислі солі, фармацевтично прийнятні солі металів, амонію та алкіловані солі амонію. До кислих солей належать солі неорганічних кислот, а також органічних кислот. Характерними прикладами придатних неорганічних кислот є соляна, бромводнева, йодводнева, фосфорна, сірчана, азотна кислоти тощо. Характерними прикладами придатних органічних кислот є мурашина, оцтова, трихлороцтова, трифтороцтова, пропіонова, бензольна, корична, лимонна, фумарова, гліколева, молочна, малеїнова, яблунева, малонова, манделова, щавлева, пікринова, піровиноградна, саліцилова, бурштинова, метансульфонова, етансульфонова, виннокам'яна, аскорбінова, памоєва, біметиленсаліцилова, етандисульфонова, глюконова, цитраконова, аспарагінова, стеаринова, пальмітинова, EDTA, гліколева, р-амінобензойна, глутамінова, бензолсульфонова, р-толуолсульфонова кислоти тощо. Подальші приклади фармацевтично прийнятних неорганічних або органічних кислих солей включають фармацевтично прийнятні солі, наведені в [J. Pharm. Sd. 1977,66, 2], включений сюди шляхом посилання. Прикладами солей металів є солі літію, натрію, калію, магнію тощо. Прикладами солей амонію та алкілованих солей амонію є солі амонію, метиламонію, диметиламонію, триметиламонію, етиламонію, гідроксиетиламонію, діетиламонію, бутиламонію, тетраметиламонію тощо. Також фармацевтично прийнятними кислими солями можуть бути гідрати, які ці сполуки здатні утворювати. Кислі солі можуть бути одержані як прямі продукти синтезу сполуки. Як альтернатива, вільна 19 79263 20 основа може бути розчинена в придатному розристовуються для одержання фармацевтичної чинникові, що містить прийнятну кислоту, і сіль композиції для зменшення ваги. виділяють випаровуванням розчинника або іншим У кращому втіленні винаходу ці сполуки викочином, відокремлюючи сіль і розчинник. ристовуються для одержання фармацевтичної Сполуки цього винаходу можуть утворювати композиції для лікування надмірної ваги або ожисольвати зі стандартними низькомолекулярними ріння. розчинниками, використовуючи способи добре В іншому кращому втіленні винаходу ці сполувідомі фахівцю в галузі. Такі сольвати також знаки використовуються для одержання фармацевтиходяться в межах цього винаходу. чної композиції для пригнічення апетиту або виВинахід також стосується проліків цих сполук, кликання відчуття ситості. які за введення зазнають хімічного перетворення У подальшому кращому втіленні винаходу ці метаболічними процесами перед утворенням аксполуки використовуються для одержання фармативних фармакологічних речовин, загалом, такі цевтичної композиції для запобігання та/або лікупроліки є функціональними похідними цих сполук, вання розладів і хвороб, пов'язаних з надмірною які легко перетворюються in vivo на потрібну сповагою або ожирінням, таких як атеросклероз, гілуку формули (І). Загальноприйняті процедури для пертонія, IGT (порушена толерантність до глюковибору й одержання придатних похідних проліків зи), діабет, особливо діабет 2 типу (NIDDM (неінописано, наприклад, в ["Design of Prodrugs", ed. H. сулін-залежний цукровий діабет)), дисліпідемії, Bundgaard, Elsevier, 1985]. Винахід також стосухвороба коронарних судин, хвороба жовчного міється активних метаболітів цих сполук. хура, остеоартрит і різні типи раку, такі як рак енСполуки цього винаходу взаємодіють з гістадометрію, грудей, простати та товстої кишки. міновим Н3-рецептором і є відповідно корисними У ще подальшому кращому втіленні винаходу для лікування багатьох станів і розладів, де взаєці сполуки використовуються для одержання фармодії з гістаміновим М3-рецептором є цілющими. мацевтичної композиції для запобігання та/або Відповідно, в іншому аспекті цей винахід столікування розладів харчування, таких як булімія та сується сполуки загальної формули (І), а також пияцтво. будь-якої її діастереомерної, енантіомерної або У подальшому кращому втіленні винаходу ці таутомерної форми, включаючи ці суміші, або її сполуки використовуються для одержання фармафармацевтично прийнятної солі для використання цевтичної композиції для лікування IGT. як фармацевтична композиція. У подальшому кращому втіленні винаходу ці Винахід також стосується фармацевтичної сполуки використовуються для одержання фармакомпозиції, що містить як активний інгредієнт прицевтичної композиції для лікування діабету 2 типу. наймні одну сполуку формули (І) або будь-яку її До такого лікування належить, між іншим, лікувандіастереомерну, енантіомерну або таутомерну ня з метою гальмування або запобігання розвитку форми, включаючи ці суміші, або її фармацевтичвід IGT до діабету 2 типу, а також гальмування або но прийнятну сіль разом з одним або кількома фазапобігання розвитку від неінсулін-залежного діармацевтично прийнятними носіями або розчиннибету 2 типу до інсулін-залежного діабету 2 типу. ками. Сполуки цього винаходу можуть також бути Крім того, винахід стосується використання використані для лікування розладів дихальних сполуки загальної формули (І), а також будь-якої її шляхів, таких як астма, як протипроносні агенти та діастереомерної, енантіомерної або таутомерної для модуляції секреції шлункової кислоти. Крім форми, включаючи ці суміші, або її фармацевтичтого, сполуки цього винаходу може бути викорисно прийнятної солі для одержання фармацевтичтані для лікування хвороб, пов'язаних з регуляцією ної композиції для лікування розладів і хвороб, сну та пробудження, для лікування нарколепсії та пов'язаних з гістаміновим Н3-рецептором. розсіяної уваги. В ще іншому аспекті винахід стосується споКрім того, сполуки винаходу може бути викособу для лікування хвороб і розладів, пов'язаних з ристані як стимулянти ЦНС або як седативні речогістаміновим Н3-рецептором, спосіб, що складавини. Ці сполуки можуть також бути використані ється з уведення суб'єкту за потреби ефективної для лікування станів, пов'язаних з епілепсію. Докількості сполуки формули (І) або будь-якої її діасдатково, ці сполуки можуть бути використані для тереомерної, енантіомерної або таутомерної форлікування хвороб руху і запаморочення. Крім того, ми, включаючи ці суміші, або її фармацевтично вони можуть бути корисними як регулятори гіпотаприйнятної солі або фармацевтичної композиції, ламо-гіпофізарної секреції, антидепресанти, модущо містить активну речовину. лятори циркуляції мозку та для лікування синдроВ одному аспекті винахід стосується сполуки з му подразнення кишок. активністю антагоніста гістамінового Н3-рецептора Крім того, сполуки цього винаходу можуть бути або активністю зворотного агоніста, яка може відвикористані для лікування слабоумства та хвороби повідно бути корисною за лікування великої кільАльцгеймера. кості станів і розладів, де блокада гістамінового Сполуки цього винаходу можуть також бути Н3-рецептора є цілющою. корисними для лікування алергічного риніту, вираВ іншому аспекті винахід стосується сполуки з зки або втрати апетиту. активністю агоніста гістамінового Н3-рецептора, Сполуки цього винаходу можуть, окрім того, яка може відповідно бути корисною за лікування бути корисними для лікування мігрені, [див. великої кількості станів і розладів, де активація McLeod et al., The Journal of Pharmacology and гістамінового Н3-рецептора є цілющою. Experimental Therapeutics 287 (1998), 43-50], і для У кращому втіленні винаходу ці сполуки виколікування інфаркту міокарду, [див. Mackins et al., 21 79263 22 Expert Opinion on Investigational Drugs 9 (2000), пропіон, топірамат або екопіпам. 2537-2542]. У ще одному подальшому аспекті ці сполуки У подальшому аспекті винаходу лікування павводять у комбінації з одним або кількома антидіцієнта цими сполуками поєднується з дієтою абетичними агентами. та/або вправами. До відносних антидіабетичних агентів налеУ подальшому аспекті винаходу ці сполуки жать інсулін, аналоги та похідні інсуліну, такі як ті, вводять у комбінації з однією або кількома додатщо описані в [ЕР 0792290 (Novo Nordisk A/S)], наковими активними речовинами в будь-якому приприклад NеВ29-тетрадеканоїл (В30) інсулін людини, датному співвідношенні(ях). Такі додаткові активні [ЕР 0214826 і ЕР 0705275 (Novo Nordisk A/S)], наагенти можуть бути вибрані з агентів проти ожиприклад AspB28 інсулін людини, [US 5504188 (Eli ріння, проти діабету, антидисліпідемічних агентів, Lilly)], наприклад Lys B28 ProB29 інсулін людини, [ЕР антигіпертонічних агентів, агентів для лікування 0368187 (Aventis)], наприклад LantusÒ, які всі ускладнень, що з'явилися внаслідок або пов'язані включені шляхом посилання, похідні GLP-1, такі як з діабетом, і агентів для лікування ускладнень і ті, що описані в [WO 98/08871 (Novo Nordisk A/S)], розладів, що з'явилися внаслідок або пов'язані з включений сюди шляхом посилання, а також ораожирінням. льно активні гіпоглікемічні агенти. Таким чином, у подальшому аспекті винаходу Краще, якщо орально активні гіпоглікемічні ці сполуки вводять у комбінації з одним або кільагенти містять імідазоліни, сульфонілсечовини, кома агентами проти ожиріння або агентами, що бігуанідини, меглітидини, оксадіазолідиндіони, регулюють апетит. тіазолідиндіони, сенситизери інсуліну, інгібітори αТакі агенти можуть бути вибрані з групи, що глюкозидази, агенти, що діють на АТФ-залежний складається з агоністів CART (кокаїн амфетамін калієвий канал b-клітин, наприклад відкривачі карегульований транскрипт), антагоністів NPY (нейлієвого каналу, таких як ті, що описані в [WO ропептид Y), агоністів МС4 (меланокортин 4), аго97/26265, WO 99/03861 і WO 00/37474 (Novo ністів МС3 (меланокортин 3) або антагоністів екзиNordisk A/S)], які включені в цей винахід шляхом ну, агоністів TNF (фактор некрозу пухлини), посилання, мітиглінід, або блокатор калієвого каагоністів CRF (фактор, що вивільнює кортикотроналу, такий як BTS-67582, натеглінід, антагоністи пін), антагоністів CRF BP (білок, що зв'язує факглюкагону, такі як ті, що описані в [WO 99/01423 і тор, що вивільнює кортикотропін), агоністів урокоWO 00/39088 (Novo Nordisk A/S і Agouron ртин, агоністів Р3-адренорецептора, таких як CLPharmaceuticals, Inc.)], які включені в цей винахід 316243, AJ-9677, GW-0604, LY362884, LY377267 шляхом посилання, GLP-1 агоністи, такі як ті, що або AZ-40140, агоністів MSH (меланоцитостимуописані в [WO 00/42026 (Novo Nordisk A/S і люючий гормон), антагоністів МСН (меланоцитоAgouron Pharmaceuticals, Inc.)], які включені в цей концентруючий гормон), агоністів ССК (холецистовинахід шляхом посилання, інгібітори DPP-IV (дикінін), інгібіторів зворотного захвату серотоніну, пептидилпептидаза-IV), інгібітори РТРази (протеїн такі як флуоксетин, сероксат або циталопрам, інгітирозинфосфатази), інгібітори печінкових ферменбіторів зворотного захвату серотоніну та норадретів, що беруть участь у стимуляції глюконеогенезу наліну, змішаних серотонін та норадренергічних та/або глікогенолізу, модулятори захвату глюкози, сполук, агоністів 5НТ (серотонін), агоністів бомбеінгібітори GSK-3 (кіназа глікогенсинтази-3), сполузину, антагоністів галаніну; гормону росту, фактоки, що модифікують метаболізм ліпідів, такі як анрів росту, таких як пролактин або лактоген плацетиліпідемічні агенти, сполуки, що зменшують спонти, сполук, що вивільнюють гормон росту, живання їжі, PPAR (проліфератор пероксисомагоністів TRH (гормон, що вивільнює тиреотропін), активований рецептор) і агоністи RXR (рецептор X модуляторів UCP 2 або 3 (роз'єднуючий протеїн 2 ретиноїдів), такі як ALRT-268, LG-1268 або LGабо 3), агоністів лептину, агоністів D A (бромкрип1069. тин, допрексину), інгібіторів ліпази/амілази, модуВ одному втіленні винаходу ці сполуки вводять ляторів PPAR (проліфератор пероксисому комбінації з інсуліном або аналогом інсуліну або активований рецептор), модуляторів RXR (рецеппохідним, таким як NеВ29-тетрадеканоїл (В30) інсутор X ретиноїдів), агоністів TRb, AGRP інгібіторів ліну людини, AspB28 інсуліну людини, Lys B28 ProB29 (протеїн з Агуті), антагоністів опіоїдів (таких як наінсуліну людини, LantusÒ, або суміш, що містить лтрексон), ексендин-4, GLP-1 та миготливого нейодин або кілька цих речовин. ротрофного фактора. У подальшому втіленні винаходу ці сполуки В одному втіленні винаходу агентом проти вводять у комбінації з сульфонілсечовиною, наожиріння є лептин. приклад толбутамід, хлорпропамід, толазамід, В іншому втіленні агентом проти ожиріння є глібенкламід, гліпізид, глімепірид, гліказид або дексамфетамін або амфетамін. глібурид. В іншому втіленні агентом проти ожиріння є В іншому втіленні винаходу ці сполуки вводять фенфлурамін або дексфенфлурамін. у комбінації з бігуанідом, наприклад метформіном. У ще одному втіленні агентом проти ожиріння У ще іншому втіленні винаходу ці сполуки ввоє сибутрамін. дять у комбінації з меглітинідом, наприклад репагУ подальшому втіленні агентом проти ожирінлінідом або натеглінідом. ня є орлістат. У ще одному втіленні винаходу ці сполуки В іншому втіленні агентом проти ожиріння є вводять у комбінації з сенситизером інсуліну тіамазиндол або фентермін. золідиндіоном, наприклад троглітазоном, циглітаУ ще одному втіленні агентом проти ожиріння зоном, піоглітазоном, розиглітазоном, ізаглітазоє фендиметразин, діетилпропіон, флуоксетин, буном, дарглітазоном, енглітазоном, CS-011/CI-1037 23 79263 24 або Т174 або сполуками, що описані в [WO сполук і за бажанням одна або кілька інших актив97/41097, WO 97/41119, WO 97/41120, WO них речовин знаходяться в межах цього винаходу. 00741121 і WO 98/45292 (Dr. Reddy's Research Фармацевтичн композиції Foundation)], які включені в цей винахід шляхом Сполуки винаходу можуть бути введені одні посилання. або в комбінації з фармацевтично прийнятними У ще одному втіленні винаходу ці сполуки моносіями або наповнювачами, як одинична або чижуть бути введені в комбінації із сенситизером сленна дози. Фармацевтичні композиції згідно з інсуліну, наприклад GI 262570, YM-440, МСС-555, винаходом можуть бути складені з фармацевтично JTT-501, AR-H039242, KRP-297, GW-409544, CREприйнятними носіями або розчинниками, а також 16336, AR-H049020, LY510929. МВХ-102, CLXбудь-якими інші відомими ад'ювантами та напов0940, GW-501516 або сполуками, що описані в нювачами згідно із загальноприйнятими способа[WO 99/19313, WO 00/50414, WO 00/63191, WO ми, такими як ті, що описані в [Remington: The 00/63192, WO 00/63193 (Dr. Reddy's Research Science and Practice of Pharmacy, 19 th Edition, Foundation) і WO 00/23425, WO 00/23415, WO Gennaro, Ed., Mack Publishing Co., Easton, PA, 00/23451, WO 00/23445, WO 00/23417, WO 1995]. Фармацевтичні композиції можуть бути спе00/23416, WO 00/63153, WO 00/63196, WO цифічно складені для введення будь-яким прийня00/63209, WO 00/63190 і WO 00/63189 (Novo тним шляхом, таким як оральним, ректальним, Nordisk A/S)], які включені в цей винахід шляхом назальним, легеневим, місцевим (включаючи ввепосилання. дення в щоку і язик), крізьшкірним, інтраперитонеУ подальшому втіленні винаходу ці сполуки альним, вагінальним і парентеральним (включаючи підшкірний, внутрішньом'язовий, вводять у комбінації з інгібітором a-глюкозидази інтратекальний, внутрішньовенний і внутрішньоабо, наприклад, воглібозою, еміглітатом, міглітолом або акарбозою. шкірний) шляхом, де оральний шлях є кращим. Зрозуміло, що кращий шлях залежатиме від загаВ іншому втіленні винаходу ці сполуки вводять льного стану й віку суб'єкта для лікування, прироу комбінації з агентом, що діє на АТФ-залежний ди стану для лікування й вибраного активного інгкалій канал b-клітин, наприклад толбутамідом, редієнта. глібенкламідом, гліпізидом, гліказидом, BTS-67582 До фармацевтичних композицій для орального або репаглінідом. введення належать тверді дозовані форми, такі як У ще іншому втіленні винаходу ці сполуки мокапсули, таблетки, драже, пілюлі, ромбовидні табжуть бути введені в комбінації з натеглінідом. летки, порошки та гранули. Де прийнятно, вони У ще одному втіленні винаходу ці сполуки можуть бути одержані з покриттям, таким як кишвводять у комбінації з антиліпідемічним агентом, ково-розчинне покриття, або вони можуть бути наприклад холестираміном, колестиполом, ікофібскладені так, щоб створити контрольоване вивільратом, гемфіброзилом, ловастатином, правастанення активного інгредієнта, таке як неперервне тином, симвастатином, пробуколом або декстроабо тривале вивільнення згідно зі способами, добтироксином. ре відомими в галузі. В іншому аспекті винаходу ці сполуки вводять До рідких дозованих форм для орального ввеу комбінації з більш ніж однією з вищезгаданих дення належать розчини, емульсії, суспензії, сиросполук, наприклад, у комбінації з метформіном і пи та еліксири. сульфонілсечовиною, такою як глібурид; сульфоДо фармацевтичних композицій для парентенілсечовиною та акарбозою; натеглінідом і метфорального введення належать стерильні водні й рміном; акарбозою та метформіном; сульфонілсеневодні розчини для ін'єкцій, дисперсії, суспензії човиною, метформіном і троглітазоном; інсуліном і або емульсії, а також стерильні порошки для відсульфонілсечовиною; інсуліном і метформіном; творення стерильних розчинів для ін'єкцій або диінсуліном, метформіном і сульфонілсечовиною; сперсії перед використанням. Рецептури як ін'єкціїінсуліном і троглітазоном; інсуліном і ловастатидепо також знаходяться в межах цього винаходу. ном тощо. До інших прийнятних для введення форм наКрім того, ці сполуки можуть бути введені в лежать супозиторії, аерозолі, мазі, креми, гелі, комбінації з одним або кількома антигіпертонічниінгалянти, шкірні накладки, імпланти тощо. ми агентами. Прикладами антигіпертонічних агенТипова оральна доза знаходиться в діапазоні тів є р-блокатори, такі як алпренолол, атенолол, від приблизно 0,001 до приблизно 100мг/кг маси тимолол, піндолол, пропранолол і метопролол, тіла на день, краще, якщо від приблизно 0,01 до інгібітори АСЕ (ангеотензин-перетворюючий ферприблизно 50мг/кг маси тіла на день, і ще краще мент), такі як беназеприл, каптоприл, еналаприл, від приблизно 0,05 до приблизно 10мг/кг маси тіла фозиноприл, лізиноприл, хінаприл і раміприл, блона день, яку вводять однією або кількома дозами, катори кальцієвих каналів, такі як ніфедипін, фенаприклад 1-3 дозами. Точна доза залежатиме від лодипін, нікардипін, ізрадипін, німодипін, дилтіачастоти й способу введення, статі, віку, маси й зем і верапаміл, а також a-блокатори, такі як загального стану суб'єкта для лікування, природи доксазоцин, урапідил, празоцин і теразоцин. Пой складності стану для лікування й будь-якої супудальше посилання може бути зроблене на тньої хвороби для лікування та інших факторів, [Remington: The Science and Practice of Pharmacy, очевидних фа хівцю в галузі. 19th Edition, Gennaro, Ed., Mack Publishing Co., Рецептури можуть загальноприйнято бути Easton, PA, 1995]. присутніми в одиничних дозованих формах спосоПотрібно розуміти, що будь-яка прийнятна бами, відомими фахівцю в галузі. Типові одиничні комбінація сполук згідно з винаходом з дієтою дозовані форми для орального введення один або та/або вправами, одна або кілька з вищезгаданих 25 79263 26 кілька разів на день, наприклад, 1-3 рази на день, орального введення, препарат може бути таблеможуть містити від 0,05 до приблизно 1000мг, тований, поміщений у тверду желатинову капсулу краще, якщо від приблизно 0,1 до приблизно у формі порошку або шариків, або він може бути 500мг, і ще краще від приблизно 0,5мг до прибликруглої форми або ромба. Кількість твердого носія зно 200мг. Для парентеральних шляхів, таких як змінюватиметься, але зазвичай становитиме від внутрішньовенне, інтратекальне, внутрішньом'язоприблизно 25мг до приблизно 1г. Якщо використове й подібне введення, типово дози становлять вується рідкий носій, то препарат може бути у фополовину дози для орального введення. Сполуки рмі сиропу, емульсії, м'якої желатинової капсули цього винаходу загалом використовуються як віабо стерильної рідини для ін'єкцій, такої як водна льна речовина або як її фармацевтично прийнятна або неводна рідка суспензія або розчин. сіль. Одним прикладом є кисла сіль сполуки, що Типова таблетка, що може бути одержана замає використання вільної основи. Якщо сполука гальноприйнятими способами таблетування, може формули (І) містить вільну основу, то такі солі містити: одержують загальноприйнятим чином реакцією Серцевина: розчину або суспензії вільної основи формули (І) з Активна сполука (як вільна сполука або її сіль) хімічним еквівалентом фармацевтично прийнятної 5,0мг кислоти, наприклад, неорганічної та органічної Лактоза Ph. Eur. 67,8мг кислоти. Характерні приклади згадані вище. До Целюлоза, мікрокрист. (Avicel) 31,4мг фізіологічно прийнятних солей сполуки з гідроксиAmberliteÒ IRP88* 1,0мг групою належать аніон вищезгаданої сполуки в Стеарат магнію Ph. Eur. q.s. комбінації з придатним катіоном, таким як натрій Покриття: або іон амонію. Гідроксипропілметилцелюлоза прибл. 9мг Для парентерального введення може бути виMywacett 9-40 Τ** прибл. 0,9мг користані розчини нових сполук формули (І) в сте* Полакрилін калію NF, дезінтегрант таблетки, рильному водному розчині, водному пропіленгліRohm і Haas. колі або сезамовій або арахісовій олії. Такі водні ** Ацильований моногліцерид, використовуварозчини мають бути за необхідності належним ний як пластифікатор для покриття плівки. чином забуферені, а рідкий розчинник спочатку За бажанням фармацевтична композиція визроблений ізотонічним із достатньою кількістю солі находу може містити сполуку формули (І) у комбіабо глюкози. Водні розчини є прийнятними, зокренації зі ще однією фармакологічно активною речома, для внутрішньовенного, внутрішньом'язового, виною, такою як ті, що були описані вище. підшкірного та інтраперитонеального введення. Приклади Всі стерильні водні середовища, що використовуЯМР-спектри записували на обладнанні Bruker ються, легко одержуються стандартними способа300МГц і 400МГц. HPLC-MS виконували на обладми, відомими фахівцю в галузі. нанні Perkin Elmer (AP1100). До прийнятних фармацевтичних носіїв налеHPLC (Спосіб А) жать інертні тверді розчинники або наповнювачі, Зворотнофазний аналіз виконували, викорисстерильні водні розчини й різні органічні розчиннитовуючи УФ-детекцію на 214 і 254нм на 218ТР54 ки. Прикладами твердих носіїв є лактоза, біла гли4,6мм´150мм С-18 силікагелевій колонці, яку на, цукроза, циклодекстрин, тальк, желатин, агар, елюювали за 1мл/хв за 42°С. Колонку врівноважупектин, аравійська камедь, стеарат магнію, стеавали 5% ацетонітрилом, 85% водою і 10% розчину ринова кислота або нижчі алкілові етери целюло0,5% трифторооцтової кислоти у воді й елюювали зи. Прикладами рідких носіїв є сироп, арахісова лінійним градієнтом від 5% ацетонітрилу, 85% воолія, оливкова олія, фосфоліпіди, жирні кислоти, ди і 10% розчину 0,5% трифторооцтової кислоти аміни жирних кислот, поліоксіетилен або вода. до 90% ацетонітрилу й 10% розчину 0,5% трифтоТаким чином, носій або розчинник можуть містити рооцтової кислоти протягом 15хв. будь-який матеріал з уповільненим вивільненням, HPLC (Спосіб В) відомий у галузі, такий як гліцерилмоностеарат RP-аналізи виконували, використовуючи сисабо гліцерилдистеарат, один або змішаний з востему Alliance Waters 2695, оздоблену Waters 2487 ком. Фармацевтичні композиції, створені комбінадвополосним детектором. УФ-детекції збирали, цією нових сполук формули (І) і фармацевтично використовуючи Symmetry C18, 3,5мм, прийнятних носіїв, потім легко вводяться в різно3,0мм´100мм колонку. Елюювали лінійним градієманітні дозовані форми, прийнятні для описаних нтом 5-90% ацетонітрилу, 90-0% води та 5% тришляхів введення. Рецептури можуть загальнофторооцтовою кислотою (1,0%) у воді протягом 8 прийнято бути заключенi в одиничні дозовані фохвилин за швидкості потоку 1,0мл/хв. рми способами, відомими в галузі фармації. Загальна процедура (А) Рецептури цього винаходу, прийнятні для ораСполуки формули (І) згідно з винаходом мольного введення, можуть бути присутні як дискрежуть бути одержані загальною процедурою (А): тні одиниці, такі як капсули або таблетки, де кожна містить попередньо визначену кількість активного інгредієнта, і які можуть містити придатний наповнювач. Ці рецептури можуть бути у формі порошку або гранул, як розчин або суспензія у водній або неводній рідині, або як олія-у-воді або вода-в-олії рідкій емульсії. Якщо твердий носій використовується для 27 79263 Етап А: Сполуки загальної формули (І) одержують з Nзахищеного аміноспирту загальної формули (II). Захисна група може бути вибрана із захисних груп, відомих у галузі й описаних у лі тературі [наприклад, Т. W. Greene, P. G. Wuts, Protective groups in organic synthesis, 2 nd edition, John Wiley & Sons Inc., New York, 1991]. Аміноспирт загальної формули (II) окиснюється у придатній спосіб, відомий в галузі, наприклад, використовуючи оксалілхлорид і диметилсульфоксид або дициклогексилкарбодиімід і диметилсульфоксид, для одержання альдегіду загальної формули (III). Етап В: Альдегід загальної формули (III) реагує з аміном загальної формули (IV) за кислотних або нейтральних умов з відновлюючим реагентом, таким як, наприклад, ацетоксиборгідрид натрію або ціаноборгідрид натрію для одержання аміну загальної формули (V). Етап С: Захисну груп у видаляють способом, відомим у галузі й описаним у літературі [наприклад, Т. W. Greene, P. G. Wuts, Protecti ve groups in organic synthesis, 2nd edition, John Wiley & Sons Inc. New York, 1991] для одержання аміну загальної формули (VI) як вільної основи або як солі. Етап D: Амін загальної формули (VI) - як вільна основа або як сіль - реагує з кислотою формули (VII) і зв'язуючим реактивом, таким як, наприклад, комбінація 1-гідрокси-7-азабензотриазолу і солі гідрохлориду 1-(3-диметиламінопропіл)-3етилкарбодііміду або комбінація 3-гідрокси-1,2,3бензотриазин-4(3Н)-ону і солі гідрохлориду 1-(3диметиламінопропіл)-3-етилкарбодііміду, за бажанням за присутності амінооснови, такої як, наприклад, триетиламін або етилдиізопропіламін, або з активованою похідною кислоти формули (VII), такої як, наприклад, кислий хлорид, кислий імідазол або фенольний естер для одержання сполуки загальної формули (І). 28 Загальна процедура (В) Сполуки формули (І) згідно з винаходом можуть також бути одержані загальною процедурою (В): Етап А: Сполуки загальної формули (І) синтезують з Nзахищеної амінокислоти загальної формули (VIII). Захисна груп може бути вибрана із захисних гр уп, відомих у галузі й описаних в літературі [наприклад, Т. W. Greene, P. G. Wuts, Protective groups in organic synthesis, 2nd edition, John Wiley & Sons Inc. New York, 1991]. Амін загальної формули (IV) - як вільна основа або як сіль - реагує з N-захищеною амінокислотою загальної формули (VIII) і зв'язуючим реактивом, таким як, наприклад, комбінація 1гідрокси-7-азабензотриазолу й солі гідрохлориду 1-(3-диметиламінопропіл)-3-етилкарбодііміду або комбінація 3-гідрокси-1,2,3-бензотриазин-4(3Н)-ону та солі гідрохлориду 1-(3-диметиламінопропіл)-3етилкарбодііміду, за бажанням за присутності амінної основи, такої як, наприклад, триетиламін або етилдиізопропіламін, або активованої похідної кислоти загальної формули (VII І), такої як, наприклад, кислий хлорид, кислий імідазол або фенольний естер, для одержання аміду загальної формули (IX). Етап В: Амід (IX) відновлюють прийнятним відновлюючим реагентом, таким як, наприклад, боран, комбінацією боргідриду натрію та йоду або комбінацією боргідриду натрію та сірчаної кислоти для одержання аміну загальної формули (V). Етап С і Етап D: Ці етапи ідентичні етапам С і D загальної процедури (А). Загальна процедура (С) 29 79263 30 фенолу тип у (XI), що відомий для фахівця в галузі або описаний у літературі [наприклад, Т. W. Greene, P. G. Wuts, Protecti ve groups in organic synthesis, 2nd edition, John Wiley & Sons Inc. New York, 1991] для одержання сполуки типу (XII). Етап В Сполуку типу (XII) обробляють алкілметалевим реагентом, таким як н-бутиллітій, вторбутиллітій або трет-бутиллітій з чи без хелатуючого реагента, такого як N,N,N',N'тетраметилетилендіамін за прийнятної температури, такої як температура між -78°С, і кімнатної температури протягом прийнятного часу (5хв16год). Додають придатний електрофіл, такий як Ν,Ν-диметилформамід. Спрямовуючу гр уп у або видаляють під час обробки, або під час етапу, використовуючи спосіб, відомий для фахівця в галузі або описаний у літературі [наприклад, Т. W. Greene, P. G. Wuts, Protecti ve groups in organic synthesis, 2nd edition, John Wiley & Sons Inc. New Етап А York, 1991] для одержання альдегіду типу (XIII). Цей етап ідентичний етапу А загальної процеЕтап С: дури (В), Альдегід типу (XIII) реагує з придатним 2Етап В галоестером, таким як, наприклад, діетилброммаЗахисну гр уп у аміну видаляють способом, вілонат за присутності прийнятної основи, такої як домим у галузі [наприклад, Т. W. Greene, P. G. nd карбонат калію в прийнятному розчинникові, такоWuts, Protective groups in organic synthesis, 2 му як етилметилкетон за прийнятної температури edition, John Wiley & Sons Inc. New York, 1991] для (наприклад, між 0°С і 200°С) для одержання естеодержання аміду загальної формули (X) або як ру типу (XIV). вільної основи або як солі. Етап D: Етап С: Естер типу (XIV) сапоніфікують способом, віАмід (X) відновлюють прийнятним відновлююдомим для фахівця в галузі або описаним у літечим реагентом таким, як наприклад, гідрид літіюратурі [наприклад, Т. W. Greene. P. G. Wuts, алюмінію, одержуючи амін загальної формули (VI). Protective groups in organic synthesis, 2 nd edition, Етап D: John Wiley & Sons Inc. New York, 1991], наприклад, Цей етап ідентичний етапу D загальної процегідроксид калію в метанолі або гідроксиду літію в дури (А). суміші діоксану й воді для одержання кислоти типу Загальна процедура (D) (XV). Етап Е: Цей етап ідентичний етапу D загальної процедури (А). Загальна процедура (Е) Етап А Група DG (наприклад 2-тетрагідропіранільна група), що спрямовує металування, приєднують до Етап А Придатний галогенарен, такий як бромована або йодована сполука загальної структури (XVI), реагує з алкіл акрилатом загальної структури 31 79263 32 (XVII) за присутності придатного каталізатора, таЕтап В: трет-Бутиловий естер (S)-2кого як, наприклад, паладієвийкаталізатор, такий ((піролідин-1-іл)метил)піролідин-1-карбонової кисяк, наприклад, ацетат паладію (II), за присутності лоти придатного ліганда, такого як трифенілфосфін, і придатної основи, такої як амінооснова, наприклад, триетиламін або етилдиізопропіламін, для одержання алкілакрилату загальної структури (XVIII), Етап В Естер типу (XVIІі) сапоніфікують способом, відомим для фахівця в галузі або описаним у літературі [наприклад, Т. W. Greene, P. G. Wuts, Триацетоксиборгідрид натрію (35,7г, Protective groups in organic synthesis, 2 nd edition, 0,168моль) додавали до суміші сирого третJohn Wiley & Sons Inc. New York, 1991], наприклад, бутилового естеру (S)-2-формілпіролідин-1гідроксид калію в метанолу або гідроксид літію в карбонової кислоти (11,2г, 0,056моль), піролідину суміші діоксану та води, для одержання кислоти (5,16мл, 0,062моль) і молекулярних сит (10г) в типу (XIX). дихлорметані (100мл). Додавали оцтову кислоту Етап С: (6,42г, 0,112моль). Реакційну суміш перемішували Цей етап ідентичний етапу D загальної процепротягом 16 годин за кімнатної температури. Осад дури (А) для одержання сполуки загальної струквидаляли фільтрацією. Фільтрат розбавляли 1N тури (Іb). водним розчином гідроксиду натрію (100мл) і третПриклад 1 (Загальна процедура (А)) бутилметиловим етером (100мл). Фази відокрем(Е)-3-(4-Бромфеніл)-1-((2S)-2-((піролідин-1лювали. Водну фазу екстрагували третіл)метил)піролідин-1-іл)пропенон бутилметиловим етером (3´80мл). Змішані органічні шари висушували над сульфатом магнію. Розчинник видаляли у вакуумі. Сирий продукт очищали флеш-хроматографією на силікагелі (90г), використовуючи етилацетат-гептан/триетиламін (1:1,5%) як елюент, для одержання 9,23г третбутилового естеру (S)-2-((піролідин-1-іл)метил)Етап А: трет-Бутиловий естер (S)-2піролідин-1-карбонової кислоти. 1 формілпіролідин-1-карбонової кислоти Н ЯМР (CDCI3, 2 набори сигналів) d 1 ,45 (s, 9Η); 1,80-2,10 (m, 8Η); 2,50-3,70 (m, 8Η); 3,90 і 4,00 (обидва m, разом 1Η); HPLC (спосіб А): елюція 10,70хв; MS: Підрах. для [М+Н]+: 255; Знайд.: 255. Етап С: (S)-2-((Піролідин-1-іл)метил)піролі дин За -78°С розчин диметилсульфоксиду (7,06мл, 0,099моль) в дихлорметані (10мл) додавали краплинами до розчину оксалілхлориду (6,40мл, 0,075моль) в дихлорметані (15мл). Реакційну суміш перемішували протягом 20хв за -78°С. Додавали розчин (S)-1-(трет-бутоксикарбоніл)-2піролідинметанолу (10г, 0,060моль) в дихлорметані (50мл). Реакційну суміш перемішували протягом 20хв за -78°С. Додавали триетиламін (27,7мл, 0,199моль). Реакційну суміш перемішували протягом 10хв за -78°С і потім нагрівали до кімнатної температури. Промивали її 10% водним розчином гідросульфату натрію (60мл). Водну фазу екстрагували дихлорметаном (30мл). Змішані органічні шари промивали насиченим водним розчином гідрокарбонату натрію (100мл) і висушували над сульфатом магнію. Розчинник видаляли у вакуумі, для одержання 11,2г сирого трет-бутилового естеру (S)-2-формілпіролідин-1-карбонової кислоти, яку використовували для наступного етапу без очищення. 1 Н ЯМР (CDCI3, 2 набори сигналів) d 1,50 (m, 9Н); 1,75-2,20 (m, 4Н); 3,20-4,00 (m, 3Н); 4,05 і 4,20 (обидва t, разом 1Н); 9,50 і 9,60 (обидва s, разом 1Н). 3,2Μ розчин гідрохлориду в етилацетаті (470мл, 1,5моль) додавали до розчину третбутилового естеру (S)-2-((піролідин-1іл)метил)піролідин-1-карбонової кислоти (9,23г, 0,036моль) в етилацетаті (100мл). Реакційну суміш перемішували протягом 45хв за кімнатної температури. Розчинник видаляли у вакуумі. Залишок розчиняли в етилацетаті (200мл). Розчинник видаляли у вакуумі, для одержання 10,30г дигідрохлоридної солі (S)-2-((піролідин-1-іл)метил)піролідину. 1 Н ЯМР (DMSO-d6) d 1,60-2,30 (m, 8Η); 3,10 (m, 2Η); 3,25 (m, 2Η); 3,55 (m, 1Η); 3,70 (m, 3Η); 3,90 (m, 1Η); 9,80 (br, 2Η); 11,20 (br, 1Η). Етап D: За 0°С гідрохлоридну сіль 1-(3диметиламінопропіл)-3-етилкарбодііміду додавали до розчину (E)-4-бром коричної кислоти (0,50г, 2,20ммоль) і S-гідрокси-1,2,3-бензотриазин-4(3Н)ону (0,36г, 2,20ммоль) в суміші дихлорметану (6мл) і N,N-диметилформаміду (6мл). Реакційну суміш перемішували протягом 20хв за 0°С. Додавали розчин дигідрохлоридної солі (S)-2 33 79263 34 ((піролідин-1-іл)метил)піролідину (0,50г, 2,20ммоль) в Ν,Ν-диметилформаміді (8мл). Реакційну суміш перемішували протягом 16 годин одночасно із підігріванням її до кімнатної температури. Суміш розбавляли етилацетатом (100мл), промивали сольовим розчином (100мл) і висушували над сульфатом магнію. Розчинник видаляли 310мг головної сполуки синтезували, як опиу вакуумі. Сирий продукт очищали флешсано для (E)-3-(4-бромфеніл)-1-((2S)-2-((піролідинхроматографією на силікагелі (40г), використовую1-іл)метил)піролідин-1-іл)пропенону, використовучи дихлорметан/метанол/25% водний амоній як ючи (Е)-4-хлоркоричну кислоту замість (E)-4елюент, для одержання 340мг головної сполуки. бромкоричної кислоти. 1 Н ЯМР (CDCI3, 2 набори сигналів) d 1,70-2,20 HPLC (спосіб А): елюція 9,04хв; MS: Підрах. (m, 8Н); 2,45-2,80 (m, 6Н); 3,60 і 3,70 (обидва m, для [М+Н]+: 319; Знайд.: 319. разом 2Н); 4,20 і 4,40 (обидва m, разом 1Н); 7,70 і Головну сполуку перетворювали на її гідро7,90 (обидва d, разом 1Н); 7,40 (m, 2Н); 7,50 (m, хлоридну сіль розчиненням її в етилацетаті (5мл). 2Н); 7,65 (d, 1Η); HPLC (спосіб А): елюція 9,19хв; Додавали 3,2Μ розчин гідрохлориду в етилацетаті MS: Підрах. для [M+H]+: 363; Знайд.: 363. (5мл). Розчинник видаляли у вакуумі. Залишок Головну сполуку перетворювали на її гідророзчиняли в етанолі (50мл). Розчинник видаляли у хлоридну сіль розчиненням її в етилацетаті (5мл). вакуумі. Додавали 3,2Μ розчин гідрохлориду в етилацетаті 1 Н ЯМР (D MSO-d6, 2 набори сигналів) d 1,80(5мл). Розчинник видаляли у вакуумі. Залишок 2,15 (m, 8Η); 3,10, 3,20,3,30, 3,45, і 3,55-3,85 (m, розчиняли в етанолі (50мл). Розчинник видаляли у разом 8Η); 4,40 і 4,75 (обидва m, разом 1Η); 7,05 і вакуумі. 7,15 (обидва d, разом 1Н); 7,50 (m, 3Н); 7,80 і 7,90 C18H23BrN2 O·НСІ·Н2О (363,30·36,46·318,02) (обидва d, разом 2Н); 10,2 (br, 1Н). Підрах.: С 47,64; Η 6,66; Ν 6,17; Приклад 4 (Загальна процедура (А)) Знайд.: С 47,41; Η 6,68; Ν 7,39. (E)-1-((S)-2-((Піролідин-1-іл)метил)піролідин-1Приклад 2 (Загальна процедура (А)) іл)-3-(4-(трифторметил)феніл)пропенон (Е)-3-(5-Бром-2-етоксифеніл)-1-((S)-2((піролідин-1-іл)метил)піролідин-1-іл)пропенон 300мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-5-бром-2-етоксикоричну кислоту замість (E)-4-бромкоричної кислоти. 1 Н ЯМР (CDCI3, 2 набори сигналів) d 1,45 (t, 3Η); 1,80-2,20 (m, 8Η); 2,45-2,80 (m, 6Η); 1,60 і 1,70 (обидва m, разом 2Η); 4,05 (q, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,75 (d, 1Η); 6,85 і 6,95 (обидва d, разом 1Η); 7,35 (d, 1Η); 7,60 (dd, 1Η); 7,85 і 7,95 (обидва d, разом 1Η); HPLC (спосіб А): елюція 9,89хв; MS: Підрах. для [М+Н]+: 407; Знайд.: 407. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. C20H27BrN2 O2·НСІ·Н 2О (407,35·36,46·18,02) Підрах.: С 52,02; Η 6,55; Ν 6,07; Знайд.: С 51,55; Η 6,42; Ν 6,60. Приклад 3 (Загальна процедура (А)) (Е)-3-(4-Хлорфеніл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенон 160мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((2S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-(трифторметил)коричну кислоту замість (Е)-4-бромкоричної кислоти. HPLC (спосіб А): елюція 9,58хв; MS: Підрах. для [М+Н]+: 353; Знайд.: 353. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. 1 Н ЯМР (D MSO-d6, 2 набори сигналів) d 1,802,15 (m, 8Η); 3,10,3,25,3,30, 3,45, і 3,55-3,80 (усі m. разом 8Н); 4,40 і 4,80 (обидва m, разом 1Н); 7,20 і 7,30 (обидва d, разом 1Н); 7,70 і 7,75 (обидва d, разом 1Н); 7,75 і 7,80 (обидва d, разом 2Н); 7,95 і 8,10 (обидва d, разом 2Н); 10,25 (br, 1Н). Приклад 5 (Загальна процедура (А)) (Е)-3-(3-Бромфеніл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенон 290мг головної сполуки синтезували, як опи 35 79263 36 сано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідинГоловну сполуку перетворювали на її гідро1-іл)метил)піролідин-1-іл)пропенону, використовухлоридну сіль розчиненням її в етилацетаті (5мл). ючи (Е)-3-бромкоричну кислоту замість (Е)-4Додавали 3,2Μ розчин гідрохлориду в етилацетаті бромкоричної кислоти. (5мл). Розчинник видаляли у вакуумі. Залишок 1 розчиняли в етанолі (50мл). Розчинник видаляли у Н ЯМР (CDCI3, 2 набори сигналів) d 1,70-1,85 вакуумі. (m, 4Η); 1,90-2,20 (m, 5Η); 2,40-2,75 (m, 6Η); 3,60 (t, Приклад 8 (Загальна процедура (А)) 1Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,70 і 6,95 (обидва d, разом 1Н); 7,45 (m, 2Н); 7,60 (d, 1Η); (E)-3-(3-Метоксифеніл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенон 7,80 (t, 1Η); HPLC (спосіб А): елюція 9,10хв; MS: Підрах. для [М+Н]+: 363; Знайд.: 363. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. 420мг головної сполуки синтезували, як опиПриклад 6 (Загальна процедура (А)) сано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин(E)-3-(2-Бромфеніл)-1-((S)-2-((піролідин-11-іл)метил)піролідин-1-іл)пропенону, використовуіл)метил)піролідин-1-іл)пропенон ючи (Е)-3-метоксикоричну кислоту замість (Е)-4бромкоричної кислоти. 1 Н ЯМР (CDCI3; 2 набори сигналів) d 1,80 (m, 4Η); 1,90-2,20 (m, 5Η); 2,45-2,80 (m, 5Η); 3,60 і 3,70 (обидва m, разом 2Н); 3,85 (s, 3Η); 4,15 і 4,40 (обидва m, разом 1Н); 6,70 і 6,85 (обидва d, разом 1Н); 6,90 (dd, 1Η); 7,05 (s, 1Η); 7,15 (d, 1Η); 7,30 (m, 1Η); 7,70 (d, 1Η); HPLC (спосіб А): елюція 7,99хв; MS: Підрах. для [М+Н]+: 315; Знайд.: 315. 250мг головної сполуки синтезували, як опиГоловну сполуку перетворювали на її гідросано для (Е)-3-(-4-бромфеніл)-1-((2S)-2хлоридну сіль розчиненням її в етилацетаті (5мл). ({піролідин-1-іл)метил)піролідин-1-іл)пропенону, Додавали 3,2Μ розчин гідрохлориду в етилацетаті використовуючи (Е)-2-бромкоричну кислоту за(5мл). Розчинник видаляли у вакуумі. Залишок мість (E)-4-бромкоричної кислоти. 1 розчиняли в етанолі (50мл). Розчинник видаляли у Н ЯМР (CDCI3, 2 набори сигналів) d 1,50-1,90 вакуумі. (m, 4Η); 1,90-2,20 (m, 4Η); 2,50-2,85 (m, 6Η); 3,55Приклад 9 (Загальна процедура (А)) (Е)-3-(43,80 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,65 Бромфеніл)-1-((R)-2-((піролідин-1і 6,85 (обидва d, разом 1Н);7,10-7,40 (m, 2Η); 7,50іл)метил)піролідин-1-іл)пропенон 7,70 (m, 2Η); 8,05 (d, 1Η); HPLC (спосіб А): елюція + 8,89хв; MS: Підрах. для [М+Н] : 363; Знайд.: 363. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. 520мг головної сполуки синтезували, як опиПриклад 7 (Загальна процедура (А)) сано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин(E)-3-(4-Метоксифеніл)-1-((S)-2-((піролідин-11-іл)метил)піролідин-1-іл)пропенону, використовуіл)метил)піролідин-1-іл)пропенон ючи (R)-1-(трет-бутоксикарбоніл)-2піролідинметанол замість (S)-1-(третбутоксикарбоніл)-2-піролідинметанолу. 1 Н ЯМР (CDCI3, 2 набори сигналів) d 1,70-2,20 (m, 8Η); 2,45-2,80 (m, 6Η); 3,60 і 3,70 (обидва m, разом 2Н); 4,15 і 4,40 (обидва m, разом 1Н); 7,70 і 7,90 (обидва d, разом 1Н); 7,40 (m, 2Н); 7,50 (m, 2Н); 7,65 (d, 1Η); HPLC (спосіб А): елюція 9,05хв; 340мг головної сполуки синтезували, як опиMS: Підрах. для [М+Н]+: 363; Знайд.: 363. сано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідинГоловну сполуку перетворювали на її гідро1-іл)метил)піролідин-1-іл)пропенону, використовухлоридну сіль розчиненням її в етилацетаті (5мл). ючи (Е)-4-метоксикоричну кислоту замість (Е)-4Додавали 3,2Μ розчин гідрохлориду в етилацетаті бромкоричної кислоти. (5мл). Розчинник видаляли у вакуумі. Залишок 1 Н ЯМР (CDCI3; 2 набори сигналів) d 1,80 (m, розчиняли в етанолі (50мл). Розчинник видаляли у 4Η); 1,90-2,10 (m, 3Η); 2,20 (m, 2Η); 2,45-2,80 (m, вакуумі. 5Η); 3,60 і 3,70 (обидва m, разом 2Η); 3,85 (s, 3Η); Приклад 10 (Загальна процедура (А)) 4,15 і 4,40 (обидва m, разом 1Η); 6,60 і 6,75 (обид(Е)-1-((R)-2-((Піролідин-1-іл)метил)піролідин-1ва d, разом 1Η); 6,90 (m, 2Η); 7,48 (d, 2Η); 7,64 і іл)-3-(4-трифторметилфеніл)пропенон 7,65 (обидва d, разом 1Н); MPLC (спосіб А): елюція 7,91хв; MS: Підрах. для [М+Н]+: 315; Знайд.: 315. 37 79263 38 ючи (Е)-3-фторкоричну кислоту замість (Е}-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, 4Η); 1,90-2,10 (m, 4Η); 2,45-2,75 (m, 7Η); 3,60 і 3,67 (t і d, разом 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,70 і 6,90 (обидва d, разом 1Η); 7,05 (dt, 1Η); 7,20 (d, 1Η); 7,25-7,40 (m, 2Η); 7,65 (d, 1Η). 352мг головної сполуки синтезували, як опиHPLC спосіб А: елюція 8,07хв. сано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідинMS: підрах. для [М+Н]+: 303; знайд.: 303. 1-іл)метил)піролідин-1-іл)пропенону, використовуГоловну сполуку перетворювали на її гідроючи (R)-1-(трет-бутоксикарбоніл)-2хлоридну сіль розчиненням її в етилацетаті (5мл). піролідинметанол замість (S)-1-(третДодавали 3,2Μ розчин гідрохлориду в етилацетаті бутоксикарбоніл)-2-піролідинметанолу і (Е)-4(5мл). Розчинник видаляли у вакуумі. Залишок трифторметилкоричну кислоту замість (Е)-4розчиняли в етанолі (50мл). Розчинник видаляли у бромкоричної кислоти. вакуумі. 1 Н ЯМР (CDCI3, 2 набори сигналів) d 1,80 (m, Приклад 13 (Загальна процедура (А)) 4Η); 1,90-2,20 (m, 4Η); 2,45-1,85 (m, 6Η); 3,60 і 3,70 (Е)-3-(4-Фторфеніл)-1-((S)-2-((піролідин-1(обидва m, разом 2Н); 4,15 і 4,40 (обидва m, разом іл)метил)піролідин-1-іл)пропенон 1Н); 6,80 і 7,00 (обидва d, разом 1Н); 7,65 (АВ, 4Н); 7,70 (d, 1Η); HPLC (спосіб А): елюція 9,33хв; MS: Підрах. для [М+Н]+: 353; Знайд.: 353. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у 280мг головної сполуки синтезували, як опивакуумі. сано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідинПриклад 11 (Загальна процедура (А)) 1-іл)метил)піролідин-1-іл)пропенону, використову(Е)-3-(3-Хлорфеніл)-1-((S)-2-((піролідин-1ючи (Е)-4-фторкоричну кислоту замість (Е)-4іл)метил)піролідин-1-іл)пропенон бромкоричної кислоти. 1 340мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-хлоркоричну кислоту замість (E)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, 4Η); 1,85-2,15 (m, 4Η); 2,40-2,75 (m, 6Η); 3,50-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,75 і 6,90 (обидва d, разом 1Н); 7,20-7,40 (m, 3Н); 7,50 (s, 1Η); 7,65 (d, 1Η). HPLC спосіб А: елюція 8,82хв. MS: підрах. для [М+Н]+: 319; знайд.: 319. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 12 (Загальна процедура (А)) (Е)-3-(3-Фторфеніл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенон 210мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використову Н-ЯМР (CDCI3, 2 набори сигналів) d 1,80 (m, 4Η); 1,85-2,20 (m, 4Η); 2,40-2,75 (m, 6Η); 3,55-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,65 і 6,80 (обидва d, разом 1Н); 7,05 (m, 2Н); 7,50 (m, 2Н); 7,65 (d, 1Η). HPLC спосіб А: елюція 8,05хв. MS: підрах. для [М+Н]+: 303; знайд.: 303. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 14 (Загальна процедура (А)) (Е)-3-(Бензо[1,3]діоксол-5-іл)-1-((S)-2((піролідин-1-іл)метил)піролідин-1-іл)пропенон 340мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(бензо[1,3]діоксол-5-іл)акрилову кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,80 (m, 4Η); 1,90-2,30 (m, 4Η); 2,45-2,80 (m, 6Η); 3,55-3,75 (m, 2Η); 4,15-4,40 (обидва m, разом 1Η); 6,00 (s, 2Η); 6,55 і 6,70 (обидва d, разом 1Η); 6,80 (dd, 1Η); 7,00 (d, 1Η). 7,02 (s, 1Η); 7,60 (d, 1Η). HPLC спосіб А: елюція 7,86хв. MS: підрах. для [М+Н]+: 329; знайд.: 329. Головну сполуку перетворювали на її гідро 39 79263 40 хлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 15 (Загальна процедура (А)) (Е)-3-(3,4-Диметоксифеніл)-1-((S)-2((піролідин-1-іл)метил)піролідин-1-іл)пропенон 390мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-бром-2-фторкоричну кислоту замість (Е)4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, 4Η); 1,85-2,20 (m, 4Η); 2,35-2,75 (m, 6Η); 3,50-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,85 і 7,05 (обидва d, разом 1Н); 7,25-7,45 (m, 3Н); 7,65 і 240мг головної сполуки синтезували, як опи7,70 (обидва d, разом 1Н). сано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідинHPLC спосіб А: елюція 9,27хв. 1-іл)метил)піролідин-1-іл)пропенону, використовуMS: підрах. для [М+Н]+: 381; знайд.: 381. ючи (Е)-3,4-диметоксикоричну кислоту замість (Е)Головну сполуку перетворювали на її гідро4-бромкоричної кислоти. хлоридну сіль розчиненням її в етилацетаті (5мл). 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, Додавали 3,2Μ розчин гідрохлориду в етилацетаті 4Η); 1,85-2,20 (m, 4Η); 2,45-2,75 (m, 6Η); 3,55-3,75 (5мл). Розчинник видаляли у вакуумі. Залишок (m, 2Η); 3,90 (s, 6Η); 4,15 і 4,40 (обидва m, разом розчиняли в етанолі (50мл). Розчинник видаляли у 1Η); 6,55 і 6,70 (обидва d, разом 1Н); 6,85 (dd, 1Η); вакуумі. 7,05 (d, 1Η); 7,10 (dd, 1Η); 7,55 (d, 1Η). Приклад 18 (Загальна процедура (А)) HPLC спосіб А: елюція 7,60. (Е)-1-((S)-2-((Піролідин-1-іл)метил)піролідин-1+ MS: підрах. для [М+Н] : 345; знайд.: 345. іл)-3-(4-(трифторметокси)феніл)пропенон Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 16 (Загальна процедура (А)) (Е)-3-(2,4-Диметоксифеніл)-1-((S)-2((піролідин-1-іл)метил)піролідин-1-іл)пропенон 98мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-трифторметоксикоричну кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,80 (m, 4Η); 1,85-2,20 (m, 4Η); 2,40-2,80 (m, 6Η); 3,55-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,70 і 320мг головної сполуки синтезували, як опи6,85 (обидва d, разом 1Н); 7,20 (d, 2Η); 7,55 (d, сано для (Е)-3-(4-бромфеніл)-1-((2S)-2-((піролідин2Η); 7,65 (d, 1Η). 1-іл)метил)піролідин-1-іл)пропенону, використовуHPLC спосіб А: елюція 9,75хв. MS: підрах. для ючи (Е)-2,4-диметоксикоричну кислоту замість (Е)[М+Н]+: 369; знайд.: 369. 4-бромкоричної кислоти. 1 Головну сполуку перетворювали на її гідроН-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, хлоридну сіль розчиненням її в етилацетаті (5мл). 4Η); 1,85-2,20 (m, 4Η); 2,45-Ζ75 (m, 6Η); 3,50-3,75 Додавали 3,2Μ розчин гідрохлориду в етилацетаті (m, 2Η); 3,82 (s, 3Η); 3,85 (s, 3Η); 4,15 і 4,40 (обид(5мл). Розчинник видаляли у вакуумі. Залишок ва m, разом 1Η); 6,45 (m, 2Η); 6,75 і 6,90 (обидва d, розчиняли в етанолі (50мл). Розчинник видаляли у разом 1Η); 7,45 (dd, 1Η); 7,85 і 7,90 (обидва d, равакуумі. зом 1Η). Приклад 19 (Загальна процедура (А)) HPLC спосіб А: елюція 8,47хв. + (Е)-3-(4-(Диметиламіно)феніл)-1-((S)-2MS: підрах. для [М+Н] : 345; знайд.: 345. ((піролідин-1-іл)метил)піролідин-1-іл)пропенон Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 17 (Загальна процедура (А)) (Е)-3-(4-Бром-2-фторфеніл)-1-((S)-2((піролідин-1-іл)метил)піролідин-1-іл)пропенон 41 79263 42 74мг головної сполуки синтезували, як описано для (7Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-(диметиламіно)коричну кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,50-2,15 (m, 8Η); 2,45-2,80 (m, 6Η); 3,00 (s, 6Η); 3,60 і 3,65 (обидва m, разом 2Η); 4,15 і 4,45 (обидва m, разом 220мг головної сполуки синтезували, як опи1Н); 6,50 і 6,65 (обидва d, разом 1Н); 6,67 (m, сано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використову2Н);7,40 (d, 2Η); 7,65 (d, 1Η). ючи 1-(((S)-піролідин-2-іл)метил)піперидин замість HPLC спосіб А: елюція 7,23хв. (S)-2-((піролідин-1-іл)метил)піролідин і (E)-4MS: підрах. для [М+Н]+: 328; знайд.: 328. Головну сполуку перетворювали на її гідрохлоркоричну кислоту замість (Е)-4-бромкоричної хлоридну сіль розчиненням її в етилацетаті (5мл). кислоти. 1 Додавали 3,2Μ розчин гідрохлориду в етилацетаті Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, (5мл). Розчинник видаляли у вакуумі. Залишок 2Η); 1,55 (m, 4Η); 1,80-2,10 (m, 4Η); 2,15-2,70 (m, розчиняли в етанолі (50мл). Розчинник видаляли у 6Η); 3,50-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом вакуумі. 1Η); 6,70 і 6,90 (обидва d, разом 1Н); 7,35 (d, 2Η); Приклад 20 (Загальна процедура (А)) 7,45 (d, 2Η); 7,65 (d, 1Η). (Е)-3-(4-Бромфеніл)-1-((S)-2-((піперидин-1HPLC спосіб А: елюція 9,37хв. іл)метил)піролідин-1-іл)пропенон MS: підрах. для [М+Н]+: 333; знайд.: 333. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 22 (Загальна процедура (А)) (Ε)-1-((S)-2-((Піперидин-1-іл)метил)піролідинЕтап 1: 1-іл)-3-(4-(трифторметил)феніл)пропенон 1-(((S)-Піролідин-2-іл)метил)піперидин 8,3г 1-(((S)-піролідин-2-іл)метил)піперидин синтезували, як описано для (S)-2-((піролідин-1іл)метил)піролідин, використовуючи піперидин замість піролідину. 1Н-ЯМР (CDCI3, вільна основа) d 1,30 (m, 1Η); 1,40 (m, 2Η); 1,55 (m, 4Η); 1,75 (m, 2Η); 1,90 (m, 1Η); 2,30 (m, 2Η); 2,35 (m, 2Η); 2,50 (m, 2Η); 2,65 (br, 1Η); 2,90 (m, 1Η); 3,00 (m, 1Η); 3,25 (m, 1Η). Етап 2: 520мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 1-(((S)-піролідин-2-іл)метил)піперидин замість (S)-2-((піролідин-1-іл)метил)піролідину. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, 2Η); 1,55 (m, 4Η); 2,85-2,10 (m, 4Η); 2,15-2,70 (m, 6Η); 3,55-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,70 і 6,95 (обидва d, разом 1Н); 7,40 (d, 2Η); 7,50 (d, 2Η); 7,60 (d, 1Η). HPLC спосіб А: елюція 9,48хв. MS: підрах. для [М+Н]+: Підрах. 377; знайд.: 377. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 21 (Загальна процедура (А)) (Е)-3-(4-Хлорфеніл)-1-((S)-((2-піперидин-1іл)метил)піролідин-1-іл)пропенон 130мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 1-(((S)-піролідин-2-іл)метил)піперидин замість (S)-2-((піролідин-1-іл)метил)піролі дину та (Е)-4(трифтoрмeтил)кoричну кислоту замість (E)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,40 (m, 2Η); 1,55 (m, 4Η); 1,80-2,10 (m, 4Η); 2,15-2,70 (m, 6Η); 3,55-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,80 і 7,05 (обидва d, разом 1Н); 7,60 (m, 4Н); 7,70 (d, 1Η). HPLC спосіб А: елюція 9,87хв. MS: підрах. для [М+Н]+: 367; знайд.: 367. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 23 (Загальна процедура (А)) (Е)-3-(3-Бромфеніл)-1-((S)-2-((піперидин-1іл)метил)піролідин-1-іл)пропенон 43 79263 140мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 1-(((S)-піролідин-2-іл)метил)піперидин замість (S)-2-((піролідин-1-іл)метил)піролідину та (E)-3бромкоричну кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, 2Η); 1,60 (m, 4Η); 1,80-2,10 (m, 4Η); 2,15-2,70 (m, 6Η); 3,50-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,70 і 6,95 (обидва d, разом 1Н); 7,25 (m, 1Н); 7,45 (m, 1Н); 7,60 і 7,61 (обидва d, разом 1Н); 7,70 (m, 1Н). HPLC спосіб А: елюція 9,60хв. MS: підрах. для [М+Н]+: 377; знайд.: 377. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 24 (Загальна процедура (А)) (Е)-3-(4-Метоксифеніл)-1-((S)-2-((піперидин-1іл)метил)піролідин-1-іл)пропенон 160мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 1-(((S)-піролідин-2-іл)метил)піперидин замість (S)-2-((піролідин-1-іл)метил)піролідину та (Е)-4метоксикоричну кислоту замість (Е)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, 2Η); 1,55 (m, 4Η); 1,85-2,10 (m, 4Η); 2,15-2,70 (m, 6Η); 3,55-3,75 (m, 2Η); 3,85 (s, 3Н); 4,15 і 4,40 (обидва m, разом 1Η); 6,60 і 6,75 (обидва d, разом 1Η); 6,90 (m, 2Η); 7,50 (d, 2Η); 7,65 (d, 1Η). HPLC спосіб А: елюція 8,61хв. MS: підрах. для [М+Н]+: 329; знайд.: 329. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 25 (Загальна процедура (А)) (Е)-3-(3,4-Диметоксифеніл)-1-((S)-2((піперидин-1-іл)метил)піролідин-1-іл)пропенон 44 190мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 1-(((S)-піролідин-2-іл)метил)піперидин замість (S)-2-((піролідин-1-іл)метил)піролідину та (Е)-3,4диметоксикоричну кислоту замість (Е)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 140 (m, 2Η); 1,55 (m, 4Η); 1,80-2,10 (m, 4Η); 2,15-2,70 (m, 6Η); 3,50-3,75 (m, 2Η); 3,90 (s, 6Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,55 і 6,75 (обидва d, разом 1Н); 6,85 (m, 1Н); 7,10 (АВ, 2Н); 7,65 (d, 1Η). HPLC спосіб А: елюція 8,00хв. MS: підрах. для [М+Н]+: 359; знайд.. 359. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 26 (Загальна процедура (А)) (Е)-3-(4-Хлор-3-нітрофеніл)-1-((S)-2((піперидин-1-іл)метил)піролідин-1-іл)пропенон 200мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 1-(((S)-піролідин-2-іл)метил)піперидин замість (S)-2-((піролідин-1-іл)метил)піролідину та (Е)-4хлор-3-нітрокоричну кислоту замість (Е)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, 2Η); 1,55 (m, 4Η); 1,85-2,10 (m, 4Η); 2,15-2,70 (m, 6Η); 3,55-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,75 і 7,05 (обидва d, разом 1Н); 7,50-7,70 (m, 2Н); 8,00 і 8,05 (обидва s, разом 1Н). HPLC спосіб А: елюція 9,19хв. MS: підрах. для [М+Н]+: 377; знайд.: 377. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 27 (Загальна процедура (А)) (E)-1-((S)-2-((Піперидин-1-іл)метил)піролідин1-іл)-3-(4-(трифторметокси)феніл)пропенон 45 79263 370мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 1-(((S)-піролідин-2-іл)метил)піперидин замість (S)-2-((піролідин-1-іл)метил)піролідину та (Е)-4(трифторметокси)коричну кислоту замість (Е)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, 2Н); 1,55 (m, 4Н); 1,85-2,10 (m, 4Н); 2,15-2,70 (m, 6Н); 3,50-3,75 (m, 2Н); 4,15 і 4,40 (обидва m, разом 1Н); 6,70 і 6,90 (обидва d, разом 1Н); 7,20 (d, 2Η); 7,55 (d, 2Η); 7,65 (d, 1Η). HPLC спосіб А: елюція 10,11хв. MS: підрах. для [М+Н]+: 383; знайд.: 383, Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 28 (Загальна процедура (А)) (E)-3-(Бифеніл-4-іл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенон 180мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(бифеніл-4-іл)акрилову кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,70-2,20 (m, 8Η); 2,45-2,80 (m, 6Η); 3,60 і 3,70 (t і m, разом 2Η); 4,20 і 4,40 (обидва m, разом 1Η); 6,75 і 6,90 (обидва d, разом 1Н); 7,30-7,50 (m, 3Н); 7,60 (m, 6Н); 7,75 (d, 1Η). HPLC спосіб А: елюція 10,26хв. MS: підрах. для [М+Н]+: 361; знайд.: 361. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 29 (Загальна процедура (А)) 4-[(E)-3-оксо-3-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропеніл]бензонітрил 46 180мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((s)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-ціанокоричну кислоту замість (Е)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, 4Η); 1,85-2,20 (m, 4Η); 2,40-2,75 (m, 6Η); 3,55-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,80 і 7,00 (обидва d, разом 1Н); 7,55-7,70 (m, 5Н). HPLC спосіб А: елюція 7,46хв. MS: підрах. для [М+Н]+: 310; знайд.: 310. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 30 (Загальна процедура (А)) (3-Хлорбензо[b]тієн-2-іл)-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)метанон 130мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 3-хлорбензо[b]тіофен-2-карбонову кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 11,352,15 (m, 8Η); 2,20-3,00 (m, 6Η); 3,30-3,80 (m, 2Η); 4,5-4,55 (m, 1Η); 7,45 (m, 2Η); 7,80 (m, 2Η). HPLC спосіб А: елюція 8,82хв. MS: підрах. для [М+Н]+: 349; знайд.: 349. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 31 (Загальна процедура (А)) (3-Метоксибензо[b]тієн-2-іл)-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)метанон 47 79263 48 310мг головної сполуки синтезували, як опиHPLC спосіб А: елюція 8,62хв. сано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідинMS: підрах. для [М+Н]+: 333; знайд.: 333. 1-іл)метил)піролідин-1-іл)пропенону, використовуГоловну сполуку перетворювали на її гідроючи 3-метоксибензо[b]тіофен-2-карбонову кислоту хлоридну сіль розчиненням її в етилацетаті (5мл). замість (Е)-4-бромкоричної кислоти. Додавали 3,2Μ розчин гідрохлориду в етилацетаті 1 (5мл). Розчинник видаляли у вакуумі. Залишок Н-ЯМР (CDCI3, 2 набори сигналів) d 1,40-2,95 розчиняли в етанолі (50мл). Розчинник видаляли у (m, 14Η); 3,45-3,75 (m, 2Η); 4,05 (s, 3Η); 4,25-4,55 (m, 1Η); 7,40 (m, 2Η); 7,75 (m, 2Η). вакуумі. Приклад 34 (Загальна процедура (А)) HPLC спосіб А: елюція 8,55хв. (7-(Етокси)бензофуран-2-іл)-((S)-2-((піролідинMS: підрах. для [М+Н]+: 345; знайд.: 345. 1-іл)метил)піролідин-1-іл)метанон Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 32 (Загальна процедура (А)) (Бензо[b]тієн-2-іл)-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)метанон 340мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 7-(етокси)бензо[b]фуран-2-карбонову кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,50 (t, 3Η); 1,60-1,85 (m, 4Η); 1,85-2,15 (m, 4Η); 2,15-2,90 (m, 6Η); 3,70 (m, 1Η); 3,90 і 4,05 (обидва m, разом 1Η); 4,20 (m, 2Η); 4,50 і 5,00 (обидва m, разом 1Н); 6,85 (d, 1Η); 7,10-7,30 (m, 2Η); 7,30-7,55 (m, 1Η). 130мг головної сполуки синтезували, як опиHPLC спосіб А: елюція 8,67хв. сано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідинMS: підрах. для [М+Н]+: 343; знайд.: 343. 1-іл)метил)піролідин-1-іл)пропенону, використовуГоловну сполуку перетворювали на її гідроючи бензо[b]тіофен-2-карбонову кислоту замість хлоридну сіль розчиненням її в етилацетаті (5мл). (Е)-4-бромкоричної кислоти. Додавали 3,2Μ розчин гідрохлориду в етилацетаті 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,55-1,85 (5мл). Розчинник видаляли у вакуумі. Залишок (m, 4Η); 1,85-2,15 (m, 4Η); 2,60 (m, 5Η); 2,80 (m, розчиняли в етанолі (50мл). Розчинник видаляли у 1Η); 3,85 (m, 2Η); 4,55 (m, 1Η); 7,40 (m, 2Η); 7,70 вакуумі. (m, 1Η); 7,85 (m, 2Η). Приклад 35 (Загальна процедура (А)) HPLC спосіб А: елюція 8,35хв. (Е)-3-(4-(Метилсульфоніл)феніл)-1-((S)-2+ MS: підрах. для [М+Н] : 315; знайд.: 315. ((піролідин-1-іл)метил)піролідин-1-іл)пропенон Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 33 (Загальна процедура (А)) (5-Хлорбензофуран-2-іл)-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)метанон Етап 1: Етиловий естер (Е)-3-(4(метилсульфоніл)феніл)акрилової кислоти 400мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи 5-хлорбензо[b]фуран-2-карбонову кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,70 (m, 4Η); 1,85-2,90 (m, 10Η); 3,65-4,10 (m, 2Η); 4,50 і 4,85 (обидва m, разом 1Η); 7,30-7,50 (m, 3Η); 7,65 (s, 1Η). Калій трет-бутоксид (10,96г, 98ммоль) в тетрагідрофурані (60мл) додавали порціями до розчину триетилфосфонацетату (21,91г, 98ммоль) в тетрагідрофурані (150мл). Реакційну суміш перемішували протягом 40хв за кімнатної температури. Розчин 4-(метилсульфоніл)бензальдегіду (Номер посилання: 42490-0025; 10,0г, 54ммоль) в тетрагідрофурані (60мл) додавали краплинами. Реакційну суміш перемішували протягом 1год за кімнатної температури. Суміш розбавляли етилацетатом 49 79263 50 (500мл) і промивали 1N соляною кислотою 1-іл)метил)піролідин-1-іл)пропенону, використову(300мл). Водну фазу екстрагували етилацетатом ючи (Е)-4-хлоркоричну кислоту замість (Е)-4бромкоричної кислоти та трет-бутиловий естер 2(2´100мл). Змішані органічні шари висушували над формілпіперидин-1-карбонової кислоти замість сульфатом магнію. Розчинник видаляли у вакуумі. трет-бутилового естеру (S)-2-формілпіролідин-1Сирий продукт очищали кристалізацією з етилацекарбонової кислоти. тату/гептану для одержання 4,3г етилового естеру 1 (E)-3-(4-(метилсульфоніл)феніл)акрилової кислоН-ЯМР (CDCI3, 2 набори сигналів) d 1,35-1,95 ти. (m, 10Η); 2,40-2,90 і 3,20 (обидва m, разом 7Η); 1 3,90 і 4,25 (обидва m, разом 1Н); 4,60 і 5,05 (обидН-ЯМР (CDCI3) d 1,35 (t, 3Η); 3,10 (s, 3Η); 4,30 ва m, разом 1Н); 6,90 (d, 1Η); 7,35 (d, 2Η); 7,45 (d, (q, 2Η); 6,55 (d, 1Η); 7,70 (m, 3Η); 7,95 (d, 2H). 2Η); 7,55 (d, 1Η). Етап 2: HPLC спосіб А: елюція 12,39хв. (E)-4-Метилсульфонілкорична кислота MS: підрах. для [М+Н]+: 333, знайд.: 333. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Розчин етилового естеру (Е)-3-(4Приклад 37 (Загальна процедура (А)) (метилсульфоніл)феніл)акрилової кислоти та гід(Е)-3-(4-Бромфеніл)-1-(2-((піролідин-1роксиду літію в діоксані/воді (100мл/100мл) переіл)метил)піперидин-1-іл)пропенон мішували протягом 16год за кімнатної температури. Промивали трет-бутилметиловим етером (200мл). Водну фазу закислювали 10% водним розчином гідросульфату натрію до рН 2. Осад виділяли фільтрацією й висушували у вакуумі. Залишок суспендували в етанолі (100мл). Розчинник видаляли. Останню процедуру повторювали один раз для одержання 2,74г сирої (Е)-490мг головної сполуки синтезували, як описаметилсульфонілкоричної кислоти, яку використоно для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин-1вували в наступному етапі без подальшого очиіл)метил)піролідин-1-іл)пропенону, використовующення. 1 чи трет-бутиловий естер 2-формілпіперидин-1Н-ЯМР (DMSO-d6) d 3,25 (s, 3Η); 6,70 (d, 1Η); карбонової кислоти замість трет-бутилового есте7,65 (d, 1Η); 7,95 (AB, 4Η); 12,60 (br, 1Η). ру (S)-2-формілпіролідин-1-карбонової кислоти. Етап 3 1 Н-ЯМР (CDCI3, 2 набори сигналів) 1,35-1,90 340мг головної сполуки синтезували, як опи(m, 10Н); 2,40-2,90 (m, 7Н); 3,90 і 4,25 (обидва m, сано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідинразом 1Н); 4,60 і 5,05 (обидва m, разом 1Н); 6,95 1-іл)метил)піролідин-1-іл)пропенону, використову(d, 1Η); 7,35 (d, 2Η); 7,45-7,65 (m, 3Η). ючи (Е)-4-метилсульфонілкоричну кислоту замість HPLC спосіб В: елюція 4,28хв. (Е)-4-бромкоричної кислоти. 1 MS: підрах. для [М+Н]+: 377; знайд.: 377. Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, Головну сполуку перетворювали на її гідро4Η); 1,85-2,20 (m, 4Η); 2-45-2,80 (m, 6Η); 3,05 (s, хлоридну сіль розчиненням її в етилацетаті (5мл). 3Η); 3,55-3,80 (m, 2Η); 4,10 і 4,40 (обидва m, разом Додавали 3,2Μ розчин гідрохлориду в етилацетаті 1Η); 6,85 і 7,05 (обидва d, разом 1Η); 7,65 (m, 3Η); (5мл). Розчинник видаляли у вакуумі. Залишок 7,95 (d, 1Η). розчиняли в етанолі (50мл). Розчинник видаляли у HPLC спосіб А: елюція 6,58хв. + вакуумі. MS: підрах. для [М+Н] : 363; знайд.: 363. Приклад 38 (Загальна процедура (А)) Головну сполуку перетворювали на її гідро(E)-1-(2-((Піролідин-1-іл)метил)піперидин-1-іл)хлоридну сіль розчиненням її в етилацетаті (5мл). 3-(4-(трифторметил)феніл)пропенон Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 36 (Загальна процедура (А)) (Е)-3-(4-Хлорфеніл)-1-(2-((піролідин-1іл)метил)піперидин-1-іл)пропенон 140мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин 130мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-(трифторметил)коричну кислоту замість (Е)-4-бромкоричної кислоти та трет-бутиловий естер формілпіперидин-1-карбонової кислоти замість трет-бутилового естеру (S)-2 51 79263 52 формілпіролідин-1-карбонової кислоти. HPLC спосіб А: елюція 7,34хв. 1 MS: підрах. для [М+Н]+: 291; знайд.: 291. Н-ЯМР (CDCI3, 2 набори сигналів) d 1,40-1,95 (m, 10Η); 2,45-2,85 (m, 7Η); 3,90-4,25 (обидва m, Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). разом 1Η); 4,60 і 5,00 (обидва m, разом 1Η); 7,00 Додавали 3,2Μ розчин гідрохлориду в етилацетаті (d, 1Η); 7,55-7,65 (m, 5Η). (5мл). Розчинник видаляли у вакуумі. Залишок HPLC спосіб В: елюція 4,44хв. розчиняли в етанолі (50мл). Розчинник видаляли у MS: підрах. для [М+Н]+: 367; знайд.. 367. Головну сполуку перетворювали на її гідровакуумі. Приклад 41 (Загальна процедура (А)) хлоридну сіль розчиненням її в етилацетаті (5мл). (Е)-1-((S)-2-((Піролідин-1-іл)метил)піролідин-1Додавали 3,2Μ розчин гідрохлориду в етилацетаті іл)-3-(тієн-3-іл)пропенон (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 39 (Загальна процедура (А)) (E)-3-(4-Метоксифеніл)-1-(2-((піролідин-1іл)метил)піперидин-1-іл)пропенон 100мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-хлоркоричну кислоту замість (Е)-4бромкоричної кислоти та трет-бутиловий естер 2формілпіперидин-1-карбонової кислоти замість трет-бутилового естеру (S)-2-формілпіролідин-1карбонової кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,30-1,95 (m, 10Η); 2,40-3,20 (m, 7Η); 3,85 (s, 3Η); 4,00 і 4,25 (обидва m, разом 1Η); 4,60 і 5,00 (обидва m, разом 1Η); 6,80 (d, 1Η); 6,90 (d, 2Η); 7,45 (d, 2Η); 7,60 (d, 1Η). HPLC спосіб В: елюція 3,79хв. MS: підрах. для [М+Н]+: 329; знайд.: 329. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 40 (Загальна процедура (А)) (Е)-1-((S)-((2-Піролідин-1-іл)метил)піролідин-1іл)-3-(тієн-2-іл)пропенон 160мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(тієн-2-іл)акрилову кислоту замість (Е)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,80 (m, 4Н); 1,85-2,15 (m, 4Н); 2,35-2,75 (m, 6Н); 3,50-3,70 (m, 2Н); 4,10 і 4,35 (обидва m, разом 1Н); 6,52 і 6,65 (обидва d, разом 1Н); 7,05 (m, 1Н); 7,20 (m, 1Н); 7,30 (m, 1Н); 7,80 (d, 1Η). 100мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(тієн-3-іл)акрилову кислоту замість (Е)-4бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, 4Η); 1,85-2,20 (m, 4Η); 2,40-2,80 (m, 6Η); 3,50-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,55 і 6,70 (обидва d, разом 1Н); 7,20-7,35 (m, 2Н); 7,45 (m, 1Н); 7,70 (dd, 1Η). HPLC спосіб А: елюція 7,32хв. MS: підрах. для [М+Н]+: 291; знайд.: 291. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 42 (Загальна процедура (А)) (Е)-3-(Фуран-2-іл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенон 78мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(фуран-2-іл)акрилову кислоту замість (Е)4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,70 (m, 4Η); 1,85-2,20 (m, 4Η); 2,40-2,80 (m, 6Η); 3,50-3,75 (m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,45 (m, 1Η); 6,55 (m, 1Η); 6,65 і 6,75 (обидва d, разом 1Η); 7,45 (m, 2Η). HPLC спосіб А: елюція 6,78хв. MS: підрах. для [М+Н]+: 275; знайд.: 275. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 43 (Загальна процедура (А)) (E)-3-(Фуран-3-іл)-1-((S)-2-((піролідин-1 53 іл)метил)піролідин-1-іл)пропенон 79263 190мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(фуран-3-іл)акрилову кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, 4Η); 1,85-2,20 (m, 4Η); 2,40-2,75 (m, 6Η); 3,45-3,70 (m, 2Η); 4,10 і 4,35 (обидва m, разом 1Η); 6,45 і 6,55 (d і m, разом 2Η); 7,40 (s, 1Η); 7,55-7,65 (m, разом 2Η). HPLC спосіб А: елюція 6,66хв. MS: підрах. для [М+Н]+: 275; знайд.: 275. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 44 (Загальна процедура (А)) 4-[(Е)-3-оксо-3-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропеніл]феніловий естер метансульфонової кислоти Етап 1: 4-Формілфеніловий естер метансульфонової кислоти За 0°С хлорид метансульфонілу (9,51мл, 0,123моль) додавали до розчину 4гідроксибензальдегіду (15г, 0,123моль) в піридині (12,91мл, 0,160моль). Реакційну суміш перемішували за 0°С протягом 3год і лишали за кімнатної температури протягом 16год. Додавали конц. соляну кислоту/льод (200мл/200мл). Суміш екстрагували етилацетатом (4´300мл). Змішані органічні шари промивали 5% водним розчином гідрокарбонату натрію (3´200мл) і сольовим розчином (100мл). їх висушували над сульфатом магнію. Розчинник видаляли у вакуумі для одержання 22,87г сирої 4-формілфенілового естеру метансульфонової кислоти, яку використовували в наступному етапі без подальшого очищення. 54 Н-ЯМР (CDCI3) d 13,22 (s, 3Η); 7,45 (d, 2Η); 8,00 (d, 2Η); 10,02 (s, 1Η). Етап 2: (Е)-3-(4-(Метансульфонілокси)феніл)акрилова кислота 1 Малонову кислоту (7,80г, 74,92ммоль) додавали до розчину сирого 4-формілфенілового естеру метансульфонової кислоти (10г, 49,95ммоль), яку синтезували в попередньому етапі, і піперидину (0,7мл, 7,09ммоль) в піридині (50мл). Реакційну суміш нагрівали до 90°С протягом 2,5год. Її охолоджували до кімнатної температури. Додавали концентровану соляну кислоту/льод (400мл/100мл). Осад відфільтровували й промивали 10% водним розчином оцтової кислоти (200мл). Його висушували у вакуумі для одержання 6,95г (E)-3-(4(метансульфонілокси)феніл)акрилової кислоти. 1 Н-ЯМР (DMSO-d6) d 3,40 (s, 3Η); 6,55 (d, 1Η); 7,40 (d, 2Η); 7,60 (d, 1Η); 7,80 (d, 2Η). Етап 3: 150мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(4-(метансульфонілокси)феніл)акрилову кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, 4Η); 1,85-2,20 (m, 4Η); 2,40-2,80 (m, 5Η); 3,15 (s, 3Η); 3,50-3,75 (m, 2Η); 4,15 і 4,40 (m, 1Η); 6,70 і 6,85 (обидва d, разом 1Η); 7,30 (m, 2Η); 7,55 (d, 2Η); 7,65 (d, 1Η). HPLC спосіб А: елюція 7,50хв. MS: підрах. для[М+Н]+: 379; знайд.: 379. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 45 (Загальна процедура (А)) 4-[(Е)-3-оксо-3-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропеніл]феніловий естер трифторметансульфонової кислоти Етап 1: (Е)-3-(4(Трифторметилсульфонілокси)феніл)акрилова кислота 13,4г (Е)-3-(4(трифторметилсульфонілокси)феніл)акрилової кислоти синтезували, як описано для (Е)-3-(4 55 79263 56 (метансульфонілокси)феніл)акрилової кислоти, Приклад 47 (Загальна процедура (А)) використовуючи хлоридметансульфоніловий ангі(E)-1-((S)-2-((Піперидин-1-іл)метил)піролідиндрид трифторметансульфонової кислоти. 1-іл)-3-(3-трифторметилфеніл)пропенон 1 Н-ЯМР (D MSO-d6) d 6,60 (d, 1Η); 7,55 (d, 2Η); 7,65 (d, 1Η); 7,90 (d, 2Η). Етап 2: 130мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(4310мг головної сполуки синтезували, як опи(трифторметилсульфонілокси)феніл)акрилову сано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідинкислоту замість (Е)-4-бромкоричної кислоти. 1 1-іл)метил)піролідин-1-іл)пропенону, використовуН-ЯМР (CDCI3, 2 набори сигналів) d 1,75 (m, ючи 1-(((S)-піролідин-2-іл)метил)піперидин замість 4Η); 1,85-2,15 (m, 4Η); 2,40-2,80 (m, 5Η); 3,55-3,75 (S)-2-((піролідин-1-іл)метил)піролідину та (Е)-3(m, 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,70 і (трифторметил)коричну кислоту замість (Е)-46,90 (обидва d, разом 1Н); 7,30 (d, 2Η); 7,60 (d, бромкоричної кислоти. 2Η); 7,65 (d, 1Η). 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,40 (m, HPLC спосіб А: елюція 9,97хв. + 2Η); 1,55 (m, 4Η); 1,80-2,15 (m, 4Η); 2,15-2,70 (m, MS: підрах. для [М+Н] : 433; знайд.: 433. 6Η); 3,60 і 3,70 (обидва m, разом 2Η); 4,15 і 4,40 Головну сполуку перетворювали на її гідро(обидва m, разом 1Н); 6,80 і 7,05 (обидва d, разом хлоридну сіль розчиненням її в етилацетаті (5мл). 1Н); 7,45-7,85 (m, разом 5Н). Додавали 3,2Μ розчин гідрохлориду в етилацетаті HPLC спосіб А: елюція 9,73хв. (5мл). Розчинник видаляли у вакуумі. Залишок MS: підрах. для [М+Н]+: 367; знайд.: 367. розчиняли в етанолі (50мл). Розчинник видаляли у Головну сполуку перетворювали на її гідровакуумі. хлоридну сіль розчиненням її в етилацетаті (5мл). Приклад 46 (Загальна процедура (А)) Додавали 3,2Μ розчин гідрохлориду в етилацетаті 3-[(Е)-3-Оксо-3-((S)-2-((піролідин-1(5мл). Розчинник видаляли у вакуумі. Залишок іл)метил)піролідин-1-іл)пропеніл]бензонітрил розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 48 (Загальна процедура (А)) 3-[(Е)-3-Оксо-3-((S)-2-((піперидин-1іл)метил)піролідин-1-іл)пропеніл]бензонітрил Етап 1: (Е)-3-(3-Ціанофеніл)акрилова кислота 11,3г (Е)-3-(3-ціанофеніл)акрилову кислоту синтезували, як описано для (Е)-3-(4(метансульфонілокси)феніл)акрилової кислоти, використовуючи 3-ціанобензальдегід (комерційно доступний в Aldrich) замість 4-формілфенілового естеру метансульфонової кислоти. 1 Н-ЯМР (D MSO-d6) d 6,70 (d, 1Η); 7,60 (m, 2Η); 7,85 (d, 1Η); 8,05 (d, 1Η); 8,25 (s, 1Η); 12,50 (br, 1Η). Етап 2: 220мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(3-ціанофеніл)акрилову кислоту замість (Е)-4-бромкоричної кислоти. 1 Н-ЯМР (як сіль трифторооцтової кислоти, CDCI3) d 1,90 (m, 1Η); 2,00-2,30 (m, 7Η); 3,05-3,20 (m, 2Η); 3,25 (m, 1Η); 3,65 (m, 1Η); 3,70-3,90 (m, 3Η); 4,15 (m, 1Η); 4,50 (m, 1Η); 6,75 (d, 1Η); 7,55 (t, 1Η); 7,65 (d, 1Η); 7,70 (d, 1Η); 7,75 (d, 1Η); 7,85 (s, 1Η). HPLC спосіб А: елюція 7,37хв. MS: підрах. для [М+Н]+: 310; знайд.: 310. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. 370мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(3-ціанофеніл)акрилову кислоту замість (Е)-4-бромкоричної кислоти та 1-(((S)-піролідин-2іл)метил)піперидин замість (S)-2-((піролідин-1іл)метил)піролідину. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,40 (m, 2Η); 1,55 (m, 4Η); 1,85-2,15 (m, 4Η); 2,15-2,55 (m, 5Η); 2,65 (m, 1Η); 3,60 і 3,75 (обидва m, разом 2Η); 4,15 і 4,40 (обидва m, разом 1Н); 6,75 і 7,05 (обидва d, разом 1Н); 7,50 (t, 1Η); 7,60-7,75 (m, 4Η); 7,85 (d, 1H). HPLC спосіб В: елюція 3,10хв. MS: підрах. для [М+Н]+: 324; знайд.: 324. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 49 (Загальна процедура (А)) 4-[(Е)-3-Оксо-3-((S)-2-((піперидин-1іл)метил)піролідин-1-іл)пропеніл]бензонітрил 57 79263 150мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-ціанокоричну кислоту замість (Е)-4бромкоричної кислоти та 1-(((S)-піролідин-2іл)метил)піперидин замість (S)-2-((піролідин-1іл)метил)піролідину. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,30-1,65 (m, 6Η); 1,95-2,15 (m, 4Η); 2,15-2,70 (m, 6Η); 3,60 і 3,70 (обидва m, разом 2Η); 4,15 і 4,40 (обидва m, разом 1Η); 6,80 і 7,05 (обидва d, разом 1Η); 7,507,70 (m, 5Η). HPLC спосіб В: елюція 3,05хв. MS: підрах. для [М+Н]+: 324; знайд.: 324. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 50 (Загальна процедура (А)) (Е)-3-(4-(Метилсульфоніл)феніл)-1-((S)-2((піперидин-1-іл)метил)піролідин-1-іл)пропенон 190мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-4-метилсульфонілкоричну кислоту замість (Е)-4-бромкоричної кислоти 1-(((S)-піролідин-2іл)метил)піперидин замість (S)-2-((піролідин-1іл)метил)піролідину. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, 2Η); 1,50-1,70 (m, 4Η); 1,85-2,15 (m, 4Η); 2,15-2,70 (m, 6Η); 3,10 (s, 3Η); 3,65 і 3,75 (обидва m, разом 2Η); 4,20 і 4,40 (обидва m, разом 1Η); 6,85 і 7,10 (обидва d, разом 1Н); 7,70 (m, 3Н); 7,95 (d, 2Η). HPLC спосіб В: елюція 2,60хв. MS: підрах. для [М+Н]+: 377; знайд.: 377. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 51 (Загальна процедура (А)) 4-[(Е)-3-Оксо-3-((S)-2-((піперидин-1іл)метил)піролідин-1-іл)пропеніл]феніловий естер метансульфонової кислоти 58 230мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(4-(метансульфонілокси)феніл)акрилову кислоту замість (Е)-4-бромкоричної кислоти та 1(((S)-піролідин-2-іл)метил)піперидин замість (S)-2((піролідин-1-іл)метил)піролідину. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, 2Η); 1,55 (m, 4Η); 1,70-2,15 (m, 4Η); 2,15-2,70 (m, 6H); 3,15 (s, 3Η); 3,60 і 3,70 (обидва m, разом 2Η); 4,15 і 4,35 (обидва m, разом 1Η); 6,70 і 6,90 (обидва d, разом 1Н); 7,30 (d, 2Η); 7,55 (d, 2Η); 7,65 (d, 1Η). HPLC спосіб В: елюція 3,17хв. MS: підрах. для [М+Н]+: 393, знайд.: 393. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 52 (Загальна процедура (А)) 4-[(E)-3-Оксо-3-((S)-2-((піперидин-1іл)метил)піролідин-1-іл)пропеніл]феніловий естер трифторметансульфонової кислоти 190мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(4(трифторметилсульфонілокси)феніл)акрилову кислоту замість (Е)-4-бромкоричної кислоти 1-(((S)піролідин-2-іл)метил)піперидин замість (S)-2((піролідин-1-іл)метил)піролідин. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,30-2,70 (m, 16Η); 3,60 і 3,70 (обидва m, разом 2Η); 4,15 і 4,40 (обидва m, разом 1Н); 6,70 і 6,95 (обидва d, разом 1Н); 7,30 (d, 2Η); 7,60 (d, 2Η); 7,65 (d, 1Η). HPLC спосіб В: елюція 4,45хв. MS: підрах. для [М+Н]+: 447; знайд.: 447. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 53 (Загальна процедура (А)) 2-Фтор-5-[(E)-3-оксо-3-((S)-2-((піперидин-1 59 іл)метил)піролідин-1-іл)пропеніл]бензонітрил 79263 Етап 1: (Е)-3-(3-Ціано-4-фторфеніл)акрилова кислота 5,52г (Е)-3-(3-ціано-4-фторфеніл)акрилової кислоти синтезували, як описано для (Е)-3-(4(метансульфонілокси)феніл)акрилової кислоти, використовуючи 4-фтор-3-ціанобензальдегід (комерційно доступний в Aldrich) замість 4формілфенілового естеру метансульфонової кислоти. 1 Н-ЯМР (D MSO-d6) d 6,60 (d, 1Η); 7,55 (m, 2Η); 8,15 (m, 1Η); 8,35 (dd, 1Η); 12,50 (br, 1Η). Етап 2: 300мг головної сполуки синтезували, як описано для (E)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-3-(3-ціано-4-фторфеніл)акрилову кислоту замість (Е)-4-бромкоричної кислоти та 1-(((S)піролідин-2-іл)метил)піперидин замість (S)-2((піролідин-1-іл)метил)піролідину. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,45 (m, 2Η); 1,55 (m, 4Η); 2,85-2,10 (m, 4Η); 2,15-2,55 (m, 5Η); 2,65 (m, 1Η); 3,60 і 3,70 (обидва m, разом 2Η); 4,15 і 4,40 (обидва m, разом 1Н); 6,70 і 7,00 (обидва d, разом 1Н); 7,20 (m, 1Н); 7,60 (dd, 1Η); 7,70 (m, 1Η); 7,80 (m, 1Η). HPLC спосіб В: елюція MS: підрах. для [М+Н]+: 342; знайд.: 342. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 54 (Загальна процедура (А)) (Е)-3-(2-Фтор-4-трифторметилфеніл)-1-((S)-2((піперидин-1-іл)метил)піролідин-1-іл)пропенон 60 5,12г (Е)-2-Фтор-4-(трифторметил)коричної кислоти синтезували, як описано для (Е)-3-(4(метансульфонілокси)феніл)акрилової кислоти, використовуючи 2-фтор-4трифторметилбензальдегід (комерційно доступний від Aldrich) замість 4-формілфенілового естеру метансульфонової кислоти. 1 Н-ЯМР (D MSO-d6) d 6,70 (d, 1Η); 7,65 (m, 2Η); 7,80 (d, 1Η); 8,10 (t, 1Η); 12,00 (br, 1Η). Етап 2: 220мг головної сполуки синтезували, як описано для (Е)-3-(4-бромфеніл)-1-((S)-2-((піролідин1-іл)метил)піролідин-1-іл)пропенону, використовуючи (Е)-2-фтор-4-(трифторметил)коричну кислоту замість (Е)-4-бромкоричної кислоти та 1-(((S)піролідин-2-іл)метил)піперидин замість (S)-2((піролідин-1-іл)метил)піролідину. 1 Н-ЯМР (CDCI3, 2 набори сигналів) d 1,40 (m, 2Η); 1,55 (m, 4Η); 1,75-2,15 (m, 4Η); 2,15-2,70 (m, 6Η); 3,60 і 3,70 (обидва m, разом 2Н); 4,15 і 4,40 (обидва m, разом 1Н); 6,95 і 7,15 (обидва d, разом 1Н); 7,30-7,45 (m, 2 Н); 7,60 m, 1Н); 7,65-7,80 (m, 2Н). HPLC спосіб В: елюція 4,54хв. MS: підрах. для [М+Н]+: 385; знайд.: 385. Головну сполуку перетворювали на її гідрохлоридну сіль розчиненням її в етилацетаті (5мл). Додавали 3,2Μ розчин гідрохлориду в етилацетаті (5мл). Розчинник видаляли у вакуумі. Залишок розчиняли в етанолі (50мл). Розчинник видаляли у вакуумі. Приклад 55 (Загальна процедура (А)) (Загальна процедура (С)): (Е)-3-(2-Фтор-4трифторметилфеніл)-1-((S)-2-((піролідин-1іл)метил)піролідин-1-іл)пропенон Етап 1: трет-Бутиловий естер (S)-2-(Піролідин-1ілкарбоніл)піролідин-1-карбонової кислоти Етап 1: (Е)-2-Фтор-4-(трифторметил)корична кислота За 0°С сіль гідрохлориду 1-(3диметиламінопропіл)-3-етилкарбодііміду (17,81г, 93ммоль) додавали до розчину (S)-1-(трет
ДивитисяДодаткова інформація
Назва патенту англійськоюAmides of aminoalkyl-substituted azetidines, pyrrolidines, piperidines and azepanes, the pharmaceutical composition based thereon and use thereof
Автори англійськоюPESCHKE BERND
Назва патенту російськоюАмиды аминоалкилзамещенных азетидинов, пирролидинов, пиперидинов и азепанов, фармацевтическая композиция на их основе и их использование
Автори російськоюПешке Бернд
МПК / Мітки
МПК: A61P 25/24, A61K 31/4025, A61P 25/28, C07D 207/09, A61P 19/02, A61P 9/10, A61P 25/26, C07D 409/06, A61P 1/08, A61K 31/454, C07D 211/26, A61P 1/04, A61P 3/10, C07D 521/00, A61P 25/20, A61P 3/06, A61P 37/00, A61P 3/00, A61P 3/04, C07D 405/06, A61P 11/02, A61P 9/12, A61P 25/08, A61P 1/12, A61P 25/00, A61P 11/06, C07D 403/10, A61P 25/06, A61K 31/4196, A61P 35/00, A61P 37/08, A61P 1/16, A61P 43/00
Мітки: азепанів, композиція, використання, фармацевтична, аміди, аміноалкілзаміщених, основі, піролідинів, азетидинів, піперидинів
Код посилання
<a href="https://ua.patents.su/42-79263-amidi-aminoalkilzamishhenikh-azetidiniv-pirolidiniv-piperidiniv-ta-azepaniv-farmacevtichna-kompoziciya-na-kh-osnovi-ta-kh-vikoristannya.html" target="_blank" rel="follow" title="База патентів України">Аміди аміноалкілзаміщених азетидинів, піролідинів, піперидинів та азепанів, фармацевтична композиція на їх основі та їх використання</a>
Попередній патент: Спосіб одержання цеолітного каталізатора ізомеризації нормальних парафінів
Наступний патент: Бурильна головка
Випадковий патент: Спосіб рішення задачі планування паралельного розподілу задач в grid-системах