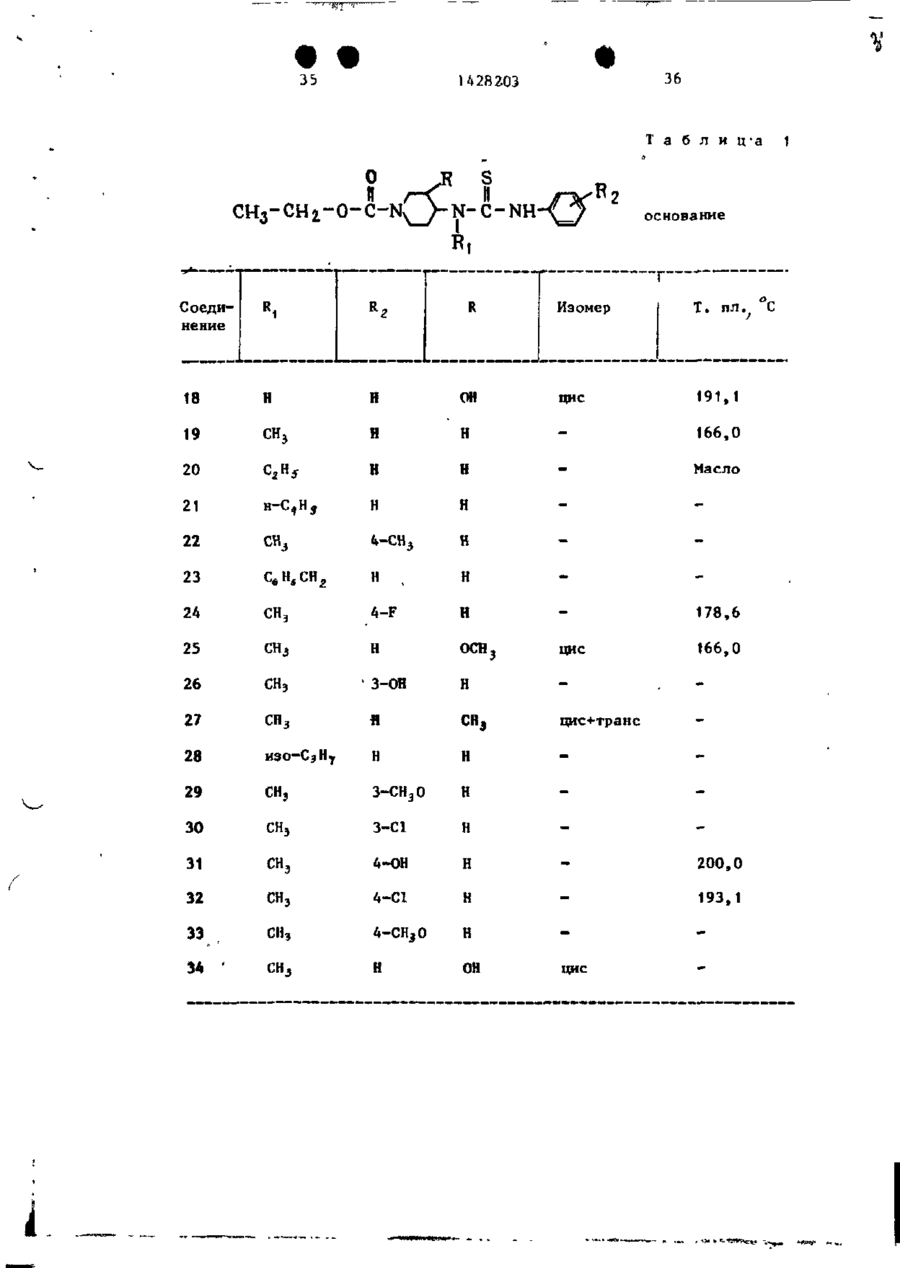
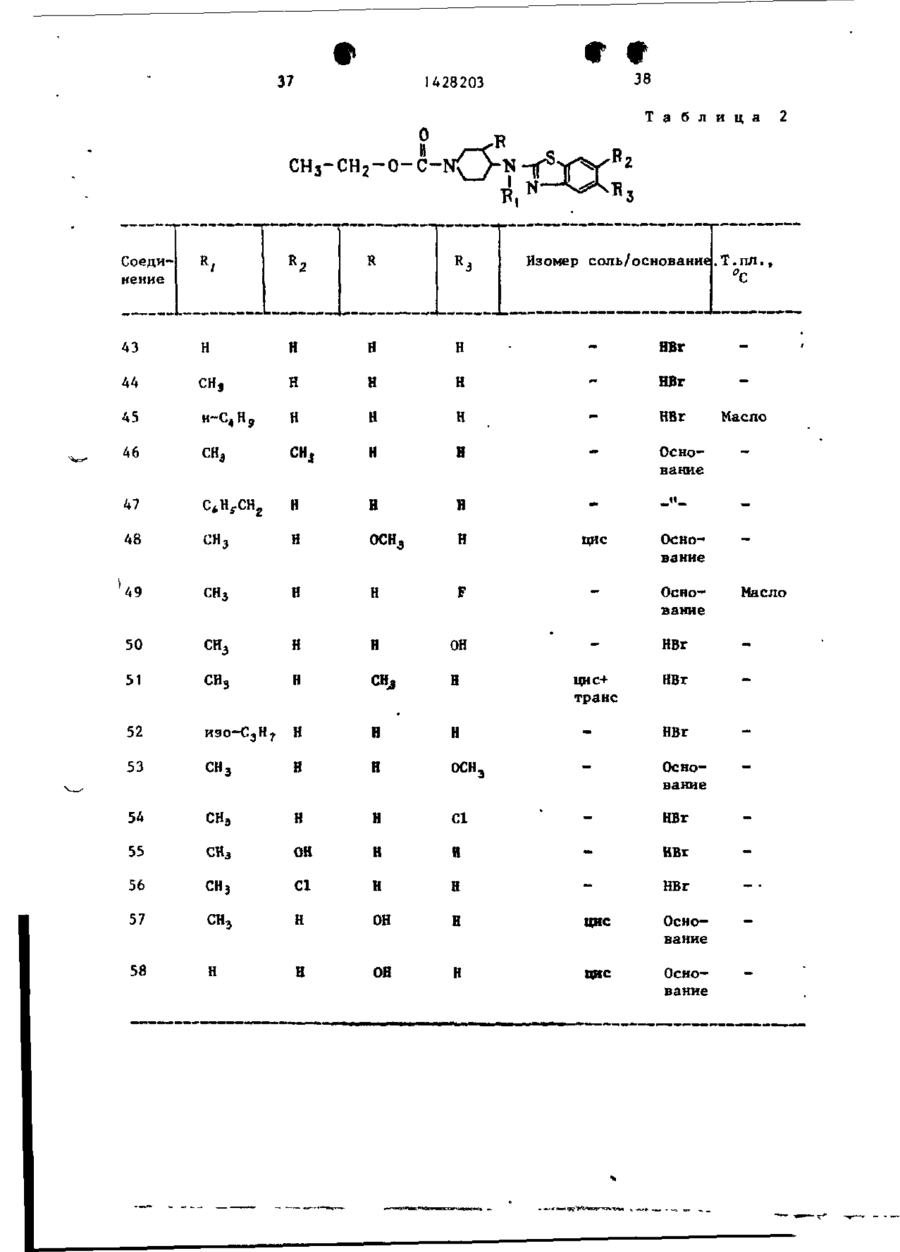
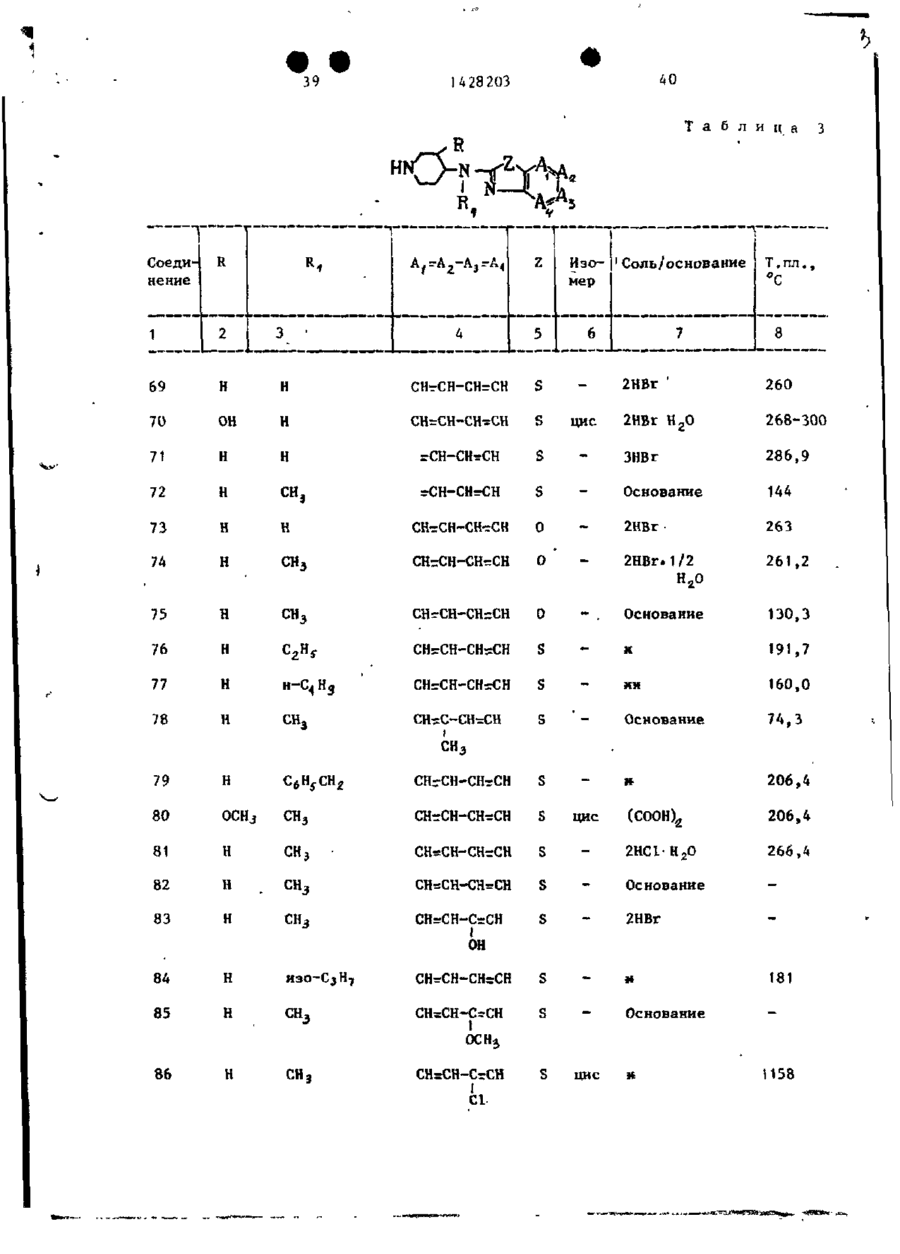
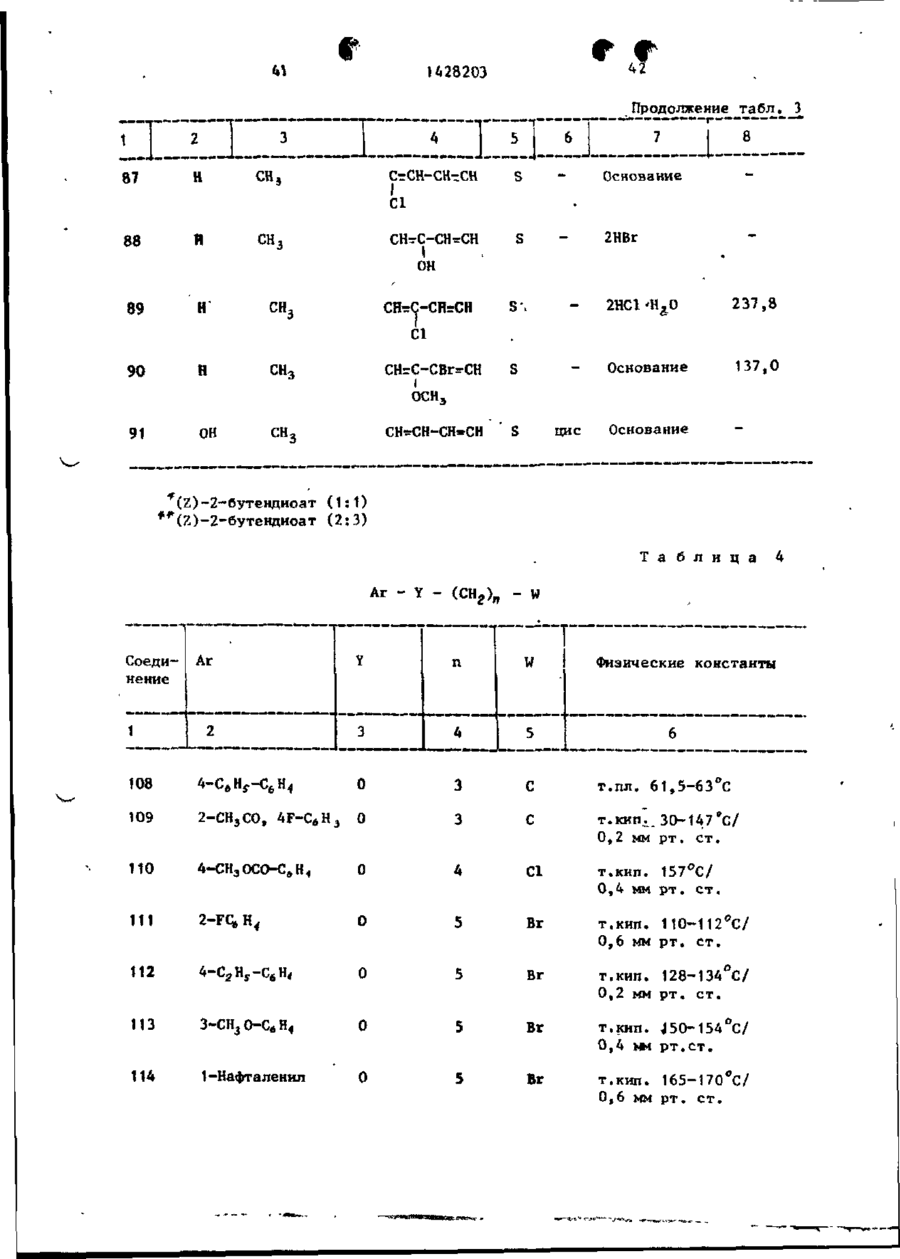
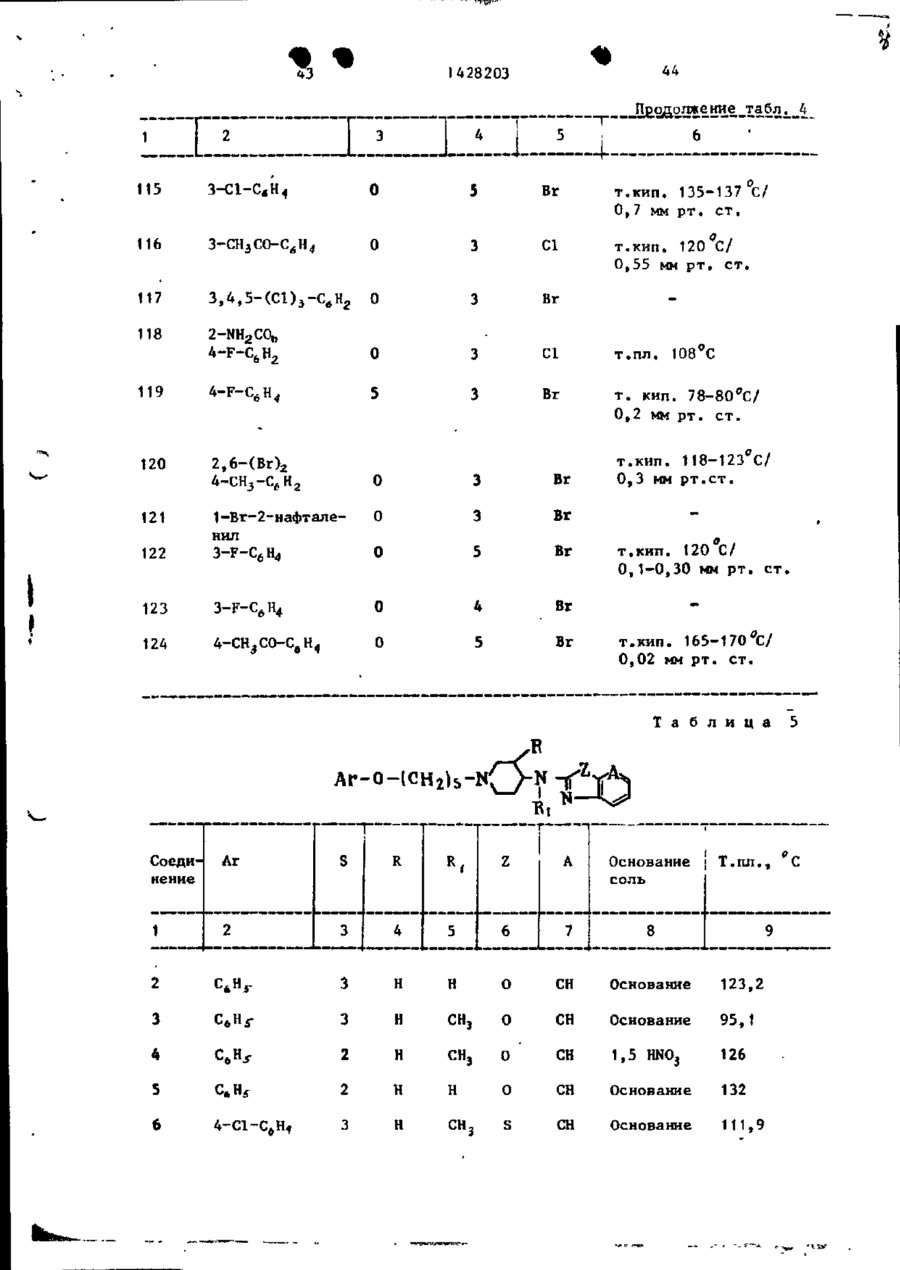
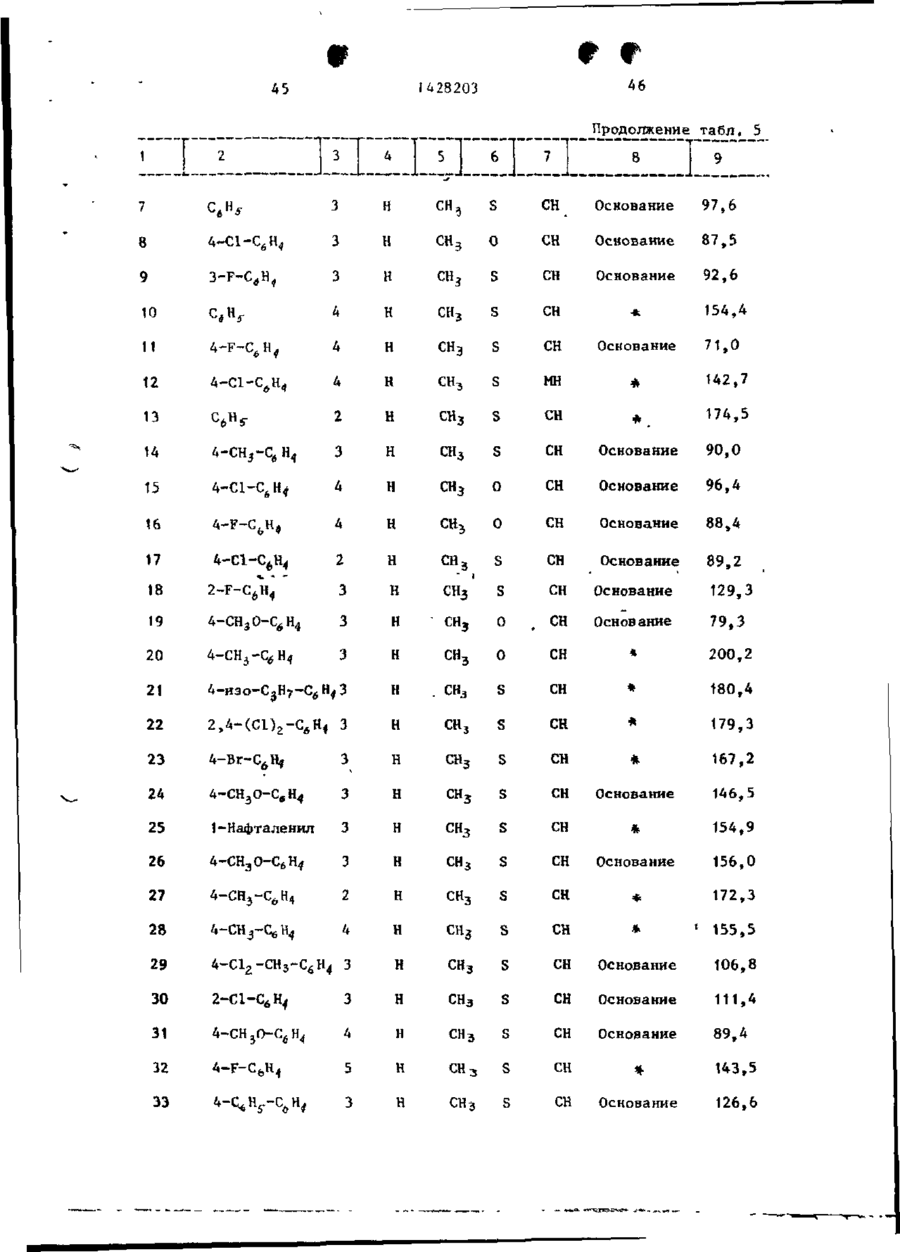
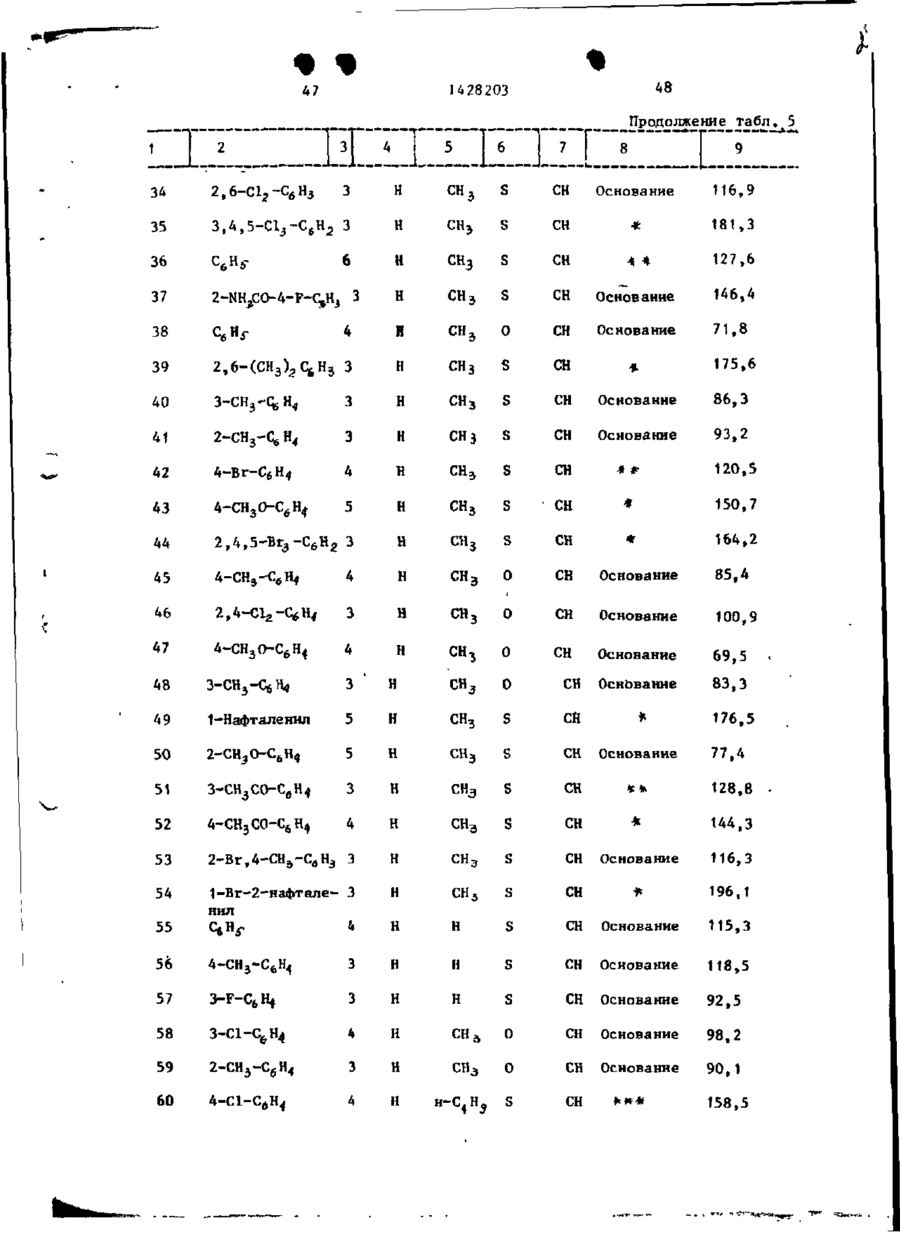
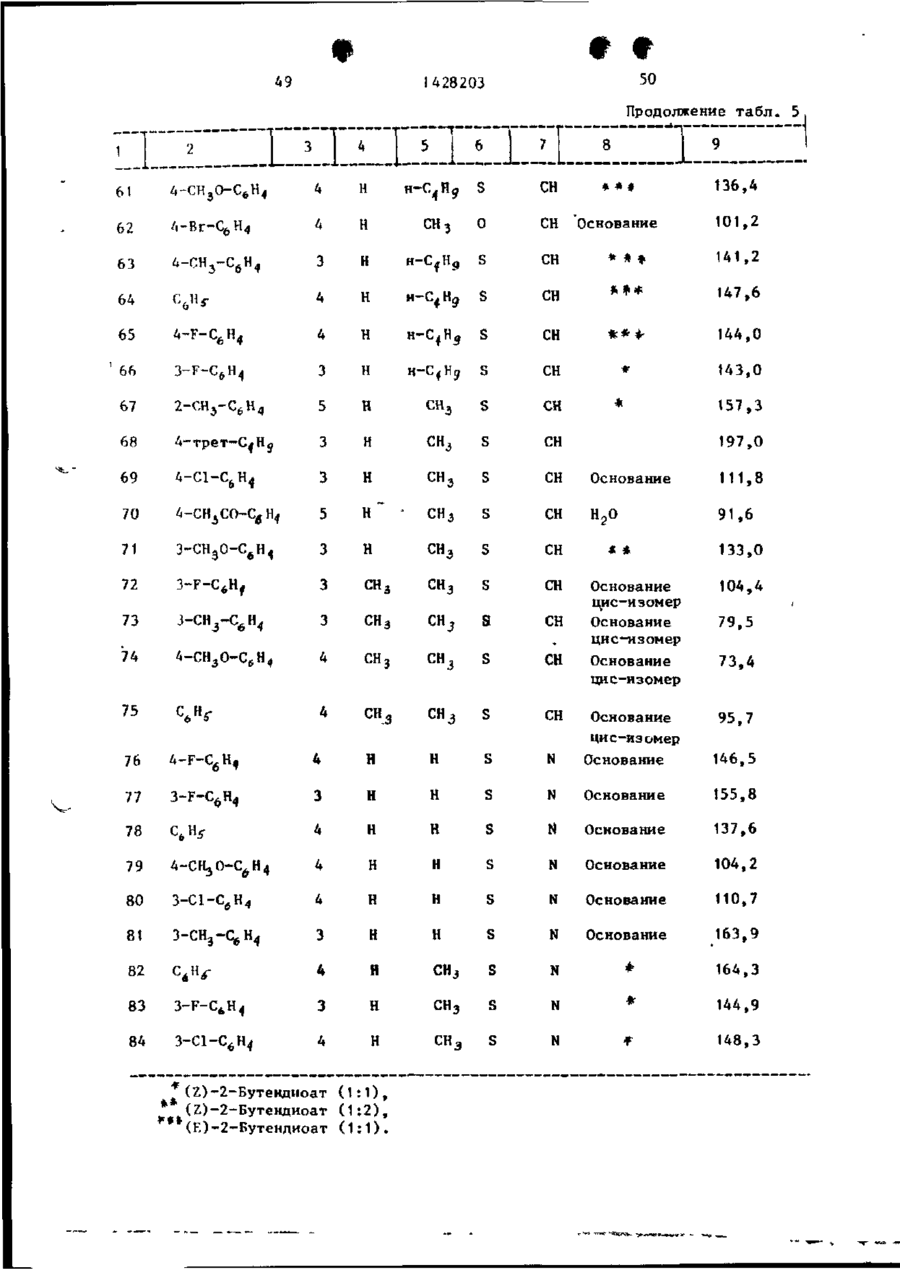
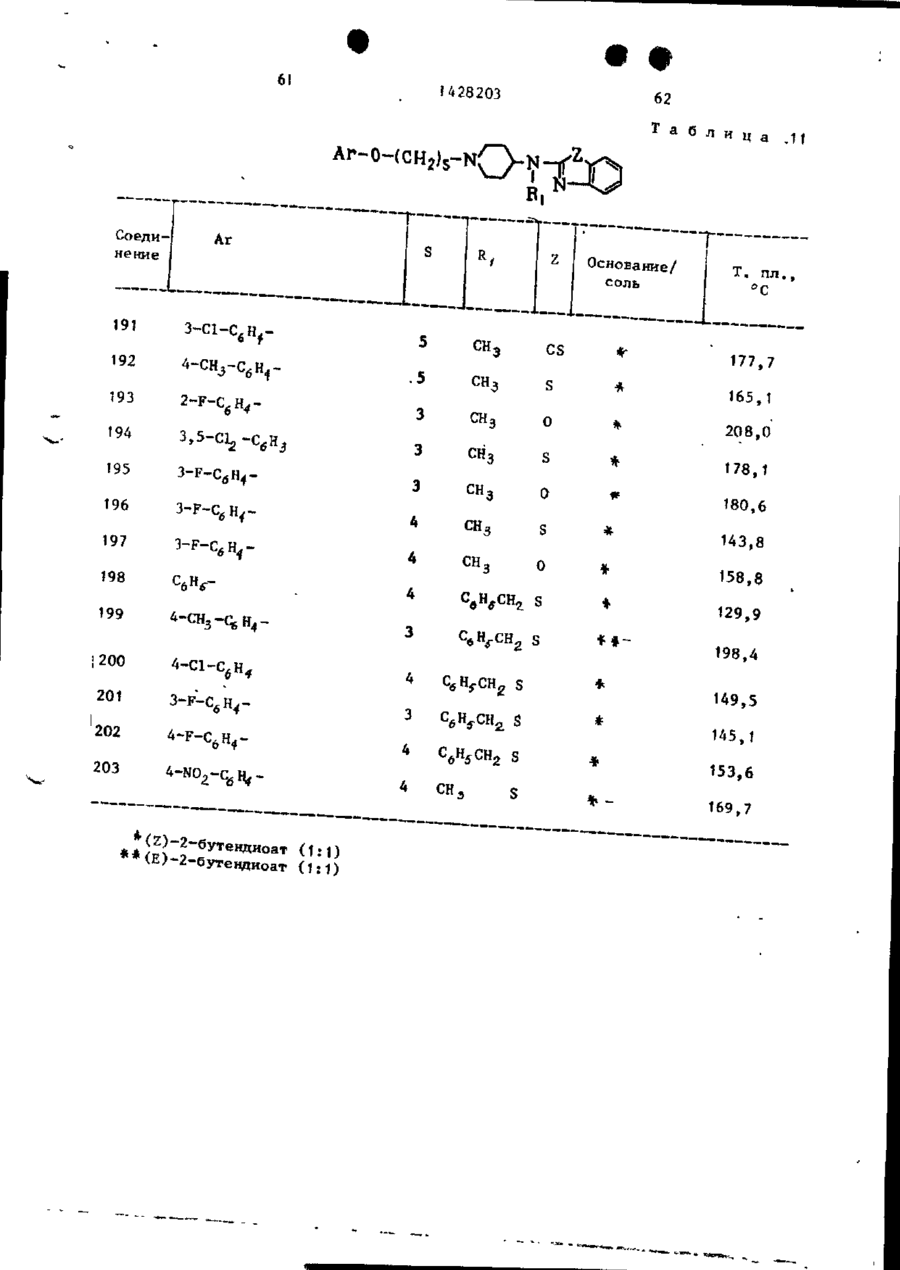
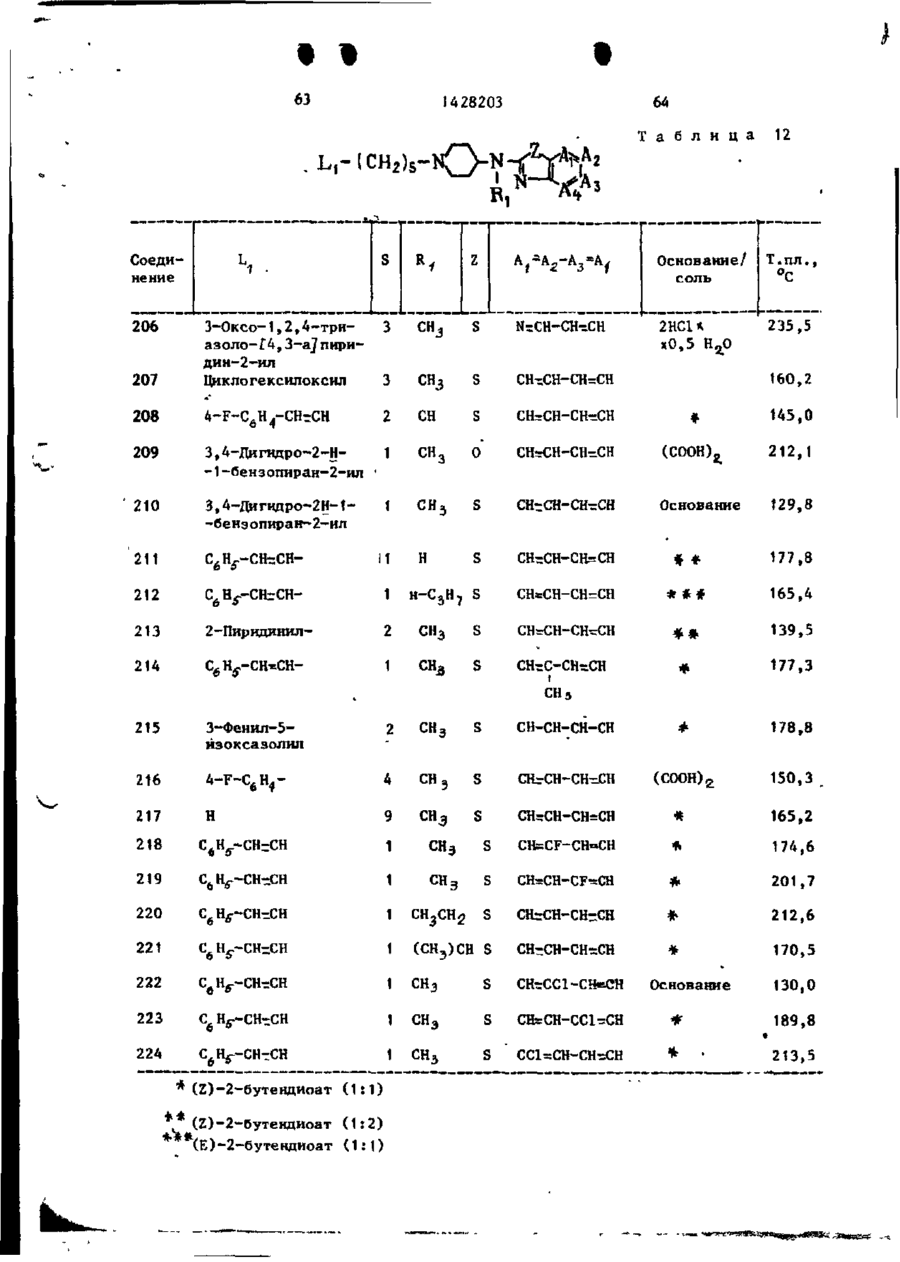
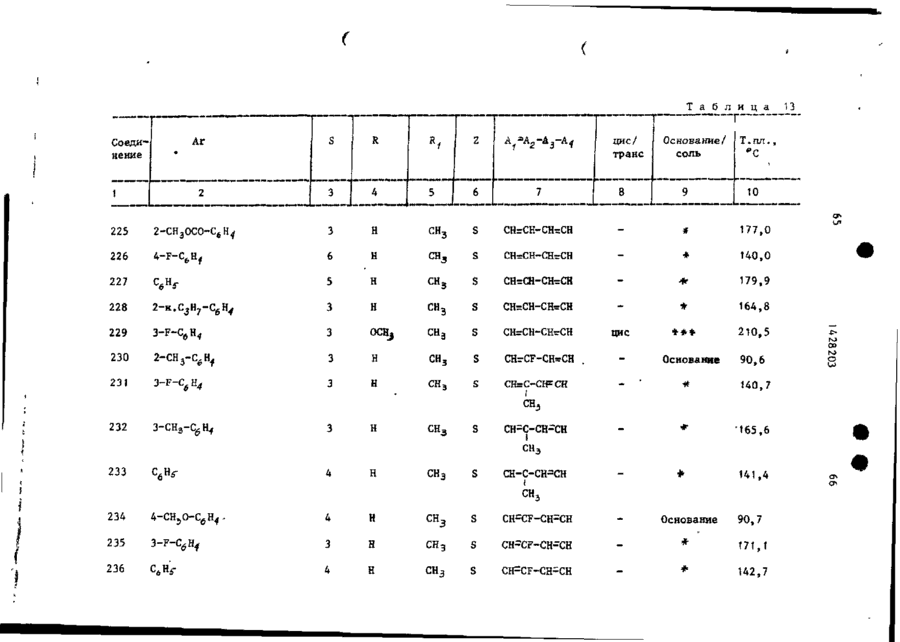
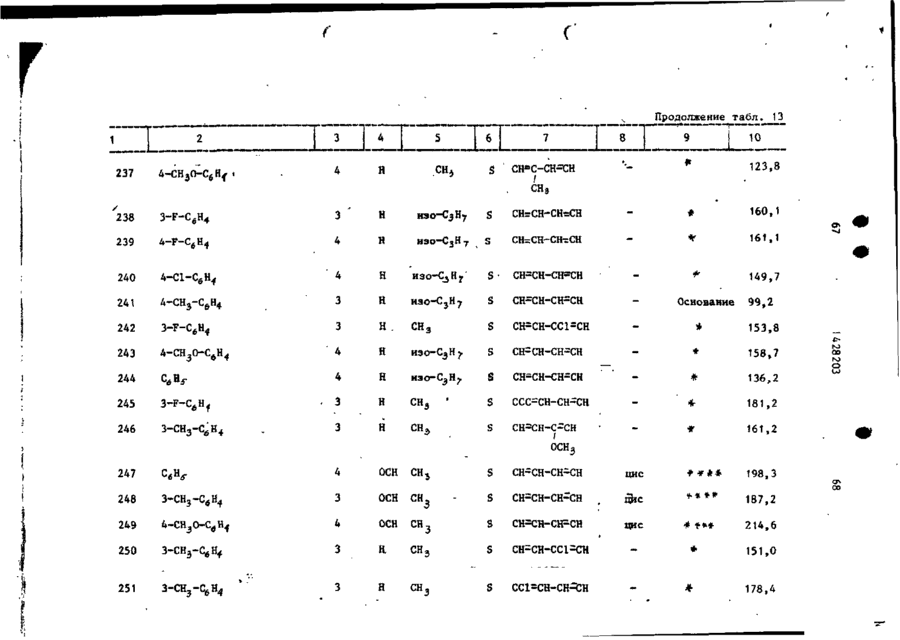
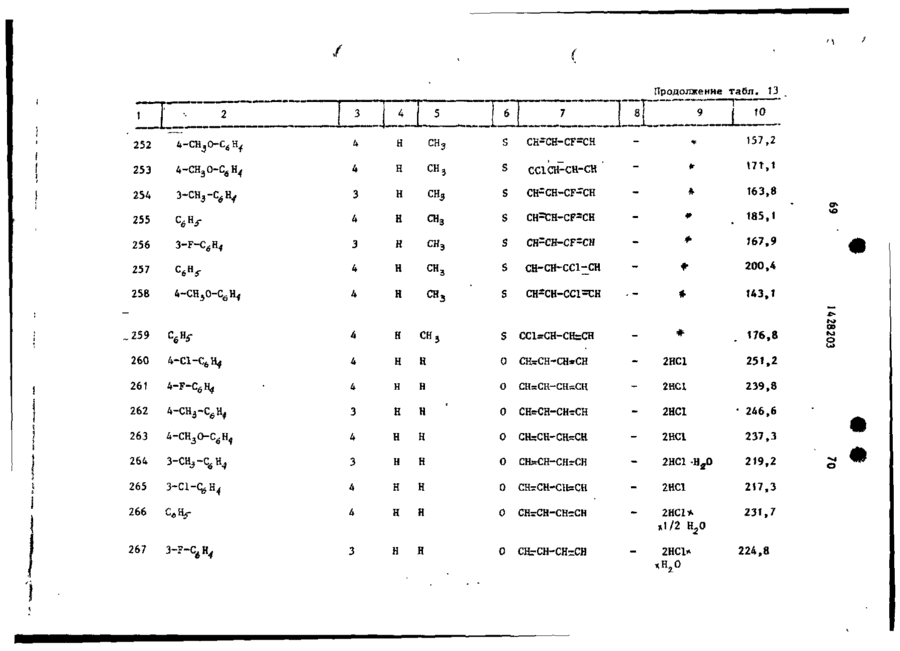
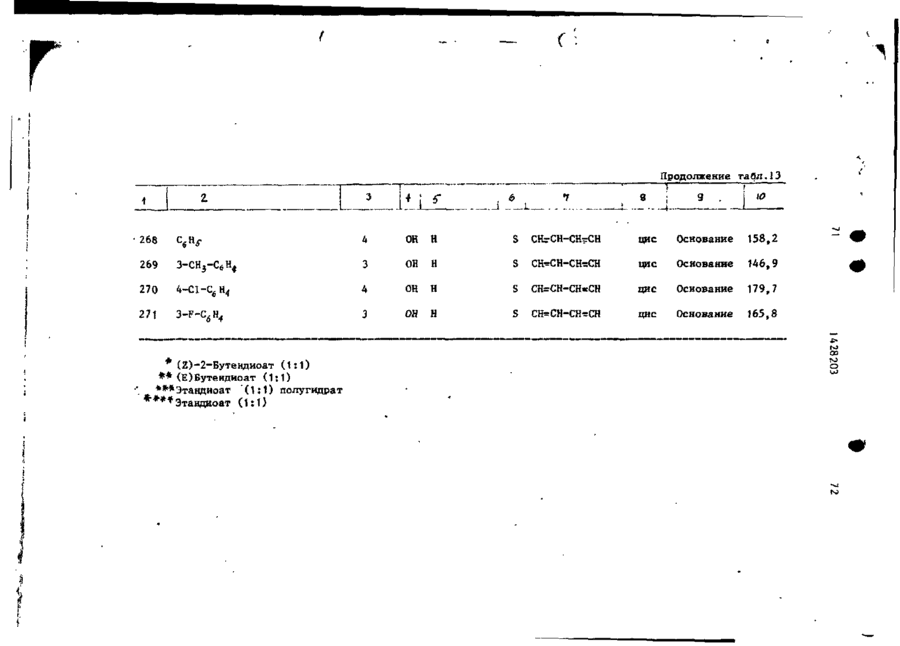
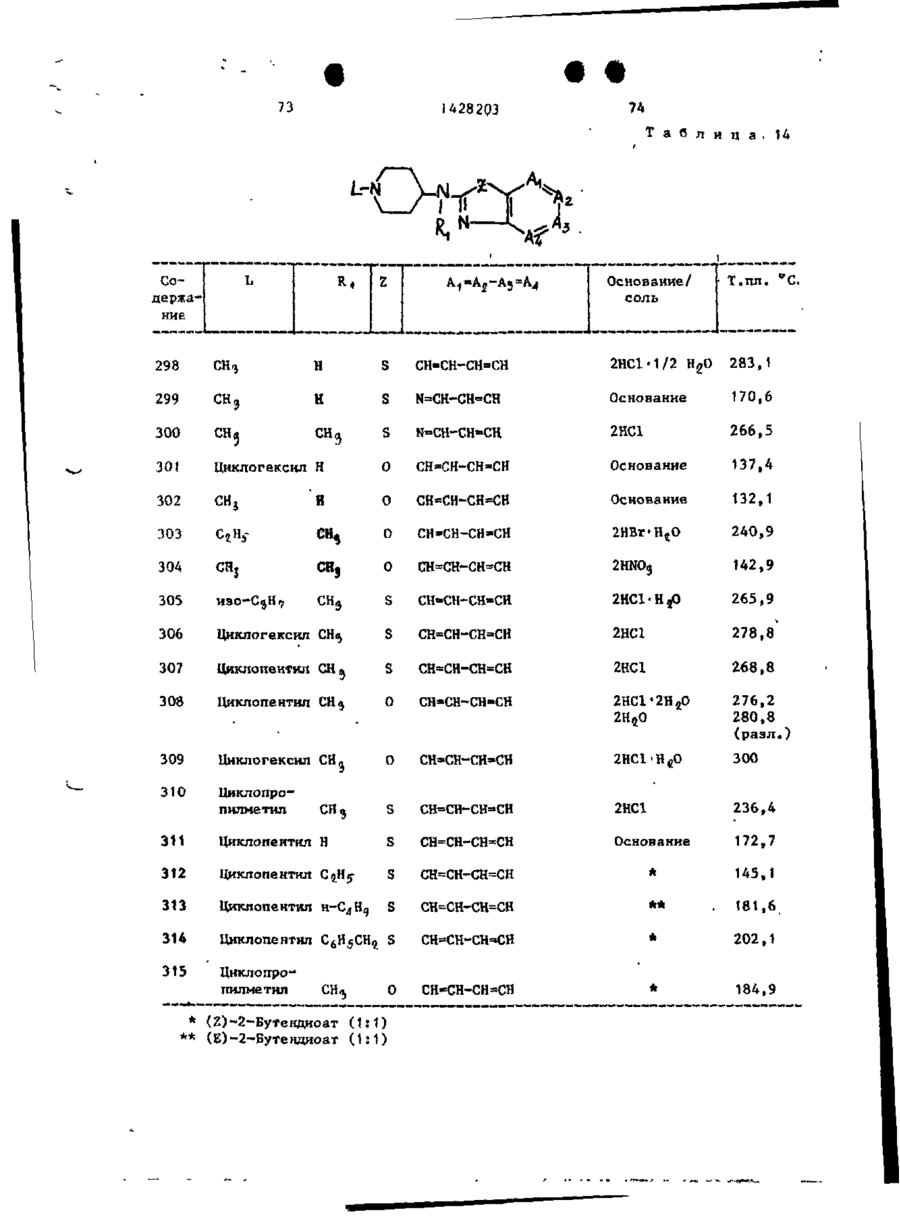
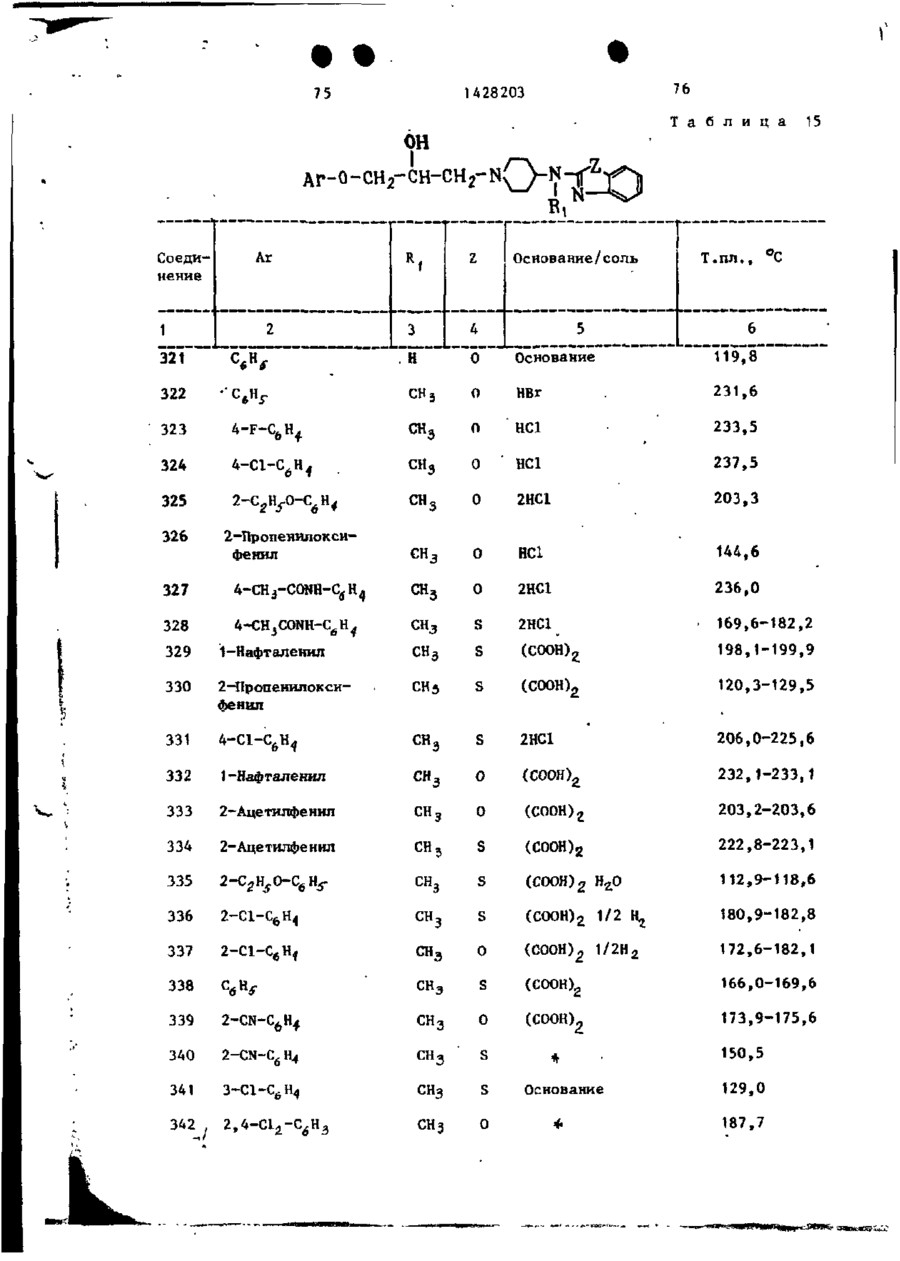
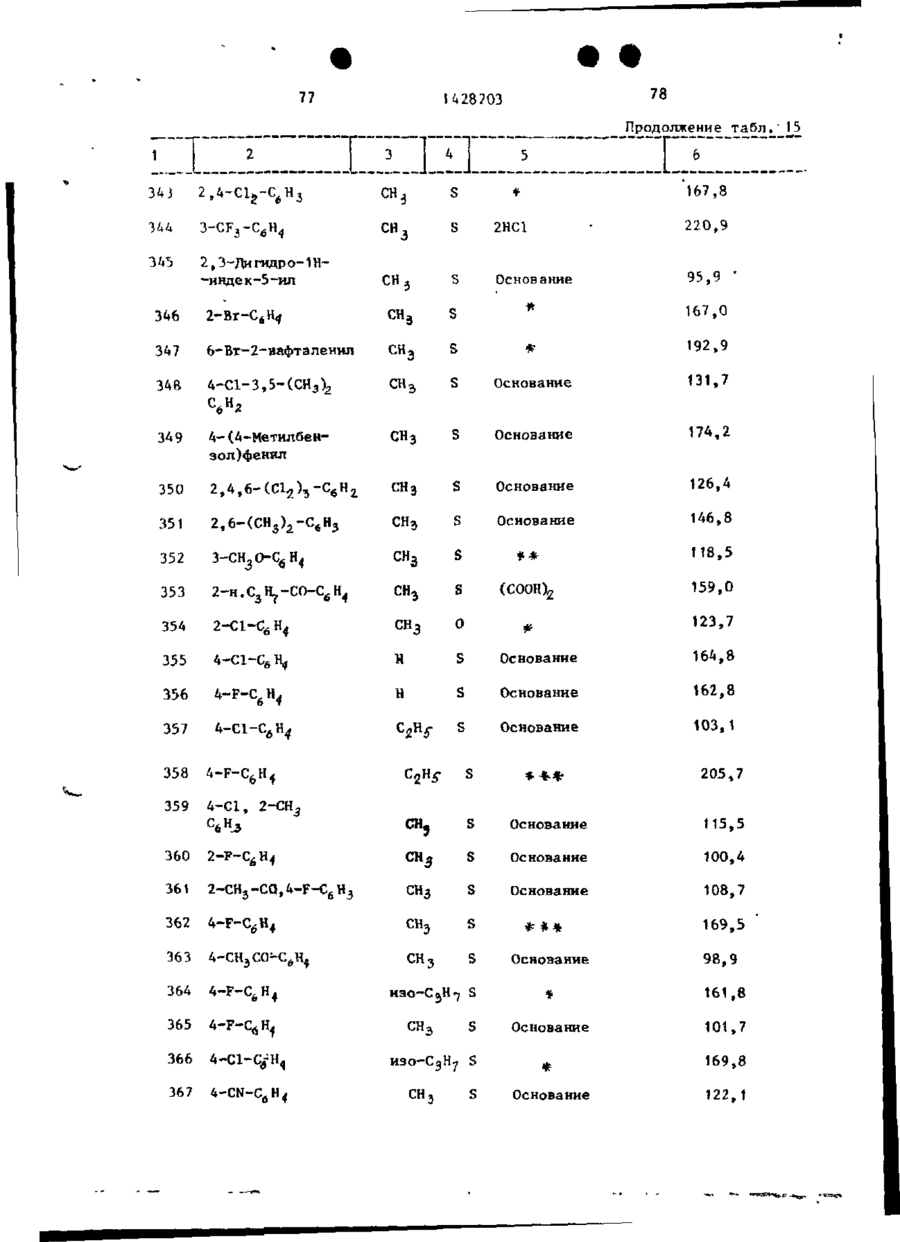
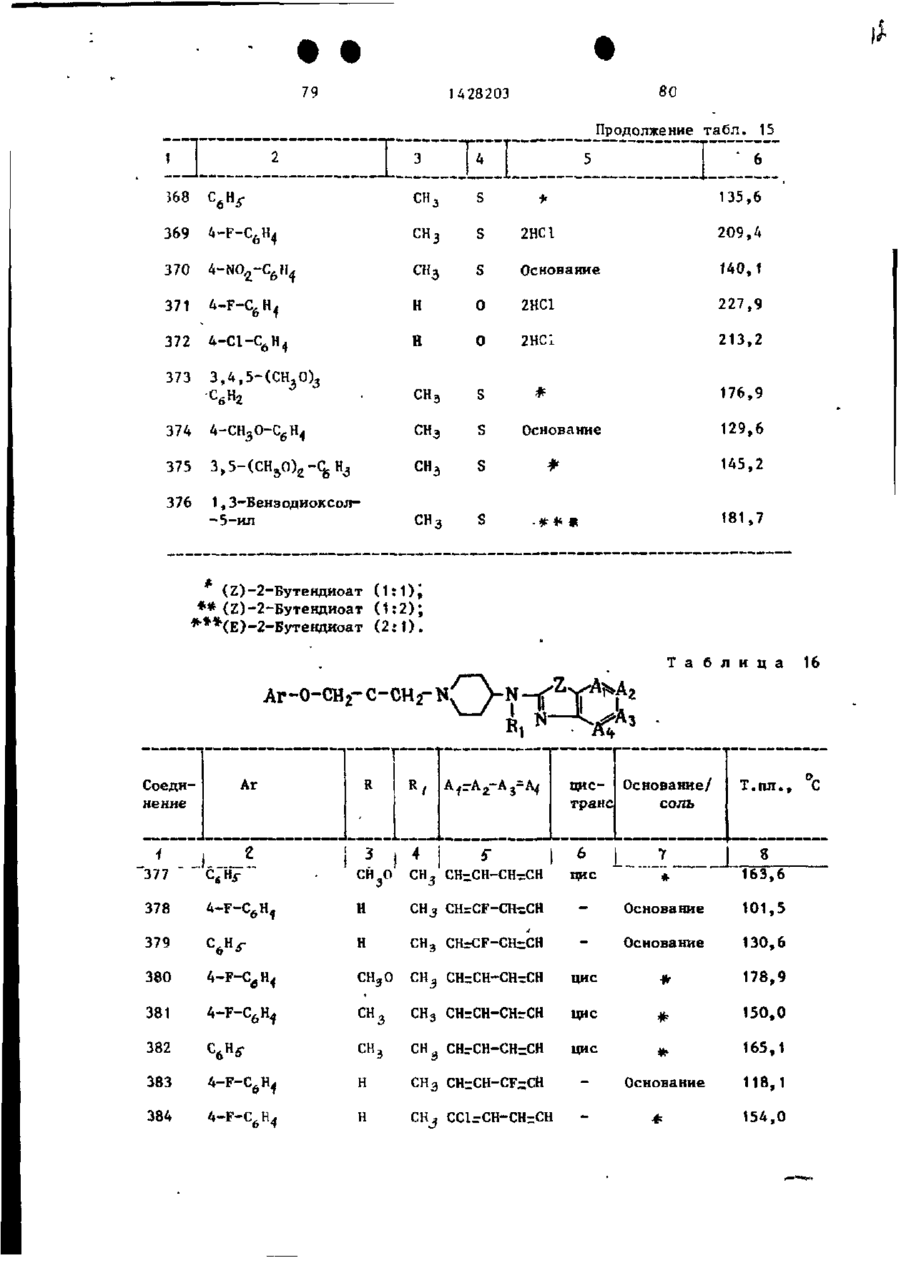
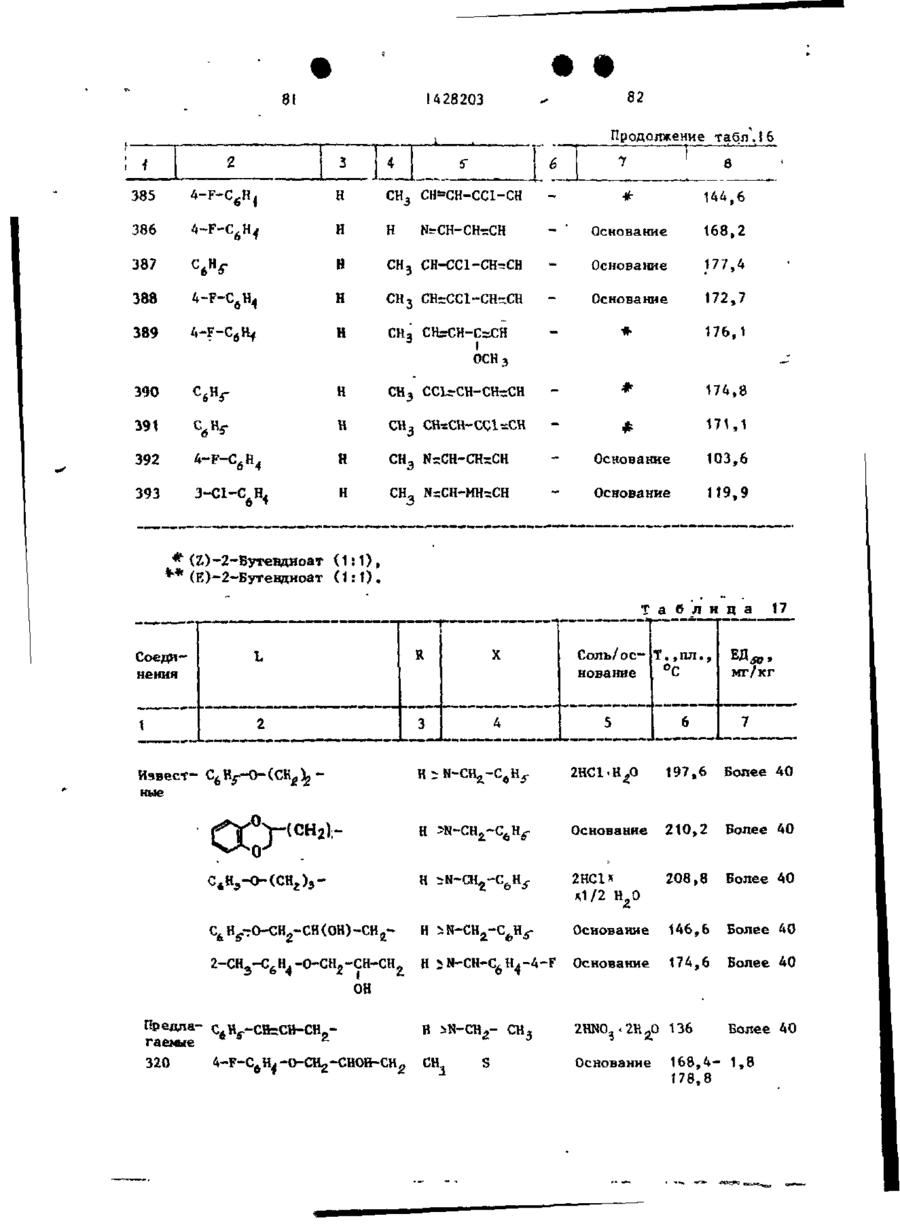
Спосіб одержання похідних бензоксазоламіна або бензотиазоламіна, або їх фармацевтично прийнятих солей, або їх стереоізомерів
Номер патенту: 2698
Опубліковано: 26.12.1994
Автори: Франс Едуард Жанссенс, Реймонд Антуан Стокброекс, Марсель Геребернус Марія Льюікс
Формула / Реферат
Способ получения производных бензоксазоламина или бензотиазоламина общей формулы
где — А1 = А2—А3=А4 — двухвалентный радикал, имеющий формулы:
где один или два атома водорода в радикале каждый независимо друг от друга может быть замещен галогеном, С1— С6- алкилом, гидроксилом или С1— С6-алкоксигруппой, Z — 0 или S; n—0 или 1; R — заместитель, выбираемый из группы, состоящей из водорода, С1— С6-алкила, гидроксила и С1— С6-алкоксигруппы; R1 или R2 — водород, С1— С6-алкил или арил- С1— С6-алкил; пунктирная линия между атомом азота, связанным с R1, промежуточным атомом углерода и атомом азота, связанным с R2, показывает, что существует двойная связь между атомом азота, связанным с R1, и указанным промежуточным атомом углерода, в случае, когда R1 отсутствует или существует двойная связь между промежуточным атомом углерода и атомом азота, связанным с R2, в случае, когда R2 отсутствует и указанный промежуточный атом углерода расположен между атомом азота, связанным с R1, и атомом азота, связанным с R2; R3 или R4 — оба являются водородами или вместе могут образовывать двухвалентный радикал формулы
L — заместитель, выбираемый из группы, содержащей С1— С12-алкил, замещенный С1— С6-алкил, арил— С2— С6-алкинил, С3— С6-циклоалкил, замещенный С3— С6-циклоалкил, радикал общей формулы а
и радикал общей формулы в
R5 — водород или С1— С12-алкилкарбонил; R6 — водород или С1 — С6-алкил; R7 — арил, радикал R1 — 0 или радикал R8—S; В— двухвалентный радикал формулы —СН2— или —О—; R8 — водород, арил, 2,3-дигидро-1Н-инденил, (2,3-дигидро- 1,4-бензодиоксин-2-ил) метил, (2Н-1-бензопиран-2-ил) метил, или фенил, замещенный С2— С6-алкенилокси, С1— С6-алкилкарбониламино- или С1— С6-алкилфенилкарбонилгруппой, и в которой указанный замещенный С3— С6-циклоалкил является С3— С6-циклоалкилом, замещенным одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из арила, арилокси или цианогруппы; указанный замещенный С1— С6-алкил является С1— С6-алкилом, замещенным заместителем, выбираемым из группы, состоящей из С3— С6-циклоалкила, пиридинила, пиридинилокси-, арила, бензоимидазолила, индолила, изоксазолила, необязательно замещенного фенилом, 3-оксо-1,2,4-триазоло(4,5-а) пиридин-2-(ЗН)-ила, радикала формулы АrY-, радикала формулы R9—О—и радикала формулы
где Y — ...О, S, NН, —СОNН, —СНСN, —СНОR10 или —SO2; R9 — водород, арил- С1— С6-алкил, С3— С6-циклоалкил, фенил, который замещен фенилом, или фенил, который замещен С1— С6. алкилоксикарбонилом; R10 — водород или С1— С6-алкил, и в которой арилом является фенил, необязательно замещенный от одного до трех заместителями, причем каждый независимо выбирается из группы, состоящей из С1— С6-алкила, С1—С6-алкилокси-, галогена, трифторметила, циано- С1— С6-алкилкарбонилa, нитро-, амино- и аминокарбонила, или их фармацевтически приемлемых солей, или их стереоизомеров, отличающийся тем, что пиперидин общей формулы
где R—R4, A1—А4, Z и пунктир имеют указанные значения, N — алкилируют соединением обшей формулы
где L имеет указанные значения; W — галоид или мезилатгруппа, в инертном растворителе, таком как N,N-диметилформамид, N,N-диметилацетамид, 4-метил-2-пентанон или ацетон в присутствии основания, такого как карбонат щелочного металла или триэтиламина, при необходимости в присутствии иодида щелочного металла при температуре от 60 °C до температуры кипения реакционной смеси с последующим выделением целевого продукта в виде основания или фармацевтически приемлемой соли, или в виде стереоизомера.
Текст
# ф СОЮЗ СОВЕТСНИХ СОЦИАЛИСТИЧЕСНИХ РЕСПУБЛИН (19) SU,,,, 1428203 A3 (504 С 07 D 498/04, 513/04, А 61 К 31/415 ГОСУДАРСТВЕННЫЙ НОМИТЕТ СССР ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ (21) 3982357/23-04 (22) 12.11.85 (31) 677412 (32) 03.12.84 (33) US (46) 30.09.88. Бюл. » 36 (71) Жансен Фармасетика Н.В. (BE) (72) Реймонд Антуан Стокброекс, Марсель Геребернус Мария Льюикс и Франс Эдуард Жанссенс (BE) (53) 547.789.6.07(088.8) (56) Патент США * 4219559, кл. 424-267, 1980. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОКСАЗОПАМИНА ИЛИ БЕНЗОТИАЗОЛАМИНА, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ, ИЛИ ИХ СТЕРЕ0И30МЕР0В (57) Изобретение касается гетероциклических соединений, в частности способа получения производных бензоксазоламина или бензотиазоламина общей формулы I L - X, где X - группа формулы где C-A ( ^A t -A 8 sA 4 ]^ формулы -СНгСН-СН=СН-, -N=:CH-CH=CH-, -CHrN-CHsCH-, -CHrCH-NrCH-, -CHSCH-CHTN-, которые могут быть моно- или дизамещены галогеном, С 1428203 СНЧЖ(0 или >SOZ, Rg-H, арил -С, -Г й -алкил, Cj-C^-тіиклоалкил, фенил, замещенный фенилом или Cf-C$£ -алкипоксикарбонилом, R,o -H или С,-С й -алкил, Аг - фенил Сон может быть моно-, ди- или тризамещен С,-С 6 -алкилом, галогеном, CF^ » CN, С,-С 6 -алкилакгигруплой, С,-С6-алкилкарбонилом, NOj,, NH2 или аминокарбонилом), или их флрмацевтически приемлемых солей, или их стереоизомеров,обладающих антианокскческой активностью, что может быть использовано в медицине, Цель изобретения - создание новых более активных веществ указанного класса. Процесс ведут реакцией соединений общих формул Н и LW, где Х L и X указаны; V - галоген или мезилатная группа, в присутствии карбоната щелочного металла или триэтиламина (при необходимости в присутствии иодида щелочного металла) в среде растворителя -И,М-диметилформамида, М^-диметилацетамида, 4-метил-2-пентанона или ацетона, при температуре от 60 °С до кипения реакционной смеси. Целевой продукт выделяют в виде основания или фармацевтически приемлемой соли, или стереоизомера. Новые вещества обладают антианоксической активностью при эффективной дозе ЕЛІІ? = 0,63 - 10 мг/кг (против > 40 мг/кг для известных соединений) и токсичности Л Д ^ М О мг/кг. 17 табл, 1 Изобретение относится к новым проэтиловый эфир 3-(метиламино)-1изводным бензоксазолз и бензотиазо-пиперидинкарбоновой кислоты ( 3 ) ; ла, обладающим пенными фармакологи-^ этиловый эфир цис-3-(фенилметокческими свойствами и которые могут си)-4- [(фенилметил)амияо]-1-пиперинайти применение в медицине. 5 динкарбоновой кислоты ( 4 ) ; Цель изобретения - способ получеэтиловый эфир 4-(бутиламино)-1— ния новых производных бензоксазола -пиперидин кар бо новой кислоты (5);* и бензотиазола, обладающих более вымонохлоргидрат этилового эфира сокой антианоксической активностью. цис-3-метокси-4-(метиламино)-Т-пипеНижеследующие примеры иллюстриру- ' " ридинкарбоновой кислоты; т. пл. 169,1 °С 0 смеси 56 ч . литийалюминийгидрида и -бромгєкеїш)окси]-3-фторбензола;' 1000 ч . тетрагидрофурана по каплям т . п л . 45 - 90°С/0,05 мм р т . с т . (107), добавляют раствор 359 ч . 2 - ( 2 , 5 - д и Подобным путем получают также соединения, приведенные в табл. 4, с метилфенокси)пропановой кислоты в 1000 ч . тетрагндрофурана. После з а Следуя тем же методикам и испольвершения прибавления перемешивание зуя соответствующие исходные соедипродолжают при кипячении с обратным нения, получают также: холодильником в течение 1,5 ч . Р е а к [(6-бром~2-нафталенилокси)метил]10 ционную смесь охлаждают и разлагают оксиран (125)£ путем последовательного добавления (4-метилфенил) [4-(окснранилметок55 ч . воды, 45 ч . 15%-ного раствора си)фенил]метанон ( 1 2 6 ) , гидроокиси натрия и 190 ч . воды и [(2,6-диметилфенокси)метил]оксисодержимое перемешивают в течение ран, т . кип. 85-90 /0,2 мм р т . с т . ' 15 30 мин. После подкисления хлористово(127), дородной кислотой неорганическое в е [(2-бром-4-фторфенокси)метил]окщество отфильтровывают. Фильтрат высиран,' т . к и п . 105°С при 66,5 Па сушивают, фильтруют и упаривают. Ос(128). таток перегоняют, получая 73 ч , 2П р и м е р 16. К перемешиваемом му и охлаждаемому (температура 0 С) 20 ~(2,5-диметилфенокси)-1-пропанола, т . кип. 150°С/11 мм р т . с т . ( 1 3 1 ) . раствору ЬЗ ч . 2-фенилциклопропанП р и м е р 19. К перемешиваемой метанола в 378 ч . диэтилового эфира и охлаждаемой смеси 33,25 ч . 2 - ( ф е по каплям прибавляют 63 ч . трехбронилметокси)-1-пропанола и 20 ч . пиримистого фосфора. Температуру смеси доводят до комнатной т-ыпри постоянном 25 дина по каплям добавляют раствор 25,2 ч . метансульфонилхлорида в 8 ч . •перемешивании и содержимое продолжапиридина при 0-5°С. После завершения ют перемешивать в течение 30 мин прибавления перемешивание продолжапри комнатной температуре. Реакционют в течение 2 ч при комнатной темную смесь выливают в 90 ч . ледяной 30 пературе. Реакционную смесь выливаводы и слои разделяют. Органический ют на смесь льда и ледяной воды и слой промывают последовательно дважпродукт реакции экстрагируют трижды ды водой и один раз раствором бикархлороформом. Объединенные экстракты боната натрия, высушивают, фильтрувысушивают, фильтруют и упаривают. ют и упаривают. Остаток перегоняют, 35 Маслянистый остаток перегоняют, п о получая 67 ч . (74,5%) (1-бром-З-булучая 41 ч . метансульфонатного эфира • тенил)бензола; т . кип. 85-94*С/ 2- (фенилметокси) -1 -пропанола 'у т . кип • /0,4 мм І>Т. с т . ( 1 2 9 ) . 151-152°С/0,03 мм р т . с т . ( 1 3 2 ) . П р и м е р 17. Смешивают 32 ч . Подобным путем получают также: 1- Г(3~хдорпропил)тио]-4-фторбензола 5 метансульфонатный эфир 2-(Э-ме50 ч . перекиси водорода и 112,5 ч . 40 тилфенокси)-1-пропанола, т , к и п . ледяной уксусной кислоты, происходит 12О*С/О,ОО02 мм р т . с т . ( 1 3 3 ) ; экзотермическая реакция и температуметансульфонатный эфир 2 - ( 2 , 6 - д и ра повышается до *> 60 *С. Содержимое метилфенокси)-1-лропанола; т . к и п . перемешивают и кипятят с обратным с 1Ю С/0,0002 мм р т . с т . ( 1 3 4 ) ; холодильником в течение 1 ч» затем 4 метансульфонатный эфир - ( 3 , 5 - д и м е при, перемешивании охлаждают в т е ч е тилфенокси)-1-пропанола, т . кип. ние 3 ч . Охлажденную реакционную 115°С/0,000Д мм р т . с т . ( 1 3 5 ) ; смесь разлагают 500 ч . воды. Водяной слой отделяют и экстрагируют один метансульфонатный эфир 2 - ( 2 , 6 - д и раз диэтштовым эфиром. Объединенные 50 хлорфенокси)-1-пропанола^ т . кип. органические слои промывают водой, 120°С/0,0О2 мм р т . с т . ( 1 3 6 ) ; высушивают сульфатом натрия и упарип-толуолсульфонатный эфир 3,4-дивают. Остаток перекристаллизовывают гидро-2Н-1-бензопиран-2-метанола^ из дииэопропилового эфира, получая т . пл. 59,4 V C ( 1 3 7 ) . после охлаждения до -20°С 18 ч . 1 £ ( 3 - 55 П р и м е р 20. Смесь 6,72 ч . -хлорпропил)сульфонил]-4-фторбензо4-фторфенола, 8,4 ч карбоната калия • ла ( 1 3 0 ) . и 200 ч 4-метилпентанона-2 а з е о т р о п П р и м е р 18. К перемешиваемой но перегоняют. Затем добавляют 17,1 ч, и кипящей с обратным холодильником 4,~(фенилметокси)циклогексилметан5 12 1428203 сульфоната и содержимое перемешивазуя смесь хлороформі ч петролейного ют и кипятят с обратным холодильником эфира (50:50 по объему) в качестве в течение двух дней, используя водоэлюента. отделитель. После охлаждения добавПервую фракцию (непрореагировавляют в2-пропандиола,' му) в качестве элюента. Чистые фракЫ]ъ = -10,08° (с * 0,5* в метано50 ции собирают и элюент упаривают. Осле) (146). таток превращают в (Х)-2-бутендиоатК перемешиваемой смеси 11 ч. (-)ную соль в ацетоне. Соль отфильтро(Ю-3-(4-фторфенокси)-1,2-пропандиовывают и высушивают, получая 4 ч. ла, 23,3 ч. пиридина и 240 ч. хло(49%) (2)-2-бутендиоата (1:1) N-[1роформа добавляют 12,3 ч. 4-метил55 " ІА-(3~хлорфенокси)бутил]-4-пиперибензолсульфонилхлорида. Смесь перединил]~М-метил-2-бензотиазоламина, мешивают в течение ночи при комнатт. пл. 138,6°С (1). ной температуре. Смесь промывают Аналогично получают соединения, последовательно подкисленной водой, приведенные в табл. 5. 15 1428203 Подобным путем получают также соединения, приведенные в табл. 6. Подобным путем получают также соединения, приведенные в табл, 7, 16 Аналогично после превращения продукта реакции в целевую кислотно-аддитивную соль получают также соединения, приведенные в табл. 8, Подобным путем получают также соеИспользуя аналогичные методики динения, приведенные в табл. 9. и соответствующие исходные соединеПодобным путем получают также: ния, получают также: (г)-2-бутендиоат (1:1) N-[i-f3моногидрат днхлоргидрата 1-бутил- 10 -(4-фторфенокси)-2-метилпролил]~4-N-(1-метилтиазоло [5,4-в]пирндин-2-пиперидинил]-1*-метил-2-бензотиазол-(1Н)-илиден)-4-пиперидинамина/ амина', т , пл. 143,6 С (168) j г. пл. 253,1°С (115), этандиоат (1:1) З-метокси-N- [1моногидрат дихлоргидрата N-(1-ме- [4-(4-метоксифенокси)бутил]-4-пипетилтиазоло [5,4-в]пиридин-2-(1Н)-ил- 15 ридинил]-К-метил-2-бензотиазоламина; иден)-1-(2-фенилэтил)-4-пнперидинамит. пл. 98,2°С (169); на; т. пл. 251,7°С (116), (г)-2-бутендиоат (1:2) N-(3-Meмоногидрат (2)-2-бутендиоата (1:2) тил-2-(ЗН)-бензотиазолилнден)-1-СЗ~ 1 М-метил-N- [1 -(1-фенил-3-бутенил)-4-(3-метилфенокси)пропил]-4-пипери-пиперидинил]-2-бензотиазоламина,' 20 динамина; т . пл. 176,0°С (170)', т. пл. 101,7 °С (117), (2)-2-бутендиоат (1:2) N-(3-Meмоногидрат дихлоргидрата N-fi-ftтил-2(ЗН)-бензотиазолилиден)-1-(4-(4-Аторфенокси)бутил]-3-пирролиди-феноксибу тип ) - 4-пипериди намина; нил]-РЛ-метил-2-бензотиаэоламина, т. пл. 187,6°С (171); т. пл. 152,5'с (118); 25 (г)-2-бутендиоат (1:2) 1-Г4-(3этандиоат (1:1) N- [1-Г4-(3-хлор-хлорфенокси)бутил]-N-(З-метил-2(ЗН)фенокси)бутил]-3-пирролидинил]-М-ме-бензотиазолилиден)-4-пиперндинамитил-2-бензотиазоламина; т.пл. 162,7 С на; т. пл. 164,6°С (172); (119); (г)-2-бутендиоат (1:2) 1-[4-(4этандиоат (1:1) N-MeTHn-N-fi-[3- 30 -фторфёнокси) бутилі -N- (, З-метил-2 ( ЗН)-(З-метилфенокси)пропил] -3-пирроли-бенэотиазолилиден)-4-пиперидинамина; динил]-2-бензотиазоламина, т. пл. 172,6вС (173); т. пл. 108,4*С (120), (2)-2-бутендиоат (1:2) 1-[4-(4этандиоат (1:1) N- [1~ХЗ-(3-фтор-метоксифенокси)бутил]-К-(3-метил-2фенокси)пропил]-3-пирролидинил]-Ы35 (ЗН)-бенз отиаз олилиден)-4-пиперидин-метил-2-бензотиазоламина; т.пл. амина; т. пл. 166,6 С С174)^ 137,О'с (121); (г)-2-бутендиоат (1:2) N-СЗ-меэтандиоат (1:1) N-Meran-N- fi — С — 4 тил-2(ЗН)-бензотиаз олилиден)-1-(3~ -феноксибутил)-3-пнрролидинил 3-2-фенил-2-пропенил)-4-пиперидинамина; -бензотиазолиламина; т.пл, 150,2°С 40 т. пл. 179,4°С (175); (122). 5-6poM-N- [1-[4-(4-фторфенокси)бутил ]-4-пиперидинил J-6-ме TOKCH-N-МЄПример 25. Смесь 5,04 ч. 1тил-2-бензотиазоламин,' т. пл. -(3-бромпропокси)-4-метилбензола, 124,6°С (176); 7,54 ч. (г)~2-бутендиоата (1:1) N(г)-2-бутендиоат (1:1) N - [ i - [ 3 45 -этил-И-(4-пиперидинил)-2-бензотиа-(3-фторфенокси)пропил]-4—пиперидизоламина, 5,3 ч. карбоната натрия, нил]-5-метокси—К-метил-2-бензотиа-' 0,1 ч. йодида калия и 180 ч. N.N-дизоламина; т . пл. 126,3 °С (177). метилформамида перемешивают и нагреПример 26. Смесь 2,3 ч, вают в течение ночи при 60°С. Реакци-- 50 Г2-(4-метоксифенил)этил]метансульфоонную смесь выливают в воду и проната, 4 ч . дибромгндрата N-(4-nHneдукт реакции экстрагируют толуолом., ридинил)-2-бензотиазоламина, 5,3 ч . Экстракт промывают трижды водой, выкарбоната натрия, 0,1 ч«Йодида калия сушивают, фильтруют и упаривают. Оси 90 ч. Ы,М-диметилформамида перетаток кристаллизуют из иэопропанола, 5 5 мешивают в течение ночи при 70°С. получая 6 ч . (75%) Я-этил-Н-[1 - [ з Реакционную смесь выливают в воду -(4~метилфенокси)пропил]-4-пиперидии продукт реакции экстрагируют толуонил]-2-бензотиазоламина; т.пл. лом. Экстракт промывают водой, вы101,0°С (123). сушивают, фильтруют и упаривают. t j 0c I 428203 тзіок т^сгіі.тн^лпт из смеси иэопрогги-- ч ;\ липз^гтспилового эфира. Пролу:-~ pev--ij-fH сгфильтповывают и т, "л і- - ,3 С і ' 7 8 ) , Подобным пу и ем получают также: N- [!-,Г2-(4-мегоксифенил)этил/-4-липеридькил]~Г' ! -метил-2-бензотиазоламин; т, п л / 9 7 , 6 ° С (179)^ Ы-Г|-Г2-(4~метоксифенил)этил]-4-пиперчггинил]тиазсло(5,4-в]пиридин-2-амин; т. лл. 158,9 й С ( 1 8 0 ) . 15 П р и м е р 27= Смесь 4,3 ч . 1-(4-клорбутокск)- і -метоксибензола > 6,6 ч . (2)-2-бутендиоата N-Сфенилметил)-N-С4-пиперидинил)-2-бензотиазоламина, 5,3 ч , карЭоната натрия, 0 , 1 ч , йодида калия и 90 ч, NjN-диметилацетамида перемешивают в течение ночи при 90^0. Реакідіонную смесь выливают в воду. Продукт реакции экстрагируют толуолом, экстракт промывают в о - 25 дой, высушивают, фильтруют и упаривают. Остаток превращают в (Е)-2-бутендиоятнук) соль в этаноле. Соль о т фильтровывают и высушивают, получая 5,6 ч . (60%) (Е)-2-бутендиоата ( 1 : 1 ) 30 К-[1-[4-(4-метоксифенокси)бутил]-4-пиперидинил]-^-(фенилметил)-2-бензотиазоламина; т . п л . 178,2 С ( 1 8 1 ) . Подобным путем получают также с о е динения, приведенные в т а б л . 10. Подобным путем получают также с о е динения, приведенные в табл. \\. 18 ле, используя смесь хлороформа иметанола (98:2 по объему) в качестве элюента. Чистые фракции собирают и элюент упаривают, Остаток превращают в этандиоатную соль в изопропано** ле. Соль отфильтровывают и высушивают, получая 6 ч. (73%) этандиоата (1:1) цис-N- fi- [4-(4-хлорфенокси)бутил]-З-метокси-4-пиперидинил]-N-метил-2-бензотиазоламина, т.пл, 210,4 С (205). Подобным путем получают также соединения, приведенные в табл. 12. Подобным путем получают также: (г)-2-бутендиоат (1:1) Ы-метил-!*-Г2-[2-(фенилметокси)пропил}-4-пипе'ридинил]-2-бензотиазоламина; т. пл. 1*50,5°С (272); (1)-2-бутендиоат (1:1) Н-метил-Н- [1-(2-метил-3-феноксипропил)-4-пиперидинил]-2-бензотиазоламина\ т.пл. 177,0°С (273); (2)-2-бутендиоат (1:1) N-MeTHn-N- [1 -[ 2-(3-метилфенокси)пропил]-4-пиперидинил]-2-бензотиазоламина,* т.пл. 168,6°С (274); (2)-2-бутендиоат (1:1) N-[i-[2~(2,6-диметилфенокси)пропил]-4-пиперидинил]-М-метил-2-бензотиазопаминаіт. пл. 130,4°С (275), N- f1-f2-(2,6-диxлopфeнoкcи)пpoпил]-4-пипepидинилj-N-мeтил-2-бeнэотиазоламина; т. пл, 106,0 С (276), (2)-2-бутендиоат (1:1) N-[1-f2-(3,5-диметилфенокси)пропил}-Д-пилеридинилЗ-Ы-метил-2—бензотиазоламина;' т. пл. 172°С (277), Подобным путем получают также (Е)-2-бутендиоат (1:1) N-(2-6eH(г)-2-бутендиоат (1:2) 1-[3-(3-фторлп эотиазолил)-8-[З-(3-фторфенокси)профенокси)пропил]-N-(3-метил-2-(ЗН)пил] -М-метил-8-азабицикло D,2,1]ок-бензогиазолилиден)—4-пиперидинамитан-3-аминаі' т. пл. 171,3°С (278)j' ка;* т . лл. 173,4°С ( 2 0 4 ) . этандиоат (1:1) (E)-N-метил-NП р и м е р 28. Смесь 5,5 ч . этандиоата ( 1 : 1 ) цис-N-(З-метокси-4- _ - [8-(3-фенил-2-пропенил)-8-азабицикло [3,2,1j-окт-3-кл]-2-бензотиазол-пиперидкнкл)-М-метил-2-бензотиазоламина, т. пл. 216,0°С (279); амина, 10,6 ч . карбоната натрия, (Е)-2-6утендиоат ( 1 : 1 ) N-(2-6eH0,1 ч . йодида калия и 200 ч . 4-мезотиазолил)^-метил-8-(4-фекоксибутилпентанона-2 перемешивают и кипятил)-8-азабицикло[3,2,1] октан-3-амитят с обратным холодильником в т е 5 0 на; т. пл. 158,0°С ( 2 8 0 ) ; чение 30 мин. После охлаждения до (г)-2-бутендиоат ( 1 : 1 ) цис-Ы-ме* 60 С добавляют 4,4 ч . 1-хлор-4-(4тил-К-[3-метил-1-(3-фекил-2-пропе-хлорбутокси)бензола. Содержимое п е нил)-4-пиперидинил]-2-бензотиазолремешивают с обратным холодильником амина; т . п л . 173,7°С ( 2 8 1 ) ; в течение 'ночи. После охлаждения добавляют воду и слои разделяют. Ор- 55 этандиоат ( 1 : 1 ) цис-Н-СЗ-метоксяганический слой высушивают, фильтру-1 - ( З-фенил-2-проп.е нил ) -4-пиперидиют и упаривают. Остаток очищают к о нил]-К-метил-2-бензотиазоламина; лоночной хроматографией на силикаге' т . пл. 230,2°С (282); • 19 1428203 этандиоат ( 1 : t ) М-(2-бензотиазо~ лил)-ї^-метил-8-(3-метилфенокси) пропил) -8-азабицикло [3,2,1]октан-3-амина,' т . пл. 183,3°С ( 2 8 3 ) ; этандиоат ( 1 : 1 ) Я-метил-і*)- Г і - ( 4 -феноксибутил)-3-пиперидинил]-2-бензотиазоламина, т . пл. 152,5°С (284); этандиоат ( 1 : 1 ) N- [1-[3-(3-фторфенокси)пропил]~3-пиперидинил]-N10 -метил-2-бензотиазоламина; т . пл. 164,5°С ( 2 8 5 ) ; Этандиоат ( 1 : 1 ) N-MeTHJi-N-[1-(3~ -фенил-2-пропенил)-3-пиперидинил]-2-бензотиазоламина; т . п л . 202,8 в С 15 (286); этандиоат ( 1 : 1 ) М-метил-1Ч-[*1-[з-(3-метилфенокси)пропил]-3-пиперидинил]-2-бензотиазоламина; т . пл. 151,3°С (287),' 20 этандиоат ( 1 : 1 ) N-[1-Г4-(4-метоксифенокси)бутил]-3-пиперидинил]-N-метил-2г-бензот**азоламина; т . пл. 152,3°С ( 2 8 8 ) ; этандиоат ( 1 : 1 ) N- [ ї - £ 4 - ( 4 - ф т о р - 25 фенилфенокси)бутил]-3-пиперидинил ] -і$-метил-2-бензотиазоламина; т . п л . 163,2°С (289)', N - f i - [3-('4-фторфенокси)-1-метилпропші}-4-пиперидинил]-Л-метил-230 -бензотиазоламина; т . пл, 115,0 С (290), (Е)-2-бутендиоат (1:1) N-[1-J>-(3-хлорфенокси)бутил3-З-пиперидинил]-М-метил-2-бензотиаэоламина,' 35 т. пл. 138,6еС (291); 4-метилбензолсульфонат (1:2) N-метил-N- [ -(З-фенил-2-пропенил)-31 -пирролидинил]-2-бензотиазол амина; т. пл. 198,8°С (292); 40 цис-4-(2-бензотиазоламина)-1-(3фенил-2-пропенил)-3-пиперидинол; т. пл. 198,3°С (293). П р и м е р 29. Смесь 3 ч. 1-бром-3-метилбутана, 3,7 ч. N-метил-**)-(4--пиперидинил)-1-бензотиазолами~ на, 4,2 ч. карбоната калия и 80 ч. ацетона перемешивают и кипятят с обратным холодильником в течение ночи. Реакционную смесь выливают в 50 воду и продукт реакции экстрагируют толуолом. Экстракт высушивают, фильтруют и упаривают. Остаток превращают в (г)-2-бутендиоатную соль в изопропаноле, Соль отфильтровывают и высушивают, получая 5 ч. (77%) (Z)- 55 -2-бутендиоата (1:1) М-метил-N- [1-(3-метилбутил)-4-пиперидинил]-2-бензотиазоламина; т, пл. 197,2°С (294) . 20 П р и м е р 30. Смесь ? ч, ( 3 -хлор-1-пропенил)бензола, 2,6 ч. 2-Сметил-(4-ггиперидинил)амико]-5-бензотиазолола, 3,5 ч . триэтиламина и 90 ч, ?^,М~диметилформамкда перемешивают и нагревают в течение 24 ч при 60 С. Реакционную смесь охлаждаютвыливают в воду и продукт реакции экстрагируют толуолом. Экстракт промывают водой, высушивают, фильтруют и упаривают. Остаток очищают колоночной хроматографией на силикагеле, используя смесь хлороформа и метанола ( 9 7 : 3 по объему) в качестве элюента. Чистые фракции собирают и элюент упаривают. Остаток превращают в (Е)-2-бутендиоатную соль в этаноле. Соль отфильтровывают и высушивают, получая 1 ч . (20%) (Е)-2-бутендиоат ( 1 : 1 ) 2-[метил [1-(3-фенил-2-пропенил)-4-пиперидинил]амино]-5-бенэотиазолола, т . пл. 228,4°С ( 2 9 5 ) . П р и м е р 3 1 . К перемешиваемой смеси 1 , 1 ч 50%-ной дисперсии гидрида натрия и 45 ч . М,М-метилформамида добавляют 3,1 ч . 3-Г4-(2-бензотиазолил)метиламино]-1-пиперидинпропанола и содержимое перемешивают и нагревают в течение 2 ч при *> 60 С. После охлаждения до 15 С добавляют 1,65 ч . хлоргидрата 4-хлорпиридина и перемешивание продолжают в течение ночи при 60 С. Реакционную смесь охлаждают и растворитель упаривают. Остаток -растворяют в воде и экстрагируют толуолом. Экстракт высушивают, фильтруют и упаривают. Остаток очищают на колонке с силикагелем, и с пользуя смесь хлороформа и метанола (98:2 по объему) в качестве элюента. Чистые фракции собирают и элюент упаривают. Остаток кристаллизуют из д и іизопропилового эфира, получая после высушивания 1,5 ч . (38%) моногидрата N-MeTRn-N-[1- [3~(4-пиридинилокси)пропил ]-4-пиперидинил]-2-бенз отиаз оламина, т . пл. 96,3°С ( 2 9 6 ) . П р и м е р 32. Смесь 4,75 ч . циклопентанона, 4,1 ч . N-(1-метилэтил) -N-(4-пиперидинил)-2-бензотиазоламина в 200 ч . метанола гидрируют при обычном давлении и при комнатной температуре в присутствии 2 ч . 10%-ного палладия на у г л е . После поглощения рассчитанного количества водорода катализатор отфильтровывают с помощью фильтра Гифло и фильтрат упаривают. Остаток очищают коло f» f. 21 1428203 22 ночной хроматографией с силикагелем, этандиоат ( 1 : 1 ) 3 - [ ( 2 - б е н з о т и а используч смесь хлороформа и метанозолил)метиламино]-сА-(феноксиметил)ла (98,5 : 1,5 по объему) в качест-8-азабицикло [3,2,1] октан-8-этанола, ее элюента. Чистые фракции собирают т . п л . 188,6°С (396), и элюент упаривают. Остаток превраэтандиоат ( 1 : 1 ) 3- [(2-бензотиащают в (7.)-2-бутендиоатнута соль в эолил)метиламино]-о(- [(4-фторфенокизопропаполе. Соль отфильтровывают си)метил]-1'-пиперидинэтанола; и высушивают, получая 3,9 ч . (56,6%) т. пл. 182,7°С (397), (2)-2-бугондиоата ( 1 : 1 ) N-(1-циклоэтандиоат ( 1 : 1 ) 3-Г(2-бензотиазо10 пентил-4-пиперидинил)-^-(1-метиллил)-метиламино]-о(- Г(З-хлорфенокси)этил)-2-6ензотиазоламина; т . шт. метилJ-1-пиперидинэтанола; т . пл. t78 > 5°G ( 2 9 7 ) . 172,9°С ( 3 9 8 ) , Подобным путем получают также с о е этандиоат ( 1 : 1 ) 3 - £ ( 2 - б е н з о т и а з о динения, приведенные в табл. 14, 15 лил)метиламино]-d-(феноксиметил)-1Подобным путем получают также: -пиперидинэтанола," т . пл. 180,2 С цис-4- [4- [(2-бензотиазолил)метил(399); амино ~]~ 1 -пиперидинил ]-1 - (4-фторфеэтандиоат ( 1 : 1 ) 3 - £ ( 2 - б е н э о т и а з о нил]диклогексанкарбонитрил; т . п л . лил)метиламино]-4- (3-хлорфенокси)184,7'С (316); 20 метил]-1-пирролидинэтанола;' т . пл, (цис + TpaHc)-N-[1-[4-(4-фторфе' 158,5°С ( 4 0 0 ) ; нокси)циклогексил]-4-пиперидинил]< - [(3-хлорфенпкси)метил]-4-(тиа< -Ы-метил-2-бензотиазоламин; т . пл. золо [5,4-в]пиридин-2-иламино)-1-пи198,4°С (317); перидинэтанол; т . пл. 127,4°С цис-4- [4- [(2-бензотиазолил)метил- 25 (401); амино]-1-пиперидинил]-1-(4-фторфедихлоргидрат (А) - 4-(2-бензоксанил)циклогексанкарбонитрил," т . п л . золиламино)-і-(2,3-дигидро-1,4-бен199,6°С ( 3 1 8 ) , зодиоксин-2-ил)-1 -пиперидинэтанола;1 N- П"(Ш-индол-3-илметил)-4-пипет. пл. 229,8°С (402), ридинил]~М-метил--2-бензотиазоламин, полугидрат дихлоргидрата (В)-4т . л л . 178,3°С ( 3 1 9 ) . -(2-беизоксазолиламино)-с4-(2 ) 3-дигидП р и м е р 3 3 . Смесь 2,5 ч . ро-1,4-бензодиоксин-2-ил)-1-пипериС(4-фторфенокси)метил]оксирана,3,7 ч . динэтанола; т . пл. 245,3 С (403),' Ы-метил-1^-(4-пиперидинил)-2--бензо— дихлоргидрат 4- [(2-бензоксазотиазоламина, 45 ч, толуола и 40 ч . лил)метиламино]-^-(4-метоксифенил)35 -1-пиперидннэтанола; т . пл. 231,1 С метанола перемешивают и кипятят с обратным холодильником в течение (404); 24 ч . Реакционную смесь упаривают. 4-метилбензолсульфонат (1:2) 3Остаток превращают в хлористоводо-[(2-бензотиаэолил)метиламино]-
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of benzoxazoleamine or benzothiazoleamine derivatives, or pharmaceutically acceptable salts thereof, or stereoisomers thereof
Назва патенту російськоюСпособ получения производных бензоксазоламіна или бензотиазоламіна, или их фармацевтически приемлемых солей, или их стереоизомеров
МПК / Мітки
МПК: C07D 513/04, A61K 31/445, C07D 498/04, C07D 413/14, C07D 417/14, C07D 407/04, C07D 207/08, C07D 451/04, C07D 319/00, C07D 211/56, A61K 31/435, C07D 417/12, A61P 25/28, C07D 413/12, A61K 31/4468, A61K 31/46, C07D 471/04, C07D 519/00
Мітки: бензотиазоламіна, стереоізомерів, одержання, похідних, прийнятих, фармацевтично, бензоксазоламіна, солей, спосіб
Код посилання
<a href="https://ua.patents.su/44-2698-sposib-oderzhannya-pokhidnikh-benzoksazolamina-abo-benzotiazolamina-abo-kh-farmacevtichno-prijjnyatikh-solejj-abo-kh-stereoizomeriv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних бензоксазоламіна або бензотиазоламіна, або їх фармацевтично прийнятих солей, або їх стереоізомерів</a>
Попередній патент: Засіб фіксування опорного елементу в штучному кришталику
Наступний патент: Спосіб одержання похідних діазабіцикло (3, 3, 1) нонана або їх солей
Випадковий патент: Уніполярна електромашина