Інгібітори цитозольної фосфоліпази а2
Номер патенту: 91053
Опубліковано: 25.06.2010
Автори: Лі Кетрін Л., Макк'ю Джон К., Варгас Річард, Клерін Валері, Марусік Сюзана, Кларк Джеймс Д., Чен Ліхрен, Уілльямс Кейра, Понг Кевін
Формула / Реферат
1. Сполука Формули І:
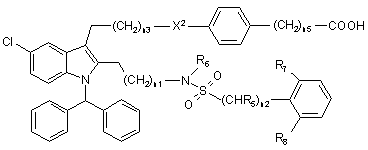 , (I)
, (I)
де:
n1 - 1 або 2;
n2 - 1 або 2;
n3 - 1 або 2;
n5 - 0, 1 або 2;
X2 - зв'язок, О, -СН2- або SO2;
кожен R5 - незалежно Н або С1-3алкіл;
R6 - Н або С1-6алкіл;
R7 вибирають з групи, що складається з ОН, бензилокси, СН3, СF3, ОСF3, С1-3алкокси, галогену, СОН, СО(С1-3алкіл), СО(ОС1-3алкіл), хінолін-5-ілу, хінолін-8-ілу, 3,5-диметилізоксазол-4-ілу, тіофен-3-ілу, піридин-4-ілу, піридин-3-ілу, -CH2-Q і фенілу, необов'язково заміщеного від однієї до трьох незалежно вибраними R30 групами;
R8 вибирають з групи, що складається з Н, ОН, NO2, СF3, ОСF3, С1-3алкокси, галогену, СО(С1-3алкіл), СО(ОС1-3алкіл), хінолін-5-ілу, хінолін-8-ілу, 3,5-диметилізоксазол-4-ілу, тіофен-3-ілу, -CH2-Q і фенілу, необов'язково заміщеного від однієї до трьох незалежно вибраними R30 групами;
Q - ОН, діалкіламіно,
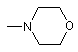 або
або 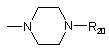 ;
;
R20 вибирають з групи, що складається з Н, С1-3алкілу і СО(С1-3алкіл); і
R30 вибирають з групи, що складається з діалкіламіно, CN й ОСF3;
за умови, що:
a) коли кожен R5 - Н, R6 - Н, n5 - 0 і R8 - Н, тоді R7 не може бути хлором;
b) коли кожен R5 - Н, R6 - Н, n5 - 0, X2 - О або -СН2- і R8 - Н, тоді R7 не може бути СН3;
c) коли кожен R5 - Н і R6 - Н, тоді R7 й R8 не можуть обидва бути фтором;
d) коли кожен R5 - Н, R6 - Н і X2 - О, тоді R7 й R8 не можуть обидва бути хлором;
e) коли кожен R5 - Н, R6 - Н, X2 - О і R8 - NO2, тоді R7 не може бути фтором; і
f) коли кожен R5 - Н, R6 - Н, X2 - SO2 і R8 - Н, тоді R7 не може бути фтором або хлором;
або її фармацевтично прийнятна сіль.
2. Сполука або сіль за пунктом 1, де X2 - СН2.
3. Сполука або сіль за пунктом 1 або пунктом 2, де n3 - 1.
4. Сполука або сіль за будь-яким із пунктів 1 - 3, де n1 - 1.
5. Сполука або сіль за будь-яким із пунктів 1 - 4, де n2 - 1.
6. Сполука або сіль за пунктом 2, де n3 - 1, n1 -1 і n2 - 1.
7. Сполука або сіль за будь-яким із пунктів 1-6, де R6 - Н.
8. Сполука або сіль за будь-яким із пунктів 1-7, де:
R7 вибирають з групи, що складається з ОН, бензилокси, СН3, СF3, ОСF3, галогену, СООСН3, СОН, СН2OН, діетиламінометилу, хінолін-5-ілу, хінолін-8-ілу, 3,5-диметилізоксазол-4-ілу, тіофен-3-ілу, піридин-4-ілу, піридин-3-ілу, фенілу, 4-диметиламінофен-1-ілу, 2-трифторметоксифен-1-ілу, 2-ціанофен-1-ілу, морфолін-1-ілметилу, піперазин-1-ілметилу, 4-ацетилпіперазин-1-ілметилу і 4-метилпіперазин-1-ілметилу; і
R8 вибирають з групи, що складається з Н, галогену, СF3 й NO2.
9. Сполука або сіль за будь-яким із пунктів 1-8, де R5 - Н.
10. Сполука або сіль за будь-яким із пунктів 1-8, де R5 - СН3.
11. Сполука або сіль за будь-яким із пунктів 1-10, де X2 - О.
12. Сполука або сіль за пунктом 11, де n3 - 1, n1 - 1 і n2 - 1, і R6 - Н.
13. Сполука або сіль за будь-яким із пунктів 1-12, де:
R7 вибирають з групи, що складається з бензилокси, ОН, галогену, СН3 й СF3; і
R8 вибирають з групи, що складається з Н, галогену і NO2.
14. Сполука або сіль за будь-яким із пунктів 1-13, де R7 - СF3 і R8 - Н.
15. Сполука або сіль за будь-яким із пунктів 1-14, де Х2 - SO2.
16. Сполука або сіль за будь-яким із пунктів 1-15, де n5 - 2.
17. Сполука або сіль за пунктом 1, де n1 - 1, n2 - 1 або 2, n3 - 1, n5 - 0; X2 - СН2, кожен R5 і кожен R6 - Н; і R8 - Н, F, СF3, OCF3, ОН, хінолін-5-іл або хінолін-8-іл, і R7 - F, СF3, ОСF3, ОН, хінолін-5-іл або хінолін-8-іл.
18. Сполука або сіль за пунктом 17, де n2 - 1.
19. Сполука Формули II:
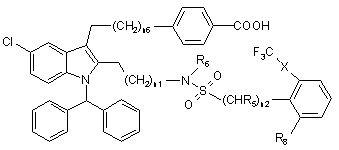 , (II)
, (II)
де:
Х - зв'язок або О;
n1 - 1 або 2;
n2 - 1 або 2;
n6 - 1 або 2;
R5 - Н або СН3;
R6 - Н або С1-6алкіл; і
R8 вибирають з групи, що складається з Н, ОН, NO2, СF3, ОСF3, ОСН3, галогену, СОСН3, СООСН3, диметиламіно, діетиламіно і CN;
або її фармацевтично прийнятна сіль.
20. Сполука або сіль за пунктом 19, де n1 - 1.
21. Сполука або сіль за пунктом 19 або пунктом 20, де n2 - 1.
22. Сполука або сіль за будь-яким із пунктів 19-21, де n6 - 2.
23. Сполука або сіль за будь-яким із пунктів 19-22, де R5 - Н.
24. Сполука або сіль за будь-яким із пунктів 19-23, де R6 - Н.
25. Сполука або сіль за будь-яким із пунктів 19-24, де R8 вибирають з групи, що складається з Н, СF3, ОСF3 і галогену.
26. Сполука або сіль за будь-яким із пунктів 19-24, де R8 - Н.
27. Сполука за пунктом 1, вибрана із групи, що складається з:
a) 4-{2-[2-[2-({[2-(бензилокси)бензил]сульфоніл}аміно)етил]-5-хлоро-1-(дифенілметил)-1H-індол-3-іл]етокси}бензойної кислоти;
b) 4-{2-[5-хлоро-1-(дифенілметил)-2-(2-{[(2-гідроксибензил)сульфоніл]аміно}етил)-1H-індол-3-іл]етокси}бензойної кислоти;
c) 4-{2-[5-хлоро-2-(2-{[(2,6-дибромобензил)сульфоніл]аміно}етил)-1-(дифенілметил)-1H-індол-3-іл]етокси}бензойної кислоти;
d) 4-(2-{1-бензгідрил-5-хлоро-2-[2-метил-6-нітрофенілметансульфоніламіно]-етил-1H-індол-3-іл}-етокси)-бензойної кислоти;
e) 4-(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(трифторметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}етокси)бензойної кислоти;
f) 4-(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2-фторо-6-(трифторметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}етокси)бензойної кислоти;
g) 4-{3-[5-хлоро-2-(2-{[(2,6-дибромобензил)сульфоніл]аміно}етил)-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
h) 4-{3-[5-хлоро-2-(2-{[(2,6-дихлоробензил)сульфоніл]аміно}етил)-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
і) 4-(3-{1-бензгідрил-5-хлоро-2-[2-(2-метил-6-нітрофенілметансульфоніламіно)етил-1Н-індол-3-іл}-пропіл)бензойної кислоти;
j) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(трифторметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
k) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-(метил{[2-(трифторметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
l) 4-{3-[2-[2-({[2,6-біс(трифторметил)бензил]сульфоніл}аміно)етил]-5-хлоро-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
m) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(метоксикарбоніл)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
n) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-фторо-6-(трифторметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
о) 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({2-[2-(трифторметил)феніл]етил}сульфоніл)аміно]етил}-1H-індол-3-іл)пропіл]бензойної кислоти;
p) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2-формілбензил)сульфоніл]аміно}етил)-1H-індол-3-іл]пропіл}бензойної кислоти;
q) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(морфолін-4-ілметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
r) 4-{3-[5-хлоро-2-{2-[({2-[(діетиламіно)метил]бензил}сульфоніл)аміно]етил}-1-(дифенілметил)-1Н-індол-3-іл]пропіл}бензойної кислоти;
s) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(гідроксиметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
t) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(піперазин-1-ілметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
u) 4-{3-[2-{2-[({2-[(4-ацетилпіперазин-1-іл)метил]бензил}сульфоніл)аміно]етил}-5-хлоро-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
v) 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({2-[(4-метилпіперазин-1-іл)метил]бензил}сульфоніл)аміно]етил}-1H-індол-3-іл)пропіл]бензойної кислоти;
w) 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({1-[2-(трифторметил)феніл]етил}сульфоніл)аміно]етил}-1H-індол-3-іл)пропіл]бензойної кислоти;
х) 4-{3-[2-(2-{[(2-бромбензил)сульфоніл]аміно}етил)-5-хлоро-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
у) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(трифторметокси)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
z) 4-{3-[5-хлоро-2-(2-{[(3-хлоро-6-фторо-2-метилбензил)сульфоніл]аміно}етил)-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
aa) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-нітро-6-(трифторметил)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
ab) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2-фторбензил)сульфоніл]аміно}етил)-1H-індол-3-іл]пропіл}бензойної кислоти;
ac) 4-{3-[2-(2-{[(біфеніл-2-ілметил)сульфоніл]аміно}етил)-5-хлоро-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
аd) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2-піридин-4-ілбензил)сульфоніл]аміно}етил)-1H-індол-3-іл]пропіл}бензойної кислоти;
ае) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2-піридин-3-ілбензил)сульфоніл]аміно}етил)-1H-індол-3-іл]пропіл}бензойної кислоти;
af) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(3-тієніл)бензил]сульфоніл}аміно)етил]-1H-індол-3-іл}пропіл)бензойної кислоти;
ag) 4-{3-[5-хлоро-2-[2-({[2-(3,5-диметилізоксазол-4-іл)бензил]сульфоніл}аміно)етил]-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
ah) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2-хінолін-5-ілбензил)сульфоніл]аміно}етил)-1H-індол-3-іл]пропіл}бензойної кислоти;
аі) 4-{3-[5-хлоро-2-{2-[({[4'-(диметиламіно)біфеніл-2-іл]метил}сульфоніл)аміно]етил}-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
aj) 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({[2'-(трифторметокси)біфеніл-2-іл]метил}сульфоніл)аміно]етил}-1H-індол-3-іл)пропіл]бензойної кислоти;
ak) 4-{3-[5-xлopo-2-[2-({[(2’-ціанобіфініл-2-іл)метил]сульфоніл}aміно)етил]-1-(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти;
а1) 3-{4-[(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(трифторметил)бензил]сульфоніл}аміно)етил]-1Н-індол-3-іл}етил)сульфоніл]феніл}пропанової кислоти;
am) 3-(4-{[2-(5-хлоро-1-(дифенілметил)-2-{2-[({1-[2-(трифторметил)феніл]етил}сульфоніл)аміно]етил}-1H-індол-3-іл)етил]сульфоніл}феніл)пропанової кислоти;
an) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2-гідроксибензил)сульфоніл]аміно}етил)-1Н-індол-3-іл]пропіл}бензойної кислоти та
ао) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2-хінолін-5-ілбензил)сульфоніл]аміно}етил)-1H-індол-3-іл]пропіл}бензойної кислоти;
або її фармацевтично прийнятна сіль.
28. Спосіб лікування запалення, спричиненого або посиленого простагландинами, лейкотриєнами або фактором активації тромбоцитів, у ссавця, де спосіб включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі.
29. Спосіб лікування болю, спричиненого або посиленого простагландинами, лейкотриєнами або фактором активації тромбоцитів, у ссавця, де спосіб включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі.
30. Спосіб лікування астми у ссавця, де спосіб включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі.
31. Спосіб лікування артритичних і ревматичних розладів у ссавця, де спосіб включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі.
32. Спосіб за пунктом 31, де розлад - ревматоїдний артрит.
33. Спосіб за пунктом 31, де розлад - остеоартрит.
34. Спосіб за пунктом 31, де розлад - ювенільний артрит.
35. Спосіб лікування або профілактики хвороби або розладу у ссавця або запобігання прогресуванню симптомів такої хвороби або розладу, де хвороба або розлад вибираються із групи, що складається з інсульту, атеросклерозу, розсіяного склерозу, хвороби Паркінсона, ураження центральної нервової системи внаслідок інсульту, ураження центральної нервової системи внаслідок ішемії і ураження центральної нервової системи внаслідок травми, де спосіб включає введення ссавцеві, який цього потребує, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі.
36. Спосіб за пунктом 35, де хвороба або розлад - інсульт.
37. Спосіб за пунктом 35, де хвороба або розлад - атеросклероз.
38. Спосіб за пунктом 35, де хвороба або розлад - розсіяний склероз.
39. Спосіб за пунктом 35, де хвороба або розлад - хвороба Паркінсона.
40. Спосіб за пунктом 35, де хвороба або розлад - ураження центральної нервової системи внаслідок інсульту, ішемії або травми.
41. Спосіб лікування або профілактики венозного або артеріального тромбозу у ссавця або запобігання прогресуванню симптомів вказаного тромбозу, де спосіб включає введення ссавцеві, який потребує такого лікування або профілактики, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі.
42. Спосіб за пунктом 41, де тромбоз - атеротромбоз.
43. Фармацевтична композиція, що містить сполуку за будь-яким із пунктів 1-27 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
Текст
1. Сполука Формули І: 3 91053 разин-1-ілметилу, 4-ацетилпіперазин-1-ілметилу і 4-метилпіперазин-1-ілметилу; і R8 вибирають з групи, що складається з Н, галогену, СF3 й NO2. 9. Сполука або сіль за будь-яким із пунктів 1-8, де R5 - Н. 10. Сполука або сіль за будь-яким із пунктів 1-8, де R5 - СН3. 11. Сполука або сіль за будь-яким із пунктів 1-10, де X2 - О. 12. Сполука або сіль за пунктом 11, де n3 - 1, n1 - 1 і n2 - 1, і R6 - Н. 13. Сполука або сіль за будь-яким із пунктів 1-12, де: R7 вибирають з групи, що складається з бензилокси, ОН, галогену, СН3 й СF3; і R8 вибирають з групи, що складається з Н, галогену і NO2. 14. Сполука або сіль за будь-яким із пунктів 1-13, де R7 - СF3 і R8 - Н. 15. Сполука або сіль за будь-яким із пунктів 1-14, де Х2 - SO2. 16. Сполука або сіль за будь-яким із пунктів 1-15, де n5 - 2. 17. Сполука або сіль за пунктом 1, де n1 - 1, n2 - 1 або 2, n3 - 1, n5 - 0; X2 - СН2, кожен R5 і кожен R6 Н; і R8 - Н, F, СF3, OCF3, ОН, хінолін-5-іл або хінолін-8-іл, і R7 - F, СF3, ОСF3, ОН, хінолін-5-іл або хінолін-8-іл. 18. Сполука або сіль за пунктом 17, де n2 - 1. 19. Сполука Формули II: (CH2)n6 COOH Cl F3 C R6 N (CH2)n1 N O O S X (CHR5)n2 R8 , (II) де: Х - зв'язок або О; n1 - 1 або 2; n2 - 1 або 2; n6 - 1 або 2; R5 - Н або СН3; R6 - Н або С1-6алкіл; і R8 вибирають з групи, що складається з Н, ОН, NO2, СF3, ОСF3, ОСН3, галогену, СОСН3, СООСН3, диметиламіно, діетиламіно і CN; або її фармацевтично прийнятна сіль. 20. Сполука або сіль за пунктом 19, де n1 - 1. 21. Сполука або сіль за пунктом 19 або пунктом 20, де n2 - 1. 22. Сполука або сіль за будь-яким із пунктів 19-21, де n6 - 2. 23. Сполука або сіль за будь-яким із пунктів 19-22, де R5 - Н. 24. Сполука або сіль за будь-яким із пунктів 19-23, де R6 - Н. 25. Сполука або сіль за будь-яким із пунктів 19-24, де R8 вибирають з групи, що складається з Н, СF3, ОСF3 і галогену. 26. Сполука або сіль за будь-яким із пунктів 19-24, де R8 - Н. 4 27. Сполука за пунктом 1, вибрана із групи, що складається з: a) 4-{2-[2-[2-({[2(бензилокси)бензил]сульфоніл}аміно)етил]-5хлоро-1-(дифенілметил)-1H-індол-3іл]етокси}бензойної кислоти; b) 4-{2-[5-хлоро-1-(дифенілметил)-2-(2-{[(2гідроксибензил)сульфоніл]аміно}етил)-1H-індол-3іл]етокси}бензойної кислоти; c) 4-{2-[5-хлоро-2-(2-{[(2,6дибромобензил)сульфоніл]аміно}етил)-1(дифенілметил)-1H-індол-3-іл]етокси}бензойної кислоти; d) 4-(2-{1-бензгідрил-5-хлоро-2-[2-метил-6нітрофенілметансульфоніламіно]-етил-1H-індол-3іл}-етокси)-бензойної кислоти; e) 4-(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}етокси)бензойної кислоти; f) 4-(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2-фторо6-(трифторметил)бензил]сульфоніл}аміно)етил]1H-індол-3-іл}етокси)бензойної кислоти; g) 4-{3-[5-хлоро-2-(2-{[(2,6дибромобензил)сульфоніл]аміно}етил)-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти; h) 4-{3-[5-хлоро-2-(2-{[(2,6дихлоробензил)сульфоніл]аміно}етил)-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти; і) 4-(3-{1-бензгідрил-5-хлоро-2-[2-(2-метил-6нітрофенілметансульфоніламіно)етил-1Н-індол-3іл}-пропіл)бензойної кислоти; j) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}пропіл)бензойної кислоти; k) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-(метил{[2(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}пропіл)бензойної кислоти; l) 4-{3-[2-[2-({[2,6біс(трифторметил)бензил]сульфоніл}аміно)етил]5-хлоро-1-(дифенілметил)-1H-індол-3іл]пропіл}бензойної кислоти; m) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(метоксикарбоніл)бензил]сульфоніл}аміно)етил]1H-індол-3-іл}пропіл)бензойної кислоти; n) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-фторо6-(трифторметил)бензил]сульфоніл}аміно)етил]1H-індол-3-іл}пропіл)бензойної кислоти; о) 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({2-[2(трифторметил)феніл]етил}сульфоніл)аміно]етил}1H-індол-3-іл)пропіл]бензойної кислоти; p) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2формілбензил)сульфоніл]аміно}етил)-1H-індол-3іл]пропіл}бензойної кислоти; q) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(морфолін-4ілметил)бензил]сульфоніл}аміно)етил]-1H-індол-3іл}пропіл)бензойної кислоти; r) 4-{3-[5-хлоро-2-{2-[({2[(діетиламіно)метил]бензил}сульфоніл)аміно]етил}-1(дифенілметил)-1Н-індол-3-іл]пропіл}бензойної кислоти; 5 s) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(гідроксиметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}пропіл)бензойної кислоти; t) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(піперазин-1ілметил)бензил]сульфоніл}аміно)етил]-1H-індол-3іл}пропіл)бензойної кислоти; u) 4-{3-[2-{2-[({2-[(4-ацетилпіперазин-1іл)метил]бензил}сульфоніл)аміно]етил}-5-хлоро-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти; v) 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({2-[(4метилпіперазин-1іл)метил]бензил}сульфоніл)аміно]етил}-1H-індол3-іл)пропіл]бензойної кислоти; w) 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({1-[2(трифторметил)феніл]етил}сульфоніл)аміно]етил}1H-індол-3-іл)пропіл]бензойної кислоти; х) 4-{3-[2-(2-{[(2бромбензил)сульфоніл]аміно}етил)-5-хлоро-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти; у) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(трифторметокси)бензил]сульфоніл}аміно)етил]1H-індол-3-іл}пропіл)бензойної кислоти; z) 4-{3-[5-хлоро-2-(2-{[(3-хлоро-6-фторо-2метилбензил)сульфоніл]аміно}етил)-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти; aa) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-нітро6-(трифторметил)бензил]сульфоніл}аміно)етил]1H-індол-3-іл}пропіл)бензойної кислоти; ab) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2фторбензил)сульфоніл]аміно}етил)-1H-індол-3іл]пропіл}бензойної кислоти; ac) 4-{3-[2-(2-{[(біфеніл-2ілметил)сульфоніл]аміно}етил)-5-хлоро-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти; аd) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2піридин-4-ілбензил)сульфоніл]аміно}етил)-1Hіндол-3-іл]пропіл}бензойної кислоти; ае) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2піридин-3-ілбензил)сульфоніл]аміно}етил)-1Hіндол-3-іл]пропіл}бензойної кислоти; af) 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(3тієніл)бензил]сульфоніл}аміно)етил]-1H-індол-3іл}пропіл)бензойної кислоти; ag) 4-{3-[5-хлоро-2-[2-({[2-(3,5-диметилізоксазол-4іл)бензил]сульфоніл}аміно)етил]-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти; ah) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2хінолін-5-ілбензил)сульфоніл]аміно}етил)-1Hіндол-3-іл]пропіл}бензойної кислоти; аі) 4-{3-[5-хлоро-2-{2-[({[4'-(диметиламіно)біфеніл2-іл]метил}сульфоніл)аміно]етил}-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойної кислоти; aj) 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({[2'(трифторметокси)біфеніл-2іл]метил}сульфоніл)аміно]етил}-1H-індол-3іл)пропіл]бензойної кислоти; 91053 6 ak) 4-{3-[5-xлopo-2-[2-({[(2’-ціанобіфініл-2іл)метил]сульфоніл}aміно)етил]-1-(дифенілметил)1H-індол-3-іл]пропіл}бензойної кислоти; а1) 3-{4-[(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2(трифторметил)бензил]сульфоніл}аміно)етил]-1Ніндол-3-іл}етил)сульфоніл]феніл}пропанової кислоти; am) 3-(4-{[2-(5-хлоро-1-(дифенілметил)-2-{2-[({1-[2(трифторметил)феніл]етил}сульфоніл)аміно]етил}1H-індол-3-іл)етил]сульфоніл}феніл)пропанової кислоти; an) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2гідроксибензил)сульфоніл]аміно}етил)-1Н-індол-3іл]пропіл}бензойної кислоти та ао) 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2хінолін-5-ілбензил)сульфоніл]аміно}етил)-1Hіндол-3-іл]пропіл}бензойної кислоти; або її фармацевтично прийнятна сіль. 28. Спосіб лікування запалення, спричиненого або посиленого простагландинами, лейкотриєнами або фактором активації тромбоцитів, у ссавця, де спосіб включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі. 29. Спосіб лікування болю, спричиненого або посиленого простагландинами, лейкотриєнами або фактором активації тромбоцитів, у ссавця, де спосіб включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі. 30. Спосіб лікування астми у ссавця, де спосіб включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі. 31. Спосіб лікування артритичних і ревматичних розладів у ссавця, де спосіб включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки за будьяким із пунктів 1-27 або її фармацевтично прийнятної солі. 32. Спосіб за пунктом 31, де розлад - ревматоїдний артрит. 33. Спосіб за пунктом 31, де розлад - остеоартрит. 34. Спосіб за пунктом 31, де розлад - ювенільний артрит. 35. Спосіб лікування або профілактики хвороби або розладу у ссавця або запобігання прогресуванню симптомів такої хвороби або розладу, де хвороба або розлад вибираються із групи, що складається з інсульту, атеросклерозу, розсіяного склерозу, хвороби Паркінсона, ураження центральної нервової системи внаслідок інсульту, ураження центральної нервової системи внаслідок ішемії і ураження центральної нервової системи внаслідок травми, де спосіб включає введення ссавцеві, який цього потребує, фармацевтично прийнятної кількості сполуки за будь-яким із пунктів 1-27 або її фармацевтично прийнятної солі. 36. Спосіб за пунктом 35, де хвороба або розлад інсульт. 37. Спосіб за пунктом 35, де хвороба або розлад атеросклероз. 7 91053 8 38. Спосіб за пунктом 35, де хвороба або розлад розсіяний склероз. 39. Спосіб за пунктом 35, де хвороба або розлад хвороба Паркінсона. 40. Спосіб за пунктом 35, де хвороба або розлад ураження центральної нервової системи внаслідок інсульту, ішемії або травми. 41. Спосіб лікування або профілактики венозного або артеріального тромбозу у ссавця або запобігання прогресуванню симптомів вказаного тромбозу, де спосіб включає введення ссавцеві, який по требує такого лікування або профілактики,фармацевтично прийнятної кількості сполуки за будьяким із пунктів 1-27 або її фармацевтично прийнятної солі. 42. Спосіб за пунктом 41, де тромбоз - атеротромбоз. 43. Фармацевтична композиція, що містить сполуку за будь-яким із пунктів 1-27 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. Даний винахід стосується хімічних інгібіторів активності різних ферментів фосфоліпази, особливо ферментів цитозольної фосфоліпази А2 (сPLA2), зокрема включаючи інгібіторі ферментів цитозольної фосфоліпази А2 альфа (PLA2 ). Лейкотрієни й простагландини представляють собою важливих медіаторів запалення, кожний з яких у різний спосіб робить свій внесок у розвиток запальної відповіді. Лейкотрієни залучають запальні клітини, такі як нейтрофіли, до ділянки запалення, сприяють екстравазації цих клітин і стимулюють вивільнення супероксиду й протеаз, які руйнують тканину. Лейкотрієни також грають патофізіологічну роль у гіперчутливості, на яку страждають астматики [Див., наприклад. В. Samuelson et al, Science, 237:1171-76 (1987)]. Простагландини збільшують запалення шляхом збільшення кровотоку і, таким чином, проникнення лейкоцитів до ділянок запалення. Простагландини також потенціюють больову відповідь, викликану стимулами. Простагландини й лейкотрієни є нестабільними й не запасаються в клітинах, але натомість синтезуються [W.L.Smith, Biochem. J., 259:315-324 (1989)] із арахідонової кислоти у відповідь на стимули. Простагландини утворюються із арахідонової кислоти під дією ферментів ЦОГ-1 і ЦОГ-2. Арахідонова кислота також є субстратом для іншого ферментного шляху, що призводить до виробництва лейкотрієнів. Арахідонова кислота, що споживається в цих двох різних запальних шляхах, вивільняється із sn2 положення мембранних фосфоліпідів ферментами фосфоліпази А2 (далі згадується як PLA2). Вважається, що реакція, яка каталізується РLА2, представляє собою обмежуючий швидкість крок у процесі біосинтезу ліпідних медіаторів, включаючи, крім інших, виробництво запальних простагландинів і лейкотрієнів. Коли фосфоліпідний субстрат PLA2 належить до класу фосфотидилхолінів із ефірним зв'язком в sn-1 положенні, лізофосфоліпід, що продукується, є безпосереднім попередником фактора активації тромбоцитів (далі згадується як PAF), іншого потужного медіатора запалення [S. I. Wasserman, Hospital Practice, 15:49-58 (1988)]. Більшість протизапальних терапій зосереджується на профілактиці виробництва або простагландинів або лейкотрієнів за цими різними шляхами, але не на всіх них. Наприклад, ібупрофен, аспірин та індометацин представляють собою НПЗЗ, які інгібують виробництво простагландинів шляхом інгібування ЦОГ-1/ЦОГ-2, але не мають жодного прямого ефекту на запальне утворення лейкотрієнів із арахідонової кислоти в інших шляхах. Навпаки, цилейтон інгібує тільки шлях перетворення арахідонової кислоти у лейкотрієни, безпосередньо не впливаючи на виробництво простагландинів. Жоден із цих широко використовуваних протизапальних агентів не діє на виробництво PAF. Отже, пряме інгібування активності PLA2 пропонується у якості корисного механізму для терапевтичного агента, тобто, перешкоджання запальній відповіді. [Див., наприклад, J. Chang et al, Biochem. Pharmacol., 36:2429-2436 (1987)]. Родина ферментів PLA2, що характеризуються наявністю сигнальної послідовності секреції і нарешті секретуються із клітин, була впорядкована й структурно визначена. Молекулярна маса цих РLА2, які секретуються, становить приблизно 14кДа, і вони містять сім дисульфідних зв'язків, які є необхідними для активності. Ці РLА2 виявлені у великих кількостях у підшлунковій залозі ссавців, бджолиній отруті та отруті різних змій. [Див., наприклад, посилання 13-15 в Chang etal, що процитований вище; і Ε. A. Dennis, Drug Devel. Res., 10:205-220 (1987).] Однак, вважається, що панкреатичний фермент виконує травну функцію й, таким чином, не повинен грати важливу роль у виробництві запальних медіаторів, виробництво яких повинно суворо регулюватися. Була визначена первинна структура першого людського непанкреатичного РLА2. Цей непанкреатичний РLА2 виявлений у тромбоцитах, синовіальній рідині і селезінці й також представляє собою фермент, що секретується. Цей фермент є членом вищезгаданої родини. [Див., J. J. Seilhamer et al, J. Biol. Chem., 264:5335-5338 (1989); R. M. Kramer et al, J. Biol. Chem., 264:5768-5775 (1989); і A. Kando et al, Biochem. Biophys. Res. Comm., 163:42-48 (1989)]. Однак, сумнівно, що цей фермент грає важливу роль у синтезі простагландинів, лейкотрієнів і PAF, тому що непанкреатичний РLА2 є позаклітинним білком, що був би важким для регуляції, і наступні ферменти в біосинтетических шляхах для цих сполук представляють собою внутрішньоклітинні білки. Крім того, існує доказ того, що РLА2 регулюється протеїнкіназою С і G білками [R. Burch and J. Axelrod, Proc. Natl. Acad. Sci. U.S.A., 84:6374-6378 (1989)], які є цитозольними білками, що повинні діяти на внутрішньоклітинні білки. Функціонування в цитозолі було б неможливим для 9 непанкреатичного РLА2, оскільки високий відновний потенціал відновить дисульфідні зв'язки й буде інактивувати фермент. У мишачій лінії клітин-макрофагів під назвою RAW 264.7 був ідентифікований мишачий PL Аг. Як повідомлялось для приблизно 60 Ш молекули характерна специфічна активність, що становить 2мкмоль/хв/мг, стійка до умов відновлення. Однак, цей білок не був очищений до гомогенності. [Див., С. С. Leslie et al, Biochem. Biophys. Acta., 963:476492 (1988)]. Посилання, процитовані вище включені авторами шляхом посилання для інформації, що має відношення до функції ферментів фосфоліпази, особливо РLА2. Була також ідентифікована й клонована цитозольна фосфоліпаза А2 альфа (далі згадується як «cРLА2α»). Див., патенти США №№5 322 776 й 5 354 677, які включені авторами шляхом посилання у повному обсязі. Фермент, описаний в цих патентах, представляє собою внутрішньоклітинний фермент РLА2, очищений з його природного джерела або зроблений іншим чином в очищеній формі, що функціонує внутрішньоклітинно для продукування арахідонової кислоти у відповідь на запальні стимули. Біологічно активні метаболіти арахідонової кислоти, ейкозаноїди, визнані важливими модуляторами передачі сигналів тромбоцитам. Інгібітори ейкозаноїдного шляху (наприклад, аспірин) зменшують формування тромбоксану А2 (ТХА2), лабільного й потужного агоніста тромбоцитів, зумовлюючи депресію функції тромбоцитів, формування тромбу, і доведену клінічну ефективність щодо зменшення захворюваності й смертності. Тромбоцити відіграють центральну роль у декількох біологічних процесах, включаючи тромбоз. [Див. S. P. Jackson and S. M. Schoenwaelder, Nature Reviews, Drag Discovery Vol.2, 1-15, October 2003; D.L. Bhatt і E.J. Topol, Nature Reviews, Drug Discovery Vol.2, 15-28, January 2003]. Відповідно, нещодавно були прикладені зусилля для характеристики тромбоцитарних рецепторів й сигнальних шляхів. Крім того, була розроблена низка моделей на гризунах для дослідження потенційних видів терапії при тромбозі. [Див. В. Nieswandt et al., J. Thrombosis and Haemostasis, 3: 1725-1736 (2005)]. Інгібітори цитозольної фосфоліпази Аг описані в патенті США №6 797 708, що включений авторами шляхом посилання у повному обсязі. На даний момент, коли було ідентифіковано кілька ферментів фосфоліпаз, буде бажано ідентифікувати хімічні інгібітори дії специфічних ферментів фосфоліпаз, які могли б використовуватися для лікування запальних станів, особливо у випадках, коли інгібування виробництва простагландинів, лейкотрієнів і PAF разом є бажаними результатами. Залишається потреба у способі для ідентифікації таких протизапальних засобів для 91053 10 терапевтичного використання при низці захворювань. У деяких варіантах втілення винахід пропонує сполуки Формули І: де: n1 -1 або 2; n2 -1 або 2; n3 -1 або 2; n5 - 0, 1 або 2; X2 - зв'язок, О, -СН2- або SO2; кожен R5 - незалежно Η або С1-3алкіл; R6 - Η або С1-6алкіл; R7 вибирають з групи, що складається з ОН, бензилокси, СН3, CF3, OCF3, С1-3алкокси, галогену, СОН, СО(С1-3алкіл), СО(OС1-3алкіл), хінолін-5-ілу, хінолін-8-ілу, 3,5-диметилізоксазол-4-ілу, тіофен-3ілу, піридин-4-ілу, піридин-3-ілу, -CH2-Q і фенілу, необов'язково заміщеного від одного до трьох незалежно вибраними R30 групами; R8 вибирають з групи, що складається з Н, ОН, NO2, CF3, OCF3, С1-3алкокси, галогену, СО(С13алкіл), СО(ОС1-3алкіл), хінолін-5-ілу, хінолін-8-ілу, 3,5-диметилізоксазол-4-ілу, тіофен-3-ілу, -СН2-Q і фенілу, необов'язково заміщеного від одного до трьох незалежно вибраними R30 групами; Q-ОН, диалкіламіно, R20 вибирають з групи, що складається з Н, С1і СО(С1-3алкіл); і R30 вибирають з групи, що складається з диалкіламіно, CN й OCF3; за умови, що: a) коли кожен R5 - Η, R6 - Η, n5 - 0 і R8 - Η, тоді R7 не може бути хлором; b) коли кожен R5 - Η, R6 - Η, n5 - 0, X2 - О або 2 СН -, і R8 - Η, тоді R7 не може бути СН3; c) коли кожен R5 - Η, R6 - Η, тоді R7 й R8 не можуть обидва бути фтором; d) коли кожен R5 - Η, R6 - Η, і X2-О, тоді R7 й R8 не можуть обидва бути хлором; e) коли кожен R5 - Η, R6 - Η, Χ-О, і R8 - NO2, тоді R7 не може бути фтором; і f) коли кожен R5 - Η, R6 - Η, Χ2 - SO2, і R8 - Η, тоді R7 не може бути фтором або хлором. У деяких оптимальних варіантах втілення пропонуються сполуки Формули II: 3алкіл 11 де: Χ - зв'язок або О; n1 -1 або 2; n2 -1 або 2; n6 -1 або 2; R5 - Η або СН3; R6 - Η або С1-6алкіл; і R8 вибирають з групи, що складається з Н, ОН, ΝΟ2, CF3, OCF3, ОСН3, галогену, СОСН3, СООСН3, диметиламіно, диетиламіно і CN. Даний винахід також пропонує способи лікування запалення, спричиненого або посиленого простагландинами, лейкотрієнами або фактором активації тромбоцитів, у ссавця, спосіб, що включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки винаходу або її фармацевтично прийнятної солі. Даний винахід додатково пропонує способи лікування болю, спричиненого або посиленого простагландинами, лейкотрієнами або фактором активації тромбоцитів, у ссавця, спосіб, що включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки винаходу або її фармацевтично прийнятної солі. Даний винахід додатково пропонує способи лікування або профілактики захворювання або розладу у ссавця, або запобігання прогресування симптомів такого захворювання або розладу, причому захворювання або розлад вибирають з групи, що складається з астми, інсульту, атеросклерозу, розсіяного склерозу, хвороби Паркінсона, артритних розладів, ревматичних розладів, ураження центральної нервової системи внаслідок інсульту, ураження центральної нервової системи внаслідок ішемії, ураження центральної нервової системи внаслідок травми, запалення, спричиненого або посиленого простагландинами, запалення, спричиненого або посиленого лейкотрієнами, болю, і запалення, спричиненого або посиленого фактором активації тромбоцитів, у ссавця, спосіб, що включає введення ссавцеві, який потребує такого лікування або профілактики, фармацевтично прийнятної кількості сполуки винаходу або її фармацевтично прийнятної солі. Даний винахід також пропонує способи для лікування або профілактики венозного або артеріального тромбозу у ссавці, або запобігання прогресування симптомів тромбозу, спосіб, що включає введення ссавцеві, який потребує такого лікування або профілактики, фармацевтично прийнятної кількості сполуки винаходу або її фармацевтично 91053 12 прийнятної солі. У деяких варіантах втілення тромбоз представляє собою атеротромбоз. Даний винахід також пропонує фармацевтичні композиції, що включають сполуку винаходу або її фармацевтично прийнятну сіль, і фармацевтично прийнятний носій. Також, відповідно до даного винаходу пропонуються фармацевтично прийнятні солі і проліки сполук, описаних авторами. Фіг.1 показує інгібування in vitro агрегації тромбоцитів у людській крові сполуками з Прикладів 14 й 25, що визначалось аналізатором функції тромбоцитів (PFΑ-100®). Фіг.2 показує поліпшений кровоток і скорочення формування тромбу сполуками з Прикладів 14 й 15, на щурячій моделі гострого тромбозу. Фіг.3 показує зниження сироваткових рівнів тромбоксану В2 у щурів з індукованим хлоридом заліза тромбозом за допомогою сполук з Прикладів 14 й 25. У деяких варіантах втілення винахід пропонує сполуки Формули І: де: n1 -1 або 2; n2 -1 або 2; n3 -1 або 2; n5 - 0, 1 або 2; X2 - зв'язок, О, -СН2- або SO2; кожен R5 - незалежно Η або С1-3алкіл; R6 - Η або С1-6алкіл; R7 вибирають з групи, що складається з ОН, бензилокси, СН3, CF3, OCF3, С1-3алкокси, галогену, СОН, СО(С1-3алкіл), СО(OС1-3алкіл), хінолін-5-ілу, хінолін-8-ілу, 3,5-диметилізоксазол-4-ілу, тіофен-3ілу, піридин-4-ілу, піридин-3-ілу, -CH2-Q і фенілу, необов'язково заміщеного від одного до трьох незалежно вибраними R30 групами; R8 вибирають з групи, що складається з Н, ОН, NO2, CF3, OCF3, С1-3алкокси, галогену, СО(С13алкіл), СО(ОС1-3алкіл), хінолін-5-ілу, хінолін-8-ілу, 3,5-диметилізоксазол-4-ілу, тіофен-3-ілу, -СН2-Q і фенілу, необов'язково заміщеного від одного до трьох незалежно вибраними R30 групами; Q-ОН, диалкіламіно, R20 вибирають з групи, що складається з Н, С1і СО(С1-3алкіл); і R30 вибирають з групи, що складається з диалкіламіно, CN й OCF3; за умови, що: a) коли кожен R5 - Η, R6 - Η, n5 - 0 і R8 - Η, тоді R7 не може бути хлором; 3алкіл 13 b) коли кожен R5 - Η, R6 - Η, n5 - 0, X2 - О або СН2-, і R8 - Η, тоді R7 не може бути СН3; c) коли кожен R5 - Η, R6 - Η, тоді R7 й R8 не можуть обидва бути фтором; 2 d) коли кожен R5 - Η, R6 - Η, і X -О, тоді R7 й R8 не можуть обидва бути хлором; e) коли кожен R5 - Η, R6 - Η, Χ-О, і R8 - NO2, тоді R7 не може бути фтором; і f) коли кожен R5 - Η, R6 - Η, Χ2 - SO2, і R8 - Η, тоді R7 не може бути фтором або хлором. У деяких варіантах втілення, X2 - СН2. У деяких інших варіантах втілення, n3 - 1. У деяких інших варіантах втілення, n3 - 1. В ще інших варіантах втілення, n2 - 1. У деяких варіантах втілення, n3 - 1; n1 - 1; і n2 1. У деяких таких варіантах втілення, R6 - Η. У деяких таких варіантах втілення, n3 - 1; n1 - 1; n2 - 1; R6 - Η; R7 вибирають з групи, що складається з СН3, CF3, OCF3, галогену, СООСН3, СОН, СН2ОН, диетиламінометилу, хінолін-5-ілу, хінолін-8-ілу, 3,5-диметилізоксазол-4-ілу, тіофен-3-ілу, піридин4-ілу, піридин-3-ілу, фенілу, 4-диметиламіно-фен1-ілу, 2-трифторметокси-фен-1-ілу, 2-ціано-фен-1ілу, морфолін-1-іл-метилу, піперазин-1-іл метилу, 4-ацетил-піперазин-1-іл метилу і 4-метилпіперазин-1-іл метилу;і R8 вибирають з групи, що складається з Н, галогену, CF3 й NO2. У деяких таких варіантах втілення, R5 - Н. У деяких інших варіантах втілення, R5 - СН3. У деяких варіантах втілення сполук Формули І, X2 - О. У деяких таких варіантах втілення, n3 - 1. У деяких таких варіантах втілення, щ-1. У деяких таких варіантах втілення, n2 - 1. У деяких таких варіантах втілення, Ro-Η. У деяких таких варіантах втілення, n3 - 1; n1 - 1; і n2 - 1. У деяких таких варіантах втілення, n3 - 1; n1 - 1; n2 - 1; R6 - Η; R7 вибирають з групи, що складається з бензилокси, ОН, галогену, СН3 й CF3; і R8 вибирають з групи, що складається з Н, галогену і NO2. У деяких таких варіантах втілення, R5 - Н. У деяких інших варіантах втілення, R5 - СН3. У деяких оптимальних варіантах втілення, R7 - CF3, і R8 - Η. У деяких варіантах втілення, X2-SO2. У деяких таких варіантах втілення, n5 - 2. У деяких інших таких варіантах втілення, n3 - 1. У деяких інших таких варіантах втілення, n1 - 1. У деяких інших таких варіантах втілення, n2 - 1. У деяких варіантах втілення, R6 - Н. У деяких інших таких варіантах втілення, n3 - 1; n1 - 1; і n2 - 1. У деяких варіантах втілення, X2 - SO2; n3 - 1; n1 - 1; n2 - 1; R6 - Н; R7 CF3; і R8 - Η. У деяких варіантах втілення, n1 - 1; n2 - 1 або 2; n3 - 1, n5 - 0; X2 - СН2, кожен R5 і кожен R6 - Н; і R7 й R8 незалежно відбираються із групи, що складається з Н, F, CF3, OCF3, ОН, хінолін-5-ілу й хінолін-8-ілу, за умови, що R7 й R8 обидва не є Н. У деяких оптимальних варіантах втілення пропонуються сполуки Формули II: 91053 14 де: Χ - зв'язок або О; n1 -1 або 2; n2 -1 або 2; n6 -1 або 2; R5 - Η або СН3; R6 - Η або С1-6алкіл; і R8 вибирають з групи, що складається з Н, ОН, ΝΟ2, CF3, OCF3, ОСН3, галогену, СОСН3, СООСН3, диметиламіно, диетиламіно і CN. У деяких варіантах втілення, n1 - 1. У деяких інших варіантах втілення, n2 - 1. У деяких інших варіантах втілення, n6 - 2. У деяких інших варіантах втілення, R5 - Н. У деяких інших варіантах втілення, R6 - Н. У деяких інших варіантах втілення, n1 - 1; n2 - 1; і n6 - 2. У деяких оптимальних варіантах втілення, R5 Н; R6 - Н; n1 - 1, n2 - 1; і n6 - 2. У деяких таких варіантах втілення, R8 вибирають з групи, що складається з Н, CF3, OCF3 і галогену, бажано Н. Даний винахід також пропонує способи лікування запалення, спричиненого або посиленого простагландинами, лейкотрієнами або фактором активації тромбоцитів, у ссавця, спосіб, що включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки винаходу або її фармацевтично прийнятної солі. Даний винахід додатково пропонує способи лікування болю, спричиненого або посиленого простагландинами, лейкотрієнами або фактором активації тромбоцитів, у ссавця, спосіб, що включає введення ссавцеві, який потребує такого лікування, фармацевтично прийнятної кількості сполуки винаходу або її фармацевтично прийнятної солі. Даний винахід також пропонує способи для лікування або профілактики венозного або артеріального тромбозу у ссавця, або запобігання прогресування симптомів тромбозу, спосіб, що включає введення ссавцеві, який потребує такого лікування або профілактики, фармацевтично прийнятної кількості сполуки винаходу або її фармацевтично прийнятної солі. У деяких варіантах втілення тромбоз представляє собою атеротромбоз. Даний винахід також пропонує фармацевтичні композиції, що включають сполуку винаходу або її фармацевтично прийнятну сіль, і фармацевтично прийнятний носій. Також, відповідно до даного винаходу пропонуються фармацевтично прийнятні солі і проліки сполук, описаних авторами. 15 Сполуки даного винаходу можуть використовуватися як фармацевтичні композиції у комбінації з фармацевтично прийнятним носієм. Така композиція може містити (на додаток до сполуки або сполук даного винаходу й носія) різні розріджувачі, наповнювачі, солі, буфери, стабілізатори, солюбілізатори та інші матеріали, загальновідомі серед спеціалістів у даній галузі. Термін "фармацевтично прийнятний" означає нетоксичний матеріал, який не перешкоджає ефективності біологічної активності активного(их) інгредієнта(ів). Характеристики носія можуть залежати від шляху введення. Фармацевтична композиція може додатково містити інші протизапальні засоби. Такі додаткові фактори й/або засоби можуть бути включені у фармацевтичну композицію з метою отримання синергістичного ефекту зі сполуками даного винаходу, або мінімізації побічних ефектів, спричинених сполукою даного винаходу. Фармацевтичні композиції винаходу можуть бути у формі ліпосоми або міцел, у яких сполуки даного винаходу є поєднані, крім інших фармацевтично прийнятних носіїв, з амфіпатичними агентами, такими, як ліпіди, які існують в агрегованій формі як міцели, нерозчинні моношари, рідкі кристали або ламелярні шари, перебуваючи у водному розчині. До прийнятних ліпідів для ліпосомної композиції належать, крім інших, моногліцериди, дигліцериди, сульфатиди, лізолецитин, фосфоліпіди, сапонін, жовчні кислоти і т. ін. Одержання таких ліпосомних композицій не виходить за межі кваліфікації звичайного спеціаліста у даній галузі, як описано, наприклад, у Патентах США №№4,235,871; 4,501,728; 4,837,028; та 4,737,323, які є включеними авторами шляхом посилання. Вжитий авторами термін "фармацевтично ефективна кількість" або "терапевтично ефективна кількість" означає загальну кількість кожного активного компонента фармацевтичної композиції або спосіб, який є достатнім для демонстрації суттєвої користі для пацієнта, наприклад, лікування, виліковування, профілактика, пригнічення або полегшення фізіологічної відповіді або стану, таких як запальний стан або біль, або прискорення лікування, виліковування, профілактика, пригнічення або полегшення таких станів. При застосуванні до індивідуально активного інгредієнта, який вводять окремо, термін стосується лише цього інгредієнта. При застосуванні до комбінації цей термін стосується комбінованих кількостей активних інгредієнтів, які в результаті забезпечують терапевтичний ефект, при введенні у комбінації, послідовно або одночасно. Кожен зі способів лікування або використання даного винаходу, описаний авторами, включає введення ссавцеві, який потребує такого лікування або використання фармацевтично .чи терапевтично ефективної кількості сполуки даного винаходу, або її фармацевтично прийнятної сольової форми. Сполуки даного винаходу можуть бути введені згідно з описаним авторами способом, окремо або у комбінації з іншими видами терапії, такими як лікування із застосуванням інших протизапальних агентів, цитокінів, лімфокінів або інших факторів кровотворення. При спільному введенні з одним 91053 16 або кількома іншими протизапальними засобами, цитокінами, лімфокінами або іншими факторами кровотворення, сполуки даного винаходу можуть вводитись або одночасно з іншим(и) протизапальним(и) засобом(ами), цитокіном(ами), лімфокіном(ами), іншим(и) фактором(ами) кровотворення, тромболітичними або антитромбічними факторами, або послідовно. При послідовному введенні, лікар приймає рішення щодо належної послідовності введення сполук даного винаходу в комбінації з іншим(и) протизапальним(и) засобом(ами), цитокіном(ами), лімфокіном(ами), іншим(и) фактором(ами) кровотворення, тромболітичними або антитромбічними факторами. Ведення сполук даного винаходу у фармацевтичній композиції або практичне втілення описаного авторами способу може здійснюватись різними традиційними способами, такими, як пероральне приймання, інгаляція або шкірна, підшкірна або внутрішньовенна ін'єкція. Якщо терапевтично ефективну кількість сполук даного винаходу вводять перорально, сполуки даного винаходу мають бути у формі таблетки, капсули, порошку, розчину або еліксиру. При введенні у формі таблетки фармацевтична композиція винаходу додатково може містити твердий носій, такий, як желатин або ад'ювант. Таблетка, капсула та порошок можуть містити від приблизно 5 до 95% сполуки даного винаходу та, в оптимальному варіанті, приблизно від 10% до 90% сполуки даного винаходу. При введенні у рідкій формі додають рідкий носій, такий, як вода, нафта, масла тваринного або олії рослинного походження, такі, як арахісова олія, мінеральна олія, фосфоліпіди, твіни, тригліцериди, включаючи тригліцериди із середньою довжиною ланцюга, соєва олія або кунжутова олія, або синтетичні олії. Рідка форма фармацевтичної композиції також може містити фізіологічний розчин, декстрозу або розчин іншого сахариду, або гліколі, такі, як етиленгліколь, пропіленгліколь або поліетиленгліколь. При введенні у рідкій формі фармацевтична композиція містить від приблизно 0,5 до 90% за масою сполуки даного винаходу, і та, в оптимальному варіанті, приблизно від 1% до 50% сполуки даного винаходу. Якщо терапевтично ефективну кількість сполук даного винаходу вводять шляхом внутрішньовенної, шкірної або підшкірної ін'єкції, сполуки даного винаходу мають бути у формі апірогенного, парентерально прийнятного водного розчину. Приготування таких парентерально прийнятних білкових розчинів, з належним дотриманням рівня рН, ізотонічності, стабільності та інших подібних чинників, не вимагає відомостей поза межами кваліфікації звичайного спеціаліста у даній галузі. Оптимальна фармацевтична композиція для внутрішньовенної, шкірної або підшкірної ін'єкції має містити, на додаток до сполук даного винаходу, ізотонічний носій, такий, як розчин хлориду натрію для ін'єкцій, розчин Рингера для ін'єкцій, розчин декстрози для ін'єкцій, Розчин декстрози та хлориду натрію для ін'єкцій, лактатний розчин Рингера для ін'єкцій або інший носій, відомий спеціалістам у даній галузі. Фармацевтична композиція також може містити стабілізатори, консерванти, 17 буфери, антиоксиданти або інші домішки, відомі спеціалістам у даній галузі. Кількість сполуки (сполук) даного винаходу у фармацевтичній композиції даного винаходу буде залежати від характеру та ступеня тяжкості стану, який піддають лікуванню, і від характеру попередніх видів лікування, яким піддавався пацієнт. І нарешті, лікар приймає рішення щодо кількості сполуки даного винаходу, яка має бути застосована для лікування кожного окремого пацієнта. Спочатку лікар буде вводити низькі дози сполуки даного винаходу й спостерігати за реакцією пацієнта. Більші дози сполук даного винаходу можна вводити до досягнення оптимального терапевтичного ефекту для пацієнта, і в цей момент зазвичай припиняють підвищення дози. Передбачається, що різні фармацевтичні композиції, що використовуються для практичного втілення способу відповідно до даного винаходу, повинні містити приблизно від 0,1мкг до приблизно 100мг (бажано приблизно від 0,1мг до приблизно 50мг, більш бажано приблизно від 1мг до приблизно 2мг) сполуки даного винаходу на кг маси тіла. Тривалість внутрішньовенної терапії з використанням фармацевтичної композиції відповідно до даного винаходу буде змінюватися, залежно від ступеня тяжкості хвороби, що підлягає лікуванню, й стану та потенційної ідіосинкратичної реакції кожного індивідуального пацієнта. Передбачається, що тривалість кожного застосування сполук даного винаходу буде в діапазоні 12-24 годин безперервного внутрішньовенного введення. І нарешті, лікар приймає рішення щодо відповідної тривалості внутрішньовенної терапії, з використанням фармацевтичної композиції відповідно до даного винаходу. Пероральна композиція на ліпідній основі цього винаходу була приготована шляхом змішування 50% PHOSAL.RTM. 53MCT (American Lecithin Company), 5% Полісорбату 80, 15% LABRASOL.RTM. Каприлокапроїлмакрогол-8 гліцеридів (Gattefosse Corp.), 15% Пропіленкарбонату й 15% активної (их) cPLA2 інгібуючої (их) сполуки (сполук) цього винаходу, кожен відсоток зазначений за масою. Фармацевтично прийнятні солі сполук Формули (І), що містять кислотний залишок можуть бути отримані з органічних і неорганічних основ. До підходящих солей з основами належать, наприклад, солі металів, такі як солі лужного металу або лужноземельного металу, наприклад солі натрію, калію або магнію; або солі з амонієм або органічним аміном, таким як морфолін, тіоморфолін, піперидин, піролідин, моно-, ди-або три- нижчий алкіламін, наприклад етил-трет-бутил-, диетил-, диізопропіл-, триетил-, трибутил- або диметилпропіламін, або моно-, ди-, або тригідрокси нижчий алкіламін, наприклад моно-, ди- або триетаноламін. Даний винахід також включає проліки сполук, описаних авторами. Вжитий авторами термін «проліки» стосується залишку, що вивільнює сполука відповідно до винаходу при введені суб'єктові-ссавцеві. Проліки можна отримати шляхом модифікації функціональних груп, присутніх у сполуках у такий спосіб, що модифікації розщеп 91053 18 люються або при рутинній маніпуляції або in vivo до вихідних сполук. Приклади проліків включають сполуки винаходу, описані авторами, які містять один або кілька молекулярних залишків, приєднаних до гідроксильної, аміно, сульфгідрильної або карбоксильної групи сполуки, і що при введені суб'єктові-ссавцеві розщеплюються in vivo з утворенням вільної гідроксильної, аміно, сульфгідрильної або карбоксильної групи, відповідно. Приклади проліків включають, крім інших, ацетатні, форміатні і бензоатні похідні спиртових й амінних функціональних груп в сполуках винаходу. Підготовка й використання проліків обговорюються в Т. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems", Vol. 14 з A.C.S. Symposium Series, та в Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, які включені авторами шляхом посилання у повному обсязі. Вжитий авторами термін «алкіл» стосується насиченої вуглеводневої групи, яка є одноланцюговою або розгалуженою. Приклади алкільних груп включають метил (Me), етил (Et), пропіл (наприклад, н-пропіл й ізопропіл), бутил (наприклад, нбутил, ізобутил, вт-бутил, т-бутил), пентил (наприклад, н-пентил, ізопентил, неопентил) і т.п.. Алкільні групи можуть містити від 1 до приблизно 20, від 1 до приблизно 10, від 1 до приблизно 8, від 1 до приблизно 6, від 1 до приблизно 4 або від 1 приблизно до З вуглецевих атомів. У деяких варіантах втілення алкільні групи можна замінити чотирма групами-замісниками, як описано нижче. Вжитий авторами термін «нижчий алкіл» означає алкільні групи, що містять до шести вуглецевих атомів. Вжитий авторами термін «гідрокси» або «гідроксил» стосується О. Вжитий авторами термін «гало» або «галоген» включає фторо-, хлоро-, бромо- та йодо-. Вжитий авторами термін «ціано» стосується CN. Вжитий авторами термін «алкокси» стосується -О-алкільної групи. Приклади алкоксигрупи включають метокси, етокси, пропокси (наприклад, нпропокси та ізопропокси), т-бутокси і т.п.. Алкоксигрупа може містити від 1 до приблизно 20, від 1 до приблизно 10, від 1 до приблизно 8, від 1 до приблизно 6, від 1 до приблизно 4 або від 1 приблизно до 3 вуглецевих атомів. Вжитий авторами термін «бензилокси» стосується -О-бензильної групи. У різних місцях в даному описі замісники сполук винаходу описуються в групах або в діапазонах. Мета такого специфічного позначення полягає в тому, що винахід включає кожну індивідуальну підкомбінацію членів таких груп і діапазонів. Наприклад, термін «С1-6алкіл» вжитий специфічно, щоб індивідуально зазначити метил, етил, пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил, і т.д. Сполуки даного винаходу можуть містити асиметричний атом (також зазначається як хіральний центр), і деякі зі сполук можуть містити один або кілька асиметричних атомів або центрів, які можуть у такий спосіб утворювати оптичні ізомери 19 (енантіомери) і діастереомери. Даний винахід включає такі оптичні ізомери (енантіомери) і діастереомери (геометричні ізомери); а також рацемічні і розділені, енантіомерно чисті R й S стереоізомери, а також інші суміші R й S стереоізомерів та їх фармацевтично прийнятних солей. Оптичні ізомери можуть бути отримані у чистому вигляді відповідно до стандартних процедур, які відомі кваліфікованим спеціалістам у даній галузі і включають, крім інших, утворення діастереомерної солі, кінетичне розділення і асиметричний синтез. Також зрозуміло, що цей винахід охоплює всі можливі регіоізомери та їх суміші, які можуть бути отримані у чистому вигляді відповідно до стандартних процедур розділення, які відомі кваліфікованим спеціалістам у даній галузі і включають, крім інших, колонкову хроматографію, тонкошарову хроматографію і високоефективну рідинну хроматографію. Нові сполуки даного винаходу можна отримати за допомогою низки шляхів, відомих кваліфікованому спеціалісту в галузі органічного синтезу. Сполуки даного винаходу можуть синтезуватися з використанням способів, описаних нижче, разом із синтетичними методами, відомими в галузі синтетичної органічної хімії або модифікаціями до них, як відомо кваліфікованим спеціалістам в даній галузі. Сполуки даного винаходу можуть бути зручно отримані відповідно до процедур, зазначених в схемах нижче, із комерційно доступних вихідних матеріалів, сполук, відомих в літературі, або легко отриманих проміжних продуктів з використанням стандартних синтетичних методів й процедур, відомих кваліфікованому спеціалісту в даній галузі. Про стандартні синтетичні методи й процедури для отримання органічних молекул і перетворень функціональних групи та маніпуляцій з ними можна легко дізнатися із відповідної наукової літератури або із стандартних підручників в даній галузі. Вважається, що у випадках, коли надаються типові або оптимальні умови процесу (тобто, температура, час реакції,мольні співвідношення реагентів, розчинники, тиск, і т.д.), можуть також використовуватися інші умови процесу, якщо не зазначено інакше. Оптимальні умови реакції можуть змінюватися в залежності від конкретних реагентів або розчинників, що використовуються, але такі умови можуть бути визначені спеціалістом, кваліфікованим в даній галузі, відповідно до рутинних процедур оптимізації. Кваліфіковані спеціалісти в галузі органічного синтезу визнають, що природа й порядок представлених кроків синтезу можуть бути різними заради оптимізації утворення сполук відповідно до винаходу. Процеси, описані авторами, можуть контролюватися за допомогою будь-якого підходящого методу, відомого в даній галузі. Наприклад, утворення продукту можна контролювати спектроскопічними засобами, такими як спектроскопія ядерного магнітного резонансу (наприклад, 1 Η або 13С) інфрачервона спектроскопія, спектрофотометрія (наприклад, УФ-видима) або масспектрометрія, або хроматографією, такою як ви 91053 20 соко ефективна рідинна хроматографія (ВЕРХ) або тонкошарова хроматографія. Отримання сполук може включати захист різних хімічних груп й зняття з них захисту. Потреба в захисті й знятті захисту, і виборі відповідних захисних груп може бути легко визначена спеціалістом, кваліфікованим у даній галузі. З хімією захисних груп можна ознайомитися, наприклад, у Greene, et al., Protective Groups in Organic Synthesis, 2d. Ed., Wiley & Sons, 1991, що включений авторами шляхом посилання у повному обсязі. Реакції процесів, описані авторами, можна проводити в підходящих розчинниках, які можуть бути легко обрані спеціалістом, кваліфікованим в галузі органічного синтезу. Підходящі розчинники можуть бути значною мірою нереакційними по відношенню до вихідних матеріалів (реагентів), проміжних продуктів або продуктів при температурах проведення реакції, тобто, температурах, які можуть коливатися від температури замороження розчинника до температури кипіння розчинника. Дана реакція може бути виконана в одному розчиннику або суміші кількох розчинників. Залежно від конкретної стадії реакції, можуть бути підібрані підходящі розчинники для певної стадії реакції. Крім інших джерел, публікацій й літератури, такі, як наприклад, WO 200044723; Li, J. P.; Newlander, Κ. Α.; Yellin, Т. О. Synthesis, 1988, 7376; Gilchrist, Т. L.; Roberts, Т. G. J. Chem. Soc. Perkin. Trans 1 1983, 1283-1292 є корисними й визнаними посиланнями щодо органічного синтезу, відомими спеціалістам у даній галузі. Кожний з попередніх документів включений авторами шляхом посилання у повному обсязі. Сполуки винаходу отримують з використанням стандартних методів, відомих кваліфікованим спеціалістам у галузі органічного синтезу. Вихідні матеріали, що використовуються для отримання сполук винаходу, є відомими, одержуються відомими методами або є комерційно доступними. Кваліфіковані спеціалісти в галузі органічного синтезу визнають, що природа й порядок представлених кроків синтезу можуть бути різними заради оптимізації утворення сполук винаходу. Приклади Отримання сполук винаходу Нижче більш докладно описується отримання представницьких сполук цього винаходу. Нижче представлено приклади, які ілюструють винахід, але вони жодним чином не повинні розглядатись як такі, що обмежують його обсяг. Спеціаліст, кваліфікація якого у межах звичайних навичок в даній галузі, визнає, що існує низка некритичних параметрів, які можуть бути змінені або модифіковані для отримання по суті тих же самих результатів. Mac-спектральні дані зазначаються як співвідношення маси-до-заряда, m/z; а для масспектральних даних з високим розділенням, зазначаються теоретичні й практичні маси, [М+Н]+, для нейтральних формул М. Результати ядерного магнітного резонансу зазначаються як δ у частках на мільйон (ррm) від стандарту, тетраметилсилану; а також вказується розчинник, ядро і параметрами сили поля. Константи спін-спінової гомоядерної взаємодії зазначаються як J величини в герцах (Hz); і 21 мультиплетність вказується як a: s, синглет; d, дублет; t, триплет; q, квартет; квінтет або br, розширений. Загальна синтетична схема (и) отримання сполук 91053 22 Сполуки відповідно до винаходу можуть бути отримані відповідно до процедур Способів А-Е, показаних нижче: Способ А Як показано вище в Способі А, початковий індол може бути алкільований у положенні С3 (вуглецевий атом в 3 положенні індольного залишку) альдегідами або відповідними ацеталями у присутності кислоти Льюїса або Бренстеда, такої як трифторидетерат бору або трифтороцтова кислота. Азот індолу може після цього бути алкільований шляхом обробки сильною основою, такою як біс(триметилсілил)амід натрію, н-BuLi, гідрид натрію або гідрид калію в розчиннику, такому як DMF, диметилсульфоксид або THF, після чого додають відповідний алкілгалід. Отриманий продукт можна обробити тетрабромід вуглецю у чотирьоххлористому вуглеці й каталітичною кількістю пероксида бензоїла для досягнення дибромінування С2 метальної групи. Дибромід можна після цього або перемішувати з карбонатом срібла у воді/ ацетоні або додати в DMSO і перемішати. Внаслідок цих обох процедур отримують альдегід, який після цього вводять в нітроальдольну реакцію 23 91053 24 з нітрометаном й ацетатом амонію зі зворотнім холодильником. Отриманий вінілнітро проміжний продукт відновлюється до аміну після обробки цинково-ртутною амальгамою в суміші THF і конц. НСI зі зворотнім холодильником. Після цього цей амін можна обробити необхідною кількістю сульфонілхлориду при двофазних умовах, водний розчин натрію бікарбонату/дихлорметан, або в органі чному розчиннику з додаванням органічної амінної основи. Кінцевий гідроліз може бути досягнутий в основних умовах за допомогою гідроксиду натрію у воді й метанолі та THF, при кімнатній температурі або при підвищеній температурі. Альтернативно, його можна розщепити обробкою тіометоксидом натрію у розчиннику, такому як THF або DMF при підвищеній температурі (50°С-100°С). Як показано вище в Способі В, галід поміщають у контейнер з бороновою кислотою, основою (наприклад, KF), джерелом палладія (наприклад Pd(OAc)2) лігандом (наприклад РРh3), і підходящим дегазованим розчинником, наприклад, DMF, МеОН, вода або їх комбінація. Після цього суміш нагрівають або термально або в мікрохвильовому реакторі. Внаслідок стандартної процедури отримують захищений (естер) продукт, що після цього гідролізує в основному середовищі з утворенням вільної кислоти. 25 Як показано в Способі С вище, формілвмісна сполука обробляється аміном, джерелом кислоти у разі потреби і підходящим відновником, таким як NaBH(OAc)3. Реакційна суміш перемішується при кімнатній температурі, або може бути нагріта, у 91053 26 разі потреби. Внаслідок стандартної процедури отримують захищений (естер) продукт, що після цього гідролізує в основному середовищі з утворенням вільної кислоти. 27 Як показано в Способі D вище, відповідно заміщений галоамін реагує з трифтороцтовим ангідридом з утворенням проміжного продукту, який можна обробити каталізатором Pd(II) у присутності основи, такої як триетиламін, Cul і підходящого алкіну, під високою температурою з отриманням бажаного проміжного індолу. Первинний спирт захищають як сілильний етер, використовуючи сілилхлорид, такий як т-бутилдифенілсілилхлорид й основу, таку як імідазол. Після цього захищений індол обробляють оксалілхлоридом, а потім метанолом з утворенням бажаного оксалатного естеру, індольний азот якого можна алкілювати, використовуючи підходящу основу, таку як карбонат цезію в перегнаному ацетонітрилі і галід. Після цього оксалат може бути відновлений дією підходящого відновника, такого як боран. Отриманий первинний спирт перетворюють у галід за допомогою, наприклад, СВr4 і фосфіну, який можна потім замістити нуклеофілом, таким як тіофенол. Отриманий 91053 28 тіоетер може бути окиснений низкою окисників, включаючи оксон й TPAP/NMO. З отриманого сульфона може бути знятий захист дією джерела фториду, такого як TBAF, CsF або HF. Отриманий спирт може бути перетворений у галід або мезилат, наприклад, з використанням метансульфонілхлориду й органічної основи, який потім може бути заміщений азидом натрію в DMF. Отриманий алкілазид може бути відновлений при дії трифенілфосфіну й вологого THF. Амін може бути сульфонований дією сульфонілхлориду при будь-яких двофазних умовах Schotten-Baumann (вод. бікарбонат й дихлорметан) або у безводному середовищі, що складається з дихлорметану й органічної основи, такої як основа Hunigs. Отриманий ефірний проміжний продукт гідролізують, використовуючи основу, таку як NaOH, KОН або LiOH, і суміші розчинників, включаючи спиртовий розчинник, воду й тетрагідрофуран. 29 Як показано в Способі Ε вище, початкова амінокислота етерифікується й Ν-алкілюється в одній посудині (за допомогою, наприклад, діазореактиву або триметилсілилдіазореактиву). Після цього цей N-алкілестер сульфонується за допомогою сульфонілхлориду, з використанням або умов Schotten-Baumann або органічних розчинників й органічних основ. І нарешті, N-алкілестер гідролізується до бажаного продукту з використанням основи, такої як NaOH, і підходящої системи розчинників, типу THF й спирту. Наступні сполуки були отримані відповідно до Способів А-Е вище. Приклад 1 4-{2-[2-[2-({[2(бензилокси)бензил]сульфоніл}аміно)етил]-5хлоро-1-(дифенілметил)-1H-індол-3іл]етокси}бензойна кислота Крок 1: До метилового ефіру 4гідроксибензойної кислоти (1.0екв.) в DMF (0.83М) додали K2СО3 (2.0екв.), а потім 2-бромо-1,1диетоксиетан, і реакційну суміш перемішували при 110°С протягом 2 днів. На ТШХ хроматограмі з'явилася нова пляма. Реакційну суміш розвели етилацетатом, промили 1н. NaOH, водою і сольовим розчином, висушили над сульфатом натрію, і видалили розчинник з отриманням бажаного продукту з 84% виходом. Цей матеріал використовувався в наступному кроці без подальшого очищення. Крок 2: До вищезгаданого продукту (1.0екв.) і 5-хлоро-2-метиліндолу (1.0екв.) в СН2Сl2 (0.12М) додали триетилсилан (3.0екв.), а після цього трифтороцтову кислоту (3.0екв.). Після перемішування упродовж ночі при кімнатній температурі, до реакційної суміші додали воду й трифтороцтову кислоту (1.0екв.) та перемішували при кімнатній температурі протягом двох днів, розвели за допомогою СН2Сl2, промили 1н. NaOH, водою і сольовим розчином і висушили над сульфатом натрію. Внаслідок розтирання матеріалу з СН2Сl2 й гексанами отримали С3 алкільований індол з 92%-ом виходом. Крок 3: До індолу, отриманого за наведеною вище схемою, (1.0екв.) в DMF (0.36М) при 25°С додали NaH (1.2екв., 60% дисперсія в олії). Коричневий розчин перемішували при температурі від 0 до -5°С упродовж 1год., і потім додали бромодифенілметан (1.1екв.). Реакційну суміш перемішували упродовж ночі, і потім додали воду, розвели етилацетатом, промили водою й сольовим розчином, висушили над сульфатом натрію й очистили колонковою хроматографією з отриманням бажаного продукту з 72% виходом. Крок 4: До N-алкільованого індолу, отриманого за наведеною вище схемою, (1.0екв.) в ССl4 (0.2М) додали N-бромосукцинімід (2.0екв.) і каталітичну кількість бензоїлпероксиду. Розчин нагрівали зі зворотнім холодильником упродовж 3год., охолодили до 25°С, відфільтрували, і тверду речовину промили з ССl4. Фільтрат сконцентрували до піни, що була висушена у вакуумі. Піну розчинили в ацетоні, і додали Ag2CO3 (1.1екв.), а потім воду, і реакційну суміш перемішували упродовж ночі при кімнатній температурі, а потім відфільтрували й 91053 30 промили ацетоном. Фільтрат сконцентрували до залишку, до якого додали воду. Цю суміш екстрагували етилацетатом, промили сольовим розчином і висушили над сульфатом натрію. Внаслідок хроматографічного очищення залишку отримали бажаний продукт з 85% виходом. Крок 5: До вищезазначеного альдегіду (1.0екв.) в CH3NO2 (0.2М) додали ацетат амонію (4екв.), і отриману суміш нагрівали зі зворотнім холодильником упродовж 4год. Після цього реакційну суміш розчинили EtOAc і промили сольовим розчином. Водну фазу екстрагували ЕtOАс. Об'єднані органічні екстракти промили сольовим розчином, висушили над сульфатом натрію, і концентрували до осадження оранжевих кристалів. Суміш зберігали у холодильнику упродовж ночі, і фільтрацією був зібраний нітроолефін (76% вихід). Упарювання фази розчинника й очищення залишку колонковою хроматографією (градієнтне елюювання 100% толуол 1% EtOAc-толуол) дозволило отримати додаткову кількість нітроолефіну (23% вихід). Крок 6: Цинковий пил (20екв.) суспендували в 5% водному розчині НСI (8Μ Ζn/5% НСI). До цієї суміші додали HgCl2 (0.28екв.). Суміш струшували протягом 10хв., водну фазу декантували й замістили свіжою 5% НСI, і знову суміш струшували протягом 5хв., і водну фазу вилучили. Таким чином отриману цинково-ртутну амальгаму додали до суміші нітроолефіну (1.0екв.) і конц. НСI (80екв.) в THF (0.04Μ нітроолефіну/THF). Суміш злегка нагрівали зі зворотнім холодильником упродовж 1год. Утворення продукту контролювали аналізом ТШХ. Суміш охолодили до кімнатної температури, і тверду речовину вилучили фільтрацією через целіт. До рідкої фази додали конц. ΝΗ4ΟΗ, і суміш сконцентрували на ротаційному випарнику. Залишок розчинили в СН2СІ2 і конц. ΝΗ4ΟΗ. Водну фазу екстрагували СН2СІ2, і органічну фазу промили сольовим розчином, висушили над сульфатом натрію та сконцентрували. Очищення колонковою хроматографією дозволило отримати бажаний продукт (65% вихід). Крок 7: До суміші і-бензилокси-2бромометилбензолу (8.9г), йодиду тетрабутиламонію (59мг) і води (150мл) додали сульфіт натрію (4.2г). Суміш нагрівали зі зворотнім холодильником упродовж ночі. Після охолодження суміші до 0°С, її підкислили 6н. НСI. Була проведена екстракція етилацетатом (100мл 6) (дещо залишилося у водному шарі). Об'єднані органічні фази висушили над MgSO4. Фільтрат сконцентрували під вакуумом. Продукт розтерли з етиловим етером з отриманням (2-Бензилокси-феніл)-метансульфонової кислоти (678мг, 8%). 1Н ЯМР (400MHz, DMSO-D6): δ 3.82 (s, 2Η) 5.09 (s, 2Η) 6.86 (t, J=7.45Hz, 1Η) 6.96 (d, J=8.08Hz, 1H) 7.14 (t, J=7.83Hz, 1H) 7.32 (d, J=7.33Hz, 1H) 7.38 (t, J=7.33Hz, 2Η) 7.46 (d, J=9.09Hz, 1H) 7.52 (d, J=7.07Hz, 2Η). Крок 8: Тетрагідрофуран (10мл), (2Бензилокси-феніл)-метансульфонову кислоту (138мг) і N,N-диметилформамід (2 краплі) охолодили до -78°С, і повільно додали оксалілхлорид (315мг). Реакційну суміш перемішували упродовж 31 3год. при температурі від -78°С до 0°С. Реакційну суміш освітлили фільтрацією. Фільтрат промили льодяною водою й гептаном, і висушили з отриманням (2-бензилокси-феніл)-метансульфоніл ! хлориду (114мг, 77%). Н ЯМР (400MHz, CDCI3): δ 5.06 (s, 2Η) 5.15 (s, 2Η) 7.04 (m, 2Η) 7.42 (m, 7 Η). Крок 9: До метил 4-{2-[2-(2-аміноетил)-1бензгідрил-5-хлоро-1Н-індол-3-іл]етокси}бензоату (1.0екв., Крок 6) і насич. NaHCO3 (0.14М) в СН2Сl2 (0.07М) додали (2-бензилокси-феніл)метансульфоніл хлорид (1.0екв., крок 8). Через 16год. суміш додали у насичений розчин бікарбонату натрію й екстрагували СН2СІ2. Об'єднану органічну фазу промили сольовим розчином, висушили над сульфатом натрію й очистили колонковою хроматографією з отриманням 77% бажаного продукту. Крок 10. Отриманий естер гідролізували перемішуванням з 1н. NaOH (5екв.) в THF (0.07М) і достатній кількості МеОН для утворення прозорого розчину. Реакцію контролювали за допомогою ТШХ (10% МеОН-СН2Сl2) на зникнення плями вихідного матеріалу. Після завершення реакції суміш сконцентрували, розвели Н2О і підкислили до рН24 за допомогою 1М НСI. Водну фазу екстрагували за допомогою ЕtOАс, а органічну фаза промили сольовим розчином, висушили над сульфатом натрію і сконцентрували з отриманням зазначеної у назві прикладу кислоти з 97% виходом. 1Н ЯМР (400MHz, CDCI3) δ 2.86 (d, J=14.40Hz, 2Η) 2.923.04 (m, 2Η) 3.13 (t, J=6.69Hz, 2Η) 4.12-4.23 (m, 2Η) 4.28 (s, 2Η) 4.34-4.45 (m, 1H) 4.90 (s, 2Η) 6.47 (d, J=8.84Hz, 1H) 6.73-6.93 (m, 6H) 6.95-7.08 (m, 4Η) 7.16-7.36 (m, 13H) 7.53 (d, J=1.77Hz, 1H) 7.92-8.04 (m, 2Η); HRMS теор. для [C46H41CIN2O6.S+Η-] 783.2301, практична 783.2292; чистота Н2О/МеОН 97%, H2O/MeCN 95%. Приклад 2 4-{2-[5-хлоро-1-(дифенілметил)-2-(2-{[(2гідроксибензил)сульфоніл]аміно}етил)-1Н-індол-3іл]етокси}бензойна кислота Крок 1: До 4-{2-[2-[2-({[2(бензилокси)бензил]сульфоніл}аміно)етил]-5хлоро-1-(дифенілметил)-1H-індол-3іл]етокси}бензойної кислоти (Крок 9, Приклад 1, 109мг, 0.14ммоль) додали THF й 10% МеОН. Додали Pd/C (11мг). Суміш перемішували при кімнатній температурі під Н2 (1атм.) упродовж ночі й відфільтрували через целіт, сконцентрували і очистили колонковою хроматографією (35% EtOAc/гекс.) з отриманням метилового естеру 4-(2{1-бензгідрил-5-хлоро-2-[2-(2-гідроксифенілметансульфоніламіно)-етил]-1Н-індол-3-іл}етокси)-бензойної кислоти (74мг, 76%), практично білої твердої речовини. Крок 2: Проміжний продукт естер гідролізували відповідно до Кроку 10 з Прикладу 1 з отриманням зазначеної у назві прикладу кислоти з 85% виходом. 'Н ЯМР (400MHz, CDCI3) δ 2.87-3.01 (m, 2Η) 3.00-3.11 (m, 2Η) 3.18 (t, J-6.57Hz, 2Η) 4.17 (s, 2Η) 4.19-4.30 (m, 2Η) 4.52 (t, J=5.81Hz, 1H) 6.52 (d, J=8.84Hz, 1H) 6.75-6.90 (m, 6H) 6.99 (dd, J=7.45, 1.64Hz, 1H) 7.01-7.13 (m, 4Η) 7.13-7.22 (m, 1H) 7.27-7.37 (m, 6H) 7.53 (d, J=2.02Hz, 1H) 7.91-8.04 91053 32 (m, 2Η); HRMS теор. для [C39H35ClN2O6.S+Η-] 695.1977, практичн. 695.1984. Приклад 3 4-{2-[5-хлоро-2-(2-{[(2,6дибромобензил)сульфоніл]аміно}етил)-1(дифенілметил)-1H-індол-3-іл]етокси}бензойна кислота Крок 1. До розчину 2,6-дибромотолуолу (5.38г, 21.53ммоль) у бензолі (1.54М) додали Nбромосукцинімід (4.21г, 23.68ммоль) і бензоїлпероксид (0.52г, 2.15ммоль). Після цього суміш нагрівали зі зворотнім холодильником упродовж ночі. Суміш охолодили до кімнатної температури, розвели Н2О і екстрагували за допомогою EtOAc. Об'єднану органічну фазу промили сольовим розчином, висушили над MgSO4 і сконцентрували з утворенням 7.65г бензилброміду, твердої речовини коричневого кольору. 1Η ЯМР (400MHz, CDCI3) δ 4.83 (s, 2Η), 7.01 (t, J=8.0Hz, 1Η), 7.55 (d, J=8.1Hz, 2Η). Крок 2. До розчину 2,6-дибромобензилброміду (1.0екв., Крок 1) в DMF(1.30M) додали тіоацетат калію (1.2екв.), і суміш залишили перемішуватися при кімнатній температурі упродовж 3-4год. Реакцію контролювали за допомогою LC/MS на зникнення вихідного матеріалу. Суміш розвели Н2О і екстрагували за допомогою EtOAc. Об'єднану органічну фазу промили сольовим розчином, висушили над MgSO4 і сконцентрували з утворенням 6.70г (89%) бензилтіоацетату у вигляді коричневої олії. Крок 3. До розчину тіоацетату (1.0екв., 6.70г, 20.7ммоль) в АсОН (0.19М) і Н2О (0.91М) додали ацетат натрію (6.7екв.). Після цього через реакційну суміш упродовж 30-45хв. інтенсивно пробульбували хлор. Після цього суміш сконцентрували, розвели ефіром, промили Н2О і сольовим розчином, висушили над MgSO4 і сконцентрували з утворенням 5.30г (74%) бажаного 2,6дибромофеніл-метансульфоніл хлориду, твердої 1 речовини коричневого кольору. Н ЯМР (400MHz, CDCI3) δ 5.55 (s, 2Η), 7.17 (t, J=8.0Hz, 1Η), 7.67 (d, J=8.1Hz, 2Η). Крок 4. Метиловий естер 4-{2-[2-(2-аміноетил)1-бензгідрил-5-хлоро-1H-індол-3іл]етокси}бензойної кислоти (Приклад 1, Крок 6, 126мг, 0.23ммоль) вступив в реакцію із 2,6дибромофеніл-метансульфоніл хлоридом (Крок 3) відповідно до процедури з Прикладу 1, Кроку 9 з утворенням 203мг бажаного сульфонаміду у вигляді білої твердої речовини в кількісному виході. Крок 5. Використовуючи процедуру в Прикладі 1, Кроці 10, сульфонамідний естер (175мг, 0.206ммоль) гідролізували, внаслідок чого отримали 146мг (85%) зазначеного у назві продукту, білої твердої речовини. 1H ЯМР 400MHz, CDCI3) δ 2.87-3.03 (m, 2Η), 3.06-3.14 (m, 2Η), 3.22 (t, J=6.9Hz, 2Η), 4.23 (t, J=6.4Hz, 2Η), 4.53 (t, J=5.9Hz, 1H), 4.72 (s, 2Η), 6.51 (d, J=8.8Hz, 1H), 6.82 (dd, J=9.0, 2.1Hz, 1H), 6.87 (d, J=8.8Hz, 2Η), 6.92 (s, 1H), 6.97 (t, J=8.0Hz, 1H), 7.05-7.12 (m, J=6.2, 2.9Hz, 4Η), 7.29-7.34 (m, 6H), 7.49 (d, J=8.1Hz, 2Η), 7.54 (d, J=2.0Hz, 1H), 8.00 (d, J=8.8Hz, 2Η). Приклад 4 33 4-(2-{1-бензгідрил-5-хлоро-2-[2-метил-6-нітрофенілметансульфоніламіно)-етил-1-H-індол-3-іл}етокси)-бензойна кислота Крок 1. До розчину 2-метил-6нітрофенілбензойної кислоти (3.02г, 16.67ммоль) в тіонілхлориді (0.56М) додали DMF (кат.), і суміш нагрівали зі зворотнім холодильником упродовж 5.5год. Після цього суміш охолодили до кімнатної температури й сконцентрували. Після цього залишок розчинили в THF (30мл) і повільно додали упродовж 20хв. до суспензії NaBH4 в THF (30мл), яку попередньо охолодили до 0°С. Суміш перемішували при кімнатній температурі упродовж 2год. і потім додали Н2О, а після цього 4М НСI. Суміш екстрагували за допомогою EtOAc. Об'єднану органічну фазу промили насич. NaHCCb і сольовим розчином, висушили над MgSO4 і сконцентрували з утворенням 2.52г (90%) бензилового спирту, твердої речовини оранжевого кольору. 1H ЯМР (400MHz, CDCI3) δ 2.53 (s, 3Η), 4.72 (s, 2Η), 7.36 (t, J=7.8Hz, 1Η), 7.46 (d, J=7.6Hz, 1H), 7.75 (d, J=8.1Hz, 1H). Крок 2. До розчину бензилового спирту (2.52г, 15.07ммоль) в СН2Сl2 (0.12М) охолодили до -78°С і під аргоном повільно додали ВВr3, 1.0Μ в СН2Сl2, (23мл, 22.6ммоль). Суміш перемішували при кімнатній температурі упродовж ночі і потім розвели Н2О (150мл). Шари відділили, і органічну фазу промили сольовим розчином, висушили над MgSO4 і сконцентрували з утворенням 2.97г (86%) 2-метил-6-нітробензилброміду, твердої речовини 1 коричневого кольору. Н ЯМР (400MHz, CDCI3) δ 2.53 (s, 3Η), 4.72 (s, 2Η), 7.36 (t, J=7.8Hz, 1H), 7.46 (d, J=7.6Hz, 1H), 7.75 (d, J=8.1Hz, 1H). Крок 3. 2-Метил-6-нітробензилбромід (Крок 2, 1.5г, 6.5ммоль) вступив в реакцію з тіоацетатом калію відповідно до процедури в Прикладі 3, Кроці 2, з утворенням 1.44г бензил тіоацетату, коричневої олії. Крок 4. Згідно процедури з Прикладу 3, Крок 3, бензил тіоацетат (1.44г, 6.39ммоль) був окиснений з утворенням 1.35г (84%) (2-метил-6-нітрофеніл) метансульфоніл хлориду, твердої речовини оранжевого кольору. 1Н ЯМР 400MHz, CDCI3) δ 2.622.65 (m, 3Η), 5.68 (s, 2Η) Широкий, 7.54 (t, J=7.8Hz, 1H), 7.58-7.60 (m, 1H), 7.91 (d, J=7.8Hz, 1H). Крок 5. Використовуючи процедуру, зазначену в Прикладі 1, Кроці 9, метиловий естер 4-{2-[2-(2аміноетил)-1-бензгідрил-5-хлоро-1Н-iндол-3іл]етокси}бензойної кислоти (Приклад 1, Крок 6, 255мг, 0.47ммоль) вступив в реакцію із сульфоніл хлоридом із Кроку 4, з утворенням 318мг сульфонаміду, твердої речовини жовтого кольору з 90% виходом. Крок 6. Естер сульфонаміду (101мг, 0.13ммоль) гідролізували відповідно до Прикладу 1, Кроку 10, внаслідок чого отримали 87мг (91%) зазначеного у назві продукту, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 2.48 (s, 3Η), 2.872.99 (m, 2Η), 3.03 -3.10 (m, 2Η), 3.22 (t, J=6.6Hz, 2Η), 4.23 (t, J=6.6Hz, 2Η), 4.33 (t, J=5.9Hz, 1H), 4.77 (s, 2Η), 6.51 (d, J=8.8Hz, 1H), 6.82 (dd, J=8.8, 2.0Hz, 1H), 6.88 (d, J=8.8Hz, 2Η), 6.91 (s, 1H), 7.04-7.12 (m, 4Η), 7.29-7.35 (m, 7 H), 7.42 (d, J=7.3Hz, 1H), 91053 34 7.54 (d, J=2.0Hz, 1H), 7.66 (d, J=7.6Hz, 1H), 7.99 (d, J=8.8Hz, 2Η). Приклад 5 4-(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}етокси)бензойна кислота Крок 1: Суміш 2(трифторметил)бензилброміду (25г, 0.14моль), сульфіту натрію (19.1г, 0.15моль), йодиду тетрабутиламонію (0.224м, 0.6ммоль) і Н2О (930мл) нагрівали зі зворотнім холодильником упродовж 2 дн. Суміш охолодили до кімнатної температури, і водну фазу декантували від оліїстого залишку й сконцентрували на роторі до суха, внаслідок чого отримали бажану натрієву сіль (22.2г, 60%) у вигляді білої твердої речовини, що використовувалася без подальшого очищення. Крок 2: Натрієву сіль (2трифторметилфеніл)метансульфонової кислоти (22.2г, 84ммоль) суспендували в МеОН (950мл) і охолодили до -20°С. При тій же температурі при продовженні охолодження через суміш упродовж 5хв. пробульбували НСI (г). Отриману білу суспензію перемішували при кімнатній температурі упродовж 1.5год., потім охолодили в крижаній бані. Отриману суспензію відфільтрували, і зібрану тверду речовину залишили сушитися на повітрі упродовж ночі, внаслідок чого отримали (2трифторметилфеніл) метансульфонову кислоту (20.3г, ~100%), білу тверду речовину, що використовувалася без подальшого очищення. Крок 3: До суспензії (2трифторметилфеніл)метансульфонової кислоти (20.3г, 84ммоль) в THF (1.9л) і DMF (5.0мл) при 20°С повільно по краплям упродовж 1год. додавали оксалілхлорид (44.7мл, 0.5моль). Температуру бані підтримували нижче 0°С упродовж 4год., у цій точці реакційну суміш випарили до об'єму ~ 250мл і розвели 500мл етилацетату. Цей розчин промили сольовим розчином в ділильній воронці й висушили над сульфатом магнію. Після цього розчин випарили до коричневої олії. Цю олію розчинили в 500мл петролейного ефіру (30-50°) і нагрівали струменевої сушкою доти, доки олія не перейшла в розчин. Після цього розчин помістили у баню із сухого льоду та ацетону для охолодження, що призвело до утворення білого кристалічного матеріалу. Цей матеріал зібрали фільтрацією й висушили, отримавши 19г (85%) (2трифторметилфеніл)метансульфоніл хлориду у вигляді білої твердої речовини. Крок 4: Як зазначено в Кроці 9, Приклад 1, метил 4-{2-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Ніндол-3-іл]етокси}бензоат (Крок 9, Приклад 1, 0.15г, 0.28ммоль) вступив в реакцію з 2(трифторметилфеніл)метансульфоніл хлоридом (0.145м, 0.50ммоль) з утворенням 0.220г сульфонаміду, білої піни, з 75% виходом. 1Н ЯМР (400MHz, CDCI3) δ 2.73-2.88 (m, 2Η), 2.96-3.09 (m, 2Η), 3.16 (t, J=6.6Hz, 2Η), 3.88 (s, 3Η), 4.19 (t, J=6.6Hz, 2Η), 4.23 (t, J=6.4Hz, 1H), 4.34 (s, 2Η), 6.51 (d, J=8.8Hz, 1H), 6.77-6.84 (m, 3Η), 6.86 (s, 1H), 6.98-7.12 (m, 4Η), 7.27-7.35 (m, 6H), 7.36-7.47 (m, 2Η), 7.53 (d, J=1.5Hz, 1H), 7.59-7.69 (m, 2Η), 7.95 (d, J=8.8Hz, 2Η). 35 Крок 5: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (137мг, 0.18ммоль) гідролізували, внаслідок чого отримали 86мг (64%) зазначеного у назві продукту, 1 білого порошку. Н ЯМР (400MHz, DMSO-d6) δ 3.04 (s, 4Η), 3.18 (t, J=6.6Hz, 2Η), 4.23 (t, J=5.9Hz, 2Η), 4.42 (s, 2Η), 6.48 (d, J=8.8Hz, 1H), 6.81 (dd, J=9.0, 2.1Hz, 1H), 6.98 (d, J=9.1Hz, 2Η), 7.03-7.18 (m, 5H), 7.29-7.42 (m, 6H), 7.48-7.62 (m, 3Η), 7.66 (d, J=2.0Hz, 2Η), 7.72 (d, J=7.8Hz, 1H), 7.85 (d, J=8.8Hz, 2Η), 12.49 (s, 1H); HRMS: теор. для C40H34CIF3N2O5S+H+, 747.19018; практ. (ESI-FTMS, [M+H]1+), 747.1886; чистота ВЕРХ H2O/CH3CN: 96.2%, Н2О/МеОН: 95.4%. Приклад 6 4-(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2фторо-6(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}етокси)бензойна кислота Крок 1: Використовуючи процедуру, описану в Прикладі 5, Кроці 1, з 2-фторо-6(трифторметилфеніл)бензилброміду (15г, 61ммоль) отримали натрієву сіль 2-фторо-6(трифторметилфеніл)метансульфонової кислоти (15г, 89%), білу тверду речовину. 1Н ЯМР (400MHz, DMSO-d6) δ 4.02 (s, 2Η), 7.26-7.66 (m, 3Η). Крок 2: Використовуючи процедуру, описану в Прикладі 5, Кроці 2, з натрієвої солі 2-фторо-6(трифторметилфеніл)метансульфонової кислоти (15г, 53ммоль) отримали 2-фторо-6(трифторметилфеніл)метансульфонову кислоту (15г), блідо оранжеву олію, що використовувалася без подальшого очищення. 1Н ЯМР (400MHz, DMSO-d6) δ 4.12 (s, 2Η), 7.39-7.73 (m, 3Η). Крок 3: Використовуючи процедуру, описану в Прикладі 5, Кроці 3, з 2-фторо-6(трифторметилфеніл)метансульфонової кислоти (15г, 53ммоль) отримали 11г сирого продукту, що був очищений низько-температурною кристалізацією із гексанів з утворенням 2-фторо-6(трифторметилфеніл)метансульфоніл хлориду (9.0г, 62%). 1H ЯМР (400MHz, CDCI3) δ 5.31 (s, 2Η), 7.38-7.51 (m, 1Η), 7.58-7.68 (m, 2Η). Крок 4: Як вказано в Кроці 9, Приклад 1, метил 4-{2-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Ніндол-3-іл]етокси}бензоат (Крок 6, Приклад 1, 0.12г, 0.22ммоль) вступив в реакцію з 2-фторо-6(трифторметилфеніл) метансульфоніл хлоридом (0.074г, 0.27ммоль) з утворенням 0.164г сульфонаміду, білої піни, з 95% виходом. 1H ЯМР (400MHz, CDCI3). δ 2.83-3.03 (m, 2Η), 3.07-3.17 (m, 2Η), 3.21 (t, J=6.6Hz, 2Η), 3.88 (s, 3Η), 4.22 (t, J=6.6Hz, 2Η), 4.31 (t, J=6.3Hz, 1H), 4.43 (s, 2Η), 6.52 (d, J=9.1Hz, 1H), 6.76-6.89 (m, 3Η), 6.92 (s, 1H), 7.07 (dd, J=6.1, 4.3Hz, 4Η), 7.23 (t, J=8.6Hz, 2Η), 7.28-7.34 (m, 5H), 7.38 -7.52 (m, 2Η), 7.54 (d, J=1.8Hz, 1H), 7.95 (d, У-9.1Hz, 2Η). Крок 5: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (136мг, 0.17ммоль) гідролізували, внаслідок чого отримали 130мг(97%) зазначеного у назві продукту, білого порошку. 1Н ЯМР (400MHz, DMSO-d6) δ 3.00-3.15 (m, 4Η), 3.17 (t, J=6.4Hz, 2Η), 4.22 (t, J=6.6Hz, 2Η), 4.45 (s, 2Η), 6.46 (d, J=8.8Hz, 1H), 91053 36 6.79 (dd, J=8.8, 2.3Hz, 1H), 6.97 (d, J=9.1Hz, 2Η), 7.03-7.13 (m, 5H), 7.16-7.41 (m, 6H), 7.48-7.70 (m, 4Η), 7.74-7.90 (m, 3Η), 12.56 (s, 1H); HRMS: теор. для C40H33CIF4N2O5S+H+, 765.18076; практ. (ESI1+ FTMS, [M+H] ), 765.1814; чистота ВЕРХ H2O/CH3CN: 96.6%, Н2О/МеОН: 97.9%. Приклад 7 4-{3-[5-хлоро-2-(2-{[(2,6дибромобензил)сульфоніл]аміно}етил)-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойна кислота Крок 1: Суміш метил-4-йодобензоату (5.3г, 20.2ммоль), аллілового спирту (1.78г, 30.3ммоль), NaHCO3 (4.24г, 50.5ммоль), Pd(OAc)2 (0.14г, 0.60ммоль), (n-Βu)4ΝΒr (6.55г, 20.2ммоль) і 4-А молекулярних сит (4.1г) у безводному DMF (69мл) перемішували при кімнатній температурі упродовж 4 днів. Реакційну суміш відфільтрували крізь целіт, і фільтрат додали у воду й екстрагували за допомогою EtOAc. Органічний шар промили сольовим розчином, висушили (Na2SO4) і сконцентрували під вакуумом. Внаслідок флеш-хроматографії (силікагель, 10-20% ЕtOАс-гексани) отримали 2.11г (85%, базуючись на відновленому вихідному матеріалі) бажаного метилового естеру 4-(3-оксо-пропіл)бензойної кислоти у вигляді прозорої олії. Крок 2: До розчину 5-хлоро-2-метиліндолу (0.86г, 5.2ммоль) і метилового естеру 4-(3-оксопропіл)-бензойної кислоти (1.0г, 5.2ммоль) у метиленхлориді (50мл) додали TFA (1.78г, 15.6ммоль), а після цього триетилсилан (1.81г, 15.6ммоль). Реакційну суміш перемішували упродовж ночі, потім додали насич. розчин NaHCO3 (50мл), і органічний шар промили насич. розчином NaHCO3, водою, сольовим розчином і висушили (Na2SO4). Розчинник вилучили під зменшеним тиском, а залишок очистили флеш колонковою хроматографією з 10-20% EtOАс/гексанами з отриманням бажаного продукту (1.67г) з 94% виходом. Крок 3: До розчину продукту з кроку 2 (1.66г, 4.86ммоль) в DMF (20мл) додали NaH (60% у мінеральній олії, 0.24г, 5.83ммоль) під атмосферою N2. Суміш перемішували упродовж 1год. при кімнатній температурі, після чого по краплям додавали бензгідрилбромід (1.8г, 7.29ммоль) в DMF (5мл). Цю реакційну суміш перемішували упродовж ночі при кімнатній температурі. Додали воду (500мл), і суміш екстрагували ЕtOАс, промили сольовим розчином, висушили (Na2SO4) і сконцентрували під зменшеним тиском до коричневого сиропу, що був очищений хроматографією на силікагелі з використанням 10% EtOАс/гексанів у якості елюенту для виділення N-бензгідриліндолу у вигляді білої твердої речовини (1.47г) з 59% виходом. Крок 4: Отриманий у кроці вище продукт (1.46г, 2.87ммоль) розчинили в ССІ4 (14.5мл), після чого додали NBS (1.02г, 5.73ммоль) і бензоїлпероксид (2мг). Реакційну суміш нагрівали зі зворотнім холодильником упродовж 1год. (до зникнення всього вихідного матеріалу за аналізом ТШХ). Цю суміш охолодили до кімнатної температури, відфільтрували, і тверду речовину промили ССІ4. Фільтрат випарили до коричневого залишку, який розчинили в ацетоні (40мл) і воді (4мл). Після цього до цього 37 розчину додали Ag2CO3 (1.75г, 3.16ммоль) й після перемішування упродовж ночі при кімнатній температурі, його відфільтрували через целіт, розчинник випарили під зменшеним тиском, і до залишку додали воду. Його екстрагували за допомогою EtOAc, промили сольовим розчином, висушили (Na2SO4) і випарили до сиропу, що був очищений 10% ЕtOАс/гексанами для виділення 2форміліндолу (1.13г) з 75% виходом. Крок 5: До розчину 2-форміліндолу, отриманого у кроці вище, (0.52г, 1ммоль) в CH3NO2 (6.2мл) додали NH4OAc (0.077г, 1ммоль), суміш нагрівали зі зворотнім холодильником упродовж 1год., після чого додали NH4OAc (0.077г, 1ммоль), продовжили нагрівати зі зворотнім холодильником упродовж додаткової 1год., знову додали NH4OAc (0.077г, 1ммоль) і нагрівання тривало упродовж ще 1год. Реакційну суміш залишили охолоджуватися до кімнатної температури, і додали ЕtOАс (50мл), а потім воду (100мл). Водний шар екстрагували за допомогою EtOAc, і об'єднані органічні шари промили сольовим розчином, висушили (Na2SO4) і випарили до жовтої піни, що була піддана хроматографічному очищенню з використанням 10% EtOАс/гексанів у якості елюента, внаслідок чого отримали нітроолефін у вигляді жовтої піни (0.38г) з 68% виходом. Крок 6: Приготували Zn(Hg) шляхом додавання HgCb (3.4г, 7.2ммоль) до суміші цинкового пилу (34.7г, 530.4ммоль) і 5% НСI (38мл) у склянці на 100мл. Суміш інтенсивно перемішували упродовж 10хв.. Водну фазу декантували, 38мл 5% НСI додали до Zn(Hg), і суміш перемішували упродовж 10хв.. Водну фазу декантували. Тверду речовину Zn(Hg) додали до вінілнітросполуки з Кроку 5 (15г, 26.57ммоль) в THF (660мл) і конц. НСI (64.5мл). Цю суміш перемішували при кімнатній температурі упродовж 1год., потім нагрівали зі зворотнім холодильником упродовж 15хв.. Реакційну суміш охолодили до кімнатної температури й відфільтрували через целіт. До фільтрату додали водн. розчин NH4OH (200мл), отриману суміш перемішували протягом 15 хвилин, і суміш сконцентрували для видалення THF. Водний шар екстрагували за допомогою СН2СІ2, і об'єднаний органічний шар промили сольовим розчином, висушили (Na2SO4) і сконцентрували до коричневої піни, що була очищена колонковою хроматографією шляхом елюювання колонки з СНСІ3 на початку для видалення неполярних домішок, а потім з 2% МеОН/СНСІ3 для виділення бажаного аміну з 46% виходом (6.1г). Крок 7. Як вказано в Кроці 9 Прикладу 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Hіндол-3-іл]пропіл}бензоат (Крок 6, 128мг, 0.24ммоль) вступив в реакцію з 2,6-дибромофеніл-метансульфонілхлоридом (Крок 3, Приклад 3) з утворенням 203мг сульфонаміду, твердої речовини жовто-коричневого кольору зі 100% виходом. Крок 8. Використовуючи процедуру, зазначену в кроці 10 Прикладу 1, естер сульфонаміду (175мг, 0.206ммоль) гідролізували з утворенням 133мг (77%) зазначеного у назві продукту, твердої речовини жовтого кольору. 1Н ЯМР (400MHz, CDCI3) δ 91053 38 1.91-2.02 (m, 2Η), 2.75 (t, J=8.1Hz, 4Η), 2.86-2.94 (m, 2Η), 2.94-3.03 (m, 2Η), 4.46-4.54 (m, 1Η), 4.70 (s, 2Η), 6.49 (d, J=9.1Hz, 1H), 6.79 (dd, J=9.0, 1.9Hz, 1H), 6.87 (s, 1H), 6.96 (t, J=8.1Hz, 1H), 7.04-7.11 (m, J=6.2, 2.4Hz, 4Η), 7.25-7.34 (m, 8Η), 7.40 (d, J=1.8Hz, 1H), 7.48 (d, J=7.8Hz, 2Η), 8.00 (d, J=7.8Hz, 2Η). Приклад 8 4-{3-[5-хлоро-2-(2-{[(2,6дихлоробензил)сульфоніл]аміно}етил)-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойна кислота Крок 1: 3 використанням умов з Прикладу 3, Кроку 1, 2,6-дихлоробензилбромід (3.32г, 13.84ммоль) вступив в реакцію з тіоацетатом калію з утворенням 2.92г (90%) бензилтіоацетату. Крок 2: 3 використанням процедури з Прикладу 3, Кроку 2, бензилтіоацетат (2.90г, 12.33ммоль) був окиснений з утворенням 1.7г (53%) сульфоніл хлориду, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 5.43 (s, 2Η), 7.32-7.39 (m, 1Η), 7.43-7.50 (m, 2Η). Крок 3: Як вказано в Кроці 9, Прикладі 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Hіндол-3-іл]пропіл}бензоат (Приклад 7, Крок 6, 149мг, 0.28ммоль) вступив в реакцію з 2,6дихлоро-феніл-метансульфоніл хлоридом з утворенням 170мг сульфонаміду, твердої речовини жовтого кольору з 80% виходом. Крок 4. Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (145мг, 0.19ммоль) гідролізували з утворенням 140мг (99%) зазначеного у назві продукту, твердої речовини жовто-коричневого кольору. 1H ЯМР (400MHz, CDCI3) δ 1.89-2.01 (m, 2Η), 2.71-2.80 (m, 4Η), 2.84-2.92 (m, 2Η), 2.95-3.03 (m, 2Η), 4.31 (t, J=6.2Hz, 1Η), 4.60 (s, 2Η), 6.49 (d, J=9.1Hz, 1H), 6.80 (dd, J=8.8, 2.0Hz, 1H), 6.87 (s, 1H), 7.01-7.10 (m, 4Η), 7.12-7.19 (m, 1H), 7.25-7.34 (m, 10 H), 7.41 (d, J=2.0Hz, 1H), 8.00 (d, J=8.1Hz, 2Η). Приклад 9 4-(3-{1-бензгідрил-5-хлоро-2-[2-(2-метил-6нітро-фенілметансульфоніламіно)-етил-1H-індол3-іл}-пропіл)-бензойна кислота Крок 1: Як вказано в Кроці 9, Прикладі 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Hіндол-3-іл]пропіл}бензоат (Приклад 7, Крок 6, 255мг, 0.47ммоль) вступив в реакцію з 2-метил-6нітро-феніл-метансульфоніл хлоридом (Приклад 4, Крок 4) з утворенням 180мг сульфонаміду, твердої речовини жовтого кольору з 51% виходом. Крок 2: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (60мг, 0.080ммоль) гідролізували з утворенням 48мг (81%) зазначеного у назві продукту, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 1.89-2.01 (m, 2Η), 2.49 (s, 3Η), 2.75 (q, J=7.2Hz, 4Η), 2.82-2.89 (m, 2Η), 2.90-2.98 (m, 2Η), 4.10-4.18 (m, 2Η), 4.76 (s, 2Η) широкий, 6.48 (d, J=8.8Hz, 1H), 6.79 (dd, J=8.8, 2.3Hz, 1H), 6.86 (s, 1H), 7.02-7.11 (m, J=6.6, 2.5Hz, 4Η), 7.27-7.35 (m, 8Η), 7.38-7.47 (m, 2Η), 7.67 (d, J=7.8Hz, 1H), 8.00 (d, J=8.3Hz, 2Η). Приклад 10 39 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}пропіл)бензойна кислота Крок 1: До суспензії 4-{3-[2-(2-аміноетил)-1бензгідрил-5-хлоро-1H-індол-3-іл]пропіл}бензойної кислоти (отриманої як описано в патенті США №6797708 В2, включеного авторами шляхом посилання у повному обсязі) (10.0г, 19ммоль) в CH3CN (100мл) і МеОН (25мл) додали (триметилсілил)діазометан (2.0Μ розч. в гексанах, 9.6мл, 19ммоль). Через 16год. суміш відфільтрували й сконцентрували з утворенням метилового естеру (8.8г, приблизно 86%), оранжевої піни, що використовувалася без очищення. Крок 2: Як вказано в Кроці 9, Прикладі 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Hіндол-3-іл]пропіл}бензоат (Приклад 1, Крок 1, 9.1г, 17ммоль) вступив в реакцію з (2трифторметилфеніл)метансульфоніл хлоридом (Приклад 5, Крок 3, 4.8г, 17ммоль) з утворенням 6.1г сульфонаміду, білої піни з 47% виходом. 1Н ЯМР (400MHz, CDCI3) δ 1.88-2.00 (m, 2Η), 2.642.77 (m, 6 Η), 2.83-2.95 (m, 2Η), 3.90 (s, 3Η), 4.05 (t, J=5.9Hz, 1Η), 4.33 (s, 2Η), 6.49 (d, J=8.8Hz, 1H), 6.70-6.88 (m, 2Η), 7.04 (dd, J=6.4, 2.7Hz, 4Η), 7.24 (s, 1H), 7.28-7.35 (m, 7 H), 7.36-7.49 (m, 3Η), 7.557.71 (m, 2Η), 7.95 (d, J=8.1Hz, 2Η). Крім того, у вигляді блідо-жовтої піни був отриманий побічний продукт N-метилсульфонамід (0.70г, 5%). 1H ЯМР (400MHz, CDCI3) δ 1.82-2.02 (m, 2Η), 2.56 (s, 3Η), 2.63-2.78 (m, 4Η), 2.79-2.89 (m, 2Η), 2.89-3.01 (m, 2Η), 3.90 (s, 3Η), 4.29 (s, 2Η), 6.42 (d, J=8.8Hz, 1Η), 6.77 (dd, J=8.8, 2.0Hz, 1Η), 6.84 (s, 1Η), 6.98-7.11 (m, 4Η), 7.21-7.28 (m, 2Η), 7.28-7.35 (m, 6 Η), 7.377.51 (m, 3Η), 7.63 (d, J=7.1Hz, 1H), 7.70 (d, J=8.6Hz, 1H), 7.95 (d, J=8.3Hz, 2Η). Крок 3: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, метиловий естер (2.6г, 3.4ммоль) гідролізували з утворенням 2.25г (88%) зазначеного у назві продукту, твердої речовини жовтого кольору. 1 Н ЯМР (400MHz, DMSO-d6) δ 1.81-1.97 (m, 2Η), 2.66-2.79 (m, 4Η), 2.95 (s, 4Η), 4.41 (s, 2Η), 6.45 (d, J=8.8Hz, 1H), 6.78 (dd, J=8.8, 2.0Hz, 1H), 7.01-7.14 (m, 5H), 7.24-7.42 (m, 8Η), 7.46 (d, J=2.0Hz, 1H), 7.50-7.66 (m, 4Η), 7.73 (d, J=7.8Hz, 1H), 7.85 (d, J=8.3Hz, 2Η), 12.77 (s, 1H); HRMS: теор. для C41H36CIF3N2O4S+H+, 745.21092; практ. (ESI-FTMS, [M+H]1+), 745.2132; Анал. теор. для C41H36CIF3N2O4S: С, 66.08; Н, 4.87; N3.76. Практ.: С, 66.07; Н, 4.57; N, 3.67. Приклад 11 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-(метил{[2(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}пропіл)бензойна кислота Крок 1: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер N-Me сульфонаміду, виділений із Прикладу 10, Кроку 2 у якості побічного продукту (0.66г, 0.85ммоль) гідролізували з утворенням 0.30г (46%) зазначеного у назві продукту, порошку блідо-жовтого кольору. 1H ЯМР (400MHz, DMSO-d6) δ 1.76-1.93 (m, 2Η), 2.63-2.81 (m, 9 Η), 3.31 (s, 2Η), 4.46 (s, 2Η), 6.46 (d, J=8.8Hz, 1H), 6.78 (dd, 7-8.8, 2.3Hz, 1H), 6.98-7.13 (m, 5H), 7.23-7.43 (m, 8Η), 7.46 (d, J=2.0Hz, 1H), 7.51-7.66 91053 40 (m, 3Η), 7.72 (d, J=7.8Hz, 1H), 7.86 (d, J=8.3Hz, 2Η), 12.75 (br s, 1H); HRMS: теор. для C42H38CIF3N2O4S+H+, 759.22657; практ. (ESI-FTMS, [M+H]1+), 759.2269; чистота ВЕРХ H2O/CH3CN: 96.2%, Н2О/МеОН: 95.7%. Приклад 12 4-{3-[2-[2-({[2,6біс(трифторметил)бензил]сульфоніл}аміно)етил]5-хлоро-1-(дифенілметил)-1H-індол-3іл]пропіл}бензойна кислота Крок 1: 2,6-Біс(трифторметил)бензоїл фторид. Використовуючи процедуру, описану W. Dmowski and K. Piasecka-Maciejewska, Tetrahedron Lett. 1998, 54, 6781-6792, включену авторами шляхом посилання у повному обсязі, 7.0г 2,6-біс (трифторметил)бензойної кислоти перетворили у кислотний фторид (7.0г, 100%), тверду речовину оранжевого кольору. 1H ЯМР (400MHz, DMSO-d6) δ 8.17 (t, J=8.0Hz, 1H), 8.40 (d, J=8.0Hz, 2Η). Крок 2: 2,6Біс(трифторметилфеніл)бензиловий спирт. Використовуючи процедуру, описану W. Dmowski and K. Piasecka-Maciejewska, Tetrahedron Lett. 1998, 54, 6781-6792, включену авторами шляхом посилання у повному обсязі, 7.0г 2,6біс(трифторметил)бензоїл фториду перетворили у спирт (6.6г, 100%), блідо-жовту олію. 1H ЯМР (400MHz, CDCI3) δ 4.95 (s, 2Η), 7.59 (t, J=8.0Hz, 1Η), 7.94 (d, У=7.8Hz, 2Η). Крок 3: 2,6-Біс(трифторметилфеніл)бензил бромід. До розчину 2,6біс(трифторметилфеніл)бензилового спирту (6.6г, 28ммоль) і 1,3-біс(дифенілфосфіно)пропану (6.9г, 17ммоль) в СН2СІ2 (50мл) при 0°С повільно додавали тетрабромід вуглецю (11г, 33ммоль). Суміш перемішували упродовж ночі при кімнатній температурі, після чого додали піпеткою до 200мл Еt2О. Суміш відфільтрували через целіт і сконцентрували. Жовте масло суспендували в 2% EtOAc-гекс. й відфільтрували через шар SiO2, внаслідок чого 1 отримали бромід (7.2г, 84%), безбарвну олію. Н ЯМР (400MHz, CDCI3) δ 4.78 (s, 2Η), 7.59 (t, J=7.9Hz, 1Η), 7.92 (d, J=7.9Hz,2Η). Крок 4: Натрієва сіль 2,6біс(трифторметилфеніл)метансульфонової кислоти. Суміш біс(трифторметилфеніл)бензил броміду (7.2г, 23ммоль), сульфіту натрію (3.1г, 25ммоль), йодиду тетрабутиламонію (0.043г, 0.1ммоль) і Н2О (20мл) нагрівали зі зворотнім холодильником упродовж 2дн. Суміш охолодили до кімнатної температури, і водну фазу відфільтрували від масляного залишку й сконцентрували на роторі до суха, внаслідок чого отримали гідробромід натрієвої солі 2,6біс(трифторметилфеніл)метансульфонової кислоти (3.2г, 32%), білу тверду речовину, що використовувалася без очищення. Крок 5: 2,6Біс(трифторметилфеніл)метансульфонова кислота. Натрієву сіль 2,6біс(трифторметилфеніл)метансульфонової кислоти (0.19г, 0.44ммоль) суспендували в МеОН (5мл) і охолоджували при -20°С упродовж бульбування через суміш протягом 5хв. НСI. Отриману білу суспензію перемішували при кімнатній температурі 41 упродовж 1.5год., відфільтрували через целіт і сконцентрували з утворенням 2,6біс(трифторметилфеніл)метансульфонової кислоти (0.14г, 100%), твердої речовини оранжевого кольору, що використовувалася без подальшого очищення. 1Н ЯМР (400MHz, DMSO-d6) δ 4.25 (s, 2Η), 7.64 (t, J=8.5Hz, 1Η), 7.96 (d, J=7.8Hz, 2Η). Крок 6: 2,6Біс(трифторметилфеніл)метансульфоніл хлорид. До суспензії 2,6біс(трифторметилфеніл)метансульфонової кислоти (0.14г, 0.44ммоль) в THF (10мл) і DMF (0.05мл) при -20°С повільно по краплям додали оксалілхлорид (0.24мл, 2.7ммоль). Температуру бані підтримували нижче 0°С упродовж 4год., після чого реакційну суміш відфільтрували через целіт і промили THF (10мл) та сконцентрували до загального об'єму ~5мл. Суміш охолодили до -40°С, і повільно додали Н2О (0.3мл). Суміш екстрагували за допомогою ЕtOАс (2 10мл), промили насич. NaНСО3 (20мл), Н2О (20мл) і сольовим розчином (20мл), висушили (Na2SO4) і сконцентрували з утворенням 99мг сирого продукту, що був очищений низькотемпературною кристалізацією із гексанів, внаслідок чого отримали 2,6біс(трифторметилфеніл)метансульфоніл хлорид (33мг, 23%), білий порошок. Концентрація маточних розчинів дозволила отримати додатковий продукт (57мг, 40%). 1H ЯМР (400MHz, CDCI3) δ 5.56 (s, 2Η), 7.70 (t, J=8.0Hz, 1Η), 7.97 (d, J=8.0Hz, 2Η). Крок 7: Як вказано в Кроці 9 Прикладу 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Hіндол-3-іл]пропіл}бензоат (Приклад 5, Крок 6, 148мг, 0.27ммоль) вступив в реакцію з 2,6біс(трифторметилфеніл)метансульфоніл хлоридом (90мг, 0.27ммоль) з утворенням 137мг сульфонаміду, блідо-жовтої піни з 60% виходом. 1H ЯМР (400MHz, CDCI3) δ 1.83-2.03 (m, 2Η), 2.682.78 (m, 4Η), 2.79-2.91 (m, 2Η), 2.92-3.03 (m, 2Η), 3.89 (s, 3Η), 4.21 (t, J=6.4Hz, 1H), 4.66 (s, 2Η), 6.51 (d, J=9.1Hz, 1H), 6.81 (dd, J=8.7, 2.1Hz, 1H), 6.87 (s, 1H), 7.00-7.11 (m, 4Η), 7.21-7.28 (m, 4Η), 7.28-7.35 (m, 4Η), 7.41 (d, J=1.5Hz, 1H), 7.59 (t, J=7.7Hz, 1H), 7.89 (d, J=7.8Hz, 2Η), 7.95 (d, J=8.1Hz, 2Η). Крок 8: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (119мг, 0.14ммоль) гідролізували з утворенням 97мг (83%) зазначеного у назві продукту, твердої речовини жовтого кольору. 1H ЯМР (400MHz, DMSO-d6) δ 1.75-1.95 (m, 2Η), 2.73 (q, J=7.5Hz, 4Η), 2.97 (s, 4Η), 4.67 (s, 2Η), 6.45 (d, J=8.8Hz, 1H), 6.79 (dd, J=8.8, 2.0Hz, 1H), 7.04 (s, 1H), 7.06-7.16 (m, 4Η), 7.27-7.43 (m, 8Η), 7.47 (d, J=2.0Hz, 1H), 7.75 (t, J=5.2Hz, 1H), 7.77-7.91 (m, 3Η), 8.10 (d, J=8.1Hz, 2Η), 12.78 (s, 1Η); HRMS: теор. для C42H35ClF6N2O4S+Н+, 813.19830; практ. (ESI-FTMS, [М+Н]1+), 813.1965. Чистота ВЕРХ H2O/CH3CN: 95.5%, Н2О/МеОН: 96.8%. Приклад 13 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(метоксикарбоніл)бензил]сульфоніл}аміно)етил]1H-індол-3-іл}пропіл)бензойна кислота Крок 1: До суміші метил 2-метилбензоату (5.0г, 0.033ммоль) і N-бромосукциніміду (5.9г, 0.033ммоль) в ССl4 (50мл) додали бензоїлперок 91053 42 сид (0.04г, 0.00016ммоль). Суміш нагрівали зі зворотнім холодильником упродовж 1.5год., охолодили до кімнатної температури, відфільтрували через целіт і сконцентрували з отриманням метил 2(бромометил)бензоату (7.2г, приблизно 94% відновлення маси), що був забруднений приблизно 14% вихідного матеріалу, що не прореагував, і використовувався без очищення. Крок 2: Суміш сирого броміду із Кроку 1 (7.2г, 0.031ммоль) і тіосечовини (2.6г, 35ммоль) в МеОН (40мл) нагрівали зі зворотнім холодильником упродовж 4год., охолодили до кімнатної температури, відфільтрували через целіт і сконцентрували з отриманням гідроброміду метил 2({[аміно(іміно)метил]тіо}метил)бензоату (10г, приблизно 100%), що використовувався без очищення. Крок 3: Ізотіоуронієву сіль із Кроку 2 (10г, 0.031ммоль) суспендували в Н2О (100мл) і охолодили до 0°С. Газ хлор пробульбували в суміш упродовж 30хв.. Зняли крижану баню, і реакційну суміш помістили в ділильну воронку й розвели EtOAc (250мл). Органічну фазу відділили й промили насич. NаНСО3 (100мл), Н2О (100мл) і сольовим розчином (100мл), висушили (MgSO4) і сконцентрували з утворенням твердої речовини оранжевого кольору (6.48г). Сирий продукт перекристалізували із 20%о EtOAc-гексанів при -78°С, внаслідок чого отримали 3.63г (47%) метил 2[(хлоросульфоніл)метил] бензоату у вигляді блідожовтих кристалів. Крок 4: До суспензії 4-{3-[2-(2-аміноетил)-1бензгідрил-5-хлоро-1H-індол-3-іл]пропіл}бензойної кислоти (0.40г, 0.76ммоль) в СН2Сl2 (5мл) додали біс(триметилсиліл)трифтороацетамід (0.30мл, 0.29г, 1.1ммоль). Суміш нагрівали зі зворотнім холодильником протягом 30 хвилин, потім охолодили до 35°С. Додали піридин (0.16мл, 0.15г, 2.0ммоль), а потім розчин метил 2[(хлоросульфоніл)метил]бензоату із Кроку 3 (0.29г, 1.1ммоль) в СН2СІ2 (2мл). Через 5год. суміш охолодили до кімнатної температури. Додали розчин конц. НСI(0.17мл) в Н2О (5мл), і суміш перемішували упродовж 45хв.. Водну фазу відділили й екстрагували за допомогою СН2СІ2 (50мл). Об'єднані органічні екстракти промили Н2О (25мл) і сольовим розчином (25мл), висушили (MgSO4) і сконцентрували з утворенням золотої піни (0.40г). Внаслідок очищення ВЕРХ отримали зазначену у назві сполуку (70мг, 12%), блідо-жовту піну. 1Н ЯМP (400MHz, DMSO-d6) δ 1.87-2.10 (m, 2Η), 2.85 (t, J=6.6Hz, 4Η), 3.03 (s, 2Η), 3.48 (s, 2Η), 3.86 (s, 3Η), 4.94 (s, 2Η), 6.57 (d, J=8.8Hz, 1H), 6.92 (dd, J=8.8, 2.3Hz, 1H), 7.14 (s, 1H), 7.17-7.29 (m, 4Η), 7.43-7.57 (m, 10 H), 7.57-7.69 (m, 3Η), 7.90-7.97 (m, 1H), 8.00 (d, J=8.3Hz, 2Η), 12.93 (s, 1H), HRMS: теор. для [C42H39ClN2O6S1 - Η]1-, 733.2144; практ. (ESI-FTMS, [M-H]1-), 733.2141; чистота ВЕРХ H2O/CH3CN: 95.3%, Н2О/МеОН: 100%. Приклад 14 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2фторо-6(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}пропіл)бензойна кислота 43 Крок 1: Використовуючи процедуру, описану в Прикладі 5, Кроці 1, з 2-фторо-6(трифторметилфеніл)бензил броміду (15г, 61ммоль) отримали натрієву сіль 2-фторо-6(трифторметилфеніл)метансульфонової кислоти (15г, 89%), білу тверду речовину. 1Н ЯМР (400MHz, DMSO-d6) δ 4.02 (s, 2Η), 7.26-7.66 (m, 3Η). Крок 2: Використовуючи процедуру, описану в Прикладі 5, Кроці 2, з натрієвої солі 2-фторо-6(трифторметилфеніл)метансульфонової кислоти (15г, 53ммоль) отримали 2-фторо-6(трифторметилфеніл)метансульфонову кислоту (15г), блідо-оранжеву олію, що використовувалася без подальшого очищення. 1H ЯМР (400MHz, DMSO-d6) δ 4.12 (s, 2Η), 7.39-7.73 (m, 3Η). Крок 3: Використовуючи процедуру, описану в Прикладі 5, Кроці 3, з 2-фторо-6(трифторметилфеніл)метансульфонової кислоти (15г, 53ммоль) отримали 11г сирого продукту, що був очищений низькотемпературною кристалізацією із гексанів, внаслідок чого отримали 2-фторо-6(трифторметилфеніл) метансульфоніл хлорид (9.0г, 62%). 1H ЯМР (400MHz, CDCI3) δ 5.31 (s, 2Η), 7.38-7.51 (m, 1Η), 7.58-7.68 (m, 2Η). Крок 4: Як вказано в Кроці 9 Прикладу 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Hіндол-3-іл]пропіл}бензоат (Приклад 7, Крок 6, 0.12г, 0.22ммоль) вступив в реакцію з 2-фторо-6(трифторметилфеніл) метансульфонілхлоридом, 0.074г, 0.27ммоль) з утворенням 0.127г сульфо1 наміду, блідо-жовтої піни, з 73% виходом. H ЯМР (400MHz, CDCI3) δ 1.79-2.02 (m, 2Η), 2.74 (t, J=8.0Hz, 4Η), 2.82-2.92 (m, 2Η), 2.92-3.02 (m, 2Η), 3.89 (s, 3Η), 4.15 (t, J=5.8Hz, 1H), 4.42 (d, 2Η), 6.50 (d, J=8.6Hz, 1H), 6.80 (dd, J=8.8, 2.0Hz, 1H), 6.87 (s, 1H), 7.07 (dd, J=6.4, 2.7Hz, 4Η), 7.19-7.28 (m, 5H), 7.29-7.35 (m, 5H), 7.39-7.56 (m, 2Η), 7.95 (d, J=8.3Hz, 2Η). Крок 4: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (115мг, 0.15ммоль) гідролізували з утворенням 101мг (89%) зазначеного у назві продукту, блідожовтого порошку. 1Н ЯМР (400MHz, DMSO-d6) δ 1.80-1.95 (m, 2Η), 2.63-2.78 (m, 4Η), 2.88-3.14 (m, 4Η), 4.45 (s, 2Η), 6.43 (d, J=8.8Hz, 1H), 6.76 (dd, J=8.8, 2.3Hz, 1H), 6.96-7.15 (m, 5H), 7.20-7.41 (m, 8Η), 7.45 (d, J=2.3Hz, 1H), 7.50-7.59 (m, 1H), 7.597.66 (m, 2Η), 7.71 (t, J=5.6Hz, 1H), 7.83 (d, J=8.3Hz, 2Η), 12.73 (s, 1H); HRMS: теор. для C41H35CIF4N2O4S+H+, 763.20149; практ. (ESI-FTMS, [М+Н]1+), 763.1998; чистота ВЕРХ H2O/CH3CN: 95.4%, Н2О/МеОН: 96.4%. Приклад 15 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({2-[2(трифторметил)феніл]етил}сульфоніл)аміно]етил}1H-індол-3-іл)пропіл]бензойна кислота Крок 1: 2-(Трифторметил)фенетиловий спирт (5.0г, 26ммоль) обробили СВr4 як у Прикладі 12, Кроці 3 для утворення броміду (6.6г, 100%), що використовувався без очищення. Крок 2: Бромід із Кроку 1 (1.5г, 5.9ммоль) обробили тіосечовиною як у Прикладі 13, Кроці 2 для отримання ізотіоуронієвої солі (2.2g), вологої тве 91053 44 рдої речовини білого кольору, що використовувалася без очищення. Крок 3: Ізотіоуронієву сіль із Кроку 2 (2.2г, ~5.9ммоль) суспендували в Н2О і обробили газом СІ2 як у Прикладі 13, Кроці 3, і отримали оранжеве масло (1.15г). До сирого продукту додали гексани (75мл), і суміш нагрівали при 60°С упродовж 4год. Фракцію, розчинну у гексанах, декантували й охолодили до -78°С з утворенням білої твердої речовини (0.13г, приблизно 7% вихід, 2 кроки), що використовувалася без очищення. Крок 4: Як вказано в Кроці 9 Прикладу 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Hіндол-3-іл]пропіл}бензоат (Приклад 7, Крок 6, 98мг, 0.18ммоль) вступив в реакцію з (2трифторметилфеніл)етансульфоніл хлоридом із Кроку 3 (75мг, 0.28ммоль) з утворенням 70мг сульфонаміду, білої піни з 50% виходом. !Н ЯМР (400MHz, CDCI3) δ . 1.88-2.03 (m, 2Η), 2.70-2.83 (m, 4Η), 2.88-3.07 (m, 6 Η), 3.07-3.23 (m, 2Η), 3.90 (s, 3Η), 4.07 (t, J=6.2Hz, 1Η), 6.51 (d, J=8.8Hz, 1H), 6.72-6.86 (m, 1H), 6.90 (s, 1H), 7.07 (d, J=6.8Hz, 4Η), 7.17-7.32 (m, 9 H), 7.35 (t, J=7.6Hz, 1H), 7.41 (d, J=2.0Hz, 1H), 7.48 (t, J=6.9Hz, 1H), 7.63 (d, J=7.8Hz, 1H), 7.95 (d, J=8.3Hz, 2Η). Крок 5: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (70мг, 0.09ммоль) гідролізували з утворенням 54мг (78%) зазначеного у назві продукту, білого порошку. 1Н ЯМР (400MHz, DMSO-d6) δ 1.82-2.22 (m, 2Η), 2.682.90 (m, 4Η), 2.99-3.24 (m, 8 Η), 6.50 (d, J=8.8Hz, 1Η), 6.83 (dd, J=8.8, 2.3Hz, 1H), 7.15 (appar d, J=6.8Hz, 5H), 7.32-7.44 (m, 8Η), 7.45-7.55 (m, 3Η), 7.59 (t, J=5.7Hz, 1H), 7.65 (t, J=7.3Hz, 1H), 7.75 (d, J=7.8Hz, 1H), 7.83-7.98 (m, J=8.3Hz, 2Η), 12.83 (s, 1H); HRMS: теор. для C42H38ClF3N2O4S+H+, 759.22657; практ. (ESI-FTMS, [M+H]1+), 759.2277; чистота ВЕРХ H2O/CH3CN: 96.0%, H2O/MeOH: 98.0%. Приклад 16 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2формілбензил)сульфоніл]аміно}етил)-1H-індол-3іл]пропіл}бензойна кислота Крок 1: До α-бромо-о-толунітрилу (10г, 51ммоль) в СН2СІ2 при 0°С додали DIBAL-H (1М в гексані, 55мл, 55ммоль), і реакційну суміш перемішували при тій же самій температурі упродовж 3.5год., потім додали в розчин холодного 5% НВr при 0°С. Суміш перемішували протягом 15 хвилин, потім шари розділили, і водний шар екстрагували за допомогою СН2СІ2, і об'єднані органічні шари промили NаНСО3 і водою, висушили над MgSO4 і випарили, внаслідок чого отримали темну рідину (9.4г). Матеріал використовувався безпосередньо в наступному кроці без подальшого очищення. Крок 2: Натрієва сіль (2-форміл-феніл)метансульфонової кислоти: Використовуючи процедуру, описану в Прикладі 5, Кроці 1, з 2бромометил-бензальдегіду (1.58г, 7.94моль) отримали натрієву сіль (2-форміл-феніл)метансульфонової кислоти (1.40г, 80%), практично білу тверду речовину. Крок 3: (2-форміл-феніл)-метансульфонова кислота: Використовуючи процедуру, описану в 45 Прикладі 5, Кроці 3, з натрієвої солі (2-формілфеніл)-метансульфонової кислоти (1.40г, 6.30ммоль) отримали (2-форміл-феніл)метансульфонову кислоту (418мг, 33%), тверду речовину блідо-жовтого кольору. Крок 4: (2-форміл-феніл)-метансульфоніл хлорид: Використовуючи процедуру, описану в Прикладі 5, Кроці 4, з (2-формілфеніл)метансульфонової кислоти (418мг, 2.09ммоль) отримали (2-форміл-феніл)метансульфоніл хлорид (367мг, 80%). 1H ЯМР (400MHz, CDCI3) δ 10.15.(s, 1Η), 7.92 (dd, 1Η), 7.747.61 (m, 3Η), 5.67 (s, 2Η). Крок 5: Як вказано в Кроці 9 Прикладу 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1і/індол-3-іл]пропіл}бензоат (Приклад 7, Крок 6, 63мг, 0.12ммоль) вступив в реакцію з (2-форміл-феніл)метансульфонілхлоридом (36мг, 0.16ммоль) з утворенням 34мг (40%) сульфонаміду, твердої речовини жовтого кольору. Крок 6: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (28мг, 0.039ммоль) гідролізували з утворенням 17мг (62%) зазначеного у назві продукту, білої твердої речовини. Приклад 17 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(морфолін-4ілметил)бензил]сульфоніл}аміно)етил]-1Н-індол-3іл}пропіл)бензойна кислота Крок 1: До метил 4-{3-[5-хлоро-1(дифенілметил)-2-(2-{[(2формілбензил)сульфоніл]аміно}етил)-1Н-індол-3іл]пропіл}бензоату (Приклад 16, Крок 5, 58мг, 0.081ммоль) в DCE (2мол) при 0°С додали морфолін (0.0092мл, 0.105ммоль) і NaBH(OAc)3 (27мг, 0.13ммоль), і реакційну суміш залишили на ніч нагріватися до кімнатної температури. Реакцію припинили додаванням насич. NaHCO3, провели екстракцію за допомогою EtOAc і висушили над MgSO4. Внаслідок очищення хроматографією на силікагелі (35%-50% EtOАс/гексани) отримали бажаний продукт у вигляді білої твердої речовини (41мг, 64%). Крок 2. Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (18мг, 0.039ммоль) гідролізували з утворенням 15мг (83%) зазначеного у назві продукту, білої твердої речовини. Приклад 18 4-{3-[5-хлоро-2-{2-[({2[(диетиламіно)метил]бензил}сульфоніл)аміно]етил}-1(дифенілметил)-1Н-індол-3-іл]пропіл}бензойна кислота Крок 1: Як вказано у Прикладі 17, Кроці 1 метил 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2формілбензил)сульфоніл]аміно}етил)-1Н-індол-3іл]пропіл}бензоат (Приклад 16, Крок 5, 58мг, 0.081ммоль) вступив в реакцію з HNEt2 (0.022мл, 0.21ммоль) і NaBH(OAc)3 (56мг, 0.26ммоль) в DCE (2мл) з утворенням метил 4-{3-[5-хлоро-2-{2-[({2[(диетиламіно)метил]бензил}сульфоніл)аміно]етил}-1(дифенілметил)-1Н-індол-3-іл]пропіл}бензоату 91053 46 (26мг, 41%) і побічного продукту метил 4-(3-{5хлоро-1-(дифенілметил)-2-[2-({[2(гідроксиметил)бензил]сульфоніл}аміно)етил]-1Ніндол-3-іл}пропіл)бензоату (8.6мг, 15%), обидва у вигляді білих твердих речовин. Крок 2. Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, метил 4-{3-[5-хлоро-2-{2[({2[(диетиламіно)метил]бензил}сульфоніл)аміно]етил}-1(дифенілметил)-1Н-індол-3-іл]пропіл}бензоат (20мг, 0.026ммоль) гідролізували з утворенням 13мг (66%) зазначеного у назві продукту, білої твердої речовини. Приклад 19 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(гідроксиметил)бензил]сульфоніл}аміно)етил]-1Ніндол-3-іл}пропіл)бензойна кислота Крок 1. Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, побічний продукт із Прикладу 18, Кроку 1, метил 4-(3-{5-хлоро-1(дифенілметил)-2-[2-({[2(гідроксиметил)бензил]сульфоніл}аміно)етил]-1Ніндол-3-іл}пропіл)бензоат (8.4мг, 0.0012ммоль) гідролізували з утворенням 5.0мг (61%) зазначеного у назві продукту, білої твердої речовини. Приклад 20 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(піперазин-1ілметил)бензил]сульфоніл}аміно)етил]-1Н-індол-3іл}пропіл)бензойна кислота й Приклад 21 4-{3-[2-{2-[({2-[(4-ацетилпіперазин-1іл)метил]бензил}сульфоніл)амін]етил}-5-хлоро-1(дифенілметил)-1 Н-індол-3-іл]пропіл}бензойна кислота Крок 1: Як вказано у Прикладі 17, Кроці 1 метил 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2формілбензил)сульфоніл]аміно}етил)-1Н-індол-3іл]пропіл}бензоат (Приклад 16, Крок 5, 45мг, 0.063ммоль) вступив в реакцію з 1ацетилпіперазином (28мг, 0.22ммоль) і NaBH(OAc)3 (26мг, 0.12ммоль) в DCE (3мл) з утворенням сульфонаміду (39мг, 75%) у вигляді білої піни. Крок 2. Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, сульфонамід (37мг, 0.045ммоль) гідролізували, внаслідок чого отримали, після після розділення препаративною ВЕРХ, метил 4-(3-{5-хлоро-1-(дифенілметил)-2-[2({[2-(піперазин-1ілметил)бензил]сульфоніл}аміно)етил]-1Н-індол-3іл}пропіл)бензоат (7.4мг, 21%) і метил 4-{3-[2-{2[({2-[(4-ацетилпіперазин-1іл)метил]бензил}сульфоніл)аміно]етил}-5-хлоро-1(дифенілметил)-1Н-індол-3-іл]пропіл}бензоат (7.7мг, 21%), обидва у вигляді твердих речовин. Приклад 22 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({2-[(4метилпіперазин-1іл)метил]бензил}сульфоніл)аміно]етил}-1Н-індол3-іл)пропіл]бензойна кислота Крок 1: Як вказано у Прикладі 17, Кроці 1 метил 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2формілбензил)сульфоніл]аміно}етил)-1H-індол-3 47 іл]пропіл}бензоат (Приклад 16, Крок 5, 44мг, 0.061ммоль) вступив в реакцію з 1метилпіперазином (0.026мл, 0.23ммоль) і NaBH(OAc)3 (34мг, 0.16ммоль) в DCE (3мл) з утворенням сульфонаміду (41мг, 84%) у вигляді білої твердої речовини. Крок 2: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, сульфонамід (39мг, 0.026ммоль) гідролізували з утворенням 27мг (69%) зазначеного у назві продукту, білої твердої речовини. Приклад 23 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({1-[2(трифторметил)феніл]етил}сульфоніл)аміно]етил}1Н-індол-3-іл)пропіл] бензойна кислота Крок 1: До а-метил-2трифторметилбензилброміду (10.0г, 39.5ммоль) в DMF (50мл) додали тіоацетат калію (8.1г, 71.1ммоль) відповідно до процедури, зазначеної в Прикладі 3, Кроці 2. Внаслідок цього отримали тіоацетат у вигляді оранжевої олії (10.49г, 91%). Крок 2: Тіоацетат із Кроку 1 (10.49г, 36.1ммоль) і ацетат натрію (21.5г, 155.4ммоль) розчинили у суміші оцтової кислоти (137мл) і води (31мл), і пробульбували газ хлор згідно процедурі, зазначеної в Прикладі 3, Кроці 3. Внаслідок після концентрації й низькотемпературної перекристалізації із гексанів отримали практично білу тверду речовину, що пізніше розтопилася в блідооранжеве масло (4.9г, 47%). 1H ЯМР (400MHz, CDCI3) δ 2.01 (d, J=6.8Hz, 3Η) 5.32 (q, J=7.1Hz, 1H) 7.56 (t, J=6.7Hz, 1H) 7.67 (t, J=7.8Hz, 1H) 7.77 (d, J=7.8Hz, 1H) 7.91 (d, J=8.1Hz, 1H). Крок 3: Використовуючи процедуру, зазначену в Прикладі 1, Кроці 9, метиловий естер 4-{3-[2-(2аміноетил)-1-бензгідрил-5-хлоро-1Н-індол-3-іл]пропіл}-бензойної кислоти (Приклад 7, Крок 6, 0.123г, 0.23ммоль) вступив в реакцію із 1-(2-трифторметил-феніл)етансульфонілхлоридом (0.79г, 0.29ммоль) з утворенням 0.042г рацемічної суміші сульфонамідів з 24% виходом. Крок 4: Естер сульфонаміду (0.042г, 0.054ммоль) гідролізували згідно Прикладу 1, Кроку 10, з утворенням 0.035г (85%) зазначеного у назві продукту, твердої речовини блідооранжевого кольору. 1 Н ЯМР (400MHz, CDCI3) δ 1.68 (d, J=7.1Hz, 3Η) 1.93 (t, J=5.4Hz, 2Η) 2.02-2.08 (m, 1H) 2.63-2.77 (m, 6H) 2.86 (t, J=7.6Hz, 2Η) 6.47 (d, J=8.8Hz, 1H) 7.01-7.07 (m, 4Η) 7.24-7.40 (m, 12 H) 7.44 (t, J=7.5Hz, 1H) 7.60 (d, J=7.6Hz, 1H) 7.85 (d, J=8.1Hz, 1H) 8.00 (d, J=8.1Hz, 2Η). Приклад 24 4-{3-[2-(2-{[(2бромбензил)сульфоніл]аміно}етил)-5-хлоро-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойна кислота Крок 1: 3 використанням процедури, зазначеної в Кроці 9 Прикладу 1, метил 4-{3-[2-(2аміноетил)-1-бензгідрил-5-хлоро-1H-індол-3іл]пропіл}бензоат (Приклад 7, Крок 6, 1.51г, 2.81ммоль) вступив в реакцію з 2-бромо-фенілметансульфонілхлоридом з утворенням 1.06г су 91053 48 льфонаміду, білої твердої речовини з 49% виходом. Крок 2: Як описано в прикладі 1, кроці 10, естер сульфонаміду (90мг, 0.117ммоль) гідролізували з утворенням 81мг (91%) зазначеного у назві продукту, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 1.89-2.02 (m, 2Η), 2.68-2.78 (m, 4Η), 2.78-2.87 (m, 2Η), 2.89-2.97 (m, 2Η), 4.21 (t, J=5.1Hz, 1Η), 4.37 (s, 2Η), 6.48 (d, J=8.8Hz, 1H), 6.79 (dd, J=8.8, 2.0Hz, 1Η), 6.84 (s, 1Η), 7.00-7.08 (m, 4Η), 7.09-7.17 (m, 1Η), 7.17-7.24 (m, 1Η), 7.257.34 (m, 8 Η), 7.36-7.45 (m, 2Η), 7.49 (dd, J=8.1, 1.3Hz, 1H), 8.01 (d, J=8.3Hz, 2Η). HRMS: теор. для C40H36BrCIN2O4S+H+, 755.13404; практ. (ESIFTMS, [М+Н]1+), 755.1341. Приклад 25 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2(трифторметокси)бензил]сульфоніл}аміно)етил]1H-індол-3-іл}пропіл)бензойна кислота Крок 1: 3 використанням процедури, зазначеної в Прикладі 1, Кроці 9, метил 4-{3-[2-(2аміноетил)-1-бензгідрил-5-хлоро-1H-індол-3іл]пропіл}бензоат (Приклад 7, Крок 6, 164мг, 0.305ммоль) вступив в реакцію з 2трифторметокси-феніл-метансульфонілхлоридом з утворенням 109мг сульфонаміду, білої твердої речовини з 46% виходом. Крок 2: Як описано в Прикладі 1, Кроці 10, естер сульфонаміду (83мг, 0.107ммоль) гідролізували з утворенням 80мг (98%) зазначеного у назві продукту, білої твердої речовини. 1Н ЯМP (400MHz, CDCI3) δ 1.86-2.03 (m, 2Η), 2.74 (q, J=7.6Hz, 4Η), 2.76 -2.86 (m, 2Η), 2.90-3.00 (m, 2Η), 4.12 (t, J=6.2Hz, 1H), 4.19 (s, 1H), 6.49 (d, J=8.8Hz, 1H), 6.80 (dd, J=8.8, 2.3Hz, 1H), 6.85 (s, 1H), 7.007.11 (m, 4Η), 7.16-7.23 (m, 2Η), 7.24 -7.28 (m, 2Η), 7.28-7.37 (m, 8Η), 7.39-7.44 (m, 2Η), 8.00 (d, 2Η). HRMS: теор. для C41H36CIF3N2O5S+H+, 761.20583; практ. (ESI-FTMS, [M+H]1+), 761.2057. Приклад 26 4-{3-[5-хлоро-2-(2-{[(3-хлоро-6-фторо-2метилбензил)сульфоніл]аміно}етил)-1(дифенілметил)-1Н-індол-3-іл]пропіл}бензойна кислота Крок 1: 2,6-Дифторо-N-(2-гідрокси-1,1диметил-етил)-бензамід. До розчину 2-аміно-2метилпропанолу (10.1г, 113.3ммоль) в СН2СІ2 (75мл) з температурою 0°С під азотом додали по краплям розчин 2,6-дифторобензоїлхлориду (10.0г, 56.6ммоль) в СН2СІ2 (50мл). Після цього реакційну суміш нагріли до кімнатної температури й перемішували упродовж ночі. Реакційну суміш розвели Н2О, і водну фазу екстрагували за допомогою СН2СІ2, висушили (MgSO4) і сконцентрували. Внаслідок очищення шляхом розтирання з гексанами отримали 12.05г (93%) аміду, білої твердої речовини. 1Н ЯМР (400MHz, CDCI3) δ 1.41 (s, 6Η), 3.66-3.75 (m, 2Η), 3.77-3.87 (m, 1Η), 5.94 (s, 1Η), 6.90-6.99 (m, 2Η), 7.31- 7.41 (m, 1Η). Крок 2: 2-(2,6-Дифторофеніл)-4,4-диметил-4,5дигідро-оксазол. До розчину аміду із Кроку 1 (11.9г, 51.9ммоль) з температурою 0°С в СН2СІ2 (50мл) додали тіонілхлорид (6.4мл, 88.3ммоль). Реакційну суміш залишили нагріватися до кімнатної температури. Через 4год. реакційну суміш сконцент 49 рували й розтерли з Et2O. Залишок розчинили в Н2О, додали 6н. NaOH і екстрагували за допомогою ЕtOАс. Об'єднану органічну фазу промили сольовим розчином, висушили (MgSO4) і сконцентрували з утворенням 9.42г (86%) дигідрооксазолу, білої твердої речовини.1H ЯМР (400MHz, CDCI3) δ 1.42 (s, 6 Η), 4.13 (s, 2Η), 6.90-7.02 (m, 2Η), 7.327.44 (m, 1Η). Крок 3: 2-(2-фторо-6-метил-феніл)-4,4диметил-4,5-дигідро-оксазол. До розчину дигідрооксазолу із Кроку 2 (9.18г, 43.5ммоль) з температурою 0°С в THF (140мл) під аргоном додали по краплям хлорид метилмагнію (3.0Μ розчин в THF, 43.5мл, 130ммоль). Через 2год. зняли льодяну баню, і суміш перемішували упродовж при кімнатній температурі. В реакційну суміш додали насичений вод. розчин NH4CI і екстрагували за допомогою ЕtOАс. Об'єднану органічну фазу промили сольовим розчином, висушили (MgSO4) і сконцентрували з утворенням 8.64г (96%) дигідрооксазолу, прозорої безбарвної олії. 1H ЯМР (400MHz, CDCI3) δ 1.42 (s, 6Η), 2.40 (s, 3Η), 4.11 (s, 2Η), 6.92 (t, J=9.0Hz, 1Η), 6.99 (d, J=7.6Hz, 1H), 7.21-7.30 (m, 1H). Крок 4: 2-фторо-6-метил-бензойна кислота. До розчину дигідрооксазолу із Кроку 3 (8.43г, 40.7ммоль) в CH3CN (70мл) додали метилйодид (9.2мл, 146ммоль), і суміш нагрівали зі зворотнім холодильником упродовж 6год. Після цього реакційну суміш охолодили до кімнатної температури й перемішували упродовж ночі. Реакційну суміш сконцентрували, і залишок розтерли з Еt2О. Залишок розчинили у рівних частинах 20% NaOH і метанол і нагрівали зі зворотнім холодильником упродовж 6год. Реакційну суміш охолодили до кімнатної температури й сконцентрували для видалення органічних розчинників. Водну фазу промили кілька разів ЕtOАс й підкислили до рН1. Водну фазу екстрагували за допомогою ЕtOАс. Об'єднану органічну фазу промили сольовим розчином, висушили (MgSO4) і сконцентрували з утворенням 3.67г (58%) бензойної кислоти, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 2.52 (s, 3Η) 6.99 (t, J=9.09Hz, 1Η) 7.05 (d, J=7.83Hz, 1H) 7.31-7.41 (m, 1H). Крок 5: До розчину кислоти із Кроку 4 (3.60г, 23.4ммоль) в тіонілхлориді (40мл) додали DMF (0.42мл), і суміш нагрівали зі зворотнім холодильником упродовж 5.5год. Суміш охолодили до кімнатної температури й сконцентрували. Залишок розчинили в THF (40мл) і додавали упродовж 20хв. до суспензії NaBH4 (3.53г, 93.4ммоль) з температурою 0°С в THF (40мл). Суміш перемішували при кімнатній температурі упродовж 2год., і потім додали Н2О й 4Μ НСI та екстрагували за допомогою ЕtOАс. Об'єднану органічну фазу промили сольовим розчином, висушили (MgSO4) і сконцентрували з утворенням 2.67г (~75%) бензилового спирту, твердої речовини блідо-жовтого кольору. 1 Н ЯМР (400MHz, CDCI3) D 2.42 (s, 3Η), 4.72 (s, 2Η), 6.88 (t, J=9.0Hz, 1Η), 6.96 (d, J=7.6Hz, 1Η), 7.07-7.20 (m, 1Η). Крок 6: До розчину бензилового спирту із Кроку 5 (2.65г, 18.9ммоль) в СН2СІ2 (15мл) додали 1,3біс(дифенілфосфіно)пропан (4.7г, 11ммоль). Су 91053 50 міш охолодили до 0°С, і повільно додавали СВr4 (7.4г, 22ммоль). Суміш перемішували упродовж ночі при кімнатній температурі. Суміш розвели за допомогою СН2СІ2 (50мл) і додали в Еt2О (75мл). Суміш відфільтрували, і розчинну фазу сконцентрували. Отриманий продукт знову розчинили в СН2СІ2 (75мл) і додали в Еt2О (100мл). Внаслідок фільтрації й концентрації отримали 3.27г (85%) броміду, оранжевої олії. 1Н ЯМР (400MHz, CDCI3) D 2.42 (s, 3Η), 4.56 (d, J=1.5Hz, 2Η), 6.91 (t, J=9.1Hz, 1Η), 6.97 (d, J=7.6Hz, 1H), 7.08-7.24 (m, 1H). Крок 7: 3 використанням процедури, зазначеної в Прикладі 3, Кроці 2, бензилбромід із Кроку 6 (3.27г, 16.1ммоль) вступив в реакцію зтіоацетатом калію з утворенням 3.17г (98%) бензилтіоацетату, коричневої олії. Ή ЯМР (400MHz, CDCI3) □ 2.35 (s, 6 Η), 4.22 (d, J=1.5Hz, 2Η), 6.88 (t, J=9.0Hz, 1H), 6.95 (d, J=7.6Hz, 1H), 7.06-7.21 (m, 1H). Крок 8: 3 використанням процедури, зазначеної в Прикладі 3, Кроці 3, бензилтіоацетат (3.17г, 16.0ммоль) був окиснений з утворенням 3.30г (80%) (3-хлоро-6-фторо-2-метил-феніл)метансульфонілхлориду, твердої речовини жовтокоричневого кольору. 1H ЯМР (400MHz, CDCl3) δ 2.52 (s, 3Η), 5.10 (d, J=1.3Hz, 2Η), 7.02 (t, J=9.0Hz, 1Η), 7.48 (dd, J=9.1,5.3Hz, 1H). Крок 9: 3 використанням процедури, зазначеної в Кроці 9, Прикладі 1, метил 4-{3-[2-(2аміноетил)-1-бензгідрил-5-хлоро-1Н-індол-3іл]пропіл}бензоат (Приклад 7, Крок 6, 163мг, 0.303ммоль) вступив в реакцію з (3-хлоро-6фторо-2-метил-феніл)-метансульфонілхлоридом із Кроку 8, з утворенням 102мг сульфонаміду, білої твердої речовини з 44% виходом. Крок 10: Як вказано у Прикладі 1, Кроці 10, естер сульфонаміду (74мг, 0.097ммоль) гідролізували з утворенням 65мг (90%) зазначеного у назві продукту, білої твердої речовини. 1Н ЯМР (400MHz, CDCI3) δ 1.89-2.05 (m, 2Η), 2.41 (s, 3Η), 2.75 (q, J=7.6Hz, 4Η), 2.83-2.93 (m, 2Η), 2.92-3.02 (m, 2Η), 4.21-4.31 (m, 3Η), 6.49 (d, J=8.8Hz, 1H), 6.72-6.83 (m, 2Η), 6.87 (s, 1H), 7.01-7.13 (m, 4Η), 7.24-7.35 (m, 9 H), 7.41 (d, J=2.0Hz, 1H), 8.00 (d, J=8.1Hz, 2Η). HRMS: теор. для C41H37Cl2FN2O4S+H+, 743.19079; практ. (ESI-FTMS, [M+H]1+), 743.1907. Приклад 27 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-нітро6-(трифторметил)бензил]сульфоніл}аміно)етил]1Н-індол-3-іл}пропіл)бензойна кислота Крок 1: 2-Бромометил-1-нітро-3трифторметил-бензол. До розчину 2-метил-1нітро-3-трифторметил-бензолу (5.0г, 24.4ммоль) в ССl4 (300мл) додали N-бромосукцинімід (4.35г, 24.4ммоль) і бензоїлпероксид (0.11г, 0.45ммоль). Суміш нагрівали зі зворотнім холодильником й залишили на світлі (300W) на 20год. Суміш охолодили до кімнатної температури, відфільтрували й сконцентрували. Внаслідок очищення колонковою хроматографією (ЕtOАс-гексани) отримали 3.03г (44%) бензилброміду, жовтої олії. 1Н ЯМР (400MHz, CDCI3) δ 4.93 (s, 2Η), 7.63 (t, J=8.1Hz, 1H), 7.94 (d, J=7.8Hz, 1H), 8.06 (d, J=8.1Hz, 1H). 51 Крок 2: 3 використанням процедури, зазначеної в Прикладі 3, Кроці 2, бензилбромід із Кроку 1 (3.02г, 10.6ммоль) вступив в реакцію з тіоацетатом калію з утворенням 2.71г (91%) бензилтіоацетату у 1 вигляді коричневої олії. H ЯМР (400MHz, CDCI3) δ 2.34 (s, 3Η), 4.55 (s, 2Η), 7.58 (t, J=7.7Hz, 1Η), 7.93 (d, J=7.8Hz, 1H), 7.98 (d, J=8.1Hz, 1H). Крок 3: (2-Нітро-6трифторметилфеніл)метансульфонілхлорид. З використанням процедури, зазначеної в Прикладі 3, Кроці 3, бензилтіоацетат (2.71г, 9.70ммоль) був окиснений з утворенням 2.42г (82%) зазначеного у назві продукту у вигляді коричневої олії. 1H ЯМР (400MHz, CDCI3) δ 5.82 (s, 2Η) broad, 7.84 (t, J=8.1Hz, 1H), 8.11 (d, J=7.8Hz, 1H), 8.27 (d, J=8.1Hz, 1H). Крок 4: 3 використанням процедури, зазначеної в Кроці 9, Прикладі 1, метил 4-{3-[2-(2аміноетил)-1-бензгідрил-5-хлоро-1H-індол-3іл]пропіл}бензоат (Приклад 7, Крок 6, 164мг, 0.305ммоль) вступив в реакцію з (2-нітро-6трифторметилфеніл)метансульфонілхлоридом із Кроку 3 з утворенням 119мг сульфонаміду у вигляді твердої речовини жовтого кольору з 49% виходом. Крок 5: Як описано у Прикладі 1, Кроці 10, естер сульфонаміду (94мг, 0.117ммоль) гідролізували з утворенням 90мг (92%) зазначеного у назві продукту, білої твердої речовини. 1Н ЯМР (400MHz, CDCI3) δ 1.90-2.04 (m, 2Η), 2.76 (q, J=7.5Hz, 4Η), 2.80 -2.90 (m, 2Η), 2.93-3.01 (m, 2Η), 4.24 (t, J=6.2Hz, 1Η), 4.87 (s, 2Η) широкий, 6.51 (d, J=8.8Hz, 1Η), 6.81 (dd, J=9.0, 2.1Hz, 1H), 6.86 (s, 1H), 7.08 (dd, J=6.8, 2.5Hz, 4Η), 7.23 -7.36 (m, 9 H), 7.42 (d, J=2.0Hz, 1H), 7.61 (t, J=8.1Hz, 1H), 7.898.09 (m, 3Η). HRMS: теор. для C41H35CIF3N3O6S+H+, 790.19599; практ. (ESI-FTMS, [M+H]1+), 790.1944. Приклад 28 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2фторбензил)сульфоніл]аміно}етил)-1H-індол-3іл]пропіл}бензойна кислота Крок 1. З використанням процедури, зазначеної в Кроці 9, Прикладі 1, метил 4-{3-[2-(2аміноетил)-1-бензгідрил-5-хлоро-1H-індол-3іл]пропіл}бензоат (Приклад 7, Крок 6, 163мг, 0.303ммоль) вступив в реакцію з (2-нітро-6трифторметил-феніл)-метансульфонілхлоридом з утворенням 15мг сульфонаміду, білої твердої речовини з 7% виходом. Крок 2. Як описано в Прикладі 1, Кроці 10, естер сульфонаміду (14мг, 0.020ммоль) гідролізували з утворенням 12мг (88%) зазначеного у назві продукту, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 1.88-2.03 (m, 2Η), 2.66-2.78 (m, 4Η), 2.81-2.90 (m, 2Η), 2.90-3.00 (m, 2Η), 4.12-4.20 (m, 3Η), 6.49 (d, J=8.8Hz, 1Η), 6.80 (dd, J=8.8, 2.3Hz, 1H), 6.86 (s, 1H), 6.94-7.01 (m, 1H), 7.02-7.12 (m, 5H), 7.23-7.36 (m, 10 H), 7.40 (d, J=2.0Hz, 1H), 8.00 (d, J-8.3Hz, 2Η). HRMS: теор. для C40H36CIFN2O4S+H+, 695.21411; практ. (ESI-FTMS, [M+H]1+), 695.2128. Приклад 29 4-{3-[2-(2-{[(біфеніл-2ілметил)сульфоніл]аміно}етил)-5-хлоро-1 91053 52 (дифенілметил)-1H-індол-3-іл]пропіл}бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1 (83мг, 0.108ммоль) помістили у контейнер для мікрохвильової реакції з фенілбороновою кислотою (19.8мг, 0.162ммоль), KF (9.4мг, 0.162ммоль), Pd(OAc)2 (3.4мг, 0.015ммоль) і PPh3 (11.8мг, 0.045ммоль). У контейнер додали DME (0.12М), МеОН (0.42М), Н2О (0.42М), і суміш дегазували під потоком аргону, закрили контейнер і нагрівали в мікрохвильовій печі Smith Creator при 120°С упродовж 1год. Реакційну суміш охолодили до кімнатної температури, відфільтрували через целіт (промиваючи ЕtOАс) і розвели за допомогою Н2О. Водний шар екстрагували за допомогою EtOAc. Об'єднану органічну фазу промили Н2О і сольовим розчином, висушили над MgSO4 і сконцентрували. Внаслідок очищення сирого продукту колонковою хроматографією (ЕtOАс-гекс.) отримали 75мг (91%) продукту Suzuki, твердої речовини жовтого кольору. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (70мг, 0.091ммоль) гідролізували з утворенням 46мг (67%) зазначеної у назві сполуки, білої твердої речовини. 1Н ЯМР (400MHz, CDCI3) δ 1.85-1.98 (m, 2Η), 2.45-2.55 (m, 2Η), 2.64-2.78 (m, 4Η), 2.822.90 (m, 2Η), 3.99 (t, J=6.3Hz, 1Η), 4.18 (s, 2Η), 6.47 (d, J=8.8Hz, 1H), 6.71-6.84 (m, 2Η), 6.97-7.08 (m, 4Η), 7.15-7.24 (m, 3Η), 7.25-7.28 (m, 4Η), 7.28-7.36 (m, 9 H), 7.40 (d, J=2.0Hz, 1H), 7.47 (dd, J=7.7, 1.1Hz, 1H), 8.01 (d, J=8.3Hz, 2Η). HRMS: теор. для C46H41CIN2O4S+H+, 753.25483; практ. (ESI-FTMS, [M+H]1+), 753.253. Приклад 30 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2піридин-4-ілбензил)сульфоніл]аміно}етил)-1Ніндол-3-іл]пропіл}бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1 (77мг, 0.10ммоль) вступив в реакцію з піридин-4бороновою кислотою відповідно до процедури, зазначеної в Прикладі 29, Кроці 1, з утворенням 33мг (43%) продукту Suzuki, білої твердої речовини. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (33мг, 0.043ммоль) гідролізували з утворенням 30мг (91%) зазначеної у назві сполуки, білої твердої речовини. 1Н ЯМР (400MHz, CDCI3) δ 1.90-2.01 (m, 2Η), 2.62-2.78 (m, 6 Η), 2.90 (t, J=7.5Hz, 2Η), 4.02 (s, 2Η), 4.56 (s, 1Η) широкий, 6.48 (d, J=8.8Hz, 1Η), 6.79 (dd, J=8.8, 2.0Hz, 1H), 6.83 (s, 1H), 6.997.10 (m, 4Η), 7.19 (dd, J=7.6, 1.3Hz, 1H), 7.22 (dd, J=4.5, 1.5Hz, 2Η), 7.24-7.28 (m, 2H), 7.28-7.34 (m, 7H), 7.36-7.46 (m, 3Η), 7.98 (d, J=8.3Hz, 2Η), 8.55 (d, J=5.8Hz, 2Η). HRMS: теор. для C45H40CIN3O4S+H+, 754.25008; практ. (ESI-FTMS, [M+H]1+), 754.2505. Приклад 31 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2піридин-3-ілбензил)сульфоніл]аміно}етил)-1Hіндол-3-іл]пропіл}бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1 (77мг, 0.10ммоль) вступив в реакцію з піридин-3бороновою кислотою відповідно до процедури, зазначеної в Прикладі 29, Кроці 1, з утворенням 53 59мг (77%) продукту Suzuki, твердої речовини жовтого кольору. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (54мг, 0.070ммоль) гідролізували з утворенням 44мг (83%) зазначеної у назві сполуки, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 1.80-1.93 (m, 2Η), 2.53-2.62 (m, 2Η), 2.67 (t, J=7.5Hz, 2Η), 2.82 (s, 2Η) широкий, 2.95-3.03 (m, 2Η), 4.09 (s, 2Η), 5.61 (dd, J=4.9, 3.4Hz, 1Η), 6.41 (d, J=8.8Hz, 1H), 6.76 (dd, J=9.0, 2.1Hz, 1H), 6.89 (s, 1H), 7.017.12 (m, 5H), 7.22-7.36 (m, 9 H), 7.36 -7.47 (m, 3Η), 7.55-7.62 (m, 1H), 7.68-7.74 (m, 1H), 7.89 (d, J=8.3Hz, 2Η), 8.60 (dd, J=5.1, 1.5Hz, 1H), 8.90 (d, J=2.3Hz, 1H). HRMS: теор. для C45H40CIN3O4S+H+, 754.25008; практ. (ESI-FTMS, [M+H]1+), 754.2505. Приклад 32 4-(3-{5-хлоро-1-(дифенілметил)-2-[2-({[2-(3тієніл)бензил]сульфоніл}аміно)етил]-1Н-індол-3іл}пропіл)бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1 (77мг, 0.10ммоль) вступив в реакцію з тіофен-3бороновою кислотою відповідно до процедури, зазначеної в Прикладі 29, Кроці 1, з утворенням 67мг (87%) продукту Suzuki, твердої речовини жовтого кольору. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (62мг, 0.080ммоль) гідролізували з утворенням 51мг (83%) зазначеної у назві сполуки, білої твердої речовини. 1Н ЯМР (400MHz, CDCI3) δ 1.88-2.00 (m, 2Η), 2.54-2.64 (m, 2Η), 2.68-2.81 (m, 4Η), 2.882.99 (m, 2Η), 4.11 (t, J=6.3Hz, 1Η), 4.20 (s, 2Η), 6.49 (d, J=8.6Hz, 1H), 6.80 (dd, J=8.8, 2.0Hz, 1H), 6.82 (s, 1H), 7.00 (dd, J=4.9, 1.4Hz, 1H), 7.05 (dd, J=6.7, 2.4Hz, 4Η), 7.13 (dd, J=3.0, 1.3Hz, 1H), 7.20-7.28 (m, 4Η), 7.28-7.34 (m, 8Η), 7.38-7.44 (m, 2Η), 7.97-8.04 (m, 2Η). HRMS: теор. для C44H39ClN2O4S2+H+, 759.21125; практ. (ESI-FTMS, [M+H]1+), 759.2099. Приклад 33 4-{3-[5-хлоро-2-[2-({[2-(3,5-диметилізоксазол-4іл)бензил]сульфоніл}аміно)етил]-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1, (77мг, 0.10ммоль) вступив в реакцію з 3,5диметилізоксазол-4-бороновою кислотою відповідно до процедури, зазначеної в Прикладі 29, Кроці 1, з утворенням 36мг (46%) продукту Suzuki, твердої речовини жовтого кольору. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (36мг, 0.046ммоль) гідролізували з утворенням 32мг (90%) зазначеної у назві сполуки, білої твердої речовини. 1Н ЯМР (400MHz, CDCI3) δ 1.88-2.04 (m, 5 Η), 2.14 (s, 3Η), 2.68-2.78 (m, 4Η), 2.78-2.85 (m, 2Η), 2.96 (t, J=7.5Hz, 2Η), 3.82-3.97 (m, 2Η), 4.18-4.27 (m, 1H), 6.49 (d, J=8.8Hz, 1H), 6.80 (dd, J=8.8, 2.0Hz, 1H), 6.83 (d, J=11.4Hz, 1H), 7.06 (dd, J=3.7, 1.6Hz, 4Η), 7.12 (dd, J=7.5, 1.1Hz, 1H), 7.267.34 (m, 10 H), 7.34-7.40 (m, 1H), 7.41 (d, J=2.0Hz, 1H), 7.99 (d, J=8.3Hz, 2H). HRMS:Teop. для C45H42CIN3O5S+H+, 772.26065; практ. (ESI-FTMS, [M+H]1+), 772.2595. Приклад 34 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2хінолін-8-ілбензил)сульфоніл]аміно}етил)-1Hіндол-3-іл]пропіл}бензойна кислота 91053 54 Крок 1. Бромід із Прикладу 24, Кроку 1, (77мг, 0.10ммоль) вступив в реакцію з 8хінолінбороновою кислотою відповідно до процедури, зазначеної в Прикладі 29, Кроці 1, з утворенням 67мг (82%) продукту Suzuki, білої твердої речовини. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (60мг, 0.073ммоль) гідролізували з утворенням 42мг (72%) зазначеної у назві сполуки, твердої речовини жовтого кольору. 1Н ЯМР (400MHz, CDCI3) δ 1.68-1.85 (m, 1Η), 1.99-2.13 (m, 1Η), 2.232.37 (m, 1Η), 2.43-2.53 (m, 3Η), 2.56-2.85 (m, 4Η), 3.91 (d, J=14.1Hz, 1Η), 4.28 (d, J=14.1Hz, 1H), 4.83 (t, J=4.7Hz, 1H), 6.39 (d, J=8.8Hz, 1H), 6.72-6.80 (m, 2Η), 6.94-7.01 (m, 2Η), 7.01 -7.09 (m, 2Η), 7.19-7.27 (m, 4Η), 7.27-7.31 (m, 4Η), 7.32-7.37 (m, 1H), 7.377.44 (m, 4Η), 7.47-7.56 (m, 3Η), 7.75-7.91 (m, 3Η), 8.22 (dd, J=8.3, 1.8Hz, 1H), 8.94 (dd, J=4.3, 1.8Hz, 1H). HRMS:Teop. для C49H42CIN3O4S+H+, 804.26573; практ. (ESI-FTMS, [M+H]1+), 804.2641. Приклад 35 4-{3-[5-хлоро-2-{2-[({[4'-(диметиламіно)біфеніл2-іл]метил}сульфоніл)аміно]етил}-1(дифенілметил)-1H-індол-3-іл]пропіл}бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1 (77мг, 0.10ммоль) вступив в реакцію з 4-(диметиламіно)фенілбороновою кислотою відповідно до процедури, зазначеної в Прикладі 29, Кроці 1, з утворенням 51мг (приблизно 52%) продукту Suzuki, білої твердої речовини. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (51мг, 0.063ммоль) гідролізували з утворенням 17мг (приблизно 41%) зазначеної у назві сполуки, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 1.87-1.98 (m, 2Η), 2.44-2.53 (m, 2Η), 2.64-2.70 (m, 2Η), 2.70-2.77 (m, 2Η), 2.79-2.89 (m, 8 Η), 4.01-4.07 (m, 1Η), 4.28 (s, 2Η), 6.46 (d, J=8.8Hz, 1Η), 6.59 (d, J=8.8Hz, 2Η), 6.76-6.81 (m, 2Η), 6.99-7.07 (m, 6 H), 7.16-7.23 (m, 2Η), 7.25-7.33 (m, 9H), 7.39 (d, J=2.3Hz, 1H), 7.44-7.49 (m, 1H), 8.00 (d, J=8.3Hz, 2Η). HRMS: теор. для (C48H46ClN3O4S+2H+)/2, 398.65215; практ. (ESI-FTMS, [M+2H]2+), 398.6504. Приклад 36 4-[3-(5-хлоро-1-(дифенілметил)-2-{2-[({[2'(трифторметокси)біфеніл-2іл]метил}сульфоніл)аміно]етил}-1H-індол-3іл)пропіл] бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1 (77мг, 0.10ммоль) вступив в реакцію з 2(трифторметокси)фенілбороновою кислотою відповідно до процедури, зазначеної в Прикладі 29, Кроці 1, з утворенням 36мг (приблизно 36%) продукту Suzuki, білої твердої речовини. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (36мг, 0.042ммоль) гідролізували з утворенням 23мг (приблизно 75%) зазначеної у назві сполуки, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 1.80-1.91 (m, 2Η), 2.54 (q, J=7.2Hz, 2Η), 2.59-2.70 (m, 4Η), 2.78-2.87 (m, 2Η), 3.90 (q, J=14.1Hz, 2Η), 4.05-4.11 (m, 1Η), 6.40 (d, J=8.8Hz, 1H), 6.67-6.76 (m, 2Η), 6.92-7.02 (m, 4Η), 7.07-7.16 (m, 3Η), 7.167.30 (m, 12 H), 7.31-7.36 (m, 2Η), 7.93 (d, J=8.3Hz, 2Η). HRMS: теор. для C47H40CIF3N2O5S+H+, 837.23713; практ. (ESI-FTMS, [M+H]1+), 837.2375. 55 Приклад 37 4-{3-[5-хлоро-2-[2-({[(2'-ціанобіфеніл-2іл)метил]сульфоніл}аміно)етил]-1-(дифенілметил)1Н-індол-3-іл]пропіл}бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1 (73мг, 0.095ммоль) вступив в реакцію з 2ціанофенілбороновою кислотою, з утворенням 23мг (30%) продукту Suzuki, твердої речовини жовтого кольору. Крок 2. Як описано в Прикладі 1, Кроці 10, естер (19мг, 0.024ммоль) гідролізували з утворенням 10мг (53%) зазначеної у назві сполуки, білої твердої речовини. 1H ЯМР (400MHz, CDCI3) δ 1.87-2.01 (m, 2Η), 2.62-2.79 (m, 6Η), 2.92 (t, J=7.6Hz, 2Η), 3.91-4.14 (m, 3Η), 6.47 (d, J=8.8Hz, 1H), 6.75-6.85 (m, 2Η), 7.01-7.08 (m, 4Η), 7.22-7.28 (m, 3Η), 7.287.36 (m, 8Η), 7.36-7.44 (m, 4Η), 7.49-7.59 (m, 1H), 7.63-7.69 (m, 1H), 8.00 (d, J=8.3Hz, 2Η). HRMS: теор. для C47H40CIN3O4S+H+, 778.25008; практ. (ESI-FTMS, [М+Н]1+), 778.2489. Приклад 38 3-{4-[(2-{5-хлоро-1-(дифенілметил)-2-[2-({[2(трифторметил)бензил]сульфоніл}аміно)етил]-1Hіндол-3-іл}етил)сульфоніл]феніл}пропанова кислота Крок 1: 2-Бромо-4-хлороанілін (1.0екв.) розчинили в СН2СІ2 (0.25М), після цього додали триетиламін й трифтороцтовий ангідрид (по 1.1екв.). Отриману суміш перемішували при кімнатній температурі протягом 1 години. Розчинник випарили, а залишок очистили флеш-хроматографією з СН2СІ2 у якості елюента, внаслідок чого отримали амід з 97% виходом, m/z (M-H)- 300.0. Крок 2: Н-(2-бромо-4-хлорофеніл)-2,2,2трифторацетамід (Крок 1, 1.0екв.) перемішали з 3бутин-1-олом (2.0екв.), дихлоробіс(трифенілфосфін)палладієм (II) (2.5%екв.), триетиламіном (3.0екв.), Cul (5%екв.) в DMF (0.2М) у герметично закритому контейнері під N2 і нагрівали до 120°С протягом 4 годин. Після цього реакційну суміш розвели етилацетатом, промили сольовим розчином й висушили над Na2SO4. Внаслідок очищення колонковою флешхроматографією з 2% МеОН/СН2Сl2 отримали алкін з 67% виходом. m/z (M-H)- 194.09 Крок 3: 2-(5-Хлоро-1Н-індол-2-іл)етанол (крок 2, 1.0екв.) та імідазол (2.0екв.) розчинили в DMF (0.3М) при кімнатній температурі з перемішуванням перед додаванням третбутилхлородифенілсилану (1.2екв.). Отриману суміш перемішували упродовж ночі при кімнатній температурі, після цього додали насичений водний розчин бікарбонату натрію й екстрагували за допомогою етилацетату. Органічну фазу промили водою й сольовим розчином й висушили над Na2SU4. Внаслідок очищення флешхроматографією з СН2СІ2 у якості елюента отримали сілильний етер у вигляді коричневої смоли з більш ніж 90% виходом, m/z (M-H)- 433.0 Крок 4: 2-({[Третбутил(дифеніл)сілил]окси}етил)-5-хлоро-1Н-індол (Крок 3, 1.0екв.) розчинили в ефірі (0.4М), і розчин охолодили до 0°С. До вищезазначеного холодного розчину додали оксалілхлорид (1.2екв.) при інтенсивному перемішуванні. Реакційну суміш перемі 91053 56 шували при 0°С протягом 1 години, після чого додали EtOH, а потім NEt3. Після цього отриману суміш розчинили більшою кількістю EtOH, після чого її додали у воду та екстрагували за допомогою EtOAc. Органічну фазу промили сольовим розчином, висушили над Na2SO4 і сконцентрували, внаслідок чого отримали кетоестер у вигляді твердої речовини жовтого кольору в 70% виходом, m/z (M-H)- 533.0 Крок 5: Етил [2-({[третбутил(дифеніл)сілил]окси}етил)-5-хлоро-1Н-індол3-іл] (оксо)ацетат (Крок 4, 1екв.), Рh2СНВr (1.5екв.) і Cs2CO3 (1.5екв.) перемішали у сухому ацетонітрилі (0.1М). Суміш нагрівали зі зворотнім холодильником протягом 2 годин. Реакційну суміш охолодили до кімнатної температури, розвели водою й екстрагували за допомогою EtOAc. Органічну фазу сконцентрували, і залишок хроматографували з СН2СІ2 у якості елюента, внаслідок чого отримали N-бензгідриліндол у вигляді оранжевої смоли з 45% виходом, m/z (M+H)+ 701.3 Крок 6: До розчину етил[1-бензгідрил-2-({[третбутил(дифеніл)сілил]окси}етил)-5-хлоро-1Н-індол3-іл](оксо)ацетату (Крок 5, 1екв.) в THF (0.1М) додали ВН3Ме2S (2М в THF) (2екв.). Отриману суміш нагрівали зі зворотнім холодильником протягом ночі під N2. Реакційну суміш охолодили до кімнатної температури, потім повільно додали 1н. NaOH, екстрагували за допомогою ЕtOАс, і промили сольовим розчином. Внаслідок концентрування отримали спирт з 65% виходом, m/z (М+Н)+ 645.0 Крок 7: До розчину 2-[1-бензгідрил-2-({[третбутил(дифеніл)сілил]окси}етил)-5-хлоро-1Н-індол3-іл]етанолу (Крок 6, 1екв.) в СН2СІ2 (0.08М) додали 1,3-біс(дифенілфосфіно)-пропан (DPPP, 0.75екв.). Розчин охолодили до 0°С під N2, після чого додали СВr4 (1.25екв.). Через 2год. температура реакції підвищилась до кімнатної температури. Розчинник випарували, а залишок очистили, використовуючи коротку силікагелеву колонку з СН2СІ2 у якості елюента, внаслідок чого отримали бромід у кількісному виході, m/z (M+H)+ 708.0 Крок 8: 1-Бензгідрил-3-(2-бромоетил)-2-({[третбутил(дифеніл)сілил]окси}етил)-5-хлоро-1Н-індол (Крок 7, 1екв.) змішали з метил-3-(4меркаптолфеніл) пропіонатом (1.5екв.) і K2СО3 (1.5екв.) в DMF (0.1М). Отриману суміш перемішували при кімнатній температурі під N2 упродовж 2год., потім розвели водою й екстрагували за допомогою ЕtOАс. Органічний екстракт промили сольовим розчином, сконцентрували і очистили флеш-хроматографією (СН2СІ2 у якості елюента), внаслідок чого отримали тіоетер у вигляді коричнюватої смоли з 80% виходом. m/z (M+H) 823.0 Крок 9: Метил 3-[4-({2-[1-бензгідрил-2-({[третбутил(дифеніл)сілил]окси}етил)-5-хлоро-1Н-індол3-іл]етил}сульфаніл)феніл]пропаноат (Крок 8, 1екв.) розчинили в ацетонітрилі (0.1М), після чого під N2 додали молекулярні сита (порошок, 4А) і Nоксид 4-метилморфоліну (NMO) (4екв.). Через 5 хвилин додали H-Pr4NRu4 (TPAP) (5%екв.). Отриману суміш нагрівали при 40°С упродовж 1.5год. Суміш сконцентрували, а залишок очистили флеш-хроматографією з СН2СІ2, а потім 1% ЕtOАс/СН2СІ2 у якості елюента, внаслідок чого 57 отримали сульфон у вигляді білої піни з 44% виходом. m/z (M+H)+ 855.1 Крок 10: Метил 3-(4-{2-[1-бензгідрил-2-({[третбутил(дифеніл)сілил]окси}етил)-5-хлоро-1Н-індол3-іл]етокси}феніл)пропаноат (Крок 9, 1екв.) розчинили у THF (0.1М) і охолодили до 0°С, після чого обробили nBu4NF (1M в THF) (1.2екв.). Отриману суміш перемішували при 0°С протягом 5 хвилин, потім нагріли до кімнатної температури й перемішували упродовж 30хв.. Розчинник випарували, а залишок очистили флеш-хроматографієюз ЕtOАс/СН2СІ2 (1:9 до 1:4) у якості елюента, внаслідок чого отримали спирт у вигляді білої піни з 90% виходом. m/z (M+H)+ 616.20 Крок 11: Метил 3-[4-{2-[1-бензгідрил-5-хлоро-2(гідроксиетил)-1Н-індол-3-іл]етил}сульфоніл)феніл]пропаноат (Крок 10, 1екв.) в СН2СІ2 (0.02М) обробили при 0°С МеSО2СІ (2.0екв.) і Et3N (2.5екв.) і перемішували протягом 1 години. Льодяну баню зняли, і реакційну суміш перемішували протягом 1 години при кімнатній температурі, після чого її розвели СН2СІ2, промили Na2PO4, сольовим розчином й висушили над Na2SO4. Внаслідок випаровування розчинника отримали мезилат у кількісному виході. m/z (M+H)+ 695.0 Крок 12: Метил 3-(4-{[2-(1-бензгідрил-5-хлоро2-{2-[(метилсульфоніл)окси]етил}-1Н-індол-3іл)етил]сульфоніл}феніл)пропаноат (Крок 11, 1.0екв.) розчинили в DMF (0.03М) і обробили NaN3 (3.0eq). Отриману суміш нагріли до 60°С і перемішували протягом 2 годин, потім охолодили до кімнатної температури, розвели водою, екстагували етилацетатом, промили сольовим розчином й висушили над Nа2SО4. Внаслідок випаровування розчинника отримали азид у кількісному виході. m/z (M+H)+ 641.1 Крок 13: Метил 3-[4-({2-[2-(2-азидоетил)-1бензгідрил-5-хлоро-1Н-індол-3іл]етил}сульфоніл)феніл]пропаноат (Крок 12, 1екв.) розчинили в THF (0.1М), і обробили трифенілфосфіном (1.1екв.). Через 2 дні додали воду, і суміш перемішували упродовж ночі, сконцентрували і очистили флеш-хроматографією, використовуючи 4% МеОН:СН2СІ2 у якості елюента, внаслідок чого отримали амін з 71% виходом. m/z (M+H)+ 615.2 Крок 14: Як вказано у Кроці 9, Прикладі 1, етил 3-[4-({2-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Hіндол-3-іл]етил}сульфоніл)феніл]пропаноат (Крок 13, 200мг, 0.32ммоль) вступив в реакцію з (2трифторметилфеніл)метансульфоніл хлоридом (Приклад 5, Крок 3, 110мг, 0.42ммоль) з утворенням 250мг сульфонаміду, блідо-жовтої піни, з 93% виходом. 1Н ЯМР (400MHz, CDCI3) δ 1.23 (t, J=12Hz, 3Η), 2.62-2.71 (m, 2Η), 2.76-2.93 (m, 4Η), 2.98-3.17 (m, 4Η), 3.27-3.38 (m, 2Η), 4.11 (q, J=7.2Hz, 2Η), 4.35 (s, 2Η), 4.57 (t, J=5.3Hz, 1H), 6.43 (d, J=9.1Hz, 1H), 6.77 (dd, J=8.8, 2.0Hz, 1H), 6.81 (s, 1H), 7.18 (d, J=2.0Hz, 1H), 7.24-7.35 (m, 10 H), 7.41 (d, J=8.6Hz, 3Η), 7.49 (t, J=8.3Hz, 1H), 7.607.77 (m, 2Η), 7.88 (d, J=8.6Hz, 2Η). Крок 15: Використовуючи процедуру, зазначену в Кроці 10 Прикладу 1, естер сульфонаміду (220мг, 0.26ммоль) гідролізували з утворенням 91053 58 200мг (92%) зазначеного у назві продукту, білої піни. 1H ЯМР (400MHz, DMSO-d6) δ 2.65 (t, J=7.6Hz, 2Η), 2.91-3.13 (m, 8Η), 3.60 (dd, J=9.7, 5.4Hz, 2Η), 4.46 (s, 2Η), 6.48 (d, J=8.8Hz, 1H), 6.83 (dd, J=8.7, 2.1Hz, 1H), 7.05-7.16 (m, 5H), 7.19 (d, J=2.3Hz, 1H), 7.33-7.47 (m, 6 H), 7.53-7.72 (m, 6 H), 7.80 (d, J=7.6Hz, 1H), 7.94 (d, J=8.3Hz, 2Η), 12.26 (s, 1H); HRMS: теор. для C42H38ClF3N2O6S2+H+, 823.18847; практ. (ESI-FTMS, [M+H]1+), 823.1887; чистота ВЕРХ H2O/CH3CN: 100%, H2O/MeOH: 100%. Приклад 39 3-(4-{[2-(5-хлоро-1-(дифенілметил)-2-{2-[({1-[2(трифторметил)феніл]етил}сульфоніл)аміно]етил}1Н-індол-3-іл)етил]сульфоніл}феніл)пропанова кислота Крок 1: Використовуючи процедуру, зазначену в Прикладі 1, Кроці 9, етил 3-[4-({2-[2-(2аміноетил)-5-хлоро-1-(дифенілметил)-1H-індол-3іл]етил}сульфоніл)феніл]пропаноат (Приклад 38, Крок 14) вступив в реакцію з 1-(2-трифторметилфеніл)-етансульфонілхлоридом (0.13г, 0.46ммоль) з утворенням етилового естеру 3-{4-[2-(1бензгідрил-5-хлоро-2-{2-[1-(2-трифторметилфеніл)-етансульфоніламіно]-етил}-1Н-індол-3-іл)етансульфоніл]-феніл}-пропіонової кислоти (0.110г, 40%). Крок 2: Естер сульфонаміду (0.11г, 0.13ммоль) гідролізували відповідно до Прикладу 1, Кроку 10, внаслідок чого отримали 0.068г (64%) зазначеного у назві продукту, білої тведої речовини. 1 Η ЯМР (400MHz, CDCl3) δ 1.67 (d, J=6.8Hz, 3Η) 2.57-2.72 (m, 4Η) 2.80 (t, J=6.8Hz, 2Η) 2.84-2.94 (m, 2Η) 3.03 (t, J=6AHz, 2Η) 3.20-3.31 (m, 2Η) 5.825.88 (m, 1H) 6.37 (s, 1H) 6.73-6.81 (m, 2Η) 6.98 (d, J=4.4Hz, 2Η) 7.05 (d, J=5.4Hz, 2Η) 7.24-7.49 (m, 11H) 7.63 (d, J=7.8Hz, 1H) 7.80 (d, J=7.8Hz, 1H) 7.88 (d, J=8.6Hz, 2Η). Приклад 40 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2гідроксибензил)сульфоніл]аміно}етил)-1H-індол-3іл]пропіл} бензойна кислота Крок 1: Використовуючи процедуру, описану в Прикладі 5, Кроці 1, з 2-бензилоксибензилброміду (пос. J. Med. Chem. 2006, 49, 31-34, R.V. Somu et al.) (32.2г, 116ммоль) отримали натрієву сіль (2бензилокси-феніл)-метансульфонової кислоти (30г, 86%), білу тверду речовину. 1Н ЯМР (400MHz, DMSO-d6) δ 3.82 (s, 2Η) 5.09 (s, 2Η) 6.816.91 (m, 1Η) 6.96 (d, J=7.58Hz, 1Η) 7.08-7.18 (m, 1Η) 7.26-7.34 (m, 1Η) 7.34-7.41 (m, 2Η) 7.45 (dd, J=1.77Hz, 1H) 7.52 (d, J=7.07Hz, 2Η). Крок 2: Використовуючи процедуру, описану в Прикладі 5, Кроці 2, з натрієвої солі (2-бензилоксифеніл)-метансульфонової кислоти (30г, 99ммоль) отримали (2-бензилокси-феніл)-метансульфонову кислоту (15г), білу тверду речовину, що використовувалася без подальшого очищення. 1H ЯМР (400MHz, DMSO-d6) δ 3.81 (s, 2Η) 5.08 (s, 2Η) 6.806.92 (m, 1Η) 6.95 (d, J=7.83Hz, 1Η) 7.07-7.17 (m, 1Η) 7.31 (d, J=6.82Hz, 1H) 7.34-7.42 (m, 2Η) 7.45 (dd, 1H) 7.52 (d, J=7.33Hz, 2Η). Крок 3: Використовуючи процедуру, описану в Прикладі 5, Кроці 3, з (2-бензилоксифеніл)метансульфонової кислоти (7г, 25.15ммоль) отри 59 мали (2-бензилокси-феніл)-метансульфоніл хлорид (2.6г, 35%). 1H ЯМР (400MHz, CDCI3) δ 5.06 (s, 2Η) 5.15 (s, 2Η) 7.00-7.10 (m, 2Η) 7.30-7.50 (m, 7Η). Крок 4: Як вказано в Кроці 9 Прикладу 1, метил 4-{3-[2-(2-аміноетил)-1-бензгідрил-5-хлоро-1Ніндол-3-іл]пропіл}бензоат (Приклад 7, Крок 6, 3.92г, 7.3ммоль) вступив в реакцію з (2бензилокси-феніл)-метансульфоніл хлоридом (2.6г, 8.76ммоль) з утворенням 4.1г метил 4-{3-[2[2-({[2-(бензилокси)бензил]сульфоніл}аміно)етил]5-хлоро-1-(дифенілметил)-1H-індол-3іл]пропіл}бензоату, білої піни, з 59% виходом. 1H ЯМP (400MHz, CDCl3) δ 1.80-1.99 (m, 2Η) 2.49-2.78 (m, 6Η) 2.85 (t, J=8.84Hz, 2Η) 3.89 (s, 3Η) 3.96-4.05 (m, 1H) 4.26 (s, 2Η) 4.90 (s, 2Η) 6.45 (d, J=8.84Hz, 1H) 6.73-6.82 (m, 2Η) 6.83-6.93 (m, 2Η) 6.94-7.08 (m, 4Η) 7.16-7.34 (m, 15 H) 7.39 (d, J=2.02Hz, 1H) 7.85-7.98 (m, 2Η). Крок 5: Метил 4-{3-[2-[2-({[2(бензилокси)бензил]сульфоніл}аміно)етил]-5хлоро-1-(дифенілметил)-1H-індол-3іл]пропіл}бензоат (5.1г, 6.4ммоль) вступив в реакцію з воднем у присутності палладію на вуглеці (0.5г) з утворенням суміші метил 4-{3-[5-хлоро-1(дифенілметил)-2-(2-{[(2гідроксибензил)сульфоніл]аміно}етил)-1H-індол-3іл]пропіл}бензоату і метил 4-{3-[1-(дифенілметил)2-(2-{[(2-гідроксибензил)сульфоніл]аміно}етил)-1Hіндол-3-іл]пропіл}бензоату (3:1) у вигляді білої піни з 74% виходом в цілому. Крок 6: Використовуючи процедуру, зазначену в Кроці 10, Прикладі 1, суміш естерів сульфонаміду (3.35г) гідролізували і очистили препаративною ВЕРХ з отриманням 1.18г (36%) зазначеного у назві продукту, білої твердої речовини. 1Н ЯМР (400MHz, CDCI3) δ 1.89-2.01 (m, 2Η) 2.64-2.96 (m, 8 Η) 4.16 (s, 2Η) 4.17-4.25 (m, 1Η) 6.50 (d, J=8.84Hz, 1H) 6.74-6.89 (m, 4Η) 6.95 (dd, J=1.64Hz, 1H) 7.017.13 (m, 4Η) 7.11-7.23 (m, 1H) 7.23-7.38 (m, 8Η) 7.41 (d, J=2.02Hz, 1H) 7.90-8.04 (m, 2Η); HRMS: теор. для C40H37CIN2O5S+H+, 693.21845; практ. (ESI-FTMS, [M+H]1+), 693.21709; чистота ВЕРХ (CH3CN-H2O): 7.24хв., 100.0%. Чистота ВЕРХ (МеОН-Н2О): 8.12хв., 100.0%. Приклад 41 4-{3-[5-хлоро-1-(дифенілметил)-2-(2-{[(2хінолін-5-ілбензил)сульфоніл]аміно}етил)-1Hіндол-3-іл]пропіл}бензойна кислота Крок 1. Бромід із Прикладу 24, Кроку 1 вступив в реакцію з 5-хінолінбороновою кислотою відповідно до процедури, зазначеної в Прикладі 29, Кроці 1, з утворенням продукту Suzuki. Крок 2. Як описано в Прикладі 1, Кроці 10, естер гідролізували, і продукт очистили препаративною ВЕРХ, внаслідок чого отримали зазначену у назві сполуку, білу тверду речовину. 1Н ЯМР (400MHz, CDCI3) δ 1Н ЯМР (400MHz, CDCI3) δ 1.771.91 (m, 2Η), 2.35-2.70 (m, 6Η), 2.76 (t, J=7.2Hz, 2Η), 3.65 (d, J=13.9Hz, 1H), 3.89 (d, J=13.9Hz, 1H), 4.00 (t, J=5.3Hz, 1H), 6.39 (d, J=9.1Hz, 1H), 6.636.79 (m, 2Η), 6.86-7.04 (m, 4Η), 7.08 -7.24 (m, 10 H), 7.24-7.40 (m, 4Η), 7.43-7.51 (m, 1H), 7.55 (dd, J=8.6, 7.1Hz, 1H), 7.62 (d, J=8.3Hz, 1H), 7.84-7.94 (m, 2Η), 8.05 (d, J=8.6Hz, 1H), 8.83 (dd, J=4.3, 1.8Hz, 1H). 91053 60 HRMS: тeop. для C49H42CIN3O4S+H+, 804.26573; практ. ESI-FTMS, [M+H]1+), 804.2663. Альтернативний спосіб для отримання проміжних сполук загальної формули: де X-галоген, бажано хлор, описаний в патентній заявці США сер. №11/064,241, поданої 23 лютого 2005 року, що включена авторами шляхом посилання у повному обсязі. Стисло, спосіб включає утворення сульфонової кислоти до перетворення в сульфонілгалід, відповідно до загальної схеми, що наведена нижче: де L-група, що відходить; Аr представляє собою залишок 2,6-дизаміщеного фенілу; R представляє собою (CHR5)n2 залишок, а М представляє собою іон металу групи І або групи II. Відповідно до схеми, сульфонові кислоти Формули IV можуть бути перетворені у сульфонілгаліди реакцією з галогенуючим реактивом (тобто, реактивом, що може перетворити не галогенний замісник, такий як, наприклад, Η або ОН, на галогенний замісник; тобто, перетворити залишок сульфонової кислоти у залишок сульфонілгаліду), наприклад, SOCl3, POCI3, ССl4/трифенілфосфін, оксалілхлорид або оксалілбромід, бажано оксалілхлорид. Галогенуючий агент переважно використовується у надлишку, особливо за наявності залишкового розчиннику у вихідному матеріалі, розчинниках чи в них обох. У разі застосування у якості галогенуючого агенту оксалілхлориду, він може використовуватися в діапазоні від приблизно 1 до приблизно 6 еквівалентів; від приблизно 2 до приблизно 4 еквівалентів або від приблизно 3 до приблизно 3.5 еквівалентів по відношенню до кількості реактиву сульфонової кислоти (сполуки Формули IV). Спеціаліст, кваліфікований в даній галузі визнає, що кількість використовуваного галогенуючого агента буде залежати, серед іншого, від кількості води у вихідному матеріалі або розчиннику й природи та реакційної здатності вихідного матеріалу й розчинників. Підходящі розчинники для реакції галогенування (крок 3 з наведеної вище схеми) включають будь-який органічний розчинник, що може принаймні частково розчиняти сполуку Формули IV. До оптимальних розчинників належать неполярні або слабко полярні розчинники, включаючи ацетоніт
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitors of cytosolic phospholipase a2
Автори англійськоюMckew John C., Lee Katherine L., Chen Lihren, Vargas Richard, Clark James D., Williams Cara, Clerin Valerie, Marusic Suzana, Pong Kevin
Назва патенту російськоюИнгибиторы цитозольной фосфолипазы а2
Автори російськоюМаккью Джон К., Ли Кетрин Л., Чен Лихрен, Варгас Ричард, Кларк Джеймс Д., Уилльямс Кейра, Клерин Валери, Марусик Сюзана, Понг Кевин
МПК / Мітки
МПК: A61K 31/404, A61P 19/00, C07D 209/14, A61P 25/00, A61P 11/00
Мітки: цитозольної, інгібітори, фосфоліпази
Код посилання
<a href="https://ua.patents.su/46-91053-ingibitori-citozolno-fosfolipazi-a2.html" target="_blank" rel="follow" title="База патентів України">Інгібітори цитозольної фосфоліпази а2</a>
Попередній патент: Засіб для встановлення з’єднання між двома секціями кабелепідтримувального пристрою, а також з’єднувач
Наступний патент: Тіофенові сполуки і активатори рецептора тромбопоетину
Випадковий патент: Спосіб лікування ендокринної неплідності












