Похідні піразолу, придатні як інгібітори альдостеронсинтази
Номер патенту: 110829
Опубліковано: 25.02.2016
Автори: Белл Майкл Грегорі, Шень Гуаньжон, Мебрі Томас Едвард, Хогестрат Паул Й., Ескрібано Ана Марія
Формула / Реферат
1. Сполука формули:
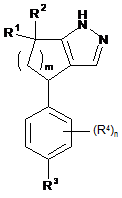 ,
,
де
n дорівнює 0 або 1;
m дорівнює 1 або 2;
R1 і R2 незалежно один від одного вибрані з групи, яку складають водень, -СН3 і -СН2СН3;
R3 являє собою -CN;
R4 незалежно в кожному випадку вибраний з групи, яку складають -F, -Сl, -Вr, -СН3 та -ОСН3;
або її фармацевтично прийнятна сіль.
2. Сполука формули:
 ,
,
де
n дорівнює 0, 1 або 2;
m дорівнює 1 або 2;
R1 і R2 незалежно один від одного вибрані з групи, яку складають водень та -СН3;
R3 являє собою -F або -Сl;
R4 у кожному випадку незалежно вибраний з групи, яку складають -F, -Сl, -Вr, -СН3 та -CF3;
або її фармацевтично прийнятна сіль.
3. Сполука формули:
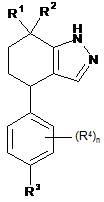 ,
,
де
n дорівнює 0 або 1;
R1 і R2 незалежно один від одного вибрані з групи, яку складають водень і -СН3;
R3 являє собою водень, -CN, -Сl, -ОСН3 або -СН3;
R4 у кожному випадку незалежно вибраний з групи, яку складають -F, -СН3 і -ОСН3;
або її фармацевтично прийнятна сіль.
4. Сполука за п. 1, де m дорівнює 1; R1 і R2 являють собою -СН3; R3 являє собою -CN; n дорівнює 0 або 1; R4 являє собою -F; або її фармацевтично прийнятна сіль.
5. Сполука за п. 1 або п. 4, де згаданою сполукою є 4-(6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)бензонітрил:
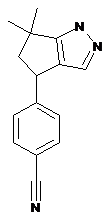 ;
;
або її фармацевтично прийнятна сіль.
6. Сполука за п. 5, де згаданою сполукою є 4-[(4R)-(6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)]бензонітрил:
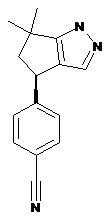 ;
;
або її фармацевтично прийнятна сіль.
7. Сполука за п. 6, де згаданою сполукою є 4-[(4R)-(6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)]бензонітрил:
 .
.
8. Сполука за п. 1 або п. 4, де згаданою сполукою є 4-(6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)-3-фторобензонітрил:
 ;
;
або її фармацевтично прийнятна сіль.
9. Сполука за п. 8, де згаданою сполукою є 4-(6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)-3-фторобензонітрил:
 .
.
10. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-9 або її фармацевтично прийнятну сіль і один(-ну) або декілька фармацевтично прийнятних носіїв, розріджувачів або допоміжних речовин.
11. Сполука за будь-яким з пп. 1-9 або її фармацевтично прийнятна сіль для застосування у терапії.
12. Сполука за будь-яким з пп. 1-9 або її фармацевтично прийнятна сіль для застосування у лікуванні хронічної хвороби нирок.
13. Сполука за пп. 1-9 або її фармацевтично прийнятна сіль для застосування у лікуванні діабетичної нефропатії.
14. Сполука за будь-яким з пп. 1-9 або її фармацевтично прийнятна сіль для застосування при виготовленні лікарського засобу для лікування хронічної хвороби нирок.
15. Сполука за будь-яким з пп. 1-9 або її фармацевтично прийнятна сіль для застосування при виготовленні лікарського засобу для лікування діабетичної нефропатії.
Текст
Реферат: Цей винахід пропонує інгібітори альдостеронсинтази формули: R R 2 H N 1 N m (R4)n R 3 , UA 110829 C2 (12) UA 110829 C2 1 2 3 4 де значення R , R , R , R , m та n визначені в описі винаходу, проміжні хімічні сполуки, способи їх одержання, фармацевтичні композиції та їх застосування. UA 110829 C2 5 10 15 20 25 Цей винахід стосується сполук і солей, придатних для інгібування альдостеронсинтази та фармацевтичних композицій на їх основі. Альдостеронсинтаза являє собою фермент, що обмежує швидкість продукування альдостерону. Підвищені рівні альдостерону у плазмі пов'язують з прогресуючою нирковою хворобою, що призводить до хронічної хвороби нирок. При вливанні альдостерону пацюкам спостерігався розвиток фіброзу нирок і посилення протеїнурії маркеру пошкодження нирок. Тваринні моделі хвороби нирок показали, що інгібітори альдостеронсинтази є придатними для лікування хвороби нирок. Основними причинами хвороби нирок є цукровий діабет, що веде до діабетичної нефропатії, і гіпертензія. Також було показано, що інгібітори альдостеронсинтази є придатними для лікування стійкої гіпертензії, зокрема в поєднанні з інгібіторами ангіотензинконвертувального ферменту (ACE) або блокаторами рецепторів ангіотензину (ARB). Дослідження також показали значно підвищені рівні альдостерону у хворих із застійною серцевою недостатністю (CHF). Було показано, що блокада альдостерону покращує виживаність хворих на застійну серцеву недостатність. Інгібітори альдостеронсинтази розкривають, наприклад, в патенті США № 5,057,521 та у публікації Європейського патенту № 0165904. Сполуки, що являють собою інгібітори альдостеронсинтази, мають також потенціал пригнічення продукування кортизолу, тестостерону та/або естрадіолу. Інгібування кортизолу, тестостерону і/або естрадіолу є небажаною побічною дією існуючих інгібіторів альдостеронсинтази. Отже існує необхідність віднаходження нових інгібіторів альдостеронсинтази. Крім того, існує також необхідність віднаходження нових інгібіторів альдостеронсинтази, які вибірково інгібують продукування альдостерону в порівнянні з інгібуванням продукування кортизолу, тестостерону і/або естрадіолу. Цей винахід пропонує альтернативні інгібітори альдостеронсинтази. Крім того, цей винахід пропонує сполуки, які можуть вибірково інгібувати продукування альдостерону в порівнянні з продукуванням кортизолу, тестостерону та/або естрадіолу. Цей винахід пропонує сполуку формули: ( )m ( ) n 30 35 40 45 50 , де n дорівнює 0, 1 або 2; m дорівнює 1 або 2; 1 2 R і R , незалежно один від одного, вибраний з групи, яку складають водень, -СН3 і -СН2СН3; 3 R являє собою водень, -CN, -F, -Cl, -CH3, -OCH3 або -CF3; 4 R , в кожному випадку незалежно, вибраний з групи, яку складають -F, -Cl, -Br, -СН3, -ОСН3, CF3 і -CN; або її фармацевтично прийнятну сіль. Цей винахід пропонує спосіб лікування хронічної хвороби нирок, який включає введення ефективної кількості сполуки за цим винаходом або її фармацевтично прийнятної солі пацієнту, який цього потребує. Цей винахід також пропонує спосіб лікування діабетичної нефропатії, який включає введення ефективної кількості сполуки за цим винаходом або її фармацевтично прийнятної солі пацієнту, який цього потребує. Цей винахід також пропонує спосіб лікування застійної серцевої недостатності або гіпертензії, який включає введення ефективної кількості сполуки за цим винаходом або її фармацевтично прийнятної солі пацієнту, який цього потребує. Цей винахід також пропонує фармацевтичну композицію, яка містить сполуку за цим винаходом або її фармацевтично прийнятну сіль і один(-ну) або декілька фармацевтично прийнятних носіїв, розріджувачів або допоміжних речовин. За конкретним варіантом здійснення винаходу згадана композиція додатково містить один або декілька інших терапевтичних агентів. Крім того, цей винахід також пропонує сполуки за цим винаходом або їх фармацевтично прийнятні солі для застосування в терапії, зокрема для лікування хронічної хвороби нирок, діабетичної нефропатії, застійної серцевої недостатності або гіпертензії. 1 UA 110829 C2 5 10 15 20 25 30 35 40 45 50 55 Крім того, цей винахід пропонує сполуки за цим винаходом або їх фармацевтично прийнятні солі для застосування у лікуванні хронічної хвороби нирок. Цей винахід також пропонує сполуки за цим винаходом або їх фармацевтично прийнятні солі для застосування при лікуванні діабетичної нефропатії. Цей винахід також пропонує сполуки за цим винаходом або їх фармацевтично прийнятні солі для застосування при лікуванні застійної серцевої недостатності і гіпертензії. Крім того цей винахід пропонує застосування сполуки за цим винаходом або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування хронічної хвороби нирок, діабетичної нефропатії, застійної серцевої недостатності або гіпертензії. Цей винахід також пропонує спосіб лікування хронічної хвороби нирок, який включає сумісне введення ефективних кількостей сполуки за цим винаходом і одного або декількох інгібіторів ангіотензинконвертувального ферменту (інгібітор ACE), блокатора рецептора ангіотензину (ARB) або антагоніста мінералокортикоїдного рецептора (MR). Інгібітори ACE охоплюють беназеприл (benazepril) (продається в США як Lotensin), каптоприл (captopril) (продається в США як Capoten), еналаприл (enalapril)/еналаприлат (enalaprilat) (продається в США як Vasotec пероральний та ін'єкційний), фозіноприл (fosinopril) (продається в США як Monopril ), лізиноприл (lisinopril) (продається в США як Zestril та Prinivil), моексиприл (moexipril) (продається в США як Univasc), периндоприл (perindopril) (продається в США як Aceon ), квінаприл (quinapril) (продається в США як Accupril ), раміприл (ramipril) (продається в США як Altace) і трандолаприл (trandolapril) (продається в США як Mavik ). ARB включають кандесартан (candesartan) (продається в США як Atacand ), ірбесартан (irbesartan) (продається в США як Avapro), олмесартан (olmesartan) (продається в США як Benicar), лосартан (losartan) (продається в США як Cozaar ), валсартан (valsartan) (продається в США як Diovan ), телмісартан (telmisartan) (продається в США як Micardis ) і епросартаном (eprosartan) (продається в США як Teveten). Цей винахід додатково пропонує спосіб лікування діабету або гіпертензії чи застійної серцевої недостатності, який включає спільне введення ефективних кількостей сполуки за цим винаходом і діуретику. Діуретики охоплюють торсемід (torsemide) (продається в США як Demadex), фуросемід (furosemide) (продається в США як Lasix), буметанід (bumetanide) (продається в США як Bumex), етакринову кислоту (ethacrynic acid) (продається в США як Edecrin), триамтерен (triamteren) (продається в США як Dyrenium ), спіронолактон (spironolactone) (продається в США як Aldactone), амілорид (amiloride) (продається в США як Midamor), індапамід (indapamide) (продається в США як Lozol ), гідрохлоротіазид (hydrochlorothiazide) (продається в США як HydroDIURIL ), метолазон (metolazone) (продається в США як Zaroxolyn або Mykrox), метилклотіазид (methylclothiazide) (продається в США як Aquatensen або Enduron), гідрохлоротіазид (hydrocholorthiazide) (продається в США як Aquazide H або Esidrix чи Microzide), хлоротіазид (chlorothiazide) (продається в США як Diuril), бендрофлуметіазид (bendroflumethiazide) (продається в США як Naturetin), політіазид (polythiazide) (продається в США як Renese ), гідрофлуметіазид (hydroflumethiazide) (продається в США як Saluron ) і хлорталідон (chlorthalidone) (продається в США як Thalitone). Для одержання повного списку також дивись, наприклад, Physician's Desk Reference, 2012 Edition, PDR Network (2011). Фіг. 1 являє собою репрезентативну порошкову рентгенограму напівгідратів 4-[(4R)-6,6диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл]бензонітрилу. Згадану порошкову рентгенограму одержали як описано в наведеному нижче Прикладі 1а. Фіг. 2 являє собою репрезентативну порошкову рентгенограму 4-[(4R)-6,6-диметил-4,5-дигідро-1Нциклопента[с]піразол-4-іл]бензонітрилу фосфорної кислоти. Згадану порошкову рентгенограму одержали як описано в наведеному нижче Прикладі 1b. Термін "азотзахисна група" означає складову, яка є стабільною в прогнозованих реакційних умовах і може бути вибірково видалена реагентами та реакційними умовами, сумісними з відновленим аміном. Такі групи добре відомі фахівцям і описані в літературі. Дивись, наприклад, Greene and Wuts, Protective Groups in Organic Synthesis, Third Edition, Chapter 7, John Wiley and Sons Inc., (1999). Фахівцю буде зрозуміло, що сполуки за цим винаходом можуть існувати в таутомерних формах, як показано нижче в I і I(а). У разі будь-якого посилання в цій заявці на одну з конкретних таутомерних форм сполук за цим винаходом, слід розуміти, що згадане посилання охоплює як таутомерні форми, так і всі їх суміші. 2 UA 110829 C2 ( )m ( )m ( ) n ( ) n I I(a) Фахівцю буде зрозуміло, що сполуки за цим винаходом містять ядро, яке має щонайменше один хіральний центр, представлений "*" в I(b) нижче: ( )m * ( ) n 5 10 I(b) Незважаючи на те, що цей винахід охоплює всі індивідуальні енантіомери, а також суміші енантіомерів згаданих сполук, в тому числі рацемати, згадані сполуки з абсолютною конфігурацією, як показано на I(с) нижче, є сполуками за цим винаходом, яким віддається перевага. ( )m ( ) n 15 20 25 30 I(c) Ізомери сполук за цим винаходом позначаються як ізомер 1, ізомер 2 тощо, починаючи з першого, що елююється (менший час утримування) у разі здійснення застосованого і описаного у цьому описі методу хроматографічного поділу. Крім того, фахівцю буде зрозуміло, що у сполуках за цим винаходом шляхом вибору певних змін можуть бути створені додаткові хіральні центри. Цей винахід включає всі індивідуальні енантіомери або діастереоізомери, а також суміші енантіомерів і діастереоізомерів згаданих сполук, в тому числі рацемати. Фахівцю також буде зрозуміло, що позначення символами (R) або (S) всіх хіральних центрів за системою Кана-Інгольда-Прелога буде змінюватись в залежності від схем заміщення конкретної сполуки. Згадані індивідуальні енантіомери або діастереоізомери можуть бути одержані із застосуванням хіральних реагентів або шляхом стереоселективних або стереоспецифічних синтетичних методів. Альтернативно індивідуальні енантіомери або діастереоізомери можуть бути виділені із сумішей стандартними хіральними хроматографічними або кристалізаційними методами в будь-якій зручній точці синтезу сполук за цим винаходом. Згадані сполуки за цим винаходом являють собою циклопентилпіразоли або тетрагідроіндазоли і відповідно реагують з будь-якою з числених неорганічних і органічних кислот з утворенням фармацевтично прийнятних солей, одержаних додаванням кислоти. Фармацевтично прийнятні солі і загальні методики їх одержання добре відомі в цій галузі. Дивись, наприклад, P. Stahl, et al. Handbook of Pharmaceutical Salts: Properties, Selection and Use, (VCHA/Wiley-VCH, 2002); S.M. Berge, et al., "Pharmaceutical Salts, ” Journal of Pharmaceutical Sciences, Vol. 66, No. 1, January 1977. Фармацевтично прийнятними солями за цим винаходом, 3 UA 110829 C2 5 10 15 20 25 30 35 40 45 50 55 60 яким відається перевага, є солі, одержані за допомогою хлористоводневої кислоти або фосфорної кислоти. Сполуки за цим винаходом за варіантом, якому віддають перевагу, включають до складу фармацевтичних композицій, які вводять різними шляхами. За варіантом, якому віддають найбільшу перевагу, такі сполуки є призначеними для перорального введення. Такі фармацевтичні композиції і способи їх одержання добре відомі в цій галузі. Дивись, наприклад, th Remington: The Science and Practice of Pharmacy (A. Gennaro, et. al., eds., 19 ed., Mack Publishing Co., 1995). Сполуки за цим винаходом, як правило, є ефективними в широкому діапазоні доз. Наприклад, добові дози зазвичай знаходяться в діапазоні від приблизно 0,01 мг/кг маси тіла до приблизно 30 мг/кг маси тіла. У деяких випадках рівні доз нижче нижньої межі вищевказаного діапазону можуть бути більш ніж достатніми, тоді як в інших випадках можуть бути використані ще більш високі дози без спричинення будь-якої шкідливої побічної дії, і тому згаданий вище діапазон дозування не є призначеним для обмеження обсягу цього винаходу будь-яким чином. Слід розуміти, що кількість фактично введеної сполуки буде визначатись лікарем з огляду на конкретні обставини, у тому числі стан, який підлягає лікуванню, вибраний шлях введення, фактично введена або введені сполуки, вік, маса і реакція конкретного пацієнта, а також тяжкість симптомів пацієнта. У значенні, вживаному у цьому описі, терміни "лікування" і "лікувати" означають уповільнення або затримку прогресування захворювання, наприклад, хвороби нирок, у пацієнта, який цього потребує. Діабет і гіпертензія є двома основними причинами хронічних хвороб нирок. Багато пацієнтів з хронічною хворобою нирок одночасно страждають на цукровий діабет і гіпертензію. Діабетичні пацієнти з хронічною хворобою нирок (діабетична нефропатія), ймовірно, мають прискорений прогрес у напрямку ESRD (термінальна стадія ниркової недостатності). Вони також належать до групи високого ризику смертності, в основному через серцево-судинні ускладнення, такі як порок серця. Хронічна хвороба нирок класифікується на основі рівнів гломерулярної фільтрації, де швидкість фільтрації зменшується від етапу 1 до етапу 5 або до термінальної стадії ниркової недостатності. Для ознайомлення з друкованими матеріалами щодо альдостеронсинтази дивись, наприклад, J. Am. Soc. Nephrol 14, 2395-2401 (2003); Kidney International, 21, 98-101 (1982); та Circulation 111, 3087-3094 (2005). У значенні, вживаному у цьому описі, термін "хронічна хвороба нирок" означає хворобу нирок, яка триває протягом більше трьох місяців. У значенні, вживаному у цьому описі, словосполучення "ефективна кількість" означає кількість сполуки за цим винаходом, що є достатньою для лікування однією або декількома дозами стану або його шкідливого впливу, які охарактеризовані у цьому описі, або кількість сполуки за цим винаходом, що є достатньою для інгібування альдостеронсинтази для досягнення цілей даного винаходу. У значенні, вживаному у цьому описі, словосполучення "спільне введення" означає введення сполуки за цим винаходом та іншої сполуки, яка охарактеризована у цьому описі, окремо, одночасно або послідовно протягом певного періоду часу, що визначається кваліфікованим фахівцем, який здійснює догляд за пацієнтом. У значенні, вживаному у цьому описі, термін "пацієнт" означає ссавця, переважно людину. Хоча всі наведені як приклад сполуки за цим винаходом є придатними інгібіторами альдостеронсинтази, певним класам сполук віддається перевага. У наведених нижче розділах описуються такі класи, яким віддається перевага: 1 2 а) обидва R і R являють собою -СН3; 1 2 b) обидва R і R являють собою водень; 1 2 с) R являє собою -СН3, а R являє собою водень; d) m дорівнює 1; e) m дорівнює 2; 3 f) R являє собою -CN; 3 g) R являє собою -F; 3 h) R являє собою -Cl; 3 i) R являє собою -СН3; 3 j) R являє собою водень; k) n дорівнює 0; l) n дорівнює 1; m) n дорівнює 2; 4 n) R являє собою -F; 4 о) R являє собою -Cl; 4 UA 110829 C2 4 5 10 15 p) R являє собою -Br; 4 q) R являє собою -СН3; 4 r) R являє собою -CN; 4 3 s) замісник R знаходиться в мета-положенні по відношенню до R ; 3 4 t) R являє собою -CN, а R являє собою -F; 3 4 u) R являє собою -CN, а R являє собою -Cl; 3 4 v) R являє собою -F або -Cl, а R являє собою -F, -Cl або -Br; 3 4 w) R являє собою -Cl, а R являє собою -F; 3 4 x) R являє собою -Cl, а R являє собою -Cl; 3 4 y) R являє собою -F, а R являє собою -F; 3 4 z) R являє собою -F, а R являє собою -Cl; аа) Сполука за цим винаходом являє собою вільну основу; bb) Сполука за цим винаходом являє собою хлористоводневу сіль; cc) Сполука за цим винаходом являє собою фосфатну сіль. Один з варіантів здійснення сполук за цим винаходом, якому віддається перевага, стосується сполук за цим винаходом, які відповідають наведеній нижче формулі, ( ) n 20 , 1 2 де n дорівнює 0, 1 або 2; R і R , незалежно один від одного, вибрані з групи, яку складають 3 4 водень, -CH3 і -CH2CH3; R являє собою водень, -CN, -F, -Cl або -CF3; R , у кожному випадку незалежно, вибраний з групи, яку складають -F, -Cl, -Br, -CH3, -CF3 і -CN; або їх фармацевтично прийнятної солі. Інший варіант здійснення сполук за цим винаходом, якому віддається перевага, стосується сполук за цим винаходом, які відповідають наведеній нижче формулі, ( ) 25 30 35 40 n , 1 2 де n дорівнює 0 or 1; R і R , незалежно один від одного, вибраний з групи, яку складають 3 4 водень і -CH3; R являє собою водень, -CN, галоген (Cl), -OCH3, -CH3; R , у кожному випадку незалежно, вибраний з групи, яку складають галоген (F), -CH3 і -OCH3; або їх фармацевтично прийнятної солі. Інший варіант здійснення сполук за цим винаходом, якому віддається перевага, стосується 1 2 сполук за цим винаходом, де n дорівнює 0 або 1; m дорівнює 1 або 2; R і R , незалежно один 3 4 від одного, вибрані з групи, водень, -СН3 і -СН2СН3; R являє собою -CN; R , у кожному випадку незалежно, вибраний з групи, яку складають -F, -Cl, -Br, -СН3 і -OCH3; або їх фармацевтично прийнятної солі. Іще один варіант здійснення сполук за цим винаходом, якому віддається перевага, 1 2 стосується сполук за цим винаходом, де n дорівнює 0 або 1; m дорівнює 1; R і R , незалежно 3 4 один від одного, вибрані з групи, яку складають водень, -CH3 і -CH2CH3; R являє собою -CN; R являє собою -F, -Cl або -Br; або їх фармацевтично прийнятної солі. Інший варіант здійснення сполук за цим винаходом, якому віддається перевага, стосується 1 2 сполук за цим винаходом, де n дорівнює 0 або 1; m дорівнює 2; R і R , незалежно один від 3 4 одного, вибрані з групи, яку складають водень і -CH3; R являє собою -CN; R являє собою -F, Cl, -Br, -CH3 або -OCH3; або їх фармацевтично прийнятної солі. Іще один варіант здійснення сполук за цим винаходом, якому віддається перевага, 5 UA 110829 C2 1 5 10 15 20 25 30 35 40 45 2 стосується сполук за цим винаходом, де n дорівнює 1; m дорівнює 1 або 2; R і R , незалежно 3 4 один від одного, вибрані з групи, яку складають водень і -CH3; R являє собою -CN; R являє собою -F, -Cl, -Br або -CH3; або їх фармацевтично прийнятної солі. Іще один варіант здійснення сполук за цим винаходом, якому віддається перевага, 1 2 стосується сполук за цим винаходом, де n дорівнює 1; m дорівнює 1; R і R являють собою 3 4 CH3; R являє собою -CN; R являє собою -F, -Cl або -Br; або їх фармацевтично прийнятної солі. Інший варіант здійснення сполук за цим винаходом, якому віддається перевага, стосується 1 2 сполук за цим винаходом, де n дорівнює 1; m дорівнює 2; R і R , незалежно один від одного, 3 4 вибрані з групи, яку складають водень і -CH3; R являє собою -CN; R являє собою -F, -Cl, -Br або -CH3; або їх фармацевтично прийнятної солі. Іще один варіант здійснення сполук за цим винаходом, якому віддається перевага, 1 2 стосується сполук за цим винаходом, де n дорівнює 1; m дорівнює 1 або 2; R і R являють 3 4 собою -CH3; R являє собою -CN; R являє собою -F; або їх фармацевтично прийнятної солі. Іще один варіант здійснення сполук за цим винаходом, якому віддається перевага, 1 2 стосується сполук за цим винаходом, де n дорівнює 1; m дорівнює 2; R і R являють собою 34 CH3; R являє собою -CN; R являє собою -F; або їх фармацевтично прийнятної солі. Інший варіант здійснення сполук за цим винаходом, якому віддається перевага, стосується 1 2 сполук за цим винаходом, де n дорівнює 0, 1 або 2; m дорівнює 1 або 2; R і R , незалежно один 3 4 від одного, вибраний з групи, яку складають водень і -CH3; R являє собою -F або -Cl; R , у кожному випадку незалежно, вибраний з групи, яку складають -F, -Cl, -Br, -CH3 і -CF3; або їх фармацевтично прийнятної солі. Іще один варіант здійснення сполук за цим винаходом, якому віддається перевага, 1 2 стосується сполук за цим винаходом, де n дорівнює 0, 1 або 2; m дорівнює 1; R і R , незалежно 3 4 один від одного, вибрані з групи, яку складають водень і -CH3; R являє собою -F або -Cl; R , у кожному випадку незалежно, вибраний з групи, яку складають -F, -Cl, -Br, -CH3 і -CF3; або їх фармацевтично прийнятної солі. Іще один варіант здійснення сполук за цим винаходом, якому віддається перевага, 1 2 стосується сполук за цим винаходом, де n дорівнює 0, 1 або 2; m дорівнює 2; R і R , незалежно 3 4 один від одного, вибрані з групи, яку складають водень і -CH3; R являє собою -F або -Cl; R , у кожному випадку незалежно, вибраний з групи, яку складають -F, -Cl, -Br, -CH3 і -CF3; або їх фармацевтично прийнятної солі. Інший варіант здійснення сполук за цим винаходом, якому віддається перевага, стосується 1 2 сполук за цим винаходом, де n дорівнює 0, 1 або 2; m дорівнює 1; R і R , незалежно один від 3 4 одного, вибрані з групи, яку складають водень і -CH3; R являє собою водень; R , у кожному випадку незалежно, вибраний з групи, яку складають -F, -Cl, -Br, -CH3 і -CN; або їх фармацевтично прийнятної солі. Іще один варіант здійснення сполук за цим винаходом, якому віддається перевага, 1 2 3 стосується сполук за цим винаходом, де m дорівнює 1; R і R являють собою -CH3; R являє 4 собою -CN; n дорівнює 0 або 1; R являє собою -F; або їх фармацевтично прийнятної солі. Варіантом здійснення сполук за цим винаходом, яким віддають особливу перевагу, є 4-(6,6диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)бензонітрил: або його фармацевтично прийнятна сіль. Іншим варіантом здійснення сполук за цим винаходом, яким віддають особливу перевагу, є 4-[(4R)-(6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)]бензонітрил 6 UA 110829 C2 5 10 15 20 25 30 35 40 або його фармацевтично прийнятна сіль. Сполукою за цим винаходом, якій віддають особливу перевагу, є 4-[(4R)-(6,6-диметил-4,5дигідро-1Н-циклопента[с]піразол-4-іл)]бензонітрил. Іншою сполукою за цим винаходом, якій віддають особливу перевагу, є 4-(6,6-диметил-4,5дигідро-1Н-циклопента[с]піразол-4-іл)-3-фторбензонітрил або його фармацевтично прийнятна сіль. Іще однією сполукою за цим винаходом, якій віддають особливу перевагу, є 4-(6,6-диметил4,5-дигідро-1Н-циклопента[с]піразол-4-іл)-3-фторбензонітрил, ізомер 1, або його фармацевтично прийнятна сіль. Іще одною сполукою за цим винаходом, якій віддають особливу перевагу, є 4-(6,6-диметил4,5-дигідро-1Н-циклопента[с]піразол-4-іл)-3-фторбензонітрил. Ще однією сполукою за цим винаходом, якій віддають особливу перевагу, є 4-(6,6-диметил4,5-дигідро-1Н-циклопента[с]піразол-4-іл)-3-фторбензонітрил, ізомер 1. Сполуки за цим винаходом є інгібіторами альдостеронсинтази. Отже цей винахід пропонує спосіб інгібування альдостеронсинтази, який включає введення пацієнту, який потребує такого лікування, сполуки за цим винаходом у кількості, яка інгібує альдостеронсинтазу. За варіантом, якому віддають перевагу, згаданим пацієнтом, якого лікують шляхом введення сполук за цим винаходом, є ссавець, переважно людина. Вважають, що сполуки за цим винаходом, як інгібітори альдостеронсинтази, є корисними для лікування хронічної хвороби нирок, діабетичної невропатії, застійної серцевої недостатності і гіпертензії. За варіантом здійснення, якому віддають перевагу, цей винахід пропонує спосіб лікування хронічної хвороби нирок, який включає введення сполуки за цим винаходом пацієнту, який цього потребує. За іншим варіантом здійснення, якому віддають перевагу, цей винахід пропонує спосіб лікування діабетичної нефропатії, причому згаданий спосіб включає введення ефективної кількості сполуки за цим винаходом або її фармацевтично прийнятної солі пацієнту, який цього потребує. За ще одним іншим прикладом здійснення, якому віддають перевагу, цей винахід пропонує спосіб лікування хронічної хвороби нирок, який включає спільне введення сполуки за цим винаходом і інгібітору ACE пацієнту, який цього потребує. За іще одним варіантом здійснення, якому віддають перевагу, цей винахід пропонує спосіб лікування хронічної хвороби нирок, який включає спільне введення сполуки за цим винаходом і ARB пацієнту, який цього потребує. Сполуки за цим винаходом або їх солі можна одержати за допомогою різноманітних методів, відомих в цій галузі, і деякі з цих методів ілюструються наведеними нижче Схемами, Препаративними методиками та Прикладами. Конкретні стадії синтезу для кожного з описаних шляхів можуть комбінуватись різними способами або поєднуватись зі стадіями з різних схем для одержання сполук за цим винаходом або їх солей. Продукти реакції на кожній стадії у 7 UA 110829 C2 5 10 15 20 25 30 35 наведених нижче схемах можуть бути виділені традиційними методами, в тому числі екстракцією, випарюванням, осадженням, хроматографуванням, фільтрацією, розтиранням або кристалізацією. Певні стереохімічні центри були залишені невизначеними і певні замісники були усунені в наведених нижче схемах заради ясності, і не є призначеним для будь-якого обмеження ідей згаданих схем. Окремі ізомери, енантіомери або діастереоізомери можуть бути відокремлені в будь-якій зручній точці у процесі синтезу сполук за цим винаходом такими методами як хіральна хроматографія. На додаток до цього, проміжні хімічні сполуки, описані в наведених нижче схемах, містять ряд азотзахисних груп. Мінлива захисна група може бути однаковою або різною в кожному випадку, залежно від конкретних умов реакції і конкретного перетворення, яке повинно бути здійсненим. Умови захисту і відщеплення захисних груп добре відомі фахівцям в цій галузі і описані в літературі. Дивись, наприклад, Greene and Wuts, Protective Groups in Organic Synthesis, Third Edition, Chapter 7, John Wiley and Sons Inc., (1999). Скорочення, які вжиті в цьому описі, визначені відповідно до Aldrichimica Acta, Vol. 17, No. 1, 1984. Інші скорочення визначені так: "ACN" означає ацетонітрил; "BINAP" означає 2,2'біс(дифенілфосфіно)-1,1'-бінафталін; "реагент Бредерека" означає трет-бутоксибіс(диметиламіно)метан; "Rh2Cl2(COD)2" означає димер хлориду циклооктадієнродія; "CMV" означає цитомегаловірус; "DCM" означає дихлорометан; "DMEA" означає диметилетиламін; "DMF" означає диметилформамід; "DMF-DMA" означає диметилформамід-диметилацеталь або 1,1-диметокси-N, N-диметилметанамін; "DMEM" означає модифіковане за способом Дульбекко середовище Ігла; "DMSO" означає диметилсульфоксид; "DOC" означає 11дезоксикортикостерон, "EtOAc" означає етилацетат, "EtOH" означає етиловий спирт або етанол; "Ex" означає приклад; "FA" означає мурашину кислоту; "флеш-хроматографія" означає очищення на силікагелі; "НІС" означає гідроксиетилцелюлозу; "IS" означає внутрішній стандарт; "IPA" означає ізопропіловий спирт або ізопропанол; "LiHMDS" означає біс(триметилсиліл)амід літію; "МеОН" означає метиловий спирт або метанол; "MTBE" означає метил-трет-бутиловий простий ефір; "NMP " означає N-метилпіролідон; "PdAllylCl" означає димер π-алілпаладію (II) хлориду; "Pd2(dba)3" означає трис(дибензиліденацетон)дипаладій; "фосфіновий ліганд" означає ди-трет-бутил-(2',4',6'-триізопропілбіфеніл-2-іл)фосфін; "Prep" означає препаративну методику; "SFC" означає надкритичну рідинну хроматографію; "TFA" означає трифтороцтову кислоту; "THF" означає тетрагідрофуран, "THP" означає тетрагідропіраніл; "Tr" означає час утримування і "тозил" означає толуолсульфоніл. У наведених нижче схемах всі замісники, якщо не вказано інше, є такими, як визначено вище. Реагенти і вихідні матеріали зазвичай є легкодоступними для фахівця в цій галузі. Інші можуть бути одержані стандартними методами органічної хімії і хімії гетероциклічних сполук, які є аналогічними синтезам відомих структурно подібних сполук і процедурам, описаним в наведених нижче Препаративних методиках та Прикладах, в тому числі будь-яких нових процедур. 40 45 Схема I описує алкілування відповідної сполуки формули (1) арилбороновою кислотою (2) у реакції 1,4-приєднання Міхаеля з одержанням сполуки (3), яка може бути оброблена реагентом Бредерека і гідразином з одержанням сполуки (I). Змінні групи є такими, як визначено раніше. 8 UA 110829 C2 5 10 15 20 Наприклад, фахівцю буде очевидним існування різноманітних умов, корисних для полегшення реакції 1,4-приєднання Міхаеля. Відповідно, разом з відповідною арилбороновою кислотою (2) може бути застосований відповідний каталізатор, такий як біс(1,5циклооктадієнродію хлорид), біс(норборнадієн)родію (I) тетрафторборат або трихлорид сурми з паладієм (II), як каталізатором, таким як ацетат паладію. З метою здійснення хірального приєднання може бути використаний відповідний фосфіновий реагент, такий як рацемічний-2,2'біс(дифенілфосфіно)-1,1'-бінафтил або хіральний BINAP (S)-(-)-2,2'-біс(дифенілфосфіно)-1,1'бінафтил. Для полегшення реакції з одержанням сполуки формули (3, стадія 1) може бути використана відповідна неорганічна основа, така як ацетат натрію, ацетат калію, карбонат калію або органічна основа, така як триетиламін, у відповідному розчиннику, такому як THF з ізопропіловим спиртом, діоксаном і водою, або кислотою, такою як оцтова кислота. Кетон у подальшому може бути алкілований диметилформаміддиметилацеталем або трет-бутоксибіс(диметиламіно)метаном (реагент Бредерека) з одержанням диметиламінометиленового аддукту, сполука (4, стадія 2), який у подальшому може бути циклізований з утворенням піразолу за допомогою гідразина, гідрата гідразина або гідрохлориду гідразина з одержанням сполук за цим винаходом на стадії 4. Альтернативно сполука формули (3) може бути безпосередньо перетворена на сполуки за цим винаходом без виділення проміжної хімічної сполуки (4) шляхом взаємодії з реагентом Бредерека і подальшим реагуванням in situ з гідразиновим реагентом з одержанням сполук за цим винаходом, стадія 3. 1 2 Альтернативно, коли обидва і R , і R являють собою водень, гем-діалкільна функціональна група може бути введена із використанням йодалкільного реагенту у присутності основи, такої як гексаметилдисилілазид літію. 25 30 35 40 Альтернативно відповідним чином захищений тетрагідроіндазол-4-он у вигляді суміші регіоізомеров піразолу може бути відокремлений хроматографічним шляхом або реагувати у вигляді суміші. Захисна група піразолу може перебувати на будь-якому атомі азоту і була довільно позначеною. Фахівцю в цій галузі буде зрозуміло, що положення захисної групи піразолу може взаємозамінюватись без впливу на результат подальших показаних реакцій. Скорочення "PG" означає захисну групу аміногрупи. Такі захисні групи добре відомі, і їх широко застосовують у цій галузі. Сполука 5 може бути алкілована реактивом Гриньяра, який одержують обробкою відповідним чином заміщеного аналогу 4-йодофенілу ізопропілмагнійхлоридом або ізопропілмагнійбромідом у відповідному розчиннику, такому як THF, з одержанням 5,6-дигідро-2Н-індазол-4-олу (6, стадія 5). За одним з варіантів здійснення винаходу карбіноли (6) можуть бути дегідратовані з відщепленням захисної групи протягом одного перетворення з одержанням алкену (7, стадія 6) шляхом обробки кислотою, такою як HCl або TFA, в спиртовому розчиннику, такому як метанол. Після цього сполука (7) може бути відновлена гідрогенізацією з одержанням сполуки (8, стадія 7). Альтернативно згадана послідовність може бути здійснена поетапно шляхом обробки (6) TFA у DCM з відновленням одержаного олефіну шляхом гідрогенізації із застосуванням 9 UA 110829 C2 каталізаторів, таких як Pt(OH)2, та відщепленням захисної групи основою, такої як КОН в МеОН, з одержанням сполуки (8). 5 10 15 20 25 30 35 40 Схема III зображує алкілування відповідної сполуки формули (9) арилбороновою кислотою з одержанням сполуки (10), яка, після гідрогенізації і відщеплення захисної групи, дає сполуку за цим винаходом. Фахівцю буде зрозумілою можливість перестановки порядку стадії 10 з одержанням сполуки (8). Наприклад, захищені регіоізомери тетрагідроіндазол-4-ону (5) можуть бути розділені за допомогою хроматографії або можуть бути введені в реакцію у вигляді суміші з відповідною основою, такою як LiHMDS, в полярному апротонному розчиннику, такому як THF, і одержаний в результаті єнолят може бути погашений (трифторометансульфонамід)ом з одержанням єнолтрифлату (9, стадія 8) у вигляді суміші регіоізомерів, яка може бути розділена за допомогою хроматографії, або може бути введена в реакцію у вигляді суміші. Сполука (9) може бути введена в реакцію з відповідною бороновою кислотою (2) за умов реакції крос-сполучення за Сузукі-Міяура з одержанням сполуки (10, стадія 9). Фахівцю буде очевидним існування множини умов, придатних для полегшення таких реакцій крос-сполучення. Відповідно, прийнятні реагенти паладію охоплюють тетракіс(трифенілфосфін)паладій(0), біс(трифенілфосфін)паладію(II) хлорид, трис(дибензиліденацетон)дипаладій(0) з трициклогексилфосфіном, (1,1'-біс(дифенілфосфіно)фероцен)паладію(II) хлорид або паладію(II) ацетат. Придатна основа охоплює карбонат цезію, карбонат натрію, карбонат калію або триосновний моногідрофосфат калію. Сполука (10) може бути гідрогенизована з відщепленням захисної групи від одержаного продукту з одержанням сполуки формули (I, стадія 10). Фахівцю в цій галузі зрозуміло, що останні два перетворення можуть бути перестановлені з одержанням сполуки (8). Препаративні методики та Приклади Наведені нижче препаративні методики та приклади додатково ілюструють цей винахід. Якщо не вказано інше, сполуки, наведені у цьому документі, називаються і нумеруються за Symyx Draw, версія 3.2 (компанія Symyx Solutions, Inc) або IUPACNAME ACDLABS. Препаративна методика 1 5,5-Диметилциклопент-2-ен-1-он 2,2-Диметилциклопентанон (50,0 г, 445,75 ммоль) додають до розчину алілдіетилфосфату (165,4 г, 846,92 ммоль) у трет-аміловому спирті (557 мл). Додають карбонат калію (75,5 г, 537,12 ммоль) і Pd(OAc)2 (5 г, 22,29 ммоль), і одержану суміш нагрівають при температурі 80C протягом 12 год. Суміш охолоджують до температури навколишнього середовища, розбавляють ацетоном (500 мл), фільтрують через діатомову землю, і концентрують досуха. Неочищений продукт переганяють у вакуумі (60С при 20 мм рт.ст.(2,67 кПа)) з одержанням 1 вказаної в заголовку сполуки (30 г, 61 %, 272,34 ммоль). H ЯМР (300,13 МГц, CDCl3) δ 7,62-7,59 (m, 1H), 6,12 (dt, J=5,9 Гц, 2,1 Гц, 1H), 2,54 (t, J=2,4 Гц, 2H), 1,10 (s, 6H). 10 UA 110829 C2 5 10 15 20 25 30 35 Препаративна методика 2 (4,5-Дифтор-2-метилфеніл)боронова кислота н-Бутиллітій (4,6 мл, 11,5 ммоль) краплями додають в атмосфері аргону до суміші 1-бром4,5-дифтор-2-метилбензолу (2,0 г, 9,6 ммоль) і триметилборату (1,5 г, 14,5 ммоль) у безводному тетрагідрофурані (30 мл) при температурі -78C протягом однієї години. Згадану реакційну суміш перемішують протягом ще однієї години при тій самій температурі, реакцію швидко припиняють, і реакційну суміш підкислюють 1н розчином HCl. Одержану суміш екстрагують етилацетатом (3). Об'єднаний органічний шар промивають розсолом, сушать безводним сульфатом натрію, фільтрують, і концентрують in vacuo. Препаративна методика 3 (+/-)-4-(3,3-Диметил-4-оксоциклопентил)бензонітрил Біс(1,5-циклооктадієнродію хлорид) (1,09 г, 2,18 ммоль) рацемічний 2,2'біс(дифенілфосфіно)-1,1'-бінафтил (3,05 г, 4,90 ммоль) додають у тетрагідрофуран (72 мл), і перемішують одержану суміш в атмосфері азоту протягом 30 хв. Цей розчин додають до суміші 4-ціанофенілборонової кислоти (80,04 г, 544,68 ммоль), 5,5-диметилциклопент-2-ен-1-ону (24 г, 217,87 ммоль), карбонату калію (40,65 г, 294,13 ммоль), тетрагідрофурана (144 мл) і ізопропілового спирту (16,7 мл) при температурі 60С. Суміш перемішують при температурі 60C протягом 16 год., після чого концентрують досуха. Неочищену суміш виливають у воду (500 мл), і екстрагують етилацетатом (2500 мл). Органічні екстракти сушать MgSO 4, фільтрують через силікагель, і концентрують досуха. Залишок очищають за допомогою флешхроматографії на силікагелі з елююванням сумішшю (6:1) гексан:етилацетат з одержанням 1 вказаної в заголовку сполуки (41 г, 88 %, 192,24 ммоль). H ЯМР (300,13 МГц, CDCl3) δ 7,65-7,62 (m, 2H), 7,37 (d, J=8,1 Гц, 2H), 3,56-3,43 (m, 1H), 2,86-2,76 (m, 1H), 2,42-2,32 (m, 1H), 2,32-2,24 (m, 1H), 1,86 (t, J=12,4 Гц, 1H), 1,17 (s, 3H), 1,15 (s, 3H). Препаративна методика 4 (+/-)-3-(3,4-Дифторофеніл)циклопентанон 3,4-Дифторофенілборонову кислоту (9,47 г, 60 ммоль), циклопент-2-енон (4,93 г, 60 ммоль), трихлорид сурми (1,37 г, 6 ммоль), ацетат натрію (9,84 г, 120 ммоль) і ацетат паладію (1,35 г, 6 ммоль) в атмосфері аргону додають в оцтову кислоту (300 мл). Реакційну суміш перемішують при кімнатній температурі протягом ночі. Реакційну суміш фільтрують, і виливають у воду. Цей матеріал екстрагують етилацетатом (3), промивають насиченим розчином бікарбонату натрію (3), розсолом (3), сушать сульфатом натрію, фільтрують, і концентрують in vacuo. Продукт очищають із застосуванням хроматографування на силікагелі з елююванням 10 % розчином етилацетату в петролейном ефірі з одержанням вказаної в заголовку сполуки у вигляді масла 1 жовтого кольору (6,9 г, 58 %). H ЯМР (300 МГц, CDCl3) δ 7,14-6,95 (m, 3H), 3,41-3,37 (m, 1H), 2,64-2,61 (m, 1H), 2,46-2,23 (m, 4H), 1,93-1,84 (m, 1H). Сполуки, наведені нижче, одержують по суті як описано для (+/-)-3-(3,4дифторофеніл)циклопентанону. Таблиця 1 Препаративна методика 5 6 7 1 H ЯМР (300 МГц) δ або ES/MS (масспектрометрія з електророзпилюванням) Хімічна назва (CDCl3) 7,32-7,37 (m, 1H), 7,05-6,96 (m, 2H), 3,41-3,38 (m, 1H), 2,72-2,60 (m, 1H), 2,462,25 (m, 4H), 1,93-1,85 (m, 1H). (+/-)-3-(4-хлор-3фторофеніл)циклопентанон (+/-)-3-(3,4дихлорофеніл)циклопентанон (+/-)-2-хлор-4-(3оксоциклопентил)бензонітрил (m/z) 228 (m/z) 219 8 (+/-)-3-(4трифторометилфеніл)циклопентанон 9 (+/-)-3-хлор-4-(3,3-диметил-4оксоциклолпентил)бензонітрил 10 (+/-)-4-(4,5-дифторо-2-метилфеніл)2,2-диметил-циклопентанон 11 (CDCl3) 7,67 (d, J=6,0 Гц, 2H), 7,55 (d, J=9,0 Гц, 2H), 3,51-3,47 (m, 1H), 2,49-2,36 (m, 2H), 2,32-2,29 (m, 3H), 1,95-1,92 (m, 1H). 8,30-7,60 (m, 3H), 3,95-3,75 (m, 1H), 2,752,53 (m, 2H), 2,17 (ddd, J=12,3 Гц, 6,1 Гц, 1,7 Гц, 1H), 1,84 (t, J=12,1 Гц, 1H), 1,076 (s, d 3H), 1,064 (s, 3H). (m/z) 238 UA 110829 C2 Таблиця 1 Препаративна методика 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 5 10 1 H ЯМР (300 МГц) δ або ES/MS (масспектрометрія з електророзпилюванням) Хімічна назва 7,59-7,64 (m, 1H), 7,13-7,20 (m, 2H), 3,463,53 (m, 1H), 2,75-2,82 (m, 1H), 2,28-2,43 (m, 2H), 1,88-1,91 (m, 1H), 1,15-1,20 (m, 6H). 7,28-7,31 (m, 2H), 7,16-7,20 (m, 2H), 3,36(+/-)-3-(4-хлорофеніл)циклопентанон 3,39 (m, 1H), 2,61-2,69 (m, 1H), 2,23-2,48 (m, 4H), 1,93-2,03 (m, 1H). 7,64 (d, J=8,4 Гц, 2H), 7,37 (d, J=8,4 Гц, 2H), (+/-)-4-(33,54-3,42 (m, 1H), 2,74-2,66 (m, 1H), 2,54оксоциклопентил)бензонітрил 2,43 (m, 2H), 2,37-2,27 (m, 2H), 2,02-1,91 (m, 1H). 7,25-7,18 (m, 2H), 7,05-7,00 (t, 2H), 3,48-3,31 (+/-)-3-(4-фторофеніл)циклопентанон (m, 1H), 2,67 (dd, 1H), 2,51-2,22 (m, 4H), 2,02-1,85 (m, 1H). (+/-)-4-(4-хлорофеніл)-2,2(m/z) 223 (M+1) диметилциклопентанон 7,28-7,2 (m, 3H), 7,1 (d, 1H), 3,48-3,37 (m, (+/-)-4-(3-хлорофеніл)-2,21h), 2,73 (dd, 1H), 2,3 (dd, 1H), 2,25-2,19 (m, диметилциклопентанон 1H), 1,8 (t, 1H), 1,15 (s, 3H), 1,1 (s, 3H) (+/-)-4-(4-хлор-3-фторофеніл)-2,2(m/z) 239,0 (M-1) диметилциклопентанон (+/-)-4-(4-хлор-2-фторофеніл)-2,2(m/z) 241,0 диметилциклопентанон 7,19 (s, 1H), 7,10 (d, 1H), 6,86 (d, 1H), 3,4(+/-)-4-(3-бром-5-фторофеніл)-2,23,3 (m, 1H), 2,74 (dd, 1H), 2,3 (dd, 1H), 2,25диметилциклопентанон 2,19 (m, 1H), 1,8 (t, 1H), 1,11 (s, 3H), 1,05 (s, 3H) (+/-)-4-(3,4-дифторофеніл)-2,2(m/z) 224,0 диметилциклопентанон (+/-)-4-(4-фторофеніл)-2,2(m/z) 205,0 (M-1) диметилциклопентанон (+/-)-4-(2-хлорофеніл)-2,2(m/z) 223,0 (M+1) диметилциклопентанон 7,25 (d, 1H), 7,15-7,05 (m, 2H), 3,4-3,3 (m, (+/-)4-(3-хлор-4-фторофеніл)-2,21H), 2,74 (dd, 1H), 2,3 (dd, 1H), 2,25-2,19 (m, диметилциклопентанон 1H), 1,8 (t, 1H), 1,11 (s, 3H), 1,05 (s, 3H) (+/-)-2,2-диметил-4(m/z) 189,0 (M+1) фенілциклопентанон 7,51-7,39 (m, 4H), 3,5-3,39 (m, 1H), 2,78 (dd, (+/-)-3-(3,3-Диметил-41H), 2,32 (dd, 1H), 2,29-2,2 (m, 1H), 1,81 (t, оксоциклопентил)бензонітрил 1H), 1,14 (s, 3H), 1,1 (s, 3H) (+/-)-2-фтор-4-(3,3-диметил-4оксоциклопентил)бензонітрил Препаративна методика 26 (+/-)-(2Z)-3-(3,4-дифторофеніл)-2-((диметиламіно)метилен)циклопентанон До (+/-)-3-(3,4-дифторофеніл)циклопентанону (6,9 г, 35 ммоль) додають N, Nдиметилформаміду диметилацеталь (80 мл), і перемішують при температурі 80C протягом ночі. Суміш охолоджують до кімнатної температури і концентрують in vacuo. Залишок очищають із застосуванням флеш-хроматографії на силікагелі з елююванням 2 % розчином метанолу в хлороформі з одержанням неочищеної суміші у вигляді масла жовтого кольору (8,5 г, 96 %). LC/MS (M+H) 234. Сполуки, наведені нижче, одержують по суті як описано для (+/-)-(2Z)-3-(3,4-дифторофеніл)2-((диметиламіно)метилен)циклопентанону. Таблиця 2 12 UA 110829 C2 Препаративна методика 27 28 29 30 31 32 33 34 35 36 37 5 10 15 20 25 ES/MS (мас-спектрометрія з електророзпилюванням) (m/z) (M+1) Хімічна назва (+/-)-(2Z)-3-(4-хлор-3-фторофеніл)-2((диметиламіно)метилен)циклопентанон (+/-)-(2Z)-3-(3,4-дихлорофеніл)-2a ((диметиламіно)метилен)циклопентанон (+/-)-2-хлор-4-[(2Z)-2-(диметиламінометилен)-3b оксоциклопентил]бензонітрил (+/-)-(2Z)-3-(4-трифторометилфеніл)-2((диметиламіно)метилен)циклопентанон (+/-)-3-хлор-4-[(2Z)-2-(диметиламінометилен)-4,4диметил-3-оксоциклопентил]бензонітрил (+/-)-(5Z)-4-(4,5-дифтор-2-метилфеніл)-5(диметиламінометилен)-2,2диметилциклопентанон (+/-)-2-фтор-4-[(2Z)-2-(диметиламінометилен)-4,4диметил-3-оксоциклопентил]бензонітрил (+/-)-(2Z)-3-(4-хлорофеніл)-2c ((диметиламіно)метилен)циклопентанон (+/-)-4-[(2Z)-2-(диметиламінометилен)-3оксоциклопентил]бензонітрил (+/-)-(2Z)-3-(4-фторофеніл)-2((диметиламіно)метилен)циклопентанон (+/-)-4-[(2Z)-2-(диметиламінометилен)-4,4a диметил-3-оксоциклопентил]бензонітрил 268 284 275 303 287 250 241 234 269 a. Потім реакційну суміш концентрують in vacuo, залишок розбавляють етилацетатом і водою. Органічну фазу відокремлюють, а водну фазу тричі екстрагують етилацетатом. Органічні шари об'єднують, промивають розсолом, сушать сульфатом натрію і концентрують in vacuo. Флеш-хроматографія з елююванням спочатку 50 % сумішшю етилацетату і петролейного ефіру, а потім 2 % сумішшю метанол/дихлорометан забезпечує одержання вказаної в заголовку сполуки. b. Така сама обробка, як у (а). Флеш-хроматографія з елююванням спочатку 50 % сумішшю етилацетату і петролейного ефіру, а потім 4 % сумішшю метанол/дихлорометан забезпечує одержання вказаної в заголовку сполуки. с. Реакцію проводять з бутокси-N, N,N',N'-тетраметилметандіаміном у толуолі, із прогріванням реакційної суміші при температурі 60C протягом ночі. Далі обробка, яка описана в (а), і у процесі хроматографування використовують суміш 2 % метанол/дихлорометан. Препаративна методика 38 (+/-)-4-[(2Z)-2-(диметиламінометилен)-4,4-діетил-3-оксоциклопентил]бензонітрил Гексаметилдисилілазид літію (40 мл, 40 ммоль) краплями додають до розчину (+/-)-4-[(2Z)-2(диметиламінометилен)-3-оксоциклопентил]бензонітрилу (0,96 г, 4 ммоль) у безводному тетрагідрофурані (100 мл) при температурі -30C в атмосфері аргону, і перемішують протягом однієї години. При тій самій температурі до згаданої суміші краплями додають йодетан (12,48 г, 80 ммоль), дозволяють реакційній суміші нагрітися до кімнатної температури, і перемішують протягом ночі. Реакцію зупиняють додаванням холодного насиченого розчину хлориду амонію (100 мл). Одержану суміш екстрагують етилацетатом (3100 мл). Об'єднаний органічний шар сушать безводним сульфатом натрію, і концентрують in vacuo з одержанням неочищеного продукту у вигляді твердої речовини чорного кольору (0,99 г, 83,4 %). Цей продукт використовують на наступній стадії без додаткового очищення. ES/MS (m/z) 297 (M+1). Сполуку, наведену нижче, одержують по суті як описано для (+/-)-4-[(2Z)-2(диметиламінометилен)-4,4-діетил-3-оксоциклопентил]бензонітрилу. Таблиця 3 Препаративна методика 39 ES/MS (мас-спектрометрія з електророзпилюванням) (m/z) (M+1) Хімічна назва (+/-)-4-[(2Z)-2-(диметиламінометилен)-4 13 255 UA 110829 C2 Таблиця 3 Препаративна методика ES/MS (мас-спектрометрія з електророзпилюванням) (m/z) (M+1) Хімічна назва метил-3-оксоциклопентил]бензонітрил 5 10 15 Препаративна методика 40 (3S)-3-(3-хлорофеніл)циклопентанон Біс(норборнадієн)родію(I) тетрафтороборат (0,20 г, 0,53 ммоль) і (S)-(-)-2,2'біс(дифенілфосфіно)-1,1'-бінафтил (0,30 г, 0,48 ммоль) розчиняють у 1,4-діоксані (18 мл). Одержаний розчин знегажують азотом протягом 2 год. 3-хлорофенілборонову кислоту (4,95 г, 31,67 ммоль) розчиняють в діоксані (24 мл) і воді (6 мл). Суміш знегажують протягом інших 2 год. Два розчини об'єднують, і перемішують протягом двох годин в потоці азоту. До згаданої реакційної суміші послідовно за допомогою шприца додають 2-циклопентенон (2,0 г, 24,36 ммоль) і триетиламін (2,1 мл, 15,07 ммоль). Одержану реакційну суміш перемішують до завершення реакції в потоці азоту. Реакційну суміш фільтрують через шар діатомової землі, і концентрують in vacuo. Залишок очищають із застосуванням флеш-хроматографії на силікагелі з елююванням сумішшю 20 % етилацетату в гексані з одержанням вказаної в заголовку сполуки 1 (4,23 г, 89,2 %) у вигляді прозорого масла жовтого кольору. H ЯМР (400 МГц, CDCl3) δ 1,9 (1H, M), 2,25 (2H, M), 2,45 (2H, M), 2,65 (1H, M), 3,35 (1H, M), 7,1 (1H, D), 7,25 (3H, M). Сполуки, наведені нижче, одержують по суті як описано для (3S)-3-(3хлорофеніл)циклопентанону. Таблиця 4 Препаративна методика 41 42 43 44 20 25 30 35 1 H ЯМР (400 МГц, CDCl3) δ або масспектрометрія 1,95 (1H, M), 2,25 (2H, M), 2,45 (2H, M), (3S)-3-фенілциклопентанон 2,65 (1H, M), 3,40 (1H, M), 7,20(3H, M), 7,3 (2H, T) 1,9 (1H, M), 2,25 (2H, M), 2,4 (2H, M), (3S)-3-(3-фторофеніл)циклопентанон 2,6 (1H, M), 3,4 (1H, M), 6,9 (2H, M), 7,0 (1H, D), 7,25 (1H, M) 1,9 (1H, M), 2,3 (2H, M), 2,45 (2H, M), (3S)-3-[4-фтор-32,65 (1H, M), 3,4 (1H, M), 7,1 (1H, T), (трифторометил)циклопентанон 7,4 (2H, M) 2-фтор-4-[(1S)-3ES/MS (m/z) 202 (M-1) оксоциклопентил]бензонітрил Хімічна назва Препаративна методика 45 4-(4-Хлор-2-фторфеніл)-2,2-диметилціклопентанон Розчин 5,5-диметилциклопент-2-ен-1-ону (42,0 г, 343,15 ммоль), 4-хлор-2фторофенілборонової кислоти (94,47 г, 514,72 ммоль), ацетату натрію (56,30 г, 686,30 ммоль), оцтової кислоти (1130 мл), Pd(OAc)2 (7,70 г, 34,31 ммоль) і трихлориду сурми (7,83 г, 34,31 ммоль) перемішують при кімнатній температурі протягом 16 год. Розчинник випарюють до невеликого об'єму, і залишок оцтової кислоти видаляють за допомогою толуолу. Додають MTBE (500 мл), і одержаний осад відфільтровують і відкидають. Згаданий розчин МТВЕ промивають водою (500 мл), водним розчином NaHCO 3 (2300 мл), сушать MgSO4, фільтрують, і концентрують досуха. Залишок очищають із застосуванням флеш-хроматографії на силікагелі з елююванням, від гексану до суміші гексану з 10 % MTBE, з одержанням вказаної в заголовку 1 сполуки (72 г, 87 %). H ЯМР (300,16 МГц, CDCl3) δ 7,21-7,06 (m, 3H), 3,67-3,59 (m, 1H), 2,81-2,72 (m, 1H), 2,41-2,31 (m, 1H), 2,21 (ddd, J=12,6 Гц, 6,3 Гц, 2,2 Гц, 1H), 1,89 (t, J=12,3 Гц, 1H), 1,159 (s, 3H), 1,137 (s, 3H). Препаративна методика 46 4-(3,3-Диметил-4-оксоциклопентил)-3-фторбензонітрил Ди-трет-бутил-(2',4',6'-триізопропілбіфеніл-2-іл)фосфін (1,75 г, 4,11 ммоль) додають до розчину 4-(4-хлор-2-фторфеніл)-2,2-диметилціклопентанону (33 г, 137,10 ммоль), ціаніду цинку (9,66 г, 82,26 ммоль) і N-метилпіролідону (148,50 мл) при температурі 125С, і перемішують суміш протягом 15 хв. До згаданого розчину додають димер π-алілпаладія(II) хлориду (0,76 г, 14 UA 110829 C2 5 10 15 20 25 30 35 4,11 ммоль), і перемішують одержану суміш протягом 30 хв. Додають діатомову землю (15 г), і охолоджують суміш до кімнатної температури. Суміш фільтрують через шар діатомової землі, і промивають МТВЕ (450 мл). Додають воду (450 мл), і одержану суміш екстрагують МТВЕ (150 мл). Суміш промивають розсолом, сушать MgSO 4, фільтрують, і концентрують досуха з 1 одержанням вказаної в заголовку сполуки (34 г, 97 %). H ЯМР (300,16 МГц, CDCl3) δ 7,47-7,33 (m, 3H), 3,76-3,63 (m, 1H), 2,83-2,76 (m, 1H), 2,43-2,33 (m, 1H), 2,25 (dd, J=6,3 Гц, 12,6 Гц, 1H), 1,91 (t, J=12,3 Гц, 1H), 1,168 (s, 3H), 1,147 (s, 3H). Препаративна методика 47 1-(п-Толілсульфоніл)-6,7-дигідро-5Н-індазол-4-он і 2-(п-толілсульфоніл)-6,7-дигідро-5Ніндазол-4-он 2,5,6,7-Тетрагідроіндазол-4-он (12,8 г, 91,2 ммоль) додають у дихлорометан (500 мл) і триетиламін (25,4 мл, 182,4 ммоль). Після цього додають п-толуолсульфонілхлорид (17,74 г, 91,2 ммоль), і перемішують одержану суміш протягом 16 год. при кімнатній температурі. Значення рН розчину темного кольору доводять до рН 3 за допомогою 1,0н розчину HCl, і суміш переносять на ділильну лійку. Органічні фази промивають водою, розсолом, сушать сульфатом натрію, фільтрують, і упарюють досуха. Залишок очищають шляхом флеш-хроматографування на силікагелі з елюююванням сумішшю (1:1) гексан/етилацетат з одержанням вказаних в заголовку сполук (9,0 г, 34 %) у вигляді суміші регіоізомеров із співвідношенням 1,5:1. ES/MS m/z 291 (M+H). Препаративна методика 48 4-[4-Гідрокси-1-(п-толілсульфоніл)-6,7-дигідро-5Н-індазол-4-іл]бензонітрил і 4-[4-гідрокси-2(п-толілсульфоніл)-6,7-дигідро-5Н-індазол-4-іл]бензонітрил 4-Йодобензонітріл (6,21 г, 26,84 ммоль) додають у THF (40,0 мл), і охолоджують до температури 0C. Додають ізопропілмагнійхлорид (16,11 мл, 32,1 ммоль), і перемішують при температурі 0 °C в атмосфері азоту протягом 60 хв. Суміш (1,5:1) 1-(п-толілсульфоніл)-6,7дигідро-5Н-індазол-4-ону і 2-(п-толілсульфоніл)-6,7-дигідро-5Н-індазол-4-ону (6,24 г, 21,5 ммоль) розчиняють у THF, і цей розчин краплями додають до аніону при температурі 0С, та потім дозволяють нагріватися до кімнатної температури. Розчин жовтувато-коричневого кольору гасять HCl (3,0 мл, 1н), і концентрують досуха. Залишок очищають хроматографуванням на силікагелі з елююванням сумішшю 60 % гексанів/етилацетат з одержанням вказаних в заголовку сполук. Цю реакцію здійснюють вдруге у такій самій пропорції, і продукти обох синтезів об'єднують з одержанням вказаних в заголовку сполук у вигляді суміші регіоізомеров (8,98 г, 53 %). ES/MS m/z 394 (M+H). Сполуки, наведені нижче, одержують по суті за методом, який описаний для 4-[4-гідрокси-1(п-толілсульфоніл)-6,7-дигідро-5Н-індазол-4-іл]бензонітрилу і 4-[4-гідрокси-2-(п-толілсульфоніл)6,7-дигідро-5Н-індазол-4-іл]бензонітрилу, з використанням відповідного арилгалогеніду. Таблиця 5 Препаративна методика 49 50 51 40 Арилгало-генід Хімічна назва 4-(п-толіл)-1-(п-толілсульфоніл)-6,74дигідро-5H-індазол-4-ол та 4-(п-толіл)-2-(птолілмагнійбромід толілсульфоніл)-6,7-дигідро-5H-індазол-4(2,0 екв.) ол 4-(4-метоксифеніл)-2-(п-толілсульфоніл)p-йодоанізол 6,7-дигідро-5H-індазол-4-ол та 4-(4(2,0 екв.) метоксифеніл)-1-(п-толілсульфоніл)-6,7дигідро-5H-індазол-4-ол 44-(4-хлорофеніл)-1-(п-толілсульфоніл)-6,7хлорофенілмагнійдигідро-5H-індазол-4-ол та 4-(4бромід хлорофеніл)-2-(п-толілсульфоніл)-6,7(2,0 екв.) дигідро-5H-індазол-4-ол ES/MS (m/z) (M+1) 383, 364 (M-18) 399, 381 (M-18) 405, 404 Препаративна методика 52 4-(6,7-Дигідро-2Н-індазол-4-іл)бензонітрил Суміш 4-[4-гідрокси-1-(п-толілсульфоніл)-6,7-дигідро-5Н-індазол-4-іл]бензонітрилу і 4-[4гідрокси-2-(п-толілсульфоніл)-6,7-дигідро-5Н-індазол-4-іл]бензонітрилу (8,56 г, 21,7 ммоль) додають у 4,0 М розчин HCl в діоксані (20,0 мл, 80,0 ммоль), нагрівають до температури 80С 15 UA 110829 C2 5 протягом 2,0 год., і концентрують досуха. Залишок розчиняють в суміші дихлорометан/вода, розділяють шари, і органічні шари сушать Na 2SO4, фільтрують, і упарюють. Залишок очищають шляхом хроматографування на силікагелі з елююванням сумішшю 80 % етилацетату/гексани з одержанням вказаної в заголовку сполуки (3,21 г, 67 %). ES/MS m/z 222 (M+H), 220 (M-H). Сполуки, наведені нижче, одержують по суті за методом, який описаний для 4-(6,7-дигідро2Н-індазол-4-іл)бензонітрилу. Таблиця 6 Препаративна методика 53 54 10 15 20 25 30 35 40 45 50 Хімічна назва ES/MS (m/z) (M+1) 4-(п-толіл)-6,7-дигідро-1H-індазол 4-(4-метоксифеніл)-6,7-дигідро-1H-індазол 211 227 Препаративна методика 55 4-(4-Хлорофеніл)-2-(п-толілсульфоніл)-6,7-дигідроіндазол 4-(4-Хлорофеніл)-2-(п-толілсульфоніл)-6,7-дигідро-5H-індазол-4-ол (0,76 г, 1,89 ммоль) додають у суміш дихлорометану (20,0 мл), триетилсилану (6,04 мл, 37,7 ммоль) і трифтороцтової кислоти (0,16 мл, 2,07 ммоль), і перемішують при кімнатній температурі протягом 2,0 год. Реакційну суміш гасять насиченим розчином NaHCO 3, розділяють, органічні фази промивають розсолом, сушать Na2SO4, фільтрують, і випарюють досуха з одержанням 1 вказаної в заголовку сполуки (0,622 г, 86 %). H ЯМР (CDCl3) δ 2,42 (s, 3H), 2,55 (m, 2H), 2,82 (t, 2H), 5,98 (t, 1H), 7,37-7,31 (m, 6H), 7,81 (s, 1H), 7,87 (d, 2H). Препаративна методика 56 4-(4-Хлорофеніл)-2-(п-толілсульфоніл)-4,5,6,7-тетрагідроіндазол 4-(4-Хлорофеніл)-2-(п-толілсульфоніл)-6,7-дигідроіндазол (0,62 г, 1,89 ммоль) додають у суміш етанолу (20,0 мл) і етилацетату (10 мл). Додають оксид платини(IV) (0,22 г), і 2 перемішують реакційну суміш у атмосфері водню (40) фунтів/дюйм (0,28 МПа)) при кімнатній температурі протягом 6,0 год. Суміш фільтрують через шар діатомової землі, і випарюють при зниженому тиску з одержанням вказаної в заголовку сполуки (0,503 г, 80 %). LC/MS m/z 389 (M+H), Tr=2,704 хв. Препаративна методика 57 1-Тетрагідропіран-2-іл-6,7-дигідро-5Н-індазол-4-он і 2-тетрагідропіран-2-іл-6,7-дигідро-5Ніндазол-4-он 2,5,6,7-Тетрагідроіндазол-4-он (US2009/11180 А1) (5,0 г, 36,7 ммоль) додають до розчину дигідропірану (3,4 г, 40,4 ммоль) у CH2Cl2 (100 мл), обробляють суміш п-толуолсульфоновою кислотою (0,1 г, 0,58 ммоль), і перемішують при кімнатній температурі протягом 3 днів. Додають насичений розчин NaHCO3, і переносять вміст в ділильну лійку. Органічні шари промивають розсолом, сушать Na2SO4, фільтрують, і концентрують досуха. Залишок очищають хроматографією на силікагелі з елююванням CH 2Cl2 з одержанням зазначеної в заголовку 1 сполуки (5,32 г, 66 %) у вигляді суміші регіоізомерів. H ЯМР (300 МГц, CDCl3) δ 8,04 (s, 1H), 7,90 (s, 1H), 5,35-5,32 (m, 1H), 4,11-4,01 (m, 1H), 3,73-3,66 (m, 1H), 2,96-2,91 (m, 1H), 2,87-2,84 (m, 1H), 2,51-2,47 (m, 2H), 2,19-2,02 (m, 4H), 1,72-1,61 (m, 4H). Препаративна методика 58 (1-Тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)трифторометансульфонат і (2тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)трифторометансульфонат 1-Тетрагідропіран-2-іл-6,7-дигідро-5Н-індазол-4-он і 2-тетрагідропіран-2-іл-6,7-дигідро-5Ніндазол-4-он (2,03 г, 9,22 ммоль) додають в THF (100 мл), розчин охолоджують до температури -78С і обробляють LiHMDS (10,14 мл, 10,14 ммоль). Після перемішування протягом 1 год. краплями додають розчин N-фенілбіс(трифторометансульфоніміду) (3,68 г, 10,14 ммоль) у THF (20 мл) при температурі -78С, і витримують з нагріванням до кімнатної температури протягом 17 год. Реакційну суміш гасять насиченим розчином NH4Cl, розбавляють діетиловим ефіром, і промивають органічні шари 0,1н розчином HCl, розсолом, сушать Na 2SO4, фільтрують, і концентрують досуха. Залишок очищають хроматографією на силікагелі з елююванням сумішшю (85:15) гексани/етилацетат з одержанням вказаних в заголовку сполук (2,3 г, 51 %) у вигляді суміші (3:1) регіоізомерів. ES/MS m/z 352 (M+H), 269 (M-THP). Препаративна методика 59 3-Метил-4-(1-тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)бензонітрил або 3-метил-4-(2тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)бензонітрил Суміш (1,0 г, 2,84 ммоль) (1-тетрагідропіран-2-іл-6,7-дигідроіндазол-4 16 UA 110829 C2 5 10 іл)трифторометансульфоната і (2-тетрагідропіран-2-іл-6,7-дигідроіндазол-4іл)трифторометансульфоната, і (4-ціано-2-метилфеніл)боронову кислоту (0,502 г, 3,12 ммоль) додають у суміш діоксану (80,0 мл) і Na2CO3 (0,601 мг, 5,68 ммоль, 2,0 М), і знегажують потоком азоту. Згаданий розчин обробляють тетракіс(трифенілфосфін) паладієм (0,33 г, 0,28 ммоль), і нагрівають до температури 80С в атмосфері азоту протягом 17 год. Суміш охолоджують до температури навколишнього середовища, і фільтрують через шар діатомової землі. Фільтрат розбавляють етилацетатом, і розділяють шари. Органічні шари промивають насиченим розчином NaHCO3, розсолом, сушать Na2SO4, фільтрують, і концентрують досуха. Залишок очищають хроматографією на силікагелі з елююванням сумішшю від (9:1) гексани/етилацетат до (4:1) гексани/етилацетат з одержанням однієї з вказаних в заголовку сполук (0,492 г, 55 %) у вигляді одного регіоізомеру. ES/MS m/z 320 (M+H), 236 (M-THP). Сполуки, наведені нижче, одержують по суті за методом, який описаний для 3-метил-4-(1тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)бензонітрилу або 3-метил-4-(2-тетрагідропіран-2-іл6,7-дигідроіндазол-4-іл)бензонітрилу із застосуванням відповідної боронової кислоти. 15 Таблиця 7 Препаративна методика 60 20 25 Боронова кислота (4-ціано-3метоксифеніл)боронова кислота Хімічна назва 2-метокси-4-(1-тетрагідропіран-2-іл-6,7дигідроіндазол-4-іл)бензонітрил або 2метокси-4-(2-тетрагідропіран-2-іл-6,7дигідроіндазол-4-іл)бензонітрил ES/MS (m/z) (M+1) 336 Препаративна методика 61 3-Метил-4-(1-тетрагідропіран-2-іл-4,5,6,7-тетрагідроіндазол-4-іл)бензонітрил або 3-метил-4(2-тетрагідропіран-2-іл-4,5,6,7-тетрагідроіндазол-4-іл)бензонітрил 3-Метил-4-(1-тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)бензонітрил або 3-метил-4-(2тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)бензонітрил (0,492 г, 1,54 ммоль) та 5 % Pd/C (мас. %) (0,15 г) додають до EtOH (20,0 мл), і перемішують суміш перемішують в атмосфері 2 водню (45-35 фунтів/дюйм (0,31-0,24 МПа)) протягом 72 год. Суміш фільтрують через шар діатомової землі, і концентрують досуха. Залишок очищають хроматографією на силікагелі з елююванням сумішшю (7:3) гексани/етилацетат з одержанням однієї з вказаних в заголовку сполук (0,162 г, 33 %) у вигляді одного регіоізомеру. ES/MS m/z 322 (M+H). Сполуку, наведену нижче, одержують по суті за методом, який описаний для 3-метил-4-(1тетрагідропіран-2-іл-4,5,6,7-тетрагідроіндазол-4-іл)бензонітрилу або 3-метил-4-(2тетрагідропіран-2-іл-4,5,6,7-тетрагідроіндазол-4-іл)бензонітрилу. 30 Таблиця 8 Препаративна методика 62 35 40 45 Хімічна назва 2-метокси-4-(1-тетрагідропіран-2-іл-4,5,6,7-тетрагідроіндазол4-іл)бензонітрил або 2-метокси-4-(2-тетрагідропіран-2-іл4,5,6,7-тетрагідроіндазол-4-іл)бензонітрил ES/MS (m/z) (M+1) 338 Препаративна методика 63 2-Фтор-4-(1-тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)бензонітрил і 2-фтор-4-(2тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)бензонітрил Суміш (0,201 г, 0,57 ммоль) (1-тетрагідропіран-2-іл-6,7-дигідроіндазол-4іл)трифторометансульфонату і (2-тетрагідропіран-2-іл-6,7-дигідроіндазол-4іл)трифторометансульфонату, а також (4-ціано-3-фторофеніл)боронову кислоту (0,103 г, 0,63 ммоль) додають у діоксан (7,0 мл) і Na2CO3 (0,12 мг, 1,14 ммоль, 2,0 М), і знегажують суміш потоком азоту. Розчин обробляють тетракіс(трифенілфосфін)паладієм (0,07 г, 0,06 ммоль), і нагрівають до температури 80С в атмосфері азоту протягом 6 год., і крім того витримують протягом 72 год. при кімнатній температурі. Реакційну суміш гасять водою, розбавляють етилацетатом, органічний шар відокремлюють, промивають насиченим розчином NaHCO 3, розсолом, сушать Na2SO4, фільтрують, і концентрують досуха. Залишок використовують у подальшій реакції без додаткового очищення (0,231 г, 125 %). Препаративна методика 64 17 UA 110829 C2 5 10 15 20 25 30 35 40 45 50 4-(6,7-Дигідро-1Н-індазол-4-іл)-2-фторбензонітрил Суміш (0,23 г, 0,71 ммоль) 2-фтор-4-(1-тетрагідропіран-2-іл-6,7-дигідроіндазол-4іл)бензонітрилу і 2-фтор-4-(2-тетрагідропіран-2-іл-6,7-дигідроіндазол-4-іл)бензонітрилу і H2SO4 (0,08 мл, 1,43 ммоль) додають у CH3CN (5,0 мл), і перемішують розчин при кімнатній температурі протягом 6,0 год. Водний розчин Na2CO3 додають для підлуговування реакційної суміші, яку потім розбавляють етилацетатом, шари розділяють, і водний шар піддають зворотному екстрагуванню етилацетатом (3). Органічні шари об'єднують, сушать Na2SO4, фільтрують, і концентрують досуха. Залишок очищають флеш-хроматографією на силікагелі з елююванням сумішшю (99:1) CH2Cl2/MeOH з одержанням вказаної в заголовку сполуки (0,102 г, 60 %). ES/MS m/z 240 (M+H). Препаративна методика 65 (+/-)-(транс)-4-(4-метил-3-оксоциклогексил)бензонітрил і Препаративна методика 66 (+/-)-(цис)-4-(4-метил-3-оксоциклогексил)бензонітрил Біс(1,5-циклооктадієнродію хлорид) (0,06 г, 0,12 ммоль), рацемічний 2,2'біс(дифенілфосфіно)-1,1'-бінафтил (0,18 г, 0,29 ммоль) додають у тетрагідрофуран (40 мл), і в атмосфері азоту перемішують одержану суміш протягом 30 хв. Цей розчин додають до суміші 4ціанофенілборонової кислоти (2,31 г, 15,69 ммоль), 6-метилциклогекс-2-ен-1-ону (Journal of Organic Chemistry, 1980 45(10), 1852-1863) (1,28 г, 11,62 ммоль), карбонату калію (2,19 г, 15,69 ммоль) та ізопропілового спирту (1,1 мл) при температурі 60С. Згадану суміш перемішують при температурі 60C протягом 16 год., і потім концентрують досуха. Неочищену суміш виливають у воду (10 мл), і екстрагують етилацетатом (220 мл). Органічні екстракти сушать MgSO4, фільтрують через силікагель, і концентрують досуха. Залишок очищають за допомогою флешхроматографії на силікагелі з елююванням сумішшю 20 % EtOAc/гексан з одержанням (транс)-4(4-метил-3-оксоциклогексил)бензонітрилу (0,55 г, 22 %) у вигляді першого елюйованого ізомеру і (цис)-4-(4-метил-3-оксоциклогексил)бензонітрилу (0,55 г, 22 %) у вигляді другого елюйованого ізомеру. ES/MS m/z 214 (М+Н). Препаративна методика 67 (+/-)-(цис/транс)-4-[7-метил-4,5,6,7-тетрагідро-2H-індазол-4-іл]бензонітрил (цис)-4-(4-Метил-3-оксоциклогексил)бензонітрил (0,55 г, 2,58 ммоль) додають у суміш толуолу (10,0 мл) і трет-бутоксибіс(диметиламіно)метану (0,67 мл, 3,22 ммоль), і перемішують при температурі 120C протягом 16 год. Згадану суміш охолоджують до кімнатної температури і концентрують in vacuo. Залишок додають у суміш MeOH (10,0 мл) і гідразину (0,07 мл, 2,32 ммоль), і перемішують при температурі 80С протягом 1,0 год. Суміш охолоджують до кімнатної температури, і концентрують in vacuo. Залишок очищають за допомогою хроматографії на силікагелі (35 %-55 % EtOAc/гексани) з одержанням (+/-)-(цис/транс)-4-[7-метил-4,5,6,7тетрагідро-2H-індазол-4-іл]бензонітрилу (0,360 г, 58 %). ES/MS m/z 238 (М+Н). Препаративна методика 68 (+/-)-4-(4,4-диметил-3-оксоциклогексил)-3-метилбензонітрил 4-Ціано-2-метилфенілборонову кислоту (0,81 г, 5 ммоль), 6,6-диметилциклогекс-2-енон (Canadian Journal of Chemistry, 1981, 59, 2096-2115) (0,55 г, 5 ммоль), SbCl3 (0,11 г, 0,5 ммоль), ацетат натрію (0,82 г, 10 ммоль) і ацетат паладію (0,11 г, 0,5 ммоль) додають в атмосфері аргону в оцтову кислоту (30 мл). Згадану реакційну суміш перемішують при кімнатній температурі протягом трьох днів. Суміш фільтрують, і фільтрат виливають у воду (150 мл). Органічну фазу відокремлюють, і екстрагують водну фазу етилацетатом (3100 мл). Об'єднані органічні шари промивають насиченим розчином бікарбонату натрію (3100 мл), розсолом (350 мл), сушать безводним сульфатом натрію, і концентрують in vacuo. Залишок очищають із застосуванням колонкової хроматографії на силікагелі з елююванням сумішшю петролейний ефір:етилацетат=10:1 з одержанням вказаної в заголовку сполуки у вигляді твердої речовини світло-жовтого кольору (0,6 г, 50 %). GC/MS 241 (М+1). Сполуки, наведені нижче, одержують по суті за методом, який описаний для (+/-)-4-(4,4диметил-3-оксоциклогексил)-3-метилбензонітрилу. 55 Таблиця 9 Препаративна методика 69 Хімічна назва (+/-)-4-(4,4-диметил-3-оксоциклогексил)-3-фторобензонітрил 18 GC/MS (m/z) (M+1) 245 UA 110829 C2 Таблиця 9 Препаративна методика 70 Хімічна назва GC/MS (m/z) (M+1) (+/-)-4-(4,4-диметил-3-оксоциклогексил)-2-фторобензонітрил a 1 5 10 15 20 25 30 a. H ЯМР (300 МГц, CDCl3) δ 7,60-7,56 (m, 1H), 7,14-7,07(m, 2H), 3,08-3,00 (m, 1H),2,73-2,67 (m, 1H), 2,51-2,46 (m, 1H), 2,03-1,60 (m, 4H), 1,25 (s, 3H), 1,12 (s, 3H). Препаративна методика 71 (+/-)-4-(4-Метоксифеніл)-4,5,6,7- тетрагідро-1H- індазол 4-(4-Метоксифеніл)-6,7-дигідро-1Н-індазол (0,141 г, 0,62 ммоль) розчиняють в суміші EtOH (10 мл) і THF (4 мл), і додають 5 % Pd/C (0,090 г). Одержану суміш перемішують в атмосфері 2 водню (40 фунтів/дюйм (0,275 МПа)) протягом 4 год. Суміш фільтрують через діатомову землю, і упарюють фільтрат досуха. Залишок очищають хроматографією на силікагелі з елююванням сумішшю (98:2) CH2Cl2:МеОН з одержанням вказаної в заголовку сполуки (0,121 г, 85 %). ES/MS m/z 229 (М+1). Приклад 1 4-[(4R)-(6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)]бензонітрил Суміш DMF-DMA (46,26 г, 388,22 ммоль) додають до (+/-)-4-(3,3-диметил-4оксоциклопентил)бензонітрилу (46 г, 213,52 ммоль), і перемішують одержану суміш при температурі 100С протягом 16 год. Надлишок DMF-DMA видаляють під вакуумом. Додають ізопропіловий спирт (248 мл), після чого додають моногідрат гідразину (10,69 г, 324,61 ммоль) і оцтову кислоту (11,12 мл). Згадану суміш нагрівають при температурі 80C протягом 12 год. Суміш охолоджують до температури навколишнього середовища, і випарюють розчинник досуха. Додають воду (50 мл), і екстрагують DCM (350 мл) одержану суміш. Органічні екстракти сушать MgSO4, фільтрують, і концентрують досуха. Залишок очищають із застосуванням флеш-хроматографії на силікагелі з елююванням сумішшю (1:1) гексанетилацетат. Суміш енантіомерів очищають із застосуванням хіральної РХВЕ Chiralpak AD з використанням 40 % IPA/60 % н-гексану (2 % DMEA), колонка розміром 20 мкм, 825 см, швидкість потоку 300 мл/хв, УФ-детектування при 254 нм і завантаження 5 г/5 хв. (R)-енантіомер (ізомер 1) одержують шляхом збору фракції, елюйованої через 5,53 хв. Згаданий (R)-енантіомер додатково очищають за допомогою флеш-хроматографії на силікагелі з елююванням сумішшю (4:1) гексан-ацетон з одержанням вказаної в заголовку сполуки (9,2 г, 38,77 ммоль) у вигляді твердої речовини жовтого кольору. ES/MS (m/z) 238(M+1), 1 H ЯМР (300,16 МГц, CDCl3) δ 7,60-7,58 (m, 2H), 7,36 (d, J=8,2 Гц, 2H), 7,17 (s, 1H), 4,36 (t, J=8,0 Гц, 1H), 2,74 (dd, J=7,7 Гц, 12,6 Гц, 1H), 2,23-2,16 (m, 1H), 1,40 (s, 3H), 1,35 (s, 3H). Приклад 1a 4-[(4R)-6,6-диметил-4,5-дигідро-1H-циклопента[c]піразол-4-іл]бензонітрила напівгідрат 1/2 H2O 35 19 UA 110829 C2 5 10 15 20 25 30 4-[(4R)-(6,6-Диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)]бензонітрил (45 мг, 0,190 ммоль) суспендують у воді (1 мл), і одержану суспензію перемішують при температурі навколишнього середовища протягом 1 год. Тверді речовини відфільтровують під вакуумом, і сушать повітрям з одержанням вказаної в заголовку сполуки (35 мг, 76 %). Порошкова рентгенографія Порошкові рентгенограми (XRD) кристалічних твердих речовин одержують із застосуванням порошкового рентгенівського дифрактометру Bruker D4 Endeavor, спорядженого джерелом CuKα (λ=1,54060 Å), і детектором Vantec, що працює при 35 кВ і 50 мА, Зразок сканують у межах від 4 2θ до 40 2θ з величиною кроку, що дорівнює 0,0087° 2θ, при швидкості сканування 0,5 с/крок, з 0,6 мм розходженням, фіксованим рівнем антирозсіювання 5,28 мм та 9,5 мм діафрагмами детектору. Сухим порошком наповнюють кварцовий тримач зразку; гладку поверхню одержують із застосуванням предметного скла. З кристалографії добре відомо, що, для будь-якої даної кристалічної форми, відносна інтенсивність дифракційних піків може змінюватись через переважну орієнтацію, яка є наслідком впливу факторів, таких як морфологія і форма кристалу. У разі присутності впливу переважної орієнтації, інтенсивність піків змінюється, однак характеристичні позиції піків поліморфних модифікацій залишаються незмінними. Дивись, наприклад, The U. S. Pharmacopeia 33-National Formulary 28 Chapter Characterization of Crystalline Solids by X-ray Powder Diffraction (XRPD) Official October 1, 2010February 1, 2011. Окрім того, з кристалографії також добре відомо, що для будь-якої даної кристалічної форми кутові положення піків можуть дещо змінюватись. Наприклад, положення піків можуть зсуватись через зміни температури або вологості, при яких аналізується зразок, зміщення зразку або наявності чи відсутності внутрішнього стандарту. У даному разі, змінність положення піків 0,2 2θ буде враховувати потенційні зміни без перешкоджання однозначній ідентифікації згаданої кристалічної форми. Підтвердження кристалічної форми може бути здійснено на основі будь-якої унікальної комбінації характерних піків (в градусах 2θ), зазвичай тих, піків які виступають більш ніж інші. Порошкові рентгенограми кристалічної форми, зібрані при температурі і відносній вологості навколишнього середовища, коригуються на основі стандартних піків NIST 675 при 8,85 і 26,77 градуси 2-тета. Одержаний зразок цільової сполуки характеризується порошковою рентгенограмою з використанням джерела випромінювання CuKα як такий, що має піки дифракції (значення 2тета), описані у наведеній нижче Таблиці. Зокрема, рентгенограма має пік при 23,75 у поєднанні з одним або декількома піками, вибраними з групи, яку складають 12,19, 15,53, 17,23, 17,78 і 20,61 з допуском на кути дифракції 0,2°. Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Кут (2-тета°) 6,06 12,19 15,53 15,77 17,23 17,78 18,31 19,00 20,61 21,62 22,31 23,75 24,55 25,01 26,09 26,41 27,96 Інтенсивність (%) 25 65 71 33 58 95 20 24 98 26 45 100 19 21 27 44 43 35 Приклад 1b 4-[(4R)-6,6-диметил-4,5-дигідро-1H-циклопента[c]піроазол-4-іл]бензонітрил кислоти 20 фосфорної UA 110829 C2 5 10 15 4-[(4R)-(6,6-Диметил-4,5-дигідро-1Н-циклопента[с]піразол-4-іл)]бензонітрил (445 мг) розчиняють в ізопропілацетаті (1 мл). До цієї суміші краплями додають 15 М розчин фосфорної кислоти (150 мкл, 1,2 екв.). Спостерігається локалізована швидка кристалізація, і шляхом нетривалої обробки ультразвуком розчину в водяній бані осаджують велику масу твердої речовини яскраво-білого кольору. Цю масу розбивають доданням ізопропілацетату (3 мл) з одержанням рихлої суспензії. Тверді речовини після цього піддають вакуумній фільтрації, і сушать повітрям з одержанням вказаної в заголовку сполуки (585 мг, 93 %). Порошкова рентгенографія Порошкові рентгенограми (XRD) кристалічних твердих речовин одержують, як описано в прикладі 1а. Вказана в заголовку сполука характеризується порошковою рентгенограмою з використанням джерела випромінювання CuKα як така, що має піки дифракції (значення 2-тета), описані у наведеній нижче Таблиці. Зокрема, рентгенограма має пік при 5,56 у поєднанні з одним або декількома піками, вибраними з групи, яку складають 12,69, 16,97, 18,25, 19,39 і 22,92 з допуском на кути дифракції 0,2°. Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 20 25 Кут (2-тета°) 5,564 11,016 12,685 14,711 16,967 18,248 18,900 19,390 21,291 22,920 24,539 24,772 25,041 Інтенсивність (%) 100 5 8 3 23 10 4 16 6 13 7 7 5 Приклад 2 4-[(4S)-6,6-диметил-4,5-дигідро-1H-циклопента[c]піразол-4-іл]бензонітрил Сполуку Прикладу 2 одержують по суті за методом, який описаний для Прикладу 1, збираючи фракцію, що елююється через 10,25 хв. Зібрану фракцію додатково очищають хроматографією на силікагелі з 80 % гексану і 20 % ацетону з одержанням вказаної в заголовку сполуки (2 г). Приклад 3 21 UA 110829 C2 (+/-)-4-(4-Хлорофеніл)-6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразол 5 10 (+/-)-4-(4-Хлорофеніл)-2,2-диметилциклопентанон (0,250 г, 1,12 ммоль) розчиняють в ізопропанолі (5 мл) і перемішують. До згаданої реакційної суміші краплями додають третбутоксибіс(диметиламіно)метан (0,33 мл, 1,57 ммоль). Реакційну суміш нагрівають у герметично закритій посудині при температурі 100С протягом 12 год., охолоджують до кімнатної температури, і концентрують досуха. Залишок розбавляють ізопропанолом (5 мл). До реакційної суміші додають гідрат гідразину (0,11 мл, 2,25 ммоль), і нагрівають до температури 100С в герметично закритій посудині протягом 5 год. Реакційну суміш концентрують in vacuo. Залишок очищають за допомогою флеш-хроматографії на силікагелі з елююванням сумішшю 20 % етилацетату в гексані з одержанням вказаної в заголовку сполуки (0,035 г, 13 %) у вигляді плівки жовтого кольору. ES/MS (m/z) 247,0 (M+1). Сполуки Прикладів, наведених нижче, одержують по суті як описано для (+/-)-4-(4хлорофеніл)-6,6-диметил-4,5-дигідро-1Н-циклопента[с]піразолу. 15 Таблиця 10 Приклад № Хімічна назва Структура ES/MS (m/z) (M+H) 4 (+/-)-4-(3-хлорофеніл)-6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол 247 5 (+/-)-4-(4-хлор-3-фторофеніл)-6,6-диметил1,4,5,6-тетрагідроциклопента[c]піразол 265 6 (+/-)-4-(4-хлор-2-фторофеніл)-6,6-диметил1,4,5,6-тетрагідроциклопента[c]піразол 265 22 UA 110829 C2 7 (+/-)-4-(3-бром-5-фторофеніл)-6,6-диметил1,4,5,6-тетрагідроциклопента[c]піразол 309 8 (+/-)-4-(3,4-дифторофеніл)-6,6-диметил1,4,5,6-тетрагідроциклопента[c]піразол 249 9 (+/-)-4-(4-фторофеніл)-6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол 231 10 (+/-)-4-(2-хлорофеніл)-6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол 247 11 (+/-)-4-(3-хлор-4-фторофеніл)-2,2-диметил1,4,5,6-тетрагідроциклопента[c]піразол 12 (+/-)-6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол 265 213 23 UA 110829 C2 13 (+/-)-3-(6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол)-бензонітрил 238 Приклад 14 (+/-)-4-(3,4-Дифторофеніл)-1,4,5,6-тетрагідроціклопента[с]піразол 5 10 15 До суміші (+/-)-(2Z)-3-(3,4-дифторофеніл)-2-((диметиламіно)метилен)циклопентанону (8,5 г, 34 ммоль) в етанолі (200 мл) додають гідрат гідразину (15 мл), і нагрівають суміш до температури 80C протягом ночі. Згадану суміш охолоджують до кімнатної температури, і концентрують in vacuo. Залишок очищають за допомогою препаративної РХВЕ із застосуванням системи CXTH з колонкою DAISO 10 μC18 25050 мм, з 9 мл впорскуванням, зі швидкістю потоку 70 мл/хв, довжиною хвилі 214 нм і рухомою фазою, що являє собою розчин 10-80 % ацетонітрилу в суміші 0,1 % TFA/H2O, з одержанням вказаної в заголовку сполуки у вигляді твердої речовини білого кольору (2,1 г, 28 %). ES/MS m/z 221 (М+Н). Сполуки наведених нижче Прикладів одержують по суті як описано для (+/-)-4-(3,4дифторофеніл)-1,4,5,6-тетрагідроціклопента[с]піразолу. Table 11 Приклад № 15 16 Хімічна назва Структура (+/-)-4-(4-хлор-3-фторофеніл)-1,4,5,6тетрагідроциклопента[c]піразол (+/-)-4-(3,4-дихлорофеніл)-1,4,5,6тетрагідроциклопента[c]піразолу a гідрохлорид 24 ES/MS (m/z) (M+1) 237 254 HCl UA 110829 C2 Приклад № Хімічна назва Структура ES/MS (m/z) (M+1) HCl 17 18 (+/-)-2-хлор-4-(1,4,5,6тетрагідроциклопента[c]піразол-4a іл)бензонітрилу гідрохлорид 244 (+/-)-4-(4-трифторометилфеніл)-1,4,5,6тетрагідроциклопента[c]піразол 253 19 (+/-)-3-хлор-4-(6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол-4b іл)бензонітрил 272 20 (+/-)-4-(4,5-дифторо-2-метилфеніл)-6,6диметил-1,4,5,6c тетрагідроциклопента[c]піразол 263 21 (+/-)-4-(6,6-діетил-1,4,5,6тетрагідроциклопента[c]піразол-4a, c іл)бензонітрилу гідрохлорид 25 HCl 266 UA 110829 C2 Приклад № Хімічна назва Структура 22 (+/-)-4-(6-метил-1,4,5,6тетрагідроциклопента[c]піразол-4a, c іл)бензонітрилу гідрохлорид 23 (+/-)-2-фтор-4-(6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол-4a іл)бензонітрилу гідрохлорид 24 (+/-)-4-(4-хлорофеніл)-1,4,5,6тетрагідроциклопента[c]піразол HCl HCl ES/MS (m/z) (M+1) 224 256 219 25 210,2 26 5 (+/-)-4-(1,4,5,6тетрагідроциклопента[c]піразол-4іл)бензонітрил (+/-)-4-(4-фторофеніл)-1,4,5,6c тетрагідроциклопента[c]піразол 203,2 a. Після завершення реакції і концентрування in vacuo, залишок розбавляють насиченим розчином бікарбонату натрію, і екстрагують етилацетатом (3). Органічні шари об'єднують, промивають розсолом, сушать сульфатом натрію, і концентрують in vacuo. Одержаний матеріал очищають із застосуванням хроматографії на силікагелі з елююванням сумішшю (2:1) петролейний ефір:етилацетат. Після цього неочищений продукт піддають описаній вище 26 UA 110829 C2 5 10 15 препаративній РХВЕ, і підкисляють розчином HCl в етилацетаті з одержанням вказаної в заголовку сполуки у вигляді твердої речовини білого кольору. b. Застосовують каталітичну кількість оцтової кислоти. Реакцію проводять при кімнатній температурі протягом дванадцяти годин. с. Замість гідрата гідразину використовують гідрохлорид гідразину. Приклад 27 4-(3,4-Дифторофеніл)-1,4,5,6-тетрагідроциклопента[с]піразол, ізомер 1 Рацемічний продукт піддають хіральній хроматографії із застосуванням колонки Chiralcel OJ-H 4,6150 мм з 20 % 3А EtOH:80 % CO2, швидкістю потоку 5,0 мл/хв з УФ-детектуванням при 230 нм, з одержанням чистого енантіомеру, ізомеру 1. Цей продукт у подальшому знову очищають за допомогою хроматографії на силікагелі з елююванням ступінчастим градієнтом від 25 % до 50 % етилацетат/толуол з одержанням вказаної в заголовку сполуки (0,121 г, 6,1 %). ES/MS (m/z) 221,2 (M+1). Сполуки наведених нижче Прикладів одержують по суті як описано для 4-(3,4дифторофеніл)-1,4,5,6-тетрагідроциклопента[с]піразолу, ізомер 1. Таблиця 12 Приклад № Хімічна назва Структура 28 4-(4-фторофеніл)-1,4,5,6тетрагідроциклопента[c]піразол, a ізомер 1 203,2 29 4-(4-хлор-3-фторофеніл)-1,4,5,6тетрагідроциклопента[c]піразол, b ізомер 1 237,2 30 4-(3,4-хлор-3-фторофеніл)-1,4,5,6тетрагідроциклопента[c]піразол, b ізомер 2 237,2 27 ES/MS (m/z) (M+1) UA 110829 C2 Таблиця 12 Приклад № Хімічна назва 31 2-фтор-4-(6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол-4c іл)бензонітрил, ізомер 1 32 Структура 4-(4-хлорофеніл)-1,4,5,6тетрагідроциклопента[c]піразол, d ізомер 1 ES/MS (m/z) (M+1) 256 219 33 4-(1,4,5,6тетрагідроциклопента[c]піразол-4e іл)бензонітрил, ізомер 1 210 34 4-(4-хлорофеніл)-6,6-диметил-4,5дигідро-1H-циклопента[c]піразол, f ізомер 1 247 35 4-(3-хлорофеніл)-6,6-диметил-1,4,5,6тетрагідроциклопента[c]піразол, g ізомер 1 28 247
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazole derivatives useful as aldosterone synthase inhibitors
Автори англійськоюBell, Michael Gregory, Hoogestraat, Paul, J., Mabry, Thomas Edward, Shen, Quanrong, Escribano, Ana Maria
Автори російськоюБелл Майкл Грегори, Хогестрат Паул Й., Мебри Томас Эдвард, Шень Гуаньжон, Эскрибано Ана Мария
МПК / Мітки
МПК: A61K 31/416, C07D 231/54, A61P 9/00, A61P 5/00, C07D 231/56, A61P 13/00
Мітки: придатні, піразолу, похідні, альдостеронсинтази, інгібітори
Код посилання
<a href="https://ua.patents.su/47-110829-pokhidni-pirazolu-pridatni-yak-ingibitori-aldosteronsintazi.html" target="_blank" rel="follow" title="База патентів України">Похідні піразолу, придатні як інгібітори альдостеронсинтази</a>
Попередній патент: Плоский ключ для циліндра замка й циліндр замка
Наступний патент: Пристрій і спосіб виготовлення вафельних блоків
Випадковий патент: В'яжуче












