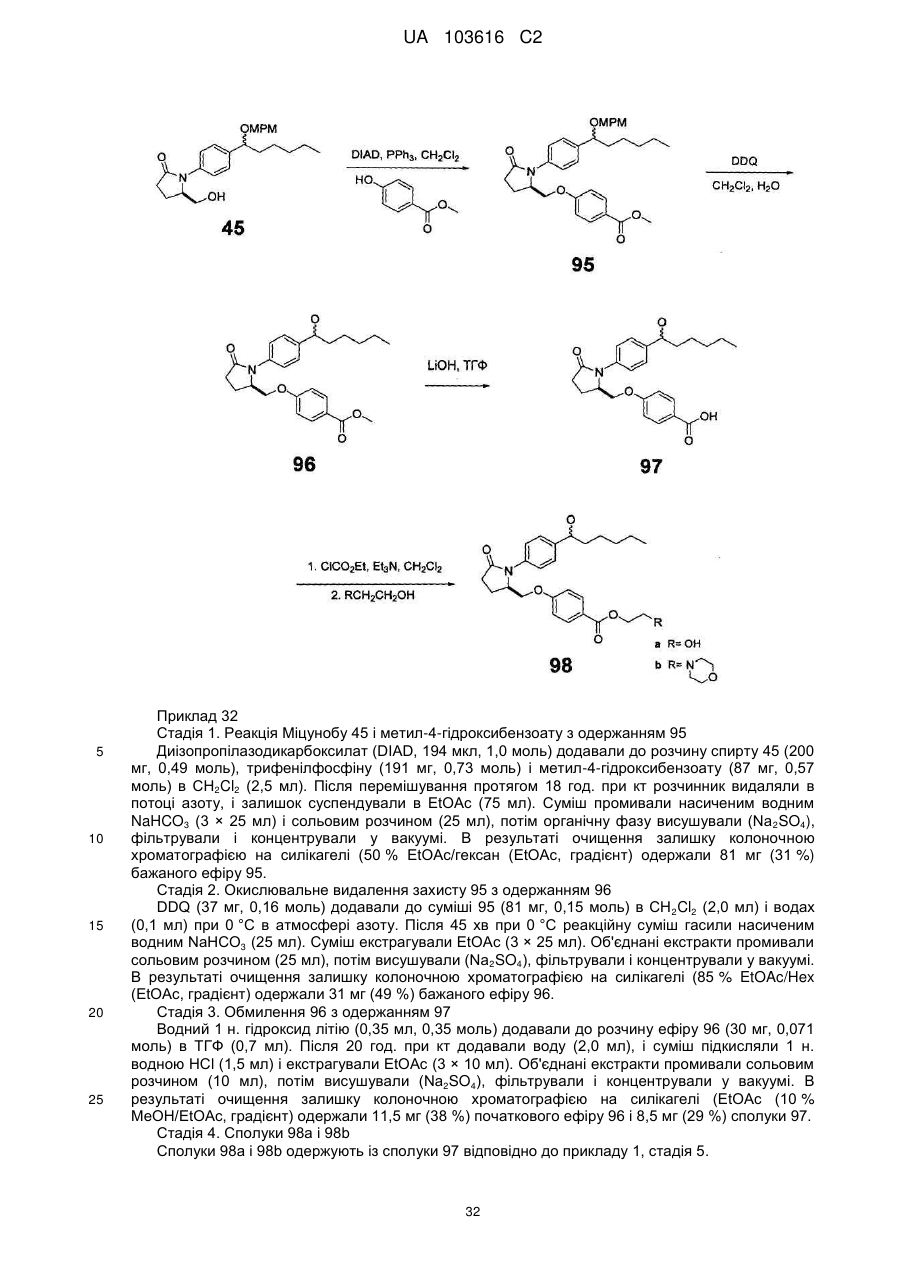
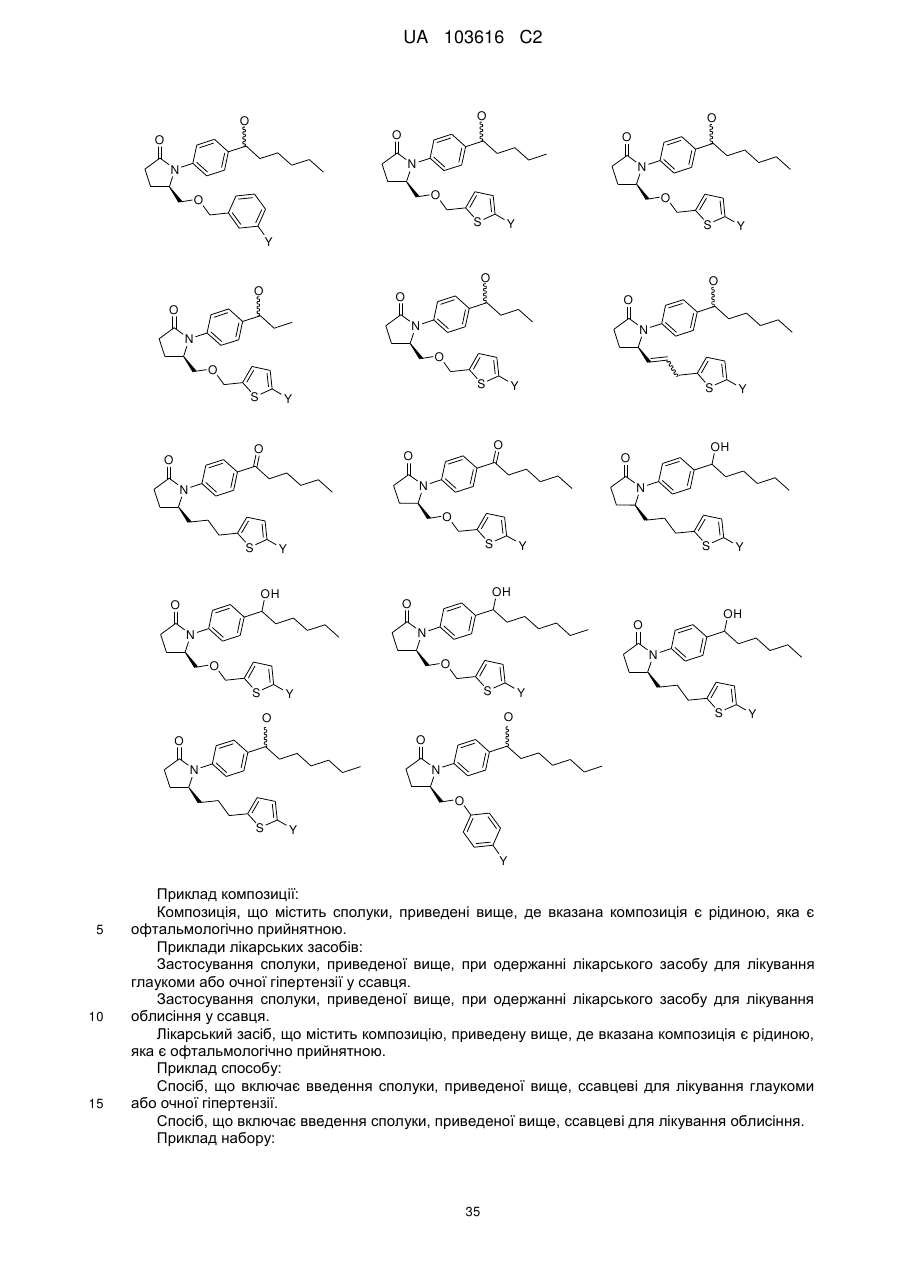
Заміщені гамма-лактами як терапевтичні агенти
Формула / Реферат
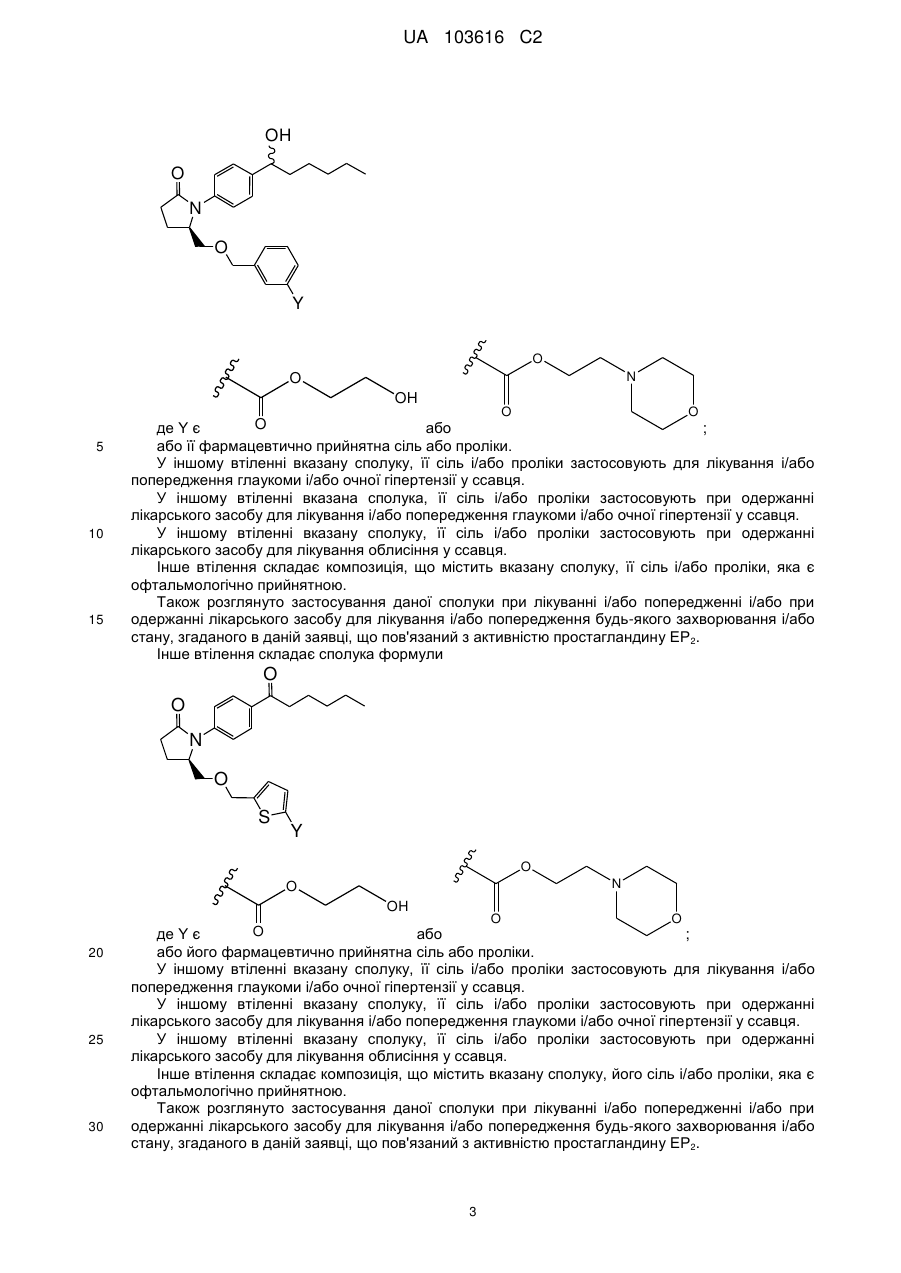
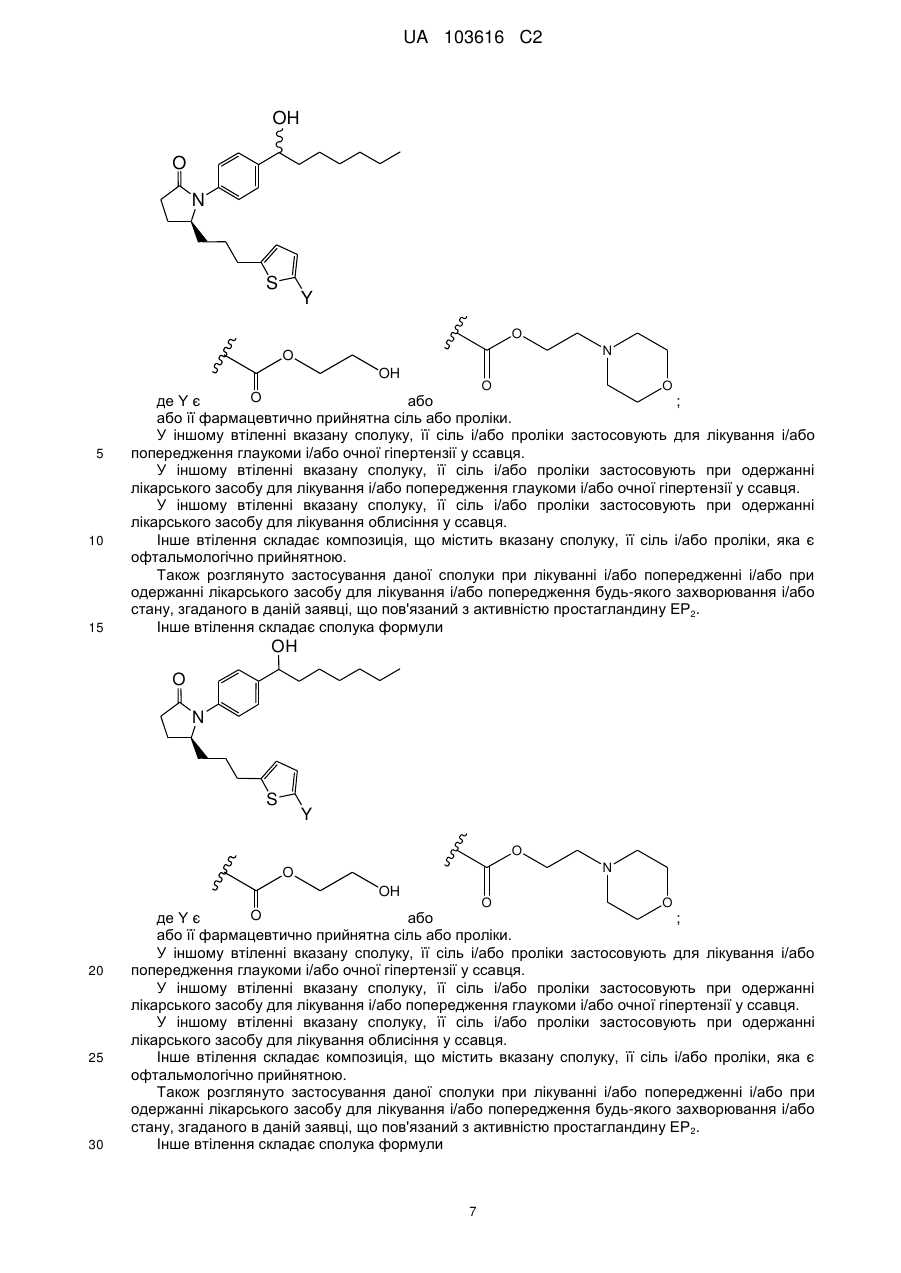
1. Сполука формули, вибрана з
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
,  ,
,
 ,
, 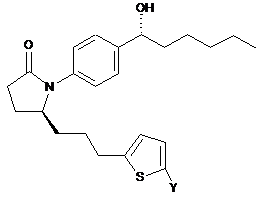 ,
,
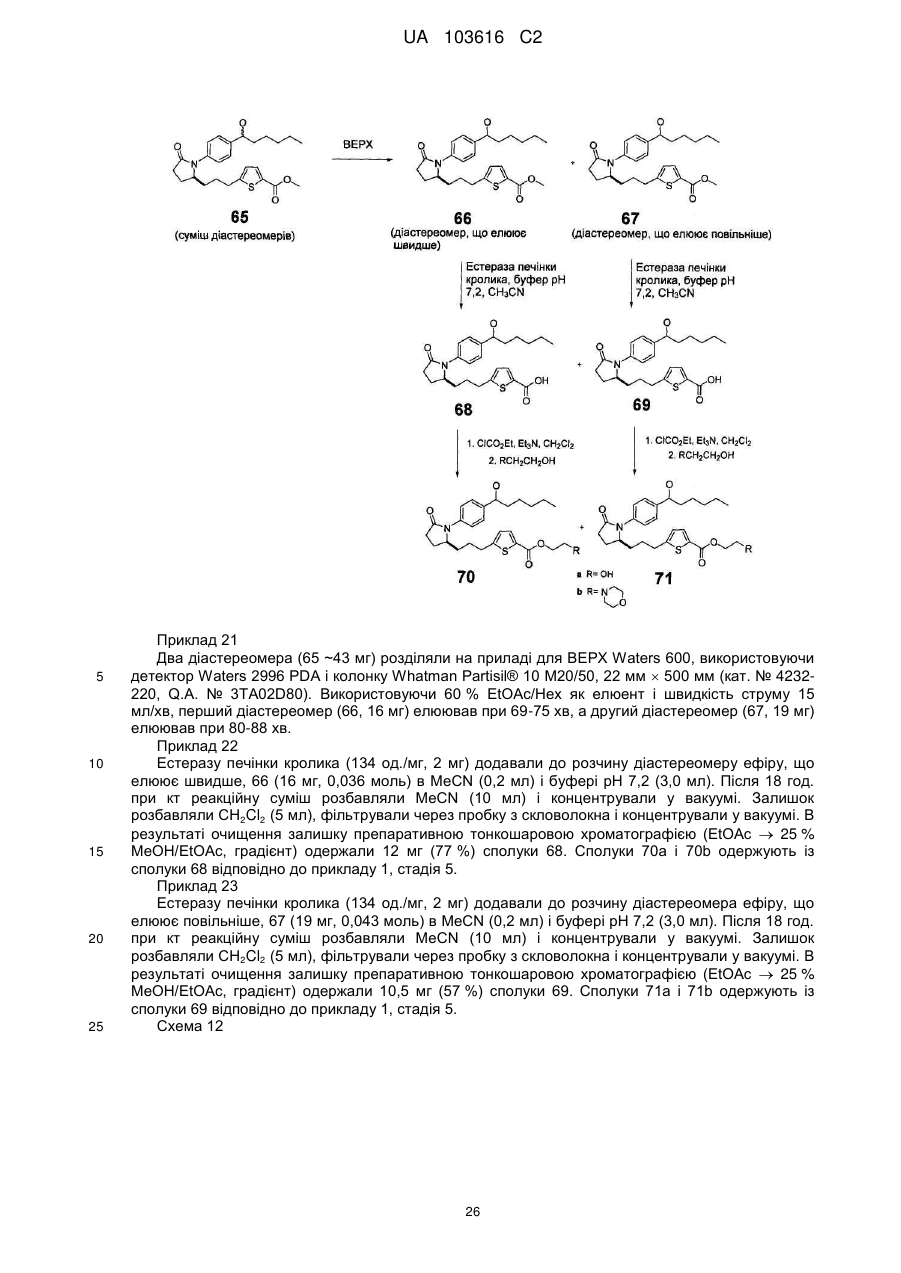
 ,
,  ,
,
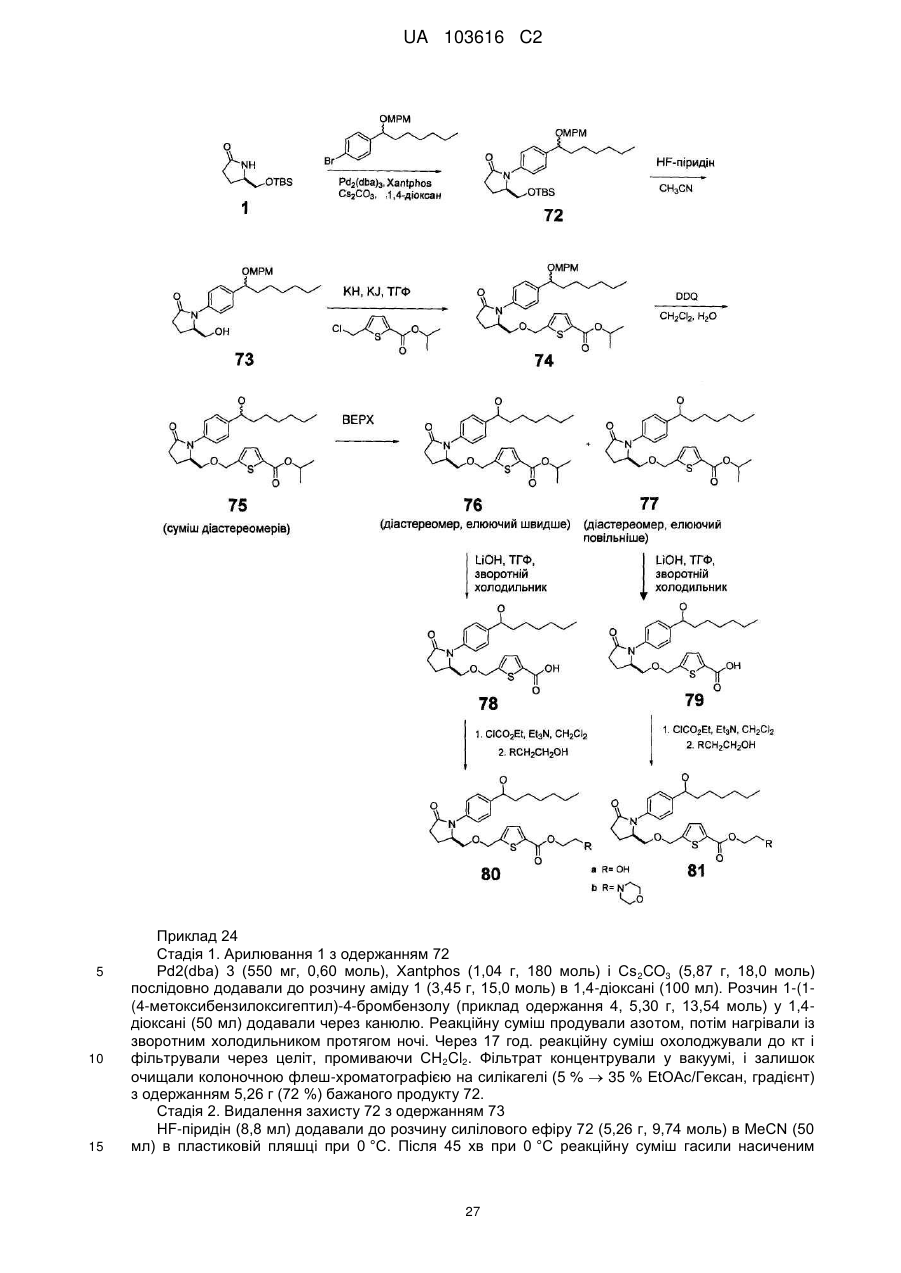
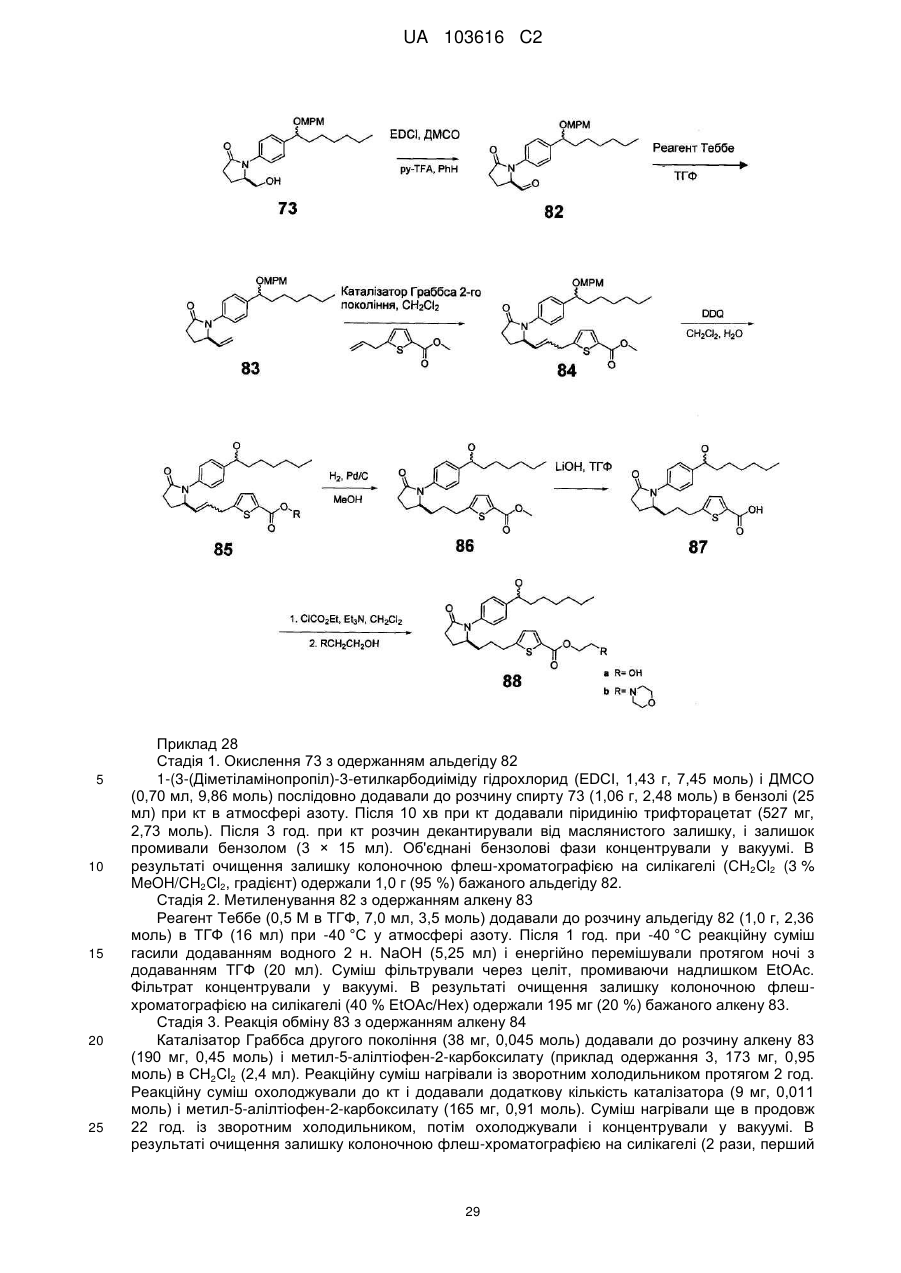
 ,
,  ,
,
 ,
,  ,
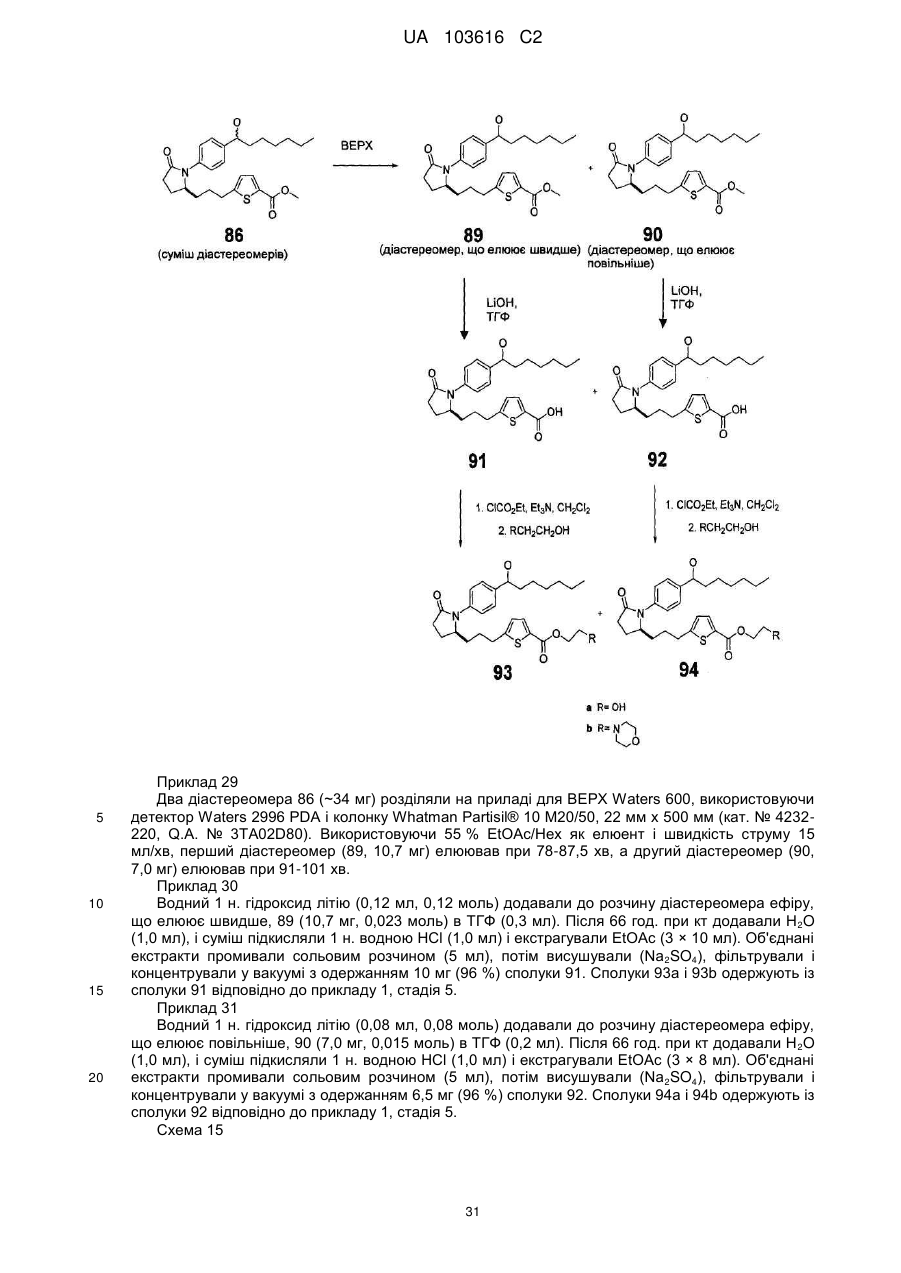
,
де Y є або
або  .
.
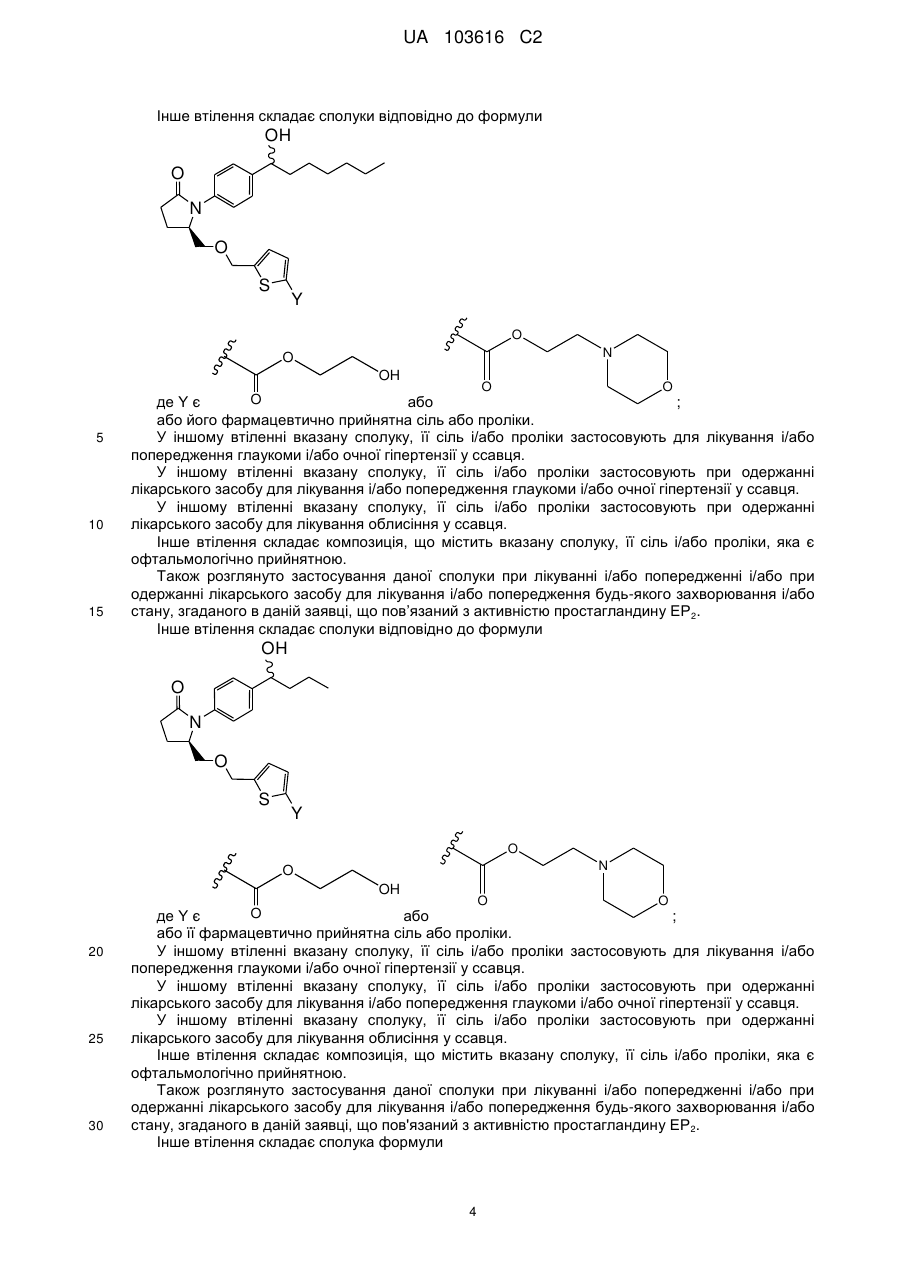
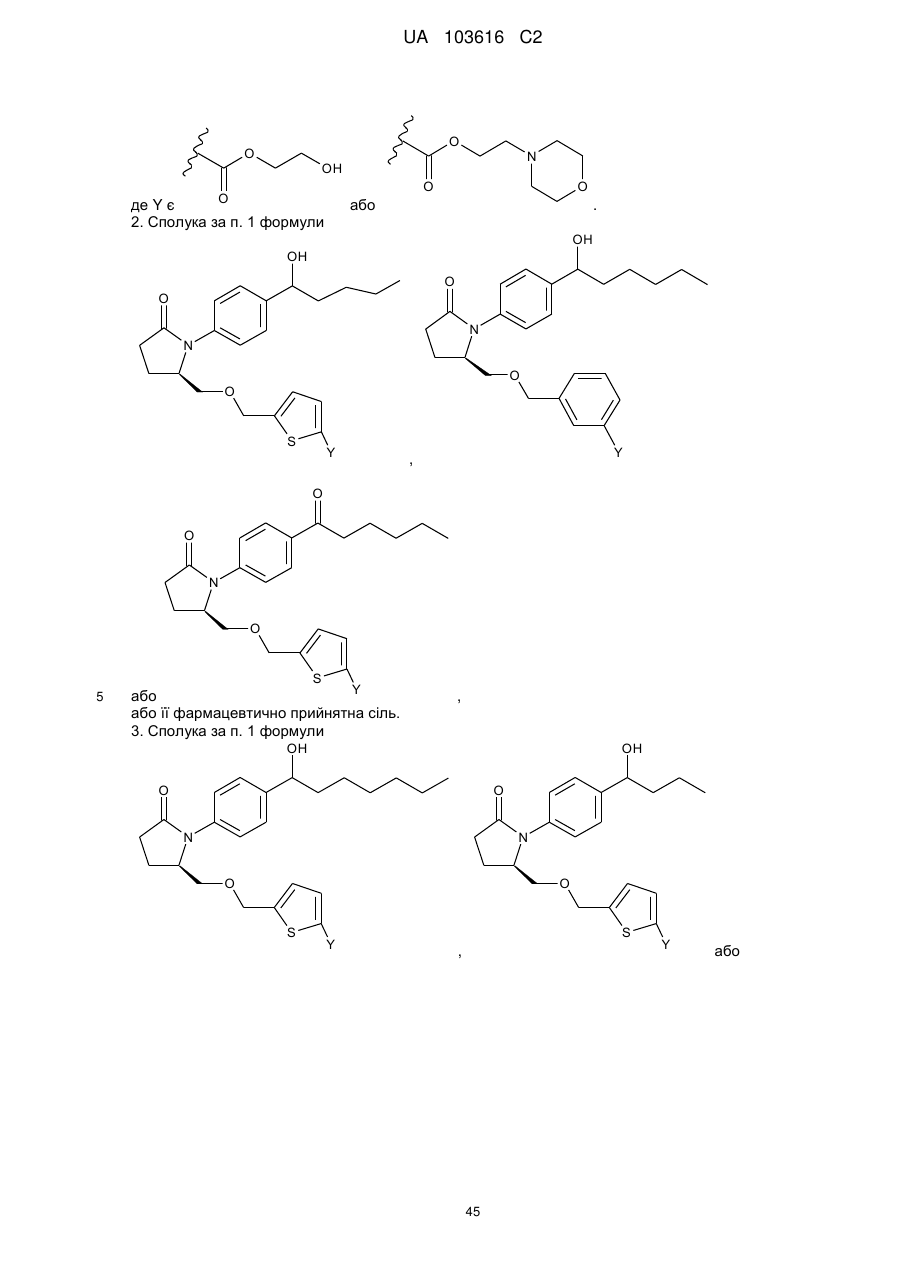
2. Сполука за п. 1 формули
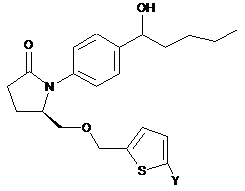 ,
, 
або .
.
або її фармацевтично прийнятна сіль.
3. Сполука за п. 1 формули
 ,
, 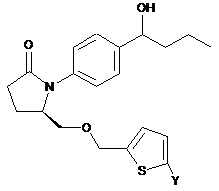 або
або

або її фармацевтично прийнятна сіль.
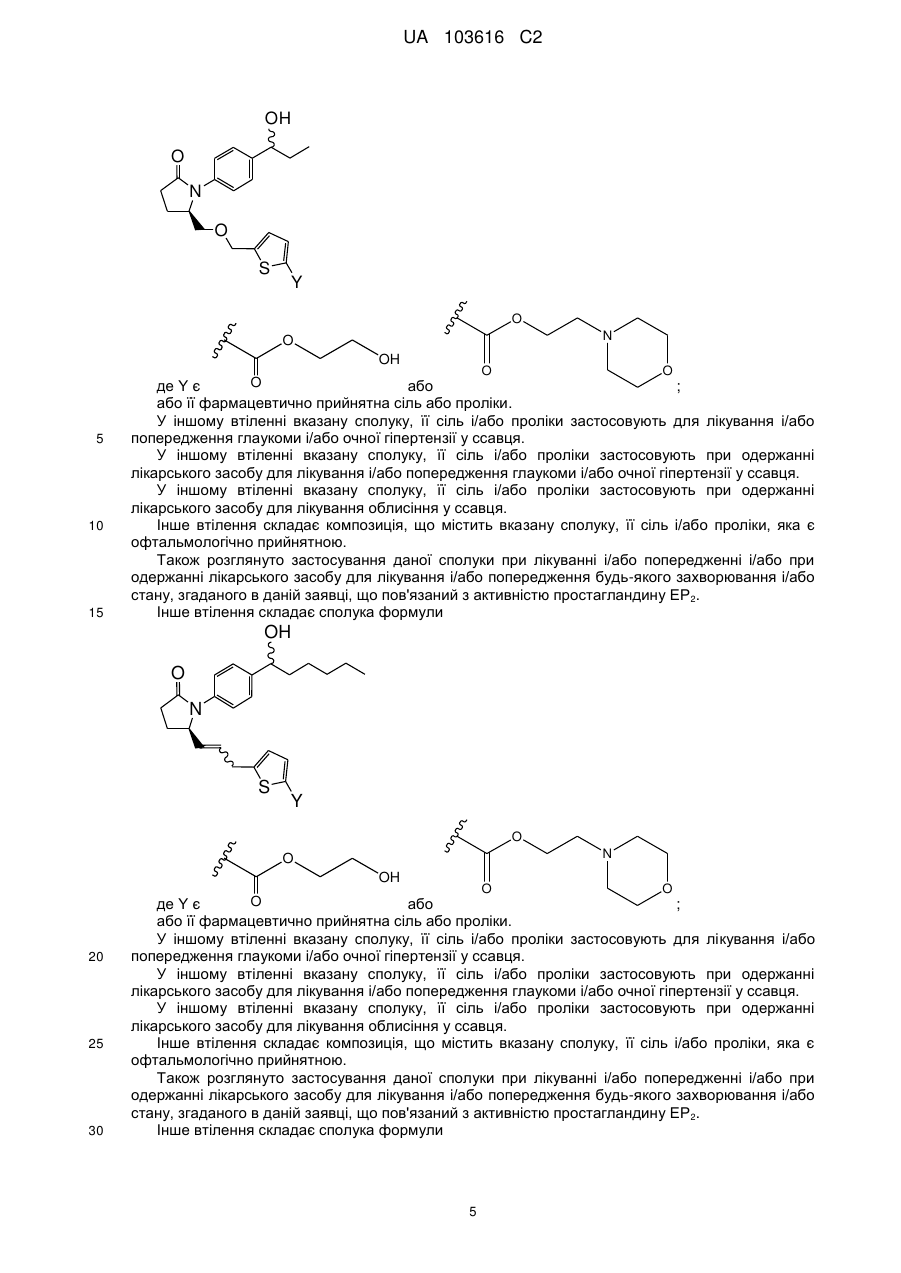
4. Сполука за п. 1 формули
 ,
, 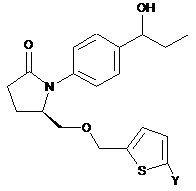 або
або

або її фармацевтично прийнятна сіль.
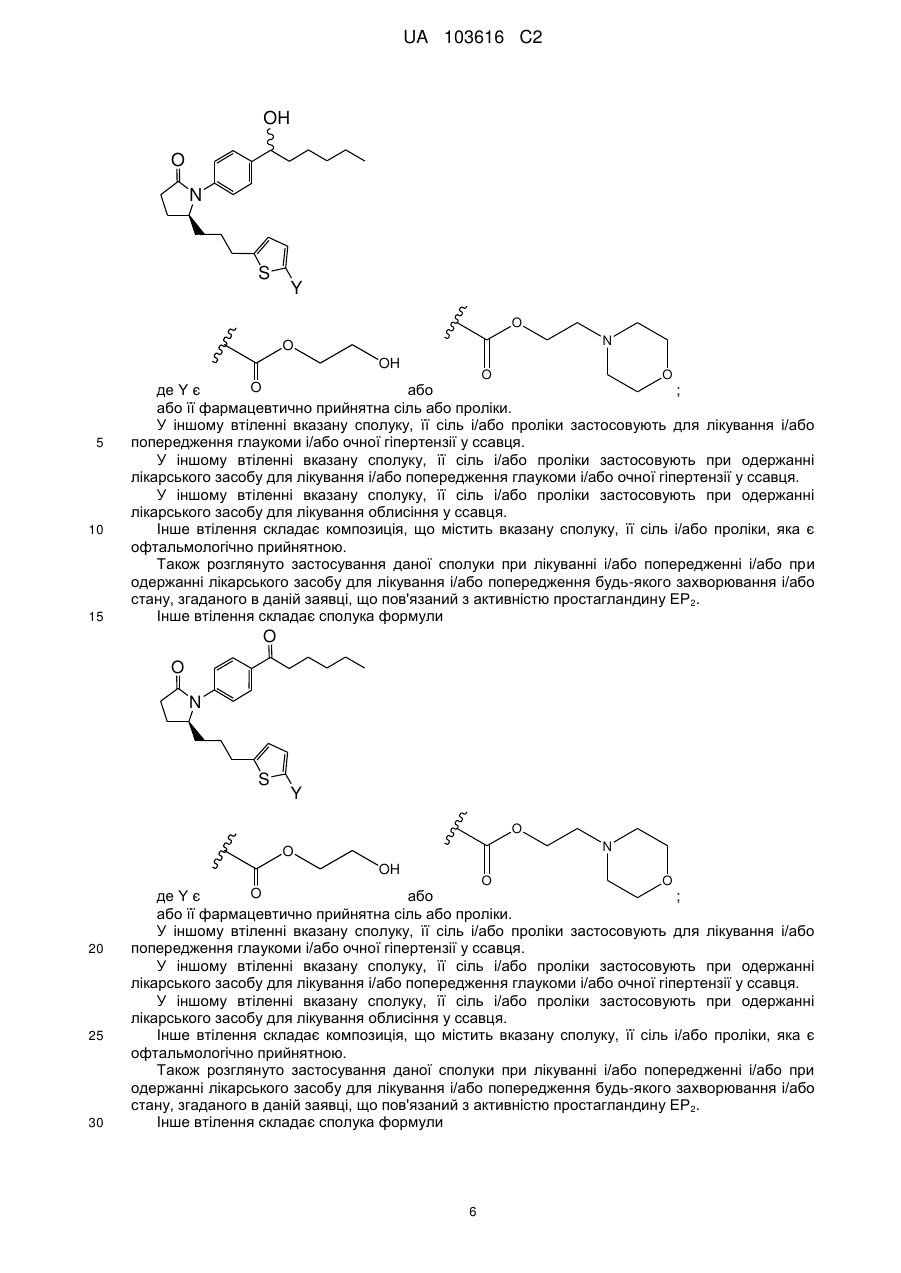
5. Сполука за п. 1 формули

або її фармацевтично прийнятна сіль.
6. Сполука за п. 1 формули

або її фармацевтично прийнятна сіль.
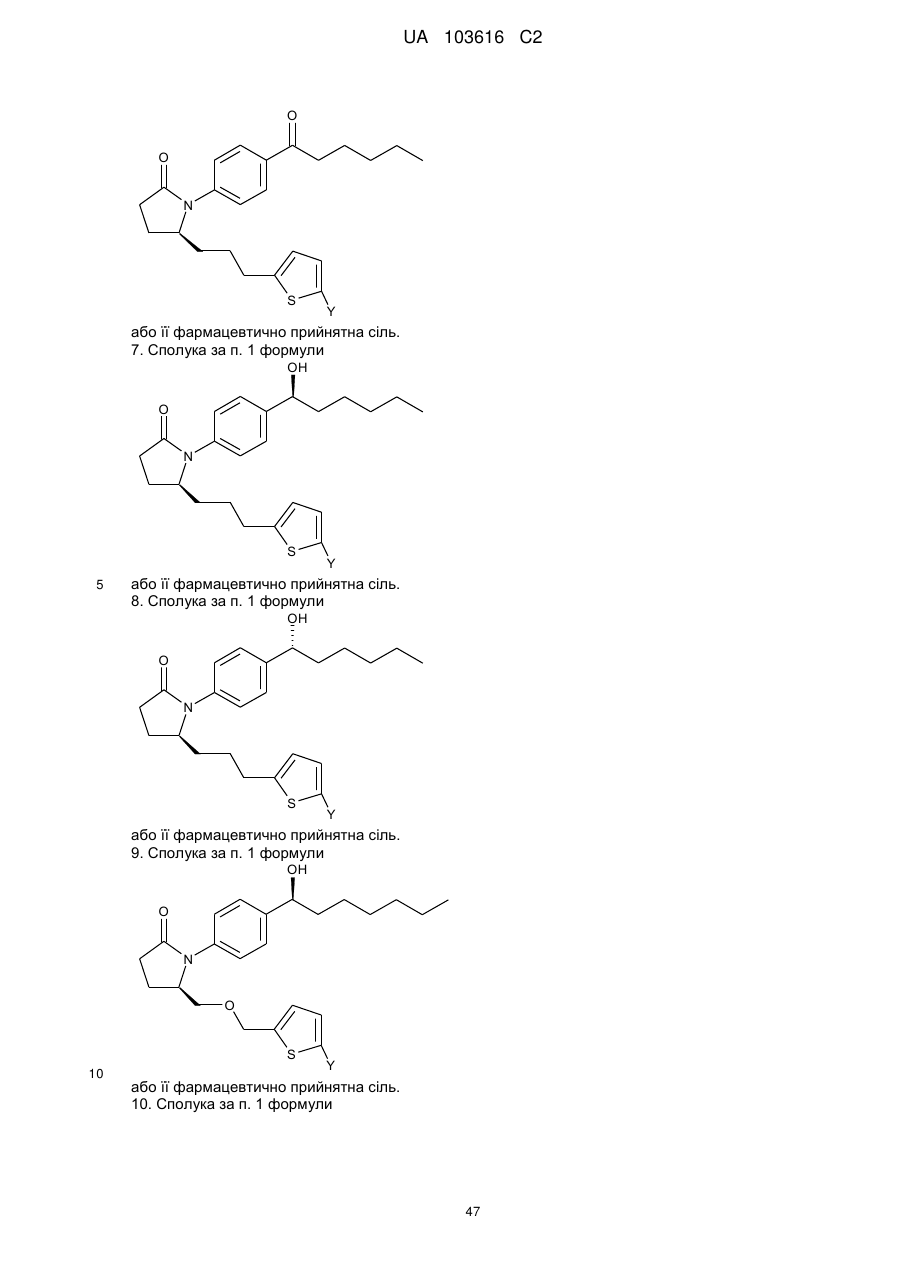
7. Сполука за п. 1 формули

або її фармацевтично прийнятна сіль.
8. Сполука за п. 1 формули

або її фармацевтично прийнятна сіль.
9. Сполука за п. 1 формули

або її фармацевтично прийнятна сіль.
10. Сполука за п. 1 формули

або її фармацевтично прийнятна сіль.
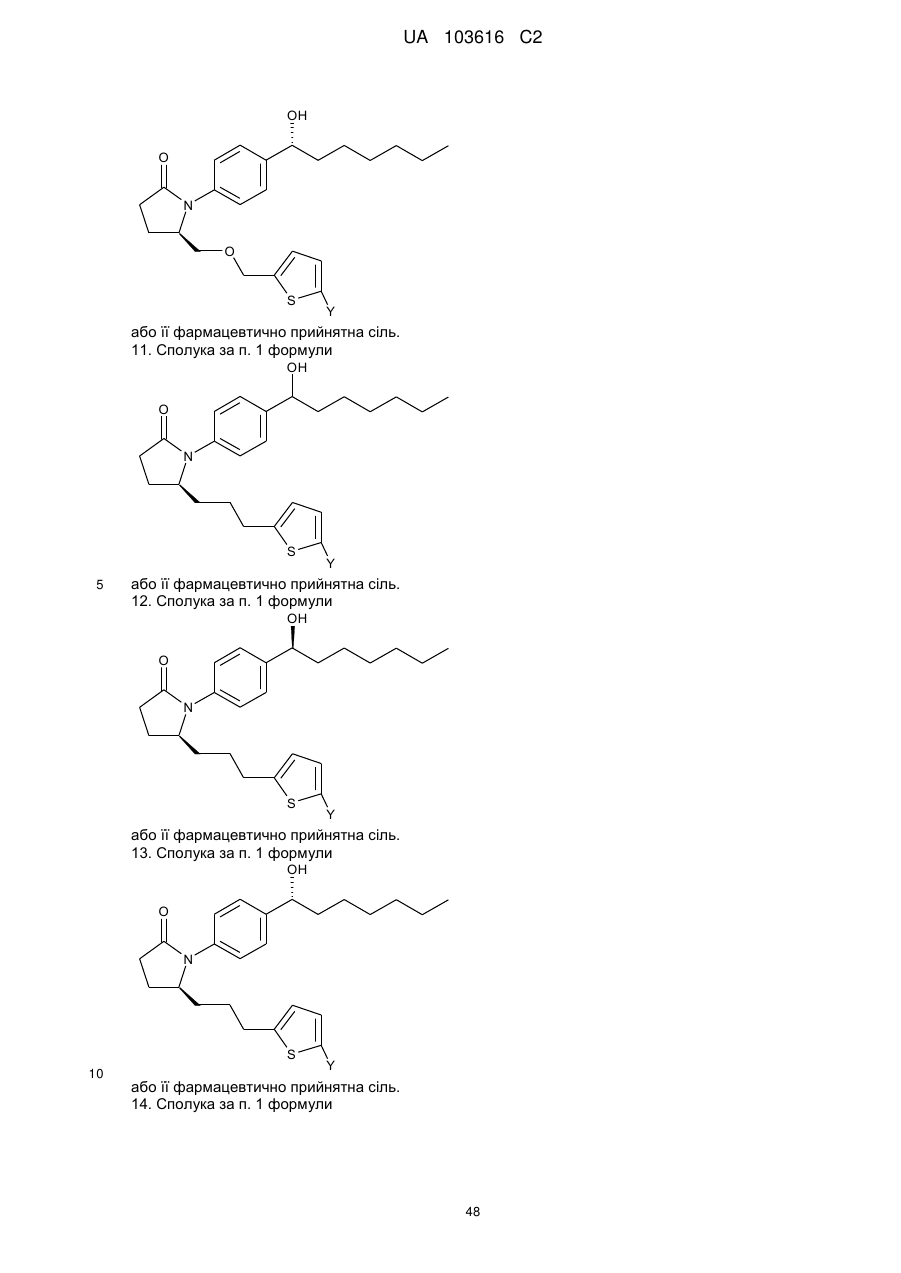
11. Сполука за п. 1 формули
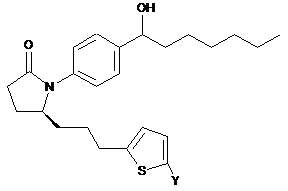
або її фармацевтично прийнятна сіль.
12. Сполука за п. 1 формули
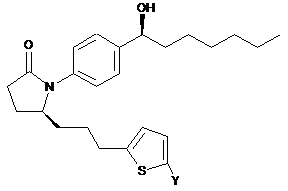
або її фармацевтично прийнятна сіль.
13. Сполука за п. 1 формули
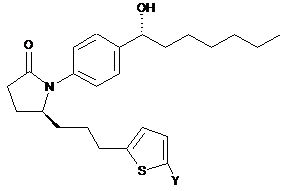
або її фармацевтично прийнятна сіль.
14. Сполука за п. 1 формули

або її фармацевтично прийнятна сіль.
15. Спосіб лікування облисіння, що включає введення суб'єктові, що потребує такого лікування, терапевтично ефективної кількості сполуки за п. 1.
Текст
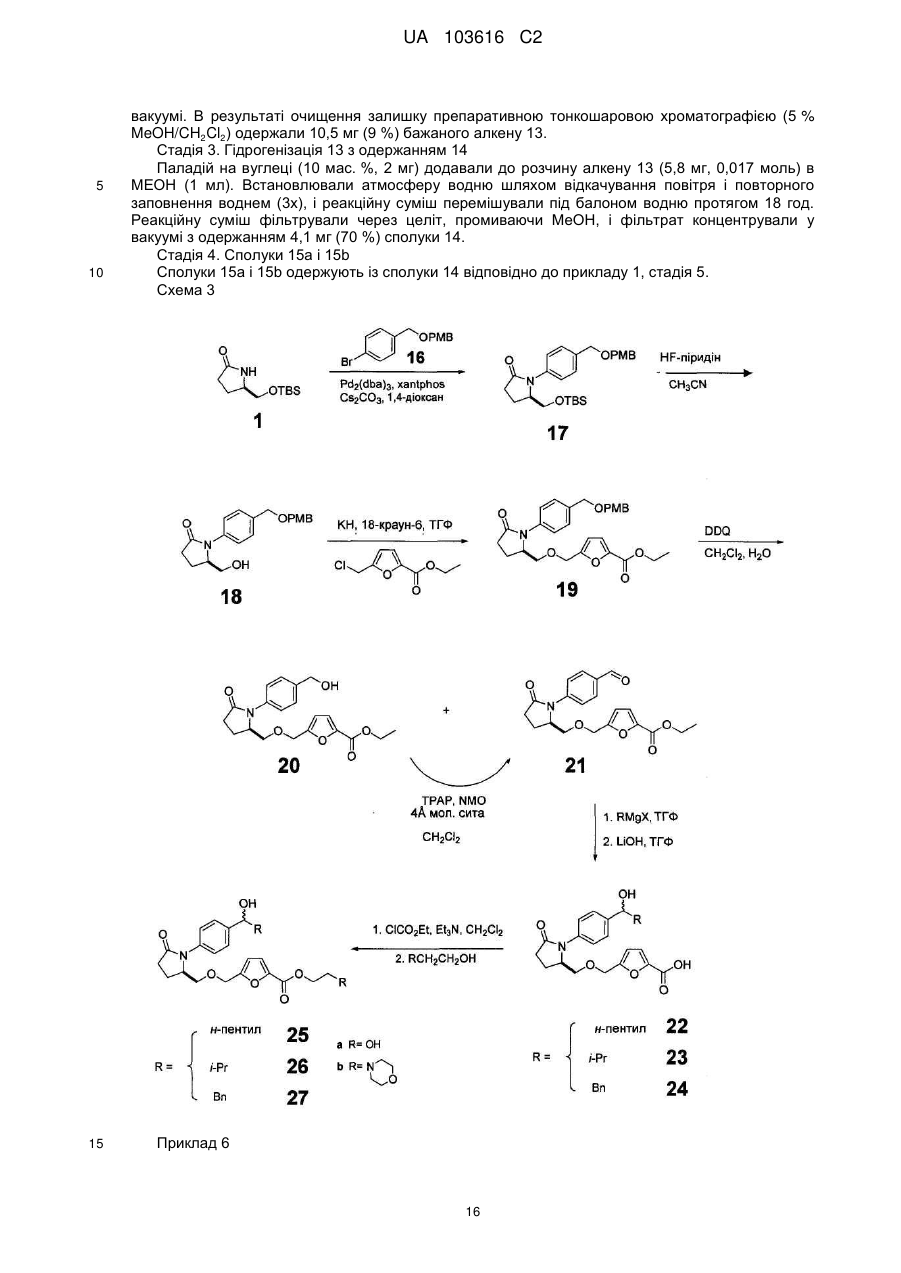
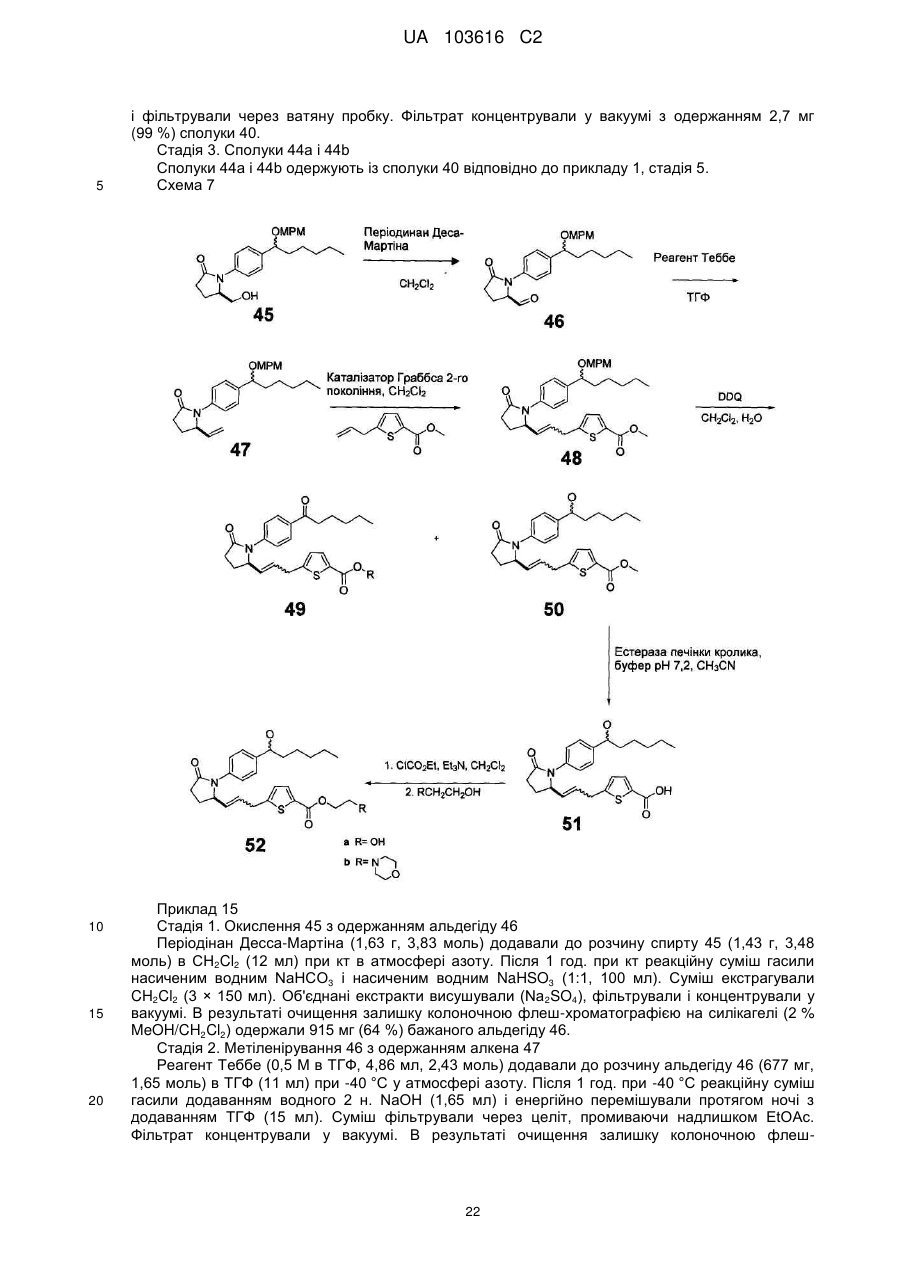
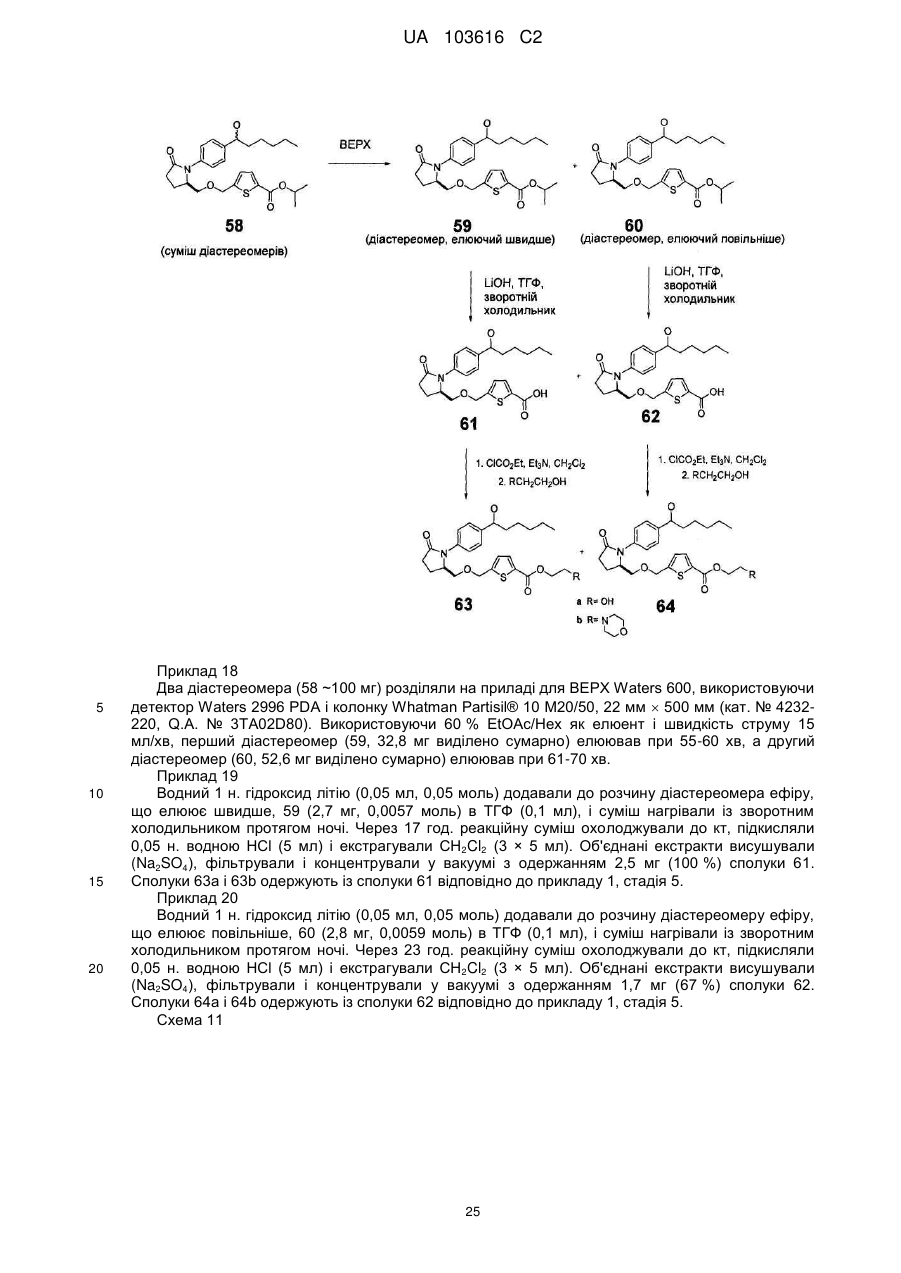
Реферат: Розкриті заміщені N-феніл-гамма-лактами, які є агоністами Ер2 і можуть використовуватися як терапевтичні агенти для лікування глаукоми, запального кишкового захворювання і облисіння. UA 103616 C2 (12) UA 103616 C2 UA 103616 C2 5 10 15 20 25 30 Очні гіпотензивні агенти корисні при лікуванні ряду різних очних гіпертензивних станів, таких як епізоди очної гіпертензії після операції і після лазерної трабекулотомії, глаукома, а також як доопераційні допоміжні засоби. Глаукома є захворюванням ока, що характеризується підвищеним внутрішньоочним тиском. На підставі етіології глаукома класифікована як первинна або вторинна. Наприклад, первинна глаукома у дорослих (природжена глаукома) може бути або відкритокутовою, або гострою або хронічною закритокутовою. Вторинна глаукома є результатом раніше існуючих очних захворювань, таких як увеїт, внутрішньоочна пухлина або обширна катаракта. Причини, що лежать в основі первинної глаукоми, до цих пір невідомі. Підвищений внутрішньоочний тиск є наслідком обструкції відтоку внутрішньоочної рідини. При хронічній відкритокутовій глаукомі передня камера і її анатомічні структури виглядають нормально, але дренаж внутрішньоочної рідини утруднений. При гострій або хронічній закритокутовій глаукомі передня камера є неглибокою, кут передньої камери звужений, і веселкова оболонка може загороджувати трабекулярну мережу на вході в шлеммів канал. Розширення зіниці може проштовхувати корінь веселкової оболонки прямо проти кута і може приводити до блокування зіниці і, таким чином, провокувати гострий напад. Очі з вузькими кутами передньої камери схильні до нападів гострої закритокутової глаукоми різного ступеня тяжкості. Вторинна глаукома викликана якою-небудь перешкодою перебігу внутрішньоочної рідини із задньої камери в передню камеру, а потім в шлеммів канал. Запальне захворювання переднього сегменту може запобігати виходу вологи, викликаючи повну задню синехію в бомбірованій веселковій оболонці, і може закупорювати дренажний канал ексудатами. Іншими поширеними причинами є внутрішньоочні пухлини, обширні катаракти, центральна венозна оклюзія сітківки, травма ока, операційні процедури і внутрішньоочна кровотеча. Розглядаючи всі типи разом, глаукома зустрічається приблизно у 2 % всіх людей у віці старшого 40 років і може бути безсимптомною протягом декількох років, після чого прогресує до швидкої втрати зору. У випадках, коли операція не показана, місцеві антагоністи βадренорецептора традиційно є ліками вибору для лікування глаукоми. Деякі ейкозаноїди і їх похідні в даний час є у продажу для застосування при лікуванні глаукоми. Ейкозаноїди і їх похідні включають різні біологічно значущі сполуки, такі як простагландини і їх похідні. Простагландини можуть бути описані як похідні простаноєвої кислоти, яка має приведену нижче структурну формулу: 7 1 COOH 3 5 9 6 4 2 14 8 16 18 10 20 12 11 13 35 40 45 50 15 17 19 Відомі різні типи простагландинів залежно від структури і замінників, яких несе аліциклічне кільце каркаса простаноєвої кислоти. Подальша класифікація заснована на числі ненасичених зв'язків в бічному ланцюзі, вказаному цифровими нижніми індексами після загального типу простагландину [наприклад, простагландин E1 (PGE1), простагландин E2 (PGE2)], і на конфігурації замінників на аліциклічному кільці, вказаний α або β [наприклад, простагландин F2α (PGF2β)]. Вважають, що селективні агоністи простагландину EP2 мають декілька медичних застосувань. Наприклад, в патенті США № 6437146 заявлено застосування селективних агоністів простагландину EP2 "для лікування або попередження запалення і болю в суглобі і м'язі (наприклад, ревматоїдного артриту, ревматоїдного спондилоартриту, остеоартриту, подагричного артриту, ювенільного артриту і так далі), запального стану шкіри (наприклад, сонячного опіку, опіків, екземи, дерматиту і так далі), запального стану ока (наприклад, кон'юнктивіту і так далі), легеневого розладу з запаленням (наприклад, астми, бронхіту, хвороби голуб'ятників, алергічного альвеоліту у сільськогосподарських працівників і так далі), стани шлунково-кишкового тракту, пов'язаного із запаленням (наприклад, афтозної виразки, хвороби Крону, атрофічного гастриту, вариолоформного гастриту, неспецифічного виразкового коліту, 1 UA 103616 C2 5 10 15 20 25 30 целіакії, регіонарного ілеіту, синдрому роздратованої кишки і так далі), гінгівіту, запалення, болю і опухання після операції або пошкодження, пирексії, болю і інших станів, пов'язаних із запаленням, алергічного захворювання, системного червоного вовчаку, склеродерми, поліміозиту, тендиніту, бурситу, вузлового періартеріїту, ревматичної лихоманки, синдрому Шегрена, хвороби Бехчета, тиреоїдиту, діабету типу I, діабетичного ускладнення (діабетичній мікроангіопатії, діабетичній ретинопатії, діабетичній нефропатії і так далі), нефротичного синдрому, апластичної анемії, важкої міастенії, увеїту, контактного дерматиту, псоріазу, хвороби Кавасакі, саркоїдозу, хвороби Ходжкина, хвороби Альцгеймера, дисфункції нирок (нефриту, нефритичного синдрому і так далі), дисфункції печінки (гепатиту, цирозу і так далі), шлунковокишкової дисфункції (діареї, запального кишкового захворювання і так далі) шоку, кісткового захворювання, що характеризується аномальним метаболізмом кістки, такого як остеопороз (зокрема, остеопорозу менопаузи), гіперкальциємії, гіперпаратиреозу, хвороби Педжета, остеолізу, гіперкальциємії злоякісності з метастазами або без метастазів кісток, ревматоїдного артриту, періодонтіту, остеоартриту, остеалгії, остеопенії, ракової кахексії, калькулезу, літіазу (зокрема, уролітіазу), солідної карциноми, мезангіального проліферативного гломерулонефриту, набряку (наприклад, серцевого набряку, мозкового набряку і так далі), гіпертензії, такої як злоякісна гіпертензія або тому подібне, передменструальної напруги, сечового конкременту, олігурії, наприклад, викликаною гострою або хронічною недостатністю, гіперфосфатурії або тому подібного". У патенті США № 6710072 заявлено застосування агоністів EP2 для лікування або попередження "остеопорозу, констипації, ниркових розладів, статевої дисфункції, облисіння, діабету, раку, а також при розладі регуляції імунітету, різних патофізіологічних захворювань, включаючи гострий інфаркт міокарду, судинний тромбоз, гіпертензію, легеневу гіпертензію, ішемічну хворобу серця, застійну серцеву недостатність і стенокардію". Короткий опис винаходу Тут розкриті сполуки, корисні при лікуванні глаукоми, запального кишкового захворювання, при стимуляції росту волосся і стимуляції перетворення пушкового волосу в довге волосся. Самі сполуки описані нижче. Докладний опис винаходу Одне втілення складає сполука формули OH O N O S Y O N O OH 35 40 45 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказана сполука, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказана сполука, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказана сполука, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP 2. Інше втілення складає сполука формули 2 UA 103616 C2 OH O N O Y O N O OH O 5 10 15 O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказана сполука, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP 2. Інше втілення складає сполука формули O O N O S Y O N O OH 20 25 30 O O O де Y є або ; або його фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, його сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP2. 3 UA 103616 C2 Інше втілення складає сполуки відповідно до формули OH O N O S Y O N O OH 5 10 15 O O O де Y є або ; або його фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов’язаний з активністю простагландину EP 2. Інше втілення складає сполуки відповідно до формули OH O N O S Y O N O OH 20 25 30 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP 2. Інше втілення складає сполука формули 4 UA 103616 C2 OH O N O S Y O N O OH 5 10 15 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP2. Інше втілення складає сполука формули OH O N S Y O N O OH 20 25 30 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP 2. Інше втілення складає сполука формули 5 UA 103616 C2 OH O N S Y O N O OH 5 10 15 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP 2. Інше втілення складає сполука формули O O N S Y O N O OH 20 25 30 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP 2. Інше втілення складає сполука формули 6 UA 103616 C2 OH O N S Y O N O OH 5 10 15 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP2. Інше втілення складає сполука формули OH O N S Y O N O OH 20 25 30 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP 2. Інше втілення складає сполука формули 7 UA 103616 C2 OH O N O Y O N O OH 5 10 15 20 25 30 35 40 45 O O O де Y є або ; або її фармацевтично прийнятна сіль або проліки. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування і/або попередження глаукоми і/або очної гіпертензії у ссавця. У іншому втіленні вказану сполуку, її сіль і/або проліки застосовують при одержанні лікарського засобу для лікування облисіння у ссавця. Інше втілення складає композиція, що містить вказану сполуку, її сіль і/або проліки, яка є офтальмологічно прийнятною. Також розглянуто застосування даної сполуки при лікуванні і/або попередженні і/або при одержанні лікарського засобу для лікування і/або попередження будь-якого захворювання і/або стану, згаданого в даній заявці, що пов'язаний з активністю простагландину EP 2. Сполуки, розкриті в даній заявці, корисні для попередження або лікування глаукоми або очної гіпертензії у ссавців або для одержання лікарського засобу для глаукоми або очної гіпертензії. Вони також корисні для лікування захворювань, розкритих рівнем техніки як такі, що піддаються лікуванню агоністом простагландину EP2, таких як перераховані вище. "Фармацевтично прийнятною сіллю" є будь-яка сіль, яка зберігає активність початкової сполуки і не надає яких-небудь додаткових шкідливих або небажаних ефектів на суб'єкта, якому її вводять, і в ситуації, в якій її вводять, в порівнянні з початковою сполукою. Фармацевтично прийнятна сіль також відноситься до будь-якої солі, яка може утворитися in vivo в результаті введення кислоти, іншої солі або проліків, які перетворяться в кислоту або сіль. Фармацевтично прийнятні солі кислотних функціональних груп можуть бути утворені з органічних або неорганічних основ. Сіль може містити одно- або полівалентний іон. Особливий інтерес представляють неорганічні іони літію, натрію, калію, кальцію і магнію. Органічні солі можуть бути одержані з амінами, зокрема, солі амонію, такі як моно-, ді- і триалкіламіни або етаноламіни. Солі можуть бути також утворені з кофеїном, трометаміном і подібними молекулами. Соляна кислота або інша фармацевтично прийнятна кислота може утворити сіль із сполукою, що включає основну групу, таку як амін або піридінове кільце. "Проліками" є сполука, що перетвориться в терапевтично активну сполуку після введення, і цей термін в даній заявці слід інтерпретувати так само широко, як в цілому розуміють в даній області техніки. Хоча це не призначено для обмеження об'єму винаходу, перетворення може здійснюватися за допомогою гідролізу складноефірної групи або якої-небудь іншої біологічно лабільної групи. Як правило, але не обов'язково, проліки неактивні або менш активні, ніж терапевтично активна сполука, в які вона перетвориться. Конкретно розглянуті складноефірні проліки сполук, розкритих в даній заявці. Складний ефір може бути утворений з карбонової кислоти C1 (тобто кінцевої карбонової кислоти природного простагландину), або складний ефір може бути утворений з карбоново-кислотної функціональної групи на іншій частині молекули, як, наприклад, на фенільному кільці. Хоча це не призначено для обмеження, складний ефір може бути алкіловий ефір, арильний ефір або гетероарильний ефір. Термін алкіл має значення, що загальноприйнято розуміється фахівцями в даній області техніки, і відноситься до нормальних, розгалужених або циклічних алкільних угрупувань. Зокрема, корисні C 1-6 алкілові ефіри, де алкільна частина ефіру має від 1 до 6 атомів вуглецю і включає, але не обмежена ними, метил, етил, пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил, терт-бутил, ізомери пентилу, ізомери 8 UA 103616 C2 5 10 15 20 25 30 35 40 45 50 55 60 гексилу, циклопропіл, циклобутил, циклопентил, циклогексил і їх комбінації, що мають 1-6 атомів вуглецю, і так далі. Метаболіт в широкому сенсі визначають як сполуку, яка утворена in vivo з розкритої сполуки. Фахівці в даній області техніки добре розуміють, що для введення або одержання лікарських коштів сполуки, розкриті в даній заявці, можна змішувати з фармацевтично прийнятними ексципієнтами, які самі по собі добре відомі в даній області техніки. Конкретно, якщо лікарський засіб потрібно вводити системно, її можна готувати у вигляді порошку, пілюлі, пігулки або тому подібного, або у вигляді розчину, емульсії, суспензії, аерозоля, сиропу або еліксиру, придатного для перорального або парентерального введення або інгаляції. Для твердих лікарських форм або лікарських засобів нетоксичні тверді наповнювачі включають, але не обмежені ними, фармацевтичні категорії маніту, лактози, крохмалю, стеарату магнію, натрієвої солі сахарину, поліалкіленгліколів, тальку, целюлози, глюкози, сахарози і карбонату магнію. Тверді лікарські форми можуть бути непокритими, або вони можуть бути покриті за допомогою відомих способів для уповільнення розпушування і всмоктування в шлунково-кишковому тракті, і за допомогою цього забезпечувати пролонговану дію протягом тривалішого періоду. Наприклад, можна використовувати речовину, уповільнюючу період, таку як гліцерилмоностеарат або гліцерилдистеарат. Вони можуть бути також покриті за допомогою способу, описаного в патентах США №№ 4256108; 4166452 і 4265874, з утворенням осмотичних терапевтичних пігулок для регульованого вивільнення. Рідкі лікарські форми, що фармацевтично вводяться, можуть, наприклад, включати розчин або суспензію одного або більш ніж одного даної корисної сполуки і можливі фармацевтичні ад'ювант в носієві, такі як, наприклад, вода, фізіологічний розчин, водна декстроза, гліцерин, етанол і тому подібне, з одержанням, таким чином, розчину або суспензії. Якщо бажано, фармацевтична композиція для введення може також містити мінорні кількості нетоксичних допоміжних речовин, таких як зволожуючі або емульгуючі агенти, pH буферні агенти і тому подібне. Типовими прикладами таких допоміжних агентів є ацетат натрію, сорбітанмонолаурат, триетаноламін, триетаноламіну олеат і так далі. Актуальні способи одержання таких лікарських форм відомі або мають бути очевидні фахівцям в даній області техніки; див., наприклад, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Ра., 16th Edition, 1980. Композиція препарату для введення у будь-якому випадку містить одну або більш ніж одного з даних придатних сполук, ефективних для одержання бажаного терапевтичного ефекту. Парентеральне введення, як правило, характеризується ін'єкцією, або підшкірною, або внутрішньом'язовою, або внутрішньовенною. Ін'єкційні препарати можна готувати в загальноприйнятих формах, або у вигляді рідких розчинів або суспензій, або у вигляді твердих форм, придатних для розчинення або суспендування в рідині перед ін'єкцією, або у вигляді емульсій. Придатними ексципієнтами є, наприклад, вода, фізіологічний розчин, декстроза, гліцерин, етанол і тому подібне. Крім того, якщо бажано, ін'єкційні фармацевтичні композиції для введення можуть також містити мінорні кількості нетоксичних допоміжних речовин, таких як зволожуючі або емульгуючі агенти, pH буферні агенти і тому подібне. Кількість даної корисної сполуки або сполуки, що вводиться, звичайно, залежить від бажаного терапевтичного ефекту або ефектів, від конкретного ссавця, підданого лікуванню, від тяжкості і природи стану ссавця, від способу введення, від ефективності і фармакодинаміки конкретно вживаної сполуки або сполук, і від думки лікаря, що лікує. Терапевтично ефективне дозування даної корисної сполуки або сполук переважно знаходиться в діапазоні від приблизно 0,5 або приблизно 1 до приблизно 100 мг/кг/доба. Рідину, яка є офтальмологічно прийнятною, готують так, щоб її можна було вводити місцевим шляхом в око. Комфорт має бути максимальним, наскільки можливо, хоча іноді з міркувань приготування препарату (наприклад, стабільності лікарського засобу) може бути необхідний менш ніж оптимальний комфорт. У разі, коли комфорт не може бути збільшений до максимуму, рідину слід готувати так, щоб ця рідина була переносима для пацієнта для місцевого очного застосування. Крім того, офтальмологічно прийнятна рідина має бути або упакована для одноразового застосування, або містити консервант для попередження зараження протягом багатократних застосувань. Для очного застосування розчини або лікарські засоби часто готують з використанням фізіологічного сольового розчину як основного наповнювача. Очні розчини переважно слід підтримувати при комфортабельному pH відповідною буферною системою. Препарати можуть також містити загальноприйняті, фармацевтично прийнятні консерванти, стабілізатори і сурфактанти. Консерванти, які можна використовувати у фармацевтичних композиціях згідно даного винаходу, включають, але не обмежені ними, бензалконію хлорид, хлорбутанол, тимеросал, 9 UA 103616 C2 5 10 15 ацетат фенілртуті і нітрат фенілртуті. Корисним сурфактантом є, наприклад, Твін 80. Так само, в очних препаратах згідно даного винаходу можна використовувати різні корисні наповнювачі. Ці наповнювачі включають, але не обмежені ними, полівініловий спирт, повідон, гідроксипропілметилцелюлозу, полоксамери, карбоксиметилцелюлозу, гідроксиетилцелюлозу і дистильовану воду. При необхідності або для зручності можна додавати регулятори тонічності. Вони включають, але не обмежені ними, солі, зокрема, хлорид натрію, хлорид калію, маніт і гліцерин, або будьякий інший придатний офтальмологічно прийнятний регулятор тонічності. Різні буфери і засоби для регулювання pH можна використовувати в такому ступені, щоб одержаний в результаті препарат був офтальмологічно прийнятним. Відповідно, буфери включають ацетатні буфери, цитратні буфери, фосфатні буфери і боратні буфери. Кислоти або основи можна використовувати для регулювання pH цих препаратів з потреби. Так само, офтальмологічно прийнятний антиоксидант для застосування в даному винаході включає, але не обмежений ними, метабісульфіт натрію, тіосульфат натрію, ацетилцистеін, бутильований гідроксианізол і бутильований гідрокситолуол. Іншими ексципієнтами, які можна включати в офтальмологічні препарати, є хелатуючі агенти. Корисним хелатуючим агентом є едетат динатрію, хоча інші хелатуючі агенти можна також використовувати замість нього або у поєднанні з ним. Інгредієнти зазвичай використовують в приведених нижче кількостях: 20 Інгредієнт Кількість (% мас/об) приблизно 0,001-5 0-0,10 0-40 1-10 0,01-10 q.s. pH 4,5-7,5 за необхідності за необхідності за необхідності до 100 % активний інгредієнт консервант наповнювач регулятор тонічності буфер регулятор pH антиоксидант сурфактант дистильована вода, 25 30 35 40 45 50 Застосування для стимуляції росту волосся У одному втіленні сполуки, розкритої в даній заявці, можуть бути корисні при лікуванні облисіння і/або втрати волосся. Алопеція (облисіння) є недоліком або нормального, або аномального волосся, і, перш за все, є косметичною проблемою у людей. Вона є недоліком довгого волосся, широкого діаметру, забарвленого волосся, що має вигляд рідкого. Проте у так званої лисої людини, хоча є помітна відсутність довгого волосся, шкіра містить пушкове волосся, яке є тонким безбарвним волоссям, для визначення присутності якого може бути потрібне мікроскопічне дослідження. Це пушкове волосся є попередником довгого волосся. Сполуки, описані в даній заявці, можна застосовувати для стимуляції, такої як перетворення росту пушкового волосся в ріст довгого волосся, а також збільшення швидкості росту довгого волосся. Користь сполук, описаних в даній заявці, для стимуляції росту волосся була відкрита, як описано нижче. В ході лікування пацієнтів, страждаючих глаукомою, лікування може проводитися тільки в одному оці. В ході щоденної практики було виявлено, що у пацієнта, який отримав лікування біматопростом, аналогом простагландину, розвивалися вії, які були довші, густіше і товще в обробленому оці, ніж в необробленому оці. При дослідженні було виявлено дуже різку відмінність. Вії були довші і виглядали товщими і густішими в обробленому оці. Зовнішній вигляд вій на віках оброблених очей здавався б достатньо привабливим, якби він був двостороннім явищем. В результаті асиметричної природи довгі вії на одній стороні можна було б розглядати як такі, що заподіюють неспокій з косметичної точки зору. В результаті цього асиметричного явища було проведено системне дослідження. Незабаром стало зрозуміло, що цей змінений зовнішній вигляд був не окремою знахідкою. Порівняння віку пацієнтів, які одержували біматопрост тільки в одне око, виявило малопомітні зміни у віях і прилеглому волоссі сторони, обробленою біматопростом, у декількох пацієнтів. Певні відмінності можна було ідентифікувати до варіюючих ступенів у віях і прилеглому волоссі всіх пацієнтів, які одержували цей лікарський засіб, на односторонній основі протягом більше 6 місяців. Зміни у віях були очевидними при обширному дослідженні у декількох пацієнтів, як тільки увагу було сфокусовано на цьому предметі. У пацієнтів зі світлим волоссям і віями відмінності були легко видні тільки за допомогою великого збільшення і освітлювальних здібностей 10 UA 103616 C2 5 10 15 20 25 30 35 40 45 50 55 60 біомікроскопа, що є щілинною лампою. В ході додаткового обстеження глаукоми увагу, як правило, було сфокусовано на самому оці. В результаті високого оптичного збільшення, необхідного для спостереження тільки одного ока одночасно, око видно при достатньо великому оптичному збільшенні, щоб вії знаходилися не у фокусі. При цих великих оптичних збільшеннях яка-небудь асиметрія вій між очима, ймовірно, непомітна без ретельного систематичного порівняння вій і прилеглого волосся вік двох очей. Спостережувані параметри, що приводять до висновку, що сильніше ріст волосся відбувалося в зоні обробки після введення аналога простагландину, були множинними. Вони включали збільшену довжину вій, збільшене число вій уздовж звичайної лінії вій, збільшену густину і блиск вій, збільшення додаткових, подібних до вій, довгого волосся в перехідних зонах, прилеглих до зон нормального зростання вій, збільшення додаткових, подібних до вій, довгого волосся в медіальній і латеральній кантальній зоні, збільшену пігментацію вій, збільшене число, збільшену довжину, а також збільшений блиск і густину тонкого волосся на шкірі прилеглого віка, і, нарешті, збільшений перпендикулярний нахил вій і подібного до вій довгого волосся. Висновок про те, що зростання волосся стимулюється аналогами простагландину, такими як біматопрост, підтвердив наявність відмінності згідно єдиного параметру, але воно засноване на множинних параметрах зовнішнього вигляду волосся в обробленій зоні проти контрольної у багатьох суб'єктів. Сполуки, описані в даній заявці, є аналогами простагландину і, отже, мають схожі активності з біматопростом, містять структурні подібності, і, отже, чекають, що вони стимулюють зростання волосся і стимулюють перетворення пушкового волосся в довге волосся. У одному втіленні сполуки, описані в даній заявці, і їх проліки можна застосовувати для стимуляції зростання волосся. Як використовують в даній заявці, зростання волосся включає волосся, пов'язані з волосистою частиною шкіри голови, брови, віка, бороди і інших зон шкіри тварин. У одному втіленні сполуки змішують з дерматологічно сумісним наповнювачем або носієм. Наповнювач, який можна використовувати для одержання композицій, як описано в даній заявці, може включати, наприклад, водні розчини, такі як, наприклад, фізіологічні сольові розчини, масляні розчини або мазі. Наповнювач, крім того, може містити дерматологічно сумісні консерванти, такі як, наприклад, бензалконію хлорид, сурфактанти, такі як, наприклад, полісорбат 80, ліпосоми або полімери, наприклад, метилцелюлозу, полівініловий спирт, полівінілпіролідон і гіалуронову кислоту; їх можна використовувати для підвищення в'язкості. Крім того, також можливо включати розчинні або нерозчинні вставки лікарських засобів, коли потрібно вводити лікарський засіб. У одному втіленні можна готувати дерматологічні композиції для місцевого лікування для стимуляції зростання волосся, яке містить ефективну для стимуляції зростання волосся кількість одну або більш ніж одну сполуку, як визначено вище, і дерматологічно сумісний носій. Ефективні кількості активних сполук можуть бути визначені звичайним фахівцем в даній області техніки, але вони варіюватимуть залежно від вживаної сполуки, частоти застосування і бажаного результату. Сполуки будуть, як правило, знаходитися в інтервалі від приблизно 0,0000001 до приблизно 50 мас. % дерматологічної композиції. Переважні сполуки знаходитимуться в інтервалі від приблизно 0,001 до приблизно 50 мас. % сумарній дерматологічній композиції, переважніше від приблизно 0,1 до приблизно 30 мас. % композиції. У одному втіленні застосування даних сполук для стимуляції зростання волосся знаходить застосування у видів ссавців, включаючи як людей, так і тварин. У людей сполуки, описані в даній заявці, можна наносити, наприклад, на волосисту частину шкіри голови, бороду особи, голову, лобкову зону, верхню губу, брови і віка. У тварини, що розводиться для одержання шкірки, наприклад, норки, сполуки, описані в даній заявці, можна наносити на всю поверхню тіла для поліпшення всієї шкірки по комерційних міркуваннях. Цей спосіб можна також використовувати з косметичних міркувань у тварин, наприклад, нанесення на шкіру собак і кішок, що мають лисини унаслідок корости або інших захворювань, що викликають який-небудь ступінь алопеції. Фармацевтичні композиції, що розглядаються для стимуляції зростання волосся, включають фармацевтичні композиції, придатні для місцевої і локальної дії. Термін "місцевий", як використовують в даній заявці, відноситься до застосування сполуки, як описано в даній заявці, включеного у відповідний фармацевтичний носій, і наносять в місці витонченого волосся або облисіння для прояву локальної дії. Відповідно, такі місцеві композиції включають ті фармацевтичні форми, в яких сполуки застосовують зовнішньо шляхом прямого контакту з шкірою, належній обробці. Загальноприйняті фармацевтичні форми для цієї мети включають тверді мазі, рідкі мазі, креми, шампуні, лосьйони, пасти, желе, спреї, аерозолі і тому подібне, і їх можна застосовувати в пластирах або просочених пов'язках залежно від частини тіла, належній 11 UA 103616 C2 5 10 15 20 25 30 35 40 45 обробці. Термін "тверда мазь" охоплює препарати (включаючи креми), що мають масляні, водорозчинні основи і основи емульсивного типу, наприклад, вазелін, ланолін, поліетиленгліколі, а також їх суміші. Зазвичай сполуки можна наносити повторно протягом пролонгованого періоду часу місцевим шляхом на частину тіла, що підлягає обробці, наприклад, віка, брови, шкіру або волосисту частину голови. Переважна схема дозування буде, як правило, включати регулярне, таке як щодобове, введення протягом періоду лікування щонайменше один місяць, переважніше щонайменше три місяці, і найпереважніше щонайменше шість місяців. Для місцевого застосування на віках або бровах препарати активних сполук можна готувати у водних розчинах, кремах, мазях або маслах, що проявляють фізіологічно прийнятну осмолярність, шляхом додавання фармацевтично прийнятних буферів і солей. Такі препарати, залежно від фармацевта, можуть містити або не містити консерванти, такі як бензалконію хлорид, хлоргексидин, хлорбутанол, парагідроксибензойні кислоти і солі фенілртути, такі як нітрат, хлорид, ацетат і борат, або антиоксиданти, а також добавки, такі як ЕДТА, сорбіт, борна кислота і тому подібне, як добавки. Крім того, зокрема, водні розчини можуть містити агенти, що підвищують в'язкість, такі як полісахариди, наприклад, метилцелюлоза, мукополісахариди, наприклад, гіалуронова кислота і хондроітинсульфат, або поліспирт, наприклад, полівініловий спирт. Можна також використовувати різні гелі і матриці, що уповільнюють вивільнення, а також розчинні і нерозчинні очні вставки, наприклад, на основі речовин, створюючих гелі in situ. Залежно від дійсного препарату і вживаної сполуки можна застосовувати різні кількості лікарського засобу і різні схеми дозування. Типова щодобова кількість сполуки для обробки віка може складати від приблизно 0,1 нг до приблизно 100 мг на віко. Для місцевого застосування на шкірі і волосистій частині голови препарат сполуки можна переважно готувати, використовуючи тверді мазі, креми, рідкі мазі або пластири як носій активного інгредієнта. Ці препарати також можуть містити або не містити консерванти залежно від фармацевта і природи застосування. Такі консерванти включають згадані вище, а також метил-, пропіл- або бутилпарагідроксибензойну кислоту, бетаїн, хлоргексидин, бензалконію хлорид і тому подібне. Можна також використовувати різні матриці для доставки сповільненого вивільнення. Зазвичай доза, яку потрібно наносити на волосисту частину голови, знаходиться в діапазоні від приблизно 0,1 нг до приблизно 100 мг на добу, переважніше від приблизно 1 нг до приблизно 10 мг на добу і найпереважніше від приблизно 10 нг до приблизно 1 мг на добу залежно від сполуки і від препарату. Для досягнення добової кількості лікарського засобу залежно від препарату сполуки можна вводити один раз або кілька разів на добу з антиоксидантами або без них. Для місцевого застосування використовують креми, тверді мазі, гелі, розчини або суспензії і так далі, що містять сполуки, розкриті в даній заявці. Місцеві препарати можуть, як правило, складатися з фармацевтичного носія, сорозчинника, емульгатора, підсилювача проникності, системи консервантів і пом'якшувальної речовини. Актуальна доза активних сполук згідно даного винаходу залежить від конкретної сполуки і від стану, предмета лікування; вибір відповідної дози знаходиться в межах компетенції фахівця в даній області техніки. Сполуки, розкриті в даній заявці, також корисні в комбінації з іншими лікарськими засобами, корисними для лікування глаукоми або інших станів. Приклади Схема 1 12 UA 103616 C2 5 10 15 20 25 30 Приклад 1 Стадія 1. Арилювання 1 з одержанням 2 Розчин аміду 1 (3,30 г, 14,4 моль) в 1,4-діоксані (25 мл) додавали до суміші 4,5біс(трифенілфосфіно)-9,9-діметилксантена (Xantphos, 600 мг, 1,04 моль), Pd2(dba) 3 (317 мг, 0,35 моль) і Cs2CO3 (6,46 г, 19,8 моль). Додавали 1-бром-4-трет-бутилбензол (2,40 мл, 13,8 моль), і реакційну суміш продували азотом. Суміш нагрівали із зворотним холодильником протягом 19 год., потім охолоджували до кт (кімнатної температури). Потім реакційну суміш фільтрували через целіт, промиваючи CH2Cl2, і фільтрат концентрували у вакуумі. В результаті очищення залишку колоночною флеш-хроматографією на силікагелі (10 % (20 % EtOAc/гексан, градієнт) одержали 3,53 г (71 %) бажаного продукту 2. Стадія 2. Видалення захисту 2 з одержанням 3 HF-піридін (5 мл) додавали до розчину силілового ефіру 2 (3,53 г, 9,76 моль) в MECN (20 мл) в пластиковій пляшці. Реакційну суміш перемішували при кт протягом 5 год., потім гасили насиченим водним NaHCO3 (250 мл). Суміш екстрагували EtOAc (3 × 100 мл). Об'єднані екстракти промивали сольовим розчином (150 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі з одержанням 2,14 г (89 %) бажаного продукту 3. Стадія 3. Алкілування 3 з одержанням ефіру 4 Гідрид натрію (11 мг, 0,46 моль) додавали до розчину спирту 3 (100 мг, 0,40 моль) в ТГФ (3 мл) при 0 °C в атмосфері азоту. Після 1 год. при 0 °C додавали метил-5-бромвалерат (67 мкл, 0,47 моль), і реакційній суміші давали нагрітися до кт. Після 3 год. аналіз ТШХ (тонкошарова хроматографія) показав велику частину початкового спирту, що залишився, і додавали іншу порцію броміду (67 мкл, 0,47 моль). Після сумарного часу реакції 22 год. реакційну суміш гасили 1 н. HCl і екстрагували EtOAc (3 × 25 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною флешхроматографією на силікагелі (40 % EtOAc/гексан (EtOAc, градієнт) одержали 19 мг (13 %) бажаного ефіру. Стадія 4. Обмилення з одержанням 4 Водний гідроксид літію (1 н., 0,5 мл) додавали до розчину ефіру із стадії 3 вище (12,3 мг, 0,034 моль) в ТГФ (0,7 мл). Після 2,5 год. при кт реакційну суміш підкисляли 0,25 M HCl (5 мл), потім екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі з одержанням 10,2 мг (86 %) сполуки 4. 13 UA 103616 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 5. Сполуки 8a і 8b Триетиламін і етилхлорформіат послідовно додавали до розчину сполуки 4 в CH 2Cl2 при кімнатній температурі. Через 2,5 год. додавали триетиламін і етилгліколь. Після перемішування протягом ночі при кімнатній температурі реакційну суміш розподіляли між H 2O і CH2Cl2. Фази розділяли, і водну фазу екстрагували CH 2Cl2 (2x). Об'єднану органічну фазу промивали 1 н. HCl, потім висушували (MgSO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (10 % CH3OH/CH2Cl2) одержали сполуки 8a. Триетиламін і етилхлорформіат послідовно додавали до розчину сполуки 4 в CH 2Cl2 при кімнатній температурі. Через 2,5 год. додавали триетиламін і 4-(2-гідроксиетил) -морфін. Після перемішування протягом ночі при кімнатній температурі реакційну суміш розподіляли між H 2O і CH2Cl2. Фази розділяли, і водну фазу екстрагували CH 2Cl2 (2x). Об'єднану органічну фазу промивали 1 н. HCl, потім висушували (MgSO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (10 % CH3OH/CH2Cl2) одержали сполуки 8b. Приклад 2 Стадія 1. Алкілування 3 з одержанням ефіру 5 Гідрид калію (23,4 мг, 0,58 моль) і 18-краун-6 (167 мг, 0,63 моль) послідовно додавали до розчину спирту 3 (130 мг, 0,53 моль) в ТГФ (3 мл) при 0 °C. Після 1 год. при 0 °C розчин метил3-(хлорметил) бензоату (одержаного з відповідного хлорангідриду, піридину і метанолу: див. J. Org. Chem. 1988, 53, 2548-2552; 116 мг, 0,63 моль) в ТГФ (1,5 мл) додавали через канюлю, і реакційній суміші давали нагрітися до кт. Через 22,5 год. реакційну суміш гасили 0,1 н. HCl (10 мл) і екстрагували EtOAc (3 × 15 мл). Об'єднані екстракти промивали насиченим водним NaHCO3 (15 мл) і сольовим розчином (15 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (30 % (50 % EtOAc/гексан, градієнт) одержали 66 мг (32 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 5 Водний гідроксид літію (1 н., 0,4 мл) додавали до розчину ефіру із стадії 1 вище (33,5 мг, 0,085 моль) в ТГФ (0,75 мл). Після 3,5 год. при кт реакційну суміш підкисляли 0,25 M HCl (5 мл), потім екстрагували CH2Cl2 (3 × 10 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (2 % MeOH/CH2Cl2) з подальшою препаративною тонкошаровою хроматографією (10 % MeOH/CH2Cl2) одержали 6,6 мг (20 %) сполуки 5. Стадія 3. Сполуки 9a і 9b Сполуки 9a і 9b одержували із сполуки 5 відповідно до прикладу 1, стадія 5. Приклад 3 Стадія 1. Алкілування 3 з одержанням ефіру 6 Гідрид калію (27 мг, 0,67 моль) і 18-краун-6 (193 мги, 0,73 моль) послідовно додавали до розчину спирту 3 (150 мг, 0,61 моль) в ТГФ (4 мл) при 0 °C. Після 1 год. при 0 °C розчин етил-5хлорметилфуран-2-карбоксилату (наявного в продажі від Aldrich Chemical Company, 138 мг, 0,73 моль) в ТГФ (1 мл) додавали через канюлю, і реакційній суміші давали нагрітися до кт. Через 18,5 год. реакційну суміш гасили 0,25 н. HCl (10 мл) і екстрагували EtOAc (3 × 15 мл). Об'єднані екстракти промивали сольовим розчином (20 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (20 % (50 % EtOAc/гексан, градієнт) одержали 78 мг (32 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 6 Водний гідроксид літію (1 н., 0,5 мл) додавали до розчину ефіру із стадії 1 вище (66,7 мг, 0,17 моль) в ТГФ (0,5 мл). Після 3 год. при кт реакційну суміш підкисляли 1 н. HCl (2 мл), потім екстрагували CH2Cl2 (3 × 10 мл). Об'єднані екстракти висушували (Na 2SO4), фільтрували і концентрували у вакуумі з одержанням 54,4 мг (88 %) сполуки 6. Стадія 3. Сполуки 10a і 10b Сполуки 10a і 10b одержують із сполуки 6 відповідно до прикладу 1, стадія 5. Приклад 4 Стадія 1. Алкілування 3 з одержанням ефіру 7 Гідрид калію (25,2 мг, 0,63 моль) і 18-краун-6 (181 мг, 0,68 моль) послідовно додавали до розчину спирту 3 (140 мг, 0,57 моль) в ТГФ (4 мл) при 0 °C. Після 1,5 год. при 0 °C розчин метил5-хлорметилтіофен-2-карбоксилату (одержаного відповідно до способів, описаних в WO2004/037808; 130 мг, 0,68 моль) в ТГФ (1,5 мл) додавали через канюлю, і реакційній суміші давали нагрітися до кт. Через 20 год. реакційну суміш гасили 0,25 н. HCl (15 мл) і екстрагували EtOAc (3 × 20 мл). Об'єднані екстракти промивали сольовим розчином (30 мл), потім висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку 14 UA 103616 C2 5 10 15 20 25 колоночною хроматографією на силікагелі (20 % (50 % EtOAc/гексан, градієнт) одержали 40,7 мг (18 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 7 Водний гідроксид літію (1 н., 0,4 мл) додавали до розчину ефіру із стадії 1 вище (37 мг, 0,092 моль) в ТГФ (0,75 мл). Після 18 год. при кт реакційну суміш підкисляли 1 н. HCl (7 мл), потім екстрагували CH2Cl2 (3 × 10 мл). Об'єднані екстракти висушували (Na 2SO4), фільтрували і концентрували у вакуумі з одержанням 22,3 мг (62 %) сполуки 7. Стадія 3. Сполуки 11a і 11b Сполуки 11a і 11b одержують із сполуки 7 відповідно до прикладу 1, стадія 5. Схема 2 Приклад 5 Стадія 1. Окислення 3 з одержанням альдегіду 12 Молекулярні сита (4Å, 300 мг), 4-метилморфоліну N-оксид (427 мг, 3,64 моль) і тетрапропіламонію перрутенат (250 мг, 0,71 моль) послідовно додавали до розчину спирту 3 (600 мг, 2,43 моль) в CH2Cl2 (15 мл) при кт. Через 23 год. реакційну суміш фільтрували через целіт, промиваючи CH2Cl2 (10 мл). Фільтрат концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (CH 2Cl2 10 % EtOAc/CH2Cl2, градієнт) одержали 92 мг (15 %) бажаного альдегіду 12. Стадія 2. Реакція Віттіга 12 з одержанням 13 Біс(триметилсиліл) амід калію (0,5 M в PhMe, 1,92 мл, 0,96 моль) додавали до розчину альдегіду 12 (86 мг, 0,35 моль) в ТГФ (2 мл) при кт. Після 15 хв при кт реакційну суміш охолоджували до -55 °C протягом 10 хв, після чого додавали розчин 5карбоксипентилтрифенілфосфонію броміду (207 мг, 0,45 моль) через канюлю. Після 10 хв при 55 °C реакційній суміші давали нагрітися до кт. Після 18 год. при кт реакційну суміш гасили насиченим водним NH4Cl (15 мл) і екстрагували EtOAc (3 × 15 мл). Об'єднані екстракти промивали сольовим розчином (20 мл), висушували (Na2SO4), фільтрували і концентрували у 15 UA 103616 C2 5 10 15 вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 10,5 мг (9 %) бажаного алкену 13. Стадія 3. Гідрогенізація 13 з одержанням 14 Паладій на вуглеці (10 мас. %, 2 мг) додавали до розчину алкену 13 (5,8 мг, 0,017 моль) в MEOH (1 мл). Встановлювали атмосферу водню шляхом відкачування повітря і повторного заповнення воднем (3x), і реакційну суміш перемішували під балоном водню протягом 18 год. Реакційну суміш фільтрували через целіт, промиваючи MeOH, і фільтрат концентрували у вакуумі з одержанням 4,1 мг (70 %) сполуки 14. Стадія 4. Сполуки 15a і 15b Сполуки 15a і 15b одержують із сполуки 14 відповідно до прикладу 1, стадія 5. Схема 3 Приклад 6 16 UA 103616 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 1. Арилювання 1 з одержанням 17 Розчин аміду 1 (2,89 г, 12,60 моль) в 1,4-діоксані (20 мл), а потім розчин 1-(4метоксибензилоксиметил)-4-бромбензолу (16: синтез див. в патенті США № 7091231, включений за допомогою посилання; 3,88 г, 12,63 моль) послідовно додавали до суміші Xantphos (877 мг, 1,52 моль), Pd2(dba) 3 (463 мг, 0,51 моль) і Cs2CO3 (3,2 г, 9,82 моль) через канюлю. Реакційну суміш продували азотом, а потім нагрівали із зворотним холодильником протягом 22 год. Реакційній суміші давали охолодитися до кт, потім фільтрували через целіт, промиваючи CH2Cl2, і фільтрат концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (5 % (25 % EtOAc/гексан, градієнт) одержали 1,70 г (30 %) бажаного продукту 17. Стадія 2. Видалення захисту 17 з одержанням 18 HF-піридін (5 мл) додавали до розчину силілового ефіру 17 (1,38 г, 3,03 моль) в MECN (15 мл) в пластиковій пляшці при 0 °C. Реакційну суміш перемішували при 0 °C протягом 3 год., потім гасили насиченим водним NaHCO3 (250 мл). Суміш екстрагували EtOAc (3 × 100 мл). Об'єднані екстракти промивали сольовим розчином (100 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (1 % (3 % MeOH/CH2Cl2, градієнт) одержали 464 мг (45 %) бажаного спирту 18. Стадія 3. Алкілування спирту 18 з одержанням 19 Гідрид калію (44 мг, 1,10 моль) і 18-краун-6 (365 мг, 1,38 моль) послідовно додавали до розчину спирту 18 (315 мг, 0,92 моль) в ТГФ (4 мл) при 0 °C. Після 1 год. при 0 °C додавали етил-5-хлорметилфуран-2-карбоксилат (0,28 мл, 1,82 моль), і реакційній суміші давали нагрітися до кт. Через 22 год. реакційну суміш гасили 0,5 н. HCl (20 мл) і екстрагували EtOAc (3 × 25 мл). Об'єднані екстракти промивали сольовим розчином (50 мл), потім висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (20 % EtOAc/гексан (EtOAc, градієнт) одержали 148 мг (32 %) бажаного продукту 19. Стадія 4. Окислювальне видалення захисту 19 з одержанням 20 і 21 2,3-дихлор-5,6-диціано-1,4-бензохінон (DDQ, 82 мг, 0,36 моль) додавали до суміші 19 (143 мг, 0,29 моль) в CH2Cl2 (4 мл) і водах (0,2 мл). Через 3 год. ТШХ показала, що початкова речовина залишилася, і додавали іншу порцію DDQ (82 мг, 0,36 моль). Ще через 1,25 год. реакційну суміш гасили насиченим водним NaHCO 3 (20 мл). Суміш екстрагували EtOAc (3 × 20 мл). Об'єднані екстракти промивали сольовим розчином (20 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (CH2Cl2 (3 % MeOH/CH2Cl2, градієнт) одержали 38 мг (35 %) бажаного спирту 20 і 61 мг домішки альдегіду 21. Альдегід 21 додатково очищали препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) з одержанням 48,7 мг (45 %) альдегіду 21. Стадія 5. Окислення 20 з одержанням 21 Молекулярні сита (4A, 3 мг), 4-метилморфоліну N-оксид (12,6 мг, 0,11 моль) і тетрапропіламонію перрутенат (2,5 мг, 0,007 моль) послідовно додавали до розчину спирту 20 (26,8 мг, 0,072 моль) в CH2Cl2 (1,5 мл) при кт. Через 20 хв реакційну суміш фільтрували через целіт, промиваючи CH2Cl2 (5 мл). Фільтрат концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 9,6 мг (36 %) бажаного альдегіду 21. Стадія 6. Реакція Гриньяра з 21 з одержанням ефіру 22 Пентілмагнію бромід (2,0 M в Et2O, 32 мкл, 0,064 моль) додавали до розчину альдегіду 21 (21,7 мг, 0,058 моль) в ТГФ (0,4 мл) при -40 °C у атмосфері азоту. Через 25 хв реакційну суміш гасили насиченим водним NH4Cl і екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 10,6 мг (41 %) бажаного ефіру. Стадія 7. Обмилення з одержанням 22 Водний гідроксид літію (1 н., 0,1 мл) додавали до розчину ефіру із стадії 6 вище (8,8 мг, 0,02 моль) в ТГФ (0,2 мл). Після 1 год. при кт реакційну суміш підкисляли 0,5 н. HCl (1 мл), потім екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі з одержанням 8,2 мг (99 %) сполуки 22. Стадія 8. Сполуки 25a і 25b Сполуки 25a і 25b одержують із сполуки 22 відповідно до прикладу 1, стадія 5. Приклад 7 17 UA 103616 C2 5 10 15 20 25 30 Стадія 1. Реакція Гриньяра з 21 з одержанням ефіру 23 Ізопропілмагнію хлорид (2,0 M в ТГФ, 31 мкл, 0,062 моль) додавали до розчину альдегіду 21 (20,5 мг, 0,055 моль) в ТГФ (0,4 мл) при -40 °C у атмосфері азоту. Через 35 хв реакційну суміш гасили насиченим водним NH4Cl і екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 5 мг (22 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 23 Водний гідроксид літію (1 н., 0,05 мл) додавали до розчину ефіру із стадії 1 вище (3,1 мг, 0,007 моль) в ТГФ (0,15 мл). Після 1 год. при кт реакційну суміш підкисляли 0,2 н. HCl (1 мл), потім екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі з одержанням 2,5 мг (86 %) сполуки 23. Стадія 3. Сполуки 26a і 26b Сполуки 26a і 26b одержують із сполуки 23 відповідно до прикладу 1, стадія 5. Приклад 8 Стадія 1. Реакція Гриньяра з 21 з одержанням ефіру 24 Бензилмагнію хлорид (2,0 M в ТГФ, 14 мкл, 0,028 моль) додавали до розчину альдегіду 21 (9,6 мг, 0,026 моль) в ТГФ (0,3 мл) при -40 °C у атмосфері азоту. Через 45 хв реакційну суміш нагрівали до 0 °C. Після 25 хв при 0 °C реакційну суміш гасили насиченим водним NH 4Cl і екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (7 % MeOH/CH2Cl2) одержали 3,3 мг (28 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 24 Водний гідроксид літію (1 н., 0,05 мл) додавали до розчину ефіру із стадії 1 вище (2,4 мг, 0,005 моль) в ТГФ (0,15 мл). Після 2,5 год. при кт реакційну суміш підкисляли 0,2 н. HCl (1 мл), потім екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі з одержанням 2,2 мг (98 %) сполуки 24. Стадія 3. Сполуки 27a і 27b Сполуки 27a і 27b одержують із сполуки 24 відповідно до прикладу 1, стадія 5. Схема 4 18 UA 103616 C2 5 10 15 20 25 30 35 Приклад 9 Стадія 1. Алкілування 18 з одержанням 28 Гідрид калію (55,5 мг, 1,38 моль) і 18-краун-6 (456 мг, 1,73 моль) послідовно додавали до розчину спирту 18 (394 мг, 1,15 моль) в ТГФ (5 мл) при 0 °C. Після 1 год. при 0 °C додавали розчин метил-5-хлорметилтіофен-2-карбоксилату (439 мг, 2,30 моль) в ТГФ (2 мл) через канюлю, і реакційній суміші давали нагрітися до кт. Через 19 год. аналіз ТШХ показав початкову речовину, що залишилася. Додавали іншу порцію KH (20 мг, 0,50 моль), і реакційну суміш нагрівали при 50 °C. Після 2 год. при 50 °C реакційну суміш охолоджували і гасили 0,5 н. HCl (20 мл) і екстрагували EtOAc (3 × 25 мл). Об'єднані екстракти промивали сольовим розчином (50 мл), потім висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (15 % EtOAc/гексан (EtOAc, градієнт) одержали 108 мг (19 %) бажаного продукту 28. Стадія 2. Окислювальне видалення захисту 28 з одержанням 29 і 30 DDQ (91 мг, 0,40 моль) додавали до суміші 28 (98 мг, 0,20 моль) в CH 2Cl2 (3 мл) і води (0,15 мл). Через 4,5 год. реакційну суміш гасили насиченим водним NaHCO 3 (15 мл) і екстрагували EtOAc (3 × 25 мл). Об'єднані екстракти промивали сольовим розчином (40 мл), потім висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 14,4 мг (19 %) спирту 29 і 16,2 мг (22 %) альдегіду 30. Стадія 3. Реакція Гриньяра з 30 з одержанням ефіру 31 Пентілмагнію бромід (2,0 M в Et2O, 22 мкл, 0,044 моль) додавали до розчину альдегіду 30 (11 мг, 0,029 моль) в ТГФ (0,2 мл) при -40 °C у атмосфері азоту. Через 1,5 год. реакційну суміш гасили насиченим водним NH4Cl і екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 4,8 мг (37 %) бажаного ефіру. Стадія 4. Обмилення з одержанням 31 Естеразу печінки кролика (134 ед./мг, 1 мг) додавали до розчину ефіру із стадії 3 вище (3,6 мг, 0,008 моль) в MeCN (0,1 мл) і буфері pH 7,2 (2,5 мл). Після 16,5 ч при кт реакційну суміш розбавляли MeCN (7 мл) і концентрували у вакуумі. Залишок суспендували в CH2Cl2 і фільтрували через ватяну пробку. Фільтрат концентрували у вакуумі з одержанням 2,0 мг (57 %) сполуки 31. Стадія 5. Сполуки 32a і 32b Сполуки 32a і 32b одержують із сполуки 31 відповідно до прикладу 1, стадія 5. Схема 5 19 UA 103616 C2 5 10 15 20 25 30 Приклад 10 Стадія 1. Алкілування 18 з одержанням 33 Гідрид калію (16 мг, 0,39 моль) додавали до розчину спирту 18 (112 мг, 0,33 моль) в ТГФ (1,0 мл) при 0 °C. Після 1 год. при 0 °C послідовно додавали 18-краун-6 (114 мги, 0,43 моль), йодид калію (5 мг, 0,03 моль) і розчин метил-3-хлорметилбензоату (121 мг, 0,66 моль) в ТГФ (0,5 мл). Реакційній суміші давали нагрітися до кт. Через 19 год. реакційну суміш гасили 0,1 н. HCl (10 мл) і екстрагували EtOAc (3 × 10 мл). Об'єднані екстракти промивали сольовим розчином (15 мл), потім висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (20 % EtOAc/Гексан EtOAc) одержали 23 мг (14 %) бажаного продукту 33. Стадія 2. Окислювальне видалення захисту 33 з одержанням 34 DDQ (23 мг, 0,10 моль) додавали до суміші 33 (23 мг, 0,047 моль) в CH 2Cl2 і водах (20:1, 0,25 мл). Через 3,75 год. реакційну суміш гасили насиченим водним NaHCO 3 (10 мл) і екстрагували EtOAc (3 × 7 мл). Об'єднані екстракти промивали сольовим розчином (10 мл), потім висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (80 % EtOAc/Hex) одержали 13 мг (58 %) альдегіду 34. Стадія 3. Реакція Гриньяра з 34 з одержанням ефіру 35 Пентілмагнію бромід (2,0 M в Et2O, 50 мкл, 0,10 моль) додавали до розчину альдегіду 34 (12,4 мг, 0,034 моль) в ТГФ (0,1 мл) при -40 °C у атмосфері азоту. Через 1 год. реакційну суміш гасили насиченим водним NH4Cl (7 мл) і екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 8,6 мг (58 %) бажаного ефіру. Стадія 4. Обмилення з одержанням 35 Естеразу печінки кролика (134 од./мг, 1 мг) додавали до розчину ефіру із стадії 3 вище (7,4 мг, 0,017 моль) в MeCN (0,1 мл) і буфері pH 7,2 (2,5 мл). Після 18 год. при кт реакційну суміш розбавляли MeCN (7 мл) і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 1,5 мг (21 %) сполуки 35. Стадія 5. Сполуки 36a і 36b Сполуки 36a і 36b одержують із сполуки 35 відповідно до прикладу 1, стадія 5. Схема 6 35 Приклад 11 20 UA 103616 C2 5 10 15 20 25 30 35 40 45 50 55 Стадія 1. Реакція Гриньяра з 30 з одержанням ефіру 37 н-Бутилмагнію хлорид (2,0 M в ТГФ, 41 мкл, 0,082 моль) додавали до розчину альдегіду 30 (20,2 мг, 0,054 моль) в ТГФ (0,1 мл) при -40 °C у атмосфері азоту. Через 1 год. реакційну суміш гасили насиченим водним NH4Cl (10 мл) і екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 12,3 мг (53 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 37 Естеразу печінки кролика (134 од./мг, 1 мг) додавали до розчину ефіру із стадії 1 вище (11,2 мг, 0,026 моль) в MeCN (0,1 мл) і буфері pH 7,2 (3,0 мл). Після 19 год. при кт реакційну суміш розбавляли MeCN (10 мл) і концентрували у вакуумі. Залишок суспендували в 5 % MeOH/CH2Cl2 і фільтрували через ватяну пробку. Фільтрат концентрували у вакуумі з одержанням 10,7 мг (99 %) сполуки 37. Стадія 3. Сполуки 41a і 41b Сполуки 41a і 41b одержують із сполуки 37 відповідно до прикладу 1, стадія 5. Приклад 12 Стадія 1. Реакція Гриньяра з 30 з одержанням ефіру 38 н-Гексилмагнію бромід (2,0 M в Et2O, 100 мкл, 0,20 моль) додавали до розчину альдегіду 30 (24,6 мг, 0,054 моль) в ТГФ (0,12 мл) при -40 °C у атмосфері азоту. Через 1,5 год. реакційну суміш гасили насиченим водним NH4Cl (10 мл) і екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 16,3 мг (54 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 38 Естеразу печінки кролика (134 од./мг, 1 мг) додавали до розчину ефіру із стадії 1 вище (13 мг, 0,028 моль) в MeCN (0,1 мл) і буфері pH 7,2 (3,0 мл). Після 18 год. при кт реакційну суміш розбавляли MeCN (10 мл) і концентрували у вакуумі. Залишок суспендували в 5 % MeOH/CH2Cl2 і фільтрували через ватяну пробку. Фільтрат концентрували у вакуумі з одержанням 11 мг (87 %) сполуки 38. Стадія 3. Сполуки 42a і 42b Сполуки 42a і 42b одержують із сполуки 38 відповідно до прикладу 1, стадія 5. Приклад 13 Стадія 1. Реакція Гриньяра з 30 з одержанням ефіру 39 н-Пропілмагнію хлорид (2,0 M в Et2O, 92 мкл, 0,18 моль) додавали до розчину альдегіду 30 (22,9 мг, 0,061 моль) в ТГФ (0,12 мл) при -40 °C у атмосфері азоту. Через 1,75 год. реакційну суміш гасили насиченим водним NH4Cl (10 мл) і екстрагували CH2Cl2 (3 × 7 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 13 мг (51 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 39 Естеразу печінки кролика (134 од./мг, 1 мг) додавали до розчину ефіру із стадії 1 вище (10,8 мг, 0,026 моль) в MeCN (0,1 мл) і буфері pH 7,2 (3,0 мл). Після 17 год. при кт реакційну суміш розбавляли MeCN (10 мл) і концентрували у вакуумі. Залишок суспендували в 5 % MeOH/CH2Cl2 і фільтрували через ватяну пробку. Фільтрат концентрували у вакуумі з одержанням 10,4 мг (99 %) сполуки 39. Стадія 3. Сполуки 43a і 43b Сполуки 43a і 43b одержують із сполуки 39 відповідно до прикладу 1, стадія 5. Приклад 14 Стадія 1. Реакція Гриньяра з 30 з одержанням ефіру 40 Етилмагнію хлорид (2,0 M в Et2O, 24 мкл, 0,048 моль) додавали до розчину альдегіду 30 (5,8 мг, 0,016 моль) в ТГФ (0,1 мл) при -40 °C у атмосфері азоту. Через 1,25 год. реакційну суміш гасили насиченим водним NH4Cl (5 мл) і екстрагували CH2Cl2 (3 × 5 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (5 % MeOH/CH2Cl2) одержали 2,5 мг (40 %) бажаного ефіру. Стадія 2. Обмилення з одержанням 40 Естеразу печінки кролика (134 од./мг, 1 мг) додавали до розчину ефіру із стадії 1 вище (2,8 мг, 0,007 моль) в MeCN (0,1 мл) і буфері pH 7,2 (2,5 мл). Після 17 год. при кт реакційну суміш розбавляли MeCN (10 мл) і концентрували у вакуумі. Залишок суспендували в 5 % MeOH/CH2Cl2 21 UA 103616 C2 5 10 15 20 і фільтрували через ватяну пробку. Фільтрат концентрували у вакуумі з одержанням 2,7 мг (99 %) сполуки 40. Стадія 3. Сполуки 44a і 44b Сполуки 44a і 44b одержують із сполуки 40 відповідно до прикладу 1, стадія 5. Схема 7 Приклад 15 Стадія 1. Окислення 45 з одержанням альдегіду 46 Періодінан Десса-Мартіна (1,63 г, 3,83 моль) додавали до розчину спирту 45 (1,43 г, 3,48 моль) в CH2Cl2 (12 мл) при кт в атмосфері азоту. Після 1 год. при кт реакційну суміш гасили насиченим водним NaHCO3 і насиченим водним NaHSO3 (1:1, 100 мл). Суміш екстрагували CH2Cl2 (3 × 150 мл). Об'єднані екстракти висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною флеш-хроматографією на силікагелі (2 % MeOH/CH2Cl2) одержали 915 мг (64 %) бажаного альдегіду 46. Стадія 2. Метіленірування 46 з одержанням алкена 47 Реагент Теббе (0,5 M в ТГФ, 4,86 мл, 2,43 моль) додавали до розчину альдегіду 46 (677 мг, 1,65 моль) в ТГФ (11 мл) при -40 °C у атмосфері азоту. Після 1 год. при -40 °C реакційну суміш гасили додаванням водного 2 н. NаOH (1,65 мл) і енергійно перемішували протягом ночі з додаванням ТГФ (15 мл). Суміш фільтрували через целіт, промиваючи надлишком EtOAc. Фільтрат концентрували у вакуумі. В результаті очищення залишку колоночною флеш 22 UA 103616 C2 5 10 15 20 25 30 хроматографією на силікагелі (30 % 50 % EtOAc/Hex) одержали 254 мг (38 %)) бажаного алкену 47. Стадія 3. Реакція обміну 47 з одержанням алкену 48 Бензиліден[1,3-біс(2,4,6-триметилфеніл)-2імідазолідиниліден]дихлор(трициклогексилфосфін)-рутеній (каталізатор Граббса, 2-го покоління, 48 мг, 0,057 моль) додавали до розчину алкена 47 (230 мг, 0,56 моль) і метил 5алілтіофен-2-карбоксилату (приклад одержання 3, 206 мг, 1,13 моль) в CH 2Cl2 (3,0 мл). Реакційну суміш нагрівали із зворотним холодильником протягом 4 год. Реакційну суміш охолоджували до кт і додавали додаткову кількість каталізатора (48 мг, 0,057 моль) і метил-5алілтіофен-2-карбоксилату (100 мг, 0,55 моль). Суміш нагрівали в перебіг ще 18 год. із зворотним холодильником, потім охолоджували і концентрували у вакуумі. В результаті очищення залишку колоночною флеш-хроматографією на силікагелі (5 % 50 % EtOAc/Hex градієнт) одержали 100 мг (32 %) бажаного алкена 48 паралельно з 130 мг (57 %) початкового алкену 47. Стадія 4. Окислювальне видалення захисту 48 з одержанням 49 і 50 DDQ (58 мг, 0,26 моль) додавали до суміші 48 (130 мг, 0,23 моль) в CH 2Cl2 (3,1 мл) і водах (0,16 мл) при 0 °C в атмосфері азоту. Через 45 хв реакційну суміш гасили насиченим водним NaHCO3 (40 мл). Суміш екстрагували EtOAc (3 × 30 мл). Об'єднані екстракти промивали сольовим розчином (25 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною флеш-хроматографією на силікагелі (50 % 75 % EtOAc/Hex, градієнт) одержали 28 мг суміші початкової речовини, що не розділялася, 48 і кетону 49 і 63 мг (62 %) бажаного спирту 50. Стадія 5. Обмилення 50 з одержанням 51 Естеразу печінки кролика (134 од./мг, 1 мг) додавали до розчину ефіру 50 (3,7 мг, 0,008 моль) в MeCN (0,2 мл) і буфері pH 7,2 (2,5 мл). Після 15,5 год. при кт реакційну суміш розбавляли MeCN (8 мл) і концентрували у вакуумі. Залишок суспендували в 10 % MeOH/CH2Cl2 і фільтрували через ватяну пробку. Фільтрат концентрували у вакуумі з одержанням 3,0 мг (84 %) сполуки 51. Стадія 6. Сполуки 52a і 52b Сполуки 52a і 52b одержують із сполуки 51 відповідно до прикладу 1, стадія 5. Схема 8 23 UA 103616 C2 5 10 15 20 Приклад 16 Стадія 1. Окислення 38/39 з одержанням 39 DDQ (5,5 мг, 0,024 моль) додавали до суміші ефіру 48 і кетону 49 (6,8 мг, 0,012 моль) в CH2Cl2 і воді (20:1, 0,25 мл) при кімнатній температурі в атмосфері азоту. Через 1,5 год. реакційну суміш гасили насиченим водним NaHCO 3 (5 мл). Суміш екстрагували EtOAc (3 × 5 мл). Об'єднані екстракти промивали сольовим розчином (5 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (60 % EtOAc/Hex) одержали 1,5 мг (28 %) бажаного кетону 49. Стадія 2. Гідрогенізація 49 з одержанням ефіру 53 Паладій на вуглеці (10 % мас/мас, 1 мг) додавали до розчину алкена 49 (1,5 мг, 0,0034 моль) в метанолі (0,5 мл). Встановлювали атмосферу водню шляхом відкачування повітря і повторного заповнення воднем (3x), і реакційну суміш перемішували під балоном водню. Після 2 год. при кт реакційну суміш фільтрували через целіт, промиваючи MeOH, і фільтрат концентрували у вакуумі з одержанням 1,3 мг (86 %) бажаного ефіру 53. Стадія 3. Обмилення 53 з одержанням 54 Естеразу печінки кролика (134 од./мг, 1 мг) додавали до розчину ефіру 53 (1,3 мг, 0,0029 моль) в MeCN (0,1 мл) і буфері pH 7,2 (2,5 мл). Після 23 год. при кт реакційну суміш розбавляли MeCN (10 мл) і концентрували у вакуумі. Залишок суспендували в 10 % MeOH/CH2Cl2 і фільтрували через ватяну пробку. Фільтрат концентрували у вакуумі з одержанням 1,2 мг (95 %) сполуки 54. Стадія 4. Сполуки 55a і 55b Сполуки 55a і 55b одержують із сполуки 54 відповідно до прикладу 1, стадія 5. Схема 9 25 30 Приклад 17 Естеразу печінки кролика (134 од./мг, 1 мг) додавали до розчину ефіру 53 (0,6 мг, 0,014 моль) в MeCN (0,1 мл) і буфері pH 7,2 (2,5 мл). Після 17 год. при кт реакційну суміш розбавляли MeCN (8 мл) і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (4 % MeOH/CH2Cl2) одержали 1 мг (17 %) сполуки 56. Сполуки 57a і 57b одержують із сполуки 56 відповідно до прикладу 1, стадія 5. Схема 10 24 UA 103616 C2 5 10 15 20 Приклад 18 Два діастереомера (58 ~100 мг) розділяли на приладі для ВЕРХ Waters 600, використовуючи детектор Waters 2996 PDA і колонку Whatman Partisil® 10 M20/50, 22 мм 500 мм (кат. № 4232220, Q.A. № 3TA02D80). Використовуючи 60 % EtOAc/Hex як елюент і швидкість струму 15 мл/хв, перший діастереомер (59, 32,8 мг виділено сумарно) елюював при 55-60 хв, а другий діастереомер (60, 52,6 мг виділено сумарно) елюював при 61-70 хв. Приклад 19 Водний 1 н. гідроксид літію (0,05 мл, 0,05 моль) додавали до розчину діастереомера ефіру, що елюює швидше, 59 (2,7 мг, 0,0057 моль) в ТГФ (0,1 мл), і суміш нагрівали із зворотним холодильником протягом ночі. Через 17 год. реакційну суміш охолоджували до кт, підкисляли 0,05 н. водною HCl (5 мл) і екстрагували CH2Cl2 (3 × 5 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі з одержанням 2,5 мг (100 %) сполуки 61. Сполуки 63a і 63b одержують із сполуки 61 відповідно до прикладу 1, стадія 5. Приклад 20 Водний 1 н. гідроксид літію (0,05 мл, 0,05 моль) додавали до розчину діастереомеру ефіру, що елюює повільніше, 60 (2,8 мг, 0,0059 моль) в ТГФ (0,1 мл), і суміш нагрівали із зворотним холодильником протягом ночі. Через 23 год. реакційну суміш охолоджували до кт, підкисляли 0,05 н. водною HCl (5 мл) і екстрагували CH2Cl2 (3 × 5 мл). Об'єднані екстракти висушували (Na2SO4), фільтрували і концентрували у вакуумі з одержанням 1,7 мг (67 %) сполуки 62. Сполуки 64a і 64b одержують із сполуки 62 відповідно до прикладу 1, стадія 5. Схема 11 25 UA 103616 C2 5 10 15 20 25 Приклад 21 Два діастереомера (65 ~43 мг) розділяли на приладі для ВЕРХ Waters 600, використовуючи детектор Waters 2996 PDA і колонку Whatman Partisil® 10 M20/50, 22 мм 500 мм (кат. № 4232220, Q.A. № 3TA02D80). Використовуючи 60 % EtOAc/Hex як елюент і швидкість струму 15 мл/хв, перший діастереомер (66, 16 мг) елюював при 69-75 хв, а другий діастереомер (67, 19 мг) елюював при 80-88 хв. Приклад 22 Естеразу печінки кролика (134 од./мг, 2 мг) додавали до розчину діастереомеру ефіру, що елюює швидше, 66 (16 мг, 0,036 моль) в MеCN (0,2 мл) і буфері pH 7,2 (3,0 мл). Після 18 год. при кт реакційну суміш розбавляли MеCN (10 мл) і концентрували у вакуумі. Залишок розбавляли CH2Cl2 (5 мл), фільтрували через пробку з скловолокна і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (EtOAc 25 % MeOH/EtOAc, градієнт) одержали 12 мг (77 %) сполуки 68. Сполуки 70a і 70b одержують із сполуки 68 відповідно до прикладу 1, стадія 5. Приклад 23 Естеразу печінки кролика (134 од./мг, 2 мг) додавали до розчину діастереомера ефіру, що елюює повільніше, 67 (19 мг, 0,043 моль) в MеCN (0,2 мл) і буфері pH 7,2 (3,0 мл). Після 18 год. при кт реакційну суміш розбавляли MеCN (10 мл) і концентрували у вакуумі. Залишок розбавляли CH2Cl2 (5 мл), фільтрували через пробку з скловолокна і концентрували у вакуумі. В результаті очищення залишку препаративною тонкошаровою хроматографією (EtOAc 25 % MeOH/EtOAc, градієнт) одержали 10,5 мг (57 %) сполуки 69. Сполуки 71a і 71b одержують із сполуки 69 відповідно до прикладу 1, стадія 5. Схема 12 26 UA 103616 C2 5 10 15 Приклад 24 Стадія 1. Арилювання 1 з одержанням 72 Pd2(dba) 3 (550 мг, 0,60 моль), Xantphos (1,04 г, 180 моль) і Cs 2CO3 (5,87 г, 18,0 моль) послідовно додавали до розчину аміду 1 (3,45 г, 15,0 моль) в 1,4-діоксані (100 мл). Розчин 1-(1(4-метоксибензилоксигептил)-4-бромбензолу (приклад одержання 4, 5,30 г, 13,54 моль) у 1,4діоксані (50 мл) додавали через канюлю. Реакційну суміш продували азотом, потім нагрівали із зворотним холодильником протягом ночі. Через 17 год. реакційну суміш охолоджували до кт і фільтрували через целіт, промиваючи CH2Cl2. Фільтрат концентрували у вакуумі, і залишок очищали колоночною флеш-хроматографією на силікагелі (5 % 35 % EtOAc/Гексан, градієнт) з одержанням 5,26 г (72 %) бажаного продукту 72. Стадія 2. Видалення захисту 72 з одержанням 73 HF-піридін (8,8 мл) додавали до розчину силілового ефіру 72 (5,26 г, 9,74 моль) в MеCN (50 мл) в пластиковій пляшці при 0 °C. Після 45 хв при 0 °C реакційну суміш гасили насиченим 27 UA 103616 C2 5 10 15 20 25 30 35 40 45 водним NaHCO3 (400 мл). Суміш екстрагували EtOAc (3 × 200 мл). Об'єднані екстракти промивали сольовим розчином (200 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною флеш-хроматографією на силікагелі (CH2Cl2 5 % MeOH/CH2Cl2, градієнт) одержали 3,9 г (94 %) бажаного спирту 73 у вигляді блідо-жовтої твердої речовини. Стадія 3. Алкілування 73 з одержанням 74 У круглодонну колбу завантажували гідрид калію (30 % мас/мас в маслі, 138 мг, 1,03 моль). Речовину промивали гексанами (3 × 1 мл), потім суспендували в ТГФ (1 мл). Суміш охолоджували до 0 °C і додавали розчин спирту 73 (339 мг, 0,80 моль) в ТГФ (1,5 мл) через канюлю. Після 1 год. при 0 °C додавали розчин ізопропіл-5-хлорметилтіофен-2-карбоксилату (приклад одержання 2, 174 мг, 0,80 моль) в ТГФ (1,5 мл) через канюлю. Додавали йодид калію (14 мг, 0,08 моль), і реакційній суміші давали нагрітися до кт. Через 18 год. реакційну суміш гасили насиченим водним NH4Cl (15 мл) і екстрагували EtOAc (3 × 25 мл). Об'єднані екстракти промивали сольовим розчином (15 мл), потім висушували (Na 2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (20 % 75 % EtOAc/Гексан, градієнт), а потім препаративною тонкошаровою хроматографією (65 % EtOAc/Гексан) одержали 65 мг (14 %) бажаного продукту 74. Стадія 4. Окислювальне видалення захисту 74 з одержанням 75 DDQ (26 мг, 0,12 моль) додавали до розчину 74 (65 мг, 0,11 моль) в CH2Cl2 (1,4 мл) і воді (0,07 мл) при 0 °C в атмосфері азоту. Через 40 хв реакційну суміш гасили насиченим водним NaHCO3 (20 мл) і екстрагували EtOAc (3 × 20 мл). Об'єднані екстракти промивали сольовим розчином (15 мл), потім висушували (Na2SO4), фільтрували і концентрували у вакуумі. В результаті очищення залишку колоночною хроматографією на силікагелі (50 % (75 % EtOAc/Гексан, градієнт), а потім препаративною тонкошаровою хроматографією (60 % EtOAc/Гексан) одержали 36 мг (69 %) сполуки 75. Приклад 25 Два діастереомера (75 ~36 мг) розділяли на приладі для ВЕРХ Waters 600, використовуючи детектор Waters 2996 PDA і колонку Whatman Partisil® 10 M20/50, 22 мм 500 мм (кат. № 4232220, Q.A. № 3TA02D80). Використовуючи 60 % EtOAc/Hex як елюент і швидкість струму 15 мл/хв, перший діастереомер (76, 14,8 мг) елюював при 50-56,5 хв, а другий діастереомер (77, 16,4 мг) елюював при 56,5-70 хв. Приклад 26 Водний 1 н. гідроксид літію (0,05 мл, 0,05 моль) додавали до розчину діастереомера ефіру, що елюює швидше, 76 (3,5 мг, 0,0072 моль) в ТГФ (0,1 мл), і суміш нагрівали із зворотним холодильником протягом ночі. Через 18 год. реакційну суміш охолоджували до кт, розбавляли водою (2 мл), підкисляли 1,0 н. водною HCl (1 мл) і екстрагували EtOAc (3 × 5 мл). Об'єднані екстракти промивали сольовим розчином (5 мл), висушували (Na 2SO4), фільтрували і концентрували у вакуумі з одержанням 3,0 мг (94 %) сполуки 78. Сполуки 80a і 80b одержують із сполуки 78 відповідно до прикладу 1, стадія 5. Приклад 27 Водний 1 н. гідроксид літію (0,05 мл, 0,05 моль) додавали до розчину діастереомера ефіру, що елюює повільніше, 77 (3,5 мг, 0,0072 моль) в ТГФ (0,1 мл), і суміш нагрівали із зворотним холодильником протягом ночі. Через 18 год. реакційну суміш охолоджували до кт, розбавляли водою (2 мл), підкисляли 1,0 н. водною HCl (1 мл) і екстрагували EtOAc (3 × 5 мл). Об'єднані екстракти промивали сольовим розчином (5 мл), висушували (Na 2SO4), фільтрували і концентрували у вакуумі з одержанням 3,2 мг (99 %) сполуки 79. Сполуки 81a і 81b одержують із сполуки 79 відповідно до прикладу 1, стадія 5. Схема 13 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted gamma lactams as therapeutic agents
Автори російськоюOld, David, W., Dinh, Danny, T.
МПК / Мітки
МПК: C07D 207/26, A61P 27/06, C07D 409/12, C07D 409/06, A61K 31/4015
Мітки: терапевтичні, гамма-лактами, агенти, заміщені
Код посилання
<a href="https://ua.patents.su/51-103616-zamishheni-gamma-laktami-yak-terapevtichni-agenti.html" target="_blank" rel="follow" title="База патентів України">Заміщені гамма-лактами як терапевтичні агенти</a>