Похідні індолінфенілсульфонаміду
Номер патенту: 79003
Опубліковано: 10.05.2007
Автори: Діттріх-Венгенрот Ельке, Оттенедер Міхаель, БІШОФФ Хільмар, Вуттке Мартіна, Вольтеринг Міхаель, Хеккрот Хайке, Тілеманн Вольфганг
Формула / Реферат
1. Похідні індолінфенілсульфонаміду загальної формули (І)
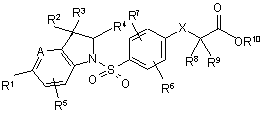 , (I)
, (I)
в якій
А означає групу C-R11 або N, в якій R11 означає водень або (С1-С4)-алкіл,
Х означає О, S або СН2,
R1 означає (С6-С10)-арил або 5-10-членний гетероарил, який містить до 3 гетероатомів з ряду N, О та/або S, які, в свою чергу, можуть бути відповідно 1-3 рази однаково або по-різному заміщені замісниками, вибраними з групи галоген, ціано, нітро, (С1-С6)-алкіл (який в свою чергу може бути заміщений гідрокси), (С1-С6)-алкокси, фенокси, бензилокси, трифторметил, трифторметокси, (С2-С6)-алкеніл, феніл, бензил, (С1-С6)-алкілтіо, (С1-С6)-алкілсульфоніл, (С1-С6)-алканоїл, (С1-С6)-алкоксикарбоніл, карбоксил, аміно, (С1-С6)-ациламіно, моно- та ді-(С1-С6)-алкіламіно та 5- або 6-членний гетероцикліл, який містить до 2 гетероатомів з ряду N, О та/або S,
або групу формули
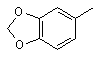 ,
,
R2 та R3 є однаковими або різними та незалежно один від одного означають водень або (С1-С6)-алкіл або разом з атомом вуглецю, до якого вони приєднані, утворюють 3-7-членне спіро-приєднане циклоалкільне кільце,
R4 означає водень або (С1-С6)-алкіл,
R5 означає водень або (С1-С6)-алкіл,
R6 означає водень або (С1-С6)-алкіл,
R7 означає водень, (С1-С6)-алкіл, (С1-С6)-алкокси або галоген,
R8 та R9 є однаковими або різними та незалежно один від одного означають водень або (С1-С4)-алкіл,
та
R10 означає водень або здатну вступати в реакцію гідролізу групу, яка може бути
розщеплена до одержання відповідної карбонової кислоти,
а також їх фармацевтично прийнятні солі, сольвати та сольвати солей.
2. Похідні індолінфенілсульфонаміду загальної формули (1) за п. 1, в якій
А означає групу C-R11 або N, в якій R11 означає водень або метил,
Х означає О або S,
R1 означає феніл або 5- або 6-членний гетероарил, який містить до 2 гетероатомів з ряду N, О та/або S, які, в свою чергу, відповідно один або два рази однаково або по-різному можуть бути заміщені замісниками, вибраними з групи фтор, хлор, ціано, (С1-С4)-алкіл, (С1-С4)-алкокси, фенокси, бензилокси, трифторметил, трифторметокси, вініл, феніл, бензил, метилтіо, метилсульфоніл, ацетил, пропіоніл, (С1-С4)-алкоксикарбоніл, аміно, ацетиламіно, моно- та ді-(С1-С4)-алкіламіно,
R2 та R3 є однаковими або різними та незалежно один від одного означають водень або (С1-С4)-алкіл або разом з атомом вуглецю, до якого вони приєднані, утворюють 5- або 6-членне спіро-приєднане циклоалкільне кільце,
R4 означає водень або метил,
R5 означає водень, метил або етил,
R6 означає водень або метил,
R7 означає водень, (С1-С4)-алкіл, (С1-С4)-алкокси, фтор або хлор,
R8 та R9 є однаковими або різними та незалежно один від одного означають водень або метил,
та
R10 означає водень.
3. Похідні індолінфенілсульфонаміду загальної формули (І) за п. 1, в якій
А означає СН або N,
Х означає О,
R1 означає феніл або піридил, які, в свою чергу, відповідно можуть бути один або два рази однаково або по-різному заміщені замісниками з групи фтор, хлор, метил, трет-бутил, метокси, трифторметил, трифторметокси, метилтіо, аміно та диметиламіно,
R2 означає водень або метил,
R3 означає метил, ізопропіл або трет-бутил,
або
R2 та R3 разом з атомом вуглецю, до якого вони приєднані, утворюють спіро-приєднане циклогексанове кільце,
R4 означає водень або метил,
R5 означає водень, метил або етил,
R6 означає водень або метил,
R7 означає метил,
R8 та R9 відповідно означають водень,
та
R10 означає водень.
4. Похідні індолінфенілсульфонаміду формули (І) за п. 1 в якій
А, R1, R4, R5 та R6 відповідно мають вказані в пп. 1-3 значення,
R2 означає водень,
R3 означає метил, ізопропіл або трет-бутил, або
R2 та R3 означають метил або разом з атомом вуглецю, до якого вони приєднані, утворюють спіро-приєднане циклогексанове кільце,
R7 означає 2-метил,
R8 - R10 означають водень,
Х означає кисень.
Текст
Даний винахід стосується нових заміщених похідних індолінфенілсульфонаміду, способу їх одержання, а також їх застосування у лікарських засобах, зокрема як ефективні активуючі рецептори PPAR-дельта сполук для профілактики та/або лікування серцево-судинних захворювань, зокрема дисліпідемії, артеріосклерозу та коронарних серцевих захворювань. Незважаючи на численні успіхи в лікуванні коронарні серцеві захворювання (КСЗ) все ще залишаються найсерйознішою проблемою здоров'я людей. В той час як лікування статинами шляхом інгібування HMGCoA-редуктази дуже успішно знижує концентрацію LDL-холестерину у плазмі, що приводить до значного зменшення випадків смертності хворих з групи ризику, переконливих стратегій лікування хворих з невигідним співвідношенням HDL/LDL-холестерину та/або хворих на гіпертригліцеридимії все ще не вистачає. На даний момент фібрати є єдиною формою лікування хворих цієї групи ризику. Вони діють як слабкі агоністи активованого проліфератором пероксисоми рецептора (РРАП)-альфа [Nature 1990, 347, 645-50]. Недоліком застосовуваних до цього часу фібратів є їх незначна взаємодія з рецептором, що призводить до збільшення щоденних дозувань та виникнення значних побічних дій. Щодо активованого проліфератором пероксисоми рецептора (РРАР)-дельта [Моl. Endochnol. 1992, 6, 1634-41], то перші фармакологічні дослідження на тваринах показують, що ефективні агоністи PPAR-дельта також можуть привести до покращення співвідношення HDL/ LDL-холестерин та гіпертригліцеридемії. В [міжнародній заявці WO 00/23407] описані PPAR-модулятори, призначені для лікування ожиріння, атеросклерозу та/або діабету. В [міжнародній заявці WO 93/15051 та європейським патенті ЕР 636608-А1] описані похідні 1-бензолсульфоніл-1,3-дигідроіндол-2-ону як антагоністи вазопресину та/або окситоцину для лікування різних захворювань. Задача даного винаходу полягала в одержанні нових сполук, які б могли бути використані як PPARдельта-модулятори. Нещодавно з'ясували, що сполуки загальної формули (І) в якій А означає груп у C-R11 або N, в якій R11 означає водень або (С1-С4)-алкіл, X означає О, S або СН 2, R1 означає (С6-С10)-арил або 5- - 10-членний гетероарил, який містить до 3 гетероатомів з ряду Ν, Ο та/або S, які, в свою чергу, можуть бути відповідно 1-3 рази однаково або по-різному заміщені замісниками, вибраними з групи галоген, ціано, нітро, (С1-С6)-алкіл (який, в свою чергу може бути заміщений гідрокси), (С1-С6)-алкокси, фенокси, бензилокси, трифторметил, трифторметокси, (С2-С6)-алкеніл, феніл, бензил, (С1С6)-алкілтіо, (С1-С6)-алкілсульфоніл, (С1-С6)-алканоїл, (С1-С6)-алкоксикарбоніл, карбоксил, аміно, (С1-С6)ациламіно, моно- та ді-( С1-С6)-алкіламіно та 5- або 6-членний гетероцикліл, який містить до 2 гетероатомів з ряду Ν, Ο та/або S, або групу формули , R2 та R3 є однаковими або різними та незалежно один від одного означають водень або (С1-С6)-алкіл або разом з атомом вуглецю, до якого вони приєднані, утворюють 3- - 7-членне спіро-приєднане циклоалкільне кільце, R4 означає водень або (С1-С6)-алкіл, R5 означає водень або (С1-С6)-алкіл, R6 означає водень або (С1-С6)-алкіл, R7 означає водень, (С1-С6)-алкіл, (С1-С6)-алкокси або галоген, R8 та R9 є однаковими або різними та незалежно один від одного означають водень або (С1-С4)-алкіл, та R10 означає водень або здатну вступати в реакцію гідролізу гр упу, яка може бути розщеплена до одержання відповідної карбонової кислоти, а також їх фармацевтично прийнятні солі, сольвати та сольвати солей проявляють фармакологічну активність та можуть бути застосовані як лікарський засіб або використані для одержання композицій лікарських засобів. В рамках винаходу під здатною вступати в реакцію гідролізу групою у визначенні R10 розуміють групу, яка зокрема сприяє перетворенню -C(O)OR10-гр упи на відповідну карбонову кислоту (R10 = водень). Такими групами є, наприклад, бензил, (С1-С6)-алкіл або (С3-С8)-циклоалкіл, які відповідно, в разі необхідності, один або кілька разів однаково або по-різному заміщені галогеном, гідрокси, аміно, (С1-С6)-алкокси, карбоксилом, (С1-С6)-алкоксикарбонілом, (С1-С6)-алкоксикарбоніламіно або (С1-С6)-алканоїлокси, або, наприклад, (С1-С4)алкіл, який, в разі необхідності, один або кілька разів однаково або по-різному заміщений галогеном, гідрокси, аміно, (С1-С4)-алкокси, карбоксилом, (С1-С4)-алкоксикарбонілом, (С1-С4)-алкоксикарбоніламіно або (С1-С4)-алканоїлокси. (С1-С6)-алкіл та (С1-С4)-алкіл в рамках винаходу означають нерозгалужений або розгалужений алкільний залишок, який містить від 1 до 6 або від 1 до 4 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкільному залишку, який містить від 1 до 4 атомів вуглецю. Прикладами переважних сполук є метил, етил, н-пропіл, ізопропіл та т-бутил. (С2-С6)-алкеніл в рамках винаходу означає нерозгалужений або розгалужений алкенільний залишок, який містить від 2 до 6 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкенільному залишку, який містить від 2 до 4 атомів вуглецю. Прикладами переважних сполук є вініл, аліл, ізопропеніл та н-бут-2-ен-1-іл. (С3-С8)-циклоалкіл в рамках винаходу означає моноциклічну циклоалкільну груп у, яка містить від 3 до 8 атомів вуглецю. Прикладами переважних сполук є циклопропіл, циклобутил, циклопентил та циклогексил. (С6-С10)-арил в рамках винаходу означає ароматичний залишок, який містить переважно від 6 до 10 атомів вуглецю. Переважними арильними залишками є феніл та нафтил. (С1-С6)-алкокси та (С1-С4)-алкокси в рамках винаходу означають нерозгалужений або розгалужений алкоксильний залишок, який містить від 1 до 6 або від 1 до 4 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкоксильному залишку, який містить від 1 до 4 атомів вуглецю Прикладами переважних сполук є метокси, етокси, н-пропокси, ізопропокси та т-бутокси. (С1-С6)-алкоксикарбоніл та (С1-С4)-алкоксикарбоніл в рамках винаходу означають нерозгалужений або розгалужений алкоксильний залишок, який містить від 1 до 6 або від 1 до 4 атомів вуглецю та приєднаний через карбонільну групу. Перевагу надають нерозгалуженому або розгалуженому алкоксикарбонільному, який містить від 1 до 4 атомів вуглецю. Прикладами переважних сполук є метоксикарбоніл, етоксикарбоніл, н-пропоксикарбоніл, ізопропоксикарбоніл та т-бутоксикарбоніл. (С1-С6)-алкоксикарбоніламіно та (С1-С4)алкоксикарбоніламіно в рамках винаходу означають аміногруп у, яка містить нерозгалужений або розгалужений алкоксикарбонільний замісник, який в алкоксильному залишку містить від 1 до 6 або від 1 до 4 атомів вуглецю та приєднаний через карбонільну груп у. Перевагу надають алкоксикарбоніламіно-залишку, який містить від 1 до 4 атомів вуглецю. Прикладами переважних сполук є метоксикарбоніламіно, етоксикарбоніламіно, н-пропоксикарбоніламіно та т-бутоксикарбоніламіно. (С1-С6)-алканоїл в рамках винаходу означає нерозгалужений або розгалужений алкільний залишок, який містить від 1 до 6 атомів вуглецю та в положенні 1 несе з'єднаний подвійним зв'язком атом кисню та який приєднаний через положення 1. Перевагу надають нерозгалуженому або розгалуженому алканоїльному залишку, який містить від 1 до 4 атомів вуглецю. Прикладами переважних сполук є форміл, ацетил, пропіоніл, н-бутирил, і-бутирил, півалоїл та н-гексаноїл. (С1-С6)-алканоїлокси та (С1-С4)-алканоїлокси в рамках винаходу означають нерозгалужений або розгалужений алкільний залишок, який містить від 1 до 6 або від 1 до 4 атомів вуглецю та в положенні 1 несе з'єднаний подвійним зв'язком атом кисню та який в положенні 1 приєднаний через інший атом кисню. Перевагу надають алканоїлокси-залишку, який містить від 1 до 4 атомів вуглецю. Прикладами переважних сполук є ацетокси, пропіонокси, н-бутирокси, і-бутирокси, півалоїлокси, н-гексаноїлокси. Моно-(С1-С6)-алкіламіно та моно-(С1-С4)-алкіламіно в рамках винаходу означають аміно-групу, яка містить нерозгалужений або розгалужений алкільний замісник, який, в свою чергу, містить від 1 до 6 або від 1 до 4 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому моноалкіламіно-залишку, який містить від 1 до 4 атомів вуглецю. Прикладами переважних сполук є метиламіно, етиламіно, нпропіламіно, ізопропіламіно та т-бутиламіно. Ді-(С1-С6)-алкіламіно та ді-(С1-С4)-алкіламіно в рамках винаходу означають аміногрупу, яка містить два однакових або різних нерозгалужених або розгалужених алкільних замісники, які, в свою чергу, відповідно містять від 1 до 6 або від 1 до 4 атомів вуглецю. Перевагу надають нерозгалуженим або розгалуженим діалкіламіно-залишкам, які відповідно містять від 1 до 4 атомів вуглецю. Прикладами переважних сполук є Ν,Ν-диметиламіно, N,N-діетиламіно, N-етил-N-метиламіно, N-метил-N-н-пропіламіно, N-ізопропіл-N-нпропіламіно, N-т-бутил-N-метиламіно, N-етил-N-н-пентиламіно та N-н-гексил-N-метиламіно. (С1-С6)-ациламіно в рамках винаходу означає аміно-групу, яка містить нерозгалужений або розгалужений алканоільний залишок, який, в свою чергу містить від 1 до 6 атомів вуглецю та приєднаний через карбонільну групу. Перевагу надають ациламіно-залишку, який містить від 1 до 2 атомів вуглецю. Прикладами переважних сполук є формамідо, ацетамідо, пропюнамідо, н-бутирамідо та півалоїламідо. (С1-С6)-алкілтіо в рамках винаходу означає нерозгалужений або розгалужений алкілтіо-залишок, який містить від 1 до 6 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкілтіозалишку, який містить від 1 до 4 атомів вуглецю. Прикладами переважних сполук є метилтіо, етилтіо, нпропілтіо, ізопропілтіо, т-бутилтіо, н-пентилтіо та н-гексилтіо. (С1-С6)-алкілсульфоніл в рамках винаходу означає нерозгалужений або розгалужений алкілсульфонільний залишок, який містить від 1 до 6 атомів вуглецю. Перевагу надають нерозгалуженому або розгалуженому алкілсульфонільному залишку, який містить від 1 до 4 атомів вуглецю. Прикладами переважних сполук є метилсульфоніл, етилсульфоніл, н-пропілсульфоніл, ізопропілсульфоніл, тбутилсульфоніл, н-пентилсульфоніл та н-гексилсульфоніл. 5- - 10-членний або 5- - 6-членний гетероарил, який містить до 3 або до 2 однакових або різних гетероатомів з ряду N, О та/або S в рамках винаходу означає моно-або, в разі необхідності, біциклічний ароматичний гетероцикл (гетероароматичну сполуку), який приєднаний через кільцевий атом вуглецю або, в разі необхідності, через кільцевий атом азоту гетероароматичної сполуки. Прикладами є фураніл, піроліл, тієніл, піразоліл, імідазоліл, тіазоліл, оксазоліл, ізоксазоліл, ізотіазоліл, піридил, піримідиніл, піридазиніл, піразиніл, бензофураніл, бензотієніл, бензімідазоліл, бензоксазоліл, індоліл, індазоліл, хінолініл, ізохінолініл, нафтиридиніл, хіназолініл, хіноксалініл. Перевагу надають 5- або 6-членному гетероарильному залишку, який містить до 2 атомів азоту, таким як, наприклад, імідазоліл, піридил, піримідиніл, піридазиніл, піразиніл. 5- або 6-членний гетероцикліл, який містить до 2 гетероатомів з ряду Ν, Ο та/або S в рамках винаходу означає насичений гетероцикл, приєднаний через кільцевий атом вуглецю або, в разі необхідності, через кільцевий атом азоту гетеро циклу. Прикладами переважних сполук є тетрагідрофурил, піролідиніл, піперидиніл, піперазиніл, морфолініл та тіоморфолініл. Галоген в рамках винаходу означає фтор, хлор, бром та йод. Перевагу надають хлору або фтору. Сполуки згідно з винаходом залежно від зразку заміщення можуть існувати в стереоізомерних формах, які ведуть себе або як картинка та дзеркальне відображення (енантіомери), або не як картинка та дзеркальне відображення (діастереомери). Винахід стосується як енантіомерів або діастереомерів, так і їх відповідних сумішей. Рацемічні форми, як і діастереомери, можна розділяти відомими способами на стереоізомерні компоненти. Крім того певні сполуки можуть існува ти у таутомерій формі. Це відомо фахівцю, а такі сполуки також належать до обсягу охорони даного винаходу. Сполуки згідно з винаходом можуть також існувати у формі солей. В рамках даного винаходу перевагу надають фізіологічно прийнятним солям. Фізіологічно прийнятними солями можуть бути солі сполук згідно з винаходом з неорганічними або органічними кислотами. Перевагу надають солям з неорганічними кислотами, такими як, наприклад, хлорводнева кислота, бромводнева кислота, фосфорна кислота або сірчана кислота, або солям з органічними карбоновими або сульфоновими кислотами, такими як, наприклад, оцтова, пропіонова, малеїнові, фумарова, яблучна, лимонна, винна, молочна, бензойна або метансульфонова, етансульфонова, бензолсульфонова, толуолсуль фонова або нафталіндисульфонова кислота. Фізіологічно прийнятними солями можуть бути також солі сполук згідно з винаходом з основами, такі як, наприклад, солі металів або солі амонію. Переважними прикладами є солі лужних металів (наприклад, солі натрію або калію), солі лужноземельних металів (наприклад, солі магнію або кальцію), а також солі амонію, утворені від аміаку або органічних амінів, таких як, наприклад, етиламін, ді- або триетиламін, етилдіізопропіламін, моноетаноламін, ді- або триетаноламін, дициклогексиламін, диметиламіноетанол, дибензиламін, N-метилморфолін, дигідроабіетиламін, 1-ефенамін, метилпіперидин, арганін, лізин, етилендіамін або 2-фенілетиламін. Сполуки згідно з винаходом можуть також бути представлені у формі їх сольватів, зокрема у формі їх гідратів. Перевагу надають сполукам загальної формули (І), в якій А означає груп у C-R11 або N, в якій R11 означає водень або метил, X означає О або S, R1 означає феніл або 5- або 6-членний гетероарил, який містить до 2 гетероатомів з ряду Ν, Ο та/або S, які, в свою чергу, відповідно один або два рази однаково або по-різному можуть бути заміщені замісниками, вибраними з групи фтор, хлор, ціано, (С1-С4)-алкіл, (С1-С4)-алкокси, фенокси, бензилокси, трифторметил, трифторметокси, вініл, феніл, бензил, метилтіо, метилсульфоніл, ацетил, пропіоніл, (С1-С4)алкоксикарбоніл, аміно, ацетиламіно, моно- та ді-(С1-С4)-алкіламіно, R2 та R3 є однаковими або різними та незалежно один від одного означають водень або (С1-С4)-алкіл або разом з атомом вуглецю, до якого вони приєднані, утворюють 5- або 6-членне спіро-приєднане циклоалкільне кільце, R4 означає водень або метил, R5 означає водень, метил або етил, R6 означає водень або метил, R7 означає водень, (С1-С4)-алкіл, (С1-С4)-алкокси, фтор або хлор, R8 та R9 є однаковими або різними та незалежно один від одного означають водень або метил, та R10 означає водень. Особливу перевагу надають сполука загальної формули (І), в якій А означає СН або N, X означає О, R1 означає феніл або піридил, які, в свою чергу, відповідно можуть бути один або два рази однаково або по-різному заміщені замісниками з групи фтор, хлор, метил, трет.-бутил, метокси, трифторметил, трифторметокси, метилтіо, аміно та диметиламіно, R2 означає водень або метил, R3 означає метил, ізопропіл або трет.-бутил, або R2 та R3 разом з атомом вуглецю, до якого вони приєднані, утворюють спіро-приєднане циклогексанове кільце, R4 означає водень або метил, R5 означає водень, метил або етил, R6 означає водень або метил, R7 означає метил, R8 та R9 відповідно означають водень, та R10 означає водень. Вказані вище загальні та переважні визначення залишків стосуються як кінцевих продуктів формули (І), так і необхідних для їх одержання вихідних або проміжних речовин. Визначення залишків, наведені вище у відповідних або переважних комбінаціях залишків, незалежно від вказаних комбінацій можна замінювати визначеннями залишків інших комбінацій. Особливе значення мають сполуки формули (I-А) в якій R2 означає водень, R3 означає метил, ізопропіл або трет.-бутил, або R2 та R3 означають метил або разом з атомом вуглецю, до якого вони приєднані, утворюють спіроприєднане циклогексанове кільце, та A, R1, R 4, R5 та R6 відповідно мають вказані вище значення. Крім того був описаний спосіб одержання сполук загальної формули (І) згідно з винаходом, який відрізняється тим, що сполуки загальної формули (II) в якій A, R2, R3, R 4 та R 5 відповідно мають вказані вище значення та Υ означає хлор або бром, піддають взаємодії зі сполукою загальної формули (III) в якій X, R6, R7, R 8 та R 9 відповідно мають вказані вище значення та Τ означає бензил або (С1-С6)-алкіл, в інертному розчиннику в присутності основи до одержання сполук загальної формули (IV) в якій Α, Τ, Χ, Υ, R2 , R3, R4, R5, R 6, R7 , R8 та R9 відповідно мають вказані вище значення, після цього ці сполуки під час здійснення реакції сполучення піддають взаємодії зі сполукою загальної формули (V) в якій R1 має вказане вище значення та R12 означає водень або метил або обидва залишки разом утворюють СН 2СН2- або С(СН3)2-С(СН3)2місток, в інертному розчиннику в присутності придатного паладієвого каталізатора та основи до одержання сполуки загальної формули (І-В) в якій А, Т, X, R1, R2 , R3 , R4, R5, R6, R7 , R8 та R9 відповідно мають вказані вище значення, [див., наприклад, W. Hahnfeld, Μ. Jung, Pharmazie 1994, 49, 18-20; idem, Liebigs Ann. Chem. 1994, 59-64], після цього сполуки (І-В) піддають взаємодії з кислотами або основами або у випадку, якщо Τ означає бензил, також піддають гідрогенолізу до одержання відповідних карбонових кислот загальної формули (І-С) в якій А, X, R 1, R2 , R3 , R4, R5, R 6, R7 , R8 та R9 відповідно мають вказані вище значення, та, в разі необхідності, карбонові кислоти (І-С) відомими способами етерифікації перетворюють на сполуки загальної формули (І). Реакцію сполучення [див (IV)+(V)®(І-В)] та подальшу реакцію розщеплення естеру [див. (І-В)®(І-С)] в описаному ряді реакцій, в разі необхідності, можна здійснювати у зворотній послідовності, крім того під час проведення реакції сполучення можна здійснювати основне розщеплення естеру in situ. На стадії (II)+(III)®(IV) інертними розчинниками є, наприклад, галогенвуглеводні, такі як дихлорметан, трихлорметан, тетрахлорметан, трихлоретан, тетрахлоретан, 1,2-дихлоретан або трихлоретилен, етери, такі як діетиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як нітрометан, етилацетат, ацетон, диметилформамід, диметилсульфоксид, ацетонітрил, N-метилпіролідинон або піридин. Крім того можуть бути застосовані суміші названих розчинників. Перевагу надають дихлорметану або тетрагідрофурану. Придатними основами на стадії (II)+(III) (IV) є звичайні неорганічні або органічні основи До них належать переважно гідроксиди лужних металів, такі як, наприклад, гідроксид літію, натрію або калію, карбонати лужних та лужноземельних металів, такі як карбонат натрію, калію або кальцію, гідриди лужних металів, такі як гідрид натрію, або органічні аміни, такі як піридин, триетиламін, етилдпзопропіламін, Nметилморфолін або N-метилпіперидиню Особливу перевагу надають аміноосновам, таким як триетиламін, піридин або етилдпзопропіламін, в разі необхідності, в присутності каталітичної кількості (приблизно 10 моль-%) 4-N,N-диметиламінопіридину або 4-піролідинпіридину. При цьому основу застосовують у кількості від 1 до 5, переважно від 1 до 2,5моль, на 1моль сполуки загальної формули (III). Реакцію загалом здійснюють при температурі від -20°С до +100°С, переважно від 0°С до +75°С. Взаємодія може відбуватися при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 5бар). Загалом працюють при нормальному тиску. На стадії (IV)+(V)®(І-В) інертними розчинниками є, наприклад, етери, такі як діетиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, спирти, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол або трет-бутанол, вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як диметилформамід, ацетонітрил або також вода. Крім того можуть бути застосовані суміші названих розчинників. Перевагу надають толуолу, диметилформаміду або ацетонітрилу. Придатними основами на стадії (IV)+(V)®(І-В) є звичайні неорганічні або органічні основи. До них належать переважно гідроксиди лужних металів, такі як, наприклад, гідроксид літію, натрію або калію, карбонати лужних або лужноземельних металів, такі як карбонат натрію, калію або кальцію, фосфати лужних металів, такі як фосфат натрію або калію, або органічні аміни, такі як піридин, триетиламін, етилдизопропіламін, N-метилморфолін або N-метилпіперидин. Особливу перевагу надають карбонату натрію або калію або фосфату калію. При цьому основу застосовують у кількості від 1 до 5, переважно від 2 до 3моль, на 1моль сполуки загальної формули (IV). Придатними паладієвими каталізаторами на стадії (IV)+(V)®(І-В) є переважно сполуки паладію (0) або паладію (II), які одержують безпосередньо перед початком реакції, такі як, наприклад, хлорид [1,1'біс(дифенілфосфіно)фероценіл]паладію (II), хлорид біс(трифенілфосфін)паладію (II), або які можуть бути одержані in situ із придатного джерела паладію, такого як, наприклад, біс(дибензиліденацетон)паладій (0) або тетракіс(трифенілфосфін)паладій (0), та придатного фосфінового ліганду. Реакцію загалом здійснюють при температурі від 0°С до +150°С, переважно від +20°С до +100°С. Взаємодія може відбуватися при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 5бар). Загалом працюють при нормальному тиску. На стадії (І-В)®(І-С) інертними розчинниками є, наприклад, галогенвуглеводні, такі як дихлорметан, 1,2дихлоретан або трихлоретилен, етери, такі як діетиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, спирти, такі як метанол, етанол, нпропанол, ізопропанол, н-бутанол або трет.-бутанол, вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як нітрометан, ацетон, диметилформамід, диметилсульфоксид, ацетонітрил або N-метилпіролідинон. Крім того можуть бути застосовані суміші названих розчинників. Перевагу надають метанолу або етанолу. Придатними основами на стадії (І-В)®(І-С) є звичайні неорганічні або органічні основи. До них належать переважно гідроксиди лужних металів, такі як, наприклад, гідроксид літію, натрію або калію, або карбонати лужних або лужноземельних металів, такі як карбонат натрію, калію або кальцію. Особливу перевагу надають гідроксиду літію або натрію. При цьому основу застосовують у кількості від 1 до 5, переважно від 1 до 3моль, на 1моль сполуки загальної формули (І-В). Придатними кислотами на стадії (І-В)®(І-С) є звичайні неорганічні кислоти, такі як, наприклад, соляна кислота або сірчана кислота, або сульфонові кислоти, такі як толуолсульфонова кислота, метансульфонова кислота або трифторметансульфонова кислота, або карбонові кислоти, такі як трифтороцтова кислота. Реакцію загалом здійснюють при температурі від -20°С до +100°С, переважно від 0°С до +30°С. Взаємодія може відбуватися при нормальному, підвищеному або пониженому тиску (наприклад, від 0 5 до 5бар). Загалом працюють при нормальному тиску. Сполуки загальної формули (II) є відомими або можуть бути одержані аналогічно способам, відомими з літературних джерел, наприклад, таким чином сполуки загальної формули (VI) в якій Α, Υ та R5 відповідно мають вказані вище значення, за допомогою нітриту натрію та хлориду цинку (II) в присутності кислоти перетворюють на похідні гідразину загальної формули (VII) в якій Α Υ та R5 відповідно мають вказані вище значення, після цього ці сполуки в присутності кислоти або кислоти Льюіса, в разі необхідності в інертному розчиннику піддають взаємодії зі сполукою загальної формули (VIII) в якій R2, R3 та R4 відповідно мають вказані вище значення, у випадку, якщо R2 та R 3 у формулі (VIII) не означають водень, до одержання сполук загальної формули (IX), а у випадку, якщо R3 у формулі (VIII) означає водень, до одержання сполук загальної формули (X) в яких A, Y, R 4 та R5 відповідно мають вказані вище значення, та потім ці сполуки (IX) або (X) відновлюють за допомогою гідриду бору, алюмінію або кремнію, наприклад, боргідрід натрію або ціаноборгідрід натрію, або шляхом гідрування в присутності придатного каталізатора, такого як, наприклад, нікель Ренея [реакції (VII)+(VIII)®(IX)®(II) див., наприклад, в Р.Е. Maligres, I. Houpis, К. Rossen, A. Molina, J Sager, V. Upadhyay, K.M. Wells, R.A. Reamer, J.E. Lynch, D. Askin, R.P Volante, P.J Reider, mempahedron 1997, 53, 10983-10992]. На стадії (VI)®(VII) інертними розчинниками є, наприклад, етери, такі як діоксан, глікольдиметиловий етер або діетиленглікольдиметиловий етер, спирти, такі як метанол, етанол, н-пропанол, ізопропанол, нбутанол або трет.-бутанол, або інші розчинники, такі як диметилформамід, диметилсульфоксид, Nметилпіролідинон або вода. Крім того можуть бути застосовані суміші названих розчинників. Переважним розчинником є вода. Придатними кислотами на стадії (VI)®(VII) є звичайні неорганічні або органічні кислоти. До них належать переважно соляна, сірчана або фосфорна кислота, карбонові кислоти, такі як мурашина, оцтова або трифтороцтова кислота, або сульфонові кислоти, такі як толуолсульфона, метансульфонова або трифторметансульфонова кислота. Особливу перевагу надають напівконцентрованим - концентрованим водним розчинам соляної кислоти, яка в той же час служить розчинником. Реакцію загалом здійснюють при температурі від -30°С до +80°С, переважно від -10°С до +25°С Взаємодія може відбуватися при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 5бар). Загалом працюють при нормальному тиску. На стадії (VII)+(VIII)®(IX) або (X) інертними розчинниками є, наприклад, галогенвуглеводні, такі як дихлорметан, трихлорметан, тетрахлорметан, трихлоретан, тетрахлоретан, 1,2-дихлоретан або трихлоретилен, етери, такі як діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, спирти, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол або трет.-бутанол, або вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як ацетонітрил або вода. Крім того можуть бути застосовані суміші названих розчинників. Реакція може бути здійснена і без розчинника. У випадку, якщо R 3 означає водень, а А означає СН або N, реакцію переважно здійснюють без розчинника до одержання продукту (X), у випадку, якщо R2 та R3 не означають водень, а А означає СН, реакцію здійснюють переважно у суміші із толуолу та ацетонітрилу до одержання продукту (IX). Придатними кислотами на стадії (VII)+(VIII)®(IX) або (X) є звичайні неорганічні або органічні кислоти. До них належать переважно соляна, сірчана або фосфорна кислота, карбонові кислоти, такі як мурашина, оцтова або трифтороцтова кислота, або сульфонові кислоти, такі як толуолсульфонова, метансульфонова або трифторметансульфонова кислота. В разі необхідності, придатними є також звичайні кислоти Льюіса, такі як, наприклад, бортрифторид, алюмінійтрихлорид або хлорид цинку. При цьому кислоти застосовують у кількості від 1 до 10моль на 1моль сполуки загальної формули (VII). У випадку, якщо R3 означає водень, а А означає СН або N, реакцію здійснюють переважно із застосуванням 1-2моль хлориду цинку до одержання продукту (X), та у випадку, якщо R2 та R3 не означають водень, а А означає СН, реакцію здійснюють із застосуванням 2-5моль трифтороцтової кислоти до одержання продукту (IX). Реакцію загалом здійснюють при температурі від 0°С до +250°С. У випадку, якщо R3 означає водень, а А означає СН або N, реакцію здійснюють переважно при температурі від +130°С до +200°С до одержання продукту (X), у випадку, якщо R2 та R3 не означають водень, а А означає СН, реакцію здійснюють переважно при температурі від 0°С до +50°С до одержання продукту (IX). Взаємодію здійснюють при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 5бар). Загалом працюють при нормальному тиску. Придатними агентами відновлення на стадії (IX) або (X)®(II)є гідриди бору, алюмінію або кремнію, такі як, наприклад, боран, диборан, бор гідрид натрію, ціаноборгідрид натрію, алюмінійгідрид літію або триетилсілан, в разі необхідності, в присутності, кислоти або кислоти Льюіса, як, наприклад, оцтова кислота, трифтороцтова кислота, алюмінійтрихлорид або бортрифторид, або гідрування за допомогою водню в присутності придатного каталізатора, такого як, наприклад, паладій на активному вугіллі, оксид платини або нікель Ренея. У випадку сполук загальної формули (X), в якій А означає N, перевагу надають гідруванню із застосуванням нікелю Ренея як каталізатора, а у випадку, якщо А у формулі (X) означає СН, відновленню із застосуванням ціаноборгідриду натрію. У випадку сполук загальної формули (IX) застосовують переважно боргідрид натрію. Придатними розчинниками на стадії (IX) або (X)®(II) є, наприклад, етери, такі як діетиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, спирти, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол або трет.-бутанол, або вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як ацетонітрил, оцтова кислота або вода. Крім того можуть бути застосовані суміші названих розчинників. При гідруванні сполук загальної формули (X), в якій А означає N, переважно застосовують етанол, а при відновленні у випадку, якщо А у формулі (X) означає СН, переважно застосовують оцтову кислота, яка як кислотна добавка до агенту відновлення, застосовувана у великій надлишковій кількості, одночасно може бути застосована як розчинник. Для відновлення сполук загальної формули (IX) переважно застосовують суміш із метанолу та толуол/ацетонітрил [після взаємодії (VII)®(IX), при додаванні 2-5моль трифтороцтової кислоти] у співвідношенні від 1:1 до 1:10. Реакцію загалом здійснюють при температурі від -20°С до +200°С. При цьому гідрування сполук формули (X), в якій А означає N, реакцію здійснюють переважно при температурі від +150°С до +200°С, в той час як відновлення сполук формули (IX) та (X), в якій А означає СН, здійснюють переважно при температурі від -10°С до +50°С. Взаємодія може бути здійснена при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 150бар). Якщо гідрування сполук (X), де А означає N, здійснюють переважно при тиску від 50 до 150бар, при відновленні сполук (IX) або (X), де А означає СН, працюють загалом при нормальному тиску. Сполуки загальної формули (III) є відомими або можуть бути одержані аналогічно способам, відомими з літературних джерел, наприклад, таким чином: сполуки загальної формули (XI) (XII) в якій R6, R7 та X відповідно мають вказані вище значення, за допомогою сполуки загальної формули в якій R8, R9 та Τ відповідно мають вказані вище значення, в інертному розчиннику в присутності основи перетворюють на сполуку загальної формули (XIII) в якій R6, R7, R8, R9, X та Τ відповідно мають вказані вище значення, та після цього цю сполуку піддають взаємодії з хлорсульфоновою кислотою [див., наприклад, Ρ.D. Edwards, R.С. Mauger, K.Μ. Cottrell, F.X. Morris, K.K. Pine, Μ.A. Syl vester, C.W. Scott, S.T. Furlong, Bioorg. Med. Chem. Lett. 2000, 10, 2291-2294]. Інертними розчинниками на стадії (XI)+(XII)®(XIII) є, наприклад, етери, такі як діетиловий етер, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як ацетон, диметилформамід, диметилсульфоксид ацетонітрил або N-метилпіролідинон. Крім того можуть бути застосовані суміші названих розчинників. Перевагу надають диметилформаміду або ацетону. Переважними основами на стадії (XI)+(XII)®(XIII) є звичайні неорганічні або органічні основи. До них належать переважно гідроксиди лужних металів, такі як гідроксид літію, натрію або калію, карбонати лужних або лужноземельних металів, такі як карбонат натрію, калію або кальцію, гідриди лужних металів, як гідрид натрію, або органічні аміни, такі як піридин, триетиламін, етилдизопропіламін, N-метилморфолін або Nметилпіперидин. Особливу перевагу надають карбонату калію. При цьому основу застосовують у кількості від 1 до 5, переважно від 1 до 2моль, на 1моль сполуки загальної формули (XI). Реакцію загалом здійснюють при температурі від -20°С до +150°С, переважно від 0°С до +80°С Взаємодія може відбуватися при нормальному, підвищеному або пониженому тиску (наприклад, від 0,5 до 5бар). Загалом працюють при нормальному тиску. Сполуки загальних формул (V), (VI), (VIII), (XI) та (XII) є комерційно доступними відомими з літературних джерел або можуть бути одержані аналогічно способам, відомим з літературних джерел. Наведені нижче схеми 1 та 2 реакцій демонструють здійснення способу згідно з винаходом: a) NaNO2, SnCI2, HCI; b) CH3CH2OH, кімнатна температура; с) ZnCI2, 170°C, 30хв.; d) NaCNBH3, CH3COOH, 35°C, 16 годин; при А = Ν: нікель Ренея, 180°С, 80бар Н2, e) DMAP, TEA, CH2CI2, кімнатна температура; f) Pd(PPh3)2CI, D MF, водний розчин Na2CO3, 100°С, 15 годин. a) NaNO2, SnCI2, HCI; b) TFA, 35°C; c) NaBH 4, CH3OH, -10°C; d) THF, TEA, -5°C; e) КОН, THF/H2O, кімнатна температура; f) Pd-каталізатор, DME, Na2CO3, 60°C, 14 годин [літературні джерела для здійснення стадій b, с): Р.Е. Maligres, I. Houpis, К. Rossen, A. Molina, J. Sager, V. Upadhyay, K.M. Wells, R.A. Reamer, J.E. Lynch, D. Askin, R.P. Volante, P.J. Reider, mempahedron 1997, 53, 10983-10992]. Сполуки формули (І) згідно з винаходом проявляють несподівано цінний спектр фармакологічних властивостей ι тому можуть бути застосовані як різносторонні лікарські засоби, зокрема для лікування захворювань, при протіканні яких активований інгібітор рецептора PPAR-дельта. Вони зокрема є придатними для лікування коронарних серцевих захворювань, профілактики інфарктів міокарда, а також для лікування рестенозу після коронарної ангіопластики або встановлення стенту. Сполуки формули (І) згідно з винаходом переважно застосовують для лікування інсультів, захворювань центральної нервової системи, хвороби Альцгеймера, остеопорозу, артеріосклерозу та гіперхолестеринемії, для підвищення паталогічно низького рівня HDL, а також для пониження підвищеного рівня тригліцериду та LDL Крім того вони можуть бути застосовані для лікування ожиріння, діабету, метаболічного синдрому (нетерпимість по відношенню до глюкози, гіперінсулінемії, дисліпідемії та артеріальної гіпертонії внаслідок резистентності по відношенню до інсуліну), фіброзу печінки та раку. Нові активні речовини можуть бути застосовані у своїй препаративній формі або, в разі необхідності, у комбінації з іншими активними речовинами, вибраними переважно з групи інгібітори СЕТР, антидіабетичні засоби, антиоксиданти, цитостатики, антагоністи кальцію, засоби для зниження артеріального тиску, гормони та/або стимулятори щитовидної залози, інгібітори HMG-CoA-редуктази, інгібітори експресії HMGCoA-редуктази, інгібітори синтезу сквалену, інгібітори АСАТ, засоби для стимулювання кровопостачання, інгібітори агрегації тромбоцитів антикоагулянти, антагоністи рецептора ангіотензину-ІІ, інгібітори абсорбції холестерину, інгібітори МТР, інгібітори альдолаза-редуктази, фібрати, ніацин, засоби, що зменшують апетит, інгібітори ліпази та агоністи PPAR-ag та/або PPAR-g. Крім того можливими є також інші комбінації з протизапальними засобами, наприклад, інгібіторами СОХ-2 та NEP, ЕСЕ-інгібіторами, інгібіторами вазопептидази та інгібіторами відновлення альдози, антиоксидантами, цитостатиками, промоторами перфузії та засобами для зменшення апетиту. Сполуки згідно з винаходом переважно комбінують з одним або кількома антидіабетичними засобами, вказаними в Червоній книзі 2002/ІІ, глава 12, з одним або кількома антитромботичними засобами, наприклад, переважно з групи інгібіторів агрегації тромбоцитів або антикоагулянтів, з однією або кількома активними речовинами, що знижують артеріальний тиск, наприклад, переважно з групи антагоністів кальцію, антагоністів ангіотензину All, інгібіторів АСЕ, b-блокаторів, а також діуретинів та/або з однією або кількома активними речовинами, що змінюють жировий обмін з групи агоністів рецептора щитовидної залози, інгібіторів синтезу холестерину, таких як, наприклад, переважно інгібітори HMG-CoAредуктази, або інгібітори синтезу скваліну, інгібіторів АС АТ, інгібіторів МТР, агоністів рецептора PPAR, фібратів, інгібіторів абсорбції холестерину, інгібіторів ліпази, полімерних адсорберів жовчної кислоти, антагоністів ліпопротеїну(ів). Під антидіабетичними засобами розуміють, наприклад, переважно інсулін та похідні інсуліну, а також ефективні при пероральному застосуванні гіпоглікемічні активні речовини. При цьому під інсуліном та похідними інсуліну мають на увазі інсулін тваринного, людського або біотехнологічного походження, а також їх суміші. Гіпоглікемічні активні речовини, ефективні при пероральному застосуванні, охоплюють, наприклад, переважно сульфонілкарбаміди, бігуаніди, похідні меглітиніду, оксадіазолідинони тіазолідиндіони, інгібітори глюкозидази, антагоністи глюкагону, агоністи GLP-1, сенсибілізатори інсуліну, інгібітори ферментів печінки, які беруть участь у стимулюванні глюконеогенезу та/або глікогенолізу, модулятори засвоєння глюкози, а також засоби для відкриття калієвих каналів, наприклад, такі, що описані в [WO 97/26265 та WO 99/03861] фірми Novo Nordisk A/S. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інсуліном. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з сульфонілкарбамідами, наприклад, переважно з толбутамідами, глібенкламідами, глімепіридами, гліпіцидами або гліклацидами. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з бігунідом, наприклад, переважно з метформіном. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з похідною меглітиніду наприклад, переважно з репаглінідом або натеглінідом. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з агоністом рецептору PPAR-гама наприклад, з класу тіазолідиндіонів, наприклад, переважно з піоглітазонами або розиглітазонами. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації зі змішаним агоністом рецепторів PPAR-альфа/гама, наприклад, переважно з GI-262570 (фарглітазар), GW 2331, GW 409544, AVE 8042, AVE 8134, AVE 0847, МK-0767 (KRP-297), AZ-242. Під засобами, які проявляють антитромботичну активність, переважно розуміють сполуки з групи інгібіторів агрегації тромбоцитів, наприклад, переважно аспірин, клопідогрель, тиклопідин, дипіридамоль, або антикоагулянти. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібіторами тромбіну, наприклад, переважно з ксимелагатраном, мелагатраном, бівалірудином клексаном. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з антагоністом GPIIb-llla, наприклад, переважно з тірофібаном, абциксимабом. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібітором фактору Ха, наприклад, переважно з DX 9065a, DPC 906, JTV 803. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з гепарином або похідними гепарину, що мають низьку молекулярну вагу. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з антагоністом вітаміну К, наприклад, переважно з кумарином. Під засобами для зниження артеріального тиску розуміють переважно сполуки з групи антаноністів кальцію, наприклад, переважно ніфедипін, верапаміл, дилтіазем, ангіотензин, All-антагоністи, інгібітори АСЕ, бета-блокатори, а також діуретини. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з антагоністом рецепторів a-1. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з резерпіном, міноксидилом, діазоксидом, дигідралазином, гидралазином, а також речовинами, які вивільняють оксид азоту, наприклад, переважно з нітрогліцерином або нітропрусидом натрію. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з Allантагоністом ангіотензину, наприклад, переважно з лозартаном, валзартаном, телмізартаном. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібітором АСЕ, наприклад, переважно з еналаприлом, каптоприлом. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з бетаблокатором, наприклад, переважно з пропранололом, атенололом. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з діуретиком, наприклад, переважно фуроземідом. Під засобами які змінюють жировий обмін, розуміють переважно сполуки з групи агоністи рецепторів щитовидної залози, інгібітори синтезу холестерину, такі як інгібітори HMG-CoA-редуктази або інгібітори синтезу сквалану, інгібітори АСАТ та МТР, агоністи рецептору PPAR, фібрати, інгібітори поглинання холестерину, інгібітори ліпази, полімерні адсорбери жовчної кислоти, антагоністи ліпопротеїну(-їв) Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з агоністом рецептора щитовидної залози, наприклад, переважно з D-тироксином, 3,5,3'-трийодтироніном (Т3), CGS 23425, акситиромом (CGS 26214). Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібітором синтезу сквалану, наприклад, переважно з BMS-188494, ТАК 457. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібітором АСАТ, наприклад, переважно з авазимібом. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібітором поглинання холестерину, наприклад, переважно з езетимібом, памаквізидом. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібітором МТР, наприклад, переважно з імплітапідом, BMS-201038, R-103757. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з агоністом рецептору PPAR-альфа, наприклад, з такими фібратами, як фенофібрат клофібрат, безафібрат, ципрофібрат, гемфібрат або, наприклад, переважно з GW 9578, GW 7647, LY-518674 або NS-220. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібітором СЕТР, наприклад, переважно з торцетрапібом (СР-529 414), JJT-705. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації зі змішаним агоністом рецепторів PPAR альфа/гама, таким як, наприклад, переважно GI-262570 (фарглітазар), GW 2331, GW 409544, AVE 8042 AVE 8134, AVE 0847, МK-0767 (KRP-297), AZ-242. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з інгібітором ліпази, наприклад, переважно з орлістатом. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з полімерним адсорбером жовчної кислоти, таким як, наприклад, переважно холестирамін, колестипол, колесольвам, холестагель, колестимід. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з антагоністом ліпопротеїну(-їв), такими як, наприклад переважно гемкабен-кальцій (СІ-1027) або нікотинова кислота. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з антагоністом рецептору ніацину. Згідно з переважною формою здійснення винаходу названі сполуки застосовують у комбінації з індуктором рецептору LDL Іншим об'єктом даного винаходу є комбінації сполук формул (І)-(III) з інгібіторами HMG-CoA-редуктази з класу статинів, таких як, наприклад, переважно ловастатин, симвастатин правастатин флувастатин, аторвастатин, розувастатин та церівастатин, пітавастатин. Ефективність сполук згідно з винаходом in vitro можна, наприклад, визначити при проведенні описаного в прикладах дослідження трансактивування. Ефективність сполук згідно з винаходом in vivo можна, наприклад, визначити при проведенні описаних у прикладах досліджень. Сполуки загальної формули (І) можуть бути застосовані звичайними способами, наприклад, перорально, парентерально, інгаляційним способом, через ніс, під язик, ректально, зовнішнім способом, наприклад, через шкіру, або місцевим способом, наприклад, за допомогою імплантатів або стентів. При парентеральному застосуванні йдеться зокрема про внутрішньовенний, внутрішньом'язовий або підшкірний спосіб застосування, наприклад, у вигляді підшкірного депо. Перевагу надають пероральному або парентеральному застосуванню, особливу перевагу - пероральному застосуванню. При цьому активні речовини можуть бути застосовані окремо або у формі композицій. Для перорального застосування придатними композиціями є, наприклад, таблетки, капсули, кульки, драже, пігулки, гранули, тверді та рідкі аерозолі, сиропи, емульсії, суспензії та розчини. Активна речовина повинна входити до складу композиції у такій кількості, завдяки якій можна було б досягти необхідний терапевтичний ефект. Загалом активна речовина може входити до складу композиції у концентрації від 0,1 до 100ваг.-%, зокрема від 0,5 до 90ваг.-%, переважно від 5 до 80ваг.-%. Зокрема концентрація активної речовини повинна складати від 0,5 до 90ваг.-%, тобто активна речовина повинна міститися у кількості, достатній для досягнення вказаного діапазону дозування. З цією метою активні речовини відомими способами можуть бути переведені у звичайні композиції. Це відбувається при застосуванні інертних, нетоксичних, фармацевтично придатних носив, допоміжних речовин, розчинників, зв'язувальних агентів, емульгаторів та/або диспергаторів. Як допоміжні речовини застосовують, наприклад воду, нетоксичні органічні розчинники, такі як парафіни, рослинні олії (наприклад, кунжутну олію), спирти (наприклад, етанол, гліцерин), гліколі (наприклад, поліетиленгліколь), тверді носи, такі як помели природних або синтетичних гірських порід (наприклад, тальк або силікати), цукор (наприклад, лактозу), емульгатори, диспергатори (наприклад, полівінілпіролідон) та змазки (наприклад, сульфат магнію). При пероральному застосуванні таблетки звісно можуть також містити добавки, такі як цитрат натрію, разом з додатковими речовинами, такими як крохмаль, желатин і т.п. Водні композиції для перорального застосування крім того можуть містити також смакові добавки або барвники. При пероральному застосуванні дозування становлять від 0,001 до 5мг/кг, переважно від 0,005 до 3мг/кг ваги тіла протягом 24 годин. Наведені нижче приклади виконання пояснюють винахід, але в жодному разі не обмежують обсяг його охорони. LC/MS-методи: Метод А: колона: Waters Symmetry C18 50´2,1мм, 3,5мкм, 0,5мл/хв., А: ацетонітрил+0,1% мурашина кислота, В: вода+0,1% мурашина кислота, 0хв. 10% А, 4 хв. 90% А, 40°С. Метод В: інструмент Fmnigan MAT 900S, TSP: P4000, AS3000, UV3000HR; колона: Symmetry С18, 150мм´2,1мм, 5,0мкм; елюент С: вода, елюент В: вода+0,3г/л 35%-ної соляної кислоти, елюент А: ацетонітрил; градієнт: 0,0хв 2% А ® 2,5 хв. 95% А ® 5хв. 95% А; піч: 70°С, потік 1,2мл/хв.; УФ-визначення 210нм. Метод С: інстр умент: Micromass Quattro LCZ, HP1100; колона: Symmetry C18, 50мм´2,1мм, 3,5мкм; елюент А: ацетонітрил+0,1% мурашина кислота, елюент В: вода+0,1% мурашина кислота; градієнт: 0,0хв. 10% А ® 4,0 хв. 90% А ® 6,0хв. 90% А; піч 40°С; потік 0,5мл/хв., УФ-визначення 208-400нм. Метод D: інструмент: Micromass Platform LCZ, HP1100; колона Symmetry C18, 50мм´2,1мм, 3,5мкм; елюент А: ацетонітрил+0,1% мурашина кислота, елюент В: вода+0,1% мурашина кислота; градієнт: 0,0хв. 10% А ® 4,0 хв. 90% А ® 6,0хв. 90% А; піч: 40°С, потік 0,5мл/хв., УФ-визначення 208-400нм. Метод Ε: інструмент: Micromass Platform LCZ, HP1100; колона: Symmetry C18, 50мм´2,1мм, 3,5мкм; елюент А: ацетонітрил+0,5% мурашина кислота, елюент В: вода+0,5% мурашина кислота, градієнт: 0,0хв. 90% А ® 4,0 хв. 10% А ® 6,0хв. 10% А; піч 50°С, потік 0,5мл/хв., УФ-визначення 208-400нм. Метод F: інстр умент: Micromass TOF-MU X-lnterface/Waters600; колона: YMC-ODS-AQ, 50мм´2,1мм, 3,5мкм; температура 20°С, потік 0,8мл/хв., елюент А: ацетонітрил+0,05% мурашина кислота, елюент В: вода+0,05% мурашина кислота, градієнт: 0,0хв. 0% А ® 0,2хв. 0% А ® 2,9 хв. 70% А ® 3,1 хв. 90% А. GC/MS: Газ-носій: гелій Потік: 1,5мл/хв. Початкова температура:60°С Температурний 14°С/хв. до 300°С, градієнт: потім 1хв. постійн. 300°С Колона: НР-5 30м´320мкм´0,25мкм (товщина плівки) Початковий час: 2хв. Темп переднього інжектора: 250°С Застосовувані скорочення: абс. абсолютний водн. водний DMAP 4-N,N-диметиламінопіридин DME 1,2-диметоксиетан DMF N,N-диметилформамід DMSO диметилсульфоксид від теор. від теоретичного (на виході) ESI електророзпилювальна іонізація (при MS) GC газова хроматографія LC-MS рідинна хроматографія-масспектроскопія MG молекулярна вага MS мас-спектроскопія ЯМР ядерний магнітний резонанс Rt індекс утримування (при DC) RT кімнатна температура Rt час утримування (при HPLC) TEA триетиламін TFA трифтороцтова кислота THF тетрагідрофуран Приклади виконання: Приклад 1 [4-({3-ізопропіл-7-метил-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-індол-1-іл}-сульфоніл)-2метилфенокси]оцтова кислота Стадія а): 1-(4-бром-2-метилфеніл)гідразин 50г (267,7ммоль) 4-бром-2-метиланіліну в 190мл концентрованої соляної кислоти протягом 30 хвилин нагрівають до 80°С Після охолодження до 5°С протягом 30хв. по краплях додають 18,5г (267,7ммоль) нітриту натрію в 95мл води Через 30 хвилин перемішування при 5°С реакційну суміш протягом 45хв. по краплях додають до розчину 384г (2моль) хлориду цинку в 190мл концентрованої соляної кислоти. Через наступні 45хв. при кімнатній температурі суспензію підлужують за допомогою 50%-ного розчину натрієвого лугу. Осад відфільтровують та кілька разів екстрагують дихлорметаном та етилацетатом. Об'єднані органічні фази сушать над сульфатом магнію та концентрують. Одержують 43,6г (81% від теор.) продукту у вигляді бежевих кристалів. LC-MS (метод В): Rt=2,06хв. MS (ESInoз): m/z=201 (М+Н)+ Стадія b): 5-бром-3-ізопропіл-7-метил-1Н-індол 7г (34,8ммоль) 1-(4-бром-2-метилфеніл)гідразину суспендують в 14мл етанолу та додають 3,9г (45ммоль) ізовалеральдегіду. Через 30 хвилин перемішування при кімнатній температурі розчинник видаляють у вакуумі, а проміжний продукт без подальшого очищення сплавлюють разом з 5,2г (38ммоль) безводного хлориду цинку при 170°С. Через 30-45хв. розплав охолоджують до кімнатної температури, поміщають в дихлорметан та екстрагують розрідженою соляною кислотою та водою. Органічну фазу сушать над сульфатом магнію, а розчинник видаляють у вакуумі. Сировину розчиняють в етилацетаті та очищують на силікагелі (розчинник: циклогексан-етилацетат 9:1). Одержують 4,2г (48% від теор.). LC-MS (метод В): Rt=3,15хв. MS (ESInoз): m/z=253 (М+Н)+ 1 Н-ЯМР (300МГц, ацетон-d6): d = 1,51 (д, 6Η), 2,67 (с, 3Н), 3,37 (м, 1Н), 7,23 (с, 1Н) 7,34 (с 1Н), 7,78 (с 1Н), 10 28 (с, 1Н). Стадія с): 5-бром-3-ізопропіл-7-метиліндолін 4,1г (16,3ммоль) 5-бром-3-ізопропіл-7-метил-1Н-індолу розчиняють в 30мл крижаної оцтової кислоти та при кімнатній температурі по частинах додають 5,1г (81ммоль) ціаноборгідріду натрію. Через 16 годин нагрівання до 35°С реакційну суміш гідролізують водою та двічі екстрагують етилацетатом. Після сушіння на сульфатом натрію розчинник видаляють у вакуумі. Сировину розчиняють в етилацетаті та очищують на силікагелі (розчинник: циклогексан-етилацетат 9:1). Одержують 1,6г (39% від теор.). LC-MS (метод С): Rt=4,27хв. MS (ESInoз): m/z=255 (М+Н)+ 1 Н-ЯМР (300МГц, ацетон-d6): d = 0,85 (д, 3Η), 0,97 (д, 3Н), 2,04 (м, 1Н), 2,81 (с, 3Н), 3,25 (м, 1Н) 3,42 (дд, 1Н), 3,58 (м, 1Н), 6,96 (с, 1Н), 7,02 (с, 1Н). Стадія d): Етиловий естер 2-метилфеноксиоцтовоі кислоти 10,81г (0,10моль) 2-метилфенолу та 13,82г (0,10моль) карбонату калію суспендують в 100мл Ν,Νдиметилформаміду та протягом 1 години перемішують при 50°С. Після цього по краплях додають 18,37г (0,11моль) етилового естеру бромоцтової кислоти та суміш протягом ночі перемішують при 50°С. Після охолодження до кімнатної температури суміш концентрують у вакуумі, додають етилацетат та тричі промивають водою. Органічну фазу сушать над сульфатом натрію, а розчинник видаляють у вакуумі Шляхом дистилювання залишку в сферичній трубі одержують 18,5г (95% від теор.) бажаного продукту. GC-MS: R t=12,50хв. MS (ESInoз): m/z=194 (М)+ 1 Н-ЯМР (300МГц, CDCI3): d = 1,29 (т, 3Н), 2,29 (с, 3Н), 4,26 (к, 2Н), 4,62 (с 2Н), 6,70 (д, 1Н) 6,89 (дт, 1Н), 7,22 (т, 1Н), 7,25 (д, 1Н). Стадія e): Етил [4-(хлорсульфоніл)-2-метилфенокси]ацетат 110г (0,5моль) етил (2-метилфенокси)ацетату поміщають в 250мл хлороформу та охолоджують до 0°С. До розчину повільно по краплях додають 330г (2,8моль) хлорсульфонової кислоти. Після перемішування протягом 4 годин при кімнатній температурі реакційну суміш виливають на лід та тричі екстрагують дихлорметаном. Органічну фазу двічі промивають водою, один раз насиченим розчином гідрокарбонату натрію та один раз насиченим розчином хлориду натрію. Після сушіння над сульфатом натрію розчинник видаляють у вакуумі. Одержують 153г (93% від теор.). LC-MS (метод С): Rt=3,95хв. MS (ESInoз): m/z=293 (М+Н)+ 1 Н-ЯМР (300МГц, CDCI3): d = 1,31 (т, 3Η), 2,36 (с, 3Н), 4,28 (к, 2Н), 4,75 (с, 2Н), 6,81 (м, 2Н) 7,85 (м,2Н). Стадія f): Етил {4-[(5-бром-3-ізопропіл-7-метил-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2-метилфенокси}ацетат 2,5г (9,8ммоль) 5-бром-3-ізопропіл-7-метиліндоліну розчиняють в 20мл тетрагідрофурану та додають 3мл (21ммоль) триетиламіну, 20мг (0,16ммоль) DMAP та 2,8г (9,8ммоль) етил [4-(хлорсульфоніл)-2метилфенокси]ацетату. Реакційну суміш протягом ночі перемішують при кімнатній температурі. Після фільтрування розчинник видаляють у вакуумі, а сировину очищують на силікагелі (розчинник: циклогексанетилацетат 9:1). Одержують 4,8г (96% від теор.). LC-MS (метод В): Rt=3,29хв. MS (ESInoз): m/z=510 (Μ+Η]+ 1 Н-ЯМР (300МГц, CDCI3): d = 0,62 (д, 3Н), 0,82 (д, 3Н), 1,29 (т, 3Н), 1,84 (м, 1Н), 2,22 (с 3Н) 2,27 (м, 1Н), 2,51 (с 3Н), 3,56 (дд, 1Н), 3,95 (дд, 1Н), 4,27 (к, 2Н), 4,68 (с, 2Н), 6,62 (м 1Н) 6,69 (с 1Н), 7,25 (с 1Н), 7,30 (м 2Н). Стадія g): [4-({3-ізопропіл-7-метил-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-індол-1-іл}-сульфоніл)-2метилфенокси]оцтова кислота 0,1г (0,19ммоль) етил {4-[(5-бром-3-ізопропіл-7-метил-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2метилфенокси}ацетату розчиняють в 6мл абсолютного диметилформаміду та в атмосфері аргону додають 7мг (0,01ммоль) хлориду бю(трифенілфосфін)паладію (II), а також 48,3мг (0,25ммоль) 4трифторметилфенілборної кислоти. Через 30 хвилин перемішування при 70°С додають 1мл 2Μ розчину карбонату натрію. Реакційну суміш протягом 16 годин нагрівають до 100°С. Після охолодження до кімнатної температури фільтрують через силікагель. Розчинник видаляють у вакуумі а сировину очищують препаративною HPLC (YMC гель ODS-AQ S 5/15мкм; елюент А: вода, елюент В: ацетонітрил градієнт 0хв. 30% В, 5хв. 30% В 50хв. 95% В). Одержують 65мг (60% від теор.). LC-MS (метод В): Rt=3,25хв. MS (ESInoз): m/z=548 (М+Н)+ 1 Н-ЯМР (300МГц, CDCI3): d = 0,80 (д, 3Н), 1,86 (м, 1Н), 2,22 (с, 3Н), 2,31 (м, 1Н), 2,50 (с 3Н), 3,58 (дд, 1Н), 3,95 (дд, 1Н), 4,69 (с, 2Н), 6,59 (м, 1Н), 6,69 (с, 1Н), 7,28 (с, 1Н), 7,33 (м 2Н). Приклад 2 [2-метил-4-({2,3,7-триметил-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-індол-1-іл}сульфоніл)фенокси]оцтова кислота Стадія а): 5-бром-2,3,7-триметил-1Н-індол 8г (39,8ммоль) 1-(4-бром-2-метилфеніл)гідразину (приклад 1/стадія а) суспендують в 14мл етанолу та додають 3,7г (52ммоль) етилметилкетону. Через 30 хвилин перемішування при кімнатній температурі розчинник видаляють у вакуумі, а проміжні продукти без подальшого очищення сплавлюють разом з 5,9г (43ммоль) безводного хлориду цинку при 170°С. Через 30-45 хвилин сплав охолоджують до кімнатної температури, поміщають в дихлорметан та екстрагують розрідженою соляною кислотою та водою. Органічну фазу сушать над сульфатом магнію, а розчинник видаляють у вакуумі. Сировину розчиняють в етилацетаті та очищують на силікагелі (розчинник: циклогексан-етилацетат 9:1). Одержують 3,8г (40% від теор.). LC-MS (метод D): Rt=4,92хв. MS (ESInoз): m/z=238 (М+Н)+ 1 Н-ЯМР (300МГц, ацетон-d6): d = 2,24 (с, 3Н), 2,43 (с, 3Н), 2,52 (с, 3Н), 7,03 (с, 1Н), 7,45 (с, 1Н), 9,96 (с, 1Н). Стадія b): 5-бром-2,3,7-триметиліндолін 38г (15,8ммоль) 5-бром-3,7-диметил-1Н-індолу розчиняють в 30мл крижаної оцтової кислоти та при кімнатній температурі по частинах додають 5г (80ммоль) ціаноборгідріду натрію. Через 16 годин нагрівання до 35°С реакційну суміш гідролізують водою та двічі екстрагують етилацетатом. Після сушіння на сульфатом натрію розчинник видаляють у вакуумі. Сировину розчиняють в етилацетаті та очищують на силікагелі (розчинник: циклогексан-етилацетат 9:1). Одержують 1,4г (37% від теор.). LC-MS (метод В): Rt=2,66хв. MS (ESInoз): m/z=240 (M+H)+ 1 Н-ЯМР (300МГц, CDCI3): d = 1,26 (д, 3Η), 1,32 (д, 3Н), 2,08 (с, 3Н), 2,85 (м, 1Н), 3,48 (м, 1Н), 6,98 (с, 2Н). Стадія с): Етил {4-[(5-бром-2,3,7-триметил-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2-метил-фенокси}ацетат 1,3г (5,7ммоль) 5-бром-2,3,7-триметиліндоліну розчиняють в 4мл тетрагідрофурану та додають 1,7мл (12,5ммоль) триетиламіну, 20мг DMAP (0,16ммоль) та 1,6г (5,7ммоль) етил [4-(хлорсульфоніл)-2метилфенокси]ацетату (приклад 1/стадія e). Реакційну суміш протягом ночі перемішують при кімнатній температурі. Після фільтрування розчинник видаляють у вакуумі, а сировину очищують на силікагелі (розчинник: циклогексан-етилацетат 9:1). Одержують 0,6г (23% від теор.). LC-MS (метод В): Rt=3,15хв. MS (ESInoз): m/z=496 (М+Н)+ 1 Н-ЯМР (300МГц, CDCI3): d = 0,56 (д, 3Н), 1,23 (д, 3Н), 1,27 (т, 3Н), 2,25 (с, 3Н), 2,49 (м, 4Н), 3,98 (м, 1Н), 4,23 (к, 2Н), 4,63 (с, 2Н), 6,64 (д, 1Н), 7,00 (м, 1Н), 7,23 (м, 1Н), 7,39 (м, 2Н). Стадія d): [2-метил-4-({2,3,7-триметил-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-індол-1-іл}сульфоніл)фенокси]оцтова кислота 0,08г (0,16ммоль) етил {4-[(5-бром-2,3,7-триметил-2,3-дигідро-1Н-індол-1-іл)-сульфоніл]-2метилфенокси}ацетату розчиняють в 6мл абсолютного диметилформаміду та в атмосфері аргону додають 7мг (0,01ммоль) хлориду біс(трифенілфосфін)паладію (II), а також 40мг (0,21ммоль) 4трифторметилфенілборноі кислоти. Через 30 хвилин перемішування при 70°С додають 1мл 2Μ розчину карбонату натрію. Реакційну суміш протягом 16 годин нагрівають до 100°С. Після охолодження до кімнатної температури фільтрують через силікагель. Розчинник видаляють у вакуумі, а сировину очищують препаративною HPLC (YMC гель ODS-AQ S 5/15мкм, елюент А: вода, елюент В: ацетонітрил, градієнт 0хв. 30% В, 5хв. 30% В, 50хв. 95% В). Одержують 64мг (74% від теор.). LC-MS (метод С): Rt=5,26хв. MS (ESInoз): m/z=534 (М+Н)+ 1 Н-ЯМР (300МГц, CDCI3): d = 0,61 (д, 3Н) 0,8 (д, 3Н), 2 61 (с, 3Н), 3,57 (м, 1Н), 3,78 (с 2Н) 3 91 (м 1Н), 6,51 (д 1Н), 6,90 (д 2Н), 6,98 (с, 1Н), 7,18 (д, 2Н), 7,40 (м, 3Н). Приклад 3 [4-({3,7-диметил-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-індол-1-іл}сульфоніл)-2метилфенокси]оцтова кислота Стадія а): 5-бром-3,7-диметил-1Н-індол 5г (24,8ммоль) 1-(4-бром-2-метилфеніл)гідразину (приклад 1/стадія а) суспендують в 14мл етанолу та додають 1,8г (32ммоль) пропюнальдегіду. Через 30 хвилин перемішування при кімнатній температурі розчинник видаляють у вакуумі, а проміжний продукт без подальшого очищення сплавлюють разом з 3,7г (27ммоль) безводного хлориду цинку при 170°С. Через 30-45 хвилин сплав охолоджують до кімнатної температури, поміщають в дихлорметан та екстрагують розрідженою соляною кислотою та водою. Органічну фазу сушать над сульфатом магнію, а розчинник видаляють у вакуумі. Сировину розчиняють в етилацетаті та очищують на силікагелі (розчинник: циклогексан-етилацетат 9:1). Одержують 1,5г (27% від теор.). LC-MS (метод С): Rt=4,65хв. MS (ESInoз): m/z=224 (М+Н)+ 1 Н-ЯМР (300МГц, ацетон-d6): d = 2,26 (с, 3Н), 2,48 (с, 3Н), 7,06 (с, 1Н), 7,12 (с, 1Н), 7,51 (с, 1Н). Стадія b): 5-бром-3,7-диметиліндолін 1,4г (6,4ммоль) 5-бром-3,7-диметил-1Н-індолу розчиняють в 30мл крижаної оцтової кислоти та при кімнатній температурі по частинах додають 2г (33ммоль) ціаноборгідріду натрію. Через 16 годин нагрівання до 35°С реакційну суміш гідролізують водою та двічі екстрагують етилацетатом. Після сушіння над сульфатом натрію розчинник видаляють у вакуумі. Сировину розчиняють в етилацетаті та очищують на силікагелі (розчинник: циклогексан-етилацетат 9:1). Одержують 0,79г (53% від теор.). LC-MS (метод В): Rt=2,38хв. MS (ESInoз): m/z=227 (М+Н)1 Н-ЯМР (300МГц, CDCI3): d = 1,29 (д, 3Н), 2,09 (с, 3Н), 3,13 (т, 1Н), 3 36 (м, 1Н), 3 72 (т, 1Н), 6 99 (с, 1Н), 7,03 (с, 1Н). Стадія с): Етил {4-[(5-бром-3,7-диметил-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2-метилфенокси}ацетат 0,7г (3,4ммоль) 5-бром-3,7-диметиліндоліну розчиняють в 4мл тетрагідрофурану та додають 1мл (7,4ммоль) триетиламіну, 20мг DMAP та 1г (3,4ммоль) етил [4-(хлорсульфоніл)-2-метилфенокси]ацетату (приклад 1/стадія e). Реакційну суміш протягом ночі перемішують при кімнатній температурі. Після фільтрування розчинник видаляють у вакуумі, а сировину очищують на силікагелі (розчинник: циклогексан/етилацетат 9:1). Одержують 1,5г (90% від теор.). LC-MS (метод D): Rt=5,25хв. MS (ESInoз): m/z=482 (М+Н)+ 1 Н-ЯМР (300МГц, CDCI3): d = 0,98 (д, 3Н), 1,28 (τ, 3Н), 2,22 (с, 3Н), 2,39 (м, 1Н), 2,52 (с, 3Н), 3,31 (дд, 1Н), 4,14 (дд, 1Н) 4,27 (к, 2Н), 4,66 (с, 2Н), 6,61 (д, 1Н), 6,93 (с, 1Н), 7,26 (м, 3Н). Стадія d): [4-({3,7-диметил-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-індол-1-іл}сульфоніл)-2метилфенокси]оцтова кислота 0,1г (0,2ммоль) етил {4-[(5-бром-3,7-диметил-2,3-дигідро-1Н-індол-1-іл)-сульфоніл]-2метилфенокси}ацетату розчиняють в 6мл абсолютного диметилформаміду та в атмосфері аргону додають 7мг (0,01ммоль) хлориду біс(трифенілфосфін)паладію (II), а також 51мг (0,26ммоль) 4трифторметилфенілборноі кислоти. Через 30 хвилин перемішування при 70°С додають 1мл 2Μ розчину карбонату натрію. Реакційну суміш протягом 16 годин нагрівають до 100°С. Після охолодження до кімнатної температури фільтрують через силікагель. Розчинник видаляють у вакуумі, а сировину очищують препаративною HPLC (YMC гель ODS-AQ S 5/15мкм; елюент А: вода, елюент В: ацетонітрил, градієнт 0хв. 30% В, 5хв. 30% В, 50хв. 95% В). Одержують 87мг (81% від теор.). LC-MS (метод D): Rt=5,18xв. MS (ESInoз): m/z=520 (M+H)+ 1 Н-ЯМР (300МГц, CDCI3): d = 0,98 (д, 3Н), 2,24 (с, 3Н), 2,41 (м, 1Н), 2,53 (с, 3Н), 3,31 (дд, 1Н), 4,15 (дд, 1Н), 4,66 (с, 2Н), 6,63 (д, 1Н) 6,93 (с, 1Н), 7,27 (м, 3Н). Приклад 4 [4-({3-ізопропіл-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-піроло[3,2-b]піридин-1-іл}сульфоніл)-2метилфенокси]оцтова кислота Стадія а): 5-хлор-3-ізопропіл-1Н-піроло[3,2-b]піридин 0,2г (1,39ммоль) 2-хлор-5-гідразинопіридину (одержання із 5-аміно-2-хлорпіридину згідно з GB 259961) суспендують в етанолі та додають 0,16г (1,8ммоль) 3-метилбутаналу. Через 30 хвилин перемішування при кімнатній температурі розчинник видаляють у вакуумі та залишок сушать у вакуумі. Після цього до проміжної сполуки додають 0,2г (1,53ммоль) безводного хлориду цинку та у масляній ванні нагрівають до 170°С. Через 30 хвилин перемішування при цій температурі суміш охолоджують до кімнатної температури. Сировину поміщають у ди хлорметан та промивають розрідженою соляною кислотою. Після сушіння над сульфатом магнію розчинник видаляють у вакуумі, а сировину очищують на силікагелі (розчинник: циклогексан-етилацетат 1:1). Одержують 133мг (49% від теор.). LC-MS (метод В): Rt=2,62хв. MS (ESInoз): m/z=195 (М+Н)+ 1 Н-ЯМР (300МГц, CDCi3): d = 1,36 (д, 6Η), 3,41 (м, 1Н), 7,09 (д, 1Н), 7,22 (с, 1Н), 7,58 (д, 1Н). Стадія b): 3-ізопропіл-5-[4-(трифторметил)феніл]-1Н-піроло[3,2-b]піридин 0,1г (0,51ммоль) 5-хлор-3-ізопропіл-1Н-піроло[3,2-b]піридину в атмосфері аргону поміщають в 0,13г (0,67ммоль) 4-трифторметилфенілборноі кислоти, а 0,018г (0,026ммоль) хлориду біс(трифенілфосфін)паладію (II) поміщають в 6мл DMF та протягом 30 хвилин нагрівають до 70°С. Після додавання 1мл 2Μ розчину карбонату натрію реакційну суміш протягом ночі нагрівають до 100°С. Після охолодження фільтрують через силікагель. Розчинник видаляють у вакуумі, а сировину очищують препаративною HPLC (YMC гель ODS-AQ S 5/15мкм; елюент А: вода, елюент В: ацетонітрил, градієнт 0хв. 30% В, 5хв. 30% В, 50хв. 95% В). Одержують 100мг (64% від теор.). LC-MS (метод С): Rt=4,47хв. MS (ESInoз): m/z=305 (М+Н)+ Стадія с): 3-ізопропіл-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-піроло[3,2-b]піридин 0,085г (0,279ммоль) 3-ізопропіл-5-[4-(трифторметил)феніл]-1Н-піроло[3,2-b]-піридину а також 0,16г (2,7ммоль) нікелю Ренея поміщають в 10мл декаліну та протягом 16 годин гідрують при 80бар та 180°С. Продукт екстрагують метанолом та без подальшого очищення застосовують на наступних стадіях одержання. LC-MS (метод D): Rt=5,00хв. MS (ESInoз): m/z=307 (М+Н)+ Стадія d): Етил [4-({3-ізопропіл-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-піроло[3,2-b]-піридин-1-іл}сульфоніл)-2метилфенокси]ацетат 0,085мг (0,277ммоль) 3-ізопропіл-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-піроло[3,2-b]піридину розчиняють в 2мл абсолютного THF та додають 0,081г (0,277ммоль) етил [4-(хлорсульфоніл)-2метилфенокси]ацетату (приклад 1/стадія e), а також 0,085мл (0,61ммоль) триетиламіну та 4мг (0,028ммоль) DMAP. Реакційну суміш протягом ночі нагрівають до 45°С. Після цього фільтрують, а розчинник видаляють у вакуумі. Сировину очищують препаративною HPLC (YMC гель ODS-AQ S 5/15мкм; елюент А: вода, елюент В: ацетонітрил градієнт 0хв. 30% В, 5 хв. 30% В, 50хв. 95% В). Одержують 37мг (24% від теор.). LC-MS (метод Е): Rt=4,78хв. MS (ESInoз): m/z=563 (М+Н)+ 1 Н-ЯМР (300МГц, D MSO-d6): d = 0,82 (д, 3Н) 1,06 (д, 3Н), 1,45 (м 1Н), 2,21 (м, 1Н), 2,33 (с 3Н), 3,91 (м 1Н), 4,15 (м, 1Н), 4,67 (с 2Н), 7 04 (д, 1Н), 7,92 (м, 5Н), 7,99 (д, 2Н), 8,34 (д, 2Н). Стадія e): [4-({3-ізопропіл-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-піроло[3,2-b]піридин-1-іл}сульфоніл)-2метилфенокси]оцтова кислота 0,029г (0,052ммоль) етил [4-({3-ізопропіл-5-[4-(трифторметил)феніл]-2,3-дигідро-1Н-піроло[3,2b]піридин-1-іл}сульфоніл)-2-метилфенокси]ацетату розчиняють в 1мл THF та додають 0,5мл 1N розчину натрієвого лугу. Реакційну суміш протягом ночі перемішують при кімнатній температурі. Після підкислювання концентрованою соляною кислотою екстрагують дихлорметаном сушать над сульфатом магнію, а розчинник видаляють у вакуумі. Одержують 27мг (97% від теор.). LC-MS (метод Е): Rt=4,43хв. MS (ESInoз): m/z=535 (М+Н)+ 1 Н-ЯМР (300МГц, DMSO-d6): d = 0,82 (д, 3Н), 1,06 (д, 3Н), 1,45 (м, 1Н), 2,21 (м, 1Н), 2,33 (с, 3Н), 3,91 (м, 1Н), 4,15 (м, 1Н), 4,67 (с, 2Н), 7,04 (д, 1Н), 7 92 (м, 5Н), 7,99 (д, 2Н), 8 34 (д, 2Н). Приклад 5 (4-{[5-(4-трифторметилфеніл)-2,3-дигідро-3-спіро-1'-циклогексил-1Н-індол-1-іл]-сульфоніл}-2метилфенокси)оцтова кислота Стадія а): Гідрохлорид 4-бромфенілгідразину Розчин 32,0г (186ммоль) 4-броманіліну в 200мл концентрованої соляної кислоти при перемішуванні охлоджують до 0°С. При цій температурі до розчину додають 12,8г (186ммоль) нітриту натрію в 150мл води. Одержаний таким чином розчин діазонію при перемішуванні при 0-4°С по краплях додають до розчину 42,7г (225ммоль) хлориду цинку (II) в 100мл концентрованої соляної кислоти. Одержаний осад відсмоктують та двічі промивають по 50мл води, після цього викристалізовують із ізопропанолу. Одержують 17,2г (41% від теор.) продукту у вигляді твердої речовини. Rf (дихлорметан/метанол 40:1)=0,46. УФ [нм] = 198, 234, 284. MS (ESInoз): m/z=187, 189 [М+Н]+ 1 Н-ЯМР (D MSO-d6 , 300МГц): d = 6,93 (2Η, д), 7,46 (2Н, д), 8,39 (1Н, с, ш.), 10,23 (Н, с.ш.). Стадія b): 5-бром-2,3-дигідро-3-спіро-1'-циклогексил-1Н-індол Через суміш із 90мл толуол/ацетонітрил (49:1) протягом 5 хвилин пропускають аргон та потім додають 6,00г (26,8ммоль) гідрохлориду 4-бромфенілгідразину. Після цього по краплях повільно додають 7,41мл (96,2ммоль) трифтороцтової кислоти, при цьому зважають на те, щоб температура не перевищувала 35°С. Потім при температурі 35°С по краплях повільно протягом 2 годин додають розчин 3,27г (29,2ммоль) циклогексанкарбальдегіду в 8,4мл суміші толуол/ацетонітрил (49:1). Протягом 4 годин суміш перемішують при 35°С та протягом 2 годин при кімнатній температурі. Після цього охолоджують до -10°С та додають 8,0мл метанолу. Протягом 30 хвилин по частинах додають 1,64мг (43,3ммоль) твердого боргідріду натрію, при цьому температура не повинна перевищувати -2°С. Потім суміш протягом 1 години перемішують при 0°С. Після додавання 150мл 6ваг.-%-ного розчину аміаку у воді фази відділяють, а органічну фазу поміщають відповідно у 3мл ацетонітрилу та метанолу. Після цього органічну фазу промивають 150мл 15%ного розчину хлориду натрію у воді та сушать над сульфатом натрію, фільтрують через 150г силікагелю та двічі промивають відповідно 200мл діетилового етеру. Ор ганічний фільтрат концентрують у вакуумі та хроматографують 200г силікагелю (70-230меш). Спочатку побічні продукту елююють циклогексаном, потім продукт елююють сумішшю циклогексан/діетиловий етер (20:1). Одержують 4,25г (50% від теор.) твердої речовини. Rf (петролейний етер/етилацетат 5:1) = 0,4. MS (ESInoз): m/z=266, 268 [M+H]+ УФ [нм] = 200, 270, 276. 1 Н-ЯМР (D MSO-d6 , 400МГц): d = 1,20-1,69 (10Н, м) 3,30 (2Н, д), 5,65 (1Н, с), 6,39 (1Н д), 7,01 (1Н, дд), 7,07 (1Н, д). Стадія с): Етил {4-[(5-бром-2,3-дигідро-3-спіро-1'-циклогексил-1Н-індол-1-іл)сульфоніл]-2-метилфенокси}ацетат Розчин 4,5г (16,9ммоль) 5-бром-2,3-дигідро-3-спіро-1'-циклогексил-1Н-індолу, 5,18мл (37,2ммоль) триетиламіну та 210мг (1,69ммоль) 4-диметиламінопіридину в 60мл абсолютного тетрагідрофурану охолоджують до -5°С та при цій температурі по краплях додають розчин 4,95г (16,91ммоль) етил [4(хлорсуль фоніл)-2-метилфенокси]ацетату (приклад 1/стадія e) в 40мл абсолютного тетрагідрофурану. Протягом 18 годин перемішують при кімнатній температурі та після цього додають 150мл дистильованої води. Тричі екстрагують відповідно 150мл етилацетату. Об'єднані органічні фази промивають 200мл насиченого розчину хлористого натрію, сушать над сульфатом натрію та концентрують у вакуумі. Сировину очищують фле ш-хорматографією 150г силікагелю (70-230меш). Для елюювання використовують суміш із циклогексану та етилацетату (6:1). Одержують 8,25г (93% від теор.) продукту у вигляді жорсткої піни. Rf (петролейний етер/етилацетат 3:1) = 0,6. MS (ESInoз): m/z=508, 510 [М+Н]+ УФ [нм] = 202, 238, 258. 1 Н-ЯМР (DMSO-d 6, 300МГц): d = 1,16 (3Η, т), 1,05-1,55 (10Н, м), 2,20 (3Н, с), 3,67 (2Н, с), 4,13 (2Н, к), 4,89 (2Н, с), 7,00 (1Н, дд), 7,34-7,42 (3Н, м), 7,55 (1Н, дд), 7,68 (1Н, д). Стадія d): {4-[(5-бром-2,3-дигідро-3-спіро-1'-циклогексил-1Н-індол-1-іл)сульфоніл]-2-метил-фенокси}оцтова кислота До розчину 3,3г (6,32ммоль) етил {4-[(5-бром-2,3-дигідро-3-спіро-1'-циклогексил-1Н-індол-1іл)сульфоніл]-2-метилфенокси}ацетату в 16мл тетрагідрофурану додають розчин 0,53г (9,47ммоль) гідроксиду калію в 8мл води. Протягом години перемішують при кімнатній температурі, потім додають 0,49г (3,16ммоль) гідрофосфатдигідрату натрію. Тетрагідрофуран видаляють у вакуумі а залишок розріджують 40мл води. Один раз промивають 40мл діетилового етеру. У водній фазі за допомогою 1N розчину соляної кислоти встановлюють рівень рН 2 та тричі екстрагують відповідно 40мл дихлорметану. Органічну фазу сушать над сульфатом натрію та концентрують у вакуумі. Одержують 2,55г (82% від теор.) продукту у вигляді жорсткої піни. Rf (петролейний етер/етилацетат 1:3) = 0,14. MS (ESInoз): m/z=494, 496 [М+Н]+ УФ [нм] = 206, 238, 258. 1 Н-ЯМР (DMSO-d 6, 200МГц): d = 1,09-1,76 (10Н, м), 2,19 (3Н, с), 3,78 (2Н, с), 4,78 (2Н с), 6 96 (1Н, д), 7,37 (3Н, д), 7,60 (11H, дд), 7,68 (1Н, с), 13,2 (1Н, с, ш.). Стадія e): (4-{[5-(4-трифторметилфеніл)-2,3-дигідро-3-спіро-1'-циклогексил-1Н-індол-1-іл]-сульфоніл}-2метилфенокси)оцтова кислота В атмосфері аргону до 84,9мг (0,45ммоль) 4-трифторметилборноі кислоти додають розчин 170мг (0,34ммоль) {4-[(5-бром-2,3-дигідро-3-спіро-1'-циклогексил-1Н-індол-1-іл)сульфоніл]-2метилфенокси}оцтовоі кислоти та 6,2мг (8,5мкмоль) хлориду 1,1'-біс(дифенілфосфіно)фероценпаладію(II) в 3мл 1,2-диметоксиетану. При ретельному перемішування додають 0,76мл 2N розчину карбонату натрію. Протягом ночі перемішують при 60°С. При кімнатній температурі до реакційного розчину додають 8,50мг (0,048ммоль) 1,3,5-триазин-2,4,6-тритіолу. За допомогою 5N розчину трифтороцтової кислоти у воді встановлюють рівень рН 4-5, після цього розчинник видаляють у вакуумі Залишок очищують за допомогою RP-HPLC (Kroma-Sil 50´20мм, елюент А: вода та 0,3% трифтороцтова кислота, елюент В: ацетонітрил, 0хв. А:В=1:1, 7хв. А:В=1:4, 8 хв. А:В=1:9). Одержують 116мг (61% від теор.) твердої речовини. Rf (метиленхлорид/метанол 10;1)=0,28. MS (ESInoз): m/z=560 [М+Н]+ УФ [нм] = 200, 292. 1 Н-ЯМР (DMSO-d6 , 200МГц): d = 1,09-1,55 (10Н, м), 2,20 (3Н, с), 3,83 (2Н, с), 4,79 (2Н, с), 6,97 (1Н, д), 7,57-7,88 (9Н м), 13,11 (1Н, с). Приклад 6 (4-{[5-(4-метоксифеніл)-2,3-дигідро-1Н-індол-1-іл]сульфоніл}-2-метилфенокси)-оцтова кислота Стадія а): Етил {4-[(5-бром-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2-метилфенокси}ацетат До розчину 792мг (4,00ммоль) 5-броміндоліну, 1,23мл (8,80ммоль) триетиламіну та 48,9мг (0,400ммоль) 4-диметиламінопіридину в 12мл тетрагідрофурану при температурі від -5 до 0°С по краплях додають розчин 1,17г (4,00ммоль) етил [4-(хлорсульфоніл)-2-метилфенокси]ацетату (приклад 1/стадія e) в 8мл тетрагідрофурану. Суміш залишають нагріватися до кімнатної температури та перемішують протягом наступних 2 годин. До реакційного розчину додають 30мл води та тричі екстрагують відповідно 20мл етилацетату. Об'єднані органічні фази сушать над суль фатом натрію, а розчинник видаляють у вакуумі. Одержують 1,5г сировини, очищеної флеш-хроматографіею (силікагель 70-230меш, елюент: циклогексан/етилацетат 5:1). Одержують 1,26г (69% від теор.) продукту у ви гляді твердої речовини. Rf (петролейний етер/етилацетат 4:1) = 0,25. MS (ESInoз): m/z=454 [M+H]+ УФ [нм] = 200, 208, 240. 1 Н-ЯМР (DMSO-d6, 200МГц): d = 1,17 (3Н, т), 2,20 (3Н с), 2,93 (2Н, т), 3,88 (2Н, т), 4,14 (2Н, к), 4,90 (2Н, с), 7,00 (1Н, д), 7,35-7,42 (3Н м), 7,58-7,65 (2Н, м). Стадія b): 4-[(5-бром-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2-метилфеноксиоцтова кислота До розчину 310мг (0,682ммоль) етил {4-[(5-бром-2,3-дигідро-1Н-індол-1-іл)-сульфоніл]-2метилфенокси}ацетату в 2мл тетрагідрофурану додають розчин 57,4мг (1,02ммоль) гідроксиду калію в 1мл води. Протягом 45 хвилин перемішують при кімнатній температурі, а розчинник видаляють у вакуумі. Залишок розріджують 3мл води та за допомогою 1N розчину соляної кислоти встановлюють рівень рН 2. Одержаний осад відсмоктують через фільтрувальну картуш. Осад двічі промивають відповідно 2мл води та сушать у вакуумі. Одержують 279мг (96% від теор.) продукту у вигляді твердої речовини. MS (ESInoз): m/z=426, 428 [М+Н]+ УФ [нм] = 200, 238. 1 Н-ЯМР (DMSO-d 6, 300МГц): d = 2,19 (3Н, с), 2,93 (2Н, т), 3,89 (2Н, т), 4,79 (2Н, с), 6,97 (1Н, д), 7,31-7,41 (3Н, м), 7,57-7,65 (2Н, м). Стадія с): (4-{[5-(4-метоксифеніл)-2,3-дигідро-1Н-індол-1-іл]сульфоніл}-2-метилфенокси)-оцтова кислота В атмосфері аргону до 54,7мг (0,360ммоль) 4-метоксифенілборноі кислоти додають 33,6мг (0,792ммоль) хлориду літію. Розчин 128мг (0,300ммоль) 4-[(5-бром-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2метилфеноксиоцтовоі кислоти та 3,5мг (3,0мкмоль) тетракіс(трифенілфосфін)паладію (0) поміщають в 3мл 1,2-диметоксиетану. При ретельному перемішуванні додають 660мкл 2Μ розчину карбонату натрію у воді. Протягом ночі залишають при 60°С та після цього охолоджують до кімнатної температури. До реакційного розчину додають 8,50мг (0,048ммоль) 1,3,5-триазин-2,4,6-тритіолу та 9,0мг (0,041ммоль) 2,2біс(гідроксиметил)-2,2',2"-нітрилотриетанолу та концентрують у вакуумі. Залишок промивають 2мл суміші циклогексан/етилацетат (2:1), поміщають у суміш із 3мл 1,2-диметоксиетану та 0,6мл води та підкислюють 0,66мл 5N розчину трифтороцтової кислоти (рН£4). Розчинник видаляють у вакуумі, залишок поміщають в тетрагідрофурану та очи щують препаративною RP-HPLC (Kroma-Sil 50´20мм, елюент А: вода та 0,3% трифтороцтова кислота, елюент В: ацетонітрил 0хв. А:В=9:1, 2 хв. А:В=9:1, 7 хв. А:В=19,8 хв. А:В=1:9). Одержують 107мг (79% від теор.) продукту у ви гляді ліофілізату. MS (ESInoз): m/z=454 [М+Н]+ УФ [нм] = 204, 246, 280. 1 Н-ЯМР (DMSO-d6, 300МГц) d = 2,19 (3Н, с) 2,97 (2Н, τ), 3,77 (3Н с), 3,91 (2Н, т), 4 78 (2Н с), 6,97 (3Н д), 7,39-7 53 (5Н, м), 7,62-7,64 (2Н, м). Приклад 7 (4-{[5-(4-трифторметилфеніл)-3,3-диметил-2,3-дигідро-1Н-індол-1-іл]сульфоніл}-2метилфенокси)оцтова кислота Стадія а): 5-бром-3,3-диметиліндолін Через суміш із 45мл толуол/ацетонітрил (49:1) протягом 5 хвилин пропускають аргон та потім додають 3,00г (13,4ммоль) 4-бромфенілгідразину. Після цього повільно додають 3,71мл (48,1ммоль) трифтороцтової кислоти, при цьому зважають на те, щоб температура не перевищувала 35°С. Потім при температурі 35°С повільно по краплях протягом 2 годин додають розчин 1,05г (14,6ммоль) ізобутиральдегіду в 4мл суміші толуол/ацетонітрил (49:1). Протягом 4 годин перемішують при 35°С та протягом 2 годин при кімнатній температурі. Після цього охолоджують до -10°С, додають 4,0мл метанолу та протягом 30 хвилин по частинах додають 819мг (21,7ммоль) твердого бор гідриду натрію. При цьому температура не повинна перевищувати -2°С. Потім протягом 1 години перемішують при 0°С. Після додавання 150мл 6ваг.-%-ного розчин аміаку у воді фази відокремлюють, та органічну фазу поміщають відповідно у 1,5мл ацетонітрилу та метанолу. Після цього органічну фазу промивають 150мл 15%-ного розчину хлориду натрію у воді та сушать над сульфатом натрію. Фільтрують через 100г силікагелю та двічі промивають відповідно 200мл діетилового етеру. Органічний фільтрат концентрують у вакуумі та хроматографують 100г силікагелю. Спочатку побічний продукту елююють циклогексаном, потім продукт елююють сумішшю циклогексан/діетиловий етер (20:1). Одержують 1,78г (54% від теор.) продукту у вигляді масла. Rf (петролейний етер/етилацетат 5:1) = 0,47. УФ [нм] = 200, 268, 276. MS (ESInoз): m/z=226 [М+Н]+ 1 Н-ЯМР (DMSO-d6, 200МГц) d = 1,20 (6Η, с), 3,18 (2Н, д), 5,66 (1Н, с, ш.), 6,42 (1Н, д), 7 02(1Н, дд) 7,10 (1Н, д). Стадія b): Етил {4-[(5-бром-3,3-диметил-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2-метил-фенокси}ацетат Розчин 920мг (4,07ммоль) 5-бром-3,3-диметиліндоліну, 906мг (8,95ммоль) триетиламіну та 49,7мг (0,407ммоль) 4-диметиламінопіридину в 12,5мл абсолютного тетрагідрофурану охолоджують до -5°С та при цій температурі по краплях додають розчин 1,19г (4,07ммоль) етил [4-(хлорсульфоніл)-2метилфенокси]ацетату (приклад 1/стадія e) в 10мл абсолютного тетрагідрофурану. Протягом 18 годин перемішують при кімнатній температурі та після цього додають 100мл дистильованої води. Тричі екстрагують відповідно 50мл етилацетату. Об'єднані органічні фази промивають 200мл насиченого розчину хлористого натрію, сушать над сульфатом натрію та концентрують у вакуумі. Сировину очищують флешхроматографією 150г силікагелю. Одержують 1,74г (89% від теор.) продукту у вигляді жорсткої піни. Rf (петролейний етер/етилацетат 3:1) = 0,48. LC-MS (метод A): Rf=5,18хв. MS (ESInoз): m/z=482 [M+H]+ УФ [нм] = 200, 238, 256. Стадія с): {4-[(5-бром-3,3-диметил-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2-метилфенокси}-оцтова кислота До розчину 990мг (2,05ммоль) етил {4-[(5-бром-3,3-диметил-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2метилфенокси}ацетату в 5мл тетрагідрофурану додають розчин 173мг (3,08ммоль) гідроксиду калію в 2,5мл води та протягом 45 хвилин перемішують при кімнатній температурі. Потім додають 160мг (1,03ммоль) гідрофосфатдигідрату натрію. Розчинник видаляють у вакуумі. Залишок поміщають у 40мл води та промивають 20мл діетилового етеру. Після цього за допомогою 1N розчину соляної кислоти встановлюють рівень рН 2 та тричі екстрагують відповідно 20мл дихлорметану. Після сушіння над сульфатом натрію розчинник видаляють у вакуумі. Одержують 805мг (86% від теор.) продукту у вигляді жорсткої піни. Rf (дихлорметан/метанол 10:1) = 0,31. MS (ESInoз): m/z = 454, 456 [М+Н]+ 1 Н-ЯМР (DMSO-d6, 300МГц) d = 1,10 (6Η, с), 2,21 (3Н, с), 3,64 (2Н, с), 4,79 (2Н, с), 6,99 (1Н, д) 7,33-7,41 (3Н, м), 7,62 (1Н, дд) 7,65 (1Н, с), 13,05 (1Н, с, ш.). Стадія d): (4-{[5-(4-трифторметилфеніл)-3,3-диметил-2,3-дигідро-1Н-індол-1-іл]сульфоніл}-2метилфенокси)оцтова кислота Розчин 77,2мг (0,17ммоль) {4-[(5-бром-3,3-диметил-2,3-дигідро-1Н-індол-1-іл)сульфоніл]-2метилфенокси}оцтовоі кислоти та 6,2мг (8,5мкмоль) хлориду 1,1'-біс-(дифенілфосфіно)фероценпаладію (II) в 1,5мл 1,2-диметоксиетану в атмосфері аргону додають до 38,0мг (0,20ммоль) 4трифторметилфенілборноі кислоти. Потім при ретельному перемішуванні додають 374мкл 2Μ розчину карбонату натрію у воді та протягом 17 годин перемішують в атмосфері аргону при 60°С. Для виведення паладію до реакційної суміші додають 8,50мг (0,048ммоль) 1,3,5-триазин-2,4,6-тритіолу та нейтралізують 5N розчином трифтороцтової кислоти у воді. Концентрують у вакуумі, а залишок поміщають у 3мл суміші із дихлорметану та метанолу (5:1) та фільтрують через картуш наповнену 2г силікагелю. Продукт елююють 20мл суміші дихлорметан/метанол (5:1), а розчинник видаляють у вакуумі. Залишок розчиняють у суміші із 400мкл тетрагідрофурану та 200мкл диметилсульфоксиду та хроматографують RP-HPLC (Kroma-Sil, 50´20мм, елюент А: вода, елюент В: ацетонітрил та 0,3% трифтороцтова кислота, градієнт 0 хв. 50% А, 50% В; 7хв. 20% А та 80% В; 8хв. 10% А та 90% В). Розчинник видаляють у вакуумі. Одержують 46,1мг (52% від теор.) продукту у вигляді твердої речовини. LC-MS (метод A): Rt=5,15хв. MS (ESInoз): m/z=520 [M+H]+ 1 Н-ЯМР (DMSO-d 6, 400МГц): d = 1,19 (6H, с), 2,21 (3Н, с), 3,70 (2Н, с), 4,79 (2Н, с), 6,99 (1Н, д), 7,52-7,62 (3Н, м), 7,67 (1Н, д), 7,71 (1Н, с), 7,76 (2Н, д), 7,85 (2Н, д). Наведені нижче в таблиці сполуки із прикладів виконання 8-96 одержують аналогічно описаним вище способам:
ДивитисяДодаткова інформація
Назва патенту англійськоюIndolin phenylsulfonamide derivatives
Автори англійськоюBischoff Chilmar, Dittrich-Wengenroth, Elke, Thielemann, Wolfgang
Назва патенту російськоюПроизводные индолинфенилсульфонамида
Автори російськоюБишофф Хильмар
МПК / Мітки
МПК: C07D 209/08, C07D 471/04, A61P 9/10, C07D 405/04, A61P 3/06, A61K 31/404, C07D 209/96, A61K 31/437, A61P 9/00
Мітки: похідні, індолінфенілсульфонаміду
Код посилання
<a href="https://ua.patents.su/51-79003-pokhidni-indolinfenilsulfonamidu.html" target="_blank" rel="follow" title="База патентів України">Похідні індолінфенілсульфонаміду</a>












