Похідні індолізину, спосіб їх отримання і їх терапевтичне застосування
Номер патенту: 109013
Опубліковано: 10.07.2015
Автори: Лассалль Жільбер, Алькуфф Шанталь, Ербер Корантен
Формула / Реферат
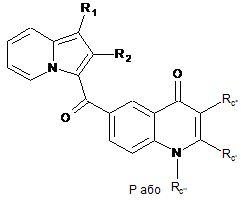
1. Сполука формули (І):
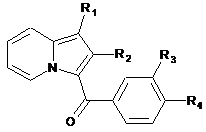 , (I)
, (I)
де:
R1 являє собою
атом водню або галогену,
алкільну групу, необов'язково заміщену -COOR5,
алкенільну групу, необов'язково заміщену -COOR5,
- COOR5 або -CONR5R6 групу,
- NR5COR6 або -NR5-SO2R6 групу,
- OR5, -O-Alk-OR5, -O-Alk-COOR5, -O-Alk-OR5, -O-Alk-NR5R6 або -O-Alk-NR7R8 групу,
або
арильну групу, зокрема феніл, або гетероарильну групу, де вказана арильна або гетероарильна група необов'язково заміщена однією або декількома групами, вибраними з: атомів галогену, алкільних груп, циклоалкільних груп, -COOR5, -CF3, -OCF3, -CN, -C(NH2)nOH, -OR5, -O-Alk-COOR5, -O-Alk-NR5R6, -O-Alk-NR7Rg, -Alk-OR5, -Alk-COOR5, -CONR5R6, -CO-NR5-OR6, -CO-NR5-SO2R7, -CONR5-Alk-NR5R6, -CONR5-Alk-NR7R8, -Alk-NR5R6, -NR5R6, -NC(O)n(CH3)2, -CO-Alk, -CO(OAlk)nOH, -COO-Alk-NR5R6, -COO-Alk-NR7R8 і 5-членних гетероарильних груп, де вказані гетероарильні групи необов'язково заміщені однією або декількома групами, вибраними з атомів галогену і алкільної, -CF3, -CN, -COOR5, -Alk-OR5, -Alk-COOR5, -CONR5R6, -CONR7R8, -CO-NR5-OR6, -CO-NR5-SO2R6, -NR5R6 і -Аlk-NR5R6 груп, або гідроксильною групою, або атомом кисню,
n є цілим числом від 1 до 3,
R2 являє собою:
атом водню,
алкільну групу,
фенільну групу, необов'язково заміщену однією або декількома алкільними групами,
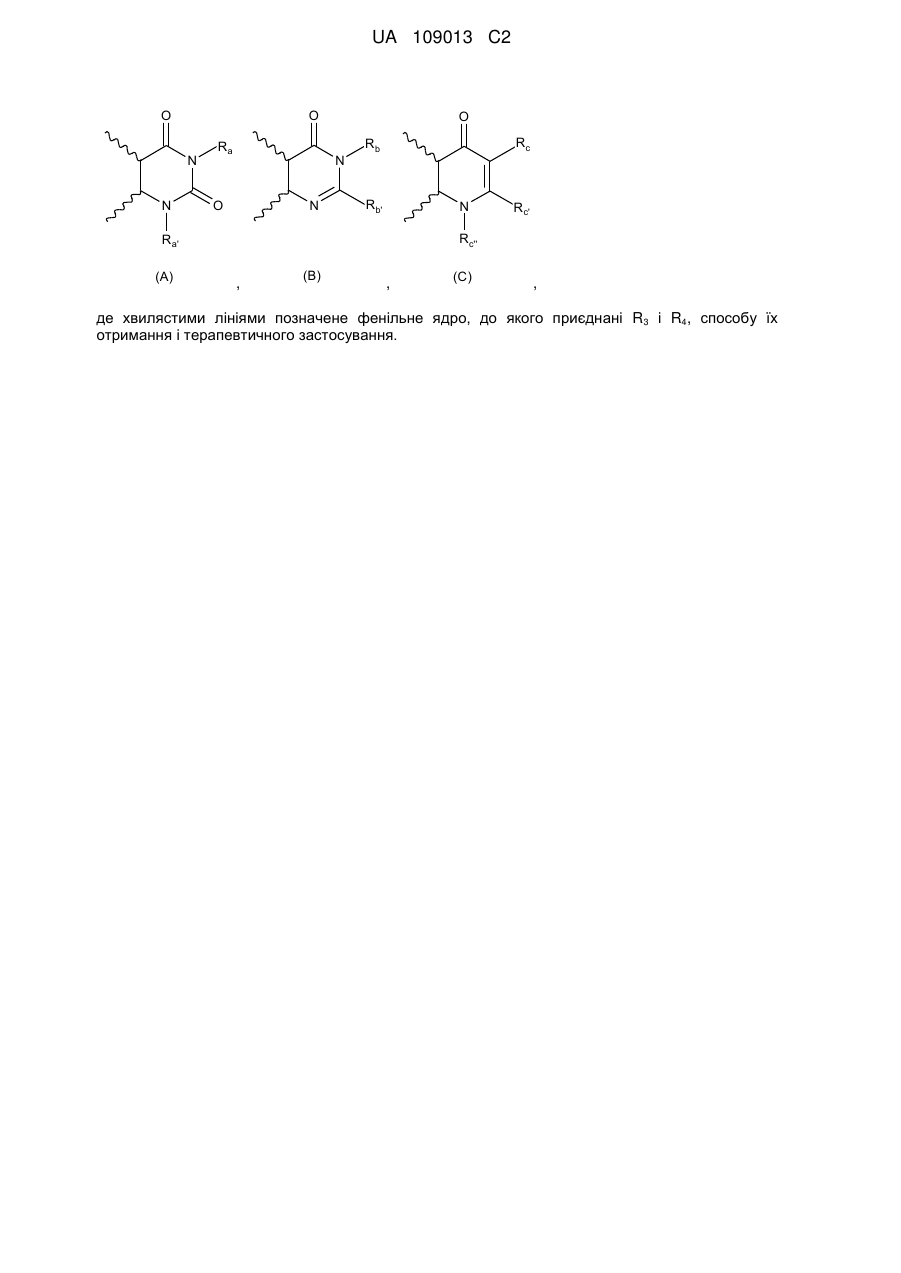
R3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6-членний азотистий гетероцикл, який відповідає одній з формул (А), (В) і (С), наведених нижче:
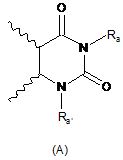 ,
, 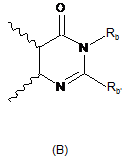 ,
, 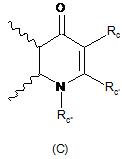 ,
,
в яких хвилястими лініями позначене фенільне ядро, до якого приєднані R3 і R4, і:
Ra являє собою атом водню або алкільну, галогеналкільну, -Alk-CF3, -Alk-COOR5, -Alk'-COOR5, -Alk-CONR5R6, -Alk'-CONR5R6, -Alk-CONR7R8, -Alk-NR5R6, -AlkCONR5-OR6, -Alk-NR7R8, -Alk-циклоалкільну, -Alk-O-R5, -Alk-S-R5, -Alk-CN, -OR5, -OAlkCOOR5, -NR5R6, -NR5-COOR6, -Alk-арильну, -Alk-O-арильну, -Alk-О-гетероарильну, -Alk-гетероарильну або гетероарильну групу, де арильна або гетероарильна група необов'язково заміщена одним або декількома атомами галогену і/або алкільною, циклоалкільною, -CF3, -OCF3, -O-R5 або -S-R5 групами,
Ra являє собою атом водню або лінійну, розгалужену, циклічну або частково циклічну алкільну групу, або -Alk-OR5, -Alk-NR5R6 або -Alk-NR7R8 групу, причому Ra' необов'язково заміщений одним або декількома атомами галогену,
Rb являє собою атом водню або алкільну або -Alk-COOR5 групу,
Rb' являє собою атом водню або алкільну, галогеналкільну, циклоалкільну, фенільну або -Alk-COOR5 групу,
Rc являє собою атом водню або алкільну, -CN, -COOR5, -CO-NR5R6, -CONR7R8, -CO-NR5-Alk-NR5R6, -CONR5-Alk-OR5, -CONR5SO2R5, -Alk-арильну або -Alk-гетероарильну групу, де арильна або гетероарильна група необов'язково заміщена одним або декількома атомами галогену і/або алкільною, циклоалкільною, -CF3, -OCF3, -О-алкільною або -S-алкільною групами,
Rс' являє собою атом водню або алкільну групу,
Rс'' являє собою атом водню або алкільну, алкенільну, галогеналкільну, циклоалкільну, -Alk-NR5R6, -Alk-NR7R8, -Alk-OR5 або -Alk-SR5 групу,
R5 і R6, які можуть бути однаковими або різними, являють собою атоми водню, галогеналкільні групи або алкільні групи, циклоалкільні групи або Ms (мезил) групу,
R7 і R8, які можуть бути однаковими або різними, являють собою атоми водню або алкільні або фенільні групи, або ж R7 і R8 разом утворюють 3-8-членне насичене кільце, яке може необов'язково містити гетероатом,
Alk являє собою лінійний або розгалужений алкіленовий ланцюг, і
Alk' являє собою лінійний, розгалужений, циклічний або частково циклічний алкіленовий ланцюг,
необов'язково в формі її фармацевтично прийнятної солі.
2. Сполука за п. 1, де R1 являє собою -OR5, -O-Alk-OR5, -COOR5 або -О-Alk-COOR5 групу або фенільну групу, необов'язково заміщену однією або декількома алкільними або -COOR5 групами, де R5 являє собою атом водню або алкільну групу, що містить від 1 до 4 атомів вуглецю, і Alk являє собою алкіленовий ланцюг, що містить 1 або 2 атоми вуглецю, або гетероарильну групу, переважно піридинільну групу.
3. Сполука за п. 1 або 2, де R1 являє собою -OR5, -O-Alk-OR5 або -O-Alk-COOR5 групу, або фенільну групу, необов'язково заміщену однією або декількома алкільними або -COOR5 групами, де R5 являє собою атом водню або метильну групу, і Alk являє собою алкіленовий ланцюг, що містить 1 або 2 атоми вуглецю, або гетероарильну групу, переважно піридинільну групу.
4. Сполука формули (І) за будь-яким з пп. 1-3, де R2 являє собою алкільну групу, що містить від 1 до 4 атомів вуглецю, або фенільну групу.
5. Сполука формули (І) за будь-яким з пп. 1-4, де R3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6-членний азотистий гетероцикл, який відповідає одній з формул (А), (В) або (С), визначених вище, і де:
Ra являє собою атом водню або алкільну або галогеналкільну, -OR5, -Alk-OR5, -Alk'-COOR5, -NR5R6, -Alk-NR7R8, -Alk-CN, -NR5-COOR6, -Alk'-CO-NR5R6, -Alk-CO-NR5-OR6 або -O-Alk-COOR5 групу, або гетероарильну, -Alk-гетероарильну або -Alk-арильну групу, де арильна або гетероарильна група необов'язково заміщена алкільною групою або атомом галогену,
Ra' являє собою атом водню або алкільну або -Alk-OR5 групу,
Rb являє собою атом водню або алкільну або -Alk-COOR5 групу,
Rb' являє собою атом водню або алкільну, галогеналкільну або -Alk-COOR5 групу,
Rc являє собою атом водню або алкільну, -COOR5, CN, -CO-NR5R6, -CO-NR7R8 групу, гетероарил або Alk-гетероарил,
Rc' являє собою атом водню або алкільну групу,
Rc'' являє собою атом водню або алкільну або алкенільну групу,
вказані алкільні або алкенільні групи, описані вище, містять від 1 до 4 атомів вуглецю,
R5 і R6 являють собою атоми водню або алкільні або галогеналкільні групи, де вказані алкільні і галогеналкільні групи містять від 1 до 4 атомів вуглецю,
R7 і R8 являють собою атоми водню або алкільні групи, що містять від 1 до 4 атомів вуглецю, або разом утворюють 5- або 6-членне насичене кільце,
Alk являє собою лінійний або розгалужений алкіленовий ланцюг, що містить від 1 до 4 атомів вуглецю, і
Alk' являє собою лінійний, розгалужений, циклічний або частково циклічний алкіленовий ланцюг, що містить від 1 до 4 атомів вуглецю.
6. Сполука формули (І) за п. 5, де R3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6-членний азотистий гетероцикл, який відповідає будь-якій з формул (А) і (С), де радикали Ra, Ra', Rc, Rс' і Rc'' є такими, як визначено в п. 1.
7. Сполука формули (І) за п. 5, де R3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6-членний азотистий гетероцикл, який відповідає формулі (С), де Rc, Rс' і Rc'' є такими, як визначено в п. 1.
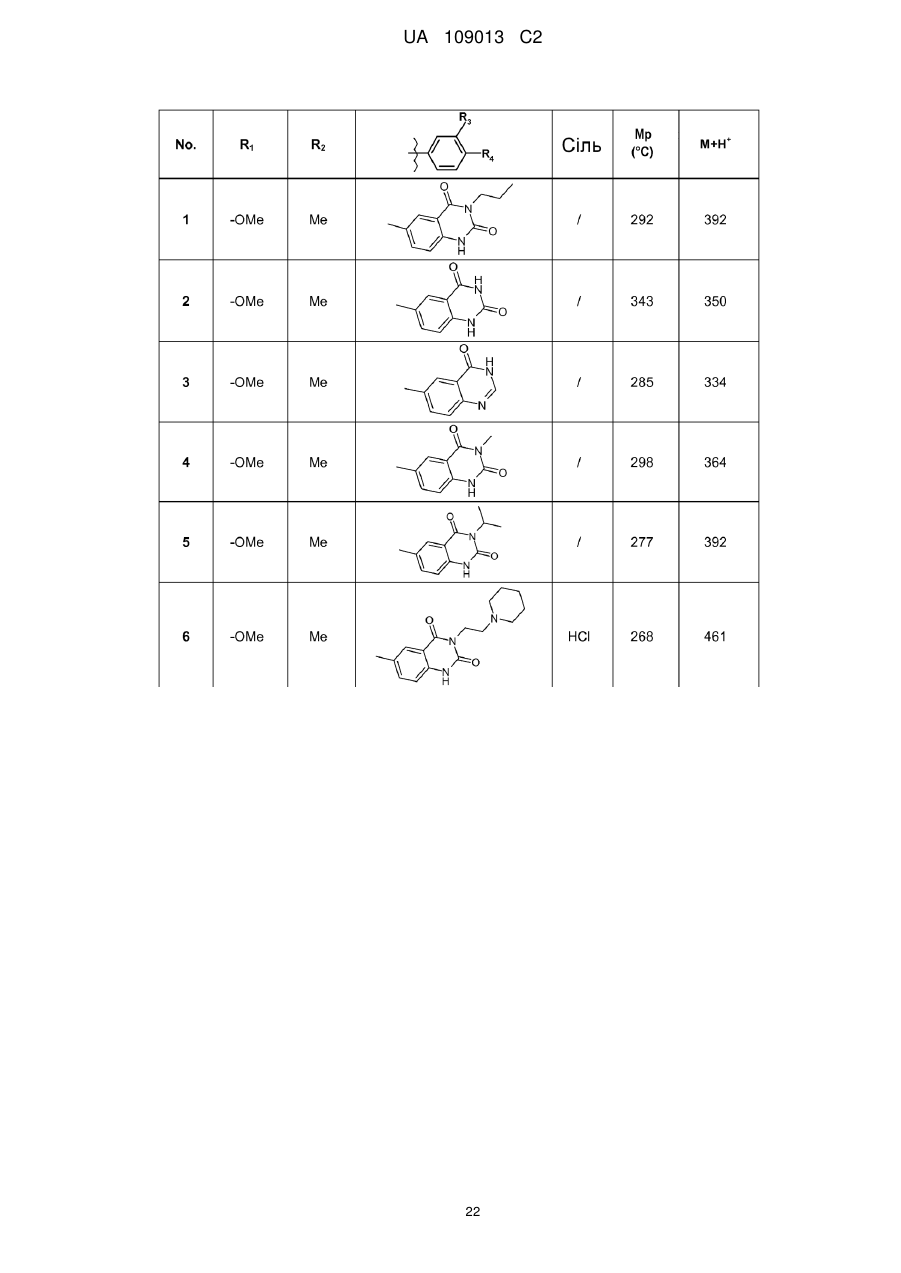
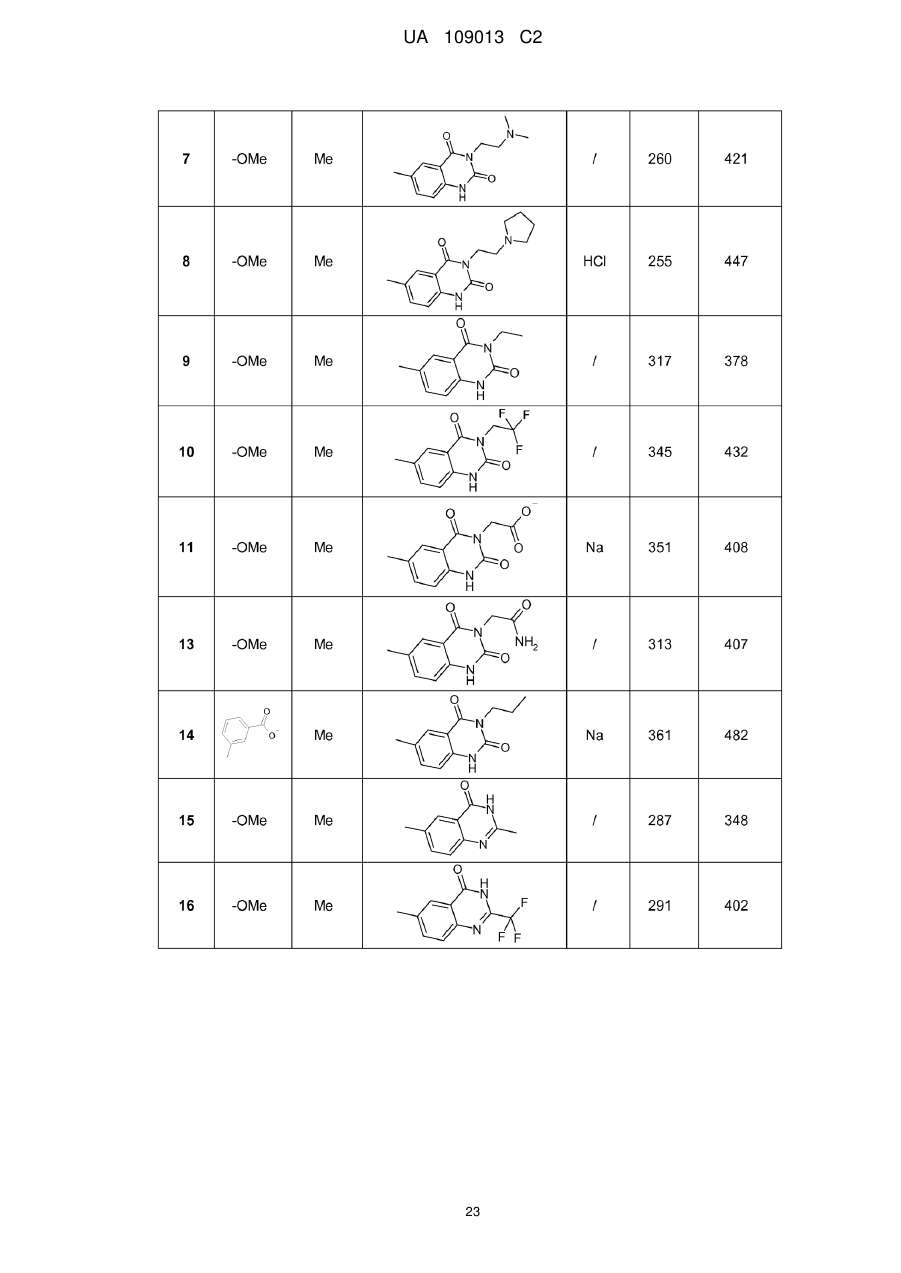
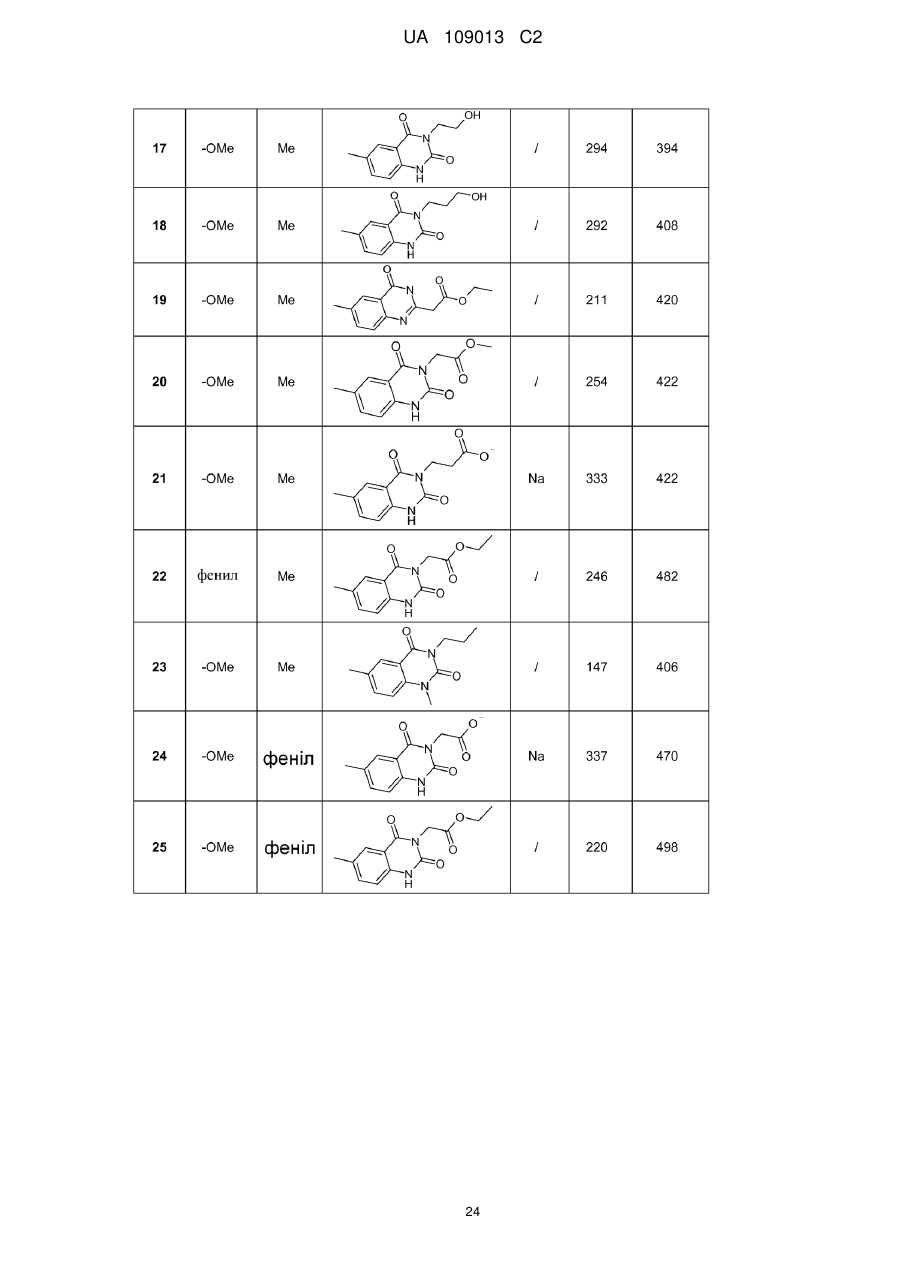
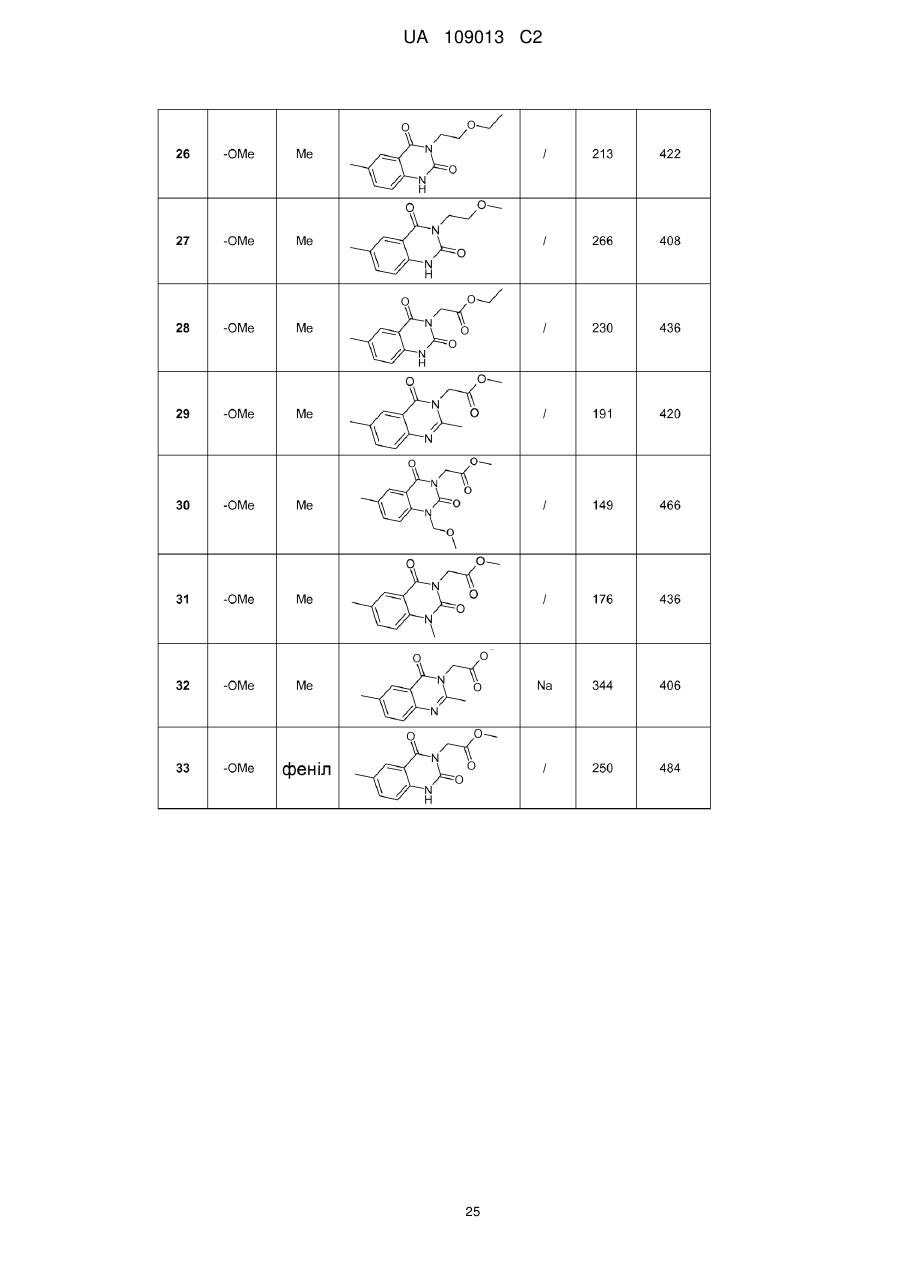
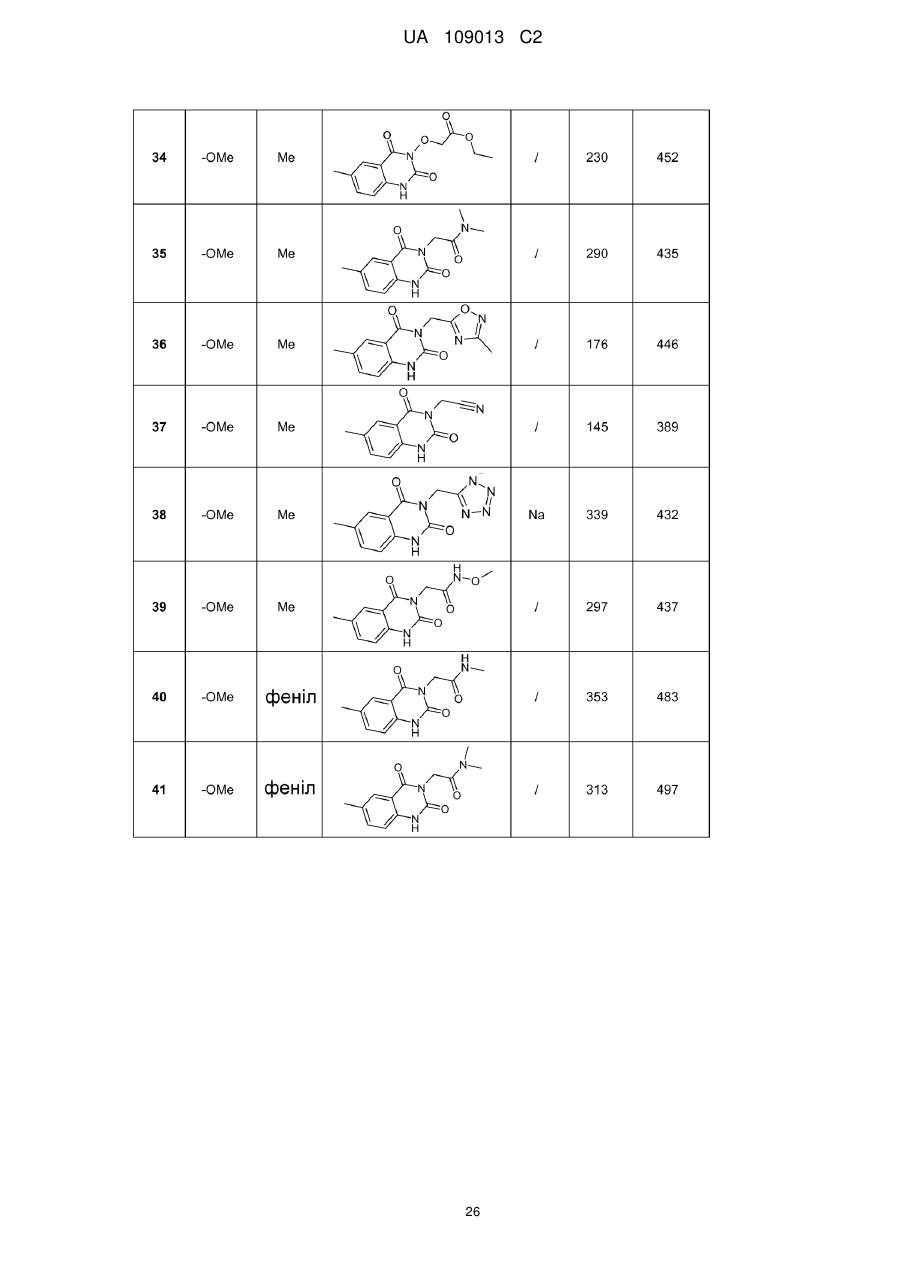
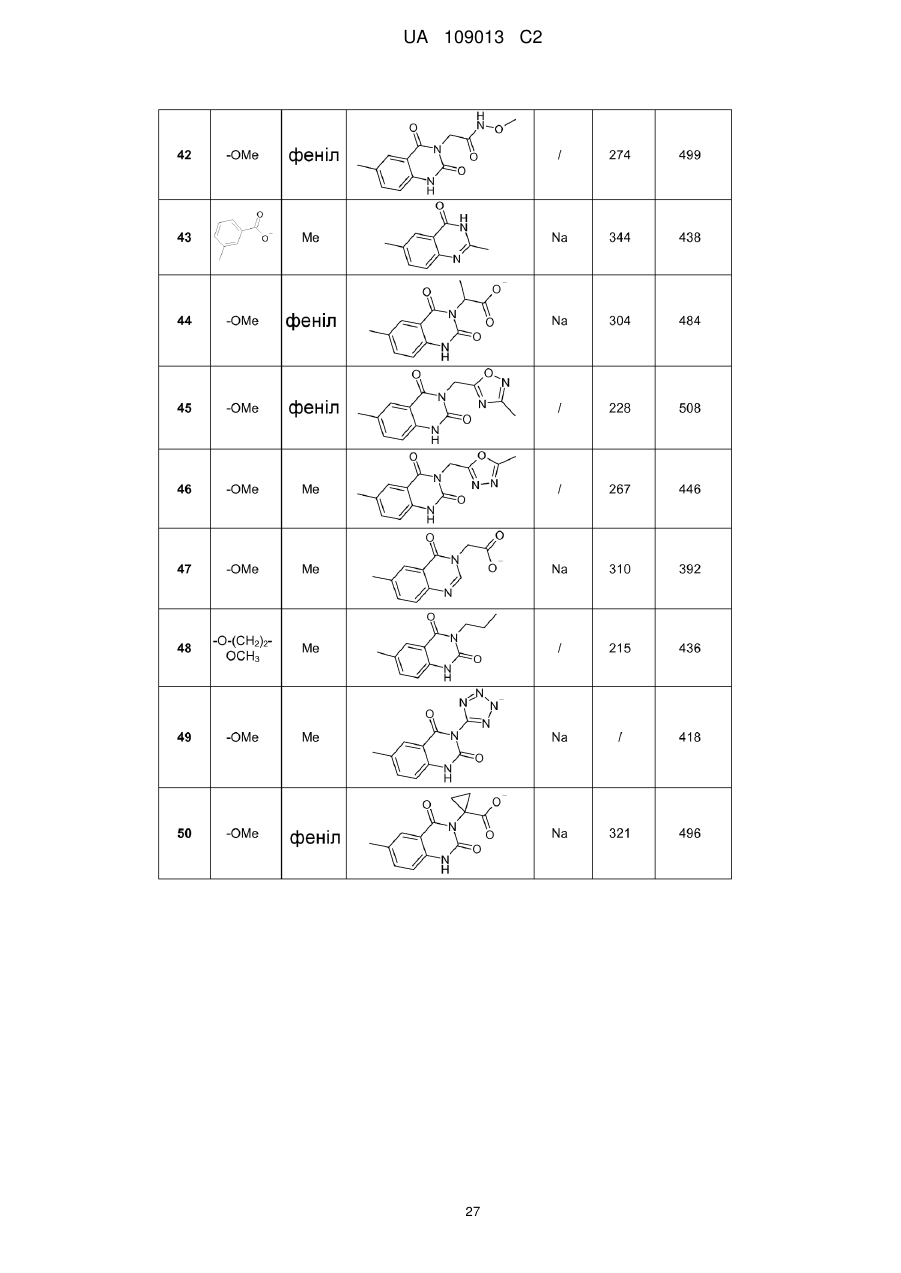
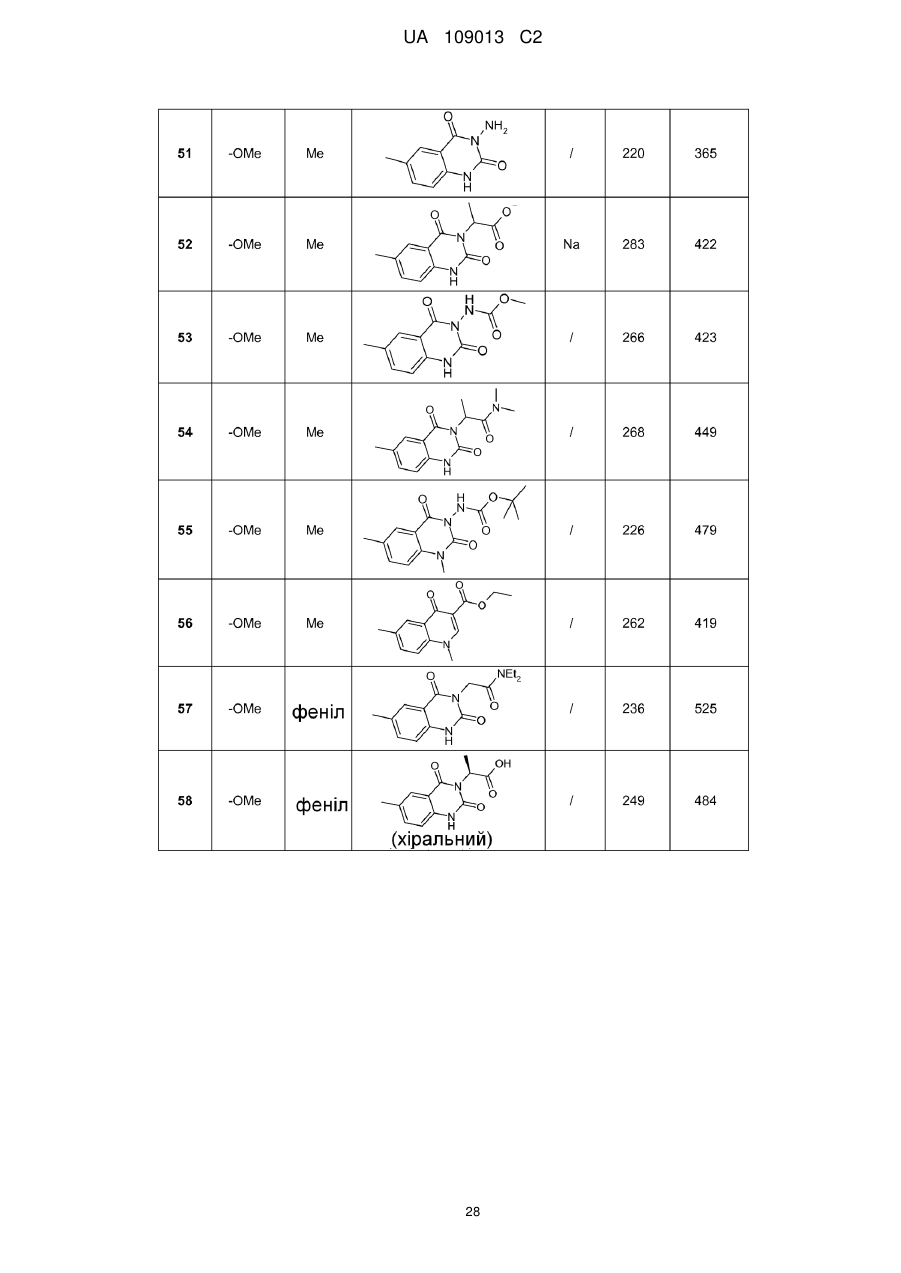
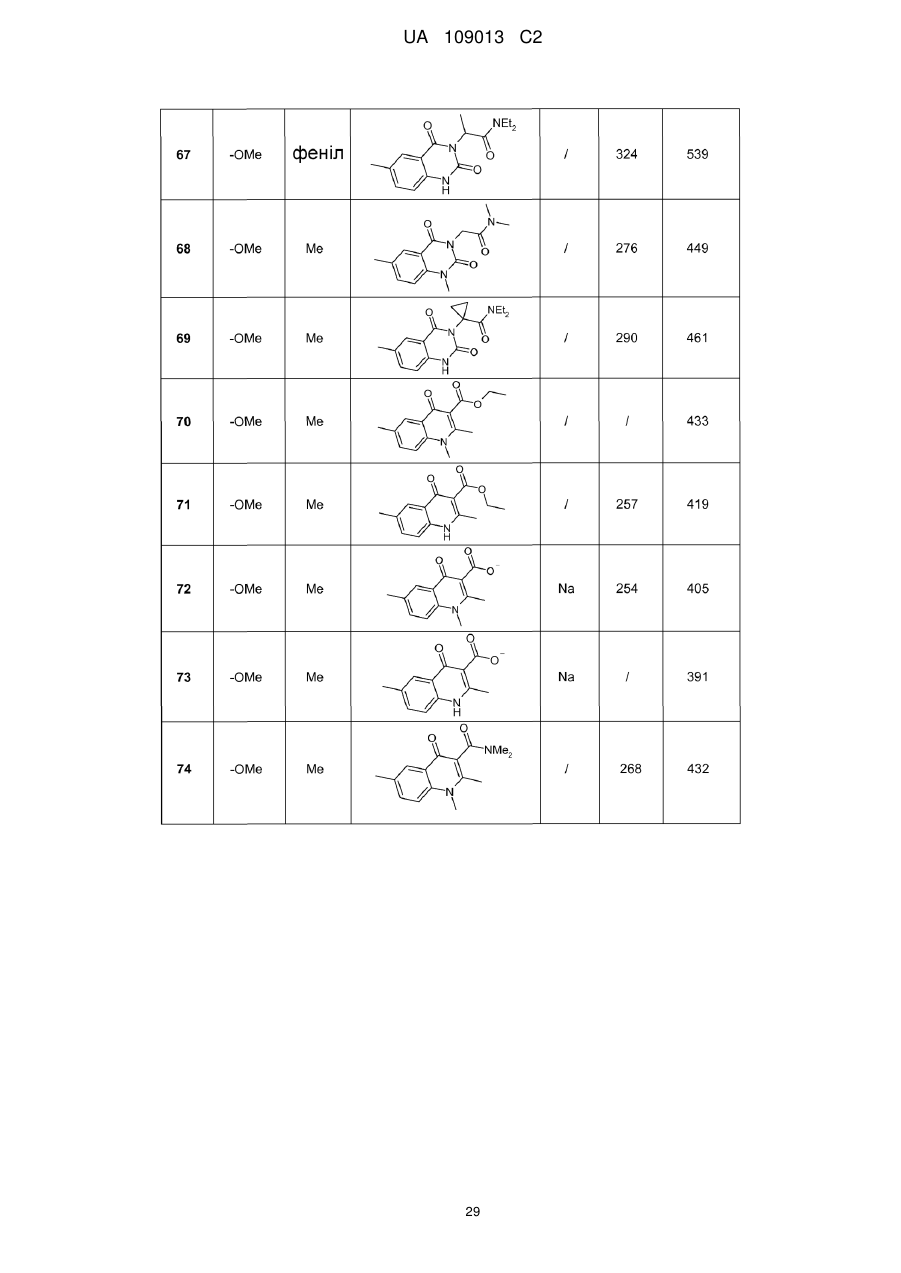
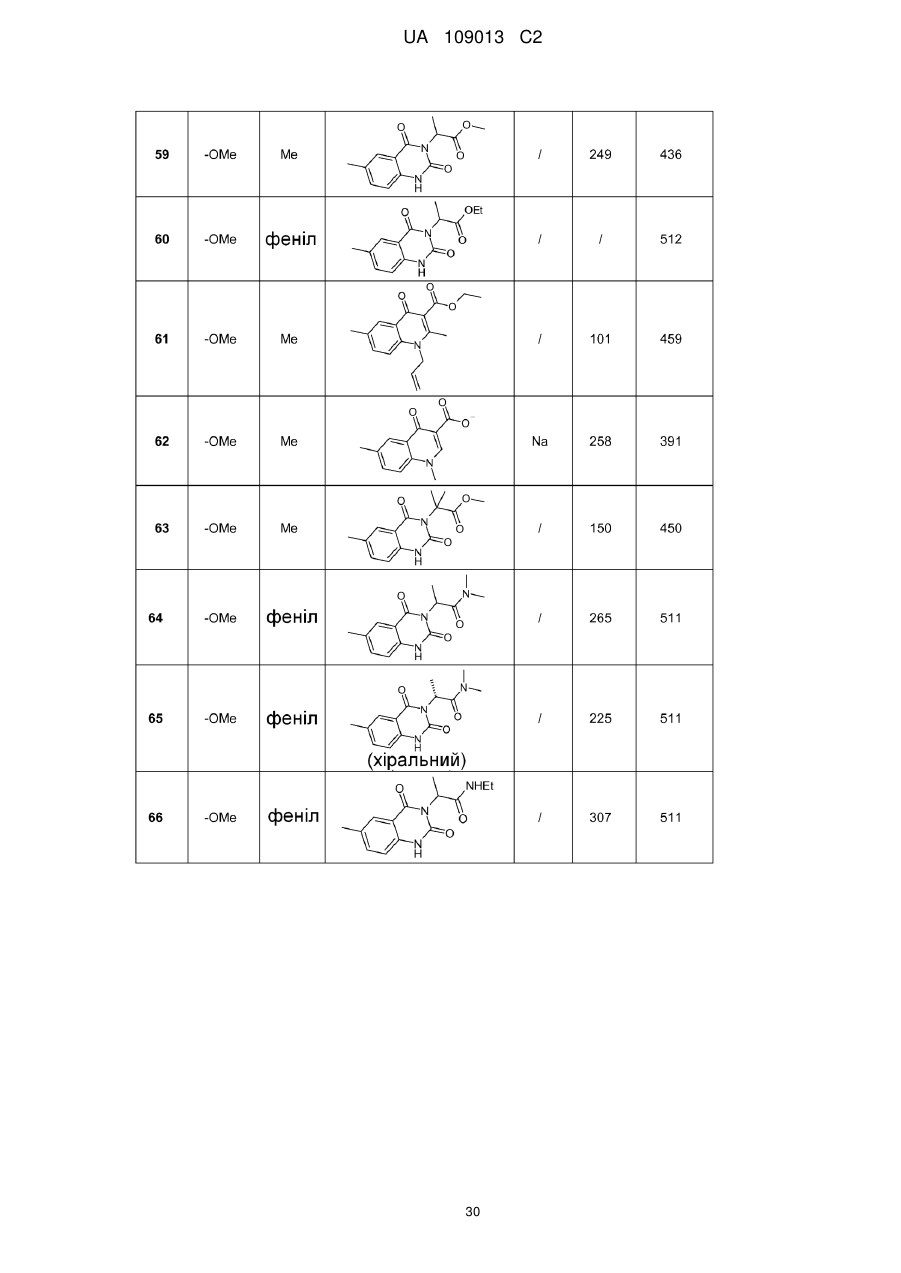
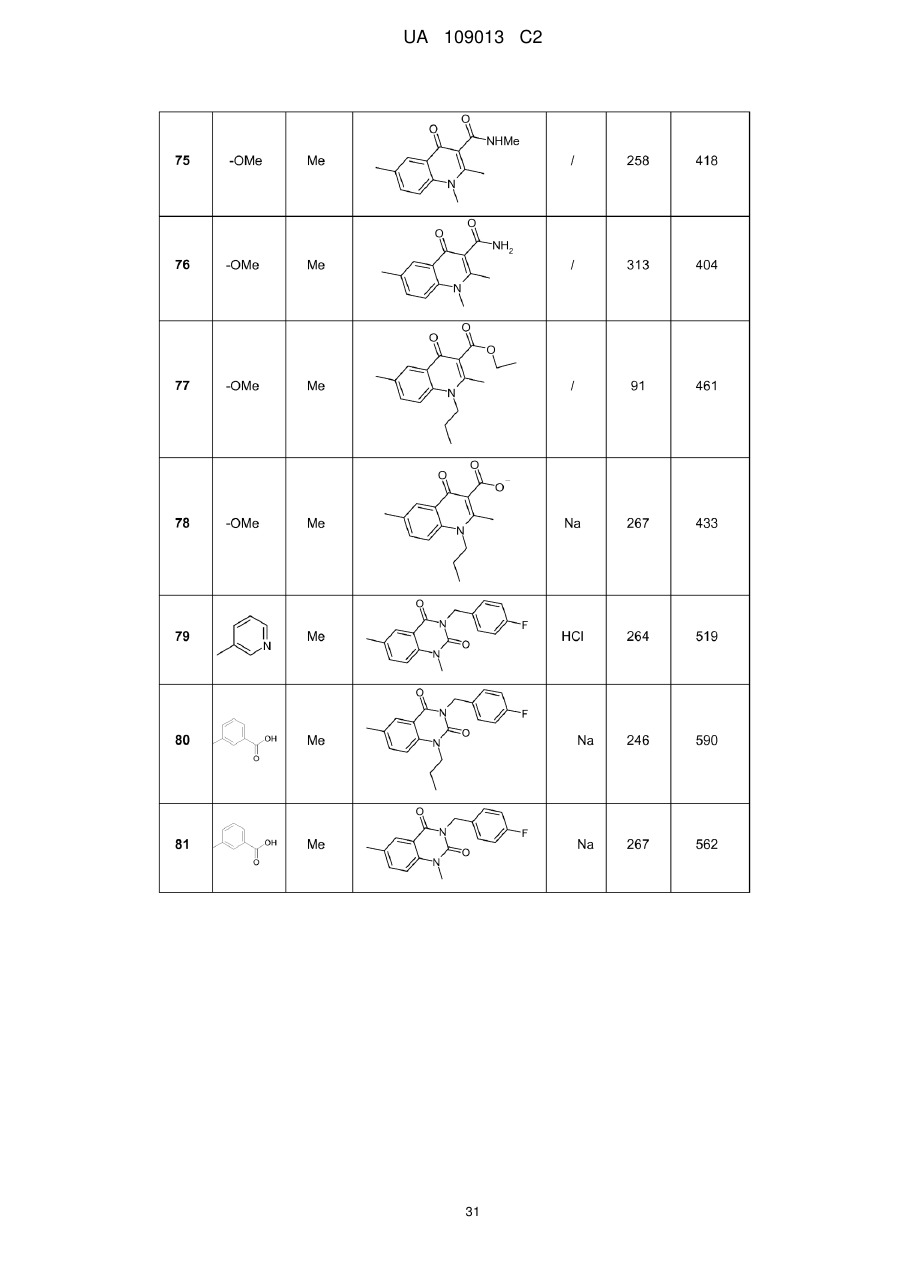
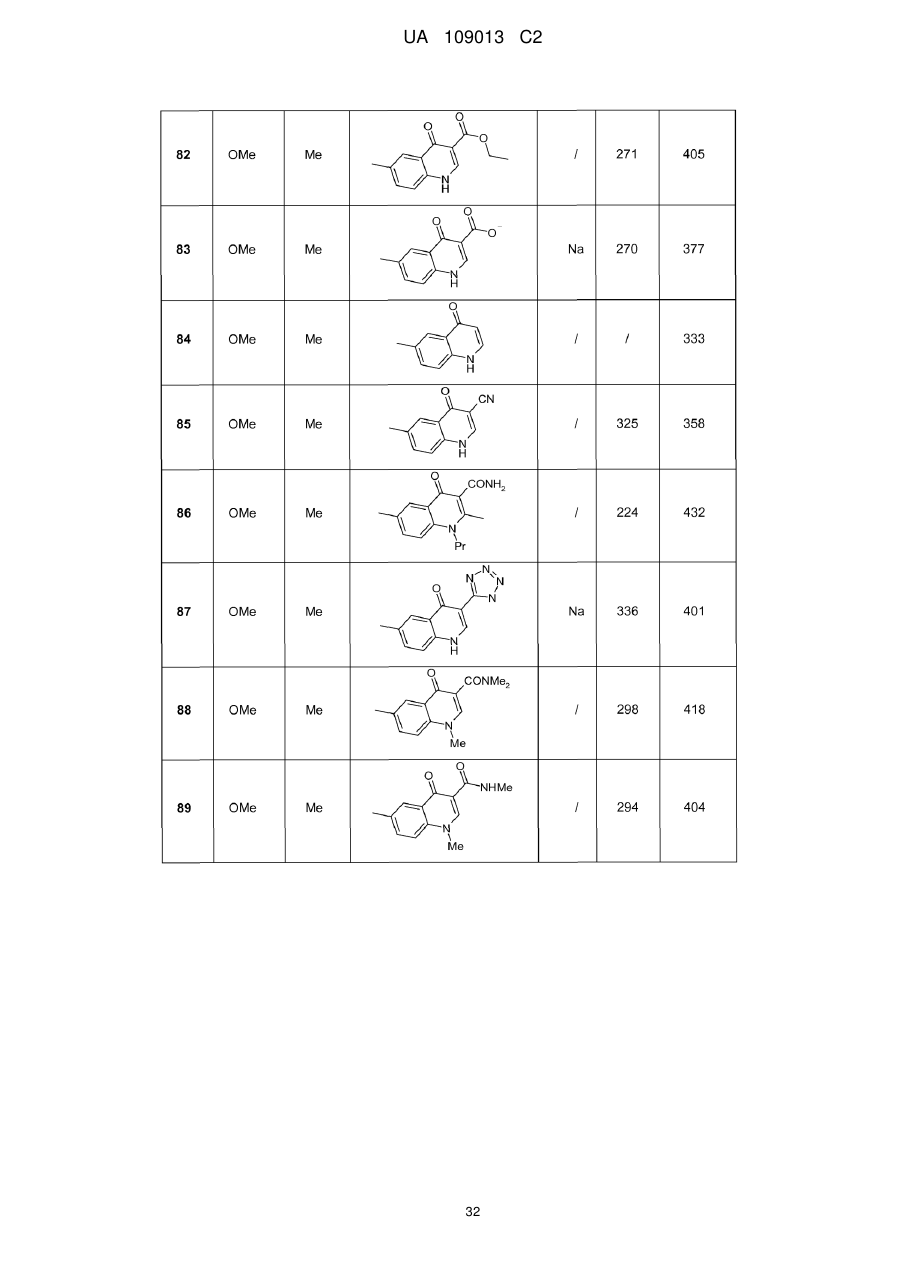
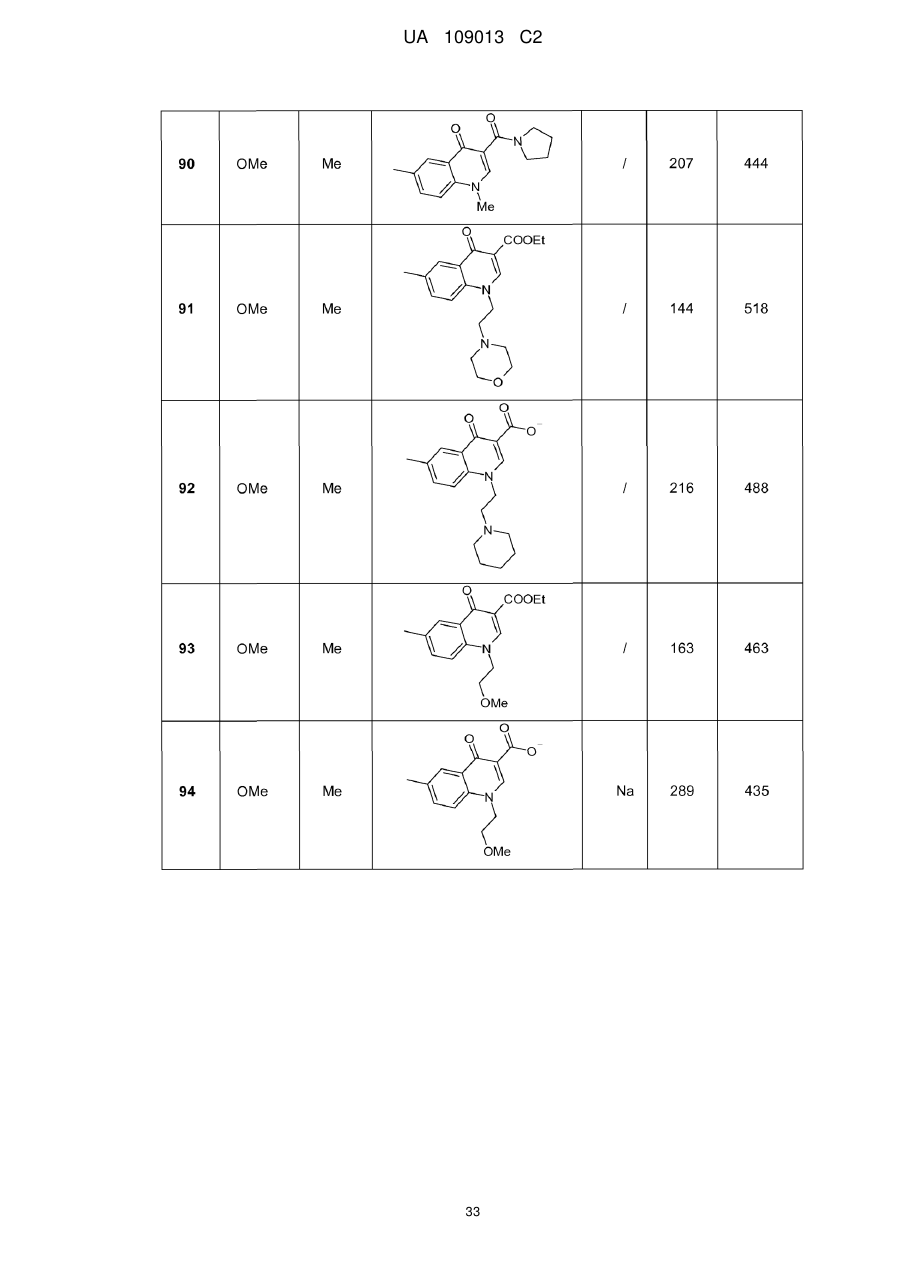
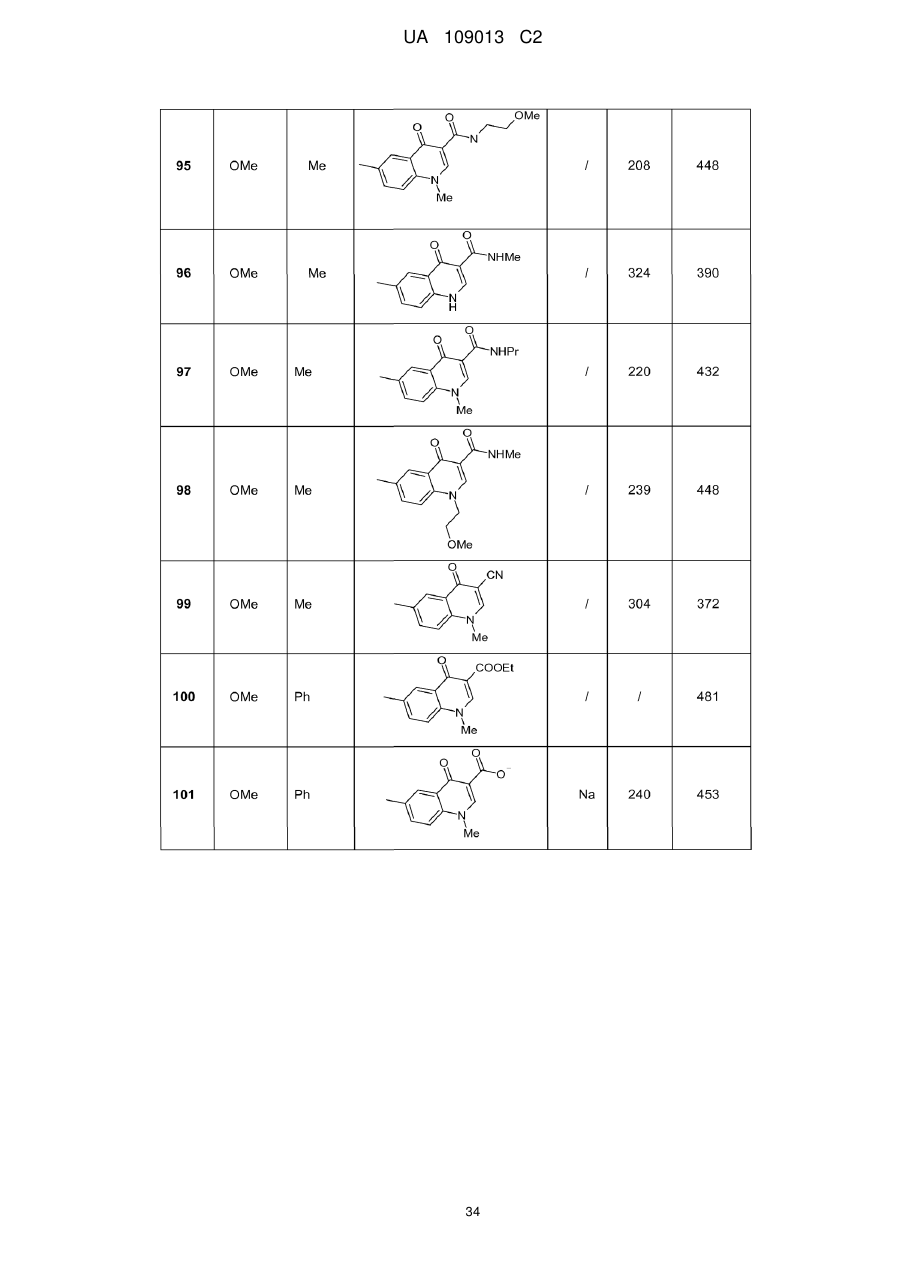
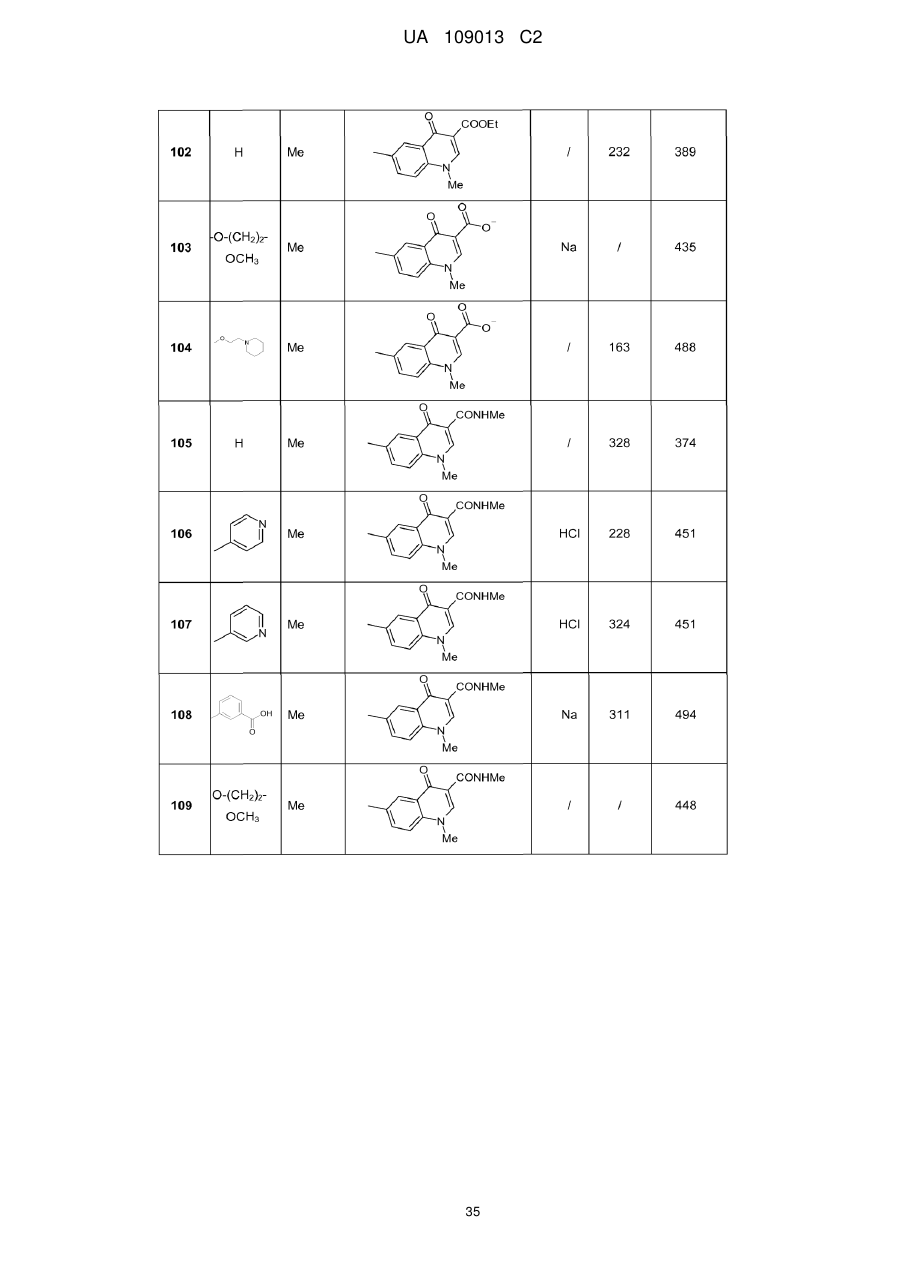
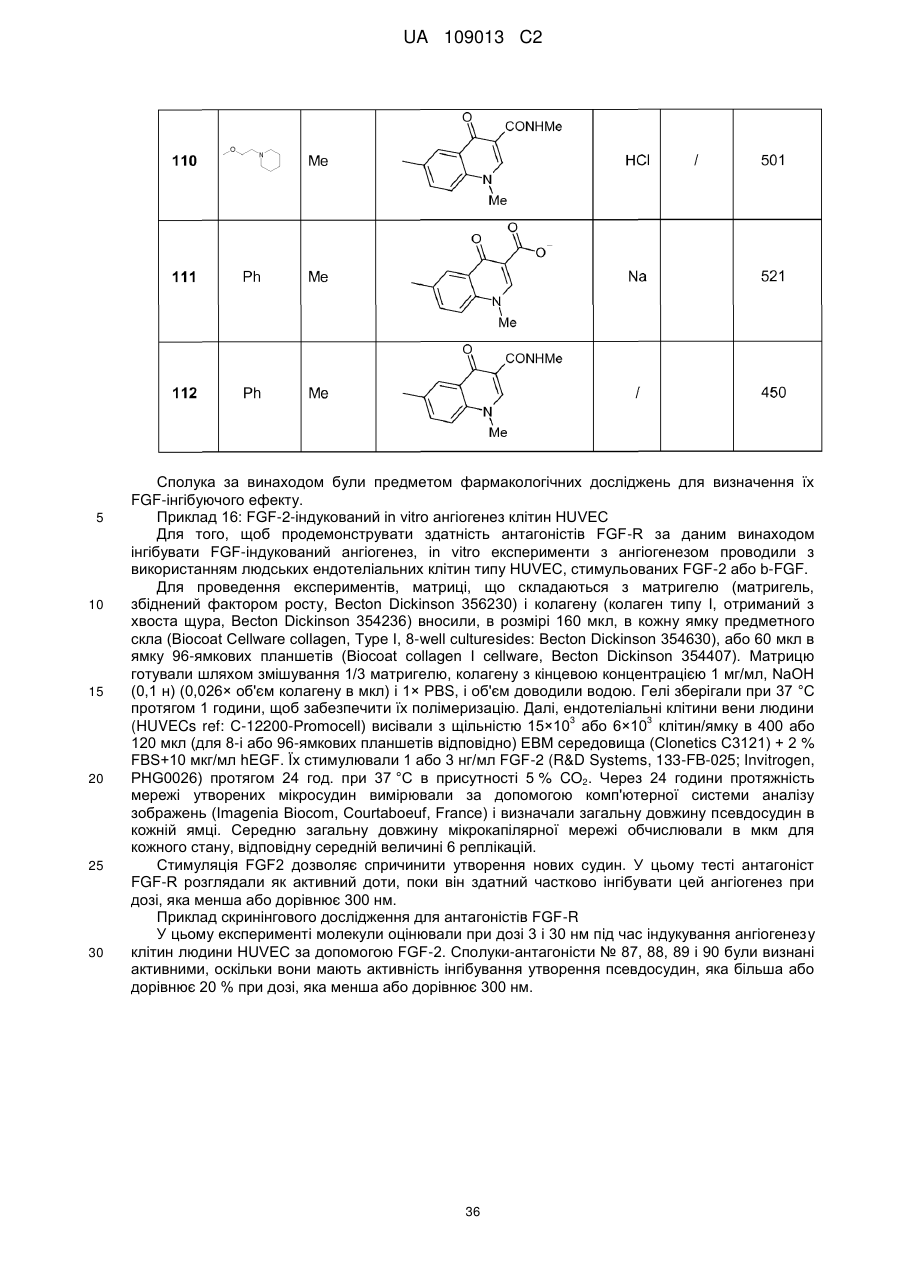
8. Сполука формули (І) за будь-яким з пп. 1-5, вибрана з наступних сполук:
2-{6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)-іл}-N,N'-диметилацетамід,
2-{6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)-іл}-N,N'-диметилацетамід,
6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-3-[(3-метил-1,2,4-оксадіазол-5-іл)метил]хіназолін-2,4(1H,3H)-діон,
3-{3-(2,4-діоксо-3-пропіл-1,2,3,4-тетрагідрохіназолін-6-іл)карбоніл}-2-метиліндолізин-1-іл}бензойна кислота,
{6-[(1-метокси-2-феніліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2H)-іл}оцтова кислота,
етил-({6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)-іл}оксі)ацетат,
3-аміно-6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]хіназолін-2,4(1Н,3Н)-діон,
6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метилхіназолін-4(3H)-он,
3-{2-метил-3-[(2-метил-4-оксо-3,4-дигідрохіназолін-6-іл)карбоніл]індолізин-1-іл}бензойна кислота,
6-{[1-(2-метоксіетокси)-2-метиліндолізин-3-іл]карбоніл}-3-пропілхіназолін-2,4(1Н,3Н)-діон,
6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4-дигідрохінолін-3-карбонова кислота,
6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4-оксо-1,4-дигідрохінолін-3-карбонова кислота,
6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-N-метил-4-оксо-1,4-дигідрохінолін-3-карбоксамід,
N-1-диметил-6-[(2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3-карбоксамід,
N-1-диметил-6-{[2-метил-1-(піридин-4-іл)індолізин-3-іл]карбоніл}-4-оксо-1,4-дигідрохінолін-3-карбоксаміду гідрохлорид.
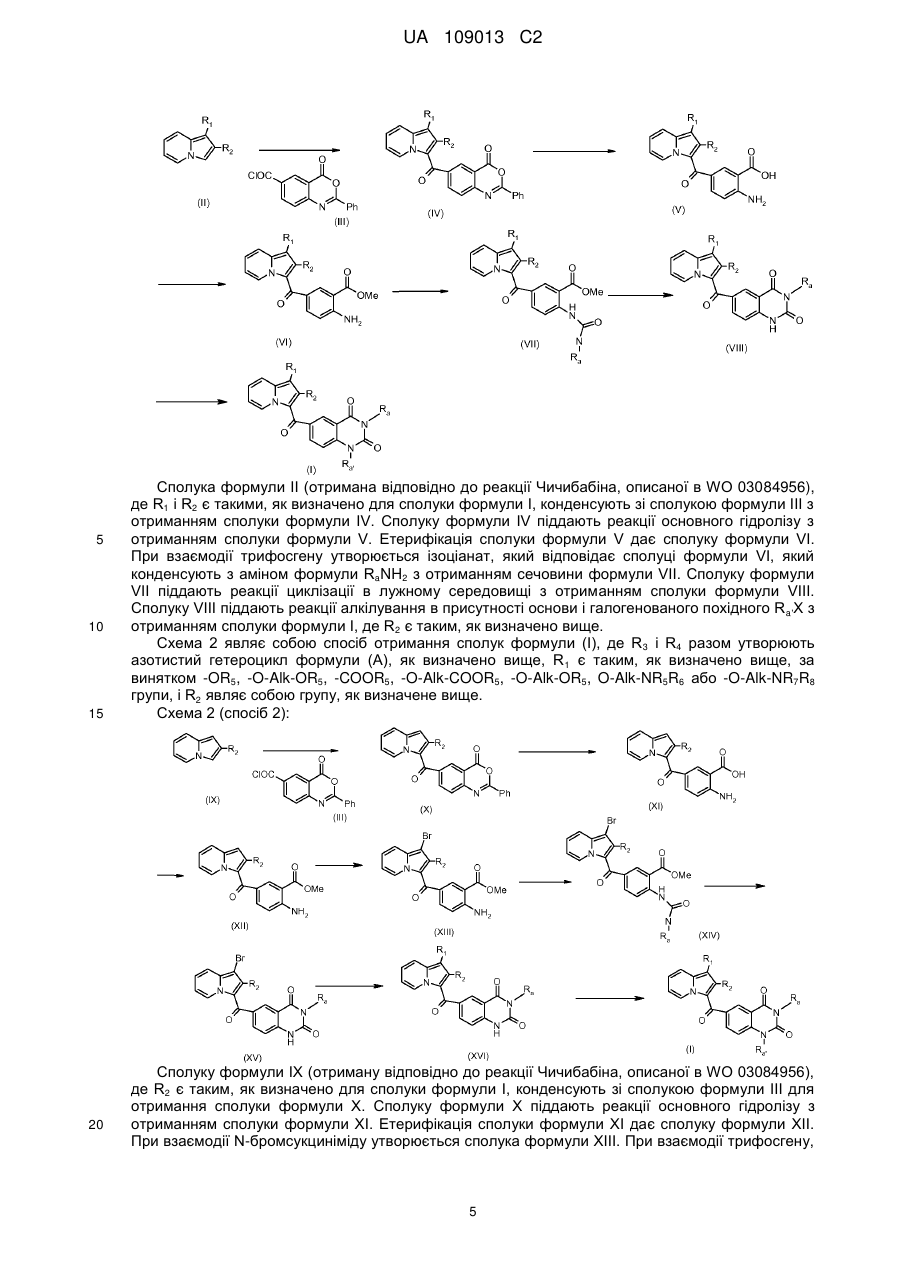
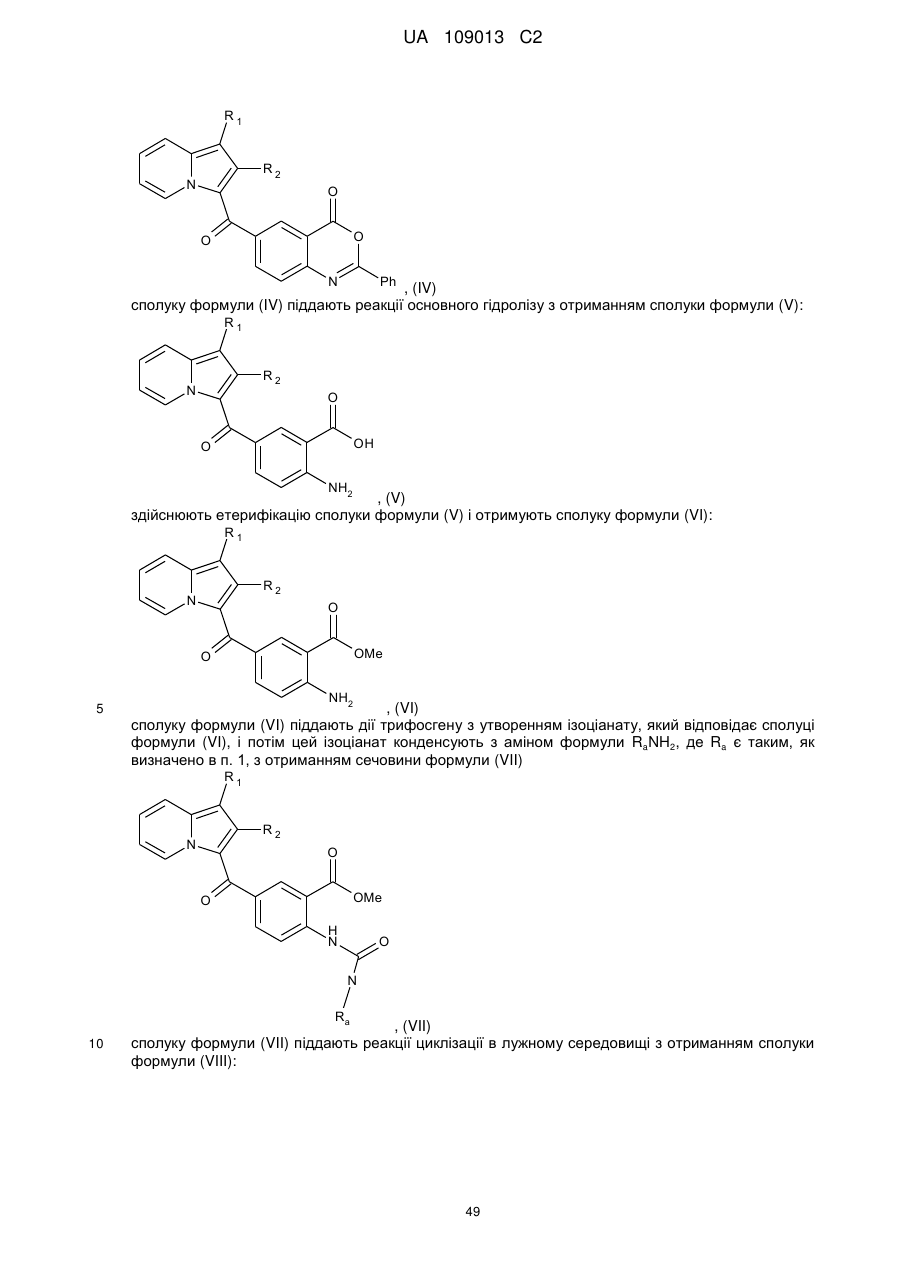
9. Спосіб отримання сполуки формули (І) за будь-яким з пп. 1-7, де R3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6-членний азотистий гетероцикл, який відповідає формулі (А), де R1 являє собою -ОR5, -O-Alk-OR5, -COOR5, -O-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 або -O-Alk-NR7R8 групу, і R2 є таким, як визначено в п. 1, який відрізняється тим, що:
сполуку формули (II)
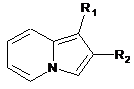 (II)
(II)
конденсують зі сполукою формули (III)
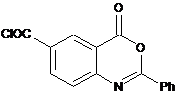 (III)
(III)
з отриманням сполуки формули (IV)
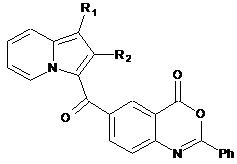 , (IV)
, (IV)
сполуку формули (IV) піддають реакції основного гідролізу з отриманням сполуки формули (V):
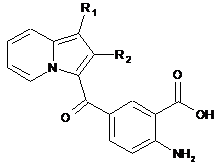 , (V)
, (V)
здійснюють етерифікацію сполуки формули (V) і отримують сполуку формули (VI):
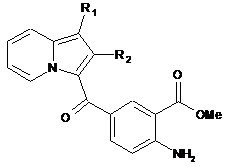 , (VI)
, (VI)
сполуку формули (VI) піддають дії трифосгену з утворенням ізоціанату, який відповідає сполуці формули (VI), і потім цей ізоціанат конденсують з аміном формули RaNH2, де Ra є таким, як визначено в п. 1, з отриманням сечовини формули (VII)
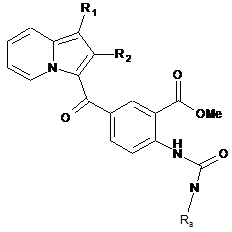 , (VII)
, (VII)
сполуку формули (VII) піддають реакції циклізації в лужному середовищі з отриманням сполуки формули (VIII):
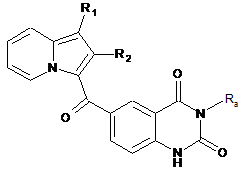 , (VIII)
, (VIII)
сполуку формули (VIII) піддають реакції алкілування в присутності основи і галогенованого похідного Ra'X, де Ra' є таким, як визначено в п. 1, і X являє собою галоген.
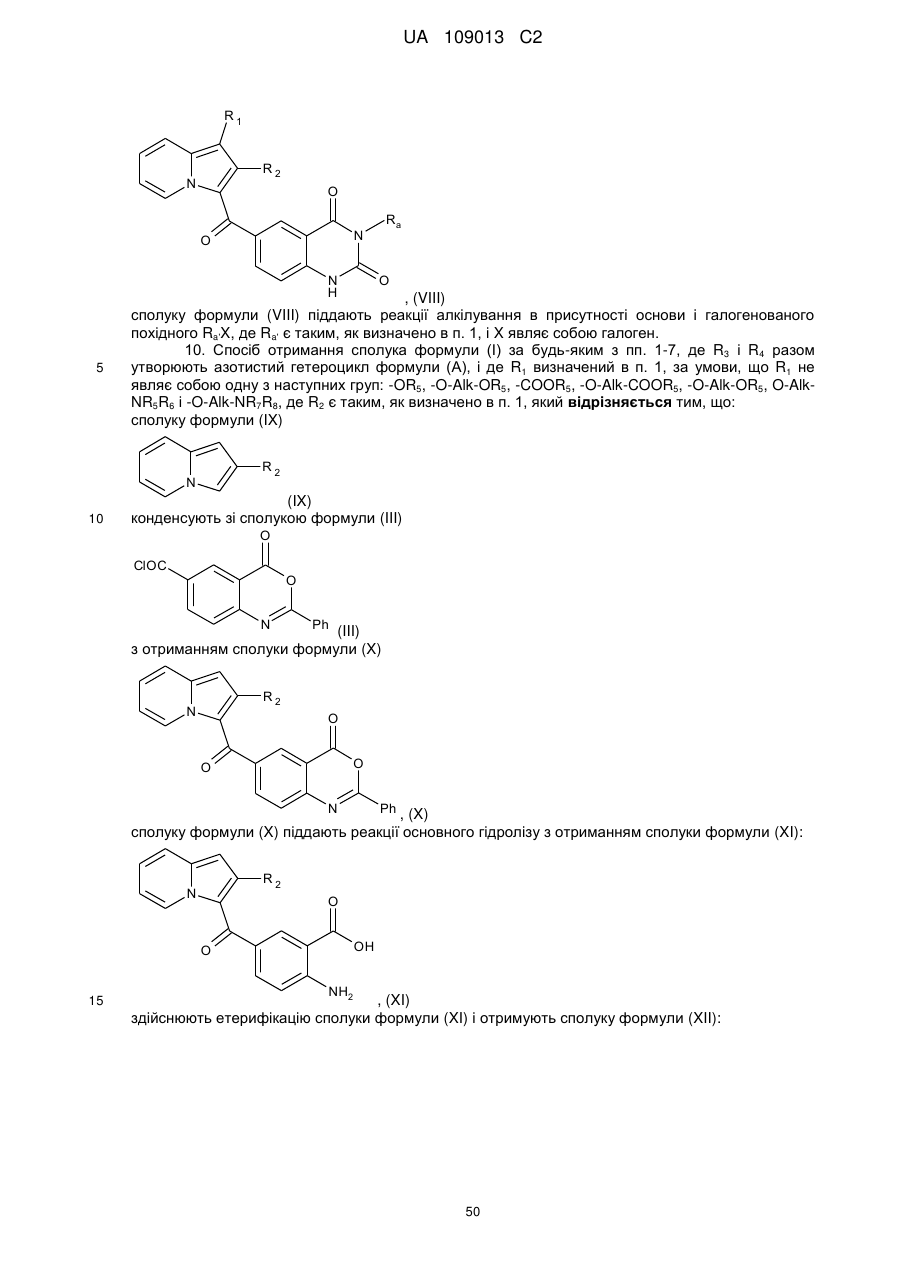
10. Спосіб отримання сполука формули (І) за будь-яким з пп. 1-7, де R3 і R4 разом утворюють азотистий гетероцикл формули (А), і де R1 визначений в п. 1, за умови, що R1 не являє собою одну з наступних груп: -OR5, -O-Alk-OR5, -COOR5, -O-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 і -O-Alk-NR7R8, де R2 є таким, як визначено в п. 1, який відрізняється тим, що:
сполуку формули (IX)
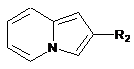 (IX)
(IX)
конденсують зі сполукою формули (III)
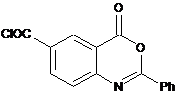 (III)
(III)
з отриманням сполуки формули (X)
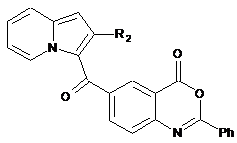 , (X)
, (X)
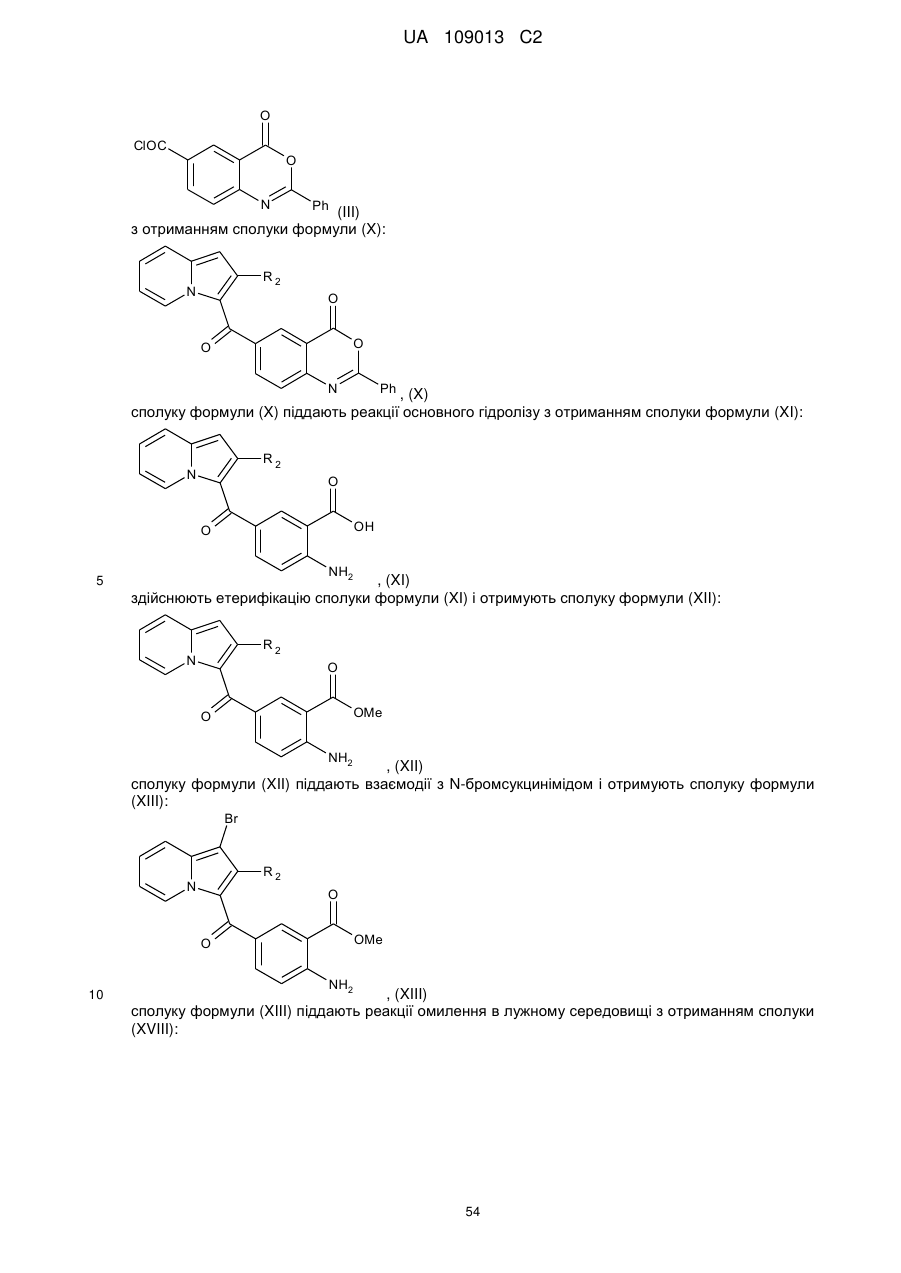
сполуку формули (X) піддають реакції основного гідролізу з отриманням сполуки формули (XI):
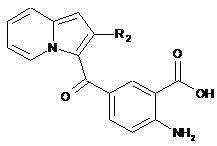 , (XI)
, (XI)
здійснюють етерифікацію сполуки формули (XI) і отримують сполуку формули (XII):
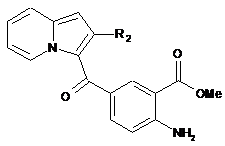 , (XII)
, (XII)
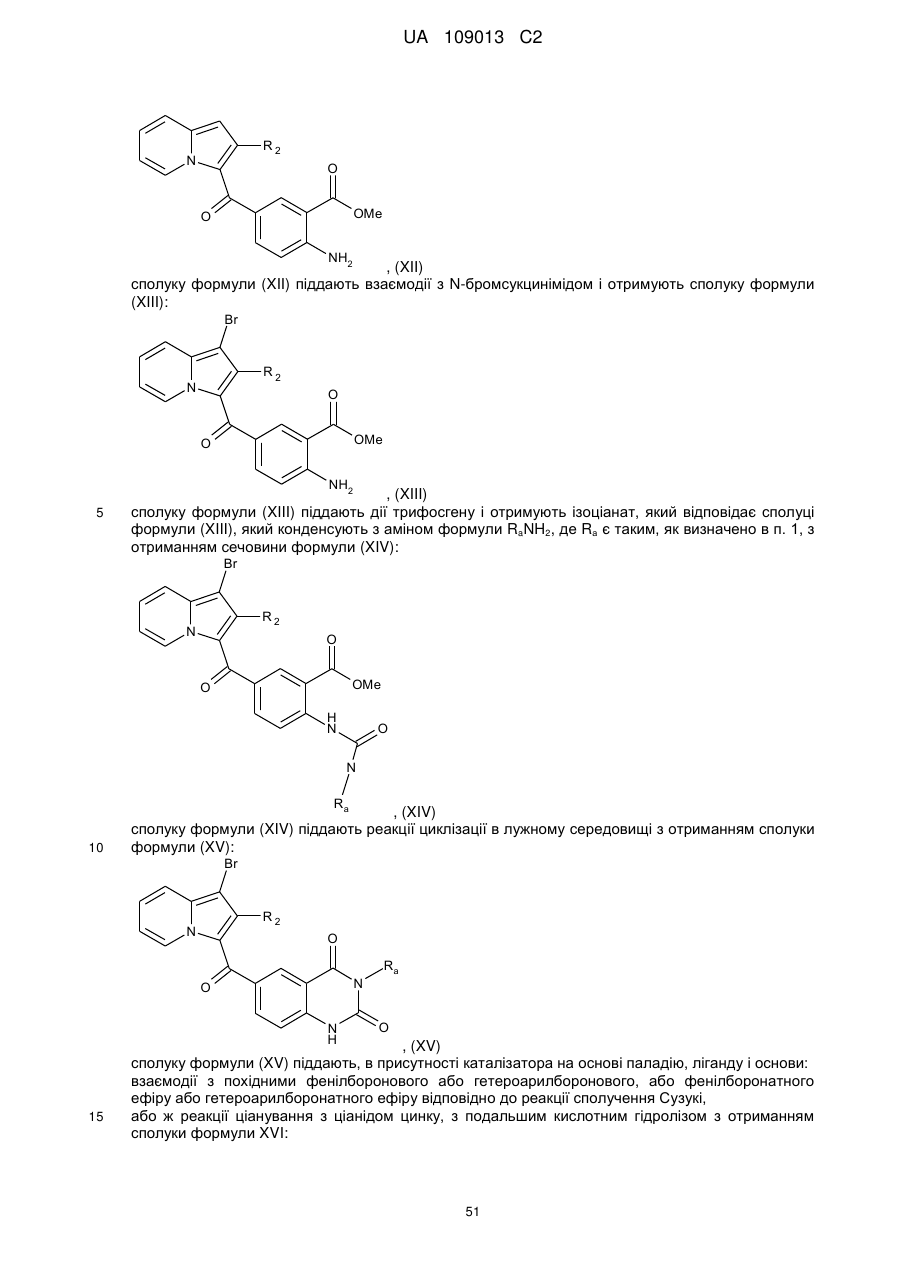
сполуку формули (XII) піддають взаємодії з N-бромсукцинімідом і отримують сполуку формули (XIII):
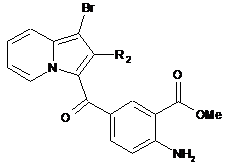 , (XIII)
, (XIII)
сполуку формули (XIII) піддають дії трифосгену і отримують ізоціанат, який відповідає сполуці формули (XIII), який конденсують з аміном формули RaNH2, де Rа є таким, як визначено в п. 1, з отриманням сечовини формули (XIV):
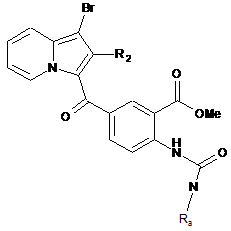 , (XIV)
, (XIV)
сполуку формули (XIV) піддають реакції циклізації в лужному середовищі з отриманням сполуки формули (XV):
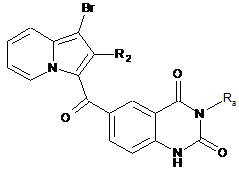 , (XV)
, (XV)
сполуку формули (XV) піддають, в присутності каталізатора на основі паладію, ліганду і основи:
взаємодії з похідними фенілборонового або гетероарилборонового, або фенілборонатного ефіру або гетероарилборонатного ефіру відповідно до реакції сполучення Сузукі,
або ж реакції ціанування з ціанідом цинку, з подальшим кислотним гідролізом з отриманням сполуки формули XVI:
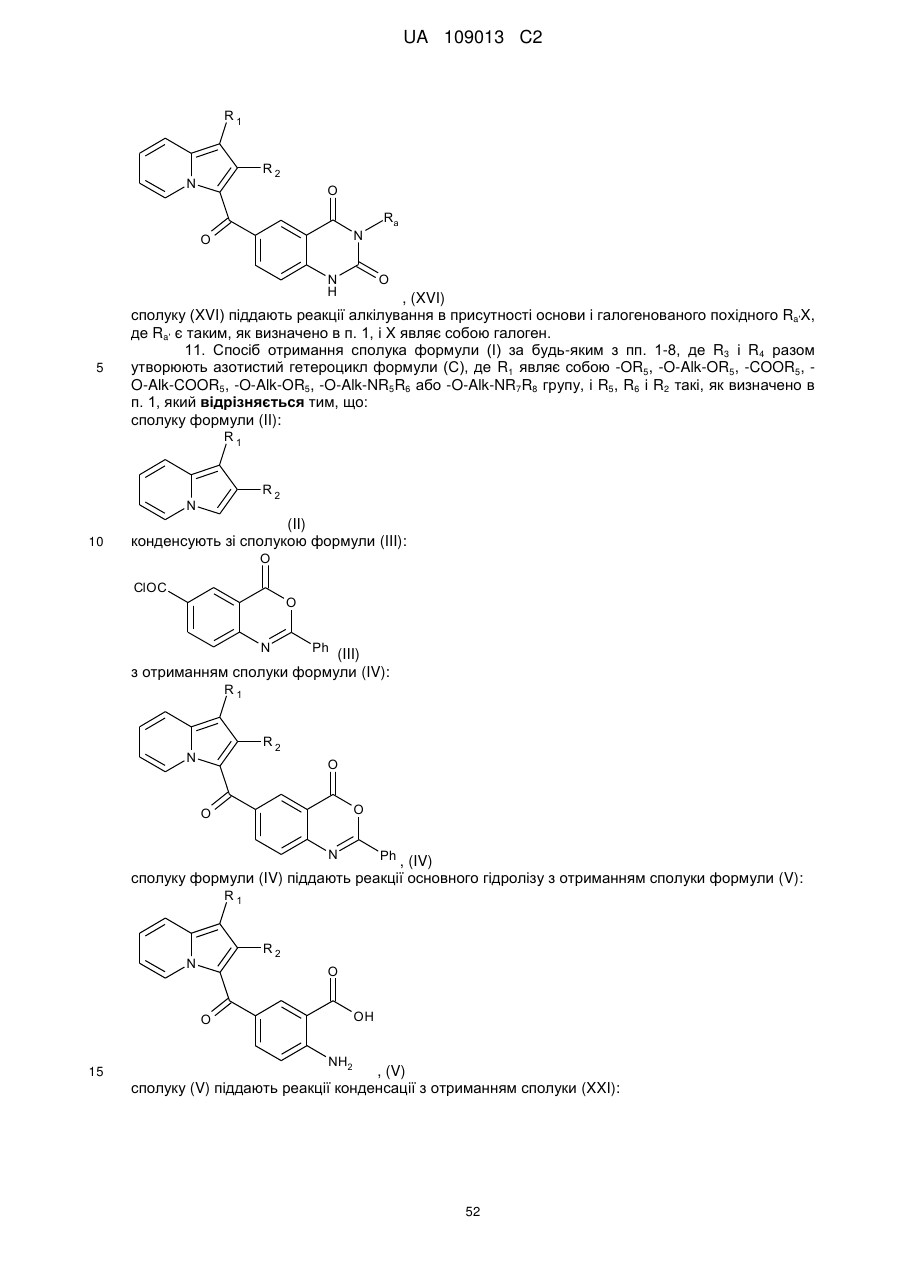
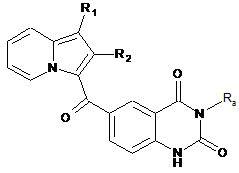 , (XVI)
, (XVI)
сполуку (XVI) піддають реакції алкілування в присутності основи і галогенованого похідного Ra'X, де Ra' є таким, як визначено в п. 1, і X являє собою галоген.
11. Спосіб отримання сполука формули (І) за будь-яким з пп. 1-8, де R3 і R4 разом утворюють азотистий гетероцикл формули (С), де R1 являє собою -OR5, -O-Alk-OR5, -COOR5, -O-Alk-COOR5, -O-Alk-OR5, -O-Alk-NR5R6 або -O-Alk-NR7R8 групу, і R5, R6 і R2 такі, як визначено в п. 1, який відрізняється тим, що:
сполуку формули (II):
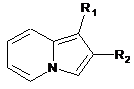 (II)
(II)
конденсують зі сполукою формули (III):
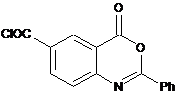 (III)
(III)
з отриманням сполуки формули (IV):
 , (IV)
, (IV)
сполуку формули (IV) піддають реакції основного гідролізу з отриманням сполуки формули (V):
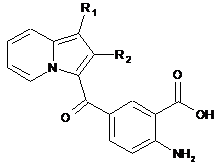 , (V)
, (V)
сполуку (V) піддають реакції конденсації з отриманням сполуки (XXI):
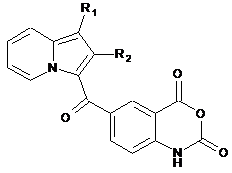 , (XXI)
, (XXI)
сполуку (XXI) піддають реакції алкілування в присутності основи і галогенованого похідного Rc''X, де Rc'' є таким, як визначено в п. 1, і X являє собою галоген, або захисної групи, і отримують сполуку формули (XXII):
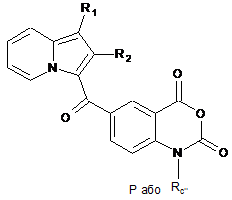 , (XXII)
, (XXII)
сполуку (XXII) піддають реакції конденсації з малоновим похідним з отриманням сполуки формули (XXIII):
 , (XXIII)
, (XXIII)
де Rc' і Rc'' визначені в п. 1,
сполуку формули (XXIII) піддають реакції зняття захисних груп.
12. Спосіб отримання сполуки формули (І) за будь-яким з пп. 1-8, де R3 і R4 разом утворюють азотистий гетероцикл формули (С), R1 являє собою арильну або гетероарильну групу, необов'язково заміщену однією або декількома алкільною, -OR5, NR5R6 або -COOR5 групами, Rc' переважно являє собою алкіл, Rc'', R5, R6 і R2 визначені в п. 1, який відрізняється тим, що:
сполуку формули (IX):
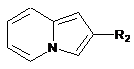 (IX)
(IX)
конденсують зі сполукою формули (III):
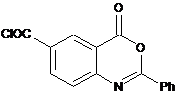 (III)
(III)
з отриманням сполуки формули (X):
 , (X)
, (X)
сполуку формули (X) піддають реакції основного гідролізу з отриманням сполуки формули (XI):
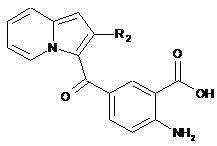 , (XI)
, (XI)
здійснюють етерифікацію сполуки формули (XI) і отримують сполуку формули (XII):
 , (XII)
, (XII)
сполуку формули (XII) піддають взаємодії з N-бромсукцинімідом і отримують сполуку формули (XIII):
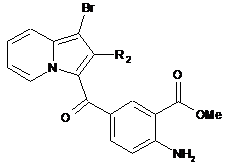 , (XIII)
, (XIII)
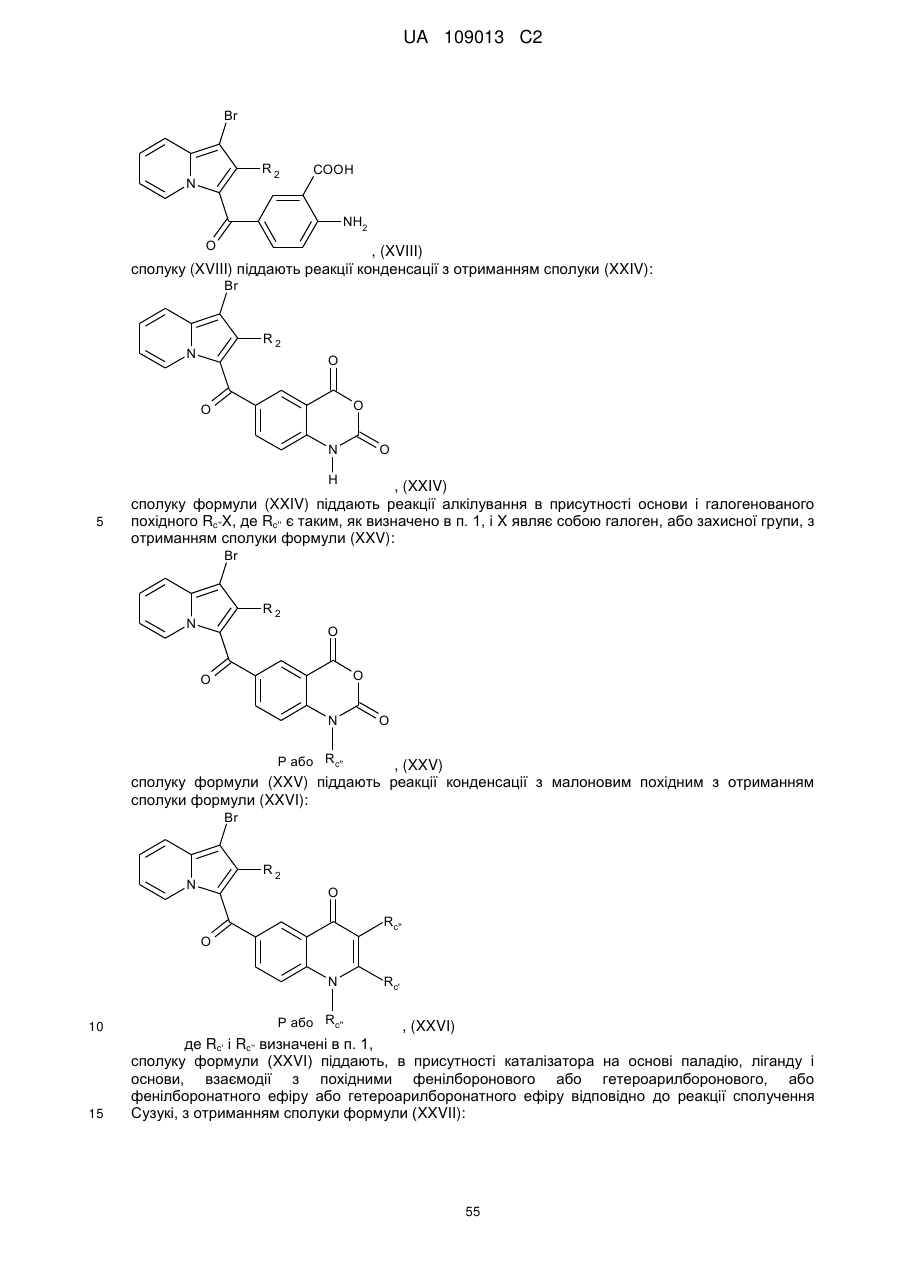
сполуку формули (XIII) піддають реакції омилення в лужному середовищі з отриманням сполуки (XVIII):
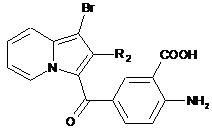 , (XVIII)
, (XVIII)
сполуку (XVIII) піддають реакції конденсації з отриманням сполуки (XXIV):
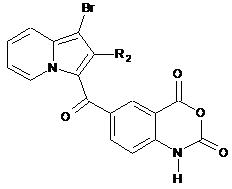 , (XXIV)
, (XXIV)
сполуку формули (XXIV) піддають реакції алкілування в присутності основи і галогенованого похідного Rc''X, де Rc'' є таким, як визначено в п. 1, і X являє собою галоген, або захисної групи, з отриманням сполуки формули (XXV):
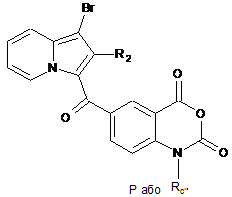 , (XXV)
, (XXV)
сполуку формули (XXV) піддають реакції конденсації з малоновим похідним з отриманням сполуки формули (XXVI):
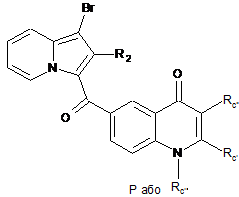 , (XXVI)
, (XXVI)
де Rc' і Rc'' визначені в п. 1,
сполуку формули (XXVI) піддають, в присутності каталізатора на основі паладію, ліганду і основи, взаємодії з похідними фенілборонового або гетероарилборонового, або фенілборонатного ефіру або гетероарилборонатного ефіру відповідно до реакції сполучення Сузукі, з отриманням сполуки формули (XXVII):
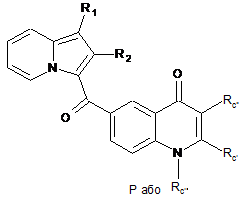 , (XXVII)
, (XXVII)
сполуку формули (XXVII) піддають реакції зняття захисних груп.
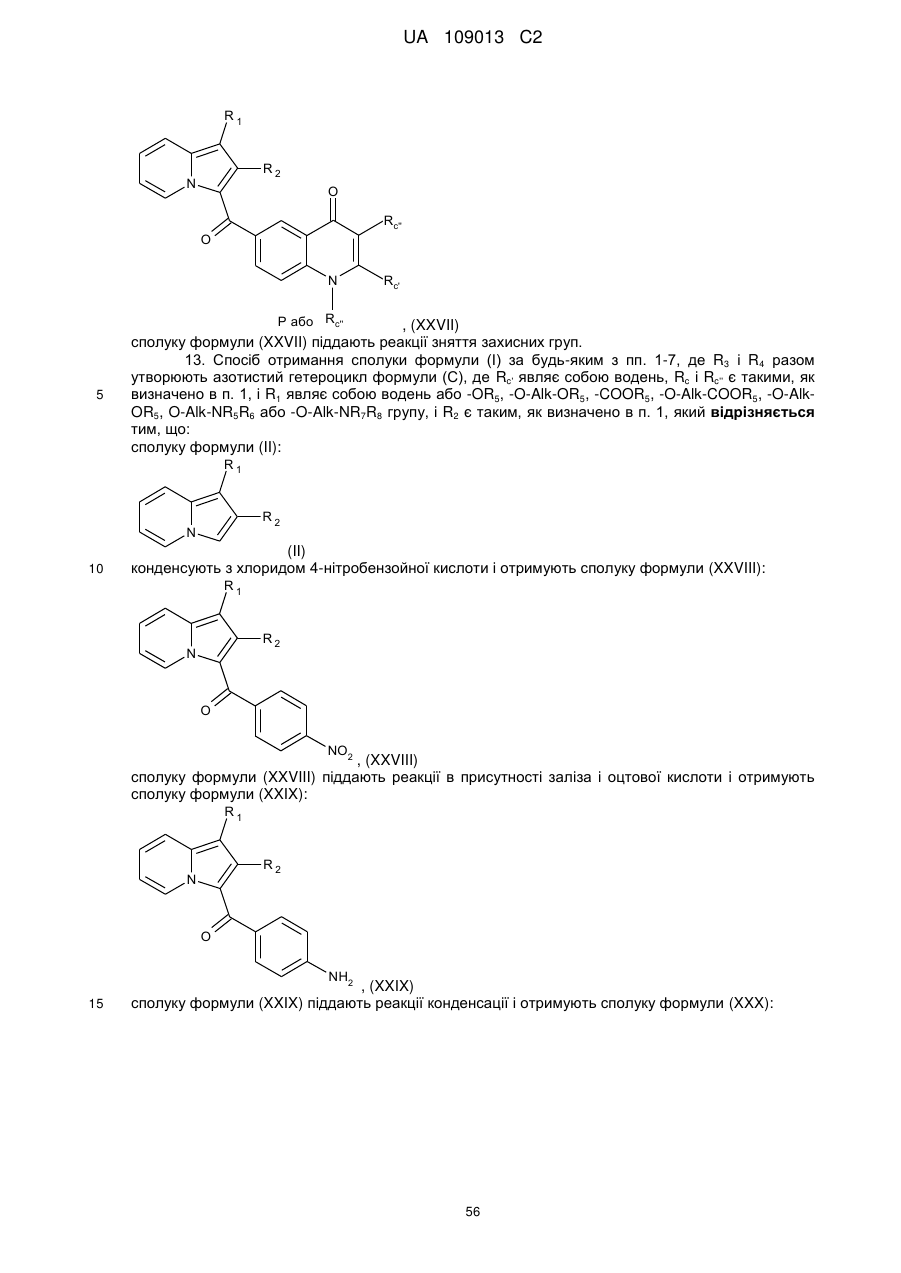
13. Спосіб отримання сполуки формули (І) за будь-яким з пп. 1-7, де R3 і R4 разом утворюють азотистий гетероцикл формули (С), де Rc' являє собою водень, Rc і Rc'' є такими, як визначено в п. 1, і R1 являє собою водень або -OR5, -O-Alk-OR5, -COOR5, -O-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 або -O-Alk-NR7R8 групу, і R2 є таким, як визначено в п. 1, який відрізняється тим, що:
сполуку формули (II):
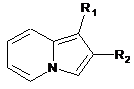 (II)
(II)
конденсують з хлоридом 4-нітробензойної кислоти і отримують сполуку формули (XXVIII):
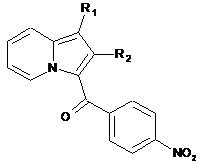 , (XXVIII)
, (XXVIII)
сполуку формули (XXVIII) піддають реакції в присутності заліза і оцтової кислоти і отримують сполуку формули (XXIX):
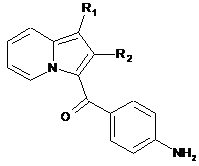 , (XXIX)
, (XXIX)
сполуку формули (XXIX) піддають реакції конденсації і отримують сполуку формули (XXX):
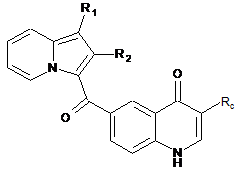 , (XXX)
, (XXX)
сполуку формули (XXX) піддають реакції алкілування в присутності галогеніду Rc''X, де Rc'' є таким, як визначено в п. 1, і X являє собою галоген, і в присутності основи.
14. Фармацевтична композиція, що містить як активний інгредієнт сполуку формули (І) за будь-яким з пп. 1-8, необов'язково в комбінації з одним або декількома відповідними інертними ексципієнтами.
15. Сполука за будь-яким з пп. 1-8 для застосування в лікуванні і профілактиці захворювань, що вимагають модуляції b-FGF.
16. Сполука за будь-яким з пп. 1-8 для застосування в лікуванні і профілактиці раку, зокрема раку, який має високий ступінь васкуляризації, такого як рак легень, молочної залози, простати, підшлункової залози, товстої кишки, нирок і стравоходу, раку, який викликає метастази, такого як рак товстої кишки, рак печінки і рак шлунка, меланома, гліома, лімфома, лейкемія, а також тромбопенії.
17. Сполука за п. 16 для застосування в комбінації з одним або декількома протираковими активними інгредієнтами і/або променевою терапією, і/або з будь-якою анти-VEGF-терапією.
18. Сполука за будь-яким з пп. 1-8 для застосування в лікуванні і профілактиці серцево-судинних захворювань, таких як атеросклероз або рестеноз після ангіопластики, захворювань, пов'язаних з ускладненнями, які виникають після імплантації ендоваскулярних стентів і/або аортокоронарних шунтів або інших судинних трансплантатів, гіпертрофії серця, судинних ускладнень після цукрового діабету, таких як діабетична ретинопатія, фіброзів печінки, нирок і легень, невропатичного болю, хронічних запальних захворювань, таких як ревматоїдний артрит або IBD (запальне захворювання кишечнику), гіперплазії передміхурової залози, псоріазу, світлоклітинної акантоми, остеоартриту, хондродистрофії (АСН), гіпохондроплазії (НСН), TD (танатофорної дисплазії), ожиріння і дегенерації жовтої плями, такої як вікова макулярна дегенерація (ARMD).
Текст
Реферат: Даний винахід стосується сполук, які відповідають формулі (І): R1 R2 N R3 R4 O , (I) де R3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6членний азотистий гетероцикл, який відповідає одній з формул (А), (В) і (С), приведених нижче: UA 109013 C2 (12) UA 109013 C2 O O N N Ra O N N O Rc Rb Rb' N Rc'' Ra' (A) Rc' , (B) , (C) , де хвилястими лініями позначене фенільне ядро, до якого приєднані R3 і R4, способу їх отримання і терапевтичного застосування. UA 109013 C2 5 10 15 20 25 30 35 40 Даний винахід стосується похідних індолізину, які є інгібіторами FGF (фактори росту фібробластів), способу їх отримання і їх терапевтичного застосування. FGF являють собою сімейство поліпептидів, які синтезуються великою кількістю клітин в процесі ембріонального розвитку і клітинами зрілих тканин при різних патологічних станах. Похідні індолізину, які є антагоністами зв'язування FGF з їх рецепторами, описані в міжнародних патентних заявках WO 03/084956 і WO 2005/028476, тоді як похідні імідазо[1,5а]піридину, які є антагоністами FGF, описані в міжнародній патентній заявці WO 2006/097625. У цей час були ідентифіковані нові похідні індолізину, які є антагоністами зв'язування FGF з їх рецепторами. Таким чином, предметом даного винаходу є сполуки, похідні індолізину, відповідні формулі (I): , де: - R1 являє собою атом водню або галогену, . алкільну групу, необов'язково заміщену -COOR5, . алкенільну групу, необов'язково заміщену -COOR5, . -COOR5 або -CONR5R6 групу, . -NR5COR6 або -NR5-SO2R6 групу, . -OR5, -O-Alk-OR5, -O-Alk-COOR5, -O-Alk-OR5, -O-Alk-NR5R6, -O-Alk-NR7R8 групу, або . арильну групу, зокрема, феніл, або гетероарильну групу, де вказана арильна або гетероарильна група необов'язково заміщена однією або декількома групами, вибраними з: атомів галогену, алкільних груп, циклоалкільних груп, -COOR5, -CF3, -OCF3, -CN, -C(NH2)nOH, OR5, -O-Alk-COOR5, -O-Alk-NR5R6, -O-Alk-NR7R8, -Alk-OR5, -Alk-COOR5, -CONR5R6, -CO-NR5-OR6, -CO-NR5-SO2R7, -CONR5-Alk-NR5R6, -CONR5-Alk-NR7R8, -Alk-NR5R6, -NR5R6, -NC(О)n(CH3)2, -COAlk, -CO(OAlk)nOH, COO-Alk-NR5R6, COO-Alk-NR7R8 і 5-членних гетероарильних груп, де вказаних гетероарильні групи необов'язково заміщені однією або декількома групами, вибраними з атомів галогену і алкільної, -CF3, -CN, -COOR5, -Alk-OR5, -Alk-COOR5, -CONR5R6, CONR7R8, -CO-NR5-OR6, -CO-NR5-SO2R6, -NR5R6 і -Alk-NR5R6 груп, або гідроксильною групою або атомом кисню, - n є цілим числом від 1 до 3, - R2 являє собою: . атом водню, . алкільну групу, . фенільну групу, необов'язково заміщену однією або декількома алкільними групами, - R3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6членний азотистий гетероцикл, який відповідає одній з формул (А), (В) і (С), приведених нижче: , де хвилястими лініями позначене фенільне ядро, до якого приєднані R 3 і R4, і: . Ra являє собою атом водню або алкільну, галогеналкільну, -Alk-CF3, -Alk-COOR5, -Alk'COOR5, -Alk-CONR5R6, -Alk'-CONR5R6, -Alk-CONR7R8, -Alk-NR5R6, -AlkCONR5-OR6, -Alk-NR7R8, Alk-циклоалкільну, -Alk-O-R5, -Alk-S-R5, -Alk-CN, -OR5, -OAlkCOOR5, -NR5R6, -NR5-COOR6, -Alk 1 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 арильну, -Alk-O-арильну, -Alk-O-гетероарильну, -Alk-гетероарильну або гетероарильну групу, де арильна або гетероарильна група необов'язково заміщена одним або декількома атомами галогену і/або алкільною, циклоалкільною, -CF3, -OCF3, -O-R5 або -S-R5 групами. . Rа' являє собою атом водню або лінійну, розгалужену, циклічну частково циклічну алкільну групу або -Alk-OR5, -Alk-NR5R6 або -Alk-NR7R8 групу, Rа' необов'язково заміщений одним або декількома атомами галогену, . Rb являє собою атом водню або алкільну або -Alk-COOR5 групу, . Rb' являє собою атом водню або алкільну, галогеналкільну, циклоалкільну, фенільну або Alk-COOR5 групу, . Rc являє собою атом водню або алкільну, -CN, -COOR5, -CO-NR5R6, -CONR7R8, -CO-NR5Alk-NR5R6, -CONR5-Alk-OR5, -CONR5SO2R5, -Alk-арильну або -Alk-гетероарильну групу, де арильна або гетероарильна група необов'язково заміщена одним або декількома атомами галогену і/або алкільною, циклоалкільною, -CF3, -OCF3, -O-алкільною або -S-алкільною групами, . Rc' являє собою атом водню або алкільну групу, . Rc" являє собою атом водню або алкільну, алкенільну, галогеналкільну, циклоалкільну, -AlkNR5R6, -Alk-NR7R8, -Alk-OR5 або -Alk-SR5 групу, - R5 і R6, які можуть бути однаковими або різними, являють собою атоми водню, галогеналкільні групи або алкільні групи, циклоалкільні групи або Ms (мезил) групу, - R7 і R8, які можуть бути однаковими або різними, являють собою атоми водню або алкільні або фенільні групи, або R7 і R8 разом утворюють 3-8-членне насичене кільце, яке може необов'язково містити гетероатом, - Alk являє собою лінійний або розгалужений алкіленовий ланцюг, і - Alk' являє собою лінійний розгалужений циклічний або частково циклічний алкіленовий ланцюг, ці сполуки знаходяться необов'язково в формі фармацевтично прийнятної солі. Сполуки формули (I) можуть містити один або декілька асиметричних атомів вуглецю. Відповідно вониможуть існувати у вигляді енантіомерів або діастереоізомерів. Ці енантіомери і діастереоізомери, а також їх суміші, включаючи рацемічні суміші, є частиною винаходу. Сполуки формули (I) можуть існувати в формі основ або кислот, або можуть утворювати солі з кислотами або основами, зокрема, фармацевтично прийнятними кислотами або основами. Такі адитивні солі є частиною винаходу. Ці солі переважно отримують з фармацевтично прийнятними кислотами або основами, але солі інших кислот або основ, придатних, наприклад, для очищення або виділення сполук формули (I), також є частиною винаходу. Сполуки формули (I) можуть існувати в формі гідратів або сольватів, а саме в формі асоціацій або комбінацій з однією або декількома молекулами води або розчинників. Такі гідрати або сольвати також є частиною винаходу. У контексті винаходу і якщо в тексті не указано інше, термін: - "алкіл" означає: лінійну або розгалужену, насичену аліфатичну групу на основі вуглеводню, що містить від 1 до 6 атомів вуглецю; - "циклоалкіл" означає: циклічну алкільну групу, що містить від 3 до 8 членів в кільці, що містить від 3 до 6 атомів вуглецю і необов'язково що містить один або декілька гетероатомів, наприклад, 1 або 2 гетероатоми, таких як азот і/або кисень, де вказана циклоалкільна група необов'язкова заміщена одним або декількома атомами галогену і/або алкільними групами. Як приклад, можна привести циклопропільну, циклопентильну, піперазинільну, піролідинільну і піперидинільну групи; - "частково циклічна алкільна група" означає: алкільну групу, в якій тільки частина утворює кільце; - "алкілен" означає: лінійну або розгалужену двовалентну алкільну групу, що містить від 1 до 6 атомів вуглецю; - "галоген" означає: хлор, фтор, бром або йод, переважно атом хлору або фтору; - "галогеналкіл" означає: алкільний ланцюг, в якому всі або деякі з атомів водню замінені на атоми галогену, такі як атоми фтору; - "алкеніл" означає: алкільну групу, що містить етиленовий ненасичений зв'язок; і - "арил" означає: циклічну ароматичну групу, що містить від 5 до 10 атомів вуглецю, наприклад, фенільну групу; - "гетероарил" означає: циклічну ароматичну групу, що містить від 3 до 10 атомів, включаючи один або декілька гетероатомів, наприклад, від 1 до 4 гетероатомів, таких як азот, кисень або сірка, і ця група, містить одне або декілька, переважно одне або два, кільця. Гетероцикли можуть містити декілька конденсованих кілець. Гетероарили необов'язково 2 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 заміщені однією або декількома алкільними групами або атомом кисню. Як приклад можна привести тієнільну, піридинільну, піразолільну, імідазолільну, тіазолільну і триазолільну групи; - "5-членний гетероарил" означає: гетероарильну групу, що складається з 5-членного кільця, що містить від 1 до 4 гетероатомів (наприклад, атоми кисню і/або азоту), необов'язково заміщену однією або декількома алкільними групами або гідроксильною групою або атомом кисню. Як приклад можна привести, наприклад, оксадіазолільну і тетразолільну групи. У числі сполук формули (I) відповідно до винаходу можна указати підгрупи сполук, в яких R 1 являє собою -OR5, -O-Alk-OR5, -COOR5 або -O-Alk-COOR5 групу або феніл, необов'язково заміщену однією або декількома алкільною або -COOR5 групами, в яких R5 являє собою атом водню або алкільну групу, що містить від 1 до 4 атомів вуглецю, і Alk являє собою алкіленовий ланцюг, що містить 1 або 2 атоми вуглецю, або гетероарильну групу, переважно піридинільну групу. Інша підгрупа сполук формули (I) відповідно до винаходу є такою, що R 1 являє собою -OR5, O-Alk-OR5 або -O-Alk-COOR5 групу або фенільну групу, необов'язково заміщену однієї або декількома алкільною або -COOR5 групами, в яких R5 являє собою атом водню або метильну групу, і Alk являє собою алкіленовий ланцюг, що містить 1 або 2 атоми вуглецю, або гетероарильну групу, переважно піридинільну групу. Переважно, R1 являє собою -OR5, -O-Alk-OR5 або -O-Alk-COOR5 групу або фенільну групу, необов'язково заміщену -COOR5 групою, де R5 являє собою атом водню або метильну групу, і Alk являє собою алкіленовий ланцюг, що містить 2 атоми вуглецю. У числі сполук формули (I) відповідно до винаходу можна указати іншу підгрупу сполук, де R2 являє собою алкільну групу, що містить від 1 до 4 атомів вуглецю, або фенільну групу. Переважно, R2 являє собою метильну або фенільну групу. У числі сполук формули (I) відповідно до винаходу можна указати іншу підгрупу сполук, в якій R3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6членний азотистий гетероцикл, який відповідає одній з приведених вище формул (А), (В) або (С), і в яких: . Ra являєсобою атом водню або алкільну або галогеналкільну, -OR5, -Alk-OR5, -Alk'-COOR5, -NR5R6, -Alk-NR7R8, -Alk-CN, -NR5-COOR6, -Alk'-CO-NR5R6, -Alk-CO-NR5-OR6 або -O-Alk-COOR5 групу або гетероарильну, -Alk-гетероарильну або -Alk-арильну групу, де арильна або гетероарильна група, необов'язково заміщена алкільною групою або атомом галогену, . Rа' являє собою атом водню або алкільну або -Alk-OR5 групу, . Rb являє собою атом водню або алкільну або -Alk-COOR5 групу, . Rb' являє собою атом водню або алкільну, галогеналкільну або -Alk-COOR5 групу. . Rс являє собою атом водню або алкільну, -COOR5, CN, -CO-NR5R6, -CO-NR7R8, Alkгетероарильну або гетероарильну групу, . Rс' являє собою атом водню або алкільну групу, . Rс" являє собою атом водню або алкільну або алкенільну групу, . вказані алкільні або алкенільні групи, описані вище, містять від 1 до 4 атомів вуглецю, . R5 і R6 являють собою атоми водню або алкільні або галогеналкільні групи, де вказані алкільні і галогеналкільні групи містять від 1 до 4 атомів вуглецю, . R7 і R8 являють собою атоми водню або алкільні групи, що містять від 1 до 4 атомів вуглецю, або разом утворюють 5- або 6-членное насичене кільце, . Alk являє собою лінійний або розгалужений алкіленовий ланцюг, що містить від 1 до 4 атомів вуглецю, і . Alk' являє собою лінійний, розгалужений, циклічний частково циклічний алкіленовий ланцюг, що містить від 1 до 4 атомів вуглецю. У числі сполук формули (I), можна також указати сполуки підгрупи, визначеної вище, де R 3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, 6-членний азотистий гетероцикл, який відповідає будь-якій з формул (А) і (С). Інша підгрупа відповідає сполукам формули (I), в якій R 3 і R4 утворюють разом з атомами вуглецю фенільного ядра, до якого вони приєднані, азотистий гетероцикл формули (С), де: Rс являє собою атом водню або алкільну, -COOR5, CN, -CO-NR5R6, -CO-NR7R8, Alkгетероарильну або гетероарильну групу, . Rс' являє собою атом водню або алкільну групу, . Rс" являє собою атом водню або алкільну або алкенільну групу, . вказані алкільна або алкенільна групи, описані вище, містять від 1 до 4 атомів вуглецю, . R5 і R6 являють собою атоми водню або алкільні або галогеналкільні групи, де вказані алкільні і галогеналкільні групи містять від 1 до 4 атомів вуглецю, 3 UA 109013 C2 5 10 15 20 25 30 35 40 45 . R7 і R8 являють собою атоми водню або алкільні групи, що містять від 1 до 4 атомів вуглецю, або разом утворюють 5- або 6-членное насичене кільце, . Alk являє собою лінійний або розгалужений алкіленовий ланцюг, що містить від 1 до 4 атомів вуглецю, і . Alk' являє собою лінійний, розгалужений, циклічний або частково циклічний алкіленовий ланцюг, що містить від 1 до 4 атомів вуглецю. У числі сполук, які є предметом винаходу, можна указати наступні сполуки: 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1,2-диметил-4-оксо-1,4-дигідрохінолін-3карбоксамід, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4-дигідрохінолін-3-карбонова кислота, 2-{6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)-іл}-N, N'-диметилацетамід, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-3-пропілхіназолін-2,4(1H, 3Н)-діон, {6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)іл}оцтова кислота, метил {6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)іл}ацетат, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метилхіназолін-4(3Н)-он, 1-{6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)-іл}-N, N-диметилциклопропанкарбоксамід, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1,2-диметил-4-оксо-1,4-дигідрохінолін-3карбоксамід, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-3-метилхіназолін-2,4(1H, 3Н)-діон, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-N-метил-4-oxo-1,4-дигідрохінолін-3карбоксамід, N-1-диметил-6-[(2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3-карбоксамід. Нижче по тексту під терміном "захисна група" розуміють групу, яка дозволяє, з одного боку, захищати реакційноздатну функціональну групу, таку як гідроксил або амін, під час синтезу, і, з іншого боку, регенерувати інтактну реакційноздатну функціональну групу по закінченні синтезу. Приклади захисних груп, а також способи захисту і зняття захисту вказані в "Protective Groups in rd Organic Synthesis", Green et al., 3 Edition (John Wiley & Sons, Inc., New York). У частині тексту, яка залишилася, термін "група, яка видаляється" означає групу, яка може бути легко відщеплена від молекули шляхом розриву гетеролітичного зв'язку з видаленням електронної пари. Отже, ця група може бути легко замінена іншою групою, наприклад, під час реакції заміщення. Такими групами, які видаляються, є, наприклад, галогени або активована гідроксильна група, така як мезил, тозил, трифлат, ацетил-, пара-нітрофеніл і т. д. Приклади груп, які видаляються, а також способи їх отримання, описані в "Advances in Organic Chemistry", rd J. March, 3 Edition, Wiley Interscience, р. 310-316. Відповідно до винаходу сполуки загальної формули (I) можуть бути отримані описаними нижче способами. На схемі 1 представлений спосіб отримання сполук формули (I), де R 3 і R4 разом утворюють азотистий гетероцикл формули (А), як визначено вище, R1 являє собою -OR5, -O-Alk-OR5, COOR5, -O-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 або -O-Alk-NR7R8 групу, і R2 являє собою групу, як визначене вище. Схема 1 (спосіб 1): 4 UA 109013 C2 5 10 15 20 Сполука формули II (отримана відповідно до реакції Чичибабіна, описаної в WO 03084956), де R1 і R2 є такими, як визначено для сполуки формули I, конденсують зі сполукою формули III з отриманням сполуки формули IV. Сполуку формули IV піддають реакції основного гідролізу з отриманням сполуки формули V. Етерифікація сполуки формули V дає сполуку формули VI. При взаємодії трифосгену утворюється ізоціанат, який відповідає сполуці формули VI, який конденсують з аміном формули RaNH2 з отриманням сечовини формули VII. Сполуку формули VII піддають реакції циклізації в лужному середовищі з отриманням сполуки формули VIII. Сполуку VIII піддають реакції алкілування в присутності основи і галогенованого похідного R a'X з отриманням сполуки формули I, де R2 є таким, як визначено вище. Схема 2 являє собою спосіб отримання сполук формули (I), де R 3 і R4 разом утворюють азотистий гетероцикл формули (А), як визначено вище, R 1 є таким, як визначено вище, за винятком -OR5, -O-Alk-OR5, -COOR5, -O-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 або -O-Alk-NR7R8 групи, і R2 являє собою групу, як визначене вище. Схема 2 (спосіб 2): Сполуку формули IX (отриману відповідно до реакції Чичибабіна, описаної в WO 03084956), де R2 є таким, як визначено для сполуки формули I, конденсують зі сполукою формули III для отримання сполуки формули X. Сполуку формули X піддають реакції основного гідролізу з отриманням сполуки формули XI. Етерифікація сполуки формули XI дає сполуку формули XII. При взаємодії N-бромсукциніміду утворюється сполука формули XIII. При взаємодії трифосгену, 5 UA 109013 C2 5 10 15 20 25 30 35 40 утворюється ізоціанат, який відповідає сполуці формули XIII, який конденсують з аміном формули RaNH2 з отриманням сечовини формули XIV. Сполуку формули XIV піддають реакції циклізації в лужному середовищі, з отриманням сполуки формули XV. Сполуку формули XV піддають, в присутності каталізатора на основі паладію, ліганду і основи, - взаємодії з похідними фенілборонового або гетероарилборонового або фенілборонатного ефіру або гетероарилборонатного ефіру відповідно до реакції сполучення Сузукі, - або ж реакції ціанування з ціанідом цинку, з подальшим кислотним гідролізом, з отриманням сполуки формули XVI. Сполуку XVI піддають реакції алкілування в присутності основи і галогенованого похідного Ra'X з отриманням сполуки формули I, де R2 є таким, як визначено вище, і R1 є таким, як визначено вище, за винятком -OR5, -O-Alk-OR5, -COOR5, -O-AlkCOOR5, -O-Alk-OR5, O-Alk-NR5R6 або -O-Alk-NR7R8 групи. Схема 3 являє собою спосіб отримання сполук формули (I), де R 3 і R4 разом утворюють азотистий гетероцикл формули (В), як визначено вище, і де R 1 є таким, як визначено вище, за винятком арильної або гетероарильної групи, необов'язково заміщеної однієї або декількома алкільною, -OR5, -NR5R6 або -COOR5 групами, і R2 є таким, як визначено вище. Схема 3 (метод 3): Сполука формули V, де R1 є таким, як визначено вище, за винятком фенольної групи, необов'язково заміщеної однієї або декількома алкільною або -COOR5 групами, піддають реакції конденсації з ангідридом кислоти з отриманням сполуки формули XVII, де R 1 і R2 є такими, як визначено вище. Сполуку XVII піддають реакції заміщення з отриманням сполуки формули I, де R1 і R2 є такими, як визначено вище. Схема 4 являє собою спосіб отримання сполук формули (I), де R 3 і R4 разом утворюють азотистий гетероцикл формули (В), як визначено вище, і де R 1 являє собою арильну або гетероарильну групу, необов'язково заміщену однієї або декількома алкільною, -OR5, -NR5R6 або -COOR5 групами, і R2 являє собою групу, як визначене вище. Схема 4 (метод 4): Сполуку формули XIII піддають реакції омилення в лужному середовищі з отриманням сполуки XVIII. Сполуку XVIII піддають реакції конденсації з ангідридом кислоти з отриманням сполуки формули XIX. Сполуку XIX піддають реакції заміщення з отриманням сполуки формули XX. Сполуку формули XX піддають, в присутності каталізатора на основі паладію, ліганду і основи, взаємодії з похідними фенілборонового або гетероарилборонового або фенілборонатного ефіру або гетероарилборонатного ефіру відповідно до реакції сполучення Сузукі, з отриманням сполуки формули I, де R1 і R2 є такими, як визначено вище. Схема 5 являє собою спосіб отримання сполук формули (I), де R 3 і R4 разом утворюють азотистий гетероцикл формули (С), як визначено вище, і де R 1 являє собою -OR5, -O-Alk-OR5, COOR5, -O-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 або -O-Alk-NR7R8 групу, і R2 є таким, як визначено вище. Схема 5 (метод 5): 6 UA 109013 C2 5 10 15 20 25 Сполуку V піддають реакції конденсації з отриманням сполуки XXI. Сполуку XXI піддають реакції алкілування в присутності основи і галогенованого похідного R с'X або захисної групи з отриманням сполуки XXII. Сполуку XXII піддають реакції конденсації з похідним малонової кислоти з отриманням сполуки формули XXIII, де R c' і Rc є такими, як визначено вище. Сполуку формули XXIII піддають реакції зняття захисних груп з отриманням сполук формули I, де R 1 і R2 є такими, як визначено вище. Схема 6 являє собою спосіб отримання сполук формули (I), де R 3 і R4 разом утворюють азотистий гетероцикл формули (С), як указано вище, і де R 1 являє собою арильну або гетероарильну групу, де арильна або гетероарильна група необов'язково заміщена однією або декількома алкільною, -OR5, -NR5R6 або -COOR5 групами, і Rc' переважно являє собою алкіл, і Rс" і R2 є такими, як визначено вище. Схема 6 (спосіб 6): Сполуку XVIII піддають реакції конденсації з отриманням сполуки XXIV. Сполуку XXIV піддають реакції алкілування в присутності основи і галогенованого похідного R с'X або захисної групи з отриманням сполуки XXV. Сполуку XXV піддають реакції конденсації з похідним малонової кислоти для отримання сполуки формули XXVI, де R c' і Rc є такими, як визначено вище. Сполуку XXVI піддають, в присутності каталізатора на основі паладію, ліганду і основи, взаємодії з похідними фенілборонового або гетероарилборонового або фенілборонатного ефіру або гетероарилборонатного ефіру відповідно до реакції сполучення Сузукі з отриманням сполуки формули XXVII. Сполуку формули XXVII піддають реакції зняття захисних груп з отриманням сполук формули I, де R1 і R2 є такими, як визначено вище. Схема 7 являє собою спосіб отримання сполук формули (I), де R 3 і R4 разом утворюють азотистий гетероцикл формули (С) з Rc', що представляє водень, і Rс і Rс" є такими, як указано 7 UA 109013 C2 вище, і де R1 являє собою водень або -OR5, -O-Alk-ОR5, -COOR5, -O-Alk-COOR5, -O-Alk-OR5, OAlk-NR5R6 або -O-Alk-NR7R8 групу, і R2 є таким, як визначено вище. Схема 7 (метод 7): 5 10 15 20 25 30 35 40 45 Сполуку формули II, де R1 і R2 є такими, як визначено вище, конденсують з хлоридом 4нітробензойної кислоти з отриманням сполуки XXVIII. Сполуку XXVIII піддають відновленню в присутності заліза і оцтової кислоти з отриманням сполуки XXIX. Сполуку XXIX піддають реакції конденсації з отриманням сполуки XXX. Сполуку XXX піддають реакції алкілування в присутності галоїду Rс'X і основи для отримання сполуки формули I, де R 1 і R2 є такими, як визначено вище. На вказаних вище схемах вихідні сполуки і реагенти, у випадку, коли спосіб їх отримання не описаний, є комерційно доступними або описані в літературі, або можуть бути отримані відповідно до способів, які описані в цьому документі або які відомі фахівцям в даній галузі. Предметом винаходу, відповідно до іншого його аспекту, також є визначені вище сполуки формул (I)-(XXX). Ці сполуки використовують як проміжні продукти для синтезу сполук формули (I). Наступні приклади описують отримання деяких сполук відповідно до винаходу. Ці приклади не є обмежувальними і тільки ілюструють даний винахід. Номери сполук з прикладів відповідають номерам, приведеним в нижченаведених таблицях, що ілюструють хімічні структури і фізичні властивості деяких сполук за винаходом. Реагенти і проміжні сполуки, у випадку, коли спосіб їх отримання не пояснюється, описані в літературі або є комерційно доступними. Деякі проміжні сполуки, які використовують для отримання сполук формули I, можуть також служити як кінцеві продукти формули (I), що стане зрозуміло з прикладів, приведених нижче. Крім того, деякі сполуки формули (I) відповідно до винаходу можуть служити як проміжні сполуки, які використовують для отримання інших сполук формули (I) відповідно до винаходу. Так, наприклад, сполуки формули (I) вибрані з наступних сполук: 2-{6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2H)-іл}-N, N'-диметилацетамід, 2-{6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-2,4-діоксо-1,4-дигідрохіназолін3(2Н)-іл}-N, N'-диметилацетамід, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-3-[(3-метил-1,2,4-оксадіазол-5іл)метил]хіназолін-2,4(1H, 3H)-діон, 3-{3-(2,4-діоксо-3-пропіл-1,2,3,4-тетрагідрохіназолін-6-іл)карбоніл}-2-метиліндолізин-1іл}бензойна кислота, {6-[(1-метокси-2-феніліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)іл}оцтова кислота, етил ({6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)іл}окси)ацетат, 3-аміно-6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]хіназолін-2,4(1H, 3H)-діон, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метилхіназолін-4(3H)-он, 3-{2-метил-3-[(2-метил-4-оксо-3,4-дигідрохіназолін-6-іл)карбоніл]індолізин-1-іл}бензойна кислота, 6-{[1-(2-метоксіетокси)-2-метиліндолізин-3-іл]карбоніл}-3-пропілхіназолін-2,4(1H, 3Н)-діон, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4-дигідрохінолін-3-карбонова кислота, 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4-оксо-1,4-дигідрохінолін-3-карбонова кислота, 8 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-N-метил-4-оксо-1,4-дигідрохінолін-3карбоксамід, N-1-диметил-6-[(2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3-карбоксамід, N-1-диметил-6-{[2-метил-1-(піридин-4-іл)індолізин-3-іл]карбоніл}-4-оксо-1,4-дигідрохінолін-3карбоксамід гідрохлорид. Скорочення - ДМФ: N, N-диметилформамід - ТГФ: тетрагідрофуран - DBU: 1,8-діазабіцикло[5,4,0]ундец-7-ен - HBTU: О-бензотриазол-1-іл-N, N, N', N'-тетраметилуронію гексафторфосфат - DIEA: Діізопропілетиламін - DME: диметиловий ефір етиленгліколю - TOTU: О-[(етоксикарбоніл)ціанометиленаміно]-N, N, N', N'-тетраметилуронію фторборат ЯМР аналіз виконували за допомогою приладу Bruker Avance з частотою 250 МГц, 300 МГц і 400 МГц. - Температури плавлення вимірювали за допомогою приладу Buchi В-450. - Мас-спектрометричні аналізи виконували за допомогою приладу Waters Alliance 2695 (UV: PDA996, MS: LCZ), Alliance 2695 (UV: PDA 996, МС: ZQ (simple Quad) Zq1), Alliance 2695 (UV: PDA 996, MS: ZQ (simple Quad) Zq2), Waters UPLC ACQUITY (UV: ACQUITY PDA, MS: SQD (simple Quad) SQW), Agilent MSD, Waters ZQ або Waters SQD. Приклад 1: (сполука № 35) 2-{6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)-іл}-N, N'-диметилацетамід Метил 2-аміно-5-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]бензоат До 8 г (23,1 ммоль) натрієвої солі 2-аміно-5-[(1-метокси-2-метиліндолізин-3іл)карбоніл]бензойної кислоти (описана в WO 03/084956) в 130 мл ДМФ додавали 1,51 мл (24,26 ммоль) метилйодиду, в інертній атмосфері при температурі навколишнього середовища. Після перемішування протягом 1 години додавали воду. Осад, який утворився, відфільтровували, промивали водою, а потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 7,17 г твердої речовини жовтого кольору. МН+: 339. Метил 2-({[2-(диметиламіно)-2-оксоетил]карбамоїл}аміно)-5-[(1-метокси-2-метиліндолізин-3іл)карбоніл]бензоат До 1,3 г (3,84 ммоль) метил 2-аміно-5-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]бензоату в 50 мл діоксану додавали 0,798 г (2,69 ммоль) трифосгену, розведеного в 10 мл діоксану, в інертній атмосфері при температурі навколишнього середовища. Після перемішування протягом 1 години, додавали 1,25 г (7,68 ммоль) ацетату Ν,Ν-диметилгліцинаміду і 2,68 мл (19,21 ммоль) триетиламіну. Реакційне середовище перемішували протягом ночі при температурі навколишнього середовища, а потім гідролізували водою. Водну фазу екстрагували дихлорметаном. Отриману органічну фазу сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отримували 1,8 г твердої речовини жовтого кольору. Температура плавлення: 228 °C. MH+=467. 2-{6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)-іл}-N, N'-диметилацетамід До 1,8 г (3,86 ммоль) метил метил 2-({[2-(диметиламіно)-2-оксоетил]карбамоїл}аміно)-5-[(1метокси-2-метиліндолізин-3-іл)карбоніл]бензоату в 25 мл ТГФ додавали 0,69 мл (4,63 ммоль) DBU при температурі навколишнього середовища в інертній атмосфері. Реакційне середовище перемішували протягом ночі при температурі навколишнього середовища. ТГФ концентрували при зниженому тиску. Залишок розчиняли у воді. Водну фазу екстрагували дихлорметаном. Отриману органічну фазу сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриману тверду речовину жовтого кольору очищали колонковою хроматографією на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отриману речовину у вигляді піни оранжевого кольору обробляли мінімальною кількістю метанолу. Після додавання води осад відфільтровували, промивали водою, а потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 1,14 г порошку жовтого кольору. Температура плавлення: 290 °C. MH+=435. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 9 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 1,82 (с, 3Н), 2,85 (с, 3Н), 3,08 (с, 3Н), 3,83 (с, 3Н), 4,75 (с, 2H), 6,95 (т, J=6,85 Гц, 1H), 7,197,24 (м, 1H), 7,32 (д, J=8,43, 1H), 7,66 (д, J=8,87 Гц, 1H), 7,91 (д, J=8,47 Гц, 1H), 8,09 (д, J=2,02 Гц, 1H), 9,53 (д, J=7,26 Гц, 1H) 11,83 (с, 1H). Приклад 2: (сполука № 68) 2-{6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-2,4-діоксо-1,4-дигідрохіназолін3(2Н)-іл}-N, N'-диметилацетамід До 0,150 г (0,35 ммоль) 2-{6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4дигідрохіназолін-3(2H)-іл}-N, N'-диметилацетаміду в 5 мл ДМФ додавали 0,04 мл (0,69 ммоль) метилйодиду і 0,225 г (0,69 ммоль) карбонату цезію в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище перемішували протягом 2,5 годин при температурі навколишнього середовища, а потім гідролізували водою. Водну фазу екстрагували етилацетатом. Отриману органічну фазу промивали водою, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Залишок очищали колонковою хроматографією на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отриману тверду речовину обробляли мінімальною кількістю метанолу. Після додавання води, осад відфільтровували, промивали водою, а потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 0,135 г твердої речовини жовтого кольору. Температура плавлення: 276 °C. МН+: 449. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,82 (с, 3Н), 2,85 (с, 3Н), 3,09 (с, 3Н), 3,60 (с, 3Н), 3,83 (с, 3Н), 4,81 (с, 2H), 6,97 (т, J=7,05 Гц, 1H), 7,21-7,26 (м, 1H), 7,62 (д, J=8,75 Гц, 1H), 7,67 (д, J=8,75 Гц, 1H), 8,02 (д, J=8,67 Н, 1H), 8,19 (д, J=2,19 Гц, 1Н), 9,75 (д, J=7,13 Гц, 1H). Приклад 3: (сполука № 36) 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-3-[(3-метил-1,2,4-оксадіазол-5іл)метил]хіназолін-2,4(1H, 3Н)діон Метил {6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2H)іл}ацетат До 2 г (5,91 ммоль) метил 2-аміно-5-[(1-метоксиіндолізин-3-іл)карбоніл]бензоату в 65 мл діоксану додавали 1,22 г (4,14 ммоль) трифосгену, розбавленого в 15 мл діоксану, в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище перемішували протягом 1 години при температурі навколишнього середовища, а потім додавали 1,48 г (11,82 ммоль) метилгліцинату і 4,12 мл (29,55 ммоль) триетиламіну. Реакційне середовище перемішували протягом 18 годин, а потім додавали 1,08 г (5,91 ммоль) DBU. Після перемішування протягом 24 годин, середовище гідролізували водою. Водну фазу екстрагували дихлорметаном. Отриману органічну фазу промивали водою, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отриману тверду речовину перекристалізовували при нагріванні з метанолу. Отримували 1,5 г твердої речовини жовтого кольору. Температура плавлення: 253 °C. МН+=422. 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-3-[(3-метил-1,2,4-оксадіазол-5іл)метил]хіназолін-2,4(1H, 3Н)діон До 0,1 г (0,25 ммоль) метил {6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4дигідрохіназолін-3(2H)-іл}ацетату в 5 мл ДМФ додавали 0,14 г (0,37 ммоль) HBTU, 0,21 мл (1,23 ммоль) DIEA, а потім 0,18 г (1,23 ммоль) (1E)-N'-гідроксіетанімідаміду в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище нагрівали при 90 °C протягом 24 годин. Після гідролізу за допомогою води, реакційну суміш екстрагували етилацетатом. Органічну фазу промивали насиченим водним розчином гідрокарбонату натрію і потім водою, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриману тверду речовину жовтого кольору очищали колонковою хроматографією на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 0,046 г твердої речовини жовтого кольору. Температура плавлення: 176 °C. МН+: 446. 1 H-ЯМР (D6-ДМСО, 500 МГц) δ м. ч.: 1,82 (с, 3Н), 2,30 (с, 3Н), 3,82 (с, 3Н), 5,36 (с, 2H), 6,96 (т, J=7,04 Гц, 1H), 7,20-7,24 (м, 1H), 7,35 (д, J=8,48 Гц, 1H), 7,66 (д, J=8,81 Гц, 1H), 7,94 (д, J=8,32 Гц, 1H), 8,11 (д, J=1,92 Гц, 1H), 9,54 (д, J=7,43 Гц, 1H), 12,01 (с, 1H). 10 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 4: (сполука № 14) Натрієва сіль 3-{3-[(2,4-діоксо-3-пропіл-1,2,3,4-тетрагідрохіназолін-6-іл)карбоніл}-2метиліндолізин-1-іл]бензойної кислоти Метил 2-аміно-5-[(1-бром-2-метиліндолізин-3-іл)карбоніл]бензоат До 0,812 г (2,6 ммоль) метил 2-аміно-5-[(2-метиліндолізин-3-іл)карбоніл]бензоату в 17 мл дихлорметану додавали 0,492 г (2,73 ммоль) N-бромсукциніміду в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище перемішували протягом 2 годин, а потім гідролізували водою. Водну фазу екстрагували дихлорметаном. Отриману органічну фазу промивали насиченим водним розчином гідрокарбонату натрію і потім насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи дихлорметаном. Отримували 0,9 г твердої речовини жовтого кольору. МН+: 387, 389. Метил 2-аміно-5-({1-[3-(метоксикарбоніл)феніл]-2- метиліндолізин-3-іл}карбоніл)бензоат До 0,410 г (1,06 ммоль) метил 2-аміно-5-[(1-бром-2-метиліндолізин-3-іл)карбоніл]бензоату в 8 мл суміші DME/H2O (5/1) додавали 0,229 г (1,27 ммоль) [3-(метоксикарбоніл)феніл]боронової кислоти, 0,492 г (2,12 ммоль) дигідрофосфату калію і 0,024 г (0,02 ммоль) тетракіс(трифенілфосфін)паладію в атмосфері аргону при температурі навколишнього середовища. Реакційне середовище нагрівали при 90 °C протягом 18 годин. Реакційне середовище екстрагували дихлорметаном, промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи дихлорметаном. Отримували 309 мг твердої речовини жовтого кольору. Температура плавлення: 232 °C. МН+: 443. Метил 5-({1-[3-(метоксикарбоніл)феніл]-2-метиліндолізин-3-іл}карбоніл)-2[(пропілкарбамоїл)аміно]бензоат У інертній атмосфері при температурі навколишнього середовища, до 308 мг (0,68 ммоль) метил 2-аміно-5-({1-[3-(метоксикарбоніл)феніл]-2-метиліндолізин-3-іл}карбоніл)бензоату в 5,6 мл діоксані додавали 0,143 мг (0,47 ммоль) трифосгену, розбавленого в 2 мл діоксану. Реакційне середовище перемішували протягом 2 годин при температурі навколишнього середовища і потім додавали 0,28 мл (2,03 ммоль) триетиламіну і 0,11 мл (1,35 ммоль) нпропіламіну, розбавленого в 4 мл діоксану. Після перемішування протягом 2 годин реакційне середовище гідролізували водою. Водну фазу екстрагували дихлорметаном. Отриману органічну фазу промивали 1 н водним розчином соляної кислоти, а потім насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 215 мг твердої речовини жовтого кольору. Температура плавлення: 143 °C. МН+: 496. Натрієва сіль 3-{3-[(2,4-діоксо-3-пропіл-1,2,3,4-тетрагідрохіназолін-6-іл)карбоніл]-2метиліндолізин-1-іл}бензойної кислоти До 0,203 мг (0,39 ммоль) метил 5-({1-[3-(метоксикарбоніл)феніл]-2-метиліндолізин-3іл}карбоніл)-2-[(пропілкарбамоїл)аміно]бензоату в 4 мл метанолу додавали 0,96 мл (0,96 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище нагрівали зі зворотним холодильником протягом 7 годин. Реакційне середовище підкислювали 1 н водним розчином соляної кислоти. Отриманий осад відфільтровували, промивали водою і сушили при зниженому тиску при 50 °C протягом ночі. До 0,158 г (0,33 ммоль) отриманої твердої речовини додавали 0,31 мл (0,31 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище перемішували протягом однієї години, а потім додавали діізопропіловий ефір. Отриманий осад відфільтровували, промивали діізопропіловим ефіром, а потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 155 мг твердої речовини жовтого кольору. Температура плавлення: 361 °C. МН+: 504. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 11 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 0,88 (т, J=7,97 Гц, 3Н), 1,52-1,64 (м, 2H), 1,96 (с, 3H), 3,80-3,88 (м, 2H), 6,94 (т, J=6,78 Гц, 1H), 7,12 (д, J=8,38 Гц, 1H), 7,16-7,22 (м, 1H), 7,34 (д, J=7,58 Гц, 1H), 7,39 (т, J=758 Гц, 1H), 7,51 (д, J=8,78 Гц, 1H), 7.80-7.86 (м, 2Н), 7,92-7,95 (м, 1H), 8,17 (д, J=2 Гц, 1H), 9,33 (д, J=7,58 Гц, 1H). Приклад 5 (сполука № 24) Натрієва сіль {6-[(1-метокси-2-феніліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін3(2Н)-іл}оцтової кислоти 6-[(1-Метокси-2-феніліндолізин-3-іл)карбоніл]-2-феніл-4Н-3,1-бензоксазин-4-он До 4,22 г (14,78 ммоль) 4-оксо-2-феніл-4Н-3,1-бензоксазин-6-карбонової кислоти (описаної в WO 06/097625) в 100 мл дихлоретану додавали 2,25 мл (16,12 ммоль) триетиламіну і 3 г (13,44 ммоль) 1-метокси-2-феніліндолізину (відповідно до методу, описаного в WO 03/084956), розбавленого в 20 мл дихлоретану, в інертній атмосфері при температурі навколишнього середовища. Після перемішування протягом ночі при температурі навколишнього середовища реакційну суміш фільтрували і промивали дихлоретаном. Фільтрат промивали водою, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Залишок фільтрували через силіконовий фільтр, елююючи дихлорметаном. Отримували 4,4 г твердої речовини жовтого кольору. МН+: 473. 2-Аміно-5-[(1-метоксііндолізин-3-іл)карбоніл]бензойна кислота До 4,4 г (9,31 ммоль) 6-[(1-метокси-2-феніліндолізин-3-іл)карбоніл]-2-феніл-4Н-3,1бензоксазин-4-ону в 50 мл N-метилпіролідону додавали, при температурі навколишнього середовища, 1,56 г (27,94 ммоль) гідроксиду калію, розчиненого в 4 мл води. Реакційне середовище нагрівали при 80 °C протягом 24 годин. Реакційне середовище виливали в 1 н водний розчин соляної кислоти. Осад, що утворився, відфільтровували і промивали водою. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 3,05 г зеленої твердої речовини. Температура плавлення: 106 °C. МН+: 387. Метил 2-аміно-5-[(1-метокси-2-феніліндолізин-3-іл)карбоніл]бензоат До 3,03 г (7,84 ммоль) 2-аміно-5-[(1-метоксііндолізин-3-іл)карбоніл]бензойної кислоти в 50 мл ДМФ додавали 0,54 мл (8,63 ммоль) метилйодиду і 2,8 г (8,63 ммоль) карбонату цезію в інертній атмосфері при температурі навколишнього середовища. Після перемішування протягом 3 годин при температурі навколишнього середовища додавали воду. Осад, що утворився, відфільтровували, промивали водою, а потім сушили при зниженому тиску при 50 °C протягом ночі. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи дихлорметаном. Отримували 1,98 г твердої речовини жовтого кольору. МН+: 401. Етил {6-[(1-метокси-2-феніліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)іл}ацетат До 0,4 г (1 ммоль) метил 2-аміно-5-[(1-метоксиіндолізин-3-іл)карбоніл]бензоату в 50 мл діоксану додавали 0,208 г (0,7 ммоль) трифосгену, розбавленого в 15 мл діоксану, в інертній атмосфері при температурі навколишнього середовища. Після перемішування протягом 1 години додавали 0,279 г (2 ммоль) етилгліцинату і 0,70 мл (5 ммоль) триетиламіну. Після перемішування при температурі навколишнього середовища протягом 2 годин реакційне середовище гідролізували водою. Після того, як суміш витримували протягом ночі при температурі навколишнього середовища, водну фазу екстрагували дихлорметаном. Отриману органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 0,362 г твердої речовини жовтого кольору. Температура плавлення: 221 °C. МН+=498. Натрієва сіль {6-[(1-метокси-2-феніліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін3(2Н)-іл}оцтової кислоти До 0,312 мг (0,63 ммоль) етил {6-[(1-метокси-2-феніліндолізин-3-іл)карбоніл]-2,4- діоксо-1,4дигідрохіназолін-3(2H)-іл}ацетату в 10 мл метанолу додавали при температурі навколишнього середовища 0,75 мл (0,75 ммоль) 1 н водного розчину гідроксиду натрію. Реакційне середовище нагрівали зі зворотним холодильником протягом 7 годин. Реакційне середовище підкислювали 1 н водним розчином соляної кислоти. Отриманий осад відфільтровували, промивали водою і сушили при зниженому тиску при 50 °C протягом ночі. 12 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 До 0,250 г (0,53 ммоль) отриманої твердої речовини додавали, при температурі навколишнього середовища, 0,52 мл (0,52 ммоль) 1 н водного розчину гідроксиду натрію. Реакційне середовище перемішували протягом однієї години і потім додавали діізопропіловий ефір. Отриманий осад відфільтровували, промивали діізопропіловим ефіром, а потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 0,237 г твердої речовини жовтого кольору. Температура плавлення: 337 °C. МН+: 470. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 3,64 (с, 3Н), 4,07 (с, 2H), 6,70 (д, J=8,55 Гц, 1H), 7,00-7,1 (м, 6H), 7,21-7,27 (м, 1H), 7,49 (д, J=8,37 Гц, 1Н), 7,76 (д, J=9,07 Гц, 1H), 7,88 (д, J=1,92 Гц, 1Н), 9,55 (д, J=7,15 Гц, 1H), 1,27 (с, 1H). Приклад 6 (сполука № 34) Етил ({6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2H)іл}окси)ацетат Метил 5-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-{[(проп-2-ен-1ілокси)карбамоїл]аміно}бензоат До 0,4 г (1,18 ммоль) метил 2-аміно-5-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]бензоату в 10 мл діоксану додавали, в інертній атмосфері при температурі навколишнього середовища, 0,251 г (0,83 ммоль) трифосгену, розбавленого в 3 мл діоксану. Після перемішування протягом 2,5 годин додавали 0,267 г (2,36 ммоль) О-проп-2-ен-1-ілгідроксиламіну і 0,82 мл (5,91 ммоль) триетиламіну. Реакційне середовище перемішували протягом однієї години, а потім гідролізували водою. Водну фазу екстрагували дихлорметаном. Отриману органічну фазу промивали 1 н водним розчином соляної кислоти і насиченим водним розчином хлориду натрію, а потім сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Отримували 0,581 г твердої речовини жовтого кольору. МН+: 438 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-3-(проп-2-ен-1-ілокси)хіназолін-2,4(1H, 3Н)діон До 0,370 мг (0,85 ммоль) метил 5-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-{[(проп-2-ен1-ілокси)карбамоїл]аміно}бензоату в 5 мл метанолу додавали 1,27 мл (1,27 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище нагрівали зі зворотним холодильником протягом 1 години. Реакційне середовище підкислювали 1 н водним розчином соляної кислоти. Водну фазу екстрагували етилацетатом. Органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи дихлорметаном. Отримували 0,293 г твердої речовини жовтого кольору. Температура плавлення: 258 °C. МН+: 406. 3-Гідрокси-6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]хіназолін-2,4(1H, 3Н)-діон До 0,276 г (0,65 ммоль) 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-3-(проп-2-ен-1ілокси)хіназолін-2,4(1H, 3H)-діону в 7 мл дихлорметану додавали, в атмосфері інертного газу при 0 °C, 0,15 мл (1,18 ммоль) фенілсилану і 0,030 г (0,03 ммоль) тетракіс(трифенілфосфін)паладію. Реакційне середовище перемішували протягом 4 годин при температурі навколишнього середовища і потім фільтрували. Осад промивали дихлорметаном. Тверду речовину розчиняли в 1 н водному розчині гідроксиду натрію. Після додавання 1 н водного розчину соляної кислоти, отриманий осад відфільтровували, промивали водою і сушили при зниженому тиску протягом ночі при 50 °C. Отримували 0,208 мг твердої речовини жовтого кольору. Температура плавлення: 300 °C. МН+: 366. Етил ({6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2,4-діоксо-1,4-дигідрохіназолін-3(2Н)іл}окси)ацетату До 0,36 г (0,99 ммоль) 3-окси-6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]хіназолін-2,4(1H, 3Н)-діону в 12,5 мл етанолу додавали 0,11 мл (0,99 ммоль) етилбромацетату, а потім 0,14 мл (0,99 ммоль) триетиламіну, при температурі навколишнього середовища в інертній атмосфері. Реакційне середовище перемішували протягом 18 годин і потім додавали 0,14 мл (0,99 ммоль) триетиламіну і 0,11 мл (0,99 ммоль) етилбромацетату. Після перемішування протягом 18 годин при температурі навколишнього середовища реакційну суміш концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол. Отримували 217 мг жовтого порошку. 13 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 МН+=452. Температура плавлення = 230 °C. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,05-1,25 (т, 3Н), 1,82 (с, 3Н), 3,64 (с, 3H), 4,16-4,22 (кв, 2H), 4,77 (с, 2Н), 6,97-6,97 (т, 1H), 7,20-7,24 (т, 1H), 7,28-7,30 (д, 1H), 7,65-7,67 (д, 1H), 7,88-7,91 (д, 1H), 8,08 (с, 1H), 9,52-9,54 (г, 1H), 11,9 (с, 1H). Приклад 7 (сполука № 51) 3-Аміно-6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]хіназолін-2,4(1H, 3Н)-діон До 0,2 г (0,6 ммоль) метил 2-аміно-5-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]бензоату в 10 мл діоксану додавали 0,123 г (0,41 ммоль) трифосгену в інертній атмосфері при температурі навколишнього середовища. Після перемішування протягом 10 хвилин додавали 58 мкл (1,2 ммоль) гідрату гідразину і 0,4 мл (3 ммоль) триетиламіну. Реакційне середовище перемішували протягом 3 годин, а потім гідролізували водою. Водну фазу екстрагували етилацетатом. Отриману органічну фазу сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 16 мг твердої речовини жовтого кольору. Температура плавлення: 220 °C. МН+=365. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,81 (с, 3Н), 3,82 (с, 3Н), 5,52 (с, 2H), 6,95 (т, J=6,95 Гц, 1H), 7,18-7,24 (м, 1H), 7,31 (д, J=8,69 Гц, 1H), 7,66 (д, J=8,69 Гц, 1Н), 7,88 (д, J=8,69 Гц, 1H), 8,09 (д, J=2,09 Гц, 1H), 9,52 (д, J=6,95 Гц, 1H), 1,90 (с, 1H). Приклад 8 (сполука № 15) 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-2-метилхіназолін-4(3Н)-он 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4H-3,1-бензоксазин-4-он 0,100 г (0,31 ммоль) 2-аміно-5-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]бензойної кислоти (приклад 150, описаний в WO 03/084956) в 1 мл оцтового ангідриду нагрівали зі зворотним холодильником протягом 3 годин. Реакційне середовище концентрували при зниженому тиску. Отримували 0,107 г твердої речовини жовтого кольору. Температура плавлення: 218 °C. 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-2-метилхіназолін-4(3Н)-он 0,100 г (0,29 ммоль) 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4H-3,1бензоксазин-4-ону в 2 мл 20 %-ного водного розчину аміаку нагрівали протягом 2 годин при 50 °C і потім гідролізували 3 мл 10 %-ного розчину гідроксиду натрію і доводили до 50 °C протягом 2 годин. Реакційне середовище підкислювали 1 н водним розчином соляної кислоти до значення рН=9. Отриманий осад відфільтровували, промивали водою і сушили при зниженому тиску при 40 °C протягом ночі. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 67 мг твердої речовини жовтого кольору. Температура плавлення: 290 °C. МН+: 348. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,75 (с, 3Н), 2,39 (с, 3Н), 3,82 (с, 3Н), 6,98 (т, J=7,07 Гц, 1H), 7,22-7,27 (м, 1H), 7,66-7,70 (м, 2H), 7,94 (д, J=8,19 Гц, 1H), 8,20 (д, J=2,23 Гц, 1H), 9,61 (д, J=7,07 Гц, 1H), 12,39 (с, 1H). Приклад 9 (сполука № 43) Натрієва сіль 3-{2-метил-3-[(2-метил-4-оксо-3,4-дигідрохіназолін-6-іл)карбоніл]індолізин-1іл}бензойної кислоти 2-Аміно-5-[(1-бром-2-метиліндолізин-3-іл)карбоніл]бензойна кислота До 1,91 г (4,69 ммоль) метил 2-аміно-5-[(1-бром-2-метиліндолізин-3-іл)карбоніл]бензоату в 30 мл метанолу додавали, при температурі навколишнього середовища, 4,92 мл (4,92 ммоль) 1 н водного розчину гідроксиду натрію. Реакційне середовище нагрівали зі зворотним холодильником протягом 10 годин і потім гідролізували 1 н водним розчином соляної кислоти. Водну фазу екстрагували етилацетатом. Отриману органічну фазу промивали водою, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Отриману тверду речовину промивали діізопропіловим ефіром і дихлорметаном, і сушили при зниженому тиску протягом ночі при 50 °C. Отримували 1,55 г твердої речовини жовтого кольору. МН+: 374 Температура плавлення: 230 °C. 6-[(1-Бром-2-метиліндолізин-3-іл)карбоніл]-2-метилхіназолін-4(3Н)-он 14 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 0,450 г (1,15 ммоль) 2-аміно-5-[(1-бром-2-метиліндолізин-3-іл)карбоніл]бензойної кислоти в 3,79 мл оцтового ангідриду нагрівали зі зворотним холодильником протягом 1,5 години в інертній атмосфері. Реакційне середовище концентрували при зниженому тиску. 0,457 г (1,15 ммоль) твердої речовини, отриманої в 8 мл 0,5 н водного розчину аміаку в діоксані, нагрівали при 50 °C протягом 1 години. Після додавання діізопропілового ефіру осад, що утворився, відфільтровували, промивали водою, а потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 182 мг твердої речовини жовтого кольору. МН+: 348. Метил 3-{2-метил-3-[(2-метил-4-оксо-3,4-дигідрохіназолін-6-ил)карбоніл]індолізин-1ил}бензоат До 0,256 г (0,65 ммоль) 6-[(1-бром-2-метиліндолізин-3-іл)карбоніл]-2-метилхіназолін-4(3H)ону в 9 мл ДМФ додавали 0,139 г (0,78 ммоль) [3-(метоксикарбоніл)феніл]боронової кислоти, 0,321 г (1,29 ммоль) дигідрату фосфату калію, розчиненого в 0,81 мл води, і 0,0149 г (0,01 ммоль) тетракіс(трифенілфосфін)паладію в атмосфері аргону при температурі навколишнього середовища. Реакційне середовище нагрівали в мікрохвильовій печі при 150 °C протягом 15 хвилин. Після розбавлення етилацетатом, органічну фазу промивали 1 н водним розчином соляної кислоти, а потім насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/2). Отримували 172 мг твердої речовини жовтого кольору. Температура плавлення: 232 °C. МН+: 452. Натрієва сіль 3-{2-метил-3-[(2-метил-4-оксо-3,4-дигідрохіназолін-6-іл)карбоніл]індолізин-1іл}бензойної кислоти До 0,171 г (0,38 ммоль) метил 3-{2-метил-3-[(2-метил-4-оксо-3,4-дигідрохіназолін-6іл)карбоніл]індолізин-1-іл}бензоату в 4 мл метанолу додавали 0,45 мл (0,45 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище нагрівали зі зворотним холодильником протягом 10 годин і потім гідролізували 1 н водним розчином соляної кислоти. Водну фазу екстрагували етилацетатом. Отриману органічну фазу промивали водою, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Отриману тверду речовину промивали водою і потім сушили при зниженому тиску протягом ночі при 50 °C. До 0,056 г отриманої твердої речовини додавали 0,12 мл (0,12 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища, в 4 мл метанолу. Реакційне середовище перемішували протягом однієї години, а потім додавали діізопропіловий ефір. Отриманий осад відфільтровували, промивали діізопропіловим ефіром, а потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 58 мг твердої речовини жовтого кольору. Температура плавлення: 344 °C. МН+: 438. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,83 (с, 3Н), 2,40 (с, 3Н), 7,04 (т, J=6,70 Гц, 1H), 7,25-7,44 (м, 3H), 7,55 (д, J=8,04 Гц, 1H), 7,70 (д, J=8,71 Гц, 1H), 7,85 (д, J=6,70 Гц, 1H), 7,92 (с, 1H), 8,04 (д, J=8,04 Гц, 1H), 8,31 (с, 1H), 9,59 (д, J=6,70 Гц, 1H), 12,53 (с, 1H). Приклад 10 (сполука № 48) 6-{[1-(2-Метоксіетокси)-2-метиліндолізин-3-іл]карбоніл}-3-пропілхіназолін-2,4(1H, 3Н)діон Метил 2-аміно-5-[(1-гідрокси-2-метиліндолізин-3-іл)карбоніл]бензоат До 0,8 г (1,93 ммоль) метил 2-аміно-5-{[1-(бензилокси)-2-метиліндолізин-3іл]карбоніл}бензоату в 30 мл ДМФ додавали 0,365 мг (5,79 ммоль) форміату амонію і 0,102 г (0,1 ммоль) паладію на вугіллі (10 %) при температурі навколишнього середовища в інертній атмосфері. Реакційне середовище перемішували протягом 3 годин при температурі навколишнього середовища і потім фільтрували. Паладій промивали етилацетатом. Органічну фазу промивали водою, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Отримували масло зеленого кольору. МН+: 325. Метил 2-аміно-5-{[1-(2-метоксіетокси)-2-метиліндолізин-3-іл]карбоніл}бензоат До 0,313 г (0,97 ммоль) метил 2-аміно-5-{[1-гідрокси-2-метиліндолізин-3-іл]карбоніл}бензоату в 10 мл ДМФ додавали 0,161 г (1,16 ммоль) 1-бром-2-метоксіетану і 0,359 мг (1,16 ммоль) карбонату цезію в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище перемішували протягом 24 годин при температурі навколишнього середовища, 15 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідролізували водою, а потім підкислювали 1 н водним розчином соляної кислоти. Водну фазу екстрагували етилацетатом. Отриману органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 150 мг жовтого масла. МН+: 383 Метил 5-{[1-(2-Метоксіетокси)-2-метиліндолізин-3-іл]карбоніл}-2[(пропілкарбамоїл)аміно]бензоат До 0,2 г (0,52 ммоль) метил 2-аміно-5-{[1-(2-метоксіетокси)-2-метиліндолізин-3іл]карбоніл}бензоату в 5 мл діоксану додавали 0,108 г (0,37 ммоль) трифосгену, розбавленого в 1 мл діоксану, в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище перемішували протягом 1 години при температурі навколишнього середовища, а потім додавали 0,22 мл (1,57 ммоль) триетиламіну і 0,09 мл (1,05 ммоль) н-пропіламіну. Після перемішування протягом 18 годин реакційну суміш гідролізували водою. Водну фазу екстрагували дихлорметаном. Отриману органічну фазу сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Отриману тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 170 мг твердої речовини жовтого кольору. Температура плавлення: 125 °C. МН+: 468. 6-{[1(2-Метоксіетокси)-2-метиліндолізин-3-іл]карбоніл}-3-пропілхіназолін-2,4(1H, 3Н)-діон До 0,17 г (0,36 ммоль) метил 5-{[1-(2-метоксіетокси)-2-метиліндолізин-3-іл]карбоніл}-2[(пропілкарбамоїл)аміно]бензоату в 5 мл метанолу додавали 0,44 мл (0,44 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище нагрівали зі зворотним холодильником протягом 7 годин. Реакційне середовище підкислювали 1 н водним розчином соляної кислоти. Отриманий осад відфільтровували, промивали водою і сушили при зниженому тиску при 50 °C протягом ночі. Отримували 79 мг твердої речовини жовтого кольору. Температура плавлення: 215 °C. МН+: 436. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 0,89 (т, J=7,17 Гц, 3Н), 1,55-1,67 (м, 2H), 1,82 (с, 3Н), 3,31 (с, 3H), 3,56-3,61 (м, 2Н), 3,83-3,90 (м, 2H), 4,05-4,10 (м, 2H), 6,95 (т, J=7,17 Гц, 1H), 7,19-7,24 (м, 1H), 7,27 (д, J=8,44 Гц, 1H), 7,63 (д, J=8,86 Гц, 1H), 7,87 (д, J=8,44 Гц, 1H), 8,10 (д, J=2,1 1 Гц, 1H), 9,51 (д, J=7,17 Гц, 1H), 1,7 (с, 1H). Приклад 11 (сполука № 62) Натрієва сіль 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4дигідрохінолін-3-карбонової кислоти (1-Метокси-2-метиліндолізин-3-іл)(4-нітрофеніл)метанон До 1,7 г (10,77 ммоль) 1-метокси-2-метиліндолізину в 15 мл дихлоретану додавали 1,8 мл (12,92 ммоль) триетиламіну, при температурі навколишнього середовища в інертній атмосфері, і потім, по краплях, по 2,2 г (11,85 ммоль) хлориду 4-нітробензойної кислоти. Реакційне середовище перемішували протягом 30 хвилин при температурі навколишнього середовища, гідролізували насиченим водним розчином гідрокарбонату натрію і потім екстрагували дихлорметаном. Органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок промивали діетиловим ефіром. Отримували 3 г твердої речовини оранжевого кольору. MH+: 311. Температура плавлення: 151 °C. (4-Амінофеніл)(1-метокси-2-метиліндолізин-3-іл)метанон До 2,97 г (9,57 ммоль) (1-метокси-2-метиліндолізин-3-іл)(4-нітрофеніл)метанону в 120 мл 2/1 суміші води і етанолу додавали 1,93 г (34,46 ммоль) заліза і 8,21 мл (143,57 ммоль) крижаної оцтової кислоти. Реакційне середовище нагрівали при 80 °C протягом 3 годин. Реакційне середовище екстрагували етилацетатом. Органічну фазу промивали насиченим водним розчином гідрокарбонату натрію і потім насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 2,58 г твердої речовини жовтого кольору. МН+: 281. 16 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 Етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3-карбоксилат До 0,4 г (1,43 ммоль) (4-амінофеніл)(1-метокси-2-метиліндолізин-3-іл)метанону в 6 мл толуолу додавали 0,36 мл діетилетоксиметиленмалонату в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище нагрівали при 110 °C протягом 1 год. 45 і потім концентрували при зниженому тиску. Отриманий залишок розчиняли в 8,2 мл дифенілового ефіру, і потім нагрівали при 230 °C протягом 1 год. 20. Після додавання діізопропілового ефіру і пентану при температурі навколишнього середовища, осад відфільтровували і промивали пентаном. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 142 мг жовтого порошку. Температура плавлення: 271 °C. МН+: 405. Етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4-дигідрохінолін-3карбоксилат До 10 г (23,24 ммоль) етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4дигідрохінолін-3-карбоксилату в 100 мл ДМФ додавали 3,8 г (27,89 ммоль) карбонату калію і 1,74 мл (27,89 ммоль) метилйодиду при температурі навколишнього середовища в інертній атмосфері. Реакційне середовище нагрівали при 90 °C протягом 1 год. 30 хв. Реакційне середовище фільтрували через фільтр з тальку, розбавляли дихлорметаном, а потім промивали водою. Органічну фазу сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 9,1 г твердої речовини жовтого кольору. Температура плавлення: 258 °C. МН+: 419. Натрієва сіль 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4дигідрохінолін-3-карбонової кислоти До 0,348 г (0,83 ммоль) етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо1,4-дигідрохінолін-3-карбоксилату в 4 мл суміші трет-бутанолу і води (1/1) додавали 0,34 мл (0,34 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище нагрівали зі зворотним холодильником протягом 2 годин. Реакційне середовище підкислювали 1 н водним розчином соляної кислоти. Отриманий осад очищали колонковою хроматографією на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). До 0,231 г отриманої твердої речовини в 4 мл метанолу додавали 0,56 мл (0,56 ммоль) 1 н водного розчину гідроксиду натрію. Реакційне середовище перемішували протягом однієї години і потім додавали діетиловий ефір. Отриманий осад відфільтровували, промивали діетиловим ефіром і потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 265 мг твердої речовини жовтого кольору. Температура плавлення: 258 °C. МН+: 391. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,75 (с, 3H), 3,8 (с, 3Н), 3,96 (с, 3Н), 6,96 (т, J=6,43 Гц, 1H), 7,22 (т, J=6,89, 1H), 7,66 (д, J=8,72 Гц, 1Н), 7,82 (д, J=8,27 Гц, 1H), 7,96 (д, J=8,27 Гц, 1Н), 8,45 (с, 1H), 8,69 (с, 1H), 9,57 (д, J=7,35 Гц, 1H). Приклад 12 (сполука № 73) Натрієва сіль 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4-оксо-1,4дигідрохінолін-3-карбонової кислоти 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-1-проп-2-ен-1-іл-2Н-3,1-бензоксазин-2,4(1H)діон До 1 г (2,85 ммоль) 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2H-3,1-бензоксазин2,4(1H)-діону в 15 мл ДМФ додавали 0,5 мл (5,71 ммоль) алілброміду і 0,19 г (4,28 ммоль) гідриду натрію при 60 % в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище перемішували протягом 2 годин при температурі навколишнього середовища і потім концентрували при зниженому тиску. Після додавання льоду до залишку, осад, що утворився, відфільтровували, промивали водою і сушили при зниженому тиску при 50 °C протягом ночі. Отримували 0,773 г твердої речовини жовтого кольору. МН+: 391. Етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4-оксо-1-проп-2-ен-1-іл-1,4дигідрохінолін-3-карбоксилат 17 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 До 0,66 г (1,52 ммоль) 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-1-проп-2-ен-1-іл-2Н-3,1бензоксазин-2,4(1H)-діону в 30 мл ДМФ додавали 0,49 мл (3,80 ммоль) етилацетоацетату, розбавленого в 20 мл безводного ДМФ, в інертній атмосфері при температурі навколишнього середовища. Реакційну суміш перемішували при температурі навколишнього середовища протягом ночі і потім екстрагували етилацетатом. Отриману органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і потім концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 0,441 г твердої речовини жовтого кольору. Температура плавлення: 101 °C. МН+: 459. Етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4-оксо-1,4-дигідрохінолін-3карбоксилат До 0,307 (0,67 моль) етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4-оксо-1проп-2-ен-1-іл-1,4-дигідрохінолін-3-карбоксилату в 12 мл суміші ДМФ трет-бутанолу і води (1/1) додавали 6,7 мг (0,02 ммоль) дихлор(2,6,10-додекатриєн)-1,12-діїлу рутенію (IV) при температурі навколишнього середовища в інертній атмосфері. Реакційне середовище нагрівали в мікрохвильовій печі протягом 30 хвилин при 120 °C і потім екстрагували етилацетатом. Отриману органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Отриманий осад очищали колонковою хроматографією на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). Отримували 94 мг твердої речовини жовтого кольору. Температура плавлення: 257 °C. МН+: 419. Натрієва сіль 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4-оксо-1,4дигідрохінолін-3-карбонової кислоти До 0,066 г (0,16 ммоль) етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-2-метил-4-оксо1,4-дигідрохінолін-3-карбоксилату в 4 мл етанолу додавали 0,32 мл (0,32 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище нагрівали зі зворотним холодильником протягом 2 годин. Реакційне середовище підкислювали 1 н водним розчином соляної кислоти. Отриманий осад очищали колонковою хроматографією на силікагелі, елююючи сумішшю дихлорметан/метанол (95/5). До 0,019 г отриманої твердої речовини в 2 мл метанолу додавали 0,04 мл (0,04 ммоль) 1 н водного розчину гідроксиду натрію. Реакційне середовище перемішували протягом однієї години і потім додавали діетиловий ефір. Отриманий осад відфільтровували, промивали діетиловим ефіром і потім сушили при зниженому тиску при 50 °C протягом ночі. Отримували 16 мг твердої речовини жовтого кольору. МН+: 391. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,79 (с, 3Н), 2,76 (с, 3Н), 3,83 (с, 3Н), 6,91 (т, J=6,28 Гц, 1H), 7,17 (т, J=7,70 Гц, 1H), 7,61-7,77 (м, 3H), 8,31 (с, 1Н), 9,50 (д, J=6,56 Гц, 1H). Приклад 13 (сполука № 96) 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-N-метил-4-оксо-1,4-дигідрохінолін-3карбоксамід 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3-карбонова кислота До 3 г (7,42 ммоль) етил 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4дигідрохінолін-3-карбоксилату в 36 мл суміші трет-бутанолу і води (1/1) додавали 3,07 мл (37,09 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище нагрівали зі зворотним холодильником протягом 2 годин. Реакційне середовище підкислювали 1 н водним розчином соляної кислоти. Отриманий осад промивали етилацетатом, метанолом і потім водою і сушили при зниженому тиску протягом ночі при 50 °C. Отримували 1,8 г твердої речовини жовто-зеленого кольору. Одночасно органічну фазу промивали насиченим розчином хлориду натрію, сушили над сульфатом натрію і концентрували при зниженому тиску. Отриманий залишок промивали ефіром і сушили при зниженому тиску протягом ночі при 50 °C. Отримували 0,85 г твердої речовини жовтого кольору. Температура плавлення: 289 °C. МН+: 377. 18 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 6-[(1-Метокси-2-метиліндолізин-3-іл)карбоніл]-N-метил-4-оксо-1,4-дигідрохінолін-3карбоксамід До 1 г (2,66 ммоль) 6-[(1-метокси-2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін3-карбонової кислоти в 23 мл безводного ДМФ додавали 0,36 г (5,31 ммоль) гідрохлориду метиламіну, 1,3 г (3,99 ммоль) TOTU і 1,37 г (10,63 ммоль) DIEA. Реакційну суміш перемішували при температурі навколишнього середовища в атмосфері азоту протягом 8 годин. До реакційного середовища додавали 0,36 г (5,33 ммоль) гідрохлориду метиламіну. Через 18 год. при температурі навколишнього середовища реакційну суміш гідролізували 1 н розчином HCl і потім екстрагували етилацетатом. Органічну фазу промивали насиченим розчином хлориду натрію, сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 0,06 г твердої речовини жовтого кольору. Температура плавлення: 324 °C. МН+=390. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,75 (с, 3H), 2,86 (д, J=4,8 Гц, 3H), 3,82 (с, 3Н), 6,99 (тд, J=6,9, 1,3 Гц, 1H), 7,25 (ддд, J=8,8, 6,8, 0,9 Гц, 1H), 7,68 (д, J=8,8 Гц, 1H), 7,81 (д, J=8,5 Гц, 1H), 7,96 (дд, J=8,6, 2,0 Гц, 1H), 8,40 (д, J=1,9 Гц, 1H), 8,80 (с, 1H), 9,61 (д, J=7,1 Гц, 1H), 9,70-9,82 (м, 1H), 12,88 (ушир.с, 1H). Приклад 14 (сполука № 105) N-1-Диметил-6-[(2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3-карбоксамід (2-Метиліндолізин-3-іл)(4-нітрофеніл)метанон До 3,56 г (27,14 ммоль) 2-метиліндолізину в 15 мл дихлоретану додавали 4,54 мл (32,52 ммоль) триетиламіну, при температурі навколишнього середовища в інертній атмосфері, а потім по краплях 5,53 г (29,85 ммоль) хлориду 4-нітробензойної кислоти. Реакційне середовище перемішували протягом 18 год. при температурі навколишнього середовища, гідролізували насиченим водним розчином гідрокарбонату натрію і потім екстрагували дихлорметаном. Органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок промивали діетиловим ефіром. Отримували 5,69 г твердої речовини жовтого кольору. МН+: 281. Температура плавлення: 149 °C. (4-Амінофеніл)(2-метиліндолізин-3-іл)метанон До 6,74 г (24,05 ммоль) (2-метиліндолізин-3-іл)(4-нітрофеніл)метанону в 120 мл 2/1 суміші води і етанолу додавали 5,66 г (86,57 ммоль) цинку і 20,63 мл (360,71 ммоль) крижаної оцтової кислоти. Реакційне середовище нагрівали при 80 °C протягом 4 годин. Додавали 0,57 г (8,7 ммоль) цинку і 2,06 мл крижаної оцтової кислоти. Кип'ятіння зі зворотним холодильником виконували протягом 1 години. Реакційну суміш відфільтровували при температурі навколишнього середовища. Отриманий залишок промивали етилацетатом і метил-ТГФ. Органічну фазу промивали насиченим водним розчином гідрокарбонату натрію і потім насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 4,9 г твердої речовини жовтого кольору. МН+: 251. Температура плавлення: 186 °C. Етил 6-[(2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3-карбоксилат До 1,83 г (6,8 ммоль) (4-амінофеніл)(2-метиліндолізин-3-іл)метанону в 23 мл толуолу додавали 1,69 мл діетилетоксиметиленмалонату в інертній атмосфері при температурі навколишнього середовища. Реакційне середовище нагрівали при 110 °C протягом 1 год. 45 і потім концентрували при зниженому тиску. Отриманий залишок розчиняли в 45 мл дифенілового ефіру і потім нагрівали при 230 °C протягом 30 хвилин. Після додавання діізопропілового ефіру при температурі навколишнього середовища, осад відфільтровували, промивали діізопропіловим ефіром, метанолом, а потім дихлорметаном і сушили при зниженому тиску при 50 °C протягом ночі. Отримували 1,2 г порошку жовтого кольору. МН+: 375. Температура плавлення: 287 °C. Етил 6-[(2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4-дигідрохінолін-3-карбоксилат До 3,73 г (9,27 ммоль) етил 6-[(2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3карбоксилату в 100 мл ДМФ додавали 1,53 г (11,12 ммоль) карбонату калію і 0,69 мл (11,12 ммоль) метилйодиду при температурі навколишнього середовища в інертній атмосфері. 19 UA 109013 C2 5 10 15 20 25 30 35 40 45 50 55 60 Реакційне середовище нагрівали при 90 °C протягом 2 годин. Додавали 0,384 г (2,78 ммоль) карбонату калію і 0,173 мл (2,78 ммоль) метилйодиду, а потім нагрівання продовжували протягом 40 хвилин. Реакційне середовище гідролізували водою і потім екстрагували етилацетатом і дихлорметаном. Органічну фазу промивали насиченим розчином хлориду натрію, сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 3,15 г твердої речовини жовтого кольору. Температура плавлення: 232 °C. МН+: 389. Етил 6-[(2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4-дигідрохінолін-3-карбоксилат До 0,5 г (1,29 ммоль) етил 6-[(2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4дигідрохінолін-3-карбоксилату в 9 мл суміші трет-бутанолу і води (1/1) додавали 0,27 мл (3,22 ммоль) 1 н водного розчину гідроксиду натрію при температурі навколишнього середовища. Реакційне середовище нагрівали зі зворотним холодильником протягом 1 години, підкислювали 1н водним розчином соляної кислоти при температурі навколишнього середовища, а потім екстрагували дихлорметаном. Органічну фазу промивали водою, сушили над сульфатом натрію і концентрували при зниженому тиску. Отриманий залишок промивали ефіром і сушили при зниженому тиску при 50 °C. Отримували 448 мг твердої речовини жовтого кольору. Температура плавлення: 308 °C. МН+: 361. N-1-Диметил-6-[(2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4-дигідрохінолін-3-карбоксамід До 0,44 г (1,22 ммоль) 6-[(2-метиліндолізин-3-іл)карбоніл]-1-метил-4-оксо-1,4-дигідрохінолін3-карбонової кислоти в 7 мл безводного ДМФ додавали 0,16 г (2,44 ммоль) гідрохлориду метиламіну, 0,6 г (1,59 ммоль) HBTU і 0,74 мл (4,27 ммоль) DIEA. Реакційне середовище перемішували при температурі навколишнього середовища в атмосфері азоту протягом 5 год. 30 хв. У реакційне середовище додавали 0,16 г (2,44 ммоль) гідрохлориду метиламіну, 602 мг (1,29 ммоль) HBTU і 0,74 мл (4,27 ммоль) DIEA. Через 48 год. при температурі навколишнього середовища реакційну суміш гідролізували насиченим розчином гідрокарбонату натрію і потім екстрагували дихлорметаном. Органічну фазу промивали насиченим розчином хлориду натрію, сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 0,273 г твердої речовини жовтого кольору. Температура плавлення: 328 °C. МН+=374. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,85 (с, 3H), 2,86 (д, J=4,8 Гц, 3H), 4,08 (с, 3Н), 6,53 (с, 1H), 7,01 (тд, J=6,9, 1,3 Гц, 1H), 7,247,33 (м, 1H), 7,67 (д, J=8,8 Гц, 1H), 7,96 (д, J=8,8 Гц, 1H), 8,06 (дд, J=8,7, 2,1 Гц, 1H), 8,48 (д, J=2,0 Гц, 1H), 8,92 (с, 1H), 9,61 (д, J=7,0 Гц, 1H), 9,67-9,76 (м, 1H). Приклад 15 (сполука № 106) Гідрохлорид N-1-диметил-6-{[2-метил-1-(піридин-4-іл)індолізиніл-3-іл]карбоніл}-4-оксо-1,4дигідрохінолін-3-карбоксаміду 6-[(1-Бром-2-метиліндолізин-3-іл)карбоніл]-N-1-диметил-4-оксо-1,4-дигідрохінолін-3карбоксамід До 0,188 г (0,5 ммоль) N-1-диметил-6-[(2-метиліндолізин-3-іл)карбоніл]-4-оксо-1,4дигідрохінолін-3-карбоксаміду в 6 мл дихлорметану додавали 0,108 мг (0,6 ммоль) Nбромсукциніміду при температурі навколишнього середовища в атмосфері азоту. Після перемішування протягом 3 год. при температурі навколишнього середовища реакційне середовище гідролізували насиченим розчином гідрокарбонату натрію і потім екстрагували дихлорметаном. Органічну фазу промивали насиченим розчином хлориду натрію, сушили над сульфатом натрію і потім концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 0,217 г твердої речовини жовтого кольору. МН+=453. N-1-Диметил-6-{[2-метил-1-(піридин-4-іл)індолізиніл-3-іл]карбоніл}-4-оксо-1,4-дигідрохінолін3-карбоксамід До 0,108 г (0,24 ммоль) 6-[(1-бром-2-метиліндолізин-3-іл)карбоніл]-N-1-диметил-4-оксо-1,4дигідрохінолін-3-карбоксаміду в 2,5 мл ДМФ додавали 0,061 г (0,29 ммоль) 4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)піридину, 0,178 г (0,72 ммоль) дигідрофосфату калію і 0,0055 г (0,004 ммоль) тетракіс(трифенілфосфін)паладію в атмосфері аргону при температурі навколишнього середовища. Реакційне середовище нагрівали в мікрохвильовій печі протягом 20 UA 109013 C2 5 10 15 20 15 хвилин при 150 °C. Реакційне середовище фільтрували через тальк. Отриманий залишок промивали дихлорметаном і метанолом. Органічну фазу концентрували при зниженому тиску. Отриманий залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи сумішшю дихлорметан/метанол (90/10). Отримували 53 мг твердої речовини жовтого кольору. Цю тверду речовину обробляли 2 мл метанолу. Додавали 0,16 мл (0,16 ммоль) 1н розчини HCl при температурі навколишнього середовища в атмосфері азоту. Після перемішування протягом 5 хвилин, додавали ефір. Отриманий осад відфільтровували, промивали ефіром і сушили при зниженому тиску при 50 °C протягом ночі. Отримували 55 мг твердої речовини жовтого кольору. Температура плавлення: 228 °C. МН+=451. 1 H-ЯМР (D6-ДМСО, 400 МГц) δ м. ч.: 1,99 (с, 3Н), 2,87 (д, J=4,7 Гц, 3H), 4,09 (с, 3Н), 7,20 (т, J=6,5 Гц, 1H), 7,48-7,55 (м, 1H) 7,93 (д, J=9,0 Гц, 1H), 7,99 (д, J=8,9 Гц, 1H), 8,02 (д, J=5,6 Гц, 2H), 8,19 (дд, J=8,8, 2,0 Гц, 1H) 8,65 (д, J=2,0 Гц, 1H), 8,83 (д, J=6,5 Гц, 2H), 8,94 (с, 1H), 9,46 (д, J=7,0 Гц, 1H), 9,65-9,74 (м, 1H). У таблиці, яка приведена нижче, представлені хімічні структури і фізичні властивості деяких сполук відповідно до винаходу. У цій таблиці: - Me і Et представляють, відповідно, метилову і етилову групи; - Хвиляста лінія означає зв'язок, приєднаний до іншої частини молекули; - Mp представляє точку плавлення сполуки, виражену в градусах Цельсія; + - M+Н являє собою масу сполуки, отриману з допомогою LC-MS (рідинна хроматографія мас-спектроскопія). феніл Таблиця 21 UA 109013 C2 22 UA 109013 C2 23 UA 109013 C2 24 UA 109013 C2 25 UA 109013 C2 26 UA 109013 C2 27 UA 109013 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIndolizine derivatives, process for the preparation thereof and therapeutic use thereof
Автори англійськоюAlcouffe, Chantal, Herbert, Corentin, Lassalle, Gilbert
Назва патенту російськоюПохыд
Автори російськоюАкульфф Шанталь, Эрбер Корантен, Лассалль Жильбер
МПК / Мітки
МПК: A61P 35/00, C07D 471/04, A61K 31/437
Мітки: застосування, терапевтичне, отримання, спосіб, похідні, індолізину
Код посилання
<a href="https://ua.patents.su/59-109013-pokhidni-indolizinu-sposib-kh-otrimannya-i-kh-terapevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні індолізину, спосіб їх отримання і їх терапевтичне застосування</a>
Попередній патент: Установка і спосіб виготовлення довгих металевих виробів
Наступний патент: Система, спосіб і установка для зняття біометричних даних
Випадковий патент: Спосіб прогнозування розвитку внутрішньоутробного інфікування плоду