Пептидні похідні
Номер патенту: 65518
Опубліковано: 15.04.2004
Автори: Нільссон Нільс Олов Інгемар, Густафссон Нільс Давід, Антонссон Карл Томас, Бюлунд Рут Ельвю
Формула / Реферат
1. Соединение общей формулы:
A1---A2---NH---(CH2)n---B---D ,I
где
А1 представляет структурный фрагмент формул IIа, IIb, IIc, IId или IIе:
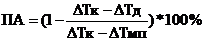
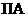
где
k = 0, 1, 2, 3 или 4,
m = 1, 2, 3 или 4,
q = 0, 1, 2 или 3,
R1 представляет Н, алкильную группу с 1-4 атомами углерода или R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу, причем альфа-заместитель представлен группой R17-(СН2)р-, где р = 0, 1 или 2 и R17 - метил, фенил, ОН, COOR12, СОNНR12, где R12 - Н или алкильная группа с 1-4 атомами углерода или бензильная группа, и R11 – Н, алкильная группа с 1-6 атомами углерода или бензильная группа или
R1 представляет Ph(4-COOR12)-CH2-, где R12 принимает вышеуказанные значения, или
R1 представляет R13-NН-СО-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R13 - Н, алкильная группа с 1-4 атомами углерода или -CH2COOR12, где R12 принимает вышеуказанные значения, или
R1 представляет R12ООС-СН2-ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R12 принимает вышеуказанные значения, или
R1 представляет R14SO2-, Ph(4-СООR12)-SO2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения, и R14 - алкильная группа с 1-4 атомами углерода, или
R1 представляет -СO-R15, где R15 - алкильная группа с 1-4 атомами углерода, или
R1 представляет -СO-OR15, где R15 принимает вышеуказанные значения, или
R1 представляет -СО-(СН2)p-COOR12, где R12 принимает вышеуказанные значения и р = 0, 1 или 2, или
R1 представляет -CH2PO(ОR16)2, -СН2SО3Н или -СН2-(5-(1Н)-тетразолил), где R16 независимо в каждом случае представляет Н, метил или этил,
R2 представляет Н или алкильную группу с 1-4 атомами углерода, или R21ООС-алкил, где алкильная группа имеет 1-4 атома углерода и где R21 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа,
R3 представляет алкильную группу с 1-4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или
R3 представляет циклопентильную, циклогексильную или фенильную группу, которые незамещены или замещены алкильной группой с 1-4 атомами углерода, или
R3 представляет фенильную группу, замещенную группой OR31, где R31 - Н или алкильная группа с 1-4 атомами углерода и k = 0, 1, или
R3 представляет 1- нафтильную или 2-нафтильную группу и k = 0, 1, или
R3 представляет цис- или транс-декалиновую группу и k = 0, 1, или
R3 представляет 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены OR31 группой, где R31 принимает вышеуказанные значения и k = 0, 1 или
R3 представляет Si(Me)3 или СН(R32)2, где R32 циклогексильная или фенильная группа,
R4 представляет Н, алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу,
А2 представляет структурный фрагмент формул IIIa, IIIb или IIIс:
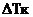
где
р = 0, 1 или 2,
m = 1, 2, 3 или 4,
Y представляет метиленовую группу или
Y представляет этиленовую группу и образованный 5-членный цикл может быть незамещен или замещен одним или двумя атомами фтора, гидроксигруппой или оксогруппой в 4-положении или может быть насыщенным или ненасыщенным, или
Y представляет -СН2-О-, -CH2-S-, -CH2-SO- с гетероатомной функциональностью в 4-положении, или
Y представляет н-пропиленовую группу, и образованный в результате 6-членный цикл может быть незамещен или замещен в 5-положении одним атомом фтора, гидроксигруппой или оксогруппой, или содержать два атома фтора в одном из 4- или 5-положений, или быть ненасыщенным в 4- и 5-положении, или содержать в 4-положении алкильную группу с 1-4 атомами углерода, или
Y представляет -СН2-О-СН2-, -CH2-S-CH2-, -CH2-SO-CH2-, или Y представляет -CH2-CH2-CH2-CH2-,
R3 принимает вышеуказанные значения,
R5 является Н, алкильной группой с 1-4 атомами углерода или R5 представляет -(СН2)р-СООR51, где р = 0, 1 или 2 и R51 - Н или алкильная группа с 1-4 атомами углерода,
n = 0, 1, 2, 3 или 4,
В представляет структурный фрагмент формул IVа, IVb, IVс или IVd:
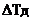
где r = 0 или 1,
X1 представляет СН2 или NН, или отсутствует,
X2 представляет СН2, NН или С=NН,
X3 представляет NН, С=NН, N-C(NН)-NН2, СН-С(NН)-NH2, СН-NН-С(NН)-NН2 или CH-CH2-C(NH)-NH2,
Х4 представляет СН2 или NН,
X5 представляет С(NН)-NН2,
X6 представляет СН или N,
R6 - Н или алкильная группа с 1-4 атомами углерода,
D - группа z или (z)2, или Н, где
z - бензилоксикарбонильная группа, связывающаяся с атомами азота амидино- или гуанидиногрупп, присутствующих в В,
как таковое или его стереоизомеры, или его физиологически приемлемые соли при условии, что когда D представляет собой Н, R12 и/или R21 не является бензилом.
2. Соединение общей формулы I по п. 1, в котором
А1 - представляет структурный фрагмент формул IIа, IIb, IIс, IId или IIе:

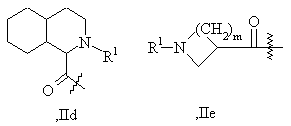
где
k = 0, 1, 2, 3 или 4,
m = 1, 2, 3 или 4,
q = 0, 1, 2 или 3,
R1 представляет R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(СH2)p-, где р = 0, 1 или 2 и R17 - группа СООR12, СОNНR12, где R12 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа, и R11 - Н, алкильная группа с 1-6 атомами углерода или бензильная группа, или
R1 представляет Рh(4-СООR12)-СН2-, где R12 принимает вышеуказанные значения, или
R1 представляет R13-NН-СО-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R13 - Н, алкильная группа с 1-4 атомами углерода или -CH2-COOR12, где R12 принимает вышеуказанные значения, или R1 представляет R12ООС-СН2-ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R12 принимает вышеуказанные значения, или
R1 представляет R14SO2-, Рh(4-СООR12)-SО2-, Ph(3-COOR12)-SO2-, Ph(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1-4 атомами углерода, или
R1 представляет -CO-R15, где R15 - алкильная группа с 1-4 атомами углерода, или
R1 представляет -CO-OR15, где R15 принимает вышеуказанные значения, или
R1 представляет -СО-(СН2)р-СООR12, где R12 принимает вышеуказанные значения и р = 0, 1 или 2,
R2 представляет Н или алкильную группу с 1-4 атомами углерода, или R21ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и где R21 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа,
R3 представляет алкильную группу с 1-4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или
R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1-4 атомами углерода, или
R3 представляет фенильную группу, замещенную группой OR31, где R31 - Н или алкильная группа с 1-4 атомами углерода и k = 0, 1, или
R3 представляет 1-нафтильную или 2-нафтильную группу и k = 0, 1, или
R3 представляет цис- или транс-декалиновую группу и k = 0, 1, или
R3 представляет 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены группой ОR31, где R31 принимает вышеуказанные значения и k = 0, 1, или
R3 представляет Si(Ме)3 или СH(R32)2, где R32 - циклогексильная или фенильная группа,
R4 представляет Н, алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу,
А2 представляет структурный фрагмент формул IIIa, IIIb или IIIс:
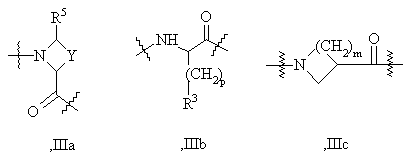
где
р = 0, 1 или 2,
m = 1, 2, 3 или 4,
Y представляет метиленовую группу или
Y представляет этиленовую группу, и образованный в результате 5-членный цикл незамещен или замещен одним или двумя атомами фтора, гидроксигруппой или оксогруппой в 4-положении или может быть ненасыщен, или
Y представляет -СН2-О-, -CH2-S-, -CH2-SO- с гетероатомной функциональностью в 4-положении, или
Y представляет н-пропиленовую группу, и образованный в результате 6-членный цикл незамещен или замещен в 5-положении одним атомом фтора, гидроксигруппой или оксогруппой или содержит в одном из 4- или 5-положений два атома фтора, или может быть ненасыщенным в 4- или 5-положениях, или содержит в 4-положении алкильную группу с 1-4 атомами углерода, или
Y представляет -СН2-О-СН2-, -CH2-S-CH2-, -CH2-SO-CH2-, или
Y представляет -CH2-CH2-CH2-CH2-,
R3 принимает вышеуказанные значения,
R5 представляет Н или алкильную группу с 1-4 атомами углерода, или
R5 представляет -(СН2)p-COOR51, где р = 0, 1 или 2 и R51 - Н или алкильная группа с 1-4 атомами углерода,
n = 0, 1, 2, 3 или 4,
В представляет структурный фрагмент формул IVа, IVb, IVс или IVd:
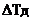
где
r = 0 или 1,
Х1 представляет СН2, NН или отсутствует,
X2 представляет СН2, NН или С=NН,
X3 представляет NН, С=NН, N-С(NH)-NH2, СН-С(NН)-NH2, СН-NН-С(NН)-NН2 или СН-СН2-С(NН)-NН2,
Х4 представляет СН2 или NН,
X5 представляет С(NН)-NН2,
Х6 представляет СН или N,
R6 - Н или алкильная группа с 1-4 атомами углерода,
D - группа z или (z)2, где
z - бензилоксикарбонильная группа, связывающаяся с атомами азота присутствующих в В амидино- или гуанидиногруппы,
как таковое или его стереоизомер, или его физиологически приемлемая соль.
3. Соединение по п. 1 или 2, отличающееся тем, что А1 представляет структурный фрагмент формул IIа или IIb.
4. Соединение по одному из предшествующих пп. 1-3, отличающееся тем, что R1 представляет R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и R11 - Н.
5. Соединение по одному из предшествующих пп. 1-4, отличающееся тем, что А2 - структурный фрагмент формулы IIIa.
6. Соединение по одному из предшествующих пп. 1-4, отличающееся тем, что А2 - структурный фрагмент формулы IIIb.
7. Соединение по одному из предшествующих пп. 1-6, отличающееся тем, что В - структурный фрагмент формулы IVа, где X1, X2 и X4 - группа СН2, X3 - группа СН-С(NH)-NН2, r = 1 и n = 1.
8. Соединение по одному из предшествующих пп. 1-6, отличающееся тем, что В - структурный фрагмент формулы IVа, где X1, X2 и X4 - группа СН2, X3 - группа N-С(NН)-NН2, r = 0 или 1 и n = 1 или 2.
9. Соединение по одному из предшествующих пп. 1-6, отличающееся тем, что В - структурный фрагмент формулы IVb, где R6 - Н и n = 1.
10. Соединение по одному или нескольким предшествующим пп. 1-6, отличающееся тем, что В - структурный фрагмент формулы IVа, где X1 и X3 - группа NН, X2 - группа С=NH, X4 -группа СН2, r = 1 и n = 2.
11. Соединение по одному из предшествующих пп. 1-6, отличающееся тем, что В - структурный элемент формулы IVа, где X1 отсутствует, X2 и X4 - группа СН2, X3 - группа N-С(NН)-NН2, r = 0 и n = 1 или 2.
12. Соединение по п. 1 или 2, отличающееся тем, что n = 1 или 2, А1 - структурный фрагмент формулы IIа, где k = 0 или 1, R1 представляет R11ООС-алкил, где алкильная группа имеет 1-4 атома углерода, R2 представляет Н, R3 представляет циклогексильную группу, А2 представляет структурный фрагмент формулы IIIa, где Y представляет метиленовую группу, этиленовую группу или н-пропиленовую группу, образованный в результате 6-членный цикл незамещен или замещен в 4-положении алкильной группой с 1-4 атомами углерода, R5 представляет Н, В представляет структурный фрагмент формулы IVа, где X1, X2 и X4 - группа СН2, X3 - группа СН-С(NН)-NH2 или N-С(NН)-NH2, r = 0 или 1, или X1 и X3 - группа NН, X2 - группа С=NН, X4 - группа CH2, r = 1, или Х1 отсутствует, X2 и X4 - группа СН2, X3 - группа N-C(NH)-NН2, r = 0.
13. Соединение по п. 1 или 2, отличающееся тем, что n = 1, А1 - структурный фрагмент формулы IIа, где k = 0 или 1, R1 представляет R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода, R2 представляет Н, R3 представляет циклогексильную группу, А2 представляет структурный фрагмент формулы IIIa, где Y представляет метиленовую группу, этиленовую группу или н-пропиленовую группу, и образованный в результате 6-членный цикл незамещен или замещен в 4-положении алкильной группой с 1-4 атомами углерода, R5 представляет Н, В представляет структурный фрагмент формулы IVb, где R6 - Н.
14. Соединение по п. 1, отличающееся тем, что выбрано из
HOOC-CH2- (R) Cgl-Aze-Pab,
HOOC-CH2-CH2- (R) Cgl-Aze-Pab,
HOOC-CH2- (R) Cgl-Pro-Pab,
HOOC-CH2-CH2- (R) Cgl-Pro-Pab,
(HOOC-CH2)2- (R) Cgl-Pro-Pab,
H- (R) Cgl-Pic-Pab,
HOOC-CH2- (R,S) CH(COOH)- (R) Cgl-Pic-Pab,
H- (R) Cha-Aze-Pab,
HOOC-CH2- (R) Cha-Aze-Pab,
HOOC-CH2- (R,S) CH(COOH)- (R) Cha-Aze-Pab,
HOOC-CH2- (R или S) CH(COOH)- (R) Cha-Aze-Pab/a,
HOOC-CH2- (R или S) CH(COOH)- (R) Cha-Aze-Pab/b,
HOOC-CH2-CH2- (R) Cha-Aze-Pab,
HOOC-CH2-NH-CO-CH2- (R) Cha-Aze-Pab,
H- (R) Cha-Pro-Pab,
HOOC-CH2- (R) Cha-Pro-Pab,
HOOC-CH2-(Me) (R) Cha-Pro-Pab,
HOOC-CH2-CH2- (R) Cha-Pro-Pab,
HOOC-CH2-CH2-(Me) (R) Cha-Pro-Pab,
HOOC-CH2- (R или S) CH(COOH)- (R) Cha-Pro-Pab/a,
HOOC-CH2- (R или S) CH(COOH)- (R) Cha-Pro-Pab/b,
HOOC-CH2-NH-CO-CH2- (R) Cha-Pro-Pab,
EtOOC-CH2-CH2-CH2- (R) Cha-Pro-Pab,
Ph(4-COOH)-SO2- (R) Cha-Pro-Pab,
H- (R) Cha-Pic-Pab,
HOOC-CH2- (R) Cha-Pic-Pab,
HOOC-CH2- (R или S) CH(COOH)- (R) Cha-Pic-Pab/a,
HOOC-CH2- (R или S) CH(COOH)- (R) Cha-Pic-Pab/b,
HOOC-CH2-CH2- (R) Cha-Pic-Pab,
HOOC-CO- (R) Cha-Pic-Pab,
HOOC-CH2-CO- (R) Cha-Pic-Pab,
Me-OOC-CH2-CO (R) Cha-Pic-Pab,
H2N-CO-CH2- (R) Cha-Pic-Pab,
Boc- (R) Cha-Pic-Pab,
Ac- (R) Cha-Pic-Pab,
Me-SO2- (R) Cha-Pic-Pab,
H- (R) Cha- (R,S) betaPic-Pab,
HOOC-CH2-CH2- (R) Cha- (R,S) betaPic-Pab,
HOOC-CH2- (R) Cha-Val-Pab,
HOOC-CH2-CH2- (R) Cha-Val-Pab,
H- (R) Hoc-Aze-Pab,
HOOC-CH2-CH2- (R) Hoc-Aze-Pab,
HOOC-CH2- (R,S) CH(COOH)- (R) Hoc-Pro-Pab,
HOOC-CH2- (R) Hoc-Pic-Pab,
(HOOC-CH2)2- (R) Hoc-Pic-Pab,
HOOC-CH2- (R) Pro(3- (S) Ph)-Pro-Pab,
HOOC-CH2-CH2- (R) Pro(3- (S) Ph)-Pro-Pab,
HOOC-CH2-CH2- (R) Tic-Pro-Pab,
HOOC-CH2-CH2- (R) Cgl-Aze-Pig,
HOOC-CH2- (R) Cgl-Pro-Pig,
H- (R) Cha-Aze-Pig,
HOOC-CH2- (R) Cgl-Aze-Pac,
H- (R) Cha-Pro-Pac,
H- (R) Cgl-Ile-Pab,
H- (R) Cgl-Aze-Pab,
HOOC- (R,S) CH(Me)- (R) Cha-Pro-Pab,
MeOOC-CH2- (R) Cgl-Aze-Pab,
EtOOC-CH2- (R) Cgl-Aze-Pab,
nBuOOC-CH2- (R) Cgl-Aze-Pab,
nHexOOC-CH2- (R) Cgl-Aze-Pab,
H- (R) Cgl-Pro-Pac,
HOOC-CH2- (R) Cha-Pro-Pac,
HOOC-CH2-CH2- (R) Cgl-Pro-Pac,
HOOC-CH2-CH2- (R) Cha-Aze-Pac,
HOOC-CH2- (R) Cha-Aze-Pig,
HOOC-CH2- (R) Cha-Pro-Pig,
HOOC-CH2-CH2- (R) Cha-Pro-Pig,
(HOOC-CH2)2- (R) Cgl-Pro-Pig,
HOOC-CH2-CH2(HOOC-CH2)- (R) Cha-Pro-Pig,
HOOC-CH2- (R) Cgl-Aze- (R,S) Itp,
HOOC-CH2- (R) Cha-Aze- (R,S) Itp,
H- (R) Cha-Pic- (R,S) Itp,
HOOC-CH2- (R) Cha-Pic- (R,S) Itp,
H- (R) Cgl-Pro- (R,S) Hig,
HOOC-CH2- (R) Cgl-Pro- (R,S) Hig,
H- (R) Cha-Pro- (R,S) Hig,
H- (R) Cgl-Aze-Rig,
HOOC-CH2- (R) Cgl-Aze-Rig,
HOOC-CH2- (R) Cha-Pro-Rig,
HOOC-CH2-CH2- (R) Cha-Aze-Rig,
HOOC-CH2- (R) Cha-Pro- (S) Itp,
H- (R) Cha-Pro- (R, S) Nig,
H- (R) Cha-Pro-Mig,
H- (R) Cha-Pro-Dig,
H- (R) Cha-Aze-Dig,
либо как таковое, либо как стереоизомер, либо как физиологически приемлемая соль.
15. Соединение по п. 14, отличающееся тем, что выбрано из
HOOC-CH2- (R) Cgl-Aze-Pab,
HOOC-CH2-CH2- (R) Cha-Aze-Pab,
HOOC-CH2- (R) Cha-Pro-Pab,
HOOC-CH2-CH2- (R) Cha-Pro-Pab,
HOOC-CH2- (R) Cha-Pic-Pab,
HOOC-CH2- (R) Cgl-Pro-Pab,
EtOOC-CH2- (R) Cgl-Aze-Pab,
HOOC-CH2- (R) Cha-Pro-Pac,
HOOC-CH2- (R) Cha-Pro-Pig,
либо как таковое, либо как стереоизомер, либо как физиологически приемлемая соль.
16. Соединение по п. 2, отличающееся тем, что выбрано из
BnOOC-CH2- (R) Cgl-Aze-Pab (Z),
BnOOC-CH2-CH2- (R) Cgl-Aze-Pab (Z),
BnOOC-CH2- (R) Cgl-Pro-Pab (Z),
BnOOC-CH2-CH2- (R) Cgl-Pro-Pab (Z),
(BnOOC-CH2)2- (R) Cgl-Pro-Pab (Z),
BnOOC-CH2- (R,S) CH(COOBn)- (R) Cgl-Pic-Pab (Z),
BnOOC-CH2- (R) Cha-Aze-Pab (Z),
BnOOC-CH2- (R,S) CH(COOBn)- (R) Cha-Aze-Pab (Z),
BnOOC-CH2- (R или S) CH(COOBn)- (R) Cha-Aze-Pab (Z) /a,
BnOOC-CH2- (R или S) CH(COOBn)- (R) Cha-Aze-Pab (Z) /b,
BnOOC-CH2-CH2- (R) Cha-Aze-Pab (Z),
BnOOC-CH2-NH-CO-CH2- (R) Cha-Aze-Pab (Z),
BnOOC-CH2- (R) Cha-Pro-Pab (Z),
BnOOC-CH2-(Me) (R) Cha-Pro-Pab (Z),
BnOOC-CH2-CH2- (R) Cha-Pro-Pab (Z),
BnOOC-CH2-CH2-(Me) (R) Cha-Pro-Pab (Z),
BnOOC-CH2- (R,S) CH(COOBn)- (R) Cha-Pro-Pab (Z),
BnOOC-CH2-NH-CO-CH2- (R) Cha-Pro-Pab (Z),
Ph(4-COOH)-SO2- (R) Cha-Pro-Pab (Z),
Boc- (R) Cha-Pic-Pab (Z),
BnOOC-CH2- (R) Cha-Pic-Pab (Z),
BnOOC-CH2- (R,S) CH(COOBn)- (R) Cha-Pic-Pab (Z),
BnOOC-CH2-CH2- (R) Cha-Pic-Pab (Z),
EtOOC-CO- (R) Cha-Pic-Pab (Z),
MeOOC-CH2-CO- (R) Cha-Pic-Pab (Z),
H2N-CO-CH2- (R) Cha-Pic-Pab (Z),
Ac- (R) Cha-Pic-Pab (Z),
Me-SO2- (R) Cha-Pic-Pab (Z),
BnOOC-CH2- (R) Cha-Val-Pab (Z)
BnOOC-CH2-CH2- (R) Cha- (R,S) Val-Pab (Z),
BnOOC-CH2-CH2- (R) Hoc-Aze-Pab (Z),
BnOOC-CH2- (R,S) CH(COOBn)- (R) Hoc-Pro-Pab (Z),
BnOOC-CH2- (R) Hoc-Pic-Pab (Z),
(BnOOC-CH2)2- (R) Hoc-Pic-Pab (Z),
BnOOC-CH2- (R) Pro(3- (S) Ph)-Pro-Pab (Z),
BnOOC-CH2-CH2- (R) Pro(3- (S) Ph)-Pro-Pab (Z),
BnOOC-CH2-CH2- (R) Tic-Pro-Pab (Z),
BnOOC-CH2-CH2- (R) Cgl-Aze-Pig (Z)2,
BnOOC-CH2- (R) Cgl-Pro-Pig (Z)2,
BnOOC-CH2- (R) Cgl-Aze-Pac (Z),
BnOOC- (R,S) CH(Me)- (R) Cha-Pro-Pab (Z),
MeOOC-CH2- (R) Cgl-Aze-Pab (Z),
EtOOC-CH2- (R) Cgl-Aze-Pab (Z),
nBuOOC-CH2- (R) Cgl-Aze-Pab (Z),
nHexOOC-CH2- (R) Cgl-Aze-Pab (Z),
BnOOC-CH2- (R) Cha-Pro-Pac (Z),
BnOOC-CH2-CH2- (R) Cgl-Pro-Pac (Z),
BnOOC-CH2-CH2- (R) Cha-Aze-Pac (Z),
BnOOC-CH2- (R) Cha-Aze-Pig (Z),
BnOOC-CH2- (R) Cha-Pro-Pig (Z),
BnOOC-CH2-CH2- (R) Cha-Pro-Pig (Z),
(BnOOC-CH2)2- (R) Cgl-Pro-Pig (Z),
BnOOC-CH2-CH2 (BnOOC-CH2)- (R) Cha-Pro-Pig (Z),
BnOOC-CH2- (R) Cha-Pic- (R,S) Itp (Z),
BnOOC-CH2- (R) Cgl-Pro- (R,S) Hig (Z),
BnOOC-CH2- (R) Cgl-Aze-Rig (Z),
BnOOC-CH2- (R) Cha-Pro-Rig (Z),
BnOOC-CH2-CH2- (R) Cha-Aze-Rig (Z),
либо как таковое, либо в виде стереоизомера, либо в виде физиологически приемлемой соли.
17. Соединение по п. 16, отличающееся тем, что выбрано из
BnOOC-CH2- (R) Cgl-Aze-Pab (Z),
BnOOC-CH2- (R) Cha-Pro-Pab (Z),
BnOOC-CH2- (R) Cha-Pic-Pab (Z),
BnOOC-CH2- (R) Cgl-Pro-Pig (Z)2,
EtOOC-CH2- (R) Cgl-Aze-Pab (Z),
BnOOC-CH2- (R) Cha-Pro-Pac (Z),
BnOOC-CH2- (R) Cha-Pro-Pig (Z),
либо как таковое, либо в виде стереоизомера, либо в виде физиологически приемлемой соли.
18. Соединение по п. 1, отличающееся тем, что выбрано из
H- (R) Pro-Phe-Pab,
HOOC-CH2- (R) Pro-Phe-Pab,
H- (R) Phe-Phe-Pab,
HOOC-CH2- (R) Phe-Phe-Pab,
HOOC-CO- (R) Phe-Phe-Pab,
либо как таковое, либо в виде стереоизомера, либо в виде физиологически приемлемой соли.
19. Соединение по п. 2, отличающееся тем, что выбрано из
Boc- (R) Pro-Phe-Pab (Z),
BnOOC-CH2- (R) Pro-Phe-Pab (Z),
Boc- (R) Phe-Phe-Pab (Z),
MeOOC-CO- (R) Phe-Phe-Pab (Z),
BnOOC-CH2- (R) Phe-Phe-Pab (Z),
либо как таковое, либо как стереоизомер, либо в виде физиологически приемлемой соли.
20. Способ получения соединения по пп. 1-19 включает присоединение защищенной у N-окончания аминокислоты, дипептида или аминокислоты, в случае применения защищенной у N-окончания аминокислоты вторую аминокислоту добавляют потом, используя стандартные методы, к соединению
H2N-(СН2)n-Х,
где n = 0, 1, 2, 3, 4, X является В или В-D, где В принимает значения, указанные для формулы I и D принимает значения, указанные для формулы I как таковые, либо имеющие гуанидино- или амидиногруппы, атомы азота которых либо моно-, либо дизащищены аминозащитной группой, представляющей собой бензилоксикарбонильную, трет-бутилоксикарбонильную, п-толуолсульфонильную группу или Х является группой, переходящей в В с последующим снятием защитной группы или групп или деблокированием N-концевого азота с последующим алкилированием N-концевого азота и, если необходимо, деблокированием по известным методикам, образовании физиологически приемлемой соли, и в тех случаях, когда в результате реакции образуется смесь стереоизомеров, смесь возможно разделяют стандартными хроматографическими методами или методами перекристаллизации с выделением при желании единственного стереоизомера.
21. Способ по п. 20 для получения соединения по любому из пп. 1-19, отличающийся тем, что включает:
а) присоединение защищенного у N-окончания дипептида, выбранного на основании значений А1 и А2 в формуле І, применением стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции:
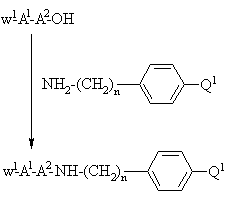 ,
,
где n принимает значения, указанные для формулы І, W1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил, бензилоксикарбонил и Q1 представляeт собой группу -С(NН)-NН2, -С(NW2)-NHW2, -С(NН)-NH-W2, -NH-C(NH)-NН2, -NH-C(NH)-NH-W2, -N(W2)-C(NH)-NH-W2 или -NH-C(NW2)-NН-W2, где W2 - аминозащитная группа, например: трет-бутилоксикарбонил, бензилоксикарбонил, или Q1 - группа -CN, -СО-NH2 или -СS-NH2, которую затем переводят в амидиногруппу, или Q1 - группа NН2 или NH-W2, где W2 принимает вышеуказанные значения, причем аминогруппу затем переводят в гуанидиногруппу (с образованием Q1 = -NН-C(NH)-NH2) после снятия защиты W2-группы, когда Q1 - группа -NН-W2 (в этом случае W2-группа должна быть ортогональна к W1-группе) известными специалистам методами или
b) присоединение защищенной у N-окончания аминокислоты, выбранной на основании значений А2 для формулы I и полученной стандартным методом присоединения пептидов, иллюстрируемым следующим уравнением реакции:
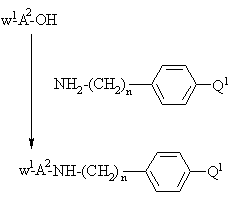
где n, W1 и Q1 принимают вышеуказанные значения, с последующим удалением W1-группы деблокированием и соединением с N-концевой защищенной аминокислотой с образованием защищенного пептида, охарактеризованного в а) вышеприведенном cпособе а), или
с) присоединение защищенного у N-окончания дипептида, выбранного на основании значений А1 и А2 для формулы I, использованием стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции:
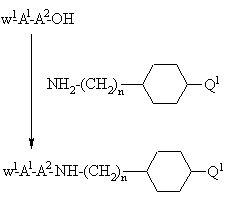 ,
,
где n принимает значения, указанные для формулы I, W1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил и Q1 - группа -С(NH)-NН2, -С(NW2)-NН-W2, -С(NН)-NН-W2, -NН-С(NН)-NН2, -NН-С(NН)-NН-W2, -N(W2)-С(NН)-NН-W2 или -NН-С(NW2)-NH-W2, где W2 - аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил, или Q1 - группа -СN, -СО-NН2 или -CS-NH2, которую затем переводят в амидиногруппу, или Q1 - группа NН2 или NН-W2-, где W2 принимает вышеуказанные значения, причем аминогруппу затем переводят в гуанидиногруппу (с образованием Q1 = -NH-С(NH)-NН2) после снятия защиты W2-группы, когда Q1 - группа -NН-W2 (в этом случае W2-группа должна быть ортогональна W1-группе) известными специалистам методами, или
d) присоединение защищенной у N-окончания аминокислоты, выбранной на основании значений А2 для формулы I, применением стандартных методов присоединения пептидов, иллюстрируемых следующим уравнением реакции:
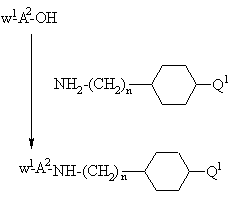 ,
,
где n, W1 и Q1 принимают вышеуказанные значения, с последующим снятием защиты W1-группы и соединением с N-концевой защищенной аминокислотой с образованием защищенного пептида, охарактеризованного в вышеприведенном способе с), или
е) присоединение защищенного у N-окончания дипептида, выбранного на основании значений А1 и А2 для формулы I, применением стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции:
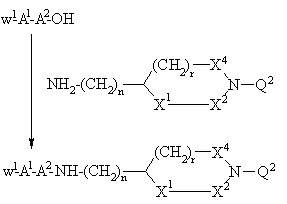 ,
,
где n принимает значения, указанные для формулы I, r = 0 или 1, когда X1,X2 и X4 - группа СН2, или r = 0, когда X2 и X4 - группа СН2 и X1 отсутствует, W1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил и Q2 - группа -С(NH)-NН2, -C(NW2)-NН-W2 или -С(NH)-NН-W2, где W2 - аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил, или Q2 равна W2, при этом аминогруппу после снятия защитной W2-группы (в этом случае W2-группа должна быть ортогональна к W1-группе) затем переводят в гуанидиногруппу применением незащищенных, N-защищенных или N,N'-дизащищенных реагентов гуанидирования известными специалисту методами, или
f) присоединение защищенной у N-окончания аминокислоты, выбранной на основании значений А2 в формуле I,
применением стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции:
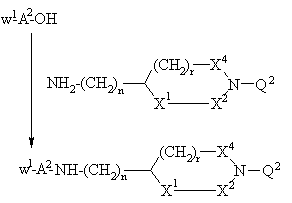 ,
,
где n, r, X1, X2, X4, W1 и Q2 принимают вышеуказанные значения, с последующим снятием защитной W1-группы и соединением с N-концевой аминокислотой в защищенной форме с образованием защищенного пептида, охарактеризованного в вышеприведенном способе е), или
g) присоединение защищенного у N-окончания дипептида, выбранного на основании значений А1 и А2 для формулы I, применением стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции:
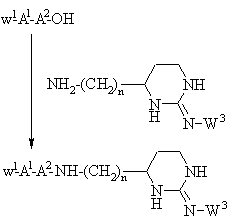 ,
,
где n принимает значения, указанные для формулы I, W1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил и W3 - Н или аминозащитная группа, например: арилсульфонил, бензилоксикарбонил или трет-бутилоксикарбонил, или
h) присоединение защищенной у N-окончания аминокислоты, выбранной на основании значений А2 для формулы I, применением стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции:
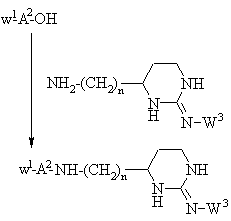 ,
,
где n, W1 и W3 принимают вышеуказанные значения, с последующим снятием защитной W1-группы и соединением с N-концевой аминокислотой в защищенной форме с образованием защищенного пептида, охарактеризованного в вышеприведенном способе g),
конечные соединения могут быть получены любым из следующих способов, зависящих от природы используемой Q1- или Q2-группы: снимают защитную группу(ы) (когда Q1 = -С(NH)-NН2, -C(NW2)-NH-W2, -С(NH)-NH-W2, -NН-С(NН)-NН2, -NH-C(NH)-NН-W2, -N(W2)-C(NН)-NН-W2 или -NH-C(NW2)-NH-W2) или селективно снимают защитную W1-группу (например, когда Q1 или Q2 = -С(NW2)-NН-W2, -C(NH)-NH-W2, -NH-C(NH)-NH-W2, -N-(W2)-C(NH)-NH-W2 или -NH-С(NW2)-NH-W2 (в этом случае W2-группа должна быть ортогональна W1-группе)) с последующим алкилированием N-концевого азота и при желании деблокированием.
22. Соединение по любому из пп. 1-19, отличающееся тем, что предназначено для применения в терапии.
23. Соединение по любому из пп. 1-5 или 7-17, отличающееся тем, что его используют в качестве противотромбозного или противосвертывающего средства.
24. Соединение по любому из пп. 1-4, 6-10 или 18-19, отличающееся тем, что его используют в качестве противовоспалительного средства.
25. Фармацевтическая композиция, содержащая эффективное количество соединения по пп. 1-19 в сочетании с одним или несколькими фармацевтическими носителями.
26. Фармацевтическая композиция по п. 25, содержащая эффективное количество соединения по любому из пп. 1-5 или 7-17 в сочетании с одним или несколькими фармацевтическими носителями для применения в качестве противосвертывающего или противотромбозного средства.
27. Фармацевтическая композиция по п. 25, содержащая эффективное количество соединения по любому из пп. 1-4, 6-10 или 18-19 в сочетании с одним или несколькими фармацевтическими носителями и предназначенная для применения в качестве противовоспалительного средства.
28. Соединение по любому из пп. 1-5 или 7-17, отличающееся тем, что его используют в качестве активного компонента для приготовления фармацевтической композиции, предназначенной для подавления тромбина в организме человека или животного.
29. Соединение по любому из пп. 1-4, 6-10 или 18-19, отличающееся тем, что его используют в качестве активного ингредиента для приготовления фармацевтической композиции, предназначенной для подавления кининогеназ в организме человека или животного.
30. Способ подавления тромбина в организме нуждающегося в таком подавлении человека или животного, состоящий во введении в организм эффективного для подавления количества соединения по любому из пп. 1-5 или 7-17.
31. Способ подавления кининогеназ в организме нуждающегося в таком подавлении человека или животного, состоящий во введении в организм эффективного для подавления количества соединения по любому из пп. 1-4, 6-10 или 18-19.
32. Соединение формулы:
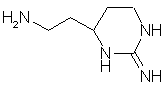
как таковое, или в котором атомы азота амидиногруппы моно- или дизащищены защитной группой, или в виде соли.
33. Соединение по п. 32 в качестве исходного соединения в синтезе ингибитора серин-протеазы.
34. Соединение формулы:
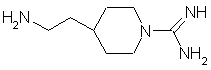
как таковое, или в котором атомы азота амидиногруппы моно- или дизащищены защитной группой, или в виде соли.
35. Соединение по п. 34 в качестве исходного соединения в синтезе ингибитора серин-протеазы.
36. Соединение формулы:
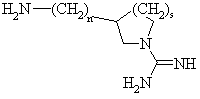 ,
,
где n = 1, или 2 и s = 0 или 1,
как таковое, или в котором атомы азота амидиногруппы моно- или дизащищены защитной группой, или в виде соли.
37. Соединение по п. 36 в качестве исходного соединения в синтезе ингибитора серин-протеазы.
38. Амидинопроизводные, выбранные из группы, состоящей из: 4-аминометил-1-(N-бензилоксикарбониламидино)бензола, 4-аминометил-1-(N-бензилоксикарбониламидино)циклогексана, 4-аминоэтил-1-бензилоксикарбониламидинопиперидина, (3RS)-1-(N-бензилоксикарбониламидино)-3-амино-метилпирролидина, (3RS)-1-(N-бензилоксикарбониламидино)-3-аминоэтилпирролидина, 3-аминометил-1-(N-бензилоксикарбониламидино)азетидина, 3-аминоэтил-1-(N-бензилоксикарбониламидино)азетидина как таковые, в виде соли или защищенные бензилоксикарбонильной группой по другому азоту.
39. Применение соединения формулы:
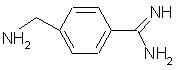 или
или
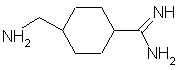
как таковое, или в котором атомы азота амидиногруппы моно- или дизащищены защитной группой, или в виде соли в качестве исходного соединения в синтезе ингибитора тромбина и в особенности пептидного ингибитора тромбина.
Текст
Данное изобретение относится к новым конкурентным ингибиторам трипсиноподобных серин-протеаз, особенно тромбина и кининогеназ, например, калликреина, к их синтезу, к лекарственным формам, содержащим эти соединения в качестве активных компонентов и к применению этих соединений в качестве ингибиторов тромбина и антикоагулянтов, а также в качестве противовоспалительных средств. Изобретение относится также к новому применению соединений в качестве исходных продуктов в синтезе ингибиторов серин-протеазы. Кроме того, изобретение относится к новым фрагментам в структуре ингибиторов серин-протеазы. Коагуляция крови является ключевым процессом, участвующим как в гемостазе (т.е. предотвращении потерь крови из поврежденных сосудов), так и в тромбозе (т.е. патологической закупорки кровеносных сосудов сгустками крови). Коагуляция является результатом серии сложных ферментативных реакций, где· одна из конечных стадий заключается в превращении профермента протромбина в активный фермент тромбин. Тромбин играет главную роль в коагуляции. Тромбин активирует тромбоциты, превращает фибриноген в мономеры фибрина, которые спонтанно полимеризуются в нити, и активирует фактор ХIII, который в свою очередь сшивает полимер в нерастворимый фибрин. Фибрин, кроме того, активирует фактор У и фактор VIII в реакции с положительной обратной связью. Таким образом, ожидается, что ингибиторы тромбина будут эффективными антикоагулянтами за счет ингибирования тромбоцитов, ингибирования образования и стабилизации тромбина. Ожидается, что путем подавления механизма положительной обратной связи ингибирование ими происходит на ранних этапах в цепи событий, ведущих к коагулированию и тромбозу. Кининогеназы относятся к серин-протеазам, которые действуют на кининогены с образованием кининов (брадикинина, каллидина и Met-Lys-брадикинина). К важнейшим кининогеназам относятся калликреин плазмы, калликреин тканей и триптаза мастоцитов. Кинины (брадикинин, каллидин), как правило, участвуют в воспалительном процессе. К примеру, процесс активного воспаления связывают с повышенной проницаемостью кровеносных сосудов, ведущей к транссудации плазмы в ткани. Будущий плазменный экссудат содержит все белковые системы циркулирующей крови. Происходящие из плазмы кининогены неизбежно реагируют с различными калликреинами с непрерывным образованием кининов до тех пор, пока продолжается активный процесс экссудации плазмы. Экссудация плазмы происходит независимо от механизма, имеющего место при воспалении, будь то аллергия, инфекция или иные факторы (Реrsson, и др., под редакцией Thorах, 1992, 47, 993-1000). Таким образом, экссудация плазмы является признаком многих заболеваний, в том числе: астмы, ринита, насморка и воспалительных заболеваний кишечника. В частности, при аллергии происходит выделение триптазы мастоцитов (Salomonsson и др., Ann. Rev. Pespir. Dis., 1992, 146, 1535-1542) с внесением своего вклада в образование кининов и иных патогенных факторов при астме, рините и заболеваниях кишечника. С биологической точки зрения кинины относятся к высоко-активным веществам, действующим на гладкую мускулатуру, с секреторной активностью, нейрогенной активностью и действием, способным влиять на воспалительные процессы, включающими активирование фосфолипазы А 2 и повышающими проницаемость сосудов. Последний эффект потенциально индуцирует непрерывный цикл с участием кининов с образованием все большего количества кининов и т.п. Тканевый килликреин преимущественно расщепляет низкомолекулярные кинининогены с образованием каллидина, а плазменный калликреин предпочтительно образует брадикинин из высокомолекулярных кининогенов. Прототипы Первые сообщения об ингибиторах тромбина, основанных на аминокислотной последовательности вблизи участка отщепления для Аa цепи фибриногена, имеются в работе Blombäck, и др. (J., Clin. Lab. Invest, 24, Suppl. 107, 59 (1969)), в которой предполагается, что последовательность Рhe-Val-Arg (Р9-Р2-Р1, далее обозначаемая, как Р3-Р2-Р1 последовательность) является наилучшим ингибитором. В патенте США 4,346,078 (S, Bajusz и др.) в качестве ингибитора тромбина, раскрыт Н-DPhе-Рrо-Аgm, т.е. дипептидильное производное с аминоалкильным гуанидином в Р1-положении. Ингибиторы тромбина, основанные на пептидных производных с циклическим аминоалкильным гуанидином, напр., 3-аминометил-1-аминопиперидином в P1-положении, раскрыты в ЕР-А2-O, 468, 231. В ЕР-А2-О, 185, 390 (S. Bajusz и др.) показано, что замена агматина альдегидом аргинина приводит к ингибитору тромбина с гораздо более высокой эффективностью. Несколько ранее появились сообщения об ингибиторах калликреина, основанных на аминокислотной последовательности возле участка расщепления Arg-Ser. В работах Kettner и Shaw (Biochemistry 1978, 17, 4778-4784 и Меth. Enzum.. 1981, 80, 826-842) сообщается о хлорметилкетонах аргинина формул Н-DPro-Phe-Arg-СН2Сl и H-DPhe-Phe-Аrg-СН2Сl, как об ингибиторах калликреина плазмы. Аналогичное сообщение о сложных эфирах и амидах, содержащих Н-DРro-Ρhe-Аrg последовательность, как об инигибиторах калликреина плазмы, приводятся в работе Farred и др. (Ann. N.Υ. Acad. Sci. 1981, 370, 765-784). Ингибиторы серин-протеаз, основанные на электрофильных кетонах, а не на альдегидах в P1положении, раскрываются в следующих патентных публикациях. В ЕР-А2-0,195,212 раскрыты пептидильные a-кетоэфиры и амиды, в ЕР-А1-0,362,002 раскрыты фторалкиламидокетоны и в ЕР-А2-0,364,344 раскрыты a, b, d-трикетопроизводные, обладающие различными свойствами ингибиторов пептидаз. Ингибиторы трипсиноподобных серин-протеаз, например: тромбина и калликреина, основанные на Сконцевых производных аргинина с бороновой кислотой, и изотиурониевые аналоги этих производных раскрыты в ЕР-А2-0,293,881. В патенте WO 92/04371 раскрыты ингибиторы кининогеназы, напр., ингибиторы калликреина, основанные на производных аргинина. В патенте ЕР-А1-0,530,167 раскрыты a-алкоксикетопроизводные аргинина в качестве ингибиторов тромбина. Задача настоящего изобретения заключается в создании новых и эффективных ингибиторов трипсиноподобной серин-протеазы, особенно к антикоагулянтным и противовоспалительным соединениям с конкурентной ингибирующей активностью по отношению к своим ферментам, т.е. вызывающим обратимое ингибирование. Более конкретно, предложены антикоагулянты для профилактики и лечения тромбоэмболических заболеваний, например: венозного тромбоза, эмболии легких, артериального тромбоза, в частности, при инфаркте миокарда и церебрального тромбоза, состояний общей сверхкоагуляции и состояний местной сверхкоагуляции, например, после пластических операций на сосудах и байпасных венечных операциях и в иных ситуациях, в которых, как полагают, свою роль играет тромбин, например, при болезни Альцгеймера, а также для ингибирования кининогеназ при лечении воспалительных нарушений, например, астмы, ринита, крапивницы, воспалительного заболевания кишечника и артрита. Еще одна цель изобретения заключается в получении ингибиторов тромбина, характеризующихся пероральной биодоступностью и селективным ингибированием тромбина по сравнению с другими серин-протеазами. И еще одна цель изобретения заключается в получении ингибиторов кининогеназ, которые могут вводиться перорально, ректально, местно, например, нанесением на кожу или путем ингаляции. Соединения В соответствии с изобретением обнаружено, что соединения общей формулы 1, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами серин-протеаз, особенно тромбина и кининогеназ, например, калликреина: А1---А2---N-----(СН2)n---В Формула l где А1 - представляет структурный фрагмент формул llа, llb, lle, lld и llе: где k равно целому числу 0, 1, 2, 3 или 4; m равно целому числу 1, 2, 3 или 4; q равно целому числу 0, 1, 2 или 3; R1 представляет Н, алкильную группу с 1-4 атомами углерода или R11 -ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(СН2)р-, где p равно целому числу 0, 1 или 2 и R17 - метил, фенил, ОН, СООR12, CONHR12, где R12 - Η или алкильная группа с 1-4 атомами углерода и R11 - Η или алкильная группа с 1-6 атомами углерода, или R1 представляет Ρh (4-COOR12)-СН2-, где R12 принимает вышеуказанные значения, или R1 представляет R13-NН-СО-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода, и где R13 - H, алкильная группа с 1-4 атомами углерода или –CH2- COOR12, где R12 принимает вышеуказанные значения, или R1 представляет R12ООС-СН2-ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода, и где R12 принимает вышеуказанные значения, или R1 представляет R14SO2-, Ρh(4-COOR12)-SO2-, Ph(3-COOR12)-SO2-, Ρh(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1-4 атомами углерода, или R1 представляет -CO-R15, где R15 - алкильная группа с 1-4 атомами углерода, или R1 представляет -СО-ОR15, где R15 принимает вышеуказанные значения, или R1 представляет -СО-(CH2)p-COOR12, где R12 принимает вышеуказанные значения, p равно целому числу 0, 1 или 2, или R1 представляет -CH2PO(OR16)2, -CH2SO3Н или -СН2-(5-(1Н)-тетразолил), где R16 независимо в каждом случае представляет Н, метил или этил; R2 представляет Н, алкильную группу с 1-4 атомами углерода или R21ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и где R21 - Η или алкильная группа с 1-4 атомами углерода; R3 представляет алкильную группу с 1-4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1-4 атомами углерода, или R3 представляет фенильную группу, замещенную группой ОR31, где R31 - Η или алкильная группа с 1-4 атомами углерода и k=0, 1 или R3 представляет 1-нафтильную или 2-нафтильную группу и k=0, 1, или R3 представляет цис- или транс-декалиновую группу и k=0, 1, или R3 представляет 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены группой OR31, где R31 принимает вышеуказанные значения, и k=0, 1, или R3 представляет Si(Me)3 или CH(R32)2, где R32 - циклогексильная или фенильная группа; R4 представляет Н, алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу; А2 представляет структурный фрагмент формул IIIа, lllb или lllс: где p=0, 1 или 2; m=1, 2, 3 или 4; Y представляет метиленовую группу или Y представляет этиленовую группу и образованный в результате 5-членный цикл незамещен или замещен одним или двумя атомами фтора, гидроксигруппой или оксогруппой в 4-положении, или ненасыщен, или Y представляет -СН2-О-, -CH2-S-, -СН2-SO- с гетероатомной функциональностью в 4-положении, или Y представляет н-пропиленовую группу , и образованный в результате 6-членный цикл незамещен или замещен в 5-положении одним атомом фтора, гидроксигруппой или оксогруппой, может содержать два атома фтора в одном из 4- или 5-положений или быть ненасыщенным в 4- и 5-положении или может содержать в 4-положении алкильную группу с 1-4 атомами углерода, или Y представляет -СН2-О-СН2-, -CH2-S-CH2-, -CH2-SО-СН2-, или Y представляет -СН2-СН2-СН2-СН2-; RЗ принимает вышеуказанные значения; R5 представляет Η или алкильную группу с 1-4 атомами углерода или R5 представляет -(СН2)р-СООR51, где p=0, 1 или 2 и R51 - Η или алкильная группа с 1-4 атомами углерода; n=0, 1, 2, 3 или 4; В представляет структурный фрагмент формул IVа, IVb, IVс или IVd: где r=0 или 1; X1 - представляет СН2, NH или отсутствует; Х2 представляет СН2 , NH или C=NH; X3 представляет NН, C=NH, N-C(NH)-NH2, СН-С(NH)-NН2, СН-NН-С(NН)-NН2 или CH-CH2 -C(NH)-NH2; X4 представляет СН2 или NН; К рекомендуемым сочетаниям Х1, Х2, X3 и X4 и r относятся: X1, X2 и X4 - группа СН2, X3 - группа СН-С(NН)-NН2 и r=0, 1 или X1, X2 и X4 - группа СН2, X3 - группа N-С(NН)-NН2 и r=0, 1 или X1 и X3 - группа NН, X2 - группа С=NН, X4 - группа СН2 и r=0, 1,или X1 и X4 - группа СН2, X2 - группа С=NН, X3 - группа NН и r=0, 1, или X1 - группа СН2, X2 и X4 - группа NH, X3 - группа С=NН и r=0, 1, или X1, X2 и X4 - группа СН2, X3 - группа СН-NН-С(NН)-NH2 и r=0,1, или X1 отсутствует, X2 и X4 - группа СН2, X3 - группа СН-C(NH)-NH2 и r=0, или X1 отсутствует, X2 и X4 - группа СН2, X3 - группа N-С(NН)-NН2 и r=0. К особенно рекомендуемым сочетаниям X 1, X2, X3, X4 и r относятся: X1, X2 и X4 - группа СН2, X3 - группа СН-С(NН)-NН2 и r=1; X1, X2 и X4 - группа СН2, X3 - группа N-C(NH)-NH2 и r=0 или 1; X1 отсутствует, X2 и X4 - группа СН2, X3 - группа N-С(NН)-NН2 и r=0; X1 и X3 - группа NН, X2 - группа С=NН, X4 - группа СН2 и r=1; X5 представляет С(NН)-NН2 или NН-С(NН)-NН2; R6 - Η или алкильная группа с 1-4 атомами углерода; Х6 представляет СН или N. К рекомендуемым соединениям формулы I относятся соединения, имеющие S-конфигурацию в аминокислоте А2, и из этих соединений особенно предпочтительны также соединения с R-конфигурацией для аминокислоты А1. В контексте настоящего изобретения термин "алкильная группа с 1-4 атомами углерода", если нет особых указаний, относится к прямой или разветвленной группе. Алкильная группа с 1-4 атомами углерода может быть представлена метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, вторбутилом и трет-бутилом. В контексте настоящего изобретения термин "алкильная группа с 1-6 атомами углерода", если нет особых указаний относится к прямой или разветвленной группе. Алкильная группа с 1-6 атомами углерода может быть представлена метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, вторбутилом, трет-бутилом, н-пентилом, изопентилом, третпентилом, неопентилом, н-гексилом или изогексилом. Когда дается ссылка на ненасыщенность, в этом случае речь идет об углерод-углеродной двойной связи. Волнистой линией у атома углерода в карбонильной группе в формулах IIа, IIb, llс, lld, llе, lllа, lllb, lllс, у атома азота в формулах lllа, lllb, lllс и у атома углерода в циклической системе в формулах IVа, IVb, IVс, IVd означает положение связи во фрагменте. Перечень применения сокращений приведен в конце данного описания. Согласно настоящему изобретению обнаружено, что соединения формулы lа, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами тромбина: lа где А1 представляет структурный фрагмент формул llа, llb, llс или lld, предпочтительно llа или llb; где k=0, 1, 2 , 3 или 4, предпочтительно 0, 1; q=0, 1, 2 или 3, предпочтительно 1; R1 - представляет Н, алкильную группу с 1- 4 атомами углерода, R11OОС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, альфазаместитель представлен группой R17-(СН2)р-, где p=0, 1 или 2, R17 - метил, фенил, ОН, СOOR12, СОNНR12, где R12 - Η или алкильная группа с 1-4 атомами углерода и R11 - Η или алкильная группа с 1-6 атомами углерода, или R1 представляет Ph(4-СООR12)-СН2-, где R12 принимает вышеуказанные значения, или R1 представляет R13-NН-СО-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R13 представляет Н, алкильную группу с 1-4 атомами углерода или –СH2СООR12, где R12 принимает вышеуказанные значения, или R1 представляет R12ООС-СН2-ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R12 принимает вышеуказанные значения, или R1 представляет R14SO2-, Ph(4-СООR12)-SO2-, Ph(3-COOR12)-SO2-, Ρh(2-COOR12)- SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1-4 атомами углерода, или R1 представляет -СО-R15, где R15 - алкильная группа с 1-4 атомами углерода, или R1 представляет -CO-OR15, где R15 принимает вышеуказанные значения, или R1 представляет -СО-(СН2)р-СООR12, где R12 принимает вышеуказанные значения и p=0, 1 или 2, или R1 представялет -СН2РО(OR16)2, -СН2SO3Η или -СН2-(5-(1Н)-тетразолил), где R16 в каждом случае независимо представляет Н, метил или этил. f Предпочтительно R1 представляет R11-ООС-алкил-, где алкильная группа имеет 1-4 атома углерода, и 11 R - Н. R2 представляет Н, алкильную группу с 1-4 атомами углерода или R21ООС-алкил-, где алкильная группа имеет 1-4 атома углерода, и R21 - Η или алкильная группа с 1-4 атомами углерода; R3 представляет алкильную группу с 1-4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1-4 атомами углерода, или R3 представляет 1-нафтильную или 2-нафтильную группу и k=0, 1, или R3 представляет цис- или транс-декалиновую группу и k=0, 1, или R3 представляет Si(Me)3 или CH(R32)2, где R32 - циклогексильная группа или фенильная группа; R4 представляет алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу, предпочтительно циклогексильную или фенильную группу; А2 представляет структурный фрагмент формул IIIа, lllb или lllс, предпочтительно lllа, где p=0, 1 или 2; m=1, 2, 3 или 4, предпочтительно 2, 3; Y представляет метиленовую группу или Y представляет этиленовую группу, и образованный в результате 5-тичленный цикл незамещен или замещен одним или двумя атомами фтора, гидроксигруппой или оксогруппой в 4-положении, или может быть насыщенным или ненасыщенным, или Y представляет -СН2-О-, -СН2-S-, -СН2- SO- с гетероатомной функциональностью в 4-положении, или Y представляет н-пропиленовую группу, и образованный в результате 6-тичленный цикл незамещен или замещен в 5-положении одним атомом фтора, гидроксигруппой или оксогруппой, замещен двумя атомами фтора в одном из 4- или 5-положениях, быть ненасыщенным в 4- или 5-положении или быть замещенным в 4-положении алкильной группой с 1-4 атомами углерода, или Y представляет -СН2-О-СН2-, -CH2-S-CH2-, -CH2-SO-CH2-, или Y представляет -СН2-СН2-СН2-СH2-; R3 представляет алкильную группу с 1-4 атомами углерода или R3 представляет группу Si(Me)3; R5 представляет Η или алкильную группу с 1-4 атомами углерода, предпочтительно Η или метил, или R5 представляет - (CH2)p-COOR51, где p=0, 1 или 2 и R51 - Η или алкильная группа с 1-4 атомами углерода, предпочтительно р=0 и R51 - Н; n=0, 1, 2, 3 или 4, предпочтительно 1, 2, 3; В представляет структурный фрагмент формул IVа, IVb, IVс или lVd, предпочтительно IVа или IVb, где Х1, Χ2, Χ3, Χ4, X5 и X6 принимают вышеуказанные значения; r=0 или 1; R6 - Η или алкильная группа с 1-4 атомами углерода, предпочтительно Н; к рекомендуемым сочетаниям X1, X2, X3, X4 и r относятся: X1, X2 и X4 - группа СН2, X3 - группа CH-C(NH)NH2 и r=0 или 1, или X1, X2 и X4 - группа СН2, X3 - группа N-С(NН)-NН2 и r=0 или 1, или X1 и X3 - группа NH, X2 - группа C=NH, X4 - группа СН2 и r=0 или 1, или X1 и X4 - группа СН2, X2 - группа C=NH: X3 - группа NН и r=0 или 1, или Χ1 - группа СН2, X2 и Χ4 - группа NН, X3 - группа С=NH и r=1, или X1, X2 и X4 - группа СН2, X3 - группа CH-NH-C(NH)-NH2 и r=0 или 1, или X1 отсутствует, X2 и X4 - группа СН2, X3 - группа СН-С(NН)-NН2 и r=0, или Х1 отсутствует, X2 и X4 - группа СН2, X3 - группа N-С(NН)-NН2 и r=0; к особенно рекомендуемым сочетаниям Х1, X2, X3, X4 и r относятся: Х1 отсутствует, X2 и X4 - группа СН2, X3 - группа N-C(NH)-NН2 и r=0 или X1, X2 и X4 - группа СН2, X3 - группа СН-С(NН)-NН2 и r=1, или X1, X2 и X4 - группа СН2, X3 - группа N-С(NН)-NН2 и r=0 или 1, или X1 и X3 - группа NН, X2 - группа С=NН, X4 - группа СН2, r=1; X5 представляет С(NН)-NН2 или NH-C(NН)-NН2, предпочтительно C(NH)NH2; Х6 представляет СН или N. Согласно рекомендуемому воплощению изобретение относится к соединениям формулы Iа, где А1 представляет структурный фрагмент формулы IIа, где k=0 или 1; R1 представляет R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода, в частности, метилен, этилен и R11 - Н; R2 представляет Н; R3 представляет циклогексильную группу; А2 представляет структурный фрагмент формулы IIIа, где Y представляет метиленовую группу, этиленовую группу или н-пропиленовую группу, и образованный 6-тичленный цикл незамещен или замещен в 4-положении алкильной группой с 1-4 атомами углерода, предпочтительно Y представляет метилен, этилен; R5 представляет Н; В представляет структурный фрагмент формулы IVа, где X1 отсутствует, X2 и X4 - группа СН2, X3 - группа H-C(NH)-NH2 , r=0, n=1 или 2; X1 и X3 - группа NH, X2 - группа С=NН, X4 - группа СН2, r=1, n=2, или X1, X2 и X4 - группа СН2, X3 - группа СН-С(NН)-ΝΗ2, r=1, n=1, или X1, X2 и X4 - группа СН2, X3 - группа N-C(NH)-NН2 , r=0 или 1, n=1 или 2, или более предпочтительно соединения, где В представляет структурный фрагмент формулы IVb, где X5 представляет С(NН)-NН2, R6 - Η, n=1. К рекомендуемым соединениям изобретения относятся соединения формул: HOOC-CH2-(R)Cgl-Aze-Pab НООС-СН2-СН2-(R)Cgl-Aze-Pab HOOC-CH2-(R)Cgl-Pro-Pab HOOC-CH2-CH2-(R)Cgl-Pro-Pab (HOOC-CH2)2-(R)Cgl-Pro-Pab H-(R)Cgl-Pic-Pab HOOC-CH2-(R,S)CH(COOH)-(R)Cgl-Pic-Pab H-(R)Cha-Aze-Pab HOOC-CH2-(R)Cha-Aze-Pab HOOC-CH2-(R,S)CH(COOH)-(R)Cha-Aze-Pab HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Aze-Pab/a HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Aze-Pab/b HOOC-CH2-CH2-(R)Cha-Aze-Pab HOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab H-(R)Cha-Pro-Pab НOOС-СН2-(R)Cha-Pro-Pab HOOC-CH2-(Me)(R)Cha-Pro-Pab HOOC-CH2-CH2-(R)Cha-Pro-Pab HOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pro-Pab/a HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pro-Pab/b HOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab EtOOC-CH2-CH2-CH2-(R)Cha-Pro-Pab Ph(4-COOH)-SO2-(R)Cha-Pro-Pab H-(R)Cha-Pic-Pab HOOC-CH2-(R)Cha-Pic-Pab HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pic-Pab/a HOOC-CH2-(RorS)CH(COOH)-(R)Cha-Pic-Pab/b HOOC-CH2-CH2-(R)Cha-Pic-Pab HOOC-CO-(R)Cha-Pic-Pab HOOC-CH2-CO-(R)Cha-Pic-Pab Me-OOC-CH2-CO-(R)Cha-Pic-Pab H2N-CO-CH2-(R)Cha-Pic-Pab Boc-(R)Cha-Pic-Pab Ac-(R)Cha-Pic-Pab Me-SO2-(R)Cha-Pic-Pab H-(R)Cha-(R,S)betaPic-Pab HOOC-CH2-CH2-(R)Cha-(R,S)betaPic-Pab HOOC-CH2-(R)Cha-Val-Pab HOOC-CH2-CH2-(R)Cha-Val-Pab H-(R)Hoc-Aze-Pab HOOC-CH2-CH2-(R)Hoc-Aze-Pab HOOC-CH2-(R,S)CH(COOH)-(R)Hoc-Pro-Pab HOOC-CH2-(R)Hoc-Pic-Pab (HOOC-CH2)2-(R)Hoc-Pic-Pab HOOC-CH2-(R)Pro(3-(S)Ph)-Pro-Pab HOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab HOOC-CH2-CH2-(R)Tic-Pro-Pab HOOC-CH2-CH2-(R)Cgl-Aze-Pig HOOC-CH2-(R)Cgl-Pro-Pig H-(R)Cha-Aze-Pig HOOC-CH2-(R)Cgl-Aze-Pac H-(R)Cha-Pro-Pac H-(R)Cgl-IIe-Pab H-(R)Cgl-Aze-Pab HOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab MeOOC-CH2-(R)Cgl-Aze-Pab EtOOC-CH2-(R)Cgl-Aze-Pab n BuOOC-CH2-(R)Cgl-Aze-Pab n HexOOC-CH2-(R)Cgl-Aze-Pab H-(R)Cgl-Pro-Pac HOOC-CH2-(R)Cha-Pro-Pac HOOC-CH2-CH2-(R)Cgl-Pro-Pac HOOC-CH2-CH2-(R)Cha-Aze-Pac HOOC-CH2-(R)Cha-Aze-Pig HOOC-CH2-(R)Cha-Pro-Pig HOOC-CH2-CH2-(R)Cha-Pro-Pig (HOOC-CH2)2-(R)Cgl-Pro-Pig HOOC-CH2-CH2(HOOC-CH2)-(R)Cha-Pro-Pig HOOC-CH2-(R)Cgl-Aze-(R,S)Itp HOOC-CH2-(R)Cha-Aze-(R,S)Itp H-(R)Cha-Pic-(R,S)Itp HOOC-CH2-(R)Cha-Pic-(R,S)Itp H-(R)Cgl-Pro-(R,S)Hig HOOC-CH2-(R)Cgl-Pro-(R,S)Hig H-(R)Cha-Pro-(R,S)Hig H-(R)Cgl-Aze-Rig HOOC-CH2-(R)Cgl-Aze-Rig HOOC-CH2-(R)Cha-Pro-Rig HOOC-CH2-CH2-(R)Cha-Aze-Rig HOOC-CH2-(R)Cha-Pro-(S)Itp H-(R)Cha-Pro-(R,S)Nig H-(R)Cha-Pro-Mig H-(R)Cha-Pro-Dig H-(R)Cha-Aze-Dig В настоящее время к особенно рекомендуемым соединениям формулы Iа относятся следующие соединения: НООС-СН2-(R)Cgl-Aze-Pab НООС-СН2-СH2-(R)Cha-Aze-Pab НООС-СН2-(R)Cha-Pro-Pab HOOC-CH2-CH2-(R)Cha-Pro-Pab HOOC-CH2-(R)Cha-Pic-Pab HOOC-CH2-(R)Cgl-Pro-Pig EtOOC-CH2-(R)Cgl-Aze-Pab HOOC-CH2-(R)Cha-Pro-Pac HOOC-CH2-(R)Cha-Pro-Pig В вышеприведенных перечнях буквы /а и /b относятся к по существу чистому стереоизомеру по атому углерода, отмеченном "R или S". Стереоизомер может быть идентифицирован для каждого соединения ссылкой на нижеследующую экспериментальную часть. Обозначение "R, S" относится к смеси стереоизомеров. В соответствии с изобретением обнаружено, что соединения общей формулы Ib, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами кининогеназ: А1---А2---NН---(СН2)n---В lb где А1 - представляет структурный фрагмент формул llа, llb или llе, предпочтительно llа или llb, где k=0, 1, 2 , 3 или 4, предпочтительно 0, 1; q=0, 1, 2 или 3, предпочтительно 1; R1 представляет Н, алкильную группу с 1-4 атомами углерода или R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(СН2)р -, где p=0, 1 или 2 и R17 - метил, фенил, ОН, COOR12, CONHR12, где R12 - Η или алкильная группа с 1-4 атомами углерода, и R11 - Η или алкильная группа с 1-6 атомами углерода, или R1 представляет Ph(4-COOR12)-СН2-, где R12 - Η или алкильная группа с 1-4 атомами углерода, или R1 представляет R13-NН-СО-алкил, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R13 - н, алкильная группа с 1-4 атомами углерода или –СH2СООR12, где R12 принимает вышеуказанные значения, или R1 представляет R12ООС-СН2-ООС-алкил-,где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R12 принимает вышеуказанные значения, или R1 представляет R14SO2-, Ρh(4-COOR12)-SO2-, Ph(3-СООR12)-SO2-, Ρh(2-СООR12)- SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1-4 атомами углерода, или R1 представляет -CO-R15-, где R15 - алкильная группа с 1-4 атомами углерода, или R1 представляет -СО-ОR15, где R15 принимает вышеуказанные значения, или R1 представляет -СО-(CH2)p-COOR12, где R12 принимает вышеуказанные значения и p=0, 1 или 2, или R1 представляет -СН2РО(ОR16)2, -СН2SO3Н или -СН2-(5-(1Н)-тетразолил), где R16 независимо в каждом случае представляет Н, метил или этил; R2 представляет Н, алкильную группу с 1-4 атомами углерода или R21ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и R21 - Η или алкильная группа с 1-4 атомами углерода; R3 представляет алкильную группу с 1-4 атомами углерода, причем алкильная группа незамещена или замещена одним или несколькими атомами фтора, или R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1-4 атомами углерода, или R3 представляет фенильную группу, замещенную группой OR21, где R21 - Η или алкильная группа с 1-4 атомами углерода и k=0, 1, или R3 представляет 1-нафтильную или 2-нафтильную группу и k=0, 1, или R3 представляет цис- или трансдекалиновую группу и k=0, 1, или R3 представляет 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены группой ОR31, где R31 принимает вышеуказанные значения и k=0, 1, или R3 представляет Si(Me)3 или СН(R32)2, где R32 - циклогексильная или фенильная группа; R4 представляет Н, алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу, предпочтительно Н; А2 представляет структурный фрагмент формул lllb или lllс, предпочтительно lllb, где p=0, 1 или 2; m=1, 2, 3 или 4, предпочтительно 2, 3; R3 принимает вышеуказанные значения; n=0, 1, 2, 3 или 4, предпочтительно 1, 2, 3; В представляет структурный фрагмент формул IVа, IVb, IVс или IVd, предпочтительно IVа или IVb, где X1, Χ2, X3, X4 принимают вышеуказанные значения; R6 - Η или алкильная группа с 1-4 атомами углерода, предпочтительно Η или метил; r=0 или 1; к рекомендуемым сочетаниям X1, Χ2, X3 и X4 относятся: X1, Х2 и X4 - группа СН2, X3 - группа СН-С(NН)-ΝΗ2 и r=0 или 1, или X1, Х2 и X4 - группа СН2, X3 - группа N-C(NН)-NН2 и r=0 или 1, или X1 и X3 - группа ΝΗ, X2 - группа С=NН, X4 - группа СН2 и r=0 или 1, или X1 и X4 - группа СН2, X2 - группа С=NН, X3 - группа ΝΗ и r=0 или 1, или X1 группа СН2 , X2 и X4 - группа NН, X3 - группа С=NН и r=1, или X1, Х2 и X4 - группа СН2, X3 - группа СН-NН-С(ΝΗ)-NН2 и r=0 или 1, или X1 отсутствует, X2 и X4 - группа СН2, X3 - группа CH-C(NH)-NН2 и r=0, или X1 отсутствует, Χ2 и Χ4 - группа СН2, Χ3 - группа H-C(NH)-NН2 и r=0; особенно рекомендуемые сочетания X1, Χ2, X3 и X4 включают: X1, Х2 и X4 - группа СН2, X3 - группа СН-С(NН)-NН2 и r=1 или X1, Х2 и X4 - группа СН2, X3 - группа R-C(NH)-NH2 и r=1; X5 представляет С(NН)-NН2 или NH-C(NH)-NH2, предпочтительно С(NН)-NН2; X6 представляет СН или N. Рекомендуемые соединения изобретения включают соединения формул: H-(R)Pro-Phe-Pab НOOС-СН2-(R)Pro-Phe-Pab H-(R)Phe-Phe-Pab НООС-СО-(R)Phe-Phe-Pab HOOC-CH2-(R)Phe-Phe-Pab H-(R)Cha-Phe-Pab HOOC-CH2-(R)Cha-Phe-Pab H-(R)Phe-Cha-Pab HOOC-CH2-(R)Phe-Cha-Pab H-(R)Cha-Cha-Pab HOOC-CH2-(R)Cha-Cha-Pab Кроме того обнаружено, что соединения общей формулы V, как таковые или в виде физиологически приемлемых солей, включая и стереоиомеры, являются эффективными ингибиторами серин-протеаз, особенно тромбина и кининогеназ, например, калликреина после перорального или парентерального введения: A1 - A2 - NH - (CH2 )n- В - D Формула V где А1 представляет структурный фрагмент формул IIа, llb, llс, lld или llе: где k=0, 1, 2, 3 или 4; m=1, 2, 3 или 4; q=0, 1, 2, или 3; R1 представляет R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(СН2)р-, где p=0, 1 или 2 и R17 - группа СООR12, СОNHR12, где R12 - Н,. алкильная группа с 1-4 атомами углерода или бензильная группа и R11 - Н, алкильная группа с 1-6 атомами углерода или бензильная группа, или R1 представляет Ρh(4-COOR12)-СН2-, где R12 принимает вышеуказанные значения, или R1 представляет R13-NH-СО-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R13 - Н, алкильная группа с 1-4 атомами углерода или -CH^COOR12, где R12 принимает вышеуказанные значения, или R1 - представляет R12ООС-СH2-ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и R12 принимает вышеуказанные значения, или R1 представляет R14SO2-, Ph(4-COOR12)-SO2-, Ph(3-СOOR12)-SO2-, Ρh(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1-4 атомами углерода, или R1 представляет -СО-R15, где R15 - алкильная группа с 1-4 атомами углерода, или R1 представляет -CO-ОR15, где R15 принимает вышеуказанные значения, или R1 представляет -СО-(СН2)р-СООR12, где R12 принимает вышеуказанные значения и p=0, 1 или 2, или R2 представляет Н, алкильную группу с 1-4 атомами углерода или R21ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и где R21 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа; R3 представляет алкильную группу с 1-4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1-4 атомами углерода, или R3 представляет фенильную группу, замещенную группой OR31, где R31 - H или алкильная группа с 1-4 атомами углерода и k=0, 1, или R3 представляет 1-нафтильную или 2-нафтильную группу и k=0, 1, или R3 представляет цис- или транс-декалиновую группу и k=0, 1, или R3 представляет 4-пиридил, 3-пирролидинил или 3-индолил, которые незамещены или замещены группой OR31, где R31 принимает вышеуказанные значения, и k=0, 1, или R3 представляет Si(Me)3 или СН(R32)2, где R32 - циклогексильная или фенильная группа; R4 представляет Н, алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу; А2, В и n принимают значения, указанные выше для формулы I; D - группа Z или (Z)2, где Z представляет бензилоксикарбонильную группу. Бензилоксикарбонильная группа (Z или (Z)2, присоединена к атомам азота амидино- или гуанидинофрагмента, присутствующих в В. Рекомендуемые и особенно рекомендуемые комбинации те же, что и приведенные выше для формулы I. Кроме того обнаружено, что соединения общей формулы Vа, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами тромбина после перорального или парентерального введения: А1 - А2 - NН - (СН2 )n- В - D Формула Vа где А1 представляет структурный фрагмент формул IIа, llb, llс или lld, предпочтительно llа или llb, где k=0, 1, 2, 3 или 4, предпочтительно 0, 1; q=0, 1, 2, или 3, предпочтительно 1; R1 представляет R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(СН2)р-, где p=0, 1 или 2 и R17 - группа СOOR12, СОNHR12, где R12 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа, и R11 - Н, алкильная группа с 1-6 атомами углерода или бензильная группа, или R1 представляет Ph(4-СООR12)-СН2-, где R12 принимает вышеуказанные значения, или R1 представляет R13-NН-СО-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R13 -H, алкильная группа с 1-4 атомами углерода или –CH2-СООR12, где R12 принимает вышеуказанные значения, или R1 представляет R12ООС-СН2-ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R12 принимает вышеуказанные значения, или R1 представляет R14SО2-, Ρh(4-СООR12)-SO2-, Ρh(3-COOR12)-SO2-, Ρh(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1-4 атомами углерода, или R1 представляет -CO-R15, где R15 - алкильная группа с 1-4 атомами углерода, или R1 представляет -СО-ОR15, где R15 принимает вышеуказанные значения, или R1 представляет -СО-(CH2)p-COOR12, где R12 принимает вышеуказанные значения и p=0, 1 или 2, или предпочтительно R1 представляет R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и R11 принимает вышеуказанные значения; R2 представляет Н, алкильную группу с 1-4 атомами углерода или R21ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и R21 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа; R3 представляет алкильную группу с 1-4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора, или R3 представляет циклолентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1-4 атомами углерода, или R3 представляет 1-нафтильную или 2-нафтильную группу и k=0, 1, или R3 представляет цис- или транс-декалиновую группу и k=0, 1, или R3 представляет Si(Ме)3 или СН(R32)2, где R32 - циклогексильная или фенильная группа; R4 представляет алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу, предпочтительно циклогексильную или фенильную группу; А2, В и n принимают значения, приведенные выше для формулы lа; D - группа Z или (Z)2; Z представляет бензилоксикарбонильную группу. Рекомендуемые цифровые показатели, группы и комбинации и особенно предпочтительные комбинации те же, что приведенные выше для формулы Iа, однако R11 - Н, алкильная группа с 1-6 атомами углерода или бензильная группа. Рекомендуемые соединения формулы Vа включают: BnOOC-CH2-(R)Cgl-Aze-Pab(Z) BnOOC-CH2-CH2-(R)Cgl-Aze-Pab(Z) BnOOC-CH2-(R)Cgl-Pro-Pab(Z) BnOOC-CH2-CH2-(R)Cgl-Pro-Pab(Z) (BnOOC-CH2)2-(R)Cgl-Pro-Pab(Z) ВnООС-СН2-(R,S)CH(COOBn)-(R)Cgl-Pic-Pab(Z) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Aze-Pab(Z) BnOOC-CH2-(RorS)CH(COOBn)-(R)Cha-Aze-Pab(Z)/a BnOOC-CH2-(RorS)CH(COOBn)-(R)Cha-Aze-Pab(Z)/b BnOOC-CH2-CH2-(R)Cha-Aze-Pab(Z) BnOOC-CH2-NH-CO-CH2-(R)Cha-Aze-Pab(Z) BnOOC-CH2-(R)Cha-Pro-Pab(Ζ) BnOOC-CH2-(Me)(R)Cha-Pro-Pab(Z) BnOOC-CH2-CH2-(R)Cha-Pro-Pab(Z) BnOOC-CH2-CH2-(Me)(R)Cha-Pro-Pab(Z) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Pro-Pab(Z) BnOOC-CH2-NH-CO-CH2-(R)Cha-Pro-Pab(Z) Ph(4-COOH)-SO2-(R)Cha-Pro-Pab(Z) Boc-(R)Cha-Pic-Pab(Z) BnOOC-CH2-(R)Cha-Pic-Pab(Z) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cha-Pic-Pab(Z) BnOOC-CH2-CH2-(R)Cha-Pic-Pab(Z) EtOOC-CO-(R)Cha-Pic-Pab(Z) MeOOC-CH2-CO-(R)Cha-Pic-Pab(Z) H2N-CO-CH2-(R)Cha-Pic-Pab(Ζ) Ac-(R)Cha-Pic-Pab(Z) Me-SO2-(R)Cha-Pic-Pab(Z) BnOOC-CH2-(R)Cha-Val-Pab(Z) BnOOC-CH2-CH2-(R)Cha-(R,S)Val-Pab(Z) BnOOC-CH2-CH2-(R)Hoc-Aze-Pab(Z) BnOOC-CH2-(R,S)CH(COOBn)-(R)Hoc-Pro-Pab(Z) ВnООС-СН2-(R)Hoc-Pic-Pab(Z) (BnOOC-CH2)2-(R)Hoc-Pic-Pab(Z) BnOOC-CH2-(R)Pro(3-(S)Ph)-Pro-Pab(Z) BnOOC-CH2-CH2-(R)Pro(3-(S)Ph)-Pro-Pab(Z) BnOOC-CH2-CH2-(R)Tic-Pro-Pab(Z) BnOOC-CH2-CH2-(R)Cgl-Aze-Pig(Z)2 ВnОOС-СН2-(R)Cgl-Pro-Pig(Ζ)2 BnOOC-CH2-(R)Cgl-Aze-Pac(Z) BnOOC-(R,S)CH(Me)-(R)Cha-Pro-Pab(Z) MeOOC-CH2-(R)Cgl-Aze-Pab(Ζ) EtOOC-CH2-(R)Cgl-Aze-Pab(Z) n BuOOC-CH2-(R)Cgl-Aze-Pab(Z) n HexOOC-CH2-(R)Cgl-Aze-Pab(Z) ВnООС-СН2-(R)Cha-Pro-Pac(Z) BnOOC-CH2-CH2-(R)Cgl-Pro-Pac(Z) BnOOC-CH2-CH2-(R)Cha-Aze-Pac(Z) BnOOC-CH2-(R)Cha-Aze-Pig(Z) BnOOC-CH2-(R)Cha-Pro-Pig(Z) BnOOC-CH2-CH2-(R)Cha-Pro-Pig(Z) (BnOOC-CH2)2-(R)Cgl-Pro-Pig(Z) BnOOC-CH2-CH2(BnOOC-CH2)-(R)Cha-Pro-Pig(Z) ВnООС-СН2-(R)Cha-Pic-(R,S)Itp(Z) ВnООС-СН2-(R)Cgl-Pro-(R,S)Hig(Z) BnOOC-CH2-(R)Cgl-Aze-Rig(Z) BnOOC-CH2-(R)Cha-Pro-Rig(Z) BnOOC-CH2-CH2-(R)Cha-Aze-Rig(Z) Особенно рекомендуются следующие соединения: BnOOC-CH2-(R)Cgl-Aze-Pab(Z) BnOOC-CH2-(R)Cha-Pro-Pab(Z) BnOOC-CH2-(R)Cha-Pic-Pab(Ζ) BnOOC-CH2-(R)Cgl-Pro-Pig(Ζ)2 EtOOC-CH2-(R)Cgl-Aze-Pab(Z) ВnООС-СН2-(R)Cha-Pro-Pac(Z) BnOOC-CH2-(R)Cha-Pro-Pig(Z) Кроме того обнаружено, что соединения общей формулы Vb, как таковые или в виде физиологически приемлемых солей, включая и стереоизомеры, являются эффективными ингибиторами калликреина после перорального или парентерального введения: А1 - А2 - NН - (СН2 )n - В - D Формула Vb где А1 представляет структурный фрагмент формул IIа, llb или llе, предпочтительно llа или llb, где k=0, 1, 2, 3 или 4 предпочтительно 0, 1; q=0, 1, 2 или 3, предпочтительно 1; R1 представляет R11ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонильной группе, причем альфа-заместитель представлен группой R17-(СН2)р-, где p=0, 1 или 2 и R17 - группа СOOR12, СОNHR12, где R12 - Η или алкильная группа с 1-4 атомами углерода, и R11 - Н, алкильная группа с 1-6 атомами углерода или бензильная группа, или R1 представляет Ph(4-СООR12)-СН2-, где R12 принимает вышеуказанные значения, или R1 представляет R13-NН-СО-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R13 – H, алкильная группа с 1-4 атомами углерода или –CH2COOR12, где R12 принимает вышеуказанные значения, или R1 представляет R12ООС-СН2-ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и возможно замещена в альфа-положении к карбонилу алкильной группой с 1-4 атомами углерода и где R12 принимает вышеуказанные значения, или R1 представляет R14SO2-, Ph(4-СООR12)-SO2-, Ph(3-COOR12)-SO2-, Ρh(2-COOR12)-SO2-, где R12 принимает вышеуказанные значения и R14 - алкильная группа с 1-4 атомами углерода, или R1 представлен -СО-R15, где R15 - алкильная группа с 1-4 атомами углерода, или R1 представляет -CO-OR15, где R15 принимает вышеуказанные значения, или R1 представляет -СО-(CH2)p-COOR12, где R12 принимает вышеуказанные значения и p=0, 1 или 2, или R2 представляет Н, алкильную группу с 1-4 атомами углерода или R21ООС-алкил-, где алкильная группа имеет 1-4 атома углерода и R21 - Н, алкильная группа с 1-4 атомами углерода или бензильная группа; R3 представляет алкильную группу с 1-4 атомами углерода, и алкильная группа незамещена или замещена одним или несколькими атомами фтора или R3 представляет циклопентильную, циклогексильную или фенильную группы, которые незамещены или замещены алкильной группой с 1-4 атомами углерода, или R3 представляет фенильную группу, замещенную группой OR31, где R31 - Η или алкильная группа с 1-4 атомами углерода и k=0, 1, или R3 представляет 1-нафтильную или 2-нафтильную группу и k=0, 1, или R3 представляет цис- или транс-декалиновую группу и k=0, 1, или R3 представляет 4-пиридил, 3-пирролидил или 3-индолил, которые незамещены или замещены группой OR31, где R31·принимает вышеуказанные значения, и k=0, 1, или R3 представляет Si(Me)3 или СH(R32)2, где R32 циклогексильная или фенильная группа; R4 представляет Н, алкильную группу с 1-4 атомами углерода, циклогексильную или фенильную группу, предпочтительно Н; А2, В и n принимают значения, указанные выше для формулы lb; D представляет Z или (Z)2. Рекомендуемые цифровые значения, группы или комбинации и особенно предпочтительные комбинации те же, что и указанные выше для формулы lb, однако R11 - Н, алкильная группа с 1-6 атомами углерода или бензильная группа. Рекомендуемые соединения формулы Vb включают: Воc-(R)Pro-Phe-Pab(Ζ) BnOOC-CH2-(R)Pro-Phe-Pab(Ζ) Воc-(R)Phe-Phe-Pab(Ζ) MeOOC-CO-(R)Phe-Phe-Pab(Z) BnOOC-CH2-(R)Phe-Phe-Pab(Z) В еще одном своем воплощении изобретение относится к новому применению соединения формулы: в качестве исходного продукта в синтезе пептидного ингибитора серин-протеазы, в частности, в синтезе пептидных ингибиторов тромбина или ингибиторов киногеназ. Соединение может быть использовано, как таковое или с амидиногруппой моно- или дизамещенной по атомам азота защитной группой, например, бензилоксикарбонилом. Защиту амидинопроизводных осуществляют известными, применяемыми для защиты амидиногруппы методами. Указанное соединение имеет название "1-амидино4-аминометилбензола" или в данном описании "Н-Раb". Ранее соединение раскрыто в Biochem. Pharm. т. 23, стр. 2247-2256. Однако, структурный фрагмент формулы: ранее не был указан в качестве структурного элемента фармацевтически активного соединения, в особенности пептидного соединения. Фрагмент придает соединениям свойства ингибитора серинпротеазы, в частности, ингибитора тромбина или ингибитора кининогеназ. В еще одном своем воплощении изобретение относится к ранее неизвестному применению соединения формулы: в качестве исходного продукта в синтезе игнибитора тромбина. Аминогруппа в указанном соединении может быть моно- или дизащищена по атомам азота такой защитной группой, как бензилоксикарбонил. Защиту амидинопроизводных известными способами, применяемыми для защиты амидиногруппы. Название этого соединения - "1-амидино-4-аминометилциклогексан" или в данном описании "Η-Рас". Ранее соединение раскрыто в патенте DЕ 2748295. Однако, структурный фрагмент формулы: ранее не указывался в качестве структурного элемента представляющего ценность ингибитора тромбина. И в еще одном своем аспекте изобретение относится к новому соединению формулы: и к применению указанного соединения в качестве исходного продукта в синтезе ингибитора серинпротеазы, в особенности ингибитора тромбина или ингибитора кининогеназы. Атомы азота в амидиногруппе соединения могут быть моно- или дизащищены такой защитной группой, как бензилоксикарбонил. Защиту амидинопроизводных осуществляют известными способами, применяемыми для защиты амидиногруппы. Название этого соединения "4-аминоэтил-1-амидинопиперидин" или в данном описании "Н-Rig". Однако, структурный фрагмент формулы: ранее не указывался в качестве структурного элемента фармацевтически активного соединения, в особенности пептидного соединения. Фрагмент придает соединениям свойства ингибитора серинпротеазы, в частности, ингибитора тромбина или ингибитора кининогеназ. В еще одном своем воплощении изобретение относится к новому соединению формулы: и к его применению в качестве исходного продукта в синтезе ингибитора серин-протеазы, в особенности ингибитора тромбина или ингибитора кининогеназы. Атомы азота в амидиногруппе соединения могут быть моно- или дизащищены такой защитной группой, как бензилоксикарбонил. Защиту амидинопроизводных проводят известными способами защиты амидиногруппы. Название этого соединения - "1,3-диаза-2-амино-4-аминоэтилциклогексан, или в данном описании "H-ltp". Однако, структурный фрагмент формулы: ранее не указывался в качестве структурного элемента фармацевтически активного соединения, особенно пептидного соединения. Фрагмент придает соединению свойства ингибитора серин-протеазы, в частности, ингибитора тромбина или ингибитора кининогеназ. В еще одном своем воплощении изобретение относится к новым соединения формулы: где n=1 или 2, S=0 или 1, и к применению этих соединений в качестве исходных продуктов в синтезе ингибиторов серин-протеаз, в особенности ингибиторов тромбина или ингибиторов кининогеназ. Атомы азота в амидино-группе соединений могут быть моно- или дизащищены такой защитной группой, как бензилоксикарбонил. Защиту амидиногруппы проводят известными способами защиты амидинопроизводных. Эти соединения имеют следующие названия: 1-амидино-3-аминометилпирролидин или "Н-Nig" при n=1 и S=1, 1-амидино-3-аминоэтилпирролидин или "Н-Нig" при n=2 и S=1, 3-аминометил-1-амидиноазетидин или "Н-Мig" при n=1 и S=0, 3-аминоэтил-1-амидиноазетидин или "Н-Dig" при n=2 и S=0. Однако, структурный фрагмент формулы: ранее не указывался в качестве структурного элемента фармацевтически активного соединения, особенно пептидного соединения. Фрагмент придает соединению свойства ингибитора серин-протеаз, в частности, ингибитора тромбина или ингибитора кининогеназ. Еще одно воплощение изобретения относится к новым соединениям, в которых атомы азота амидиногруппы моно- или ди-защищены бензилоксикарбонильной группой. Примеры подобных соединений включают: 4-аминометил-1-(N-бензилоксикарбониламидино)бензол(Н-Раb(Z)), 4-аминометил-1-(N,N’-ди(бензилоксикарбонил)амидино)бензол(Н-Раb(Z)2), 4-аминометил-1-(N-бензилоксикарбониламидино)циклогексан(Н-Рас(Z)), 4-аминометил-1-(N,N’-ди(бензилоксикарбонил)амидино)циклогексан(Н-Рас(Z)2), 4-аминоэтил-1-(N-бензилоксикарбониламидино)пиперидин(Н-Rig(Z)), 4-аминоэтил-1-(N,N’-ди(бензилоксикарбонил)амидино)пиперидин(H-Rig(Z)2), (3RS)-1-(N-бензилоксикарбониламидино)-3-аминометилпирролидин(Н-Nig(Z)), (3RS)-1-(N,N’-ди(бензилоксикарбонил)амидино)-3-аминометилпирролидин(Н-Nig(Z)2), (3RS)-1-(N-бензилоксикарбонил)амидино-3-аминоэтилпирролидин(Η-Ηig(Z)), (3RS)-1-(N,N’-ди(бензилоксикарбонил)амидино)-3-аминоэтилпирролидин(Н-Нig(Z)2) , 3-аминометил-1-(N-бензилоксикарбониламидино)азетидин(Н-Мig(Z)), 3-аминометил-1-(N,N’-ди(бензилоксикарбонил)амидино)азетидин(Н-Mig(Z)2), 3-аминоэтил-1-(N-бензилоксикарбониламидино)азетидин(Н-Dig(Z)), 3-аминоэтил-1-(Ν,N'-ди(бензилоксикарбонил)амидино)азетидин(Η-Dig(Z)2). Указанные соединения применяют в качестве исходных продуктов в получении заявленных пептидных производных формул 1, la, l6, У, Уа и Уо. Применение в медицине и фармацевтике В изобретении отображены препараты и способы лечения у человека и животных тех состояний, при которых требуется подавление тромбина и физиологических нарушений, в особенности воспалительных заболеваний. Ожидается, что подавляющие тромбин соединения изобретения окажутся полезными для лечения и профилактики у человека и животных тромбоза и сверхкоагулируемости в крови и тканях. Кроме того ожидается, что соединения найдут применение в тех ситуациях, когда происходит избыточное образование тромбина без признаков сверхкоагулируемости, как например, при болезни Альцгеймера и панкреатите. Болезненные состояния, при которых данные соединения потенциально применимы для лечения и/или профилактики, включают: венозный тромбоз, эмболию легких, артериальный тромбоз, например, при инфаркте миокарда, неустойчивую стенокардию, приступ в результате тромбоза и периферийный артериальный тромбоз, общей эмболии, как правило, из предсердия в ходе артериальной фибрилляции или из левого желудочка после трансмурального инфаркта миокарда. Кроме того ожидается, что соединения найдут применение в профилактике атеросклеротических заболеваний, например: коронарной артериальной болезни, серебральной артериальной болезни и периферийной артериальной болезни. Ожидается также, что соединения будут обладать синергическим антитромботическим действием при их применении с любым антитромботическим агентом с иным механизмом действия, например, с таким антитромбоцитарным агентом, как ацетилсалициловая кислота. Эти соединения, как ожидается, будут полезны при лечении в сочетании с тромболитиками тромботических заболеваний, например, инфаркта миокарда. Кроме того, ожидается, что соединения найдут применение для профилактики повторной окклюзии после тромбоза, чрескожной трансполосной пластической операции на сосудах (РТСА) и коронарных байпасных операциях. Ожидается также, что соединения найдут применение для профилактики ретромбоза после микрохирургии и хирургии на сосудах в целом. Ожидается также применение соединений для лечения и профилактики рассеянной внутрисосудистой коагуляции, вызванной бактериями, множественными травмами, интоксикацией и иными причинами. Кроме того, ожидается, что соединения будут применимы для антикоагулянтной обработки в случаях, когда кровь контактирует с чужеродными поверхностями в организме, например, в виде сосудистых имплантантов, сосудистых трансплантантов, сосудистых катетеров, механических и биологических протезов или любого другого медицинского устройства. Ожидается также возможность применения соединений для антикоагулянтной обработки в случаях, когда кровь контактирует с медицинскими устройствами вне организма, например, в ходе сердечно-сосудистой хирургии с применением аппарата сердце-легкие или при гемодиализе. Еще одно ожидаемое применение антикоагулянтных соединений изобретения состоит в ополаскивании катетеров и медицинских устройств, применяемых в организме больных in vivo, и в качестве антикоагулянтов для консервации крови, плазмы и других производных крови in vitro. Противовоспалительные соединения изобретения, как ожидается найдут применение, в частности, для лечения и профилактики у человека и животных воспалительных заболеваний, например: астмы, ринита, панкреатита, крапивницы, воспалительных заболеваний кишечника и артрита. Эффективное количество ингибирующего кининогеназу соединения может быть использовано в виде чистого соединения или в виде его смеси с физиологически приемлемыми носителями и разбавителями, или в сочетании с другими терапевтическими агентами. Способность соединений подавлять активность калликреинов определяют анализом по известным методикам с применением хромогенных субстратов. Противовоспалительное действие соединений настоящего изобретения может быть исследовано, например, по ингибированию ими вызванных аллергеном экссудативных воспалительных процессов в слизистой дыхательных или слизистой кишечника. Лекарственные формы Соединения изобретения, как правило, подлежат введению перорально, ректально, нанесением на кожу, через нос, через трахею, через бронхи, парентерально или путем ингаляции. Соединения вводятся в виде лекарственных форм, содержащих активный компонент в виде свободного основания или в виде фармацевтически приемлемой неядовитой соли, образованной добавлением органической или неорганической кислоты, напр.: гидрохлорида, гидробромида, сульфата, гидросульфата, нитрата, лактата, ацетата, цитрата, бензоата, сукцината, тартрата, трифторацетата и т.п., в фармацевтически приемлемой дозированной форме. В зависимости от вида заболевания и состояния больного, подлежащего лечению, и от пути введения препараты могут вводиться в различных дозах. Дозированные формы могут быть твердыми, полужидкими и жидкими, приготовленными по известной технологии. Обычно количество активного компонента составляет 0,1-99%мас., на препарат, более конкретно, 0,1-50%маc. на препарат, предназначенный для парентерального введения, и 0,2-75%маc. на препарат, приемлемый для перорального введения. Приемлемые ежедневные дозы соединений изобретения для лечения составляют 0,001-100мг/кг массы тела при пероральном введении и 0,001-50мг/кг массы тела при парентеральном введении. Получение Еще одной задачей изобретения является способ получения соединений. Соединения формул I и V могут быть получены способами, включающими присоединение защищенного в N-окончании дипептида или аминокислоты, если используют N-концевую аминокислоту с последующим прибавлением по известным методикам второй аминокислоты, к соединению формулы: Н2N---(СН2)n ---X, где (n=0,1, 2, 3 или 4, X - группа В или B-D, где В принимает значения, указанные для формулы 1, и D принимает значения, указанные для формулы V, причем атомы азота в гуанидино- или амидиногруппе незащищены или моно- или дизазащищены аминозащитной группой, например: бензилоксикарбонильной, трет-бутилоксикарбонильной или п-толуолсульнильной группой, или X - группа, переносимая в В, с последующим удалением защитных групп или деблокированием N-концевого азота и затем алкилированием N-концевого азота и при желании деблокированием известными методами. При желании могут быть получены физиологически приемлемые соли, а в тех случаях, когда в результате реакции образуется смесь стереоизомеров, их возможно разделяют стандартными хроматографическими методами или перекристаллизацией с выделением при желании единственного стереоизомера. Соединения формул I или V могут быть получены одним из следующих, раскрываемых более подробно способов. Способ Iа Способ состоит в присоединении к защищенному в N-окончании дипептиду, выбранному исходя из значений А1 и А2 для формул I и V и полученному стандартным способом соединения пептидов, соединения формулы: использованием стандартной методики присоединения пептидов, иллюстрируемой следующей схемой реакции: В приведенных формулах n принимает значения, указанные для формулы l, W 1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил и бензилоксикарбонил и Q1 - группа -C(NH)NH2, -C(NW 2)-NH-W 2, -С(NН)-NН-W 2, -NH-C(NН)-NН2, -NН-С(NН)-NН-W 2, -N(W 2)-C(NH)-NH-W 2 или -NHC(ΝW 2)-NН-W 2, где W 2 - аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил, или Q1 - группа -CN, -СО-NН2 или -СS-ΝΗ2, которая затем переносится в амидиногруппу (например, с образованием Q1 = -C(NH)-NH2 ) известными специалистам методами, или Q1 группа NH2 или NH-W 2, где W 2 принимает вышеуказанные значения, причем аминогруппа затем переносится в гуанидиногруппу (с образованием Q1 = -NН-С(NH)-NН2 ) после удаления W 2-группы, когда Q1 - группа -NH-W 2 (W 2 в этом случае должна быть ортогональна Kw1) известными специалистам методами. Конечные соединения могут быть получены одним из следующих способов в зависимости от природы применяемой Q1 - группы. удаляют защитную группу-(ы) (когда Q1 - группа -С(NН)-NН2, -C(NW 2)-NН-W 2, C(NH)-NH-W 2, -NH-C(NH)-NH2, -NH-C(NН)-NН-W 2, -N(W 2)-С(NН)-NН-W 2 или -NН-С(NW 2)-NH-W 2) или проводят селективное деблокирование с удалением W 1 - группы (напр., когда R1 - группа -С(NW 2)-NНW 2, C(NH)-NH-W 2, -NH-C(NH)-NH-W 2, -N(W 2)-C(NH)-NH-W 2 или -NH-C(NW 2)-NH-W 2 (W 2-группа в этом случае должна быть ортогональна к W 1-группе) с последующим алкилированием по известным методикам Nконцевого азота и при желании деблокированием известными методами. Способ lb Способ состоит в присоединении к защищенной в N-окончании аминокислоте, выбранной исходя из значения А 2 для формул I или V и полученной стандартными методами, соединения формулы: использованием стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: где n, W 1 и Q1 принимают вышеуказанные значения, с последующим удалением W 1-группы деблокированием и присоединением N-концевой аминокислоты в защищенной форме, тем самым защищая пептид, описанный в cпособе Iа. Затем согласно cпособу Iа продолжают синтез конечных пептидов. Способ llа Способ состоит из реакции защищенного в N-окончании дипептидa, выбранного исходя из значений A1 и A2 для формул I или V и синтезированного стандартным методом соединения пептидов, с соединением формулы: использованием стандартного метода присоединения пептидов, иллюстрируемого следующим уравнением реакции: где n - принимает значения, указанные для формулы l, W 1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил и Q1 - группа -С(NН)-NH2, -C(NW 2)-NH-W 2, C(NH)-NH-W 2, -NН-С(NН)-NН2, -NН-С(NН)-NΗ-W 2, -N(W 2)-С(NН)-NН-W 2 или -NH-C(W 2)-NH-W 2, где W 2 аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил, или Q1 - группа -СN, СO-NН2 или -CS-NН2, которая затем переносится в амидиногруппу (с образованием, например, Q1 = С(NН)-NН2 ) известными специалистам методами, или Q1 - группа NН2 или NH-W 2, где W 2 принимает вышеуказанные значения, причем аминогруппа переносится в гуанидиногруппу (с образованием Q1 = -NHC(NH)-NН2 ) после удаления W 2-группы деблокированием, когда Q1 - группа -NН-W 2 (в этом случае W 2группа должна быть ортогональна W 1--группе) известными специалистам методами. Конечные соединения могут быть получены любым из следующих способов в зависимости от характера применяемой Q1-группы. Снимают защитную группу-(ы) (когда Q1 - группа -С(NН)-NН2, -С(NW 2)-NН-W 2, -C(NH)-NH-W 2, -NН-С(NН)NН2, -ΝΗ-C(NΗ)-ΝΗ-W 2, -N(W 2)-С(NН)-NН-W 2 или -NH-C(NW 2)-NH-W 2) или селективно удаляют деблокированием W 1-группу (напр., когда Q1 - группа -C(NW 2)-NН-W 2, -С(NН)-NН-W 2, -NH-C(NH)-NH-W 2, N(W 2)-C(NH)-NH-W 2 или -NН-С(NW 2)-NН-W 2) W 2-группа в этом случае должна быть ортогональна Kw1группе) с последующим алкилированием по известным методикам N-концевого азота и при желании деблокированием известными методами. Способ llb Способ состоит из реакции с защищенной в N-окончании аминокислоты, выбранной исходя из значения А2 для формул I или V и полученной стандартными методами, с соединением формулы: применением стандартной уравнением реакции: методики присоединения пептидов, иллюстрируемой следующим где n, W 1 и Q1 принимают вышеуказанные значения, с последующим удалением W 1-группы деблокированием и присоединением N-концевой защищенной аминокислоты и получением в результате защищенного пептида, охарактеризованного в способе IIа. Синтез конечных пептидов осуществляют по методике способа IIа. Способ IIIа Способ состоит в реакции защищенного в N-окончании дипептида, выбранного исходя из значений А1 и A2 для формул I или V и полученного по стандартной методике соединения пептидов с соединением формулы: использованием стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: где n принимает значения, указанные для формулы I, r=0, 1, когда X1, Х2 и X4 - группа СН2, или r=0, когда X2 и X4 - группа СН2, и X2 отсутствует, W 1 - N-концевая аминозащитная группа, например: третбутилоксикарбонил или бензилоксикарбонил и Q2 - группа -C(NH)-NH2, -C(NW 2)-NH-W 2 или -С(NН)-NН-W 2, где W 2-аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил, или Q2 равна W 2, причем аминогруппа после удаления W 2 - группы деблокированием (в этом случае W 2 - группа должна быть ортогональна W 1 - группе) переносится затем в гуанидиногруппу использованием по известным методикам незащищенного, N-защищенного или N,N'-дизащищенного реагента гуанидирования (с образованием Q2 = -С(NН)-NН2 , -С(NW 2)-NН-W 2 или -С(NН)-NН-W 2). Конечные соединения могут быть получены любым из следующих способов, зависящих от характера применяемой Q2 - группы. Удаляют защитную группу-(ы) (когда Q2 - группа -С(NH)-NН2, -С(NW 2)-ΝΗ-W 2 или -С(NН)-NН-W 2) или селективно удаляют деблокированием W 1 - группу (напр., когда Q2 - группа -C(NW 2)-NHW 2, -С(NН)-NН-W 2, в этом случае W 2 - группа должна быть ортогональна к W 1 - группе) с последующим алкилированием известными методами N-концевого азота и при желании деблокированием по известным методикам. Способ lllb Способ состоит из реакции защищенной в N-окончании аминокислоты, выбранной исходя из значения А2 для формул I или V и полученной стандартными методами, с соединением формулы: использованием стандартной уравнением реакции: методики соединения пептидов, иллюстрируемой следующим где n, r, X1, Х2 и X4, W 1 и Q2 принимают вышеуказанные значения, с последующим удалением W 1 группы деблокированием и присоединением N-концевой аминокислоты в защищенной форме с образованием в результате защищенного дипептида, охарактеризованного в способе IIIа. Затем по методике способа IIIа продолжают синтез конечных пептидов. Способ IVа Способ состоит в реакции защищенного в N-окончании дипептида, выбранного исходя из значений А1 и 2 A для формул I или V и полученного стандартным методом соединения пептидов, с соединением формулы: использованием стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: где n принимает значения, указанные для формулы l, W 1 - N-концевая аминозащитная группа, например: трет-бутилоксикарбонил или бензилоксикарбонил и W 3-Η или аминозащитная группа, например: арилсульфонил, бензилоксикарбонил или третбутилоксикарбонил. Конечные соединения могут быть получены любым из следующих способов. Удаляют защитную группу-(ы) или селективно удаляют W 1 группу деблокированием (в этом случае W 1 - группа должна быть ортогональна к W 3 - группе) с последующим алкилированием N-концевого азота и при желании деблокированием. Способ IVb Способ состоит в реакции защищенной в N-окончании аминокислоты, выбранной из значений А2 для формул I или V и полученной стандартными методами методами, с соединением формулы: использованием стандартной методики присоединения пептидов, иллюстрируемой следующим уравнением реакции: где n, W 1 и W 3 принимают вышеуказанные значения, с последующим удалением W 1-группы деблокированием (W 1-группа должна быть ортогональна к W 3-группе) и присоединением N-концевой аминокислоты в защищенной форме с получением в результате защищенного пептида, охарактеризованного в способе IVа. Затем по методике способа IVа продолжают синтез конечных пептидов. Последующее описание предназначено для иллюстрации аспектов изобретения. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Общие экспериментальные методики Масс-спектры регистрируют на тройном квадрупольном масс-спектрометре Финнигэн ΜΑΤ ΤSQ 700, снабженном электронапыляемой поверхностью раздела. 1 Н ЯМР и 13С ЯМР определения проводят на спектрометрах БРУКЕР АС-Р 300 и ВРУКЕР AM 500, первый из которых работает при 1 Н частоте в 500,14МГц и 13С частоте в 125,76МГц, а второй при 1Н и 13С частоте соответственно в 300,13МГц и 75,46. Образцы массой 10-50мг растворяют в 0,6мл одного из следующих растворителей: СDСI 3 (изотопная чистота >99,8%), СD3ОD (изотопная чистота >99,95%), D2O (изотопная чистота >99,98%) или ДМСО-d6 (изотопная чистота >99,8%). Все растворители производства фирмы Др. Глазер АГ, Базель. Величины 1Н и 13С химических сдвигов в CDCI 3 и CD3OD даны относительно тетраметилсилана в качестве внешнего стандарта. 1Н химические сдвиги в D2O даны относительно натриевой соли 3(триметилсилил)-d4-пропановой кислоты, а 13С химические сдвиги в D2O приведены относительно 1,4диоксана (67,3част./млн), каждый из которых является внешним стандартом. Калибровка по внешнему стандарту может в отдельных случаях привести к небольшим отличиям в химических сдвигах по сравнению с калибровкой по внутреннему стандарту, однако, разница в 1Н химических сдвигах менее 0,02част./млн, а в 13С химических сдвигах менее 0,1част./млн. 1 Н ЯМР спектр пептидных последовательностей, содержащих пролин или "пролиноподобный остаток, часто отличается наличием резонанса из двух серий. Это явление соответствует существованию двух вносящих свой вклад в спектр конформеров относительно вращения по амидной связи, при этом пролин является N-частью амидной связи. Конформеры обозначены, как имеющие цис- и транс-конфигурацию. В соединениях изобретения последовательности (R)Сhа-Аzе-, (R)Cha-Pro- и (R)Cha-Pic- часто приводят к цис-транс-равновесию с преобладанием одного из конформеров (>90%). В этих случаях приводятся только 1 Н химические сдвиги основного конформера. И только в тех случаях, когда сигналы меньшего ротамера четко различимы, их приводят в ЯМР документации. Тот же критерий имеет место для NН-сигналов в CDCI 3, когда в ЯМР документации приводятся только четко разрешимые сигналы. Это означает, что число протонов, указанных для некоторых промежуточных соединений, будет меньше числа протонов, ожидаемых на основании химической формулы. Тонко-слойную хроматографию проводят на продажных стеклянных или алюминиевых пластинках, покрытых силикагелем 60F254, Фирмы Мерк. Визуальный анализ осуществляют сочетанием УФ облучения с последующим опрыскиванием раствором, приготовленным смешиванием 372мл EtOH (95%), 13,8мл концентрированной H2SO4, 4,2мл концентрированной уксусной кислоты и 10,2мл пметоксибензальдегидного или фосфомолибденового реактива (5-10%маc. в EtOH (95%)) и нагреванием. Колоночную хроматографию проводят на силикагеле 60 (40-63мм, 230-400меш) фирмы Мерк под давлением воздуха. Жидкостную хроматографию высокого разрешения с обращенными фазами (в Примерах сокращенно ОФЖХ) проводят на приборе Уотерс М-590, снабженном тремя колонками с обращенными фазами Кромсил 100, С8 (Эка-Нобель) различного размера: аналитическая (4,6мм x 250мм), полупрепаративная (1" (25,4мм) x 250мм) и препаративная (2" (50,8мм) х 500мм), с детектированием при 226нм. Сушку вымораживанием осуществляют с применением прибора Лэйбоулд-Герэус модели Лайовак GТ 2. Получение исходных продуктов Воc-(R)Рgl-ОН Получен из Η-(R)Ρgl-OΗ по методике, приведенной для получения Boc-(R)Cha-OH (см. ниже). Boc-(R)Cha-OH К раствору H-(R)Cha-OH (21,55г, 125,8ммоля) в 130мл 1Μ NaOH и 65мл ТГФ добавляют 30г (137,5ммоля) (Вос)2O и смесь перемешивают 4,5ч при комнатной температуре. После испарения ТГФ добавляют 150мл воды. Водную щелочную фазу промывают дважды EtOAc, затем подкисляют 2Μ KHSO4 и экстрагируют EtOAc (3x150мл). Объединенную органическую фазу промывают водой, рассолом и сушат (Nа2SO4). Испарением растворителя получают 30,9г (90,5%) заглавного соединения в виде белого твердого вещества. Воc-(R)Нор-ОН Получен по методике, приведенной для Boc-(R)Chа-ОН, на основе Н-(R)Нор-ОН. 1 Н-ЯМР (300МГц, CDCI 3) d : 1,45 (с, 9Н), 2 (м, 1Н) , 2,22 (м, 1Н) , 2,75 (ш.т, 2Н) , 4,36 (ш.с, 1Н), 5,05 (ш.с, 1Н), 7,15-7,33 (м, 5Н). 4-(трет-Бутилоксикарбониламиноэтил)пиридин К раствору 10,81г (100ммолей) 4-аминометилпиридина в 100мл ТГФ в течение 20 минут добавляют при 10°С раствор 24г (110ммолей) (Вос)2O в 70мл ТГФ. Раствор оставляют нагреваться до комнатной температуры и перемешивают 4ч (в ходе реакции образуется осадок и взвесь приобретает красную окраску). Растворитель удаляют, остаток растворяют в EtOAc и фильтруют через силикагель. Испарением растворителя получают заглавное соединение в виде красного масла, который постепенно кристаллизуется. Сырой продукт используют без дополнительной очистки. 1 Н-ЯМР (300МГц, CDCI 3) d : 1,45 (с, 9Н), 4,32 (д, 2Н), 5,05 (ш.с, (NН)), 7,2 (д, 2Н), 8,55 (д, 2Н). 4-Аминометил-1-(N-бензилоксикарбониламидино)бензол (Н-Раb(Z)) (I) 4-Цианобензилазид К раствору 49,15г (251ммоль) 4-цианобензилбромида в 200мл ДМФА добавляют при комнатной температуре раствор 20,23г (0,31моля) азида натрия в 50мл воды. Протекает экзотермическая реакция, и спустя 1,5ч реакционную смесь разбавляют 200мл толуола (Внимание! Во избежании отделения потенциально взрывоопасных азидов перед добавлением воды к реакционной смеси рекомендуется добавлять толуол) и 500мл воды. Водную фазу экстрагируют дополнительным количеством толуола (2x50мл). Объединенные органические экстракты промывают водой (2x50мл), и рассолом, сушат (MgSO4) и фильтруют. Раствор используют как таковой на следующей стадии. 1 Н-ЯМР (300МГц, CDCI 3) d : 4,4 (с, 2Н), 7,4 (д, 2Н), 7,7 (Д, 2Н). (ll) 4-Амидинобензилазид В смесь 250мл абсолютного этанола и раствора со стадии (l) (примерно 200мл) пробулькивают при 5°С до насыщения хлористый водород. Выдерживанием 24ч при 8°С и испарением большей части растворителя с последующим осаждением добавлением безводного эфира получают белые кристаллы, которые отфильтровывают и растворяют в 1,8л спиртового аммиака. Спустя 48ч большую часть растворителя удаляют и после добавления 200мл 3,75Μ раствора NаОН осаждается в виде бесцветных кристаллов 4-амидинобензилазид. Кристаллы отфильтровывают и в этот момент выход 4амидинобензилазида составляет 22,5г (всего 51%). Гидрохлорид Этилимидатобензилазида 1 Н-ЯМР (500МГц, CD3OD) d : 1,6 (т, 3Н), 4,5 (с, 2Н), 4,65 (к, 2H), 4,8 (ш.с, 2Н), 7,6 (д, 2Н), 8,1 (д, 2Н). 4-Амидинобензилазид 1 Н-ЯМР (500МГц, CDCI 3) d : 4,3 (с, 2Н), 5,7 (ш.с, 3Н), 7,3 (д, 2Н), 7,6 (д, 2Н). 13 С-ЯМР (125МГц, CDCI 3) d : углерод амидиногруппы: 165,5. (lll) 4-(Бензилоксикарбониламидино)бензилазид Кристаллы со стадии (ll) растворяют в 500мл хлористого метилена, полученный раствор сушат (K2СО3) и после фильтрования добавляют 27мл (194ммоля) триэтиламина. К перемешиваемому раствору медленно прибавляют 25мл бензилхлорформата с охлаждением реакционной смеси в бане со льдом. Через 30 минут добавляют еще 2мл бензилхлорформата и перемешивание продолжают 30 минут. После добавления воды в водной фазе добавлением 2Μ НСI устанавливают рН 7. Органическую фазу сушат (MgSO4) и растворитель удаляют в вакууме. Наконец из смеси эфир-хлористый метилен-тексан выделяют в виде бесцветных кристаллов 4-(бензилоксикарбониламидино)бензилазид. 1 Н-ЯМР (500МГц, CDCI 3) d : 4,4 (с, 2Н), 5,3 (с, 2Н), 6,3-7 (ш.с, 1Н), 7,3-7,4 (м, 5Н), 7,5 (д, 2Н), 7,9 (д, 2Н), 9,3-9,6 (ш.с, 1Н). 13 С-ЯМР (125МГц, CDCI 3) d : 167,5 (углерод амидиногруппы). (IV) 4-аминометил-1-(N-бензилоксикарбониламидино)бензол (Н-Раb(Z)). К раствору 4-(бензилоксикарбониламидина)бензилазида со стадии (III) в 160мл ТГФ добавляют при комнатной температуре 26,3г (100ммолей) трифенилфосфина. Спустя 16ч добавляют еще 6,6г (25ммолей) трифенилфосфина и перед удалением растворителя в вакууме раствор оставляют на 4ч. Остаток растворяют в хлористом метилене и экстрагируют 2Μ НСI. Водную фазу промывают хлористым метиленом и эфиром и затем подщелачивают 3,75Μ раствором гидроксида натрия. Экстрагированием хлористым метиленом с последующей сушкой (K2СО3) и удалением растворителя в вакууме получают 20г (общий выход на исходный цианобензилбромид 28%) желтого масла, затвердевающего при стоянии. 1 Н-ЯМР (500МГц, CDCI 3) d : 1,2-2,2 (ш.с, 2Н), 3,8 (с, 2Н), 5,2 (с, 2Н), 7,2-7,35 (м, 5Н), 7,4 (д, 2Н), 7,8 (д, 2Н), 9,1-9,6 (ш.с, 1Н). 13 С-ЯМР (125МГц, CDCI 3) d : 164,6 и 168,17 (углероды амидиногруппы и карбонила). Н-Рig(Z)2 (I) 4-(трет-Бутилоксикарбониламинометил)пиперидин К раствору 17,7г 4-трет-бутилоксикарбониламинометилпиридина в 125мл МеОН добавляют 2г 5% RhAI 2O3 и смесь гидрируют примерно сутки при 0,34МПа. 1Н-ЯМР спектр указывает на неполное гидрирование. Поэтому катализатор отфильтровывают, растворитель удаляют в вакууме, остаток растворяют в 100мл уксусной кислоты и после добавления 2г 5% Rh-AI 2O3 смесь гидрируют 4 дня при 0,34МПа. Катализатор отфильтровывают и большую часть уксусной кислоты удаляют в вакууме. После добавления к остатку 50мл воды смесь подщелачивают 5Μ NаОН и водную фазу экстрагируют СН2Сl2 (1х200мл + 1x1x100мл). Объединенную органическую фазу промывают 25мл воды и сушат (MgSO4). Испарением растворителя получают 17,2г коричневатого масла, которое растворяют в 50мл диэтилового эфира. Добавлением 200мл пентана получают осадок, фильтрование которого дает 7,7г коричневого порошка. Испарением маточного раствора получают 7г белого масла. Коричневый порошок растворяют в 100мл EtOAc и органическую фазу промывают 1Μ KНSO4 (1x50мл + 1x25мл). Объединенную кислую фазу подщелачивают 2Μ NaOH и экстрагируют EtOAc (1x200мл + 1x75мл). Объединенную органическую фазу сушат и после испарения получают в виде белого порошка 5,2г заглавного соединения. Обработкой вышеуказанного белого масла, полученного из маточного раствора, тем же способом дополнительно получают 3,4г продукта. Общий выход 40%. 1 Н-ЯМР (500МГц, CDCI 3, смесь двух ротамеров, 3:1) d : (основной ротамер) 1,11 (дк, 2Н), 1,44 (с, 9Н), 1,49-1,6 (м, 1Н), 1,63-1,7 (м, 2Н), 2,58 (дт, 2Н), 2,93-3,03 (м, 2Н), 3,07 (м, 2Н), 4,75 (ш.с, 1Н (NН)). Разрешаемые сигналы, создаваемые меньшим ротамером, появляются при d 1,21 (дк) и 1,91 (дт). (II) Вос-Рig(Z)2 К раствору 2г (9,33ммоля) 4-(трет-бутилоксикарбониламинометил)пиперидина в 60мл СН3СН добавляют 3,34г (9,33ммоля) N,N-(дибензилоксикарбонил)метилизомочевины и смесь перемешивают 22ч при 60°С. Растворитель испаряют и остаток растворяют в EtOAc. Органическую фазу промывают 1Μ KHSO4 (2x20мл), водой (1x20мл), рассолом (1x20мл) и сушат (MgSO4). Испарением растворителя с последующей колоночной хроматографией с применением в качестве элюента смеси петролейный эфирEtOAc (1:1) получают 2,43г (50%) целевого продукта. 1 Н-ЯМР (500МГц, CDCI 3) d : 1,19-1,31 (м, 2Н), 1,43 (с, 9Н), 1,63-1,8 (м, 3Н), 2,66-3,05 (м, 4Н), 3,7-4,5 (ш.с, 2Н), 4,65 (ш.т, 1Н (NH)), 5,13 (с, 4Н), 7,2-7,4 (м, 10Н), 10,5 (ш.с, 1Н (NН)). Отдельные сигналы, в особенности для пиперидинового цикла избирательно уширены вследствие процесса внутримолекулярного обмена. Особенно это заметно для 2- и 6-СH2-групп пиперидинового цикла, дающих широкий пик в интервале 3,7-4,5ч/млн. (III) H-Pig(Z)2 Раствор 163мг (0,31ммоля) Boc-Pig(Z)2 в 5мл EtOAc, насыщенного НСI (г), перемешивают 3ч и 20 минут при комнатной температуре. Растворитель испаряют и остаток растворяют в 30мл CH2CI 2. Органическую фазу промывают 5мл 2Μ NаОН, 5мл воды, 5мл рассола и сушат (MgSО4). Испарением растворителя получают 100мг (76%) заглавного соединения. 1 Н-ЯМР (500МГц, CDCI 3) d : 1,18-1,37 (м, 2Н), 1,46-1,63 (м, 1Н), 1,68-1,83 (м, 2Н), 2,57 (д, 2Н), 2,86-3,03 (м, 2Н), 3,7-4,5 (ш.с, 2Н), 5,13 (с, 4Н), 7,2-7,4 (м, 10Н). Отдельные сигналы, в особенности для пиперидинового цикла избирательно широки вследствие процесса внутримолекулярного обмена. Особенно это заметно для 2- и 6-СН2-групп пиперидинового цикла, дающих широкий пик в интервале 3,7-4,5част./млн. 4-Аминометил-1-(N-бензилоксикарбониламидино)циклогексан (Н-Рас(Z) x 2НСl) (l) N-/N-4-(Бензилоксикарбонил)амидинобензил/-трет-бутилкарбамат К охлаждаемому льдом раствору 1,81г (6,4ммоля) 4-(бензилоксикарбонил)амидинобензиламина и 1мл (7,1ммоля) триэтиламина в 25мл хлористого метилена при перемешивании добавляют 1,466г (6,7ммоля) (Вос)2O. Спустя 20 минут добавляют дополнительное количество хлористого метилена и смесь промывают 5%-ой уксусной кислотой и 10%-ым раствором карбоната натрия. Сушкой (сульфатом магния) и удалением растворителя в вакууме получают остаток, который может быть кристаллизован из смеси хлористый метилен-гексан. Выход 1,66г (68%). (II) N-/N-4-Амидинобензил)-трет-бутилкарбамат Смесь 1,6г (4,2ммоля) N-/4-(бензилоксикарбонил)амидинобензил/-трет-бутилкарбамата, 5мл уксусной кислоты и 160мг 10% палладия на угле в 50мл этанола перемешивают 2ч в атмосфере водорода. Катализатор удаляют фильтрованием через целит и удалением растворителя в вакууме получают ацетат заглавного соединения с количественным выходом. (III) N-/N-Амидиноциклогексилметил/-трет-бутилкарбамат Ацетат N-/4-амидинобензил/-трет-бутилкарбамата (17ммолей) гидрируют в 100мл метанола гидрируют 20ч при 3,4МПа в присутствии 863мг 5% родия на оксиде алюминия. Катализатор отфильтровывают и растворитель удаляют в вакууме. Остаток растворяют в воде и раствор подщелачивают гидроксидом натрия. Последующим экстрагированием хлористым метиленом, сушкой объединенной органической фазы (карбонат калия) и удалением растворителя в вакууме получают 3,8г (87%) заглавного соединения. (IV) N-/N-4-(Бензилоксикарбонил)амидиноциклогексилметил/-трет-бутилкарбамат К перемешиваемому при О°С раствору 2,04г (8ммолей) N-/4-амидиноциклогексил/карбамата, 1,23мл (8,8ммоля) триэтиламина и 197мг ДМАП в 40мл хлористого метилена добавляют 1,25мл (8,8ммоля) бензилхлорформата. Спустя 10 минут реакционную смесь разбавляют хлористым метиленом и экстрагируют водой, разбавленной уксусной кислотой и раствором гидрокарбоната натрия. Органическую фазу наносят на колонку оксида кремния и последующим элюированием хлористым метиленом, содержащим возрастающие количества этилацетата, получают 2,49г (80%) заглавного соединения. (V) 4-Аминометил-1-(N-бензилоксикарбониламидино)циклогексан (Н-Рас(Z) х 2НСI). Через раствор 2г (5,1ммоля) N-/4-(бензилоксикарбонил)-амидиноциклогексилметил/-третбутилкарбамата в 40мл этилацетата пропускают хлористый водород. Спустя 10 минут добавляют метанол и после удаления в вакууме некоторого количества растворителя происходит кристаллизация дигидрохлорида заглавного соединения. 4-Аминометил-1-(N-бензилоксикарбониламидино)пиперидин (Η-Pig(Z) x НСl) (l) 4-(N-трет-Бутилоксикарбониламинометил)-1-(N-бензилоксикарбониламидино)пиперидин (Вос-Рig(Z)) В 25мл этанола смешивают 7,8г (36,4ммоля) 4-(N-трет-бутилоксикарбониламинометил)пиперидина и 8,98г (40ммолей) N-бензилоксикарбонил-S-метилизотиомочевины. Смесь нагревают шесть часов при 6070°С и оставляют на два дня при комнатной температуре. Растворитель испаряют и остаток растворяют в CH2CI 2. Органический слой промывают дважды 0,3 МSКН O4 и один раз рассолом. Объединенный органический слой сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента ступенчатого градиента СН2СI 2/МеOН (100/0, 97/3, 95/5, 90/10) получают 5,22г (37%) заглавного соединения. (II) Н-Рig(Ζ) х НСl (4-аминометил-1-(Н-бензилоксикарбониламидино)пиперидин В 100мл этилацетата, насыщенного НСl (г), растворяют 5,22г (13,5ммоля) Вос-Рig(Z). Смесь оставляют на один час и затем испаряют. Остаток растворяют в воде и промывают смесью диэтилового эфира с этилацетатом. Сушкой вымораживанием водного слоя получают 4г (91%) заглавного соединения. 1 Н-ЯМР (D2O, 300МГц) d : 1,4-1,6 (м, 2Н), 2,05 (ш.д, 2Н), 2,19 (м, 1Н), 3,07 (д, 2Н), 3,34 (ш.т, 2Н), 4,08 (ш.д, 2Н), 5,4 (с, 2Н), 7,5-7,63 (м, 5Н). МС: m/z 291 (М+ + 1). 4-Аминоэтил-1-бензилоксикарбониламидинопиперидин (Н-Rig(Ζ)) (l) 1-Бензилоксикарбониламидино-4-гидроксиэтилпиперидин Смесь 6,2г (0,028моля) 4-гидроксиэтилпиперидина и 3,6г (0,028моля) N-бензилокеикарбонил-Sметилизотиомочевины в 50мл ацетонитрила кипятят примерно сутки. Испарением и колоночной хроматографией на силикагеле с элюированием этилацетатом получают 3,5г (41%) заглавного соединения. 1 Н-ЯМР (300МГц, CDCI 3) d : 1,1-1,85 (м, 7Н), 2,83 (ш.т, 2Н), 4,7 (ш.т, 2Н), 4,18 (ш.д, 2Н), 5,12 (с, 2Н), 6,97,2 (м, 2Н), 7,2-7,5 (м, 5Н). (II)-1-Бензилоксикарбониламидино-4-мезилоксиэтилпиперидин К охлаждаемому льдом раствору 3,5г (0,0115моля) 1-бензилоксикарбониламидино-4гидроксиэтилпиперидина, 1,15г (0,0115моля) триэтиламина в 40мл хлористого метилена и 10мл тетрагидрофурана прибавляют по каплям 1,3г (0,0115моля) мезилхлорида. Реакционную смесь перемешивают 1ч. Смесь переносят в воду и органический слой отделяют. Водный слой экстрагируют хлористым метиленом, объединенные органические слои сушат (Nа2SО4) и испаряют. Продукт используют на следующей стадии без дополнительной очистки. Выход 4,4г (100%). 1 Н-ЯМР (500МГц, CDCI 3) d : 1,15-1,3 (м, 2Н), 1,65-1,8 (м, 5Н), 2,84 (ш.т, 2Н), 3,01 (с, 3Н), 4,2 (ш.д, 2Н), 4,27 (т, 2Н), 5,12 (с, 2Н), 7,1-7,5 (м, 7Н). (III) 4-Азидоэтил-1-бензилоксикарбониламидинопиперидин К раствору 4,4г (0,0115моля) сырого 1-бензилоксикарбониламидино-4-мезилоксиэтилпиперидина в 100мл диметилформамида добавляют 4,5г (0,069моля) азида натрия и смесь нагревают 2,5ч при 100°. Затем смесь переносят в воду и трижды экстрагируют этилацетатом. Объединенную органическую фазу промывают водой, сушат (Nа2SO4) и испаряют. Остаток подвергают колоночной хроматографии на силикагеле с применением в качестве элюента смеси этилацетат-гептан (1:1). Выход 3г (79%). 1 Н-ЯМР (500МГц, CDCI 3) d : 1,2 (дк, 2Н), 1,5-1,8 (м, 5Н), 2,85 (дт, 2Н), 3,35 (т, 2Н), 4,22 (шд. 2Н), 5,13 (с, 2Н), 6,9-7,2 (ш., 2Н), 7,2-7,45 (м, 5Н). (IV) 4-Аминоэтил-1-бензилоксикарбониламидинопиперидин (Н-Rig(Z)) К 30мл воды добавляют 0,4г 10% Pd-С. В 30мл воды растворяют 1г (0,031моля) боргидрида натрия и раствор осторожно прибавляют к ожлаждаемой льдом взвеси Pd-C в воде. В 80мл тетрагидрофурана растворяют 2,9г (8,8ммоля) 4-азидоэтил-1-бензилоксикарбониламидинопиперидина и полученный раствор по каплям прибавляют к охлаждаемой льдом вышеуказанной водной взвеси. После перемешивания 4ч при комнатной температуре смесь вновь охлаждают льдом, после чего добавляют 30мл 2Μ НСl. Смесь фильтруют через целит и целит ополаскивают дополнительным количеством воды. Тетрагидрофуран испаряют и водную фазу промывают этилацетатом. После подщелачивания водной фазы 2Μ NаОН ее трижды экстрагируют хлористым метиленом. Объединенную органическую фазу промывают водой, сушат (Nа2SО4) и испаряют. Продукт используют на следующей стадии без дополнительной очистки. 1 Н-ЯМР (500МГц, CDCI 3) d : 1,1-1,5 (м, 6Н), 1,55-1,65 (м, 1Н), 1,73 (ш.д, 2Н), 2,72 (ш., 2Н), 2,81 (дт, 2Н), 4,2 (ш.д, 2Н), 5,12 (с, 2Н), 6,9-7,2 (ш., 2Н), 7,2-7,5 (м, 2Н). (3RS)-1-(N-Бензилоксикарбониламидино)-3-аминометилпирролидин (H-(R,S)Nig(Z)) (I) (3RS)-3-Гидроксиметилпирролидин (3RS)-1-Бензил-3-гидроксиметилпирролидин (16,4г, 0,0857моля) (H-R,S)Hig(Z) (I), см выше) смешивают с 1,6г Pd-С (10%), 5мл воды и 150мл этанола и смесь гидрируют при 0,26МПа примерно сутки. После фильтрования через гайфло и испарения растворителя 1 Н-ЯМР указывает на неполноту реакции. Продолжение гидрирования при 0,26МПа в присутствии 1,6г Pd-C (10%) в 5мл воды и 150мл этанола в течение трех дней завершают восстановление. Фильтрованием через гайфло и испарением растворителя с количественным выходом получают заглавное соединение. (ll) (3RS)-1-(N-Бензилоксикарбониламидино)-3-гидроксиметилпирролидин В толуоле растворяют 1,01г (0,01моля (3RS)-3-гидроксиметилпирролидина и 2,29г (0,011моля) Nбензилоксикарбонил-О-метилизомочевины (амин не очень растворим в толуоле) и смесь нагревают 3 часа при 60°С с последующим перемешиванием примерно сутки при комнатной температуре. После испарения смеси 1Н-ЯМР указывает на неполноту реакции. Поэтому смесь растворяют в 15мл ацетонитрила и нагревают три часа при 60°С с последующим перемешиванием при комнатной температуре примерно сутки. Растворитель испаряют и остаток растворяют в СН2СI 2, промывают водой один раз, сушат (Nа2SO4) и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента СН2СI 2-МеOН (95:5) получают 0,7г (25 %) продукта. МС: m/z 278 (М+ + 1). (lll) (3RS)-1-(N-Бензилоксикарбониламидино)-3-мезилоксиметилпирролидин В 15мл смеси диэтиловый эфир-СH2СI 2 (1:1) растворяют 0,7г (2,53ммоля) (3RS)-1-(Nбензилоксикарбониламидино)-3-гидроксиметилпирролидина и 0,7мл (5,05ммоля) триэтиламина и смесь охлаждают до 0°С. Затем медленно прибавляют 0,25мл (3,29ммоля) метансульфонилхлорида в 3мл диэтилового эфира и реакционную смесь перемешивают три часа при 0°С. Растворитель испаряют, остаток растворяют в этилацетате и экстрагируют 0,3Μ раствором KHSO4. Водный слой промывают один раз CH2CI 2. Водный слой нейтрализуют 10Μ раствором NaOH и экстрагируют дважды CH2CI 2. Объединенный органический слой сушат (Na2SO4), фильтруют и после испарения получают 0,45г (50%) заглавного соединения. (IV) (3RS)-1-(Н-Бензилоксикарбониламидино)-3-азидометилпирролидин В 10мл диметилформамида растворяют 0,45г (1,27ммоля) (3RS)-1-(N-бензилоксикарбониламидино)-3метилоксиметилпирролидина и 0,124г (1,9ммоля) азида натрия и смесь нагревают четыре часа при 60°С с последующим перемешиванием примерно сутки при комнатной температуре. После добавления воды смесь дважды экстрагируют смесью толуол-этилацетат (2:1). Объединенный органический слой сушат (Na2SО4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента СН2Сl2-МеOН (95:5) получают 0,262г (68%) продукта. МС: m/z 303 (М+ + 1). (v) (3RS)-1-(n-Бензилоксикарбониламидино)-3-аминометилпирролидин (Н-(R,S)Nig(Z)) Смешивают 32мг Pd-C (10%) и 2,6мл Н2О и осторожно пропускают ток азота. Добавляют 98мг NаВН4 в 2,6мл H2O с последующим медленным прибавлением 262мг (0,87ммоля) (3RS)--1-(Nбензилоксикарбониламидино)-3-мезилоксиметилпирролидина в 7мл МеОН. После выдерживания один час к смеси добавляют 5мл 1Μ НСI и фильтруют через гайфло. Органический растворитель испаряют при пониженном давлении, оставшийся водный слой один раз промывают этилацетатом, подщелачивают раствором NаОН и несколько раз экстрагируют CH2CI 2. Объединенный органический слой сушат (Nа2SO4), фильтруют и после испарения получают 130мг (54%) продукта. МС: m/z 277 (М+ + 1). (3RS)-1-(N-Бензилоксикарбониламидино)-3-аминоэтилпирролидин (Н-(R,S)Hig(Ζ)) (l) (3RS)-1-Бензил-3-гидрометилпирролидин К взвеси 6,22г литийалюминийгидрида в 160мл диэтилового эфира в атмосфере аргона медленно прибавляют 25,2г (0,1063моля) (3RS)-1-бензил-2-оксо-4-метоксикарбонилпирролидина. После перемешивания примерно сутки смесь кипятят один час. Реакционную смесь охлаждают до комнатной температуры, добавляют 0,2г Nа2SO^ х 10Н2О с последующим медленным прибавлением в указанном порядке 6мл воды, 18мл 3,75Μ раствора NаОН и 6мл воды. Из взвеси удаляют избыток воды добавлением Nа2SO4-целлита, фильтруют и после испарения получают 20,3г продукта. 1 Н-ЯМР (СDСI 3, 300МГц) d : 1,64-1,77 (м, 1Н), 1,93-2,07 (м, 1Н), 2,27-2,4 (м, 2Н), 2,51 (дд, 1Н), 2,62 (дд, 1Н), 2,82 (м, 1Н), 3,52 (дд, 1Н), 3,59 (с, 2Н), 3,67 (дд, 1Н), 7,15-7,4 (м, 5Н). (II) (3RS)-1-Бензил-3-хлорметилпирролидин К кипящему раствору 15,3г (0,08моля) (3RS)-1-бензил-3-гидроксиметилпирролидина в 220мл CHCI 3 медленно прибавляют тионилхлорида в 60мл CHCI 3 и кипячение продолжают один час. После испарения смеси остаток растворяют в воде. Водный слой промывают этилацетатом и подщелачивают 62Μ раствором NаОН. Водный слой трижды экстрагируют этилацетатом, объединенный органический слой сушат (Na2SO4), фильтруют и после испарения с количественным выходом получают продукт (16,8г). 1 Н-ЯМР (СDСI 3, 300МГц) d : 1,55 (м, 1Н), 2,05 (м, 1Н), 2,38 (дд, 1Н) , 2,48-2,64 (м, 3Н; там же 2,58 (т, 2Η)), 2,73 (дд, 1Н), 3,51 (д, 2Н), 3,6, (с, 2Н), 7,2-7,4 (м, 5Н). (lll) (3RS)-1-Бензил-3-цианометилпирролидин В 250мл диметилсульфоксида растворяют 16,8г (0,08моля) (3RS)-1-бензил-3-хлорметилпирролидина и 5,88г (0,12моля) цианида натрия. Смесь перемешивают два дня при 60°С и одну неделю при комнатной температуре. После добавления воды смесь трижды экстрагируют этилацетатом. Объединенный органический слой промывают рассолом, сушат (Na2SO4), фильтруют и после испарения получают 14,7г (92%) продукта. 1 Н-ЯМР (СDСI 3, 500МГц) d : 1,55 (м, 1Н), 2,13 (м, 1Н), 2,35 (дд, 1Н), 2,42 (т, 2Н), 2,44-2,59 (м, 2Н), 2,65 (м, 1Н), 2,73 (дд, 1Н), 3,61 (с, 2Н), 7,2-7,4 (м, 5Н). (IV) (3RS)-1-Бензил-3-аминоэтилпирролидин К взвеси 2,94г литииалюминийгидрида в 74мл диэтилового эфира медленно прибавляют в атмосфере аргона 14,7г (0,0734моля) (3RS)-1-бензил-3-цианометилпирролидина, растворенного в 220мл диэтилового эфира. После перемешивания смеси примерно сутки добавляют 6мл воды, 18мл 3,75Μ раствора NаОН и 6мл воды. Взвесь сушат в присутствии Na2SO4-целлита с удалением избытка воды, фильтруют с отсосом и после испарения получают 14,84г (99%) продукта. 1 Н-ЯМР (СDСI 3, 300МГц) d : 1,41 (м, 1Н), 1,51 (к, 2Н), 1,9-2,1 (м, 2Н; там же 2,05 (дд, 1Н)), 2,18 (м, 1Н), 2,43 (м, 1Н), 2,55-2,75 (м, 3Н), 2,8 (каждущийся т, 1Η), 3,58 (кажущийся д, 2Н), 7,15-7,4 (м, 5Н). (V) (3RS)-1-Бензил-3-(N-трет-бутилоксикарбониламиноэтил)-пирролидин К смеси 14,84г (0,0726моля) (3RS)-1-бензил-3-аминоэтилпирролидина, 72,6мл 1Μ раствора NaOH, 6мл воды и 145мл ТГФ добавляют 17,44г (0,08моля) ди-трет-бутилдикарбоната и смесь перемешивают примерно сутки. Раствор концентрируют и трижды экстрагируют этилацетатом. Объединенный органический слой промывают рассолом, сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента ступенчатого градиента СН2Сl2МеOН (95/5, 80/10) получают 14,69г (80 %) продукта. 1 Н-ЯМР (СDСI 3, 300МГц) d : 1,25-1,65 (м, 12Н; там же 1,4 (с, 9Н)), 1,9-2,25 (м, 3Н), 2,46 (м, 1Н), 2,67 (м, 1Н), 2,8 (кажущийся т, 1Н), 3,09 (м, 2Н), 3,59 (с, 2Н), 4,6 (ш.с, NН), 7,15-7,35 (м, 5Н). (VI) (3RS)-3-(N-трет-Бутилоксикарбониламиноэтил)пирролидин (3RS)-1-бензил-3-(N-трет-бутилоксикарбонил)аминоэтил)-пирролидин (3,1г, 0,01моля) гидрируют при 0,28МПа в присутствии 0,6г катализатора Пирлмана (Рd(ОН)2) в 46мл этанола примерно сутки. После удаления катализатора фильтрованием через целит и испарением растворителя 1Н-ЯМР показал незавершенность реакции. Поэтому еще раз добавляют 0,6г катализатор Пирлмана в 40мл этанола (95%) и смесь выдерживают примерно сутки под давлением Η2 в 0,28МПа. Фильтрованием через целит и испарением растворителя с количественным выходом получают продукт (2,18г). МС: m/z 214 (М+) (VII) (3RS)-1-(N-Бензилоксикарбониламидино)-3-аминоэтилпирролидин (Н-(RS)Hig(Z)) В 30мл толуола растворяют 2,18г (0,0102моля) (3RS)-3-(N-третбутилоксикарбониламиноэтил)пирролидин и 2,81г (0,0125моля) N-бензилоксикарбонил-Sметилизотиомочевины и смесь нагревают восемь часов при 60-70°С с последующим перемешиванием один день при комнатной температуре. После добавления 0,3Μ раствора KHSO4 водный слой промывают смесью толуола с этилацетатом и оставляют на 2 дня, в течение которых происходит удаление Восгруппы. Кислотную водную фазу подщелачивают и четырежды экстрагируют CH2CI 2. Объединенный органический слой сушат (Na2SO4) и после испарения получают 2г (51%) заглавного соединения. 1 Н-ЯМР (СDСI 3, 330К, 300МГц) d : 1,45-1,7 (м, 3Н), 2,07 (м, 1Н), 2,26 (м, 1Н), 2,74 (т, 2Η), 3 (кажущийся т, 1Η), (3,33 (кажущийся к, 1Н), 3,45-3,8 (м, 2Н), 5,12 (с, 2Н), 6,72 (ш.с, 2 NН), 7,15-7,45 (м, 5Н). (4RS)-1,3-диаза-2-тозилимино-4-аминоэтилциклогексан (H-(R,S)ltp(TS)) (l) (4RS)-1,3-диаза-2-тозилимино-4-карбоксициклогексан Получен по методике, приведенной в Journal of Org. Chem. стр. 46, 1971. (ll) (4RS)-1,3-диаза-2-тозилимино-4-гидроксиметилциклогексан К охлажденной взвеси (температура бани со льдом) 9,9г (33ммоля)(4RS)-1,3-диаза-2-тозилимино-4карбоксициклогексана в 330мл сухого ТГФ осторожно прибавляют 12,9г (345ммолей) LiАlН4 и реакционную смесь перемешивают примерно сутки при комнатной температуре. Реакционную смесь обрабатывают согласно рекомендациям Физер и Физера, напр., добавлением к смеси 12,9г воды, 38,7г 3,75Μ NaΟΗ, 12,9г воды, CH2CI 2 и целлита с последующим фильтрованием. Испарением растворителя получают 7г (75%) целевого продукта. МС: m/z 284 (М+ + 1). (lll) (4RS)-1,3-диаза-2-тозилимино-4-мезилоксиметилциклогексан К охлажденной взвеси (температура бани со льдом 7г (24,7ммоля) (4RS)-1,3-диаза-2-тозилимино-4гидроксиметилциклогексана в 6,9мл (49,4ммоля) триэтиламина и 125мл CH2CI2 осторожно прибавляют 2,9мл (37,1ммоля) ΜsСI. Спустя 1ч 15мин добавляют воду, органический слой отделяют, сушат (Na2SO4), фильтруют и после испарения с количественным выходом получают заглавное соединение. МС: m/z 362 (М+ + 1). (IV) (4RS)-1,3-диаза-2-тозилимино-4-цианометилциклогексан В 75мл ДМСО растворяют 8,9г (24,7ммоля) (4RS)-1,3-диаза-2-тозилимино-4мезилоксиметилциклогексана и 1,3г (27,2ммоля) NaCN. После перемешивания 60 часов при 60°С добавляют еще NаСN в количестве 0,31г (6ммолей) и раствор перемешивают три часа при 65°С. После добавления 150мл воды из раствора выпадают кристаллы. Фильтрованием и сушкой кристаллов получают 5,4г (75%) целевого продукта. МС: m/z 293 (М+ + 1). (4RS)-1,3-Диаза-2-тозилимино-4-аминоэтилциклогексан (Н-(R,S)ltp(TS)) К охлажденной взвеси (температура бани со льдом) 2,4г (8,2ммоля) (4RS)-1,3-диаза-2-тозилимино-4цианометилциклогексана в 90мл ТГФ осторожно прибавляют 935мг LiAIH4. После перемешивания 2 часа добавляют 1г Н2О, 3г 3,75Μ NаОН, 1г Н2O, Na2SO4), целлит и СН2СI 2. Фильтрованием смеси и удалением растворителя в вакууме получают 2,2г (80%) целевого продукта. 1 Н -ЯМР (500МГц, MeOD) d : 1,52-1,71 (м, 3Н), 1,88-1,96 (м, 1Н), 2,37 (с, 3Н), 2,64-2,73 (м, 2Н), 3,2-3,4 (м, 2Н, частично перекрывается сигналами растворителя), 3,44-3,53 (м, 1Н), 7,28 (д, 1Н), 7,71 (д, 2Н). (4S)-1,3-диаза-2-тозилимино-4-аминоэтилциклогексан (Н-(S)ltp(TS)) Получен на основе оптически чистой 2,4-диаминомасляной кислоты по методике, приведенной для получения Н-(R,S)ltp(TS). 1 Н -ЯМР (300,13МГц, СDСI 3) d : 0,97-1,15 (ш.с, 1Н), 1,48-1,69 (м, 3Н), 1,84-1,95 (м, 1Н), 2,37 (с, 3Н), 2,682,82 (м, 1Н), 2,86-2,98 (м, 1Н), 3,22-3,44 (м, 2Н), 3,45-3,58 (м, 1Н), 7,19 (д, 2Н), 7,19 (д, 2Н), 7,72 (д, 2Н). 13 С-ЯМР (300,13МГц, СDСI 3) d : 154,5 (углерод гуанидино-группы). H-Aze-OEt: x НСl Получен из Н-Аzе-ОН по методике синтеза Η-Ρi c-OEt x НСl (см. ниже). H-Aze-OMe x HCl Получен по методике, приведенной в работе: Seebach D., и др., Liebigs Ann. Сhem. стр. 687, 1990. H-Pab(Z) x НСl Получен прибавлением 1 молярного эквивалента 5Μ НСl в изопропаноле к раствору сырого H-Pab(Z) в EtOH (около 1г/10мл) и немедленным осаждением из раствора Н-Раb(Z) x НСl. После фильтрования осадок промывают 2 раза холодным EtOH и сушкой получают с количественным выходом заглавное соединение. Н-Рic-OEt х НСl В 100мл абс. этанола образуют взвесь L-пипеколиновой кислоты (4г, 0,031моля), через которую осторожно пробулькивают НСI (г) до образования прозрачного раствора. Раствор охлаждают в бане со льдом и к нему в течение 15 минут по каплям прибавляют 17мл тионилхлорида. Баню удаляют и смесь кипятят 2,5ч. После испарения растворителя получают с количественным выходом продукт в виде его гидрохлорида. 1 Н -ЯМР (300МГц, D2O) d : 1,33 (т, 3Н), 1,8-2,1 (м, 5Н), 2,3-2,5 (м, 1Н), 3,1-3,3 (м, 1Η), 3,5-3,7 (м, 1Η), 4,14 (дд, 1Н), 4,44 (к, 2Н). H-(R,S) бетаPiс-ОМе х НСl К охлаждаемой в бане со льдом смеси 2г (15,5ммоля) нипекотиновой кислоты и 8мл метанола добавляют хлористый тиони (2,76г, 23,2ммоля), после чего смесь перемешивают 20 часов при комнатной температуре. Растворитель испаряют, остаток растворяют в небольшом количестве метанола и после добавления диэтилового эфира осаждается Н-(R,S) бетаРiс-ОМе x НСl в виде белых кристаллов. Кристаллы 2,57г (92%) отделяют фильтрованием. Boc-(R)Cgl-OH К раствору 32,6г (0,13ммоля) Воc-(R)-PgI-OH в 300мл метанола добавляют 5г Rh-Аl2О3 и смесь гидрируют 3 дня при 5,2-2,8МПа. После фильтрования и испарения растворителя ЯМР показал присутствие около 25% метилового эфира заглавного соединения. Сырой продукт растворяют в 500мл ТГФ и 300мл воды и к раствору добавляют 20г LiОН. Смесь перемешивают примерно сутки и ТГФ испаряют. Оставшуюся водную фазу подкисляют КНSO4 и трижды экстрагируют этилацетатом. Объединенный органический слой промывают водой, сушат (Na2SO4) и после испарения получают 28,3г (83%) целевого продукта. 1 Н-ЯМР (300МГц, СDСI 3) d : 0,9-1,7 (м, 20Н), 4-4,2 (м, 1Н), 5,2 (д, 1Н). Boc-(R)Cgl-OSu К охлаждаемому льдом раствору 2,01г (7,81ммоля) Вос-(R()Сgl-OН и 1,83г (15,6ммоля) ГСИ в 25мл СН3СN добавляют 1,69г (8,2ммоля) ДЦК и реакционную смесь оставляют нагреваться до комнатной температуры. После перемешивания 3 дня осадок ДЦМ отфильтровывают и растворитель испаряют. Остаток растворяют в ΕtOAc и органическую фазу промывают Н2O, КНSO4, NаНСО3, рассолом и сушат (Na2SO4). Испарением растворителя с количественным выходом получают заглавное соединение. Воc-(R)Сhа-ОSu Boc-(R)Cha-OH (1экв.), ГСИ (1,1экв.) и ДЦК или ЦМЭ-КДИ (1,1экв.) растворяют в ацетонитриле (Примерно 2,5мл/моль кислоты) и все перемешивают при комнатной температуре примерно сутки. Образовавшийся в ходе реакции осадок отфильтровывают, растворитель испаряют и продукт сушат в вакууме. (В случае применения ЦМЭ-КДИ в реакции полученный после испарения CH3CN остаток растворяют в ЕtОАс, органическую фазу промывают водой и сушат). Испарением растворителя получают заглавное соединение. 1 Н-ЯМР (500МГц, СDСI 3, 2 ротамера в соотношении прим. 1:1) 0,85-1,1 (м, 2Н), 1,1-1,48 (м, 4Н), 1,5-1,98 (м, 16Н; там же 1,55 (ш.с, 9Н)), 2,82 (ш.с, 4Н), 4,72 (ш.с, 1Н, основной ротамер), 4,85 (ш.с, 1Н, меньший ротамер). Вос-(R)Нос-ОН К раствору 3,2г (11,46ммоля) Воc-(R)Нор-ОН (см. выше) в метаноле (75мл) добавляют 0,5г родия на активированном оксиде алюминия (Rh-AΙ 2Ο3) и смесь перемешивают 18ч под давлением водорода в 0,41МПа. Катализатор удаляют фильтрованием через гайфло и испарением почти с количественным выходом получают продукт. 1 Н-ΗΜΡ (500МГц, СDСI 3) d : 0,9 (м, 2Н), 1,08-1,33 (м, 6Н), 1,43 (с, 9Н), 1,6-1,74 (м, 6Н), 1,88 (ш.с, 1Н), 4,27 (ш. с, 1Н). Boc-(R)Hoc-OSu Получен из Boc-(R)Hoc-OH по методике получения Вос-(R)Сh a-OSu Воc-(R)Ρrо(3-(S)Ρh)-ОН Получен по методике, приведенной в работе: J. Y. L. Chung и др., Journal of Organic Chemistry, №1, стр. 270-275, 1990. Воc-(R)Cgl-Aze-OH (l) Boc-(R)Cgl-Aze-OMe К перемешиваемой смеси 3,86г (15ммолей) Boc-(R)Cgl-ОН, 2,27г (15ммолей) Н-Аzе-OМе x НСl и 2,75г (22,5ммоля) ДМАП в 40мл СН3СN добавляют при 5°С 3,16г (16,5ммоля) ЭДК и реакционную смесь перемешивают 48ч при комнатной температуре. Растворитель испаряют и остаток растворяют в 150мл EtOAc и 20мл Н2О. Отделенный органический слой промывают 0,5Μ KНSO4 (2x20мл), насыщенным раствором NаНСОз (2x10мл), 10мл Н2O, 10мл рассола и сушат (MgSO4). Испарением растворителя получают 4,91г (92%) заглавного соединения, используемого на следующей стадии без дополнительной очистки. 1 Н-ЯМР (500МГц, СDСI 3, 0,1г/мл) основной ротамер: 0,83-1,25 (м, 5Н), 1,38 (с, 9Н), 1,47-1,84 (м, 6Н), 2,18-2,27 (м, 1Н), 2,5-2,62 (м, 1Н), 3,72 (с, 3Н), 3,94-4,06 (м, 1Н), 4,07-4,15 (м, 1Н), 4,39-4,47 (м, 1Н), 4,68 (дд, J=9,1, J=5,1, 1Н), 5,09 (д, J=9,2 , 1Η). Разрешаемые пики меньшего ротамера: 2,27-2,35 (м, 1Н), 3,77 (с, 3Н), 3,8-3,87 (м, 1Н), 3,88-3,95 (м, 1Н), 4,92 (д, J=9,2, 1Н), 5,21 (дд, J=9,1, J=5,1H). (II) Вос-(R)Сgl-Аzе-ОН Гидролиз Boc-(R)Cgl-Azе-ОМе проводят по методике гидролиза Вос-(R)Сhа-Рic-OEl (см. ниже). Продукт кристаллизуют из смеси ЕtОН-ацетон-вода (1:1:3,95). Выход 80%. 1 Н-ЯМР (500МГц, СDСI 3) d : 0,85-1,3 (м, 5Н), 1,4 (с, 9Н), 1,5-1,9 (м, 6Н), 1,95-2,2 (м, 2Н), 3,92 (м, 1Н), 4,09 (м, 1Н), 4,35 (м, 1Н), 4,95 (м, 1Н), 5,16 (ш.д, 1Н). Воc-(R)Cgl-Ρic-OН (l) Воc-(R)Cgl-Piс-ОМе К раствору Вос-(R)Сgl-OН (2,086г, 8,1ммоля) и триэтиламина (1,13мл, 8,1ммоля) в толуоле (25мл) и ДМФА (5мл) добавляют пивалоилхлорид (1мл, 8,1ммоля). Затем при температуре бани со льдом добавляют смесь Н-Рiс-ОМе x НСl (1,46г, 8,1ммоля) и триэтиламина (1,13мл, 8,1ммоля) в ДМФА (20мл). Реакционную смесь оставляют медленно нагреваться до комнатной температуры и спустя 24ч разбавляют водой и экстрагируют толуолом. После промывания 0,3Μ KHSO4, 10% N2CO3 и рассолом испарением растворителя в вакууме получают 2,52г (81%) бесцветного масла, которое используют без дополнительной очистки. 1 Н-ЯМР (500МГц, СDСI 3), 2 ротамера в отношении 5:1) d : 0,8-1,8 (м, 25Н), 2,25 (д, 1Н), 2,75 (т, 1Η, меньший ротамер) , 2,3 (т, 1Н), 3,7 (с, 3Н), 3,85 (д, 1Н), 4,3 (т, 1Η, меньший ротамер), 4,5-4,6 (м, 1Н), 5,25 (д, 1Н), 5,3 (д, 1Н). (ll) Вос-(R)Сgl-Piс-ОН Получен по методике гидролиза Воc-(R)Cha-Pic-OEl (см. ниже) использованием продукта вышеприведенной стадии (I). Продукт кристаллизован из диизопропилового эфира и гексана. 1 Н-ЯМР (500МГц, СDСI 3, 2 ротамера в отношении 5:1) d : 0,8-1,8 (м, 25Н), 2,3 (д,1Н), 2,8 (т, 1Н, меньший ротамер), 3,3 (т, 1Н), 3,9 (д, 1Н), 4,4 (т, 1Н, меньший ротамер), 4,5-4,6 (м, 1Н), 5,1 (с, 1Н, меньший ротамер), 5,3 (д, 1Н), 5,4 (д, 1Н). Boc-(R)Cgl-Pro-OH К смеси 3,59г (31,24ммоля) L-пролина, 20мл воды и 1,18г (29,7ммоля) гидроксида натрия добавляют 2,8г (7,8ммоля) Boc-(R)Cgl-OSu 10мл ДМФА. Из-за плохой растворимости добавляют еще 30мл ДМФА и реакционную смесь перемешивают три дня. После испарения растворителя добавляют воду. Водную фазу промывают этилацетатом, подкисляют 0,3Μ KHSO4 и трижды экстрагируют этилацетатом. Органическую фазу промывают один раз водой и один раз рассолом, сушат (Na2SO4), фильтруют и после испарения получают 2,3г (83%) продукта. 1 Н-ЯМР (300МГц, СDСI 3) d : 0,89-2,17 (м, 23Н), 2,37 (м, 1Н), 3,55 (к, 1Н), 3,9 (ш.с, 1Н), 4,28 (т, 1Η), 4,52 (ш.с, 1Н), 5,22 (ш.с, 1Н (ΝΗ)). Вос-(R)Cha-Azе-ОН Получен реакцией Воc-(R)Chа-ОН с Н-Аzе-OEt x НСl (см. ниже) по методике получения Воc-(R)Cha-ProOH. Вос-(R)Cha-Рrо-ОН В 750мл 0,87Μ раствора гидроксида натрия растворяют Н-(S)Pro-OH (680ммолей) и к раствору в течение 20мин по каплям прибавляют Воc-(R)Cha-OSu. (170ммолей) в ДМФА (375мл). Реакционную смесь перемешивают 20ч при комнатной температуре, затем смесь подкисляют (2М KНSO4) и трижды экстрагируют этилацетатом. Органические слои объединяют и трижды промывают водой и один раз рассолом. После сушки над сульфатом натрия и испарения растворителя сиропообразное масло растворяют в диэтиловом эфире, растворитель испаряют и наконец сушкой продукта в вакууме получают с почти количественным выходом Воc-(R)Cha-Pro-OH в виде белого порошка. 1 Н-ЯМР (500МГц, СDСI 3) смесь двух ротамеров, 9:1)6 : 0,8-1,05 (м, 2Н), 1,05-1,55 (м, 15Н; там же 1,5 (ш.с, 9Н)), 1,55-1,8 (м, 5Н), 1,8-2,15 (м, 3Н), 2,47 (м, 1Н), 3,48 (м, 1Н), 3,89 (м, 1Н), 4,55 (м, 2Н), 5,06 (м, 1Н). Разрешаемые сигналы меньшего ротомера появляются при d 2,27 (м), 3,58 (м), 4,33 (м), 5 (м). Воc-(Me)(R)Cha-Pro-OSu (l) Вос(Ме)(R)Cha-Pro-OH Получен реакцией Воc-(Me)(R)Cha-OSu и Н-Рrо-ОН по вышеприведенной методике получения Воc(R)Cha-Pro-OH. (ll) Вос-(Ме)(R)Cha-Pro-OSu Получен на основе Воc-(Me)(R)Chа-Рrо-ОН по методике, приведенной для синтеза Воc-(R)Сhа-ОSu. Boc-(R)Cha-Pic-OH (la) Boc-(R)Cha-Pic-OEt В 150мл СН2Сl2 растворяют 6,3г (0,023моля) Boc-(R)Cha-OН. Раствор охлаждают в бане со льдом, после чего добавляют 6,3г (0,047моля) N-гидроксибензотриазола и 11,2г (0,0265моля) ЦМЭ-КДИ. Через 15 мин баню со льдом убирают и реакционную смесь перемешивают 4ч при комнатной температуре. Растворитель испаряют, остаток растворяют в 150мл ДМФА и раствор охлаждают в бане со льдом. После прибавления 4,1г (0,021моля) Н-Рic-OEt x НСl добавлением N-метилморфолина устанавливают рН примерно 9. Через 15мин баню со льдом убирают и реакционную смесь перемешивают 3 дня. Растворитель испаряют, остаток растворяют в этилацетате и промывают разбавленным раствором KНSО4 (водн.), NаНСО3 (водн.) и водой. Органический слой сушат (Na2SO4) и после испарения растворителя получают 7,7г (89%) Воc-(R)Cha-Pic-OEt, который используют без дополнительной очистки. 1 Н-ЯМР (500МГц, CDCI 3, 2 ротамера в отношении 3:1) d : 0,7-1 (м, 2Н), 1,1-1,9 (м, 29Н; там же 1,28 (т, 3Н)), 1,45 (ш.с, 9Н), 2,01 (ш.д, 1Н, основной ротамер), 2,31 (ш.д, 1Н), 2,88 (ш.т, 1Н, меньший ротамер), 3,33 (ш. т, 1Η, основной ротамер), 3,8 (ш.д, 1Н, основной ротамер), 4,15-4,3 (м,2Н), 4,5-4,7 (м, 2Н, меньший ротамер), 4,77 (ш.у, 1Н, основной ротамер), 4,9 (ш.д, 1Н, меньший ротамер), 5,28 (ш.д, 1Н, основной ротамер), 5,33 (ш.д, 1Н, основной ротамер). (lb) Boc-(R)Cha-Pic-OMe К перемешиваемой смеси 875мг (3,22ммоля) Boc-(R)Cha-ОН и 450мкл (3,23ммоля) триэтиламина в 10мл толуола и 2мл ДМФА добавляют 400мкл (3,23ммоля) пивалоилхлорида. Через 45 минут к образовавшейся взвеси добавляют смесь 596мг (3,32ммоля) гидрохлорида метил-(S)-пипеколята и 463мкл (3,32ммоля) триэтиламина в 5мл ДМФА. Спустя 2ч добавляют 1000мкл (0,72ммоля) триэтиламина и перемешивание продолжают еще 18ч. После добавления к реакционной смеси воды и толуола органическую фазу промывают 0,3Μ KHSO4, 10% Na2CO3 и рассолом. Сушкой (MgSO4) и удалением растворителя в вакууме получают 1,16г заглавного соединения. (ll) Вос-(R)Сhа-Рic-OH Воc-(R)Сhа-Рic-OEt (5,6г, 0,014моля) смешивают со 100мл ТГФ, 100мл воды и 7г LiОН и смесь перемешивают примерно сутки при комнатной температуре. ТГФ испаряют, водный раствор подкисляют KНSO4 (водн.) и трижды экстрагируют этилацетатом. Объединенную органическую фазу промывают водой, сушат (Na2SO4) и после испарения получают 4,9г (94%) Вос-(R)Cha-Piс-ОН, которую используют без дополнительной очистки. Соединение может быть кристаллизовано из смеси диизопропиловый эфиргексан. Метиловый эфир, образованный по вышеприведенной методике (Ιb), может быть гидролизован использованием методики, приведенной в разделе (ll) для этилового эфира. 1 Н-ЯМР (500МГц, СDСI 3, 2 ротамера в отношении 3,5:1) d: 0,8-1,1 (м, 2Н), 1,1-2,1 (м, 27Н; там же 1,43 (с, 9Н, основной ротамер), 1,46 (с, 9Н, меньший ротамер)), 2,33 (ш.д. 1Н), 2,8 (ш.т, 1Η, меньший ротамер), 3,33 (ш,т, 1Η, меньший ротамер), 3,85 (ш.д, 1Н, основной ротамер), 4,57 (ш.д, 1Н, меньший ротамер), 4,68 (м, 1Н, меньший ротамер), 4,68 (м, 1Н, меньший ротамер), 4,77 (ш.к, 1Н, основной ротамер), 5,03 (ш.с, 1Н, меньший ротамер), 5,33 (ш.д, 1Н, основной ротамер); 5,56 (м, 1Н, основной ротамер). Воc-(R)Cha-(R,S) бетаРiс-ОН (I) Boc-(R)Cha-(R,S)бетаРiс-ОМе К раствору 2г (7,3ммоля) Вое-(R)Cha-OH и 0,81мл (7,3ммоля) 4-Н-метилморфолина в 20мл ацетонитрила добавляют 0,9мл (7,3ммоля) пивалоилхлорида. Спустя 1ч 30 минут добавляют 1,3г (7,3ммоля) Н-(R,S)бетаРiс-ОМе х НСl и 1,62мл (14,6ммоля) 4-N-метилморфолина и реакционную смесь перемешивают 24ч. Растворитель испаряют и остаток растворяют в толуоле и небольшом количестве диэтилового эфира. После промывания 0,3Μ KНSO4 и раствором KНСО3 и сушки над Na2SO4 растворитель удаляют в вакууме. Вытеснительной хроматографией с применением в качестве элюента смеси гексанэтилацетат 7:3) поулчают 2,4г (83%) целевого продукта. (II) Boc-(R)Cha-(R,S)бетаРiс-ОН В 35мл ТГФ растворяют при комнатной температуре 2,35г (5,9ммоля) Вос-(R)Сha-(R,S)бетаРiс-ОМе и к раствору добавляют 2,1г LiОН в 35мл воды. После перемешивания 5ч ТГФ удаляют в вакууме. Водную фазу подкисляют 2Μ ΚΗSO4 и экстрагируют этил ацетатом, сушат над Na2SO4 и после испарения получают 2г (89%) продукта. Boc-(R)Cha-\/al-OH (I) Boc-(R)Cha-Val-ОМе К перемешиваемой смеси 6,75г (25ммолей) Воc-(R)Сhа-ОН и 3,5мл (25ммолей) триэтиламина в 50мл ДМФА добавляют при комнатной температуре 3,1мл (25ммолей) пивалоилхлорида. После перемешивания 3 часа добавляют 4,16г (25ммолей) гидрохлорида метилового эфира валина в 50мл ДМФА и 3мл триэтиламина. После перемешивания примерно сутки добавляют несколько кристаллов ДМАП и реакционную смесь нагревают 5 минут при 50°С. Растворитель удаляют в вакууме и к остатку добавляют эфир и толуол. Промыванием 0,3Μ KНSO4 и 10% Na2SO4 с последующей сушкой (MgSO4) и удалением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси толуол-этилацетат. Выход заглавного соединения 6,99г (73%). (II) Boc-(R)Cha-Val-OH Смесь 8,73г (23ммоля) Вос-(R)Сhа-\/al-OMe и 5,6г (230ммолей) гидроксида лития в 75мл ΤГΦ и 75мл воды перемешивают 4 часа. ТГФ удаляют в вакууме, оставшийся раствор разбавляют водой и экстрагируют эфиром. Подкислением 2М KНSО4 и экстрагированием этилацетатом с последующей сушкой (MgSO4) и удалением растворителя в вакууме получают 8,15г (96%) заглавного соединения. Воc-(R)Hoc-Azе-ОН (l) Boc-(R)Hoc-Aze-OEt В 15мл CH2CI 2 при комнатной температуре растворяют 1г (3,5ммоля) Воc-(R)Hoc-OH и 0,95г (7ммолей) ГБТ. Раствор охлаждают в бане со льдом и к нему добавляют 0,77г (4ммоля) ЭДК. Баню со льдом убирают и реакционную смесь перемешивают 3ч при комнатной температуре. Растворитель испаряют и остаток растворяют в 20мл ДМФА. Добавляют 0,58г (3,5ммоля) H-(R)Aze-OН и добавлением N-метилморфолина устанавливают рН примерно 9. Затем реакционную смесь перемешивают один день. После распределения реакционной смеси между водой и толуолом органическую фазу отделяют, промывают 0,3Μ KНSO4, разбавленным раствором KНСО3, рассолом, сушат над Na2SO4 и испаряют. Колоночной хроматографией (1% ΕtΌΗ в CH2CI2 и гептан-EtОАс) получают 0,35г (25%) целевого продукта. (ll) Воc-(R)Hoc-Azе-ОН В 10мл ТГФ растворяют при комнатной температуре 0,65г (1,6ммоля) Воc-(R)Нос-Аze-OEt и к раствору добавляют 0,59г LiОН в 10мл воды. После перемешивания 24ч добавляют 2Μ KHSO4 и ТГФ удаляют в вакууме. Водную фазу подкисляют дополнительным количеством KНSO4, затем экстрагируют этилацетатом, сушат над Na2SO4 и после испарения получают 0,5г (85%) заглавного соединения. Вос-(R)Нос-Рrо-ОН Получен из Воc-(R)HOc-OSu по методике получения Вос-(R)Cha-Pro-OH 1 Н-ЯМР (500МГц, СDСI 3) d : 0,8-0,94 (м, 2Н), 1,05-1,36 (м, 7Н), 1,36-1,48 (ш.с, 9Н), 1,48-1,78 (м, 7Н), 1,982,14 (м, 2Н), 2,34 (м, 1Н), 3,48 (м, 1Н), 3,85 (м, 1Н), 4,43 (м, 1Н), 4,52 (ш.д, 1Н), 5,26 (ш.д, 1); сигналы меньшего ротамера появляются при d : 1,92, 2,25, 4,2 и 4,93. Boc-(R)Hoc-Pic-OH (I) Воc-(R)Hoc-Piс-ОМе Получен реакцией Воc-(R)Нос-ОН с Н-Рiс-ОМе x НСl по методике, приведенной для синтеза Воc(R)Сhа-Рic-OEt (см. выше). (ll) Вос-(R)Нос-Piс-ОН Получен из Воc-(R)Hoc-Piс-ОМе по методике, приведенной для синтеза Воc-(R)Cha-Piс-ОН (см. выше). 1 Н -ЯМР (500МГц, СDСI 3) d : 0,82-0,97 (м, 2Н), 1,1-1,36 (м, 7Н), 1,36-1,5 (ш.с, 9Н), 1,5-1,82 (м, 11Н), 2,35 (ш.д, 1Н), 3,28 (ш.т, 1Н), 4,63 (м, 1Н), 5,33 (ш.с, 1Н), 5,44 (ш.д, 1Н); сигналы меньшего ротамера появляются при d : 1,88, 2,8, 4,25, 4,55 и 4,97. Вос-(R)Рrо-Рhе-ОН (l) Boc-(R)Pro-Phe-OMe К раствору 2г (9,29ммоля) Boc-(R)Prо-ОН и 0,94г (9,29ммоля) триэтиламина в 70мл смеси толуолДМФА (5:2) добавляют 1,12г (9,29ммоля) пивалоилхлорида и реакционную смесь перемешивают 30 минут при комнатной температуре. После охлаждения смеси до 0°С добавляют смесь 2г (9,29ммоля) Н-Phe-OMe и 0,94г триэтиламина в 40мл ДМФА и реакционную смесь перемешивают примерно сутки при комнатной температуре. Реакционную смесь разбавляют толуолом, органическую фазу промывают 0,3Μ KHSO4 (3x50мл), 50мл воды и сушат (Na2SO4). Испарением растворителя с количественным выходом получают заглавное соединение, которое используют на следующей стадии без дополнительной очистки. (II) Воc-(R)ΡRo-Phe-OH Смесь 4г (10,6ммоля) Воc-(R)Ρho-Phе-OМе и 8,93г (21,3ммоля) LiОН x Н2O в 140мл водного ТГФ (1:1) интенсивно перемешивают примерно сутки при комнатной температуре. ТГФ испаряют, водную фазу подкисляют 1Μ KHSO4 и экстрагируют EtOAc (3x75мл). Объединенную органическую фазу промывают водой и сушат (Na2SO4). Фильтрование и испарение растворителя дает остаток, очисткой которого кристаллизацией из диизопропилового эфира получают 2,329г (60%) заглавного соединения в виде белого кристаллического вещества. Boc-(R)Pro(3-(S)Ph)-Ρro-OH (l) Boc-(R)Pro(3-(S)Ph)-Ρro-OBn К смеси 1,61г Boc-(R)Pro(3-(S)Ph)-Ρro-OH, 1,65г H-Prο-OBn x HCl и 0,75г ГБТ в 11мл ДМФ добавляют при комнатной температуре 0,84мл НММ и 2,92г ЦМЭ-КДИ и реакционную смесь перемешивают три дня. Растворитель испаряют и остаток растворяют в 300мл EtOAc. Органическую фазу промывают водой (2x100мл), 1Μ KНSО4 (2x100мл), 1Μ NaOH (3x100мл) водой (3x100мл) и сушат (MaSO4). Испарением растворителя получают масло (2,53г), очисткой которого колоночной хроматографией с применением в качестве элюента CH2CI 2-МеОН (97:3) получают 2,11г (88%) заглавного соединения. (II) Boc-(R)Pro(3-(S)Ph)-Prо-ОН В 70мл EtOH растворяют 0,94г Boc-(R)Pro(3-(S)Ph-)-ΡrO-OH гидрируют в присутствии 0,42г 5% Pd-C в течение 3,5 часов. Фильтрованием катализатора и испарением растворителя получают с количественным выходом заглавное соединение. Вос-(R)Tiс-Рrо-ОН Получен по методике, приведенной в патенте ЕР-0,479,489-А2 (P.D. Gesellchen R.T. Shuman). ВnOOC-CH2-NH-CO-CH2-Br К раствору п-ТSОН X H-Gly-OBw (5ммолей) и триэтиламина (5ммолей) в 10 CH2CI 2 добавляют раствор 2-бромуксусной кислоты (5ммолей) в 10мл CH2Cl2 и дициклогексилкарбодиимид (5ммолей). Смесь перемешивают примерно сутки при комнатной температуре и фильтруют. Органическую фазу промывают дважды 0,2Μ KHSO4, 0,2Μ NaOH, рассолом и сушат. Испарением и колоночной хроматографией (СH2СI 2МеОН, 95:5) с количественным выходом получают целевое соединение. 1 Н-ЯМР (300МГц, СDСI 3) d : 3,89 (с, 2Н), 4,05-4,11 (д, 2Н), 5,19 (с, 2Н), 7,06 (ш.с, 1Н), 7,3-7,4 (м, 5Н). Вос-(R)Сgl-llе-OН Получен по методике получения Вос-(R)Сgi-Рrо-ОН использованием Н-llе-ОН вместо Н-Рrо-ОН. Выход 91%. Вос-(R)Рhe-Phе-ОН (l) Вос-(R)Phе-Рhе-ОМе В 30мл ацетонитрила растворяют Вос-(R)Рhе-ОН (18,8ммоля; производство фирмы Бахэм Файнхемикалиен АГ), Ρhe-ОМе (20,7ммоля) и 4-диметиламинопиридин (37,7ммоля). К охлажденному до температуры ледяной воды раствору добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (24,5ммоля). Охлаждающую баню убирают и реакционную смесь перемешивают примерно сутки. Растворитель удаляют при пониженном давлении и остаток растворяют в 50мл этилацетата. Промыванием органической фазы аликвотами по 56мл 0,5Μ гидросульфата калия, 1Μ бикарбоната натрия и наконец водой с последующим испарением растворителя получают 7,5г Вос-(R)Phe-Phе-ОМе (94%), который используют на следующей стадии без дополнительной очистки. (ll) Воc-(R)Phe-Phe-OH К раствору Boc-(R)Phe-Phe-OMe (16,4ммоля) в 40мл тетрагидрофурана быстро прибавляют раствор гидроксида лития (32,8ммоля) в 20мл воды. Реакционную смесь перемешивают 3,5ч, после чего растворитель удаляют при пониженном давлении. Остаток ратворяют в 56мл этилацетата и промывают 50мл 0,5Μ сульфата калия и затем 50мл воды. Удалением растворителя получают 8г (колич.) Boc-(R)PhePhe-OH в виде аморфного вещества. 1Н-ЯМР (200МГц, d-СDСI 3) d : 7,4-6,7 (м, 10Н), 5,7-4,2 (м, 6Н), 1,34 (с, 9Н). HO-CH2-COOBn Получен по методике, приведенной в работе: Latters A. и др. Bull. Soc. Chim. France, №11, стр. 4018-23, 1971. Бензил-2-(орто-нитробензолсульфонилокси)ацетат (2-NO2)Ph-SO2-OCH2-COOBn В 25мл CH2CI 2 и 25мл диэтилового эфира растворяют 1,66г (10ммолей) бензилгликолята. Смесь охлаждают до 0°С и добавляют 2,8мл (10ммолей) триэтиламина. Поддерживая температуру при 0°С, небольшими порциями в течение 15 минут прибавляют 2,44г (11ммолей) онитробензолсульфонилхлорида. После перемешивания взвеси 50 минут при 50°С добавляют 20мл воды и 30мл CH2CI 2. Фазы разделяют, органическую фазу промывают 20мл 1Μ НСl и 20мл воды, сушат (Na2SO4), фильтруют и испарением в вакууме получают 3,34г остатка, которой подвергают колоночной хроматографии с применением в качестве элюента смеси гептан-ΕtOAc (2:1) и получением 1,18г (34%) заглавного соединения. 1 Н-ЯМР (300МГц, СDСI 3) d : 4,92 (с, 2Н), 5,17 (с, 2Н), 7,83 (м, 5Н), 7,76 (м, 3Н), 8,16 (дд, 1Н). Бензил-2-(пара-нитробензолсульфонилокси)ацетат (4-NO2)Ph-SO2-OCH2-COOBn Получен по методике, использованной для синтеза бензил-2-(о-нитробензолсульфонилокси)ацетата и приведенной выше. Конечное соединение получено после испарения растворителя в кристаллической форме и достаточно чисто для применения без дополнительной очистки (выход 64%). 1 Н-ЯМР (300МГц, СDСI 3) d : 4,79 (с, 2Н), 5,13 (с, 2Н), 7,2-7,4 (м, 5Н), 8,1 (д, 2Н), 8,2 (д, 2Н). TfO-СН2-СООМе К смеси 4,05мл (50ммолей) метилгликолята и 4,04мл (50ммолей) пиридина в CH2CI 2 (в общей сложности 62,5мл) при 0°С в течение 25 минут прибавляют по каплям 10,09мл (60ммолей) ангидрида трифторметансульфоновой кислоты в CH2Cl2 и затем перемешивают 1ч при 0°С. После промывания 0,3Μ KНСO4, насыщенным раствором Na2SO4, сушки (Na2SO4) и фильтрования испарением растворителя в вакууме получают 9,94г (90%) заглавного соединения. ΤfO-CH2-COOEt Получен из этилгликолята по методике, приведенной для синтеза TfO-СН2-СООМе. ΤfО-СН?-СОО-н-Вu Получен из бутилгликолята по методике, приведенной для синтеза TfO-СН2-СООМе. ΤfO-CH2-COOBn. Получен на основе НО-СН2СООВn, по методике получения TfO-СН2СООМе. Τfo-CH2COO-H-Hex (l) НO-СН2СOO-н-Нех К гликолевой кислоте (215мг, 2,82ммоля) в 12,8мл СН3СN добавляют 719мг (3,39ммоля) 1гексилйодида и 429мг (2,82ммоля) ДБУ. После перемешивания примерно сутки и кипячения 6ч растворитель испаряют, добавляют этилацетат и 1Μ KHSO4 и фазы разделяют. Органический слой промывают рассолом, сушат (MgSO4), фильтруют и испарением в вакууме получают 333мг (74%) продукта. (ll) ΤfО-СН2СОО-н-Нех Получен из НO-СН2СОО-н-Нех по методике, приведенной для синтеза TfO-CH2COOMe. Н-Мig (Z) (3-аминометил-1-(N-бензилоксикарбониламидино)азетидин (I) 3-Аминометил-1-бензгидрилазетидин получен согласно литературному источнику, см.: A.G. Anderson Jr., R. Lok , J, Оrg. Сhem., 37, 3953, 1972. (ll) 3-(N-трет-Бутилоксикарбониламинометил)-1-бензгидрилазетидин К раствору 3,5г (13,9ммоля) 3-аминометил-1-бензгидрилазетидина в 45мл ΤГΦ добавляют раствор 0,56г (13,9ммоля) NaOH в 45мл воды. После охлаждения реакционной смеси до 0°С к ней добавляют 3,03г (13,9ммоля) ди-трет-бутилдикарбоната. Охлаждающую баню убирают спустя несколько минут и смесь перемешивают примерно сутки при комнатной температуре. ТГФ испаряют и остаток экстрагируют диэтиловым эфиром (3х45мл). Объединенный органический слой промывают рассолом, сушат над Na2SO4 и фильтруют. Испарением растворителя получают 4,6г (94%) заглавного соединения. (lll) 3-(S-трет-бутилоксикарбониламинометил)азетидин В 170мл МеОН растворяют 3,4г (9,6ммоля) 3-(N-трет-бутилоксикарбониламинометил)-1бензгидрилазетидина и гидрируют примерно сутки при 5МПа в присутствии 0,3г Ρd(OΗ)2. Катализатор отфильтровывают и растворитель испаряют. Очисткой сырого продукта колоночной хроматографией с применением в качестве элюента смесей МеОН-СН2СI 2 (1:9), затем МеОН (насыщен NH3 (г))-СН2СI 2 получают 1,2г (67%) заглавного соединения. (IV) 3-(N-трет-Бутилоксикарбониламинометил)-1-(N-бензилоксикарбониламидино)азетидин (Вос-Мig(Z)) В 6,5мл толуола смешивают 0,9г (4,8ммоля) 3-(Н-трет-бутилоксикарбониламинометил)азетидина и 1,3г (6,3ммоля) N-бензилоксикарбонил-О-метилизомочевины и все нагревают 72ч при 70°С и затем оставляют еще на 72ч при комнатной температуре. Испарением с последующей колоночной хроматографией с применением в качестве элюента EtOAc, затем МеОН (насыщен NН3 (г))-СН2СI 2 (1:9) получают 0,67г (38%) заглавного соединения в виде белого порошка. (V) 3-аминометил-1-(N-бензилоксикарбониламидино)азетидин (Н-Мig(Z)) В 10мл ΕtОАс, насыщенного НСl (г), растворяют 0,67г (1,85ммоля) Вос-Мig(Z), перемешивают 10мин при комнатной температуре, после чего по каплям прибавляют 10мл насыщенного водн. раствора KОН. Слои разделяют и водную фазу экстрагируют EtOАс (3x 8мл). Органические слои объединяют, промывают рассолом, сушат (Na2SO4) и испарением получают 0,43г (89%) заглавного соединения. 1 Н -ЯМР (300МГц, CСDСI 3) d : 2,55-2,65 (м, 1Н), 2,84 (д, 2Н), 3,66 (дд, 2Н), 4,03 (дд, 2Н), 5,07 (с, 2Н), 7,27,4 (м, 5Н). МС: m/z 263 (М+ + 1). 3-аминоэтил-1-(N-бензилоксикарбониламидино)азетидин (Н-Dig(Z)) (l) 3-(карбоновая кислота)-1-бензгидрилазетидин получен по литературному источнику, см. Anderson Jr., R.Lok, J. Org. Chem. 37, 3953, 1972. (ll) 3-Гидроксиметил-1-бензгидрилазетидин К суспензии 4,9г (130,2ммоля) LiАlН4 в 30мл ТГФ при комнатной температуре медленно прибавляют раствор 8,7г (32,5ммоля) 3-(карбоновая кислота)-1-бензгидрилазетидина в 80мл сухого ТГФ. После кипячения реакционной смеси 3,5ч избыток гидрида гидролизуют осторожным прибавлением при охлаждении NH4Cl (водн.), желеобразную массу фильтруют и фильтровальный пирог неоднократно промывают ТГФ. Испарением растворителя получают 7,1г (86%) заглавного соединения в виде бледножелтых кристаллов. (III) 3-метансульфонатометил-1-бензгидрилазетидин К раствору 6,62г (26,1ммоля) 3-гидроксиметил-1-бензгидрилазетидина в 50мл сухого пиридина прибавляют при 0°С 4,5г (39,2ммоля) метансульфонилхлорида. Реакционную смесь перемешивают 1ч и затем оставляют на ночь в холодильнике. Реакционную смесь переносят в смесь воды со льдом, осадок отделяют, промывают водой и после сушки в вакууме получают 7,75г (89,5%) заглавного соединения. (IV) 3-цианометил-1-бензгидрилазетидин К раствору 7,75г (23,4ммоля) 3-метансульфонатометил-1-бензгидрилазетидина в 50мл ДМФА добавляют раствор 3,44г (70ммолей) NаСN в 10мл воды. Смесь нагревают 20ч при 65°С, охлаждают и переносят в смесь воды со льдом. Осадок отделяют, промывают водой и после сушки в вакууме получают 5,7г (93%) заглавного соединения. (V) 3-аминоэтил-1-бензгидрилазетидин К суспензии 2,9г (76ммолей) LiAlH4 в 80мл сухого ТГФ при комнатной температуре медленно прибавляют 5,7г (21,7ммоля) 3-цианометил-1-бензгидрилазетидина. После кипячения реакционной смеси 4ч избыток гидрида гидролизуют осторожным прибавлением при охлаждении NH4Cl (водн.). Желеобразную смесь фильтруют и фильтровальный пирог несколько раз промывают ТГФ. Растворитель испаряют, остаток растворяют в диэтиловом эфире, промывают рассолом и сушат над Na2SO4. Испарением растворителя получают 5г (87%) заглавного соединения. (IV) 3-(N-трет-бутилоксикарбониламиноэтил)-1-бензгидрилазетидин Целевое соединение получено с выходом 6,5г (95%) из 3-аминоэтил-1-бензгидрилазетидина по методике получения 3-(N-трет-бутилоксикарбониламинометил)-1-бензгидридазетидина. (VII) 3-(N-трет-бутилоксикарбониламиноэтил)азетидин Целевое соединение получено с выходом 1,2г (70%) из 3-(N-трет-бутилоксикарбониламиноэтил)-1бензгидрилазетидина по методике получения 3-(N-трет-бутилоксикарбониламинометил)азетидина. (VIII) 3-(N-трет-бутилоксикарбониламиноэтил)-1-(N-бензилоксикарбонилимидино)азетидин (Воc-Dig(Z)) Целевое соединение получено с выходом 0,09г (34%) из 3-(N-третбутилоксикарбониламиноэтил)азетидина по методике получения 3-(N-третбутилоксикарбониламинометил)-1-(N-бензилоксикарбониламидино)азетидина. (IX) 3-Аминоэтил-1-(N-бензилоксикарбониламидино)азетидин В 10мл EtOAc, насыщенного НСl (г), растворяют 0,589г (1,56ммоля) Воc-Dig(Z) и перемешивают 10мин при комнатной температуре. По каплям прибавляют 10мл насыщенного раствора KОН (водн.), слои разделяют и водную фазу экстрагируют ΕtОАс (3х8мл). Органические слои объединяют, промывают рассолом, сушат над Na2SO4 и испарением получают 0,415г (96%) заглавного соединения. 1 Н-ЯМР (500МГц, СDСI 3) d : 1,6 (дт, 2Н), 1,52-2,54 (м, 3Н), 3,53 (ш.с, 2Н), 4 (ш.т, 2Н), 5 (с, 2Н), 7,17-7,31 (м, 5Н). ПРИМЕРЫ ПРИМЕР 1 НООС-СН2-(R)Cgl-Αze-Pab (l) Вос-(R)Сgi-Аzе-Раb(Z) К перемешиваемой смеси 3,4 (10ммолей) Вос-(R)Сgl-Аzе-OН (см. раздел: получение исходных соединений) и 5,13г (42ммоля) ДМАП в 120мл СН3СN добавляют 3,18г Н-Раb(Z) x НСl (см. раздел: получение исходных соединений). После перемешивания 2 часа при комнатной температуре смесь охлаждают до -8°С и затем добавляют 2,01 (10,5ммолей) ЭДК. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивание продолжают еще 47 часов. Растворитель испаряют и остаток растворяют в 200мл ΕtОАс. Органическую фазу промывают 50мл воды, 0,5Μ KHSO4 (1x50мл + 2x25мл), NаНСО3 (2x25мл насыщенного раствора), 50мл воды и сушат. Испарение растворителя дает 5,21г (86%) заглавного соединения. 1 Н-ΗΜΡ (500МГц, СDСI3) d : 0,8-1,9 (м, 20Н; в нем же 1,3 (с, 9Н)), 2,35-2,6 (м, 2Н), 3,74 (ш.т, 1Н), 4,1 (м, 1Н), 4,25-4,4 (м, 2Н), 4,45-4,6 (м, 1Н, ротамеры), 4,75-5 (м. 1Н, ротамеры), 5,08 (ш.д, 2Н), 5,15 (с, 2Н), 7,157,35 (м, 5Н), 7,41 (д, 2Н), 7,77 (д, 2Н), 8,21 (м, 1Н). (ll) H-(R)Cgl-Aze-Pab(Z) К охлажденному (температура бани со льдом) раствору 18,8г НСI (г) в 195мл EtОАс добавляют 4,69г (7,743ммоля) Воc-(R)Cgl-Aze-Pab (Z) вместе с 40мл ЕtОАс. Реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают 30мин. К прозрачному раствору добавляют 140мл Εt2О с образованием при этом осадка. Реакционную смесь оставляют еще на 1ч 40 минут при комнатной температуре. Осадок отфильтровывают, быстро промывают 150мл Et2O и сушат в вакууме. Затем осадок растворяют в 50мл воды и подщелачивают 15мл 2М NаОН. Щелочную фазу промывают CH2CI 2 (1x100мл + 1x50мл). Объединенную органическую фазу промывают 20мл воды, 20мл рассола и сушат (MgSO4). Испарением растворителя получают 3,44г (88%) заглавного соединения. 1 Н-ЯМР (500МГц, СDСI 3) d : 0,8-2 (м, NН), 2,51 (м, 1Н), 2,67 (м, 1Н), 3,07 (д, 1Н), 4,11 (м, 1Н), 4,18 (м, 1Н), 4,43 (дд, 1Н), 4,53 (дд, 1Н), 4,91 (м, 1Н), 5,22 (с, 2Н), 7,2-7,4 (м, 7Н), 7,45 (д, 2Н), 8,51 (д, 2Н). (III) ВnOOC-CH2-(R)Cgl-Azе-Раb(Z) Смесь 1,13г (2,2ммоля) Н-(R)Сgl-Аze-Pab(Z), 0,9г (2,6ммоля) бензил-2-(онитробензолсульфонилокси)ацетата ((2-NО2)-Рh-SО2-ОСН2-СООВn, см. раздел: получение исходных соединений), 0,99г (5,6ммоля) K2СО3 и 113мл CH3CN нагревают 3ч на масляной бане при 60°С. После испарения растворителя добавляют ЕtОАс и смесь промывают водой. Органическую фазу экстрагируют 1М KНSO4 и полученную водную фазу промывают EtOAc. Кислотную водную фазу подщелачивают 1н. NаОН до рН>8 и экстрагируют EtOAc. Органическую фазу промывают водой, сушат (Na2SO4), фильтруют и испарением в вакууме получают 1,17г остатка, который дважды подвергают колоночной хроматографии с применением в качестве элюента в первый раз СН2СI 2-МеОН (насыщен NН3) (95:5) и во второй раз диэтиловый эфир -МеОН (насыщен NН3) (9:1) с получением 0,526г (36%) заглавного соединения. Алкилирование кроме того проводят с применением бензил-2-(п-нитробензолсульфонилокси)ацетата ((4-NО2)Рh-SO2-OCH2-СООВn, см. раздел: получение исходных соединений) и использованием вышеприведенной методики, в результате чего получают заглавное соединение с выходом 52%. 1 Н-ЯМР (300МГц, СDСI 3) d : 0,85-2,15 (м, 11Н), 2,48 (м, 1Н), 2,63 (м, 1Н), 2,88 (д, 1Н), 3,24 (д, 1Н), 3,27 (д, 1Н), 3,95 (м, 1Н), 4,05 (м, 1Н), 4,44 (м, 1Н), 4,55 (м, 1Н), 4,91 (м, 1Н), 5,07 (c, 2Н), 5,22 (с, 2Н ), 7,2-7,4 (м, 10Н), 7,45 (д, 2Н), 7,79 (д, 2Н), 8,42 (м, 1Н). (IVа) НOOС-СН2-(R)Сgl-Аzе-Раb x 2НСl В 5мл метанола растворяют 20мг (0,031ммоля) ВnOOС-CH2-(R)Cgl-Azе-Раb(Z). Добавляют несколько капель хлороформа и 5% Pd-C и смесь гидрируют 1ч при атмосферном давлении. После фильтрования и испарения лиофилизацией продукта из воды получают 11мг (72%) заглавного соединения. 1 Н-ЯМР (500МГц, D2О) d : 1-2 (м, 11Н), 2,1 (м, 1Н), 2,44 (м, 1Н), 2,82 (м, 1Η), 3,9 (с, 2Н), 4,09 (д, 1Н), 4,44,5 (м, 2Н), 4,66 (с, 2Н), 5,08 (м, 1Н), 7,65 (д, 2Н), 7,89 (д, 2Н), 13 С-ЯМР (75,5МГц, D2O) d : 167,3, 167,9, 169,9 и 172,4 (углероды амидиногруппы и карбонила). (IVb) НOOС-СН2-(R)Сgl-Аzе-Раb В EtOH (99%) растворяют ВnООС-СН2-(R)Сgl-Аzе-Раb(Z) и гидрируют при атмосферном давлении в присутствии 5% Pd-C. Фильтрованием катализатора через целлит и испарением растворителя получают с 97%-ным выходом заглавное соединение. 1 Н-ЯМР (500МГц, СD3OD, смесь двух ротамеров) основной ротамер d : 1-1,12 (м, 1Н), 1,13-1,34 (м, 4Н), 1,55-1,7 (м, 3Н), 1,73-1,85 (м, 2Н), 1,94-2,02 (ш.д, 1Н), 2,32-2,42 (м, 1Н), 2,54-2,64 (м, 1Н), 2,95-3,1 (АВсистема плюс д, 3Н), 4,18-4,25 (ш.к. 1Н), 4,28-4,32 (ш.к, 1Н), 4,43-4,6 (АВ-система, 2Н), 4,8-4,85 (дд, 1Н), 7,48-7,54 (д, 2Н), 7,66-7,71 (д, 2Н). Разрешимые сигналы меньшего ротамера появляются при d : 0,95 (м), 1; 43 (м), 2,24 (м), 2,84 (д), 3,96 (м, 4,03 (м), 7,57 (ш.д.), 7,78 (ш.д.). 13 С-ЯМР (125МГц, CD3OD) d : 168, 173, 176,3 и 179 (углероды амидиногруппы и карбонила). ПРИМЕР 2 НOOС-СН2-СН2-(R)Cgl-Аzе-Раb х 2НСl (l) Н-(R)Cgl-Аzе-Раb(Z) Получен по методике, приведенной в Примере 1 (II) обработкой гидрохлорида основанием с получением свободного основания. (II) ВnООС-СН2-СН2-(R)Сgl-Аzе-Раb(Z) В 2мл изопропанола растворяют 0,19г (0,38ммоля) Н-(R)Cgl-Aze-Pab(Z) и 70мл (0,43ммоля) бензилакрилата и смесь оставляют на 6 дней. Колоночной хроматографией с применением в качестве элюента CH2CI 2- ТГФ (8:2) получают 0,12г (48%) заглавного соединения. 1 Н-ЯМР (500МГц, СDСI 3) d : 0,8-1,9 (м, 10Н), 1,95 (ш.д, 1Н), 2,4-2,6 (м, 4Н), 2,7-2,8 (м, 3Н; в нем же 2,79 (д, 1Н)), 4,13 (м, 1Н), 4,37 (дд, 1Н), 4,6 (дд, 1Н), 4,97 (дд, 1Н), 5,09 (дд, 1Н), 5,22 (с, 2Н), 7,25-7,4 (м, 10Н), 7,47 (д, 2Н), 7,83 (д, 2Н), 8,61 (ш.т, 1Η). (lll) НООС-СН2-СН2-(R)Сgl-Аzе-Раb x 2НСl В 10мл этанола растворяют 0,1г (0,15ммоля) ВnOOС-СН2-СН2-(R)Cgl-Аzе-Раb(Z) и гидрируют 1ч при атмосферном давлении в присутствии 5% Рd-С. Раствор фильтруют, испаряют и сырой продукт очищают с помощью ОФЖХ с применением СН3СN-0,1Μ NН4OАс (1:4). Полученный продукт сушат вымораживанием, обрабатывают избытком конц. НСI и после повторной сушки вымораживанием получают 31мг дигидрохлорида. 1 Н-ЯМР (300МГц, D2O) d : 0,8-2,1 (м, 11Н), 2,38 (м, 1Н), 2,7-2,9 (м, 3Н), 3,2-3,4 (м, 2Н), 3,98 (д, 1Н), 4,354,55 (м, 2Н), 4,6 (с, 2Н), 5,04 (дд, 1Н), 7,59 (д, 2Н), 7,83 (д, 2Н). 13 С-ЯМР (75МГц, D2O) d :167,2, 167,6, 172,3 и 175,5 (углероды амидиногруппы и карбонила). ПРИМЕР 3 HOOC-CH2-(R)Cgl-Prо-Раb x 2НСl (l) Boc-(R)Cgl-Prо-Раb(Z) В 30мл ацетонитрила смешивают 2,3г (6,49ммоля) Вос-(R)Cgl-Pro-OH (см. раздел: получение исходных соединений), 2,38г (19,47ммолей) ДМAП и 1,84г (6,49ммоля) Н-Раb(Z) (см. раздел: получение исходных соединений). Смесь охлаждают до -15°С и к ней добавляют 1,31г (6,81ммоля) ЭДК. Смесь оставляют нагреваться до комнатной температуры и затем перемешивают примерно сутки. После испарения остаток растворяют в этилацетате и 0,3Μ раствора KHSO4. Кислотную водную фазу трижды экстрагируют этилацетатом. Органическую фазу дважды промывают 0,3Μ раствором KНSO4, дважды раствором NаНСО3 и один раз рассолом, сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого продукта колоночной хроматографией на силикагеле с применением в качестве элюента этилацетата получают 1,77г (44%) продукта. 1 Н-ЯМР (500МГц, СDСI 3) d : 0,9-1,49 (м, 14Н), 1,5-2,1 (м, 9Н), 2,37 (ш.с, 1Н), 3,53 (к, 1Н), 3,94 (ш.с, 1Н), 4,02 (м, 1Н), 4,43 (ш.с, 2Н), 4,65 (д. 1Н), 5,09 (ш.с, 1Н), 5,2 (с, 2Н), 7,18-7,4 (м, 5Н), 7,45 (д, 2Н), 7,62 (ш.с, 1Н), 7,81 (м, 2Н). (II) H-(R)Cgl-Pro-Pab(Z) В 75мл насыщенного НСl этилацетата растворяют 1,45г (2,34ммоля) Воc-(R)Cgl-Pro-Pab(Z) и смесь оставляют на 10 минут при комнатной температуре. Испарением растворителя получают дигидрохлорид продукта. 1 Н-ЯМР (300МГц, D2O) d : 1-1,45 (м, 5Н), 1,58-2,2 (м, 9Н), 2,3-2,5 (м, 1Н), 3,75-3,9 (м, 2Н), 4,25 (д, 2Н), 4,5-4,66 (м, 3Н), 5,49 (с, 2Н), 7,45-7,7 (м, 7Н), 7,87 (д, 2Н). Амин получен растворением дигидрохлорида в 0,1Μ растворе NаОН и трехкратным экстрагированием водной фазы этилацетатом. Органическую фазу промывают один раз рассолом, сушат (Na2SO4), фильтруют и после испарения получают 1,19г (97%) заглавного соединения. (III) ВnOOC-CH2-(R)Cgl-Pro-Pab(Z) В 4мл дихлорметана смешивают 0,34г (0,65ммоля) Н-(R)Cgl-Pro-Pab(Z), 0,215г (0,65ммоля) ВnООССН2-ОТf (см. раздел: получение исходных соединений), 0,299г (2,17ммоля) K2СО3 и смесь кипятят полчаса. Затем реакционную смесь перемешивают примерно сутки при комнатной температуре. Реакционную смесь разбавляют СН2СI 2 и органический слой промывают один раз водой и рассолом, сушат (Na2SO4), фильтруют и испаряют. Очисткой сырого подукта колоночной хроматографией с применением ступенчатого градиента СН2СI 2-МеОН (97:3, затем 95:5) получают 299мг смеси двух продуктов (согласно ТСХ). Эту смесь дополнительно очищают колоночной хроматографией с применением ступенчатого градиента этилацетат-толуол (9:1, 93:7, 95:5, 100:0) и получением 46мг (9%) (ВnООС-СН2)2-(R)Cgl-ProPab(Z), который элюируется с колонки первым и вслед за которым элюировано 133мг (31%) целевого BnOOC-CH2-(R)Cgl-Pro-Pab(Z). 1 Н-ЯМР (300МГц, СDСI 3) d : ВnOOC-CH2-(R)Cgl-Pro-Pab(Z): 0,9-1,3 (м, 5Н), 1,4-2,1 (м, 9Н), 2,3-2,4 (м, 1Н), 3,05 (д, 1Н), 3,2-3,37 (АВ-система с центром при d 3,29, 2Н), 3,5-3,6 (м, 2Н), 4,29-4,57 (АВХ-система с центром при d 4,43, 2Н), 4,62 (д, 1Н), 4,91 (кажущийся синглет, 2Н), 5,19 (с, 2Н), 6,75 (ш.с, NН), 7,1-7,5 (м, 12Н), 8,7-8,8 (м, 2Н + NН), 9,45 (ш.с, NН). 1 Н-ЯМР (300МГц, СDСI 3) d : (ВnOOС-СН2)2-(R)Сgl-Pro-Pab(Z): 0,68-0,9 (м, 2Н), 1-1,3 (м, 3Н), 1,43 (ш.д, 1Н), 1,55-2 (м, 7Н) , 2,05 (ш.д, 1Н) , 2,3-2,4 (м, 1Н), 3,15 (д, 1Н), 3,25-3,48 (м, 2Н), 3,55-3,79 (АВ-система с центром при d 3,67, 4Н), 4,38-4,58 (АВХ-система с центром при d 4,48, 2Н), 4,68 (д, 1Н), 4,82-4,98 (АВсистема с центром при d 4,91, 4Н), 5,19 (с, 2Н), 6,66 (ш.с, NН), 7,1-7,5 (м, 17Н), 7,75 (д, 2Н), 7,8 (т, NН), 9,37 (ш.с, NН). 13 С-ЯМР (75МГц, СDСI 3) d : 164,7, 168,1, 171,5, 172,3 и 172,6 (углероды амидиногруппы и карбонила). (IV) HOOC-CH2-(R)Cgl-Prо-Раb x 2НСl Смешивают 0,133г (0,2ммоля) ВnООС-СН2-(R)Cgl-Prо-Раb(Z) с 0,06г 5% Pd-C, 1мл 1Μ раствора НСl и 10мл этанола и смесь гидрируют 1час в атмосфере Н2. После фильтрования через гайфло и испарения растворителя двухкратным вымораживанием из с входом 93мг (90%) получают продукт. 1 Н-ЯМР (300МГц, D2O) d : 1-1,45 (м, 5Н), 1,5-2,1 (м, 9Н), 2,2-2,4 (м, 1Н), 3,55-3,85 (м, 4Н; в нем же 3,79 (с, 2Н)), 4,23 (д, 1Н), 4,33-4,57 (м, 3Н), 7,44 (д, 2Н), 7,69 (д, 2Н). 13 Н-ЯМР (75МГц, D2O) d : 166,9, 167,2, 169,1, 174,5 (углероды амидиногруппы и карбонила). ПРИМЕР 4 НOOС-СН2-СН2-(R)Сgl-Рrо-Раb x 2НСl (l) ВnOOC-CH2-CH2-(R)Cgl-Pro-Pab(Z) В 3мл этанола растворяют 0,406г (0,762ммоля) Н-(R)Cgl-Pro-Pab(Z). (см. Пример 3) и к раствору добавляют 132мкл (0,861ммоля) бензилакрилата. После перемешивания реакционной смеси при комнатной температуре смесь испаряют и очисткой сырого продукта колоночной хроматографией с применением в качестве элюента ступенчатого градиента СН2Сl2-МеOН (95:5 и 90:1) с выходом 0,399мг (75%) получают проудкт. 1 Н-ЯМР (300МГц, СDСI 3) d : 0,8-1 (м, 1Н), 1-1,3 (м, 4Н), 1,35-2,2 (м, 9Н), 3,4-3,6 (м, 2Н), 4,26-4,52 (АВХсистема с центром при 4,4 , 2Н), 4,64 (дд, 1Н), 5,05 (с, 2Н), 5,2 (с, 2Н), 7,2-7,38 (м, 10Н), 7,43 (д, 2Н), 7,78 (д, 2Н), 13 С-ЯМР (75МГц, СDСI 3) d : 164,7, 167,9, 171,3, 172,7 и 175,4 (углероды амидиногруппы и карбонила). (ll) НООС-СН2-СН2-(R)Сgl-Рrо-Раb x 2НСl ВnООС-СН2-СН2-(R)Сgl-Рro-Pab(Z) (0,261г, 0,383ммоля) смешивают с 0,075г 5% Рd-С, 1мл 1Μ раствора НСl и 10мл этанола и смесь гидрируют два часа при атмосферном давлении. После фильтрования через гайфло и испарения растворителя двухкратным вымораживанием из воды получают 0,196г (96%) продукта. 1 Н-ЯМР (300МГц, D2O) d : 1,17-1,4 (м, 5Н), 1,6-1,82 (м, 5Н), 1,92-2,2 (м, 4Н), 2,32-2,48 (м, 1Н), 2,81 (т, 2Η), 3,11-3,36 (АВХ2-система с центром при d 3,24, 2Н), 3,63-3,9 (м, 2Н), 4,25 (д, 1Н), 4,42-4,63 (м, 3Н), 7,54 (д, 2Н), 7,78 (д, 2Н). 13 С-ЯМР (75МГц, D2O) d : 167,167,3, 174,6 и 174,7 (углероды амидиногруппы и карбонила). ПРИМЕР 5 (HOOC-CH2)2-(R)Cgl-Pro-Pab х 2НСl (BnOOC-CH2)2-(R)Cgl-Prо-Раb(Z) (46мг, 0,056ммоля, см. Пример 3), смешивают с 25мг 5% Pd-C, 0,7мл 1Μ раствора НСl и 7мл этанола и смесь гидрируют один час при атмосферном давлении. Катализатор удаляют фильтрованием через гайфло и растворитель испаряют. Конечный продукт в количестве 25мг (77%) получен двухкратной сушкой вымораживанием из воды. 1 Н -ΗΜΡ (300МГц, D2О) d : 1-1,4 (м, 5Н), 1,45-2,2 (м, 9Н), 2,25-2,45 (м, 1Н), 3,53-3,84 (м, 2Н), 3,84-4,22 (АВ-система с центром при d 4,03, 4Н), 4,26 (д, 1Н), 4,35-4,6 (м, 3Н), 7,53 (д, 2Н), 7,77 (д, 2Н). 13 С-ЯМР (75МГц, D2O) d : 167,1, 167,3 , 170,6 и 174,5 (углероды амидиногруппы и карбонила). ПРИМЕР 6 H-(R)Cgl-Piс-Раb x 2НСl (l) Boc-(R)CgI-Piс-Раb(Z) К перемешиваемому раствору 0,875г (2,37ммоля) Вос-(R)Сgl-Рiс-ОН (см. раздел: получение исходных соединений), 1,22г (9,97ммоля) ДМАП и 0,706г (2,49ммоля Н-Раb(Z) (см. раздел: получение исходных соединений) в смеси 30мл ацетонитрила и 1мл ДМФА добавляют при -18°С 0,478г (2,49ммоля) ЭДК. Реакционную смесь оставляют на два часа нагреваться до комнатной температуры и перемешивание продолжают 48с. После удаления растворителя в вакууме остаток растворяют в 50мл этилацетата. Раствор промывают 15мл воды, 0,3Μ KHSO4 (3x15мл), раствором Na2CO3 (2x15мл) и водой. Удалением растворителя получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-гептан (9:1). Выход 0,96г (64%). (ll) Н-(R)Сgl-Piс-Раb(Z) Через раствор 0,56г (0,88ммоля) Boc-(R)Cgl-Piс-Раb(Z) в 25мл этилацетата пробулькивают хлористый водород. Через две минуты из раствора осаждаются кристаллы. Растворитель удаляют в вакууме и к остатку добавляют 50мл этилацетата. Промыванием 2Μ раствором гидроксида натрия (2x15мл) и экстрагированием водной фазы 25мл этилацетата с последующей сушкой (сульфат натрия) объединенных экстрактов и удалением растворителя в вакууме получают 0,448г (95%) целевого продукта. (lll) H-(R)Cgl-Pic-Pab x 2НСl Раствор 98мг (0,18ммоля) Н-Сgl-Piс-Раb(Z) в 5мл 95% этанола и 1мл воды перемешивают 4 часа в атмосфере водорода в присутствии 5% Pd-C. После фильтрования смеси добавляют 0,3мл 1Μ соляной кислоты. Этанол удаляют в вакууме и сушкой вымораживанием остатка получают 70мг (81%) целевого соединения. 1 Н-ΗΜΡ (300МГц, CD3OD): d 1-1,56 (м, 1Н), 1,56-1,94 (м, 9Н), 1,56-1,94 (м, 9Н), 2,32 (ш.д, 1Н),3,32-3,45 (м, 1Н), 3,9 (ш.д, 1Н), 4,35 (д, 1Н), 4,5 (с, 2Н), 5,1-5,2 (м, 1Н), 7,55 (д, 2Н), 7,76 (д, 2Н). 13 С-ЯМР (75МГц, D2O) d : 167,2, 170,5 и 173,4 (углероды амидиногруппы и карбонила). ПРИМЕР 7 HOOC-CH2-(R,S)CH(COOH)-(R)Cgl-Pic-Pab x 2HCl (l) BnOOC-CH2-(R,S)CH(COOBn)-(R)Cgl-Pic-Pab(Z) Смесь 350мг (0,66ммоля) H-(R)Cgl-Piс-Раb(Z) (см. Пример 6) и 233мг дибензилмалеата в 2,5мл этанола выдерживают 4 дня при комнатной температуре. Этанол удаляют в вакууме и остаток подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-гептан (9:1) и получением 0,108мг целевого продукта. (ll) HOOC-CH2-(R,S)CH(COOH)-(R)Cgl-Piс-Раb х 2НСl Раствор 105мг (0,13ммоля) ВnООС-СН2-(R,S)CH(COOBn)-(R)Cgl-Pic-Pab(Z) в 5мл 95%-го этанола и 1мл воды гидрируют 5 часов в присутствии 5% Рd-С. После добавления 0,3мл 1Μ соляной кислоты смесь фильтруют и растворитель удаляют в вакууме. Остаток растворяют в воде и сушкой вымораживанием получают 54мг (73%) целевого соединения. 1 Н-ЯМР (300МГц, СD3ОD, смесь двух диастереомеров, 5:4) d : 1,1-1,6 (м, 7Н), 1,6-2,04 (м, 9Н), 2,23-2,42 (м, 1Н), 2,93-3,15 (м, 2Н), 3,3-3,42 (м, 1Н, частично экранирован MeOD-пиком), 3,71-3,95 (м, 1Н), 3,98-4,1 (м, 1Н), 4,4-4,6 (м, 3Н), 5,1-5,2 (м, 1Н), 7,49-7,6 (м, 2Н), 7,7-8,1 (м, 2Н). 13 С-ЯМР (75 МГц, D2O) d : 167,1, 168,95, 169,6, и 173,1 (углероды амидиногруппы и карбонила). МС: m/z 516 (М+ + 1). ПРИМЕР 8 Н-(R)Сhа-Аzе-Раb x 2НСl (l) Boc-(R)Cha-Aze-Pab(Z) К перемешиваемой смеси 0,72г (2,03ммоля) Воc-(R)Сhа-Аzе-OН (см. раздел: получение исходных соединений), 1,04г (8,53ммоля) ДМАП и 604мг (2,13ммоля) Н-Раb(Z) (см. раздел: получение исходных соединений) в 20мл ацетонитрила добавляют при -18°С 604мг (2,13ммоля) ЭДК. Реакционную смесь оставляют на ночь нагреваться при комнатной температуре и растворитель затем удаляют в вакууме. Остаток растворяют в 40мл этилацетата и органическую фазу последовательно промывают 10мл воды, 0,3Μ KHSO4 (3х10мл), Na2CO3-NaCl (водн., 2x10мл) и наконец 10мл рассола. Сушкой (Na2SO4) и удалением растворителя в вакууме получают остаток, который подвергают колоночной хроматографии с применением в качестве элюента смеси этилацетат-метанол (9:1) и получением 645мг (51%) заглавного соединения. (ll) Н-(R)Сhа-Аzе-Раb(Z)
ДивитисяДодаткова інформація
Назва патенту англійськоюPeptide derivatives
Назва патенту російськоюПептидные производные
МПК / Мітки
МПК: A61P 11/02, C07D 211/26, A61K 31/445, C07K 2/00, C07K 5/078, A61K 31/397, C07D 239/14, A61K 38/55, C07K 1/10, C07K 5/065, C07K 5/062, C07K 5/06, A61P 43/00, A61K 38/00, A61P 1/00, C07C 237/12, C12N 9/99, A61P 25/28, C07K 5/02, C07D 239/12, C07D 207/09, A61P 17/00, A61P 7/02, C07D 211/16, C07C 271/64, C07D 205/00, A61P 19/02, A61P 29/00, A61P 11/06, C07D 211/60, C07C 257/00
Код посилання
<a href="https://ua.patents.su/59-65518-peptidni-pokhidni.html" target="_blank" rel="follow" title="База патентів України">Пептидні похідні</a>












