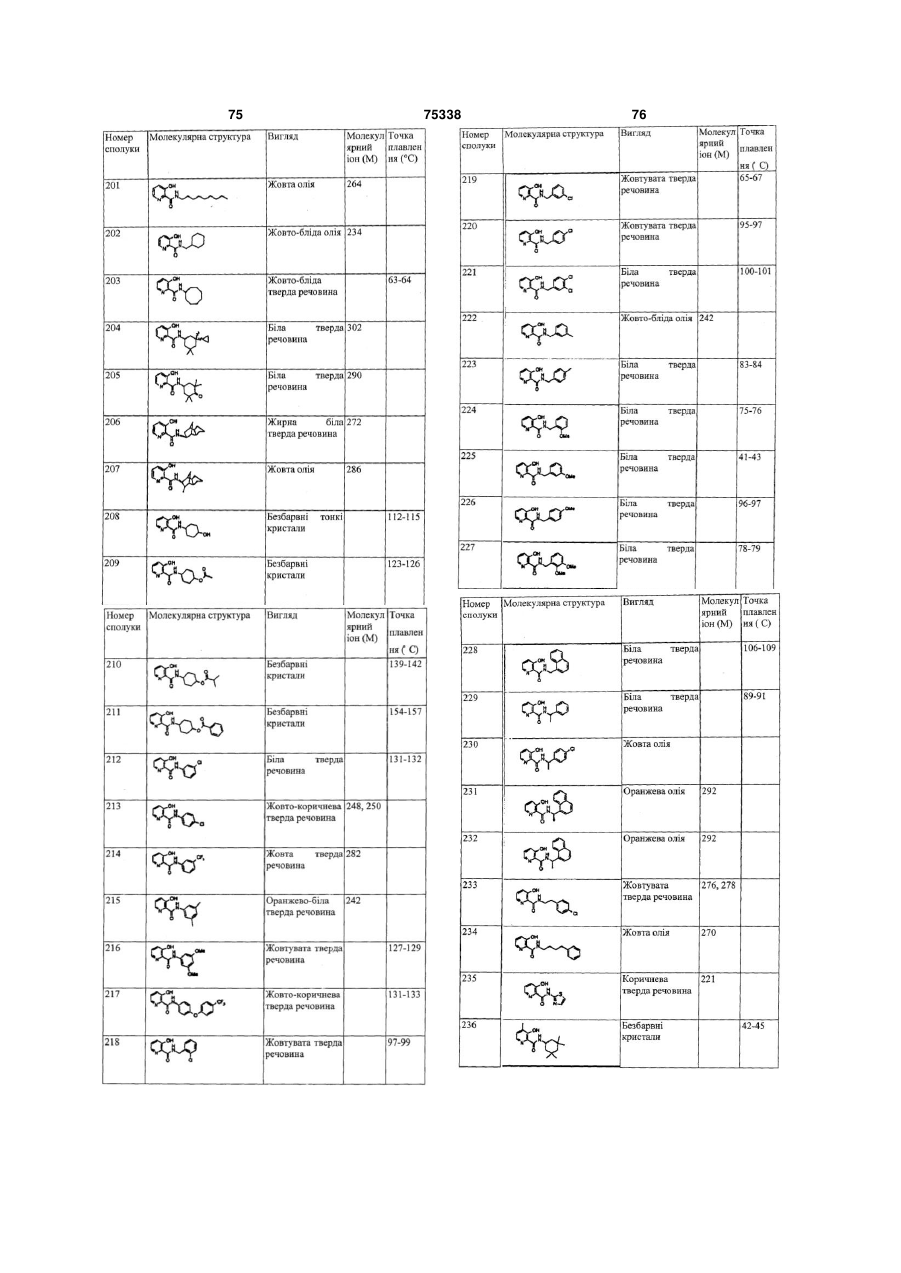
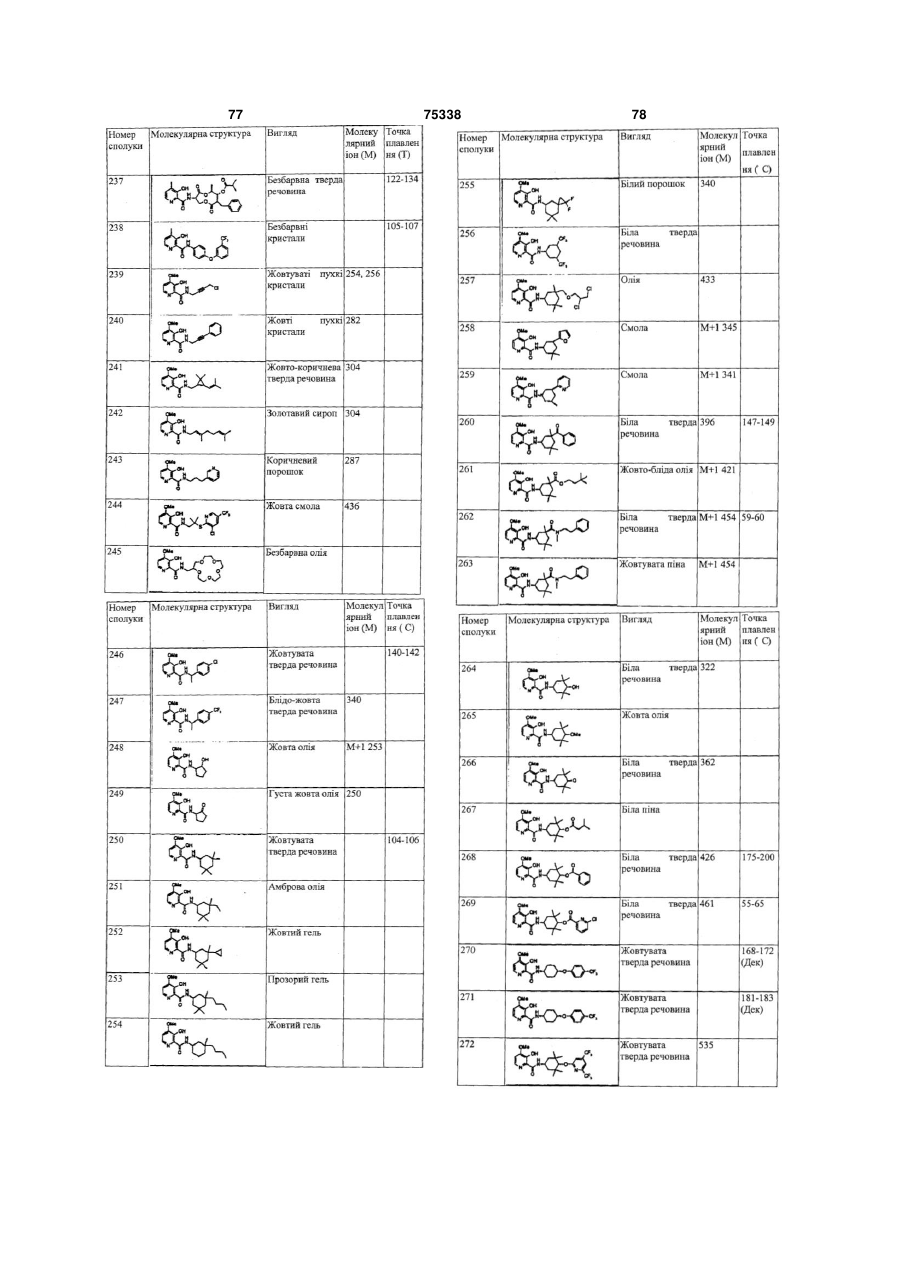
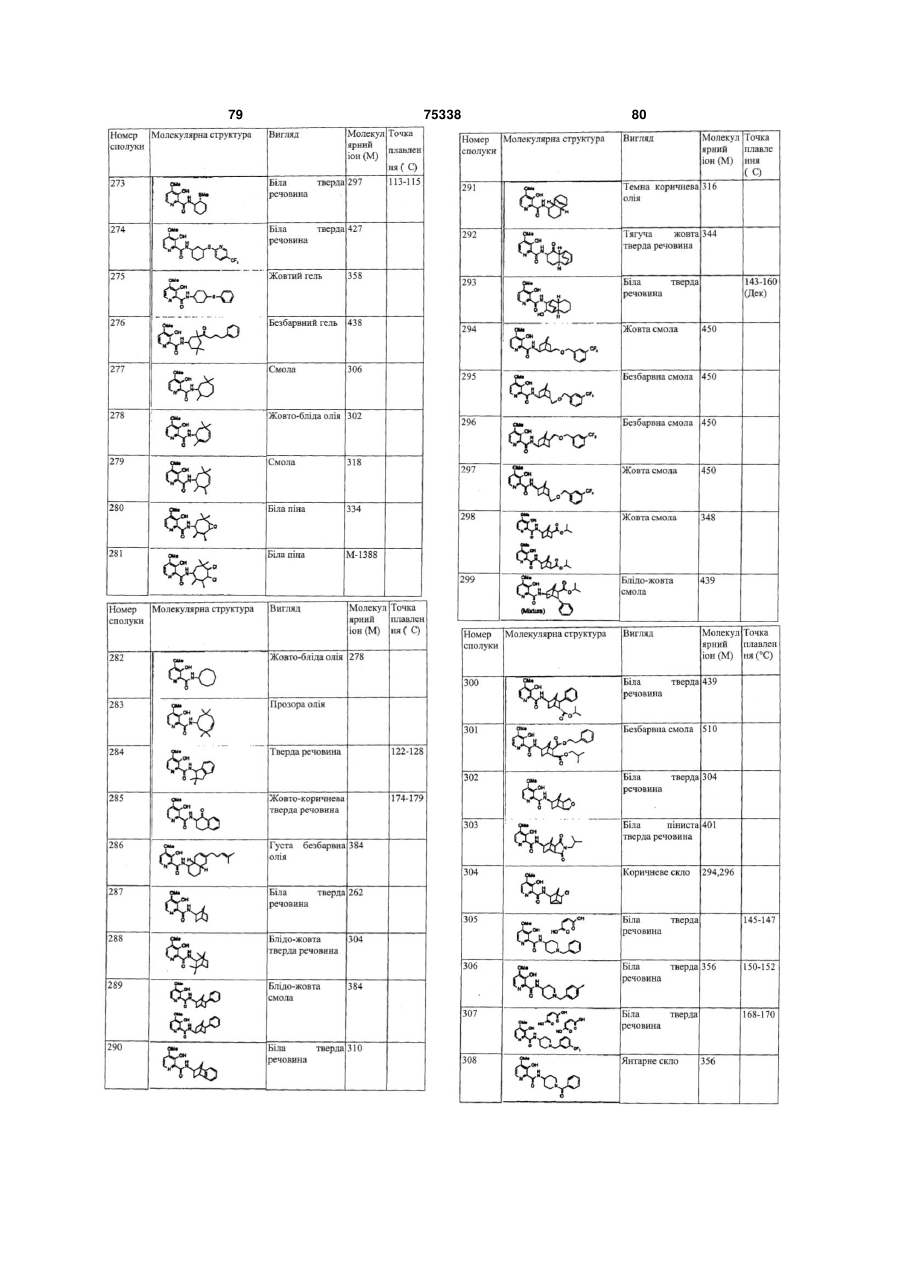
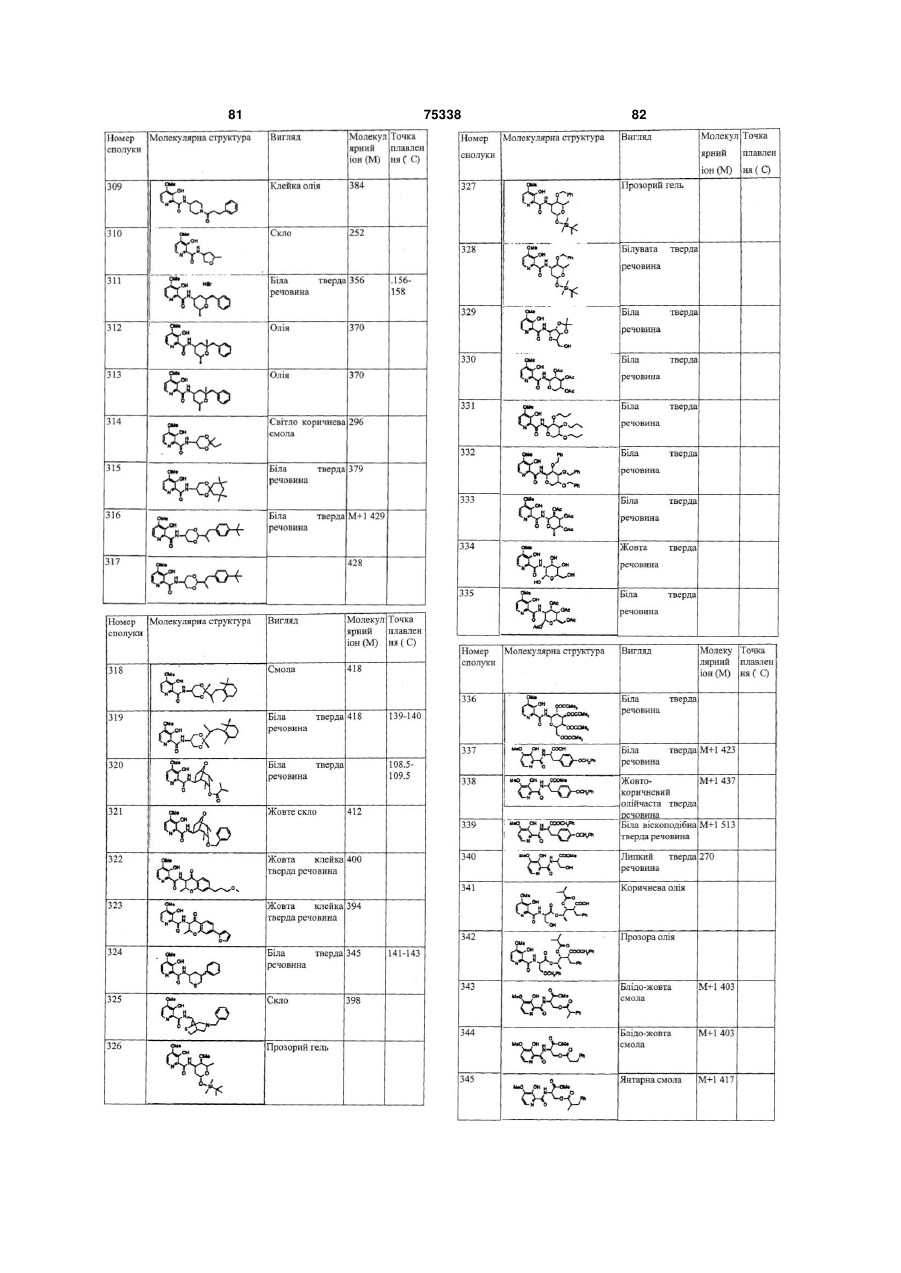
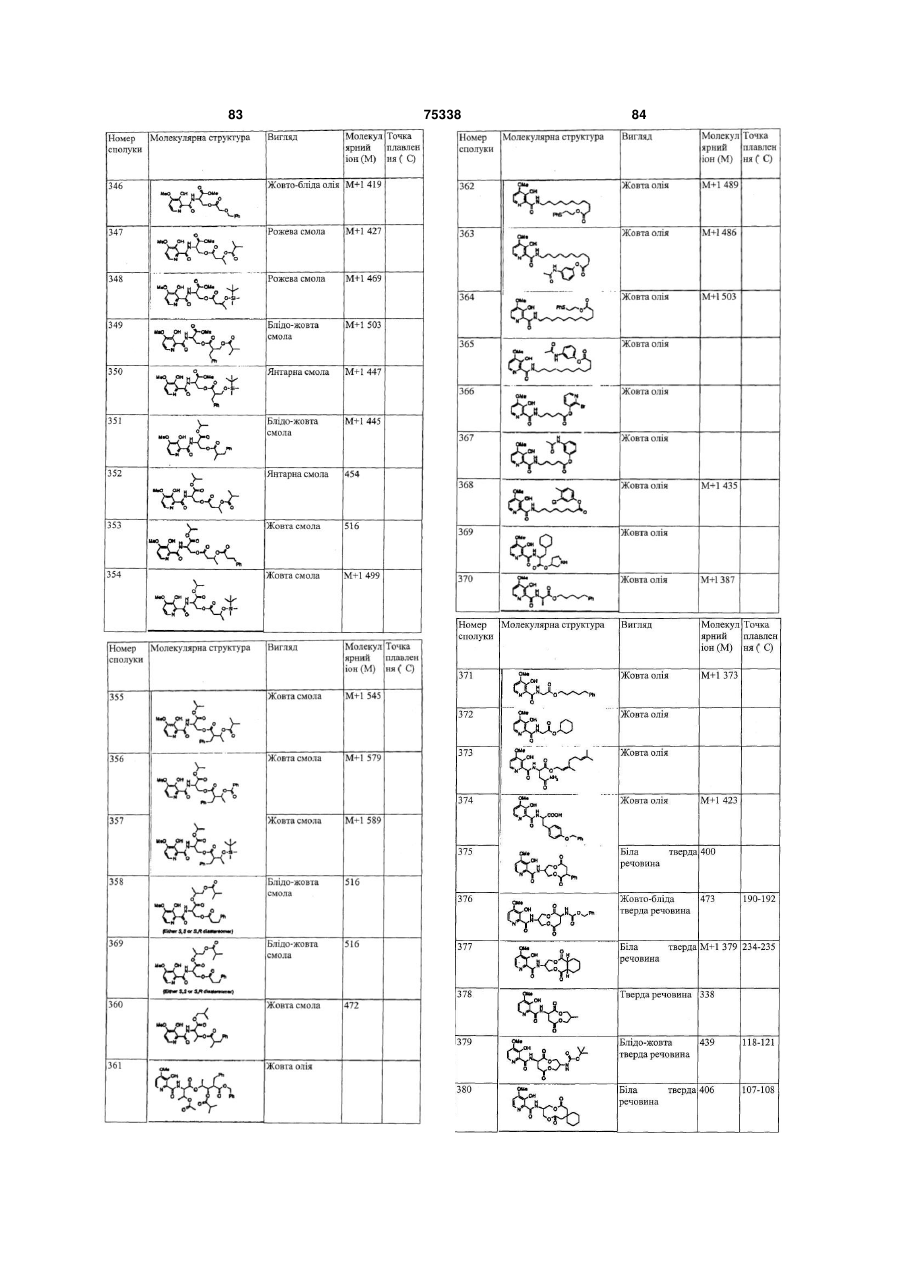
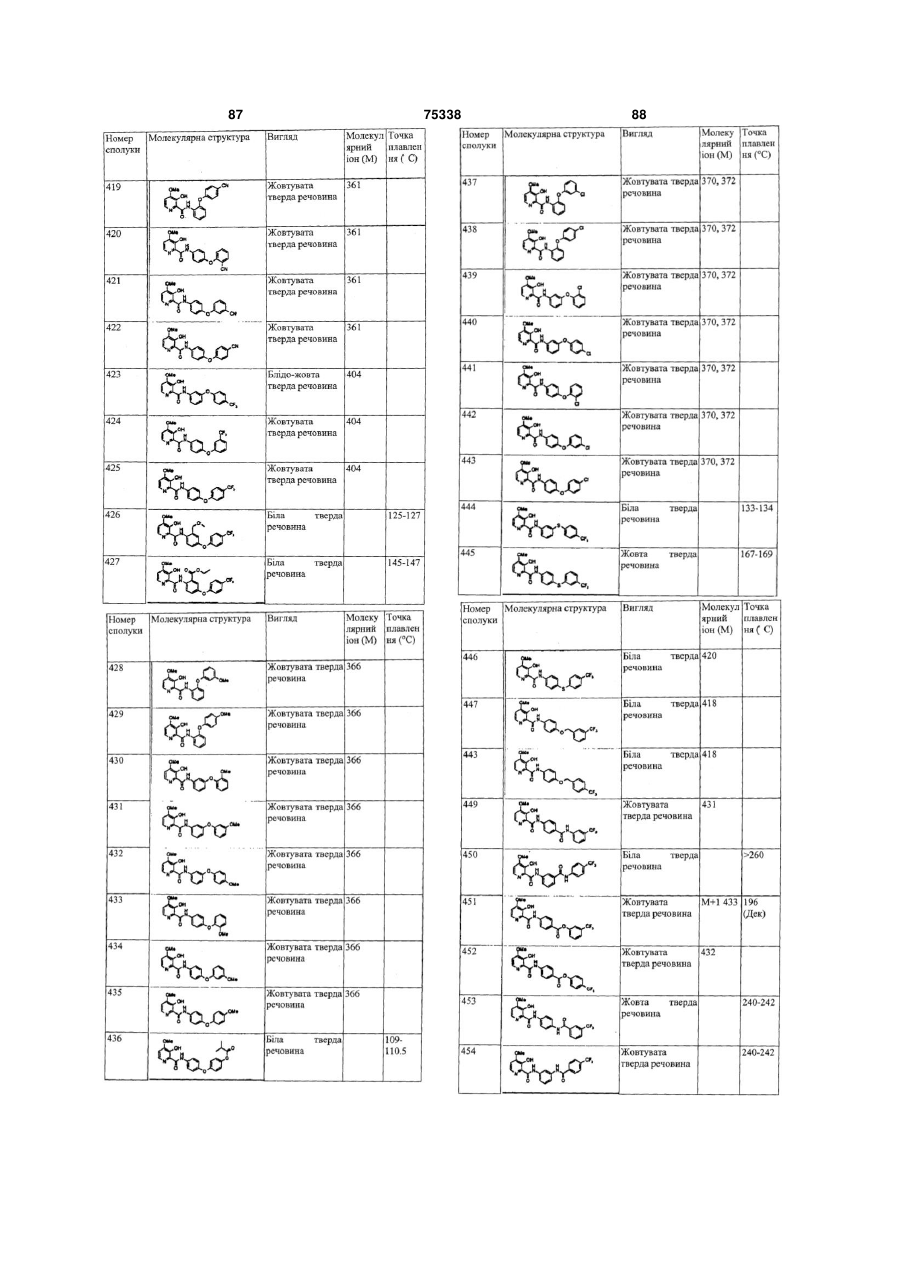
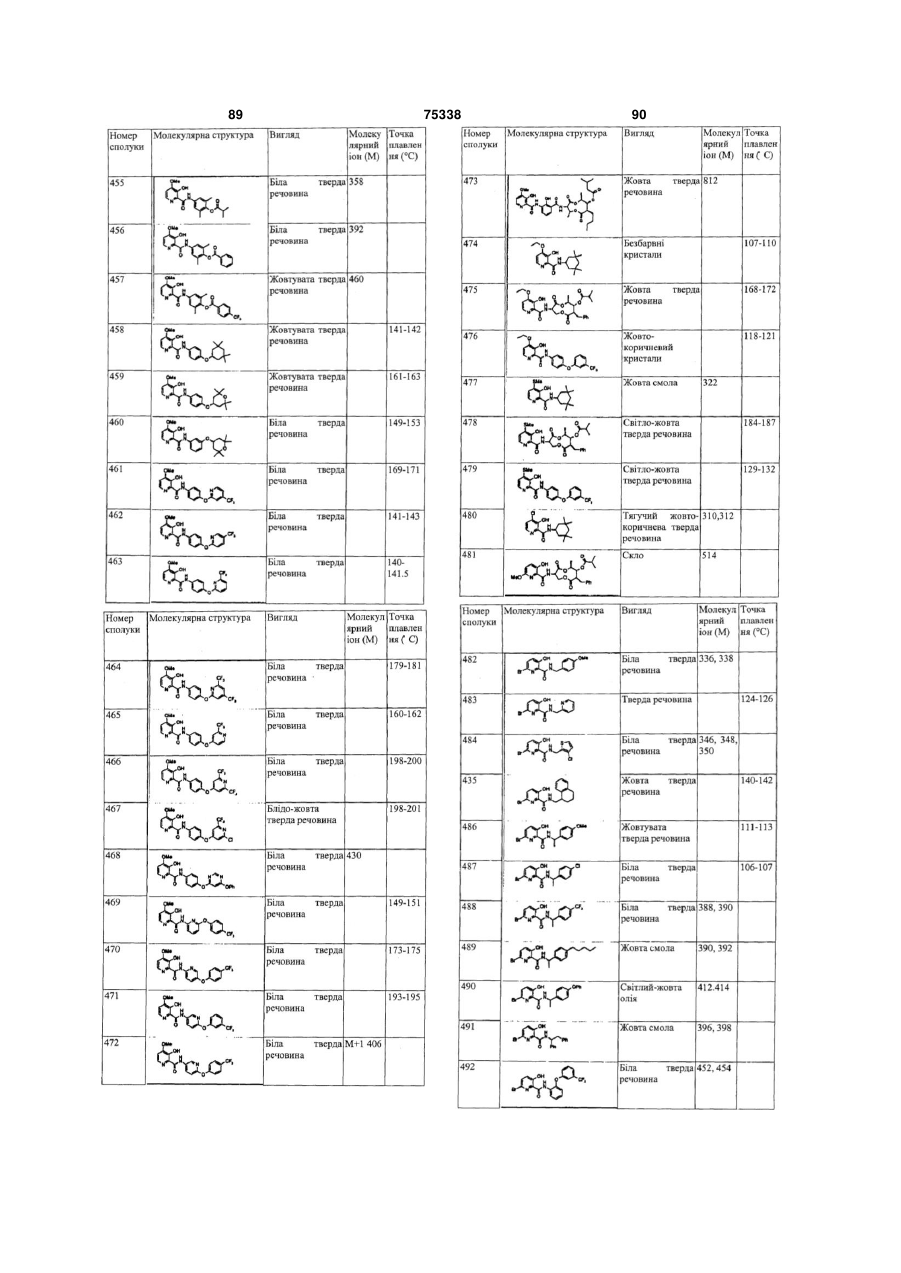
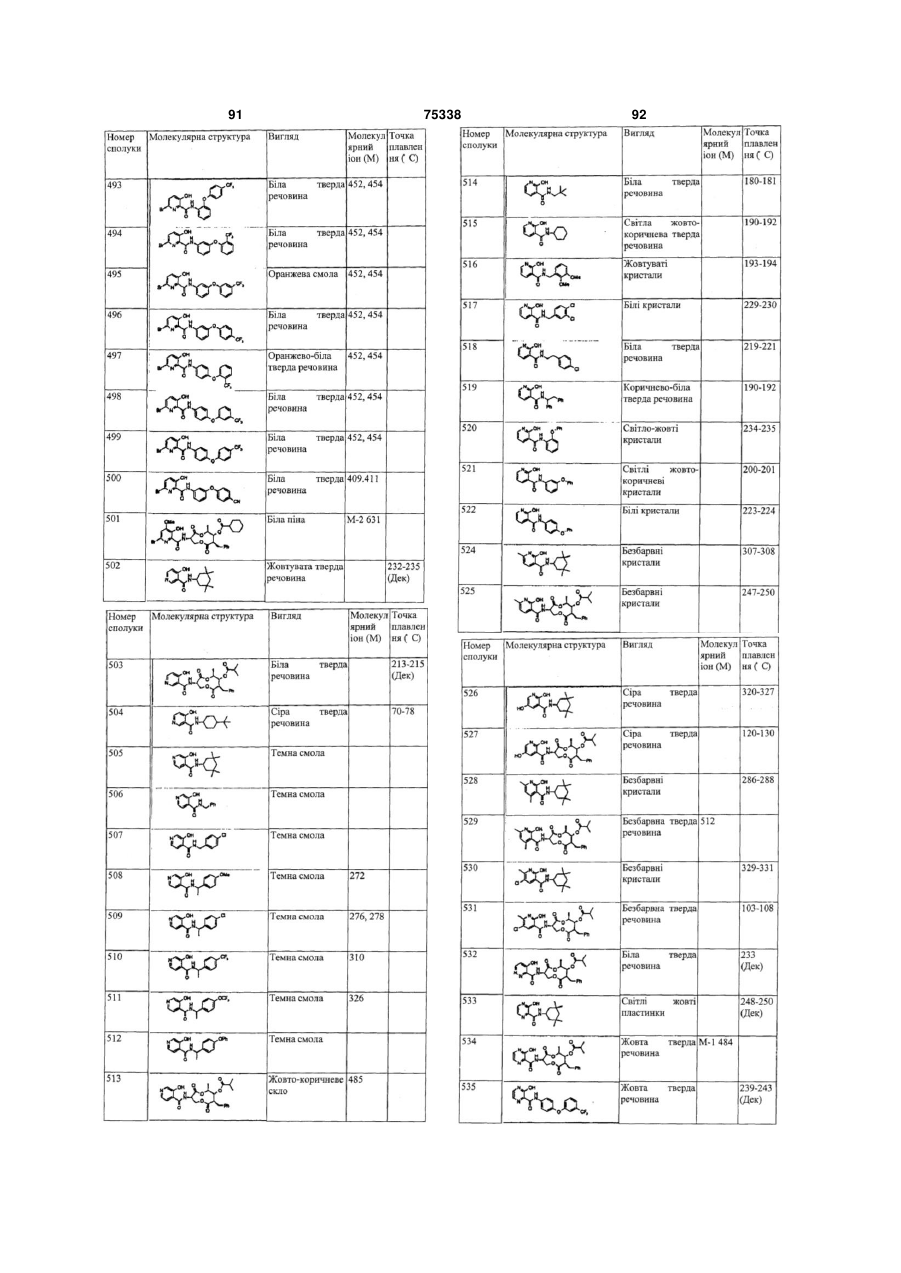
Гетероциклічні ароматичні аміди, фунгіцидна композиція та спосіб контролю або запобігання грибковій інвазії
Номер патенту: 75338
Опубліковано: 17.04.2006
Автори: Генрі Меттью Джеймс, Дент Вілльям Хантер ІІІ, Адамскі Бутц Дженіфер Лінн, Надер Бассам Салім, Рікс Майкл Джон, Найаз Нурмохамед Мохамед, Роджерс Річард Брюер, Гаєвскі Роберт Пітер, Фітцпатрік Джина Марі, Месел Джон Луїс, Моррісон Ірен Має, Мейєр Кевін Джеральд, Йао Ченглін
Формула / Реферат
1. Гетероциклічний ароматичний амід формули І
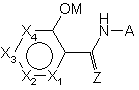 , (I)
, (I)
де:
а) 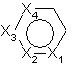 являє собою 5- або 6-членне гетероциклічне ароматичне кільце, в якому
являє собою 5- або 6-членне гетероциклічне ароматичне кільце, в якому
(і) кожний із Х1-Х4 є незалежно О, S; NR', N, CR" або зв'язком;
(іі) не більше ніж один із Х1-Х4 є О, S або NR';
(ііі) не більше ніж один із Х1-Х4 є зв'язком;
(iv) коли будь-який із Х1-Х4 є S, О або NR', будь-який із суміжних Х1-Х4 має представляти зв'язок; та
(v) принаймні будь-який із Х1-Х4 повинен бути О, S, NR' або N; де
R' є Н, С1-С3 алкілом, С2-С3 алкенілом, С2-С3 алкінілом, гідрокси, ацилокси, С1-С6 алкоксиметилом, СНF2, циклопропілом або С1-C4 алкокси; та
R" є незалежно Н, галогеном, ціано, гідрокси, С1-С3 алкілом, С1-С6 галоалкілом, циклопропілом, С1-С3 алкокси, С1-С3 галоалкокси, С1-С3 алкілтіо, арилом, (С1-С3)NHC(О) алкілом, NHC(О)Н, С1-С3 галоалкілтіо, С2-С4 алкенілом, С2-С4 галоалкенілом, С2-С4 алкінілом, С2-С4 галоалкінілом або нітро,
де суміжні R" замісники можуть утворювати кільце або суміжний R' та R" замісники можуть утворювати кільце;
б) Z є О, S або NOR2, де R2 є Н або С1-С3 алкілом; та
в) А являє собою
(і) С1-С14 алкіл, С2-С14 алкеніл, або С2-С14 алкініл, будь-який з них може бути розгалуженим або нерозгалуженим, незміщеним або заміщеним галогеном, гідрокси, нітро, ароїлом, арилокси, C1-C8 ацилокси, С1-С6 алкілтіо, арилтіо, арилом, гетероарилом, гетероарилтіо, гетероарилоксі С1-С6 ацилом, С1-С6 галоалкілом, С1-С6 алкокси або С1-С6 галоалкокси,
(іі) С3-С14 циклоалкіл, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, який може бути незаміщеним або заміщеним галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, C1-C8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами,
ііі) С6-С14 бі- або трициклічна кільцева система, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, які можуть бути незаміщеними або заміщеними галогеном, гідрокси, С2-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, C1-C8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами,
(iv) арил або гетероарил, який може бути незаміщеним або заміщеним нітро, С1-С6 алкілом, С1-С6 галоалкілом, С3-С6 циклоалкілом, С2-С6 алкенілом, С2-С6 алкінілом, арилом, гетероарилом, галогеном, гідрокси, С1-С6 алкокси, С1-С6 галоалкокси, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами, С1-С6 алкілтіо, С1-С6 алкісульфонілом, С1-С6 алкісульфінілом, (С1-С6)ОС(О) алкілом, ОС(О) арилом, (С3-С6)ОС(О) циклоалкілом, (С1-С6)NHC(О) алкілом, (С3-С6)NHC(О) циклоалкілом, NHC(О) арилом, NHC(О) гетероарилом, (С3-С6) циклоалкілтіо, С3-С6 циклоалкілсульфонілом, С3-С6 циклоалкілсульфінілом, арилокси, гетероарилокси, гетероарилтіо, гетероарилсульфінілом, гетероарилсульфонілом, арилтіо, арилсульфінілом, арилсульфонілом, C(O)Ry, C(NORx)Ry, де будь-який алкіл або циклоалкіл, що містить замісник, може бути заміщений одним або більше галогенами, та в якому будь-який арил або гетероарил, що містить замісник, також може бути незаміщеним або заміщеним галогеном, ціано, нітро, ароїлом, арилокси, арилом, гетероарилом, С1-С6 ацилом, С1-С6 галоалкілом, С1-С6 алкокси, С1-С6 галоалкокси, С1-С6 карбоалкокси або амідо незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами, де Ry та Rx є незалежно Н, С1-С6 алкілом, С2-С6 алкенілом, С3-С6 циклоалкілом, арилом або гетероарилом, та
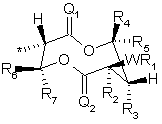 , (V)
, (V)
де * - точка приєднання,
Q1, Q2 є O або S;
W є О, СН2, СНR6 або зв'язком;
R1 є С1-С6 алкілом, С2-С8 алкенілом, C2-C8 алкінілом, С3-С8 циклоалкілом, арилом або гетероарилом;
R2 є Н, С1-С3 алкілом, C2-C9 алкенілом або C2-C5 алкінілом;
R3 є Н, R1, OR1, OC(O)R1, OC(O)OR1 або OC(O)NR1R6;
R4 та R5 є незалежно Н, С1-С6 алкілом або С2-С6 алкенілом, за умови, що сума вуглеців для R4 плюс R5 дорівнює шести або менше, та надалі за умови, що R4 та R5 може об'єднуватись в С3-С6 кільце;
R6 та R7 є незалежно Н, С1-С6 алкілом, С3-С6 циклоалкілом, С2-С5 алкенілом або С2-С5 алкінілом за умови, що принаймні будь-який із R6 та R7 є Н; за умови, що коли

є
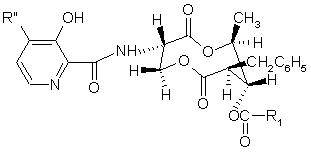
де
R" є Н або ОСН3, тоді
R1 не є ізобутирил, тиглоїл, ізовалерил або 2-метилбутаноїл;
г) М являє собою Si(t-Bu)Me2, Si(Ph)Me2, SiEt3, SіМе3, C(Z)R8, SO2R9, де R8 є Н, С1-С6 алкілом, С2-С6 алкенілом, С2-С6 алкінілом, С3-С6 циклоалкілом, алкоксіалкілом, галоалкілом, алкоксіалкенілом, галоалкенілом, алкоксіалкінілом, галоалкінілом, заміщеним та незаміщеним арилалкілом, заміщеним та незаміщеним арилалкенілом, заміщеним та незаміщеним арилалкінілом, заміщеним та незаміщеним арилом, заміщеним та незаміщеним гетероарилом, С1-С6 алкокси, С3-С6 циклоалкокси, С1-С6 галоалкокси, С2-С6 алкенілокси, С2-С6 галоалкенілокси, С2-С6 алкінілокси, С2-С6 галоалкінілокси, С1-С6 тіоалкокси, заміщеним та незаміщеним арилалкокси, заміщеним та незаміщеним арилалкенілокси, заміщеним та незаміщеним арилалкінілокси, заміщеним та незаміщеним арилокси, заміщеним та незаміщеним гетероарилокси, аміно незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами, та
R9 є С1-С6 алкілом, С2-С6 алкенілом, С3-С6 алкінілом, С3-С6 циклоалкілом, арилом або гетероарилом; або його гідрати, солі та комплекси.
2 . Сполука за п. 1, де
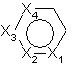
є ізомером піридину, піридазину, піримідину, піразину, піролу, піразолу, імідазолу, фурану, тіофену, оксазолу, ізоксазолу, тіазолу, тідіазолу та ізотіазолу.
3. Сполука за п. 2, де
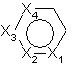
є ізомером піридину, піридазину, піримідину, піразину, піразолу, оксазолу, ізотіазолу та тіазолу.
4. Сполука за п. 1, де А є С1-C14 алкілом, С2-С14 алкенілом, або С2-С14 алкінілом, будь-який з них може бути розгалуженим або нерозгалуженим, незаміщеним або заміщеним галогеном, гідрокси, нітро, ароїлом, арилокси, С1-C8 ацилокси, С1-С6 алкілтіо, арилтіо, арилом, гетероарилом, гетероарилтіо, гетероарилокси, С1-С6 ацилом, С1-С6 галоалкілом, С1-С6 алкокси або С1-С6 галоалкокси.
5. Сполука за п. 1, де А є С3-С14 циклоалкілом, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, які можуть бути незаміщеними або заміщеними галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, С1-С6 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами.
6. Сполука за п. 1, де А є С6-С14 бі- або трициклічна кільцева система, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, які можуть бути незаміщеними або заміщеними галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, С1-С8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеними або заміщеними однією або двома С1-С6 алкілгрупами.
7. Сполука за п. 1, де А є арилом або гетероарилом, який може бути незаміщеним або заміщеним нітро, С1-С6 алкілом, С1-С6 галоалкілом, С3-С6 циклоалкілом, С2-С6 алкенілом, С2-С6 алкінілом, арилом, гетероарилом, галогеном, гідрокси, С1-С6 алкокси, С1-С6 галоалкокси, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами, С1-С6 алкілтіо, С1-С6 алкісульфонілом, С1-С6 алкісульфінілом, (С1-С6)ОС(O) алкілом, ОС(O) арилом, (С3-С6)ОС(O) циклоалкілом, С1-С6 NНС(O) алкілом, (С3-С6)NHC(О) циклоалкілом, NHC(О) арилом, NHC(О) гетероарилом, С3-С6 циклоалкілтіо, С3-С6 циклоалкілсульфонілом, С3-С6 циклоалкілсульфінілом, арилокси, гетероарилокси, гетероарилтіо, гетероарилсульфінілом, гетероарилсульфонілом, арилтіо, арилсульфінілом, арилсульфонілом, C(O)Ry, C(NORx)Ry, де будь-який алкіл або циклоалкіл, що містить замісник, може бути заміщений одним або більше галогенами, та де будь-який арил або гетероарил, що містить замісник, також може бути незаміщеним або заміщеним галогеном, ціано, нітро, ароїлом, арилокси, арилом, гетероарилом, С1-С6 ацилом, С1-С6 галоалкілом, С1-С6 алкокси, С1-С6 галоалкокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами, де Ry та Rx є незалежно Н, С1-С6 алкілом, С2-С6 алкенілом, С3-С6 циклоалкілом, арилом або гетероарилом.
8. Сполука за п. 1, де А є
 ,
,
де * = точка приєднання;
Q1, Q2 є O або S;
W є О, СН2, СНR6 або зв'язком;
R1 є С1-С6 алкілом, C2-C8 алкенілом, C2-C8 алкінілом, С3-C8 циклоалкілом, арилом або гетероарилом;
R2 є Н, С1-С3 алкілом, С2-С5 алкенілом або С2-С5 алкінілом;
R3 є Н, R1, OR1, OC(O)R1, OC(O)OR1 aбo OC(O)NR1R6;
R4 та R5 є незалежно Н, С1-С6 алкілом або С2-С6 алкенілом, за умови, що сума вуглеців R4 плюс R5 дорівнює шести або менше, та надалі за умови, що R4 та R5 можуть бути об'єднані в С3-С6 кільце;
R6 та R7 є незалежно Н, С1-С6 алкілом, С3-С6 циклоалкілом, С2-С5 алкенілом або С2-С5 алкінілом за умови, що принаймні будь-який із R6 та R7 є Н; за умови, що коли

є
 ,
,
де
R" є Н або ОСН3, тоді
R1 не є ізобутирилом, тиглоїлом, ізовалерилом, або 2-метилбутаноїлом
9. Сполука за п. 1, де Z є О.
10. Сполука за п. 1, де Х1 є N, Х2 та Х3 є СН, та Х4 є СН або СОМе, СМе, CCl, COEt aбo CSMe.
11. Сполука за п. 10, де Z є О та А є С1-C14 алкілом, С2-С14 алкенілом або С2-С14 алкінілом, будь-які з них можуть бути розгалуженими або нерозгалуженими, незаміщеними або заміщеними галогеном, гідрокси, нітро, ароїлом, арилокси, С1-С6 ацилокси, С1-С6 алкілтіо, арилтіо, арилом, гетероарилом, гетероарилтіо, гетероарилокси, С1-С6 ацилом, С1-С6 галоалкілом, С1-С6 алкокси або С1-С6 галоалкокси.
12. Сполука за п. 10, де Z є О та А є С3-С14 циклоалкілом, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, який може бути незаміщеним або заміщеним галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, C1-C8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами.
13. Сполука за п. 10, де Z є О та А є С6-С14 бі- або трициклічною кільцевою системою, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, які можуть бути незаміщеними або заміщеними галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, C1-C8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, C1-C6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами.
14. Сполука за п. 10, де Z є О та А є арилом або гетероарилом, який може бути незаміщеним або заміщеним нітро, С1-С6 алкілом, С1-С6 галоалкілом, С3-С6 циклоалкілом, С2-С6 алкенілом, C2-С6 алкінілом, арилом, гетероарилом, галогеном, гідрокси, С1-С6 алкокси, С1-С6 галоалкокси, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами, С1-С6 алкілтіо, С1-С6 алкісульфонілом, С1-С6 алкісульфінілом, (С1-С6)ОС(О) алкілом, ОС(О) арилом, (С3-С6)ОС(О) циклоалкілом, (С1-С6)NHC(О) алкілом, (С3-С6)NHC(О) циклоалкілом, NHC(О) арилом, NHC(О) гетероарилом, С3-С6 циклоалкілтіо, С3-С6 циклоалкілсульфонілом, С3-С6 циклоалкілсульфінілом, арилокси, гетероарилокси, гетероарилтіо, гетероарилсульфінілом, гетероарилсульфонілом, арилтіо, арилсульфінілом, арилсульфонілом, C(O)Ry, C(NORx)Ry, де будь-який алкіл або циклоалкіл, що містить замісник, може бути заміщений одним або більше галогенами, та де будь-який арил або гетероарил, що містить замісник, також може бути незаміщеним або заміщеним галогеном, ціано, нітро, ароїлом, арилокси, арилом, гетероарилом, С1-С6 ацилом, С1-С6 галоалкілом, С1-С6 алкокси, С1-С6 галоалкокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами, де Ry та Rx є незалежно Н, С1-С6 алкілом, С2-С6 алкенілом, С3-С6 циклоалкілом, арилом або гетероарилом.
15. Сполука за п. 10, де Z є О та А є
 ,
,
де * - точка приєднання;
Q1, Q2 є О або S;
W є О, CH2, СНR6 або зв'язком;
R1 є C1-C8 алкілом, C2-C8 алкенілом, C2-C8 алкінілом, С3-C8 циклоалкілом, арилом або гетероарилом;
R2 є Н, С1-С3 алкілом, C2-C5 алкенілом або С2-С5 алкінілом;
R3 є Н, R1, OR1, OC(O)R1, OC(O)OR1 або OC(O)NR1R6;
R4 та R5 є незалежно Н, С1-С6 алкілом або С2-С6 алкенілом, за умови, що сума вуглеців для R4 плюс R5 дорівнює шести або менше, та надалі за умови, що R4 та R5 можуть об'єднуватись в С3-С6 кільце;
R6 та R7 є незалежно Н, С1-С6 алкілом, С3-С6 циклоалкілом, С2-С5 алкенілом або С2-С5 алкінілом за умови, що принаймні будь-який із R6 та R7 є Н;
за умови, що коли

є
 ,
,
де
R" є Н або ОСН3, тоді
R1 не є ізобутирилом, тиглоїлом, ізовалерилом або 2-метилбутаноїлом.
16. Сполука за п. 1, де X1 є N, Х2 є CR", Х3 є N, X4 є CR", та М є С(O)СН3, С(O)СН2СН2OСН3.
17. Сполука за п. 1, де Х1 є N, Х2 є CR", Х3 є CR", X4 є N, та М є С(O)СН3, С(О) СН2СН2OСН3.
18. Сполука за п. 1, де X1 є N, Х2 є N, Х3 є CR", X4 є CR", та М є С(O)СН3, С(O) СН2СН2OСН3.
19. Сполука за п. 1, де Х1 є N, Х2 є CR", Х3 є О, X4 є зв'язком, та М є С(O)СН3, С(O) СН2СН2OСН3.
20. Сполука за п. 1, де Х1 є N, Х2 є CR", Х3 є S, X4 є зв'язком, та М є С(O)СН3, С(O) СН2СН2OСН3.
21. Сполука за п. 1, де Х1 є N, Х2 є NR’, Х3 є CR", X4 є зв'язком, та М є С(O)СН3, С(O) СН2СН2OСН3.
22. Сполука за п. 1, де Х1 є CR", Х2 є СR", Х3 є N, X4 є CR", та М є С(O)СН3, С(О) СН2СН2OСН3.
23. Сполука за п. 1, де Х1 є N, Х2 є S, Х3 є зв'язком, Х4 є CR", та М є С(O)СН3, С(О) СН2СН2OСН3.
24. Сполука за п. 1, де М є С(O)СН3 або С(O)СН2СН2OСН3.
25. Сполука за п. 1, де Z є О та М С(O)СН3 або С(О)СН2СН2OСН3.
26. Сполука за п. 11, де М є С(O)СН3 або С(O)СН2СН2OСН3.
27. Сполука за п. 12, де М є С(O)СН3, або С(O)СН2СН2OСН3.
28. Сполука за п. 13, де М є С(O)СН3 або С(O)СН2СН2OСН3.
29. Сполука за п. 14, де М є С(O)СН3 або С(O)СН2СН2OСН3.
30. Сполука за п. 15, де М є С(O)СН3 або С(O)СН2СН2OСН3.
31. Фунгіцидна композиція, що включає сполуки за п. 1 та фітологічно прийнятний носій.
32. Композиція за п. 31, що додатково включає принаймні одну іншу сполуку, яка вибрана із групи, що складається із інсектицидів, фунгіцидів, гербіцидів, нематоцидів, мітицидів, артоподоцидів, бактерицидів та їх комбінації.
33. Спосіб контролю або запобігання грибковій інвазії, який відрізняється тим, що даний спосіб включає застосування в місці виникнення грибка або в місці, де інвазія підлягає контролю або запобіганню, фунгіцидно ефективної кількості сполуки за п. 1.
34. Фунгіцидна композиція, що включає гетероциклічний ароматичний амід за п.1 або його гідрат, сіль або комплекс і фітологічно прийнятний носій.
Текст
1. Гетероциклічний ароматичний амід мули І UA (21) 2002032214 (22) 04.08.2000 (24) 17.04.2006 (86) PCT/US00/21523, 04.08.2000 (31) 60/149,977 (32) 20.08.1999 (33) US (31) 60/150,248 (32) 23.08.1999 (33) US (31) 09/620,662 (32) 20.07.2000 (33) US (46) 17.04.2006, Бюл. № 4, 2006 р. (72) Рікс Майкл Джон, US, Дент Вілльям Хантер, US, Роджерс Річард Брюер, US, Йао Ченглін , US, Надер Бассам Салім, US, Месел Джон Луїс, US, Фітцпатрік Джина Марі, US, Мейєр Кевін Джеральд, US, Найаз Нурмохамед Мохамед, US, Моррісон Ірен Має, US, Генрі Меттью Джеймс, US, Адамскі Бутц Дженіфер, US, Гаєвскі Роберт Пітер, US (73) ДАУ АГРОСАЙЄНСІЗ ЛЛС, US (56) WO 9637472, A, 28.11.1996 WO 9940081, A, 12.08.1999 JP 10053583, A, 30.04.1998 DATABASE CHEMABS Online CHEMICAL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; retrieved from STN Database accession no. CA63:16300d XP002164206 WO 9610016, A, 04.04.1996 US 4588735, A, 13.05.1986 FR 2649699, A, 18.01.1991 2 (19) 1 3 75338 4 в) А являє собою W є О, СН2, СНR6 або зв'язком; (і) С1-С14 алкіл, С2-С14 алкеніл, або С2-С14 алкініл, R1 є С1-С6 алкілом, С2-С8 алкенілом, C2-C8 алкінібудь-який з них може бути розгалуженим або нелом, С3-С8 циклоалкілом, арилом або гетероарирозгалуженим, незміщеним або заміщеним галолом; геном, гідрокси, нітро, ароїлом, арилокси, C1-C8 R2 є Н, С1-С3 алкілом, C2-C9 алкенілом або C2-C5 ацилокси, С1-С6 алкілтіо, арилтіо, арилом, гетероалкінілом; арилом, гетероарилтіо, гетероарилоксі С1-С6 ациR3 є Н, R1, OR1, OC(O)R1, OC(O)OR1 або лом, С1-С6 галоалкілом, С1-С6 алкокси або С1-С6 OC(O)NR1R6; галоалкокси, R4 та R5 є незалежно Н, С1-С6 алкілом або С2-С6 (іі) С3-С14 циклоалкіл, що містить 0-3 гетероатоми алкенілом, за умови, що сума вуглеців для R4 та 0-2 ненасичені зв'язки, який може бути незаміплюс R5 дорівнює шести або менше, та надалі за щеним або заміщеним галогеном, гідрокси, С1-С6 умови, що R4 та R5 може об'єднуватись в С3-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, кільце; арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, R6 та R7 є незалежно Н, С1-С6 алкілом, С3-С6 цикгетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, лоалкілом, С2-С5 алкенілом або С2-С5 алкінілом за C1-C8 ацилокси, арилом, гетероарилом, С1-С6 ациумови, що принаймні будь-який із R6 та R7 є Н; за лом, карбоарилокси, карбогетероарилокси, С1-С6 умови, що коли OM карбоалкокси або амідо, незаміщеним або заміH N A X4 щеним однією або двома С1-С6 алкілгрупами, X3 ііі) С6-С14 бі- або трициклічна кільцева система, що X2 X1 Z містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, які можуть бути незаміщеними або заміщеними є O галогеном, гідрокси, С2-С6 алкілом, С1-С6 галоалкіOH R" CH3 H лом, ціано, нітро, ароїлом, арилокси, гетероарилоH NH O O CH2C6H5 кси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 H H N O H H алкокси, С1-С6 галоалкокси, C1-C8 ацилокси, ариO OC R1 лом, гетероарилом, С1-С6 ацилом, карбоарилокси, O карбогетероарилокси, С1-С6 карбоалкокси або де амідо, незаміщеним або заміщеним однією або R" є Н або ОСН3, тоді двома С1-С6 алкілгрупами, R1 не є ізобутирил, тиглоїл, ізовалерил або 2(iv) арил або гетероарил, який може бути незаміметилбутаноїл; щеним або заміщеним нітро, С1-С6 алкілом, С1-С6 г) М являє собою Si(t-Bu)Me2, Si(Ph)Me2, SiEt3, галоалкілом, С3-С6 циклоалкілом, С2-С6 алкенілом, SіМе3, C(Z)R8, SO2R9, де R8 є Н, С1-С6 алкілом, С2С2-С6 алкінілом, арилом, гетероарилом, галогеС6 алкенілом, С2-С6 алкінілом, С3-С6 циклоалкілом, ном, гідрокси, С1-С6 алкокси, С1-С6 галоалкокси, алкоксіалкілом, галоалкілом, алкоксіалкенілом, карбоарилокси, карбогетероарилокси, С1-С6 каргалоалкенілом, алкоксіалкінілом, галоалкінілом, боалкокси або амідо, незаміщеним або заміщеним заміщеним та незаміщеним арилалкілом, заміщеоднією або двома С1-С6 алкілгрупами, С1-С6 алкілним та незаміщеним арилалкенілом, заміщеним та тіо, С1-С6 алкісульфонілом, С1-С6 алкісульфінілом, незаміщеним арилалкінілом, заміщеним та неза(С1-С6)ОС(О) алкілом, ОС(О) арилом, (С3міщеним арилом, заміщеним та незаміщеним геС6)ОС(О) циклоалкілом, (С1-С6)NHC(О) алкілом, тероарилом, С1-С6 алкокси, С3-С6 циклоалкокси, (С3-С6)NHC(О) циклоалкілом, NHC(О) арилом, С1-С6 галоалкокси, С2-С6 алкенілокси, С2-С6 галоNHC(О) гетероарилом, (С3-С6) циклоалкілтіо, С3-С6 алкенілокси, С2-С6 алкінілокси, С2-С6 галоалкінілоциклоалкілсульфонілом, С3-С6 циклоалкілсульфікси, С1-С6 тіоалкокси, заміщеним та незаміщеним нілом, арилокси, гетероарилокси, гетероарилтіо, арилалкокси, заміщеним та незаміщеним арилалгетероарилсульфінілом, гетероарилсульфонілом, кенілокси, заміщеним та незаміщеним арилалкініарилтіо, арилсульфінілом, арилсульфонілом, локси, заміщеним та незаміщеним арилокси, заC(O)Ry, C(NORx)Ry, де будь-який алкіл або цикломіщеним та незаміщеним гетероарилокси, аміно алкіл, що містить замісник, може бути заміщений незаміщеним або заміщеним однією або двома С1одним або більше галогенами, та в якому будьС6 алкілгрупами, та який арил або гетероарил, що містить замісник, R9 є С1-С6 алкілом, С2-С6 алкенілом, С3-С6 алкінітакож може бути незаміщеним або заміщеним галом, С3-С6 циклоалкілом, арилом або гетероарилогеном, ціано, нітро, ароїлом, арилокси, арилом, лом; або його гідрати, солі та комплекси. гетероарилом, С1-С6 ацилом, С1-С6 галоалкілом, 2. Сполука за п.1, де С1-С6 алкокси, С1-С6 галоалкокси, С1-С6 карбоалX4 кокси або амідо незаміщеним або заміщеним одніX3 єю або двома С1-С6 алкілгрупами, де Ry та Rx є X2 X1 незалежно Н, С1-С6 алкілом, С2-С6 алкенілом, С3С6 циклоалкілом, арилом або гетероарилом, та є ізомером піридину, піридазину, піримідину, піраQ1 (V) зину, піролу, піразолу, імідазолу, фурану, тіофену, R4 H оксазолу, ізоксазолу, тіазолу, тідіазолу та ізотіазоR5 O * O WR1 лу. R6 H 3. Сполука за п.2, де R R 7 Q2 2 X4 R3 де * - точка приєднання, Q1, Q2 є O або S; X3 X2 X1 5 75338 6 Q1 є ізомером піридину, піридазину, піримідину, піраR4 H зину, піразолу, оксазолу, ізотіазолу та тіазолу. R5 O * 4. Сполука за п.1, де А є С1-C14 алкілом, С2-С14 O WR1 R6 H алкенілом, або С2-С14 алкінілом, будь-який з них R R7 Q2 2 R може бути розгалуженим або нерозгалуженим, 3 , незаміщеним або заміщеним галогеном, гідрокси, де * = точка приєднання; нітро, ароїлом, арилокси, С1-C8 ацилокси, С1-С6 Q1, Q2 є O або S; алкілтіо, арилтіо, арилом, гетероарилом, гетероаW є О, СН2, СНR6 або зв'язком; рилтіо, гетероарилокси, С1-С6 ацилом, С1-С6 галоR1 є С1-С6 алкілом, C2-C8 алкенілом, C2-C8 алкініалкілом, С1-С6 алкокси або С1-С6 галоалкокси. лом, С3-C8 циклоалкілом, арилом або гетероари5. Сполука за п.1, де А є С3-С14 циклоалкілом, що лом; містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, R2 є Н, С1-С3 алкілом, С2-С5 алкенілом або С2-С5 які можуть бути незаміщеними або заміщеними алкінілом; галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкіR3 є Н, R1, OR1, OC(O)R1, OC(O)OR1 aбo лом, ціано, нітро, ароїлом, арилокси, гетероарилоOC(O)NR1R6; кси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 R4 та R5 є незалежно Н, С1-С6 алкілом або С2-С6 алкокси, С1-С6 галоалкокси, С1-С6 ацилокси, ариалкенілом, за умови, що сума вуглеців R4 плюс R5 лом, гетероарилом, С1-С6 ацилом, карбоарилокси, дорівнює шести або менше, та надалі за умови, карбогетероарилокси, С1-С6 карбоалкокси або що R4 та R5 можуть бути об'єднані в С3-С6 кільце; амідо, незаміщеним або заміщеним однією або R6 та R7 є незалежно Н, С1-С6 алкілом, С3-С6 цикдвома С1-С6 алкілгрупами. лоалкілом, С2-С5 алкенілом або С2-С5 алкінілом за 6. Сполука за п.1, де А є С6-С14 бі- або трициклічна умови, що принаймні будь-який із R6 та R7 є Н; за кільцева система, що містить 0-3 гетероатоми та умови, що коли 0-2 ненасичені зв'язки, які можуть бути незаміщеними або заміщеними галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, С1-С8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеними або заміщеними однією або двома С1-С6 алкілгрупами. 7. Сполука за п.1, де А є арилом або гетероарилом, який може бути незаміщеним або заміщеним нітро, С1-С6 алкілом, С1-С6 галоалкілом, С3-С6 циклоалкілом, С2-С6 алкенілом, С2-С6 алкінілом, арилом, гетероарилом, галогеном, гідрокси, С1-С6 алкокси, С1-С6 галоалкокси, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1С6 алкілгрупами, С1-С6 алкілтіо, С1-С6 алкісульфонілом, С1-С6 алкісульфінілом, (С1-С6)ОС(O) алкілом, ОС(O) арилом, (С3-С6)ОС(O) циклоалкілом, С1-С6 NНС(O) алкілом, (С3-С6)NHC(О) циклоалкілом, NHC(О) арилом, NHC(О) гетероарилом, С3-С6 циклоалкілтіо, С3-С6 циклоалкілсульфонілом, С3-С6 циклоалкілсульфінілом, арилокси, гетероарилокси, гетероарилтіо, гетероарилсульфінілом, гетероарилсульфонілом, арилтіо, арилсульфінілом, арилсульфонілом, C(O)Ry, C(NORx)Ry, де будь-який алкіл або циклоалкіл, що містить замісник, може бути заміщений одним або більше галогенами, та де будь-який арил або гетероарил, що містить замісник, також може бути незаміщеним або заміщеним галогеном, ціано, нітро, ароїлом, арилокси, арилом, гетероарилом, С1-С6 ацилом, С1-С6 галоалкілом, С1-С6 алкокси, С1-С6 галоалкокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами, де Ry та Rx є незалежно Н, С1-С6 алкілом, С2-С6 алкенілом, С3-С6 циклоалкілом, арилом або гетероарилом. 8. Сполука за п.1, де А є OM H N X4 A X3 X2 X1 Z є OH R" H NH H N O O O H CH3 O O H CH2C6H5 H H OC O R1 , де R" є Н або ОСН3, тоді R1 не є ізобутирилом, тиглоїлом, ізовалерилом, або 2-метилбутаноїлом 9. Сполука за п.1, де Z є О. 10. Сполука за п.1, де Х1 є N, Х2 та Х3 є СН, та Х4 є СН або СОМе, СМе, CCl, COEt aбo CSMe. 11. Сполука за п.10, де Z є О та А є С1-C14 алкілом, С2-С14 алкенілом або С2-С14 алкінілом, будь-які з них можуть бути розгалуженими або нерозгалуженими, незаміщеними або заміщеними галогеном, гідрокси, нітро, ароїлом, арилокси, С1-С6 ацилокси, С1-С6 алкілтіо, арилтіо, арилом, гетероарилом, гетероарилтіо, гетероарилокси, С1-С6 ацилом, С1С6 галоалкілом, С1-С6 алкокси або С1-С6 галоалкокси. 12. Сполука за п.10, де Z є О та А є С3-С14 циклоалкілом, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, який може бути незаміщеним або заміщеним галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, C1-C8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси або амідо, незаміщеним або заміщеним однією або двома С1-С6 алкілгрупами. 13. Сполука за п.10, де Z є О та А є С6-С14 бі- або трициклічною кільцевою системою, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, які можуть бути незаміщеними або заміщеними галогеном, 7 75338 8 OM гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, H N A X4 нітро, ароїлом, арилокси, гетероарилокси, С1-С6 X3 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1X2 X1 Z С6 галоалкокси, C1-C8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетеє O роарилокси, C1-C6 карбоалкокси або амідо, незаOH R" CH3 H міщеним або заміщеним однією або двома С1-С6 H NH O O CH2C6H5 алкілгрупами. H H N O 14. Сполука за п.10, де Z є О та А є арилом або H H O гетероарилом, який може бути незаміщеним або OC R1 заміщеним нітро, С1-С6 алкілом, С1-С6 галоалкіO , лом, С3-С6 циклоалкілом, С2-С6 алкенілом, C2-С6 де алкінілом, арилом, гетероарилом, галогеном, гідR" є Н або ОСН3, тоді рокси, С1-С6 алкокси, С1-С6 галоалкокси, карбоаR1 не є ізобутирилом, тиглоїлом, ізовалерилом або рилокси, карбогетероарилокси, С1-С6 карбоалкок2-метилбутаноїлом. си або амідо, незаміщеним або заміщеним однією 16. Сполука за п.1, де X1 є N, Х2 є CR", Х3 є N, X4 є або двома С1-С6 алкілгрупами, С1-С6 алкілтіо, С1CR", та М є С(O)СН3, С(O)СН2СН2OСН3. С6 алкісульфонілом, С1-С6 алкісульфінілом, (С117. Сполука за п.1, де Х1 є N, Х2 є CR", Х3 є CR", X4 С6)ОС(О) алкілом, ОС(О) арилом, (С3-С6)ОС(О) є N, та М є С(O)СН3, С(О) СН2СН2OСН3. циклоалкілом, (С1-С6)NHC(О) алкілом, (С318. Сполука за п.1, де X1 є N, Х2 є N, Х3 є CR", X4 є С6)NHC(О) циклоалкілом, NHC(О) арилом, NHC(О) CR", та М є С(O)СН3, С(O) СН2СН2OСН3. гетероарилом, С3-С6 циклоалкілтіо, С3-С6 циклоал19. Сполука за п.1, де Х1 є N, Х2 є CR", Х3 є О, X4 є кілсульфонілом, С3-С6 циклоалкілсульфінілом, зв'язком, та М є С(O)СН3, С(O) СН2СН2OСН3. арилокси, гетероарилокси, гетероарилтіо, гетеро20. Сполука за п.1, де Х1 є N, Х2 є CR", Х3 є S, X4 є арилсульфінілом, гетероарилсульфонілом, арилзв'язком, та М є С(O)СН3, С(O) СН2СН2OСН3. тіо, арилсульфінілом, арилсульфонілом, C(O)Ry, 21. Сполука за п.1, де Х1 є N, Х2 є NR’, Х3 є CR", X4 C(NORx)Ry, де будь-який алкіл або циклоалкіл, що є зв'язком, та М є С(O)СН3, С(O) СН2СН2OСН3. містить замісник, може бути заміщений одним або 22. Сполука за п.1, де Х1 є CR", Х2 є СR", Х3 є N, X4 більше галогенами, та де будь-який арил або геє CR", та М є С(O)СН3, С(О) СН2СН2OСН3. тероарил, що містить замісник, також може бути 23. Сполука за п.1, де Х1 є N, Х2 є S, Х3 є зв'язком, незаміщеним або заміщеним галогеном, ціано, Х4 є CR", та М є С(O)СН3, С(О) СН2СН2OСН3. нітро, ароїлом, арилокси, арилом, гетероарилом, 24. Сполука за п.1, де М є С(O)СН3 або С1-С6 ацилом, С1-С6 галоалкілом, С1-С6 алкокси, С(O)СН2СН2OСН3. С1-С6 галоалкокси, С1-С6 карбоалкокси або амідо, 25. Сполука за п.1, де Z є О та М С(O)СН3 або незаміщеним або заміщеним однією або двома С1С(О)СН2СН2OСН3. С6 алкілгрупами, де Ry та Rx є незалежно Н, С1-С6 26. Сполука за п.11, де М є С(O)СН3 або алкілом, С2-С6 алкенілом, С3-С6 циклоалкілом, С(O)СН2СН2OСН3. арилом або гетероарилом. 27. Сполука за п.12, де М є С(O)СН3, або 15. Сполука за п.10, де Z є О та А є С(O)СН СН OСН . H * R6 O R7 2 Q1 R4 R5 WR1 H O Q2 R2 R3 , де * - точка приєднання; Q1, Q2 є О або S; W є О, CH2, СНR6 або зв'язком; R1 є C1-C8 алкілом, C2-C8 алкенілом, C2-C8 алкінілом, С3-C8 циклоалкілом, арилом або гетероарилом; R2 є Н, С1-С3 алкілом, C2-C5 алкенілом або С2-С5 алкінілом; R3 є Н, R1, OR1, OC(O)R1, OC(O)OR1 або OC(O)NR1R6; R4 та R5 є незалежно Н, С1-С6 алкілом або С2-С6 алкенілом, за умови, що сума вуглеців для R4 плюс R5 дорівнює шести або менше, та надалі за умови, що R4 та R5 можуть об'єднуватись в С3-С6 кільце; R6 та R7 є незалежно Н, С1-С6 алкілом, С3-С6 циклоалкілом, С2-С5 алкенілом або С2-С5 алкінілом за умови, що принаймні будь-який із R6 та R7 є Н; за умови, що коли 2 3 28. Сполука за п.13, де М є С(O)СН3 або С(O)СН2СН2OСН3. 29. Сполука за п.14, де М є С(O)СН3 або С(O)СН2СН2OСН3. 30. Сполука за п.15, де М є С(O)СН3 або С(O)СН2СН2OСН3. 31. Фунгіцидна композиція, що включає сполуки за п.1 та фітологічно прийнятний носій. 32. Композиція за п.31, що додатково включає принаймні одну іншу сполуку, яка вибрана із групи, що складається із інсектицидів, фунгіцидів, гербіцидів, нематоцидів, мітицидів, артоподоцидів, бактерицидів та їх комбінації. 33. Спосіб контролю або запобігання грибковій інвазії, який відрізняється тим, що даний спосіб включає застосування в місці виникнення грибка або в місці, де інвазія підлягає контролю або запобіганню, фунгіцидно ефективної кількості сполуки за п.1. 34. Фунгіцидна композиція, що включає гетероциклічний ароматичний амід за п.1 або його гідрат, сіль або комплекс і фітологічно прийнятний носій. 9 75338 Дана патентна заявка вимагає пріоритету стосовно попередніх [заявок 60/149,977 та 60/150,248, що були подані до Патентного відомства Сполучених Штатів 20 серпня 1999 року, та 23 серпня 1999 року] відповідно, повний зміст яких розкривається в тексті даної патентної заявки як посилання. Попередні [патентні заявки 60/149,977 та 60/150,248] обидві вимагають пріоритету відповідно до попередньої [заявки 60/144,646, поданої 20 червня 1999 року], повний зміст якої розкривається в тексті даної патентної заявки як посилання. Дана патентна заявка вимагає пріоритету відповідно до [заявки 09/620,662, поданої 20 липня 2000], повний зміст якої розкривається в тексті даної патентної заявки як посилання. Даний винахід стосується фунгіцидних сполук та способів їхнього застосування. Більш конкретно - даний винахід стосується нових фунгіцидних гетероциклічних ароматичних амідів, методик, включаючи застосування фунгіцидно активних кількостей таких сполук стосовно локусів рослин патогенів. Даний винахід також стосується методик приготування гетероциклічних ароматичних амідів та їх фунгіцидних сполук. Фахівцям в цій сфері добре відоме велике розмаїття протигрибкових сполук і методик. Антиміцин, наприклад, було ідентифіковано, як природну речовину, що виробляється Streptomyces spp. та має антибіотичні властивості [Barrow. C.J.; et al. Journal ntibiotics, 1997, 50(9), 729]. Ці речовини, як було виявлено, також є ефективними протигрибковими засобами [The Merck Index, Twelfth Edition, S. Budavari, Ed., Merck and Co., Whitehouse Station N.J., 1996, стор.120]. [В патентній заявці WO 97/08135] описано аміди ациламіносаліцилової кислоти, що можуть ефективно використовуватись як пестициди. [В патентній заявці ЕР-А-О-661269] описано заміщені аміди гетероциклічної карбонової кислоти, що можуть ефективно застосовуватись як фармацевтичні засоби. [В патентній заявці JP-A-7-233165] описано протигрибкові дилактони із 3-гідроксипіридинокарбоксилові групи, що мають протигрибкові властивості. Похідні ізобутирилу, тиглоїлу, ізовалерілу та 2-метилбутирилу цих сполук в подальшому було описано в: [Tetrahedron 1998, 54, 12745-12774; J. Antibiot. 1997, 50(7), 551; J. Antibiot. 1996, 49(7), 639; J. Antibiot. 1996, 49(12), 1226; and Tetrahedron Lett. 1998, 39, 4363-4366]. Проте, потреба в нових протигрибкових засобах все ще залишається досить високою. Даний винахід представляє протигрибкові засоби, що мають високу залишкову активність, більш високу активність при менших дозах застосування, мають лікувальні властивості, а також більш широкий спектр ефективної дії. Один із аспектів даного винаходу представляє сполуки, що включають гетероциклічні ароматичні аміди (ГАА) за Формулою І: (I) 10 де Х1-Х4, Μ, Ζ та А є такими, що визначаються в подальшому. Винахід також включає гідрати, солі та їх сполуки. Даний винахід також представляє протигрибкові сполуки, що включають ГАА в поєднанні із фітологічно прийнятними носіями і/або розчинниками. Спосіб застосування сполук гетероциклічних ароматичних амідів розкрито нижче. Метою даного винаходу є створення ГАА та їх сполук, що є ефективними як протигрибкові засоби. Іншою метою даного винаходу є розробка методики здійснення контролю та/або запобігання грибковій інвазії, при цьому зазначена методика включатиме застосування ГАА та їх сполук, що їх містять. Подальші цілі та переваги даного винаходу буду розкрито за допомогою наступного опису винаходу. Даний винахід стосується різноманітних сполук ГАА, які є активними як протигрибкові засоби. До меж даного винаходу також входять речовини, до складу яких входять сполуки ГАА, а також методика застосування сполук ГАА. Способи приготування сполук ГАА також входять до складу даного винаходу, а також способи їх приготування і застосування як протигрибкових засобів. Сполуки ГАА Нові протигрибкові сполуки ГАА за даним винаходом описано за допомогою наступної Формули І: (I) де а) представляє 5- або 6- членне гетеро циклічне ароматичне кільце, в якому (і) кожен із Х1-Х4 є незалежно О, S, NR', N, CR" або зв'язком; (іі) не більше ніж один із Х1-Х4 є О, S або NR'; (ііі) не більше ніж один із Х1-Х4 є а зв'язком; (iv) коли будь-який із Х1-Х4 є S, О або NR', один із суміжних Х1-Х4 повинен бути представлений зв'язком; та (ν) принаймні будь-який із Х1-Х4 повинен бути O, S, NR' або Ν; де R' є Н, С1-С3 алкілом, С2-С3 алкенілом, С2-С3 алкінілом, гідрокси, ацилокси, С1-С6 алкоксиметилом, CHF2, циклопропілом або С1-С4 алкокси; та R" є незалежно Н, галогеном, ціано, гідроксиС1-С3 алкілом, С1-С3 галоалкілом, циклопропілом, С1-С3 алкокси, С1-С3 галоалкокси, С1-С3 алкілтіо, арилом, С1-С3 NHC(O) алкілом, NHC(O)H, С1-С3 галоалкілтіо, С2-С4 алкенілом, С2-С4 галоалкенілом, С2С4 алкінілом, С2-С4 галоалкінілом або нітро, де суміжні заступники R" можуть утворювати кільце або суміжні заступники R' та R" можуть утворювати кільце; б) Ζ є О, S або NOR2 в якому R2 є Η або С1-С3 алкілом; та 11 75338 12 в) А представляє Q1, Q2 є О або S; (і) C1-C14 алкіл, С2-С14 алкеніл, або С2-С14 алкіW є О, СН2, CHR6, або зв'язком; ніл, будь-який з них може бути розгалуженим або R1 є С1-С8, алкілом, C2-C8 алкенілом, С2-С8, нерозгалуженим, незаміщеним або заміщеним алкінілом, С3-C8, циклоалкілом, арилом або гетегалогеном, гідрокси, нітро, ароїлом, арилокси, С1роарилом; С8 ацилокси, С1-С6 алкілтіо, арилтіо, арилом, гетеR2 є Н, С1-С3 алкілом, С2-С5 алкенілом або С2роарилом, гетероарилтіо, гетероарилокси, С1-С6 С5 алкінілом; ацилом, С1-С6 галоалкілом, С1-С6 алкокси або С1R3 є Н, R1, OR1, ОС (О) R1, OC(O)OR1 або С6 галоалкокси, OC(O)NR1R6; (іі) С3-С14 циклоалкіл, що містить 0-3 гетероаR4 та R5 є незалежно Η, С1-С6 алкілом, або С2томи та 0-2 ненасичені зв'язки, що можуть бути С6 алкенілом, за умови, що сума вуглеців для R4 незаміщеними або заміщеними галогеном, гідрокта R5 дорівнює шести або менше, та в подальшоси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, му, за умови, що R4 та R5 можуть бути об'єднані в ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, С3-С6 кільце; арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоR6 та R7 є незалежно Н, С1-С6 алкілом, С3-С6 алкокси, С1-С8 ацилокси, арилом, гетероарилом, циклоалкілом, С2-С5 алкенілом або С2-С5 алкінілом С1-С6 ацилом, карбоарилокси, карбогетероарилокза умови, що принаймні один із R6 та R7 є Н; си, С1-С6 карбоалкокси, а також амідо незаміщеза умови, що, коли ним або заміщеним однією або двома С1-С6 алкіл групами, (ііі) С6-С14 бі- або трициклічна кільцева система, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки, що може бути незаміщена або заміщена галогеном, гідрокси, С1-С6 алкілом, С1-С6 галоалкілом, ціано, нітро, ароїлом, арилокси, гетероарилокси, С1-С6 алкілтіо, арилтіо, гетероарилтіо, С1-С6 алкокси, С1-С6 галоалкокси, С1-С8 ацилокси, арилом, гетероарилом, С1-С6 ацилом, карбоарилокси, карбогетероарилокси, С1-С6 карбоалкокси, а також амідо незаміщеним або заміщеним однією або двома С1-С6 алкіл групами, де (iv) арил або гетероарил, що може бути незаR" є Η або ОСН3, тоді міщеним або заміщеним нітро, С1-С6 алкілом, С1R1 не є ізобутирилом, тиглоїлом, ізовалериС6 галоалкілом, С3-С6 циклоалкілом, С2-С6 алкенілом, або 2-метилбутаноїлом; лом, С2-С6 алкінілом, арилом, гетероарилом, галоd) M представляє геном, гідрокси, С1-С6 алкокси, С1-С6 галоалкокси, Η, Si(t-Bu)Me2, Si(Ph)Me2, SiEt3, SiMe3, карбоарилокси, карбогетероарилокси, С1-С6 карC(Z)R8SО2R9 де R8 є Η, С1-С6 алкілом, С2-С6 алкебоалкокси або амідо незаміщеним або заміщеним нілом, С2-С6 алкінілом, С3-С6 циклоалкілом, алкокоднією або двома С1-С6 алкіл групами, С1-С6 алкісиалкілом, галоалкілом, алкоксиалкенілом, галоалтіо, С1-С6 алкісульфонілом, С1-С6 алкісульфінілкенілом, алкоксіалкінілом, галоалкінілом, лом, С1-С6 ОС(О)алкілом, ОС(О)арилом, С3-С6 заміщеним та незаміщеним арилалкаїлом, заміОС(О) циклоалкілом, С1-С6 NHC(O) алкілом, С3-С6 щеним та незаміщеним арилалкенілом, заміщеним NHС(О)циклоалкілом, NHС(О)арилом, та незаміщеним арилалкінілом, заміщеним та неNНС(О)гетероарилом, С3-С6 циклоалкілтіо, С3-С6 заміщеним арилом, заміщеним та незаміщеним циклоалкілсульфонілом, С3-С6 циклоалкілсульфігетероарилом, С1-С6 алкокси, С3-С6 циклоалкокси, нілом, арилокси, гетероарилокси, гетероарилтіо, С1-С6 галоалкокси, С2-С6 алкенілокси, С2-С6 галогетероарилсульфінілом, гетероарилсульфоніл, алкенілокси, С2-С6 алкінілокси, С2-С6 галоалкінілоарилтіо, арилсульфінілом, арилсульфонілом, кси, С1-С6 тіоалкокси, заміщеним та незаміщеним C(O)Ry, C(NORx)Ry; в яких будь-який алкіл або циарилалкокси, заміщеним та незаміщеним арилалклоалкіл, що містить заступник може бути заміщекенілокси, заміщеним та незаміщеним арилалкініний одним, або більше галогенами, та де будьлокси, заміщеним та незаміщеним арилокси, заякий арил або гетероарил, що містить заступник, міщеним та незаміщеним гетероарилокси, аміно може також бути незаміщеним або заміщеним ганезаміщеним або заміщеним однією або двома С1логеном, ціано, нітро, ароїлом, арилокси, арилом, С6 алкіл групами, та R9 є С1-С6 алкілом, С2-С6 алгетероарилом, С1-С6 ацилом, С1-С6 галоалкілом, кенілом, С3-С6 алкінілом, С3-С6 циклоалкілом, ариС1-С6 алкокси, С1-С6 галоалкокси, С1-С6 карбоаллом, або гетероарилом. кокси або амідо, незаміщеними або заміщеними Терміни алкіл, алкеніл, алкініл та подібні, як їх одним, або двома С1-С6 алкіл групами, де Ry та Rx вжито тут, включають як, прямі так і розгалужені є незалежно Н, С1-С6 алкілом, С2-С6 алкенілом, С3групи; терміни алкеніл, алкенілен та подібні, вклюС6 циклоалкілом, арилом або гетероарилом, та чають тут групи, що містять один або більше по(ν) де *= точка приєднання де двійних зв'язків; а терміни алкінілом, алкінілен та подібні, мають на увазі групи, що містять один або більше потрійних зв'язків. Циклоалкіл, як їх вжито тут, стосується групи С3-С14 циклоалкілу, що містить 0-3 гетероатоми та 0-2 ненасичені зв'язки. Біабо трициклічні кільцеві системи стосуються С6 13 75338 14 С14 аліфатичних кільцевих систем, що містять 0-3 гетероатоми та 0-2 ненасичені зв'язки. Терміни, що будуть вживатися в подальшому в тексті заявки мають як заміщену так і незаміщену форми. включають відповідні ізомери піридину, піридазиЯкщо спеціально не зазначено протилежне, а зану, піримідину, піразину, піролу, піразолу, імідазоміщена форма стосується заміщення однією або лу, фурану, тіофену, оксазолу, ізоксазолу, тіазолу, більше групами, обраними із галогену, гідрокси, ізотіазолу, та тідіазолу. Найбільш переважними ціано, нітро, ароїлу, арилокси, арилу, арилтіо, гегетероциклічними ароматичними кільцями є піритероарилу, гетероарилокси, гетероарилтіо, С1-С8 дин, піримідин, піразин, піридазин, тіазол, ізотіаацилу, С1-С6 галоалкілу, С1-С6 алкокси, С1-С6 газол, тідіазол, та оксазол. Особливо переважні лоалкокси, С1-С6 алкілтіо, С1-С6 галоалкілтіо, карсклади за Формулою І базуються на 2-амідо-3боарилокси, карбогетероарилокси, С1-С6 карбоалгідроксипіридині, 2-амідо-3-гідрокси-4кокси або амідо незаміщеного або заміщеного метоксипіридині, 2-амідо-3-гідроксипіразині, та 4однією або двома С1-С6 алкіл групами. Всі переліамідо-5-гідроксипірамідині. чені терміни та визначення мають на увазі, що Автори визнають, що приготування певних виконуються вимоги правил хімічних зв'язків та комбінації груп заступників сполук, що підпадають енергетики деформації. під надані тут визначення, може бути неможливим, Термін арил, як він вживається тут, стосується із просторових або хімічних причин. Такі сполуки заміщеного фенілу або нафтилової групи. Термін не включено в сферу дії даного винаходу. гетероарил стосується будь-якого з 5 або 6 членРізноманітні гідрати, солі та комплекси сполук ного кільця, що містить один, або більше гетероаза формулою 1 можуть бути приготовані із застотоми; ці гетероароматичні кільця можуть також суванням звичайних методик. Наприклад, солі бути поєднанні із іншими ароматичними системаможуть утворюватись шляхом заміни атому гідроми. Терміни, що будуть вживатися в подальшому в ксилу водню (М=Н) катіоном, наприклад NH4+, тексті заявки мають як заміщену так і незаміщену +N(Bu)4, K+, Na+, Ca2+, Li+, Mg2+, Fe2+, Сu2+, і т.ін. форми. А заміщена форма стосується заміщення Ці похідні є також корисними в зв'язку із даним однією або більше групами, обраними з нітро, С1винаходом. С6 алкілу, С1-С6 галоалкілу, С3-С6 циклоалкілу, С2В тексті даної патентної заявки всі температуС6 алкенілу, С2-С6 алкінілу, арилу, гетероарилу, ри представлено в градусах за Цельсієм (°С), а всі галогену, гідрокси, Сі-Сб алкокси, Сі-Сб галоалкопроценти є процентами від ваги, якщо не зазначекси, С1-С6 алкілтіо, С1-С6 алкісульфонілу, С1-С6 но протилежне. Термін проміле означає "часток на алкісульфінілу, С1-С6 ОС(О)алкіл, ОС(О) арилу, мільйон" (parts per million). Термін psi означає "фуС3-С6 ОС(О) циклоалкілу, С1-С6 NHC(О) алкілу, С3нтів на квадратний дюйм" (pounds per square inch). С6 NHС(О)циклоалкілу, NHC(O)арилу, Термін m.p. означає "точка плавлення" (Точка NHС(О)гетероарилу, С3-С6 циклоалкілтіо, С3-С6 плавлення). Термін b.р. означає "точка кипіння" циклоалкілсульфонілу, С3-С6 циклоалкілсульфіні(boiling point). лу, арилокси, гетероарилокси, гетероарилтіо, геПриготування сполук тероарилсульфінілу, гетероарилсульфонілу, арилСполуки за даним винаходом готуються із затіо, арилсульфінілу, арилсульфонілу, C(O)Ry, стосуванням методик, добре відомих фахівцям в C(NORx)Ry де Ry та Rx є незалежно Н, С3-С6 алкіданій сфері. Необхідним похідним матеріалом є лом, С2-С6 алкенілом, С3-С6 циклоалкілом, арилом речовини, що є доступними комерційно, або є легабо гетероарилом, де будь-який алкіл або циклоако синтезованими із застосуванням стандартних лкіл, що містять заступник можуть бути заміщениметодик. ми одним, або більше галогенами, та за умови, що ПРИГОТУВАННЯ ПІРИДИН-2виконуються вимоги правил хімічних зв'язків та КАРБОКСАМІДІВ. енергетики деформації. Необхідний ГАА (2) готується шляхом здійсТермін галоген та гало, як вони вживаються нення реакції відповідної ортотут, включають хлорин, бромін, флуорин та йод. гідроксигетероароматичної карбоксильної кислоти Термін галоалкіл та подібні стосуються груп замі(1) із аміном в присутності зв'язуючої речовини щених одним, або більше атомами галогену. (фосген або 1-[3-25 диметиламінопропіл]-3Термін Me, як він вживається тут, стосується етилкарбодіімід гідрохлорид (EDCI)) та 1метил групи. Термін Et стосується етил групи. Тегідроксибензотриазол (HOBt) або 1-гідрокси-7рмін Рr стосується групи пропілу. Термін Вu стосуазабензотриазол (HOAt) та поглинач кислоти, нається групи бутилу. Термін Ph стосується феніл приклад, N-метилметилморфолін (NMM), триетигрупи. Термін EtOAc стосується етил ацетату. ламін, 4-(диметиламіно) піридин (DMAP), або дііТермін алкокси, як він вживається тут, стосузопропілетиламін) (Схема 1). В деяких випадках ється прямого або розгалуженого ланцюга алкокси кислотні хлориди із захищеними гідрокси групами, групи. Термін галоалкокси стосується алкокси груякі (3), можуть реагувати із відповідними амінами пи, заміщеної одним, або більше атомами гадля утворення перехідних амідів (4). Видалення логену. захисної групи шляхом гідрування в присутності Термін гетероатом, як він вживається тут, стопаладієвого (Pd) каталізатора утворює необхідний сується О, S та N. продукт (2Х). Перекриття гідроксильної групи гетеПереважні 5- або 6- членні гетероциклічні роциклу в сполуці 2 ацильною, сульфонільною, ароматичні кільця за формулою або силільною групою (М) може бути виконано шляхом здійснення реакції відповідної сполуки 2 із хлоридом карбоксильної кислоти, сульфоніл хло 15 75338 16 ридом, або силілхлоридом (МСІ) в придатному 11. Відрив 11 t-BuLi із наступним карбоксилюванрозчиннику, як, наприклад, піридині, із застосуванням та кислотним гідролізом призвів до утворення ням каталізатора ацилювання, такого, як DMAP необхідного 4-етоксипіридину 1Х (X=OEt). забезпечення відповідних похідних О-ацилу, Осульфонілу, або О-силілу (2Y). ПРИГОТУВАННЯ ОРТОГІДРОКСИГЕТЕРОАРОМАТИЧНИХ КАРБОКСИЛЬНИХ КИСЛОТ 1. Приготування карбоксильних кислот 1 (Х1=N, Х2=Х3=СН, Х4= незалежно С-Ме, C-SMe, C-Cl) показано на Схемі 2. Реакція 3-гідрокси-2бромпіридину (5) із 2-(триметилсиліл) етоксиметил хлоридом (SEM-Cl) із застосуванням калій третбутоксиду як основи в суміші 1:1 диметилформамід (DMF) - тетрагідрофуран (THF) привела до утворення необхідного ефіру 6. Відрив ефіру 6 за допомогою літій діізопропіламіду (LDA), із наступною конденсацією за допомогою відповідного електрофілу (йодометан, диметилдисульфід, або гексахлоретан) призвів до утворення 4-заміщеного піридину 7. Бромін/літієвий обмін між піридином 7 та nбутиллітієм (n-BuLi) із наступним карбоксилюванням вуглекислотою (СО,) та кислотний гідроліз призвели до утворення необхідної 4-заміщеної-3гідроксипіколінової кислоти 1Х. Приготування кислотного хлориду 3 описано на Схемі 4. Таким чином, 3-гідроксипіколінову кислоту (12) перетворили на складний ефір метилу 13 в зрошуваному метанолі із застосуванням трифлориду бору як каталізатора. Метил 13 після цього бромінували із застосування броміну на водяній основі для утворення дибромід 14. Ефір бензилу 15 після цього готували шляхом ущільнення сполуки 14 хлоридом бензилу в присутності гідриду натрію. Поступовий метано л із сполуки 15 в метанол/калій карбонаті призвів до утворення похідної 4-метоксипіколінової кислоти 16. Перетворення сполуки 16 на кислотний хлорид 3 виконували із застосуванням оксаліл хлориду із застосування бензолу як розчинника та каталітичної кількості DMF. ПРИГОТУВАННЯ 4-ЕТОКСИ-3ГІДРОКСИПІКОЛІНОВОЇ КИСЛОТИ (1, X1=Ν, Х2=Х3=СН, Х4=COEt) (ДИВ. СХЕМИ 1 ТА 3). Альтернативно, 3-гідроксипіридин (8) може конденсуватись SEM-C1 для утворення 9 (Схема 3). Відрив 9 із застосуванням трет-бутипитю (tBuLi) із наступним ущільненням Nфлуоробензолсульфонімідом призвело до утворення 4-флуоро похідної 10. Ущільнення сполуки 10 натрій етилату призвело до утворення диефіру а. ПРИГОТУВАННЯ 3-(2-(ТРИМЕТИЛСИЛІЛ) ЕТОКСИМЕТОКСИ)-ПІРИДИНУ (9). При перемішуванні до розчину DMF (100мл) та THF (100мл), додавали твердий калій третбутоксид (17.96г, 0.16моль). Після розчинення твердої речовини, розчин охолоджували до 5°С і одразу додавали розчин 3-гідроксипіридину (14.25г, 0.15моль). Після перемішування протягом 17 75338 18 10 хвилин, суміш охолоджували до -10°С та по (15мл) до залишків і отриману суміш перемішувакраплях додавали SEM-Cl, 25г, 0.15моль при такій ли при кімнатній температурі протягом двох годин. швидкості, що внутрішня температура залишалась Наприкінці цього періоду, нерозчинний матеріал відфільтровували, промивали невеликою кількістю на рівні -5°С. Після закінчення змішування, суміш THF та висушували повітрям до утворення сполуперемішували при 0°С протягом 1 години, а потім ки, зазначеної в заголовку у вигляді білої твердої ще 2 години при кімнатній температурі. Суміш виречовини (1.05г). ливали у воду (600мл), і потім екстрагували ефіПРИГОТУВАННЯ 6-БРОМО-3-БЕНЗИЛОКСИром (3 150мл). Екстракти ефіру об'єднували, і 4-МЕТОКСИПІРИДИН-2-КАРБОКСИЛЬНОЇ КИСпослідовно промивали 2Ν NaOH (100мл), водою ЛОТИ (16) ТА ЇЇ КИСЛОТНОГО ХЛОРИДУ (3) (ДИВ. (50мл), та насичували розчином NaCl (100мл), СХЕМУ 4). висушували (MgSO4) та концентрували до утворення а коричневої рідини. Шляхом дистиляції отримали необхідний ефір 9 у вигляді безкольорової рідини (20.8г), т.к. 95-99°С @ 0.03мм Hg. б. ПРИГОТУВАННЯ 4-ФЛУОРО-3(2(ТРИМЕТИЛСИЛІЛ) ЕТОКСИМЕТОКСИ) ПІРИДИНУ (10). а. ПРИГОТУВАННЯ МЕТИЛ 4,6-ДИБРОМО-3При перемішуванні до розчину 9 (12.39г, ГІДРОКСИПІРИДИН-2-КАРБОКСИЛАТУ (14). 0.055моль) в ефірі (200мл) охолодженому до До 2л колби із, 3 горловинами, розтрубом для 70°С в атмосфері аргону повільно додавали t-BuLi скапування та механічною мішалкою, наливали (4мл, 1.5Μ розчин пентану). Під час змішування, воду (800мл) та метил 3-гідроксипіридин-2температуру реакції підтримували на рівні -68°С. карбоксилат (15.3г). До цього розчину при переміПісля закінчення змішування суміш перемішували шуванні повільно додавали бромін (32г). Під час додатково 60 хвилин яри -70°С, а потім пропусперебігу реакції, від розчину відділяли тверду рекали через канюлю при перемішуванні до розчину човину, а реакційну залишали суміш загусати. ПісΝ-флуоробензолсульфоніміду (18.92г) в сухому ля закінчення змішування, суміш енергійно переTHF (200мл), який також охолоджували до рівня мішували до зникнення забарвлення броміну. 1Н1 70°С в атмосфері аргону. Після закінчення змішуН-ЯМР (CDCІ3) невеликого зразка неочищеного вання, охолоджувальну баню видаляли а реакційпродукту показав, що співвідношення моно і дибну температуру доводили до рівня кімнатної. Доромінованого продукту складає 3:1. Натрій карбодавали воду (100мл) а органічну фазу відділяли, нат (31.8г) повільно додавали до реакційної суміші висушували (MgSO4) та концентрували для утвоі по краплях додавали додатковий бромін (12г). рення коричневої олії. При хроматографії (силікаПісля зникнення забарвлення броміну, реакційну гель, гексан-ацетон, 9:1) було утворено необхідсуміш доводили приблизно до рівня рН5 концентний продукт 10 у вигляді оранжевої олії (7.5г), яка рованим НСІ, і екстрагували отриману суміш містила приблизно 15% початкового матеріалу. СН2СІ2 (3 150мл). Органічні екстракти об'єднуваЦю неочищену суміш використовували безпосерели, висушували (MgSO4) та концентрували для дньо в наступній реакції. утворення твердої речовини оранжевого кольов. ПРИГОТУВАННЯ 4-ЕТОКСИ-3-(2ру(14г). Цю речовину можна рекристалізувати із (ТРИМЕТИЛСИЛІЛ)ЕТОКСИМЕТОКСИ)ПІРИДИНУ метилциклогексану (після опрацювання деревин(11). ним вугіллям) для утворення речовини 14 у вигляПри перемішуванні до розчину натрій етилату ді білої твердої речовини, т.п.181-183°С. (0.9г, 13ммоль) в етанолі (10мл) додали 10 (1.07г, б. ПРИГОТУВАННЯ МЕТИЛ 4,6-ДИБРОМО-34.4ммоль). Отриману суміш перемішували при БЕНЗИЛОКСИПІРИДИН-2-КАРБОКСИЛАТУ (15). кімнатній температурі протягом 48 годин, а потім При перемішуванні до розчину натрій гідриду виливали у воду (100мл). Отриману суміш екстра(0.6г) в DMF (50мл) повільно додавали розчин 14 гували ефіром (3 50мл). Екстракти ефіру об'єдну(7.1г). Після закінчення змішування, суміш перемівали, висушували (MgSO4) та концентрували. шували при кімнатній температурі протягом 15 Отриману амброву олію хроматографували (силіхвилин, а після цього додавали бензил хлорид кагель, гексан-ацетон, 4:1) для утворення сполуки (3.05г). Суміш після цього нагрівали до 90°С про11 у вигляді жовтої олії(0.6г). тягом шести годин, охолоджували, виливали у г. 4-ЕТОКСИ-3-ПДРОКСИПІРИДИН-2воду (500мл) та екстрагували ефіром (2 200мл). КАРБОКСИЛЬНА КИСЛОТА (1, Xt=Ν, Χ2=X3=CH, Екстракти ефіру об'єднували, промивали 2N NaOH X4=COEt). (50мл), висушували (MgSO4) і випаровували розПри перемішуванні розчин 11 (2.9г) в THF чинник для утворення сполуки 15 у вигляді світло (50мл) в атмосфері аргону охолоджували до жовтої твердої речовини (8.3г). Рекристалізація із 70°С. До нього повільно додавали t-BuLi (8мл, невеликого об'єму метанолу дала аналітичний 1.5М розчин пентану), температуру реакції підтризразок, т.п.75-76°С. мували на рівні -66°С. Після закінчення змішув. 6-БРОМО-3-БЕНЗИЛОКСИ-4вання, суміш перемішували при температурі МЕТОКСИПІРИДИН-2-КАРБОКСИЛЬНА КИСЛОТА 70°С протягом 45 хвилин, а потім виливали на (16). суспензію подрібненої твердої вуглекислоти в ефіПри енергійному перемішуванні сполуки 15 рі. Отриману суміш перемішували до досягнення (25.5г), калій карбонат (75г) та метанол (300мл) кімнатної температури, після чого розчинники винагрівали на рефлюксі протягом 30 годин. Суміш паровували. Додавали THF (25мл) та 4N НС1 охолоджували, виливали у воду (800мл), а рівень 19 75338 20 рН доводили до 2 шляхом додавання концентроперкислота) в СН2СІ2 (100мл) перемішували при ваного НСІ. Отриману суміш екстрагували СН2СІ2 кімнатній температурі протягом 40 годин. Реакційну суміш екстрагували 5% розчином натрій бісу(3 150мл). Органічні екстракти об'єднували, висульфіту (100мл), а потім розчином - 0.5N NaOH шували (MgSO4) а розчинник випаровували для (150мл). Після висушування (MgSO4), випаровуваутворення майже безбарвної олії (20.5г), яка повіли розчинник для утворення 4.9г метил 3льно твердішала при відстоюванні. її рекристалібензилоксипіколінатат-1-оксиду у вигляді білої зували із метанолу (125мл)/вода (40мл) для утвотвердої речовини. Рекристалізація із метилциклорення необхідної кислоти 16 (11.6г), т.п.134-135°С. гекасну/толуолу призводить до утворення кристаг. ПРИГОТУВАННЯ 6-БРОМО-3лічної твердої речовини, т.п.104-106°С. БЕНЗИЛОКСИ-4-МЕТОКСИПІРИДИН-2-КАРБОНІЛ Розчин цієї сполуки (16.1г) в оцтовому ангідХЛОРИДУ (3). рид (80мл) перемішували та нагрівали на масляній При перемішуванні до розчину 16 (2.54г, бані при 125°С протягом 3 годин. Надлишок оцто7.5ммоль) в бензолі (30мл) що містить DMF (3 вого ангідриду видаляли на роторному випарнику краплі) однією дозою додавали оксаліл хлорид а залишки збирали в метанолі (200мл). Додавали (1.90г, 15ммоль). Після закінчення виділення газу концентровану, сірчану кислоту (1мл), і нагрівали (приблизно 45 хвилин), новий однорідний розчин отриману суміш на рефлюксі протягом 90 хвилин. перемішували додатково протягом 15 хвилин, пісРозчинник випаровували, і до залишків додавали ля чого випаровували розчинник. Додавали 1,2насичений натрій бікарбонат. Отриману суміш ексдихлоретаном (30мл), та знову випаровували розчинник для утворення певної кількості речовини 3 трагували СН2СІ2 (3 100мл). Органічні фракції у вигляді майже безбарвної олії. Цю. речовину об'єднували, висушували (MgSO4) і випаровували розчиняли в СН2СІ2 (10мл) або THF (10мл) та вирозчинник для утворення 15.5г метил 3користовували безпосередньо в наступних реакції бензилокси-6-гідроксипіколінат у вигляді жовтої поєднання. твердої речовини. Рекристалізація із толуолу при6-БРОМО-З-ГІДРОКСИПІКОЛІНОВА КИСЛОТА звела до утворення блідо-жовтої твердої речови(17). ни, т.п.91-92°С. При перемішуванні до розчину цієї сполуки (10.25г) в толуолі (125мл), нагрітому на масляній бані при 60°С, додавали карбонат срібла (16.6г), а потім метил йодид (8.52г). Отриману суміш перемішували та нагрівали протягом 3 годин до 60°С. До механічно перемішуваного розчину метил Після охолодження, суміш відфільтровували через 3-гідроксипіколінату (30.6г) у воді (800мл) повільно Celite® а розчинник випаровували для утворення додавали бромін (32г) протягом 30 хвилин. Після жовтої олії. Силікагель хроматографія (4:1 гекзакінчення додавання, перемішування продовжусан/ацетон) дала майже знебарвлену олію, дані вали додатково ще протягом 1 години. Ефір 1 Н-ЯМР та МС якої співпадали із метил 3(300мл) додавали продовжуючи перемішування до бензилокси-6-метоксипіколінатом. Гідроліз складрозчинення твердих речовин. Органічний шар відного ефіру до кислоти 18, зазначеної в заголовку, діляли а водяну фазу екстрагували ефіром було завершено LiOH.H2O, як описано вище для (200мл). Органічні фази об'єднували, висушували подібних ефірів. (MgSО4) і випаровували розчинник для утворення 4-ГІДРОКСИПІРАМІДИН-5-КАРБОКСИЛЬНА 32.8г метил 6-бромо-3-гідроксипіколінату у вигляді КИСЛОТА (19). жовтуватої твердої речовини. Рекристалізація із метанолу/води дала аналітичний зразок, т.п.115117°С. При перемішуванні до розчину цього складного ефіру (2.32г) в THF (15мл) 30 додавали розчин LiOH Н2О (1г) у воді (7мл). Отриману суміш перемішували 2 години при кімнатній температурі потім виливали до воду (100мл). Рівень рН доводили до приблизно 3 1N HCІ, після цього суміш екстрагували СН2СІ2 (3 100мл). Органічний екстракт висушували (MgSO4), фільтрували та концентрували для утворення 2.0г білої твердої речовини, чий 1НЯМР та МС співпадає із необхідною кислотою, зазначеною в заголовку 17. 3-БЕНЗИЛОКСИ-6-МЕТОКСИПІКОЛІНОВА КИСЛОТА (18). Розчин метил 3-бензилоксипіколінатату (4.86г) та 3-хлоропероксибензойної кислоти (5.75г, 60% Етил 4-гідроксипірамідин-5-карбоксилату може бути приготовано, виконуючи процедуру [М. Pesson et al, Eur. J. Med. Chem.-Chim. Ther; 1974, 9, 585]. Розчин цього складного ефіру (500мг, 3ммоль) в THF (10мл) та МеОН (5мл) опрацьовували LiОН.Н2О (373мг, 8.9ммоль) та перемішували протягом ночі. Суміш гасили концентрованим НСІ (1мл) та екстрагували EtOAc (2 20мл). Об'єднані органічні екстракт висушували (MgSO4) та концентрували для утворення 260мг сполуки 19, зазначеної в заголовку, у вигляді твердої речовина оранжевого кольору, т.п.220°С (дек). 4-ГІДРОКСИ-2-МЕТИЛПІРИМІДИН-5КАРБОКСИЛЬНА КИСЛОТА (20). 21 75338 22 Етил 4-гідрокси-2-метилпіримідин-56.9ммоль). Через 30 хвилин при 0°С, суміш виликарбоксилат було приготовано із дотриманням вали на 300г льоду/води, що призводило до утвопроцедури [Geissman et al., J. Org. Chem., 1946, рення піни. Перемішування продовжували протя11, 741]. Розчин цього складного ефіру (750мг, гом 30 хвилин, після чого тверду речовину 4.11ммоль) в THF (10мл) та МеОН (5мл) опрацьозбирали шляхом фільтрації та промивали водою. вували LiОН.Н2О (431мг, 10.3ммоль) та перемішуВологу тверду речовину збирали в EtOAc, висушували протягом ночі. Суміш гасили концентрованим вали (MgSO4) фільтрували та концентрували. Це призводило до утворення 0.95г жовтуватої твердої НСl (1мл) та екстрагували EtOAc (2 20мл). Об'єдречовини, т.п.180-182°С, спектри 1Н-ЯМР якої наний органічний екстракт висушували (MgSO4) та співпадали із метил 6-хлоро-3-гідрокси-5концентрували для утворення 155мг сполуки 20, метоксипіразин-2-карбоксилатом. зазначеної в заголовку, у вигляді білої твердої Цю тверду речовину (0.9г, 4.1ммоль) опрацьоречовини, т.п.180°С(дек). вували 1N NaOH (60мл), а суміш перемішували 5,6-ДИХЛОРО-3-ГІДРОКСИПІРАЗИН-2протягом 1 години, після чого окислювали конценКАРБОКСИЛЬНА КИСЛОТА (21). трованим НСІ. Осад збирали шляхом фільтрації та промивали водою і розчиняли в EtOAc, висушували (MgSO4), фільтрували та концентрували. Це призводило до утворення 0.62г блідо жовтої твердої речовини, т.п.25 170-173°С, спектри якої співМетил 3-аміно-5,6-дихлоропіразин-2падали із кислотою 22, зазначеною в заголовку. карбоксилат (5.0г, 23ммоль) перемішували в кон4-ГІДРОКСИІЗОТІАЗОЛ-3-КАРБОКСИЛЬНА центрованій сірчаній кислоті (140мл) та охолоджуКИСЛОТА (23). вали до 0°С. Повільно додавали натрій нітрит, Цю кислоту отримали виконуючи процедуру, підтримуючи температуру біля 0°С. Після додатщо показано на схемі 5. кових 30 хвилин при 0°С, суміші залишали нагріватися до температури навколишнього середовища та перемішували протягом 3 годин. Суміш виливали на 500г льоду, що призводило до кипіння і утворення піни. Через 30 хвилин, суміш тричі екстрагували EtOAc. Об'єднаний органічний екстракт висушували (MgSO4), фільтрували та концентрували. Жовту тверду речовину, що залишилась, промивали водою та висушували повітрям, до отримання 5.0г жовтої твердої речовини, т.п.114Так, при перемішуванні до розчину твердої ре116°Са спектр 13С-ЯМР якої співпадає із метил човини КОН (88%, 6.98г, 0.11моль) в 75мл ЕtOН в складним ефіром сполуки, зазначеної в заголовку. колбі, промитій азотом, додавали тіолоцтову кисЦю тверду речовину (5.0г) опрацьовували 1N лоту (8.36г, 0.11моль), промиту 25мл ЕtOН. Суміш NaOH (20мл) та суміш нагрівали при 90°С протяперемішували в азоті протягом 5 хвилин в запаягом 1.5 годин. Після охолодження, суміш окислюній колбі. До цього розчину додавали 0.1моль невали концентрованим НСІ, а потім тричі екстрагуочищену бром заміщену речовину (приготовану вали ЕtOАс. Висушування (MgSO4), фільтрування безпосередньо перед цим [за методикою М. та концентрація призвели до утворення 0.48 г теHatanaka та Т. Ishimam, J. Med. Chem., 1973, 16, 1 мно-жовтої твердої речовина, спектри Н-ЯМР та 798]). Колбу промивали азотом та запаювали. СуМС якої, співпадали із зазначеною в заголовку міш перемішували на водяній бані протягом 3 гокислотою 21. дин, після чого додавали до 300мл СН2Сl2 та 6-ХЛОРО-3-ГІДРОКСИ-5-МЕТОКСИПІРАЗИН1000мл вода. Водяний прошарок екстрагували 2-КАРБОКСИЛЬНА КИСЛОТА (22). чотири рази 200мл СН2Сl2. Об'єднані органічні екстракти промивали 100мл холодної води, насичували соляним розчином та висушували. Неочищену суміш відфільтровували та концентрували. Отриману в результаті олію хроматографували на силікагелі, із застосуванням диетил ефіру, як елюПри перемішуванні розчин метил 3-аміно-5,6єнта, для утворення 13г світло жовтої олії, яку задихлоропіразин-2-карбоксилату (5.0г, 23ммоль) та лишали твердіти під час відстоювання, до утвонатрій метилату (3.6г, 67.5ммоль) в абсолютному рення смолистої твердої речовини. Спектральні МеОН (50мл) нагрівали на рефлюксі протягом 2 дані співпадали із етил 2-ацетиламіно-4-ацетилтіогодин, потім залишали охолоджуватись та окис3-оксобутаноатом. лювали концентрованим НСІ. Осад збирали шляПри енергійному перемішуванні розчину цієї хом фільтрування, промивали водою та висушусполуки (12.95г) в 450мл хлороформу, охолоджевали повітрям до утворення 3.6г коричневої ному на водяній бані до температури 5°С, по краптвердої речовини. Рекристалізація із гексан-ЕtOАс лях додавали бромін (15.8г, 2 еквіваленти) в 50мл (1:1) призвела до утворення 2.6г блідо жовтої твехлороформу протягом 45 хвилин. Перемішування рдої речовини спектри якої співпадали із метил 3продовжували на крижаній бані протягом ще 45 аміно-6-хлоро-5-метоксипіразин-2-карбоксилатом. хвилин, а після цього при температурі· навколишЦю сполуку (1г, 4.6ммоль) збирали в концентнього середовища - ще протягом 30 годин. Після рованій сірчаній кислоті, охолоджували до 0°С, та цього суміш промивали 200мл води, після чого повільно опрацьовували нітритом натрію (0.5г, 23 75338 24 ще 100мл води. Об'єднані продукти промивання 5.8ммоль) в THF (20мл), МеОН (4мл), та води повторно екстрагували 100мл хлороформу. Об'єд(10мл), до утворення 608мг 5-бензилокси-1-метилнані розчини хлороформу промивали насиченим 4-карбоксильної кислоти (25) у вигляді білої тверрозчин солі та висушували над MgSO4. Розчин дої речовини, т.п.117-122°С. відфільтровували та концентрували до неочищеПРИГОТУВАННЯ ІНШИХ ГЕТЕРОАРОМАТИної олії. Останню хроматографували на силікагелі ЧНИХ КАРБОКСИЛЬНИХ КИСЛОТ. із застосуванням серійного градієнта від ефіру 4-Гідроксинікотинову кислоту готували [за нафти -СН2Сl2 (3:1) до СН2Сl2, для утворення перпроцесом М. Mittelbach et al., Arch. Pharm. ших 0.79г етил 5-бромо-4-гідроксиізотіазол-3(Weinheim, Germany) 1985, 318, 481-486]. 2карбоксилату, а потім -3.40г етил 4Гідрокси-6-метилнікотинова кислота може бути гідроксиізотіазол-3-карбоксилату у вигляді безбарприготованою за наступною методикою [A Dornow, вних кристалів, т.п.44-7°С, що співпадали за МС та Chem. Ber. 1940, 73, 153]. 4,6-Диметил-21 H-1Н-ЯМР. гідроксинікотинова кислота може бути приготоваДо 710мг останнього складного ефіру в 30мл ною [за методикою R. Mariella та Е. Belcher, J. Am. THF додавали 370мг LiOH.H2O (2.2 еквіваленти) в Chem. Soc, 1951, 73, 2616]. 5-Хлоро-2-гідрокси-610мл води. Суміш перемішували протягом 3 годин метилнікотинова кислота може бути приготовано при температурі оточуючого середовища, а після [за процесом A. Cale et. al., J. Med. Chem., 1989, цього охолоджували в холодильнику. Тверду ре32, 2178]. 2,5-Дигідроксинікотинова кислота може човину - осад збирали шляхом фільтрації для бути приготованою [за методикою P. Nantkaутворення 710мг дилітій солі карбоксильної кислоNamirski та A Rykowski, Chem. Abstr., 1972, 77, ти. Цю сіль збирали в 7мл води, охолоджували на 114205]. 3-Гідроксиізонікотинову кислоту готували крижаній бані, та доводили до рівня рН1, додаван[за методикою J. D. Crum та С Η. Fuchsman, J. ням 2N НСl. Розчин, отриманий в результаті, тричі Heterocycl. Chem. 1966, 3, 252-256]. 3екстрагували 50мл EtOAc. Об'єднані екстракти Гідроксипіразин-2-карбоксильну кислоту можна промивали 5мл розсолу, висушували (Na2SO4), приготувати [за методикою P. Krapcho et al., J. фільтрували, а фільтрат залишали в холодильниHeterocycl. Chem. 1997, 34,27]. 5,6-Диметил-3ку. Охолоджений розчин перефільтрували, а фільгідроксипіразин-2-карбоксильна кислота може бути трат концентрували для утворення 230мг безбарприготована шляхом гідролізу відповідного етилу вної твердої речовини, т.п.185-89°С, спектри 1Hскладного ефіру, синтез якого [описано S. I. ЯМP та 13С-ЯМР якої співпадали із сполукою 23, Zavyalov та А. Г. Zavozin, Izv. Akad. Nauk SSSR, зазначеною в заголовку. 1980, (S), 1067-1070]. 4-Гідроксипіридазин-33-БЕНЗИЛОКСИ-1-МЕТИЛПІРАЗОЛ-4карбоксильну кислоту готували [за методом І. КАРБОКСИЛЬНА КИСЛОТА (24) І 5Ichimoto, K. Fujii, та С. Tatsumi, Agric. Biol. Chem. БЕНЗИЛОКСИ-1-МЕТИЛПІРАЗОЛ-41967, 31, 979]. 3,5-Дигідрокси-1,2,4-триазин-6КАРБОКСИЛЬНА КИСЛОТА (25). карбоксильну кислоту готували [за методом Е. Falco, E. Pappas, та Г. Hitchings, J. Am. Chem. Soc, 1956, 78, 1938]. 5-Гідрокси-3-метилтіо-1,2,4триазин-6-карбоксильну кислоту готували [за методом R. Barlow та A. Welch, J. Am. Chem. Soc, 1956, 78, 1258]. Гідроксиізотіазол-, гідроксиізоаксозол-, та гідроксипіразол-карбоксильні кислоти Розчин етилу 3-гідрокси-1-метилпіразол-4готували [за методом Т. М. Willson et al., Bioorg. карбоксилату та етил 5-гідрокси-1-метилпіразол-4Med. Chem. Lett., 1996, 6, 1043]. 3-Гідрокси-1,2,5карбоксилату (отриманий за процесом [Y. Wang, et тідіазол-4-карбоксильну кислоту готували [за меal., Zhejiang Gongxueyuan Xuebao, 1994, 2, 67]), тодом J. M. Ross et al., J. Am. Chem. Soc, 1964, 86, бензолювали за методом [S. Yamamoto, et al., Па2861]. 3-Гідроксиізоаксозол-4-карбоксильну кислотент Японії JP 62148482, 1987], а суміш відділяли ту отримали за методикою, [описаною K. Bowden колонковою хроматографією, із застосуванням 3:1 et al., J. Chem. Soc. (C), 1968, 172]. 3-Гідрокси-1гексанів: ЕtOАс як елюентів, для забезпечення фенілпіразол-4-карбоксилат готували [згідно меетил 3-бензилокси-1-метилпіразол-4-карбоксилату тодики. W. Taylor та R. Т. Cook, Tetrahedron, 1987, та етил 5-бензилокси-1-метилпіразол-443, 607]. 3-Бензилоксихінолін-2-карбоксильну кис1 карбоксилату, чистих, для H-ЯМР. лоту було приготовано із дотриманням процедури Етил 3-бензилокси-і-метилпіразол-4[D. L. Boger та J. Н. Chen, J. Org. Chem. 1995, 60, карбоксилат (283мг, 1.08ммоль) в THF (10мл), 7369-7371]. МеОН (2мл), та воду (5мл) опрацьовували ЗАГАЛЬНЕ ПРИГОТУВАННЯ ПРОМІЖНИХ LiOH.H2O (91мг, 2.17ммоль) та перемішували проАМІНІВ ТА АНІЛІНІВ. тягом ночі. Суміш гасили концентрованим НСl Синтез циклічних, ациклічних та бензиламінів (1мл) та екстрагували EtOAc (2 20мл). Об'єднані виконували шляхом скорочення відповідних оксиорганічні шари висушували (MgSO4) та концентрумів або шляхом застосування метал гідридів або вали для утворення білої твердої речовини реакцій розчинення металів, [як описано R.O. (227мг), т.п.169-172°С, спектри якої співпадали із Hutchins та М.К. Hutchins in Comprehensive Organic 3-бензилокси-1-метилпіразол-4-карбоксильною Synthesis; B.M. Trost, Ed.; Pergamon Press: Oxford, кислотою (24). 1991; Vol 8, p.65; або J.W. Huffman in Етил 5-бензилокси-1-метилпіразол-4Comprehensive Organic Synthesis; B.M. Trost, Ed.; карбоксилат (755мг, 2.9ммоль) подібним чином Pergamon Press: Oxford, 1991; Vol 8, p.124]. Навпагідролізували із застосуванням LiОН.Н2О (243мг, ки, ці аміни можна приготувати безпосередньо із 25 75338 26 необхідних кетонів та альдегідів шляхом реакції Leuckart, [як описано R. Carlson, Т. Lejon, T. Lunstedt та Ε. LeClouerec, Acta Chem, Scand. 1993, 47, 1046]. Аніліни в цілому, готували, шляхом каталітичного скорочення відповідних нітроароматиків із застосуванням Pd на деревинному вугіллі або сульфідованої платині на деревинному вугіллі як каталізаторі. Ці процедури документально оформлені, [наприклад, в R.L. Augustine, Catalytic Hydrogenation, Marcel Decker, Inc., New York, 1965]. Аміни 49, які представляють 9-членні дилактонові кільцеві системи, готували згідно процедури, [описаної М. Shimano, N. Kamei, Т. Shibata, К. Inoguchi, N. Itoh, Т. Ikari та Н. Senda, Tetrahedron, 1998, 54, 12745], або шляхом модифікації цих процедур. Подібні модифікації показано на схемі 6. Так, 26 (із посилання вище) було скорочено літій борогідридом, і отриманий в результаті первинний ПРИГОТУВАННЯ РЕЧОВИНИ 27 (ДИВ. СХЕспирт було перекрито триізопропілсіланом (TIPS) МУ 6). для утворення сполуки 27. Вільна гідроксил група До розчину літій борогідриду (2.0М в THF, сполуки 27 вступала в реакцію із 1-бромо-2-метил7.5мл, 15ммоль) в 7.5мл сухого THF додавали 2-пропеном із наступним каталітичним скорочен0.1мл триметил борату. Цю суміш охолоджували в ням подвійного зв'язку для утворення речовини 28. атмосфері азоту до -30°С. До цього розчину по Вибіркове вилучення пара-метоксибензилу (РМВ) краплях додавали розчин сполуки 26 (4.58г, блокуючої групи із наступним ущільненням ІУ410ммоль) в 10мл THF протягом 10 хвилин. Розчин В0С-0-бензил-Ь-серину призвело до утворення перемішували при температурі -30°С протягом 1 речовини 29. Вилучення TIPS групи із наступним години, а потім при температурі 0°С протягом 5 окисленням гідрокси групи, отриманої в результаті, годин. По краплях додавали насичений розчин призвело до утворення речовини 30. Цю речовину нашатирного спирту (10мл), суміш перемішували (30) в подальшому перетворили в амін 31 за пропротягом 10 хвилин, а фази відділяли. Водяну фацедурами, описаними в названих вище посиланзу екстрагували EtOAc (2 25мл), а об'єднані органях. нічні фази промивали насиченим розсолом, висушували над сульфатом натрію, та випаровували до висушування. Неочищений продукт хроматографували до утворення 2.1г білої твердої речовини. Зразок піддавали рекристалізації із гексанEtOAc до утворення дрібних білих кристалів, т.п.91-93°С. [ ]D25=+31.9° (С=1.04, СНСl3). Цей діол (2.04г, 6.22ммоль) розчиняли в 4мл сухого DMF та додавали імідазол (680мг, 10ммоль). Розчин охолоджували на крижаній бані, а потім додавали триізопропілхлоросилан (1.39мл, 6.5ммоль) протягом 2 хвилин. Суміш перемішували при кімнатній температурі протягом 4 годин, після чого додавали до крижаної води, та екстрагували 20% ефіром в гексані (3 5мл). Об'єднані органічні фази промивали розсолом, висушували, та фільтрували через короткий фільтр силікагель, який промивали 20мл Таким же чином, описано синтез амінодилакцього розчинника. Розчинник випаровували до тонів 38 та 48, із дефіцитом екзоциклічної функціутворення 2.77г речовини 27 у вигляді блідої тягуональності складного ефіру, на схемах 7 та 8, відчої олії, очищеної 1Н-ЯМР. повідно. ПРИГОТУВАННЯ СПОЛУКИ 28 (ДИВ. СХЕМУ 6). Натрій гідрид (60% дисперсії олії, 400мг, 10ммоль) виливали до 50мл колби та тричі промивали гексанами. Додавали DMF (15мл) і перемішували суспензію при додаванні по краплях сполуки 27 протягом 15 хвилин (2.53г, 5.19ммоль) в 5мл сухого DMF. Реакцію перемішували протягом 15 хвилин і після цього охолоджували до рівня нижче 10°С, і додавали 1-бромо-2-метил-2-пропен (1мл, 10ммоль) протягом 5 хвилин, із наступним перемішування протягом 2 годин при кімнатній температурі. Суміш розділяли між гексанами /крижано-холодним розчином нашатирного спирту, отриманого при приготуванні сполуки 27, а неочи 27 75338 28 щений продукт хроматографували для утворення хроматографії для утворення 811мг досить чистої 2.20г безбарвної олії, очищеної 1H-ЯМР та елеметягучої олії. Кислоту розчиняли в 30мл ЕtOАс та нтарним аналізом. Цю речовину (2.38г, 4.4ммоль) додавали 200мг каталізатора Перлмана. Суспенрозчиняли в 50мл ЕtOАс в азоті в 100мл колбі Мозію струшували при 50psi тиску водню протягом 4 ртона. Додали 150мг 5% Pt на вуглеці, а суміш годин, додавали 300мг свіжого каталізатору, і проперемішували в 1 атмосфері водню протягом 20 довжували струшування ще протягом 2 годин. Рехвилин Каталізатор видаляли шляхом фільтрації, човину потім фільтрували, а розчинник випаровуа розчинник випаровували для утворення 2.35г вали для утворення тягучої гуми, яка була досить сполуки 28 у вигляді безбарвної олії, очищеної чистою для подальшого застосування. 1 H-ЯМР. ТРЕОНІНДІТІАН 33 (ДИВ. СХЕМУ 7). ПРИГОТУВАННЯ СПОЛУКИ 29 (ДИВ, СХЕПентілдітіан 32 [Hirai, Heterocyles 1990, 30 (2, МУ 6). Spec. Issue), 1101] (200мг, 0.97ммоль) розчиняли в До 50мл колби, обладнаної магнітною мішал10мл СН2СІ2 при кімнатній температурі. Додавали кою, заливали розчин ефіру 28 (2.0г, 3.68ммоль) в N-(Z)-O-t-Бутил-(L)-треонін (900мг, 2.91ммоль) із 40мл СН2СІ2 та 2мл води. Цей розчин перемішунаступним додаванням DMAP (36мг 0.29ммоль). вали в азоті та охолоджували на крижаній бані при До цієї суміші по краплях додавали розчин дициктемпературі
ДивитисяДодаткова інформація
Назва патенту англійськоюHeterocyclic aromatic amides, fungicide composition and a method for control and prevention of invasion
Назва патенту російськоюГетероциклические ароматические амиды, фунгицидная композиция и способ контроля или предотвращения грибковой инвазии
МПК / Мітки
МПК: A01N 55/00, C07H 23/00, C07D 261/18, C07D 241/44, C07D 213/82, C07D 413/14, C07D 495/08, C07D 417/12, C07H 15/04, A01N 43/72, C07D 249/10, C07D 285/01, C07D 493/08, A01N 43/58, A01N 43/60, C07D 275/00, C07D 231/22, C07D 239/32, C07D 213/81, C07D 277/46, A01N 43/54, C07D 405/12, C07H 15/18, C07D 401/12, C07D 231/20, C07D 241/24, C07F 7/10, C07D 413/12, C07H 13/00, C07D 405/14, A01N 43/40, C07H 9/00, A01N 47/12, C07D 253/00, C07D 409/12, C07D 409/14, C07D 277/20, C07D 239/28, C07D 333/38, C07D 417/14
Мітки: аміди, ароматичні, грибковій, гетероциклічні, контролю, композиція, спосіб, запобігання, інвазії, фунгіцидна
Код посилання
<a href="https://ua.patents.su/62-75338-geterociklichni-aromatichni-amidi-fungicidna-kompoziciya-ta-sposib-kontrolyu-abo-zapobigannya-gribkovijj-invazi.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні ароматичні аміди, фунгіцидна композиція та спосіб контролю або запобігання грибковій інвазії</a>
Попередній патент: Спосіб вирощування групи сапфірових монокристалічних виробів із внутрішнім порожнистим об’ємом
Наступний патент: Електричний нагрівач
Випадковий патент: Спосіб виробництва варено-копчених ковбас