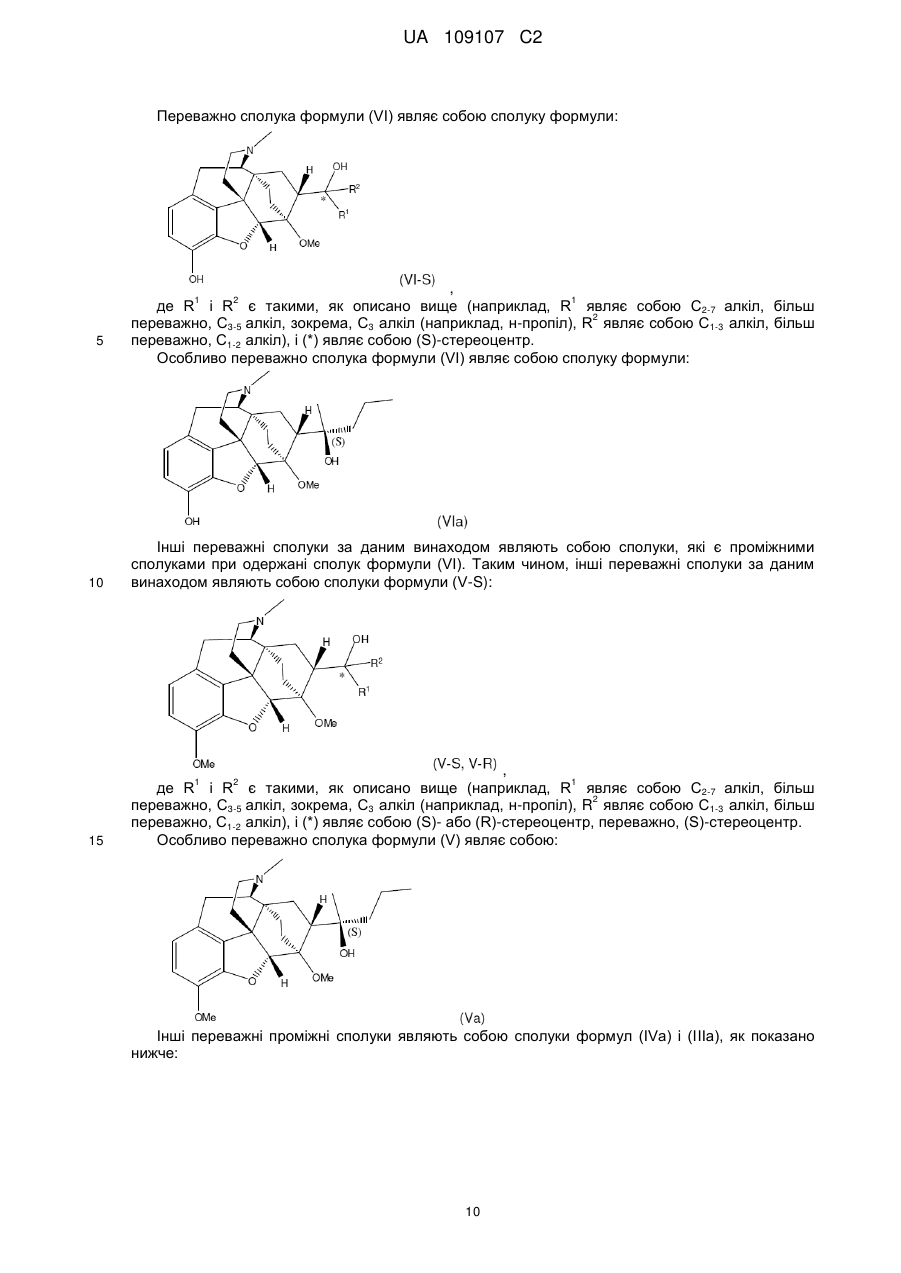
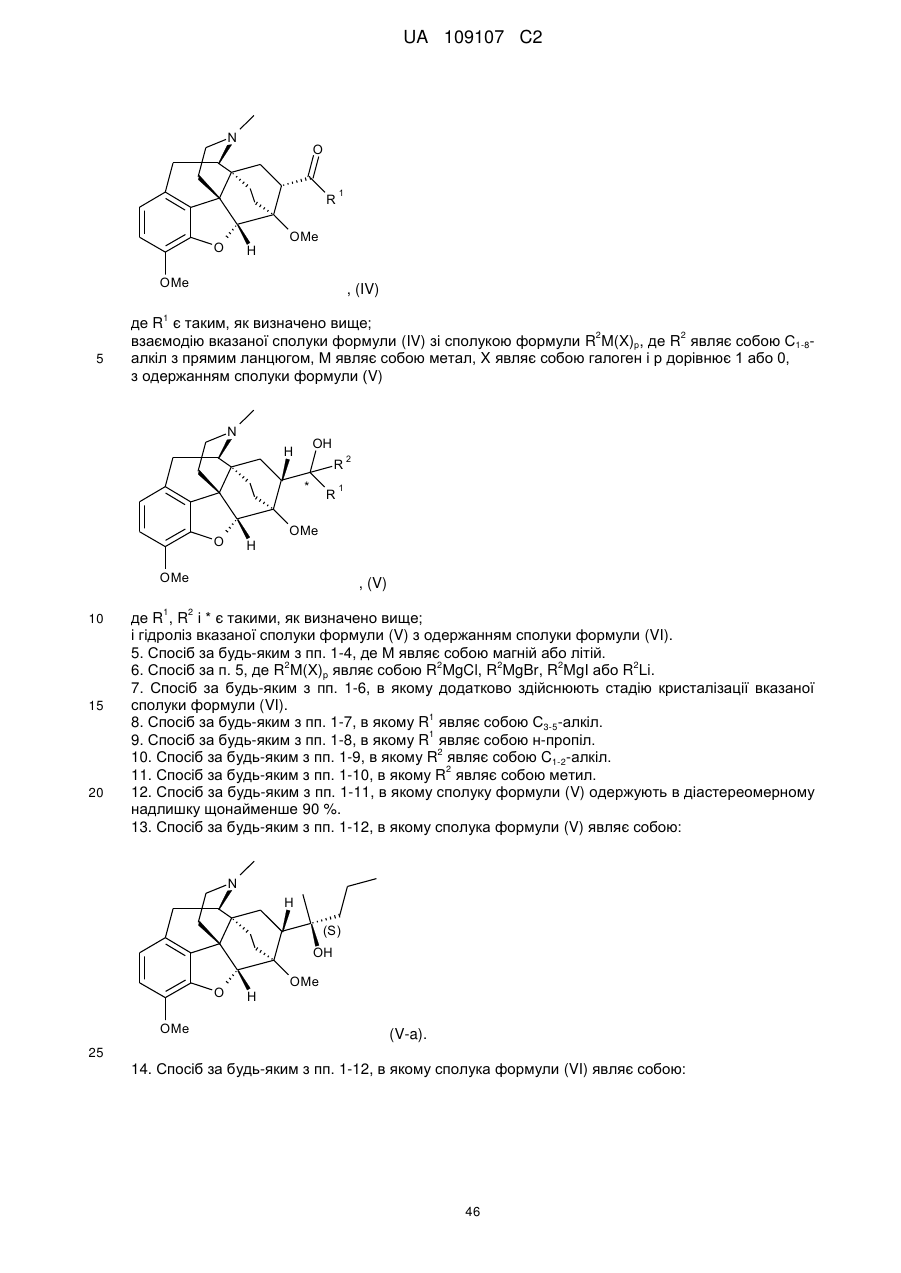
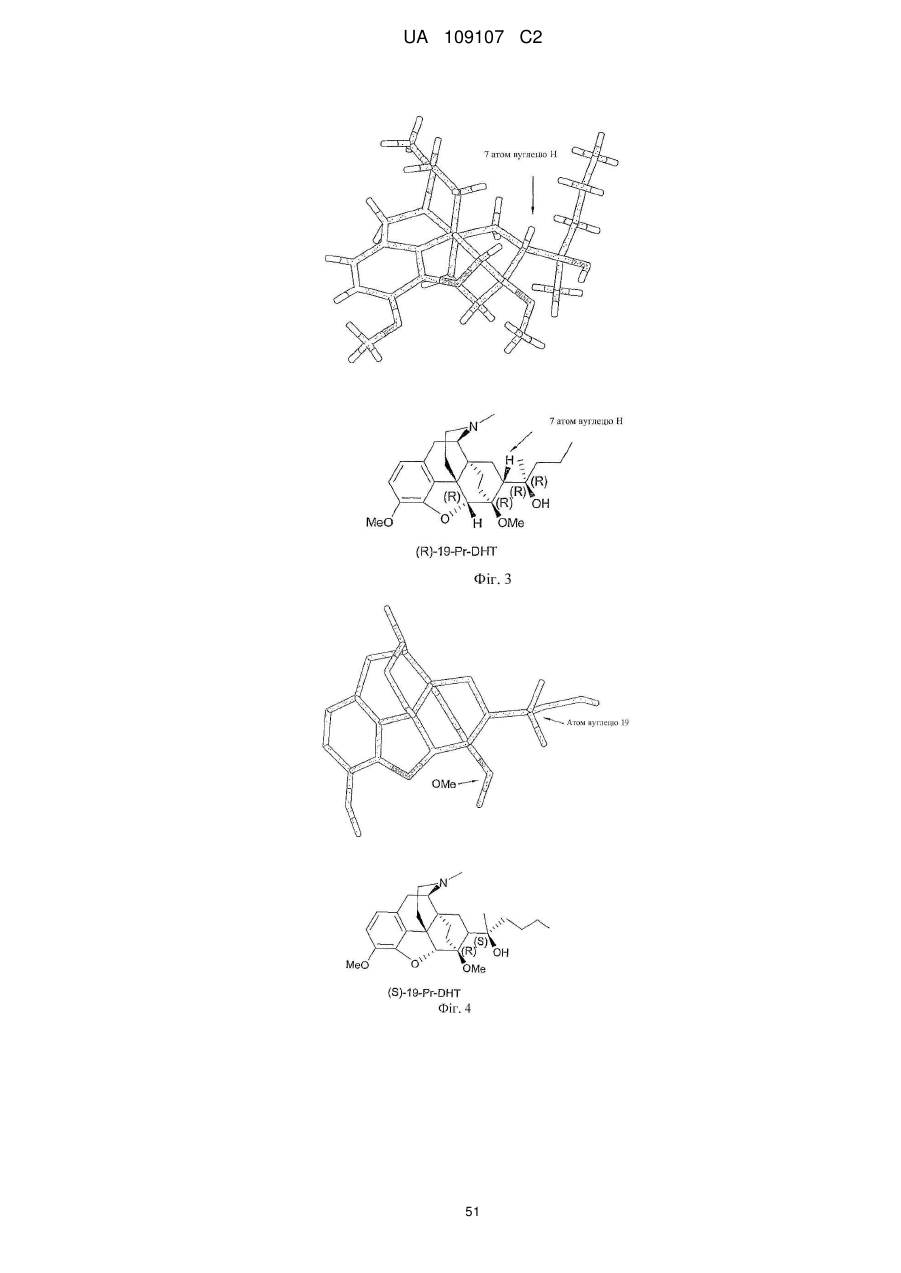
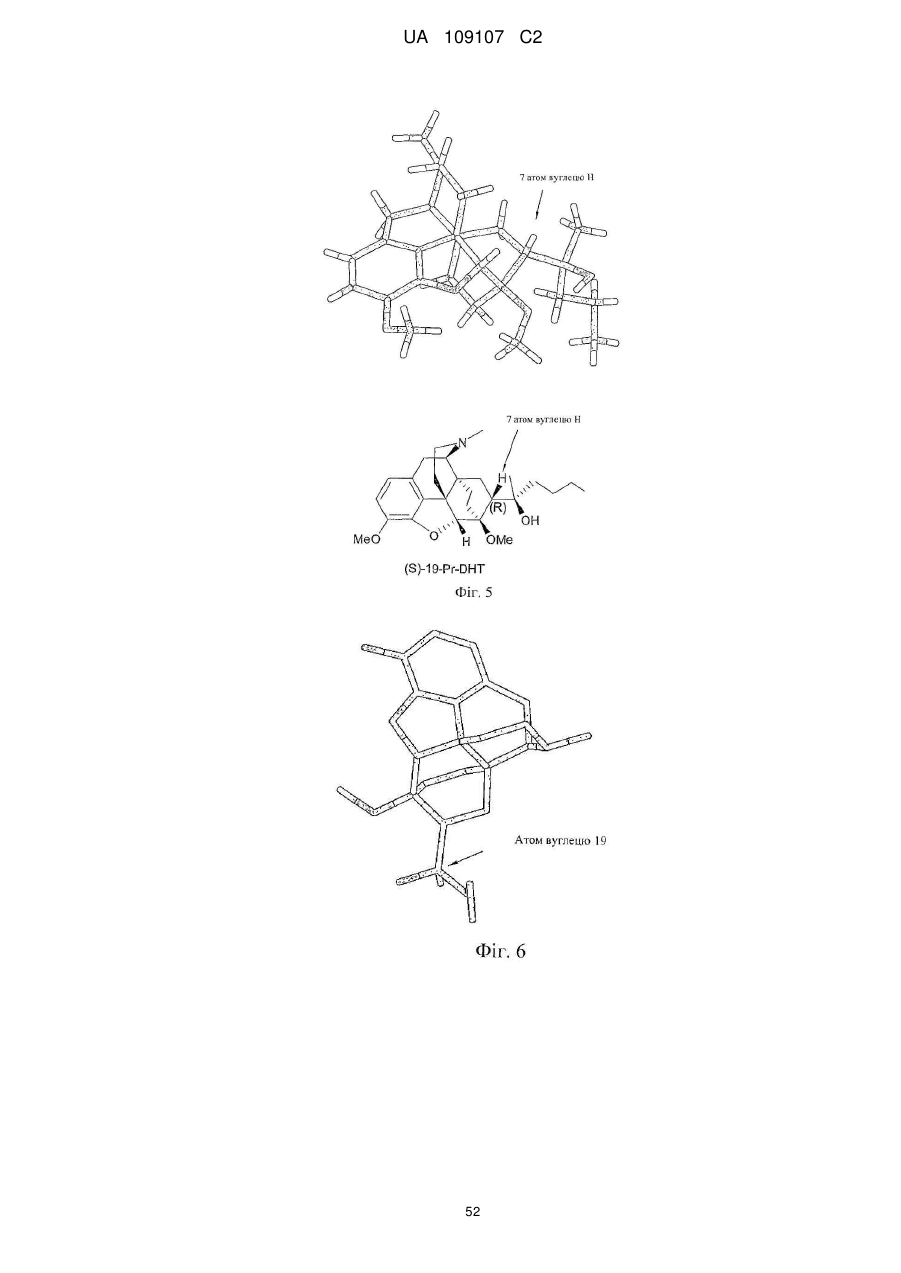
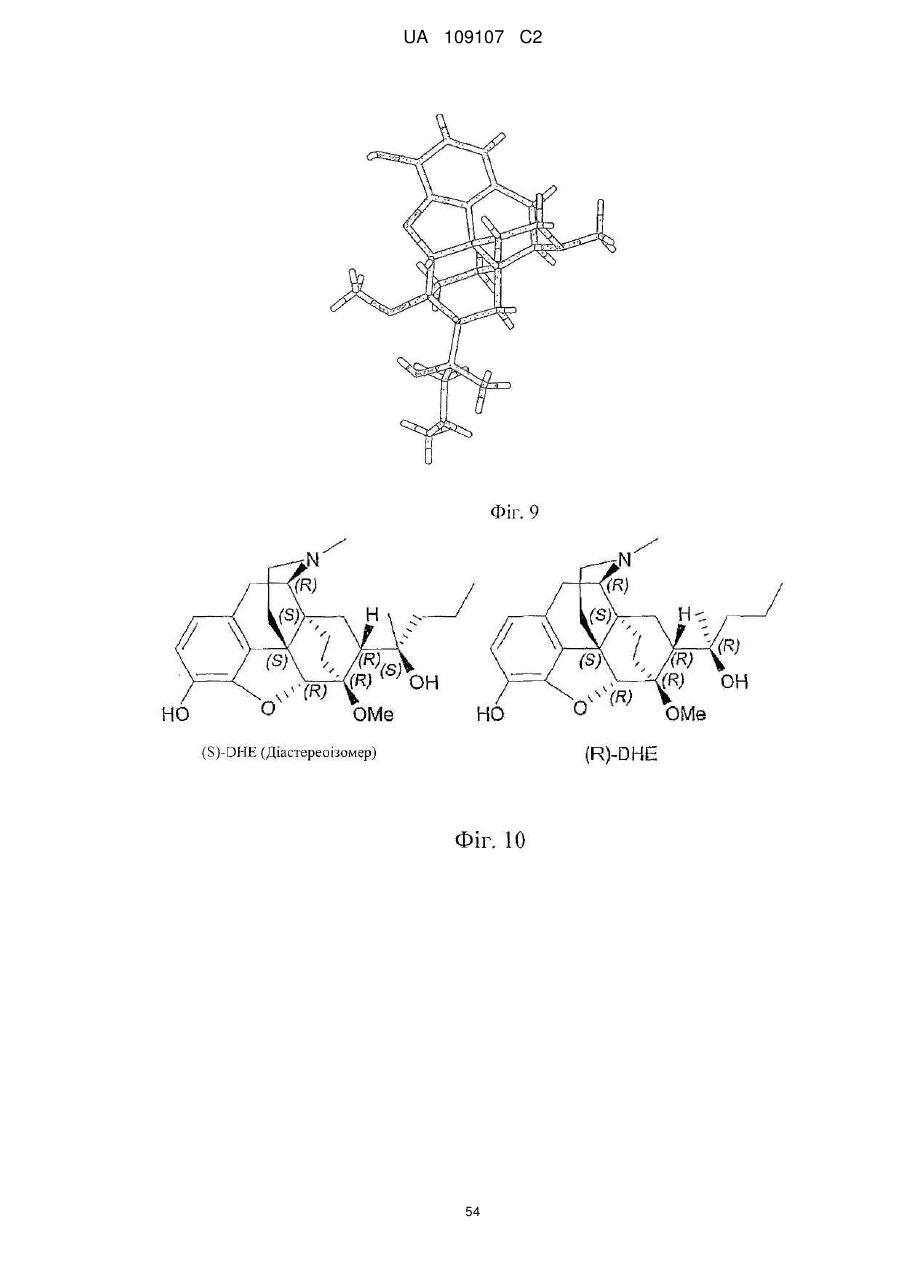
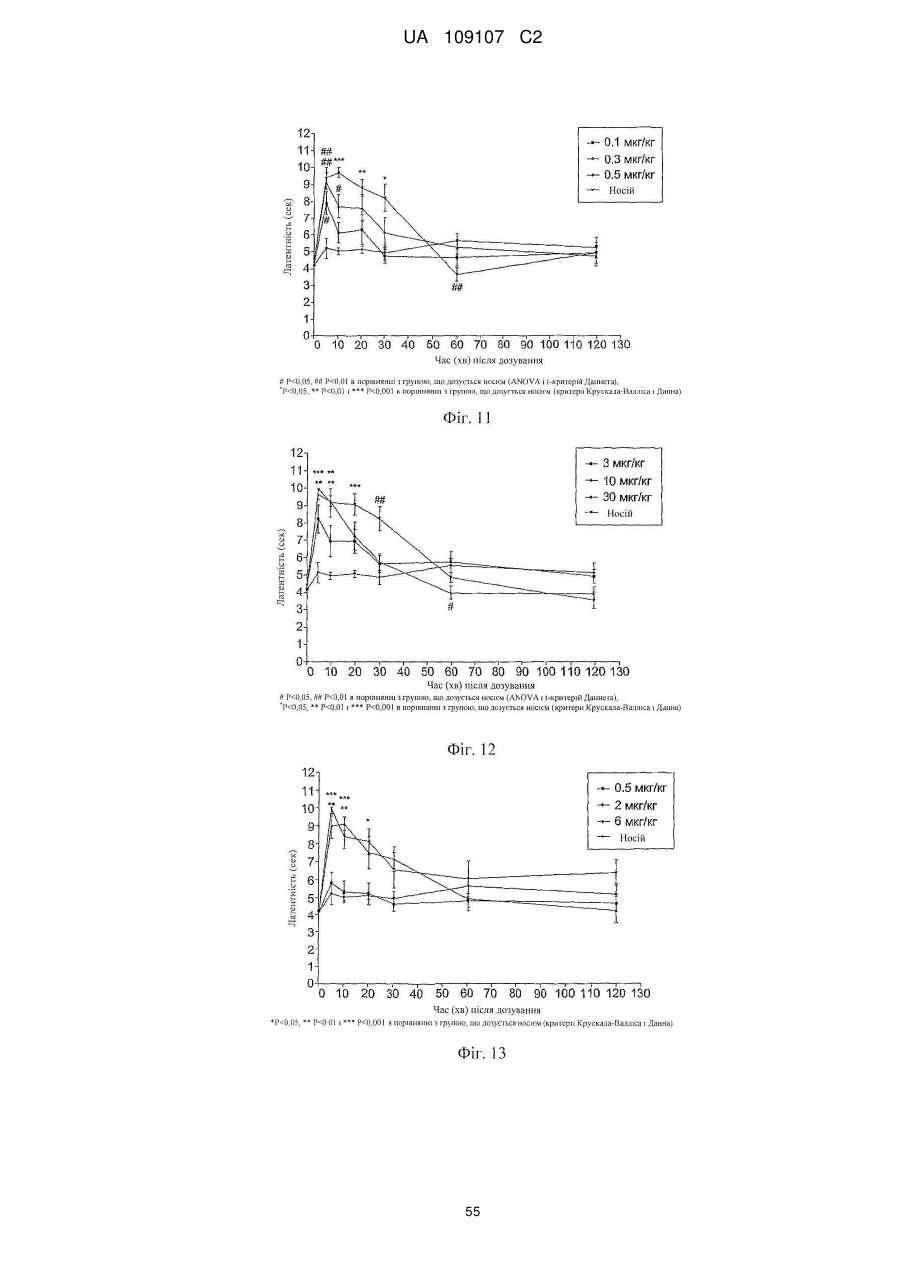
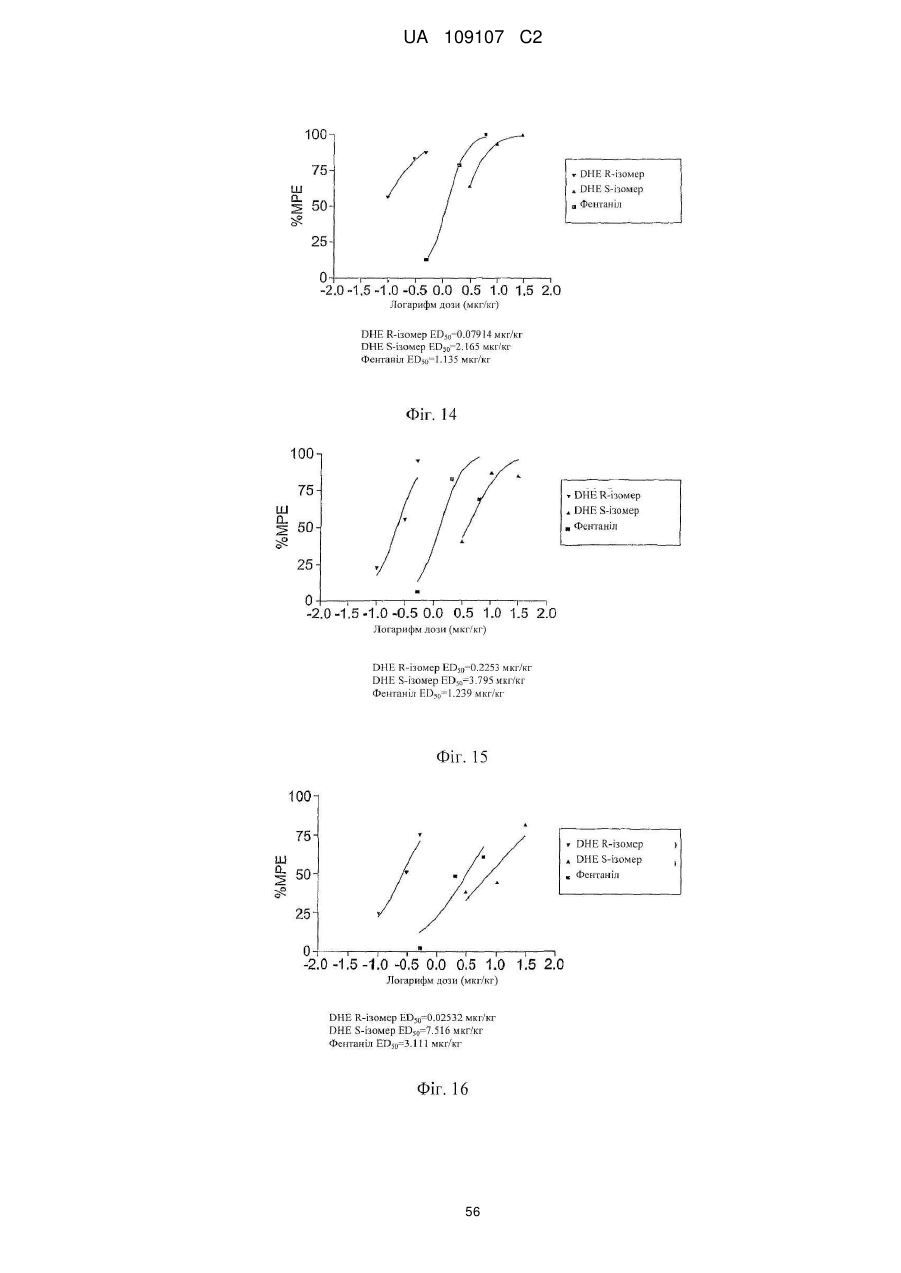
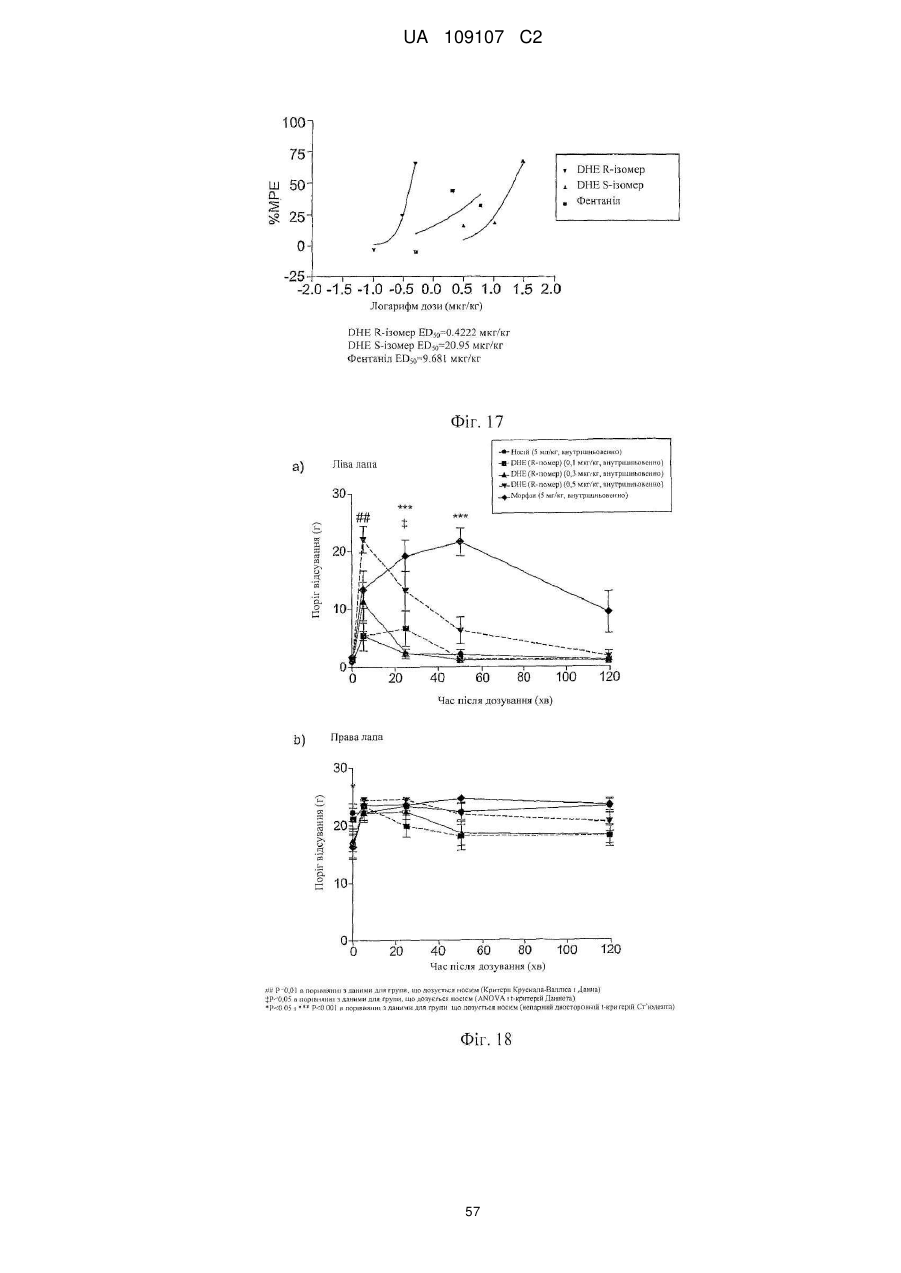
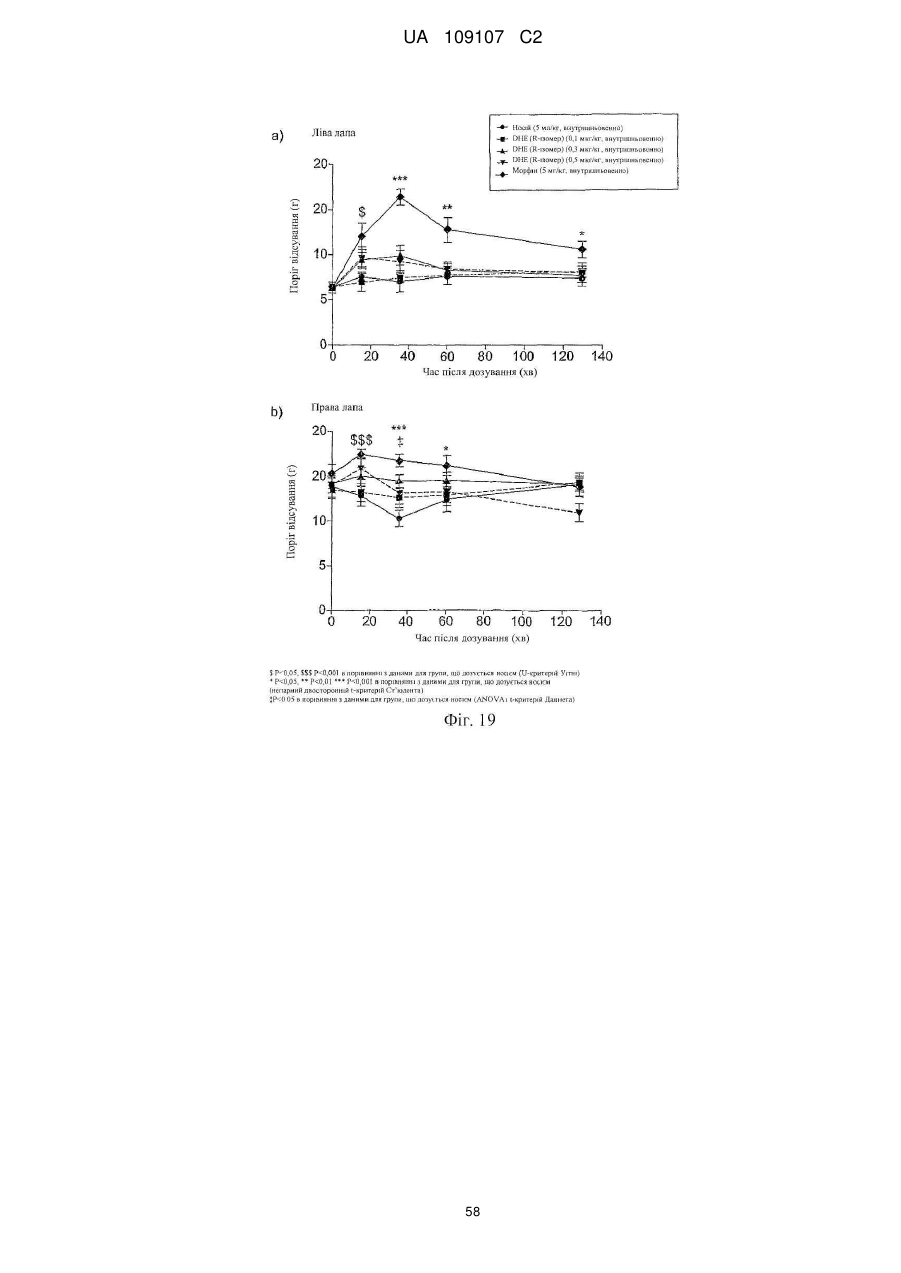
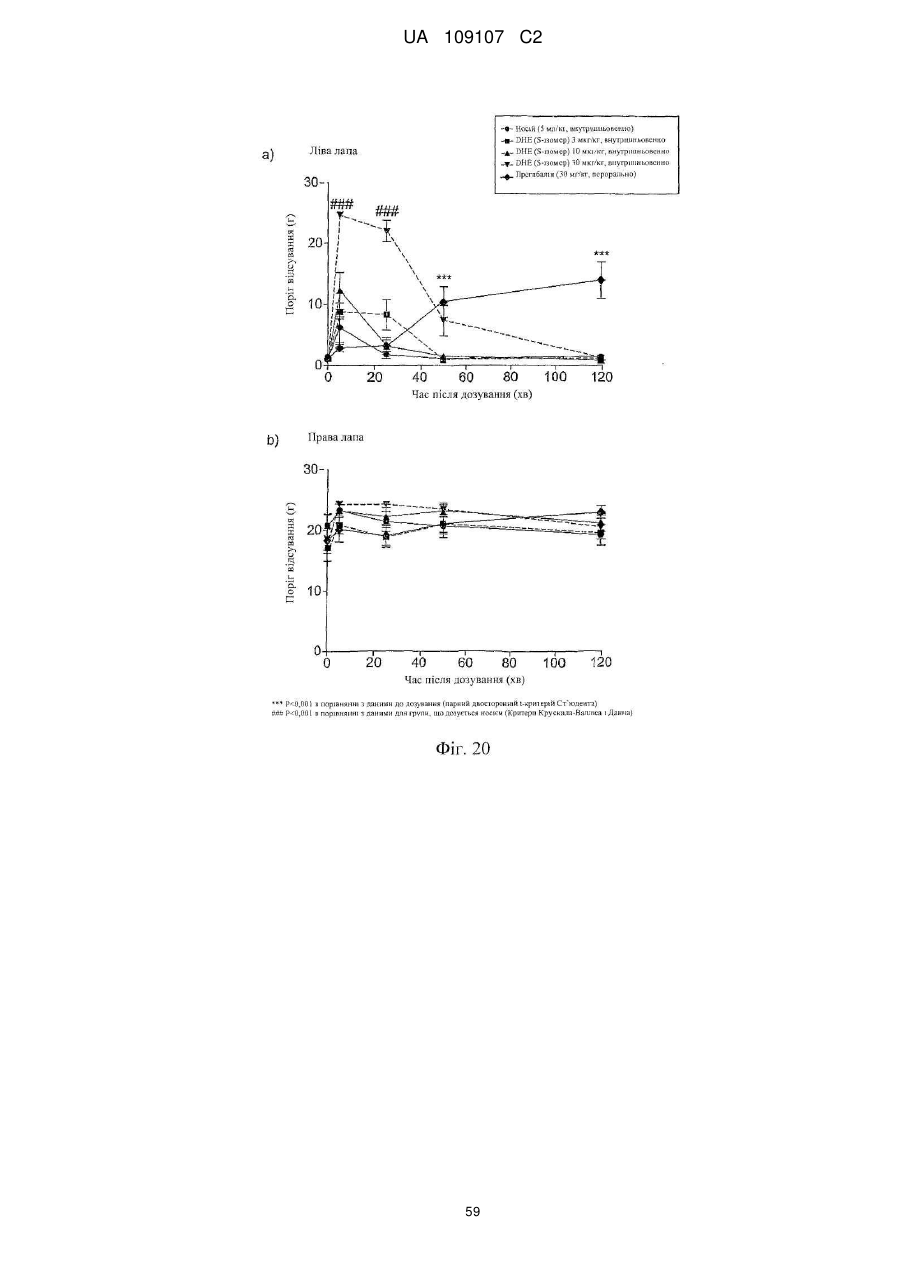
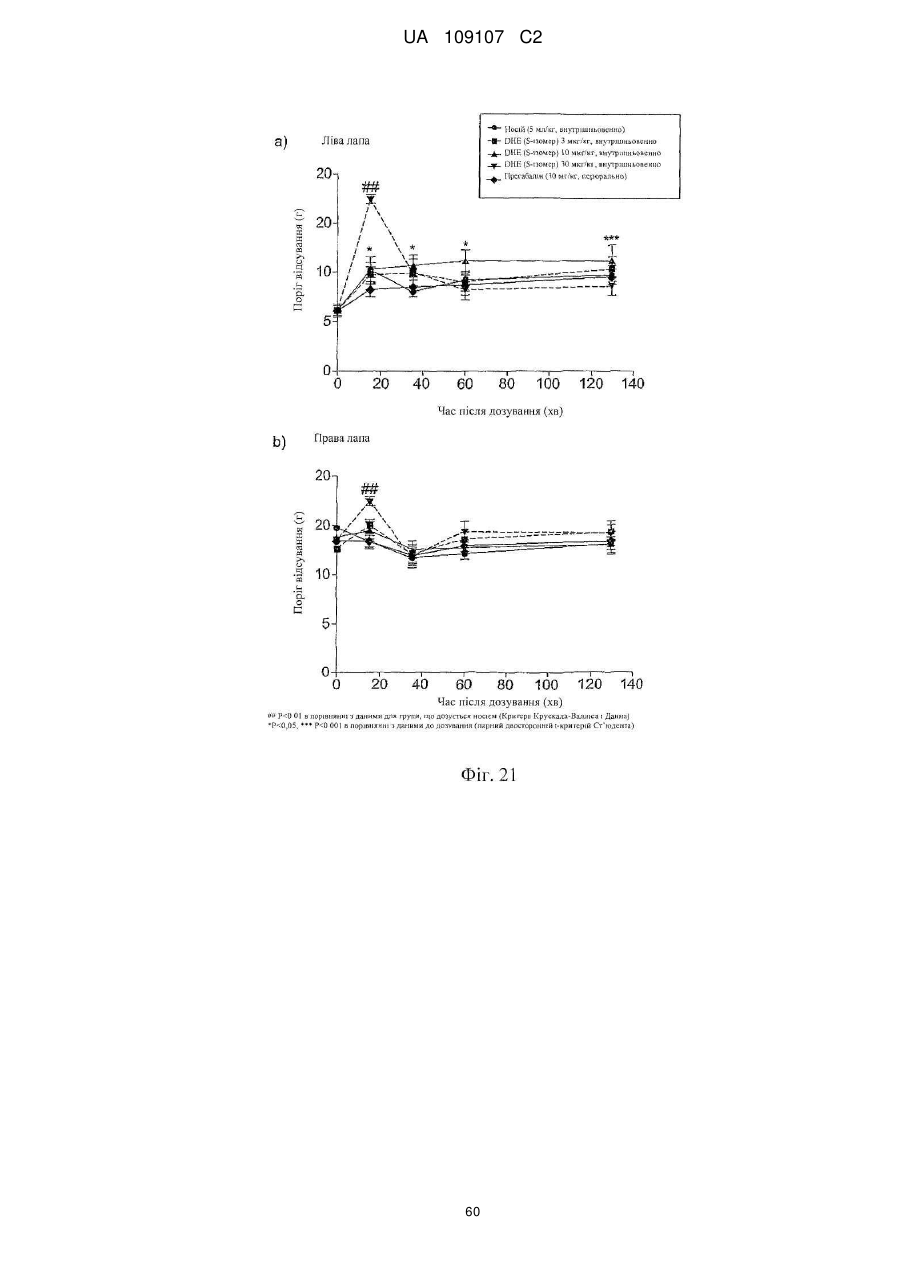
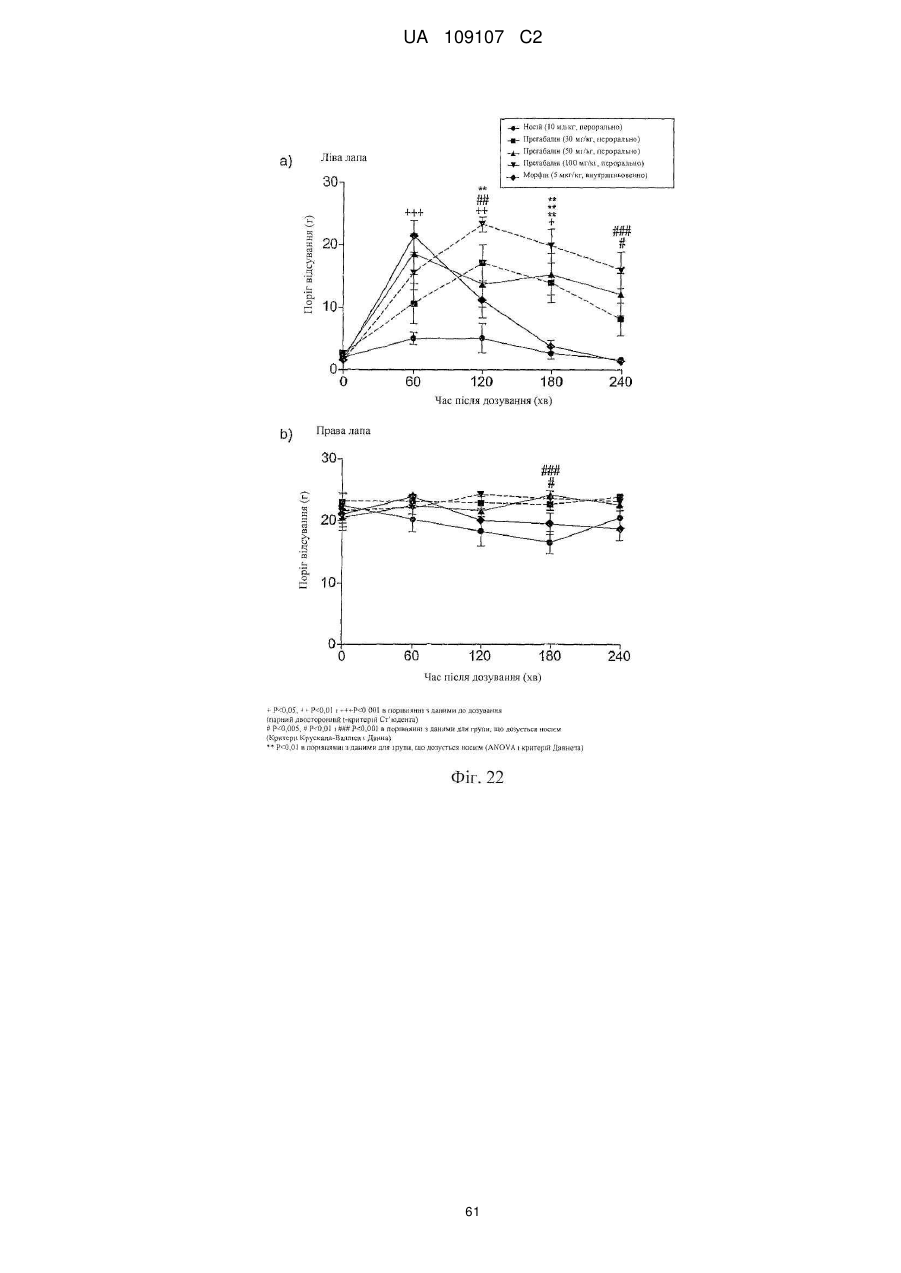
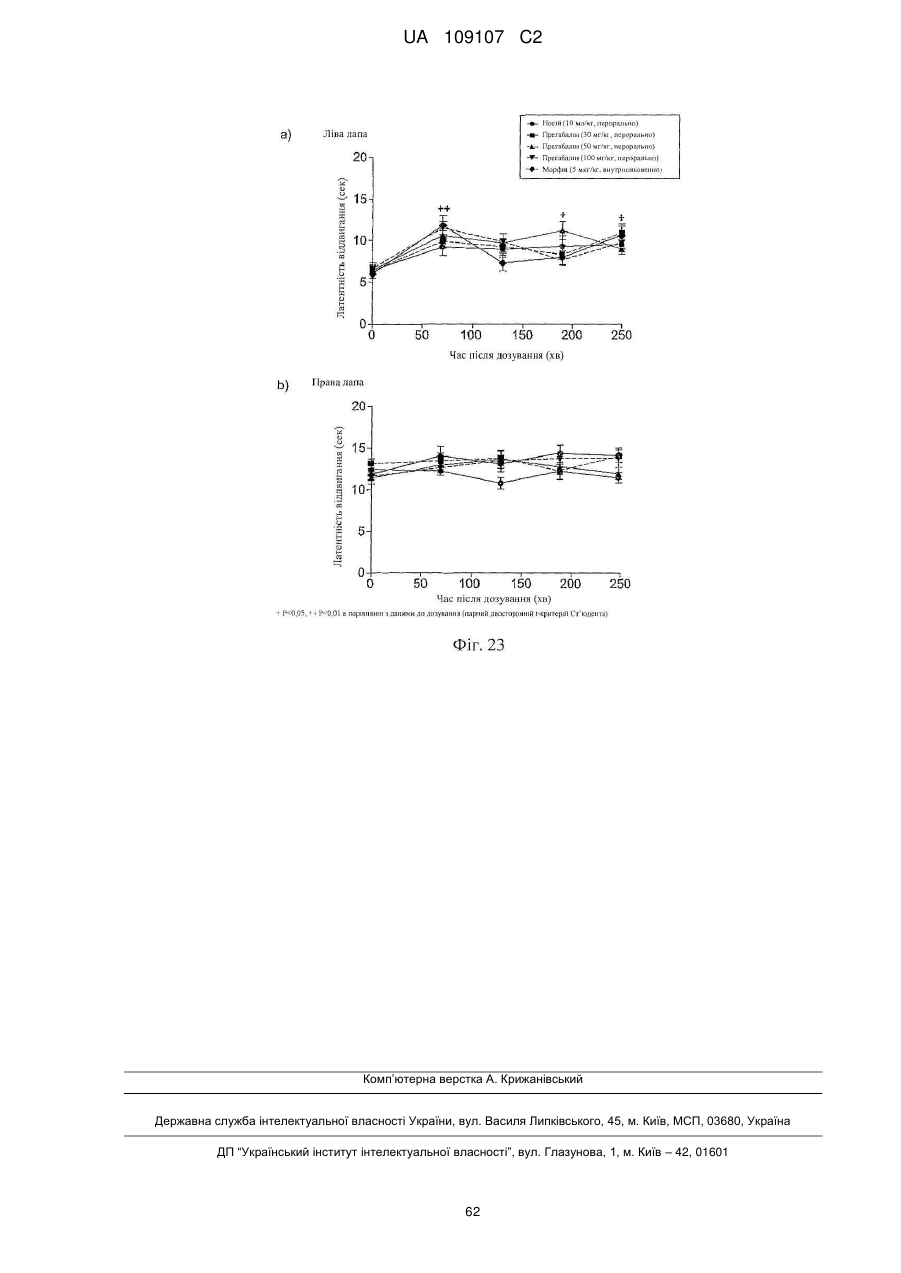
Дигідроеторфіни і їх одержання
Номер патенту: 109107
Опубліковано: 27.07.2015
Автори: Тернер Карл Девід, Хардінг Дебора Філліс, Уайтлок Стів
Формула / Реферат
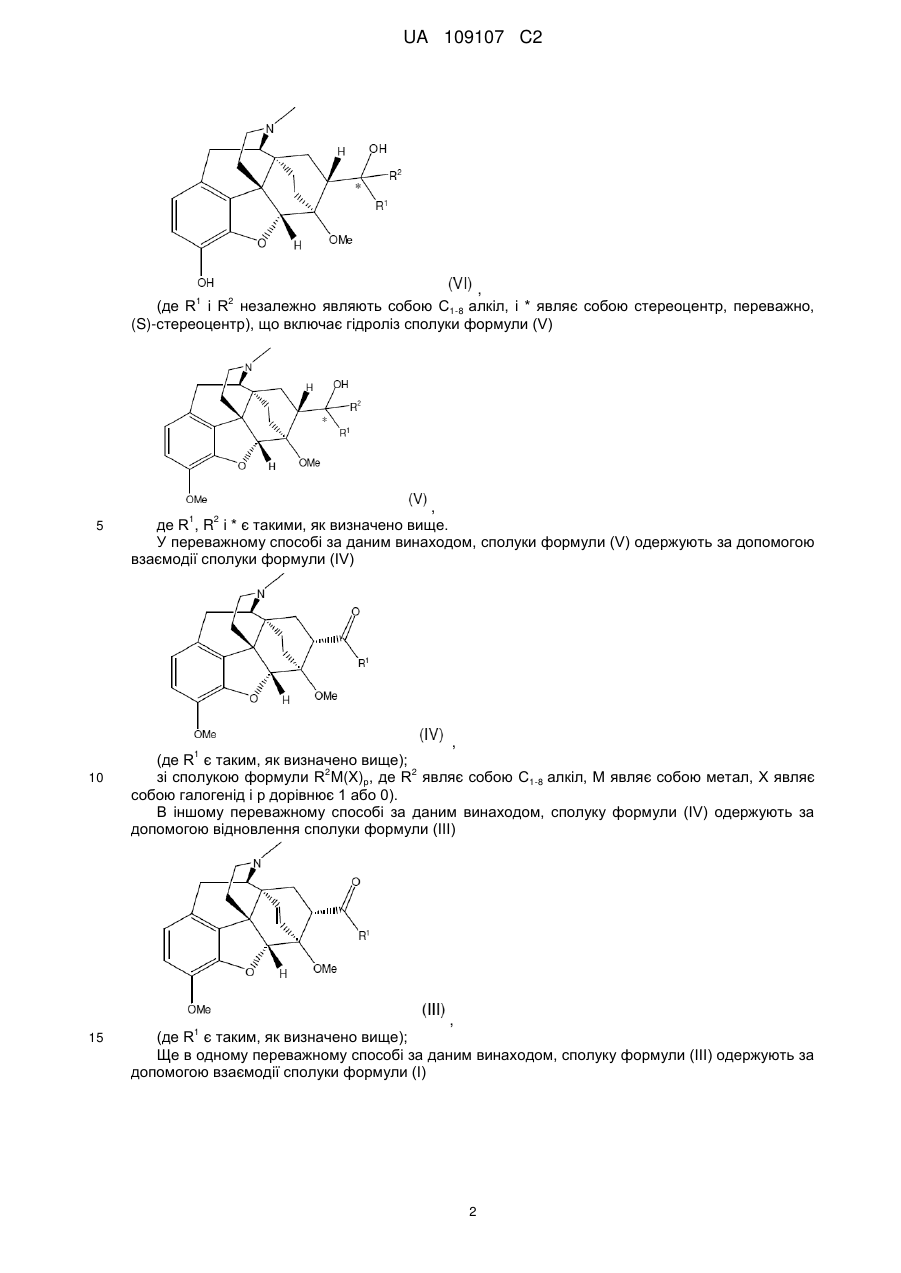
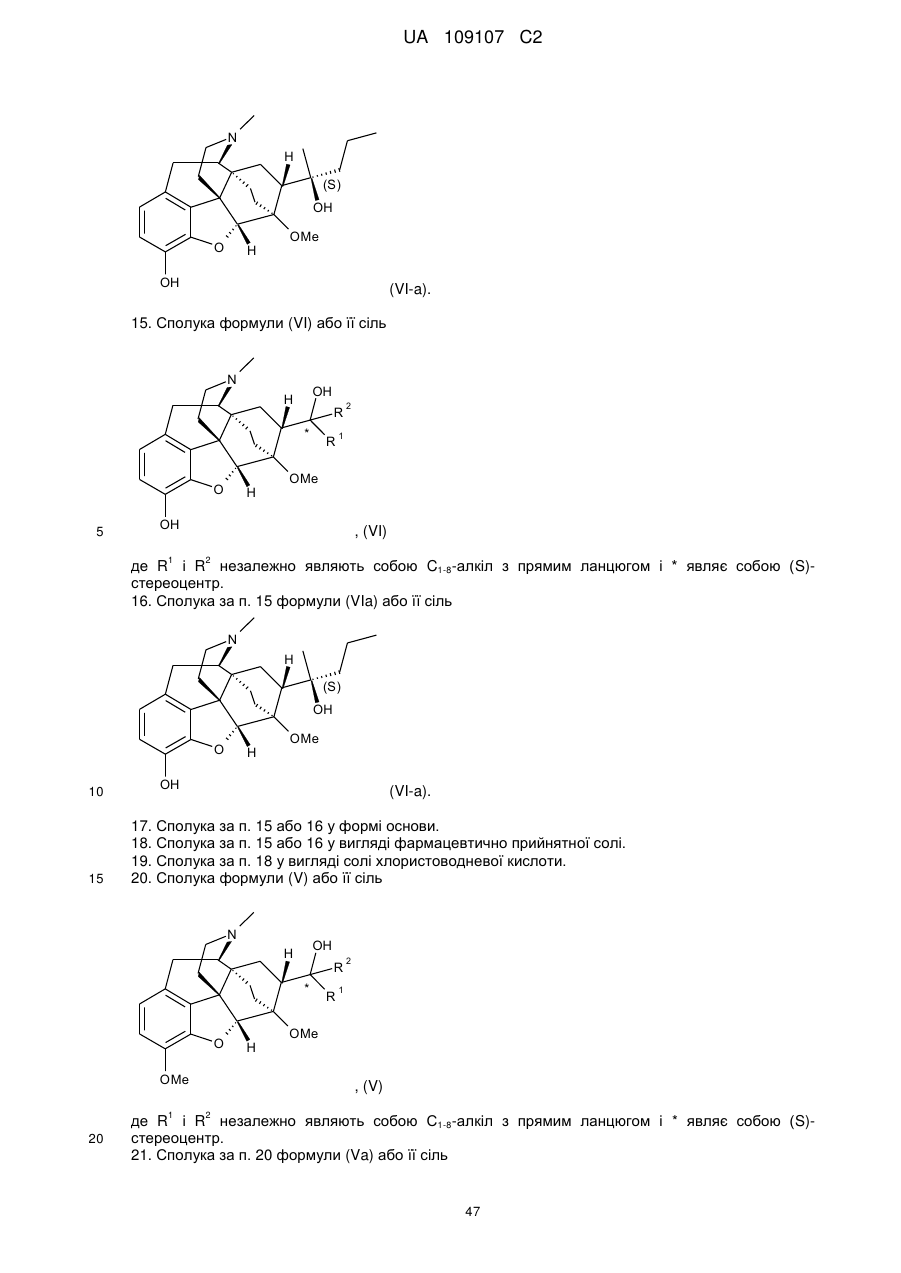
1. Спосіб одержання сполуки формули (VI) або її солі
 , (VI)
, (VI)
де R1 і R2 незалежно являють собою С18-алкіл з прямим ланцюгом і * являє собою (S)-стереоцентр,
в якому здійснюють взаємодію сполуки формули (IV)
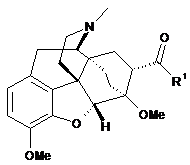 , (IV)
, (IV)
де R1 є таким, як визначено вище,
зі сполукою формули R2М(Х)р, де R2 являє собою C1-8-алкіл з прямим ланцюгом, М являє собою метал, X являє собою галоген і р дорівнює 1 або 0,
з одержанням сполуки формули (V)
 , (V)
, (V)
де R1, R2 і * є такими, як визначено вище;
і гідроліз вказаної сполуки формули (V) з одержанням сполуки формули (VI).
2. Спосіб за п. 1, в якому вказану сполуку формули (IV) одержують за допомогою відновлення сполуки формули (III)
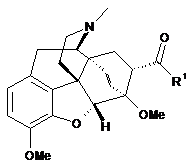 , (III)
, (III)
де R1 є таким, як визначено вище.
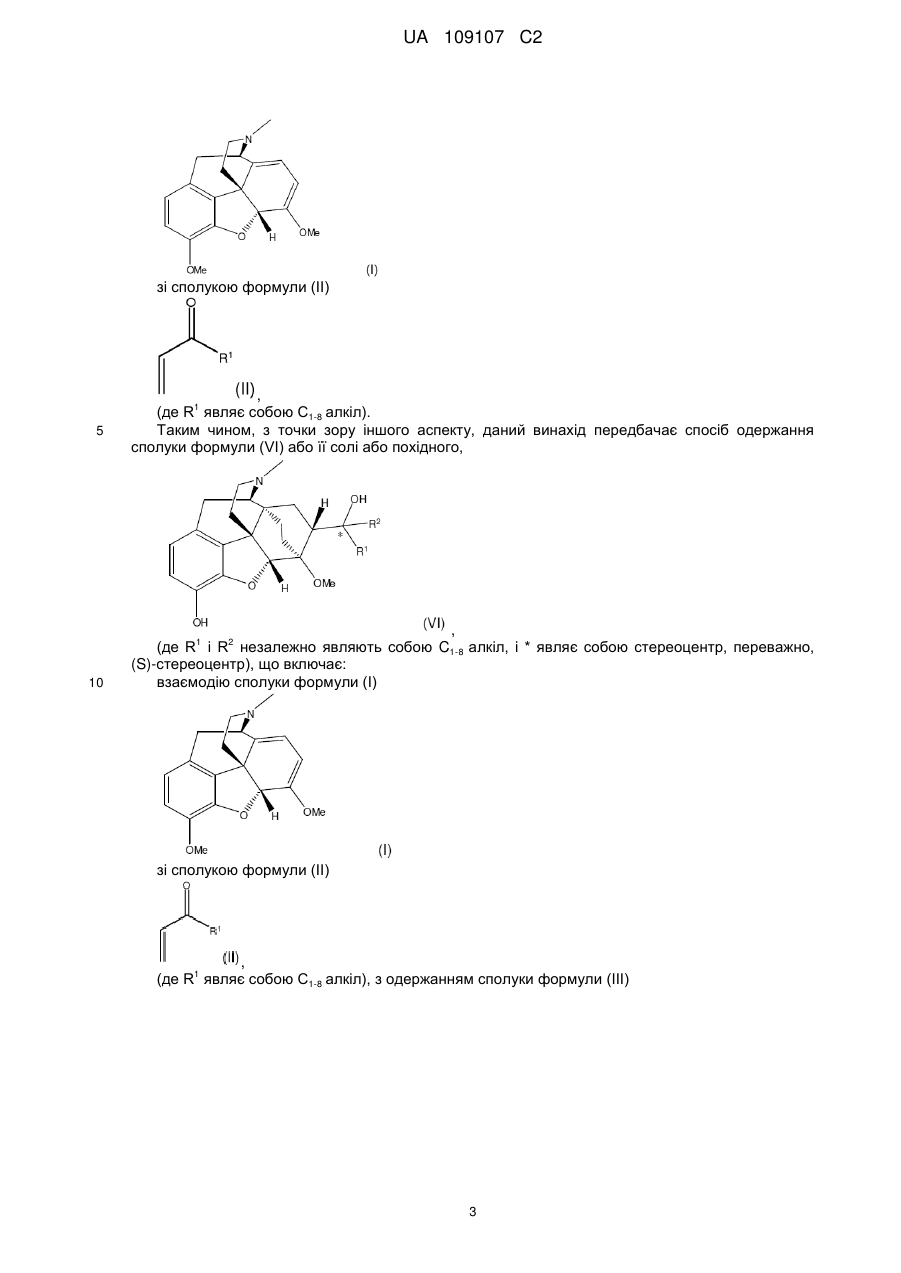
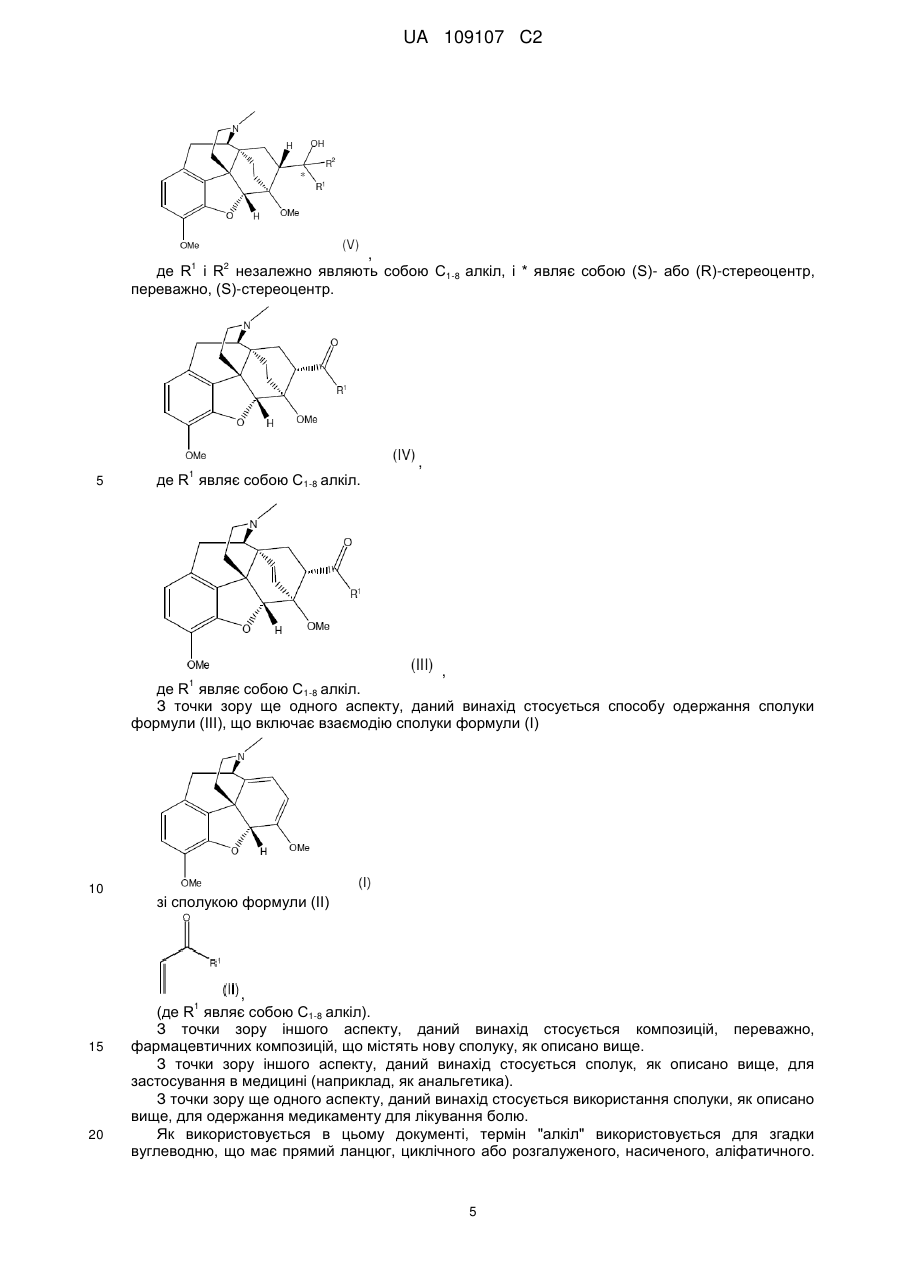
3. Спосіб за п. 2, в якому вказану сполуку формули (III) одержують за допомогою взаємодії сполуки формули (І)
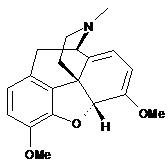 (I)
(I)
зі сполукою формули (II)
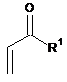 , (II)
, (II)
де R1 являє собою С1-8-алкіл з прямим ланцюгом.
4. Спосіб одержання сполуки формули (VI) або її солі
 , (VI)
, (VI)
де R1 і R2 незалежно являють собою C1-8-алкіл з прямим ланцюгом і * являє собою (S)-стереоцентр,
в якому здійснюють:
взаємодію сполуки формули (І)
 (I)
(I)
зі сполукою формули (II)
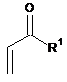 , (II)
, (II)
де R1 являє собою С1-8-алкіл з прямим ланцюгом,
з одержанням сполуки формули (III)
 , (III)
, (III)
де R1 є таким, як визначено вище;
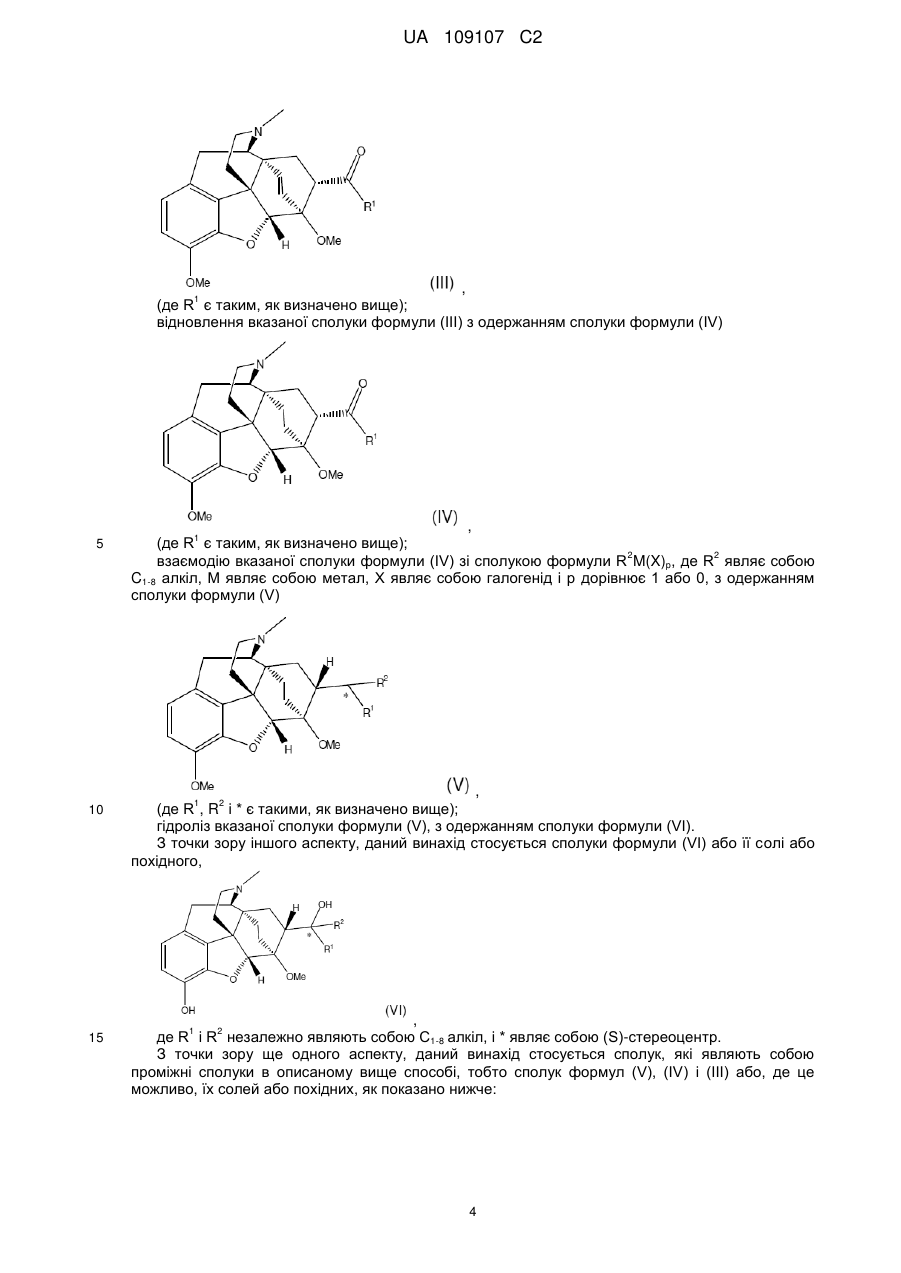
відновлення вказаної сполуки формули (III) з одержанням сполуки формули (IV)
 , (IV)
, (IV)
де R1 є таким, як визначено вище;
взаємодію вказаної сполуки формули (IV) зі сполукою формули R2M(X)р, де R2 являє собою С1-8-алкіл з прямим ланцюгом, М являє собою метал, X являє собою галоген і р дорівнює 1 або 0,
з одержанням сполуки формули (V)
 , (V)
, (V)
де R1, R2 і * є такими, як визначено вище;
і гідроліз вказаної сполуки формули (V) з одержанням сполуки формули (VI).
5. Спосіб за будь-яким з пп. 1-4, де М являє собою магній або літій.
6. Спосіб за п. 5, де R2M(X)p являє собою R2MgCl, R2MgBr, R2MgI або R2Li.
7. Спосіб за будь-яким з пп. 1-6, в якому додатково здійснюють стадію кристалізації вказаної сполуки формули (VI).
8. Спосіб за будь-яким з пп. 1-7, в якому R1 являє собою С3-5-алкіл.
9. Спосіб за будь-яким з пп. 1-8, в якому R1 являє собою н-пропіл.
10. Спосіб за будь-яким з пп. 1-9, в якому R2 являє собою C1-2-алкіл.
11. Спосіб за будь-яким з пп. 1-10, в якому R2 являє собою метил.
12. Спосіб за будь-яким з пп. 1-11, в якому сполуку формули (V) одержують в діастереомерному надлишку щонайменше 90 %.
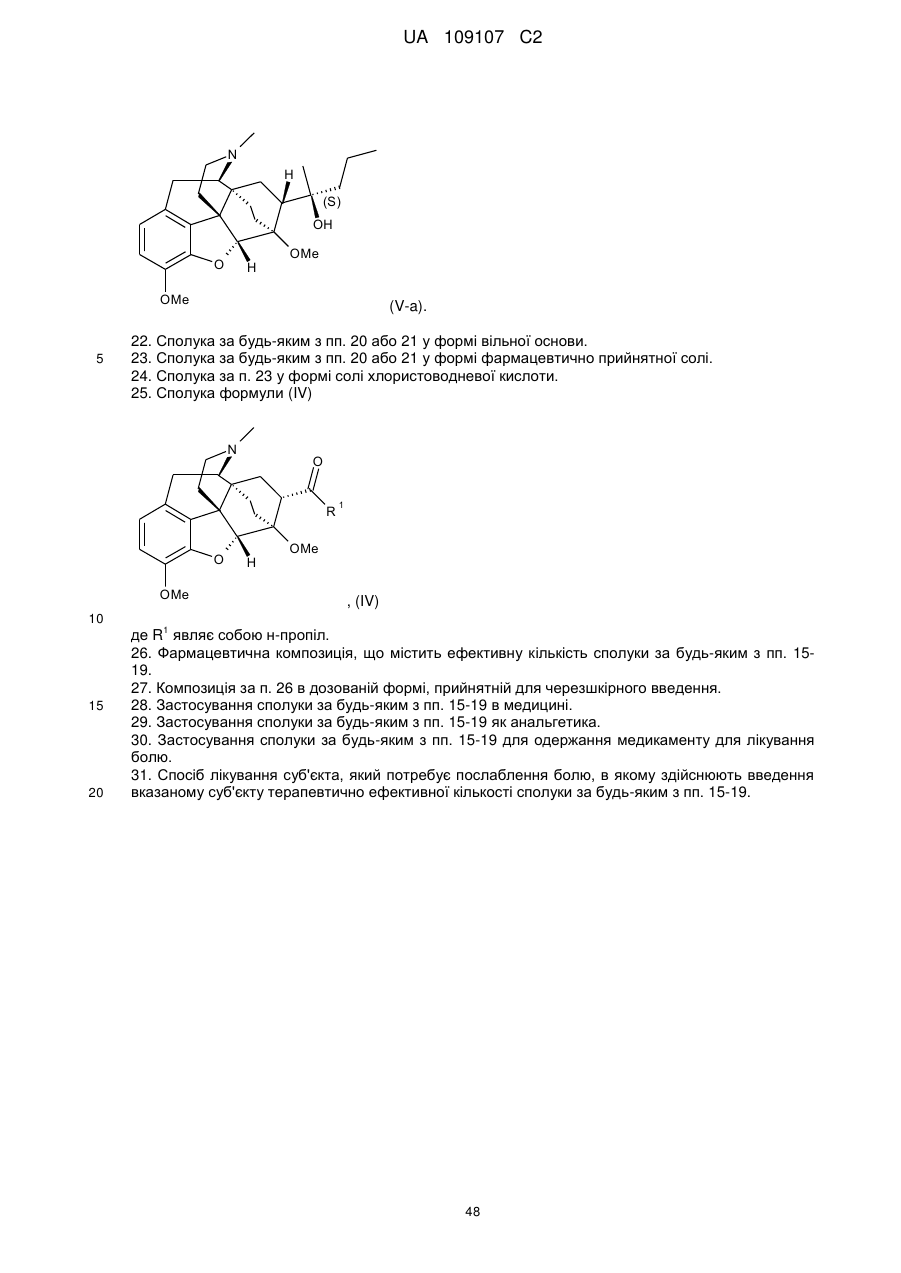
13. Спосіб за будь-яким з пп. 1-12, в якому сполука формули (V) являє собою:
 (V-a).
(V-a).
14. Спосіб за будь-яким з пп. 1-12, в якому сполука формули (VI) являє собою:
 (VI-a).
(VI-a).
15. Сполука формули (VI) або її сіль
 , (VI)
, (VI)
де R1 і R2 незалежно являють собою C1-8-алкіл з прямим ланцюгом і * являє собою (S)-стереоцентр.
16. Сполука за п. 15 формули (VIa) або її сіль
 (VI-a).
(VI-a).
17. Сполука за п. 15 або 16 у формі основи.
18. Сполука за п. 15 або 16 у вигляді фармацевтично прийнятної солі.
19. Сполука за п. 18 у вигляді солі хлористоводневої кислоти.
20. Сполука формули (V) або її сіль
 , (V)
, (V)
де R1 і R2 незалежно являють собою С1-8-алкіл з прямим ланцюгом і * являє собою (S)-стереоцентр.
21. Сполука за п. 20 формули (Va) або її сіль
 (V-a).
(V-a).
22. Сполука за будь-яким з пп. 20 або 21 у формі вільної основи.
23. Сполука за будь-яким з пп. 20 або 21 у формі фармацевтично прийнятної солі.
24. Сполука за п. 23 у формі солі хлористоводневої кислоти.
25. Сполука формули (IV)
 , (IV)
, (IV)
де R1 являє собою н-пропіл.
26. Фармацевтична композиція, що містить ефективну кількість сполуки за будь-яким з пп. 15-19.
27. Композиція за п. 26 в дозованій формі, прийнятній для черезшкірного введення.
28. Застосування сполуки за будь-яким з пп. 15-19 в медицині.
29. Застосування сполуки за будь-яким з пп. 15-19 як анальгетика.
30. Застосування сполуки за будь-яким з пп. 15-19 для одержання медикаменту для лікування болю.
31. Спосіб лікування суб'єкта, який потребує послаблення болю, в якому здійснюють введення вказаному суб'єкту терапевтично ефективної кількості сполуки за будь-яким з пп. 15-19.
Текст
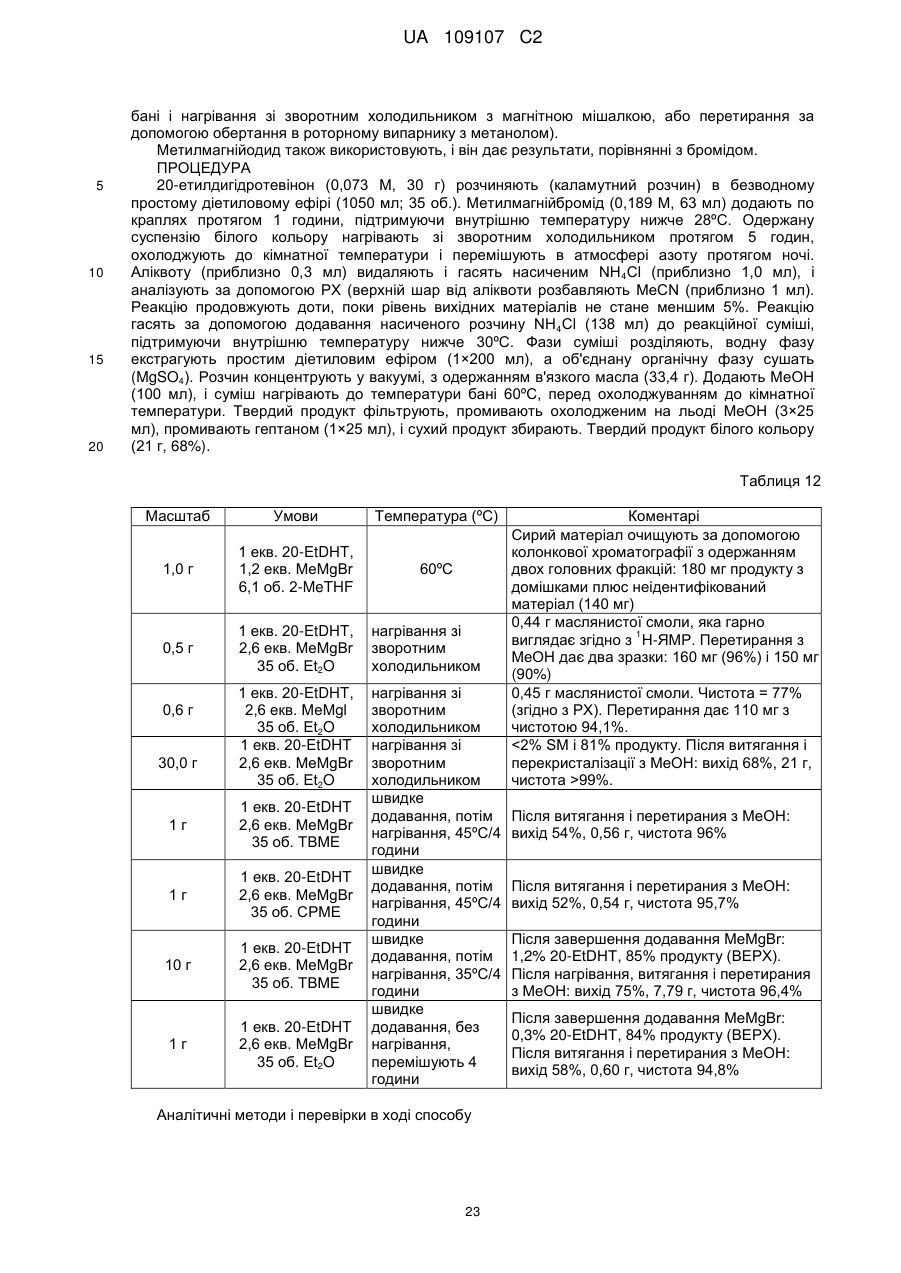
Реферат: Даний винахід стосується способу одержання сполуки формули (VI) або її солі або похідного, 1 2 де R і R незалежно являють собою C1-8-алкіл і * являє собою стереоцентр. UA 109107 C2 (12) UA 109107 C2 UA 109107 C2 Даний винахід стосується нового способу одержання дигідроеторфіну, по суті, (S)дигідроеторфіну, а також проміжних сполук, що одержуються під час його синтезу. (R)-дигідроеторфін (показано нижче) являє собою сильнодіючий аналгетичний засіб. 5 10 Його використовують, головним чином, в Китаї, в сублінгвальній формі при дозах, що знаходяться в межах від 20 до 180 мкг. У порівнянні з іншими анальгетиками, як повідомляється, він викликає сильну аналгезію і відносно м'які побічні впливи. Використання (R)-дигідроеторфіну в трансдермальних пластирах також описується в JP-10-231248. Наскільки відомо заявнику, однак, такі пластири не є комерційно доступними. Дигідроеторфін являє собою один з варіантів еторфіну. (R)-Еторфін являє собою виключно сильнодіючий опіоїд, що використовується для анестезування тварин, наприклад, слонів. Його розробили в 1960 роках, і способи синтезу для його одержання добре відомі. Приклад 12 з GB 925723, наприклад, описує синтез еторфіну, де реагент Гріньяра (пропілмагніййодид) додається до похідного тебаїну, як показано нижче: 15 20 25 30 Результати, представлені в прикладі 12, стверджують, що α-ізомер одержується при перетиранні сирого продукту реакції з метанолом і що β-ізомер може кристалізуватися з метанольних вихідних розчинів, коли їх розбавляють водою і рідину декантують. З цієї причини заявник чекав, що спосіб синтезу, описаний в GB 925723, може застосовуватися до дигідроеторфіну і в результаті можуть бути одержані як (R)-, так і (S)-діастереомери. Виявлено, однак, що цього не відбувається. Замість цього, додавання пропілмагнію галогеніду до похідного дигідротебаїну відбувається при несподівано високій стереоселективності і одержується тільки (R)-діастереомер. Наскільки знають заявники, (S)-ізомер дигідроеторфіну ніколи не був одержаний. З цієї причини є необхідність в альтернативному способі синтезу, який дає (S)-дигідроеторфін, і зокрема, в процедурі, яка дає (S)-дигідроеторфін при великому діастереомерному надлишку. Цей ізомер необхідний для підтвердження стереохімії відомих стереоізомерів. Тепер заявник знайшов спосіб, який задовольняє ці потреби. Крім того, заявник виявив, що (S)-ізомер дигідроеторфіну має корисні фармакологічні властивості і, зокрема, аналгетичні впливи. Таким чином, з точки зору одного з аспектів, даний винахід стосується способу одержання сполуки формули (VI) або її солі або похідного, 1 UA 109107 C2 , 1 2 (де R і R незалежно являють собою C1-8 алкіл, і * являє собою стереоцентр, переважно, (S)-стереоцентр), що включає гідроліз сполуки формули (V) 5 10 15 , 1 2 де R , R і * є такими, як визначено вище. У переважному способі за даним винаходом, сполуки формули (V) одержують за допомогою взаємодії сполуки формули (IV) , 1 (де R є таким, як визначено вище); 2 2 зі сполукою формули R M(X)p, де R являє собою C1-8 алкіл, M являє собою метал, X являє собою галогенід і р дорівнює 1 або 0). В іншому переважному способі за даним винаходом, сполуку формули (IV) одержують за допомогою відновлення сполуки формули (III) , 1 (де R є таким, як визначено вище); Ще в одному переважному способі за даним винаходом, сполуку формули (III) одержують за допомогою взаємодії сполуки формули (I) 2 UA 109107 C2 зі сполукою формули (II) 5 10 , 1 (де R являє собою C1-8 алкіл). Таким чином, з точки зору іншого аспекту, даний винахід передбачає спосіб одержання сполуки формули (VI) або її солі або похідного, , 1 2 (де R і R незалежно являють собою C1-8 алкіл, і * являє собою стереоцентр, переважно, (S)-стереоцентр), що включає: взаємодію сполуки формули (I) зі сполукою формули (II) , 1 (де R являє собою C1-8 алкіл), з одержанням сполуки формули (III) 3 UA 109107 C2 , 1 (де R є таким, як визначено вище); відновлення вказаної сполуки формули (III) з одержанням сполуки формули (IV) 5 10 15 , 1 (де R є таким, як визначено вище); 2 2 взаємодію вказаної сполуки формули (IV) зі сполукою формули R M(X)p, де R являє собою C1-8 алкіл, M являє собою метал, X являє собою галогенід і р дорівнює 1 або 0, з одержанням сполуки формули (V) , 1 2 (де R , R і * є такими, як визначено вище); гідроліз вказаної сполуки формули (V), з одержанням сполуки формули (VI). З точки зору іншого аспекту, даний винахід стосується сполуки формули (VI) або її солі або похідного, , 1 2 де R і R незалежно являють собою C1-8 алкіл, і * являє собою (S)-стереоцентр. З точки зору ще одного аспекту, даний винахід стосується сполук, які являють собою проміжні сполуки в описаному вище способі, тобто сполук формул (V), (IV) і (III) або, де це можливо, їх солей або похідних, як показано нижче: 4 UA 109107 C2 , 1 2 де R і R незалежно являють собою C1-8 алкіл, і * являє собою (S)- або (R)-стереоцентр, переважно, (S)-стереоцентр. 5 1 , де R являє собою C1-8 алкіл. , 1 де R являє собою C1-8 алкіл. З точки зору ще одного аспекту, даний винахід стосується способу одержання сполуки формули (III), що включає взаємодію сполуки формули (I) 10 15 20 зі сполукою формули (II) , 1 (де R являє собою C1-8 алкіл). З точки зору іншого аспекту, даний винахід стосується композицій, переважно, фармацевтичних композицій, що містять нову сполуку, як описано вище. З точки зору іншого аспекту, даний винахід стосується сполук, як описано вище, для застосування в медицині (наприклад, як анальгетика). З точки зору ще одного аспекту, даний винахід стосується використання сполуки, як описано вище, для одержання медикаменту для лікування болю. Як використовується в цьому документі, термін "алкіл" використовується для згадки вуглеводню, що має прямий ланцюг, циклічного або розгалуженого, насиченого, аліфатичного. 5 UA 109107 C2 5 10 15 20 25 30 35 40 45 50 Переважні алкільні групи, присутні в сполуках (II)-(VI), являють собою алкільні групи з прямим ланцюгом. Переважні алкільні групи мають формулу C nH2n+1, де n дорівнює 1-8. Типові алкільні групи включають метил, етил, пропіл, бутил, пентил, гексил, гептил і октил. Переважні алкільні групи в сполуках (II)-(VI) є незаміщеними. Сполуки формули (I) являє собою тебаїн і є комерційно доступним, наприклад, від Tasmanian Alkaloids, Pty. Альтернативна сполука формули (I) може бути одержана відповідно до процедур, описаних в літературі. 1 У переважному способі за даним винаходом, R в сполуці формули (II), переважно, являє собою C2-7 алкіл, більш переважно, C3-5 алкіл, зокрема, C3 алкіл (наприклад, н-пропіл). Особливо переважна сполука формули (II) являє собою гексен-3-он. Вона є комерційно доступною, наприклад, від Sigma-Aldrich. Сполука формули (I) взаємодіє зі сполукою формули (II) з одержанням сполуки формули (III). Реакція, якій піддаються ці сполуки, як правило, згадується як реакція Дільса-Альдера. Реакція Дільса-Альдера може здійснюватися при звичайних умовах, відомих в даній галузі. Реакція сполук формул (I) і (II) може здійснюватися, наприклад, в будь-якому звичайному розчиннику. Розчинники, що мають температури кипіння вищу 60ºC, є переважними (наприклад, метанол і етанол). Етанол є особливо переважним розчинником. У типовій реакції між сполуками формул (I) і (II), сполуки нагрівають зі зворотним холодильником в надлишку розчинника, наприклад, протягом 10-24 годин. Хід реакції може 1 відстежуватися з використанням, наприклад, ТШХ і/або H-ЯМР. У переважній реакції використовують 1,2-15 молярних еквівалентів, більш переважно, 1,5-10 молярних еквівалентів або 2-8 молярних еквівалентів сполуки формули (II) відносно сполуки формули (I). В особливо переважній реакції використовують приблизно 1,2-2 молярні еквіваленти, більш переважно, 1,31,8 молярні еквіваленти, наприклад, приблизно 1,5 молярні еквіваленти сполуки формули (II) відносно сполуки формули (I). Потім реакційну суміш охолоджують і концентрують. Одержаний продукт, сполуки формули (III), може бути одержаний за допомогою звичайної процедури витягання і необов'язково очищений. Очищення може здійснюватися, наприклад, за допомогою кристалізації з метанолу або ізопропілового спирту. Більш переважно, сполука формули (III) кристалізується безпосередньо з реакційного розчинника. Вона може необов'язково перекристалізовуватися. Вихід реакції, переважно, становить щонайменше 60%, більш переважно щонайменше 65%, наприклад щонайменше 80%. Максимальний вихід становить 100%. Чистота сполуки формули (III), переважно, становить щонайменше 95%, більш переважно щонайменше 97%, ще більш переважно щонайменше 99%, наприклад, 99,5%. Максимальна чистота становить 100%. Чистоту, переважно, визначають з використанням ВЕРХ. У переважному способі за даним винаходом сполука формули (III) має формулу: , 1 1 де R є таким, як визначено вище, наприклад, R являє собою C2-7 алкіл, більш переважно, C3-5 алкіл, зокрема, C3 алкіл (наприклад, н-пропіл). Сполука формули (III) може відновлюватися за допомогою будь-якої відповідної відомої реакції відновлення, але, переважно, відновлюється з використанням реакції гідрування (наприклад, з використанням H2 в апараті Парра або перенесення водню). Сполуки формули (III) може, наприклад, гідруватися в розчиннику (наприклад, етанолі) за допомогою каталізатора (наприклад, паладію на вугіллі) під тиском водню (наприклад, аж до 50 фунт/кв. дюйм (3,1 кг/кв. см) H2). Об'єм реакції, переважно, знаходиться в межах 5-80 л, більш переважно, 10-20 л, наприклад, становить приблизно 12 л. Кількість каталізатора, що використовується, переважно, знаходиться в межах 10-60 мас.%, більш переважно, 30-55 мас.%, наприклад, становить приблизно 50 мас.%. Реакція може здійснюватися при температурі від 30 до 100ºC, переважно, при температурі від 40 до 60ºC, наприклад, при 50 або 65ºC. Після закінчення реакції, будь-який каталізатор (наприклад, паладій), що використовується в ній, може видалятися за допомогою фільтрування. Продукт сполуки формули (IV), може потім 6 UA 109107 C2 5 10 15 20 25 30 35 40 45 50 виділятися за допомогою звичайної процедури витягання. Сполука формули (IV) необов'язково очищується. Наприклад, промивання C1-8 алканом, таким як гептан, видаляє етанол. Одна з переваг реакції гідрування полягає, однак, в тому, що сполука формули (IV) може використовуватися без очищення за допомогою хроматографії і/або кристалізації. Вихід реакції, переважно, становить щонайменше 50%, більш переважно щонайменше 65%, ще більш переважно, 85%, ще більш переважно щонайменше 90%. Максимальний вихід становить 100%. Сполуки формули (IV), переважно, одержують з чистотою щонайменше 95%, більш переважно щонайменше 99%, наприклад щонайменше 99,5%. Максимальна чистота становить 100%. Чистоту, переважно, визначають з використанням ВЕРХ. У переважному способі за даним винаходом сполука формули (IV) має формулу: , 1 1 де R є таким, як визначено вище, наприклад, R являє собою C2-7 алкіл, більш переважно, C3-5 алкіл, зокрема, C3 алкіл (наприклад, н-пропіл). 2 2 Сполуки формули (IV) взаємодіє зі сполукою формули R M(X)p, де R являє собою C1-8 алкіл, M являє собою метал (наприклад, лужний або лужноземельний метал), X являє собою галогенід і р дорівнює 1 або 0, з одержанням сполуки формули (V). У переважних сполуках 2 2 формули R M(X)p, R являє собою C1-3 алкіл, більш переважно, C1-2 алкіл, наприклад, метил. 2 В інших переважних сполуках формули R M(X)p, M являє собою магній або літій, переважно, магній. Коли M являє собою Mg, р переважно дорівнює 1. Коли M являє собою літій, р переважно дорівнює 0. Коли він присутній, X переважно являє собою Cl, Br або I. Метилмагнійгалогенід, зокрема, метилмагнійбромід і метилмагніййодид, є переважною 2 сполукою формули R M(X)p, особливо метилмагнійбромід. 2 Реакція сполуки формули (IV) зі сполукою формули R M(X)p, як правило, згадується як реакція нуклеофільного додавання. Коли M являє собою Mg і X являє собою галогенід, реакцію часто згадують як реакцію додавання Гріньяра. Реакція додавання може здійснюватися в будьякому звичайному розчиннику. Переважні розчинники є неводними (наприклад, являють собою безводні розчинники). Один з прикладів переважного розчинника являє собою простий ефір, наприклад, MTБE, ТГФ або простий діетиловий ефір. MTБE або простий діетиловий ефір є переважними. Простий діетиловий ефір є особливо переважним розчинником. ТГФ є особливо 2 переважним, коли використовується сполука формули R M(X)p, де M являє собою Mg, X являє собою Cl і р дорівнює 2. Реакцію додавання, переважно, здійснюють при температурі в межах від 20 до 60ºC, більш переважно, від 30 до 45ºC, наприклад, приблизно 35ºC. Переважно, використовується деякий 2 надлишок сполуки формули R M(X)p. Зокрема, переважно, використовують 1,2-4 еквіваленти, 2 більш переважно, 1,5-3 еквіваленти сполуки формули R M(X)p відносно сполуки формули (IV). Сполука формули (V) може виділятися з використанням звичайних технологій. Воно необов'язково може перетиратися, наприклад, разом з метанолом. На додаток до цього або альтернативно, сполука формули (V) може очищуватися за допомогою колонкової хроматографії. Сполука формули (V) може також кристалізуватися. Переважно, сполука формули (V) кристалізується за допомогою метанолу. Вихід реакції, переважно, становить щонайменше 20%, більш переважно щонайменше 30%, наприклад, 20-60%, ще більш переважно щонайменше 65%. Максимальний вихід становить 100%. Чистота сполуки формули (V), переважно, становить щонайменше 95%, ще більш переважно щонайменше 99%, наприклад щонайменше 99,5%. Максимальна чистота становить 100%. Чистоту, переважно, визначають з використанням ВЕРХ. Реакція додавання генерує новий стереоцентр в сполуці формули (V) на атомі вуглецю 19. 1 2 Конфігурація цього стереоцентра залежить щонайменше частково, від природи R і R . Таким чином, можуть генеруватися як (R)-, так і (S)-стереоцентри. Спосіб за даним винаходом може, з цієї причини, давати рацемічну суміш сполук формули (V). Відповідно, даний винахід передбачає рацемічну суміш сполук формули (VI), наприклад, 19-(R)- і (S)-дигідроеторфін. 7 UA 109107 C2 5 10 15 20 25 30 35 40 У переважних способах за даним винаходом, (S)-стереоцентр генерується на атомі вуглецю 19. В особливо переважних способах, (S)-стереоцентр генерується на атомі вуглецю 19 в діастереомерному надлишку щонайменше 85%, більш переважно щонайменше 90%, наприклад щонайменше 95% або щонайменше 99%. Таким чином, в переважному способі, сполука формули (V) одержується за відсутності або по суті за відсутності (R)-ізомеру. Переважно, в сполуці формули (V) присутньо менше 1 мас.%, ще більш переважно, менше 0,5 мас.% (R)ізомеру. 1 В особливо переважному способі за даним винаходом, R являє собою C3-6 алкіл 2 (наприклад, пропіл), R являє собою C1-2 алкіл (наприклад, метил) і (S)-стереоцентр генерується в реакції додавання на атомі вуглецю 19 при діастереомерному надлишку щонайменше 85%, більш переважно щонайменше 90%, наприклад щонайменше 95% або щонайменше 99%. Таким чином, в переважному способі за даним винаходом сполука формули (V) має формулу: , 1 2 1 де R і R є такими, як описано вище, наприклад, R являє собою C2-7 алкіл, більш 2 переважно, C3-5 алкіл, зокрема, C3 алкіл (наприклад, н-пропіл), R являє собою C1-3 алкіл, більш переважно, C1-2 алкіл, наприклад, метил, і (*) являє собою стереоцентр, переважно, (S)стереоцентр. В особливо переважному способі за даним винаходом сполука формули (V) являє собою: Як згадується вище, сполука формули (V) може необов'язково кристалізуватися. У переважному способі за даним винаходом, сполука формули (V) кристалізується. Для способу кристалізації може використовуватися будь-який звичайний розчинник, наприклад, C1-4 спирти, вода, ацетон, ацетонітрил, DCM і MTБE. Метанол, етанол, вода і їх суміші є переважними розчинниками для кристалізації, зокрема, етанол/вода і етанол. У типовому способі кристалізації деяку кількість сполуки формули (V), одержаної від реакції додавання, розчиняють у вибраному розчиннику, переважно, в мінімальній його кількості, і розчину дозволяють постояти, наприклад, протягом 3-4 днів. Переважно, кристалізація здійснюється при температурі від -5 до 5ºC, наприклад, від 0 до 4ºC. Сполука формули (V), переважно, гідролізується за допомогою гідроксиду лужного металу, з утворенням сполуки формули (VI). Переважний гідроксид лужного металу являє собою KOH. У реакції гідролізу, переважно, використовують деякий надлишок гідроксиду лужного металу, наприклад, надлишок 10-40 еквівалентів відносно сполуки формули (V). Реакція може здійснюватися в будь-якому звичайному розчиннику. Переважний розчинник являє собою діетиленгліколь. Реакцію гідролізу, переважно, здійснюють при температурі в межах 150-220ºC, наприклад, приблизно 180-200ºC. Хід реакції може відстежуватися за допомогою звичайних технологій, наприклад, ТШХ, але, як правило, вона буде займати 10-20 годин, наприклад, 12-18 годин. Після завершення реакції сполука формули (VI) може виділятися з використанням звичайних технологій. Сполука формули (VI) може перетиратися. Вихід реакції, переважно, становить щонайменше 40%, більш переважно щонайменше 45%, ще більш переважно, 85%, і ще більш переважно щонайменше 90%. Максимальний вихід становить 100%. Чистота сполуки формули 8 UA 109107 C2 5 10 15 20 25 30 35 40 (VI), переважно, становить щонайменше 90%, ще більш переважно щонайменше 95%. Максимальна чистота становить 100%. Чистоту, переважно, визначають з використанням ВЕРХ. Сполука формули (VI) може також кристалізуватися. Переважні розчинники для використання при кристалізації являють собою AcCN і MTБE. Більш переважно, сполуки формули (VI) кристалізується за допомогою C1-4 спирту і/або води, наприклад, етанолу і/або суміші етанол/вода. У переважній реакції гідролізу стереохімія кожного з стереоцентрів, присутніх в сполуці формули (V), зберігається. Переважно, сполуки формули (VI), наприклад, 19-S-дигідроеторфін, одержують за відсутності або по суті за відсутності (R)-ізомеру. Переважно, присутньо менше 1 мас.%, більш переважно, менше 0,5 мас.%, ще більш переважно, менше 0,01 мас.% (R)ізомеру. Таким чином, в переважному способі сполука формули (VI) являє собою: , 1 2 1 де R і R є такими, як описано вище, наприклад, R являє собою C2-7 алкіл, більш 2 переважно, C3-5 алкіл, зокрема, C3 алкіл (наприклад, н-пропіл), R являє собою C1-3 алкіл, більш переважно, C1-2 алкіл, наприклад, метил, і (*) являє собою стереоцентр, переважно, (S)стереоцентр. Переважно, сполука формули (VI) має чистоту щонайменше 99%, наприклад, як визначають за допомогою ВЕРХ. В особливо переважному способі сполука формули (VI) являє собою: Сполуки (V) і (VI), описані вище, можуть перетворюватися на їх солі і похідні за допомогою технологій, добре відомих в даній галузі. Переважні солі являють собою фармацевтично прийнятні солі. Переважні похідні являють собою фармацевтично прийнятні похідні. Похідне, яке іноді одержується в малих кількостях (наприклад, 99,5% Вихід 80%, 105,4 г. Матеріал осаджується. Чистота >99,5% Аналітичні методи і перевірки в ході способу (IPC) 1 Для IPC використовують H-ЯМР (400 МГц) плюс метод ВЕРХ 38XB під час роботи в лабораторії. Реакцію вважають завершеною, коли залишається 99,5 немає немає 1 H-ЯМР (CDCl3; 400 МГц); δ=0,80 (3H, т), 1,4 (1H, м), 1,6 (3H, секст.), 1,9 (1H, д), 2,0 (1H, ушир.), 2,4-2,6 (8H, м), 2,9 (2H, ушир.), 3,35 (2H, д), 3,6 (3H, c), 3,85 (3H, c), 4,6 (1H, c), 5,6 (1H, д), 6,0 (1H, д), 6,55 (1H, д), 6,7 (1H, д) 13 C-ЯМР (CDCl3; 75 МГц); δ=13,71, 16,89, 22,49, 30,25, 43,26, 43,51, 45,57, 45,72, 47,40, 49,94, 53,78, 56,68, 60,06, 81,52, 95,84, 113,61, 119,36, 125,89, 134,07, 135,53, 141,87, 148,07. + МС; [M+H] =410,3. РХ; чистота >99,5%. ТШХ; 5:95; MeOH:DCM; rf=0,66 для однієї плями. Переваги оптимізованого способу Збільшення виходу до 80%. 19 UA 109107 C2 5 Кількість 1-гексен-3-ону знижується до 1,5 еквівалента без зменшення перетворення або виходу. Зменшення кількості еквівалентів 1-гексен-3-ону робить можливим поліпшення виділення (пряма кристалізація з реакційного розчинника), що дає матеріал дуже високої чистоти. Об'ємна ефективність є дуже високою (максимум приблизно 4 об. загалом). Чистота поліпшується до >99% (згідно з ВЕРХ). 1 IPC показує завершення при перетворенні >97% згідно з H-ЯМР (99% Аналітичні методи і перевірки в ході способу 1 Використовують H-ЯМР (400 МГц) для IPC плюс метод ВЕРХ 38XB під час роботи в лабораторії. Хід реакції відстежують за допомогою аналізу РХ: реакція, здійснювана в масштабі 100 г, показує відсутність 20-етилтевінону і 96% 20-етилдигідротевінону. Для підтвердження чистоти і для роботи методу РХ-МС продукт реакції в масштабі 100 г використовують в аналітичній лабораторії. Зовнішній вигляд Твердий продукт білого кольору Аналітичні результати ВЕРХ (% площа/площа) Коментарі 20-етилтевінону не залишається. Інші >99 домішки не виявляються. 15 20 25 Аналіз 1 H-ЯМР (CDCl3, 400 МГц); δ=0,75 (1H, т, т), 0,9 (1H, т), 1,35 (1H, т, д), 1,5-1,75 (7H, м), 2,1 (1H, т, д), 2,3 (5H, м), 2,5 (2H, кв.), 2,6-2,7 (3H, м), 3,0 (1H, кв., т), 3,1 (1H, д), 3,5 (3H, c), 3,9 (3H, c), 4,5 (1H, д), 6,6 (1H, д), 6,7 (1H, д). 13 C-ЯМР (CDCl3, 75 МГц); δ=13,73, 16,99, 17,31, 21,98, 28,67, 30,70, 35,17, 35,66, 43,51, 45,24, 45,78, 48,28, 48,91, 52,26, 56,76, 61,35, 94,96, 114,01, 119,16, 128,71, 132,47, 141,76, 146,80. РХ; >99%. 1 Залишковий розчинник (згідно H-ЯМР); залишкового етанолу немає. Переваги оптимізованого способу Зменшення об'єму реакції від 17 до 12 об. дозволяє пряму кристалізацію продукту. Продукт виділяється з виходом 72%, з чистотою >99%. Температура приблизно 65ºC, очевидно, є оптимальною для розчинності і реакційної здатності. 21 UA 109107 C2 Сушіння твердого продукту на фільтрувальному шарі і промивання гептаном видаляє сліди етанолу до прийнятного рівня, готового для наступної стадії. Стадії 3 і 4: Реакція Гріньяра і кристалізація 5 10 15 20 Результати роботи наводяться в таблиці 12, нижче. Досліджують різні ефірні розчинники, при цьому простий діетиловий ефір дає матеріал, найкращий за якістю, хоча різниця між простим діетиловим ефіром і MTБE, як виявлено, є відносно невеликою. Як правило, сирий матеріал, одержаний при реакції Гріньяра, містить дві головних домішки + (приблизно 10% кожні, РХ-МС). Обидві домішки мають однакову масу ([M+H] =428,4) як продукт). Одна з двох домішок експериментально визначається як складовий ізомер, який виникає внаслідок реакції закривання кільця і відкривання кільця при надлишку реагенту Гріньяра на 20-етилдигідротевіноні. Друга домішка, яка має час утримування (РХ-МС), схожий з продуктом, як передбачається, є діастереоізомером (R)-19-пропілдигідротевінолу. Обидві домішки ефективно віддаляються за допомогою перекристалізації з метанолу. Роль температури реакції досліджують за допомогою простого діетилового ефіру, і виявлено, що профілі реакції, з точки зору як ходу реакції, так і домішок (аналіз РХ) порівнянні при кімнатній температурі і при температурі дефлегмації. Таким чином, відмінності, що спостерігаються в чистоті, відмічені в реакціях, як вважається, виникають з відмінностей в процедурах очищення (перекристалізація з використанням масляної 22 UA 109107 C2 5 10 15 20 бані і нагрівання зі зворотним холодильником з магнітною мішалкою, або перетирання за допомогою обертання в роторному випарнику з метанолом). Метилмагнійодид також використовують, і він дає результати, порівнянні з бромідом. ПРОЦЕДУРА 20-етилдигідротевінон (0,073 M, 30 г) розчиняють (каламутний розчин) в безводному простому діетиловому ефірі (1050 мл; 35 об.). Метилмагнійбромід (0,189 M, 63 мл) додають по краплях протягом 1 години, підтримуючи внутрішню температуру нижче 28ºC. Одержану суспензію білого кольору нагрівають зі зворотним холодильником протягом 5 годин, охолоджують до кімнатної температури і перемішують в атмосфері азоту протягом ночі. Аліквоту (приблизно 0,3 мл) видаляють і гасять насиченим NH 4Cl (приблизно 1,0 мл), і аналізують за допомогою РХ (верхній шар від аліквоти розбавляють MeCN (приблизно 1 мл). Реакцію продовжують доти, поки рівень вихідних матеріалів не стане меншим 5%. Реакцію гасять за допомогою додавання насиченого розчину NH 4Cl (138 мл) до реакційної суміші, підтримуючи внутрішню температуру нижче 30ºC. Фази суміші розділяють, водну фазу екстрагують простим діетиловим ефіром (1×200 мл), а об'єднану органічну фазу сушать (MgSO4). Розчин концентрують у вакуумі, з одержанням в'язкого масла (33,4 г). Додають MeOH (100 мл), і суміш нагрівають до температури бані 60ºC, перед охолоджуванням до кімнатної температури. Твердий продукт фільтрують, промивають охолодженим на льоді MeOH (3×25 мл), промивають гептаном (1×25 мл), і сухий продукт збирають. Твердий продукт білого кольору (21 г, 68%). Таблиця 12 Масштаб Умови Температура (ºC) 1,0 г 1 екв. 20-EtDHT, 1,2 екв. MeMgBr 6,1 об. 2-MeTHF 60ºC 0,5 г 1 екв. 20-EtDHT, 2,6 екв. MeMgBr 35 об. Et2O нагрівання зі зворотним холодильником 1 екв. 20-EtDHT, 2,6 екв. MeMgl 35 об. Et2O 1 екв. 20-EtDHT 2,6 екв. MeMgBr 35 об. Et2O нагрівання зі зворотним холодильником нагрівання зі зворотним холодильником швидке додавання, потім нагрівання, 45ºC/4 години швидке додавання, потім нагрівання, 45ºC/4 години швидке додавання, потім нагрівання, 35ºC/4 години швидке додавання, без нагрівання, перемішують 4 години 0,6 г 30,0 г 1г 1 екв. 20-EtDHT 2,6 екв. MeMgBr 35 об. TBME 1г 1 екв. 20-EtDHT 2,6 екв. MeMgBr 35 об. CPME 10 г 1 екв. 20-EtDHT 2,6 екв. MeMgBr 35 об. TBME 1г 1 екв. 20-EtDHT 2,6 екв. MeMgBr 35 об. Et2O Аналітичні методи і перевірки в ході способу 23 Коментарі Сирий матеріал очищують за допомогою колонкової хроматографії з одержанням двох головних фракцій: 180 мг продукту з домішками плюс неідентифікований матеріал (140 мг) 0,44 г маслянистої смоли, яка гарно 1 виглядає згідно з H-ЯМР. Перетирання з MeOH дає два зразки: 160 мг (96%) і 150 мг (90%) 0,45 г маслянистої смоли. Чистота = 77% (згідно з РХ). Перетирання дає 110 мг з чистотою 94,1%. 99%. Після витягання і перетирания з MeOH: вихід 54%, 0,56 г, чистота 96% Після витягання і перетирания з MeOH: вихід 52%, 0,54 г, чистота 95,7% Після завершення додавання MeMgBr: 1,2% 20-EtDHT, 85% продукту (ВЕРХ). Після нагрівання, витягання і перетирания з MeOH: вихід 75%, 7,79 г, чистота 96,4% Після завершення додавання MeMgBr: 0,3% 20-EtDHT, 84% продукту (ВЕРХ). Після витягання і перетирания з MeOH: вихід 58%, 0,60 г, чистота 94,8% UA 109107 C2 1 5 Використовують H-ЯМР (400 МГц) плюс метод ВЕРХ 38XB під час лабораторної роботи. Реакцію відстежують за допомогою аналізу РХ, і гасять аліквоту реакції (насичений розчин NH4Cl): 99 білого кольору 99%. Переваги оптимізованого способу Реакція працює в деякому діапазоні ефірних розчинників, хоча простий діетиловий ефір, очевидно, дає самий чистий сирий продукт. Матеріал чудової чистоти одержують після перекристалізації з метанолу. Стадія 5: Гідроліз 20 25 30 Реакція здійснюється без значних змін (таблиця 13). Перекристалізацію здійснюють з суміші етанол/вода, а потім з етанолу. ПРОЦЕДУРА (S)-DHE (10 г) додають до EtOH (60 мл) і нагрівають зі зворотним холодильником до розчинення. Вода (32 мл) утворює каламутний розчин, якому дозволяють охолоджуватися до кімнатної температури протягом приблизно 2 годин. Твердий продукт білого кольору збирають за допомогою фільтрування. (4,26 г, витягання 42 мас.%). Чистота 98%. Загальний вихід рівний 45 мас.%. Таблиця 13 Масштаб Умови Температура (ºC) 15 г (S)-19-пропілдигідротевінол (1 екв.), KOH (20,85 екв.), діетиленгліколь (16,6 об.) 185 Аналітичні методи і перевірки в ході способу 24 Коментарі Реакцію нагрівають при 185ºC протягом приблизно 18 годин за допомогою повітряного конденсора. Вихід сирого продукту 107%, чистота 95% UA 109107 C2 1 5 Для IPC під час роботи в лабораторії використовують H-ЯМР (400 МГц) плюс метод ВЕРХ 38XB. Реакцію відстежують за допомогою аналізу РХ і потім гасять, коли не залишається (S)-19пропілдигідротевінолу. Реакція завершується на 92%. Для підтвердження чистоти і для роботи РХ-МС використовують метод UFC-LC-MUN-1 в аналітичній лабораторії. Аналітичні результати Зовнішній вигляд Твердий продукт жовтувато-коричневого кольору ВЕРХ (площа/площа %) 95,0 1 10 15 20 25 30 35 H-ЯМР (CDCl3, 400 МГц); δ=0,7 (1H, м), 0,8 (3H, т), 1,0-1,1 (5H, м), 1,3 (1H, м), 1,5-1,8 (6H, м), 1,85 (1H, т), 1,95 (1H, т, д), 2,1-2,3 (5H, м), 2,6 (1H, д), 2,7 (1H, т), 3,0 (1H, д), 3,5 (3H, c), 4,3 (1H, c), 4,8 (1H, c), 6,0 (1H, ушир.), 6,4 (1H, д), 6,7 (1H, д). 13 C-ЯМР (CDCl3, 75 МГц); δ=15,10, 16,95, 18,00, 21,99, 25,37, 29,82, 31,96, 35,43, 36,15, 38,93, 43,51, 45,22, 46,50, 49,04, 52,72, 61,33, 80,42, 97,38, 116,61, 119,46, 127,92, 132,07, 137,56, 145,67. РХ; 98,8%. Хіральна РХ; 99,44% (S)-DHE, 0,554 (R)-DHE. Переваги оптимізованого способу Значне поліпшення чистоти сирого матеріалу, одержаного при реакції, до 95%. Усунення перетирання з метанолом - матеріал перекристалізується з суміші етанол/вода і з етанолу. Стадія 6: Перекристалізація Збільшення вмісту води до приблизно 35% (загальний об'єм 9,2 об.) призводить до утворення твердого продукту білого кольору. Додаткові перекристалізації з етанолу і суміші етанол/вода поліпшують чистоту матеріалу (таблиця 14). ПРОЦЕДУРА (1) (S)-DHE (3,0 г) додають до EtOH (10 мл) і суспензію нагрівають зі зворотним холодильником, з одержанням розчину оранжевого кольору. Розчину дозволяють охолоджуватися до кімнатної температури протягом 16 годин. Одержаний твердий продукт білого кольору збирають за допомогою фільтрування (2,1 г, 70 мас.%). Чистота >99%. (2) (S)-DHE (1,8 г) додають до EtOH (7 мл), і суміш нагрівають зі зворотним холодильником до одержання розчину. Додають воду (2 мл), і каламутному розчину дозволяють охолоджуватися до кімнатної температури протягом 2 годин. Одержаний твердий продукт білого кольору збирають за допомогою фільтрування (1,29 г, 72 мас.%). Таблиця 14 Масштаб 10 г 3,0 г Умови Температура (ºС) 9,2 об. смеси нагрівання зі EtOH/вода, приблизно зворотним 65/35 холодильником 3,3 об. (EtOH) нагрівання зі зворотним холодильником 25 Коментарі Матеріал нагрівають в EtOH, потім додають воду. Твердий продукт білого кольору, витягання 42 мас.%, чистота 98% Твердий продукт білого кольору, витягання 70 мас.%, чистота >99% UA 109107 C2 Продовження таблиці 14 Масштаб 1,8 г 5 Умови Температура (ºС) нагрівання зі 4,5 об. (20% води/80% зворотним EtOH) холодильником Коментарі При нагріванні зі зворотним холодильником додають воду, потім дозволяють охолоджуватися. Витягання 72 мас.%, чистота >99% Аналітичні методи і перевірки в ході способу 1 Для IPC під час лабораторної роботи використовують H-ЯМР (400 МГц) плюс метод ВЕРХ 38XB. Для підтвердження чистоти і для робіт РХ-МС використовують метод UFC-LC-MUN-1 в аналітичній лабораторії. Для підтвердження хіральної чистоти використовують метод UFC-LCMUN-2 в аналітичній лабораторії. Аналітичні результати Зовнішній вигляд Твердий продукт білого кольору ВЕРХ (площа/площа %) Хіральна чистота (ВЕРХ), % >99% 99,98 10 15 20 25 30 35 40 45 Переваги оптимізованого способу Перекристалізація з суміші етанол/вода або з етанолу дає матеріал з хорошою загальною чистотою і
ДивитисяДодаткова інформація
Автори російськоюWhitlock, Steve, Harding, Deborah, Phyllis, Turner, Carl, David
МПК / Мітки
МПК: A61K 31/4353, A61P 29/00, C07D 489/00
Мітки: дигідроеторфіни, одержання
Код посилання
<a href="https://ua.patents.su/64-109107-digidroetorfini-i-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Дигідроеторфіни і їх одержання</a>
Попередній патент: Пристрій і спосіб проведення каталітичних реакцій у газовій фазі та їх застосування
Наступний патент: Антитіло до pd-l1 та його застосування для посилення функції t-клітин
Випадковий патент: Спосіб лікування фебрильної шизофренії