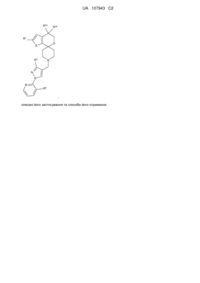
Сполуки спіропіперидину як антагоністи рецептора orl-1
Номер патенту: 107943
Опубліковано: 10.03.2015
Автори: Беніто Кольядо Ана Белен, Толедо Ескрібано Мігель Анхель, Педрегал-Терсеро Консепсьйон, Лафуенте Бланко Селія, Хіменес-Агвадо Альма Марія, Мартінес-Грау Марія Анхелес, Діаз Буезо Нурія
Формула / Реферат
1. Сполука формули:
 ,
,
де
R1 - фтор або хлор;
кожен з R2a та R2b є воднем або кожен є фтором;
R3 - водень, метил, гідроксиметил або (С1-С3)-алкоксиметил;
R4 - вибраний з групи, яку складають фтор, хлор, ціаногрупа, ціанометил, (С1-С3)-алкіл, циклопропіл, гідроксиметил, метокси, циклопропілметокси, амінокарбонілметокси, (С1-С3)-алкоксиметил, циклопропілоксиметил, циклопропілметоксиметил, 1-гідрокси-1-метилетил, амінокарбонілоксиметил, метиламінокарбонілоксиметил, диметиламінокарбонілоксиметил, амінокарбоніл, амінокарбонілметил, -CH2-NR5R6, гідроксіімін, метоксіімін, морфолін-4-іл, морфолін-4-ілметил, Аr1, -СН2Аr1, тетрагідрофуран-2-іл, 3-оксоморфолін-4-ілметил, 2-оксопіролідин-1-ілметил та 2-оксопіперидин-1-ілметил;
R5 водень, (С1-С3)-алкіл, ціанометил, -С(О)СН3або амінокарбонілметил;
R6 - водень або метил; та
Аr1 складова, вибрана з групи, яку складають імідазол-1-іл, імідазол-2-іл, 2-метилімідазол-1-іл, піразол-1-іл, 1,2,3-триазол-1-іл, 1,2,3-триазол-2-іл, 1,2,4-триазол-1-іл, ізоксазол-3-іл, оксазол-5-іл та 3-метил-1,2,4-оксадіазол-5-іл;
або будь-яка фармацевтично прийнятна сіль цієї сполуки.
2. Сполука за п. 1, де R1 - хлор,
або будь-яка фармацевтично прийнятна сіль цієї сполуки.
3. Сполука за будь-яким з п. 1 або п. 2, де кожен з R2a та R2b є фтором,
або будь-яка фармацевтично прийнятна сіль цієї сполуки.
4. Сполука за п. 1, де R1 - фтор, та кожен з R2a та R2b є воднем,
або будь-яка фармацевтично прийнятна сіль цієї сполуки.
5. Сполука за будь-яким з пп. 1-4, де R3 - метил, або будь-яка фармацевтично прийнятна сіль цієї сполуки.
6. Сполука за будь-яким з пп. 1-5, де R4 - фтор, гідроксиметил, метоксиметил або піразол-1-ілметил,
або будь-яка фармацевтично прийнятна сіль цієї сполуки.
7. Сполука за п. 1 або будь-яка фармацевтично прийнятна сіль цієї сполуки, вибрана з групи:
[2-[4-[(2-хлоро-4,4-дифтороспіро[5Н-тієно[2,3-с]піран-7,4'-піперидин]-1'-іл)метил]-3-метилпіразол-1-іл]-3-піридил]метанол;
2-хлоро-4,4-дифторо-1'-[[3-метил-1-[3-(піразол-1-ілметил)-2-піридил]піразол-4-іл]метил]спіро[5Н-тієно[2,3-с]піран-7,4'-піперидин] або
[4-[(2-хлоро-4,4-дифтороспіро[5Н-тієно[2,3-с]піран-7,4'-піперидин]-1'-іл)метил]-1-(3-фторо-2-піридил)піразол-3-іл]метанол.
8. Сполука за п. 1, яка являє собою [2-[4-[(2-хлоро-4,4-дифтороспіро[5Н-тієно[2,3-с]піран-7,4'-піперидин]-1'-іл)метил]-3-метилпіразол-1-іл]-3-піридил]метанол, або будь-яка фармацевтично прийнятна сіль цієї сполуки.
9. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-8 або будь-яку фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятний носій, розріджувач або наповнювач.
10. Фармацевтична композиція за п. 9, яка відрізняється тим, що також містить щонайменше один додатковий терапевтичний інгредієнт.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що додатковий інгредієнт являє собою SSRI-антидепресант.
12. Сполука за будь-яким з пп. 1-8 або будь-яка фармацевтично прийнятна сіль цієї сполуки для застосування в терапії.
13. Сполука за будь-яким з пп. 1-8 або будь-яка фармацевтично прийнятна сіль цієї сполуки для застосування для лікування ожиріння або надмірної ваги у людини.
14. Сполука за будь-яким з пп. 1-8 або будь-яка фармацевтично прийнятна сіль цієї сполуки для застосування для лікування мігрені.
15. Сполука за будь-яким з пп. 1-8 або будь-яка фармацевтично прийнятна сіль цієї сполуки для застосування для лікування депресії.
Текст
Реферат: Антагоніст рецептора ORL-1 формули: UA 107943 C2 (12) UA 107943 C2 R2a R2b R1 O S R3 N N N N R4 , описані його застосування та способи його отримання. UA 107943 C2 5 10 15 20 25 30 Орфанін FQ (OFQ)/ноцицептин являє собою пептид, що складається з 17 амінокислот, і який має високу спорідненість до G-білок-зв'язаного ORL1-рецептору (GPCR). ORL1-рецептор є GPCR класу А, що експресується головним чином у центральній нервовій системі та периферичній нервовій системі, а також у шлунково-кишковому тракті, гладеньких м'язах та імунній системі. Незважаючи на свою структурну спорідненість з опіоїдними пептидами/рецепторами, система OFQ/ноцицептин не демонструє значної перехресної реактивності з класичними опіоїдними пептидами/рецепторами і демонструє антиопіоїдну активність in vivo (наприклад, повідомлялось про те, що ORQ/ноцицептин демонструє антиноцицептивні властивості). Антагоністи рецепторів ноцицептину/орфаніну FQ (NOC/OFQ), зокрема антагоністи ORL-1рецептору, демонстрували антидепресантну активність і аноректичну активність у численних дослідженнях на тваринних моделях депресії та харчової поведінки. Як такі, антагоністи ORL-1 вважаються придатними для лікування депресії та/або лікування надмірної ваги, ожиріння та/або підтримання ваги після лікування з приводу надмірної ваги або ожиріння. У WO2003/095427 описані певні сполуки спіропіперидинілу як антагоністи ORL-1 для застосування як аналгетичних препаратів. У роботі Yoshizumi, Takashi et al. (2008), Design, synthesis, and structure-activity relationship study of a novel class of ORL-1 receptor antagonists based on N-biarylmethyl spiropiperidine, Bioorganic & Medicinal Chemistry Letters vol. 18, pg. 3778-3782, наведено опис певних сполук Nбіарилметилспіропіперидину як селективних антагоністів ORL-1. Цей винахід пропонує сімейство сполук 4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]пірану] з високою антагоністичною активністю відносно ORL-1-рецептору та високим ступенем зайнятості ORL-1-рецептору in vivo у ЦНС. На додаток до цього, певні сполуки, як визначено селективністю у відношенні активності hERG-каналів, а також високим рівнем селективності у відношенні фізіологічно важливих рецепторів (наприклад, мю, каппа і дельта опіоїдних, серотонінових та дофамінових рецепторів), мають сприятливий кардіотоксикологічний профіль. Окрім того, певні сполуки за цим винаходом мають сприятливі біофармацевтичні та фармакокінетичні властивості (наприклад, розчинність, придатність до перорального застосування та ЦНС проникність). Певні сполуки за цим винаходом демонструють знижений оксидативний метаболізм, наслідком чого є сприятлива пероральна біодоступність. Певні сполуки також продемонстрували (за допомогою тваринних моделей), що сполуки за цим винаходом є придатними для лікування мігрені. Цей винахід пропонує сполуки Формули I: R R 2a R 2b 1 O S R 3 N N N N R , 35 40 4 де 1 R - фтор або хлор; 2a 2b кожен з R та R є воднем або кожен є фтором; 3 R - водень, метил, гідроксиметил, або (C1-C3)-алкоксиметил; 4 R - обраний з групи, яку складають фтор, хлор, ціаногрупа, ціанометил, (C 1-C3)-алкіл, ціклопропіл, гідроксиметил, метокси, ціклопропілметокси, амінокарбонілметокси, (C 1-C3)алкоксиметил, ціклопропілоксиметил, ціклопропілметоксиметил, 1-гідрокси-1-метилетил, амінокарбонілоксиметил, метиламінокарбонілоксиметил, диметиламінокарбонілоксиметил, 1 UA 107943 C2 5 5 10 15 20 25 30 35 40 45 50 55 60 6 амінокарбоніл, амінокарбонілметил, -CH2-NR R , гідроксіімін, метоксіімін, морфолін-4-іл, 1 1 морфолін-4-ілметил, Ar , -CH2Ar , тетрагідрофуран-2-іл, 3-оксоморфолін-4-ілметил, 2оксопіролідин-1-ілметил, та 2-оксопіперидин-1-ілметил; 5 R - водень, (C1-C3)-алкіл, ціанометил, -C(O)CH3, або амінокарбонілметил; 6 R - водень або метил; та 1 Ar - складова, обрана з групи, яку складають імідазол-1-іл, імідазол-2-іл, 2-метилімідазол-1іл, піразол-1-іл, 1,2,3-триазол-1-іл; 1,2,3-триазол-2-іл; 1,2,4-триазол-1-іл, ізоксазол-3-іл, оксазол5-іл, та 3-метил-1,2,4-оксадіазол-5-іл; або будь-які фармацевтично прийнятні солі цих сполук. За іншим аспектом цього винаходу пропонується фармацевтична композиція, яка містить сполуку Формули I або її фармацевтично прийнятну сіль, у комбінації з фармацевтично прийнятним носієм, розріджувачем або допоміжною речовиною. У одному з варіантів здійснення за цим аспектом винаходу згадана фармацевтична композиція також містить щонайменше один додатковий терапевтичний інгредієнт, наприклад, антидепресант з групи SSRI, наприклад, флуоксетин. На додаток до цього, цей аспект винаходу пропонує фармацевтичну композицію, призначену для лікування депресії, що містить сполуку Формули I або її фармацевтично прийнятну сіль, у комбінації з одним або декількома фармацевтично прийнятними допоміжними речовинами, носіями або розріджувачами. За іншим варіантом здійснення цього аспекту винаходу пропонується фармацевтична композиція, призначена для лікування надмірної ваги, ожиріння та/або підтримання ваги, що містить сполуку Формули I або її фармацевтично прийнятну сіль, у комбінації з одним або декількома фармацевтично прийнятними допоміжними речовинами, носіями або розріджувачами. Інший варіант здійснення пропонує фармацевтичну композицію, призначену для лікування мігрені, яка містить сполуку Формули I або її фармацевтично прийнятну сіль, у комбінації з одним або декількома фармацевтично прийнятними допоміжними речовинами, носіями або розріджувачами. Цей винахід також пропонує спосіб лікування депресії у ссавця, що включає введення ссавцю, який потребує такого лікування, ефективної кількості сполуки Формули I або її фармацевтично прийнятної солі. Іще один варіант здійснення пропонує спосіб лікування депресії у ссавця, який включає введення ссавцю, який потребує такого лікування, ефективної кількості сполуки Формули I або її фармацевтично прийнятної солі та ефективної кількості антидепресанту з групи SSRI або його фармацевтично прийнятної солі, наприклад, флуоксетину. Інші варіанти здійснення цього винаходу пропонують способи лікування надмірної ваги та/або ожиріння та/або спосіб підтримання ваги, які включають(-є) введення ссавцю, який потребує такого лікування, ефективної кількості сполуки Формули I або її фармацевтично прийнятної солі. У одному з конкретних варіантів здійснення за цими аспектами винаходу, згаданим ссавцем є людина. Цей винахід також пропонує сполуку Формули I або її фармацевтично прийнятну сіль для застосування у терапії. За цим аспектом цей винахід пропонує сполуку Формули I або її фармацевтично прийнятну сіль для застосування при лікуванні депресії у ссавців, зокрема, людей. Цей винахід також пропонує сполуку Формули I або її фармацевтично прийнятну сіль у комбінації з антидепресантом з групи SSRI або його фармацевтично прийнятною сіллю, наприклад, флуоксетином, для застосування при лікуванні депресії у ссавців, зокрема, людей. На додаток до цього, цей аспект винаходу включає будь-що з наведеного нижче: сполуку Формули I або її фармацевтично прийнятну сіль для застосування при лікуванні надмірної ваги; сполуку Формули I або її фармацевтично прийнятну сіль для застосування при лікуванні ожиріння; сполуку Формули I або її фармацевтично прийнятну сіль для застосування з метою підтримки ваги (для підтримки ваги), зокрема, після лікування з приводу надмірної ваги або ожиріння; сполуку Формули I або її фармацевтично прийнятну сіль для застосування при лікуванні мігрені. Інший аспект цього винаходу пропонує застосування сполуки Формули I або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування депресії. Інший приклад здійснення цього винаходу пропонує застосування сполуки Формули I або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування надмірної ваги, ожиріння та/або підтримання ваги. Ще інший приклад здійснення цього винаходу пропонує застосування сполуки Формули I або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування мігрені. Сполуки за цим винаходом є основами і, відповідно, реагують з рядом органічних та неорганічних кислот з одержанням фармацевтично прийнятних солей. Фармацевтично прийнятні солі кожної із сполук за цим винаходом передбачаються обсягом цієї заявки. Словосполучення "фармацевтично прийнятна сіль", у значенні, вживаному у цьому описі, означає будь-яку сіль сполуки Формули I, що є по суті нетоксичною для живих організмів. До 2 UA 107943 C2 5 10 15 20 25 30 35 40 45 50 55 60 числа таких солей належать солі, наведені у Journal of Pharmaceutical Science, 66, 2-19 (1977), які є відомими фахівцю. Скорочення, застосовані у цьому описі, визначені, як наведено нижче: "BSA" означає бичачий сироватковий альбумін. "mCPP" означає мета-хлорофенілпіперазин, неселективний агоніст серотонінового рецептору. "EDTA" означає етилендіамінтетраоцтову кислоту. "EGTA" означає етиленглікольтетраоцтову кислоту. "GTP" означає гуанозинтрифосфат. "HEPES" означає 4-(2-гідроксиетил)-1-піперазинетансульфонову кислоту. "HPLC" означає рідинну хроматографію високого тиску. "IC50" означає концентрацію, яка забезпечує досягнення 50 % максимального пригнічення. "LC/MS" означає рідинну хроматографію з подальшою мас-спектроскопією. "LC/MS/MS" означає рідинну хроматографію з подальшою мас-спектроскопією і наступною другою іонізаційною мас-спектроскопією. "mFST" означає тест примусового плавання на мишах; це тваринна модель антидепресантної активності. "MS" означає мас-спектроскопію. "MS (ES+)” означає мас-спектроскопію з іонізацією електророзпилюванням. "NMR" означає ядерний магнітний резонанс. "RO Tracer" означає 2-[(2-фторфеніл)метил]-3-(2-фтороспіро[4,5-дигідротієно[2,3-c]піран7,4'-піперидин]-1'-іл)-N, N-диметилпропанамід. "RO" означає ступінь зайнятості рецептору. "SCX column" означає колонку з сильною катіонобмінною смолою. "SNAr" означає нуклеофільне ароматичне заміщення. "SSRI" означає селективний інгібітор повторного поглинання серотоніну. "tBu" означає трет-бутилову складову. "TLC" означає тонкошарову хроматографію. "XRD" означає дифракцію рентгенівських променів (рентгенографію). Сполуками за цим винаходом, яким віддають перевагу, є сполуки де: 1 1) R - хлор; 2a 2b 2) кожен з R та R є фтором; 1 2a 2b 3) R - хлор та кожен з R та R є фтором; 1 2a 2b 4) R - фтор та кожен з R та R є воднем; 3 5) R - водень, метил, гідроксиметил, або метоксиметил; 3 6) R - метил; 3 7) R - гідроксиметил; 1 2a 2b 3 8) R - хлор, кожен з R та R є фтором, та R є метилом; 1 2a 2b 3 9) R - хлор, кожен з R та R є фтором, та R є гідроксиметил; 4 10) R - фтор, гідроксиметил, метоксиметил, або піразол-1-ілметил; 4 11) R - фтор; 4 12) R - гідроксиметил; 4 13) R - метоксиметил; 4 14) R - піразол-1-ілметил; 4 15) будь-яка зі сполук, яким віддається перевага з 1) по 9) де R - фтор; 4 16) будь-яка зі сполук, яким віддається перевага з 1) по 9) де R - гідроксиметил; 4 17) будь-яка зі сполук, яким віддається перевага з 1) по 9) де R - метоксиметил; 4 18) будь-яка зі сполук, яким віддається перевага з 1) по 9) де R - піразол-1-ілметил; Сполуками, яким віддається перевага, є [2-[4-[(2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-іл)метил]-3метилпіразол-1-іл]-3-піридил]метанол; 2-хлоро-4,4-дифторо-1'-[[3-метил-1-[3-(піразол-1-ілметил)-2-піридил]піразол-4іл]метил]спіро[5H-тієно[2,3-c]піран-7,4'-піперидин]; та [4-[(2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-іл)метил]-1-(3-фторо-2піридил)піразол-3-іл]метанол; або будь-яка фармацевтично прийнятна сіль цієї сполуки (тобто Приклад 1, Приклад 23, Приклад 53, Приклад 62 та Приклад 63). Сполукою за цим винаходом, якій віддається особлива перевага є [2-[4-[(2-хлоро-4,4дифторо-спіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-іл)метил]-3-метилпіразол-1-іл]-3піридил]метанол, або будь-яка фармацевтично прийнятна сіль цієї сполуки, як наприклад L 3 UA 107943 C2 5 10 15 20 тартрат та/або гідрохлорид, як наведено у Прикладі 1, у Прикладі 62 та у Прикладі 63. 2a 2b Сполукам, де кожен з R та R є фтором, віддають особливу перевагу, тому що згадані сполуки мають більш сприятливий фармакокінетичний профіль та є більш стабільними при окиснювальних реакціях метаболізму. Це має загальний вплив на поліпшення біодоступності згаданої сполуки при пероральному введенні. Загальна хімія Сполуки за цим винаходом можна одержати за наведеними нижче схемами синтезу за допомогою способів, добре відомих та застосовуваних у цій галузі. Відповідні реакційні умови для стадій цих схем є добре відомими у цій галузі, і відповідні заміни розчинників та кореагентів відомі фахівцю у цій галузі. Подібним же чином, фахівцям у цій галузі буде зрозуміло, що проміжні продукти синтезу можуть виділятись та/або очищатись різними добре відомими способами за мірою потреби або необхідності, і що часто буде виникати можливість застосування різних проміжних продуктів безпосередньо на подальших стадіях синтезу з незначним очищенням або зовсім без очищення. Крім цього, фахівцю буде зрозуміло, що, за деяких обставин, порядок, за яким вводяться складові, не є важливим. Конкретний порядок стадій, необхідних для одержання сполук Формули I, залежить від конкретної сполуки, що синтезується, вихідної сполуки та відносної лабільності заміщених складових, що добре розуміється досвідченим хіміком. Усі замісники, якщо не вказується інше, відповідають наведеним вище визначенням; усі реагенти є добре відомими та застосовуваними у цій галузі. Схема 1 R R 2a R 2b 1 O S R 3 Hal N N R 2a R N 2b N R R IV II 1 R 4' R O S R 3 N CHO III 3 N N N N N N N 4' R V 35 2b 1 R 30 R O S 25 2a R 4' I' За умов амінування, сполуку III включають до реакції з відповідно заміщеним піразолкарбальдегідом та відновником, наприклад, триацетоксиборогідридом натрію, у відповідному розчиннику, такому як тетрагідрофуран, при температурі навколишнього середовища, з одержанням сполуки II. За відповідних умов сполучення, сполуку II сполучають із сполукою IV, де Hal – хлор, бром або йод, з відповідним каталізатором, наприклад, йодидом міді, відповідною основою, наприклад, карбонатом калію, у розчиннику, такому як толуол, при 4 4 4 підвищеній температурі, з одержанням сполуки I', де R ' являє собою R або попередник R . Якщо Hal на згаданій сполуці IV є F або Cl, нуклеофільне ароматичне заміщення (SNAr) є альтернативним способом одержання сполуки I'. Конкретніше, сполука II може реагувати із сполукою IV у відповідному розчиннику, такому як диметилформамід, з відповідною основою, такою как карбонат калію, при підвищеній температурі, з одержанням сполуки I'. Сполука III також може реагувати з відповідно заміщеною альдегідною сполукою V за наведених вище 4 UA 107943 C2 4 4 умов гідроамінування, з одержанням необхідної сполуки I'. Якщо R ' є попередником R , його 4 перетворюють на R відомими способами. Схема 2 O F F Cl Cl N Pg N Pg N VII VI IIIa XIV O S N boc XV O S VIII OH O S Cl O S N Cl + O S O S Cl F O S N XIII N IIIb S O N Pg OH Br XI 15 20 25 30 35 F O S N Pg 5 10 O Br S XII O F Br O S F F F O S N Pg N Pg N X IX IIIc Сполуку IIIa, сполуку IIIb та сполуку IIIc можна одержати, як показано на Схемі 2. Сполука XIV та сполука XV реагують у відповідному розчиннику, такому як дихлорметан, у присутності відповідної кислоти, такої як трифтороцтова кислота. Одержаний трифторацетат підлуговують водним розчином гідроксиду натрію з одержанням сполуки XIII у формі вільної основи. Сполуку XIII у прийнятному розчинику, такому як метил-трет-бутиловому ефірі, обробляють розчином сульфурилхлориду у оцтовій кислоті при температурі навколишнього середовища, з одержанням сполуки VIII у вигляді солі хлористоводневої кислоти. Після цього сполуку VIII захищають групою захисту азоту за умов, добре відомих фахівцю, з одержанням сполуки VII (Наприклад, дивись: Greene and Wuts, Protective Groups in Organic Synthesis, Third Edition, Chapters 2 and 7, John Wiley and Sons Inc., (1999)). Як правило, згаданою захисною групою є Boc- (трет-бутилоксикарбоніл) група. Сполука VII реагує з N-бромосукцинімідом у відповідному розчиннику, такому як хлоробензол, з опромінюванням джерелом світла, з одержанням бромідної сполуки, яку потім обробляють основним розчином, таким як водний розчин бікарбонату натрію, з одержанням гідроксилвмісної сполуки. Згадана гідроксилвмісна сполука, з виділенням або без нього, може також окислюватись за відповідних умов окислення, наприклад, у броміді калію, тетраметилпіперидин-N-оксиді та водному розчині гіпохлориду натрію, з одержанням необхідної кетосполуки VI. Сполука VI після цього реагує з (біс(2метилетил)аміно)сульфотрифторидом у відповідному розчиннику, такому як тетрагідрофуран, при підвищеній температурі; для одержання сполуки IIIa у одержаного продукту відщеплюють захисну групу. Сполуку формули XIII захищають з одержанням сполуки XII способом, подібним до способу, що був застосованим для одержання сполуки VII. Сполуку XII у відповідному розчиннику, такому як тетрагідрофуран, при зниженій температурі обробляють відповідною основою, такою як літійтетраметилпіперидин, потім додають N-фторобензолсульфонімід, з одержанням фторидної сполуки, від якої відщеплюють захисну групу водним розчином HCl, і підлуговують водним розчином NaOH, з одержанням сполуки IIIb. За таким самим способом, що і спосіб, застосований для одержання наведеної вище сполуки VI, сполуку IX можна одержати із сполуки XII шляхом тристадійного синтезу, наприклад, бромінуванням, гідроксилуванням та окисленням. Кожний проміжний продукт синтезу може виділятись як чиста сполука для проведення додаткової реакції або реагування без виділення, як описано у процесі синтезу сполуки VI. Сполуку IX після цього обробляють відповідним реагентом обміну галоген-метал, таким як бутиллітій, у відповідному розчиннику, такому як тетрагідрофуран, при зниженій температурі, з подальшою обробкою фторуючим реагентом, 5 UA 107943 C2 таким як N-фторобензолсульфонімід, з одержанням необхідного фторованого продукту, від якого потім відповідним чином відщеплюють захисну групу з одержанням необхідної сполуки IIIc. Схема 3 5 10 15 20 25 Сполуки формули V можна одержати як показано на Схемі 3. Сполука XVI реагує із сполукою XVII з одержанням сполуки формули XV за умов ароматичного нуклеофільного заміщення (SNAr) або сполучення, опис яких було наведено вище для перетворення сполуки II на сполуку I'. Якщо Z являє собою складноефірну групу, її можна відновити до спирту спочатку за допомогою відповідного відновнику, такого як алюмогідрид літію, у відповідному розчиннику, такому як тетрагідрофуран. Спирт після цього окислюють до альдегіду за допомогою відповідного окиснювача, такого як оксид магнію (IV), у розчиннику, такому як дихлорметан. 4 4 4 4 Якщо R ' являє собою попередник R , перетворення R ' на R буде включати, але ними не обмежуватись, такі реакції, як амінування, з одержанням необхідного нового аміну; відновлення складного ефіру, кетону або альдегіду доспирту, який може потім перетворюватись на алкоксисполуку або карбамат; відновлення нітрилу до аміду або аміну; перетворення складного ефіру на гетероцикл, наприклад, оксадіазол, за відповідних умов (Приклади дивись у: Richard C. Larock, Comprehensive Organic Transformations, Second Edition, Chapters 2 and 7, John Wiley and Sons Inc., (1999)). Наведені нижче Препаративні методики та Приклади пояснюють способи, прийнятні для синтезу сполук за цим винаходом. Назви багатьох сполук, показаних у Препаративних методиках та Прикладах, надаються за структурами, які були одержані за допомогою "Symyx Draw 3.1" або "Autonom 2000 Name". Препаративна методика 1: 4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран] O S N H 30 35 40 3-тіофенетанол (123,03 мл, 1,11 моль) додають до розчину N-трет-бутоксикарбоніл-4піперидону (185 г, 928,48 ммоль) у дихлорметані (1300 мл), та перемішують при кімнатній температурі. Потім трифтороцтову кислоту (280,82 мл, 3,71 молі) додають краплями (5 хв) з охолодженням за допомогою льодяно/водяної бані (внутрішня тепература = 14-30 °C; попередження: виділяється CO2). Цю реакційну суміш повільно нагрівають до температури навколишнього середовища та перемішують при цій температурі протягом 20 год. Для одержання бежевої твердої кристалічної речовини розчинник при охолодженні випарюють у вакуумі. Тверду речовину суспендують у метил-трет-бутиловому простому ефірі (200 мл), відфільтровують, промивають метил-трет-бутиловим простим ефіром (21000 мл), та сушать під вакуумом для одержання 4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]-1-іуму трифтороацетату у вигляді білої твердої речовини з виходом 95 %. MS=(m/z): 210 (M+1). До перемішуваної суспензії 4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]-1-іуму трифтороацетату (285 г, 881,44 ммоль) у дихлорметані (1 л) додають 10 M гідроксиду натрію 6 UA 107943 C2 5 (220,36 мл, 2,20 моль) при охолодженні у льодо/водяняній бані, та одержувану суміш перемішують доти, доки не буде отримана двофазна суміш. Згадані фази розділяють, та водний шар екстрагують дихлорметаном (2200 мл). Об'єднані органічні речовини концентрують під вакуумом для одержання в'язкої олії, яку розтирали з водою до одержання ясно-жовтого осаду. Осад відфільтровують, промивають водою (300 мл) та гексаном (200 мл), та сушать під вакуумом при 35 °C протягом 20 год., одержуючи вказану в заголовку сполуку у вигляді ясножовтої твердої речовини з виходом 86 %. MS (m/z): 210 (M+1). Препаративна методика 2: трет-бутил-спіро[4,5-дигідротієно[2,3-c]піран-7,4'-піперидин]-1'карбоксилат 10 O S N O 15 20 O Спіро[4,5-дигідротієно[2,3-c]піран-7,4'-піперидин] (60 г, 286,6 ммоль) у 2метилтетрагідрофурані (600 мл) перемішують при 22 °C протягом 10 хв. Потім краплями додають трет-бутоксикарбоніл-трет-бутилкарбонат (65,6 г, 301 ммоль) у 2метилтетрагідрофурані (300 мл). 12 годин потому додають водний розчин хлориду натрію (250 мл), та відокремлюють органічний шар. Водний шар промивають двічі 2метилтетрагідрофураном (250 мл), об'єднані органічні шари промивають розсолом, сушать сульфатом натрію, відфільтровують, та концентрують під зниженим тиском до одержання вказаної в заголовку сполуки з виходом 99 %. MS (m/z): 310 (M+1). Препаративна методика 3: 2-фтороспіро[4,5-дигідротієно[2,2-c]піран-7,4’-піперидин] F O S N H 25 30 35 40 45 1. трет-бутил-2-фтороспіро[4,5-дигідротієно[2,3-c]піран-7,4'-піперидин]-1'-карбоксилат 2,2,6,6-тетраметилпіперидин (18,7 мл, 110,5 ммоль) додають у тетрагідрофуран (200 мл), та охолоджують розчин в атмосфері азоту при -78 °C. Додають 2,5 M розчину бутиллітію в гексані (37,2 мл, 93 ммоль), та перемішують суміш протягом 30 хв при -78 °C. До щойно одержаного розчину 2,2,6,6-тетраметилпіперидину літію додають розчин трет-бутил-спіро[4,5дигідротієно[2,3-c]піран-7,4'-піперидин]-1'-карбоксилату (20 г, 58,2 ммоль) у тетрагідрофурані (90 мл), підтримуючи температуру нижчою -70 °C. 20 хв потому за допомогою канюлі додають в атмосфері азоту заздалегідь охолоджений розчин N-фторобензолсульфоніміду (30,26 г, 93,07 ммоль) у тетрагідрофурані (200 мл) при -20 °C. Після 1 год. перемішування додають воду (20 мл) та водний розчин хлориду амонію (50 мл). Потім відокремлюють органічний шар, та двічі промивають водний шар метил-трет-бутиловим простим ефіром (225 мл). Органічні речовини об'єднують, та випарюють розчинник під зниженим тиском. Неочищену речовину очищують РХВЕ з нормальною фазою, застосовуючи гексан/метил-трет-бутиловий простий ефір як розчинники, до одержання трет-бутил-2-фтороспіро[4,5-дигідротієно[2,3-c]піран-7,4'-піперидин]1'-карбоксилату з виходом 50 %. MS (m/z): 328 (M+1). 2. 2-фтороспіро[4,5-дигідротієно[2,2-c]піран-7,4’-піперидин]37 % Хлористоводневу кислоту (11,75 мл, 125,22 ммоль) додають до розчину трет-бутил-2’фторо-4",5’-дигідро-1H-спіро[піперидин-4,7’-тієно[2,3-c]піран]-1-карбоксилату (8,2 г, 25,04 ммоль) у ізопропіловому спирті (57,4 мл) при 45 °C. Одержаний розчин перемішують при 45 °C протягом 6,5 год. Розчинник випарюють до утворення жовтої суспензії. Додають воду (50 мл), та підлуговують суміш 5н водним розчином гідроксиду натрію. Водну фазу екстрагують етилацетатом (3100 мл), та об'єднані органічні екстракти промивають розсолом (50 мл), 7 UA 107943 C2 сушать сульфатом натрію, відфільтровують, та концентрують під зниженим тиском до одержання вказаної в заголовку сполуки з виходом 96 %. MS (m/z): 228 (M+1). Препаративна методика 4: 2'-хлоро-4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]у гідрохлорид 5 Cl O S N H HCl 10 15 20 25 Розчин 4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]у (50 г, 238,88 ммоль) в суміші оцтової кислоти (400 мл) та метил-трет-бутилового простого ефіру (40 мл) охолоджують до 15 °C. Потім розчин сульфурилхлориду (21,20 мл, 262,77 ммоль) в оцтовій кислоті (100 мл) додають краплями протягом 40 хв при цій температурі (внутрішня тепература становить 1522 °C), та перемішують суміш при кімнатній температурі протягом 20 год. Потім розчин сульфурилхлориду (11,56 мл, 143,33 ммоль) в оцтовій кислоті (50 мл) додають краплями при кімнатній температурі. Цю реакційну суміш перемішують при кімнатній температурі протягом 30 хв, та потім при перемішуванні її додають краплями (30 хв) до метил-трет-бутилового простого ефіру (1 л), охолоджуючи одержану суміш на льодо/водяній бані. Утворюється біла суспензія, та тверду речовину відфільтровують. Для одержання другої порції речовини згаданий фільтрат концентрують (за допомогою роторного випарювача з поповненням метил-трет-бутилового простого ефіру). Одержану тверду речовину суспендують у метил-трет-бутиловому простому ефірі (300 мл), суспензію перемішують при кип'ятінні зі зворотним холодильником (баня: 100 °C), та додають метанол (30 мл) доти, доки не утвориться непрозора суспензія. Потім згадану суспензію охолоджують до кімнатної температури протягом ночі. Цю суспензію додатково охолоджують у льодо/водяній бані, та відфільтровують. Тверду речовину промивають метил-трет-бутиловим простим ефіром (50 мл), та об'єднують з першою порцією для одержання вказаної в заголовку сполуки з виходом 60 %. MS (m/z): 244 (M+1). Препаративна методика 5: 2'-хлоро-4',4'-дифторо-4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3c]піран] F F Cl O S N H 30 35 40 45 1. трет-бутил-2-хлороспіро[4,5-дигідротієно[2,3-c]піран-7,4’-піперидин]-1’-карбоксилат До суспензії гідрохлоридної солі 2-хлороспіро[4,5-дигідротієно[2,2-c]піран-7,4’-піперидин]у (140 г, 0,49 молі) у дихлорметані (1,12 л) порціями додають триетиламін (67,25 мл, 1,05 моля), N, N-диметил-4-піридинамін (3,05 г, 0,025 моля) та ді-трет-бутилдикарбонат (111,22 г, 0,509 моля), та одержувану суміш перемішують при кімнатній температурі протягом ночі. Реакційну суміш промивають 1н HCl (2) та водою. Органічну фазу сушать сульфатом магнію, відфільтровують, та концентрують під зниженим тиском для одержання трет-бутил-2хлороспіро[4,5-дигідротієно[2,3-c]піран-7,4’-піперидин]-1’-карбоксилат з виходом 53 %. MS (m/z): 244 (M+1-Boc). 2. трет-бутил-4'-оксо-2'-хлоро-4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]-1карбоксилат У 5 л реактор з рубашкою N-бромсукцинімід (115,02 г, 639,77 ммоль) додають до розчину трет-бутил-2-хлороспіро[4,5-дигідротієно[2,3-c]піран-7,4’-піперидин]-1’-карбоксилату (200 г, 581,61 ммоль) у хлоробензолі (1,60 л) при кімнатній температурі. Одержувану суспензію освітлюють 3100 Вт лампами, розташованими мало не в контакті з зовнішньою стінкою реактора, і температура реактора складає 45 °C. 4 год. потому додають N-бромсукцинімід 8 UA 107943 C2 5 10 15 20 25 30 35 40 45 50 55 (26,14 г, 145,40 ммоль), та зберігають температуру 40 °C протягом 15 год. Реакційну суміш охолоджують до 0 °C, та додають метил-трет-бутиловий простий ефір (500 мл). Тверду речовину відфільтровують, та розчин концентрують до приблизно 1000 мл розчину у хлоробензолі. Потім додають метил-трет-бутиловий простий ефір (1000 мл), тверді речовини відфільтровують, та фільтрат концентрують для одержання 600 мл хлоробензолового розчину. Додають диметилсульфоксид (806,47 мл, 11,35 моль) та бікарбонат натрію (95,38 г, 1,14 моль) при кімнатній температурі. Після перемішування протягом 24 год. при кімнатній температурі додають воду/льод (1000 мл), та розділяють фази. Органічну фазу промивають водою (21 л), та концентрують для одержання розчину у хлоробензолі. Потім додають дихлорметан (1,2 л), та охолоджують цю суміш до 5 °C (льодо/водяна баня). Додають бромід калію (20,27 г, 170,31 ммоль) та 2,2,6,6-тетраметилпіперидин-N-оксид (4,43 г, 28,38 ммоль). Потім 6 % розчин у воді гіпохлориту натрію (644,40 мл, 567,68 ммоль), доведений до pH=9 додаванням бікарбонату(-ів) натрію, додають до згаданої реакційної суміші при 5 °C, та одержувану суміш перемішують 1 год., дозволяючи нагрітися від 5 °C до кімнатної температури. Додають воду (1 л), та розділяють фази. Органічну фазу промивають водою (20,5 л), та охолоджують на льодо/водяній бані. Потім бромід калію (2,03 г, 17,03 ммоль), 2,2,6,6-тетраметилпіперидин-Nоксид (0,05 г, 0,32 ммоля) та 6 % розчин гіпохлориту натрію у воді (128,88 мл, 113,54 ммоль), доведений до pH=9 твердим бікарбонатом натрію, додають до згаданої реакційної суміші при 5 °C, та одержувану суміш перемішують 1 год., дозволяючи нагрітися від 5 °C до кімнатної температури. Потім додають воду (1 л), та розділяють фази. Органічну фазу промивають водою (21 л), сушать, та концентрують для одержання темно-брунатної твердої речовини. Тверду речовину розтирають у гексані (500 мл), метил-трет-бутиловому простому ефірі/гексані 5 % (250 мл) та метил-трет-бутиловому простому ефірі/гексані 10 % (250 мл) для одержання трет-бутил-4'-оксо-2'-хлоро-4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]-1карбоксилату у вигляді a ясно-брунатної твердої речовини з виходом 66 %. MS (m/z): 258 (M+1 (Boc)). 3. трет-бутил-2'-хлоро-4',4'-дифторо-4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]-1карбоксилат У 500 мл мірну колбу PFA з гвинтовою кришкою загружают тетрагідрофуран (81 мл), додають (біс(2-метоксиетил)аміно)сульфотрифторид (183,62 г, 829,94 ммоль) та трет-бутил 4'оксо-2'-хлоро-4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]-1-карбоксилат (135 г, 377,24 ммоль). Одержувану суспензію перемішують при 70 °C протягом 24 год. Потім її охолоджують до кімнатної температури, та повільно виливають у суміш льоду та насиченого водного розчину бікарбонату натрію (4 л) при перемішуванні (газовиділення). Метил-трет-бутиловий простий ефір застостосовують для переносу залишкового матеріалу з колб. Після завершення газовиділення, для досягнення pH 8 при перемішуванні додають твердий бікарбонат натрію. Одержувану суміш екстрагують метил-трет-бутиловим простим ефіром (3500 мл) до тих пір, поки вона буде виявлятися хроматографією у тонкому шарі у водній фазі. Об'єднані органічні речовини промивають водою (3500 мл) та розсолом (500 мл), сушать сульфатом натрію, та концентрують для одержання темної в'язкої олії (250 г). Неочищену речовину розчиняють у дихлорметані, та відфільтровують через шар силікагелю елююванням з сумішшю метил-третбутиловий простий ефір/гексан 10 % (6 л) та метил-трет-бутиловий простий ефір/гексан (4 л). Фракції збирають доти, доки продукт виявляється TLC (елюєнт 20 % метил-трет-бутилового простого ефіру/гексан UV, Rf=0,5). Фільтрат концентрують для одержання ясно-брунатної твердої речовини, яку сушать під вакуумом при 40 °C, до досягнення постійної ваги для одержання 70 % виходу трет-бутил-2'-хлоро-4',4'-дифторо-4',5'-дигідроспіро[піперидин-4,7'тієно[2,3-c]піран]-1-карбоксилату. MS (m/z): 324 (M+1 tBu). 4. 2'-хлоро-4',4'-дифторо-4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран] 37 % хлористоводневу кислоту (74,12 мл, 789,78 ммоль) додають до розчину трет-бутил-2'хлоро-4',4'-дифторо-4',5'-дигідроспіро[піперидин-4,7'-тієно[2,3-c]піран]-1-карбоксилату (60 г, 157,96 ммоль) в ізопропіловому спирті (420 мл) при 45 °C. Одержаний розчин перемішують при 45 °C протягом 15 год. Потім суміш концентрують до 1/4 об'єму для одержання білої суспензії. Додають воду (100 мл), та суспензію підлуговують 6н водним розчином гідроксиду натрію до одержання двошарової суміші, яку екстрагують метил-трет-бутиловим простим ефіром (3100 мл). Об'єднані органічні речовини промивають розсолом (50 мл), сушать сульфатом натрію, та концентрують для одержання ясно-брунатної твердої речовини, яку сушать під вакуумом доти, доки не досягнуть постійної ваги, з виходом 97 % згаданої в заголовку сполуки. MS (m/z): 280 (M+1). Препаративна методика 6: 2,4,4-трифтороспіро[5H-тієно[2,3-c]піран-7,4'-піперидин] 60 9 UA 107943 C2 F F F O S N H 5 10 15 20 25 30 35 40 45 50 1. трет-бутил-2-бромо-4-гідрокси-спіро[4,5-дигідротієно[2,3-c]піран-7,4'-піперидин]-1'карбоксилат N-бромсукцинімід (2,2 екв.) додають до розчину трет-бутил-спіро[4,5-дигідротієно[2,3c]піран-7,4'-піперидин]-1'-карбоксилату (13,5 г) у хлоробензолі (108 мл). Одержувану суспензію освітлюють 260 Вт лампочкою протягом ночі. Ще додають до суміші N-бромсукцинімід (1,7 г), та згадану суміш опромінюють 260 Вт лампочкою протягом 3 год. Розчинник видаляють під зниженим тиском, одержуючи залишок, який розчиняють в ацетоні (650 мл), та додають розчин нітрату срібла (8,8 г) у воді (650 мл). Суміш перемішують при кімнатній температурі у темряві протягом ночі. Суміш відфільтровують, та ацетон випарюють. Додають етилацетат, та органічний шар промивають насиченим водним розчином бікарбонату натрію та розсолом. Органічний шар сушать сульфатом натрію, відфільтровують, та випарюють розчинник під зниженим тиском. Залишок очищують хроматографією за методикою Isco на нормальній фазі (елюєнт: гексан/етилацетат 15-60 %) для одержання трет-бутил-2-бромо-4-гідрокси-спіро[4,5дигідротієно[2,3-c]піран-7,4'-піперидин]-1'-карбоксилату з виходом 38 %. MS (m/z): 426/428 (M+23/M+2+23) 2. трет-бутил-2'-бромо-4'-оксо-спіро[піперидин-4,7'-тієно[2,3-c]піран]-1-карбоксилат Бромід калію (535,67 мг, 4,50 ммоль) додають до розчину трет-бутил-2-бромо-4-гідроксиспіро[4,5-дигідротієно[2,3-c]піран-7,4'-циклогексан]-1'-карбоксилату (7,28 г) та 2,2,6,6тетраметилпіперидин-N-оксид (281,33 мг, 1,80 ммоль) у дихлорметані (70 мл) при 0 °C. В іншій посудині бікарбонат натрію додають до 10 % розчину гіпохлориту натрію у воді (22,34 мл, 36,01 ммоль) до досягнення pH 9. Цей розчин гіпохлориту натрію-бікарбонату натрію додають краплями при 0 °C, та одержувану темну суспензію перемішують при 0 °C протягом 15 хв. Додають дихлорметан (20 мл) та воду (20 мл), та розділяють фази. Органічну фазу промивають водою (20 мл), та сушать сульфатом натрію. Розчинник видаляють під зниженим тиском для одержання трет-бутил-2'-бромо-4'-оксо-спіро[піперидин-4,7'-тієно[2,3-c]піран]-1-карбоксилату з виходом 99 %. MS (m/z): 346/348 (M+1 tBu/M+3-tBu) 3. трет-бутил-2-бромо-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-карбоксилат У 100 мл мірну колбу PFA з гвинтовою кришкою до безводного тетрагідрофурану (3,5 мл) додають (біс(2-метоксиетил)аміно)сульфотрифторид (5,16 мл, 27,96 ммоль). Потім додають трет-бутил-2'-бромо-4'-оксо-спіро[піперидин-4,7'-тієно[2,3-c]піран]-1-карбоксилат (4,5 г, 11,19 ммоль). Розчин перемішують при 70 °C протягом ночі. Після цього додають метил-третбутиловий простий ефір (30 мл), та згадану реакційну суміш обережно виливають у бікарбонат натрію (насичений водний розчин), охолоджений у льодяній бані. Спостерігають виділення CO 2, та додають бікарбонат натрію (насичений водний розчин) до pH 8. Суміш екстрагують метилтрет-бутиловим простим ефіром. Органічний шар декантують, промивають розсолом (2), сушать сульфатом магнію, та випарюють розчинник під зниженим тиском. Неочищену речовину очищують хроматографією за методикою Isco на нормальній фазі, елююючи сумішшю метилтрет-бутиловий простий ефір/гексан, для одержання 3,2 г трет-бутил-2-бромо-4,4-дифтороспіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-карбоксилату. MS (m/z): 368/370 (M+1-tBu/M+3-tBu). 4. трет-бутил-2,4,4-трифтороспіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-карбоксилат 2,5 M бутиллітію в гексані (47 мл) додають до розчину трет-бутил-2-бромо-4,4-дифтороспіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-карбоксилату (1,99 г, 4,69 ммоль) у тетрагідрофурані (50 мл) в атмосфері азоту та при -78 °C. Цю суміш перемішують при -78 °C протягом 1 год., та додають тверду речовину N-фторо-бензолсульфонімід (3,69 г, 11,73 ммоль). Суміші дозволяють нагрітися до кімнатної температури, та перемішують при кімнатній температурі протягом ночі. Додають насичений водний розчин хлориду амонію, та органічну фазу екстрагують етилацетатом, сушать сульфатом натрію, та видаляють розчинник під зниженим тиском. Неочищений матеріал очищують хроматографією за методикою Isco на нормальній фазі (гексан/етилацетат 3-12 %) для одержання 1,3 г трет-бутил-2,4,4-трифтороспіро[5H-тієно[2,3c]піран-7,4'-піперидин]-1'-карбоксилату, який додатково очищують за допомогою РХВЕ для одержання 0,818 г цієї сполуки. MS (m/z): 308 (M+1-tBu). 5. 2,4,4-трифтороспіро[5H-тієно[2,3-c]піран-7,4'-піперидин] 10 UA 107943 C2 5 трет-бутил-2,4,4-трифтороспіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-карбоксилат (2,00 г, 5,50 ммоль) розчиняють у хлористоводневій кислоті (4н розчин у діоксані) (10 мл, 40 ммоль). Суміш перемішують при кімнатній температурі протягом 1год, та потім пропускають через картридж з 50 г SCX (тверда катіонобмінна смола), одержуючи 1,3 г вказаної в заголовку сполуки после випарювання фракції 2н розчину аміаку у метанолі. MS (m/z): 264 (M+1). Препаративна методика 7: 2-хлоро-4,4-дифторо-1'-[(3-метил-1H-піразол-4-іл)метил]спіро[5Hтієно[2,3-c]піран-7,4'-піперидин] F F Cl O S N N N 10 15 20 До розчину 2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'-піперидину (105 г, 375 ммоль) у тетрагідрофурані (1,58 л) додають 3-метил-1H-піразол-4-карбальдегід (43,40 г, 394,12 ммоль), та перемішують суміш при кімнатній температурі протягом 1 год. Потім додають порошкоподібний триацетоксиборогідрид натрію (95,46 г, 450,42 ммоль) 3 порціями. Суміш перемішують при кімнатній температурі протягом 15 год. Потім реакційну суміш виливають у холодний як льод, насичений водний розчин бікарбоната натрію (400 мл). Фази розділяють. Водну фазу екстрагують етилацетатом (100 мл). Об'єднані органічні шари промивають 50 % розсолом, і тверда речовина осаджується в органічній фазі. Органічну фазу концентрують до одержання 170 г згаданої в заголовку сполуки. MS (m/z): 374 (M+1). Сполуки за Препаративними методиками 8-11 виготовляють по суті так, як описано у Препаративній методиці 7, із застосуванням 1,2-дихлоретана як розчинника. Препар. метод. № Вихід(%) 322 (M+1) 99 Структура Фізичні дані: MS (m/z) 93 Хімічна назва 338 (M+1) F 8 O S 2-фторо-1'-[(3-метил-1Hпіразол-4-іл)метил]спіро[4,5дигідротієно[2,3-c]піран-7,4'піперидин] N N N Cl 9 O S 2-хлоро-1'-[(3-метил-1Hпіразол-4-іл)метил]спіро[4,5дигідротієно[2,3-c]піран-7,4'піперидин] N N N 11 UA 107943 C2 Препар. метод. № Вихід(%) F 358 (M+1) 99 Структура Фізичні дані: MS (m/z) 99 Хімічна назва 324 (M+1) F F 10 O S 2,4,4-трифторо-1'-[(3-метил-1Hпіразол-4-іл)метил]спіро[5Hтієно[2,3-c]піран-7,4'-піперидин] N N N Cl 11 O S 2-хлоро-1'-(1H-піразол-4ілметил)спіро[4,5дигідротієно[2,3-c]піран-7,4'піперидин] N N N Препаративна методика 12: 2-[4-[(2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'піперидин]-1'-іл)метил]-3-метилпіразол-1-іл]піридин-3-карбальдегід F F Cl O S N N N N O H 5 10 15 20 У 250 мл колбу вміщують йодид міді(I) (1,91 г, 10,03 ммоль), 2-хлоро-4,4-дифторо-1'-[(3метил-1H-піразол-4-іл)метил]спіро[5H-тієно[2,3-c]піран-7,4'-піперидин] (25 г, 66,87 ммоль), карбонат калію (19,60 г, 140,43 ммоль), толуол (50 мл) та якір магнітної мішалки. Реакційну суміш дегазують за допомогою 5 циклів вакуумування/відновлення тиску. Потім додають 2бромо-3-формілпіридин (18,66 г, 100,31 ммоль) та транс-N, N’-диметилциклогексан-1,2-диамін (3,16 мл, 20,06 ммоль). Реакційну масу перемішують при кімнатній температурі протягом 5 хв. Потім її занурюють у заздалегідь нагріту масляну баню при 115 °C, та перемішують протягом 15 год. при цій температурі. Реакційну суміш охолоджують до кімнатної температури, розбавляють 300 мл етилацетату та відфільтровують через целіт. Потім промивають етилацетатом (100 мл) та водним розчином гідроксиду амонію (3 %) (4100 мл) для видалення слідів міді, потім промивають водою (50 мл) та розсолом (50 мл). Розчин сушать сульфатом натрію. Розчинник випарюють у вакуумі до одержання жовто-брунатної твердої речовини. Тверду речовину пропускають через шар силікагелю із застосуванням як елюєнта суміші 2пропанол/дихлорметан (3-5 % 2-пропанолу), одержуючи вказану в заголовку сполуку з виходом 69 %. MS (m/z): 479 (M+1). Препаративна методика 13: 2-[4-[(2-фтороспіро[4,5-дигідротієно[2,3-c]піран-7,4'-піперидин]1'-іл)метил]-3-метилпіразол-1-іл]піридин-3-карбальдегід 12 UA 107943 C2 F O S N N N N O H 5 Сполука за Препаративною методикою 13 виготовлена по суті так, як сполука, описана у Препаративній методиці 12, із застосуванням 2-бромопіридин-3-карбальдегіду та 2-фторо-1'-[(3метил-1H-піразол-4-іл)метил]спіро[4,5-дигідротієно[2,3-c]піран-7,4'-піперидин]у. Залишок очищують хроматографією за методикою Isco на нормальній фазі з виходом 83 % згаданої в заголовку сполуки. MS (m/z): 427 (M+1). Препаративна методика 14: N-[(2-хлоро-3-піридил)метил]ацетамід O Cl N N 10 15 До розчину (2-хлоро-3-піридил)метанаміну (300 мг, 2,10 ммоль) у дихлорметані (2 мл) при кімнатній температурі додають оцтовий ангідрид (198,88 мкл, 2,10 ммоль) та триетиламін (293,26 мкл, 2,10 ммоль). Через 1 год. реакцію припиняють насиченим водним розчином бікарбонату натрію, та екстрагують розчин дихлорметаном. Органічний шар відділяють, сушать сульфатом магнію, та випарюють розчинник у вакуумі для одержання 184 мг N-[(2-хлоро-3піридил)метил]ацетаміду. MS (m/z): 185 (M+1) Препаративна методика 15: (2-бромо-3-піридил)метилметансульфонат O O S O Br N 20 25 30 35 1. (2-бромо-3-піридил)метанол У 2 л круглодонну колбу (споряджену мішалкою, в атмосфері азоту та при 0 °C) вміщують 2бромо-3-піридин-карбоксальдегід (22,15 г, 119,08 ммоль) та метанол (200 мл), додають борогідрид натрію (1,35 г, 35,72 ммоль) трьома порціями. Через 1 год. при 0 °C додають воду (200 мл), та реакційну масу концентрують під зниженим тиском для видалення метанолу. Одержаний залишок розчиняють у етилацетаті, та промивають водою (200 мл). Органічний екстракт промивають розсолом, сушать сульфатом магнію, відфільтровують, та концентрують для одержання 22 г (2-бромо-3-піридил)метанолу у вигляді білої твердої речовини. MS (m/z): 188 (M+1), 190 (M+3). 2. (2-бромо-3-піридил)метилметансульфонат У круглодонну колбу, яка вміщує розчин (2-бромопіридин-3-іл)метанолу (8 г, 42,55 ммоль) у дихлорметані (212 мл) при 0 °C, додають триетиламін (8,90 мл), потім додають метансульфонілхлорид (3,95 мл), та перемішують суміш при цій температурі протягом 1,5 год. Після цього суміш промивають водою, органічний шар декантують, сушать сульфатом магнію, та випарюють розчинник під зниженим тиском з виходом 10,4 г вказаної в заголовку сполуки, яку використовують без додаткового очищення. MS (m/z): 266, 268 (M+1; M+3). Препаративна методика 16: 2-(2-бромо-3-піридил)пропан-2-ол 13 UA 107943 C2 Br O N 5 10 Діізопропіламід літію (2M, 12,5 мл, 25 ммоль) розчиняють у тетрагідрофурані (40 мл), та охолоджують до -78 °C. 2-бромопіридин (3,9 г, 25 ммоль) додають краплями, та перемішують рекційну масу протягом 3 год. до додавання ацетону (1 мл, висушений над тільки що активованими молекулярними ситами), та дозволяють нагрітися до кімнатної температури. Реакційну масу гасять насиченим хлоридом амонію, та екстрагують етилацетатом. Органічний шар сушать сульфатом магнію, та випаровують. Залишок очищують флеш хроматографією на сілікагелевій колонці, елююючи сумішшю 20 % гексан/трет-бутил метиловий простий ефір до 1 6 одержання вказаної в заголовку сполуки (1,4 г, 26 %). H-ЯМР (d -диметилсульфоксид): 8,23 (dd, J=1,9 Гц, 4,5 Гц, 1H), 8,19 (dd, J=2,0 Гц, 7,8 Гц, 1H), 7,44 (dd, J=4,5 Гц, 7,7 Гц, 1H), 5,43 (s, 1H), 2,12 (s, 1H), 1,46 (s, 6H). Препаративна методика 17: етил-3-метил-1H-піразол-4-карбоксилат O 15 20 O N N Сірчану кислоту (18 мл, 337,69 ммоль) додають до суспензії 3-метил-1H-піразол-4карбонової кислоти (10 г, 79,29 ммоль) в етанолі (90 мл), та перемішують суміш при 85 °C протягом 20 год. Після цього розчинник частково видаляють. Залишок підлуговують 1M розчином гідроксиду натрію до pH 6-7, та екстрагують дихлорметаном. Органічний шар декантують, сушать сульфатом магнію, та випарюють розчинник під зниженим тиском з виходом 10,3 г вказаної в заголовку сполуки, яку використовують без додаткової очистки. MS (m/z): 155 (M+1). Препаративна методика 18: метил-2-фторопіридин-3-карбоксилат 25 F O N 30 35 O 2 M розчин діізопропіламіду літію (11,3 мл, 22,5 ммоль) повільно додають до розчину 2фторопіридину (2 г, 20,5 ммоль) у тетрагідрофурані (90 мл) в атмосфері азоту при -78 °C. 4 години потому при цій температурі додають метилхлороформіат (1,9 мл, 24,6 ммоль), суміш потім перемішують протягом 1 години при -78 °C, та дозволяють суміші досягти кімнатної температури протягом ночі. Реакційну суміш повільно виливають у воду, та екстрагують у диетиловий ефір. Органічний шар промивають розсолом, сушать сульфатом натрію, та випарюють розчинник у вакуумі. Залишок очищують хроматографією за методикою Isco на нормальній фазі, елююючи сумішшю гексан/диетиловий ефір (9/1) до одержання 495,2 мг згаданої в заголовку сполуки. MS (m/z): 156 (M+1). Препаративна методика 19: 1-(3-фторо-2-піридил)-3-метилпіразол-4-карбальдегід O N N F N 40 трет-бутилат калію (29,25 г, 260,68 ммоль) додають до розчину 3-метил-1H-піразол-4карбальдегіду (26,00 г, 236,12 ммоль) у диметилформаміді (250 мл), та охолоджують на водяній 14 UA 107943 C2 5 10 бані. Суміш перемішують при кімнатній температурі протягом 10 хв. Потім додають 2,3дифторопіридин (25 г, 217,24 ммоль), та перемішують суміш при кімнатній температурі протягом 20 год. Суміш виливають у льодо/водяну суміш, та екстрагують в етилацетат (320 мл). Органічні речовини сушать сульфатом магнію, та випарюють розчинник у вакуумі. Залишок очищують за допомогою хроматографії на силікагелі, застосовуючи як елюєнт гексан/ізопропіловий спирт, для одержання неочищеної речовини із залишками диметилформаміду. Матеріал потім розчиняють в етилацетаті (100 мл), та промивають водою (320 мл). Водну фазу екстрагують етилацетатом (220 мл). Об'єднані органічні шари сушать сульфатом натрію, та концентрують до одержання 19 г згаданої в заголовку сполуки. MS (m/z): 206 (M+1). Препаративна методика 20: 2-(4-форміл-3-метилпіразол-1-іл)піридин-3-карбонітрил O N N N N 15 Сполука за Препаративною методикою 20 виготовлена по суті так, як сполука, описана у Препаративній методиці 19, із застосуванням 3-метил-1H-піразол-4-карбальдегіду та 2фторопіридин-3-карбонітрилу. Вказану в заголовку сполуку одержують з виходом 23 %. MS (m/z): 213 (M+1). Препаративна методика 21: метил-2-(4-форміл-3-метилпіразол-1-іл)піридин-3-карбоксилат 20 O N N O N 25 30 O Суміш 3-метил-1H-піразол-4-карбальдегіду (300 мг, 2,72 ммоль), карбонату калію (565 мг, 4,08 ммоль), метил-2-фторопіридин-3-карбоксилату (507 мг, 3,27 ммоль) та диметилформаміду (2 мл), перемішують при 60 °C протягом 16 год. Додають воду, та екстрагують згадану сполуку в етилацетат. Органічний шар промивають розсолом, сушать сульфатом натрію, та випарюють розчинник. Неочищену суміш очищують хроматографією за методикою Isco на нормальній фазі, застосовуючи суміш гексан:етилацетат, 2:1 як елюєнт, з одержанням 422 мг згаданої в заголовку сполуки. MS (m/z): 246 (M+1). Сполуки за Препаративними методиками 22-23 можуть бути виготовлені по суті так, як сполука, описана у Препаративній методиці 21, із застосуванням відповідного 2хлоропіридилового реагента. Препар. метод.№ Хімічна назва Структура Вихід (%) Фізичні дані: MS (m/z) 56 259 (M+1) O 22 N N-[[2-(4-форміл-3-метилпіразол1-іл)-3-піридил]метил]ацетамід N N 15 O N UA 107943 C2 Препар. метод.№ Хімічна назва Структура Вихід (%) Фізичні дані: MS (m/z) 52 260 (M+1) O O 23 етил1-(3-форміл-2-піридил)-3метилпіразол-4-карбоксилат N N O N Препаративна карбальдегід методика 24: 1-[3-(диметиламінометил)-2-піридил]-3-метилпіразол-4 O N N N N 5 10 15 20 25 30 1. етил-1-[3-(диметиламінометил)-2-піридил]-3-метилпіразол-4-карбоксилат Ця сполука виготовлена по суті так, як сполука, описана у Препаративній методиці 7, із застосуванням етил-1-(3-форміл-2-піридил)-3-метилпіразол-4-карбоксилату та диметиламіну з виходом 95 %, та використовується після обробки без додаткового очищування. MS (m/z): 289 (M+1) 2. [1-[3-(диметиламінометил)-2-піридил]-3-метилпіразол-4-іл]метанол До розчину етил-1-[3-(диметиламінометил)-2-піридил]-3-метилпіразол-4-карбоксилату (217,7 г, 0,75 ммоль) у тетрагідрофурані (5 мл), охолодженого до 0 °C, та в атмосфері азоту додають 1 M розчин алюмогідриду літію у тетрагідрофурані (0,9 мл, 0,9 ммоль), та перемішують суміш при цій температурі протягом 5 хвилин. Реакційну масу гасять насиченим водним розчином хлориду амонію, та неочищену речовину екстрагують етилацетатом. Відокремлюють органічний шар, сушать сульфатом натрію, та випарюють розчинник у вакуумі. В цьому конкретному прикладі сполуку не виділяли в органічний екстракт, та на завершення відділяли від водного розчину за допомогою картриджа з SCX для одержання 146 мг (78 %) [1-[3-(диметиламінометил)-2піридил]-3-метилпіразол-4-іл]метанолу, який використовують без додаткової очистки. MS (m/z): 247 (M+1). 3. 1-[3-(диметиламінометил)-2-піридил]-3-метилпіразол-4-карбальдегід 3,3,3-триацетокси-3-йодофталід (0,553 г, 1,3 ммоль) додають до розчину [1-[3(диметиламінометил)-2-піридил]-3-метилпіразол-4-іл]метанолу (0,146 г, 0,59 ммоль) у дихлорметані (4 мл) при кімнатній температурі. Через одну годину реакційну масу гасять добавлянням 2н розчину карбонату натрію, та екстрагують сполуку у дихлорметан. Відокремлюють органічний шар, сушать сульфатом магнію, та випарюють розчинник у вакуумі для одержання 126 мг 1-[3-(диметиламінометил)-2-піридил]-3-метилпіразол-4-карбальдегіду, який використовують без додаткової очистки. MS (m/z): 245 (M+1). Препаративна методика 25: 1-(3-фторо-2-піридил)-3-(ізопропоксиметил)піразол-4карбальдегід O O N N N F 35 16 UA 107943 C2 5 10 15 20 25 30 35 1. етил-3-(бромометил)-1-(3-фторо-2-піридил)піразол-4-карбоксилат До розчину етил-1-(3-фторо-2-піридил)-3-метилпіразол-4-карбоксилату (10,2 г, 40,9 ммоль) у хлоробензолі (205 мл), додають N-бромсукцинімід (8 г) при кімнатній температурі. Цю реакційну суміш перемішують, та опромінюють під лампами 100 Вт при кімнатній температурі протягом ночі. Потім ще додають N-бромсукцинімід (2 г), та 2 години потому вихідний матеріал не виявляється. Тверді речовини відфільтровують, та випарюють розчинник. Неочищену речовину очищують хроматографією за методикою Isco на нормальній фазі, застосовуючи як елюєнт дихлорметан та метанол, до одержання 5,3 г етил-3-(бромометил)-1-(3-фторо-2піридил)піразол-4-карбоксилату. MS (m/z): 328; 330 (M+1; M+3). 2. ізопропіл-1-(3-фторо-2-піридил)-3-(ізопропоксиметил)піразол-4-карбоксилат До розчину етил-3-(бромометил)-1-(3-фторо-2-піридил)піразол-4-карбоксилату (1,5 г, 4,57 ммоль) у пропан-2-олі (23 мл), додають ізопропоксид літію (3,02 г) та перемішують суміш протягом ночі при кімнатній температурі. Після цього ще додають ізопропоксид літію (4,5 г) трьома порціями кожна по 1,5 г, кожні 16 годин. Після останнього додавання реакційну суміш на закінчення перемішують при 40 °C протягом 16 годин. Розчинник випарюють, розчиняють залишок в етилацетаті, та промивають розсолом. Органічний шар декантують, та сушать сульфатом натрію. Розчинник випарюють, та залишок очищують хроматографією за методикою Isco на нормальній фазі, застосовуючи як елюєнт дихлорметан та метанол, до одержання 317 мг ізопропіл-1-(3-фторо-2-піридил)-3-(ізопропоксиметил)піразол-4-карбоксилату. MS (m/z): 322(M+1). 3. [1-(3-фторо-2-піридил)-3-(ізопропоксиметил)піразол-4-іл]метанол До розчину ізопропіл-1-(3-фторо-2-піридил)-3-(ізопропоксиметил)піразол-4-карбоксилату (316 мг, 0,98 ммоль) в диетиловому ефірі (4,9 мл) в атмосфері азоту, охолодженому до 0 °C, додають 1 M розчин алюмогідриду літію в тетрагідрофурані (1,2 мл). Суміш перемішують при 0 °C протягом 1 год. Додають воду (46 мкл), та перемішують протягом 5 хв, потім послідовно вводять 15 % водний розчин NaOH (46 мкл) та воду (138 мкл). Тверді речовини відфільтровують, та випарюють розчинник, одержуючи 241 мг [1-(3-фторо-2-піридил)-3(ізопропоксиметил)піразол-4-іл]метанолу, який використовують без додаткового очищення. MS (m/z): 266(M+1). 4. 1-(3-фторо-2-піридил)-3-(ізопропоксиметил)піразол-4-карбальдегід Суміш [1-(3-фторо-2-піридил)-3-(ізопропоксиметил)піразол-4-іл]метанол (241 мг; 0,91 ммоль) та оксид марганця(IV) (791 мг) перемішують у дихлорметані (5 мл) при кімнатній температурі протягом ночі. Після цього реакційну суміш відфільтровують через целіт, та випарюють розчинник, одержуючи 197 мг вказаної в заголовку сполуки, яку використовують без додаткового очищення. MS (m/z): 264 (M+1). Препаративна методика 26: 1-(3-фторо-2-піридил)-3-(метоксиметил)піразол-4-карбальдегід O O N N N 40 45 50 F 1. етил-1-(3-фторо-2-піридил)-3-(метоксиметил)піразол-4-карбоксилат До розчину етилового складного ефіру 3-бромометил-1-(3-фторо-піридин-2-іл)-1H-піразол-4карбонової кислоти (1,13 г, 3,44 ммоль) в ацетоні (23 мл) додають йодид калію (200,1 мг), карбонат калію (865,33 мг) та метанол (4,18 мл). Суміш перемішують при кімнатній температурі протягом 48 годин. Виявляють метиловий та етиловий складні ефіри описаних сполук. Розчинники випаровують. Залишок розбавляють дихлорметаном та промивають водою. Органічний шар декантують, сушать сульфатом магнію, та випарюють розчинник. Неочищену речовину очищують хроматографією за методикою Isco на нормальній фазі, застосовуючи як елюєнт етилацетат та гексан, з виходом 599 мг суміші метилового складного ефіру та етилового складного ефіру. MS (m/z): 266 (M+1) та 280 (M+1). 2. [1-(3-фторо-2-піридил)-3-(метоксиметил)піразол-4-іл]метанол Ця сполука є по суті сполукою, виготовленою як сполука, описана на етапі 3 препаративної методики 25 (етап відновлення), з виходом 93 %, та з використанням як вихідний матеріал етил1-(3-фторо-2-піридил)-3-(метоксиметил)піразол-4-карбоксилату (до складу суміші також включений метиловий складний ефір). [1-(3-фторо-2-піридил)-3-(метоксиметил)піразол-4 17 UA 107943 C2 5 іл]метанол використовують без додаткового очищення. MS (m/z): 238 (M+1). 3. 1-(3-фторо-2-піридил)-3-(метоксиметил)піразол-4-карбальдегід Ця сполука є по суті сполукою, виготовленою як сполука, описана на етапі 4 препаративної методики 25 (етап окиснювання), з виходом 91 %, та з використанням як вихідний матеріал [1(3-фторо-піридин-2-іл)-3-метоксиметил-1H-піразол-4-іл]метанолу. Вказану в заголовку сполуку використовують без додаткового очищення. MS (m/z): 236 (M+1). Препаративна методика 27: 3-метил-1-(3-морфоліно-2-піридил)піразол-4-карбальдегід O N O N N N 10 15 Суміш 1-(3-фторо-2-піридил)-3-метилпіразол-4-карбальдегіду (230 мг, 1,12 ммоль) та морфоліну (2 мл, 22,93 ммоль) нагрівають мікрохвильвим опромінюванням (температура 160 °C, час лінійного наростання: 2 хв, час витримування: 10 хв, потужність: 250 Вт). Надлишок морфоліну видаляють у вакуумі, та розбавляють залишок дихлорметаном, промивають у насиченому водному розчині бікарбонату натрію. Відокремлюють органічний шар, сушать сульфатом магнію, та випарюють розчинник у вакуумі. Залишок очищують хроматографією за методикою Isco на нормальній фазі, використовуючи суміш гексан/етилацетат як елюєнт (від 50 % до 100 % етилацетату), з виходом 72 % згаданої в заголовку сполуки. MS (m/z): 273 (M+1). Препаративна методика 28: 2-бромо-3-(метоксиметил)піридин 20 Br O N 25 30 До розчину (2-бромопіридин-3-іл)метанолу (20 г, 106,37 ммолі) в 140 мл тетрагідрофурану додають 60 % гідрид натрію у мінеральному маслі (6,38 г, 155,5 ммоль) при 0 °C в атмосфері азоту. Розчин перемішують при 0 °C протягом 30 хв. У розчин додають метилйoдид (7,95 мл, 127,6 ммоль), та перемішують суміш при кімнатній температурі протягом ночі. Суміш гасять додаванням води, та неочищену речовину екстрагують етилацетатом. Відокремлюють органічний шар, сушать сульфатом магнію, та випарюють розчинник у вакуумі, одержуючи 2бромо-3-(метоксиметил)піридин з виходом 98 %, який використовують без додаткової очистки. MS (m/z): 202 (M+1), 204 (M+3). Сполуки з Препаративних методик 29-30 виготовляють по суті так, як описано у Препаративній методиці 28, із застосуванням відповідного алкілйодідного реагенту. Препар. метод.№ Структура Br 29 2-бромо-3-(етоксиметил)піридин N 18 Вихід (%) Фізичні дані: MS (m/z) 99 Хімічна назва 216, 218 (M+1, M+3) O UA 107943 C2 Препар. метод.№ Хімічна назва 30 2-бромо-3(циклопропілметоксиметил)піридин Структура Br O Вихід (%) Фізичні дані: MS (m/z) 100 242, 244 (M+1, M+3) N Препаративна методика 31: 2-бромо-3-(ізопропоксиметил)піридин Br O N 5 10 15 20 25 30 1. 2-бромо-3-(бромометил)піридин У 25 мл колбу Шленка загружают 2-бромо-3-піридин-бензиловий спирт (1 г, 5,32 ммоль) та дихлорметан (15 мл). Одержаний розчин охолоджують до 0 °C у бані з суміші сольового розчину та льоду за допомогою енергійного перемішування магнітною мішалкою. Потім краплями додають трибромід фосфорору (0,55 мл, 5,80 ммоль) для регулювання кількості екзотермічного тепла, так щоб температура суміші була нижчою 10 °C. Одержують в'язку суспензію, і після завершення додавання баню видаляють, та суспензію нагрівають до кімнатної температури. Потім суміш поступово нагрівають до кипіння, кип'ятять зі зворотним холодильником протягом 3 год., та потім охолоджують до кімнатної температури протягом ночі. У заздалегідь охолоджену при 0 °C суміш додають суміш льоду та води, потім додаванням 2 M розчину карбонату натрію pH суміши доводять до лужного. Відокремлюють органічний шар, та водний розчин двічі промивають дихлорметаном (210 мл). Усі органічні речовини об'єднують, сушать сульфатом магнію, відфільтровують, та випарюють розчинник під зниженим тиском, одержуючи 1,2 г 2-бромо-3-бромометилпіридину, який використовують без додаткової очистки. 2. 2-бромо-3-(ізопропоксиметил)піридин До розчину ізопропілового спирту (7,31 мл, 95,65 ммоль) в диметилформаміді (50 мл) при 0 °C додають гідрид натрію (3,63 г, 90,87 ммоль), та перемішують суміш при кімнатній температурі протягом 30 хв (цю реакцію виконують із застосуванням захисного засобу, виконаного як захисний щиток). Потім додають шприцем 2-бромо-3-бромометилпіридин (6 г, 23,91 ммоль) в 10 мл диметилформаміду, та перемішують суміш при кімнатній температурі протягом 1 год. Додають воду, та екстрагують суміш етилацетатом, промивають розсолом та водою, сушать сульфатом магнію, відфільтровують, та випарюють розчинник під зниженим тиском. Неочищену речовину очищують хроматографією за методикою Isco на нормальній фазі, застосовуючи етилацетат та гексан як елюєнт (градієнт від 5 % до 25 % етилацетату), одержуючи 3,67 г згаданої в заголовку сполуки. MS (m/z): 230, 232 (M+1, M+3) Препаративна методика 32: 2-(2-бромо-3-піридил)ацетонітрил Br CN N 35 40 Суміш 2-бромо-3-бромометилпіридин (840 мг, 3,35 ммоль) та цианіду натрію (187,99 мг, 3,68 ммоль) перемішують, та кип'ятять зі зворотнім холодильником протягом 1год у суміші вода (10 мл)-етанол (2 мл). Цю реакційну суміш розбавляють дихлорметаном, та промивають насиченим водним розчином бікарбонату натрію. Відокремлюють органічний шар, сушать сульфатом магнію, та випарюють розчинник у вакуумі до одержання 83 % вказаної в заголовку сполуки, який використовують без додаткового очищення. MS (m/z): 197 (M+1), 199 (M+3). 19 UA 107943 C2 Препаративна карбальдегід методика 33: 1-[3-(циклопропоксиметил)-2-піридил]-3-метилпіразол-4 O N N O N 5 10 15 20 25 30 35 40 45 1. етил-1-[3-(гідроксиметил)-2-піридил]-3-метилпіразол-4-карбоксилат До розчину етилового складного ефіру 1-(3-форміл-піридин-2-іл)-3-метил-1H-піразол-4карбонової кислоти (1 г, 3,9 ммоль) в метанолі (25 мл), додають борогідрат натрію (220,2 мг, 5,8 ммоль). Суміш перемішують при кімнатній температурі протягом 2 год. Розчинник видаляють, неочищену речовину розчиняють в етилацетаті, та промивають насиченим водним розчином хлориду амонію. Відокремлюють органічний шар, сушать сульфатом натрію, відфільтровують, та випарюють розчинник під зниженим тиском, одержуючи 1 г етил-1-[3-(гідроксиметил)-2піридил]-3-метилпіразол-4-карбоксилату. MS (m/z): 262 (M+1) 2. етил-3-метил-1-[3-(вінілоксиметил)-2-піридил]піразол-4-карбоксилат Трифтороацетат паладію(II) (5,1 мг, 15,3 мкмолі) та 4,7-дифеніл-фенантролін (5,1 мг, 15,3 мкмолі) розчиняють в н-бутилвініловому простому ефірі (6,1 мл, 61,2 ммоль) та етиловому складному ефірі 1-(3-гідроксиметил-піридин-2-іл)-3-метил-1H-піразол-4-карбонової кислоти (800 мг, 3,1 ммоль), і додають декілька крапель триетиламіну. Колбу герметизують, та перемішують суміш при 75 °C протягом 24 год. Потім суміш охолоджують до 24 °C, та фільтрують через шар целіту. Розчинник видаляють під зниженим тиском, та залишок очищують хроматографією за методикою Isco на нормальній фазі, застосовуючи гексан та етилацетат як елюєнти (5-20 % етилацетату), одержуючи 605 мг етил-3-метил-1-[3-(вінілоксиметил)-2-піридил]піразол-4карбоксилату. MS (m/z): 288 (M+1) 3. етил-1-[3-(циклопропоксиметил)-2-піридил]-3-метилпіразол-4-карбоксилат 1,0 M розчин диетилцинку в гексані (365,7 мкл, 3,5 ммоль) додають в атмосфері азоту до дихлорметану (0,9 мл). Охолоджують розчин до 0 °C, та дуже повільно додають розчин трифтороцтової кислоти (268,4 мкл, 3,5 ммоль) в дихлорметані (0,9 мл). 20 хв потому додають розчин дийодометану (286,1 мкл, 3,5 ммоль) в дихлорметані (0,9 мл). Ще через 20 хв додають розчин етилового складного ефіру 3-метил-1-(3-вінілоксиметил-піридин-2-іл)-1H-піразол-4карбонової кислоти (510 мг, 1,8 ммоль) в дихлорметані (0,9 мл). Суміш перемішують при кімнатній температурі протягом ночі. Додають 5 % HCl, та екстрагують водний шар етилацетатом. Відокремлюють органічний шар, сушать сульфатом натрію, та видаляють розчинник під зниженим тиском. Неочищену речовину очищують хроматографією за методикою Isco на нормальній фазі, застосовуючи гексан та етилацетат як елюєнти (5-20 % етилацетату), для одержання 310 мг етил-1-[3-(циклопропоксиметил)-2-піридил]-3-метилпіразол-4карбоксилату. MS (m/z): 302 (M+1) 4. 1-[3-(циклопропоксиметил)-2-піридил]-3-метилпіразол-4-карбальдегід До розчину етилового складного ефіру 1-(3-циклопропоксиметилпіридин-2-іл)-3-метил-1Hпіразол-4-карбонової кислоти (410 мг, 1,03 ммоль) у тетрагідрофурані (0,15 M) при 0 °C в атмосфері азоту, додають 1,0 M розчин алюмогідриду літію в тетрагідрофурані (1,2 екв.). Суміш перемішують при кімнатній температурі протягом 1 год., додають насичений водний розчин хлориду амонію, та екстрагують водний шар етилацетатом. Відокремлюють органічний шар, сушать сульфатом натрію, та видаляють розчинник під зниженим тиском. Неочищену речовину розчиняють у дихлорметані (14 мл), та додають оксид марганця(IV) (1,2 г, 13,9 ммоль). Суміш перемішують при кімнатній температурі протягом ночі, потім відфільтровують через шар целіту, та випарюють розчинник під зниженим тиском. Неочищену речовину пропускають через шар силікагелю (елюєнт: етилацетат та дихлорметан). Розчинник видаляють під зниженим тиском, одержуючи 90 мг вказаного в заголовку продукту. MS (m/z): 258 (M+1). Препаративна методика 34: 1-[3-(метоксиметил)-2-піридил]-3-метилпіразол-4-карбальдегід 50 20 UA 107943 C2 O N N O N 5 10 15 1. етил-1-[3-(метоксиметил)-2-піридил]-3-метилпіразол-4-карбоксилат Ця сполука виготовлена по суті так, як сполука, описана у Препаративній методиці 12, із застосуванням етил-3-метил-1H-піразол-4-карбоксилату та 2-бромо-3-(метоксиметил)піридину з виходом 83 %. MS (m/z): 276 (M+1). 2. [1-[3-(метоксиметил)-2-піридил]-3-метилпіразол-4-іл]метанол Ця сполука виготовлена по суті так, як сполука, описана у Препаративній методиці 24 (етап 2), із застосуванням етил-1-[3-(метоксиметил)-2-піридил]-3-метилпіразол-4-карбоксилату з виходом 88 %. MS (m/z): 234 (M+1). 3. 1-[3-(метоксиметил)-2-піридил]-3-метилпіразол-4-карбальдегід Суміш [1-[3-(метоксиметил)-2-піридил]-3-метилпіразол-4-іл]метанолу (2,2 г, 9,4 ммоль) та оксид марганцю (IV) (19 г, 188,8 ммоль) перемішують в дихлорметані (20 мл) при кімнатній температурі протягом ночі. Потім цю реакційну суміш відфільтровують через целіт, та випарюють розчинник під зниженим тиском, одержуючи 1,8 г вказаної в заголовку сполуки, яку використовують без додаткового очищення. MS (m/z): 232 (M+1). Препаративна методика 35: 2-бромо-3-(імідазол-1-ілметил)піридин N Br N N 20 25 30 До розчину (2-бромо-3-піридил)метилметансульфонату (2,5 г, 9,39 ммоль) в етанолі (46,97 мл) при кімнатній температурі, додають карбонат калію (2,62 г) та 1H-імідазол (1,31 г). Суміш перемішують при 50 °C. Утворюють в'язку емульсію, додають 10 мл етанолу, та згадану в'язку емульсію перемішують при 50 °C протягом ночі. Додають воду до розчинення усіх твердих речовин. Потім розчин концентрують під зниженим тиском, залишок розбавляють етилацетатом, та промивають бікарбонатом натрію (насичений водний розчин). Органічний шар декантують, сушать сульфатом магнію, та розчинник випарюють у вакуумі. Неочищену речовину очищують хроматографією за методикою Isco на нормальній фазі, застосовуючи як елюєнт дихлорметан та метанол (від 98/2 до 90/10), одержуючи 1,42 г згаданої в заголовку сполуки. MS (m/z): 238, 240 (M+1, M+3). Сполуки Препаративних методик 36-40 виготовляють по суті так, як описано у Препаративній методиці 35, з відповідних азотвмісних гетероциклів. Препар. метод. № Структура Вихід (%) Фізичні дані: MS (m/z) 39 Хімічна назва 239, 241 (M+1, M+3) N N 36 Br 2-бромо-3-(1,2,4-триазол-1ілметил)піридин N 21 N UA 107943 C2 Препар. метод. № Хімічна назва Структура N 37 Br 2-бромо-3-(триазол-2ілметил)піридин Вихід (%) Фізичні дані: MS (m/z) N N a 239, 241 (M+1, M+3) 63 a 239, 241 (M+1, M+3) 41 238, 240 (M+1, M+3) 61 252, 254 (M+1, M+3) 33 N N N 38 39 Br 2-бромо-3-(триазол-1ілметил)піридин N N N Br 2-бромо-3-(піразол-1ілметил)піридин N N N 40 Br 2-бромо-3-[(2-метилімідазол1-іл)метил]піридин N N a) Обидві сполуки одержані в результаті однії й тієї ж реакції. Препаративна методика 41: 2-[(2-бромо-3-піридил)окси]ацетамід Br O O N NH2 5 10 15 До розчину 2-бромо-3-піридинолу (1,5 г, 8,49 ммоль) у тетрагідрофурані (15 мл) при 0 °C додають 60 % розчин гідриду натрію у мінеральному маслі (509,44 мг, 12,74 ммоль), та перемішують суміш при цій температурі протягом 30 хв. Потім додають 2-хлороацетамід (16,98 ммоль), та перемішують суміш при кімнатній температурі протягом уик-енду. Суміш гасять водою, та екстрагують етилацетатом. Відокремлюють органічний шар, сушать сульфатом магнію, та випарюють розчинник у вакуумі до одержання вказаної в заголовку сполуки з виходом 75 %. Сполуку використовують без будь-якого додаткового очищування. MS (m/z): 231 (M+1), 233 (M+3). Препаративна методика 42: 2-бромо-3-(ціклопропілметокси)піридин Br N 20 O До розчину 2-бромо-3-піридинолу (500 мг, 2,83 ммоль;) у диметилформаміді (3 мл) додають при 0 °C розчин 60 % гідриду натрію у мінеральному маслі (169,81 мг, 4,25 ммоль). Суміш перемішують при цій температурі протягом 15 хв, та додають бромометилциклопропан (329,66 мкл, 3,40 ммоль). Потім реакційну суміш перемішують при кімнатній температурі протягом 1 22 UA 107943 C2 5 год., гасять водою, та екстрагують етилацетатом. Відокремлюють органічний шар, промивають розсолом, сушать сульфатом магнію, та випарюють розчинник у вакуумі. Неочищену речовину пропускають через короткий шар силікагелю, та сполуку елюють дихлорметаном з виходом 23 % згаданої в заголовку сполуки. MS (m/z): 228 (M+1), 230 (M+3). Препаративна методика 43: етил-1-(3-фторо-2-піридил)-4-формілпіразол-3-карбоксилат O O O N N F N 10 15 20 25 30 35 40 1. етил-4-форміл-1H-піразол-3-карбоксилат У 100 мл круглодонну колбу загружают напівкарбазіду гідрохлорид (2 г, 17,93 ммоль), етилпуриват (11,8 мл) та етаноат натрію (2,97 г). Потім додають воду (9 мл). Суміш перемішують при кімнатній температурі протягом 90 хв, потім відфільтровують, та промивають тверді речовини додатковою кількістю води. Білу тверду речовину сушать під вакуумом при 40 °C протягом ночі. 2,66 г етил-2-(карбамоїлгідразоно)пропаноату одержують без домішок. Фосфорилхлорид (3,28 мл) додають краплями у диметилформамід (7,13 мл) при 0 °C. Для досягнення кімнатної температури охолоджувальну баню видаляють. Потім згадану суміш нагрівають до 40 °C, та додають одержаний раніше етил-2-(карбамоїлгідразоно)пропаноат (2,66 г, 15,36 ммоль) декількома порціями протягом 15-20 хв (під час додавання виділяється газ). Коли внутрішня тепература складає 55 °C, нагрівну баню віддаляють так, щоб внутрішня тепература дорівнювала від 60 °C до 70 °C. Потім суміш нагрівають до 80 °C. Як тільки реакційна суміш стабілізується при 80 °C, виділення газу майже не спостерігається. Одержувану суспензію перемішують при 80 °C протягом 2 год. Реакційну суміш виливають у льодо/водяну (30 мл) суміш, та перемішують, одержуючи суспензію. 50 % розчин гідроксиду натрію додають краплями до досягнення pH 10. Розчин перемішують при 50 °C протягом 5 хв. Потім розчин охолоджують за допомогою льодо/водяної бані, та додають 35 % водний розчин хлористоводневої кислоти до досягнення pH 7. Суміш екстрагують етилацетатом. Органічний шар декантують, сушать сульфатом магнію, та випарюють розчинник під зниженим тиском. Залишок розтирають з гексаном та декількома краплями дихлорметану, одержуючи 1,6 г етил-4форміл-1H-піразол-3-карбоксилату, який використовують на наступному етапі без додаткового очищування. MS (m/z): 169 (M+1). 2. етил-1-(3-фторо-2-піридил)-4-формілпіразол-3-карбоксилат Суміш етил-4-форміл-1H-піразол-3-карбоксилату (1,6 г, 9,52 ммоль), 2,3-дифторопіридину (1,20 г) та карбонату калію (1,97 г) у диметилформаміді (8 мл) нагрівають та перемішують при 100 °C протягом 1,5 год. Потім цю реакційну суміш перемішують при кімнатній температурі протягом ночі. Додають воду, та екстрагують органічну фазу етилацетатом, декантують, сушать сульфатом магнію, та випарюють розчинник під зниженим тиском. Неочищену речовину очищують хроматографією за методикою Isco на нормальній фазі, використовуючи етилацетат та гексан до одержання 711 мг згаданої в заголовку сполуки. MS (m/z): 264 (M+1). Препаративна методика 44: 3-метил-1-(3-(тетрагідрофуран-2-іл)піридин-2-іл)-1H-піразол-4карбальдегід O N N N O 45 1. 3-(2,5-дигідрофуран-2-іл)-2-фторопіридин У пробірку з нагвинчуваною кришкою вміщують ацетат калію (440 мг, 4,5 ммоль), тетрабутиламонію бромід (1,4 г, 4,5 ммоль) та 4е молекулярні сита у безводному 23 UA 107943 C2 5 10 15 20 25 диметилформаміді (1,8 мл), додають в атмосфері азоту 2-фторо-3-йодопіридин (400 мг, 1,8 ммоль), 2,3-дигідрофуран (1,4 мл, 18 ммоль) та ацетат паладію (20 мг, 0,09 ммоль). Реакційну пробірку швидко ущільнюють, та збовтують протягом ночі при кімнатній температурі. Суміш розбавляють диетиловим ефіром, та фільтрують через целіт. Згаданий фільтрат промивають водою, сушать сульфатом магнію, відфільтровують, та випарюють розчинник у вакуумі. Одержаний залишок очищують за допомогою силікагелю, застосовуючи хроматографію за методикою Isco на нормальній фазі, елююючи сумішшю гексан:ацетон (градієнт від 5 % до 30 % ацетону), до одержання 170 мг 3-(2,5-дигідрофуран-2-іл)-2-фторопіридин. MS (m/z): 166 (M+1). 2. 2-фторо-3-(тетрагідрофуран-2-іл)піридин У круглодонну колбу вміщують 3-(2,5-дигідрофуран-2-іл)-2-фторопіридин (170 мг, 1 ммоль) та 10 % Pd/C у метанолі (3,1 мл), викачують повітря під вакуумом, та заповнюють воднем за допомогою балону. Реакційну суміш перемішують протягом ночі при кімнатній температурі, та відфільтровують через целіт. Розчинник випарюють у вакуумі до одержання 148 мг 2-фторо-3(тетрагідрофуран-2-іл)піридину. MS (m/z): 168 (M+1). 3. 3-метил-1-(3-(тетрагідрофуран-2-іл)піридин-2-іл)-1H-піразол-4-карбальдегід У пробірку з нагвинчуваною кришкою вміщують 2-фторо-3-(тетрагідрофуран-2-іл)піридин (148 мг, 0,88 ммоль) у диметилформаміді (2,2 мл), та додають 3-метил-1H-піразол-4карбальдегід (81 мг, 0,74 ммоль) та карбонат калію (152 мг, 1,1 ммоль). Реакційну пробірку швидко укупорюють (попередження:можливе збільшення тиску; застосовувати захисний екран), та перемішують її уміст, помістивши її у заздалегідь розігріту масляну баню при 110 °C, протягом 18 год. магнітною мішалкою. Суміш розбавляють водою, та екстрагують етилацетатом. Відокремлюють органічний шар, сушать сульфатом магнію, відфільтровують, та випарюють розчинник у вакуумі. Одержаний залишок очищують за допомогою силікагелю із застосуванням хроматографії за методикою Isco на нормальній фазі, елююючи сумішшю гексан:ацетон (градієнт від 5 % до 20 % ацетону) до одержання 116 мг згаданої в заголовку сполуки. MS (m/z): 258 (M+1). Препаративна методика 45: 3-(2-бромо-пірид-3-іл)ізоксазол Br O N N 30 35 40 45 50 55 1. 2-бромопіридин-3-карбальдегідоксим До розчину 2-бромопіридин-3-карбальдегіду (2,04 г) в етанолі (25 мл) додають гідроксиламіну гідрохлорид (948 мг, 13,16 ммоль) та етаноат натрію (1,09 г, 13,16 ммоль). Суміш перемішують при кімнатній температурі протягом ночі. Розчинник випарюють під зниженим тиском, та розділяють залишок між дихлорметаном та водою. Відокремлюють органічний шар, сушать сульфатом натрію, відфільтровують, та випарюють розчинник у вакуумі, одержуючи 2 г 2-бромопіридин-3-карбальдегідоксиму. MS (m/z): 201/203 (M+1/M+3) 2. [3-(2-бромо-3-піридил)ізоксазол-5-іл]триметилсілан У перемішувану суспензію 2-бромопіридин-3-карбальдегідоксиму (400 мг, 1,99 ммоль) у дихлорметані (3,98 мл) при 0 °C, слідом за N-хлоросукцинімідом (337,19 мг, 2,49 ммоль) порціями додають піридин (201,13 мкл, 2,49 ммоль). Потім, слідом за триетиламіном (346,68 мкл, 2,49 ммоль), додають (триметилсиліл)ацетілен (350,60 мкл, 2,49 ммоль). Суміш перемішують, дозволяючи їй нагрітись від 0 °C до кімнатної температури. Через дві год. додають додаткову кількість піридину (321,81 мкл, 3,98 ммоль) та N-хлоросукциніміду (539,51 мг, 3,98 ммоль), та перемішують суміш при кімнатній температурі протягом 16 год. Цю реакційну суміш потім гасять насиченим розчином хлоридом амонію. Шари розділяють, згадані органічні речовини сушать сульфатом магнію, відфільтровують, та концентрують під зниженим тиском, одержуючи [3-(2-бромо-3-піридил)ізоксазол-5-іл]триметилсілан з кількісним виходом. MS (m/z): 297/299 (M+1/M+3) 3-(2-бромо-3-піридил)ізоксазол До розчину [3-(2-бромо-3-піридил)ізоксазол-5-іл]триметилсілану (620 мг, 2,09 ммоль) у метанолі (18 мл), однією порцією додають карбонат калію (29,12 мг, 208,59 мкмолі). Суміш перемішують при кімнатній температурі протягом 24 г. Розчинник видаляють у вакуумі. Неочищену речовину розділяють між етилацетатом та насиченим розчином хлориду амонію. Органічні речовини промивають водою, та сушать сульфатом магнію, відфільтровують, та концентрують під зниженим тиском. Неочищену речовину очищують хроматографією за 24 UA 107943 C2 методикою Isco на нормальній фазі, застосовуючи як елюєнт гексан/етилацетат від 66/33 до 50/50, одержуючи 140 мг вказаної в заголовку сполуки у вигляді белої твердої речовини. MS (m/z): 225/227 (M+1/M+3) Препаративна методика 46: 1-(3-хлоро-2-піридил)-3-метилпіразол-4-карбальдегід 5 H O N N Cl N 10 15 До розчину 3-метилпіразол-4-карбальдегіду (0,5 г, 4,5 ммоль) у безводному диметилформаміді (15 мл) додають карбонат калію (2,5 г, 18 ммоль) при кімнатній температурі. Згадану реакційну суміш перемішують при 40 °C протягом 30 хв, та потім додають 1-фторо-2хлоропіридин (0,77 г, 6 ммоль, ). Реакційну суміш гріють при 70 °C протягом 16 год. Після завершення реакційну суміш охолоджують до кімнатної температури, розбавляють водою, та потім екстрагують етилацетатом. Органічний шар сушать сульфатом натрію, відфільтровують, та концентрують під зниженим тиком. Неочищену суміш очищують хроматографією на силікагелі, елююючи сумішшю гексан/етилацетат (75:25, 65:35), одержуючи 0,525 г (52 %) згаданої в заголовку сполуки. MS (m/z): 222 (M+1). Препаративна методика 47: 1-(3-ціклопропіл-2-піридил)-3-метилпіразол-4-карбальдегід H O N N N 20 25 30 35 40 1. етиловий складний ефір 1-(3-бромопіридин-2-іл)-3-метилпіразол-4-карбонової кислоти До розчину етилового складного ефіру 3-метилпіразол-4-карбонової кислоти (2,0 г, 13 ммоль) у безводному диметилформаміді (30 мл) додають карбонат калію (7,2 г, 52 ммоль) при кімнатній температурі. Реакційну суміш перемішують при 40 °C протягом 30 хв, та потім додають 1-фторо-2-бромопіридин (3,0 г, 17 ммоль). Згадану реакційну суміш перемішують при 70 °C протягом 4 год. Реакційну суміш охолоджують до кімнатної температури, розбавляють водою, та екстрагують етилацетатом. Органічний шар сушать безводним сульфатом натрію, відфільтровують, та концентрують під зниженим тиском. Неочищену суміш очищують хроматографією на силікагелі, елююючи сумішшю гексан/етилацетат (85:15, 80:20), та одержують 3,2 г (79 %) етилового скадного ефіру 1-(3-бромопіридин-2-іл)-3-метилпіразол-4карбонової кислоти. MS (m/z): 312 (M+3), 310 (M+1). 2. етиловий скадний ефір 1-(3-ціклопропілпіридин-2-іл)-3-метилпіразол-4-карбонової кислоти Суміш етилового складного ефіру 1-(3-бромопіридин-2-іл)-3-метилпіразол-4-карбонової кислоти (1,5 г, 5,5 ммоль), фосфату калію (4,0 г, 19,2 ммоль), ціклопропіл боронової кислоти (0,7 г, 8,2 ммоль) та суміші толуол/вода (2:1, 15 мл) дегазують азотом, та додають трициклогексилфосфен (0,153 г, 0,54 ммоль) та ацетат паладію (0,061 г, 0,27 ммоль). Суміш знову дегазують азотом, реакційну посудину ущільнюють, та нагрівають при 100 °C протягом 16 год. Реакційну суміш концентрують, розбавляють водою, та екстрагують етилацетатом. Органічний шар сушать сульфатом натрію, відфільтровують, та концентрують під зниженим тиском. Неочищену суміш очищують хроматографією на сілікагелі, елююючи сумішшю гексан/етилацетат (85:15), та одержують 1,6 г (93 %) етилового скадного ефіру 1-(3ціклопропілпіридин-2-іл)-3-метилпіразол-4-карбонової кислоти. MS (m/z): 272 (M+1). 3. [1-(3-ціклопропілпіридин-2-іл)-3-метилпіразол-4-іл]метанол До перемішуваної суспензії алюмогідриду літію (0,44 г, 11,7 ммоль) у безводному 25 UA 107943 C2 5 10 15 тетрагідрофурані (25 мл) додають розчин етилового скадного ефіру 1-(3-бромопіридин-2-іл)-3метилпіразол-4-карбонової кислоти (1,6 г, 5,8 ммоль) у безводному тетрагідрофурані (5 мл) в атмосфері азоту при -78 °C. Після завершення додавання реакційну суміш підігрівають до кімнатної температури, потім збовтують протягом ночі. Реакційну суміш гасять 1н розчином гідроксиду натрію, потім відфільтровують через целіт. Відокремлюють органічний шар, та екстрагують водний шар етилацетатом. Об'єднаний органічний шар промивають водою та розсолом, сушать сульфатом натрію, відфільтровують, та концентрують, одержуючи 1,1 г (84 %) [1-(3-ціклопропілпіридин-2-іл)-3-метилпіразол-4-іл]метанолу. MS (m/z): 230 (M+1). 4. 1-(3-ціклопропіл-2-піридил)-3-метилпіразол-4-карбальдегід До розчину [1-(3-ціклопропілпіридин-2-іл)-3-метилпіразол-4-іл]метанолу (1,1 г, 5,0 ммоль) у безводному дихлорметані (15 мл) додають хлорохромат піридинію (1,2 г, 5,5 ммоль) в атмосфері азоту. Реакційну суміш перемішують при кімнатній температурі протягом 2 год., та потім відфільтровують через целіт. Згаданий фільтрат концентрують під зниженим тиском. Неочищену суміш очищують на силікагелі, елююючи сумішшю гексан/етилацетат (90:10, 80:20), та одержують 0,2 г (20 %) згаданої в заголовку сполуки. MS (m/z): 228 (M+1). Препаративна методика 48: 4-[(2-бромо-3-піридил)метил]морфолін-3-он Br O N N O 20 25 До розчину 2-бромо-3-бромометилпіридину (0,68 г, 2,36 ммоль) в диметилілформаміді (10 мл) додають гідрид натрію (0,11 г, 60 % суспензія, 2,82 ммоль), морфолін-3-он (0,20 г, 1,97 ммоль) та йодид тетрабутиламонію (каталіз.) при 0 °C. Суміш перемішують при кімнатній температурі протягом 16 год. По завершенню, реакційну суміш розділяють між етилацетатом (25 мл) та водою (25 мл). Водний шар екстрагують етилацетатом (225 мл), та об'єднані органічні екстракти сушать сульфатом натрію, та концентрують у вакуумі. Неочищену речовину очищують колонковою хроматографією на силікагелі, елююючи сумішшю гексан/етилацетат (55:45), та одержують 0,35 г (66 %) згаданої в заголовку сполуки. MS (m/z): 271/273 (M+1, M+3). Сполуки Препаративних методик 49-50 виготовляють по суті так, як описано у Препаративній методиці 48, з відповідного лактамного реагенту. 30 Преп. метод № Хімічна назва Br 49 1-[(2-бромо-3-піридил)метил] піролідин-2-он 80 N N 1-[(2-бромо-3піридил)метил]піперидин-2-он N Фізичні дані: MS (m/z) 255/257 (M+1, M+3) 59 269/271 (M+1/ M+3) O Br 50 Вихід (%) Структура O N Препаративна методика 51: етил-1-(3-хлоро-2-піридил)-4-формілпіразол-3-карбоксилат 35 До розчину етил-4-формілпіразол-3-карбоксилату (1,70 г, 10,1 ммоль) та 3-хлоро-2 26 UA 107943 C2 5 фторопіридину (1,99 г, 15,1 ммоль) у диметилформаміді (20 мл) додають карбонат калію (2,80 г, 20,2 ммоль), та перемішують суміш при 100 °C протягом 16 год. Після завершення реакційну суміш розділяють між водою (25 мл) та етилацетатом (25 мл). Водний шар екстрагують етилацетатом (325 мл), та об'єднані органічні екстракти сушать сульфатом натрію, концентрують у вакуумі, та очищують колонковою хроматографією на сілікагелі, елююючи сумішшю гексан/етилацетат (50:50), одержуючи 1,5 г (54 %) згаданої в заголовку сполуки. MS (m/z): 280 (M+1). Препаративна методика 52: етил-1-(3-метил-2-піридил)-4-формілпіразол-3-карбоксилат 10 15 20 Суміш етил-1-(3-хлоро-2-піридил)-4-формілпіразол-3-карбоксилату (1,0 г, 3,5 ммоль), триметилбороксину (0,44 г, 3,50 ммоль) та карбонату калію (1,4 г, 10,1 ммоль) у діоксані (18 мл) та водою (2 мл) дегазують газоподібним азотом протягом 10 хв, та потім додають трифенілфосфін паладію (0,40 г, 0,3 ммоль), та перемішують при 110 °C протягом 16 год. По завершенню реакційну суміш розділяють між дихлорметаном (50 мл) та водою (25 мл). Водний шар екстрагують дихлорметаном (225 мл), та об'єднані органічні екстракти сушать сульфатом натрію, та концентрують у вакуумі. Неочищену суміш очищують колонковою хроматографією на сілікагелі, елююючи сумішшю гексан/етилацетат (70:30), та одержують 0,12 г (13 %) згаданої в заголовку сполуки. MS (m/z): 260 (M+1). ПРИКЛАД 1: [2-[4-[(2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'іл)метил]-3-метилпіразол-1-іл]-3-піридил]метанолу (L)-тартрат F F Cl O S N OH HO O N O N OH N OH OH 25 30 35 До розчину 2-[4-[(2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-іл)метил]3-метилпіразол-1-іл]піридин-3-карбальдегіду (12,50 г, 26,10 ммоль) у дихлорметані (125 мл) при 0 °C додають борогідрид натрію (0,395 г, 10,44 ммоль) та метанол (37,50 мл). Льодяну баню віддаляють, та реакційну суміш перемішують при кімнатній температурі протягом 30 хв. Додають воду (50 мл), та концентрують суміш до половини об'єму, одержуючи білий клейкий твердий залишок. Додають дихлорметан (100 мл), та розділяють двофазну суміш. Органічний шар промивають водою (50 мл), сушать сульфатом натрію, та концентрують до половинного об'єму (приблизно 100 мл). Додають метил-трет-бутиловий простий ефір (100 мл), та розчин концентрують для одержання залишку. Тверду речовину відфільтровують, та сушать під вакуумом до одержання 12 г [2-[4-[(2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'піперидин]-1'-іл)метил]-3-метилпіразол-1-іл]-3-піридил]метанолу. MS (m/z): 481 (M+1). 27 UA 107943 C2 5 Вільну основу вказаної в заголовку сполуки (0,48 г, 1 ммоль) розчиняють у 3 мл метанолу, та додають розчин (L)-тартарової кислоти (0,15 г, 1 ммоль) у метанолі. Суміш перемішують протягом 10 хв. Розчинник випарюють, та залишок сушать у вакуумі протягом ночі до одержання [2-[4-[(2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран-7,4'-піперидин]-1'-іл)метил]-3метилпіразол-1-іл]-3-піридил]метанол-(L)-тартрату з кількісним виходом. MS (m/z): 481 (M+1). ПРИКЛАД 2: 2-хлоро-4,4-дифторо-1'-[[1-[3-(4H-імідазол-2-іл)-2-піридил]-3-метилпіразол-4іл]метил]спіро[5H-тієно[2,3-c]піран-7,4'-піперидин] F F Cl O S N N N N N N 10 15 20 25 30 40 % розчин гліоксалю у воді (4,69 мл, 40,71 ммоль) та 2н розчин аміаку в метанолі (54,29 мл, 108,57 ммоль) додають до суспензії 2-[4-[(2-хлоро-4,4-дифторо-спіро[5H-тієно[2,3-c]піран7,4'-піперидин]-1'-іл)метил]-3-метилпіразол-1-іл]піридин-3-карбальдегіду (6,50 г, 13,57 ммоль) у метанолі (10 мл). Реакційну суміш перемішують протягом 5 хв при 0 °C, та потім при 40 °C протягом 1 год. У суспензію додають дихлорметан (10 мл), до майже повного розчинення усього матеріалу. Суміш перемішують протягом 4 год., одержуючи ясно-брунатний розчин. Згаданий розчин перемішують протягом 8 год. при 40 °C. Додають 40 % розчин гліоксалю у воді (2,34 мл, 20,36 ммоль) і 2н розчин аміаку в метанолі (27,14 мл, 54,29 ммоль), та перемішують суміш при 40 °C протягом 15 год. Цю реакційну суміш концентрують до приблизно 100 мл, та виливають у суміш льод/вода (400 мл), з утворенням бежевого твердого залишку. Тверду речовину відфільтровують, промивають водою, та сушать під вакуумом (7 г). Тверду речовину об'єднують з іншою неочищеною речовиною, виготовленою по суті у той самий спосіб (10 г). Об'єднану тверду речовину розчиняють у дихлорметані, та відфільтровують через шар силікагелю, елююючи сумішшю дихлорметан/метанол (96/4). Порції, які містять продукт, об'єднують, та концентрують для одержання ясно-жовтої твердої речовини (11g). Тверду речовину екстрагують сумішшю 10 % гексан/дихлорметан при кип'ятінні зі зворотним холодильником, одержаний екстракт фільтрують та концентрують. Тверду речовину додатково очищують за допомогою хроматографії на силікагелі, елююючи сумішшю 2н розчин гідроксиду амонію в метанолі/дихлорметан, для одержання 6,5 г вказаної в заголовку сполуки. MS (m/z): 518 (M+1). ПРИКЛАД 3: 2-фторо-1'-[[1-[3-(1H-імідазол-2-іл)-2-піридил]-3-метилпіразол-4іл]метил]спіро[4,5-дигідротієно[2,3-c]піран-7,4'-піперидин] F O S N N N H N N N 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSpiropiperidine compounds as orl-1 receptor antagonists
Автори англійськоюBenito Collado, Ana Belen, Diaz Buezo, Nuria, Jimenez-Aguado, Alma Maria, Lafuente Blanco, Celia, Martinez-Grau, Maria Angeles, Pedregal-Tercero, Concepcion, Toledo Escribano, Miguel Angel
Автори російськоюБенито Кольядо Ана Белен, Диаз Буезо Нурия, Хименес-Агвадо Альма Мария, Лафуенте Бланко Селия, Мартинес-Грау Мария Анхелес, Педрегал-Терсеро Консепсьйон, Толедо Эскрибано Мигель Анхель
МПК / Мітки
МПК: C07D 495/20, A61P 25/00, A61K 31/444
Мітки: спіропіперидину, рецептора, сполуки, orl-1, антагоністи
Код посилання
<a href="https://ua.patents.su/68-107943-spoluki-spiropiperidinu-yak-antagonisti-receptora-orl-1.html" target="_blank" rel="follow" title="База патентів України">Сполуки спіропіперидину як антагоністи рецептора orl-1</a>
Попередній патент: Дробарка карпенка
Наступний патент: Спосіб фракціонування потоку крекінг-газу для отримання фракції, багатої на етилен, і потоку палива та установка для його здійснення
Випадковий патент: Пристрій фазового виявлення цілей