Спіро-азабіциклічні сполуки, способи їх одержання та фармацевтична композиція
Номер патенту: 54375
Опубліковано: 17.03.2003
Автори: Мюррей Роберт Джон, Балєстра Майкл, Гордон Джон Чарлз, Гріффіт Роналд Конрад
Формула / Реферат
1. Спиро-азабициклические соединения формулы I
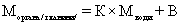 , (I)
, (I)
где
R представляет водород или метил, и
n = 1 или 2; или их фармацевтически приемлемые соли присоединения кислоты или энантиомеры.
2. Соединение по п. 1, в котором R представляет водород, или его фармацевтически приемлемая соль присоединения кислоты или энантиомер.
3. Соединение по п. 1, представляющее спиро[1-азабицикло[2,2,2]октан-3,5'-оксазолидин]-2'-он или его фармацевтически приемлемую соль присоединения кислоты или энантиомер.
4. Соединение по п. 1, представляющее (+)-спиро[1-азабицикло[2,2,2]октан-3,5'-оксазолидин]-2’-он или его фармацевтически приемлемую соль присоединения кислоты.
5. Соединение по п. 1, представляющее (-)-спиро[1-азабицикло[2,2,2]октан-3,5'-оксазолидин]-2'-он или его фармацевтически приемлемую соль присоединения кислоты или энантиомер.
6. Соединение по п. 1, представляющее спиро[1-азабицикло[2,2,1]гептан-3,5'-оксазолидин-2'-он] или его фармацевтически приемлемую соль присоединения кислоты или энантиомер.
7. Соединение по п. 1, представляющее 3'-метилспиро[1-азабицикло[2,2,2]-октан-3,5'-оксазолидин-2']-он или его фармацевтически приемлемую соль присоединения кислоты или энантиомер.
8. Соединение по любому из пп. 1-7 или его фармацевтически приемлемая соль присоединения кислоты или энантиомер, обладающие свойствами агонистов никотиновых ацетилхолиновых рецепторов.
9. Соединение по любому из пп. 1-8, или его фармацевтически приемлемая соль присоединения кислоты или энантиомер для производства медикаментов для лечения или профилактики психотических расстройств или расстройств с ухудшением интеллекта.
10. Соединение по п. 9, в котором расстройством является шизофрения, болезнь Альцгеймера, дефицит способности к обучению, дефицит познавательной функции или расстройства, связанные с гиперактивностью и дефицитом внимания.
11. Соединение по любому из пп. 1-8 или его фармацевтически приемлемая соль присоединения кислоты или энантиомер для производства лекарственного средства для лечения или профилактики беспокойства или страха.
12. Фармацевтическая композиция, проявляющая свойства никотиновых ацетилхолиновых рецепторов, включающая эффективное количество соединения, охарактеризованного в любом из пп. 1-8, или его фармацевтически приемлемой соли присоединения кислоты или энантиомера, в смеси с фармацевтически приемлемым разбавителем или носителем.
13. Способ получения соединения формулы (I), охарактеризованного в п. 1, или его фармацевтически приемлемой соли присоединения кислоты или энантиомера, отличающийся тем, что соответствующее соединение формулы (II)
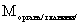 , (II)
, (II)
где n имеет значения, определенные в п. 1, подвергают циклизации, и при желании полученное соединение формулы (I), в которой R представляет водород, превращают в соединение, в котором R представляет метил, с помощью алкилирования, или получают один энантиомер соединения формулы (I) путем выделения его из смеси энантиомеров, и, при желании или необходимости, превращают полученное в результате соединение формулы (I) или его фармацевтически приемлемую соль присоединения кислоты или энантиомер в его фармацевтически приемлемую соль присоединения кислоты или энантиомер, или наоборот.
14. Способ получения соединения формулы (I), охарактеризованного в п. 1, или его фармацевтически приемлемой соли присоединения кислоты или энантиомера, отличающийся тем, что соответствующее соединение формулы (III)
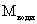 , (III)
, (III)
где n и R имеют значения, определенные в п. 1, подвергают реакции с соединением, дающим карбонил, при желании соединение формулы (I), в которой R представляет водород, превращают в соединение, в котором R представляет метил, с помощью алкилирования, или получают один энантиомер соединения формулы (I) путем выделения его из смеси энантиомеров, и, при желании или необходимости, превращают полученное в результате соединение формулы (I) или его фармацевтически приемлемую соль присоединения кислоты или энантиомер в его фармацевтически приемлемую соль присоединения кислоты или энантиомер, или наоборот.
15. Соединение формулы (IV)
 , (IV)
, (IV)
где n имеет значения, определенные в п. 1, или его фармацевтически приемлемая соль присоединения кислоты или энантиомер.
16. Соединение формулы (III)
 , (III)
, (III)
где n имеет значения, определенные в п. 1, и R представляет метил, или его фармацевтически приемлемая соль присоединения кислоты или энантиомер.
Текст
1 Спиро-азабициклические соединения формулы где R представляет водород или метил, и п = 1 или 2, или их фармацевтически приемлемые соли присоединения кислоты или энантиомеры 2 Соединение по п 1, в котором R представляет водород, или его фармацевтически приемлемая соль присоединения кислоты или энантиомер 3 Соединение по п 1, представляющее спиро[1азабицикло[2,2,2]октан-3,5'-оксазолидин]-2'-он или его фармацевтически приемлемую соль присоединения кислоты или энантиомер 4 Соединение по п 1, представляющее (+)спиро[1-азабицикло[2,2,2]октан-3,5'-оксазолидин]2-он или его фармацевтически приемлемую соль присоединения кислоты 5 Соединение по п 1, представляющее (-)спиро[1-азабицикло[2,2,2]октан-3,5'-оксазолидин] 2'-он или его фармацевтически приемлемую соль присоединения кислоты или энантиомер 6 Соединение по п 1, представляющее спиро[1азабицикло[2,2,1]гептан-3,5'-оксазолидин-2'-он] или его фармацевтически приемлемую соль присоединения кислоты или энантиомер 7 Соединение по п 1, представляющее 3'метилспиро[1-азабицикло[2,2,2]-октан-3,5'оксазолидин-2']-он или его фармацевтически приемлемую соль присоединения кислоты или энантиомер 8 Соединение по любому из пп 1-7 или его фармацевтически приемлемая соль присоединения кислоты или энантиомер, обладающие свойствами агонистов никотиновых ацетилхолиновых рецепторов 9 Соединение по любому из пп 1-8, или его фармацевтически приемлемая соль присоединения кислоты или энантиомер для производства медикаментов для лечения или профилактики психотических расстройств или расстройств с ухудшением интеллекта 10 Соединение по п 9, в котором расстройством является шизофрения, болезнь Альцгеймера, дефицит способности к обучению, дефицит познавательной функции или расстройства, связанные с гиперактивностью и дефицитом внимания 11 Соединение по любому из пп 1-8 или его фармацевтически приемлемая соль присоединения кислоты или энантиомер для производства лекарственного средства для лечения или профилактики беспокойства или страха 12 Фармацевтическая композиция, проявляющая свойства никотиновых ацетилхолиновых рецепторов, включающая эффективное количество соединения, охарактеризованного в любом из пп 18, или его фармацевтически приемлемой соли присоединения кислоты или энантиомера, в смеси с фармацевтически приемлемым разбавителем или носителем 13 Способ получения соединения формулы (I), охарактеризованного в п 1, или его фармацевтически приемлемой соли присоединения кислоты или энантиомера, отличающийся тем, что соответствующее соединение формулы (II) о ю го ю 54375 N=C=O НО где п имеет значения, определенные в п 1, подвергают циклизации, и при желании полученное соединение формулы (І), в которой R представляет водород, превращают в соединение, в котором R представляет метил, с помощью алкилирования, или получают один энантиомер соединения формулы (I) путем выделения его из смеси энантиомеров, и, при желании или необходимости, превращают полученное в результате соединение формулы (I) или его фармацевтически приемлемую соль присоединения кислоты или энантиомер в его фармацевтически приемлемую соль присоединения кислоты или энантиомер, или наоборот 14 Способ получения соединения формулы (I), охарактеризованного в п 1, или его фармацевтически приемлемой соли присоединения кислоты или энантиомера, отличающийся тем, что соответствующее соединение формулы (III) соединение, в котором R представляет метил, с помощью алкилирования, или получают один энантиомер соединения формулы (I) путем выделения его из смеси энантиомеров, и, при желании или необходимости, превращают полученное в результате соединение формулы (I) или его фармацевтически приемлемую соль присоединения кислоты или энантиомер в его фармацевтически приемлемую соль присоединения кислоты или энантиомер, или наоборот 15 Соединение формулы (IV) (СН2)п NH-NH 2 (IV) где п имеет значения, определенные в п 1, или его фармацевтически приемлемая соль присоединения кислоты или энантиомер 16 Соединение формулы (III) (СН 2 )п (СН 2 )п NHR НО NHR НО , (О Н где п и R имеют значения, определенные в п 1, подвергают реакции с соединением, дающим карбонил, при желании соединение формулы (I), в которой R представляет водород, превращают в Данное изобретение относится к новым соединениям, способам их получения, содержащим их композициям и их использованию при лечении Как известно, спиро-азабициклические соединения обладают терапевтической активностью в ряде расстройств центральной нервной системы Тайваньская патентная заявка 201312, Европейская патентная заявка 452101 (обе из Института биологических исследований Израиля), международная патентная заявка WO 95/03303 (Институт биологических исследований Израиля, опубликованная после самой ранней даты приоритета данной заявки) и Европейская патентная заявка 350118 (Merck Sharpe and Dahme) раскрывают спиро-связанные с 5-членными кольцами азабициклические соединения, включая производные азабицикло(2 2 2) октана и/или азабицикло(2 2 1)гептана, которые имеют активность мускариновых агонистов, и которые показаны для лечения заболеваний, обусловленных недостаточностью центральной холинергическои функции Европейская патентная заявка 337547 (Merck Sharpe and Dahme) раскрывает спиро-связанные с (III) где п имеет значения, определенные в п 1, и R представляет метил, или его фармацевтически приемлемая соль присоединения кислоты или энантиомер 5-членными кольцами азабициклические соединения, которые являются антагонистами рецепторов 5-НТз и которые показаны для лечения шизофрении, тошноты, мигрени и болезни Альцгеймера В настоящее время мы идентифицировали новуюгруппу спиро-азабициклических соединений, которые имеют полезные фармакологические свойства Таким образом, в соответствии с изобретением, мы представляем соединения формулы (СН 2 )п в которой R представляет собой водород или метил, а 54375 n = 1 или 2, и его фармацевтически приемлемые соли присоединения кислот (кислотно-аддитивные соли) Мы предпочитаем соединения формулы 1, в которой R представляет водород Мы предпочитаем соединения формулы 1, в которой п = 2 В качестве еще одного аспекта изобретения мы предоставляем процесс получения соединений формулы 1 или их фармацевтически приемлемых солей присоединения кислот, который включает (а) получение соединения формулы 1, в которой R представляет водород, путем циклизации соответствующего соединения формулы II По способу (с) реакция алкилирования происходит в условиях, хорошо известных специалистам в данной области, например, с помощью обработки соединения формулы 1, в котором R представляет водород сильным основанием с последующей обработкой метилгалогенидом, например, метилиодидом Соединения формулы II могут быть получены с помощью перегруппировки по Куртиусу соединения формулы IV (СН 2 )п IV (СНг )п NH-NH 2 N=C=O НО в которой п соответствует приведенному выше определению, (Ь) получение соединения формулы 1 с помощью реакции соответствующего соединения формулы III (СН 2 )п NHR но в которой п и R соответствуют приведенному выше определению, с дающим карбонил соединением, или (c) получение соединения формулы 1, в которой R представляет метил, путем алкилирования соответствующего соединения формулы 1, в которой R представляет водород, (d) получение одного энантиомера соединения формулы 1 путем выделения данного энантиомера из смеси энантиомеров, и когда это желательно или необходимо, превращение полученного в результате соединения формулы 1 или его соли присоединения кислоты, в его фармацевтически приемлемую соль присоединения кислоты, или наоборот По способу (а) реакция происходит при нагревании соединения формулы II в полярном протонном растворителе, например, воде В процессе (Ь) примеры карбонил-дающих соединений включают карбонилдиимидазол, карбонилдихлорид (фосген) и трифосген Реакция замыкания кольца происходит при нагревании или кипячении с обратным холодильником соединения формулы III с карбонил-диимидазолом в полярном органическом растворителе, таком как тетрагидрофуран, в течение 1 - 4 часов или до завершения реакции Альтернативно фосген может барботироваться через раствор соединения формулы III в органическом растворителе, таком как тетрагидрофуран или толуол, при повышенной температуре в течение 1 - 4 часов или до тех пор, пока реакция не завершится где п соответствуют приведенному выше определению Типичные условия реакции перегруппировки Куртиуса обсуждаются в работе J March, "Advanced Organic Chemistry" (1985) 3rd Edition, стр 984 - 5, однако мы предпочитаем проводить реакцию с помощью обработки соединения формулы IV в воде с нитритом натрия и нагревания приблизительно до 85°С в течение приблизительно 1 часа Соединение формулы IV не выделяется, и реакция циклизации, описанная в способе (а), протекает непосредственно in situ Соединения формулы IV могут быть получены с помощью обработки соединения формулы V, где п соответствуют приведенному выше определению, a R' представляет алкильную или арильнуюгруппу, безводнымгидразином Реакция может проводиться в полярном протонном растворителе при температуре окружающей среды в течение 4 - 1 2 часов Мы предпочитаем, чтобы R' представлял алкил, обычно, метил, этил или трет-бутил Соединения формулы V могут быть получены по реакции соединения формулы VI, IV где п соответствуют приведенному выше определению, с эфиром уксусной кислоты в присутствии н-бутиллития Эфир уксусной кислоты (например, трет-бутиловый или этиловый эфир) сначала обрабатывают н-бутиллитием при - 78°С, и реакция протекает при добавлении соединения формулы VI и нагревания до комнатной температуры Продукт получают пригашений реакции во 54375 дои Соединения формулы VI либо известны, либо могут быть получены с использованием известных способов Соединения формулы III могут быть получены с помощью реакции соединений формулы VII VII где п соответствуют приведенному выше определению, с аммиаком или метиламином Данная реакция может проводиться в стандартных условиях, например, путем объединения реагентов в полярном протонном растворителе при температуре окружающей среды или повышенной температуре Соединения формулы III могут быть также получены с помощью реакции соединения формулы VI триметилсилилцианидом (МезЄіС N) С последующим восстановлением, например, литийалюминийгидридом или Никелем Рене Условия реакции известны специалистам в данной области Соединения формулы VII могут быть получены из соответствующих соединений формулы VI с использованием одного из реагентов, хорошо известных в области получения оксиранов из кетонов (см , например, реакции, на которые имеются ссылки в работе J March, "Advanced Organic Chemistry" (1985) 3rd Edition, стр 1161) Мы установили, что триметилсульфоксонийиодид является подходящим реагентом, и реакция может проводиться в ДМСО при температуре между комнатной и 80°С в течение периода времени до 2 часов или до тех пор, пока реакция не завершится Соли присоединения кислоты соединений формулы 1, которые могут быть упомянуты, включают соли минеральных кислот, например, хлористоводородные и бромистоводородные соли, и соли, образуемые с органическими кислотами, такими как соли муравьиной, уксусной, яблочной, бензойной и фумаровой кислот Соли присоединения кислот соединений формулы 1 могут быть образованы по реакции свободного основания или соли, их энантиомера или защищенного производного, с одним или более эквивалентами соответствующей кислоты Реакция может осуществляться в растворителе или среде, в которой соль не растворима, или в растворителе, в котором соль растворима, например, воде, диоксане, этаноле, тетрагидрофуране или диэтиловом эфире, или в смеси растворителей, которые могут удаляться в вакууме или с помощью сушки вымораживанием Реакция может быть четатетическим процессом или может проводиться на ионообменной смоле Соединения изобретения и промежуточные продукты могут выделяться из их реакционных смесей с помощью стандартных приемов Соединения формулы 1 существуют в таутомерией или энантиомерной формах, все из кото 8 рых включены в объем изобретения Различные оптические изомеры могут быть выделены путем разделения рацемической смеси соединений с помощью обычных приемов, например, фракционной кристаллизации или хиральной ВЭЖХ Альтернативно, индивидуальные энантиомеры могут быть получены путем реакции соответствующих оптически активных исходных материалов в условиях реакции, которые не вызывают рацемизацию Промежуточные соединения также существуют в энантиомерных формах и могут использоваться в виде очищенных энантиомеров, рацематов или смесей Соединения изобретения показаны в качестве фармацевтических средств в частности, при лечении или профилактике психотических расстройств и расстройств, связанных с ухудшением интеллекта Примеры психотических расстройств включают шизофрению, маниакальный психоз и маниакально-депрессивный синдром Примеры расстройств или заболеваний, связанных с нарушением интеллекта, включают болезнь Альцгеймера, снижение способности к обучению, недостаточность познавательной функции и расстройства, характеризующиесягиперактивностью и дефицитом внимания Соединения изобретения могут быть также полезны в качестве анальгетиков и при лечении или профилактике болезни Паркинсона и Хартингтона, нейродегенеративных расстройств, при которых имеется потеря холинергических синапсов, синдрома Туретта, депрессии и тревоге или страхе Кроме того, соединения могут быть показаны для лечения или профилактики расстройств, связанных с перелетами на большие расстояния, и для использования с целью прекращения курения В соответствии с еще одним аспектом изобретения, мы представляем соединения изобретения для применения в качестве фармацевтического средства, особенно для лечения и профилактики указанных выше заболеваний или состояний Для указанного выше использования доза, назначаемая к приему конечно используют в зависимости от используемого соединения, способа назначения и желаемого лечения Однако, в целом, удовлетворительные результаты получают, когда соединения изобретения вводят в ежедневной дозе приблизительно от 0,1мг до 20мг на кг массы тела животного, предпочтительно, при назначении дробными дозами от 1 до 4 раз в день в форме средства пролонгированного действия Для человека общая ежедневная доза находится в диапазоне от 5мг до 1400мг, более предпочтительно, от 10мг до 100мг, а формы единичных доз, подходящие для орального применения, включают от 2мг до 1400мг соединения в смеси с твердым или жидким фармацевтическим носителем или разбавителем Соединения формулы 1 и их фармацевтически приемлемые соли, могут использоваться сами по себе или в форме соответствующих лекарственных препаратов для энтерального или парентерального назначения В соответствии с еще одним аспектом изобретения, предоставляется фармацевтическая композиция, включающая предпочтительно менее 80% и более 50% по весу 54375 соединения изобретения в смеси с фармацевтически приемлемым разбавителем или носителем Примеры разбавителей и носителей включают для таблеток и драже лактозу, крахмал, тальк, стеариновую кислоту, для капсул винную кислоту или лактозу, для инъецируемых растворов воду, спирты,глицерин, растительные масла, для свечей натуральные или отвержденные масла или вески Предоставляется также способ получение такой фармацевтической композиции, который включает смешивание ингредиентов В соответствии с еще одним аспектом изобретения, предоставляется использование соединения формулы 1 или его фармацевтически приемлемой соли, в производстве медикаментов для лечения или профилактики одного из указанных выше заболеваний или состояний, и способ лечения или профилактики одного из упомянутых выше заболеваний или состояний, который включает назначение пациенту терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли Соединение формулы IV и соединения формулы III, в которой R представляет метил, являются новыми полезными промежуточными продуктами Таким образом, согласно еще одному аспекту изобретения мы предлагаем соединения формулы IV или их соли Мы также предоставляем соединения формулы III, в которой R представляет метил или их соли Соединения формулы 1 являются агонистами никотиновых ацетилхолиновых рецепторов Без ограничений какой-либо теорией считается, что агонисты рецепторов подтипа L7nAChR (никотиновых ацетилхолиновых рецепторов) должны быть полезными при лечении или профилактике психотических расстройств и расстройств с нарушениями интеллекта, и имеют преимущества над соединениями, которые являются соединениями подтипа или также являются агонистами соединений подтипа L4nAChR Поэтому, предпочтительными являются соединения, которые селективны в отношении подтипа L7nAChR Фармакологическую активность соединений изобретения можно измерить с помощью описанных ниже испытаний или тестов ТЕСТА Анализ на средство с подтипом L7nAChR Связывание 1125-а(-Бунгаротоксина (ВТХ) с мембранамигиппокампа крыс Гиппокампы крысгомогенизируют в 20 объемах холодногогомоге-низационного буфера (ГБ концентрация ингредиентов (мМ) трис(гидроксиметил)аминометан 50, МдСЫ, NaCI 120, KCI 5, рН 7,4) гомогенат центрифугируют в течение 5 минут при ЮООд, надосадочную жидкость сохраняют, а осадок подвергают повторному экстрагированию Надосадочную жидкость, собранную из всех пробирок, центрифугируют в течение 20 минут при 12000д, промывают и повторно суспендируют вгБ Мембраны (30 - 80мкг) инкубируют с 5нМ [1 ]а-ВТХ, 1мг/мл БСА (бычий сывороточный альбумин), испытуемым препаратом, и 10 или 2мМ СаСЬ, или 0,5мМ EGTA этиленгликольбис([3-аминоэтиловый эфир в течение 2 при 21 °С, а затем фильтруют и промывают 4 раза через стекловолоконные фильтры Whatman (толщина С) с использованием коллектора клеток Brandel Для обеспечения минимального количества безрезультатных определений (0,07% общего числа определений в минуту) существенной является предварительная обработка фильтров в течение 3 часов смесью 1% BSA/0,01% PEI (полиэтиленимин) в воде Неспецифическое связывание описывалось как ЮОмкМ (-)-никотина, и специфическое связывание обычно составляло 75% ТЕСТ Б Анализ на сродство с подтипом L4nAChR Связывание [Н ]-(-)-никотина С использованием модифицированной процедуры Martino-Barrows and Kellar (Мої Pharm 31169 - 174, 1987),головной мозг крыс (кору игиппокамп)гомогенизируют как в анализе связывания [1125]ВТХ, центрифугируют в течение 20 минут при 12000д, дважды промывают, а затем повторно суспендируют вгБ, содержащем ЮОмкМ диизопропилфторфосфата Через 20 минут при 4°С мембраны (~ 0,5мг) инкубируют с ЗнМ [Н3]-(-)никотина, испытуемым препаратом, 1мкМ атропина и или с 2мМ СаСЬ, или 0,5мМ EGTA в течение 1 часа при 4°С, а затем фильтруют через стекловолоконные фильтры Whathmad (толщина С) (после предварительной обработки в течение 1 часа 0,5% PEI) с использованием коллектора клеток Brandel Неспецифическое связывание описывалось ЮОмкМ карбахола, а специфическое связывание обычно составляло 84% Анализ данных связывания по тестам А и Б Значения IC50 и псевдохилловских коэффициентов (пн) вычислялись с использованием программы построения нелинейной кривой ALL FIT (DeLean A , Manson P J and Podbard D (1977) Am J Physiol, 235 E97 - E102) Кривые насыщения подгонялись к односайтовой модели с использованием программы нелинейной регрессии ENZF1TTER (Leatherbarrow R J (1987)), получая значения Ко 1,67 и 1,70нМ для лигидандов [1 1 5 ]аВТХ и [Н3]-(-)-никотина соответственно Значения К, оценивались с использованием общего уравнения Cherd-Prusoff К, = [1С50] / ((2 + ([лиганд] / [K D ]) n ) 1n - 1), где величина п = 1 использовалось, когда пн 1,5 Образцы анализировались трижды, и разброс результатов обычно составлял ± 5% Значения К| определялись с использованием 6 и более концентраций препарата По сравнению с соединениями предшествующего уровня техники соединения изобретения имеют преимущество в том, что они могут быть менее токсичными, более эффективными, более длительно действующими, иметь более широкий спектр активности, обладать более сильным действием, вызывать меньше побочных эффектов, более легко всасываться или имеют другие полезные фармакологические свойства Изобретение иллюстрируется следующими примерами ПРИМЕР 1 11 54375 12 Моногидрохлорид спиро[1совсем белого твердого вещества, т пл 289 291 °С 1Н ЯМР (500Мгц, ДМСО) 1,7-1,9 (м, ЗН), азабицикло[2 2 2]октан-3,5'-оксазолидин]-2'-она р 2,05 (м, 1Н), 2,25 (шир с, 1Н), 3,15 (м, ЗН), 3,2-3,5 (а) Бутиловый эфир 2-(3-Гидрокси-1(м, 1Н), 3,4 - 3,6 (м, ЗН), 3,6 (д , 1Н), 7,75 (с , 1Н), азабицикло[2 2 2]окт-3-ил)уксусной кислоты 10,95 (шир с, 1Н) К раствору диизопропиламина (6,7мл) в тетрагидрофуране (ТГФ) (20мл) при 0°С добавляют ПРИМЕР 2 2,ЗМ HBuLi (20мл) Реакционную смесь перемеМоногидрохлорид (+) - и (-)-Спиро[1 шивают в течение 40 минут, а затем охлаждают азабицикло[2 2 2]октан-3,5-оксазолидин]-2'-она до - 78°С К данной смеси по каплям добавляют К раствору соединения примера 1 (3,8г) в абраствор трет-бутил ацетата (6,4мл) в 10мл ТГФ и солютном этаноле добавляют раствор дибензоилперемешивание продолжают дополнительно в L-винной кислоты (7,474г) в абсолютном этаноле, течение 15 минут К смеси по каплям добавляют и к смеси добавляют небольшую порцию этилацехинуклидин-3-он (свободное основание) (5,0г) в тата После стояния в течение часа образовалось ТГФ (15мл),и смеси дают подогреться до 0°С в твердое вещество, которое отфильтровывают и течение 1 часа К данному раствору добавляют фильтрат оставляют Твердое вещество раствоводу (100мл), раствор дважды экстрагируют хлоряют в водной гидроокиси натрия, экстрагируют роформом, и комбинированные экстракты однохлороформом 3 х 50мл, сушат над MgSO4, фильткратно промывают солевым раствором Полученруют и концентрируют в вакууме Остаток раствоный раствор сушат над MqSO4, фильтруют и ряют в метаноле, и через смесь барботируют гасушат в вакууме, получая 9,53г указанного в подзообразный HCI до тех пор, пока рН не будет ниже заголовке соединения в виде не совсем белого 2 К раствору добавляют диэтиловый эфир, и потвердого вещества лученное в результате белое твердое вещество отфильтровывают, получая 0,63г (+)-энантиомера, (Ь)гидразид 2-(3-Гидрокси-1 точка плавления > 250°С азабицикло[2 2 2]окт-3-ил)уксусной кислоты К раствору 3,5г соединения стадии (а) в 15мл метиленхлорида добавляют трифторуксусную кислоту (39мл), и смесь перемешивают при температуре окружающей среды в течение трех часов Затем смесь концентрируют в вакууме Остаток растворяют в метаноле (30мл) и добавляют 18М H2SO4, (Змл), и смесь перемешивают в течение ночи Затем смесь выливают в раствор карбоната натрия в воде, экстрагируют три раза хлороформом, сушат над MqSO4, фильтруют и концентрируют в вакууме, получая желтое твердое вещество Твердое вещество растворяют в метаболе (10мл), и к данному раствору добавляют гидразин (2мл), и затем смесь нагревают до кипения с обратным холодильником в течение одного часа Затем смесь концентрируют в вакууме Полученное твердое вещество суспендируют в толуоле (50мл) и в течение двух часов нагревают до дефлегмации в аппарате, снабженном ловушкой Dean-Stark Затем реакционной смеси дают охладиться, и продукт отфильтровывают, получая 1,82г указанного в подзаголовке соединения в виде рыжевато-коричневого твердого вещества [ 250°С [a] D = 61,473 (с = 0,7727, СНзОН) (с) Моногидрохлорид Спиро[1 азабицикло[2 2 2]октан-3,5'оксазолидин]-2'-она К раствору 0,91г соединения стадии (Ь) в воде (7мл) добавляют 12М НСІ, получая раствор с рН = 1 Смесь охлаждают до 0°С и добавляют О°С раствор нитрата натрия (0,33г) в 5мл воды Раствор перемешивают при 0°С в течение двадцати минут, и затем еще в течение двадцати минут нагревают до 70°С Реакционную смесь охлаждают до температуры окружающей среды, подщелачивают 50% NaOH / Н2О Раствор насыщают NaCI и экстрагируют хлороформом 4 х 20мл, сушат над MgSO4, фильтруют и концентрируют в вакууме Остаток растворяют в метаноле, и через смесь барботируют газообразный HCI до тех пор, пока рН не будет ниже 2 К раствору добавляют диэтиловый эфир, и полученное в результате белое твердое вещество отфильтровывают, получая 0,73г указанного в заголовке соединения в виде не ПРИМЕРЗ Моногидрохлорид Спиро[1азабицикло[2 2 1]гептан-3,5'-оксазолидин-2'-она] (а) Этиловый эфир З-Гидрокси-1азабицикло[2 2 1]гепт-3-ил уксусной кислоты К охлажденному (- 78°С) раствору диизопропиламина (2,65мл, 0,0203 моля) в тетрагидрофуране (150мл), в течение одной минуты по каплям добавляют 2,5М HBULI В гексанах (8,1мл, 0,0203 моля) Через десять минут, в течение одной минуты по каплям добавляют этилацетат (1,97мл, 0,0203 моля) Еще через десять минут, в течение пяти минут по каплям добавляют 1азабицикло[2 2 1]гептан-3-он (1,5г, 0,0135 моля, полученный по методу, описанному в J Спет Soc Спет С о т т и п 1618, 1988) в тетрагидрофуране (25мл) Через двадцать пять минут холодную баню удаляют, и смесь оставляют для подогревания до температуры окружающей среды К смеси 14 54375 вают, получая указанное в подзаголовке в виде масла желтого цвета (37,6г, 77%) (b) 3-Гидрокси-1-азабицикло[2 2 2]окт-3-ил метиламинометан К раствору 25мл (0,72 моля) конденсированного метиламида в 75мл метанола добавляют 10,2г (0,073 моля) продукта стадии (а) и раствор перемешивают при комнатной температуре в течение 16 часов Реакционную смесь концентрируют при пониженном давлении и получающееся масло растворяют в 75мл СНСІз и концентрируют, получая 12,4г (100%) указанного в подзаголовке соединения в виде масла (c) Моногидрохлорид 3'-Метил-спиро[1азабицикло[2 2 2]октан-3,5'-оксазолидин-2'-она] К раствору продукта стадии (Ь) (8,0г, 0,47 моля) в 100мл ТГФ добавляют 9,15г (0,056 моля) карбонилдиимидазола, и смесь нагревают с обратным холодильником в течение 3 часов Затем в) Моногидрохлорид Спиро[1 реакционную смесь охлаждают до комнатной темазабицикло[2 2 1]гептан-3,5'окса-золидин-2'-она] пературы и концентрируют в вакууме Остаточное К охлажденному (0°С) раствору продукта стамасло растворяют в 200мл СН2СІ2, раствор продии (Ь) (1,11г, 0,006 моля) в воде (50мл) с рН, домывают НгО (1 х 100мл), солевым раствором (1 х веденному до 1 концентрированной НСІ, в течение 50мл), пушат над MgSO4 и упаривают, получая двух^ минут по каплям добавляют водный раствор желтое твердое вещество Данное вещество расNa NO 2 (0,455г, 0,0066 моля) После завершения творяют в 50мл смеси метанол / изопропанол 1 добавления, холодную баню удаляют, и смесь в 1, подкисляют НСІ в метаноле, а осадок собирают, течение одного часа нагревают до 85°С Смеси промывают холодным метанолом и сушат, полудают охладиться до температуры окружающей чая 5,6г (51%) целевого соединения в виде бессреды, и подщелачивают до рН 10 смесью 50% цветного твердого вещества, т пл 305 - 307°С 1Н NaOH / Н2О Смесь три раза экстрагируют хлоЯМР (500Мгц, ДМСО) 1,8 (м , ЗН), 2,05 (м , 1Н) роформом (150мл), сушат над MgSO4, фильтруют 2,25 (шире, 1Н), 2,75 (с, ЗН), 3,1 - 3,2 (м , ЗН), и концентрируют в вакууме Остаток подвергают 3,25 - 3,35 (м , 1Н), 3,4 - 3,5 (м , 1Н), 3,5 - 3,6 (м , флэш-хроматографии на силикагеле с использо2Н), 3,7 (д , 1Н), 10,9 (шир с, 1Н) ванием смеси мета-нол / этилацетат [1 1] Соот 13 добавляют воду (100мл), а затем хлороформ (250мл) Органический слой отделяют, а водный слой экстрагируют хлороформом (100мл) Объединенные органические экстракты сушат над MgSO4, фильтруют и концентрируют в вакууме, получая указанное в подзаголовке соединение (1,12г) Ь) Гидразид З-Гидрокси-1 азабицикло[2 2 1]гепт-3-ил уксусной кислоты К раствору продукта стадии (а) (1,12г, 0,0056 моля) в метаноле (20мл) при комнатной температуре добавляют безводный гидразин (1,76мл, 0,056 моля), и смесь перемешивают в течение ночи Смесь концентрируют в вакууме и дважды азеотропно отгоняют с толуолом (100мл) с помощью нагревания до дефлегмации в аппарате, снабженном ловушкой Дина-Старка с получением указанного в подзаголовке соединения (1,11 г) ветствующие фракции собирают и концентрируют Остаток затем растворяют в хлороформе, фильтруют и концентрируют в вакууме Остаток растворяют в смеси этилацетат / метанол и обрабатывают насыщенным раствором HCI / этилацетат до тех пор, пока рН раствора не будет 250°С 1 Н ЯМР (500Мгц, ДМСО) 1,95 (м , 1Н), 2,1 (м , 1Н), 3,0 (с , 1Н), 3,2 3,4 (м , 5Н), 3,5 - 3,6 (м , ЗН), 7,8 ( с , 1Н), 10,6 (шир с , 1Н) ПРИМЕР 4 Моногидрохлорид 3'-Метил-спиро[1 азабицикло[2 2 2]октан-3,5'-оксазолидин-2'-она] (а) Спиро-1-азабицикло[2 2 2]октан-3-оксиран К суспензии гидрида натрия (11,6г 60% масляная дисперсия, трижды промытая гексаном 0,35 моля) в 600мл ДМСО, по частям добавляют 101,4 (0,35 моля) триметилсульфоксоний иодида После уменьшения выпадения газа, смесь перемешивают при комнатной температуре в течение 30 минут В течение 30-минутного периода по каплям добавляют раствор хинуклидин-3-она (44г, 3,35 моля) в 200мл ТГФ, и смесь в течение 1 часа нагревают до 70 - 80°С Реакционную смесь охлаждают до комнатной температуры, выливают в 1л ледяной воды, и водный раствор экстрагируют СНСІз, (4 х 300мл) Органические экстракты промывают НгО (3 х 500мл), насыщенным рассолом (1 х 300мл), сушат над MqSO4, и раствор упари ПРИМЕР 5 Соединения моногидрохлорид спиро[1азабицикло[2 2 2]октан-3,5'-оксазолидин]-2'-она, моногидрохлорид (+ )-спиро[1 азабицикло[2 2 2Іоктан-3,5'-окса-золидин]-2'-она, моногидрохлорид (-)-спиро[1 азабицикло[2 2 2]октан-3,5'-окса-золидин]-2'-она, монохлорид спиро[1-азабицикло[2 2 1]гептан3,5'-оксазолидин-2'-она] и моногидрохлорид З'-метил спиро[1 азабицикло[2 2 2]октан-3,5'-оксазолидин-2'-она] испытывались в соответствии с описанным выше тестом А и дали значения сродства связывания (К|) менее ЮмкМ, что указывает на их ожидаемую полезную терапевтическую активность Соединения моногидрохлорид спиро[1азабицикло [2 2 2]октан-3,5'-оксазолидин]-2'-она, моногидрохлорид (+)-спиро[1 азабицикло[2 2 2]октан-3,5'-окса-золидин]-2'-она, моногидрохлорид (-)-спиро[1 азабицикло[2 2 2]октан-3,5'-окса-золидин]-2'-она, моногидрохлорид спиро[1азабицикло[2 2 1]гептан-3,5'-окса-золидин-2'-она] и моногидрохлорид З'-метил спиро[1 азабицикло[2 2 2]октан-3,5'-оксазолидин-2'-она] испытывал ись в соответствии с описанным выше тестом В и дали значения К|, по крайней мере, в 1,6 раза больше, чем значения, которые даны в тесте А, что указывает на то, что они обладают желаемой избирательностью 15 54375 Підписано до друку 03 04 2003 р 16 Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюSpiro-azabicyclic compounds, processes for producing thereof and pharmaceutical composition
Автори англійськоюMurrey Robert John
Назва патенту російськоюСпиро-азабициклические соединения, способы их получения и фармацевтическая композиция
Автори російськоюМюррей Роберт Джон
МПК / Мітки
МПК: C07D 453/00, A61K 31/424, A61P 25/24, A61P 25/28, C07D 498/20, A61K 31/439, A61P 25/26, C07D 487/08, A61K 31/42, A61P 25/22, A61P 25/18, A61P 43/00, A61P 25/04
Мітки: композиція, сполуки, способи, фармацевтична, одержання, спіро-азабіциклічні
Код посилання
<a href="https://ua.patents.su/8-54375-spiro-azabiciklichni-spoluki-sposobi-kh-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Спіро-азабіциклічні сполуки, способи їх одержання та фармацевтична композиція</a>
Попередній патент: Спосіб виготовлення модуля мікросхемної карти для безконтактних мікросхемних карт
Наступний патент: Механічний яс
Випадковий патент: Спосіб отримання 2-ариліден-п-ментан-3-онів