Мікроелементна композиція, що має гемопротекторну і гемостимулюючу активність
Номер патенту: 65365
Опубліковано: 15.07.2005
Автори: Мисливець Світлана Онисимівна, Киричок Лора Михайлівна, Григор'єва Ганна Савівна, Серединська Наталія Миколаївна, Мохорт Микола Антонович, Узленкова Наталія Євгенівна, Стефанов Олександр Вікторович, Конахович Наталія Филимонівна
Формула / Реферат
1. Спосіб електронно-променевого переплаву губчастого активного металу, що включає подачу його на попереднє нагрівання в зону дії електронних променів з наступною плавкою в проміжну ємність, що має вигляд компактного блока криці круглого перерізу, рафінування металу в проміжній ємності, злив рідкого металу в кристалізатор і формування в ньому злитка, який відрізняється тим, що губчастий активний метал подають на попереднє нагрівання і плавку у вигляді компактного блока плоского перерізу, причому при попередньому нагріванні блока підтримують його температуру на рівні температури, що забезпечує дегазацію металу і випаровування летких домішок, і робочий тиск у вакуумній камері не вище 13 Па, а плавку ведуть при робочому тиску не нижче ![]() Па, при цьому швидкість випаровування (
Па, при цьому швидкість випаровування (![]() ) основи губчастого металу задають зі співвідношення
) основи губчастого металу задають зі співвідношення ![]() , де
, де ![]() - маса компактного блока, кг;
- маса компактного блока, кг; ![]() - маса злитка, кг;
- маса злитка, кг; ![]() - сумарна площа випаровування, м2;
- сумарна площа випаровування, м2; ![]() - тривалість плавки, год.
- тривалість плавки, год.
2. Спосіб за п. 1, який відрізняється тим, що попереднє нагрівання компактного блока губчастого активного металу здійснюють електричними нагрівачами, зокрема в індукторі або прохідній муфельній печі.
Текст
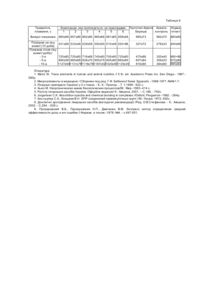
Винахід стосується нового лікарського засобу, а саме - композиції певних співвідношень іонів есенціальних мікроелементів (заліза(lll), цинку(ll), марганцю(ll), міді(ll), кобальту(ll), хрому(lll) і N-2,3діметилфенілантранілової кислоти у вигляді їх комплексів, а також селену(ІY), молібдену(YІ) і ванадію(Y) у вигляді їх кисневих солей у присутності відомих допоміжних речовин, яка має гемопротекторну і гемостимулюючу активність. Винахід призначений для застосування у фармації і медицині. Актуальність створення нових засобів для лікування захворювань системи крові обумовлена визнанням її вирішальної ролі у підтриманні гомеостазу і формуванні неспецифічних і специфічних реакцій захисту організму людини в умовах впливу різних негативних факторів. Разом з тим, запити профілактики і фармакотерапії системи крові до сьогодні випереджають реальні можливості їх задоволення, оскільки більшість відомих гемопротекторів не адекватні поліморфному характеру патологічних змін гемопоезу за умов дії на організм сильних зовнішніх подразнювачів. Внаслідок цього ці засоби не сповна відповідають цілеспрямованої корекції стану різних клітинних форм системи крові, тобто не мають оптимальну гемопротекторну і гемостимулюючу активність. Ці недоліки характерні для більшості препаратів на основі індивідуальних сполук і композицій, реалізованих як гемопротектори. На всіх етапах гепомоезу ключове місце належить ферментним системам, у формуванні яких визначальну роль відіграють есенціальні мікроелементи (т.з. біометали), які містяться в активних центрах ферментів або активують їх [1,2]. На молекулярному рівні аномалії кровотворення розглядаються як наслідок ферментного дискомфорту, пов’язаного із дисбалансом вмісту і стану мікроелементів [1]. Тому засоби, які містять мікроелементи, якнайбільше відповідають критеріям фізіологічної ефективності як такі, що здатні зберегти від небезпечних впливів основний плацдарм кровотворення та активізувати його регенераторні властивості. Тим не менш, відповідність широко відомих вітамінно-мікроелементних препаратів запитам гемотерапії неоднозначна через маскувальний ефект вітамінів або небажаність їх введення при деяких патологіях (наприклад, в лікарських схемах хіміо- та променевої терапії). При цьому реальний діапазон "власне мікроелементних" фармакологічних агентів досі вкрай обмежений. За прототип цього винаходу обрано відомий лікарський засіб "Краплі Береш Плюс", який містить низку ессенціальних мікроелементів і склад якого відповідає наступному співвідношенню компонентів (мас.ч.): Іон заліза(ll) 2.0 (за рахунок заліза сірчанокислого (10.0) семиводного) Іон міді(ll) 0.25 (за рахунок міді сірчанокислої (1.0) п’ятиводної) Іон цинку(ll) 1.1 (за рахунок цинку сірчанокислого (5.0) семиводного) Іон кобальту(ll) 0.025 (за рахунок кобальту хлориду (0.1) шестиводного) Іон марганцю(ll) 0.31 (за рахунок марганцю сірчанокислого (0.94) одноводного) Іон нікелю(ll) 0.11 (за рахунок нікелю сірчанокислого (0.48) шестиводного) Іон молібдену (YI) 0.19 (за рахунок амонію (0.35) молібденовокислого чотириводного) Іон ванадію(Y) 0.12 (за рахунок амонію ванадієвокислого (0.28) мета) Магній сірчанокислий семиводний 4.1 Натрію фторид 0.2 Калію-натрію виннокислий 2.0 чотириводний Натрію етилендіамінтетраоцтовий 3.0 двоводний Кислота борна 0.6 Кислота аскорбінова 0.3 Кислота бурштинова 0.5 Кислота винно-кам’яна 0.5 Кислота сірчана 98% 2.76 Гліцин 2.3 Гліцерин 87% 6.0 Вода дистильована фармакопейна до 1000 Краплі Береш виробництва AT "Береш-Киів" (Україна) ФФ "Береш" (Угорщина) відомі як лікарський засіб для компенсації недостатності мікроелементів і підвищення резистентності організму, в т.ч. для протекції системи крові [3]. Препарат "Краплі Береш Плюс" обраний прототипом заявляемого об’єкту як найбільш близький його аналог за сумою ознак, а саме: суттєвою близькістю складу мікроелементної компоненти (іони заліза, цинку, марганцю, міді, кобальту, молібдену, ванадію) і специфікою фармакологічної активності. Фармакотерапевтична активність прототипу - Крапель Береш Плюс проявляється внаслідок включення до його складу надзвичайно широкого числа інгредієнтів (всього - 19), у т.ч. 8-й солей мікроелементів, 3-х солей натрію і магнію та 6-й кислот. Крім очевидних фармакоекономічних недоліків підвищеної інгредієнтності і відповідної складності процесу отримання прототипу, останній містить багато неорганічних та органічних кислот (протиіонів) різної природи, у т.ч. велику кількість сірчаної кислоти. Вказаний факт диктується вимушеністю підтримання розчинної форми мікроелементів, що введені до прототипу виключно у вигляді простих солей, для яких характерна здатність до гідролізу і відповідна неефективна біодоступність [4]. Відзначений "супер-розширений" склад та високий вміст деяких інгредієнтів у складі Крапель Береша Плюс можуть обумовити відносне зниження нешкідливості прототипу з точки зору вимог до сучасних гемопротекторів (особливо з урахуванням рекомендованих для людини високих доз - 8мл/день - та тривалого часу приймання препарату). Це стосується, перш за все, надзвичайно високої кислотності препарату (сертифіковане значення рН крапель від 1.8 до 2.4), присутності етилендіамінтетраоцтової кислоти (токсикологічні наслідки тривалого застосування останньої, як й інших представників т.з. "комплексонів", є неоднозначними), а також невідповідності складу прототипу принципу досягнення оптимального співвідношення "успіх лікування/ризик лікування" через відому кардіо- або гепатотоксичність баластних іонних форм мікроелементів (залізо, мідь) із низькою біодоступністю (т.з. гісто хімічна реакція Перлса). Слід відзначити, що на тлі широкого компонентного дизайну Крапель Береш Плюс у їх складі відсутні деякі важливі мікроелементи, які вважаються незамінними для формування системи антиоксидантного захисту (наприклад, селен і хром). Відзначені фактори є недоліками композиції препарату-прототипу, які знижують рівень його фармакотерапевтичної активності як лікарського, у т.ч. - гемопротекторного і гемостимулюючого агента, та обмежують діапазон його безпечного застосування для різних контингентів пацієнтів. Задачею винаходу є підвищення рівня гемопротекторної і гемостимулюючої активності мікроелементним композиційним засобом, який виявляє ці ефекти і має високу нешкідливість. Реалізація цієї задачі досягається запропонованою композицією, яка містить іони мікроелементів (Fe(III), Ζn(ll), Μn(ll), Сu(ll), Со(ll), Сr(lll)) і N-2,3-діметилфенілантранілової кислоти у вигляді комплексів останньої із цими металами, а також Se(IY), Mo(YI) і V(Y) у вигляді їх кисневих солей (натрію селенокислого і натрію молібденовокислого, амонію ванадієвокислого мета). Присутність у цій композиції сукупності 9-й ессенціальних мікроелементів при включенні 6-й з них у комплекси із N-2,3-ддметилфеншантраншовою кислотою (субстанція лікарського засобу "мефенамінова кислота", далі - HL) визначає можливість вирішення задачі винаходу. Далі наводимо конкретні приклади створення композиції, що пропонується. При її створенні використані фармакопейні "Кислота мефенамінова" (ЄФ 1999, стор. 671) і відомі допоміжні речовини, а також стандартизовані солі мікроелементів марки "ч.д.а.". Для коректної оцінки рівня фармакологічної активності заявляємої композиції, порівняно із прототипом, в якості останнього використано готову лікарську форму "Крапель Береш Плюс" відомого складу у флаконах по 30мл, №1, виробництва ФФ "Береш" (Угорщина), зареєстровану в Україні (реєстраційне посвідчення №3535 від 23.07.98) як лікарський засіб [5]. Приклад 1. Заявляємий об’єкт. У реактор вміщують 9.0л дистильованої води і 2кг мефенамінової кислоти, додають 4.5л водного розчину гідроксиду натрію, який містить 330г 98% NaOH і перемішують до розчинення кислоти HL (розчин має бути трохи мутним). До отриманого розчину при перемішуванні одномоментно додають суміш водних розчинів хлоридів металів: 1.61л 0.7Μ FeCl3, 1.99л 0.7Μ ZnCl2, 0.48л 0.7Μ MnCl2, 0.45л 0.5Μ CuCl2, 52мл 0.5Μ СоСl2 і 60мл 0.5Μ СrСl3. Осад, що виділився, витримують протягом 30хв для забезпечення повноти реакції. Після цього отриману масу вміщують на лотки і висушують в сушильній шафі при 60 (±5)°С до кінцевої вологи 10 (±2) %. Висушену масу пропускають крізь гранулятор з отвором 2мм і переносять до попередньо підігрітого до 45 (±5)°С гранулятора типу "Glatt". У гранулятор додають допоміжні речовини: 2.0кг цукрової пудри і 7.1л водного 1% крохмального клейстеру, до якого внесено 9г натрію додецилсульфату. Гранулюють протягом 4 годин до утворення гранул із кінцевою вологістю 1-3% (гранулят 1). У другий гранулятор типу "Glatt", до якого завантажено 260г лактози (цукор молочний), вміщують 0.5л водного розчину, який містить 2.44г натрію селенокислого (98%), 3.22г натрію молібденовокислого (99.5%) і 0.67г амонію ванадієвокислого мета, а також 8г цукрового піску. Суміш гранулюють до утворення гранул із кінцевою вологістю 1-3% (гранулят 2). У реактор із перемішуванням вміщують грануляти 1 і 2 та опудрюють допоміжними речовинами - 195г крохмалю картопляного, 28г аеросилу та 59г кальція стеарату до утворення однорідного цільового продукту. Приклад 2. Заявляємий об’єкт. Цільовий продукт - композицію, одержану згідно із описом за прикладом №1, відомим способом вміщують у стандартні тверді желатинові капсули по 250мг/капсула. Відхилення за масою окремих капсул не перевищує ± 10%. В прикладах №3-6 заявляєму композицію отримували із дотриманням методів та прийомів відповідно прикладу №1, однак змінюючи співвідношення інгредієнтів. Зміни відображено у таблиці 1. Цільовий продукт, який одержано за описаним способом, є гранульованим порошком темно-фіолетового кольору із вкрапленнями у розсипу або у твердих желатинових капсулах (приклад №2). Вихід продукту складає 93-95% (втрати тільки механічні). Для проведення якісної і кількісної ідентифікації продукт попередньо розтирали у ступці до стану порошку (вміст капсул за прикладом №2 перед цим вивільняли з оболонок). Ідентифікацію здійснено за фізикохімічними характеристиками самої композиції, продуктів її "мокрого озолення" і екстрагування водою або органічним розчинником, а також твердого залишку після екстрагування. Визначення вмісту мікроелементів проведене методом атомно-адсорбційної спектроскопії (ААС) після "мокрого озолення" цільового продукту, а також у його екстрактах у воді та органічних розчинниках і у твердому залишку. При визначенні заліза, цинку, марганцю, міді, кобальту, хрому, молібдену і селену використано режим полум’яної атомізації, причому для селену - з боргідридною приставкою, а ААС процедура для ванадію передбачала режим електротермічної атомізації. Довжини хвиль детектування складали (нм): 248.3, 279.6, 213.8, 324.8, 240.7, 357.3, 313.3, 318.4 і 196.0 для заліза, цинку, марганцю, міді, кобальту, хрому, молібдену, ванадію і селену, відповідно. Якісний і кількісний аналіз вмісту N-2,3-діметилфенілантранілової кислоти проведено УФ-спектроскопічним методом за характеристичним поглинанням екстракту цільового продукту у діметилформаміді, підкисленого 1Μ хлористоводневою кислотою, при довжині хвилі 351 (± 2) нм у порівнянні із стандартним розчином фармакопейної кислоти. Для ідентифікації стану мікроелементів (Fe, Ζn, Μn, Сu, Со, Сr) у вигляді їх комплексів із кислотою HL залучено низку незалежних спектральних методів. Визначення іонів мікроелементів проведено на АА-спектрометрі Perkin-Elmer 3110. Електронні спектри у видимому та УФ- діапазоні реєстрували на приладі Specord-Uv-VIS, спектри ЕПР - на приладі Varian-MX (-180°С), ІЧ спектри - на приладі UR-20 (у таблетках КВr). Встановлено (таблиця 2) повний кількісний перехід усіх введених активних компонентів до цільового продукту при достовірному збереженні їх масового співвідношення відносно вихідного (крім води, що видаляється при висушуванні, та механічних втрат). При цьому зберігається нативність селену(ІY), молібдену(YІ) і ванадію(Y) у вигляді їх введених кисневих солей. Введені метали-мікроелементи Fe, Zn, Μn, Сu, Со і Сr та N-2,3-діметилфеніл-антранілова кислота кількісно переходять із продукту до екстрактів в органічних розчинниках (діметилформаміді або хлороформі) і не детектуються у водному екстракті та твердому залишку. Ці мікроелементи і кислота HL також не змінюють вихідного масового співвідношення, ступеню окислення та ідентифікуються у формі їх комплексів MLn. Про існування у продукті цих комплексів свідчать: - стабільний інтенсивний червоно-фіолетовий колір його екстрактів в органічних розчинниках; - розміщення смуг в ІЧ спектрах композиції (n cooas » 1600см -1; n coos » 1400см -1) та електронних спектрах (інтенсивна смуга при 565нм з плечем при 660-680нм у спектрі відбиття композиції; смуга при 465нм у спектрах поглинання екстракту в діоксані), характерне для індивідуальних комплексів цих же мікроелементів з N-2,3-діметилфенілантраніловою кислотою і для комплексів d-металів у кисневому оточенні октаедричного типу, у цілому [6]; - спектри ЕПР заявляемого продукту і його екстракту у діоксані із сигналами, які за положенням і формою характерні для парамагнітних комплексів Fe(lll), Мn(ll), Сu(ll), Со(ll) і Сr(lll) з кисеньвміщуючими лігандами [7], у т.ч. - для індивідуальних комплексів цих же мікроелементів з N-2,3-діметилфенілантраніловою кислотою. Таким чином, заявляємий об’єкт є композицією іонів металів Fe(lll), Ζn(ll), Μn(ll), Сu(ll), Со(ll), Сr(lll) та N2,3-діметилфенілантранілової кислоти у вигляді її комплексів із цими металами, а також селену(ІY), молібдену(YІ) і ванадію(Y) у вигляді їх кисневих солей у присутності відомих допоміжних речовин при масовому співвідношенні компонентів, яке вказано у таблиці 2. Якщо вихідні співвідношення компонентів відрізняються від означених у прикладах 1-4, деякі із фізико-хімічних характеристик продукту зазнають певних змін. Конкретно, для прикладу №6 встановлена присутність невеликих кількостей Fe(III), Ζn(Π), Мn(ll) і Сu(ll) (Со(ll) і Сr(lll) - слідових кількостей) у водному екстракті з цільового продукту з одночасною зміною деяких спектральних характеристик (у т.ч. уширення смуги 565нм у спектрі відбиття), а для прикладу №5 - присутність слідів вільної кислоти HL (короткохвильовий зсув n coo у ІЧ спектрі). Це дозволяє вважати, що за межами співвідношень інгредієнтів, зазначених прикладами №1-4, кінцевий продукт може містити домішки гідроксосполук вказаних металів-мікроелементів або незв’язаної у комплекс кислоти HL. Капсулювання гранульованого цільового продукту не обумовлює жодних змін його фізико-хімічних властивостей продукту (порівн.. приклади №1 та №2). Відповідно до задачі винаходу, оцінка ефективності заявляємої мікроелементної композиції проведена на підставі визначення її гемопротекторної і гемостимулюючої активності в моделях порушень гемопоезу різної етіології у порівнянні із прототипом - мікроелементним лікарським засобом "Краплі Береш Плюс". Вплив цих продуктів на стан системи кровотворення оцінено в наступних експериментальних моделях [8]: - при залізодефіцитній анемії, викликаній комбінованою дією хронічної крововтрати і комплексоутворювача - дефероксаміну, який зв’язує і виводить залізо; - при гемолітичній анемії, викликаній гемолітичним токсином - фенілгідразіном; - при гіпопластичній анемії, викликаній інтоксикацією бензолом; - при пригніченні кровотворення на тлі застосування хіміотерапевтичного алкілуючого засобу "Ембіхін"; - при аномаліях гемопоезу, викликаних іонізуючим опроміненням у моделі променевої терапії. Експериментальну залізодефіцитну анемію створювали у комбінованій моделі внутрішньочеревного введення білим щурам дефероксаміну (десфералу) у дозі 184мг/кг протягом 9 діб на тлі хронічної крововтрати (забір крові із хвостової вени через день у кількості 10% від загальної кількості циркулюючої крові). Композицію, яка заявляється, і засіб-прототип вводили щоденно, починаючи з 2-ї доби після першого кровопускання протягом 10 діб. Експериментальну гемолітичну анемію відтворювали у білих щурів, яким щоденно внутрішньом’язово вводили фенілгідразін у дозі 20мг/кг, раз на добу протягом 4 діб. Заявляєму композицію і засіб-прототип вводили щоденно, починаючи з 2-ї доби після першого введення фенілгідразіну протягом 14 діб. Експериментальну гіпопластичну анемію відтворювали у білих мишей, яким щоденно підшкірно вводили бензол у дозі 1.0мл/кг, раз на добу протягом 10 діб. Заявляєму композицію і засіб-прототип вводили щоденно після останнього введення бензолу протягом 14 діб. Модель хіміотерапії ембіхіном відтворювали за наступною схемою: одноразове внутрішньовенне введення препарату у дозі 0.8мг/кг, що відповідає сумарній дозі для людини (0.5 ЛД50). Заявляєму композицію і засіб-прототип вводили щоденно з 5 доби до і протягом 15 діб після введення ембіхіну. Експериментальну модель променевої терапії відтворювали при загальному рентгенівському опроміненні білих щурів на апараті РУМ-17 при стандартних технічних умовах (поле 40x40см, фільтри 0.5мм Cu+1мм А1) при дозі опромінення по м’яких тканинах 6.2 Гр. Заявляєму композицію і засіб-прототип вводили щоденно, починаючи з 1-ї доби і протягом 14 діб після опромінення. У вибраних моделях активність заявляемого об’єкту і прототипу оцінювали за наступними показниками, які різнобічно характеризують їх гемопротекторні і гемостимулюючі властивості: - показники периферічної крові (гемоглобін, еритроцити, лейкоцити, тромбоцити, гематокріт та ін.); - показники клітинного складу кісткового мозку (показники мієлограми); - показники обміну заліза при залізодефіцитній анемії - вміст заліза, загальна і латентна залізозв’язуюча здатність сироватки крові (ЗЗЗС і ЛЗЗС, відповідно), насиченість залізом трансферину у сироватці крові. Контрольовані характеристики периферічної крові визначали стандартними методами. При визначенні показників кістково-мозкового кровотворення тварин декапітували та відвивали кістковий мозок із стегнової кістки фізіологічним розчином. Об'єктивним показником специфічного впливу заявляемого об’єкту і прототипу на загальний стан анемізованих тварин є резистентність до фізичних навантажень (працездатність), яку визначали за тривалістю плавання з моменту занурення у воду до повного знесилення та осідання на дно. Посудину для плавання заповнювали кип’яченою водою з температурою 27-20°С. Умови експерименту виключали дотик кінцівок тварин до дна або стінок посудини. Для стандартизації навантажень перед плаванням до проксимальної частини хвоста кріпили вантаж, який становив 10% від маси тіла. При визначенні працездатності використано білих щурів в моделі залізодефіцитної анемії, яких лікували композицією, що заявляється, або препаратомпрототипом, починаючи з другого дня після десфералу та крововитрати. В усі х вибраних моделях об’єкти дослідження вводили тваринам всередину через зонд у 1% крохмальному клейстері: композицію, що заявляється у вигляді завису в дозі 25мг/кг; прототип у вигляді крапель в дозі 0.2мл/кг. Інтактні тварини (норма-контроль) і анемізовані тварини (негативний контроль) протягом експериментів отримували крохмальний клейстер за тими ж схемами, що і тварини дослідних гр уп. Для коректної оцінки активності композиції, яка заявляється, щодо анемізованих тварин встановлювали також її нешкідливість за показником гострої токсичності відповідно до методики дослідження середньолетальної дози [9]. Композицію вводили внутрішньошлунково дорослим тваринам трьох видів (білі шури, білі миші, собаки) у 1% крохмальному клейстері в дозах 1260-5000мг/кг. Токсичний ефект враховували протягом 5 діб. ЛД50 заявляемого об’єкту становить для білих мишей 1900мг/кг, для білих щурів - 2240мг/кг, для собак - 2400мг/кг, тобто відповідає класу малотоксичних речовин. При вивченні хронічної токсичності не встановлено негативного впливу заявляємої композиції на динаміку показників функціонального стану органів і систем організму дослідних тварин (щоденне введення білим щурам в дозах 25мг/кг і 125мг/кг протягом 6 місяців), а також тератогенної, ембріотоксичної, місцевоподразнюючої й алергенної дії. За результатами хронічного експерименту не виявлено патологічних змін морфологічного статусу вн утрішніх органів. Таким чином, за даними гострого і хронічного експерименту заявляема композиція, згідно прийнятої класифікації, відноситься до класу малотоксичних речовин з високою нешкідливістю. Це обумовлює доцільність встановлення переваг її специфічних фармакологічних ефектів відповідно до задачі винаходу. В таблицях 3-7 наведено порівняльні дані з активності заявляємої композиції і прототипа, яка виражена у здатності до нормалізації показників системи крові анемізованих тварин в показових моделях порушень гемопоезу різної етіології. Експеримент показав, що при відтворенні вибраних експериментальних моделей реєструються виражені зміни формули периферічної крові і показників мієлограми, характерні для пригнічення кровотворення і стану анемії. В периферічній крові виникає типове зменшення вмісту гемоглобіну і еритроцитів у поєднання із лейкопенією, а також значне викривлення вмісту тромбоцитів. В моделі залізодефіцитної анемії зареєстровано класичні патологічні прояви у вигляді значного падіння вмісту заліза у сироватці крові та її насиченості трансферином на тлі компенсуючого зростання загальної і латентної залізозв’язуючої здатності. У кістковому мозку спостерігаються зміни диференціації клітинних клонів, найбільш показовими наслідками яких є падіння вмісту мієлоцитів і клітин еритрону. Проведені лікувально-профілактичні заходи, незалежно від застосованої моделі анемії, покращують практично всі показники крові, аномально змінені внаслідок анемізації тварин. При цьому чітко виражені переваги гемопротекторного і гемостимулюючого ефектів заявлємої композиції. Інтегрально це проявляється у повній нормалізації важливих показників периферічної крові і кісткового мозку або у стійкій тенденції до такої нормалізації порівняно із негативнім контролем, яка, в середньому, у 1.2-1.3 рази перевищує таку для прототипа. Зокрема, заявляема композиція забезпечує (1.4-1.5)-кратне підвищення вмісту гемоглобіна стосовно анемії-контролю, а прототип - лише у (1.1-1.2) рази. Принциповою перевагою композиції, що заявляється, є фактична нормалізація загальної картини крові, тоді як прототип не забезпечує цього (зокрема, залишаючи вміст гемоглобіну в 1.3 рази нижчим за норму). Показово, що заявляема композиція, на відміну від прототипу, практично нормалізує і баланс обміну заліза при залізодефіцитній анемії (вміст заліза, ЗЗЗС, ЛЗЗС і насиченість залізом трансферину у сироватці крові) (таблиця 3), що свідчить про її вплив на взаємопов'язані складові процесу гемостимуляції. Переваги композиції, що пропонується, стосовно рівня інтегральної гемопротекторної і гемостимулюючої активністі заявляємої композиції особливо виражені в умовах впливу хіміотерапевтичного засобу ембіхін та іонізуючого опромінення (таблиці 6 і 7). На тлі дії цих сильних уражаючих чинників (які спричиняють ембіхінову інтоксикацію і променеву хворобу середнього ступеню, відповідно, із вираженою негативною специфікою щодо системи кровотворення) гемопротекторна і гемостимулююча активність заявляемо! композиції у 1.3-2.2 рази переважає таку для прототипа, а за деякими показниками - до 50 разів(вміст базофілів). При цьому, на відміну від прототипу, можна відзначити нормалізуючий вплив композиції на кістковий мозок, тобто її виражений гемостимулюючий ефект щодо плацдарму кровотворення. Одержано принципові дані, які свідчать про здатність композиції, яка заявляється, не тільки сприяти збереженню працездатності анемізованих тварин на піку анемії (таблиця 8), але й повністю відновити її протягом пост-анемічного періоду. Так, уже через 3-й доби після завершення анемізації резистентність лікованих композицією тварин до фізичних навантажень практично співпадає із такою для інтактних, а у кінці спостереження (10 доба) навіть перевищує її. Активність прототипу за цим показником є значно меншою: поступається заявляємій композиції у 1.6 рази на піку анемії, у 1.5 рази - протягом відновлювального періоду та не досягає вихідного покажчика навіть на 10-у добу після завершення анемізації. За сумою всіх гемокомпетентних показників і впливом на працездатність анемізованих тварин заявляємо композиція має значні переваги перед прототипом - засобом "Краплі Береш плюс". При цьому високий рівень активності заявляємого об’єкту забезпечується меншим набором компонентів, порівняно із прототипом. Максимальна гемопротекторна і гемостимулююча активність та ефект збереження фізичної працездатності досягаються заявляємою композицією за прикладами №1-4, тобто при наступному співвідношенні компонентів (мас.ч.): Іон заліза(lll) 2.4-3.6 Іон цинку(ll) 3.2-4.8 Іон марганцю(ll) 0.64-0.96 Іон міді(ll) 0.56-0.84 Іон кобальту(ll) 0.056-0.084 Іон хрому(lll) 0.056-0.084 Іон селену(ІY) 0.04-0.06 Іон молібдену(YI) 0.056-0.084 Іон ванадію(Y) 0.008-0.012 N-2,3-діметилфенілантранілат іон 76.0-94.0 За межами вказаних співвідношень специфічна фармакологічна активність композиції дещо зменшується (приклад 5) або залишається на рівні, який вже досягнуто при відносно меншому вмісті компонентів (приклад 6). Ефект композиції практично не залежить від обраної лікарської форми: гранульованого порошку (приклади 1, 3 і 4) або капсул (приклад 2). Таким чином, мікроелементна композиція, яка заявляється, забезпечує досягнення більш високого гемопротекторного і гемостимулюючого ефекту, ніж у прототипу - відомого лікарського препарату "Краплі Береш плюс" - на тлі встановленої нешкідливості заявляемого об’єкту. Досягнення високої специфічної фармакологічної активності при оптимальній нешкідливості достовірно обумовлює відповідність заявляємої композиції застосуванню для лікування і профілактики патологій кровотворення різного генезу, у т.ч. в умовах хіміо- та радіотерапії. Приклади створення мікроелементної композиції, яка заявляється Таблиця 1 Компонент 0.7 Μ FeCl3 0.7 Μ ZnCl2 0.7 Μ MnCl2 0.5 Μ CuCl2 0.5 Μ СоСІ2 0.5 Μ CrCl 3 Na2SeО3 Na2MoO4 NH4VO 3 HL NaOH** № прикладу 1 2* 3 4 Об’єм взятого розчину хлориду мікроелементу-металу (мл): 1610 1610 1288 1930 1990 1990 1590 2390 480 480 385 575 450 450 360 540 52 52 42 62 60 60 48 85 Кількість взятих солей мікроелементів (г): 2.44 2.44 1.95 2.93 3.22 3.22 2.57 3.86 0.67 0.67 0.54 0.80 Кількість взятих(г): 2000 2000 1788 2211 330 330 295 365 5 6 1260 1570 360 330 38 50 1960 2415 600 560 65 75 1.76 2.39 0.60 3.17 4.00 1.01 1741 287 2258 373 Примітки: *) Приклад №2 є композицією, створеною за прикладом №1, яку розфасовано у капсули. **) Об’єм водного розчину NaOH однаковий для всіх прикладів і складає 13.5л. ***) Якісний та кількісний склад допоміжних речовин однаковий для всіх прикладів і аналогічний наведеному у прикладі №1. Визначений вміст компонентів у композиції, яка заявляється, і у прототипі (мас.ч.) Таблиця 2 Компонент Fe(III) (±0.02) Zn(II) (±0.02) Mn(II) (±0.02) № прикладу 4 1 2* 3 3.01 4.0 0.80 3.01 4.0 0.80 2.40 3.20 0.64 3.60 4.80 0.96 5 6 2.35 3.15 0.59 3.64 4.86 1.00 Прототип 2.0 1.1 0.31 Cu(II) (±0.02) Co(II) (±0.003) Сr(lll) (±0.003) Se(IY) (±0.003) Mo(YI) (±0.003) V(Y) (±0.002) Ni(II) (±0.002) Кислота HL (±0.05) 0.70 0.07 0.07 0.05 0.07 0.01 85.0 0.70 0.07 0.07 0.05 0.07 0.01 85.0 0.56 0.056 0.056 0.040 0.056 0.008 76.0 0.84 0.084 0.084 0.060 0.084 0.012 94.0 0.51 0.051 0.051 0.036 0.052 0.009 74.0 0.87 0.088 0.088 0.065 0.087 0.015 96.0 0.25 0.025 0.19 0.12 0.11 Примітки: *) Приклад №2 є композицією, створеною за прикладом №1, яку розфасовано у капсули. **) Якісний та кількісний склад допоміжних речовин однаковий для всіх прикладів і аналогічний наведеному у прикладі №1. Порівняльна оцінка активності композиції, яка пропонується, і прототипу за впливом на показники системи крові при залізодефіцитній анемії (10 доба після закінчення введення десфералу, n=6) Таблиця 3 Композиція, яка пропонується, за прикладами: Показник 1 Гемоглобін Еритроцити, Т/л Лейкоцити Моноцити Лімфоцити Тромбоцити Вміст Fe ЗЗЗС ЛЗЗС Насиченість трансферином, % 2 3 4 5 Прототип- Анемія Норма Краплі -інтакт Береша контроль 6 Показники периферійної крові, г/л*: 146±8 145+8 138±8 150±8 130±8 148±8 120+6 103±5 165+12 5.7±0.4 5.8±0.5 5.5±0.4 5.9±0.3 5.1±0.3 5.8±0.4 4.7±0.3 4.5±0.4 6.1±0.3 14.6±0.6 14.0±0.5 14.0±0.7 14.1±0.8 13.6±0.5 14.6±0.7 13.0±0.7 12.0+0.8 13.8±0.9 0.75±0.03 0.70±0.020.67±0.030.75±0.020.62±0.020.72±0.03 0.56±0.04 0.49±0.020.69±0.03 7.5±0.4 7.6±0.4 7.5±0.5 7.3±0.6 7.8±0.3 7.5±0.4 8.1+0.4 8.8±0.4 7.2±0.6 450±41 460±40 465±44 436±25 480±41 460±31 550±36 600±41 420±24 Показники сироватки крові, ммол/л**: 27.8±0.7 28.0±0.6 27.0±0.5 28.2±0.5 23.8±0.7 27.8±1.0 20.4±1.6 16.8±0.5 26.0±0.8 56.3±1.4 56.4±1.5 56.2±1.2 56.0±1.2 57.9±1.4 56.8±1.4 61.3±1.6 68.8±1.6 53.3±1.5 30.3±1.2 30.5±1.4 30.0±1.3 29.2+1.5 33.3±1.2 30.6±1.5 36.1±1.4 42.4±1.7 27.0±1.2 44.8±1.6 44.8±1.7 44.4±1.2 45.2±1.5 43.0±1.1 44.8±1.9 39.5±1.4 35.6±1.3 48.7±1.1 *) г/л - одиниця вимірювання для всіх показників, крім вмісту еритроцитів **) ммоль/л - одиниця вимірювання для всіх показників, крім насиченості трансферином Порівняльна оцінка активності композиції, яка пропонується, і прототипу за впливом на показники системи крові при гіпопластичній анемії (25 доба після введення бензолу, n=6) Таблиця 4 Показник Композиція, яка пропонується, за прикладами: 1 2 3 4 5 6 Гемоглобін Еритроцити, Т/л Лейкоцити Лімфоцити Тромбоцити Показники периферійної крові, г/л*: 146±8 146±6 136±8 146±4 125±8 142±5 7.0±0.3 6.9±0.3 6.7±0.47.1±0.56.0±0.3 6.9±0.4 10.0±0.410.0+0.39.6+0.69.9±0.38.9±0.510.0±0.6 5.1+0.2 5.0±0.1 4.8±0.35.2+0.44.6±0.2 5.0+0.4 380+7 375±10 360±10 383±5 320±11 370±8 Показники кісткового мозку: Мієлоцити нейтрофільні, % Метамієлоцити, % Індекс дозрівання елементів еритр. ряду Прототип Краплі Береша Анеміяконтроль Нормаінтакт 116±5 5.8±0.3 8.3±0.3 4.4+0.1 290±7 100+6 5.3±0.2 7.0±0.2 4.0±0.2 270±10 145±8 7.0+0.2 10.0±0.3 5.2±0.2 385±8 17 16 14 17 12 15 12 9 15 12 12 10 11 9 10 8 6 10 1.0 1.0 0.95 1.0 0.80 0.98 0.80 0.72 0.90 *) г/л - одиниця вимірювання для всіх показників, крім вмісту еритроцитів Порівняльна оцінка активності композиції, яка пропонується, і прототипу за впливом на показники системи крові при гемолітичній анемії (10 доба після введення фенілгідразіну, n=6) Таблиця 5 Показник Композиція, яка пропонується, за прикладами: ПрототипАнеміяКраплі Береша контроль 2 3 4 5 6 Показники периферійної крові, г/л*: 135±7 138±6 136+8 146±5 127±6 140±8 115±5 105±6 1 Гемоглобін Еритроцити, 6.8±0.3 6.9±0.2 6.7±0.4 6.9±0.2 5.9±0.4 6.7±0.3 Т/л Лейкоцити 9.0±0.4 9.2±0.3 9.6±0.6 10.1±0.6 8.3±0.5 9.6±0.3 Еозинофіли 0.20±0.010.20±0.020.18±0.010.20±0.050.15±0.010.20±0.04 Моноцити 0.33±0.010.34±0.020.32±0.020.34±0.030.30±0.040.33±0.01 Лімфоцити 5.8±0.2 5.7±0.3 5.5±0.4 5.3±0.4 6.3±0.2 5.8±0.3 Тромбоцити 420±10 417±7 398±4 400±10 370±12 390±8 5.9±0.3 8.0±0.3 0.12±0.01 0.25±0.01 6.4±0.3 350±10 5.5±0.2 Нормаінтакт 145±8 7.0±0.2 7.0±0.2 10.0±0.3 0 0.18±0.04 0.15±0.01 0.36±0.01 6.7±0.4 5,2±0.4 310±10 400±9 *) г/л - одиниця вимірювання для всіх показників, крім вмісту еритроцитів Порів няльна оцінка актив ності композиції, яка пропонується, і прототипу за в плив ом на показники системи кров і на тлі вв едення ембіх іну (на 15 добу піс ля початку вв едення ембіх іну) (n=10) Таблиця 6 Показник 1 Композиція, яка пропонується, за прикладами: 2 3 4 5 6 ПрототипКраплі Береша Вплив ембіхінуконтроль Нормаінтакт Паличкоядерні 0.080±0.0010.082±0.0010.074±0.0030.084±0.0020.063±0.0010.072±0.0030.055±0.0050.040±0.002 0.10+0.05 нейтрофіли Сегменто3.40±0.02 3.40±0.06 3.28±0.05 3.66±0.08 3.00±0.10 3.00±0.05 2.60±0.05 2.0±0.10 4.0±0.20 ядерні нейтрофіли Лейкоцити 7.8±0.6 7.9±0.3 8.0±0.6 8.2±0.6 6.8±0.4 7.0±0.2 6.5±0.3 4.5±0.3 9.5±0.2 Лімфоцити 4.0±0.4 4.1±0.2 4.2±0.4 4.5±0.4 3.5±0.4 3.8±0.1 3.3±0.1 2.5±0.1 4.8±0.2 Моноцити 0.36±0.02 0.36±0.02 0.34±0.01 0.38±0.01 0.30±0.02 0.32±0.01 0.26±0.02 0.14±0.01 0.40±0.01 Тромбоцити 195±6 190 ±7 188±4 194±7 180±4 182±4 175±7 150±7 200±4 Показники кістков ого мозку, % Промієлоцити 2.1±0.2 2.0±0.2 1.9±0.1 2.1+0.2 1.7±0.2 2.0±0.5 1.5±0.1 1.1±0.1 2.0±0.1 Мієлоцити 12.1±0.7 11.6±0.9 11.6±0.4 12.1±0.3 10.9±0.2 11.0±0.5 10.5±0.3 9.1±0.5 11.1±0.3 нейтрофільні Мета12.3±0.6 12.1±0.6 12.0±0.4 12.5±0.6 11.7±0.3 12.0±0.4 10.0±0.4 8.2±0.2 13.2±0.4 мієлоцити Нейтрофіли 14.5±0.4 14.4±0.2 14.2±0.3 14.5±0.2 13.5±0.5 14.5±0.6 10.3±0.5 9.1±0.2 15.2±0.5 паличкояд. Базофіли 0.03±0.001 0.02±0.001 0.05±0.001 0.01±0.001 0.10±0.001 0.04±0.001 1.59±0.001 3.20±0.001 0.01±0.001 Лімфоцити 10.1±0.8 10.0±0.7 10.3±0.6 9.8±0.6 12.2±0.8 11.1±0.9 14.4±0.8 19.2±1.0 10.0±0.7 *) г/л - одиниця в имірюв ання для в сіх показників , крім вмісту еритроцитів Порівняльна оцінка активності композиції, яка пропонується, і прототипу за впливом на показники системи крові в умовах дії іонізуючого опромінення (14 доба після опромінення дозою 6.2 Гр, n=8) Таблиця 7 Показник Композиція, яка пропонується, за прикладами: 1 2 3 4 5 6 Показники периферійної крові: 94.0±2.196.0+2.091.8±3.096.6±2.585.2+3.090.0±3.0 4.5±1.0 5.0±0.3 4.1±0.4 4.7±0.4 3.7±0.4 4.0±0.4 3.9±0.5 4.0±0.3 3.6±0.6 4.0±0.6 3.0±0.6 3.4±0.6 380±25 380±27 360±41 386±41 300±45 360±54 6.0±1.0 6.0±1.0 7.0±1.5 5.8±0.9 8.1±1.5 6.0±2.0 Показники кісткового мозку: Клітини еритрону, % 20.0±2.820.0±0.819.2±1.620.7±1.218.0±2.019.0±0.9 Коеф. 4.0 4.2 3.8 4.2 2.9 4.8 гранулоцити/лімфоцити Гемоглобін, г/л Еритроцити, 1012/л Лейкоцити, 109/л Тромбоцити, г/л ШОЕ, мм/год Прототип-Опромінення- Норма Краплі контроль -інтакт Береша 76.0±2.0 3.7±0.3 1.9±0.3 270±7 12.6±0.8 66.6±3.0 3.2±0.3 0.5±0.1 174±45 26.0±2.4 117.6+2.1 5.6±0.8 7.6±0.9 600±55 5.0±1.0 15.2±1.0 11.5±2.2 22.4±0.4 6.8 10.0 3.0 Порівняльна оцінка активності композиції, яка пропонується, і прототипу за впливом на працездатність анемізованих тварин (тривалість плавання) (n=10) Таблиця 8 Тривалість плавання, с Композиція, яка пропонується, за прикладами: Прототип-Краплі Анемія- Норма 1 2 3 4 5 6 Береша контроль -інтакт Вихідні показники 960±68 957±86 962±80 960±66 961±65 958±48 965±73 962±75 960±80 Показник на піку анемії (10 доба) Показник після піку анемії (доба): - 3-я - 5-а - 10-а 531±68 533±48 529±58 550±50 515±48 520+66 327±72 278±33 940±90 720±85 725±80 716±68 745±80 700±90 725±60 890±58 880±68 826±70 900±75 805±90 865±85 1127±641131±781116±761187±521020±901125±45 470±86 607±84 816±90 320±40 359±33 384±60 980+80 975±90 965±82 Література 1. Mertz W. Trace elements in human and animal nutrition // 5 th. ed. Academic Press Inc. San Diego.- 1987.580p. 2. Микроэлементы в медицине / Сборники под ред. Г.Ф. Бабенко// Киев: Здоров'я .-1968-1977.-№№1-7. 3. Лікарські препарати України/ у 3-х томах. - К.-Х.: Прапор. - Т. 1,1999 - 622 с. 4. Хьюз М. Неорганическая химия биологических процессов//М.: Мир.-1983.-414 с. 5. Регістр лікарських засобів України. Офіційне видання/ К.: Авіцена, 2001. – С.186. - 792с. 6. Jorgensen C.K. Absorbtion spectra and chemical bonding in complexes //Oxford, Pergamon -1962. - 284p. 7. Альтшулер С.Α., Козырев В.Н. ЭПР соединений промежуточных групп //М.: На ука. 1972.-552с. 8. Доклінічні дослідження лікарських засобів (методичні рекомендації) /Ред. О.В.Сте фанова. - К.: Авіцена, 2002. - С.284. - 528 с 9. Прозоровский В.Б., Прозоровская Н.П., Демченко В.М. Экспресс метод определения средней эффективности дозы и его ошибки // Фармак. и токсик.-1978.-№4. - с.497-501.
ДивитисяДодаткова інформація
Назва патенту англійськоюMicroelement-based composition possessing hemoprotective and hemostimulating activity
Автори англійськоюHryhorieva Hanna Savivna, Konakhovych Natalia Fylymonivna, Mokhort Mykola Antonovych, Stefanov Oleksandr Viktorovych, Uzlenkova Natalia Yevhenivna
Назва патенту російськоюМикроэлементная композиция, обладающая гемопротекторным и гемостимулирующим действием
Автори російськоюГригорьева Анна Саввовна, Конахович Наталья Филимоновна, Мохорт Николай Антонович, Стефанов Александр Викторович, Узленкова Наталья Евгеньевна
МПК / Мітки
МПК: A61P 7/00, A61K 33/26, A61K 33/32, A61K 33/34, A61K 33/30
Мітки: композиція, мікроелементна, гемостимулюючу, активність, гемопротекторну, має
Код посилання
<a href="https://ua.patents.su/8-65365-mikroelementna-kompoziciya-shho-maeh-gemoprotektornu-i-gemostimulyuyuchu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Мікроелементна композиція, що має гемопротекторну і гемостимулюючу активність</a>
Попередній патент: Спосіб виготовлення полімерного стрижневого ізолятора
Наступний патент: Звукова інформаційно-повідомлювальна система
Випадковий патент: Піноутворювальні композиції і способи їх одержання