Спосіб отримання похідних хіназоліну чи їх солей
Номер патенту: 5562
Опубліковано: 28.12.1994
Автори: Йосікуно Іто, Масасі Хасімото, Юкіхіза Баба, Козо Савада, Такаюкі Намікі, Чіьосі Касахара, Теруо Оку
Формула / Реферат
Способ получения производных хиназолина общей формулы
где R1 присоединен к хиназолиновому кольцу в положении 7 или 8 и означает атом водорода, галоген, низший алкокси и СF3;
R2 присоединен к хиназолиновому кольцу в положении 5 или 6 и означает атом водорода, галогена, низшую алкоксигруппу;
R3- нафтил (низший) алкил или фенил (низший) алкил, замещенный одним или двумя заместителями, выбранными из галогена, низшей алкоксигруппы или СF3;
А- атом кислорода или серы;
Y- карбонил, тиокарбонил или сульфонил;
Z- низший алкилен, или их солей, отличающийся тем, что соединение
где R1, R2, R3, А, Y и Z имеют указанные значения;
Ra4 - защищенная карбоксигруппа, подвергают гидролизу с выделением целевого продукта в свободном виде или в виде соли.
Текст
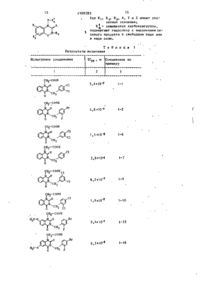
Изобретение касается производных хиназолина, в частности соединений общей формулы CH=fcH-C-NK-C=A К где R.,- в положении 7 или 8 - Н, гал or єн, * низшая алкоксигруппаи CF 3 ; R ? - в положении 5 или 6 - Н, галоген, низшая алкоксигруппа; R 3 - нафтил(низший) алкил , фенил(низший)алкил, моноили дпзамещенный галогеном, низшей алкоксигруппой или СР.; К - Z-C(O)-OH; А - сера или кислород; Y - ?С(0); }C(S) f сульфонил; Z - низший алкилен» обладающих ингибирующей активностью по отношению к альдозредуктазе, и может быть использовано в медицине. Цель изобретения - создание новых ве* ществ с активностью, не характерной для данного класса. Синтез ведут гидролизом защищенного карбоксила в соединении указанной формулы с последующим выделением целевого продукта в свободном виде или в виде соли. Новые соединения малотоксичны (LD^o = = 1000 мг/кг) и могут быть использованы для лечения диабетических осложнений - заживления ран, роговицы, каТаракты, нейропатии, ретинопатии и нефропатии. 2 табл. '• Изобретение относится к способу получения новых производных хинаэолина, которые обладают ингибирующей активностью по отношению к альдоэредуктазе. Целью изобретения является создание производных хиназолина, проявляю'щих активность, не характерную для данного ряда соединений. П р и м е р 1. Получают следующие соединения. 1. Смесь этилового эфира 2-^3(3,4-дихлорбензил)-1,2,3 ,4-тетрагидро-2,4-диоксохиназолин-1-ил ]уксусной кислоты (1,2 г) и 3 мл водного 1 н. раствора гидроксида натрия в 25 мл метанола кипятят с обратным холодильником в течение 1 ч. После охлаждения растворитель удаляют при пониженном давлении, получая остаток, который подкисляют водной 1 к. хлористоводородной кислотой и экстрагируют З 1588283 этилацетатом. Экстракт промывают р а с солом, сушат и выпаривают. Полученный таким образом продукт очищают путем перекристаллизации из диизопропи- лового эфира, получая 1,075 г 2 - £ 3 (3,4-дихлорбензил)-1,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил]уксусной кислоты. Т . п л . 225-227 С. ИК-спектр (нуджол), с м " 1 : 1695, JQ 1650, 1600. ЯМР-спектр (DMCO дейтерированный), м . д . : 4,88 (2Н, с и н г л е т ) ; 5,13 (2Н, с и н г л е т ) ; 7,17-8,20 (7Н, мультиплет). 2. 2- [3-(4-Бром-2-фторбензил)j j jI,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил ]уксусная кислота, Т.пл. 208210°С. ИК-спектр (нуджол), см " : 1730, і 1/00, 1660, 1610. 2 0 ЯМР-спектр (DMCO дейтерированный), м.д.: 4,90 (2Н, синглет); 5,17 (2Н, синглет); 6,9-8,1 (7Н, мультиплет). 3. 2-(3-Бензил-1,2,3 ,4-тетрагидро2,4-диоксохиназолин-1-ил)уксусная 25 кислота. Т.пл. 222-223°С. ИК-спектр (нуджол), см -': 1725, 1700, 1655, 1605, 1480. ЯМР-спектр (DMCO дейтерированный), м.д.: 4,87 (2Н, синглет); 5,15 (2Н, 3 ( ) синглет)І 7,17-8,23 (9Н, мультиплет). 4. 2-[3-(3,4-Дихлорфенил)-1,2,3,4тетрагидро-2,4-диоксохиназолин-1-ил ]уксусная кислота. Т.пл. 268 С. ИК-спектр (нуджол), см" 1 : 1730, 35 1720, 1670, 1640, 1610. ,ч ЯМР-спектр (DMCO-дейтерированный), .м.д.: 4,88 (2Н, синглет); 7,18-8,17 (7Н, мультиплет). 5. 2-СЗ-(3,4--Дихлорбензил)-1 ,2,3, 4-тетрагидро-2,4-диоксохиназолин-1ил} пропионовая кислота. Т.пл. 93 С. ИК-спектр (нуджол), см" 1 : 1700, 1655, 1605. 45 ЯМР-спектр (дейтерохлороформ), м . д . : 1,70 (ЗН, дублет, J = 7 Г ц ) ; 5,15 (2Н, с и н г л е т ) ( 5,38 (1Н, кварт е т , J = 7 Гц)І 7,00-8,37 (7Н, мультиплет) , 6. 2-[3-(3,4-Дихлорбензил)-1 , 2 , 3 , 50 4-тетрагидро-2-оксо-4-тиоксохиназолин-1-ил уксусная кислота. Т.пл. 253,5-254,5°С. ИК-спектр (нуджол), с м " 1 : 1705, 55 1680, 1660, 1600, 1585. ЯМР-спектр (DMCO дейтерированный), м . д . : 4,95 (2Н, синглет)» 5,80 (2Н, с и н г л е т ) , 7,20-8,70 (7Н, мультиплет). 7. 2 - [ 3 - ( 4 - Х л о р б е н з и л ) - 1 , 2 , 3 ,4-тетрагидро-2,4-диоксохиназолин-1-илjyKсусная кислота. Т.пл. 229-230°С. ИК-спектр (нуджол), см "': 1725, 1705, 1660, 1600, 1480. ЯМР-спектр (DMCO дейтерированный), м . д . : 4,90 (2Н, с и н г л е т ) ; 5,13 (2Н, с и н г л е т ) ; 7,23-8,23 (8Н, мультиплет), 8. 2-[3-(2,6-Дихлорбензил)-1,2,3, 4 - т е т р а г и д р о - 2 , 4 - диоксохиназолин-1ил]уксусная кислота. Т . п л . 273-275°С. ИК-спектр (нуджол), см ~ f : 1720, 1660, 1605, 1475. ЯМР-спектр (DMCO дейтерированный), м . д . : 4,85 (2Н, с и н г л е т ) ; 5,40 (2Н, с и н г л е т ) ; 7,07-8,13 (7Н, мультиплет). 9. 2-СЗ-(3,5-Ддхлорбензил)-1,2,3, 4-тетрагидро-2,4-дноксохинаэолин-1ил]уксусная кислота. Т.пл J 212-213°С. . ИК-спектр (нуджол), c M " f : 1740, 1720,' 1690, 1635, 1605, 1560, 1480. ШР-спектр (DMCO дейтерированный) , м . д , : 4,88 (2Н, с и н г л е т ) , 5,13 (2Н, с и н г л е т ) ; 7,13-8,20 (7Н, мультиплет). 10. 2 - [ 3 - ( 2 ,4-Дихлорбензил)-1 , 2 , 3,4-тетрагидро-2,4-диоксохиназолин1-ил]уксусная кислота. Т.пл. 223 С. ИК-спектр (нуджол), с м " 1 : 1720, 1675, 1615. ЯМР-спектр (DMCO дейтерированный), " м . д . : 4,90 (2Н, с и н г л е т ) і "5,18 (2Н, синглет)І 7,00-8,15 (7Н, мультиплет). ТІ. 2-[3-(3,5-Дихлорбензил)-1 , 2 , 3,4-тетрагидро-2,4-диоксохиназолин1-ил]уксусная кислота. Т . п л . 207°С. ИК-спектр (нуджол), см "Ч 1710, 1665, 1605. 'j ' ЯМР-спектр (DMCO дейтерированный), м . д . : 4,90 (2Н, с и н г л е т ) ; 5,20 (2Н, с и н г л е т ) ; 7,09-8,17 (7Н, синглет) . 12. 2-[1,2,3,4-Тетрагидро-3-(4-метоксибензил)-2,4-диоксохиназолин-1ил] уксусная кислота. Т . п л . 213—215 С. И.К-спектр (нуджол), см" : 1720, 1700, 1660, 1600, 1480. ЯМР-спектр (DMC0 дейтерированный) м . д . : 3,70 (ЗН, с и н г л е т ) ; 4,88 (2Н, с и н г л е т ) ; 5,08 (2Н, с и н г л е т ) ; 6,90 (2Н, дублет, J = 6 Г ц ) ; 7,30 (2Н, дублет, J = 6 Г ц ) ; 7,22-8,22 (4Н, ,' мультиплет). • 13. 2-[1,2,3,4-Тетрагидро-3-(1нафталметил)-2,4-диоксохиназолин-1ил]уксусная кислота. Т . п л . 216-218°С. 1 ИК-спектр (нуджол), с м " : 1705, 1660, 1605. ЯМР-спектр (DMCO дейтерированный), м . д . : 4,93 (2Н, с и н г л е т ) ; 5,67 (2Н, 5 1588283 с и н г л е т ) ; 7,03-8,40 (11Н, мультиплет); 20. 2~[3-(4-Хлор-2-фторбенэил)13,20 (1Н, шир. синглет). 1,2,3,4-тетрагидро-2,4-диоксокиназолин-1-ил]уксусная кислота. Т.пл. 14. 2-[1,2,3,4-Teтpaгидpo-2,4-ди215°С. oкco-3-(2-пиpидилмeтил)xинaэoлин-1~ 5 ил]yкcycнaя кислота. Т.пл. 220-223°С. ЯМР-спектр ( M Q дейтерированный) , D C м . д . : 4,88 (2Н, синглет); 5,18 (2Н, ИК-спектр (нуджол), с м " 1 : 1710, синглет); 7,12-8,22 (7Н, мультиплет). 1660, 1610. 21. 2-[3-(4-Ером-3-хлорбензил)ЯМР-спектр ( M O дейтерированный), D C 1,2,3,4~тетрагидро-2,4-диоксохиназом . д . : 4,90 (2Н, синглет); 5,27 (2Н, лин-1-ил]уксусная кислота. Т . п л . 233синглет) ; 7,15-8,55 (8Н, мультиплет). 234°С. 15. 2- [3-(4-Бром-2-фторбензил)ИК-спектр (нуджол), с м ~ ' : 1696, 1,2,3,4-тетрагидро-7-метокси-2,4-ди1680, 1600, 1470. оксохиназолин-1-ил }уксусная кислота. ЯМР-спектр ( M O дейтерированный), D C 15 Т.пл. 222-223°С. м . д . : 4,93 (2Н, синглет), 5,17 (2Н, ИК-спектр (нуджол), с м " 1 : 1715, синглет), 7,05-8,25 (7Н, мультиплет). 1660, 1620. 22. 2-[3-(2,3-Дихлороензил)-1 , 2 , ЯМР-спектр ( M O дейтерированный), D C 3,4-тетрагиДро-2,4-диоксохиназолин20 м . д . : 3,88 (ЗН, синглет); 4,88 (2Н, 1-ил ]уксусная кислота. Т.пл. 212°С. с и н г л е т ) ; 5,12 (2Н, синглет)І 6 , 8 3 ИК-спектр (нуджол), см - 1 : 1720, 8,07 (6Н, мультиплет). 1700, 1660, 1600, 1480. 16. 2-[.3-(4-Бром-2-фторбензил)ЯМР-спектр ( M O дейтерированный), D C 1,2,3,4-тетрагидро-6-метокси-2,4-дим . д . : 4,93 (2Н, синглет)* 5,27 (2Н, оксохиназолин-1-ил]уксусная кислота, с и н г л е т ) ; 6,83-8,23 (7Н, мультиплет). Т.пл. 224-226°С. 23. 2-[1,2,3,4-Тетрагидро-3-(4-меИК-спектр (нуджол), см " ' : 1740, тилбензил)-2,4-диоксохиназолин-1-ил ] 1690, 1640, 1500, 1480. уксусная кислота. Т.пл. 223-224 С. ЯМР-спектр (DMC0 дейтерированный), ИК-спектр Снуджол) , см - 1 : 1725, м . д . : 3,83 (ЗН, синглет); 4,87 (2Н, 30 1700, 1655, 1605, 1480. с и н г л е т ) ; 5,17 (2Н, синглет), 6,87ЯМР-спектр (DMC0 дейтерированный), 7,73 (6Н, мультиплет). м . д . : 2,27 (ЗН, синглет); 4,88 (2Н, 17. 2-[3-(4-Бром-2- фторбензил)-6синглет) І 5,10 (2Н, синглет)*, 6,97хлор-1,2,3,4-тетрагидро-2,4-диоксохи8,20 (8Н ,мультиплет) . назолин-1-ил ]уксусная кислота. Т.пл. i t 24. 2-[3-(4-Хлор-3-метоксибензил)238-239°С. 1,2 ( 3,4-тетрагидро-2,4-диоксохиназоИК-спектр (нуджол), с м - 1 : 1725, лин-1-ил ]уксусная кислота. Т.пл. 1710 (плечо), 1665, 1605. 184°С. ЯМР-спектр ( M O дейтерированный), D C ИК-спектр (нуджол), с м ' 1 : 1725, м . д . : 4,88 (2Н, синглет); 5,15 (2Н, 40 1700, 1650, 1610. синглет)І 7,05-8,12 (6Н, мультиплет). ЯМР-спектр ( M O дейтерированный), D C 18. 2-[2-(3,4-Дихлорбензил)-3,4м . д . : 3,81 (ЗН, с и н г л е т ) ; 4,92 (2Н, диги,дро-3-оксо-2Н-1 ,2 ,4-бензотиадиас и н г л е т ) ; 5,18 (2Н, с и н г л е т ) ; 6 , 7 8 зин-4-ил]уксусной кислоты 1,1-диоксид, 8,18 (7Н, мультиплет). Т.пл. 190°С. і 45 ИК-спектр (нуджол), см : 1720, 25. 2-£3-(З-Хлор-4-метоксибензил)1690, 1660. 1,2,3,4-тетрагидро-2,4-диоксохиназоЯМР-спектр ( M O дейтерированный), D C лин-1-ил]уксусная кислота. Т . п л . м . д . : 3,98 (2Н, синглет), 4,90 (2Н, 198°С. с и н г л е т ) 4 7,20-8,07 (7Н, мультиплет). 50 ИК-спектр (нуджол), с м - ' : 1740, 19. 2- [3-(2-Фтор-4-иодбензил)1695, 1640, 1605. 1,2,3,4-тетрагидро-2,4-диоксохиназоЯМР-спектр (DMC0 дейтерированный), лин-1-ил ]уксусная кислота. Т.пл. м.д.: 3,83 (ЗН, с и н г л е т Ь 4,90 (211, 217°С. / с и н г л е т ) ; 5,08 (2Н, с и н г л е т ) ; 6 , 9 9 ИК-спектр (нуджол), с м - 1 : 1765, 55 8,15 (7Н, мультиплет). 1705, 1645, 1605, 1480. 26. 2-[3-(4~Бром-2-фторбензил)ЯМР-спектр ( M O дейтерированный), D C 1,2,3,4-тетрагидро~8-метокси-2,4-ди~ м . д . : 4,87 (2Н, синглет), 5,13 (2Н, оксохкназолин-1-ил]уксусная к и с л о т а , синглет)і 6,77-8,23 (7Н, мультиплет). Т.пл. 204-206°С. 1588283 1 ИК-спектр (нуджол), см - : 17ЗО, 1700, 1660, 1600. ЯМР-спектр ( M O дейтерированный), D C м . д . : 3,83 (ЗН, с и н г л е т ) ; 5,00 (2Н, синглет)І 5,15 (2Н, синглет); 7,137,80 (6Н, мультиплет), 27. 2-[1,2,3,4-Тетрагидро-2,4-диоксо-З-(2-тиенилметил)хиназолин-1-илj уксусная кислота. Т.пл. 2А8~250°С 10 (разлагается). 1 ИК-спектр (нуджол), см™ : 1 7 2 5 , 1700, 1655, 1605. ЯМР-спектр ( M O дейтерированный), D C м . д . : 4,88 (2Н, с и н г л е т ) ; 5,28 (2Н, с и н г л е т ) ; 6,87-8,23 (7Н, мультиплет) -, 12,67 (1Н, шир, синглет). 28. 2-[1 ,2,3,4-Тетрагидро-3-(2нафтилметил)-2 ,4-диоксохиназолин-1ил]уксусная кислота. Т.пл. 183-185*С. 20 ЯМР-спектр ( M O дейтерированный), D C м . д . : 4,92 (2Н, с и н г л е т ) ; 5,33 (2Н, синглет) ; 7 ,23-8 ,23 (11Н , мультиплет). 29. 2- [3-(4-Бром-2-фторбензил)-5хлор-1,2,3 э 4-тетрагидро-2,4-диоксохи- 25 назолин-1-ил ]уксусная кислота. Т.пл. 217-218°С. ИК-спектр (нуджол), с м " 1 : 1725, 1700, 1660, 1590. 30. 2-[3-(4-Бром-2-фторбензил)30 1,2,3,4-тетрагидро-5-метокси-2,4-диоксохиназолин- 1-ил JyiccycHaH кислота. Т.пл. 253-255°С. ИК-спектр (нуджол), с м " 1 : 1735, 1700, 1640, 1600. 35 ЯМР-спектр ( M O дейтерированный), D C м . д . : 3,83 (ЗН, синглет), 4,83 (2Н, синглет)І 5,08 (2Н, синглет)І 6,807,80 (6Н, мультиплет). •~ П р и м е р 2. Смесь этилового 40 эфира 2-[3-(4-бром-2-фторбензил)-7хлор-1,2,3,4-тетрагидро-2,4-диоксохиназолин-1~ил]уксусной кислоты (249 г) и 795 мл водного 1 н. раствора гидроксида натрия в 1,6 л метанола кипя- 45 тят с обратным холодильником 30 мин при перемешивании. Растворитель выпаривают , остаток растворяют в горячей воде (5 л ) . Водный раствор выливают в 3 л охлажденной льдом 0,5 н. 50 хлористо-водородной кислоты. Осадок отфильтровывают и перекристаллизовывают из смеси 6 л этанола и 3 л воды, получают 198 г 2-[3-(4-бром-2-фторбенэил)-7-хлор-1,2,3,4-тетрагидро55 2 ,4-диоксохиназолин-1-ил ]уксусной кислоты. Т.пл. 223-224°С. ИК-спектр (нуджол) , , см- 1 : 1700, 1660, 1600. 1720, 8 ЯМР-спектр ( M O дейтерированный,) . D C м . д . : 4,88 (2Н, с и н г л е т ) i 5,12 (2Н, с и н г л е т ) ; 7,05-8 ,12 (6Н, мультиплет). П р и м е р 3. Раствор этилового эфира 2-[3-(4-бром-2-фторбензил)-7хлор-1 ,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил]уксусной кислоты (69 г) и 191 мл водного 1 н, раствора гидроксида натрия в 350 мл этилового спирта перемешивают 3 ч при 60°С. После охлаждения до 0°С осадок отфильтровывают , промывают водой и сушат над пятиокисью фосфора. После перекристаллизации из 360 мл воды получают 39,2 г натриевой соли 2 - [ 3 - ( 4 бром-2-фторбензил)-7-хлор-1,2,3,4тетрагидро-2,4-диоксохиназолин-1-ил J уксусной кислоты. Т.пл. выше 300°С. 1 ИК-спектр (нуджол), см - : 3500, 1705, 1670, 1610. ЯМР-спектр (в тяжелой воде) , м . д . : 4,66 (2Н, с и н г л е т ) ; 5,21 (2Н, сингл е т ) ; 7,1-7,4 (6Н, мультиплет); 8,04 (1Н, дублет, J = 9 Гц). П р и м е р 4. Получают следующие соединения. 1 . Раствор этилового эфира 2-[7бром-3-(4-бром-2-фторбензил)-1 ,2 ,3 ,4тетрагидро-2,4-диоксохиназолин-1-ил ] уксусной кислоты (3,0 г) и 5,83 мл водного \ н. раствора гидроксида натрия в 69,6 мл метанола кипятят с обратным холодильником 1 ч при перемешивании. После охлаждения растворитель выпаривают, полученный остаток подкисляют 1 н. водной хлористо-водородной кислотой и экстрагируют этилацетатом. Экстракт промывают рассолом и сушат. После удаления растворителя остаток подвергают перекристаллизации из смеси этилацетата и н-гексана и получают 2,36 г 2-£7-бром-3-(4-бром2-фторбензил)-1,2,3,4-тетрагидро-2,4диоксохиназолин-1-ил]уксусной кислоты. Т.пл. 217°С. ИК-спектр (нуджол), см " 1 : 1725, 1710, 1660, 1600, 1580, 1490. ЯМР-спектр ( M O дейтерированный), D C м . д . : 4,90 (2Н, синглет); 5,13 (2Н, синглет); 7,14 (1Н, дв.дублет, J = 8,8 Гц)» 7,34 (1Н, дублет, J = = 8 Гц),- 7,50-7,58 (2Н> мультиплет) ; 7,78 (1Н, с и н г л е т Ь 7,99 (1Н, дублет, J = 8 Гц). 2. 2-[3-(4-Бром-2-фторбензил)~ 1,2,3,4-тетрагидро-7-иод-2,4-диоксохиназолин-1-нл]уксусная кислота. Т.пл. 251-252,5°С. 1588283 1 210-211°С. ИК-спектр (нуджол), см-1 : 1710, 1660, 1580, 1360. ЯМР-спектр (DMCO дейтерированкый) м . д . : 3,50 ОН, шир.синглет) j 4,8,7 (2Н, с и н г л е т ) ; 5,14 (2Н, синглет); ...7',Ю-7,56 (5Н,- мультиплет); 8,15 (1Н , 20 д в . д у б л е т , J = 6,6 и 7,5 Гц), А. 2-С7-Хлор-3-(2-фтор-4-иодбензил)-1 ,2 ,3,4-тетрагидро-2,4-диоксохи' назолин-1-ил]уксусная кислота. Т.пл. 232-233°С. ИК-спектр (нуджол), с м ' 1 : 1730, 1710, 1670, 1610. . ЯМР-спектр (DMCO дейтерированный) м . д . : 4,90 (2Н, с и н г л е т ) ; 5,12 (2Н, синглет)^ 6,93-8,10 (6Н , мультиплет) 5. 2-[7-Хлор-3-(2-фтор-3-иодбенз и л ) - ! ,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил]уксусная кислота. Т.пл. 1б5-1б7°С. ИК-спектр (нуджол), с м " 1 : 1720, 1700, 1660, 1600. 6. 2- [7-Хлор-З-(З-хлор-4-иодбензил)-1,2,3,4-тетрагидро-2,4-диоксохиназолин-\-ил Зуксусная кислота. Т.пл, 240°С. ИК-спектр (нуджол), с м " 1 : 1725, 1710, 1665, 1605, 158.0. 7. 2- [7-Хлор-3-[4-хлор-3-(трифторметил)бензилJ-1,2,3,4-тетрагидро-2,4диоксохиназолин-1-ил^уксусная кислот а . Т . п л . 212-213°С. ИК-спектр (нуджол), с м " 1 : 1720, 1705, 1660, 1600, 1575. 8. 2-{7-Хлор-3- [3 ,5-бис(трифторметил)бензил ]-1 , 2 , 3 ,4-тетрагидро-2,Адиоксохиназолин-1-ил ^уксусная кислот а . Т . п л . 202-2ОЗ°С. ИК-спектр (нуджол), см" : 1740, 1700, 1650, 1605, 1590. 9. 2-[3-(4-Бром-2-фторбензил)-8-' хлор~1,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил]уксусная кислота. Т . п л . 212-215°С. 10 1 ИК-спектр (нуджол), см~ : 1710, 1670, 1600, 1580, 1490. ЯМР-спектр (DMCO дейтерированный) м . д . : 4,89 (2Н, с и н г л е т ) ; 5,13 (2Н, с и н г л е т ) І 7,13 (1Н, д в . д у б л е т , J = = 8,8 Гц) * 7,34 ОН, дублет, J = = 8 Гц)* 7,55 ( Ш , дублет, J = 8 Гц) 7,75 (2Н, мультиплет); 7,89 (1Н, син глет). 3 . 2-[3-(4-Бром-2-фторбензил)-7фтор-1,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил]уксусная кислота,Т.пл. 25 30 35 . е« ИК-спектр (нуджол), с м - : 1730, 1710, 1670, 1605 ( п л е ч о ) , 1595. ЯМР-спектр (DMCO дейтерированный), м . д . : 5,03 (2Н, с и н г л е т ) ; 5,12 (2Н, с и н г л е т ) ; 7,10-8,23 (6Н, мультиплет). 10. 2-[3-(4-Бром~2-фторбензил)6 ,7-дихлор-1,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил]уксусная кислота. Т.пл.. 255°С. ИК-спектр (нуджол), с м - 1 : 1720, 1675, 1600, 1570, 1485. ЯМР-спектр (DMCO дейтерированный), м . д . : £,90 (2Н, синглет) ; 5,13 (2НВ с и н г л е т ) І 7,17 (1Н, д в . д у б л е т , J * = 8 , 8 Гц)І 7,34 (1Н, дублет, J = = 8 Гц)І 7,55 (1Н, дублет, J = 8 Г ц ) ; . 7,93 (1Н,. с и н г л е т ) ; 8,19 ( Ш , синглет) . 11. 2-[3-(4-Бром-2-фторбензил)5,7-дихлор-1,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил ]уксусная кислота. Т.пл. 238-239°С. ИК-спектр (нуджол), с м - 1 : 3250, 1730, 1710, 1670, 1665 ( п л е ч о ) , 1605, 1590, 1570. ЯМР-спектр (DMCO дейтерированный), м . д . : 4,92 (2Н, синглет)• 5,10 (2Н, с и н г л е т ) ; 7,13-7,63 (5Н, мультиплет). 12. 2- [3-(4-Бром-2-фторбеизил)-7трифторметил-1,2 ,3,4-тетрагидро-2 , 4 диоксохиназолин-1-илjyKcусная кислот а . Т.пл. 230-231°С. ИК-спектр (нуджол), см~' : . 1 7 0 0 , 1660, 1580, 1360. 13. 2-[6,7-Дихлор~3-(2-фтор-4~ иодбензил)-1,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил Зуксусная кислота. Т.пл. 255-257°С. ИК-спектр (нуджол), см ' 1 : 1725 (плечо), 1710, 1675, 1600, 1570. ЯМР-спектр (DMCO дейтерированный), • ' м . д . : . 4,90 (2Н, синглет) І 5,12 (2Н, синглет) І 6,90-7,70 (ЗН, мультиплет)',^ 7,93 (1Н, синглет),- 8,18 (1Н, сингл е т ) ; 13,30 (1К, шир . с и н г л е т ) . 14. 2- [7-Бром-З-(2-фтор-4-иодбен- ' зил)-1,2,3,4-тетрагидро-2,4-диоксохиназолин-1-ил]уксусная кислота. Т . п л . 252-2530С ИК-спектр (нуджол), с м - 1 : 1715, 1675, 1600, ЯМР-спектр (DMCO д е й т е р и р о в а н н ы й ) , м . д . : 4,90 (2Н, с и н г л е т ) ; 5,12 (2Н, с и н г л е т ) І 6 , 9 6 (1Н, т р и п л е т , J = = 8 Г ц ) І 7,50 (2Н, т р и п л е т , J = 8 Г ц ) ; 7 , 6 4 .(1Н, д у б л е т , J = 10 Гц) І 7 , 7 8 О Н , синглет)-, 7,98 О Н , д у б л е т , J = 8 Г ц ) . . . . • . . ' . . - • И 1588283\г 15. 2-^7-Фтор-3-(2-фтор-4-иодбенП р и м е р 6. Смесь этилового эфира 2-[3-(3,4-дихлорбензил)-1 ,2,3, эил)-1 , 2 , 3 , 4 - т е т р а г и д р о - 2 , 4 - д и о к с о х и 4-тетрагидро-2 ,4-дитиоксохиназолинназолин-1-ил}уксусная киспота. Т . п л . 214-215°С. 1-ил]уксусной кислоты (85 мг) , 0,5 мл ИК-спектр (нуджол), с м " ' : 3480, водного 1 н. раствора гидроксида нат1710, 1660, 1620, 1600. рия и 1 мл тетрагидрофурана перемешиЯМР-спектр (DMCO дейтерированный), вают при комнатной температуре в тем . д . : 4,9 (2Н, с и н г л е т ) ; 5,1 (2Н, чение 20 ч. Реакционную смесь вылисинглет)} 7,0 (1Н, д в . д у б л е т , J ю вают в смесь этилацетата и 0,5 н. * 8,8 Гц)( 7,2 (1Н, д в . д у б л е т , J = хлористо-водородной кислоты. Органи= 8,8 Гц) і 7 , 4 - 7 , 7 (ЗН, мультиплет); ческий слой отделяют, промывают его 8,1 (1Н, д в . д у б л е т , J = 7,8 Г ц ) . водой и рассолом и сушат над сульфа16. 2-[3-(2-Фтор-4-иодбензил)-7том магния. Растворитель удаляют и и о д - 1 , 2 , 3 , 4 - т е т р а г и д р о - 2 , 4 - д и о к с о х и - 15 остаток подвергают кристаллизации из назолин-1-ил]уксусная кислота. Т.пл . хлороформа, получая 36 мг 2-[3-(3,4279-281°С. дихлорбензил)-1-1,2,3,4-тетрагидро-2,4ИК-спектр (нуджол) , с м и : 1715, дитиоксохиназолин-1-ил]уксусной кис1680, 1600, 1340, 1260, 840. лоты. Т.пл. 222-223 °С (разлагается). ЯМР-спектр (DMCO дейтерированный), 20 ИК-спектр (нуджол), см ' : 1710, м . д . : 4,90 (2Н, с и н г л е т ) , 5,12 (2Н, 1685. с и н г л е т ) , 6,96 (1Н, триплет, J = ЯКР-спектр (DMCO дейтерированный), = 8 Г ц ) І 7,46-7,89 ( 5 4 , мультиплет). м.д.: 5,54 (2Н, шир.синглет)j 5,75 П р и м е р 5. Получают следую(2Н, синглет); 7,17-7,60 (5Н, мульщие соединения. 25 типлет)^ 7,88 (1Н, триплет, J =7 Гц)\ 1. Смесь 1,5 г этилового эфира 8,16 (1Н, дублет, J = 8 Гц). 2- [(2^-бензилкарбамоил)анилино^уксусИспытание вне организма. ной киспоты и 2,85 г Н ,N'-тиокарбонилМетод ферментативного анализа. диимидазола перемешивают при 120 С Используют следующие реагенты, мл: 30 мин. После охлаждения реакционную 30 0,5 М фосфатный буфер (рН 6,2) 0,1; смесь разбавляют хлороформом и раздераствор сульфата лития 2,0 М 0,2; ляют хроматографически на силикагеле. предлагаемое соединение (растворено При элюировании хлороформом получают в физиологическом солевом растворе) этиловый эфир 2-(3-бензил-1,2,3,40,1; раствор фермента (раствор альдозтетрагидро-4-оксо-2-тиоксохиназолин- ів редуктазы, приготовленный, как описа1-ил)уксусной кислоты. Смесь этиловоно) 0,5; 60 мМ О,Ь~глицеральдегида го эфира 2-(3-бензил-1,2 ,3 ,4-тетра0,05; 2,5 мМ никотинамидадениндинукгидро-4-оксо-2-тиоксохиназолин-1-ил)леотид фосфата (НАДО, восстановленуксусной кислоты и 2 мл 1 н. раствора ная форма) 0,05. гидроксида натрия в 10 мл метанола Указанные реагенты смешивают и 4Q перемешивают 4 ч при комнаткой темподвергают взаимодеиствиют при Зэ С пературе . Реакционную смесь выливают в течение 2 мин, причем уменьшение в разбавленную хлористо-водородную количества НАДФ измеряют автоматическислоту и экстрагируют хлороформом. ки анализатором скорости реакции (моЭкстракт промывают рассолом и сушат. дель Эл-Кей-Би-8600, торговый знак При удалении растворителя получают фирма мЭл-Кей-Би Продуктер Эй.Би"). 280 мг 2-(3-бензил-1,2,3,4-тетрагидЗа единицу ферментативной активности ро-4-оксо-2-тиоксохнназолин-1-ил)укпринято изменение степени поглощения сусной кислоты. Т.пл. 194-197 С» на 0,001 в минуту. ИК-спектр (нуджол), см-': 1720, 5С Метод приготовления раствора фер1700. мента. ЯМР-спектр (дейтерометанол), м.д.: Удаляют ядра из глаз кролика и со4,90 (2Н, синглет); 5,20 (2Н, сингбирают их. Эти хрусталики гомогенизилет) , 7,00-7,50 (9Нj мультиплет). руют с тремя объемами дистиллирован2. 2-ГЗ-(3,4-Дихпорбензил)-1 ,2,3, 55 ной воды при 4 С (все последующие операции также проводят при 4 С) и 4-тетрагидро-4-оксо-2-тиоксохиназоцентрифугируют с ускорением 10 000 G ЛИН-1-ИЛ ]уксусная кислота. Т.пл. 105в течение 60 мин. Жидкость над осад1 ком подвергают диализу против 2 л ИК-спектр (хлороформ): 1700 см " 13 1588283 0,05 М раствора соли, и диализованный раствор используют в качестве раствора фермента. Результаты испытания представлены в табл. 1. Каждая величина И К ^ (М) представляет собой концентрацию веществ , при которой активность альдозредуктазы ингибируется на 50%. 5 10 Испытание в организме. Определяют ингибирующее действие медикамента на накопление сорбитола в седалищном нерве. Самцам крыс Спрагью-Доулей (воз15 раст 6 нед.) не дают пищи в течение 24 ч и затем превращают их в диабетиков путем внутрибрюшинной инъекции (2 мл/кг) стрептозотоцина (75 мг/кг), растворенного в 0,002 М цитратном 20 буферном растворе (рН 4,5). Через 7 сут после инъекции стептозотоцина определяют содержание глюкозы в крови, отбирая кровь из хвостовой вены. Крыс с содержанием глюкозы в крови 25 свыше 300 мг/дл используют в качестве животных с диабетом, индуцированным стрептозотоцином. Животных с диабетом произвольно разделяют на две группы А и В. 30 I К - содержание сорбитола в седалищном нерве контрольных крыс, Результаты испытания представлены в табл. 2. Тест на острую токсичность. Для проведения теста используют 2-[3-(4-бром-2-фторбензил)-7-хлор1,2,3,4-тeтpaгидpo-2,4-диoкcoxинaзoлин-1-илjyкcycнyю кислоту. После того, как крысам SD-штамма (одна группа 5 животных) орально ввели 0,5%-ную метилцеллюлозную суспензию, содержащую тестовое соединение» крыс наблюдали в течение 2 нед. Полученные результаты: LDf-0 > >1000 мг/кг. Результаты теста показывают, что тестовое соединение является низкотоксичным. Таким образом, предлагаемые соединения являются малотоксичными. Полученные производные хиназолина и их фармацевтически приемлемые соли обладают ингибирующей активностью по отношению к альдозредуктазе и представляют ценность, например, для терапевтического лечения диабетических осложнений, таких как заживление повреждений и ран роговицы, катаракты, нейропатии, ретинопатии, нефропатии, особенно катаракты и нейропатии. Медикамент суспендируют в водном 0,5%-ном растворе метилцеллюлозы и Ф о р м у л а и з о б р е т е н и я вводят перорально каждой крысе в Способ получения производных хинагруппе А раз в день в течение 5 сут золина общей формулы (диабетические крысы, обработанные 35 медикаментом), Каждой крысе в группе В и нормальным крысам дают носитель - 0,5%-ный водный раствор метилцеллюлозы (необработанные диабетические крысы и 40 где R, присоединен к хиназолиновому контрольные крысы). кольцу в положении 7 или 8 и означает атом водорода, галоЧерез 6 ч после последнего введеген, низший алкокси и CF^; ния медикамента или носителя животных убивают и определяют аналитически 45 R. присоединен к хиназолиновому кольцу в положении 5 или 6 и содержание сорбитола в седалищном означает атом водорода, галонерве. Процент ингибирования I накопгена, низшую алкоксигруппу; ления сорбитола в седалищном нерве - нафтил(низший)алкил или фенилдля медикамента рассчитывают следую(нйзший)алкил, замещенный одщим образом: 50 ним или двумя заместителями, і = с-|~-|~) * 1 0 0 > выбранными из галогена, низшей алкоксигруппы или СЬ"3; где S - содержание сорбитола в седа- атом кислорода или серы; лищном нерве необработанных - карбонил, тиокарбонил или диабетических крыс; 55 S« - содержание сорбитола в седасульфонил; лищном нерве диабетических Z - низший алкилен, крыс, обработанных медикаменили их солей, о т л и ч а ю щ и й том; с я тем, что соединение 15 1G 588283 где R^, R,, R. t A, Y и Z имеют указанные значения; & і ~ защищенная карбоксигруппа, , подвергают гидролизу с вьщелением целевого продукта в свободном виде или в виде соли. Z-R Y -N Т а б л и ц а 1 Результаты испытания ._ Испытуемое соединение Соединение по примеру сн2-соон 5,4*10"* 1-1 4,6*10-' 1-2 1,1 «10 "в 1-6 2,8*10-1 1-7 8,2*10 1-9 1,9x10'* 1-10 5,4x10'» 1-15 6.2Х101-* 1-16 XI хн. сн^-соон .Вг О О * F сн2-соон S сн 9 1 сн2-соон о ""СНг О сн 2 -соон а о С1 ХН. С ООН о о н3с-а . СНз сі СН 9 -С0ОН І 2 'СН, сн2-соон хн Вг 17 18 1588283 Продолжение т а б л . 1 СН--СООН 2 I О 2 О Вг 1-17 F сн 2 -соон 1-1 ,0 CHj-COOH 5,3 J-T9 о CH 2 ~COOf{ .п 8,8*10 -9 1-20 ,Бг о 6,1 -2 сн; С ООН сн2-соон 8,2 «10 "^ 1-22 1,1x10-' 1-25 7,7.10-3 1-28 6,6 1-29 01 О СНп-СООН I 2 сі сі-г 2 -соон о о сн 2 -соон О С1 О л ,Вг 1588283 20 Продолжение табл.) 3 сн,-соон о 0СН3О 7,6x10-9 сн 1-30 F сн2-соон О ^ . B t А О 5.7М0-5 F сн2-соон Вг. Вг 3,1*10-» сн, о - г сн2~соон О -сн. ' 4-2 F сн 2 -соон 2,6*10" 5 4-3 о С1 л С^-СООН X ^0 ^ Л 2,3.10-9 4-4 "2 I F О сн2-соон 4-5 О с н,-соон I си ^ .к ^о о ^. .і СНо^ ^ сн2~соон о С1 2,5-10-9 4-6 "СІ 5.0М0-» 4-7 сн2-соон 4-9 хн, 21 22 1588283 Продолжение т а б л . 1 CH2-COOF{ Вг СІ СІ О сн 2 3,4*10-9 4-10 2.9НО- 9 4-11 5,1 4-12 3,5x10"» 4-13 З,ЇМО" 9 4-14 2,8*10-* 4-15 F сно-соон С1 Вг О С1 О СН сн 2 -соон Вг сн2-соон С1 1 С1 О СН, сн2-соон о О СН, * F сн.-соон о СН, си 2 -соон 4-16 СН сн 2 -соон 5,2 МО" 9 ті сп 2 —гоон 1.6М0-* ..X 5-2 23 1588283 Т а б л и ц а Соединение (медикамент) по примеру 1-19 4-1 2 Дозировка, мг/кг 32 32 32 2 I % J , . Л 101 103 99 Редактор О.Юрковецкая Составитель А.Свиридова Техред П.Олийнык Корректор А.Обручар Заказ 2429 Тираж 328 Подписное ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР 113035, Москва, Ж-35, Раушская наб., д. 4/5 Производственно-издательский комбинат "Патент", г.Ужгород, ул. Гагарина,101
ДивитисяДодаткова інформація
Назва патенту англійськоюThe process for preparation of quinazoline derivatives of their salts
Автори англійськоюTeruo Oku
Назва патенту російськоюСпособ получения производных хиназолина или их солей
Автори російськоюТеруо Оку
МПК / Мітки
МПК: C07D 239/80, C07D 265/26, A61P 27/12, A61P 43/00, A61K 31/5415, A61K 31/54, A61K 31/505, C07D 521/00, C07D 239/91, A61P 1/16, C12N 9/99, C07D 285/24, A61P 3/08, A61P 25/00, C07D 239/93, A61P 3/10, C07D 239/95, C07D 401/06, C07D 409/06, C07D 239/96, A61K 31/517, A61P 13/02, A61P 15/00, A61P 27/02
Мітки: отримання, хіназоліну, спосіб, солей, похідних
Код посилання
<a href="https://ua.patents.su/12-5562-sposib-otrimannya-pokhidnikh-khinazolinu-chi-kh-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання похідних хіназоліну чи їх солей</a>
Попередній патент: Спосіб отримання заміщенних похідних імідазолу
Наступний патент: Пристрій для детонаційного нанесення покриття на внутрішню поверхню виробів
Випадковий патент: Спосіб одержання дієтичної добавки