Заміщені похідні фенілпіперазину, фармацевтична композиція та спосіб лікування афективних або неврологічних захворювань і розладів
Номер патенту: 72948
Опубліковано: 16.05.2005
Автори: Андерсен Кім, Міккельсен Гітте, Рухланд Томас, Крог-Єнсен Крістіан, Мольтсен Айнер Кнуд, Роттлондер Маріо
Формула / Реферат
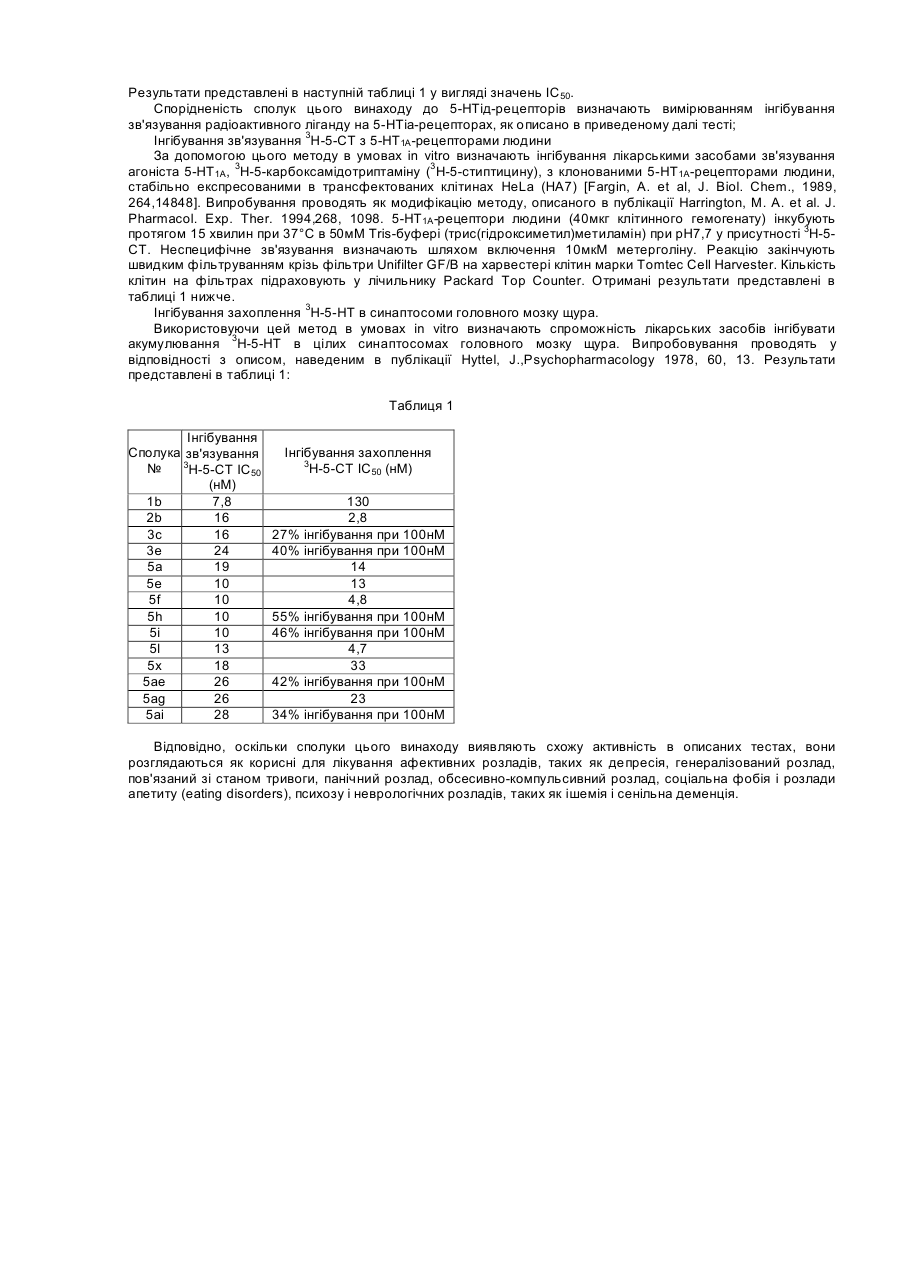
1. Сполуки загальної формули І
 , (I)
, (I)
де Ζ являє собою NH, NR"', О або S; R'" являє собою водень, С1-6-алкіл;
R7 і R8 незалежно являють собою водень, галоген, С1-6-алкіл, С3-8-циклоалкіл, CN, СF3 або С1-6-алкоксигрупу; або R7 і R8 разом утворюють 5- або 6-членний арил або гетероарил, конденсований з бензольним кільцем;
Y являє собою Ν, С або СН;
пунктирна лінія представляє необов'язковий зв'язок;
R6 і R6’ являють собою Η або С1-6-алкіл;
Χ являє собою -О- або -S-;
n дорівнює 2, 3, 4 або 5;
m дорівнює 2 або 3;
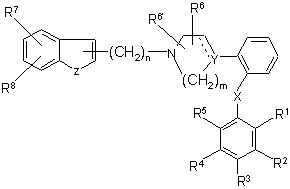
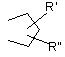
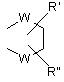
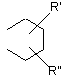
R1, R2, R3, R4 і R5 є незалежно вибраними з групи, яка складається з водню, галогену, С1-6-алкілу, С2-6-алкенілу, С2-6-алкінілу, С3-8-циклоалкілу, арилу, гідроксильної групи, гідроксі-С1-6-алкілу, С1-6-алкоксигрупи, С3-8-циклоалкоксигрупи, С1-6-алкілсульфанілу, ацилу, NR9R10, де R9 і R10 незалежно являють собою водень, С1-6-алкіл, С2-6-алкеніл, С2-6-алкініл, С3-8-циклоалкіл або арил; або R9 і R10 разом з азотом, до якого вони приєднані, утворюють 1-морфолініл, 1-піперидиніл, 1-гомопіперидиніл, 1-піперазиніл, 1-гомопіперазиніл, 1-імідазоліл, 1-піроліл або піразоліл, усі з яких можуть бути додатково заміщені С1-6-алкілом; або два суміжних замісники з R1-R5 разом утворюють кільце, конденсоване з фенільним кільцем і вибране з групи, що складається з
 ,
,
 ,
,
 ,
,
 ,
,
де W являє собою О або S, і R' і R" являють собою водень або С1-6-алкіл.
2. Сполука за п. 1, де Ζ являє собою NH і арил приєднаний у положенні 3.
3. Сполука за будь-яким з попередніх пунктів, де R7 і R8 незалежно є вибраними з водню, галогену, С1-6-алкілу або R7 і R8 разом утворюють конденсоване піридильне кільце.
4. Сполука за будь-яким з попередніх пунктів, де n дорівнює 2, 3 або 4.
5. Сполука за будь-яким з попередніх пунктів, де m дорівнює 2.
6. Сполука за будь-яким з попередніх пунктів, де R6 і R6’, обидва, являють собою водень.
7. Сполука за будь-яким з попередніх пунктів, де Y являє собою N.
8. Сполука за будь-яким з попередніх пунктів, де R1, R2, R3, R4 і R5 незалежно є вибраними з водню, алкоксигрупи, NR3R4, де R3 і R4 незалежно являють собою водень, С1-6-алкіл; або R3 і R4 разом утворюють 1-морфоліно; або два суміжних замісники з R1, R2, R3, R4 і R5 разом утворюють конденсований цикл, що складається з -O-СН2-O-, -O-СН2-СН2-O- або -СН2-СН2-СН2-.
9. Сполука за будь-яким з попередніх пунктів, де один або два замісники з R1, R2, R3, R4, R5 не є воднем.
10. Сполука за будь-яким з попередніх пунктів, де зазначена сполука являє собою:
1-{1-[3-(диметиламіно)фенокси]феніл}-4-[2-(1Н-індол-3-іл)етил]піперазин;
1-[1-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[2-(1Н-індол-3-іл)етил]піперазин;
1-{1-[3-(диметиламіно)фенокси]феніл}-4-[3-(1Н-індол-3-іл)пропіл]піперазин;
1-[1-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,4-бензодіоксан-6-ілокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,4-бензодіоксан-6-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3-метоксифенокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин;
1-(2-феноксифеніл)-4-[4-(1Н-індол-3-іл)бутил]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[4-(1Н-індол-3-іл)бутил]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин;
1-[2-(3-(диметиламіно)фенокси)феніл]-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[4-(1Н-індол-3-іл)бутил]піперазин;
1-[2-(4-метоксифенокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3-диметиламіно)фенокси)феніл]-4-[4-(1Н-індол-3-іл)бутил]піперазин;
1-(2-феноксифеніл)-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин;
1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-(2-феноксифеніл)-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(7-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин;
1-(2-феноксифеніл)-4-[3-(7-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-(2-феноксифеніл)-4-[3-(5,7-дифтор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(7-бром-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3-(диметиламіно)фенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(1Н-піроло[3,2-h]хінолін-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(5,7-дифтор-1Н-індол-3-іл)пропіл]піперазин;
1-(2-феноксифеніл)-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2-метоксифенокси)феніл]-4-[3-(1Н-піроло[3,2-h]хінолін-3-іл)пропіл]піперазин;
1-[2-(3-метоксифенокси)феніл]-4-[3-(1Н-піроло[3,2-h]хінолін-3-іл)пропіл]піперазин;
1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3-метоксифенокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин;
1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3-метоксифенокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3-етоксифенокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл}піперазин;
1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3-(діетиламіно)фенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин;
1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин;
1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3-метоксифенокси)феніл]-4-[3-(7-фтор-1Н-індол-3-іл)пропіл]піперазин;
1-(2-феноксифеніл)-4-[3-(5,7-диметил-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(7-бром-1Н-індол-3-іл)пропіл]піперазин;
1-[2-(3,4,5-триметоксифенокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин.
11. Фармацевтична композиція, яка містить, принаймні, одну сполуку формули І за будь-яким з пп. 1-10 або її фармацевтично прийнятну кислотно-адитивну сіль, або проліки в терапевтично ефективній кількості у поєднанні з одним або декількома фармацевтично прийнятними носіями або розріджувачами.
12. Застосування сполуки формули І за будь-яким з пп. 1-10 або її кислотно-адитивної солі, або проліків для одержання фармацевтичного препарату для лікування афективних або неврологічних захворювань і розладів.
13. Спосіб лікування у людей афективних або неврологічних захворювань і розладів, викликаних відхиленнями від норми в серотоніновій системі центральної нервової системи, при якому вводять ефективну кількість сполуки формули І за будь-яким з пп. 1-10.
14. Спосіб за п. 13, де зазначене захворювання являє собою депресію, психоз, генералізований розлад, пов'язаний зі станом тривоги, панічний розлад, обсесивно-компульсивний розлад, розлад регуляції імпульсу (impulse control disorder), алкогольну залежність, агресію, ішемію, сенільну деменцію і соціальну фобію.
Текст
Цей винахід відноситься до нових заміщених похідних фенілпіперазину, що виявляють значну активність до зв'язування з 5-НТід-рецептором, фармацевтичних композицій, що містять дані сполуки, і їх застосуванню для лікування деяких психіатричних і неврологічних розладів. Багато сполук даного винаходу є також сильнодіючими інгібіторами зворотного захоплення серотоніну та/або лігандами D3/D4 і тому, як вважається, особливо корисні для лікування депресії і психозу. У клінічних і фармакологічних дослідженнях було показано, що агоністи і парціальні агоністи 5-НТ1A корисні для лікування ряду афективних розладів, таких як генералізований розлад, пов'язаний зі станом тривоги, панічний розлад, обсесивно-компульсивний розлад, депресія та агресія. Повідомлялося, що ліганди 5-НТ1A можуть бути корисними для лікування ішемії. Огляд антагоністів 5-НТ1A і запропонованих потенційних терапевтичних мішеней для цих антагоністів, що базується на результатах доклінічних і клінічних досліджень, представлено у Schechter et al., Serotonin, 1997, Vol.2, Issue 7. Відзначається, що антагоністи 5-НТ1A можуть бути корисними при лікуванні шизофренії, старечого слабоумства, слабоумства, пов'язаного з хворобою Альцгеймера, а в сполученні з антидепресантами SSRI також корисні для лікування депресії. Інгібітори зворотного захоплення 5-НТ уявляють собою добре відомі лікарські засоби-антидепресанти і є корисними для лікування панічних розладів і соціальної фобії. Ефект комбінованого введення сполуки, що інгібує зворотне захоплення серотоніну, і антагоніста 5-НТ1Aрецептора був оцінений в декількох дослідженнях [Innis, R.B. et al., Eur. J. Pharmacol., 1987, 143, p.195-204 та Gartside S.E., Br. J. Pharmacol. 1995, 115, p.1064-1070, Blier P. et al., Trends Pharmacol. Sci. 1994, 15, 220]. У цих дослідженнях було встановлено, що спільне введення антагоніста 5-НТ1А-рецептора та інгібітору зворотного захоплення серотоніну призводить до більш швидкого початку лікувальної дії. D4-дофамінові рецептори відносяться до підкласу D2-подібних дофамінових рецепторів, які, як вважається, відповідальні за антипсихотичну дію нейролептиків. Побічна дія нейролептичних лікарських засобів, які, насамперед, діють через антагонізм стосовно D2-рецепторів, обумовлені, як відомо, антагонізмом у відношенні D2-рецептора в ділянках смугастого тіла головного мозку. Однак D4-дофамінові рецептори розташовані, головним чином, не в ділянках смугастого тіла, а в інших ділянках мозку, і це дозволяє зробити припущення, що антагоністи D4-дофамінового рецептора не будуть викликати екстрапірамідних побічних дій. Це наочно показує антипсихотична дія клозапіну, який виявляє більш високу спорідненість до D4-, чим до D2рецепторів, і не викликає екстрапірамідних побічних ефектів [Van Тоl et al., Nature, 1991, 350, 610; Hadley, Medicinal Research Reviews, 1996, 16, 507-526; та Sanner, Exp. Opin. Ther. Patents, 1998, 8, 383-393]. Було показано, що ряд лігандів D4, які, як заявлялося, є селективними антагоністами D4-рецепторів (L745,879 і U-101958), мають антипсихотичну активність [Mansbach et al., Psychopharmacology, 1998, 135,194200]. Однак раніше повідомлялося, що ці сполуки у різних дослідах визначення ефективності in vitro виявляють себе парціальними агоністами D4-рецепторів [Gazi et al., Br. J. Pharmacol., 1998, 124, 889-896; та Gazi et al., Br. J. Pharmacol., 1999,128, 613-620]. Крім того, було показано, що клозапін, який являє собою ефективний антипсихотичний засіб, є також прихованим антагоністом [Gazi et al., Br. J. Pharmacol., 1999, 128, 613-620]. Таким чином, ліганди D4, що є парціальними агоністами або антагоністами D4-рецепторів, можуть бути корисними при лікуванні психозів. Антагоністи дофамінових D4 також можуть бути корисними при лікуванні порушень пізнавальної здатності [Jentsch et al., Psychopharmacology, 1999, 142, 78-84]. Крім того, було висловлене припущення, що антагоністи дофамінових D4 можуть бути корисними для зменшення дискінезії, яка має місце в результаті лікування хвороби Паркінсона за допомогою L-дофа [Tahar et al., Eur. J.Pharmacol., 2000, 399,183-186]. D3-дофамінові рецептори також належать до підкласу D2-дофамінових рецепторів, і вони переважно розташовані в лімбічних частинах головного мозку [Sokoloff et al., Nature, 1990, 347,146-151], таких як nucleus accumbens, причому блокада дофамінових рецепторів асоційована з антипсихотичною активністю [Willner, Int. Clinical Psychopharmacology, 1997, 12, 297-308]. Крім того, було описано підвищення рівня D3-рецепторів у лімбічній частині головного мозку пацієнтів, що страждають на шизофренію [Gurevich et al., Arch. Gen. Psychiatry, 1997, 54, 225-32]. Отже, антагоністи D3-рецепторів можуть надавати можливість ефективної антипсихотичної терапії, вільної від екстрапірамідних побічних ефектів класичних антипсихотичних лікарських засобів, що виявляють свою дію, головним чином, за допомогою блокадиD2-рецепторів [Shafer et al., Psychopharmacology, 1998,135, 1-16; Schwartz et al., Brain Research Reviews, 2000, 31, 277-287]. Більш того, блокада D3-рецепторів призводить до незначної стимуляції в префронтальній корі головного мозку [Merchant et al. Cerebral Cortex, 1996, 6, 561-570], яка могла б бути корисною при негативних симптомах і порушеннях пізнавальної здатності, пов'язаних із шизофренією. Крім того, антагоністи дофамінових D3 можуть повертати у протилежному напрямку EPS (збуджувальний постсинапсичний потенціал), індуковані антагоністом D2 [Miilan et al., Eur. J. Pharmacol., 1997, 321, R7-R9] і не викликають змін у пролактині [Reavill et al., J. Pharmacol. Exp. Ther., 2000, 294, 1154-165]. Отже, антагоністичні властивості антипсихотичного лікарського засобу щодо D3 могли б зменшувати негативні симптоми і порушення пізнавальної здатності та призводити до поліпшеного профілю побічної дії у відношенні EPS і гормональних змін. Агоністи дофамінових D3 вважалися також придатними для лікування шизофренії [Wustow et al., Current Pharmaceutical Design, 1997, 3, 391-404]. Відповідно, вважається, що лікарські засоби, які діють на 5-НТ1A-рецептор, як агоністи, так і антагоністи, потенційно застосовні в терапії психіатричних і неврологічних розладів і, отже, є дуже бажаними. Крім того, антагоністи, що мають у той же час значну активність у відношенні інгібування зворотного захоплення серотоніну та/або активність стосовно D4- та/або D3, можуть бути особливо корисними для лікування різних психіатричних і неврологічних захворювань. Сполуки, структурно подібні до сполук даного винаходу, були описані раніше. Похідні тіофену описані в WO 99/02516 у якості лігандів для 5-НТ1A-рецептора. У WO 97/26252 як інсектициди описані похідні піперазинілу. У WO 95/14004 заміщені похідні алкіламіноіндолу описані в якості 5НТ1A, 5-НТ1B і 5-НТ1D-похідних. Зараз було встановлено, що сполуки певного класу похідних фенілпіперазину з .високою спорідненістю зв'язуються з 5-НТ1A-рецептором. Крім того, було встановлено, що багато які з цих сполук мають інші дуже корисні властивості, наприклад, значну інгібіторну активність у відношенні зворотного захоплення серотоніну та/або спорідненість до D4- і/або D3-рецептора. Таким чином, цей винахід відноситься до нових сполук загальної формули І; (I) де Ζ являє собою NH, NR'", О або S; R'" являє собою водень, C1-6-алкіл; R7 і R8 незалежно являють собою водень, галоген, C1-6-алкіл, C3-8-циклоалкіл, CN, CF3 або C1-6алкоксигрупу; або R7 і R8 разом утворюють 5- або 6-членний арил або гетероарил, конденсований з бензольним кільцем; Υ являє собою Ν, С або СН; пунктирна лінія представляє необов'язковий зв'язок; R6 і R6 являють собою Η або C1-6-алкіл; X являє собою -О- або -S-; n дорівнює 2, 3,4 або 5; m дорівнює 2 або 3; R1, R2, R3, R4 і R5 є незалежно обраними з групи, яка складається з водню, галогену, C1-6-алкілу, С2-6алкенілу, С2-6-алкінілу, С3-8-циклоалкілу, арилу, гідроксильної групи, гідрокси-C1-6-алкілу, C2-6-алкоксигрупи, С39 10 9 10 незалежно являють собою водень, C1-68-циклоалкоксигрупи, C1-6-алкілсульфанілу, ацилу, NR R , де R і R 9 10 алкіл, C2-6-алкеніл, C2-6-алкініл, С3-8-циклоалкіл або арил; або R і R разом з азотом, до якого вони приєднані, утворюють 1-морфолініл, 1-піперидиніл, 1-гомопіперидиніл, 1-піперазиніл, 1-гомопіперазиніл, 1-імідазоліл, 1піроліл або піразоліл, усі з яких можуть бути додатково заміщені C1-6-алкілом; або два суміжних замісники з R1R5 разом утворюють кільце, конденсоване з фенільним кільцем і обране з групи, що складається з де W являє собою О або S, і R' і R" являють собою водень або C1-6-алкіл. Сполуки даного винаходу мають спорідненість до 5-НТ1А-рецептора. Відповідно, винаходом пропонується: сполука, описана вище, як лікарський засіб; фармацевтична композиція, яка містить, принаймні, одну сполуку формули І, визначену вище, або її фармацевтично прийнятну кислотно-адитивну сіль, або проліки в терапевтично ефективній кількості у поєднанні з одним або декількома фармацевтично прийнятними носіями або розріджувачами. Цей винахід відноситься до застосування сполуки формули І, визначеної вище, або її кислотно-адитивної солі, або пролінів для одержання фармацевтичного препарату для лікування перелічених вище розладів. Винахід відноситься до способу лікування у людей захворювань і розладів, викликаних відхиленнями від норми в серотоніновій системі центральної нервової системи, який містить введення ефективної кількості сполуки формули І, визначеної вище. Сполуки цього винаходу, як вважається, корисні для лікування афективних розладів, таких як депресія, генералізований розлад, пов'язаний зі станом тривоги, панічний розлад, обсесивно-компульсивні розлади, соціальна фобія, розлади апетиту, психоз, і неврологічних розладів, таких як ішемія і сенільну деменцію. Переважним варіантом здійсненням винаходу є сполука формули І, як представлено вище, де Ζ являє собою ΝΗ, і утворений індол є приєднаним у положенні 3. Іншим переважним варіантом здійснення винаходу є сполука формули І, як представлено вище, де R7 і R8 незалежно є обраними з водню, галогену, C1-6-алкілу або R7 і R8 разом утворюють конденсоване піридильне кільце. Ще одним переважним варіантом здійснення винаходу є сполука формули і, як представлено вище, де n дорівнює 2, 3 або 4. Ще одним переважним варіантом здійснення винаходу є сполука формули І, як представлено вище, де m дорівнює 2. Ще одним переважним варіантом здійснення винаходу є сполука формули І, як представлено вище, де R6 і R6 ,обоє, являють собою водень. Ще одним переважним варіантом здійснення винаходу є сполука формули І, як представлено вище, де Υ являє собою N. Ще одним переважним варіантом здійснення винаходу є сполука формули І, як представлено вище, де R1, 2 R , R3, R4 і R5 є незалежно обраними з водню, алкоксигрупи, NR3R4, де R3 і R4 незалежно являють собою водень, C1-6-алкіл; або R3 і R4 разом утворюють 1-морфоліно; або два суміжних замісники з R1, R2, R3, R4 і R5 разом утворюють конденсований цикл, що складається з -О-СН2-О-, -О-СН2-СН2-О- або -СН2-СН2-СН2-· Ще одним переважним варіантом здійснення винаходу є сполука формули І, як представлено вище, де один або два замісники з R1, R2, R3, R4, R5 не є воднем. Найбільш переважним варіантом здійснення винаходу є сполука, яка відповідає формулі І, як представлено вище, при цьому сполука являє собою: 1-{1-[3-(диметиламіно)фенокси]феніл}-4-[2-(1Н-індол-3-іл)етил]піперазин; 1-[1-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[2-(1Н-індол-3-іл)етил]піперазин; 1-{1-[3-(диметиламіно)фенокси]феніл}-4-[3-(1 Н-індол-3-іл)пропіл]піперазин; 1-[1-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,4-бензодіоксан-6-ілокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,4-бензодіоксан-6-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-метоксифенокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[4-(1Н-індол-3-іл)бутил]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[4-(1Н-індол-3-іл)бутил]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин; 1-[2-(3-(диметиламіно)фенокси)феніл]-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[4-(1Н-індол-3-іл)бутил]піперазин; 1-[2-(4-метоксифенокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-диметиламіно)фенокси)феніл]-4-[4-(1Н-індол-3-іл)бутил]піперазин; 1-(2-феноксифеніл)-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин; 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-(диметиламіно)фенокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-фтор-1 Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(7-хлор-1 Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(7-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(5,7-дифтор-1 Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(7-бром-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-(диметиламіно)фенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-{1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(1Н-піроло[3,2-h]хінолін-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(5,7-дифтор-1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2-метоксифенокси)феніл]-4-[3-(1Н-піроло[3,2-h]хінолін-3-іл)пропіл]піперазин; 1-[2-(3-метоксифенокси)феніл]-4-[3-(1Н-піроло[3,2-h]хінолін-3-іл)пропіл]піперазин; 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин; 1 -[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-метоксифенокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин; 1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-метоксифенокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-етоксифенокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-(діетиламіно)фенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин; 1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин; 1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3-метоксифенокси)феніл]-4-[3-(7-фтор-1Н-індол-3-іл)пропіл]піперазин; 1-(2-феноксифеніл)-4-[3-(5,7-диметил-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(7-бром-1Н-індол-3-іл)пропіл]піперазин; 1-[2-(3,4,5-триметоксифенокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин. Деякі із сполук загальної формули І можуть існувати у виді оптичних ізомерів, і такі оптичні ізомери також включені в обсяг цього винаходу. Термін "C1-6-алкіл" відноситься до розгалуженої або нерозгалуженої алкільної групи, що має від одного до шести атомів вуглецю, включаючи такі, як метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2-бутил, 2-метил-2-пропіл і 2-метил-1-пропіл. Аналогічно, терміни "C1-6-алкеніл" і "С2-6-алкініл", відповідно, відносяться до груп, що містять від двох до шести атомів вуглецю включно і, принаймні, один подвійний або потрійний зв'язок, відповідно. Термін "галоген" означає фтор, хлор, бром або йод. Термін "С3-8-циклоалкіл" відноситься до моноциклічного або біциклічного карбоциклу, що має від трьох до восьми атомів вуглецю, такий як циклопропіл, циклопентил, циклогексил, циклогептил або циклооктил. Переважними варіантами здійснення є циклопропіл, циклопентил, циклогексил. Терміни "C1-6-алкоксигрупа", "C1-6-алкілсульфаніл", "С3-8-циклоалкоксигрупа" позначають групи, в яких алкільна група являє собою C1-6-алкіл, визначений вище. Термін "ацил" означає СНО та -СО-алкіл, де алкільна група являє собою C1-6-алкіл, визначений вище. Термін "5- або 6-членні кільця, які являють собою арил або гетероарил" відноситься до таких груп як феніл, піроліл, піридил, піримідил, фураніл, тієніл. Прикладами адитивних солей органічної кислоти за винаходом є солі малеїнової, фумарової, бензойної, аскорбінової, бурштинової, щавлевої, біс-метиленсаліцилової, метансульфонової, етандисульфонової, оцтової, пропіонової, винної, саліцилової, лимонної, глюконової, молочної, яблучної, мигдалевої, коричної, цитраконової, аспарагінової, стеаринової, пальмітинової, ітаконової, гліколевої, р-амінобензойної, глютамінової, бензолсульфонової і теофіліноцтової кислот, а також утворені з 8-галогентеофілінами, наприклад, 8-бромотеофіліном. Прикладами адитивних солей неорганічної кислоти за винаходом є солі хлористоводневої, бромістоводневої, сірчаної, сульфамінової, фосфорної і азотної кислот. Кислотно-адитивні солі за винаходом переважно уявляють собою фармацевтично прийнятні солі, одержані з нетоксичних кислот. Крім того, сполуки за цим винаходом можуть знаходитися в несольватованих, а також сольватованих формах з фармацевтично прийнятними розчинниками, такими як вода, етанол тощо. Звичайно сольватовані форми розглядаються як еквівалентні несольватованим формам для мети даного винаходу. Деякі сполуки цього винаходу містять хіральні центри, і такі сполуки існують в формі ізомерів (тобто енантіомерів). Винахід включає всі такі ізомери та будь-які їх суміші, включаючи рацемічні суміші. Рацемічні форми можуть бути розподілені на оптичні антиподи відомими способами, наприклад, розподілом діастереомерних солей оптично активної кислоти і вивільненням оптично активної амінової сполуки за допомогою обробки основою. Інший спосіб розподілу рацематів на оптичні антиподи заснований на хроматографії на оптично активній матриці. Рацемічні сполуки цього винаходу також можуть бути розподілені на їхні оптичні антиподи, наприклад, фракційною кристалізацією d-або І-солей (наприклад, тартратів, манделатів або камфорсульфонату). Сполуки цього винаходу також можуть бути розподілені за допомогою утворення діастереомерних похідних. Можуть використовуватися і додаткові способи розподілу оптичних ізомерів, відомі кваліфікованому фахівцю даної галузі. Такі способи включають способи, описані [в публікації J. Jaques, A. Collet, S. Wilen, "Enantiomers, Racemates, and Resolution", John Wiley and Sons, New York (1981)]. Оптично активні сполуки можуть бути одержані з оптично активних початкових матеріалів. Сполуки за цим винаходом можуть бути одержані одним з наведених нижче способів, які містять: а) взаємодію вторинного аміну формули (III) де R1-R6', X, Υ і m є такими, як визначено вище, з алкілувальним агентом загальної формули: де R7, R8, Ζ і n є такими, як визначено вище, і G являє собою придатну вилучну групу, таку як галоген, мезилат або тозилат; b) взаємодію сполуки формули (IV) де R1-R6, Χ, Υ, n та m є такими, як визначено вище, і Q(OH)2 являє собою діол, такий як заміщений етиленгліколь, пропіленгліколь або діол, зв'язаний з полімером; с гідразином формули (V) c) відновлення аміду формули (VI) де Z, R1-R8, Χ, Υ, n та m є такими, як визначено вище; d) відновлення сполуки формули (VII) де R1-R8, Χ, Υ і m є такими, як визначено вище. Алкілування відповідно до цього способу звичайно проводиться кип'ятінням реагентів у колбі зі зворотним холодильником або нагріванням і витримуванням їх при визначеній температурі в придатному розчиннику, такому як ацетон, ацетонітрил, метилізобутилкетон, тетрагідрофуран, діоксан, етанол, 2-пропанол, етилацетат, Ν,Ν-диметилформамід, диметилсульфоксид або 1-метил~2-піролідинон, у присутності основи, такої як триетиламін або карбонат калію, і, необов'язково, каталітичної кількості йодиду калію. Вторинні аміни формули III одержують послідовними реакціями, представленими вище. 2фторнітробензол піддавали взаємодії з нуклеофілом формули VIII в апротонному розчиннику, такому як Ν,Νдиметилформамід, з використанням органічних або неорганічних основ при підвищеній температурі. Після відновлення проміжної нітросполуки IX у стандартних умовах, таких як гідрування з паладієвим каталізатором або залізом у кислотних розчинниках, похідне аніліну X перетворювалося в цільовий вторинний амін формули III. Одержання піперазину проводилося або взаємодією з гідрохлоридом біс(2-хлоретил)аміну при підвищеній температурі, або багатостадійним синтезом відповідно до описаних в літературі методик [Kruse et al., Reel. Trav. Chim, Pays-Bas, 1988, 107, 303-309]. Альтернативно, вторинні аміни формули III одержують з використанням монозаміщених циклічних діамінів формули XII у якості ключової проміжної сполуки. Замісник R являє собою придатну захисну групу, таку як етокси-, метокси- або 2-метил-2-пропілоксикарбонільну групу або бензильну групу, або придатний твердий носій, такий як смола Меріфілда (Merrifield resin) або карбаматну групу твердого носія, такого як смола wang на основі карбаматної групи-лінкера [Zaragoza, Tetrahedron Lett., 1995, 36, 8677-8678]. Монозаміщені циклічні діаміни формули XII одержують з комерційно доступних початкових речовин або способами, відомими кваліфікованому у даній галузі хіміку. Монозаміщений циклічний діамін формули XII піддають взаємодії з η61,2-дихлорбензол-η5-циклопентадієнілзалізом(ІІ) гексафторфосфатом при підвищеній температурі в апротонному розчиннику, такому як сухий тетрагідрофуран, з використанням придатної основи, такої як карбонат калію. η6-1,2-дихлорбензол-η5-циклопентадієнілзалізо(ІІ) гексафторфосфат одержують за методиками, описаними у літературі [Pear son and Gelormani, J. Org. Chem., 1994, 59, 4561-4570]. Отримане в такий спосіб монохлорпохідне формули XIII потім піддають взаємодії з нуклеофілом формули VIII в апротонному розчиннику, такому як сухий тетрагідрофуран, або з використанням придатної основи, такої як карбонат калію, або перед взаємодією нуклеофіл формули VIII депротонують з використанням основи, такої як гідрид натрію. Розкладання комплексу, проведене відповідно до методик, описаних в літературі [Pearson et al., J. Org. Chem. 1996, 61, 1297-1305], з наступним видаленням захисної групи методами, відомими кваліфікованому у даній галузі хіміку, або відщеплення від твердого носія відповідно до методик, описаних в літературі [Zaragoza, Tetrahedron Lett., 1995, 36, 8677-8678; та Conti et al., Tetrahedron Lett, 1997, 38, 29152918], приводить до одержання цільових вторинних амінів формули III, відповідних вторинним амінам формули XV, R=H. Нуклеофіли формули VIII комерційно доступні, та їх одержують способами, відомими кваліфікованому у даній галузі хіміку, або відповідно до методик, описаних в літературі [Guillaumet and Hretani, J. Heterocyclic. Chem., 26, 193-196, 1989]. Алкілувальні агенти формули одержують відповідно до методик, описаних в літературі [J. Med. Chem., 1983, 26, 1470-1477; Brodfuehrer et al., J.Org. Chem., 1997, 62, 9192-9202; Anelli et al., J. Org. Chem., 1987, 52, 2559-2562; Brodfuehrer et al., J. Org Chem., 1997, 62, 9192-9202], або способами, відомими кваліфікованому хіміку. Одержання індолу у відповідності зі способом b проводиться взаємодією ацеталей формули IV з арилгідразинами формули V, що приводить до одержання відповідних гідразонів, з наступним перетворенням їх в індоли методом синтезу індолів по Фішеру. Синтез переважно проводиться послідовними реакціями, що протікають в одній ємності, з використанням в якості каталізаторів кислот Льюїса, переважно хлориду цинку або трифториду бора, або протонних кислот, переважно сірчаної кислоти або фосфорної кислоти, у придатному розчиннику, такому як оцтова кислота або етанол, при підвищеній температурі. Ацеталі формули IV одержують за допомогою послідовності реакцій (2), як представлено вище, з використанням монозаміщених циклічних діамінів формули XII, де у якості ключових проміжних продуктів. Ключові проміжні продукти формули XII одержують алкілуванням циклічних діамінів формули XI ацеталями формули (XVI) в умовах, описаних вище для способів а. Полімерзв'язані ацеталі формули XVI одержують взаємодією при підвищеній температурі альдегідів формули G-(CH2)n+1-CHO з комерційно доступним 2,2-диметил-1,3-діоксолан-4-іл-метоксиметилполістиролом у придатному розчиннику, такому як толуол, з використанням п-толуолсульфонової кислоти як каталізатора. 4хлорбутаналь, 5-хлорпентаналь і 6-хлоргексаналь були отримані способом, аналогічним описаному у публікації Normant et al., Tetrahedron 1994, 50(40), 11665. Реакції відновлення відповідно до способів с та d звичайно проводять з використанням LiAlhU, АІН3 або диборану в інертному розчиннику, такому як тетрагідрофуран, діоксан або діетиловий ефір, при кімнатній або при злегка підвищеній температурі. Аміди формули VI одержують із вторинних амінів формули III і заміщених індол-3-ілалкілкарбонових кислот або хлорангідридів карбонових кислот за способами, відомими кваліфікованому у даній галузі хіміку. Аміди формули VII одержують з 3-незаміщених індолів і вторинних амінів формули Ill відповідно до описаних в літературі багатостадійних методик [Nichols et at., Synthesis, 1999, б, 935938, та Speeter and Anthony, J. Am. Chem. Soc, 1954, 76, 6208-6210]. Приклади Усі реакції проводилися під тиском у атмосфері азоту. Температури плавлення були визначені на апараті Biichi SMP-20 і не корегувалися. Аналітичні дані РХ-МС були отримані на апараті РЕ Sciex API 150ЕХ, постаченим джерелом іонного розпилення і РХ системою Shimadazu LC-8A/SLC-10А. Рідинну хроматографію (РХ) проводили (50´4,6мм YMC ODS-A з розміром частинок 5мкм) елююванням з лінійним градієнтом сумішшю вода/ацетонітрил/трифтороцтова кислота (градієнт від 90:10:0,05 до 10:90:0,03) протягом 7 хвилин з об'ємною швидкістю 2мл/хв. Сполуки 3с, 3е, 3f і 3І РХ (Waters Symmetry, 30´4,6мм, С18, розмір частинок 3,5мкм) проводили елююванням з лінійним градієнтом сумішшю вода/ацетонітрил/трифтороцтова кислота (градієнт від 90:10:0,05 до 10:90:0,03) протягом 4 хвилин з об'ємною швидкістю 2мл/хв. Чистота визначалася інтегруванням УФ сліду (UV trace) (254нм). Час утримання Rt виражали в хвилинах. Препаративне РХ-МС-розподілення проводили на тому ж апараті. РХ (50´20мм YMC ODS-A з розмірам частинок 5мкм) проводили елююванням з лінійним градієнтом сумішшю вода/ацетонітрил/трифтороцтова кислота (градієнт від 80:20:0,05 до 10:90:0,03) протягом 7 хвилин з об'ємною швидкістю 22,7мл/хв. Фракційний збір проводили за допомогою МС-детектування розгалуженого потоку, 1 Н ЯМР спектри записували при 500,13МГц на апараті Bruker Avance DRX500 або при 250,13МГц на апараті Bruker AC 250. У якості розчинників використовували дейтеровані хлороформ (99,8% D) або диметилсульфоксид (99,9% D). TMS використовувався як внутрішній стандарт. Величини хімічних зсувів виражали в млн-1. Для позначення різних ЯМР сигналів використовували наступні абревіатури: с= синглет, д= дуплет, т= триплет, кв= квартет, кві= квінтет, м= гептет, дд= подвійний дуплет, дт= подвійний триплет, дкв= подвійний квартет, тт= триплет триплетів, м= мультиплет і уш= уширений синглет. ЯМР сигналами, що відповідають кислотним протонам, звичайно зневажали. Вміст води в кристалічних сполуках визначали титруванням за Карлом Фішером. Термін "стандартні методики обробки" включає екстракцію зазначеним органічним розчинником з початкових водяних розчинів, сушіння об'єднаних органічних екстрактів (безводними MgSO4 або Na2SO4), фільтрування і випарювання розчинника у вакуумі. Для хроматографії на колонках використовували силікагель типу Kieselgel 60, 230400меш відповідно за ASTM. Для іонообмінної хроматографії використовувалися наступні матеріали: SCXколонки (1г) від Varian Mega Bond Elut®, Chrompack cat. №220776. Перед використанням SCX-колонки попередньо оброблялися 10% розчином оцтової кислоти в метанолі (3мл). Для хроматографії з оберненою фазою використовувалися наступні матеріали: С-18-колонки (1г) від Varian Mega Bond Elut®, Chrompack cat. №220508. Перед використанням С-18-колонки попередньо оброблялися метанолом (3мл) і водою (3мл). Для розкладання комплексів опроміненням використовувалося джерело ультрафіолетового світла (300 W) від Philipps. Приклад 1 Оксалат 1-{2-[3-(диметиламіно)фенокси]феніл]-4-[2-(1Н-індол-3-іл)етил]піперазину (1а) 1-хлор-2-нітробензол (15,0г), 3-(диметиламіно)фенол (13,0г) і гідроксид калію (11,8г) розчиняють у Ν,Νдиметилформаміді (350мл) та кип'ятять у колбі зі зворотним холодильником протягом 18 годин. Потім реакційну суміш охолоджують, виливають у воду й обробляють у відповідності зі стандартною методикою обробки з використанням етилацетату. Сирий продукт очищають хроматографією на силікагелі (гептан:етилацетат:триетиламін, 80:10:10). Чистий проміжний продукт розчиняють у суміші етанолу (200мл) і оцтової кислоти (20мл). Після додавання Pd/C (5%, 4,5г) реакційну суміш піддають вібрації в атмосфері водню (3 бари) протягом 3 годин. Реакційну суміш фільтрують і після нейтралізації обробляють у відповідності зі стандартною методикою обробки з використанням етилацетату, одержуючи в результаті чистий анілін (11,2г). Сирий анілін, біс-(2-хлоретил)амін гідрохлорид (8,6г) і хлорбензол (200мл) кип'ятять у колбі зі зворотним холодильником протягом 48 годин. Реакційну суміш охолоджують до кімнатної температури і леткі розчинники випарюють у вакуумі з одержанням сирого 1-{[3-(диметиламіно)фенокси]феніл}піперазину (18,6г). Розчин сирого піперазину, ди-трет-бутилдикарбонату (32г) і карбонату калію (68г) у суміші тетрагідрофуран:вода (1:1) нагрівають до 50°С та витримують при цій температурі протягом 18 годин. Органічний шар відокремлюють і водну фазу екстрагують етилацетатом. Об'єднані органічні фази обробляють у відповідності зі стандартною методикою обробки з наступним очищенням хроматографією на силікагелі (гептан:етилацетат, 8:2) з одержанням чистого ВОС-захищеного 1-{[3-(диметил)фенокси]феніл}піперазину (9,4г). Розчин ВОС-похідного в суміші сухого ТГФ (30мл) і трифтороцтової кислоти (30мл) перемішують при кімнатній температурі протягом 1 години. Леткі розчинники випарюють у вакуумі і додають етилацетат і 1N водяний розчин гідроксиду натрію. Органічну фазу збирають і обробляють у відповідності зі стандартною методикою обробки, одержуючи чистий 1-{[3-(диметиламіно)фенокси]феніл}піперазин (6,0г). Суміш частини чистого піперазину (1,37г), 3-(2-брометил)1Н-індолу (1,0г), карбонату калію (2,2г), йодиду калію (кат.) і метилізобутилкетону кип'ятять у колбі зі зворотним холодильником протягом 24 годин. Суміш охолоджують до кімнатної температури, фільтрують і леткі розчинники випарюють у вакуумі з одержанням олії, яку очищають хроматографією на силікагелі (гептан:етилацетат:триетиламін, 26:70:4), одержуючи зазначену в заголовку сполуку у вигляді олії. Зазначену в заголовку сполуку кристалізують у формі оксалату з ацетону (1,27г). Т. пл. 210-203°С. 1Н-ЯМР/250МГц (ДМСО-d6): 2,85 (с, 6Н); 3,00-3,35 (м, 12Н); 6,15 (д, 1Н); 6,35 (с, 1Н); 6,45 (д, 1Н); 6,85 (д, 1Н); 6,95-7,15 (м, 6Н); 7,20 (с, 1Н); 7,35 (д, 1Н); 7,55 (д, 1Н); 10,90 (с, 1Н). МС: m/z: 441 (МН+), 144. Елементний аналіз. Обчислено для C28H32 N4O: С, 67,89; Н, 6,47; N, 10,56. Знайдено: С, 67,34; Н, 6,59; N, 10,30. Використовуючи такий самий загальний спосіб, одержують наступні сполуки: Оксалат 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[2-(1Н-індол-3-іл)етил]піперазину (1b). Т. пл. 221 228°С. 1Н-ЯМР (250МГц, ДМСО-d6): 3,00-3,35 (м, 12Н); 6,00 (с, 2Н); 6,40 (дд, 1Н); 6,65 (д, 1Н); 6,80-6,90 (м, 2Н); 6,95-7,15 (м, 5Н); 7,20 (д, 1Н); 7,35 (д, 1Н); 7,55 (д, 1Н); 10,90 (с, 1Н). МС: m/z 443 (МН+), 311,131. Елементний аналіз. Обчислено для C27H27N3O3: С, 65,10; Н, 5,54; N, 7,86. Знайдено: С, 64,86; Н, 5,55; N, 7,60. Приклад 2 1-{2-[3-(Диметиламіно)фенокси]феніл}-4-[3-(1Н-індол-3-іл)пропіл]піперазин (2а) До суспензії алюмогідриду літію (8,0г) у тетрагідрофурані (500мл) краплями додають розчин 3індолпропіонової кислоти (20г) у тетрагідрофурані (100мл). Реакційну суміш перемішують протягом 1 години при кімнатній температурі та потім охолоджують до 5°С. Послідовно додають воду (16мл), 15% водяний розчин гідроксиду натрію (8,0мл) і воду (40мл), після чого реакційну суміш перемішують при кімнатній температурі протягом ночі і фільтрують. Випарювання летких розчинників приводить до одержання чистого 3(1Н-індол-3-іл)пропанолу (19,1г) у вигляді олії. 3-(1Н-індол-3-іл)пропанол (18,6г) і тетрабромід вуглецю (42,1г) розчиняють в ацетонітрилі (1л), охолоджують до0°С та невеликими порціями додають трифенілфосфін (30,7г). Реакційну суміш додатково перемішують протягом 3 годин при кімнатній температурі, леткі розчинники випарюють у вакуумі й отриману олію очищають хроматографією на силікагелі (гептан:етилацетат, 2:1) з одержанням 3-(3-бромпропіл)-1Н-індолу (25,6г). Цей проміжний продукт з'єднують з піперазиновими фрагментами, використовуючи спосіб, описаний у прикладі 1, у результаті чого одержують зазначену в заголовку сполуку, яку виділяють у вигляді твердої аморфної речовини. 1 Н-ЯМР (250МГц, ДМСО-d6): 1,80 (кв, 2Н); 2,25-2,40 (м, 6Н); 2,65 (т, 2Н); 2,85 (с, 6Н); 3,05 (м, 4Н); 6,10 (дд, 1Н); 6,30 (т, 1Н); 6,45 (дд, 1Н); 6,80-7,10 (м, 8Н); 7,30 (д, 1Н); 7,50 (д, 1Н); 10,70 (шир, 1Н). МС: m/z: 455 (МН+), 295, 239, 201, 130. Аналогічно одержують наступні сполуки: Оксалат 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазину (2b), Т. пл. 156162°С. 1Н-ЯМР (250МГц, ДMCO-d6): 1,80 (кв, 2Н); 2,25-2,40 (м, 6Н); 2,70 (т, 2Н); 3,05 (м, 4Н); 6,00 (с, 2Н); 6,35 (дд, 1Н); 6,55 (д, 1Н); 6,85 (д, 2Н); 6,90-7,15 (м, 6Н); 7,30 (д, 1Н); 7,50 (д, 1Н); 10,75 (с, 1Н). МС: m/z: 456 (МН+), 297, 201,130. Елементний аналіз. Обчислено для C28H29N3O3: С, 73,81; Н, 6,43; N, 9,23. Знайдено: С, 73,28; Н, 6,45; N, 9,00. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин дигідрохлорид (2с). Т. пл. 165°С (розкладання). 1 Н-ЯМР (250МГц, ДМСО-d6): 2,08 (м, 2Н); 2,73 (т, 2Н); 3,02 (м, 2Н); 3,15 (м, 4Н); 3,55 (т, 4Н); 6,00 (с, 2Н); 6,40 (д, 1Н); 6,65 (с, 1Н); 6,80 (д, 1Н), 6,85 (д, 1Н); 7,00 (м, 2Н); 7,05 (м, 2Н); 7,25 (д, 1Н); 7,38 (с, 1Н); 7,55 (дд, 1Н); 10,45 (с, 1Н), 11,00 (с, 1Н). МС (m/z): 490 (МН+). Елементний аналіз. Обчислено для C28H30CI 3N3O3: С, 59,73; Н, 5,38; N, 7,47. Знайдено: С, 59,13; Н, 5,36; N, 7,26. 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-фтор-1Н-iндол-3-іл)пропіл]піперазин дигідрохлорид (2d). Т. пл. 183189°С. 1Н-ЯМР (500МГц, ДМСO-d6): 2,12 (м, 2Н); 2,73 (т, 2Н); 3,05-3,25 (м, 6Н); 3,55 (д, 2Н); 3,65 (д, 2Н); 3,75 (с, 3Н); 6,53 (м, 1Н); 6,88-7,20 (м, 9Н); 7,27-7,40 (м, 3Н); 11,05 (с, 2Н). МС (m/z): 460 (МН+). Елементний аналіз. Обчислено для C28H32CI 2FN3O2: С, 63,16; Н, 6,06; N, 7,89. Знайдено: С, 63,04; Н, 6,07; N, 7,88. 1-[2-(1,4-бензодіоксан-6-ілокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин (2е). 1Н-ЯМР (250МГц, CDCI 3): 1,90 (кві, 2Н); 2,40-2,60 (м, 6Н); 2,79 (т, 2Н); 3,15 (т, 4Н); 4,22 (с, 4Н); 6,45 (м, 2Н); 6,77 (д, 1Н); 6,85-7,22 (м, 7Н); 7,35 (д, 1Н); 7,60 (д, 1Н); 7,92 (с, 1Н). МС (m/z): 470 (МН+). 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (2f). 1Н-ЯМР (250МГц, CDCI 3): 1,90 (кві, 2Н); 2,38-2,53 (м, 6Н); 2,73 (т, 2Н); 3,16 (т, 4Н); 4,26 (с, 4Н); 6,38 (дд, 1Н); 6,60-6,75 (м, 2Н); 6,83-7,10 (м, 6Н); 7,23-7,30 (м, 3Н); 7,92 (с, 1Н). РХ/МС (m/z): 488 (МН+), Rt=2,53, чистота 99,8%. 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин (2g). 1Н-ЯМР (250МГц, CDCI 3): 1,90 (кві, 2Н); 2,35-2,50 (м, 6Н); 2,75 (т, 2Н); 3,18 (т, 4Н); 4,28 (с, 4Н); 6,40 (дд, 1Н); 6,60-6,75 (м, 3Н); 6,80-7,08 (м, 6Н); 7,32 (д, 1Н); 7,50 (д, 1Н); 7,95 (с, 1Н). PX/MG (m/z): 504 (МН+), Rt=2,60, чистота 99,6%. 1-[2-(1,4-бензодіоксан-6-ілокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин (2h).1 Н-ЯМР (250МГц, CDCI 3): 1,90 (кві, 2Н); 2,35-2,55 (м, 6Н); 2,75 (т, 2Н); 3,15 (т, 4Н); 4,23 (с, 4Н); 6,45 (м, 2Н); 6,78-6,15 (м, 7Н); 7,32 (д, 1Н), 7,50 (д, 1Н); 7,92 (с, 1Н). РХ/МС (m/z): 504 (МН+), Rt=2,62, чистота 99,7%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин (2i). 1Н-ЯМР (250МГц, CDCI 3): 1,90 (кві, 2Н); 2,35-2,50 (м, 6Н); 2,73 (т, 2Н); 3,19 (т, 4Н); 3,83 (с, ЗН); 6,70-7,08 (м, 10Н); 7,32 (д, 1Н), 7,49 (д, 1Н); 7,94 (с, 1Н). РХ/МС (m/z): 476 (МН+), Rt=2,59, чистота 99,8%. 1-[2-(3-Метоксифенокси)феніл]-4-[3-(6-хлор-1Н-індол-3-іл)пропіл]піперазин (2j).1Н-ЯМР (250МГц, CDCI 3): 1,89 (кві, 2Н); 2,33-2,60 (м, 6Н); 2,73 (т, 2Н); 3,13 (т, 4Н); 3,75 (с, ЗН); 6,49 (м, 2Н); 6,58 (дд, 1Н); 6,95-7,20 (м, 7Н); 7,32 (д, 1Н), 7,49 (д, 1Н); 7,92 (с, 1Н). РХ/МС (m/z): 476 (МН+), Rt=2,64, чистота 99,7%. Приклад 3 1-[2-(2-Метоксифенокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин (3а) 4-[(4-Нітрофенокси)карбонілоксиметил)фенокcиметилполістирол (267,0г, 235ммоль) суспендують у сухому Ν,Ν-диметилформаміді. (2л). До суміші додають N-метилморфолін (238,0г, 2,35моль) і піперазин (102,0г, 1,17моль) і отриману суміш перемішують при кімнатній температурі протягом 16 годин. Смолу відфільтровують і промивають N,N-диметилформамідом (2´1л), тетрагідрофураном (2´1л), водою (1´500мл), метанолом (2´1л), тетрагідрофураном (2´1л), метанолом (1´1л). І, нарешті, смолу промивають дихлорометаном (3´500мл) і сушать у вакуумі (25°С, 36 годин), у результаті одержують майже безбарвну смолу (240,0г). Частину отриманої в такий спосіб смоли (115,1г, 92ммоль) суспендують у сухому тетрагідрофурані (1,6л), додають h6-1,2-дихлорбензол-h5-циклопентадієнілзалізо(ІІ) гексафторфосфат (76,0г, 184ммоль) і потім карбонат калію (50,9г, 368ммоль). Реакційну суміш перемішують при 60°С протягом 16 годин. Після прохолодження до кімнатної температури смолу відфільтровують і промивають тетрагідрофураном (2´500мл), водою (2´250мл), тетрагідрофураном (2´500мл), водою (2´250мл), метанолом (2´250мл), дихлорометаном (2´500мл), метанолом (2´250мл). І, нарешті, смолу промивають дихлорометаном (3´500мл) і сушать у вакуумі (25°С, 36 годин), у результаті одержують темно-оранжеву смолу (142г). До розчину 2-гідроксианізолу (2,2г, 17,7ммоль) у тетрагідрофурані (50мл) обережно при кімнатній температурі додають чистий гідрид натрію (15,5ммоль) (будьте уважні: виділяє водень). Суміш додатково перемішують протягом 30 хвилин після припинення виділення водню. Потім додають частину отриманої раніше смоли (2,8г, 1,72ммоль) і суміш перемішують при 40°С протягом 12 годин. Після охолодження до кімнатної температури смолу відфільтровують і промивають тетрагідрофураном (2´50мл), сумішшю тетрагідрофуран/вода (1:1) (2´50мл), Ν,Ν-диметилформамідом (2´50мл), водою (2´50мл), метанолом (3´50мл), тетрагідрофураном (3´50мл) і послідовно метанолом і тетрагідрофураном (кожним по 50мл, 5 циклів). І, нарешті, смолу промивають дихлорометаном (3´50мл) і сушать у вакуумі (25°С, 12 годин). Отриману в такий спосіб смолу (3,0г, 1,84ммоль) і 0,5Μ розчин 1,10 - фенантроліну в суміші піридин/вода (3:1, 20мл) поміщають у світлопроникну реакційну трубку. Для розкладання комплексу суспензію піддають вихровому перемішуванню (vortexed) і опромінюють видимим світлом протягом 12 годин. Характерною ознакою стадії розкладання комплексу є поява інтенсивного червоного забарвлення рідкої фази в процесі опромінення. Смолу відфільтровують і промивають метанолом (2´25мл), водою (2´25мл) і тетрагідрофураном (3´25мл) доти, доки промивні розчини не будуть безбарвними (5 циклів) і опромінення повторюють до повного розкладання комплексу (5 циклів). Після завершення розкладання комплексу смолу промивають дихлорометаном (3´25мл) і сушать у вакуумі (25°С, 12 годин). Смолу (приблизно 2,5г, 1,84ммоль) суспендують у суміші трифтороцтова кислота:дихлорометан (1:1, 25мл) і перемішують при кімнатній температурі протягом 2 годин. Смолу відфільтровують і промивають метанолом (1´5мл) і дихлорометаном (1´5мл). Рідкі фази поєднують і леткі розчинники випарюють з одержанням темно-коричневої олії (1,5г). Олію розчиняють в ацетонітрилі (10мл). До отриманого в такий спосіб розчину додають карбонат калію (46мг, 0,33ммоль) і 3-(3-бромпропіл)-1Н-індол (33мг, 0,14ммоль), суміш нагрівають до 70°С та витримують при цій температурі протягом 12 годин. До суміші додають ізоціанометилполістирол (250мг, 0,29ммоль) і суміш повільно охолоджують до кімнатної температури. Смолу відфільтровують і промивають метанолом (1´2мл) і дихлорометаном (1´2мл). З об'єднаних рідких фаз випарюють леткі розчинники з одержанням темнокоричневої олії. Сирий продукт очищають за допомогою препаративної ВЕРХ з оберненою фазою. Отриманий розчин послідовно завантажують у попередньо підготовлену іонообмінну колонку. Колонку промивають метанолом (4мл) і ацетонітрилом (4мл), після чого продукт елюють 4N розчином аміаку в метанолі (4,5мл). Випарювання летких розчинників приводить до одержання зазначеної в заголовку сполуки 3а у вигляді жовтої олії (66мл). РХ/МС (m/z) 442 (МН+), Rt=4,15, чистота: 93%. Аналогічно одержують наступні сполуки: 1-(2-феноксифеніл)-4-[4-(1Н-індол-3-іл)бутил]піперазин (3b): РХ/МС (m/z) 426 (МН+), Rt=4,36,: чистота 79%. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[4-(1Н-індол-3-іл)бутил]піперазин (3с): РХ/МС (m/z) 470 (МН+), Rt=2,62, чистота: 89%. 1-[2-(2-метоксифенокси)феніл]-4-[2-(6-хлор-1Н-iндол-3-іл)етил]піперазин (3d): РХ/МС (m/z) 462 (МН+), Rt=4,35, чистота: 76%. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[2-(6-хлор-1Н-iндол-3-іл)етил]піперазин (3е): РХ/МС (m/z) 476 (МН+), Rt=2,64, чистота 89%. 1-{2-[3-(диметиламіно)фенокси]фенiл}-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин (3f): РХ/МС (m/z) 475 (МН+), Rt=2,32, чистота: 91%. 1-[2-(2-метоксифенокси)феніл]-4-[4-(1Н-індол-3-іл)бутил]піперазин (3g): РХ/МС (m/z) 456 (МН+), Rt=4,31, чистота: 90%. 1-[2-(4-метоксифенокси)феніл]-4-[3-(1Н-індол-3-iл)пропіл]піперазин(3h): РХ/МС (m/z) 442 (МН+), Rt=4,18, чистота: 90%. 1-{2-[3-(диметиламіно)фенокси]феніл}-4-[4-(1Н-індол-3-іл)бутил]піперазин (3і): РХ/МС (m/z) 469 (МН+), Rt=2,27, чистота: 88%. 1-(2-феноксифеніл)-4-[2-(6-хлор-1Н-індол-3-іл)етил]піперазин (3j): РХ/МС (m/z) 432 (МН+), Rt=4,40, чистота: 70%. Приклад 4 2-(4-хлорбутил)-1,3-діоксолан-4-ілметоксиметилполістирол (4а) У круглодонну колбу об'ємом 2 л завантажують 2,2-диметил-1,3-діоксолан-4-ілметоксиметилполістирол (90г, 72ммоль, комерційно доступний як (±)-1-(2,3-ізопропілідин)гліцеринполістирол від CalbiochemNovabiochem, №01-64-0291 за каталогом). Додають толуол (900мл), потім моногідрат п-толуолсульфонової кислоти (5,0г, 26ммоль), сульфат натрію (25г) і 5-хлорпентаналь (25,5г, 211ммоль) і одержану суміш кип'ятять у колбі зі зворотним холодильником протягом 12 годин. Зворотний холодильник заміняють апаратом ДинаСтарка і суміш додатково кип'ятять при температурі дефлегмації протягом 3 годин. Після охолодження реакційної суміші до 60°С смолу відфільтровують і промивають толуолом (200мл), сумішшю тетрагідрофуран/піридин (1:1, 200мл), сумішшю тетрагідрофуран/вода/піридин (10:10:1,200мл), метанолом (200мл), водою (200мл), тетрагідрофураном (200мл), дихлорометаном (200мл), метанолом (3´200мл) і дихлорометаном (3´200мл). Смолу сушать у вакуумі (55°С, 12 годин), у результаті одержують зазначену в заголовку сполуку 4а (97г). Аналогічно одержують наступні сполуки: 2-(3-Хлорпропіл)-1,3-діоксолан-4-ілметоксиметилполістирол (4b) 2-(5-Хлорпентил)-1,3-діоксолан-4-ілметоксиметилполістирол (4с). Приклад 5 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (5а) 2-(3-хлорбутил)-1,3-діоксолан-4-ілметоксиметилполістирол (70г, 90,3ммоль) суспендують у сухому Ν,Νдиметилформаміді (700мл). Додають йодид натрію (68г, 452ммоль), потім діізопропілетиламін (232мл, 1,36моль) і піперазин (117г, 1,36моль). Реакційну суміш нагрівають до 80°С та перемішують при цій температурі протягом 12 годин. Після охолодження суміші до кімнатної температури смолу відфільтровують і промивають N.N-диметилформамідом (3´500мл), метанолом (3´500мл), тетрагідрофураном (3´500мл) і послідовно метанолом і тетрагідрофураном (кожним по 250мл, 5 циклів). І, нарешті, смолу промивають дихлорометаном (3´500мл) і сушать у вакуумі (25°С, 36 годин), у результаті одержують майже безбарвну смолу (76г). Частину отриманої смоли (50г, 60,6ммоль) потім суспендують у сухому тетрагідрофурані (600мл). Додають η6-1,2-дихлорбензол-h5-циклопентадієнілзалізо(ІІ) гексафторфосфат (48г, 116,2ммоль) і потім карбонат калію (32г, 233ммоль). Реакційну суміш перемішують при 60°С протягом 12 годин. Після охолодження до кімнатної температури смолу відфільтровують і промивають тетрагідрофураном (2´500мл), водою (2´250мл), тетрагідрофураном (2´500мл), метанолом (2´250мл), дихлорометаном (2´500мл), метанолом (2´250мл). І, нарешті, смолу промивають дихлорометаном (3´500мл) і сушать у вакуумі (25°С, 36 годин), у результаті одержують темно-оранжеву смолу (70г). До розчину 5-гідрокси-1,4-бензодіоксану (2,8г, 18,4ммоль) у тетрагідрофурані (50мл) при кімнатній температурі обережно додають чистий гідрид натрію (15,5ммоль) (будьте уважні: виділяє водень). Після припинення виділення водню суміш додатково перемішують протягом 30 хвилин. Потім додають частину отриманої раніше смоли (2,8г, 2,3ммоль) і суміш перемішують при 40°С протягом 12 годин. Після охолодження до кімнатної температури смолу відфільтровують і промивають тетрагідрофураном (2´50мл), сумішшю тетрагідрофуран/вода (1:1) (2´50мл), Ν,Ν-диметилформамідом (2´50мл), водою (2´50мл), метанолом (3´50мл), тетрагідрофураном (3´50мл) і послідовно метанолом і тетрагідрофураном (кожним по 50мл, 5 циклів). Та, нарешті, смолу промивають дихлорометаном (3´50мл) і сушать у вакуумі (25°С, 12 годин). Частину отриманої смоли (200мг, 0,15ммоль) і 0,5Μ розчин 1,10 - фенантроліну в суміші піридин/вода (3:1) (10мл) поміщають у світлопроникну реакційну пробірку. Суспензію піддають вихровому перемішуванню (vortexed) і опромінюють протягом 12 годин. Характерною ознакою стадії розкладання комплексу є поява інтенсивного червоного забарвлення рідкої фази в процесі опромінення. Смолу відфільтровують і промивають метанолом (2´10мл), водою (2´10мл) і тетрагідрофураном (3´10мл) доти, доки розчини не будуть залишатися безбарвними (близько 5 циклів) і опромінення повторюють доти, доки розкладання комплексу не пройде повністю (близько 4 циклів). Після завершення розкладання комплексу смолу промивають дихлорометаном (3´10мл) і сушать у вакуумі (25°С, 12 годин). Отриману смолу (160мг, 0,15ммоль) і 4-фторфенілгідразин гідрохлорид (35мг, 0,21ммоль) змішують у реакційній пробірці. Додають 0,5Μ розчин безводного хлориду цинку в оцтовій кислоті (1,5мл) і реакційну пробірку герметично закривають. Реакційну суміш перемішують протягом 12 годин при 70°С. Після охолодження до кімнатної температури реакційну суміш фільтрують і смолу, що залишилася, промивають диметилсульфоксидом (1,5мл). До об'єднаних фільтратів обережно додають насичений водяний розчин карбонату натрію (1,5мл) (будьте уважні: виділяється діоксид вуглецю). Розчин завантажують у попередньо оброблену колонку для хроматографії з оберненою фазою С-18. Колонку промивають водою (4мл) і продукт елюють метанолом (4,5мл). Після випарювання летких розчинників сирий продукт очищають за допомогою препаративної ВЕРХ з оберненою фазою. Отриманий розчин завантажують у попередньо підготовлену іонообмінну колонку. Колонку промивають метанолом (4мл) і ацетонітрилом (4мл) і потім елюють продукт 4N розчином аміаку в метанолі (4,5мл). Випарювання летких розчинників приводить до одержання зазначеної в заголовку сполуки 5а у вигляді жовтої олії (2мг). РХ/МС (m/z) 488 (МН+), Rt=4,22, чистота: 84%. Аналогічно одержують наступні сполуки: 1-(2-феноксифеніл)-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин (5b): РХ/МС (m/z) 426 (МН+), Rt=4,44, чистота: 88%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-хлор-1Н-iндол-3-іл)пропіл]піперазин (5с): РХ/МС (m/z) 476 (МН+), Rt=4,46, чистота: 95%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин (5d): РХ/МС (m/z) 522 (МН+), Rt=4,52, чистота: 91%. 1-(феноксифеніл)~4-[3-(1Н-індол-3-іл)пропіл]піперазин (5е): РХ/МС (m/z) 412 (МН+), Rt=4,25, чистота: 98%. 1-(2-феноксифеніл)-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (5f): РХ/МС (m/z) 430 (МН+), Rt=4,32, чистота: 96%. 1-(2-феноксифеніл)-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин (5g): РХ/МС (m/z) 492 (МН+), Rt=4,60, чистота: 84%. 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин (5h): РХ/МС (m/z) 552 (МН+), Rt=4,49, чистота: 86%. 1-{2-[3-(диметиламіно)фенокси]феніл}-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин (5і): РХ/МС (m/z) 469 (МН+), Rt=3,73, чистота: 86%. 1-(2-феноксифеніл)-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин (5j): РХ/МС (m/z) 446 (МН+), Rt=4,52, чистота: 88%. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин (5k): РХ/МС (m/z) 470 (МН+), Rt=4,38, чистота: 70%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (5l): РХ/МС (m/z) 460 (МН+), Rt=4,24, чистота: 87%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(7-хлор-1Н-індол-3-іл)пропіл]піперазин (5m): РХ/МС (m/z) 476 (МН+), Rt=4,42, чистота: 96%. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (5n): РХ/МС (m/z) 474 (МН+), Rt=4,25, чистота: 99%. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин (5о): РХ/МС (m/z) 582 (МН+), Rt=4,58, чистота: 85%. 1-(2-феноксифеніл)-4-[3-(7-хлор-1Н-індол-3-іл)пропіл]піперазин (5р): РХ/МС (m/z) 430 (МН+), Rt=4,38, чистота: 87%. 1-(2~феноксифеніл)-4-[3-(5,7-дифтор-1Н-індол-3-іл)пропіл]піперазин (5q); РХ/МС (m/z) 448 (МН+), Rt=4,44, чистота: 84%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(7-бром-1Н-індол-3-іл)пропіл]піперазин (5r): РХ/МС (m/z) 520 (МН+), Rt=4,50, чистота: 77%. 1-{2-[3-(диметиламіно)фенокси]феніл}-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (5s): РХ/МС (m/z) 473 (МН+), Rt=3,63, чистота: 96%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин (5t): РХ/МС (m/z) 568 (МН+), Rt=4,63, чистота: 82%. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин (5u): РХ/МС (m/z) 490 (МН+), Rt=4,45, чистота: 90%. 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин (5v): РХ/МС (m/z) 506 (МН+), Rt=4,46, чистота: 83%. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл}-4-[3-(1Н-троло[3,2-h]хінолін-3-іл)пропіл]піперазин (5w): РХ/МС (m/z) 507 (МН+), Rt=3,30, чистота: 97%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(5,7-дифтор-1Н-індол-3-іл)пропіл]піперазин (5х): РХ/МС (m/z) 478 (МН+), Rt=4,36, чистота: 75%. 1-(2-феноксифеніл)-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин (5у): РХ/МС (m/z) 5,38 (МН+), Rt=4,69, чистота: 92%. 1-[2-(2-метоксифенокси)феніл]-4-[3-(1Н-піроло[3,2-h]хінолін-3-іл)пропіл]піперазин (5z): РХ/МС (m/z) 493,2 (МН+), Rt=3,29, чистота: 96%. 1-[2-(3-метоксифенокси)феніл]-4-[3-(1Н-піроло[3,2-h]хінолін-3-іл)пропіл]піперазин (5аа): РХ/МС (m/z) 493 (МН+), Rt=3,38, чистота: 96%. 1-[2-(1,4-бензодіоксан-5-ілокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин (5ab): РХ/МС (m/z) 484 (МН+), Rt=4,35, чистота: 84%. 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин (5ас): РХ/МС (m/z) 486 (МН+), Rt=4,38, чистота: 80%. 1-[2-(3-метоксифенокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин (5ad): РХ/МС (m/z) 442 (МН+), Rt=4,25, чистота: 85%. 1-[2-(1,4-бензодіоксан-5-iлокси)феніл]-4-[3-(1Н-індол-3-іл)пропіл]піперазин (5ае); РХ/МС (m/z) 471 (МН+), Rt=4,13, чистота: 83%. 1-[2-(1,3-бензодіоксолан-5-ілокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин (5af): PX/MC (m/z) 536 (MH+), Rt=4,49, чистота: 88%. 1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (5ag): PX/MC (m/z) 515 (МН+), Rt=4,17, чистота: 94%. 1-[2-(3-метоксифенокси)феніл]-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин (5ah): PX/MC (m/z) 476 (МН+), Rt=4,53, чистота: 92%. 1-[2-(3-етоксифенокси)феніл]-4-[3-(5-метил-1Н-індол-3-іл)пропіл]піперазин (5аі): PX/MC (m/z) 470 (МН+), Rt=4,68, чистота: 85%. 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-йод-1Н-індол-3-іл)пропіл]піперазин (5aj): PX/MC (m/z) 598 (МН+), Rt=4,61, чистота: 70%. 1-{2-[3-(діетиламіно)фенокси]феніл}-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (5аk): PX/MC (m/z) 501 (МН+), Rt=3,18, чистота: 87%. 1-[2-(2,6-диметоксифенокси)феніл]-4-[3-(5-фтор-1Н-індол-3-іл)пропіл]піперазин (5al): PX/MC (m/z) 490 (МН+), Rt=4,26, чистота: 88%. 1-{2-[3-(морфолін-4-iл)фенокси]феніл}-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин (5am): PX/MC (m/z) 475 (МН+), Rt=4,42, чистота: 78%. 1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-хлор-1Н-індол-3-іл)пропіл]піперазин (5an): PX/MC (m/z) 531 (МН+), Rt=4,34, чистота: 81%. 1-{2-[3-(морфолін-4-іл)фенокси]феніл}-4-[3-(5-под-1Н-індол-3-іл)пропіл]піперазин (5ао): PX/MC (m/z) 623 (МН+), Rt=4,56, чистота: 71%. 1-[2-(3-метоксифенокси)феніл]-4-[3-(7-фтор-1Н-індол-3-іл)пропіл]піперазин (5aq): PX/MC (m/z) 460 (МН+), Rt=4,38, чистота: 70%. 1-(2-феноксифеніл)-4-[3-(5,7-диметил~1Н-індол-3-iл)пропіл]піперазин (5аr): PX/MC (m/z) 440 (МН+), Rt=4,64, чистота: 78%. 1-{2-(1,3-бензодіоксолан-5члокси)феніл]-4-[3-(7-бром-1Н-індол-3-іл)пропіл]піперазин (5as): PX/MC (m/z) 534 (МН+), Rt=4,46, чистота: 75%. 1-[2-(3,4,5-триметоксифенокси)феніл]-4-[3-(5-бром-1Н-індол-3-іл)пропіл]піперазин (5at): PX/MC (m/z) 580 (МН+), Rt=4,34, чистота: 81%. Фармакологічне тестування Сполуки цього винаходу були випробувані добре відомими і відтворними способами. Тести проводилися наступним чином: Інгібування зв'язування [3 H]-ΥΝΙ-09151-2 з дофаміновими D4-рецепторами людини За допомогою цього методу в умовах in vitro визначають інгібування лікарськими засобами зв'язування [3H]YM-09151-2 (0,06нм) з мембранами клонованих дофамінових D4.2-рецепторів людини, експресованих у СНО-клітинах. Модифікований метод від NEN Life Science Products, Inc., сертифікат технічних даних РС253310/96. Результати представлені в наступній таблиці 1 у вигляді значень ІС50. Інгібування зв'язування [3 Н]-спіперону з D3-рецєпторами людини З використанням цього тесту визначають in vitro інгібування лікарськими препаратами зв'язування [3Н]спіперону (0,3нМ) з мембранами клонованих дофамінових D3-рецепторів людини, експресованих у СНОклітинах. Метод модифікований з R. G. MacKenzie et al., Eur. J. Pharm.-Mol. Pharm. Sec, 1994, 266, 79-85. Результати представлені в наступній таблиці 1 у вигляді значень IC50. Спорідненість сполук цього винаходу до 5-НТід-рецепторів визначають вимірюванням інгібування зв'язування радіоактивного ліганду на 5-НТіа-рецепторах, як описано в приведеному далі тесті; Інгібування зв'язування 3Н-5-СТ з 5-НТ1А-рецепторами людини За допомогою цього методу в умовах in vitro визначають інгібування лікарськими засобами зв'язування агоніста 5-НТ1А, 3Н-5-карбоксамідотриптаміну (3 Н-5-стиптицину), з клонованими 5-НТ1А-рецепторами людини, стабільно експресованими в трансфектованих клітинах HeLa (HA7) [Fargin, A. et al, J. Biol. Chem., 1989, 264,14848]. Випробування проводять як модифікацію методу, описаного в публікації Harrington, Μ. A. et al. J. Pharmacol. Exp. Ther. 1994,268, 1098. 5-НТ1А-рецептори людини (40мкг клітинного гемогенату) інкубують протягом 15 хвилин при 37°С в 50мМ Tris-буфері (трис(гідроксиметил)метиламін) при рН7,7 у присутності 3Н-5СТ. Неспецифічне зв'язування визначають шляхом включення 10мкМ метерголіну. Реакцію закінчують швидким фільтруванням крізь фільтри Unifilter GF/B на харвестері клітин марки Tomtec Cell Harvester. Кількість клітин на фільтрах підраховують у лічильнику Packard Top Counter. Отримані результати представлені в таблиці 1 нижче. Інгібування захоплення 3Н-5-НТ в синаптосоми головного мозку щура. Використовуючи цей метод в умовах in vitro визначають спроможність лікарських засобів інгібувати акумулювання 3Н-5-НТ в цілих синаптосомах головного мозку щура. Випробовування проводять у відповідності з описом, наведеним в публікації Hyttel, J.,Psychopharmacology 1978, 60, 13. Результати представлені в таблиці 1: Таблиця 1 Інгібування Сполука зв'язування 3 № Н-5-СТ IC50 (нМ) 1b 7,8 2b 16 3c 16 3е 24 5а 19 5е 10 5f 10 5h 10 5і 10 5l 13 5х 18 5ае 26 5ag 26 5аі 28 Інгібування захоплення 3 Н-5-СТ IC50 (нМ) 130 2,8 27% інгібування при 100нМ 40% інгібування при 100нМ 14 13 4,8 55% інгібування при 100нМ 46% інгібування при 100нМ 4,7 33 42% інгібування при 100нМ 23 34% інгібування при 100нМ Відповідно, оскільки сполуки цього винаходу виявляють схожу активність в описаних тестах, вони розглядаються як корисні для лікування афективних розладів, таких як депресія, генералізований розлад, пов'язаний зі станом тривоги, панічний розлад, обсесивно-компульсивний розлад, соціальна фобія і розлади апетиту (eating disorders), психозу і неврологічних розладів, таких як ішемія і сенільна деменція.
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted derivatives of phenylpiperazine, a pharmaceutical composition and a method for treatment of affective or neurologic diseases and disorders
Автори англійськоюRUHLAND THOMAS, Krog-Jensen Christian, Rottlaender Mario, MOLTZEN EJNER
Назва патенту російськоюЗамещенные производные фенилпиперазина, фармацевтическая композиция и способ лечения аффективных или неврологических заболеваний и расстройств
Автори російськоюРухланд Томас, Крог-Енсен Кристиан, Роттлондер Марио, Мольтсен Айнэр Кнуд
МПК / Мітки
МПК: A61P 25/22, C07D 209/14, C07D 405/12, C07D 471/04, A61P 25/28, A61P 25/00, A61P 25/24, A61K 31/496, A61P 43/00, A61K 31/5377, A61P 25/18, A61P 25/32
Мітки: заміщені, неврологічних, афективних, композиція, спосіб, фармацевтична, лікування, фенілпіперазину, розладів, захворювань, похідні
Код посилання
<a href="https://ua.patents.su/12-72948-zamishheni-pokhidni-fenilpiperazinu-farmacevtichna-kompoziciya-ta-sposib-likuvannya-afektivnikh-abo-nevrologichnikh-zakhvoryuvan-i-rozladiv.html" target="_blank" rel="follow" title="База патентів України">Заміщені похідні фенілпіперазину, фармацевтична композиція та спосіб лікування афективних або неврологічних захворювань і розладів</a>
Попередній патент: Система автоматичного регулювання швидкості обертання електричних двигунів групи витяжних вентиляторів
Наступний патент: Спосіб одержання {2-[4-(a-феніл-п-хлорбензил)піперазин-1-іл]-етоксі}оцтової кислоти і проміжні сполуки
Випадковий патент: Вітродвигун