Карбоксамідні опіоїдні сполуки
Формула / Реферат
1. Композиція, що містить сполуку Формули (І)
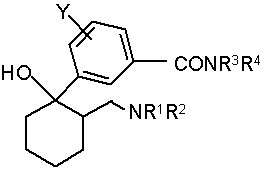 , Формула (I)
, Формула (I)
де:
R1 та R2 незалежно вибрані з групи, що включає водень, нижчий алкіл та алкілдіїл, де R1 та R2, взяті разом з атомами, до яких вони приєднані, утворюють моноциклічне кільце;
R3 та R4 незалежно вибрані з групи, що включає водень, нижчий алкіл, C3-7циклоалкіл та алкілдіїл, де R3 та R4, взяті разом з атомами, до яких вони приєднані, утворюють моноциклічне кільце;
Y являє собою водень, нижчий алкіл, нижчий алкокси, галоген або трифторметил;
та її фармацевтично прийнятні енантіомери, діастереомери, таутомери, сольвати та солі.
2. Сполука за пунктом 1, в якій R1 та R2 незалежно вибрані з групи, що включає водень та С1-4алкіл.
3. Сполука за пунктом 1, в якій R1 таR2 незалежно вибрані з групи, що включає водень та метил.
4. Сполука за пунктом 1, в якій R1 та R2 кожний являє собою метил.
5. Сполука за пунктом 1, в якій R3 та R4 незалежно вибрані з групи, що включає водень, С1-4алкіл, С3-7циклоалкіл та С1-4алкілдіїл, де R3 та R4, взяті разом з атомами, до яких вони приєднані, утворюють моноциклічне кільце.
6. Сполука за пунктом 1, в якій R3 та R4 незалежно вибрані з групи, що включає водень, метил та циклопропіл.
7. Сполука за пунктом 1, в якій R3 та R4 кожний являє собою водень.
8. Сполука за пунктом 1, в якій Y являє собою водень, С1-4алкіл, С1-4алкокси або галоген.
9. Сполука за пунктом 1, в якій Y являє собою водень, метил або метокси.
10. Сполука за пунктом 1, в якій Y являє собою водень.
11. Сполука за пунктом 1, яка існує у вигляді її 1R,2R/1S,2S енантіомерних пар.
12. Сполука, вибрана з групи, що включає
3-[(1-RS,2-SR)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід;
3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід;
(-)-3-[(1R,2R)-rеl-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід;
(+)-3-[(1S,2S)-rеl-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід;
3-[(1-RS,2-RS)-2-[(диметиламiно)метил]-1-гідроксициклогексил]-N,N-діетилбензамід;
N-циклопропіл-3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід та
3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-N-метилбензамід.
13. Сполука, вибрана з групи, що включає (-)-3-[(1R,2R)-rel-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід та (+)-3-[(1S,2S)-rel-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід.
14. Сполука, яка являє собою (+)-3-[(1S,2S)-rеl-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід.
15. Фармацевтична композиція, що містить сполуку за пунктом 1 та фармацевтично прийнятний носій.
16. Спосіб лікування болю у суб'єкта, що цього потребує, який включає введення суб'єкту терапевтично ефективної кількості сполуки за пунктом 1.
17. Фармацевтична композиція, що містить сполуку за пунктом 14 та фармацевтично прийнятний носій.
18. Спосіб лікування болю у суб'єкта, що цього потребує, який включає введення суб'єкту терапевтично ефективної кількості сполуки за пунктом 14.
Текст
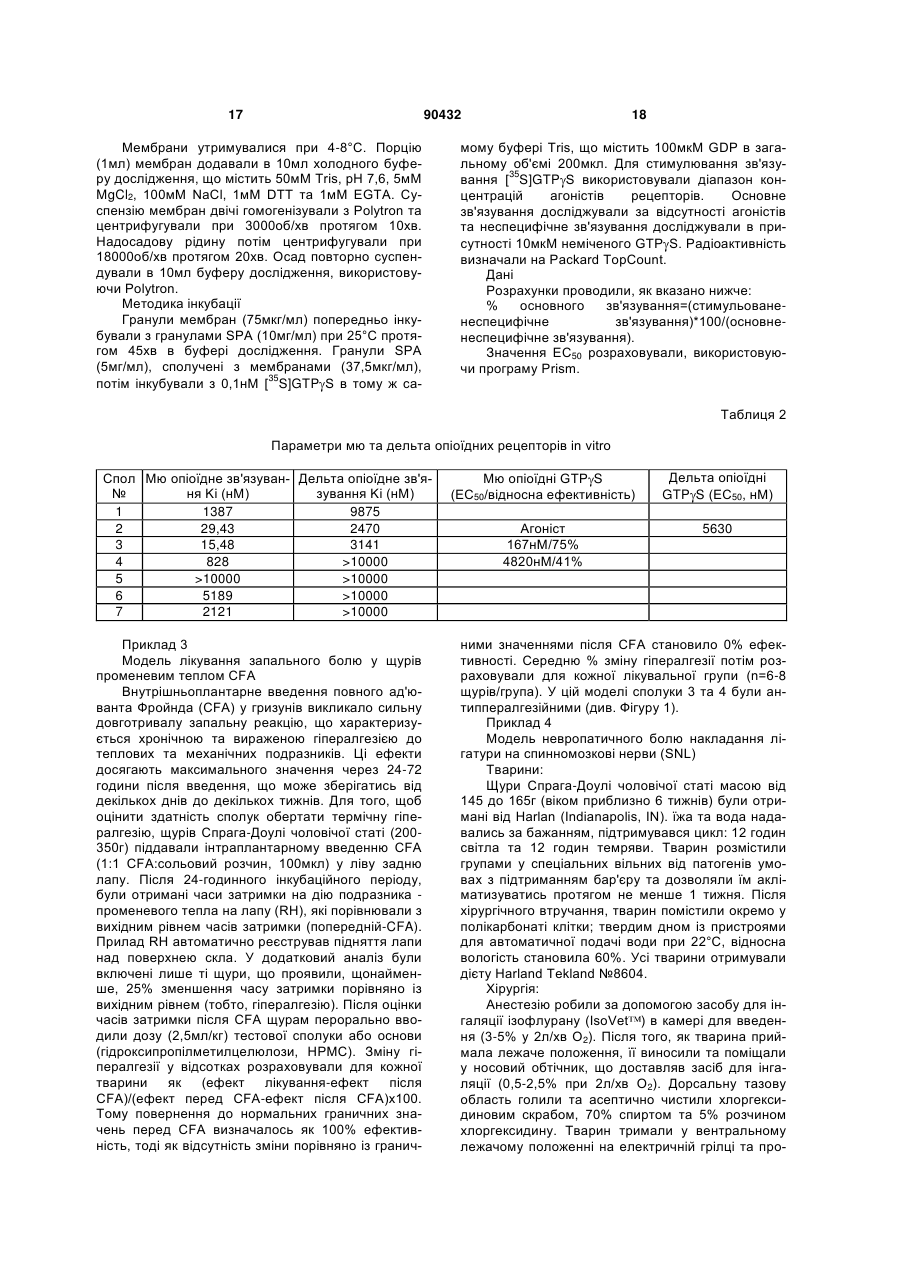
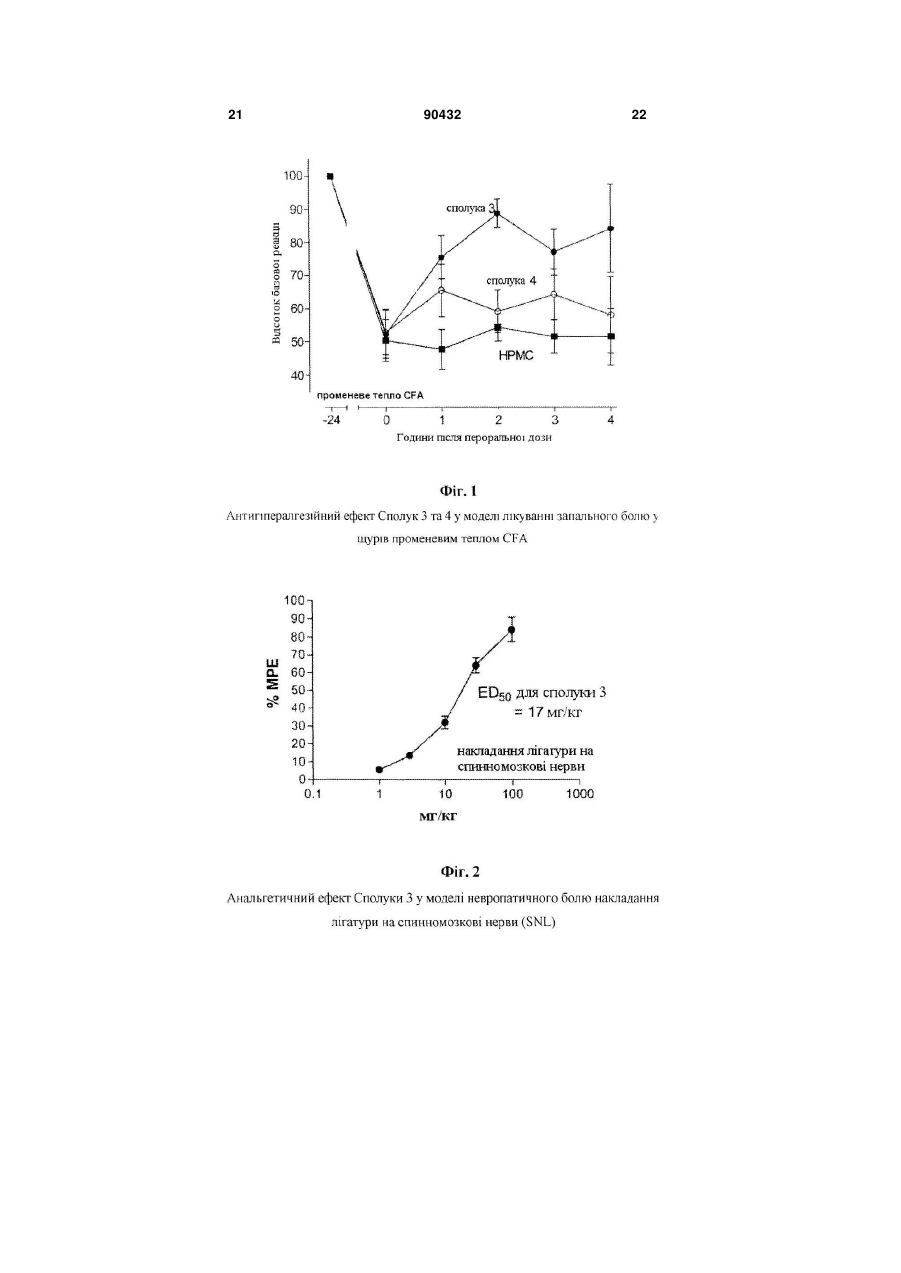
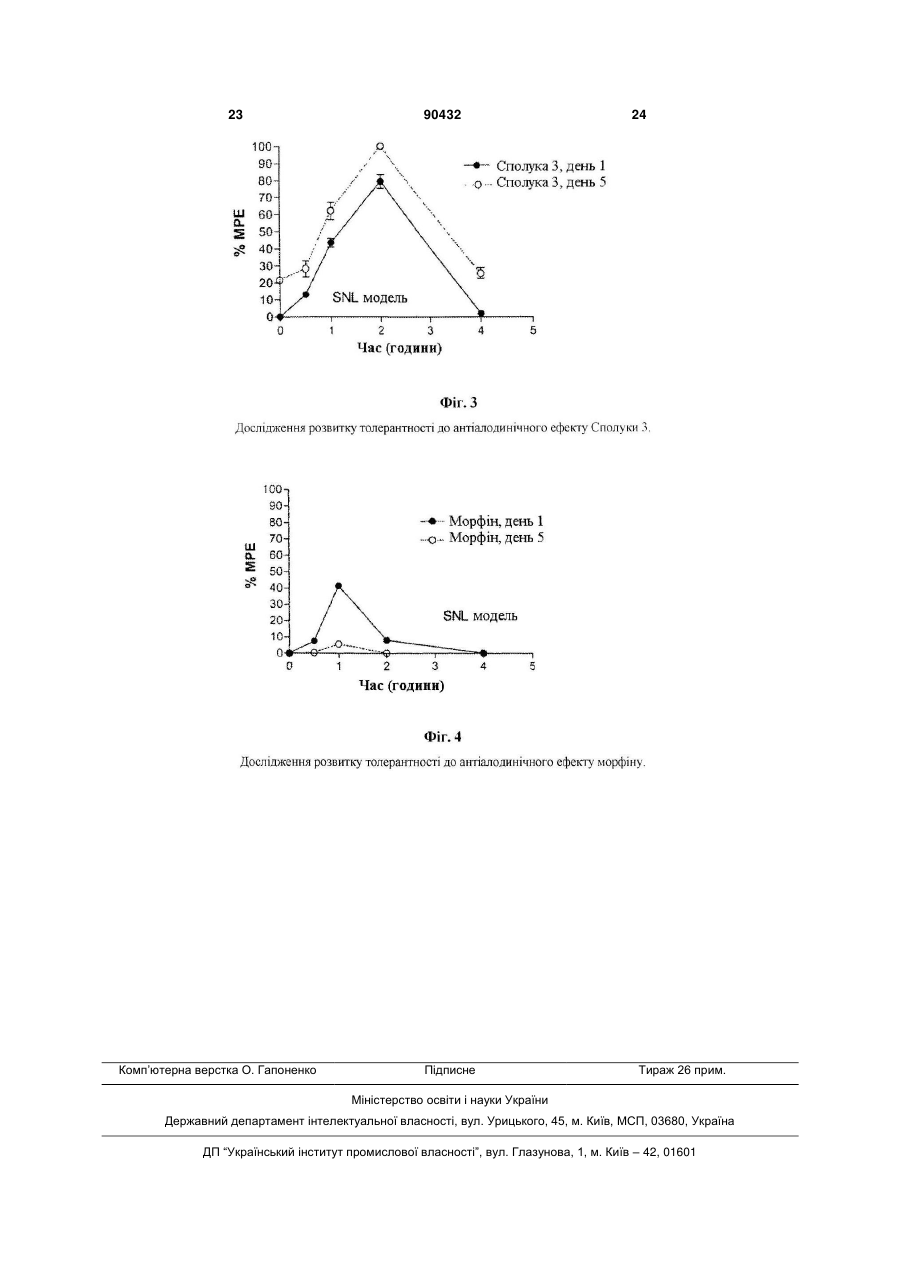
1. Композиція, що містить сполуку Формули (І) 2 3 90432 4 12. Сполука, вибрана з групи, що включає 3-[(1-RS,2-SR)-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід; 3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід; (-)-3-[(1R,2R)-rеl-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід; (+)-3-[(1S,2S)-rеl-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід; 3-[(1-RS,2-RS)-2-[(диметиламiно)метил]-1гідроксициклогексил]-N,N-діетилбензамід; N-циклопропіл-3-[(1-RS,2-RS)-2[(диметиламіно)метил]-1-гідроксициклогексил]бензамід та 3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1гідроксициклогексил]-N-метилбензамід. 13. Сполука, вибрана з групи, що включає (-)-3[(1R,2R)-rel-2-[(диметиламіно)метил]-1 гідроксициклогексил]-бензамід та (+)-3-[(1S,2S)-rel2-[(диметиламіно)метил]-1-гідроксициклогексил]бензамід. 14. Сполука, яка являє собою (+)-3-[(1S,2S)-rеl-2[(диметиламіно)метил]-1-гідроксициклогексил]бензамід. 15. Фармацевтична композиція, що містить сполуку за пунктом 1 та фармацевтично прийнятний носій. 16. Спосіб лікування болю у суб'єкта, що цього потребує, який включає введення суб'єкту терапевтично ефективної кількості сполуки за пунктом 1. 17. Фармацевтична композиція, що містить сполуку за пунктом 14 та фармацевтично прийнятний носій. 18. Спосіб лікування болю у суб'єкта, що цього потребує, який включає введення суб'єкту терапевтично ефективної кількості сполуки за пунктом 14. Дана заявка претендує на пріоритет попередньої патентної заявки US №60/571,298, поданої 14 травня 2004 року, яка повністю включена в дану заявку за допомогою посилання. Дослідження та розробка винаходу, описаного нижче, федерально не спонсорувалися. Гідрохлорид трамадолу, (1RS,2RS)-2(диметил-аміно)-метил-1-(3-метоксифеніл)циклогексанол HCl (трамадол), є анальгетиком центральної дії, що має несподівану відмінність від морфіну, прототитипного чистого опоїдного анальгетика. Хоча трамадол був введений у клінічну практику у 1970-і роки та не очікувалось, що він має механічні відмінності від опіатів, дані, отримані на даний час у ході доклінічних досліджень, клінічних випробувань та з епідеміологічних звітів, та широке розповсюджене використання для пацієнтів вказують на те, що відмінність існує. Трамадол є атиповим анальгетиком центральної дії і тому його ефективність викликана багатьма механізмами дії. Сполука та її енантіомери мають слабко-афінні зв'язки із -опіоїдними рецепторами гризунів та людей та зв'язки з меншою афінністю з - або -опіоїдними рецепторами. Одесметильний метаболіт трамадолу зв'язаний з більш високою афінністю, ніж вихідна сполука, проте все ще з більш низькою афінністю, ніж морфін. Таким чином, активація -опіоїдних рецепторів є одним з компонентів механізму дії трамадолу, проте цього недостатньо для пояснення антиноцицептивної та анальгетичної активності та ефективності трамадолу. По-друге, у деяких обстеженнях передбачається не-опіоїдний компонент, що включає неповну оборотність налоксону у більшості тваринних моделей та у людських випробуваннях; та ослаблення його антиноцицептивного або анальгетичного ефекту не-опіоїдними антагоністами. Тому ці результати узгоджуються з подвійними вкладами опіоїду та не-опіоїду, з домінуючим внеском, який, можливо, залежить від зразків, маршруту введення або конкретної природи болю. Було зроблено припущення, що джерело подвійних механізмів полягає у різній фармакології двох енантіомерів трамадолу, один з яких більш подібний до опіатів, ніж інший. Анальгетиками, що діють через -опіоїдний рецептор, типово є феноли та фенольні ефіри. Часто вони мають такий недолік, що полягає у їх метаболічній інактивації шляхом конверсії у глюкуроніди, що швидко виділяються. Було знайдено, що карбоксамідна группа є ефективним біоізостеричним замісником фенольної групи в деяких бензоморфанів та морфінанів, що привело до одержання серії опіоїдів з більш довгим біологічним періодом напіврозкладу (Wenlland, Μ. Ρ. el al. Bioorg. Med. Chem. Lett. 2001, 11(5), 623-6; Wentland, M. P. el al. Bioorg. Med. Chem. Lett. 2001, 11(13), 1717-1721; Bidlack, Jean M. el al. J. Pharmacol. Exp. Then, 2002, 302(1), 374-380). Одержання певних 1-арил-(2діалкілмінометил)циклогексан-1-олів описано у заявці РСТ WO 03/080557, виданій 10 жовтня 2003p. (Sundermann, В. et аt., Grunenthal GMBH Assignee). Род аналогів трамадолу описано у заявці РСТ WO 03/048113, виданій 12 червня 2003p. (Senanayake, С. Η. el al., Seprecor Assignee). Таким чином, існує необхідність у направленні метаболічної інактивації трамадолу, що відбувається через конверсію його гідрокси метаболіту у відповідний глюкуронід. Даний винахід заміняє метокси замісник трамадолу на карбоксамідну групу. Даний винахід забезпечує карбоксамідні опіоїдні сполуки Формули (І): 5 де: R1 та R2 незалежно вибрані з групи, що включає водень, нижчий алкіл та алкілдіїл, де R1 та R2, взяті разом з атомами, до яких вони приєднані, утворюють моноциклічне кільце; R3 та R4 незалежно вибрані з групи, що включає водень, нижчий алкіл, С3-7циклоалкіл, та алкілдіїл де R3 та R4, взяті разом з атомами, до яких вони приєднані, утворюють моноциклічне кільце; Υ являє собою водень, нижчий алкіл, нижчий алкокси, галоген або три фтор метил; та їх фармацевтично прийнятні енантіомери, діастереомери, таутомери, сольвати та солі. На Фігурі 1 показано антигіпералгезійний ефект Сполук 3 та 4 у моделі лікування запального болю у щурів променевим теплом CFA. На Фігурі 2 показано анальгетичний ефект Сполуки 3 в моделі невропатичного болю накладання лігатури на спинномозкові нерви (SNL). На Фігурі 3 показані результати вивчення розвитку толерантності до антіалодинічного ефекту Сполуки 3. На Фігурі 4 показані результати вивчення розвитку толерантності до антіалодинічного ефекту морфіну. Втілення даного винаходу включають ті сполуки Формули (І), в яких R1 та R2 незалежно вибрані з групи, що включає водень та С1-4алкіл. Втілення даного винаходу включають ті сполуки Формули (І), в яких R1 та R2 незалежно вибрані з групи, що включає водень та метил. Втілення даного винаходу включають ті сполуки Формули (І), в яких R1 та R2 кожний являє собою метил. Втілення даного винаходу включають ті сполуки Формули (І), в яких R3 та R4 незалежно вибрані з групи, що включає водень, С1-4алкіл, С33 4 7циклоалкіл та С1-4алкілдіїл, де R та R , взяті разом з атомами, до яких вони приєднані, утворюють моноциклічне кільце. Втілення даного винаходу включають ті сполуки Формули (І), в яких R3 та R4 незалежно вибрані з групи, що включає водень, метил та циклопропіл. Втілення даного винаходу включають ті сполуки Формули (І), в яких R3 та R4 кожний являє собою водень. Втілення даного винаходу включають ті сполуки Формули (І), в яких Υ являє собою водень, С14алкіл, С1-4алкокси або галоген. Втілення даного винаходу включають ті сполуки Формули (І), в яких Υ являє собою водень, метил або метокси. Втілення даного винаходу включають ті сполуки Формули (І), в яких Υ являє собою водень. Подальше втілення даного винаходу включає такі сполуки Формули (І) у вигляді їх 1R,2R/1S,2S енантіомерних пар. Приклади сполук за даним винаходом включають 3-[(1-RS,2-SR)-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід; 3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід; (-)-3-[(1R,2R)-rеІ-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід; 90432 6 (+)-3-[(1S,2S)-rеl-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід; 3-[(1-RS,2-RS)-2-[(диметиламiно)метил]-1гідроксициклогексил]-N,N-діетил-бензамід; N-циклопропіл-3-[(1-RS,2-RS)-2[(диметиламіно)метил]-1-гідрокcициклогексил]бензамід; та 3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1гідроксициклогексил]-N-метилбензамід. Сполуки за даним винаходом також можуть бути присутні у формі фармацевтично прийнятних солей. Для використання в медицині, солі сполук за даним винаходом відносяться до нетоксичних "фармацевтично прийнятних солей" (Ref. International J. Pharm., 1986, 33, 201-217; J. Pharm.Sci., 1997 (Jan), 66, 1, 1). Інші солі, проте, можуть бути корисні при одержанні сполук за даним винаходом або їх фармацевтично прийнятних солей. Характерні органічні або неорганічні кислоти включають, але не обмежуються, соляну кислоту, бромистоводневу кислоту, йодоводневу кислоту, перхлорну кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту, оцтову кислоту, пропіонову кислоту, гліколеву кислоту, молочну кислоту, бурштинову кислоту, малеїнову кислоту, фумарову кислоту, яблучну кислоту, винну кислоту, лимонну кислоту, бензойну кислоту, мигдальну кислоту, метансульфонову кислоту, гідрокхіетансульфонову кислоту, бензолсульфонову кислоту, щавлеву кислоту, памову кислоту, 2нафталинсульфонову кислоту, ртолуолсульфонову кислоту, циклогексансульфамінову кислоту, саліцилову кислоту, цукрову кислоту або трифтороцтову кислоту. Характерні органічні або неорганічні основи включають, але не обмежуються, основні або катіонні солі, такі як бензатин, хлорпрокаїн, холін, діетаноламін, етилендіамін, меглумін, прокаїн, алюміній, кальцій, літій, магній, калій, натрій та цинк. Якщо сполуки за даним винаходом є хіральними, вони можуть відповідно існувати, як енантіомери. Крім того, сполуки можуть існувати у вигляді діастереомерів. Слід розуміти, що всі такі стереоізомери та їх рацемічні суміші включені в межі даного винаходу. До того ж, деякі з кристалічних форм сполук можуть існувати у вигляді поліморфів, та, як такі, мається на увазі, включені в межі даного винаходу. Крім того, деякі зі сполук можуть утворювати сольвати з водою (тобто, гідрати) або звичайними органічними розчинниками, та такі сольвати також, мається на увазі, включені в межі даного винаходу. Якщо не вказано інше, термін "алкіл" відноситься до насиченого прямого або розгалуженого ланцюга, що містить виключно 1-8 атомів вуглецю, замішених атомами водню; переважно, 1-6 атомів вуглецю, заміщених атомами водню; та, найбільш переважно, 1-4 атомів вуглецю, заміщених атомами водню. Якщо не вказано інше, термін "алкокси" відноситься до насиченого вуглеводневого спиртового радикалу з прямим або розгалуженим ланцюгом, отриманого видаленням атома водню з гідроксидного кисню спирту. Вуглеводневий ланцюг містить виключно 1-8 атомів вуглецю, заміщених атомами 7 водню; переважно, 1-6 атомів вуглецю, заміщених атомами водню; та, найбільш переважно, 1-4 атомів вуглецю, заміщених атомами водню. Нові карбоксамідо опіоїдні сполуки за даним винаходом є корисними модуляторами -опіоїдних рецепторів. Зокрема, карбоксамідо опіоїдні сполуки за даним винаходом є модуляторами опіоїдних рецепторів, корисними як анальгетики. Додатково, карбоксамидо опіоїдні сполуки за даним винаходом є модуляторами -опіоїдних рецепторів, корисними як анальгетики з покращеними фармакокінетичними властивостями. Приклади болю, призначеного для розгляду у рамках даного винаходу, включають біль, опосередкований центральною нервовою системою, біль, опосередкований периферійною нервовою системою, біль, пов'язаний із структурними травмами або пошкодженнями м'яких тканин, біль, пов'язаний із прогресуючими хворобами, такий, як раковий біль, невропатичний біль та гострий біль, такий, як спричинений сильним пораненням, травмою або хірургічним втручанням, та хронічний біль, такий, як викликаний невропатичними станами, діабетичною периферійною нейропатією, постгерпетичною невралгією, тригемінальною невралгією, синдроми постінсультного болю або кластерні чи мігренозні головні болі, але не обмежуються ними . Корисність сполук за даним винаходом як модуляторів -опіоїдних рецепторів може бути визначена відповідно до методик, описаних у цій заявці. Втіленням винаходу є фармацевтична композиція, що містить один або більше сполук за даним винаходом в сполученні з фармацевтично прийнятним носієм. Іншим втіленням є фармацевтична композиція, одержана за допомогою змішування будь-якої зі сполук, описаних вище, з фармацевтично прийнятним носієм. Подальшим втіленням є спосіб одержання фармацевтичної композиції, який включає змішування будь-якої зі сполук, описаних вище, з фармацевтично прийнятним носієм. Ще іншим втіленням даного винаходу є спосіб лікування болю, модульованого мю-опіоїдним лігандом. В способі лікування болю, модульованого опіоїдним лігандом, суб'єкту, що цього потребує, вводять будь-яку зі сполук, які визначено в даній заявці, в терапевтично ефективній дозі для модуляції -опіоїдних рецепторів. Cпoлукa може бути введена суб'єкту, що цього потребує, будь-яким традиційним шляхом введення, включаючи, але не обмежуючись, пероральне назальне, під'язикове, офтальмологічне, трансдермальне, ректальне, вагінальне та парентеральне (тобто підшкірне, внутрішньом'язове, інтрадермальне, внутрішньовенне, тощо). Іншим втіленням винаходу є спосіб лікування болю у суб'єкта, що вже толерантний до одного або більше -опіоїдних лікарських засобів, відмінних від сполуки або сполук, які визначені в даній заявці, який включає введення суб'єкту, що цього потребує, будь-якої зі сполук, які визначені в даній заявці, в терапевтично ефективній дозі для модуляції -опіоїдних рецепторів. Сполука може бути введена суб'єкту, що потребує такого лікування, будь-яким традиційним шляхом введення, вклю 90432 8 чаючи, але не обмежуючись, пероральне назальне, під'язикове, офтальмологічне, трансдермальне, ректальне, вагінальне та парентеральне (тобто підшкірне, внутрішньом'язове, інтрадермальне, внутрішньовенне, тощо). Терапевтично ефективна доза для використання сполук або фармацевтичних композицій на їх основі за даним винаходом включає діапазон доз від приблизно 0,001мг до приблизно 1,000мг, зокрема від приблизно 0,1мг до приблизно 500мг або, більш особливо від приблизно 1мг до приблизно 250мг активного інгредієнта на день для людини з середньою вагою (70кг). Карбоксамідо опіоїди, описані в даній заявці, можуть бути введені в зниженій дозі відносно їх гідроксидублікатів, як дозволено їх покращеним фармакокінетичним профілем. Для перорального введення, фармацевтична композиція переважно забезпечена у формі таблеток, що містять 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250 та 500 міліграмів активного інгредієнта для симптоматичного коректування дозування для суб'єкта, якого лікують. Переважно, сполуки за даним винаходом можуть бути введені в одиничній добовій дозі або загальне добове дозування може бути введене в розділених дозах два, три або чотири рази на день. Фахівцю в даній галузі техніки очевидно, що терапевтично ефективна доза для активних сполук за винаходом або фармацевтичної композиції на їх основі, буде змінюватися відповідно до бажаного результату. Таким чином, оптимальні дозування для введення легко можуть бути визначені та будуть змінюватися в залежності від конкретної сполуки, що використовують, способу введення, концентрації препарату та розвитку хворобливого стану. Крім того, чинники, пов'язані з індивідуальним суб'єктом, якого лікують, включаючи вік пацієнта, вагу, режим харчування та час введення, призведуть до необхідності коректувати дозу до відповідного терапевтичного рівня. Сполуки за даним винаходом можуть бути введені в будь-якій з описаних вище композицій та режимів дозування або за допомогою тих композицій та режимів дозування, встановлених з рівня техніки кожного разу, коли для суб'єкта, що цього потребує, необхідне використання сполук за винаходом як модуляторів мю-опіоїдних рецепторів. Скорочення, що використовуються в даній заявці, особливо в Схемах та Прикладах, є такими, як вказано нижче: Спол = сполука д = день/дні DMF = диметилформамід DPPF = 1,1’-біс(дифенілфосфіно)фероцен ЕtOАс = етил ацетат ЕtOΗ = етанол год = година/години HATU = О-(7-Азабензотриазол-1-іл)-N,N,Ν',Ν'тетраметилуронію гексафторфосфат Μ = молярний MeCN = ацетонітрил МеОН = метанол хв. = хвилини 9 90432 10 rt/RT = кімнатна температура THF = тетрагідрофуран TFA = трифтороцтова кислота OTf = трифлат TEA = триетиламін Загальні способи синтезу Характерні сполуки за даним винаходом можуть бути синтезовані відповідно до загальних способів синтезу, описаних нижче та проілюстрованих більш детально на схемах, які наведено далі. Оскільки схеми є ілюстрацією, не потрібно розглядати, що винахід обмежений наведеними хімічними реакціями та умовами. Одержання різних вихідних речовин, що використовуються в схемах, добре відоме фахівцю в даній галузі техніки. Протягом будь-якого з процесів одержання сполук за даним винаходом, може бути необхідним та/або бажаним захистити чутливі або хімічко активні групи на будь-якій з молекул, яких це стосується. Це може бути досягнуто за допомогою традиційних захисних груп, таких як описано в Protective Groups in Orgаnіс Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; та T.W. Greene & P.G.M. Wilts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991. Захисні групи можуть бути видалені на придатній подальшій стадії, використовуючи способи, відомі з рівня техніки. Характерні сполуки за даним винаходом можуть бути синтезовані за допомогою способів, проілюстрованих на Схемі А. Циклогексанон А1 може бути перетворений, використовуючи реакцію Маніха з формальдегідом та аміном формули А2, одержуючи сполуку формули A3, де R1 та R2 є такими, як попередньо визначено. Y-функціоналізований арил-магнієвий реагент формули А4, одержаний відповідно до літератури (Knochel, P. et al. Synlett, 2003, 6, 885-887), може бути доданий до кетону формули A3, одержуючи сполуку формули А5. Обробкою сполуки формула А5 аніоном гідроксиду одержують карбоксамідо сполуки формули А6. На Схемі В наведено альтернативний шлях синтезу сполук за даним винаходом. Виходячи з Yфункціоналізованого похідного метаболіту трамадолу, В1, який може бути синтезований, використовуючи способи, відомі з літератури, обробкою трифлатним ангідридом одержують сполуки формули В2. Сполуки формули В2 можуть бути перетворені на сполуки формули В3 за допомогою метоксикарбонілювання, використовуючи газоподібний монооксид вуглецю, барботуючи йо го через метанол в присутності каталізатора паладію та ліганду, такого як (1,1’біс(дифенілфосфіно)фероцен. Сполуки формули В3 можуть бути омилені, використовуючи гідроксид, з одержанням їх відповідної карбонової кислоти, В4. Сполуки формули В4 можуть, крім того, бути перетворені на сполуки Формули (І) за допомогою сполучення карбоксигрупи з аміном формули В5 в присутності відповідного агента сполучення, такого як НATU, в апротонному розчиннику. 11 90432 12 Діастереомери за даним винаходу може бути розділені за допомогою обернено-фазової або нормально-фазової хроматографії або фракційної кристалізації. Рацемічні сполуки за даним винаходом можуть бути розділені на їх індивідуальні енантіомери, використовуючи способи, відомі з літератури (ЕР 786450). Специфічні приклади Специфічні сполуки, які представлені в даному винаході, були одержані відповідно до наступних прикладів та послідовності реакцій; приклади та діаграми, що зображають послідовності реакцій, представлені за допомогою ілюстрації, щоб допомогти в розумінні винаходу, їх не потрібно аналізувати з метою обмеження будь-яким чином винаходу, який викладено у формулі винаходу, яку наведено після опису. Сполуки за даним винаходом можуть також бути використані як проміжні сполуки в подальших прикладах для одержання додаткових сполук за даним винаходом. Не було зроблено ніякої спроби оптимізувати виходи, отримані в будь-якій з реакцій. Фахівцю в даній галузі техніки відомо, як збільшити такі виходи за допомогою звичайних варіацій часу реакцій, температур, розчинників та/або реагентів. Реагенти були придбані з комерційних джерел. Спектри ядерного магнітного резонансу (ЯМР) для атомів водню були зняті у вказаному розчиннику з (TMS), як внутрішнім стандартом, на спектрометрі Вruker Biospin, Inc. DPX-300 (300МГц). Значення виражені в мільйонних частках нижче області TMS. Мас-спектри (MS) були одержані на спектрометрі Micromass Platform LC або спектрометрі Agilent LC, використовуючи електророзпилювальну технологію. Стереоізомерні сполуки можуть бути охарактеризовані як рацемічні суміші або як окремі діастереомери та енантіомери, використовуючи рентгенографічну кристалографію та інші методи, які відомі фахівцю в даній галузі техніки. Зокрема, хіральні розділення проводили за допомогою препаративної ВЕРХ, використовуючи динамічну осьову компресію, тип колонки Prochrom LC50. Оптичні обертання визначали, використовуючи поляриметр Perkin-Елмера модель 241. Якщо не вказано інше, речовини, що використовуються в прикладах, були одержані від легко доступних комерційних постачальників або синтезовані за допомогою стандартних способів, що відомі фахівцю в галузі хімічних синтезів. Групи замісників, які змінюються в прикладах, є воднями, якщо не зазначено інше. Методика А 3-[(2-Диметиламіно)метил)-1-гідроксициклогексил]-бензонітрил Зразок 3-[(2-диметиламіно)метил]-1гідроксициклогексил]-бензонітрил у (Методика А, 1,66г, 6,4ммоль) у вигляді суміші діастереомерів розчиняли в трет-бутанолі (20мл), додавали порошкоподібний гідроксид калію (1,8г, 32,1ммоль) та реакцію доводили до кипіння зі зворотним холодильником протягом 1год. Після охолодження реакції додавали хлороформ (50мл) та воду (50мл). Органічний шар відокремлювали, сушили (K2СО3), фільтрували га концентрували, одержуючи 3-[(2-диметиламіно)метил]-1гідроксициклогексил]-бензамід у вигляді діастереомерної суміші (1,6г, 93%). Суміш очищали на обернено фазовій колонці С-18, використовуючи 0,5% ацетат амонію у воді та ацетонітрил як елюенти. Сполуку 1, 3-[(1-RS,2-SR)-2[(диметиламіно)метил]-1-гідроксициклогексил]бензамід, елюювали першою. Наступною елюювали Сполуку 2, 3-[(1-RR,2-SS)-2[(диметиламіно)метил]-1-гідроксициклогексил]бензамід. В альтернативному способі розділення Сполук 1 та 2 використовують колонку С-18 та 0,01Μ сульфат натрію у воді (скоректований до рН 2,5 сірчаною кислотою)/метанол:ізократична суміш 85/15, та промивають чистим метанолом між стадіями. Чисті фракції відокремленої Спол 2 та чисті фракції відокремленої Спол 1, окремо, але однаково Хлорид ізопропілмагнію (5,4мл 2Μ розчину в THF, 10,9ммоль) по краплям додавали до розчину 3-йодобензонітрилу (2г, 8,7ммоль) в THF (20мл) при 0°С. Після перемішування протягом 30хв, додавали 2-димеіиламінометил-циклогексанон та льодяну баню видаляли. Через 1год реакцію гасили насиченим водним хлоридом амонію (20мл) та додавали етил ацетат (40мл). Органічну фазу відокремлювали та потім екстрагували водним розчином 1N соляної кислоти (2х20мл). Кислотні екстракти об'єднували та потім підлужували 2N розчином гідроксиду натрію. Основний розчин потім екстрагували хлороформом (3х20мл). Органічні екстракти об'єднували, сушили (K2СО3), фільтрували та концентрували при зниженому тиску, одержуючи 3-[(2-диметиламіно)метил]-1гідроксициклогексил]-бензонітрил у вигляді суміші чотирьох діастереомерів (1,66г, 73%). Приклад 1 3-[(1-RS,2-RS)-2-[(Диметиламіно)метил]-1гідроксициклогексил|-бензамід, Спол 1 13 90432 обробляли: розчинники випарювали та одержану суміш (чистий ізомер+вода+0,01Μ ацетат амонію у воді (скоректований до рН=2,5 сірчаною кислотою)) впорскували у колонку С-18, попередньо промиту водою, щоб видалити будь-які солі. Потім, чисту діастереомерну суміш скачували з колонки з градієнтом води та метанолу. Приклад 2 3-[(1-RS,2-RS)-[(2-Диметиламіно)метил]-1гідроксициклогексил]-бензамід, Спол 2 Зазначену у заголовку сполуку елюювали другою при розділенні, описаному в Прикладі 1: CIMS (М+Н) m/z=277. Приклад 3 (-)-3-[(1R,2R)-rel-[(2-Диметиламіно)метил]-1гідроксициклогексил]-бензамід, Спол 3 3-[(1-RS,2RS)-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід потім перетворювали, використовуючи колонку Chiralpak AD з 100% ацетонітрилу як елюенту та з 100% етанолу для промивання колонки між кожним впорскуванням, одержуючи (-)-3-[(1R,2R)-rel-2[(диметиламіно)метил]-1-гідроксициклогексил]25 бD бензамід (2,25г): MS m/z 277,0 (МН+); -33,5 (с 1, CHCl3); Аналітична обернено-фазова ВЕРХ (градієнт 10-90% MeCN, 0,1% водний TFA) tR=1,52хв, -99%; 1Н ЯМР (CDCl3) 1,35-1,43 (s, 1Η), 1,55-1,65 (m, 2H), 1,66-1,68 (m, 3H), 1,74-1,79 (m, 1Н), 1,88 (d, 1Η, J=13Гц). 2,02-2,05 (m, 3Η), 2,18 (s, 6Η), 2,43-2,46 (m, 1Н), 5,69 (s, 1Н), 6,44 (s, 1H), 7,43 (t, 1H, J=7,7Гц), 7,69-7,72 (m, 2H), 8,0 (s, 1H). Приклад 4 (+)-3-[(1S,2S)-rel-[(2-Диметиламіно)метил]-1гідроксициклогексил|-бензамід, Спол 4 Другою сполукою, яку елюювали при розділенні, описаному в Прикладі 3, був (+)-3-[(1S,2S)rel-2-[(диметиламіно)метил]-1гідроксициклогексил]-бензамід, (2,3г), MS m/z 277 25 бD (МН+); +33,6 (с 1, СHCl3); Аналітична обернено-фазова ВЕРХ (градієнт 10-90% MeCN, 0,1% водний TFA) tR=1,49хв, -99%; 1Н ЯМР (CDCl3) 1,35-1,43 (s, 1Н), 1,55-1,65 (m, 2H), 1,66-1,68 (m, 3H), 1,74-1,80 (m, 1H), 1,88 (d, 1H, J=13,2Гц), 2,022,06 (m, 3H), 2,18 (s, 6H), 2,43-2,45 (m 1H), 5,75 (s, 1H), 6,46 (s, 1H), 7,43 (t, 1H, J=1,1Гц), 7,69-7,72 (m, 2H), 8,01 (s, 1Н). Методика В 3-[(1-RS,2-RS)-2-[(Диметиламіно)метил]-1гідроксициклогексил]-феніловий ефір трифторметансульфонової кислоти 1,0г зразку 60% NaH в маслі поміщали в колбу та промивали гексанами. NaH суспендували в 20мл СН2СІ2 та охолоджували на льодяній бані. Додавали зразок 3-[(1-RS,2-RS)-2[(димeтилaмiнo)мeтил]-1-riдpoкcициклoгeкcил]фeнoлy (6,3г, 0,024моль) в СН2СІ2 (20мл). Після перемішування протягом 1год, по краплям додавали розчин трифлатного ангідриду (6мл в 10мл СН2СІ2). Льодяну баню видаляли та реакційну суміш перемішували при кімнатній температурі протягом 2год. Потім реакційну суміш промивали водою, сольовим розчином та сушили (Na2SO4). Розчинник випарювали, одержуючи 11г масла. 14 Залишок пропускали через колонку з силікагелем (4:1, СН2СІ2:МеОН), одержуючи 7,9г (83%) 3-[(1RS,2-RS)-2-[(диметиламіно)метил]-1гідроіхициклогексил]-фенілового ефіру трифторметансульфонової кислоти. MS m/z=233 (M-OTf). Методика С Метил 3-[(1-RS,2-RS)-[(2диметиламіно)метил]-1-гідроксициклогексил]бензоат У товстостінну колбу поміщали 3-[(1-RS,2RS)2-[(диметиламіно)метил]-1-гідроксициклогексил]феніловий ефір трифторметансульфонової кислоти (6,8г, 0,018моль), DMF (130мл), МеОН (54мл), DPPF (380мг, 8мол%), Pd(OAc)2 (163мг, 4моль%) та TEA (5,4мл). Газоподібний монооксид вуглецю барботували через реакційну суміш протягом 5хв та колбу закривали та нагрівали до 100°С протягом 2год. Після охолодження реакційну суміш виливали у воду та екстрагували 70:30 Еt2О/ЕtOАс (3х). Органічні фази об'єднували, промивали водою, сольовим розчином, сушили (Na2SO4) та фільтрували. Розчинник випарювали у вакуумі та залишок пропускали через колонку з силікагелем (90:10:1 CH2Cl2:MeOH:NH4OH), одержуючи 2,5г (48%) зазначеної у заголовку сполуки. MS m/z=292 (МH+). 1Н ЯМР (CDCl3) 8,2-7,4 (Ar, 4Н); 3,9 (s, 3H); 2,3 (d, 1Н); 2,1 (s, 6Н); 1,9-1,3 (m, 10Н). Методика D 3-[(1-RS,2-RS)-[(2-Диметиламіно)метил]-1гідроксициклогексил]-бензойна кислота Зразок метил 3-[(1-RS,2-RS)-2[(диметиламіно)метил]-1-гідроксициклогексил]бензоату (2,5г, 8,6ммоль), МеОН (20мл) та 3N NaOH (9мл) кип'ятили зі зворотним холодильником протягом 1,5год. МеОН випарювали у вакуумі та залишок підкисляли HCl (конц.). Розчинник випарювали у вакуумі та залишок розтирали з Еt2О. Тверду речовину сушили протягом ночі у вакуумі, одержуючи 2,2г (92%) 3-[(1-RS,2-RS)-2[(диметиламіно)метил]-1-гідроксициклогексил]бензойної кислоти. Приклад 5 3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1гідроксициклогексил]-N,N-діетил-бензамід, Спол 5 Зразок 3-[(1-RS,2-RS)-2[(диметиламіно)метил]-1-гідроксициклогексил]бензойної кислоти (0,1г, 0,36ммоль), СН2СІ2 (5мл) та діетиламін (0,08мл, 0,36ммоль) поміщали в колбу та перемішували протягом 5хв. До реакційної суміш додавали HATU (0,13г 0,36ммоль) та перемішування продовжували протягом 2год. Додавали воду та органічну фазу відокремлювали, знову промивали водою, сушили (Na2SO4) та фільтрували. Фільтрат випарювали у вакуумі та залишку пропускали через колонку з силікагелем (90:10:1, СН2СІ2:MeOH:NH4OH), одержуючи 42мг (35%) 3[(1-RS,2-RS)-2-[(диметиламіно)метил]-1гідроксициклогексил]-N,N-діетил-бензаміду: MS + 1 m/z=333 (МН ); Н ЯМР (CDCl3) 7,7-7,2 (Ar, 4Н), 3,6 та 3,2 (bq, 4H), 2,4 (dd, 1Η), 2,1 (s, 6Н), 2,0-1,5 (m, 10Н), 1,1 (bt, 6H). Приклад 6 N-Циклопропіл-3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід, Спол 6 15 Використовуючи методику Прикладу 5, замінюючи діетиламін на циклопропіламін, одержували зазначену у заголовку сполуку з виходом 45%. MS m/z=317 (МН+); 1Н ЯМР (CDCl3) 7,7-7,2 (Ar, 4Н); 2,1 (s, 6Н); 2,0-1,5 (m, 12H); 0,5 (2t, 4H). Приклад 7 3-[(1-RS,2-RS)-2-[(Диметиламіно)метил]-1гiдpoкcициклoгeкcил]-N-метилбензамід 90432 16 Використовуючи методику Прикладу 5, замінюючи діетиламін на N-метиламін, одержували зазначену у заголовку сполуку з виходом 37%. MS m/z=291 (МН+); 1Н ЯМР (CDCl3) 7,7-7,2 (Ar, 4Н), 2,9 (d, 3Η); 2,1 (s, 6H), 2,3-1,5 (m, 10Н), Сполуки 1-7 Формули (І), наведені в Таблиці 1, були синтезовані, використовуючи методики, описані вище. Таблиця 1 Спол № 1 2 3 4 5 6 7 3-[(1-RS,2-SR)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід 3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід (-)-3-[(1R,2R)-rel-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід (+)-3-[(1S,2S)-rel-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід 3-[(1-RS,2-RS)-2-[(диметиламiно)метил]-1-гідроксициклогексил]-N,N-діетил-бензамід N-циклопропіл-3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-бензамід 3-[(1-RS,2-RS)-2-[(диметиламіно)метил]-1-гідроксициклогексил]-N-метилбензамід Біологічні приклади Приклад 1 Аналіз зв'язування з мю та дельта опіоїдними рецепторами мозку щура Активність сполук за винаходом, як опіоїдів, продемонстрована за допомогою аналізу зв'язування з мю та дельта опіоїдніми рецепторами мозку щура, як описано нижче. Методика Самців щурів Wistar (150-250г, VAF, Charles River, Kingston, NY) вбивали шляхом дислокації шийних хребців, та їхні мізки видаляли та негайно поміщали в охолоджуваний льодом буфер ТрисНСІ (50мМ, рН 7,4). Передній мозок відокремлювали від решти мозку фронтальним зрізом, починаючи з дорсального кінця біля горбка та проходячи вентрально по середньомозково-мостовому з'єднанню. Після препарування передні мозки гомогенізували в буфері Трис у тефлоново-скляному гомогенізаторі. Гомогенат розводили до концентрації 1г тканини переднього мозку на 100мл буферу Трис та центрифугували при 39000 g протягом 10хв. Осад повторно суспендували в такому самому об'ємі буферу Трис з кількома короткими імпульсами гомогенізатора Polytron. Цей корпускулярний препарат використовували для проведення аналізів зв'язування з опіоїдними рецепторами. Після інкубування з мю-опіоїдним селективним пептидним лігандом [3H]DAMGO або дельтаопіоїдним селективним лігандом [3H]DPDPE при 25°С вміст пробірок фільтрували через листовий фільтр Whatman GF/B за допомогою клітинного харвестера Brandel. Пробірки та фільтри промивали тричі 4мл 10мМ HEPES (рН 7,4) та радіоактивність, пов'язану з фільтрувальними циклами, вимірювали, використовуючи сцинтиляційну рідину Формули 989 (New England Nuclear, Boston, MA) в сцинтиляційному лічильнику. Аналіз Дані використовували для розрахунку значення Ki, використовуючи GraphPad Prism. Приклад 2 Аналіз зв'язування [35S]GTP S в мембранах людських мю-опіоїдних-СНΟ клітин Препарат мембран Мембрани людських мю-СНО клітин були придбані у Receptor Biology, Inc. (Baltimore, MD). Приблизно 10мг/мл протеїну мембрани суспендували в 10мМ TPIS-HCІ рН 7,2, 2мМ EDTA, 10% цукрози. Мембрани утримувалися при 4-8°С. 1мл мембран додавали в 15мл холодного буферу дослідження, що містить 50мМ HEPES, рН 7,6. 5мМ MgCІ2, 100мМ NaCl, 1мМ DTT та 1мМ EDTA. Суспензію мембран двічі гомогенізували з Polytron та центрифугували при 3000об/хв протягом 10хв. Надосадову рідину потім центрифугували при 18000об/хв протягом 20хв Осад повторно суспендували в 10мл буферу дослідження з Polytron. Методика інкубації Гранули мембран (20мкг/мл) попередньо інкубували з гранулами Сцинтиляційного аналізу близькості (SPA, 10мг/мл) при 25°С протягом 45хв в буфері дослідження. Гранули SPA (5мг/мл), сполучені з мембранами (10мкг/мл), потім інкубували з 0,5нМ [35S]GTP S в тому ж самому буфері HEPES, що містить 50мкМ GDP в загальному об'ємі 200мкл. Для стимулювання зв'язування [35S]GTP S використовували діапазон концентрацій агоністів рецепторів. Основне зв'язування досліджували за відсутності агоністів та неспецифічне зв'язування досліджували в присутності 10мкМ неміченого GTP S. Дані аналізували на Packard TopCount. Дані Дані розраховували, як вказано нижче: % основного зв'язування=(стимульованенеспецифічне зв'язування)*100/(основненеспецифічне зв'язування). % інгібування=(% основного зв'язування 1мкМ DAMGO-% основного зв'язування сполуки)*100/(% основного зв'язування 1мкМ DAMGO-100) Аналіз зв'язування [35S]GTP S в мембранах клітин NG108-15 Препарат мембран Мембрани клітин NG108-15 були придбані у Applied Cell Sciences (Rockville, MD). Порцію (8мг/мл) протеїну мембрани суспендували в 10мМ TPIS-HCl рН 7,2, 2мМ EDTA, 10% цукрози. 17 90432 Мембрани утримувалися при 4-8°С. Порцію (1мл) мембран додавали в 10мл холодного буферу дослідження, що містить 50мМ Tris, рН 7,6, 5мМ MgCl2, 100мМ NaCl, 1мМ DTT та 1мМ EGTA. Суспензію мембран двічі гомогенізували з Polytron та центрифугували при 3000об/хв протягом 10хв. Надосадову рідину потім центрифугували при 18000об/хв протягом 20хв. Осад повторно суспендували в 10мл буферу дослідження, використовуючи Polytron. Методика інкубації Гранули мембран (75мкг/мл) попередньо інкубували з гранулами SPA (10мг/мл) при 25°С протягом 45хв в буфері дослідження. Гранули SPA (5мг/мл), сполучені з мембранами (37,5мкг/мл), потім інкубували з 0,1нМ [35S]GTP S в тому ж са 18 мому буфері Tris, що містить 100мкМ GDP в загальному об'ємі 200мкл. Для стимулювання зв'язування [35S]GTP S використовували діапазон концентрацій агоністів рецепторів. Основне зв'язування досліджували за відсутності агоністів та неспецифічне зв'язування досліджували в присутності 10мкМ неміченого GTP S. Радіоактивність визначали на Packard TopCount. Дані Розрахунки проводили, як вказано нижче: % основного зв'язування=(стимульованенеспецифічне зв'язування)*100/(основненеспецифічне зв'язування). Значення ЕС50 розраховували, використовуючи програму Prism. Таблиця 2 Параметри мю та дельта опіоїдних рецепторів in vitro Спол Мю опіоїдне зв'язуван- Дельта опіоїдне зв'я№ ня Ki (нМ) зування Kі (нМ) 1 1387 9875 2 29,43 2470 3 15,48 3141 4 828 >10000 5 >10000 >10000 6 5189 >10000 7 2121 >10000 Приклад 3 Модель лікування запального болю у щурів променевим теплом CFΑ Внутрішньоплантарне введення повного ад'юванта Фройнда (CFA) у гризунів викликало сильну довготривалу запальну реакцію, що характеризується хронічною та вираженою гіпералгезією до теплових та механічних подразників. Ці ефекти досягають максимального значення через 24-72 години після введення, що може зберігатись від декількох днів до декількох тижнів. Для того, щоб оцінити здатність сполук обертати термічну гіпералгезію, щурів Спрага-Доулі чоловічої статі (200350г) піддавали інтраплантарному введенню CFA (1:1 СFА:cольовий розчин, 100мкл) у ліву задню лапу. Після 24-годинного інкубаційного періоду, були отримані часи затримки на дію подразника променевого тепла на лапу (RH), які порівнювали з вихідним рівнем часів затримки (попередній-CFA). Прилад RH автоматично реєстрував підняття лапи над поверхнею скла. У додатковий аналіз були включені лише ті щури, що проявили, щонайменше, 25% зменшення часу затримки порівняно із вихідним рівнем (тобто, гіпералгезію). Після оцінки часів затримки після CFA щурам перорально вводили дозу (2,5мл/кг) тестової сполуки або основи (гідроксипропілметилцелюлози, НРМС). Зміну гіпералгезії у відсотках розраховували для кожної тварини як (ефект лікування-ефект після CFA)/(ефект перед CFA-ефект після CFA)x100. Тому повернення до нормальних граничних значень перед CFA визначалось як 100% ефективність, тоді як відсутність зміни порівняно із гранич Мю опіоїдні GTP S (ЕС50/відносна ефективність) Дельта опіоїдні GTP S (ЕС50, нМ) Агоніст 167нМ/75% 4820нМ/41% 5630 ними значеннями після CFA становило 0% ефективності. Середню % зміну гіпералгезії потім розраховували для кожної лікувальної групи (n=6-8 щурів/група). У цій моделі сполуки 3 та 4 були антиппералгезійними (див. Фігуру 1). Приклад 4 Модель невропатичного болю накладання лігатури на спинномозкові нерви (SNL) Тварини: Щури Спрага-Доулі чоловічої статі масою від 145 до 165г (віком приблизно 6 тижнів) були отримані від Harlan (Indianapolis, IN). їжа та вода надавались за бажанням, підтримувався цикл: 12 годин світла та 12 годин темряви. Тварин розмістили групами у спеціальних вільних від патогенів умовах з підтриманням бар'єру та дозволяли їм акліматизуватись протягом не менше 1 тижня. Після хірургічного втручання, тварин помістили окремо у полікарбонаті клітки; твердим дном із пристроями для автоматичної подачі води при 22°C, відносна вологість становила 60%. Усі тварини отримували дієту Harland Tekland №8604. Хірургія: Анестезію робили за допомогою засобу для інгаляції ізофлурану (ІsoVet ) в камері для введення (3-5% у 2л/хв О2). Після того, як тварина приймала лежаче положення, її виносили та поміщали у носовий обтічник, що доставляв засіб для інгаляції (0,5-2,5% при 2л/хв О2). Дорсальну тазову область голили та асептично чистили хлоргексидиновим скрабом, 70% спиртом та 5% розчином хлоргексидину. Тварин тримали у вентральному лежачому положенні на електричній грілці та про 19 90432 водили хірургічну процедуру, описану Kіm та Chung (1992). Ліві параспінальні м'язи відокремлювали від спінальних процесів на рівні від попереку 4 до хрестця 2 (L4-S2). Після ретрагування м'язів, поперечний процес L6 видаляли з використанням малих кусачок. Тоді можна було спостерігати спінномозкові нерви L4 та L5. L5 потім ізолювали та накладали лігатуру з використанням 6-0 шовкового шовного матеріалу. Негайно після операції перед відновлення від анестезії вводили теплий сольовий розчин та дозу антибіотика тривалої дії. Оцінка механічної алодинії: Через, щонайменше, один тиждень після хірургічного втручання тварин помістили окремо у камеру для тестування Lucite з дном з дротової сітки. Механічну (тактильну) алодинію вимірювали шляхом реєстрації тиску, при якому уражена лапа відсувалася від градуйованих подразників (мінімальна відстань фон Фрея становила від 4,0 до 148,1мН, еквівалентних 0,25-15г тиску), прикладеного до плантарної поверхні лапи (між подушечками пальців) відповідно до процедури, описаної Chaplan el al. (1994) для розрахунку граничної величини відсування лапи (PWT). Нормальні щури могли витримувати, щонайменше, 15г тиску без відклику. Щури SNL могли дати відклик при вже 0,25г тиску. Щурів включали до цього дослідження, тільки якщо їх PWT була нижче за 4,0г. Тестування сполук за методом фон Фрея: Тварин використовували для тестування сполуки через 2-8 тижнів після операції. Тварин завжди попередньо тестували на граничну величину відхилення від вихідного рівню на день проведення тестування. Після голодування протягом 16 годин, PWT оцінювали через 30 хвилин, 1 годину, 2 години та 4 години після отримання дози. Дослідження ефекту дози проводили під час максимального ефекту. Дослідження проводили всліпу. Статистичний аналіз: Дані нормалізували, та результати представили як % МРЕ (максимально можливий ефект) ліків. % МПЕ х г/сила - вихідний рівень/сил а Х 100 15г5г/си - вихідний рівень г/сила Ефект прикладів сполук наведено у Таблиці 3, а значення ED50 для Сполуки 3 становить 17мг/кг при 2 годинах (див. Фігуру 2). Таблиця 3 Вплив сполук у моделі накладання лігатури на спинномозкові нерви Сполука № 2 2 3 4 4 Доза 3мг/кг внутрішньовенно 30мг/кг, перорально 30мг/кг, перорально 100мг/кг, перорально МРЕ або значення ED50 87% 88% ED50=17мг/кг 39% 95% 20 Приклад 5 Дослідження розвитку толерантності Розвиток толерантності до анальгетичного ефекту мю-опіоїдних сполук є широко відомим. Розвиток толерантності до антиалодинічного ефекту Сполуки 3 досліджували шляхом введення сполуки до щурів, в яких було накладено лігатуру на спинномозкові нерви, протягом п'яти днів. Антіалодинічний ефект сполуки оцінювали на перший та на п'ятий день. Дозування протягом п'яти днів не зменшило антіалодинічний ефект сполуки; ефект сполуки був подібним або дещо збільшеним шляхом повторного дозування (див. Фігуру 3). На відміну, толерантність до антіалодинічного ефекту типового мю-опіоїдного морфіну розвинулась швидко, через п'ять днів дозування залишився невеликий антіалодинічний ефект, або він зовсім зник (див. Фігуру 4). Приклад 6 Метаболічна стійкість Для дослідження метаболічної стійкості Сполуки 3 використовували декілька підходів. Сполуку інкубували з мікросомами печінки, взятими від мишей, щурів, собак та людей, та визначали процентний вміст сполуки, що залишилась через десять хвилин. У всіх зразках, що були протестовані, сполука була метаболічно стійкою. Примітно, що за цих умов тестування метаболізм сполуки у мікросомах печінки людини не спостерігався. Таблиця 4 Метаболічна стабільність Сполуки 3 in vitro у декількох зразках (% сполуки, що залишився через 10 хвилин після інкубування мікросомами печінки) Зразки Миша Щур Собака Людина %, що залишився через 10 хвилин 88,2 94,5 92,6 101,4 У наступному дослідженні мікросом печінки людини, відсоток сполуки, що залишився, визначався при декількох часах інкубації (30, 60 та 90хв). Було визначено, що період напіврозкладу сполуки in vitro становить >100 хвилин. У дослідженні з використанням рекомбінантних людських ізоформ Р450, сполука була лише слабким інгібітором (ІС50>10мкМ) усіх ізоформ, що були протестовані, 3А4, 2D6, 2С9, 2С19 та 1А2. У дослідженнях in vitro з використанням мікросом печінки людини глюкуронідації сполуки виявлено не було. Взяті разом, ці декілька досліджень метаболізму in vitro вказують на незвичайну метаболічну стійкість сполуки. 21 90432 22 23 Комп’ютерна верстка О. Гапоненко 90432 Підписне 24 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCarboxamido opioid compounds
Автори англійськоюCarson John R., Pitis Philip M.
Назва патенту російськоюКарбоксамидные опиоидные соединения
Автори російськоюКарсон Джон Р., Питис Филипп М.
МПК / Мітки
МПК: C07C 237/00
Мітки: опіоїдні, сполуки, карбоксамідні
Код посилання
<a href="https://ua.patents.su/12-90432-karboksamidni-opiodni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Карбоксамідні опіоїдні сполуки</a>
Попередній патент: Пристрій приводу допоміжних механізмів газотурбінного двигуна
Наступний патент: Порошкова металургійна суміш для виготовлення пресованих порошкових заготовок
Випадковий патент: Пристрій для переміщення виробу