Композиція, що включає остеогенний білок та фосфат кальцію, яка має форму твердого штифта, придатного для внутрішньокісткової ін’єкції, спосіб її одержання та застосування
Формула / Реферат
1. Композиція для ін'єкційного доставляння остеогенних білків, яка включає остеогенний білок та матеріал, який містить фосфат кальцію, причому композиція має форму твердого штифта, придатного для внутрішньокісткової ін'єкції.
2. Композиція за п. 1, яка відрізняється тим, що остеогенний білок вибирають із групи, яка складається з білків, що належать до родини кісткових морфогенетичних білків (BMP).
3. Композиція за п. 1, яка відрізняється тим, що остеогенний білок вибирають із групи, яка складається з ВМР-2, ВМР-4, ВМР-5, ВМР-6, ВМР-7, BMP-10, BMP-12, ВМР-13 та МР52.
4. Композиція за п. 1, яка відрізняється тим, що остеогенним білком є ВМР-2.
5. Композиція за п. 1, яка відрізняється тим, що остеогенним білком є ВМР-12.
6. Композиція за п. 1, яка відрізняється тим, що остеогенним білком є ВМР-13.
7. Композиція за п. 1, яка відрізняється тим, що остеогенним білком є МР52.
8. Композиція за п. 1, яка відрізняється тим, що остеогенний білок є присутнім у кількості від приблизно 1 % до приблизно 90 % від маси композиції.
9. Композиція за п. 1, яка відрізняється тим, що остеогенний білок є присутнім у кількості від приблизно 15 % до приблизно 40 % від маси композиції.
10. Композиція за п. 1, яка відрізняється тим, що остеогенний білок є гетеродимерним.
11. Композиція за п. 1, яка відрізняється тим, що додатково включає інгібітор резорбції кісток.
12. Композиція за п. 11, яка відрізняється тим, що інгібітором резорбції кісток є бісфосфонат.
13. Композиція за п. 12, яка відрізняється тим, що бісфосфонат вибирають із групи, яка складається з алендронату, цимадронату, клодронату, ЕВ 1053, етидронатів, ібандронату, неридронату, олпадронату, памідронату, ризедронату, тилудронату, YH 529, золедронату і їх фармацевтично прийнятних солей, естерів, кислот та їх сумішей.
14. Композиція за п. 1, яка відрізняється тим, що матеріал, який містить фосфат кальцію включає матеріал, вибраний з групи, яка складається з аморфного апатитного фосфату кальцію, слабкокристалічного апатитного фосфату кальцію, гідроксіапатиту, трифосфату кальцію, фтороапатиту та їх комбінацій.
15. Композиція за п. 1, яка відрізняється тим, що матеріал, який містить фосфат кальцію, включає слабкокристалічний апатитний фосфат кальцію.
16. Композиція за п. 15, яка відрізняється тим, що слабкокристалічний апатитний фосфат кальцію має співвідношення кальцію з фосфатом менше за 1:1,5.
17. Композиція за п. 15, яка відрізняється тим, що слабкокристалічний апатитний фосфат кальцію має співвідношення кальцію з фосфатом приблизно 1:1,4.
18. Композиція за п. 1, яка відрізріяється тим, що матеріал, який містить фосфат кальцію, є присутнім у кількості від приблизно 10 % до приблизно 99 % від маси композиції.
19. Композиція за п. 1, яка відрізняється тим, що матеріал, який містить фосфат кальцію, є присутнім у кількості від приблизно 40 % до приблизно 60 % від маси композиції.
20. Композиція за п. 1, яка відрізняється тим, що штифт є циліндричним, і його діаметр становить приблизно від 0,1 мм до 3,0 мм.
21. Композиція за п. 1, яка відрізняється тим, що довжина штифта становить приблизно від 1,0 мм до 5,0 см.
22. Спосіб одержання композиції для ін'єкційного доставляння остеогенних білків, який включає етапи:
a. змішування сухої форми остеогенного білка з сухою формою матеріалу, який містить фосфат кальцію, для одержання сухої суміші,
b. відновлення вологовмісту сухої суміші шляхом додавання водного буфера для утворення пасти,
с. формування пасти для утворення композиції у формі штифта і
d. висушування композиції у формі штифта з етапу (с) для утворення композиції у формі штифта, придатного для внутрішньокісткової ін'єкції.
23. Спосіб за п. 22, який відрізняється тим, що остеогенний білок вибирають із групи, яка складається з ВМР-2, ВМР-4, ВМР-5, ВМР-6, ВМР-7, ВМР-10, ВМР-12, ВМР-13 та МР52.
24. Спосіб за п. 22, який відрізняється тим, що кількість остеогенного білка від приблизно 1 % до приблизно 90 % від маси композиції змішують з носієм, що містить фосфат кальцію.
25. Спосіб за п. 22, який відрізняється тим, що кількість остеогенного білка від приблизно 15 % до приблизно 40 % від маси композиції з носієм, що містить фосфат кальцію.
26. Спосіб за п. 22, який відрізняється тим, що композиція додатково включає інгібітор резорбції кісток, і суху форму інгібітора резорбції кісток змішують у сухій суміші.
27. Спосіб за п. 26, який відрізняється тим, що інгібітором резорбції кісток є бісфосфонат.
28. Спосіб за п. 27, який відрізняється тим, що бісфосфонат вибирають із групи, яка складається з алендронату, цимадронату, клодронату, ЕВ 1053, етидронатів, ібандронату, неридронату, олпадронату, памідронату, ризедронату, тилудронату, YH 529, золедронату і їх фармацевтично прийнятних солей, естерів, кислот та їх сумішей.
29. Спосіб за п. 22, який відрізняється тим, що матеріал, який містить фосфат кальцію, включає матеріал, вибраний з групи, яка складається з аморфного апатитного фосфату кальцію, слабкокристалічного апатитного фосфату кальцію, гідроксіапатиту, трифосфату кальцію, фтороапатиту та їх комбінацій.
30. Спосіб за п. 22, який відрізняється тим, що матеріал, який містить фосфат кальцію, включає слабкокристалічний апатитний фосфат кальцію.
31. Спосіб за п. 30, який відрізняється тим, що слабкокристалічний апатитний фосфат кальцію має співвідношення кальцію з фосфатом менше за 1:1,5.
32. Спосіб за п. 30, який відрізняється тим, що слабкокристалічний апатитний фосфат кальцію має співвідношення кальцію з фосфатом приблизно 1:1,4.
33. Спосіб за п. 22, який відрізняється тим, що кількість матеріалу, який містить фосфат кальцію, від приблизно 10 % до приблизно 99 % від маси композиції змішують з остеогенним білком.
34. Спосіб за п. 22, який відрізняється тим, що кількість матеріалу, який містить фосфат кальцію, від приблизно 40 % до приблизно 60 % від маси композиції змішують з остеогенним білком.
35. Спосіб за п. 22, який відрізняється тим, що водний буфер вибирають із групи, яка складається з фосфатно-буферного розсолу, розсолу, буферів на основі гліцину та їх комбінацій.
36. Спосіб за п. 22, який відрізняється тим, що співвідношення водного буфера з сухою сумішшю становить від приблизно 0,5:1 до приблизно 2:1.
37. Спосіб за п. 22, який відрізняється тим, що формування здійснюють, застосовуючи спосіб, вибраний з групи, яка складається зі штампування, екструдування, пресування, свердління та їх комбінацій.
38. Спосіб за п. 22, який відрізняється тим, що додатково включає етап нарізання композиції у формі штифта до або після етапу (d).
39. Спосіб за п. 22, який відрізняється тим, що композиція у формі штифта є циліндричною, і діаметр циліндричної композиції у формі штифта становить приблизно від 0,1 мм до 3,0 мм.
40. Спосіб за п. 22, який відрізняється тим, що довжина композиції у формі штифта становить приблизно від 1,0 мм до 5,0 см.
41. Застосування ефективної кількості композиції за будь-яким з пп. 1-21, для одержання медикаменту для лікування ссавця, який має дефект кістки, причому застосування включає введення у місце дефекту кістки ефективної кількості композиції для ін'єкційного доставляння остеогенних білків за будь-яким з пп. 1-21.
42. Застосування ефективної кількості композиції за будь-яким з пп. 1-21, для одержання медикаменту для лікування ссавця, який має дефект кістки, причому застосування включає етапи:
a. введення у місце дефекту кістки ефективної кількості композиції для ін'єкційного доставляння остеогенних білків за будь-яким з пп. 1-21, і
b. введенняу місце дефекту кістки ефективної кількості інгібітора резорбції кісток.
43. Застосування за п. 42, яке відрізняється тим, що етап (а) здійснюють перед етапом (b).
44. Застосування за п. 42, яке відрізняється тим, що етап (b) здійснюють перед етапом (а).
45. Застосування за п. 42, яке відрізняється тим, що етап (а) та етап (b) здійснюють одночасно.
Текст
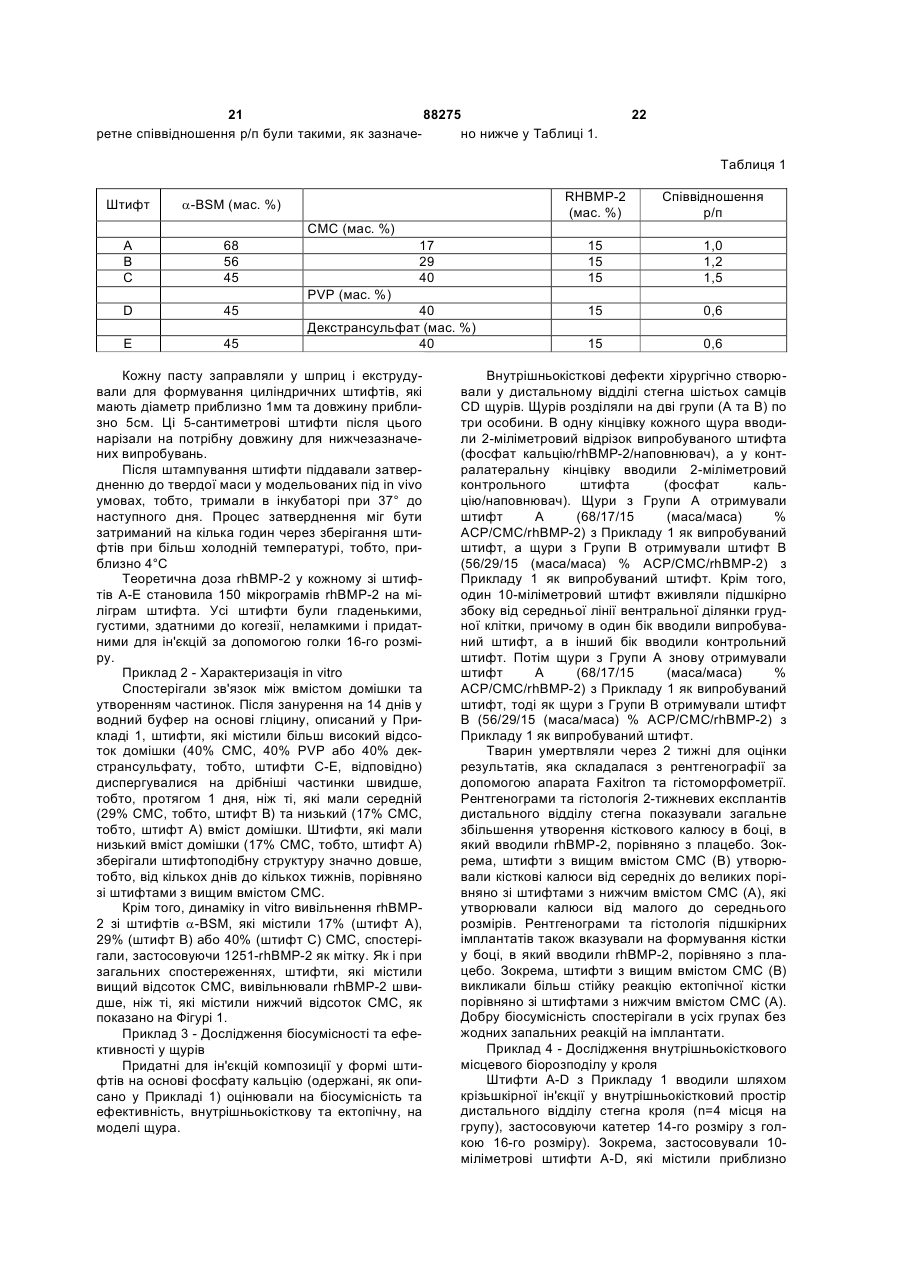
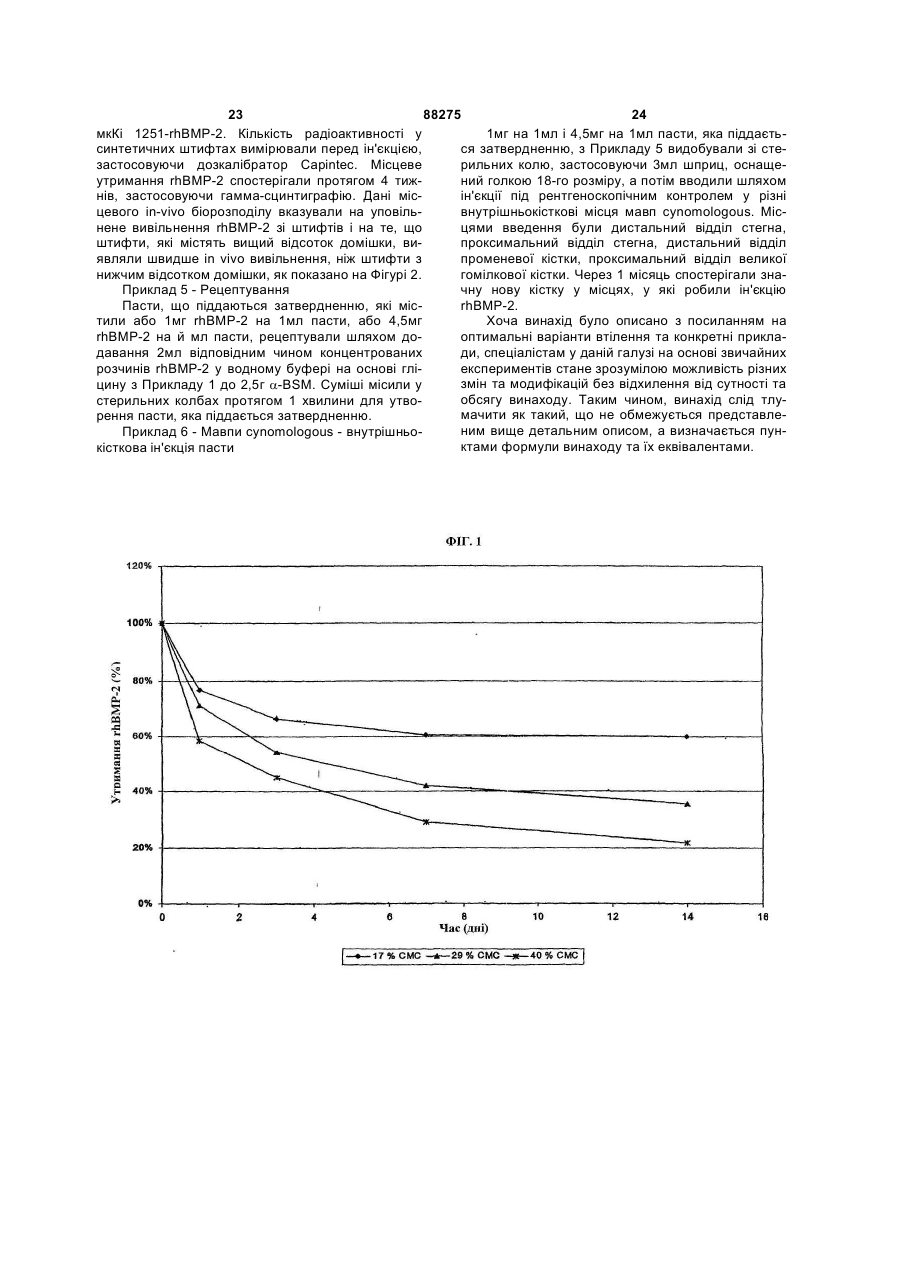
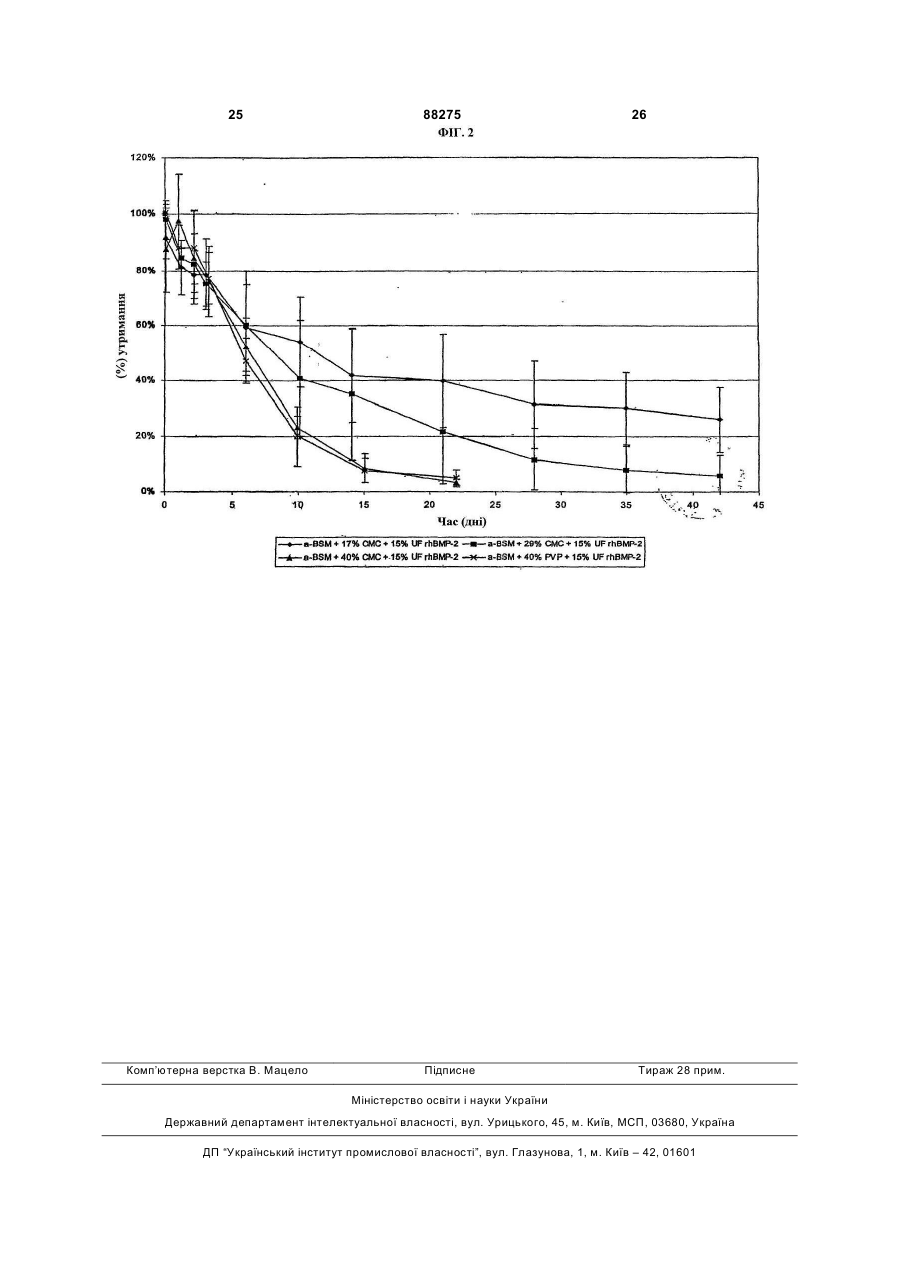
1. Композиція для ін'єкційного доставляння остеогенних білків, яка включає остеогенний білок та матеріал, який містить фосфат кальцію, причому композиція має форму твердого штифта, придатного для внутрішньокісткової ін'єкції. 2. Композиція за п. 1, яка відрізняється тим, що остеогенний білок вибирають із групи, яка складається з білків, що належать до родини кісткових морфогенетичних білків (BMP). 3. Композиція за п. 1, яка відрізняється тим, що остеогенний білок вибирають із групи, яка складається з ВМР-2, ВМР-4, ВМР-5, ВМР-6, ВМР-7, BMP-10, BMP-12, ВМР-13 та МР52. 4. Композиція за п. 1, яка відрізняється тим, що остеогенним білком є ВМР-2. 5. Композиція за п. 1, яка відрізняється тим, що остеогенним білком є ВМР-12. 6. Композиція за п. 1, яка відрізняється тим, що остеогенним білком є ВМР-13. 7. Композиція за п. 1, яка відрізняється тим, що остеогенним білком є МР52. 8. Композиція за п. 1, яка відрізняється тим, що остеогенний білок є присутнім у кількості від приблизно 1 % до приблизно 90 % від маси композиції. 9. Композиція за п. 1, яка відрізняється тим, що остеогенний білок є присутнім у кількості від приблизно 15 % до приблизно 40 % від маси композиції. 10. Композиція за п. 1, яка відрізняється тим, що остеогенний білок є гетеродимерним. 2 (19) 1 3 88275 4 22. Спосіб одержання композиції для ін'єкційного має співвідношення кальцію з фосфатом приблиздоставляння остеогенних білків, який включає но 1:1,4. етапи: 33. Спосіб за п. 22, який відрізняється тим, що a. змішування сухої форми остеогенного білка з кількість матеріалу, який містить фосфат кальцію, сухою формою матеріалу, який містить фосфат від приблизно 10 % до приблизно 99 % від маси кальцію, для одержання сухої суміші, композиції змішують з остеогенним білком. b. відновлення вологовмісту сухої суміші шляхом 34. Спосіб за п. 22, який відрізняється тим, що додавання водного буфера для утворення пасти, кількість матеріалу, який містить фосфат кальцію, с. формування пасти для утворення композиції у від приблизно 40 % до приблизно 60 % від маси формі штифта і композиції змішують з остеогенним білком. d. висушування композиції у формі штифта з етапу 35. Спосіб за п. 22, який відрізняється тим, що (с) для утворення композиції у формі штифта, водний буфер вибирають із групи, яка складається придатного для внутрішньокісткової ін'єкції. з фосфатно-буферного розсолу, розсолу, буферів 23. Спосіб за п. 22, який відрізняється тим, що на основі гліцину та їх комбінацій. остеогенний білок вибирають із групи, яка склада36. Спосіб за п. 22, який відрізняється тим, що ється з ВМР-2, ВМР-4, ВМР-5, ВМР-6, ВМР-7, співвідношення водного буфера з сухою сумішшю ВМР-10, ВМР-12, ВМР-13 та МР52. становить від приблизно 0,5:1 до приблизно 2:1. 24. Спосіб за п. 22, який відрізняється тим, що 37. Спосіб за п. 22, який відрізняється тим, що кількість остеогенного білка від приблизно 1 % до формування здійснюють, застосовуючи спосіб, приблизно 90 % від маси композиції змішують з вибраний з групи, яка складається зі штампування, носієм, що містить фосфат кальцію. екструдування, пресування, свердління та їх ком25. Спосіб за п. 22, який відрізняється тим, що бінацій. кількість остеогенного білка від приблизно 15 % до 38. Спосіб за п. 22, який відрізняється тим, що приблизно 40 % від маси композиції з носієм, що додатково включає етап нарізання композиції у містить фосфат кальцію. формі штифта до або після етапу (d). 26. Спосіб за п. 22, який відрізняється тим, що 39. Спосіб за п. 22, який відрізняється тим, що композиція додатково включає інгібітор резорбції композиція у формі штифта є циліндричною, і діакісток, і суху форму інгібітора резорбції кісток зміметр циліндричної композиції у формі штифта шують у сухій суміші. становить приблизно від 0,1 мм до 3,0 мм. 27. Спосіб за п. 26, який відрізняється тим, що 40. Спосіб за п. 22, який відрізняється тим, що інгібітором резорбції кісток є бісфосфонат. довжина композиції у формі штифта становить 28. Спосіб за п. 27, який відрізняється тим, що приблизно від 1,0 мм до 5,0 см. бісфосфонат вибирають із групи, яка складається 41. Застосування ефективної кількості композиції з алендронату, цимадронату, клодронату, ЕВ за будь-яким з пп. 1-21, для одержання медикаме1053, етидронатів, ібандронату, неридронату, олнту для лікування ссавця, який має дефект кістки, падронату, памідронату, ризедронату, тилудронапричому застосування включає введення у місце ту, YH 529, золедронату і їх фармацевтично придефекту кістки ефективної кількості композиції для йнятних солей, естерів, кислот та їх сумішей. ін'єкційного доставляння остеогенних білків за 29. Спосіб за п. 22, який відрізняється тим, що будь-яким з пп. 1-21. матеріал, який містить фосфат кальцію, включає 42. Застосування ефективної кількості композиції матеріал, вибраний з групи, яка складається з за будь-яким з пп. 1-21, для одержання медикамеаморфного апатитного фосфату кальцію, слабкокнту для лікування ссавця, який має дефект кістки, ристалічного апатитного фосфату кальцію, гідропричому застосування включає етапи: ксіапатиту, трифосфату кальцію, фтороапатиту та a. введення у місце дефекту кістки ефективної їх комбінацій. кількості композиції для ін'єкційного доставляння 30. Спосіб за п. 22, який відрізняється тим, що остеогенних білків за будь-яким з пп. 1-21, і матеріал, який містить фосфат кальцію, включає b. введення у місце дефекту кістки ефективної слабкокристалічний апатитний фосфат кальцію. кількості інгібітора резорбції кісток. 31. Спосіб за п. 30, який відрізняється тим, що 43. Застосування за п. 42, яке відрізняється тим, слабкокристалічний апатитний фосфат кальцію що етап (а) здійснюють перед етапом (b). має співвідношення кальцію з фосфатом менше за 44. Застосування за п. 42, яке відрізняється тим, 1:1,5. що етап (b) здійснюють перед етапом (а). 32. Спосіб за п. 30, який відрізняється тим, що 45. Застосування за п. 42, яке відрізняється тим, слабкокристалічний апатитний фосфат кальцію що етап (а) та етап (b) здійснюють одночасно. Ця заявка заявляє пріоритет попередньої заявки США №60/502,493, поданої 12 вересня 2003, включеної авторами шляхом посилання. Предмет винаходу стосується галузі остеогенних білків та їх фармацевтичних композицій. Ідіопатичний остеопороз є хворобою невідомої етіології, яка характеризується прогресуючою втратою кісткової маси та підвищеною ламкістю, що призводить до помітного підвищення схильності до переломів. Остеопороз належить до найбільш поширених з усіх скелетно-м'язових порушень, від яких страждають п'ятдесят шість відсотків жінок віком понад 45 років. Praemer et al., "Musculoskeletal Conditions in the United States", 5 88275 6 Amer. Acad, of Orthopaedic Surgeons, Park Ridge, IL містить фосфат кальцію, є слабкокристалічним (1992). Оскільки ймовірність його виникнення з апатитним фосфатом кальцію. Матеріал, який місвіком зростає, а відсоток літніх людей серед насетить фосфат кальцію, в оптимальному варіанті є лення збільшується, остеопороз з часом стає деприсутнім у кількості від приблизно 10% до придалі поширенішим. Остеопороз важко лікувати близно 99%, у ще кращому варіанті - від приблизлокально, і на даний час способу лікування не віно 40% до приблизно 60% від масою остеогенної домо. І нарешті, що найбільш важливо, остеопороз композиції у формі штифта і у кількості від приблиє пов'язаним зі значною захворюваністю та смертзно 30% до приблизно 70%, у ще кращому варіанті ністю. Найбільш серйозним переломом внаслідок - від приблизно 45% до приблизно 55% від маси остеопорозу є перелом проксимального відділу остеогенної композиції у формі пасти, яка піддастегнової кістки у ділянці тазостегнового суглоба. ється затвердненню. Щороку трапляється понад 300 000 переломів стеДодаткові варіанти втілення даного винаходу гна, і це є найпоширенішим типом переломів сестосуються остеогенних композицій, які також ред літніх людей. У кожної шостої жінки європейвключають інгібітор резорбції кісток. Інгібітором ської раси протягом життя трапляється перелом резорбції кісток в оптимальному варіанті є бісфостегна [Cummings et al., Arch. Intern. Med., vol.149, сфонат, вибраний з-поміж алендронату, цимадроpp.2455-2458 (1989)], а у тих, хто досяг 90-річного нату, клодронату, ЕВ 1053, етидронатів, ібандровіку, цей показник становить один до трьох. нату, неридронату, олпадронату, памідронату, Крім лікування остеопорозних кісток, існує поризедронату, тилудронату, YH 529, золедронату і треба у способах лікування або профілактики поїх фармацевтично прийнятних солей, естерів, кисв'язаних з остеопорозом переломів, наприклад, лот та їх сумішей. шляхом місцевого введення остеогенних білків. Додаткові варіанти втілення даного винаходу Остеогенними білками є білки, здатні викликати стосуються остеогенних композицій, які також або сприяти викликанню формування хрящів включають домішку, вибрану з-поміж фармацевта/або кісток. Багато таких остеогенних білків в тично прийнятних солей, полісахаридів, пептидів, останні роки було виділено й охарактеризовано, і білків, амінокислот, синтетичних полімерів, природеякі з них було одержано рекомбінантними сподних полімерів, поверхнево-активних речовин та їх собами. комбінацій, у ще кращому варіанті - вибрану зКрім того, було розроблено різні композиції, поміж карбоксиметилцелюлози, гідроксипропілмепризначені для доставлення остеогенних білків до тилцелюлози, метилцелюлози, полілактиду, полімісця, в якому вимагається формування кістки. етиленгліколю, полівінілпіролідону, поліоксіетилеАле, незважаючи на значні зусилля в цій галуноксиду, карбоксивінілового полімеру, зі, все ж залишається потреба в ефективному спополівінілового спирту, декстрансульфату та їх собі відновлення та/або лікування остеопорозних комбінацій. Домішка в оптимальному варіанті є та остеопенічних кісток і мінімізації або зниження присутньою у кількості від приблизно 1% до причастоти або тяжкості пов'язаних з остеопорозом близно 90%, у ще кращому варіанті - від приблизпереломів. но 20% до приблизно 40% від маси остеогенної Даний винахід стосується композицій для прикомпозиції у формі штифта і у кількості від приблидатного для ін'єкцій доставлення остеогенних білзно 1% до приблизно 90%, у ще кращому варіанті ків, тобто, остеогенних композицій. Ці композиції від приблизно 10% до приблизно 20% від маси можуть мати форму твердого штифта, в оптимаостеогенної композиції у формі пасти, яка піддальному варіанті - циліндричного твердого штифта, ється затвердненню. або пасти, яка піддається затвердненню. КомпоЯкщо остеогенна композиція згідно з даним зиції включають остеогенний білок та матеріал, винаходом має форму твердого циліндричного який містить фосфат кальцію. штифта, діаметр циліндричного штифта в оптимаУ деяких оптимальних варіантах втілення дальному варіанті становить приблизно від 0,1мм до ного винаходу остеогенний білок належить до ро3,0мм, у ще кращому варіанті - приблизно 1,0мм, і дини кісткових морфогенетичних білків, у ще крадовжина циліндричного штифта в оптимальному щому варіанті - є білком, до яких належать ВМР-2, варіанті становить приблизно від 0,5см до 5,0см. ВМР-4, ВМР-5, ВМР-6, ВМР-7, BMP-10, BMP-12 та Додатковий варіант втілення даного винаходу ВМР-13, у найкращому варіанті - ВМР-2. Остеостосується способу одержання композиції у формі генний білок в оптимальному варіанті є присутнім штифта для ін'єкційного доставлення остеогенних у кількості від приблизно 1% до приблизно 90%, у білків, причому вищезгадана композиція включає ще кращому варіанті - від приблизно 15% до приостеогенний білок та матеріал, який містить фосблизно 40% від маси твердих штифтів згідно з фат кальцію, і спосіб включає етапи (а) змішуванвинаходом і у кількості від приблизно 0,01% до ня сухої форми остеогенного білка з сухою форприблизно 2%, у ще кращому варіанті - від примою матеріалу, який містить фосфат кальцію, для близно 0,03% до приблизно 1% від маси пасти одержання сухої суміші; (b) відновлення вологовзгідно з винаходом. місту сухої суміші шляхом додавання водного буУ деяких оптимальних варіантах втілення дафера для утворення пасти; (с) штампування пасти ного винаходу матеріал, який містить фосфат для утворення композиції у формі штифта і (d) кальцію включає матеріал, вибраний з-поміж амовисушування композиції у формі штифта з етапу рфного апатитного фосфату кальцію, слабкокрис(с) для утворення композиції у формі штифта для талічного апатитного фосфату кальцію, гідроксіаін'єкційного доставлення остеогенних білків. В оппатиту, трифосфату кальцію, фтороапатиту та їх тимальних варіантах втілення водний буфер викомбінацій. У найкращому варіанті матеріал, який бирають з-поміж фосфатно-буферного розсолу, 7 88275 8 розсолу, буферів на основі гліцину та глутамінової належать зрощування кісток, відновлення хрящів, кислоти та їх комбінацій. Співвідношення об'єму та виправлення проблем незрощування та спінальна маси (мл:г) водного буфера з сухою сумішшю стахірургія. Придатні для ін'єкцій тверді штифти та новить від приблизно 0,5:1 до приблизно 2:1. паста, яка піддається затвердненню, згідно з даШтампування в оптимальному варіанті здійснюють ним винаходом також застосовують для сприяння шляхом штампування, екструдування, пресування, ростові кісток, яке вимагається при застосуванні свердління або комбінування цих способів. У дезамісних імплантатів суглобів, як описано у попеяких оптимальних варіантах втілення композиції у редній заявці США №60/502,526, ["Promotion of формі штифта вирізають до або після етапу (d). Bone Ingrowth in Joint Replacement Implants Using Ще один варіант втілення даного винаходу Osteogenic Proteins;] предмет цієї попередньої стосується способу одержання композиції у формі заявки включено авторами шляхом посилання у пасти для ін'єкційного доставлення остеогенних повному обсязі. білків, причому вищезгадана композиція включає Перший варіант втілення даного винаходу остеогенний білок та матеріал, який містить фосстосується композиції у формі штифта для ін'єкфат кальцію, і спосіб включає етап змішування ційного доставлення остеогенних білків, яка вклюсухої форми матеріалу, який містить фосфат чає остеогенний білок та матеріал, який містить кальцію, з водним буфером, який містить остеофосфат кальцію. Композиція згідно з цим першим генний білок, для утворення пасти. В оптимальних варіантом втілення даного винаходу необов'язково варіантах втілення даного винаходу водний буфер може включати інші домішки (зв'язувальні речовивибирають з-поміж фосфатно-буферного розсолу, ни, наповнювачі) та/або активні агенти, такі як інгірозсолу, буферів на основі гліцину та глутамінової бітор резорбції кісток. кислоти та їх комбінацій. Співвідношення водного Ця тверда композиція у формі штифта є прибуфера з матеріалом, який містить фосфат кальдатною для місцевого внутрішньокісткового достацію, становить від приблизно 0,5:1 до приблизно влення і, таким чином, може вводитись безпосе2:1. редньо у місце остеопорозу або остеопенії для Інші варіанти втілення даного винаходу стосуефективного викликання формування та/або підються способів лікування ссавця, який має дефект тримання кістки. Крім того, придатна для ін'єкцій кістки, включаючи введення у місце дефекту кістки композиція у формі штифта має профіль уповільефективної кількості заявленої авторами композиненого вивільнення по відношенню до остеогенноції для ін'єкційного доставлення остеогенних білго білка при доставленні у такий спосіб. В оптимаків. Інші варіанти втілення даного винаходу стосульному варіанті тверді штифти згідно з даним ються способів лікування ссавця, який має дефект винаходом є циліндричними і мають діаметр від кістки, включаючи етапи (а) введення у місце деприблизно 0,1мм до приблизно 3,0мм, у ще крафекту кістки ефективної кількості заявленої автощому варіанті - приблизно 1,0мм, що дозволяє рами композиції для ін'єкційного доставлення освводити їх за допомогою голки 16-го розміру. Крім теогенних білків і (b) введення у місце дефекту того, тверді штифти в оптимальному варіанті макістки ефективної кількості інгібітора резорбції кісють довжина від приблизно 1,0мм до приблизно ток. Введення інгібітора резорбції кісток здійсню5,0см. ють до етапу (а), після етапу (а) або одночасно з На відміну від існуючих придатних для ін'єкцій етапом (а). композицій, остеогенну композицію згідно з цим Фігура 1 є графіком, який показує динаміку випершим варіантом втілення даного винаходу вводять у твердій формі, таким чином, уникаючи невільнення in vitro rhBMP-2 зі штифтів a-BSM із задоліків, характерних для рідких або в'язких компостосуванням 125I-rhBMP-2 як мітки. зицій. Наприклад, при застосуванні рідких або Фігура 2 є графіком, який показує місцеве гелеподібних композицій остеогенний агент може утримання in vivo rhBMP-2 зі штифтів a-BSM із передчасно розчинитися рідинами організму ще застосуванням 125I-rhBMP-2 як мітки. до досягнення сприятливого для кісток ефекту. В цілому способи та композиції згідно з даним Даний винахід дозволяє уникнути ефекту розвевинаходом стосуються відновлення кісткової ткадення завдяки застосуванню твердого носія, який нини та супутнього збільшення кісткової маси, гусповільно розпадається in vivo, таким чином, забезтини кісток та міцності кісток. Тобто, предмет випечуючи уповільнене, тривале вивільнення активнаходу охоплює придатні для ін'єкцій тверді ного(их) агента(ів). Крім того, на відміну від рідких штифти та пасти, які включають остеогенний біабо в'язких композицій, які можуть мігрувати від лок, фосфат кальцію як носій і, необов'язково, домісця введення, тверді композиції згідно з даним мішки та активні агенти, такі як інгібітор резорбції винаходом затримуються і залишаються у місці, де кісток, а також способи одержання таких остеогенвимагається ріст кістки, для сприяння ростові кістних композицій та способи лікування з застосуванки. Вони також забезпечують більш точну ін'єкцію ням таких остеогенних композицій. Тверді штифти твердого штифта у ділянки низької кісткової маси. та паста, яка піддається затвердненню, на основі Зазвичай композиція має залишатись у потрібному фосфату кальцію згідно з даним винаходом є примісці протягом періоду від приблизно 5 днів до датними для внутрішньокісткового доставлення приблизно 2 місяців. Якщо композиція диспергуостеогенних білків. Завдяки застосуванню способів ється передчасно, то потрібний ефект сприяння та композицій згідно з даним винаходом, існує моростові кістки або не досягається, або сформована жливість зменшення тяжкості остеопорозу або кістка не має потрібної міцності. І нарешті, хоча частоти випадків остеопорозних пошкоджень, що остеогенну композицію згідно з цим варіантом втізрештою знижує кількість випадків переломів кіслення даного винаходу вводять у твердій формі, в ток. До інших випадків клінічного застосування 9 88275 10 оптимальному варіанті її формують як циліндричЦей етап здійснюють за умов, коли відбуваний штифт, і, таким чином, вона є придатною для ється практично рівномірне змішування. При зміін'єкції або імплантації в організм. Звичайно, якщо шуванні комбінують інгредієнти, і його застосовупотрібно, можуть бути застосовані й інші форми ють для регулювання ступеня реакції між штифтів, наприклад, шестикутну, квадратну або інгредієнтами. Хоча всі потрібні інгредієнти в оппівкруглу форми. Крім того, суттєво послаблюєтьтимальному варіанті містяться в сухій суміші, можся загальновідоме хірургічне ускладнення, пов'яна також додавати домішку або додатковий активзане з викликанням емболії під час процедури внуний агент безпосередньо перед започаткуванням трішньокісткової ін'єкції завдяки застосуванню змішування або перед завершенням змішування. твердих штифтів (на відміну від рідких або гелепоТака домішка або додатковий активний агент в дібних форм). Знижується можливість зміщення оптимальному варіанті перебуває в сухій формі; внутрішньокісткових фрагментів кісток, жиру або однак до пасти також може додаватися гідратоваемболії, викликаних ін'єкцією під тиском великого на форма домішки або додаткового активного агеоб'єму рідкого/гелеподібного носія, оскільки ввента. дений об'єм висококонцентрованого твердого На третьому етапі способу згідно з даним виштифта є значно меншим, ніж той, який би виманаходом пасту штампують для утворення компогався, якби подібна доза вводилась у рідкій або зиції у формі штифта. Штампування або формугелеподібній формі. Композицію вводять у місце, в вання здійснюють, застосовуючи будь-який із якому вимагається ріст кістки, у будь-який зручний багатьох відомих способів, таких як штампування, спосіб, включаючи введення за допомогою традиекструдування, пресування, свердління та/або ційної голки для підшкірних вливань або шприца. вирізання. В оптимальному варіанті втілення цього Ще один варіант втілення даного винаходу винаходу пасту помішують у шприц для підшкірних стосується способу одержання твердої композиції ін'єкцій і видавлюють через фігурну кінцеву насаду формі штифта для ін'єкційного доставлення оску. У цьому разі вставляють плунжер шприца і затеогенних білків. На першому етапі суху форму стосовують достатній тиск для видавлювання безостеогенного білка змішують з сухою формою макінечної довжини пасти на суху поверхню. Після теріалу, який містить фосфат кальцію, для одерцього її нарізають на відрізки, застосовуючи ріжужання сухої суміші. Іншими словами, спочатку зачий інструмент, такий як лезо, скальпель, ніж або стосовують порошкоподібні або сухі форми інший подібний засіб, для утворення придатних остеогенного білка та матеріалу, який містить фодля ін'єкцій композицій у формі штифта. Нарізання сфат кальцію, для утворення сухої суміші. Якщо також може відбуватися після етапу висушування, до композиції включають домішки та/або додаткові який описано нижче. В альтернативному варіанті активні агенти, ці матеріали також можуть застопасту поміщують у циліндричну форму, катетер, совуватись у сухій або порошкоподібній формі і проникну для повітря або газу трубу (наприклад, із включатися до сухої суміші. силастика або Teflon®/FEP), або будь-який інший На другому етапі вологовміст сухої суміші відпристрій екструзійного типу. новлюють шляхом додавання водного буфера для На кінцевому етапі композицію у формі штифутворення пасти. До придатних водних буферів, та, одержану на попередньому етапі, висушують крім інших, належать, фосфатно-буферний розсіл, або затверджують для утворення композиції у форозсіл, буфери на основі гліцину та їх комбінації. рмі штифта для ін'єкційного доставлення остеоПри застосуванні ВМР-2 як остеогенного білка генних білків згідно з даним винаходом (перший перевагу віддають застосуванню буфера на основі варіант втілення). Висушування здійснюють на гліцину, який має рівень рН приблизно 4,5; у ще повітрі або шляхом інкубації при підвищеній темкращому варіанті застосовують буфер на основі пературі, тобто, принаймні 37°С. Температуру вигліцину, який складається з 5 ммоль L-глутамінової сушування обмежують лише для запобігання розкислоти, 2,5% гліцину, 0,5% цукрози, 5 ммоль NaCl падові остеогенного білка, який відбувається в і 0,01% полісорбату 80. діапазоні температур приблизно від 55°С до 60°С. Співвідношення об'єму та маси (мл:г) водного Якщо висушування здійснюють у печі з температубуфера з сухою сумішшю становить від приблизно рою 37°С, то висушування триває приблизно при0,5:1 до приблизно 2:1. Однак нижня межа цього наймні одну годину, в оптимальному ж варіанті масового співвідношення обмежується лише з висушування здійснюють до наступного дня. Комогляду на те, що до сухої суміші має бути додана позиція у формі штифта в оптимальному варіанті достатня кількість рідини для того, щоб забезпечумає залишкову вологість, меншу за 10%. валися можливість утворення пасти, яка може буТретій варіант втілення даного винаходу стоти утворена шляхом ін'єкції за допомогою шприца сується пастоподібної композиції, яка піддається або якимось іншим способом. Крім того, верхня затвердненню, для ін'єкційного доставлення осмежа цього масового співвідношення обмежується теогенних білків, яка включає остеогенний білок та лише з огляду на те, що до сухої суміші не повиматеріал, який містить фосфат кальцію. Композинна додаватися надмірна кількість рідини, щоб ція згідно з цим третім варіантом втілення даного після наступного висушування не руйнувалася винаходу необов'язково може включати інші доміпотрібна геометрична форма, тобто, форма штишки (зв'язувальні речовини, наповнювачі) та/або фта; іншими словами, якщо застосовують надто активні агенти, такі як інгібітор резорбції кісток. багато рідини, то після висушування остеогенної Ця паста є придатною для місцевого внутрішсполуки форма штифта, утвореного на третьому ньокісткового доставлення і, таким чином, її ввоетапі цього способу, може бути порушена. дять шляхом ін'єкції безпосередньо у місце остеопорозу або остеопенії, після чого паста твердне до 11 88275 12 набуття твердої форми і ефективно викликає фоВМР-4, ВМР-5, ВМР-6 та ВМР-7, описані, наприрмування та/або підтримання кістки. Оскільки пасклад, у патенті США №5,108,922, 5,013,649, та твердне після ін'єкції у середовище з темпера5,116,738, 5,106,748, 5,187,076 та 5,141,905, ВМРтурою принаймні 37°С, тобто, в організм ссавця, 8, описаний у РСТ WO 91/18098, ВМР-9, описаний це дозволяє уникнути багатьох недоліків, пов'язау РСТ WO 93/00432, ВМР-10, описаний у РСТ WO них із застосуванням рідких або гелеподібних ком94/26893, ВМР-11, описаний у РСТ WO 94/26892, позицій. Так само, як і описана вище тверда приВМР-12 та BMP-13, описані у РСТ WO 95/16035, датна для ін'єкцій композиція у формі штифта, BMP-15, описаний у патенті США №5,635,372, і композиція у формі пасти, яка піддається затвердВМР-16, описаний у патенті США №6,331,612. До ненню, має профіль уповільненого вивільнення по інших білків TGF-B, які можуть бути корисними як відношенню до остеогенного білка. Термін придаактивні агенти у даному винаході, належать Vgr 2, тності для ін'єкцій пасти, яка піддається затвердJones et al., Моl. Endocrinol., vol.6, pp.1961 1968 ненню, збільшують шляхом заморожування пасти. (1992), та будь-які з факторів росту та диференціЧетвертий варіант втілення даного винаходу ації (GDF), включаючи описані у РСТ WO стосується способу одержання композиції у формі 94/15965, WO 94/15949, WO 95/01801, WO пасти для ін'єкційного доставлення остеогенних 95/01802, WO 94/21681, WO 94/15966, WO білків. Згідно з цим способом, суху форму матері95/10539, WO 96/01845, WO 96/02559, та інші. Таалу, який містить фосфат кальцію, змішують з вокож корисним у даному винаході може бути ВІР, дним буфером, який містить остеогенний білок, описаний у WO 94/01557, НР00269, описаний у JP для утворення пасти. Коли до композиції включа7 250688, і МР52, описаний у РСТ WO 93/16099. ють домішки та/або додаткові активні агенти, ці Описи всіх вищезазначених патентів, журнальні матеріали застосовують або у сухій формі для публікації та опубліковані міжнародні заявки вклюпопереднього змішування з сухою формою матечено авторами шляхом посилання. ріалу, який містить фосфат кальцію, або у гідратоВ оптимальному варіанті активний агент вклюваній формі для прямого змішування з водним чає принаймні один білок, вибраний з підкласу буфером та матеріалом, який містить фосфат білків, відомих під загальною назвою BMP, які букальцію. Змішування здійснюють в умовах, за яких ло описано як такі, що мають остеогенну активвідбувається практично рівномірне змішування. ність та інші типи активності, що стосуються росту При змішуванні комбінують інгредієнти, і його зата диференціації. До підгрупи білків BMP, яким стосовують для регулювання ступеня реакції між віддають перевагу при застосуванні згідно з даним інгредієнтами. винаходом, належать ВМР-2, ВМР-4, ВМР-5, ВМРДо придатних водних буферів, крім інших, на6, ВМР-7, ВМР-10, ВМР-12 та ВМР-13, у найкралежать, фосфатно-буферний розсіл, розсіл, буфещому варіанті - ВМР-2, послідовність якого описари на основі гліцину та їх комбінації. При застосуно у патенті США №5,013,649, розкриття якого ванні BMP-2 як остеогенного білка перевагу включено авторами шляхом посилання. віддають застосуванню буфера на основі гліцину, Активний агент одержують рекомбінантним який має рівень рН приблизно 4,5; у ще кращому способом або очищують із білкової композиції. варіанті застосовують буфер на основі гліцину, Активний агент, якщо TGF-b, такий як BMP, або який складається з 5 ммоль L-глутамінової кислоінший димерний білок, може бути гомодимерним ти, 2,5% гліцину, 0,5% цукрози, 5 ммоль NaCl і або може бути гетеродимерним з іншими BMP 0,01% полісорбату 80. Масове співвідношення (наприклад, гетеродимером, який складається з водного буфера з сухим фосфатом кальцію станоодного мономера ВМР-2 та ВМР-6) або з іншими вить від приблизно 0,5:1 до приблизно 2:1. представниками надродини TGF-b, такими як акВ альтернативному варіанті суху форму остеотивіни, інгібіни та TGF-b1 (наприклад, гетеродимегенного білка змішують з сухою формою матеріаром, який складається з одного мономера BMP та лу, який містить фосфат кальцію, для одержання відповідного представника надродини TGF-b). сухої суміші, і вологовміст сухої суміші після цього Приклади таких гетеродимерних білків описано, відновлюють шляхом додавання водного буфера наприклад, у патенті РСТ WO 93/09229, розкриття для утворення пасти. Ці етапи мають бути ідентиякого включено авторами шляхом посилання. Акчними першому та другому етапам вищезгаданого тивний агент може включати ДНК, що кодує BMP способу одержання твердої композиції у формі та клітини, перетворені або трансфіковані генами, штифта (другий варіант втілення), за винятком що кодують ВМР-білки. того, що масове співвідношення водного буфера з Активний агент також може включати додаткосухим фосфатом кальцію становить від приблизно ві агенти, такі як білки Hedgehog, Frazzled, Chordin, 0,5:1 до приблизно 2:1. Noggin, Cerberus та Follistatin. Загальний опис цих Деталі стосовно активного агента, носія, дородин білків представлено у публікаціях Sasai et мішок та інгібіторів резорбції кісток, придатних для al., Cell, vol.79, pp.779-790 (1994) (Chordin); PCT застосування згідно з даним винаходом, предстаWO 94/05800 (Noggin); і Fukui et al., Dev. Biol., влено нижче. vol.159, pp.131-139 (1993) (Follistatin). Білки Активний агент, присутній в остеогенних комHedgehog описано у PCT WO 96/16668, WO позиціях згідно з даним винаходом, в оптимально96/17924 та WO 95/18856. Родина білків Frazzled є му варіанті вибирають з групи білків, відомих як описаною відносно нещодавно родиною білків, які такі, що трансформують надродину білків фактора мають високу гомологію з позаклітинним доменом росту-бета (TGF-b). Ця родина включає активіни, зв'язування родини рецепторних білків, відомих як інгібіни та кісткові морфогенетичні білки (BMP). До Frizzled. Родину генів та білків Frizzled описано у цих BMP належать BMP-білки ВМР-2, ВМР-3, публікації Wang et al., J. Biol. Chem., vol.271, 13 88275 14 pp.4468-4476 (1996). Активний агент також може втілення матеріал, який містить фосфат кальцію, є включати інші розчинні рецептори, такі як зрізані твердим слабкокристалічним апатитним фосфарозчинні рецептори, описані у PCT WO 95/07962. том кальцію, який має співвідношення кальцію з Після ознайомлення з WO 95/07982 спеціалістові в фосфатом (Са/Р), порівнюване зі співвідношенням даній галузі стане зрозуміло, що зрізані розчинні у природних мінералах кісток, у ще кращому варірецептори можна одержати для багатьох інших анті - співвідношення кальцію з фосфатом, менше рецепторних білків. Вони також охоплюються обза приблизно 1:1,5, у найкращому варіанті - присягом даного винаходу. Вищезгадані публікації близно 1:1,4. включено авторами шляхом посилання. Придатні РСА-матеріали визначають шляхом Кількістю активного агента, який застосовують комбінування прекурсорів РСА, гідратування обзгідно з винаходом, є кількість, ефективна для меженою кількістю води (для утворення пасти або стимулювання підвищеної остеогенної активності замазки), штампування штифтів циліндричної фоприсутніх або проникаючих прогеніторів (клітинрми та забезпечення затверднення сформованого попередників остеобластів) або інших клітин (далі матеріалу для утворення РСА-матеріалу. Потрібні -"ефективна кількість"), і вона залежить від розміру прекурсори є здатними до затверднення у вологота характеру порушення, яке піддають лікуванню, му середовищі або при температурі тіла або наа також складу застосовуваного носія на основі ближеній до неї температурі менше, ніж за 5 гофосфату кальцію. Зазвичай кількість остеогенного дин, в оптимальному варіанті - за 10-30 хвилин. білка, присутнього у твердій остеогенній композиЗгідно з даним винаходом, фосфат кальцію як ції у формі штифта згідно з даним винаходом, станосій може включати будь-який замісний матеріал новить від приблизно 1% до приблизно 90%, у ще для кісток, який містить будь-яку з вищезгаданих кращому варіанті - від приблизно 15% до приблизформ фосфату кальцію як первинний компонент, но 40% від маси остеогенної композиції. Взагалі, тобто, принаймні 90% за масою складає кальцій кількість остеогенного білка, присутнього в остеота/або його фосфат. Замісний матеріал для кісток генній композиції згідно з даним винаходом у фоможе включати лише одну з вищезгаданих форм рмі пасти, яка піддається затвердненню, становить фосфату кальцію, з додатковими компонентами від приблизно 0,01% до приблизно 2%, у ще краабо без них; замісник кісток може включати комбіщому варіанті - від приблизно 0,03% до приблизно націю вищезгаданих форм фосфату кальцію, з 1% від маси остеогенної композиції. додатковими компонентами або без них. Крім того, Згідно з усіма варіантами втілення даного визастосовують одну або кілька з вищезазначених находу, матеріал, який містить фосфат кальцію, форм фосфату кальцію для одержання матеріалу, застосовують як носій. Вжитий авторами вираз який містить фосфат кальцію, придатного для за"матеріал, який містить фосфат кальцію" означає стосування згідно з даним винаходом. Способи будь-який синтетичний замісний матеріал для кісодержання таких матеріалів є загальновідомими ток, який включає фосфат кальцію як первинний серед спеціалістів. Однак прийнятним може бути компонент, тобто, принаймні 90% за масою склабудь-який спосіб, який забезпечує одержання судає кальцій та/або його фосфат. Матеріал, який хого, тобто, порошкоподібного матеріалу, який містить фосфат кальцію згідно з даним винаходом, містить фосфат кальцію. може бути будь-яким відомим спеціалістам біосуВжитий авторами термін "аморфний" означає місним матеріалом, який містить фосфат кальцію. матеріал, який має здебільшого аморфний харакПридатні матеріали, які містять фосфат кальцію, тер. Здебільшого аморфний характер означає біодержують будь-яким з різних способів і з застосульше, ніж 75% аморфного вмісту, в оптимальному ванням будь-яких вихідних компонентів, або моваріанті - більше, ніж 90% аморфного вмісту, і хажуть бути придбані через торгову мережу. рактеризується широкою, без особливостей, дифУ деяких оптимальних варіантах втілення даракційною картиною рентгенівських променів. ного винаходу матеріал, який містить фосфат Вжиті авторами терміни "слабкокристалічний кальцію, є присутнім у кількості від приблизно 10% апатитний фосфат кальцію," "РСА-фосфат кальдо приблизно 99%, у ще кращому варіанті - від цію" та "РСА-матеріал" описують синтетичний приблизно 40% до приблизно 60% від маси тверслабкокристалічний апатитний фосфат кальцію. дої остеогенної композиції у формі штифта згідно з Слабкокристалічний апатитний (РСА) матеріал не даним винаходом. У деяких інших оптимальних обов'язково обмежується однією фазою фосфату варіантах втілення даного винаходу матеріал, який кальцію, якщо він має характерну дифракцію рентмістить фосфат кальцію, є присутнім у кількості від генівських променів (XRD) та характер інфрачерприблизно 30% до приблизно 70%, у ще кращому воної спектрометрії з перетворенням Фур'є (FTIR). варіанті - від приблизно 45% до приблизно 55% від РСА-фосфат кальцію має практично такий самий маси остеогенної композиції у формі пасти, яка XRD-спектр, що й кістка. XRD-спектр в цілому хапіддається затвердненню, згідно з даним винахорактеризується лише двома широкими піками у дом. В оптимальному варіанті матеріал, який місділянці 20-35Е, з один з центром 26Е, а інший з тить фосфат кальцію або носій, застосовують у центром 32Е. FTIR-спектр характеризується пікасухій, тобто, порошкоподібній формі. ми 563см-1, 1034см-1, 1638см-1 та 3432см-1 (±2см-1); До форм фосфату кальцію, придатних для загострі виступи спостерігають на 603см-1 та 875см-1, стосування згідно з цим винаходом, крім інших, з дублетами, які мають максимум 1422см-1 та належать, аморфний апатитний фосфат кальцію 1457см-1. РСА-матеріали, застосуванню яких від(АСР), слабкокристалічний апатитний фосфат дають перевагу згідно з даним винаходом, описакальцію (РСА), гідроксіапатит (НА), трифосфат но у патентах США №№5,650,176, 5,683,461 та кальцію та фтороапатит. В оптимальному варіанті 6,214,368, кожен з яких включено авторами шля 15 88275 16 хом посилання. Прийнятні матеріали також описаодержання придатної для ін'єкцій композиції згідно но у кількох споріднених заявках під назвами "Deз даним винаходом. У деяких оптимальних варіанlivery Vehicle", "Conversion of Amorphous Calcium тах втілення даного винаходу домішка(и) є присутPhosphate to Form a Novel Bioceramic", "Orthopedic ньою у кількості від приблизно 1% до приблизно and Dental Ceramic Implants" та "Bioactive Ceramic 90%, у ще кращому варіанті - від приблизно 20% Composites," кожну з яких було подано 16 жовтня до приблизно 40% від маси твердої остеогенної 1997p. і передано ЕТЕХ Corporation (Cambridge, композиції у формі штифта. У деяких оптимальних MA), які включено авторами шляхом посилання. З варіантах втілення даного винаходу домішка(и) є огляду на широту розкриття кожного з вищезазнаприсутньою у кількості від приблизно 1% до причених патентних документів, одержання відповідблизно 90%, у ще кращому варіанті - від приблизних РСА-матеріалів авторами цього винаходу дено 10% до приблизно 20% від маси остеогенної тально не описується. Достатніми є стислі композиції у формі пасти, яка піддається затвердхарактеристики РСА. РСА-матеріал характеризуненню. ється саморозсмоктуваністю та мінімальною крисПридатні для ін'єкцій остеогенні композиції згіталічністю. Його кристалічний характер є практичдно з даним винаходом також можуть включати но таким самим, як у природної кістки. РСАдодатковий активний агент або додаткові активні матеріал також є біосумісним і не є шкідливим для агенти. Такі додаткові активні агенти змішують, в організму-хазяїна. оптимальному варіанті - у сухій формі, хоча гідраКристалічний гідроксіапатит (НА) описано, натовані форми також є придатними для застосуприклад, у патентах США №№33,221 та 33,161, які вання, з активним агентом, носієм та водною рідивключено авторами шляхом посилання. У цих паною для одержання придатної для ін'єкцій тентах описано одержання композицій для реміостеогенної композиції згідно з даним винаходом. нералізації на основі фосфату кальцію та дрібноВ альтернативному варіанті такі додаткові активні кристалічного некерамічного поступово агенти вводять разом з остеогенними композиціярозсмоктуваного матеріалу гідроксіапатитного ми згідно з даним винаходом, або послідовно, або носія на основі такої самої кальцієвофосфатної одночасно (далі - "схема спільного введення"). композиції. Подібну кальцієвофосфатну систему, Додаткові активні агенти згідно з даним винаходом яка складається з тетрафосфату кальцію (ТТСР) застосовують для досягнення додаткових потрібта монофосфату кальцію (МСР) або його моногідних ефектів або, у деяких випадках, застосовують ратної форми (МСРМ), описано у патентах США для протидії можливим небажаним ефектам, та№№5,053,212 та 5,129,905, які включено авторами ким як інфікування, запалення та тимчасова резошляхом посилання. Додаткові кристалічні НАрбція. матеріали (під загальною назвою даліт) є описаНаприклад, хоча й багато відомо про остеоними у патенті США №5,962,028, розкриття якого генний потенціал TGF-b-білків, останні повідомвключено авторами шляхом посилання. лення показують, що місцеве введення певних В остеогенних композиціях згідно з даним виостеоіндуктивних агентів, таких як ВМР-2, стимунаходом також застосовують домішки. Багато талює тимчасову остеокластну активність (місцеві ких зв'язувальних речовин, які підвищують когезійділянки резорбції кісток) у місці введення. Цю реану здатність, та наповнювачів, які стабілізують кцію, яка іноді передує формуванню нових кісток, і/або модулюють вивільнення активних інгредієнвикликаному BMP, називають "феноменом тимчатів, є загальновідомими серед спеціалістів у галузі сової резорбції". Агенти, про які відомо, що вони рецептування. До придатних домішок, крім інших, інгібують резорбцію кісток, таким чином, можуть належать, фармацевтично прийнятні солі, полісавідігравати важливу роль у затримання або знихариди, пептиди, білки, амінокислоти, синтетичні женні початкової резорбції кісток, пов'язаної з місполімери, природні полімери та/або поверхневоцевим введенням BMP, без інгібування наступного активні речовини. До корисних полімерів налеформування кістки. жать, наприклад, ті, які описано у патенті США Таким чином, в оптимальних варіантах втілен№5,171,579, повний опис якого включено автораня даного винаходу інгібітор резорбції кісток зами шляхом посилання. До оптимальних домішок стосовують як додатковий активний агент, присутналежать целюлозні матеріали, такі як карбоксиній у придатній для ін'єкцій остеогенній композиції, метилцелюлоза (CMC), гідроксипропілметилцелюабо вводять разом з придатною для ін'єкцій остеолоза (НРМС) та метилцелюлоза (МС), синтетичні генною композицією для запобігання або мінімізаполімери, такі як полілактиди та поліетиленгліколі, ції початкової резорбції кісток, пов'язаної з внутрінаприклад, полілактид/поліетиленгліколь, полівінішньокістковим доставленням активного агента, лпіролідон (PVP), поліетиленгліколь (PEG), поліотакого як BMP. Вжитий авторам термін "інгібуванксіетиленоксид, карбоксивініловий полімер та поня резорбції кісток" стосується запобігання втраті лівініловий спирт (PVA), і декстрансульфат та його кісткової маси, зокрема, інгібування видалення комбінації. До інших корисних домішок, крім інших, існуючої кістки через пряму або непряму зміну належать, альгінат натрію, хітозан, колаген, желаутворення або активності остеокласта. Таким читин, гіалуронан та різні пептиди, білки та амінокином, вжитий авторами термін "інгібітор резорбції слоти. Застосування домішок, які мають шипучий кісток" стосується агентів, які запобігають або інгіефект, у даному винаході не передбачається. бують втрату кісткової маси шляхом прямої або В оптимальному варіанті втілення даного винепрямої зміни утворення або активності остеонаходу домішку застосовують у сухій або порошкласта. коподібній формі, яку змішують з активним(и) агеУ деяких оптимальних варіантах втілення інгінтом(ами), носієм та водною рідиною для бітором резорбції кісток є дифосфонат. Вжитий 17 88275 18 авторами термін "бісфосфонат" стосується відпобісфосфонати погано абсорбуються у шлункововідних бісфосфонових кислот та солей і різних кишковому тракті при пероральному прийманні. кристалічних та аморфних форм бісфосфонату. З Для подолання цієї низької біодоступності застоклінічної точки зору бісфосфонатна терапія виявисовують внутрішньовенне введення; однак цей лася такою, що суттєво знижує показники кістковоспосіб вважають дорогим і незручним через триго ремоделювання, збільшує густину мінералів у валість та частоту дозування. Таким чином, даний кістках і у остеопенічних жінок знижує ризик перевинахід, допомагає подолати цей недолік через ломів стегна та хребта (див., наприклад, публікавведення бісфосфонату у придатній для ін'єкцій цію Н. Fleiscn, Bisphosphonates in Bone Disease, остеогенній композиції згідно з даним винаходом from the Laboratory to the Patient, 3rd ed., Parthenon та її місцеве доставлення безпосередньо до місця Publishing (1997), яку включено авторами шляхом потрібної дії. посилання). Наведений вище опис стосовно введення інгіДо дифосфонатів, придатних для застосуванбітора резорбції кісток в цілому стосується ввеня згідно з даним винаходом, крім інших, наледення будь-якого додаткового активного агента. жать, алендронат, цимадронат, клодронат, ЕВ До інших придатних додаткових активних агентів, 1053, етидронати, ібандронат, неридронат, олпадкрім інших, належать, інші остеогенні білки, антиронат, памідронат, ризедронат, тилудронат, YH біотики, протизапальні агенти, фактори росту, пеп529, золедронат та їх фармацевтично прийнятні тиди, білки, цитокіни, олігонуклеотиди, антисмиссолі, естери, кислоти та їх суміші. Корисною кількілові олігонуклеотиди, ДНК та полімери. Ці сполуки стю дифосфонату, а отже, кількістю будь-якого в оптимальному варіанті додають у сухій формі, інгібітора резорбції кісток є кількість, ефективна шліхом їх змішування для утворення пасти згідно для запобігання або інгібування тимчасової втрати зі способами одержання за даним винаходом. кісткової маси, яка буває пов'язаною з місцевим Згідно з даним винаходом, пропонуються сповведенням остеогенного білка, такого як BMP (далі соби та композиції для лікування пацієнтів, у яких - "ефективна кількість"), шляхом прямої або неспостерігаються дефекти кісток. Вжитий авторами прямої зміни утворення або активності остеокластермін "дефект кісток" включає остеопорозну кістта. Точна необхідна доза залежить від розміру та ку, остеопенічну кістку, перелом кістки, дефект характеру дефекту кістки, яку піддають лікуванню, хряща або будь-який інший пов'язаний з кісткою а також кількості остеогенного агента, який ввоабо хрящем стан, який може бути поліпшений або дять. Як правило, кількість дифосфонату, який виправлений завдяки стимулюванню росту кістки доставляють, в оптимальному варіанті становить або хряща. Таким чином, п'ятий варіант втілення від приблизно 0,1 до приблизно 3000мг, у ще краданого винаходу стосується способу лікування щому варіанті - від приблизно 10 до приблизно ссавця, який має дефект кістки, шляхом введення 1000мг, у найкращому варіанті - від приблизно 10 у місце дефекту кістки ефективної кількості придадо приблизно 500мг на кубічний сантиметр матетної для ін'єкцій композиції у формі штифта або ріалу. пасти згідно з даним винаходом. Коли застосовують схему спільного введення Шостий варіант втілення даного винаходу стозгідно з даним винаходом, інгібітор резорбції кісток сується способу лікування ссавця, який має дезазвичай доставляють у відповідному носії. Носій фект кістки, шляхом введення у місце дефекту може бути будь-яким фармацевтично прийнятним кістки ефективної кількості придатної для ін'єкцій носієм, одним з тих, які є загальновідомими серед композиції у формі штифта або пасти згідно з даспеціалістів і загальнодоступними [див., наприним винаходом і шляхом введення ефективної клад, публікацію Martin, E.W., Remington's Pharmaкількості інгібітора резорбції кісток. Інгібітор резорceutical Sciences (Mack Pub. Co., current edition), бції кісток також вводять у місце дефекту кістки, яку включено авторами шляхом посилання]. Носії, але він може вводитись якимось іншим шляхом, яким віддають перевагу, формують у тверді штифтобто, парентерально, шляхом хірургічної імпланти або пасти, як зазначено в цьому описі. тації, перорально, внутрішньовенно. Крім того, Згідно зі схемою спільного введення, інгібітор введення інгібітора резорбції кісток може відбуварезорбції кісток вводять послідовно, до, після або тися до, одночасно або після введення придатної одночасно з придатними для ін'єкцій композиціями для ін'єкцій композиції у формі штифта або пасти у формі твердого штифта або пасти згідно з даним згідно з даним винаходом. винаходом. Крім того, інгібітор резорбції кісток Зазвичай способи та композиції згідно з даним може вводитись місцево (внутрішньокістково), але винаходом забезпечуються для лікування пацієнможливе також інше парентеральне введення, тів, які виявляють ознаки остеопорозних або оснаприклад, внутрішньом'язове або підшкірне або теопенічних станів, включаючи остеопорозні попероральне приймання або внутрішньовенна ін'єкшкодження кісток. Таких пацієнтів виявляють за ція для системного доставлення. В оптимальному допомогою процедур, які є загальновідомими севаріанті інгібітор резорбції кісток, наприклад, бісред спеціалістів у даній галузі. Такі процедури дафосфонат, доставляють системно, тобто, перорають клінічному лікареві інформацію щодо місця та льно або внутрішньовенно, до або одночасно з тяжкості остеопорозних або остеопенічних пошковведенням придатної для ін'єкцій композиції у фоджень кісток. Крім визначення місця (місць) пормі твердого штифта або пасти згідно з даним шкодження, які мають бути піддані лікуванню, клівинаходом. Крім того, інгібітор резорбції кісток нічний лікар може використовувати цю інформацію імплантують у місце, яке піддають лікуванню, для вибору належного режиму введення та дози шляхом хірургічної імплантації. Однак слід зазнаостеоіндуктивного агента для пацієнта. До діагносчити, що, незважаючи на терапевтичні переваги, тичних процедур, які застосовують, належать ви 19 88275 20 мірювання кісткової маси/густини з застосуванням лише голку для підшкірних вливань. Композицію у двоенергетичної рентгенівської абсорбціометри формі твердого штифта після цього вводять у кін(DEXA), Kilgus, et al., J. Bone & Joint Surgery, vol.75 цеву насадку голки для підшкірних вливань. Після B, pp.279-287 (1992); Markel, et al., Acta Orthop. заправлення композиції у голку вставляють другий Scand., vol.61, pp.467 498 (1990); та кількісної комдротяний провідник катетера, який застосовують п'ютерної томографії (QCT), Laval Jeantet, et al., J. для просування твердої композиції у кінець голки. Comput. Assist. Tomogr., vol.17, pp.915-921 (1993); Голку після цього виймають, залишаючи дротяний Markel, Calcif. Tissue Int., vol.49, pp.427-432 (1991); провідник катетера для зачеплення композиції у одиничної фотонної абсорбціометри, Markel, et al. потрібному місці кістки. І нарешті, дротяний провіCalcif. Tissue Int., vol.48, pp.392-399 (1991); швиддник катетера виймають, залишаючи на місці твекості проходження ультразвуку (UTV); Heaney, et рду композицію. В іншому варіанті втілення компоal., JAMA, vol.261, pp.2986-2990 (1989); Langton, et зицію у формі твердого штифта згідно з al., Clin. Phys. Physiol. Meas., vol.11, pp.243-249 винаходом попередньо розміщують у корпусі гол(1990); і радіографічної оцінки, Gluer, et al., J. Bone ки. Після поміщення у потрібне анатомічне місце Min. Res., vol.9, pp.671-677 (1994). До інших спосопри вийманні пристрою у корпус голки просувають бів виявлення пацієнтів з підвищеним ризиком плунжер шприца, залишаючи композицію у формі перелому кісток належать визначення пов'язаних з твердого штифта у потрібному місці. віком чинників, таких як уважність, а також попеКомпозиції, які є предметом винаходу, дозворедня історія пов'язаних з остеопорозом перелоляють доставляти терапевтично ефективну кільмів. Porter, et al., BMJ, vol.301, pp.638-641 (1990): кість остеогенного білка до місця пошкодження, в Hui, et al., J. Clin. Invest., vol.81, pp.1804-1809 якому вимагається формування хряща та/або кіст(1988). Вищенаведені публікації включено автораки. Композиції застосовують як заміну для аутоломи шляхом посилання. гічного кісткового трансплантата при нових та неКонкретні режими дозування визначають за зрощених переломах, спінальній хірургії та відповідними клінічними показаннями, а також за виправленні дефектів кісток у галузі ортопедії, при різними змінними показниками пацієнта (напривідновленні черепних / щелепно-лицьових кісток, клад, масою, віком, статтю) та клінічними проявадля відновлення кісток при остеомієліті і в галузі ми (наприклад, ступенем пошкодження, місцем стоматології для нарощування альвеолярного ураження і т.ін.). гребеня та усунення періодонтальних дефектів і Придатні для ін'єкцій остеогенні композиції згізаглиблень після видалення зубів. дно з даним винаходом вводять будь-яким клінічПредставлені нижче приклади пояснюють дано прийнятним способом ін'єкції. Багато шприців ний винахід і жодним чином не обмежують його. серійного виробництва є придатними для застосуВинахід передбачає зміни, варіанти та незначні вання згідно з даним винаходом з метою введення удосконалення, які не виходять за межі його обсякомпозицій згідно з даним винаходом. До таких гу. шприців, крім інших, належить шприц Calasept® Приклади (JS Dental Manufacturing, Ridgefield CT); аспіраційУсі матеріали, застосовані у цих прикладах, ний шприц Henke-Ject® та стоматологічні шпривідповідають фармацевтичним вимогам. Матеріаці/голки Hypo® (Smith & Nephew MPL, Franklin лом, який містить фосфат кальцію, був замісний Park, IL); голки для внутрішньокісткових ін'єкцій від матеріал для кісток серійного виробництва (далі MPL, Inc., Chicago IL; та шприці Luer-Lok® (Becton "a-BSM"), який реалізується під торговою назвою Dickinson, Franklin Lakes, NJ). Будь-який шприц, CEREDEX™ корпорацією Etex Corporation, 38 який є придатним для вміщення та доставлення Sydney Street, Cambridge, MA 02139, і є детально пасти або придатного для ін'єкцій штифта і/або описаним у патентах США №№5,683,461, дозволяють здійснювати екструзію з обтюратором, 6,117,456 та 6,214,368 і РСТ WO 98/16209. Остеоє прийнятними для застосування. генним білком, який застосовували як активний В одному варіанті втілення винаходу композиагент, був рекомбінантний людський кістковий ції у формі твердого штифта доставляють внутріморфогенетичний білок-2 (rhBMP-2). Способи шньокістково, застосовуючи голку для підшкірних одержання та характеристики rhBMP-2 є загальновливань відповідного розміру та типу, крізьшкірно відомими. Wang, et al., Proc. Nat'l Acad. Sci. U.S.A., або хірургічно поміщену у вибране анатомічне vol.87, pp.2220-2224 (1990). місце. Крізьшкірне поміщення голки для підшкірних Приклад 1 - Рецептування вливань здійснюють, застосовуючи ручну пальпа[66] Одержували різні придатні для ін'єкцій цію відомих анатомічних орієнтирів, з застосувантверді штифти з (А-Е) a-BSM, rhBMP-2 та однієї зі ням або без застосування рентгеноскопії для візусполук, до яких належать карбоксиметилцелюлоза алізації поміщення. Рентгеноскопію також (CMC), полівінілпіролідон (PVP) та декстрансульзастосовують у зв'язку з хірургічною імплантацією фат. Сухі порошки кожного компонента комбінуваперед і/або одночасно з поміщенням голки для ли у стерильній колбі для змішування і їх вологовпідшкірних вливань. міст відновлювали до стану густої замазки шляхом В оптимальному варіанті втілення у потрібне додавання водного буфера на основі гліцину, який анатомічне місце спочатку крізьшкірно вводять має рівень рН приблизно 4,5 і містить 5 ммоль Lдротяний провідник катетера (також відомий як "kглутамінової кислоти, 2,5% гліцину, 0,5% цукрози, wire"), який служить провідником для голки для 5 ммоль NaCl та 0,01% полісорбату 80, у зазначепідшкірних вливань. Голка для підшкірних вливань ному співвідношенні рідини (мл) та порошку (г) вставляють над дротяним провідником катетера, (р/п) і місили протягом 1 хвилини для утворення який після цього виймають, залишаючи на місці пасти. Кількість кожного інгредієнта, а також конк 21 88275 ретне співвідношення р/п були такими, як зазначено нижче у Таблиці 1. 22 Таблиця 1 Штифт А В С 68 56 45 D 45 Е 45 RHBMP-2 (мас. %) Співвідношення р/п 15 15 15 a-BSM (мас. %) 1,0 1,2 1,5 15 0,6 15 0,6 CMC (мас. %) 17 29 40 PVP (мас. %) 40 Декстрансульфат (мас. %) 40 Кожну пасту заправляли у шприц і екструдували для формування циліндричних штифтів, які мають діаметр приблизно 1мм та довжину приблизно 5см. Ці 5-сантиметрові штифти після цього нарізали на потрібну довжину для нижчезазначених випробувань. Після штампування штифти піддавали затвердненню до твердої маси у модельованих під in vivo умовах, тобто, тримали в інкубаторі при 37° до наступного дня. Процес затверднення міг бути затриманий на кілька годин через зберігання штифтів при більш холодній температурі, тобто, приблизно 4°С Теоретична доза rhBMP-2 у кожному зі штифтів А-Е становила 150 мікрограмів rhBMP-2 на міліграм штифта. Усі штифти були гладенькими, густими, здатними до когезії, неламкими і придатними для ін'єкцій за допомогою голки 16-го розміру. Приклад 2 - Характеризація in vitro Спостерігали зв'язок між вмістом домішки та утворенням частинок. Після занурення на 14 днів у водний буфер на основі гліцину, описаний у Прикладі 1, штифти, які містили більш високий відсоток домішки (40% CMC, 40% PVP або 40% декстрансульфату, тобто, штифти С-Е, відповідно) диспергувалися на дрібніші частинки швидше, тобто, протягом 1 дня, ніж ті, які мали середній (29% CMC, тобто, штифт В) та низький (17% CMC, тобто, штифт А) вміст домішки. Штифти, які мали низький вміст домішки (17% CMC, тобто, штифт А) зберігали штифтоподібну структуру значно довше, тобто, від кількох днів до кількох тижнів, порівняно зі штифтами з вищим вмістом CMC. Крім того, динаміку in vitro вивільнення rhBMP2 зі штифтів a-BSM, які містили 17% (штифт А), 29% (штифт В) або 40% (штифт С) CMC, спостерігали, застосовуючи 1251-rhВМР-2 як мітку. Як і при загальних спостереженнях, штифти, які містили вищий відсоток CMC, вивільнювали rhВМР-2 швидше, ніж ті, які містили нижчий відсоток CMC, як показано на Фігурі 1. Приклад 3 - Дослідження біосумісності та ефективності у щурів Придатні для ін'єкцій композиції у формі штифтів на основі фосфату кальцію (одержані, як описано у Прикладі 1) оцінювали на біосумісність та ефективність, внутрішньокісткову та ектопічну, на моделі щура. Внутрішньокісткові дефекти хірургічно створювали у дистальному відділі стегна шістьох самців CD щурів. Щурів розділяли на дві групи (А та В) по три особини. В одну кінцівку кожного щура вводили 2-міліметровий відрізок випробуваного штифта (фосфат кальцію/rhВМР-2/наповнювач), а у контралатеральну кінцівку вводили 2-міліметровий контрольного штифта (фосфат кальцію/наповнювач). Щури з Групи А отримували штифт А (68/17/15 (маса/маса) % ACP/CMC/rhBMP-2) з Прикладу 1 як випробуваний штифт, а щури з Групи В отримували штифт В (56/29/15 (маса/маса) % ACP/CMC/rhBMP-2) з Прикладу 1 як випробуваний штифт. Крім того, один 10-міліметровий штифт вживляли підшкірно збоку від середньої лінії вентральної ділянки грудної клітки, причому в один бік вводили випробуваний штифт, а в інший бік вводили контрольний штифт. Потім щури з Групи А знову отримували штифт А (68/17/15 (маса/маса) % ACP/CMC/rhBMP-2) з Прикладу 1 як випробуваний штифт, тоді як щури з Групи В отримували штифт В (56/29/15 (маса/маса) % ACP/CMC/rhBMP-2) з Прикладу 1 як випробуваний штифт. Тварин умертвляли через 2 тижні для оцінки результатів, яка складалася з рентгенографії за допомогою апарата Faxitron та гістоморфометрії. Рентгенограми та гістологія 2-тижневих експлантів дистального відділу стегна показували загальне збільшення утворення кісткового калюсу в боці, в який вводили rhBMP-2, порівняно з плацебо. Зокрема, штифти з вищим вмістом CMC (В) утворювали кісткові калюси від середніх до великих порівняно зі штифтами з нижчим вмістом CMC (А), які утворювали калюси від малого до середнього розмірів. Рентгенограми та гістологія підшкірних імплантатів також вказували на формування кістки у боці, в який вводили rhВМР-2, порівняно з плацебо. Зокрема, штифти з вищим вмістом CMC (В) викликали більш стійку реакцію ектопічної кістки порівняно зі штифтами з нижчим вмістом CMC (А). Добру біосумісність спостерігали в усіх групах без жодних запальних реакцій на імплантати. Приклад 4 - Дослідження внутрішньокісткового місцевого біорозподілу у кроля Штифти A-D з Прикладу 1 вводили шляхом крізьшкірної ін'єкції у внутрішньокістковий простір дистального відділу стегна кроля (n=4 місця на групу), застосовуючи катетер 14-го розміру з голкою 16-го розміру). Зокрема, застосовували 10міліметрові штифти A-D, які містили приблизно 23 88275 24 мкКі 1251-rhBMP-2. Кількість радіоактивності у 1мг на 1мл і 4,5мг на 1мл пасти, яка піддаєтьсинтетичних штифтах вимірювали перед ін'єкцією, ся затвердненню, з Прикладу 5 видобували зі стезастосовуючи дозкалібратор Capintec. Місцеве рильних колю, застосовуючи 3мл шприц, оснащеутримання rhBMP-2 спостерігали протягом 4 тижний голкою 18-го розміру, а потім вводили шляхом нів, застосовуючи гамма-сцинтиграфію. Дані місін'єкції під рентгеноскопічним контролем у різні цевого in-vivo біорозподілу вказували на уповільвнутрішньокісткові місця мавп cynomologous. Міснене вивільнення rhBMP-2 зі штифтів і на те, що цями введення були дистальний відділ стегна, штифти, які містять вищий відсоток домішки, випроксимальний відділ стегна, дистальний відділ являли швидше in vivo вивільнення, ніж штифти з променевої кістки, проксимальний відділ великої нижчим відсотком домішки, як показано на Фігурі 2. гомілкової кістки. Через 1 місяць спостерігали знаПриклад 5 - Рецептування чну нову кістку у місцях, у які робили ін'єкцію Пасти, що піддаються затвердненню, які місrhBMP-2. тили або 1мг rhBMP-2 на 1мл пасти, або 4,5мг Хоча винахід було описано з посиланням на rhBMP-2 на й мл пасти, рецептували шляхом дооптимальні варіанти втілення та конкретні прикладавання 2мл відповідним чином концентрованих ди, спеціалістам у даній галузі на основі звичайних розчинів rhBMP-2 у водному буфері на основі гліекспериментів стане зрозумілою можливість різних змін та модифікацій без відхилення від сутності та цину з Прикладу 1 до 2,5г a-BSM. Суміші місили у обсягу винаходу. Таким чином, винахід слід тлустерильних колбах протягом 1 хвилини для утвомачити як такий, що не обмежується представлерення пасти, яка піддається затвердненню. ним вище детальним описом, а визначається пунПриклад 6 - Мавпи cynomologous - внутрішньоктами формули винаходу та їх еквівалентами. кісткова ін'єкція пасти 25 Комп’ютерна верстка В. Мацело 88275 Підписне 26 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition comprising an osteogenic protein and a calcium phosphate in the form of a solid rod usable for intraosseous injection, process for the preparation and use thereof
Автори англійськоюLi Rebekka, Siherman Hovard, Kim H'yun
Назва патенту російськоюКомпозиция, которая включает остеогенный белок и фосфат кальция, которая имеет форму твердого штифта, пригодного для внутрикостной инъекции, способ ее получения и применения
Автори російськоюЛи Ребекка, Сигерман Говард, Ким Хьюн
МПК / Мітки
МПК: A61K 38/02, A61P 19/08, A61K 33/06
Мітки: твердого, включає, кальцію, штифта, спосіб, яка, ін'єкції, білок, внутрішньокісткової, остеогенний, придатного, форму, застосування, одержання, фосфат, композиція, має
Код посилання
<a href="https://ua.patents.su/13-88275-kompoziciya-shho-vklyuchaeh-osteogennijj-bilok-ta-fosfat-kalciyu-yaka-maeh-formu-tverdogo-shtifta-pridatnogo-dlya-vnutrishnokistkovo-inehkci-sposib-oderzhannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Композиція, що включає остеогенний білок та фосфат кальцію, яка має форму твердого штифта, придатного для внутрішньокісткової ін’єкції, спосіб її одержання та застосування</a>
Попередній патент: Спосіб обробки насиченої залізом відпрацьованої сірчаної кислоти або насичених залізом сірчанокислих матеріалів
Наступний патент: Кувальна машина з роликами між супортом та повзуном вузла пуансона
Випадковий патент: Спосіб електронно-променевого оплавлення поверхні циліндричного зливка великого діаметра