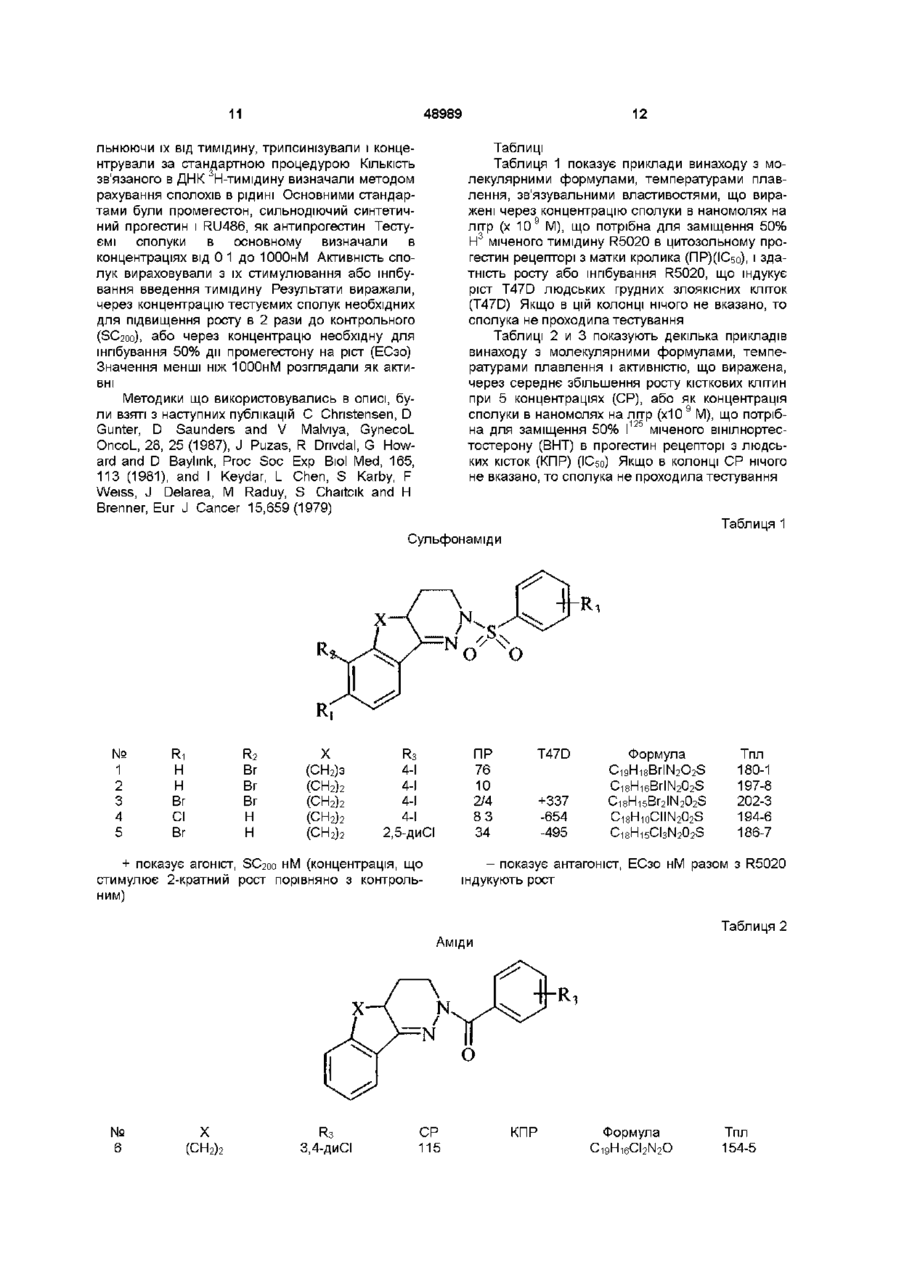
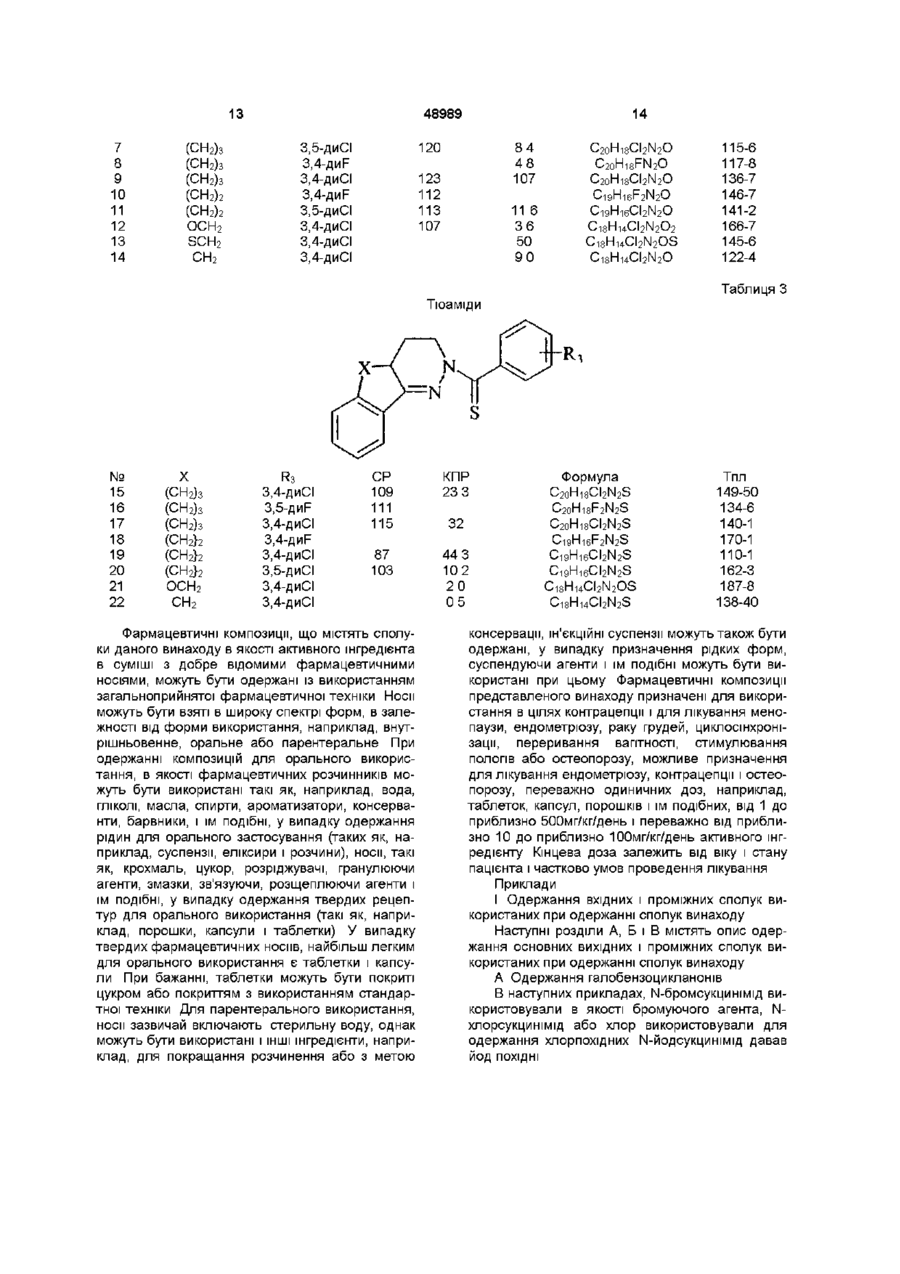
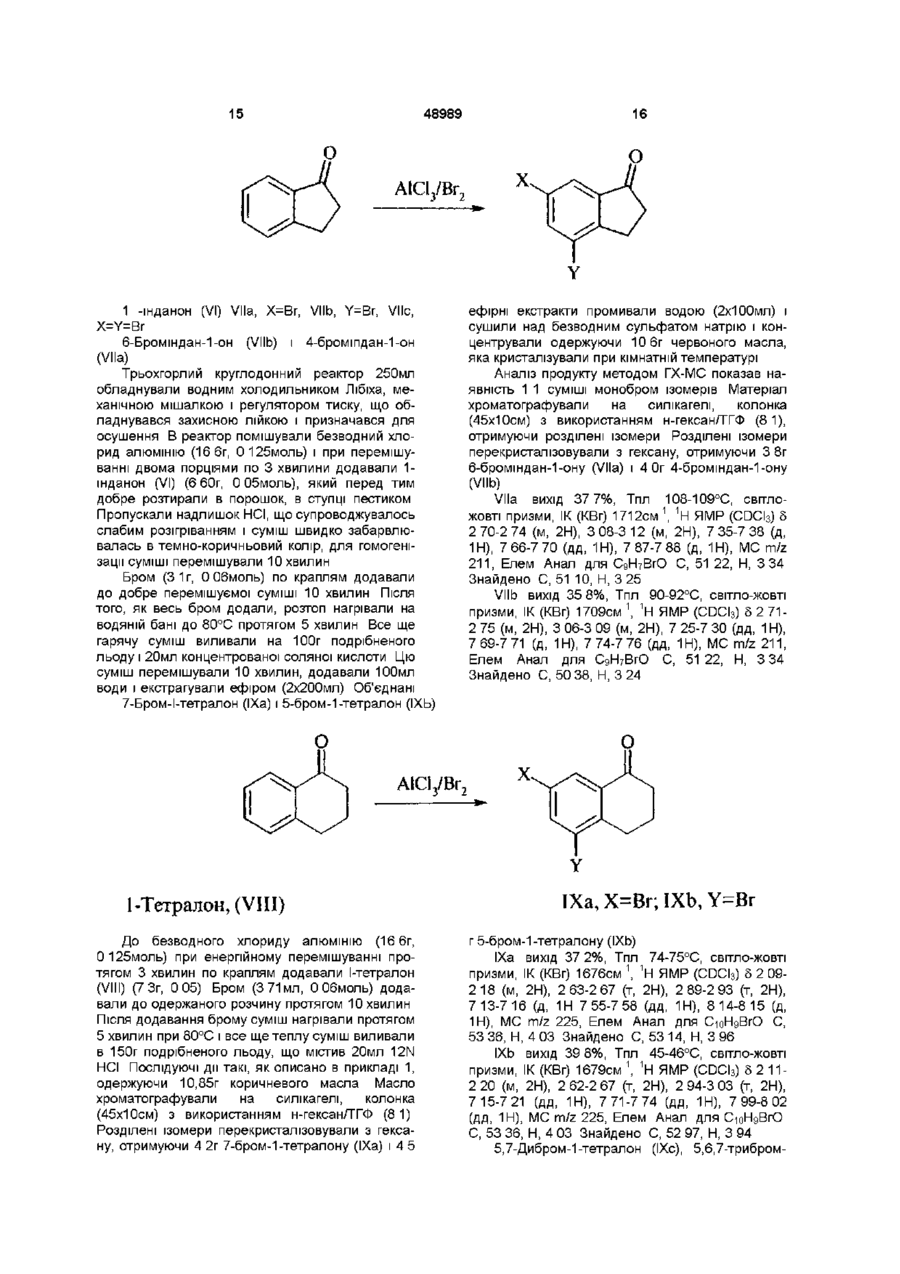
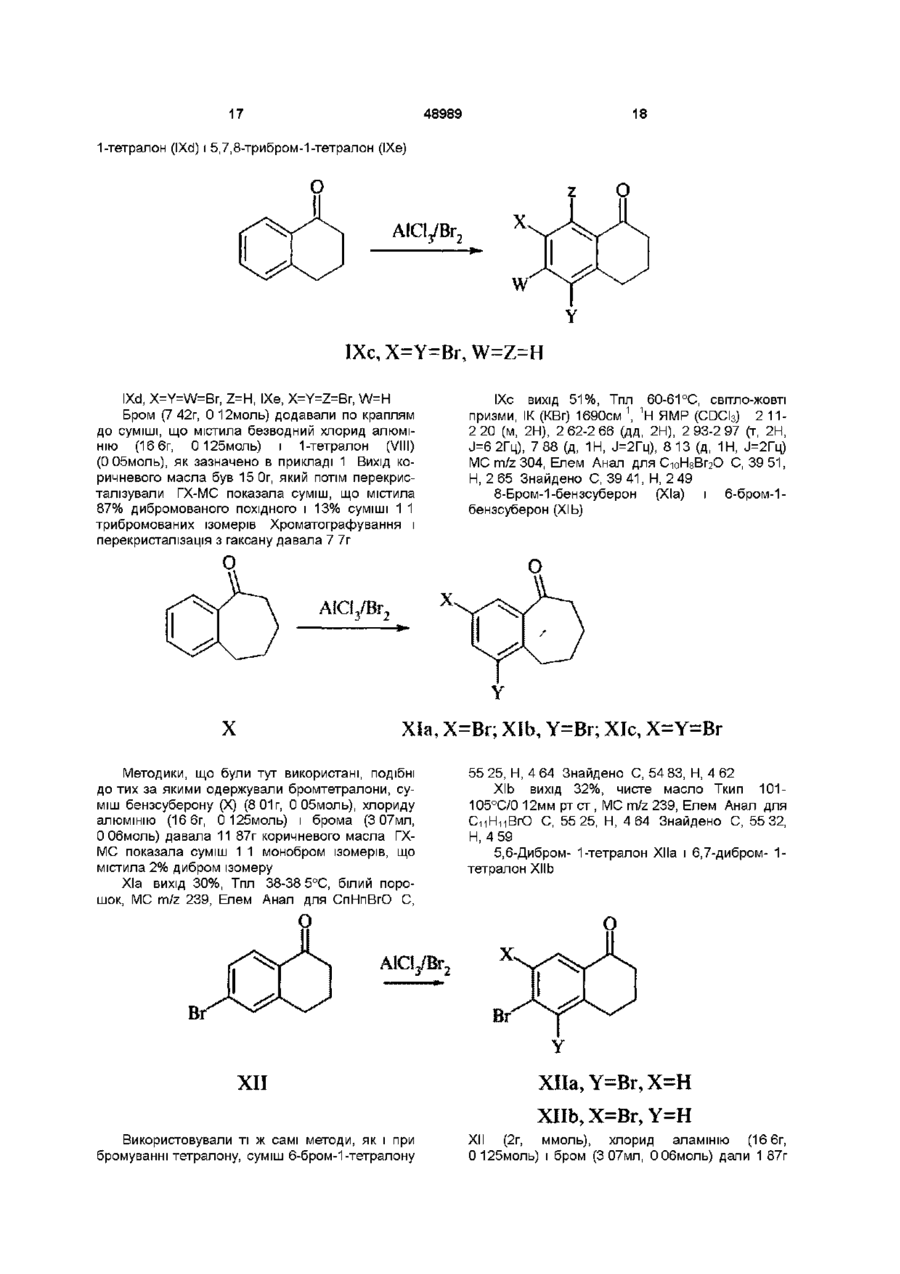
Похідні 1-арилсульфоніл, арил(тіо)карбонілпіридазину, спосіб їх одержання, фармацевтична композиція та спосіб лікування
Формула / Реферат
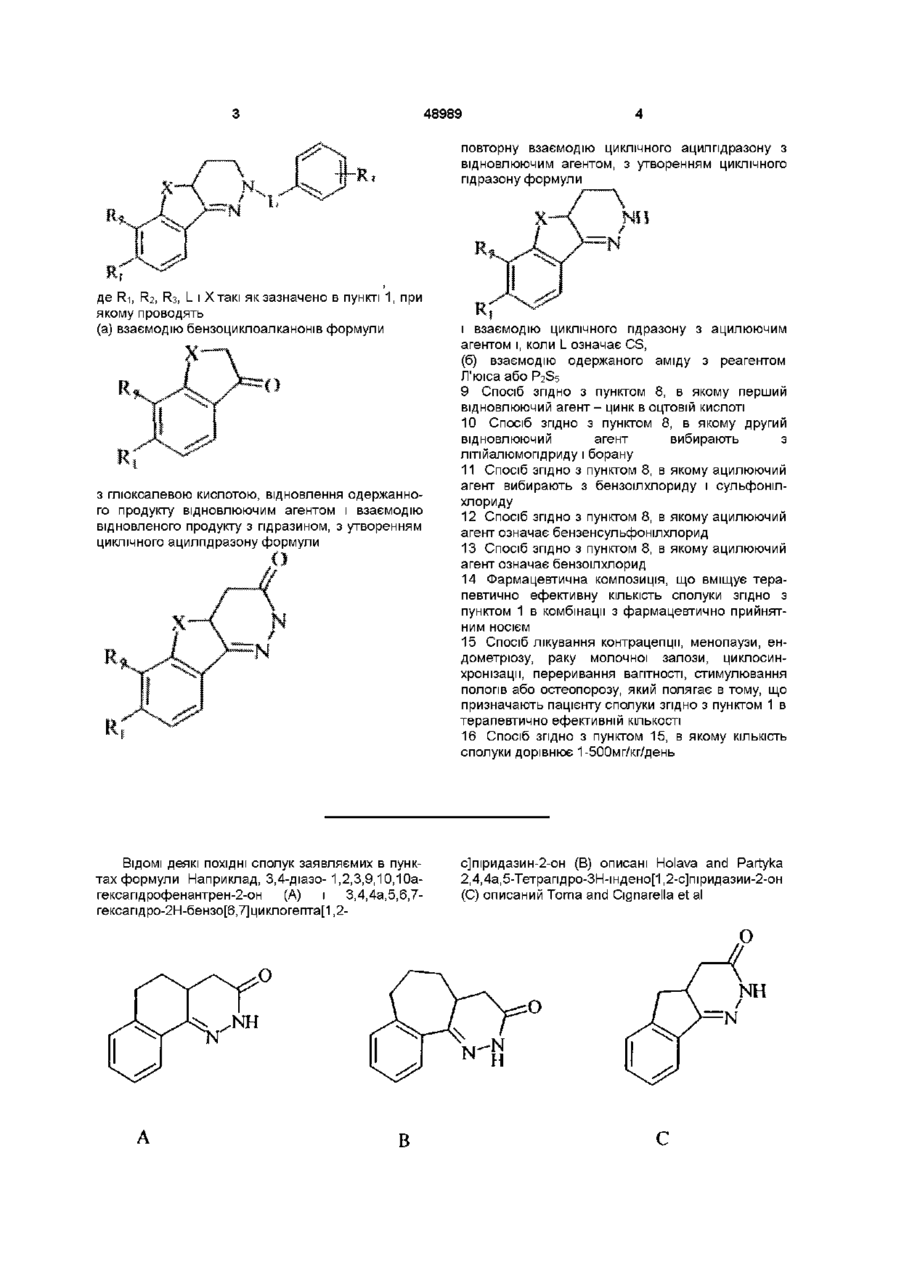
1. Похідні 1-арилсульфоніл, арил(тіо)карбонілпіридазину формули
де L вибирають з групи, що містить CO, CS або SO2;
де R1 і R2 незалежно вибирають з групи, що містить Н, галоген, алкіл (С1-С6), галогеналкіл (С1-С6), нітро, ціано, карбоксильну і карбоалкоксильну (С1-С6) групу, за умови, що коли L означає SO2, R1 і R2 одночасно не водні;
де R3 незалежно вибирають з 1-3 членів, групи, що містить Н, галоген, алкіл (С1-С6), галогеналкіл (С1-С6), нітро, ціано, карбоксильну або карбоалкоксильну (С1-С6) групи;
де Χ або (СН2)n, або Y-(CH2)n-1, де Υ означає О або S і n знаходиться в інтервалі від 1 до 3.
2. Сполука згідно з пунктом 1, в якій L означає SO2, принаймні один з R1 і R2 галоген, R3 незалежно вибирають з галогену або СF3 і Χ означає (СН2)n, де n=1-3.
3. Сполука згідно з пунктом 1, в якій L означає CO або CS, R1 і R2 водень, R3 означає 3,4-дихлор і Χ означає (СН2)n, де n=1-3.
4. Сполука згідно з пунктом 1, вибрана з групи, що містить 8-бром-3,4,4а,5,6,7-гексагідро-2-(4-йодбензенсульфоніл)-2Н-бенз[6,7]циклогепта[1,2-с]піридазин; 8-бром-3,4-діазо-1,2,3,9,10,10а-гексагідро-3-(4-йодбензенсульфоніл)фенангрен; 7,8-дибром-3,4-діазо-1,2,3,9,10,10а-гексагідро-3-(4-йодбензенсульфоніл)фенантрен; 3-(3,4-дихлорбензоїл)-3,4-діазо-1,2,3,9,10,10а-гексагідрофенантрен; і 2-(3,5-дихлорбензоїл)-3,4,4а,5,б,7-гексагідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин.
5. Сполука згідно з пунктом 1, вибрана з групи, що містить 2-(3,4-дифтортіобензоїл)-3,4,4а,5,6,7-гексагідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин; 2-(3,4-дихлорбензоїл)-3,4,4а,5,6,7-гексагідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин; 3-(3,4-дифторбензоїл)-3,4-діазо-1,2,3,9,10,10а-гексагідрофенантрен; 3-(3,5-дихлорбензоїл)-3,4-діазо-1,2,3,9,10,10а-гексагідрофенантрен; і 3-(3,4-дихлорбензоїл)-3,4-діазо-9-окса-1,2,3,9,10,10а-гексагідрофенатpeн.
6. Сполука згідно з пунктом 1, вибрана з групи, що містить 3-(3,4-дихлорбензоїл)-3,4-діазо-9-тіа-1,2,3,9,10,10а-гексагідрофенантрен; 3-(3,4-дихлорбензоїл)-3,4-діазо-9-окса-1,2,3,9,9а-тетрагідрофлуорен; 2-(3,5-дихлортіобензоїл)-3,4,4а,5,6,7-гексагідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин; 2-(3,4-дифтортіобензоїл)-3,4,4а,5,б,7-гексагідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин; 2-(3,4-дихлортіобензоїл)-3,4,4а,5,6,7-гексагідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин.
7. Сполука згідно з пунктом 1, вибрана з групи, що містить 3-(3,4-дифтортіобензоїл)-3,4,4а,5,6,7-гексагідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин; 3-(3,4-дихлортіобензоїл)-3,4,4а,5,6,7-гексагідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин; 3-(3,5-дихлортіобензоїл)-3,4-діазо-1,2,3,9,10,10а-гексагідрофенантрен; 3-(3,4-дихлортіобензоїл)-3,4-діазо-9-окса-1,2,3,9,10,10а-гексагідрофенантрен; 7-хлор-3,4-діазо-1,2,3,9,10,10а-гексагідро-3-(4-йодбензенсульфоніл)фенантрен; 7-хлор-3,4-діазо-1,2,3,9,10,10а-гексагідро-3-(2,5-дихлорбензенсульфоніл)фенантрен; і 3-(3,4-дихлорбензоїл)-3,4-діазо-1,2,3,9,9а-тетрагідрофлуорен.
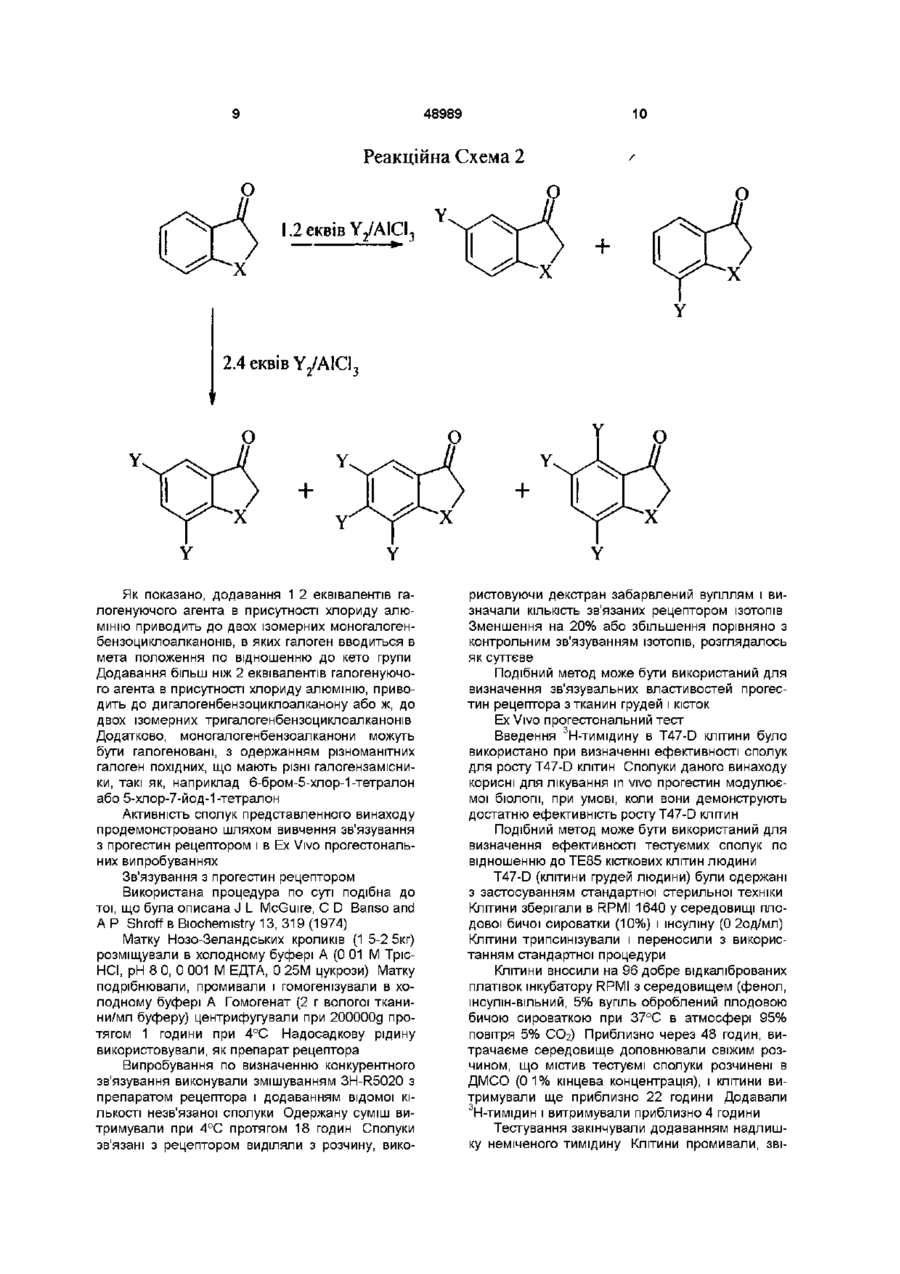
8. Спосіб одержання сполук формули
,
де R1, R2, R3, L і X такі як зазначено в пункті 1, при якому проводять:
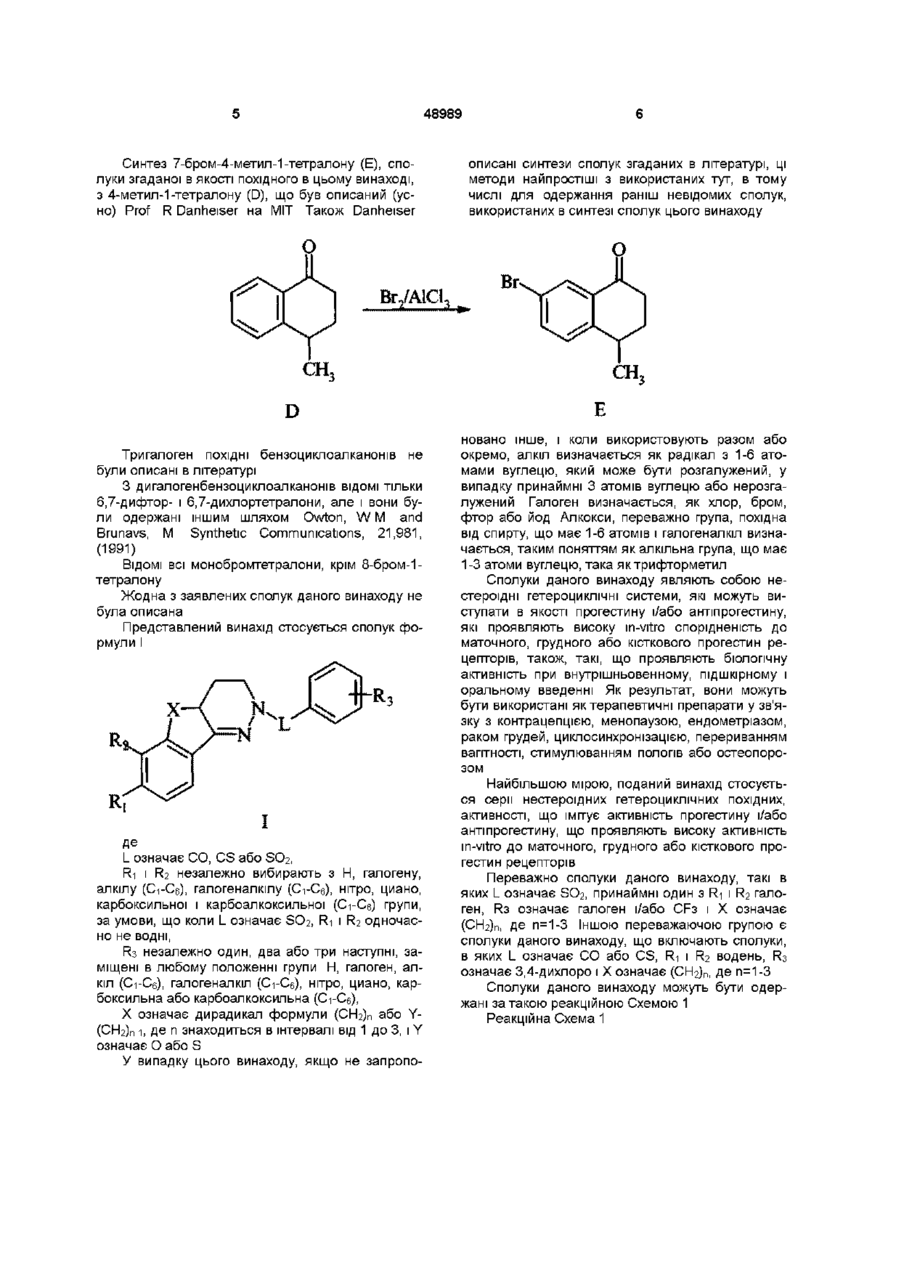
(а) взаємодію бензоциклоалканонів формули
з гліоксалевою кислотою, відновлення одержанного продукту відновлюючим агентом і взаємодію відновленого продукту з гідразином, з утворенням циклічного ацилгідразону формули
повторну взаємодію циклічного ацилгідразону з відновлюючим агентом, з утворенням циклічного гідразону формули
і взаємодію циклічного гідразону з ацилюючим агентом і, коли L означає CS,
(б) взаємодію одержаного аміду з реагентом Л'юїса або P2S5.
9. Спосіб згідно з пунктом 8, в якому перший відновлюючий агент - цинк в оцтовій кислоті.
10. Спосіб згідно з пунктом 8, в якому другий відновлюючий агент вибирають з літійалюмогідриду і борану.
11. Спосіб згідно з пунктом 8, в якому ацилюючий агент вибирають з бензоїлхлориду і сульфонілхлориду.
12. Спосіб згідно з пунктом 8, в якому ацилюючий агент означає бензенсульфонілхлорид.
13. Спосіб згідно з пунктом 8, в якому ацилюючий агент означає бензоїлхлорид.
14. Фармацевтична композиція, що вміщує терапевтично ефективну кількість сполуки згідно з пунктом 1 в комбінації з фармацевтично прийнятним носієм.
15. Спосіб лікування контрацепції, менопаузи, ендометріозу, раку молочної залози, циклосинхронізації, переривання вагітності, стимулювання пологів або остеопорозу, який полягає в тому, що призначають пацієнту сполуки згідно з пунктом 1 в терапевтично ефективній кількості.
16. Спосіб згідно з пунктом 15, в якому кількість сполуки дорівнює 1-500 мг/кг/день.
Текст
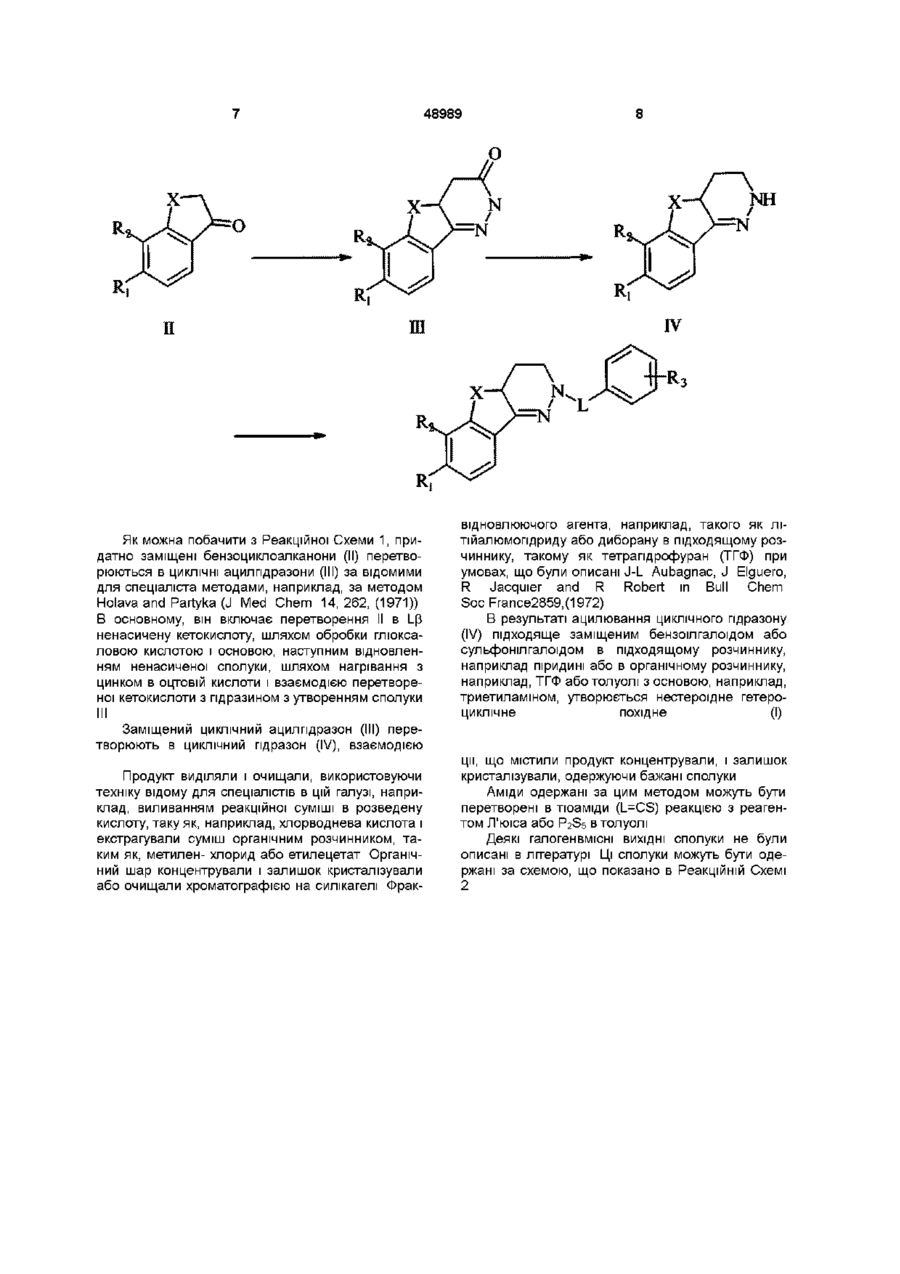
1 ПОХІДНІ 1-арилсульфоніл, арил(тю)карбонілпіридазину формули де L вибирають з групи, що містить CO, CS або SO2, де Ri і R2 незалежно вибирають з групи, що містить Н, галоген, алкіл (С-і-Сє), галогеналкіл ( d Сб), нітро, ціано, карбоксильну і карбоалкоксильну (С-і-Сб) групу, за умови, що коли L означає SO2, Ri і R2 одночасно не водні, де R3 незалежно вибирають з 1-3 членів, групи, що містить Н, галоген, алкіл (С-і-Сє), галогеналкіл ( d Сб), нітро, ціано, карбоксильну або карбоалкоксильну (С-і-Сб) групи, де X або (СНгіп, або Y-(CH2)n 1, де Y означає О або S і п знаходиться в інтервалі від 1 до З 2 Сполука згідно з пунктом 1, в якій L означає SO2, принаймні один з Ri і R2 галоген, R3 незалежно вибирають з галогену або CF3 і X означає (Cbhjn, де п=1-3 3 Сполука згідно з пунктом 1, в якій L означає CO або CS, Ri і R2 водень, R3 означає 3,4-дихлор і X означає (Cbbjn, де п=1-3 4 Сполука згідно з пунктом 1, вибрана з групи, що містить 8-бром-3,4,4а,5,6,7-гексапдро-2-(4 йодбензенсульфоніл)-2Н-бенз[6,7]циклогепта[1,2с]піридазин, 8-бром-3,4-діазо-1,2,3,9,10,10агексапдро-3-(4-йодбензенсульфоніл)фенангрен, 7,8-дибром-3,4-діазо-1,2,3,9,10,10а-гексапдро-3-(4йодбензенсульфоніл)фенантрен, 3-(3,4дихпорбензоіл)-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен, і 2-(3,5-дихлорбензоіл)3,4,4а,5,б,7-гексапдро-2Н-бенз[6,7]циклогепта[1,2с]піридазин 5 Сполука згідно з пунктом 1, вибрана з групи, що містить 2-(3,4-дифтортюбензоіл)-3,4,4а,5,6,7гексапдро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин, 2-(3,4-дихлорбензоіл)-3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин, 3-(3,4дифторбензоіл)-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен, 3-(3,5-дихлорбензоіл)-3,4діазо-1,2,3,9,10,10а-гексапдрофенантрен, і 3-(3,4дихлорбензоіл)-3,4-діазо-9-окса-1,2,3,9,10,10агексапдрофенатрен 6 Сполука згідно з пунктом 1, вибрана з групи, що містить 3-(3,4-дихлорбензоіл)-3,4-діазо-9-тіа1,2,3,9,10,10а-гексапдрофенантрен, 3-(3,4дихлорбензоіл)-3,4-діазо-9-окса-1,2,3,9,9атетрапдрофлуорен, 2-(3,5-дихлортюбензоіл)3,4,4а,5,6,7-гексапдро-2Н-бенз[6,7]циклогепта[1,2с]піридазин, 2-(3,4-дифтортюбензоіл)-3,4,4а,5,б,7гексапдро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин, 2-(3,4-дихлортюбензоіл)-3,4,4а,5,6,7-гексапдро2Н-бенз[6,7]циклогепта[1,2-с]піридазин 7 Сполука згідно з пунктом 1, вибрана з групи, що містить 3-(3,4-дифтортюбензоіл)-3,4,4а,5,6,7гексапдро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин, 3-(3,4-дихлортюбензоіл)-3,4,4а,5,6,7-гексапдро2Н-бенз[6,7]циклогепта[1,2-с]піридазин, 3-(3,5дихлортюбензоіл)-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен, 3-(3,4-дихлортюбензоіл)-3,4діазо-9-окса-1,2,3,9,10,10а-гексапдрофенантрен, 7-хлор-3,4-діазо-1,2,3,9,10,10а-гексапдро-3-(4йодбензенсульфоніл)фенантрен, 7-хлор-3,4-діазо1,2,3,9,10,10а-гексапдро-3-(2,5дихлорбензенсульфоніл)фенантрен, і 3-(3,4дихлорбензоіл)-3,4-діазо-1,2,3,9,9атетрапдрофлуорен 8 Спосіб одержання сполук формули О 00 00 48989 повторну взаємодію циклічного ацилпдразону з відновлюючим агентом, з утворенням циклічного пдразону формули де R-i, R2, R3, L 1 Хтакі як зазначено в пункті 1, при якому проводять (а) взаємодію бензоциклоалканонів формули з глюксалевою кислотою, відновлення одержанного продукту відновлюючим агентом і взаємодію відновленого продукту з гідразином, з утворенням циклічного ацилпдразону формули ВІДОМІ деякі ПОХІДНІ сполук заявляємих в пунктах формули Наприклад, 3,4-діазо- 1,2,3,9,10,10агексапдрофенантрен-2-он (А) і 3,4,4а,5,6,7гексапдро-2Н-бензо[6,7]циклогепта[1,2 і взаємодію циклічного пдразону з ацилюючим агентом і, коли L означає CS, (б) взаємодію одержаного аміду з реагентом Л'юіса або P2S5 9 Спосіб згідно з пунктом 8, в якому перший відновлюючий агент- цинк в оцтовій кислоті 10 Спосіб згідно з пунктом 8, в якому другий відновлюючий агент вибирають з літійалюмопдриду і борану 11 Спосіб згідно з пунктом 8, в якому ацилюючий агент вибирають з бензоілхлориду і сульфонілхлориду 12 Спосіб згідно з пунктом 8, в якому ацилюючий агент означає бензенсульфонілхлорид 13 Спосіб згідно з пунктом 8, в якому ацилюючий агент означає бензоілхлорид 14 Фармацевтична композиція, що вміщує терапевтично ефективну КІЛЬКІСТЬ сполуки згідно з пунктом 1 в комбінації з фармацевтично прийнятним носієм 15 Спосіб лікування контрацепції, менопаузи, ендометрюзу, раку молочної залози, циклосинхронізаци, переривання вагітності, стимулювання пологів або остеопорозу, який полягає в тому, що призначають пацієнту сполуки згідно з пунктом 1 в терапевтично ефективній КІЛЬКОСТІ 16 Спосіб згідно з пунктом 15, в якому КІЛЬКІСТЬ сполуки дорівнює 1-500мг/кг/день с]піридазин-2-он (В) описані Holava and Partyka 2,4,4а,5-Тетрапдро-ЗН-шдено[1,2-с]піридазии-2-он (С) описаний Toma and Cignarella et al NH A В С 48989 Синтез 7-бром-4-метил-1-тетралону (Е), сполуки згаданої в якості похідного в цьому винаході, з 4-метил-1-тетралону (D), що був описаний (усно) Prof R Danheiser на MIT Також Danheiser описані синтези сполук згаданих в літературі, ці методи найпростіші з використаних тут, в тому числі для одержання раніш невідомих сполук, використаних в синтезі сполук цього винаходу D Тригалоген ПОХІДНІ бензоциклоалканонів не були описані в літературі З дигалогенбензоциклоалканонів ВІДОМІ ТІЛЬКИ 6,7-дифтор- і 6,7-дихлортетралони, але і вони були одержані іншим шляхом Owton, W М and Brunavs, M Synthetic Communications, 21,981, (1991) ВІДОМІ ВСІ монобромтетралони, крім 8-бром-1тетралону Жодна з заявлених сполук даного винаходу не була описана Представлений винахід стосується сполук формули І Де L означає CO, CS або SO2, Ri і F 2 незалежно вибирають з Н, галогену, ? алкілу (Сі-Сє), галогеналкілу (Сі-Сє), нітро, циано, карбоксильної і карбоалкоксильної (Сі-Сє) групи, за умови, що коли L означає SO2, Ri і R2 одночасно не водні, R3 незалежно один, два або три наступні, заміщені в любому положенні групи Н, галоген, алкіл (Сі-Сє), галогеналкіл (Сі-Сє), нітро, циано, карбоксильна або карбоалкоксильна (Сі-Сє), X означає дирадикал формули (Cbbjn або Y(СЬІ2)п і, де п знаходиться в інтервалі від 1 до 3, і Y означає О або S У випадку цього винаходу, якщо не запропо новано інше, і коли використовують разом або окремо, алкіл визначається як радікал з 1-6 атомами вуглецю, який може бути розгалужений, у випадку принаймні 3 атомів вуглецю або нерозгалужений Галоген визначається, як хлор, бром, фтор або йод Алкокси, переважно група, похідна від спирту, що має 1-6 атомів і галогеналкіл визначається, таким поняттям як алкільна група, що має 1-3 атоми вуглецю, така яктрифторметил Сполуки даного винаходу являють собою нестероідні гетероциклічні системи, які можуть виступати в якості прогестину і/або антіпрогестину, які проявляють високу m-vitro спорідненість до маточного, грудного або кісткового прогестин рецепторів, також, такі, що проявляють біологічну активність при внутрішньовенному, підшкірному і оральному введенні Як результат, вони можуть бути використані як терапевтичні препарати у зв'язку з контрацепцією, менопаузою, ендометріазом, раком грудей, циклосинхронізацією, перериванням вагітності, стимулюванням пологів або остеопорозом Найбільшою мірою, поданий винахід стосується серії нестероідних гетероциклічних похідних, активності, що імітує активність прогестину і/або антіпрогестину, що проявляють високу активність m-vitro до маточного, грудного або кісткового прогестин рецепторів Переважно сполуки даного винаходу, такі в яких L означає SO2, принаймні один з Ri і R2 галоген, R3 означає галоген і/або CF3 і X означає (СЬІ2)п, де п=1-3 Іншою переважаючою групою є сполуки даного винаходу, що включають сполуки, в яких L означає CO або CS, Ri і R2 водень, R3 означає 3,4-дихлоро і X означає (СЬІ2)п, де п=1-3 Сполуки даного винаходу можуть бути одержані за такою реакційною Схемою 1 Реакційна Схема 1 48989 NH R П Ш Як можна побачити з Реакційної Схеми 1, придатно заміщені бензоциклоалканони (II) перетворюються в ЦИКЛІЧНІ ацилпдразони (III) за відомими для спеціаліста методами, наприклад, за методом Holava and Partyka (J Med Chem 14,262,(1971)) В основному, він включає перетворення II в І_р ненасичену кетокислоту, шляхом обробки глюксаловою кислотою і основою, наступним відновленням ненасиченої сполуки, шляхом нагрівання з цинком в оцтовій кислоти і взаємодією перетвореної кетокислоти з гідразином з утворенням сполуки w відновлюючого агента, наприклад, такого як літійалюмопдриду або диборану в підходящому розчиннику, такому як тетрапдрофуран (ТГФ) при умовах, що були описані J-L Aubagnac, J Elguero, R Jacquier and R Robert in Bull Chem Soc France2859,(1972) В результаті ацилювання циклічного пдразону (IV) підходяще заміщеним бензоїлгалоїдом або сульфонілгалоїдом в підходящому розчиннику, наприклад піридині або в органічному розчиннику, наприклад, ТГФ або толуолі з основою, наприклад, триетиламіном, утворюється нестероідне гетероциклічне похідне (І) Заміщений циклічний ацилпдразон (III) перетворюють в циклічний пдразон (IV), взаємодією Продукт виділяли і очищали, використовуючи техніку відому для спеціалістів в цій галузі, наприклад, виливанням реакційної суміші в розведену кислоту, таку як, наприклад, хлорводнева кислота і екстрагували суміш органічним розчинником, таким як, метилен- хлорид або етилецетат Органічний шар концентрували і залишок кристалізували або очищали хроматографією на силікагелі Фрак ції, що містили продукт концентрували, і залишок кристалізували, одержуючи бажані сполуки Аміди одержані за цим методом можуть бути перетворені в тюаміди (L=CS) реакцією з реагентом Л'юіса або P2S5 в толуолі Деякі галогенвмісні ВИХІДНІ сполуки не були описані в літературі Ці сполуки можуть бути одержані за схемою, що показано в Реакційній Схемі 2 48989 10 Реакційна Схема 2 .2еквівУ2/АІСІ3 X 2.4еквів¥2/А1СІ3 X Як показано, додавання 1 2 еквівалентів галогенуючого агента в присутності хлориду алюмінію приводить до двох ізомерних моногалогенбензоциклоалканонів, в яких галоген вводиться в мета положення по відношенню до кето групи Додавання більш ніж 2 еквівалентів галогенуючого агента в присутності хлориду алюмінію, приводить до дигалогенбензоциклоалканону або ж, до двох ізомерних тригалогенбензоциклоалканонів Додатково, моногалогенбензоал канони можуть бути галогеновані, з одержанням різноманітних галоген похідних, що мають різні галогензамісники, такі як, наприклад 6-бром-5-хлор-1-тетралон або 5-хлор-7-йод-1-тетралон Активність сполук представленного винаходу продемонстровано шляхом вивчення зв'язування з прогестин рецептором і в Ex Vivo прогестональних випробуваннях Зв'язування з прогестин рецептором Використана процедура по суті подібна до тої, що була описана J L McGuire, С D Banso and A P Shroff в Biochemistry 13, 319 (1974) Матку Нозо-Зеландських кроликів (1 5-2 5кг) розміщували в холодному буфері А (0 01 М ТрісНСІ, рН 8 0, 0 001 М ЕДТА, 0 25М цукрози) Матку подрібнювали, промивали і гомогенізували в холодному буфері А Гомогенат (2 г вологої тканини/мл буферу) центрифугували при 200000д протягом 1 години при 4°С Надосадкову рідину використовували, як препарат рецептора Випробування по визначенню конкурентного зв'язування виконували змішуванням 3H-R5020 з препаратом рецептора і додаванням відомої КІЛЬКОСТІ незв'язаної сполуки Одержану суміш витримували при 4°С протягом 18 годин Сполуки зв'язані з рецептором виділяли з розчину, вико ристовуючи декстран забарвлений вугіллям і визначали КІЛЬКІСТЬ зв'язаних рецептором ІЗОТОПІВ Зменшення на 20% або збільшення порівняно з контрольним зв'язуванням ІЗОТОПІВ, розглядалось як суттєве Подібний метод може бути використаний для визначення зв'язувальних властивостей прогестин рецептора з тканин грудей і кісток Ex Vivo прогестональний тест Введення 3Н-тимідину в T47-D клітини було використано при визначенні ефективності сполук для росту T47-D клітин Сполуки даного винаходу корисні для лікування in vivo прогестин модулюємої біологи, при умові, коли вони демонструють достатню ефективність росту T47-D клітин Подібний метод може бути використаний для визначення ефективності тестуємих сполук по відношенню до ТЕ85 кісткових клітин людини T47-D (клітини грудей людини) були одержані з застосуванням стандартної стерильної техніки Клітини зберігали в RPMI 1640 у середовищі плодової бичої сироватки (10%) і інсуліну (0 2од/мл) Клітини трипсинізували і переносили з використанням стандартної процедури Клітини ВНОСИЛИ на 96 добре відкаліброваних платівок інкубатору RPMI з середовищем (фенол, інсулін-вільний, 5% вупль оброблений плодовою бичою сироваткою при 37°С в атмосфері 95% повітря 5% СОг) Приблизно через 48 годин, витрачаєме середовище доповнювали свіжим розчином, що містив тестуємі сполуки розчинені в ДМСО (0 1% кінцева концентрація), і клітини витримували ще приблизно 22 години Додавали 3 Н-тимідин і витримували приблизно 4 години Тестування закінчували додаванням надлишку неміченого тимідину Клітини промивали, зві 48989 11 12 Таблиці Таблиця 1 показує приклади винаходу з молекулярними формулами, температурами плавлення, зв'язувальними властивостями, що виражені через концентрацію сполуки в наномолях на літр (х 10 9 М), що потрібна для заміщення 50% Н3 міченого тимідину R5020 в цитозольному прогестин рецепторі з матки кролика (ПР)(ІС5о), і здатність росту або інгібування R5020, що індукує ріст T47D людських грудних злоякісних кліток (T47D) Якщо в цій колонці нічого не вказано, то сполука не проходила тестування Таблиці 2 и 3 показують декілька прикладів винаходу з молекулярними формулами, температурами плавлення і активністю, що виражена, через середнє збільшення росту кісткових клітин при 5 концентраціях (СР), або як концентрація сполуки в наномолях на літр (хЮ 9 М), що потрібна для заміщення 50% І125 міченого вшілнортестостерону (ВНТ) в прогестин рецепторі з людських кісток (КПР) (ІС50) Якщо в колонці СР нічого не вказано, то сполука не проходила тестування льнюючи їх від тимідину, трипсинізували і концентрували за стандартною процедурою КІЛЬКІСТЬ зв'язаного в ДНК Н-тимідину визначали методом рахування сполохів в рідині Основними стандартами були промегестон, сильнодіючий синтетичний прогестин і RU486, як антипрогестин Тестуємі сполуки в основному визначали в концентраціях від 0 1 до ЮООнМ Активність сполук вираховували з їх стимулювання або інгібування введення тимідину Результати виражали, через концентрацію тестуємих сполук необхідних для підвищення росту в 2 рази до контрольного (SC200), або через концентрацю необхідну для інгібування 50% дії промегестону на ріст (ЕСзо) Значення менші ніж ЮООнМ розглядали як активні Методики що використовувались в описі, були взяті з наступних публікацій С Chnstensen, D Gunter, D Saunders and V Malviya, GynecoL OncoL, 28, 25 (1987), J Puzas, R Dnvdal, G Howard and D Baylmk, Proc Soc Exp Biol Med, 165, 113 (1981), and I Keydar, L Chen, S Karby, F Weiss, J Delarea, M Raduy, S Chaitcik and H Brenner, Eur J Cancer 15,659(1979) Таблиця 1 Сульфонаміди № 1 2 3 4 5 Ri Н Н Вг СІ Вг R2 Вг Вг Вг Н Н X (СН2)з (СН2)2 (СН2)2 (СН2)2 (СН2)2 R3 4-І 4-І 4-І 4-І 2,5-диСІ ПР 76 10 2/4 83 34 + показує агоніст, SC2oo нМ (концентрація, що стимулює 2-кратний рост порівняно з контрольним) T47D +337 -654 -495 Формула Ci 9 Hi 8 BrlN 2 O 2 S Ci 8 Hi 6 BrlN 2 O 2 S Ci 8 Hi 5 Br 2 IN 2 O 2 S Ci 8 Hi 0 CIIN 2 0 2 S Ci 8 Hi 5 CI 3 N 2 0 2 S Тпл 180-1 197-8 202-3 194-6 186-7 - показує антагоніст, ЕСзо нМ разом з R5020 індукують рост Таблиця 2 Аміди О № 6 X (СН2)2 R3 3,4-диСІ СР 115 КПР Формула Ci 9 Hi 6 CI 2 N 2 O Тпл 154-5 48989 13 7 8 9 10 11 12 13 14 (СН2)з (СН2)з (СН2)з (СН2)2 (СН2)2 ОСН2 SCH 2 СН 2 3,5-диСІ 3,4-диР 3,4-диСІ 3,4-flnF 3,5-диСІ 3,4-диСІ 3,4-диСІ 3,4-диСІ 14 120 84 48 107 123 112 113 107 11 6 36 50 90 C20H18CI2N2O C2oHi8FN20 C20H18CI2N2O C19H16F2N2O C19H16CI2N2O C18H14CI2N2O2 C18H14CI2N2OS C18H14CI2N2O 115-6 117-8 136-7 146-7 141-2 166-7 145-6 122-4 Таблиця 3 Тюаміди № 15 16 17 18 19 20 21 22 X (СН2)з (СН2)з (СН2)з (СНзЬ (СН2}2 (СН2}2 осн 2 сн2 R 3 3,4-диСІ 3,5-flnF 3,4-диСІ 3,4-flHF 3,4-диСІ 3,5-диСІ 3,4-диСІ 3,4-диСІ СР 109 111 115 КПР 23 3 87 103 44 3 102 20 05 Фармацевтичні композиції, що містять сполуки даного винаходу в якості активного інгредієнта в суміші з добре відомими фармацевтичними носіями, можуть бути одержані із використанням загальноприйнятої фармацевтичної техніки Носи можуть бути взяті в широку спектрі форм, в залежності від форми використання, наприклад, внутрішньовенне, оральне або парентеральне При одержанні композицій для орального використання, в якості фармацевтичних розчинників можуть бути використані такі як, наприклад, вода, ГЛІКОЛІ, масла, спирти, ароматизатори, консерванти, барвники, і їм подібні, у випадку одержання рідин для орального застосування (таких як, наприклад, суспензії, еліксири і розчини), носи, такі як, крохмаль, цукор, розріджувачі, гранулюючи агенти, змазки, зв'язуючи, розщеплюючи агенти і їм подібні, у випадку одержання твердих рецептур для орального використання (такі як, наприклад, порошки, капсули і таблетки) У випадку твердих фармацевтичних носив, найбільш легким для орального використання є таблетки і капсули При бажанні, таблетки можуть бути покриті цукром або покриттям з використанням стандартної техніки Для парентерального використання, носи зазвичай включають стерильну воду, однак можуть бути використані і ІНШІ інгредієнти, наприклад, для покращання розчинення або з метою Формула C2oHi8CI2N2S C2oHi8F2N2S C2oHi8CI2N2S Ci9Hi6F2N2S Ci9Hi6CI2N2S CigHi6CI2N2S Ci 8 Hi 4 CI 2 N 2 OS Ci8rli4CI2N2S 32 Тпл 149-50 134-6 140-1 170-1 110-1 162-3 187-8 138-40 консервації, ІН'ЄКЦІЙНІ суспензії можуть також бути одержані, у випадку призначення рідких форм, суспендуючи агенти і їм подібні можуть бути використані при цьому Фармацевтичні композиції представленого винаходу призначені для використання в цілях контрацепції і для лікування менопаузи, ендометрюзу, раку грудей, циклосінхронізацм, переривання вагітності, стимулювання пологів або остеопорозу, можливе призначення для лікування ендометрюзу, контрацепції і остеопорозу, переважно одиничних доз, наприклад, таблеток, капсул, порошків і їм подібних, від 1 до приблизно 500мг/кг/день і переважно від приблизно 10 до приблизно 100мг/кг/день активного інгредієнту Кінцева доза залежить від віку і стану пацієнта і частково умов проведення лікування Приклади І Одержання вхідних і проміжних сполук використаних при одержанні сполук винаходу Наступні розділи А, Б і В містять опис одержання основних вихідних і проміжних сполук використаних при одержанні сполук винаходу А Одержання галобензоцикланонів В наступних прикладах, N-бромсукцинімід використовували в якості бромуючого агента, Nхлорсукцинімід або хлор використовували для одержання хлорпохідних N-йодсукцинімід давав йод ПОХІДНІ 48989 15 AiCl 3 /Br 2 1 -інданон (VI) Vila, X=Br, Vllb, Y=Br, Vile, X=Y=Br б-Бромшдан-1-он (Vllb) і 4-броміпдан-1-он (Vila) Трьохгорлий круглодонний реаісгор 250мл обладнували водним холодильником Лібіха, механічною мішалкою і регулятором тиску, що обладнувався захисною лійкою і призначався для осушення В реактор помішували безводний хлорид алюмінію (16 6г, 0 125моль) і при перемішуванні двома порціями по 3 хвилини додавали 1інданон (VI) (6 60г, 0 05моль), який перед тим добре розтирали в порошок, в ступці пестиком Пропускали надлишок НСІ, що супроводжувалось слабим розігріванням і суміш швидко забарвлювалась в темно-коричньовий колір, для гомогенізації суміші перемішували 10 хвилин Бром (3 1г, 0 Обмоль) по краплям додавали до добре перемішуємої суміші 10 хвилин Після того, як весь бром додали, розтоп нагрівали на водяній бані до 80°С протягом 5 хвилин Все ще гарячу суміш виливали на 100г подрібненого льоду і 20мл концентрованої соляної кислоти Цю суміш перемішували 10 хвилин, додавали ЮОмл води і екстрагували ефіром (2х200мл) Об'єднані 7-Бром-І-тетралон (ІХа) і 5-бром-1-тетралон (ІХЬ) ефірні екстракти промивали водою (2х100мл) і сушили над безводним сульфатом натрію і концентрували одержуючи 10 6г червоного масла, яка кристалізували при кімнатній температурі Аналіз продукту методом ГХ-МС показав наявність 1 1 суміші монобром ізомерів Матеріал хроматографували на силікагелі, колонка (45x10см) з використанням н-гексанЛТФ (8 1), отримуючи розділені ізомери Розділені ізомери перекристалізовували з гексану, отримуючи 3 8г 6-бромшдан-1-ону (Vila) і 4 0г 4-бромшдан-1-ону (Vllb) Vila вихід 37 7%, Тпл 108-109°С, світложовті призми, ІК (КВг) 1712см \ 1Н ЯМР (CDCI3) 5 2 70-2 74 (м, 2Н), 3 08-3 12 (м, 2Н), 7 35-7 38 (д, 1Н), 7 66-7 70 (дд, 1Н), 7 87-7 88 (д, 1Н), МС m/z 211, Елем Анал для С9Н7ВЮ С, 51 22, Н, 3 34 Знайдено С, 51 10, Н, 3 25 Vllb вихід 35 8%, Тпл 90-92°С, СВІТЛО-ЖОВТІ призми, ІК (КВг) 1709см \ 1Н ЯМР (CDCI3) 5 2 712 75 (м, 2Н), 3 06-3 09 (м, 2Н), 7 25-7 ЗО (дд, 1Н), 7 69-7 71 (д, 1Н), 7 74-7 76 (дд, 1Н), МС m/z 211, Елем Анал для С 9 Н 7 Вг0 С, 51 22, Н, 3 34 Знайдено С, 50 38, Н, 3 24 АІСІ 3 /Вг 2 1-Тетралон, (VIII) До безводного хлориду алюмінію (16 6г, 0 125моль) при енергійному перемішуванні протягом 3 хвилин по краплям додавали І-тетралон (VIII) (7 3г, 0 05) Бром (3 71мл, 0 Обмоль) додавали до одержаного розчину протягом 10 хвилин Після додавання брому суміш нагрівали протягом 5 хвилин при 80°С і все ще теплу суміш виливали в 150г подрібненого льоду, що містив 20мл 12N НСІ Послідуючі дії такі, як описано в прикладі 1, одержуючи 10,85г коричневого масла Масло хроматографували на силікагелі, колонка (45x10см) з використанням н-гексанЛТФ (8 1) Розділені ізомери перекристалізовували з гексану, отримуючи 4 2г 7-бром-1-тетралону (ІХа) і 4 5 ІХа, X=Br; IXb, Y=Br г 5-бром-1-тетралону (ІХЬ) ІХа вихід 37 2%, Тпл 74-75°С, СВІТЛО-ЖОВТІ призми, ІК (КВг) 1676см \ 1Н ЯМР (CDCI3) 5 2 092 18 (м, 2Н), 2 63-2 67 (т, 2Н), 2 89-2 93 (т, 2Н), 7 13-7 16 (д, 1Н 7 55-7 58 (дд, 1Н), 8 14-8 15 (д, 1Н), МС m/z 225, Елем Анал для СюН9ВгО С, 53 36, Н, 4 03 Знайдено С, 53 14, Н, 3 96 ІХЬ вихід 39 8%, Тпл 45-46°С, СВІТЛО-ЖОВТІ призми, ІК (КВг) 1679см \ 1Н ЯМР (CDCI3) 5 2 112 20 (м, 2Н), 2 62-2 67 (т, 2Н), 2 94-3 03 (т, 2Н), 7 15-7 21 (дд, 1Н), 7 71-7 74 (дд, 1Н), 7 99-8 02 (дд, 1Н), МС m/z 225, Елем Анал для СюН9ВгО С, 53 36, Н, 4 03 Знайдено С, 52 97, Н, 3 94 5,7-Дибром-1-тетралон (ІХс), 5,6,7-трибром 17 48989 18 1-тетралон (IXd) і 5,7,8-трибром-1-тетралон (ІХе) z О А!С! 3 /Вг 3 Y IXd, X Y W B, Z=H, IXe, X Y Z B, W H == = r == = r = Бром (7 42г, 0 12моль) додавали по краплям до суміші, що містила безводний хлорид алюмінію (16 6г, 0 125моль) і 1-тетралон (VIII) (0 05моль), як зазначено в прикладі 1 Вихід коричневого масла був 15 0г, який потім перекристалізували ГХ-МС показала суміш, що містила 87% дибромованого похідного і 13% суміші 1 1 трибромованих ізомерів Хроматографування і перекристалізація з гаксану давала 7 7г ІХс вихід 51%, Тпл 60-61 °С, СВІТЛО-ЖОВТІ призми, ІК (КВг) 1690см \ 1Н ЯМР (CDCI3) 2 112 20 (м, 2Н), 2 62-2 66 (дд, 2Н), 2 93-2 97 (т, 2Н, и=6 2Гц), 7 88 (д, 1Н, и=2Гц), 8 13 (д, 1Н, и=2Гц) МС m/z 304, Елем Анал для Ci 0 H 8 Br 2 O C, 39 51, Н, 2 65 Знайдено С, 39 41, Н, 2 49 8-Бром-1 -бензсуберон (ХІа) і 6-бром-1 бензсуберон (XIЬ) АІСІ 3 /Вг 2 ХІа, X=Br; Xlb, Y=Br; ХІс, X=Y= X Методики, що були тут використані, подібні до тих за якими одержували бромтетралони, суміш бензсуберону (X) (8 01г, 0 05моль), хлориду алюмінію (16 6г, 0125моль) і брома (3 07мл, 0 Обмоль) давала 11 87г коричневого масла ГХМС показала суміш 1 1 монобром ізомерів, що містила 2% дибром ізомеру ХІа вихід 30%, Тпл 38-38 5°С, білий порошок, МС m/z 239, Елем Анал для СпНпВгО С, АЇС1./Вг2 XII 55 25, Н, 4 64 Знайдено С, 54 83, Н, 4 62 ХІЬ вихід 32%, чисте масло Ткип 101105°С/0 12мм рт ст , МС m/z 239, Елем Анал для С Ц Н Ц В Г О С, 55 25, Н, 4 64 Знайдено С, 55 32, Н, 4 59 5,6-Дибром- 1-тетралон ХІІа і 6,7-дибром- 1тетралон ХІІЬ X XHa,Y=Br,X=H XHb, X=Br, Використовували ті ж самі методи, як і при бромуванні тетралону, суміш 6-бром-1-тетралону Y=H XII (2г, ммоль), хлорид аламшію (16 6г, 0 125моль) і бром (3 07мл, 0 Обмоль) дали 1 87г 19 коричневого масла після ВІДПОВІДНИХ ДІЙ В Одержання циклічних ацилпдразонів 3,4-Діазо-1,2,3,9,9а-тетрапдрофлуорен-2-он (XIII) Вказана сполука одержана за методикою, що описана Toma, L , Cignarella, G , Вапоссо, D and Ronchetti, F J Med Chem 33,1591-4,1990 3,4-Діазо-1,2,3,9,10 Л Оа гексапдрофенантрен-2-он (XIV) Вказана сполука одержана за методикою, що описана Holava, Н М and Partyka, R A J Med Chem 14,262, (1971) 3,4 4а,5,6,7-гексапдро-2Нбенз[6,7]циклогепта[12-с]піридазин-2-он(Х\/) Вказана сполука одержана за методикою, що описана Holava, Н М and Partyka, R A J Med Chem 14, 262, (1971) 8-Бром-3,4-діазо-1,2,3,9,10,10aгексапдрофенантрен-2-он (XVI) Вказана сполука одержана взаємодією 5бром-1-тетралону (ІХЬ) (20ммоль) з глюксиловою кислотою (20ммоль), продукт відновлювали надлишком цинку в оцтовій кислоті і надлишком гідразину за умовами, що вказані в Holava, Н М and Partyka, R A J Med Chem 14,262, (1971) одержуючи вказану сполуку 7,8-Дибром-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен-2он(ХУІІ) Вказана сполука одержана взаємодією 5,6дибром-1-тетралону (ХІІа) (Юммоль) з глюксиловою кислотою (Юммоль), продукт відновлювали надлишком цинку в оцтовій кислоті і надлишком гідразину, як вказано в Holava, Н М and Partyka, RA J Med Chem 14,262, (1971), одержуючи вказану сполуку 7-Хлор-3,4-діазо 1,2,3,910,10агексапдрофенантрен-2он (XVIII) Вказана сполука одержана взаємодією 6хлор-1-тетралону (ХПа) (Rosowsky, A, Chaykovsky, М , Yeager, S A et al J Het Chem 8, 809, (1971)) 50ммоль з глюксиловою кислотою 50ммоль і основою, і подальшим відновленням надлишком цинку в оцтовій кислоті і подальшою обробкою надлишком гідразину, як вказано в Holava, HM and Partyka, R A J Med Chem 14, 262, (1971), одержуючи вказану сполуку 8-Бром-3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]никлогепта[1,2-с]піридазин-2-он (XIX) Вказана сполука одержана взаємодією 6бром-1-бензсуберону ХІЬ з глюксиловою кислотою, відновленням надлишком цинку в оцтовій кислоті і подальшою обробкою надлишком гідразину, як вказано в Holava, Н М and Partyka, R A J Med Chem 14,262, (1971), одержуючи вказану сполуку С Одержання циклічних пдразонів 3,4-Діазо-1,2,3,9,10,10а-гексапдрофенантрен (XX) 3,4-Діазо-1,2,3,9,10,10а-гексапдрофенантрен2-он (XIV) (2 5г, 12 5ммоль) розчиняли в ТГФ і по краплям додавали 1 еквівалент літійалюмопдриду (21 мл, 1М розчин в ТГФ) Після ЗО хвилин при 22°С , по краплям додавали 15% розчин NaOH і желатиноподібний осад відфільтровували Фільтрат сушили над сульфатом магнію, фільтрували і 48989 20 відганяли розчинник під вакуумом, одержане масло, як вихідний матеріал, використовували без подальшої очистки 7-Хлор-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен (XXI) 7-Хлор-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен-2-он (XVIII) розчиняли в ТГФ і по краплям додавали 1 еквівалент літійалюмопдриду (1М розчин в ТГФ) Після ЗО хвилин при 22°С, по краплям додавали 15% розчин NaOH і осад відфільтровували Фільтрат сушили над сульфатом магнію, фільтрували і відганяли розчинник під вакуумом, одержане масло, як вихідний матеріал, використовували без подальшої очистки 8-Бром-3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин(ХХІІ) 8-Бром-3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин-2-он (XIX) (1г, З 4ммоль) розчиняли в ТГФ і по краплям додавали 2 еквіваленти диборану (1М розчин в ТГФ) Після 2 годин при 22°С суміш гасили 1 мл 6М НСІ і нейтралізували 50% розчин NaOH, потім сушили над сульфатом магнію і фільтрували Розчинник відганяли під вакуумом, одержане масло, використовували без подальшої очистки 8-Бром-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен (XXIII) 8-Бром-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен-2-он (XVI) (1 0г, 3 бммоль) розчиняли в ТГФ (ЮОмл) і по краплям додавали 2 еквіваленти диборану (1М розчин в ТГФ) Після 1 годин при 22°С суміш нагрівали на паровій бані 5 хвилин, гасили 1мл 6М ПСІ і нейтралізували 15% розчин NaOH, потім сушили над сульфатом магнію і фільтрували Розчинник відганяли під вакуумом, одержане масло, використовували без подальшої очистки 7,8-Дибром-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен (XXIV) 7,8-Дибром-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен-2-он (XVII) (0 71г, 1 98ммоль) суспендували в ТГФ і по краплям при 22°С додавали 2 еквіваленти диборану (3 96мл, 1М розчин в ТГФ) Суміш швидко нагрівали до 45°С до розчинення твердого залишку і потім перемішували при кімнатній температурі 60 годин Гасили 1мл 6М НСІ і нейтралізували 50% розчин NaOH, потім сушили над сульфатом магнію її фільтрували Розчинник відганяли під вакуумом, одержане масло, використовували без подальшої очистки 3,4-Діазо-1,2,3,9,9а-тетрапдрофлуорен (XXV) 3,4-Діазо-1,2,3,9,9а-гексапдрофлуорен-2-он (XIII) (3 5г, 17 5ммоль) розчиняли в ТГФ і по краплям додавали 1 еквівалент літійалюмопдриду (1М розчин в ТГФ) Після ЗО хвилин при 22°С, по краплям додавали 15% розчин NaOH і желатиноподібний осад відфільтровували Фільтрат сушили над сульфатом магнію, фільтрували і відганяли розчинник під вакуумом, одержане масло, як вихідний матеріал, використовували без подальшої очистки З 4-Діазо-9-окса-1,2,3 9,10,10атетрапдрофенантрен(ХХУІ) 21 3,4-Діазо-9-окса-1,2,3,9,10,10aгексапдрофлуорен-2-он (15ммоль) одержували, як описано в (Cignarella, G , Вапоссо, D , Curzu, М М , Pinna, G А , Cazzulam, Р , Cassm, M , Lumachi, В Eur J Med Chem 25(9), 749-56, (1990)) взаємодією з 2 еквівалентами диборану З 4-Діазо-9-тіа-1,2 3,9,10,10атетрапдрофенантрен (XXVII) 3,4-Діазо-9-тіа-1,2,3,9,10,10агексапдрофлуорен-2-он (Іоммоль) одержували, як описано в (Nakao, tohru, Tanaka, Hiroshi, Monmoto, Yasuto, Takehara, Shuzo, Demizu, Kemchi, Tahara, Tetsuya Yakugaku Zasshi, 110(12), 922-31 (1990)) Взаємодією з 2 еквівалентами диборану Наступні приклади ілюструють представлений винахід, і не спрямовані на обмеження кордонів цього винаходу Приклади Приклад 1 8-Бром-3,4,4а,5,6,7-гексапдро-2(4-йодбензенсульфоніл)-2Нбенз[6,7]циклогепта[1,2-с]піридазин 8-Бром-3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин (XIX) (1 0г, З бммоль) і 4-йодбензенсульфонілхлорид (1 2г, З бммоль) додавали до суміші 50мл дихлорметану і 50мл піридину Суміш перемішували 64 години при 22°С до глибоко червоного кольору Суміш концентрували під вакуумом і піридиновий розчин виливали на лід і 6М НСІ, екстрагували дихлорметаном Органічний шар концентрували під вакуумом і фільтрували крізь силікагель за допомогою дихлорметану, одержуючи 1 Зг майже білої речовини, яку перекристалізовували з ізопропанол/хлороформ, отримуючи білу речовину з Тпл 180-181 °С Розраховано для Ci9Hi8BrlN2O2S С, 41 85, Н, 3 33, N, 5 14 Знайдено С, 41 68, Н, З 27, N, 5 03 Приклад 2 8-Бром-3,4-діазо-1,2,3,9,10,Юагексапдро-3-(4-йодбензенсульфопіл)-фенантрен 8-Бром-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен (XXI) (1 0г, 3 77ммоль) і 4йодбензенсульфонілхлорид (1 14г, 3 77ммоль) розчиняли в ЮОмл піридину Суміш перемішували 16 годин при 22°С до глибоко червоного кольору Суміш виливали на лід і 6М НСІ і екстрагували дихлорметаном Органічний шар концентрували під вакуумом і фільтрували крізь силікагель, елюент дихлорметан, одержуючи 0 Зг неочищенної речовини, яку перекристалізовували з гексану, отримуючи 0 28г майже білої речовини з Тпл 197-198°С Розраховано для CisHieBrllN^S С, 40 76, Н, З 04, N, 5 27 Знайдено С, 40 59, Н, 2 89, N, 5 06 Приклад 3 7,8-Дибром-3,4-діазо1,2,3,9,10,Юа-гексапдро-3-(4йодбензенсульфоніл)-фенантрен 7,8-Дибром-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен (XVI) (0 7г, 1 9ммоль) і 4йодбензенсульфонілхлорид (1 14г, 3 77ммоль) розчиняли в ЮОмл піридину Суміш перемішували 16 годин при 22°С до глибоко червоного коліру Суміш виливали на лід і 6М НСІ і екстрагували дихлорметаном Органічний шар концентрували під вакуумом і фільтрували крізь 48989 22 силікагель, елюент дихлорметан, одержуючи неочищену речовину, яку перекристалізовували з гексану, отримуючи 0 1г білої речовини з Тпл 202-203°С Розраховано для Ci8Hi5Br2lN2O2S C, 35 44, Н, 2 48, N, 4 59 Знайдено С, 35 54, Н, 2 47, N, 4 61 Приклад 4 7-Хпор-3,4-діазо-1,2,3,9,10,10агексапдро-3-(4-йодбензенсульфоніл)-фенантрен 7-Хпор-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен (XXI) (1 1г, 5 0ммоль) і 4йодбензенсульфонілхлорид (1 2г, 3 9ммоль) розчиняли в 50мл дихлорметану і 50мл піридину Суміш перемішували 20 годин при 22°С до глибоко червоного кольору Суміш концентрували під вакуумом і піридоновий розчин виливали на лід і 6М НСІ, екстрагували дихлорметаном Органічний шар концентрували під вакуумом і фільтрували крізь силікагель, елюент дихлорметан, одержуючи майже білу речовину, яку перекристалізовували з гексану, отримуючи 0 5г білої речовини з Тпл 194-195°С Розраховано для C18H10CIIN2O2S С, 44 42, Н, 3 31, N, 5 76 Знайдено С, 44 73, Н, 3 24, N, 5 31 Приклад 5 7-Хпор-3,4-діазо-1,2,3,9 10,10агексапдро-3-(2,5-дихлорбензенсульфоніл)фенантрен 7-Хлор-3,4-діазо-1,2,3,9,10,10агексапдрофенантрен (XXI) (1 0г, 4 77ммоль) і 2,5дихлорбензенсульфонілхлорид (1 2г, 4 9ммоль) розчиняли в ЮОмл піридину Суміш перемішували 16 годин при 22°С до глибоко червоного кольору Суміш виливали на лід і 6М НСІ і екстрагували дихлорметаном Органічний шар концентрували під вакуумом і фільтрували крізь силікагель, елюент дихлорметан, одержуючи 0 5г неочищенної речовини, яку ДВІЧІ перекристалізовували з гексан/хлороформ, отримуючи 0 25г майже білої речовини з Тпл 186-187°С Розраховано для C18H15CI3N2O2S С, 50 31, Н, 3 52, N, 6 52 Знайдено С, 50 23, Н, 3 45, N, 6 44 Приклад 6 3-(3,4-Дихлорбензоіл)-3,4-діазо1,2,3,9,10,10а-гексапдрофенантрен 3,4-Діазо-1,2,3,9,Ю,10а-гексапдрофенантрен (XXI) (2 67г, 14 3ммоль) і 3,4дихлорбензоілхлорид (3 0г) розчиняли в ЮОмл піридину Суміш перемішували 16 годин при 22°С Суміш виливали в дихлорметан і ДВІЧІ промивали 2М НСІ і потім сушили над сульфатом натрію і фільтрували Фільтрат концентрували і фільтрували крізь силікагель, елюент дихлорметан, одержуючи 3 7г майже білої речовини з Тпл 154-5°С Розраховано для C19H16CI2N2O С, 63 52, Н, 4 49, N, 7 80 Знайдено С, 63 18, Н, 4 39, N, 7 52 Приклад 7 3-(3,5-Дихлорбензоіл)3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин 3,4,4а,5,6,7-Гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин (XV) (2 0г, 10ммоль) і 3,5-дихлорбензоілхлорид (21 г, Юммоль) розчиняли в 75мл дихлорметану і додавали 5мл триетиламіну Суміш перемішували 16 годин при 22°С і розчинник відганяли під вакуумом Залишок розчиняли в дихлорметані і про 23 мивали розведеною НСІ, сушили над сульфатом натрію і фільтрували і хроматографували на силікагелі, елюент дихлорметан, одержуючи 2 5г білої речовини з Тпл 115-116°С Розраховано для C20H18CI2N2O С, 64 35, Н, 4 86, N, 7 50 Знайдено С, 64 38, Н, 4 56, N, 7 56 Приклад 8 2-(3,4-Дифторбензоіл)3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин 3,4,4а,5,6,7-Гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин (XV) (2 0г, Юммоль) і 3,4-дифторбензоілхлорид (21г, Юммоль) розчиняли в 75мл дихлорметану і додавали 5мл триетиламіну Суміш перемішували 16 годин при 22°С і розчинник відганяли під вакуумом Залишок розчиняли в дихлорметані і промивали розведеною НСІ, сушили над сульфатом натрію і фільтрували і хроматографували на силікагелі, елюент дихлорметан, одержуючи 2 8г білої речовини з Тпл 117-118°С Розраховано для C20H18F2N2O С, 70 58, Н, 5 33, N, 8 23 Знайдено С, 70 59, Н, 5 26, N, 8 35 Приклад 9 3-(3,4-Дихлорбензоіл)3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]пиклогепта[1,2-с]піридазин 3,4,4а,5,6,7-Гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин (XV) (2 24г, 11 2ммоль) і 3,4-дихлорбензоілхлорид (2 34г, 11 2ммоль) розчиняли в ЮОмл дихлорметану і додавали Юмл триетиламіну Суміш перемішували 16 годин при 22°С і розчинник відганяли під вакуумом Залишок розчиняли в дихлорметані і промивали розведеною НСІ, сушили над сульфатом натрію і фільтрували і хроматографували на силікагелі, елюент дихлорметан, одержуючи 2 0г жовто-блідої речовини з Тпл 136-137°С Розраховано для C20H18CI2N2O С, 64 35, Н, 4 86, N, 7 50 Знайдено С, 64 29, Н, 4 80, N, 7 39 Приклад 10 3-(3,4-Дифторбензоіл)-3,4-діазо1,2,3,9,10,10а-гексапдрофепантрен 3,4-Діазо-1,2,3,9,10,10а-гексапдрофенантреп (XIV) (1 83г, 9 82ммоль) і 3,4дифторбензоілхлорид (1 73г, 9 82ммоль) розчиняли в 75мл дихлорметану і додавали 5мл триетиламіну Суміш перемішували 16 годин при 22°С і розчинник відганяли під вакуумом Залишок розчиняли в дихлорметані і промивали розведеною НСІ, сушили над сульфатом натрію і фільтрували і хроматографували на силікагелі, елюент дихлорметан, одержуючи 1 4г білої речовини з Тпл 146-147°С Розраховано для C19H16F2N2O С, 69 93, Н, 4 94, N, 8 58 Знайдено С, 69 78, Н, 4 72, N,8 79 Приклад 11 3-(3,5-Дихлорбензоіл)-3,4-діазо1,2,3,9,10,10а-гексапдрофенантрен 3,4-Діазо-1,2,3,9,10,10а-гексапдрофенантрен (XIV) (2 67г, 14 3ммоль) і 3,5дихлорбензоілхлорид (3 0г) розчиняли в 250мл дихлорметану і додавали 10мл триетиламіну Суміш перемішували 1 годину при 22°С і розчинник відганяли під вакуумом Жовтий залишок розчиняли в дихлорметані і промивали розведеною НСІ, сушили над сульфатом натрію і фільт 48989 24 рували і хроматографували на силікагелі, елюент ефір/дихлорметан (21), одержуючи 3 0г білої речовини з Тпл 141 -142°С Розраховано для C19H16CI2N2O С, 63 52, Н, 4 49, N, 7 84 Знайдено С, 63,45, Н, 4 14, N, 7 70 Приклад 12 3-(3,4-Дихлорбензоіл)-3,4-діазо9-окса-1,2,3,9,10,10а-гексапдрофенантрен 3,4-Діазо-9-окса-1,2,3,9,10,10агексапдрофенантрен XXVI (1 73г, 9 2ммоль) і 3,4дихлорбензоілхлорид (1 93г) розчиняли в 200мл дихлорметану і додавали 150мл триетиламіну Суміш перемішували 14 годин при 22°С і розчинник відганяли під вакуумом Жовтий залишок розчиняли в дихлорметані і промивали розведеною НСІ, сушили над сульфатом натрію і фільтрували і хроматографували на силікагелі, елюент дихлорметан, одержуючи 1 2г майже білої речовини з Тпл 166-167°С Розраховано для Ci8Hi4Cl2Na202 С, 59 85, Н, 3 91, N, 7 75 Знайдено С, 59 83, Н, 3 86, N,7 73 Приклад 13 3-(3,4-Дихлорбензоіл)-3,4-діазо9-тіа-1,2,3,9,10,10а-гексапдрофенантрен 3,4-Діазо-9-тіа-1,2,3,9,10,10агексапдрофенантрен XXVI (1 33г, 6 бммоль) і 3,4дихлорбензоілхлорид (1 38г, 6 бммоль) розчиняли в ЮОмл дихлорметану і додавали ЮОмл триетиламіну Суміш перемішували 48 годин при 22°С і розчинник відганяли під вакуумом Жовтий залишок розчиняли в дихлорметані і промивали розведеною НСІ, сушили над сульфатом натрію і фільтрували і хроматографували на силікагелі, елюент ефір/дихлорметан (2 1), одержуючи 1 0г майже білої речовини, яку перекристалізовували з бензол-гексан, одеожуючи 0 84г білої речовини з Тпл 145-146°С Розраховано для C18H14CI2N2OS С, 59 85, Н, З 91, N, 7 75 Знайдено С, 59 83, Н, 3 86, N,7 73 Приклад 14 3-(3,4-Дихлорбензоіл)-3,4-діазо1,2,3,9,9а-тетрапдрофлоурен 3,4-Діазо-1,2,3,9,9атетрапдрофлуорен (XXV) (1 6г, 9 Зммоль) і 3,4дихлорбензоілхлорид (1 95г, 9 Зммоль) розчиняли в ЮОмл дихлорметану і додавали Юмл триетиламіну Суміш перемішували 16 годин при 22°С і розчинник відганяли під вакуумом Жовтий залишок розчиняли в дихлорметані і промивали розведеною НСІ, сушили над сульфатом натрію і фільтрували і хроматографували на силікагелі, елюент дихлорметан, одержуючи 11г майже білої речовини з Тпл 122-124°С Розраховано для C18H14CI2N2O С, 62 60, Н, 4 09, N, 8 12 Знайдено С, 62 50, Н, 4 11, N, 7 90 Приклад 15 2-(3,5-Дихлортюбензоіл)3,4,4а,5,6,7-гексапдро-2Н-бенз[6,7]циклогепта[ 1,2-с]піридазин 2-(3,5-Дихлорбензоіл)-3,4,4а,5,6,7-гексапдро2Н-бенз[6,7]циклогепта[1,2-с]піридазин з Прикладу 7 (1 22г, 3 27ммоль) і пентасульфід фосфору (2 14г, 3 9ммоль) розчиняли в 200мл толуолу і нагрівали 1 годину при Ю0°С Суміш охолоджували, фільтрували крізь шар силікагелю і промивали дихлорметаном Фільтрат випарювали досуха і залишок очищали колонковою хроматографією, елюент дихлорметан, одержуючи 1 2г жовтої речовини, яку перекристалізовували з ефіру, отримуючи бажану сполуку (1 0г) з 25 Тпл 149-150°С Розраховано для C20H18CI2N2S С, 61 40, Н, 4 66, N, 7 19 Знайдено С, 61 67, Н, 4 65, N, 7 06 Приклад 16 2-(3,4-Дифтортюбензоіл)3 4 4а 5 6,7-гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин 2-(3,4-Дифторбензоіл)-3,4,4а,5,6,7гексатідро-2Н-бенз[6,7]циклогепта[1,2-с]піридазин 3 Прикладу 8 (1 5г, 4 4ммоль) і пентасульфід фосфору (1 74г, 5 Зммоль) розчиняли в 200мл толуолу і нагрівали 1 годину Суміш охолоджували, фільтрували крізь шар силікагелю і промивали дихлорметаном Фільтрат випарювали досуха і залишок очищали колонковою хроматографією, елюент дихлорметан, одержуючи 1 Зг жовтої речовини, яку перекристалізовували з ефіру, отримуючи бажану сполуку (0 83г) з Тпл 134-136°С Розраховано для C2oHi8FN2S С, 67 40, Н, 5 09, N, 7 86 Знайдено С, 61 28, Н, 5 03, N, 7 94 Приклад 17 2-(3,4-Дихлортюбснзоіл)3,4,4а,5,6,7-гексапдро-2Нбенз[6,7]циклогепта[1,2-с]піридазин 2-(3,4-Дихлорбензоіл)-3,4,4а,5,6,7-гексапдро2Н-бенз[6,7]циклогепта[1,2-с]піридазин з Прикладу 9 (1 5г, 4 Оммоль) і пентасульфід фосфору (2 7г, 6 Оммоль) розчиняли в 150мл толуолу і нагрівали ЗО хвилин при 100°С Суміш охолоджували, фільтрували крізь шар силікагелю і промивали дихлорметаном Фільтрат випарювали досуха і залишок очищали колонковою хроматографією, елюент дихлорметан, одержуючи 1 Зг жовтої речовини, яку перекристалізовували з ефіру, отримуючи бажану сполуку (1 0г) з Тпл 140-141 °С Розраховано для C20H18CI2N2S С, 61 40, Н, 4 66, N, 7 19 Знайдено С, 61 78, Н, 4 69, N, 7 09 Приклад 18 3-(3,4-Дифтортюбензоіл)-3,4діазо-1,2,3,9,10,10а-гексапдрофенантрен 3-(3,4-Дифторбензоіл)-3,4-діазо1,2,3,9,10,10а-гексапдрофенантрен з Прикладу 10 (1 0г, 3 06ммоль) і пентасульфід фосфору (2 05г, 4 6ммоль) розчиняли в 150мл толуолу і нагрівали 1 5 годину Суміш охолоджували, фільтрували крізь шар силікагелю і промивали дихлорметаном Фільтрат випарювали досуха і залишок очищали колонковою хроматографією, елюент дихлорметан, одержуючи 0 8г жовтої речовини, з Тпл 170-171°С Розраховано для C19H16F2N2S С, 66 65, Н, 4 71, N, 8 18 Знайдено С, 66 32, Н, 4 76, N, 819 Приклад 19 3-(3,4-Дихлортюбензоіл)-3,4діазо-1,2,3,9,10,10а-гексапдрофенантрен 3-(3,4-Дихлорбензоіл)-3,4-діазо1,2,3,9,10,10а-гексапдрофенантрен з Прикладу 10 (1 06г, 2 95ммоль) її пентасульфід фосфору (1 17г, 3 83ммоль) розчиняли в 150мл толуолу і 48989 26 нагрівали 1 5 годину Суміш охолоджували, фільтрували крізь шар силікагелю і промивали дихлорметаном Фільтрат випарювали досуха і залишок очищали колонковою хроматографією, елюент дихлорметан, одержуючи 0 8г жовтої речовини, зТпл 110-111 °С Розраховано для C19H16C2N2S С, 60 80, Н, 4 ЗО, N, 7 46 Знайдено С, 60 74, Н, 4 11, N, 7 47 Приклад 20 3-(3,5-Дихлортюбензоіл)-3,4діазо-1,2,3,9,10,10а-гексапдрофенантрен 3-(3,5-Дихлорбензоіл)-3,4-діазо1,2,3,9,10,10а-гексапдрофенантрен з Прикладу 11 (1 5г, 4,2ммоль) м пентасульфід фосфору (1 69г, 4 2ммоль) розчиняли в 150мл толуолу і нагрівали при 80°С 1 годину Суміш охолоджували, фільтрували крізь шар силікагелю і промивали дихлорметаном Фільтрат випарювали досуха і залишок очищали колонковою хроматографією, елюент дихлорметан, перекристалізовували зефір/гексан, одержуючи 11г жовтої речовини з Тпл 162-163°С Розраховано для C19H16CI2N2S С, 60 80, Н, 4 30, N, 7 46 Знайдено С, 60 78, Н, 4 26, N, 7 22 Приклад 21 3-(3,4-Дихлортюбензоіл)-3,4діазо-9-окса-1,2,3,9,10,10а-гексапдрофенантрен 3-(3,4-Дихлорбензоіл)-3,4-діазо-9-окса1,2,3,9,10,10а-гексапдрофенантрен з Прикладу 12 (0 6г, 1 ббммоль) і пентасульфід фосфору (0 96г, 2 1ммоль) розчиняли в ЮОмл толуолу і нагрівали 1 5 години Суміш охолоджували, фільтрували крізь шар силікагелю і промивали дихлорметаном Фільтрат випарювали досуха і залишок очищали колонковою хроматографією, елюент дихлорметан, одержуючи 0 5г жовтої речовини з Тпл 187-188°С Розраховано для C18H14CI2N2OS С, 57 ЗО, Н, З 74, N, 7 43 Знайдено С, 57 09, Н, 3 75, N, 7 29 Приклад 22 3-(3,4-Дихлортюбензоіл)-3,4діазо-1,2,3,9,9а-тетрапдрофлуорен 3-(3,4-Дихлорбензоіл)-3,4-діазо-1,2,3,9,9атетрапдрофлуорен з Прикладу 14 (0 63г, 1 8ммоль) и пентасульфід фосфору (1 05г, 2 Зммоль) розчиняли в ЮОмл толуолу і нагрівали 1 5 години Суміш охолоджували, фільтрували крізь шар силікагелю і промивали дихлорметаном Фільтрат випарювали досуха і залишок очищали колонковою хроматографією, елюент дихлорметан, одержуючи 0 5г жовтої речовини з Тпл 138-140°С Розраховано для C18H14CI2N2S С, 59 84, Н, 3 91, N, 7 76 Знайдено С, 59 77, Н, 3 97, N, 7 76 27 48989 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 1-arylsulfonyl, aryl(thio)carbonylpyridazine, method of their preparation, pharmaceutical composition and method of treatment
Назва патенту російськоюПроизводные 1-арилсульфонил, арил(тио)карбонилпиридазина, способ их получения, фармацевтическая композиция и способ лечения
МПК / Мітки
МПК: C07D 491/04, A61P 15/00, A61K 31/50, A61P 15/06, A61P 35/00, A61P 15/18, C07D 491/044, C07D 495/04, C07D 237/26, A61K 31/502, A61K 31/00, C07D 237/36, A61K 31/5025
Мітки: 1-арилсульфоніл, фармацевтична, лікування, композиція, похідні, одержання, спосіб, арил(тіо)карбонілпіридазину
Код посилання
<a href="https://ua.patents.su/14-48989-pokhidni-1-arilsulfonil-ariltiokarbonilpiridazinu-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-арилсульфоніл, арил(тіо)карбонілпіридазину, спосіб їх одержання, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Спосіб підвищення продуктивності каталітичного розчину карбонілювання (варіанти), спосіб карбонілювання метанолу
Наступний патент: Спосіб зброджування сусла із крохмалевмісної сировини
Випадковий патент: Спосіб оцінки рівня популяційного здоров'я населення