Похідні етаноламіну, спосіб їх одержання, фармацевтична композиція, спосіб лікування
Номер патенту: 41869
Опубліковано: 15.10.2001
Автори: Таке Казухіко, Танігуті Кійосі, Нагано Масанобу, Тсубакі Казунорі, Като Такесі, Сіокава Юіті
Формула / Реферат
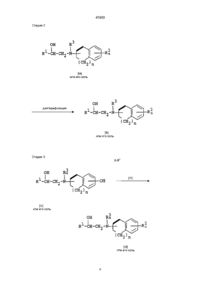
1. Производные этаноламина общей формулы (I):
где R1 - фенил, нафтил, инданил, пиридил, бензофуразанил или бензодиоксолил, каждый из которых может содержать такие заместители, как атом галогена или гидрокси,
R2 - атом галогена, нитрогруппа, оксигруппа, низшая алкинильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой,
R3 - атом водорода, бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппой,
n - целое число от 0 до 3, а
жирная линия означает простую связь или двойную связь,
при этом, если n равняется 1, то
1) R1 - нафтил, пиридил, бензофуразанил или бензодиоксолил, каждый из которых может содержать такие заместители, как галоген или гидрокси,
2) R2 - атом галогена, нитрогруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой,
3) R3 - бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппой,
4) жирная линия означает двойную связь, и его фармацевтически приемлемые соли.
2. Соединение формулы (I) по п. 1, в котором
R1 - фенильная группа, необязательно замещенная атомом галогена,
R2 - низшая алкоксигруппа, замещенная карбоксильной группой или этерифицированной карбоксильной группой,
R3 - атом водорода,
n равно 0, 2 или 3,
жирная линия означает простую связь.
3. Соединение по п. 2, в котором
R1 - фенильная группа, замещенная атомом галогена,
R2 - метоксигруппа, замещенная низшей алкоксикарбонильной группой.
4. Соединение по п. 3, в котором
R1 - фенильная группа, замещенная атомом хлора,
R2 - метоксигруппа, замещенная низшей этоксикарбонильной группой,
n равно 2.
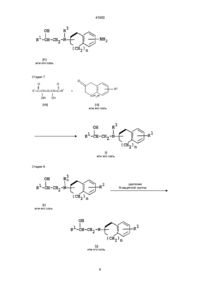
5. Соединение по п. 4, которое является (1R,6'S)-2-[(3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-ил)амино]-1-(3-хлорфенил)этанолом или его гидрохлоридом.
6. Производные этаноламина формулы (I) по п. 1, обладающие антиспазматической, антигиперанакинезиатической и антидизурической активностью.
7. Способ получения производных этаноламина общей формулы (I):
где R1 - фенил, нафтил, инданил, пиридил, бензофуразанил или бензодиоксолил, каждый из которых может содержать такие заместители, как атом галогена или гидрокси,
R2 - атом галогена, нитрогруппа, оксигруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой,
R3 - атом водорода, бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппой,
n - целое число от 0 до 3, а
жирная линия означает простую связь или двойную связь,
при этом, если n равняется 1, то
1) R1 - нафтил, пиридил, бензофуразанил или бензодиоксолил, каждый из которых может содержать такие заместители, как галоген или гидрокси,
2) R2 - атом галогена, нитрогруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой,
3) R3 - бензил или низшая алкильная группа, дополнительно замещенная низшей алкилтиогруппой,
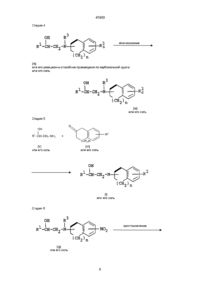
4) жирная линия означает двойную связь, и его фармацевтически приемлемые соли, отличающийся тем, что осуществляют взаимодействие соединения формулы (II):
с соединением формулы (III):
или его солью с получением соединения формулы (I) или его соли, где R1, R2, R3 и жирная линия имеют значения, указанные выше.
8. Фармацевтическая композиция для лечения и/или профилактики расстройств мочеиспускания, спазмов или повышенной перистальтики желудочно-кишечного тракта, отличающаяся тем, что в качестве активного ингредиента она включает эффективное количество соединения общей формулы (I) по п. 1 совместно с фармацевтически приемлемым нетоксичным носителем или инертным наполнителем.
9. Способ лечения и/или профилактики расстройств мочеиспускания, спазмов или повышенной перистальтики желудочно-кишечного тракта, состоящий в назначении людям или животным эффективного количества соединения формулы (I) по п. 1.
Текст
1 Производные этаноламина общей формулы (I) ОН -ca R (CI Vn .(„ где R1 - фенил, нафтил, инданил, пиридил, бензофуразанил или бензодиоксолил, каждый из которых может содержать такие заместители, как атом галогена или гидрокси, R2 - атом галогена, нитрогруппа, оксигруппа, низшая алкинильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой, R3 - атом водорода, бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппои, п - целое число от 0 до 3, а жирная линия означает простую связь или двойную связь, при этом, если п равняется 1, то 1) R1 - нафтил, пиридил, бензофуразанил или бензодиоксолил, каждый из которых может со ю держать такие заместители, как галоген или гидрокси, 2) R2 - атом галогена, нитрогруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой, 3) R3 - бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппои, 4) жирная линия означает двойную связь, и его фармацевтически приемлемые соли 2 Соединение формулы (І) по п 1, в котором R1 - фенильная группа, необязательно замещенная атомом галогена, R2 - низшая алкоксигруппа, замещенная карбоксильной группой или этерифицированной карбоксильной группой, R3 - атом водорода, п равно 0, 2 или 3, жирная линия означает простую связь 3 Соединение по п 2, в котором R1 - фенильная группа, замещенная атомом галогена, R2 - метоксигруппа, замещенная низшей алкоксикарбонильной группой 4 Соединение по п 3, в котором R1 - фенильная группа, замещенная атомом хлора, 2 R - метоксигруппа, замещенная низшей этоксикарбонильной группой, п равно 2 5 Соединение по п 4, которое является (1R,6'S)2-[(3-этоксикарбонилметокси-6,7,8,9-тетрагидро5Н-бензоциклогептен-6-ил)амино]-1-(3хлорфенил)этанолом или его гидрохлоридом 6 Производные этаноламина формулы (І) по п 1, обладающие антиспазматической, антигиперанакинезиатической и антидизурической активностью 7 Способ получения производных этаноламина общей формулы (I) О (О 00 41869 где R1 - фенил, нафтил, инданил, пиридил, бензофуразанил или бензодиоксолил, каждый из которых может содержать такие заместители, как атом галогена или гидрокси, R2 - атом галогена, нитрогруппа, оксигруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой, R - атом водорода, бензил или низшая алкильная группа, необязательно замещенная низшей алкилтиогруппой, п - целое число от 0 до 3, а жирная линия означает простую связь или двойную связь, при этом, если п равняется 1, то 1) R1 - нафтил, пиридил, бензофуразанил или бензодиоксолил, каждый из которых может содержать такие заместители, как галоген или гидрокси, 2) R2 - атом галогена, нитрогруппа, низшая алкильная группа, необязательно замещенная ацильной группой, низшая алкенильная группа, необязательно замещенная ацильной группой, низшая алкоксигруппа, необязательно замещенная ацильной группой, или аминогруппа, необязательно замещенная ацил(низшей)алкильной группой, 3) R3 - бензил или низшая алкильная группа, дополнительно замещенная низшей алкилтиогруппой, 4) жирная линия означает двойную связь, и его фармацевтически приемлемые соли, отличаю щийся тем, что осуществляют взаимодействие соединения формулы (II) Настоящее изобретение относится к новым производным этаноламина и их фармакологически приемлемым солям, которые могут быть использованы в качестве лекарств Известны некоторые производные этаноламина, проявляющие антиспазматическую активность и обладающие расслабляющим воздействием при сокращении гладких мышц, как это описано, например, в Европейских патентах с номерами 0211721, 0225415 и 0383686 Настоящее изобретение относится к новым производным этаноламина и их фармакологически приемлемым солям Более конкретно, оно относится к новым производным этаноламина и их фармакологически приемлемым солям, которые обладают по отношению к кишечнику селективной симпатомиметической активностью и активностью против учащенного мочеиспускания, способу их получения, содержащим их фармакологическим композициям и способу их терапевтического использования для лечения и/или профилактики расстройств желудочно-кишечного тракта, вызванных сокращением гладких мышц человека или животных, а еще более конкретно, к способу лечения и/или профилактики спазма повышенной перистальтики желудоч но-кишечного тракта в случае синдрома раздражения кишечника, гастрита, язвы желудка, язвы двенадцатиперстной кишки, воспаления тонкой кишки, воспаления желчного пузыря, воспаления желчных протоков, мочекаменной болезни и т п и к способу лечения и/или профилактики расстройств мочеиспускания, таких как учащенное мочеиспускание, недержание мочи и т п в случае нервного учащенного мочеиспускания, нейрогенной дисфункции мочевого пузыря, ночной полиурии, нестабильного мочеиспускания, спазма мочевого пузыря, хронического цистита, хронического простатита и т п Ожидается также, что заявляемые соединения могут быть использованы в качестве терапевтических и/или профилактических средств против ожирения и глаукомы Первая цель настоящего изобретения состоит в том, чтобы предложить новые и полезные производные этаноламина и их фармакологически приемлемые соли, которые обладают по отношению к кишечнику селективной симпатомиметической активностью и активностью против учащенного мочеиспускания Еще одна цель настоящего изобретения состоит в том, чтобы предложить фармацевтическую композицию, которая включает указанные о X R -CH-CH, (II) с соединением формулы (III) Е3 HN -R' п (но или его солью с получением соединения формулы (I) или его соли, где R1, R2, R и жирная линия имеют значения, указанные выше 8 Фармацевтическая композиция для лечения и/или профилактики расстройств мочеиспускания, спазмов или повышенной перистальтики желудочно-кишечного тракта, отличающаяся тем, что в качестве активного ингредиента она включает эффективное количество соединения общей формулы (І) по п 1 совместно с фармацевтически приемлемым нетоксичным носителем или инертным наполнителем 9 Способ лечения и/или профилактики расстройств мочеиспускания, спазмов или повышенной перистальтики желудочно-кишечного тракта, состоящий в назначении людям или животным эффективного количества соединения формулы (I) по п 1 41869 производные этаноламина и их фармакологически приемлемые соли в качестве активных ингредиентов Наконец, еще одна цель настоящего изобретения состоит в том, чтобы предложить терапевтический метод для лечения и/или профилактики указанных выше заболеваний человека или животных, с использованием указанных производных этаноламина и их фармакологически приемлемых солей Заявляемые производные этаноламина могут быть представлены следующей общей формулой (I) щенная ацильной группой, низшая алкокси-группа, дополнительно замещенная ацильной группой, или амино-группа, дополнительно замещенная ацил (низшей) алкильной группой, R3 - атом водорода, N-защитная группа или низшая алкильная группа, дополнительно замещенная низшей алкилтио-группой, п - целое число от 0 до 3, а жирная линия означает простую связь или двойную связь, при этом, если п равняется 1, то 1) R1 - конденсированная ароматическая углеводородная группа или гетероциклическая группа, каждая из которых может содержать такие заместители, как галоген, окси-группа, защищенная окси-группа, арилокси-группа, низшая алкоксигруппа, галоид (низшая) алкокси-группа, нитрогруппа, циано-группа, амино-группа или ациламино-группа, 2) R2 - атом галогена, нитро-группа, низшая алкильная группа, дополнительно замещенная ацильной группой, низшая алкенильная группа, дополнительно замещенная ацильной группой, низшая алкокси-группа, дополнительно замещенная ацильной группой, или амино-группа, дополнительно замещенная ацил (низшей) алкильной группой, 3) R3 - N-защитная группа или низшая алкильная группа, дополнительно замещенная низшей алкилтио-группой, 4) жирная линия означает двойную связь, и их фармацевтически приемлемые соли Заявляемое соединение 1 или его соли могут быть получены по следующим процессам R ОН K 1 -CH-CH 2 -N сн 2 ) п (I) где R1 - арильная или гетероциклическая группа, каждая из которых может содержать такие заместители, как галоген, окси-группа, защищенная окси-группа, арилокси-группа, низшая алкокси-группа, галоид (низшая) ал кокс и-груп па, нитро-группа, диано-группа, амино-группа или ациламино-группа, R2 - атом водорода, атом галогена, нитрогруппа, гидрокси-группа, низшая алкильная группа, дополнительно замещенная ацильной группой, низшая алкенильная группа, дополнительно заме Стадия 1 О "О Р. или его соль R2 ОН 2 —f II —НОН сн 2 ) п [I] или его соль 41869 Стадия 2 ОН R 1 R -CH-CH2-N [la] или его соль диэтерификация • R -CH-CH~-N [ІЬ] или его соль Стадия 3 X-R4 ОН ^ s R -CH-CHj-N [IV] [Ic] или его соль R* он или его соль 41869 Стадия 4 аминирование (сн 2 ) п [Ib] или его реакционно-способное производное по карбональнои группе или его соль ОН R R1-CH-CH2-N (сн 2 ) п или его соль Стадия 5 ОН R 1 -CH-CH 2 -NH 2 [VI] или его соль [V] или его соль он R 1 -CH-CH 2 -N lCH 2>n И или его соль Стадия 6 восстановление 2 [ig] или его соль ) п 41869 OH R •—С —hNH9 [ih] или его соль Стадия 7 О О R 1 -C-CH-O-CH-C-R 1 ОН ОН [VII] или его соль ОН R 1 • > R -CH-CH^N [I] или его соль Стадия 8 ОН удаление N-защитной группы (сн 2 ) п или его соль OH -^4. 1 R -CH-CH 2 -N СН или его соль 2}п 41869 где R1, R2 и R3 и жирная линия имеют каждая то же значение, что и ранее, Ra2 - низшая алкильная группа, замещенная этерифицированной карбокси-группой, низшая алкенильная группа, замещенная этерифицированной карбокси-группой, низшая алкокси-группа, замещенная этерифицированной карбокси-группой, или амино-группа, замещенная этерифицированной карбокси (низшей) алкильной группой, RB2 - низшая алкильная группа, замещенная карбокси-группой, низшая алкенильная группа, замещенная карбокси-группой, низшая алкокси-группа, замещенная карбокси-группой, или аминогруппа, замещенная карбокси (низшей) алкильной группой, Ra3 - защитная группа или низшая алкильная группа, дополнительно замещенная низшей алкил-тио-группой, Rc2 - низшая алкокси-группа, дополнительно замещенная ацильной группой, R4 - низшая алкильная группа, дополнительно замещенная ацильной группой, К - кислотный остаток, Rd2 - низшая алкильная группа, низшая алкенильная группа, низшая алкокси-группа, каждая из которых включает карбамоильную группу, дополнительно замещенную низшей алкильной группой, низшей алкокси (низшей) алкильной группой, арилсульфонильной группой, низшей алкилсульфонильной группой или гетероциклической группой, или амино-группа, замещенная карбамоил (низшей) алкильной группой, в которой карбамоил может быть замещен низшей алкильной группой, низшей алкокси (низшей) алкильной группой, арилсульфонильной группой, низшей алкилсульфонильной группой или гетероциклической группой, Rt,3 - N защитная группа Приведенные выше и далее по тексту описания настоящего изобретения, соответствующие примеры различных определений, которые должны быть включены в объем притязаний по настоящему изобретению, подробно разъясняются ниже Термин "низший" использован, если не сделано дополнительных оговорок, для обозначения группы, содержащей от 1 до 6 атомов углерода Подходящим "галогеном" и галогеном в термине "галоген" (низшая) алкокси-группа может быть фтор, хлор, бром или йод, из которых предпочтительными являются хлор или бром Подходящей "низшей алкильной группой" и низшим алкильным фрагментом в терминах "ацил (низшая) алкильная группа" и "низшая алкилтиогруппа" может быть алкильная группа с прямой или разветвленной целью, например, метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изо-бутильная группа, пентильная группа, изо-пентильная группа, гексильная группа и т д , из которых предпочтительными являются метильная группа или этильная группа Подходящей "низшей алкенильной группой" может быть алкенильная группа с прямой или разветвленной цепью, например, этенильная группа, пропенильная группа, пентинильная группа, изопропенильная группа, бутенильная группа, гексе нильная группа и т д , из которых предпочтительной является этенильная группа, пропенильная группа, пентинильная группа, изопропенильная группа, бутенильная группа, гексенильная группа и т д , из которых предпочтительной является этенильная группа Подходящей "низшей алкокси-группой" и низшим алкокси-фрагментом в термине "галоген (низшая) алкокси-группа" может быть алкоксигруппа с прямой или разветвленной цепью, например, метокси-группа, этокси-группа, пропокси-группа, изо-пропокси-группа, бутокси-группа, пентилокси-группа и т д , из которых предпочтительными являются метокси-группа, этокси-группа, пропокси-группа или пентилокси-группа Подходящей "защищенной окси-группой" может быть замещенная низшая и алкокси-группа, такая как низшая алкокси (низшая) алкокси-группа (например, метоксиметокси-группа и т п ), низшая алкокси (низшая) алкокси (низшая) алкокси-группа например, метоксиэтоксиметокси-группа и т п ) замещенная или незамещенная арил (низшая) алкокси-группа (например, бензилокси-группа, нитробензилокси-группа и т п ) и т д , ацилокси-группа, такая как низшая алканоилокси-группа (например, ацетокси-группа, пропионилокси-группа, пивалоилокси-группа и т п ), ароилокси-группа (например, бензоилокси-группа, флюоренкарбонилокси-группа и т п ), низшая алкоксикарбокси-группа (например, метоксикарбокси-группа, этоксикарбоксигруппа, пропоксикарбокси-группа, изо-пропоксикарбокси-группа, бутоксикарбокси-группа, изо-бутоксикарбокси-группа, трет-бутокс и карбокси-группа, пентилоксикарбокси-группа, гексилоксикарбокси-группа и т п ), замещенная или незамещенная арил (низшая) алкоксикарбокси-группа (например, бензилокси-группа, бромбензилокси-группа и т п ) и т д , три (низший) алкилсилилокси-группа (например, триметилсилилокси-группа и т п ) и аналогичные группы Подходящей "арильной группой" и арильным фрагментом в терминах "арилокси-группа" и "арилсульфонильная группа" может быть неконденсированная или конденсированная ароматическая углеводородная группа, такая как фенильная группа, нафгильная группа, фенильная группа, замещенная низшей алкильной группой (например, толлильная группа, ксилильная группа, мезитильная группа, куменильная группа, ди(трет-бутил)фенильная группа и т п ) инденильная группа, инданильна группа и аналогичные группы, из которых предпочтительными являются фенильная группа, нафгильная группа или инданильная группа Подходящей "гетероциклической группой" может быть такая гетероциклическая группа, которая содержит по крайней мере один гетероатом, выбранный из группы, содержащей атомы азота, серы и кислорода, и может включать насыщенные или ненасыщенные, моноциклические или полициклические гетероциклические группы, при этом предпочтительно гетероциклическая группа является N-содержащей гетероциклической группой, такой как ненасыщенная 3-6 членная гетеромоноциклическая группа, содержащая от 1 до 4 атомов азота, например, пирролильная группа, пирролинильная группа, имидазолильная группа, пиразо 41869 лильная группа, пиридильная группа, пиримидинильная группа, пиразинильная группа, пиридазинильная группа, триазолильная группа например, 4Н-1,2,4-триазолилыная группа, 1Н-1,2,3-триазолильная группа, 2Н-1,2,3-триазолилыная группа и т п ), тетразолильная группа (например, 1Н-тетразолильная группа, 2Н-тетразолильная группа и тп), насыщенная 3-6 членная гетеромоноциклическая группа, содержащая от 1 до 4 атомов азота (например, пирролидинильная группа, имидазолидинильная группа, пиперидино-группа, пиперазинильная группа и т п ), ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 5 атомов азота, например, индол ильная группа, изоиндолильная группа, индолизинильная группа, бензимидазолильная группа, хинолильная группа, изохинолильная группа, индазолильная группа, бензотриазолильная группа, тетразолопиридазинильная группа (например, теразоло[1,5-Ь]пиридазинильная группа и т п ) и т д , ненасыщенная 3-6 членная гетеромоноциклическая группа, содержащая атом кислорода, например, пиранильная группа, фурильная группа итд , ненасыщенная 3-6 членная гетеромоноциклическая группа, содержащая от 1 до 2 атомов серы, например, тиенильная группа и т д , ненасыщенная 3-6 членная гетеромоноциклическая группа, содержащая от 1 до 2 атомов кислорода и от 1 до 3 атомов азота, например, оксазолильная группа, изоксазолильная группа, оксадиазолильная группа (например, 1,2,4-оксадиазолильная группа, 1,3,4-оксадиазолильная группа, 1,2,5-оксадиазолильная группа и т п ) и т д , насыщенная 3-6 членная гетеромоноциклическая группа, содержащая от1 до 2 атомов кислорода и от 1 до 3 атомов азота (например, морфолинильная группа и т д ) , ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 2 атомов кислорода и от 1 до 3 атомов азота (например, бензофуразанильная группа, бензоксазолильная группа, бензоксадиазолильная группа и т п ), ненасыщенная 3-6 членная гетеромоноциклическая группа, содержащая от 1 до атомов серы и от 1 до 3 атомов азота, например, тиазолильная группа, тиадиазолильная группа (например, 1,2,4тиадиазолильная группа, 1,3,4-тиадиазолильная группа, 1,2,5-тиадиазолильная группа и т п ) и т д , насыщенная 3-6 членная гетеромоноциклическая группа, содержащая от 1 до 2 атомов серы и от 1 до 3 атомов азота (например, тиазолидинильная группа и т д ) , ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 2 атомов серы и от 1 до 3 атомов азота (например, бензотиазолильная группа, бензотиадиазолильная группа и т п ), ненасыщенная конденсированная гетероциклическая группа, содержащая от 1 до 2 атомов кислорода (например, бензофуранильная группа,бензодиоксолильная группа и т п ) и аналогичные группы Предпочтительными из указанных гетероциклических групп являются пиридильная группа, бензофуразал ильная группа или бензодиоксолильная группа Подходящей "ацильной группой" и ацильным фрагментом в терминах "ациламино-группа" и "ацил (низшая) алкильная группа" может быть карбоксильная группа, этерифицированная карбоксильная группа, карбамоильная группа, дополнительно замещенная низшей алкильной группой, низшей алкокси (низшей) алкильной группой, арилсульфонильной группой, низшей алкилсульфонильной группой или гетероциклической группой, низшая алканоильная группа, ароильная группа, гетероциклокарбонильная группа и аналогичные группы Этерифицированная карбоксильная группа может быть незамещенной или содержать в качестве заместителя низшую алкоксикарбонильную группу (например, метоксикарбонильную группу, этоксикарбонильную группу, пропоксикарбонильную группу, бутоксикарбонильную группу, гексилоксикарбонильную группу, 2-иод этоксикарбонильную группу, 2,2,2-трихлорэтоксикарбонильную группу и т п), замещенную или незамещенную арилоксикарбонильную группу (например, феноксикарбонильную группу, 4-нитрофеноксикарбонильную группу, 2-нафгилфеноксикарбонильную группу и т п), замещенную или незамещенную арил (низшую) алкоксикарбонильную группу (например, бензилоксикарбонильную группу, фенэтилоксикарбонильную группу, бензгидрилоксикарбонильную группу, 4-нитробензилоксикарбонильную группу и т п) и аналогичные группы, предпочтительной из которых является низшая алкоксикарбонильная группа Карбамоильной группой, замещенной низшей алкильной группой, может быть метилкарбамоильная группа, этилкарбамоильная группа, пропилкарбамоильная группа, диметил карбамоильная группа, диэтилкарбамоильная группа N-метил-Ы-этил-карбамоильная группа и аналогичные группы Карбамоильной группой, замещенной низшей алкокси (низшей) алкильной группой может быть метоксиметилкарбамоильная группа, этоксиметил карбамоильная группа, это кс и эти л карбамоильная группа и аналогичные группы, предпочтительной среди которых является метоксиэтилкарбамоильная группа Карбамоильной группой, замещенной арилсульфонильной группой может быть фенилсульфонил карбамоильная группа, толилсульфонилкарбамоильная группа и аналогичные группы Карбамоильной группой, замещенной низшей алкилсульфонильной группой может быть метилсульфонилкарбамоильная группа, этилсульфонилкарбамоильная группа и аналогичные группы Карбамоильной группой, замещенной гетероциклической группой, может быть карбамоильная группа, замещенная одной из гетероциклических групп, которые уже рассмотрены выше Низшая алканоильная группа может быть незамещенной или замещенной, как, например, формильная группа, ацетильная группа, пропионильная группа, бутирильная группа, изо-бутирильная группа, валерильная группа, изо-валерильная группа, пивалоильная группа, гексаноильная группа, трифторацетильная группа или анало 41869 гичные группы, предпочтительными из которых являются ацетильная группа, пропионильная группа, бутирильная группа и пивалоильная группа Ароильная группа может быть бензоильной группой, нафгоильной группой, толуильной группой, ди (трет-бутил) бензоильной группой и аналогичной группой Гетероциклическим фрагментом в термине "гетероциклокарбамоильная группа" может быть одна из упомянутых выше гетероциклических групп Подходящей "N-защитной группой" может быть замещенная или незамещенная алканоильная группа (например, формильная группа, ацетильная группа, пропионильная группа, трифгорацетильная группа и т п ), фталоильная группа, низшая алкоксикарбонильная группа (например, третбутоксикарбонильная группа, трет-амилоксикарбонильная группа и т п), замещенная или незамещенная арилалкилокси карбонильная группа (например, бензилоксикарбонильная группа, п-нитробензилоксикарбонильная группа и т п ), замещенная или незамещенная аренсульфонильная группа (например, бензолсульфонильная группа, тозильная группа и т п ), нитрофенилсульфенильная группа, арилалкильная группа (например, тритильная группа, бензильная группа и т п) или аналогичные группы, из которых предпочтительной является бензильная группа Подходящим "кислотным остатком" может быть галогено-группа (например, фтор, хлор, бром, йод), а ренсульфонилокси-группа (например, бензолсульфонилокси-группа, тозилоксигруппа и т п алкансульфонилокси-группа например, мезилокси-группа, этансульфонилокси-группа и т п и аналогичные группы, из которых предпочтительной является одна из галогено-групп Предпочтительным соединением [I] является такое, которое в качестве R1 содержит фенильную группу, произвольно замещенную галогеном, в качестве R2 - низшую алкокси-группу, замещенную карбоксильной группой или этерифицированной карбоксильной группой, в качестве R3 - водород, п имеет значение 0, 2 или 3, а жирная линия означает простую связь Более предпочтительно соединением I является такое, которое в качестве R1 содержит фенильную группу, замещенную галогеном, в качестве R2 - метокси-группу, замещенную этерифицированной карбоксильной группой (более предпочтительно - низшей алкоксикарбонильной группой), в качестве R3 - водород, п имеет значение 0, 2 или 3, а жирная линия означает простую связь Наиболее предпочтительно соединением [I] является такое, которое в качестве R1 содержит фенильную группу, замещенную галогеном, в качестве R - метокси группу, замещенную низшей алкоксикарбонильной группой, в качестве R3 - водород, п имеет значение 2, а жирная линия означает простую связь Подходящими фармакологически приемлемыми солями заявляемого соединения [I] являются обычные нетоксичные соли, такие как соли присоединения неорганических кислот (например, гидрохлориды, гидробромиды, сульфаты, фосфаты и т п), соли органических кислот (например, формиаты, ацетаты, трифторацетаты, оксалаты, малеаты, фумараты, тартраты, метансульфонаты, бензолсульфонаты, толуолсульфонаты и т п ), соли щелочных металлов (например, соль натрия, соль калия и т п или аналогичные соли Стадии получения заявляемого соединения [I] детально поясняются ниже Стадия 1. Целевое соединение [I] или его соль можно получить в результате взаимодействия соединения [II] с соединением [III] или его солью Подходящими солями соединения [III] могут быть такие же соли, что и рассмотренные выше для соединения [I] Реакцию предпочтительно проводят в присутствии основания, такого как карбонат щелочного металла (например, карбонат натрия, карбонат калия и т п ) , карбонат щелочноземельного металла (например, карбонат магния, карбонат кальция, бикарбонат щелочного металла (например, бикарбонат натрия, бикарбонат калия и т п ) , три (низший) алкиламин (например, триэтиламин, триэтиламин и т п ) , пиколин или аналогичное основание Реакцию обычно проводят в стандартном растворителе, таком как спирт (например, метанол, этанол, пропанол, изо-пропанол и т п ) , диэтиловый эфир, тетрагидрофуран, диоксан, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении Стадия 2. Целевое соединение [Ib] или его соль можно получить, подвергнув соединение [la] или его соль реакции деэтерификации Подходящими солями соединения [la] могут быть такие же неорганические или органические соли присоединения, что и рассмотренные выше для соединения [I] Подходящими солями соединения [Ib] могут быть такие же соли, что и рассмотренные выше для соединения [I] Реакцию проводят в соответствии со стандартными методами, такими как гидролиз, восстановление и т п Гидролиз предпочтительно проводят в присутствии основания или кислоты, в том числе кислоты Льюиса Приемлемыми солями могут быть неорганические основания и органические основания, такие как щелочной металл (например, литий, натрий, калий и т п ) , щелочноземельный металл (например, магний, кальций и т п ) , гидроксид или карбонат или бикарбонат указанных металлов, триалкиламин (например, триметиламин, триэтиламин и т п ) , пиколин, 1,5-диазабицикло[4 3 0 ] нон-5-ен, 1,4-диазабицикло [2 2 2] октан, 1,8диазабицикло[5 4 0]ундец-7-ен или аналогичные основания Приемлемыми кислотами могут быть органическая кислота (муравьиная кислота, уксусная кислота, пропионовая кислота, трихлоруксусная кислота, три фтору ксусная кислота и т п ) , неорганическая кислота (например, соляная кислота, бромистоводородная кислота, иодистоводородная 41869 кислота, серная кислота и т п ) и кислота Льюиса (например, трехбромистый бор и т п ) Реакцию обычно проводят в таких растворителях, как вода, спирт (например, метанол, этанол и т п ), ксилол, монометиловый эфир диэтиленгликоля, хлористый метилен, тетрагидрофуран, смесь указанных растворителей или любой другой растворитель, который не оказывает вредного воздействия на ход реакции В качестве растворителя можно также использовать жидкое основание или жидкую кислоту Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении Восстановление проводят преимущественно для удаления эфирного фрагмента, такого как 4нитробензильная группа, 2-йодоэтильная группа, 2,2,2-трихлорэтильная группа или аналогичная группа Метод восстановления, пригодный для проведения реакции элиминирования, может включать химическое восстановление или каталитическое восстановление Подходящими восстановителями агентами, пригодными для использования при химическом восстановлении, являются комбинации металла (например, олова, цинка, железа и т п) или соединения металла (например, хлорида хрома, ацетата хрома и т п ) с органической или неорганической кислотой (например, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, п-толуолсульфокислотой, соляной кислотой, бромистоводородной кислотой и т п ) Подходящими катализаторами, пригодными для использования при каталитическом восстановлении, являются стандартные катализаторы, такие как платиновые катализаторы (например, платиновая фольга, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т п ), палладиевые катализаторы (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т п ), никелевые катализаторы (например, восстановленный никель, оксид никеля, никель Ренея и т п ), кобальтовые катализаторы, (например, восстановленный кобальт, кобальт Ренея и т п ), железные катализаторы (например, восстановленное железо, железо Ренея и т п ), медные катализаторы (например, восстановленная медь, медь Ренея, медь Ульмана и т п ) или аналогичные катализаторы Температура данной реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при нагревании В условиях проведения этой реакции, если в качестве исходного соединения используется соединение [Іа], в котором R3 - защитная группа и/или жирная линия обозначает двойную связь, можно получить соединение [ІЬ], в котором R3 - водород, а жирная линия обозначает простую связь Этот случай входит в объем притязаний по настоящему изобретению Стадия 3. Целевое соединение [Id] или его соль можно получить в результате взаимодействия соединения [Ic] или его соли с соединением [IV] Подходящими солями соединений [Ic] и [Id] могут быть такие же соли, что и рассмотренные выше для соединения [I] Когда при осуществлении этой реакции используют соединение [IV], содержащее галоген в качестве заместителя X, то реакцию предпочтительно проводят в присутствии снования, такого как щелочной металл (например, литий, натрий, калий и т п ) , гидроксид или карбонат или бикарбонат щелочного металла (например, едкий натр, карбонат калия, бикарбонат калия и т п ) , щелочноземельный металл (например, кальций, магний и т п), гидрид щелочного металла (например, гидрид натрия и т п ) , гидрид щелочноземельного металла (например, гидрид кальция, алкоксид щелочного металла, (например, метоксид натрия, этоксид натрия, трет-бутоксид калия и т п ) алкоксид щелочной земельного металла (например, метоксид магния, этоксид магния и т п ) или аналогичное основание, или в присутствии йодида щелочного металла (например, йодида натрия, иодида калия и т п ) и указанного основания Эту реакцию обычно проводят в стандартных растворителях, таких как тетрагидрофуран, N.N-диметилформамид, ацетон, смесь указанных растворителей или любой другой растворитель, который не оказывает вредного воздействия на ход реакции В том случае, если соединение [IV] представляет собой жидкость, его также можно использовать в качестве растворителя Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении Стадия 4. Целевое соединение [le] или его соль можно получить в результате взаимодействия соединения [Ib] или его реакционно-способного производного по карбоксильной группе или соли соединения [Ib] с амином Подходящими солями соединений [le] и [Ib] и его реакционно-способного производного по карбоксильной группе могут быть те же, что и приведенные в качестве примера для соединения [I] Подходящим амином может быть аммиак, аренсульфонамид, амин, замещенный гетероциклической группой Аренсульфонамид может быть бензолсульфонамидом, метилбензолсульфонамидом, этилбензолсульфонамидом и т д , из которых предпочтительными является метилбензолсульфонамид Реакцию обычно проводят в стандартном растворителе, который не оказывает вредного воздействия на ход реакции, таком как вода, спирт (например, метанол, этанол, пропанол и т п ) , N,Nдиметилформамид или смесь указанных растворителей В случае, если упомянутые выше кислоты, применяемые при химическом восстановлении, представляют собой жидкости, можно также использовать их в качестве растворителя Далее, подходящим растворителем, применяемым при каталитическом восстановлении, могут быть упомянутые выше растворители и другие стандартные растворители, такие как диэтиловый эфир, диоксан, тетрагидрофуран и т п или их смесь 10 41869 Амином, замещенным гетероциклической группой, может быть амин, замещенный одной из гетероциклических групп, которые уже рассмотрены выше, такой как аминотриазол, аминотиадиазол, аминотриазол, аминотетразол и аналогичные амины, из которых предпочтительным является аминотетразол Подходящие реакционно-способные производные по карбоксильной группе соединения [Ib] могут включать сложный эфир, галоидангидрид, ангидрид кислоты и т п Подходящими примерами реакционно-способных производных являются галоидангидрид ы (например, хлорангидриды, бромангидриды и т п ), симметричные ангидриды кислоты, смешанные ангидриды кислоты с 1,1'-карбонилдиимидазолом или кислотой, такой как алифатическая карбоновая кислота например, уксусная кислота, пиваловая кислота и т п , замещенная фосфорная кислота (например, диалкилфосфорная кислота, дифенилфосфорная кислота и т п), сложный эфир, такой как низший алкильный эфир (например, метиловый эфир, этиловый эфир, пропиловый эфир, гексиловый эфир и т п ), замещенный или незамещенный арил (низший) алкильный эфир (например, бензиловый эфир, бензгидриловый эфир, п-хлорбензиловый эфир и т п), замещенный или незамещенный арильный эфир (например, фениловый эфир, толиловый эфир, 4-нитрофениловый эфир, 2,4-динитрофениловый эфир, пентахлорфениловый эфир, нафгиловый эфир и т п ) или эфир с N.N-диметилгидроксиламином, Nгидроксисукцинимидом, N-гидроксифталамином или 1-окси-6-хлор-1Н-бензотриазолом и т д Подходящими солями соединения (VI] могут быть те же, что и приведенные в качестве примера для соединения [I] Подходящими восстановительными агентами могут быть диборан, комплекс боран-органический амин например, комплекс боран-пиридин и т п , цианоборгидрид щелочного металла например, цианоборгидрид натрия, цианоборгидрид лития и т п и т д Реакцию можно вести также в кислой среде (например, в присутствии уксусной кислоты и т п ), а температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при нагревании Стадия 6. Целевое соединение [In] или его соль можно получить, подвергнув соединение [Ig] или его соль реакции восстановления Подходящими солями соединения [Ig] могут быть те же, что и рассмотренные выше для соединения [I] Стадию восстановления можно осуществлять с помощью химического восстановления, каталитического восстановления и т д Подходящими восстановительными агентами, пригодными для использования при химическом восстановлении, являются комбинации металла (например, олова, цинка, железа и т п) или соединения металла (например, хлорида хрома, ацетата хрома и т п) с органической или неорганической кислотой (например, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, п-толуолсульфокислотой, соляной кислотой, бромистоводородной кислотой и т п) Подходящими катализаторами, пригодными для использования при каталическом восстановлении, являются стандартные катализаторы, такие как платиновые катализаторы (например, платиновая фольга, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т п ), палладиевые катализаторы (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т п), никелевые катализаторы (например, восстановленный никель, оксид никеля, никель Ренея и т п ), кобальтовые катализаторы (например, восстановленный кобальт, кобальт Ренея и т п ) , железные катализаторы (например, восстановленное железо, железо Ренея и т п), медные катализаторы (например, восстановленная медь, медь Ренея, медь Ульмана и т п ) или аналогичные катализаторы Реакцию обычно проводят в таких стандартных растворителях, как вода, ацетон, диоксан, хлороформ, хлористый метилен, хлористый этилен, тетрагидрофуран, этилацетат, N.N-диметилформамид, пиридин или любой другой растворитель, который не оказывает твердого взаимодействия на ход реакции Указанные среди прочих гидрофильные растворители можно использовать в смеси с водой В том случае, если соединение [Ib] используют в виде свободной кислоты, реакцию проводят в присутствии стандартного конденсирующего агента, такого как г\І,І\І-дихлоргексилкарбодиимид, N-циклогексил-М-морфолиноэтилкарбодиимид, Nэтил-1\Г-(3-диметиламинопропил) карбодиимид, хлористый тионил, хлористый оксалил, галогенид низшего алкоксикарбонила (например, хлороформиат, изо-бутилхлороформиат и т п), 1-(п-хлорбензолсульфонилокси)-6-хлор-1Н-бензотриазол и т д Реакцию также проводят в присутствии стандартного основания, такого как триэтиламин, пиридин, едкий натр и т д Восстановление обычно проводят в стандартном растворителе, который не оказывает вредного воздействия на ход реакции, таком как вода, спирт (например, метанол, этанол, пропанол и т п ), г\І,г\І-диметилформамид или смесь указанных растворителей В случае если упомянутые выше кислоты, применяемые при химическом восстановлении, представляют собой жидкости, можно также использовать их в качестве растворителя Далее, подходящими растворителями, применяемыми при каталитическом восстановлении, могут быть упомянутые выше растворители и другие стан Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении Стадия 5. Целевое соединение [If] или его соль можно получить в результате взаимодействия соединения [V] или его соли с соединением [VI] или его солью в присутствии восстановительного агента Подходящими солями соединений [V] могут быть такие же неорганические или органические соли присоединения, что и рассмотренные выше для соединения [I] 11 41869 карбонат или бикарбонат указанных металлов, триалкиламин (например, триметиламин, триэтиламин и т п), пиколин, 1,5-диазобицикло [4 3 0] нон-5-ен, 1,4-диазобицикло [2 2 2] октан, 1,8-диазобицикло [5 4 0] унден-7-ен или аналогичные основания Приемлемыми кислотами могут быть органическая кислота (муравьиная кислота, уксусная кислота, пропионовая кислота, трихлоруксусная кислота, три фтору ксусная кислота и т п ), неорганическая кислота (например, соляная кислота, бромистоводородная кислота, серная кислота, хлористый водород, бромистый водород, фтористый водород и т п) и соли присоединения кислот (например, пиридина гидрохлорид и т п ) Реакцию элиминирования с использованием тригалогенуксусной кислоты (например, трихлоруксусной кислоты, трифторуксусной кислоты и т п) или аналогичной кислоты предпочтительно проводят в присутствии нуклеофильных агентов (например, анизола, фенола и т п ) Реакцию обычно проводят в таких стандартных растворителях, как вода, спирт (например, метанол, этанол и т п ), хлористый метилен, хлороформ, ттрахлорметан, тетрагидрофуран, смесь указанных растворителей или любой другой растворитель, который не оказывает вредного воздействия на ход реакции В качестве растворителя можно также использовать жидкое основание или жидкую кислоту Метод восстановления, пригодный для проведения реакции элиминирования может включать химическое восстановление, каталитическое восстановление и т д Подходящими восстановительными агентами, пригодными для использования при химическом восстановлении, являются комбинации металла (например, олова, цинка, железа и т п) или соединения металла (например, хлорида хрома, ацетата хрома и т п), с органической или неорганической кислотой (например, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, п-толуолсульфокислотой, соляной кислотой, бромистоводородной кислотой и т п) Подходящими катализаторами, пригодными для использования при каталитическом восстановлении, являются стандартные катализаторы, такие как платиновые катализаторы (например, платиновая фольга, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т п ), палладиевые катализаторы (например, губчатый палладий, палладиевая чернь, оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т п), никелевые катализаторы (например, восстановленный никель, оксид никеля, никель Ренея и т п ), кобальтовые катализаторы (например, восстановленный кобальт, кобальт Ренея и т п ) , железные катализаторы (например, восстановленное железо, железо Ренея и т п), медные катализаторы (например, восстановленная медь, медь Ренея, медь ульмана и т п ) или аналогичные катализаторы дартные растворители, такие как диэтиловыи эфир, хлористый метилен, диоксан, этилацетат, тетрагидрофуран и т п или их смесь Температура данной реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при нагревании В условиях проведения этой реакции, если в качестве исходного соединения используется соединение [Ід], в котором RS-N-защитная группа и/или жирная линия обозначает двойную связь, можно получить соединение (In) в котором R3 водород, а жирная линия обозначает простую связь Этот случай входит в объем притязаний по настоящему изобретению Стадия 7. Целевое соединение [I] или его соль можно получить в результате взаимодействия соединения [VII] или его соли с соединением [III] или его солью в присутствии восстановительного агента Подходящими солями соединения [I] и соединения [III] могут быть те же соли, что и рассмотренные выше для соединения [I] Подходящими восстановительными агентами могут быть боргидридное соединение, такое как боргидрид щелочного металла (например, боргидрид натрия, цианоборгидрид натрия, цианоборгидрид лития, триэтилборгидрид лития и т п ), цианоборгидрид тетрабутиламмония и т д , из которых предпочтительным является боргидрид щелочного металла Реакцию предпочтительно проводят в присутствии основания, такого как карбонат щелочного металла (например, карбонат натрия, карбонат калия и т д ), карбонат щелочноземельного металла (наприер, карбонат магния, карбонат кальция, бикарбонат щелочного металла, например, бикарбонат натрия, бикарбонат калия и т п ), три (низший) алкиламин (например, триметиламин, триэтиламин и т п ), пиколин или аналогичное основание Реакцию обычно проводят в стандартном растворителе, таком как вода, спирт (например, метанол, этанол, пропанол, изо-пропанол и т п), диоксман, либо в любом органическом растворителе, который не оказывает твердого воздействия на ход реакции Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении Стадия 8. Целевое соединение [Ij] или его соль можно получить, подвергнув соединение [її] или его соль реакции элиминирования N-защитной группы Подходящими солями соединений [її] и [Ij] могут быть такие же соли, что и рассмотренные выше для соединения [I] Реакцию проводят в соответствии с со стандартными методами, такими как гидролиз, восстановление и т п Гидролиз предпочтительно проводят в присутствии основания или кислоты, в том числе кислоты Льюиса Приемлемыми основаниями могут быть неорганические основания и органические основания, такие как щелочной металл (например, литий, натрий, калий и т п ), щелочноземельный металл (например, магний, кальций и т п), гидроксид или В том случае, если N-защитной группой является бензильная группа, восстановление предпочтительно проводят в присутствии комбинации 12 41869 палладиевого катализатора (например, палладиевой черни, палладия на угле и т п ) и муравьиной кислоты или ее соли (например, формиата аммония и т п) Восстановление обычно проводят в стандартном растворителе, который не оказывает вредного воздействия на ход реакции, таком как вода, метанол, этанол, пропанол, N.N-диметилформамид или смесь указанных растворителей В случае если упомянутые выше кислоты, применяемые при химическом восстановлении, представляют собой жидкости, можно также использовать их в качестве растворителя Далее, подходящими растворителями, применяемыми при каталитическом восстановлении, могут быть упомянутые выше растворители и другие стандартные растворители, такие как диэтиловый эфир, диоксан, тетрагидрофуран и т п или их смесь Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении В условиях проведения этой реакции, если в качестве исходного соединения используется соединение [N], в котором R - низшая алкильная группа, низшая алкенильная группа или низшая алкокси-группа, каждая из которых замещена этерифицированной карбоксильной группой, амино-группа, замещенная этерифицированной карбокси (низшей) алкильной группой, или нитро-группа и/или жирная линия обозначает двойную связь, можно получить соединение [Ij], в котором R - низшая алкильная группа, низшая алкенильная группа или низшая алкокси-группа, каждая из которых замещена карбоксильной группой, амино-группа, замещенная карбокси (низшей) алкильной группой, или амино-группа, а жирная линия обозначает простую связь Этот случай входит в объем притязаний по настоящему изобретению Исходные соединения [II] [Ilia], [Nib] [IHe], [Hid] и [VII] или их соли могут быть получены по следующим стадиям Стадия А O-R5 R3-NH деалкирование [VIII] или его соль R3-NH [IX] или его соль Стадия В X-R4 [IV] R3-NH [IX] или его соль R3-NH или его соль 13 41869 Стадия С удаление N-защитной группы 3 RK -N '(СН2)П [ШЬ] или его соль -(СН 9 ) Ic] или его соль Стадия D О О окисление R 1 -C-CH 3 •>• О R 1 -C-CH-O-C-R 1 ОН ОН [VII] [X] Стадия Е о ОН 1 R -CH-CH2Y 1 1 R -CH-CH 2 [XI] Стадия F •(СН,) [XII] или его соль [XIII] или его соль Стадия G N \ Ч— •(сн 2 ) п •(СН9) [XIII] или его соль Ic] или его соль 14 41869 Стадия Н FL3 HN -4- I -к •(сн 2 ) п "(СИ,) Ic] или его соль [II Id] или его соль Стадия N \ —| R2 (СН 2 ) П [XII] или его соль [XIV] или его соль Стадия J [Illc] или его соль [XIV] или его соль где R2, R2 R3 R3 R4, X и жирная линия имеют каждая то же значение, что и ранее, R5 - низшая алкильная группа, Rc3 - атом водорода или низшая алкильная группа, дополнительно замещенная низшей алкилтио-группой, Y1 - кислотный остаток, Y2 - низшая алкилсульфонилокси-группа или арилсульфонилокси-группа, Rd3 - N-защитная группа или низшая алкильная группа, дополнительно замещенная низшей алкилтио-группой Указанные выше стадии получения исходных соединений детально поясняются ниже Стадия А. Соединение [IX] или его соль можно получить, подвергнув соединение [VIII] или его соль реакции деалкилирования Подходящими солями соединения [VIII] могут быть соли присоединения неорганических и органических кислот, уже приведенные выше в качестве примера для соединения [1] Подходящими солями соединения [IX] могут быть те же соли, что и рассмотренные выше для соединения [1] Реакцию проводят в присутствии кислоты, в том числе кислоты Льюиса (например, соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, трехбромистого бора, треххлористого бора и т п ) или три (низший алкил) силилиодида (например, триметилсилилиодида и тп) Реакцию обычно проводят в таких растворителях, как вода, уксусная кислота, хлористый метилен, тетрагидрофуран, смесь указанных растворителей, либо в любом другом растворителе, который не оказывает вредного воздействия на ход реакции Далее, если упомянутые выше кислоты представляют собой жидкости, можно также использовать их в качестве растворителя Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении 15 41869 Стадия В. Соединение [Ilia] или его соль можно получить в результате взаимодействия соединения [IX] или его соли с соединением [IV] Подходящими солями соединения [Ilia] могут быть те же соли, что и рассмотренные выше для соединения [I] Когда при осуществлении этой реакции используют соединение [IV], содержащее галоген в качестве заместителя X, то реакцию предварительно проводят в присутствии основания, такого как щелочной металл (например, литий, натрий, калий и т п , гидроксид или карбонат или бикарбонат щелочного металла (например, едкий натр, карбонат калия, бикарбонат калия и т п), щелочноземельный металл (например, кальций, магний и т п ), гидрид щелочного металла (например, гидрид натрия и т п ), гидрид щелочноземельного металла (например, гидрид кальция, алкоксид щелочного металла например, метоксид натрия, этоксид натрия, трет-бутоксид калия и т п ), алкоксид щелочноземельного металла (например, метоксид магния, этоксид магния и т п ) или аналогичное основание, или в присутствии иодида щелочного металла (например, иодида натрия, иодида калия и т п ) и указанного основания Температура реакции не имеет большого значения, реакцию обычно проводят при кипячении Стадия Е. Соединение [II] можно получить, подвергнув соединение [XI] реакции с основанием Подходящим основанием может быть щелочной металл (например, литий, натрий, калий и т п ), гидроксид или карбонат или бикарбонат щелочного металла (например, едкий натр, карбонат калия, бикарбонат калия и т п), щелочноземельный металл (например, кальций, магний и т п), гидрид щелочного металла (например, гидрид натрия и т п), гидрид щелочноземельного металла (например, гидрид кальция), алкоксид щелочного металла (например, метоксид натрия, этоксид натрия, трет-бутоксид калия т п ), алкоксид щелочноземельного металла (например, метоксид магния, этоксид магния и т п ) или аналогичное основание Реакцию обычно проводят в стандартном растворителе, таком как вода, спирт (например, метанол, этанол и т п ), диэтиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции, или смесь указанных растворителей Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении Стадия F. Соединение [XIII] или его соль можно получить в результате взаимодействия соединения [XII] или его соли с низшим алкансульфанилгалогенидом или аренсульфонилгалогенидом Подходящими солями соединений [XII] и [XIII] могут быть соли присоединения неорганических и органических кислот, уже приведенных выше в качестве примера для соединения [I] Подходящими низшими алкансульфонилгалогенидами могут быть мезитилхлорид, этансульфонилбромид и т п Подходящими аренсульфонилгалогенидами могут быть бензолсульфонилхлорид, тозилхлорид ит п Реакцию предпочтительно проводят в присутствии основания, как это разъясняется при описании стадии 1 Реакцию обычно проводят в стандартном растворителе, таком как вода, спирт (например, метанол, этанол и т п ), диэтиловый эфир, тетрагидрофуран, диоксан, пиридин, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции, или смеси указанных растворителей Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при нагревании Стадия G. Соединение [Шс] или его соль можно получить следующим способом, а именно 1) на соединение [XIII] или его соль вначале действуют азидным соединением, а затем 2) подвергают полученный продукт каталитическому восстановлению Подходящими солями соединений [IIIc] и [XIII] могут быть те же соли, что и рассмотренные выше для соединения [I] Далее, реакцию предпочтительно проводят в условиях катализатора с переносом фазы (например в присутствии тетра-н-бутиламмонийбромида и т п ) Реакцию обычно проводят в таких стандартных растворителях, как тетрагидрофуран, диоксан, ароматические углеводороды например, бензол, толуол, ксилол и т п), N.N-диметилформамид, ацетон, смесь указанных растворителей или любой другой растворитель, который не оказывает вредного воздействия на ход реакции Если соединение [VI] представляет собой жидкость, его можно использовать в качестве растворителя Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении Стадия С. Соединение [III с] или его соль можно получить, подвергнув соединение [III] или его соль реакции элиминирования - защитной группы Подходящими солями соединений [IIIb] и [Шс] могут быть те же соли, что и рассмотренные выше для соединения [I] Эту реакцию можно осуществлять так же, как и стадию 8, поэтому сведения об условиях ее проведения (например, используемом растворителе, температуре процесса и т п ), могут быть взяты из описания стадии 8 Стадия D. Соединение [VII] можно получить, подвергнув соединение[X]реакции окисления Подходящими окислительным агентом, используемым в этой реакции, может быть диоксид селена и т п Реакцию обычно проводят в таких стандартных растворителях, как вода, диоксан, уксусный ангидрид или любой другой растворитель, который не оказывает вредного воздействия на ход реакции, или смесь указанных растворителей 16 41869 Используемым на первом этапе азидным соединением может быть азид щелочного металла (например, азид натрия, азид калия и т п ), азид щелочноземельного металла (например, азид кальция т п ), азид водорода и т д Реакцию обычно проводят в стандартном растворителе, таком как тетрагидрофуран, диоксан, диметилсульфоксид, N.N-диметилформамид, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении так и при кипячении Температура реакции не имеет большого значения, реакцию предпочтительно проводят при комнатной температуре и как при нагревании, так и при кипячении Стадия J. Соединение [Шс] или его соль можно получить в результате взаимодействия соединений [XIV] или его соли с гидразином Подходящими солями соединений [IIIc] и [XIV] могут быть соли присоединения неорганических и органических кислот, уже приведенные выше в качестве примера для соединения [I] Реакцию обычно проводят в таких стандартных растворителях, как вода, спирт (например, метанол, этанол и т п ), или любой другой растворитель, который не оказывает вредного воздействия на ход реакции, или смеси указанных растворителей Температура реакции не имеет большого значения, реакцию можно проводить при комнатной температуре и как при нагревании, так и при кипячении Соединения, получаемые по описанным выше процессам, можно выделять и очищать обычными методами, такими как распыление, перекристаллизация, колоночная хроматография, переосаждение и т п , и превращать обычными способами, в случае необходимости, в требуемые соли Следует отметить, что соединение [I] и другие соединения могут включать, благодаря асимметричным атомам углерода, один или два стерео-изомера, и все такие изомеры или их смеси входят в объем притязаний по настоящему изобретению Заявляемое соединение [I] и его фармакологически приемлемые соли, обладают по отношению к кишечнику селективной симпатомиметической активностью и активностью против учащенного мочеиспускания, и могут быть использованы для лечения и/или профилактики расстройств желудочно-кишечного тракта, вызванных сокращением гладких мышц человека или животных, а еще более конкретно, для лечения и/или профилактики спазма повышенной перистальтики желудочно-кишечного тракта в случае синдрома раздражения кишечника, гастрита, язвы желудка, язвы двенадцатиперстной кишки, воспаления тонкой кишки, воспаления желчного пузыря, воспаления желчных протоков, мочекаменной болезни и т п и для лечения и/или профилактики расстройств мочеиспускания, таких как учащенное мочеиспускание, недержание мочи и т п в случае нервного учащенного мочеиспускания, нейрогенной дисфункции мочевого пузыря, ночной полиурии, нестабильного мочеиспускания, спазма мочевого пузыря, хронического цистита, хронического простатита и т п Ожидается также, что заявляемые соединения могут быть использованы в качестве терапевтических и/или профилактических средств против ожирения и глаукомы Второй этап этой реакции можно осуществлять так же, как и каталитическое восстановление, описанное на стадии 8, поэтому сведения о катализаторе, типе реакции и об условиях ее проведения (например, используемом растворителе, температуре процесса и т п ) могут быть взяты из описания процесса каталитического восстановления, приведенного для стадии 8 Восстановление можно также проводить в присутствии комбинации палладиевого катализатора (например, палладиевой черни, палладия на угле и т п ) и муравьиной кислоты или ее соли (например, формиата аммония и т п) Стадия F. Соединение [Hid] или его соль можно получить в результате взаимодействия соединения [Шс] или его соли с N-защитным агентом или низшим алкилтио (низшим) алкилгалогенидом Подходящими солями соединений [IIIc] и [Hid] могут быть те же соли, что и рассмотренные выше для соединений [I] Подходящими N-защитным агентом может быть галогенпроизводное уже упомянутых N-защитных групп, такое как хлористый ацетил, хлористый трет-бутоксикарбонил, хлористый бензил, бромистый бензил и т п Подходящим низшим алкилтио (низшим) алкилгалогенидом может быть метилти о мети л хлорид, метилтиоэтилхлорид и т д Реакцию обычно проводят в присутствии основания, как это описано для стадии 1 Реакцию обычно проводят в таких стандартных растворителях, как вода, спирт (например, метанол, этанол и т п ), диоксан, тетрагидрофуран, пиридин или любой другой растворитель, который не оказывает вредного воздействия на ход реакции, или смеси указанных растворителей Температура реакции не имеет большого значения, реакцию можно проводить как при охлаждении, так и при кипячении Стадия I. Соединение [XIV] или соль его можно получить в результате взаимодействия соединения [XII] или его соли с фталимидом в присутствии трифенилфосфина и диэтил азодикарбоксилата Подходящими солями соединений [XII] и [XIV] могут быть те же соли, что и рассмотренные выше для соединения [I] Реакцию обычно проводят в стандартном растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан, либо в любом другом органическом растворителе, который не оказывает вредного воздействия на ход реакции С целью проиллюстрировать полезность заявляемого соединения [I] ниже приводятся фармакологические данные для соединения [I] Испытание 1. Воздействие на изолированную периферическую толстую кишку крыс (а) Метод испытаний 17 41869 Используют самцов крыс разного возраста (вес 180-230 г) Перед проведением эксперимента животных не кормят в течение 24 час Периферическую толстую кишку удаляют сразу же после умерщвления животных и помещают в ванну, содержащую 25 мл раствора Tyrode, через который при 37°С продувается газовая смесь, содержащая 95% кислорода и 5% углекислого газа Образец закрепляют под нагрузкой 0,5 г и спонтанные сокращения регистрируют изометрически После того как подвижность становится однородной, в ванну вводят тестируемое соединение и наблюдают сокращения в течение 30 минут Эффект от воздействия тестируемого соединения оценивают, сравнивая сокращения до и после добавления тестируемого соединения растворов, лосьонов, ингалянтов, глазных препаратов, суспензий, эмульсий, мазей, гелей и т п При желании в эти препараты могут быть включены вспомогательные вещества, стабилизирующие агенты, смачивающие или эмульгирующие агенты,буферные смеси или другие обычно применяемые добавки Поскольку дозировка соединения [I] варьирует в зависимости от возраста и состояния пациента, средние дозы 0,1 мг, 1 мг, 10 мг, 50 мг, 100 мг, 250 мг, 500 мг и 1000 мг соединения [I] могут быть эффективными для лечения указанных болезней В общем случае средняя суточная доза для одного человека составляет от 0,1 мг до 1000 мг Следующие препараты и примеры приводятся для пояснения настоящего изобретения Препарат 1. К смеси 3-метокси - 6,7,8,9 -тетрагидро-5Нбензоциклогептен-6-она (3,6 г), бензиламина (2,5) и уксусной кислоты (27 мл) при охлаждении на водяной бане прибавляют порциями цианоборгидрид натрия (0,49 г) и смесь перемешивают при комнатной температуре в течение 5 час К смеси прибавляют дополнительное количество бензиламина (2,5 мл) и цианоборгидрида натрия (0,10 г) и перемешивание продолжают еще в течение 2 час Реакционную массу подщелачивают (рН > 8) и 10%-ным раствором едкого натра (150 мл) и один раз экстрагируют этилацетатом Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, нгексан-этилацетат, от 3 1 к 2 1 до 1 1), получая Nбензил-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-амин (4,8 г) в виде масла (б) Результаты тестовых испытаний Тестируемое соединение (Пример №) 1 2-3) 3-2) IC 5 0 (M) 6,8хЮ10 8,4хЮ10 6,6хЮ10 Испытание 2. Воздействие на изолированную матку небеременных крыс (а) Метод испытаний Используют самок крыс разного возраста (вес 150-180 г) За 48 и 24 час перед использованием крысам, чтобы вызвать течку, подкожно вводят эстрадиол (торговое название овагорион бензоат, Teikoku Hormone Mfg Co Ltd) с дозой 40 микрограмм на одну крысу Животных убивают и удаляют меточные рожки Каждый образец под нагрузкой 1 г помещают в ванну, содержащую 25 мл раствора Locke, через который при 37°С продувается газовая смесь, содержащая 95% кислорода и 5% углекислого газа Спонтанные сокращения регистрируют изометрически После того, как спонтанные сокращения становятся однородными, в ванну вводят тестируемое соединение Наблюдают подвижность в течение 20 минут Эффект от воздействия тестируемого соединения оценивают, сравнивая сокращения до и после добавления тестируемого соединения ИК-спектр (пленка) 3320 см 1 ЯМР-спектр (хлороформ-d, 5) 1,3-2,2 (5Н, мульт), 2,6 - 3,0 (5Н, мульт), 3,78 (ЗН, сингл), 3,79 (1Н, дубл , J = 13 Гц), 3,89 (1Н, дубл , 13 Гц), 6,63 (1Н, дублет дублетов, J = 8 Гц), 6,73 (1Н, дубл , J = 2 Гц), 6,99 (1Н, дубл , J = 8 Гц), 7,2 - 7,4 (5Н, мульт) Масс-спектр (m/z) 281 Препарат 2. Следующие соединения были получены по методике, аналогичной той, которая описана для препарата 1 1) І\І-бензил-2-метокси-6,7,8,9-тетрагидро5Н-бензоциклогептен-6-амин ИК-спектр (пленка) 3320 см 1 ЯМР-спектр (хлороформ-d, 5) 1,2-2,2 (5Н, мульт), 2,6 - 3,0 (5Н, мульт), 3,77 (ЗН, сингл), 3,77 (1Н, дубл , J = 13 Гц), 3,87 (1Н, дубл , 13 Гц), 6,6-6,7 (2Н, мульт), 7,0-7,1 (1Н, мульт), 7,1 - 7 , 4 (5Н, мульт) Масс-спектр (m/z) 281 2) І\І-бензил-3-нитро-6,7,8,9-тетрагидро-5Нбензоциклогептен-6-амин, т пл 64-68°С ИК-спектр (Nujol) 1520, 1335 см 1 ЯМР-спектр (хлороформ-d, 5) 1,4-1,65 (1Н, мульт), 1,75-2,15 (ЗН, мульт), 2,65-3,05 (5Н, мульт), 3,80 (1Н, дубл , J = 13 Гц), 3,89 (1Н, дубл , 13 Гц), 7,2-6,35 (6Н, мульт), 7,93-8,03 (2Н, мульт) Масс-спектр (m/z) 296 (б) Результаты тестовых испытаний Тестируемое соединение (Пример №) 1 2-3) 3-2) IC 5 0 (M) 1,0хЮ7 4,4хЮ7 2,4хЮ7 Для терапевтических целей соединение [I] и его фармакологически приемлемая соль по настоящему изобретению могут быть использованы в форме фармацевтического препарата, содержащего в качестве активного ингредиента одно из указанных соединений в смеси с фармакологически приемлемым носителем, таким как органический или неорганический твердый, полутвердый или жидкий наполнитель, пригодный для орального, парентерального или наружного (местного) назначения Фармацевтические препараты могут быть в виде капсул, таблеток, драже, гранул, свеч, 18 41869 3) 1\1-метилтиоэтил-(7-нитро-1,2,3,4-тетрагидро-2-нафгил)амин ИК-спентр (пленка) 3300, 1510, 1340 см 1 ЯМР-спектр (хлороформ-d, 5) 1,56-1,82 (1Н, мульт), 2,00-2,19 (1Н, мульт), 2,11 (ЗН, сингл), 2,60-3,20 (9Н, мульт), 7,22 (1Н, дубл , J = 9,1 Гц), 7,89-8,02 (2Н, мульт) Препарат 3. Смесь І\І-бензил-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-амина (3,0 г), и 47%ной бромистоводородной кислоты (106 мл) перемешивают при температуре 130°С в течение 1,5 час После охлаждения реакционную массу упаривают в вакууме К остатку прибавляют 28%-ный водный раствор аммиака и смесь экстрагируют один раз этилацетатом Экстракт дважды промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, хлороформ-метанол, от 25 1 до 15 1), получая 8бензиламино-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2-ол (1,9 г) в виде масла, которое застывает при стоянии и один раз экстрагируют этилацетатом Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, хлороформэтанол, от 25 1 к 5 1), получая бензил -3-этокси карбон ил-мето кси-6,7,8,9-тетра гид ро-5Н -бензоциклогептен-6-амин (2,0 г) в виде масла ИК-спектр (пленка) 3600, 3300, 1750 см 1 ЯМР-спектр (хлороформ-d, 5) 1,29 (ЗН, трипл , J = 7 Гц), 1,3-2,2 (5Н, мульт), 2,6-3,0 (5Н, мульт), 3,78 (1Н, дубл , J = 13 Гц), 3,88 (1Н, дубл , J= 13 Гц), 4,26 (2Н, кварт, J= 7 Гц), 4,58 (2Н, сингл), 6,61 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,76 (1Н, дубл , J = 2 Гц), 6,98 (1Н, дубл , J = 8 Гц), 7,0-7,4 (5Н, мульт) Масс-спектр (m/z) 353 Препарате. Следующие соединения были получены по методике, аналогичной той, которая описана для препарата 5 1) Бензил-2-этоксикарбонилметокси-6,7,8,9тетрагидро-5Н- бензоциклогегтген-6-амин ИК-спектр (пленка) 3300, 1740 см 1 ЯМР-спектр (хлороформ-d, 5) 1,29 (ЗН, трипл , J = 7 Гц), 1,3-2,2 (5Н, мульт), 2,5-3,0 (5Н, мульт), 3,77 (1Н, дубл , J = 13 Гц), 3,87 (1Н, дубл , J = 13 Гц), 4,26 (2Н кварт, J = 7 Гц), 4,58 (2Н, сингл), 6,62 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,69 (1Н, дубл , J = 2 Гц), 7,06 (1Н, дубл , J = 8 Гц), 7,1-7,4 (5Н, мульт) Масс-спектр (m/z) 353 2) М-бензил-2-бис-(этоксикарбонил)метокси6,7,8,9-тетрагидро-5Н- бензоциклогептен-6-амин ИК-спектр (пленка) 3220, 1740 см 1 ЯМР-спектр (хлороформ-d, 5) 1,29 (6Н, трипл , J = 7 Гц), 1,38 (1Н, шир сингл), 1,4-1,6 (1 Н, мульт), 1,6-2,1 (ЗН, мульт), 2,5-2,9 (5Н, мульт), 3,7-3,9 (2Н, мульт), 4,30 (4Н, кварт, J = 7 Гц), 5,15 (1Н, сингл ), 6,66 (1Н, дублет дублетов, J = 2 Гц), 7,05 (1Н, дубл , J = 8 Гц), 7,1-7,4 (5Н, мульт) Масс-спектр (m/z) 426 (М+Н)+ 3) 1\1-бензил-3-этоксикарбонилметокси-5,6, 7,8,9,10-гексагидро-5Н-бензоциклооктен-6-амин ИК-спектр (пленка) 1750, 1600 см 1 ЯМР-спектр (хлороформ-d, 5) 1,1-2,0 (6Н, мульт), 1,29 (ЗН, трипл , J = 7,1 Гц), 2,6-3,0 (5Н, мульт), 3,85 (1Н, дубл, J = 13,4 Гц), 3,93 (1Н, дубл J = 13,4 Гц), 4,25 (2Н, кварт , J = 7,1 Гц), 4,57 (2Н, сингл), 6,6-6,8 (2Н, мульт), 6,95-7,1 (1Н, мульт), 7,2-7,55 (5Н, мульт) Масс-спектр (m/z) 367 4) Этил 2-[8-(бензиламино)-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2 -илокси]пропионат ИК-спектр (пленка) 3320, 1720, 1600 см 1 ЯМР-спектр (хлороформ-d, 5) 1,28 (ЗН, трипл , J = 7,0 Гц), 1,35-2,10 (4Н, мульт), 1,60 (ЗН, дубл , J = 6,8 Гц), 2,6-2,95 (5Н, мульт), 3,77 (1Н, дубл , J = 13 Гц), 3,87 (1Н, дубл , J = 13 Гц), 4,20 (2Н, кварт, J= 7,0 Гц), 4,70 (1Н, кварт, J = 6,8 Гц), 6,56 (1Н, дублет дублетов J = 2,7 Гц, 8,2 Гц), 6,74 (1Н, дубл , J = 2,7 Гц), 6,96 (1Н, дубл , J = 7,2 Гц), 7,2-7,4 (5Н, мульт) Препарат 7. Смесь N-бензил-З-этоксикарбонилметокси6,7,8,9-тетрагидро-5Н- бензоциклогептен-6-амина Тпл 87-89°С ИК-спектр (Nujol) 3470 см 1 ЯМР-спектр (хлороформ-d, 5) 1,4-2,2 (4Н, мульт), 2,5-3,7 (7Н, мульт), 3,80 (2Н, сингл), 6,46,6 (2Н, мульт), 6,8-7,0 (1Н, мульт), 7,1-7,4 (5Н, мульт) Масс-спектр (m/z) 267 Препарат 4. Следующие соединения были получены по методике, аналогичной той, которая описана для препарата 3 1) 6-Бензиламино-6,7,8,9-тетрагидро-5Нбензоциклогептен-2-ол Тпл 124-125°С ИК-спектр (Nujol) 3280 см 1 ЯМР-спектр (хлороформ-d, 5) 1,4-2,2 (4Н, мульт), 2,2-3,6 (7Н, мульт), 3,78 (1Н, дубл , J= 13 Гц), 3,88 (1Н, дубл , J = 13 Гц), 6,4-6,6 (2Н, мульт), 6,9-7,0 (1Н, мульт), 7,2-7,4 (5Н, мульт) Масс-спектр (m/z) 267 2) 9-бензиламино-5,6,7,8,9,10-гексангидробензоциклооктен-2-ол ИК-спектр (жидкость) 3280, 2680, 2580, 1605 см 1 ЯМР-спектр (хлороформ-d, 5) 1,1-1,8 (6Н, мульт), 2,5-3,0 (5Н, мульт), 3,87 (2Н, сингл), 6,54 (1Н, дубл , J = 2,7 Гц), 6,61 (1Н, дублет дублетов, J = 2,7 Гц, 8,1 Гц), 6,96 (1Н, дубл , J = 8,1 Гц), 7,157,5 (5Н, мульт) Масс-спектр (m/z) 281 Препаратб. К охлаждаемому льдом раствору 8-бензиламино-6,7,8,9-тетрагидро-5Н-бензоциклогегттен-2ола (1,7 г) в толуоле (56 мл) прибавляют порциями гидрид натрия (60%-ная дисперсия в минеральном масле, 0,31 г) После того, как прибавление заканчивается, смесь перемешивают при 70°С в течение 1 час После охлаждения прибавляют смесь этил б ром ацетата (0,81 мл) и тетра-н-бутиламмонийбромида (0,10 г) в толуоле (14 мл) и полученную массу перемешивают при 70°С в течение 4 час После охлаждения смесь выливают в насыщенный водный раствор хлористого аммония 19 41869 (1,8 г), формиата аммония (3,2 г), 10%-ного палладия на угле (50% вл 0,72 г) и этанола (50 мл) кипятят с обратным холодильником в течение 0,5 час После охлаждения катализатор отфильтровывают и остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, хлороформ-этанол, от 1 1 до 5 1), получая 3-этоксикарбонилметокси-6,7,8,9-тетрагидро-5Н- бензоциклогегтген-6-амин (1,2 г) в виде масла ИК-спектр (пленка) 3360, 1750 см 1 ЯМР-спектр (хлороформ-d, 5) 1,29 (ЗН, трипл , J = 7 Гц), 1,4-2,5 (6Н, мульт), 2,5-3,2 (5Н, мульт), 4,26 (2Н, кварт, J = 7 Гц), 4,58 (2Н, сингл), 6,62 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,75 (1Н, дубл , J = 2 Гц), 6,98 (1Н, дубл , J = 8 Гц) Масс-спектр (m/z) 263 Препарат 8. Следующее соединение было получено путем взаимодействия соединения, полученного по методике, аналогичной той, которая описана для препарата 7, с хлористым водородом 2-Этоксикарбонилметокси-6,7,8,9-тетрагидро-5Н- бензоциклогептен-6-амин гидрохлорид Тпл 151-156°С ИК-спектр (Nujol) 3100-2000, 1740 см 1 ЯМР-спектр (МДМСО-de, 5) 1,0-1,5 (1Н, мульт), 1,21 (ЗН, трипл, J = 7 Гц), 1,6-2,3 (ЗН, мульт), 2,5-3,2 (5Н, мульт), 4,16 (2Н, кварт, J = 7 Гц), 4,72 (2Н, сингл), 6,66 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,74 (1Н, дубл , J = 2 Гц), 7,04 (1Н, дубл , J = 8 Гц), 8,0-8,5 (ЗН, шир сингл ) Масс-спектр (m/z) 263 (М+ - HCI) Препарат 9. Следующее соединение было получено путем взаимодействия соединения, полученного по методике, аналогичной той, которая описана для препарата 1, с хлористым водородом |\|-бензил-3-метокси-5,6,7,8,9,10-гексагидробензоциклооктен-6 -амин-гидрохлорид Тпл 178-180°С ИК-спектр (Nujol) 2640, 2575, 1600, 1580 см 1 ЯМР-спектр (flMCO-d6, 5) 0,8-1,1 (1Н, мульт), 1,3-1,55(1 Н, мульт), 1,88-1,9 (4Н, мульт), 2,55-2,8 (2Н, мульт), 2,95-3,3 (ЗН, мульт), 3,72 (ЗН, сингл), 4,27 (2Н, мульт), 6,7-6,85 (2Н, мульт), 7,0-7,1 (1Н, мульт), 7,35-7,65 (5Н, мульт), 9,2-9,5 (1Н, мульт), 9,6-8,9 (1Н, мульт) Препарат 10. Следующие соединения были получены путем взаимодействия соединений, полученных по методике, аналогичной той, которая описана для препарата 5, с хлористым водородом 1) М-бензил-2-пентилоксикарбонилметокси6,7,8,9-тетрагидро-5Н-бензоциклогегттен-6-амин гидрохлорид Тпл 188-193°С ИК-спектр (Nujol) 1605, 1580 см 1 ЯМР-спектр (ДМСО-de, 5) 0,9 (ЗН, трипл , J = 7,0 Гц), 1,1-1,5 (5Н, мульт), 1,6-2,1 (4Н, мульт), 2,25-2,45 (1Н, мульт), 2,6-3,3 (5Н, мульт), 3,91 (2Н, трипл, J = 6,4 Гц), 4,1-5,3 (2Н, мульт), 6,68 (1Н, дублет дублетов, J = 8,2 Гц), 6,84 (1Н, дубл , J = 2,5 Гц), 7,01 (1Н, дубл , J = 8,2 Гц), 7,35-7,5 (ЗН, мульт), 7,6-7,7 (2Н, мульт), 8,3-7,5 (2Н, мульт) 2) І\І-бензил-3-(2-оксопентилокси)-6,7,8,9тетрагидро-5Н-бензоциклогегттен-6-амингидрохлорид Тпл 166-169°С ИК-спектр (Nujol) 2425, 2375, 1715, 1610 см 1 ЯМР-спектр (flMCO-de, 5) 0,87 (ЗН, трипл , J = 7,4 Гц), 1,05-1,4 (1Н, мульт), 1,54 (2Н, секст , J = 7,4 Гц), 1,8-2,1 (1Н, мульт), 2,3-2,45 (1 Н, мульт), 2,45-2,6 (2Н, мульт), 2,6-3,3 (5Н, мульт), 4,26 (2Н, сингл ), 4,75 (2Н, сингл ), 6,64 (1Н, дублет дублетов, J = 2,6 Гц, 8,3 Гц), 6,84 (1Н, дубл , J = 2,6 Гц), 7,02 (1Н, дубл, J = 8,3 Гц), 7,35-7,5 (ЗН, мульт), 7,6-7,7 (2Н, мульт), 9,35-9,75 (2Н, мульт) 3) М-бензил-3-[(РЗ)-2-оксопеі-гган-3-илокси)6,7,8,9-тетрагидро-5Н- бензоциклогептен-6-амин гидрохлорид Тпл 162-166°С ИК-спектр (Nujol) 2420, 2350, 1715, 1605 см 1 ЯМР-спектр (ДМСО-de, 5) 0,8-1,1 (ЗН, мульт), 1,05-1,4 (1Н, мульт), 1,7-2,1 (4Н, мульт), 2,14 (ЗН, сингл), 2,2-2,4 (1Н, мульт), 2,6-3,3 (5Н, мульт), 4,25 (2Н, сингл), 4,65 (1Н, мульт), 6,5-6,7 (1Н, мульт), 5,8-6,9 (1Н, мульт), 7,0-7,05 (1Н, мульт), 7,4-7,65 (5Н, мульт), 8,8-9,2 (2Н, мульт) Масс-спектр (m/z) 351 (M-HCI)+ 4) М-бензил-2-этоксикарбонилметокси-6, 7-дигидро-5Н-бензоциклогегттен-7-амин гидрохлорид Тпл 121,5-131 °С ИК-спектр (Nujol) 2750-2300, 1755, 16001570, 1200 с м 1 ЯМР-спектр (flMCO-d 6 , 5) 1,21 (ЗН, трипл, J = 7,1 Гц), 2,16 (1Н, мульт), 2,39 (1Н, мульт), 2,72,95 (2Н, мульт), 4,02 (1Н, мульт), 4,1-4,25 (4Н, мульт), 4,76 (2Н, сингл), 6,11 (1Н, дублет дублетов, J = 11,8 Гц, 3,4 Гц), 6,67 (1Н, дубл , J = 11,8 Гц), 6,78 (1Н, дублет дублетов, J = 8,3 Гц), 2,6 Гц), 6,89 (1Н, дубл , J = 2,6 Гц), 7,14 (1Н, дубл , J = 8,3 Гц), 7,4-7,45 (ЗН, мульт), 7,55-7,65 (2Н, мульт), 9,7 (2Н, шир) Масс-спектр (m/z) 351 (М+), 244 (Основной), 91 5) (3)-бензил-2-этоксикарбонилметокси6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-амингидрохлорид Тпл 120-130°С [a] D 2 1 = + 28,9°С (с = 0,34, ЕЮН) ИК-спектр (Nujol) 3500, 3420, 1730 см 1 ЯМР-спектр (ДМСО-de, 5) 1,1-1,4 (1Н, мульт), 1,21 (ЗН, трипл, J = 7 Гц), 1,7-2,1 (2Н, мульт), 2,2-2,4 (1Н, мульт), 2,6-2,8 (2Н, мульт), 2,8-3,3 (ЗН, мульт), 4,17 (2Н, кварт, J = 2 Гц), 4,24,4 (2Н, мульт), 4,72 (2Н, сингл), 6,67 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,86 (1Н, дубл , J = 2 Гц), 7,04 (1Н, дубл , J = 8 Гц), 7,3-7,5 (ЗН, мульт), 7,57,7 (2Н, мульт), 9,2-8,6 (2Н, шир мульт) Масс-спектр (m/z) 353 6) (Р)-^бензил-2-этоксикарбонилметокси6,7,8,9-тетрагидро-5Н-бензоциклогегттен-6-амин гидрохлорид Тпл 129-131 °С [a] D 2 2 = -28,4° (с = 0,38 ЕЮН) ИК-спектр (Nujol) 3550-3100, 1730 см 1 ЯМР-спектр (MCO-d6, 5) 1,1-1,4 (1Н, мульт), 1,21 (ЗН, трипл, J = 7 Гц), 1,8-2,2 (2Н, мульт), 2,3-2,5 (1Н, мульт), 2,6-2,8 (2Н, мульт), 2,8-3,3 (ЗН, мульт), 4,17 (2Н, кварт, J = 2 Гц), 4,24,4 (2Н, мульт), 4,72 (2Н, сингл), 6,67 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,86 (1Н, дубл , J = 2 Гц), 20 41869 7,03 (1H, дубл , J = 8 Гц), 7,4-7,5 (ЗН, мульт), 7,67,8 (2Н, мульт), 9,2-9,8 (2Н, шир мульт) Масс-спeicrp (m/z) 353 Препарат 11. К смеси 8-бензиламино-6,7,8,9-тетрагидро5Н-бензоциклопентен-2-ола (970 мг) и 1,1,1-трихлор-2-метил-2-пропанолгидрата (1,28 г) в ацетоне (30 мл) прибавляют порциями порошок КОН (1,71 г) и полученную смесь перемешивают при комнатной температуре в течение 20 час После удаления растворителя в вакууме остаток выливают в 1N раствор едкого натра (30 мл) и моют диэтиловым эфиром рН водного слоя доводят до 6,0 с помощью 3N раствора соляной кислоты Выделившийся осадок отфильтровывают Фильтрат упаривают в вакууме и к остатку прибавляют воду Полученный осадок выделяют фильтрованием и сушат, получая 2-[8-бензиламино-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2-илокси]-2-метилпропионовую кислоту (0,51 г) ную воду, туда же затем прибавляют н-гексан Выпавшие осадки отфильтровывают и промывают нгексаном Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток растирают с гексаном и отфильтровывают Фильтрат упаривают в вакууме и получают 1-метилен-7-метокси-1,2,3,4-тетрагидронафгалин (1,69 г) в виде масла ИК-спектр (пленка) 3080, 1620 (широкая полоса), 1600 см ЯМР-спектр (flMCO-d6, 5) 1,6-1,9 (2Н, мульт), 2,4-2,6 (2Н, мульт), 2,71 (2Н, триплетоподоб, J = приб 6 Гц), 3,74 (ЗН, сингл), 4,96 (1Н, дубл , J = 1 Гц), 6,78 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 7,03 (1Н, дубл , J = 8 Гц), 7,16 (1Н, дубл , J = 2 Гц) Масс-спектр (m/z) 175 Препарат 14. К раствору нитрата таллия (2,4 г) в метаноле (24 мл) прибавляют в одну порцию раствор 1метилен-7-метокси-1,2,3,4-тетрагидронафталина (1,0 г) в метаноле (7 мл) Смесь перемешивают в течение 1 минуты и разбавляют хлороформом (24 мл) Образовавшийся осадок отфильтровывают и фильтрат промывают насыщенным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле (элюент - н-гексан этилацетат, 8 1) и получают 3-метокси-1,2,3,4-тетрагидро-5Н-бензоциклогегттен-6он (0,78 г) Тпл 187-189°С ИК-спектр (Nujol) 3450, 1600 см 1 ЯМР-спектр (NaOD, 5) 1,2-1,45 (1Н, мульт), 1,48 (6Н, сингл), 1,5-2,0 (ЗН, мульт), 2,45-2,95 (5Н, мульт), 3,65-3,9 (2Н, мульт), 6,6-6,8 (2Н, мульт), 6,95-7,05 (1Н, мульт), 7,2-7,4 (5Н, мульт) Масс-спектр (m/z) 354 (М+1)+ Препарат 12. Хлористый тионил (0,2 мл) прибавляют при 10°С и при перемешивании к этанолу (5 мл) Через 10 минут к смеси порциями прибавляют 2-[8бензиламино-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2-илокси]-2-метилпропионовую кислоту (0,49 г) Реакционную массу перемешивают при комнатной температуре в течение 1 час, затем кипятят с обратным холодильником в течение 3 час После охлаждения смесь выливают в водный раствор бикарбоната натрия и экстрагируют этилацетатом Экстракт промывают водой, сушат над сульфатом магния и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-метанол (100 1), и получают этил-2-[8бензиламино-6,7,8,9-тетрагидро-5Н-бензоциклогептен -2-илокси]-2-метилпропионат (0,43 г) ИК-спектр (жидкость) 1725,1600см ЯМР-спектр (хлороформ-d, 5) 1,25 (ЗН, трипл , J = 7 Гц), 1,35-1,55 (1Н, мульт), 1,57 (6Н, сингл), 1,65-2,1 (ЗН, мульт), 2,6-2,9 (5Н, мульт), 3,76 (1Н, дубл , J = 13 Гц), 3,87 (1Н, дубл , J = 13 Гц), 4,22 (2Н, кварт, J = 7,1 Гц), 6,55 (1Н дублет дублетов, J = 2,6 Гц, 8,2 Гц), 6,71 (1Н, дубл , J = 2,6 Гц), 6,92 (1Н, дубл , J = 8,2 Гц), 7,2-7,35 (5Н, мульт) Масс-спектр (m/z) 381 Препарат 13. К суспензии метилтрифенилфосфонийбромида (4,2 г) в тетрагидрофуране (10 мл) при охлаждении в бане со льдом порциями прибавляют трет-бутоксид калия (1,34 г) По завершении прибавления баню со льдом убирают и смесь перемешивают при комнатной температуре в течение 2,5 час Затем к смеси прибавляют 7-метокси-1-тетралон (1,78 г) и смесь дополнительно перемешивают еще в течение 30 минут Выливают в ледя Тпл 50-52°С ИК-спектр (пленка) 1700 с м 1 ЯМР-спектр (хлороформ-d, 5) 1,8-2,1 (2Н, мульт), 2,56 (2Н, триплетоподобн , J = прибл 7 Гц), 2,8-3,0 (2Н, мульт), 3,68 (2Н, сингл ), 3,78 (ЗН, сингл), 6,7-6,8 (2Н, мульт), 7,0-7,1 (1Н, мульт) Масс-спектр (m/z) 190 Препарат 15. (3)-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогегтген-6-амин гидрохлорид (35,5 г) нафтализуют холодным 2N раствором едкого натра (155 мл) и смесь один раз экстрагируют этилацетатом (310 мл) Экстракт промывают один раз насыщенным раствором соли (155 мл), сушат над безводным сульфатом натрия, упаривают в вакууме и получают (3)-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогегтген-6-амин (30,1 г) Смесь (3)-3-метокси-6,7,8,9-тетрагидро-5Нбензоциклогептен-6-амина (30,1 г), 10%-ного палладия на угле (50% вл , 5,96 г), уксусной кислоты (0,89 мл), бензальдегида (31,6 мл) и этанола (300 мл) перемешивают при комнатной температуре в течение 3 час После этого к смеси подают водород и перемешивают еще в течение 1,5 час Катализатор отфильтровывают и промывают этанолом Удаление растворителя в вакууме позволяет получить остаток, который растворяют в этилацетате (423 мл) К полученному раствору при механическом перемешивании и при охлаждении на водяной бане прибавляют 4 раствор хлористого водорода в этилацетате (77 мл) После перемешивания при комнатной температуре в течение 1,5 час смесь отфильтровывают и кристаллы на фильтре промывают этилацетатом (50 мл) Полу 21 41869 ченный продую" сушат в вакууме и получают (S)-Nбензил-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-амин гидрохлорид (47,3 г) в виде кристаллов белого цвета Тпл 223-224°С [a] D 2 1 = + 39,2° (с = 0,49, Et ОН) ИК-спектр (Nujol) 3050-2100, 1600, 1570 см 1 ЯМР-спектр (ДМСО-de, 5) 1,1-1,4 (1Н, мульт), 1,8-2,1 (2Н, мульт), 2,3-2,5 (1Н, мульт), 2,6-2,8 (2Н, мульт), 2,8-3,0 (1Н, мульт), 3,0-3,3 (2Н, мульт), 3,72 (ЗН, сингл), 4,26 (2Н, шир сингл), 6,69 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,84 (1Н, дубл , J =2 Гц), 7,03 (1Н, дубл , J = 8 Гц), 7,3-7,5 (ЗН, мульт), 7,6-7,8 (2Н, мульт), 9,3-9,8 (2Н, шир мульт) Масс-спектр (m/z) 281 Препарат 16. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 15 (Р)-|\|-бензил-3-метокси-6,7,8,9-тетрагидро5Н-бензоциклогептен- 6-амин гидрохлорид Тпл 223-224°С [a] D 2 0 = -42,7° (с = 0,36, ЕЮН) ИК-спектр (Nujol) 3100-2100, 1610,1580 см 1 ЯМР-спектр (ДМСО-de, 5) 1,0-1,4 (1Н, мульт), 1,8-2,1 (2Н, мульт), 2,3-2,5 (1Н, мульт), 2,6-2,8 (2Н, мульт), 2,8-3,0 (1Н, мульт), 3,0-3,3 (2Н, мульт), 3,72 (ЗН, сингл ), 4,2-4,4 (2Н, мульт), 6,63 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,84 (1Н, дубл , J = 2 Гц), 7,03 (1Н, дубл , J = 8 Гц), 7,3-7,5 (ЗН, мульт), 7,6-7,8 (2Н, мульт), 9,3-9,8 (2Н, шир мульт) Масс-спектр (m/z) 281 Препарат 17. 1) К суспензии (3)-І\І-бензил-3-метокси6,7,8,9-тетрагидро-5Н-бензоциклогегттен- 6-амин гидрохлорида (46,8 г) в дихлорметане (147 мл) при -10°С по каплям в течение 50 минут прибавляют 1М раствор трехбромистого бора в дихлорметане (294 мл), позволяя смеси в течение указанного времени нагреться до температуры 10°С По окончании прибавления дают смеси нагреться до комнатной температуры и перемешивают так, чтобы общее время перемешивания составило 3 час Растворитель почти полностью упаривают в вакууме и оставшуюся смесь быстро охлаждают в бане со льдом смесью воды (600 мл) и этилацетата (450 мл) Доводят рН смеси до 8,0, прибавляя сначала твердый бикарбонат натрия (74 г), а затем 1N раствор едкого натра (60 мл) Т пл 232-233°С [a] D 2 2 = + 36,6° (с = 0,42, ЕЮН) ИК-спектр (Nujol) 32200, 2380 см 1 ЯМР-спектр (ДМСО-de, 5) 1,0-1,4 (1Н, мульт), 1,7-2,1 (2Н, мульт), 2,2-2,4 (1Н, мульт), 2,5-2,7 (2Н, мульт), 2,8-3,2 (ЗН, мульт), 4,24 (2Н, шир сингл ), 6,52 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,67 (1Н, дубл , J = 2 Гц), 6,89 (1Н, дубл , J = 8 Гц), 7,3-7,5 (ЗН, мульт), 7,5-7,7 (2Н, мульт), 9,29,5 (2Н, шир мульт), 9,24 (1Н, сингл ) Масс-спектр (m/z) 267 Препарат 18. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 17-1) (Р)-8-бензиламино-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен- 2-ол Масс-спектр (m/z) 267 Препарат 19. К смеси (3)-3-метокси-6,7,8,9-тетрагидро5Н-бензоциклогептен- 6-амин гидрохлорида (энантиомерный избыток 54% по данным хиральной HPLC хроматографии 13,8 г) N-бензилоксикарбонил-О-лейцина (20,9 г) N-оксибензотриазола (10,6 г) и N.N-диметилформамида (276 мл) прибавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (12,2 г) После перемешивания в течение 3 час при комнатной температуре смесь упаривают в вакууме Остаток разбавляют хлористым метиленом и последовательно моют водой, 3N раствором соляной кислоты, насыщенным водным раствором бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме Перекристаллизацией остатка из этилацетата получают сырой продукт, который далее очищают перекристаллизацией из этанола, получая смесь диастереомеров (6R) и (63)-І\І-(г\І-бензилоксикарбонил-О-лейцил)-3-метокси-6,7,8,9 -тетрагидро5Н-бензоциклогептен-6-амина (15,0 г) Тпл 158-159°С ИК-спектр (Nujol) 3300, 1680, 1640 см 1 ЯМР-спектр (хлороформ-d, 5) 0,87 (12Н, дубл , J = 6 Гц), 1,3-1,8 (12Н, мульт), 1,8-2,0 (4Н, мульт), 2,6-3,1 (8Н, мульт), 3,74 (ЗН, сингл), 3,75 (ЗН, сингл), 3,9-4,3 (4Н, мульт), 4,9-5,2 (4Н, мульт), 5,5-5,7 (1Н, мульт), 5,7-5,9 (1Н, мульт), 6,6-6,75 (4Н, мульт), 6,9-7,1 (2Н, мульт), 7,2-7,5 (ЮН, мульт) Масс-спектр (m/z) 438 Препарат 20. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 19 (6R)- и (63)-г\І-(г\І-бензилоксикарбонил-І_-лейцин)-3-метокси-6,7,8,9 -тетрагидро-5Н-бензоциклогептен-6-амин Тпл 168-173°С ИК-спектр (Nujol) 3280, 1685, 1635 см 1 ЯМР-спектр (хлороформ-d, 5) 0,87 (12Н, дубл , J = 6 Гц), 1,3-1,8 (12Н, мульт), 1,8-2,0 (4Н, мульт), 2,6-3,1 (8Н, мульт), 3,74 (ЗН, сингл), 3,75 (ЗН, сингл), 3,9-4,3 (4Н, мульт), 4,9-5,25 (5Н, мульт), 5,6-5,9 (1Н, мульт), 6,55-6,75 (4Н, мульт), 6,9-7,1 (2Н, мульт), 7,2-7',4 (ЮН, мульт) Препарат 21. Смесь (6R) и (63)-І\І-(г\І-бензилоксикарбонилО-лейцил)-3-метокси-6,7,8,9-тетрагидро-5Н-бензо Слои отделяют друг от друга и водный слой дополнительно один раз экстрагируют этилацетатом Органические вытяжки объединяют, промывают насыщенным раствором соли (300 мл), сушат над безводным сульфатом натрия и упаривают в вакууме 2) Полученный остаток растворяют в этилацетате (377 мл) и обрабатывают при охлаждении на водяной бане 4N раствором хлористого водорода в этилацетате (73 мл) После перемешивания при комнатной температуре в течение 1 час, смесь отфильтровывают и осадок на фильтре промывают этилацетатом (45 мл ) Продукт сушат в вакууме, получая (3)-8-бензиламино-3-метокси6,7,8,9-тетрагидро-5Н-бензоциклогегттен- 2-ол гидрохлорид (43,3 г) в виде белых кристаллов 22 41869 циклогегтген-6-амина (6R 6S = 77 23, 20 г), формиата аммония (11,5 г), 10%-ного палладия на угле (50% вл , 4,0 г) и этанола (450 мл) кипятят с обратным холодильником в течение 0,5 час После охлаждения катализатор отделяют фильтрованием и промывают этанолом Фильтрат и промывочные растворы объединяют и упаривают в вакууме Остаток разбавляют этилацетатом, моют насыщенными растворами бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая смесь диастереомеров (6R) и (63)-І\І-О-лейцил-3-метокси-6,7,8,9 тетрагидро-5Н-бензоциклогептен-6-амина (13,5 г) ке Выпавший осадок отделяют, промывают диизо-пропиловым эфиром и сушат, получая гидробромид целевого продукта (2,9 г) Эту соль нейтрализуют 28%-ным водным раствором аммиака и упаривают полученную смесь в вакууме Остаток разбавляют насыщенным водным раствором бикарбоната натрия и экстрагируют три раза н-бутанолом Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая (Р)-8-амино-6,7,8,9-тетрагидро-5Нбензоциклогептен-2-ол Полученный продукт, по данным ЯМР- и ИК-спектроскопии, загрязнен бромистым аммонием, но может быть без дальнейшей очистки использован на следующей стадии Дополнительно количество продукта (3,46 г), который также загрязнен бромистым аммонием, получают из маточника по аналогичной обработке, как описано выше Физические данные приведены для гидробромида целевого продукта Оптическое расщепление диастереомеров проводят перекристаллизацией из ди-изо-пропилового эфира, получая (бР)-изомер (7,0 м 92,8%) диастереомерный избыток по данным HPLC) Дополнительное количество продукта (1,8 г 91,6% диастереомерный избыток получают из маточного раствора после удаления растворителя с последующей перекристаллизацией из ди-изо-пропилового эфира Следующую порцию продукта (0,61 г 92,3% диастереомерный избыток) получают из второго маточного раствора после колоночной хроматографии на силикагеле (20-400 меш, градиентное элюирование, сначала хлороформ изопропанол, от 501 до 25 1, затем изо-пропанол) с последующей перекристаллизацией из ди-изопропилового эфира Все полученные серые образцы (6R)- изомера (9,4 г) объединяют и вновь очищают перекристаллизацией из ди-изо-пропилового эфира, получая (бР)-Ы-О-лейцил-З-метокси6,7,8,9-тетрагидро-5Н-бензоциклогегттен-6-амин (7,9 г, 95,2% диастереомерный избыток) Тпл 298-299°С [a] D 2 7 = -24,6° (с = 0,55, ЕЮН) ИК-спектр (Nujol) 3400, 1610, 1580 см 1 ЯМР-спектр (ДМСО-de, 5) 1,1-2,2 (4 Н, мульт), 2,5-3,2 (5Н, мульт), 6,4-6,6 (2Н, мульт), 6,85-6,95 (1Н, мульт), 7,85 (ЗН, шир сингл), 9,20 (1Н, сингл) Масс-спектр (m/z) 177 Препарат 24. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 23 (3)-8-амино-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2-ол гидробромид Тпл 297-299°С [a] D 2 1 = +24,6° (с = 0,65, ЕЮН) ИК-спектр (Nujol) 3400, 1610, 1580 см 1 ЯМР-спектр (ДМСО-de, 5) 1,1-2,2 (4Н, мульт), 2,5-3,2 (5Н, мульт), 6,4-6,6 (2Н, мульт), 6,85-6,95 (1Н, мульт), 7,85 (ЗН, шир сингл), 9,20 (1Н, сингл) Масс-спектр (m/z) 177 Препарат 25. Смесь (Р)-8-амино-6,7,8,9-тетрагидро-5Нбензоциклогептен-2-ола (5,8 г загрязнен бромистым аммонием), бензальдегида (5,3 мл), уксусной кислоты (0,15 мл), 10%-ного палладия на угле (50% вл , 1,1 г) и этанола перемешивают под давлением водорода в течение 1 часа, а затем прибавляют дополнительное количество бензальдегида (5,3 мл) После перемешивания в течение 0,5 час пускают через смесь ток водорода и перемешивание продолжают еще в течение 3 час К реакционной массе прибавляют дополнительную порцию уксусной кислоты (0,15 мл) и смесь перемешивают под давлением водорода 1 атм еще в течение 1 час Катализатор отфильтровывают и промывают этанолом Удаляя растворитель в вакууме, получают остаток, который разбавляют этилацетатом, моют насыщенными растворами бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле (градиентное элюирование, сначала хлороформ, затем хромоформ-метаном, от 100 1, к 50 1 до 10 1), получая (Р)-8-бензиламино-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2-ол (6,6 г) Физичес Тпл 117-118°С [a] D 2 7 = + 5,6° (с = 0,60, ЕЮН) ИК-спектр (Nujol) 3380, 3320, 1610 см 1 ЯМР-спектр (хлороформ-d, 5) 0,8-1,0 (6Н, мульт), 1,2-1,4 (1Н, мульт), 1,47 (2Н, шир сингл ), 1,5-1,8 (4Н, мульт), 1,8-2,1 (2Н, мульт), 2,7-2,8 (2Н, мульт), 2,8-3,1 (2Н, мульт), 3,2-3,4 (1Н, мульт), 3,76 (ЗН, сингл), 4,0-4,2 (1Н, мульт), 6,66,7 (2Н, мульт), 6,9-7,1 (2Н, мульт) Масс-спектр (m/z) 304 Препарат 22. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 21 (63)-І\І-І_-лейцил-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-амин Тпл 117-118°С [a] D 2 7 = -5,4° (с = 0,66 ЕЮН) ИК-спектр (Nujol) 3380, 3320, 1610 см 1 ЯМР-спектр (хлороформ-d, 5) 0,8-1,0 (6Н, мульт), 1,2-1,4 (1Н, мульт), 1,33 (2Н, шир сингл 1,5-1,8 (4Н, мульт), 1,8-2,1 (2Н, мульт), 2,7-2,8 (2Н, мульт), 2,8-3,1 (2Н, мульт), 3,2-3,4 (1Н, мульт), 3,76 (ЗН, сингл), 4,0-4,2 (1Н, мульт), 6,6-6,7 (2Н, мульт), 6,9-7,1 (2Н, мульт) Масс-спектр (m/z) 304 Препарат 23. Смесь (6Р)-І\І-О-лейцил-3-метокси-6,7,8,9тетрагидро-5Н-бензоциклогегтген- 6-амина (8,0 г) и 47%-ной бромистоводородной кислоты (262 мл) перемешивают при 150°С в течение 15,5 час После охлаждения до комнатной температуры реакционную смесь оставляют на ночь в холодильни 23 41869 Тпл 152-153°С [a] D 2 4 = + 18,6° (с = 0,78 ДМСО) ИК-спектр (Nujol) 3520, 3300, 1730, 1620 см 1 ЯМР-спектр (ДМСО-de, 5) 1,1-1,4 (1Н, мульт), 1,65-2,05 (2Н, мульт), 2,1-2,3 (1Н, мульт), 2,55-3,15 (5Н, мульт), 3,71 (ЗН, сингл), 3,99 (2Н, сингл), 4,07 (1Н, дубл , J = 14,5 Гц), 4,17 (1Н, дубл , J = 13,5 Гц), 6,66 (1Н, дублет дублетов, J = 2,7 Гц, 8,2 Гц), 6,80 (1Н, дубл , J = 2,7 Гц), 7,00 (1Н, дубл , J = 8,2 Гц), 7,3-7,6 (5Н, мульт) Препарат 29. Смесь І\І-бензил-3-метокси-6,7,8,9-тетрагидро-5Н-бензо-циклогегтген-6-амина (68,7 г), формиата аммония (68,15 г) и 10%-ного палладия на угле (50% вл 6,8 г) в этаноле (1,2 л) кипятят с обратным холодильником в течение 1 час После охлаждения катализатор отфильтровывают и растворитель удаляют в вакууме К остатку прибавляют воду и 28%-ный водный раствор аммиака и полученную смесь экстрагируют этилацетатом Экстракт промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая 3-метокси6,7,8,9-тетрагидро-5Н-бензоциклогегттен-6-амин (35,8 г) в виде масла кие данные приведены для гидрохлорида целевого продукта, который перекристаллизовывают из смеси ди-изо-пропиловый эфир - этанол (3 1) Тпл 234-235°С [a] D 2 7 = -34,5°(c = 0,51, ЕЮН) ИК спектр (Nujol) 3250,2400 с м 1 ЯМР-спектр (ДМСО-de, 5) 1,0-1,4 (1Н, мульт), 1,7-2,1 (2Н, мульт), 2,2-2,4 (1Н, мульт), 2,5-2,7 (2Н, мульт), 2,8-3,2 (ЗН, мульт), 4,24 (2Н, шир сингл ), 6,52 (1Н, дублет дублетов, J = 2 Гц, 8 Гц), 6,67 (1Н, дубл , J = 2 Гц), 6,89 (1Н, дубл J = 8 Гц), 7,3-7,4 (ЗН, мульт), 7,5-7,7 (2Н, мульт), 9,2-9,5 (2Н, шир мульт), 9,24 (1Н, сингл ) Масс-спектр (m/z) 267 Препарат 26. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 25 (3)-8-бензиламино-6,7,8,9-тетрагидро-5Нбензоциклогептен-2-ол гидрохлорид Тпл 233-235°С Препарат 27. Смесь І\І-бензил-3-нитро-6,7,8,9-тетрагидро5Н-бензоциклогептен-6-амина (2,8 г), муравьиной кислоты (8 мл) и уксусного ангидрида (16 мл) перемешивают при комнатной температуре в течение 15 час Реакционную часть выливают в водный раствор бикарбоната натрия и дважды экстрагируют этилацетатом Экстракт сушат над безводным сульфатом натрия и упаривают, получая Nбензил-І\І-формил-3-нитро-6,7,8,9-тетрагидро-5Нбензоциклогептен -6-амин (2,71 г) Тпл 126-128°С ИК-спектр (Nujol) 1650,1510 с м 1 ЯМР-спектр (хлороформ-d, 5) 1,20-1,50 (1Н, мульт), 1,85-2,40 (ЗН, мульт), 2,60-2,95 (ЗН, мульт), 3,15-3,70 (2Н, мульт), 4,36 (0,5Н, дубл, J = 15,5 Гц), 4,49 (0,5Н, дубл , J = 15 Гц), 4,52 (0,5 Н, дубл , J = 15,5 Гц), 4,76 (0,5 Н, дубл , J = 15 Гц), 7,10-7,47 (6Н, мульт), 7,65-7,78 (1Н, мульт), 7,90-8,15 (1Н, мульт), 8,31 (0,5Н, сингл), 8,42(0,5 Н, сингл) Масс-спектр (m/z) 324 Препарат 28. |\|-бензил-3-метокси-6,7,8,9-тетрагидро-5Нбензоциклогептен-6-амин гидрохлорид (6,0 г) нейтрализуют 7%-ным раствором аммиака и смесь дважды экстрагируют этилацетатом Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая масло (5, 29 г) Масло растворяют в 1-пропанола (10 мл) и полученный раствор прибавляют к горячему раствору О-(-)-винной кислоты (3,1 г) в 1-пропаноле (50 мл) После охлаждения выпавшие кристаллы отфильтровывают и перекристаллизовывают дважды с дополнительным количеством О-(-)-винной кислоты (сначала 0,7 г, затем 68 мг) из 1-пропанола, получая (S)-N-6eHзил-3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен -6-амин(О)-тартрат (1 1) (1,7 г) Энантиомерный избыток (100%) определяют на двух хиральных колонках (CHIRALCEL, OD) Условия HPLC хроматографии - элюент гексан-2-пропанол (9 1), скорость потока жидкости 0,6 мл/мин, температура колонки 25°С, контролируемая длина волны 220 нм Время удерживания составляет 24,6 минут ЯМР-спектр (хлороформ-d, 5) 1,38-2,10 (4Н, мульт), 1,45 (2Н, шир сингл), 2,6-3,06 (5Н, мульт), 3,77 (ЗН, сингл), 6,64 (1Н, дублет дублетов, J = 2,7 Гц, 8,1 Гц), 6,71 (1Н, дубл , J = 2,7 Гц), 6,98 (1Н, дубл , J = 8,1 Гц) Масс-спектр (m/z) 191 Препарат 30. Следующее соединение было получено путем взаимодействия соединения, полученного по методике, аналогичной той, которая описана для препарата 29, с хлористым водородом 3-Этоксикарбонилметокси-5,6,7,8,9,10-гексагидробензоциклооктен -6-амин гидрохлорид ИК-спектр (хлороформ-d) 1760, 1600 см 1 ЯМР-спектр (ДМСО-de, 5) 0,9-1,9 (6Н, мульт), 1,21 (ЗН, трипл , J = 7,1 Гц), 2,5-3,6 (5Н, мульт), 4,17 (2Н, кварт, J = 7,1 Гц), 4,73 (2Н, сингл), 6,7-6,9 (2Н, мульт), 7,07, 1 (1Н, мульт), 8,20 (ЗН, шир сингл) Масс-спектр (m/z) 277 (M-HCI)+ Препарат 31. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 29 2-Этоксикарбонилметокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен -7-амин ИК-спектр (пленка) 3610, 3360, 3300, 3180, 1755, 1610,1580, 1205, 1180 см 1 ЯМР-спектр (хлороформ-d, 5) 1,15-1,3 (2Н, мульт), 1,30 (ЗН, трипл , J = 7,1 Гц), 1,41 (2Н, шир сингл), 2,0-2,15 (2Н, мульт), 2,65-2,75 (4Н, мульт), 2,9-3,05 (1Н, мульт), 4,27 (2Н, кварт, J = 7,1 Гц), 4,59 (2Н, сингл), 6,62 (1Н, дублет дублетов, J = 8,2 Гц 6 2,6 Гц), 6,72 (1Н, дубл , J = 2,6 Гц), 7,01 (1Н, дубл , J = 8,2 Гц) Масс-спектр (m/z) 263 (М+), 248, 246, 161 (осн) Препарат 32. К горячему раствору D-миндальной кислоты (25,65 г) в этилацетате (300 мл) прибавляют раствор 3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-амина (35,8 г) в этилацетате (150 мл) 24 41869 После охлаждения выпавшие кристаллы отфильтровывают и перекристаллизовывают из смеси этилацетат-этанол (2 1) и получают (Р)-З-метокси6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-амин (О)-миндалят (23,4 г) Энантиомерный избыток (54%) определяют на хиральнои колонке (ULTRON ES-OVM) Условия HPLC хроматографии - элюент буферный 0,02 М раствор фосфорной кислоты ацетонитрил (9 1), скорость потока жидкости 1,0 мл/мин, температура колонки 25°С, контролируемая длина волны 220 нм Время удерживания составляет 11,8 минут Оба фильтрата объединяют и упаривают в вакууме Остаток превращают в его (І_)-миндалят обычным способом Кристаллы перекристаллизовывают из смеси этилацетат-этанол (2 1) и получают (3)-3-метокси-6,7,8,9-тетрагидро5Н-бензоциклогептен-6-амин (І_)-миндалят (17,98 г) Энантиомерный избыток (70%) определяют на той же колонке и в тех же условиях Время удерживания составляет 7,9 минут Тпл 109-120°С ИК-спектр (Nujol) 3310, 3150, 1515, 1350 см 1 ЯМР-спектр (хлороформ-d, 5) 1,75-2,05 (8Н, мульт), 2,3 (2Н, мульт), 2,6-2,85 (2Н, мульт), 3,15-3,65 (4Н, мульт), 3,85 (2Н, дубл , J = 12,8 Гц), 4,02 (2Н, дубл , J = 12,8 Гц), 4,98 (1Н, дубл , J = 8,2 Гц), 5,32 (1Н, мульт), 7,2-7,4 (14Н, мульт), 8,01 (2Н, дублет дублетов, J = 8,2 Гц, 2,2 Гц), 8,14 (1Н, дубл , J = 2,2 Гц), 8,29 (1Н, дубл , J = 2,2 Гц) Масс-спектр (m/z) 312 (М+), 221, 91 (осн ) Препарат 35. Смесь 7-бензиламино-3-нитро-6,7,8,9-тетрагидро-5Н-бензоциклогептен-5-ола (6,51 г) бисульфата калия (13,0 г) нагревают при температуре 210°С в течение 20 минут и суспендируют с смеси дихлорметана (150 мл), воды (100 мл) и 28%-ного раствора аммиака Суспензию фильтруют Дихлорметановый слой отделяют, сушат над безводным сульфатом натрия и хроматографируют на силикагеле, используя в качестве элюента дихлорметанметанол Первый элюат дает N-бензил6,7-дигидро-2-нитро-5Н-бензоциклогептен-7-амин (3,11 г) в виде темно-коричневого твердого вещества Препарат 33. Раствор бензиламина (8,18 г) в бензоле (100 мл) прибавляют по каплям в течение 20 минут к суспензии 8,9 -дигидро-3-нитро-5Н-бензоциклогептен-5-она (15,51 г) в этаноле (155 мл) при комнатной температуре Полученную смесь перемешивают при указанной температуре в течение 3,5 час оставляют при той же температуре на ночь и отфильтровывают Фильтрат упаривают, получая 7-бензиламино-3-нитро-6,7,8,9-тетрагидро-5Нбензоциклогептен-5-он (25,41 г) в виде темно-коричневого масла ИК-спектр (пленка) 3330, 1680, 1515, 1350 см 1 ЯМР-спектр (хлороформ-d, 5) 1,75-1,95 (2Н, мульт), 2,1-2,3 (1Н, мульт), (1Н, мульт), 2,9-3,15 (ЗН, мульт), 3,2-3,4 (2Н, мульт), 3,81 (1Н, дубл , J = 13,2 Гц), 3,91 (1Н, дубл , J = 13,2 Гц), 7,25-7,45 (6Н, мульт), 8,23 (1Н, дублет дублетов, J = 8,2 Гц, 2,4 Гц), 8,60 (1Н, дубл , J = 2,4 Гц) Препарат 34. Водный раствор (92 мл) боргидрида натрия (18,29 г) прибавляют по каплям при комнатной температуре к перемешиваемому раствору 7-бензиламино-3-нитро-6,7,8,9-тетрагидро-5Н-бензоциклогептен-5-она (25,01 г) в течение более 20 минут Полученную смесь перемешивают в течение 4 час, оставляют на ночь при той же температуре и упаривают в вакууме Остаток разбавляют водой и экстрагируют дважды дихлорметаном Экстракты объединяют, моют насыщенным раствором соли, сушат над сульфатом натрия, обрабатывают 4N раствором хлористого водорода в этилацетате и упаривают в вакууме Остаток суспендируют в метаноле и отфильтровывают Фильтрат упаривают в вакууме, разбавляют водным раствором аммиака и экстрагируют дважды дихлорметаном Экстракты объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и хроматографируют на силикагеле, используя в качестве элюента дихлорметан-метанол Элюат упаривают в вакууме и остаток промывают диэтиловым эфиром, получая 7-бензиламино-3-нитро-6,7,8,9-тетрагидро-5Н-бензоциклогептен-5-од (7,33 г) в виде темно-желтого порошка (смесь диастереомеров) Тпл 62,5-69°С ИК-спектр (Nujol) 3310, 1660, 1580, 1520, 1340 с м 1 ЯМР-спектр (хлороформ-d, 5) 2,0 (1Н, шир ), 2,0-2,15 (2Н, мульт), 2,8-2,95 (2Н, мульт), 3,453,55 (1Н, мульт), 3,89 (2Н, сингл), 6,11 (1Н, дублет дублетов, J = 12,2 Гц, 4,2 Гц), 6,50 (1Н, дублет дублетов, J = 12,2 Гц, 1,6 Гц), 7',2-7',4 (6Н, мульт), 7,97 (1Н дублет дублетов, J = 8,2 Гц, 2,4 Гц), 8,04 (1Н, дубл , и = 2,4Гц) Масс-спектр (m/z) 294 (М+), 203, 91 (осн ) Второй элюат дает 6,7-дигидро-2-нитро-5Нбензоциклогептен-7-амин (95 мг) в виде масла ИК-спектр (пленка) 3350, 3280, 3170, 1610, 1580, 1510, 1340 с м 1 ЯМР-спектр (хлороформ-d, 5) 1,58 (1Н, шир сингл), 1,85-2,1 (2Н, мульт), 2,85-2,95 (2Н, мульт), 3,71 (1Н, мульт), 6,01 (1Н, дублет дублетов, J = 12,2 Гц, 4,0 Гц), 6,42 (1Н, дублет дублетов, J = 12,2 Гц, 1,6 Гц), 7,2-7,4 (6Н, мульт), 7,28 (1Н, дубл , J = 8,2 Гц), 7,97 (1Н, дублет дублетов, J = 8,2 Гц, 2,4 Гц), 8,04 (1Н, дубл , J = 2,4 Гц) Масс-спектр (m/z) 204 (М + , осн ) Препарат 36. Раствор І\І-бензил-6,7-дигидро-2-нитро-5Нбензоциклогептен-7-амина (3,03 г) в этаноле (19 мл) и диоксане (19 мл), прибавляют по каплям к перемешиваемой смеси порошка железа (3,03 г) и хлористого аммония (0,36 г) в этаноле (15 мл), диоксане (15 мл) и воде (15 мл) при кипячении в течение 20 минут Полученную смесь кипятят с обратным холодильником в течение 20 минут еще горячую реакционную смесь фильтруют Фильтрат упаривают в вакууме и остаток распределяют между этилацетатом и водным раствором бикарбоната натрия Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента дихлорметан и метанол, и получают І\І7-бензил-6,7-дигидро-5Н-бензоциклогептен-2,7-диамин (2,52 г) в виде коричневого масла 25 41869 ИК-спентр (пленка) 3440, 3350 3220, 1620 слой целита и фильтрат упаривают в вакууме Остаток очищают перегонкой при пониженном давлении, получая 2-ацетил-6-хлорпиридин (1,84 г) Т кип 105-110°С/5 мм ртст ИК-спектр (пленка) 1700, 1570, 1560 см 1 ЯМР-спектр (хлороформ-d, 5) 2,71 (ЗН, сингл), 7,52 (1Н, дублет дублетов, J = 1,0 Гц, 7,9 Гц), 7,81 (1Н, псевдо трипл , J = 7,8 Гц), 7,97 (1Н, дублет дублетов, J = 1,0 Гц, 7,6 Гц) Масс-спектр (m/z) 156 (М+) Препарат 40. К раствору 2-ацетил-6-хлорпиридина (7,48 г) в 1,4-диоксане (112 мл) прибавляют 4N раствор хлористого водорода в 1,4-диоксане (12,6 мл) К полученному раствору при 30°С прибавляют по каплям хлористый сульфурил (13,51 мл) После перемешивания в течение 0,5 час, к смеси прибавляют ледяную воду (150 мл), органический слой отделяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь н-гексана и толуола (1 1), и получают хлорметил-6-хлор-2-пиридилкетон (7,05 г) в виде твердого вещества см ЯМР-спектр (хлороформ-d, 5) 1,57 (1Н, шир), 1,95-2,1 (2Н, мульт), 2,6-2,8 (2Н, мульт), 3,4-3,6 (ЗН, мульт), 3,8 (2Н, сингл ), 5,92 (1Н, дублет дублетов, J = 12,0 Гц, 4,0 Гц), 6,32 (1Н, дублет дублетов, J = 12,0 Гц, 1,8 Гц), 6,4-6,55 (2Н, мульт), 6,92 (1Н, дубл , 7,8 Гц), 7,2-7,4 (5Н, мульт) Масс-спектр (m/z) 264 (М+), 157 (осн ), 91 Препарат 37. Водный раствор (6 мл) нитрата натрия (609 мкг) прибавляют по каплям к перемешиваемой суспензии ІЧ7-бензил-6,7-дигидро-5Н-бензоциклогептен-2,7-диамина (2,22 г) в 6N растворе серной кислоты (22 мл) в течение 15 минут при охлаждении льдом и полученную смесь перемешивают при той же температуре в течение 30 минут Полученный раствор прибавляют по каплям при перемешивании к раствору серной кислоты (3 мл) в воде (15 мл) при 75°С в течение 15 минут Полученную смесь перемешивают при указанной температуре еще в течение 30 минут, охлаждают в бане со льдом, подщелачивают 28%-ным водным раствором аммиака (15 мл) и шесть раз экстрагируют дихлорметаном Экстракты объединяют, упаривают в вакууме и хроматографируют через силикагель, используя дихлорметан и метанол в качестве элюента, и получают І\І-бензиламино-6,7дигидро-5Н-бензоциклогегтген-2-ол (1,72 г) в виде бледно-коричневого масла см 1 Тпл 61-62°С ИК-спектр (Nujol) 1720 с м 1 ЯМР-спектр (хлороформ-d, 5) 5,07 (2Н, сингл), 7,57 (1Н, дублет дублетов, J = 1 Гц, 7,9 Гц), 7,86 (1Н, псевдо трипл , J = 7,7 Гц), 8,03 (1Н, дублет дублетов, J = 1,0 Гц, 7,6 Гц) Препарат 41. Раствор хлорметил-6-хлор-2-пиридилкетона (8,126 г) в тетрагидрофуране (32 мл) и раствор борана в тетрагидрофуране (1,0 М, 25,7 мл) одновременно прибавляют к смеси раствора (RJ-тетрагидро-3,3-дефенил-1 Н63Н-пирроло[1,2-с][1,3,2] оксазоборола в тетрагидрофуране (прибл 0,335 М, 8,9 мл) и раствора барана в тетрагидрофуране (1,0 М, 4,3 мл) при -5°С в атмосфере азота в течение не менее 0,5 час и полученную смесь перемешивают еще в течение 3,5 час При 0°С к реакционной смеси по каплям прибавляют метанол и оставляют при перемешивании на ночь при комнатной температуре Смесь упаривают в вакууме и остаток распределяют между этилацетатом и 1N раствором соляной кислоты Органический слой отделяют, а водный слой дополнительно экстрагируют этилацетатом ИК-спектр (пленка) 3270, 2650, 1600, 1570 ЯМР-спектр (хлороформ-d, 5) 1,95-2,15 (2Н, мульт), 2,6-2,8 (2Н, мульт), 3,30 (1Н, шир ), 3,453,55 (1Н, мульт), 3,83 (1Н, дубл , J = 13,2 Гц), 3,90 (1Н, дубл , 13,2 Гц), 5,92 (1Н, дублет дублетов, J = 12,2 Гц, 4,0 Гц), 6,31 (1Н, дублет дублетов, J = 12,2 Гц, 11,8 Гц), 6,5-6,65 (2Н, мульт), 6,96 (1Н, дубл , J = 7,8 Гц), 7,2-7,35 (6Н, мульт) Масс-спектр (m/z) 265 (М+), 158 (осн ), 91 Препарат 38. В атмосфере азота к раствору 6-хлор-2пиридилальдегида (2,0 г ) в диэтиловом эфире (20 мл) прибавляют при 0°С раствор метилмагнийбромида в диэтиловом эфире (ЗМ, 5,65 мл) и перемешивают в течение 1,5 час, затем прибавляют насыщенный раствор хлористого аммония (30 мл) и органический слой отделяют Водный слой дополнительно экстрагируют диэтиловым эфиром Органические вытяжки объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают перегонкой при пониженном давлении, получая 1-(6-хлор-2-пиридил) этанол (2,13 г ) Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают (-)-2-хлор-1-(6-хлор-2пиридил) этанол (7,98 г) в виде масла [а]р32 = 16,3° (с = 0,81, хлористый метилен) Препарат 42. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 41 (-)-2-хлор-1-(2-нафтил) этанол Тпл 93-94°С [а]о = 40,09° (с = 1,07, хлористый метилен) ИК-спектр (Nujol) 3210 с м 1 ЯМР-спектр (хлороформ-d, 5) 2,80 (1Н, шир ), 3,5-3,9 (2Н, мульт), 5,05 (1Н, дублет дубле Ткип 140-145°С/5 мм рт ст ИК-спектр (пленка) 3375, 1585, 1560, 1435, 1410 с м 1 ЯМР-спектр (CDCI3-D2O, 5) 1,52 (ЗН, дубл , J = 6,6 Гц), 4,87 (1Н, кварт, J = 6,6 Гц), 7,2-7,34 (2Н, мульт), 7,66 (1Н, трипл , J = 7,8 Гц) Масс-спектр (m/z) 156 (М+), 142, 114, 78 Препарат 39. Смесь 1-(6-хлор-2-пиридил) этанола (2,13 г) и двуокиси марганца (8,4 г) в хлороформе (21 мл) кипятят с обратным холодильником в течение 8 час После охлаждения смесь фильтруют через 26 41869 тов, J = 3,6 Гц, 8,5 Гц), 7,4-7,5 (ЗН, мульт), 7,8 (4Н, мульт) Препарат 43. Смесь (-)-2-хлор-1-(6-хлор-2-пиридил) этанола (1,028 г) изо-пропенилацетата (1,8 мл) и PS Amano липазы (2,06 г) в абсолютном ди-изо-пропиловом эфире (31 мл) перемешивают при комнатной температуре в течение 2,5 дней Нерастворяющийся материал удаляют фильтрованием и фильтрат упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают (-)-2-хлор-1-(6-хлор-2-пиридил) этанол (0,40 г) [а]р 2 8 8 = -30,0° (с = 0,935, хлористый метилен) ИК-спектр (жидкость) 3375, 1580, 1560 см 1 ЯМР-спектр (хлороформ-d, 5) 3,54 (1Н, дубл , J = 6,3 Гц), 3,80 (1Н, дублет дублетов, J = 661 Гц, 11,1 Гц), 3,91 (1Н, дублет дублетов, J = 4,8 Гц, 11,1 Гц), 4,90-5,04 (1Н, мульт), 7,29 (1Н, дубл , J = 7,9 Гц), 7,40 (1Н, дубл , J = 7,6 Гц), 7,71 (1Н, псевдо трипл , J = 7,7 Гц) Препарат 44. Смесь (-)-2-хлор-1-(6-хлор-2-пиридил) этанола (390 мг), 2М раствора едкого натра (3,9 мл) и диэтилового эфира (0,2 мл) перемешивают при комнатной температуре в течение 3 часов Далее к смеси прибавляют насыщенный раствор соли и этилацетат Органический слой отделяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают (-)-1-(6-хлор-2пиридил)-1,2-эпоксидэтан (250 мг) в виде масла [а]р 3 0 8 = -34,4° (с=0,57, хлористый метилен) ИК-спектр (жидкость) 1590, 1560, 1540, 1420 см 1 ЯМР-спектр (хлороформ-d, 5) 2,88 (1Н, дублет дублетов, J = 2,5 Гц, 5,8 Гц), 3,18 (1Н, дублет дублетов, J = 4,1 Гц, 5,8 Гц), 3,99 (1Н, дублет дублетов, J = 2,5 Гц, 4,1 Гц), 7,16 (1Н, дублет дублетов, J = 9,7 Гц, 7,6 Гц), 7,27 (1Н, дублет дублетов, J = 0,7 Гц, 7,9 Гц), 7,65 (1Н, псевдо трипл , J = 7,7 ГЦ) Масс-спектр (m/z) 156 (М+) Препарат 45. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 44 (+) -2-нафтилоксиран Тпл 75-76°С [a] D = +34,17°(c 1,03, толуол) ИК-спектр (Nujol) 1265, 1240, 820, 740 см-1 ЯМР-спектр (хлороформ-d, 5) 2,89 (1Н, дублет дублетов, J = 2,6 Гц, 5,5 Гц), 3,20 (1Н, дублет дублетов, J = 4,1, 5,5 Гц), 4,01 (1Н, дублет дублетов, J = 2,6 Гц, 4, Гц), 7,31 (1Н, дублет дублетов, J = 1,7 Гц, 8,5 Гц), 7,4-7,5 (2Н, мульт), 7,8 (4Н, мульт) Масс-спектр (m/z) 170 (М+), 141 Препарат 46. К суспензии 3-нитро-6,7,8,9-тетрагидро-5Нбензоциклогептен-5-она (7,0 г) в метаноле (70 мл) при 21°С-30°С прибавляют порциями боргидрид натрия (1,29 г) и полученную смесь перемеши вают в течение 1 час Выливают смесь в ледяную воду (210 мл) и выпавший осадок отфильтровывают, промывают водой и сушат, получая 3-нитро6,7,8,9-тетрагидро-5Н-бензоциклогегттен-5-ол (6,81 г) Тпл 116-118°С ИК-спектр (Nujol) 3260, 3160, 1520, 1340 см 1 ЯМР-спектр (хлороформ-d, 5) 1,25-2,18 (7Н, мульт), 2,66-3,10 (2Н, мульт), 4,89-5,06 (1Н, мульт), 7,23 (1Н, дубл , J = 8,2 Гц), 7,98 (1Н, дублет дублетов, J = 2,5 Гц, 8,2 Гц), 8,38 (1Н, дубл , J = 2,5 Гц) Препарат 47. Смесь 3-нитро-6,7,8,9-тетрагидро-5Н-бензоциклогегтген-5-ола (70,67) и бисульфата натрия (53,00 г) нагревают при 160°С в течение 1 час После охлаждения к реакционной массе прибавляют смесь воды (400 мл) и этилацетата (400 мл) Органический слой отделяют, а водяной слой дополнительно экстрагируют этилацетатом (200 мл) Органические вытяжки объединяют, промывают насыщенным раствором соли (150 мл), сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь н-гексана и хлороформа (1 1), и получают 2-нитро-6,7-дигидро-5Н-бензоциклогегттен (48,1 г) Т пл 43,0°С ИК-спектр (Nujol) 1520, 1340, 1280, 1085, 930, 900, 835, 760, 740 см 1 ЯМР-спектр (хлороформ-d, 5) 1,88-2,10 (2Н, мульт), 2,40-2,59 (2Н, мульт), 2,83-3,03 (2Н, мульт), 6,06 (1Н, дублет триплетов, J = 12,2 Гц, 4,5 Гц, 4,5 Гц), 6,45 (1Н, дублет триплетов, J = 12,2 Гц, 2,0 Гц, 2,0 Гц), 7,22 (1Н, дубл , J = 8,2 Гц), 7,93 (1Н, дублет дублетов J = 2,4 Гц, 8,2 Гц), 8,00 (1Н, дубл , J = 2,4 Гц) Препарат 48. Смесь 2-нитро-6,7-дигидро-5Н-бензоциклогептена (48,10 г) и м-хлорбензойной кислоты (80%, 65,75 г) в хлороформе (962 мл) кипятят с обратным холодильником в течение 4 час После охлаждения к смеси прибавляют 1N раствор едкого натра (350 мл) Органический слой отделяют, а водный слой дополнительно экстрагируют хлороформом Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и добавляют к смеси силикагель (100 г) Нерастворимый материал отфильтровывают, а фильтрат упаривают в вакууме, получая 3-нитро-6,7,8,9-тетрагидро-5Н-бензоцикло-5,6-эпоксигегтган (53,90 г) Тпл 62-64°С ИК-спектр (Nujol) 1610,1580, 1520, 1340 см 1 ЯМР-спектр (хлороформ-d, 5) 1,43-2,32 (4Н, мульт), 2,82-3,08 (2Н, мульт), 3,35-3,54 (1Н, мульт), 4,06 (1Н, дубл , J = 4,2 Гц), 7,26 (1Н, дубл , J = 8,3 Гц), 8,08 (1Н, дублет дублетов, J = 2,4 Гц, 8,3 Гц), 8,37 (1Н, дубл , J = 2,4 Гц) Препарат 49. В атмосфере азота прибавляют раствор 3нитро-6,7,8,9-тетрагидро-5Н-бензоцикло-5,6-эпоксигептана (53,9 г) в бензоле (540 мл) к хлориду цинка (41,9 г) и полученную смесь перемешивают в течение 1 дня Прибавляют к смеси силикагель и нерастворимый материал отфильтровывают 27 41869 Фильтрат упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают 3-нитро-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-он (33,83 г) Тпл 84-86°С ИК-спектр (Nujol) 1700,1550, 1505, 1340 см 1 ЯМР-спектр (хлороформ-d, 5) 1,95-2,17 (2Н, мульт), 2,55-2,71 (2Н, мульт), 3,00-3,16 (2Н, мульт), 3,83 (2Н, сингл), 7,34 (1Н, дубл , J = 8,0 Гц), 8,01-8,17 (2Н, мульт) Препарат 50. Смесь 3-нитро-6,7,8,9-тетрагидро-5Н-бензоциклогегтген-6-она (0,20 г), порошка железа (218 мг), хлористого аммония (52 мг), воды (1,2 мл) и этанола (4 мл) кипятят с обратным холодильником в течение 2 час После охлаждения нерастворимый материал отфильтровывают и фильтрат упаривают в вакууме К остатку прибавляют этилацетат и воду Органический слой отделяют, а водный слой дополнительно экстрагируют этилацетатом Органические вытяжки объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают 3-амино-6,7,8,9-тетрагидро-5Н-бензоциклогептин-6-он (153 мг) час После охлаждения к реакционной массе прибавляют ледяную воду (100 мл) и хлороформ (200 мл) Нерастворимый материал отфильтровывают Органический слой отделяют, а водную фазу дополнительно экстрагируют этилацетатом Экстракты объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом магния и обрабатывают активированным углем (0,65 г) Полученный раствор упаривают в вакууме, а остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента толуол, и получают 3-бром-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-он (6,34 г) Тпл 51-59°С ИК-спектр (Nujol) 1700 с м 1 ЯМР-спектр (хлороформ-d, 5) 1,89-2,08 (2Н, мульт), 2,47-2,65 (2Н, мульт), 2,83-3,00 (2Н, мульт), 3,68 (2Н, сингл), 7,03 (1Н, дубл , J = 7,7 Гц), 7,31 (1Н, дубл , J = 2,0 Гц), 7,33 (1Н, дублет дублетов, J = 7,7 Гц, 2,0 Гц) Препарат 53. Смесь 3-бром-6,7,8,9-тетрагидро-5Н-бензоциклогегтген-6-она (2,00 г) этилакрилата 91,26 г) ацетата палладия (94 мг), трис (2-метилфенил) фосфина (764 мг), триэтиламина 1 (1,69 г) в N,Nдиметилформамиде (20 мл) перемешивают в атмосфере водорода при температуре 100°С в течение 20 час После охлаждения к смеси приливают ледяную воду (20 мл) Образовавшийся осадок отфильтровывают и растворяют в этилацетате (20 мл) Полученный раствор моют три раза водой (20 мл), сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента хлороформ, и получают (Е)-3-(8оксо-6,7,8,9-тетрагидро-5Н-бензоциклогептен-2ил) акрилат (1,34 г) ИК-спектр (хлороформ) 375,1690,1610 см 1 ЯМР-спектр (хлороформ-d, 5) 1,90-2,0 (2Н, мульт), 2,48-2,66 (2Н, мульт), 2,77-2,94 (2Н, мульт), 3,62 (2Н, сингл), 6,45-6,60 (2Н, мульт), 6,93 (1Н, дубл , J = 8,6 Гц) Препарат 51. Следующее соединение было получено по методике, аналогичной той, которая описана для препарата 50 |\|-бензил-г\1-формил-(3-амино-6,7,8,9-тетрагидро-5Н -бензоциклогептен-6-ил) амин ИК-спектр (жидкость) 3680, 3450, 3390, 1660 см 1 Конформер А ЯМР-спектр (CDCI3 - D2O, 5) 1,14-1,46 (1Н, мульт), 1,78-2,20 (ЗН, мульт), 2,39 - 2,73 (ЗН, мульт), 3,04-3,88 (2Н, мульт), 4,364,78 (2Н, мульт), 6,26-6,90 (ЗН, мульт), 7,20-7,44 (5Н, мульт), 8,27 (1Н, сингл ) Конформер Б ЯМР-спектр (CDCI3-D2O, 5) 1,14-1,46 (1Н, мульт), 1,78-2,20 (ЗН, мульт), 2,39-2,73 (ЗН, мульт), 3,04-3,88 (2Н, мульт), 4,36-4,78 (2Н, мульт), 6,26-6,90 (ЗН, мульт), 7,20-7,44 (5Н, мульт), 8,39 (1Н, сингл ) Конформер А Конформер Б = 1 2,3 Масс-спектр (m/z) 294 (М+), 159, 144, 131, 91 Препарат 52. К раствору 3-амино-6,7,8,9-тетрагидро-5Нбензоциклогептен-6-она (9,42 г) в смеси уксусной кислоты (1,85 мл), концентрированной серной кислоты (9,24 мл) и воды (24,56 мл) при охлаждении в бане со льдом и солью прибавляют порциями раствор нитрата натрия (4,08 г) в воде (6,00 мл) и полученную массу перемешивают в течение 1 часа Полученный раствор прибавляют к раствору бромистой меди (10,02 г) и бромистого натрия (9,40 г) в смеси 47%-ной бромистоводородной кислоты (27,72 мл) и воды (61,52 мл) при 75°С и полученную массу перемешивают еще в течение 0,5 Т пл 87-88°С ИК-спектр (Nujol) 1705, 1690 см 1 ЯМР-спектр (хлороформ-d, 5) 1,34 (ЗН, трипл J = 7,1 Гц), 1,91-2,12 (2Н, мульт), 2,52-2,67 (2Н, мульт), 2,89-3,07 (2Н, мульт), 3,74 (2Н, сингл), 4,26 (2Н, кварт, J = 7,1 Гц), 6,40 (1Н, дубл , J = 16,0 Гц), 7,18 (1Н, J = 7,7 Гц), 7,32 (1Н, дубл , J = 1,0 Гц), 7,36 (1Н, дублет дублетов, J = 7,7 Гц, 1,0 Гц), 7,64 (1Н, дубл , J = 16,0 Гц) Препарат 54. Раствор (Е)-3-(8-оксо-6,6,7,8,9-тетрагидро5Н-бензоциклогептен-2-ил) акрилата (400 мг) в этаноле (8 мл) гидрируют над 10%-ным палладием на угле (24 мг) После удаления катализатора раствор упаривают в вакууме и остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь н-гексана и этилацетата (10 1), и получают (Е)-3-(8-оксо6,7,8,9-тетрагидро-5Н-бензоциклогегттен-2-ил) пропионат (311 мг) Тпл 66-68°С ИК-спектр (Nujol) 1720, 1695 см 1 ЯМР-спектр (хлороформ-d, 5) 1,23 (ЗН, трипл, J = 7,1 Гц), 1,91-2,08 (2Н, мульт), 2,482,70 (4Н, мульт), 2,80-3,02 (4Н, мульт), 3,70 (2Н, сингл ), 4,13 (2Н, кварт , J = 7,1 Гц), 6,96-7,06 (ЗН, мульт) Препарат 55. Раствор г\І-бензил-І\І-формил-(3-амино-6,7,8, 9-тетрагидро-5Н-бензоциклогептен-6-ил) амина 28 41869 (0,80 г) в муравьиной кислоте (16 мл) кипятят с обратным холодильником в течение 2 час После охлаждения раствор упаривают в вакууме Остаток растворяют в етилацетате и полученный раствор последовательно моют 1N раствором едкого натра, 1N раствором соляной кислоты, насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-метанол (20 1), и получают г\І-бензил-І\І-формил-(3-формиламино-6,7,8,9-тетрагидро-5Н- бензоциклогептен-6-ил) амин (0,84 г) ИК-спектр (жидкость) 3400, 1735, 1610, 1585, 1510 с м 1 ЯМР-спектр (хлороформ-d, 5) 1,29 (ЗН, трипл J = 7,1 Гц), 1,34-2,09 (5Н, мульт), 2,52-2,95 (6Н, мульт), 3,82 (1Н, сингл), 3,85 (1Н, сингл), 3,88 (2Н, дубл , J = 7,1 Гц), 4,15 (1Н, трипл , J = 3,5 Гц), 4,24 (2Н, кварт, J = 7,1 Гц), 6,35 (1Н, дублет дублетов, J = 2,5 Гц, 8,0 Гц), 6,47 (1Н, дубл , J = 2,5 Гц), 6,90 (1Н, дубл , J = 8,0 Гц), 7,17-7,36 (5Н, мульт) Масс-спектр (m/z) 352 (М+), 219, 207, 146 Препарат 58. В течение 0,5 час поддерживая температуру на уровне 30°С, к энергично перемешиваемой суспензии боргидрида натрия (15,77 г) в смеси 1,4диоксана (315 мл) и этанола (98 мл) прибавляют раствор (2)-2-(3-метоксифенил)-2-нитроэтана (33,85 г) в 1,4-диоксане (315 мл) После перемешивания еще в течение 2 час, полученную массу разбавляют ледяной водой (393 мл) и избыток боргидрида разлагают 50%-ным водным раствором уксусной кислоты (47,4 мл) К полученному раствору прибавляют хлорид натрия (68 г) и этилацетат Органический слой отделяют, а водную фазу дополнительно экстрагируют этилацетатом Экстракты объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме Остаток очищают перегонкой при пониженном давлении, получая 1метокси-3-(2-нитроэтила бензил (23,62 г) Ткип 104-107°С/1 мм рт ст ИК-спектр (жидкость) 1540, 1375 см 1 ЯМР-спектр (хлороформ-d, 5) 3,29 (2Н, трипл, J = 7,4 Гц), 3,80 (ЗН, сингл), 4,60 (2Н, трипл, J = 7,4 Гц), 6,70-6,87 (ЗН, мульт), 7,197,33 (1Н, мульт) Препарат 59. К раствору 1-метокси-8-(2-нитроэтил)бензола (22,59 г) и трет-бутилакрилата (15,98 г) в дихлорметане (180 мл) прибавляют при охлаждении в бане со льдом раствор 1,8-диазабицикло [5 4 0]ундец-7-ена (1,90 г) в дихлорметане (45 мл ) После перемешивания при комнатной температуре в течение 18,5 час к раствору прибавляют ледяную воду (70 мл) Органический слой отделяют и последовательно моют 1N раствором соляной кислоты и насыщенным раствором соли Полученный раствор обрабатывают силикагелем (70 г) и упаривают в вакууме, получая трет-бутил-5-(3-метоксифенил)-4-нитровалерат (29,39 г) ИК-спектр (хлороформ) 3660, 3425, 3400, 1690, 1660 с м 1 ЯМР-спектр (хлороформ-d, ) 1,16-1,49 (1Н, мульт), 1,80-2,30 (ЗН, мульт), 2,42-2,82 (ЗН, мульт), 3,07-3,90 (ЗН, мульт), 4,28-4,86 (2Н, мульт), 6,50-7,20 (ЗН, мульт), 7,20-7,46 (5Н, мульт), 7,66-7,93 (1Н, мульт), 8,25-8,66 (2Н, мульт) Масс-спектр (m/z) 322 (М+), 187, 172, 159 Препарат 56. Гидрид натрия (в виде 60%-ной дисперсии в масле, 100 мг) промывают петролейным эфиром и прибавляют к нему при охлаждении на бане со льдом раствор ІЧ-бензил-ІЧ-формил (3-формиламино-6,7,8,9-тетрагидро-5Н-бензоциклогегттен-6-ил) амина (675 мг) в тетрагидрофуране (10 мл) Смесь перемешивают в течение 20 минут, а затем прибавляют к ней раствор этил бром ацетата (0,28 мл) в тетрагидрофуране (1 мл) и перемешивают еще в течение 1 час К смеси прибавляют насыщенный раствор хлористого аммония Органический слой отделяют, моют насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-метанол (50 1), и получают этил г\І-[(8-І\І-бензилформиламино)-6,7,8,9тетрагидро-5Н-бензоциклогегттен-2-ил] форми ламиноацетат (752 мг) 1 ИК-спектр (хлороформ) 2940, 1745, 1665 см ЯМР-спектр (хлороформ-d, 5) 1,28 (ЗН, трипл , J = 7,1 Гц), 1,22-1,50 (1Н, мульт), 1,832,84 (6Н, мульт), 3,09-3,76 (2Н, мульт), 4,20 (2Н, кварт, J = 7,1 Гц), 4,28-4,86 (4Н, мульт), 8,248,46 (2Н, мульт) Масс-спектр (m/z) 408 (М+), 307, 273, 245, 172 Препарат 57. Смесь этил г\І-[(8-І\І-бензилформиамино)6,7,8,9-тетрагидро-5Нбензоциклогегтген-2-ил] формиламиноацетата (501 мг), 6N раствора соляной кислоты (6,1 мл) и этанола (10 мл) кипятят с обратным холодильником в течение 1 дня После охлаждения раствор выливают в ледяную воду (20 мл) и доводят его рН до 12 с помощью раствора едкого натра Водную фазу экстрагируют этилацетатом и экстракт моют насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток очищают колоночной хроматографией на силикагеле, используя в качестве элюента смесь хлороформ-эта нол (20 1), и получают этил г\І-[(8-г\І-бензиламино)-6,7,8,9-тетрагидро-5Нбензоциклогептен-2-ил] аминоацетат (217 мг) ИК-спектр (жидкость) 1720, 1600, 1545 см 1 ЯМР-спектр (хлороформ, 5) 1,37 (9Н, сингл), 1,98-2,34 (4Н, мульт), 2,94 (1Н, дублет дублетов, J = 5,9 Гц, 14,1 Гц), 3,18 (1Н, дублет дублетов, J = 8,5 Гц, 14,1 Гц), 3,71 (ЗН, сингл), 4,64-4,83 (1Н, мульт), 6,61-6,75 (ЗН, мульт), 7,09-7,21 (1Н, мульт) Масс-спектр (m/z) 308 (М+-1) Препарат 60. К раствору трет-бутил-5-(3-метоксифенил)4-нитровалерата (10,00 г) в 1,4-диоксане (10 мл) при охлаждении в бане со льдом прибавляют 4N раствор хлористого водорода в 1,4-диоксане (17,8 мл) После перемешивания в течение 3 дней при комнатной температуре к полученному раствору прибавляют ледяную воду (60 мл) и хлорид натрия (6 г) рН раствора доводят до 9,5 с помощью 29 41869 насыщенного водного раствора бикарбоната натрия и моют раствор етилацетатом Далее, после того, как рН раствора доводят до 1 с помощью 6N раствора соляной кислоты, реакционную смесь экстрагируют этилацетатом Экстракт промывают насыщенным водным раствором соли, сушат над безводным сульфатом натрия, обрабатывают силикагелем (20 г) и упаривают в вакууме, получая 5-(3-метоксифенил)-4-нитровалериановую кислоту (8,00 г) ИК-спектр (жидкость) 2950-2300, 1700, 1540 см 1 ЯМР-спектр (хлороформ-d, 5) 2,03-2,57 (4Н, мульт), 3,03 (1Н, дублет дублетов, J = 6,1 Гц, 14,1 Гц), 3,28 (1Н, дублет дублетов, J = 8,2 Гц, 14,1 Гц), 3,79 (ЗН, сингл), 4,72-4,91 (1Н, мульт), 6,68-6,90 (ЗН, мульт), 7,17-7,31 (1Н, мульт) Масс-спектр (m/z) 252(M + -1) Препарат 61. Смесь 5-(3-метоксифенил)-4-нитровалериановой кислоты (1,00 г ) и хлористого тионила (0,34 мл) в 1,2-дихлорэтане (2 мл) кипятят с обратным холодильником в течение 1 час После охлаждения к раствору при -12°С прибавляют хлорид алюминия (0,53 г ) и полученную массу перемешивают в течение 0,5 час Раствор выливают в ледяную воду (15 мл) Органический слой отделяют, а водную фазу дополнительно экстрагируют дихлорметаном Экстракты объединяют, моют насыщенным раствором бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая 2-метокси-8-нитро-6,7,8,9-тетрагидро-5Н-бензоциклогептен-5-он (772 мг) J = 14,4 Гц, 5,0 Гц), 3,19 (1Н, дублет дублетов, J = 14,4 Гц, 5,2 Гц), 3,86 (ЗН, сингл), 4,37-4,58 (1Н, мульт), 5,53 (1Н, дубл , J = 7,5 Гц), 6,67 (1Н, дубл , J = 2,5 Гц), 6,87 (1Н, дублет дублетов, J = 2,5 Гц, 8,6 Гц), 7,79 (1Н, дубл , J = 8,6 Гц) Препарат 63. Раствор 2-метокси-8-нитро-6,7,8,9-тетрагидро-5Н-бензоциклогептен-5-она (0,20 г) в уксусной кислоте (2 мл) гидрируют под давлением 4 атм водорода в присутствии палладия на угле (0,20 г) После удаления катализатора доводят рН раствора до 12 с помощью раствора едкого натра и экстрагируют этилацетатом Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая 3-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-6-амин (153 мг) ЯМР-спектр (хлороформ-d, 5) 1,38-2,10 (4Н, мульт), 1,41 (2Н, шир сингл), 2,60-3,06 (5Н, мульт), 3,77 (ЗН, сингл), 6,64 (1Н, дублет дублетов, J = 8,1 Гц, 2,7 Гц), 6,71 (1Н, дубл , J = 2,7 Гц), 6,98 (1Н, дубл , J = 8,1 Гц) Препарат 64. Смесь трет-бутил 5-(3-метоксифенил)-4-нитровалерата (0,31 г) 10%-ного палладия на угле (0,31 г) и формиата аммония (0,63 г) в метаноле (3,1 мл) перемешивают при комнатной температуре в течение 0,5 час После удаления нерастворимого материала, фильтрат упаривают в вакууме К остатку приливают этилацетат и воду, органический слой отделяют Водную фазу дополнительно экстрагируют этилацетатом Органические вытяжки объединяют, моют насыщенным раствором соли, сушат над безводным сульфатом магния и упаривают в вакууме, получая трет-бутил-4-амино-5-(3-метоксифенил) валерат (245 мг) Т пл 120-122°С ИК-спектр (Nujol) 1665, 1590, 1545 см 1 ЯМР-спектр (хлороформ-d, 5) 2,21-2,55 (2Н, мульт), 2,65-2,84 (1Н, мульт), 2,93-3,14 (1Н, мульт), 3,37 (1Н, дублет дублетов, J = 5,6 Гц, 14,6 Гц), 3,62 (1Н, дублет дублетов, J = 7,8 Гц, 14,6 Гц), 3,87 (ЗН, сингл), 4,85-5,03 (1Н, мульт), 6,76 (1Н, дубл , J = 2,5 Гц), 6,91 (1Н, дублет дублетов, J = 2,5 Гц, 8,7 Гц), 7,82 (1Н, дубл , J = 8,7 Гц) Препарат 62. К раствору (3)-(-)-4-ацетиламино-5-(3-метоксифенил) валериановой кислоты (706 мг) в 1,2дихлорэтане (2,1 мл) прибавляют при 0°С хлористый тионил (0,25 мл) и перемешивают смесь в течение 3 час К смеси прибавляют дихлорметан (2,1 мл), а затем порциями при -10°С хлорид алюминия (0,72 г) После перемешивания в течение 2 час раствор выливают в ледяную воду и подкисляют разбавленной соляной кислотой Экстрагируют дихлорметаном, экстракт промывают насыщенным раствором бикарбоната натрия и соли, сушат над безводным сульфатом натрия и упаривают в вакууме Остаток перекристаллизовывают из смеси н-гексана и этилацетата, получая (3)-(-)-8-ацетоамино-2-метокси-6,7,8,9-тетрагидро-5Н-бензоциклогептен-5-он (329 мг) в виде порошка Т пл 132°С [ a ] D 2 1 1 = -97,2° (с = 0,51, МеОН) ИК-спектр (Nujol) 3310, 1650, 1595 см 1 ЯМР-спектр (хлороформ-d, 5) 1,38-1,60 (1Н, мульт), 1,98 (ЗН, сингл), 2,10-2,32 (1Н, мульт), 2,50-2,84 (2Н, мульт), 2,90 (1Н, дублет дублетов, см 1 ИК-спектр (жидкость) 3455, 1620, 1600, 1580 ЯМР-спектр (хлороформ-d, 5) 1,44 (9Н, сингл), 1,51-1,95 (2Н, мульт), 2,05 (2Н, шир сингл), 2,21-2,47 (2Н, мульт), 2,50 (1Н, дублет дублетов, J = 8,6 Гц, 13,3 Гц), 2,80 (1Н, дублет дублетов, J = 4,8 Гц, 13,3 Гц), 3,80 (ЗН, сингл), 6,65-6,86 (ЗН, мульт), 7,15-7,30 (1Н, мульт) Масс-спектр (m/z) 280 (М+), 224 К раствору трет-бутил-4-амино-5-(3-метоксифенил) валерата (0,22 г) в 1,4-диоксане (0,2 мл) прибавляют уксусный ангидрид (0,08 мл) и раствор перемешивают в течение 80 минут Далее, к раствору прибавляют этанол и смесь перемешивают 15 минут рН реакционной смеси доводят до 12 с помощью раствора едкого натра и экстрагируют водный раствор этилацетатом Экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и упаривают в вакууме, получая трет-бутил 4-ацетиламино-5-(3-метоксифенил) валерат (246 мг) ИК-спектр (жидкость) 3275, 3060, 1720, 1640, 1540, 1365 с м 1 ЯМР-спектр (хлороформ-d, 5) 1,43 (9Н, сингл), 1,52-1,90 (2Н, мульт), 1,83 (2Н, шир сингл), 2,15-2,42 (2Н, мульт), 2,70 (1Н, дублет дублетов, J = 7,2 Гц, 13,5 Гц), 2,85 (1Н, дублет дублетов, J = 5,6 Гц, 13,5 Гц), 3,79 (ЗН, сингл), 4,01-4,24 (1Н, мульт), 6,56 (1Н, шир дубл , J = 8,5 Гц), 6,67-6,84 (ЗН, мульт), 7,15-7,28 (1Н, мульт) Масс-спектр (m/z) 322 (М+), 266, 206 30
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of ethanolamine, a process for obtaining thereof, a pharmaceutical composition, a method for the treatment
Автори англійськоюSHIOKAWA YOUICHI, NAGANO MASANOBU, TANIGUCHI KIYOSHI, TAKE KAZUHIKO, KATO TAKESHI, TSUBAKI KAZUNORI
Назва патенту російськоюПроизводные этаноламина, способ их получения , фармацевтическая композиция, способ лечения
Автори російськоюСиокава Юити, Нагано Масанобу, Танигути Кийоси, Таке Казухико, Като Такеси, Тсубаки Казунори
МПК / Мітки
МПК: A61P 25/02, C07D 271/08, A61K 31/4035, A61K 31/24, C07C 323/25, C07D 213/61, A61K 31/47, C07C 217/74, C07C 229/44, C07C 229/32, C07D 317/58, C07C 227/00, A61K 31/34, A61K 31/13, C07C 229/16, A61K 31/404, A61K 31/41, C07D 209/48, C07C 215/00, C07D 277/20, C07C 229/42, C07D 285/04, C07D 235/14, A61K 31/275, C07C 255/26, A61K 31/4245, C07D 215/12, A61K 31/40, A61K 31/341, C07D 253/00, A61K 31/42, C07D 277/62, C07C 229/18, A61K 31/135, C07D 271/10, C07D 487/04, C07D 521/00, C07C 235/20, C07D 271/06, C07C 219/00, C07D 209/04, C07C 229/46, A61K 31/425, A61K 31/428, C07D 307/52, A61K 31/433, C07D 261/08, C07D 271/12, A61P 7/10, A61K 31/403, A61K 31/19, A61K 31/426, C07D 257/00
Мітки: похідні, спосіб, одержання, лікування, композиція, етаноламіну, фармацевтична
Код посилання
<a href="https://ua.patents.su/46-41869-pokhidni-etanolaminu-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні етаноламіну, спосіб їх одержання, фармацевтична композиція, спосіб лікування</a>
Попередній патент: Спосіб первинної екзогенної профілактики карієсу тимчасових зубів
Наступний патент: Спосіб лікування виразкової хвороби дванадцятипалої кишки та хронічного гастродуоденіту
Випадковий патент: Гербіцидний засіб