Похідні імідазохіноліну як ліганди рецептора аденозин а3
Номер патенту: 78889
Опубліковано: 25.04.2007
Автори: Балог Марія, Араньї Петер, Боер Кінга, Тімарі Геза, Т. Надь Лайош, Капуі Зольтан, Баторі Шандор, Мікус Ендре, Валс Ержебет, БАЛАЖ Ласло, Гербер Каталін, Урбан-Сабо Каталін, Варгане Ссереді Юдіт
Формула / Реферат
1. Сполуки загальної формули (І)
 , (I)
, (I)
де
R1 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу;
R2 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу;
R3 означає атом водню, або нерозгалужену або розгалужену С1-4 алкільну групу, С3-6 циклоалкільну групу, феніл-, тієніл- або фурильну групу, необов'язково заміщену одною або більшою кількістю нерозгалужених або розгалужених С1-4 алкільних груп, нерозгалужених або розгалужених С1-4 алкоксигруп або атомом галогену; шести- або п'ятичленне ароматичне кільце, яке містить один, два або три атоми азоту, або п'ятичленне ароматичне кільце, яке містить один атом азоту і один атом кисню або один атом азоту і один атом сірки, необов'язково заміщений одною або більшою кількістю нерозгалужених або розгалужених С1-4 алкільних груп, нерозгалужених або розгалужених С1-4 алкоксигруп або атомом галогену;
R4, R5, R6 і R7 незалежно означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, нерозгалужену або розгалужену С1-4 алкоксигрупу, гідроксигрупу або атом галогену, або R4 і R7 означають атом водню і R5 і R6 утворюють разом метилендіоксигрупу;
R8 означає атом водню або є ціаногрупою, амінокарбонільною групою, С1-4 алкоксикарбонільною групою, карбоксигрупою;
R9 і R10 незалежно означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, С3-6 циклоалкільну групу.
Х означає –СН2-групу, -NH-групу, -NR11-групу або атом сірки, атом кисню, сульфогрупу або сульфоксигрупу, де R11 означає нерозгалужену або розгалужену С1-4 алкільну групу або С3-6 циклоалкільну групу;
Z означає атом кисню, атом сірки, -NH-групу або -NR12-групу, де R12 означає нерозгалужену або розгалужену С1-4 алкільну групу або С3-6 циклоалкільну групу;
n має значення 0, 1 або 2;
m має значення 0, 1, 2 або 3;
о має значення 0, 1, 2 або 3;
р має значення 0 або 1;
r має значення 0 або 1, за умови, що принаймні один з m і о не є нулем,
і їх солі, сольвати і ізомери, а також їх солі і сольвати.
2. Сполуки загальної формули (І) за п. 1
 , (I)
, (I)
де
R1 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу;
R2 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу;
R3 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу, С3-6 циклоалкільну групу, феніл-, тієніл- або фурильну групу, необов'язково заміщену одною або більшою кількістю нерозгалужених або розгалужених С1-4 алкільних груп, нерозгалужених або розгалужених С1-4 алкоксигруп або атомом галогену;
R4, R5, R6 і R7 незалежно означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, нерозгалужену або розгалужену С1-4 алкоксигрупу, гідроксигрупу або атом галогену, або R4 і R7 означають атом водню і R5 і R6 утворюють разом метилендіоксигрупу;
R8 означає атом водню або є ціаногрупою, амінокарбонільною групою, С1-4 алкоксикарбонільною групою, карбоксигрупою;
R9 і R10 незалежно означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, С3-6 циклоалкільну групу,
Х означає –СН2-групу, -NH-групу, -NR11-групу або атом сірки, атом кисню, сульфогрупу або сульфоксигрупу, де R11 означає нерозгалужену або розгалужену С1-4 алкільну групу або С3-6 циклоалкільну групу;
Z означає атом кисню, атом сірки, -NH-групу або -NR12-групу, в якій R12 означає нерозгалужену або розгалужену С1-4 алкільну групу або С3-6 циклоалкільну групу;
n має значення 0, 1 або 2;
m має значення 0, 1, 2 або 3;
о має значення 0, 1, 2 або 3;
р має значення 0 або 1;
r має значення 0 або 1, за умови, що принаймні один m і о не є нулем,
і їх солі, сольвати і ізомери, а також їх солі і сольвати.
3. Сполуки загальної формули (І) за будь-яким з пп. 1-2
 , (I)
, (I)
де
R1 означає атом водню або метильну групу;
R2 означає атом водню або метильну групу;
R3 означає феніл- або тієніл-, або фурильну групу;
R4, R5, R6 і R7 незалежно означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, нерозгалужену або розгалужену С1-4 алкоксигрупу, гідроксигрупу або атом галогену, або
R4 і R7 означають атом водню і R5 і R6 утворюють разом метилендіоксигрупу;
R8 означає атом водню або ціаногрупу;
R9 і R10 означають атом водню, метил-, етил- або циклопропільну групу,
Х означає -NH-групу або атом кисню;
Z означає атом кисню, атом сірки, -NH-групу або -NR-групу, де R12 означає нерозгалужену або розгалужену С1-4 алкільну групу або С3-6 циклоалкільну групу; і
n має значення 1;
m має значення 2;
о має значення 2;
р має значення 0;
r має значення 0
і їх солі, сольвати і ізомери, а також їх солі і сольвати.
4. Сполуки за будь-яким з пп. 1-3:
1-(9-бензиламіно-10-ціаноімідазо[1,2-![]() ]хінолін-2-карбоніл)-4-метилпіперазин,
]хінолін-2-карбоніл)-4-метилпіперазин,
1-(9-бензиламіно-10-ціаноімідазо[1,2-![]() ]хінолін-2-карбоніл)морфолін,
]хінолін-2-карбоніл)морфолін,
1-(9-фурфуриламіно-10-ціаноімідазо[1,2-![]() ]хінолін-2-карбоніл)-4-метилпіперазин,
]хінолін-2-карбоніл)-4-метилпіперазин,
1-(9-фурфуриламіно-10-ціаноімідазо[1,2-![]() ]хінолін-2-карбоніл)піперазин,
]хінолін-2-карбоніл)піперазин,
1-(9-фурфуриламіно-10-ціаноімідазо[1,2-![]() ]хінолін-2-карбоніл)морфолін,
]хінолін-2-карбоніл)морфолін,
1-(9-теніламіно-10-ціаноімідазо[1,2-![]() ]хінолін-2-карбоніл)морфолін,
]хінолін-2-карбоніл)морфолін,
1-(9-теніламіно-10-ціаноімідазо[1,2-![]() ]хінолін-2-карбоніл)піперазин,
]хінолін-2-карбоніл)піперазин,
та їх солі, сольвати і ізомери, а також їх солі і сольвати.
5. Спосіб одержання сполук загальної формули (І)
 , (I)
, (I)
та їх солей, сольватів і ізомерів, в якому у формулі R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, X, Z, n, m, о, р і r мають визначені у пункті 1 значення, який відрізняється тим, що сполуку загальної формули (VIII)
 , (VIII)
, (VIII)
в якій R9, R10, Z, m, о, р і r мають визначені у пункті 1 значення, ацилюють кислотою або хімічно активною похідною кислоти загальної формули (II)
 , (II)
, (II)
в якій R1, R2, R3, R4, R5, R6, R7, R8, X і n мають визначені в пункті 1 значення, і, якщо бажано, замісники одержаної сполуки загальної формули (І) перетворюють один в одний відомими способами і/або сполуку загальної формули (І) перетворюють у її сіль або сольват, або вивільняють з її солі або сольвату, і/або її розкладають на її оптично активні ізомери або оптично активний ізомер перетворюють у рацемічну сполуку.
6. Спосіб за п. 5, який відрізняється тим, що ацилювання проводять у присутності основи у органічному розчиннику.
7. Спосіб за будь-яким з пп. 5-6, який відрізняється тим, що хімічно активною похідною кислоти загальної формули (ІI) є придатний галогенід кислоти або змішаний ангідрид.
8. Спосіб за будь-яким з пп. 5-7, який відрізняється тим, що органічним розчинником є галогенований вуглеводень, переважно хлороформ.
9. Спосіб за будь-яким з пп. 5-8, який відрізняється тим, що основою є органічна основа, переважно триетиламін.
10. Фармацевтична композиція, яка відрізняється тим, що вона містить одну або більшу кількість сполук загальної формули (І)
 , (I)
, (I)
де у формулі R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, X, Z, n, m, о, р і r мають визначені у пункті 1 значення, і/або їх солі, сольвати, ізомери, їх солі, сольвати і один або більшу кількість допоміжних матеріалів, які звичайно використовують у фармацевтичній промисловості.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що вона містить як активну речовину одну або більшу кількість сполук за п. 3.
12. Застосування сполук загальної формули (І)
 , (I)
, (I)
де у формулі R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, X, Z, n, m, о, р і r мають визначені у пункті 1 значення, для лікування патологічних станів, при яких рецептор А3 впливає на розвиток захворювання.
13. Застосування сполук загальної формули (І)
 , (I)
, (I)
де у формулі R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, X, Z, n, m, о, р і r мають визначені у пункті 1 значення, як лігандів рецептора А3 у випадку дисфункції серця, нирок, дихальної системи і центральної нервової системи для інгібування захисної дії аденозину на клітини пухлин, які ростуть, для запобігання дегранулюванню тучних клітин, для інгібування утворення цитокінів, для зниження внутрішнього тиску в оці, для інгібування вивільнення ![]() , для перешкоджання міграції еозинофільних і нейтрофільних гранулоцитів і інших запальних клітин, для інгібування стискання трахеї і для перешкоджання просочуванню плазми крові через кровоносну судину.
, для перешкоджання міграції еозинофільних і нейтрофільних гранулоцитів і інших запальних клітин, для інгібування стискання трахеї і для перешкоджання просочуванню плазми крові через кровоносну судину.
14. Застосування сполук загальної формули (І)
 , (I)
, (I)
де у формулі R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, X, Z, n, m, о, р і r мають визначені у пункті 1 значення, як антагоністів рецептора А3, як активних інгредієнтів у протизапальних, протиастматичних, антиішемічних фармацевтичних композиціях, антидепресантах, антиаритмічних фармацевтичних композиціях, композиціях, що захищають функцію нирок, що запобігають утворенню пухлин, проти хвороби Паркінсона і які стимулюють когнітивну функцію, а також як активних компонентів композицій, які можуть використовуватись при лікуванні або профілактиці наступних захворювань: ушкодження серцевого м'яза під час реперфузії, хронічне обструктивне захворювання легень (ХОЗЛ), дихальна недостатність у дорослих (ARDS), включаючи хронічний бронхіт, легеневу емфізему або утруднене дихання, алергічні реакції (наприклад риніт, відповіді, індуковані на отруту сумаха отруйного, кропивниця, склеродерма, артрит), інші аутоімунні захворювання, запальні захворювання кишечнику, Адіссонова хвороба, хвороба Крона, псоріаз, захворювання суглобів, гіпертонія, ненормальні неврологічні реакції, глаукома і діабет.
15. Застосування сполук загальної формули (І)
 , (I)
, (I)
де у формулі R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, X, Z, n, m, о, р і r мають визначені у пункті 1 значення, як активних компонентів для лікування таких патологій як астма, ХОЗЛ і ARDS, глаукома, пухлини, алергічні і запальні захворювання, ішемія, гіпоксія, аритмія і захворювання нирок.
Текст
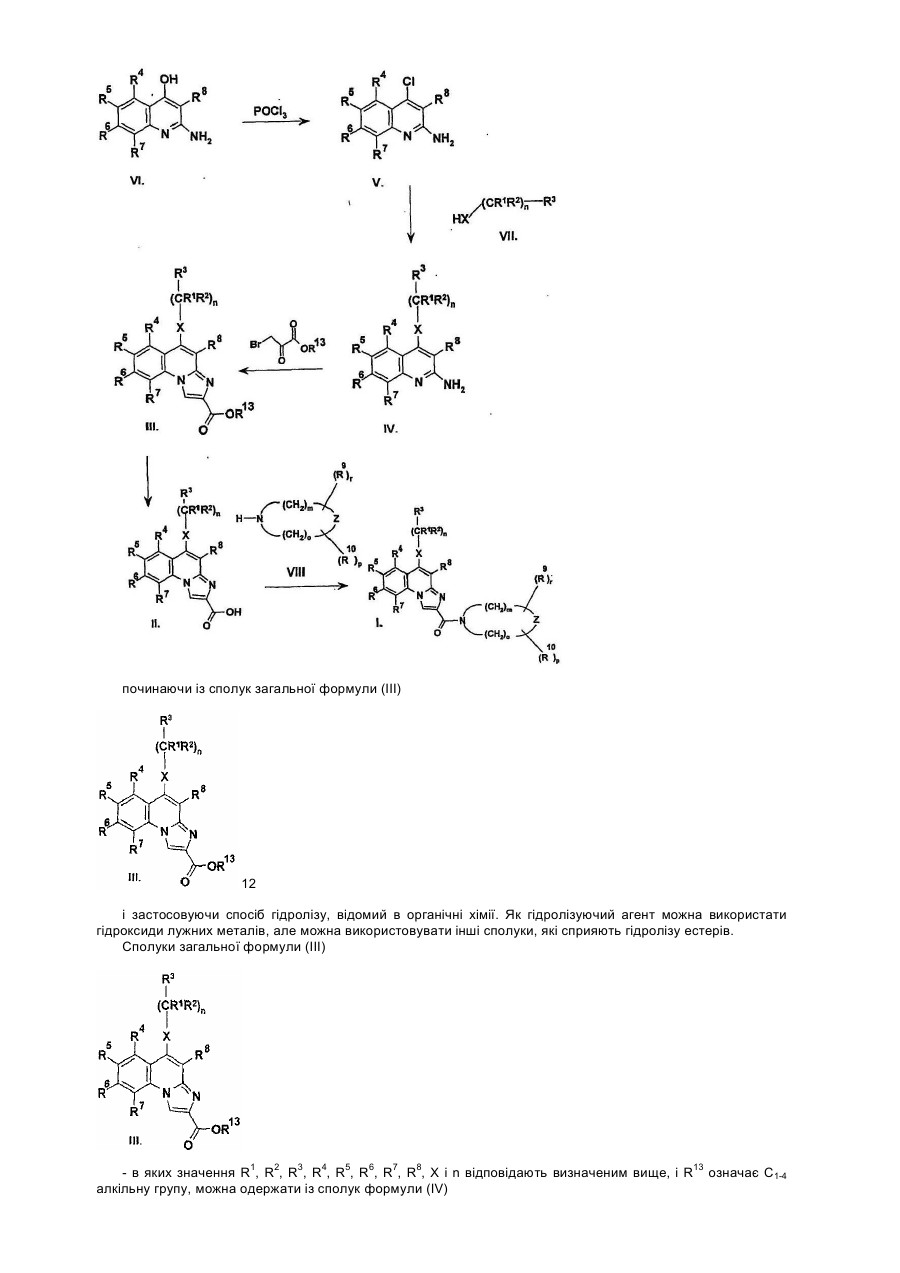
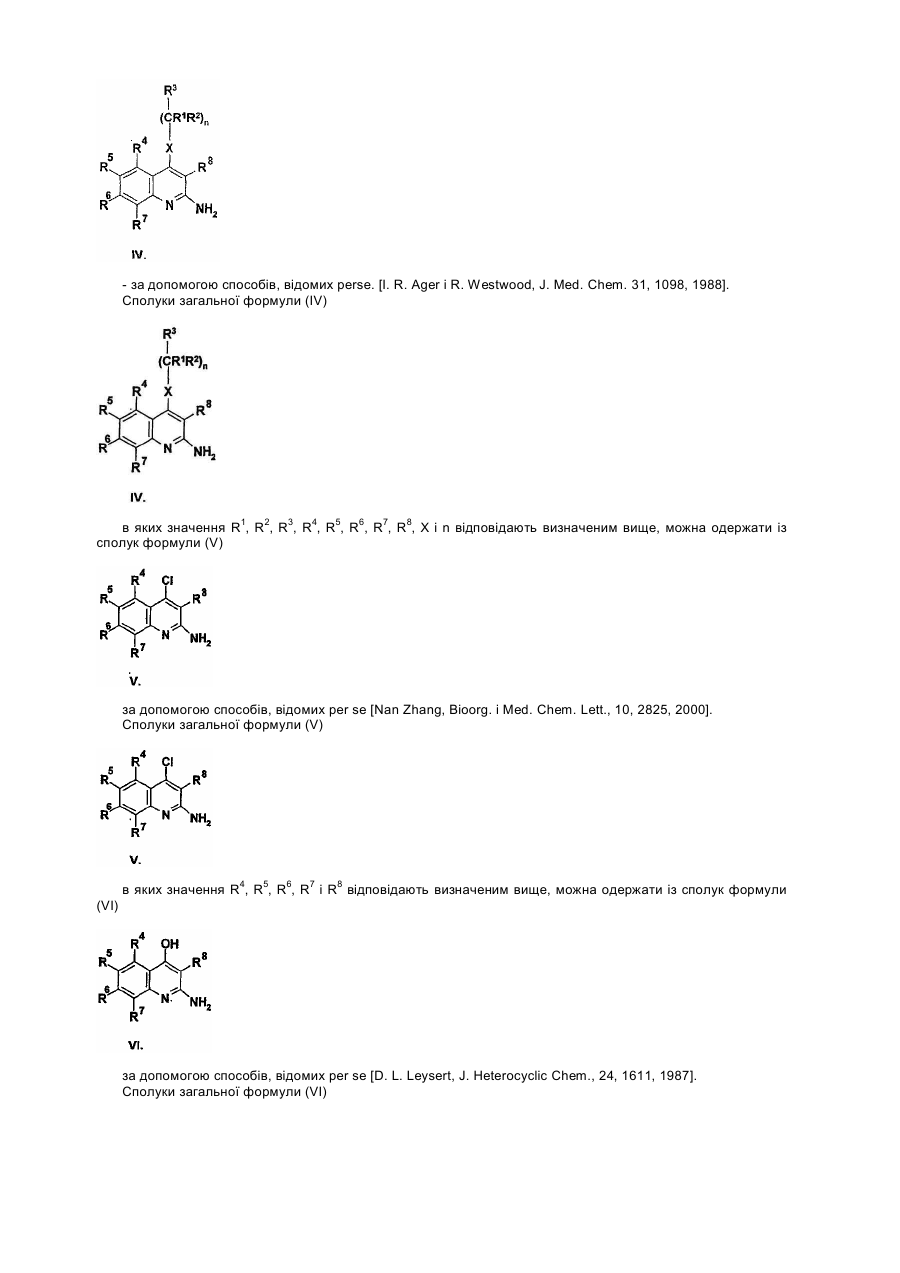
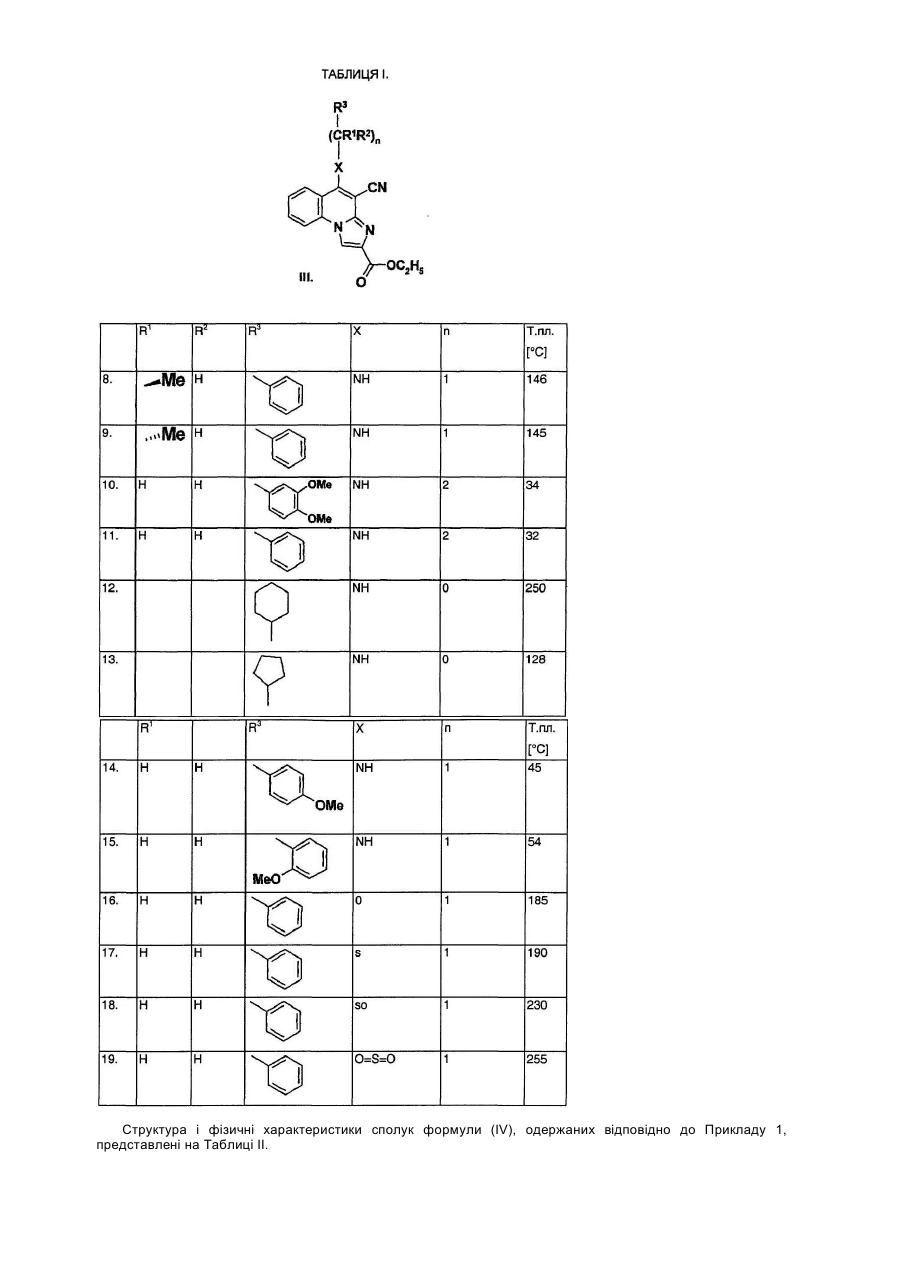
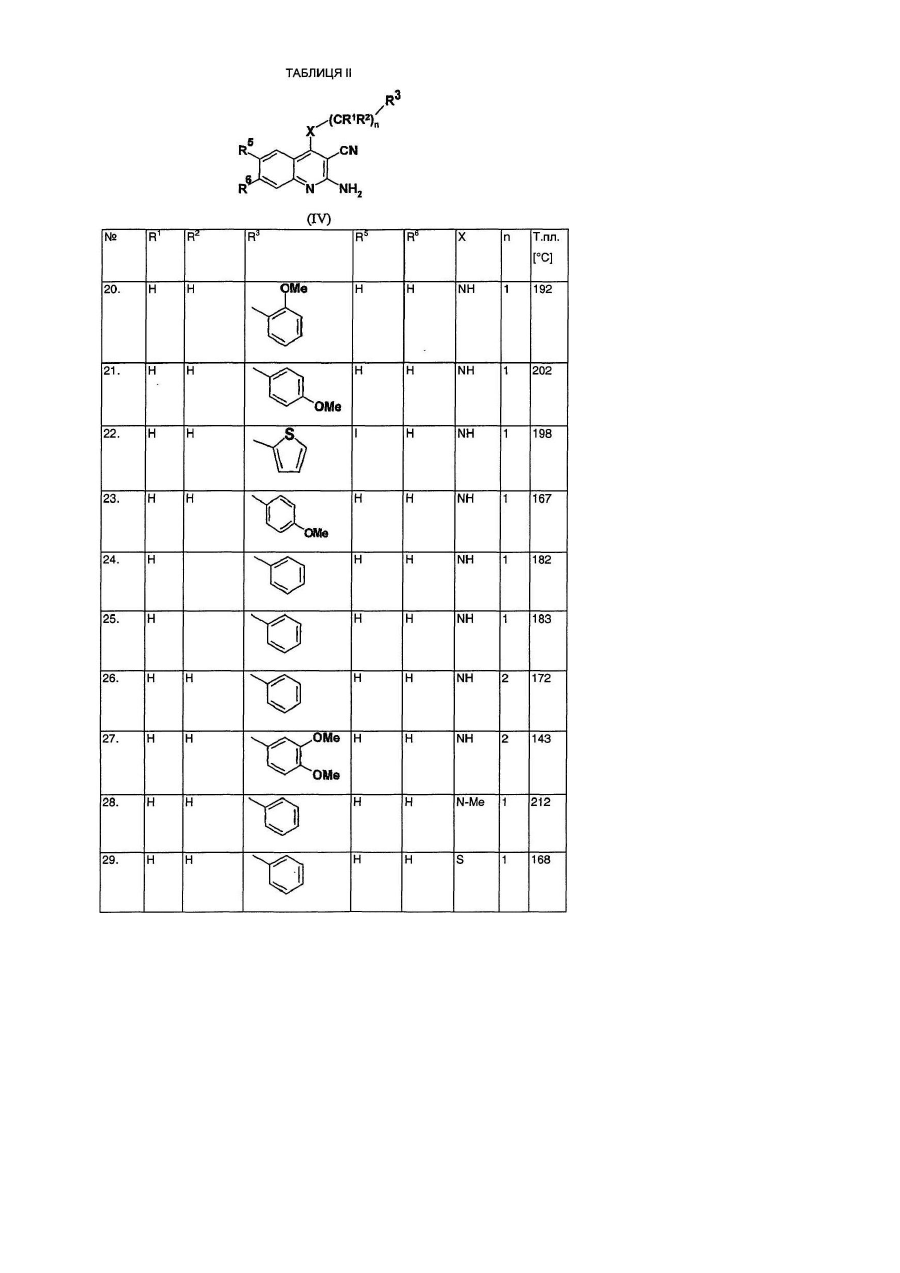
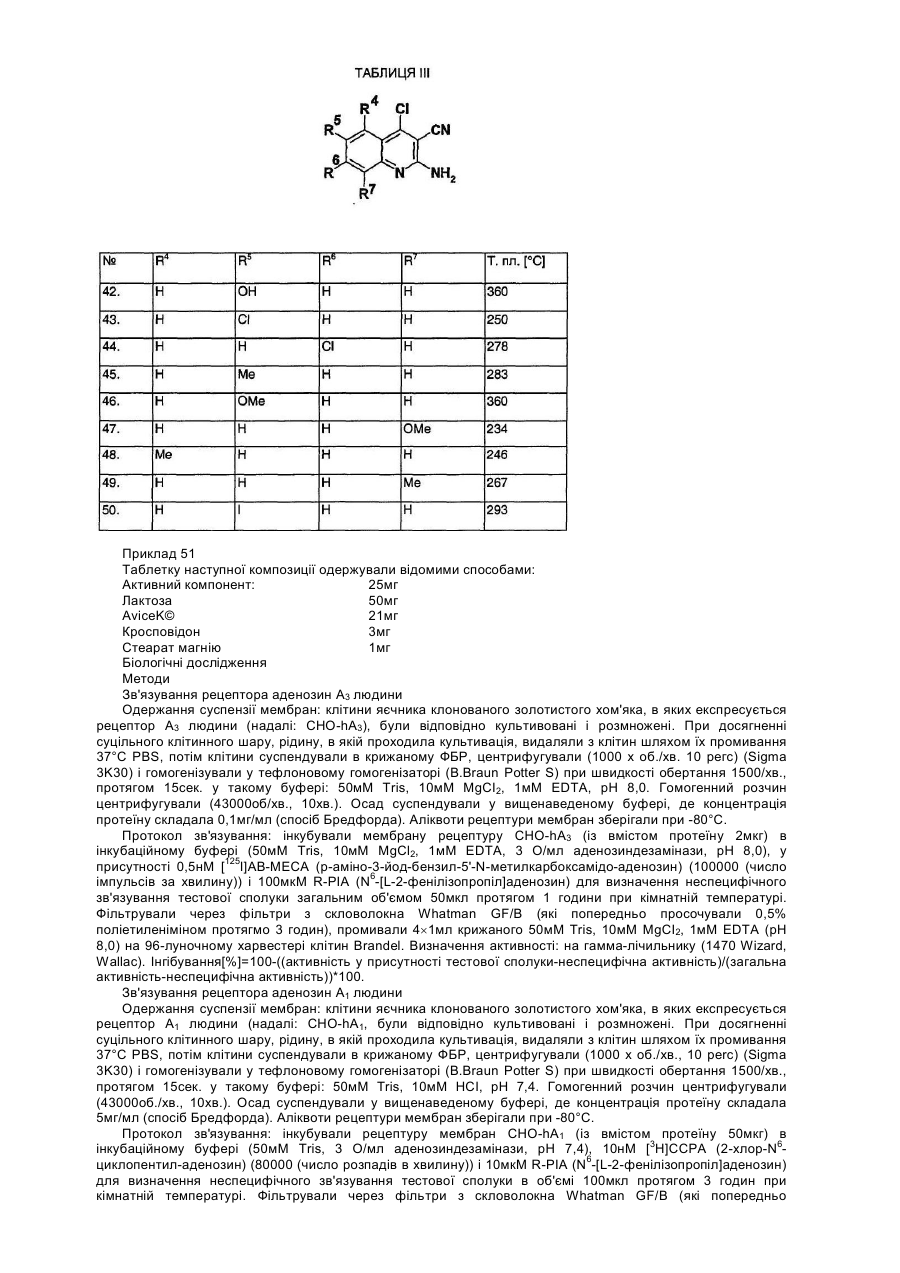
Даний винахід стосується лігандів рецептора аденозин А3 загальної формули (І), переважно антагоністів, а також їх солей, сольватів і ізомерів, фармацевтичних композицій, які їх містять, використання сполук загальної формули (І) та їх солей, сольватів і ізомерів, а також одержання сполук загальної формули (І) та їх солей, сольватів і ізомерів. Аденозин є відомим компонентом деяких ендогенних молекул, (ATP, NAD+, нуклеїнових кислот). Окрім того, він відіграє важливу регуляторну функцію у багатьох фізіологічних процесах. Вплив аденозину на роботу серця був відкритий вже у 1929. [Drury і Szentgyorgyi, J Phydiol 68:213, 1929]. Виявлення зростаючої кількості фізіологічних функцій, опосередкованих аденозином, а тож виявлення нових підтипів рецепторів аденозину дало можливість застосування специфічних лігандів в терапії [Poulse, S. А. та Quinn, R. I. Bioorganic і Medicinal Chemistry 6:619,1998]. На сьогодні рецептори аденозин розділили на три основні класи: А1, А2 і А3. Підтип А1 частково відповідальний за інгібування аденилатциклази шляхом конденсування до G, мембранного протеїну, частково впливає на інші системи вторинних месенджерів. Підтип рецептора А2 може бути поділений на два додаткові підвиди - А2а та А2b -, які стимулюють активність аденилатциклази. Послідовність рецепторів аденозин А3 була нещодавно встановлена з бібліотеки к днк яєчка пацюків. Пізніше було доведено, що вона відповідає новому функціональному рецептору аденозин. Активація рецепторів А3 також пов'язана із декількома системами вторинного месенджеру: інгібуванням аденилатциклази, стимулюванням фосфоліпази С і D. Рецептори аденозин виявлені у декількох органах і регулюють їх функції. Обидва рецептори А1 і А2а відіграють важливу роль у центральній нервовій системі і серцево-судинній системі. У ЦНС, аденозин інгібує вивільнення синаптичих трансмітерів, дія яких опосередкована рецепторами А1. У серці, рецептори А1 також обумовлюють негативну інотропну, хронотропну та дромотропну дію аденозину. Рецептори аденозин А2а, які знаходяться у відносно великій кількості у стіратумі, проявляють функціональну взаємодію із рецепторами допамін при регулюванні синаптичної трансміссії. Рецептори аденозин А2а на ендотеліальних клітинах і клітинах гладких м'язів відповідають за індуковану аденозином вазодилятацію. Ґрунтуючись на ідентифікації мРНК, рецептори аденозин А2b широко розповсюджені у кожному виді клітин, але найбільший рівень їх експресії спостерігається у кишечнику та міхурі. Ймовірно, що цей підвид також має важливу регуляторну функцію при регулюванні судинного тонусу і відіграє важливу роль у функціонуванні тучних клітин. На відміну від рецепторів А1 і А2а, де розподілення в тканині визначали на основі рівню потеїну, присутність рецепторів А2b і А3 визначали на основі їх рівню мРНК. Рівень експресії рецепторів аденозин А3 є достатньо низьким у порівнянні із іншими підвидами і віно значно залежить від кожного виду. Рецептори аденозин А3 експресуються в першу чергу в центральній нервовій системі, яєчку та імунній системі, та, очевидно, включені в модулювання вивільнення медіатора із тучних клітин при реакції гіперчутливості негайного типу. Антагоністи рецептора А3, наскільки вони описані в літературі, належать до групи флавонідів, похідних 1,4-дигідропіридину, тріазолохіназолінів, тіазолонафтирідинів та тіазолопіримідинів. Даний винахід стосується нового виду ефективних антагоністів А3, які мають структуру амінохіноліну. Для використанні в терапії необхідним є забезпечення того, що молекули не будуть зв'язуватись, або будуть зв'язуватись лише у випадку дуже великої концентрації до підвидів рецептора аденозин A1, A2a і А2b. Наш винахід стосується сполук загальної формули (І) а також їх солей, сольватів і ізомерів, які мають високий ступінь селективність відносно рецептора аденозин підвиду А3. Наша мета полягала в одержанні лігандів А3, переважно антагоністів, в першу чергу які б мали структуру хіноліну, які б проявляли сильний антагоністичний ефект і високу ступінь селективності відносно рецептора А3, тобто які інгібували б рецептор А3 при концентрації, набагато нижчій за ту, при якій вони інгібують рецептори А1, А2а і А2b. Наступні цілі полягали в одержанні стабільності, біодоступності, терапевтичного індексу і показників токсичності, що дозволили б розробити на основі цих речовин лікарські засоби, а тож в тому, щоб нові сполуки придатно абсорбувались в шлунково-кишковому тракті для їх перорального застосування. Ми виявили, що сполуки загальної формули (І) - в якій R1 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу; R2 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу; R3 означає атом водню, або нерозгалужену або розгалужену С^ алкільну групу, С3-6 циклоалкільну групу, феніл-, тієніл-, або фурильну групу, необов'язково заміщену одною або більшою кількістю нерозгалужених або розгалужених С1-4 алкільних груп, нерозгалужених або розгалужених С1-4 алкоксигруп, або атомом галогену; де шести- або п'яти-членне ароматичне кільце містить один, два або три атоми азоту, або п'яти-членне ароматичне кільце містить один атом азоту і один атом кисню, або один атом азоту і один атом сірки, і необов'язково заміщене одною або більшою кількістю нерозгалужених або розгалужених С1-4 алкільних груп, нерозгалужених або розгалужених С1-4 алкоксигруп або атомом галогену; R4, R5, R6 і R7, незалежно, означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, нерозгалужену або розгалужену С1-4 алкоксигрупу, гідроксигрупу або атомом галогену, або R4 і R7 означають атом водню, a R5 і R6 утворюють разом метилендіокси групу; R8 означає атом водню або ціаногрупу, амінокарбонільну групу, С1-4 алкоксикарбонільну групу, або карбоксигрупу; R9 і R10, незалежно, означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, С3-6 циклоалкільну групу. X означає -СН2- групу, -NH- групу, -NR11- групу, або атом сірки, атом кисню, сульфогрупу або сульфоксигрупу - де R11 означає нерозгалужену або розгалужену С1-4 алкільну групу або С3-6 циклоалкільну групу; Ζ означає атом кисню, атом сірки, -ΝΗ- групу або -NR12- групу, - де R12 означає нерозгалужену або розгалужену С1-4 алкільну групу або С3-6 циклоалкільну групу; m означає нуль, 1, 2 або 3; n означає нуль, 1 або 2; о означає нуль, 1, 2 або 3; p означає нуль або 1, r означає нуль або 1, за умови, що принаймні один m і о не є нулем, і їх солі, сольвати і ізомери, а також їх солі і сольвати відповідають вищенаведеним критеріям. Детальними визначеннями вищенаведених замісників є наступні: Під нерозгалуженою або розгалуженою С1-4 алкільною групою ми розуміємо метил-, етил-, пропіл-, ізопропіл-, бутил-, ізобутил-, вторинний-бутил-, третинний-бутил-, переважно етил- або метильну групу. Під нерозгалуженою або розгалуженою С1-4 алкоксигрупою ми розуміємо метокси-, етокси-, пропокси-, ізопропокси-, бутокси-, ізобутокси-, вторинний-бутокси-, третинний-бутокси-, переважно етокси- або метоксигрупу. Під С3-6 циклоалкільною групою ми розуміємо циклопропіл-, циклобутил-, циклопентил- або циклогексильну групу. Гетероароматичне кільце, яке містить один, або два, або три атоми азоту, означає пірольне, імідазольне, піразольне, 1,2,3-тріазольне, 1,2,4-тріазольне, піридинове, піримідинове, піридазинове, піразинове і 1,3,4-триазинове кільце. Кільце, необов'язково, заміщене С1-4 алькіною, або алкоксигрупою, або атомом галогену. Гетероароматичне кільце, яке містить один атом азоту і один атом кисню або сірки, означає оксазольне, ізоксазольне, тіазольне, ізотіазольне кільце. Кільце, необов'язково, заміщене С1-4 алькільною, або алкокси групою, або атомом галогену. -(CH2)m-Z-(CH2)o- група утворює з атомом азоту оксазирідино-, діазирідино-, 1,2-діазетидино-, 1,3діазетидино-, ізоксазолідино-, оксазолідино-, імідазолідино-, піразолідино-, тіазолідино-, морфоліно, піперазино-, або 4-метил-піперазино-групу, яка необов'язково заміщена С1-4 алкільною групою або С3-6 циклоалкільною групою. Під солями сполук загальної формули (І) ми розуміємо солі, одержані з неорганічних і органічних солей і основ. Переважними солями є ті, які одержані з фармакологічно прийнятних кислот, таких як, наприклад, соляна кислота, сірчана кислота, етансульфонова кислота, винна кислота, бурштинова кислота, яблучна кислота, лимонна кислота, а також фармацевтично прийнятних основ, таких як, наприклад, гідроксид натрію, гідроксид калію, етаноламін. Під сольватами ми розуміємо сольвати, одержані із різноманітними розчинниками, такими як, наприклад, вода або етанол. Сполуки загальної формули (І) демонструють геометричний і оптичний ізомеризм, тому винахід також стосується сумішей геометричних ізомерів, рацемічних або оптично активних геометричних ізомерів, а також їх солей і сольватів. Переважною групою сполук загальної формули (І) є та, де R1 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу; R2 означає атом водню або нерозгалужену або розгалужену С1-4 алкільну групу; R3 означає атом водню, або нерозгалужену або розгалужену С1-4 алкільну групу, С3-6 циклоалкільну групу, феніл-, тієніл-, або фурильну групу, необов'язково заміщену одною або більшою кількістю нерозгалужених або розгалужених С1-4 алкільних груп, нерозгалужених або розгалужених С1-4 алкоксигруп, або атомом галогену; R4, R5, R6 і R7, незалежно, означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, нерозгалужену або розгалужену С1-4 алкоксигрупу, гідроксигрупу або атом галогену, або R4 і R7 означають атом водню, a R5 і R6 утворюють разом метилендіокси групу; R8 означає атом водню або ціаногрупу, амінокарбонільну групу, С1-4 алкоксикарбонільну групу, або карбоксигрупу; R9 і R10 незалежно означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, або С3-6 циклоалкільну групу; X означає -СН2- групу, -NH- групу, -NR11- групу, або атом сірки, атом кисню, сульфогрупу або сульфоксигрупу, де R11 означає нерозгалужену або розгалужену С1-4 алкільну групу, або С3-6 циклоалкільну групу; Ζ означає атом кисню, атом сірки, -ΝΗ- групу або -NR12- групу, - де R означає нерозгалужену або розгалужену С1-4 алкільну групу, або С3-6 циклоалкільну групу; m означає нуль, 1, 2 або 3; n означає нуль, 1 або 2; о означає нуль, 1, 2 або 3; p означає нуль або 1, r означає нуль або 1, за умови, що принаймні один m і о не є нулем, і їх солі, сольвати і оптично активні ізомери, а також їх солі і сольвати. Більш переважною групою сполук загальної формули (І) є та, де R1 означає атом водню або метильну групу; R означає атом водню або метильну групу; R означає феніл-, тієніл-, або фурильну групу; R4, R5, R6 і R7, незалежно, означають атом водню, нерозгалужену або розгалужену С1-4 алкільну групу, нерозгалужену або розгалужену С1-4 алкоксигрупу, гідроксигрупу або атомом галогену, або R4 і R7 означають атом водню і R5 і R6 утворюють разом метилендіоксигрупу; R8 означає атом водню або ціаногрупу; R9 і R10 означають атом водню, метил- етил-, або циклопропільну групу. X означає -NH- групу, або атом кисню; Ζ означає атом кисню, атом сірки, -ΝΗ- групу або -NR12- групу, - де R12 означає нерозгалужену або розгалужену С1-4 алкільну групу або С3-6 циклоалкільну групу; m означає 2; η означає 1; 0 означає 2; p означає нуль; г означає нуль, і їх солі, сольвати і ізомери, а також їх солі і сольвати. Особливо переважними є наступні сполуки, які відповідають вищенаведеним критеріям: 1-(9-бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)-4-метилпіперазин 1-(9-бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)морфолін 1-(9-фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)-4-метилпіперазин 1-(9-фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)піперазин 1-(9-фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)морфолін 1-(9-тієніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)морфолін 1-(9-тієніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)піперазин та їх солі, сольвати і ізомери, а також їх солі і сольвати. Цей винахід також стосується фармацевтичних композицій, які містять як активні речовини сполуки загальної формули (І) або їх ізомери, солі і сольвати, які є переважно композиціями для перорального застосування, але рецептури для вдихання, парентеральні і трансдермальні рецептури також включені до об'єму цього винаходу. Вищевказані фармацевтичні композиції можуть бути у твердих або рідких формах, таких як таблетки, драже, капсули, пластирі, розчини, суспензії або емульсії. Тверді композиції, перш за все таблетки і капсули, є переважними. Такі фармацевтичні композиції одержують за допомогою звичайних фармацевтичних допоміжних матеріалів і стандартними способами. Сполуки загальної формули (І) можна використовувати для лікування патологій, при яких рецептор А3 сприяє розвитку захворювання. Сполуки, які мають селективний вплив на рецептор А3, можна використовувати при лікуванні або профілактиці дисфункцій серця, нирок, дихальної системи, центральної нервової системи. Вони блокують захисну дію аденозину на клітини пухлин, які розвиваються, запобігають дегрануляції тучних клітин, перешкоджають утворенню цитокінів, зменшують внутрішній тиск в оці, запобігають вивільненню TNFa, перешкоджають пересуванню еозинофільних і нейтрофільних гранулоцитів і інших запальних клітин, стають на перешкоді стискуванню трахеї і перешкоджають плазмі крові проходити через кровоносні судини. Ґрунтуючись на такій дії, антагоністи рецептора аденозин А3 можуть бути терапевтично корисними як протизапальні, протиастматичні, антиішемічні лікарські засоби, як антидепресанти, антиаритмічні лікарські засоби, засоби, що захищають функцію нирок, що запобігають утворенню пухлин, засоби проти хвороби Паркінсона і лікарські засоби, які стимулюють когнітивну функцію. Також вони можуть бути корисними при лікуванні та профілактиці наступних захворювань: ушкодження серцевого м'яза під час реперфузії, хронічне обструктивне захворювання легень (ХОЗЛ), дихальна недостатність у дорослих (ARDS), включаючи хронічний бронхіт, легеневу емфізему або утруднене дихання, алергічні реакції (наприклад риніт, відповіді, індуковані на отруту сумаха отруйного, кропивниця, склеродерма, артрит), інші аутоімунні захворювання, запальні захворювання кишечнику, Адіссонова хвороба, хвороба Крона, псоріаз, захворювання суглобів, гіпертонія, ненормальні неврологічні реакції, глаукома і діабет [К. N. Klotz, Naunyn-Schmiedberg's Arch. Pharmacol. 362:382, 2000; P. G. Baraldi es P. A. Borea, TiPS 21:456, 2000]. Сполуки згідно з даним винаходом можна і переважно застосовують при лікуванні таких дисфункцій як астма, ХОЗЛ і ARDS, глаукома, пухлини, алергічні і запальні захворювання, ішемія, гіпоксія, аритмія серця і захворювання нирок. Даний винахід стосується також використання сполук загальної формули (І) при лікуванні вищевказаних патологій. Денна доза, яка пропонується, складає 0,1-1000мг активного компонента в залежності від природи і тяжкості захворювання, а також від статі, ваги пацієнта і т.д. Наступним предметом цього винаходу є одержання сполук загальної формули (І). Замісники у формулах проміжних сполук загальних формул (II), (III), (IV), (V), (VI), (VII) і (VIII) мають вищевказані значення. У способі за цим винаходом, сполуки загальної формули (VIII) ацилюють кислотами або їх хімічно активними похідними загальної формули (II), застосовуючи способи ацилювання, які відомі в органічній хімії. Як ацилюючий агент переважно застосовують галогеніди кислот або суміш ангідридів. Одержану сполуку загальної формули (І) якщо бажано, перетворюють в одну із її солей або сольватів, або вивільняють із її солі або сольвату і виділяють як геометричні або оптичні ізомери. Замісники сполук загальної формули (І) можна перетворювати один в інший відомими способами. Суміш ангідридів, використану у реакції ацилювання, можна одержати з півалоїлхлориду, переважно із застосовуванням органічних основ, розчинених у хлороформі, переважно застосовуючи триетиламін, але можна застосувати інші способи, відомі в органічній хімії. Ацилювання можна проводити у широких температурних межах, переважно між 0°С і 100°С. Проміжні сполуки загальної формули (II) - де значення R1, R2, R3, R4, R5, R6, R7, R8, X і n відповідають визначеним вище - можна одержати декількома відомими способами, наприклад способом, ілюстрованим на Схемі 1. починаючи із сполук загальної формули (III) 12 і застосовуючи спосіб гідролізу, відомий в органічні хімії. Як гідролізуючий агент можна використати гідроксиди лужних металів, але можна використовувати інші сполуки, які сприяють гідролізу естерів. Сполуки загальної формули (III) - в яких значення R1, R2, R3, R4, R5, R6, R7, R8, X і n відповідають визначеним вище, і R13 означає С1-4 алкільну групу, можна одержати із сполук формули (IV) - за допомогою способів, відомих perse. [I. R. Ager і R. Westwood, J. Med. Chem. 31, 1098, 1988]. Сполуки загальної формули (IV) в яких значення R1, R2, R3, R4, R5, R6, R7, R8, X і n відповідають визначеним вище, можна одержати із сполук формули (V) за допомогою способів, відомих per se [Nan Zhang, Bioorg. і Med. Chem. Lett., 10, 2825, 2000]. Сполуки загальної формули (V) в яких значення R4, R5, R6, R7 і R8 відповідають визначеним вище, можна одержати із сполук формули (VI) за допомогою способів, відомих per se [D. L. Leysert, J. Heterocyclic Chem., 24, 1611, 1987]. Сполуки загальної формули (VI) - в яких значення R4, R5, R6, R7 і R8 відповідають визначеним вище, можна одержати за допомогою способів, відомих per se [Pfizer (Inc) патент США 4175193]. Сполуки за цим винаходом за загальними формулами (І), (II), (III), (IV) і (V), їх одержання і біологічна активність представлені у наступних Прикладах, без звуження об'єму винаходу до Прикладів. Приклади Приклад 1 1-(9-Бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)-4-метил-піперазин: У загальній формулі (І) R1 і R2 означають атом водню, R3 є фенільною групою, R4, R5, R6 і R7 є атомом водню, R8 є ціаногрупою, R12 є метильною групою, X означає -NH-групу, Ζ означає атом азоту, значення n відповідає 1, значення m і о відповідає 2, і значення r і p відповідає 0. а. 2-Аміно-3-ціано-4-хлорхінолін: Суміш 1,0г 2-аміно-3-ціано-4-гідроксихіноліну і 15мл фосфорилхлориду нагрівали при перемішуванні при 110°С. Реакційну суміш охолоджували, заливали на 100мл крижаної води і нейтралізовували 60мл 10% розчину гідроксиду натрію. Одержаний жовтий осад відфільтровували, промивали 50мл води. Після висушування одержували 7,5г вказаної в заголовку сполуки, Τ пл.: 210°С. ЯМР, dН (400МГц, ДМСО-d6): 7,21м.ч., (с, 2Н, ΝΗ2), 7,35-7,40м.ч., (дд, 1Н, 6-Н), 7,53-7,57м.ч., (д, 1Н, 5Н), 7,70-7,75м.ч., (дд, 1Н, 7-Н), 7,93-7,98м.ч., (д, 1Н, 8-Н) b. 2-Аміно-3-ціано-4-бензиламінохінолін 5г 2-Аміно-3-ціано-4-хлорхіноліну і 11мл бензиламіну нагрівали при перемішуванні при 130°С. Реакційну суміш заливали у 50мл води, одержаний осад відфільтровували, промивали 50мл води. Блідо-жовтий осад перекристалізовували з 25мл диметилформаміду з одержанням 5,2г вказаної в заголовку сполуки. Т.пл.: 206°С. ЯМР, dΗ (400МГц, ДМСО-d6): 5,02-5,03м.ч., (д, 2Н, N-CH2), 6,22м.ч., (с, 2Н, NH2), 7,14-7,16м.ч., (дд, 1Н, 6Н), 7,24-7,26 м.ч., (дд, 1Н, 5-Н), 7,30м.ч., (с, 5Н, Ph), 7,50-7,52м.ч., (дд, 1Н, 7-Н), 8,16-8,19м.ч., (д, 1Н, 8-Н), 8,30-8,33м.ч., (т, 1Н, NH). Використовуючи 2-амінометилпіридин, або 3-амінометилпіридин, або 4-амінометилпіридин замість бензиламіну, можна одержати відповідні сполуки загальної формули IV. с. Моногідрат етил 9-бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоксилату: До розчину 2,74г 2-аміно-3-ціано-4-бензиламінохіноліну у 100мл абс. етанолу, додавали 2,14г етилбромпірувату при перемішуванні при 70°С. Реакційну суміш нагрівали із зворотнім холодильником 2 години, одержаний осад відфільтровували. Білі кристали перекристалізовували з 120мл ацетонітрилу. Одержували 1,1г вказаної в заголовку сполуки, Τ пл.: 112-114°С. ЯМР, dΗ (400МГц, ДМСО-d6): 1,32м.ч. (т, 3Н, СООСН2СН3), 4,30м.ч. (κ, 2Η, СООСН2СН3), 5,09м.ч. (д, 2Н, РhСН2), 7,25-7,38м.ч. (м, 5Н), 7,64-7,67м.ч. (м, 1Н), 7,85-7,88м.ч. (м, 1Н), 8,43-8,53м.ч. (м, 3Н), 9,04м.ч. (с, 1Н, 3-Н). d. 9-Бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонова кислота: Суміш 2,71г моногідрату етил 9-бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоксилату, 42мл етанолу і 40мл 10% гідроксиду натрію перемішували при 25°С 6 годин. До густої суспензії додавали 100мл води і рівень рН суміші доводили до рівня рН=3 96% оцтовою кислотою. Блідо-жовті кристали відфільтровували, промивали тричі 25мл води, і сушили. Одержували 2,3г вказаної в заголовку сполуки, Τ пл.: 178-182°С. ЯМР, dΗ (200МГц, ДМСО-d6): 5,09м.ч. (д, 2Н, РhСН2), 7,22-7,40м.ч. (м, 5Н), 7,59-7,67м.ч. (м, 1Н), 7,817,89м.ч. (м, 1Н), 8,37-8,54м.ч. (м, 3Н), 8,90м.ч. (с, 1Н, 3-Н). e. 1-(9-Бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)-4-метилпіперазин: До розчину 1,71г 9-бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонової кислоти і 0,8мл триетиламіну в 15мл хлороформу додавали по краплях розчин 0,6г півалоїлхлориду в 10мл хлороформу при перемішуванні при 5°С протягом 15 хвилин. Реакційну суміш перемішували при 5°С 1 годину, потім додавали до неї суміш 0,5г N-метилпіперазину, 10мл хлороформу і 0,8мл триетиламіну. Суміш перемішували при 25°С 7 годин, розводили 100 мл хлороформу, екстрагували послідовно 50мл води, 50мл 5% розчину гідрокарбонату натрію і 50мл води, сушили над сульфатом натрію і концентрували у вакуумі. Блідо-жовтий кристалічний матеріал перекристалізовували з 6мл Ν,Ν-диметилформаміду, одержували 0,6г вказаної в заголовку сполуки, Τ пл.: 217°С. ЯМР, dΗ (400МГц, ДМСО-d6): 2,17м.ч. (с, 3Н), 2,24м.ч. (м, 4Н), 3,57м.ч. (м, 2Н), 4,11м.ч. (м, 2Н), 5,08м.ч. (д, 2Н, РhСН2), 7,23-7,38м.ч. (м, 5Н), 7,62-7,65м.ч. (м, 1Н), 7,83-7,87м.ч. (м, 1Н), 8,36-8,42м.ч. (м, 2Н), 8,508,52м.ч. (м, 1Н), 8,80м.ч. (с, 1Н, 3-Н). Приклад 2 1-(9-Бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)морфолін: У загальній формулі (І) R1 і R2 означають атом водню, R3 є фенільною групою, R4, R5, R6 і R7 є атомом водню, R8 є ціаногрупою, X означає -NH-групу, Ζ означає атом кисню, значення n відповідає 1, значення m і о відповідає 2, і значення r і p відповідає 0. До суміші 1,71г 9-бензиламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонової кислоти і 0,8мл триетиламіну в 15мл хлороформу розчин 0,6г півалоїлхлориду в 10мл хлороформу додавали при перемішуванні при 5°С протягом 15 хвилин. Реакційну суміш перемішували при 5°С 1 годину, потім суміш 0,45г морфоліну, 10мл хлороформу і 1,6мл триетиламіну додавали до неї. Суміш перемішували при 25°С 3 години, потім оброблювали як описано в попередньому прикладі. Одержані блідо-жовті кристали перекристалізовували з 10мл Ν,Ν-диметилформаміду з одержанням 0,55г вказаної в заголовку сполуки, Τ пл.: 279°С. ЯМР, dΗ (400МГц, ДМСО-d6): 3,6м.ч. (м, 6Н), 4,2м.ч. (м, 2Н), 5,08м.ч. (д, 2Н, РhСН2), 7,23-7,38м.ч. (м, 5Н), 7,62-7,65м.ч. (м, 1Н), 7,84-7,87м.ч. (м, 1Н), 8,37-8,39м.ч. (м, 2Н), 8,50-8,53м.ч. (м, 1Н), 8,75м.ч. (с, 1Н, 3Н). Приклад 3 1-(9-Фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)-4-метилпіперазин: У загальній формулі (І) R1 і R2 означають атом водню, R3 є 2-фурильною групою, R4, R5, R6 і R7 є атомом водню, R8 є ціаногрупою, R12 є метильною групою, X означає -ΝΗ-групу, Ζ означає атом азоту, значення n відповідає 1, значення m і о відповідає 2, і значення r і p відповідає 0. а. 2-Аміно-3-ціано-4-фурфуриламінохінолін: 10г 2-Аміно-3-ціано-4-хлорхіноліну нагрівали з 19г фурфуриламіну при 120°С 3 години. Реакційну суміш охолоджували до 25°С і перемішували 6 разів з 50мл води. Кристали відфільтровували і сушили. Одержаний продукт перекристалізовували з 60мл Ν,Ν-диметилформаміду з одержанням 5,8г вказаної в заголовку сполуки, Τ пл.: 206°С. ЯМР, dΗ (200МГц, ДМСО-d6): 4,98м.ч. (д, 2Н, Фурил-СН2), 6,29м.ч. (с, 2Н), 6,35-6,42м.ч. (м, 2Н), 7,107,18м.ч. (м, 1Н), 7,31-7,35м.ч. (м, 1Н), 7,47-7,60м.ч. (м, 2Н), 8,13-8,20м.ч. (м, 2Н). b. Моногідрат етил 9-фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоксилату: До розчину 2,64г 2-аміно-3-ціано-4-фурфуриламінохіноліну в 100мл абс. етанолу, додавали 2,14г етилбромпірувату при 70°С при перемішуванні. Реакційну суміш нагрівали із зворотнім холодильником 2 години і кристали, які випали в осад, відфільтровували з одержанням 1,15г вказаної в заголовку сполуки. Τ пл.: 242-245°С. ЯМР, dΗ (200МГц, ДМСО-d6): 1,33м.ч. (т, 3Н, СООСН2СН3), 4,31м.ч. (κ, 2Η, СООСН2СН3), 5,05м.ч. (д, 2Н, Фурил-СН2), 6,40-6,43м.ч. (м, 2Н), 7,58-7,66м.ч. (м, 2Н), 7,80-7,88м.ч. (м, 1Н), 8,31м.ч. (т, 1Н), 8,41-8,45м.ч. (м, 2Н), 9,04м.ч. (с, 1Н, 3-Н). с. 9-Фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонова кислота: Суміш 2,52г моногідрату етил 9-фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоксилату, 40мл етанолу і 33мл 10% гідроксиду натрію перемішували при 25°С 3 години. До густої суспензії додавали 80мл води, 96% оцтовою кислотою суміш оксилювали до рівня рН=3. Блідо-жовті кристали відфільтровували, промивали тричі 25мл води і сушили. Одержували 2,32г вказаної в заголовку сполуки, Τ пл.: 180-185°С. ЯМР, dΗ (200МГц, ДМСО-d6): 5,05м.ч. (д, 2Н, Фурил-СН2), 6,39-6,42м.ч. (м, 2Н), 7,56-7,64м.ч. (м, 2Н), 7,79-7,87м.ч. (м, 1Н), 8,27м.ч. (т, 1Н), 8,36-8,46м.ч. (м, 2Н), 8,93 м.ч. (с, 1Н, 3-Н). d. 1-(9-Фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)-4-метилпіперазин: До суміші 1,79г 9-фурфуриламіно-10-ціаноімідазо[1,2-a]хінолін-2-карбонової кислоти і 0,8мл триетиламіну в 15мл хлороформу додавали по краплях розчин 0,6г півалоїлхлориду в 10мл хлороформу при перемішуванні при 5°С протягом 15 хвилин. Реакційну суміш перемішували при 5°С 1 годину, потім суміш 0,46г N-метилпіперазину, 10мл хлороформу і 0,8мл триетиламіну додавали до неї. Суміш перемішували при 25°С 3 години, розводили 100мл хлороформу, екстрагували послідовно 50мл води, 50мл 5% розчину гідрокарбонату натрію і 50мл води, сушили над сульфатом натрію і концентрували у вакуумі. Блідо-жовтий кристалічний матеріал перекристалізовували з 50мл етанолу. Одержували 0,18г вказаної в заголовку сполуки, Τ пл.: 237°С. ЯМР, dΗ (200МГц, ДМСО-d6): 2,17м.ч. (с, 3Н), 2,24м.ч. (м, 4Н), 3,57м.ч. (м, 2Н), 4,11м.ч. (м, 2Н), 5,05м.ч. (д, 2Н, Фурил-СН2), 6,40-6,44м.ч. (м, 2Н), 7,57-7,65м.ч. (м, 2Н), 7,80-7,88м.ч. (м, 1Н), 8,23м.ч. (т, 1Н), 8,398,46 м.ч. (м, 2Н), 8,81 м.ч. (с, 1Н, 3-Н). Приклад 4 1-(9-Фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)піперазин: У загальній формулі (I) R1 і R2 означають атом водню, R3 є 2-фурильною групою, R4, R5, R6 і R7 є атомом водню, R8 є ціаногрупою, X означає -NH- групу, Ζ означає -ΝΗ-групу, значення n відповідає 1, значення m і о відповідає 2, і значення г і ρ відповідає 0. До суміші 1,79г 9-фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонової кислоти - одержаної як описано в Прикладі 3 - і 0,8мл триетиламіну в 15мл хлороформу, додавали по краплях розчин 0,6г півалоїлхлориду в 10мл хлороформу при перемішуванні при 5°С протягом 15 хвилин. Реакційну суміш перемішували при 5°С 1 годину, потім додавали до неї суміш 0,46г піперазину, 10мл хлороформу і 0,8мл триетиламіну. Суміш перемішували при 25°С 3 години, розводили 100мл хлороформу, екстрагували послідовно 50мл води, 50мл 5% розчину гідрокарбонату натрію і 50мл води, сушили над сульфатом натрію і концентрували у вакуумі. Блідо-жовтий кристалічний матеріал перекристалізовували з 50мл етанолу. Одержували 0,14г вказаної в заголовку сполуки, Τ пл.: 239°С ЯМР, dΗ (200МГц, ДМСО-d6): 2,7м.ч. (м, 4Н), 3,5м.ч. (м, 2Н), 4,05м.ч. (м, 2Н), 5,05м.ч. (д, 2Н, Фурил-СН2), 6,40-6,44м.ч. (м, 2Н), 7,57-7,65м.ч. (м, 2Н), 7,80-7,88м.ч. (м, 1Н), 8,23м.ч. (т, 1Н), 8,39-8,46м.ч. (м, 2Н), 8,81 м.ч. (с, 1Н, 3-Н). Приклад 5 1-(9-Фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл) морфолін: У загальній формулі (І) R1 і R2 означають атом водню, R3 є 2-фурильною групою, R4, R5, R6 і R7 є атомом водню, R8 є ціаногрупою, X означає -ΝΗ- групу, Ζ означає атом кисню, значення n відповідає 1, значення m і о відповідає 2, і значення r і p відповідає 0. До суміші 1,79г 9-фурфуриламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонової кислоти - одержаної як описано в Прикладі 3 - і 0,8мл триетиламіну в 15мл хлороформу, додавали по краплях розчин 0,6г півалоїлхлориду в 10мл хлороформу при перемішуванні при 5°С протягом 15 хвилин. Реакційну суміш перемішували при 5°С 1 годину, потім додавали до неї суміш 0,66г морфоліну, 10мл хлороформу і 0,8мл триетиламіну. Суміш перемішували при 25°С 3 години, розводили 100мл хлороформу, екстрагували послідовно 50мл води, 50мл 5% розчину гідрокарбонату натрію і 50мл води, сушили над сульфатом натрію і концентрували у вакуумі. Блідо-жовтий кристалічний матеріал перекристалізовували з 50мл етанолу. Одержували 0,18г вказаної в заголовку сполуки, Тпл.: 267°С ЯМР, dΗ (200МГц, ДМСО-d6): 3,6м.ч. (м, 6Н), 4,2м.ч. (м, 2Н), 5,05м.ч. (д, 2Н, Фурил-СН2), 6,40-6,44м.ч. (м, 2Н), 7,57-7,65м.ч. (м, 2Н), 7,80-7,88м.ч. (м, 1Н), 8,23м.ч. (т, 1Н), 8,39-8,46м.ч. (м, 2Н), 8,81м.ч. (с, 1Н, 3-Н). Приклад 6 1-(9-Тієнфіламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)морфолін: У загальній формулі (І) R1 і R2 означають атом водню, R3 є 2-тієнільною групою, R4, R5, R6 і R7 є атомом водню, R8 є ціаногрупою, X означає -ΝΗ- групу, Ζ означає атом кисню, значення n відповідає 1, значення m і о відповідає 2, і значення r і p відповідає 0. a. 2-Аміно-3-ціано-4-тієніламінохінолін: 10г 2-Аміно-3-ціано-4-хлорхіноліну нагрівали з 19г тієнілметиламіну при 115°С 4 години. Реакційну суміш охолоджували до 25°С і перемішували 6 разів з 50мл води. Кристали відфільтровували, промивали двічі 50мл води і сушили. Одержаний продукт перекристалізовували з 60мл Ν,Ν-диметилформаміду з одержанням 6,8г блідо-жовтої вказаної в заголовку сполуки, Τ пл.: 208-209°С. ЯМР, dΗ (200МГц, ДМСО-d6): 5,18м.ч. (д, 2Н, Тиєніл-СН2), 6,28м.ч. (с, 2Н), 6,96-7,00м.ч. (м, 1Н), 7,077,19м.ч. (м, 2Н), 7,31-7,42м.ч. (м, 2Н), 7,48-7,56м.ч. (м, 1Н), 8,09-8,13м.ч. (м, 1Н), 8,30м.ч. (т, 1Н). b. Етил 9-тієніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоксилат: До розчину 5,61г 2-аміно-3-ціано-4-тієніламінохіноліну в 200мл абс. етанолу додавали 4,29г етилбромпірувату при 70°С при перемішуванні. Реакційну суміш нагрівали із зворотнім холодильником 2 години і кристали, які випали в осад, відфільтровували з одержанням 2,54г вказаної в заголовку сполуки. Τ пл.: 255-256°С. ЯМР, dΗ (200МГц, ДМСО-d6): 1,33м.ч. (т, 3Н, СООСН2СН3), 4,31м.ч. (κ, 2Η, СООСН2СН3), 5,24м.ч. (д, 2Н, Тиєніл-СН2), 6,96-7,00м.ч. (м, 1Н), 7,14м.ч. (м, 1Н), 7,40-7,43м.ч. (м, 1Н), 7,61-7,68м.ч. (м, 1Н), 7,82-7,90м.ч. (м, 1Н), 8,42-8,46м.ч. (м, ЗН), 9,05м.ч. (с, 1Н, 3-Н). с. 9-Тієніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонова кислота: Суміш 2,54г етил 9-тієніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоксилату, 40мл етанолу і 33мл 10% гідроксиду натрію перемішували при 25°С 6 годин. До густої суспензії додавали 80мл води, 96% оцтовою кислотою суміш оксилювали до рівня рН=3. Блідо-жовті кристали відфільтровували, промивали 5 разів 10мл води і сушили. Одержували 2,18г вказаної в заголовку сполуки, Τ пл.: 209-217°С з розкладенням. ЯМР, dΗ (400МГц, ДМСО-d6): 5,24м.ч. (д, 2Н, Тиєніл-СН2), 8,88м.ч. (с, 1Н, 3-Н). d. 1-(9-Тіеніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)морфолін: До суміші 1,80г 9-тієніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонової кислоти і 1,1мл триетиламіну в 10мл хлороформу, додавали по краплях розчин 0,87г півалоїлхлориду в 10мл хлороформу при перемішуванні при 5°С протягом 15 хвилин. Реакційну суміш перемішували при 5°С 1 годину, потім суміш 0,61г морфоліну, 10мл хлороформу і 1,1мл триетиламіну додавали до неї. Суміш перемішували при 25°С З години, розводили 100мл хлороформу, екстрагували послідовно 50мл води, 50мл 5% розчину гідрокарбонату натрію і 50мл води, сушили над сульфатом натрію і концентрували у вакуумі. Жовтий кристалічний матеріал перекристалізовували з 200мл етанолу. Одержували 0,19г вказаної в заголовку сполуки, Τ пл.: 315°С. ЯМР, dΗ (400МГц, ДМСО-d6): 3,6м.ч. (м, 6Н), 4,2м.ч. (м, 2Н), 5,24м.ч. (д, 2Н, Тиєніл-СН2), 6,97-7,00м.ч. (м, 1Н), 7,14м.ч. (м, 1Н), 7,41м.ч. (м, 1Н), 7,61-7,65м.ч. (м, 1Н), 7,83-7,87м.ч. (м, 1Н), 8,37-8,45м.ч. (м, 3Н), 8,82м.ч. (с, 1Н, 3-Н). Приклад 7 1-(9-Тієніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбоніл)піперазин У загальній формулі (І) R1 і R2 означають атом водню, R3 - 2-тієнільну групу, R, R5, R6 і R7 є атомом водню, R8 є ціаногрупою, X означає -ΝΗ- групу, Ζ означає -ΝΗ- групу, значення n відповідає 1, значення m і о відповідає 2, і значення r і p відповідає 0. До суміші 1,80г 9-тієніламіно-10-ціано-імідазо[1,2-a]хінолін-2-карбонової кислоти, одержаної як описано в Прикладі 6 - і 1,1мл триетиламіну в 10мл хлороформу додавали по краплях розчин 0,87г півалоїлхлориду в 10мл хлороформу при перемішуванні при 5°С протягом 15 хвилин. Реакційну суміш перемішували при 5°С 1 годину, потім додавали до неї суміш 0,61г піперазину, 10мл хлороформу і 1,1мл триетиламіну. Суміш перемішували при 25°С 3 години, розводили 100мл хлороформу, екстрагували послідовно 50мл води, 50мл 5% розчину гідрокарбонату натрію і 50мл води, сушили над сульфатом натрію і концентрували у вакуумі. Блідо-жовтий кристалічний матеріал перекристалізовували з 50мл етанолу. Одержували 0,19г вказаної в заголовку сполуки, Τ пл.: 269°С. ЯМР, dΗ (400МГц, ДМСО-d6): 2,7м.ч. (м, 4Н), 3,5м.ч. (м, 2Н), 4,05м.ч. (м, 2Н), 5,24м.ч. (д, 2Н, ТиєнілСН2), 6,97-7,00м.ч. (м, 1Н), 7,14м.ч. (м, 1Н), 7,41м.ч. (м, 1Н), 7,61-7,65м.ч. (м, 1Н), 7,83-7,87м.ч. (м, 1Н), 8,378,45м.ч. (м, 3Н), 8,82 м.ч. (с, 1Н, 3-Н). Структура і фізичні характеристики сполуки формули (III), одержаних у Прикладі 1, представлені у Таблиці І. Структура і фізичні характеристики сполук формули (IV), одержаних відповідно до Прикладу 1, представлені на Таблиці II. Структура і фізичні характеристики сполук формули (V), одержаних відповідно до Прикладу 1, представлені на Таблиці III. Приклад 51 Таблетку наступної композиції одержували відомими способами: Активний компонент: 25мг Лактоза 50мг AviceK© 21мг Кросповідон 3мг Стеарат магнію 1мг Біологічні дослідження Методи Зв'язування рецептора аденозин А3 людини Одержання суспензії мембран: клітини яєчника клонованого золотистого хом'яка, в яких експресується рецептор А3 людини (надалі: СНО-hА3), були відповідно культивовані і розмножені. При досягненні суцільного клітинного шару, рідину, в якій проходила культивація, видаляли з клітин шляхом їх промивання 37°С PBS, потім клітини суспендували в крижаному ФБР, центрифугували (1000 x об./хв. 10 регс) (Sigma 3K30) і гомогенізували у тефлоновому гомогенізаторі (B.Braun Potter S) при швидкості обертання 1500/хв., протягом 15сек. у такому буфері: 50мМ Tris, 10мМ МgСІ2, 1мМ EDTA, рН 8,0. Гомогенний розчин центрифугували (43000об/хв., 10хв.). Осад суспендували у вищенаведеному буфері, де концентрація протеїну складала 0,1мг/мл (спосіб Бредфорда). Аліквоти рецептури мембран зберігали при -80°С. Протокол зв'язування: інкубували мембрану рецептуру СНО-hА3 (із вмістом протеїну 2мкг) в інкубаційному буфері (50мМ Tris, 10мМ MgCl2, 1мМ EDTA, 3 О/мл аденозиндезамінази, рН 8,0), у присутності 0,5нМ [125І]АВ-МЕСА (р-аміно-3-йод-бензил-5'-N-метилкарбоксамідо-аденозин) (100000 (число імпульсів за хвилину)) і 100мкМ R-PIA (N6-[L-2-фенілізопропіл]аденозин) для визначення неспецифічного зв'язування тестової сполуки загальним об'ємом 50мкл протягом 1 години при кімнатній температурі. Фільтрували через фільтри з скловолокна Whatman GF/B (які попередньо просочували 0,5% поліетиленіміном протягмо 3 годин), промивали 4´1мл крижаного 50мМ Tris, 10мМ МgСІ2, 1мМ EDTA (рН 8,0) на 96-луночному харвестері клітин Brandel. Визначення активності: на гамма-лічильнику (1470 Wizard, Wallac). Інгібування[%]=100-((активність у присутності тестової сполуки-неспецифічна активність)/(загальна активність-неспецифічна активність))*100. Зв'язування рецептора аденозин А1 людини Одержання суспензії мембран: клітини яєчника клонованого золотистого хом'яка, в яких експресується рецептор А1 людини (надалі: CHO-hA1, були відповідно культивовані і розмножені. При досягненні суцільного клітинного шару, рідину, в якій проходила культивація, видаляли з клітин шляхом їх промивання 37°С PBS, потім клітини суспендували в крижаному ФБР, центрифугували (1000 x об./хв., 10 perc) (Sigma 3K30) і гомогенізували у тефлоновому гомогенізаторі (B.Braun Potter S) при швидкості обертання 1500/хв., протягом 15сек. у такому буфері: 50мМ Tris, 10мМ НСІ, рН 7,4. Гомогенний розчин центрифугували (43000об./хв., 10хв.). Осад суспендували у вищенаведеному буфері, де концентрація протеїну складала 5мг/мл (спосіб Бредфорда). Аліквоти рецептури мембран зберігали при -80°С. Протокол зв'язування: інкубували рецептуру мембран СНО-hA1 (із вмістом протеїну 50мкг) в інкубаційному буфері (50мМ Tris, 3 О/мл аденозиндезамінази, рН 7,4), 10нМ [3Н]ССРА (2-хлор-N6циклопентил-аденозин) (80000 (число розпадів в хвилину)) і 10мкМ R-PIA (N6-[L-2-фенілізопропіл]аденозин) для визначення неспецифічного зв'язування тестової сполуки в об'ємі 100мкл протягом 3 годин при кімнатній температурі. Фільтрували через фільтри з скловолокна Whatman GF/B (які попередньо просочували 0,5% поліетиленіміном протягом 3 годин), промивали 4р. 1мл крижаного 50мМ Tris (рН 7,4) на 96-луночному харвестері клітин Brandel. Визначення активності: у присутності 200мкл HiSafe-3 коктейлю на бета-лічильнику (1450 Microbeta, Wallac). Інгібування[%]=100-((активність у присутності тестової сполукинеспецифічна активність)/(загальна активність-неспецифічна активність))*100. Зв'язування аденозин А2а рецептора людини Протокол зв'язування: Інкубували 7мкг мембран (рецепторів аденозин А2а людини трансфектованих у клітини НЕК-293, джерело: Receptor Biology, Inc.), буфер (50мМ Tris-НСІ, 10мМ MgCI2, 1мМ EDTA, 2 О/мл аденозиндезамінази, рН 7,4), 20нМ [3H]CGS-21680 (2-[р-(2-карбонілетил)фенілетиламіно]-5'-Nетилкарбоксамідо-аднозин) (200000dpm) і 50мкМ NECA (5'-N-етилкарбоксамідо-аденозин) для визначення неспецифічного зв'язування тестової сполуки загальним об'ємом 100мкл за 90хв. при кімнатній температурі. Фільтрували у вакуумі через фільтри з скловолокна Whatman GF/B (які попередньо просочували протягом 3 годин 0,5% поліетиленіміном), промивали 4 рази 1мл крижаного 50мМ Tris, 10мМ МgСІ2,1мМ EDTA, 0,9% NaCI, рН 7,4) у 96-луночному харвестері клітин Brandel. Визначення активності: на бета-лічильнику (1450 Microbeta, Wallac) у присутності 200мкл коктейлю HiSafe-3. Інгібування[%]=100-((активність у присутності тестової сполуки-неспецифічна активність)/(загальна активність-неспецифічна активність))*100. Зв'язування аденозин А2b рецептора людини Протокол зв'язування: інкубували 20,8мкг мембран (рецепторів аденозин А2b людинии трансфектованих у НЕК-293 клітини, source: Receptor Biology, Inc.), буфер (50мМ Tris-HCI, 10мМ MgCI2,1мМ EDTA, 0,1мМ бензамідин, 2 U/мл аденозиндезамінази, рН 6,5), 32,4 нМ [3H]DPCPX (8-циклопентил-1,3-дипропілксантин) (800000dpm) і 100мкМ NECA (5'-n-етилкарбоксамідо-аденозин) для встановлення неспецифічного зв'язування тестової сполуки загальним об'ємом 100мкл протягом 30хв. при кімнатній температурі. Фільтрували у вакуумі 25мм рт. ст. через фільтри з скловолокна Whatman GF/C (які попередньо просочені 0,5% поліетиленіміном протягом 3 годин), промивали 4 рази 1мл крижаного 50мМ Tris-HCI (pH 6,5) у 96луночному харвестері клітин Brandel. Визначення активності: у присутності 200мкл коктейлю HiSafe-3 на бета-лічильнику (1450 Microbeta, Wallac). Інгібування[%]=100-((активність у присутності тестової сполукинеспецифічна активність)/(загальна активність-неспецифічна активність))*100 Результати Ми вважали сполуки біологічно активними якщо вони інгібували звязування радіолганда на рецепторах аденозин А3 людини при активності вище 80% при 1мкМ за наших еспериментальних умов. Константу дисоціації (Kd) [125І]АВ-МЕСА у СНО-hА3 мембранній рецептурі визначали шляхом дослідження на основі насичення ізотопами використовуючи аналіз Скетчарада [G. Scatchard, Ann. Ν. Υ. Acad. Sci. 51:660, 1949]. Значення IC5 переводили у константу спорідненості (Ki) застосовуючи рівняння Ченга-Прусоффа [Y. J. Cheng і W. Н. Prusoff, Biochem. Pharmacol. 22:3099,1973]. Декілька сполук загальної формули (І), (II), (III), (IV) і (V) проявили значну біологічну дію. Найбільш важливу дію мали сполуки загальної формули (І), визначені у пунктах 1-3 формули винаходу. Особливо переважними є сполуки, наведені в Прикладах, їх значення Ki знаходились у межах 0,8нМ і 700нМ. Значення Ki найбільш переважних сполук відповідають 0,8 і 15нМ. Сполуки мають відповідну біодоступність і селективність принаймні 3 порядку величини відносно підтипів рецептора аденозин A1, A2a і А2b, людини. Крім того, їх дія при внутрішньовенному і пероральному введенні є тривалою, значення ED50 низькими, токсикологічні характеристики і побічний вплив є бажаними. Вищевказані показники свідчать про придатність для терапевтичного застосування сполук загальної формули (І).
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazoquinoline derivatives as an adenosine a3 receptor ligands
Автори англійськоюBalog Maria, Batori, Sandor, Timari, Geza, Boer, Kinga, Kapui, Zoltan
Назва патенту російськоюПроизводные имидазохинолина как лиганды рецептора аденозина а3
Автори російськоюБалог Мария
МПК / Мітки
МПК: A61P 9/00, A61P 17/00, A61K 31/415, A61P 35/00, A61P 25/00, A61P 13/12, C07D 471/04, A61P 29/00, A61P 3/00, A61P 11/00
Мітки: похідні, рецептора, аденозин, імідазохіноліну, ліганди
Код посилання
<a href="https://ua.patents.su/15-78889-pokhidni-imidazokhinolinu-yak-ligandi-receptora-adenozin-a3.html" target="_blank" rel="follow" title="База патентів України">Похідні імідазохіноліну як ліганди рецептора аденозин а3</a>
Попередній патент: Пристрій для миття ємкостей
Наступний патент: Спосіб виплавки металу
Випадковий патент: Спосіб амінування ненасиченої сполуки в тонких плівках