Фармацевтична комбінація, що містить інгібітор b-raf та інгібітор деацетилази гістонів, та її застосування при лікуванні проліферативних захворювань
Формула / Реферат
1. Фармацевтична комбінація, що містить:
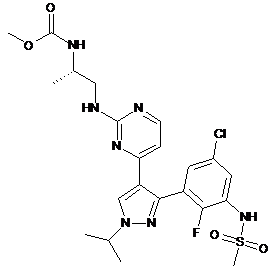
(а) інгібітор B-Raf формули (I)
 (I)
(I)
або його фармацевтично прийнятну сіль; та
(b) інгібітор деацетилази гістонів, який являє собою панобіностат, або його фармацевтично прийнятну сіль,
для одночасного, окремого або послідовного введення.
2. Фармацевтична комбінація за п. 1 для застосування при лікуванні проліферативного захворювання у суб'єкта, що потребує цього.
3. Фармацевтична комбінація за п. 1 для застосування при отриманні лікарського засобу для лікування проліферативного захворювання.
4. Фармацевтична комбінація за п. 3, де проліферативне захворювання являє собою рак.
5. Фармацевтична комбінація за п. 4, де проліферативне захворювання являє собою меланому, рак легень (у тому числі недрібноклітинний рак легень (НДКРЛ)), колоректальний рак (КРР), рак молочної залози, рак нирок, нирково-клітинну карциному (НКК), рак печінки, гострий мієлогенний лейкоз (ГМЛ), мієлодиспластичні синдроми (МДС), рак щитовидної залози, рак підшлункової залози, нейрофіброматоз або гепатоцелюлярну карциному.
6. Застосування комбінації за будь-яким з пп. 1-4 для виробництва лікарського засобу для лікування проліферативного захворювання.
7. Спосіб лікування проліферативного захворювання у пацієнта-людини, що включає одночасне, окреме або послідовне введення терапевтично ефективної кількості
(а) інгібітора B-Raf формули (І)
 (I)
(I)
або його фармацевтично прийнятної солі; та
(b) інгібітора деацетилази гістонів, який являє собою панобіностат, або його фармацевтично прийнятної солі,
пацієнту з проліферативним захворюванням.
8. Спосіб за п. 7, у якому проліферативне захворювання являє собою меланому, рак легень, колоректальний рак (КРР), рак молочної залози, рак нирок, нирково-клітинну карциному (НКК), рак печінки, гострий мієлогенний лейкоз (ГМЛ), мієлодиспластичні синдроми (МДС), недрібноклітинний рак легенів (НДКРЛ), рак щитовидної залози, рак підшлункової залози, нейрофіброматоз або гепатоцелюлярну карциному.
9. Спосіб за п. 8, у якому проліферативне захворювання характеризується мутацією B-Raf.
10. Спосіб за п. 9, у якому проліферативне захворювання характеризується мутацією B-Raf V600.
11. Спосіб за п. 7, у якому проліферативне захворювання являє собою меланому.
12. Комбінований препарат, який містить:
(а) інгібітор B-Raf формули (І)
 (I)
(I)
або його фармацевтично прийнятну сіль; та
(b) інгібітор деацетилази гістонів панобіностат або його фармацевтично прийнятну сіль,
для одночасного, окремого або послідовного введення.
13. Фармацевтична композиція, що містить:
(а) інгібітор B-Raf формули (І)
 (I)
(I)
або його фармацевтично прийнятну сіль; та
(b) інгібітор деацетилази гістонів панобіностат або його фармацевтично прийнятну сіль.
Текст
Реферат: Винахід стосується фармацевтичної комбінації, що містить: (а) інгібітор B-Raf формули (I) UA 115151 C2 (12) UA 115151 C2 O O NH N HN Cl N N N NH F O S O (I) або його фармацевтично прийнятну сіль; та (b) інгібітор деацетилази гістонів, який являє собою панобіностат або його фармацевтично прийнятну сіль, для одночасного, окремого або послідовного введення. UA 115151 C2 5 10 15 20 25 30 35 40 45 50 Галузь техніки Комбінація інгібітора кінази B-Raf та інгібітора деацетилази гістонів, яку застосовують для лікування проліферативних захворювань. Винахід стосується також застосування такої комбінації при лікуванні проліферативних захворювань; фармацевтичних композицій зазначеної комбінації засобів та способів лікування суб'єкта, який страждає від проліферативного захворювання, що включає введення суб'єкту терапевтично ефективної кількості такої комбінації. Рівень техники Протеїнкінази являють собою велику родину білків, які відіграють головну роль у регуляції широкого спектра клітинних процесів та у забезпеченні контролю клітинної функції. Аберантну активність кінази спостерігали в багатьох хворобливих станах, включаючи доброякісні та злоякісні проліферативні порушення, а також захворювання, викликані неналежною активацією імунної та нервової систем. Сигнальний шлях Ras-Raf-MEK-ERK передає сигнали від рецепторів клітинної поверхні до ядра та є необхідним для проліферації і виживання клітин. Оскільки 10-20 % типів раку людини характеризується онкогенною мутацією Ras, і багато типів раку людини мають активовані рецептори фактора росту, то цей шлях є ідеальною мішенню для втручання. Родина серин/треонін кіназ Raf включає три члени: C-Raf (або Raf-1), B-Raf та A-Raf. Активуючі алелі B-Raf було виявлено у ~70 % випадків меланоми, 40 % випадків папілярної тиреоїдної карциноми, 30 % випадків карциноми яєчників низького ступеня злоякісності та в 10 % випадків колоректального раку. Більшість мутацій B-Raf виявлено в домені кінази, де на частку єдиного заміщення (V600E) припадає 80 %. Мутовані білки B-Raf активують шлях RafMEK-ERK або за рахунок підвищеної активності кінази щодо MEK, або за рахунок активації CRaf. Інгібітор B-Raf у застосовуваній у даний час комбінованій терапії пригнічує клітинні процеси, в яких бере участь кіназа B-Raf, шляхом блокування сигнального каскаду в цих ракових клітинах і, зрештою, викликає затримку росту та/або загибель клітин. Оборотне ацетилювання гістонів являє собою головний регулятор генної експресії, який діє шляхом зміни доступності ДНК для факторів транскрипції. У нормальних клітинах деацетилаза гістонів (HDA) та ацетилтрансфераза гістонів разом регулюють рівень ацетилювання гістонів для підтримки балансу. Пригнічення HDA призводить до накопичення гіперацетильованих гістонів, що призводить до різних клітинних відповідей. Інгібітори деацетилази гістонів було досліджено щодо їхньої терапевтичної дії на ракові клітини. У недавніх розробках у сфері досліджень інгібіторів деацетилази гістонів було отримано активні сполуки, високоефективні та стабільні, які підходять для лікування проліферативних захворювань. Цей винахід базується на тому відкритті, що гальмування клітинного циклу та апоптоз у результаті інгібування B-Raf посилюється, якщо лікування інгібітором B-Raf комбінують з лікуванням інгібітором деацетилази гістонів. Інгібітор деацетилази гістонів сенсибілізує клітини меланом до загибелі під дією B-Raf, навіть у випадку клітин, які раніше набули резистентності до інгібіторів B-Raf. Суть винаходу Винахід стосується терапевтичної комбінації, що містить: (а) інгібітор B-Raf та (b) інгібітор деацетилази гістонів, придатний для окремого, одночасного або послідовного введення суб'єкту, що потребує цього, з метою лікування або попередження проліферативного захворювання. У даній галузі техніки відомі інгібітори B-Raf та їхнє застосування для лікування проліферативних захворювань. Вемурафеніб (PLX4032) являє собою інгібітор BRAF, схвалений FDA для лікування пацієнтів з меланомою, в яких пухлини експресують генну мутацію, що отримала назву BRAF V600E. Бензімідазол-піридилові ефіри описані в патенті США 7482367, який включений у даний документ за допомогою посилання в повному обсязі, де описані також інгібітори B-Raf, прийнятні в комбінаціях згідно з даним винаходом. Піразол-піримідини, описані в публікації WO 2011/025927, яка включена в даний документ за допомогою посилання в повному обсязі, являють собою інший клас інгібіторів B-Raf, придатних для представлених комбінацій. Переважний інгібітор B-Raf для комбінацій за винаходом являє собою сполуку Формули (I) 1 UA 115151 C2 5 10 15 20 25 Інгібітори деацетилази гістонів також відомі в даній галузі техніки. Такі сполуки включають беліностат, панобіностат, тріхостатін А, BL-1521, PX-118490, CUDC-101, праціностат, воріностат, ONO-4817, тоседостат, піроксамід, батімастат, тефіностат та буфексамак. Панобіностат являє собою особливо прийнятний інгібітор деацетилази гістонів для застосування в комбінаціях згідно з даним винаходом. Панобіностат має хімічну назву Nгідрокси-3-[4-[[[2-(2-метил-1H-індол-3-іл)-етил]аміно]метил]феніл]-2E-2-пропенамід і він описаний у заявці на патент PCT WO 02/22577, яка включена в даний документ за допомогою посилання в повному обсязі. Панобіностат має хімічну формулу Детальний опис винаходу Винахід стосується терапевтичної комбінації, що містить: (а) інгібітор B-Raf та (b) інгібітор деацетилази гістонів, для окремого, одночасного або послідовного введення. Даний винахід стосується, зокрема, терапевтичної комбінації, що містить: (а) інгібітор B-Raf формули (I) або його фармацевтично прийнятну сіль та (b) інгібітор деацетилази гістонів. Відповідні комбінації, охоплені цим аспектом винаходу, включають комбінації, в яких інгібітор деацетилази гістонів являє собою беліностат, панобіностат, тріхостатін А, BL-1521, PX118490, CUDC-101, праціностат, воріностат, ONO-4817, тоседостат, піроксамід, батімастат, тефіностат або буфексамак. Даний винахід додатково стосується фармацевтичної комбінації, що містить: (а) інгібітор B-Raf та (b) інгібітор деацетилази гістонів панобіностат або його фармацевтично прийнятну сіль. 2 UA 115151 C2 Прийнятні комбінації, охоплені цим аспектом винаходу, включають комбінації, в яких інгібітор B-Raf являє собою вемурафеніб, RAF265 або сполуку Формули (I). Даний винахід стосується, зокрема, фармацевтичної комбінації, що містить: (а) інгібітор B-Raf формули (I) 5 10 15 20 25 30 35 40 45 або його фармацевтично прийнятну сіль та (b) інгібітор деацетилази гістонів панобіностат або його фармацевтично прийнятну сіль. Тут і далі комбінації інгібітора B-Raf та інгібітора деацетилази гістонів, комбінації інгібітора BRaf Формули (I) та інгібітора деацетилази гістонів, комбінації інгібітора B-Raf та інгібітора деацетилази гістонів панобіностату, а також комбінації інгібітора B-Raf Формули (I) та інгібітора деацетилази гістонів панобіностату окремо та в сукупності називаються Комбінацією згідно з винаходом. Даний винахід стосується, зокрема, Комбінації згідно з винаходом, прийнятної для окремого, одночасного або послідовного введення суб'єкту, що потребує цього, для лікування або попередження проліферативного захворювання. Даний винахід стосується також Комбінації згідно з винаходом для застосування при отриманні фармацевтичної композиції або лікарського засобу для лікування або попередження проліферативного захворювання у суб'єкта, що потребує цього. Даний винахід додатково стосується застосування Комбінації згідно з винаходом для отримання фармацевтичної композиції або лікарського засобу для лікування або попередження проліферативного захворювання. Даний винахід стосується способу лікування суб'єкта, який страждає на проліферативне захворювання, що включає введення зазначеному суб'єкту Комбінації згідно з винаходом у кількості, яка сукупно є терапевтично ефективною проти проліферативного захворювання. У даному винаході додатково представлена комерційна упаковка, що містить в якості терапевтичних засобів Комбінацію згідно з винаходом разом з інструкціями з одночасного, окремого або послідовного введення для застосування з метою відстрочення прогресування або лікування проліферативного захворювання. Загальні терміни, використовувані в цьому документі, мають такі значення, якщо спеціально не вказано інше: Терміни "містить" та "включає" використані в цьому документі в їхньому необмеженому значенні, якщо не вказано інше. Терміни в однині в контексті опису даного винаходу (особливо в контексті подальшої формули винаходу) слід розуміти як такі, що охоплюють і однину, і множину, якщо в цьому документі не вказано або з контексту явно не випливає інше. При використанні форми множини для сполук, солей і т.п. слід мати на увазі також одну сполуку, сіль або т.п. Терміни "комбінація", "терапевтична комбінація" або "фармацевтична комбінація", використовувані в даному документі, означають або фіксовану комбінацію у вигляді одиничної дозованої лікарської форми, або набір компонентів для комбінованого введення, в якому окремі компоненти комбінації (a) та (b) можуть бути введені незалежно в один і той самий час або окремо з інтервалами часу, які забезпечують можливість прояву спільного, наприклад, синергетичного ефекту компонентів комбінації. Термін "фармацевтична композиція" в даному документі стосується суміші або розчину, що містять щонайменше один терапевтичний засіб, який підлягає введенню суб'єкту, наприклад, ссавцю або людині, для попередження або лікування конкретного захворювання або стану, що вразили ссавця. 3 UA 115151 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "фармацевтично прийнятний" в даному документі стосується таких сполук, матеріалів, композицій та/або лікарських форм, які за результатами ретельної медичної клінічної оцінки є придатними для контакту з тканинами організму суб'єкта, наприклад, ссавця або тварини, без надмірної токсичності, подразнення, алергічної реакції або інших проблем або ускладнень, пропорційно до прийнятного співвідношення користі та ризику. Термін "комбінований препарат" у даному документі стосується, зокрема, "набору компонентів" у тому розумінні, що компоненти комбінації (а) та (b), описані вище, можуть бути дозовані незалежно або із застосуванням різних фіксованих комбінацій з певними кількостями компонентів комбінації (а) та (b), тобто одночасно або в різні моменти часу. Потім елементи набору компонентів можуть бути, наприклад, введені одночасно або з хронологічним зсувом, тобто в різні моменти часу і з рівними або різними інтервалами часу для будь-якого елементу набору компонентів. Відношення загальної кількості компонента комбінації (а) до компонента комбінації (b), що підлягають введенню в комбінованому препараті, може варіюватися, наприклад, відповідно до потреб підгрупи пацієнтів, що підлягають лікуванню, або потреб одного пацієнта. Термін "спільне введення" або "комбіноване введення" при використанні в даному документі охоплює введення обраних терапевтичних засобів одному пацієнту та включає схеми лікування, в яких ці засоби необов'язково вводять одним і тим самим способом введення або в один і той самий час. Термін "лікує" або "лікування" при використанні в даному документі включає полегшення, зменшення або поліпшення щонайменше одного симптому у суб'єкта або забезпечення відстрочення прогресування захворювання. Наприклад, лікування може являти собою зменшення одного або більше симптомів порушення або повне усунення порушення, такого як рак. У значенні за даним винаходом термін "лікувати" означає також зупинку, відстрочення виникнення (тобто період до клінічного прояву захворювання) та/або зменшення ризику розвитку або погіршення захворювання. Термін "захищати" при використанні в даному документі означає попередження, відстрочення або лікування, або всі ці дії, відповідно до обставин, розвитку, тривалості або ускладнення захворювання у суб'єкта. Термін "спільно терапевтично активні" або "спільний терапевтичний ефект" означає те, що терапевтичні засоби можуть бути введені окремо (з хронологічним зсувом, особливо при послідовному введенні) з переважними для них інтервалами часу, теплокровним тваринам, особливо людям, що підлягають лікуванню, і вони все ще проявляють (переважно синергетичну) взаємодію (спільний терапевтичний ефект). І в цьому випадку можна, крім іншого, потім визначити рівні в крові, які вказують на те, що обидві сполуки містяться в крові людини, яка підлягає лікуванню, щонайменше протягом певного інтервалу часу. Термін "фармацевтично ефективна кількість" або "клінічно ефективна кількість", або "терапевтично ефективна кількість" комбінації терапевтичних засобів являє собою кількість, достатню для забезпечення помітного поліпшення щодо базової лінії клінічно спостережуваних ознак і симптомів порушення, яке лікують зазначеною комбінацією. Термін "суб'єкт" або "пацієнт" при використанні в даному документі включає тварин, які можуть страждати або бути ураженими раком або будь-яким порушенням, яке включає, прямо або побічно, рак. Приклади суб'єктів включають ссавців, наприклад, людей, собак, корів, коней, свиней, овець, кіз, котів, мишей, кролів, щурів та трансгенних тварин, які не є людиною. У переважному варіанті реалізації винаходу суб'єкт являє собою людину, наприклад, людину, що страждає, має ризик виникнення, або потенційно здатна захворіти на рак. Терміни "близько" або "приблизно" мають значення в межах 10 %, більш переважно, в межах 5 % від даного значення або діапазону. Компоненти (а) та (b) комбінації можуть бути введені у вільній формі або у формі фармацевтично прийнятної солі. "Фармацевтично прийнятна сіль" при використанні в даному документі, якщо не вказано інше, включає солі кислотних та основних груп, які можуть бути присутніми в сполуках згідно з даним винаходом. Сполуки згідно з даним винаходом, що є основними за природою, можуть утворювати широкий спектр солей із різними неорганічними та органічними кислотами. Кислоти, які можуть бути використані для отримання фармацевтично прийнятних кислотно-адитивних солей таких основних сполук згідно з даним винаходом, являють собою кислоти, які утворюють нетоксичні кислотно-адитивні солі, тобто солі, що містять фармацевтично прийнятні аніони, такі як ацетатні, бензоатні, бромідні, хлоридні, цитратні, фумаратні, гідробромідні, гідрохлоридні, йодидні, лактатні, малеатні, малеатні, нітратні, оксалатні, саліцилатні, сукцинатні та тартратні солі. Панобіностат, зокрема, вводять у вигляді його лактатної солі. Інгібітор B-Raf Формули (I), 4 UA 115151 C2 5 10 15 20 25 30 35 40 45 зокрема, вводять у формі вільної основи у вигляді таких лікарських форм, як тверда дисперсія або мікроемульсія. Якщо інше не зазначено або явно не випливає з контексту, то посилання на терапевтичні засоби, що є прийнятними для Комбінації згідно з винаходом, включає і вільні основи цих сполук, і всі фармацевтично прийнятні солі цих сполук. Даний винахід стосується також комбінації, такої як комбінований препарат або фармацевтична композиція, що містить Комбінацію згідно з винаходом, зокрема, комбінований препарат або фармацевтичну композицію, що містить (a) інгібітор B-Raf формули (I) або його фармацевтично прийнятну сіль та (b) інгібітор деацетилази гістонів панобіностат або його фармацевтично прийнятну сіль. Даний винахід стосується, зокрема, Комбінації згідно з винаходом, придатної для лікування або попередження проліферативного захворювання у суб'єкта, що потребує цього. В цьому варіанті реалізації даного винаходу Комбінацію згідно з винаходом застосовують для лікування або попередження проліферативного захворювання, що включає введення суб'єкту комбінованої терапії, наприклад, такої, що містить ефективну кількість інгібітора B-Raf Формули I та панобіностат. Переважно, ці інгібітори вводять у терапевтично ефективних дозах, які, при комбінуванні, забезпечують сприятливий ефект. Введення може бути окремим, одночасним або послідовним. В одному з варіантів реалізації винаходу проліферативне захворювання являє собою рак. Термін "рак" в даному документі означає широкий спектр пухлин, в тому числі всі солідні пухлини та гематологічні злоякісні захворювання. Приклади таких пухлин включають, але не обмежуються ними, доброякісні або злоякісні пухлини головного мозку, легень (зокрема, дрібноклітинний рак легень та недрібноклітинний рак легень), плоских клітин, сечового міхура, шлунка, підшлункової залози, молочної залози, голови та шиї, нирок, сечоводу, яєчників, передміхурової залози, товстої та прямої кишок, стравоходу, яєчок, гінекологічні пухлини (наприклад, саркома матки, саркома фаллопієвих труб, ендометрію, шийки матки, піхви або вульви), пухлини щитовидної залози, підшлункової залози, кісток, шкіри, меланому, пухлини матки, яєчників, прямої кишки, анального каналу, товстої кишки, яєчок, хворобу Ходжкіна, пухлини стравоходу, тонкого кишечника, ендокринної системи (наприклад, щитовидної, паращитовидної або надниркової залози), саркоми м'яких тканин, уретри, пеніса, лейкози, лімфоми, неоплазми центральної нервової системи, саркоми, мієломи, біліарні пухлини, пухлини печінки, нейрофіброматоз, гострий мієлогенний лейкоз (ГМЛ), мієлодиспластичні синдроми (МДС) та саркому Капоші. У додатковому варіанті реалізації даного винаходу проліферативне захворювання являє собою меланому, рак легень (в тому числі недрібноклітинний рак легень (НДКРЛ)), колоректальний рак (КРР), рак молочної залози, рак нирок, такий як, наприклад, нирковоклітинна карцинома (НКК), рак печінки, ендометріальний рак, гострий міелогенний лейкоз (ГМЛ), мієлодиспластичні синдроми (МДС), рак щитовидної залози, зокрема, папілярний рак щитовидної залози, рак підшлункової залози, нейрофіброматоз або гепатоцеллюлярну карциному. У додатковому варіанті реалізації даного винаходу проліферативне захворювання являє собою солідну пухлину. Термін "солідна пухлина" означає, зокрема, меланому, рак молочної залози, рак яєчників, колоректальний рак та рак шлунково-кишкового тракту в цілому, рак шийки матки, рак легенів (включаючи дрібноклітинний рак легенів і недрібноклітинний рак легенів), рак голови та шиї, рак сечового міхура, рак передміхурової залози або саркому Капоші. Комбінації 5 UA 115151 C2 5 10 15 20 25 30 35 40 45 50 55 60 згідно з даним винаходомпригнічують зростання солідних пухлин, а також рідинних пухлин. Крім того, залежно від типу пухлини та конкретної застосовуваної комбінації може бути досягнуто зменшення об'єму пухлини. Комбінація згідно з винаходом, описана в цьому документі, підходить також для попередження метастатичного поширення пухлин і росту або розвитку мікрометастазів. Комбінація згідно з винаходом, описана в цьому документі, підходить для лікування пацієнтів з несприятливим прогнозом, зокрема, таких пацієнтів з несприятливим прогнозом, які страждають від метастатичної меланоми, колоректального раку або раку підшлункової залози. Комбінація згідно з винаходом особливо підходить для лікування пацієнтів, які раніше набули резистентності до лікування інгібіторами B-Raf. У додатковому варіанті реалізації винаходу проліферативне захворювання являє собою меланому або колоректальний рак, зокрема, меланому або колоректальний рак із резистентністю до лікування інгібіторами B-Raf. Комбінація згідно з винаходом особливо підходить для лікування ракових захворювань із генетичною альтерацією на шляху сигнальної трансдукції RAS/RAF/MEK, такої як, наприклад, мутація B-Raf або ампліфікація гена. В одному з важливих варіантів реалізації винаходу рак, який підлягає лікуванню, характеризується мутацією B-Raf, наприклад, колоректальний рак та меланома з мутованим BRaf, зокрема, така меланома або колоректальний рак із резистентністю до лікування інгібіторами B-Raf. Зокрема, мутація B-Raf являє собою мутацію V600, наприклад, мутацію V600E, V600K або V600G. Природа пролиферативних захворювань є багатофакторною. За деяких обставин можна комбінувати ліки з різними механізмами дії. Однак просте комбінування терапевтичних засобів з різним механізмом дії необов'язково призводить до отримання комбінацій з переважною дією. Введення фармацевтичної комбінації згідно з даним винаходом може призводити не тільки до сприятливого ефекту, наприклад, синергетичного терапевтичного ефекту, наприклад, щодо полегшення, відстрочення прогресування або пригнічення симптомів, але і до додаткових, несподіваних сприятливих ефектів, наприклад, до меншої кількості побічних ефектів, більшої тривалості відповіді, поліпшення якості життя або зниження тяжкості захворювання, у порівнянні з монотерапією із застосуванням тільки одного фармацевтично терапевтичного засобу, застосовуваного в комбінації згідно з даним винаходом. Додаткова перевага полягає в тому, що можуть бути використані більш низькі дози терапевтичних засобів Комбінації згідно з винаходом, наприклад, необхідні дози найчастіше можуть бути не тільки зменшені, але й можуть рідше застосовуватися, або можуть бути використані для зменшення випадків побічних ефектів, які спостерігаються при застосуванні тільки одного з компонентів комбінації. Це відповідає бажанням і вимогам пацієнтів, що підлягають лікуванню. За допомогою загальновизнаних експериментальних моделей можна показати, що Комбінація згідно з винаходом забезпечує сприятливі ефекти, описані раніше в даному документі. Фахівці у даній галузі техніки можуть вибрати релевантну експериментальну модель для підтвердження зазначених переважних ефектів. Фармакологічна активність Комбінації згідно з винаходом може бути продемонстрована, наприклад, у дослідженні на клітинній лінії, як описано далі. Відповідно до додаткового аспекту, в даному винаході представлена синергетична комбінація для введення людям, що містить інгібітор B-Raf Формули I та панобіностат, при цьому діапазон доз для кожного компонента відповідає синергетическим діапазонам, передбачуваним за результатами прийнятної in vitro моделі пухлини або клінічного дослідження. Як правило, інгібітор B-Raf Формули I вводять у дозі в діапазоні від 10 мг до 450 мг за добу, більш конкретно від 50 до 350 мг за добу, наприклад, 100, 200 або 300 мг за добу, а панобіностат вводять у дозі в діапазоні від 100 до 1500 мг за добу, наприклад, 200-1000 мг за добу, наприклад, 200, 400, 500, 600, 800, 900 або 1000 мг за добу, при цьому добову дозу вводять однією або двома щоденними дозами. Одним із завдань даного винаходу є забезпечення фармацевтичної композиції, що містить Комбінацію згідно з винаходом, яка спільно терапевтично ефективна проти проліферативного захворювання. В такій композиції комбінація компонентів (а) та (b) може бути введеною або в одній композиції, або в разовій лікарській формі, яку вводять паралельно, але окремо, або може бути введеною послідовно будь-яким прийнятним способом. Разова лікарська форма також може бути фіксованою комбінацією. Фармацевтичні композиції для окремого введення обох компонентів комбінації або для введення у фіксованій комбінації, тобто єдиної лікарської композиції, що містить Комбінацію згідно з винаходом, можуть бути отримані за способами, відомим per se, і вони являють собою 6 UA 115151 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиції, які підходять для ентерального, такого як пероральне або ректальне, або парентерального введення ссавцям (теплокровним тваринам), у тому числі людині, що містять терапевтично ефективну кількість щонайменше одного фармакологічно активного компонента комбінації окремо, наприклад, як описано вище, або в комбінації з одним або більше фармацевтично прийнятних носіїв, особливо прийнятних для ентерального або парентерального застосування. Нова фармацевтична композиція може містити від близько 0,1 % до близько 99,9 %, переважно від близько 1 % до близько 60 % терапевтичного(-них) засобу(-ів). Прийнятні фармацевтичні композиції для комбінованої терапії для ентерального або парентерального введення являють собою, наприклад, композиції у формі одиниць дозування, таких як вкриті цукром таблетки, таблетки, капсули або супозиторії, або ампули. Якщо не вказано інше, їх отримують за способами, відомими per se, наприклад, шляхом різного стандартного змішування, розтирання в порошок, прямого пресування, гранулювання, покриття цукром, розчинення, процесами ліофілізації, гранулювання з розплаву або прийомами виготовлення, зрозумілими фахівцям у даній галузі техніки. Слід розуміти, що окремий вміст компонента комбінації, що міститься в окремій дозі кожної лікарської форми, необов'язково має становити ефективну кількість, оскільки необхідна ефективна кількість може бути досягнута шляхом введення безлічі одиниць дозування. В одному з варіантів реалізації даний винахід стосується також Комбінації згідно з винаходом для застосування при отриманні фармацевтичної композиції або лікарського засобу для лікування або попередження проліферативного захворювання у суб'єкта, що потребує цього. Відповідно до даного винаходу, терапевтично ефективна кількість кожного з комбінованих компонентів Комбінації згідно з винаходом може бути введена одночасно або послідовно та в будь-якому порядку, і ці компоненти можуть бути введені окремо або у вигляді фіксованої комбінації. Наприклад, спосіб лікування проліферативного захворювання згідно з даним винаходом може включати (i) введення засобу (а) у вільній формі або у формі фармацевтично прийнятної солі і (ii) введення засобу (b) у вільній формі або у формі фармацевтично прийнятної солі, одночасно або послідовно в будь-якому порядку, у спільно терапевтично ефективних кількостях, переважно в синергетично ефективних кількостях, наприклад, у щоденних або переривчастих дозах, відповідних кількостях, описаних у цьому документі. Окремі компоненти Комбінації згідно з винаходом можуть бути введені окремо в різний час протягом курсу терапії або паралельно в окремих або єдиних формах комбінації. Тому даний винахід слід розуміти як такий, що охоплює всі такі режими одночасного лікування або лікування, що чергується, і слід відповідним чином інтерпретувати термін "введення". Ефективна доза кожного компонента комбінації, застосовуваного в Комбінації згідно з винаходом, може варіюватися залежно від конкретної застосовуваної сполуки або фармацевтичної композиції, способу введення, стану, що підлягає лікуванню, і тяжкості стану, що підлягає лікуванню. Отже, режим дозування Комбінації згідно з винаходом вибирають відповідно до різних факторів, включаючи спосіб введення і ниркову та печінкову функцію пацієнта. Досвідчений клініцист або лікар може легко визначити та призначити ефективну кількість окремих терапевтичних засобів, необхідну для полегшення, протидії або зупинки розвитку стану. Оптимальні співвідношення окремих і комбінованих доз, а також концентрації комбінованих компонентів (а) та (b) Комбінації згідно з винаходом, які забезпечують ефективність без токсичності, базуються на кінетиці доступності терапевтичних засобів для сайтів-мішеней, і їх визначають за способами, відомими фахівцям у даній галузі техніки. Ефективна доза кожного компонента комбінації може вимагати більш частого введення однієї сполуки (сполук), порівняно з іншою сполукою(-ами) в комбінації. Тому для забезпечення правильного дозування упаковані фармацевтичні продукти можуть містити одну або більше лікарських форм, які містять комбінацію сполук, та одну або більше лікарських форм, що містять одну сполуку комбінації, але не містять іншої сполук (сполук) комбінації. При застосуванні комбінованих компонентів, які використані в Комбінації згідно з винаходом, у формі, що продається у вигляді одних ліків, їхня доза та спосіб введення можуть відповідати інформації, представленій на вкладці упаковки відповідних ліків. що продаються, якщо в цьому документі не вказано інше. Оптимальна доза кожного компонента комбінації для лікування проліферативного захворювання може бути визначена емпірично для кожного індивідуума із застосуванням відомих способів, і вона залежить від безлічі факторів, включаючи, але не обмежуючись ними, ступінь поширення захворювання; вік, масу тіла, загальний стан здоров'я, стать і харчування 7 UA 115151 C2 5 10 15 20 25 30 35 індивідуума; час і спосіб введення; та інші лікарські засоби, які приймає індивідуум. Оптимальні дози можуть бути встановлені за допомогою стандартного тестування і процедур, відомих у даній галузі техніки. Кількість кожного компонента комбінації, що може бути змішаною з матеріалами носіїв для отримання разової лікарської форми, варіюється залежно від індивідуума, що проходить лікування, і конкретного способу введення. У деяких варіантах реалізації винаходу разові лікарські форми, що містять комбінацію засобів, описану в цьому документі, містять такі кількості кожного засобу комбінації, які зазвичай вводять при окремому введенні цих засобів. Частота введення доз може варіюватися залежно від застосовуваної сполуки і конкретного стану, що підлягає лікуванню або попередженню. Як правило, переважним є застосування мінімальної дози, достатньої для забезпечення ефективної терапії. Як правило, паціенти можуть бути перевірені на терапевтичну ефективність із застосуванням аналізів, прийнятних для стану, що підлягає лікуванню або попередженню, які добре відомі фахівцям у даній галузі техніки. Даний винахід стосується способу лікування суб'єкта, що страждає від проліферативного захворювання, який включає введення зазначеному суб'єкту Комбінації згідно з винаходом у кількості, яка спільно терапевтично ефективна проти проліферативного захворювання. Зокрема, проліферативне захворювання, яке підлягає лікуванню Комбінацією згідно з винаходом, являє собою меланому або колоректальний рак, зокрема, меланому або колоректальний рак із мутованим B-Raf, наприклад, меланому або колоректальний рак із мутованим V600 B-Raf, зокрема, таку меланому або колоректальний рак із мутованим B-Raf, який є стійким до лікування інгібіторами B-Raf, такими як вемурафеніб або сполуки Формули I. Крім того, лікування може включати хірургічне втручання або радіотерапію. Даний винахід додатково стосується Комбінації згідно з винаходом для застосування при лікуванні проліферативного захворювання, зокрема, рака. Даний винахід додатково стосується комерційної упаковки, що містить терапевтичні засоби Комбінації згідно з винаходом разом з інструкціями щодо їхнього одночасного, окремого або послідовного введення при застосуванні для відстрочення прогресування або лікування проліферативного захворювання у суб'єкта, що потребує цього. Наступні Приклади ілюструють даний винахід, описаний вище; однак вони жодним чином не обмежують обсягу даного винаходу. Переважні ефекти фармацевтичної комбінації за винаходом можуть бути визначені також за допомогою інших експериментальних моделей, відомих фахівцям у даній галузі техніки. Приклад 1 Способи: Клітинні лінії Вестернблоттінг Клітинні лінії Mel-P1-pre; Mel-P1-post; Mel-P3-pre та Mel-P3-post отримали з пухлин меланоми у пацієнтів до та після вемурафенібу. Культури отримали перенесенням свіжого матеріалу меланоми з організму пацієнтів у середовище RPMI із додаванням 10 % ембріональної бичачої сироватки та пеніциліну/стрептоміцину. Клітини помістили в чашки для тканинних культур, а на наступний день замінили середовище свіжим середовищем, що містить або контроль, ДМСО-носій; або 5 мкМ інгібітора B-Raf Формули (I); або 30 нМ панобіностату, або комбінацію обох засобів (COMBO), на зазначений період часу. Білки екстрагували з клітин протягом 30 хвилин при 4 °C, використовуючи буфер для радіо-імунопреципітації (RIPA) (1 % NP40, 0,5 % дезоксихолату натрію, 0,1 % SDS у PBS) з інгібіторами протеази (Roche, Базель, Швейцарія). Концентрацію білків визначали за допомогою набору для аналізу білків Dc (Bio-Rad, Геркулес, штат Каліфорнія). Білки (40 мкг) розділяли на поліакриламідних гелях із 12 % SDS та переносили на мембрани Immobilon-P (Millipore, Біллеріка, штат Массачусетс) при 15 мА/см2 протягом 2 годин, використовуючи пристрій Bio-Rad для напівсухого переносу. Мембрани блокували 5 % розчином сухого знежиреного молока у Tris-буферному сольовому розчині (TBS). Мембрани випробовували первинним антитілом, розведеним у 0,5 % розчині Tween в TBS (TTBS) протягом щонайменше двох годин, потім тричі промивали, щоразу по п'ять хвилин. Вторинні антитіла розбавляли 1:3000 у TTBS та наносили на мембрани на одну годину при кімнатній температурі. Потім мембрани чотири рази промивали TTBS, щоразу по 15 8 UA 115151 C2 Аналіз проточної цитометрії загибелі та фенотипу клітин Проточна цитометрия клітинного циклу Аналіз анексину-V JC-1 Аналіз z-VADFMK-FITC 5 20 хвилин та проявляли хемілюмінесцентним розчином, посиленим пероксидним буфером Immuno-Star HRP (Bio-Rad), використовуючи LAS3000 (FujiFilm). Використані первинні антитіла: ERK1/2 (№ 9102, Cell Signalling); p-ERK (sc-7974, Santa Cruz); PARP-1 (sc8007, Santa Cruz); HDAC1 (sc-81598, Santa Cruz); HDAC2 (sc-55541, Santa Cruz); HDAC3 (sc-130319, Santa Cruz); HDAC8 (sc-56687, Santa Cruz); GAPDH (sc-32233, Santa Cruz). Використані вторинні антитіла: антимишачий IgG-HRP (1706516, Bio-Rad); антищурячий IgG-HRP (1706515, Bio-Rad). Використовували проточну цитометрію для визначення загибелі клітин із застосуванням клітинного циклу або аналізу анексину. Додатково вимірювали мітохондріальну деполярізацію з мітохондріальним барвником JC-1, а активацію каспаз вимірювали за допомогою барвника z-VAD-FMKFITC. У всіх цих експериментах клітини поміщали в чашки для тканинних культур, а на наступний день середовище замінювали свіжим середовищем, що містить зазначену концентрацію інгібітора B-Raf Формули (I) та/або панобіностату. Якщо концентрація не вказана, то клітини обробляли 5 мкМ інгібітора B-Raf Формули (I) та 30 нМ панобіностату. Через 48 годин злиплі та плаваючі клітини збирали та об'єднували, і забарвлювали для аналізу проточної цитометрії, як детально описано нижче. Для аналізу клітинного циклу клітини забарвлювали розчином, що містить 0,1 % Triton-X, йодиду пропідію (50 нг/мкл) (Sigma, Сент-Луїс, штат Міссурі) та рибонуклеази А (50 нг/мкл) (Worthingtin Biochemical Corp, Лейквуд, штат Нью-Джерсі). Аналізували вміст ДНК із щонайменше 2000 клітин, використовуючи програму ModFIT (Verity Software, США). Визначали кількість клітин з вмістом суб-G1, використовуючи програму CellQuest (Becton Dickinson, Франклін Лейкс, штат Нью-Джерсі). Вміст суб-G1 є показником загибелі клітин. Забарвлення анексином V виконували за допомогою APC-кон'югованого анексину-V, як детально описано виробником (BD Biosciences, Франклін Лейкс, штат Нью-Джерсі). Клітини, позитивно забарвлені анексином та/або PI (вісь y), є апоптичними або некротичними. Аналіз JC-1 виконували шляхом седиментації зібраних клітин при 2000 об./хв. протягом 5 хвилин на настільній центрифузі, потім повторним суспендуванням клітин в теплому повному середовищі RPMI, що містить 10 мкМ JC-1 (Molecular Probes, Юджин, штат Орегон). Клітини інкубували при 37 °C протягом 20 хвилин у темряві, один раз промили PBS, потім повторно суспендували у PBS та аналізували за допомогою проточної цитометрії. Клітини, що показали зсув флуоресценції з зеленого на червоний, вважали клітинами з втратою мітохондріального потенціалу. Аналіз JC-1 виконували седиментацією зібраних клітин при 2000 об./хв. протягом 5 хвилин на настільній центрифузі, потім повторним суспендуванням клітин в теплому повному середовищі RPMI, що містить 10 мкМ z-VAD-FMK-FITC (Molecular Probes, Юджин, штат Орегон). Клітини інкубували при 37 °C протягом 30 хвилин у темряві, один раз промивали PBS, потім повторно суспендували в PBS та аналізували задопомогою проточної цитометрії. Клітини, що показали збільшення зеленої флуоресценції, вважали клітинами з активованою каспазою. Результати: Клітинні лінії: Mel-PX-Pre та Mel-PX-post являють собою клітинні лінії, отримані від пацієнта X до і після обробки вемурафенібом. Терапевтичні засоби: B-Raf являє собою інгібітор B-Raf Формули I, а HDAI являє собою панобіностат. SD являє собою стандартне відхилення. Забарвлення у клітинному циклі та суб-G1 аналіз мертвих клітин 9 UA 115151 C2 Клітинний цикл, сер. Клітинна лінія Mel-P3-Pre Mel-P3-Pre Mel-P3-Pre Mel-P3-Pre Mel-P3-Pre Mel-P3-Pre Mel-P3-Pre Mel-P3-Pre Mel-P3-Post Mel-P3-Post Mel-P3-Post Mel-P3-Post Mel-P3-Post Mel-P3-Post Mel-P3-Post Mel-P3-Post Меланоцити (NHEM) Меланоцити (NHEM) Меланоцити (NHEM) Меланоцити (NHEM) cуб- станд. G1 % відх. 3 1 10 2 12 2 20 3 17 2 42 4 52 5 61 4 2 1 2 0 2 1 4 2 15 4 17 4 25 9 36 6 1 0 B-Raf, мкМ 0 0,1 1 10 0 0,1 1 10 0 0,1 1 10 0 0,1 1 10 0 HDAI, нМ 0 0 0 0 30 30 30 30 0 0 0 0 30 30 30 30 0 10 0 3 0 30 10 30 Клітинний цикл, станд. відх. G1 G2/M S G1 G2/M S 65 85 90 92 70 67 64 71 47 65 68 72 69 77 77 62 88 10 6 6 4 21 29 30 26 17 12 10 7 22 15 16 33 3 24 10 5 4 9 4 6 3 36 23 22 21 9 8 7 5 6 1 0 0 0 1 3 5 1 1 1 0 1 3 1 1 1 1 1 0 0 0 1 2 3 1 1 1 1 0 2 1 1 1 1 1 1 0 0 1 1 3 1 1 1 0 1 0 1 0 1 1 1 98 1 1 0 0 0 1 1 88 7 5 1 0 1 2 1 98 1 1 0 0 0 Забарвлення анексином на квадрат Стандартне відхилення BКлітинна HDAI, Верхній Верхній Нижній Нижній Верхній Верхній Нижній Нижній Raf, лінія нМ лівий правий лівий* правий лівий правий лівий правий мкМ Mel-P30 0 1 2 95 2 0 0 0 0 Pre Mel-P30,1 0 0 4 88 7 0 1 1 1 Pre Mel-P31 0 0 6 85 8 0 1 2 1 Pre Mel-P310 0 1 13 73 13 0 1 1 0 Pre Mel-P30 30 1 6 85 8 0 0 1 0 Pre Mel-P30,1 30 1 10 65 24 0 0 3 2 Pre Mel-P31 30 1 11 52 35 0 1 4 4 Pre Mel-P310 30 2 12 47 39 1 1 1 2 Pre Mel-P30 0 1 4 93 3 0 0 1 0 Post Mel-P30,1 0 0 4 91 5 0 0 1 1 Post Mel-P31 0 0 4 91 5 0 1 1 1 Post Mel-P310 0 0 6 89 5 0 1 0 0 Post Mel-P30 30 0 8 83 9 0 1 2 1 Post 10 UA 115151 C2 Mel-P3Post Mel-P3Post Mel-P3Post 0,1 30 1 9 75 16 0 1 3 3 1 30 1 11 71 18 0 0 1 2 10 30 2 19 61 19 1 2 5 2 *Нижній лівий являє собою "здорові" клітини Клітинна лінія Mel-P3-Pre Mel-P3-Pre Mel-P3-Pre Mel-P3-Pre Mel-P3-Post Mel-P3-Post Mel-P3-Post Mel-P3-Post Mel-P1-Pre Mel-P1-Pre Mel-P1-Pre Mel-P1-Pre Mel-P1-Post Mel-P1-Post Mel-P1-Post Mel-P1-Post Mel-P4-Pre Mel-P4-Pre Mel-P4-Pre Mel-P4-Pre Mel-P4-Post Mel-P4-Post Mel-P4-Post Mel-P4-Post Аналіз суб-G1 мертвих клітин (більша кількість клітинних ліній) B-Raf, мкМ HDAI, нМ cуб-G1, % 0 0 3 10 0 20 0 30 17 10 30 61 0 0 2 10 0 4 0 30 15 10 30 36 0 0 9 10 0 10 0 30 21 10 30 38 0 0 7 10 0 10 0 30 14 10 30 23 0 0 9 10 0 58 0 30 40 10 30 87 0 0 17 10 0 54 0 30 24 10 30 86 станд. відх. 1 3 2 4 1 2 4 6 1 1 1 1 1 1 4 1 1 2 7 1 1 2 1 4 Забарвлення JC1 для визначення мітохондріальної деполяризації Деполяризовані Клітинна лінія B-Raf, мкМ HDAI Станд. відх. мітохондрії Mel-P3-Post 0 0 92 0 Mel-P3-Post 5 0 88 1 Mel-P3-Post 0 30 86 2 Mel-P3-Post 5 30 62 2 5 Забарвлення z-VAD-fmk-FITC для визначення каспаза-позитивних клітин z-VAD-fmkКлітинна лінія B-Raf, мкМ HDAI, нМ Станд. відх. позитивні Mel-P3-Post 0 0 7 4 Mel-P3-Post 5 0 14 1 Mel-P3-Post 0 30 23 1 Mel-P3-Post 5 30 43 3 10 Інгібітор B-Raf Формули (I) випробували на відповідних pre та post клітинних лініях, отриманих від пацієнтів до лікування і після продовження лікування вемурафенібом. Інгібітор BRaf Формули (I) викликає ефективну зупинку G1 та апоптоз Baf-мутантної меланоми, що залежить від клітинної лінії. У клітинній лінії меланоми Mel-P3 інгібітор B-Raf Формули (I) викликає ефективну зупинку G1 та низький ступінь апоптозу в клітинній лінії "pre", слабшу зупинку G1 і відсутність апоптозу в клітинній лінії "post". Комбінування панобіностату з 11 UA 115151 C2 5 10 15 20 25 30 35 40 45 50 55 інгібітором B-Raf Формули (I) викликає синергетичне збільшення апоптозу в лініях меланоми. Посилення апоптозу спостерігали також в "post" клітинних лініях, які раніше набули резистентності до інгібітору B-Raf, вемурафенібу. Це дозволяє припустити, що інгібітори деацетилази гістонів можуть реверсувати отриману резистентність до інгібування B-Raf в меланомі і можуть забезпечувати можливість інгібування B-Raf для ініціації апоптозу у резистентних лініях. Випробували безліч різних відповідних клітинних ліній, і, хоча чутливість була різною, панобіностат та інгібітор B-Raf Формули (I) діяли для синергетичного посилення апоптозу (метод Чоу та Талалая). Меланоцити не гинули у відповідь на обробку інгібітором деацетилази гістонів панобіностатом; інгібітором B-Raf Формули (I) або обома засобами в комбінації. Дослідили також клітинні події, пов'язані із загибеллю клітини, які виникають у результаті обробки вемурафеніб-резистентних клітин меланоми комбінацією інгібітора B-Raf Формули (I) і панобіностату. Клітини Mel-P3-post, які не піддалися апоптозу у відповідь тільки на інгібування B-Raf, представляли особливий інтерес. Комбінація інгібітора B-Raf Формули (I) та панобіностату підвищує кількість клітин із активованою каспазою і призводить до отримання клітин із втратою потенціалу на зовнішній мембрані мітохондрій. Додатково спостерігали розщеплення PARP в клітинах, оброблених комбінацією ліків. Розщеплення PARP спостерігали також у клітинах Mel-P3-pre, які також піддалися апоптозу під дією інгібітора B-Raf, при цьому апоптоз був синергетично посилений панобіностатом. Ці спостереження дозволяють припустити активацію класичного каскаду апоптозу, що включає мітохондріальну деполяризацію. Приклад 2 Для вивчення впливу інгібування деацетилази гістонів на сенсибілізацію клітин меланоми до інгібування B-Raf виконали аналіз генної експресії на клітинах до і після обробки тільки інгібітором B-Raf та порівняли результати з клітинами, обробленими комбінацією інгібітора BRaf та інгібітору деацетилази гістонів. У відповідь на інгібітор деацетилази гістонів, залежно від клітинної лінії, змінилася велика кількість генів, автори винаходу були зацікавлені у визначенні клітинних шляхів, які можуть бути важливими мішенями для лікування інгібітором деацетилази гістонів. Для кожної клітинної лінії виконували параметричний аналіз насичення генів (GSEA), порівнюючи інгібування тільки B-Raf з комбінацією. Результати для всіх ліній об'єднали, використовуючи metaGSEA у програмному забезпеченні GenePattern і набори генів клітинних процесів С5. Активуюча регуляція при лікуванні деацетилазою гістонів: злиття мембран регуляція каскаду mapk метаболізм жирних кислот метаболізм похідних амінокислот транспорт вуглеводів метаболізм стероїдів відповідь на позаклітинний подразник іонний гомеостаз сигнальний шлях трансмембранної рецепторної білкової тирозинкінази метаболізм монокарбонових кислот Пригнічуюча регуляція при лікуванні деацетилазою гістонів: секреція цитокінів активація активності jnk позитивна регуляція активності jnk реплікація вірусного генома регуляція активності jnk метаболізм нуклеооснов, нуклеозидів та нуклеотидів гуморальна імунна реакція метаболізм нуклеотидів процес біосинтезу нуклеотидів метаболізм тРНК Висновки: Інгібітори деацетилази гістонів демонструють можливість застосування в комбінованому лікуванні з інгібіторами B-Raf. Комбінування може бути ефективним в якості первинного лікування, а також для пацієнтів з невдалим первинним лікуванням тільки інгібітором B-Raf. Інгібітор B-Raf Формули (I) демонструє ефективне інгібування клітинного циклу та апоптоз, який залежить від клітинної лінії, що посилюється при додаванні інгібітора деацетилази гістонів. 12 UA 115151 C2 Інгібітор деацетилази гістонів може сенсибілізувати клітини меланоми до загибелі, викликаної інгібітором B-Raf, навіть у клітинних лініях, які раніше набули резистентності до інгібіторів BRAF. ФОРМУЛА ВИНАХОДУ 5 1. Фармацевтична комбінація, що містить: (а) інгібітор B-Raf формули (I) O NH O N HN Cl N N 10 15 20 25 N NH F O S O (I) або його фармацевтично прийнятну сіль; та (b) інгібітор деацетилази гістонів, який являє собою панобіностат, або його фармацевтично прийнятну сіль, для одночасного, окремого або послідовного введення. 2. Фармацевтична комбінація за п. 1 для застосування при лікуванні проліферативного захворювання у суб'єкта, що потребує цього. 3. Фармацевтична комбінація за п. 1 для застосування при отриманні лікарського засобу для лікування проліферативного захворювання. 4. Фармацевтична комбінація за п. 3, де проліферативне захворювання являє собою рак. 5. Фармацевтична комбінація за п. 4, де проліферативне захворювання являє собою меланому, рак легень (у тому числі недрібноклітинний рак легень (НДКРЛ)), колоректальний рак (КРР), рак молочної залози, рак нирок, нирково-клітинну карциному (НКК), рак печінки, гострий мієлогенний лейкоз (ГМЛ), мієлодиспластичні синдроми (МДС), рак щитовидної залози, рак підшлункової залози, нейрофіброматоз або гепатоцелюлярну карциному. 6. Застосування комбінації за будь-яким з пп. 1-4 для виробництва лікарського засобу для лікування проліферативного захворювання. 7. Спосіб лікування проліферативного захворювання у пацієнта-людини, що включає одночасне, окреме або послідовне введення терапевтично ефективної кількості (а) інгібітора B-Raf формули (І) O O NH N HN Cl N N 30 N NH F O S O (I) або його фармацевтично прийнятної солі; та (b) інгібітора деацетилази гістонів, який являє собою панобіностат, або його фармацевтично прийнятної солі, 13 UA 115151 C2 5 10 пацієнту з проліферативним захворюванням. 8. Спосіб за п. 7, у якому проліферативне захворювання являє собою меланому, рак легень, колоректальний рак (КРР), рак молочної залози, рак нирок, нирково-клітинну карциному (НКК), рак печінки, гострий мієлогенний лейкоз (ГМЛ), мієлодиспластичні синдроми (МДС), недрібноклітинний рак легенів (НДКРЛ), рак щитовидної залози, рак підшлункової залози, нейрофіброматоз або гепатоцелюлярну карциному. 9. Спосіб за п. 8, у якому проліферативне захворювання характеризується мутацією B-Raf. 10. Спосіб за п. 9, у якому проліферативне захворювання характеризується мутацією B-Raf V600. 11. Спосіб за п. 7, у якому проліферативне захворювання являє собою меланому. 12. Комбінований препарат, який містить: (а) інгібітор B-Raf формули (І) O NH O N HN Cl N N 15 N NH F O S O (I) або його фармацевтично прийнятну сіль; та (b) інгібітор деацетилази гістонів панобіностат або його фармацевтично прийнятну сіль, для одночасного, окремого або послідовного введення. 13. Фармацевтична композиція, що містить: (а) інгібітор B-Raf формули (І) O O NH N HN Cl N N 20 N NH F O S O (I) або його фармацевтично прийнятну сіль; та (b) інгібітор деацетилази гістонів панобіностат або його фармацевтично прийнятну сіль. Комп’ютерна верстка Г. Паяльніков Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical combination comprising a b-raf inhibitor and a histone deacetylase inhibitor and their use in the treatment of proliferative diseases
Автори англійськоюGallagher, Stuart John, Hersey, Peter
Автори російськоюГаллахер Стюарт Джон, Хэрси Питер
МПК / Мітки
МПК: A61K 31/506, A61K 31/4045
Мітки: лікуванні, проліферативних, інгібітор, комбінація, захворювань, гістонів, фармацевтична, b-raf, деацетилази, застосування, містить
Код посилання
<a href="https://ua.patents.su/16-115151-farmacevtichna-kombinaciya-shho-mistit-ingibitor-b-raf-ta-ingibitor-deacetilazi-gistoniv-ta-zastosuvannya-pri-likuvanni-proliferativnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична комбінація, що містить інгібітор b-raf та інгібітор деацетилази гістонів, та її застосування при лікуванні проліферативних захворювань</a>
Попередній патент: Курильний виріб, що містить елемент для спрямування потоку повітря
Наступний патент: Пестицидна суспензія на основі олії
Випадковий патент: Спосіб видалення рідини зі свердловини












