Похідні гідроксамової кислоти з трьома циклічними замісниками, спосіб їх одержання, проміжні сполуки, лікарський препарат та спосіб його одержання
Номер патенту: 44230
Опубліковано: 15.02.2002
Автори: Броудхерст Майкл Джон, Браун Пол Ентоні, Джонсон Уільям Хенрі
Формула / Реферат
1. Производные гидроксамовой кислоты с тремя циклическими заместителями формулы I
,
в которой R представляет собой циклопропил, циклобутил, циклопентил или циклогексил;
R представляет собой насыщенное 5 -8-членное моноциклическое или мостиковое азотсодержащее гетероциклическое кольцо, которое присоединено через атом азота и которое, будучи моноциклом, необязательно содержит в качестве члена кольца NR4 , О, S или SO2 и/или необязательно замещено по одному или более атомам углерода гидроксилом, низшим алкилом, низшим алкокси, оксо- или кетализованной оксогруппой, карбамоилом, моно(низший алкил)карбамоилом или ди(низший алкил)карбамоилом;
R3 представляет собой 5- или 6-членное азотсодержащее гетероциклическое кольцо, которое (а) присоединено через атом азота, (б) необязательно содержит азот или кислород в качестве дополнительного члена кольца, (в) необязательно замещено оксогруппой по одному или двум атомам углерода, соседним со связывающим их атомом азота, и (г) необязательно конденсировано с бензольным кольцом или необязательно замещено по одному или более атомам углерода низшим алкилом и/или по любому (ым) дополнительному (ым) атому (ам) азота низшим алкилом;
R4 представляет собой водород, низший алкил, фенил или защитную группу;
m = 1 или 2;
n = 1 - 4, и их фармацевтически приемлемые соли.
2. Соединения по п. 1, в которых R1 представляет собой циклопропил, циклобутил или циклопентил;
R2 представляет собой насыщенное 5-, 6-или 7-членное моноциклическое или мостиковое азотсодержащее гетероциклическое кольцо, которое присоединено через атом азота и которое, будучи моноциклом, необязательно содержит в качестве члена кольца NR4, О, S или SO2 и/или необязательно замещено по одному или более атомам углерода гидроксилом, низшим алкилом, низшим алкокси, оксо- или кетализованной оксогруппой, карбомоилом, моно(низший алкил)карбамоилом или ди(низший алкил)карбамоилом;
R3 представляет собой 5- или 6-членное азотсодержащее гетероциклическое кольцо, которое (а) присоединено через атом азота, (б) необязательно содержит N или О в качестве дополнительного члена кольца в положении, отличном от соседнего со связывающим атомом азота, (в) замещено оксогруппами по двум атомам углерода, соседним со связывающим их атомом азота, и (г) необязательно конденсировано с бензольным кольцом или необязательно замещено по одному или более атомам углерода низшим алкилом или по любому(ым) дополнительному(ым) атому(ам) азота низшим алкилом;
R4 представляет собой водород, низший алкил или защитную группу.
3. Соединения по п. 1 или 2, в которых R2 представляет собой 1-пирролидинил, пиперидино, 4-фенил-1-пиперазинил, морфолинил, тетрагидро-1,4-тиазин-4-ил, 1,1-диоксил тетрагидро-1,4-тиазин-4-ила, тиазолидин-3-ил, гексагидроазепино или октагидроазоцино, необязательно замещенные по одному или более атомам углерода гидрокси, низшим алкилом, низшим алкокси, кетализованной оксогруппой или моно(низший алкил)карбамоилом; или 3-азабицикло[3.2.2]нонан.
4. Соединения по п. 3, в которых R2 представляет собой пиперидинил или гидроксипиперидинил.
5. Соединения по п. 4, где гидроксипиперидинил является 4-гидроксипиперидинилом.
6. Соединения по любому из пп.1 - 5, где R3 представляет собой группу формулы
,
в которой R5 и R6 каждый представляет собой водород или вместе представляют собой дополнительную связь или остаток конденсированного бензольного кольца;
R7 представляет собой водород или низший алкил;
Χ представляет собой -СО-, -CH2-, -С (низший алкил)2-, -N(низший алкил)-, или, если R7 представляет собой низший алкил и Χ представляет собой -N(низший алкил)-, то эти низшие алкильные группы могут быть объединены с образованием 5-, 6- или 7-членного кольца;
R9 и R10 каждый представляет собой водород или низший алкил.
7. Соединения по п. 6, в которых R3 представляет собой группу формулы (с), R7 представляет собой низший алкил и Χ представляет собой -С (низший алкил)2-.
8. Соединения по п. 7, в которых R3 представляет собой 3,4,4-триметил-2,5-диоксо-1 -имидазолидинил.
9. Соединения по любому из пп.1 - 8, в которых тип равны 1.
10. Соединение по п. 1, представляющее собой 1-[3-циклопропил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1 -имидазолидинил) этил ]пропионил ] -пиперидин.
11. Соединение по п. 1, представляющее собой 1-[3-циклопропил-2(R)-[1(R или S)-(гидроксикарбамоил)-2-(3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-4-пиперидинол.
12. Соединение по п. 1, представляющее собой 1-[3-циклобутил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-пиперидин.
13. Соединение по п. 1, представляющее собой 1-[3-циклобутил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-4-пиперидинол.
14. Соединение по п.1, представляющее собой 1 - [3-циклопентил-2 (R) - [1(R или S) -(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-4-пиперидинол.
15. Соединение по п. 1, представляющее собой 1 - [3-циклопентил-2 (R) - [1(R или S) -(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-4-пиперидин.
16. Соединения по п. 2, выбранные из
3-[3-циклобутил-2 (R) - [1(R или S) - (гидроксикарбамоил)-2-(3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-3-азабицикло [3.2.2]нонана,
3-[3-циклопропил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-3-азабицикло [3.2.2 ]нонана и
3-[3-циклопентил-2 (R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-3-азабицикло [3.2.2 ]нонана.
17. Соединения по п. 1, выбранные из
1-[3-циклогексил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ] пиперидина,
4-[3-циклопентил-2 (R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-тетрагидро-1,4-тиазина,
S,S-диоксид-4-[3-циклопентил-2 (R)- [1R или S) - (гидроксикарбамоил) -2- (3,4,4-триметил-2, 5-диоксо-1-имидазолидинил) этил ]пропионил ]-тетрагидро-1,4-тиазина,
4-[3-циклобутил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-тетрагидро-1,4-тиазина,
4-[3-циклогексил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-тетрагидро-1,4-тиазина,
3-[3-циклопентил-2(R)-[1(R или S)-гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-5,5-диметил-N-пропил-4(R) -тиазолидинкарбоксамида,
4-[3-циклопентил-2(R)-[1(R или S)-гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]морфолина,
3-[3-циклопентил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-N,5, 5-триметил-4(R)-тиазолидинкарбоксамида,
4-[3-циклобутил-2(R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-4-фенилпиперазина,
4-[3-циклобутил-2 (R)-[1(R или S)-(гидроксикарбамоил)-2-(3,4,4-триметил-2,5-диоксо-1-имидазолидинил)этил ]пропионил ]морфолина,
1-[3-циклобутил-2 (R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]пирролидина,
8-[3-циклобутил-2 (R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-1,4-диокса-8-азаспиро[4,5 ]декана,
1-[3-циклобутил-2 (R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]-4-метоксипиперидина,
1-[3-циклобутил-2 (R)-[1(R или S)-(гидроксикарбамоил)-2-(3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]октагидроазоциана,
1-[3-циклобутил-2 (R)-[1(R или S)-(гидроксикарбамоил) -2- (5,5-диметил-2,4-диоксо -3-оксазолидинил)этил ]пропионил ]пиперидина,
1-[3-циклобутил-2 (R)-[1(R или S)-(гидроксикарбамоил) -2- (3,4,4-триметил-2,5-диоксо-1-имидазолидинил) этил ]пропионил ]гексагидроазепина,
1-[3-циклобутил-2 (R) - [2-гексагидро-1,3-диоксопиразоло [1,2-а] [1,2,4 ]триазол-2-ил)-1(R или S)-(гидроксикарбамоил)этил]пропионил ]пиперидина и
1-[3-циклобутил-2 (R)-[1(R или S)-(гидроксикарбамоил)-2-фталимидоэтил ]пропионил] пиперидина.
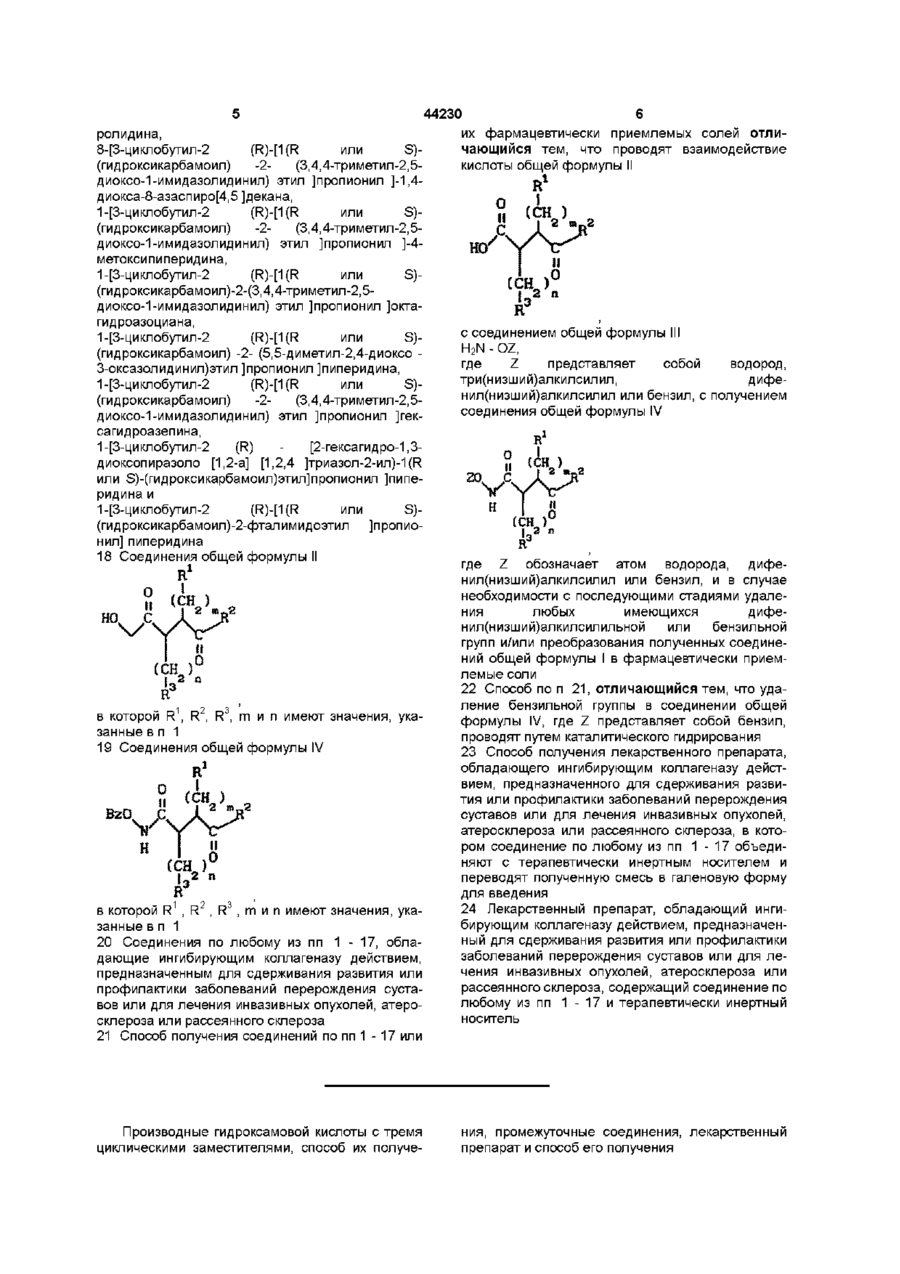
18. Соединения общей формулы II
,
в которой R1, R2, R3, m и n имеют значения, указанные в п. 1.
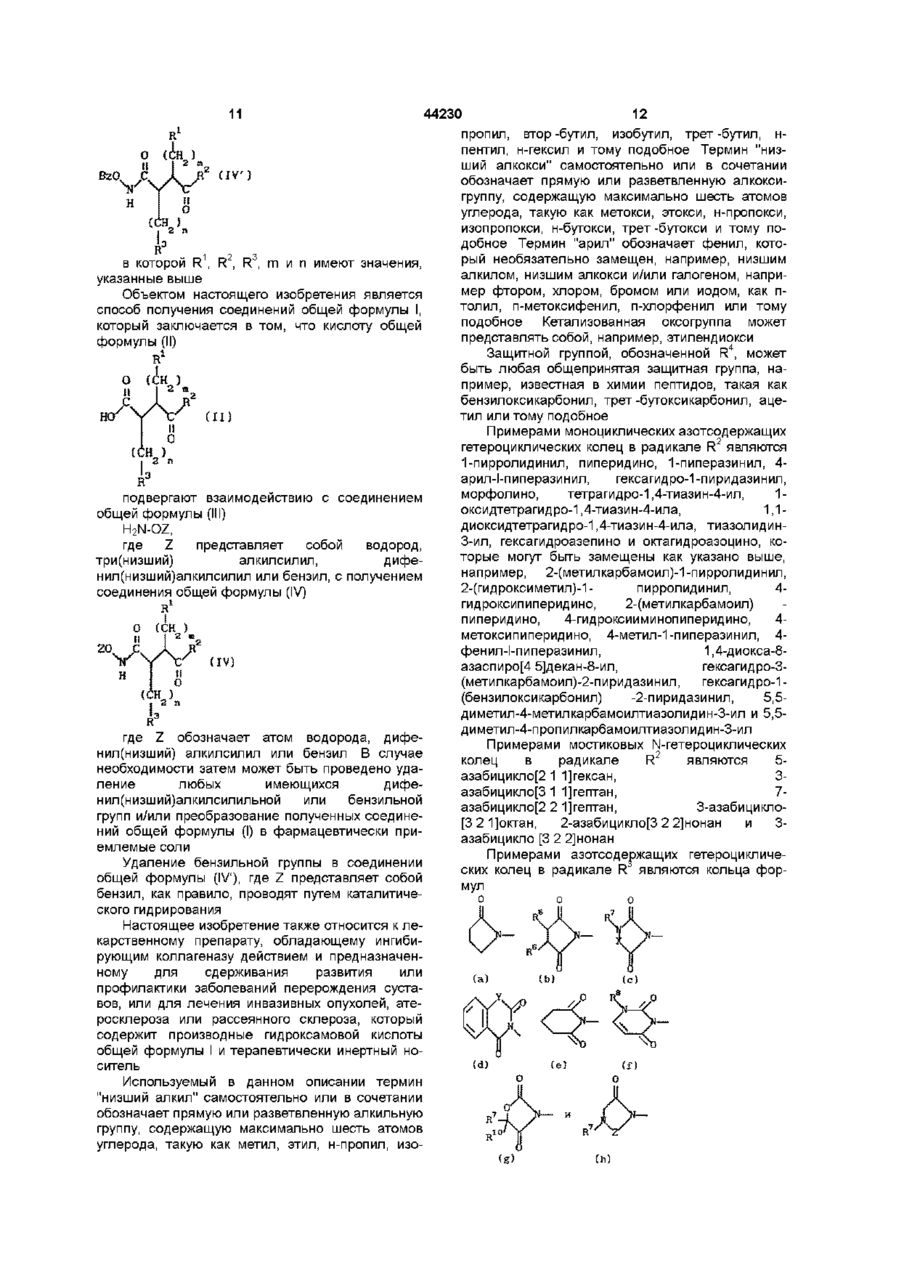
19. Соединения общей формулы IV
,
в которой R1 , R2 , R3 , m и n имеют значения, указанные в п. 1.
20. Соединения по любому из пп. 1 - 17, обладающие ингибирующим коллагеназу действием, предназначенным для сдерживания развития или профилактики заболеваний перерождения суставов или для лечения инвазивных опухолей, атеросклероза или рассеянного склероза.
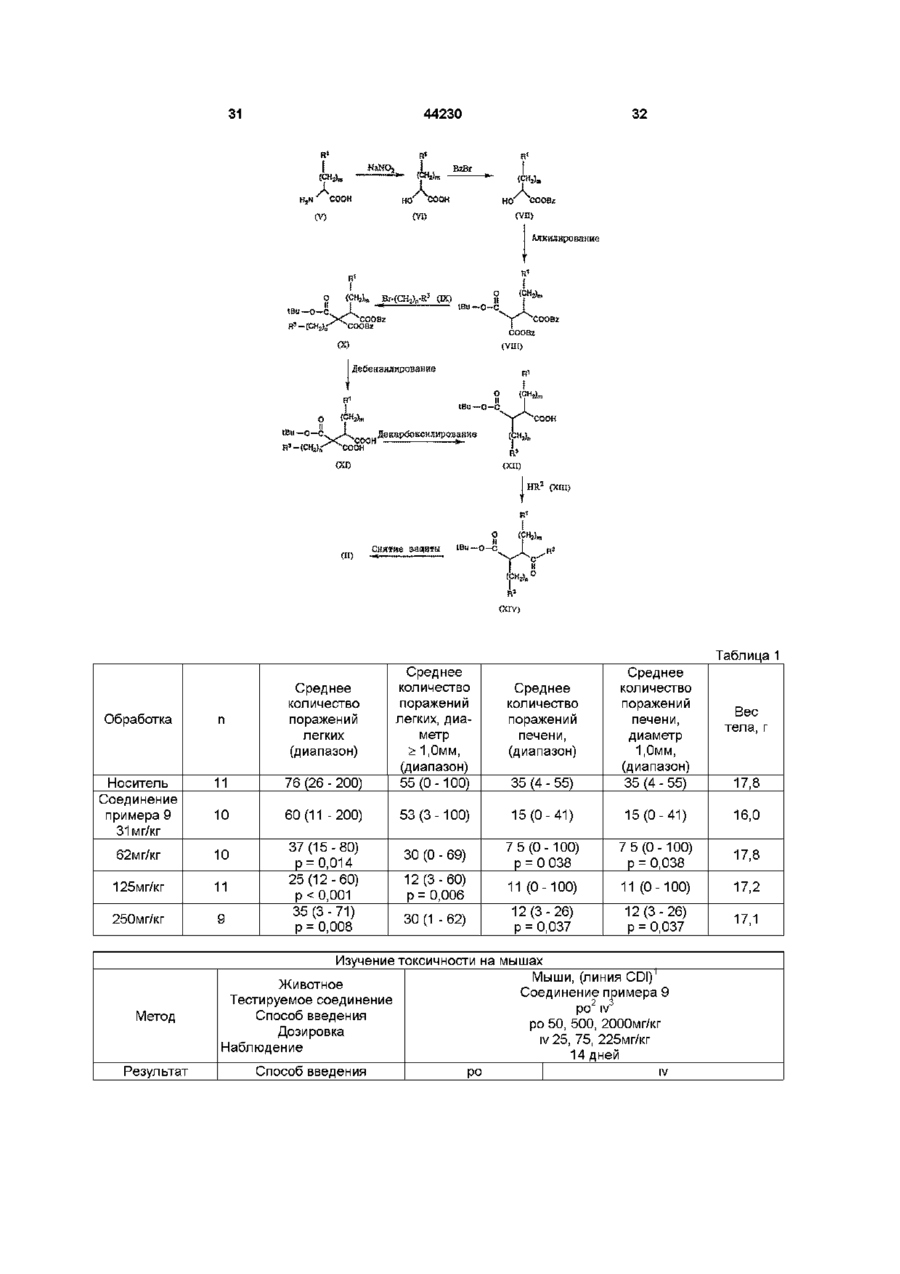
21. Способ получения соединений по пп.1 - 17 или их фармацевтически приемлемых солей отличающийся тем, что проводят взаимодействие кислоты общей формулы II
,
с соединением общей формулы III
Η2Ν - ΟΖ,
где Ζ представляет собой водород, три(низший)алкилсилил, дифенил(низший)алкилсилил или бензил, с получением соединения общей формулы IV
,
где Ζ обозначает атом водорода, дифенил(низший)алкилсилил или бензил, и в случае необходимости с последующими стадиями удаления любых имеющихся дифенил(низший)алкилсилильной или бензильной групп и/или преобразования полученных соединений общей формулы І в фармацевтически приемлемые соли.
22. Способ по п. 21, отличающийся тем, что удаление бензильной группы в соединении общей формулы IV, где Ζ представляет собой бензил, проводят путем каталитического гидрирования.
23. Способ получения лекарственного препарата, обладающего ингибирующим коллагеназу действием, предназначенного для сдерживания развития или профилактики заболеваний перерождения суставов или для лечения инвазивных опухолей, атеросклероза или рассеянного склероза, в котором соединение по любому из пп. 1 - 17 объединяют с терапевтически инертным носителем и переводят полученную смесь в галеновую форму для введения.
24. Лекарственный препарат, обладающий ингибирующим коллагеназу действием, предназначенный для сдерживания развития или профилактики заболеваний перерождения суставов или для лечения инвазивных опухолей, атеросклероза или рассеянного склероза, содержащий соединение по любому из пп. 1 - 17 и терапевтически инертный носитель.
Текст
1 Производные гидроксамовой кислоты с тремя циклическими заместителями формулы I л в которой R представляет собой циклопропил, циклобутил, циклопентил или циклогексил, R представляет собой насыщенное 5 -8-членное моноциклическое или мостиковое азотсодержащее гетероциклическое кольцо, которое присоединено через атом азота и которое, будучи моноциклом, необязательно содержит в качестве члена кольца NR4 , О, S или SO2 и/или необязательно замещено по одному или более атомам углерода гидроксилом, низшим алкилом, низшим алкокси, оксо- или кетализованной оксогруппой, карбамоилом, моно(низший алкил)карбамоилом или ди(низший алкил)карбамоилом, R3 представляет собой 5- или 6-членное азотсодержащее гетероциклическое кольцо, которое (а) присоединено через атом азота, (б) необязательно содержит азот или кислород в качестве дополнительного члена кольца, (в) необязательно замещено оксогруппой по одному или двум атомам углерода, соседним со связывающим их атомом азота, и (г) необязательно конденсировано с бензольным кольцом или необязательно замещено по одному или более атомам углерода низшим алкилом и/или по любому (ым) дополнительному (ым) атому (ам) азота низшим алкилом, R4 представляет собой водород, низший алкил, фенил или защитную группу, m = 1 или 2, п = 1 - 4, и их фармацевтически приемлемые соли 2 Соединения по п 1, в которых R1 представляет собой циклопропил, циклобутил или циклопентил, R2 представляет собой насыщенное 5-, 6-или 7членное моноциклическое или мостиковое азотсодержащее гетероциклическое кольцо, которое присоединено через атом азота и которое, будучи моноциклом, необязательно содержит в качестве члена кольца NR4, О, S или SO2 и/или необязательно замещено по одному или более атомам углерода гидроксилом, низшим алкилом, низшим алкокси, оксо- или кетализованной оксогруппой, карбомоилом, моно(низший алкил)карбамоилом или ди(низший алкил)карбамоилом, R3 представляет собой 5- или 6-членное азотсодержащее гетероциклическое кольцо, которое (а) присоединено через атом азота, (б) необязательно содержит N или О в качестве дополнительного члена кольца в положении, отличном от соседнего со связывающим атомом азота, (в) замещено оксогруппами по двум атомам углерода, соседним со связывающим их атомом азота, и (г) необязательно конденсировано с бензольным кольцом или необязательно замещено по одному или более атомам углерода низшим алкилом или по любому(ым) дополнительному(ым) атому(ам) азота низшим алкилом, R4 представляет собой водород, низший алкил или защитную группу 3 Соединения по п 1 или 2, в которых R2 представляет собой 1-пирролидинил, пиперидино, 4фенил-1-пиперазинил, морфолинил, тетрагидро1,4-тиазин-4-ил, 1,1 -диоксил тетрагидро-1,4тиазин-4-ила, тиазолидин-3-ил, гексагидроазепино или октагидроазоцино, необязательно замещенные по одному или более атомам углерода гидрокси, низшим алкилом, низшим алкокси, кетализованной оксогруппой или моно(низший алкил)карбамоилом, или 3азабицикло[3 2 2]нонан 4 Соединения по п 3, в которых R2 представляет собой пиперидинил или гидроксипиперидинил о о го 44230 5 Соединения по п 4, где гидроксипиперидинил является 4-гидроксипиперидинилом 6 Соединения по любому из пп 1 - 5, где R3 представляет собой группу формулы о в которой R и R каждый представляет собой водород или вместе представляют собой дополнительную связь или остаток конденсированного бензольного кольца, R7 представляет собой водород или низший алкил, X представляет собой -СО-, -СЬЬ-, -С (низший алкил)2-, -ІЧ(низший алкил)-, или, если R7 представляет собой низший алкил и X представляет собой -|\|(низший алкил)-, то эти низшие алкильные группы могут быть объединены с образованием 5-, 6или 7-членного кольца, R9 и R10 каждый представляет собой водород или низший алкил 7 Соединения по п 6, в которых R3 представляет собой группу формулы (с), R представляет собой низший алкил и X представляет собой -С (низший алкил)28 Соединения по п 7, в которых R3 представляет собой 3,4,4-триметил-2,5-диоксо-1 имидазолидинил 9 Соединения по любому из пп 1 - 8, в которых тип равны 1 10 Соединение по п 1, представляющее собой 1[3-циклопропил-2^)-[1 (R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1 -имидазолидинил) этил ]пропионил ] пиперидин 11 Соединение по п 1, представляющее собой 1[3-циклопропил-2^)-[1 (R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-4пиперидинол 12 Соединение по п 1, представляющее собой 1[3-4nmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]пиперидин 13 Соединение по п 1, представляющее собой 1[3-MHKno6y™>2(R)-[1(R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-4пиперидинол 14 Соединение по п 1, представляющее собой 1 [З-циклопентил-2 (R) [1 (R или S) (гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-4пиперидинол 15 Соединение по п 1, представляющее собой 1 [З-циклопентил-2 (R) [1 (R или S) (гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-4пиперидин 16 Соединения по п 2, выбранные из 3-[3-циклобутил-2 (R) - [1 (R или S) - (гидроксикарбамоил)-2-(3,4,4-триметил-2,5-диоксо-1имидазолидинил) этил ]пропионил ]-3-азабицикло [3 2 2]нонана, 3-[3-4Hmonponnn-2(R)-[1(R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-3азабицикло [3 2 2 ]нонана и 3-[3-циклопентил-2 (R)-[1(R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-3азабицикло [3 2 2 ]нонана 17 Соединения по п 1, выбранные из 1-[3-MHmoreKcnn-2(R)-[1(R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ] пиперидина, 4-[3-циклопентил-2 (R)-[1 (R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]тетрагидро-1,4-тиазина, 3,3-диоксид-4-[3-циклопентил-2 (R)- [1R или S) (гидроксикарбамоил) -2- (3,4,4-триметил-2, 5диоксо-1-имидазолидинил) этил ]пропионил ]тетрагидро-1,4-тиазина, 4-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]тетрагидро-1,4-тиазина, 4-[3-циклогексил-2^)-[1 (R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]тетрагидро-1,4-тиазина, 3-[3-qHmoneHTHn-2(R)-[1(R или S)гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-5,5flHMeTHn-N-nponnn-4(R) -тиазолидинкарбоксамида, 4-[3-циклопентил-2^)-[1 (R или S)гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]морфолина, 3-[3-qHmoneHTHn-2(R)-[1(R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-N,5, 4-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-4фенилпиперазина, 4-[3-циклобутил-2 (R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил ]пропионил ]морфолина, 1 -[З-циклобутил-2 (R)-[1 (R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]пир 44230 ролидина, 8-[3-циклобутил-2 (R)-[1 (R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-1,4диокса-8-азаспиро[4,5 ]декана, 1-[3-циклобутил-2 (R)-[1 (R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]-4метоксипиперидина, 1-[3-циклобутил-2 (R)-[1 (R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]октагидроазоциана, 1-[3-циклобутил-2 (R)-[1 (R или S)(гидроксикарбамоил) -2- (5,5-диметил-2,4-диоксо 3-оксазолидинил)этил ]пропионил ]пиперидина, 1-[3-циклобутил-2 (R)-[1 (R или S)(гидроксикарбамоил) -2(3,4,4-триметил-2,5диоксо-1-имидазолидинил) этил ]пропионил ]гексагидроазепина, 1 -[З-циклобутил-2 (R) [2-гексагидро-1,3диоксопиразоло [1,2-а] [1,2,4 ]триазол-2-ил)-1 (R или 3)-(гидроксикарбамоил)этил]пропионил Пиперидина и 1-[З-циклобутил-2 (R)-[1 (R или S)(гидроксикарбамоил)-2-фталимидоэтил ]пропионил]пиперидина 18 Соединения общей формулы II R H V 1 ЇІ (CHJ C ССН R 3 23п в которой R1, R2, R3, m и п имеют значения, указанные в п 1 19 Соединения общей формулы IV .1 "V О И R (СН ) 2 т. н (СН Г Із2 п R3 1 в которой R , R2 , R3 , m и п имеют значения, указанные в п 1 20 Соединения по любому из пп 1 - 1 7 , обладающие ингибирующим коллагеназу действием, предназначенным для сдерживания развития или профилактики заболеваний перерождения суставов или для лечения инвазивных опухолей, атеросклероза или рассеянного склероза 21 Способ получения соединений по пп 1 - 17 или Производные гидроксамовой кислоты с тремя циклическими заместителями, способ их получе их фармацевтически приемлемых солей отличающийся тем, что проводят взаимодействие кислоты общей формулы II го „ г не / (СН) с соединением общей формулы III H2N - OZ, где Z представляет собой водород, три(низший)алкилсилил, дифенил(низший)алкилсилил или бензил, с получением соединения общей формулы IV г о 20. V W II .С. 3 сені0 к І-.2 п где Z обозначает атом водорода, дифенил(низший)алкилсилил или бензил, и в случае необходимости с последующими стадиями удаления любых имеющихся дифенил(низший)алкилсил ильной или бензил ьной групп и/или преобразования полученных соединений общей формулы І в фармацевтически приемлемые соли 22 Способ по п 21, отличающийся тем, что удаление бензильной группы в соединении общей формулы IV, где Z представляет собой бензил, проводят путем каталитического гидрирования 23 Способ получения лекарственного препарата, обладающего ингибирующим коллагеназу действием, предназначенного для сдерживания развития или профилактики заболеваний перерождения суставов или для лечения инвазивных опухолей, атеросклероза или рассеянного склероза, в котором соединение по любому из пп 1 - 17 объединяют с терапевтически инертным носителем и переводят полученную смесь в галеновую форму для введения 24 Лекарственный препарат, обладающий ингибирующим коллагеназу действием, предназначенный для сдерживания развития или профилактики заболеваний перерождения суставов или для лечения инвазивных опухолей, атеросклероза или рассеянного склероза, содержащий соединение по любому из пп 1 - 17 и терапевтически инертный носитель ния, промежуточные соединения, лекарственный препарат и способ его получения 44230 Изобретение относится к новым производным гидроксамовой кислоты, обладающим ценными фармакологическими свойствами, в частности проявляющим свойства ингибитора коллагеназы, которые могут быть использованы для задержки развития или профилактики заболеваний перерождения суставов, таких как ревматоидный артрит или остеоартрит, или при лечении инвазивных опухолей, атеросклероза или рассеянного склероза, а также к способу их получения, промежуточным продуктам для их получения, лекарственному препарату и способу его получения Производными гидроксамовой кислоты, охватываемыми настоящим изобретением, являются соединения общей формулы R1 1 в которой R представляет собой циклопропил, циклобутил, циклопентил или циклогексил, R представляет собой насыщенное 5-8членное моноциклическое или мостиковое азотсодержащее гетероциклическое кольцо, которое присоединено атомом азота и, если является моноциклическим, может дополнительно содержать в кольце NR4, О, S или SO2 и/или может быть необязательно замещено на одном или более атомах углерода гидроксилом, низшим алкилом, низшим алкокси, оксоили кетализованной оксогруппой, карбамоилом, моно(низший алкил)карбамоилом или ди(низший алкил)карбамоилом, R3 представляет собой 5-или 6-членное азотсодержащее гетероциклическое кольцо, которое (а) присоединено атомом азота, (б) необязательно может содержать дополнительно азот или кислород в кольце, (в) необязательно замещено оксогруппой на одном или двух атомах углерода, соседних со связывающим их атомом азота, и (г) необязательно конденсировано с бензольным кольцом или необязательно может содержать на одном или более атомах углерода низший алкил и/или на любом(ых) дополнительном(ых) атоме(ах) азота низший алкил, R4 представляет собой водород, низший алкил, фенил или защитную группу, m равно 1 или 2, п равно 1 - 4, и их фармацевтически приемлемые соли Предпочтительны соединения формулы I, в которых R1 представляет собой циклопропил, циклобутил или циклопентил, R2 представляет собой насыщенное 5-,6-или 7-членное моноциклическое или мостиковое азотсодержащее гетероциклическое кольцо, которое присоединено через атом азота и которое, если является моноциклическим, необязательно содержит дополнительно в кольце NR4, О, S или SO2 и/или необязательно замещено на одном или бо 8 лее атомах углерода гидроксилом, низшим алкилом, низшим алкокси, оксо- или кетализованной оксогруппой, карбамоилом, моно(низший алкил)карбамоилом или ди(низший алкил)карбамоилом, R3 представляет собой 5- или 6-членное азотсодержащее гетероциклическое кольцо, которое (а) присоединено через атом азота, (б) необязательно содержит дополнительно в кольце N или О в положении, отличном от соседнего со связывающим атомом азота, (в) возможно замещено оксогруппами на двух атомах углерода, соседних со связывающим их атомом азота, и (г) необязательно конденсировано с бензольным кольцом или необязательно замещено на одном или более атомах углерода низшим алкилом или на любом(ых) дополнительном(ых) атоме(ах) азота низшим алкилом, R4 представляет собой водород, низший алкил или защитную группу Из них наиболее предпочтительны соединения формулы І, в которых R2 представляет собой 1-пиррол ид инил, пиперидино, 4-фенил-Іпиперазинил, морфолинил, тетрагидро-1,4-тиазин4-ил, 1,1-диоксид тетрагидро-1,4-тиазин-4-ила, тиазолидин-3-ил, гексагидроазепино или октагидроазоцино, необязательно замещенные на одном или более атомах углерода гидрокси, низшим алкилом, низшим алкокси, кетализованной оксогруппой или моно(низший алкил)карбамоилом, или 3азабицикло[3 2 2]нонан Особенно предпочтительны соединения формулы І, в которых R2 представляет собой пиперидинил или гидроксипиперидинил В частности, соединения формулы I, где гидроксипиперидинил является 4гидроксипиперидинилом Среди вышеуказанных предпочтительных соединений можно назвать соединения формулы I, где R3 представляет собой группу формулы 0 0 О (Ы (с) в которой R5 и R6 каждый представляет собой водород или вместе представляют собой дополнительную связь или остаток конденсированного бензольного кольца, R7 представляет собой водород или низший алкил, X представляет собой -СО-, -СЬЬ-, -С(низший алкил)2-, -N-низший алкил-, или, если R7 представляет собой низший алкил и X представляет собой -N-низший алкил-, то эти низшие алкильные группы могут вместе образовывать 5- 6- или 7-членные кольца, и R9 и R1 каждый представляет собой водород или низший алкил Особенно предпочтительны соединения, в которых R3 представляет собой группу формулы (с), R7 представляет собой низший алкил и X представляет собой -С(низший алкил)2В частности, соединения, в которых R3 пред ставляет собой 3,4,4-триметил-2,5-диоксо-1имидазолидинил Обычно в указанных выше соединениях т и п равны 1 Среди наиболее предпочтительных соединений следует назвать 1-[3-циклопропил-2(Р)-[1(Р или S) - (гидроксикарбамоил)-2-(3,4,4-триметил2,5-диоксо-1-имидазолидинил)этил]пропионил]пиперидин, 1-[3-циклопропил-2(Р)-[1(Р или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-4пиперидинол, 1-[3-циклобутил-2(Р-[1(Р ли S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил ]пропионил]пиперидин, 1-[3-MHmo6yTHn-2(R-[1(R и S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-4пиперидинол, 1-(3-L(HmoneHTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-4пиперидинол, 1-(3-qHmoneHTHn-2(R)-[1(R ли S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1имидазолидинил)этил]пропионил]пиперидин либо соединения, выбранные из 3-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-3азабицикло[3 2 2]нонана, 3-[3-L(HmonponHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионид]-3азабицикло[3 2 2]нонана и 3-(3-qHmoneHTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-3азабицикло-[3 2 2]нонана, либо соединения, выбранные из 1-[3-L(HmoreKCHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]пиперидина, 4-[3-L(HmoneHTHn-2(R)-(l(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]тетрагидро-1,4-тиазина, S.S-диоксида 4-[3-L(HmoneHTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]тетрагидро-1,4-тиазина, 4-[3-MHmo6yTHn-2(R-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]тетрагидро-1,4-тиазина, 4-[3-L(HmoreKCHn-2(R-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]тетрагидро-1,4-тиазина, 3-[3-qHmoneHTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-5, 5 44230 10 диметил-Ы-пропил-4 ( 4-[3-L(HmoneHTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1имидазолидинил)этил]пропионил]морфолина, 3-[3-qHmoneHTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-М,5, 54-(3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-4фенилпиперазина, 4-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1имидазолидинил)этил]пропионил]морфолина, 1-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1имидазолидинил)этил]пропионил]пирролидина, 8-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-1,4диоксо-8-азаспиро [4,5 ]декана, 1-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-4метоксипиперидина, 1-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1имидазолидинил)этил]пропионил]октагидроазоцина, 1-[3-MHmo6yTHn-2(R)-[1(R или S)(гидроксикарбамоил)-2-(5,5-диметил-2,4-диоксо-3оксазолидинил)этил]пропионил]пиперидина, 1-[3-MHmo6yTHn-2(R-[1(R или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]гексагидроазепина, 1 -[3-L(Hmo6yTHn-2(R-[2-(reKcarHflpo-1,3диоксопиразоло[1,2-а]-[1,2,4]триазол-2-ил)-1 (R или 3)-(гидроксикарбамоил)этил]пропионил]пиперидина и 1-[3-MHmo6yTHn-2(R-[1(R или S)(гидроксикарбамоил)-2фталимидоэтил]пропионил]пиперидина Настоящее изобретение также относится к новым промежуточным продуктам общей формулы 1 в которой R1, R2, R3, m и п имеют значения, указанные выше, или соединения общей формулы (IV) 11 44230 12 пропил, втор -бутил, изобутил, трет -бутил, нпентил, н-гексил и тому подобное Термин "низший алкокси" самостоятельно или в сочетании CIV) обозначает прямую или разветвленную алкоксигруппу, содержащую максимально шесть атомов углерода, такую как метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси и тому подобное Термин "арил" обозначает фенил, который необязательно замещен, например, низшим в которой R , R , R , m и п имеют значения, алкилом, низшим алкокси и/или галогеном, наприуказанные выше мер фтором, хлором, бромом или иодом, как пОбъектом настоящего изобретения является толил, п-метоксифенил, п-хлорфенил или тому способ получения соединений общей формулы I, подобное Кетализованная оксогруппа может который заключается в том, что кислоту общей представлять собой, например, этилендиокси формулы 4 Защитной группой, обозначенной R , может быть любая общепринятая защитная группа, например, известная в химии пептидов, такая как бензилоксикарбонил, трет-бутоксикарбонил, ацетил или тому подобное СП) Примерами моноциклических азотсодержащих гетероциклических колец в радикале R2 являются ECH J 1-пирролидинил, пиперидино, 1-пиперазинил, 4• 2 л арил-І-пиперазинил, гексагидро-1-пиридазинил, R морфолино, тетрагидро-1,4-тиазин-4-ил, 1подвергают взаимодействию с соединением оксидтетрагидро-1,4-тиазин-4-ила, 1,1общей формулы (III) диоксидтетрагидро-1,4-тиазин-4-ила, тиазолидинH2N-OZ, 3-ил, гексагидроазепино и октагидроазоцино, когде Z представляет собой водород, торые могут быть замещены как указано выше, три(низший) алкилсилил, дифенапример, 2-(метилкарбамоил)-1-пиррол ид инил, нил(низший)алкилсилил или бензил, с получением 2-(гидроксиметил)-1пиррол ид инил, 4соединения общей формулы (IV) гидроксипиперидино, 2-(метилкарбамоил) R пиперидино, 4-гидроксииминопиперидино, 4О (СН } метоксипиперидино, 4-метил-1-пиперазинил, 42 m фенил-І-пиперазинил, 1,4-диокса-8(IV) азаспиро[4 5]декан-8-ил, гексагидро-3(метилкарбамоил)-2-пиридазинил, гексагидро-1(бензилоксикарбонил) -2-пиридазинил, 5,5диметил-4-метилкарбамоилтиазолидин-З-ил и 5,53 R диметил-4-пропилкарбамоилтиазолидин-З-ил где Z обозначает атом водорода, дифеПримерами мостиковых N-гетероциклических нил(низший) алкилсилил или бензил В случае колец в радикале R2 являются 5необходимости затем может быть проведено удаазабицикло[2 1 1]гексан, 3ление любых имеющихся дифеазабицикло[3 1 1]гептан, 7нил(низший)алкилсил ильной или бензил ьной азабицикло[2 2 1]гептан, 3-азабициклогрупп и/или преобразование полученных соедине[3 2 1]октан, 2-азабицикло[3 2 2]нонан и 3ний общей формулы (І) в фармацевтически приазабицикло [3 2 2]нонан емлемые соли Примерами азотсодержащих гетероцикличеУдаление бензильной группы в соединении ских колец в радикале R являются кольца форобщей формулы (IV), где Z представляет собой бензил, как правило, проводят путем каталитического гидрирования Настоящее изобретение также относится к лекарственному препарату, обладающему ингибирующим коллагеназу действием и предназначенному для сдерживания развития или профилактики заболеваний перерождения суставов, или для лечения инвазивных опухолей, атеросклероза или рассеянного склероза, который содержит производные гидроксамовой кислоты общей формулы I и терапевтически инертный носитель Используемый в данном описании термин "низший алкил" самостоятельно или в сочетании обозначает прямую или разветвленную алкильную группу, содержащую максимально шесть атомов углерода, такую как метил, этил, н-пропил, изо•і 1 о о 13 44230 14 5 6 в которых R и R каждый представляет собой скими кислотами, такие как уксусная кислота, виводород или вместе представляют собой дополноградная кислота, янтарная кислота, фумаровая нительную связь или остаток конденсированного кислота, малеиновая кислота, малоновая кислота, бензольного кольца, салициловая кислота, лимонная кислота, метан7 сульфоновая кислота, п-толуолсульфокислота и R представляет собой водород, низший алтд кил или арил, X представляет собой -СО-, -СЬЬ-, -СН(низший Соединения общей формулы I содержат по алкил)-, -С(низший алкил)2-, -NH-, -І\І(низший алменьшей мере два асимметричных атома углерокил)- или -О-, или, если R представляет собой да и могут, следовательно, существовать как в низший алкил и X представляет собой -І\І(низший виде оптически активных энантиомеров, так и в алкил)-, низшая алкильная группа может быть виде диастереоизомеров или в виде рацематов присоединена с образованием 5-, 6- или 7Настоящее изобретение включает все эти формы членного кольца, В соответствии со способом, охватываемым 8 настоящим изобретением, соединения формулы I R представляет собой водород, низший али их фармацевтически приемлемые соли получакил или арил, 9 10 ют R и R каждый представляет собой водород или низший алкил, (а) взаимодействием кислоты общей формулы 1 1 Y представляет собой -О-, -NH- или -І\І(низший R алкил)-, о Z представляет собой S, SO или SO2 " і2 Примерами таких колец являются 2-оксо-1 (II) но пирролидинил, 2,5-диоксо-1-пирролидино, фталимидо, 1,2-диметил-3,5-диоксо-1,2,4-триазолидинССН ) 4-ил, 3-метил-2,5-диоксо-1-имидазолидинил, 3,4,4і 2 а триметил-2,5-диоксо-І—имидазолидинил, 2-метил3,5-диоксо-1,2,4-оксадиазол-4-ил, З-метил-2,4,5где R1, R2, R3, m и п имеют значения, указантриоксо-1 -имидазолидинил, 2,5-диоксо-3-фенил-1 ные выше, с соединением общей формулы имидазолидинил, 2,6-диоксопиперидино, 5,5H2N-OZ, (III) диметил-2,4-диоксо-3-оксазолидинил и гексагидгде Z представляет собой водород, ро-1,3-диоксапиразоло[1,2-а] [1,2,4]триазол-2-ил три(низший алкил) сил ил или дифенил (низший Одна группа предпочтительных соединений алкил)силил, и, если желательно, с последующим формулы I включает такие, в которых R предснятием любой дифенил (низший алкил)ставляет собой 1-пирролидинил, пиперидино, 4силильной группы, имеющейся в продукте реакарил-1 -пиперазино, морфоли-но, тетрагидро-1,4ции, либо, если Z означает бензил, осуществляют тиазин-4-ил, тетрагидро-1,4-тиазин-4-ил, 1,1(б) каталитическое гидрирование соединения диоксид, тиазолидин-3-ил, гексагидроазепино или общей формулы октагидроазоцино, необязательно замещенные по R одному или более атомам С гидрокси, низшим алкилом, низшим алкокси, кетализированной оксогруппой или моно (низший алкил)карбамоилом, прежде всего пиперидино, который необязательно замещен гидрокси, в частности 4гидроксипиперидино, или 3азабицикло[3 2 2]нонан Также предпочтительны3 ми являются соединения формулы І, в которой R где R1, R2, R3, m и п имеют значения, указанпредставляет собой группу формулы (Ь), (с), преные выше, и Bz представляет собой бензил, и, жде всего, в которой R7 представляет собой низесли желательно, переводят полученное соедиший алкил и X представляет собой -С(низший алнение формулы І в фармацевтически приемлемую кил)2-, в частности 3,4,4-триметил-2,5-диоксо-1соль имидазолидинил, или (п) Взаимодействие кислоты формулы II с соедиПредпочтительно т и п оба равны 1 нением формулы III в соответствии с вариантом Соединения формулы I образуют фармацев(а) способа можно проводить обычным методом тически приемлемые соли с основаниями, как гидНапример, кислоту формулы II можно подвергать роксиды щелочных металлов (например, гидровзаимодействию с соединением формулы III в ксид натрия и гидроксид калия), гидроксиды инертном органическом растворителе, таком как щелочноземельных металлов (например, гидродихлорметан, диметилформамид и тому подобксид кальция и гидроксид магния), гидроксид амное, с использованием 1-гидроксибензотриазола, мония и тому подобное Соединения формулы I, в присутствии конденсирующего агента, такого как которые являются основаниями, образуют фаргидрохлор и д 1-этил-3-(3-диметиламинопропил)мацевтически приемлемые соли с кислотами В карбодиимида, при температуре от примерно 0°С качестве таких солей рассматриваются не только до примерно комнатной температуры Альтернасоли с неорганическими кислотами, такие как гативно, кислота формулы II может быть преобразологенводородные кислоты (например, хлористована в соответствующий хлорангидрид (например, водородная кислота и бромистоводородная кис использованием оксалилхлорида) и хлорангидслота), серная кислота, азотная кислота, рид кислоты может затем быть подвергнут взаифосфорная кислота и т д , но и соли с органичемодействию с соединением формулы III Предпоч W I8 1 15 44230 16 тительными соединениями формулы III являются рида щелочного металла, такого как гидрид натакие, в которых Z представляет собой треттрия, с получением соединения формулы VIII Оббутилдиметилсилил или трет работка последнего сильным основанием, бутилдифенилсилил Когда используют соединенапример гидридом щелочного металла, как гидние формулы III, в котором Z представляет собой рид натрия, и взаимодействие с соединением три(низший алкил)силил, эту группу удаляют в формулы IX приводят к получению дибензилпроцессе реакции и обработки и получают сразу трет -бутил-бутантрикарбоксилата формулы X, соединение формулы I С другой стороны, когда который затем дебензилируют каталитическим используют соединение формулы III, в котором Z гидрированием, например, в присутствии паллапредставляет собой дифенил (низший алдиевого катализатора, такого как палладий на угкил)силил, эта группа остается в продукте реакции ле, с получением монотрет -бутили должна быть впоследствии удалена известным бутантрикарбоксилата формулы XI Декарбоксиспособом, например с помощью фторид-ионов лированием этого соединения, например нагреванием в толуоле с триэтиламином, которое может Каталитическое гидрирование соединения проводиться in situ, получают монотрет формулы IV в соответствии с вариантом (б) спобутилсукцинат формулы XII, который конденсирусоба можно проводить известным специалистам ют с циклическим амином формулы XIII, наприспособом, например в инертном органическом мер, согласно хлорангидридному способу или исрастворителе в присутствии катализатора из блапользуя 1-гидроксибензтриазол в присутствии городного металла Пригодными инертными оргаконденсирующего агента, такого как гидрохлорид ническими растворителями являются, например, 1-этил-3-(3-диметиламинопропил)-карбодиимид, с низшие спирты, такие как метанол, этанол и т д получением соединения формулы XIV, которое Что касается катализатора, им может быть, наподвергают обработке для снятия защитной группример, платиновый, палладиевый или родиевый пы (например, обработкой трифторуксусной кикатализатор, который может быть нанесен на маслотой), в результате чего получают кислоту фортериал пригодного носителя Палладий на угле мулы II является предпочтительным катализатором Температура и давление не являются критическими, Соединение формулы IV, которое используют хотя обычно каталитическое гидрирование провов качестве исходного продукта при осуществлении дят при комнатной температуре и при атмосферварианта (б) способа, является новым и также ном давлении входит в объем притязаний настоящего изобретения Соединения формулы I могут быть переведены в фармацевтически приемлемые соли обраСоединения формулы IV могут быть получеботкой основанием, а основные соединения форны, например, взаимодействием кислоты формумулы I могут быть переведены в лы II с 0-бензилгидроксиламином Эту реакцию фармацевтически приемлемые соли обработкой можно осуществлять известным способом, наприкислотами Такую обработку можно осуществлять мер, в инертном растворителе, таком как дихлоробычными способами метан или диметилформамид, с использованием 1-гидроксибензотриазола в присутствии конденсиКислоты формулы II, которые используются в рующего агента, такого как гидрохлорид 1-этил-Зкачестве исходных продуктов при осуществлении (З-диметиламинопропил)карбодиимида способа, являются новыми и также относятся к настоящему изобретению Остальные соединения, которые используются в качестве промежуточных продуктов при полуКислоты формулы II могут быть получены, начении соединений формулы I, являются известпример, как показано в следующей схеме реакции, ными соединениями или аналогами известных где R1, R2, R3, m и п имеют значения, указанные соединений, которые могут быть получены спосовыше, Bz представляет собой бензил и tBu предбами, аналогичными для получения известных ставляет собой трет-бутил (см схему в конце соединений описания) Что касается приведенной реакционной схеКак отмечалось ранее, соединения формулы I мы, каждая ее стадия может быть осуществлена в и их фармацевтически приемлемые соли являютсоответствии с методами, известными специалися ингибиторами коллагеназы Ингибирующая стам Так, на первой стадии аминокислоту формуколлагеназу активность in vitro настоящих соедилы V, которая может быть получена в соответстнений и солей может быть продемонстрирована с вии со способом, описанным Chenault H R, использованием коллагеназы, полученной из Dahmer G M , J Am Chem Soc 1989, 111, 6354 культуры человеческих синовиальных фибропла6364, подвергают преобразованию путем обрастов по методу Dayer J-M et al , Proc Natl Acad ботки нитритом натрия в присутствии концентриSci USA (1976), 73 945, с последующей активарованной серной кислоты в гидроксикислоту форцией проколлагеназы в кондиционированной сремулы VI, которую затем подвергают де путем обработки трипсином Активность коллавзаимодействию с бензилбромидом в присутствии геназы измеряют с использованием Сорганического основания, например триалкиламиацетилированного коллагена I типа из хвостовых на, такого как триэтиламин, с получением соотсухожилий крыс в качестве субстрата и используя ветствующего бензилового эфира формулы VII метод микротитрования проб на планшете JohnПоследний затем активируют, например, реакцией son-Wmt, В, Anal Biochem (1980), 104, 175 IC50 с ангидридом трифторметансульфоновой кислоты означает такую концентрацию соединения или и обрабатывают бензил-трет-бутил-малонатом в соли настоящего изобретения при использовании присутствии сильного основания, например гидфермента, которая уменьшает расщепление ве 18 17 44230 щества и растворение на 50% по сравнению с Как отмечалось ранее, соединение формулы I результатом, достигаемым только при использоили его фармацевтически приемлемые соли могут вании одного фермента применяться для сдерживания развития или профилактики заболеваний, прежде всего для сдерРезультаты, полученные по вышеописанному живания развития и профилактики заболеваний, исследованию для представленных соединений и связанных с перерождением суставов, или при солей данного изобретения, приведены ниже лечении инвазивных опухолей, атеросклероза или Продукт из примера N ICso (нМ) рассеянного склероза Дозировка может изме2 18,0 няться в широких пределах и, естественно, уста4 7,0 навливается с учетом индивидуальных требова5 2,5 ний в каждом конкретном случае Обычно при 7 6,5 назначении взрослым пригодной является суточ9 8,5 ная доза от примерно 5 мг до примерно 30 мг, 16 4,1 предпочтительно от примерно 10 мг до примерно 17 2,35 15 мг, хотя верхний предел может быть повышен, 23 34,0 если это целесообразно Суточная доза может Соединения формулы I и их фармацевтически быть введена в виде одной дозировки или отприемлемые соли могут быть использованы как дельными дозами лекарства, например, в виде фармацевтических препаратов Фармацевтические препараты могут Следующие примеры иллюстрируют настоябыть назначены орально, например, в виде таблещее изобретение более детально В этих приметок, покрытых таблеток, драже, твердых и мягких рах все температуры указаны в градусах Цельсия желатиновых капсул, растворов, эмульсий или Пример 1, суспензий Однако они также могут быть назначеРаствор 0,575г 1-[2(R)-[1(R или S)ны ректально, например, в виде суппозиториев (бензилоксикарбамоил)-2-(3,4,4-триметил-2,5или парентерально, например, в виде инъекциондиоксо-1-имидазолидинил)этил]-3ных растворов циклопропилпропионил]пиперидина (диастереоизомер 1) в 10мл этанола гидрируют в присутствии Лекарственные препараты, приготовленные из 0,4г катализатора 5% палладия на угле в течение соединений формулы I и их фармацевтически 6 часов Катализатор удаляют фильтрацией и приемлемых солей, могут содержать терапевтираствор упаривают Остаток очищают флэшчески инертные, неорганические или органические хроматографией на силикагеле, используя диносители Примером таких носителей для таблехлорметан/метанол (96 4) для элюирования с поток, покрытых таблеток, драже и твердых желатилучением 0,37г 1-[3-циклопропил-2(Р)-[1(Р или S)новых капсул могут быть лактоза, кукурузный (гидроксикарбамоил)-2-(3,4,4-триметил-2,5крахмал или его производные, тальк, стеариновая диоксо-1кислота или ее соли Пригодными носителями для мягких желатиновых капсул являются, например, имидазолидинил)этил]пропионил]пиперидина растительные масла, воски, жиры, полутвердые и (диастереоизомер 1) в виде белой пены жидкие полиолы и тому подобное В случае мягких ЯМР (MeOD) 3,78 - 3,64 (m, ЗН), 3,62 (dd, 1H, желатиновых капсул обычно не требуется носитеJ = 15,8), 3,49 - 3,41 (m, 1H), 3,39 (dd, IH, J = 15,5), лей благодаря природе активного ингредиента 3,33 - 3,27 (m, 1H), 2,95 - 2,87 (m, 1H), 2,83 (s, 3H), Пригодными носителями для приготовления рас1,74 - 1,46 (m, 7H), 1,33 (s, 3H), 1,31 (s, 3H), 1,20 творов и сиропов являются, например, вода, по1,13 (m, 1H), 0,61 -0,50(171, 1H), 0,44 - 0,33 (m, 2H), лиолы, сахароза, инертный сахар, глюкоза и тому 0,06 - 0,05 (m, 2H), MC 409 (M+H)+ подобное Пригодными носителями для приготовИсходный продукт получают следующим обления инъекционных растворов являются, наприразом мер, вода, спирты, полиолы, глицерин, раститель(і) Раствор 4,9г 2(Р-амино-3-циклопроные масла и тому подобное Природные и пилпропионовой кислоты (полученной способом отвержденные масла, воски, жиры, полутвердые аналогично описанному Chenault Н R , Dahmer J и полиолы и тому подобное являются пригодными Whitesides G М в J Am Chem Soc 1989,111,6354носителями для приготовления суппозиториев 6364) в 50мл воды, содержащей 4,05мл концентрированной серной кислоты, нагревают до 45° В Фармацевтические препараты могут также сотечение более 30 минут прибавляют по каплям держать консерванты, стабилизаторы, увлажняюраствор 10,5г нитрита натрия в 20мл воды Расщие агенты, эмульсии, подслащивающие вещесттвор перемешивают при 45° в течение 4 часов и ва, красители, ароматизирующие агенты, соли для затем охлаждают до комнатной температуры регулирования осмотического давления буфера, Раствор экстрагируют тремя порциями этилацетаагенты для покрытия или антиоксиданты та по 50мл Объединенные экстракты промывают Лекарственные препараты, содержащие соводой и сушат над безводным сульфатом магния единение формулы I или его фармацевтически Растворитель упаривают до остатка 3,95г желтого приемлемую соль и терапевтически приемлемый масла, содержащего 3-циклопропил-2(Рноситель, а также способ приготовления таких препаратов также являются предметами настоягидроксипропионовую кислоту, которую использущего изобретения Этот способ заключается в ют в следующей стадии без дополнительной очисмешивании соединения формулы I или его фарстки Р^дихлорметан/метанол (9 1)] = 0,65 мацевтически приемлемой соли с терапевтически (м) Раствор 3,95г продукта стадии (і) в 50мл инертным материалом носителя с включением этилацетата обрабатывают 5,32мл триэтиламина смеси в галеновую вводимую форму и 3,8мл бензилбромида Смесь перемешивают и 19 44230 20 нагревают с обратным холодильником в течение 3 растворитель упаривают Остаток очищают флэшчасов, затем дают остыть до комнатной темперахроматографией на силикагеле, используя гектуры в течение ночи Суспензию промывают 2М сан/эти л ацетат (7 3) и затем гексан/эти л ацетат соляной кислотой, водой и насыщенным водным (6 4) для элюирования, с получением 6,4г 2,3раствором хлорида натрия После высушивания дибензил-3-трет -бутил-1-циклопропил-4(3,4,4над безводным сульфатом магния растворитель триметил-2,5-диоксо-1-имидазолидинил)упаривают Остаток очищают флэш2(R),3(R,S),3-6yraHTpHKap6oKCHnaTa в виде смеси диастереомеров 1 1 в виде прозрачного масла хроматографией на силикагеле, используя гексан/эти л ацетат (2 1) для элюирования, с получеЯМР (CDC13) 7,47 - 7,28 (m, 20H), 5,31 - 5,03 нием 3,36г бензил-З-циклопропил-2 (R)(m, 8H), 4,32-4,18 (m, 4H), 3,19 - 3,15 (m, 1H), 3,16 гидроксипропионата в виде желтого масла - 3,12 (m, 1H), 2,86 (s, 6H), 2,00 - 1,90 (m, 1H), 1,89 - 1,79 (m, 1H), 1,64 - 1,49 (m, 1H), 1,48 - 1,38 (m, ЯМР (CDC13) 7,39 - 7,28 (m, 5H), 5,19 (d, 1H, J 1H), 1,37 (s, 12Н), 1,36 (s, 9H), 1,32 (s, 9H), 0,9-0,8 = 14), 5,15 (d, 1H, J = 14), 4,31 - 4,24 (m, 1H), 2,81 (m, 2H), 0,41 - 0,3 (m, 4H), 0,15 - 0,05 (m, 2H), 0,04 (шир d, 1Н), 1,69 -1,54 (m, 2Н), 0,87 - 0,74 (m, 1Н), 0,04 (m, 2H) 0,45 - 0,34 (m, 2H), 0,08 - 0,07 (m, 2H) (їм) Раствор 3,36г продукта стадии (іі) и 1,49мл (vi) Раствор 3,0г продукта стадии (v) в 30мл 2пиридина в 10мл дихлорметана прибавляют по пропанола гидрируют в присутствии 0,Зг 5% палкаплям к раствору 3,07мл ангидрида трифтормеладия на угле в течение 2 часов Катализатор тансульфоновой кислоты в 15мл дихлорметана удаляют фильтрацией и раствор упаривают Оспри 0° в течение 30 минут при перемешивании таток вновь упаривают из 20мл толуола и затем Смесь перемешивают при 0° в течение 2 часов и растворяют в 50мл толуола Раствор обрабатызатем промывают водой и насыщенным водным вают 0,693мл триэтиламина и смесь нагревают с раствором хлорида натрия После высушивания обратным холодильником в течение 2 часов Раснад безводным сульфатом магния растворитель твор охлаждают до комнатной температуры и упаривают с получением 5,37г бензил-3промывают 2М соляной кислотой, водой и насыциклопропил-2(Рщенным водным раствором хлорида натрия После высушивания над безводным сульфатом магтрифторметилсульфонилоксипропионата в виде ния растворитель упаривают с получением 1,85г оранжевого масла, используемого на следующей моно-4-трет -бутиловый эфир-2^стадии без дополнительной очистки Rf [гексан/эти л ацетат (4 1)] = 0,5 (циклопропилметил)-З^ или 3)-[(3,4,4-триметил(iv) Раствор 3,8г бензил-трет -бутилмалоната в 2,5-диоксо-1-имидазолидинил)метил]сукциновой 50мл 1,2-диметоксиэтана обрабатывают 0,504г кислоты в виде смеси диастереоизомеров при80% дисперсией гидрида натрия в минеральном близительно 6 1 в виде желтого масла масле Смесь перемешивают при комнатной темМС 383 (М+Н)+, пературе в течение 30 минут и затем охлаждают Rf [дихлорметан/метанол (9 1)] = 0,41 до 0° Раствор 5,37г продукта стадии (іи) в 20мл (VII) Раствор 1,0г продукта стадии (vi) в 10мл дихлорметана прибавляют по каплям при 0° дихлорметана охлаждают до 0° и обрабатывают Смесь перемешивают при 0° в течение 2 часов и последовательно 0,665мл N-этилморфолина, затем оставляют нагреваться до комнатной тем0,481г 1-гидробензотриазола и 0,602г гидрохлорипературы в течение ночи Растворитель упаривада 1-этил-3-(3ют и остаток растворяют в етилацетате Раствор диметиламинопропил)карбодиимида Смесь пепромывают водой и насыщенным водным растворемешивают при 0° в течение 30 минут и затем ром хлорида натрия После высушивания над обрабатывают 0,517мл пиперидина Раствор осбезводным сульфатом магния растворитель упатавляют нагреваться до комнатной температуры и ривают с получением 6,54г 2,3-дибензил 3перемешивают в течение ночи Раствор промытрет бутил-1-циклопропил-2^), 3(R,S), 3вают 5% водным раствором гидрокарбоната напропантри карбоксилата в виде смеси диастереотрия, 2 М соляной кислотой и насыщенным водмеров 1 1 в виде оранжевого масла ным раствором хлорида натрия После высушивания над безводным сульфатом магния ЯМР (CDCI3) 7,46 - 7,36 (m, 20H), 5,19 - 5,07 растворитель упаривают с получением 1,01 г 1(m, 8H), 3,89 (d, 1H, J = 10), 3,85 (d, 1H, J = 10), [2(R)-[1(R или 3)-(трет-бутоксикарбонил)-2- (3,4,43,37 - 3,26 (m, 2H), 1,68 - 1,52 (m, 2H), 1,52 - 1,38 триметил-2,5-диоксо-1-имидазолидинил)этил1-3(m, 2H), 1,41 (s, 9H), 1 39 (s, 9H), 0,79 - 0,63 (m, циклопропилпропионил]пиперидина в виде смеси 2H), 0,49 - 0,38 (m, 4H), 0,12 - 0,07 (m, 4H) диастереоизомеров приблизительно 6 1 в виде (v) Раствор 6,4г продукта стадии (iv) в 30мл желтой смолы МС 450(М+Н) + , 1,2-диметоксиэтана обрабатывают 0,446г 80% дисперсии гидрида натрия в минеральном масле Rf [дихлорметан/метанол (95 5)] = 0,51 Смесь перемешивают при комнатной температуре (VIM) Раствор 1,0г продукта стадии (vn) в 2мл в течение 30 минут Раствор 3,84г 1-(бромметил)трифторуксусной кислоты перемешивают при 3,4,4-триметил-2,5-имидазолидиндиона в 20мл комнатной температуре в течение 2,5 часов Рас1,2-диметоксиэтана прибавляют по каплям в течетворитель упаривают и остаток вновь выпаривают ние более 15 минут Смесь перемешивают при из толуола Остаток растворяют в диэтиловом комнатной температуре в течение 36 часов, расэфире и раствор экстрагируют двумя порциями творитель упаривают и остаток растворяют в ети5% водного раствора гидрокарбоната натрия лацетате и промывают водой и насыщенным водОбъединенные экстракты подкисляют до рН 2 ным раствором хлорида натрия После концентрированной соляной кислотой и продукт высушивания над безводным сульфатом магния экстрагируют двумя порциями дихлорметана 22 21 44230 Объединенные органические экстракты промыва(бензилоксикарбамоил)-2-(3,4,4-триметил-2,5ют водой и насыщенным водным раствором хлодиоксо-1 -имидазолидинил)этил]-3-циклопропил]рида натрия и сушат над безводным сульфатом 3-азабицикло [3 2 2]нонана(диастереоизомер 1), магния Растворитель упаривают с получением полученного по способу, аналогично описанному в 0,634г белой пены, содержащей 1-[2(R)-[1(R или примере 1(I)-(IX), получают 0,496г 3-[33)-карбокси-2-(3,4,4-триметил-2,5-диоксо-1циклoпpoпил-2-(R)-(1 (R или S)имидазолидинил)этил]-3(гидроксикарбамоил)-2-(3,4,4-триметил-2,5циклопропилпропионил]пиперидин в виде смеси диоксо-1-имидазолидинил)этил]пропионил]-3диастереоизомеров 6 1, которую используют на азабицикло[3 2 2]нонана(диастереоизомер 1) в следующей стадии без дополнительной очистки виде белой пены Rf [дихлорметан/ метанол (9 1)] = 0,31 ЯМР (MeOD) 4,03 - 3,1 (m 5H), 3,48 - 3,31 (m, (їх) Раствор 0,634г продукта стадии (VIM) в 2Н), 2,96 - 2,86 (m, 1H), 2,82 (s, ЗН), 2,14 - 2,03 (m, 10мл дихлорметана охлаждают до 0° Раствор 2Н), 1,80 - 1,68 (m, 4H), 1,68 - 1,53 (m, 5H), 1,32 (s, обрабатывают последовательно 0,41мл NЗН), 1,31 (s, ЗН), 1,21 - 1,12 (m, 1H), 0,64 - 0,52 (m, этилморфолина, 0,296г 1-гидробензотриазола и 1Н), 0,45 - 0,33 (m, 2H), 0,08 - 0,05 (m, 2H) + 0,371 г гидрохлорида 1 -этил-3-(3MC 449 (М+Н) Пример 4 диметиламинопропил)карбодиимида Смесь перемешивают при 0° в течение 30 минут ДобавляСпособом, подобно описанному в первом абют раствор 0,238г О-бензилгидроксиламина в 2мл заце примера 1, из 0,6г 1-[2(R)-[1(R или S) - (бендихлорметана Смесь оставляют нагреваться до зилоксикарбамоил)-2-(3,4,4-триметил-2,5-диоксокомнатной температуры и перемешивают в тече1-имидазолидинил)этил]-3ние ночи Раствор промывают двумя порциями 5% циклобутилпропиоводного раствора гидрокарбоната натрия и посленил]пиперидина(диастереоизомер1), полученного довательно 2 М соляной кислотой, водой и насыпо способу, аналогично описанному в примере l(i)щенным водным раствором хлорида натрия По(ix), получают 0,5г 1-[3-циклoбyтил-2-(R)-[1(R или сле высушивания над безводным сульфатом 3)-(гидроксикарбамоил)-2-(3,4,4-триметил-2,5магния растворитель упаривают Остаток очищадиоксо-1ют флэш-хроматографией на силикагеле с исимидазолидинил)этил]пропионил]пиперидина пользованием дихлорметана/метанола (98 2) для (диастереоизомер 1) в виде белой пены элюирования с получением 0,592г 1-[2(R)-[1(R или ЯМР (MeOD) 3,67 (dd, IH, J=15,10), 3)-(бензилоксикарбамоил)-2-(3,4,4-три-метил-2,53,64 - 3,46 (m, 4H), 3,34 (dd, 1H,J= 15,8), диоксо-1-имидазолидинил)этил]-33,12 (td, 1H, J = 13,3), 2,92-2,84 (m, 1H), циклопропилпропионил]пиперидина (диастереои2,82 (s, 3H), 2,22 - 2,09 (m, 1H), 2,07 - 1,93 (m, зомер 1) в виде белой пены 2H), 1,90-1,42 (m, 12H), 1,33 (s, 3H), 1,32 (s, 3H) ЯМР (MeOD) 7,45 - 7,31 (m, 5H), 4,87 (d, 1H, J MC 423 (M+H)+ = 13), 4,79 (d, 1H, J = 13), 3,78 - 3,65 (m, ЗН), 3,63 Пример 5 (dd, 1H J = 15,8), 3,53 - 3,45 (m, 1H), 3,44 (dd, 1H, J = 15,5), 3,34 - 3,27 (m, 1H), 2,87 (s, ЗН), 2,84 - 2,78 Способом, подобно описанному в первом аб(m, 1H), 1,78 -1,49 (m, 7H), 1,49 - 1,40 (m, 1H), 1,36 заце примера 1, из 0,4г 1-[2(R)-[1(R или S)(s, ЗН), 1,32 (s, ЗН), 1,12 - 1,04 (m, 1H), 0,61 - 0,50 (бензилоксикарбамоил)-2-(3,4,4-триметил-2,5(m, 1H), 0,48 - 0,37 (m, 2H), 0,07 - 0,06 (m, 2H) диоксо-1-имидазолидинил)этил]-3циклобутилпропионил]-4-пиперидинола (диастеMC 499 (М+Н)+ реоизомер 1), полученного по способу, аналогично Пример 2 описанному в примере 1(I)-(IX), получают 0,294г 1Способом, подобно описанному в первом аб[3-4nmo6yTHn-2-(R-[1(R или 3)заце примера 1, из 0,391г I-[2(R)-(I(R или S)(бензилоксикарбамоил)-2-(3,4,4-триметил-2,5(гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1 -имидазолидинил)этил]-3диоксо-1 -имидазолидинил) этил]пропионил 1-4пиперидинола в виде белой пены циклопропилпропионил]-4ЯМР (MeOD) 4,15-4,05 (m, 1H), 4,04-3,90 пиперидинола(диастереоизомер1), полученного (m, 1Н), 3,90 - 3,80 (m, 1Н), 3,72 - 3,57 (m, по способу, аналогично описанному в примере l(i)1Н), 3,45 - 3,30 (m, 2H), 3,18-3,06 (m, 2H), (ix), получают 0,33г 1-[3-4Hmonponnn-2-(R)-[1(R 2,94 - 2,85 (m, 1Н), 2,84 (d, ЗН, J = 5), или 3)-(гидроксикарбамоил)-2-(3,4,4-триметил-2,52,21 - 1,36 (m, 13H), 1,33 (d, ЗН, J = 3), 1,31 (d, диоксо-1-имидазолидинил)этил]пропионил]-4ЗН, 1 = 6 ) MC 439 (M+H)1 пиперидинола (диастереоизомер 1) в виде белой Пример 6 пены Способом, подобно описанному в первом абЯМР (MeOD) 4,22 - 4,02 (m, 2H), 3,90 - 3,81 заце примера 1, из 0,642г 3-[2(R)-[1(R или S)(m, 1Н), 3,69 - 3,56 (m, 1Н), 3,49 - 3,38 (m, 2H), 3,37 (бензилоксикарбамоил)-2-(3,4,4-триметил-2,5- 3,18 (m, 2H), 3,11 - 3,01 (m, 1H), 2,97 - 2,86 (m, диоксо-1-имидазолидинил)этил]-3-циклобутил]-31Н), 2,83 (d, ЗН, J = 5), 2,01 - 1,78 (m, 2H), 1,68 азабицикло[3 2 2]нонана (диастереоизомер 1), 1,36 (m, ЗН), 1,33 (s, ЗН), 1,31 (d, ЗН, J = 5), 1,24 полученного по способу, аналогично описанному в 1,13 (m, 1H), 0,62-0,50 (m 1H), 0,49 - 0,33 (m, 2H), примере l(i)-(ix), получают 0,348г 3-[3-циклобутил0,09 - 0,05 (m, 2H), 2(R)-[1 (R или 3)-(гидроксикарбамоил)-2-(3,4,4MC 425 (M+H)+ триметил-2,5-диоксо-1Пример 3 имидазолидинил)этил]пропионил]-3-азабицикло Способом, подобно описанному в первом аб[3 2 2 ]нонана (диастереоизомер 1) в виде белой заце примера 1, из 0,822г 3-[2(R)-[1(R или S) 23 44230 24 пены ЯМР (MeOD) 3,92 - 3,83 (m, 2H), 3,76 (dd, рования с получением 0,123г 1-[3-циклопентил1Н, J = 15,13), 3,67 - 3,57 (m, 2H), 3,34 (dd, 1H, J = 2(R)-[1 (R или 3)-(гидроксикарбамоил)-2-(3,4,415,5), 3,28 - 3,21 (m, 1H), 2,96 - 2,87 (m, 1H), 2,83 триметил-2,5-диоксо-1(s, 3H), 2,23 - 2,13 (m, 1H), 2,12 - 1,92 (m, 4H), 1,91 имидазолидинил)этил]пропионил]пиперидина -1,48 (m, 14H), 1,35 (s, 3H), 1,34 (s, 3H) (диастереоизомер 1) в виде белой пены MC 463 (M+H)+ ЯМР (MeOD) 3,74 - 3,66 (m, ЗН), 3,53 - 3,45 (m, 2Н), 3,34 (dd, J = 14,7, 1Н), 3,23 (dt, J = 4,14, Пример 7 1H), 2,90 - 2,84 (m, 4H), 1,80 - 1,45 (m, 14Н), 1,38 Способом, подобно описанному в первом аб1,23 (m, 7H), 1,15-1,01 (m, 2H) заце примера 1, из 0,5г 1-[2(R)-[1(R или S) - (бензилоксикарбамоил)-2-(3,4,4-триметил-2,5-диоксо-1 MC 437 (M+H)+ -имидазолидинил)этил]-3-циклопентилпропионил]Пример 10 4-пиперидинола (диастереоизомер 1), полученноСпособом, подобно описанному в первом абго по способу, аналогично описанному в примере заце примера 1, исходя из 0,328г 1-(2(R)-[1(R или l(i)-(ix), получают 0,4г 1-[3-циклопентил-2(Р)-[1(Р S) - (бензилоксикарбамоил)-2-(3,4,4-триметил-2,5или S)- (гидроксикарбамоил)-2-(3,4,4-триметилдиоксо-1 -имидазолидинил)этил]-32,5-диоксо-1 -имидазолидинил)этил]пропионил]-4циклогексилпропионил]-пиперидина (диастереоипиперидинола (диастереоизомер 1) в виде белой зомер 1), полученного по способу, аналогично пены описанному в примере l(i)-(ix), получают 0,269г 1[3-циклогексил-2^)-[І^ или S)ЯМР (MeOD) 4,20 - 4,02 (m, 2H), 3,91 - 3,83 (m, 1Н), 3,76 - 3,64 (m, 1Н), 3,48 - 3,32 (m, 2H), 3,26 (гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1- 3,08 (m ЗН), 2,05 - 1,42 (m, 12H), 1,38 - 1,25 (m, 7H), 1,18-1,01 (m, ЗН) имидазолидинил)этил]пропионил]пиперидина (диастереоизомер 1) в виде белой пены MC 453 (M+H)+ Пример 8 ЯМР (MeOD) 3,87 - 3,77 (m, 2H), 3,7 (dd, J = 14,9, 1Н), 3,64 - 3,56 (m, 2H), 3,38 - 3,28 (m, 2H), Способом, подобно описанному в первом аб2,9 - 2,83 (m, 4H), 1,84 - 1,45 (m, 12H), 1,35 (s, ЗН), заце примера 1, из 0,57г 3-[2(R)-[1 (R или S) - (бен1,33 (s, ЗН), 1,25 -1,05 (m, 5H), 0,98 - 0,78 (m, 2H) зилоксикарбамоил)-2-(3,4,4-триметил-2,5-диоксо-1 -имидазолидинил)этил]-3-циклопентил]-3MC 451 (М+Н)+ азабицикло [3 2 2 ]нонана (диастереоизомер 1), Пример 11 полученного по способу, аналогично описанному в Способом, подобно описанному в примере 9, примере l(i)-(ix), получают 0,48г 3-[3-циклопентилисходя из 0,8г 1-[2(R)-[1(R или 3)-карбокси-22(R)-[1(R или S)- (гидроксикарбамоил)-2-(3,4,4(3,4,4-триметил-2,5-диоксо-1триметил-2,5-диоксо-1имидазолидинил)этил]-3-циклопентилпропионил]тетрагидро-1,4-тиазина (диастереоизомер 1), поимидазолидинил)этил]пропионил]-3-азабицикло лученного по способу, аналогично описанному в [3 2 2]нонана (диастереоизомер 1) в виде белой примере 1(I)-(VIII), получают 0,Зг 4-[3-циклопентилпены 2(R-[1(R или 3)-(гидроксикарбамоил)-2- (3,4,4ЯМР (MeOD) 3,88 - 3,67 (m, 5H), 3,39 - 3,31 триметил-2,5-диоксо-1(m, 2H), 2,92 - 2,85 (m, 4H), 2,15 - 2,06 (m, 2H), 1,83 - 1,45 (m, 16H), 1,36 - 1,28 (m, 7H), 1,16 - 1,02 (m, имидазолидинил)этил]пропионил]-тетрагидро-1,42H) тиазина (диастереоизомер 1) в виде белой пены MC 477(M+H)+ ЯМР (MeOD) 4,02 - 3,96 (m, 2H), 3,92 - 3,85 (m, 2Н), 3,7 (dd, J = 13,9, 1Н), 3,37 (dd, J = 13,6, Пример 9 1H), 3,25 - 3,18 (m, 1H), 2,9 - 2,84 (m, 4H), 2,82 Раствор 0,421г смеси примерно 6 1 диасте2,75 (m, 1H), 2,7 - 2,55 (m, ЗН), 1,78 - 1,45 (m, 8H), реоизомера 1 и диастереоизомера 2 1-[2(R)-[1(R 1,35 (s, ЗН), 1,34 (s, ЗН) 1,18 -1,04 (m, 2H) или 3)-карбокси-2-(3,4,4-триметил-2,5-диоксо-1имидазолидинил)этил]-3MC 455(M+H)+ циклопентилпропионил]пиперидина, полученной Пример 12 по способу, аналогично описанному в примере l(i) Способом, подобно описанному в примере 1, исходя из 0,Зг 5,8-диоксида 4-[2(R)-[1(R или S) - (VIM), В 10МЛ дихлорметана охлаждают до 0° (бензилоксикарбамоил)-2-(3,4,4-триметил-2,5Раствор обрабатывают 0,211 г 1диоксо-1 -имидазолидинил)этил]-3гидроксибензотриазола, 0,24г гидрохлорида 1 этил-3-(3-диметиламинопропил)карбодиимида и циклопентилпропионил]-тетрагидро-1,4-тиазина 0,22мл N-метилморфолина Смесь перемешивают (диастереоизомер 1), полученного по способу, при 0° в течение 15 минут Прибавляют раствор аналогично описанному в примере 1(I)-(IX), полу0,295г О-(трет -бутилдиметилсилил)чают 0,2г S.S-диоксида 4-[3-циклoпeнтил-2(R)-[1(R гидроксиламина и 0,22мл N-метилморфолина в или 3)-(гидроксикарбамоил)-2-(3,4,4-триметил-2,55мл дихлорметана Смесь оставляют нагреваться диоксо-1-имидазолидинил)этил]пропионил]до комнатной температуры и перемешивают в тетрагидро-1,4-тиазина (диастереоизомер 1) в течение ночи Раствор промывают двумя порциявиде белого твердого вещества ми 5% водного раствора гидрокарбоната натрия и ЯМР (MeOD) 4,45 - 4,3 (m, 2H), 4,0 - 3,93 (m, последовательно 2 М соляной кислотой и насы1Н), 3,78 - 3,65 (m, 2H), 3,55 - 3,39 (m, 2H), щенным водным раствором хлорида натрия По3,30 - 3,21 (m, 2H), 3,14 - 3,03 (m, 2H), сле высушивания над безводным сульфатом маг2,9 - 2,85 (m, 4H), 1,78 - 1,45 (m, 9H), 1,36 (s, ния растворитель упаривают Остаток очищают ЗН), 1,34 (s, ЗН), 1,18-1,0 (m, 2H) флэш-хроматографией на силикагеле с использоMC 487 (М+Н)+ ванием дихлорметана/метанола (96 4) для элюиПример 13 25 44230 26 Способом, подобно описанному в примере 9, диоксо-1исходя из 0,8г 1-[2(R)-[1(R или 3)-карбокси-2имидазолидинил)этил]пропионил]морфолина (3,4,4-триметил-2,5-диоксо-1(диастереоизомер 1) в виде белого твердого веимидазолидинил)этил]-3-циклобутилпропионил]щества тетрагидро-1,4-тиазина (диастереоизомер 1), поЯМР (MeOD) 3,83 - 3,56 (m, 9H), 3,41 (dd, J = лученного по способу.аналогично описанному в 14.6, 1Н), 3,19 (dt, J = 4,ll, 1H), 2,91 - 2,81 (m, 4H), примере 1(I)-(VIII), получают 0,24г 4-[3-циклобутил1,77 - 1,42 (m, 8H), 1,38 - 1,23 (m, 7H), 1,19 - 0,99 2(R-[1(R или 3)-(гидроксикарбамоил)-2- (3,4,4(m, 2H) триметил-2,5-диоксо-1MC 439 (M+H)+ имидазолидинил)этил]пропионил]тетрагидро-1,4Пример 17 тиазина (диастереоизомер 1) в виде белого тверСпособом, подобно описанному в примере 9, дого вещества исходя из 1,289г смеси диастереоизомеров 3[2(R)-[1(RS)-Kap6oKCH-2-(3,4,4-TpHMe™>2,5ЯМР (MeOD) 3,98 - 3,75 (m, 4H), 3,64 (dd, J = диоксо-1-имидазолидинил) этил]-313,8, 1Н), 3,35 (dd, J = 15,6, 1H), 3,07 (td, J = 10,4, 1H), 2,9 - 2,83 (m, 1H), 2,82 (s, 3H), 2,78 - 2,72 (m, циклопентилпропионил]-І\І,5,5-триметил-4^)1H), 2,66 - 2,52 (m, 3H), 2,18 - 2,08 (m, 1H), 2,05 тиазолидинкарбоксамида (диастереоизомер 1), 1,93 (m, 2H), 1,85 - 1,45 (m, 6H), 1,13 (s, 3H), 1,11 полученный по способу, аналогично описанному в (s, 3H) примере 1(I)-(VIII), получают 0,629г 3-[3циклопентил-2^)-[1 (R или S)MC 441 (M+H)+ Пример 14 (гидроксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]пропионил]-1\1,5,5Способом, подобно описанному в примере 9, триметил-4^)-тиазолидинкарбоксамида (диастеисходя из 1,22г 1-[2(R)-[1(R или 3)-карбокси-2реоизомер 1) в виде белого твердого вещества (3,4,4-триметил-2,5-диоксо-1имидазолидинил)этил]-3-циклогексилпропионил]ЯМР (MeOD) 4,09 - 4,51 (m, 2H), 4,47 и 4,43 тетрагидро-1,4-тиазина (диастереоизомер 1), по(оба s, общий 1Н), 3,82 и 3,62 (оба dd, J = 14,10, лученного по способу, аналогично описанному в общий 1Н), 3,37 и 3,17 (оба dd, J = 14,5, общий примере I(I)-(VIII), получают 0,45г 4-[3-циклогексил1Н), 3,13 - 2,70 (m, 8H), 1,96 - 1,25 ( т , 21Н), 1,23 2(R)-[1 (R или 3)-(гидроксикарбамоил)-2-(3,4,40,99 ( т , 2Н) триметил-2,5-диоксо-1МС 526 (М+Н)+ имидазолидинил)этил]пропионил]тетрагидро-1,4Пример 18 тиазина (диастереоизомер 1) в виде белого тверСпособом, подобно описанному в первом абдого вещества ЯМР (MeOD) 4,12 - 4,03 (m, 2H), заце примера 1, из 0,289г 1-[2(R)-[1(R или S) 3,95 - 3,88 (m, 1Н), 3,75 - 3,65 (m, 2H), 3,38 (dd, J = (бензилоксикарбамоил)-2-(3,4,4-триметил-2, 514,6, 1Н), 2,88 - 2,82 (m, 4H), 2,78 - 2,72 (m, 1H), диоксо-1-имидазолидинил)этил]-32,68 - 2,55 (m, ЗН), 1,82 - 1,53 (m, 7Н), 1,35 (s, ЗН), циклобутилпропионил]-4-фенилпиперазина (диа1,34 (s, ЗН), 1,26-0,8 (m, 8H) стереоизомер 1), полученного по способу, аналогично описанному в примере 1(I)-(IX), получают MC 469 (М+Н)+ 0,121г 1-[3-циклобутил-2^)-(1^ или S)Пример 15 [(гидроксикарбамоил)метил]-2-(3,4,4-триметил-2,5Способом, подобно описанному в примере 9, диоксо-1-имидазолидинил)этил]пропионил]-4исходя из 1,164г смеси диастереоизомеров 3фенилпиперазина (диастереоизомер 1) в виде [2(R)-[1(RS)-Kap6oKCH-2-(3,4,4-TpHMe™>2,5белого твердого вещества диоксо-1-имидазолидинил)этил]-3циклопентилпропионил]-5,5-диметил-1-пропил-4 ЯМР (MeOD) 7,25 (m, 2H), 7,00 (m, 2H), ^)-тиазолидинкарбоксамида, полученного по спо6,85 (m, 1H), 3,94 - 3,73 (m, 4H), 3,66 (dd, J = собу, аналогично описанному в примере 1(I)-(VIII), 14.7, 1Н), 3,43 (dd, J = 14,6, 1H), 3,23 - 3,09 (m, 4H), получают 0,329г 3-[3-циклопентил-2^-[1^ или S)2,96 - 2,84 (m, 1H), 2,84 (s, ЗН), (гидроксикарбамоил)-2-(3,4,4-триметил-2,52,27-2,13 (m, 1H), 2,09 -1,95 (m, 2H), диоксо-1-имидазолидинил)этил]пропионил]-5,51,90 -1,48 (m, 6H), 1,35 (s, ЗН), 1,34 (s,3H) диметил-І\І-пропил-4^)-тиазолидинкарбоксамида MC 499 (M)+ (диастереоизомер 1) в виде белого твердого веПример 19 щества Способом, подобно описанному в первом абЯМР (MeOD) 5,09 - 4,72 (m, 2H), 4,51 и 4,46 заце примера 1, из 0,455г 4-[2(R)-(1(R или S) (оба s, общий 1Н), 3,84 и 3,64 (оба dd, J = 14,8, (бензилоксикарбамоил)-2-(3,4,4-триметил-2,51Н), 3,40 - 3,05 (m, 4H), 2,90 - 2,73 (m, 4H), 1,94 диоксо-1-имидазолидинил)этил]-31,25 (m, 23H), 1,23 - 1,01 (m, 2H), 0,99 - 0,85 (m, циклобутилпропионил]морфолина (диастереоизоЗН) мер 1), полученного по способу, аналогично описанному в примере 1(I)-(IX), получают 0,194г 4-[3MC 554 (M+H)+ циклобутил-2^)-[1^ или З)-(гидроксикарбамоил)Пример 16 2-(3,4,4-триметил-2,5-диоксо-1Способом, подобно описанному в первом абимидазолидинил)этил]пропионил]морфолина заце примера 1, из 0,223г 4-[2(R)-(1(R или S)(диастереоизомер 1) в виде белого твердого векарбокси-2-(3,4,4-триметил-2,5-диоксо-1щества имидазолидинил)этил]-3-циклопентилпропионил]морфолина (диастереоизомер 1), полученного по ЯМР (MeOD) 3,80-3,51 (m, 9H), 3,42 (dd, способу, аналогично описанному в примере 1(i)J=14,6, 1Н), 3,14-3,06 (dt, J = 4,ll, 1H), (ix), получают 0,112г 4-[3-циклопентил-2^)-[1^ 3,04 - 2,86 (m, 1H), 2,85 (s, ЗН), 2,23-2,11 (m, или 3)-(гидроксикарбамоил)-2-(3,4,4-триметил-2,51H), 2,06 - 1,95 (m, 2H), 1,91-1,73 (m, 2H), 1,71-1,46 27 44230 28 (m, 4H), 1,35 (s,3H), 1,34 (s, 3H) добавляют дополнительные порции 0,54г метилиодида и 0,895г оксида серебра и смесь переMC 425 (M l + мешивают еще 3 дня Растворитель упаривают и Пример 20 остаток суспендируют в этилацетате и фильтруют Способом, подобно описанному в первом абЭтилацетатный раствор концентрируют и остаток заце примера 1, из 0,625г 1-[2(R)-[1(R или S) очищают флэш-хроматографией на силикагеле с (бензилоксикарбамоил)-2-(3,4,4-триметил-2,5использованием этилацетата для элюирования диоксо-1-имидазолидинил)этил]-3Получают 0,61г 1-[2(R)-[1(R или Б)-(трет,циклобутилпропионил]пирролидина (диастереоибутоксикарбонил)-2-(3,4,4-триметил-2,5-диоксо-1зомер 1), полученного по способу, аналогично имидазолидинил)этил]-3-циклобутилпропионил]-4описанному в примере l(i)-(ix), получают 0,384г 1метоксипиперидина в виде бесцветной смолы [3-циклобутил-2-(Р)-[1(Р или S)(гидроксикарбамоил)-2-(3,4,4-триметил-2,5(м) Способом, подобно описанному в примере диоксо-11(VIII)-(IX), из 0,61г 1-[2(R)-[1(R или S) - (третбутоксикарбонил)-2-(3,4,4-триметил-2,5-диоксо-1имидазолидинил)этил]пропионил]морфолина имидазолидинил)этил]-4-циклобутилпропионил]-4(диастереоизомер 1) в виде белого твердого веметоксипиперидина получают 0,443г 1-(2(R)-[1(R щества ЯМР (MeOD) 3,77 - 3,69 (m, 1H), 3,61 (dd, или S) -(бензилоксикарбамоил)-2-(3,4,4-триметилJ = 14,6, 1Н), 3,53 - 3,44 (m, 2H), 3,39-3,31 (m, 2H), 2,5-диоксо-1-имидазолидинил)этил]-32,93 - 2,85 (m, 2H), 2,84 (s, 3H),2,26 - 2,13 (m, 1H), циклобутилпропионил]-4-метоксипиперидина 2,07-1,71 (m, 8H), (диастереоизомер 1) в виде бесцветной смолы 1,69-1,46 (m, 4H), 1,36 (s, ЗН), 1,33 (s,3H) MC 409 (M+H)+ Пример 23 Пример 21 Способом, подобно описанному в первом абзаце примера 1, из 0,94г 1-[2(R)-[1(RS)Способом, подобно описанному в первом аб(бензилоксикарбамоил)-2-(3,4,4триметил-2,5заце примера 1, из 0,176г 8-[2(R)-[l(R или S)диоксо-1 -имидазолидинил)этил]-3(бензилоксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1-имидазолидинил)этил]-3циклобутилпропионилі-октагидроазоцина (диациклобутилпропионил]-1,4-диокса-8стереоизомер 1), полученного по способу, аналоазаспиро[4,5]декана (диастереоизомер 1), полугично описанному в примере l(i)-(ix), получают ченного по способу, аналогично описанному в 0,663г 1-[3-4nmo6yTHn-2(R)-[1(R или S)примере 1(I)-(IX), получают 0,084г 8-[3-циклобутил(гидроксикарбамоил)-2-(3,4,4-триметил-2,52(R)-[1 (R или 3)-(гидроксикарбамоил)-2-(3,4,4диоксо-1триметил-2,5-диоксо-1-ими дазолидиимидазолидинил)этил]пропионил]-1,4-диокса-8нил)этил]пропионил]октагидроазоцина (диастеазаспиро[4,5]декана (диастереоизомер 1) в виде реоизомер 1) в виде белого твердого вещества белого твердого вещества ЯМР (MeOD) 3,77 (dd J=14,10,1H), ЯМР (MeOD) 4,02 (s, 4H), 3,81 - 3,60 (m, 5H), 3,66 - 3,43 (m, 4Н), 3,33 (dd, J = 14,5, 1H), 3,99 (dd, J = 14,6, 1Н), 3,20 - 3,10 (m, 1H), 2,93 3,07 (dt, J = 10,4, 1H), 2,91 -2,81 (m, 4H), 2,85 (m, 1Н), 2,84 (s, ЗН), 2,21 - 2,09 (m, 1H), 2,06 2,29-2,16 (m, 1H), 2,10 -1,95 (m, 2H), 1,93 (m, 2H), 1,80 - 1,46 (m, ЮН), 1,35 (s, ЗН), 1,33 1,90-1,46 (m, 16H), 1,34 (s, 6H) (s, ЗН) MC 451 (M+H)+ + MC 481 (М+Н) Пример 24 Пример 22 Способом, подобно описанному в первом абзаце примера 1, из 0,37г 1-[2(R)-[1(R или S) - (бенСпособом, подобно описанному в первом абзилоксикарбамоил)-2-(5,5-диметил-2,4-диоксо-3заце примера 1, из 0,443г 1-[2(R)-[1(R или S)оксазолидинил)этил]-3(бензилоксикарбамоил)-2-(3,4,4-триметил-2,5диоксо-1 -имидазолидинил)этил]-3циклобутилпропионил]пиперидина (диастереоизомер 1), полученного по способу, аналогично циклобутилпропионил]-4-метоксипиперидина описанному в примере l(v) - (їх) с использованием (диастереоизомер 1) получают 0,319г 1-[33-(бромметил)-5,5-диметилоксазолидин-2,4-диона циклoбyтил-2(R)-[1(R или з)-(гидроксикарбамоил)вместо 1-(бромметил)-3,4,4триметил-2,52-(3,4,4-триметил-2,5-диоксо-1имидазол инд иона получают 0,131 г 1-[3имидазолидинил)этил]пропионил]-4циклобутил2(R)-(1 (R или S)метоксипиперидина (диастереоизомер 1) в виде белого твердого вещества ЯМР (MeOD) 3,96 (гидроксикарбамоил)-2-(5,5-диметил-2,4-диоксо-33,80 (m, 2Н), 3,69 - 3,59 (m, 1Н), 3,54 - 3,23 (m, 7H), оксазолидинил)этил]пропионил]пиперидина (диа3,18 - 3,09 (m, 1H), 2,93 - 2,80 (m, 4H), 2,21 - 2,09 стереоизомер 1) в виде белого твердого вещест(ш, 1Н), 2,07-1,41 ( т , 12Н), 1,41 -1,38(т, 6Н) ва МС 453 (М+Н)+ ЯМР (MeOD) 3,72 - 3,53 (m, 5H), 3,39 (dd, J = 14,6, 1Н), 3,14 (dt, J = 10,4, 1H), 2,95 - 2,86 (m, 1H), Исходный продую" получают следующим об2,23 - 2,11 (m, 1H), 2,08 - 1,94 (m, 2H), 1,90-1 44 разом (m, 18Н) (і) Раствор 0,925г 1-[2(R)-[1(R или S) - (третбутоксикарбонил)-2-(3,4,4-триметил-2,5-диоксо-1MC 410(M+H) + имидазолидинил)этил]-3-циклопропилпропионил]Пример 25 4-гидроксипиперидина в 8мл диметилформамида Способом, подобно описанному в первом абобрабатывают 1,08г метилиодида и 1,79г оксида заце примера 1, из 0,42г 1-[2(R)-(1(R или S) - (бенсеребра Смесь перемешивают при комнатной зилоксикарбамоил)-2-(3,4,4-триметил-2,5-диоксотемпературе в темноте в течение 2 дней Затем 1-имидазолидинил)этил]-3 29 44230 30 циклобутилпропионил]гексагидроазепина (диастеенты, могут быть получены обычным способом реоизомер 1), полученного по способу, аналогично Ингредиент На таблетку описанному в примере 1(I)-(IX), получают 0,197г 1Производное гидрокса[3-циклобутил-2(Р)-[1(Р или S)мовой кислоты 10,0мг Лактоза 125,0мг (гидроксикарбамоил)-2-(3,4,4-триметил-2,5Кукурузный крахмал 75,0мг диоксо-1Тальк 4,0мг имидазолидиСтеарат магния 1,0мг нил)этил]пропионил]гексагидроазепина (диастеОбщий вес 215,0мг реоизомер 1) в виде белого твердого вещества ЯМР (MeOD) 3,77 - 3,64 (m, 2H), 3,62 - 3,45 Пример Б (m, ЗН), 3,33 (dd, J = 14,5, 1Н), 3,07 (dt, J = 10,4, Капсулы, содержащие следующие ингредиен1H), 2,91 - 2,81 (m, 4H), 2,24 - 2,13 (m, 1H), 2,09 ты, могут быть получены обычным способом 1,95 (m, 2H), 1,90 - 1,47 (m, 14Н), 1,35 (s, ЗН), 1,34 Ингредиент На капсулы (s, ЗН) Производное гидроксамовой кислоты 10,0мг MC 437 (М+Н)+ Лактоза 165,0мг Пример 26 Кукурузный крахмал 20,0мг Способом, подобно описанному в первом абТальк 5,0мг заце примера 1, из 0,37г 1-[2(R)-(1(R или S) - (бенОбщий вес капсулы 200,0мг зилоксикарбамоил)-2-(гексагидро-1,3диоксопиразоло[1,2-а][1,2,4]триазол-2-ил)этил]-3Эффективность воздействия соединения, поциклобутилпропионил]пиперидина (диастереоилученного по примеру 9, на частоту возникновения зомер 1), полученного по способу, аналогично опухолевых поражений легких и печени у особей описанному в примере l(i)-(ix) с использованием 2мышей линии C57BI/6Hsd после инокуляпии (бромметил)гексагидро-1,3-диоксопиразоло [1,2B16F10 клеток меланомы а][1,2,4]триазола, получают 0,118г 1-[3Описание эксперимента циклобутил-2^)-[2-(гексагидро-1,3Женским особям мышей линии C57BI/6Hsd, диоксопиразоло[1,2-а][1,2,4]триазол-2-ил)-1 (R или возраст 8-9 недель, вводили в виде инъекции в S)(гидроксикарбамобоковую хвостовую вену 1*105 культивированных B16F10 клеток ткани мышиной меланомы Лечеил)этил]пропионил]пиперидина (диастереоизомер ние начинали на третий день после инъекции опу1) в виде белого твердого вещества холевых клеток Соединение примера 9 использоЯМР (MeOD) 3,68 - 3,56 (m, 8H), 3,52 - 3,39 вали в композиции с носителем CMC/Ацетат (в (m, 2H), 3,17-3,09 (m, 1H), 2,97 - 2,90 (m, 1H), 2,35 соответствии с протоколом Weiwyn) и вводили - 2,27 (m, 2H), 2,21 - 2,11 (m, 1H), 2,07 - 1,95 (m, перорально в объеме 0,1мл дважды в день семь 2Н), 1,88-1,44 (m, 12H) дней в неделю Все животные подвергались лечеMC 422 (M+H)+ нию в течение 13 дней Эксперимент завершали Пример 27 через два дня после последнего введения лекарСпособом, подобно, описанному в первом абства Животных умерщвляли метафаном и визузаце примера 1, из 0,222г 1-[2(R или S) - (бензиально обследовали внутренние органы, пораженлоксикарбамоил)-2-фталимидоэтил1-3ные опухолью Результаты представлены в циклобутилпропионил]пиперидина, полученного таблице 1 по способу, аналогично описанному в примере l(i)(ix) с использованием І\І-(бромметил)фталимида, Дополнительный пример испытаний ингибиполучают 0,01 Зг 1-[3-4Hmo6yrHn-2(R)-[1(R или S)рующего действия соединения, полученного по (гидроксикарбамоил)-2примеру 9 фталимидоэтил]пропионил]пиперидина (диастеМетодика испытаний эффективность ингибиреоизомер 1) в виде белого твердого вещества рующего действия на матричную металлопротеиназу определялась как способность ингибировать ЯМР (MeOD) 7,87 - 7,75 (m, 4H), 3,83 (dd, J = потери в организме гидроксипролина (являющего14,8, 1Н), 3,66 - 3,58 (m, ЗН), 3,53 - 3,45 (m, 1H), ся маркером содержания коллагена) из носовых 3,35 - 3,25 (m, 1H), 3,20 - 3,12 (m, 1H), хрящевых цилиндров рогатого скота, имплантиро3,04 - 2,97 (m, 1H), 2,23-2,11 (m, 1H), ванных подкожно в область спины крысам Было 2,08-1 95 (m, 2H), 1,89-1,41 (m, 12H) проведено три серии испытаний, в соответствии с MC 428 (М+Н)+ которыми животным вводили ингибитор матричСледующие примеры иллюстрируют фарманой металлопротеиназы (ММПИ) в течение 14-21 цевтические составы, содержащие производные суток При этом степень разрушения хрящевой гидроксамовой кислоты, охватываемые настояткани оценивали по потерям веса животными щим изобретением Результаты представлены в таблице 2 Пример А Таблетки, содержащие следующие ингредиСхема реакции 44230 31 32 НО СООВг Ал кэширование 8 T2) (IX) tBu—О—С. COOBz (X) (VHI) Дебензилирование О tBu— o— c Де карбоксил ир ован ив 3 R {XII) (XI) (ХШ> ши-о-с | г й І: о 1,0мм, (диапазон) 55(0-100) 10 60 (11 - 200) 62 м г/кг 10 125 м г/кг 11 250м г/кг 9 Метод Результат 37(15-80) р = 0,014 25(12-60) р 2000мг/кг 34 > 225мг/кг При 225мг/кг легкая пилоэрекция и слегка согнутое положение тела у одного животного в день введених дозы и легкая потеря веса у другого животного 1 - вес животного 20 - ЗОг на момент умерщвления, i/sex/доза плюс 5/sex при утвержденной дозе, 2 -пероральное введение, 3 - внутривенное введение, 4 - минимальная летальная доза, Метод Результат Изучение токсичности на крысах Животное Крысы (линия CD) Тестируемое соединение Соединение примера 9 Способ введения РО2 Дозировка 50, 500, 2000мг/кг Наблюдение 14 дней Способ введения ро MNLD' > 2000мг/кг 1 - вес животного 150 -180г на момент умерщвления, 5/sex, 2 -пероральное введение, 3 - минимальная летальная доза, Обработка/суточная доза Контрольный опыт без введения ММПИ 5мг/Кг(х2) 10мг/Кг(х2) 25мг/Кг(х2) 50мг/Кг(х2) Контрольный опыт без имплантации Таблица 2 Содержание гидроксиламина в пМ/мг в хрящевых тканях (% защиты) Опыт А Опыт Б Опыт В 46 90 53,58 53 56 80,15(40,5%) 85,36 (48,4%) 105,29(78,7%) 81,07(93,3%) 76,39 (56%) 77,89 (59,7%) 71,76(44,6%) 79,50 (63,6%) 82,62 94,32 119,32 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044) 456 - 20 - 90
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 233/74, C07D 487/04, A61K 31/425, A61K 31/54, A61P 37/00, A61P 9/10, C07D 263/30, A61K 31/5377, C07D 263/44, A61K 31/435, C07D 403/06, A61K 31/55, C07D 209/48, A61P 43/00, C07D 491/113, A61P 29/00, A61K 31/4427, C07D 417/06, A61K 31/535, A61K 31/4178, C07D 401/06, A61K 31/445, A61P 35/00
Мітки: лікарський, спосіб, одержання, кислоти, гідроксамової, замісниками, сполуки, препарат, проміжні, похідні, циклічними, трьома
Код посилання
<a href="https://ua.patents.su/17-44230-pokhidni-gidroksamovo-kisloti-z-troma-ciklichnimi-zamisnikami-sposib-kh-oderzhannya-promizhni-spoluki-likarskijj-preparat-ta-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні гідроксамової кислоти з трьома циклічними замісниками, спосіб їх одержання, проміжні сполуки, лікарський препарат та спосіб його одержання</a>
Попередній патент: Пристрій для спалювання та спосіб спалювання текучого вуглецевого викопного пального
Наступний патент: Гербіцидна композиція, яка містить триазолінон (варіанти), та спосіб боротьби з небажаною рослинністю
Випадковий патент: Спосіб розробки рудного покладу