Агоністи рецепторів глюкагонподібного пептиду-1, їх застосування та спосіб одержання
Номер патенту: 87122
Опубліковано: 25.06.2009
Автори: Вонг Венлонг, Зхоу Кайхонг, Вонг Мінгвей, Нан Файун
Формула / Реферат
1. Агоніст рецептора глюкагонподібного пептиду-1, який має наступну структурну формулу:
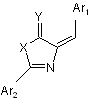 ,
,
де кожен з Ar1 і Аr2 незалежно являє собою заміщений феніл, причому замісники являють собою одну, дві або три групи, необов'язково вибрані з наступної групи: заміщений алкоксил або алкіламіно; заміщений алканоїлокси або алканоїламіно С3-С6-циклоалканоїл; бензоїл; бензилоїл; теноїл; трет-бутоксикарбоніл; адамантан формоксил; манделоїл; алкоксил; алкіламіно; циклоалкоксил; циклоалкіламіно; алканоїлкси; алканоїламіно; циклоалканоїлкси, циклоалканоїламіно;
X являє собою О або S;
Y являє собою О або S.
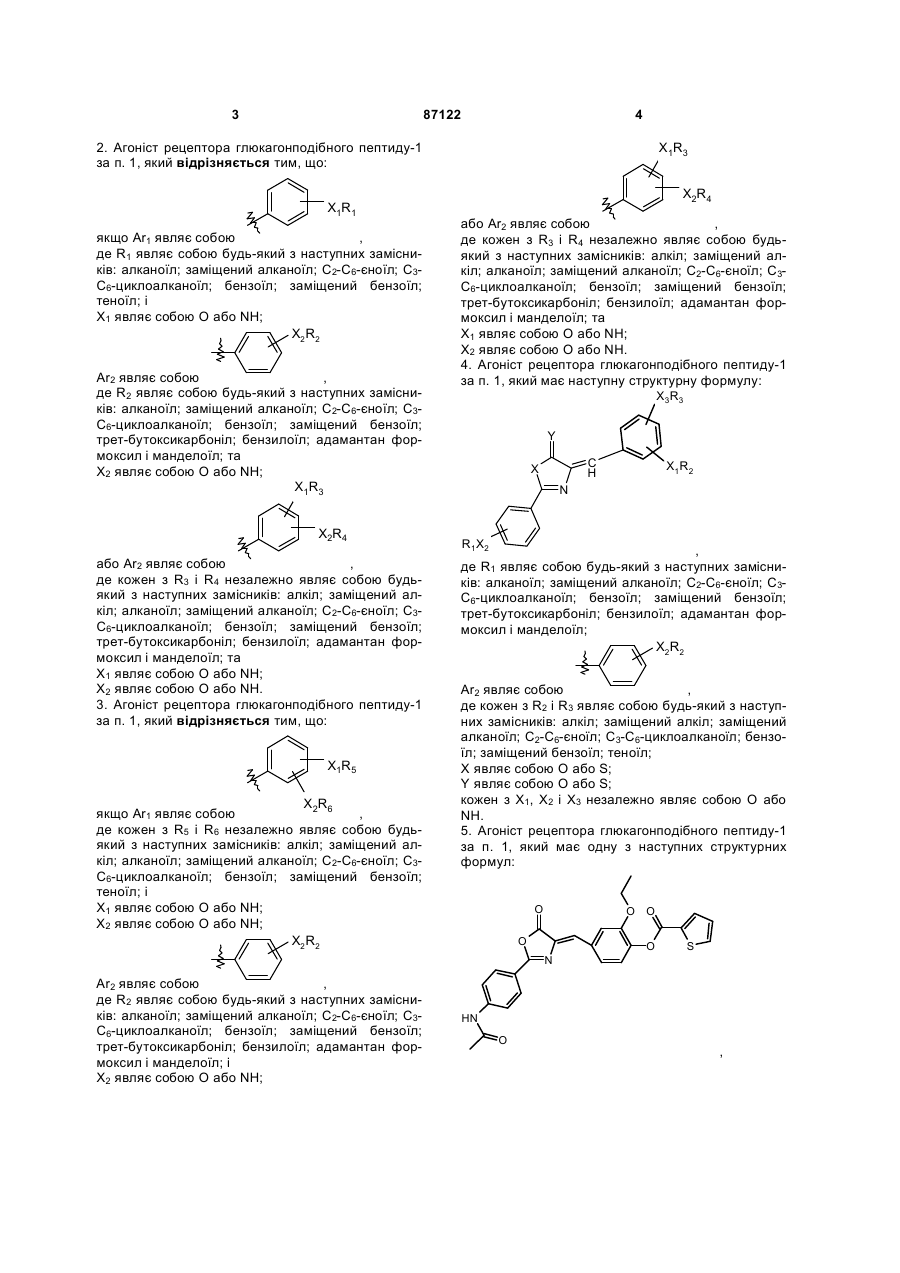
2. Агоніст рецептора глюкагонподібного пептиду-1 за п. 1, який відрізняється тим, що:
якщо Ar1 являє собою 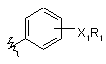 ,
,
де R1 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл; і
Х1 являє собою О або NH;
Аr2 являє собою  ,
,
де R2 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; трет-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; та
Х2 являє собою О або NH;
або Аr2 являє собою 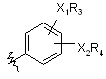 ,
,
де кожен з R3 і R4 незалежно являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; тpeт-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; та
Х1 являє собою О або NH;
Х2 являє собою О або NH.
3. Агоніст рецептора глюкагонподібного пептиду-1 за п. 1, який відрізняється тим, що:
якщо Ar1 являє собою 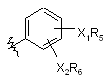 ,
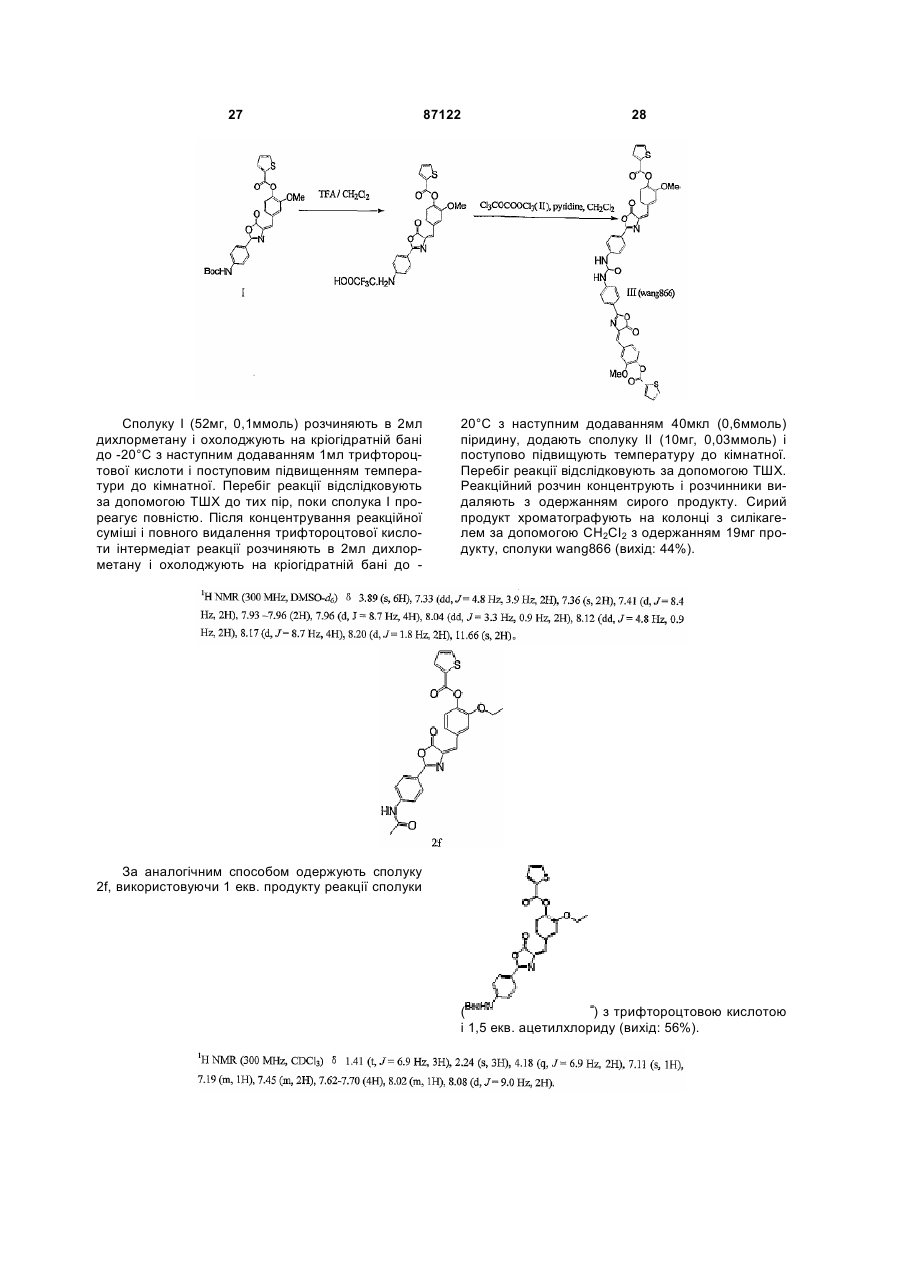
,
де кожен з R5 і R6 незалежно являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл; і
Х1 являє собою О або NH;
Х2 являє собою О або NH;
Аr2 являє собою  ,
,
де R2 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; трет-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; і
Х2 являє собою О або NH;
або Аr2 являє собою 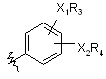 ,
,
де кожен з R3 і R4 незалежно являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; тpeт-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; та
Х1 являє собою О або NH;
Х2 являє собою О або NH.
4. Агоніст рецептора глюкагонподібного пептиду-1 за п. 1, який має наступну структурну формулу:
 ,
,
де R1 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; трет-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл;
Аr2 являє собою  ,
,
де кожен з R2 і R3 являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл;
X являє собою О або S;
Y являє собою О або S;
кожен з Х1, Х2 і Х3 незалежно являє собою О або NH.
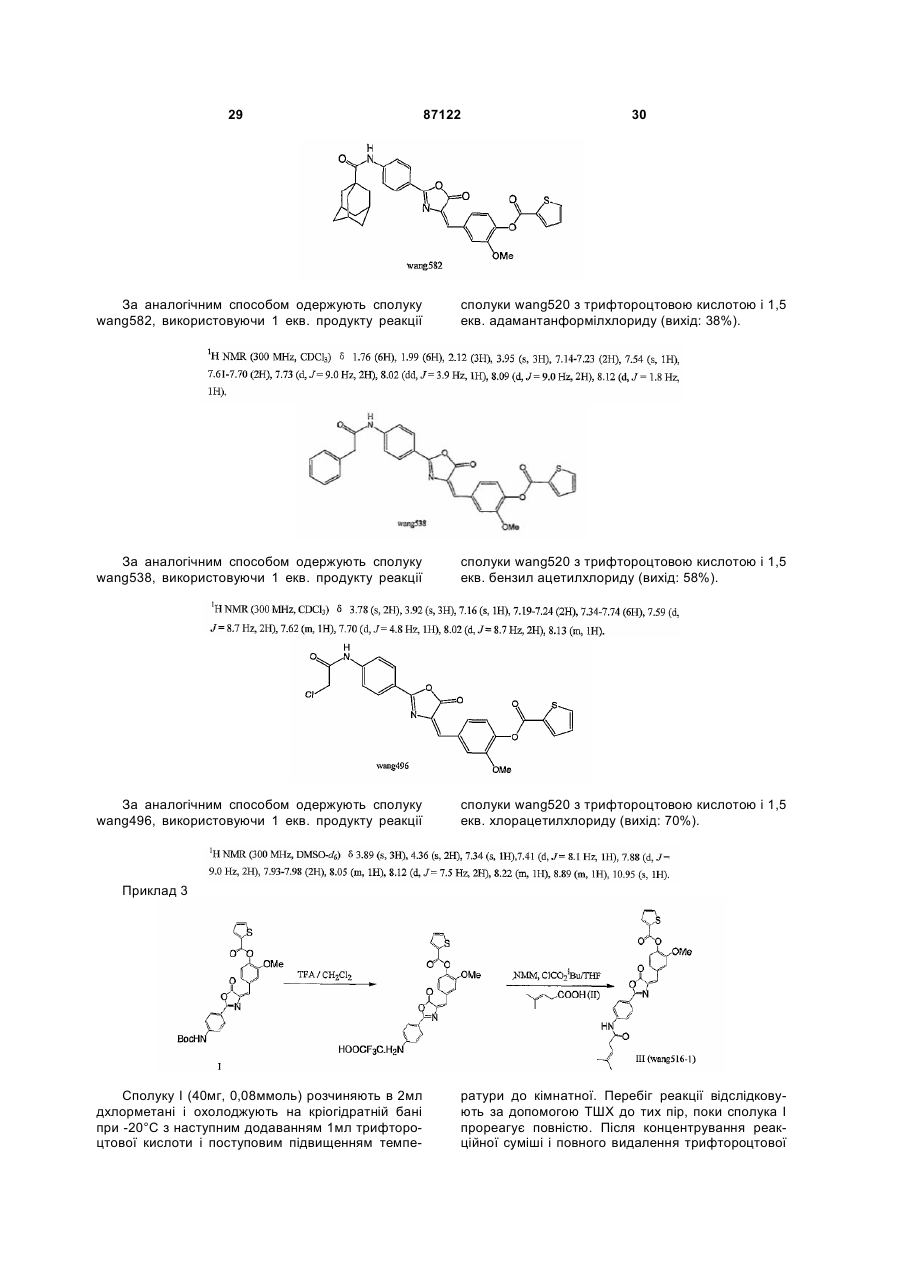
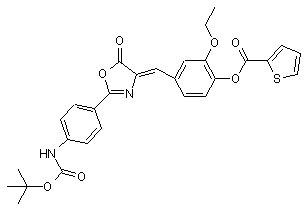
5. Агоніст рецептора глюкагонподібного пептиду-1 за п. 1, який має одну з наступних структурних формул:
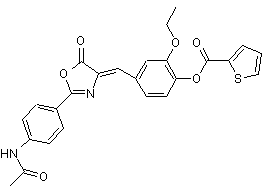 ,
, 
та 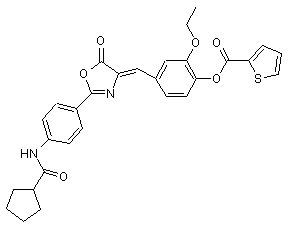 .
.
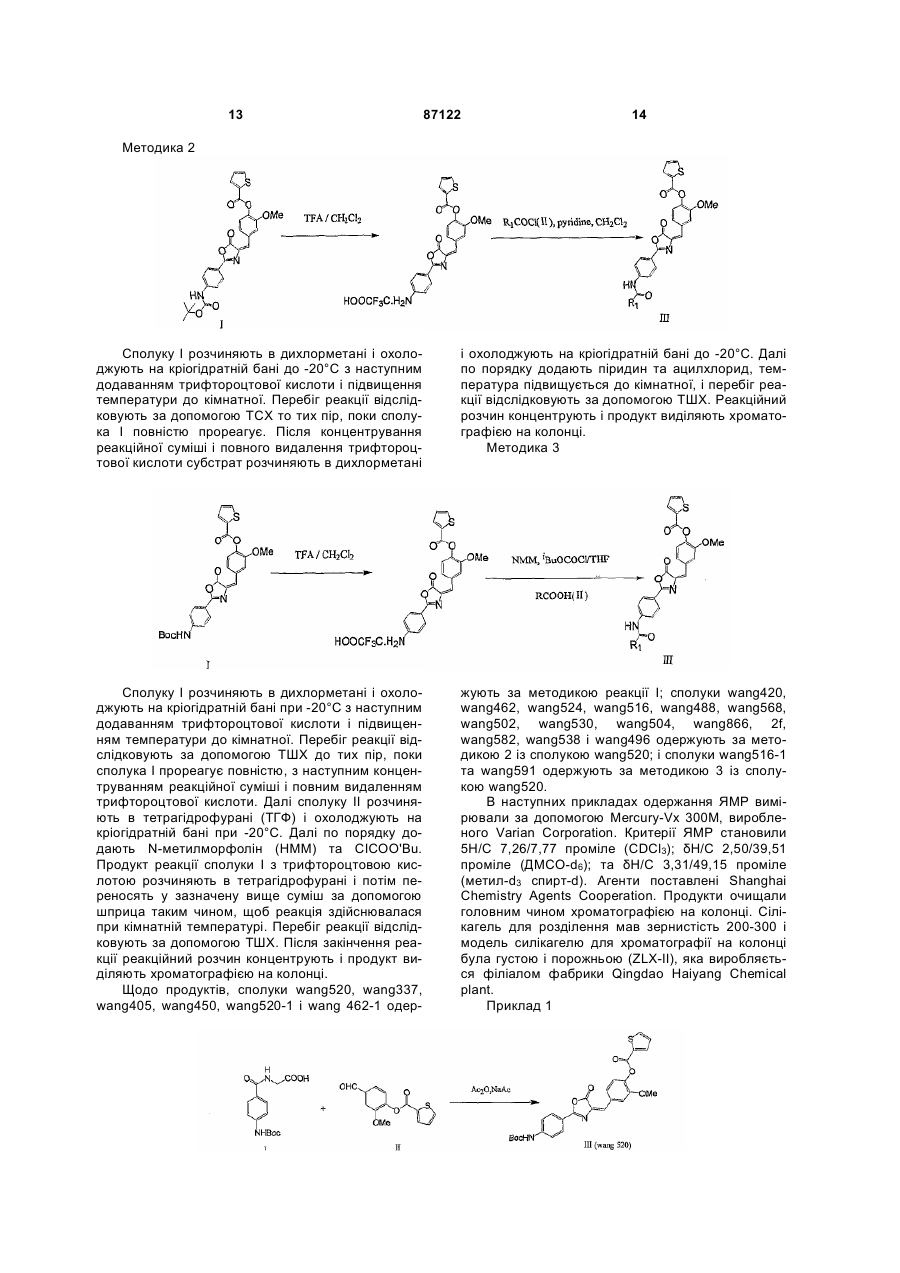
6. Спосіб одержання агоніста рецептора глюкагонподібного пептиду-1 за п. 1, який відрізняється тим, що сполуку 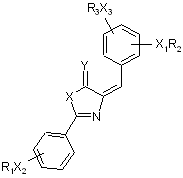 одержують конденсацією продукту реакції сполуки
одержують конденсацією продукту реакції сполуки 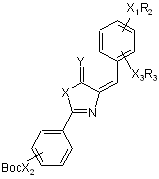 трифтороцтової кислоти із сполукою R1COX4,
трифтороцтової кислоти із сполукою R1COX4,
де R1 являє собою будь-який замісник з наступної групи: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; тpeт-бутоксикарбоніл; заміщений бензоїл; бензилоїл; адамантан формоксил та манделоїл;
де кожен з R2 і R3 являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл;
X являє собою О або S;
Y являє собою О або S;
кожен з Х1, Х2 і Х3 незалежно являє собою О або NH;
Х4 являє собою Сl або ОН.
7. Спосіб одержання агоніста рецептора глюкагонподібного пептиду-1 за п. 6, який відрізняється тим, що розчинник, який використовують в реакції конденсації, являє собою дихлорметан, тетрагідрофуран, диметилфуран, дихлоретан, толуол, бензол, воду, діоксан або суміш зазначених розчинників.
8. Спосіб одержання агоніста рецептора глюкагонподібного пептиду-1 за п. 6, який відрізняється тим, що температуру реакціїпідтримують від -78 °С до кімнатної температури.
9. Спосіб одержання агоніста рецептора глюкагонподібного пептиду-1 за п. 6, який відрізняється тим, що як активатор в реакції конденсації застосовують піридин, триетиламін, діізопропілетиламін, DMAP, N-метилморфолін або ізобутилхлорформіат.
10. Застосування агоніста рецептора глюкагонподібного пептиду-1 за п. 1 як лікарського засобу для лікування захворювань, пов'язаних з порушенням вуглеводного обміну, таких як діабет II типу, нечутливість до інсуліну або ожиріння тощо.
Текст
1. Агоніст рецептора глюкагонподібного пептиду-1, який має наступну структурну формулу: Ar1 Y , де кожен з Ar1 і Аr2 незалежно являє собою заміщений феніл, причому замісники являють собою одну, дві або три групи, необов'язково вибрані з наступної групи: заміщений алкоксил або алкіламіно; заміщений алканоїлокси або алканоїламіно С3-С6-циклоалканоїл; бензоїл; бензилоїл; теноїл; трет-бутоксикарбоніл; адамантан формоксил; манделоїл; алкоксил; алкіламіно; циклоалкоксил; циклоалкіламіно; алканоїлкси; алканоїламіно; циклоалканоїлкси, циклоалканоїламіно; X являє собою О або S; Y являє собою О або S. UA Ar2 (19) (21) a200607009 (22) 25.12.2003 (24) 25.06.2009 (86) PCT/CN2003/001115, 25.12.2003 (31) 200310109331.0 (32) 12.12.2003 (33) CN (46) 25.06.2009, Бюл.№ 12, 2009 р. (72) НАН ФАЙУН, CN/CN, ВОНГ МІНГВЕЙ, CN/CN, ВОНГ ВЕНЛОНГ, CN/CN, ЗХОУ КАЙХОНГ, CN/CN (73) ШАНГХАІ ІНСТІТЬЮТ ОФ МАТІРІЯ МЕДІКА, ЧАЙНІЗ АКЕДЕМІ ОФ САЙНС, CN (56) SHINKAI H ET AL: "N-ACYLPHENYLALANINES AND RELATED COMPOUNDS. A NEW CLASS OF ORAL HYPOGLYCEMIC AGENTS" JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY. WASHINGTON, US, vol. 31, no. 11, 1 November 1988 (1988-11-01), pages 2092-2097, XP000670266 ISSN: 0022-2623 HASAIN, M. I. ET AL: "Synthesis and hypoglycemic activity of some new N1-[p-(2-phenyl-4- arylidene-5imidazolon-1-yl)-m-methoxyphen yl]-N5-(p-substituted benzenesulfonyl) biguanide hydrochlorides" INDIAN DRUGS, 24(1), 11-13, 15, 55 CODEN: INDRBA; ISSN: 0019-462X, 1986, XP008081163 JP3050532, A, 05.03.1991 JP9244229, A, 19.09.1997 JP11273865, A, 08.10.1999 WO03050098, A, 19.06.2003 JP53084968, A, 26.07.1978 US4912221, A, 27.03.1990 SHAFI P.M. ET AL: 'A new synthetic route to 4arylidene-2-phenyl-2-imidazolin-5-ones' INDIAN J. CHEM, SECT.B:ORG. CHEM. INCL. MED. CHEM. vol. 38B, no. 3, 1999, pages 378 - 379, XP008083150 AGARWAL R. ET AL: 'Synthesis of 2-aryl-1-(-4morpholinophenyl)-4-(3,4-disub stituted 2 (11) 1 3 87122 4 2. Агоніст рецептора глюкагонподібного пептиду-1 за п. 1, який відрізняється тим, що: X1R1 якщо Ar1 являє собою , де R1 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл; і Х1 являє собою О або NH; X2R2 Аr2 являє собою , де R2 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3С6-циклоалканоїл; бензоїл; заміщений бензоїл; трет-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; та Х2 являє собою О або NH; X 1 R3 X2R4 , або Аr2 являє собою де кожен з R3 і R4 незалежно являє собою будьякий з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл; С2-С6-єноїл; С3С6-циклоалканоїл; бензоїл; заміщений бензоїл; тpeт-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; та Х1 являє собою О або NH; Х2 являє собою О або NH. 3. Агоніст рецептора глюкагонподібного пептиду-1 за п. 1, який відрізняється тим, що: X1R5 X2R6 якщо Ar1 являє собою , де кожен з R5 і R6 незалежно являє собою будьякий з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл; С2-С6-єноїл; С3С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл; і Х1 являє собою О або NH; Х2 являє собою О або NH; X2R2 X 1 R3 X2R4 або Аr2 являє собою , де кожен з R3 і R4 незалежно являє собою будьякий з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл; С2-С6-єноїл; С3С6-циклоалканоїл; бензоїл; заміщений бензоїл; тpeт-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; та Х1 являє собою О або NH; Х2 являє собою О або NH. 4. Агоніст рецептора глюкагонподібного пептиду-1 за п. 1, який має наступну структурну формулу: X3R3 Y C H X X1R2 N R1X2 , де R1 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3С6-циклоалканоїл; бензоїл; заміщений бензоїл; трет-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; X2R2 Аr2 являє собою , де кожен з R2 і R3 являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл; X являє собою О або S; Y являє собою О або S; кожен з Х1, Х2 і Х3 незалежно являє собою О або NH. 5. Агоніст рецептора глюкагонподібного пептиду-1 за п. 1, який має одну з наступних структурних формул: O O O O O S N Аr2 являє собою , де R2 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3С6-циклоалканоїл; бензоїл; заміщений бензоїл; трет-бутоксикарбоніл; бензилоїл; адамантан формоксил і манделоїл; і Х2 являє собою О або NH; HN O , 5 87122 6 X1R2 O O O Y O O S X3R3 X N N HN O ВосX2 O O O O O O S N HN O та . 6. Спосіб одержання агоніста рецептора глюкагонподібного пептиду-1 за п. 1, який відрізняється R3X3 X1R2 Y X N RX 1 2 тим, що сполуку одержують конденсацією продукту реакції сполуки Даний винахід стосується групи агоністів рецептора глюкагон-подібного пептиду-1 (ГПП-1Р, GLP-1R). Особливо даний винахід стосується групи низькомолекулярних органічних сполук, що являють собою похідні заміщеного п'ятичленного гетероциклічного кільця, які можуть застосовуватися як не-пептидні агоністи ГПП-1Р. Сполуки за даним винаходом можуть застосовуватися як лікарські засоби для лікування захворювань, пов'язаних з порушенням метаболізму вуглеводів, таких трифтороцтової кислоти із сполукою R1COX4, де R1 являє собою будь-який замісник з наступної групи: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; тpeтбутоксикарбоніл; заміщений бензоїл; бензилоїл; адамантан формоксил та манделоїл; де кожен з R2 і R3 являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6циклоалканоїл; бензоїл; заміщений бензоїл; теноїл; X являє собою О або S; Y являє собою О або S; кожен з Х1, Х2 і Х3 незалежно являє собою О або NH; Х4 являє собою Сl або ОН. 7. Спосіб одержання агоніста рецептора глюкагонподібного пептиду-1 за п. 6, який відрізняється тим, що розчинник, який використовують в реакції конденсації, являє собою дихлорметан, тетрагідрофуран, диметилфуран, дихлоретан, толуол, бензол, воду, діоксан або суміш зазначених розчинників. 8. Спосіб одержання агоніста рецептора глюкагонподібного пептиду-1 за п. 6, який відрізняється тим, що температуру реакції підтримують від -78 °С до кімнатної температури. 9. Спосіб одержання агоніста рецептора глюкагонподібного пептиду-1 за п. 6, який відрізняється тим, що як активатор в реакції конденсації застосовують піридин, триетиламін, діізопропілетиламін, DMAP, N-метилморфолін або ізобутилхлорформіат. 10. Застосування агоніста рецептора глюкагонподібного пептиду-1 за п. 1 як лікарського засобу для лікування захворювань, пов'язаних з порушенням вуглеводного обміну, таких як діабет II типу, нечутливість до інсуліну або ожиріння тощо. як діабет II типу, нечутливість до інсуліну та ожиріння і т.п. Даний винахід також стосується способу виробництва зазначених ГПП-1Р агоністів. Цукровий діабет (ЦД) являє собою розповсюджене ендокринне метаболічне захворювання із спадковою тенденцією. Його спричиняє, головним чином, абсолютна або відносна гіпосекреція інсуліну, що спричиняє метаболічні порушення обміну цукрів, жирів, білків і в подальшому вітамінів, води та електролітів. Прояви включають підвищення 7 рівня глюкози в крові та сечі, у пацієнтів виникають симптоми полідипсії, поліфагії, поліурії, сухості в роті та загальної слабкості. Захворюваність на цукровий діабет становить від 1% до 5% і демонструє тенденцію до поступового збільшення. Цукровий діабет, рак і серцево-судинні захворювання вважаються трьома найбільш серйозними групами захворювань в усьому світі. Метою лікування цукрового діабету є виправлення порушень метаболізму вуглеводів, тобто усунення симптомів, сприяння відновленню функції панкреатичного острівця, зменшення резистентності до інсуліну, підтримання загального стану здоров'я і фізичної сили, та попередження і лікування різноманітних ускладнень. Цукровий діабет загалом поділяють на два типи: інсулінзалежний цукровий діабет (типі, ІЗЦД) та інсуліннезалежний цукровий діабет (тип II, ІНЗЦД). Оскільки патогенез двох зазначених типів цукрового діабету відрізняється, лікарські засоби для їх лікування також істотно відрізняються, відповідно до описаного нижче. Цукровий діабет І типу спричиняється вірусною інфекцію у особи, яка має спадкову вразливість, що викликає парадоксальну реакцію острівцевих клітин підшлункової залози, опосередковану шляхом імунного механізму, таким чином, що острівці підшлункової залози стають пошкодженими і навіть повністю втрачають свою функцію. Близько 5% випадків цукрового діабету відноситься до типу І. На сьогоднішній день лікарські засоби для лікування цукрового діабету І типу головним чином включають екзогенний інсулін (в тому числі людський інсулін і тваринний інсулін), лікарські засоби з інсулін-подібною дією, інсулін-подібний фактор росту-1 (ІФР-1), новітні препарати інсуліну тривалої дії та гіпоглікемічні таблетки Йін Кі (Jin Qi), і т.д. Невелика частина випадків цукрового діабету II типу спричинена безпосереднім пошкодженням острівцевих β-клітин, що зменшує секрецію інсуліну. Більшість випадків цукрового діабету II типу спричинені комбінацією факторів, яка може включати генетичні риси, спосіб життя, чинники навколишнього середовища, метаболічні порушення, ожиріння і т.п. При цьому захворюванні тканини м'язів, печінки та жирова тканина стають нечутливими до інсуліну, що зменшує захоплення глюкози. Більшість хворих на діабет страждають на цукровий діабет II типу. На сьогоднішній день лікарські засоби для клінічного лікування ІНЗЦД головним чином включають сульфонілсечовини, бігуаніди, інші гіпоглікемічні засоби та ад'юванти і т.п. Гіпоглікемічні лікарські засоби з групи похідних сульфонілсечовини зв'язуються з рецепторами на клітинній мембрані острівцевих β-клітин, закриваючи канали для іонів калію і, таким чином, блокуючи вихід іонів калію та спричиняючи деполяризацію клітинної мембрани; при цьому канали для іонів кальцію залишаються відкритими, що дозволяє іонам кальцію з позаклітинного простору входити всередину клітини. Підвищення концентрації іонів кальцію всередині клітини запускає вивільнення інсуліну. Гіпоглікемічні лікарські засоби похідні сечовини можуть бути поділені на два покоління відповідно до часу введення в практику. Перше 87122 8 покоління включає толпропамід та друге покоління включає глібенкламід (Euglucan), гліклазид (Diamicron), гліпізид і гліквідон, тощо. Гіпоглікемічні лікарські засоби з групи бігуанідів пригнічують апетит, покращують зв'язування інсуліну з рецепторами, сприяють анаеробному гліколізу в клітинах, інгібують тканинне дихання та інгібують печінковий глюконеогенез. Гіпоглікемічні лікарські засоби групи бігуанідів, головним чином, включають метформін, фенформін і буформін. Інші гіпоглікемічні лікарські засоби, головним чином, включають лікарські засоби похідні тіазолідиндіону (такі як троглітазон, розиглітазон і піоглітазон, тощо), регулятори β3-адренорецепторів, антагоністи рецепторів глюкагону, засоби, що перешкоджають метаболізму жирних кислот, інгібітори α-глікозидази (такі, як акарбоза, воглібоза, міглітол), та інгібітори альдозоредуктази, тощо. Нещодавній розвиток досліджень в галузі ендогенного пептидного гормону, пов'язаного з метаболізмом вуглеводів, забезпечив нову ідею для лікування цукрового діабету. Коли організм людини захоплює поживні матеріали, ентероендокринні клітини вивільняють ентеропептидний гормон, який головним чином включає глюкагон-подібний пептид-1 (ГПП-1) і глюкозозалежний інсулінотропний пептид (ГІП) і регулює метаболізм, впливаючи на вироблення інсуліну, перистальтику шлунковокишкового тракту і проліферацію острівцевих клітин підшлункової залози. При цьому ГПП-1 (glucagon-like peptide-1, GLP-1) секретується ентеро-панкреатичними клітинами і активує аденілатциклазу для синтезу цАМФ шляхом високо специфічного зв'язування з рецептором ГПП-1 острівцевих β-клітин, що далі активує протеінкіназу. Метаболічний сигнал (метаболізм вуглеводів) і сигнал кінази (зв'язування ГПП-1) співробітничають на рівні клітинної мембрани, щоб кінець кінцем спричинити відкриття Са2+ каналів і іони кальцію стали надходити до клітини, таким чином, щоб далі стимулювати секрецію інсуліну водночас з інгібуванням вироблення глюкагону, зменшуючи рівень глюкози в крові після прийому їжі для підтримання концентрації глюкози в крові на постійному рівні. Також ГПП-1 здійснює функцію нейрорегуляції і може затримувати випорожнення шлунка та пригнічувати апетит. Все це великою мірою сприяє контролю цукрового діабету. В нормі ГПП-1 стимулює секрецію інсуліну в залежності від концентрації глюкози в крові. Якщо концентрація глюкози в крові зменшується, дія ГПП-1 із стимуляції секреції інсуліну знижується. Таким чином, дія ГПП-1 на зменшення рівня глюкози в крові є самообмеженою і не може спричинити гіпоглікемії. Отже, лікарські засоби з ГПП-1подібною дією є дуже бажаними в лікуванні цукрового діабету. Агоністи ГПП-1Ρ були одним з фокусів дослідницької діяльності міжнародних організацій, що здійснюють розробку лікарських засобів. На сьогоднішній день дослідники ГПП-1 Ρ фокусуються, головним чином, на поліпептидним регуляторах. Наприклад, АС 2993 від Amylin Corporation переданий для клінічних випробувань в США (IND). АС 2993 являє собою поліпептид з 39 амінокислот, який здійснює ефект стимуляції секреції 9 інсуліну як ГПП-1. Оскільки поліпептидні лікарські засоби є нетрадиційними з точки зору перорального введення і легко руйнуються, на цей час новим напрямком досліджень є не-пептидний регулятор ГПП-1Р. Об'єктом даного винаходу є створення групи новітніх низькомолекулярних органічних сполук похідних заміщеного п'ятичленного гетероциклічного кільця, які можуть застосовуватися як агоністи рецептора глюкагон-подібного пептиду-1 (ГПП1Р), що таким чином забезпечує шлях до пошуку провідних сполук або лікарських засобів для лікування цукрового діабету. Іншим об'єктом даного винаходу є забезпечення способу виготовлення цих сполук. Агоністи рецептора глюкагон-подібного пептиду-1 згідно даного винаходу мають специфічну структурну формулу: де кожен з Аr1 і Аr2 незалежно являє собою заміщений феніл, прийому замісники являють собою одну, дві або три групи, необов'язково вибрані з наступних груп: заміщений алкоксил або алкіламіно; заміщений алканоілокси або алканоїламіно, С3-С6-циклоалканош, бензоїл, безилоїл, теноїл, трет-бутоксикарбоніл, адамантан формоксил та манделоїл алкоксил; алкіламіно; алканоїламіно; циклоалкоксил; циклоалкіламіно; алканоїлкси; алканоїламіно; циклоалканоілкси: циклоалканоїламіно; X являє собою О або S; Υ являє собою О або S. 87122 10 Аr2 являє собою де R2 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; третбутоксикарбоніл; заміщений бензоїл; адамантан формоксил; і манделоїл; і Х2 являє собою О або NH; або Аr2 являє собою де кожен з R3 і R4 незалежно являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл, С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; третбутоксикарбоніл; заміщений бензоїл; бензилоїл; адамантан формоксил; і манделоїл; та Х1 являє собою О або NH; Х2 являє собою О або NH. Якщо Аr1 являє собою , де кожен з R5 і R6 незалежно являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; алканоїл, заміщений алканоїл, С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл і Х1 являє собою О або NH; X2 являє собою О або NH. Ar2 являє собою де R2 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл, С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; трет-бутоксикарбоніл; бензилоїл; адамантан формоксил; і манделоїл; і Х2 являє собою О або NH; Якщо Аr1 являє собою де R1 являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноіл; і якщо Χ1 являє собою О або ΝΗ, або Аr2 являє собою де кожен з R3 і R4 незалежно являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; алканоїл; заміщений алканоїл, С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; третбутоксикарбоніл; бензилоїл; адамантан формоксил; і манделоїл; та Х1 являє собою О або NH; Х2 являє собою О або NH. Даний винахід здійснюється шляхом наступних кроків. Згідно хімічного рівняння: Де кожен з Аr1 і Аr2 незалежно являє собою заміщений феніл і замісники являють собою одну, дві або три групи, необов'язково обраних з наступної групи: трет-бутоксикарбоніл і теноїл, заміщені 11 киснем або аміно; X являє собою О або S і Υ являє собою О або S. 87122 12 Або згідно наступного хімічного рівняння: де R1, являє собою будь-який з наступних замісників: алканоїл; заміщений алканоїл; С2-С6єноїл; С3-С6-циклоалканоїл; бензоїл; третбутоксикарбоніл; заміщений бензоїл; бензилоїл; адамантан формоксил та манделоїл; де кожен з R2 і R3 являє собою будь-який з наступних замісників: алкіл; заміщений алкіл; заміщений алканоїл; С2-С6-єноїл; С3-С6-циклоалканоїл; бензоїл; заміщений бензоїл; теноїл; X являє собою О або S; Υ являє собою О або S; кожен з Х1, Х2 і Х3 незалежно являє собою О або ΝΗ; та Х4 являє собою СІ або ОН. Сполуку III одержують шляхом конденсації сполуки І із сполукою II. Конденсацію здійснюють в наступному розчиннику: дихлорметан, оцтовий ангідрид, тетрагідрофуран, диметилфуран, дихлоретан, толуол, бензол, вода, діоксан або суміш зазначених розчинників. При необхідності до реакційної суміші можуть бути додані деякі активатори, такі як піридин, N-метилморфолін, ізобутилхлорформіат, триетиламін, діізопропілетиламін або DMAP, тощо. Згідно умов реакції для сполук температура реакції загалом становить від -78°С до кімнатної температури (наприклад, для сполуки Wang462, тощо), або при нагріванні від 50°С до 230°С (наприклад, для сполуки Wang520, тощо). Час реакції визначають відповідно до конкретних реагентів. Загалом, перебіг реакції визначають за допомогою ТШХ. Після закінчення реакцій загальні способи після реакційної обробки включають фільтрацію з використанням насосу, концентрування реакційного розчину для видалення розчинника, екстракцію та виділення за допомогою хроматографії на колонці, тощо. Кінцевий продукт III перевіряють за допомогою ЯМР. Спосіб синтезу структурної одиниці заміщеного п'ятичленного гетероциклічного кільця за даним винаходом описано в Organic Syntheses, CV 2, 55. В даному винаході спроектовані і синтезовані новітні агоністи рецептора глюкагон-подібного пептиду-1 (ГПП-1Р). Агоністи ГПП-1Р за даним винаходом мають добру здатність зв'язуватися з ГПП1Р, сприяючи синтезу цАМФ, і можуть застосовуватися для виготовлення лікарських засобів для лікування захворювань, пов'язаних з порушенням метаболізму вуглеводів, таких як діабет II типу, нечутливість до інсуліну (інсулінорезистентність) та ожиріння, тощо. Крім того, вони можуть подолати той недолік лікарських засобів регуляторів поліпептидної структури, що вони є нетрадиційними для перорального введення і легко руйнуються, який присутній в рівні техніки. Сполуки за даним винаходом мають відносно просту структуру, і їх можна легко одержати. На Фіг.1 показано результати визначення експресії репортерного гену для сполук за даним винаходом, які використовують для оцінки активуючої дії зазначених сполук на ГПП-1Р. На Фіг.1 відносна активність люциферази, індукована 30нМ позитивного стандарту ГПП-1, прийнята за 100%. На Фіг.2 показано вплив сполуки 2f на концентрацію цАМФ в клітинах 293/GLP-1R. Далі винахід буде пояснений з посиланням на наступні специфічні приклади, але вони ніяким чином не обмежують даного винаходу. Спосіб одержання сполук в наступних прикладах виготовлення 1-3 головним чином включає три робочі методики реакцій, як описано нижче. Методика 1 Сполуки І і II, натрію ацетат і оцтовий ангідрид змішують, нагрівають до розплавлений (150230°С) і витримують в розплавленому стані протягом 1 години. Далі до реаційної суміші додають етанол і охолоджують. Продукт відокремлюють кристалізацією з наступною фільтрацією. Залишкову рідину концентрують до повного видалення розчинника і продукт виділяють хроматографією на колонці. 13 87122 14 Методика 2 Сполуку І розчиняють в дихлорметані і охолоджують на кріогідратній бані до -20°С з наступним додаванням трифтороцтової кислоти і підвищення температури до кімнатної. Перебіг реакції відслідковують за допомогою ТСХ то тих пір, поки сполука І повністю прореагує. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти субстрат розчиняють в дихлорметані і охолоджують на кріогідратній бані до -20°С. Далі по порядку додають піридин та ацилхлорид, температура підвищується до кімнатної, і перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і продукт виділяють хроматографією на колонці. Методика 3 Сполуку І розчиняють в дихлорметані і охолоджують на кріогідратній бані при -20°С з наступним додаванням трифтороцтової кислоти і підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю, з наступним концентруванням реакційної суміші і повним видаленням трифтороцтової кислоти. Далі сполуку II розчиняють в тетрагідрофурані (ТГФ) і охолоджують на кріогідратній бані при -20°С. Далі по порядку додають N-метилморфолін (НММ) та CICOO'Bu. Продукт реакції сполуки І з трифтороцтовою кислотою розчиняють в тетрагідрофурані і потім переносять у зазначену вище суміш за допомогою шприца таким чином, щоб реакція здійснювалася при кімнатній температурі. Перебіг реакції відслідковують за допомогою ТШХ. Після закінчення реакції реакційний розчин концентрують і продукт виділяють хроматографією на колонці. Щодо продуктів, сполуки wang520, wang337, wang405, wang450, wang520-1 і wang 462-1 одер жують за методикою реакції І; сполуки wang420, wang462, wang524, wang516, wang488, wang568, wang502, wang530, wang504, wang866, 2f, wang582, wang538 і wang496 одержують за методикою 2 із сполукою wang520; і сполуки wang516-1 та wang591 одержують за методикою 3 із сполукою wang520. В наступних прикладах одержання ЯМР вимірювали за допомогою Mercury-Vx 300М, виробленого Varian Corporation. Критерії ЯМР становили 5Н/С 7,26/7,77 проміле (CDCl3); δΗ/C 2,50/39,51 проміле (ДМСО-d6); та δΗ/C 3,31/49,15 проміле (метил-d3 спирт-d). Агенти поставлені Shanghai Chemistry Agents Cooperation. Продукти очищали головним чином хроматографією на колонці. Сілікагель для розділення мав зернистість 200-300 і модель силікагелю для хроматографії на колонці була густою і порожньою (ZLX-II), яка виробляється філіалом фабрики Qingdao Haiyang Chemical plant. Приклад 1 15 87122 16 При кімнатній температурі сполуку II (466мг, 1,78ммоль), сполуку І (576мг, 1,96ммоль), натрію ацетат (146мг, 1,78ммоль) і 2мл оцтового ангідриду змішують з наступним нагріванням до 170°С до розплавлення суміші і витримують в розплавленому стані протягом 1 години. Далі до одержаної суміші додають 2мл етанолу і після цього охолоджують до кімнатної температури. Жовту тверду речовину відокремлюють і фільтрують. Залишкову рідину концентрують до повного видалення розчинника з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (5:1 об./об.) з одержанням 556мг продукту, сполуки wang520 (вихід: 60%). При кімнатній температурі сполуку II (466мг, 1,78ммоль), сполуку І (576мг, 1,96ммоль), натрію ацетат (146мг, 1,78ммоль) і 2мл оцтового ангідриду змішують з наступним нагріванням до 200°С до розплавлення суміші і витримують в розплавленому стані протягом 1 години. Далі до одержаної суміші додають 2мл етанолу і потім охолоджують до кімнатної температури. Рідину концентрують до повного видалення розчинника з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (1:1 об./об.) з одержанням 158мг сполуки wang462-1. При кімнатній температурі сполуку II (1,46мг, 9,6ммоль), сполуку І (1,9г, 10,7ммоль), натрію ацетат (0,8г, 9,8ммоль) та 2,8мл оцтового ангідриду змішують з наступним нагріванням до 170°С до розплавлення суміші і витримують в розплавленому стані протягом 1 години. Далі до одержаної суміші додають 5мл етанолу і потім охолоджують до кімнатної температури. Тверду речовину жовтого кольору відокремлюють і фільтрують з одержанням 2,0г продукту, сполуки wang337 (вихід: 62%). 17 87122 18 При кімнатній температурі сполуку II (262мг, 1,0ммоль), сполуку І (200мг, 1,0ммоль), натрію ацетат (82мг, 1,0ммоль) та 1мл оцтового ангідриду змішують з наступним нагріванням до 170°С до розплавлення суміші і витримують в розплавленому стані протягом 1 години. Далі до одержаної суміші додають 5мл етанолу і потім охолоджують до кімнатної температури. Тверду речовину жовто го кольору відокремлюють і фільтрують. Залишкову рідину концентрують до повного видалення розчинника з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (6:1 об./об.) з одержанням 235мг продукту, сполуки wang405 (вихід: 58%). При кімнатній температурі сполуку II (262мг, 1,0ммоль), сполуку І (250мг, 1,1ммоль), натрію ацетат (82мг, 1,0ммоль) і 4мл оцтового ангідриду змішують з наступним нагріванням, і витримують реакційну суміш при 210-230°С протягом 1 години. Далі до одержаної суміші додають 5мл етанолу і потім охолоджують до кімнатної температури. Тверду речовину жовтого кольору відокремлюють і фільтрують з одержанням 100мг продукту, сполуки wang450 (вихід: 22%). Приклад 2 Сполуку І (50мг, 0,1ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до 20°С з наступним додаванням 40мкл (0,6ммоль) піридину і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (2:1 об./об.) з одержанням 38мг продукту, сполуки wang420 (вихід: 90%). 19 87122 20 Сполуку І (50мг, 0,1ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1 мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (27мкл, 0,39ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (1,5:1 об./об.) з одержанням 26мг продукту, сполуки wang462 (вихід: 56%). Сполуку І (40мг, 0,08ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (23мкл, 0,2ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (5:1 об./об.) з одержанням 15мг продукту, сполуки wang524 (вихід: 36%). 21 87122 22 Сполуку І (40мг, 0,08ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2 мл дихлорметану і охолоджують на кріогідратній бані до 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (25мкл, 0,2ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (4:1 об./об.) з одержанням 25мг продукту, сполуки wang516 (вихід: 62,5%). Сполуку І (40мг, 0,08ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (23мкл, 0,2ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (4:1 об./об.) з одержанням 25мг продукту, сполуки wang488 (вихід: 64%). Сполуку І (40 мг, 0,08ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до 23 87122 24 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (23мкл, 0,2ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники ви даляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (4:1 об./об.) з одержанням 26мг продукту, сполуки wang568 (вихід: 57%). Сполуку І (40мг, 0,08ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2 мл дихлорметану і охолоджують на кріогідратній бані до 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (23мкл, 0,2ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (4:1 об./об.) з одержанням 22мг продукту, сполуки wang502 (вихід: 56%). Сполуку І (40мг, 0,08ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (23мкл, 0,2ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (4:1 об./об.) з одержанням 24мг продукту, сполуки wang530 (вихід: 57%). 25 87122 26 Сполуку І (40мг, 0,08ммоль) розчиняють в 2мл дихлорметану і охолоджують на, кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (23мкл, 0,2ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (6:1 об./об.) з одержанням 4мг продукту, сполуки wang504 (вихід: 10%). Сполуку І (40мг, 0,08ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (27мкл, 0,2ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем за допомогою СН2СІ2 з одержанням 40мг продукту, сполуки wang554 (вихід: 89%). 27 Сполуку І (52мг, 0,1ммоль) розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням температури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової кислоти інтермедіат реакції розчиняють в 2мл дихлорметану і охолоджують на кріогідратній бані до 87122 28 20°С з наступним додаванням 40мкл (0,6ммоль) піридину, додають сполуку II (10мг, 0,03ммоль) і поступово підвищують температуру до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ. Реакційний розчин концентрують і розчинники видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем за допомогою СН2СІ2 з одержанням 19мг продукту, сполуки wang866 (вихід: 44%). За аналогічним способом одержують сполуку 2f, використовуючи 1 екв. продукту реакції сполуки ( ) з трифтороцтовою кислотою і 1,5 екв. ацетилхлориду (вихід: 56%). 29 87122 30 За аналогічним способом одержують сполуку wang582, використовуючи 1 екв. продукту реакції сполуки wang520 з трифтороцтовою кислотою і 1,5 екв. адамантанформілхлориду (вихід: 38%). За аналогічним способом одержують сполуку wang538, використовуючи 1 екв. продукту реакції сполуки wang520 з трифтороцтовою кислотою і 1,5 екв. бензил ацетилхлориду (вихід: 58%). За аналогічним способом одержують сполуку wang496, використовуючи 1 екв. продукту реакції сполуки wang520 з трифтороцтовою кислотою і 1,5 екв. хлорацетилхлориду (вихід: 70%). Приклад 3 Сполуку І (40мг, 0,08ммоль) розчиняють в 2мл дхлорметані і охолоджують на кріогідратній бані при -20°С з наступним додаванням 1мл трифтороцтової кислоти і поступовим підвищенням темпе ратури до кімнатної. Перебіг реакції відслідковують за допомогою ТШХ до тих пір, поки сполука І прореагує повністю. Після концентрування реакційної суміші і повного видалення трифтороцтової 31 87122 32 кислоти сполуку II (19мкл, 0,16ммоль) розчиняють в 2мл тетрагідрофурану і охолоджують на кріогідратній бані при -20°С, перемішуючи протягом 10хв при цій температурі. Далі по порядку додають Nметилморфолін (НММ) (53мкл, 0,48ммоль) і СІСОО'Вu (21мкл, 0,16ммоль) при перемішуванні протягом 0,5 години при -20°С. Продукт реакції сполуки І з трифтороцтовою кислотою розчиняють в 1 мл тетрагідрофурану і потім переносять у за значену вище суміш за допомогою шприца, таким чином, щоб реакція здійснювалася при кімнатній температурі протягом 15 годин. Реакційний розчин концентрують і розчинники повністю видаляють з одержанням сирого продукту. Сирий продукт хроматографують на колонці з силікагелем сумішшю петролейний ефір/етилацетат (5:1 об./об.) з одержанням 12мг продукту, сполуки wang516-1 (вихід: 30%). За аналогічним способом одержують сполуку wang591, використовуючи 1 екв. продукту реакції сполуки wang520 з трифтороцтовою кислотою і 2,0 екв. сполуки Вос-АІа-ОН (вихід: 18%). Приклад 14 Сполуку wang568 (11мг, 0,02ммоль) розчиняли в 2мл дихлорметану та охолоджували до -78°С, витримуючи при цій температурі протягом 10 хвилин, з наступним додаванням 0,2мл розчину ВСІ3/н-гексан (1М), і продовжували реакцію протягом 30 хвилин при температурі -78°С. Далі температуру підвищували до -18°С і продовжували реакцію протягом 4 годин. Для гасіння реакції додавали 2мл ефіру і перемішували протягом 30 хвилин при кімнатній температурі з наступним додаванням 5мл води. Водну та органічну фази розділяли. Водну фазу екстрагували дихлорметаном, об'єднували екстракт з органічною фазою, висушували за допомогою безводного MgSO4 і концентрували. Сирий продукт виділяли за допомогою хроматографії на колонці сумішшю петролейний ефір/етилацетат (1:2, об./об.) з одержанням сполуки wang477 (1,5мг, вихід: 17%). 33 87122 34 Сполуку wang591 (3мг) розчиняли в 1,5мл дихлорметану і охолоджували на льодяній бані протягом 5 хвилин з наступним додаванням 1,5мл дихлорметану, далі охолоджували на льодяній бані протягом 5 хвилин і додавали 0,15мл трифтороцтової кислоти. Далі температуру поступово підвищували до кімнатної і перебіг реакції відслідковували за допомогою ТШХ. Після зникнення початкових матеріалів розчинник і трифтороцтову кислоту видаляли за допомогою насосу з одержанням 2мг продукту, сполуки wang605 (вихід: 65%). Приклад 4 Експерименти з вивчення біологічної активно кандидати розводили поступово з 30мМ 8 разів із співвідношенням 1:3 з одержанням градієнта концентрації (тобто, 30мМ, 10мМ, 3мМ, 1мМ, 0,3мМ, 0,1мМ, 0,03мМ і 0,01мМ) з наступним додаванням на вищезазначену 96-коміркову пластину в кількості 1мкл/комірку. Далі клітини культивували при 37°С з 5% СО2 протягом 6 годин. Активність люциферази визначали згідно із специфікацією набору системи для аналізу люциферази Steadyglo™ та підрахунок здійснювали за допомогою машини для рахування Victor 2. Позитивний контроль являв собою 30нМ стандарту ГПП-1. 1.3. Результати експерименту Результати експерименту репортерного гена для сполук-кандидатів наведені на Фіг.1 і в табл.1. На Фіг.1 показано, що сполука wang520 в кінцевій концентрації 30мкМ має найкращу відносну активність (94%), яка є значно покращеною в порівнянні з активністю сполуки 2f. Крім того, наведені в табл. 1 сполуки демонструють дозозалежність дії на ГПП-1Р, причому середня ефективна доза (ЕС50) сполук wang520, wang516, wang554, wang488, wang516-2, wang502 і wang504 менше 10мкМ. Такі результати забезпечують напрямок для визначення переважної структури взаємодії сполук з ГПП-1Р. сті 1. Вивчення експресії репортерного гену За умов зв'язування ГПП-1Р з ГПП-1 або агоністами, його Gα-субодиниця активується для стимуляції аденілатциклази, що спричиняє підвищення концентрації внутрішньоклітинного цАМФ. Оскільки регіон промотору в гені проінсуліну має елемент відповіді цАМФ, за умов зв'язування цАМФ з цим елементом відповіді активується транскрипція гену проінсуліну, таким чином, щоб підвищити чутливість острівцевих β-клітин до глюкози, і покращує експресію і секрецію інсуліну (Diabetes, 2000, vol.49: 1156-1164). Скринінгова модель використовує забарвлення ембріональних ниркових клітин людини, стабільно трансфікований вектором експресії гену ГП-1Р і вектором експресії репортерного гена люциферази під керуванням елемента відповіді цАМФ, для виявлення його відповіді на сполуку-кандидат (Cell Biology, 1992, Vol.89: 8641-8645; Proc. Natl. Acad. Sci. U.S.A. 1987, Vol.84: 3434-3438). При скринінгу сполук-кандидатів сполука, яка може індукувати експресію репортерного гена люциферази, має здатність активувати ГПП-1. 1.1. Експериментальні матеріали та інструменти: Штамм клітин: НЕК 293/GLPlR+Luc штам, який стабільно експресує ГПП-1Р та люциферазу (National New Medicaments Screening Center). Сироватка телячого плоду (GIBCO/BRL Cooperation) Система аналізу люциферази Steady-glo™ (Promega Corporation) Стандарт ГПП-1 (Sigma Corporation) G418 (Invitrogen Corporation) Інкубатор з діоксидом вуглецю Forma (Forma Corporation) Лічильна машина Victor 2 (Wallae Corporation) Сполуки-кандидати: сполуки wang524, wang520, wang462, 2f, wang516, wang516-2, wang502 та wang504. 1.2. Експериментальний процес Клітини HEK293/GLP1R+Luc в кількості 20000 клітин/100мкл/комірку інокулювали на 96-коміркову пластину і культивували при 37°С протягом ночі з середовищем для культивування DMEM з вмістом 10% сироватки телячого плоду і 500мкг/мл G418. Сполуки-кандидати wang516-2, wang502 і wang504 відповідно розводили до 2мМ, 1мМ, 0,3мМ, 0,1мМ, 0,03мМ, 0,01мМ і 0,003мМ, та інші сполуки Таблиця 1 Номер сполуки wang524 wang520 wang462 wang516 2f wang866 wang554 wang488 wang516-2 wang502 wang504 EC50/мкM 46,5 4,6 11,6 6,85 13,0 54,41 5,24 6,73 6,063,31 4,87 2. Визначення концентрації внутрішньоклітинного цАМФ Оскільки визначення концентрації внутрішньоклітинного цАМФ непрямим способом шляхом визначення експресії репортерного гена являє собою непрямий процес, виконували безпосередній функціональний ре-скринінг з набором для визначення цАМФ, щоб впевнитися в тому, що сполука може 35 надійно підвищувати концентрацію внутрішньоклітинного цАМФ. 2.1. Експериментальні матеріали та інструменти Набір для визначення цАМФ (Applied Biosystem Corporation) Інкубатор з діоксидом вуглецю Forma (Forma Corporation) Лічильна машина Victor 2 (Wallaе Corporation) Штамм клітин: НЕК 293/GLPlR+Luc штам, який стабільно експресу є ГПП-1Р та люциферазу (National New Medicaments Screening Center). Сполука-кандидат: сполука 2f. Стандарт цАМФ (входить до набору, Applied Biosystem Corporation) 2.2. Здійснення експерименту Клітини НЕК 293 в кількості 20000 клітин/100мкл/комірку інокулювали на 96-коміркову пластину і культивували при 37°С протягом ночі. Сполуку 2f розводили диметилсульфоксидом до 1,00Е-03М, 1,00Е-04М, 1,00Е-05М, 1,00Е-06М та 1,00Е-07М з наступною інокуляцією до вищезазначеної 96-коміркової пластини в кількості 11/комірку. Далі клітини культивували при 37°С з 5% СО2 протягом 1 години. Концентрацію внутрішньоклітинного цАМФ визначали згідно із специфікацією набору системи cAMP-Screen Direct™. 2.3. Результати експерименту Результат визначення концентрації внутрішньоклітинного цАМФ показано на Фіг.2. Як видно з Фіг.2, при підвищенні концентрації сполуки 2f концентрація цАМФ, продукована за умов такої стимуляції, демонструє експоненційне підвищення. Це показує, що сполука 2f, як агоніст ГПП-1Р, має певний вплив на передачу сигналу ГПП-1Р. Якщо концентрація сполуки 2f збільшується до 30мкМ і 100мкМ, концентрація цАМФ демонструє тенденцію до зменшення, що спричиняється токсичним впливом на клітини високої концентрації сполуки 2f. 3. Тест ліганд-зв'язуючої активності З метою визначення зв'язуючої активності сполуки до ліганду, готували клітини, високо експресуючі ГПП-1Р. Мічений 125І ГПП-1 використовували як ліганд в ході додавання до сполукикандидата. Якщо сполука-кандидат конкурентним чином зв'язує мічений 125І ГПП-1, кількість ізотопних міток на клітинній мембрані зменшується. Відповідно, може бути оцінена спорідненість сполукикандидата до ліганду (J МоІ Endocrinol. 2000 Vol.25: 321-35; J Biomol Screen, 2000 Vol.5: 37784). 3.1. Експериментальні матеріали та інструменти Штам клітин НЕК 293/GLPlR+Luc (National New Medicaments Screening Center) 87122 36 Мічена сполука: 125І-мічений GLP-1 (Amersham Biosciences Cooperation) Робоча станція Wallac MicroBata (Perkin Elmer Cooperation) Збірник клітин TomTech (TomTec Cooperation) Буферний розчин для тестування: 20мМ трис-НСІ (рН 7.4) (Shanghai Shenggong biological engineering technology LTD), 100мМ NaCl (Shanghai Chemical agents Cooperation), 15мМ NaF (Shanghai Chemical agents Cooperation), 2мМ дезоксипіридоксину (Sigma Cooperation), 0,2мМ фенилметилсульфонілфторид (Sigma Cooperation), апротинин (Shanghai Chemical agents Cooperation) (1мкг/мл), та леупептин (Shanghai Chemical agents Cooperation) (1мкг/мл). Розчин для промивання: 20мМ трис-НСІ (рН 7.4), 100мМ NaCl, та 15мМ NaF Сцинтиляційна рідина (Wallac Cooperation) Сполуку-кандидат розводили диметилсульфоксидом з градієнтом концентрацій 0,1нМ, 1нМ, 10нМ, 100нМ, 1000нМ, 10000нМ, і 100000нМ. 3.2. Експериментальний процес 105 Клітин НЕК 293/GLPlR+Luc в логарифмічній фазі росту інкубували разом з 125І-міченим ГПП-1 позитивним пептидом (кінцева концентрація 40пМ) в 200мкл буферного розчину для тестування при 25°С протягом 4 годин, і в той час додавали немічений позитивний пептид або сполукукандидат. Клітини збирали збирачем клітин, далі тричі промивали розчином для промивання. Додавали сцинтиляційну рідину і здійснювали підрахунок для кожної комірки за допомогою лічильника Microbata. 3.3. Результати експерименту Результати експерименту із зв'язування з рецептором показані в табл.3. Як видно з даних табл.3, сполука 2f має кращу спорідненість до ГПП-1Р, але спорідненість сполук wang520 і wang516 є трохи слабшою, а інші сполуки в досліджуваному інтервалі концентрацій не зв'язуються значною мірою з рецептором. Таблиця 3 Номер сполуки wang524 wang450 wang405 wang327 wang520 wang462 wang866 wang516 wang420 2f EC50/мкM >100мкM >100мкM >100мкM >100мкM 60-100мкM >100мкM >100мкM 40-80мкM >100мкM 31мкM 37 Комп’ютерна верстка А. Рябко 87122 Підписне 38 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюGlucagon-like peptide-1 receptor agonists, the preparation and the use of the same
Автори англійськоюNan Fajun, Wang Mingwei, Wang Wenlong, Zhou Caihong
Назва патенту російськоюАгонисты рецепторов глюкагонподобного пептида-1, их применение и способ получения
Автори російськоюНан Файун, Вонг Мингвей, Вонг Венлонг, Зхоу Кайхонг
МПК / Мітки
МПК: A61K 31/4164, C07D 263/42, C07D 233/70, C07D 263/46, C07D 277/34, A61K 31/426, C07D 233/84, A61K 31/421, C07D 277/36
Мітки: застосування, одержання, спосіб, глюкагонподібного, пептиду-1, агоністи, рецепторів
Код посилання
<a href="https://ua.patents.su/19-87122-agonisti-receptoriv-glyukagonpodibnogo-peptidu-1-kh-zastosuvannya-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Агоністи рецепторів глюкагонподібного пептиду-1, їх застосування та спосіб одержання</a>
Попередній патент: Неводна частинкоутворювальна композиція конденсованого піролокарбазолу і спосіб її приготування
Наступний патент: Водна суспензія циклесоніду для аерозольного розпилення
Випадковий патент: Побутова теплиця